INSTITUTO POLITECNICO NACIONAL PRACTICA N° 6





ALVAREZ ALVAREZ VERONICA
MONTIEL ZUÑIGA XAREMI
VALDES ORTIZ ALVARO ANTONIO
Efectuar la hidrólisis total de una proteína
Identificar algunos aminoácidos presentes en un hidrolizado de proteína, por medio de sus propiedades físico-químicas
Identificar por cromatografía en placa fina algunos de los aminoácidos presentes en un hidrolizado de proteína.
Antecedentes teóricos
Fundamentos teóricos
¿Qué son las proteínas?
Largas cadenas de aminoácidos unidos por enlaces peptídicos.
Constituyentes fundamentales de todas las células y tejidos del cuerpo.
Constituyentes esenciales de la dieta necesarios para la síntesis de tejido corporal, enzimas, algunas hormonas y componentes proteicos de la sangre.
Se componen por carbono, hidrogeno, oxigeno, nitrógeno y azufre.
A) Fibrosas o estructurales
B)Globulares
C) Conjugadas
SEGÚN SU NIVEL DE COMPLEJIDAD
A) primarias
B) secundarias
C) terciarias
D) cuaternaria
Moléculas simples formadas por la hidrólisis completa de una proteína

Unidad principal delas proteínas
Son esencialmente un ácido orgánico que contiene un grupo amínico en el átomo de carbono que se encuentra adyacente al grupo carboxilo

Un grupo amino, -NH2, que aparece como su forma protonada -NH3+
Un grupo carboxilo, -COOH, que aparece como su forma disociada -COO-
Un hidrógeno, -H
Una cadena lateral, que es la que distingue unos aminoácidos de otros.
Tanto el grupo amino como el carboxilo aparecen ionizados; amino como -NH3+ y carboxilo comoCOO-.
Alifaticos
Aromáticos
Hidroxiaminocidos
Tioaminoácidos
Aminas secundarias
Dicarboxilicos
Dibasicos
Hidrólisis de una proteína
La hidrólisis de proteínas es la ruptura de la estructura primaria, es decir la ruptura de la secuencia de una proteína.
La hidrólisis de las proteínas termina por fragmentar las proteínas en aminoácidos.
Debido a la hidrólisis, las propiedades moleculares de las proteínas cambian, produciéndose la disminución del peso molecular, el aumento de la carga y la liberación de grupos hidrofóbicos, entre otros fenómenos.

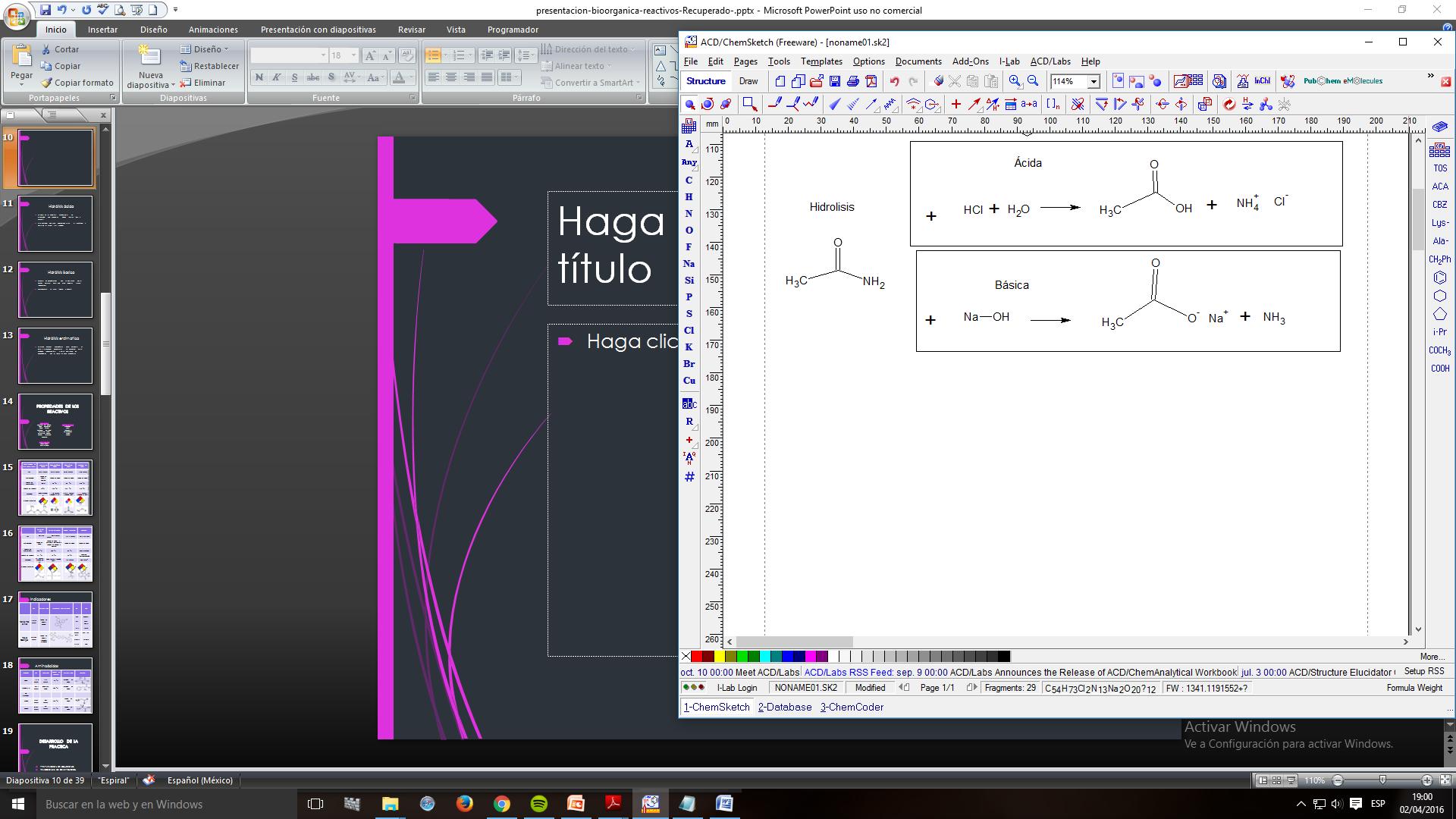
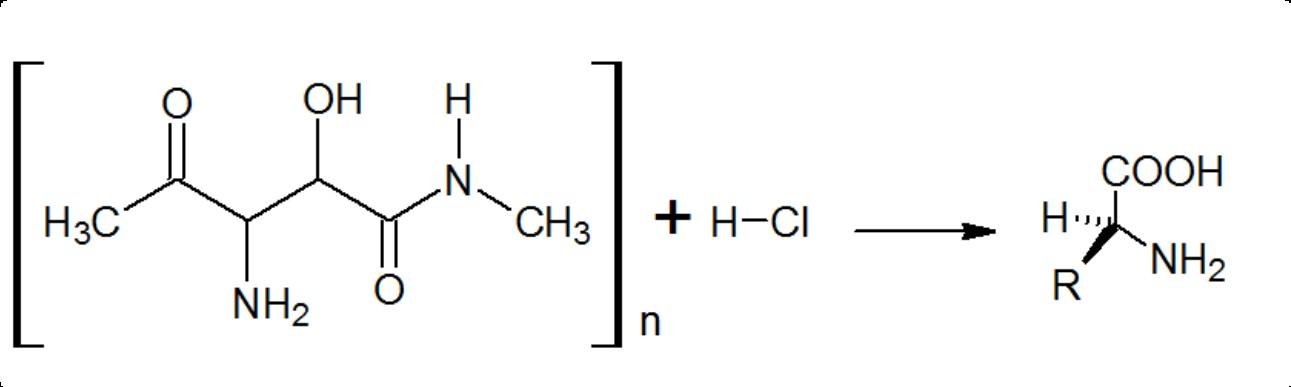
Se basa en la ebullición prolongada de la proteína con soluciones ácidas fuertes (HCl y H2SO4).
Este método destruye completamente el triptófano y parte de la serina y la treonina.
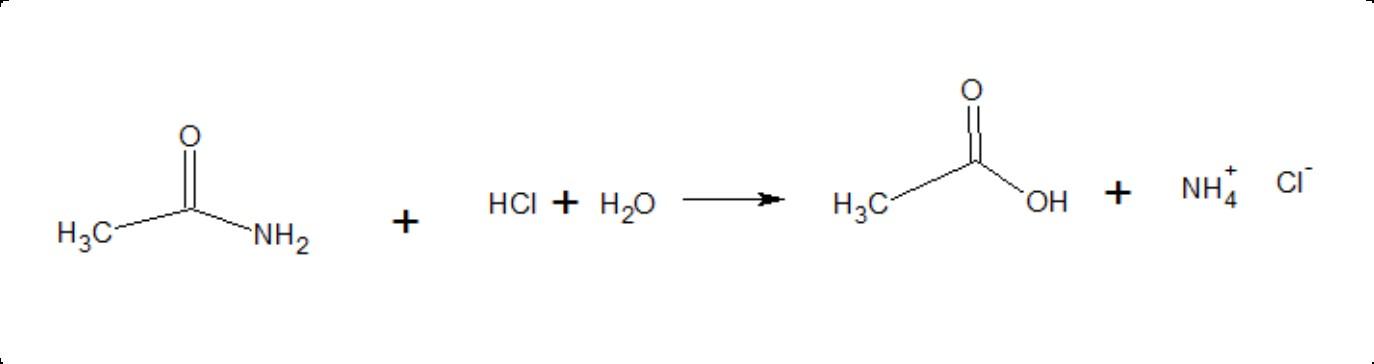

Se utilizan enzimas proteolíticas cuya actividad es

REACTIVOS
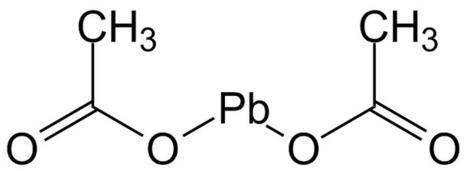
Acetato de plomo
Ácido clorhídrico
Ácido nítrico
Hidróxido de sodio
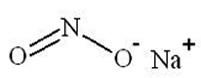
Nitrito de sodio
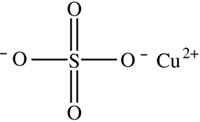
Sulfato de cobre
Alcohol terbutilico
Ninhidrina
INDICADORES
Fenolftaleina
Rojo Congo
AMINOACIDOS
Esenciales
Valina
Fenilalanina
No esenciales
Glicina
Alanina
0 3 0

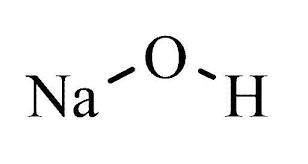
















a) PREPARACION DE SOLUCIONES
b) REACCIONES DE IDENTIFICACION
I. HIDRÓLISIS DE GRENETINA
II. SOLUCION NEUTRALIZADA DE HIDROLIZADO DE GRENETINA
III. SOLUCION DE GRENETINA SIN HIDROLIZAR
IV. SOLUCION DE ALBUMINA
REACCION DE HIDRÓLISIS DE UNA PROTEINA
DENOMINADAGRENETINA
matraz
• 1g grenetina +
• 10mL HCl
reflujo
• Calentar suavemente
• 35 minutos
agregar
Filtrar







En caliente
• 0.5g carbón
activado
• Calentar 2 minutos
II. Solución neutralizada de hidrolizado de grenetina (solución “B”)
REACTIVOS
cantidad
Reactivo
5.0 mL SOLUCION A
La necesaria
El necesario
NaOH 10%
Papel PH
1. Reacción Xantoproteica
2. Reacción de precipitación
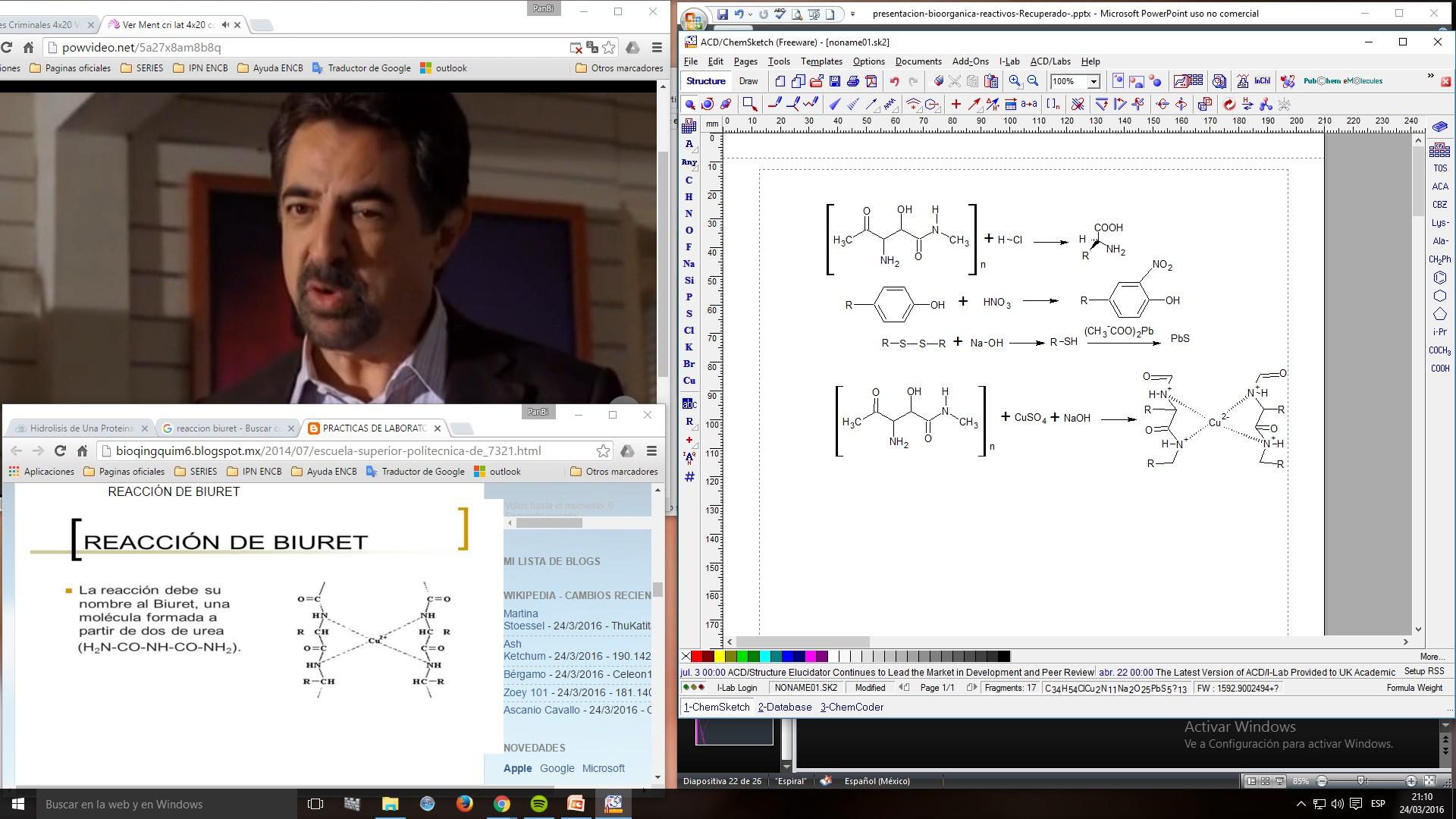
3. Reacción de Biuret
4. Reacción con Ninhidrina
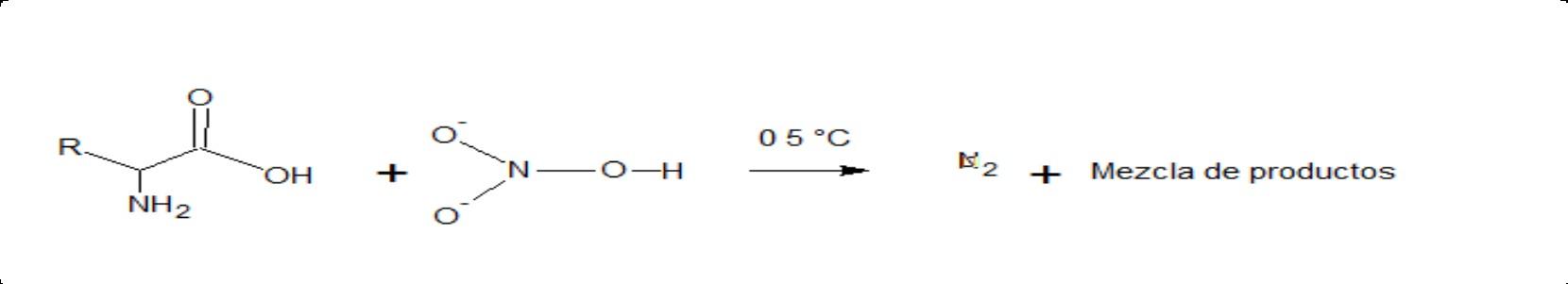
5. Reacción con ácido nitroso
6. Acción reguladora de aminoácidos
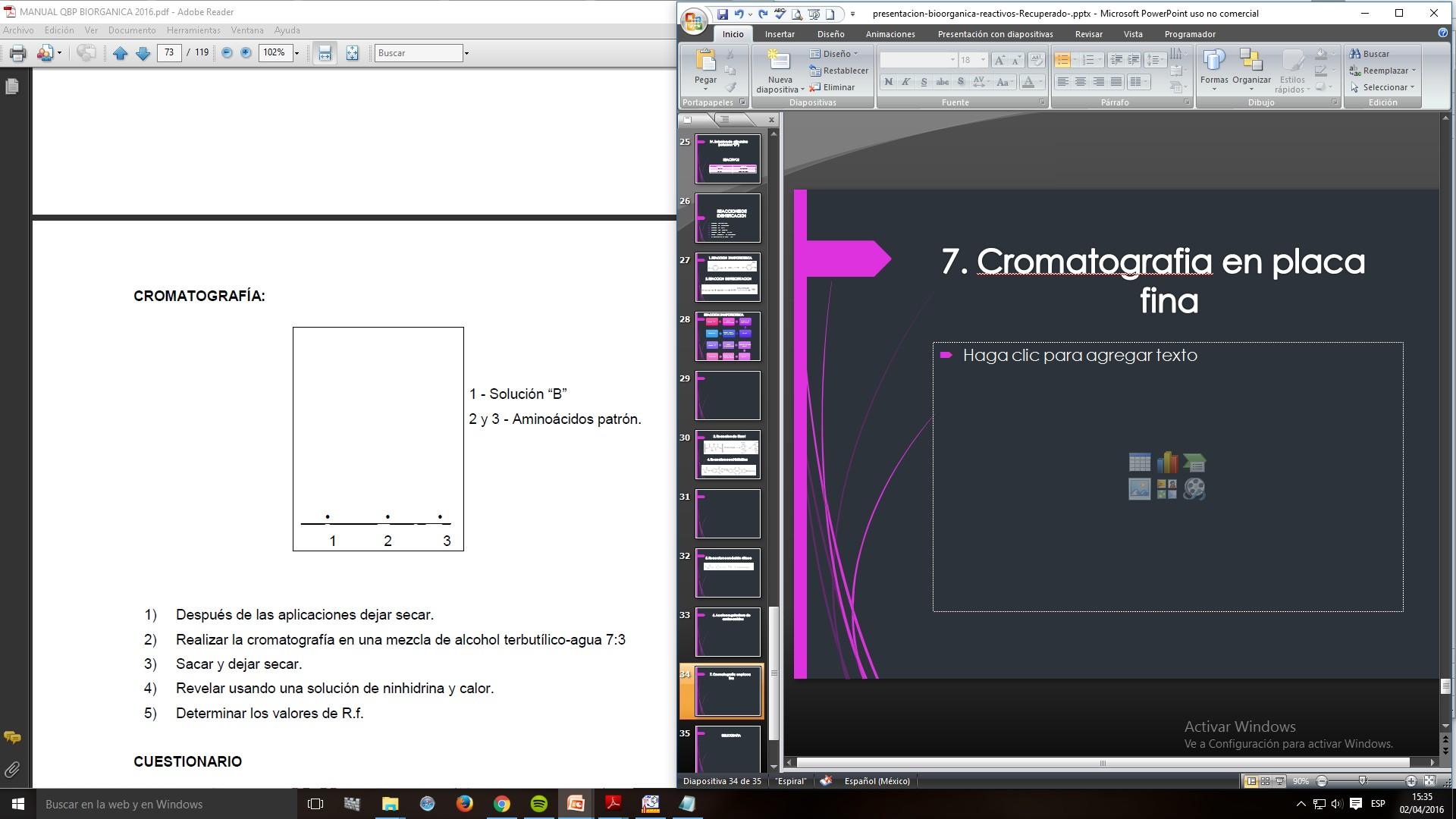
7. Cromatografía en placa fina


Solución “A”
HNO3 (CONCENTRADO)









Calentar en baño maría
Solución “A”
Adicionar NaOH 10% (pH básico)
Enfriar
Observar
Solución A
Solución D
NaOH al10% Pb(CH3COO)2 AL 10% Calentar a ebullición 5 minutos
OBSERVAR
H2O



Testigo H2O, NaOH al 10% Solución C, NaOH al 10%
Solución D
Solución A, NaOH al 10% Solución D, NaOHal 10%
Adicionar CuSO4 al 2%

Agitar
OBSERVAR
Solución A
H2O



Solución B
Solución C
Adicionar ninhidrina al 3%
Calentar 5 min en baño maría
OBSERVAR
Solución D
Solución al 1% de Aa patrón D
NaOH al 10%
Testigo sin proteína
Solución A
Solución C
Adicionar HCl concentrado


Enfriar adicionar NaNO2 al 5% OBSERVAR
Solución D
Solución B
Adicionar solución de rojo Congo
Adicionar NaOH 0.1 N
OBSERVAR
H2O

Adicionar solución fenolftaleína al 1%

Aplicar dos gotas de cada sustancia (solución B, aminoácidos patrón) Dejar secar
Realizar cromatografía en una mezcla 7:3 alcohol terbutilicoagua











Revelar usando solución de ninhidrina y calor Determinar valores de R.f
Sacar y dejar secar
Lehninger, PRINCIPIOS DE BIOQUIMICA, editorial omega, quinta edición.
Mathews, Van Holde, Ahern, BIOCHEMISTRY, editorial , tercera edición.
Rendina G. TECNICAS DE BIOQUIMICA APLICADA, edicion 1974, editorial interamericana.