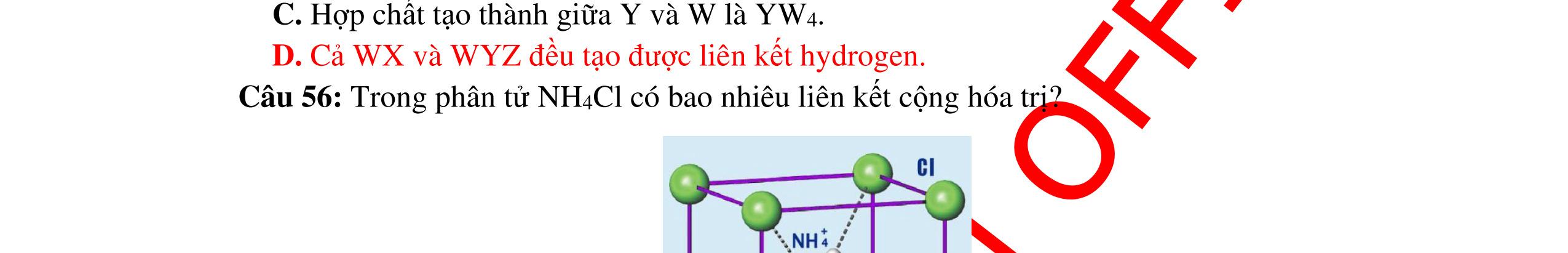
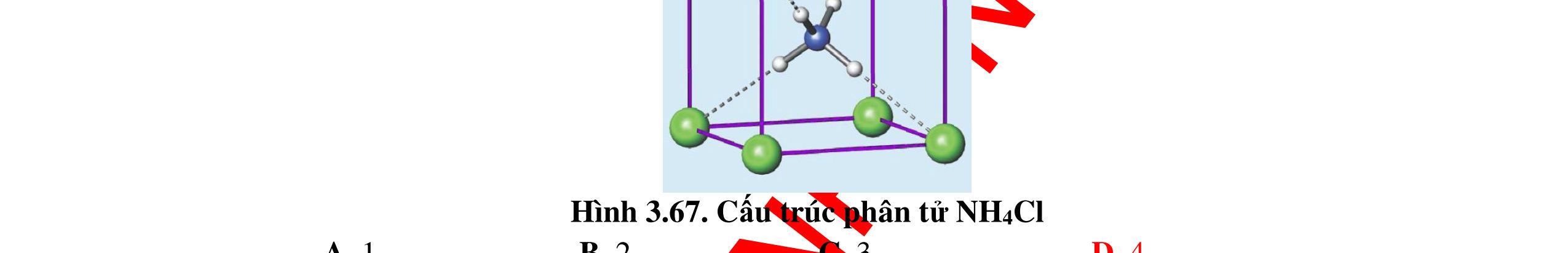
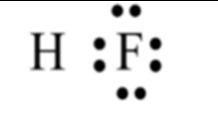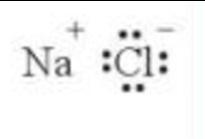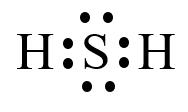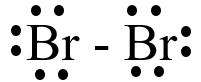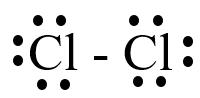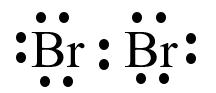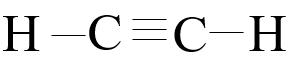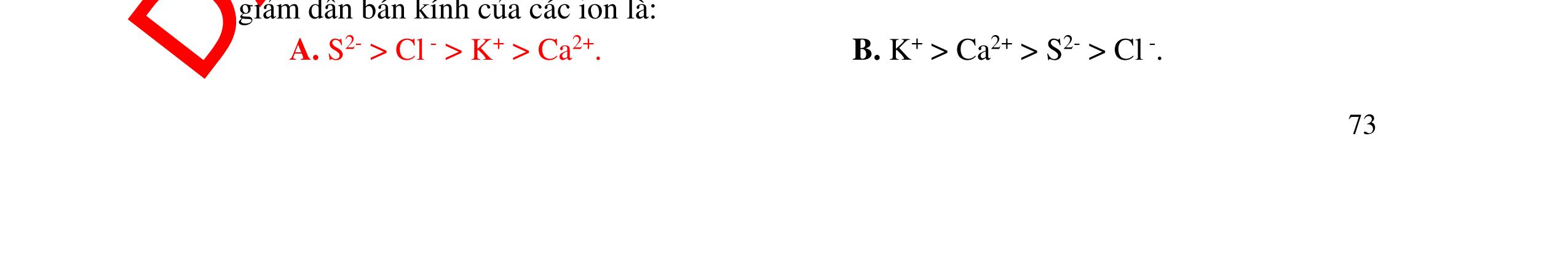LIÊN KẾT HÓA HỌC
LIÊN KẾT HÓA HỌC
● Liên kết hóa học là sự kết hợp giữa các nguyên tử tạo thành phân tử hay tinh thể bền vững hơn.
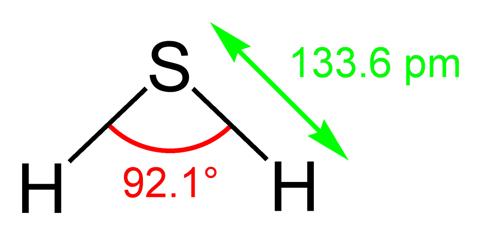
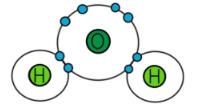
Ví dụ: Hai nguyên tử hydrogen liên kết với nhau tạo phân tử H2.
● Trong liên kết hóa học, chỉ có các electron thuộc lớp ngoài cùng và phân lớp sát ngoài cùng tham gia vào quá trình tạo thành liên kết (electron hóa trị). .
● Các electron hóa trị được biểu diễn bằng các dấu chấm đặt xung quanh nguyên tố.
Ví dụ: Biểu diễn các electron hóa trị của các nguyên tố thuộc chu kỳ 3.
● Quy tắc octet: Khi hình thành liên kết hóa học, các nguyên tử có xu hướng nhường, nhận hoặc góp chung electron để đạt tới cấu hình electron bền vững của nguyên tử khí hiếm.
Ví dụ: Nguyên tử Sodium nhường 1 electron để đạt cấu hình của khí hiếm Neon.
Ví dụ: Nguyên tử Fluorine nhận 1 electron để đạt cấu hình của khí hiếm Neon.



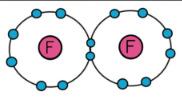
Ví dụ: Hai nguyên tử Fluorine góp chung electron tạo phân tử F2.

LIÊN KẾT ION
● Sự hình thành ion
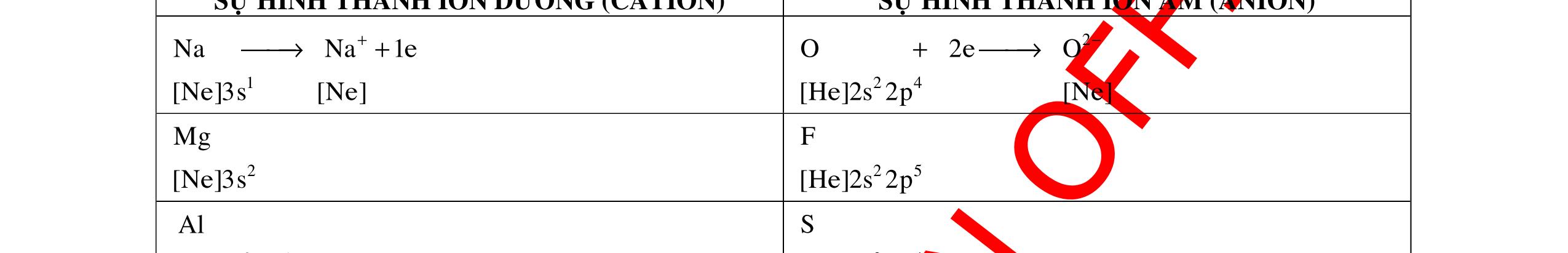
o Các kim loại có 1, 2 hoặc 3 electron lớp ngoài cùng có xu hướng nhường electron để tạo ion dương (cation).
o Số đơn vị điện tích của ion dương (cation) bằng số electron mà nguyên tử đã nhường.

Ví dụ: Nguyên tử Sodium nhường 1 electron để tạo ion Sodium (mang điện dương, điện tích 1+).
o Các phi kim có 5,6 hoặc 7 electron lớp ngoài cùng có xu hướng nhận electron để tạo ion âm (Anion).

o Số đơn vị điện tích của ion âm (anion) bằng số electron mà nguyên tử đã nhận.
Ví dụ: Nguyên tử Fluorine nhận 1 electron để tạo ion Fluoride (mang điện âm, điện tích 1-).
● Liên kết ion được hình thành bởi lực hút tĩnh điện giữa các ion mang điện trái dấu.
Liên kết ion thường được hình thành giữa kim loại điển hình và phi kim điển hình.
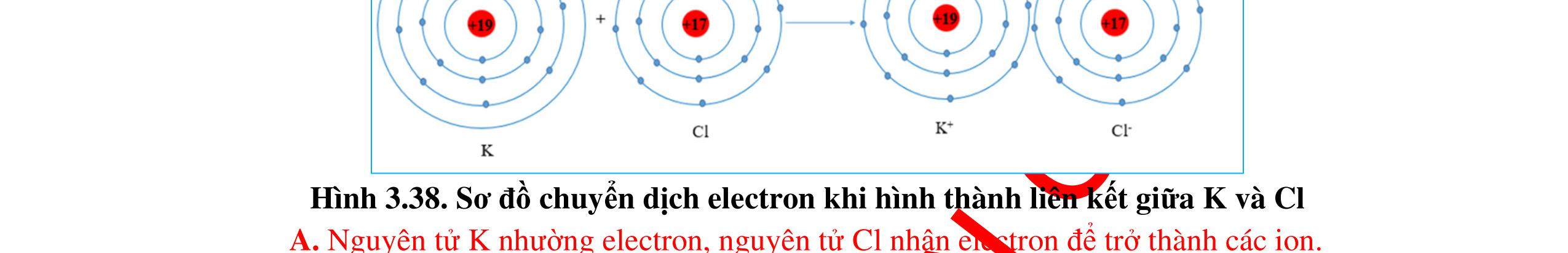
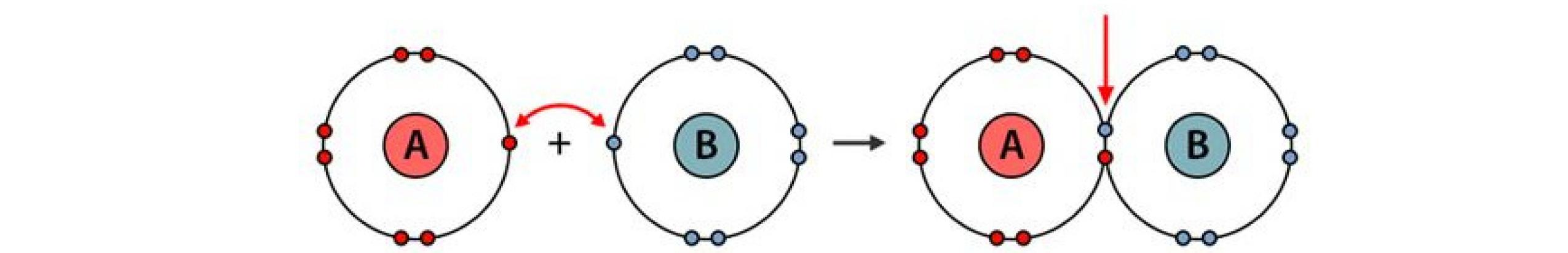
Ví dụ: Sự hình thành liên kết ion trong phân tử sodium chloride.

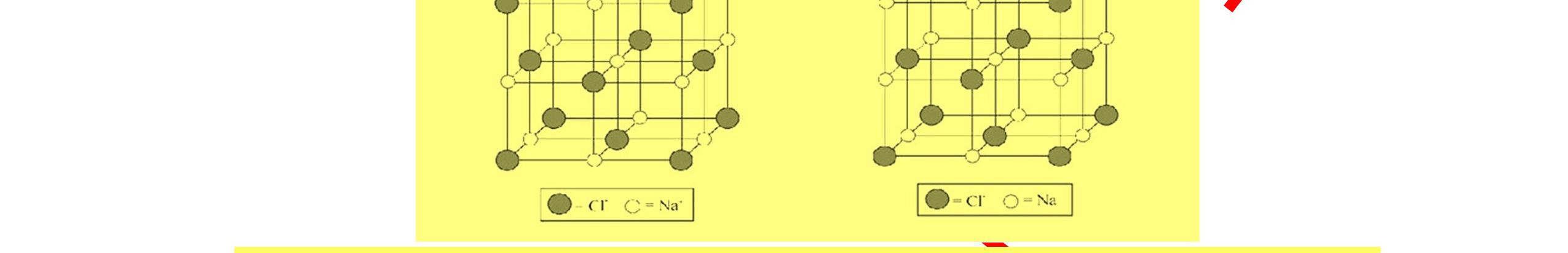
● Tinh thể ion là tinh thể được tạo nên bởi các cation và anion.
● Các ion được sắp xếp theo một trật tự nhất định trong không gian theo kiểu mạng lưới. Các ion dương và ion âm được sắp xếp luân phiên.
● Số ion cùng dấu bao quanh một ion trái dấu phụ thuộc vào kiểu mạng
chảy, khó bay hơi.
o Thường tan nhiều trong nước tạo dung dịch dẫn điện.
● Tên của hợp chất ion
Tên của hợp chất lưỡng nguyên tố được xác định khi biết tên của hai phần tử liên quan.
1. Tên của cation kim loại được gọi theo một số nguyên tắc sau
NT1. Kim loại chỉ tạo một cation có tên cùng tên của kim loại Na (sodium) → Na+ (sodium).



NT2. Kim loại tạo thành nhiều cation với các điện tích khác nhau, thì điện tích dương được biểu thị bằng chữ số La Mã trong ngoặc đơn sau tên của kim loại: Fe (iron) → Fe2+ iron(II) ion ; Fe3+ iron(III) ion
NT3. Các cation được hình thành từ các nguyên tử phi kim có tên tận cùng bằng -ium: NH4 + ammonium ion; H3O+ hydronium ion
2. Tên anion được gọi theo một số nguyên tắc sau
NT1. Các anion đơn nguyên tử được hình thành bằng cách thay thế phần cuối của tên nguyên tố bằng -ide: Phi kim Tên gốc Tên ion
Bromine brom- Br bromide ion
Chlorine chlor- Cl chloride ion
Fluorine fluor- F fluoride ion
Iodine iod- I iodide ion
Nitrogen nitr- N3 nitride ion
Oxygen ox- O2 oxide ion Phosphorus phosph- P3 phosphide
Sulfur sulf- S2 sulfide Hydrogen hydr- H hydride ion
Một số anion đa nguyên tử cũng có tên kết thúc bằng -ide: OH hydroxide ion CN cyanide ion O2 2 peroxide ion
NT2. Các anion đa nguyên tử chứa oxy có tên kết thúc bằng -ate hoặc -ite và được gọi là oxyanion. -ate được sử dụng cho oxyanion phổ biến nhất hoặc của một nguyên tố và -ite được sử dụng cho oxyanion có cùng điện tích nhưng ít hơn một nguyên tử O: NO3 nitrate ion SO4 2 sulfate ion NO2 nitrite ion SO3 2 sulfite ion
Tiếp đầu ngữ được sử dụng khi oxyanion của một nguyên tố có đến bốn phần tử, như với các halogen. Tiền tố per- chỉ ra một nguyên tử O nhiều hơn oxyanion kết thúc bằngate; hypo- chỉ ra một nguyên tử O ít hơn oxyanion kết thúc bằng -ite:
ClO4 perchlorate ion (nhiều hơn 1 O hơn chlorate)
ClO3 chlorate ion
ClO2 chlorite ion (ít hơn 1 O so với chlorate)
ClO hypochlorite ion (ít hơn 1 O so với chlorite)
LIÊN KẾT CỘNG HÓA TR
Ị
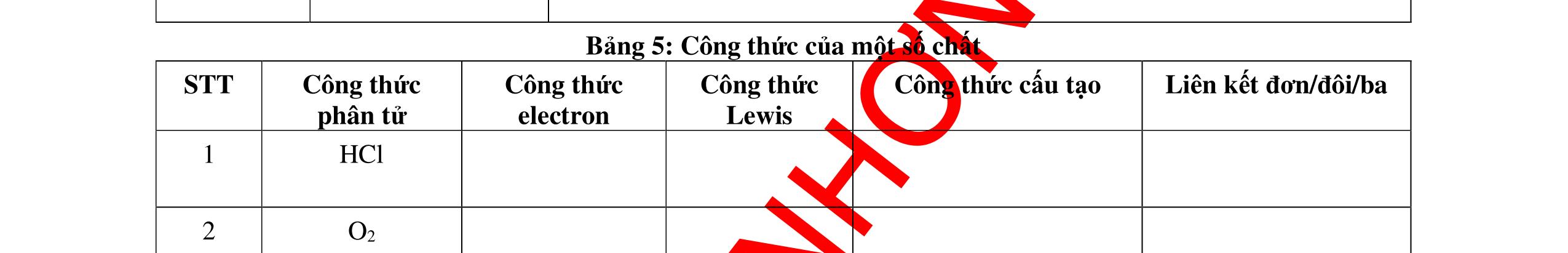
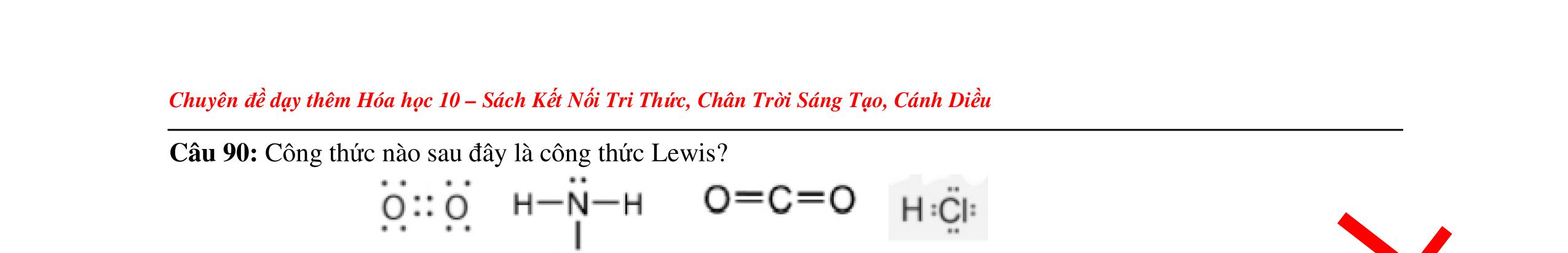
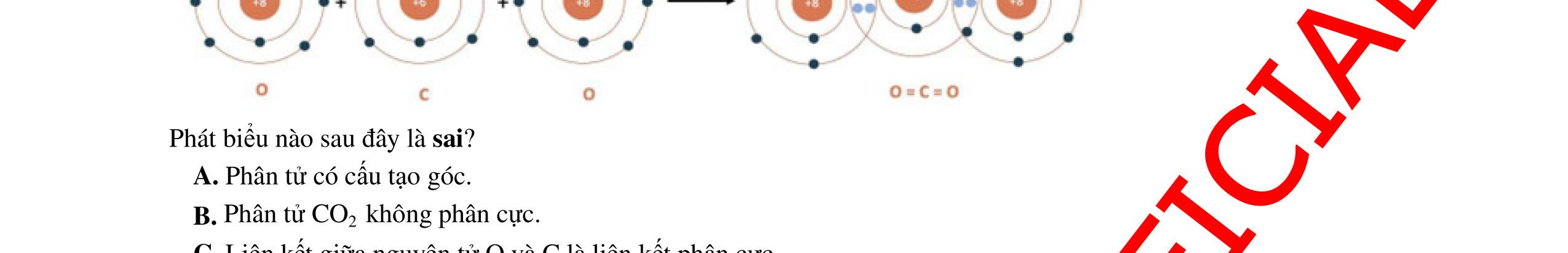
● Liên kết cộng hóa trị là liên kết được hình thành bởi một hay nhiều cặp electron chung giữa hai nguyên tử. Liên kết tạo thành từ cặp electron chung thường gặp giữa phi kim và phi kim.
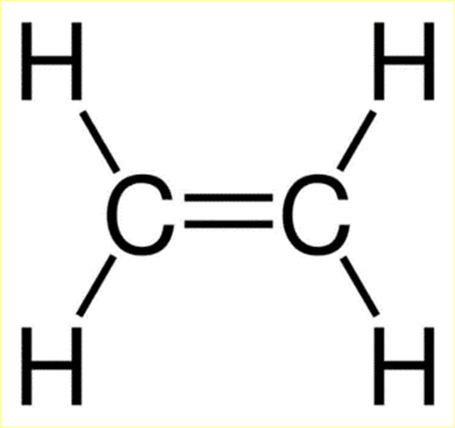
o Liên kết đơn hình thành từ một cặp electron dùng chung.
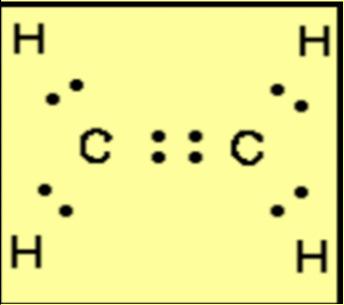
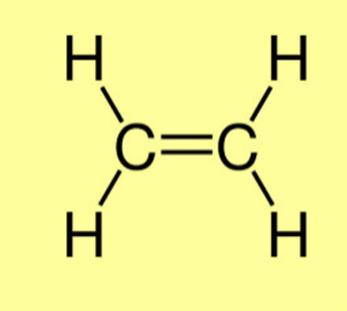
o Liên kết đôi hình thành từ hai cặp electron dùng chung.
o Liên kết ba hình thành từ ba cặp electron dùng chung.




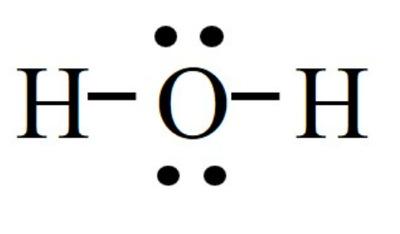
NĂNG LƯỢNG LIÊN KẾT
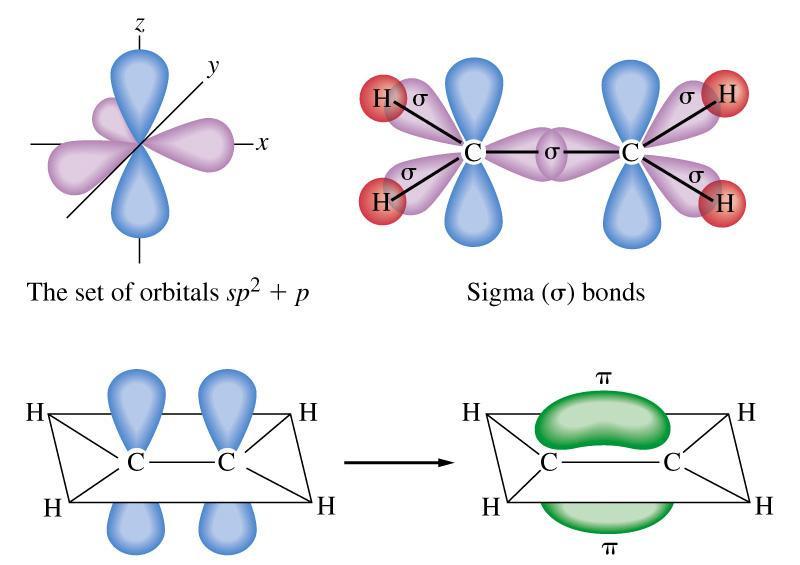
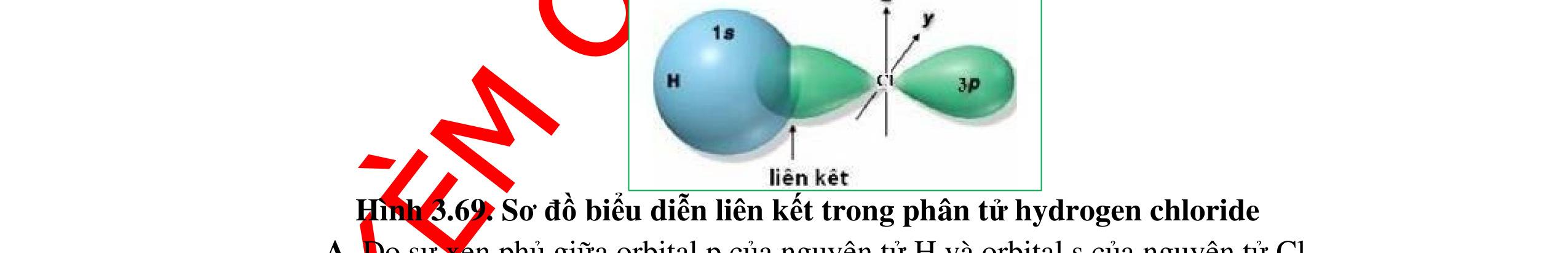
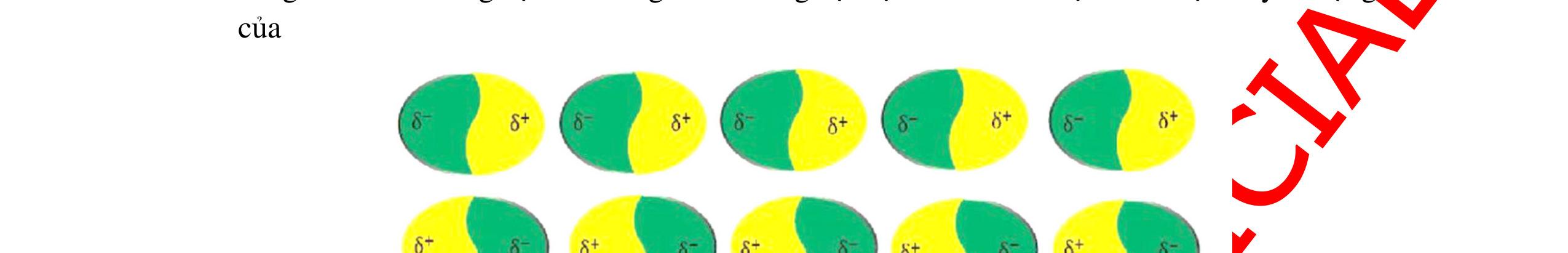
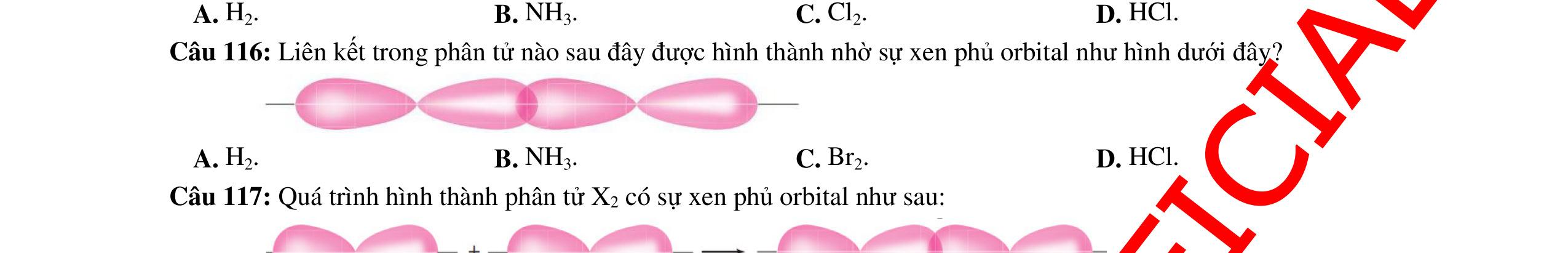
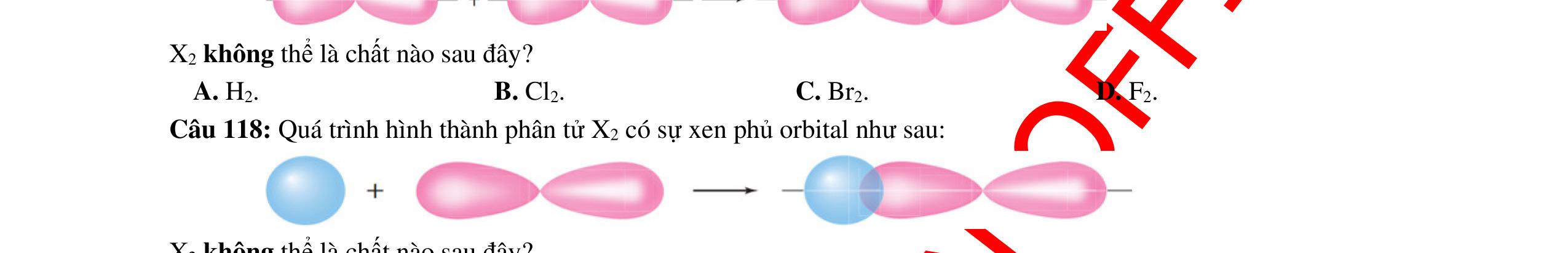
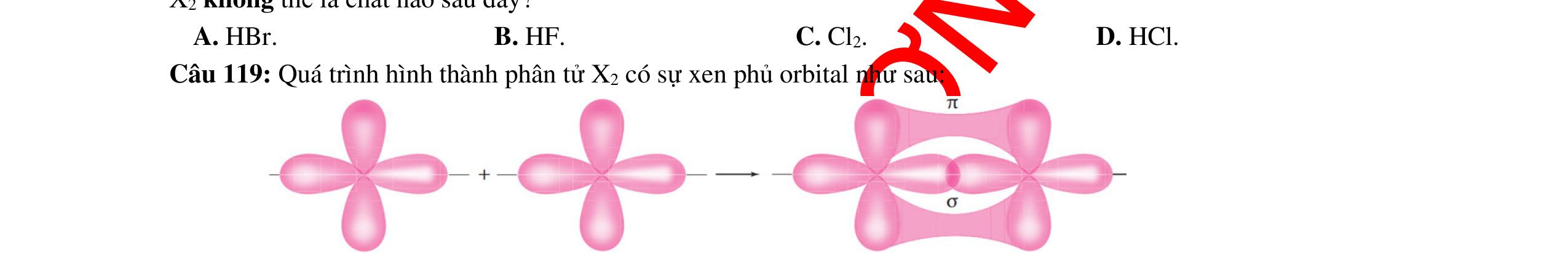
● Sự hình thành liên kết sigma và liên kết pi.

o Liên kết được tạo nên từ sự xen phủ trục của 2 AO gọi là liên kết sigma (δ)
Sự xen phủ trục của hai orbital s - s

Sự xen phủ trục của hai orbital s - p


Sự xen phủ trục của hai orbital p - p
o Liên kết được tạo nên từ sự xen phủ bên của 2 AO gọi là liên kết pi (π)
Sự xen phủ trục của các orbital p - p
● Năng lượng liên kết là năng lượng cần thiết để phá vỡ một liên kết xác định trong phân tử ở thể khí, tại 25oC và 1 bar.
● Năng lượng liên kết cho biết độ bền của liên kết. Năng lượng liên kết càng lớn, liên kết càng bền. .
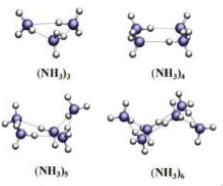
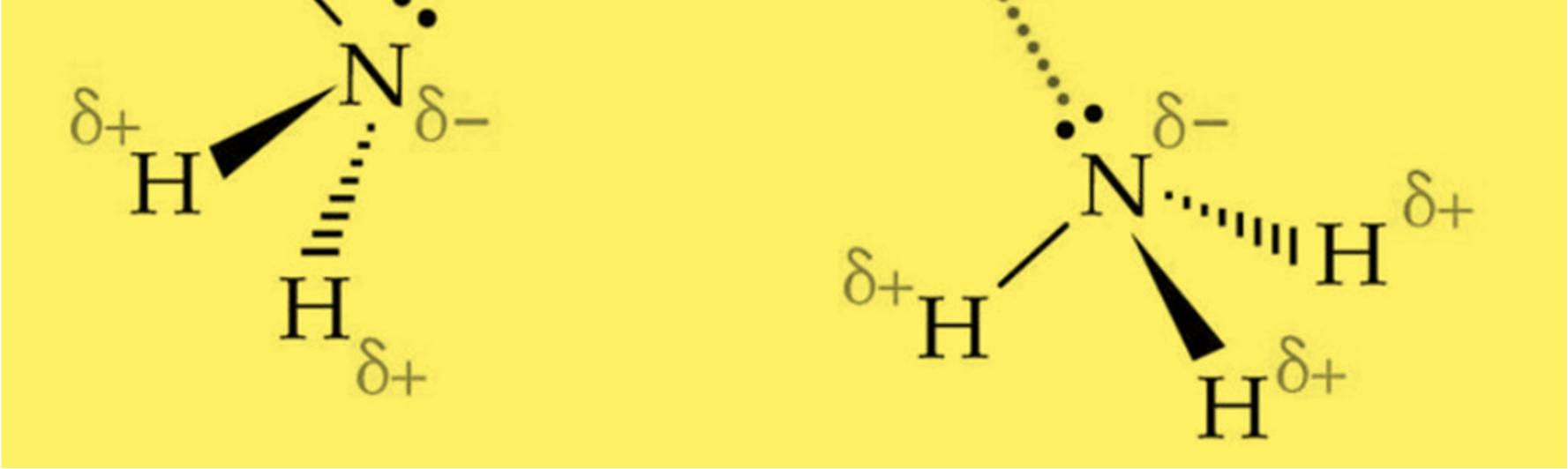
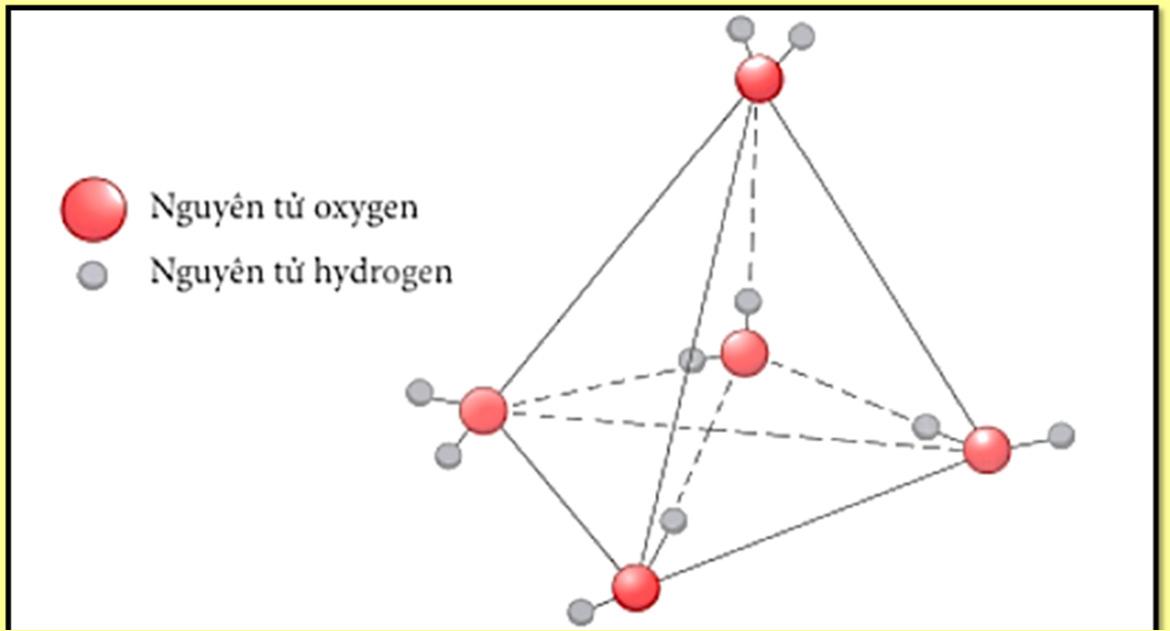
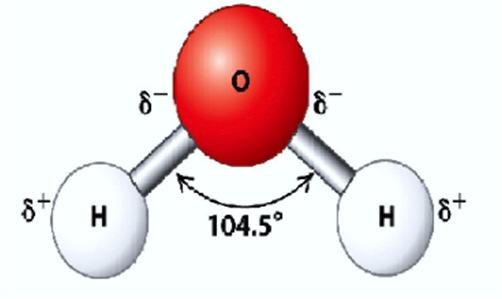
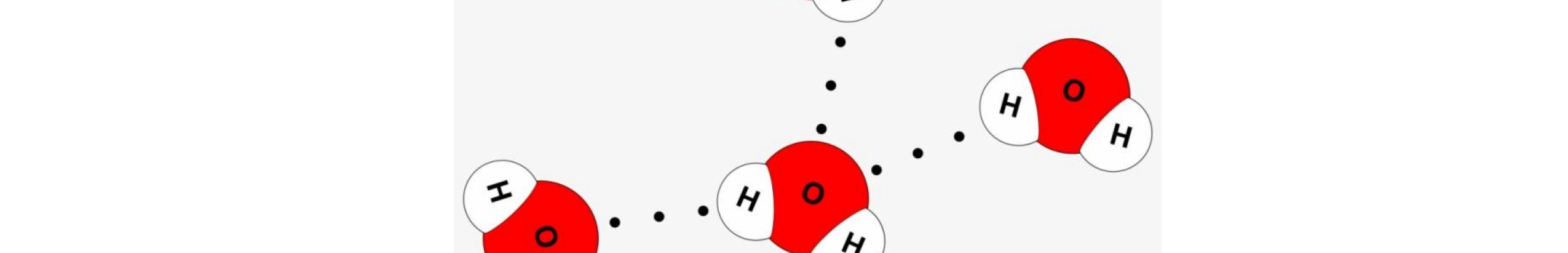
LIÊN KẾT HYDROGEN VÀ TƯƠNG TÁC VAN DER WAALS
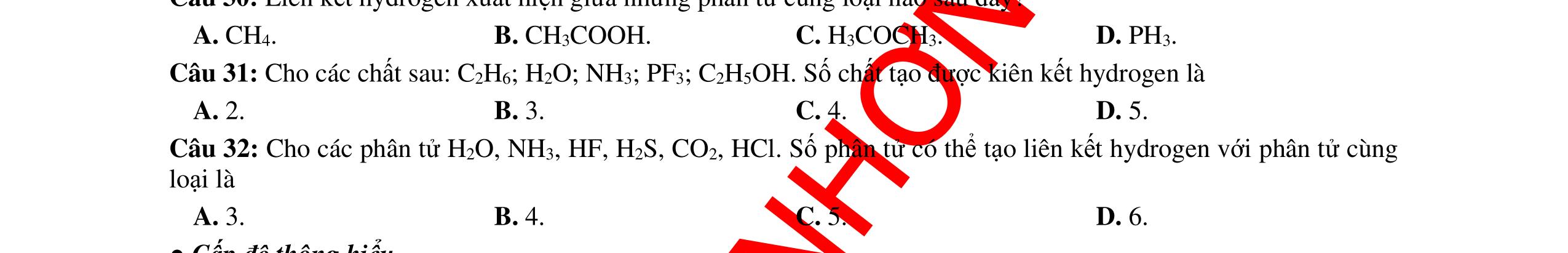
● Liên kết hydrogen là một loại liên kết yếu được hình thành giữa nguyên tử H (Đã liên kết với một nguyên tử khác có độ âm điện lớn) với một nguyên tử khác (có độ âm điện lớn) còn cặp electron riêng.
● Các nguyên tử có độ âm điện lớn thường gặp trong liên kết hydrogen là N, O, F.
● Liên kết hydrogen tăng nhiệt độ nóng chảy, nhiệt độ sôi của các chất.






Giải thích sự hình thành phân tử dựa trên quy tắc octet Bài 1: Các nguyên tử sau đây nhường hay nhận electron để đạt được cấu hình của khí hiếm gần nhất? a) Magnesium. b) Chlorine. Đáp án: a) Cấu hình electron rút gọn của Mg là [ ] 2 Ne3s. Nguyên tử Mg có thể đạt được cấu hình của khí hiếm Neon với 8 electron ở lớp vỏ hóa trị khi nhường 2 electron nằm ở phân lớp 3s. Quá trình nhường electron được biểu diễn như sau: Mg → 2 Mg2e. + + [ ] 2Ne3s [ ]Ne Sau khi nhường electron, nguyên tử Mg tạo thành ion có 12 proton trong hạt nhân (mang điện tích dương) và 10 electron (mang điện tích âm) ở lớp vỏ → trở thành ion dương (2+). b) Cấu hình electron rút gọn của Cl là [ ] 25 Ne3s3p. Nguyên tử Cl có thể đạt được cấu hình Ne bằng cách mất đi 7 electron hóa trị. Tuy nhiên, sẽ thuận lợi hơn rất nhiều về mặt năng lượng để đạt được cấu hình của nguyên tử argon (Ar) bằng cách thêm 1 electron vào lớp vỏ hóa trị. Electron này sẽ tạo lớp vỏ ngoài cùng với 8 electron bền vững và chuyển nguyên tử Cl thành một ion chloride mang điện âm. Quá trình nhận electron được biểu diễn như sau: Cl1e + → Cl. [ ] 25Ne3s3p [ ]Ar
(Trong ion Cl có 17 proton và 18 electron → ion Cl mang điện tích 1–). Bài 2: Cho mô hình nguyên tử của một số nguyên tố. Ion do mỗi nguyên tố đó tạo nên có cấu hình electron của các khi hiếm tương ứng nào?



✔ Nguyên tử sodium có 1 electron lớp ngoài cùng, dễ dàng nhường 1e tạo cấu hình của khí hiếm neon.
✔ Nguyên tử aluminium có 3 electron lớp ngoài cùng, dễ dàng nhường 3e tạo cấu hình của khí hiếm neon.
✔ Nguyên tử oxygen có 6 electron lớp ngoài cùng, dễ dàng nhận thêm 2e tạo cấu hình của khí hiếm neon.
Bài 3: Sử dụng bảng tuần hoàn và quy tắc octet để dự đoán số electron hóa trị nhường hay nhận của nguyên tử các nguyên tố sau đây trong quá trình hình thành liên kết ion. Viết sơ đồ biểu diễn quá trình nhường, nhận electron trong từng trường hợp.
a) Lithium.
b) Bất cứ nguyên tố M nào thuộc nhóm IIA.
c) Nguyên tố nằm ở ô số 15 trong bảng tuần hoàn. d) Carbon. Đáp án:
a) Lithium (Li), kim loại thuộc nhóm IA; do đó sẽ nhường 1 electron trên mỗi nguyên tử. Li → Li+ + 1e
b) Kim loại nhóm IIA sẽ mất đi 2 electron. M → M2+ + 2e
c) Nguyên tố số 15 là phosphorus (P), một phi kim nhóm VA. Do đó, nó sẽ nhận thêm 3 electron. Sơ đồ là P + 3e → P3-
d) Carbon (C) nằm nhóm IVA và là một phi kim. Do đó, nó sẽ nhận được 4 electron. Tuy nhiên, thường không có quá 3 electron tham gia vào quá trình hình thành liên kết ion, vì vậy có thể kết luận rằng carbon sẽ không phản ứng dễ dàng để tạo liên kết ion. Bài 4: Hãy dự đoán xu hướng nhường, nhận electron của mỗi nguyên tử trong từng cặp nguyên tử sau. Vẽ mô hình (hoặc viết số electron theo lớp) quá trình các nguyên tử nhường, nhận electron để tạo ion:
a) K (Z = 19) và F (Z = 9). b) Mg (Z = 12) và O (Z = 8) Hướng dẫn giải:
a) K (Z = 19): 1s22s22p63s23p64s1 => Có 1 electron ở lớp vỏ ngoài cùng => Xu hướng nhường 1 electron:

+ F (Z = 9): 1s22s22p5 => Có 7 electron ở lớp vỏ ngoài cùng => Xu hướng nhận 1 electron




b) Mg (Z = 12): 1s22s22p63s2 => Có 2 electron ở lớp vỏ ngoài cùng => Xu hướng nhường 2 electron - O (Z = 8): 1s22s22p4 => Có 6 electron ở lớp vỏ ngoài cùng => Xu hướng nhận 2

1 – b; 2 – e; 3 – a; 4 – d; 5 – g; 6 – f; 7 – c.
Bài 6: Methane là một hợp chất hóa học với công thức hóa học CH4. Methane là alkan đơn giản nhất, và là thành phần chính của khí tự nhiên. Methane là một trong những loại nguyên liệu quan trọng không thể thiếu trong quá trình sản xuất công nghiệp và sinh hoạt hàng ngày của con người. Dựa vào quy tắc octet, hãy đề xuất công thức cấu tạo của methane. (Cho ZC = 6; ZH = 1). Bài 7: Các quá trình nhường, nhận electron thường được biểu diễn với nguyên tử độc lập. Trong thực tế, các electron nhường đi bởi kim loại cũng chính là electron nhận vào của phi kim mà nó phản ứng. Các hợp chất hình thành như vậy gọi là hợp chất ion. Không nguyên tử nào có thể nhường electron khi không có nguyên tử khác nhận electron. Các công thức dùng để biểu diễn hợp chất ion đại diện cho tỉ lệ kết hợp của ion dương và ion âm trong hợp chất. Tỉ lệ này được xác định bởi điện tích trên các ion, được xác định bởi số lượng các electron nhường hoặc nhận. Viết phương trình biểu diễn sự hình thành ion của các cặp chất sau và công thức của hợp chất ion tạo thành trong mỗi trường hợp.
a) Na và Cl. b) Mg và F. Cho số hiệu nguyên tử của các nguyên tố Na, Cl, Mg và F lần lượt là 11, 17, 12, 9. Đáp án:
a) Sodium (Na) thuộc nhóm IA, ta có: Na → Na+ + 1e Chlorine (Cl) thuộc nhóm VIIA, ta có Cl + 1e → Cl Các ion tạo thành (Na+ và Cl ), sẽ kết hợp theo tỷ lệ 1:1 vì tổng điện tích dương và tổng điện tích âm trong công thức cuối cùng phải bằng không. => Công thức là NaCl. Quá trình chuyển electron thực tế để đạt octet có thể hình dung như sau: Na + Cl → Na+ Cl [Ne]3s1 [Ne]3s23p5 [Ne] [Ne]3s23p6
b) Magnesium (Mg) thuộc nhóm IIA sẽ nhường hai electron trên mỗi nguyên tử, trong khi fluorine (F) của nhóm VIIA sẽ nhận một electron trên mỗi nguyên tử. Mg → Mg2+ + 2e F + 1e → F Như vậy, cần có hai nguyên tử fluorine để nhận các electron từ một nguyên tử magnesium. Theo quan điểm khác, sẽ cần hai ion F để cân bằng điện tích của một ion Mg2+. Hợp chất tạo thành là MgF2. Bài 8: Sodium chloride (NaCl) là muối có nhiều ứng dụng trong các ngành công nghiệp như sản xuất cao su, trong khai thác dầu khí, trong dung dịch khoan giếng khoan, …). Bên cạnh đó, trong công nghiệp thực phẩm sodium chloride là thành phần chính có trong muối ăn và còn được sử dụng để bảo quản thực phẩm do có khả năng hút ẩm. Ước tính lượng sodium chloride tiêu thụ cho ngành công nghiệp mỗi năm lên đến khoảng 200 triệu tấn - chiếm hơn 80% sản lượng muối trên toàn thế giới. Vận dụng quy tắc octet, biểu diễn sự hình thành liên kết trong phân tử sodium chloride (NaCl) từ nguyên tử của các nguyên tố sodium và chloride.
Hình 3.1. Mô hình cấu trúc phân tử sodium chloride Đáp án: + Cấu hình electron của sodium: 11Na: [Ne]3s1 => Để được cấu hình bền của khí hiếm

Neon gần nó nhất nguyên tử Na có xu hướng nhường 1 electron ở lớp ngoài cùng. Na → Na+ + 1e
+ Cấu hình electron của chlorine: 17Cl: [Ne]3s23p5 => Để được cấu hình bền của khí hiếm

Argon gần nó nhất nguyên tử Chlorine có xu hướng nhận 1 electron. Cl + 1e→ Cl + Sơ đồ sự tạo thành phân tử sodium chloride Na+ + Cl → NaCl

Sơ đồ tạo thành phân tử sodium chloride
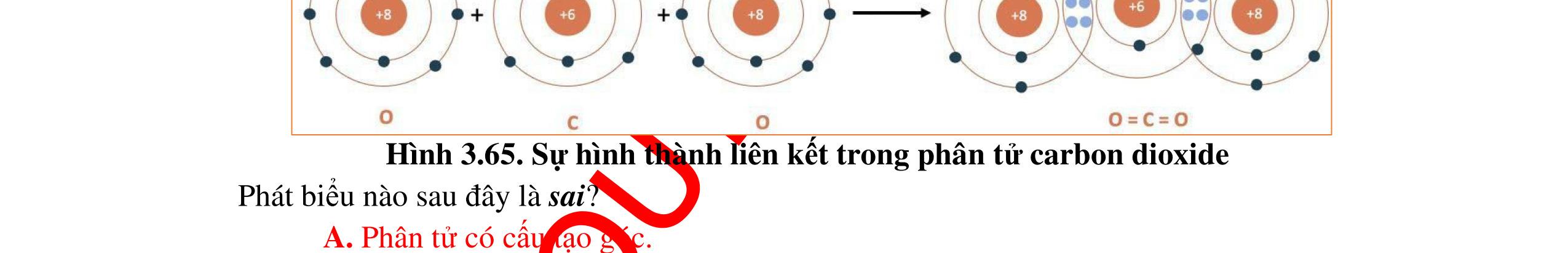
Bài 9: Vận dụng quy tắc octet để giải thích sự hình thành liên kết trong các phân tử: F2, H2, HF, CH4, NF3, KBr. (Cho số hiệu nguyên tử của F = 9 , H = 1, C = 6, N = 7, K = 19 và Br = 35). Đáp án: * Sự tạo thành phân tử F2 + 9F: 1s22s22p5 => Xu hướng của fluorine khi hình thành liên kết hoá học là nhận thêm 1 electron đạt cấu hình bền của khí hiếm. Khi hình thành liên kết trong phân tử F2 mỗi nguyên tử fluorine có xu hướng góp chung 1 electron để đạt cấu hình bền vững của khí hiếm Ne. Sơ đồ sự tạo thành phân tử F2
+ 1H: 1s1 => Khi hình thành liên kết trong phân tử H2 mỗi nguyên tử hydrogen có xu hướng góp chung 1 electron để đạt cấu hình bền của khí hiếm Helium.


Sơ đồ sự tạo thành phân tử H2
* Sự tạo thành phân tử HF
+ HF => Khi hình thành liên kết trong phân tử HF mỗi nguyên tử fluorine và hydrogen có xu hướng góp chung 1 electron để đạt cấu hình bền của khí hiếm Ne và He gần nó nhất.

Sơ đồ sự tạo thành phân tử HF
* Sự tạo thành phân tử CH4 + 6C: 1s22s22p2 + 1H: 1s1 => Khi hình thành liên kết trong phân tử CH4 mỗi nguyên tử carbon có xu hướng góp chung 4 electron để đạt cấu hình bền của khí hiếm Ne và mỗi nguyên tử hydrogen có xu hướng góp chung 1 electron để đạt cấu hình bền của khí hiếm He gần nó nhất.
=> Khi hình thành liên kết trong phân tử NF3 mỗi nguyên tử nitrogen có xu hướng góp chung 3 electron để đạt cấu hình bền của khí hiếm Ne và mỗi nguyên tử fluorine có xu hướng góp chung 1 electron để đạt cấu hình bền của khí hiếm Ne gần nó nhất.
Sơ đồ sự tạo thành phân tử NF3 *Phân tử KF
+ 19K: 1s22s22p63s23p64s1 => Xu hướng cơ bản của nguyên tử potassium khi hình thành liên kết hoá học là nhường đi 1 electron ở lớp ngoài cùng để đạt cấu hình bền vững của khí hiếm Argon.




+ 35Br: 1s22s22p63s23p63d104s24p5 => Xu hướng cơ bản của nguyên tử bromine khi hình thành liên kết hoá học là nhận vào 1 electron để đạt cấu hình bền vững của khí hiếm gần nó nhất. Sơ đồ sự tạo thành phân tử KBr Bài 10: Cho số hiệu nguyên tử của potassium, chlorine lần lượt là 19 và 17. Nguyên tử potassium, chlorine có xu hướng nhường hay nhận bao nhiêu electron để đạt được cấu hình bền vững của khí hiếm?

Sơ đồ sự tạo thành ion Cl-
Bài 11: Nêu tên và công thức hoá học của một chất ở thể rắn, một chất ở thể lỏng và một chất ở thể khí (trong điều kiện thường) trong đó nguyên tử oxygen đạt được cấu hình electron bền của khí hiếm Neon.


Đáp án:
+ Chất ở thể rắn chứa oxygen trong đó oxygen đạt cấu hình bền của khí hiếm Neon là Na2O. Đây là hợp chất ion, trong hợp chất này nguyên tử oxygen nhận 2 electron đạt cấu hình bền của khí hiếm Ne gần nó nhất.
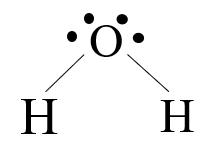
+ Chất ở thể lỏng chứa oxygen trong đó oxygen đạt cấu hình bền của khí hiếm Neon là H2O. Đây là hợp chất cộng hoá trị, trong hợp chất này nguyên tử oxygen góp chung 2 electron (đạt cấu hình bền của khí hiếm Ne gần nó nhất) cùng với 2 nguyên tử hydrogen tạo thành liên kết cộng hoá trị có cực trong đó đôi electron dùng chung lệch về phía nguyên tử oxygen.
+ Chất ở thể khí chứa oxygen trong đó oxygen đạt cấu hình bền của khí hiếm Neon là O2 Đây là hợp chất cộng hoá trị, trong hợp chất này mỗi nguyên tử oxygen góp chung 2 electron (đạt cấu hình bền của khí hiếm Ne gần nó nhất) tạo thành liên kết cộng hoá trị không phân cực trong đó đôi electron dùng chung nằm ở giữa hai nguyên tử oxygen. Bài 12: Sodium bromide (NaBr) là hợp chất được sử dụng trong nhiếp ảnh, tổng hợp hữu cơ, sản xuất các loại thuốc như: thuốc an thần, thuốc ngủ, thuốc chống co giật,… …. Trong phân tử sodium bromide, các nguyên sodium và bromine đã đạt được cấu hình electron nguyên tử của khí hiếm gần nhất, xác định các khí hiếm đó. (Cho số hiệu nguyên tử của một số khí hiếm: ZHe = 2; ZNe = 10; ZAr = 18; ZKr = 36). Mô hình cấu trúc mạng tinh thể sodium bromide Đáp án 11Na: [Ne]3s1 => Khi tham gia phản ứng hoá học xu hướng của Na là nhường 1 electron để đạt cấu hình bền vững của khí hiếm Ne.
+ 35Br: [Ar]3d104s24p5 => Khi tham gia phản ứng hoá học xu hướng của Br là nhận thêm 1 elctron để đạt cấu hình bền vững của khí hiếm Kr.
Bài 13: Potassium chloride là hóa chất được sử dụng làm phân bón. Cho số hiệu nguyên tử của potassium và chloride lần lượt là 19 và 17. Dựa trên quy tắc octet đề nghị công thức phân tử của potassium chloride. Đáp án:
+ Cấu hình electron của potassium: 19K: [Ar]4s1 => Để được cấu hình bền của khí hiếm

Ar gần nó nhất nguyên tử K có xu hướng nhường 1 electron ở lớp ngoài cùng.
+ Cấu hình electron của chloride: 17Cl: [Ne]3s23p5 => Để được cấu hình bền của khí hiếm

Ar gần nó nhất nguyên tử Cl có xu hướng nhận 1 electron.
+ Sơ đồ sự tạo thành phân tử potassium chloride:
Sơ đồ sự tạo thành phân tử potassium chloride
⇨ CTPT của potassium chloride: KCl
Bài 14: Khi hình thành liên kết H-H (H + H → H2) và ngược lại khi phá vỡ liên kết H2 → H + H thì hệ thu năng lượng hay giải phóng năng lượng ? Xét về mặt năng lượng thì phân tử H2 có năng lượng lớn hơn hay nhỏ hơn hệ hai nguyên tử hydrogen riêng rẽ ? Trong hai hệ đó thì hệ nào bền hơn ?
Sơ đồ sự tạo thành phân tử hydrogen Đáp án:
- Khi hình thành liên kết H + H → H2 hệ giải phóng ra năng lượng và ngược lại khi phá vỡ liên kết H2 → H + H thì thu thêm năng lượng. - Xét về mặt năng lượng thì phân tử H2 có năng lượng lớn hơn hệ hai nguyên tử H riêng rẽ nhưng nhỏ hơn tổng năng lượng của hai hệ này do đó trong hai hệ đó thì hệ H2 bền hơn hệ 2H. Bài 15: Hai hợp chất A và B đều được tạo nên từ hai nguyên tố nitrogen và hydrogen.
Biết:
● Trong hợp chất A chứa 1 nguyên tử nitrogen và x nguyên tử hydrogen.
● Trong B chứa 2 nguyên tử nitrogen và y nguyên tử hydrogen. Giá trị x và y lớn nhất có thể là bao nhiêu? (Cho số hiệu nguyên tử của nitrogen và hydrogen lần lượt là: 7N và 1H; các hợp chất tạo ra đều thỏa mãn quy tắc bát tử).
Đáp án:
+ Cấu hình electron của nguyên tử nitrogen: 7N: 1s22s22p3 => Mỗi nguyên tử nitrogen còn thiếu 3 electron để đạt cấu hình bền vững của khí hiếm gần nó nhất.
+ Cấu hình electron của nguyên tử hydrogen: 1H: 1s1 => Mỗi nguyên tử hydrogen còn thiếu 1 electron để đạt cấu hình bền vững của khí hiếm gần nó nhất.


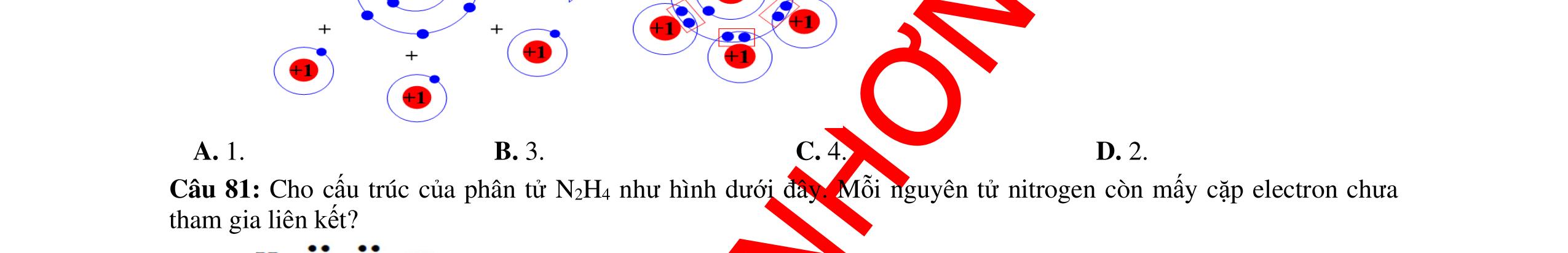
⇨ Trong phân tử NHx và N2Hy các nguyên tử nitrogen và hydrogen có xu hướng góp chung electron để đạt cấu hình electron bền vững của khí hiếm gần nó nhất.
⇨ x = 3; y = 4
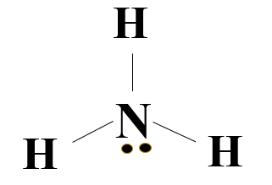
+ Phân tử ammonia: NH3.
+ Phân tử hydrazin: N2H4. Bài 16: Phosphine là hợp chất hóa học giữa phosphorus với hydrogen, có công thức hóa học là PH3. Đây là chất khí có khả năng tự bốc cháy trong không khí ở nhiệt độ thường và tạo thành khối phát sáng bay lơ lửng (hiện tượng "ma trơi"). Giải thích sự tạo thành liên kết hóa học trong phosphine và biễu diễn phân tử phosphine theo quy tắc Octet (Cho: ZP = 15, ZH = 1).
Hiện tượng “ma trơi” Đáp án: + 1H: 1s1 +15P: 1s22s22p63s23p3 => Khi tham gia hình thành liên kết hoá học trong phân tử phosphine (PH3), mỗi nguyên tử hydrogen góp chung 1 electron, mỗi nguyên tử phosphorus góp chung 3 electron đạt cấu hình bền của khí hiếm gần nó nhất. Phân tử phosphine theo quy tắc Octet
Bài 17: Trong khi xem lại các ghi chú của mình, Lan nhận thấy rằng cô ấy đã vẽ cấu trúc (công thức Lewis) của acetaldehyde (C2H4O) trong sổ tay của mình như hình bên. Theo em công thức Lewis của acetaldehyde mà Lan đề nghị theo quy tắc octet có chính xác hay không? Giải thích? Nếu sai hãy đề nghị công thức Lewis mới mà các nguyên tử thoả mãn quy tắc octet. Biết rằng mỗi gạch (–) trong các công thức biểu diễn hai electron hoá trị chung.
O H
: :
H H
Cấu trúc do Lan đề xuất có hai sai sót: Nguyên tử hydrogen với liên kết đôi có bốn electron hóa trị (khi hình thành liên kết hoá học, H chỉ có thể chứa tối đa 2 electron ở lớp vỏ).
H
H
O
H
: : Nguyên tử carbon thứ 2 liên kết với oxygen chỉ có 6 electron hóa trị (nó phải có 8 electron hoá trị theo quy tắc octet). Cấu trúc Lewis được chấp nhận như hình bên. Bài 18: Cho cấu trúc Lewis của một số hợp chất sau:
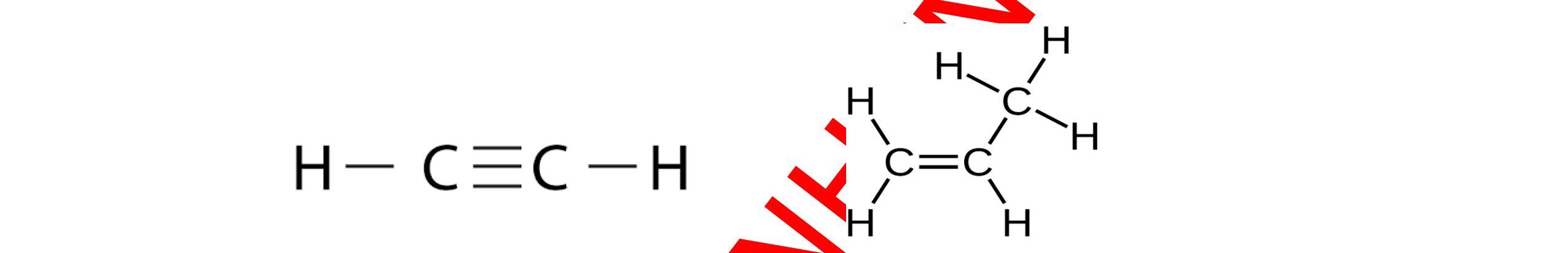
HCCH
(a) (b) (c) (d) (e) Những nguyên tử nào trong các phân tử trên thoả mãn quy tắc octet? Biết rằng mỗi gạch (–) trong các công thức biểu diễn hai electron hoá trị chung. Hướng dẫn giải:
(a) Trong phân tử BF3 với công thức được đề nghị, nguyên tử fluorine thoả mãn quy tắc octet, nguyên tử boron còn thiếu 2 electron nữa mới đạt quy tắc octet.
(b) Trong phân tử P2O5, 5 nguyên tử oxygen thoả mãn quy tắc octet, 2 nguyên tử phosphorus thuộc chu kì 3, mỗi nguyên tử có 10 electron xung quanh không thoả mãn quy tắc octet.




(c) Trong các phân tử C2H2 các nguyên tử carbon và hydrogen đều thoả mãn quy tắc octet.
(d) Trong phân tử HNO2 tất cả các nguyên tử oxygen, nitrogen và hydrogen đều thoả mãn quy tắc octet lớp ngoài cùng có 8 electron với O và N, 2 electron với H.
(e) Trong phân tử CH3Br, tất cả các nguyên tử C, H và Br đều thoả mãn quy tắc octet lớp ngoài cùng có 8 electron với C và Br, 2 electron với H. Bài 19: Methane là một hợp chất hóa học với công thức hóa học CH4. Methane là alkan đơn giản nhất, và là thành phần chính của khí tự nhiên. Methane là một trong những loại nguyên liệu quan trọng không thể thiếu trong quá trình sản xuất công nghiệp và sinh hoạt hàng ngày của con người. Dựa vào quy tắc octet, hãy đề xuất công thức cấu tạo của methane. (Cho ZC = 6; ZH = 1).
ướng dẫn giải:
6C: [He]2s22p2
1H: 1s1
Trong phân tử CH4, khi tham gia hình thành liên kết hoá học, mỗi nguyên tử H góp chung 1 electron, nguyên tử C góp chung 4 electron để đạt quy tắc octet.
Công thức cấu tạo của CH4:

Dạng 1: Sự hình thành cation và anion Bài 1: Có ít nhất 14 nguyên tố được coi là “nguyên tố vi lượng thiết yếu” cho cơ thể người. Cụm từ “vi lượng thiết yếu” cho thấy các nguyên tố này được đưa vào cơ thể với lượng rất nhỏ nhưng lại không thể thiếu. Hai trong số các nguyên tố vi lượng thiết yếu này là chromium và zinc. Mô hình cấu tạo nguyên tử của hai nguyên tố này được cho ở hình 3.7. Viết cấu hình electron nguyên tử của Cr, Cr3+, Zn, Zn2+ . Hình 3.7.a. Mô hình nguyên tử chromium Hình 3.7.b. Mô hình nguyên tử zinc Hình 3.7. Mô hình nguyên tử của chromium và zinc.


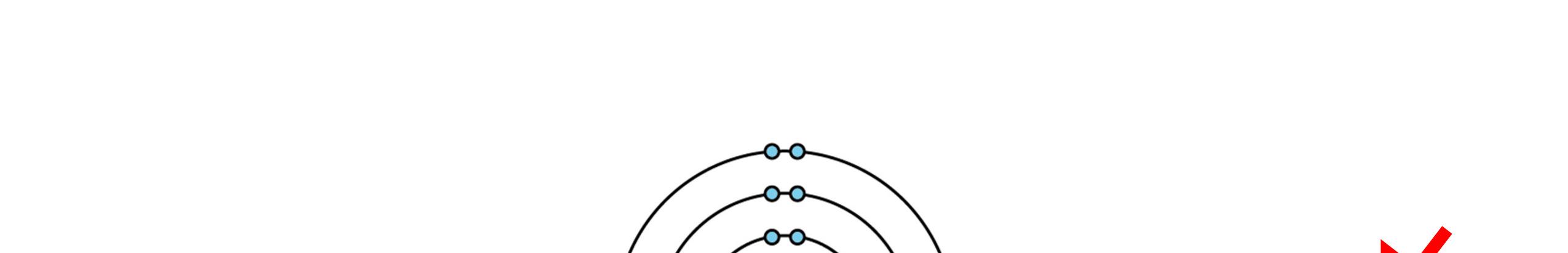
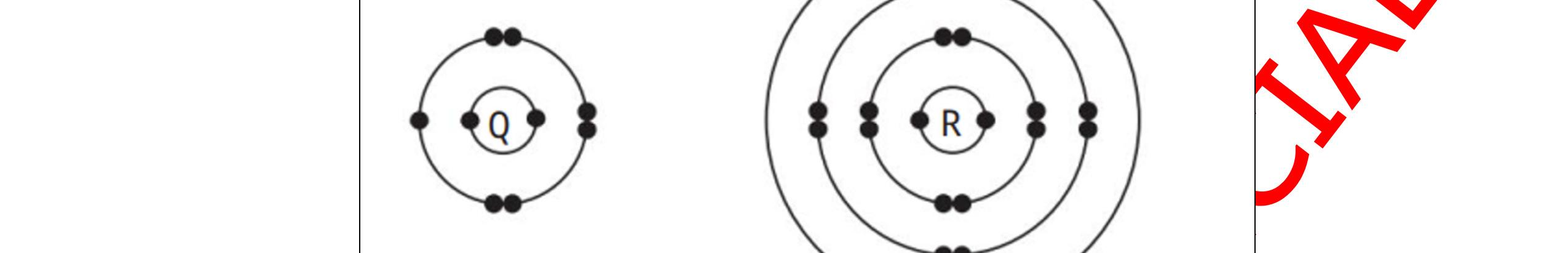
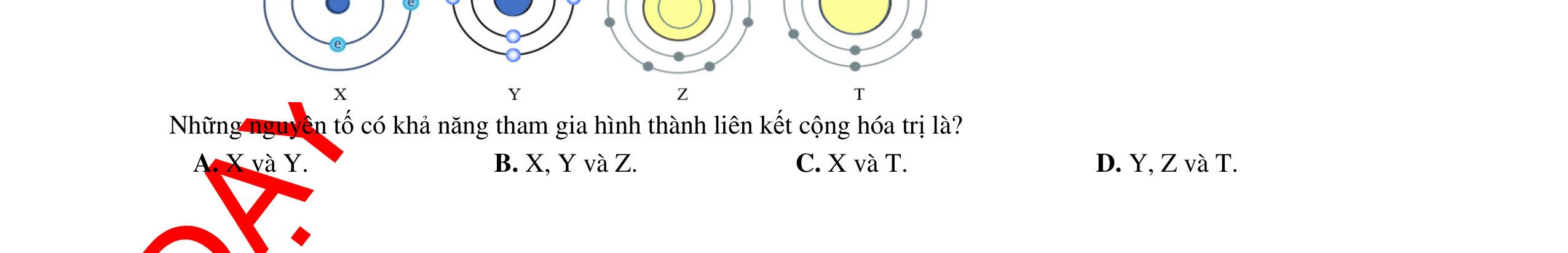
Bài 3: Cho mô hình nguyên tử của một số nguyên tố:
Hình 3.8.a. Mô hình nguyên tử magnesium


Hình 3.8.b. Mô hình nguyên tử sulfur



Hình 3.8.c. Mô hình nguyên tử bromine

Hình 3.8.d. Mô hình nguyên tử nitrogen
Hình 3.8.e. Mô hình nguyên tử hydrogen
Hình 3.8.f. Mô hình nguyên tử oxygen Hình 3.8. Mô hình nguyên tử của một số nguyên tố Dựa vào mô hình cấu tạo nguyên tử ở hình 3.8, hoàn thành thông tin trong bảng sau.
Hình 3.9. Nguyên tố magnesium
Đáp án:
+ Cấu hình electron nguyên tử Mg: [Ne]3s2 .
+ Cấu hình ion magnesium: Mg2+: [Ne]. Sơ đồ tạo cation: Mg → Mg2+ + 2e

Bài 5: Cho các ion sau: 17Cl ; 20Ca2+; 8O2-; 13Al3+; 3Li+; 9F . Viết cấu hình electron của mỗi ion trên. Cấu hình đã viết của mỗi ion giống với cấu hình electron của nguyên tử nào? (Cho số hiệu nguyên tử của một số khí hiếm ZHe = 2; ZNe = 10; ZAr = 18).
Đáp án: + 3Li: [He]2s1 => 3Li+: [He]. + 9F: [He]2s22p5 => 9F : [Ne]. + 13Al: [Ne]3s23p1 => 13Al3+: [Ne]. + 20Ca: [Ar]4s2 => 20Ca2+: [Ar]. + 17Cl: [Ne]3s23p5 => 17Cl : [Ar]. + 8O: [He]2s22p4 => : 8O2-: [Ne]. Bài 6: Hoàn thành thông tin của bảng sau: Kí hiệu Na+ Cl Proton 11 13 15 17 Neutron 12 16 Electron 10 18
Hình 3.10. Mô hình cấu tạo nguyên tử của Magnesium và Chlorine Mô tả cách các nguyên tử magnesium và nguyên tử chlorine tạo thành ion.
Đáp án: Nguyên tử magnesium nhường 2e tạo cation magnesium, nguyên tử chlorine nhận 1 e tạo anion cloride.
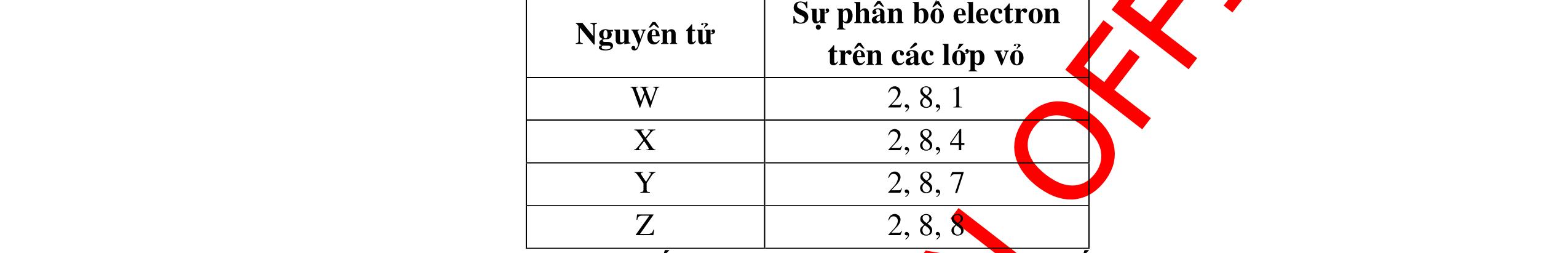
Mg→ Mg2+ + 2e Cl + 1e → ClMg2+ + 2Cl- → MgCl2 Bài 2: Cho X, Y, Z, T là những nguyên tố có số hiệu nguyên tử lần lượt là 8, 11, 20, 17. a. Viết cấu hình electron nguyên tử các nguyên tố X, Y, Z, T.
b. Viết công thức hợp chất tạo thành và xác định liên kết hóa học giữa các cặp chất:
● X và Y
● X và Z
● Y và T
● Z và T.
Đáp án:
a. 8X: 1s22s22p4 .

11Y: 1s22s22p63s1
20Z: 1s22s22p63s23p64s2 .
17T: 1s22s22p63s23p5 b.
+ Giữa X và Y tạo thành hợp chất ion có CTPT: Y2X.
+ Giữa X và Z tạo thành hợp chất ion có CTPT: ZX.
+ Giữa Y và T tạo thành hợp chất ion có CTPT: YT.
+ Giữa Z và T tạo thành hợp chất ion có CTPT: ZT2.
Bài 3: Hình dưới đây biểu diễn quá trình tạo thành liên kết ion trong phân tử sodium chloride. Hãy viết các bước để minh họa cho hình ảnh em quan sát được.
Hình 3.11. Quá trình tạo thành liên kết ion trong phân tử sodium chloride Đáp án: Na → Na+ + 1e Cl + 1e →Cl Na+ + Cl- → NaCl
Bài 4: Cho các hợp chất sau: K2O, H2O, H2S, SO2, NaCl, K2S, CaF2, HCl. Hợp chất nào trong phân tử có có chứa liên kết ion? Giải thích? Đáp án: K2O, NaCl, K2S, CaF2. Hợp chất ion thường tạo bởi kim loại điển hình và phi kim điển hình. Bài 5: Điền từ thích hợp vào chỗ trống: Sodium thuộc nhóm IA, bromine thuộc nhóm VIIA, hợp chất của hai nguyên tố này là hợp chất …(1)… Ở điều kiện thường, hợp chất này tồn tại ở thể …(2)… với cấu trúc …(3)… tạo nên bởi các …(4)… và …(5)… Ở trạng thái …(6)… hoặc trong dung dịch các ion bị tách khỏi mạng lưới tinh thể, có thể chuyển động …(7)… nên chúng dẫn điện tốt. Hướng dẫn giải:

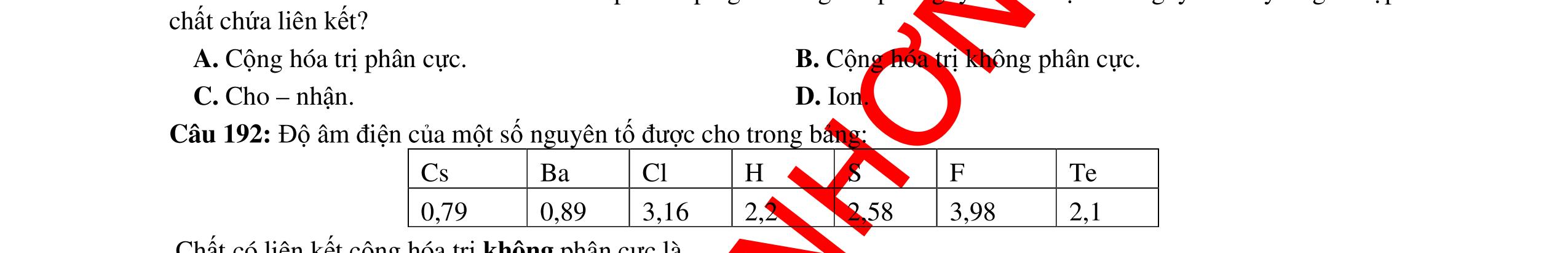
Dựa vào đặc điểm và tính chất của các hợp chất ion có thể hoàn thành các thông tin còn thiếu nhau sau: Sodium thuộc nhóm IA, bromine thuộc nhóm VIIA, hợp chất của hai nguyên tố này là hợp chất (1) ion. Ở điều kiện thường, hợp chất này tồn tại ở thể (2) rắn với cấu trúc (3) tinh thể tạo nên bởi các (4) ion dương/ion âm và (5) ion âm/ion dương. Ở trạng thái (6) nóng chảy hoặc trong dung dịch các ion bị tách khỏi mạng lưới tinh thể, có thể chuyển động (7) tự do nên chúng dẫn điện tốt.
Bài 6: Phân loại các hợp chất ion dưới đây vào các nhóm sau: hợp chất tạo nên bởi các ion đơn nguyên tử, hợp chất tạo nên bởi các ion đa nguyên tử và hợp chất tạo nên bởi các ion đơn nguyên tử và đa nguyên tử: NaCl, NH4NO3, Ca3(PO4)2, NH4H2PO4, K2Cr2O7, CH3COONa, CuSO4, BaBr2, AlCl3 Hướng dẫn giải:
+) Ion đơn nguyên tử là những ion tạo thành từ một nguyên tử: Na+, Ca2+, K+, Cu2+, Ba2+ , Al3+, Cl .
+) Ion đa nguyên tử: Tạo thành từ hai hay nhiều nguyên tử: NH4 +, NO3 , PO4 3-, H2PO4 , Cr2O7 2-, CH3COO , SO4 2-
+) Những phân tử tạo thành từ các ion đơn nguyên tử: NaCl, BaBr2, AlCl3.
+) Những phân tử tạo thành từ các ion đơn nguyên tử và ion đa nguyên tử: Ca3(PO4)2, K2Cr2O7, CH3COONa, CuSO4
+) Những phân tử tạo thành từ các ion đa nguyên tử: NH4NO3, NH4H2PO4.
Bài 7: Cho các hợp chất ion sau đây: KCl, NH4NO3, CuSO4, Na2CO3, Ca(OH)2, K3PO4, FeCl3, Al2(SO4)3
a) Xác định các ion cấu thành các hợp chất trên.
b) Chỉ ra các ion đơn nguyên tử và ion đa nguyên tử. Hướng dẫn giải:
a) Các ion cấu thành các hợp chất: KCl: Tạo thành từ K+ và Cl ; NH4NO3: Tạo thành từ NH4 + và NO3 ; CuSO4: Cu2+ và SO4 2-; Na2CO3: Na+ và CO3 2-; Ca(OH)2: Ca2+ và OH ; K3PO4: K+ và PO4 3-; FeCl3: Fe3+ và Cl ; Al2(SO4)3: Al3+ và SO4 2-
b) Các ion đơn nguyên tử và đa nguyên tử:
+) Ion đơn nguyên tử: K+, Cl , Cu2+, Na+, Ca2+, K+, Fe3+, Al3+ . +) Ion đ
+) Viết cấu hình electron của nguyên tử các nguyên tố, căn cứ vào số electron hoá trị từ đó suy ra xu hướng nhường hoặc nhận electron của nguyên tử các nguyên tố.
+) 11Na: [Ne]3s1 => Nguyên tử Na có thể nhường 1 electron để đạt cấu hình bền của khí hiếm và mang điện tích 1+ => a – 1.
+) 17Cl: [Ne]3s23p5 => Nguyên tử Cl có thể nhận 1 electron để đạt cấu hình bền của khí hiếm và mang điện tích 1- => b – 4.
+) 20Ca: [Ar]4s2 => Nguyên tử Ca có thể nhường 2 electron để đạt cấu hình bền của khí hiếm và mang điện tích 2+ => c – 2.
+) 8O: [He]2s22p4 => Nguyên tử O có thể nhận 2 electron để đạt cấu hình bền của khí hiếm và mang điện tích 2- => d – 5.
+) 13Al: [Ne]3s23p1 => Nguyên tử Al có thể nhường 3 electron để đạt cấu hình bền của khí hiếm và mang điện tích 3+ => e – 3.
+) 7N: [He]: 2s22p3 => Nguyên tử N có thể nhận 3 electron để đạt cấu hình bền của khí hiếm và mang điện tích 3- => f – 6.
Bài 9: Cho biết nguyên tử của một nguyên tố X có tổng số electron thuộc phân lớp s là 5, điện tích hạt nhân của nguyên tử nguyên tố Y là +14,418.10-19C.
a) Xác định X và Y. b) Liên kết giữa X và Y thuộc loại liên kết gì? Hướng dẫn giải: a) X có tổng số electron thuộc phân lớp s là 5 => Cấu hình electron nguyên tử của X là: 1s22s22p63s1
⇨ X thuộc nhóm IA của bảng tuần hoàn, là kim loại điển hình, X là sodium (Na). Y có điện tích hạt nhân là +14,418.10-19C => Số hạt proton trong hạt nhân của Y là: (+14,418.10-19) : (+1,602.10-19-) = 9 => Cấu hình electron nguyên tử của Y: 1s22s22p5
⇨ Y thuộc nhóm VIIA của bảng tuần hoàn, là phi kim điển hình, Y là fluorine (F).
b) Liên kết giữa X và Y thuộc loại liên kết ion.
Bài 10: Sắp xếp theo chiều tăng dần bán kính của các ion? Hãy giải thích. N3-, O2-, F , Na+, Mg2+, Al3+
Biết số hiệu nguyên tử của N, O, F, Na, Mg, Al lần lượt là 7, 8, 9, 11, 12, 13. Hướng dẫn giải: 6 ion trên đều có cùng số electron ở lớp vỏ, chúng có số hạt proton ở hạt nhân khác nhau dẫn tới điện tích hạt nhân khác nhau. Ion nào có điện tích hạt nhân càng lớn thì hút electron càng mạnh => Lớp vỏ càng co vào gần hạt nhân => Bán kinh ion càng nhỏ ⇨ Thứ tự theo chiều tăng dần bán kính của các ion trên là: Al3+ < Mg2+ < Na+ < F < O2- < N3Bài 11: Nguyên tố A là nguyên tố phổ biến thứ ba, và là kim loại phổ biến nhất trong vỏ Trái Đất. A chiếm khoảng 17% khối lớp rắn của Trái Đất. Nguyên tố B là là nguyên tố phổ biến nhất theo khối lượng trong vỏ Trái Đất. B liên tục được bổ sung trong bầu khí quyển của Trái đất bằng quá trình quang hợp. Nguyên tử A chỉ có 7 electron trên phân lớp p, còn nguyên tử B chỉ có 4 electron trên phân lớp p. a) Viết công thức hoá học của hợp chất tạo bởi A và B.
b) Hợp chất tạo bởi A và B có tính dẫn điện không? Tại sao?
c) Nêu một vài ứng dụng của hợp chất tạo bởi A và B trong thực tế cuộc sống?
Hướng dẫn giải:
a) Nguyên tử A chỉ có 7 electron trên phân lớp p => Cấu hình electron nguyên tử của A là: 1s22s22p63s23p1
Nguyên tử B chỉ có 4 electron trên phân lớp p => Cấu hình electron nguyên tử của B là: 1s22s22p4
⇨ Công thức hoá học của hợp chất tạo bởi A và B là: Al2O3
b) Hợp chất tạo bởi A và B dẫn điện ở trạng thái nóng chảy vì nó là hợp chất ion. c) Trong thực tế Al2O3 là thành phần chính của quặng boxit được sử dụng phổ biến để sản xuất nhôm trong công nghiệp, tạo gốm sứ alumina, là chất che phủ các bề mặt ma sát trên cơ thể.
Bài 12: Cho các ion sau: Na+, Mg2+, Al3+, O2-, F , N3-. Viết phương trình biểu diễn sự hình thành các ion trên. Hướng dẫn giải: +) Na → Na+ + 1e +) O + 2e → O2+) Mg → Mg2+ + 2e +) F + 1e → F +) Al → Al3+ + 3e +) N + 3e → N3-
Bài 13: Cho các ion sau: 35Br , 20Ca2+ , 16S2, 19K+ , 7N3, 13Al3+ . a) Viết cấu hình electron của mỗi ion. b) Mỗi cấu hình đã viết giống với cấu hình electron của nguyên tử nào?
Hướng dẫn giải: a) +) 35Br : 1s22s22p63s23p63d104s24p6 +) 20Ca2+: 1s22s22p63s23p6 +) 16S2-: 1s22s22p63s23p6 +) 7N3-: 1s22s22p6 +) 13Al3+: 1s22s22p6 +) 19K+: 1s22s22p63s23p6 b) Các ion 20Ca2+ , 16S2, 19K+ có cấu hình electron giống với cấu hình electron của nguyên tử Ar.
Các ion 7N3, 13Al3+ có cấu hình electron giống với cấu hình electron của nguyên tử Ne.
Ion 35Br có cấu hình electron giống với cấu hình electron của nguyên tử Kr.
Bài 14: Cation X+ do 5 nguyên tử của 2 nguyên tố hóa học tạo nên. Tổng số proton trong X+ là 11.
1) Xác định công thức và gọi tên cation X+ .
2) Viết công thức electron của ion X+. Cho biết cấu trúc hình học của ion này?
Hướng dẫn giải:
1) Số proton trung bình của một hạt nhân nguyên tử trong X+ là = 2,2. Vậy một nguyên tố trong X+ có điện tích hạt nhân nhỏ hơn 2,2, nguyên tố đó là H (Z = 1). Ta loại trường hợp He (Z = 2) vì He là khí hiếm không tạo được hợp chất. Vậy công thức ion X+ có dạng: [A5-nHn]+. Trong đó : (5-n).ZA + n = 11. Ta lập bảng sau: n 1 2 3 4
ZA (A) 2,5 (loại) 3 (Li) 4 (Be) 7 (N)
Ta loại các trường hợp A là Li, Be vì các ion X+ tương ứng không tồn tại. Trường hợp A là nitơ thỏa mãn vì ion amoni tồn tại. Vậy X+ là ion NH4 + .
2) Công thức electron của ion NH4 + như sau: Công thức electron Công thức cấu tạo




Bài 15: Vì sao ở điều kiện thường các hợp chất ion thường tồn tại ở thể rắn, cứng nhưng lại giòn và dễ vỡ?
Hình 3.12. Cấu trúc mạng tinh thể sodium chloride Đáp án: Trong tinh thể ion, giữa các ion có cấu trúc tinh thể và lực hút tĩnh điện rất mạnh nên các hợp chất ion thường là chất rắn, và giòn, khó nóng chảy, khó bay hơi ở điều kiện thường. Tuy nhiên chúng lại giòn, các hợp chất ion thường vỡ ra dưới áp suất vì khi tác dụng lực lên tinh thể ion, cứ một ion bị khẽ di chuyển sẽ kéo theo toàn bộ sự sắp xếp sẽ bị xáo trộn do các ion trái dấu sẽ tự đẩ
Hình 3.13. Bổ sung chế độ dinh dưỡng giàu nguyên tố X hạn chế đột quỵ. ● Nguyên tố Z được dùng để chế tạo dược phẩm, phẩm nhuộm và là chất nhạy cảm với ánh sáng. Nguyên tử nguyên tố Z có 17 electron trên các phân lớp p. Đáp án:
+ Do X chứa 7 electron trên phân lớp s => Cấu hình electron nguyên tử của X: 1s22s22p63s23p64s1 X là potassium=> Để được cấu hình bền của khí hiếm nguyên tử X có xu hướng nhường 1 electron ở lớp ngoài cùng.
+ Do Z chứa 17 electron ở phân lớp p => Cấu hình electron của Z: 1s22s22p63s23p63d104s24p5 Z là Bromine => Để được cấu hình bền của khí hiếm Ar nguyên tử Z có xu hướng nhận 1 electron.
Sự hình thành liên kết trong phân tử XZ. Sự tạo thành ion: K → K+ + 1e Cl + 1e → Cl Sự tạo thành liên kết: K+ + Cl → KCl.
Bài 17: Anion X có cấu hình electron ở phân lớp ngoài cùng là 4p6. Viết cấu hình electron của nguyên tử nguyên tố X. Viết quá trình hình thành liên kết và giải thích bản chất liên kết hoá học giữa X và barium. (Cho ZBa = 56). Đáp án:

+ Do X có cấu hình electron phân lớp ngoài cùng là 4p6 => Cấu hình electron đầy đủ của X là: [Ar]3d104s24p5. (X là Bromine).
+ X là một phi kim điển hình do lớp ngoài cùng của X có 7 electron => Xu hướng của X khi tham gia hình thành liên kết hoá học là nhận thêm 1 electron đạt cấu hình bền của khí hiếm.
+ 56Ba: [Xe]6s2 => Xu hướng của Barium khi tham gia hình thành liên kết hoá học là nhường 2 electron đạt cấu hình bền của khí hiếm.
+ CTPT của hợp của hợp chất tạo từ X và Ba là BaX2 và liên kết giữa Ba và X trong BaX2 có tính chất ion.
+ Quá trình hình thành liên kết giữa X và Barium.
Sự tạo thành ion: Ba →Ba2+ + 2e Br + 1e → Br
Sự tạo thành liên kết: Ba2+ + 2Br → BaBr2
Bài 18: Viết cấu hình electron của Cl (Z = 17) và Ca (Z=20). Cho biết vị trí của Ca và Cl (chu kì, nhóm) trong bảng tuần hoàn. Liên kết giữa calcium và chlorine trong hợp chất thuộc loại liên kết gì? Vì sao? Viết sơ đồ hình thành liên kết đó.
Đáp án: Cl (Z = 17) : 1s22s22p63s23p5
Ca (Z = 20): 1s22s22p63s23p64s2
Chlorine nằm ở ô số 17, chu kỳ 3, nhóm VIIA.
Calcium nằm ở ô số 20, chu kỳ 4, nhóm IIA.
Liên kết trong hợp chất CaCl2 là liên kết ion vì Ca là kim loại điển hình, Cl là phi kim điển hình.
Sơ đồ hình thành liên kết: Cl + 1e → Cl
Ca → Ca2+ + 2e
Các ion Ca2+và Cl- tạo thành mang điện tích trái dấu, hút nhau bằng lực hút tĩnh điện, tạo thành hợp chất CaCl2: Ca2+ + 2Cl → CaCl2
Bài 19: Viết công thức hóa học của hợp chất ion do mỗi cặp ion tạo thành: a) Na+ và O2. b) K+ và N3. c) Ca2+ và Cl . d) Al3+ và F Hướng dẫn giải: Công thức hóa học của các hợp chất ion do mỗi cặp ion tạo thành: a) Na2O. b) K3N. c) CaCl2. d) AlF3.
Bài 20: Viết công thức hóa học của hợp chất ion do mỗi cặp ion tạo thành: a) NH4 + và HSO4 . b) K+ và CO3 2. c) Ca2+ và PO4 3d) NH4 + và HPO4 2. Hướng dẫn giải: Công thức hóa học của các hợp chất ion do mỗi cặp ion tạo thành: a) NH4HSO4. b) K2CO3 c) Ca3(PO4)3. d) (NH4)2HPO4 Bài 21: Ion uranyl (UO2 2+) là dạng uranium tan trong nước phổ biến. Công thức hóa học của hợp chất ion uranyl nitrate là gì? Công thức hóa học của hợp chất ion uranyl phosphate là gì? Hướng dẫn giải: +) Công thức hóa học của hợp chất ion uranyl nitrate là: UO2(NO3)2 +) Công thức hóa học của hợp chất ion uranyl phosphate là: (UO2)3(PO4)2.
Bài 22: Cho các hợp chất sau: K2O, H2O, H2S, SO2, NaCl, K2S, CaF2, HCl. Hợp chất nào trong phân tử có chứa liên kết ion? Giải thích? Hướng dẫn giải:
K2O, NaCl, K2S, CaF2 Hợp chất ion thường tạo bởi kim loại điển hình và phi kim điển hình. Bài 23: Trong chín ô trống trong ma trận dưới đây, hãy viết công thức của các hợp chất ion được tạo thành bằng cách kết hợp mỗi ion kim loại (M) với mỗi ion phi kim (X). Ma trận này bao gồm các công thức chung cho tất cả các kết hợp có thể có từ các ion có điện tích độ lớn từ một đến ba. X X2 X3 M+ M2+ M3+ Hướng dẫn giải: Các ion kết hợp với nhau tạo thành phân tử sao cho tổng điện tích của phân tử tạo thành bằng 0: X- X2- X3M+ MX M2X M3X M2+ MX2 MX M3X2 M3+ MX3 M2X3 MX
Bài 24:
a, Viết cấu hình electron của các nguyên tử A, B biết rằng: - Tổng số các loại hạt cơ bản trong nguyên tử A là 34 trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 10. - Kí hiệu của nguyên tử B là 9 19B. b, Liên kết trong hợp chất tạo thành từ A và B thuộc loại liên kết gì? Vì sao? Viết công thức của hợp chất tạo thành . Đáp án a, Gọi tổng số hạt proton, neutron, electron của nguyên tử A là P, N, E (trong đó P = E).
Ta có: P + N + E = 34 và P + E - N = 10.
Từ đây tìm được P = E = 11; N = 12. Kí hiệu của nguyên tử B là B nên ZB = 9 Cấu hình electron của A, B:
A (Z = 11): 1s22s22p63s1 B (Z = 9): 1s22s22p5 b, Liên kết trong hợp chất giữa A và B là liên kết ion vì A là kim loại điển hình (nhóm IA), B là phi kim điển hình (nhóm VIIA). Sơ đồ hình thành liên kết: A → A+ + 1e B + 1e → B
Các ion A+và B- tạo thành mang điện tích trái dấu, chúng hút nhau bằng lực hút tĩnh điện, tạo thành hợp chất AB: A+ + B → AB.
Bài 25: Viết phương trình hoá học và dùng sơ đồ biểu diễn sự trao đổi electron trong phản ứng giữa: a) Sodium và chlorine.
b) Calcium và fluorine. c) Magsenium và oxygen. d) Aluminum và oxygen. Cho số hiệu nguyên tử của các nguyên tử: ZNa = 11; ZCl = 17; ZCa = 20; ZF = 9; ZMg = 12; ZAl = 13. Đáp án:
a) Na → Na+ + 1e và Cl + 1e → Cl 2Na + Cl2 → 2Na+ + 2Cl → 2NaCl b) Ca → Ca2+ + 2e và F + 1e → F Ca + F2 → Ca2+ + 2F → CaF2 c) Mg → Mg2+ + 2e và O + 2e → O22Mg + O2 → Mg2+ + O2- → 2MgO d) Al → Al3+ + 3e và O + 2e → O24Al + 3O2 → 4Al3+ + 6O2- → 2Al2O3
Bài 26: Mô tả sự dịch chuyển electron từ nguyên tử lithium sang nguyên tử fluorine để tạo thành hợp chất lithium fluoride theo 2 cách. a. Theo cấu hình electron. b. Theo sơ đồ ký hiệu Lewis. Đáp án: a. Li + F → Li+ + F → LiF [He]2s1 [He]2s22p5 1s2 [He]2s22p6 b. Li + F Li + F
Bài 27: Theo nghiên cứu của Đại học Harvard vào năm 2013, trẻ em sinh sống tại những khu vực có nguồn nước bị nhiễm Fluorine có chỉ số IQ trung bình sẽ thấp hơn so với những trẻ em sống tại vùng khác. Anion F (fluoride) có độc tính mạnh với hệ thần kinh. Với lượng tương đối thấp: 0,2 gam ion F trên cơ thể có trọng lượng 70 kg có thể gây tử vong. Tuy nhiên, sự có mặt của anion fluoride lại giúp men răng chắc khỏe và chống chọi các bệnh về Hình 3.14. Men răng được bổ sung ion fluoride sâu răng, vì vậy anion fluoride được thêm vào nước uống đóng chai với nồng độ với nồng độ 1mg ion F trên 1L nước và bổ sung một lượng nhỏ dưới dạng muối sodium fluoride (NaF) trong kem đánh răng. a. Viết sơ đồ mô tả sự hình thành hợp chất NaF từ nguyên tử Na (Z = 11) và F (Z = 9)?
b. Một bạn học sinh nặng khoảng 70kg sử dụng loại nước chứa ion F với lượng 1mg/1L để giúp men răng chắc khỏe, chống sâu răng. Sau khi đọc thông tin về độc tính của ion F , bạn học sinh rất lo lắng. Hãy tính xem với thể tích nước mà bạn học sinh này uống một ngày là bao nhiêu lít thì ion F có trong nước đạt đến mức có thể gây độc tính?
c. Theo hiệp hội nha khoa Hoa Kỳ, một người trưởng thành nên bổ sung 3,0 mg F mỗi ngày dưới dạng muối sodium fluoride (NaF) để ngăn ngừa sâu răng. Lượng NaF không gây độc cho cơ thể khi ở mức 3,19.10-2 gam/ 1 kg cơ thể. Một mẫu kem đánh răng chứa 0,28% NaF, hãy tính khối lượng mẫu kem đánh răng mà một người nặng 75 kg có thể nuốt nhưng không gây độc tính với cơ thể? Đáp án: a + Quá trình hình thành liên kết trong hợp chất NaF
Sự tạo thành ion: Na →Na+ + 1e F + 1e → F Sự tạo thành liên kết: Na+ + F → NaF. b .
1 mg/ 1L là liều lượng không độc. 0,2 g/ 70kg là liều lượng đến mức F gây độc tính (ở đâu đấy?).
0,2 g = 200 mg tương ứng 200L nước. Vậy một người 70kg uống 200 L nước chứa F mới có khả năng nhiễm độc fluoride. c. 3,19.10-2 ⋅ 75 = 2,3925 g. mkem đánh răng= 2,3925.100/0,28 = 854,464 gam.
Bài 28: a) Nêu sự khác nhau cơ bản trong cấu tạo mạng tinh thể nguyên tử và tinh thể ion. Liên kết hoá học trong hai loại mạng trên thuộc loại liên kết gì?.
b) Giải thích tại sao naphtalene và iodine lại dễ thăng hoa nhưng không dẫn điện, trái lại NaCl lại rất khó thăng hoa nhưng lại dẫn điện khi ở trạng thái dung dịch hoặc trạng thái nóng chảy?

Hình 3.15. Sự thăng hoa của Iodine Đáp án:
Tinh thể nguyên tử
Cấu trúc mạng tinh thể Các nguyên tử nằm ở các nút mạng tinh thể, liên kết với nhau bằng liên kết cộng hóa trị. Vì vậy các tinh thể nguyên tử như kim cương, than chì,
Tinh thể ion
Các ion âm và dương phân bố luân phiên, đều đặn ở các nút mạng tinh thể. Các ion này liên kết với nhau bằng liên kết ion. Vì vậy các tinh thể ion như NaCl, CaF2,… đều cứng,
gemani, silic,… đều rất cứng, nhiệt độ sôi và nhiệt độ nóng chảy rất cao.
Liên kết hoá học Liên kết cộng hoá trị
nhiệt độ sôi và nhiệt độ nóng chảy cao.
Liên kết ion
b) Phân tử naphtalen và iodine có liên kết cộng hoá trị bền. Ở trạng thái rắn, naphtalen và iodine đều có mạng tinh thể phân tử, các phân tử tương tác với nhau bằng tương tác van der Waals kém bền vững. Vì vậy, khi đun nóng các phân tử dễ dàng tách ra khỏi nhau và bay hơi (thăng hoa). Hơi naptalen và iodine đều là phân tử trung hòa nên không dẫn điện. Ngược lại, phân tử NaCl có cấu trúc tinh thể ion, lực liên kết mạnh nên khó nóng chảy và khó bay hơi (khó thăng hoa). Ở trạng thái nóng chảy hoặc dung dịch, NaCl phân li thành ion Na+ và Cl các ion chuyển động tự do nên dẫn được điện.
Bài 29: Biểu đồ dưới đây cho biết mối quan hệ giữa năng lượng của hệ các ion trái dấu so với khoảng cách giữa chúng:
Hình 3.16. Biểu đồ mối quan hệ giữa năng lượng và khoảng cách của hệ các ion trái dấu Biểu đồ cho thấy khoảng cách giữa các ion càng gần thì năng lượng càng giảm => càng thuận lợi để hệ đạt được trạng thái năng lượng tối thiểu (trạng thái bền vững). Tuy nhiên, ở khoảng cách nhỏ quá, các ion lại đẩy nhau do hạt nhân của các ion đều mang điện tích dương. Năng lượng tối thiểu đại diện cho độ bền liên kết và khoảng cách r0 tại mức năng lượng tối thiểu gọi là độ dài liên kết.
Bằng cách thực hiện một loạt các phép tính, người ta thấy rằng các hợp chất ion được hình thành bởi các ion có điện tích lớn hơn sẽ tạo ra các liên kết mạnh hơn và các hợp chất ion có độ dài liên kết ngắn hơn sẽ hình thành liên kết mạnh hơn. Sử dụng nhận định trên để dự đoán và giải thích độ bền liên kết giữa các hợp chất ion sau: NaCl và Na2O; NaCl và NaF.
Đáp án: Do hợp chất ion được hình thành bởi các ion có điện tích lớn hơn sẽ tạo ra liên kết bền hơn và các hợp chất ion có độ dài liên kết ngắn hơn sẽ hình thành liên kết bền hơn nên: + NaCl và Na2O: Ion O2- có điện tích lớn hơn Cl , ngoài ra kích thước ion O2- lại nhỏ hơn kích thước ion Cl nên liên kết trong Na2O bền hơn so với NaCl.

+ NaCl và NaF: Tuy các ion Cl và F có cùng điện tích nhưng bán kính Cl lại lớn hơn bán kình F nên liên kết trong NaF bền hơn trong NaCl. Thật vậy hợp chất có liên kết ion bền hơn sẽ có nhiệt độ nóng chảy cao hơn:

Na2O NaF NaCl Nhiệt độ nóng chảy (0C) 1132 993 801 Bài 30: X, Y, Z là các hợp chất ion thuộc vào dãy sau: NaF, MgO và MgF2 (sắp xếp ngẫu nhiên không theo thứ tự). Nhiệt độ nóng chảy của các hợp chất X, Y, Z được thể hiện qua biểu đồ hình 3. Hình 3.17. Biểu đồ thể hiện nhiệt độ nóng chảy của X, Y và Z. Xác định các hợp chất X, Y và Z? Giải thích Đáp án: Nhiệt độ nóng chảy của các ion là nhiệt độ tại đó có đủ năng lượng dưới dạng nhiệt để phá vỡ lực hút tĩnh điện mạnh giữa các ion và phá vỡ cấu trúc mạng tinh thể, chuyển trạng thái từ rắn sang lỏng. Hợp chất có liên kết ion bền hơn sẽ có nhiệt độ nóng chảy cao hơn.
Do điện tích anion hình thành trong hợp chất MgO cao hơn điện tích anion hình thành trong hợp chất MgF2, trong khi bán kính của O2- và F là khác biệt không đáng kể (O và F cùng ở chu kì 2) nên nhiệt độ nóng chảy của MgO cao hơn MgF2.
Do điện tích của cation hình thành trong MgF2 cao hơn điện tích cation hình thành trong NaF, trong khi bán kính của Na+ lớn hơn bán kính của Mg2+ nên NaF có nhiệt độ nóng chảy thấp hơn MgF2. Vậy X là NaF, Y là MgF2 và Z là MgO.

Bài 31: Trong đời sống muối ăn (NaCl) và các gia vị, phụ gia C5H8NO4Na: (bột ngọt) C7H5O2Na (Chất bảo quản thực phẩm) đều có chứa ion sodium. Hiệp hội Tim mạch Hoa Kỳ khuyến cáo lượng ion sodium mỗi ngày được nạp vào cơ thể mỗi người cần thấp hơn 2300mg để bảo vệ tim mạch và thận. Nếu trung bình mỗi ngày một người dùng tổng cộng 5 gam muối ăn; 0,5 gam bột ngọt; 0,05 gam chất bảo quản thì lượng sodium tiêu thụ có vượt quá

Hình 3.18. Dùng quá nhiều sodium mức tiêu thụ cho phép nói trên không? gây ảnh hưởng tới tim mạch.
Đáp án: Lượng sodium người đó tiêu thụ một ngày là: [(5 x 23) : 58,5] + [0,5 x 23) : 169] + [0,05 x 23) : 144] = 2,042 gam = 2042 mg < 2300 mg => Người đó tiêu thụ lượng sodium chưa vượt mức cho phép.