
CHUYÊN ĐỀ ÔN THI LỚP 12 MÔN HÓA HỌC Ths Nguyễn Thanh Tú eBook Collection CHUYÊN ĐỀ ĐẦY ĐỦ ÔN THI LỚP 12 MÔN HÓA HỌC - 8 CHƯƠNG - LÍ THUYẾT TRỌNG TÂM - CÁC DẠNG BÀI TẬP - BÀI TẬP TỰ LUYỆN CƠ BẢN NÂNG CAO WORD VERSION | 2022 EDITION ORDER NOW / CHUYỂN GIAO QUA EMAIL TAILIEUCHUANTHAMKHAO@GMAIL COM Hỗ trợ trực tuyến Fb www.facebook.com/DayKemQuyNhon Mobi/Zalo 0905779594 Tài liệu chuẩn tham khảo Phát triển kênh bởi Ths Nguyễn Thanh Tú Đơn vị tài trợ / phát hành / chia sẻ học thuật : Nguyen Thanh Tu Group vectorstock com/28062440
CHƯƠNG 5: ĐẠI CƯƠNG KIM LOẠI
BÀI 8: KIM LOẠI – DÃY HOẠT ĐỘNG HÓA HỌC
Mục tiêu
Kiến thức
+Trìnhbày được vị trí, đặc điểm cấu hình lớp electronngoàicùng, một số mạng tinh thể phổ biến, liên kết kim loại.
+ Nêu được tính chất vật líchung của kim loại: ánhkim, dẻo, dẫn điện và dẫn nhiệt tốt.
+ Chỉ ra được tính chất hóa học chung của kim loại làtính khử.
+Phântích được quy luật sắp xếp trongdãy điện hóacáckim loại vàý nghĩa của nó.
Kĩ năng
+ Sosánh được bản chất của liên kết kim loại với liên kết ionvà cộng hóa trị.
+ Dự đoán được chiều phản ứng oxihóa– khử dựa vàodãy điện hóa.
+ Viết được các phương trìnhhóa học của phản ứng oxihóa– khử chứng minhtính chất của kim loại.
+ Giải được cácbài tập cóliênquan như: tính phần trăm khối lượng kim loại cótrong hỗn hợp...
DẠYKÈMQUYNHƠNOFFICIAL Trang1
I. LÍ THUYẾT TRỌNG TÂM
1. Vị trí, cấu tạo của kim loại trong bảng tuần hoàn
Trên110nguyên tố hóa học đã biết tới gần 90nguyên tố làkim loại.
Cácnguyên tố kim loại có mặt ở: NhómIA (trừ H),nhómIIA,nhómIIIA( trừ Bo)và một phần cácnhómIVA,VA,VIA. CácnhómB.
Họ latanvàactini.
Chú ý: Các nguyên tố kim loại có 1, 2 hoặc 3 electron lớp ngoài cùng.
2. Tính chất vật lí
a. Tính chất chung
Ở điều kiện thường cáckim loại đều ở trạng thái rắn (trừ Hg trạng thái lỏng).
Tính chất vật líchung của kim loại gâynên bởi sự có mặt của cácelectron tự dotrong mạng tinh thể, gồm:
Tính dẻo: Au>Ag>Al>Cu...
Tính dẫn điện: Ag>Cu>Au>Al>Fe...
Tính dẫn nhiệt: Ag>Cu>Au>Al... Cóánhkim.
b. Tính chất riêng
Khối lượng riêng: nhỏ nhất làLi, lớn nhất làOs.
Nhiệt độ nóng chảy: nhỏ nhất làHg, lớn nhất làW.
Tính cứng: mềm nhất làK,Rb,Cs, cứng nhất làCr. 3. Tính chất hóa học -Tính chất hóa học chung của kim loại làtính khử:
DẠYKÈMQUYNHƠNOFFICIAL Trang2
n
-Tác
2 Kimlo¹i+OOxitkimlo¹i Ví dụ: t 2 343Fe3OFeO 2 Kimlo¹i+Cl/SMuèi Ví dụ: t 2 32Fe3Cl2FeCl -Tác dụng với dung dịch axit 24 2Kimlo¹i(®øngtrícH)+HCl/HSOlongMuèi+H Chú ý: Fe lên muối Fe(II).
MMne
dụng với phikim
324 2 Kimlo¹i+HNO/HSO®ÆcMuèi+S¶nphÈmkhö+HO
Chú ý:
1. Kim loại lên số oxi hóa cao nhất (Fe lên muối Fe(III))

2. Al, Fe, Cr không phản ứng với đặc, nguội và đặc, nguội. 3 HNO 24 HSO
Ví dụ: 3 3 2 2 FeCuNOFeNOCu
-Tác dụng với muối
Kim loại mạnh hơn + Muối của kim loại yếu hơn kim loại yếu hơn + Muối của kim loại mạnh hơn
-Tác dụng với nước
Cáckim loại nhómIA,IIA (trừ Be,Mg)cótính khử mạnh, khử được nước ở nhiệt độ thường. 2 2Kimlo¹i+HOBaz¬+H
4. Dãy điện hóa của kim loại
Dạng oxihóavà dạng khử của cùng một nguyên tố kim loại tạo nên cặp oxihóa– khử của kim loại
Ví dụ: 2 Ag/Ag,Cu/Cu, Dãy điện hóa: Ý nghĩa: Chophép dự đoán chiều của phản ứng giữa hai cặp oxihóa– khử theoquy tắc anpha: SƠ ĐỒ HỆ THỐNG HÓA ĐẠI CƯƠNG KIM LOẠI (có1,2 hoặc

DẠYKÈMQUYNHƠNOFFICIAL Trang3
3e ở lớp
Tính
vật lý: o Ở nhiệt độ thường,
ở
ở
o
riêng: Khối
Khối
ngoàicùng)
chất
Hg
thể lỏng, cáckim loại khác đều
thể rắn.
Tính chất
lượng riêng nhỏ nhất: Li.
lượng riêng lớn nhất: Os.
Nhiệt độ nóng chảy thấp nhất: Hg.
Nhiệt độ nóng chảy cao nhất: W.
Kim loại cứng nhất: Cr.
Kim loại mềm nhất: Cs.
o Tính chất chung(docácelectron tự dogâyra)
Tính dẻo: Au>Ag>Al...
Tính dẫn điện: Ag>Cu>Au>Al>Fe...
Tính dẫn nhiệt: Ag>Cu>Al>Fe...
Tínhánhkim
Tính chất hóa học
o Tác dụng với phikim
Tác dụng với ( trừ Ag,Au,Pt) Oxit bazơ. 2O t 2 343Fe2OFeO
Tác dụng với cácphikimkhác( ) Muối. 22 Cl,S,I... t FeSFeS t 2 32Fe3Cl2FeCl t 2 2FeIFeI
o Tác dụng với axit
Tác dụng với dung dịch HCl, loãng: 24HSO 2Kimlo¹i®øngtrícH+AxitMuèi+H
Chú ý: Fe tạo muối Fe(II). Tác dụng với đặc ( trừ Au,Pt): 324 HNO,HSO 324 2 Kimlo¹i+HNO/HSO®ÆcMuèi+SPK+HO
Chú ý: Fe tạo muối Fe(III). Sản phẩm khử của 32 2243 HNO:NO;NO;NO;N;NHNO. Sản phẩm khử của đặc: . 24HSO 22 SO;S;HS
Chú ý: Fe,Al,Cr bị thụ động hóatrong đặc nguội, đặc nguội. 3HNO 24HSO
o Tác dụng dung dịch muối
Kim loại từ Mg trở đi trongdãy điện hóa Kimlo¹i+Muèikimlo¹iMuèimíi+Kimlo¹imíi 4 4 FeCuSOFeSOCu
Kim loại mạnh nhómIA,IIA( trừ BevàMg)vàocácdung dịch muối: KLtantrong nước trước rồi phản ứng với muối.
DẠYKÈMQUYNHƠNOFFICIAL Trang4
Tác dụng với ở nhiệt độ thường: cáckim loại ở nhómIAvàIIA( trừ Be,Mg) 2 HO 2 n22R2nHO2ROHnH

Tác dụng với ở nhiệt độ cao:Fe,Zn... 2 HO
Cáckim loại: Cu,Ag,Au...không phản ứng với . 2 HO

DẠYKÈMQUYNHƠNOFFICIAL Trang5
Một số trường hợp thường
2 2 CuFeFeCu 3 22FeFe3Fe 3 22 FeCuCuFe 2 3 AgFeFeAg
Tính dẫn điện, tính dẫn nhiệt,
tính
Ví dụ: ChoNavàodung dịch 4CuSO 2 22Na2HO2NaOHH 4 224 CuSO2NaOHCuOHNaSO o Tác dụng với nước
Dãy điện hóa o Chiều phản ứng: Quy tắc
gặp:
II. CÁC DẠNG BÀI TẬP Dạng 1: Lí thuyết trọng tâm Kiểu hỏi 1: Tính chất vật lí Ví dụ mẫu Ví dụ 1: Kim loại cócáctính chất vật líchunglà: A.
ánhkim,tính đàn hồi. B. Tính dẻo,
dẫn điện, tính dẫn nhiệt, ánhkim. C. Tính dẻo, tính dẫn điện, tínhkhónóng chảy, ánhkim. D. Tính dẻo, tính dẫn điện, tính dẫn nhiệt, tính cứng. Hướng dẫn giải
Ở điều kiện thường, cáckim loại cócáctính chất vật líchunglàtính dẻo, dẫn điện, dẫn nhiệt vàcóánhkimdo
sự có mặt của cácelectron tự dogâynên.
Chọn B.
Ví dụ 2: Chodãycáckim loại: Na,Al,W,Fe.Kim loại trongdãy cỏ nhiệt độ nóng chảy cao nhất là
A. Na. B. Al. C. W. D. Fe.
Hướng dẫn giải
Kim loại có nhiệt độ nóng chảy cao nhất làW().Do đó, vonfram(W) thường được dùng để chế tạo 3410C
dâytócbóng đèn.
Chọn C.
Kiểu hỏi 2: Tính chất hóa học – Dãy hoạt động hóa học
Ví dụ mẫu
Ví dụ 1: Trongcác phản ứng hóa học, nguyên tử kim loại
A. thể hiện tínhoxihóa.
B. thể hiện tính khử.
C. không thể hiện tínhoxihóavàkhông thể hiện tính khử.
D. vừa thể hiện tínhoxihóa, vừa thể hiện tính khử.
Hướng dẫn giải
Tính chất hóa học chung của kim loại làtính khử. n MMne Chọn B.
Ví dụ 2: Dãy gồm cáckim loại được sắp xếp theo thứ tự tăng dần khả năng hoạt động hóa học từ tráisang phải
là:
B. Fe,Mg,Al,K. C. Fe,Al,Mg,K. D. Fe,Al,K,Mg. Hướng dẫn giải Theo chiều từ tráisang phải trongdãy điện hóa, khả năng hoạt động hóa học của kim loại giảm dần. Tacó sắp xếp trongdãy điện hóa:K,Mg,Al,Fe. Thứ tự khả năng hoạt động hóa học tăng dần từ tráisang phải: Fe,Al,Mg,K. Chọn C. Ví dụ 3: Dãy gồm cáckim loại đều tác dụng với dung dịch loãnglà: 24HSO
A. Al,Mg,K,Fe.
A. Fe,Cu,Mg. B. Al,Mg,Ba. C. Ba,Na,Ag. D. Na,Al,Cu. Hướng dẫn giải
DẠYKÈMQUYNHƠNOFFICIAL Trang6
Phản ứng của kim loại với dung dịch axitHCl, loãng thỏa mãn điều kiện: Kim loại đứng trước Htrong 24HSO dãy điện hóa.
Tacó:CuvàAg đứng sauHtrongdãy điện hóanênkhông phản ứng được với dung dịch loãng. 24HSO
Loại đáp ánA,C,D. Chọn B. Ví dụ 4: Chodãycáckim loại: Na,K,Fe,Ca. Số kim loại trongdãytác dụng được với nước ở nhiệt độ thường là A. 3. B. 1. C. 2. D. 4. Hướng dẫn giải Cáckim loại ở nhómIAvàIIA (trừ Be,Mg)có thể khử được ở nhiệt độ thường thành . 2 HO 2H
Cóbakim loại trongdãytác dụng được với nước ở nhiệt độ thường: Na(IA),K(IA),Ca(IIA). Chọn A. Chú ý: Mg không khử được ở nhiệt độ thường, nhưng ở nhiệt độ cao, Mg có khả năng phản ứng với 2 HO tạo thành khí: 2 HO 2H 2 22 2
KhichoNavàodung dịch thấy 4CuSO
A. cókhíbayravàcó kết tủa màuxanhlam. B. cókhíbayravàcó kết tủa Cumàu đỏ. C. có kết tủa Cumàu đỏ. D. cókhíbayra. Hướng dẫn giải Tacó:Nacó khả năng phản ứng với ở điều kiện thường. 2 HO KhichoNavàodung dịch ,Na sẽ phản ứng với trongdung dịch trước, tạo thànhdung 4CuSO 2 HO 4CuSO dịch bazơ vàkhíkhôngmàuthoátra.
DẠYKÈMQUYNHƠNOFFICIAL Trang7
t MgHOMgOHH Ví dụ 5:
Sau đó, dung dịch bazơ sinhra ở trên phản ứng với , tạo kết tủa màuxanhlam. 4CuSO 2 CuOH 4 224 2NaOHCuSOCuOHNaSO Chọn A. Ví dụ 6: Phản ứng nàosau đây không xảy ra? A. B. C. D. AlAg 3FeFe 2ZnPb 2CuFe Hướng dẫn giải
2 22Na2HO2NaOHH
Chọn D.
Bài tập tự luyện dạng 1
Câu 1: Kim loại cótính chất vật líchunglà dẫn điện, dẫn nhiệt, dẻo vàcóánhkim.Nguyênnhân của những tính chất vật líchung của kim loại làdotrongtinh thể kim loại có
A. nhiều electron độc thân. B. cácion dương chuyển động tự do
C. cácelectron chuyển động tự do. D. nhiều ion dương kim loại.
Câu 2: Tính chất hóa học chung của kim loại là
A. tínhoxihóa. B. tính khử. C. tínhaxit. D. tính bazơ.
Câu 3: Phát biểu nàosau đây sai?
A. Kim loại có nhiệt độ nóng chảy cao nhất làW.
B. Kim loại cứng nhất làCr.
C. Kim loại nặng nhất làOs.
D. Kim loại dẫn điện tốt nhất làAu.
Câu 4: Kim loại X được sử dụng trong nhiệt kế, áp kế và một số thiết bị khác, ở điều kiện thường, Xlà chất lỏng. Kim loại Xlà
A. Cr. B. Pb. C. Hg. D. W. Câu 5: Chodãycáckim loại: Na,Ca,Cr,Zn. Số kim loại trongdãytác dụng với tạo thànhdung dịch 2 HO bazơ là A. 1. B. 3. C. 2. D. 4. Câu 6: Hiện tượng gì xảy rakhinhúng đinh sắt sạch vàodung dịch ?4CuSO
A. Đinh sắt tan dần đến hết vàodung dịch, dung dịch nhạt dần màuxanh.
B. Có lớp Cumàu đỏ bámtrên đinh sắt, màuxanh của dung dịch nhạt dần. C. Có lớp Cumàu đỏ bámtrên đinh sắt, màuxanh của dung dịch đậm dần.
D. Đinh sắt tan dần đến hết vàodung dịch, dung dịch chuyển sangmàu đỏ
Câu 7: Dãysosánhtính chất vật lí của kim loại nào
DẠYKÈMQUYNHƠNOFFICIAL Trang8
3
3 2Fe2Fe3Fe 2 2
Phản ứng của kim loại với muối thỏa mãnquy tắc
Al3AgAl3Ag
ZnPbZnPb
A.
nhiệt: Ag>Cu>Al>Fe. B.
C.
độ nóng chảy:
D.
Câu 8: Cho phản ứng hóa học: .Trong
ứng trên
ra 4 4 FeCuSOFeSOCu A. sự khử và sự oxihóaCu. B.
. 2Fe 2Fe 2Cu C.
oxihóaFevà sự
D.
. 2
dưới đây làsai?
Dẫn
Tỉ khối: Li<Fe<Os.
Nhiệt
Hg<Al<W.
Tính cứng: Cs<Cr<Fe.
phản
xảy
sự khử và sự khử
sự
oxihóaCu.
sự oxihóaFevà sự khử
Cu
Câu 9: Dãy gồm cácion xếp theo chiều tăng dần tínhoxihóalà: A. B. 222 Zn;Cu;Fe;Ag 232 Zn;Fe;Cu;;Ag C. D. 222 Zn;Fe;Cu;Ag.
Câu 10: Kim loại Cukhông phản ứng được với dung dịch
A. . B. . C. D. 33FeNO 3AgNO 3HNO 32PbNO
Câu 11: Dãy gồm cáckim loại được xếp theo thứ tự tính khử tăng dần từ tráisang phải là: A. Al,Mg,Fe. B. Fe,Al,Mg. C. Fe,Mg,Al. D. Mg,Fe,Al.
Câu 12: Phát biểu nàosau đây đúng?
A. Tính chất hóa học đặc trưng của kim loại làtính khử.
B. Ở điều kiện thường, cáckim loại đều có khối lượng riêng lớn hơn khối lượng riêng của nước.
C. Cáckim loại đều chỉ có một số oxihóaduy nhất trongcác hợp chất.
D. Ở điều kiện thường, tất cả cáckim loại đều ở trạng thái rắn.
Câu 13: Phương trìnhhóa học nàosau đây sai?
A. B. 4 4 FeCuSOFeSOCu 3 32 Zn2AgNOZnNO2Ag
C. D. 24 42CuHSOCuSOH 3 3 33 FeCl3AgNOFeNO3AgCl
Câu 14: Dãykim loại được sắp xếp theo chiều tăng dần về khả năng dẫn điện là: A. Fe,Al,Au,Ag,Cu. B. Al,Fe,Cu,Au,Ag. C. Fe,Al,Au,Cu,Ag. D. Ag,Cu,Au,Al,Fe. Câu 15: Chocáckim loại: Na,Fe,Al,Znvàcácdung dịch muối .Cóbaonhiêukim 2 4 3CuCl,ZnSO,AgNO loại phản ứng được với cả badung dịch muối? A. 1. B. 2. C. 3. D. 4. Dạng 2: Kim loại tác dụng với phi kim Phương pháp giải Viết phương trìnhhóa học vàtínhtheo phương trìnhhóa học. Ngoàiracó thể áp dụng các định luật bảo toàn: bảo toàn khối lượng, bảo toànelectron, bảo toànnguyên tố...
DẠYKÈMQUYNHƠNOFFICIAL Trang9
222 Fe;Zn;Cu;Ag.
Ví
đủ mgamFe
A. 5,6. B. 8,4.
Hướng dẫn giải Theo đề bài: 3FeCl n0,1mol Phương trìnhhóa học: t 2 32Fe3Cl2FeCl 0,1 0,1mol Fe mm0,1.565,6gam
dụ: Đốt cháy vừa
bằng khíclothu được 16,25gam muối clorua.Giá trị của mlà
C. 2,8. D. 11,2.
Chọn A. Ví dụ mẫu
4XnO2XO m0,25mmol M32
Tacó phương trình: x Tacóquátrình: gamoxitX 2
m0,25m 4M32n x M32n Tacó bảng: n 1 2 3 xM 32 64 96 Không thỏa mãn Cu Không thỏa mãn Kim loại Xlà đồng (Cu). Chọn C. Ví dụ 2: Đốt cháy2,15gam hỗn hợp gồm Zn,AlvàMgtrongkhíoxi dư, thu được 3,43gam hỗn hợp X.Toàn bộ X phản ứng vừa đủ với Vmldung dịch HCl0,5M. Biết các phản ứng xảy rahoàntoàn.Giá trị của Vlà A. 160. B. 480. C. 240. D. 320. Hướng dẫn giải Zn 2,15gamAlO3,43 Mg
Bảo toàn khối lượng: 2 hhkimlo¹iOx mmm 2O m3,432,151,28gam 2O n0,04mol Bảo toànnguyên tố O: 2OOX n2n0,08mol
DẠYKÈMQUYNHƠNOFFICIAL Trang10
Ví dụ 1: Oxihóahoàntoànmgamkim loại X cần vừa đủ 0,25mgamkhí .Xlàkim loại nàosau đây? 2O A. Al. B. Fe. C. Cu. D. Ca. Hướng dẫn giải Gọi hóa trị của kim loại Xlàn(). n1,2,3 Phương trìnhhóa học: t 2 2n x
HClH nn0,16mol V0,160,32lÝt=320ml 0,5 Chọn D. Ví dụ 3: Một hỗn hợp X gồm và .X phản ứng hết với 9,6gamMgvà16,2gamAl tạo ra74,1gam hỗn 2Cl 2O hợp muối cloruavàoxit.Thành phần phần trăm theo thể tích của trongXlà 2Cl A. 50,00%. B. 55,56%. C. 66,67%. D. 44,44%. Hướng dẫn giải nMg =0,4mol;nAl =0,6mol Bảo toàn khối lượng: XMgAlcloruaoxitmmmm X m74,19,616,248,3gam
Gọi số mol của và lần lượt làx,ymol. 2Cl 2O 71x32y48,3* Quátrìnhcho nhận electron:
DẠYKÈMQUYNHƠNOFFICIAL Trang11
2 2
Cl2e2Cl 3 2 2 AlAl3e O4e2O
2 2
Oxittác dụng với axit,tacó: 2 2 2HOHO 0,160,08mol 2x4y20,430,6 2x4y2,6** Từ (*)và(**)suyra: x0,5;y0,4 2Cl %0,5 V0.100%55,56% ,50,4 Chọn B. Ví dụ 4: Cho tác dụng với 16,2gamkim loại R(cóhóa trị không đổi làn)thu được 58,8gam chất rắn X. 2Cl Cho dư tác dụng với X đến khi phản ứng hoàntoànthu được 63,6gam chất rắn Y.Kim loại Rlà 2O A. Mg. B. Al. C. Zn. D. Ba.
MgMg2e
Bảo toànelectron:
ClOMgAl 2n4n2n3n
DẠYKÈMQUYNHƠNOFFICIAL Trang12
Fe
t
Theo
Hướng dẫn giải Tacóquátrình: 2 2 Cl O 1 2 RXY Bảo toàn khối lượng choquátrình(1): 2 RClX mmm 2Cl m58,816,242,6gam 2Cl n0,6mol Bảo toàn khối lượng choquátrình(2): 2 XOY mmm 2O m63,658,84,8gam 2O n0,15mol Quátrìnhcho nhận electron: n 2 2 2 RRneCl2e2Cl O4e2O Bảo toànelectron: 2 2RClO nn2n4n R 2.0,64.0,151,8 n mol nn R M16,29n 1,8 n Với thỏa mãn. R n3M27 Kim loại Rlànhôm(Al). Chọn B. Ví dụ 5: Đun nóng một hỗn hợp gồm 2,8gam bột Fevà0,8gam bột S. Lấy sản phẩm thu được chovàodung dịch HCl vừa đủ, thu được một hỗn hợp khíbayra (giả sử hiệu suất phản ứng là100%). Tổng khối lượng các khíthoátralà A. 1,2gam. B. 1,8gam. C. 0,9gam. D. 1,5gam. Hướng dẫn giải
S n0,05mol;n0,025mol
Phương trìnhhóa học:
FeSFeS1
đề bài: 0,05 0,025 mol Phản ứng: 0,0250,0250,025 mol
Sau phản ứng: 0,025 0 0,025 mol Sản phẩm gồm Fe dư (0,025mol)vàFeS(0,025mol). Khicho sản phẩm vàodung dịch HCl, xảy racác phản ứng: 22 Fe2HClFeClH2 0,025 0,025mol
Theo phương trình(2): 2H n0,025mol 2H m0,025.20,05gam
Theo phương trình(3): 2 HS n0,025mol 2 HS m0,025340,85gam
2 2 khÝHHS mmm0,050,850,9gam Chọn C. Bài tập tự luyện dạng 2
Câu 1: Đốt cháyhoàntoànmgamAltrong dư, thu được 13,35gam muối. Giá trị của mlà 2Cl
A. 2,7. B. 5,4. C. 1,35. D. 5,6. Câu 2: Đốt cháyhoàntoànmgamMg bằng khí dư thu được 4gamoxit.Giá trị của mlà 2O A. 2,4. B. 4. C. 1,2. D. 1,8. Câu 3: Đốt 8,1gamkim loại Rtrong dư. Sau phản ứng thu được 15,3gamoxit.Kim loại Rlà 2O
A. Zn. B. Al. C. Cu. D. Fe. Câu 4: Cho5,4gam hỗn hợp gồm haikim loại kiềm thuộc haichukìliên tiếp tác dụng với khí dư, thu 2Cl được hỗn hợp muối có khối lượng 15,95gam.Haikim loại đó là A. NavàK. B. LivàNa. C. KvàRb. D. RbvàCs. Câu 5: Thể tích khí clo (đktc) vừa đủ tác dụng với 7,4 gam hỗn hợp Al, Zn tạo ra 28,7 gam hỗn hợp muối clorualà A. 4,48lít. B. 3,36lít. C. 6,72lít. D. 8,96lít. Câu 6: Đốt cháyhoàntoàn4,04gam một hỗn hợp bột kim loại gồm Al,Fe,Cutrongkhôngkhíthu được 5,96 gam hỗn hợp baoxit.Hòatan hết hỗn hợp baoxit bằng dung dịch HCl2M. Thể tíchdung dịch HCl cần dùnglà A. 0,50lít. B. 0,70lít. C. 0,12lít. D. 1,00lít. Câu 7: Đốt cháymgam hỗn hợp bakim loại Mg,Cu,Znthu được 34,5gam hỗn hợp rắn X gồm baoxitkim loại. Để hòatan hết hỗn hợp X cần vừa đủ dung dịch chứa 0,8molHCl.Giá trị của mlà A. 28,1. B. 21,7. C. 31,3. D. 24,9.
DẠYKÈMQUYNHƠNOFFICIAL Trang13
22 FeS2HClFeClHS3 0,025 0,025mol
Câu 8: Cho tác dụng với 16,2gamkim loại R(cóhóa trị duy nhất) thu được 58,8gam chất rắn X.Cho 2Cl 2O dư tác dụng với X đến khi phản ứng hoàntoànthu được 63,6gam chất rắn Y.Rlà A. Mg. B. Al. C. Zn. D. Ba. Câu 9: Nung53,4gam hỗn hợp gồm FevàCungoàikhôngkhíthu được 72,6gamY gồm CuO,FeO, 23FeO và . Thể tíchdung dịch hỗn hợp HCl2Mvà 1M cần dùng tối thiểu để hòatan hết Ylà 34FeO 24HSO
A. 500ml. B. 600ml. C. 700ml. D. 800ml. Dạng 3: Kim loại tác dụng với axit HCl, loãng 24HSO Phương pháp giải Viết phương trìnhhóa học vàtínhtheo phương trìnhhóa học. 24long 2Kimlo¹i+HCl/HSOMuèi+H
n2n nn Hỗn hợp haiaxit: 24 2HClHSOH n2n2n Bảo toàn khối lượng: 2KLaxitmuèiH mmmm muèiKLgècaxitmmm Ví dụ: ChomgamFetác dụng với dung dịch HCl dư thu được 1,12lítkhí (đktc). Giá trị của mlà 2H
A. 5,60. B. 1,12. C. 2,80. D. 1,40. Hướng dẫn giải
H n0,05mol
DẠYKÈMQUYNHƠNOFFICIAL Trang14
2
22Fe2HClFeClH 0,05 0,05mol m0,05562,8gam Chọn
Chú ý: Chỉ cáckim loại đứng trước Htrongdãy điện hóa mới phản ứng được với HCl, loãng. 24HSO Ngoàitacó thể áp dụng các định luật bảo toàn khối lượng. Bảo toànnguyên tố H: 2 24 2 Ví
HClH HSOH mẫu Ví
Phương trìnhhóa học:
A.
dụ
dụ 1: HòatanhoàntoànFevàodung dịch loãng vừa đủ thu được 4,48lít (đktc). Cô cạn dung 24HSO 2H dịch trong điều kiện khôngcóoxithu được mgam muối khan.Giá trị của mlà
1,08 5,4nmol;n mol M M96
Phương
24 42 M M MHSOMSOH 1,08 5,4mol M M96 Tacó
M MM 1,085,4M24Mg MM96 Vậy
đó làmagie(Mg). Chọn B. Ví dụ 3: Cho5gam hỗn hợp X gồm AgvàAlvàodung dịch HCl dư. Saukhi phản ứng xảy rahoàntoàn,thu được 3,36lítkhí (đktc). Phần trăm khối lượng của AltrongXlà 2H A. 54,0%. B. 49,6%. C. 27,0%. D. 48,6%. Hướng dẫn giải 2H n0,15mol DoAgkhông phản ứng được với dung dịch HCl,nêntacó phương trìnhhóa học: 322Al6HCl2AlCl3H 0,1 0,15mol
DẠYKÈMQUYNHƠNOFFICIAL Trang15
Al
A. 30,4. B. 15,2. C. 22,8. D. 20,3. Hướng dẫn giải 2H n0,2mol Phương trìnhhóa học: 24 42FeHSOFeSOH 0,20,2mol 4FeSO mm0,2.15230,4gam Chọn A. Ví dụ 2: Cho1,08gamkim loại M(hóa trị IIkhông đổi) tác dụng với dung dịch loãng vừa đủ, sau 24HSO phản ứng thu được 5,4gam muối sunfattrunghòa.Kim loại Mlà A. Fe. B. Mg. C. Zn. D. Ca. Hướng dẫn giải 4 M MSO M
trìnhhóa học:
phương trình:
kim loại
m0,1272,7gam
2H n0,3mol
C
A BHClMuèi+H
DẠYKÈMQUYNHƠNOFFICIAL Trang16
Phương
Al %2,7m100%54% 5 22 Zn2HClZnClH1 x xmol 22 Mg2HClMgClH2 y ymol Theo
Chọn A. Chú ý: Hai kim loại không phản ứng được với HCl, loãng thường gặp là Cu và Ag. 24 HSO Ví dụ 4: Hòatanhoàntoàn2,17gam hỗn hợp bakim loại A,B,Ctrongdung dịch HCl dư thu được 2,24lít khí (đktc) vàmgam muối. Giá trị của mlà 2H A. 9,27. B. 5,72. C. 6,85. D. 6,48. Hướng dẫn giải 2H n0,1mol Tacóquátrình: 2
Bảo toànnguyên tố H: 2HClH n2.n2.0,10,2mol
Bảo toàn khối lượng: 2hhkimlo¹iHClmuèiH mmmm muèi 2,170,236,5m0,12
muèi m2,170,2.36,50,1.29,27gam Chọn A. Ví dụ 5: Hòatanhoàntoàn15,4gam hỗn hợp X gồm ZnvàMg bằng dung dịch HCl dư, thu được 6,72lítkhí (đktc). Thể tích (đktc) cần để phản ứng hoàntoàn với hỗn hợp Xtrênlà 2H 2O A. 4,48lít. B. 3,92lít. C. 2,08lít. D. 3,36lít. Hướng dẫn giải
Gọi số mol của ZnvàMg lần lượt làx,ymol.
65x24y15,4*
trìnhhóa học:
phương trình(1)và(2)tacó: 2H nxymol
Chọn D. Bài tập tự luyện dạng 3 Câu 1: Hòatanhoàntoàn6,5gamZn bằng dung dịch loãng,thu được Vlítkhí (đktc). Giá trị của 24HSO 2H Vlà
A. 4,48. B. 2,24. C. 3,36. D. 1,12. Câu 2: Cho hỗn hợp gồm 2,7gamAlvà11,2gamFetác dụng hoàntoàn với dung dịch HCl dư, sau phản ứng thu được Vlít (Ở đktc). Giá trị của Vlà 2H
A. 7,84. B. 8,96. C. 6,72. D. 10,08.
Câu 3: Cho10,0gam bột FevàCu phản ứng với dung dịch HClloãng (dư), đến khi phản ứng xảy rahoàntoàn thu được 3,36lítkhí (đktc). Khối lượng Cutrong10,0gam hỗn hợp là 2H
A. 2,8gam. B. 5,6gam. C. 8,4gam. D. 1,6gam. Câu 4: Hòa tan hoàn toàn 1,58 gam hỗn hợp gồm ba kim loại Fe, Al và Mg bằng dung dịch HCl thu được 1,344lítkhí (đktc). Cô cạn dung dịch sau phản ứng, khối lượng muối khanthu được là 2H
A. 5,84gam. B. 3,71gam. C. 3,77gam. D. 5,96gam. Câu 5: Cho1,67gam hỗn hợp gồm haikim loại ở haichukìliên tiếp thuộc nhómIIAtác dụng hết với dung dịch HCl dư, thoátra0,672lítkhí (ở đktc). Haikim loại đó là 2H
A. BevàMg. B. MgvàCa. C. SrvàBa. D. CavàSr. Câu 6: Cho1,5gam hỗn hợp AlvàMg phản ứng hết với dung dịch HCl dư thu được 1,68lítkhí (đktc). 2H Khối lượng của MgtrongXlà
A. 0,60gam. B. 0,90gam. C. 0,42gam. D. 0,48gam. Câu 7: Hòatan9,14gam hỗn hợp Cu,Mg,Al bằng dung dịch HCl dư thu được 7,84lítkhíX (đktc), dung dịch Yvà2,54gam chất rắn Z. Khối lượng muối cloruacótrongdung dịch Ylà A. 19,025gam. B. 21,565gam. C. 31,450gam. D. 33,990gam.
DẠYKÈMQUYNHƠNOFFICIAL Trang17
xy0,3** Từ (*)và(**)suyra: x0,2;y0,1 Khicho hỗn hợp X phản ứng với tacó phương trìnhhóa học: 2O t 2 2ZnO2ZnO3 0,20,1mol
t 2 2MgO2MgO4 0,10,05 mol
Theo phương trình(3)và(4)tacó: 2O n0,10,050,15mol lít 2O V0,1522,43,36
Câu 8: Hòatanhoàntoàn5,85gam bột kim loại Mvàodung dịch HCl,thu được 7,28lítkhí (đktc). Kim 2H loại Mlà
A. Mg. B. Al. C. Zn. D. Fe. Câu 9: Hoàtanhoàntoàn16gam hỗn hợp MgvàFe bằng dung dịch loãng20% (vừa đủ). Sau phản 24HSO ứng thấy khối lượng dung dịch tăng thêm15,2gam. Nồng độ phần trăm của cótrongdung dịch sau 4MgSO phản ứng là
A. 19,76%. B. 11,36%. C. 15,74%. D. 9,84%. Câu 10: Cho1,8gamkim loại Rvào một bình chứa dung dịch HCl dư, sau phản ứng khối lượng bìnhdung dịch axitHCl tăng thêm1,65gam.Kim loại Rlà A. Mg. B. Ba. C. Be. D. Ca. Dạng 4: Kim loại tác dụng với axit đặc, nóng 324 HNO,HSO Phương pháp giải
• Viết phương trìnhhóa học vàtínhtheo phương trìnhhóa học. Chú ý:Al,Fe,Cr bị thụ động hóatrong đặc, nguội và đặc, nguội (không phản ứng). 3HNO 24HSO
• Sử dụng bảo toànelectronvà phương trìnhionrút gọn (đối với bài và ) H 3NO
°Tacó bảng ghi nhớ: đặc, nóng 24HSO 3HNO Sản phẩm khử (SPK) :khímùi hắc. 2SO S: chất rắn màuvàng. :khímùi trứng thối. 2 HS
:khímàunâu đỏ. 2NO
NO:khíkhôngmàu,hóanâutrongkhôngkhí. :khíkhôngmàu,gây cười. 2 NO :khíkhôngmàu, nhẹ hơn khôngkhí. 2N : muối tan trong dung dịch bazơ tạo khí mùi 43NHNO khai. Chú ý:SPK thường tạo thànhkhicáckim loại 43NHNO như
DẠYKÈMQUYNHƠNOFFICIAL Trang18
Mg,Al,Zn phản ứng với dung dịch loãng.
KLchoe 43 NhËnecñac ¸ ckhÝ KLchoeNhËnecñac ¸ ckhÝNHNO nn nn n 8 etrao®æ in 2 2 SOSHS=2n6n8n 2 2 2 43NONONONNHNO n3n8n10n8n Khối lượng muối 2 4 e SOtrongmuèi ntrao®æ i n 2 3 e NOtrongmuèiKL n ntrao®æ i
3HNO
dụ mẫu Ví dụ 1: Cho21,6gam một kim loại hóa trị IIIkhông đổi tác dụng hết với dung dịch loãng,thu được 3HNO 6,72lítkhí là sản phẩm khử duy nhất (ở đktc). Kim loại đó là 2 NO A. Al. B. Zn. C. Na. D. Mg. Hướng dẫn giải 2 NO n0,3mol Gọi kim loại cần tìmlàM. Quátrìnhcho nhận electron: 3 5 1MM3e2N8e2N Bảo toànelectron: 2 MNO3.n8.n M 3.n8.0,3 M 80,3 n0,8mol 3 M M21,627Al 0,8 Kim loại Mlànhôm(Al). Chọn A. Ví dụ 2: Hòatanhoàntoàn2,46gam hỗn hợp X gồm AlvàCu bằng dung dịch loãng dư, thu được 3HNO dung dịch Xvà0,896lítkhí (ở đktc) khôngmàu,hóanâutrongkhôngkhí,là sản phẩm khử duy nhất. Phần trăm khối lượng của kim loại CutrongX bằng A. 78,05%. B. 66,67%. C. 50,00%. D. 25,00%. Hướng dẫn giải Khíkhôngmàu,hóanâutrongkhôngkhílàkhíNO. NO n0,04mol Gọi số mol của AlvàCutrong hỗn hợp X lần lượt làx,ymol.
DẠYKÈMQUYNHƠNOFFICIAL Trang19 2 4
mmm 43 3
Số molaxit 2 2 StrongSPKSOSHS
2 24 4
StrongSPK
2 2 2 43
3 3
Chú ý: Đối với kim loại tác dụng với dung dịch và
3NO 2
Ví dụ: 2 3 2 3Cu8H2NO3Cu2NO4HO Ví
muèikimlo¹iSOtrongmuèi
muèikimlo¹i NHNOnÕucãNOtrongmuèiKL mmm m
nnnn
HSO
SOtrongmuèi nn n
StrongSPKNONONONNHNO nnn2n2n2n
HNO NtrongSPKNOtrongmuèiKL nn n
Muối +NO+ H
HO
27x64y2,46* Quátrìnhcho nhận electron: 3 5 2AlAl3eN3eN 2 CuCu2e Bảo toànelectron: AlCuNO3.n2.n3.n 3.x2.y3.0,04 3x2y0,12** Từ (*)và(**)suyra: x0,02;y0,03 Cu m0,03641,92gam
Cu %1,92m100%78,05% 2,46
Chọn A. Ví dụ 3: ChomgamCutantrong dư, sau phản ứng thấy có11,2lít (đktc) hỗn hợp khíNOvà có 3HNO 2NO tỉ khối so với oxilà1,0625.Giá trị của mlà A. 20,8. B. 24,0. C. 40,0. D. 44,8. Hướng dẫn giải Theo đề bài: hh hh hh n0,5mol;M34m0,53417gam Gọi số mol của NOvà trong hỗn hợp lần lượt làx,ymol. 2NO
DẠYKÈMQUYNHƠNOFFICIAL Trang20
Tacó
trình: xy0,5x0,375 30x46y17y0,125 Quátrìnhcho nhận electron: 2 5 2 5 4 CuCu2eN3eN N1eN Bảo toànelectron: 2CuNONO2n3nn Cu 2n30,3750,125 Cu 3.0,3750,125 n20,625mol Cuph¶nøng mm0,6256440gam = mCuphảnứng =0,625.64=40gam Chọn C.
hệ phương
Ví dụ 4: Hòa tan hoàn toàn 13 gam Zn trong dung dịch vừa đủ thu được 0,448 lít khí (đktc) và 3HNO 2N dung dịch X chứa mgam muối. Giá trị của mlà A. 37,8. B. 65,6. C. 18,9. D. 39,8. Hướng dẫn giải 2 Zn N n0,2mol;n0,02mol
DẠYKÈMQUYNHƠNOFFICIAL Trang21
(đktc). Giá trị
A. 2,24. B. 1,12. C.
Hướng dẫn giải 3 Cu HCl NaNO n0,075mol;n0,16mol;n0,08mol 3 3 HHCl NNaNO O nn0,16mol nn0,08mol Phương trìnhhóa học: 2 3 2 3Cu8H2NO3Cu2NO4HO 0,0750,160,08 mol Sosánh: 3NO Cu H nnn 30,025;0,02;0,04 82 phản ứng hết, tínhtoán số moltheo . H H
Quátrìnhcho nhận electron: 0 2 5 2ZnZn2e2N10eN Sosánh: 2 ekimlo¹ichoZn ekhÝnhËnN n2n0,4moln10n0,2mol Sản phẩm khử có . 43NHNO 43NHNO 0,40,2 n 80,025mol Bảo toànnguyên tố Zn: 32ZnZnNO nn0,2mol Dung dịch muối X gồm 0,2mol và0,025mol . 32ZnNO 43NHNO muèi m0,2.1890,025.80 39,8gam
Chọn D. Ví dụ 5: Cho4,8gamCuvào200mldung dịch chứa HCl0,8Mvà 0,4M thấy thoátraVlítkhíNO 3NaNO
của Vlà
0,896. D. 0,56.
Theo phương trình: NOH 1 nn0,04mol 4 lít NO VV0,0422,40,896 Chọn C. Ví dụ 6: Hòatanhoàntoàn hỗn hợp X gồm Fe,Cu,Agtrongdung dịch dư. Kết thúc phản ứng thu được 3HNO 13,44lít hỗn hợp khíY (đktc) gồm theo tỉ lệ số mol tương ứng là3:2:1vàdung dịch Z 2 2 NO,NO,NO (không chứa muốỉ ). số mol đã phản ứng là 43NHNO 3HNO
A. 2,5mol. B. 2,4mol. C. 2,3mol. D. 2,2mol. Hướng dẫn giải Y n0,6mol Tỉ lệ về số mol của ,NOvà là3:2:1. 2NO 2 NO Gọi số mol của ,NOvà trongY lần lượt là3x,2x,xmol. 2NO 2 NO Tacó: 3x2xx0,6x0,1 Vậy số mol của ,NOvà trongY lần lượt là0,3mol;0,2mol;0,1mol. 2NO 2 NO Lại có: 2 2 3 NONONOetrao®æ i NOtrongmuèi n nn3n8n 3 NOtrongmuèi n 0,33.0,28.0,11,7mol Lại có: 2 2 NtrongSPKNONONO nnn2n NtrongSPK n0,30,22.0,10,7mol 3 3 HNOph¶nøng NtrongSPKNOtrongmuèi n n n1,70,72,4mol
1,12lítkhíNO 3HNO (đktc). Khối lượng muối thu được là A. 10,76gam. B. 10,67gam. C. 17,60gam. D. 16,70gam. Câu 3: Chomgam bột Fevàodung dịch lấy dư, ta được hỗn hợp X gồm haikhí vàNOcó thể 3HNO 2NO tíchlà8,96lít (đktc) và tỉ khối đối với O bằng 1,3125.Giá trị của mlà
DẠYKÈMQUYNHƠNOFFICIAL Trang22
Chọn B. Bài tập tự luyện dạng 4 Bài tập cơ bản Câu 1: Hòatanhoàntoàn1,6gamCu bằng dung dịch ,thu được Xmol (là sản phẩm khử duy nhất 3HNO 2NO của ).Giá trị của xlà 5N A. 0,15. B. 0,25. C. 0,10. D. 0,05. Câu 2: Cho1,37gam hỗn hợp Mg,Al,Cutác dụng với dung dịch loãng dư thu được
A. 33,60. B. 11,20. C. 1,12 D. 3,36. Câu 4: Cho8,3gam hỗn hợp AlvàFetác dụng với dung dịch loãng dư thìthu được 45,5gam muối 3HNO nitratkhan. Thể tíchkhíNO (đktc, sản phẩm khử duy nhất) thoátralà
A. 4,48lít. B. 6,72lít. C. 2,24lít. D. 3,36lít.
Câu 5: Hòatanmgam hỗn hợp X gồm FevàCu bằng dung dịch dư thu được 6,72lít (đktc) hỗn hợp 3HNO khíB gồm NOvà có khối lượng 12,2gam. số mol phản ứng là 2NO 3HNO
A. 0,7mol. B. 0,8mol. C. 0,9mol. D. 1,0mol.
Câu 6: Hòatan9,6gamCuvào180mldung dịch hỗn hợp 1Mvà 0,5M, kết thúc phản ứng thu 3HNO 24HSO được Vlít (đktc) khíkhôngmàuduy nhất thoátra,hóanâungoàikhôngkhí.Giá trị của Vlà
A. 1,344. B. 4,032. C. 2,016. D. 1,008. Câu 7: Chomgam hỗn hợp gồm Fe,AlvàCutác dụng với dung dịch đặc, nóng, vừa đủ thu được 3,36 24HSO lítkhí ở đktc vàdung dịch Y chứa 22,8gam muối. Giá trị của mlà 2SO
A. 4,2. B. 6,3. C. 8,4. D. 4,8. Câu 8: Cho2,16gamkim loại Mgtác dụng với dung dịch dư thu được 0,896lítkhíNO (đktc) vàdung 3HNO dịch X. Khối lượng muối khanthu được khilàmbay hơi dung dịch Xlà
A. 13,92gam. B. 8,88gam. C. 13,32gam. D. 6,52gam. Câu 9: Hòatanhoàntoàn19,5gam một kim loại Mtrongdung dịch tathu được 4,48lítNO (đktc, là 3HNO sản phẩm khử duy nhất). Kim loại Mlà A. Cu. B. Fe. C. Al. D. Zn. Câu 10: Hòa tan 4,8 gam Cu kim loại trong 120 ml dung dịch X gồm 1M vả 0,5M. Sau khi 3HNO 3HNO phản ứng kết thúcthu được khíNOduy nhất (đktc) vàdung dịch Y. Thể tíchdung dịch NaOH0,5M tối thiểu để kết tủa hết ion trongdung dịch Ylà 2Cu
A. 0,50lít. B. 0,38lít. C. 0,30lít. D. 0,40lít. Bài tập nâng cao
Câu 11: Hòatanhoàntoàn12,42gamAl bằng dung dịch loãng dư, thu được dung dịch Xvà1,344lít 3HNO (ở đktc) hỗn hợp khíY gồm haikhílà và . Tỉ khối của hỗn hợp khíYso với khí là18. số mol 2 NO2N 2H phản ứng là 3HNO A. 1,710mol. B. 0,855mol. C. 0,165mol. D. 0,330mol. Dạng 5: Kim loại tác dụng với dung dịch muối Bài toán 1: Kim
DẠYKÈMQUYNHƠNOFFICIAL Trang23
loại mạnh tác dụng với dung dịch muối Phương pháp giải Cáckim loại Na,K,Ba,Ca,...(kim loại tantrong nước): Ban đầu: 2 2Kimlo¹i+HOKiÒm+H
Sau đó: ( Điều kiện: có kết tủa, bay hơi hoặc chất điện li yếu). KiÒm+MuèiS¶nphÈm Viết phương trìnhhóa học vàtínhtheo phương trìnhhóa học. Ví dụ mẫu Ví dụ 1: Chomgam hỗn hợp Na,Kvàodung dịch chứa muối thu được dung dịch vẫn cònmàuxanh, 4CuSO 3,36lítkhí (đktc) và chất rắn Bkhôngtan. Lọc lấy chất rắn, đem nungtrongkhôngkhí đến khối lượng 2H không đổi thì được mgam rắn C.Giá trị của mlà
DẠYKÈMQUYNHƠNOFFICIAL Trang24
2
2 2 2Na2HO2NaOHH1 2 2 2K2HO2KOHH2 4 224 CuSO2NaOHCuOHNaSO3 4 224 CuSO2KOHCuOHKSO4 t 2 2 CuOHCuOHO5
2
2
1 1
2 2
2
CCuO
Chọn D. Bài toán 2: Kim loại trung bình/ yếu tác dụng với
Phương pháp giải •
trình hóa học theo thứ tự
ứng
A. 9,8. B. 14,7. C. 4,9. D. 12,0. Hướng dẫn giải
H n0,15mol
Phương trìnhhóa học:
Theo(1)và(2)tacó:
NaOHKOHH nn2.n2.0,150,3mol
Theo(3)và(4)tacó:
NaOHKOH CuOH
n.nn.0,30,15mol
Theo(5)tacó:
CuOCuOH nn0,15mol
mm0,158012gam
dung dịch muối
Viết phương
phản
(nếu nhiều kim loại, nhiều muối phản ứng) và tính theo phương trìnhhóa học: Cáckim loại trungbìnhvà yếu: Kim loại đứng trước đẩy kim loại đứng sau khỏi dung dịch muối.

DẠYKÈMQUYNHƠNOFFICIAL Trang25
Chú ý:Các trường hợp cần nhớ: Muối tác dụng được với muối : 2Fe Ag 2 3 FeAgFeAg
Fetác dụng với muối thì tạo ra muối : 3Fe 2Fe 3 2Fe2Fe3Fe •Ngoàiracó thể áp dụng phương pháp tăng giảm khối lượng: ddgi¶mKLtngKLb¸mvµoKLtanra ddtngKLgi¶mKLtanraKLb¸mvµo mmmm mmmm Ví dụ:mgamFe phản ứng vừa đủ với 200mldung dịch 1M.Giá trị của mlà 4CuSO A. 5,6. B.11,2. C. 16,8. D. 22,4. Hướng dẫn giải 4CuSO n0,2mol Phương trìnhhóa học: 4 4 FeCuSOFeSOCu 0,20,2 mol m0,2.5611,2gam Chọn B. Ví dụ mẫu Ví dụ 1: Ngâm một đinh sắt trong100mldung dịch aM.Saukhi phản ứng kết thúc, lấy đinh sắt ra 4CuSO khỏi dung dịch, rửa nhẹ, làmkhô thấy khối lượng đinh sắt tăng thêm1,6gam.Giá trị của alà A. 2,0. B. 0,2. C. 1,0. D. 0,1. Hướng dẫn giải Phương trìnhhóa học 4 4 FeCuSOFeSOCu 1 1 mol Khối lượng thanhFe tăng: 64568gam
DẠYKÈMQUYNHƠNOFFICIAL Trang26
3 32 Fe2AgNOFeNO2Ag1
0,02mol hết,
3
3 3 2 2
XAgCummmm 0,02.1080,04.644,72gam Chọn C. Ví dụ 3: Một hỗn hợp X gồm 6,5gamZnvà4,8gamMgchovào200mldung dịch Y gồm 0,5M 32CuNO và 0,3Mthu được mgam chất rắn Z.Giá trị của mlà 3AgNO A. 23,61. B. 12,16. C. 20,16. D. 21,06. Hướng dẫn giải
x x mol Khối lượng thanhFe tăng: 1,6gam 1,61 x0,2mol 8 Theo phương trình: 4 CuSOFe nn0,2mol 4MCuSO 0,2aC 2M 0,1
Chọn A. Ví dụ 2: Cho2,8gam bột sắt vào200mldung dịch gồm 0,1Mvà 0,5M.Khicác phản ứng 3AgNO 32CuNO xảy rahoàntoànthu được mgam chất rắn X.Giá trị của mlà A. 4,48. B. 3,28. C. 4,72. D. 4,08. Hướng dẫn giải 3 32 Fe AgNO CuNO n0,05mol;n0,02mol;n0,1mol
DoAg đứng sauCutrongdãy điện hóa,nêntacó thứ tự phản ứng:
0,050,02
Fe dư:
AgNO 00,02,050,04mol 2
FeCuNOFeNOCu2 0,040,1 0,04mol
Fe hết, dư.
32CuNO Chất rắn X gồm Ag(0,02mol)vàCu(0,04mol).
Chọn D. Bài tập tự luyện dạng 5 Bài tập cơ bản Câu 1: Ngâm một thanhZnvào một cốc thủy tinh chứa 50mldung dịch 0,5M đến khidung dịch 32CuNO trong cốc mất hẳn màuxanh,thì khối lượng thanhZnsau phản ứng sẽ
A. tăng 0,025gamso với ban đầu.
B. giảm 0,025gamso với ban đầu. C. giảm 0,1625gamso với ban đầu.
D. tăng 0,16gamso với ban đầu.
Câu 2: Nhúng một thanhnhôm nặng 45gamvào400mldung dịch 0,5M.Sau một thời gian lấy thanh 4CuSO nhômracân nặng 46,38gam. Khối lượng Cuthoátralà
A. 0,64gam. B. 1,28gam. C. 1,92gam. D. 2,56gam. Câu 3: Ngâm một đinh sắt trong200mldung dịch xM.Saukhi phản ứng hoàntoàn, lấy đinh sắt ra 4CuSO khỏi dung dịch, rửa nhẹ, làmkhô thấy khối lượng đinh sắt tăng thêm3,2gam. Giả sử tất cả lượng Cusinhra đều bám hết vào đinh sắt. Giá trị của Xlà A. 1,0. B. 1,5. C. 2,0. D. 0,5.
DẠYKÈMQUYNHƠNOFFICIAL Trang27 2 32 3 3 Cu CuNO Zn Mg Ag AgNO NO n0,1moln0,1mol n0,1mol;n0,2mol; n0,06mol n0,06mol n0,26mol Thứ tự phản ứng: 3 32 3 3 2 2 3 32 3 3 2 2 Mg2AgNOMgNO2Ag1 0,030,06 0,06mol MgCuNOMgNOCu2 0,10,1 0,1mol Zn2AgNOZnNO2Ag3 ZnCuNOZnNOCu4 Ta thấy: Chỉ xảy ra phản ứng
dư. Chất
Z
dư
(1)và(2)vàMgcòn
rắn
gồm Cu(0,1mol);Ag(0,06mol);Zn(0,1mol)vàMg
0,20,10,30,07mol ZCuAgZnMgdmmmmmm 0,1.640,06.1080,1.650,07.2421,06gam
Câu 4: Cho51,75gam bột kim loại Mhóa trị IIvào200mldung dịch 1M.Saukhi phản ứng xảy ra 2CuCl hoàntoàn,thu được 51,55gam hỗn hợp kim loại. Kim loại Mlà A. Fe. B. Mg. C. Zn. D. Pb. Câu 5: Hòatan3,9gam hỗn hợp bột MgvàAlvào100mldung dịch 2M, phản ứng vừa đủ, saukhi 2FeCl phản ứng hoàntoànthu được agam chất rắn. Khối lượng bột MgvàAl lần lượt là
A. 2,4gamvà1,5gam.
B. 2,7gamvà1,2gam. C. 1,2gamvà2,7gam. D. 0,96gamvà2,94gam.
Câu 6: Cho 0,3 mol magie vào 100 ml dung dịch hỗn hợp chứa 2M và 1M, sau khi 33FeNO 32CuNO phản ứng xảy rahoàntoàn, giả sử chỉ xảy ra phản ứng giữa kim loại vàdung dịch muối. Khối lượng kim loại thu được là
A. 12,00gam. B. 11,20gam. C. 13,87gam. D. 16,60gam. Câu 7: Cho0,288gamMgvà1,95gamZntác dụng vừa đủ với Vmldung dịch Xcó chứa đồng thời 4FeSO 0,15Mvà 0,2M.Khicác phản ứng xảy rahoàntoànthu được chất rắn chứa haikim loại. Giá trị của V 4CuSO là
A. 80. B. 100. C. 200. D. 120. Câu 8: Choagam hỗn hợp bột X gồm ZnvàFevào một lượng dư dung dịch ,sau phản ứng hoàntoàn, 4CuSO lọc bỏ phần dung dịch, thu được agam bột rắn. Phần trăm theo khối lượng của Fetrrong hỗn hợp Xlà A. 9,86%. B. 85,30%. C. 82,20%. D. 90.27%. Bài tập nâng cao
Câu 9: Cho2,74gamkim loại Bavào12gamdung dịch hỗn hợp chứa 0,005mol và0,005mol 44 2 NHSO sau đó đun nóng để đuổi hết khí.Saukhi kết thúc tất cả các phản ứng thu được dung dịch X(coi như 4CuSO nước bay hơi không đáng kể). Nồng độ phần trăm của chất tantrongdung dịch Xlà A. 14,60%. B. 14,92%. C. 9,75%. D. 12,80%.
Câu 10: Cho hỗn hợp gồm MgvàZncó tỉ lệ mol tương ứng 2:1vào500mldung dịch 0,2Mvà 243FeSO 0,3M.Saukhicác phản ứng xảy rahoàntoàn (giả sử chỉ xảy ra phản ứng giữa kim loại vàdung dịch 4CuSO muối), thu được dung dịch Yvàmgam chất rắn Z.Chodung dịch NaOH dư vàodung dịch Y, lấy kết tủa nung ngoàikhôngkhí đến khối lượng không đổi, thu được 15,2gam hỗn hợp chứa haioxit.Giá trị của mlà A. 12,88. B. 13,32. C. 17,44. D. 9,60. ĐÁP ÁN Dạng 1: Lí thuyết
DẠYKÈMQUYNHƠNOFFICIAL Trang28
trọng tâm 1–C 2–B 3–D 4–C 5–C 6–B 7–D 8–D 9–C 10–D 11–B 12–A 13–C 14–C 15–B Câu 1:
Kim loại cótính chất vật líchunglà dẫn điện, dẫn nhiệt, dẻo vàcóánhkimgâynên bởi sự có mặt của các
electron tự dotrong mạng tinh thể kim loại.
Câu 2:Tính chất hóa học chung của kim loại làtính khử n MMne
Câu 3: A,B,C đúng. Dsaivìkim loại dẫn điện tốt nhất làAg.
Câu 5: Na,Catác dụng với nước tạo dung dịch bazơ.
Câu 6:
Phương trìnhhóa học: 4 4 FeCuSOFeSOCu
Kim loại Cusinhracómàu đỏ bámtrên đinh sắt, màuxanh của dung dịch nhạt dần. 4CuSO
Câu 7:
Kim loại cứng nhất làCr,kim loại mềm nhất làK,Rb,Cs Dsai.
Câu 10:
Theoquy tắc ,Cu phản ứng được với dung dịch và . 33FeNO 3AgNO
Culàkim loại nên phản ứng được với .3HNO Cukhông phản ứng được với 32PbNO
Câu 11:
Trongdãy điện hóa từ tráisang phải, tính khử giảm dần nêndãy gồm cáckim loại được xếp theo thứ tự tính khử tăng dần từ tráisang phải là:Fe,Al,Mg. Câu 15: Cóhaikim loại phản ứng được với badung dịch muối trênlàNavàAl.
DẠYKÈMQUYNHƠNOFFICIAL Trang29
Dạng 2:
dụng
1–A 2–A 3–B 4–B 5–C 6–C 7–A 8–B 9–B Câu 1: 3AlCl n0,1mol Phương trìnhhóa học: t 2 32Al3Cl2AlCl 0,1 0,1mol
Kim loại tác
với phi kim
m0,1272,7gam Câu 2: MgOMg Mg nn0,1molm2,4gam Câu 3: Bảo toàn khối lượng: 2 2 OoxitR O mmm15,38,17,2gamn0,225mol
R M8,19n 0,9 Với RlàAl. R n1M27 Câu 4: Giả sử haikim loại cần tìmcócông thức làAvàB. Gọi công thức trungbình của haikim loại AvàBlà . M Phương trìnhhóa học: t 2 2MCl2MCl
Theo phương trình: MMClnn 5,415,95 MM35,5 M18,17 Mà AMBMMM
DẠYKÈMQUYNHƠNOFFICIAL Trang30
Gọi kim loại Rcóhóa trị n(). n1,2,3 Phương trìnhhóa học: 2 2n4RnO2RO 0,90,225mol n AvàBlàLi()vàNa(). M7 M23 Câu 5: Bảo toàn khối lượng: 2 ClmuèiKl mmm28,77,421,3gam lít 2 2 Cl Cl n0,3molV6,72 Câu 6: Tacó: oxitKLOoxit Ooxit mmm5,964,041,92gamn0,12mol Bảo toànnguyên tố O: 2 HOOoxit nn0,12mol
DẠYKÈMQUYNHƠNOFFICIAL Trang31
V(lít)là thể tíchdung dịch hỗn hợp HClvà 24HSO 24 HCl HSO n2Vmol;nVmol Tacó: oxitklOoxit Ooxit mmm72,653,419,2gamn1,2mol Bảo toànnguyên tố O: 2 HOOoxit nn1,2mol Bảo toànnguyên tố H: 24 2 HClHSOHO n2n2n 2V2V21,2V0,6 Thể tíchdung dịch axit cần dùnglà0,6lít=600ml. Dạng 3: Kim loại tác dụng với axit HCl, loãng 24HSO 1–B 2–A 3–D 4–A 5–D 6–A 7–C 8–B 9–B 10–A Câu 1: Zn n0,1mol Tacó: lít 2 2 ZnH H nn0,1molV0,1.22,42,24
Bảo toànnguyên tố H: 2 HClHO n2n0,1220,24mol lít. HCl V0,240,12 2 Câu 7: Bảo toànnguyên tố H: 2 HCl HO n n20,4mol Bảo toànnguyên tố O: 2 HOOoxit nn0,4mol KloxitOoxit mmm34,50,4.1628,1gam Câu 8: Bảo toàn khối lượng: 2 2 ClXR Cl mmm58,816,242,6gamn0,6mol
2 2 OYX O mmm63,658,84,8gamn0,15mol
Gọi hóa trị của kim loại Rlàn(). n1,2,3
Bảo toànelectron: 2 2 RClOR 2.0,64.0,151,8n.n2n4nn mol nn
R M16,29n 1,8 n
Với RlàAl. R n3M27 Câu 9: Gọi
Câu 2: Al Fe n0,1mol;n0,2mol Tacó: 2 HFeAl 33 nnn0,2.0,10,35mol 22 lít V0,35.22,47,84 Câu 3: DoCukhông phản ứng được với dung dịch HClmà chỉ cóFe phản ứng nên: 2FeH nn0,15mol Fe m0,15.568,4gam Cu m108,41,6gam Câu 4: 2 2 H HClH n0,06moln2n0,12mol Bảo toàn khối lượng: muèi m1,580,12.36,50,06.25,84gam
Câu 5: 2H n0,03mol Gọi công thức chung của haikim loại thuộc haichukìliên tiếp thuộc nhómIIAlà . M Tacó: 2MH M 1,67 nn0,03molM55,67 0,03 Mà Haikim loại đó làCavàSr. CaMSrMMM Câu 6: 2H n0,075mol
DẠYKÈMQUYNHƠNOFFICIAL Trang32
Từ (*)và(**)suyra: 11 x;y3040 Mg 1 m.240,6gam 40 Câu 7: KhíXlà 2H 2H n0,35mol Bảo toànnguyên tố H: 2HClH n2n0,3520,7mol Bảo toàn khối lượng: 2KlHClmuèiCrH mmmmm muèi m9,140,7.36,52,540,35.231,45gam
Gọi số mol của Al,Mg lần lượt làx,ymol. 27x24y1,5* Bảo toànelectron: 2AlMgH 3n2n2n3x2y0,15**
Tacó phương trình: M M 5,850,325M9n 2Mn Với Kim loại Mlànhôm(Al). M n3M27 Câu 9: Gọi số mol của Mg,Fetrong hỗn hợp ban đầu lần lượt làx,ymol. 24x56y16* Tacó: 2 2 2 dungdÞchtngklHH H mmmm1615,20,8gamn0,4mol MgSO MgSO ddsau
Bảo toàneletron: 2MgFeH 2n2n2nxy0,4** Từ (*)và(**)suyra: xy0,2 m 0,2120 C% .100%.100%11,36% m 211,2 Câu 10: Giả sử kim loại Rcóhóa trị n(). n1,2,3 Phương trìnhhóa học: n22R2nHCl2RClnH Tacó: b×nhtngkimlo¹ikhÝkhÝkimlo¹ib×nhtng mmmmmm1,81,650,15gam 2H 0,15 n0,075mol 2 Theo phương trình: 2RH R 220,15 nn0,075molM12n nnn
Bảo toànnguyên tố H: 24 2HSOH nn0,4mol
DẠYKÈMQUYNHƠNOFFICIAL Trang33
Câu 8: 2H n0,325mol Gọi kim loại Mcóhóa trị n(). n1,2,3 Phương trìnhhóa học: n2 M
2M2nHCl2MClnH 5,85 0,325mol M 24HSO ddban®Çu m100%0,4.98.100 m 196gamC%20 ddsau m19615,2211,2gam 4 4
DẠYKÈMQUYNHƠNOFFICIAL Trang34
3
2
X X
Từ
Bảo toànelectron: 2 FeNONOFe Fe 0,33.0,13nn3nn20,2molm11,2gam Câu 4: Tacó: 3 3muèiklNONO mmmm45,58,337,2gam 3 etrao®æ i NO 37,2 nn==0,6mol 62 Lại có: lít NONO NO etrao®æ i 0,6 n3nn0,2molV0,222,44,48 3 Câu 5: Gọi số mol của NOvà trong hỗn hợp khíB lần lượt làxvàymol. 2NO Tacó hệ phương trình: xy0,3x0,1 30x46y12,2y0,2 Lại có: 2 3 NONO trao®æiNO nn3nn30,10,20,5mol Bảo toànnguyên tố N: 3 2 3 HNONNONO O nnnn0,50,20,10,8mol Câu 6:
Với RlàMg. R n2,M24
Dạng 4: Kim loại tác dụng với axit đặc, nóng 324 HNO,HSO 1–D 2–B 3–B 4–A 5–B 6–C 7–C 8–A 9–D 10–B 11–A Câu 1: Bảo toànelectron: 2 NOCu 1,6 n2n20,05mol 64
Câu 2: NO n0,05mol
Tacó: 3 NOetrao®æ i NOtrongmuèi n n3n3.0,050,15mol
muèikimlo¹iNOtrongmuèimmm 1,3762.0,1510,67gam
Câu 3: X n0,4mol
Gọi số mol của ,NOtrong hỗn hợp khíX lần lượt làx,ymol. 2NO xy0,4* Tacó:
X/O
d1,3125M1,31253242M420,416,8gam46x30y16,8**
(*)và(**)suyra: x0,3;y0,1
DẠYKÈMQUYNHƠNOFFICIAL Trang35
2 4
kl
43 32 3 muèi
Câu
Gọi
số
Bảo toànelectron: MNOM 0,6 nn3nnmol n M M19,532,5n 0,6 n Với MlàZn. M n2M65 Câu 10: 3 24 Cu HNO HSO n0,075mol;n0,12mol;n0,06mol 3 H NO n0,120,0620,24mol;n0,12mol Phương trìnhhóa học: 2 3 2 3Cu8H2NO3Cu2NO4HO 0,0750,240,12 mol
3 24 Cu HNO HSO n0,15mol;n0,18mol;n0,09mol
3 H NO n0,1820,090,36mol;n0,18mol
Phương trìnhhóa học: 2 3 2 3Cu8H2NO3Cu2NO4HO 0,150,360,18 0,09mol
Ta thấy: phản ứng hết. 3NO Cu H n nn 30,05;0,045;0,09H 8 2
Theo phương trình,tacó: lít NO NO n0,09molVV0,09.22,42,016
Câu 7: Tacó: 2 2 2 4 4 SOetrao®æ i SOSO n2n2nn0,15mol Mà
muèikl
SO mmmm22,80,15.968,4gam
Câu 8: Mg NO n0,09mol;n0,04mol
Nhận thấy: Có muối . MgNO2n3n 43NHNO Bảo toànelectron: 43 43 3 MgNONHNONHNO 2.0,093.0,042n3n8nn 87,510mol
NHNOMgNO mmm0,091487,5108013,92gam
9: NO n0,2mol
nlà
oxihóa của Mtrong muối nitrat.
DẠYKÈMQUYNHƠNOFFICIAL Trang36 Nhận
Cu
0,0750,240,12 382 H 3NO Dung
2 2 43 Cu0,075mol,H0,240,0758:30,04mol,SO,NO 2 NaOHCuH n2nn20,0750,040,19mol lít. NaOH V0,190,38 0,5 Câu 11: Al Y n0,46mol;n0,06mol Gọi số molkhí và trong hỗn hợp Y lần lượt làx,ymol. 2 NO2N xy0,06mol* Tacó: 2Y/H Y 44x28yd18M36 3644x28y2,16** xy Từ (*)và(**)suyra: x0,03;y0,03 Nhận thấy: Sản phẩm khử có cả . 2 2 Al HOH 3n1,388n10n0,54 43NHNO 43NHNO 1,380,54 n 80,105mol Tacó: 3 2 2 43 AlNOtrongmuèikimlo¹i NtrongSPKNONNHNO n 3n1,38mol n2n2n2n0,33mol 3 HNOp n1,380,331,71 Dạng 5: Kim loại tác dụng với dung dịch muối 1–B 2–C 3–C 4–C 5–C 6–A 7–D 8–A 9–A 10–C Câu 1: Dung dịch trong cốc mất hẳn màuxanh phản ứng hết. 32CuNO 32CuNO n0,025mol Phương trìnhhóa học: 3 3 2 2 ZnCuNOZnNOCu 0,0250,025 0,025mol kimlo¹igi¶m m0,02565640,025gam Câu 2:
thấy:
phản ứng hết, và dư.
dịch Y chứa:
Gọi số molCuthoátralàxmol. Phương trìnhhóa học: 4 243 2Al3CuSOAlSO3Cu 2x xmol 3
kimlo¹itngCuAl 2x mmm46,384564x.27x0,03 3 Cu m0,03.641,92gam Câu 3: 4CuSO n0,2xmol Phương trìnhhóa học: 4 4 FeCuSOFeSOCu 0,2x0,2x 0,2xmol Tacó: tng m0,2x.64563,2x2 Câu 4: Sau phản ứng thu được hỗn hợp kim loại nên hết, kim loại Mcòn dư. 2CuCl 2CuCl n0,2mol
Phương trìnhhóa học: 2 2 MCuClMClCu 0,20,2 0,2mol Tacó: Kim loại MlàZn. kimlo¹igi¶m m0,20,2M640,2M65 Câu 5: 2FeCl n0,2mol Gọi số mol của MgvàAltrong hỗn hợp kim loại lần lượt làx,ymol. 24x27y3,9* Bảo toànelectron: MgAlFe 2n3n2n2x3y0,4** Từ (*)và(**)suyra: x0,05;y0,1 Mg Al m0,05.241,2gam;m0,1.272,7gam Câu 6: 33 32 Fe(NO) CuNO n0,2mol;n0,1mol Quátrìnhcho- nhận electron:
DẠYKÈMQUYNHƠNOFFICIAL Trang37
DẠYKÈMQUYNHƠNOFFICIAL Trang38
Từ (*)và(**)suyra: 65x56y64xyx8y Fe 56y 56y %m .100% .100%9,72% 65x56y658y56y Câu 9: Ba n0,02mol Phương trìnhhóa học: 2 22Ba2HOBaOHH 0,02 0,020,02mol 2 44 4 32 2 Ba(OH)NHSOBaSO2NH2HO 0,0050,0050,0050,01mol 4 4 2 2 BaOHCuSOCuOHBaSO 0,0050,0050,0050,005mol Dung dịch sau phản ứng chỉ chứa chất tan 2 2BaOHd BaOH:n0,01mol Bảo toàn khối lượng: ddsauph¶nøngm 2,74120,0220,01170,012330,0059811,71gam 2BaOH C0,01171 %1.100%14,60% 1,71
2 3 2 2 2 MgMg2e Fe1eFe 0,3 0,6mol0,20,20,2mol Cu2eCu 0,10,20,1mol Fe2eFe 0,20,20,1mol klCuFe mmm0,1640,15612gam Câu7: 4 4 3 3 Mg Zn FeSO CuSO n0,012mol;n0,03mol;n0,15V10mol;n0,2V10mol Bảo toànelectron: 2 2MgZnFeCu 2n2n2n2n 3 3 20,01220,0320,15V1020,2V10V120ml Câu 8: Gọi số mol của ZnvàFetrong hỗn hợp X lần lượt làx,ymol. a65x56y* Bảo toànelectron: ZnFeCuCu 2n2n2nnxymol Chất rắn làCu a64xy**
Câu 10:
Gọi số mol của MgvàZn lần lượt là2x,xmol. Để chất rắn chứa haioxitthìdung dịch Y phải chứa (2xmol); (xmol); (ymol)và ( 2Mg 2Zn 2Fe 2 4SO 0,45mol). Bảo toàn điện tích: (*) 22x2x2y0,4526x2y0,9 HaioxitlàMgOvà .23FeO Bảo toànnguyên tố: 2 2 23 MgO FeO Mg Fe 1 nn2xmol;nn0,5ymol 2
toànnguyên tố FevàCu Z chứa 0,14molFevà0,15molCu. Z m0,14.560,15.6417,44gam
Trang39
DẠYKÈMQUYNHƠNOFFICIAL
402x1600,5y15,280x80y15,2** Từ (*)và(**)suyra: x0,13;b0,06 Bảo
BÀI 10: ĐIỀU CHẾ KIM LOẠI
Mục tiêu
Kiến thức
+Trìnhbày được nguyên tắc chung để điều chế kim loại.
+Nêu được nguyên tắc điều chế kim loại bằng phương pháp điện phân.
+Nêu được nguyên tắc điều chế kim loại bằng phương pháp nhiệt luyện.
+Nêu được nguyên tắc điều chế kim loại bằng phương pháp thủy luyện. Kĩ năng
+ Biết cách lựa chọn được phương pháp điều chế kim loại cụ thể chophù hợp.
+ Viết được các phương trìnhhóa học điều chế kim loại cụ thể.
+ Giải được các bài tập về tính khối lượng nguyên liệu sản xuất được một lượng kim loại xác định theo hiệu suất hoặc ngược lại…
DẠYKÈMQUYNHƠN
Trang1 CHƯƠNG 5
OFFICIAL
I. LÍ THUYẾT TRỌNG TÂM
A. Nguyên tắc chung Khử ionkim loại thànhnguyên tử: n MneM
B. Phương pháp
1. Phương pháp nhiệt luyện Điều chế kim loại cótính khử trungbình như: Zn,Fe,Sn, Pb… Nguyên tắc: Oxitkim loại Kim loại 2 C,CO,H,Al
2. Phương pháp thủy luyện Điều chế những kim loại có tính khử yếu như: Cu, Hg, Ag,Au… Nguyên tắc: Kim loại mạnh đẩy kim loại yếu ra khỏi dung dịch muối của nó.
3. Phương pháp điện phân
a. Điện phân nóng chảy Điều chế kim loại hoạt động hóa học mạnh như: K, Na, Ca,Mg,Al. Nguyên tắc: Khử ionkim loại bằng dòng điện (Điện phân nóng chảy muối, bazơ, oxit của các kim loại có tính khử mạnh).
b. Điện phân dung dịch Điều chế kim loại hoạt động trungbình hoặc yếu. Nguyên tắc: Điện phândung dịch muối của chúng. Công thức Faraday: AIt m nF
Trong đó: m: Khối lượng chất thu được ở cực âm(gam).
A: Khối lượng molnguyên tử chất thu được ở điện cực.
n: Số electronmànguyên tử hoặc ion đã cho hoặc nhận.
I: Cường độ dòng điện (ampe).
t: Thời gian điện phân(giây).
F: Hằng số Faraday(F=96500).
Ví dụ: Fe2O3 +3CO 2Fe+3CO2 t
Ví dụ: Fe+ → +Cu 2Cu2Fe
Ví dụ: 2Al2O3 4Al+3O2 ↑ dpnc Ở catot: 33 AleAl
Ở anot: 2 2 24 OOe
Ví dụ: CuCl2 Cu+Cl2 dpdd
Ở catot: 22 CueCu Ở anot: 2 22 ClCle
DẠYKÈMQUYNHƠN
Trang2
OFFICIAL
NHIỆT LUYỆN
ĐIỀU CHẾ KIM LOẠI
Nguyên tắc chung: Khử ion kim loại thành nguyên tử: M n+ + ne → M
THỦY LUYỆN
HÓA
Điều chế kim loại cótính khử trungbình như: Zn,Fe,Sn,Pb…
Nguyên tắc: Oxitkim loại Kim loại 2 C,CO,H,Al
Điều chế những kim loại cótính khử yếu như: Cu,Hg,Ag,Au..
Nguyên tắc: Kim loại mạnh đẩy kim loại yếu ra khỏi dung dịch muối của nó.
Điện phân nóng chảy
Điện phân nóng chảy muối, bazơ, oxit của các kim loại có tính khử mạnh như: K, Na, Ca,Al. dpnc n 22MCl2MnCl dpnc xy 2 y MOxMO 2 dpnc 22 n 4MOH4M2nHOnO
ĐIỆN PHÂN
Điện phân dung dịch
Công thức Faraday
Khối lượng mol nguyên tử của chất thu được ở điện cực.
Cường độ dòng điện (A).
A.I.t m nF
Khối lượng chất thu được ở điện cực (gam).
Thời gian điện phân (giây).
Điện phân dung dịch muối của các kim loại có tính khử yếu và trung bình như Zn, Fe, Sn,Pb,Cu,Hg,Ag,… Catot (-): sự khử :không bị điện phân. 3LiAl Thứ tự điện phân: 322 AgFeCuFe...
Anot (+): sự oxi hóa Một số anion gốc axit 2 3 434 SO,NO,PO,... không bị điện phân. Thứ tự điện phân: 2 2 SIBrClRCOOOHHO
etraodoi I.t n F
Số electronmà nguyên tử hoặc ion đã cho hoặc nhận.
Hằng số Faraday (F=96500).
DẠYKÈMQUYNHƠN
Trang3 SƠ ĐỒ
OFFICIAL
HỆ THỐNG
II. CÁC DẠNG BÀI TẬP
Dạng 1: Lí thuyết trọng tâm Ví dụ mẫu
Ví dụ 1: Nguyên tắc chung để điều chế kim loại là
A. oxihóaionkim loại trong hợp chất thànhnguyên tử kim loại.
B. khử ionkim loại trong hợp chất thànhnguyên tử kim loại.
C. cho hợp chất chứa ionkim loại tác dụng với chất oxihóa.
D. cho hợp chất chứa ionkim loại tác dụng với chất khử.
Hướng dẫn giải
Nguyên tắc điều chế kim loại là khử ionkim loại thànhnguyên tử. n MneM
→ Chọn B. Ví dụ 2: Dãycáckim loại có thể điều chế bằng phương pháp nhiệt luyện là: A. Na,Fe,Cu B. Fe,Cu,Zn C. Mg,K,Cu D. Na,Ca,Ba
Hướng dẫn giải Phương pháp nhiệt luyện dùng để điều chế cáckim loại trungbìnhvà yếu.
→ Cáckim loại đứng sauAltrongdãy điện hóa đều có thể được điều chế bằng phương pháp nhiệt luyện. VìNa,Mg,K,Ca,Ba đều đứng trước Altrongdãy điện hóa → Loại A,C,D.
→ Chọn B.
Ví dụ 3: Cho một luồng khíH2 dư đi qua ống sứ chứa CuO,PbO,CaO,Al2O3, Fe2O3 nungnóng ở nhiệt độ cao.Saukhi phản ứng xảy rahoàntoàn, chất rắn còn lại trong ống sứ là:
A. Cu,Pb,Ca,Al2O3,Fe B. CuO,PbO,Ca,Al,Fe C. Cu,Pb,CaO,Al2O3,Fe D. Cu,PbO,CaO,Al,Fe Hướng dẫn giải
H2 khử được oxit của cáckim loại đứng sauAltrongdãy điện hóathànhkim loại.
→ H2 khử được CuO,PbO,Fe2O3 thànhCu,PbvàFe.
→ Chất rắn còn lại trong ống sử làCu,Pb,CaO,Al2O3,Fe.
→ Chọn C. Ví dụ 4: Trongquátrình điện phândung dịch Pb(NO3)2 với các điện cực trơ, ion di chuyển về 2Pb
A. anotvà bị khử. B. catotvà bị oxihóa. C. catotvà bị khử. D. anotvà bị oxihóa. Hướng dẫn giải
DẠYKÈMQUYNHƠN
Trang4
OFFICIAL
Trongquátrình điện phândung dịch Pb(NO3)2 với các điện cực trơ, ion di 2Pb chuyển về phíacatot và xảy raquátrình khử ion thànhkim loại. 2Pb 2 Pb2ePb Bênanot xảy raquátrình điện phân nước. 2H2O → O2 + +4e 4H → Chọn C. Ví dụ 5: Hình vẽ sau đây mô tả thí nghiệm khíXtác dụng với chất rắn Y,nung nóngsinhrakhíZ:
Phản ứng hóa học nàosau đây thỏa mãnthí nghiệm trênlà?
A. CaSO3 +2HCl CaCl2 +SO2 +H2O t
B. CuO+CO Cu+CO2 t
C. 2C+Fe3O4 3Fe+2CO2 t D. Fe2O3 +3H2 2Fe+3H2O t

Hướng dẫn giải KhíZ được tạo thành từ khíXvà chất rắn Y → Loại A,C. KhíZsinhralàm vẩn đục dung dịch nước vôitrong → Loại D. Vậy phản ứng hóa học thỏa mãnthí nghiệm trênlà: CuO+CO Cu+CO2 t (KhíZ) KhíZlàm vẩn đục nước vôitrong: CO2 +Ca(OH)2 → CaCO3 +H2O → Chọn B. Bài tập tự luyện dạng 1 Câu
oxitkim loại thànhkim loại ở nhiệt độ cao. D. dùngkim loại cótính khử mạnh đẩy kim loại cótính khử yếu hơn ra khỏi dung dịch muối. Câu 2: Phương phápduy nhất để điều chế kim loại kiềm là A. nhiệt luyện. B. điện phânnóng chảy. C. thủy luyện. D. điện phândung dịch.
DẠYKÈMQUYNHƠN
Trang5
OFFICIAL
1: Nguyên tắc điều chế kim loại là A. oxihóaionkim loại
B. khử ionkim loại
C.
2
thànhkim loại.
thànhnguyên tử kim loại.
dùngH
hoặc CO để khử
Câu 3: Kim loại nàosau đây không thể điều chế bằng phương pháp thủy luyện?
A. Ag B. Mg C. Cu D. Fe Câu 4: Nungnóng hỗn hợp bột MgO,Fe2O3,PbO,Al2O3 ở nhiệt độ cao rồi chodòngkhíCO (dư) đi qua hỗn hợp thu được chất rắn gồm: A. MgO,Fe,Pb,Al2O3 B. MgO,FeO,Pb,Al2O3 C. MgO,Fe,Pb,Al D. Mg,Fe,Pb,Al
Câu 5: Phản ứng điều chế kim loại nào dưới đây thuộc
hành phản ứng khử oxitXthànhkim loại bằng khí H2 (dư) theo sơ đồ hình vẽ bên.OxitXlà A. Al2O3 B. FeO C. K2O D. MgO Câu 8: Phương phápchung để điều chế Na,Ca,Altrongcông nghiệp là

A. thủy luyện. B. nhiệt luyện. C. điện phândung dịch. D. điện phânnóng chảy. Câu 9: Để thu được kim loại Cu từ CuSO4 bằng phương pháp thủy luyện có thể dùngkim loại nàosau đây?
A. Fe B. Na C. Ag D. Ca
Câu 10: Dãy gồm cácoxit đều bị Al khử ở nhiệt độ caothànhkim loại là:
A. FeO,CuO,Cr2O3 B. FeO,MgO,CuO C. PbO,K2O,SnO D. Fe3O4,SnO,BaO
Câu 11: Dãy gồm haikim loại đều có thể điều chế bằng phương pháp thủy luyện là:
A. FevàCa B. MgvàNa C. AgvàCu D. FevàBa Câu 12: Dãy gồm haikim loại được điều chế bằng phương pháp nhiệt luyện là: A. Cu,Fe,Pb B. Cu,Fe,Mg C. Na,Ba,Cu D. Na,Ba,Fe Câu 13: Chocáckim loại sau:K,Ba,CuvàAg. Số kim loại điều chế được bằng phương pháp điện phân dung dịch (điện cực trơ) là A. 1 B. 4 C. 3 D. 2 Câu 14: Chocác trường hợp sau: (1) Điện phânnóng chảy MgCl2.(2) Điện phândung dịch ZnSO4. (3) Điện phândung dịch CuSO4.(4) Điện phândung dịch NaCl. Số trường hợp ionkim loại bị khử thànhkim loại là A. 1 B. 2 C. 3 D. 4 Câu 15: Khi điện phân hỗn hợp Cu(NO3)2,AgNO3,HNO3 thì thứ tự xảy ra sự khử của những ionlà: A. B. C. D. 2 Cu,Ag,H
DẠYKÈMQUYNHƠN
Trang6
OFFICIAL
A. MgCl2 → Mg+Cl2 B.
→ Zn+CO C. Zn+CuSO4 → ZnSO4 +Cu D.
2O3 → 4Al+3O2 Câu 6: Khi điện phândung dịch CuCl2 để điều chế kim loại Cu,quátrình
ra
A. B.
D. 2 Cu2eCu 2 Cl2e2Cl 2 CuCu2e 2 2ClCl2e
phương pháp thủy luyện?
C+ZnO
2Al
xảy
ở catot (cực âm)là
C.
Câu 7: Tiến
2Ag,H,Cu
2 Ag,Cu,H
2 Cu,H,Ag
dụ: Cho luồng khíCO (dư) đi qua4,8gam hỗn hợp X gồm CuOvàFe2O3 (tỉ lệ mollà1:1)nung nóng đến khi phản ứng hoàn toàn, thu được m gam chất rắn. Giá trị của mlà A. 3,52 B. 4,48 C. 2,40 D. 4,16 Hướng dẫn giải Gọi số mol của CuOvàFe2O3 lần lượt làa,amol. Tacó: 4,8 a0,02mol 80160
Phương trìnhhóa học: CuO+CO Cu+CO2
DẠYKÈMQUYNHƠN OFFICIAL Trang7 Dạng
Phương
Viết
trìnhhóa
2 t xy 2 2 CCO O MOM HHO Chú ý:
Công
2 2 2 OtrongoxitpuCOpuCO OtrongoxitpuHpuHO nnn nnn Nếu hỗn
2 OtrongoxitpuCOHpu nn Bảo toàn khối lượng: 2 22 oxitCO/HchatranspuCO/HO oxitkimloaiOtrongoxit Otrongoxitpuchatrangiam mmmm mmm mm
t
t
chatranCuFe mmm
→
Ví
Ví
dùng2,24lítkhíH2 (đktc). Giá trị alà A. 5,8 B. 23,2 C. 11,6 D. 17,4 Hướng dẫn giải 2H n0,1mol Phương trìnhhóa học: Fe3O4 +4H2 3Fe+4H2O t 0,025 0,1 mol 34FeO am0,025.2325,8gam → Chọn A. Ví dụ 2: Để khử hoàn toàn 19,36 gam hỗn hợp CuO, FeO, Fe2O3, Fe3O4 cần dùng7,392lítkhíCO (ở đktc). Khối lượng chất rắn sau phản ứng là A. 14,08gam B. 15,08gam C. 10,05gam D. 10,45gam
2: Oxit kim loại tác dụng với chất khử
pháp giải
phương trình hóa học và tính theo phương
học.
Mlàcáckim loại sauAltrongdãy điện hóa.
thức tínhnhanh:
hợp haikhí:
Ví
0,02 → 0,02 mol Fe2O3 +3CO 2Fe+3CO2
0,02 → 0,04 mol
0,02.640,04.563,52gam
Chọn A.
dụ mẫu
dụ 1: Khử hoàntoànagamoxitFe3O4 cần
Hướng dẫn giải CO n0,33mol Tacó: OtrongoxitpuCOphanung nn0,33mol chatrangiamOtrongoxitpu mm0,33.165,28gam Khối lượng chất rắn sau phản ứng là: chatransaupuchatranbandauchatrangiam mmm19,365,2814,08gam → Chọn A. Ví dụ 3: Khử 16gamFe2O3 bằng CO dư, sản phẩm khíchovàobình đựng nước vôitrong dư thu được agam kết tủa. Biết các phản ứng xảy rahoàntoàn.Giá trị của alà A. 30 B. 20 C. 10 D. 40 Hướng dẫn giải 23FeO n0,1mol Phương trìnhhóa học: Fe2O3 +3CO 2Fe+3CO2 t 0,1 → 0,3 mol Sản phẩm khíthu được chovàobìnhCa(OH)2 dư nên 32 CaCOCO nn0,3mol 3CaCO am0,3.10030gam → Chọn A. Ví dụ 4: Trongbìnhkíncó chứa 0,5molCOvàmgamFe3O4 Đun nóngbình cho tới khi phản ứng xảy rahoàntoàn,thu được hỗn hợp khícó tỉ khối so với COban đầu là1,457.Giá trị của mlà A. 16,8 B. 21,5 C. 22,8 D. 23,2 Hướng dẫn giải Hỗn hợp khíthu được sau phản ứng gồm CO dư (xmol)vàCO2 (ymol). Bảo toànnguyên tố C:
DẠYKÈMQUYNHƠN
Trang8
OFFICIAL
Theo đề bài: hh M1,457.2840,796 2 2 COduCO COCO mm 40,796 nn 28x44y40,796 0,5 (**) 28x44y20,398
2CObandauCOduCO nnn0,5mol (*) xy0,5
Từ (*)và(**)suyra: x0,1;y0,4 Phương trìnhhóa học: 4CO+Fe3O4 3Fe+4CO2 t 0,1 0,4 mol
FeO mm0,1.23223,2gam
→ Chọn D. Bài tập tự luyện dạng 2 Bài tập cơ bản Câu 1: Để khử hoàntoàn19,6gam hỗn hợp X gồm Fe,FeO,Fe2O3 cần dùng vừa đủ 2,24lítH2 (đktc). Khối lượng Fethu được là
A. 15gam B. 16gam C. 17gam D. 18gam Câu 2: ChoVlítkhíCO (ở đktc) phản ứng với một lượng dư hỗn hợp chất rắn gồm CuOvàFe3O4 nung nóng.Saukhi phản ứng hoàntoàn, khối lượng hỗn hợp chất rắn giảm 0,32gam.Giá trị của Vlà
A. 0,112 B. 0,224 C. 0,448 D. 0,560 Câu 3: Cho luồng khíCO (dư) đi qua9,1gam hỗn hợp gồm CuOvàAl2O3 nungnóng đến khi phản ứng hoàntoàn,thu được 8,3gam chất rắn. Khối lượng CuOcótrong hỗn hợp ban đầu là
A. 4,0gam B. 8,3gam C. 2,0gam D. 0,8gam Câu 4: ChokhíCOqua ống chứa 15,2gam hỗn hợp gồm CuOvàFeOnungnóng.Sau một thời gianthu được hỗn hợp khíBvà13,6gam chất rắn C.ChoBtác dụng với dung dịch Ca(OH)2 dư thu được mgam kết tủa. Giá trị của mlà
A. 15 B. 10 C. 20 D. 25 Câu 5: Dẫn luồng khí CO dư đi qua 2,4 gam hỗn hợp CuO và Fe2O3 nung nóng đến phản ứng xảy ra hoàntoàn,thu được 1,76gam chất rắn. Phần trăm khối lượng CuOcótrong hỗn hợp ban đầu là
A. 47,06% B. 26,67% C. 66,67% D. 33,33% Câu 6: ChoVlít (đktc) khíH2 đi qua bột CuO đun nóng,thu được 38,4gamCu. Nếu choVlítkhíH2 đi qua bột Fe2O3 đun nóngthì lượng Fethu được là
A. 25,2gam B. 26,4gam C. 22,4gam D. 33,6gam Câu 7: Cho4,48lítkhíCO (đktc) phản ứng với 8gam một oxitkim loại, saukhi phản ứng hoàntoàn,thu được mgamkim loại và hỗn hợp khícó tỉ khối so với H2 là20.Giá trị của mlà
A. 7,2 B. 3,2 C. 6,4 D. 5,6 Câu 8: Chomgam hỗn hợp X gồm CuO,Fe2O3,FeOtác dụng vừa đủ với 100mldung dịch chứa H2SO4 1MvàHCl1M. Để khử hoàntoànmgam hỗn hợp X(nungnóng) cần tối thiểu VlítkhíCO (đktc). Giá trị của Vlà A. 4,48 B. 6,72 C. 3,36 D. 1,12 Bài tập nâng cao Câu 9: DùngCO khử hoàntoàn2,88gam hỗn hợp X gồm Fe,FeO,Fe2O3 thu được 2,24gam chất rắn. Mặt khác, để hòatanhoàntoàn2,88gamX cần vừa đủ 100mldung dịch HCl, nồng độ amol/l. Kết thúc thí nghiệm, thu được 224mlkhí (đktc). Giá trị của alà A. 1,0 B. 0,5 C. 1,6 D. 0,8
DẠYKÈMQUYNHƠN
Trang9
OFFICIAL
34
Câu 10: ChokhíCOquamgam hỗn hợp X gồm FeO,Fe2O3,Fe3O4 nungnóng,sau một thời gianthu được hỗn hợp chất rắn Yvà hỗn hợp khíZ.Chotoàn bộ Zvàodung dịch Ca(OH)2 dư, đến phản ứng hoàn toànthu được 4gam kết tủa. Mặt khác,hòatanhoàntoànYtrongdung dịch H2SO4 đặc, nóng (dư) thu được 1,008lítkhíSO2 (đktc) là sản phẩm khử duy nhất vàdung dịch chứa 18gam muối. Giá trị của m gần nhất với A. 9 B. 6 C. 5 D. 7 Dạng 3: Điện phân
Bài toán 1: Xác định lượng chất trong quá trình điện phân Phương pháp giải
Ví dụ: Điện phân100mldung dịch CuSO4 1M với điện cực trơ, cường độ dòng điện là5Atrong thời gian25phút44giâythì dừng lại. Khối lượng dung dịch giảm sau điện phânlà A. 2,88gam B. 3,84gam C. 2,56gam D. 3,20gam Hướng dẫn giải Đổi: 25phút44giây=25.60+44=1544giây Theo hệ quả của công thức Faraday: etraodoi It51544 n 0,08mol F96500
OFFICIAL
phân.
DẠYKÈMQUYNHƠN
Trang10
etraodoi
n
Tính
đã
chất thu
sau
Chú ý: khikhianotkhicatot VVV dungdichgiamKLkhithoatra mmm catotkimloaicatotmm Chú ý: Nếu biết catot bắt đầu thoát khí → Khí thoátra ở cả hai điện cực. Khi đó nước bắt đầu điện phân ở catot:2H2O+2e → +H2 2OH
Xác định lượng chất trong phản ứng điện phân Công thức Faraday: AIt m nF
Bước 1: Tính etraodoin
It
F
Bước 2: Viết quátrình điện
Bước 3:
lượng chất
điện phân hoặc lượng
được
điện phân.
Ví dụ mẫu Ví
Quátrình điện phân: Ở catot(-): 2 Cu2eCu 0,08 → 0,04mol Ở anot(+):2H2O → O2 + +4e 4H 0,02 0,08mol 2 Cu O m0,04.642,56gam m0,02320,64gam
Tacó: 2dungdichgiamCuO mmm
dungdichgiam m2,560,643,2gam
→ Chọn D.
dụ 1: Điện phân200mldung dịch AgNO3 0,4M với điện cực trơ, I=5A.Sau
19phút18giây, khối lượng Agthu được ở catotlà
A. 7,56gam B. 4,32gam C. 8,64gam D. 6,48gam Hướng dẫn giải Đổi: 19phút18giây=19.60+18=1158giây Theocông thức Faraday: Ag AIt m nF Ag 10851158 m 196500 Ag m6,48gam → Chọn D. Ví dụ 2: Điện phân500mldung dịch CuSO4 0,1M (điện cực trơ) với cường độ dòng điện 10A, thời gian điện phânlà32phút10giây. Tổng thể tíchkhí (đktc) sinhra ở catotvàanotlà A. 1,12lít B. 0,56lít C. 3,36lít D. 2,24lít Hướng dẫn giải Đổi: 32phút10giây=32.60+10=1930giây 4CuSO n0,05mol Tacó: etraodoi It10.1930 n 0,2mol F96500
DẠYKÈMQUYNHƠN
Trang11
OFFICIAL
Ở
2H2O → +O2 +4e 2
4H 2H2
→ +H2 2OH Ở
2 2 etraodoiCH u n2n2n 2H0,22.0,052n 2H 0,22.0,05 n 0,05mol 2 lít 2H V0,0522,41,12 Ở
2etraodoiOn4n 2O0,24n 2O 0,2 n0,05mol 4 lít 2O V0,05.22,41,12 → Tổng thể
ở
Quátrình điện phân: Ở catot(-):
anot(+):
Cu2eCu
O+2e
catot,tacó:
anot,tacó:
tíchkhísinhra
catotvàanotlà lít 1,121,122,24
→ Chọn D.
Ví dụ 3: Điện phândung dịch chứa mgam hỗn hợp gồm Cu(NO3)2 vàKCl bằng điện cực trơ, màng ngăn xốp với cường độ dòng điện không đổi. Sau thời giant giây, ở anotthoátra2,688lít hỗn hợp khí (đktc). Nếu thời gian điện phânlà2t giây, thể tíchkhíthoátra ở anot gấp 3 lần thể tíchkhíthoátra ở catot (đo cùng điều kiện), đồng thời khối lượng catot tăng 18,56gam.Giá trị của mlà A. 55,34 B. 63,46 C. 53,42 D. 60,87
Hướng dẫn giải Quátrình điện phân: Ở catot(-): Ở anot(+): → Cl2 +2e 2 Cu2eCu 2Cl 2H2O+2e → +H2 2H2O → +O2 +4e 2OH 4H Xét thời giantgiây: khioanot n0,12mol Gọi số molCl2 làxmol. 2O n0,12xmol Tacó: 22 etraodoiClO n2n4n2x40,12x0,482xmol Xét thời gian2tgiây: etraodoi n2.0,482x0,964xmol
DẠYKÈMQUYNHƠN
Trang12
OFFICIAL
2 Hkhiocatot 1 0,5x nn.0,240,5x0,08mol 3 3 Khối lượng catot tăng 18,56gam: Cu 18,56 n0,29mol 64 Tacó phương trình: 2etraodoiCuH n2n2n 0,5x0,964x2.0,292.0,08 3 x0,06 Bảo toànnguyên tố Cu,Cl: 32 2 CuCuNO KClCl nn0,29mol n2n2x0,12mol m0,29.1880,12.74,563,46gam
Tacó: 2 2 2 etraodoiCl Cl O n2n0,964x2xnxmoln 0,241,5xmol 44
khioanot nx0,241,5x0,240,5xmol
Chọn B. Bài toán 2: Xác định thời gian điện phân Phương pháp giải Bước 1: Viết quátrình điện phân. Bước 2: Xác định lượng sản phẩm thu được ở một tronghai điện cực. Bước 3: Tính . etraodoin Bước 4: Tính thời gian điện phân: e nF t I
Ví dụ: Điện phân 100 ml dung dịch CuSO4 0,2M vàAgNO3 0,1M với cường độ dòng điện I3,86A .Sautgiây, khối lượng kim loại bámtrêncatotlà 1,72gam.Giá trị của tlà A. 250 B. 1000 C. 500 D. 750 Hướng dẫn giải
phân hết, chưa điện phân: Ag 2Cu kimloaiAg mm0,01.1081,08gam Nếu và đều điện phân hết: Ag 2Cu kimloaiAgCummm 0,01.1080,02.642,36gam
Ta thấy: điện phân hết, 1,081,722,36Ag điện phân một phần.
DẠYKÈMQUYNHƠN OFFICIAL Trang13
Cu
e tn.F0,03.96500750s I3,86 → Chọn D. Ví dụ mẫu Ví dụ 1: Điện phân với điện cực trơ dung dịch chứa 0,2molCu(NO3)2, cường độ dòng điện 2,68A, trong thời gian t (giờ), thu được dung dịch X. Cho 14,4
→
4 3 CuSO AgNO n0,02mol;n0,01mol 2Cu Ag n0,02mol;n0,01mol Ở catot (−): (1) Ag1eAg (2) 2 Cu2eCu Nếu điện
2Cu
Tacó: CukimloaiAgmmm
1,721,080,64gam
n0,01mol
Theo(1),(2): etraodoiAgCu nn2n
0,0120,010,03mol
gam bột FevàoX,thu được khíNO (sản phẩm khử duy nhất của )và13,55N
gam chất rắn. Biết các phản ứng xảy ra hoàn toàn và hiệu suất của quá trình điện phânlà100%.Giá trị của tlà A. 1,00 B. 1,20 C. 0,50 D. 0,25 Hướng dẫn giải 2 3 3 2CuNO Cu NO n0,2moln0,2mol;n0,4mol
thamgia điện phânlàxmol.
điện phân:
catot (−):
DẠYKÈMQUYNHƠN
Trang14
OFFICIAL
Fe → +2e +2e → Cu 2Fe 2Cu +
→
4H 3NO Bảo toànelectron: 2 FeCuH 3 2n2nn 4 Fe 2n2.0,2x0,75.2x Fe n0,20,25xmol Tacó: Fedu m14,4560,20,25x3,214xgam Cu m640,2x12,864xgam Sau phản ứng thu được 13,5gam chất rắn gồm Fe dư vàCusinhra. 3,214x12,864x13,5 x0,05 etraodoi n2x0,1mol → Thời gian điện phânlà: tnF0,1965003600s1h I2,68 → Chọn A. Bài toán 3: Đồ thị Phương pháp giải
Gọi số mol
2Cu Quátrình
Ở
Ở anot(+): 2H2O → O2 + +4e 2 Cu2eCu 4H x → 2x mol 2x 2x mol Sau điện phân, dung dịch X có , 2x mol và 0,4 mol 20,2xmolCu H . 3NO Cho 14,4 gam Fe vào dung dịch X thu được 13,5 gam chất rắn nên ta có quá trìnhtrao đổi electron:
+3e
NO+2H2O
Bước 1: Đặt ẩn I F
Bước 2: Xác định dạng đồ thị. Từ đó viết được quátrình điện phân.
Dạng đồ thị có dạng gấp khúc3 đoạn: Đoạn 2có độ dốc lớn hơn đoạn 1thìkim loại điện phân hết ở đoạn 1,catotthoátrakhíH2 ở đoạn 2. Đoạn 2có độ dốc nhỏ hơn đoạn 1thìkim loại còn dư sau đoạn 1,anotthoátrakhíO2 ở đoạn 2. Bước 3: Tínhtoántheo dữ kiện của đồ thị. Ví dụ mẫu Ví dụ 1: Hòa tan hoàn toàn m gam hỗn hợp CuSO4 và
NaCl vào nước, thu được dung dịch X. Tiến hành điện phânX với các điện cực trơ, màng ngăn xốp, dòng điện có cường độ không đổi. Tổng số molkhíthu được trên cả hai điện cực (n) phụ thuộc vào thời gian điện phân (t) được mô tả như đồ thị bên (đồ thị gấp khúc tại các điểm M,N). Giả sử hiệu suất điện phânlà100%, bỏ qua sự bay hơi của nước. Giá trị của mlà A. 13,42 B. 11,08 C. 15,76 D. 17,48 Hướng dẫn giải Gọi I x F

OFFICIAL
DẠYKÈMQUYNHƠN
Trang15
Ở
(1) (2) 2 Cu2eCu 2 2ClCl2e 2H2O+2e +H2 (3)2H2O +O2 +4e(4) 2OH 4H Do độ dốc của đoạn 2> độ dốc của đoạn 1 → Ở đoạn 2sinhrakhíCl2 vàH2 Xét đoạn 1: Chỉ cóCl2 thoátra (xảy ra(1)và(2)). etraodoi tasnaxmol Lại có: 2 khisinhra ClsinhraoOM n0,04moln0,04mol 2 etraodoi Cl nax2n0,08mol Bảo toànelectron: 2 CuClsinhraOM nn0,04mol → Khi đó đã phản ứng hết: 2Cu 2 4CuSOCCu u nnn0,04mol Xét đoạn 2và3:Khí gồm Cl2,H2 vàO2 (xảy ra(2),(3)và(4)). etraodoi t3,5asn3,5ax0,083,50,080,080,2mol 2H 0,2 n0,1mol 2
Quátrình điện phân: Ở catot(-):
anot(+):
Tacó: (*) 22 ClOetraodoi 2n4nn0,2mol Khísinhra ở đoạn 2,3là: 0,210,040,17mol 222 ClOH nnn0,17mol (**) 22 ClO nn0,170,10,07mol Từ (*)và(**)suyra: 2 2 Cl O n0,04mol;n0,03mol 2 2 2 ClsinhraClsinhradoanOMClsinhraodoan2,3 nnn0,040,040,08mol Bảo toànnguyên tố Cl: 2NaClCl n2n0,16mol m0,04.1600,16.58,515,76gam → Chọn C. Ví dụ 2: Hòa tan m gam hỗn hợp CuSO4 và KClvào nước thu được dung dịch X. Điện phân dung dịch X với cường độ dòng điện không đổi (điện cực trơ, màng ngăn xốp). Thể tíchkhí(V) thoát ra theo thời gian (t) được biểu diễn theo đồ thị bên. Nếu dừng điện phân ở thời điểm 250 giâythu được dung dịch Y.Nhúngthanhnhôm (dư) vào Y, sau khi phản ứng hoàn toàn thu được dung dịch Z. Khối lượng dung dịch Zthay đổi như thế nàoso với dung dịch Y? A. Giảm 1,88gam. B. Tăng 1,84gam. C. Giảm 1,52gam. D. Tăng 0,04gam. Hướng dẫn giải

DẠYKÈMQUYNHƠN OFFICIAL Trang16
x
Quátrình điện phân: Ở catot(-): Ở anot(+): (1) (2) 2 Cu2eCu 2 2ClCl2e 2H2O+2e +H2 (3)2H2O +O2 +4e(4) 2OH 4H Do độ dốc của đoạn 2< độ dốc của đoạn 1 → Ở đoạn 2sinhrakhíO2 Xét đoạn 1: Chỉ cóCl2 thoátra (xảy ra(1)và(2)). etraodoi t200sn200xmol Bảo toànelectron: 2 2 2 CCuCl u CCl l 200x nnn100xmol 2 n2n200xmol Khi đó hết, còn dư. Cl 2Cu Xét đoạn 2:KhísinhralàO2 (xảy ra(1)và(4)).
Gọi I
F
DẠYKÈMQUYNHƠN OFFICIAL Trang17 etraodoi
2
Khi
2
2
Bảo
2 2 Hetraodoi Oetraodoi 1
2 1
4 2
Khi đó khísinhra: 222 ClHO 3,808 nnn0,17mol 22,4 100x62,5x50x0,17 4x810 Từ khi bắt đầu điện phân đến thời điểm 250giây (xảy raquátrình(1),(2)và(3)): 4 etraodoi n2508100,2mol 2Cu Cl n175x0,14mol;n200x0,16mol Quátrình điện phân: Ở catot(-): Ở anot(+): 2 Cu2eCu 2 2ClCl2e 0,10,20,10,16 0,16mol 2H2O +O2 +4e 4H 0,04 0,010,04mol Dung dịch Y gồm (0,04mol), dư (0,14–0,1=0,04mol). H 2Cu Phương trìnhhóa học: 3 2 3 Al+3HAlH 2 0,04 0,02mol 0,04 3 23 2Al3Cu2Al3Cu 0,04 0,04mol 0,08 3
t350sn350x200x150xmol
Bảo toànelectron:
Osinhradoan2 Cusinhradoan2 150x n 37,5xmol 4 150x n 75xmol 2
đó khí đã hết:
Cu
Cu n100x75x175xmol
Xét đoạn 3:Khí gồm H2 vàO2 (xảy ra(3)và(4)). etraodoiodoan3 t450sn450x350x100xmol
toànelectron:
nn50xmol
nn25xmol
O n37,5x25x62,5xmol
Vậy dung dịch Y giảm 1,52gam.
→ Chọn C.
Bài tập tự luyện dạng 3 Bài tập cơ bản
Câu 1: Điện phânnóng chảy muối với điện cực trơ. Khicatotthu được 16gamkim loại Mthì ở n MCl anotthu được 5,6lítkhíCl2 (đktc). Kim loại Mlà
A. Mg B. Fe C. Cu D. Ca Câu 2: Điện phân đến hết 0,2 mol Cu(NO3)2 trong dung dịch với điện cực trơ, thì sau điện phân khối lượng dung dịch đã giảm baonhiêugam?
A. 3,2gam B. 12,8gam C. 16,0gam D. 20,0gam Câu 3: Điện phân500mldung dịch CuSO4 0,4M (điện cực trơ) cho đến khi ở catotthu được 9,6gam kim loại thì thể tíchkhí (đktc) thu được ở anotlà
A. 4,48lít B. 2,24lít C. 1,12lít D. 1,68lít Câu 4: Điện phân dung dịch hỗn hợp gồm 14,9 gam KCl và 28,2 gam Cu(NO3)2 (điện cực trơ, màng ngăn xốp) đến khi khối lượng dung dịch giảm 15,1gamthì ngừng điện phân (giả thiết lượng nước bay hơi không đáng kể). Khối lượng kim loại thu được ở catotlà
A. 15,1gam B. 6,4gam C. 7,68gam D. 9,6gam Câu 5: Điện phân200mldung dịch CuSO4 với điện cực trơ bằng dòng điện một chiều I=9,65A.Khi thể tíchkhíthoátra ở cả hai điện cực đều là1,12lít (đktc) thì dừng điện phân. Khối lượng kim loại sinhra ở catotvà thời gian điện phânlà
A. 3,2gamvà2000s. B. 2,2gamvà800s. C. 6,4gamvà3600s. D. 5,4gamvà800s. Câu 6: Điện phândùng điện cực trơ dung dịch muối sunfatkim loại hóa trị II với cường độ dòng điện 3A.Sau1930giây thấy khối lượng catot tăng 1,95gam. Muối sunfat đã điện phânlà
A. CuSO4 B. NiSO4 C. MgSO4 D. ZnSO4 Câu 7: Điện phâncómàng ngăn 500mldung dịch chứa hỗn hợp gồm CuCl2 0,1MvàNaCl0,5M (điện cực trơ, hiệu suất 100%) với cường độ dòng điện 5Atrong3860giây.Dung dịch thu được sau điện phân có khả năng hòatanmgamAl.Giá trị lớn nhất của mlà A. 4,05 B. 2,70 C. 1,35 D. 5,40 Câu 8: Hòatanhoàntoàn hỗn hợp X gồm CuSO4 vàKClvào nước, thu được dung dịch Y. Điện phânY (cómàng ngăn, điện cực trơ) đến khi nước bắt đầu điện phân ở cả hai điện cực thì dừng điện phân. Số molkhíthoátra ở anot bằng 4 lần số molkhíthoátra từ catot. Phần trăm khối lượng của CuSO4 trongX là A. 61,70% B. 34,93% C. 50,63% D. 44,61%
DẠYKÈMQUYNHƠN
Trang18
dungdichYthaydoiAlHCu mmmm0,04.270,02.20,04.641,52gam
OFFICIAL
2
tập nâng cao
Điện phân
Bài
Câu 9:
(với điện cực trơ) 200 ml dung dịch CuSO4 nồng độ x mol/l, sau một thời gian thu được dung dịch Y vẫn cònmàuxanhvà khối lượng giảm 8gamso với dung dịch ban đầu. Cho16,8gam bột sắt vàoY,saukhicác phản ứng xảy rahoàntoànthu được 12,4gamkim loại. Giá trị của xlà A. 2,25 B. 3,25 C. 1,25 D. 1,50
Câu 10: Điện phân với điện cực trơ dung dịch chứa 0,1molCu(NO3)2, cường độ dòng điện 2,68A,trong thời giant giờ, thu được dung dịch X.Cho10gamFevàoX,thu được khíNO (sản phẩm khử duy nhất của )và7,8gam hỗn hợp kim loại. Các phản ứng xảy rahoàntoànvà hiệu suất điện phân100%.Giá
A. 0,60 B. 1,00 C. 0,25 D. 1,2
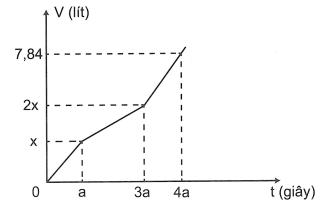


Câu 11: Điện phândung dịch hỗn hợp NaClvà0,05molCuSO4 bằng dòng điện một chiều có cường độ 2A (điện cực trơ, cómàng ngăn). Sau thời giantgiâythì ngừng điện phân,thu được khí ở hai điện cực có tổng thể tíchlà2,352lít (đktc) vàdung dịch X.Dung dịch Xhòatan được tối đa 2,04gamAl2O3. Giả sử hiệu suất điện phânlà100%,cáckhísinhrakhôngtantrongdung dịch. Giá trị của tlà A. 9650 B. 8685 C. 7720 D. 9408
Câu 12: Tiến hành điện phân (điện cực trơ, màng ngăn) một dung dịch hỗn hợp RSO4 0,3MvàKCl0,2M với cường độ dòngI=0,5A.Sau thời giantgiâythu được kim loại ở catotvà1,344lít (đktc) hỗn hợp khí ở anot.Sau thời gian3tgiâythu được hỗn hợp khícó thể tíchlà4,256lít (đktc). Biết hiệu suất phản ứng là100%,Rcóhóa trị không đổi. Giá trị của tlà
A. 23160 B. 27020 C. 19300 D. 28950
OFFICIAL
Câu 13: Hòa tan hoàn toàn m gam hỗn hợp CuSO4 vàNaClvào nước, thu được dung dịch X. Tiến hành điện phân X với các điện cực trơ, màng ngăn xốp, dòng điện có cường độ không đổi. Tổng số mol khí thu được trên cả hai điện cực (n) phụ thuộc vào thời gian điện phân (t) được mô tả như đồ thị hình bên (đồ thị gấp khúc tại các điểm M,N). Giả sử hiệu suất điện phânlà100%, bỏ qua sự bay hơi của H2O.Giá trị của mlà
A. 23,64 B. 16,62
C. 20,13 D. 26,22
Câu 14: Điện phân dung dịch hỗn hợp CuSO4 và KCl bằng dòng điện một chiều có cường độ 5A (điện cực trơ, màng ngăn xốp, hiệu suất điện phân100%,cáckhísinhra khôngtantrongdung dịch). Toàn bộ khísinhratrongquá trình điện phân (ở hai điện cực) theo thời gian được biểu diễn bằng đồ thị bên.Giá trị của zlà A. 5790 B. 3860 C. 6755 D. 7720 Câu 15: Điện phândung dịch X chứa Cu(NO3)2 vàNaCl với điện cực trơ thấy thể tíchkhíthoátra ở cả hai điện cực (Vlít) và thời gian điện phân(tgiây) phụ thuộc nhau như trên đồ thị bên. Nếu điện phân dung dịch trong thời gian 2,5a giây rồi chodung dịch sau điện phântác dụng với lượng Fe dư (NOlà sản phẩm khử duy nhất của )thì khối lượng Fe tối đa đã 5N phản ứng là A. 7,0gam B. 4,2gam C. 6,3gam D. 9,1gam
DẠYKÈMQUYNHƠN
Trang19
5N trị của tlà
Dạng 1: Lí thuyết trọng tâm
1 - B 2 - B 3 - B 4 - A 5 - C 6 - A 7 - B 8 - D 9 - A 10 - A 11 - C 12 - A 13 - D 14 - C 15 - C
Câu 2: Phương phápchung để điều chế cáckim loại kiềm (Na,K…),kim loại kiềm thổ (Ca,Ba,Mg…)vànhôm (Al)trongcông nghiệp là điện phânnóng chảy muối hoặc oxit của chúng.
Câu 4:
KhíCO chỉ khử được oxit của kim loại đứng sauAltrongdãy hoạt động hóa học. → Hỗn hợp rắn gồm: MgO,Fe,Pb,Al2O3.
Câu 5: Cơ sở của phương pháp thủy luyện là khử những ionkim loại trongdung dịch muối bằng kim loại cótính khử mạnh hơn như Fe,Zn…
Câu 6: Trongquátrình điện phândung dịch, bêncatot (cực âm)luôn xảy raquátrình khử ionkim loại
Câu 7: OxitX phải thỏa mãn điều kiện làXlàoxit của kim loại đứng sauAltrongdãy điện hóa. → OxitXlàFeO.
Câu 8: Phương phápchung để điều chế Na,Ca,Altrongcông nghiệp là điện phânnóng chảy.
Câu 9: Cơ sở của phương pháp thủy luyện là khử những ionkim loại trongdung dịch muối bằng kim loại cótính khử mạnh hơn Fe,Zn…
A đúng vìFecótính khử mạnh hơn Cu.
BsaivìNacótính khử rất mạnh vàNa khử nước cótrongdung dịch CuSO4
CsaivìAgcótính khử yếu hơn Cu.
DsaidoCacótính khử rất mạnh nênCa khử nước cótrongdung dịch CuSO4
Câu 10: Ở nhiệt độ cao,Alcó thể khử được oxit của những kim loại cótính khử yếu hơn Al.
Câu 13: Cáckim loại được điều chế bằng phương pháp điện phândung dịch là:Cu,Ag.
Câu 14:
Các trường hợp ionkim loại bị khử thànhkim loại là:(1),(2),(3).
Dạng 2: Oxit kim loại tác dụng với chất khử 1 - D 2 - C 3 - A 4 - B 5 - D 6 - C 7 - D 8 - D 9 - C 10 - D
DẠYKÈMQUYNHƠN
Trang20 ĐÁP ÁN
OFFICIAL
2 Cu2eCu
Câu 1: Tacó: 2OmatdiH nn0,1mol chatrangiam m0,1.161,6gam Fethuduoc m19,61,618gam Câu 2: Tacó: chatrangiamOmatdi mm0,32gam lít COphanungOmatdi CO 0,32 nn0,02molV0,02.22,40,448 16 Câu 3: Tacó: chatrangiam m9,18,30,8gam COphanungOmatdi nn0,05mol Phương trìnhhóa học: CuO+CO Cu+CO2 t 0,050,05mol CuO m0,05.804gam Câu 4: Tacó: chatrangiam m15,213,61,6gam 2 COCOOmatdi 1,6 nnn0,1mol 16
DẠYKÈMQUYNHƠN
Trang21
OFFICIAL
3
t x → xmol Fe2O3 +3CO 2Fe+3CO2
t y →
gồm: Cu(xmol);Fe(2ymol)
CuO
ChokhíBtác dụng với dung dịch Ca(OH)2: 32 CaCOCO nn0,1mol
m0,110010gam
Câu 5: Gọi số mol của CuOvàFe2O
trong hỗn hợp ban đầu lần lượt làx,ymol. (*) 80x160y2,4 Phương trìnhhóa học: CuO+CO Cu+CO2 (1)
(2)
2ymol Chất rắn
(**) 64x112y1,76
Từ (*)và(**)suyra: x0,01;y0,01
m0,01800,8gam
CuO %0,8m.100%33,33% 2,4
Câu 6: Cu n0,6mol
Xét phản ứng CuO+H2: 2CuH nn0,6mol Xét phản ứng Fe2O3 +H2: 2FeH Fe 22.0,6 nn0,4molm22,4gam 33
Câu 7: CO n0,2mol Tacó: 2 khi khi khi H d20M40m40.0,28gam Bảo toàn khối lượng: COoxitklkhikl mmmmm0,2.28885,6gam Câu 8: 24HSO HCl H n0,1mol;n0,1moln0,3mol
Chomgam hỗn hợp Xtác dụng vừa đủ với dung dịch hỗn hợp axit: 2 OH 1 nn0,15mol 2 Tacó: COOpu nn0,15mol lítV0,15.22,43,36 Câu 9: 2 Fe H n0,04mol;n0,01mol Gọi số mol của Fe,FeO,Fe
DẠYKÈMQUYNHƠN
Trang22
OFFICIAL
Xét
ứng X+CO: Fekhông
ứng
CO FeO+CO Fe+CO2 (1) t y → ymol Fe2O3 +3CO 2Fe+3CO2 (2) t z → 2zmol (**) Fesauphanung nxy2z0,04 Xét phản ứng X+HCl: Fe+2HCl → FeCl2 +H2 (3) x → 2x → xmol FeO+2HCl → FeCl2 +H2O(4) y → 2ymol Fe2O3 +6HCl → 2FeCl3 +3H2O(5) z → 6zmol (***) 2H nx0,01
2O3 trong hỗn hợp X lần lượt làx,y,zmol. (*) 56x72y160z2,88
phản
phản
với
DẠYKÈMQUYNHƠN OFFICIAL Trang23 Từ
Theo
MHCl
Câu
3 2 243 CaCO SO FeSO
Quy
X
Tacó: 2 3 2 COCaCO OmatdiCO OYOX nn0,04molnn0,04molnn0,04mol Xét phản ứng Y+H2SO4: 4FeFeSO n2n20,0450,09mol Bảo toànelectron: 2 FeSOOYOY 30,0920,0453n2n2nn 0,09mol 2 Mặt khác: 2 3 2 COCaCO OmatdiCO OXOY nn0,04molnn0,04molnn0,04mol OX n0,090,040,13mol XFeOX mmm0,09.560,13.167,12gam Dạng 3: Điện phân 1 - C 2 - C 3 - D 4 - C 5 - A 6 - D 7 - B 8 - D 9 - C 10 - D 11 - C 12 - B 13 - A 14 - A 15 - D Câu 1: 2Cl n0,25mol Quátrình điện phân: Ở catot(-): Ở canot(+): n MneM 2 2ClCl2e Bảo toànelectron: n 2Cl M M M 16 nn2nn20,25M32n M Với MlàCu. M n2M64 Câu 2: Phương trình điện phân: Cu(NO3)2 +H2O → Cu+ O2 +2HNO3 1 2 0,2 → 0,2 → 0,1mol 2ddgiamCuO mmm0,2640,13216gam
(*),(**)và(***)tacó hệ phương trình: 56x72y160z2,88x0,01 xy2z0,04y0,01 x0,01 z0,01
phương trình(3),(4),(5)tacó: HCl n2x2y6z
HCl n2.0,012.0,016.0,010,1mol
0,1 aC1M 0,1
10:
n0,04mol;n0,045mol;n0,045mol
đổi hỗn hợp
về FevàO.
DẠYKÈMQUYNHƠN OFFICIAL Trang24
→
Tacó: 22
mmmm
Cucatot Cucatot n2.0,010,10,12molm0,12.647,68gam Câu 5: khi n0,5mol Gọi số mol của CuSO4 làxmol. Quátrình điện phân: Ở catot(-) Ở anot(+) 2H2O → +O2 +4e 2 Cu+2eCu 4H x → 2xmol 0,05 → 0,2mol 2H2O+2e → +H2 2OH 0,1 0,05mol Bảo toànelectron: Cu 2x0,10,2x0,05molm0,05643,2gam Lại có: etraodoi It0,296500 n0,2molt2000s F9,65 Câu 6: Tacó: etraodoi kl It3.1930 n 0,06moln0,03mol F96500 Khối lượng catot tăng là khối lượng kim loại được sinhra kl m1,95gam
Câu 3: 4CuSO Cu n0,2mol;n0,15mol Quátrình điện phân: Ở catot(-): Ở anot(+): 2H2O → O2 + +4e 2 Cu2eCu 4H 0,30,15mol 0,075 0,3mol lít 2O V0,075.22,41,68 Câu 4: 32 KCl CuNO n0,2mol;n0,15mol Giả sử bị điện phân hết Cl 2 2ClCubidienphan nn0,1mol Khi đó: Có nước bị điện phân ở anot. 2 ddgiamClCu mmm0,1710,16413,515,1gam Gọi số mol của O2 sinhra ở anotlàxmol. Quátrình điện phân: Ở catot(-) Ở anot(+) 2 Cu+2eCu 2 2ClCl2e mol 0,2 → 0,1 → 0,2mol 4x0,22x0,1 2H2O → +O2 +4e 4H x
4xmol
ddgiamCuClO
15,12x0,1640,17132xx0,01
Kim loại đó làZn, muối sunfatlàZnSO4. kl M1,9565 0,03 Câu 7: 2CuCl NaCl n0,05mol,n0,25mol 2Cu Cl n0,05mol,n0,0520,250,35mol Tacó: etraodoi It53860 n 0,2mol F96500 Quátrình điện phân: Ở catot(-) Ở anot(+) 2 Cu+2eCu 2 2ClCl2e 0,05→ 0,1→ 0,05mol0,2 0,2mol 2H2O+2e → +H2 2OH 0,1 → 0,1mol Dung dịch sau điện phân chứa: (0,1mol), Cl;OHNa KhihòatanAl bằng dung dịch thu được, phương trìnhhóa học: 2Al+ +2H2O → +3H2 ↑ 2OH 22AlO 0,1 0,1mol Al m0,1.272,7gam Câu 8: Giả sử số molKCltrongXlà1mol,khi đó quátrình điện phân xảy ra như sau: Gọi số mol của CuSO4 vàH2 sinhra lần lượt làa,bmol.
DẠYKÈMQUYNHƠN OFFICIAL Trang25
Ở
2 Cu+2eCu 2 2ClCl2e a → 2a mol 1 →
2H2O+2e → +H2 2OH 2b bmol Theo đề bài,tacó: 2 2 2 CuHCl ClH 2n2nn2a2b1a0,375 n4n4b0,5b0,125 Vậy hỗn hợp X gồm CuSO4 (0,375mol)vàKCl(1mol). 4CuSO %m44,61% Câu 9: 4CuSO n0,2xmol Gọi số mol bị điện
2Cu
catot(-) Ở anot(+)
0,5mol
phânlàamol.
Quátrình điện phân:
Khối lượng dung dịch giảm là8gam 2CuO mm8 a a.64.328a0,1 2 2 Cudu n0,2x0,1mol Vìdung dịch Y vẫn cònmàuxanhnên còn dư. 2Cu → Dung dịch Y gồm , (0,2mol)và (0,2xmol). 2Cu 0,2x0,1molH 2 4SO Khicho bột sắt vàodung dịch Y,tacócác phản ứng: Fe + → + Cu(1) 2Cu 2Fe → mol 0,2x0,10,2x0,1 0,2x0,1 Fe + → +H2 (2) 2H 2Fe 0,1 0,2mol Theo phương trình(1)và(2)tacó: klgiamFephanungCusinhra mmm 16,812,4560,2x0,156.0,1640,2x0,1
DẠYKÈMQUYNHƠN OFFICIAL Trang26 Ở
catot(-) Ở anot(+) 2H2O → O2 + +4e 2 Cu+2eCu 4H a → 2a → amol mol a2a2a 2
điện phân: Ở catot(-) Ở anot(+) 2H2O → O2 + +4e 2 Cu+2eCu 4H x → 2xmol 2x 2xmol → Dung dịch X chứa: (ymol), (2xmol) 2Cu H ThêmFevàodung dịch X: Quátrìnhcho nhận electron: 3 2 4HNO3eNO2HO 2 FeFe2e 2x → 1,5xmol 0,75x+y 1,5x+2ymol 2 Cu2eCu y → 2y → ymol Fedu m100,75xy.56gam
x1,25 Câu 10: Gọi số mol của bị điện phânvà chưa bị điện phân lần lượt làx,ymol. 2Cu 2Cu (*) xy0,1 Quátrình
DẠYKÈMQUYNHƠN OFFICIAL Trang27 Suyra:
chatranCuFedu mmm7,864y100,75xy5642x8y2,2 Từ
giờ. etraodoi It
F Câu 11: Gọi số mol của H2
2
2 lần
CatotAnot 2 Cu2eCu 2 2ClCl2e 0,05→0,1 mol y → 2ymol 2 2 2HO2eH2OH 2 2 2HO4HO4e 2xx 2xmol 4z z 4zmol 2 HOHHO Dung dịch Xhòatan được Al2O3 nêndung dịch Xcó tacó: OH Al2O3 + → +H2O 2OH 22AlO (1) 23AlO OH
(2) khiohaidiencuc
Câu
4
Sau
Ở
Ở
2
2 2ClCl2e 2 22HO2e2OHH 2 2 2HO4HO4e Bảo
tố Cl: 2Cl namol Gọi số molO2 sinhralàbmol. (*)
Số
đổi: 22
Sau
gian3tgiây: 2 etraodoi Cl
2O 6a12b2a n a3bmol 4
(**)
(*)và(**)suyra: x0,06;y0,04
n2x0,12molt4321s1,2
,Cl
,O
lượt làx,y,zmol.
n0,02moln0,04mol2x4z0,04
n0,105xyz0,105
Bảo toànelectron: (3) 0,12x2y4z2x2y4z0,1 Từ (1),(2)và(3)suyra: x0,03;y0,07;z0,005
etraodoi n2y4z20,0740,0050,16mol
t7720s
12:
RSO Cl n3amol;n2amol
thời giantgiây:
catot(-)
anot(+)
R2eR
toànnguyên
ab0,06
molelectrontrao
etraodoiClO n2n4n2a4bmol
thời
n6a12bmol;namol
Và 2H 6a12b2.3a n 6bmol 2
Tacó: (**) 222 HOCl nnn0,192a9b0,19
Từ (*)và(**)suyra: a0,05;b0,01 t27020s Câu 13: Quátrình điện phân: Ở catot(-): Ở anot(+): (1) (2) 2 Cu2eCu 2 2ClCl2e (3) (4) 2 22HO2e2OHH 2 2 2HO4HO4e
Xét đoạn 1:SinhrakhíCl2 Tại : tas 2Cl etraodoi I0,12n0,06moln0,12mol Fa Xét đoạn 2:Do độ dốc của đoạn 2> độ dốc của đoạn 1 → Ở đoạn 2sinhrakhíCl2 vàH2. Bảo toàne: 22 ClH nnumol Xét đoạn 3:SinhrakhíH2 vàO2 Tại : Gọi số mol của O2 vàH2 lần lượt làv,2vmol. t3,2as 22 OH2nn Tacó: (*) 222 khiClHO nnnn0,06uu2vv0,2882u3v0,228
DẠYKÈMQUYNHƠN
Trang28
OFFICIAL
22
ClO It0,12 n .3,2a0,384mol2n4n20,06u4v2u4v0,264 Fa Từ (*)và(**)suyra:
Tacó: 42 2 CuSOClgd1 NaClClthoatra nn0,06mol;n2n20,06u0,24mol m0,06.1600,24.58,523,64gam Câu 14: Quátrình điện phân: Ở catot(-): Ở anot(+): (1) (2) 2 Cu2eCu 2 2ClCl2e (3) (4) 2 22HO2e2OHH 2 2 2HO4HO4e Do độ dốc của đoạn 2< độ dốc của đoạn 1 → Ở đoạn 2sinhrakhíCl2 vàO2. Xét đoạn 1: lít 2Cl txsV0,896 2Cl n0,04mol Xét đoạn 2: lít 2O tysV1,5680,8960,672 2O n0,03mol
Lại có: (**)
etraodoi
u0,06;v0,036
DẠYKÈMQUYNHƠN OFFICIAL Trang29
2 2 2HO4HO4e Do độ dốc của đoạn 2< độ dốc của đoạn 1 → Ở đoạn 2sinhrakhíCl2 vàO2 Xét
lít
2Cl tasVx 2Cl x nmol 22,4 Xét đoạn 2: lít 2O t3asV2xxx 2O x nmol 22,4 Bảo toànelectron: Cu 3x nmol 22,4 Xét đoạn 3: lít (*) 22 OH t4asVV7,84x 22 OH x nn0,35mol 22,4 Bảo toànelectron: (**) 2 2 H O x nmol 22,4 1,5x nmol 22,4 Từ (*)và(**)suyra: x2,24 Tại :cókhíCl2 (0,1mol),O2 thoátravàcókim loại Cu. t2,5as Tacó: 2 32 2 O HNOO etraodoi Cu Cutrongdd n0,075moln4n0,3mol n0,5moln0,25moln0,30,250,05mol 2 3FeHNO Fe Cu 3 nnn0,1625molm9,1gam 8
Bảo toànelectron: 22 CuClO nn2n0,1mol Xét đoạn 3: lít (*) 22 OH tzsVV3,2480,8962,352 22 OH nn0,105mol Bảo toànelectron: (**) 2 2 22 O H OH 4n0,04.22n0,1.24n2n0,12 Từ (*)và(**)suyra: 2 2 H O n0,05mol;n0,055mol etraodoi n20,120,050,3mol z5790s Câu 15: Quátrình điện phân: Ở catot(-): Ở anot(+): (1) (2) 2 Cu2eCu 2 2ClCl2e (3) (4) 2 22HO2e2OHH
đoạn 1:
CHƯƠNG 1: NGUYÊN TỬ
BÀI 9: ĂN MÒN KIM LOẠI – HỢP KIM
Mục tiêu
Kiến thức
+Nêu được khái niệm hợp kim, ăn mònkim loại, ăn mònhóa học, ăn mòn điện hóa.
+ Trìnhbày được tính dẫn (dẫn nhiệt, dẫn điện, nhiệt độ nóng chảy…), ứng dụng của một số hợp kim(thépkhông gỉ, đuyra).
+ Chỉ ra được điều kiện xảy ra sự ăn mònkim loại.
+Nêu được các biện pháp bảo vệ kim loại khỏi bị ăn mòn.
Kĩ năng
+ Sosánh được bản chất của liên kết kim loại với liên kết ionvà cộng hóa trị.
+ Phân biệt được ăn mònhóa học và ăn mòn điện hóa ở một số hiện tượng thực tế.
+ Biết cách sử dụng có hiệu quả một số đồ dùng bằng hợp kim dựa vào những đặc tính của chúng.
+ Giải được cácbài tập cóliênquan như tính phần trăm khối lượng kim loại trong hợp kim,tính lượng kim loại bị ăn mòn…
DẠYKÈMQUYNHƠN
Trang1
OFFICIAL
I. LÍ THUYẾT TRỌNG TÂM
A.
1.
HỢP KIM
Khái niệm
Hợp kimlà vật liệu kim loại có chứa một kim loại cơ bản và một số kim loại hoặc phikimkhác.
Ví dụ: Thép là hợp kim của sắt với cacbon và một số nguyên tố khác
2.
Tính chất
Hợp kim có nhiều tính chất hóa học tương tự tính chất của các đơn chất tham gia tạo thành hợp kim, nhưng cótính chất vật lívà cơ học khác nhiều.
Ví dụ: Thép inoc: Fe – Cr – Mn là hợp kim không bị ăn mòn….
3. Ứng dụng
Hợp kim được sử dụng nhiều hơn kim loại nguyên chất và được ứng dụng rộng rãitrongcácngànhkinh tế quốc dân.
B. SỰ ĂN MÒN KIM LOẠI
1. Khái niệm
OFFICIAL
Sự ăn mònkim loại là sự phá hủy kim loại hoặc hợp kimdotác dụng của các chất trongmôi trường xung quanh.
Trong đó, kim loại bị oxihóathànhion dương: n MMne
2. Phân loại
Cóhai loại: ăn mònhóa học và ăn mòn điện hóa.
a. Ăn mòn hóa học
Khái niệm: Làquátrìnhoxihóa- khử, trong đó cácelectron của kim loại được chuyển trực tiếp đến các chất trongmôi trường. Đặc điểm: Khôngphátsinhdòng điện. Quátrình ăn mòn diễn ra chậm, khi tăng nhiệt độ, tốc độ ăn mònnhanh hơn.
Điều kiện xảy ra ăn mòn: Môi trường khôngcó chất điện li. Một kim loại nguyên chất tiếp xúc với môi trường chất điện li.
Ví dụ: Al tác dụng với dung dịch HCl hoặc cho hợp kim Cu – Zn tác dụng với khí Cl2 b. Ăn mòn điện hóa
Khái niệm: Làquátrìnhoxihóa- khử, trong đó kim loại bị ăn mòndotác dụng của dung dịch chất điện livà tạo nêndòngelectron chuyển dời từ cực âm đến cực dương.
Đặc điểm: Cóphátsinhdòng điện. Quátrình ăn mòn diễn ranhanh.
DẠYKÈMQUYNHƠN
Trang2
Điều kiện xảy ra ăn mòn:
Các điện cực phải khácnhau về bản chất: cặp 2kim loại khácnhau hoặc cặp kim loại với phikim.
Các điện cực phải tiếp xúc trực tiếp hoặc gián tiếp với nhau với nhauquadây dẫn.
Các điện cực cùng tiếp xúc với dung dịch chất điện li.
Ví dụ: Để gang trong không khí ẩm.
3. Phương pháp chống ăn mòn kim loại
a. Phương pháp bảo vệ bề mặt
Dùng chất bền vững với môi trường phủ ngoài mặt kim loại.
Ví dụ: Sơn, mạ, ngâm dầu, mỡ….
b. Phương pháp điện hóa
Nối kim loại cần được bảo vệ với một kim loại hoạt động mạnh hơn để tạo thànhpin điện hóa,khi đó kim loại hoạt động mạnh hơn sẽ bị ăn mòn trước.
Ví dụ: Để bảo vệ vỏ tàu thuyền làm bằng thép, người ta gắn vào vỏ tàu những khối Zn để bảo vệ. SƠ ĐỒ HỆ THỐNG HÓA
KHÁI NIỆM TÍNH CHẤT ỨNG DỤNG
KHÁI NIỆM
OFFICIAL
Vật liệu kim loại có chứa một kim loại cơ bản và một số kim loại hoặc phikimkhác
Tính chất hóa học: tương tự tính chất của các đơn chất thamgia tạo thành hợp kim
Tính chất vật lí và cơ học: khác nhiều tính chất của các đơn chất thamgia tạo thành hợp kim
Ứng dụng rộng rãitrongcácngànhkinh tế quốc dân
Sự
PHÂN
đến các chất trongmôi trường. Dotác dụng O2,H2O ở to cao.
kiện xảy ra ăn mòn điện hóa: 1.Các điện cực khác nhau về bản chất: Kim loại –Kim loại; Kim loại –C(Pt) 2.Các điện cực tiếp xúc trực tiếp hoặc gián tiếp. 3.Các điện cực cùng tiếp xúc với dung dịch điện li.
Phương pháp bề mặt: Bôi dầu mỡ, sơn, mạ,
Phương pháp điện hóa: Dùng kim loại có tính khử mạnh hơn làm vật hi sinh.
DẠYKÈMQUYNHƠN
Trang3
HỢP
ĂN MÒN
KIM
KIM LOẠI
LOẠI BẢO VỆ KIM LOẠI
phá hủy bề mặt domôi trường Ăn mòn hóa học Ăn mòn điện hóa Khôngcó dòng điện Códòng điện Các
chuyển trực tiếp
electron của kim loại được
Điều
II. CÁC DẠNG BÀI TẬP
Dạng 1: Lí thuyết trọng tâm
Kiểu hỏi 1: Lí thuyết về hợp kim
Ví dụ mẫu
Ví dụ 1: Phát biểu nàosau đây sai?
A. Hợp kimlà vật liệu kim loại có chứa một kim loại cơ bản và một số kim loại khác hoặc phikim.
B. Tính chất của hợp kim phụ thuộc vàothành phần, cấu tạo của hợp kim.
C. Hợp kimcótính chất hóa học kháctính chất của cáckim loại tạo rachúng.
D. Hợp kimcótính chất vật lívàtính cơ học khác nhiều cáckim loại tạo rachúng.
Hướng dẫn giải
Hợp kimlà vật liệu kim loại có chứa một kim loại cơ bản và một số kim loại hoặc phikimkhác A đúng.
OFFICIAL
Tính chất của hợp kim phụ thuộc vàothành phần các đơn chất thamgia, cấu tạo mạng tinh thể của hợp kimB đúng.
Hợp kim có nhiều tính chất hóa học tương tự tính chất của các đơn chất tham gia tạo thành hợp kim, nhưng tính chất vật lívàtính chất cơ học của hợp kim lại khác nhiều với tính chất các đơn chất Csai, D đúng. Chọn C. Ví dụ 2: Phát biểu nàosau đây sai về tính chất của hợp kim?
A. Liên kết trong đa số tinh thể hợp kim vẫn làliên kết kim loại.
B. Hợp kim thường dẫn nhiệt và dẫn điện tốt hơn kim loại nguyên chất.
C. Độ cứng của hợp kim thường lớn hơn độ cứng của kim loại nguyên chất.
D. Nhiệt độ nóng chảy của hợp kim thường thấp hơn nhiệt độ nóng chảy của kim loại nguyên chất. Hướng dẫn giải Đáp ánBsaivì hợp kimcòn chứa một số kim loại hoặc phikimkhácnênlàm giảm độ dẫn điện và dẫn nhiệt của kim loại nguyên chất. Chọn B. Ví dụ 3: Một hợp kim gồm cáckim loại sau:Ag,Zn,Fe,Cu.Hóa chất có thể hòatanhoàntoàn hợp kim trênthànhdung dịch là
A. dung dịch NaOH. B. dung dịch H2SO4 đặc, nguội.
C. dung dịch HCl. D. dung dịch HNO3 loãng. Hướng dẫn giải Để hòatanhoàntoàn hợp kimthìdung dịch đó phải hòatan tất cả cáckim loại cótrong hợp kim. Dung dịch NaOHkhônghòatan được Ag,Fe,Cu Loại A.
DungdichH2SO4 đặc nguội khônghòatan được Fe Loại B.
Dung dịch HClkhônghòatan được AgvàCu Loại C.
DẠYKÈMQUYNHƠN
Trang4
Dung dịch HNO3 hòatan được cáckim loại trong hợp kim.
Chọn D.
Kiểu hỏi 2: Lí thuyết về ăn mòn điện hóa
Ví dụ mẫu
Ví dụ 1: Phản ứng hóa học xảy ratrongquátrình ăn mònkim loại thuộc loại
A. phản ứng thủy phân.
B. phản ứng trao đổi. C. phản ứng oxihoá- khử.
D. phản ứng phân hủy.
Hướng dẫn giải Ăn mònkim loại là sự phá hủy kim loại hoặc hợp kimdotác dụng của các chất trongmôi trường.
Vậy phản ứng hóa học xảy ratrongquátrình ăn mònkim loại thuộc loại phản ứng oxihóa– khử. Chọn C. Ví dụ 2: Sắt tâylà sắt tráng thiếc. Nếu lớp thiếc bị xước sâu tới lớp sắt, khi để trongkhôngkhí ẩm thìkim loại bị ăn mòn trước là
A. thiếc. B. sắt. C. cả hai đều bị ăn mòn như nhau.
D. khôngkim loại nào bị ăn mòn.
Hướng dẫn giải
Kim loại cótính khử mạnh hơn sẽ bị ăn mòn trước.
Theodãy điện hóa của kim loại, tính khử: Fe>Sn.
Sắt sẽ bị ăn mòn trước.
Chọn B. Ví dụ 3: Trong thực tế, không sử dụng cáchnàosau đây để bảo vệ kim loại sắt khỏi bị ăn mòn?
A. Gắn đồng với kim loại sắt.
B. Tráng kẽm lên bề mặt sắt.
C. Phủ một lớp sơn lên bề mặt sắt.
D. Tráng thiếc lên bề mặt sắt. Hướng dẫn giải
Fecótính khử mạnh hơn CunênFe sẽ bị ăn mòn trước Sắt không được bảo vệ khỏi bị ăn mòn A đúng.
Tráng kẽm lên bề mặt sắt, ngăn khôngcho sắt tiếp xúc với môi trường Sắt được bảo vệ khỏi bị ăn mòn (phương pháp bảo vệ bề mặt) Bsai. Phủ một lớp sơn lên bề mặt sắt, ngăn khôngcho sắt tiếp xúc với môi trường nên sắt được bảo vệ khỏi bị ăn mòn (phương pháp bảo vệ bề mặt) Csai.
DẠYKÈMQUYNHƠN
Trang5
OFFICIAL
n MMne
Tráng thiếc lên bề mặt sắt, ngăn khôngcho sắt tiếp xúc với môi trường nên sắt được bảo vệ khỏi bị ăn mòn (phương pháp bảo vệ bề mặt) Dsai. Chọn A.
Ví dụ 4: Một vật bằng hợp kimZn-Cu bị ăn mòn điện hóatrongkhôngkhí ẩm.
Quátrình xảy ra ở cực âmlà A. B. 22H2eH 2 ZnZn2e C. D. 2 CuCu2e 2 22HO2e2OHH
Hướng dẫn giải
Ở cực âm xảy ra sự oxihóa: 2 ZnZn2e Ở cực dương xảy ra sự khử: và 2 22HO2e2OHH 22H2eH Chọn B.
Ví dụ 5: Trongthí nghiệm nàosau đây xảy ra ăn mòn điện hóa?
A. Cholá đồng nguyên chất vàodung dịch gồm Fe(NO3)3 vàHNO3 B. Để thanhthép đã sơn kíntrongkhôngkhíkhô.
C. Nhúngthanh kẽm nguyên chất vàodung dịch HCl.
D. Cholá sắt nguyên chất vàodung dịch gồm CuSO4 vàH2SO4 loãng. Hướng dẫn giải
Akhông xảy ra ăn mòn điện hóavì đồng phản ứng được với Fe(NO3)3 vàHNO3 nhưng không tạo thành cặp điện cực.
Bkhông xảy ra ăn mòn điện hóavì cặp điện cực không được tiếp xúc với dung dịch chất điện lido đã bị sơn kín.
Ckhông xảy ra ăn mòn điện hóavìkhông xuất hiện cặp điện cực khácnhau về bản chất.
Dcó xảy ra ăn mòn điện hóavìlá sắt sẽ phản ứng với dung dịch CuSO4 tạo thànhkim loại Cu.Kim loại Cusinhrabámvàolá sắt tạo thành cặp điện cực Fe–Cu cùng được nhúngtrongdung dịch gồm CuSO4 vàH2SO4 Chọn D.
Chú ý: Điều kiện xảy ra ăn mòn điện hóa học là đồng thời:
Các điện cực phải khác nhau về bản chất, có thể là cặp hai kim loại khác nhau, kim loại – phi kim hay kim loại – hợp chất.
Các điện cực phải tiếp xúc trực tiếp hoặc gián tiếp với nhau qua dây dẫn. Các điện cực cùng tiếp xúc với dung dịch chất điện li.
Bài tập tự luyện dạng 1
Câu 1: Bản chất của sự ăn mònkim loại là
A. là phản ứng oxihóa– khử.
B. là phản ứng hóa hợp.
DẠYKÈMQUYNHƠN
Trang6
OFFICIAL
C. là phản ứng trao đổi. D. là phản ứng thay thế.
Câu 2: Sự ăn mònkim loại không phải là
A. sự khử kim loại.
B. sự oxihóakim loại.
C. sự phá hủy kim loại hoặc hợp kimdotác dụng của các chất trongmôi trường.
D. sự biến đơn chất kim loại thành hợp chất.
Câu 3: Tônlà sắt được tráng
A. Na. B. Mg. C. Zn. D. Al.
Câu 4: Phát biểu nào dưới đây sai?
A. Nguyên tắc chung để điều chế kim loại là khử ionkim loại thànhnguyên tử kim loại.
B. Bản chất của ăn mònkim loại làquátrìnhoxihóa- khử.
C. Tính chất hóa học đặc trưng của kim loại làtính khử.
D. Ăn mònhóa học phátsinhdòng điện.
OFFICIAL
Câu 5: Để bảo vệ ống thép (dẫn nước, dẫn dầu, dẫn khí đốt) bằng phương pháp điện hóa, người ta mạ vào mặt ngoài của ống thép bằng kim loại gì?
A. Ag. B. Pb. C. Zn. D. Cu. Câu 6: Đốt thanh hợp kimFe-Ctrongkhíoxi,quátrình ăn mònnào đã xảy ra?
A. Ăn mòn điện hóa. B. Ăn mònhóa học.
C. Cả ăn mòn điện hóavà ăn mònhóa học. D. Không xảy ra.
Câu 7: Cho một hợp kimCu-AlvàoH2SO4 loãng dư thấy hợp kim
A. bị tan một phần doAl phản ứng. B. khôngtan.
C. bị tan một phần doCu phản ứng. D. bị tanhoàntoàn.
Câu 8: Có những vật làm bằng sắt được mạ những kim loại khácnhau dưới đây. Nếu các vật này đều bị xước sâu đến lớp sắt thì vật nào bị gỉ chậm nhất?
A. Sắt tráng kẽm. B. Sắt tráng thiếc. C. Sắt tráng đồng. D. Sắt tráng bạc.
Câu 9: Trường hợp nàosau đây, kim loại bị ăn mòn điện hóa học?
A. Nhúng sợi dây bạc nguyên chất vàodung dịch HNO3 loãng.
B. Nhúngthanhnhômnguyên chất vàodung dịch CuSO4
C. Đốt sợi dây đồng trongbình đựng khíclo.
D. Nhúngthanh sắt nguyên chất vàodung dịch H2SO4 loãng.
Câu 10: Nếu vật làm bằng hợp kimFe-Zn bị ăn mòn điện hóathìtrongquátrình ăn mòn
A. kẽm đóng vaitròcatotvà bị oxihóa. B. sắt đóng vaitròanotvà bị oxihóa.
C. kẽm đóng vaitròanotvà bị oxihóa. D. sắt đóng vaitròcatotvàionH+ bị oxihóa.
Câu 11: Cáchnàosau đây sai khidùng để chống ăn mòn vỏ tàu biển bằng sắt?
A. Ghépkim loại Znvàophíangoài vỏ tại ở phần chìmtrong nước biển.
B. Ghépkim loại Cuvàophíangoài vỏ tàu ở phần chìmtrong nước biển.
DẠYKÈMQUYNHƠN
Trang7
C. Sơn lớp sơn chống gỉ lên bề mặt vỏ tàu.
D. Mạ đồng lên bề mặt vỏ tàu.
Câu 12: Chocác hợp kimsau:Al-Zn(I);Fe-Zn(ll);Zn-Cu(III)vàMg-Zn(IV).Khi tiếp xúc với dung dịch axitHCl,các hợp kimmàZn bị ăn mòn trước là
A. (II),(III)và(IV). B. (III)và(IV). C. (I),(II)và(III). D. (II)và(III).
Câu 13: Chocác điều kiện sau:
(1)Các điện cực phải khácnhau về bản chất, có thể là cặp haikim loại khácnhau hoặc cặp kim loại với phikim.
(2)Các điện cực phải tiếp xúc trực tiếp hoặc gián tiếp với nhauquadây dẫn.
(3)Các điện cực cùng tiếp xúc với dung dịch chất điện li.
(4)Kim loại tác dụng trực tiếp với cáchóa chất hoặc với hơi nước ở nhiệt độ cao. Ăn mòn điện hóa học xảy rakhicùngcócác điều kiện:
OFFICIAL
A. (1),(2). B. (1),(2),(3). C. (1),(2),(4). D. (2),(3),(4). Câu 14: Phương pháp bảo vệ kim loại nào không phải là phương pháp điện hóa?
A. Phủ kínlên bề mặt kim loại cần bảo vệ một kim loại cótính khử mạnh hơn.
B. Nối kim loại cần bảo vệ với một tấm kim loại kháccótính khử mạnh hơn.
C. Chế tạo hợp kim từ kim loại cần bảo vệ và một kim loại cótính khử mạnh hơn.
D. Sơn, mạ hoặc bôi dầu mỡ lênkim loại cần bảo vệ.
Câu 15: Có bốn dung dịch riêng biệt: CuSO4,ZnCl2,FeCl3,AgNO3.Nhúngvào mỗi dung dịch một thanh Ni. Số trường hợp xảy ra ăn mòn điện hóalà
A. 1. B. 4. C. 3. D. 2. Câu 16: Vật làm bằng hợp kimZn-Cutrongmôi trường khôngkhí ẩm (hơi nước cóhòatanO2) đã xảy raquátrình ăn mòn điện hóa. Tại anot xảy raquátrình
A. oxihóaCu. B. khử Zn. C. oxihóaZn. D. khử O2 Câu 17: Để bảo vệ kim loại khỏi sự ăn mòn,cócác phương phápsau:
(1)Cáchli với môi trường. (2)Dùng hợp kim chống gỉ. (3)Dùng phương pháp điện hóa. (4) Đánh bóng bề mặt. (5)Lauchùi thường xuyên. (6)Dùng chất chống ăn mòn. Phương pháp đúng là: A. (1),(2),(3),(6). B. (1),(2),(3),(4). C. (1),(2),(3). D. (1),(2),(3),(5),(6). Câu 18: Thực hiện cácthí nghiệm sau:
(1)NhúngthanhFenguyên chất vàodung dịch CuCl2.
(2)NhúngthanhFenguyên chất vàodung dịch FeCl3
(3)NhúngthanhFenguyên chất vàodung dịch HClloãng,có lẫn CuCl2
(4)Chodung dịch FeCl3 vàodung dịch AgNO3.
(5) Để thanhthéplâungàyngoàikhôngkhí ẩm.
DẠYKÈMQUYNHƠN
Trang8
Số trường hợp xảy ra ăn mòn điện hóa học là
A. 4. B. 2. C. 1. D. 3.
Câu 19: Tiến hànhcácthí nghiệm sau:
(1)Cho hơi nước đi qua ống đựng bột sắt nungnóng.
(2) Để thanhthép (hợp kim của sắt với cacbon)trongkhôngkhí ẩm.
(3)Cho từng giọt dung dịch Fe(NO3)2 vàodung dịch AgNO3
(4)Cholá đồng nguyên chất vàodung dịch AgNO3.
(5)Cholá kẽm vàodung dịch H2SO4 (loãng)có nhỏ thêmvài giọt dung dịch CuSO4. Trongcácthí nghiệm trên, số trường hợp có xảy ra ăn mòn điện hoálà
A. 3. B. 2. C. 4. D. 1.
Câu 20: Tiến hànhcácthí nghiệm sau:
(1)Cholá hợp kimFe-Cuvàodung dịch H2SO4 loãng.
(2)CholáCuvàodung dịch AgNO3
(3)CholáZnvàodung dịch HNO3 loãng.
(4) Đốt dâyMgtrongbình đựng khíCl2
OFFICIAL
(5)Choinox (hợp kimFe–Cr–Ni-C)vàodung dịch HCl đặc nóng. (6) Đốt hợp kim đồng bạch (Cu-Ni)trongkhôngkhí. Số thí nghiệm chỉ xảy ra ăn mònhóa học là
A. 6. B. 5. C. 4. D. 3. Dạng 2: Bài toán về hợp kim Phương pháp giải
DẠYKÈMQUYNHƠN
Trang9
ABC
MMM Ví
Hàm lượng kim loại Atrong hợp kim: A hopkim m %A100% m
Xác định công thức hợp kim:AxByCz… Tacó: CAB
%%m m%m x:y:z::
dụ: Trong hợp kimAl-Mg, cứ có9molAlthìcó1molMg.Thành phần phần trăm khối lượng của hợp kimlà A. 80%Alvà20%Mg. B. 81%Alvà19%Mg. C. 91%Alvà9%Mg. D. 83%Alvà17%Mg Hướng dẫn giải Trong hợp kimAl-Mg, cứ 9molAlthìcó1molMgnêncông thức của hợp kimlàAl9Mg.
Chọn C. Ví dụ mẫu
Ví dụ 1: Một loại đồng thaucó chứa 59,63%Cuvà40,37%Zn. Hợp kimnàycó cấu tạo tinh thể của hợp chất hóa học giữa đồng và kẽm. Công thức hóa học của hợp chất là A. Cu3Zn2 B. Cu2Zn3 C. Cu2Zn. D. CuZn2
Hướng dẫn giải Gọi công thức tổng quát của hợp chất là:CuxZny Xét tỉ lệ: CuZn CuZn
%m%m x:y:MM 59,6340,37 : 6465 0,932:0,621 3:2
Chọn x=3,y=2 Vậy công thức hóa học làCu3Zn2. Chọn A. Bài tập tự luyện dạng 2
Câu 1: Trong hợp kimAl-Ni, cứ 10molAlthìcó1molNi.Thành phần phần trăm về khối lượng của hợp kimnàylà
A. 81%Alvà19%Ni. B. 82%Alvà18%Ni. C. 83%Alvà17%Ni. D. 84%Alvà16%Ni. Câu 2: Hợp kimFe-Zncó cấu tạo tinh thể dung dịch rắn, trong đó có72,1%Fe về khối lượng. Công thức hóa học của hợp chất là
A. FeZn. B. Fe3Zn. C. Fe3Zn2. D. Fe2Zn. Câu 3: Nung một mẩu gang có khối lượng 100 gam trong khí O2 dư thấy sinh ra 8,96 lít CO2 (đktc). Thành phần phần trăm khối lượng cacbontrong mẩu ganglà
A. 4,8%. B. 2,2%. C. 2,4%. D. 3,6%. Câu 4: Khicho7,7gam hợp kim gồm natrivàkalivào nước thấy thoátra3,36lítH2 (đktc). Thành phần phần trăm khối lượng của cáckim loại trong hợp kimlà
A. 25,32%Kvà74,68%Na. B. 26,33%Kvà73,67%Na. C. 27,33%Kvà72,67%Na. D. 28,33%Kvà71,67%Na.
DẠYKÈMQUYNHƠN OFFICIAL Trang10
Al 9.27 %m.100%91% 927124 Mg %m100%91%9%
Dạng 1: Lí thuyết trọng tâm
1 - A 2 - A 3 - C 4 - D 5 - C 6 - B 7 - A 8 - A 9 - B 10 - C 11 - B 12 - D 13 - B 14 - D 15 - D 16 - C 17 - D 18 - D 19 - A 20 - D
Câu 8:
Khả năng hoạt động hóa học của cáckim loại trên được sắp xếp theo thứ tự ZnFeSnCuAg Sắt tráng kẽm bị gỉ chậm nhất.
Câu 9:
Trường hợp bị ăn mòn điện hóa học là:Nhúngthanhnhômnguyên chất vàodung dịch ZnSO4 vìsinh rakim loại Zn, tạo thành cặp điện cực khácnhau về bản chất và được tiếp xúc,nhúngtrong chất điện li.
Câu 10:
Znlàkim loại đứng trước Fetrongdãy điện hóa,nênZn đóng vaitròlàanotvà bị oxihóa.
Câu 11: A,C,D đúng. BsaivìCu đứng sauFetrongdãy điện hóanênFe sẽ bị ăn mòn trước GhépCuvàokhôngcótác dụng bảo vệ vỏ tàu biển.
Câu 15: Trường hợp xảy ra ăn mòn điện hóalà ở dung dịch: CuSO4 vàAgNO3.
Câu 16: Ở anot xảy raquátrìnhoxihóaZn: 2 ZnZn2e
Câu 18: Các trường hợp xảy ra ăn mòn điện hóalà:(1),(3),(5). Câu 19: Các trường hợp xảy ra ăn mòn điện hóalà(2),(4),(5). Câu 20: Các trường hợp xảy ra ăn mòn điện hóalà(3),(4),(6). Dạng 2: Bài toán về hợp kim 1 - B 2 - B 3 -
DẠYKÈMQUYNHƠN
Trang11 ĐÁP ÁN
OFFICIAL
A
A
1: Tacó: Al Ni 10.27 %m .100%82% 10.271.59 %m100%82%18% Câu 2: Tacó: %Zn100%72,1%27,9% Gọi công thức tổng quát của hợp chất là: xy FeZn Xét tỉ lệ: FeZn FeZn %m%m72,127,9 x:y::1,2875:0,433:1 MM5665 Chọn x=3,y=1
4 -
Câu
DẠYKÈMQUYNHƠN OFFICIAL Trang12
Từ
Na
Na
K
Vậy công thức hóa học làFe3Zn. Câu 3: Tacó: 2CCO C nn0,4molm0,4.124,8gam
C %4,8m.100%4,8% 100
Câu 4: Gọi số mol của NavàKtrong hợp kim lần lượt làx,ymol. 23x39y7,7(*)
Quátrìnhcho nhận electron: NaNa1e
22H2eH
KK1e
Bảo toànelectron: 2NaKH nn2nxy2.0,150,3(**)
(*)và(**)tacó hệ phương trình: 23x39y7,7x0,25 xy0,3y0,05
m0,25235,75gam
%5,75m100%74,68% 7,7
m100%74,68%25,32%
CHƯƠNG 6: KIM LOẠI KIỀM, KIM LOẠI KIỀM THỔ, NHÔM VÀ HỢP CHẤT CỦA CHÚNG
BÀI 11: KIM LOẠI KIỀM VÀ HỢP CHẤT QUAN TRỌNG CỦA KIM LOẠI KIỀM Mục tiêu
Kiến thức
+ Biết được vị trí của kim loại kiềm trong bảng tuần hoànvà cấu hìnhelectronnguyên tử.
+ Biết được tính chất vật líchung của kim loại kiềm và một số hợp chất quan trọng.
+ Biết tính chất hóa học của kim loại kiềm và một số hợp chất quan trọng của kim loại kiềm.
+ Biết được một số ứng dụng quan trọng, trạng thái tự nhiên, phương pháp điều chế kim loại kiềm vàcác hợp chất quan trọng của kim loại kiềm.
Kĩ năng
+ Viết được cấu hìnhelectron của nguyên tử kim loại kiềm vàion tương ứng.
+Xác định đúng sản phẩm các phản ứng của kim loại kiềm và một số hợp chất của quan trọng.
+ Giải được cácbàitoán từ đơn giản đến phức tạp liênquan đến kim loại kiềm và một số hợp chất quan trọng của kim loại kiềm.
OFFICIAL
DẠYKÈMQUYNHƠN
Trang1
I. LÍ THUYẾT TRỌNG TÂM
A. KIM LOẠI KIỀM
1. Cấu hình electron Cấu hìnhelectronnguyên tử của kim loại kiềm có dạng [Khí hiếm] 1ns
Nguyên tố 3Li 11Na 19K 37Rb 55Cs Cấu hình electron nguyên tử 1He2s1He3s1Ar4s1Kr5s1Xe6s
Nguyên tử kim loại kiềm dễ mất một electron ở lớp ngoàicùng tạo thànhioncó điện tích1+. MM1e Vì vậy cấu hìnhelectron của ionkim loại kiềm là cấu hìnhelectron của khí hiếm đứng sát trước nó.
2. Vị trí trong bảng tuần hoàn
Kim loại kiềm thuộc nhómIAtrong bảng tuần hoàn (đứng đầu cácchukì2 đến 7). Dựa vào cấu hìnhelectronnguyên tử, xác định vị trí của kim loại kiềm: Số thứ tự nguyên tố = Số hiệu nguyên tử
Chukì= Số lớp electron NhómIA(vìcó1electron ở lớp ngoàicùng)
3. Tính chất vật lí
Cáckim loại kiềm cómàu trắng bạc vàcóánhkim, dẫn điện tốt, nhiệt độ nóng chảy và nhiệt độ sôi thấp, khối lượng riêng nhỏ, độ cứng thấp.
Trongcáckim loại kiềm thìLicó độ cứng, nhiệt độ nóng chảy và nhiệt độ sôicao nhất, khối lượng riêng nhỏ nhất; cònCscó độ cứng và nhiệt độ nóng chảy thấp nhất, khối lượng riêng lớn nhất.
4. Tính chất hóa học
Kim loại kiềm cótính khử rất mạnh vàtính khử tăng dần từ Li đến Cs: MM1e
DẠYKÈMQUYNHƠN
Trang2
OFFICIAL
Các
kim
ra rất dễ dàng ở điều kiện thường và mạnh liệt. Chú ý: Trong hợp chất kim loại kiềm chỉ có số oxihóa+1 •Tác dụng với oxi: (xảy ratrongoxikhô) 2 222NaONaO (xảy ratrongkhôngkhíkhô) 2 2 4NaO2NaO •Tác dụng với clo: 2 2KCl2KCl •Tác dụng với axit: 22Na2HCl2NaClH •Tác dụng với : 2 HO 2 22Na2HO2NaOHH
phản ứng của
loại kiềm xảy
Chú ý: Kim loại kiềm phản ứng dễ dàng với oxi và nước vì vậy để bảo quản kim loại kiềm người ta phải ngâmchìmtrong dầu hỏa.
5. Ứng dụng
Hợp kimNa-K được dùnglàm chất trao đổi nhiệt tronglò phản ứng hạt nhân.
Hợp kimLi-Alsiêu nhẹ, được dùngtrong kĩ thuật hàngkhông.
Kim loại Cs được dùnglàm tế bàoquang điện.
6. Trạng thái tự nhiên
Do khả năng phản ứng mạnh nêntrong tự nhiên,kim loại kiềm chỉ tồn tại ở dạng hợp chất. Như muối NaCI hoặc các muối silicat,aluminat.
7. Điều chế
Kim loại kiềm được điều chế bằng phương pháp điện phânnóng chảy muối halogenua của chúng.
Ví dụ: 2 2NaCl 2NaCl ®iÖnph©nnãngch¶y
B.
MỘT
SÔ HỢP
OFFICIAL
CHẤT QUAN TRỌNG CỦA KIM LOẠI KIỀM
1. Natri hiđroxit (NaOH)
a. Tính chất vật lí
NaOH (còn gọi là xút ăn da) là chất rắn, không màu, dễ nóng chảy, hút ẩm mạnh, tan nhiều trong nước và tỏa nhiệt mạnh. b. Tính chất hóa học NaOHlà một bazơ mạnh (kiềm), trongdung dịch: NaOHNaOH
DẠYKÈMQUYNHƠN
Trang3
•NaOHtác dụng với oxitaxit như CO2,SO2,... 2 2 32 CO2OHCOHO 2 3COOHHCO • Tác dụng với axit 243 HCl,HSO,HNO... 2 HOHHO •Tác dụng với muối như 4243CuSO,FeSO 2 2 Cu2OHCuOH 3 3 Fe3OHFeOH •Tác dụng với các chất lưỡng tính như 23 3AlO,AlOH 23 22 AlO2OH2AlOHO 22 3 AlOHOHAlO2HO Chú ý: Các phản ứng của NaOHlàdoionOH gâyra. c. Ứng dụng
NaOHlàhóa chất quan trọng, đứng hàng thứ haisauaxitsunfuric.NaOH được dùng để nấu xàphòng, chế phẩm nhuộm, tơ nhân tạo, tinh chế quặng nhômvàdùngtrongcông nghiệp chế biến dầu mỏ. 2. Natri hiđrocacbonat 3NaHCO a. Tính chất vật lí là chất rắn màu trắng, íttantrong nước. 3NaHCO b. Tính chất hóa học
phân hủy:
232 NaHCONaOHNaCOHO
2
32 HCOOHCOHO
Chú ý: Các muối hiđrocacbonat kháccócác phản ứng tương tự .3NaHCO c. Ứng dụng được dùngtrongcông nghiệp dược phẩm (như chế thuốc giảm đau dạ dày,...)vàtrongcông 3NaHCO nghiệp thực phẩm (như làm bột nở, ...). 3. Natri cacbonat 23NaCO a. Tính chất vật lí là chất rắn, màu trắng, tan nhiều trong nước. Ở nhiệt độ thường tồn tại dạng muối ngậm
DẠYKÈMQUYNHƠN OFFICIAL Trang4
t2 3 322 2HCOCOCOHO cótính lưỡng
vừa
3
3
axit,
23
. 232
b.
hóa học là muối của axit yếu nêncótính chất chung của muối. 23
Tác dụng với axit 23 3 NaCOHClNaHCONaCl 2 3 3COHHCO 23 22 NaCO2HCl2NaClHOCO 2 3 22 CO2HHOCO Thamgia phản ứng trao đổi ion
dễ bị nhiệt
3NaHCO t 3 2322 2NaHCONaCOCOHO
tính(doion )vì vậy
tác dụng được với dung dịch
NaHCO
HCO 3NaHCO
vừa tác dụng được với dung dịch kiềm. 3 22 NaHCOHClNaClHOCO 3 22 HCO2HHOCO
3
3
NaCO nước
NaCO.10HO
Tính chất
NaCO
Chú ý: Các muối cacbonatkháccócác phản ứng tương tự .23NaCO
c. Ứng dụng
làhóa chất quan trọng trongcông nghiệp thủy tinh, bột giặt, phẩm nhuộm, giấy, sợi,... 23NaCO
4. Kali nitrat 3KNO
a. Tính chất vật lí
làtinh thể khôngmàu,tan nhiều trong nước, bền trongkhôngkhí. 3KNO
b. Tính chất hóa học
Khi đun nóng ở nhiệt độ cao hơn nhiệt độ nóng chảy thì bị phân hủy: 3KNO t 3 222KNO2KNOO
c. Ứng dụng
được dùnglàmphânbón(phân đạm, phânkali)và được dùng để chế tạo thuốc nổ (thuốc súng 3KNO là hỗn hợp gồm 68% ,15%Svà17%C).3KNO Chú ý: Muối cũng cótính chất hóa học tương tự 3NaNO 3KNO
Trong dung dịch là muối trơ, nó không tham gia các phản ứng trao đổi ion hay phản ứng axit – 3KNO bazơ. Phản ứng cháy của thuốc súng xảy ratheo phương trình:
DẠYKÈMQUYNHƠN OFFICIAL Trang5
NaCOBaClBaCO2NaCl
232 3
22 3 3COBaBaCO
t KNOCSNCOKS KIM LOẠI
(IA) Cấu hìnhelectron lớp ngoàicùng: 1 ns Cáckim loại kiềm: Li,Na,K,Rb,Cs. Tính chất vật lý: Cómàu trắng bạc. Mạng tinh thế: Lập phương tâm khối. Khối lượng riêng tương đối nhỏ. Nhiệt độ nóng chảy, nhiệt độ sôi,tính cứng: Thấp ( giảm dần từ )LiCs Tính chất hóa học: Tính khử mạnh Tác dụng phikim: o Tác dụng với 2 2 2 O:4RnO2RO
3 222 23 3
KIỀM
Chúý: Ở nhiệt độ cao tạo và . 22RO2RO
o Tác dụng với phikimkhác: 2 2KCl2KCl
Tác dụng nước
o Phản ứng ở nhiệt độ thường: 2 22R2HO2ROHH
Người ta bảo quản kim loại kiềm bằng cách ngâm chìm trong dầu hỏa vì chúng dễ tác dụng với nước, với oxi.
Tác dụng với axit:
o Tác dụng với dung dịch loãng: 24HCl,HSO
Kim loại kiềm +Axit Muối + 2H
OFFICIAL
Chú ý: Nếu axit đã phản ứng hết mà kim loại còn dư thì kim loại đó sẽ tác dụng với nước trongdung dịch. 22Na2HCl2NaClH 2 22Na2HO2NaOHH d
Tác dụng với đặc ( trừ Au,Pt) 324 HNO,HSO
Kim loại + 324®Æ c 2 HNO/HSOMuèi+SPK+HO
Chú ý: Sản phẩm khử có thể xuống ,S hoặc .Cáckim loại kiềm đều nổ khi tiếp xúc 2 HS 43NHNO với axit.
Ứng dụng: Xesi(Cs) được dùnglàm tế bàoquang điện. Chế tạo hợp kimcó nhiệt độ nóng chảy thấp, siêu nhẹ (Li–Aldùngtrong kĩ thuật hàngkhông). Một số hợp chất quan trọng:
NaOH (Xút ăn da) o Bazơ mạnh (kiềm) o Ứng dụng: nấu xàphòng, chế phẩm nhuộm, tơ nhân tạo, tinh chế quặng nhôm, chế biến dầu mỏ...
o Chất rắn màu trắng, íttantrong nước, dễ bị nhiệt phân hủy.
Ứng dụng: Chế thuốc đau dạ dày, nước giải khát,công nghệ thực phẩm (bột nở)...
Chất rắn màu trắng, tan nhiều trong nước chomôi trường kiềm.
Là muối của axit yếu.
Ứng dụng: Sản xuất thủy tinh, bột giặt, nhuộm, giấy, sợi...
DẠYKÈMQUYNHƠN
Trang6
3
t 3 2322 2NaHCONaCOCOHO o
o
23NaCO o
o
o
NaHCO
Là hợp chất lưỡng tính.
(diêmtiêu) 3KNO
o Tinh thể khôngmàu.Phân hủy ở nhiệt độ cao hơn nhiệt độ nóng chảy. t 3 222KNO2KNOO
o Ứng dụng: dùnglàmphânbón, chế tạo thuốc nổ (thuốc súng).
II. CÁC DẠNG BÀI TẬP
Dạng 1: Lí thuyết trọng tâm
Kiểu hỏi 1: Xác định vị trí và cấu hình electron
Ví dụ mẫu
Ví dụ 1: Cấu hìnhelectron lớp ngoàicùng của nguyên tử K()là Z19
A. B. C. D. 12s 13s 14s 15s
Hướng dẫn giải
Cấu hìnhelectron của Klà: .226261 1s2s2p3s3p4s Chọn C. Chú ý: Electron được điền theo mức năng lượng: 1s2s2p3s3p4s3d...
Ví dụ 2:Nguyên tử Na(), cấu hìnhelectron lớp ngoàicùng của ion là Z11 Na
A. B. C. D. 262s2p 263s3p 13s 12s
Hướng dẫn giải
Cấu hìnhelectron của Nalà .2261 1s2s2p3s
Tacó: NaNa1e 2261 126 1s2s2p3s1s2s2p Vậy cấu hình của ion là . Na 126 1s2s2p Chọn A.
Chú ý: Cấu hìnhelectron của ion phải dựa vào cấu hìnhnguyên tử. Ví dụ 3:Ionkim loại có cấu hìnhelectron lớp ngoàicùnglà .Kim loại Mlà M 262s2p A. Na. B. Li. C. K. D. Cs. Hướng dẫn giải Cấu hìnhelectron của là . M 226 1s2s2p
Tacó: MM1e 2261226 1s2s2p3s1s2s2p
Vậy cấu hìnhelectron của Mlà (có11electron)nênMlàNa. 2261 1s2s2p3s
Chọn A.
DẠYKÈMQUYNHƠN
Trang7
OFFICIAL
Chú ý: Xác định tênnguyên tố có thể dựa vào số electronnguyên tử.
Kiểu hỏi 2: Tính chất
Ví dụ mẫu
Ví dụ 1: Kim loại kiềm có nhiệt độ nóng chảy thấp nhất là
A. Li. B. K. C. Na. D. Cs.
Hướng dẫn giải
Dựa vào bảng tính chất vật lí khẳng định Cscó nhiệt độ nóng chảy thấp nhất. Chọn D.
Ví dụ 2:Kim loại kiềm cótính khử mạnh nhất là
A. K. B. Li. C. Cs. D. Na.
Hướng dẫn giải
Tính khử của kim loại kiềm tăng dần từ Li đến Cs. Chọn C.
OFFICIAL
Ví dụ 3: Trongphòngthí nghiệm, kim loại Na được bảo quản bằng cáchngâmchìmtrong: A. nước. B. rượu etylic. C. dầu hỏa. D. giấm ăn. Hướng dẫn giải
Kim loại Natác dụng được với nước, rượu etylic, giấm ăn (có nước và )vì vậy ba chất này 3 CHCOOH không thể bảo quản Loại A,B,D. Na Dầu hỏa là hiđrocacbon nênkhông phản ứng với C đúng. Na Chọn C. Ví dụ 4: Cho mẩu nhỏ kim loại Navàodung dịch ,saukhi phản ứng hoàntoànthu được kết tủa là 4CuSO
DẠYKÈMQUYNHƠN
Trang8
Hướng
giải Trongdung dịch có nước vì vậy 4CuSO Trước
2 22Na2HO2NaOHH Sau đó: 4 24 2 CuSO2NaOHCuOHNaSO Chọn
Chú ý: Kim loại kiềm phản ứng với nước cótrongdung dịch trước. Ví dụ 5:Chocác chất: . Số chất tác dụng được với dung dịch NaOHlà 24 3Na,NaSO,NaCl,NaHCO A. 4. B. 2. C. 1. D. 3. Hướng dẫn gỉải Trongdung dịch NaOHcó nước vì vậy Na phản ứng được với nước trongdung dịch NaOH.
A. Cu B. . C. D. .
2 CuOH CuO 24NaSO
dẫn
hết:
B.
Mặt khác cótính lưỡng tínhnên phản ứng được với dung dịch bazơ NaOH. 3NaHCO
Vậy các chất tác dụng được với dung dịch NaOHlà: .3Na,NaHCO
Chọn B.
Ví dụ 6:Phát biểu nàosau đây sai?
A. được dùng chế thuốc giảm đau dạ dày. 3NaHCO
B. íttantrong nước. 3NaHCO
C. dễ bị nhiệt phân hủy. 3NaHCO
D. khôngtác dụng với dung dịch NaOH. 3NaHCO
Hướng dẫn giải
Dựa vàotính chất vật lí,tính chất hóa học và ứng dụng của Dsai. 3NaHCO
Chọn D.
Kiểu hỏi 3: Điều chế và ứng dụng Ví dụ mẫu
OFFICIAL
Ví dụ 1: Trongcông nghiệp, kim loại Na được điều chế bằng cách điện phânnóng chảy
A. NaCl. B. C. D. 23NaCO 24NaSO 3NaNO Hướng dẫn giải
Các kim loại kiềm được điều chế trong công nghiệp bằng phương pháp điện phân nóng chảy muối halogenua của nó. Chọn A.
Ví dụ 2: Trongcông nghiệp, NaOH không được dùng để
A. nấu xàphòng. B. sản xuất muối ăn. C. tinh chế quặng nhôm. D. chế phẩm nhuộm. Hướng dẫn giải
NaOH được sản xuất từ NaCllà muối ăn có nhiều trong tự nhiênvì vậy NaOHkhông thể dùng để sản xuất muối ăn.
Chọn B.
Chú ý: Trongcông nghiệp điều chế phải đi từ nguyên liệu sẵn
DẠYKÈMQUYNHƠN
Trang9
có Bài tập tự luyện dạng 1 Bài tập cơ bản Câu 1: Kim loại nàosau đây làkim loại mềm?
Ba.
Câu 2: Kim loại nàosau đây tan
trong nước dư ở nhiệt độ thường?
Câu 3: Số electron
ngoàicùng
Z19
A.
B. Al. C. Na. D. Cu.
hết
A. Mg. B. Fe. C. Al. D. Na.
lớp
của nguyên tử K là
A. 1. B. 2. C. 3. D. 4.
Câu 4: Kim loại kiềm mềm nhất là
A. Na. B. K. C. Li. D. Cs.
Câu 5: Kim loại kiềm có khối lượng riêng nhỏ nhất là
A. Na. B. Li. C. K. D. Cs.
Câu 6: Trongcác hợp chất, kim loại kiềm có số oxihóalà
A. +2. B. +1. C. -1. D. +3.
Câu 7: Trong hợp chất , số oxihóa của nguyên tố Nalà 22NaO
A. +1. B. +3. C. +2. D. +4.
Câu 8: Trongcông nghiệp, kim loại Na được điều chế bằng phương pháp
A. thủy luyện.
B. nhiệt luyện.
C. điện phândung dịch. D. điện phânnóng chảy.
Câu 9: Cáckim loại kiềm có
A. độ cứng thấp.
B. có nhiệt độ nóng chảy cao.
C. khối lượng riêng lớn. D. tính khử yếu.
Câu 10: ChoNavào nước thu được sản phẩm làkhí và 2H
A. B. C. D. 2 NaO 22NaO NaOH NaH
Câu 11: Phát biểu nàosau đây sai?
A. Xesi được dùnglàm tế bàoquang điện.
B. Hợp kimLi–Al được dùngtrong kĩ thuật hàngkhông.
C. Hợp kimLi–Nadùnglàm chất trao đổi nhiệt tronglò phản ứng hạt nhân.
D. Kim loại Na được dùng để sản xuất muối ăn trongcông nghiệp.
Câu 12: Chất nàosau đây được gọi làxút ăn da?
A. B. C. D. 23NaCO NaOH KOH NaCl
Câu 13: Trong nước biển chứa nhiều chất nàosau đây?
A. B. C. D. NaOH NaCl 23NaCO 24NaSO
Câu 14: Phát biểu nàosau đây đúng?
A. được dùngtrongcông nghiệp thủy tinh, bột giặt, giấy, sợi. 23NaCO
B. Thuốc súnglà hỗn hợp gồm KCl,S,C.
C. Nhiệt phân thu được sản phẩm gồm . 3KNO 222 KO,NO,O
DẠYKÈMQUYNHƠN
Trang10
OFFICIAL
ion .
ion .
D. Nhiệt phân thu được sản phẩm gồm 3NaHCO 222 NaO,CO,HO Câu 15: Điện phânnóng chảy NaCl ở catot xảy raquátrình A. khử
B. oxihóaion Na
Na
C. khử
D. oxihóaion Cl Cl Câu 16: Chocác chất: Na, . Số chất tác dụng được với dung dịch HCllà 2423 3NaSO,NaCO,NaHCO A. 1. B. 2. C. 4. D. 3. Câu 17: Phát biểu nàosau đây đúng?
A. cótính lưỡng tính. 3NaHCO
B. Nakhôngtác dụng với dung dịch NaCl.
C. khôngtác dụng với dung dịch NaOH. 3NaHCO
D. khôngtác dụng với dung dịch 23NaCO 2BaCl
Câu 18: Chocác chất: . Số chất tác dụng với dung dịch HCl tạo ra chất khílà 3NaOH,Na,K,KHCO
A. 1. B. 4. C. 2. D. 3.
Câu 19: Chocác chất: . Số chất tác dụng được với dung dịch NaOHlà 32 3KCl,Al,NaHCO,CO,AlOH
A. 3. B. 4. C. 2. D. 1.
Câu 20: Chocác chất: Số chất tác dụng được với dung dịch 2 4 HCl,KOH,BaCl,NaHSO,FeS 23NaCO là
A. 3. B. 4. C. 2. D. 1. Dạng 2: Bài toán xác định kim loại
Phương pháp giải
OFFICIAL
Bước 1: Viết phương trình phản ứng xảy ra rồi tínhtheo phương trìnhhóa học. Ngoàiracó thể dùng phương pháp bảo toànnguyên tố hoặc bảo toànelectron để tínhnhanh số mol. Bước 2:Tínhnguyên tử khối hoặc phân tử khối trungbình. Nếu bàitoán một kim loại thìtínhnguyên tử khối theocông thức , từ đó suyratên Mm n kim loại.
Nếu bàitoán hỗn hợp thìtìmphân tử khối trungbình từ đó kết hợp với điều kiện hh hh Mm n của bàitoán để
DẠYKÈMQUYNHƠN
Trang11
Ví dụ: Hòatan hết 4,68gamkim loại kiềm Mvào dư, thu được
là A. Rb. B. Li. C. K. D. Na. Hướng dẫn giải 2H n0,06mol Cách1: Phương trìnhhóa học: 2 22M2HO2MOHH 0,12 0,06mol Cách2: Bảo toànelectron: 2MH n2n2.0,060,12mol Mm4,6839 n0,12
tìmkim loại.
1,344lítkhí (đktc). Kim loại M 2 HO 2H
Vậy Mlàkali(K). Chọn C. Ví dụ mẫu Ví dụ 1:Hòatanhoàntoàn9,2gam hỗn hợp X gồm haikim loại kiềm vào400mldung dịch HCl0,5M thu được dung dịch Y chứa bốn chất tancó nồng độ mol bằng nhau.Haikim loại trongXlà A. LivàNa. B. LivàRb. C. LivàK. D. NavàK. Hướng dẫn giải Gọi công thức chung của haikim loại là . M Vìthu được bốn chất tancó số mol bằng nhaunêntacó số mol bằng số mol vàhaikim loại MOH MCl phải có số mol bằng nhau.
DẠYKÈMQUYNHƠN OFFICIAL Trang12
2 2
Có
KL
hỗn hợp gồm muối cacbonatvà hiđrocacbonat của một kim loại kiềm tác dụng với axitHCl dư thu được 0,448lítkhí ở đktc. Kim loại kiềm là A. K. B. Li. C. Na. D. Rb. Hướng dẫn giải: Tacó sơ đồ phản ứng: 3 2 2 23 MHCO HClMClHOCO MCO Bảo toànnguyên tố C: 2hhCO nn0,02mol hh hh hh Mm1,995 n0,02 3 23 MHCO MCO M M95M17,5M34 Kim loại MlàNa. Chọn C. Bài tập tự luyện dạng 2
2
2M2HCl2MClH 0,20,20,2mol 2M2HO2MOHH 0,2 0,2mol
một kim loại kiềm làLi(M<23).
9,2 n0,4molM23 0,4
Màhaikim loại có số mol bằng nhaunên Li MMM 23 2
M=39(Kali) Haikim loại trongXlàLivàK. Chọn C. Ví dụ 2:Cho1,9gam
Câu 1: Cho0,39gam một kim loại kiềm Xvào nước, thu được 0,112lítkhí (ở đktc). Kim loại kiềm 2H Xlà
A. Na. B. K. C. Li. D. Cs.
Câu 2: Hòatan hết 1,4gamkim loại kiềm Xvào200gam ,thu được dung dịch có khối lượng là 2 HO 201,2gam.Kim loại kiềm Xlà
A. Rb. B. Na. C. K. D. Li.
Câu 3: Hòatan hết 1,15gamkim loại Xvàodung dịch HCl,thu được 0,56lítkhí (ở đktc). Kim loại Xlà
A. Na. B. Ba. C. K. D. Ca.
Câu 4: Cho0,3gam hỗn hợp gồm haikim loại kiềm ở haichukì kế tiếp nhauvào nước, thu được 0,112 lítkhí (ở đktc). Haikim loại kiềm là 2H
A. Li,Na. B. Na,K. C. Li,K. D. K,Cs.
Câu 5: Hòatan hết 0,3gam hỗn hợp gồm haikim loại kiềm ở haichukì kế tiếp nhauvàodung dịch dịch HCl dư, thu được 0,224lítkhí (ở đktc). Haikim loại kiềm là:
A. Li,Na. B. Na,K. C. K,Cs. D. Li,K.
OFFICIAL
Câu 6: Đốt cháyhoàntoàn4,6gamkim loại kiềm Xtrongkhíclo dư, thu được 11,7gam muối. Kim loại kiềm Xlà
A. Na. B. Li. C. K. D. Cs. Câu 7: Cho5,3gam muối tác dụng với dung dịch HCl dư, thu được 1,12lítkhí ở đktc. Muối 23MCO là 23MCO
A. B. C. D. 23NaCO 23LiCO 23KCO 23CsCO Câu 8: Hoàtanhoàntoàn6,645gam hỗn hợp muối clorua của haikim loại kiềm thuộc haichukì kế tiếp nhauvào nước được dung dịch X.Chotoàn bộ dung dịch Xtác dụng hoàntoàn với dung dịch 3AgNO (dư), thu được 18,655gam kết tủa. Haikim loại kiềm trênlà
A. RbvàCs. B. NavàK. C. LivàNa. D. KvàRb. Câu 9: Hoàtanhoàntoàn1,1gam hỗn hợp gồm kim loại kiềm Xvàkim loại kiềm thổ Y() XYMM trongdung dịch HCl dư, thu được 1,12lítkhí (đktc). Kim loại Xlà 2H
A. Li. B. Na. C. Rb. D. K. Câu 10: Hòatan hết 0,897gamkim loại Xvào4,459ml tạo radung dịch kiềm có nồng độ 29,34%. 2 HO
DẠYKÈMQUYNHƠN
Trang13
riêng
A.
Dạng 3: Bài toán liên quan đến dung dịch kiềm Bài toán 1: Dung dịch kiềm tác dụng với axit Phương pháp giải Phản ứng trunghòa: 2 HOHHO Taluôncó: HOH nn
Biết khối lượng
của là1gam/ml.Kim loại Xlà 2 HO
Na. B. Ba. C. K. D. Ca.
Ngoàiracó thể giải bàitoán bằng cáchdùng sơ đồ vàcác phương pháp bảo toànnguyên tố, bảo toàn điện tích, bảo toànelectron. Chú ý: Bàitoánhòatanhoàntoànkim loại kiềm M với nước thu được dung dịch bazơ, sau đó trunghòa dung dịch bazơ bằng axit loãng: 24HCl/HSO 2 22M2HO2M2OHH Taluôncó: 2 M HOH nn2n Ví dụ:Trunghòa100mldung dịch NaOH1M cần dùngVmldung dịch 0,5M.Giá trị của Vlà 24HSO A. 100. B. 50. C. 200. D. 150. Hướng dẫn giải: NaOH OH n0,1moln0,1mol
Phản ứng trunghòa: 2 HOHHO 0,10,1mol
H HSO n n20,05mol
V0,050,1lÝt=100ml 0,5 Chọn A. Ví dụ mẫu Ví dụ 1:Hòatanhoàntoàn hỗn hợp NavàKvào nước dư, thu được dung dịch Xvà0,672lítkhí 2H (đktc). Thể tíchdung dịch HCl0,1M cần dùng để trunghòadung dịch Xlà A. 150ml. B. 300ml. C. 600ml. D. 900ml. Hướng dẫn giải 2H n0,03mol
DẠYKÈMQUYNHƠN
Trang14
OFFICIAL
24
Dung dịch Xcó: 2HOH n2n20,030,06mol Phản ứng trunghòa: HOH nn0,06mol HClH nn0,06mol HCl V0,060,6lÝt600ml 0,1 Chọn C. Bài toán 2: Bài toán tác dụng với dung dịch kiềm 2CO Phương pháp giải
Khicho tác dụng với dung dịch kiềm thìcó thể xảy ra phản ứng: 2CO 2 2 32 CO2OHCOHO1

•Bàitoáncho biết số mol của và : OH 2CO Xét tỉ lệ 2
n T n
OH CO
Nếu thìkhi đó:
1<T<2thìkhi
Nếu thìkhi đó: T2
Chú ý: muèicationkimlo¹ianiongècaxit mmm
•Bàitoánkhi chưa biết số mol thìxéthai trường hợp: 2CO
TH1: Chỉ tạo muối trunghòa,khi đó dư, hết và chỉ xảy ra phản ứng (1). OH 2CO
TH2: Tạo cả hai muối và ,khi đó cả và đều hết, xảy ra cả phản ứng (1)và(2). 2 3CO 3HCO OH 2CO Ví dụ: Hấp thụ 4,48lít (đktc) vào16,8gamKOHthu được mgam muối. Giá trị của mlà 2CO A. 28,3. B. 20,8. C. 28,0. D. 23,8.
DẠYKÈMQUYNHƠN OFFICIAL Trang15
2 3 COOHHCO2
T1 3 HCOOH nn Nếu
đó: 2 2 3 2 3 COCOOH COHCO OH nnn n2nn
2 2 3 CCO O nn
Hướng dẫn giải 2CO KOH n0,2mol;n0,3mol OH K n0,3mol;n0,3mol Xét tỉ lệ: 2 OH CO 1n0,3 T 1,52 n0,2 Tạo hai muối và 2 3CO 3HCO Khi đó 2 2 3 3 COCOOH HCO nnn0,30,20,1mol n0,20,10,1mol 2 3 3muèiKCOHCO mmmm 0,3390,1600,16123,8gam
Chọn D.
Ví dụ: Hấp thụ hết Vlít ở đktc vào100mldung dịch NaOH0,15M,thu được dung dịch chứa 5,3 2CO
gam muối. Giá trị của Vlà A. 2,24. B. 1,12. C. 3,36. D. 4,48. Hướng dẫn giải Phương trìnhhóa học: 2 232 CO2NaOHNaCOHO1 (2) 2 3CONaOHNaHCO
TH1: Chỉ tạo muối trunghòa 23NaCO 2 23CONaCO nn0,05mol 2CO V0,05.22,41,12lÝ t
TH2: Tạo cả hai muối (xmol)và (ymol). 23NaCO 3NaHCO NaOH n0,015mol Tacó hệ phương trình: 2xy0,015x0,0650Lo¹i 106x84y5,3y0,145
Chọn B
Ví dụ mẫu Ví dụ 1: Hấp thụ hết 3,36lít (đktc) vào200mldung dịch NaOH1M,thu được dung dịch X chứa 2CO A..0,05mol và0,10mol23NaCO 3NaHCO B. 0,10mol và0,05mol 23NaCO
DẠYKÈMQUYNHƠN OFFICIAL Trang16
3NaHCO C..0,075mol và0,075mol 23NaCO 3NaHCO D. 0,125mol và0,025mol 23NaCO 3NaHCO Hướng dẫn giải 2CO ONaOH H n0,15mol;nn0,2mol Xét tỉ lệ: Tạo hai muối và . 2 OH CO 1n0,24 T 2 n0,153 2 3CO 3HCO Khi đó: 2 2 3 2 3 3 COCOOH HCOOHCO nnn0,05mol nnn0,1mol Chọn A.
2,44gam.

DẠYKÈMQUYNHƠN OFFICIAL Trang17 Ví
2: Hấp
2CO
Hướng dẫn giải 2CO NaOH KOH n0,015mol;n0,01mol;n0,01mol OH Na K n0,02mol;n0,01mol;n0,01mol Xét tỉ lệ: Tạo hai muối và . 2 OH CO 1n0,024 T 2 n0,0153 2 3CO 3HCO Khi đó: 2 2 3 2 2 3 3 COCOOH COHCO CO nnn0,005mol nnn0,01mol Muối gồm cationkim loại ( và ),anion gốc axit( và ) NaK 2 3CO 3HCO 2 3 3chÊtr¾nkhanmuèiNaKCOHCO mmmmmm 0,01230,01390,005600,01611,53gam Chọn C. Bài toán 3: Cho hoặc tác dụng với dung dịch kiềm 25PO 34HPO Phương pháp giải Khi tác dụng với dung dịch kiềm thìcó thể xảy ra phản ứng: 34HPO 3 34 42 HPO3OHPO3HO 2 34 42 HPO2OHHPO2HO 34 242 HPOOHHPOHO Chú ý:Khicho tác dụng với dung dịch kiềm taquybàitoán về phản ứng dung dịch kiềm 25PO 34HPO do 252 34PO3HO2HPO Tacó: 34 25HPOPOn2n Bàitoáncho biết số mol của và : OH 34HPO Xét tỉ lệ: 34 OH HPO n T n Nếu thìkhi đó: T3 3 34 4 PHPO O nn
dụ
thụ hoàntoàn0,336lítkhí (đktc) vào100mldung dịch gồm NaOH0,1MvàKOH
0,1Mthu được dung dịch X.Cô cạn toàn bộ dung dịch Xthu được baonhiêugam chất rắn khan? A. 2,58gam. B. 2,22gam. C. 1,53gam. D.
nn2n nnn
Nếu thìkhi đó: 2T3 3 34 4 2 3 34 4 4
HPOPOOH HPOHPO PO
Nếu thìkhi đó: T2 3 34 4 PHPO O nn
nnn nnn
HPOHPOOH HPOHPO HPO
Nếu thìkhi đó: 1T2 2 34 4 2 34 24 4
Nếu thìkhi đó: T1 24 HPOOH nn
Bàitoán chưa biết số mol của hoặc thìtadùng sơ đồ sau: OH 34HPO 34 2 2
HPOKiÒmChÊttan+HO (HOH HO)
Xéthai trường hợp: TH1: Kiềm dư, hết H OHH nn Khi đó: 2 HOHnn
Dùng bảo toàn khối lượng để tính vàsosánh nếu thì thỏa mãn. HOHn,n OHH nn TH2: Kiềm hết, dư H HOH nn Khi đó: 2 HOOHnn
Dùng bảo toàn khối lượng để tính vàsosánh nếu thì thỏa mãn. HOHn,n HOH nn
Ví dụ: Cho200mldung dịch 0,3Mvào500mldung dịch 0,16M.Saukhi phản ứng 34HPO 2BaOH xảy rahoàntoàn, khối lượng muối thu được là A.12,02gam. B.16,68gam. C.12,20gam. D.11,56gam. Hướng dẫn giải
DẠYKÈMQUYNHƠN
Trang18
OFFICIAL
34 2 HPO BaOH n0,06mol;n0,08mol 2 OH Ba n0,16mol;n0,08mol Xét tỉ lệ: 34 OH HPO 2n0,16 T 2,673 n0,06 Tạo hai muối và . 3 4PO 2 4HPO Khi đó: 3 4 2 4 PO HPO n0,162.0,060,04mol n0,060,040,02mol 2 2 3 4 4muèiBaHPOPO mmmm 0,08.1370,02.960,04.95 16,68gam Chọn B.
Ví dụ:Chodung dịch chứa xmolNaOHvàodung dịch chứa 0,02mol thu được dung dịch chứa 34HPO
HPONaOHChÊttanHO (HOH HO) Chọn C. Ví dụ mẫu Ví dụ 1:Cho0,02mol vàodung dịch chứa 0,03molKOH.Saukhi phản ứng hoàntoàn,dung 34HPO dịch thu được chứa A.0,01mol và0,01mol . 24KHPO 24KHPO B. 0,01mol và0,01mol . 34KPO 34KPO C. 0,015mol và0,005mol . 24KHPO 34KPO D. 0,01mol và0,01mol . 24KHPO 34KPO Hướng dẫn giải
TH1: dư và hết OHH HOH nn Khi đó: 2 HOH nn0,06mol Bảo toàn khối lượng: 34 2 NaOHHPOchÊttanHO mmmm 40x0,02.983,060,06.18 x0,0545 Trường hợp này loại vì OHH nn TH2: hết và dư OHH HOH nn Khi đó: 2 HOOH nnxmol Bảo toàn khối lượng: 34 2 NaOHHPOchÊttanHO mmmm 40x0,02983,0618x x0,05 Trường hợp này loại vì HOH nn
DẠYKÈMQUYNHƠN
Trang19
OFFICIAL
3,06gam chất tan.Giá trị của xlà A.0,03. B.0,04. C.0,05. D.0,06. Hướng dẫn giải: 34HPO NaOH H OH n3n0,06mol;nnxmol Tacó sơ đồ: 34 2 2
Chọn A. Ví dụ 2:Cho1,42gam tác dụng hoàntoàn với 50mldung dịch KOH1M,thu được dung dịch X. 25PO Cô cạn dung dịch Xthu được chất rắn khan gồm A. và . B. và . 34 KPOKOH 24KHPO 34KPO C. và . D. và . 24KHPO 24KHPO 34HPO 24KHPO Hướng dẫn giải
Tạo hai muối và hay và . 2 4HPO 3 4PO 24KHPO 34KPO Chọn B. Ví dụ 3: Cho2,13gam vàodung dịch chứa xmolNaOHvà0,02mol .Saukhicác phản 25PO 34NaPO ứng xảy rahoàntoàn,thu được dung dịch chứa 6,88gamhai chất tan.Giá trị của xlà A.0,030. B.0,050. C.0,057. D.0,139. Hướmg dẫn giải
DẠYKÈMQUYNHƠN OFFICIAL Trang20
KOH OH
25 34 25
NaOH OH nxmolnxmol Tacó sơ đồ: 34 2 34 NaOH HPO ChÊttan+HO NaPO TH1: dư và hết OHH HOH nn Khi đó: 2 HOH nn0,09mol Bảo toàn khối lượng: 34 34 2 NaOHHPONaPOchÊttanHO mmmmm 40x0,03.980,02.1646,880,09.18 x0,057 Loại vì HOH nn
Xét tỉ lệ: Tạo hai muối và . 34 OH HPO 1n0,03 T 1,52 n0,02 24HPO 2 4HPO Khi đó: 2 34 4 2 34 24 4 HPOHPOOH HPOHPO HPO nnn0,01mol nnn0,01mol
25 34 25 PO HPOPO n0,01moln2n0,02mol
n0,05moln0,05mol
Xét tỉ lệ: 34 OH HPO 2n0,05 T 2,53 n0,02
PO HPOPO H n0,015moln2n0,03moln0,09mol
x0,03 Thỏa mãn. Chọn A. Chú ý: Các dạng bài tập thì đều chuyển về tác dụng với kiềm. 25 PO 34 HPO Bài tập tự luyện dạng 3 Bài tập cơ bản Câu 1: Dẫn 3,36lít (đktc) khí vào120mldung dịch NaOH2M.Sau phản ứng thu được 2CO
A. 0,15mol . B. 0,12mol . 3NaHCO 23NaCO C. 0,09mol và0,06mol . D. 0,09mol và0,06mol . 3NaHCO 23NaCO 23NaCO 3NaHCO Câu 2: Hòatanmgamkim loại Navào nước, thu được dung dịch X.TrunghòaX cần vừa đủ 100ml dung dịch 1M.Giá trị của mlà 24HSO
A. 2,3. B. 4,6. C. 6,9. D. 9,2. Câu 3: Hòatan hết hỗn hợp X gồm haikim loại kiềm vào nước, thu được dung dịch Yvà0,12molkhí Để trunghòaY cần vừa đủ Vmldung dịch hỗn hợp gồm HCl0,5Mvà 0,25M.Giá trị của V 2H 24HSO là
A. 120. B. 60. C. 480. D. 240. Câu 4: Hòatan hết một lượng hỗn hợp gồm KvàNavào dư, thu được dung dịch Xvà0,672lítkhí 2 HO (đktc). ChoXvàodung dịch dư, đến khi phản ứng xảy rahoàntoàn,thu được mgam kết tủa. 2H 3FeCl Giá trị của mlà
A. 2,14. B. 6,42. C. 1,07. D. 3,21. Câu 5: Trộn 100mldung dịch có gồm và với 100mldung dịch KOHamol/l,thu pH1 HCl 3HNO được 200mldung dịch có .Giá trị của alà pH12 A. 0,15. B. 0,12. C. 0,3. D. 0,03. Câu 6: Sục từ từ cho đến hết 3,36lít (đktc) khí qua0,1lítdung dịch chứa đồng thời 1Mvà 2CO 23NaCO NaOH1Mthìkhông thấy khíthoátra. Nồng độ các chất tancótrongdung dịch sau phản ứng là (Biết thể tíchdung dịch
DẠYKÈMQUYNHƠN OFFICIAL Trang21
TH2: hết và dư OHH HOH nn Khi đó: 2 HOOH nnxmol Bảo toàn khối lượng: 34 34 2 NaOHHPONaPOchÊttanHO mmmmm 40x0,03980,021646,8818x
thay đổi không đáng
A. 0,5Mvà 2M. B. 1Mvà 0,5M. 23NaCO 3NaHCO 23NaCO 3NaHCO C. 1Mvà 1M. D. 0,5Mvà 0,5M. 23NaCO 3NaHCO 23NaCO 3NaHCO Câu 7: Sục từ từ 4,48lít vào100mldung dịch hỗn hợp 2MvàKOH1,5Mthu được
2CO 23NaCO dịch X.Chodung dịch dư
2BaCl
kể)
dung
vàoXthu được khối lượng kết tủa là
A. 39,40gam. B. 59,10gam. C. 78,80gam. D. 29,55gam.
Câu 8: Cho0,02mol vàodung dịch chứa 0,02molKOHvà0,02mol .Saukhi phản ứng 25PO 34KPO hoàntoàn,dung dịch thu được chứa
A. 0,04mol và0,02mol . B. 0,06mol và0,01molKOH. 24KHPO 24KHPO 34KPO
C. 0,05mol và0,01mol . D. 0,03mol và0,03mol . 24KHPO 34KPO 24KHPO 34KPO
Bài tập nâng cao
Câu 9: Hấp thụ hoàntoàn4,48lítkhí (đktc) vào0,5lítdung dịch gồm NaOH0,4MvàKOH0,2M, 2CO thu được dung dịch X.ChoX phản ứng hoàntoàn với dung dịch dư, khối lượng kết tủa thu được là 2BaCl
OFFICIAL
A. 9,85gam. B. 29,55gam. C. 19,70gam. D. 39,40gam. Câu 10: Hòatan hết 0,2molFeO bằng dung dịch đặc, nóng (dư), thu được khí (sản phẩm 24HSO 2SO khử duy nhất). Hấp thụ hoàntoànkhí sinhra ở trênvàodung dịch chứa 0,07molKOHvà0,06mol 2SO NaOH,thu được dung dịch chứa mgam muối. Giá trị của mlà A. 15,32 B. 12,18. C. 19,71. D. 22,34. Dạng 4: Muối cacbonat và muối hiđrocacbonat tác dụng với axit Phương pháp giải
cho từ từ
DẠYKÈMQUYNHƠN
Trang22
3
muối thìkhi đó tacoi là 2CO 2 3CO 2CO23HCO Ví dụ mẫu Ví dụ 1: Nhỏ từ từ từng giọt đến hết 30mldung dịch HCl1Mvào100mldung dịch 0,2Mvà 23NaCO 0,2M,sau phản ứng thu được số mol là 3NaHCO 2CO A. 0,020. B. 0,030. C. 0,015. D. 0,010. Hướng dẫn giải: Tacó: 2 3 23 3 3 CO HCl NaCO HCO NaHCO H n0,02moln0,03mol n0,02moln0,02mol n0,02moln0,03mol Phương trìnhhóa học:
Nếu
dung dịch axit mạnh vàodung dịch muối và thì phản ứng xảy ra 2 3CO 3HCO theo thứ tự sau: 2 3 3HCOHCO
22 HHCOCOHO
Nếu cho từ dung dịch muối và vào dung dịch axit mạnh thì xảy ra phản ứng 2 3CO 3HCO đồng thời 2 3 22 2HCOCOHO
3 22 HHCOCOHO
Nếu bàitoáncho tác dụng với dung dịch
Trước phản ứng: 0,01 0,04 mol Phản ứng: 0,010,01 0,01 mol 2CO n0,01mol Chọn D. Ví dụ 2: Nhỏ từ từ đến hết 100mldung dịch X gồm 1,5Mvà 1Mvào200mldung 23KCO 3NaHCO dịch HCl1M,sinhraVlítkhí (đktc). Giá trị của Vlà A. 2,80. B. 3,36. C. 5,60. D. 6,72. Hướng dẫn giải: Tacó:
DẠYKÈMQUYNHƠN OFFICIAL Trang23 2 3
2 3 23 3 3 CO HCl KCO HCO NaHCO H
n0,15moln0,1mol n0,1moln0,2mol Ta thấy: hết 2 3 3 H COHCO n0,2mol2nn0,4molH Tỉ lệ: 2 3 2 3 3 3 CO COHCO HCO n0,153n:n3:2 n0,12 Gọi số mol của và lần
2 3CO 3HCO Phương trìnhhóa học: 2 3 22 CO2HCOHO 3x6x3xmol 3 22 HCOHCOHO 2x2x2xmol 6x2x0,2x0,025mol Theo phương trình: 2CO n5x50,0250,125mol lít 2CO V0,12522,42,8 Chọn A. Ví dụ 3: Hấp thụ hoàntoànVlítkhí (ở đktc) vào200mldung dịch X gồm NaOH1Mvà 2CO 23NaCO 0,5M,thu được dung dịch chứa 19,9gam chất tan.Giá trị của Vlà A. 3,36. B. 2,24. C. 1,12. D. 0,66. Hướng dẫn giải Coi là . Đặt: 2CO23HCO 23 2HCOCO H nnxmoln2xmol 23 NaOH NaCO OH n0,2moln0,2mol;n0,1mol
3HCOHCO 0,020,020,02mol
3 22 HHCOCOHO
n0,15moln0,2mol
lượt là3xmolvà2xmol.
Tacó sơ đồ: 23 2 23
NaOH HCO ChÊttan+HO NaCO
TH1: dư và hết () OHH HOH nn
Khi đó: 2 HOH nn2xmol Bảo toàn khối lượng: 23 23 2 HCONaOHNaCOchÊttanHO mnmmm 62x0,2400,110619,92x18 (Thỏa mãn) x0,05 lít 2CO V0,05.22,41,12
TH2: hết và dư ( ) OHH HOH nn Khi đó: 2 HOOH nn0,2mol Bảo toàn khối lượng: 23 23 2 HCONaOHNaCOchÊttanHO mnmmm 62x0,2.400,1.10619,90,2.18 (Loại) x0,079 Chọn C. Chú ý: Các dạng bài tập tác dụng với dung dịch kiềm nếu có chất chưa biết số mol thì chuyển về 2 CO tác dụng với kiềm sau đó dùng sơ đồ và xét hai trường hợp tương tự bài toán chưa biết số mol 23 HCO của hoặc (Bàitoán3). OH 34 HPO
Bài tập tự luyện dạng 4 Bài tập cơ bản Câu 1: Nhỏ từ từ từng giọt đến hết 150mldung dịch HCl1Mvào100mldung dịch chứa 1M, 23NaCO sau phản ứng thu được số mol là 2CO
A. 0,05mol. B. 0,10mol. C. 0,04mol. D. 0,01mol. Câu 2: Cho từ từ từng giọt đến hết 100mldung dịch 1Mvào100mldung dịch HCl1Mthu 23NaCO được Vlítkhí (ở đktc). Giá trị của Vlà 2CO
A. 2,24. B. 3,36. C. 1,12. D. 4,48. Câu 3: Nhỏ từ từ từng giọt đến hết 150mldung dịch HCl1Mvào100mldung dịch gồm 0,5M 23NaCO và 1M.Sau phản ứng thu được số mol là 3NaHCO 2CO
A. 0,05mol. B. 0,10mol. C. 0,04mol. D. 0,01mol. Câu 4: Cho từ từ từng giọt đến hết 150mldung dịch gồm 0,5Mva 1Mvào200ml 23NaCO 3NaHCO dung dịch HCl1Mthu được Vlítkhí (ở đktc). Giá trị của Vlà 2CO
A. 2,24. B. 3,36. C. 1,12. D. 4,48. Câu 5: Cho1,9gam hỗn hợp gồm muối cacbonatvà hiđrocacbonat của một kim loại kiềm tác dụng với axitHCl dư thu được 0,448lítkhí ở đktc. Kim loại kiềm là
DẠYKÈMQUYNHƠN
Trang24
OFFICIAL
A. K. B. Li. C. Na. D. Rb.
Bài tập nâng cao Câu 6: Hòatanhoàntoànmgam hỗn hợp gồm Na, ,NaOHvà trongdung dịch 2 NaO 23NaCO 24HSO 40%(loãng, vừa đủ) thu được 8,96lít hỗn hợp khícó tỉ khối đối với bằng 16,75vàdung dịch Ycó 2H nồng độ 51,449%.Cô cạn toàn bộ dung dịch Ythu được 170,4gam muối trunghoàkhan.Giá trị của mlà A. 23,8. B. 50,6. C. 50,4. D. 37,2. Câu 7: Xlàdung dịch HCl nồng độ xmol/l.Ylàdung dịch nồng độ ymol/l. Nhỏ từ từ 100ml 23NaCO Xvào100mlY,saucác phản ứng thu được lít (đktc). Nhỏ từ từ 100mlYvào100mlX,sau 1V 2CO phản ứng thu được lít (đktc). Biết tỉ lệ Tỉ lệ x:y bằng 2V 2CO 12 V:V4:7 A. 11:4. B. 7:5. C. 11:7. D. 7:3. Câu 8: Nungmgam hỗn hợp X gồm và ở nhiệt độ cao đến khối lượng không đổi, thu 3KHCO 3CaCO được chất rắn Y.ChoYvào nước dư, thu được 0,25mgam chất rắn Zvàdung dịch E. Nhỏ từ từ dung dịch HCl1MvàoE, đến khikhí bắt đầu thoátrathì hết lítdung dịch HClvà đến khikhíthoátra vừa 1V hết thì thể tíchdung dịch HCl đã dùnglà lít. Tỉ lệ bằng 2V 12V:V A. 3:5. B. 5:6. C. 2:3. D. 3:4. Câu 9: Dung dịch X gồm 2M và 2M. Nhỏ từ từ đến hết 100 ml dung dịch Y gồm 3KHCO 23NaCO 1MvàHCl1Mvào100mldung dịch Xthu được Vlít (đktc) vàdung dịch Z.Chodung 24HSO 2CO dịch tới dư vàodung dịch Z,thu được mgam kết tủa. Giá trị của mvàV lần lượt là 2 BaOH
OFFICIAL
A. 82,4và2,24. B. 59,1và1,12. C. 59,1và2,24. D. 82,4và1,12. Câu 10: Hấp thụ hết 4,48lít (đktc) vàodung dịch chứa hỗn hợp gồm xmolKOHvàymol , 2CO 23KCO thu được 200mldung dịch X.Cho từ từ 100mlXvào150mldung dịch HCl1M,thu được 2,688lít 2CO (đktc). Cho lượng dư dung dịch vào100mlX,thu được 39,4gam kết tủa. Giá trị của xvày 2 BaOH lần lượt là A. 0,10và0,20. B. 0,20và0,15. C. 0,10và0,15. D. 0,20và0,30. ĐÁP ÁN
DẠYKÈMQUYNHƠN
Trang25
Dạng 1: Lí thuyết trọng tâm 1–C 2–D 3–A 4–D 5–B 6–B 7–A 8–D 9–A 10–C 11–D 12–B 13–B 14–A 15–A 16–D 17–A 18–D 19–B 20–A Câu 11: A,B,C đúng. Dsaivì để sản xuất muối ăn trongcông nghiệp, người ta đi từ nước biển. Câu 14: A đúng. Bsaivì thuốc súnglà hỗn hợp gồm . 3 KNO,S,C Csaivì t 3 22 1 KNOKNOO 2 Dsaivì t 3 2322 2NaHCONaCOCOHO
Câu 15:
Trongquátrình điện phân, ở catot xảy raquátrình khử (cationkim loại hoặc ), ở anot xảy raquá 2 HO trìnhoxihóa(anion gốc axit hoặc ). 2 HO
Câu 16:Có3 chất tác dụng với HCllà: . 23 3Na,NaCO,NaHCO
Câu 17: A đúng.
BsaivìNatác dụng được với trongdung dịch NaCl. 2 HO
Csaivì cótính lưỡng tính,cótác dụng với dung dịch NaOH. 3NaHCO
Dsaivì tác dụng với tạo kết tủa . 23NaCO 2BaCl 3BaCO
Câu 18:Có3 chất tác dụng với HCl tạo ra chất khílà:Na,K, .3KHCO
Câu 19:Có4 chất tác dụng với NaOHlà: , , , . Al 3NaHCO2CO3 AlOH
Câu 20:Có3 chất tác dụng với dung dịch là:. 23NaCO 2 4HCl,BaCl,NaHSO Dạng 2: Bài toán xác định kim loại 1–B 2–D 3–A 4–B 5–A 6–A 7–A 8–C 9–A 10–A Câu 1: Tacó: 2 2 H XH n0,005moln2n0,01mol XlàK. X M0,3939 0,01
OFFICIAL
DẠYKÈMQUYNHƠN
Trang26
XlàLi. X
Câu
nlàhóa trị của X n1;2;3 Tacó: 2 2 H H X 2n0,05n0,025moln mol nn X M1,1523n 0,05 n Với XlàNa. X n1M23 Câu 4: Tacó: 2 2 H XH X 0,3 n0,005moln2n0,01molM30 0,01 Nhận thấy: Haikim loại làNavàK. Na KM30M Câu 5:
Câu 2: Bảo toàn khối lượng: 2 2 2 2 HXHOdd H XH mmmm0,2gamn0,1moln2n0,2mol
M1,47 0,2
3: Gọi
thấy:
loại
toàn khối lượng:
toànelectron:
DẠYKÈMQUYNHƠN OFFICIAL Trang27
XCl x
Li
và
2 2 XY
XY
XYMM Câu
Tacó: 2 HO
Gọi số mol của Xlàxmol và X M0,8971 2H n0,5xmol 2 2dungdÞchsauph¶nøngXHOHm mmm5,356xgam M17x 5100%29,342 ,356x Từ (1)và(2)suyra: XlàNa. X x0,039M23 Dạng 3: Bài toán liên quan đến dung dịch kiềm 1–D 2–B 3–D 4–A 5–B 6–A 7–D 8–A 9–C 10–B Câu 1: 2CO NaOH OH n0,15mol;n0,24moln0,24mol Tacó: Tạo hai muối. 2 OH CO Tn0,241,61T2 n0,15 2 2 23 3 3 3 CO NaCO COOH NaHCO HCO nnn0,09moln0,09mol n0,150,090,06moln0,06mol Câu 2: NaNaOH Na H OH n0,2moln0,2molnn0,2molm4,6gam
Tacó: 2 2 hh H XH 0,3 n0,01moln2n0,02molM15 0,02 Nhận
Haikim
làLivàNa. Li NaM15M Câu 6: Bảo
2 2 ClmuèiX Cl mmm7,1gamn0,1mol Bảo
XlàNa. 2XCl X 4,6 n2n0,2molM23 0,2 Câu 7: Tacó: Muối là . 2 23 23 CO MCO MCO n0,05moln0,05molM106M23 23NaCO Câu 8: AgCl XClAgCl n0,13molnn0,13mol
M51,1M15,6
Nhận thấy: Haikim loại làLivàNa.
NaM15,6M Câu 9: Tacó:
XlàLi.
HXYH
nn2n0,05n0,111M22
10:
m4,459gam
DẠYKÈMQUYNHƠN OFFICIAL Trang28 Câu 3: Tacó: H
n
000 Lại
2HOH
Câu
2 2 H HOH
3 3 FeOH FeOH 0,06 n30,02moln2,14gam Câu
: H n0,01mol Dung
sau phản ứng có dư. pH12OH Tacó: OHd d OH0,01n0,002mol XOH 0,012 n0,010,0020,012mola0,12 0,1 Câu
: 2 23 CO NaCONaOH n0,15mol;nn0,1mol Giả sử tác dụng với NaOH tạo hai muối 2CO 23 2 3 2 NaCOOCO H NaHCOCOOH nnn0,05mol n2nn0,2mol Sau phản ứng có 23 3 NaCO NaHCO n0,050,10,05mol;n0,2mol 23 3 MNaCO MNaHCO 0,05 0,2 C 0,5M;C 2M 0,1 0,1 Câu 7: 2 23 CO NaCO KOH n0,2mol;n0,2mol;n0,15mol 2 3CO OH n0,2mol;n0,15mol Giả sử chỉ tác dụng với KOH tạo hai muối 2CO 2 2 3 2 3 COCOOH COHCO OH nnn0,05mol n2nn0,25mol Sau phản ứng có 2 3CO n0,050,20,15mol 2 3 3 3 BaCO BaCO CO nn0,15molm0,15.19729,55gam Câu 8: 25 34 PO HPO n0,02moln0,04mol Nhận thấy: KOH hết. HOH nn Theo đáp án, cũng phản ứng hết nêndung dịch sau phản ứng chứa 2 muối. 34HPO TH1:Dung dịch gồm (amol)và (bmol) 34KPO 24KHPO
0,5V0,25V2
10,001Vmol
có:
n2n0,24mol0,001V0,24V240ml
4:
n0,03moln2n0,06mol
5
dịch
6
Bảo toànnguyên tố loại 3a2b0,08a0,04 ab0,06b0,1
TH2:Dung dịch gồm (xmol)và (ymol) 24KHPO 24KHPO Bảo toànnguyên tố K,P: thỏa mãn 2xy0,08x0,02 xy0,06y0,04
Câu 9: Gọi công thức chung của NavàKlà M
Nhận thấy: Thu được hỗn hợp muối (amol)và (bmol). 2
n 12 n 23MCO 3MHCO
OH CO
Bảo toànnguyên tố C: ab0,2*
Bảo toànnguyên tố : M 2ab0,3** Từ (*)và(**)suyra: a0,1;b0,1 Tacó: 2 3 3 3 BaCO BaCO MCO nnn0,1molm19,7gam
Câu 10: Gọi công thức chung của NavàKlà M
Bảo toànelectron: 2 2SOFeOSO 2nnn0,1mol
n 12 n 23MSO 3MHSO Bảo toànnguyên tố S: ab0,1* Bảo toànnguyên 3 22 HCOHCOHO 0,10,050,05mol
OH SO tố : M 2ab0,13** Từ (*)và(**)suyra: a0,03;b0,07 m0,07390,06230,03800,078112,18gam Dạng 4: Muối cacbonat và muối hiđrocacbonat tác dụng với axit 1–A 2–C 3–B 4–B 5–C 6–B 7–B 8–B 9–A 10–A Câu 1: Phương trìnhhóa học: 2 3 32 COHHCOHO 0,10,150,1mol
2CO n0,05mol Câu 2:
DẠYKÈMQUYNHƠN OFFICIAL Trang29
2CO OM H n0,2mol;nn0,5.0,40,5.0,20,3mol
Tacó: OM H nn0,060,070,13mol Ta thấy: Thu được hai muối (amol)và (bmol). 2
DẠYKÈMQUYNHƠN OFFICIAL Trang30 lít 2 2 CO CO H 1 nn0,05molV0,05.22,41,12 2 Câu 3: Phương trìnhhóa học: 2 3 32 COHHCOHO 0,050,150,05mol 3 22 HCOHCOHO 0,150,10,1mol Câu 4: 23 3 NaCO NaHCO HCl n0,075mol;n0,15mol;n0,2mol 2 3 3 CO HCO H n0,075mol;n0,15mol;n0,2mol Tacó: Gọi số mol và phản ứng lần lượt làxvà2xmol. 2 3 3 CO HCO n0,0751 n0,152 2 3CO 3HCO Lại có: 2 3 3 HCOpHCOp n2nn2.x2x4x0,2x0,05 Bảo toànnguyên tố C: lít 2 2 2 3 3 CO CO COpHCOp nnn3x0,15molV3,36 Câu 5: 2CO n0,02mol Phương trìnhhóa học: 23 22 MCO2HCl2MClCOHO1 3 22 MHCOHClMClCOHO2 Giả sử 1,9gam chỉ chứa muối thì chỉ xảy ra phản ứng (1). 23MCO Tacó: 23 2MCOCO nn0,02mol 23MCO M M1,995M17,5* 0,02 Giả sử 1,9gam chỉ chứa muối thì chỉ xảy ra phản ứng (2). 3MHCO Tacó: 3 2MHCOCO nn0,02mol 3MHCO M M1,995M34** 0,02 Từ (*)và(**)suyra: M 17,5M34 MàMlàkim loại kiềm nênMlànatri(). M23 Câu 6: khÝ m0,416,75213,4gam 24NaSO ddsaup m170,4gamm170,4:52,449%331,2gam
DẠYKÈMQUYNHƠN OFFICIAL Trang31 Tacó sơ đồ: 2 2424222 1,2mol 23 Na NaO HSONaSOHCOHO NaOH NaCO Bảo
24 24 HSO ddHSO 1,2.98n1,2molm4294gam 0% Tacó:
Câu 7: Tacó: 2 2 CO1 1 2 CO2 n0,1x0,1yV0,1x0,1y4x7 0,1xV0,1x7y5 n 2 2 Câu 8: Hỗn hợp X gồm (amol)và
3KHCO 3CaCO Y gồm
2 3HOHCO
Thoát hết khí: 2 3HOHCO nn2n2b2.0,5ab3bmol 12 V:V2,5:35:6 Câu 9: 2 4 H SO n0,3mol;n0,1mol Dung dịch Xcó: 2 3 3 CO HCO n0,2mol;n0,2mol Phương trìnhhóa học: 2 3 3COHHCO 0,20,20,2mol 3 22 HCOHCOHO 0,40,10,1mol
toànS:
m29413,4331,2,50,6
(bmol).
CaO(bmol)và (0,5amol). 23KCO ChoYvào nước dư: 2 2 CaOHOCaOH b bmol
23 3 2 KCOCaOH2KOHCaCO
Sau pư: 0,5ab 2bbmol Tacó: 100.abm a3b 100b0,25m
Nhỏ từ từ dung dịch HCl1MvàoEthoátkhínêndung dịch E gồm KOH(2bmol)và (0,5a–b 23KCO mol) Khi bắt đầu thoátkhí:
nnn2b0,5ab2,5bmol
lít V2,24 Tacó: 3 HCOd n0,20,20,10,3mol Bảo toànnguyên tố C: 3BaCO n0,3mol Bảo toànnguyên tố S: 4BaSO n0,1mol m0,3.1970,1.23382,4gam Câu 10:Dung dịch X: 2 33HCO;CO Cho lượng dư dung dịch vào100mlXthu được 0,2mol : 2 BaOH 3BaCO 2 3 3HCOCO nn0,2mol
Tacó hệ phương trình: ab0,15a0,09 a0,5b0,12b0,06
(0,3mol); (x+2ymol)
DẠYKÈMQUYNHƠN OFFICIAL Trang32
2
3
Từ
Ở thí nghiệm với thì hết. HH Cho100mldung dịch X từ từ vào0,15mol : H 3 22 HCOHCOHO aaamol
3 22 CO2HCOHO 0,5bb0,5bmol
Tacó: 3 2
HCO CO n0,093 n0,062
100mldung dịch Xcó (0,05mol)và (0,15mol). 2 3CO 3HCO Trong200mldung dịch Xcó: (0,1mol);
2 3CO 3HCO K Bảo toàn điện tích:
x2y0,120,30,5*
Bảo toànnguyên tố C:
0,2y0,10,30,4**
(*)và(**)suyra: x0,1;y0,2
CHƯƠNG 6: KIM LOẠI KIỀM, KIM LOẠI KIỀM THỔ, NHÔM VÀ HỢP CHẤT CỦA CHÚNG
BÀI 12: KIM LOẠI KIỀM THỔ VÀ HỢP CHẤT QUAN TRỌNG CỦA KIM LOẠI KIỀM THỔ
Mục tiêu
Kiến thức
+ Biết được vị trí của kim loại kiềm thổ trong bảng tuần hoànvà cấu hìnhelectronnguyên tử.
+Nêu được tính chất vật líchung của kim loại kiềm thổ và một số hợp chất quan trọng.
+Trìnhbày được tính chất hóa học của kim loại kiềm thổ và một số hợp chất quan trọng của kim loại kiềm thổ.
+ Chỉ ra được một số ứng dụng các hợp chất quan trọng của kim loại kiềm thổ.
+Trìnhbày được thế nàolà nước cứng, tác hại của nước cứng vàcáchlàm mềm nước cứng. Kĩ năng
+ Viết được cấu hìnhelectron của nguyên tử kim loại kiềm thổ vàion tương ứng.
+ Xác định đúng sản phẩm các phản ứng của kim loại kiềm thổ và một số hợp chất của quan trọng.
OFFICIAL
+ Giải được cácbàitoán từ đơn giản đến phức tạp liênquan đến kim loại kiềm thổ và một số hợp chất quan trọng của kim loại kiềm thổ.
+ Giải được cácbài tập xác định loại nước cứng vàcáchlàm mềm nước cứng.
+ Vận dụng kiến thức để giải quyết cácbàitoán thực tế.
DẠYKÈMQUYNHƠN
Trang1
I. LÍ THUYẾT TRỌNG TÂM
A. KIM LOẠI KIỀM THỔ
1. Cấu hình electron
Cấu hìnhelectron:[Khí hiếm] . 2ns
Nguyên tử kim loại kiềm thổ dễ mất haielectron ở lớp ngoàicùng tạo thànhioncó điện tích2+. 2 MM2e
Cấu hìnhelectron của ionkim loại kiềm thổ là cấu hìnhelectron của khí hiếm gần nhất đứng trước nó.
Ví dụ: Cấu hình electron của Mg(): Z12 23 Nes
2. Vị trí trong bảng tuần hoàn
Vị trínguyên tố trong bảng tuần hoàn: Số thứ tự = số hiệu nguyên tử.
Chukì= số lớp electron. NhómIIA(vìcó2electron lớp ngoàicùng).
Ví dụ: Cấu hình electron của nguyên tử Mg: 22621223 ssps
Nguyên tố Mg thuộc ô thứ 12, chu kì 3, nhóm IIA.
3. Tính chất vật lí
Cáckim loại kiềm thổ cómàu trắng bạc, có thể dát mỏng.
OFFICIAL
Nhiệt độ nóng chảy và nhiệt độ sôi tương đối thấp (nhưng cao hơn kim loại kiềm).
Khối lượng riêng tương đối nhỏ, độ cứng tương đối thấp.
Chú ý: Tính chất vật lí của kim loại kiềm thổ thay đổi không theo quy luật vì chúng có mạng tinh thể khác nhau
4. Tính chất hóa học
Kim loại kiềm thổ cótính khử mạnh vàtính khử tăng dần từ Be đến Ba: 2 MM2e
Trong hợp chất kim loại kiềm thổ chỉ có số oxihóa+2. Tính khử của kim loại kiềm thổ thể hiện quacác phản ứng với phikim,axit, nước,...
DẠYKÈMQUYNHƠN
Trang2
ứng chậm. B. MỘT SỐ HỢP CHẤT QUAN TRỌNG CỦA KIM LOẠI KIỀM THỔ 1. Canxi hiđroxit: 2 CaOH Là chất rắn màu trắng, íttantrong nước. Tên gọi khác:vôitôi Dung dịch gọi làdung dịch nước vôitrong. 2CaOH có đầy đủ tính chất của một bazơ. 2CaOH Được dùngtrongcông nghiệp sản xuất amoniac,cloruavôi ; vật liệu xây dựng... 2CaOCl
Chú ý: Ở nhiệt độ thường, Be không tác dụng với nước, Mg phản
Chú ý: 1. Dung dịch nước vôi trong thường dùng để nhận biết 2 CO 2 32 2 COCaOHCaCOHO 2. Phản ứng tạo clorua vôi. 2 22 2 CaOHClCaOClHO 2. Canxi cacbonat: 3CaCO Là chất rắn, màu trắng, khôngtantrong nước, phân hủy ở .1000C t 3 2CaCOCaOCO Tan được trongcácaxit mạnh. 2 3 22 CaCO2HCaCOHO
Trong tự nhiên tồn tại ở dạng đá vôi, đá hoa, đá phấn, vàthành phần chính của vỏ vàmai 3CaCO ốc, sò, hến... Đá vôi được dùnglàm vật liệu xây dựng, sản xuất vôi,xi măng, thủy tinh,... Chú ý: 1. bị hòa tan trong nước có 3 CaCO 2 CO 322 32CaCOCOHOCaHCO 2. Sự tạo thành thạch nhũ trong hang động, cặn trong ấm nước là do phản ứng: t 3 322 2 CaHCOCaCOCOHO 3. Canxi sunfat: 4CaSO Canxisunfat() tồn tại ba dạng: 4CaSO
Thạch cao sống: 42 CaSO.2HO
Thạch caonung: hoặc 42 CaSOHO 42 CaSO0,5HO
Thạch caokhan: 4CaSO
Chú ý:
DẠYKÈMQUYNHƠN
Trang3
OFFICIAL
Thạch cao nung được dùng để bó bột khi gãy xương, đúc khuôn, nặn tượng. 4. Nước cứng a. Khái niệm Nước cứng là nước chứa nhiều ion hoặc hoặc cả haiion đó. 2Ca 2Mg Nước mềm là nước chứa ít hoặc không chứa ion và . 2Ca 2Mg Chú ý: Nước cứng là khái niệm đánh giá nước tự nhiên.
b. Phân loại
Nước cứng cóba loại tính cứng:
Tính cứng tạm thời làtính cứng gâynên bởi ion , dưới dạng muối . 2Ca 2Mg 3HCO
Tính cứng vĩnh cửu làtính cứng gâyra bởi ion , dưới dạng muối sunfat hoặc clorua. 2Ca 2Mg
Tính cứng toàn phần gồm cả tính cứng tạm thời và cả tính cứng vĩnh cửu.
Chú ý:
1. Khi đun nóng mà mất tính cứng thì tính cứng đó được gọi là tính cứng tạm thời.
2. Các bài tập phân biệt tính cứng là dựa vào thành phần ion âm.
c. Tác dụng của nước cứng
Tạo cặn trong nồi hơi, trong ấm nước, trong ống dẫn nước.
Khi giặt quần áo với nước cứng thìxàphòng bị kết tủa, tốn xàphòng,làm quần áonhanh hỏng do kết tủa bámvào quần áo.
OFFICIAL
Làm giảm mùi vị của thức ăn, nước uống, làm thức ăn lâuchín.
d. Cách làm mềm nước cứng
Nguyên tắc làm mềm nước cứng là giảm nồng độ ion và trong nước cứng. 2Ca 2Mg
Dùngcácdung dịch muối hoặc dùng phương pháptrao đổi ionlàm mềm được tất cả 23 34CO,PO các loại tính cứng. Dùngcách đun nóng hoặc dùngdung dịch kiềm như NaOH,KOH, vừa đủ chỉ làm mềm 2 CaOH
được tính cứng tạm thời.
Chú ý: Phương pháp làm mềm nước bằng cách tạo kết tủa với và gọi là phương pháp kết 2Ca 2Mg tủa.
SƠ ĐỒ
HỆ THỐNG HÓA
KIM LOẠI KIỀM THỔ (IIA): Cấu hìnhelectron lớp ngoàicùng: ,cáckim loại kiềm thổ: Be,Mg, 2ns Ca,Sr,Ba.
TÍNH CHẤT VẬT LÝ
Cómàu trắng bạc.
Khối lượng riêng tương đối nhỏ.
Nhiệt độ nóng chảy, nhiệt độ sôi,tính cứng: o Thấp nhưng cao hơn nhómIA.
o Hơi cứng hơn kim loại kiềm nhưng vẫn tương đối mềm.
TÍNH CHẤT HÓA HỌC
Tính khử mạnh
DẠYKÈMQUYNHƠN
Trang4
Tác dụng phi kim o Tác dụng với 2 2 O:2RO2RO
Tác dụng nước
o Kim loại kiềm thổ (trừ Be,Mg) phản ứng với nước ở nhiệt độ thường: 2 22R2HOROHH
Chú ý: Bekhông phản ứng với nước, Mgkhông phản ứng ở nhiệt độ thường nhưng phản ứng được với nước ở nhiệt độ cao. Tác dụng với axit o Tác dụng với dung dịch loãng: 24HCl,HSO 2Kimlo¹ikiÒmthæ+AxitMuèiH o Tác dụng với đặc (trừ Au,Pt) 324 HNO,HSO 324 2 Kimlo¹i+HNO/HSO®ÆcMuèiSPKHO Chú ý: Sản phẩm khử có thể xuống hoặc 2 HS,S 43NHNO MỘT SỐ HỢP CHẤT QUAN TRỌNG
(vôi tôi) 2CaOH o Chất rắn màu trắng, íttantrong nước. o Dung dịch được gọi là nước vôitronglà một bazơ mạnh. 2 CaOH o Ứng dụng: chế tạo vữa; khử chua đất trồng; sản xuất ,cloruavôi...3NH
4CaSO o : Thạch cao sống; dùng để sản xuất xi măng. 42 CaSO.2HO o hoặc : Thạch caonung; thường dùng để làm phấn viết, bó 42 CaSOHO 42 CaSO0,5HO bột, đúc tượng. o : Thạch caokhan.
DẠYKÈMQUYNHƠN
Trang5
OFFICIAL
4CaSO (vôi sống) 3CaCO o Chất rắn màu trắng, khôngtantrong nước, phân hủy ở nhiệt độ 1000C o Sự xâm thực của nước mưa: 322 32CaCOCOHOCaHCO o Sự tạo thành thạch nhũ trongcáchang động: 3 322 2 CaHCOCaCOCOHO NƯỚC CỨNG ( CHỨA NHIỀU VÀ ) 2Ca 2Mg Phân loại o Nước cứng tạm thời: chứa 3HCO
o Nước cứng vĩnh cửu: chứa 2 4 SO,Cl
o Nước cứng toàn phần: chứa 2 34 HCO,SO,Cl
Phương pháp làm mềm nước cứng:
o Đối với nước cứng tạm thời: Đun sôi; vừa đủ. 2 CaOH
o Đối với nước cứng: phương pháptrao đổi ion:dùng hoặc . 23NaCO 34NaPO
Tác hại:
o Làm giảm hương vị khi nấu ăn, phatrà, thực phẩm lâuchín.
o Giặt quần áo: tốn xàphòng, quần áonhanh hỏng.
o Tắc ống dẫn nước.
II. CÁC DẠNG BÀI TẬP
Dạng 1: Lí thuyết trọng tâm Ví dụ mẫu
Ví dụ 1: Vị trí của kim loại M()trong bảng tuần hoànlà Z12
A. chukì2,nhómIIA. B. chukì3,nhómIIA. C. chukì2,nhómIIIA. D. chukì3,nhómIIIA. Hướng dẫn giải: Cấu hìnhelectronM(): . Z12 2262 1s2s2p3s Nguyên tử Mcó: Số hiệu nguyên tử Ô thứ 12. Z12 3 lớp electron Chukì3. 2electron lớp ngoàicùng NhómIIA.
Do đó, M thuộc ô thứ 12,chukì3,nhómIIAtrong bảng tuần hoàn. Chọn A.
DẠYKÈMQUYNHƠN
Trang6
OFFICIAL
Ví dụ 2: Chất tác dụng với dung dịch tạo ra kết tủa trắng là 2 CaOH A. . B. . C. D. . 32CaHCO 2BaCl 32BaNO 2CaCl Hướng dẫn giải: A đúng vì phản ứng được với và tạo kết tủa trắng. 32CaHCO 2 CaOH 3 3 2 2 CaOHCaHCO2CaCO2HO B,C,Dsaivì không phản ứng được với 2 CaOH 2 322BaCl,BaNO,CaCl Chọn A. Ví dụ 3: Dung dịch không thể làm mềm nước cótính cứng tạm thời là A. dung dịch NaOH. B. dung dịch 23NaCO C. dung dịch HCl. D. dung dịch 34NaPO Hướng dẫn giải:
Nước có tính cứng tạm thời có thể làm mềm bằng dung dịch kiềm hoặc các dung dịch muối NaOH
. 23 34CO,PO
HClkhông thể làm mềm nước cứng tạm thời.
Chọn C.
Ví dụ 4: Nung thạch cao sống ở ,thu được thạch caonung.Công thức của thạch caonunglà 160C
A. . B. . C. D. . CaO 42 CaSO.2HO 42 CaSO.HO 4CaSO Hướng dẫn giải Một số dạng tồn tại của canxisunfat
: Thạch caokhan 4CaSO
: Thạch caonung 42 CaSO.HO : Thạch cao sống 42 CaSO2HO
Chọn C. Ví dụ 5: Trong khí thải công nghiệp thường có chứa các khí và. Để loại bỏ các chất khí đó 2SO 2NO trong hệ thống xử líkhí thải ta sử dụng A. dung dịch B. 2 CaOH 2 HO C. khí . D. dung dịch HCl. 3NH
OFFICIAL
Hướng dẫn giải hấp thụ hoàntoàn được và do xảy ra phản ứng, đồng thời sẵn cóvà rẻ tiền 2 CaOH 2SO 2NO 2 CaOH nênhay được sử dụng trongcông nghiệp. Chọn A. Ví dụ 6: Phản ứng giải thích sự hìnhthành thạch nhũ trongcáchang động và cặn trong ấm đun nước là
DẠYKÈMQUYNHƠN
Trang7
CaCOCaOCO B. 22 3 32COHOCaCOCaHCO C. 2 32 2 COCaOHCaCOHO D. t 3 322 2 CaHCOCaCOCOHO Hướng dẫn giải: Cặn trong ấm nước hoặc thạch nhũ là chất rắn, được tạo ra từ chất tancó sẵn trong nước tự nhiên đó là . 32CaHCO Phương trìnhhóa học: t 3 322 2 CaHCOCaCOCOHO Chọn D. Bài tập tự luyện dạng 1 Câu 1: Chất thường được dùng để khử chua đất trong sản xuất nông nghiệp là
A. t 3 2
A. . B. . C. D. . 4CaSO 3CaCO CaO 2CaCl
Câu 2: Kim loại nàosau đây không tantrong nước?
A. Na. B. Be. C. Ca. D. Ba.
Câu 3: Thành phần chính của đá vôilà
A. B. C. D. . 4CaSO 3CaCO 2 CaOH CaO
Câu 4: Vật liệu thường được dùng để bó bột khigãy xương, nặn tượng là
A. đá vôi. B. thạch caokhan. C. thạch cao sống. D. thạch caonung.
Câu 5: Để xử lí sơ bộ nước thải công nghiệp chứa cácionkim loại nặng, người ta thường dùng
A. dung dịch NaCl. B. nước vôitrong. C. nước máy. D. dung dịch 24HSO
Câu 6: Dung dịch tác dụng được với là 3CaCO
A. dung dịch HCl. B. dung dịch NaCl. C. dung dịch NaOH. D. dung dịch 2 NaS
Câu 7: Trong tự nhiên,canxisunfat tồn tại dưới dạng muối ngậm nước () được gọi là 42 CaSO.2HO
OFFICIAL
A. thạch caonung. B. thạch caokhan. C. đá vôi. D. thạch cao sống. Câu 8: Để làm sạch lớp cặn trongcác dụng cụ đun và chứa nước nóng, người tadùng
A. nước vôitrong. B. giấm ăn. C. dung dịch muối ăn. D. ancoletylic. Câu 9: Một mẫu nước cứng chứa cácion: . Chất được dùng để làm mềm 22 2 3 4Ca,Mg,HCO,Cl,SO nước cứng trênlà
A. B. C. HCl. D. 3NaHCO 23NaCO 24HSO Câu 10: Cho mẫu nước cứng chứa cácion: .Hoá chất được dùng để làm mềm mẫu 22 3Ca,Mg,HCO nước cứng trênlà
A. HCl. B. C. D. NaCl. 23NaCO 24HSO Câu 11: Muối dễ bị phân hủy khi đun nónglà
A. B. NaCl. C. D. 2CaCl 32CaHCO 24NaSO Câu 12: Dung dịch khitác dụng với axit vừa tạo khí, vừa tạo kết tủa là 24HSO A. . B. C. D. 23NaCO 2BaCl 32BaHCO 2 CaOH Câu 13: Dãy gồm các chất đều có thể làm mất tính cứng
DẠYKÈMQUYNHƠN
Trang8
tạm thời của nước là: A. B. 23 HCl,NaOH,NaCO. 3423 NaOH,NaPO,NaCO. C. D. 223 KCl,CaOH,NaCO 223 HCl,CaOH,NaCO Câu 14: Một loại nước cứng khi đun sôithì mất tính cứng. Trong loại nước cứng nàycóhòatancác chất: A. . B. 4 2CaSO,MgCl 3 3 2 2CaHCO,MgHCO C. D. . 322MgHCO,CaCl 3 2 2 CaHCO,MgCl Câu 15: Dãy gồm các chất đều có thể làm mất tính cứng vĩnh cửu của nước là: A. B. C. D. 23NaOH,NaCO 3423 NaPO,NaCO 223 CaOH,NaCO 2423 KSO,NaCO Câu 16: Chocácphát biểu sau: (a) Nước cứng chứa nhiều ion hoặc . 2Ca 2Mg
(b) Tất cả kim loại kiềm thổ đều tantrong nước ở nhiệt độ thường.
(c)Khi giặt quần áo bằng xàphòngtrong nước cứng thì tốn xàphòng.
(d) được sử dụng rộng rãitrong nhiều ngànhcông nhiệp. 2 CaOH
(e) Thạch cao sống cócông thức là . 42 CaSOHO
(g) Đun nóngcó thể làm mềm nước cótính cứng vĩnh cửu. Số phát biểu đúng là
A. 3. B. 1. C. 2. D. 4. Câu 17: Lần lượt cho mẫu Bavào lượng dư cácdung dịch: . Số trường 24 3 34 KSO,NaHCO,HNO,NHCl hợp có xuất hiện kết tủa là
A. 3. B. 4. C. 2. D. 1. Câu 18: Tiến hànhcácthí nghiệm sau:
(a)Chodung dịch vàodung dịch . 23NaCO 24HSO
(b)Chokim loại Navàodung dịch 4CuSO
(c)Chodung dịch vàodung dịch 43 2 NHCO 2 CaOH
OFFICIAL
(d)Chodung dịch vàodung dịch . 3NaHCO 2 CaOH (e)Chodung dịch vàodung dịch . 44 2 NHSO 2 BaOH (g)Chodung dịch vàodung dịch . 4NaHSO 32BaHCO Số thí nghiệm có đồng thời cả kết tủa vàkhílà A. 2. B. 3. C. 4. D. 5. Câu 19: Chocác
DẠYKÈMQUYNHƠN
Trang9
12
22 3COXX 22 42 CO2XXHO 35 22 XXTXHO 35 42 2XXTX2HO Hai chất lần lượt là: 25X,X A. . B. . C. D. 232 KCO,BaCl 32KOH,BaHCO 3 2KHCO,BaOH 2KOH,BaOH Câu 20: Kim loại nàosau đây khử được ionFe2+ trongdung dịch FeSO4 thànhFelà A. Cu. B. Ca. C. Ba. D. Mg. Dạng 2: Bài toán liên quan đến tính chất của kim loại kiềm thổ Phương pháp giải Viết phương trình phản ứng xảy ra rồi tínhtheo phương trìnhhóa học. Ngoàiracó thể dùng phương pháp bảo toànnguyên tố hoặc bảo toànelectron để tínhnhanh số mol. Chú ý 1:
phản ứng xảy ratheo sơ đồ sau: ®iÖnph©n
2cãmµngngn2X2HO 2XYZ
1.Kim loại Ca,Batác dụng với nước giống kim loại kiềm.
2.Bàitoánkim loại Mgkhitác dụng với dung dịch thường có sản phẩm muối . 3HNO 4NH
Chú ý 2: Với bàitoánxác định kim loại:
Nếu bàitoán một kim loại thìtínhnguyên tử khối theocông thức , từ đó suyratênkim loại. Mm n
Nếu bàitoán hỗn hợp thìtìmphân tử khối trungbình , từ đó kết hợp với điều kiện của bài hh hh Mm n toán để tìmkim loại. Ví dụ: Cho4,8gamkim loại M thuộc nhómIIAtan hết trongdung dịch HCl dư, thu được 4,48lítkhí ở đktc. Kim loại Mlà A. Ca. B. Be. C. Mg. D. Ba. Hướng dẫn giải: 2H n0,2mol Phương trìnhhóa học: 22M2HClMClH 0,2 0,2mol M Mm4,824Mg n0,2 Vậy kim loại Mlàmagie(Mg). Chọn C.
OFFICIAL
DẠYKÈMQUYNHƠN
Trang10
2
X X X
Ví dụ mẫu Ví dụ 1: Hòatan hết 5gamkim loại kiềm thổ Xvàodung dịch HCl dư thu được 2,8lít ở đktc. Kim 2H loại Xlà A. Ba. B. Mg. C. Ca. D. Sr. Hướng dẫn giải: 2H n0,125mol
Cách 1: Tínhtheo phương trìnhhóa học Phương trìnhhóa học:
22X2HOXOHH 0,125 0,125mol
Mm540 n0,125
Kim loại XlàCa(canxi).
Cách 2: Bảo toànelectron Quátrìnhcho nhận electron: 2 2XX2e2H2eH Bảo toànelectron: 2 XHX 2n2nn0,125mol X X X Mm540 n0,125 Kim loại XlàCa(canxi). Chọn C. Ví dụ 2: Hoàtan hết 6,4gam hỗn hợp M gồm kim loại X(nhómIIA)vàoxit của nó cần vừa đủ 400ml dung dịch HCl1M.Kim loại Xlà A. Ba. B. Mg. C. Be. D. Ca. Hướng dẫn giải: HCl n0,4mol Phương trìnhhóa học: 22 X2HClXClH1 22 XO2HClXClHO2 Theo phương trình(1),(2): MXXOHCl 1 nnnn0,2mol 2 M M M Mm6,432 n0,2 X XO
DẠYKÈMQUYNHƠN OFFICIAL Trang11
X
Vậy
2N vàdung dịch chứa mgam muối. Giá trị của mlà A. 15,60. B. 15,52. C. 16,50. D. 16,25. Hướng dẫn giải: 2 Mg N n0,1mol;n0,012mol Sosánh: 2 choecñaklMg nhËnecñakhÝN n2n0,2moln10n0,12mol Sản phẩm khử có . 43NHNO 43NHNO 0,20,12 n 80,01mol Sơ đồ phản ứng: 32 3 22 43 MgNOMgHNOMuèi NHO NHNO
M32M
16M32
XlàMg(magie) Chọn B.
Ví dụ 3: Cho2,4gamMgtác dụng với dung dịch dư, thu được 0,2688lít (ở đktc) khí duy nhất 3HNO
Chọn A.
nn
KLchoekhinhËne
Chú ý: Trường hợp sản phẩm khử có thì ta luôn có: 43 NHNO 43 8
(Chương 5 – Bài 8 – Dạng 4)
Bài tập tự luyện dạng 2 Bài tập cơ bản Câu 1: Đốt cháyhoàntoàn7,2gamkim loại M(cóhoá trị không đổi) trong hỗn hợp khí vào . 2Cl 2O Sau phản ứng thu được 23,0gam chất rắn và thể tích hỗn hợp khí đã phản ứng là5,6lít (đktc). Kim loại Mlà
A. Ca. B. Cu. C. Mg. D. Al. Câu 2: Hòa tan hoàn toàn 24 gam hỗn hợp X gồm và (M là kim loại có hóa trị 2MO,MOH 3MCO không đổi) trong100gamdung dịch 39,2%,thu được 1,12lítkhí (đktc) vàdung dịch Y chỉ chứa 24HSO một chất tanduy nhất có nồng độ 39,41%.Kim loại Mlà
A. Cu. B. Zn. C. Mg. D. Ca. Câu 3: Hòatanhoàntoàn2,45gam hỗn hợp X gồm haikim loại kiềm thổ vào200mldung dịch HCl 1,25M,thu được dung dịch Y chứa ba chất tancó nồng độ mol bằng nhau.Haikim loại trongXlà A. MgvàCa. B. BevàMg. C. MgvàSr. D. BevàCa. Câu 4: Cho7,1gam hỗn hợp gồm một kim loại kiềm Xvà một kim loại kiềm thổ Ytác dụng hết với lượng dư dung dịch HClloãng,thu được 5,6lítkhí (đktc). Kim loại X,Y lần lượt là A. KvàBa. B. LivàBe. C. NavàMg. D. KvàCa.
Câu 5: Hỗn hợp A gồm một kim loại kiềm Xvà một kim loại kiềm thổ Y.Cho28,8gamAhòatan hết vào nước, thu được 6,72lít (Ở đktc). Nếu trộn thêm2,8gamLivào28,8gamAthu được hỗn hợp B 2H trong đó phần trăm khối lượng Li bằng 13,29%.Kim loại kiềm thổ Ylà A. Ca. B. Mg. C. Ba. D. Sr. Câu 6: Cho0,04molMgtan hết trong thu được 0,01molkhíX(là sản phẩm khử duy nhất của 3HNO ).KhíXlà5N A. . B. . C. . D. . 2NO NO 2 NO 2N Câu 7: Cho2,16gamMgtan hết trongdung dịch .Saukhicác phản ứng xảy rahoàntoàn,thu 3HNO được 0,896lítkhíNO (ở đktc) vàdung dịch X.Cô cạn cẩn thận dung dịch Xthu được mgam muối khan. Giá trị của mlà A. 13,92. B. 13,32. C. 14,50. D. 13,50.
DẠYKÈMQUYNHƠN OFFICIAL Trang12
Bảo toànnguyên tố Mg: 32MgMgNO nn0,1mol 43 32 muèi NHNOMgNO mmmm0,01800,114815,6gam
NHNO
n
Câu 8: Cho hỗn hợp gồm 6,72gamMgvà0,8gamMgOtác dụng hết với lượng dư dung dịch .3HNO Saukhicác phản ứng xảy rahoàntoàn,thu được 0,896lít một khíX (đktc) vàdung dịch Y.Làmbay hơi dung dịch Ythu được 46gam muối khan.KhíXlà
A. B. C. D. 2 NO 2NO 2N NO Câu 9: Hòatan10,65gam hỗn hợp gồm một oxitkim loại kiềm và một oxitkim loại kiềm thổ bằng dung dịch HCl dư được dung dịch X.Cô cạn dung dịch X, lấy muối khan đem điện phânnóng chảy hoàntoàn với điện cực trơ thìthu được 3,36lítkhí (đo ở đktc) ở anotvàagam hỗn hợp kim loại ở catot.Giá trị của alà
A. 5,85. B. 8,25. C. 9,05. D. 9,45. Bài tập nâng cao Câu 10: Chomgam hỗn hợp gồm (trong đó oxi chiếm 9,639% khối lượng) 2 2 Na,NaO,K,KO,Ba,BaO tác dụng với một lượng dư ,thu được 0,672lít (đktc) và200mldung dịch X.ChoXtác dụng 2 HO 2H với 200 ml dung dịch chứa hỗn hợp gồm 0,2M và HCl 0,1 M, thu được 400 ml dung dịch có 24HSO .Giá trị của m gần nhất với giá trị nàosau đây?
pH13
OFFICIAL
A. 6,6. B. 6,8. C. 7,2. D. 5,4. Dạng 3: Bài toán liên quan đến tính chất của hợp chất hiđroxit và muối cacbonat
Phương pháp giải
• Hợp chất hiđroxit của kim loại cóhai loại:
Loại tantrong nước: cótính chất của bazơ kiềm. Loại khôngtantrong nước chỉ có và . 2MgOH2 BeOH
• Phản ứng của hợp chất hiđroxit của kim loại kiềm thổ với axit:
Phản ứng trunghòa: 2 HOHHO
Taluôncó: HOH nn Chú ý:Bàitoánhòatanhoàntoànkim loại kiềm, kiềm thổ với nước thu được dung dịch bazơ, sau đó trunghòadung dịch bazơ bằng axit loãngtaluôncó: 24HCl/HSO 2HOH n2n • Hợp chất muối cacbonat của kim loại kiềm thổ khôngtan, muối hiđrocacbonat của kiềm thổ tan tốt. Chúng đều tác dụng với axit mạnh tạo khí .Ngoàira muối hiđrocacbonat còncó thể tác dụng với 2CO dung dịch bazơ.
DẠYKÈMQUYNHƠN
Trang13
Ví dụ mẫu Ví dụ 1: Chomgam hỗn hợp Na,Bavào nước thu được 100mldung dịch Xvà0,112lít (ở
2
Giá trị pH của dung dịch Xlà A. 1. B. 2. C. 12. D. 13. Hướng dẫn giải 2H n0,005mol
đktc).
H
Hướng dẫn giải Gọi công thức của muối hiđrocacbonat là . 3n MHCOn1,2,3 Phương trìnhhóa học: 3 24 24 2 2 n n 2MHCOnHSOMSO2nCO2nHO 9,125 7,5 mol M61n 2M96n
Tacó phương trình: 7,59,125 M2M96n 61n M12n 21
Với MlàMg (thỏa mãn) n2M24 Vậy công thức của muối hiđrocacbonat là . 32MgHCO Chọn D. Ví dụ 3: Hòatanhoàntoàn9,95gam hỗn hợp X gồm Na,KvàBavào100mldung dịch HCl1Mthu được dung dịch Yvà2,24lítkhí (đktc). Cô cạn dung dịch Ythu được mgam chất rắn. Giá trị của mlà 2H A. 13,50. B. 17,05. C. 15,20. D. 11,65. Hướng
DẠYKÈMQUYNHƠN OFFICIAL Trang14 Chokim
2HOH
O0,01
pH14logOH13 Chọn
loại kiềm, kiềm thổ vào nước thu được dung dịch bazơ:
n2n0,01mol
H00,1M ,1
D.
Ví dụ 2: Cho9,125gam muối hiđrocacbonat phản ứng hết với dung dịch dư, thu được dung dịch 24HSO chứa 7,5gam muối sunfattrunghòa.Công thức của muối hiđrocacbonat là A. . B. . C. . D. . 3NaHCO 32CaHCO 32BaHCO 32MgHCO
giải 2H HCl HCl n0,1mol;n0,1molnn0,1mol Coikim loại tác dụng với nước trước tạo dung dịch kiềm, khi đó: 2HOH n2n0,2mol Sau đó dung dịch kiềm tác dụng với axit: 2 HOHHO 0,10,1 mol OHd n0,20,10,1mol KLClOHmmmm 9,950,1.35,50,1.1715,20gam Chọn C.
dẫn
Chú ý: Khi cho kim loại tan trong nước vào dung dịch axit ta coi kim loại tác dụng với nước tạo thành dung dịch kiềm, dung dịch kiềm sinh ra mới tác dụng với axit.
Ví dụ 4: Hỗn hợp X gồm haikim loại kiềm và một kim loại kiềm thổ. Hòatanhoàntoàn1,788gamX vào nước, thu được dung dịch Yvà537,6mlkhí (đktc). Dung dịch Z gồm vàHCl,trong đó số 2H 24HSO mol của HCl gấp hai lần số mol của .Trunghòadung dịch Y bằng dung dịch Z tạo ramgam hỗn 24HSO hợp muối. Giá trị của mlà A. 3,792. B. 4,656. C. 4,460. D. 2,790. Hướng dẫn giải 2H n0,024mol Tacó: 2HOHddY n2n0,048mol
OFFICIAL
phần
nhau.
DẠYKÈMQUYNHƠN
Trang15
2 CaOH gam chất rắn khan.Giá trị của mlà A. 9,21. B. 9,26. C. 8,79. D. 7,47. Hướng dẫn giải 3 3 CaCO1 CaCO2 n0,02mol;n0,03mol Xét phần hai: Phương trìnhion: 2 3 32 HCOOHCOHO 0,03 0,03mol 22 3 d 3COCaCaCO 0,03 0,03mol
Gọi số mol của HClvà lần lượt là2x,xmol. 24HSO 24HHClHSO nn2n4xmol Phản ứng trunghòa: HOH nn0,048mol 4x0,048 x0,012 Tacó: 2 24 4 HCl HSO Cl SO nn2x0,024mol;nnx0,012mol Muối gồm cáccationkim loại vàanion gốc axit 2 4Cl,SO muèi m1,7880,02435,50,012963,792gam Chọn A. Ví dụ 5: Dung dịch X chứa cácion và0,1mol .ChiaXthànhhai
bằng
2 3Ca,Na,HCO Cl Phần một chotác dụng với dung dịch NaOH dư, thu được 2gam kết tủa. Phần haichotác dụng với dung dịch dư, thu được 3gam kết tủa. Mặc khác, nếu đun sôi đến cạn dung dịch Xthìthu được m
Khicô cạn dung dịch X xảy ra phản ứng: 2 3 322 2HCOCOCOHO 0,060,03 mol
Khối lượng muối khicô cạn dung dịch X: 2 2 3CrCaNaClCO mmmmm
0,04.400,08.230,1.35,50,03.608,79gam
Chọn C. Bài tập tự luyện dạng 3 Bài tập cơ bản Câu 1: Trong một cốc nước có chứa ion ;0,01mol ;0,005mol ;0,05mol ;0,01 2Ca Na 2Mg 3HCO mol . Đun sôi cốc nước trên đến phản ứng xảy rahoàntoàn. Nước trong cốc saukhi đun nónglà Cl A. nước cứng vĩnh cửu. B. nước cứng tạm thời. C. nước mềm. D. nước cứng toàn phần. Câu 2: Cho dung dịch X gồm 0,007 mol ; 0,003 mol ; 0,006 mol ; 0,006 mol và Na 2Ca Cl 3HCO 0,001mol . Để loại bỏ hết trongX cần dùngdung dịch chứa agam .Giá trị của alà 3NO 2Ca 2 CaOH A. 0,180. B. 0,120. C. 0,444. D. 0,222. Câu 3: Dung dịch X gồm 0,1 mol ;0,2mol ;0,1mol ;0,2mol vàamol .Cô cạn K 2Mg Na Cl 2Y dung dịch X,thu được mgam muối khan.Ion vàgiá trị của m lần lượt là 2Y A. và30,1. B. và56,5. C. và42,1. D. và37,3. 2 3CO 2 4SO 2 3CO 2 4SO Câu 4: Để trunghoàdung dịch X gồm 0,1molNaOHvà0,15mol cần Vlítdung dịch Y gồm 2 BaOH HCl0,1Mvà 0,05M.Giá trị của Vlà 24HSO A. 2. B. 1. C. 3. D. 4.
DẠYKÈMQUYNHƠN OFFICIAL Trang16
dung dịch Xcó 1 2 3HCO n0,03mol Xét phần một: Phương trìnhion: 2 3 32 HCOOHCOHO 0,03 0,03mol 2 2 3d 3COCaCaCO 0,020,02mol
dung dịch Xcó 1 2 2Ca n0,02mol
Vậy dung dịch X chứa: (0,04mol); (0,06mol); (0,1mol). 2Ca 3Na;HCO Cl Bảo toàn điện tích: 2 3 CaNaHCOCl 2nnnn Na n10,060,10,0420,08mol
Câu 5: Hòatan một mẫu hợp kimBa-Navào nước được dung dịch Xvà6,72lítkhí (đktc). Trunghòa dung dịch Xthì thể tíchHCl0,1M cần dùnglà
OFFICIAL
A. 0,60lít. B. 0,30lít. C. 0,06lít. D. 0,80lít. Câu 6: Hòatan hết 15,755gamkim loại Mtrong200mldung dịch HCl1M,cô cạn dung dịch sau phản ứng thu được 23,365gam rắn khan.Kim loại Mlà A. Ba. B. Al. C. Na. D. Zn. Câu 7: Hòatanhoàntoàn8,94gam hỗn hợp gồm Na,KvàBavào nước thu được dung dịch Xvà2,688 lítkhí (đktc). Dung dịch Y gồm HClvà tỉ lệ tương ứng là4:1.Trunghòa vừa đủ dung dịch 2H 24HSO X bởi dung dịch Y, tổng khối lượng các muối tạo ralà A. 13,70gam. B. 12,78gam. C. 18,46gam. D. 14,26gam. Bài tập nâng cao Câu 8: Dung dịch X chứa đồng thời và . Đun nóng X đến khi phản 22 3Na,Ca,Mg,Cl,HCO 2 4SO ứng xảy rahoàntoànthu được 3,68gam kết tủa, dung dịch Yvàcó2,24lítkhíthoátra (đktc). Khi đun nóng để cô cạn dung dịch Ythìthu được 13,88gam chất rắn khan. Tổng khối lượng muối cótrongdung dịch Xban đầu là
A. 22,84gam. B. 35,76gam. C. 17,76gam. D. 23,76gam. Câu 9: Cho200mldung dịch 0,1Mvào300mldung dịch 0,1M,thu được dung 2 BaOH 3NaHCO dịch Xvà kết tủa Y.Cho từ từ dung dịch HCl0,25MvàoX đến khi bắt đầu cókhísinhrathì hết Vml. Biết các phản ứng đều xảy rahoàntoàn.Giá trị của Vlà
A. 80. B. 40. C. 60. D. 160. Câu 10: Nungmgam hỗn hợp X gồm và ở nhiệt độ cao đến khối lượng không đổi, thu 3KHCO 3CaCO được chất rắn Y.ChoYvào nước dư, thu được 0,25mgam chất rắn Zvàdung dịch E. Nhỏ từ từ dung dịch HCl1MvàoE,khikhí bắt đầu thoátra cần dùng lítdung dịch HClvàkhikhíthoátra hết, thì thể 1V tíchdung dịch HCl đã dùnglà

DẠYKÈMQUYNHƠN
Trang17
1 10
A. 3:5. B. 5:6. C.
Dạng 4: Bài toán tác dụng với dung dịch kiềm có hoặc 2CO 2 BaOH 2 CaOH Phương pháp giải Khicho tác dụng với dung dịch kiềm thìcó thể xảy ra phản ứng: 2CO 2 2 32 CO2OHCOHO1 2 3 COOHHCO2 •Bàitoáncho biết số mol của và ,tính lượng kết tủa thu được. OH 2CO Bước 1:Xét tỉ lệ vàtính 2 OH CO n T n 2 3CO n
lít. Tỉ lệ là 2V 12V:V
2:3. D. 3:4.
Nếu thìkhi đó: 1T2 2 2 3 COCOOH nnn
Nếu thìkhi đó: T2 2 2 3 CCO O nn
Bước 2: Sosánh số mol và để tính số mol kết tủa 2 3CO 2M 3MCO
•Bàitoán chưa biết số mol thìxéthai trường hợp: 2CO
TH1: Chỉ tạo muối trunghòa,khi đó dư, hết và chỉ xảy ra phản ứng (1). OH 2CO 2 COmin nn
TH2: Tạo cả hai muối và ,khi đó cả và đều hết, xảy ra cả phản ứng (1)và(2). 2 3CO 3HCO OH 2CO 2 COmaxOH nnn
Hoặc: 2 2 3 3COCOHCO nnn •Bàitoánxác định lượng bazơ chưa biết thìxéthai trường hợp: TH1: Nếu 2 COOHph¶nøng nnn2n TH2: Nếu 2 2 CO COOHph¶nøng nnnnn Ví dụ: Hấp thụ hoàntoàn1,12lítkhí (ở đktc) vào200mldung dịch nồng độ 0,2M,thu 2CO 2 BaOH được mgam kết tủa. Giá trị của mlà A. 7,88. B. 5,91. C. 9,85. D.1,97. Hướng dẫn giải
DẠYKÈMQUYNHƠN
Trang18
OFFICIAL
2 2 CO
2Ba OH n0,04mol;n0,08mol Xét 2 OH CO 1n0,08 T 1,62 n0,05 Tạo hai muối và . 2 3CO 3HCO Khi đó: 2 3CO n0,080,050,03mol Phương trìnhhóa học: 22 3 3BaCOBaCO 0,040,030,03mol 3BaCO mm0,03.1975,91gam Chọn B. Ví dụ:ChoVlít (đktc) vào700ml 0,1M,sau phản ứng thu được 9,85gam kết tủa. Giá 2CO 2 BaOH trị lớn nhất của Vlà
BaOH n0,05mol;n0,04mol
A. 2,240. B. 1,680. C. 2,016. D. 3,360. Hướng dẫn giải 3 2 BaCO BaOH n0,07mol;n0,05mol OH n0,14mol Lượng lớn nhất khi tạo cả hai muối và ; 2CO 2 3CO 3HCO 2 COmaxOH nmn0,140,050,09mol lít. 2CO V0,09.22,42,016 Chọn C. Ví dụ: Hấp thụ hết 4,48lítkhí (đktc) lội vào8lít tathu được 12gam kết tủa A. Nồng độ 2CO 2 CaOH
mol/l của dung dịch là 2 CaOH A. 0,08M. B.0,06M. C. 0,04M. D.0,02M. Hướng dẫn giải Gọi nồng độ mol/l của dung dịch làxM. 2 CaOH 2 2 CO CaOH n0,2mol;n4xmol 2CaOHOH n2n8xmol
DẠYKÈMQUYNHƠN
Trang19
OFFICIAL
Ví dụ mẫu Ví dụ 1: Hấp thụ hoàntoàn1,12lítkhí (ở đktc) vào200mldung dịch nồng độ 0,1Mvà 2CO 2 BaOH NaOH0,1Mthu được mgam kết tủa. Giá trị của mlà A. 7,88. B. 3,94. C. 9,85. D. 1,97. Hướng dẫn giải 2 2 CO NaOH BaOH n0,05mol,n0,02mol,n0,02mol 2 2BaOH OH Ba n0,06mol;nn0,02mol
3CaCO n0,12mol Ta thấy: nên: 3 2CaCOCOnn 2 3OCOCaCO H nnn0,20,120,32mol 16x0,32 x0,02 Chọn D.
Xét tạo cả và 2
OH CO 1n0,06 T 1,22 n0,05 2 3CO 3HCO Khi đó: 2 2 3 COCOOH nnn0,060,050,01mol Phương trìnhhóa học: 22 3 3BaCOBaCO 0,020,010,01mol
3BaCO mm0,011971,97gam Chọn D. Ví dụ 2: Hấp thụ hoàn toàn V lít khí (ở đktc) vào dung dịch chứa 0,015 mol thu được 2CO 2 BaOH 1,97gam kết tủa. Giá trị nhỏ nhất của Vlà A. 0,224. B. 0,672. C. 0,336. D. 0,448. Hướng dẫn giải
2 BaCO BaOH OH n0,01mol,n0,015moln0,03mol
Lượng là nhỏ nhất khikhông tạo muối ,khi đó: 2CO 3HCO 2 3 CO BaCO nnn0,01mol
lít 2CO V0,224 Chọn A. Ví dụ 3: Hấp thụ hết xmolkhí bởi dung dịch thu được 1,97gam kết tủa vàdung dịch X. 2CO 2 BaOH
Lọc bỏ kết tủa, choXtác dụng dung dịch vừa đủ thu được 2,97gam kết tủa. Giá trị của xlà 2 CaOH A. 0,02. B. 0,06. C. 0,03. D. 0,04. Hướng dẫn
DẠYKÈMQUYNHƠN OFFICIAL Trang20
3
giải 3BaCO n0,01mol Cho X tác dụng với dung dịch vừa đủ thu được kết
2 CaOH
mol). Phương trìnhhóa học: 3 3 32 2 2 BaHCOCaOHBaCOCaCO2HO a aa mol Tacó: 3 3BaCOCaCO mmm2,97gam 197a100a2,97 a0,01 Bảo toànnguyên tố C: 2 3 32COBaCOBaHCO nn2n x0,0120,01 0,03
tủa Dung dịch chứa (a
32BaHCO
Chọn C. Chú ý: Dung dịch sau phản ứng có trong dung dịch. 22CaBa 2 3CO Dung dịch sau phản ứng (có chứa và ) có trong dung dịch. 2Ca 2Ba ®unnãng hoÆckiÒm 3HCO Bài tập tự luyện dạng 4 Bài tập cơ bản Câu 1: Hấp thụ hết 0,448lít (ở đktc) vàodung dịch chứa amol .Sau phản ứng thu được 2 2CO 2 CaOH gam kết tủa. Giá trị của alà A. 0,01. B. 0,02. C. 0,03. D. 0,04 Câu 2: Hấp thụ hết Vlít (ở đktc) vàodung dịch chứa 0,02mol ,thu được 1gam kết tủa 2CO 2 CaOH vàdung dịch X. Đun nóngXthuthêm được 1gam kết tủa nữa. Biết các phản ứng xảy rahoàntoàn.Giá trị của Vlà
A. 0,224. B. 0,448. C. 0,672. D. 0,560. Câu 3: Hấp thụ hoàntoàn0,672lítkhí (đktc) vào1lítdung dịch gồm NaOH0,025Mvà 2CO 2 CaOH 0,0125M,thu được xgam kết tủa. Giá trị của xlà A. 2,00. B. 1,00. C. 1,25. D. 0,75. Câu 4: Hấp thụ hoàntoàn3,36lítkhí (đktc) vào125mldung dịch 1M,thu được dung 2CO 2 BaOH dịch X.Coi thể tíchdung dịch khôngthay đổi, nồng độ mol của chất tantrongdung dịch Xlà A. 0,6M. B. 0,2M. C. 0,1M. D. 0,4M. Câu 5: Hấp thụ hoàntoàn2,24lítkhí (đktc) vào750mldung dịch 0,2M,thu được mgam 2CO 2 BaOH kết tủa. Giá trị của mlà A. 29,55. B. 39,40. C. 9,85. D. 19,70. Câu 6: Hấp thụ hoàntoàn4,48lítkhí (đktc) vào0,5lítdung dịch gồm NaOH0,4MvàKOH0,2M, 2CO thu được dung dịch X.ChoX phản ứng hoàntoàn với dung dịch dư, khối lượng kết tủa thu được là 2BaCl A. 9,85gam. B. 29,55gam C. 19,70gam. D. 39,40gam. Câu 7: Hấp thụ hết Vlít (đktc) vàodung dịch hỗn hợp gồm 0,4molKOH,0,3molNaOHvà0,4 2CO mol thu được dung dịch Y.ChoYtác dụng với dung dịch dư, thu được 39,4gam kết tủa. 23KCO 2BaCl Biết các phản ứng xảy rahoàntoàn.Giá trị của Vlà A. 18,92. B. 15,68. C. 20,16. D. 16,72. Câu 8: Sục Vlít (đktc) vàodung dịch chứa 0,2mol thu được kết tủa vàdung dịch X. Để 2CO 2 BaOH kết tủa hết ion trongX cần tối thiểu 100mldung dịch NaOH1M.Giá trị của Vlà 2Ba
A. 5,60. B. 4,48. C. 3,36. D. 2,24. Câu 9: Hấp thụ 0,6mol vàodung dịch chứa hỗn hợp gồm amolNaOHvàamol .Sau 2CO 2 BaOH phản ứng thu được kết tủa vàdung dịch chỉ chứa 46,9gamcác muối. Giá trị của alà
A. 0,25. B. 0,10. C. 0,20. D. 0,35.
DẠYKÈMQUYNHƠN
Trang21
OFFICIAL
Bài tập nâng cao Câu 10: Hỗn hợp X gồm Na,Ba, vàBaO.Hòatanhoàntoàn21,9gamXvào nước, thu được 1,12 2 NaO lítkhí (đktc) vàdung dịch Y,trong đó có20,52gam . Hấp thụ hoàntoàn6,72lítkhí 2H 2 BaOH 2CO (đktc) vàoY,thu được mgam kết tủa. Giá trị của mlà A. 15,76. B. 39,40. C. 21,92. D. 23,64. Dạng 5: Bài toán đồ thị Phương pháp giải Đồ thị cho từ từ đến dư vàodung dịch chỉ


DẠYKÈMQUYNHƠN
Trang22
OFFICIAL
chứa
2CO
Đồ thị: Phản ứng xảy ratheo thứ tự: 2 32 2 COMOHMCOHO 2 32 32COMCOHOMHCO Đoạn 1: Kết tủa chưa đạt cực đại: 2COnn Tại đỉnh kết tủa cực đại: 2 2 2 BaOH/CaOHmax COmax an n nn Đoạn 2: Kết tủa đã bị hòatan một phần 2OCO H nnn Cho từ từ vàodung dịch gồm amol với bmolKOH/NaOH. 2CO 2 2 BaOH/CaOH Đồ thị: Phản ứng xảy ratheo thứ tự:
amol hoặc amol :
2 CaOH
2 BaOH
Chọn A.
Ví dụ: Dung dịch X chứa NaOHvà0,15mol . Sục từ từ vàoX, lượng kết tủa tạo thành 2 BaOH 2CO được mô tả trong đồ thị sau:

DẠYKÈMQUYNHƠN OFFICIAL Trang23 2 32 2 COMOHMCOHO 2 3
2 32 32
2
2 2 2
NaOH/KOH32 an nx
2
H
2143 xxxx
2
CONaOHNaHCO
COMCOHOMHCO
Trong đó, MlàBa hoặc Ca. Đoạn 1:
COnn
Đoạn 2: (kết tủa cực đại):
BaOH/CaOHmax
bnxx
Đoạn 3: Kết tủa đã bị hòatan một phần
OCO
nnn
Chú ý: Đồ thị dạng hìnhthangcânnêntacó:
Ví dụ: Cho từ từ đến dư vàodung dịch chứa amol . Sự phụ thuộc khối lượng kết tủa vào 2CO 2 BaOH số mol được biểu diễn bằng đồ thị sau: 2CO Giá trị của alà A. 0,020. B. 0,010. C. 0,030. D. 0,015. Hướng dẫn giải: Tại đỉnh kết tủa cực đại: 3BaCO n0,02mol
BaOHmax ann0,02mol
Số molNaOHcótrongdung dịch Xlà A. 0,20. B. 0,40. C. 0,30. D. 0,15.


Hướng dẫn giải Khí từ amol đến 2amol,tacó: 2CO
Chọn D. Ví dụ mẫu Ví dụ 1: Cho từ từ CO2 đến dư vàodung dịch 0,02molCa(OH)2 Sự phụ thuộc khối lượng kết tủa vào thể tíchCO2 (ở đktc) được biểu diễn bằng đồ thị bên.Giá
DẠYKÈMQUYNHƠN OFFICIAL Trang24
Hướng dẫn giải 3 2 CaCO CaOH OH n0,01mol;n0,02moln0,04mol Đoạn 1: Kết tủa chưa đạt cực đại. lít 2CO 1 nn0,01molV0,0122,40,224 Đoạn 2: Kết tủa đã bị hòatan một phần. 2 2OCOCO H OH nnnnnn0,040,010,03mol lít 2CO V0,03.22,40,672
2mBaOH ax ann0,15mol
NaOH/KOH n2aaa0,15mol
trị của V1 vàV2 lần lượt là A. 0,224và0,672. B. 0,224và0,336. C. 0,448và0,672. D. 0,336và0,448
Chọn A. Ví dụ 2: Sục khí vào V ml dung dịch hỗn hợp NaOH 0,2M và 0,1 M. Đồ thị biểu diễn 2CO 2 BaOH
khối lượng kết tủa theo số mol phản ứng như hìnhbên.Giá trị của Vlà 2CO A. 300. B. 250. C. 400. D. 150. Hướng dẫn giải:
NaOH
0,1V 0,2V n mol;n mol 1000 1000


0,4V nmol 1000 Đoạn 1: Kết tủa chưa đạt cực đại: 2CO nn0,03mol Đoạn 3: Kết tủa đã bị hòatan một phần, nên: 2OCO H nnn
00,4V ,030,13 1000 V400ml Chọn C. Ví dụ 3: Người tahòatanhoàntoàn hỗn hợp NaOHvà vào nước dư thu được dung dịch X. 2 BaOH Sục khí vàodung dịch X. Kết quả thí nghiệm thu được biểu diễn trên đồ thị bên.Giá trị của xlà 2CO A. 2,75 B. 2,50. C. 3,00 D. 3,25. Hướng dẫn giải
DẠYKÈMQUYNHƠN
Trang25
OFFICIAL
2
BaOH
OH
Đoạn 1: Kết tủa chưa đạt cực đại 2CO nn0,4a0,5a1,25 Đồ thị cóhìnhthanhcânnên: x2aa0,4a x21,251,250,41,25 x3,25 Chọn D. Bài tập tự luyện dạng 5 Bài tập cơ bản
Câu 1: Cho từ từ khí đến dư vàodung dịch . Sự phụ thuộc khối lượng kết tủa vào thể tích 2CO 2 CaOH được biểu diễn bằng đồ thị bên.Giá trị của Vlà 2CO
A. 3,36. B. 4,48. C. 5,60. D. 6,72. Câu 2: Cho từ từ khí đến dư vàodung dịch chứa 0,2mol . Sự phụ thuộc khối lượng kết 2CO 2 BaOH tủa vào thể tích được biểu diễn bằng đồ thị bên.Giá trị của Vlà 2CO
A. 3,36. B. 4,48. C. 5,60. D. 6,72. Câu 3: Cho từ từ khí đến dư vàodung dịch chứa xmol . Sự phụ thuộc khối lượng kết tủa 2CO 2 CaOH vào thể tích được biểu diễn bằng đồ thị bên.Giá trị của xlà 2CO


DẠYKÈMQUYNHƠN
Trang26
OFFICIAL
A. 0,10. B. 0,20. C. 0,05. D. 0,15. Câu 4: Dung dịch X gồm NaOH0,2Mvà 0,1M. Sục từ từ đến dư vàoVmldung dịch X. 2 BaOH 2CO Sự phụ thuộc số mol kết tủa vào số mol được biểu diễn bằng đồ thị bên.Giá trị của Vlà 2CO


OFFICIAL
A. 200. B. 300. C. 240. D. 150. Câu 5: Sục từ từ khí đến dư vàodung dịch chứa amol và1,5amolNaOH. Sự phụ thuộc 2CO 2 CaOH số mol kết tủa vào số mol được biểu diễn bằng đồ thị bên.Giá trị của xvày lần lượt là 2CO
A. 0,04và0,12. B. 0,04và0,14. C. 0,03và0,12. D. 0,03và0,14. Câu 6: Sục từ từ một lượng vàodung dịch hỗn hợp gồm vàKOH. Sự phụ thuộc số mol 2CO 2 CaOH kết tủa vào số mol được biểu diễn bằng đồ thị bên.Giá trị của xlà 2CO
A. 0,12. B. 0,11. C. 0,13. D. 0,10.

DẠYKÈMQUYNHƠN
Trang27
Câu 7: Sục từ từ đến dư vàodung dịch có chứa 0,1molNaOH;xmolKOHvàymol . Sự 2CO 2 BaOH phụ thuộc số mol kết tủa vào số mol được biểu diễn bằng đồ thị bên.Giá trị của x,y,z lần lượt là 2CO

OFFICIAL
A. 0,60;0,40và1,50. B. 0,30;0,60và1,40. C. 0,30;0,30và1,20. D. 0,20;0,60và1,25. Bài tập nâng cao Câu 8: Hòatan hết mgam hỗn hợp X gồm Na, ,K, ,BavàBaO,trong đó oxi chiếm 8,75% 2 NaO 2 KO về khối lượng vào nước thu được dung dịch Yvà1,568lítkhí (đktc). Cho từ từ khí đến dư vào 2H 2CO dung dịch Y. Sự phụ thuộc khối lượng kết tủa vào thể tích (ở đktc) được biểu diễn bằng đồ thị bên. 2CO Biết các phản ứng xảy rahoàntoàn.Giá trị của m gần nhất với giá trị nào nhất sau đây? A. 12. B. 14. C. 15. D. 13. Câu 9: Hòatan27,6gam hỗn hợp gồm Na, ,BavàBaOvào dư, thu được dung dịch Xvàb 2 NaO 2 HO mol . Sục khí vàoY, kết quả thí nghiệm được biểu diễn trên đồ thị bên.Giá trị của blà 2H 2CO A. 0,10. B. 0,12. C. 0,15. D. 0,18. Câu 10: Dẫn từ từ khí đến dư vàoVlítdung dịch 0,1M. Khối lượng kết tủa thu được 2CO 2 BaOH phụ thuộc vào thể tích (đktc) được biểu diễn như đồ thị bên.Giá trị của xlà 2CO

DẠYKÈMQUYNHƠN
Trang28
A. 1,12. B. 2,24. C. 3,36. D. 5,60
ĐÁP ÁN
Dạng 1: Lí thuyết trọng tâm
1–C 2–B 3–B 4–D 5–B 6–A 7–D 8–B 9–B 10–B 11–C 12–C 13–B 14–B 15–B 16–A 17–C 18–C 19–D 20–D

Câu 16: Có3phát biểu đúng là(a),(c),(d). (b)saivìBekhôngtantrong nước, Mg khử nước chậm ở nhiệt độ thường. (e)saivìcông thức của thạch cao sống là . 42 CaSO2HO (g)saivì đun nóng chỉ có thể làm mềm nước cứng tạm thời, khônglàm mềm nước cứng vĩnh cửu. Câu 17:Có2 trường hợp tạo kết tủa là: . 24 3KSO,NaHCO
Câu 18: Có4thí nghiệm tạo đồng thời kết tủa vàkhílà:(b),(c),(e),(g). Câu 19:
DẠYKÈMQUYNHƠN
Trang29
OFFICIAL
Sơ đồ hoàn chỉnh: 1 2 ®iÖnph©n 2 22 cãmµngngn X X 2KCl2HO 2KOHHCl 3 2 3 X COKOHKHCO 4 2 232 X CO2KOHKCOHO 5 3 3 2 2 X KHCOBaOHBaCOKOHHO 3 3232 2 2KHCOBaOHBaCOKCO2HO Câu 20: AsaivìCukhông khử được . 2Fe
DẠYKÈMQUYNHƠN OFFICIAL Trang30
2 2
Từ
Bảo
2 2
M M
n
0,4M961.100%39,41M24 21,8 MlàMg(Magie). Câu 3: Gọi công thức chung của haikim loại kiềm thổ A,BlàZ. HCl n0,25mol Dung dịch Y gồm vàHCl dư với 2ZCl 2 2 2 AClBClHCldZClHCld nnnn2n Mặt khác: 2HClpZCln2n Tacó: 2 2 2 HClpHCld ZClZCl ZCl Z 1 nn0,25mol2nn0,25moln0,1moln0,1mol 2 Chỉ cóBevàCa thỏa mãn. AB Z AB MMM2,4524,5 24,5MM49 0,1 2 Câu 4: 2 2 2 H HXYH XY n0,25molnn2n0,25n0,5
B,Csaivìkhichovàodung dịch ,Ca,Ba sẽ khử trước, sau đó tạo kết tủa . 4FeSO 2 HO 2 FeOH D đúng, phương trìnhhóa học: 2 2 MgFeMgFe Dạng 2: Bài toán liên quan đến tính chất của kim loại kiềm thổ 1–C 2–C 3–D 4–C 5–C 6–C 7–A 8–C 9–B 10–A Câu 1: 22ClO n0,25mol Gọi số mol và phản ứng lần lượt làxvàymol 2Cl 2O xy0,251 Bảo toàn khối lượng:
ClO mm237,215,8gam71x32y15,82
(1)và(2)suyra: x0,2;y0,05
toànelectron:
MClO
0,6 nn2n4n0,6nM12n
Tacó bảng sau: n 1 2 3 M 12 (loại) 24(Mg) 36 (loại) Câu 2: 24 2 HSO CO n0,4mol;n0,05mol Muối thu được là 44MSO MSOn0,4mol dungdÞchsauph¶nøngm 241000,05.44121,8gam
DẠYKÈMQUYNHƠN OFFICIAL Trang31 Một tronghaikim
Theo đáp áncóNavàMg thỏa X,Y 14,2M28,4 14,2M28,4
Tacó: Kim
X X X 22,8m100%13,29%m1,4gamn0,2mol
Lại có: 2H XY Y n0,5nn0,3n0,2mol Ylàkim loại Ba. Y M28,81,4137 0,2 Câu 6: Bảo toànelectron: là MgX 2nnnn8X 2 NO Câu
: Mg
Sản
khử có.. Mg
43
43
n
Muối
.
3 3
.43NHNO Bảo toànelectron: Xlà . 43MgXNHNO 2nnn8nn10 2N Câu 9: 2Cl n0,15mol Bảo toànnguyên tố Cl: HClp HClOoxit 1 n0,3molnn0,15mol 2 kimlo¹ioxitOoxit ammm10,650,15168,25gam Câu 10: 24HSO HCl H n0,04mol;n0,02moln0,1mol Dung dịch có dư pH13OH OHd OH(X) n0,04moln0,10,040,14mol Tacó: 2 HOhh Ohh OH n2n2n0,14moln0,04mol Ohh 9,639m m10,04.16m6,64gam6,6 00
loại có
mãn. Câu 5:
loại XlàLi. 22,8100%8,86%13,29% ,828,8
,828,8
7
NO n0,09mol;n0,04mol
Nhận thấy:
phẩm
NO 2n0,183n0,12
NHNO
NHNO 0,180,12
80,0075mol
gồm (0,09mol); (0,0075mol)
32MgNO 43NHNO
m0,091480,00758013,92gam
Câu 8: Mg MgO n0,28mol;n0,02mol
Bảo toànnguyên tố Mg: Có muối
2 2 MgMgOMgNO MgNO nnn0,3molm44,4gam46
DẠYKÈMQUYNHƠN OFFICIAL Trang32
t
2 2 2 3
:
2 3 32
2CaOH OH
2
một dung dịch Loại AvàC. 2Y 2 3CO 2Mg 2 3CO Bảo toàn điện tích: 2 2 4 KMgNaCl SO n2nnn n 0,2mol 2 m0,1.390,2.240,1.230,2.35,50,2.9637,3gam Câu 4: OH H n0,10,15.20,4mol;n0,2Vmol Tacó: lít OHH nn0,2V0,4V2 Câu 5: Tacó: 2HOH n2n0,6mol Trunghòa1/10dung dịch X cần: lít. HCl H 0,6 0,06n0,06molV 0,6 10 0,1 Câu 6: Tacó: Chất rắn sau phản ứng có hiđroxit kim loại. muèiMCl mmm22,855gam23,365 Sơ đồ phản ứng: 2 n n2MHClHOMClMOHH Gọi số mol phản ứng làxmol 2 HO 2 2 H HClHO 1 nnn0,5x0,2mol 2
Dạng 3: Bài toán liên quan đến tính chất của hợp chất hiđroxit và muối cacbonat 1–C 2–D 3–D 4–A 5–A 6–A 7–C 8–D 9–A 10–B Câu 1: Bảo toàn điện tích: 2 3 2 HCOClNaMg Ca nnn2n n 0,02mol 2
Phương trìnhhóa học:
2 3 322 2HCOCOCOHO 0,050,025
Nhận thấy: kết tủa hết.
22 COCaMg nnnCa;Mg
Nước sau đun sôikhôngcòn Nước mềm.
22Ca;Mg
Câu 2
Tacó:
HCOOHCOHO 0,0060,006 mol
1 nn0,003mola0,222gam
Câu 3: không thể là vì và không tồn tại trongcùng
DẠYKÈMQUYNHƠN OFFICIAL Trang33 Bảo
2 2
mmmmm
2
2
OH H
24 24 24 HSOHSO HSO HCl 4n2n0,24n0,04moln0,16mol 2 4muèiKNaBaClSO
Câu 8: Sơ đồ phản ứng: 22 0,1mol 22 t 2 34 COHO XNa,Ca,Mg :3,68gam Cl,HCO,SOY:13,88gam Tacó: 2 2HOCO nn0,1mol Bảo toàn khối lượng: 2 2 XCOHO Y mmmmm0,1440,1183,6813,8823,76gam Câu 9: 3 2 NaHCO BaOH n0,02mol;n0,03mol Phương trìnhhóa học: 2 3 32 HCOOHCOHO 0,030,040,03mol 22 3 3BaCOBaCO 0,020,030,02mol Dung dịch X gồm: 2 3 Na,OH(0,01mol);CO0,01mol Khicho từ từ HClvàodung dịch X: Phương trìnhhóa học: 2 HOHHO 2 3 3HCOHCO 2 3 HCl HCl OHCO 0,02nnn0,02molV 0,08lÝt=80ml 0,25 Câu 10:
toàn khối lượng:
MHClHOchÊtr¾nH
15,7550,2.36,518x23,3650,5x0,2.2x0,03
Bảo toànelectron:
MHM M 0,23n.n2nn M68,5n n Tacó bảng sau: n 1 2 3 M 68,5 (loại) 137(Ba) 205,5 (loại) Câu 7: Tacó:
H
n2n0,24moln0,24mol
mmmm18,46gam
DẠYKÈMQUYNHƠN OFFICIAL Trang34 Sơ đồ phản ứng: 2 3 3 23 HO t 3 23 Z:CaCO0,0025mmol KHCO0,0075mmolKCO0,00375mmol Y KOH0,005mmol CaCO0,0025mmolCaO0,0025mmol E KCOd
Nhỏ từ từ dung dịch HCl1MvàoE, để khí bắt đầu xuất hiện thì 23KOHKCOHCl1 nnn0,00625mmol Nhỏ tiếp HCl đến khikhíthoátra vừa hết thì HCl2 n0,00625m0,00125m0,0075mmol 1HCl1 2HCl2 Vn0,00625m5:6 Vn0,0075m Dạng 4: Bài toán tác dụng với dung dịch kiềm hoặc 2CO 2 BaOH 2 CaOH 1–B 2–C 3–C 4–B 5–D 6–C 7–C 8–A 9–A 10–A Câu 1: 2 3 CO CaCO n0,02mol;n0,02mol Tacó: 3 2 2 CaCOCO CaOH OH OH 1 nnn0,04molnn0,02mol 2 Câu 2: 3 3 CaCO1 CaCO2 n0,01mol;n0,01mol Tacó: lít 2 2 3 3 CO CO CaCO1CaCO2 nn2n0,03molV0,0322,40,672 Câu 3: 2 2CO OH Ca n0,05mol;n0,03mol;n0,0125mol Xét Tạo hai muối. 2 OH CO Tn51T2 n3 Tacó: 2 2 3 COCOOH nnn0,02mol Nhận thấy: 2 2 2 3 3 3 CaCO CaCO CaCO Ca nnnn0,0125moln0,0125.1001,25gam Câu 4: 2 2CO OH Ba n0,25mol;n0,15mol;n0,125mol Xét: Tạo hai muối 2 OH CO Tn51T2 n3 Tacó: 2 3 3 3 2 CO BaHCO HCO OH HCO 1 n2nn0,05molnn0,025mol 2 32MBaHCO 0,025 C 00,2M ,125 Câu 5: 2CO OH n0,3mol;n0,1mol; Xét: Tạo muối trunghòa 2 OH CO n T3T2 n Tacó: 3 2 3 BaCOCO BaCO nn0,1molmm0,119719,7gam
0,00125mmol
hai
DẠYKÈMQUYNHƠN OFFICIAL Trang35
2
3
2 2 2 3 CO
CO
2 OH Ba Na
2 2 3 2 3 COCOOH COHCO OH
2 2 3
Na 3
2
Bảo
3 2 3 NaHCO CO nn n22a0,6mol Tacó:
23a602a0,6611,23a46,9a0,2425mol TH2: Muối gồm (amol); (1,2–3amol); 2 2 3BaCO nn Na 3HCO 2Ba Bảo toàn điện tích: 3 2 HCONa Ba nn n20,62amol Tacó: Thỏa mãn 23a1370,62a611,23a46,9a0,25mol Câu 10: Tacóquátrình: 26,72lÝtCO 2 2 2 2 Na NaOH DdY mgamkÕttña Ba 20,52gamBaOH HO NaO 1,12lÝtH BaO 2 2 2 H CO BaOH n0,05mol;n0,12mol;n0,3mol
Câu 6: 2CO OH n0,3mol;n0,2mol; Xét: Tạo hai muối 2 OH CO Tn31T2 n2 Tacó: 2 2 3 COCOOH nnn0,1mol
2 3 3 3 BaCO BaCO CO nn0,1molm0,1.19719,7gam
Câu 7: 3BaCO OH n0,7mol;n0,2mol; Coi chỉ phản ứng với bazơ tạo
muối. 2CO Sau phản ứng thu được: 2 2 23 3 COKCOCOOH nnnn1,1xmol lít. 2CO 1,1x0,2x0,9molV0,9.22,420,16 Câu 8: TrongXcòn X chứa muối .
Ba
32BaHCO Tacó:
HCOOH nn0,1mol
Lại có: lít
CO
HCO OH 0,10,4n2nnn20,25molV0,2522,45,60
Câu 9:
n3amol;namol;namol
Tacó:
nnn3a0,6mol n2nn1,23amol
TH1: Muối gồm (amol); (1,2–3amol);
BaCO nn
HCO
3CO
toàn điện tích:
Không thỏa mãn
DẠYKÈMQUYNHƠN OFFICIAL Trang36
tố Na: NaOHNa nn0,14mol OHY n0,140,12.20,38mol Ta thấy: Tạo hai muối và . 2 OH CO n 12 n 2 3CO 3HCO 2 2 3 COCOOH nnn0,380,30,08mol Phương trìnhhóa học: 22 3 3BaCOBaCO 0,120,080,08mol 3BaCO mm0,0819715,76gam Dạng 5: Bài toán đồ thị 1–A 2–C 3-B 4–A 5–A 6–D 7–B 8–D 9–B 10–A Câu 1: Tacó: 2 3 2 COCaCO CO 15 nn 0,15molV0,1522,43,36lÝ t 100 Câu 2: 3BaCO OH n0,15mol;n0,4mol Tacó: lít. 2 2 2 3 CO CO OHCO nnn0,40,150,25molV0,25.22,45,6 Câu 3: Tại 2 2 3 CO COCaCO 10VVnn10,1mol 00 Tại 2 3 2 2 CO CaCOmaxCO CaOH V2Vnn20,10,2molxn0,2mol Câu 4: Tại 2 3 2 CO BaCOCO n0,015molnn0,015mol
Quy đổi hỗn hợp XlàNa,BavàO. Bảo toànnguyên tố: 2BaBaOH nn0,12mol Quátrìnhcho nhận electron: 2 2 2 NaNa1eO2eO BaBa2e2H2eH
Gọi số mol của NavàO lần lượt làx,ymol. 23x16y21,90,12.1375,46*
Bảo toànelectron: x2.0,122.y2.0,05x2y0,14** Từ (*)và(**)suyra: x0,14;y0,14 Bảo toànnguyên
Tại , kết tủa đạt cực đại
DẠYKÈMQUYNHƠN OFFICIAL Trang37
2 2 2 CO
max KOH OH OCO
2 BaOHmax
Đồ
NaOHKOH
2 3 2 H BaCO CO
Quy đổi hỗn hợp XlàM(xmol),Ba(ymol)vàO.(Trong đó Mlàcông thức chung của NavàK) OH nx2ymol Tacó: 2OCO H nnnx2y0,030,250,28 Quátrìnhcho nhận electron: 2 2 2 MM1eO2eO BaBa2e2H2eH Bảo toànelectron: O O x2y2n20,070,28n0,07mol 0,07.16 m812,8 ,75% Câu 9: Tại mol, kết tủa đạt cực đại 2CO nb 2Ba nbmol Tại mol,tacó: 2CO n4b Na n4bb3bmol Gọi số molOtrong hỗn hợp làamol 233b137b16a27,61
Tại 2CO n0,065mol
Tacó: 3 2OBaCOCO H 0,2V0,1V.2nnn0,08mol10,08V200ml 000 Câu 5: 3CaCO OH n0,02mol;n3,5amol
2CO nxmol
2 2 COCaOH nnxmolxa Tại ,tacó: 2CO n0,1mol
NaOH n0,1x1,5x0,1xx0,04mol Tại ,tacó 2CO nymol
2 3 COOCaCO H nnn3,50,040,020,12mol
Câu 6:
CaOH
H nn0,15moln0,15mol n0,450,150,3mol n0,6mol xnn0,60,50,1mol
Câu 7:
ynn0,6mol
thị hìnhthangcân,nhìnnhanh thấy: 0,201,6zz1,4
nn1,40,60,20,60,4molx0,40,10,3
Câu 8:
n0,07mol;n0,03mol;n0,25mol
Bảo toànelectron: 2NaBaOH n2n2n2n3b2b2a2b2
Từ (1)và(2)suyra: a0,18;b0,12
Câu 10:
Gọi số mol tương ứng với ygam kết tủa làzmol.
Tại thời điểm mol kết tủa chưa đạt cực đại nên: n3z
Tại thời điểm mol, kết tủa đạt cực đại n4z
DẠYKÈMQUYNHƠN OFFICIAL Trang38
2CO nn3zmola3z22,41
2 2
BaOHmax
Tại
2 2OCOCO H
6a3,36a z3z20,15 2,4 z0,05 Từ
COmax
nn4zmolax4z22,42 nn4zmol
thời điểm mol, kết tủa bị hòatan một phần nên: n2z
nnnn6zmol
(1)và(2)tacó: lít. x4z3z22,41,12
Mục tiêu
Kiến thức
+Trìnhbày được tính chất vật lí,tính chất hóa học và phương pháp điều chế kim loại nhôm.
+Trìnhbày được tính chất hóa học vàcác phản ứng thường gặp của một số hợp chất của nhôm.
+Trìnhbày được một số ứng dụng quan trọng của nhômvà hợp chất của nhôm.
Kĩ năng
+ Xác định được các sản phẩm phản ứng của nhômvà hợp chất của nhôm.
+ Giải thành thạo cácbài tập liênquan đến nhômvà hợp chất của nhôm.
+ Vận dụng kiến thức lí thuyết để giải quyết cácbài tập thực tiễn.
DẠYKÈMQUYNHƠN
Trang1 BÀI 13: NHÔM VÀ HỢP CHẤT CỦA NHÔM
OFFICIAL
1. Tính chất vật lí và ứng dụng
Chất Tính chất vật lí Ứng dụng
Al
Màu trắng bạc, mềm, nhẹ, dễ kéo sợi, dễ dát mỏng, dẫn điện và dẫn nhiệt tốt.
23AlO
Chất rắn, màu trắng, không tan trong nước, bền nhiệt.
Làm vật liệu chế tạo máybay,ôtô,…
Làmnhà cửa vàtrangtrí nội thất.
Làm dụng cụ nhà bếp, dây dẫn điện.
Tạo hỗn hợp tecmit (bột ) để hàn đường ray. 23AlFeO
Dùng để sản xuất nhôm (từ quặng boxit: ). 232 AlO.2HO
Nhômoxitkhandùnglàm đá mài, giấy nhám. Nhôm oxit lẫn các oxit khác là các loại đá quý dùng làm đồ trang sức…
OFFICIAL
Chất rắn màu trắng, kết tủa ở dạng keo. Hấp phụ các cặn bẩn trong nước. 243AlSO Tan tốt trong nước. Phènchua được dùngtrongngành 24242 3 AlSO.KSO.24HO thuộc da,công nghiệp giấy, chất cầm màu,làmtrong nước,…
3 AlOH
DẠYKÈMQUYNHƠN
Trang2 I. LÍ
THUYẾT TRỌNG TÂM
Tính
Chất
Al Tính khử mạnh (Al không phản ứng với đặc nguội và 24HSO đặc nguội). 3HNO t 2 234Al3O2AlO (lớp bảo vệ nhôm không bị ăn mòn trong không khí 23AlO ẩm). t 2 3 3 24 2 3 3 xy42 24 24222 3 2Al3Cl2AlCl 2Al6HHCl,HSO2Al3H Al l HNOAlNONHHO AlHSOAlSOSOS,HSHO oãng đ,n (phản ứng nhiệt nhôm) t xy 232yAl3FeO3xFeyAlO (tantrong kiềm loãng) 2 222Al2OH2HO2AlO3H 23AlO Tính lưỡng tính 3 23 2 23 22 AlO6HAl3HO AlO2OH2AlOHO 3 AlOH Tính lưỡng tính Bị nhiệt phân 3 2 3 22 3 t 232 3 AlOH3HAl3HO AlOHOHAlO2HO 2AlOHAlO3HO
2.
chất hóa học
Tính chất Phản ứng đặc trưng
điện cực làm bằng than chì vì vậy ở cực dương xảy ra quátrình đốt cháycacbon tạo raCOvà .2CO Cần chocriolit vàothùng điện phân để hạ nhiệt 36 NaAlF độ nóng chảy của xuống còn , tăng tính dẫn 23 AlO900C điện của hỗn hợp, và tạo chất lỏng nổi lêntrên bảo vệ nhôm không bị oxihóa bởi oxikhôngkhí.
SƠ ĐỒ HỆ THỐNG HÓA
1. NHÔM (Al)
Tính chất vật lí:
Màu trắng bạc, khá mềm, dễ khéo sợi, dát mỏng.
Nhẹ, dẫn điện và nhiệt tốt. Tính chất hóa học:
Tác dụng với phikim: Chú ý: Al bền
DẠYKÈMQUYNHƠN OFFICIAL Trang3
3 32 34 Al3NH3HOAlOH3NH
AlOHHOAlOH Nếu axit dư thì xảy ra tiếp phản ứng: 3 2 3 AlOH3HAl3HO 3. Sản xuất nhôm Nguyên liệu Phương
Quặng
232
đpnc 23 2
Muối 3Al
Phản ứng với kiềm (thường dùng dung dịch kiềm để nhận biết Alvà các hợp chất của Al)
(Chú ý: Dung dịch khônghòatan được ) 3NH 3 AlOH 3 3 Al3OHAlOH Nếu kiềm dư thì xảy ra tiếp phản ứng: 22 3 AlOHOHAlO2HO Muối 2AlO Phản ứng với axit 222 33 2 2 3 AlOCO2HOAlOHHCO
pháp Kĩ thuật
boxit
AlO.2HO Điện phânnóng chảy
2AlO4Al3O
Hai
trong không khí do có màng oxit rất bền vững bảo vệ: 23AlO . t 2 234Al3O2AlO Tác dụng với axit: Chú ý: Al bị thụ động trongdung dịch đặc, nguội và đặc, nguội. 3HNO 24HSO Alkhitác dụng với dung dịch loãngcó thể tạo sản phẩm khử . 3HNO 43NHNO 3 33432 8Al30HNO8AlNO3NHNO9HO Tác dụng oxitkim loại (nhiệt nhôm)
Al khử được oxitkim loại: 232334 CrO,FeO,FeO,... t 23 232AlCrO2CrAlO
Tác dụng với dung dịch kiềm
Alkhôngtác dụng với nước vìtrên bề mặt được bảo vệ bởi rất bền, nhưng tantrong 23AlO 23AlO dung dịch kiềm nêntacó: . 2 222Al2NaOH2HO2NaAlO3H
Ứng dụng:
Chế tạo máybay,ôtô,tên lửa, tàu vũ trụ.
Trangtrí nội thất, dây dẫn điện, dụng cụ nhà bếp.
Hỗn hợp Tecmit(Al trộn với )dùnghàn đường ray. 23FeO
Điều chế: Nguyên liệu để sản xuất nhômlà: quặng boxit ,criolit . 232 AlO.2HO 336 3NaF.AlFhayNaAlF
2. MỘT SỐ HỢP CHẤT QUAN TRỌNG
Nhôm sunfat
Phènchua: hay . 24242 3 KSO.AlSO.24HO42 2 KAlSO.12HO
Phènnhôm:thayion bằng hay trongcông thức phènchua. K
Nhôm oxit
dụng: Dạng oxit ngậm nước: quặng boxitdùng để sản xuất nhôm. Dạng khan: đá quýdùnglàm đồ trang sức. Nhôm hiđroxit
DẠYKÈMQUYNHƠN
Trang4
OFFICIAL
đpnc,criolit
23 22AlO4Al3O
3 2 3 22 3 AlOH3HAl3HO AlOHOHAlO2HO Bị nhiệt phân hủy: t 232 3 2AlOHAlO3HO Một số phản ứng điều chế: 3 32 34 2 2 3 222 33 Al3NH3HOAlOH3NH AlOHHOAlOH AlOCO2HOAlOHHCO II. CÁC DẠNG BÀI TẬP Dạng 1: Lí thuyết trọng tâm Ví dụ mẫu
Li,Na 4NH
Làoxit lưỡng tính: 3 23 2 23 22 AlO6H2Al3HO AlO2OH2AlOHO
Ứng
Là hiđroxit lưỡng tính:
Ví dụ 1. Thành phần chính của quặng boxitlà:
A. B. 232 AlO2HO 232 FeOnHO
C. . D. . 24242 3 AlSO.KSO.24HO 3FeCO
Hướng dẫn giải
Thành phần chính của quặng boxitlà . 232 AlO2HO
Chọn A.
Ví dụ 2. Trongcông nghiệp, nhôm được sản xuất bằng phương pháp điện phânnóng chảy chất nàosau đây?
A. . B. . C. . D. 3AlCl 23AlO 243AlSO 3 AlOH
Hướng dẫn giải
Trong công nghiệp, nhôm được sản xuất bằng phương pháp điện phân nóng chảy nhôm oxit 23AlO trongcriolit. Phương trìnhhóa học: . đpnc,criolit 23 22AlO4Al3O
OFFICIAL
Chọn B. Ví dụ 3. Chất được dùng để làmtrong nước đục, chất cầm màulà:
A. muối ăn. B. phènchua. C. giấm ăn. D. nước vôi. Hướng dẫn giải
Phènchua được dùngtrongngành thuộc da,công nghiệp giấy, chất cầm màutrongngành nhuộm vải, chất làmtrong nước.
Chọn B.
Ví dụ 4. Chất cótính lưỡng tínhlà: A. .
DẠYKÈMQUYNHƠN
Trang5
3 AlOH
. 3 AlOH Phương
học: 3 2 3 22 3 AlOH3HAl3HO AlOHOHAlO2HO Chọn B. Chú ý: Altác dụng được với cả NaOHvàHCl nhưng không phải là chất cótính lưỡng tính. Ví dụ 5. Chocác chất: . Số chất phản ứng được với cả dung dịch HCl 23 3243Al,Fe,AlO,AlOH,AlSO vàdung dịch NaOHlà: A. 1. B. 2. C. 3. D. 4. Hướng dẫn giải
B. . C. . D. . 243AlSO
Al 3AlCl Hướng dẫn giải Chất cótính lưỡng tínhlà
trìnhhóa
Cóba chất phản ứng được với cả dung dịch HClvàdung dịch NaOHlà: . 23 3Al,AlO,AlOH
Chọn C.
Bài tập tự luyện dạng 1
Bài tập cơ bản
Câu 1: Công thức của phènchualà:
A. . B. . 242 3 AlSO.24HO 24242 3 AlSO.KSO.24HO C. . D. . 3242 AlCl.KSO.24HO 24242 3 AlSO.NaSO.24HO
Câu 2: Chất cótính lưỡng tínhlà:
A. Al. B. . C. . D. Fe. 3AlCl 23AlO
Câu 3: Chất không tan được trongdung dịch kiềm dư là:
A. Mg. B. Al. C. D. 3 AlOH 23AlO
OFFICIAL
Câu 4: Cho từ từ dung dịch NaOH đến dư vàodung dịch chất X thấy lúc đầu có kết tủa keobông,sau đó kết tủa tan dần đến hết. Chất Xlà:
A. B. C. D. 4CuSO 3FeCl 3AlCl 4MgSO
Câu 5: Hỗn hợp tecmit được sử dụng dùng để hàn đường ray. Hỗn hợp tecmit gồm bột với 23FeO
A. Mg. B. Cu. C. Fe. D. Al. Câu 6: Trongcông nghiệp, kim loại nhôm được điều chế bằng phương pháp:
A. nhiệt luyện. B. thủy luyện. C. điện phândung dịch. D. điện phânnóng chảy. Câu 7: không phản ứng với dung dịch: 23AlO
A. HCl. B. C. KOH. D. Câu 8: tác dụng được với dãycác chất: 23AlO
A. B. NaCl,NaOH. C. D. HCl,NaOH. 243 NaSO,HNO 33 HNO,KNO Câu 9: Trongcông nghiệp, nhôm được sản xuất bằng cách điện phânnóng chảy:
A. . B. . C. . D. . 3AlCl 3 AlOH 23AlO 2NaAlO Câu 10: Dãy gồm cácoxit đều bị Al khử ở nhiệt độ caolà:
A. B. C. D. FeO,MgO,CuO. 2 PbO,KO,SnO. 34 FeO,SnO,BaO. 23 FeO,CuO,CrO. Câu 11: Nước thải công nghiệp chế biến cafe, chế biến giấy, chứa hàm lượng chất hữu cơ cao ở dạng hạt lơ lửng. Trongquátrình xử lí loại nước thải này, để làmchocác hạt lơ lửng nàykeo tụ lại thành khối lớn, dễ dàngtáchra khỏi nước (làmtrong nước), người tathêmvào nước thải một lượng dung dịch: A. phènchua.
DẠYKÈMQUYNHƠN
Trang6
B. muối ăn. C.
D.
Câu 12: Cho sơ đồ phản ứng: .Trong sơ đồ trên,
một phản 243 AlSOXYAl ứng, các chất X,Y lần lượt là: A. và . B. và . 2NaAlO3 AlOH 3 AlOH 2NaAlO C. và . D. và . 3 AlOH23AlO 23AlO3 AlOH
giấm ăn.
amoniac.
mỗi mũi tênlà
Câu 13: Tiến hànhcácthí nghiệm sau:
(a)Chodung dịch NaOHvàodung dịch 32CaHCO
(b)Chodung dịch HCl tới dư vàodung dịch .2NaAlO
(c) Sục khí tới dư vàodung dịch . 3NH 3AlCl
(d) Sục khí tới dư vàodung dịch 2CO 2NaAlO
Saukhicác phản ứng kết thúc, số thí nghiệm thu được kết tủa là:
A. 1. B. 3. C. 2. D. 4.
Câu 14: Cho dãy các chất sau: . Số chất phản ứng được với dung 323 33 Al,NaHCO,AlO,AlOH,AlCl
dịch NaOHlà: A. 3. B. 5. C. 4. D. 2.
Câu 15: Chocácphát biểu sau:
(a) Điều chế kim loại Al bằng cách điện phânnóng chảy 23AlO
(b) Tất cả kim loại kiềm thổ đều tantrong nước ở nhiệt độ thường.
(c) Quặng boxitcóthành phần chínhlà .36 NaAlF
(d)Nhôm tự bốc cháykhi tiếp xúc với khíclo.
(e) Thạch cao sống cócông thức là . 42 CaSOHO
(f) Đun nóngcó thể làm mềm nước cótính cứng vĩnh cửu.
Số phát biểu đúng là: A. 2. B. 1. C. 3. D. 4.
Câu 16: Chocácphát biểu sau:
(a)Cácoxit của kim loại kiềm đều tantrong nước, giải phóng hiđro.
(b)Kim loại K được điều chế bằng phương pháp điện phânnóng chảy. (c)Kim loại Na khử được ion trongdung dịch thànhAl. 3Al
(d)Có thể điều chế Mg bằng cáchchokhíCO khử MgO ở nhiệt độ cao.
(e)Kim loại Allà chất lưỡng tính,tan được trongdung dịch axitvà kiềm. (f)Dung dịch NaOHcó thể làm mất tính cứng của nước cứng tạm thời. Số phát biểu đúng là: A. 2. B. 3. C. 4. D. 5. Câu 17: Phát biểu nàosau đây sai?
A. Trongcông nghiệp, kim loại Al được điều chế bằng cách điện phân nóng chảy. 23AlO
B. phản ứng được với dung dịch HClvàdung dịch KOH. 3 AlOH
C. Kim loại Altan được trongdung dịch đặc, nguội. 3HNO
D. Trongcác phản ứng hóa học, kim loại Al chỉ đóng vaitrò chất khử. Câu 18: Chocácphát biểu sau:
(a) Sục khí tới dư vàodung dịch ,thu được kết tủa trắng. 2CO 2NaAlO (b) Nhỏ dung dịch vàodung dịch ,thu được kết tủa trắng. 32BaHCO 4KHSO
DẠYKÈMQUYNHƠN
Trang7
OFFICIAL
(c)Dung dịch làm mềm được nước cứng toàn phần. 23NaCO
(d) Thạch caonungdùng để nặn tượng, bó bột khigãy xương.
(e) Hợp kimliti–nhômsiêu nhẹ, được dùngtrong kĩ thuật hàngkhông. Số phát biểu đúng là: A. 3. B. 2. C. 5. D. 4. Bài tập nâng cao Câu 19: Cho sơ đồ phản ứng sau:
Các chất X,Y,ZvàT tương ứng thỏa mãn sơ đồ trênlà: A. và B. và 24 3
AlSO,BaOH,BaCO 2 BaCl. 24 24 3 AlSO,NaOH,NaSO24 HSO. C. và D. và
2 AlSO,BaOH,BaSO 2 BaCl.
24 4
3 3 2 2
2 NaAlO. Câu 20: Chocác sơ đồ phản ứng sau: (dư) aX2 BaOHYZ
(dư) 2 bXBaOH 2 YTHO Biết các phản ứng đều xảy ratrongdung dịch và chất Ytác dụng được với dung dịch loãng.Hai 24HSO chất nàosau đây đều thỏa mãntính chất của X? A. B. 3243 AlCl,AlSO. 324 3 3 AlNO,AlSO. C. D. 33 3 AlNO,AlOH. 333 AlCl,AlNO. Dạng 2: Nhôm hoặc
DẠYKÈMQUYNHƠN OFFICIAL Trang8
3 3 3 3 aXYAlOHZ bXTZAlCl cAlClYAlOHT
nhôm oxit tác dụng với dung dịch bazơ Phương pháp giải * Altác dụng với dung dịch bazơ: Phương trìnhhóa học: 2 222Al2OH2HO2AlO3H Nhận xét: . 2 AlOH H 2 nnn 3 * tác dụng với dung dịch bazơ: 23AlO Phương trìnhhóa học: . 23 22 AlO2OH2AlOHO Nhận xét: . 23 2 AlOOHAlO nn2n Ví dụ: Hòatan hết mgamAltrongdung dịch NaOH,thu được 3,36lítkhí (đktc). Giá trị của mlà: 2H A. 2,70. B. 5,40. C. 4,05. D. 1,35. Hướng dẫn giải . 2H n0,15mol
3 2
3
3
AlNO,BaOH,BaNO
Tacó: . 2AlH Al 22 nn.0,150,1molm0,1.272,7gam 33
AlAlO
AlO AlO OH AlAlO n2nn2n0,10,3n0,1mol mmm0,1270,110212,9gam
Chomgam hỗn hợp
Xvàodung
DẠYKÈMQUYNHƠN OFFICIAL Trang9
Chọn A. Ví dụ mẫu Ví dụ 1: Hòatan hết mgam hỗn hợp Alvà cần vừa đủ 300mldung dịch NaOH1M,thu được 23AlO 3,36lítkhí (đktc). Giá trị của mlà: 2H A. 2,7. B. 10,2. C. 12,9. D. 23,1. Hướng dẫn giải 2H n0,15mol Do tantrongdung dịch NaOHkhôngthu được khí nêntacó: 23AlO 2H 2AlH 22 nn.0,150,1mol 33 Mặt khác: 23 23 23 23
Chọn
C.
Chú ý: Nếu hỗn hợp Alvà phản ứng với dung dịch bazơ, taluôncó: 23AlO 23OAlAlO H nn2n
Phương trìnhhóa học: 2 24242 3 24 42 H 2Al3HSOAlSO3H x 1,5xmol FeHSOFeSOH y ymol n1,5xy0,3mol1,5xy0,3* Chomgam hỗn hợp Xvàodung dịch NaOH dư: 2H n0,15mol DoFekhông phản ứng được với dung dịch NaOHnêntacó: 2AlH 22 nn0,150,1molx0,1 33 Thế vào(*)ta được: x0,1 y0,31,50,10,15 AlFe mmm0,1.270,15.5611,1gam.
Ví dụ 2: Chomgam hỗn hợp X gồm AlvàFevàodung dịch loãng, dư thu được 6,72lítkhí 24HSO 2H (đktc). Nếu chomgamXtác dụng với dung dịch NaOH dư thoátra3,36lítkhí (đktc). Giá trị của m 2H là: A. 11,100. B. 13,900. C. 12,450. D. 14,475. Hướng dẫn giải Gọi số mol của AlvàFetrongmgam hỗn hợp X lần lượt làx,ymol.
dịch loãng, dư: . 24HSO 2H n0,3mol
Bài tập tự luyện dạng 2
Câu 1: ChomgamAltan hết trongdung dịch NaOH dư, thu được 3,36lítkhí ở đktc. Giá trị của m 2H là:
A. 2,70. B. 5,40. C. 4,05. D. 1,35. Câu 2: Hòatan hết mgam cần vừa đủ 200mldung dịch NaOH1,5M.Giá trị của mlà: 23AlO
A. 5,1. B. 10,2. C. 30,6. D. 15,3. Câu 3: Hòatan hết mgam hỗn hợp X gồm Alvà cần vừa đủ 200mldung dịch NaOH1,5M,thu 23AlO được 3,36lítkhí ở đktc. Giá trị của mlà: 2H
A. 7,8. B. 10,2. C. 12,9. D. 5,4. Câu 4: Hòatan hết hỗn hợp X gồm Alvà cần vừa đủ 200mldung dịch NaOH1M,thu được khí 23AlO vàdung dịch chứa mgam muối .Giá trị của mlà: 2H 2NaAlO
A. 8,2. B. 16,4. C. 10,2. D. 5,4. Câu 5: Hòatan hết mgam hỗn hợp X gồm Alvà (có tỉ lệ mol1:1) cần vừa đủ 200mldung dịch 23AlO NaOH1,5M.Giá trị của mlà: A. 7,8. B. 10,2. C. 12,9. D. 5,4. Câu 6: Chomgam hỗn hợp X gồm Al,Mgvàodung dịch NaOH dư, thu được 0,15mol . Mặt khác, 2H nếu chomgamXvàodung dịch HCl dư, thìthu được 0,25molkhí .Giá trị của mlà: 2H
A. 8,70. B. 2,40. C. 5,10. D. 6,45. Câu 7: Cho15,6gam hỗn hợp X gồm Alvà tác dụng với lượng dư dung dịch NaOH,thu được 23AlO 6,72lítkhí hiđro (đktc). Khối lượng của trong15,6gamXlà: 23AlO A. 5,4gam. B. 2,7gam. C. 10,2gam. D. 12,9gam. Câu 8: Cho1,56gam hỗn hợp gồm Alvà phản ứng hết với dung dịch HCl (dư), thu được Vlítkhí 23AlO (đktc) vàdung dịch X. Nhỏ từ từ dung dịch đến dư vàodung dịch Xthu được kết tủa, lọc hết 2H 3NH lượng kết tủa, nung đến khối lượng không đổi thu được 2,04gam chất rắn. Giá trị của Vlà: A. 0,448. B. 0,224. C. 1,344. D. 0,672. Câu 9: Hòatan hết mgam hỗn hợp X gồm Al,Fetrongdung dịch loãng, dư thu được 0,4mol 24HSO khí. Nếu hòatan hết Xtrongdung dịch NaOH dư, thìthu được 0,3molkhí.Giá trị của mlà: A. 11,00. B. 12,28. C. 13,70. D. 19,50. Câu 10: Cho hỗn hợp X gồm Alvà tác dụng với lượng vừa đủ 200mldung dịch NaOH2M,thu 23AlO được 6,72lítkhí hiđro (đktc). Khối lượng của trongXlà: 23AlO A. 5,4gam. B. 2,7gam. C. 10,2gam. D. 12,9gam.
Dạng 3: Bài toán muối tác dụng với dung dịch kiềm 3Al Bài toán 1: Xác định sản phẩm
DẠYKÈMQUYNHƠN
Trang10 Chọn A.
OFFICIAL
Cách2: Xét tỉ lệ . 3 OH Al n k n
n0,015moln0,015mol n0,05moln0,05mol
Cách1: Phương trìnhhóa học:
DẠYKÈMQUYNHƠN OFFICIAL Trang11
3
?
3 3 Al3OHAlOH1
Phương pháp giải Cho Sau phản ứng, dư: OH0,050,0450,005mol 22 3 AlOHOHAlO2HO2 0,0050,005 mol Sau phản ứng (2): 3AlOH n0,0150,0050,01mol kettua m0,01780,78gam Cách2: Xét tỉ lệ . 3 OH Al 3n0,053,34 n0,015 Khi đó: 3 3 AlOHAlOH n4nn40,0150,050,01molm0,01780,78gam Cách3: Tacó sơ đồ: 3 3 0,05mol 2 0,015mol ? NaCl0,045mol AlClNaOHAlOH NaAlO?mol
3 bbiet iet
OHAlAlOH
Quátrình phản ứng: 3 3 22 3 Al3OHAlOH1 AlOHOHAlO2HO2
Cách1:
Tínhtheo phương trìnhhóa học.
Nếu thìkhi đó k3 3 OH AlOH n n 3
Nếu thìkhi đó 3k4
3 3 AlOHAlOH n4nn
Cách 3: Tacó thể dùng sơ đồ phản ứng kết hợp với phương pháp bảo toànnguyên tố, bảo toàn điện tích để giải nhanh. Ví dụ: Cho100mldung dịch 0,15Mvào250mldung dịch NaOH0,2M,saukhi phản ứng xảy ra 3AlCl hoàntoàn,thu được mgam kết tủa. Giá trị của xlà: A. 1,56. B. 0,78. C. 1,17. D. 1,30. Hướng dẫn giải 3 3AlCl Al NaOH OH
0,0150,0450,015mol
Bảo toànnguyên tố Cl:
Bảo toànnguyên tố Na: .
Chọn D. Ví dụ 2: Cho200mldung dịch KOH1,35Mvào50mldung dịch 1,5M, phản ứng xongthu được 3AlCl mgam kết tủa. Giá trị của mlà: A. 7,02. B. 4,68. C. 5,85. D. 2,34. Hướng dẫn giải
DẠYKÈMQUYNHƠN OFFICIAL Trang12
3NaClAlCl n3n0,045mol
Ví
1:
3 3 NaOH OH AlCl Al
3 OH Al
n
3 3 OH AlOH AlOH
. 3 OH Al n
n
3 3
Chọn D. Ví dụ 3: Cho100mldung dịch gồm KOH1,4MvàNaOH1Mvào50mldung dịch 1,4M, phản 3AlCl ứng xongthu được mgam kết tủa. Giá trị của mlà:
Hướng dẫn giải 3 3 KOH NaOH OH AlCl Al n0,14mol;n0,1moln0,24mol n0,07moln0,07mol
2 2NaOHNaClNaAlONaAlO nnnn0,050,0450,005mol
Bảo toànnguyên tố Al: 3 2 3 3 ANaAlO lOH AlOH Al nnnn0,0150,0050,01mol m0,01.780,78gam
Chọn B.
dụ mẫu Ví dụ
Cho từ từ đến hết 100mldung dịch NaOH1,5Mvào50mldung dịch 1,5M,saukhicác 3AlCl phản ứng xảy rahoàntoànthu được mgam kết tủa. Giá trị của mlà: A. 12,4. B. 7,8. C. 15,6. D. 3,9. Hướng dẫn giải
n0,15moln0,15mol n0,075moln0,075mol
Xét tỉ lệ:
n 23
Khi đó:
n0,15 n30,05molmm0,05783,9gam 3
3 3 KOH OH AlCl Al n0,27moln0,27mol n0,075moln0,075mol
Xét tỉ lệ:
34
Khi đó:
3 AlOH AlOH AlOH n4nn40,0750,270,03molmm0,03782,34gam
A. 3,90. B. 3,12. C. 5,46. D. 6,24.
n0,2moln0,4mol;n0,6mol n0,7moln1,4mol;n0,7mol
n 34 n Chất rắn thu được gồm và . 23 AlO0,1mol 4 BaSO0,6mol 23 4chatranAlOBaSO mmm0,11020,6233150gam Chọn A. Chú ý: không bị nhiệt phânnên khối lượng không đổi. 4BaSO Bài toán 2: Xác định chất tham gia Phương pháp giải Cho Kettua3+ 3 ?biet biet
2 243
Xét tỉ lệ: 3 OH Al n 34 n
Khi đó: 3 3 AlOHAlOH n4nn4.0,401,40,2mol.
Khi đó: 3 3 3 AlOH AlOH AlOH n4nn4.0,070,240,04molmm0,04.783,12gam. OH+AlAlOH Phương trìnhhóa học: 3 3 3 22
Al3OHAlOH1 Al4OHAlO2HO2
Chọn B. Ví dụ 4: Cho200mldung dịch 1Mvào700mldung dịch 1M,saukhi phản ứng 243AlSO 2 BaOH kết thúc, lọc tách lấy kết tủa đem nungngoàikhôngkhí đến khối lượng không đổi thu được mgam chất rắn. Giá trị của mlà: A. 150,0. B. 20,4. C. 160,2. D. 139,8. Hướng dẫn giải
Taxéthai trường hợp: TH1: Kết tủa chưa bị hòatan,khi đó dư, hết (chỉ xảy ra phản ứng (1)): . 3Al OH 3AlOHOHmin n3n
Nung kết tủa gồm và ta được:
DẠYKÈMQUYNHƠN OFFICIAL Trang13
3
4 2 2 AlSO Al SO BaOH OH Ba
Xét tỉ lệ: 3 3 AlOH0,2mol 4
OH Al t 232 3 2AlOHAlO3HO 0,20,1mol
Lại có: 2 44 BaSOSO nn0,6mol
BaSO0,6mol
TH2: Kết tủa bị hòa tan một phần, khi đó cả và đều hết. Xảy ra cả phản ứng (1) và (2): 3Al OH
Chú ý: Khi giải bàitoán dạng nàyngoài việc sử dụng các phản ứng để tínhtoán ở bên,tacó thể dùng sơ đồ phản ứng kết hợp với phương pháp bảo toànnguyên tố, bảo toàn điện tích để giải nhanh. Ví dụ: Cho200mldung dịch 1,5MvàoVlítdung dịch NaOH0,5Mthu được 15,6gam kết tủa. 3AlCl
Cách1: Tínhtheo phương trìnhhóa học (tương tự như kiểu 1) Cách2: Sử dụng công thức tínhnhanh. Vìsau phản ứng còn kết tủa nên phải hết. OH Nếu thì kết tủa là cực đại, khi đó: 3OAlOH H n3n 3 3AAlOH l n3n Nếu kết tủa bị tan một phần, khi đó: . 3OAlOH H n3n
DẠYKÈMQUYNHƠN
Trang14
OFFICIAL
3
OHmaxAl
.
3AlOH
n4nn
Giá trị lớn
Vlà: A.
giải 3 3 3 AlCl Al AlOH n0,3moln0,3mol n0,2mol Lượng NaOHlà lớn nhất khi phản ứng thu được kết tủa lớn nhất sau đó kết tủa tan dần.
3 NaOH OHmaxAl OH
Chọn
Cho 3+ 3 ?biet biet Al+NaOHAlOH
nhất của
1,2. B. 1,8. C. 2,4. D. 2,0. Hướng dẫn
Khi đó tacó: .
1 n4nn4.0,30,21molnn1molV2 0, lí 5 t
D.
phản ứng xảy ra 3AlCl hoàntoàn,thu được 6,24gam kết tủa. Giá trị của xlà: A. 1,2. B. 1,5. C. 1,0. D. 1,6. Hướng dẫn giải 3 NaOH OH AlOH n0,32moln0,32mol n0,08mol Cách1: Vìsau phản ứng còn kết tủa nên phải hết. OH Phương trìnhhóa học:
3 3 3 3 OAlOH H AlOHOHAl Al nn n4nnn 4 Cách3: Sử dụng bảo toànnguyên tố. Ví dụ: Cho100mldung dịch xmol/lítvào200mldung dịch NaOH1,6Msaukhi
DẠYKÈMQUYNHƠN OFFICIAL Trang15 3 3 3 3 3 22 Al AlCl
3
3 3 3 3 3
Al AlCl Al
NaCl AlClNaOHAlOH NaAlO
3 KOH OH AlOH n0,2moln0,2mol n0,05mol Ta thấy nêntacó: 3OAlOH H n3n 3 3 3 3 3 AlOHOHAl Al AlCl Al n4nn0,24n0,05 0,0625 n0,0625moln0,0625molx1,25M 0,05 Chọn A. Ví dụ 2: ChoVlítdung dịch NaOH0,3Mvào200mldung dịch 0,2Mthu được một kết tủa 243AlSO keo trắng. Nung kết tủa này đến khối lượng không đổi thìthu được 1,02gam chất rắn. Giá trị nhỏ nhất của Vlà: A. 0,4. B. 0,3. C. 0,2. D. 0,1. Hướng dẫn giải
Al3OHAlOH1 0,080,240,08mol Al4OHAlO2HO2 0,020,08mol n0,080,020,1mol 0,1 n0,1molx1M 0,1
Cách2: Ta thấy nêntacó:
OAlOH H n3n
AlOHOHAl
n4nn0,324n0,08 0,1 n0,1moln0,1molx1M 0,1
Cách3: Tacó sơ đồ:
3 3 2 a0,32mol mol 0,08mol
Bảo toànnguyên tố Cl: . 3NaClAlCln3n
Bảo toànnguyên tố Al: . 3 2 2 3 AlClANaAlONaAlO lOH nnnna0,08mol Bảo toànnguyên tố Na: . 2NaOHNaClNaAlO 0,1 nnn0,323aa0,08a0,1molx1 0,1 Chọn C. Ví dụ mẫu Ví dụ 1: Cho200mldung dịch KOH1Mvào50mldung dịch xmol/l, phản ứng xongthu được 3AlCl 3,9gam kết tủa. Giá trị của xlà: A. 1,25. B. 1,20. C. 1,50. D. 1,00. Hướng dẫn giải
Saukhinung kết tủa keo trắng: . 23 3 AlO AlOH n0,01moln0,02mol
Lượng NaOH là nhỏ nhất khi kết tủa chưa bị hòa tan. Khi đó: . 3OAlOH H 0,06n3n3.0,020,0 l 6molV0í,2t 0,3 Chọn C. Bài tập tự luyện dạng 3 Bài tập cơ bản
Câu 1: Cho50mldung dịch KOH1,5Mvàodung dịch dư, thu được mgam .Giá trị của 3AlCl 3 AlOH mlà: A. 1,95. B. 2,34. C. 4,68. D. 5,85. Câu 2: Cho từ từ Vmldung dịch NaOH1Mvào100mldung dịch hỗn hợp gồm HCl1Mvà 0,5M 3AlCl thìthu được lượng kết tủa lớn nhất. Giá trị của Vlà: A. 100. B. 150. C. 200. D. 250. Câu 3: Thể tích dung dịch NaOH 0,25M cần cho vào 15 ml dung dịch 0,5M để thu được 243AlSO lượng kết tủa lớn nhất là:
A. 210ml. B. 60ml. C. 180ml. D. 90ml. Câu 4: Cho từ từ 0,25 lít dung dịch NaOH 1,04M vào dung dịch chứa 0,04 mol ; 0,024 mol 24HSO và0,016mol , phản ứng xongthu được mgam kết tủa. Giá trị của mlà: 3FeCl 243AlSO
A. 2,568. B. 4,128. C. 1,560. D. 5,064. Câu 5: Cho 47,4 gam phèn chua vào nước thu được dung dịch X. Cho X vào 200 ml dung dịch 1M,thu được mgam kết tủa. Giá trị của mlà: 2 BaOH A. 7,8. B. 62,2. C. 54,4. D. 46,6. Câu 6: ChoVlítdung dịch NaOH2Mvàodung dịch chứa 0,1mol và0,1mol ,thu 24HSO 243AlSO được 7,8gam kết tủa. Giá trị của V lớn nhất là: A. 0,45. B. 0,25. C. 0,35. D. 0,50. Câu 7: Cho một mẫu Kvào200mldung dịch nồng độ xM,sau phản ứng thu được kết tủa và 243AlSO 5,6lítkhí (ở đktc). Lọc kết tủa đem nung đến khối lượng không đổi, thu được 5,1gam chất rắn. Giá trị của xlà: A. 0,375. B. 0,200. C. 0,050. D. 0,150. Câu 8: Cho300mldung dịch NaOH0,1M phản ứng với 100mldung dịch 0,1M.Saukhi 243AlSO phản ứng xảy rahoàntoàn,thu được agam kết tủa. Giá trị của alà: A. 2,34. B. 1,17. C. 1,56. D. 0,78.
DẠYKÈMQUYNHƠN OFFICIAL Trang16
243AlSO Al
.
3
n0,04moln0,08mol
Câu 9: Cho400mldung dịch E gồm xmol/lvà ymol/ltác dụng với 612mldung dịch 3AlCl 243AlSO NaOH1M,saukhicác phản ứng kết thúcthu được 8,424gam kết tủa. Mặt khác,khicho400mlEtác dụng với dung dịch (dư) thìthu được 33,552gam kết tủa. Tỉ lệ x:ylà: 2BaCl
A. 3:4. B. 3:2. C. 4:3. D. 7:4. Câu 10: Cho500mldung dịch 0,1MvàoVmldung dịch 0,1M;saukhicác phản 2 BaOH 243AlSO ứng kết thúcthu được 12,045gam kết tủa. Giá trị của Vlà: A. 300. B. 75. C. 200. D. 150. Câu 11: X là dung dịch , Y là dung dịch . Trộn 200 ml dung dịch X với 300 ml 243AlSO 2 BaOH dung dịch Y thu được 8,55 gam kết tủa. Trộn 200 ml dung dịch X với 500 ml dung dịch Y thu được 12,045gam kết tủa. Nồng độ của dung dịch Xlà:
OFFICIAL
A. 0,075M. B. 0,100M. C. 0,150M. D. 0,050M. Bài tập nâng cao Câu 12: HòatanhoàntoànmgamAlvàodung dịch loãng chứa 0,2mol ,thu được khí và 24HSO 2H dung dịch X. Nếu cho220mldung dịch NaOH2MvàoXthìthu được 3agam kết tủa. Mặt khác, nếu cho 240mldung dịch NaOH2MvàoXthìthu được agam kết tủa. Giá trị của mvàa lần lượt là:
A. 2,7và1,56. B. 2,7và4,68. C. 5,4và1,56. D. 5,4và4,68. Câu 13: Hòatanhoàntoàn4,74gamphènchuavào nước, thu được dung dịch X.ChoVmldung dịch 0,1MvàoX,thu được 4,506gam kết tủa. Giá trị của V gần nhất với: 2 BaOH A. 175. B. 195. C. 95. D. 220. Câu 14: Cho 7,65 gam hỗn hợp gồm Al và Mg tan hoàn toàn trong 500 ml dung dịch HCl 0,4M và 0,6Mthu được dung dịch Xvàkhí .Cho850mldung dịch NaOH1MvàoX,thu được 16,5 24HSO 2H gam kết tủa. Mặt khác nếu cho từ từ dung dịch KOH0,6Mvà 0,5Mvàodung dịch X đến khi 2 BaOH thu được kết tủa lớn nhất rồi lọc lấy kết tủa nung đến nhiệt độ không đổi thu được mgam chất rắn. Giá trị của m gần nhất với: A. 72. B. 84. C. 82. D. 58. Câu 15: Cho hỗn hợp X gồm 0,12molCuO;0,1molMgvà0,05mol tanhoàntoàntrongdung 23AlO dịch chứa đồng thời 0,15mol (loãng)và0,55molHCl,thu được dung dịch Yvàkhí . Nhỏ từ 24HSO 2H từ dung dịch hỗn hợp 0,1MvàNaOH0,6Mvàodung dịch Y đến khithu được khối lượng kết 2 BaOH tủa lớn nhất, lọc kết tủa đem nung đến khối lượng không đổi, thu được mgam rắn khan.Giá trị của m gần nhất với giá trị nàosau đây? A. 52,52. B. 48,54. C. 43,45. D. 38,72. Dạng 4:
DẠYKÈMQUYNHƠN
Trang17
Bài toán hỗn hợp gồm Al với kim loại Na (hoặc K hoặc Ba) tác dụng với nước hoặc tác dụng với dung dịch kiềm dư Phương pháp giải Khicho hỗn hợp Alvàkim loại (Na,K,Ba)vào nước hayvàodung dịch kiềm:
Trước
phản ứng:
Sau đó xảy ra phản ứng: . 2 222Al2HO2OH2AlO3H
Cách1: Tínhtheo phương trìnhhóa học (chúý phải xétAl hết hayAl dư).
Cách2: Sử dụng công thức tínhnhanh.
Cho hỗn hợp vào nước: Nếu Al dư, khi đó hết, khi đó: OH 2 HNa/KBa n2n4n Nếu Al hết, dư: OH 2 HNa/KBaAl 2nn2n3n
Cho hỗn hợp vàodung dịch kiềm dư (Al hết): 2 HNa/KBaAl 2nn2n3n
Ví dụ: Chomgam hỗn hợp Na,Alvào nước, thu được 0,4mol . Nếu chomgam hỗn hợp trênvào 2H dung dịch NaOH dư, thìthu được 0,7mol .Giá trị của mlà: 2H
A. 18,4. B. 15,4. C. 19,1. D. 10,8. Hướng dẫn giải Tronghaithí nghiệm lượng chất ban đầu như nhau, nhưng số molkhí thu được ở thí nghiệm (2) lớn 2H hơn ở thí nghiệm (1), chứng tỏ ở thí nghiệm (1)nhôm phải dư. Gọi số mol của NavàAl lần lượt làxvàymol.
Cách1: Cho hỗn hợp vào nước (Al dư).
DẠYKÈMQUYNHƠN OFFICIAL Trang18
tiêncó
2 2 2 2 2 2 2 2Na2HO2Na2OHH 2K2HO2K2OHH Ba2HOBa2OHH
2 2 2 2 22 H 2Na2HO2Na2OHH x x0,5xmol 2Al2HO2OH2AlO3H xx 1,5xmol n2x0,4molx0,2 Cho hỗn hợp vàodung dịch NaOH dư (Al hết). 2 2 2 2 22 H 2Na2HO2Na2OHH 0,2 0,1mol 2Al2HO2OH2AlO3H y 1,5ymol n0,11,5y0,7moly0,4 m0,2.230,4.2715,4gam Cách2: Cho hỗn hợp vào nước (Al dư): . 2 HNaNa 0,4 n2nn0,2mol 2 Cho hỗn hợp vàodung dịch NaOH dư (Al hết): 2 HNaAlAl 0,720,22nn3nn30,4molm0,2230,42715,4gam
Chọn B.
Ví dụ mẫu Ví dụ 1: Chomgam hỗn hợp BavàAlvào nước dư saukhicác phản ứng xảy rahoàntoànthu được
7,168lítkhí (đktc) và3,08gam chất rắn khôngtan.Giá trị của mlà: 2H A. 14,32. B. 18,36. C. 15,28. D. 17,02. Hướng dẫn giải
Chất rắn khôngtanlàAl dư (3,08gam). Gọi số molBatrong hỗn hợp ban đầu làxmol. Phương trìnhhóa học:
B.
Ví dụ 2: Hỗn hợp X gồm Na,AlvàFe (với tỉ lệ số mol giữa NavàAl tương ứng là2:1).ChoXtác dụng với (dư) thu được chất rắn YvàVlítkhí.Chotoàn bộ Ytác dụng với dung dịch loãng 2 HO 24HSO (dư) thu được 0,25Vlítkhí. Biết cáckhí đo ở cùng điều kiện, các phản ứng đều xảy rahoàntoàn. Tỉ lệ số mol của FevàAltrongX tương ứng là: A. 16:5. B. 5:16. C. 1:2. D. 5:8. Hướng
DẠYKÈMQUYNHƠN OFFICIAL Trang19
2 2 22 2 22 2 2 H Ba2HOBaOHH xxx mol BaOH2Al2HOBaAlO3H x2x 3xmol n4x0,32molx0,08mol Theo phương trình: Alpu Alpu BaAAlpuldu n2x0,16molm4,32gam
dụng với
Gọi số molkhí làxmol. 2H Vì tỉ lệ số mol .Na:Al2:1 KhichoXvào nước thìAlvàNa đều hết,
ứng. Chất rắn YlàFe. Tacó: . Al Na namoln2amol Bảo toànelectron: . 2 HNaAl Al 2nn3n3a2a2xna0,4xmol ChoYtác dụng với loãng dư: 24
Tacó: . 2H n0,25xmol
2H n0,32mol
mmmm0,08.1374,323,0818,36gam
Chọn
dẫn giải ChoX(Na,Al,Fe)tác
dư: 2 HO
Fekhông phản
HSO
n0,25x5nn0,25xmol n0,4x8
Fe FeH Al
Bảo toànelectron: . 2
Chọn D.
Bài tập tự luyện dạng 4 Bài tập cơ bản
Câu 1: Chomgam hỗn hợp gồm AlvàNavào nước dư, saukhicác phản ứng xảy rahoàntoàn,thu được 2,24lítkhí (đktc) và2,35gam chất rắn khôngtan.Giá trị của mlà: 2H A. 3,70. B. 4,85. C. 4,35. D. 6,95. Câu 2: Hòatan hết 13,275gam hỗn hợp gồm BaOvàAlvào nước thu được dung dịch X. Sục dư 2CO vàoX,thu được 7,41gam kết tủa. Phần trăm khối lượng BaOtrong hỗn hợp là:
A. 80,876%. B. 78,806%. C. 70,688%. D. 80,678%. Câu 3: Cho hỗn hợp NavàAlcó tỉ lệ số mol tương ứng là1:2vào nước dư. Saukhicác phản ứng xảy rahoàntoànthu được 0,896lítkhí (ở đktc) vàmgam chất rắn khôngtan.Giá trị của mlà: 2H
A. 0,78. B. 0,54. C. 4,32. D. 1,08.
Câu 4: Cho 8,6 gam hỗn hợp K, Fe, Mg và Al vào nước. Sau khi các phản ứng xảy ra hoàn toàn, thu được 4,48lítkhí (đktc) vàmgambakim loại khôngtan.Giá trị của mlà: 2H
A. 2,7. B. 2,0. C. 4,0. D. 3,6.
Câu 5: Hỗn hợp X gồm K,Mg,Al.ChiaXthànhba phần bằng nhau: Phần một chovàodung dịch HCl dư, thu được 2,016lítkhí. Phần haichovào nước dư, thu được 0,896lítkhí. Phần bachovàodung dịch NaOH dư, thu được 1,568lítkhí. Biết các phản ứng xảy rahoàntoàn,cáckhí đo ở đktc. Phần trăm khối lượng AltrongXlà: A. 46,15%. B. 33,33%. C. 45,25%. D. 35,54%.
Câu 6: Hỗn hợp X gồm Al,Na.ChomgamXvào nước dư, thu được Vlítkhí . Nếu chomgamvào 2H dung dịch NaOH dư, thìthu được 1,75Vlítkhí .Các thể tíchkhí đo ở cùng điều kiện, các phản ứng 2H xảy rahoàntoàn. Phần trăm khối lượng NatrongXlà: A. 77,31%. B. 39,87%. C. 49,87%. D. 29,87%. Câu 7: Hỗn hợp X gồm Ba,Al.ChiamgamXthànhhai phần bằng nha: Phần một chovào nước dư, thu được 1,344lítkhí. Phần haichovàodung dịch dư, thu được 2,016lítkhí. 2 BaOH Biết các phản ứng xảy rahoàntoàn,cáckhí đo ở đktc. Giá trị của mlà: A. 3,405. B. 6,810. C. 5,190. D. 4,565. Câu 8: Hỗn hợp X gồm Ba,NavàAl,trong đó số mol của Al bằng 6 lần số mol của Ba.ChomgamX vào nước dư đến phản ứng hoàntoàn,thu được 1,792lítkhí (đktc) và0,54gam chất rắn. Giá trị của 2H mlà: A. 3,90. B. 5,27. C. 3,45. D. 3,81. Bài tập nâng cao
DẠYKÈMQUYNHƠN
Trang20
OFFICIAL
Câu 9: Chia hỗn hợp X gồm K,AlvàFethànhhai phần bằng nha:
Cho phần một vàodung dịch KOH (dư) thu được 0,784lítkhí (đktc). 2H
Cho phần haivào một lượng dư thu được 0,448lítkhí (đktc) vàmgam hỗn hợp kim loại Y. 2 HO 2H
HòatanhoàntoànYvàodung dịch HCl (dư) thu được 0,56lítkhí (đktc). 2H
Khối lượng của K,Al,Fetrong mỗi phần hỗn hợp X lần lượt là:
A. 0,39gam;0,54gam;1,40gam. B. 0,78gam;1,08gam;0,56gam.
C. 0,39gam;0,54gam;0,56gam. D. 0,78gam;0,54gam;1,12gam.
Câu 10: Hòatanhoàntoànmgam hỗn hợp X gồm NavàAlvào nước dư, thu được dung dịch Y.ChiaY làba phần bằng nhau:
Cho từ từ dung dịch HCl1Mvào phần một đến khi bắt đầu xuất hiện kết tủa thìdùng hết 100ml.
Cho từ từ 450mldung dịch HCl1Mvào phần hai,thu được 3agam kết tủa.
Cho từ từ 750mldung dịch HCl1Mvào phần ba,thu được agam kết tủa.
Giá trị của mlà: A. 44,40. B. 28,50. C. 40,65. D. 36,90.
OFFICIAL
Dạng 5: Bài toán nhiệt nhôm
Bài toán 1: Phản ứng nhiệt nhôm xảy ra hoàn toàn Phương pháp giải
Phương trìnhhóa học: . t xy 23 2yAl3MOyAlO3xM
Với Mlàkim loại đứng sauAltrongdãy điện hóa. Hỗn hợp sau phản ứng nhiệt nhômhoàntoàn gồm vàAl dư hoặc và dư. 23 AlO,M 23 AlO,Mxy MO
Bước 1: Xác định chất hết, chất dư.
Nếu hỗn hợp sau phản ứng tác dụng với NaOHsinhrakhí , chứng tỏ cóAl dư. 2H
Nếu hỗn hợp sau phản ứng gồm haikim loại, chứng tỏ cóAl dư. Nếu hỗn hợp sau phản ứng chotác dụng với dung dịch axitthu được khí ,thì chưa thể xác định Al dư 2H hay dư. xy MO
Bước
DẠYKÈMQUYNHƠN
Trang21
2: Tínhtoántheoyêu cầu bàitoán. Chú ý 1: Nếu Al dư, khi đó có vàAl phản ứng với dung dịch kiềm, cáckim loại còn lại (trừ Zn) 23AlO không phản ứng. 2 22 23 22 2Al2OH2HO2AlO3H AlO2OH2AlOHO Taluôncó: 2 23 AlH Al A d lOAlOHp u banđa u u du 2 nn 3 n2n2nn
Chú ý 2: Sử dụng các định luật bảo toàn: Bảo toàn khối lượng, bảo toànnguyên tố, bảo toànelectron để giải nhanh. Ví dụ: DùngmgamAl để khử hết 1,6gam (phản ứng nhiệt nhôm).Cho sản phẩm sau phản ứng 23FeO hoàntoàntác dụng với lượng dư dung dịch NaOHthu được 0,672lítkhí (đktc). Giá trị của mlà:
A. 0,540. B. 1,755. C. 1,080. D. 0,810. Hướng dẫn giải .
H n0,01mol;n0,03mol
Cho sản phẩm sau phản ứng hoàntoàntác dụng với dung dịch NaOH dư thu được khí còn dư 2 HAl sau phản ứng nhiệt nhôm. Tínhtoántheo số mol . 23FeO Phương trìnhhóa học:
DẠYKÈMQUYNHƠN
Trang22
OFFICIAL
Al
du banđau Adu l
Tacó sơ đồ: 2 2 2NaOH 3 H t 34 HCl H du AlOn0,3mol AlFeOFe An1,2mol l Xét dư: . YNaOH 2 2 H AlduH 22 n0,3mol;nn.0,30,2mol 33 Xét dư: . YHCl 2H n1,2mol Bảo toànelectron: . 2AlduFeH Fe Fe 3n2n2n30,22n21,2n0,9mol Bảo toànnguyên tố Fe: . 34 FeOFe 1 nn0,3mol 3 Bảo toànnguyên tố O: . 34 23 23 FeOAlO AlO 4n3n0,341,2moln0,4mol Bảo toànnguyên tố Al: 23 AlbandauAlOAldu n2nn0,4.20,21mol. .m0,3.2321.2796,6gam
23 2 FeO
t 23 23 2AlFeOAlO2Fe 0,020,01 mol
Tacó: 2AlH
Alpu
22 nn.0,030,02mol 33 nnn0,020,020,04molm0,04271,08gam
Chọn C. Ví dụ mẫu Ví dụ 1: Thực hiện phản ứng nhiệt nhômmgam hỗn hợp X gồm Alvà ,thu được hỗn hợp Y.Cho 34FeO Yvàodung dịch NaOH dư, thu được 6,72lítkhí. Mặt khác, nếu choYvàodung dịch HCl dư thìthu được 26,88lítkhí.Giá trị của mlà: A. 136,8. B. 91,2. C. 69,6. D. 96,6. Hướng dẫn giải
Chọn D.
Ví dụ 2: Nungnóng46,6gam hỗn hợp gồm Alvà (trong điều kiện khôngcókhôngkhí) đến khi 23CrO phản ứng xảy rahoàntoàn.Chia hỗn hợp thu được sau phản ứng thànhhai phần bằng nhau. Phần một phản ứng vừa đủ với 300mldung dịch NaOH1M(loãng). Để hòatan hết phần hai cần vừa đủ dung dịch chứa amolHCl.Giá trị của alà: A. 0,9. B. 1,3. C. 0,5. D. 1,5. Hướng dẫn giải Taxéttrong mỗi phần (23,3gam). Xét phần một +NaOH: . NaOH
Xét phần hai+HCl: Bảo toànnguyên tố Al: 3 AlClAlbandau nn0,3mol
Bảo toànnguyên tố Cr: 2 23CrClCrO n2n0,2mol Bảo toànnguyên tố Cl: . 3 2 HClCAlClCrCl l nn3n2n3.0,32.0,21,3mol Chọn B.
Bài toán 2: Phản ứng nhiệt nhôm không hoàn toàn Phương pháp giải Phương trìnhhóa học: t xy 23 2yAl3MOyAlO3xM
Với Mlàkim loại đứng sauAltrongdãy điện hóa. Hỗn hợp sau phản ứng nhiệt nhômkhônghoàntoàn gồm dư, MvàAl dư. 23xy AlO,MO Dựa vào phương trìnhhóa học để tìm mối quan hệ số mol giữa các chất đó. Sử dụng các phương pháp bảo toànnguyên tố, bảo toànelectron, bảo toàn khối lượng để giải nhanhcácbàitoánnày. Ví dụ: Trộn 10,8gam bột Al với 34,8gam bột rồi tiến hành phản ứng nhiệt nhômtrong điều kiện 34FeO khôngcókhôngkhí,thu được hỗn hợp X.HòatanhoàntoànX bằng dung dịch loãng (dư), thu 24HSO được 10,752lítkhí (đktc). Hiệu suất của phản ứng nhiệt nhômlà: 2H A. 80%. B. 90%. C. 70%. D. 60%. Hướng dẫn giải
DẠYKÈMQUYNHƠN
Trang23
OFFICIAL
Tacó sơ
NaOH 2 23 t 23 3HCl du 2 ANaAlO lO AlCrOCrAlCl AlCrCl
OH n0,3moln0,3mol
đồ:
Tacó: . 23 AlbandauAlOAlduOAlbandau Hpu n2nnnn0,3mol
Mặt khác: . 23 23 23 AlCrO CrO CrO mm23,3gamm23,30,3.2715,2gamn0,1mol
Tacó: . 34 Al FeO n0,4mol;n0,15mol
Gọi số molAl phản ứng là8xmol. Phương trìnhhóa học: t 34 23 8Al3FeO4AlO9Fe
Trước: 0,4 0,15 mol Pư: 8x 3x 4x 9x mol
Sau pư: mol 0,48x0,153x4x9x
Hỗn hợp X gồm Al dư, dư, ,Fetác dụng với loãng. 34FeO23AlO 24HSO Bảo toànelectron: . 2AlduFeH 3n2n2n30,48x29x0,482x0,04
Xét tỉ lệ: Hiệu suất tínhtheoAl hoặc đều được. 34AFeO l nn 83 Hiệu suất của phản ứng nhiệt nhômlà: . H3x0,12.100%.100%80% 0,150,15 Chọn A. Ví dụ mẫu Ví dụ 1: Nung hỗn hợp X gồm 2,7gamAlvà10,8gamFeO,sau một thời gianthu được hỗn hợp Y. Để hòatanhoàntoànY cần vừa đủ Vmldung dịch 1M.Giá trị của Vlà:lít
DẠYKÈMQUYNHƠN
Trang24
OFFICIAL
Phương
t 23 2Al3FeOAlO3Fe 0,10,150,050,15mol Hỗn hợp Y gồm 23 AlO0,05mol;Fe0,15mol Tacó: 24 2423HSO 3 4 AAlSO lO FeFeSO Bảo toànnguyên tố Al,Fe: 23243 4 AlOAlSO FeSOFe nn0,05mol nn0,15mol Bảo toànnhóm . 24 4 243 4HSO FeSOAlSO 0,3 SO:n3nn30,05 lít300m 0,150,3mol lV0,3 1 Chọn C. Ví dụ 2: Thực hiện phản ứng nhiệt nhôm hỗn hợp gồm Alvàmgamhaioxit sắt trongkhí trơ, thu được hỗn hợp rắn X.ChoXvàodung dịch NaOH dư, thu được dung dịch Y, chất khôngtanZvà0,672lítkhí (đktc). Sục khí dư vàoY,thu được 7,8gam kết tủa. ChoZtan hết vàodung dịch ,thu 2H 2CO 24HSO
24HSO A. 375. B. 600. C. 300. D. 400. Hướng dẫn giải Al FeO n0,1mol;n0,15mol
trìnhhóa học:
được dung dịch chứa 15,6 gam muối sunfat và 2,464 lít khí (ở đktc, sản phẩm khử duy nhất của 2SO ). Biết các phản ứng xảy rahoàntoàn.Giá trị của mlà: 24HSO A. 6,48. B. 5,04. C. 6,96. D. 9,66. Hướng dẫn giải Quy đổi hỗn hợp ban đầu thànhAl,FevàO.
Tacó: 2 2 4 StaomuoiSO O nn0,11mol
Mặt khác: . 2 4 muoiFe Fe SmOtaouoi mmm15,6gamm15,60,11.965,04gam Vậy . FeO mmm5,040,12.166,96gam Chọn C. Bài tập tự luyện dạng 5 Bài tập cơ bản Câu 1: Nung hỗn hợp gồm 10,8gamAlvà16,0gam (trong điều kiện khôngcókhôngkhí),sau 23FeO khi phản ứng xảy rahoàntoànthu được chất rắn Y. Khối lượng kim loại trongYlà: A. 16,6gam. B. 11,2gam. C. 5,6gam. D. 22,4gam. Câu 2: Hỗn hợp X gồm vàAlcó tỉ lệ mol tương ứng 1:3. Thực hiện phản ứng nhiệt nhômX 34FeO (khôngcókhôngkhí) đến khi phản ứng xảy rahoàntoànthu được hỗn hợp gồm: A. và . B. ,Fevà . 34Al,Fe,FeO23AlO 23AlO 34FeO C. vàFe. D. Al,Fevà . 23AlO 23AlO Câu 3: Nung hỗn hợp gồm 0,12molAlvà0,04mol một thời gian,thu được hỗn hợp rắn X.Hòa 34FeO tanhoàntoànXtrongdung dịch HCl dư, thu được 0,15molkhí vàmgam muối. Giá trị của mlà: 2H
A. 32,58. B. 33,39. C. 31,97. D. 34,10.
DẠYKÈMQUYNHƠN OFFICIAL Trang25
đồ: . du t 23 AAl l FeFe OAlO Xét
2H
Tacó: . 2AlduH 22
33 Xét . 32AlOH
23 3 Albandau AlOAlbandauAldu AlOH 1
2
Tacó sơ
dư: XNaOH
n0,03mol
nn0,030,02mol
YCO:nn0,1mol
Bảo toànnguyên tố Al: .
nn0,1molnnn0,04mol
Bảo toànnguyên tố O: . 23OAlO n3n0,12mol Xét . tạo muối 224SO ZHSO:n0,11mol
Câu 4: Nung hỗn hợp gồm 7,2gam bột Alvà15,2gam bột trong điều kiện khôngcóoxi,sau phản 23CrO ứng hoàntoàn,thu được chất rắn X. Khối lượng kim loại tự docótrongXlà: A. 1,8gam. B. 12,2gam. C. 22,4gam. D. 10,4gam. Câu 5: Hỗn hợp X gồm Alvà . Đun nóngmgamX(trong điều kiện khôngcóoxi) đến phản ứng xy FeO hoàntoànthu được hỗn hợp Y. Biết Y phản ứng được tối đa với 0,28molNaOHtrongdung dịch, thu được 6,72lít (ở đktc) vàcòn lại 5,04gam chất rắn khôngtan.Công thức của oxit vàgiá trị m 2H xy FeO là: A. FeOvà14,52. B. và13,20. C. và14,52. D. và14,52. 34FeO 23FeO 34FeO Câu 6: Nungnóngmgam hỗn hợp gồm Alvà trong điều kiện khôngcókhôngkhí.Saukhi phản 34FeO ứng kết thúcthu được hỗn hợp rắn X.ChoXtác dụng hoàntoàn với dung dịch NaOH dư thu được dung dịch Y, chất rắn Zvà3,36lítkhí (đktc). Sục khí dư vàodung dịch Ythu được 39gam kết tủa. 2H 2SO Giá trị của mlà:
OFFICIAL
A. 45,6. B. 48,3. C. 36,7. D. 57,0. Câu 7: Nung hỗn hợp 15,2gam gồm vàmgamAl ở nhiệt độ cao.Saukhi phản ứng hoàntoànthu 23CrO được 23,3gam hỗn hợp rắn X.Chotoàn bộ hỗn hợp X phản ứng với HCl dư thoátraVlítkhí ở đktc. 2H Giá trị của Vlà: A. 10,08. B. 4,48. C. 3,36. D. 7,84. Câu 8: Trộn 5,4 gam bột Al với 12,8 gam rồi tiến hành phản ứng nhiệt nhôm trong điều kiện 23FeO khôngcókhôngkhí một thời gianthu được hỗn hợp X.ChoXvàodung dịch NaOH (dư), phản ứng xong thu được 1,68lítkhí (đktc). Giả sử chỉ có phản ứng khử oxitkim loại thànhkim loại. Hiệu suất của 2H phản ứng nhiệt nhômlà:
A. 93,75%. B. 90,25%. C. 82,50%. D. 75,00%. Câu 9: Thực hiện phản ứng nhiệt nhôm hỗn hợp gồm m gam Al và 4,56 gam (trong điều kiện 23CrO khôngcó ),saukhi phản ứng kết thúc,thu được hỗn hợp X.Chotoàn bộ Xvào một lượng dư dung 2O dịch HCl(loãng,nóng),saukhicác phản ứng xảy rahoàntoàn,thu được 2,016lít (đktc). Còn nếu 2H chotoàn bộ Xvào một lượng dư dung dịch NaOH (đặc, nóng),saukhicác phản ứng kết thúcthì số mol NaOH đã phản ứng là: A. 0,14. B. 0,08. C. 0,16. D. 0,06. Câu 10: Nung hỗn hợp bột gồm Alvà (trong điều kiện khôngcóoxi),thu được hỗn hợp chất rắn 23FeO X.ChiaXthànhhai phần bằng nhau.Cho phần một vàodung dịch HCl (dư) thu được 7,84lítkhí 2H (đktc). Cho phần haivàodung dịch NaOH (dư) thu được 3,36lítkhí (đktc). Biết rằng các phản ứng 2H đều xảy rahoàntoàn. Phần trăm khối lượng của FetrongXlà: A. 33,61%. B. 42,32%. C. 66,39%. D. 46,47%. Câu 11: Hỗn hợp X gồm 3,92gamFe,16gam vàmgamAl.NungX ở nhiệt độ caotrong điều 23FeO kiện khôngcókhôngkhí,thu được hỗn hợp chất rắn Y.ChiaYthànhhai phần bằng nhau. Phần một tác dụng với dung dịch loãng (dư), thu được 4amolkhí . Phần hai phản ứng với dung dịch NaOH 24HSO 2H dư, thu được amolkhí . Biết các phản ứng đều xảy rahoàntoàn.Giá trị của mlà: 2H A. 3,51. B. 4,05. C. 5,40. D. 7,02.
DẠYKÈMQUYNHƠN
Trang26
Câu 12: Trộn 21,6gam bột Al với mgam hỗn hợp gồm thu được hỗn hợp Y.NungY ở 2334 Fe,FeO,FeO nhiệt độ caotrong điều kiện khôngcókhôngkhí đến phản ứng xảy rahoàntoàn,thu được chất rắn Z.Cho Ztác dụng với dung dịch NaOH dư thu được 6,72lít (đktc). Mặt khác, nếu choZtác dụng với dung 2H dịch loãng dư thu được 19,04lítNO (sản phẩm khử duy nhất, ở đktc). Giá trị của mlà: 3HNO
A. 58,6. B. 46,0. C. 62,0. D. 50,8. Bài tập nâng cao
Câu 13: Tiến hành phản ứng nhiệt nhôm hỗn hợp X gồm 0,03mol ;0,04molFeOvàamolAl.23CrO Sau một thời gian phản ứng, trộn đều, thu được hỗn hợp chất rắn Y.ChiaYthànhhai phần bằng nhau. Phần một phản ứng vừa đủ với 400mldung dịch NaOH0,1M(loãng). Phần hai phản ứng với dung dịch HClloãng,nóng (dư), thu được 1,12lítkhí (đktc). Giả sử trong phản ứng nhiệt nhôm, chỉ bị 2H 23CrO khử thànhCr. Phần trăm khối lượng đã phản ứng là: 23CrO
A. 20,00%. B. 66,67%. C. 33,33%. D. 50,00%. Câu 14: Đun nóng hỗn hợp gồm Alvà (trong điều kiện khôngcókhôngkhí) đến khi phản ứng 23FeO xảy rahoàntoàn,thu được 28,92gam hỗn hợp rắn X. Nghiền nhỏ, trộn đều rồi chiaXlàmhai phần. Cho phần một vàodung dịch NaOH dư, thu được 1,008lítkhí (đktc) và3,36gam chất rắn. Cho phần haivào 608mldung dịch 2,5M,thu được 3,808lítkhíNO (đktc) vàdung dịch chỉ chứa mgam muối. Giá 3HNO trị của mlà: A. 98,67. B. 101,07. C. 101,55. D. 99,75. Câu 15: Đun nóng hỗn hợp gồm Alvàmgamhaioxit sắt trongkhí trơ, thu được hỗn hợp rắn X.ChoX vào dung dịch NaOH dư, thu được dung dịch Y, chất không tan Z và 0,672 lít khí (đktc). Sục khí 2H dư vàoY,thu được 7,8gam kết tủa. ChoZtan hết vàodung dịch ,thu được dung dịch chứa 2SO 24HSO 15,6gam muối sunfatvà2,464lítkhí (ở đktc, sản phẩm khử duy nhất của ). Biết các phản 2SO 24HSO ứng xảy rahoàntoàn.Giá trị của mlà: A. 6,48. B. 5,04. C. 6,96. D. 6,29. Dạng 6: Bài toán Al tác dụng với dung dịch 3HNO Ví dụ mẫu Ví dụ 1: Hòatanhoàntoàn12,42gamAlvào bằng dd loãng dư thu được dung dịch Xvà1,344lít
OFFICIAL
DẠYKÈMQUYNHƠN
Trang27
khí
gồm và có tỉ khối so với
2N2 NO 2H
trị của mlà:
giải Tacó: . Al hhkhí n0,46mol;n0,06mol Gọi
mol của và lần
2N2 NO ab0,061
3HNO
(đktc)
bằng 18.Cô cạn cẩn thận dung dịch Xthu được mgam
muối khan.Giá
A. 38,34. B. 34,08. C. 106,38. D. 69,81. Hướng dẫn
số
lượt làavàbmol.
Mặt khác: . 2hkhí/ h hH hkhí 28a44bd18M2.1836 3628a44b2,162 0,06
Từ (1)và(2)suyra: .ab0,03 Ta thấy 22 khínhane klchoeAl NNO n3n1,38moln10n8n0,54mol 43NHNO 1,380,54 n 0,105mol 8
Bảo toànnguyên tố Al: . 33 AAl lNO nn0,46mol Muối sau phản ứng gồm và . 3 AlCl0,46mol 43 NHNO0,105mol muoi m0,105800,46213106,38gam Chọn C. Ví dụ 2: Hòatanhoàntoàn3,79gam hỗn hợp X gồm AlvàZn (tỉ lệ số mol2:5)vàodung dịch chứa 0,394mol thu được dung dịch YvàVlítkhí (đktc). Y phản ứng tối đa với 3,88lítdung dịch 3HNO 2N NaOH0,125M.Giá trị của Vlà: A. 0,1120. B. 0,2240. C. 0,3584. D. 0,2688. Hướng dẫn giải . NaOH OH n0,485moln0,485mol Dung dịch Y phản ứng được với NaOH Ycó chứa . 43NHNO Gọi số mol của AlvàZn lần lượt là2avà5amol. Tacó: .2a.275a.653,79a0,01 Số mol của AlvàZntrongX lần lượt là0,02và0,05mol.
DẠYKÈMQUYNHƠN OFFICIAL Trang28
Tacó sơ đồ: 3 2 0,02mol 3 4 22 ymol 00,394mol ,05mol 3 Al:0,02mol Zn:0,05mol Al HNOYNH:xmolNHO Zn Hdu:zmol NO Quátrìnhcho nhận electron: 3 3 22 2 3 42 AlAl3e2NO12H10eN6HO 0,020,06mol12y10yymol ZnZn2eNO10H8eNH3HO 0,050,1mol10x8xxmol Bảo toànelectron: 8x10y0,060,11 Bảo toàn H:10x12yz0,3942 Y phản ứng tối đa với NaOHthìcó phản ứng:
Theo phương trình: .xz0,080,20,4853 Từ (1),(2)và(3)suyra: và . x0,005;y0,012 z0,2 lít. 2H V0,01222,40,2688
Chọn D. Bài tập tự luyện dạng 6 Bài tập cơ bản Câu 1: Cho15,6gam hỗn hợp X gồm Alvà tan hết trongdung dịch loãng dư, thu được 23FeO 3HNO 4,48lítkhíNO (sản phẩm khử duy nhất, đktc). Phần trăm khối lượng của trongXlà: 23FeO A. 65,38%. B. 48,08%. C. 34,62%. D. 51,92%. Câu 2: Cho2,19gam hỗn hợp gồm Cu,Altác dụng hoàntoàn với dung dịch dư, thu được dung 3HNO dịch Yvà0,672lítkhíNO (ở đktc, là sản phẩm khử duy nhất). Khối lượng muối trongYlà: A. 6,39gam. B. 7,77gam. C. 8,27gam. D. 4,05gam. Câu 3: Hòatanhoàntoàn25,3gam hỗn hợp X gồm Mg,Al,Zn bằng dung dịch .Saukhi phản 3HNO ứng kết thúcthu được dung dịch Yvà4,48lít (đktc) khíZ (gồm hai hợp chất khíkhôngmàu)có khối lượng 7,4gam.Cô cạn dung dịch Ythu được 122,3gam hỗn hợp muối. Số mol đã thamgia phản 3HNO ứng là:
A. 0,4mol. B. 1,4mol. C. 1,9mol. D. 1,5mol. Câu 4: Hỗn hợp X gồm Mg(0,10mol)vàZn(0,15mol).ChoXtác dụng với dung dịch loãng 3HNO (dư), sau phản ứng khối lượng dung dịch tăng 13,23gam. Số mol thamgia phản ứng là: 3HNO
A. 0,6200mol. B. 1,2400mol. C. 0,6975mol. D. 0,7750mol. Câu 5: HòatanhoàntoànmgamAl bằng dung dịch loãng,thu được 5,376lít (đktc) hỗn hợp khí 3HNO X gồm vàdung dịch chứa 8mgam muối. Tỉ khối của Xso với bằng 18.Giá trị của mlà: 22 N,NO 2H
A. 17,28. B. 19,44. C. 18,90. D. 21,60. Câu 6: Chomgam hỗn hợp gồm Mg,Fevàodung dịch loãng, dư thu được dung dịch Xvà5,6lít 3HNO khíNO(là sản phẩm khử duy nhất ở đktc). Chodung dịch dư vàodung dịch Xthu được 24gam kết 3NH tủa. Giá trị của mlà: A. 11,25. B. 10,75. C. 10,25. D. 12,25.
DẠYKÈMQUYNHƠN OFFICIAL Trang29
2 4 32 3 22 2 2 22 HOHHO zz mol NHOHNHHO xx mol Al4OHAlOHO 0,020,08 mol Zn4OHZnO2HO 0,050,2 mol
Câu 7: Cho hỗn hợp gồm 0,1molMgvà0,04molAlvào lượng dư dung dịch . Phản ứng kết thúc, 3HNO thu được dung dịch có khối lượng tăng 3,48 gam so với dung dịch ban đầu. Số mol đã 3HNO 3HNO thamgia phản ứng là: A. 0,40mol. B. 0,04mol. C. 0,50mol. D. 0,60mol. Câu 8: Hòatanhoàntoàn12,84gam hỗn hợp gồm Fe,AlvàMgcó số mol bằng nhautrongdung dịch loãng (dư), thu được dung dịch X chứa 75,36gam muối và hỗn hợp khíY gồm và 3HNO 22 N,NO,NO .TrongY, số mol bằng số mol . Biết tỉ khối của Yso với bằng 18,5. Số mol đã 2NO 2N 2NO 2H 3HNO thamgia phản ứng là:
A. 1,275mol. B. 1,080mol. C. 1,140mol. D. 1,215mol.
Bài tập nâng cao Câu 9: Cho7,65gam hỗn hợp X gồm Alvà (trong đó Al chiếm 60% khối lượng) tanhoàntoàn 23AlO trongdung dịch Y gồm và ,thu được dung dịch Z chỉ chứa ba muối trunghòavàmgam 24HSO 3NaNO hỗn hợp khíT(trongTcó0,015mol ).Chodung dịch dư vàoZ đến khicác phản ứng xảy ra 2H 2BaCl hoàntoàn,thu được 93,2gam kết tủa. Còn nếu choZ phản ứng với NaOHthì lượng NaOH phản ứng tối đa là0,935mol.Giá trị của m gần nhất với giá trị nàosau đây? A. 2,5. B. 3,0. C. 1,5. D. 1,0. Câu 10: Hòatanhoàntoàn hỗn hợp rắn X gồm vàFevàodung dịch chứa 0,5molHClvà 32Al,FeNO 0,03mol ,thu được dung dịch Y chỉ chứa 25,13gamcác muối và0,05mol hỗn hợp khíTcó tỉ 3NaNO khối so với bằng 10,6(trongTcó chứa 0,02mol ).ChoY phản ứng tối đa 0,58molNaOHtrong 2H 2H dung dịch. Mặt khác, nếu chodung dịch dư vàoY,thu được 78,23gam kết tủa Z. Biết các phản 3AgNO ứng xảy rahoàntoàn. Phần trăm khối lượng của FetrongXlà: A. 17,09%. B. 31,78%. C. 25,43%. D. 28,60%.
OFFICIAL
DẠYKÈMQUYNHƠN
Trang30
Dạng 7: Bài toán cho muối aluminat tác dụng với dung dịch axit Bài toán 1: Xác định sản phẩm Phương pháp giải Cho 2 3 bbie ie ? tt HAlOAlOH Phương trìnhhóa học nối tiếp: Khi cho muối aluminat tác dụng với dung dịch axit xảy ra phản ứng: 2 2 3 AlOHHOAlOH1 Nếu dư thì xảy ra tiếp: H 3 2 3 AlOH3HAl3HO2 Phương trìnhhóa học songsong: 2 2 3 3 2 2 AlOHHOAlOH1 AlO4HAl2HO2 Cách1: Tínhtheo phương trìnhhóa học nối tiếp.
Chú ý 1: Nếu trongdung dịch có thì sẽ phản ứng với trước, sau đó mới phản ứng với OHH OH . 2AlO
Cách2: Xét phương trìnhhóa học songsong: Nếu thì chỉ xảy ra(1),khi đó: 2HAlO nn 3 AlOHHnn Nếu thì xảy ra cả (1)và(2),khi đó: 2HAlO nn
Ta được: Cách3: Dùng bảo toànnguyên tố. Ví dụ: Cho200mldung dịch HCl2Mvào100mldung dịch gồm NaOH0,6Mvà 1M, phản ứng 2NaAlO xongthu được mgam kết tủa. Giá trị của mlà: A. 7,80. B. 3,90. C. 3,12. D. 1,56. Hướng dẫn giải
DẠYKÈMQUYNHƠN OFFICIAL Trang31
3 3 3 3 2 HAlOHAl AAlOH lO Al nn4n nnn
2 2 HCl H NaOH OH NaAlO AlO
2 2 2 3 3 2 3 OHHHO 0,060,06 mol AlOHHOAlOH1 0,10,10,1mol AlOH3HAl3HO2 0,080,24 mol Tacó: . 3 3 AlOHdu AlOHdu n0,10,080,02molm0,02.781,56gam Cách2: Trước hết xảy ra phản ứng: 2 OHHHO 0,060,06mol Số mol phản ứng với : H 2AlO H n0,40,060,34mol Ta thấy nêntacó 2HAlO nn 2 3 3 AlOH AlOH AlOH 4nn4.0,10,34 n 0,02mol 33 m0,02781,56gam Cách3: Tacó sơ đồ: 2 3 AlOH AlOH 4nn n 3
n0,4moln0,4mol n0,06moln0,06mol n0,1moln0,1mol
Cách1: Phương trìnhhóa học:
Bảo toànnguyên tố Na: . 2 NaClNaAlONaOH nnn0,10,060,16mol Bảo toànnguyên tố Cl: . 3 3AlClNaClHClAlCl 0,40,163nnnn 0,08mol 3
toànnguyên
5,85. D. 4,68. Hướng dẫn giải
Chọn A. Ví dụ 2: Cho100mldung dịch HCl1,6Mvào100mldung dịch 1M, phản úngxongthu được 2NaAlO mgam kết tủa. Giá trị
DẠYKÈMQUYNHƠN OFFICIAL Trang32
2
NaAlO
3
của mlà: A. 3,90. B. 7,80. C. 5,85. D. 6,24. Hướng dẫn giải 2 2 HCl H NaAlO AlO n0,16moln0,16mol n0,1moln0,1mol Ta thấy nênkhi đó 2HAlO nn 3 2AlOHHAlO n4n3n 2 3 AlOH AlOH 4nn4.0,10,16 n 0,08mol 33 m0,08786,24gam Chọn D. Bài toán 2: Xác định chất tham gia Phương pháp giải
0,1mol 3 0,4mol 3 ? 0,06mol
NaCl HClAlOH AlClNaOH
Bảo
tố Al: 3 2 3 3 AlClANaAlO lOH AlOH nnnn0,10,080,02mol 3AlOH m0,02781,56gam
Chọn D. Ví dụ mẫu Ví dụ 1: Cho100mldung dịch HCl0,5Mvào100mldung dịch 1M, phản úngxongthu được 2NaAlO mgam kết tủa. Giá trị của mlà: A. 3,90. B. 7,80. C.
2 2 HCl H NaAlO AlO n0,05moln0,05mol n0,1moln0,1mol
Ta thấy nênkhi đó 2HAlO nn 3 AlOHH nn0,05mol
AlOH mm0,05783,9gam
Xéthai trường hợp: TH1: Kết tủa chưa bị hòa tan, dư, hết. Chỉ xảy ra phản ứng (1), khi đó ta có: 2 AlOH
TH2: Kết tủa bị hòa tan một phần, và đều hết. Xảy ra cả phản ứng (1) và (2), khi đó: 2 AlOH
DẠYKÈMQUYNHƠN OFFICIAL Trang33 Cho + 2 3 ? b bi i et et H+AlOAlOH Phương trìnhhóa học: 2 2 3 3 2 2 AlOHHOAlOH1 AlO4HAl2HO2 Kết tủa bị hòa tan một phần, và đều hết. Xảy ra cả phản ứng (1) và (2), khi đó: 2 AlOH 3 3 3 3 2 AlOH HOH Al AlO ne H ucó AlO Al nnn4n nnn Ta được: 3 2 HneuAlOH OH Al ó O c nn3n n 4 Chú ý 1: Nếu trong dung dịch có thì sẽ phản ứng với trước, sau đó mới phản ứng với OHH OH . 2AlO Chú ý 2: Ngoàira,tacó thể sử dụng các định luật bàotoàn. Cho + 2 3 ?bietbiet H+AlOAlOH Phương trìnhhóa học: 2
3HAlOH min Oneucó H nnn
3 2 neucAlOHHmaxAlO Oó H n4n3nn Chú ý 1: Nếu trong dung dịch có thì sẽ phản ứng với trước, sau
mới phản
với OHH OH 2AlO Chú ý 2: Ngoàira,tacó thể sử dụng các định luật bàotoàn. Ví dụ: Cho100mldung dịch HCl1,1Mvào100mldung dịch xmol/l, phản ứng xongthu được 2NaAlO 3,9gam kết tủa. Giá trị của xlà: A. 0,50. B. 0,55. C. 0,65. D. 0,60. Hướng dẫn giải 3 HCl H AlOH n0,11moln0,11mol n0,05mol
2 3 3 2 2 AlOHHOAlOH1 AlO4HAl2HO2
đó
ứng
DẠYKÈMQUYNHƠN OFFICIAL Trang34 Kết tủa
hòa tan
đều
ra
đó: 2
3 2 2 HAlOH MNaAlO AlO n3n0,1130,05
n
2 2 2 3 BaOH OH NaAlO AlO AlOH n0,02moln0,04mol
Lượng HCl lớn nhất
3 2AlOH Hmax neu l có AO OH
Ví
của xlà: A. 0,1. B. 0,2. C. 0,3. D. 0,4. Hướng dẫn giải 3 HCl H NaOH OH AlOH n0,1moln0,1mol n0,05moln0,05mol n0,01mol Phương trìnhhóa học: 2 2 2 3 3 2 2 OHHHO AlOHHOAlOH AlO4HAl2HO Tacó hệ phương trình: 3 3 3 3 2 AlOHHOH Al AAlOH lO Al nnn4n nnn Ta được: 3 2 nAlOHHeuc OH Al ó O nn3n0,10,0530,01 0,02 n 0,02molx0,2 4 4 0,1 Chọn B. Ví dụ 2: Cho100mldung dịch HClxMvào100mldung dịch hỗn hợp gồm NaOH0,5Mvà 2NaAlO 0,2M. Phản ứng xongthu được 0,78gam kết tủa. Giá trị nhỏ nhất của xlà:
bị
một phần, và
hết. Xảy
cả phản ứng (1) và (2), khi
AlOH
0,065
0,065molCx0,65M 44 0,1
Chọn C. Ví dụ: ChoVlítdung dịch HCl2Mvào200mldung dịch X gồm 0,1Mvà 0,1M,thu 2 BaOH 2NaAlO được 0,78gam kết tủa. Giá trị lớn nhất của Vlà:lít A. 0,045. B. 0,055. C. 0,035. D. 0,050. Hướng dẫn giải
n0,02moln0,02mol n0,01mol
khi kết tủa đã bị hòa tan một phần, khi đó:
0,09n4n3nn40,0230,010,040,09mol líV0,045 2 t
Chọn A.
dụ mẫu Ví dụ 1: Cho100mldung dịch HCl1Mvào100mldung dịch hỗn hợp gồm NaOH0,5Mvà x 2NaAlO mol/l. Phản ứng xongthu được 0,78gam kết tủa. Giá trị
A. 0,6. B. 0,5. C. 1,2. D. 1,0. Hướng dẫn giải
Lượng HCl nhỏ nhất khi kết tủa chưa bị hòatan,khi đó:
Chọn A. Ví dụ 3: Hòatanhoàntoànmgam hỗn hợp (tỉ lệ mol tương ứng là4:3)vào nước, thu 223 NaO,AlO được dung dịch X.Cho từ từ dung dịch HCl1MvàoX, kết quả thí nghiệm được ghi ở bảng sau: Thể tíchdung dịch HCl(ml) 300 600 Khối lượng kết tủa (gam) a a2,6 Giá trị của avàm lần lượt là: A. 23,4và35,9. B. 15,6và27,7. C. 15,6và55,4. D. 23,4và56,3. Hướng dẫn giải Gọi số mol của lần lượt là4xvà3xmol. 223 NaO,AlO
Bảo toànnguyên tố Al: 10,68x y 6x2 303 Từ (1)và(2)suyra: x0,05;y0,2
Vìkhi thể tíchHCl tăng từ 300mllên600mlmà kết tủa vẫn tăng, chứng tỏ tại 300mlcòn dư 2NaAlO Gọi số mol kết tủa tương ứng với agamlàymol.
Tacó sơ đồ:
NaO:4xmolNaAlO:6xmol AlO:3xmolNaOH:2xmol A0,68xlCl:mol XHClAlOH 3 NaCl:8xmol
NaAlO:6xymol
DẠYKÈMQUYNHƠN OFFICIAL Trang35
2 2 3 NaOH OH NaAlO AlO AlOH n0,05moln0,05mol n0,02moln0,02mol n0,01mol
3HAlOH min OH 0,06 nnn0,010,050,06molx0,6 0,1
ymol
XHClAlOH
Tacó: 2 2 2 HO 23 du Bảo toànnguyên tố Cl: . NaClHCl nn0,3mol Bảo toànNa: NaX n6xy0,36xy0,38x1 Khi tăng HCl từ 300mllên600ml nếu kết tủa chưa bị tanthì: tăng m0,37823,4gam2,6gam Chứng tỏ tại 600ml kết tủa bị tan một phần. Tacó sơ đồ: 3 3 0,6 1 ymol 30
2du 3 0,3mol
NaCl:0,3mol
m0,054620,05310227,7gam a0,27815,6gam
Chọn B.
Bài tập tự luyện dạng 7 Bài tập cơ bản
Câu 1: Hòatanhoàntoànmgam hỗn hợp gồm và vào nước thu được dung dịch Xtrong 2 NaO23AlO suốt. Thêm từ từ dung dịch HCl1MvàoX,khi hết 100mlthì bắt đầu xuất hiện kết tủa; khi hết 300ml hoặc 700mlthì đều thu được agam kết tủa. Giá trị của avàm lần lượt là: A. 15,6và27,7. B. 23,4và35,9. C. 23,4và56,3. D. 15,6và55,4. Câu 2: Dẫn Vlítkhí (đktc) vàodung dịch dư, thu được kết tủa X.NungX đến khối lượng 2CO 2NaAlO không đổi thu được 10,2gam chất rắn Y.Giá trị của Vlà: A. 2,24. B. 4,48. C. 3,36. D. 6,72. Câu 3: Hòatanhoàntoànmgam hỗn hợp Na,Al (tỉ lệ mol tương ứng là5:4),thu được dung dịch X. Cho từ từ dung dịch HCl1MvàoX, kết quả thí nghiệm được ghi ở bảng sau: Thể tíchdung dịch HCl(ml) 210 430 Khối lượng kết tủa (gam) a a1,56 Giá trị của mlà: A. 6,69. B. 11,15. C. 9,80. D. 6,15. Câu 4: Cho8,63gam hỗn hợp X gồm Na,K,Bavà (trong đó oxi chiếm 19,47% về khối lượng) 23AlO tan hết vào nước thu được dung dịch Yvà1,344litkhí (đktc). Cho0,32lítdung dịch HCl0,75Mvào 2H dung dịch Y,thu được mgam kết tủa. Giá trị của mlà: A. 5,46. B. 1,04. C. 2,34. D. 2,73. Câu 5: Chomgam hỗn hợp gồm (trong đó oxi chiếm 9,638% khối lượng) 22 Na,NaO,K,KO,Ba,BaO tác dụng với một lượng dư ,thu được 0,0672lítkhí (đktc) và20mldung dịch X.ChoXtác 2 HO 2H dụng với 20mldung dịch chứa hỗn hợp gồm 0,2MvàHCl0,1M,thu được 40mldung dịch có 24HSO .Giá trị của m gần nhất với: pH13 A. 0,66. B. 0,68. C. 0,72. D. 0,54. Bài tập nâng cao Câu 6: Cho0,926gam hỗn hợp gồm (trong đó oxi chiếm 3,456%)tác dụng 22 Na,NaO,K,KO,Ba,BaO với một lượng dư ,thu được 0,112lítkhí (đktc) và200mldung dịch X. Hấp thụ 0,224lít 2 HO 2H 2CO (đktc) vào200mlX,thu được 0,394gam kết tủa. Nếu cho0,002mol vào200mldung dịch X 243AlSO thìthu được mgam kết tủa. Giá trị của mlà: A. 1,088. B. 0,622. C. 0,466. D. 0,778. Câu 7: Hỗn hợp X gồm Al,Ba,NavàK.HòatanhoàntoànmgamXvào nước dư, thu được dung dịch Yvà0,0405molkhí .Cho từ từ đến hết dung dịch chứa 0,018mol và0,03molHClvàoY, 2H 24HSO thu được 1,089 gam hỗn hợp kết tủa và dung dịch Z chỉ chứa 3,335 gam hỗn hợp các muối clorua và muối sunfattrunghòa. Phần trăm khối lượng của kim loại BatrongXlà:
DẠYKÈMQUYNHƠN
Trang36
OFFICIAL
A. 42,33%. B. 37,78%. C. 29,87%. D. 33,12%.
Câu 8: Hòatanmgam hỗn hợp X gồm Ba,BaO,Alvà vào nước dư, thu được 0,008molkhí 23AlO 2H vàdung dịch Y.ChiaYlàmhai phần bằng nhau. Nhỏ từ từ dung dịch HCl0,1Mvào phần một đến khi bắt đầu xuất hiện kết tủa thì hết 20ml. Sục từ từ 0,0054molkhí vào phần hai,thu được 0,4302gam 2CO kết tủa vàdung dịch Z chỉ chứa một chất tan.Giá trị của mlà: A. 0,599. B. 1,198. C. 0,536. D. 1,070.
Câu 9: Hòatanhoàntoànmgam hỗn hợp X gồm Al,NavàBaOvào nước dư, thu được dung dịch Yvà 0,085molkhí .Cho từ từ đến hết dung dịch chứa 0,03mol và0,1molHClvàoY,thu được 2H 24HSO 3,11 gam hỗn hợp kết tủa và dung dịch Z chỉ chứa 7,43 gam hỗn hợp các muối clorua và muối sunfat trunghòa.Giá trị của mlà: A. 2,79. B. 3,76. C. 6,50. D. 3,60. Câu 10: Hỗn hợp X gồm Al,K, vàBaO(trong đó oxi chiếm 10% khối lượng của X).Hòatanhoàn 2 KO toànmgamXvào nước dư, thu được dung dịch Yvà0,0056molkhí .Cho từ từ đến hết dung dịch 2H chứa 0,004mol và0,002molHClvàoY,thu được 0,498gam hỗn hợp kết tủa vàdung dịch Z chỉ 24HSO chứa 0,6182gam hỗn hợp các muối cloruavà muối sunfattrunghòa.Giá trị của mlà: A. 0,9592. B. 0,5760. C. 0,5004. D. 0,9596. Dạng 8: Bài toán đồ thị Bài toán 1: Đồ thị muối nhôm tác dụng với dung dịch kiềm Phương pháp giải * Nếu cho từ từ dung dịch NaOH đến dư vào dung dịch chứa a mol . Đồ thị: 3Al


OFFICIAL
DẠYKÈMQUYNHƠN
Trang37
Phản ứng xảy ratheo thứ tự: 3 3 22 3 Al3OHAlOH AlOHOHAlO2HO *
từ dung dịch
Nếu cho từ
NaOH đến dư vào dung dịch chứa a mol và b mol . Đồ thị: 3+Al +H

DẠYKÈMQUYNHƠN OFFICIAL Trang38
2 3 3 22 3 HOHHO Al3OHAlOH AlOHOHAlO2HO
biểu diễn ở 33AlNO đồ thị dưới
Giá trị của a,b tương ứng là:
dẫn giải Tại đỉnh kết tủa đạt cực đại: 3Al OH nn0,3mol an3n0,9mol Tại điểm cuối của đồ thị: . 3OHAl bn4n4.0,31,2mol Chọn C. * Nếu trong dung dịch muối chứa nhiều chất phản ứng vào tạo kết tủa thì ta phải dựa vào phương trình phân tử. Khicho từ từ dung dịch đến dư vàodung dịch hỗn hợp gồm thì 2 BaOH 243243 HSO,AlCl,AlSO phản ứng lần lượt xảy ra như sau:
Phản ứng xảy ratheo thứ tự:
Chú ý: Tínhtheo phương trìnhhóa học (chúý thứ tự phản ứng) hoặc sử dụng công thức tínhnhanh như sau: Đoạn 1: Kết tủa chưa đạt cực đại: ne H có O Hu n3nn Tại đỉnh kết tủa đạt cực đại: 3 Amax l Omaxneuc H Hó nn n3nn
Đoạn 2: Kết tủa đã bị hòatan một phần: 3OHA neucó l H n4nnn
Tại điểm cuối của đồ thị: Kết tủa tanhoàntoàn: 3 OHAlneucó H n4nn Ví dụ: Cho từ từ dung dịch NaOH đến dư vàodung dịch Kết quả thí nghiệm được
đây.
A. 0,3và0,6. B. 0,6và0,9. C. 0,9và1,2. D. 0,5và0,9. Hướng


DẠYKÈMQUYNHƠN OFFICIAL Trang39 24 42 2 24 4 3 2 3 3 2 2 3 22 3 2 2 HSOBaOHBaSO2HO1 AlSO3BaOH3BaSO2AlOH2
17,1gam kết tủa thì tại
243AlSO 24 4 3 2 3 AlSO3BaOH3BaSO2AlOH x 3x2xmol 233.3x78.2x17,1x0,02mol Tại thì phản ứng hết theo phương trình: 2BaOH OH n0,16moln0,32mol 3Al 3 22 Al4OHAlO2HO 0,080,32 mol Bảo toànnguyên tố Al: . 3 3 243 AlClAAlSO l nn2n0,080,0220,04mol
AlCl3BaOH2AlOH3BaCl3 2AlOHBaOHBaAlO4HO4
Khi đó đồ thị có dạng như sau: Ví dụ: Cho từ từ đến dư dung dịch vàodung dịch chứa mgam hỗn hợp và . 2 BaOH 243AlSO 3AlCl Sự phụ thuộc của khối lượng kết tủa vào số mol được biểu diễn bằng đồ thị sau: 2 BaOH Giá trị của mlà: A. 10,68. B. 6,84. C. 12,18. D. 9,18. Hướng dẫn giải Gọi số mol làx. 243AlSO Nhìnvào đồ thị tacó: Khithu được
đó phản ứng vừa hết theo phương trình:
Chọn C.
Ví dụ mẫu
Ví dụ 1: Cho từ từ dung dịch NaOH đến dư vàodung dịch chứa amol . Khối lượng kết tủa thu được phụ thuộc vào số mol 3AlCl NaOH được biểu diễn bằng đồ thị trên.Giá trị của alà: A. 0,15. B. 0,10. C. 0,12. D. 0,20.
Hướng dẫn giải Tại thời điểm
Khi đó, kết tủa đã hòatan một phần, tacó:

Chọn A. Ví dụ 2: Cho từ từ dung dịch NaOH đến dư vàodung dịch chứa a mol HCl và b mol . Khối lượng kết tủa thu 3AlCl được phụ thuộc vào số molNaOH được biểu diễn bằng đồ thị bên.Giá trị của avàb lần lượt là: A. 0,15và0,20. B. 0,10và0,30. C. 0,10và0,20. D. 0,15và0,30. Hướng dẫn giải Nhìnvào đồ thị bêntacó: HHCl ann0,1mol Tại điểm cuối của đồ thị, kết tủa tanhoàntoàn,tacó: 3 3 3 OHAlH Al Al n4nn1,34n0,1n0,3mol
B.


Ví dụ 3: Hòatanagam hỗn hợp gồm Alvà 23AlO vàodung dịch loãng, dư, thu được dung dịch
HSO X và 1,008 lít khí (đktc). Cho từ từ dung dịch 2H NaOH1Mvàodung dịch X. Số mol kết tủa thu được phụ thuộc vào thể tích dung dịch NaOH được biểu diễn bằng đồ thị bên.Giá trị của alà: A. 2,34. B. 7,95. C. 3,87. D. 2,43. Hướng dẫn giải
DẠYKÈMQUYNHƠN OFFICIAL Trang40
.m0,02.3420,04.133,512,18gam
3 3 3
Al Al
. 3
3 NaOH OH AlOH n0,5moln0,5mol nn0,1mol
.
OHAl
n4nn0,54.n0,1n0,15mol
3 AlClAl ann0,15mol
Chọn
24


DẠYKÈMQUYNHƠN OFFICIAL Trang41 Hòa tan hỗn hợp gồm Al và vào dung dịch loãng, dư thu được dung dịch X gồm 23AlO 24HSO và dư. 243AlSO24HSO Dung dịch X chứa và phản ứng với 3AlH OH Nhìnvào đồ thị: H n0,24mol Tại thời điểm , khi đó kết tủa chưa đạt cực đại: ONaOH H NaOH Vlítnn 0, 0,36mol 36 OH H 0,360,24n3nnn 0,04mol 3 Tại thời điểm
NaOH
. 3 3 OHAl HAl
Bảo
. 2AlH 2 nn0,03mol 3 Bàotoànnguyên tố Al: 3 3 23 23 AAl l AAlAlOAlO l nn0,090,03nn2nn 0,03mol 22 Chọn C. Bài toán 2: Đồ thị muối aluminat tác dụng với dung dịch axit Phương pháp giải *Cho từ từ dung dịch đến dư vàodung dịch chứa amol . Đồ thị: H 2AlO Phản ứng xảy ratheo thứ tự: 2 2 3 3 2 3 AlOHHOAlOH AlOH3HAl3HO *Cho từ từ dung dịch đến dư vàodung dịch chứa amol vàbmol . Đồ thị: H 2 AlOOH
, khi đó kết tủa đã hòa tan một phần: ONaOH H
Vlítnn 0, 0,56mol 56
0,560,240,04n4nnnn 0,09mol 4
toànelectron:
Tại điểm cuối của đồ thị: Kết tủa tanhoàntoàn: 2 neu HAlOOcó H n4nn Ví dụ: Cho từ từ dung dịch HCl đến dư vào dung dịch chứa amolNaOHvàbmol . Khối lượng kết tủa 2NaAlO thu được phụ thuộc vào số mol NaOH được biểu diễn bằng đồ thị sau:Giá trị của avàb lần lượt là: A. 0,10và0,15. B. 0,20và0,15. C. 0,10và0,35. D. 0,20và0,35. Hướng dẫn giải Nhìnvào đồ thị, tacó: NaOHOH ann0,2mol Tại điểm cuối của đồ thị: 2 2HAlOOHAlO 0,80,2n4nnn 0,15mol 4 Chọn B. Ví dụ mẫu Ví dụ 1: Cho từ từ dung dịch HCl đến dư vàodung dịch chứa a mol . Khối lượng kết tủa thu được phụ thuộc vào số 2NaAlO molNaOH được biểu diễn bằng đồ thị bên.Giá trị của mlà: A. 10,92. B. 7,80. C. 12,48. D. 11,70. Hướng dẫn


DẠYKÈMQUYNHƠN OFFICIAL Trang42 Phản ứng xảy ratheo thứ tự: 2 2 2 3 3 2 3 HOHHO AlOHHOAlOH AlOH3HAl3HO Chú
Đoạn 1:
H OHneucó nnn Tại
2 Amax lO mneucó
giải Tại thời điểm , kết tủa chưa đạt cực đại: HHCl nn0,05mol H nn0,05mol Tại thời điểm , kết tủa bị hòatan một phần: HHCl nn0,45mol n0,05mol Tacó: 2 2 HAlO AlO 0,4530,05n4nnn 0,15mol 4 Lại có: 2maxAlO nn0,15mol
ý: Tínhtheo phương trìnhhóa học (chúý thứ tự phản ứng) hoặc sử dụng công thức tínhnhanh như sau:
Kết tủa chưa đạt cực đại:
đỉnh kết tủa đạt cực đại:
HaxOH nn nnn
Đoạn 2: Kết tủa đã bị hòatan một phần: 2HAlO OHneucó n4n3nn
Chọn D. Ví dụ 2: Hòatanhoàntoànagam hỗn hợp X gồm và vào nước thu được dung dịch Y. 23AlO2 NaO
Cho từ từ dung dịch HCl1MvàoY. Khối lượng kết tủa thu được phụ thuộc vào thể tíchdung dịch HCl được biểu diễn bằng đồ thị bên.Giá trị của alà: A. 14,40. B. 19,95. C. 29,25. D. 24,60. Hướng dẫn giải Nhìnvào đồ thị ta thấy dung dịch Y gồm và . OH 2AlO Tại thời điểm ,khi đó: HCl HCl Vn0,15mol 150ml
Tại thời điểm , kết tủa chưa đạt cực đại: HCl HCl Vn0,35mol 350ml
nnnn0,350,150,2mol
Tại thời điểm , kết tủa đã hòa tan một phần: HCl HCl Vn0,75mol 750ml
Trongdung dịch Ycó (0,3mol)vàNaOH dư (0,15mol). 2NaAlO Bảo toànnguyên tố Na: . 2 NaO 0,30,15 n 0,225mol 2



Bảo toànnguyên tố Al: . 23AlO 0,3 n0,15mol 2 .a0,225.620,15.10229,25gam
Chọn C. Bài tập tự luyện dạng 8 Bài tập cơ bản Câu 1: Khi nhỏ từ từ đến dư dung dịch NaOHvàodung dịch hỗn hợp gồm amolHClvàbmol , kết quả thí nghiệm 3AlCl được biểu diễn trên đồ thị bên. Tỉ lệ a:blà: A. 4:3. B. 2:1. C. 1:1. D. 2:3. Câu 2: Khi nhỏ từ từ dung dịch NaOH đến dư vàodung dịch , kết quả thí nghiệm được biểu diễn theo đồ thị 3AlCl sau (số molcác chất tínhtheo đơn vị mol).Giá trị của x là:
DẠYKÈMQUYNHƠN
Trang43
OFFICIAL
.m0,15.7811,7gam
H OH
OHH nn0,15mol
.
2 2 HAlO OHAlO 0,750,1530,2n4n3nnn 0,3mol 4
A. 0,82. B. 0,80. C. 0,78. D. 0,84. Câu 3: Khi nhỏ từ từ dung dịch HClvàodung dịch hỗn hợp gồm amol vàbmol 2 BaOH 22BaAlO , kết quả thí nghiệm được biểu diễn trên đồ thị bên. Tỉ lệ a:blà: A. 1:2. B. 2:1. C. 2:3. D. 1:3.
Câu 4: Nhỏ từ từ dung dịch 0,2M vào ống 2 BaOH nghiệm chứa . Khối lượng kết tủa thu được 243AlSO phụ thuộc vào thể tích được biểu diễn bằng 2 BaOH đồ thị bên.Giá trị của V gần nhất với: A. 1,7. B. 2,1. C. 2,4. D. 2,5.
Câu 5: Nhỏ từ từ dung dịch vàodung dịch hỗn 2 BaOH hợp và . Khối lượng kết tủa thu được 243AlSO 3AlCl phụ thuộc vào số mol được biểu diễn bằng đồ 2 BaOH thị bên. Tổng giá trị bằng: xy
A. 163,2. B. 162,3. C. 132,6. D. 136,2.
Câu 6: Khi nhỏ từ từ đến dư dung dịch NaOH vào dung dịch X chứa xmol vàymol , số mol kết 24HSO 243AlSO tủa thu được phụ thuộc vào số mol NaOH được biểu diễn bằng đồ thị sau. Mặt khác, nếu chodung dịch chứa 0,7mol vàoX, phản ứng hoàntoànthu được mgam kết 2 BaOH tủa. Giá trị của m gần nhất với:
A. 170,0. B. 145,0. C. 167,0. D. 151,5. Câu 7: Chomgam hỗn hợp gồm NavàAlvào một lượng nước dư, thu được dung dịch X. Nhỏ từ từ đến dư dung dịch HClvàoX, kết quả thí nghiệm được biểu diễn đồ thị bên.Giá trị của mlà:




A. 10,4. B. 9,6. C. 19,6. D. 17,3.

DẠYKÈMQUYNHƠN
Trang44
OFFICIAL
Câu 8: Hòatanmgam hỗn hợp gồm và vào 2 NaO23AlO
nước thu được dung dịch X.Cho từ từ dung dịch HCl1M vào dung dịch X. Lượng kết tủa phụ thuộc vào thể tích dung dịch HCl được biểu diễn đồ thị bên.Giá trị của mlà:
A. 32,8. B. 22,6. C. 16,4. D. 26,7.
Câu 9: Hòatan hỗn hợp gồm Alvà trong 23AlO
200mldung dịch HCl nồng độ x(mol/l)thu được dung dịch Xvàkhí (ở đktc). Cho từ từ dung 2H dịch NaOH1Mvàodung dịch X. Khối lượng kết tủa phụ thuộc vào thể tíchdung dịch NaOH được biểu diễn bằng đồ thị bên.Giá trị của xlà:
A. 2,0. B. 4,0. C. 1,5. D. 3,0. Câu 10: Hòa tan hỗn hợp gồm Na và vào 23AlO nước thu được dung dịch X và V lít khí (ở 2H đktc). Cho từ từ dung dịch HCl 1M vào dung dịch X. Lượng kết tủa phụ thuộc vào thể tíchdung dịch HCl được biểu diễn bằng đồ thị bên.Giá trị của V là:
A. 4,48. B. 8,96. C. 5,04. D. 3,92. Câu 11: Cho m gam hỗn hợp X gồm Ba, BaO, Al vào nước dư phản ứng kết thúc thu được 1,792lítkhí (đktc), dung dịch Y.Cho từ từ dung dịch HCl1MvàoY. Khối lượng kết tủa thu được phụ thuộc vào thể tíchdung dịch HCl được biểu diễn bằng đồ thị bên.Giá trị của mlà:

A. 5,35. B. 5,19. C. 5,67. D. 5,53. Câu 12: Nhỏ từ từ dung dịch đến 2 BaOH dư vào dung dịch hỗn hợp và 24NaSO . Khối lượng kết tủa thu được phụ 243AlSO thuộc vào thể tích số mol được 2 BaOH biểu diễn bằng đồ thị bên.Giá trị của xlà:


A. 0,40. B. 0,20. C. 0,25. D. 0,30.

DẠYKÈMQUYNHƠN
Trang45
OFFICIAL
Câu 13: Cho từ từ đến dư dung dịch NaOH0,1M vào300mldung dịch hỗn hợp gồm amol/l 24HSO và b mol/l. Đồ thị hình bên mô tả sự 243AlSO phụ thuộc của số mol kết tủa vào số mol 3 AlOH NaOH đã dùng. Tỉ số gần nhất với giá trị nào a b sau đây?
A. 1,7. B. 2,3. C. 2,7. D. 3,3. Câu 14: Khi nhỏ từ từ đến dư dung dịch NaOHvào dung dịch hỗn hợp gồm xmol vàymol 243AlSO , kết quả thí nghiệm được biểu diễn trên đồ 24HSO thị bên. Tỉ lệ x:ylà: A. 1:2. B. 1:1. C. 2:3. D. 2:1. Bài tập nâng cao Câu 15: HòatanhoàntoànagamAltrongdung dịch ,thu được dung dịch X. Nhỏ rất từ từ 2 BaOH dung dịch 0,5Mvàodung dịch Xvà lắc nhẹ để các phản ứng xảy rahoàntoàn. Đồ thị biểu diễn 24HSO sự phụ thuộc tổng khối lượng kết tủa (mgam)theo thể tíchdung dịch (Vml) như sau: 24HSO Giá trị của alà: A. 8,10. B. 4,05. C. 5,40. D. 6,75.



DẠYKÈMQUYNHƠN
Trang46
OFFICIAL
Dạng 1: Lí thuyết trọng tâm 1 – B 2 – C 3 – A 4 – C 5 – D 6 – D 7 – B 8 – D 9 – C 10 – D 11 – A 12 – C 13 – B 14 – B 15 – A 16 – A 17 – C 18 – C 19 – C 20 – D Câu 1: Đáp án B Phènchuacócông thức là hay . 24242 3 KSO.AlSO.24HO42 2 KAlSO.12HO
Câu 4: Đáp án C Nhỏ từ từ dung dịch NaOH đến dư vàodung dịch X.Lúc đầu có kết tủa keobônglà ,sau đó kết 3 AlOH tủa tan dần hết Chất Xlà . 3AlCl
Câu 10: Đáp án D Ở nhiệt độ caoAl khử được cácoxit của kim loại đứng sauAltrongdãy hoạt động hóa học. Cácoxit bị Al khử ở nhiệt độ caolà: . 23FeO,CuO,CrO Câu 12: Đáp án C Phương trìnhhóa học:
Câu 13: Đáp án B
(a) Đúng vìthu được kết tủa .3CaCO (b)Saivìkhôngthu được kết tủa. (c),(d) đúng vìthu được kết tủa 3 AlOH
Câu 14: Đáp án B Cả 5 chất đều phản ứng được với NaOH.
Câu 15: Đáp án A
Cácphát biểu đúng là:(a),(d). (b)saivì ở nhiệt độ thường, Bekhôngtantrong nước. (c)saivì quặng boxitcóthành phần chínhlà .23AlO (e)saivì thạch cao sống cócông thức là . 42 CaSO.2HO (g)saivì đun nóng chỉ có thể làm mềm nước cứng cótính cứng tạm thời.
Câu 16: Đáp án A
DẠYKÈMQUYNHƠN OFFICIAL Trang47 ĐÁP ÁN
13
BÀI
3 AlCl3NaOHAlOH3NaCl
24
t
đ
pnc
3 3 22
AlOHNaOHNaAlO2HO
24
3 3
2
32 3
23 2 AlSO6NaOH2AlOH3NaSO X 2AlOHAlO3HO Y 2AlO4Al3O
Cácphát biểu đúng là:(b),(g).
(a)saivìcáckim loại kiềm mới tan được trong nước và giải phóngkhí hiđro, cònoxit của kim loại kiềm thìtantrong nước không giải phóngkhí hiđro.
(c)saivìtrongdung dịch Natác dụng với nước trước nênkhông thử được ion . 3Al (d)saivìCO chỉ khử được oxit của kim loại đứng sauAltrongdãy hoạt động hóa học màMg đứng trước Al Không khử được.
(e)saivìAllàkim loại, không phải chất lưỡng tính.
Câu 17: Đáp án C
CsaivìAlkhôngtantrong đặc, nguội. 3HNO
Câu 18: Đáp án C
Cả 5phát biểu đều đúng.
Câu 19: Đáp án C
Từ phản ứng (c) Loại B,D.
Dựa vàoA,C Xlà ,Ylà ,Tlà . 243AlSO 2 BaOH 2BaCl
Từ phản ứng (b) Zlà . 4BaSO
Câu 20: Đáp án D
OFFICIAL
Ytác dụng với dung dịch loãng Ykhông thể là không thể là . 24HSO 4 BaSOX 243AlSO
Loại A,B. Xkhông thể là vì sẽ khôngcó sản phẩm T Loại C. 3 AlOH Dạng 2: Nhôm hoặc nhôm oxit tác dụng với dung dịch bazơ 1 – A 2 – D 3 – C 4 – B 5 – C 6 – C 7 – C 8 – D 9 – A 10 – C Câu 1: Đáp án A
DẠYKÈMQUYNHƠN
Trang48
2
2H Al Al
3
NaOH
23 23 AlONaOH AlO 1
2
2H NaOH
Tacó: 2H Al 2n n0,1mol 3 Mà 23 23NaOHAlAlOAlO 0,30,1 nnnn
2
H n0,15mol
Tacó: .
2n n0,1molm2,7gam
Câu 2: Đáp án D
n0,3mol
Tacó:
nn0,15molm0,15.10215,3gam
Câu 3: Đáp án C
n0,15mol,n0,3mol
0,1mol
Câu 4: Đáp án B
Bảo toànnguyên tố Na: . 2 2 NaOHNaAlO NaAlO nn0,2molm0,2.8216,4gam
Câu 5: Đáp án C
Gọi số mol của Al, trong hỗn hợp X lần lượt làx,xmol. 23AlO
Tacó: 23 23
nn2nx2x0,2.1,5x0,1 mmm0,1.270,1.10212,9gam
NaOHAlAlO XAlAlO
Câu 6: Đáp án C
Xét phản ứng X với NaOH: Chỉ Al phản ứng, Mgkhông phản ứng với NaOH. 2H Al 2n n0,1mol 3
Xét phản ứng X với HCl: Cả Al,Mg đều phản ứng. Bảo toànelectron: 2 AlMgHMg 2.0,253.0,13n2n2nn 0,1mol 2 AlMg mmm0,1270,1245,1gam
H Al AlOXAl 2n n0,2molmmm15,60,2.2710,2gam 3 Al H H 3n30,02 n 0,03molV0,0322,4lít 0,672 22 Câu 9: Đáp án A Xét phản ứng của X với dung dịch NaOH dư: Tacó: 2H Al 2n n0,2mol 3 Xét phản ứng của X với dung dịch loãng, dư: 24HSO
DẠYKÈMQUYNHƠN
Trang49
OFFICIAL
23XAlAlO mmm0,1.270,1.10212,9gam.
Câu 7: Đáp án C 2H n0,3mol Tacó: . 2 23 Câu 8: Đáp án D Chất rắn là 23 23AlOchatran AlOn0,02mol Gọi số mol của Alvà trong hỗn hợp ban đầu lần lượt làx,ymol. 23AlO 27x102y1,56* Bảo toànnguyên tố Al: . 23 23 AlAlOAlOchatran n2n2nx2y0,04** Từ (*)và(**)suyra: .x0,02;y0,01 2 2
DẠYKÈMQUYNHƠN OFFICIAL Trang50 Bảo
2 AlFeHFe
3n2n2nn
2 AlFe
Câu
2H NaOH
Tacó: 2H Al
33 Mà . 23 23 23 NaOHAlAlOAlO AlO
nnnn
Dạng 3: Bài toán muối tác đụng với dung dịch kiềm 3+Al 1 – A 2 – D 3 – C 4 – B 5 – D 6 – A 7 – A 8 – D 9 – D 10 – D 11 – A 12 – A 13 – A 14 – A 15 - B Câu
3 3 KOHAlOH AlOH
3 HCl
. 3OHHAl
NaOH V0,250lít250m
Câu
3 243 3 AlSO Al
3OHAl
NaOH V0,0450,18 0,25 lít180ml Câu
3 3 NaOH H Fe Al n0,26mol,n0,08mol,n0,024mol,n0,032mol Phương
toànelectron:
2.0,43.0,2
0,1mol
mmm0,2.270,1.5611gam
10: Đáp án C
n0,3mol,n0,4mol
2n2.0,3 n 0,2mol
0,40,2
20,1molm10,2gam
1: Đáp án A
10,051,5 nn 0,025molm0,025781,95gam33
Câu 2: Đáp án D
AlCl n0,1mol,n0,05mol
Lượng kết tủa thu được lớn nhất
nn3n0,10,05.30,25mol
,5 1 2l
3: Đáp án C
n7,510moln0,015mol
Lượng kết tủa thu được lớn nhất
n3n30,0150,045mol
4: Đáp án B
trìnhion:
DẠYKÈMQUYNHƠN OFFICIAL Trang51 2 3 3 3 3 22 3
Kết tủa gồm: 3 3
.
3 2 42 2 4 2 2 KAlSO12HO Al SO BaOH Ba OH
Nhận thấy Khôngcó kết tủa 3OHAl n4n 3 AlOH Phương trìnhhóa học: 22 4 4BaSOBaSO
. 4BaSO
3 3AlOH Al
3OHHAl nn4nn0,20,240,10,9mol NaOH V0,90,4lít 5 2 Câu 7: Đáp án A Khísinhralà , chất rắn là . 2H 23AlO 2 23 H AlO n0,25mol,n0,05mol Tacó: 2 23 3 KOH H AlOAlOH nn2n0,5mol n2n0,1mol Nhận thấy Kết tủa bị hòatan một phần. 3OAlOH H n3n 3 3 243 243 OAlOH H AlSO Al MAlSO nn0,50,1 n 0,15moln0,075mol 44 0,075xC 0,375M 0,2 Câu 8: Đáp án D
HOHHO 0,080,08 mol Fe3OHFeOH 0,0240,0720,024mol Al3OHAlOH 0,0320,0960,032mol AlOHOHAlO2HO 0,0120,012 mol
FeOH0,024mol;AlOH0,0320,0120,02mol
m0,024.1070,02.784,128gam
Câu 5: Đáp án D
n0,1moln0,1mol;n0,2mol n0,2moln0,2mol;n0,4mol
0,20,20,2mol
mm0,2.23346,6gam
Câu 6: Đáp án A
H n0,1mol,n0,2mol,n0,2mol
Lượng NaOH phản ứng là lớn nhất
DẠYKÈMQUYNHƠN OFFICIAL Trang52 3 243 NaOH AlSO Al n0,03mol,n0,01moln0,02mol Nhận thấy: NaOH phản ứng hết, dư. 3OHAl n3n 3Al 3 3 OH AlOH AlOH n n0,01molm0,01780,78gam 3 Câu 9: Đáp án D Xét phản ứng của E với dung dịch dư: 4BaSO nn0,144mol Bảo toànnguyên tố S: . 4 24 24 3 3 BaSOAlSO AlSO 0,144 0,048 3nnn30,048moly0,12* 0,4 Xét
E với NaOH: Kết tủa tan một phần. 3 3 NaOH AlOH AlOHn0,108mol,n0,612mol3n 3 3 3 3 243 OAlOH H Al AlClAAlSO l nn0,6120,108 n 0,18mol 44 0,084 nn2n0,182.0,0480,084molx0,21** 0,4 Từ (*)và(**)suyra: .x:y0,21:0,127:4 Câu
2
3 3 243 AlOHAlOH AlSO
m3a2338a0,17812,045gama0,015 V0,0150,15 0, lít150ml 1 Câu 11:
án A Gọi
lần
làa,bM. 243 2AlSO,BaOH Xét phản ứng của 200mldung dịch X với 300mldung dịch Y: . 243 2 AlSO BaOH n0,2amol,n0,3bmol Nhận thấy, với cùng một lượng phản ứng, ở lần trộn sau nhiều hơn thìthu được 243AlSO 2 BaOH lượng kết tủa lớn hơn Ban đầu phản ứng hết, dư. 2 BaOH 243AlSO 4 3 OH BaSO AlOH n2.0,3bn0,3bmol,n 0,2bmol 33 m0,3b2330,2b788,55gamb0,1mol* Xét phản ứng của 200mldung dịch X với 500mldung dịch Y: 243 2 AlSO BaOH n0,2amol,n0,5bmol
phản ứng của
10: Đáp án D
BaOH n0,05mol
Gọi số mol của làamol. 243AlSO Kết tủa gồm: và . 4 BaSO3amol3 AlOH Tacó:
n4nn8a0,1mol
Đáp
nồng độ mol của
lượt
Nhận thấy: Lượng tăng lần. 2 BaOH0,5b1,67 0,3b Lượng kết tủa tăng lần. 12,0451,41 8,55 Kết tủa bị hòatan một phần. 3 AlOH 3 3 AlOHAlOH n4nn1,6abmol
Lại có: 4 243BaSOAlSO n3n3.0,2a0,6amol m0,6a233781,6ab12,045gam**
Từ (*)và(**)suyra: a0,075 Câu 12: Đáp án A Khithêm240mldung dịch NaOH2M: Kết tủa bị hòatan Dung dịch chứa: . 2 2 4 AlO,Na0,48mol,SO0,2mol Bảo toàn điện tích: . 2 2 4 2AlOSONaAlO n2nnn0,480,2.20,08mol
Khithêm220mldung dịch NaOH2M: Dung dịch chứa: hoặc . 2 3 4 Na0,44mol,SO0,2mol,Al 2AlO Nhận thấy: Dung dịch chứa: . 2 4NaSO n2n 2 2 4 AlO,Na0,44mol,SO0,2mol Bảo toàn điện tích: . 2 2 4 2AlOSONaAlO n2nnn0,440,2.20,04mol Bảo toànnguyên tố Al ở cả 2 phần:
DẠYKÈMQUYNHƠN OFFICIAL Trang53
3 3 2 2 32 AlOH1AAlOH2 lO1 AlO2 Al Al AlOHAlO a3a nnnn0,080,04a1,56 7878 a nnn0,080,1molm2,7gam 78 Câu 13: Đáp án A 2 3 42 2 4 KAlSO12HO SO Al n0,01moln0,02mol,n0,01mol Gọi số mol của làamol. 2 BaOH Kết tủa gồm: và . 4BaSO3 AlOH Nhận thấy: 4BaSO 4,5060,02233namol TH1: Kết tủa chưa bị hòatan. 3 OH AlOH n2a n mol 33 Tacó: . 2a m78a2334,506a0,0158mol 3
DẠYKÈMQUYNHƠN OFFICIAL Trang54
Bảo
3 2 AlAAlOH lO X
Từ (*)và(**)suyra: x0,15;y0,1 . Hdu n0,80,15.20,15.30,05mol Khithêm hỗn hợp KOHvà vàodung dịch X: 2 BaOH TH1: Kết tủa đạt cực đại (0,3mol). 4BaSO Tacó: 4 2 BaSO KOH BaOH OH nn0,3mol,n0,36mol n0,3.20,360,96mol Nhận thấy: Khôngcó kết tủa 3 2OHHAlMg nn4n2n 3 AlOH Kết tủa: 4 2 MgOH0,15mol,BaSO0,3mol. m0,15580,323378,6gam* TH2: Kết tủa đạt cực đại (0,15mol). 3 AlOH 3 2AlOHMgOHOHHdu nn3n2n0,0530,1520,150,8mol Mà . 4 2 2 KOH BaSO BaOH BaOH OH 0,8n2n2nn .0,50,25moln 2.0,50,6
Loại. 3 3AlOH Al 0,158.2 n 0,105n 3 TH2: Kết tủa bị hòatan một phần. 3 3 AlOHAlOH n4nn0,042amol
Tacó: 2BaOH m0,042a.78233a4,506a0,018mol V0,0180,18 0,1 lít180ml
Câu 14: Đáp án A 24 HCl HSO NaOH H n0,2moln0,3mol,n0,85mol n0,20,3.20,8mol
Khithêm0,85molNaOHvàodung dịch X: Dung dịch thu được chứa: hoặc 2 3 4 Na0,85mol,Cl0,2mol,SO0,3mol,Al 2AlO Nhận thấy: chứa 2 4NaClSO nn2nX 2 4 2Na0,85mol,Cl0,2mol,SO0,3mol,AlO Bảo toàn điện tích: . 2AlO n0,850,20,3.20,05mol Gọi số mol của và lần lượt làx,ymol. 2MgOH3 AlOH 58x78y16,5*
toànnguyên tố Al:
nnn0,05ymol m24x270,05y7,65gam**
DẠYKÈMQUYNHƠN OFFICIAL Trang55 Kết
4 2 3
Từ
24
Xét
X
:
23
pu Hdu
n0,850,740,11mol Xét phản ứng của Y với dung dịch vàNaOH: 2 BaOH Gọi số mol của ,NaOH lần lượt làx,6xmol. 2 BaOH 2 BNaOHOaOH H nnn8xmol TH1: Kết tủa đạt cực đại (0,1mol). 3 AlOH Kết tủa: 4 3 2 2 AlOH0,1mol,MgOH0,1mol,CuOH0,12mol,BaSO Tacó: 3 2 2 2 4 2 4 OHHAlMgCu BaSO BaOH SO nn3n2n2n8x0,1130,120,12x0,10625 nx0,10625molnn0,10625mol m0,1780,1580,12980,1062523350,11625gam* TH2: Kết
đạt
đại
. 2BaOH OH nx0,15moln8.0,151,2mol Nhận thấy: khôngcó . 2 2 3OHHMgCuAl nn2n2n4n 3 AlOH Kết tủa: 4 2 2 BaSO0,15mol,MgOH0,1mol,CuOH0,12mol m0,152330,1580,129852,51gam** Từ (*)và(**) Chất rắn: 4 BaSO0,15mol,MgO0,1mol,CuO0,12mol cr m0,152330,1400,128048,55gam Dạng 4: Bài toán hỗn hợp gồm Al với kim loại Na (hoặc K hoặc Ba) tác dụng với nước hoặc tác dụng với dung dịch kiềm dư 1 – B 2 – D 3 – B 4 – B 5 – A 6 – D 7 – B 8 – C 9 – C 10 - A Câu 1: Đáp án B 2H n0,1mol Sau phản ứng còn lại 2,35gam chất rắn khôngtan Al dư. Tacó: 2 HNaNa n2nn0,05mol
tủa:
MgOH0,15mol,AlOH0,15mol,BaSO0,25mol. m0,15.580,15.780,25.23378,65gam**
(*)và(**) Chất rắn: 23 4 MgO0,15mol,AlO0,075mol,BaSO0,25mol. cr m0,15400,0751020,2523371,9gam
Câu 15: Đáp án B
HHSOHCl n2nnn0,1520,550,85mol
phản ứng của
với
H
HCuOMgAlO
n2n2n6n20,1220,160,050,74mol
tủa
cực
(0,15mol).
. AlpuNa AlpuNaAldu nn0,05molmmmm0,05.270,05.232,354,85gam
Câu 2: Đáp án D . 3AlOH n0,095mol Bảo toànnguyên tố Al: . 3AlAlOH nn0,095mol BaOhhAl BaO
mmm13,2750,095.2710,71gam %m80,678%
Câu 3: Đáp án B
2H n0,04mol Sau phản ứng cóAlkhôngtan Na phản ứng hết. Tacó: 2 HNaNa Al n2nn0,02moln0,0220,04mol Mà: . AlpuNa Aldu nn0,02moln0,040,020,02mol . chatran m0,02.270,54gam
mmm0,1.390,1.276,6gam m8,66,62gam Câu 5: Đáp án A . 2 2 2 H1 H2 H3 n0,09mol,n0,04mol,n0,07mol
Gọi số mol của K,Mg,Altrong hỗn hợp X ở mỗi phần lần lượt làx,y,zmol. Xét phần một: Bảo toànelectron: KMgAl n2n3n0,18molx2y3z0,18*
DẠYKÈMQUYNHƠN
Trang56
OFFICIAL
Câu 4: Đáp án B 2H n0,2mol Hỗn hợp gồm bakim loại khôngtan gồm: Fe,Mg,Al dư. Tacó: 2 HKK Alpu n2nn0,1moln0,1mol klpuKAlpu cr Xét phần hai: Lượng khí thu được ít hơn ở phần ba Al dư. 2H Tacó: 2 HK 0,04 n2nx0,02** 2 Xét phần ba: Tacó: 2KAlH n3n2nx3z0,07.20,14*** Từ (*),(**),(***)suyra: .x0,02;y0,02;z0,04 Al 0,0427%m 100%46,15% 0,02390,02240,0427 Câu 6: Đáp án D
Gọi số mol của sinhrakhiX phản ứng với làamol Số mol của khiX phản ứng với 2H 2 HO 2H
NaOH dư là1,75amol. Nhận thấy, khichovàodung dịch NaOHthu được nhiều khí hơn KhichoXvào nước Al dư. 2H Tacó: . 2 NaHNa 2nnn0,5amol KhichoXvàoNaOH dư Al phản ứng hết. Tacó: 2 HNaAlAl Na
1 2nn3nn2.1,75a0,5aamol 3 %0,5a.23 m .100%29,87% 0,5a23a27
Câu 7: Đáp án B Nhận thấy, khichovàodung dịch thu được nhiều khí hơn KhichoXvào nước Al dư. 2 BaOH 2H Xét phần một: . 2 HBa Ba n4n0,06moln0,015mol Xét phần hai: . 2 HBaAlAl 20,0920,0152n2n3nn 0,05mol 3
Câu 8: Đáp án C 2H n0,08mol Gọi số mol của Ba,Na,Altrong hỗn hợp X lần lượt làx,y,6xmol. Sau phản ứng có0,54gam chất rắn Al dư (0,02mol). Tacó: 2 HNaBa n2n4n0,08mol2xy0,04*
DẠYKÈMQUYNHƠN OFFICIAL Trang57
AlbAlduAlpu BaNaA đ l
mmmm0,011370,02230,06273,45gam Câu 9: Đáp án C 2 2 2 H1 H2 H3 n0,035mol,n0,02mol,n0,025mol Xét phản ứng của X với ,thu được hỗn hợp kim loại Al dư. 2 HO 2 K Alpu H2 K 1 nn0,01moln 2 m0,39gam Xét phản ứng của X với KOH: 2 AlKAl Al H1 20,0350,012n3nnn30,02molm0,54gam Xét phản ứng của Y với HCl:
.
AlBa mmm20,05.270,015.1376,81gam
Muối thu được: .2 22 NaAlOymol,BaAlOxmol Bảo toànnguyên tố:
2 22AlpuNaAlOBaAlO nn2ny2x0,04mol
nnn0,040,020,06molx0,01y0,040,01.20,02
DẠYKÈMQUYNHƠN OFFICIAL Trang58 . AAlAlpu lY nnn0,01mol Tacó:
2Fe Fe Fe AlY H3
Câu
Xét
Xét
3 3 HCl
H
Xét phần 3: kết tủa bị hòatan. 3 AlOH . 3 3 AlOHAlOH2 17 nnmol 360 Tacó: 3 3 2 2 2 2 HCl AlOH AlOH OHAlOAlO OHAlO AlO nnn3nnn4n3n 07 n,750,13600,25mol 4 Bảo toàn điện tích: . 2 NaAlOOH nnn0,250,10,35mol Bảo toànnguyên tố Na,Al Na Al n0,35mol,n0,25mol X m30,35230,252744,4gam Dạng 5: Bài toán nhiệt nhôm 1 – A 2 – D 3 – C 4 – B 5 – D 6 – B 7 – D 8 – A 9 – B 10 – D 11 – D 12 – D 13 – B 14 – D 15 - C Câu 1: Đáp án A 23 Al FeO n0,4mol,n0,1mol Phương trìnhhóa học: t 23 23 2AlFeOAlO2Fe 0,40,1 0,2mol Kim loại trongY: Al dư . Fe0,2mol, 0,40,20,2mol klY m0,2560,22716,6gam Câu 2: Đáp án D Gọi số mol của vàAl lần lượt làa,3amol. 34FeO Phương trìnhhóa học: 2323 8Al3FeO4AlO9Fe 3aa
.
0,025.20,01.33n2n2nn20,01molm0,56gam
10: Đáp án A Dung dịch Y chứa: 2 Na,AlO,OH
phần 1: bắt đầu xuất hiện tủa OHH nn0,1mol
phần 2: kết tủa được tạo thành. 3 AlOH
OAlOH2AlOH2
nnnn0,450,10,35mol
Fe2HClFeClH 0,090,09 mol 2Al6HCl2AlCl3H 0,040,04 mol AlO6HCl2AlCl3HO 0,040,08 mol FeO8HClFeCl2FeCl4HO 0,010,040,02mol
gồm 0,12mol ;0,1mol và0,02mol . 3AlCl 2FeCl 3FeCl .m0,12.133,50,1.1270,02.162,531,97gam
DẠYKÈMQUYNHƠN OFFICIAL Trang59
Muối
Nhận thấy: phản ứng hết, Al dư. 34 a3a FeO 38 Hỗn hợp thu được gồm: . 34Al,Fe,FeO Câu 3: Đáp án C 23 23 8Al3FeO4AlO9Fe Ban đầu: 0,12 0,04 mol Phản ứng: x0,375x0,5x1,125xmol Sau phản ứng: 0,12x0,040,375x0,5x1,125xmol X gồm: . 23 34 Fe1,125xmol;Al0,12xmol;AlO0,5xmol;FeO0,040,375xmol Tacó: . 2 HAlFe 3 n.nn1,5.0,12x1,125x0,15x0,08mol 2 X gồm: 0,09molFe;0,04molAl;0,04mol ;0,01mol . 23AlO 34FeO Phương trìnhhóa học: 22 32 23 32 34 232 Câu 4: Đáp án B . 23 Al CrO 4 nmol,n0,1mol 15 Phương trìnhhóa học: 2323 2AlCrOAlO2Cr 0,20,10,2mol Kim loại trongX:Cr,Al dư. klX m7,20,2270,25212,2gam Câu 5: Đáp án D 2H n0,08mol Y phản ứng với NaOHsinhrakhí Hỗn hợp Y gồm: ,Fe,Al dư. 2H 23AlO Tacó: . 2H Aldu 2n n0,2mol 3
DẠYKÈMQUYNHƠN OFFICIAL Trang60
. 2 2
H 33
V7,í 8 2 4t 2 Câu 8: Đáp án A . 23 2 Al FeO H n0,2mol,n0,08mol,n0,075mol Phương trìnhhóa học: 2323 2AlFeOAlO2Fe 0,20,08 Nhận thấy Hiệu suất tínhtheo . 0,20,08 21 23FeO Tacó: 2 23 H Alpu Aldu Alpu FeOpu 2n n 20,075 n 0,05moln0,20,050,15moln 0,075mol 33 2 . 23 23 FeOpu FbđeO %n0,075 H.100%.100%93,75% n 0,08 Câu 9: Đáp án B
Mặt khác: 23 23NaOHAlduAlOAlO O 0,280,2nn2nn 0,04moln0,04.30,12mol 2 Chất rắn khôngtanlà . Fe Fen0,09mol Xét Công thức của oxit sắt là . FeO n:n0,09:0,123:4 34FeO . 23 XYAlOFeAldu mmmmm0,04.1020,09.560,2.2714,52gam Câu 6: Đáp án B 2 3 H AlOH n0,15mol,n0,5mol X phản ứng với NaOHsinhrakhí X gồm: Al, ,Fe. 2H 23AlO 2H Aldu 2n n0,1mol 3 Bảo toànnguyên tố Al: 23 23 3 AAlAlduAlOAlO lOH 0,50,1nnn2nn 0,2mol 2 Bảo toànnguyên tố O: . 34 23 34FeOAlOFeO 4n3nn0,15mol . 34XAlFeO mmm0,5.270,15.23248,3gam Câu 7: Đáp án D . 23CrO n0,1mol Bảo toàn khối lượng: . 23 CrOAlXAl Al mmmm23,315,28,1gamn0,3mol Phương trìnhhóa học: 23 23 CrO2AlAlO2Cr 0,10,30,10,2mol
Hỗn hợp rắn X gồm: Cr(0,2mol), (0,1mol),Al dư . 23AlO 0,30,20,1mol
HCrAldu
nnn0,2.0,10,35moll
DẠYKÈMQUYNHƠN OFFICIAL Trang61
23 23 Fe AlO XAlduAlOFe Fe
Ytác dụng với NaOHsinhrakhí gồm: ,Fe,Al dư. 2 HY 23AlO Bảo toànnguyên tố Fe: 23FFeFeO eY nn2n0,070,120,27mol Bảo toànnguyên tố O: . 2323 FeOAlO nn0,1mol Xét phần 2: . 2 H2 Aldu 2n2a n mol 33 Xét phần 1: . 2 AlduFeH1 2a0,27 3n2n2n3.2.2.4aa0,045 32 Bảo toànnguyên tố Al: . 23AlAlduAlO Al 2.0,045 nn2n2.2.0,10,26molm7,02gam 3 Câu 12: Đáp án D . 2 Al H NO n0,8mol,n0,3mol,n0,85mol Ztác dụng với NaOHsinhrakhí gồm: ,Fe,Al dư. 2 HZ 23AlO
23 2 CrO H n0,03mol,n0,09mol Tacó: . 23 2323 CrCrO AlOCrO n2n0,06mol,nn0,03mol Nhận thấy X chứa Al dư. 2 HCrnn Bảo toànelectron: . 2 AlduCrHAldu 0,0920,0623n2n2nn 0,02mol 3 X gồm: Al dư (0,02mol), (0,03mol),Cr(0,06mol). 23AlO Mặt khác,Crkhông phản ứng với dung dịch NaOH. 23 NaOHAlOAldu n2nn20,030,020,08mol Câu 10: Đáp án D 2 2 H1 H2 n0,35mol,n0,15mol Xtác dụng với NaOHsinhrakhí gồm: ,Fe,Al dư. 2 HX 23AlO Xét phần (2): . 2 H2 Aldu 2n n0,1mol 3 Xét phần (1): 2AlduFeHFe 1 2.0,353.0,13n2n2nn 0,2mol 2
n n0,1mol 2 mmmm0,1270,11020,25624,1gam %0,256m100%46,47% 24,1
Câu 11: Đáp án D 23 Fe FeO n0,07mol,n0,1mol
Tacó: 2H Aldu 2n20,3 n 0,2mol 33
Bảo toànnguyên tố Al: . 23 23AlAlOAlduAlO OY 0,80,2n2nnn 0,3moln0,330,9mol 2
Quy đổi hỗn hợp X gồm FevàO. Bảo toànnguyên tố O: . OXOY nn0,9mol
Bảo toànelectron: . AlFeNOOFe 3.0,852.0,93.0,83n3n3n2nn 0,65mol 3 . XFeO mmm0,65.560,9.1650,8gam
Câu 13: Đáp án B . 2 NaOH H n0,04mol,n0,05mol
Xét phản ứng của 1/2Y với NaOH: VìCr, đều không phản ứng với NaOH,nên muối thu được là . 23CrO 2NaAlO . 2 AlNaAN đ lOOH b a nnn0,04moln0,08mol Gọi số mol của Cr,Fe,Al dư cótrong từng phần của Y lần lượt làx,y,zmol.
Tacó: . Alpu n0,82zmol
Xét phản ứng nhiệt nhôm: Bảo toànelectron: . AlpuFeCr 3n2n3n30,082z22y32x3x2y3z0,12*
Xét phản ứng của 1/2Y với HCl: Bảo toànelectron: . 2CrFeAlH 2n2n3n2n2x2y3z0,1**
DẠYKÈMQUYNHƠN OFFICIAL Trang62
Từ (*)và(**)suyra: .x0,02 23 23 23 Cr CrOpu CrOpuX CrOpu n n0,01moln0,02mol 2 %0,02m100%66,67% 0,03 Câu 14: Đáp án D 2 3 H NO HNO n0,045mol,n0,17mol,n1,52mol Xtác dụng với NaOHsinhrakhí gồm: ,Fe,Al dư. 2 HX 23AlO Xét phần 1: Fekhông phản ứng với NaOH Chất rắn làFe . Fe n0,06mol . 23 Fe AlO n n0,03mol 2 Lại có: . 2H Aldu 2n20,045 n 0,03mol 33
phần hai:
hai chứa: Al(0,09mol),Fe(0,18mol), (0,09mol).
toànnguyên
DẠYKÈMQUYNHƠN OFFICIAL Trang63
Bảo
3 2 2HNOmuoiNOHO muoi mmmmm
Câu
án C 2 2 3 H SO AlOH n0,03mol,n0,1mol,n0,11mol Xtác
với NaOHsinhrakhí gồm: ,Fe,Al dư. 2 HX 23AlO Tacó: . 2H Aldu 2n n0,02mol 3 Bảo
23 23 3 23 AlduAlO Al oxit OAlOH OAlO X Osat 0,10,02n2nnn 0,04mol 2 n3n0,12moln Chất rắn ZlàFe. Tacó: 2 2 4 SOSOmuoi nn0,11mol Mà . 2 4 muoiFeSFe O mmmm15,60,11965,04gam . FeO mmm5,040,12.166,96gam Dạng 6: Bài toán Al tác dụng với dung dịch 3HNO 1 – A 2 – B 3 – C 4 – D 5 – D 6 – A 7 – A 8 – D 9 - C 10 - C Câu 1: Đáp án A Bảo toànelectron: . AlNOAl 3n3nn0,2mol 23FeO %15,60,227 m 100%65,38% 15,6 Câu 2: Đáp án B Tacó: . 3 NO NONOtrongmuoi n0,03moln3n0,09mol . 3 YKLNOtrongmuoi mmm2,190,09.627,77gam Câu 3: Đáp án C
231AlFeAlO mmmm0,03.270,06.560,03.1027,23gam.
Xét
Tacó: . 2 1m28,927,2321,69gam3m Phần
23AlO Bảo
tố N: 3 43 23 43 43 23 23 HNOetraodoiNHNONOAlO NHNONONHNONOAlOAlO nn2nn6n 8n3n2nn6nn0,03mol
Bảo toànnguyên tố H: . 3 432 2 HNONHNOHOHO 1,524.0,03n4n2nn 0,7mol 2
toàn khối lượng:
m21,691,52.630,17.300,7.1899,75gam
15: Đáp
dụng
toànnguyên tố Al:
Tacó: Z Z 7,2 n0,2molM37 0,2
TH1:Z gồm NO(xmol)và (ymol). 2 NO
Tacó: xy0,2x0,1TM 30x44y7,4y0,1
Gọi số mol cótrongYlàamol. 43NHNO
n3n8n8n1,18amol m25,31,18a6280a122,3a0,05mol n4n10n10n0,140,1100,05101,9mol
TH2:Z gồm
DẠYKÈMQUYNHƠN OFFICIAL Trang64
2 43 3 3 2 43 NONONHNO
Y
NOtrongmuoiKL
HNOpuNONONHNO
2
3
Loại. Y
dtăng
Bảo
43 3
MgAlZn NHNO
2n3n2n
8 Câu 5: Đáp án D Gọi số mol lần lượt làa,bmol. 22 N,NO Tacó: . ab0,24a0,12 28a44bb0,12 18,2ab Bảo toànelectron: . 432 2 43AlNHNONONNHNO 13m m 3n8n8n10nn 8.0,1210.0,120,27mol 827 72 Lại có: . 43 33 muoi NHNOAlNO mm mmm8m2130,2780m21,6 2772 Câu 6: Đáp án A . 2 NO n0,25mol Bảo toànelectron: . MgFeAlNO 2n3n3n3n0,75mol
(umol)và (vmol). 2N 2 NO Tacó: uv0,2u0,0875TM 28u44v7,4v0,1125
Gọi số mol cótrongYlàbmol. 43NHNO .
43
NONONHNONOtrongmuoiKL n3n8n8n1,7758bmol
m25,31,7758b6280b122,3b0,023mol
Câu 4: Đáp án D Sơ đồ phản ứng: Dung dịch +Khí. 3XHNO
Tacó: dX
mmmm13,230,1.240,04.270,15.650
Sản phẩm khử duy nhất là . 43NHNO
toànelectron: .
43
HNOpuNHNO
n 0,0775moln10n0,775mol
DẠYKÈMQUYNHƠN OFFICIAL Trang65
3
3 HNO NHNOetraodoiNHNONOmuoikl
Nhận thấy: . 3 3 3 3 3 2FeNOAlNOMgNO mmm0,12.2420,12.2130,12.14872,3675,36gam Có muối 43 43 43NHNO NHNO NHNO,m75,3672,363gamn0,0375mol TrongY số mol của bằng số mol của Quy đổi hỗn hợp Y về NO(xmol)và (ymol). 2N 2NO 2 NO Tacó: . 2Y/H d30x44y 18,5218,5xy* xy Bảo toànelectron: 2 43FeAlMgNONONHNO 3n3n2n3n8n8n3x8y0,66** Từ (*)và(**)suyra: .xy0,06 Bảo toànnguyên tố N: 3 43 2 3 HNO NHNONONONOmuoikl nn2nn2n 30,1220,1230,1220,03750,060,0621,215mol Câu 9: Đáp án C DoT chỉ chứa khí phản ứng hết chứa muối . 23 HNO Z 2 4SO Z chỉ chứa ba muối trunghòa chứa: Z 242444 3 2 AlSO,NaSO,NHSO Sơ đồ phản ứng chính: 243 3 42 HSO,NaNO 2 2 23 4 Al,Na,NH Al H X Y THO AlO SO Tacó: 23 Al Al AlO m60%.7,654,59gamn0,17mol 7,654,59 n 0,03mol 102 Bảo toànnguyên tố Al: 3 23AAlAlO l nn2n0,170,0320,23mol Xét phản ứng của Z với 2 4 24 4 2 BaSO HSO SO BaCl:nn0,4moln0,4mol
Kết tủa gồm: 3 23 FeOH,MgOHAlOH. 3OFeMgAlOH H n3n2n3n0,75mol
Tacó: . klOkl H mmmm240,75.1711,25gam
Câu 7: Đáp án A Tacó: Khôngcókhíthoátra. MgAl ddtăngmm0,1.240,04.273,48gamm Sản phẩm khử duy nhất là . 43NHNO Bảo toànelectron: . 43 43MgAlNHNONHNO 20,130,042n3n8nn 0,04mol 8
Bảo toànnguyên tố:
43 43
nn2nn2n2.0,10,04.32.0,040,4mol
Câu 8: Đáp án D Gọi số mol của Fe,Al,Mg lần lượt làa,a,amol. 56a27a24a12,84a0,12mol
DẠYKÈMQUYNHƠN OFFICIAL Trang66 Xét
3 4 4
Bảo
2 4
Na
. Z
Bảo
24
2
H HO
n
Bảo
24 3 2 XHSONaNOZTHO T T mmmmmm 7,650,4980,0958547,065m0,35518 m1,47gam Câu 10: Đáp án C Vì hỗn hợp T chứa phản ứng dư với ,sau đó phản ứng với Dung dịch Y chứa ion 2 HFe 3Fe H ,không chứa ion . 2Fe 3Fe Sơ đồ phản ứng chính: . 3 32 2 HCl,NaNO 3 2 2 4 Al Al,FeH XFeNO Y THO Cl,NH,Na Fe Xét phản ứng của T với :3AgNO 2 AgClAgAg Ag Fe mmmm78,230,5.143,56,48gam n0,06moln Xét
Bảo
. 2 2 NaOHNNaAlONaClNaAlO aY nnnnn0,580,030,50,11mol Bảo
tố Al: . 3 2 AlANaAlO l nnn0,11mol Tacó: . 3 2 4 4NaOHAlFeNHNH n4n2nnn0,02mol Bảo toànnguyên tố H: . 2 22 4 HClNHOHHO H 0,54.0,020,02.2n4n2n2nn 0,19mol 2 Bảo toàn khối lượng: 3 2 XHClNaNOYTHO X mmmmmm m25,1310,6.2.0,050,19.180,5.36,50,03.858,81gam Gọi số mol của Fevà trong hỗn hợp X lần lượt làx,ymol. 32FeNO Tacó hệ phương trình: .56x180y8,810,1127x0,04 xy0,06 y0,02 Fe %0,0456m100%25,43% 8,81 Dạng 7: Bài toán cho muối aluminat tác dụng với dung dịch axit 1 – A 2 – B 3 – B 4 - C 5 – A 6 – B 7 – C 8 – B 9 – B 10 - B
phản ứng của Z với NaOH: .
NaOHAlNHNH n4nnn0,9354.0,230,015mol
toàn điện tíchtrongdung dịch Z: 3
4AlNaNHSO
3n3nn2n n2.0,43.0,230,0150,095mol
m0,23.270,4.960,015.180,095.2347,065gam
toànnguyên tố H:
422
HSONHHO
2n4n2n2n 20,440,01520,015
0,355mol 2
toàn khối lượng:
phản ứng của Y với NaOH:
toànnguyên tố Na:
toànnguyên
DẠYKÈMQUYNHƠN OFFICIAL Trang67 Câu 1: Đáp án A Sơ đồ phản ứng: 2 2 2 HO 23 NaONaAlO X AlONaOH Tacó: NaOH n0,1mol Tại : Kết tủa chưa đạt
HCl
3 AlOH 3 2 2 3 2 HAlOHAlOpuHOHAlOpu AlOHAlOpu nnnnnn0,3mol nn0,30,10,2mol a0,27815,6gam Tại : Kết tủa đã đạt cực đại, bị hòatan một phần. HCl n0,7mol 3 AlOH 2 3 2 2 2 AlOXH AlOH HAlOX HOHAlOX AlOX 4nn n 0,2n4n0,6 3 nn4n0,60,7n0,3mol Bảo toànnguyên tố Al: 23 2 2 2 AlOAlOX NaONaOHNaAlO 11 nn0,30,15mol 22 1 1 nnn0,10,30,2mol 2 2 m0,2620,1510227,7gam Câu 2: Đáp án B Phương trìnhhóa học: 222 33 t 232 3 COAlO2HOAlOHHCO 0,2 0,2mol 2AlOHAlO3HO 0,20,1 mol .V0,2.22,44,lít 48 Câu 3: Đáp án B Gọi số mol của Na,Al lần lượt là5xvà4xmol. Sơ đồ phản ứng: 2 2 HO du NaAlO:4xmolNa:5xmol X NaOH:xmolAl:4xmol Tại 210ml nếu kết tủa đã đạt cực đại, tacó: gia pu m H 1,56 n0,430,210,22mol;n0,02mol 78 Nhận thấy: Tại 210ml, còn dư. Hpugiamn3n 2AlO Gọi số mol kết tủa tương ứng với agamlàymol . 3 2 AAlOH lOpu nnymol 2 HNaOHAlOpu nn4n0,21xy0,211
cực đại.
n0,3mol
DẠYKÈMQUYNHƠN OFFICIAL Trang68 Tại
đã đạt
3
2 3 AlOXH AlOH H H
n
23 2 2
AlO OX OX OX H OH H
.
2 3 3
AlOH AlOH
33 Câu 5: Đáp án A . H n0,01mol Dung dịch sau phản ứng có dư pH13OH Tacó: . OHdu OHHO b Hdu đ n0,004molnnn0,0040,010,014mol Lại có: . 2 bđOH hh OH 0,09639m n2n2n0,014220,003m0,66gam 16 Câu 6: Đáp án B Xét hỗn hợp 22H HO:n0,005mol 2 O O OOH H m0,9263,456%0,032gamn0,002mol n2n2n0,014mol Xét . 2 3 2CO BaCO XCO:n0,01mol;n0,002mol Tacó: . 2 2 2 3 COCOOH Ba nnn0,0040,002n0,002mol Xét 3 2 4 243Al SO XAlSO:n0,004mol;n0,006mol Tacó: . 2 4 3 3 BaSOBa AlOHAlOH nn0,002mol m0,0022330,002780,622gamn4nn0,002mol
430ml: Kết tủa
cực đại, bị hòatan một phần.
AlOH
4nn
3y0,02n4.4x3y0,02mol nx16x3y0,020,43mol2
Từ (1)và(2)suyra: .x0,05;y0,16
Na Al n0,05.50,25mol;n0,05.40,2mol m0,25.230,2.2711,15gam.
Câu 4: Đáp án C
HHCl
nn0,24mol; 1 m1,68gamn0,105molnn0,025mol 3 n0,06moln2n0,12mol
Phương trìnhhóa học: 23 22 AlO2OH2AlOHO 0,0350,070,07mol
OHdu n0,120,070,05mol
Số molHCl phản ứng với bằng: . 2 AlO0,240,050,19mol
AlOH
4nn4.0,070,19 n 0,03molm0,03782,34gam
DẠYKÈMQUYNHƠN OFFICIAL Trang69 Câu 7:
án C Sơ đồ phản ứng: 2 3 0,066mol 4 2 2 4 0,018mol 2
H:0,0405mol AlOH H
Al,Na,K BaSO XHO YSO Ba ZCl:0,03mol SO,ionKL Cl Tacó: . 2OH H n2n0,081mol Bảo toànnhómOH: 3 3 4 AlOHAlOHOHH BaSO Ba 0,0810,066nn3nn 0,005mol 3 1,0890,00578 n 0,003moln0,003mol 233 Bảo toànnhóm 2 4 4SOZ SO:n0,0180,0030,015mol ionkltrongZ X Ba m3,3350,03.35,50,015.960,83gam m0,830,003.1370,005.271,376gam %0,003137m100%29,87% 1,376 Câu 8: Đáp án B Sơ đồ phản ứng: 2 2 H:0,002mol 2 3 2 CO:0,0054mol 0,4302gam 2du 3 32 H:0,008mol T Ba,Al BaCO XHOBa Y O AlOH AlO,OH Z:BaHCO Xét . OHdu 1/2YHCl:n0,002mol Xét 2 1/2YCO: Gọi số mol lần lượt làa,b,cmol. 3 3 3 2BaCO,AlOH,BaHCO 197a78b0,43021 Bảo toànnguyên tố C: . 2 3 32COBaCOBaHCO nnna2c0,00542 Bảo toànnguyên tố Ba,Al: . 2 2 BaY AlO nac;nb Bảo toàn điện tíchtrongY: 2acb0,0023 Từ (1),(2),(3)suyra .a0,0006;b0,004;c0,0024 Vậy X gồm Ba(0,006mol);Al(0,008mol).
Đáp
3,335gam4 0,03mol
1,089gam
DẠYKÈMQUYNHƠN OFFICIAL Trang70 Bảo
2
OX
n
2 m0,0061370,008270,01161,198gam Câu
B Sơ đồ phản
2 3 0,16mol 4 2 2 4
2
H:0,085mol AlOH H 3,11gam Al,Na BaSO XHO YSO Ba ZCl:0,1mol CSO,ionKL l Gọi
Tacó: 2
Bảo
4 BaSOBaO
Bảo
3 3AlOHAlOHOHH 0,172a0,162a0,01nn3nn mol 33
3 Bảo toànnhóm . 2 4 4SOZ SO:n0,030,010,02mol ionkltrongZ X m7,430,135,50,02961,96gam m1,960,01.137160,01.273,76gam Câu 10: Đáp án B Quy đổi hỗn hợp XthànhAl,K,Ba,O. Sơ đồ phản ứng: 2 3 24 4 2 0,004mol 2 2 0,002mol 4 0,6182gam H:0,0056mol AlOH H0,498gam SO BaSO XAl,KHO Y HO Ba,O HCl ZCl;SO ionKL Tacó: . O KL m0,1mm0,9m Mặt khác: . 2 OHO H 0,1m n2n2n0,01122.0,01120,0125m 0,16 . 3 OHtrongOHH nnn1,2.100,0125m
toànelectron: .
BaAlH
2n3n2n
0,01mol
9: Đáp án
ứng:
0,03mol
7,43gam4 0,1mol
số molBaOlàamol.
OHBaO H n2n2n0,172amol
toànnguyên tố Ba:
nnamol
toànnhómOH:
20,2a0,01 33a783,11a0,01mol
DẠYKÈMQUYNHƠN OFFICIAL Trang71 Tacó: 2 4muoiKLOHtrongClSO 3 mmmmmm 0,4980,61820,9m171,2100,125m0,00235,50,00496 m0,576gam Dạng 8: Bài toán đồ thị 1 – A 2 – A 3 – D 4 – B 5 – A 6 – C 7 – D 8 – B 9 – A 10 – A 11 – A 12 – D 13 – C 14 – A 15 - A Câu 1: Đáp án A Theo đồ thị: .a0,8mol Tại , kết tủa chưa đạt cực đại. NaOH n2mol 3 AlOH Tacó: . 3 3NaOHHClAlOHAlOH 20,8nn3nn 0,4mol 3 Tại , kết tủa đã đạt cực đại và bị hòatan một phần. NaOH
3 AlOH Tacó: 3 3 3 3 3 NaOHHClAAlOH l Al AlOHAl 2,80,80,4nn4nnn 0,6mol 4 nn0,6molhayb0,6 a:b0,8:0,64:3 Câu
án
Theo đồ thị: 3 3 AlOHmax Al
3 3
3
, kết tủa đã đạt cực đại và bị
NaOH
3 AlOH Tacó:
3 3 NaOHAAlOH l n4nn0,2440,140,82mol Câu
án D Theo đồ thị: 2BaOH OH OH 1 n0,1molann0,05mol 2 Tại , kết tủa đã đạt cực đại và bị hòatan một phần. HCl n0,7mol 3 AlOH Tacó: 3 2 2 22 2 HCl AlOHOHAlO AlO BaAlOAlO 0,70,10,23nn4n3nn 0,3mol 4 1 nn0,15molhayb0,15 2 .a:b0,05:0,151:3 Câu 4: Đáp án B Theo đồ thị: . 4 4 BaSO BaSO m69,9gamn0,3mol
n2,8mol
2: Đáp
A
n0,24moln0,24mol
Tại , kết tủa chưa đạt cực đại. NaOH n0,42mol
3 AlOH Tacó: .
NaOHAlOHAlOH 0,42 n3nn0,14mol
Tại
hòatan một phần.
nxmol
.
3: Đáp
DẠYKÈMQUYNHƠN OFFICIAL Trang72
xy69,993,3163,2 Câu 6: Đáp án C Xét 3 2 4 H Al SO ZNaOH:n2xmol;n2ymol;nx3ymol Theo đồ
Tại , kết tủa chưa đạt cực đại. OH n1,0mol 3 AlOH Tacó: . 3 3AlOHAlOHOHH 10,4nn3nn 0,2mol 3 Tại , kết tủa đã đạt cực đại và bị hòatan một phần. OH n1,4mol 3 AlOH Tacó: . 3 3 3AlOHOHHAl Al 1,40,40,2nn4nnn 0,3mol 4 Dung dịch X gồm . 3 2 4 H0,4mol,Al0,3mol,SO0,65mol Xét 2 XBaOH: Tacó: . 2 44 3 3 BaSOSO AlOHAlOHH nn0,65mol n4nnn4.0,31,40,40,2mol m0,65.2330,2.78167,05gam Câu 7: Đáp án D Xét :XHCl Theo đồ thị: OHdu n0,1mol Tại , kết tủa chưa đạt cực đại. H n0,3mol 3 AlOH Tacó: . 3 3AlOHAlOHHOH nnnn0,30,10,2mol Tại , kết tủa đã đạt cực đại và bị hòatan một phần. H n0,7mol 3 AlOH
Bảo toànnhóm . 3 4 2434 BaSOAlSO Al 1 SO:nn0,1moln0,2mol 3
2BaOH OH n0,2Vmoln0,4Vmol
Tại Vlít , kết tủa bị hòatan hết nên 2 BaOH 3 AlOH 3OHAl n4n0,4V0,2.3Vlít2,1. 2 Câu 5: Đáp án A Tại , đã bị hòatan hết nên: 2BaOH n0,6mol 3 AlOH 3 3AlOHAl 0,62 4nnn0,3mol 4 Tại , kết tủa max, kết tủa một phần. 2BaOH n0,3mol 4BaSO 3 AlOH Tacó: . 4 BaSOmax n0,3molx0,323369,9gam
Lại có: 4 3 BaSOmaxAlOHmax ynn0,32330,37893,3gam
thị: 2x0,4x0,2mol
Bảo toàn điện tích: 2 NaAlOOH nnn0,30,10,4mol
Bảo toànnguyên tố Al,Na: 2 Na Al Na AlO nn0,4mol;nn0,3mol
DẠYKÈMQUYNHƠN OFFICIAL Trang73
Tacó: . 3 2 2 AlOHHOHAlO AlO 0,70,10,2.3nn4n3nn 0,3mol 4 Xét 2 Na,AlHO Sơ đồ phản ứng: 2 2 NNa a HOX AlAlO;OH
Xét 2232 NaO,AlOHO Sơ đồ phản ứng: 2 2 23 2 NaONa HOX AlOAlO;OH Bảo toàn điện tích: 2 NaAlOOH nnn0,20,20,4mol Bảo toànnguyên tố Al,Na: 2 23 2 NaO AlO Na AlO 1 1 nn0,2mol;nn0,1mol 2 2 m0,2620,110222,6gam Câu 9: Đáp án A Xét :XNaOH Theo đồ thị: Hdu n0,1mol Tại , kết tủa chưa đạt cực đại. OH n0,25mol 3 AlOH Tacó: . 3 3AlOHAlOHOHH 0,250,1nn3nn 0,05mol 3 Tại , kết tủa đã đạt cực đại và bị hòatan một phần. OH n0,45mol 3 AlOH Tacó: . 3 3 3AlOHOHHAl Al 0,450,10,05nn4nnn 0,1mol 4
m0,3.230,3.2717,3gam Câu 8: Đáp án B Xét :XHCl Theo đồ thị: OHdu n0,2mol Tại , kết tủa chưa đạt cực đại. H n0,3mol
3 AlOH Tacó: . 3 3AlOHAlOHHOH nnnn0,30,20,1mol
Tại , kết tủa đã đạt cực đại và bị hòatan một phần. H n0,7mol
3 AlOH Tacó: . 3 2 2 AlOHHOHAlO AlO 0,70,20,13nn4n3nn 0,2mol 4
DẠYKÈMQUYNHƠN OFFICIAL Trang74 Xét
,
tủa đã đạt
đại
H
3 AlOH
. 3 2 2 AlOHHOHAlO AlO
2 2
H n0,05mol 3 AlOH Tacó: . 3 3AlOHAlOHHOH nnnn0,050,020,03mol Tại , kết tủa đã đạt cực đại và bị hòatan một phần. H n0,09mol 3 AlOH Tacó: . 3 2 2 AlOHHOHAlO AlO 0,090,020,033nn4n3nn 0,04mol 4 Xét 2 XHO Quy đổi XthànhBa,Al,O. Sơ đồ phản ứng: 2 2 2 2du H:0,08mol Ba,AlHOBa Y O AlO;OH
232 Al,AlOHO
Sơ đồ phản ứng: 3 23 Al H HClX AlOAl;Cl Bảo toàn điện tích: . 3 ClAlH n3nn0,1.30,10,4mol . HClCl 0,4 nn0,4molx2M 0,2 Câu 10: Đáp án A Xét :XHCl Theo đồ thị: OHdu n0,2mol Tại , kết tủa chưa đạt cực đại. H n0,3mol
3 AlOH Tacó: . 3 3AlOHAlOHHOH nnnn0,30,20,1mol
Tại
kết
cực
và bị hòatan một phần.
n0,7mol
Tacó:
0,70,20,13nn4n3nn 0,2mol 4
Xét 232 Na,AlOHO Sơ đồ phản ứng: 2 23 2du Na Na HOX AlOAlO;OH
Tacó:
du2 H H OHAlO 1 nnn0,2molV0,222,4l 4,4 2 8ít
Câu 11: Đáp án A Xét :XHCl Theo đồ thị: OHdu n0,02mol
Tại , kết tủa chưa đạt cực đại.
TH2: Kết tủa gồm và max. 3 AlOH 4BaSO Tacó: Thỏa mãn.
DẠYKÈMQUYNHƠN OFFICIAL Trang75
2 2
Ba
X
Câu
án D Tại đã
2BaOH 3 OH n0,32moln0,64mol,AlOH Tacó: 4 3 3 BaSO OHAlAl n0,3mol 0,64 n4nn0,16mol 4 Tại , kết tủa đạt cực đại nêntaxéthai trường hợp: maxvà 2BaOH OH nxmoln2xmol
4
Không
4 2 3
2
nn0,3mol m0,32330,047873,02gamn0,1640,60,04mol x0,3mol Câu 13: Đáp án C . 3 H Al n0,6amol;n0,6bmol Tại , kết tủa chưa đạt cực đại. NaOH n2,4bmol 3 AlOH Tacó: . 3 NaOHHAlOH 2,4b0,6ann3n2,4b0,6a3yy3 Tại , kết tủa đã đạt cực đại và bị hòatan một phần. NaOH n1,4amol 3 AlOH Tacó: . 3 3 NaOH AlOHHAl nn4nn1,4a0,6a4.0,6by 2,4b0,6a1,4a0,6a40,6b a:b8:32,672,7 3 Câu 14: Đáp án A 3 H Al n2ymol;n2xmol
Bảo toàn điện tích:
AlOOH
nn0,040,02 n 0,03mol 22
Bảo toànnguyên tố Ba,Al: 2 2 Ba Al Ba AlO nn0,03mol;nn0,04mol
Bảo toànelectron: .
2 BaAlOH
OX 0,03.20,04.30,08.22n3n2n2nn 0,01mol 2
m0,031370,04270,01165,35gam
12: Đáp
bị hòatan hết.
3 AlOH max.
BaSO TH1: Kết tủa gồm maxvà . 3 AlOH 4BaSO Tacó: . 3 3 AlOHmaxAlOH 11 nnn.2x0,16x0,24mol 33
thỏa mãn đồ thị. 1 m0,16.780,24.23364,8gam69,9
BBaSO aOH
AlOH
kết tủa cực đại.
cực
và bị hòatan một phần.
DẠYKÈMQUYNHƠN OFFICIAL Trang76
Tacó: 2 HAlOOH n4nn2xy4y1,31 Tại gam, kết tủa cực đại gồm maxvà . m70 4BaSO 3 AlOH Tacó: . 2 24 4 HSOpuBaSOBa H nnnxmoln2xmol . 3AlOH 4y2x2xy n 3ymol233x78y702 Từ (1)và(2)suyra: x0,2;y0,3 . Al m0,3.278,1gam
Theo đồ thị: .2y0,4y0,2 Tại , chưa
OH n0,7mol 3 AlOH Tacó: . 3 3AlOHAlOHOHH 0,70,4nn3nn 0,1mol 3 Tại , đã kết tủa
đại
OH n1,1mol 3 AlOH Tacó: . 3 3 3AlOHOHHAl Al 1,10,40,1nn4nnn 0,2mol 4 2x0,2x0,1 x:y0,1:0,21:2 Câu 15: Đáp án A Xét : 2 AlBaOH Gọi số mol vàAl lần lượt làxvàymol. 2 BaOH Sơ đồ phản ứng: 2 2 2 ymolxmol du Ba:xmol AlBaOHXAlO:ymol OH
Bảo toàn điện tích: . 2 2OHBaAlO n2nn2xymol
Xét : 24XHSO Tại hay bị hòatan hết. V1300ml 3 H n1,3mol,AlOH
CHƯƠNG 7: SẮT VÀ MỘT SỐ KIM LOẠI QUAN TRỌNG
BÀI 15: SẮT VÀ HỢP CHẤT CỦA SẮT
Mục tiêu
Kiến thức
+ Chỉ ra được vị trí, cấu hìnhelectron lớp ngoàicùng,tính chất vật lý của sắt.
+Trìnhbày được tính chất hoá học của sắt: tính khử trungbình(tác dụng với oxi, lưu huỳnh, clo, nước, dung dịch axit,dung dịch muối).
+Phântích được tính khử của hợp chất sắt(II) vàtínhoxihóa của hợp chất sắt(III).
+Nêu được thành phần của gangvàthép.
+Trìnhbày được nguyên tắc điều chế và ứng dụng của sắt và một số hợp chất của sắt. Kĩ năng
+ Viết được phương trìnhhóa học và phương trìnhionthu gọn minh họa tính chất hóa học của sắt và hợp chất của sắt...
OFFICIAL
+ Nhận biết được ionFe2+,Fe3+ trongdung dịch.
+Phân biệt được một số đồ dùng bằng gang,thép.
+ Giải cácbài tập hóa học cóliênquan như: xác định kim loại dựa vào số liệu thực nghiệm, tính phần trăm khối lượng kim loại hoặc oxitkim loại trong hỗn hợp, tính khối lượng quặng...
DẠYKÈMQUYNHƠN
Trang1
I. LÍ THUYẾT TRỌNG TÂM
A. SẮT
1. Vị trí trong bảng tuần hoàn
Cấu hình:Fe :[Ar]3d64s2 . Z26
→ Fe thuộc ô26,chukì4,nhómVIIIB.
2. Tính chất vật lí
Kim loại màu trắng, hơi xám, khối lượng riêng lớn. Dẫn điện, dẫn nhiệt tốt. Cótính nhiễm từ.
3. Tính chất hóa học Tính khử trungbình.
•Tác dụng với phikim: Ở nhiệt độ cao, sắt khử được nguyên tử phi kim thànhionâm.
•Tác dụng với axit: HCl,H2SO4 loãng+Fe → Muối Fe2+ +H2 HNO3,H2SO4 đặc, nóng+Fe → Muối Fe3++SPK +H2O
•Tác dụng với muối:
Fe chỉ khử được những ion kim loại đứng sau nó trongdãy điện hóa(theoquy tắc α).
4. Trạng thái tự nhiên
Kim loại phổ biến thứ hai,sauAl. Tồn tại chủ yếu ở dạng hợp chất (quặng).
Ví dụ: Fe + S FeS
2O
OFFICIAL
Ví dụ: Fe + 2HCl → FeCl2 + H2 Ví dụ: Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O Chú ý: Fe bị thụ động hóa trong HNO3 đặc, nguội và H2SO4 đặc, nguội.
Ví dụ: Fe + CuSO4 → FeSO4 + Cu
Ví dụ: Quặng hematit đỏ: Fe2O3 khan. Quặng hematit nâu: Fe2O3.nH2O. Quặng manhetit: Fe3O4 (giàu sắt nhất, hiếm). Quặng xiđerit: FeCO3 Quặng pirit: FeS2
Sắt còn có mặt trong hemoglobin (hồng cầu của máu) → Vận chuyển oxi.
B. HỢP CHẤT CỦA SẤT
1. Hợp chất Fe (II)
Tính khử đặc
DẠYKÈMQUYNHƠN
Trang2
trưng: Fe2+ → Fe3+ +e
t 3Fe +
2 Fe3O4 t 2Fe + 3Cl2 2FeCl3 t
•FeO: Chất rắn, màu đen, khôngcótrong tự nhiên.
Làoxit bazơ. Cótính khử. Điều chế: DùngH2 hayCO khử Fe2O3. Nhiệt phân Fe(OH)2 trong điều kiện không có khôngkhí. Fe(OH)2 FeO+H2O t •Fe(OH)2: Chất rắn, màu trắng hơi xanh,khôngtan trong nước.
Cótính bazơ. Cótính khử. Điều chế: Cho muối sắt(II) tác dụng với dung dịch kiềm
Fe2+ +2OH → Fe(OH)2↓ • Muối Fe(II): Đa số tantrong nước. Cótính khử.
Điều chế: Cho Fe (hoặc FeO, Fe(OH)2) tác dụng với axitHCl hoặc H2SO4 loãng.
2. Hợp chất Fe (III)
Tínhoxihóa đặc trưng: Fe3+ +1e → Fe2+ • Fe2O3: Chất rắn màu đỏ nâu, không tan trong nước.
Làoxit bazơ. Cótínhoxihóa.
Điều chế: Phân hủy Fe(OH)3.
2Fe(OH)3 Fe2O3 +3H2O t •Fe(OH)3: Chất rắn, màunâu đỏ, khôngtantrong nước.
Cótính bazơ.
Điều chế: Cho muối sắt(III) tác dụng với dung dịch kiềm.
Fe3+ +3OH → Fe(OH)3↓
• Muối Fe(III): Đa số đều tantrong nước. Cótínhoxihóa.
C. HỢP KIM CỦA SẮT
Ví dụ: FeO + 2HCl → FeCl2 + H2O
Ví dụ: FeO + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O
Ví dụ: Fe2O3 + CO 2FeO + CO2 t
Ví dụ: Fe(OH)2 + 2HCl → FeCl2 + 2H2O
Ví dụ: 4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3↓
OFFICIAL
Ví dụ: 2FeCl2 + Cl2 → 2FeCl3 Chú ý: Muối sắt(II) điều chế được phải dùng ngay vì để trong không khi sẽ chuyển dần thành muối sắt(III).
Ví dụ: Fe2O3 + 6HCl → FeCl3 + 3H2O
Ví dụ: Fe2O3 + 3H2 2Fe + 3H2O t
Ví dụ: 2Fe(OH)3 + 6HCl → 2FeCl3 + 3H2O
Ví dụ: 2FeCl3 + Fe → 3FeCl2
DẠYKÈMQUYNHƠN
Trang3
1. Gang
• Gang là hợp kim của sắt với cacbon trong đó có
từ 2 - 5% khối lượng cacbon, ngoài ra còn một lượng nhỏ cácnguyên tố Si,Mn,S...
•Phân loại:
Gang xám: chứa cacbon ở dạng than chì, dùng để đúc bệ máy, ống dẫn nước.
Gang trắng: chứa ít cacbon hơn ở dạng xementit(Fe3C),dùng để luyện thép.
• Nguyên tắc sản xuất: Khử quặng oxit bằng than cốc tronglòcao.
2. Thép
• Thép là hợp kim của sắt chứa từ 0,01 - 2% khối lượng của cacboncùng với một số nguyên tố khác (Si,Mn,Cr,Ni...)
•Phân loại:
Thép mềm: chứa không quá 0,1% C, dùng để kéo sợi, chế tạo vật dụng trong đời sống vàxây dựng nhà cửa.
Thép cứng: chứa trên0,9%C,dùng để chế tạo công cụ, chi tiết máy.
Thép đặc biệt: đưa thêm một số nguyên tố làmchothépcó những tính chất đặc biệt.
• Nguyên tắc sản xuất: Giảm hàm lượng các tạp chất C, S, Si, Mn, ... có trong gang bằng cách oxi hóacác tạp chất đó thànhoxit rồi biến thành xỉ và táchra khỏi thép.
SƠ ĐỒ HỆ THỐNG HÓA
SẮT
Vị trí trong bảng tuần hoàn
OFFICIAL
Ví dụ: Vòng bi, vở xe bọc thép
Ví dụ: Thép chứa 13% Mn rất cứng được dùng làm máy nghiền đá.
+ Sắt thuộc ô26,nhómVIIIB,chukì4trong bảng tuần hoàn.
+ Số oxihóatrong hợp chất: +2,+3.
Trạng thái tự nhiên
+ Sắt làkim loại phổ biến sauAl.
+Trong tự nhiên, sắt tồn tại chủ yếu ở dạng hợp chất.
Fe2O3 khan: Quặng hematit đỏ.
DẠYKÈMQUYNHƠN
Trang4
Fe2O3.nH2O: Quặng hematitnâu.
Fe3O4: Quặng manhetit(giàu sắt nhất nhưng hiếm).
FeCO3:Quặng xiđerit.
FeS2: Quặng pirit sắt.
+ Sắt còncótronghemoglobin của máulàm nhiệm vụ vận chuyển, duytrì sự sống.
Tính chất vật lí
+Màu trắng hơi xám,có khối lượng riêng lớn (kim loại nặng).
+ Dẫn điện và nhiệt tốt. Khác với kim loại khác, sắt cótính nhiễm từ.
Tính chất hóa học
+Tác dụng với phikim:
+Tác dụng với axit:
Fe+HCl/H2SO4 loãng → Muối Fe(II)+H2
Fe+HNO3/H2SO4 đặc, nóng → Muối Fe(III)+SPK+H2O
Chú ý: Fe bị thụ động hóatrongdung dịch HNO3 đặc, nguội vàH2SO4 đặc, nguội.
+Tác dụng với muối: Fe khử được muối của kim loại đứng saunótrongdãy điện hóa.
HỢP CHẤT VÀ HỢP KIM CỦA SẤT
HỢP CHẤT CỦA SẤT
Hợp chất sắt (II)
+Cótính khử (đặc trưng) vàtínhoxihóa.
FeO:oxit bazơ, chất rắn, màu đen. Fe(OH)2: bazơ, chất rắn, màu trắng hơi xanh.
Muối Fe(II):màu lục nhạt.
Các phản ứng quan trọng:
4Fe(OH)2 +O2 +2H2O → 4Fe(OH)3
Fe(OH)2 FeO+H2O t khoângcoùkhoângkhí
Fe2+ +Ag+ → Fe3+ +Ag
Hợp chất sắt (III) +Cótínhoxihóa.
Fe2O3:oxit bazơ, chất rắn, màu đỏ nâu.
Fe(OH)3: bazơ, chất rắn, màunâu đỏ.
Muối Fe(III):màuvàngnâu.
Các phản ứng quan trọng: 2Fe(OH)3 Fe2O3 +3H2O t
2FeCl3 +Fe → 3FeCl2
2FeCl3 +H2S → 2FeCl2 +S+2HCl
DẠYKÈMQUYNHƠN
Trang5
OFFICIAL
2FeCl3 +2KI → 2FeCl2 +I2 +2KCl
HỢP KIM CỦA SẤT
Gang
Khái niệm
Là hợp kim của Fe với Cvà lượng nhỏ Si,Mn,S...
Hàm lượng cacbon:2%-5%
Nguyên tắc
Khử quặng oxit (thường làFe2O3) bằng than cốc tronglòcao.
Thép
Khái niệm
Là hợp kim của Fe,CvàSi,Mn,Cr,Ni,...
Hàm lượng cacbon:0,01-2%
Nguyên tắc
Oxihóacác tạp chất C,S,Si,Mn,...cótronggang.
II. CÁC DẠNG BÀI TẬP
Dạng 1: Lý thuyết trọng tâm
Kiểu hỏi 1: Lý thuyết về sắt Ví dụ mẫu
OFFICIAL
Ví dụ 1: Kim loại Fe không phản ứng với chất nàosau đây trongdung dịch?
A. CuSO4. B. MgCl2. C. FeCl3. D. AgNO3. Hướng dẫn giải
Fecó thể khử được ion của cáckim loại đứng saunótrongdãy điện hóa của kim loại nênFe phản ứng được với Cu2+,Fe3+,Ag+ Phương trìnhhóa học: Fe+CuSO4 → FeSO4 +Cu Fe+2FeCl3 → 3FeCl2 Fe+2AgNO3 → Fe(NO3)2 +2Ag → Fekhông phản ứng được với dung dịch MgCl2. → Chọn B. Ví dụ 2: Cho bột Fevàodung dịch AgNO3
DẠYKÈMQUYNHƠN
Trang6
dư. Saukhi phản ứng xảy rahoàntoàn,thu được dung dịch gồm các chất tanlà: A. Fe(NO3)2;Fe(NO3)3. B. Fe(NO3)2;AgNO3. C. Fe(NO3)3;AgNO3. D. Fe(NO3)2;Fe(NO3)3;AgNO3. Hướng dẫn giải Ban đầu khichoFevàodung dịch AgNO3: Fe+2AgNO3 → Fe(NO3)2 +2Ag Sau đó, AgNO3 còn dư nên xảy ra phản ứng:
Fe(NO3)2 +AgNO3 → Fe(NO3)3 +Ag
→ Saukhi phản ứng xảy rahoàntoàn,thu được dung dịch chứa chất tan:Fe(NO3)3 vàAgNO3 còn dư.
→ Chọn C.
Chú ý: Khi Fe tác dụng với muối Ag dư luôn thu được muối Fe(III).
Kiểu hỏi 2: Lý thuyết về hợp chất của sắt
Ví dụ mẫu
Vi dụ 1: Thành phần chính của quặng manhetitlà
A. Fe2O3. B. FeCO3. C. Fe3O4. D. FeS2.
Hướng dẫn giải
Các quặng sắt quan trọng:
Quặng manhetit:Fe3O4;
Quặng hematit đỏ: Fe2O3;
Quặng hematitnâu:Fe2O3.nH2O;
Quặng xiđerit: FeCO3;
Quặng pirit:FeS2.
→ Thành phần chính của quặng manhetitlàFe3O4
→ Chọn C.
Ví dụ 2: Phát biểu nàosau đây sai?
A. Hàm lượng cacbontrongthépcao hơn tronggang.
B. Sắt làkim loại màu trắng hơi xám, dẫn nhiệt tốt.
C. Quặng pirit sắt cóthành phần chínhlàFeS2.
OFFICIAL
D. Sắt(III) hiđroxit là chất rắn, màunâu đỏ, khôngtantrong nước.
Hướng dẫn giải
Hàm lượng cacbontrongthép khoảng 0,01-2% thấp hơn trongganglà2-5% → Asai. Sắt làkim loại màu trắng, hơi xám, dẫn nhiệt tốt → B đúng.
Quặng pirit sắt cóthành phần chínhlàFeS2 → C đúng.
Fe(OH)3 là chất rắn, màunâu đỏ, khôngtantrong nước → D đúng.
→ Chọn A. Ví dụ 3: HòatanhoàntoànFe3O4 vàodung dịch HCl dư được dung dịch X.ChiaXlàmba phần rồi tiến hànhbathí nghiệm:
TN1:ThêmNaOH dư vào phần một được kết tủa Y.NungYtrongkhôngkhí đến khối lượng không đổi.
TN2:Cho bột Cuvào phần hai.
TN3: Sục khíCl2 vào phần ba.
Số phản ứng oxihóa- khử xảy ralà A. 2. B. 3. C. 4. D. 5.
DẠYKÈMQUYNHƠN
Trang7
Hướng dẫn giải
HòatanhoàntoànFe3O4 vàodung dịch HCl dư:
Fe3O4 +8HCl → 2FeCl3 +FeCl2 +4H2O
→ Dung dịch X gồm: FeCl3,FeCl2 vàHClcòn dư.
TN1:ThêmNaOH dư vào phần một được kết tủa Y.NungYtrongkhôngkhí đến khối lượng không đổi.
FeCl3 +3NaOH → Fe(OH)3 +3NaCl
FeCl2 +2NaOH → Fe(OH)2 +2NaCl
HCl+NaOH → NaCl+H2O
2Fe(OH)3 Fe2O3 +H2O t
4Fe(OH)2 +O2 2Fe2O3 +4H2O t
→ Có1 phản ứng oxihóa- khử.
TN2:Cho bột Cuvào phần hai:
Cu+2FeCl3 → CuCl2 +2FeCl2
→ Có1 phản ứng oxihóa- khử.
TN3: Sục khíCl2 vào phần ba:
Cl2 +2FeCl2 → 2FeCl3
→ Có1 phản ứng oxihóa- khử.
OFFICIAL
Vậy tổng có3 phản ứng oxihóa- khử. → Chọn B. Ví dụ 4: ChoamolFetác dụng với amolkhíCl2 thu được hỗn hợp rắn X.ChoXvào nước, thu được dung dịch Y (biết các phản ứng xảy rahoàntoàn).Chocác chất (hoặc hỗn hợp các chất) sau:AgNO3, NaOH,Cu,HCl, hỗn hợp KNO3 vàH2SO4 loãng. Số chất (hoặc hỗn hợp các chất) có thể tác dụng được với dung dịch Ylà
DẠYKÈMQUYNHƠN
Trang8
A. 2. B. 4. C. 3. D. 5. Hướng dẫn giải Phương trìnhhóa học: 2Fe+3Cl2 → 2FeCl3 Ban đầu: a amol Phản ứng: amol 2a 3 2a 3 Sau phản ứng: 0mol a 3 2a 3 Hỗn hợp rắn X gồm: FevàFeCl3. SaukhichovàoH2OthìFe dư phản ứng vừa đủ với FeCl3 tạo dung dịch FeCl2
→ Các chất (hoặc hỗn hợp chất) có thể tác dụng được với dung dịch Ylà:AgNO3,NaOH, hỗn hợp
KNO3 vàH2SO4 loãng.
→ Chọn C
Bài tập tự luyện dạng 1
Bài tập cơ bản
Câu 1: Cấu hìnhelectronnàosau đây là của Fe?
A. [Ar]4s23d6 . B. [Ar]3d64s2 . C. 3d8 . D. [Ar]3d74s1 .
Câu 2: Kim loại Fe không tác dụng với dung dịch
A. CuSO4. B. HCl. C. FeCl3. D. AlCl3.
Câu 3: Các số oxihóa thường gặp của sắt là
A. +2,+4. B. +1,+2. C. +2,+3. D. +1,+2,+3.
Câu 4: Cấu hìnhelectronnàosau đây là của ionFe2+?
A. [Ar]3d6 B. [Ar]3d5 C. [Ar]3d4 D. [Ar]3d3
Câu 5: Quặng nàosau đây có chứa oxit sắt?
OFFICIAL
A. Đolomit. B. Xiđerit. C. Hematit. D. Boxit. Câu 6: Hợp chất nàosau đây của sắt vừa cótínhoxihóa, vừa cótính khử?
A. FeO. B. Fe2O3 C. Fe(OH)3 D. Fe.
Câu 7: Kim loại Fe bị thụ động bởi dung dịch
A. HCl đặc, nguội. B. H2SO4 loãng. C. HClloãng. D. HNO3 đặc, nguội. Câu 8: Chất cótínhoxihóa nhưng khôngcótính khử là
A. FeO. B. Fe2O3 C. Fe. D. FeCl2 Câu 9: Trongcác loại quặng sắt, quặng cóhàm lượng sắt cao nhất là
A. pirit sắt. B. manhetit. C. xiđerit. D. hematit đỏ. Câu 10: Chodung dịch FeCl3 tác dụng với dung dịch NaOH tạo thành kết tủa cómàu
A. nâu đỏ. B. trắng. C. xanh thẫm. D. trắng xanh. Câu 11: Haidung dịch đều phản ứng được với kim loại Felà
A. CuSO4 vàZnCl2 B. CuSO4 vàHCl. C. ZnCl2 vàFeCl3 D. HClvàAlCl3 Câu 12: Phản ứng giữa cặp chất nào dưới đây không tạo thành muối Fe(II)?
A. FeO+HCl. B. Fe(OH)2 +H2SO4 loãng, C. FeCO3 +HNO3 loãng. D. Fe+Fe(NO3)3. Câu 13: Dãy gồm cáckim loại đều tác dụng với dung dịch FeCl3 là:
A. Fe,Mg,Cu,Ag,Al. B. Cu,Ag,Au,Mg,Fe. C. Fe,Zn,Cu,Al,Mg. D. Au,Cu,Al,Mg,Zn.
Câu 14: ChoNavàodung dịch FeSO4 ta thấy xuất hiện
A. bọt khíthoátra. B. chất rắn màuxám trắng bámlên bề mặt kim loại Na.
C. bọt khíthoátravàcó kết tủa màu trắng xanh, kết tủa hóanâutrongkhôngkhí.
D. có kết tủa màuxanh lục.
Câu 15: NhúngthanhFevàodung dịch CuSO4.Sau một thời gian, hiện tượng quansát được là:
DẠYKÈMQUYNHƠN
Trang9
A. ThanhFecómàu trắng vàdung dịch nhạt dần màuxanh.
B. ThanhFecómàu trắng xámvàdung dịch nhạt dần màuxanh,
C. ThanhFecómàu đỏ vàdung dịch nhạt dần màuxanh.
D. ThanhFecómàu đỏ vàdung dịch dần cómàuxanh.
Câu 16: Tiến hànhcácthí nghiệm sau:
(1)CholáFevàodung dịch gồm CuSO4 vàH2SO4 loãng.
(2)CholáCuvàodung dịch gồm Fe(NO3)3 vàH2SO4 loãng.
(3)CholáZnvàodung dịch HCl.
(4) Để miếng gangngoàikhôngkhí ẩm. Số thí nghiệm xảy ra ăn mòn điện hóalà
A. 3. B. 4. C. 2. D. 1.
Câu 17: Cho từng chất: Fe, FeO, Fe(OH)2, Fe(OH)3, Fe3O4, Fe2O3, Fe(NO3)2, Fe(NO3)3, FeCO3, Fe2(SO4)3 lần lượt phản ứng với dung dịch H2SO4 đặc, nóng và dung dịch HCl. Số trường hợp xảy ra phản ứng oxihóa- khử là
OFFICIAL
A. 8. B. 10. C. 9. D. 7. Câu 18: Chocácphát biểu sau:
(a)NhúngthanhFevàodung dịch FeCl3 xảy ra ăn mòn điện hóa.
(b) Sục khíH2Svàodung dịch CuSO4 thấy xuất hiện kết tủa xanh nhạt.
(c) Nhỏ dung dịch Na2CO3 vàodung dịch FeCl3 thấy xuất hiện kết tủa nâu đỏ vàkhí.
(d)NhúngthanhAlvàodung dịch NaOHloãng, nguội thấy thanhAltan dần.
(e) Đốt dây sắt trongkhíCl2 thấy tạo thành muối Fe(II)bámtrêndây sắt.
Số phát biểu đúng là
A. 3. B. 4. C. 5. D. 2.
Bài tập nâng cao
Câu 19: PhikimXtác dụng với kim loại Mthu được chất rắn Y.HòatanYvào nước được dung dịch Z. ThêmAgNO3 dư vàodung dịch Z được chất rắn G.ChoGvàodung dịch HNO3 đặc nóng dư thu được khímàunâu đỏ và chất rắn F.Kim loại Mvà chất rắn F lần lượt là A. AlvàAgCl. B. FevàAgCl. C. CuvàAgBr. D. FevàAgF. Câu 20: HòatanhoàntoànFe3O4 trongdung dịch H2SO4 loãng, dư, thu được dung dịch X.Trongcác chất: NaOH,Cu,Fe(NO3)2,KMnO4,BaCl2,Cl2 vàAl, số chất phản ứng được với dung dịch Xlà
DẠYKÈMQUYNHƠN
Trang10
Dạng 2: Tính chất của kim loại Ví dụ mẫu Ví dụ 1: ChomgamFetác dụng với oxithu được 23,2gamFe
O
trị
A. 16,8. B. 11,2.
dẫn giải 34FeO n0,1mol Phương
A. 7. B. 4. C. 6. D. 5.
3
4.Giá
của mlà
C. 8,4. D. 5,6. Hướng
trìnhhóa học:
3Fe+2O2 Fe3O4 t 0,3← 0,1 mol Fe m0,35616,8gam → Chọn A. Ví dụ 2: Hòatanhoàntoàn14,8gam hỗn hợp gồm FevàCutrongdung dịch HCl dư, sau phản ứng thu được 3,36lítH2 (đktc). Khối lượng Cucótrong hỗn hợp là A. 3,2gam. B. 6,4gam. C. 9,6gam. D. 12,8gam. Hướng dẫn giải 2H n0,15mol
DoCukhông phản ứng được với HClnêntacó phương trìnhhóa học: Fe+2HCl → FeCl2 +H2 0,15 ← 0,15mol Fe m0,15.568,4gam Cu m14,88,46,4gam → Chọn B. Ví dụ 3: Cho16,8gamFevào200mldung dịch CuSO4 0,75M.Sau một thời gian lấy thanh sắt racân nặng 17,6gam. Khối lượng đồng bámtrênthanh sắt là A. 19,2gam. B. 6,4gam. C. 0,8gam. D. 9,6gam. Hướng dẫn giải ; Fe n0,3mol
DẠYKÈMQUYNHƠN
Trang11
OFFICIAL
chaátraéntaêng m64.156.18gam xxmol chaátraéntaêng m64x56x8xgam Theo đề bài: taêng m17,616,80,8gam 8x0,8 x0,1 → Khối lượng đồng bámtrênthanh sắt là: Cu m0,1646,4gam → Chọn B. Ví dụ 4: ChoagamFetác dụng với dung dịch HNO3 thu được 2,24lítkhíNO (sản phẩm khử duy nhất, ở đktc), dung dịch Xvàcòn dư 5,6gamFe.Cô cạn Xthu được bgam muối khan.Giá trị của a,b lần lượt là: A. 14,0;27,0. B. 8,4;27,0. C. 14,0;36,3. D. 11,2;27,0.
4CuSO n0,15mol
Phương trìnhhóa học: Fe+CuSO4 → FeSO4 +Cu 11 mol
Hướng dẫn giải NO n0,1mol Dosau phản ứng còn dư Fenên muối thu được là muối sắt(II). Quátrìnhcho nhận electron: 2 FeFe2e 5 2N3eNe Bảo toànelectron: FepöNO2n3n Fepö 30,1 n20,15mol Tacó: FepöFedö amm0,15565,614gam Bảo toànnguyên tố: 32FepöFeNO nn0,15mol
32FeNO bm0,1518027gam → Chọn A. Chú ý: Khi hỗn hợp kim loại có chứa Fe, mà sau phản ứng với HNO3 hoặc H2SO4 đặc nóng, sau phản ứng có kim loại còn dư thì thu được muối Fe(II) Ví dụ 5: ChoagamFevào100mldung dịch hỗn hợp gồm HNO3 0,8MvàCu(NO3)2 1M.Saukhicác phản ứng xảy rahoàntoàn,thu được 0,92agam hỗn hợp kim loại vàkhíNO (sản phẩm khử duy nhất của N+5).Giá trị của alà A. 8,4. B. 11,0. C. 11,2. D. 5,6. Hướng dẫn giải
DẠYKÈMQUYNHƠN OFFICIAL Trang12
3HNO
2Cu
3HNO
Gọi số mol của Fe phản ứng làxmol. Quátrìnhcho nhận electron: 2 FeFe2e 3 2 4HNO3eNO2HO x → 2xmol0,080,06mol 2 Cu2eCu 0,10,20,1mol Bảo toànelectron: 2x0,060,2 x0,13 Tacó: giaûm ma0,92a0,08agam Lại có: giaûmFepöCu mmm0,13560,1640,88gam 0,08a0,88gam
;
n0,08mol
n0,1mol
nn0,08mol
→ Chọn B. Ví dụ 6: Đốt 8,4gam bột sắt trongkhíclo một thời gian đến khi phản ứng hoàntoàn,thu được 15,5gam chất rắn X.Chotoàn bộ chất rắn Xvàodung dịch AgNO3 dư, khuấy đều, saukhicác phản ứng xảy ra hoàntoàn,thu được mgam kết tủa. Giá trị của mlà A. 57,7. B. 55,7. C. 39,5. D. 28,7. Hướng dẫn giải Fe n0,15mol Bảo toàn khối lượng: 2 FeClX mmm 2Cl m15,58,47,1gam 2Cl n0,1mol
Phương trìnhhóa học: 2Fe+3Cl2 → 2FeCl3 0,150,1 → mol 1 15 → Chất rắn X gồm: Fe dư ( mol)vàFeCl3 ( mol). 1 12 1 15 KhichoXvàodung dịch AgNO3: Fe+2FeCl3 → 3FeCl2 → 0,1mol 1 12 1 15
DẠYKÈMQUYNHƠN
Trang13
OFFICIAL
a11
→ keáttuûaAgAgCl mmmm0,251080,2143,555,7gam → Chọn B. Chú ý: Có thể dùng bảo toàn e để giải nhanh bài toán Bài tập tự luyện dạng 2 Bài tập cơ bản
Chomgam sắt tác dụng vừa đủ với agamkhíclo,sau phản ứng thu được 32,5gamFeCl3.Giá trị của alà A. 21,3. B. 14,2. C. 13,2. D. 23,1. Câu 2: Cho6gamFevào100mldung dịch CuSO4 1M.Saukhi phản ứng xảy rahoàntoàn,thu được m gam hỗn hợp kim loại. Giá trị của mlà
→ Sau phản ứng: Fecòn dư: 0,05molvà0,1molFeCl2 Fe+3AgNO3 dư → Fe(NO3)3 +3Ag 0,05 →0,15 mol FeCl2 +3AgNO3 → Fe(NO3)3 +2AgCl+Ag 0,1 → 0,20,1 mol
Câu 1:
A. 7,0. B. 6,8. C. 6,4. D. 12,4. Câu 3: Cho0,3mol hỗn hợp FevàFeOtan vừa hết trongdung dịch H2SO4 loãng,thu được khíH2 và dung dịch chứa mgam muối. Giá trị của mlà
A. 45,6. B. 30,4 C. 60,0. D. 30,0. Câu 4: Choamol sắt tác dụng với 1,25amolkhíclo,thu được hỗn hợp rắn X.ChoXvào nước, thu được dung dịch Y. Biết các phản ứng xảy rahoàntoàn.Các chất trongdung dịch Ylà
A. FeCl3 B. FeCl2 C. FeCl2,Fe. D. FeCl2,FeCl3 Câu 5: HòatanhoàntoànFevàodung dịch H2SO4 loãng vừa đủ thu được 4,48lítH2 (đktc). Cô cạn dung dịch trong điều kiện khôngcóoxithu được 55,6gam muối. Công thức phân tử của muối là
A. FeSO4. B. Fe2(SO4)3. C. FeSO4.9H2O. D. FeSO4.7H2O. Câu 6: Choamol sắt tác dụng với amolkhíclo,thu được hỗn hợp rắn X.ChoXvào nước thu được dung dịch Y, nhỏ AgNO3 dư vàodung dịch Ythu được 79gam kết tủa. Biết các phản ứng xảy rahoàn toàn.Giá trị alà
OFFICIAL
A. 0,10. B. 0,15. C. 0,20. D. 0,25. Câu 7: ChomgamFevàodung dịch chứa 1,38molHNO3, đun nóng đến kết thúc phản ứng còn0,75m gam chất rắn khôngtanvàcó0,38mol hỗn hợp NO,NO2 (khôngcòn sản phẩm khử khác)thoátra ở đktc. Giá trị của mlà
A. 70. B. 56. C. 84. D. 112. Câu 8: Cho8,4gamFevàodung dịch HNO3 loãng.Saukhi phản ứng xảy rahoàntoànthu được 2,688lít khíNO (đktc, là sản phẩm khử duy nhất) vàdung dịch A. Khối lượng Fe(NO3)3 trongdung dịch Alà A. 14,95gam. B. 21,95gam. C. 16,54gam. D. 14,52gam. Câu 9: Cho45gam hỗn hợp bột FevàFe3O4 vàoVlítdung dịch HCl1M, khuấy đều để các phản ứng xảy rahoàntoàn, thấy thoátra4,48lítkhí (đktc) và5gamkim loại khôngtan.Giá trị của Vlà A. 0,4. B. 0,6. C. 1,2. D. 1,4. Câu 10: Cho27,75gam hỗn hợp A gồm Fe,Fe3O4 tác dụng với 300mldung dịch HNO3 aM.Saukhi phản ứng xảy rahoàntoànthu được 3,36lítkhíNO,là sản phẩm khử duy nhất (đktc), dung dịch Bvà 2,19gamkim loại chưa tan.Giá trị của alà
A. 3,2. B. 1,2. C. 2,4. D. 1,6. Bài tập nâng cao Câu 11: Hòatan1,12gamFe bằng 300mldung dịch HCl0,2M,thu được dung dịch XvàkhíH2.Cho dung dịch AgNO3 dư vàoXthu được khíNO (sản phẩm khử duy nhất của N+5)vàmgam kết tủa. Biết các phản ứng xảy rahoàntoàn.Giá trị của mlà
A. 7,36. B. 8,61. C. 9,15. D. 10,23. Câu 12: Đốt cháy16,8gam bột FetrongVlít (đktc) hỗn hợp khí gồm Cl2 vàO2 thu được hỗn hợp rắn X gồm cácoxitvà muối (không thấy khíthoátra).HòatanXtrong480mldung dịch HCl1M,thu được dung dịch Y.Chodung dịch AgNO3 dư vàoY, thấy thoátra0,03molkhíNO (sản phẩm khử duy nhất của N+5), đồng thời thu được 132,39gam kết tủa. Giá trị của Vlà A. 6,272. B. 6,720. C. 7,168. D. 5,600. Dạng 3: Hợp chất của sắt Bài toán 1: Quy đổi tương đương hỗn hợp oxit sắt Phương pháp giải
DẠYKÈMQUYNHƠN
Trang14
Hỗn hợp oxit sắt (FeO,Fe2O3,Fe3O4)
+ Thường được quy đổi hỗn hợp thành hỗn chứa FeOvàFe2O3
+ Nếu ,thìtaquy đổi hỗn hợp thành chỉ chứa Fe3O4. 23FeOFeOnn Ví dụ mẫu
Ví dụ 1: Cho7,68gam hỗn hợp gồm FeO,Fe3O4,Fe2O3 tác dụng vừa hết với 260mldung dịch HCl1M thu được dung dịch X.Chodung dịch X phản ứng với dung dịch NaOH dư thu được kết tủa Y.NungY ngoàikhôngkhí đến khối lượng không đổi, thu được mgam chất rắn. Giá trị của mlà A. 16,0. B. 8,0. C. 24,0. D. 12,0. Hướng dẫn giải HCl n0,26mol Quy đổi hỗn hợp oxit sắt ban đầu gồm FeO(xmol)vàFe2O3 (ymol). 72x160y7,68 * Phương trìnhhóa học: FeO+2HCl → FeCl2 +H2O x 2xmol Fe2O3 +6HCl → 2FeCl3 +3H2O y6ymol 2x6y0,26
OFFICIAL
DẠYKÈMQUYNHƠN
Trang15
HCl NaOH
FFeOH
FeO
Bảo
tố Fe: 2FeO → Fe2O3 0,04 → 0,02mol Fe2O3 → Fe2O3 0,03 → 0,03mol 23FeO mm0,051608gam → Chọn B. Chú ý: Có thể quy đổi hỗn hợp thành Fe và O Ta có: OH 1 nn0,13mol 2 Fe 7,680,13.16 n 56 0,1mol Bảo toàn nguyên tố Fe:
** Từ và suyra: ; ***x0,04 y0,03 Tacóquátrình:
2 2 2O,t
23 23 3 3
FeCl eO
FeOFeClFeOH
toànnguyên
23 FeOFe 1 nn0,05mol 2 23FeO n0,05.160 8gam Ví dụ 2: Hỗn hợp A gồm FeO,Fe2O3,Fe3O4 (trong đó số molFeO bằng số molFe2O3.Hòatan46,4gam trongdung dịch H2SO4 loãng dư thu được 200mldung dịch X. Thể tíchdung dịch KMnO4 0,1M cần thiết để phản ứng hết 100mldung dịch Xlà A. 200ml. B. 500ml. C. 250ml. D. 150ml. Hướng dẫn giải Số molFeO bằng số molFe2O3 nên hỗn hợp Acoi như là chỉ gồm Fe3O4 A n0,2mol Phương trìnhhóa học: Fe3O4 +4H2SO4 → Fe2(SO3)3 +FeSO4 +4H2O 0,2 → 0,2 →0,2 mol Dung dịch X gồm: Fe2(SO4)3;FeSO4 vàH2SO4 dư. 100mldung dịch X phản ứng với KMnO4: 10FeSO4 +2KMnO4 +8H2SO4 → 5Fe2(SO4)3 +2MnSO4 +K2SO4 +8H2O 0,1 →0,02 mol 4KMnO V0,020,2lit200ml 0,1 → Chọn A. Bài toán 2: Quy đổi hỗn hợp thành các nguyên tố Phương pháp giải Ví dụ: Nung nóng 12,6 gam Fe ngoài không khí, sau một thời gianthu được mgam hỗn hợp X gồm Fe, FeO, Fe2O3 và Fe3O4 Hỗn hợp này phản ứng với dung dịch H2SO4 đặc, nóng dư, thu được 4,2lít khí SO2 (sản phẩm khử duy nhất, ở đktc). Giá trị của mlà A. 18. B. 16. C. 15. D. 12. Hướng dẫn giải Tacóquátrình:12,6gamFe
DẠYKÈMQUYNHƠN
Trang16
2
23 34 Fe
24
OFFICIAL
O
FeO X FeO FeO
HSOñaëc,noùng,dö 2 4,2lítSOñktc
, Fe n0,225mol 2SO n0,1875mol
Hỗn hợp gồm Fevàoxit sắt được quy đổi về Fe,O. Hỗn hợp gồm Fe,FeS,FeS2 được quy đổi về Fe,S.
Bước 1: Viết quá trình nhường nhận electron cho cả quá trình (đầu - cuối) và áp dụng định luật bảo toànelectron.
Bước 2: Kết hợp bảo toàn khối lượng, bảo toàn nguyên tố tínhtheoyêu cầu đề bài.
Coi hỗn hợp X gồm Fe(0,225mol)vàO(xmol). Quátrìnhcho nhận electron: Fe → Fe+3 +3e 0,225 → 0,675 mol O+2e → O2–x → 2xmol S+6 +2e →S+4 0,1875 → 0,375mol Bảo toànelectron: 0,6752x0,375 x0,15 Bảo toàn khối lượng: XFeO mmm 0,225560,1516 15gam → Chọn C. Ví dụ mẫu Ví dụ 1: Cho6,72gam hỗn hợp gồm Fe,FeO,Fe2O3,Fe3O4 phản ứng hết với 500mldung dịch HNO3 aMloãng dư thu được 0,448lítkhíNO (đktc, là sản phẩm khử duy nhất) vàdung dịch X.Dung dịch Xcó thể hòatan tối đa 8,4gamFe.Giá trị của alà A. 1,50. B. 1,14. C. 1,11. D. 0,57 Hướng dẫn giải
DẠYKÈMQUYNHƠN
Trang17
OFFICIAL
Coi hỗn
Fe(xmol)vàO(ymol). 56x16y6,72 * Tacóquátrình: 3 8,4gamFe2 2 500mlddHNOaM 1 DdXFe Fe 6,72gamO 0,448litNO Xét ,quátrìnhcho nhận electron: 1 Fe → Fe+3 +3eO+2e → O–2 x → x → 3x moly →2y mol N+5 +3e → N+2 0,06 ←0,02 mol Bảo toànelectron: 3x2y0,06 3x2y0,06 **
NO n0,02mol
hợp gồm
và suyra: ;
**x0,09 x0,105 Dung dịch X gồm Fe3+ (0,09mol)vàH+, còn dư phản ứng tối đa với 0,15molFe: 3NO Fe+ 2Fe3+ → 3Fe2+ 0,045 ← 0,09 → 0,135mol 3Fe+8H+ +2 → 3Fe2+ +2NO+4H2O 3NO 0,105 → 0,105 → 0,07mol Tacó:
NOFe n2n20,1350,1050,48mol
NO n0,070,020,09mol
cả quátrình:
NONOtrongmuoá
nn n0,480,090,57mol 0,57 a1,14 0,5
Chọn B. Ví dụ 2: Hòatanhoàntoàn3,76gam hỗn hợp X ở dạng bột gồm S,FeSvàFeS2 trongdung dịch HNO3 đặc, nóng, dư, thu được 0,48molNO2 (sản phẩm khử duy nhất) vàdung dịch Y.Chodung dịch Ytác dụng với dung dịch Ba(OH)2 dư, lọc vànung kết tủa đến khối lượng không đổi thu được mgam hỗn hợp rắn Z.Giá trị của mlà A. 11,650. B. 12,815. C. 17,545. D. 15,145 Hướng dẫn giải Coi hỗn hợp X gồm Fe(amol)vàS(bmol). 56a32b3,76
DẠYKÈMQUYNHƠN OFFICIAL Trang18
* Tacóquátrình: 2 2 3 3 BaOHdö O,t 23 3 HNOñaëc,noùng,dö 2 4 4 4 2 FeOH FeO Fe DdY Z Fe BaSO SO BaSO S 0,48molNO Quátrìnhcho nhận electron: Fe → Fe+3 +3e N+5 +1e → N+4 a →a →3a mol 0,48 ← 0,48mol S → S+6 +6e b →b →6b mol Bảo toànelectron: 3a6b0,48 ** Từ và suyra: ; ***a0,03 b0,065 Bảo toànnguyên tố Fe: 3 23 FeOFe 1 nn0,015mol 2
Từ
*
2 3
Xét
3 3 HNO
i
→
Chọn C. Bài toán 3: Khử oxit sắt, sản phẩm thu được tác dụng với chất oxi hóa mạnh Phương pháp giải Tacóquátrình:
Bước 1: Viết quátrình nhường nhận electroncho cả quátrình (đầu - cuối) vàáp dụng định luật bảo toàn electron. Bước 2: Kết hợp bảo toàn khối lượng, bảo toànnguyên tố tínhtheoyêu cầu đề bài. Ví dụ mẫu Ví dụ 1: Cho một luồng khíCO đi qua ống sứ đựng mgamFe2O3 nungnóng.Sau một thời gianthu được 10,44gam chất rắn X gồm Fe,FeO,Fe2O3 vả Fe3O4.Hòatan hết Xtrongdung dịch HNO3 đặc, nóng dư thu được 4,368lítNO2 (sản phẩm khử duy nhất ở đktc). Giá trị của mlà A. 8. B. 12. C.10. D. 6. Hướng dẫn giải
DẠYKÈMQUYNHƠN OFFICIAL Trang19
23
mmm
→
324 HNO/HSOñaëc,t CO 3 xy 3423 2 FeOXFeO,FeO,FeO,Fe FeSPKHO
2
Tacóquátrình: 3 HNOñaëc,noùng,dö 2 CO 23 23 34 2 Fe FeO 10,44gamX 0,195molNO FeO mgamFeO FeO CO Quátrìnhcho nhận electron: C+2 → C+4 +2eN+5 +1e → N+4 Bảo toànelectron: 2CONO 2nn0,195mol CO n0,0975mol Bảo toànnguyên tố C: 2 COCO nn0,0975mol Bảo toàn khối lượng: 23 2FeOCOXCO mmmm m0,0975.2810,440,0975.44 m12 → Chọn B.
Bảo toànnguyên tố S: 6 4 BaSOS nn0,065mol
4FeOBaSO
0,015.1600,065.233
17,545gam
NO n0,195mol
Bài tập tự luyện dạng 3 Bài tập cơ bản
Câu 1: Khử hoàntoàn4,8gamFe2O3 bằng CO dư ở nhiệt độ cao. Khối lượng Fethu được sau phản ứng là
A. 3,36gam. B. 2,52gam. C. 1,68gam. D. 1,44gam. Câu 2: Cho2,32gamFe3O4 tác dụng vừa đủ với Vmldung dịch H2SO4 0,2Mloãng.Giá trị của Vlà
A. 300. B. 100. C. 400. D. 200. Câu 3: Thêmdung dịch NaOH dư vàodung dịch chứa 0,3molFe(NO3)3 Lọc kết tủa, đem nung đến khối lượng không đổi thì khối lượng chất rắn thu được là
A. 24,0gam. B. 96,0gam. C. 32,1gam. D. 48,0gam. Câu 4: Khử hoàntoàn17,6gam hỗn hợp X gồm Fe,FeO,Fe2O3 cần 2,24lítCO (ở đktc). Khối lượng sắt thu được là
OFFICIAL
A. 5,6gam. B. 8,0gam. C. 6,72gam. D. 16,0gam. Câu 5: Hòatan1,16gam hỗn hợp FeO,Fe2O3,Fe3O4 (trong đó số molFeO bằng số molFe2O3), cần vừa đủ Vmldung dịch HCl0,1M.Giá trị của Vlà
A. 400. B. 160. C. 800. D. 180. Câu 6: Khử hoàntoàn một oxit sắt X ở nhiệt độ cao cần vừa đủ VlítkhíCO (ở đktc), sau phản ứng thu được 0,84gamFevà0,02molkhíCO2.Công thức của Xvàgiá trị V lần lượt là
A. Fe2O2 và0,440. B. FeOvà0,224. C. Fe3O4 và0,448. D. Fe2O3 và0,224. Câu 7: ChokhíCO đi qua ống chứa 10gamFe2O3 đốt nóng,thu được mgam hỗn hợp X (gồm baoxit). Hỗn hợp X đem hoàtrongHNO3 đặc, nóng, dư thu được 8,96lítNO2.Giá trị của mlà
A. 8,4. B. 7,2. C. 6,8. D. 5,6. Câu 8: Hỗn hợp chất rắn A gồm 16gamFe2O3 và23,2gamFe3O4.HòatanhoàntoànA bằng dung dịch HCl dư thu được dung dịch B. ChoNaOH dư vảo dung dịch B,thu được kết tủa C. Lọc bỏ kết tủa, rửa sạch rồi đem nungtrongkhôngkhí đến khối lượng không đổi thu được mgam chất rắn D. Giá trị của mlà A. 80,0. B. 32,8. C. 40,0. D. 16,0. Câu 9: Đem hòatan5,6gamFetrongdung dịch HNO3 loãng,saukhi kết thúc phản ứng, còn lại 1,12 gam chất rắn không tan. Lọc bỏ chất không tan, lấy dung dịch thu được cho vào lượng dư dung dịch AgNO3, thấy xuất hiện mgam chất rắn khôngtan.Giá trị của mlà A. 4,48. B. 8,64. C. 6,48. D. 19,36. Câu 10: Đốt cháyxmolFe bằng oxithu được 5,04gam hỗn hợp A. HòatanA bằng dung dịch HNO3 dư thu được 0,035mol hỗn hợp Y gồm NOvàNO2 (sản phẩm khử duy nhất). Tỉ khối hơi của Y đối với H2 bằng 19.Giá trị của xlà
A. 0,04. B. 0,05. C. 0,06. D. 0,07. Câu 11: Trộn 100mldung dịch FeCl2 1Mvào100mldung dịch AgNO3 2,5Mthu được mgam kết tủa. Giá trị của mlà
DẠYKÈMQUYNHƠN
Trang20
A. 28,7. B. 35,9. C. 14,4. D. 34,1. Câu 12: Cho20gam hỗn hợp gồm Fe,FeO,Fe3O4,Fe2O3 tác dụng vừa hết với 700mldung dịch HCl 1Mthu được dung dịch Xvà3,36lítkhíH2 (đktc). ChoX phản ứng với dung dịch NaOH dư thu được kết tủa Y.NungYngoàikhôngkhí đến khối lượng không đổi thu được mgam chất rắn. Giá trị của mlà
A. 16,8. B. 24,0. C. 24,8. D. 35,6. Câu 13: Cho9,12gam hỗn hợp gồm FeO,Fe2O3,Fe3O4 tác dụng với dung dịch HCl dư. Saukhicác phản ứng xảy rahoàntoàn,thu được dung dịch X.Cô cạn dung dịch Xthu được mgamFeCl2 và9,75gam FeCl3.Giá trị của mlà
A. 8,75. B. 7,62. C. 7,80. D. 6,72. Câu 14: Hòatanhoàntoàn hỗn hợp gồm 0,08molFeS2 vàxmolCu2SvàoaxitHNO3 (vừa đủ), thu được dung dịch X (chỉ chứa hai muối sunfat)vàkhíduy nhất NO.Giá trị của xlà
OFFICIAL
A. 0,03. B. 0,06. C. 0,08. D. 0,04. Bài tập nâng cao Câu 15: Nung một hỗn hợp rắn gồm amolFeCO3 vàbmolFeS2 trongbìnhkín chứa khôngkhí (dư). Sau khicác phản ứng xảy rahoàntoàn, đưa bình về nhiệt độ ban đầu thu được chất rắn duy nhất làFe2O3 và hỗn hợp khí. Biết áp suất khítrongbình trước vàsau phản ứng bằng nhau, mối liên hệ giữa avàblà (biết saucác phản ứng, lưu huỳnh ở mức oxihóa+4)
A. . B. . C. . D. . a4b a2b ab a0,5b Câu 16: Cho8,16gam hỗn hợp X gồm Fe,FeO,Fe3O4 vàFe2O3 phản ứng hết với dung dịch HNO3 loãng (dung dịch Y),thu được 1,344lítNO (đktc) vàdung dịch Z.Dung dịch Zhòatan tối đa 5,04gamFe,sinh rakhíNO. Biết trongcác phản ứng, NOlà sản phẩm khử duy nhất của N+5 Số molHNO3 cótrongYlà A. 0,54mol. B. 0,78mol. C. 0,50mol. D. 0,44mol. Câu 17: Hòatanhoàntoàn4,56gam hỗn hợp X ở dạng bột gồm FeSvàFeS2 vàStrongdung dịch HNO3 đặc nóng dư thu được 0,48molNO2 (là sản phẩm khử duy nhất) vàdung dịch Y.Chodung dịch Ytác dụng với dung dịch Ba(OH)2 dư, lọc vànung kết tủa đến khối lượng không đổi, được mgam hỗn hợp rắn Z.Giá trị gần nhất của mlà A. 15,8. B. 20,5. C. 16,5. D. 18,5. Câu 18: Cho 5,8 gam muối FeCO3 tác dụng với dung dịch HNO3 vừa đủ, thu được hỗn hợp khí chứa CO2,NOvàdung dịch X.Chodung dịch HCl rất dư vàodung dịch X được dung dịch Y,dung dịch Ynày cần hòatan tối đa mgamCu,sinhra sản phẩm khử NOduy nhất. Giá trị của mlà A. 11,2. B. 16,0. C. 14,4. D. 9,6. Dạng 4: Bài tập tổng hợp Phương pháp giải Vận dụng linh hoạt định luật bảo toànnguyên tố, định luật bảo toàn khối lượng. Ví dụ mẫu
DẠYKÈMQUYNHƠN
Trang21
Ví dụ 1: Hòatan hết mgam hỗn hợp X gồm Fe,FeO,Fe2O3 vàFe3O4 vàodung dịch HCl dư, thu được a molH2 vàdung dịch chứa 31,19gam hỗn hợp muối. Mặt khác,hòatanhoàntoànmgamXtrongdung dịch chứa 0,55molH2SO4 (đặc) đun nóng,thu được dung dịch Yvà0,14molSO2 (sản phẩm khử duy nhất của S+6).Cho400mldung dịch NaOH1MvàoY,sau khỉ phản ứng kết thúc được 10,7gam một chất kết tủa. Giá trị của alà A. 0,05. B. 0,04. C. 0,06. D. 0,03. Hướng dẫn giải
DẠYKÈMQUYNHƠN OFFICIAL Trang22
NaOH OH
24HSO H
Sơ đồ phản ứng: 2 22 3 23 NaOH 3424d/n2 2 FFeCl e HClHHO FeClFeO XFeO dungdichYduynhat FeOHSOSO HO Gọi
*
Gọi số mol của Otrong hỗn hợp Xlàcmol. Xét phản ứng của của X với H2SO4 đặc, nóng. • Trường hợp 1:H2SO4 dư. → Kết tủa làFe(OH)3, 3FeOH n0,1mol Quátrìnhcho nhận electron: Fe → Fe+3 +3eO+2e → O2–S+6 +2e → S+4 Bảo toànelectron: 2FeOSO3n2n2n 3ab2c20,143a3b2c0,28 ** Tacó: 4H+ + +2e → SO2 +2H2O 2 4SO 0,56 ←0,14 mol Theo phương trình số molH+ phản ứng tạo raSO2 là0,56mol.
n0,4moln0,4mol
n0,55moln1,1mol
số mol của FeCl2,FeCl3 trong muối lần lượt làa,bmol. 127a162,5b31,19
Quy đổi hỗn hợp XthànhFevàO. Bảo toànnguyên tố Fe Fe nabmol
khác, bảo toàn điện tíchtrongYta thấy: Loại. 3 2 4FeSO 3n2n Giả sử Y chứa Fe2+: 2 2FeOH Fe 10,7 n0,12moln0,12mol 90 Mặt khác, bảo toàn điện tíchtrongY,ta thấy: Loại 2 2 4FeSO 2n2n
hợp 2không thỏa mãn đề bài.
Chọn D.
dụ
Trong quá trình bảo quản, một mẫu FeSO4.7H2O (có khối lượng m gam) bị oxi hóa bởi oxi khôngkhí tạo thành hỗn hợp X chứa các hợp chất của Fe(II)vàFe(III).Hòatantoàn bộ Xtrongdung dịch loãng chứa 0,035molH2SO4 thu được 100mldung dịch Y Thí nghiệm 1:Cho lượng dư dung dịch BaCl2 vào20mldung dịch Ythu được 2,33gam kết tủa. Thí nghiệm 2:Thêmdung dịch H2SO4 (loãng, dư) vào20mldung dịch Y,thu được dung dịch Z. Nhỏ từ từ dung dịch KMnO4 0,03MvàoZ đến khi phản ứng vừa đủ thì hết 18ml. Giá trị của mvà phần trăm số molFe(II) đã bị oxihóatrongkhôngkhí lần lượt là A. 13,90và27%. B. 4,17và5%. C. 13,90và73%. D. 4,17và10%.
DẠYKÈMQUYNHƠN OFFICIAL Trang23
2H
•
→
Fe3+ . TrongYcó: 2
O
Giả sử Y
Fe3+: 3 3FeOH Fe
Mặt
Hpö Hdö n0,562cmoln1,10,562cmol Dung dịch Y chứa Fe3+,H+ dư, 2 4SO KhichoNaOHvàodung dịch Y: 3 HFeOHOH n3nn
1,10,562c30,10,4 c0,22mol *** Từ , , suyra: ; . * *****a0,22 b0,02
Bảo toànnguyên tố Cl: 2 3 HClCFeClFeCl l nn2n3n HCl n2.0,223.0,020,5mol Bảo toànnguyên tố HvàO: 22 2 HClHHOHOX n2n2n2n2n
1 n.0,50,22.20,03mol 2
Trường hợp 2:H2SO4 không dư. Tacó:Y phản ứng với NaOHthu được kết tủa duy nhất
TrongY chứa muối duy nhất Fe2+ hoặc
4242 SHSOSO
nnn0,550,140,41mol
chứa
n0,1moln0,1mol
Trường
→
Ví
2:
N+5)có tỉ khối so với H2 là18,5. số mol của HNO3 phản ứng là A. 1,8. B. 3,2. C. 2,0. D. 3,8 Câu 2: Hòatan hết 23,18gam hỗn hợp X gồm Fe,MgvàFe(NO3)3 vàodung dịch chứa 0,92molHClvà 0,01molNaNO3,thu được dung dịch Y (chất tan chỉ chứa 46,95gam hỗn hợp muối) và2,92gam hỗn hợp Z gồm bakhíkhôngmàu(trong đó cóhaikhícó số mol bằng nhau).Dung dịch Y phản ứng tối đa
DẠYKÈMQUYNHƠN OFFICIAL Trang24
←
2 4
←
3 2 FeY Fe n0,0150,0135 .100% .100%10% n 0,015 → Chọn D. Bài tập tự luyện dạng 4 Câu 1: Hòatanmgam hỗn hợp X gồm FeO,Fe(OH)2,FeCO3 vàFe3O4 (trong đó Fe3O4 chiếm 1/3 tổng số mol hỗn hợp) vàodung dịch HNO3 loãng (dư), thu được 8,96lít (đktc) hỗn hợp khí gồm CO2 vàNO (sản phẩm khử duy nhất của
Hướng dẫn giải Xéttrong100mldung dịch Y: Sơ đồ phản ứng tạo dung dịch Y: 2 24 2 O 3 42HSO 2 4 Fe FeSO.7HOYFe SO Gọi số mol của FeSO4.7H2Ovà số molFe2+ lần lượt làx,ymol Bảo toànnguyên tố Fe 3Fe nxymol TrongYcó: 2 24 42 4 SHSOFeSO7HO O nnnx0,035mol Xéttrong20mldung dịch Y: •Thí nghiệm 1: 4BaSO n0,01mol Phương trìnhion: 22 4 4BaSOBaSO 0,01
0,01 mol Do đó:
SO 20.x0,035 n 0,01molx0,015mol 100
Khối lượng của mẫu là: 42 FeSO7HO mm0,015.2784,17gam
•Thí nghiệm 2: 4 4 KMnO n5,4.10mol Phương trìnhion: 2 32 4 2 8H5FeMnO5FeMn4HO
mol 32,710 45,410 3 20.y2,7.10y0,0135mol 100 Phần trăm Fe(II) bị oxihóa
với 0,91molKOH,thu được 29,18gam kết tủa. Biết các phản ứng xảy rahoàntoàn. Phần trăm thể tích của khícóphân tử khối lớn nhất trongZlà
A. 58,82%. B. 45,45%. C. 51,37%. D. 75,34%. Câu 3: Để mgam hỗn hợp E gồm Al,FevàCutrongkhôngkhí một thời gian,thu được 34,4gam hỗn hợp X gồm cáckim loại vàoxit của chúng.Cho6,72lítkhíCOquaXnungnóng,thu được hỗn hợp rắn Yvà hỗn hợp khíZcó tỉ khối so với H2 là18.HòatanhoàntoànYtrongdung dịch chứa 1,7molHNO3, thu được dung dịch chỉ chứa 117,46gam muối và4,48lít hỗn hợp khíT gồm NOvàN2O. Tỉ khối của T so với H2 là16,75.Giá trị của mlà A. 27. B. 31. C. 32. D. 28. Câu 4: Cho hỗn hợp X gồm Fe,Fe3O4 vàFe(NO3)2 tan hết trong 400 ml dung dịch KHSO4 0,4M. Sau phản ứng thu được dung dịch Y chỉ chứa 29,52gam muối trunghòavà0,448lítNO (đktc, sản phẩm khử duy nhất). Chodung dịch NaOH dư vàoYthìcó8,8gamNaOH phản ứng. Dung dịch Yhòatan tối đa m gam bột Cu. Biết các phản ứng xảy rahoàntoàn.Giá trị của mlà
OFFICIAL
A. 0,96. B. 1,92. C. 2,24. D. 2,40. Câu 5: Hòa tan hết 15,0 gam hỗn hợp X gồm Fe, Fe3O4, FeCO3 và Fe(NO3)3 trong dung dịch chứa NaHSO4 và0,16molHNO3,thu được dung dịch Yvà hỗn hợp khíZ gồm CO2 vàNO (tỉ lệ mol tương ứng 1:4).Dung dịch Yhòatan tối đa 8,64gam bột Cu, thấy thoátra0,03molkhíNO. Nếu chodung dịch Ba(OH)2 dư vàoY,thu được 154,4gam kết tủa. Biết các phản ứng xảy rahoàntoànvàkhíNOlà sản phẩm khử duy nhất của cả quátrình. Phần trăm khối lượng của Fetrong hỗn hợp Xlà
A. 48,80%. B. 33,60%. C. 37,33%. D. 29,87%.
DẠYKÈMQUYNHƠN
Trang25
Dạng 1: Lí thuyết trọng tâm
1-B 2-D 3-C 4-A 5-C 6-A 7-D 8-B 9-B 10-A 11-B 12-C 13-C 14-C 15-C 16-C 17-A 18-D 19-C 20-A
Câu 7:
Kim loại Fe,Al,Cr đều bị thụ động bởi dung dịch H2SO4 đặc, nguội vàHNO3 đặc, nguội.
Câu 8: Fe2O3 có số oxihóa bằng +3(cao nhất) → Fe2O3 cótínhoxihóa nhưng khôngcótính khử.
Câu 10:
Phương trìnhhóa học:
FeCl3 +3NaOH → Fe(OH)3 +3NaCl (màunâu đỏ)
Câu 12: Csaivì xảy ra phản ứng oxihóa khử thu được muối sắt(III).
OFFICIAL
Câu 14:
Phương trình phản ứng: Na+H2O → NaOH+ H2↑ 1 2
FeSO4 +2NaOH → Fe(OH)2 ↓trắng xanh +Na2SO4 4Fe(OH)2 +O2 +2H2O → 4Fe(OH)3↓ nâu đỏ → Hiện tượng: có bọt khíthoátra(H2), xuất hiện kết tủa màu trắng xanh(Fe(OH)2)sau đó kết tủa hóa nâutrongkhôngkhí(Fe(OH)3).
Câu 15: Phương trìnhhóa học: Fe+CuSO4 → FeSO4 +Cu → Hiện tượng: ThanhFecómàu đỏ vàdung dịch nhạt dần màuxanh.
Câu 16:
(1) đúng vì tạo ra cặp điện cực kim loại Fe-Cucùng đặt trong một dung dịch chất điện li. (2),(3)vìkhôngcó cặp điện cực khác bản chất. (4) đúng vì tạo ra cặp điện cực Fe-Ccùng đặt trong một dung dịch chất điện li. Cácthí nghiệm xảy ra ăn mòn điện hóalà:(1),(4). Câu 17: Các
DẠYKÈMQUYNHƠN
Trang26 ĐÁP
ÁN
HCl:Fe,Fe(NO
Với H2SO4 đặc,
trường hợp xảy ra phản ứng oxihóa- khử là: Với
3)2.
nóng:Fe,FeO,Fe(OH)2,Fe3O4,Fe(NO3)2,FeCO3 Câu 18: (a)saivìkhông đủ điều kiện xảy ra ăn mòn điện hóa. (b)saivìsau phản ứng thu được kết tủa CuS(màu đen).
(c) đúng vìsau phản ứng thu được Fe(OH)3 (kết tủa màunâu đỏ) vàkhíCO2 thoátra.
(d) đúng vìAlcó khả năng phản ứng với NaOH.
(e)saivìsau phản ứng thu được muối Fe(III).
Câu 19:
Kim loại MlàFe,phikimXlàCl2.
Chất rắn Y:FeCl3,Fe dư.
Dung dịch Z:FeCl2,FeCl3
Chất rắn G:AgClvàAg. Chất rắn F:AgCl.
Câu 20:
Phương trìnhhóa học: Fe3O4 +4H2SO4 → FeSO4 +Fe2(SO4)3 +4H2O
→ Dung dịch X gồm: FeSO4,Fe2(SO4)3 vàH2SO4 dư. Các chất có khả năng phản ứng được với dung dịch Xlà:NaOH,Cu,Fe(NO3)2,KMnO4,BaCl2,Cl2, Al. Dạng 2: Tinh chất của kim loại
DẠYKÈMQUYNHƠN
Trang27
OFFICIAL
2 2 2 FeCl Cl Cl 0,2.3 n0,2moln0,3molm21,3gam
Fe
4CuSO
Phương
Fe+CuSO4 → FeSO4 +Cu 0,1 ← 0,1 → 0,1 mol FeduCu mmm60,1560,1646,8gam
Bảo
tố Fe: 4 FeSOFeFeO
4FeSO
Phương
2Fe+3Cl2 → 2FeCl3 ←1,25a → mol 5a 6 5a 6
1-A 2-B 3-A 4-D 5-D 6-C 7-D 8-D 9-C 10-A 11-C 12-B Câu 1:
2
Câu 2: ;
n0,107mol
n0,1mol
trìnhhóa học:
Câu 3:
toànnguyên
nnn0,3mol
mm0,315245,6gam
Câu 4:
trìnhhóa học:
Hỗn hơp rắn X chứa: FeCl3 ( mol);Fe dư ( mol) 5a 6 a 6 HòatanXvào nước: Fe+2FeCl3 → 3FeCl2 → mol a 6 5a 6 a 2 Dung dịch Y chứa: FeCl3 vàFeCl2. Câu 5: Phương trìnhhóa học: Fe+H2SO4 → FeSO4 +H2 0,2 ← 0,2 mol FeSO4 +xH2O → FeSO4.xH2O 0,2 → 0,2 mol
muoá i M278x7 → Công thức của muối làFeSO4.7H2O. Câu 6: Phương trìnhhóa học: 2Fe+3Cl2 → 2FeCl3 ← a → mol 2a 3 2a 3 Fe+2FeCl3 → 3FeCl2 → amol a 3 2a 3 FeCl2 +3AgNO3 → 2AgCl↓
DẠYKÈMQUYNHƠN OFFICIAL Trang28
+Ag↓ +Fe(NO3)3 a → 2a → amol Tacó: AgClAg mmm2a.143,5108a79gama0,2 Câu 7: Kết thúc phản ứng còn0,75mgam chất rắn khôngtan → Thu được muối Fe(II)và Fepu mm0,75m0,25mgam Gọi số molFe phản ứng làxmol. 32FepuFeNO nnxmol Tacó: 3pö 2 3 HNO NONONOtrongmuoá i nn nn 1,382x0,38x0,5 0,25m0,5.56m112gam Câu 8: ; Fe n0,15mol NO n0,12mol
Xét: Dung dịch A chứa hai muối: muối sắt(II) và muối Fe NO Fe 2n0,33n0,363n0,45 sắt(III). Gọi số molFe(NO3)2 vàFe(NO3)3 lần lượt làx,ymol. Bảo toànnguyên tố Fe: xy0,15 *
Quátrìnhcho nhận electron: Fe → Fe+2 +2eN+5 +3e → N+2 Fe → Fe+3 +3e Bảo toànelectron: 2x3y0,36 ** Từ và suyra: ; ***x0,09 y0,06 33FeNO m0,0624214,52gam
Câu 9: 2H n0,2mol Sau phản ứng còn5gamkim loại → Dung dịch chứa FeCl2 Quy đổi hỗn hợp phản ứng thànhFevàOcó số mol lần lượt làx,ymol. 56x16y45540 * Bảo toànelectron: 2FeOH 2n2n2nxy0,2 ** Từ và suyra: ; ***x0,6 y0,4 HClFe n2n0,621,2mol
DẠYKÈMQUYNHƠN OFFICIAL Trang29
HCl V1,21,2lit 1 Câu 10: Saukhi phản ứng hoàntoàncòn2,19gamkim loại
→
Aphaûnöùng m27,752,1925,56gam Gọi số molFevàFe3O4 phản ứng lần lượt làx,ymol. 56x232y25,56 * Quátrìnhcho nhận electron: Fe → Fe+2 +2e 8 2 3 3Fe2e3Fe N+5 +3e → N+2 Tacó: NO n0,15mol Bảo toànelectron: 2x2y0,45 ** Từ và suyra: ; ***x0,27 y0,045 Bảo toànnguyên tố Fe: 34 32FepuFeOFeNO nn3n0,2730,0450,405mol 3 3 HNO NONOtrongmuoá i nn n
chưa tan
Dung dịch B chứa muối sắt(II).
0,40520,15 0,96mol 0,96 a3,2 0,3
Câu 11: Phương trìnhhóa học: Fe +2HCl → FeCl2 +H2 0,02 → 0,04 → 0,02mol Dung dịch saucó:0,02molFeCl2 và0,02molHCl.
KhichoAgNO3 vàothì: 3Fe2+ +4H+ + → 3Fe3+ +NO+2H2O 3NO 0,015 ← 0,02 mol Fe2+ +Ag+ → Fe3+ +Ag 0,005 → 0,005mol Ag+ +Cl → AgCl 0,06 → 0,06mol raénAgAgCl mmm9,15gam
Câu 12: ; Fe n0,3mol HCl n0,48mol Tacó: HNO du Hpu n4n0,12moln0,480,120,36mol
toànnguyên tố
DẠYKÈMQUYNHƠN OFFICIAL Trang30
Ag
Tacó: AgClAg mmm143,52x0,481080,452x132,39x0,21 lít 22 XClO Vnn22,40,210,09.22,46,72 Dạng 3: Hợp chất sắt 1-A 2-D 3-A 4-D 5-A 6-C 7-C 8-C 9-B 10-D 11-D 12-B 13-B 14-D 15-C 16-C 17-C 18-B Câu 1: 23FeO n0,03mol Phương trìnhhóa học:
Bảo
O,H: 22 2 OHOHO 1 2nnnn0,36:40,09mol 2
Gọi số mol của Cl2 làxmol. Bảo toànnguyên tố Cl: 2 ClHClAgClAgCl 2nnnn2x0,48mol Bảo toànelectroncho cả quátrình: 22 FeClOAgNO 3n2n4nn3n
n3.0,32x4.0,093.0,030,452xmol
Fe2O3 +3CO 2Fe+3CO2 t 0,03 → 0,06mol Fe m0,06.563,36gam Câu 2: 34FeO n0,01mol Phương trìnhhóa học: Fe3O4 +4H2SO4 → FeSO4 +Fe2(SO4)3 +4H2O 0,01 → 0,04mol V0,040,2lit200ml 0,2 Câu 3: Tacóquátrình: NaOH t 3 23 3 3 FeNOFeOHFeO Bảo toànnguyên tố Fe: 23 33FeOFeNO 1 nn0,15mol 2 23FeO m0,1516024gam Câu 4: CO OCO FeXO n0,1molnn0,1molmmm17,60,11616gam
DẠYKÈMQUYNHƠN OFFICIAL Trang31
Câu 5: Số molFeO bằng số molFe2O3 → Quy đổi hỗn hợp ban đầu chỉ chứa Fe3O4 34 3 FeO n5.10mol Phương trìnhhóa học: Fe3O4 +8HCl → FeCl2 +2FeCl3 +4H2O →0,04 mol 35.10 HCl V0,040,4lit400ml 0,1 Câu 6: Fe n0,015mol 2OCO nn0,02mol Fe O n3 n4 → Oxit sắt làFe3O4 Lại có: 2COCO nn0,02molV0,448lit Câu 7: 2NO n0,4mol Bảo toànelectron: 2 CONOCO 0,4 2nnn0,2mol 2
DẠYKÈMQUYNHƠN OFFICIAL Trang32
Từ
y0,035 Câu 11: Phương trìnhhóa học: Fe2+ +Ag+ → Fe3+ +Ag Cl +Ag+ → AgCl TH1: Tạo AgCl tối đa trước → ; AgCl n0,2mol Ag n0,05mol m34,1gam TH2: Tạo Ag tối đa trước → ; Ag n0,1mol AgCl n0,15mol m32,325gam Thực tế cả hai phản ứng diễn ra đồng thời 32,325m34,1 Câu 12: 2 2 H H HpövôùiFe n0,15moln2n0,3mol
Mặt khác:
23 COOmaátñi XFeOOmaátñi nn0,2molmmm100,2.166,8gam Câu 8: ; 23FeO n0,1mol 34FeO n0,1mol Bảo toànnguyên tố Fe: 2334 FeOFeO D 2n3n n 0,25mol 2 D m0,2516040gam Câu 9: Sau phản ứng còn lại chất rắn không tan → Dung dịch chứa muối Fe(NO3)2, khi thêm AgNO3 vào dung dịch thu được chất rắn khôngtanlàAg. Fepu m5,61,124,48gam 2Fepu Ag Fe nn0,08moln
CrAg mm0,08.1088,64gam
Câu 10: Gọi số mol của NOvàNO2 trong hỗn hợp Y lần lượt làa,bmol. ab0,035 * Tacó: 2 Y Y Y H d19M38m380,0351,33gam30a46b1,33 ** Từ và suyra: ***ab0,0175 Gọi số mol của O2 làymol. 56x32y5,04 1 Bảo toànelectron: 2 2FeONONO 3n4n3nn3x4y0,07
2
và suyra: ; 12x0,07
DẠYKÈMQUYNHƠN OFFICIAL Trang33
FeO mmm9,120,031604,32gamn0,06mol Mà FeOFeCl FeCl nn0,06molm0,061277,62gam Câu 14: Dung dịch X chứa Fe2(SO4)3 vàCuSO4 Bảo toànnguyên tố Fe: 2FeS2 → Fe2(SO4)3 0,080,04 mol Cu2S → 2CuSO4 x2xmol Bảo toànnguyên tố S: 22 4 243 FeSCuS CuSOFeSO 2nn3nn 2.0,08x3.0,042x x0,04 Câu 15: Phương trìnhhóa học: 4FeCO3 +O2 → 2Fe2O3 +4CO2 a → → amol a 4 4FeS2 +11O2 → 2Fe2O3 +8SO2 b → → 2bmol 11b 4
HHCl Hpövôùioxit nn0,7moln0,4mol Phương trìnhhóa học: 2H+O → H2O 0,4→0,2 mol OtronghhOoxit nn0,2mol Fetronghh m200,2.1616,8gam Fetronghh n0,3mol Bảo toànnguyên tố: 23 FeFeOY 1 nn0,15mol 2 23FeO mm0,1516024gam Câu 13: 3FeCl n0,06mol CoiFe3O4 làFeOvàFe2O3 → Hỗn hợp gồm FeOvàFe2O3. Tacó: 3 23 23FeClFeOFeO 0,06 n2nn0,03mol 2 23FeOhhFeO
Áp suất khítrongbình trước vàsau phản ứng bằng nhau → Số molkhí trước vàsau phản ứng bằng nhau.
OCOSO
a11ba2bab 44
Câu 16: NO n0,06mol Dung dịch Z phản ứng được với tối đa 5,04gamFe → Dung dịch Z chứa HNO3 dư. Quy đổi hỗn hợp gồm FevàOcó số mol lần lượt làx,ymol. 56x16y8,16 * Bảo toànelectron: FeONO 3n2n3n3x2y0,18 ** Từ và suyra: ; . ***x0,12 y0,09 Xét cả quátrình: Fe 5,04 n0,120,21mol 56 Zhòatan tối đa Fenênsau phản ứng tạo Fe(II). Bảo toànelectron: FeNOONO 20,2120,092n3n2nn 0,08mol 3 Bảo toànnguyên tố Fe: 32FeFeNO nn0,21mol Bảo toànnguyên tố N: 32 3HNO NOFeNO n2nn0,2120,080,5mol
DẠYKÈMQUYNHƠN OFFICIAL Trang34
Câu 17: Quy đổi hỗn hợp XthànhFe,Scó số mol lần lượt làx,ymol. 56x32y4,56 * Bảo
2FeSNO 3n6nn3x6y0,48 ** Từ và suyra: ; ***x0,05 y0,055 Kết tủa: BaSO4,Fe(OH)3 → Hỗn hợp rắn Z:BaSO4,Fe2O3 Bảo toànnguyên tố S,Fe: ; 4 BaSOS nn0,055mol 23 Fe FeO n0,05 n 0,025mol 22 423 ZBaSOFeO mmm0,055.2330,025.16016,815gam Câu 18: 3FeCO n0,05mol Phương trìnhhóa học: 3FeCO3 +10HNO3 → 3Fe(NO3)3 +3CO2 +NO+5H2O
222
nnn
toànelectron:
DẠYKÈMQUYNHƠN OFFICIAL Trang35 Dung dịch Y chứa 3 2 3 2 2 FeNO:0,05molFeCl Cu NOHO CuCl HCl:d Để lượng Culà tối đa nên muối hìnhthànhlà muối Fe2+,Cu2+ VìHCl dư → 33
Bảo
3
e
2 Cu
Dạng 4: Bài tập tổng hợp 1-B
Câu
hhkhi
Sơ đồ phản ứng: 32HNO 3 22 3 3 34 FeO FeOH FeNONOCOHO FeCO FeO Tacó: hhkhi M18,5237 Gọi số mol của CO2 vàNOtrong hỗn hợp khí lần lượt làx,ymol. Ta được hệ phương trình: xy0,4xy0,244x30y0,437 Bảo toànelectron: 3 3 2 4 FeOFFeOFeCONO eOH nnnn3n0,2.30,6mol X n0,6mol MàFe3O4 chiếm 1/3 tổng số mol hỗn hợp 34FeO n0,6:30,2mol Bảo
tố Fe: 34 3 33 2 FeO FeOFeCOFeOH FeNOnn3nnn 33FeNO n0,60,20,231mol Bảo toànnguyên tố N: 3 33 HNOFNO eNO n3nn310,23,2mol Câu 2: Xét phản ứng: Y+NaOHthu được dung dịch chứa: Na+ (0,01mol),K+ (0,91mol),Cl (0,92mol) Nhận thấy: Bảo toàn điện tích vừa đủ → Ykhông chứa . NaKCl nnn 3NO Bảo toàn khối lượng cho phản ứng đầu: 3 2 XHClNaNOYZHO mmmmmm 2 2 HO HO m7,74gamn0,43mol Trongdung dịch Y, gọi ulà tổng khối lượng của Fe2+,Fe3+,Mg2+ vlà số mol của 4NH Tacó: 23 4 muoiFe,Fe,MgNaNHCl mmmmm
NOFeNO n3n0,15mol
toànelectron:
CuNOFCu
30,150,052n3nnn 0,25mol
m0,256416gam
2-B 3-D 4-C 5-C
1:
n0,4mol
toànnguyên
Z chứa H2 (0,01mol)vàhaitrongbakhíNO,N2,N2O.
TH1:Z chứa NOvàN2 có số mol lần lượt làa,bmol.
Bảo toànnguyên tố NvàOtrongZ ; (thỏa mãn) a0,05b0,05
TH2:Z chứa N2 vàN2Ocó số mol lần lượt làa,bmol.
Bảo toànnguyên tố N,OtrongZ ; mol (loại vìkhôngcó cặp khícùng số mol) a0,025 b0,05
TH3:Z chứa NOvàN2Ocó số mol lần lượt làa,bmol
Bảo toànnguyên tố N,OtrongZ → Loại vì số molâm. → TrongZ gồm H2 (0,01mol),NO(0,05mol)vàN2 (0,05mol)
DẠYKÈMQUYNHƠN OFFICIAL Trang36
u18v0,01230,9235,546,95 u18v14,06 * KhithêmNaOHvàodung dịch Y: OHtrongkeáttuû a n 0,91v klOH mmmu170,91v29,18
** Từ và suyra: ; ***u13,88 v0,01 Bảo toànnguyên tố H: 2 2 4 HClNHOH H n4n2n2n 2H n0,01mol Mặt khác: 3 3XklNONO 23,1813,88 mmmm 0,15mol 62 Bảo toànnguyên tố N: NZ n0,15mol Mà 2 Z HNZOZ OZ m2,92gammmmm0,05mol
Câu 3: , CO n0,3mol T n0,2mol Sơ đồ phản ứng: 3 2 3 3 HNO 2 O 2 CO 2 3 4 dö2 Al Fe NO Al Y CuTHO Kimloaïi NO FeX NO Oxit Cu NH Z:CO,CO Tacó: Z M18.236 Gọi số mol của CO,CO2 trong hỗn hợp Z lần lượt làx,ymol. Tacó hệ phương trình: xy0,3xy0,1528x44y360,3 2OCO nn0,15mol
NO %V45,45%
Tacó: YXO mmm34,40,15.1632gam
Quy đổi hỗn hợp Y gồm bakim loại (Al,Fe,Cu)vàO(amol).
Lại có: T M16,75233,5
Gọi số mol của NO,N2Otrong hỗn hợp T lần lượt làu,vmol. Tacó hệ phương trình: uv0,2u0,15 30u44v33,5.0,2v0,05
Gọi số molNH4NO3 trong hỗn hợp muối làbmol. Tacó:
DẠYKÈMQUYNHƠN OFFICIAL Trang37
YklO kl mmmmm3216a 1
2 43 3muoákl etraoñoåiONONONHNO NO nn2n8n3n8n Bảo toànnguyên tố N: 3 2 43 3muoáikl HNO NONONHNO NO nnn2n2n 1,74.0,1510.0,052a10ba5b0,3 2 Khối lượng muối saukhicô cạn: 43 3muoáikl muoáikl NHNO NO mmmm117,46gam m6230,1580,052a8b80b117,46 m124a576b64,76 3 Từ , và suyra: ; ; 1 23a0,25 b0,01 m28 Câu 4: , , NO n0,02mol NaOH n0,22mol 4KHSO n0,16mol Sơ đồ phản ứng: 4 2 KHSO 23 34 NaOH 2 43 32 NOHO Fe XFeO YFe,Fe,K SP SO,NO FeNO Gọi số mol của Fe2+,Fe3+ trong hỗn hợp Y lần lượt làa,bmol. Xét phản ứng của Y với dung dịch NaOH: 3 2OHFeFe n3n2n2a3b0,22 * Bảo toàn điện tíchtrongY: 2 3 2 4 3FeFeKSONO 2n3nn2nn 3NO n0,220,162.0,160,06mol Tacó: muoá i m56ab0,16390,16960,066229,52 ab0,075 ** Từ và suyra: ; . * ** 3a510 b0,07 KhichoYtác dụng với Cu:
DẠYKÈMQUYNHƠN OFFICIAL Trang38 Cu+ 2Fe3+ → 2Fe2+ +Cu2+ 0,035 ← 0,07mol Cu m0,035.642,24gam Câu 5: Cu
Nhận
Dung dịch Y phản ứng Cuthu được khíNO →Y chứa H+ và → Chỉ có muối Fe3+ 3NO tạo
Sơ đồ phản ứng chính: 4 3 3 34 NaHSO 2 HNO 2 3 2 43 32 Fe FeO Fe,H,NaNO X Y ZHO FeCO COSO,NO FeNO Xét phản ứng của Y với lượng tối đa Cu → Muối sắt chỉ có của Fe2+ Bảo toànelectron: 3 3CuNOFeFe 2n3nnn0,135.23.0,030,18mol Mặt khác: 4H+ + +3e → NO+2H2O 3NO 0,12 ← 0,03mol H n0,12mol Xét phản ứng Y với Ba(OH)2: 4 4 3 BaSOBaSOFeOH mmmm154,40,18.107135,14gam 2 4 4 4 BaSO NaHSOSOYNaY n0,58molnnn → Dung dịch Y chứa: Fe3+ (0,18mol),H+ (0,12mol), (0,58mol),Na+ (0,58mol), 2 4SO 3NO Bảo toàn điện tích: 3 2 4 3FeHNaSONO 3nnn2nn 3NO n0,18.30,120,580,58.20,08mol Bảo toànnguyên tố H: 4 3 2 2 NaHSOHNOHHOHO 0,580,160,12nnn2nn 20,31mol Bảo toàn khối lượng: 4 3 2 XNaHSOHNOYZHO mmmmmm Z m4,92gam Gọi số mol của CO2 vàNOtrongZ lần lượt làx,ymol. Tacó hệ phương trình: 44x30y4,92x0,03 x:y1:4y0,12 Bảo toànnguyên tố N: 3 3 3 2 HNO NO FeNO NO 2nnnn
n0,135mol
thấy:
thành.
DẠYKÈMQUYNHƠN OFFICIAL Trang39 32FeNO 0,080,120,16 n 20,02mol Bảo toànnguyên tố C: 3 2FeCOCO nn0,03mol Bảo toànnguyên tố O: 2 34 3 4 3 2 2 3 4 3 2 FeOFeCO NaHSOHNO NOCOHO FeNO SONO 4n3n6n4n3n4n3nn2nn 34FeO n0,01mol Bảo toànnguyên tố Fe: 3 34 3 32 FeFeOFeCO FeFeNOFe n3nnnnn0,1mol FeX %0,156 m137,33% 5
CHƯƠNG 7: SẮT VÀ MỘT SỐ KIM LOẠI QUAN TRỌNG
BÀI 14: CROM VÀ HỢP CHẤT CỦA CROM
Mục tiêu
Kiến thức
+Nêu được vị trí, cấu hìnhelectronhoá trị, tính chất vật lí (độ cứng, màu, khối lượng riêng) của crom, số oxihoá.
+Trìnhbày được tính chất hoá học của cromlàtính khử (phản ứng với oxi,clo, lưu huỳnh, dung dịch axit).
+ Chỉ ra được tính chất của hợp chất crom(III), Cr2O3, Cr(OH)3 (tính tan, tính oxi hoá và tính khử, tính lưỡng tính)
+ Chỉ ra được tính chất của hợp chất crom(VI), K2CrO4, K2Cr2O7 (tính tan, màu sắc, tính oxi hoá).
Kĩ năng
OFFICIAL
+ Viết được các phương trìnhhóa học thể hiện tính chất của cromvà hợp chất crom.
+ Giải được bài tập hóa học cóliênquan như: tính thể tích hoặc nồng độ dung dịch K2Cr2O7 tham gia phản ứng ...
DẠYKÈMQUYNHƠN
Trang1
I. LÍ THUYẾT TRỌNG TÂM
A. CROM
1. Vị trí trong bảng tuần hoàn
Cấu hình:Cr : Z24 51Ar3d4s
→Cr thuộc ô số 24,nhómVIB,chukì4trong bảng tuần hoàn.
2. Tính chất vật lí
Làkim loại màu trắng ánh bạc.
Làkim loại cứng nhất có thể rạch được thủy tinh.
3. Tính chất hóa học
Tính khử mạnh: ZnCrFe
•Tác dụng với phikim Ở nhiệt độ thường Cr chỉ tác dụng với flo, nhiệt độ caotác dụng với oxi,clo...
•Tác dụng với nước
Crkhôngtác dụng với nước docómàngoxit bảo vệ.
•Tác dụng với axit
HCl,H2SO4 loãng+Cr Cr2+ +H2 t HNO3,H2SO4 đặc, nóng+Cr → Cr3+ +SPK+H2O
4. Sản xuất, ứng dụng
Sản xuất: Tách Cr2O3 từ quặng cromit, sau đó điều chế bằng phương pháp nhiệt nhôm. Ứng dụng: Sản xuất thépkhông gỉ, mạ kim loại...
B.
HỢP CHẤT CỦA CROM
1. Hợp chất crom(II)
•CrO: Chất rắn, màu đen, khôngtantrong nước.
Oxit bazơ, cótính khử.
• Cr(OH)2: Chất rắn, màu vàng, không tan trong nước. Bazơ, cótính khử.
• Muối Cr(II):Cótính khử mạnh.
2. Hợp chất crom(III)
• Cr2O3: Chất rắn, màu lục thẫm, không tan trong nước.
Oxit lưỡng tính (giống Al) tan trong axit và kiềm đặc.
Độ cứng của crom chỉ kém kim cương.
OFFICIAL
Ví dụ: 4Cr + 3O2 2Cr2O3 t 2Cr + 3Cl2 2CrCl3 t
Ví dụ: Cr + 2HCl CrCl2 + H2 t
Ví dụ: Cr + 4HNO3 → Cr(NO3)3 + NO + 2H2O Chú ý: Cr bị thụ động trong axit HNO3 đặc, nguội và H2SO4 đặc, nguội.
Ví dụ: CrO + 2HCl → CrCl2 + H2O 4CrO + O2 2Cr2O3 t
Ví dụ: Cr(OH)2 + 2HCl → CrCl2 + 2H2O 4Cr(OH)2 + O2 + 2H2O → 4Cr(OH)3
Ví dụ: 2CrCl2 + Cl2 → 2CrCl3
DẠYKÈMQUYNHƠN
Trang2
•Cr(OH)3: Chất rắn, màu lục xám,khôngtantrong nước.
Là một hiđroxit lưỡng tính.
• Muối Cr(III):Cótínhoxihóavàtính khử.
Môi trường axitcótínhoxihóa. Môi trường kiềm cótính khử.
3. Hợp chất crom(VI)
•CrO3: Chất rắn, màu đỏ thẫm. Làoxitaxit.
Cótínhoxihóa mạnh.
• Muối Cr(VI):Cótínhoxihóa mạnh.
Trong môi trường thích hợp, các muối cromat và đicromat chuyển hóa lẫn nhautheocân bằng: 2 2 4 272 2CrO2HCrOHO
SƠ BỒ HỆ THỐNG HÓA
Ví dụ: Cr(OH)3 + NaOH → NaCrO2 + 2H2O Cr(OH)3 + 3 HCl → CrCl3 + 3H2O
Ví dụ: 2CrCl3 + Zn → 2CrCl2 + ZnCl2
Ví dụ: 2NaCrO2 + 3Br2 + 8NaOH → 2Na2CrO4 + 6NaBr + 4H2O
Ví dụ: CrO3 + H2O → H2CrO4 2CrO3 + H2O → H2Cr2O7
OFFICIAL
Chú ý: H2CrO4 và H2Cr2O7 không tách được ở dạng tự do, chỉ tồn tại trong dung dịch.
Chú ý: Một số chất vô cơ và hữu cơ như: S, P, C, C2H5OH bốc cháy khi tiếp xúc với CrO3 Ví dụ: 22 33 27 2 CrO6Fe14H6Fe2Cr7HO
Chú ý: Môi trường axit: dung dịch màu da cam. Môi trường kiềm: dung dịch màu vàng.
CROM:làkim loại cứng nhất, độ cứng chỉ kémkim cương Vị trí: + Cấu hìnhelectron: 51Ar3d4s → Thuộc ô số 24,nhómVIB,chukì4. Tính chất hóa học: +Tác dụng với phikim Ở nhiệt độ thường, Cr chỉ tác dụng với flo.
+Tác dụng với nước
Cromkhôngtác dụng với nước docómàngoxit bảo vệ.
+Tác dụng với axit
HCl,H2SO4 loãng,nóng → Cr2+ +H2
HNO3,H2SO4 đặc nóng → Cr3+ +SPK+H2O
Chú ý: Cr bị thụ động với axitHNO3 đặc nguội vàH2SO4 đặc nguội.
Ứng dụng, sản xuất
DẠYKÈMQUYNHƠN
Trang3
(màuvàng)(màudacam)
Ứng dụng: Sản xuất thépkhông gỉ, mạ kim loại...
Sản xuất: TáchCr2O3 từ quặng cromit,sau đó điều chế bằng phương pháp nhiệt nhôm.
HỢP CHẤT CỦA CROM
Cr(II)
+CrO:Oxit bazơ, cótính khử, màu đen.
+Cr(OH)2: bazơ, cótính khử, màuvàng.
+ Muối Cr(II):Cótính khử mạnh.
Cr(III)
+Cr2O3:Oxit lưỡng tính (giống Al),tantrongaxitvà kiềm đặc, màu lục.
+Cr(OH)3: Hiđroxit lưỡng tính (giống Al),màu lục xám.
+ Muối Cr(III):Cótínhoxihóavàtính khử.
Môi trường axitcótínhoxihóa.
Môi trường kiềm cótính khử.
Cr(VI)
+CrO3:Oxitaxit,tínhoxihóa rất mạnh, màu đỏ thẫm.
+ Muối Cr(VI):Cótínhoxihóa mạnh.
+Cân bằng chuyển hóa giữa muối cromatvà đicromat 2 2 4 272 2CrO2HCrOHO
màu vàngmàu da cam II. CÁC DẠNG BÀI TẬP
Dạng 1: Lí thuyết trọng tâm Kiểu hỏi 1: Lí thuyết về crom Ví dụ mẫu Ví dụ 1: Kim loại cromtantrongdung dịch
OFFICIAL
A. HNO3 đặc, nguội.
B. HClloãng,nóng. C. H2SO4 đặc, nguội. D. NaOHloãng,nóng. Hướng dẫn giải
Crom bị thụ động hóatrongdung dịch HNO3 đặc, nguội vàH2SO4 đặc, nguội → Cromkhôngtantrongdung dịch HNO3 đặc, nguội vàH2SO4 đặc, nguội → A,Csai.
Cromtan được trongdung dịch HClloãng,nóng tạo muối Crom(II)clorua → B đúng.
Cromkhôngtan được trongdung dịch NaOH → Dsai.
→ Chọn B.
Ví dụ 2: Cấu hìnhelectronnàosau đây là của ionCr3+?
A. [Ar]3d6 B. [Ar]3d5 C. [Ar]3d4 D. [Ar]3d3 Hướng dẫn giải
DẠYKÈMQUYNHƠN
Trang4
Cấu hìnhelectron của cromlà:[Ar]3d54s1 .
Tacó:Cr → Cr+3 +3e
[Ar]3d54s1 → [Ar]3d3
→ Cấu hìnhelectron của ionCr3+ là[Ar]3d3
→ Chọn D.
Ví dụ 3: Ứng dụng nàosau đây không phải của crom?
A. Có thể dùng cắt thủy tinh.
B. Tạo thép cứng, thépkhông gỉ, chịu nhiệt.
C. Cromlàkim loại nhẹ nên tạo các hợp kimdùngtrongngànhhàngkhông.
D. Dùng để mạ bảo vệ.
Hướng dẫn giải
A đúng vìcromlàkim loại cứng nhất nêncó thể dùng để cắt thủy tinh.
B đúng vìcromcó thể dùnglàm hợp kim cứng và chịu nhiệt tạo thép cứng, thépkhông gỉ, chịu nhiệt.
Csaivìcromlàkim loại nặng.
D đúng vì lớp mạ cromcótác dụng bảo vệ kim loại khỏi bị ăn mòn.
→ Chọn C.
Kiểu hỏi 2: Lí thuyết về hợp chất crom Ví dụ mẫu
Ví dụ 1: Phát biểu nàosau đây sai?
A. Crtác dụng được với dung dịch NaOH đặc.
B. CrOlàoxit bazơ, tan dễ dàngtrongdung dịch axit.
C. CrO3 tan dễ trong nước, tác dụng dễ dàng với dung dịch kiềm loãng.
D. Cr2O3 làoxit lưỡng tính,tantrongdung dịch axitvà kiềm đặc Hướng dẫn giải
AsaivìCrkhôngtác dụng được với dung dịch NaOH.
B,C,D đúng vìlàtính chất của một số hợp chất của crom.
→ Chọn A.
Ví dụ 2: Chocácphát biểu sau:
(a)Cr2O3 làoxit lưỡng tínhvà được dùng tạo màu lục cho đồ sứ, đồ thủy tinh.
(b)Trongcác phản ứng, cationCr3+ vừa thể hiện tính khử, vừa thể hiện tínhoxihóa. (c)Crom(VI)oxit bốc cháykhi tiếp xúc với lưu huỳnh, cacbon,photpho,amoniac. (d)Chovài giọt dung dịch NaOHvàodung dịch K2Cr2O7,màu của dung dịch khôngthay đổi. Số phát biểu đúng là A. 1. B. 2. C. 3. D. 4. Hướng dẫn giải
(a) đúng vìlàtính chất và ứng dụng của crom(III)oxit.
DẠYKÈMQUYNHƠN
Trang5
OFFICIAL
(b) đúng vìCr3+ có số oxihóatrunggiannên vừa thể hiện tính khử, vừa thể hiện tínhoxihóa.
(c) đúng vì crom(VI) oxit (CrO3) có tính oxi hóa mạnh nên bốc cháy khi tiếp xúc với lưu huỳnh, cacbon,photpho,amoniac. (d) sai vì ta có cân bằng: nên khỉ nhỏ thêm dung dịch NaOH vào 2 2 272 4 CrOHO2CrO2H
dung dịch muối đicromat thìdung dịch từ màudacam sẽ chuyển sangmàuvàng của muối cromat.
DẠYKÈMQUYNHƠN OFFICIAL Trang6
Ví dụ 3: Cho sơ đồ chuyển hóasau: 4 FeSOX NaOH NaOH,Y 227 243 2 24KCrOCr(SO)NaCrONaCrO Biết X,Ylàcác chất vô cơ. XvàY lần lượt là A. K2SO4 vàBr2. B. H2SO4 loãngvàBr2. C. NaOHvàBr2 D. H2SO4 loãngvàNa2SO4 Hướng dẫn giải Tacó sơ đồ: 4 FeSOX NaOH NaOH,Y 227 243 2 24 1 2 3 KCrOCr(SO)NaCrONaCrO Phương trìnhhóa học: 1 227 4242424242 3 3 KCrO6FeSO7HSOKSOCrSO3FeSO7HO (X) 224 2242 3 CrSO8NaOH2NaCrO3NaSO4HO 3 2 224 2 2NaCrO8NaOH3Br2NaCrO6NaBr4HO (Y) → X,Y lần lượt làH2SO4 loãngvàBr2. → Chọn B. Bài tập tự luyện dạng 1 Câu 1: Oxitnàosau đây làoxitaxit? A. Fe2O3. B. CrO3. C. FeO D. Cr2O3 Câu 2: Phát biểu nàosau đây sai? A. Crom thuộc chukì4,nhómVIA. B. Cromlàkim loại cứng nhất, C. Trong hợp chất, cromcó số oxihóa từ +1 đến +6. D. Cromcótính khử mạnh hơn sắt. Câu 3: Công thức hóa học của crom(III) hiđroxit là A. Cr2O3. B. CrO3. C. Cr(OH)3 D. Cr(OH)2 Câu 4: Chất được dùng để tạo màu lục cho đồ sứ, đồ thủy tinhlà: A. CrO. B. CrO3. C. Cr2O3. D. Cr(OH)3 Câu 5: Phản ứng nàosau đây tạo ra muối crom(II)?
→ Chọn C.
A. Cr+H2SO4 loãng, nóng →
B. CrO3 +KOH →
C. K2Cr2O7 +HBr → D. Cr+S →
Câu 6: Phát biểu nàosau đây sai?
A. Cr(OH)3 là hiđroxit lưỡng tính. B. CrOlàoxit bazơ.
C. CrO3 làoxit bazơ. D. Cr2O3 làoxit lưỡng tính
Câu 7: ChokhíCl2 tác dụng với dung dịch CrCl3 trongmôi trường NaOH. Sản phẩm thu được là:
A. NaCrO2,NaCl,NaClO,H2O. B. Na2CrO4,NaClO,H2O.
C. Na2CrO2,NaCl,H2O. D. Na2CrO4,NaCl,H2O.
Câu 8: Phát biểu nàosau đây sai?
A. Dung dịch K2Cr2O7 cómàudacam.
B. Cr2O3 tan được trongdung dịch NaOHloãng.
C. CrO3 làoxitaxit.
D. Trong hợp chất, cromcó số oxihóa đặc trưng là+2,+3,+6.
Câu 9: Cho sơ đồ: chứng tỏ: 2H2 4O27 H 2CrOCrO
A. Ion tòn tại trongmôi trường bazơ. 2 27CrO
B. Ion tồn tại trongmôi trường axit. 2 4CrO
C. Sự chuyển hóaqua lại giữa muối cromatvà muối đicromat.
OFFICIAL
D. Dung dịch từ màudacam chuyển sangdung dịch màuvàng . 2 4CrO 2 27CrO
Câu 10: Chất Xlà hợp chất của cromcó khả năng làm bốc cháyS,C,P,C2H5OHkhi tiếp xúc với nó.X là
A. Cr2(SO4)3 B. Cr2O3 C. Cr(OH)3 D. CrO3
Câu 11: Phát biểu nàosau đây sai?
A. Crom(VI)oxitlàoxit bazơ.
B. Ancoletylic bốc cháykhi tiếp xúc với CrO3
C. Khi phản ứng với dung dịch HCl,kim loại Cr bị oxihóathànhCr2+ .
D. Crom(III)oxitvàcrom(III) hiđroxit đều là chất cótính lưỡng tính.
Câu 12: Nhỏ từ từ dung dịch KOHvàodung dịch Cr2(SO4)3 đến dư, hiện tượng quansát được là:
A. Xuất hiện keo tủa màuvàng.
B. Xuất hiện kết tủa keomàu lục xám.
C. Xuất hiện kết tủa keomàuvàng,sau đó kết tủa tan dần tạo dung dịch màuxanh lục.
D. Xuất hiện kết tủa keomàu lục xám,sau đó kết tủa tan dần tạo dung dịch màuxanh lục.
Câu 13: Chocác chất sau:CrO3,Fe,Cr(OH)3,Cr. Số chất tantrong được trongdung dịch NaOHlà
A. 1. B. 2. C. 3. D. 4.
Câu 14:Chocác nhận định sau:
(a)Cromlàkim loại màu trắng ánh bạc, có độ cứng lớn nhất trong tất cả cáckim loại.
(b)Crom bị thụ động trongcácdung dịch axit như HNO3 đặc, nguội vàH2SO4 đặc, nguội.
(c)Trongcông nghiệp, crom được dùng để sản xuất thép.
(d)Cromtác dụng với dung dịch HCltheo tỉ lệ mol1:2.
DẠYKÈMQUYNHƠN
Trang7
Số nhận định đúng lả
A. 4. B. 2. C. 3. D. 1.
Câu 15: Chocácphát biểu sau:
(a)K2CrO4 cómàudacam,là chất oxihóa mạnh.
(b)Kim loại AlvàCr đều tantrongdung dịch kiềm đặc.
(c)Kim loại Crcó độ cứng cao nhất trongcác tất cả cáckim loại.
(d)Cr2O3 được dùng để tạo màu lục cho đồ sứ, đồ thủy tinh.
(e) Ở trạng thái cơ bản kim loại, cromcó6electron độc thân.
(f)CrO3 là một oxitaxit,là chất oxihóa mạnh, bốc cháykhi tiếp xúc với lưu huỳnh, photpho,... Số phát biểu đúng là
A. 3. B. 5. C. 4. D. 2.
Dạng 2: Bài tập về crom và hợp chất của crom
Bài toán 1: Bài tập về crom
Phương pháp giải
Viết phương trìnhhóa học vàtínhtheo phương trìnhhóa học.
Ví dụ mẫu
OFFICIAL
Ví dụ 1: Cho5,2gamCrtác dụng hoàntoàn với dung dịch HCl đặc, nóng, dư thu được xmolH2.Giá trị của xlà
A. 0,15. B. 0,20. C. 0,10. D. 0,25. Hướng dẫn giải Cr n0,1mol Phương trìnhhóa học: Cr+2HCl → CrCl2 +H2 0,1 → 0,1 mol 2H n0,1mol → Chọn C. Ví dụ 2: Hòatan hết 1,08gam hỗn hợp CrvàFetrongdung dịch HClloãng,nóngthu được 448mlkhí (đktc). Khối lượng cromcótrong hỗn hợp là
A. 1,015gam. B. 0,520gam. C. 0,065gam. D. 0,560gam. Hướng dẫn giải 2H n0,02mol Gọi số mol của CrvàFe lần lượt làx,ymol. 52x56y1,08
Phương trìnhhóa học: Cr+2HCl → CrCl2 +H2 x → x mol
DẠYKÈMQUYNHƠN
Trang8
*
Fe+2HCl → FeCl2 +H2 y → ymol 2H nxy0,02molxy0,02 ** Từ và suyra: ; ***x0,01 y0,01 Cr m0,01.520,52gam → Chọn B. Bài toán 2: Bài tập về hợp chất của crom Phương pháp giải Viết phương trìnhhóa học vàtínhtheo phương trìnhhóa học. Ví dụ mẫu Ví dụ 1: Cho sơ đồ: CrCl3 +KOH+Cl2 → K2CrO4 +KCl+H2O. Để oxihóahoàntoàn0,04molCrCl3 thànhK2CrO4 thì thể tíchCl2 tối thiểu (đktc) cần dùnglà A. 0,672lít. B. 1,344lít. C. 0,560lít. D. 0,896lít. Hướng dẫn giải Phương trìnhhóa học: 2CrCl3 +16KOH+3Cl2 → 2K2CrO4 +12KCl+8H2O 0,04 → 0,06mol lít 2Cl V0,0622,41,344 → Chọn B. Ví dụ 2: Cho0,6molKItác dụng hết với dung dịch K2Cr2O7 trongaxitsunfuricthìthu được một đơn chất, số mol của đơn chất là A. 0,3mol. B. 0,4mol. C. 0,5mol. D. 0,6mol. Hướng dẫn giải Phương trìnhhóa học: K2Cr2O7 +6KI+7H2SO4 → Cr2(SO4)3 +4K2SO
DẠYKÈMQUYNHƠN OFFICIAL Trang9
4 +3I2 +7H2O 0,6 → 0,3mol Tacó: 2I n0,3mol → Chọn A. Ví dụ 3: Thể tích của dung dịch K2Cr2O7 0,1M vừa đủ phản ứng với dung dịch chứa
4 trongmôi trường H2SO4 dư là A. 100ml. B. 150ml. C. 200ml.
dẫn giải Phương
K2Cr2O7 +6FeSO4 +7H2SO4 → Cr2(SO4)3 +3Fe2(SO4
3 +K2SO4 +7H2O 0,01← 0,06mol
0,06molFeSO
D. 250ml. Hướng
trìnhhóa học:
)
→ Chọn A.
Bài tập tự luyện dạng 2
Câu 1: Cho1,04gamCr phản ứng hết với dung dịch H2SO4 loãng, dư, đun nóngthu được VmlkhíH2 (đktc). Giá trị của Vlà A. 448. B. 896. C. 224. D. 672. Câu 2: Cho3,035gam hỗn hợp X gồm AlvàCrtác dụng hoàntoàn với dung dịch NaOH dư, thu được 1,512lítkhíH2 (đktc). Phần trăm về khối lượng của Crtrong hỗn hợp Xlà A. 60%. B. 40%. C. 55%. D. 50%.
Câu 3: Thể tích của dung dịch K2Cr2O7 0,05M vừa đủ phản ứng với dung dịch chứa 0,06 mol FeSO4 trongmôi trường H2SO4 dư là A. 100ml. B. 150ml. C. 200ml. D. 250ml. Câu 4: Cho0,8molKItác dụng hết với dung dịch K2Cr2O7 trongaxitsunfuricthìthu được một đơn chất, số mol của đơn chất thu được là A. 0,3. B. 0,4. C. 0,5. D. 0,6. Câu 5: Để oxihóahoàntoàn0,01molCrCl3 thànhK2CrO4 bằng Cl2 khicó mặt KOH, lượng tối thiểu Cl2 vàKOH tương ứng lần lượt là A. 0,030molvà0,080mol. B. 0,015molvà0,040mol. C. 0,015molvà0,080mol. D. 0,030molvà0,030mol.
DẠYKÈMQUYNHƠN
Trang10
ddKCrO
OFFICIAL
Tacó: 227 227 KCrO
0,01n0,01molV 0,1lít100ml 0,1
Dạng 1: Lí thuyết trọng tâm
1-B 2-A 3-C 4-C 5-A 6-C 7-D 8-B 9-C 10-D 11-A 12-D 13-B 14-A 15-C
Câu 1:
Fe2O3,FeOlàoxit bazơ.
Cr2O3 làoxit lưỡng tính.
CrO3 làoxitaxit.
Câu 2:
Asaivìcrom thuộc chukì4,nhómVIB.
Câu 5:
A đúng vì trong dung dịch HCl, H2SO4 loãng nóng, màng oxit bị phá hủy, crom khử ion H+ tạo ra muối Cr(II)vàkhí hiđro.
Cr+H2SO4 → CrSO4 +H2 B,C,Dsai.
Câu 6: CsaivìCrO3 làoxitaxit.
Câu 7:
Phương trìnhhóa học: 2CrCl3 +16NaOH+3Cl2 → 2Na2CrO4 +12NaCl+8H2O
Sản phẩm thu được lả Na2CrO4,NaCl,H2O.
Câu 8:
OFFICIAL
BsaivìCr2O3 tuylàoxit lưỡng tính nhưng tantrongaxitvà kiềm đặc chứ khôngtan được trong kiềm loãng.
Câu 11: Asaivìcrom(VI)oxitlàoxit axỉt.
Câu 12:
Nhỏ từ từ dung dịch KOHvàodung dịch Cr2(SO4)3: Ban đầu thu được kết tủa màu lục xám: Cr2(SO4)3 +6KOH → 2Cr(OH)3 +3K2SO4 Sau đó kết tủa tan dần tạo dung dịch màuxanh lục: Cr(OH)3 +NaOH → NaCrO2 +2H20 Câu 13: CrO3 làoxitaxitvàCr(OH)3 là hiđroxit lưỡng tínhnêntan được trongdung dịch NaOH. Câu 15: Cácphát biểu đúng là:(c),(d),(e),(f). (a)saivìK2Cr2O4 cómàuvàngchanh. (b)saivìCrkhông phản ứng với dung dịch kiềm đặc. Dạng 2: Bài tập về crom và hợp chất của crom 1-A 2-A 3-C 4-B 5-C
DẠYKÈMQUYNHƠN
Trang11
ĐÁP ÁN
Câu 1: 2 Cr HCr n0,02molnn0,02molV0,448lit448ml Câu 2: 2H n0,0675mol Chỉ cóAl phản ứng với dung dịch NaOH 2AlH 2 nn0,045mol 3 Al m0,045271,215gam Cr m3,0351,2151,82gam Cr %1,82m.100%60% 3,035
Câu 3: Phương trìnhhóa học: K2Cr2O7 +6FeSO4 +7H2SO4 → Cr2(SO4)3 +3Fe2(SO4)3 +K2SO4 +7H2O 0,01 ← 0,06mol Tacó: 227 227 KCrO ddKCrO 0,01n0,01molV00,2lit200ml ,05 Câu 4: Phương trìnhhóa học: K2Cr2O7 +6KI+7H2SO4 → Cr2(SO4)3 +4K2SO4 +3I2 +7H2O 0,8 →0,4 mol 2I n0,4mol Câu 5: Phương trìnhhóa học: 2CrCl3 +16KOH+3Cl2 → 2K2CrO4 +12KCl+8H2O 0,01 → 0,08 → 0,015mol ; 2Cl n0,015mol KOH n0,08mol
DẠYKÈMQUYNHƠN
OFFICIAL Trang12
CHƯƠNG 8: HÓA HỌC MÔI TRƯỜNG
BÀI 16: HÓA HỌC MÔI TRƯỜNG
Mục tiêu
Kiến thức
+ Biết được hóa học đã đóng góp phần thiết thực giải quyết các vấn đề về sức khỏe, nêu được tác hại của một số chất gây nghiện.
+ Chỉ ra được một số khái niệm về ô nhiễm môi trường, ô nhiễm khôngkhí,ô nhiễm đất, nước.
+Trìnhbày được vấn đề về ô nhiễm môi trường cóliênquan đến hóa học.
+ Chỉ ra được vấn đề bảo vệ môi trường trong đời sống, sản xuất và học tập cóliênquan đến hóa học. Kĩ năng
+ Tìm được thôngtintrongbài học, trêncác phương tiện thôngtin đại chúng về vấn đề sức khỏe, ô nhiễm môi trường.
OFFICIAL
+ Xử lýcácthôngtin,rútra nhận xét về một số vấn đề ô nhiễm và chống ô nhiễm môi trường.
+ Vận dụng để giải quyết một số tình huống về môi trường trong thực tiễn.
+Tínhtoán lượng khí thải, chất thải trongphòngthí nghiệm vàtrong sản xuất.
DẠYKÈMQUYNHƠN
Trang1
LÍ THUYẾT TRỌNG TÂM
Hóa học và vấn đề ô nhiễm môi trường a.Ô nhiễm không khí
Ô nhiễm khôngkhílà sự có mặt của các chất lạ hoặc sự biến đổi quan trọng trongthành phần không khí.
Cáckhígâyô nhiễm: , bụi… 22x CO,CO,SO,NO,CFC
Tác hại:
Ảnh hưởng đến sức khỏe con người. Ảnh hưởng đến sự sinh trưởng vàphát triển của động, thực vật.
Hiệu ứng nhàkính(do…). 2CO
Phá hủy tầng ozon(do…). CFC
Mưa axit(do…). 22SO,NO b.Ô nhiễm môi trường nước Sự ô nhiễm môi trường nước là sự thay đổi thành phần vàtính chất của nước gây ảnh hưởng đến hoạt động sống bình thường của con người vàsinh vật.
OFFICIAL
Nguyênnhân: Nguồn gốc tự nhiên: mưa, gió,bão Kéotheo chất bẩn.
Nguồn gốc nhân tạo: sinh hoạt, giaothông vận tải, thuốc trừ sâu…
Tácnhângâyô nhiễm: ionkim loại nặng ;anion ở nồng 2222 Hg,Pb,Cu,Mn,...
độ cao; thuốc bảo vệ thực vật, phânbónhóa học …
Tác hại: ảnh hưởng đến sức khỏe, sự sinh trưởng vàphát triển của con người và động, thực vật. c.Ô nhiễm môi trường đất Khicó mặt một số chất vàhàm lượng của chúng vượt quá giới hạn thì hệ sinhthái mất cân bằng và môi trường đất bị ô nhiễm. Ô nhiễm đất dokim loại nặng là nguồn ô nhiễm nguy hiểm đối với hệ sinhthái đất.
Nguyênnhân:
Nguồn gốc tự nhiên:núi lửa, ngập úng,xâm nhập mặn …
Nguồn gốc con người: docáctácnhânhóa học, vật lí,sinh học gâyra.Tácnhânhóa học tạo ra từ chất thải nông nghiệp như: phânbónhóa học, chất bảo vệ thực vật, chất kíchthíchsinh trưởng, chất thải sinh hoạt.
Tác hại: gây tổn hại lớn đối với đời sống và sản xuất.
DẠYKÈMQUYNHƠN
Trang2
I.
22 344 NO,PO,SO
Ô NHIỄM KHÔNG KHÍ
Ô nhiễm khôngkhílà sự có mặt của các chất lạ hoặc sự biến đổi quan trọng trong thành phần khôngkhí.
Cáckhí gâyô nhiễm: CO, CO2, SO2, NOx, CFC, bụi…
HÓA HỌC MÔI TRƯỜNG
Ô NHIỄM MÔI TRƯỜNG NƯỚC
Sự ô nhiễm môi trường nước là sự thay đổi thành phần vàtính chất của nước gây ảnh hưởng đến hoạt động sống bình thường của con người vàsinh vật.
Tácnhângâyra ô nhiễm: ion kim loại nặng (Hg2+,Pb2+ , Cu2+,Mn2+,…), anion thuốc bảo vệ thực vật, phânbónhóa học….
Ô
NHIỄM MÔI TRƯỜNG ĐẤT
Khicó mặt một số chất và hàm lượng của chúng vượt quá giới hạn thì hệ sinhthái mất cân bằng vàmôi trường đất bị ô nhiễm.
Tácnhângâyô nhiễm: tácnhân vật lí,sinh học, hóa học (phân bón, thuốc bảo vệ thực vật, chất kíchthíchsinh trưởng, chất thải sinh hoạt…)
Ảnh hưởng đến đời sống, sản xuất, sức khỏe của con người
DẠYKÈMQUYNHƠN
Trang3 SƠ ĐỒ HỆ THỐNG
OFFICIAL
HÓA
MỘT SỐ
Rượu Nicotin Cafein Moocphin
CHẤT GÂY NGHIỆN
II. CÁC DẠNG BÀI TẬP
Dạng 1: Lí thuyết trọng tâm Ví dụ mẫu
Ví dụ 1: Cáctácnhânhóa học gâyô nhiễm môi trường nước gồm
A. cáckim loại nặng: 223 Hg,Pb,Sb,...
B. cácanion: 32 344 NO;PO;SO.
C. thuốc bảo vệ thực vật, phânbónhóa học. D. cả A,B,C.
Hướng dẫn giải
Tác nhân gây ô nhiễm môi trường nước bao gồm các ion của kim loại nặng, các anion ; thuốc bảo vệ thực vật vàphânbónhóa học. 32 344 NO;PO;SO Chọn D.
Ví dụ 2: Nguồn năng lượng được coilà nguồn năng lượng sạch là:
A. năng lượng mặt trời, năng lượng hóa thạch.
B. năng lượng mặt trời, năng lượng hạt nhân.
C. năng lượng gió, năng lượng nước.
D. năng lượng hạt nhân, năng lượng nước.
Hướng dẫn giải
Năng lượng sạch là dạng năng lượng mà trong quá trình sinh công bản thân nó không tạo ra những chất thải độc hại gây ảnh hưởng chomôi trường xungquanh.
Do đó, nguồn năng lượng sạch gồm năng lượng gióvà năng lượng nước, năng lượng mặt trời… Năng lượng hạt nhânvà năng lượng hóa thạch không phải là năng lượng sạch. Chọn C. Ví dụ 3: Chất khíXgâyra hiện tượng hiệu ứng nhàkínhvàthamgiavàoquátrìnhquang hợp câyxanh tạo tinh bột. Chất khíXlà
A. N2 B. O2 C. H2 D. CO2 Hướng dẫn giải Khígây hiện tượng hiệu ứng nhàkínhvàthamgiavàoquátrìnhquang hợp của câyxanh tạo tinh bột làCO2 Chọn D. Ví dụ 4: Hóa học góp phần tạo ra ăcquy khôvà ăcquy chìaxittrongxemáy,ôtô. Nguồn năng lượng được sử dụng là A. cơ năng. B. quang năng. C. điện năng. D. động năng. Hướng dẫn giải Nguồn năng lượng được sử dụng là điện năng. Chọn C.
DẠYKÈMQUYNHƠN
Trang4
OFFICIAL
Ví dụ 5: Tại những bãi đào vàng, nước sông đã nhiễm một loại chất cực độc do thợ vàng sử dụng để tách vàng khỏi cátvà tạp chất. Đất ở vensông cũng bị nhiễm chất độc này. Chất độc này cũng có nhiều trong vỏ sắn. Chất độc nàylà
A. xianua.
B. nicotin. C. thủy ngân. D. đioxin. Hướng dẫn giải Vàng bị hòatantrongxianua kiềm (KCN,NaCN)khicóoxinên được sử dụng vàocông nghệ khai thác vàng. Tuy nhiên, công nghệ này mang đến những hệ lụy không nhỏ, làm ô nhiễm nguồn nước, ô nhiễm môi trường đất, hủy hoại hệ sinhthái của nhiều vùng đất.
Mặt khác,xianua cũng có nhiều trong vỏ sắn, vì vậy màcó hiện tượng saykhi ăn sắn. Chọn A. Bài tập tự luyện dạng 1
OFFICIAL
Câu 1: Tácnhân chủ yếu gây mưa axitlà A. COvàCH4. B. CH4 vàNH3. C. SO2 vàNO2. D. COvàCO2. Câu 2: Ionkim loại Xkhivào cơ thể vượt mức chophép sẽ gâynguy hiểm cho sự phát triển cả về trí tuệ và thể chất của con người. Ở cáclàng nghề tái chế ăcquy cũ, nhiều người bị ung thư, trẻ em chậm phát triển, còi cọc vì nhiễm độc ionkim loại này.Kim loại Xlà
A. đồng. B. magie. C. chì. D. sắt. Câu 3: Lớp ozon ở tầng bình lưu của khí quyển là tấm lá chắn tia tử ngoại của mặt trời, bảo vệ sự sống trêntrái đất. Hiện tượng suy giảm tầng ozon đang là một vấn đề môi trường toàn cầu. Nguyênnhân của hiện tượng nàylàdo
A. chất thải CFCdocon người gâyra. B. các hợp chất hữu cơ.
C. sự thay đổi khí hậu. D. chất thải CO2.
Câu 4: Những vùng đất ngập nước, vùngcó trầm tíchxác thực vật nước mặn tích tụ 4000–5000 năm là môi trường thuận lợi hìnhthànhpiritlà hoạt chất chủ yếu gâyphènhóa đất làmcho đất bị nhiễm phèn. Công thức hóa học của piritlà
A. FeS2 B. CuS. C. FeCO3 D. FeS. Câu 5: Khôngkhí không bị ô nhiễm bởi
A. khí thải công nghiệp.
C. bụi nhỏ liti với số lượng rất nhiều.
B. khí từ các phương tiện giaothông.
D. sự quang hợp của câyxanh.
Câu 6: Để phòng nhiễm độc CO,làkhíkhôngmàu,khôngmùi, rất độc, người tadùng chất hấp thụ là
A. đồng (II)oxitvàmagieoxit. B. đồng (II)oxitvàthan hoạt tính.
C. đồng (II)oxitvàmanganoxit. D. than hoạt tính.
Câu 7: Chocácphát biểu sau:
(1)Khithoátrangoàikhí quyển, freonphá hủy tầng ozon.
(2) Để xử lí thủy ngân rơi
DẠYKÈMQUYNHƠN
Trang5
vãi, người tacó thể sử dụng bột lưu huỳnh. (3)Trongkhí quyển, nồng độ CO2 vượt quátiêu chuẩn chophépgâyra hiệu ứng nhàkính. (4)Trongkhí quyển, nồng độ CO2 vàSO2 vượt quátiêu chuẩn chophépgâyra hiện tượng mưa axit. Số phát biểu đúng là A. 3. B. 2. C. 4. D. 5.
Câu 8: Etanol được coilà cồn sinh học, nócótínhcháysinh nhiệt như xăng. Người tapha trộn etanolvào xăng để giảm sự phụ thuộc vào việc nhập khẩu xăng dầu, ngoàiracòngiúp giảm lượng CO từ 20–30%, CO2 khoảng 2%so với xăng khoáng thường. Kể từ ngày1/1/2018 ở Việt Nam xăng E5(pha5%etanol với 95% xăng khoáng) sẽ chính thức thay thế xăng RON92.Công thức phân tử của etanollà
A. B. C. D. 262CHO 4 CHO 242CHO 26 CHO
Câu 9: Dạng năng lượng nàosau đây không sinhrado phản ứng hóa học?
A. Dòng điện từ pin, ăcquy.
C. Hoạt động của tàu ngầm.
B. Sức côngphá của thuốc nổ.
D. Nhiệt năng của bếp gas.
Câu 10: Trongquátrình xử lý nước ngầm thành nước máysinh hoạt, cần quagiai đoạn phun nước dưới dạng tiavàokhôngkhí. Việc làmnàycóvaitrò
A. làm chết cácvisinh vật kị khí.
B. oxihóaH2Svà một số chất hữu cơ.
C. loại bỏ ion sắt trong nước ngầm. D. tất cả cácnguyênnhântrên.
Câu 11: Một chất dẻo được dùng phổ biến làpoli(vinylclorua).Khi đốt cáctúi đựng PVC phế thải, nó tạo ra một chất rất độc làmô nhiễm môi trường và tạo kết tủa với AgNO3 Chất độc đó là
OFFICIAL
A. khícacbonoxit. B. bồ hóng (mồ hóng,C). C. nitơ đioxit. D. hiđro clorua. Câu 12: Khi mất điện nhiều gia đình phải sử dụng động cơ điezen để phát điện, phục vụ nhu cầu thắp sáng, chạy thiết bị … Không nên chạy động cơ điezen trong phòng đóng kín các cửa mà luôn ở nơi thoáng.Phát biểu nàosau đây sai?
A. Khi hoạt động, động cơ điezen sinhrakhíSO2 độc.
B. Khi hoạt động, động cơ điezen tiêu thụ nhiều khíCO2,sinhrakhíO2 độc.
C. Nhiều khí hiđrocacbon chưa cháy hết là những khí độc.
D. Khi hoạt động, động cơ sinhrakhíCO độc.
Dạng 2: Bài tập tổng hợp Ví dụ mẫu
Ví dụ 1: Một loại than đá có chứa 2% lưu huỳnh dùngcho một nhàmáy nhiệt điện. Nếu nhàmáy đốt hết 100 tấn thantrong một ngày đêm thì khối lượng khíSO2 donhàmáy xả vàokhí quyển trong một năm là A. 1420 tấn. B. 1250 tấn. C. 1530 tấn. D. 1460 tấn.
DẠYKÈMQUYNHƠN
Trang6
Hướng dẫn giải Khối lượng lưu huỳnh trong100 tấn than đá là: tấn S m2%.1002 Bảo toànnguyên tố S: 2 soSnn Khối lượng SO2 nhàmáy xả ratrong một ngày đêm:tấn 2SO 2 m644 32ngµy Khối lượng SO2 xả vàokhí quyển trong một năm: tấn 2SO m43651460 nm Chọn D. Ví dụ 2: Hàm lượng lưu huỳnh chophéptrong xăng là dưới 0,3%. Đốt cháyhoàntoàn10gam xăng, sản phẩm cháy (coi như chỉ có CO2, SO2, H2O) làm mất màu vừa đủ dung dịch có hòa tan Loại xăng này chứa hàm lượng lưu huỳnh chophéphaykhông? 4 43,510molKMnO A. Không,vìhàm lượng S vượt quá0,3%.
B. Có,vìhàm lượng S bằng 0,25%.
C. Có,vìhàm lượng S bằng 0,28%.
D. Có,vìhàm lượng S lớn hơn 0,3%. Hướng dẫn giải Phương trìnhhóa học: 2 422442 5SO2KMnO2HOKSO2MnO5SO mol 4 48,75.103,5.10 Bảo toànnguyên tố S: 2
4 SOS nn8,7510mol Hàm lượng của Scótrong xăng là: 4 S S %m8,751032 m100%100%0,28%0,3% m 10 xng
Loại xăng nàycó chứa hàm lượng lưu huỳnh chophép. Chọn C. Bài tập tự luyện dạng 2 Câu 1: Trongdanh mục tiêu chuẩn vệ sinh đối với lương thực, thực phẩm, bộ Y tế quy định có năm chất ngọt nhân tạo được dùng để chế biến lương thực, thực phẩm, nhưng cóquy định liều lượng sử dụng an toàn.Ví dụ chất AcesulfamK, liều lượng có thể chấp nhận được là0–15mg/kg trọng lượng cơ thể một ngày. Như vậy, một người nặng 60kg,trong một ngàycó thể dùng lượng chất này tối đa là
A. 12mg. B. 1500mg. C. 10mg. D. 900mg. Câu 2: Theotínhtoán, năm 2000 cả nước tiêu thụ lượng nhiên liệu tương đương 1,5 triệu tấn dầu và thải ramôi trường khoảng 113700 tấn khíCO2.Trong một ngày lượng tiêu thụ tương đương với khối lượng dầu và lượng khíCO2 thải vàomôi trường là
A. 0,003 triệu tấn dầu, 200 tấn CO2
C. 0,005 triệu tấn dầu, 415 tấn CO2.
III. PHẦN ĐÁP ÁN
B. 0,004 triệu tấn dầu, 311 tấn CO2
D. 0,012 triệu tấn dầu, 415 tấn CO2.
DẠYKÈMQUYNHƠN
Trang7
OFFICIAL
Dạng 1: Lí thuyết trọng tâm 1-C 2-C 3-A 4-A 5-D 6-D 7-C 8-D 9-C 10-D 11-D 12-B Dạng 2: Bài tập tổng hợp 1-D 2-B





























































