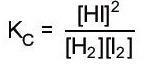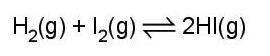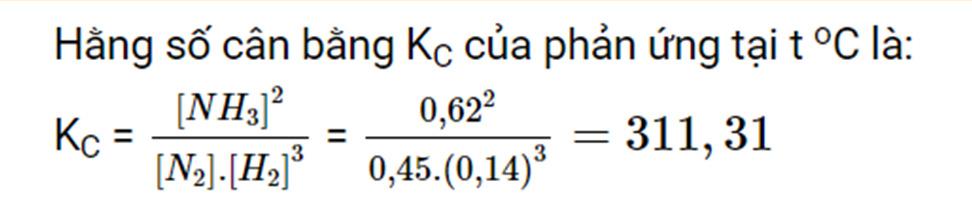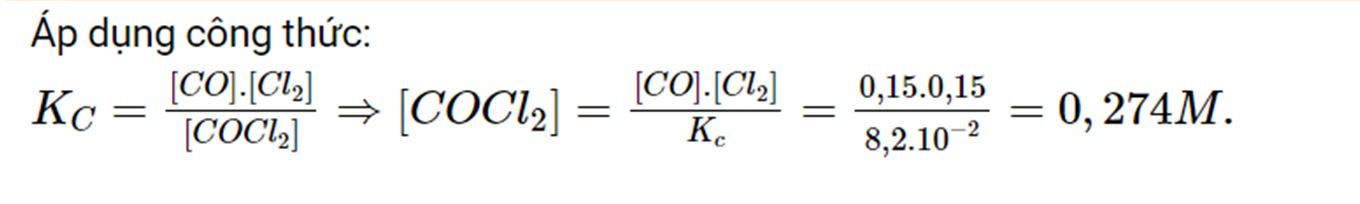CHUYÊN ĐỀ DẠY THÊM
HÓA HỌC 11

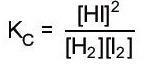
vectorstock com/28062440

Ths Nguyễn Thanh Tú
eBook Collection
CHUYÊN ĐỀ DẠY THÊM HÓA HỌC 11 - SÁCH
MỚI NĂM 2023 (CHƯƠNG 1 CÂN BẰNG HÓA
HỌC) BÀI TẬP VẬN DỤNG TỰ LUẬN - TRẮC
NGHIỆM - BÀI TẬP THEO CẤP ĐỘ
WORD VERSION | 2024 EDITION
ORDER NOW / CHUYỂN GIAO QUA EMAIL
TAILIEUCHUANTHAMKHAO@GMAIL COM
Tài liệu chuẩn tham khảo
Phát triển kênh bởi
Ths Nguyễn Thanh Tú
Đơn vị tài trợ / phát hành / chia sẻ học thuật :
Nguyen Thanh Tu Group
Hỗ trợ trực tuyến
Fb www.facebook.com/DayKemQuyNhon
Mobi/Zalo 0905779594
CHƯƠNG 1: CÂN BẰNG HÓA HỌC
BÀI 1: KHÁI NIỆM VỀ CÂN BẰNG HÓA HỌC (Thời gian thực hiện: tiết)

I. PHẢN ỨNG MỘT CHIỀU, PHẢN ỨNG THUẬN NGHỊCH VÀ CÂN BẰNG HÓA HỌC.
- Phản ứng một chiều ( → ) là phản ứng chỉ xảy ra theo chiều từ chất tham gia tạo thành sản phẩm mà sản phẩm không thể tác dụng với nhau để tạo lại chất ban đầu.
- Phản ứng thuận nghịch ( ⇀ ↽ ) là phản ứng xảy ra theo hai chiều trái ngược nhau, chiều từ trái sang phải là chiều thuận, chiều từ phải sang trái là chiều nghịch.
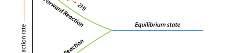
Trạng thái cân bằng của phản ứng thuận nghịch là trạng thái mà tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch.
II. HẰNG SỐ CÂN BẰNG CỦA PHẢN ỨNG THUẬN NGHỊCH.
Phản ứng thuận nghịch: aA + bB ⇀ ↽ cC + dD
Khi ở trạng thái cân bằng KC= [][] [][] cd ab CD AB
Trong đó [A], [B], [C] và [D] là nồng độ mol các chất A, B, C, và D ở trạng thái cân bằng. A, b, c, d là hệ số tỉ lượng các chất trong phương trình hóa học.
Chú ý:

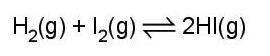
+ Chất rắn không xuất hiện trong biểu thức hằng số cân bằng.
+ Hằng số cân bằng KC của phản ứng xác định chỉ phụ thuộc vào nhiệt độ và bản chất phản ứng.
+ KC càng lớn phản ứng thuận càng dễ xảy ra
1
III. SỰ CHUYỂN DỊCH CÂN BẰNG HÓA HỌC.
Sự chuyển dịch cân bằng hóa học là sự chuyển dịch từ trạng thái cân bằng này sang trạng thái cân bằng khác.
IV. CÁC YẾU TỐẢNH HƯỞNG ĐẾN CÂN BẰNG HÓA HỌC.
* Nguyên lí Le Chateleir: Một phản ứng thuận nghịch đang ở trạng thái cân bằng khi chịu
một tác động từ bên ngoài như biến đổi nồng độ, áp suất, nhiệt độ thì cân bằng sẽ chuyển
dịch theo chiều làm giảm tác động đó.
* Các yếu tốảnh hưởng đến cân bằng hóa học:
1. Nhiệt độ.
+ Khi tăng nhiệt độ, chuyển dịch theo chiều phản ứng thu nhiệt (∆rH 0 298 >0), chiều làm giảm
tác động của việc tăng nhiệt độ.
+ Khi giảm nhiệt độ, chuyển dịch theo chiều phản ứng tỏa nhiệt (∆rH 0 298 <0), chiều làm giảm
tác động của việc giảm nhiệt độ.
Ví dụ: 2NO2(g) nâu đỏ ⇀ ↽ N2O4(g) không màu ∆rH 0 298 = - 58 kJ.
YKÈMQUYNHƠNOFFICIAL
+ Khi ngâm trong nước nóng (tăng nhiệt độ), màu nâu đỏ của hỗn hợp khí đậm lên (phản
ứng xảy ra theo chiều nghịch – chiều phản ứng thu nhiệt).
+ Khi ngâm trong nước lạnh (giảm nhiệt độ), màu của hỗn hợp nhạt dần (phản ứng xảy ra theo chiều thuận – chiều phản ứng tỏa nhiệt).
2. Áp suất.
+ Khi tăng áp suất cân bằng chuyển dịch theo chiều giảm áp suất (giảm số mol chất khí).
+ Khi giảm áp suất cân bằng chuyển dịch theo chiều tăng áp suất của hệ (tăng số mol chất khí).
+ Khi hệ cân bằng có tổng hệ số tỉ lượng của các chất khí ở hai vế của phương trình hóa học
bằng nhau hoặc trong hệ không có chất khí, việc tăng hoặc giảm áp suất không làm chuyển
dịch cân bằng của hệ.
Ví dụ: 2NO
+ Nếu tăng áp suất bằng cách đẩy pit – tông thì màu nâu đỏ nhạt dần (phản ứng xảy ra theo chiều thuận).
+ Nếu giảm áp suất bằng cách kéo pit – tông thì màu nâu đỏ đậm dần (phản ứng xảy ra theo chiều nghịch).
3. Nồng độ. + Khi tăng nồng độ cân bằng sẽ chuyển dịch theo chiều giảm nồng độ của chất đó.
+ Khi giảm nồng độ cân bằng sẽ chuyển dịch theo chiều tăng nồng độ của chất đó.
Ví dụ: C(s) + CO2(g) ⇀ ↽ 2CO(g)

Nếu tăng nồng độ CO2 hoặc giảm nồng độ CO (phản ứng xảy ra theo chiều thuận).
Ví dụ: CH3COONa + H2O ⇀ ↽ CH3COOH + NaOH


Nếu tăng nồng độ CH3COOH thì màu hồng nhạt của dung dịch bị mất màu (phản ứng xảy ra theo chiều nghịch).
Nếu tăng nồng độ CH3COONa thì màu hồng đậm dần( phản ứng xảy ra thèo chiều thuận).
Chú ý:
+ Chất xúc tác không ảnh hưởng đến cân bằng hóa học.
+ Việc thêm hoặc bớt chất rắn không ảnh hưởng đến cân bằng hóa học.
2
2
⇀ ↽ N2O4(g)
∆rH 0 298 = - 58
Ạ
(g) nâu đỏ
không màu
kJ.
3
CHƯƠNG 1: CÂN BẰNG HÓA HỌC
BÀI 2: CÂN BẰNG TRONG DUNG DỊCH NƯỚC (Thời gian thực hiện: tiết)
I. SỰĐIỆN LI, CHẤT ĐIỆN LI, CHẤT KHÔNG ĐIỆN LI.
1. Chất điện li.
II. THUYẾT BRØNSTED – LOWRY VỀ ACID – BASE.
Thuyết Brønsted – Lowry: Acid là chất cho proton (H+), base là chất nhận proton. Acid và base có thể là phân tử hoặc ion.

+ Quá trình phân li các chất trong nước hoặc trạng thái nóng chảy tạo thành các ion gọi là sự
điện li.
+ Chất điện li bao gồm: acid, base và muối.
2. Phân loại chất điện li.
YKÈMQUYNH
+ Chất điện li mạnh là chất khi tan trong nước, các phân tử hòa tan đều phân li thành ion.
+ Chất điện li yếu là chất khi tan trong nước, chỉ có một số phân tử hòa tan phân li thành ion, phần còn lại vẫn tồn tại dưới dạng phân tử trong dung dịch.
+ Chất không điện li là chất khi hòa tan trong nước, các phân tử không phân li thành ion.
Chất điện li mạnh Chất điện li yếu Chất không điện li
+ Acid mạnh: HCl, HBr,
HI, H2SO4, HNO3,
HClO4
+ Base mạnh (base tan):
KOH, NaOH, Ca(OH)2,
Ba(OH)2, LiOH...
+ Hầu hết các muối.
+ Acid yếu: acid vô cơ yếu HF, H2S,
HClO, H2SO3, H2CO3, H3PO4 và
acid hữu cơ (RCOOH) như
Đường glucose
(C6H12O6), đường saccharose
Ví dụ: HCl(acid) + H2O (base) → H3O+ (acid) + Cl-

NH3 (base) + H2O(acid) ⇀ ↽ NH4 + (acid) + OH(base)


Chất cho proton (H+) Chất nhận proton (H+)
+ Các aicd HCl, H2SO4, HI…
+Cácionkimloạitrong dungdịch (trừ Na+ , K+, Ba2+, Ca2+) như Al3+, Cu2+
+ Các ion như H+, NH4 +, H3O+, HSO4 -
+ Các oxide base và base (trừ oxide và base của các kim loại Zn, Sn, Pb, Al, Cr) và NH3.
+ Các anion gốc acid yếu không có H như CO3 2-, CH3COO-, S2-, SO3 2-…)
Chất lưỡng tính là chất vừa có khả năng cho proton, vừa có khả năng nhận proton.
+ Oxide lưỡng tính như SnO, PbO, ZnO, Al2O3, Cr2O3.
+ Hydroxide lưỡng tính như Sn(OH)2, Pb(OH)2, Zn(OH)2, Al(OH)3, Cr(OH)3
+ Gốc acid yếu như HCO3 -, HSO3 -, HS-, HPO4 2-, H2PO4 -… và muối của acid yếu hoặc base yếu như (NH4)2CO3, CH3COONH4
III. KHÁI NIỆM pH. CHẤT CHỈ THỊ ACID – BASE.
- Nước là chất điện li rất yếu H2O ⇀ ↽ H+ + OH -
- Tích số ion của nước là KW = 2
+- -14 HO K=[H].[OH]=1,0.10 (ở 250C).
+ Môi trường trung tính là môi trường có [H+] = [OH-] = 10-7M hay pH = 7.
+ Môi trường acid là môi trường có [H+] > 1,0.10-7M hay pH < 7
+ Môi trường base là môi trường có [H+] < 1,0.10-7M hoặc pH > 7
CH3COOH...
+ Base yếu (base không tan): NH3,
Mg(OH)2, Cu(OH)2 Fe(OH)3
+ Muối HgCl2, Hg(CN)2
(C12H22O11), ethanol (C2H5OH)... HCl
- pH là chỉ sốđánh giá độ acid hay độ base của một dung dịch. Thang pH thường dùng có giá trị từ 1 đến 14.
4
→ H+ + Cl- CH3COOH ⇀ ↽ CH3COO- + H+ Ạ
5
ƠNOFFICIAL
- Chất chỉ thị acid – base là chất có màu sắc biến đổi theo giá trị pH của dung dịch.
Câu 1: Viết biểu thức tính KC cho các phản ứng sau:
a) 2SO2(g) + O2(g) ⇀ ↽ 2SO3 (g) b) 2C(s) + O2(g) ⇀ ↽ 2CO(g)
c) AgCl(s) ⇀ ↽ Ag+(aq) + Cl-(aq) d) CaCO3(s) ⇀ ↽ CaO(s) + CO2(g)
e) Cu2O(s) + ½ O2(g) ⇀ ↽ 2CuO(s)
pH = - lg[H+] và [H+] = 10-pH; pOH = - lg[OH-] và [OH-] = 14 10 [] H + ; pH + pOH =14
IV. CHUẨN ĐỘ ACID – BASE.
YKÈMQUYNHƠNOFFICIAL
Trong phương pháp chuẩn độ acid – base, người ta dùng dung dịch acid hoặc dung dịch base (kiềm) đã biết chính xác nồng độ làm dung dịch chuẩn để xác định nồng độ dung dịch base hoặc dung dịch acid chưa biết nồng độ
Câu 2: Viết biểu thức hằng số cân bằng KC cho phản ứng (*), (**) dưới đây.
H2(g) + I2(g) ⇀ ↽ 2HI(g) (*)
½ H2(g) + ½ I2(g) ⇀ ↽ HI(g) (**)
Theo em, giá trị hai hằng số cân bằng này có bằng nhau không?
5. Ý nghĩa thực tiễn cân bằng trong dung dịch nước của ion Al3+, Fe3+ và CO32-.
Ion Al3+, Fe3+ dễ bị thủy phân trong nước tạo thành base không tan và cho môi trường acid.
M3+ + 3H2O ⇀ ↽ M(OH)3 + 3H+
Ion CO3 2- bị thủy phân cho môi trường base.
CO3 2- + H2O ⇀ ↽ HCO3 - + OH-

Ví dụ:
+ Phèn chua K2SO4.Al2(SO4)3.24H2O và phèn sắt (NH4)2SO4. Fe2(SO4)3.24H2O được dùng
trong quá trình xử lí nước (làm trong nước) và làm sạch gỉ sét trên inox.
+ Muối Fe2(CO3)3 và Al2(CO3)3 không tồn tại trong dung dịch mà bị thủy phân trong nước
tạo thành kết tủa và giải phóng khí.
Fe2(CO3)3 + 3H2O → 2Fe(OH)3 + 3CO2
Al2(CO3)3 + 3H2O → 2Al(OH)3 + 3CO2
Câu 3: Phản ứng xảy ra khi cho khí Cl2 tác dụng với nước là một phản ứng thuận nghịch. Viết phương trình hoá học của phản ứng, xác định phản ứng thuận, phản ứng nghịch.
6
Ạ
7 BÀI TẬP VẬN DỤNG DẠNG 1: PHẢN ỨNG MỘT CHIỀU – PHẢN ỨNG THUẬN NGHỊCH VÀ CÂN BẰNG HÓA HỌC.
………………………………………………………………………………………………… ………………………………………………………………………………………………… …………………………………………………………………………………………………
………………………………………………………………………………………………… …………………………………………………………………………………………………
…………………………………………………………………………………………………
Câu 4: Methanol (CH3OH) là nguyên liệu quan trọng trong công nghiệp hoá học. Dựa vào
hằng số cân bằng của các phản ứng ở 25 oC, hãy lựa chọn phản ứng thích hợp để điều chế
CH3OH. Giải thích.
CO(g) + 2H2(g) ⇀ ↽ CH3OH(g) KC = 2,26.104 (1)
CO2(g) + 3H2(g) ⇀ ↽ CH3OH(g) + H2O(g) KC = 8,27.10-1 (2) …………………………………………………………………………………………………
Câu 7: Cho phản ứng sau:
COCl2(g) ⇀ ↽ CO(g) + Cl2(g) KC=8,2.10-2 (900 K).
Ở trạng thái cân bằng, nếu nồng độ CO và Cl2 đều bằng 0,15M thì nồng độ COCl2 là bao nhiêu?
Câu5: Ammonia (NH3) được điều chế bằng phản ứng: N2(g) + 3H2(g) ⇀ ↽ 2NH3(g). Ở toC, nồng độ các chất ở trạng thái cân bằng là: [N2] = 0,45 M; [H2] = 0,14 M; [NH3] = 0,62 M. Tính hằng số cân bằng KC của phản ứng trên tại t oC.
…………………………………………………………………………………………………
…………………………………………………………………………………………………
Câu 6: Cho 0,4 mol SO2 và 0,6 mol O2 vào một bình dung tích 1 lít được giữở một nhiệt độ
không đổi. Phản ứng trong bình xảy ra như sau:
YKÈMQUYNHƠNOFFICIAL
2SO2(g) + O2(g) ⇀ ↽ 2SO3(g)
Khi phản ứng đạt đến trạng thái cân bằng, lượng SO3 trong bình là 0,3 mol. Tính hằng số cân
bằng KC của phản ứng tổng hợp SO3 ở nhiệt độ trên.
………………………………………………………………………………………………… …………………………………………………………………………………………………
…………………………………………………………………………………………………
Câu 8: Cho cân bằng hoá học sau:
CO(g) + H2O(g) ⇀ ↽ CO2(g) + H2(g)
Ở 700oC, hằng số cân bằng KC = 8,3. Cho 1 mol khí CO và 1 mol hơi nước vào bình kín, dung tích 10 lít và giữở 700oC. Tính nồng độ các chất ở trạng thái cân bằng.
…………………………………………………………………………………………………
8
…………………………………………………………………………………………………
………………………………………………………………………………………………… ………………………………………………………………………………………………… …………………………………………………………………………………………………
Ạ
9
………………………………………………………………………………………………… ………………………………………………………………………………………………… ………………………………………………………………………………………………… …………………………………………………………………………………………………
Câu 9: Trong công nghiệp, halogen được sản xuất từ phản ứng:
CH4(g) + H2O(g) ⇀ ↽ 3H2(g) + CO(g)
a) Tính hằng số cân bằng KC của phản ứng trên ở 760 oC. Biết ở nhiệt độ này, tất cả các chất
đều ở thể khí và nồng độ mol của CH4, H2O, H2 và CO ở trạng thái cân bằng lần lượt là 0,126
M; 0,242 M; 1,150 M và 0,126 M.
YKÈMQUYNHƠNOFFICIAL
b*) Ở 760 oC, giả sử ban đầu chỉ có CH4 và H2O có nồng độ bằng nhau và bằng x M. Xác định x, biết nồng độ của H2 ở trạng thái cân bằng là 0,6 M.
DẠNG 2: CÁC YẾU TỐẢNH HƯỞNG ĐẾN CÂN BẰNG HÓA HỌC.
Câu 11: Nhũđá được hình thành trong các hang động liên quan đến cân bằng sau đây:
Ca(HCO3)2 (aq) ⇀ ↽ CaCO3(s) + CO2(aq) + H2O(l)
Nếu nồng độ CO2 hoà tan trong nước tăng lên thì có thuận lợi cho sự hình thành nhũđá hay không? Giải thích. …………………………………………………………………………………………………
Câu 12: Cân bằng 2NO2(g) ⇀ ↽ N2O4(g) chuyển dịch theo chiều nào khi tăng áp suất của hỗn hợp (bằng cách nén hỗn hợp) ởđiều kiện nhiệt độ không đổi. Biết rằng áp suất tỉ lệ với số mol chất khí.
Câu 10*: Một bình phản ứng có dung tích không đổi, chứa hỗn hợp khí N2 và H2 với nồng độ
tương ứng là 0,3 M và 0,7 M. Sau khi phản ứng tổng hợp NH3 đạt trạng thái cân bằng ở t0C, H2
chiếm 50% thể tích hỗn hợp thu được. Xác định giá trị hằng số cân bằng KC ở t0C của phản ứng. …………………………………………………………………………………………………
Câu 13: Cân bằng sau chuyển dịch theo chiều nào khi tăng nhiệt độ?
2SO2(g) + O2(g) ⇀ ↽ 2SO3(g) rH 0 298 =−197,8kJ.
…………………………………………………………………………………………………
Câu 14: Cho các cân bằng sau:
CaCO3(s) ⇀ ↽ CaO(s) + CO2(g) rH 0 298 = 176 kJ
2SO2(g) + O2(g) ⇀ ↽ 2SO3(g) rH 0 298 = -198 kJ
Nếu tăng nhiệt độ, các cân bằng trên chuyển dịch theo chiều nào? Giải thích. …………………………………………………………………………………………………
Câu 15: Ester là hợp chất hữu cơ dễ bay hơi, một số ester được dùng làm chất tạo mùi thơm cho các loại bánh, thực phẩm. Phản ứng điều chế ester là một phản ứng thuận nghịch: CH3COOH(l) + C2H5OH(l) ⇀ ↽ CH3COOC2H5(l) + H2O(l)
Hãy cho biết cân bằng trên chuyển dịch theo chiều nào nếu
a) Tăng nồng độ của C2H5OH. b) Giảm nồng độ của CH3COOC2H5. …………………………………………………………………………………………………
10
………………………………………………………………………………………………… ………………………………………………………………………………………………… …………………………………………………………………………………………………
………………………………………………………………………………………………… ………………………………………………………………………………………………… Ạ
11
…………………………………………………………………………………………………
Câu 16: Cho các cân bằng sau:
a) 2SO2(g) + O2(g) ⇀ ↽ 2SO3(g) b)CO(g) +H2O(g) ⇀ ↽ H2(g) +CO2(g)
c) PCl5(g) ⇀ ↽ Cl2(g) + PCl3(g) d) H2(g) + I2(g) ⇀ ↽ 2HI(g)
Nếu tăng áp suất và giữ nguyên nhiệt độ, các cân bằng trên chuyển dịch theo chiều nào? Giải thích.
………………………………………………………………………………………………… …………………………………………………………………………………………………
Câu 17: Cho các cân bằng hóa học sau:
a) Cl2 (g) + H2O(l) ⇀ ↽ HCl(l) + HClO(l)
b) CaCO3 (s) ⇀ ↽ CaO (s) + CO2 (g)
c) 2Fe2O3 (s) + 3C (s) ⇀ ↽ 4Fe (s) + 3CO2 (g)
d) Fe (s) + H2O (g) ⇀ ↽ FeO (s) + H2 (g)
e) N2 (g) + 3H2 (g) ⇀ ↽ 2NH3 (g)
f) Cl2 (g) + H2S (g) ⇀ ↽ 2HCl (g) + S (s)
g) Fe2O3 (s) + 3CO (g) ⇀ ↽ 2Fe (s) + 3CO2 (g)
Hãy xác định chiều cân bằng chuyển dịch khi tăng áp suất chung của hệ? Giải thích.
YKÈMQUYNHƠNOFFICIAL
Câu 18: Xét các hệ cân bằng sau trong một bình kín:
a) C(s) + H2O(g) ⇀ ↽ CO(g) + H2(g) rH 0 298 = 131 kJ
b) CO(g) + H2O(g) ⇀ ↽ CO2(g) + H2(g) rH 0 298 = -41 kJ
Các cân bằng trên dịch chuyển theo chiều nào khi thay đổi một trong các điều kiện sau
(1) Tăng nhiệt độ.
(2) Thêm lượng hơi nước vào hệ
(3) Thêm khí H2 vào hệ.
(4) Tăng áp suất chung bằng cách nén cho thể tích của hệ giảm xuống.
(5) Dùng chất xúc tác.
Câu 19: Trong công nghiệp, khí hydrogen được điều chế như sau:
Cho hơi nước đi qua than nung nóng, thu được hỗn hợp khí CO và H2 (gọi là khí than ướt):
C(s) + H2O(g) ⇀ ↽ CO(g) + H2 rH 0 298 = 130 kJ
Trộn khí than ướt với hơi nước, cho hỗn hợp đi qua chất xúc tác Fe2O3:
CO(g) + H2O(g) ⇀ ↽ CO2(g) + H2(g) rH 0 298 = -42 kJ
a) Vận dụng nguyên lí Le Chatelier, hãy cho biết cần tác động yếu tố nhiệt độ như thế nào để các cân bằng (1), (2) chuyển dịch theo chiều thuận.
b) Trong thực tế, ở phản ứng (2), lượng hơi nước được lấy dư nhiều (4 – 5 lần) so với khí carbon monoxide. Giải thích.
c) Nếu tăng áp suất, cân bằng (1), (2) chuyển dịch theo chiều nào? Giải thích.
Câu20: Trongcơ thể người, hemoglobin(Hb)kếthợpvớioxygentheophản ứngthuậnnghịch được biểu diễn đơn giản như sau:
Hb(aq) + O2(g) ⇀ ↽ HbO2(aq)
Ở phổi, nồng độ oxygen lớn nhất nên cân bằng trên chuyển dịch sang phải, hemoglobin kết hợp với oxygen. Khi đến các mô, nồng độ oxygen thấp, cân bằng trên chuyển dịch sang trái, giải phóng oxygen. Nếu thiếu oxygen ở não, con người có thể bịđau đầu, chóng mặt.
a) Vận dụng nguyên lí chuyển dịch cân bằng Le Chatelie, em hãy đề xuất biện pháp để oxygen lên não được nhiều hơn?
b) Khi lên núi cao, một số người cũng gặp hiện tượng bị đau đầu, chóng mặt. Dựa vào cân bằng trên, em hãy giải thích hiện tượng này.
………………………………………………………………………………………………… ………………………………………………………………………………………………… ………………………………………………………………………………………………… …………………………………………………………………………………………………
12
………………………………………………………………………………………………… Ạ
13
………………………………………………………………………………………………… …………………………………………………………………………………………………
YKÈMQUYNHƠNOFFICIAL
DẠNG 3: PHÂN LOẠI CHẤT ĐIỆN LI MẠNH – CHẤT ĐIỆN LI YẾU VÀ CHẤT KHÔNG ĐIỆN LI.
Câu 21: Cho các chất sau: HBr, HI, H2S, KOH. Hãy phân loại thành acid mạnh, base mạnh, acid yếu và base yếu.
…………………………………………………………………………………………………
…………………………………………………………………………………………………
Câu 22: Cho biết những chất nào sau đây thuộc loại chất điện li HCl, Fe, BaCl2, Ca(OH)2,CH3COOH, O2. Viết phương trình điện li.
………………………………………………………………………………………………… …………………………………………………………………………………………………
Câu 25: Nước Javel (chứa NaClO và NaCl) được dùng làm chất tẩy rửa, khử trùng. Trong dung dịch, ion ClO- nhận proton của nước để tạo thành HClO.
a) Viết phương trình hoá học của phản ứng xảy ra và xác định chất nào là acid, chất nào là base trong phản ứng trên.
b) Dựa vào phản ứng, hãy cho biết môi trường của nước Javel là acid hay base.
Câu 23: Viết phương trình điện li của các chất: H2SO4, Ba(OH)2, Al2(SO4)3, HF, HI, KNO3, Na2SO4 ………………………………………………………………………………………………… ………………………………………………………………………………………………… ………………………………………………………………………………………………… …………………………………………………………………………………………………
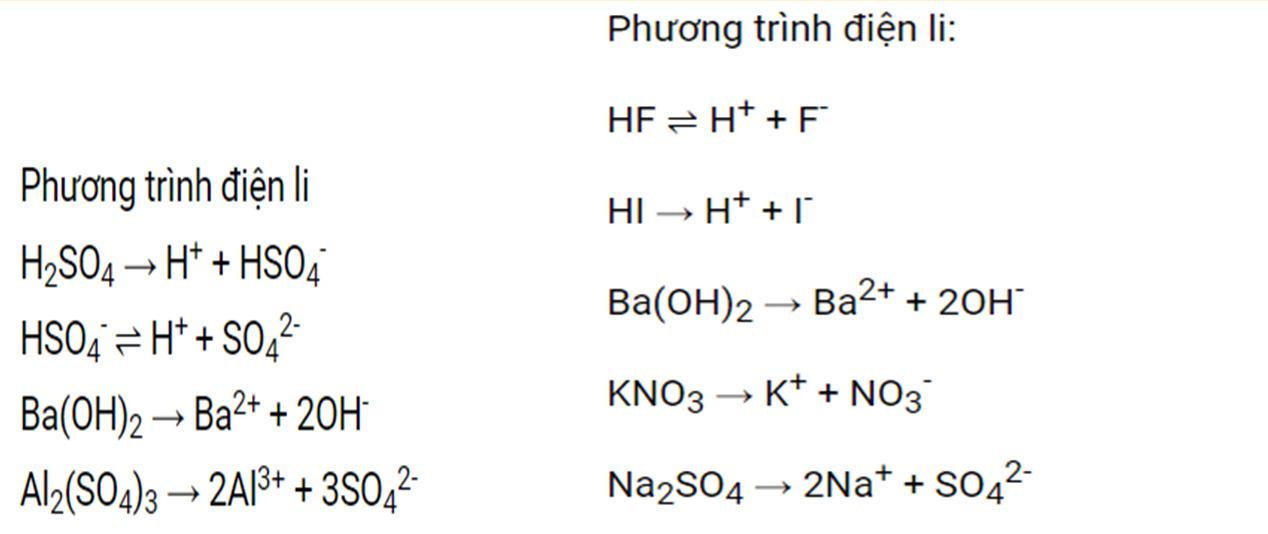
Câu24: Dựa vào thuyết acid – base của Brønsted – Lowry, hãy xác định chất nào là acid, chất nào là base trong các phản ứng sau:
a) CH3COOH + H2O ⇀ ↽ CH3COO- + H3O+
b) S2- + H2O ⇀ ↽ HS- + OH-
c) NH4 + + H2O ⇀ ↽ NH3 + H3O+ ………………………………………………………………………………………………… ………………………………………………………………………………………………… …………………………………………………………………………………………………
DẠNG 4: TÍNH NỒNG ĐỘ MOL CỦA CÁC ION TRONG DUNG DỊCH
Câu 26: Trong 200 ml dung dịch có chứa 20,2 gam KNO3. Xác định nồng độ [K+] và [NO3 -] trong dung dịch ban đầu.
Câu 27: Hòa tan 1,7 gam NaNO3 và 2,61 gam Ba(NO3)2 vào nước đểđược 100ml dung dịch X. Tính nồng độ mol/l của ion Na+, Ba2+ và NO3 - trong dung dịch X.
14
Ạ
15
………………………………………………………………………………………………… ………………………………………………………………………………………………… …………………………………………………………………………………………………
………………………………………………………………………………………………… ………………………………………………………………………………………………… …………………………………………………………………………………………………
………………………………………………………………………………………………… ………………………………………………………………………………………………… ………………………………………………………………………………………………… …………………………………………………………………………………………………
YKÈMQUYNHƠNOFFICIAL
Câu 28: Trộn 150 mL dung dịch MgCl2 0,5M với 50 mL dung dịch NaCl 1M thu được dung dịch A. Tính nồng độ ion Cl- có trong dung dịch A. ………………………………………………………………………………………………… ………………………………………………………………………………………………… …………………………………………………………………………………………………
Câu 29: Trộn lẫn 100 mL dung dịch K2SO4 0,5M và 200 mL dung dịch Fe2(SO4)3 0,1M. Tính nồng độ mol/l của các ion trong dung dịch sau cùng. ………………………………………………………………………………………………… ………………………………………………………………………………………………… …………………………………………………………………………………………………
Câu 31: Tính pH của các dung dịch sau:
a) Dung dịch HCl 0,1 M. b) Dung dịch H2SO4 0,005 M.
c) Dung dịch NaOH 0,1 M. d) Dung dịch Ca(OH)2 0,01 M. …………………………………………………………………………………………………
Câu 30: Trộn lẫn 100 mL dung dịch HCl 1M và 100 mL dung dịch KOH 0,5M, phản ứng xảy ra hoàn toàn thu được dung dịch A. Tính nồng độ mol/l của các ion trong dung dịch A.
Câu 32:
a) Một dung dịch có [H+] = 0,001 M. Tính pH và [OH-] của dung dịch.
b) Một dung dịch có [OH-] = 2,5 x 10-10 M. Tính pH và xác định môi trường của dung dịch này.
………………………………………………………………………………………………… …………………………………………………………………………………………………
Câu 33:
a) Một mẫu dịch vị có pH = 2,5. Xác định nồng độ mol của ion H+ có trong mẫu dịch vịđó.
b) Một mẫu nước mưa có pH = 4,82. Xác định nồng độ mol của ion H+ có trong mẫu nước mưa.
Câu 34: Một loại dầu gội đầu có nồng độ ion OH- là 10-5,17 mol/ L.
a) Tính nồng độ ion H+, pH của loại dầu gội nói trên.
b) Môi trường của loại dầu gội trên là acid, base hay trung tính.
………………………………………………………………………………………………… …………………………………………………………………………………………………
Câu 35: Một học sinh làm thí nghiệm xác định độ pH của đất như sau: Lấy một lượng đất cho vào nước rồi lọc lấy phần dung dịch. Dùng máy đo pH đo được giá trị pH là 4,52.
16
………………………………………………………………………………………………… ………………………………………………………………………………………………… ………………………………………………………………………………………………… DẠNG 5: XÁC ĐỊNH pH và [H+] CỦA DUNG DỊCH ACID – BASE. Ạ
…………………………………………………………………………………………………
17
…………………………………………………………………………………………………
………………………………………………………………………………………………… …………………………………………………………………………………………………
a) Hãy cho biết môi trường của dung dịch là acid, base hay trung tính.
b) Loại đất trên được gọi là đất chua. Hãy đề xuất biện pháp để giảm độ chua, tăng độ pH của đất. ………………………………………………………………………………………………… ………………………………………………………………………………………………… …………………………………………………………………………………………………
Câu 36:
YKÈMQUYNHƠNOFFICIAL
a) Pha 500 mL dung dịch HCl 0,2 M vào 500 mL nước. Tính pH của dung dịch thu được.
b) Tính khối lượng NaOH cần để pha 100ml dung dịch NaOH có pH = 12. ………………………………………………………………………………………………… ………………………………………………………………………………………………… …………………………………………………………………………………………………
Câu 37: Trộn 100 mL dung dịch HCl 0,25M với 300 mL dung dịch HNO3 0,05M. Tính giá trị pH của dung dịch thu được sau khi trộn. ………………………………………………………………………………………………… …………………………………………………………………………………………………
Câu38: Trộn20 mL dungdịch HCl 0,05Mvới 20mL dungdịch H2SO4 0,075M thu được40ml dung dịch A có pH bằng a. Tính giá trị của a.
Câu 39: Trộn 100 mL dung dịch KOH 0,12M với 100 mL dung dịch Ba(OH)2 0,04M. Tính pH của dung dịch thu được sau khi trộn.
Câu 40: Trộn 50 mL dung dịch NaOH 0,01M, 50 mL dung dịch KOH 0,02M và 200 mL dung dịch Ba(OH)2 0,005M thu được dung dịch có pH bằng b. Tính giá trị của b.
DẠNG 6: XÁC ĐỊNH pH CỦA DUNG DỊCH SAU PHẢN ỨNG GIỮA ACID VÀ BASE.
18
Ạ
19 ………………………………………………………………………………………………… …………………………………………………………………………………………………
………………………………………………………………………………………………… ………………………………………………………………………………………………… ………………………………………………………………………………………………… …………………………………………………………………………………………………
………………………………………………………………………………………………… ………………………………………………………………………………………………… …………………………………………………………………………………………………
…………………………………………………………………………………………………
YKÈMQUYNHƠNOFFICIAL
Câu 41: Trộn 20 mL dung dịch KOH 0,35M với 80 mL dung dịch HCl 0,1 M được 100 mL dung dịch có pH là a. Tính giá trị của a.
………………………………………………………………………………………………… …………………………………………………………………………………………………
Câu 42: Tính pH của dung dịch thu được sau khi trộn 40 mL dung dịch HNO3 0,5M với 60 mL dung dịch NaOH 0,5M.
…………………………………………………………………………………………………
Câu 46: Cho 100 mL dung dịch KOH 0,1M vào 100 mL dung dịch H2SO4 có pH=1. Xác định môi trường của dung dịch sau phản ứng.
Câu 43: Trộn 200 mL dung dịch H2SO4 0,05M với 300 mL dung dịch NaOH 0,05 M thu được 500 ml dung dịch A. Tính giá trị pH của dung dịch A.
…………………………………………………………………………………………………
………………………………………………………………………………………………… …………………………………………………………………………………………………
Câu 44: Trộn lẫn 200 ml dung dịch H2SO4 0,15M với 100 ml dung dịch KOH 0,3 M thu được 300 ml dung dịch A. Giá trị pH của dung dịch thu được là ………………………………………………………………………………………………… …………………………………………………………………………………………………
Câu 45: Cho 100 mL dung dịch HCl có pH = 2 vào 100 mL dung dịch NaOH 0,03M. Tính giá trị của pH sau phản ứng.
Câu 47: Trộn 100 mL dung dịch KOH có pH=12 với 100 mL dung dịch HCl 0,012M. Tính chỉ số pH của dung dịch thu được sau khi trộn.
20
Ạ
21 ………………………………………………………………………………………………… ………………………………………………………………………………………………… …………………………………………………………………………………………………
………………………………………………………………………………………………… ………………………………………………………………………………………………… …………………………………………………………………………………………………
………………………………………………………………………………………………… ………………………………………………………………………………………………… …………………………………………………………………………………………………
YKÈMQUYNHƠNOFFICIAL
Câu 48: Trộn 100 mL dung dịch HCl có pH=2 với 100 mL dung dịch NaOH để thu được dung dịch có pH = 7 thì pH của dung dịch NaOH là bao nhiêu?
Câu 51: Ở các vùng quê, người dân thường dùng phèn chua (K2SO4. Al2(SO4)3.24H2O) để làm trong nước nhờứng dụng của phản ứng thủy phân ion Al3+. Giải thích. Chất hay ion nào là acid, là base trong phản ứng thủy phân Al3+
…………………………………………………………………………………………………
………………………………………………………………………………………………… …………………………………………………………………………………………………
…………………………………………………………………………………………………
Câu 49: Trộn 300 mL dung dịch HCl 0,05 mol/L với 200 mL dung dịch Ba(OH)2 a mol/L thu
được 500 mL dung dịch có pH= 12. Tính giá trị của a.
…………………………………………………………………………………………………
…………………………………………………………………………………………………
………………………………………………………………………………………………… …………………………………………………………………………………………………
Câu 50: Để xác định nồng độ của một dung dịch HCl, người ta đã tiến hành chuẩn độ bằng dung dịch NaOH 0,1 M. Để chuẩn độ 10 mL dung dịch HCl này cần 20 mL dung dịch NaOH.
Xác định nồng độ của dung dịch HCl trên.
Câu 52: Tương tự phèn chua, hãy cho biết dung dịch phèn (NH4Fe(SO4)2.12H2O) có môi trường acid hay base. Giải thích. Vì sao người ta có thể dùng phèn sắt để loại bỏ các chất lơ lửng trong nước?
Câu 53: Đất chua là đất có độ pH dưới 6,5 để cải thiện đất trồng bị chua người nông dân có thể bổ sung chất nào trong các chất sau đây vào đất: CaO. P2O5. Giải thích.
Câu 54: Trong môi trường acid, diệp lục có màu vàng đến đỏ còn trong môi trường kiềm, diệp lục có màu xanh.
a) Giải thích vì sao khi vắt chanh vào nước luộc rau muống thì màu xanh của nước lại bị nhạt đi.
b) Vì sao khi luộc bánh chưng, cho thêm một chút thuốc muối (NaHCO3) sẽ làm lá dong gói bánh có màu xanh đẹp hơn? …………………………………………………………………………………………………
Câu 55: Bình thường, chỉ số pH của nước tiểu ở người dao động trong khoảng 4,5 – 8,0. Nếu pH của nước tiểu giảm xuống dưới 4,5 thì có nghĩa là bị dư acid, còn cao hơn 8,0 thì có nghĩa là bị dư kiềm. Sỏi thận là khối chất rắn hình thành trong thận, gây đau khi ngăn cản dòng nước tiểu từ thận xuống niệu quản. Một trong các dấu hiệu của bệnh sỏi thận là nước tiểu bị dư acid hoặc dư kiềm. Đề xuất cách làm đơn giản để có thể tiên lượng bệnh sỏi thận.
TRẮC NGHIỆM KHÁCH QUAN
22
………………………………………………………………………………………………… ………………………………………………………………………………………………… ………………………………………………………………………………………………… DẠNG 7: GIẢI THÍCH HIỆN TƯỢNG THỰC TẾ. Ạ
23
…………………………………………………………………………………………………
………………………………………………………………………………………………… …………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
ẦN 1 CÂN BẰNG HÓA HỌC.
PH
Câu 1. Phát biểu nào sau đây không đúng?
A. Trong phản ứng một chiều, chất sản phẩm không phản ứng được với nhau tạo thành chất đầu.
B. Trong phản ứng thuận nghịch, các chất sản phẩm có thể phản ứng với nhau để tạo thành chất đầu.
C. Phản ứng một chiều là phản ứng luôn xảy ra không hoàn toàn.
D. Phản ứng thuận nghịchlàphản ứngxảy ratheo hai chiều trái ngượcnhau trong cùng điều kiện.
Câu 2. Cho các nhận xét sau:
a) Ở trạng thái cân bằng, tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch.
b) Ở trạng thái cân bằng, các chất không phản ứng với nhau.
c) Ở trạng thái cân bằng, nồng độ các chất sản phẩm luôn lớn hơn nồng độ các chất đầu.
d) Ở trạng thái cân bằng, nồng độ các chất không thay đổi.
Các nhận xét đúng là
A. (a) và (b). B. (b) và (c). C. (a) và (c). D. (a) và (d).
Câu 3. Phát biểu nào sau đây về một phản ứng thuận nghịch tại trạng thái cân bằng là không
đúng?
A. Tốc độ của phản ứng thuận bằng tốc độ của phản ứng nghịch.
B. Nồng độ của tất cả các chất trong hỗn hợp phản ứng là không đổi.
C. Nồng độ mol của chất phản ứng luôn bằng nồng độ mol của chất sản phẩm phản ứng.
D. Phản ứng thuận và phản ứng nghịch vẫn diễn ra.
Câu 4. Một cân bằng hóa học đạt được khi
YKÈMQUYNHƠNOFFICIAL
A. nhiệt độ phản ứng không đổi.
B. tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch.
C. nồng độ chất phản ứng bằng nồng độ sản phẩm.
D. không có phản ứng xảy ra nữa dù có thêm tác động của các yếu tố bên ngoài như: nhiệt
độ, nồng độ, áp suất.
Câu 5. Tìm câu sai: Tại thời điểm cân bằng hóa học thiết lập thì
A. tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch.
B. số mol các chất tham gia phản ứng không đổi.
C. số mol các sản phẩm không đổi.
D. phản ứng không xảy ra nữa.
Câu 6. Hằng số cân bằng của phản ứng xác định chỉ phụ thuộc vào
A. áp suất. B. chất xúc tác. C. nồng độ. D. nhiệt độ.
Câu 7. Hệ phản ứng sau ở trạng thái cân bằng: H2 (g) + I2 (g) ⇀ ↽ 2HI(g). Biểu thức của hằng số cân bằng của phản ứng trên là
]
2 IH HI × B. KC = [ ] [ ] [] HI IH 2 22 × C. KC = [ 2 IH HI × D. KC = [ ] [ ] []2 22 HI IH ×
Câu 8. Sự chuyển dịch cân bằng là sự chuyển dịch
B. phản ứng trực tiếp theo chiều nghịch.
C. từ trạng thái cân bằng này thành trạng thái cân bằng khác.
D. phản ứng tiếp tục xảy ra cả chiều thuận và chiều nghịch.
Câu 9. Cho các yếu tố: nồng độ (a), nhiệt độ ( b), áp suất (c), diện tích tiếp xúc (d), xúc tác (e). Yếu tốảnh hưởng đến cân bằng hóa học là
A. (a), (b), (c), (d). B. (a), (b), (d), (e). C. (a), (b), (c). D. (a), (b), (c), (e).
Câu 10. Cho cân bằng hoá học: N2 (g) + 3H2 (g) ⇀ ↽ 2NH3 (g); phản ứng thuận là phản ứng toả nhiệt. Cân bằng hoá học không bị chuyển dịch khi
A. thay đổi áp suất của hệ. B. thay đổi nồng độ N2.
C. thay đổi nhiệt độ D. thêm chất xúc tác Fe.
Câu 11. Cho cân bằng hoá học: PCl5(g) ⇀ ↽ PCl3(g) + Cl2(g) ∆H > 0. Cân bằng chuyển dịch theo chiều thuận khi
A. thêm PCl3 vào hệ phản ứng B. tăng nhiệt độ của hệ phản ứng
C. thêm Cl2 vào hệ phản ứng D. tăng áp suất của hệ phản ứng
Câu 12. Cho cân bằng hóa học sau: H2(g) + I2(g) ⇀ ↽ 2HI(g) Yếu tố nào sau đây không ảnh hưởng đến cân bằng hóa học của phản ứng trên
A. Tăng nồng độ H2 B. Giảm nồng độ HI.
C. Tăng áp suất của hệ. D. Tăng nhiệt độ.
2NO (g) ∆H > 0. Hãy cho biết những yếu tố nào sau đây ảnh hưởng đến sự chuyển dịch cân bằng hoá học trên?
Câu 13. Cho cân bằng hoá học: N2(g) + O2(g) ⇀ ↽
A. nhiệt độ và nồng độ B. áp suất và nồng độ
C. nồng độ và chất xúc tác. D. chất xúc tác và nhiệt độ
Câu 14. Cho phản ứng thuận nghịch ở trạng thái cân bằng: 4NH3(g) + 3O2(g) ⇀ ↽ 2N2(g)+ 6H2O(g) ∆H < 0.
Cân bằng sẽ chuyển dịch theo chiều thuận khi
A. tăng nhiệt độ B. thêm chất xúc tác. C. tăng áp suất. D. loại bỏ hơi n
ước.
cân bằng mới nếu nồng độ của N2O4 tăng lên 9 lần thì nồng độ của NO2
24
Ạ
25
A. KC = [ ] [][]22 [][]22
A. phản ứng trực tiếp theo chiều thuận .
Câu 15. Xét cân bằng: N2O4 (g) ⇀ ↽ 2NO2 (g) ở 250C. Khi chuyển dịch sang một trạng thái
A. tăng 9 lần. B. tăng 3 lần. C. tăng 4,5 lần. D. giảm 3 lần.
Câu 16. Phản ứng nào sau đây không chuyển dịch cân bằng khi áp suất tăng
A. N2(g) + 3H3(g) ⇀ ↽ 2NH3(g) B. N2(g) + O2(g) ⇀ ↽ 2NO(g)
C. 2CO(g) + O2(g) ⇀ ↽ 2CO2(g) D. N2O4(g) ⇀ ↽ 2NO2(g)
Câu 17. Ở nhiệt độ không đổi, hệ cân bằng nào sẽ dịch chuyển về bên phải nếu tăng áp suất
A. 2H2(g) + O2(g) ⇀ ↽ 2H2O(g). B. 2SO3(g) ⇀ ↽ 2SO2(g) + O2(g)
C. 2NO(g) ⇀ ↽ N2(g) + O2(g) D. 2CO2(g) ⇀ ↽ 2CO(g) + O2(g)
Câu 18. Cho các cân bằng hoá học:
N2(g) + 3H2(g) ⇀ ↽ 2NH3(g) (1) H2(g) + I2(g) ⇀ ↽ 2HI(g) (2)
2SO2(g) + O2(g) ⇀ ↽ 2SO3(g) (3) 2NO2(g) ⇀ ↽ N2O4(g) (4)
Khi thay đổi áp suất những cân bằng hóa học bị chuyển dịch là
A. (1), (2), (3). B. (2), (3), (4). C. (1), (2), (4). D. (1), (3), (4).
Câu 19. Cho các cân bằng sau :
(1) 2SO2(g) + O2(g) ⇀ ↽ 2SO3(g) (2) N2(g) + 3H2(g) ⇀ ↽ 2NH3(g)
(3) CO2(g) + H2(g) ⇀ ↽ CO(g) + H2O(g) (4) 2HI (g) ⇀ ↽ H2(g) + I2(g)
Khi thay đổi áp suất, nhóm gồm các cân bằng hoá học đều không bị chuyển dịch là
A. (1) và (2). B. (1) và (3). C. (3) và (4). D. (2) và (4).
Câu 20. Cho các cân bằng sau
YKÈMQUYNHƠNOFFICIAL
(I) 2HI (g) ⇀ ↽ H2 (g) + I2 (g) (II) CaCO3 (s) ⇀ ↽ CaO (s) + CO2 (g)
(III) FeO (s) + CO (g) ⇀ ↽ Fe (s) + CO2 (g) (IV) 2SO2 (g) + O2 (g) ⇀ ↽ 2SO3 (g)
Khi giảm áp suất của hệ, số cân bằng bị chuyển dịch theo chiều nghịch là
A. 4 B. 3 C. 2 D. 1
Câu 21. Trong phản ứng tổng hợp ammonia N2(g) + 3H2(g) ⇀ ↽ 2NH3(g) ΔH = – 92kJ
Để thu được nhiều khí NH3, áp dụng biện pháp
A. giảm nhiệt độ và áp suất. B. tăng nhiệt độ và áp suất.
C. tăng nhiệt độ và giảm áp suất. D. giảm nhiệt độ và tăng áp suất
Câu 22. Phản ứng tổng hợp ammonia: N2(g) + 3H2(g) ⇀ ↽ 2NH3(g) ΔH = – 92kJ
Yếu tố không giúp tăng hiệu suất tổng hợp ammonia là
A. Lấy ammonia ra khỏi hỗn hợp phản ứng.
C. Thêm khí nitrogen vào hỗn hợp phản ứng.
B. Tăng nhiệt độ
D. Tăng áp suất.
Câu 23. Cho phản ứng ở trạng thái cân bằng: H2(g) + Cl2(g) ⇀ ↽ 2HCl(g) ΔH < 0 . Cân
bằng sẽ chuyển dịch về bên trái (phản ứng xảy ra theo chiều nghịch), khi
A. tăng nhiệt độ B. tăng nồng độ khí H2
C. tăng nồng độ khí Cl2 D. tăng áp suất.
Câu24. Cho phản ứng: 2NaHCO3 (s) ⇀ ↽ Na2CO3(s) + CO2(g) +H2O(g) ΔH= +129kJ.
Phản ứng xảy ra theo chiều nghịch khi
A. giảm nhiệt độ B. tăng nhiệt độ
C. giảm áp suất. D. thêm xúc tác
Câu 25. Trong hệ phản ứng ở trạng thái cân bằng: 2SO2 (g) + O2 (g) ⇀ ↽ 2SO3(g) ΔH < 0.
Nồng độ của SO3 sẽ tăng, nếu
A. giảm nồng độ của SO2. B. tăng nồng độ của SO2.
C. tăng nhiệt độ của hệ D. giảm nồng độ của O2
Câu 26. Cho phản ứng sau ở trang thái cân bằng: H2 (g) + F2 (g) ⇀ ↽ 2HF(g) ΔH < 0. Sự biến đổi nào sau đây không làm chuyển dịch cân bằng hoá học?
A. Thay đổi áp suất. B. Thay đổi nhiệt độ
C. Thay đổi nồng độ khí H2 hoặc F2. D. Thay đổi nồng độ khí HF.
Câu27. Phản ứngsảnxuấtvôi: CaCO3 (s) ⇀ ↽ CaO(s)+CO2 (g) ΔH>0.Biệnphápkĩ thuật tác động vào quá trình sản xuất để tăng hiệu suất phản ứng là
A. tăng nhiệt độ. B. giảm áp suất. C. tăng áp suất. D. cả A và B. Câu 28. Cho cân bằng hóa học: 2SO2(g) + O2(g) ⇀ ↽ 2SO3(g). Phản ứng thuận là phản ứng tỏa nhiệt. Phát biểu nào sau đây đúng?
A. Cân bằng chuyển dịch theo chiều thuận khi tăng nhiệt độ
B. Cân bằng chuyển dịch theo chiều nghịch khi giảm nồng độ O2
C. Cân bằng chuyển dịch theo chiều thuận khi giảm áp suất hệ phản ứng.
D. Cân bằng chuyển dịch theo chiều nghịch khi giảm nồng độ SO3
Câu 29. Cho các phản ứng sau:
(1). H2(g) + I2(s) ⇀ ↽ 2HI(g) ΔH > 0.
(2). 2NO(g) + O2(g) ⇀ ↽ 2NO2 (g) ΔH < 0.
(3). CO(g) + Cl2(g) ⇀ ↽ COCl2(g) ΔH < 0.
(4). CaCO3(s) ⇀ ↽ CaO(s) + CO2(g) ΔH > 0.
Khi giảm nhiệt độ hoặc tăng áp suất các cân bằng nào trên đều chuyển dịch theo chiều thuận?
A. (1), (2). B. (1), (3), (4). C. (2), (4). D. (2), (3).
Câu 30. Cho cân bằng hóa học sau: 2SO2(g) + O2(g) ⇀ ↽ 2SO3(g) ΔH < 0. Khi giảm nhiệt độ và khi giảm áp suất thì cân bằng của phản ứng trên chuyển dịch tương ứng là
A. Thuận và thuận. B. Thuận và nghịch.
C. Nghịch và nghịch. D. Nghịch và thuận.
26
Ạ
27
Câu31. Cho cân bằng sau trong bình kín: 2NO2(g)(nâu đỏ) ⇀ ↽ N2O4(g)(không màu). Biết khi giảm nhiệt độ của bình thì màu nâu đỏ nhạt dần. Phản ứng thuận có
A. ∆H < 0, phản ứng thu nhiệt B. ∆H > 0, phản ứng tỏa nhiệt
C. ∆H > 0, phản ứng thu nhiệt D. ∆H < 0, phản ứng tỏa nhiệt
Câu 32. Cho cân bằng hóa học: 2SO2 (g) + O2 (g) ⇀ ↽ 2SO3 (g). Khi tăng nhiệt độ thì tỉ khối
của hỗn hợp khí so với H2 giảm đi. Phát biểu đúng khi nói về cân bằng này là
A. Phản ứng nghịch toả nhiệt, cân bằng dịch chuyển theo chiều thuận khi tăng nhiệt độ.
B. Phản ứng thuận toả nhiệt, cân bằng dịch chuyển theo chiều nghịch khi tăng nhiệt độ
C. Phản ứng nghịch thu nhiệt, cân bằng dịch chuyển theo chiều thuận khi tăng nhiệt độ
D. Phản ứng thuận thu nhiệt, cân bằng dịch chuyển theo chiều nghịch khi tăng nhiệt độ
Câu 33. Cho cân bằng (trong bình kín) sau:
CO(g) + H2O(g) ⇀ ↽ CO2(g) + H2(g) ∆H < 0.
Trong các yếu tố:
(1) tăng nhiệt độ. (2) thêm một lượng hơi nước. (3) thêm một lượng H2
(4) tăng áp suất chung của hệ. (5) dùng chất xúc tác.
Các yếu tố làm thay đổi cân bằng của hệ là
A. (1), (4), (5) B. (1), (2), (4) C. (1), (2), (3) D. (2), (3), (4)
Câu 34. Cho phản ứng đang ở trạng thái cân bằng: N2 (g) + 3H2 (g) ⇀ ↽ 2NH3 (g) ∆H < 0
Cho các yếu tố sau:
(1). tăng nhiệt độ. (2). tăng áp suất. (3). giảm nhiệt độ.
(4). hóa lỏng và lấy NH3 ra khỏi hỗn hợp. (5). giảm áp suất.
YKÈMQUYNHƠNOFFICIAL
Muốn cho cân bằng chuyển dịch theo chiều thuận thì cần phải
A. (2), (4). B. (1), (2), (4). C. (2), (3), (4). D. (1), (5).
Câu 35. Cho cân bằng hóa học sau: 2SO2 (k) + O2 (k) ⇌ 2SO3 (k) ; ΔH < 0. Cho các biện

pháp:
(1) Tăng nhiệt độ. (2) Tăng áp suất chung của hệ phản ứng.
(3) Hạ nhiệt độ. (4) Dùng thêm chất xúc tác V2O5
(5) Giảm nồng độ SO3. (6) Giảm áp suất chung của hệ phản ứng.
Trong các biện pháp trên, những biện pháp nào làm cân bằng chuyển dịch theo chiều thuận?
A. (1), (2), (4), (5). B. (2), (3), (5). C. (2), (3), (4), (6). D. (1), (2), (5).
Câu 36. Cho cân bằng hóa học sau: 2SO2(g) + O2 (g) ⇀ ↽ 2SO3 (g) ΔH < 0 . Để cân bằng
trên chuyển dịch về phía thuận, thì tác động đến các yếu tố như thế nào?
A. Nhiệt độ tăng, áp suất chung tăng, nồng độ SO2 và O2 tăng
B. Nhiệt độ giảm, áp suất chung tăng, nồng độ SO2 và O2 tăng.
C. Nhiệt độ giảm, áp suất chung tăng, tăng nồng độ SO3, tăng lượng xúc tác.
D. Nhiệt độ tăng, áp suất chung giảm, tăng lượng xúc tác.
Câu 37. Trong công nghiệp, đểđiều chế khí than ướt, người ta thổi hơi nước qua than đá đang nóng đỏ, phản ứng hoá học xảy ra như sau:
C(s) + H2O (g) ⇀ ↽ CO(g) + H2(g) ∆H = +131kJ.
Điều khẳng định nào sau đây là đúng?
A. Tăng áp suất chung của hệ làm cân bằng không thay đỏi.
B. Tăng nhiệt độ của hệ làm cân bằng chuyển sang chiều thuận.
C. Dùng chất xúc tác làm cân bằng chuyển sang chiều thuận.
D. Tăng nồng độ hydrogen làm cân bằng chuyển sang chiều thuận.
Câu 38. Cho phản ứng thuận nghịch: 2 HgO(s) ⇀ ↽ 2 Hg(l) + O2(g) , ∆H >0. Để thu được lượng oxygen lớn nhất cần phải
A. Cho phản ứng xảy ra ở nhiệt độ cao, áp suất cao.
B. Cho phản ứng xảy ra ở nhiệt độ cao, áp suất thấp.
C. Cho phản ứng xảy ra ở nhiệt độ thấp, áp suất thấp.
D. Cho phản ứng xảy ra ở nhiệt độ thấp, áp suất cao.
Câu 39. Xét cân bằng sau: CaCO3 (s) ⇀ ↽ CaO (s) + CO2 (g) ΔH= 178,5kJ Người ta thực hiện các biện pháp sau:
(a) Tăng nhiệt độ (b) Thêm lượng CaCO3 vào.
(c) Lấy bớt CO2 ra. (d) Tăng áp suất chung bằng cách nén cho bớt thể tích của hệ giảm xuống.
Có bao nhiêu yếu tố làm cân bằng trên sẽ chuyển dịch theo chiều thuận
A. 4 B. 3 C. 1 D. 2
Câu 40. Cho cân bằng hoá học sau:
H2(g) + I2(g) ⇀ ↽ 2HI(g) = -9,6 kJ
Nhận xét nào sau đây không đúng?
A. Khi tăng nhiệt độ, cân bằng trên chuyển dịch theo chiều nghịch.
B. Ở nhiệt độ không đổi, khi tăng áp suất thì cân bằng không bị chuyển dịch.
C. Ở nhiệt độ không đổi, khi tăng nồng độ H2 hoặc I2 thì giá trị hằng số cân bằng tăng.
D. Ở trạng thái cân bằng, tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch.
PHẦN 2. CÂN BẰNG TRONG DUNG DỊCH NƯỚC
Câu 41. Câu nào dưới đây là đúng khi nói về sựđiện li?
A. Sựđiện li là sự hòa tan một chất o nước tạo ra dung dịch .
B. Sựđiện li là sự phân li 1 chất dưới tác dụng của dòng điện .
28
Ạ
29
C. Sựđiện li là sự phân li 1 chất thành ion dương và ion âm khi chất đó tan trong nước hay
ở trạng thái nóng chảy.
D. Sựđiện li thực chất là quá trình oxi hóa khử
Câu 42. Dung dịch nào sau đây có khả năng dẫn điện?
A. Dung dịch đường saccarose. B. Dung dịch muối ăn.
C. Dung dịch ethanol. D. Dung dịch benzene trong alcohol.
Câu 43. Chất nào sau đây là chất điện li?
A. Đường saccarose (C12H22O11). B. NaCl rắn khan.
C. Dung dịch C2H5OH. D. NaOH nóng chảy.
Câu 44. Dung dịch nào sau đây không dẫn được điện ?
A. HCl trong C6H6 (benzene). B. Dung dịch KNO3 trong nước.
C. Dung dịch CH3COONa trong nước. D. Dung dịch HCl trong nước.
Câu 45. Chất nào sau đây không dẫn điện được?
A. KCl rắn khan. B. CaCl2 nóng chảy.
C. NaOH nóng chảy. D. HBr hòa tan trong nước.
Câu 46. Dãy chất nào sau đây trong nước đều là chất điện li mạnh?
A. H2SO4, Cu(NO3)2, CaCl2, H2S.. B. HCl, H3PO4, Fe(NO3)3, NaOH.
C. H2SO4, MgCl2, Al2(SO4)3, Ba(OH)2 D. HNO3, CH3COOH, BaCl2, KOH.
Câu 47. Dãy chất nào sau đây toàn chất điện li yếu ?
YKÈMQUYNHƠNOFFICIAL
A. H2S, H2SO3, H2SO4, NaClO4 B. H2CO3, H3PO4, CH3COOH, Ba(OH)2
C. H2S, CH3COOH, HClO, HgSO4. D. H2CO3, H2SO3, HClO, Al2(SO4)3.
Câu 48. Cho các chất sau: KAl(SO4)2.12H2O (phèn chua), C2H5OH, C12H22O11 (saccarose), CH3COOH, Ca(OH)2, CH3COONH4. Số chất thuộc chất điện li là
A. 3 B. 4 C. 5 D. 2
Câu 49. Trong dung dịch H2S (dung môi là nước) có thể chứa
A. H2S, H+, HS-, S2. B. H2S, H+, HS. C. H+, HS. D. H+ và S2.
Câu 50. Trong dung dịch acetic acid (CH3COOH) có những phần tử nào? Bỏ qua sự phân li của nước.
A. CH3COO-, H+, CH3COOH B. H+, CH3COOH, H2O
C. CH3COO-, H+ D. CH3COO-, H+, CH3COOH, H2O
Câu 51. Dung dịch nào sau đây có cùng nồng độ mol dẫn điện tốt nhất?
A. K2SO4 B. KOH C. NaCl D. KNO3
Câu 52. Các dung dịch sau đây có cùng nồng độ 0,10 mol/L ,dung dịch nào dẫn điện kém nhất
A. HCl B. HF C. HI D. HBr
Câu 53. Có 4 dung dịch có cùng nồng độ mol: CH3COOH (1), C6H12O6 (2), NaNO3 (3), Dãy sắp xếp theo thứ tựđộ dẫn điện tăng dần?
A. (1), (2), (3) B. (3), (2), (1) C. (2), (3), (1) D. (2), (1), (3)
Câu 54. Có 4 dung dịch có cùng nồng độ mol: sodium chloride NaCl (1), ethanol (C2H5OH) (2), acetic acid (CH3COOH) (3), potassium sulfate K2SO4 (4). Dãy sắp xếp theo thứ tự tăng dần vềđộ dẫn điện của dung dịch?
A. NaCl < C2H5OH < CH3COOH < K2SO4.
B. C2H5OH < CH3COOH < NaCl < K2SO4
C. C2H5OH < CH3COOH < K2SO4 < NaCl.
D. CH3COOH < NaCl < C2H5OH < K2SO4.
Câu 55. Phương trình điện li nào sau đây viết đúng?
A. H2SO4 ⇀ ↽ H+ + HSO4 - B. HF ⇀ ↽ H+ + F-
C. H2SO3 → H+ + HSO3 - D. Na2S ⇀ ↽ 2Na+ + S2Câu 56. Phương trình điện li nào dưới đây viết không đúng ?
A. Zn(OH)2 → Zn2+ + 2OH- B. CH3COOH ⇀ ↽ CH3COO- + H+
C. NaOH → Na+ + OH- D. Na2SO4 → 2Na+ + SO4 2-
Câu57. Đối với dung dịch acid yếu CH3COOH 0,10M, nếu bỏ qua sựđiện li của nước thì đánh giá nào về nồng độ mol ion sau đây là đúng?
A. [H+] = 0,10M. B. [H+] < [CH3COO-]. C. [H+] > [CH3COO-]. D. [H+] < 0,10M. Câu 58. Đối với dung dịch acid mạnh HNO3 0,10M, nếu bỏ qua sựđiện li của nước thì đánh giá nào về nồng độ mol ion sau đây là đúng?
A. [H+] = 0,10M. B. [H+] < [NO3 -]. C. [H+] > [NO3 -]. D. [H+] < 0,10M.
Câu 59. Cho 2 dung dịch acid là HNO3 và HClO có cùng nồng độ. Sự so sánh nào sau đây là đúng?
A. 3HNO < [ ] HClO B. 3HNO H+ = HClO H+ C. 3HNO H+ > HClO H+ D. 3NO < ClO
Câu 60. H2SO4 và HNO3 là axit mạnh còn HNO2 là axit yếu có cùng nồng độ 0,01mol/L và ở cùng nhiệt độ. Nồng độ ion H+ trong mỗi dung dịch được xếp theo thứ tự nào là đúng?
A. [H+] 3HNO < [H+] 24HSO < [H+] 2HNO B. [H+] 2HNO < [H+] 3HNO < [H+] 24HSO
C. [H+] 2HNO < [H+] 24HSO < [H+] 3HNO D. [H+] 24HSO < [H+] 3HNO < [H+] 2HNO
Câu 61. Theo định nghĩa acid−base của Brønsted – Lowry, các chất và ion thuộc dãy nào dưới đây chỉđóng vai trò là acid
A. HSO4 -, NH4 +, CO3 2- B. NH4 +, HCO3 -, CH3COO-
C. HSO4 -, NH4 +,HNO3 D. CH3COO-, HCO3 - , S2.
30
Ạ
31
Câu 62. Chất nào sau đây thuộc loại acid theo Brønsted – Lowry?
A. H2SO4, Na+, CH3COO- B. HCl, NH4 +, HSO4 –
C. H2S , H3O+, HPO3 2- D. HNO3, Mg2+, NH3
Câu 63. Theo thuyết Brønsted – Lowry, ion nào sau đây vừa có tính acid, vừa có tính base?
A. NO3. B. PO4 3. C. HCO3. D. SiO3 2.
Câu 64. Theo định nghĩa về acid - base của Brønsted – Lowry có bao nhiêu ion trong số các ion sau đây là base (có khả năng nhận proton): Na+, Cl , CO3 2 , HCO3 , CH3COO , NH4 + , S2-?
A. 5. B. 2. C. 3. D. 4.
Câu 65. Theo thuyết acid - base của Brønsted – Lowry, nhận xét nào sau đây đúng?
A. NH4 +, SO4 2- và NO3 - có tính acid.
B. HCO3-, S2- và Al3+ có tính base.
C. HCO3 -, Cl- và K+ có tính trung tính.
D. HCO3 -, H2O và HS- có tính lưỡng tính.
Câu 66. Trong dung dịch HCl 0,001 M.Tích số ion của nước là
A. Kw = [ H+ ] .[ OH-] <1,0.10 -14 B. Kw = [ H+ ] .[ OH- ] =1,0.10 -14
C. Kw = [ H+ ] .[ OH-]> 1,0.10 -14 D. Không xác định được
Câu 67. Hãy chỉ ra điều sai về pH
A. pH = -lg [H+] B. pH + pOH = 14
C. [H+] = 10 a thì pH= a D. [H+]. [OH-] = 10-14
Câu 68. Chọn phát biểu đúng trong số các phát biểu sau đây ?
A. Dung dịch có pH < 7 làm quỳ tím hoá xanh.
B. Giá trị pH tăng thì độ axit giảm.
YKÈMQUYNHƠNOFFICIAL
C. Dung dịch có pH >7 làm quỳ tím hoá đỏ
D. Giá trị pH tăng thì độ axit tăng.
Câu 69. pH của dung dịch A chứa HCl 0,0001M là
A. 10 B. 12 C. 4 D. 2
Câu 70. Dung dịch KOH 0,001M có pH bằng
A. 3 B. 11 C. 2 D. 12
Câu 71. pH của dung dịch nào sau đây có giá trị nhỏ nhất?
A. Dung dịch HCl 0,1 M. B. Dung dịch CH3COOH 0,1 M.
C. Dung dịch NaCl 0,1 M. D. Dung dịch NaOH 0,01 M.
Câu 72. Đo pH của một cốc nước chanh được giá trị pH bằng 2,4. Nhận định nào sau
đây không đúng?
A. Nước chanh có môi trường acid.
B. Nồng độ ion [H+] của nước chanh là 10-2,4 mol/L.
C. Nồng độ ion [H+] của nước chanh là 0,24 mol/L.
D. Nồng độ của ion [OH-] của nước chanh nhỏ hơn 10-7 mol/L.
Câu 73. Đối với dung dịch acid mạnh HNO3 0,1M (coi HNO3 phân li hoàn toàn), đánh giá nào dưới đây là đúng?
A. pH > 1 B. pH = 1 C. pH < 1 D. [H+]< [NO3 ]
Câu 74. Cho các dung dịch NaCl, NaOH, NH3, Ba(OH)2 có cùng nồng độ mol, dung dịch có pH lớn nhất là
A. NaOH B. Ba(OH)2 C. NH3 D. NaCl
Câu 75. Dung dịch nào sau đây có pH nhỏ nhất (có cùng nồng độ mol) là
A. NaOH B. H2SO4 C. Ba(OH)2 D. HCl
Câu 76. Cho các dung dịch NaOH (1), H2SO4 (2) , HCl (3) , KNO3 (4) có cùng nồng độ mol.
Giá trị pH của dung dịch được sắp xếp tăng dần từ trái sang phải là
A. (3), (2), (4), (1). B. (4), (1), (2), (3). C. (1), (2), (3), (4). D. (2), (3), (4), (1).
Câu 77. Các dung dịch sau được xếp theo chiều tăng dần vềđộ pH (có cùng nồng độ)
A. H2S, NaCl, HNO3, KOH. B. HNO3, H2S, NaCl, KOH.
C. KOH, NaCl, H2S, HNO3 D. HNO3, KOH, NaCl, H2S. Câu 78. Thêm 900 ml nước vào 100 ml dung dịch H2SO4 0,05M thì thu được dung dịch mới có pH bằng
A. 1 B. 2 C. 3 D. 4
Câu 79. Thêm 450 ml nước vào 50 ml dung dịch 2Ba(OH) có 0,005M thì thu được dung dịch mới có pH bằng
A. 11 B. 12 C. 13 D. 1
Câu80. Thêm nước vào 10 mL dung dịch HCl 1,0 mol/L đểđược 1000 mL dung dịchA. Dung dịch mới thu được có pH thay đổi như thế nào so với dung dịch ban đầu?
A. pH giảm đi 2 đơn vị B. pH giảm đi 0,5 đơn vị
C. pH tăng gấp đôi. D. pH tăng 2 đơn vị
Câu 81. Dung dịch nào sau đây có nồng độ OH- cao nhất
A. Dịch vị dạ dày. B. Dung dịch café đen.
C. Dung dịch sữa tươi. D. Dung dịch xà phòng.
Câu 82. Khi cho giấy quì tím vào dung dịch giấm ăn pha loãng thì quì tím
A. không đổi màu. B. hóa xanh C. mất màu. D. hóa đỏ.
Câu 83. Nếu dòng điện chạy qua được dung dịch nước của một chất X, những phát biểu nào
sau đây sai?
a) Chất X là chất điện li.
b) Trong dung dịch chất X có các ion dương và ion âm.
32
Ạ
33
c) Chất X ở dạng rắn khan cũng dẫn điện.
d) Trong dung dịch chất X có electron tự do.
A. a, d. B. b, c, d. C. a, b. D. c, d.
Câu 84. Hình ảnh sau, mô tả phương pháp nào sau đây
A. Phương pháp phân tích định tính. B. Phương pháp phân tích định lượng.
C. Phương pháp phân tích phổ D. Phương pháp chuẩn độ
YKÈMQUYNHƠNOFFICIAL
Câu 85. Để xác định nồng độ dung dịch kiềm chưa biết người ta dùng dung dịch acid (có nhỏ
vài giọt chất chỉ thị) đã biết trước nồng độ và sử dụng dụng cụ thí nghiệm như hình vẽ sau.
C. Vẫn thực hiện được vì khi đến điểm tương đương dung dịch vẫn chuyển sang hồng nhạt.
D. Không vì không thể nhận biết được điểm tương đương.
Câu 87. Chọn phát biểu đúng trong số các phát biểu sau đây ?
A. Dung dịch acid làm cho phenolphthalein chuyển thành màu hồng.
B. Giá trị pH tăng thì độ axit tăng.
C. Dung dịch base làm cho quì tím chuyển sang màu xanh.
D. Chuẩn độ là phương pháp xác định nồng độ chính xác nhất hiện nay.
Câu 88. Tại sao phèn chua có tác dụng làm trong nước?
A. Phèn chua phản ứng với các chất bẩn thành các chất tan trong nước.
B. Phèn chua có chứa các ion K+, Al3+, SO4 2- có thể hấp thụ các chất lơ lửng trong nước.
C. Khi hòa tan trong nước, phèn chua thủy phân ra ion H+, ion này hấp phụ rất tốt các chất lơ lửng trong nước.
D. Khi hòa tan trong nước, phèn chua thủy phân ra Al(OH)3. Al(OH)3 với bề mặt phát triển, hấp phụ các chất lơ lửng trong nước, kéo chúng cùng lắng xuống dưới.
Câu 89. Hiệntượngxảyrakhithêmtừ từ dungdịchNa2CO3 vàodungdịchmuốiFeCl3 thấy
A. kết tủa màu nâu đỏ vì xảy ra hiện tượng thủy phân.
B. dung dịch vẫn có màu nâu đỏ vì chúng không phản ứng với nhau.
C. có kết tủa nâu đỏ tạo thành sau đó tan do tạo bọt khí CO2
D. xuất hiện kết tủa màu nâu đỏ và đồng thời có bọt khí thoát ra.
Câu 90. ChodungdịchK2CO3 vàodungdịchAlCl3.Hiệntượngxảyralà
A. lúc đầu không có kết tủa, sau đó xuất hiện kết tủa trắng.
B. có kết tủa trắng xuất hiện.
C. có kết tủa trắng và bọt khí xuất hiện.
D. có kết tủa trắng xuất hiện sau đó tan thành dung dịch trong suốt.
--------------HẾT-------------
Phát biểu không đúng là
A. Bộ dụng cụ trên mô tả phương pháp chuẩn độ.
B. Chất chỉ thị sử dụng trong trường hợp này là phenolphtalein.
C. Khi lượng acid trong bình tam giác hết, 1 giọt base từ burette sẽ làm chỉ thị đổi màu.


D. Điểm tương đương trong trường hợp này là dung dịch từ màu hồng thành không màu.
Câu 86. Khi chuẩn độ dung dịch NaOH chưa biết nồng độ bằng dung dịch HCl, nếu không sử dụng chất chỉ thị là phenolphthalein thì có thực hiện được hay không?
A. Vẫn thực hiện được vì nguyên tắc là phản ứng trung hòa.
B. Không vì không có phenolphthalein phản ứng không xảy ra được.
ĐÁP ÁN
DẠNG 1: PHẢN ỨNG MỘT CHIỀU – PHẢN ỨNG THUẬN NGHỊCH VÀ CÂN BẰNG
HÓA HỌC.
Câu 1: Viết biểu thức tính KC cho các phản ứng sau:
34
Ạ
35
a) 2SO2(g) + O2(g) ⇀ ↽ 2SO3 (g)
b) 2C(s) + O2(g) ⇀ ↽ 2CO(g)
c) AgCl(s) ⇀ ↽ Ag+(aq) + Cl-(aq)


Đáp án
Câu 2: Viết biểu thức hằng số cân bằng KC cho phản ứng (*), (**) dưới đây.
H2(g) + I2(g) ⇀ ↽ 2HI(g) (*)
½ H2(g) + ½ I2(g) ⇀ ↽ HI(g) (**)
Theo em, giá trị hai hằng số cân bằng này có bằng nhau không?
Đáp án
YKÈMQUYNHƠNOFFICIAL
Câu 3: Phản ứng xảy ra khi cho khí Cl2 tác dụng với nước là một phản ứng thuận nghịch. Viết
phương trình hoá học của phản ứng, xác định phản ứng thuận, phản ứng nghịch.
Đáp án
Câu 4: Methanol (CH3OH) là nguyên liệu quan trọng trong công nghiệp hoá học. Dựa vào hằng số cân bằng của các phản ứng ở 25 oC, hãy lựa chọn phản ứng thích hợp để điều chế
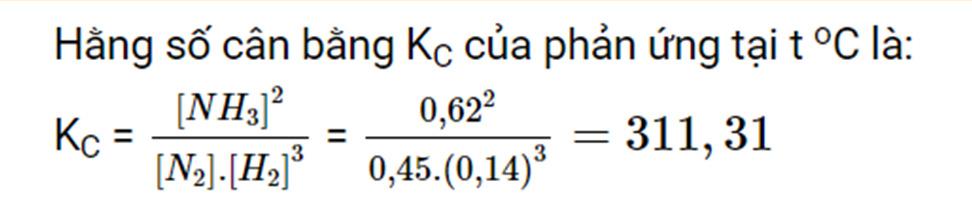


CH3OH. Giải thích.
CO(g) + 2H2(g)
CO
↽ CH3OH(g) KC = 2,26.104 (1)
Đáp án
Câu 5: Ammonia (NH3) được điều chế bằng phản ứng: N2(g) + 3H2(g) ⇀ ↽ 2NH3(g). Ở to

nồng độ các chất ở trạng thái cân bằng là: [N2] = 0,45 M; [H2] = 0,14 M; [NH3] = 0,62 M. Tính hằng số cân bằng KC của phản ứng trên tại t oC.
Đáp án
Câu 6: Cho 0,4 mol SO2 và 0,6 mol O2 vào một bình dung tích 1 lít được giữở một nhiệt độ không đổi. Phản ứng trong bình xảy ra như sau:
2SO2(g) + O2(g) ⇀ ↽ 2SO3(g)
Khi phản ứng đạt đến trạng thái cân bằng, lượng SO3 trong bình là 0,3 mol. Tính hằng số cân
bằng KC của phản ứng tổng hợp SO3 ở nhiệt độ trên.
Đáp án
Câu 7: Cho phản ứng sau: COCl2(g) ⇀ ↽ CO(g) + Cl2(g) KC=8,2.10-2 (900 K). Ở trạng thái cân bằng, nếu nồng độ CO và Cl2 đều bằng 0,15M thì nồng độ COCl2 là bao nhiêu?
Đáp án
Câu 8: Cho cân bằng hoá học sau:
CO(g) + H2O(g) ⇀ ↽ CO2(g) + H2(g)
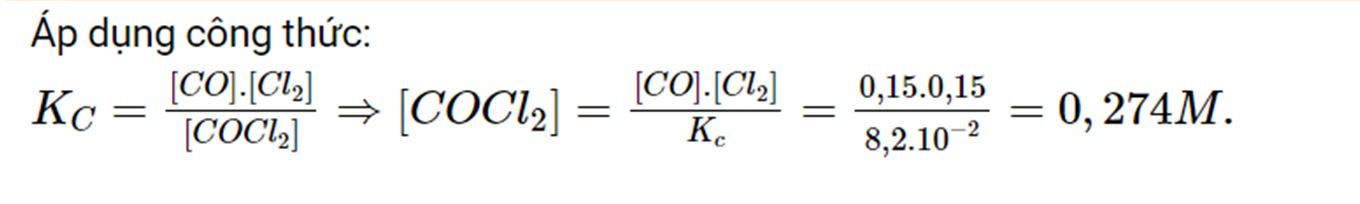
Ở 700oC, hằng số cân bằng KC = 8,3. Cho 1 mol khí CO và 1 mol hơi nước vào bình kín, dung tích 10 lít và giữở 700oC. Tính nồng độ các chất ở trạng thái cân bằng.
Đáp án
36
⇀
⇀ ↽
KC
Ạ
2(g) + 3H2(g)
CH3OH(g) + H2O(g)
= 8,27.10-1 (2)
37
C,
Câu 9: Trong công nghiệp, halogen được sản xuất từ phản ứng:

CH4(g) + H2O(g) ⇀ ↽ 3H2(g) + CO(g)
a) Tính hằng số cân bằng KC của phản ứng trên ở 760 oC. Biết ở nhiệt độ này, tất cả các chất
đều ở thể khí và nồng độ mol của CH4, H2O, H2 và CO ở trạng thái cân bằng lần lượt là 0,126
M; 0,242 M; 1,150 M và 0,126 M.
b*) Ở 760 oC, giả sử ban đầu chỉ có CH4 và H2O có nồng độ bằng nhau và bằng x M. Xác
định x, biết nồng độ của H2 ở trạng thái cân bằng là 0,6 M.
Đáp án
YKÈMQUYNHƠNOFFICIAL
DẠNG 2: CÁC YẾU TỐẢNH HƯỞNG ĐẾN CÂN BẰNG HÓA HỌC.
Câu 11: Nhũđá được hình thành trong các hang động liên quan đến cân bằng sau đây:
Ca(HCO3)2 (aq) ⇀ ↽ CaCO3(s) + CO2(aq) + H2O(l)


Nếu nồng độ CO2 hoà tan trong nước tăng lên thì có thuận lợi cho sự hình thành nhũđá hay không? Giải thích.
Đáp án
Câu 12: Cân bằng 2NO2(g) ⇀ ↽ N2O4(g) chuyển dịch theo chiều nào khi tăng áp suất của hỗn hợp (bằng cách nén hỗn hợp) ởđiều kiện nhiệt độ không đổi. Biết rằng áp suất tỉ lệ với số mol chất khí.

Đáp án
Câu 13: Cân bằng sau chuyển dịch theo chiều nào khi tăng nhiệt độ?
2SO2(g) + O2(g) ⇀ ↽ 2SO3(g) rH 0 298 =−197,8kJ.
Đáp án
Câu 10*: Một bình phản ứng có dung tích không đổi, chứa hỗn hợp khí N2 và H2 với nồng độ
tương ứng là 0,3 M và 0,7 M. Sau khi phản ứng tổng hợp NH3 đạt trạng thái cân bằng ở t0C, H2
chiếm 50% thể tích hỗn hợp thu được. Xác định giá trị hằng số cân bằng KC ở t0C của phản ứng. Đáp án
Câu 14: Cho các cân bằng sau: CaCO3(s) ⇀ ↽ CaO(s) + CO2(g) rH 0 298 = 176 kJ

38
Ạ
39
2SO2(g) + O2(g) ⇀ ↽ 2SO3(g) rH 0 298 = -198 kJ
Nếu tăng nhiệt độ, các cân bằng trên chuyển dịch theo chiều nào? Giải thích.
Đáp án
CaCO3(s) ⇀ ↽ CaO(s) + CO2(g) rH 0 298 = 176 kJ theo chiều thuận
2SO2(g) + O2(g) ⇀ ↽ 2SO3(g) rH 0 298 = -198 kJ theo chiều nghịch.
Câu 15: Ester là hợp chất hữu cơ dễ bay hơi, một số ester được dùng làm chất tạo mùi thơm
cho các loại bánh, thực phẩm. Phản ứng điều chế ester là một phản ứng thuận nghịch:
CH3COOH(l) + C2H5OH(l) ⇀ ↽ CH3COOC2H5(l) + H2O(l)
Hãy cho biết cân bằng trên chuyển dịch theo chiều nào nếu
a) Tăng nồng độ của C2H5OH. b) Giảm nồng độ của CH3COOC2H5
Đáp án
Câu 16: Cho các cân bằng sau:
a) 2SO2(g) + O2(g) ⇀ ↽ 2SO3(g) b)CO(g) +H2O(g) ⇀ ↽ H2(g) +CO2(g)
c) PCl5(g) ⇀ ↽ Cl2(g) + PCl3(g) d) H2(g) + I2(g) ⇀ ↽ 2HI(g)
Nếu tăng áp suất và giữ nguyên nhiệt độ, các cân bằng trên chuyển dịch theo chiều nào? Giải thích.
Đáp án
YKÈMQUYNHƠNOFFICIAL
Câu 17: Cho các cân bằng hóa học sau:
a) Cl2 (g) + H2O(l) ⇀ ↽ HCl(l) + HClO(l)
b) CaCO3 (s) ⇀ ↽ CaO (s) + CO2 (g)
c) 2Fe2O3 (s) + 3C (s) ⇀ ↽ 4Fe (s) + 3CO2 (g)
d) Fe (s) + H2O (g) ⇀ ↽ FeO (s) + H2 (g)
e) N2 (g) + 3H2 (g) ⇀ ↽ 2NH3 (g)
f) Cl2 (g) + H2S (g) ⇀ ↽ 2HCl (g) + S (s)
g) Fe2O3 (s) + 3CO (g) ⇀ ↽ 2Fe (s) + 3CO2 (g)
Hãy xác định chiều cân bằng chuyển dịch khi tăng áp suất chung của hệ? Giải thích.
Đáp án
a) e) f) chiều thuận
b) c) chiều nghịch
d) g) không dịch chuyển


Câu 18: Xét các hệ cân bằng sau trong một bình kín:
c) C(s) + H2O(g) ⇀ ↽ CO(g) + H2(g) rH 0 298 = 131 kJ
d) CO(g) + H2O(g) ⇀ ↽ CO2(g) + H2(g) rH 0 298 = -41 kJ
Các cân bằng trên dịch chuyển theo chiều nào khi thay đổi một trong các điều kiện sau
(1) Tăng nhiệt độ.
(2) Thêm lượng hơi nước vào hệ
(3) Thêm khí H2 vào hệ.
(4) Tăng áp suất chung bằng cách nén cho thể tích của hệ giảm xuống.


(5) Dùng chất xúc tác.
Đáp án

40
Ạ
41
Câu20: Trongcơ thể người,hemoglobin(Hb)kếthợpvớioxygentheophản ứngthuậnnghịch
được biểu diễn đơn giản như sau:
Hb(aq) + O2(g) ⇀ ↽ HbO2(aq)
Ở phổi, nồng độ oxygen lớn nhất nên cân bằng trên chuyển dịch sang phải, hemoglobin kết hợp với oxygen. Khi đến các mô, nồng độ oxygen thấp, cân bằng trên chuyển dịch sang trái, giải phóng oxygen. Nếu thiếu oxygen ở não, con người có thể bịđau đầu, chóng mặt.
a) Vận dụng nguyên lí chuyển dịch cân bằng Le Chatelie, em hãy đề xuất biện pháp để oxygen lên não được nhiều hơn?
b) Khi lên núi cao, một số người cũng gặp hiện tượng bị đau đầu, chóng mặt. Dựa vào cân
bằng trên, em hãy giải thích hiện tượng này.
Đáp án
Câu 19: Trong công nghiệp, khí hydrogen được điều chế như sau:

Cho hơi nước đi qua than nung nóng, thu được hỗn hợp khí CO và H2 (gọi là khí than ướt):
C(s) + H2O(g) ⇀ ↽ CO(g) + H2 rH 0 298 = 130 kJ
Trộn khí than ướt với hơi nước, cho hỗn hợp đi qua chất xúc tác Fe2O3:
CO(g) + H2O(g) ⇀ ↽ CO2(g) + H2(g) rH 0 298 = -42 kJ
a) Vận dụng nguyên lí Le Chatelier, hãy cho biết cần tác động yếu tố nhiệt độ như thế nào để

các cân bằng (1), (2) chuyển dịch theo chiều thuận.
YKÈMQUYNHƠNOFFICIAL
b) Trong thực tế, ở phản ứng (2), lượng hơi nước được lấy dư nhiều (4 – 5 lần) so với khí carbon monoxide. Giải thích.



c) Nếu tăng áp suất, cân bằng (1), (2) chuyển dịch theo chiều nào? Giải thích.
Đáp án
DẠNG 3: PHÂN LOẠI CHẤT ĐIỆN LI MẠNH – CHẤT ĐIỆN LI YẾU VÀ CHẤT KHÔNG ĐIỆN LI.
Câu 21: Cho các chất sau: HBr, HI, H2S, KOH. Hãy phân loại thành acid mạnh, base mạnh, acid yếu và base yếu.

Đáp án
Câu 22: Cho biết những chất nào sau đây thuộc loại chất điện li HCl, Fe, BaCl2, Ca(OH)2,CH3COOH, O2. Viết phương trình điện li.
Đáp án
42
Ạ
43
DẠNG 4: TÍNH NỒNG ĐỘ MOL CỦA CÁC ION TRONG DUNG DỊCH
Câu 26: Trong 200 ml dung dịch có chứa 20,2 gam KNO3. Xác định nồng độ [K+] và [NO3 -]
trong dung dịch ban đầu.
Đáp án
Câu 23: Viết phương trình điện li của các chất: H2SO4, Ba(OH)2, Al2(SO4)3, HF, HI, KNO3, Na2SO4

Đáp án
Câu 27: Hòa tan 1,7 gam NaNO3 và 2,61 gam Ba(NO3)2 vào nước đểđược 100ml dung dịch X. Tính nồng độ mol/l của ion Na+, Ba2+ và NO3 - trong dung dịch X.

Đáp án
Câu 24: Dựa vào thuyết acid – base của Brønsted – Lowry, hãy xác định chất nào là acid, chất nào là base trong các phản ứng sau:




a) CH3COOH + H2O ⇀ ↽ CH3COO- + H3O+
b) S2- + H2O ⇀ ↽ HS- + OH.
c) NH4 + + H2O ⇀ ↽ NH3 + H3O+
Đáp án
YKÈMQUYNHƠNOFFICIAL
Câu 25: Nước Javel (chứa NaClO và NaCl) được dùng làm chất tẩy rửa, khử trùng. Trong dung dịch, ion ClO- nhận proton của nước để tạo thành HClO.
a) Viết phương trình hoá học của phản ứng xảy ra và xác định chất nào là acid, chất nào là base trong phản ứng trên.
b) Dựa vào phản ứng, hãy cho biết môi trường của nước Javel là acid hay base.
Đáp án
Câu 28: Trộn 150 mL dung dịch MgCl2 0,5M với 50 mL dung dịch NaCl 1M thu được dung dịch A. Tính nồng độ ion Cl- có trong dung dịch A.
Đáp án
Câu 29: Trộn lẫn 100 mL dung dịch K2SO4 0,5M và 200 mL dung dịch Fe2(SO4)3 0,1M. Tính nồng độ mol/l của các ion trong dung dịch sau cùng.
44
Ạ
45
Câu 30: Trộn lẫn 100 mL dung dịch HCl 1M và 100 mL dung dịch KOH 0,5M, phản ứng xảy ra hoàn toàn thu được dung dịch A. Tính nồng độ mol/l của các ion trong dung dịch A.
Đáp án
Câu 34: Một loại dầu gội đầu có nồng độ ion OH- là 10-5,17 mol/ L.
a) Tính nồng độ ion H+, pH của loại dầu gội nói trên.
b) Môi trường của loại dầu gội trên là acid, base hay trung tính.
Đáp án
DẠNG 5: XÁC ĐỊNH pH và [H+] CỦA DUNG DỊCH ACID – BASE.
Câu 31: Tính pH của các dung dịch sau:

a) Dung dịch HCl 0,1 M. b) Dung dịch H2SO4 0,005 M.
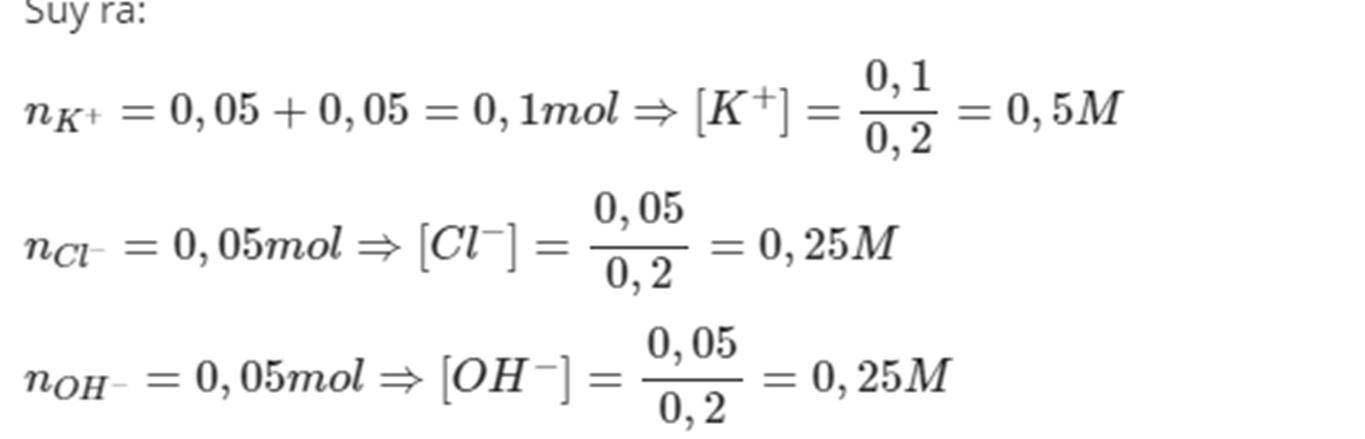
c) Dung dịch NaOH 0,1 M. d) Dung dịch Ca(OH)2 0,01 M.
Câu 32:

a) Một dung dịch có [H+] = 0,001 M. Tính pH và [OH-] của dung dịch.
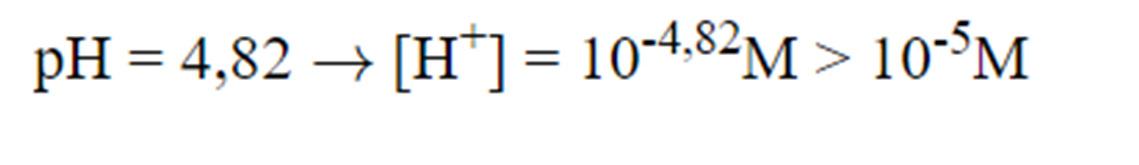
b) Một dung dịch có [OH-] = 2,5 x 10-10 M. Tính pH và xác định môi trường của dung dịch này.
Đáp án
YKÈMQUYNHƠNOFFICIAL
Câu 35: Một học sinh làm thí nghiệm xác định độ pH của đất như sau: Lấy một lượng đất cho vào nước rồi lọc lấy phần dung dịch. Dùng máy đo pH đo được giá trị pH là 4,52.
a) Hãy cho biết môi trường của dung dịch là acid, base hay trung tính.


b) Loại đất trên được gọi là đất chua. Hãy đề xuất biện pháp để giảm độ chua, tăng độ pH của đất.
Câu 36:
a) Pha 500 mL dung dịch HCl 0,2 M vào 500 mL nước. Tính pH của dung dịch thu được.
b) Tính khối lượng NaOH cần để pha 100ml dung dịch NaOH có pH = 12.

Câu 33:
a) Một mẫu dịch vị có pH = 2,5. Xác định nồng độ mol của ion H+ có trong mẫu dịch vịđó.

b) Một mẫu nước mưa có pH = 4,82. Xác định nồng độ mol của ion H+ có trong mẫu nước
mưa. Đáp án
Câu 37: Trộn 100 mL dung dịch HCl 0,25M với 300 mL dung dịch HNO3 0,05M. Tính giá trị pH của dung dịch thu được sau khi trộn.
46
Ạ
47
Đ
áp án
Đáp
án
Đáp án pH =1
Câu38: Trộn20 mL dungdịch HCl 0,05Mvới 20mL dungdịch H2SO4 0,075M thu được40ml dung dịch A có pH bằng a. Tính giá trị của a.
Đáp án pH =1
Câu 39: Trộn 100 mL dung dịch KOH 0,12M với 100 mL dung dịch Ba(OH)2 0,04M. Tính pH của dung dịch thu được sau khi trộn.
Đáp án pH =13
Câu 40: Trộn 50 mL dung dịch NaOH 0,01M, 50 mL dung dịch KOH 0,02M và 200 mL dung dịch Ba(OH)2 0,005M thu được dung dịch có pH bằng b. Tính giá trị của b.
Đáp án pH =12
DẠNG 6: XÁC ĐỊNH pH CỦA DUNG DỊCH SAU PHẢN ỨNG GIỮA ACID VÀ BASE.

Câu 41: Tính pH của dung dịch thu được sau khi trộn 40 mL dung dịch HNO3 0,5M với 60 mL dung dịch NaOH 0,5M.
Đáp án pH =13
Câu 42: Trộn 20 mL dung dịch KOH 0,35M với 80 mL dung dịch HCl 0,1 M được 100 mL dung dịch có pH là a. Tính giá trị của a.
Đáp án pH =2
Câu 43: Trộn 200 mL dung dịch H2SO4 0,05M với 300 mL dung dịch NaOH 0,05 M thu được 500 ml dung dịch A. Tính giá trị pH của dung dịch A.
Đáp án pH =2
YKÈMQUYNHƠNOFFICIAL
Câu 44: Trộn lẫn 200 ml dung dịch H2SO4 0,15M với 100 ml dung dịch KOH 0,3 M thu được 300 ml dung dịch A. Giá trị pH của dung dịch thu được là
Đáp án pH =1
Câu 45: Cho 100 mL dung dịch HCl có pH = 2 vào 100 mL dung dịch NaOH 0,03M. Tính giá trị của pH sau phản ứng.
Đáp án pH =2
Câu 46: Cho 100 mL dung dịch KOH 0,1M vào 100 mL dung dịch H2SO4 có pH=1. Xác định môi trường của dung dịch sau phản ứng.
Đáp án pH =7
Câu 47: Trộn 100 mL dung dịch KOH có pH=12 với 100 mL dung dịch HCl 0,012M. Tính chỉ số pH của dung dịch thu được sau khi trộn.
Đáp án pH =3
Câu 48: Trộn 100 mL dung dịch HCl có pH=2 với 100 mL dung dịch NaOH để thu được dung
dịch có pH = 7 thì pH của dung dịch NaOH là bao nhiêu?
Đáp án pH =12
Câu 49: Trộn 300 mL dung dịch HCl 0,05 mol/L với 200 mL dung dịch Ba(OH)2 a mol/L thu
được 500 mL dung dịch có pH= 12. Tính giá trị của a.
Đáp án a=0,05

Câu 50: Để xác định nồng độ của một dung dịch HCl, người ta đã tiến hành chuẩn độ bằng dung dịch NaOH 0,1 M. Để chuẩn độ 10 mL dung dịch HCl này cần 20 mL dung dịch NaOH.
Xác định nồng độ của dung dịch HCl trên.
Đáp án
DẠNG 7: GIẢI THÍCH HIỆN TƯỢNG THỰC TẾ.
Câu 51: Ở các vùng quê, người dân thường dùng phèn chua (K2SO4. Al2(SO4)3.24H2O) để làm trong nước nhờứng dụng của phản ứng thủy phân ion Al3+. Giải thích. Chất hay ion nào là acid, là base trong phản ứng thủy phân Al3+
Đáp án
Câu 52: Tương tự phèn chua, hãy cho biết dung dịch phèn (NH4Fe(SO4)2.12H2O) có môi trường acid hay base. Giải thích. Vì sao người ta có thể dùng phèn sắt để loại bỏ các chất lơ lửng trong nước?

Đáp án
Câu 53: Đất chua là đất có độ pH dưới 6,5 để cải thiện đất trồng bị chua người nông dân có thể bổ sung chất nào trong các chất sau đây vào đất: CaO. P2O5. Giải thích.
48
Ạ
49
Đáp án
Câu 54: Trong môi trường acid, diệp lục có màu vàng đến đỏ còn trong môi trường kiềm, diệp lục có màu xanh.
a) Giải thích vì sao khi vắt chanh vào nước luộc rau muống thì màu xanh của nước lại bị nhạt đi.
b) Vì sao khi luộc bánh chưng, cho thêm một chút thuốc muối (NaHCO3) sẽ làm lá dong gói bánh có màu xanh đẹp hơn?

Đáp án
Câu 55: Bình thường, chỉ số pH của nước tiểu ở người dao động trong khoảng 4,5 – 8,0. Nếu
pH của nước tiểu giảm xuống dưới 4,5 thì có nghĩa là bị dư acid, còn cao hơn 8,0 thì có nghĩa

là bị dư kiềm. Sỏi thận là khối chất rắn hình thành trong thận, gây đau khi ngăn cản dòng nước
tiểu từ thận xuống niệu quản. Một trong các dấu hiệu của bệnh sỏi thận là nước tiểu bị dư acid
hoặc dư kiềm. Đề xuất cách làm đơn giản để có thể tiên lượng bệnh sỏi thận.
YKÈMQUYNHƠNOFFICIAL
Đáp án -------------HẾT------------
50
Ạ
4
NHÓM BORH – 18SHH
44
IV.Phụlục(Hồsơdạyhọc) Error!Bookmarknotdefined.
PHẦN1. NỘIDUNG DẠYHỌC
CHỦĐỀ:CÂNBẰNGHÓAHỌC
Họcxongchủđềnày,họcsinhcóthể:
• Trìnhbàyđượckháiniệmphảnứngthuậnnghịchvàtrạngtháicân bằngcủamộtphảnứngthuậnnghịch.
• Viếtđượcbiểuthứchằngsốcânbằng(Kc)củamộtphảnứngthuận nghịch.
• Thựchiệnđượcthínghiệmnghiêncứuảnhhưởngcủanhiệtđộtới chuyểndịchcânbằng:
(1)Phảnứng:2NO2⇌N2O4
(2)Phảnứngthuỷphânsodiumacetate

• VậndụngđượcnguyênlíchuyểndịchcânbằngLeChatelierđểgiải thíchảnhhưởngcủanhiệtđộ,nồngđộ,ápsuấtđếncânbằnghoáhọc.
a Phảnứngmộtchiều
Xétphảnứngsau:
BaCl2 +Na2SO4 → BaSO4 +2NaCl(1)


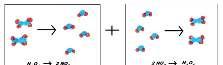

Khi cho dung dịch BaCl2 tác dụng với dung
dịch Na2SO4 thì phản ứng tạo thành kết tủa
BaSO4 cómàutrắngvàdungdịchNaCl.
Cũng trong điều kiện đó, BaSO4 và NaCl
không phản ứng được với nhau tạo dung dịch
trong suốt ban đầu, nghĩa là phản ứng chỉ xảy ratheomộtchiềutừtráisangphải.
Phảnứngnhưthếgọilàphảnứngmộtchiều.
Trong phương trình hóa học của phản ứng một chiều,ngườitadùngmộtmũitênchỉchiềuphản ứng.
b. Phảnứngthuậnnghịch
Xétphảnứngsau:
N2O4 (k) ⇌ 2NO2 (k) (2)



Ởđiềukiệnxácđịnh,N2O4 chuyểnhóathành NO2,đồngthờiNO2 cũngchuyểnhóangược
lại tạo thành N2O4 ban đầu (phản ứng đime hóa),nghĩalàtrongcùngđiềukiện,phảnứng xảy ra theo hai chiều trái ngược nhau. Phản
ứng như thế được gọi là phản ứng thuận nghịch.
Hình3:Hìnhmôphỏngphảnứng(2)
Trongphươngtrìnhhóahọccủaphảnứngthuậnnghịch, ngườitadùnghaimũitênngượcchiềunhau.
Hình4:Hìnhmôphỏngphảnứngthuậnnghịch
Em hãy kể tên các hiện tượng trong đời sống có liên quan đến phản ứng thuận nghịch, phản ứng mộtchiều.
Phảnứngthuậnnghịchxảyratheocảhaichiều:cácchất tham gia tương tác với nhau tạo ra sản phẩm (chiều thuận) đồng thời các chất sản phẩm cũng tương tác với nhau tạo ra chất tham gia (chiều nghịch) trong cùng một điều kiện. Lưu ý trong trường hợp khi tốc độ phản ứng nghịch rất nhỏ so với tốc độ phản ứng thuận (vN << vT ) thì có thể coi phản ứng xảyra theo một chiều (phản ứng bấtthuậnnghịch).





• Phản ứng một chiều là phản ứng chỉ xảy ra một chiều từ trái sang phải. Trong phương trình hóa học của phản ứng một chiều, người ta dùng một mũi tên chỉ chiềuphảnứng.
• Phản ứng thuận nghịch là những phản ứng xảyra theo hai chiều trái ngược nhau trong cùng điều kiện. Trong phương trình hóa học của phản ứng thuận nghịch, ngườitadùnghaimũitênngượcchiềunhau.
NHÓM BORH – 18SHH
5
Hı̀nh1:Hiệntượngcủaphảnứng(1)
PHẢNỨNGMỘTCHIỀU,PHẢNỨNGTHUẬNNGHỊCH 1
Hı̀nh2:Hı̀nhmôphỏngphảnứngmộtchiều Ạ
6
YKÈMQUYNHƠNOFFICIAL
NHÓM BORH – 18SHH
Bạncóbiết?
Sựtạothànhthạchnhũtrongcáchangđộng:
Trong các hang động như động Hương Tích (chùa Hương), động Thiên Cung, hang Đầu Gỗ (Vịnh Hạ Long), động Phong Nha (Quảng Bình) và các hang động ở nhiều địa phương khác có nhiều thạchnhũvớihìnhdángkhácnhau,trônglạmắtvàrấtđẹp. Đóchínhlàkếtquảlâudàicủasựchuyểnhóalẫnnhaugiữa2muối Ca(HCO3)2 và CaCO3. Thành phần chính của núi đá vôi là CaCO3, khi gặp nước mưa và khí CO2 trong không khí, CaCO3 chuyển hóa thành Ca(HCO3)2 tan trong nước chảy qua khe đá vào trong hang động. Dần dần Ca(HCO3)2 chuyển hóa lại thành CaCO3 rắn, không tan. Quá trình này xảy ra liên tục, lâu dài tạo thành thạch nhũ với nhữnghìnhthùkhácnhau. CaCO
Ở trạng thái cân bằng, không phải là phản ứng dừng lại, mà
phảnứngthuậnvà phảnứngnghịch vẫnxảyranhưngvớitốc
độbằngnhau.Tứclàtrong mộtđơnvịthời gian,nồngđộcác
chất phản ứng giảm đi bao nhiêu theo phản ứng thuận, thì nó
sẽ được thêm lại bấy nhiêu theo phản ứng nghịch. Do đó, có
thểgọicânbằnghóahọclàcânbằngđộng.
Vậy,cânbằnghóahọclàtrạngtháicủaphảnứngthuậnnghịch
khitốcđộphảnứngthuậnbằngtốcđộphảnứngnghịch.
Đặc điểm của phản ứng thuận nghịch là các chất phản ứng
không chuyển hóa hoàn toàn thành các chất sản phẩm, nên




tronghệcânbằngluôncómặtcácchấtphảnứngvàsảnphẩm.
Hình5:Biểuđồbiểudiễnsựbiếnthiên tốcđộphảnứngthuậnvàphảnứng nghíchtheothờigian
• Cân bằng hóa học là trạng thái của phản ứng thuận nghịch khi tốc độ phản ứng thuậnbằngtốcđộphảnứngnghịch.

• Cânbằnghóahọclàmộtcânbằngđộng.
• Ở trạng thái cân bằng, trong hệ luôn luôn có mặt các chất phản ứng và các chất sảnphẩm.

Bạncóbiết?
NGỘ ĐỘC CARBON MONOXIDE LÀ GÌ?
Xétphảnứngthuậnnghịchsau:
ChoH2 vàI2 vàotrongmộtbìnhkínởnhiệtđộcao và không đổi. Lúc đầu tốc độ phản ứng thuận (Vt)
lớn vì nồng độ H2 và I2 lớn, trong khi đó tốc độ
phản ứng nghịch (Vn) bằng không, vì nồng độ HI
bằng không. Trong quá trình diễn ra phản ứng, nồng độ HI và I2 giảm dần (từ 0.5M → 0.393M)
nênV giảmdần,cònVn tăngdầnvìnồngđộHItăngdần.ĐếnmộtlúcnàođóVt trởnênbằngVn,khi đó nồng độ các chất trong phản ứng thuận nghịch trên đâyđược giữ nguyên, nếu nhiệt độ không biến đổi.Trạngtháinàycủaphảnứngthuậnnghịchđượcgọilàcânbằnghoáhọc.
Cáctếbàohồngcầuvậnchuyểnoxyđếncácmôđểchúng cóthểhoạtđộng.Khithiếuoxy,cáctếbàokhôngthểthực hiện các trách nhiệm sinh hóa của chúng.Oxy di chuyển
đếncáctếbàogắnvớihemoglobin,mộtloạiproteinđược

tìm thấy trong các tế bào màu đỏ.Trong các trường hợp ngộ độc carbon monoxide, CO liên kết mạnh hơn nhiều vớihemoglobin,ngănchặnquátrìnhgắnoxyvàlàmgiảm
lượng oxy đến tế bào.Điều trị bằng cách cho bệnh nhân
thởoxynguyênchấtđểloạibỏcarbonmonoxide.Phảnứngcânbằngđượchiểnthịbêndướiminh
họasựchuyểndịchvềphíabênphảikhilượngoxydưđượcthêmvàohệthống:
Hb(CO)4 (aq) + 4O2 (g) ⇋ Hb(O2)4 (aq) + 4CO (g)






7 NHÓM BORH
– 18SHH
3(r) +H2O+CO2 ⇌ Ca(HCO3)2(dd)
I2(k) + H2(k) ⇌ 2HI (k) T=0:0.5 0.5 T≠0:0.393 0.393 0.786 Tcb :0.107 0.107 0.786 CÂNBẰNGHÓAHỌC 2Ạ
8
YKÈMQUYNHƠNOFFICIAL
NHÓM BORH – 18SHH
3 HẰNGSỐCÂNBẰNGKC
Xétphảnứngthuậnnghịchsau:
aA (k) + bB (k) ⇌ cC (k) + dD (k)
Giảsửphảnứngthuậncũngnhưphảnứngnghịchđềuthuộcloạiđơngiản.
Tốcđộphảnứngthuận: Vt =kt.[A]a.[B]b
Tốcđộphảnứngnghịch:Vn =kn.[C]c.[D]d

PhảnứngđạtđếntrạngtháicânbằngkhiVt =Vn haykt.[A]a.[B]b =kn.[C]c.[D]d
Suyra:
YKÈMQUYNHƠNOFFICIAL
Vìkt và kn là cáchằng sốtốc độphảnứng, chỉphụthuộc vàonhiệt độvà bảnchấtcủa cácchất,nên ứngvớimộtnhiệtđộxácđịnh(vàmộtphảnứngxácđịnh),tacó:
Giải:
NồngđộbanđầucủaH2,CO2 vàCOlầnlượtlà:0,15M,0,16Mvà0,1M.Trongbìnhxảyracân
bằng:
H2(k) +CO2(k)⇌H2O (k) +CO (k) cóKc =4,4
Banđầu: 0.15 0.16 0 0.1
P/ứ : x x x x
C/bằng : 0.15-x 0.16-x x x+0.1


Tacó:
Kc = = .( ) ( ).( ) =4.4=>x=0.092


Ởtrạngtháicânbằnghệchứa:
[H2]=0,058M;
[CO2]=0,068M;
Kíhiệu[]chỉnồngđộcácchấtA,B,C,Dlúcđạttrạngtháicânbằng.Kc đượcgọilàhằngsố
cân bằng của phản ứng liên hệ đến nồng độ mol (mol/L). Kc chỉ phụ thuộc vào nhiệt độ và bản chất của chất tham gia phản ứng, sản phẩm tạo thành, mà không phụ thuộc vào nồng độ các chất trong phảnứng.
Cóthểphátbiểuđịnhluậtnàynhưsau:Khimộtphảnứngđồngthểđạttrạngtháicânbằngthìtỉ sốtíchsốnồngđộsảnphẩmvớitíchsốnồngđộchấtthamgialàmộthằngsốởmộtnhiệtđộxácđịnh.
Ứngdụng:Dựavàogiátrịhằngsố cân bằng ta có thể xác định được thànhphầncủahệởtrạng tháicân bằng.
Vídụ:Chophảnứng:
H2(k)+CO2(k)⇌H2O(k)+CO(k) cóKc=4,4.
Tínhnồngđộcủacácchấtởtrạngtháicânbằng
nếulúcđầutrongbìnhphảnứng,cóthểtích10 lít,chứa1,5molH2;1,6molCO2và1molCO.
[H2O]=0,092M;
[CO]=0,192M.
Nếutrongcânbằngcóchấtrắnthamgiathìnồngđộchấtrắnđượccoilàhằngsố,nênnókhôngcó mặttrongbiểuthứchằngsốcânbằng.
• Khi một phản ứng đồng thể đạt trạng thái cân bằng thì tỉ số tích số nồng độ sản phẩmvớitíchsốnồngđộchấtthamgialàmộthằngsốởmộtnhiệtđộxácđịnh.
• Hằngsốcânbằngcủaphảnứngđượcxácđịnhbằngcôngthức: Kc = = .
• Ứng dụng : Dựa vào giá trị hằng số cân bằng ta có thể xác định được thành phần củahệởtrạngtháicânbằng.
NHÓM BORH – 18SHH
9 NHÓM BORH – 18SHH
= . . Kc = = . .
Ạ
10
Bạncóbiết? MÁUNGHÈOSẮT?
Sắt là thành phần quan trọng của hồng cầu.Những bệnh nhân có lượng sắt thấp và có số lượng hồng cầu thấp hơn bình thường



thường sẽ bị thiếu máu gây những triệu chứng như: da xanh xao, nhợtnhạt;lông,tóc,móngkhôvàdễgãy;mệtmỏi,hoamắt,….
MộtcáchđểđánhgiánồngđộsắttronghuyếtthanhlàsửdụngFerrozine,mộtphântửhữucơphức tạp.FerrozinetạosảnphẩmvớiFe 3+ ,tạoramàuhồng.Đểxácđịnhcácyếutốảnhhưởngđếnphản ứng,tacầnđohằngsốcânbằng.Nếuhằngsốcânbằngkhôngđủlớn,tứclàphảnứngkhôngnằm vềphíatạonênsảnphẩmthìphảicầnthậnkhidùngphươngphápđonày.
SỰCHUYỂNDỊCHCÂNBẰNGHOÁHỌCVÀCÁCYẾUTỐẢNHHƯỞNG.
NGUYÊNLÝCHUYỂNDỊCHCÂNBẰNGLƠSA-TƠ-LI-Ê
Tiểusử:
YKÈMQUYNHƠNOFFICIAL
Henri Louis Le Chatelier (1850 – 1936) là nhà hóa học người Pháp xuất



thân từ một gia đình Công giáo La Mã tư sản nên ông được thụ hưởng một nềngiáodụcđặcbiệt.
Năm 1877, sau khi trở thành một giảng viên đại học, ông bắt đầu dấn thân vào sự nghiệp nghiên cứu. Công việc ban đầu của Le Chatelier đã dẫn đến nghiên cứu thử nghiệm vềnhiệt động lực học. Năm 1884, ông đưa ra một nguyên tắc chung xác định cách các hệ thống ởtrạng thái cân bằng hóa họcduytrìsựổnđịnhcủachúng,nêurõrằng:
Bất kỳ hệ nào ở trạng thái cân bằng hóa học ổn định , chịu tác động của nguyên nhân bên ngoài có xu hướng thay đổi nhiệt độ hoặc sự ngưng tụ của nó (áp suất, nồng độ, số lượng phân tử trong đơn vị thể tích), toàn bộ hoặc một số bộ phận của nó, có thể chỉ trải qua những sửa đổi bên trong như vậy, nếu được sản xuất đơn lẻ, sẽ dẫn đến sự thay đổi nhiệt độ hoặc sự ngưng tụ có dấu hiệu ngược lại với nguyên nhân bên ngoài. NguyêntắckìdiệucủaLeChateliersauđóchuyểnsangcâuhỏilàmthếnàođểápdụngkhoahọcnhiệt động hóa học vào sự phát triển của các quá trình công nghiệp.Vào khoảng thời gian đó ông đề nghị tăng sản lượng công nghiệp sản xuấtamoniacbằng cách sử dụng nhiệt thấp và áp suất cao, như được chỉrabởinguyêntắccânbằnghóahọccủaông.Tươngtự,sựquantâmđếncácứngdụngcôngnghiệp củahóahọcđãkhiếnônghoànthiệnmỏhànoxyacetylene,đạtđượcnhiệtđộcựccaocầnthiếtđểhàn vàcắtkimloại.
a. Ảnhhưởngcủanồngđộ: Xéthệcânbằngsau: Fe3+ + SCN- ⇌ Fe(SCN)2+ (3) (vàngnâu) (đỏmáu)





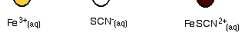




Khi hệởtrạngtháicânbằng,nghĩalàvt =vn nồng độ
cácchấttrongphảnứngkhôngbiếnđổinữa.Nếutacho
thêm dung dịch Fe3+ vào hệ cân bằng thì nồng độ Fe3+ tăng lên làm cho vt > vn, Fe3+ phải phản ứng thêmvớiSCN- tạoraFe(SCN)2+ chotớikhivt lạibằngvn,lúcđócânbằngmớiđượcthiếtlập.Ởtrạng
tháicânbằngmới,nồngđộcácchấtsẽkhácvớiởtrạngtháicânbằngcũ.Hiệntượngđóđượcgọilàsự chuyểndịchcânbằng.
Sự chuyển dịch cân bằng hoá học là sự dịch chuyển từ trạng thái cân bằng này sang trạng thái cân bằng khác do tác động của các yếu tố từ bên ngoài lên cân bằng.
Vậy khi thêm Fe3+ vào hệ cân bằng, cân bằng sẽ chuyển dịch
trừ trái sang phải (theo chiều thuận), chiều làm giảm nồng độ
Fe3+thêmvào.
Quátrìnhchuyểndịchcânbằngxảyratươngtựkhitalấybớt
Fe(SCN)2+ rakhỏicânbằng,vìkhiđóvt >vn.
Ngược lại, nếu ta cho thêm 1 lượng Fe(SCN)2+ vào hệ cân
bằng,hoặclấybớtFe3+ (hoặcSCN-) rathìlúcđóvt <vn,cân

bằng sẽ chuyển dịch từ phải sang trái (chiều nghịch), nghĩa là
theo chiều làm giảm nồng độ Fe(SCN)2+ hoặc theo chiều tăng
nồngđộFe3+
Kết luận: Khi tăng hoặc giảm nồng độ một chất trong cân bằng, thì cân bằng bao giờ cũng chuyển dịch theo chiều làm giảm tác động của việc tăng hoặc giảm nồng độ của chất đó
Lưu ý: Nếu trong hệ cân bằng có chất rắn (ở dạng nguyên chất) thì việc thêm bớt hoặc bớt lượng chất rắn không ảnh hưởngđếncânbằng,nghĩalàcânbằngkhôngchuyểndịch.
NHÓM BORH – 18SHH

11 NHÓM BORH – 18SHH
4
Ạ
12
Hình6:Môphỏngmàucủaphảnứng(3)
Hình7:HiệntượngkhithêmFe3+vàohệcân bằng(3)
Hình8:HiệntượngkhithêmFe(SCN)2+vào hệcấnbằng(2)
b. Ảnhhưởngcủaápsuất:
Xéthệcânbằngsautrongxilanhcópittongởnhiệtđộthườngvàkhôngđổi:
2NO2(k) ⇌ N2O4(k) (3)


Thí nghiệm chứng tỏ rằng, khi hệ đang ở trạng thái cân bằng, nếu ta tăng áp suất chung của hệ lên, bằng cách đẩy pít tông vào để cho thể tích chung của hệ giảm xuống, thì số mol khí NO2 sẽ giảm bớt, đồng thờisốmolkhíN2O4 sẽtăngthêm,nghĩalàcânbằng chuyểndịchtheochiềunghịch.
Hình9:Hìnhmôphỏnghoạtđộngcủapittong
Nhậnxét:Nhìnvàophảnứng(3)tathấycứhaimolkhíNO2 phảnứngtạoramộtmolkhíN2O4,nghĩa làphảnứngnghịchlàmgiảmsốmolkhítronghệ,dođólàmgiảmápsuấtchungcủahệ.
Nhưvậy,khităngápsuấtchungcủahệcânbằng trên, cân bằng chuyển dịch theo chiều nghịch, chiều làm giảm áp suất chung của hệ, nghĩa là chuyểndịchvềphíalàmgiảmtácđộngcủaviệc tăngápsuấtchung.
Hình10:Thínghiệmchứngminhảnhhưởngcủaápsuất đếncânbằng(3)
YKÈMQUYNHƠNOFFICIAL
Bây giờ nếu ta làm giảm áp suất chung của hệ cân bằng trên bằng cách kéo pít tông ra để cho thể tích chung của hệ tăng lên, thì số mol khí
NO2 sẽ tăng thêm, đồng thời số mol khí N2O4 sẽ giảm bớt. Vậy, cân bằng chuyển dịch theo chiều thuận, chiều làm tăng số mol khí trong hệ, nghĩa là chuyểndịchvềphíalàmgiảmtácđộngcủaviệcgiảmápsuấtchung.
Kếtluận: Khi tăng hoặc giảm áp suất chung của hệ cân bằng, thì cân bằng bao giờ cũng chuyển dịch theo chiều làm giảm tác động của việc tăng hoặc giảm áp suất đó.
Từ việc khảo sát trên ta suyra rằng, khi hệ cân bằng có số mol khí ở cả hai vế của phương trình hoá họcbằngnhauhoặchệcânbằngkhôngcóchấtkhíthìápsuấtkhôngảnhhưởngđếncânbằng.
Thídụ,ápsuấtkhôngảnhhưởngđếncáccânbằngsau: Fe
Bạncóbiết?

VìsaodùngCO2 trongnướcngọtcógas?
KhíCO2 làsảnphẩmđượcsinhratrongquátrìnhđốtcháy
hoặchôhấpcủangười,độngvật.Ởđiềukiệnbìnhthường, CO2 là chất khí không mùi, không màu nhưng có vị chua
nhẹ. CO2 khi hòa tan trong nước tạo thành một dung dịch yếucủaaxitcacbonic.






CO2 +H2O⇌H2CO3
ChínhCO2 kếthợpvớihươngliệutrongnướcngọtcógatạonênvịchuađặctrưngchosảnphẩm.
Khi uống, axit cacbonic kích thích vòm miệng ta làm ta cảm nhận được vị chua ngọt đặc trưng của nướcgiảikhát.KhôngcóCO2,thứcuốngvôcùngnhạtnhẽo.
Ngoàira,khicácbọtkhíCO2 sủilêntrênbềmặtcùngtiếng“xịt”đặcbiệtgiúpsảnphẩmhấpdẫnhơn. Đánhthứccảthịgiác vàthínhgiáccủa ngườisử dụng.Mặcdùcó nhữngkhíkháchơnCacbondioxit vềmộtđiểmnàođónhưngtổnghợptấtcảyếutố.Hòatan,antoàn,bềnvững,phổbiến,rẻthìCacbon dioxitđứngnhất.
Vìsaokhibậtnắpchai,cókhítràora?
TheoLiveScience.Cácnhàmáysảnxuấtnướcngọtdùngápsuấtlớn để ép CO2 hòa tan vào nước. Với tỉ lệ khối lượng/diện tích khoảng 84,36kg/cm2.Tiếpđóngườitalạinạpnướcvàobìnhvàđóngkín,giữ nguyênápsuấtlớnnày.

CO2 +H2O⇌H2CO3


Lúcnàycânbằngchuyểndịchtheochiềuthuậntạoaxitcacbonic.
Khi mởnắpchai,ápsuấtbênngoàithấptác độngđếnsự cân bằng CO2 trongnước,phản ứngchuyển dịch theo chiều nghịch nên hàng triệu phân tử Cacbon dioxit lập tức bayvào không khí. Làmcác bọt khíthoátragiốngnhưlúcđunnướcsôi.
Khi ta uống nước ngọt, dạ dày và ruột không hề hấp thụ khí CO2. Môi trường nhiệt độ cao trong dạ dàylàmCO2 nhanhchóngtheođườngmiệngthoátrangoài.Mangđibớtmộtnhiệtlượngtrongcơthể làmchongườiuốngcócảmgiácmátmẻ,dễchịu.
CO2 có tác dụng kích thích nhẹ thành dạ dày, tăng cường việc tiết dịch vị. Giúp ít cho quá trình tiêu hóa.KhíCacbondioxitkhôngthamgiacácphảnứngcháy.Dovậyđượcứngdụngtrongmộtsốbình cứuhỏa,đặcbiệtlàcácloạiđượcthiếtkểđểdậpcháydođiện.
NHÓM BORH – 18SHH

13 NHÓM BORH
18SHH
–
2O3(r)+3CO
⇌2Fe(r)+3CO2(k) 2HI(k)⇌H2(k)+I2(k)
(k)
Ạ
14
c. Ảnhhưởngcủanhiệtđộ: HằngsốcânbằngKc củaphảnứngxácđịnhchỉphụthuộcvàonhiệtđộ,nênkhinhiệtđộbiếnđổi,cân bằngsẽchuyểndịchmộttrạngtháicânbằngmớiứngvớigiátrịmớicủahằngsốcânbằng.
Thídụ: N2O4(k) ⇌ 2NO2(k) H=58kJ>0


Giá trị 58kJ là nhiệt của phản ứng thuận, phản ứng thu nhiệt. Phản ứng nghịch là phản ứng toả nhiệt với H=-58kJ<0.
Khihỗnhợptrênđangởtrạngtháicânbằng,nếuđunnónghỗnhợpkhíbằngcáchngâmbìnhđựnghỗn hợp vào nước sôi, màu nâu đỏ của hỗn hợp khí đậm lên, nghĩa là cân bằng chuyển dịch theo chiều thuận,chiềucủaphảnứngthunhiệt.
Nếu làm lạnh bằng cách ngâm
bình đựng hỗn hợp khí vào nước đá, màu của hỗn hợp khí nhạt đi, nghĩa là cân bằng chuyển dịch theochiềunghịch,chiềucủaphản
ứngtoảnhiệt.
Kết luận: Khi tăng nhiệt độ, cân bằng chuyển dịch theo chiều phản
YKÈMQUYNHƠNOFFICIAL
ứng thu nhiệt, nghĩa là chiều làm
Hình11:Thínghiệmchứngminhảnhhưởngcủanhiệtđộđếncânbằng(3)
giảm tác động của việc tăng nhiệt độ. Khi giảm nhiệt độ, cân bằng chuyển dịch theo chiều phản ứng
toả nhiệt, nghĩa là chiều làm giảm tác động của việc giảm nhiệt độ.
Các yếu tố nồng độ, áp suất và nhiệt độ ảnh hưởng đến cân bằng hoá học đã được Lơ Sa-tơ-li-ê (nhà hoá học Pháp – tác giả của nguyên lý chuyển dịch cân bằng) tổng kết thành nguyên lí được gọi là nguyênlíLơSa-tơ-li-ênhưsau:
“Một phản ứng thuận nghịch đang nằm ở trạng thái cân bằng khi chịu tác động từ bên ngoài như biến
đổi nồng độ, áp suất, nhiệt độ, thì cân bằng sẽ chuyển dịch theo chiều làm giảm các tác động bên ngoài đó.”
d.Vaitròcủachấtxúctác: Chấtxúctáckhônglàmbiếnđổinồngđộcácchấttrongcânbằngvàcũngkhônglàmbiếnđổihằngsố cânbằng,nên không làm cân bằng chuyển dịch.Chấtxúctáclàmtăngtốcđộphảnứngthuậnvàtốcđộ phản ứng nghịch với số lần bằng nhau, nên khi phản ứng thuận nghịch chưa ở trạng thái cân bằng thì
chấtxúctáccótácdụnglàmchocânbằngđượcthiếtlậpnhanhchónghơn.
• Sựchuyểndịchcânbằnghoáhọclàsựdịchchuyểntừtrạngtháicânbằngnàysangtrạng tháicânbằngkhácdotácđộngcủacácyếutốtừbênngoàilêncânbằng.
• Nhữngyếutốảnhhưởngđếncânbằnghóahọclànồngđộ,ápsuất,nhiệtđộ.
• Nguyên lí chuyển dịch Le Chatelier : Một phản ứng thuận nghịch đang nằmở trạng thái cân bằng khi chịu tác động từ bên ngoài như biến đổi nồng độ, áp suất, nhiệt độ, thì cân bằngsẽchuyểndịchtheochiềulàmgiảmcáctácđộngbênngoàiđó.
• Chấtxúctáckhôngảnhhưởngđếncânbằnghóahọc.
5 ÝNGHĨACỦATỐCĐỘPHẢNỨNGVÀCÂNBẰNGHÓAHỌC TRONGSẢNXUẤTHÓAHỌC
Đểthấyýnghĩacủatốcđộphảnứngvàcânbằnghóahọctrongsảnxuấthóahọc,chúngtalấymộtsố thídụsauđây:
Thí dụ 1: Trong quá trình sản xuất axit
sunfuricphảithựchiệnphảnứngsau:
2SO2(k) +O2(k) ⇌2SO3(k) ∆H<0
Trong phản ứng nàyngười ta dùng oxykhông khí.
Hình12:Sơđồminhhọasảnxuấtamoniactrongcôngnghiệp
15 NHÓM BORH – 18SHH
Ạ
16
NHÓM BORH – 18SHH
Ởnhiệtđộthường,phảnứngxảyrarấtchậm.Đểtăngtốcđộphảnứngphảidùngchấtxúctácvàthực hiện phản ứng ở nhiệt độ khá cao. Nhưng đây là phản ứng tỏa nhiệt, nên khi tăng nhiệt độ, cân bằng chuyểndịchtheochiềunghịchlàmgiảmhiệusuấtcủaphảnứng.Đểhạnchếtácdụngnày,ngườitađã dùng một lượng dư không khí, nghĩa là tăng nồng độ oxi, làm cho cân bằng chuyển dịch theo chiều thuận.
Thí dụ 2: Trongcôngnghiệp,amoniacđượctổnghợptheophảnứngsau:

N2(k) +3H2(k) ⇌2NH3(k) ∆H<0


YKÈMQUYNHƠNOFFICIAL
Đặcđiểmcủaphảnứngnàylàtốcđộrấtchậmởnhiệtđộthường,tỏanhiệtvàsốmolkhícủasảnphẩm
íthơnsovớisốmolkhícủacácchấtphảnứng.Dođó,ngườitaphảithựchiệnphảnứngnàyởnhiệtđộ cao,ápsuấtcaovàdùngchấtxúctác.Ởápsuấtcao,cânbằngchuyểndịchsangphíatạoraNH3,nhưng
ởnhiệtđộcao,cânbằngchuyểndịchngượclại,nênchỉthựchiệnđượcởnhiệtđộthíchhợp.
PHẦN3.
Hình13:Sơđồminhhọasản xuấtamoniactrongcôngnghiệp

THỐNG BÀITẬP
Bạncóbiết?
MụcđíchcủabểchứaAmoniac.
Bể chứa amoniac trong hình trên thực hiện hai việc, Một là nó lưu trữ amoniac ở áp suất cao để giảm thiểu phản ứng ngược dẫnđếnítamoniachơnvànhiềunitơvàhydrohơn.Thứhai,nó gửi một thông điệp quan trọng. Amoniac được sử dụng để sản xuất methamphetamine, một loại ma túy nguy hiểm bị lạm dụng. Khóa và các cơ chế an toàn khác được tích hợp trong bể giúp ngăn chặn hành vi trộm cắp amoniacđểsửdụngchohoạtđộngbấthợpphápnày.
17 NHÓM BORH – 18SHH
Ạ
26
NHÓM BORH – 18SHH
HỆ
BÀITẬP
I. Mứcđộthônghiểu
Câu1:Chocânbằnghóahọc: N2(k) +3H2(k) ⇋2NH3(k)
Phảnứngthuậnlàphảnứngtoảnhiệt.Cânbằnghóahọckhôngbịchuyểndịchkhi
A.thayđổiápsuấtcủahệ. B.thayđổinồngđộN2.
C.thayđổinhiệtđộ. D.thêmchấtxúctácFe.
Câu2:Chocácphátbiểusau:
(1)Phảnứngthuậnnghịchlàphảnứngxảyratheo2chiềungượcnhau.
(2)Phảnứngbấtthuậnnghịchlàphảnứngxảyratheo1chiềuxácđịnh.
(3)Cânbằnghóahọclàtrạngtháimàphảnứngđãxảyrahoàntoàn.
(4)Khiphảnứngthuậnnghịchđạttrạngtháicânbằnghóahọc,lượngcácchấtsẽkhôngđổi.
(5)Khiphảnứngthuậnnghịchđạttrạngtháicânbằnghóahọc,phảnứngdừnglại.
Cácphátbiểusailà:
A.2,3.
B.3,4.
C.3,5.
D.4,5.
YKÈMQUYNHƠNOFFICIAL
Giải:Chấtxúctácchỉlàmtăngtốcđộphảnứngchứkhônglàmthayđổicânbằng.
Câu3:Chọnphátbiểuđúng:
Phảnứngthuậnnghịchlà
(1)phảnứngcóthểxảyratheochiềuthuậnhaytheochiềunghịchtùyđiềukiệnphảnứng.
(2)phảnứngxảyrađồngthờitheohaichiềungượcnhautrongcùngmộtđiềukiện.
(3)phảnứngtựxảyrachođếnkhihếtcácchấtphảnứng.
Câu4:Chocânbằnghóahọc:
Cânbằngkhôngbịchuyểndịchkhi
A.tăngnhiệtđộcủahệ. B.giảmnồngđộHI.
C.tăngnồngđộH2 D.giảmápsuấtchungcủahệ.
Giải:
-Đâylàphảnứngthunhiệt(∆H>0)
-∑sốmoltrướckhiphảnứng=∑sốmolsaukhiphảnứng,dođóápsuấtchungcủahệkhônglàmthay
đổisựcủadịchchuyểncânbằng.
Câu5:Phảnứngthuậnnghịchlàphảnứng
A.trongcùngđiềukiện,phảnứngxảyratheohaichiềutráingượcnhau.
B.cóphươngtrìnhhoáhọcđượcbiểudiễnbằngmũitênmộtchiều.
C.chỉxảyratheomộtchiềunhấtđịnh.
D.xảyragiữahaichấtkhí.
Câu6:Chocânbằnghóahọc: 2SO2(k) +O2(k) ⇋ 2SO3(k)
Phảnứngthuậnlàphảnứngtỏanhiệt.Phátbiểunàosauđâylàđúng?
A.Cânbằngchuyểndịchtheochiềuthuậnkhităngnhiệtđộ.
B.CânbằngchuyểndịchtheochiềunghịchkhigiảmnồngđộO2.
C.Cânbằngchuyểndịchtheochiềuthuậnkhigiảmápsuấthệphảnứng.
D.CânbằngchuyểndịchtheochiềunghịchkhigiảmnồngđộSO3.
Câu7:Chocânbằng:
Nhậnxétnàosauđâykhôngđúng?
N2(k)+3H2(k) ⇋2NH3(k); H<0
A.Khihệđạttrạngtháicânbằng,nồngđộNH3 khôngthayđổi.
B.Phảnứngnghịchthunhiệt.
NHÓM BORH – 18SHH
27 NHÓM BORH – 18SHH
A.1 B.2 C.3 D.1và2 Ạ
28
H2 (k)+I2 (k) ⇋2HI (k);∆H>0.
C.Khităngnhiệtđộ,cânbằngchuyểndịchtheochiềunghịch.
D.Khigiảmnhiệtđộ,cânbằngchuyểndịchtheochiềunghịch.
Câu8:Chocânbằnghóahọcsau:
2SO2(k) +O2(k) ⇋ 2SO3(k); ∆H<0
Đểcânbằngdịchchuyểntheochiềunghịchthì
A.tăngápsuất,giảmnhiệtđộ,giảmnồngđộO2
B.giảmápsuất,tăngnhiệtđộ,lấySO2 rakhỏihệ.
C.lấySO3 raliêntục.
D.khôngdùngxúctácnữa.
Câu9:Chobiếtcânbằngsauđượcthựchiệntrongbìnhkín:
PCl5(k) ⇋ PCl3(k)+Cl2(k), H>0
YếutốnàosauđâylàmtăngnồngđộPCl3 trongcânbằng?
A.LấybớtPCl5 ra.
B.ThêmCl2 vào.
YKÈMQUYNHƠNOFFICIAL
C.Giảmnhiệtđộ.
D.Tăngnhiệtđộ.
Câu10:Trạngtháicânbằngcủamộtphảnứngthuậnnghịchxảyrakhi:
A.tốcđộphảnứngthuậnbằngtốcđộphảnứngnghịch.
B.phảnứngthuậnvàphảnứngnghịchdừnglại.
C.nồngđộcácchấtphảnứngbằngnồngđộcácchấtsảnphẩm.
D.nồngđộcácchấtphảnứnggiảm,cònnồngđộcácchấtsảnphẩmtăng.
Câu11:Chocânbằnghóahọc:
Cânbằngkhôngbịchuyểndịchkhi
A.tăngnhiệtđộcủahệ.
B.giảmnồngđộHI.
C.tăngnồngđộH2
D.giảmápsuấtchungcủahệ.
Câu12:Chọnphátbiểuđúng
Phảnứngthuậnnghịchlà
(1)phảnứngcóthểxảyratheochiềuthuậnhaytheochiềunghịchtùyđiềukiệnphảnứng.
(2)phảnứngxảyrađồngthờitheohaichiềungượcnhautrongcùngmộtđiềukiện.
(3)phảnứngtựxảyrachođếnkhihếtcácchấtphảnứng.
A.1
B.2
C.3
D.1và2
Câu13:Phảnứngthuậnnghịchlàphảnứng
A.trongcùngđiềukiện,phảnứngxảyratheohaichiềutráingượcnhau.
B.cóphươngtrìnhhoáhọcđượcbiểudiễnbằngmũitênmộtchiều.
C.chỉxảyratheomộtchiềunhấtđịnh.
D.xảyragiữahaichấtkhí.
NHÓM BORH – 18SHH
29 NHÓM BORH – 18SHH
Ạ
30
H2(k) +I2(k) ⇋2HI(k); H>0.
Câu14:HằngsốcânbằngKCcủamộtphảnứngxácđịnhchỉphụthuộcvào
A.nồngđộcácchất.
B.ápsuất.
C.nhiệtđộphảnứng.
D.hiệusuấtphảnứng.
Câu15:NgườitachoN2 vàH2 vàotrongbìnhkíndungtíchkhôngđổivàthựchiệnphảnứng: N2 +3H2 ⇋2NH3
Saumộtthờigian,nồngđộcácchấttrongbìnhnhưsau:[N2]=2M;[H2]=3M;[NH3]=2M.Nồngđộ mol/lcủaN2 vàH2 banđầulầnlượtlà:
A.3và6.
B.2và3.
C.4và8.
D.2và4.
YKÈMQUYNHƠNOFFICIAL
Câu16:Phátbiểunàovềchấtxúctáclàkhôngđúng?
A.Chấtxúctáclàmtăngtốcđộphảnứng.
B.Chấtxúctáclàmgiảmthờigianđạttớicânbằngcủaphảnứng.
C.Chấtxúctácđượchoànnguyênsauphảnứng.
D.Chấtxúclàmchophảnứngdịchchuyểntheochiềuthuận.
Câu17:Chophảnứngthuậnnghịchsau:
A2(k) +B2(k) ⇋2AB(k);∆H>0
Đểcânbằngdịchchuyểnsangchiềuthuậnthì
A.tăngnhiệtđộ,giảmápsuất.
B.tăngnhiệtđộ,giữnguyênápsuất.
C.giảmnhiệtđộ,tăngápsuất.
D.nhiệtđộvàápsuấtđềutăng.
Câu18:XácđịnhbiểuthứchằngsốcânbằngKc củacácphảnứngsau:
C (r) + CO2 (k) ⇋ 2CO (k)
N2 (k) +3H2 (k) ⇋ 2NH3 (k)
CaCO3 (r) ⇋ CaO (r) +CO2 (k) 2SO2(k) + O2(k) ⇋ 2SO3(k)
Giải: Kc = ; Kc = ! . ! ; Kc=[CO2] ; Kc = " ! ."
Câu19:NgườitachoN2 vàH2 vàotrongbìnhkíndungtíchkhôngđổivàthựchiệnphảnứng: N2 +3H2 ⇋2NH3
Saumộtthờigian,nồngđộcácchấttrongbìnhnhưsau:[N2]=2M;[H2]=3M;[NH3]=2M.Nồngđộ mol/lcủaN2 vàH2 banđầulầnlượtlà:
A.3và6. B.2và3.
C.4và8. D.2và4.
Câu20:HằngsốcânbằngKC củamộtphảnứngxácđịnhchỉphụthuộcvào
A.nồngđộcácchất. B.ápsuất. C.nhiệtđộphảnứng. D.hiệusuấtphảnứng.
Câu21:Trạngtháicânbằngcủamộtphảnứngthuậnnghịchxảyrakhi
A.tốcđộphảnứngthuậnbằngtốcđộphảnứngnghịch.
B.phảnứngthuậnvàphảnứngnghịchdừnglại.
C.nồngđộcácchấtphảnứngbằngnồngđộcácchấtsảnphẩm.
NHÓM BORH – 18SHH
31
NHÓM BORH – 18SHH
Ạ
32
D.nồngđộcácchấtphảnứnggiảm,cònnồngđộcácchấtsảnphẩmtăng.
II.Mứcđộvậndụng
Câu22:Xétcáchệcânbằngsautrongmộtbìnhkín:
C(r) + H2O(k) ⇋CO(k) +H2(k) ; ∆H>0 (1)
CO(k) +H2O(k) ⇋CO2(k) +H2(k); ∆H<0 (2)
Cáccânbằngtrênchuyểndịchnhưthếnàokhibiếnđổitrongmộtcácđiềukiệnsau?
a)Tăngnhiệtđộ.
b)Thêmlượnghơinướcvào.
c)ThêmkhíH2 ra.
d)Tăngápsuấtchungbằngcáchnénchothểtíchcủahệgiảmxuống.
e)Dùngchấtxúctác.
Giải:
Phảnứng(1) Phảnứng(2)
YKÈMQUYNHƠNOFFICIAL
Tăngnhiệtđộ →
Thêmhơinước →
TăngH
Tăngápsuất ←
Tổngsốmol2vếbằngnhaunêncânbằng khôngđổi
Chấtxúctác Khôngđổi Khôngđổi
Câu23:Chophảnứng: H2 (k) +I2 (k) ⇋2HI (k)
Ởnhiệtđộ4300ChằngsốcânbằngKC củaphảnứngtrênbằng53,96.Đunnóngmộtbìnhkíndungtích không đổi 10 lít chứa 4,0 gamH2 và 406,4 gamI2. Khi hệ phản ứng đạt trạng thái cân bằng ở 4300C, nồngđộcủaHIlà
A.0,151M. B.0,320M. C.0,275M. D.0,225M.
Giải: H2 (k) + I2(k) ⇋ 2HI
Banđầu: 2 1.6
Phảnứng: x x 2x
nH2=4/2=2mol;nI2 =406,4/254=1,6mol
Kcb = # $ #$ =53,96 ($ / ) ($ / )( , / )=53,96
⇒x=1,375(nhận)hoặcx=2,5(loại)(đk:x<1,6)
VậynồngđộcủaHI=2x/10=0,275M
ChọnC
Câu24:Mộtbìnhphảnứngcódungtíchkhôngđổi,chứahỗnhợpkhíN2 vàH2 vớinồngđộtươngứng là 0,3 M và 0,7 M. Sau khi phản ứng tổng hợp NH3 đạt trạng thái cân bằng ở t0C, H2chiếm 50% thể tíchhỗnhợpthuđược.HằngsốcânbằngKC ởt0Ccủaphảnứngcógiátrịlà
A.2,500. B.0,609. C.0,500. D.3,125.
Giải:Tacó:3H2 +N2 ⇋ 2NH3 (1).
Gọialà[N2]phảnứng.
Vậytheophảnứng(1):[H2]phảnứnglà3a;[NH3]phảnứnglà2a.
Khiđạtđếntrạngtháicânbằng:[N2]=0,3–a,[H2]=0,7–3a
NHÓM BORH – 18SHH
33
BORH
NHÓM
– 18SHH
←
→
← ←
2
Ạ
34
Đểđơngiảntaxét1líthỗnhợp.
Saukhiphảnứngđạtcânbằng:0,3–a+0,7–3a+2a=1–2a
MặtkhácH2 chiếm50%thểtíchhỗnhợpthuđược=> ,( ) $ =½=>x=0,1
Khiđạtcânbằng[N2]=0,3–0,1=0,2(M)
[H2]=0,7–0,3=0,4(M)
[NH3]=0,2(M).
KC = ! !. * = .$ .,!. .$ =3.125 ChọnD
Câu25:Chocânbằnghóahọcsau:
Chocácbiệnpháp:
(1)Tăngnhiệtđộ.
(2)Tăngápsuấtchungcủahệphảnứng.
(3)Hạnhiệtđộ.
(4)DùngthêmchấtxúctácV2O5
YKÈMQUYNHƠNOFFICIAL
(5)GiảmnồngđộSO3
(6)Giảmápsuấtchungcủahệphảnứng.
Nhữngbiệnphápnàolàmcânbằngtrênchuyểndịchtheochiềuthuận?
A.(1),(2),(4),(5) B.(2),(3),(5) C.(2),(3),(4),(6) D.(1),(2),(4).
Giải:
-Đâylàmộtphảnứngtỏanhiệt(∆H<0).
-Cósựchênhlệchsốmoltrướcvàsauphảnứng.
Vìvậy,cácyếutốlàmcânbằngdịchchuyểntheochiềuthuậnlà:
+Hạnhiệtđộ(2).
NHÓM BORH – 18SHH
+Tăngápsuất(3).
+GiảmnồngđộSO3(5).
Câu26:Sựtăngápsuấtảnhhưởngnhưthếnàođếntrạngtháicânbằngcủacácphảnứnghóahọcsau:
a)3O2(k) ⇋2O3(k) b)H2(k)+Br2(k) ⇋2HBr (k) c)N2O4(k) ⇋2NO2(k)
Giải:
Nếu sau phản ứng có sự giảmthể tích thì áp suất tăng làmcân bằng chuyển dịch theo chiều thuận và ngượclại,ápsuấtkhôngcóảnhhưởngtớicânbằngcủacácphảnứngkhôngthayđổithểtíchkhí.
a)3O2(k) ⇋2O3(k)
Phảnứng(a)cósựgiảmthểtích,cânbằngchuyểntheochiềuthuậnkhiápsuấttăng.
b)H2(k) +Br2(k) ⇋2HBr (k)
Phảnứng(b)khôngcósựthayđổithểtích,cânbằngkhôngphụthuộcvàoápsuất.
c)N2O4(k) ⇋2NO2(k)
Phảnứng(c)cósựtăngthểtích,cânbằngchuyểntheochiềunghịchkhiápsuấttăng.
Câu27:Sảnxuấtamoniactrongcôngnghiệpdựatrênphươngtrìnhhóahọcsau:
2N2(k) +3H2(k) ⇋2NH3(k);∆H=-92kJ
ĐểtạoranhiềuNH3thìngườitacóthểsửdụngnhữngbiệnphápnào?Giảithích.
Giải:
Đểthuđượcnhiềuamoniac,hiệuquảkinhtếcaocóthểdùngcácbiệnphápsauđây:
-TăngnồngđộN2 vàH2
-Tăngápsuấtchungcủahệlênkhoảng100atm,vìphảnứngthuậncósựgiảmthểtíchkhí.
- Dùng nhiệt độ phản ứng thích hợp khoảng 400 - 450oC và chất xúc tác để tăng tốc độ phản ứng tạo
thànhNH3.Chúýrằngchấtxúctáckhônglàmchuyểndịchcânbằng.
Câu28:Chophảnứng:
NHÓM BORH – 18SHH
35
2SO2 (k) +O2 (k) ⇋2SO3 (k);∆H<0
Ạ
36
2SO2(k) +O2 (k) ⇋2SO3 (k); ∆H<0
Cânbằngchuyểndịchtheochiềunàokhi
a)tăngnồngđộSO2. b)giảmnồngđộO2. c)giảmápsuất. d)tăngnhiệtđộ.
Trảlời:
a) Khi tăng nồng độ SO2 thì cân bằng chuyển dịch theo chiều thuận nghĩa là chiều làm giảm nồng độ
SO2
b)KhigiảmnồngđộO2 thìcânbằngchuyểndịchtheochiềunghịchnghĩalàchiềutạoraO2
c)Khigiảmápsuấtthìcânbằngchuyểndịchtheochiềunghịchnghĩalàchiềutăngsốmolkhí.
d)Khităngnhiệtđộcânbằngchuyểndịchtheochiềunghịchnghĩalàchiêuphảnứngthunhiệt.
Câu29:
Chophảnứngthuậnnghịchsau:
2NaHCO3(r) ⇋Na2CO3(r) +CO2(k) +H2O (k); ∆H=129kJ
CóthểdùngnhữngbiệnphápgìđểchuyểnhóanhanhvàhoàntoànNaHCO3 thànhNa2CO3?
Trảlời:
Chiềuthuậncủaphảnứngcó∆H=129kJ>0:thunhiệtvàcósốmolkhítănglên.
YKÈMQUYNHƠNOFFICIAL
Vâybiệnphápđểcânbằngchuyểndịchhoàntoàntheochiềuthuậnlà:
-Đunnóng(tăngnhiệtđộ).
-Giảmápsuấtbằngcáchthựchiệnphảnứngtrongbìnhhở.
Câu30:Chophảnứng:
H2 (k) +CO2 (k) ⇋H2O (k) +CO (k) cóKc =4,4.
Tính nồng độ của các chất ở trạng thái cân bằng nếu lúc đầu trong bình phản ứng, có thể tích 10 lít, chứa1,5molH2;1,6molCO2và1molCO.
Giải:
NồngđộbanđầucủaH2,CO2 vàCOlầnlượtlà:0,15M,0,16Mvà0,1M.Trongbìnhxảyracânbằng:
CO
Banđầu: 0,15 0,16 0 0,1
Phảnứng: x x x x
Cânbằng: 0,15-x 0,16-x x 0,1+x
Ápdụngđịnhluậttácdụngkhốilượngtacó:
KC = 1$2.32 1$.32$ = 4( , 4) ( , 4)( , 4) =4,4 x=0,092
Ởtrangtháicânbằnghệchứa:[H2]=0,058M;[CO2]=0,068M;[H2O]=0,092M;[CO]=0,192M
Câu31:NồngđộbanđầucủaSO2 vàO2 tronghệ:2SO2 +O2 ⇋2SO3 tươngứnglà4Mvà2M.
a) Tínhhằngsốcânbằngcủaphảnứng.Biếtkhiđạttrạngtháicânbằngcó80%SO2 đãthamgia
phảnứng.
b) Đểcânbằngcó90%đãphảnứngthìlượngO2 lúcđầulàbaonhiêu?
Giải:
a)Hiệusuấtlà80% [SO2]pu=4.80%=3,2M.
2SO2 + O2 ⇋ 2SO3
Banđầu: 4 2
Phảnứng: 3,2 1,6 3,2
Cânbằng: 0,8 0,4 3,2.
K= ),$ ,5 . ,, =40
b)Hiệusuấtlà90% [SO2]pu=4.90%=3,6M.
2SO2 + O2 ⇋ 2SO3
Banđầu: 4 x
Phảnứng: 3,6 1,8 3,6
Cânbằng: 0,4 (x-1,8) 3,6.
Kkhôngđổi=40
⇒ ), ,, .( ,5) =40⇒x=3.825M
NHÓM BORH – 18SHH
37
NHÓM BORH – 18SHH
Ạ
38
2(k)
2(k) ⇋ H2O (k)
(k)
KC =
H
+
+ CO
,
4,4
Câu32:Chophảnứngsau:
H2O (k) +CO2 (k) ⇋H2 (k) +CO2 (k)
Ở 700oC hằng số cân bằng của phản ứng trên là Kc =1,873. Tính nồng độ H2O và CO ở trạng tháicânbằng,biếtrằnghỗnhợpbanđầugồm0,3molH2Ovà0,3molCOtrongbình10lítở700oC.
Giải:
H2O(k) + CO(k) ⇌ H2(k) + CO2(k)
Banđầu: 0,03 0,03 0 0 (M)
Phảnứng: x x x x (M)
Cânbằng: 0,03-x 0,03-x x x (M)
Hằngsốcânbằng:
Kc = ( , ) ) =1,837 ⟹ , ) =√1.873 ⟹x≈0,01733(M)
NồngđộcânbằngcủaCOvàH2Olà:
0,03–x=0,01267(M)
Câu33:Xétcânbằng:
YKÈMQUYNHƠNOFFICIAL
Khichuyểndịchsangmộttrạngtháicânbằngmớinếunồng
NO2 nhưthếnào?
A.Tăng9lần B.Tăng3lần C.Tăng4,5lần D.Giảm3lần.
Giải:
Xétphảnứng:N2O4(k) ⇋ 2NO2(k) ở250C [N2O4]tănglên9lầnthì[NO2]tănglênlà:
Ápdụngcôngthức:Kc = ; khităng[N2O4]lên9lầnthì[NO2]cầntăngthêmlà3lầnđểđạtđến trạngtháicânbằng. ChọnB
III. Mứcđộvậndụngcao:
Câu34:Clodùngđểkhửtrùngnướctrongsinhhoạt.Tuynhiênnướcclokhôngsửdụngđượckhinuôi trồngthủysản.Đểsửdụngthìcầnphơinắng2-3ngày.Theoem,phơinắngnhằmmụcđíchgì?
Giải:
Clophảnứngvớinướctheophươngtrìnhhóahọcsau:Cl2 +H2O⇋HClO+HCl
Dướitácdụngcủaánhsáng,HClObịphânhủytheophảnứng:2HClO⇋2HCl+O2
HClO không bền dưới ánh sáng nên bị phân hủy hoàn toàn tạo thành HCl và O2. Khi đó phản ứng chuyển dịch theo chiều thuận do nồng độ HClO giảm, Cl2 tác dụng từ từ với H2O cho tới hết, HClO cũngbịphânhủydầnhết.
Câu35:HỗnhợpkhíXgồmN2 vàH2 cótỉkhốisovớiHebằng1,8.ĐunnóngXmộtthờigiantrong bìnhkín (cóbộtFelàmxúctác),thu đượchỗnhợp khíY cótỉ khốisovới Hebằng2. Tínhhiệusuất củaphảnứngtổnghợpNH3.
Giải:Chọnsốmolcủahỗnhợplà1.
GọisốmolcủaN2 làx,thìcủaH2 là1–x,sốmolN2 phảnứnglàa
N2 + 3H2 ⇋ 2NH3
Banđầu: a 1–a
Phảnứng: x 3x 2x
Sauphảnứng: a-x 1-a-3x 2x
HỗnhợpX: 28a+2(1–a)=1,8.4
a=0,2
HỗnhợpYcósốmollà:a–x+1–a–3x+2x=1–2x
mY =(1–2x)2.4
TacómX =mY (1–2x)2.4=1,8.4
NHÓM BORH – 18SHH
NHÓM BORH – 18SHH
39
N2O4(k) ⇋ 2NO2(k) ở25oC.
độcủaN2O4 tănglên
9lầnthìnồngđộcủa
Ạ
40
x=0,05
HiệusuấtH%= =25%
Câu36:Câutụcngữ“Nướcchảyđámòn”mangýnghĩahóahọcgì?
(Gợiý:ThànhphầnchủyếucủađálàCaCO3)
Giải:
Thành phần chủ yếu của đá là CaCO3. Trong không khí có khí CO2 nên nước hòa tan một phần tạo
thànhaxitH2CO3
Dođóxảyraphảnứnghóahọc:CaCO3 +CO2 +H2O⇋Ca(HCO3)2
KhinướcchảycuốntheoCa(HCO3)2,theonguyênlíchuyểndịchcânbằngthìcânbằngsẽchuyểndịch theochiềuthuận.Kếtquảlàsaumộtthờigiannướcđãlàmchođábịbàomòndần.
Câu37:Viếtcácbiểuthứchằngsốcânbằngchocácphảnứngsau:
a. CaCO3(r) ⇋ CaO(r) + CO2(k)
b. Cu2O (r) + $ O2(k) ⇋ 2CuO
c. 2SO2(k) + O2(k) ⇋ 2SO3 (1)
SO2 (k) + $ O2(k) ⇋ SO3(k) (2)
2SO3(k) ⇋ 2SO2(k) + O2(k) (3)
YKÈMQUYNHƠNOFFICIAL
Hãychobiếtmốiliênhệgiữabahằngsốcânbằngứngvớibatrườnghợptrongcâuc)ởcùngnhiệtđộ.
Giải
Hằngsốcânbằngcủacácphảnứng:
a. Kc =[CO2]
b. Kc = *
c. Kc1 = " ! " * Kc2 = " ! " */ Kc3 = " * " !
Mốiliênhệgiữa3hằngsố:
Kc3 = <* Kc2==>?
Kc3 =(< )$
41 NHÓM BORH – 18SHH
Ạ