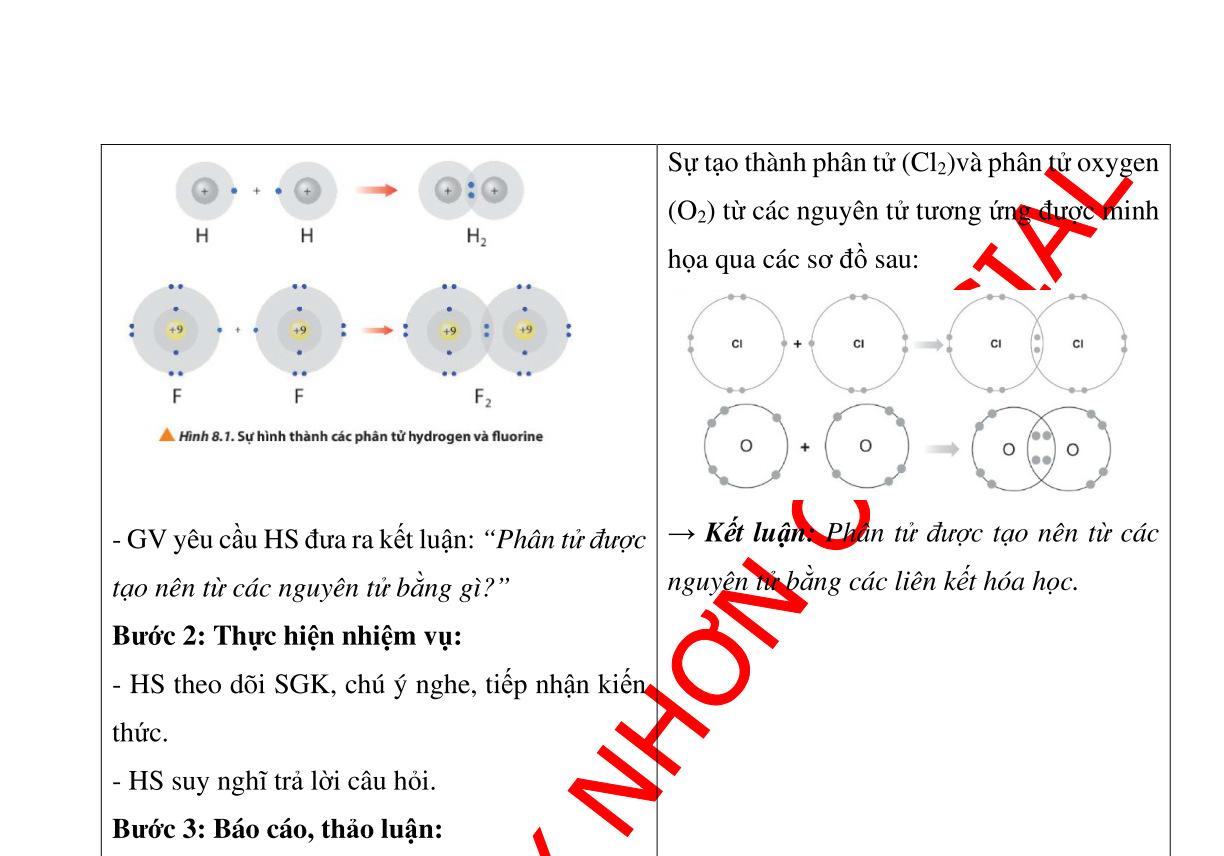
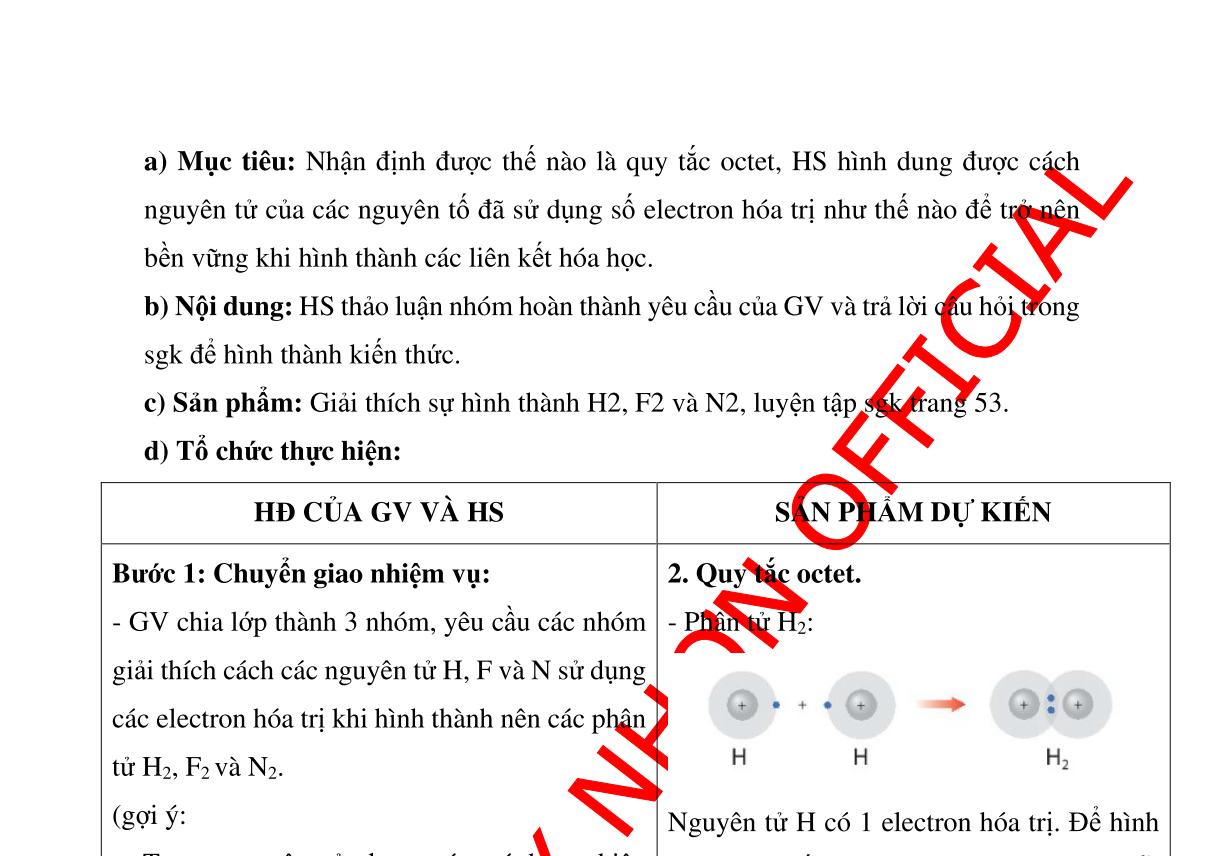
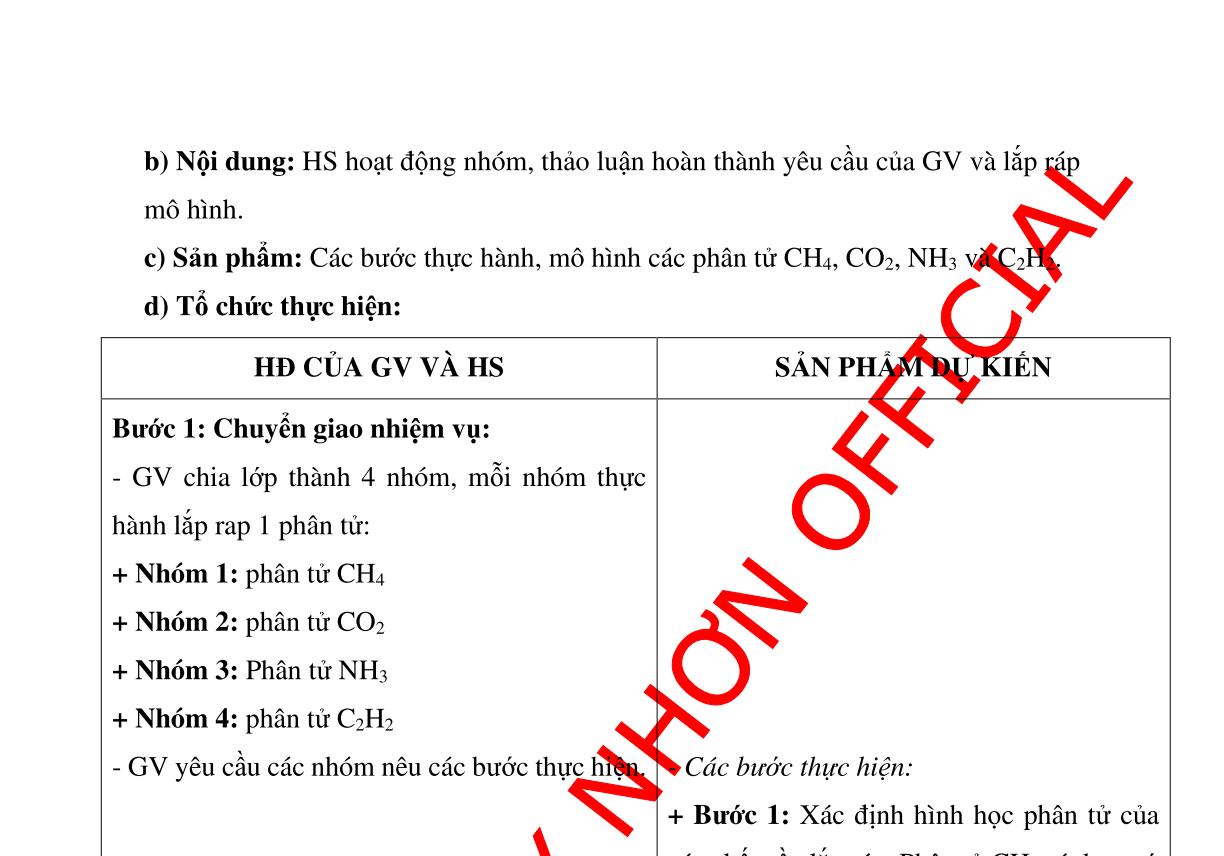
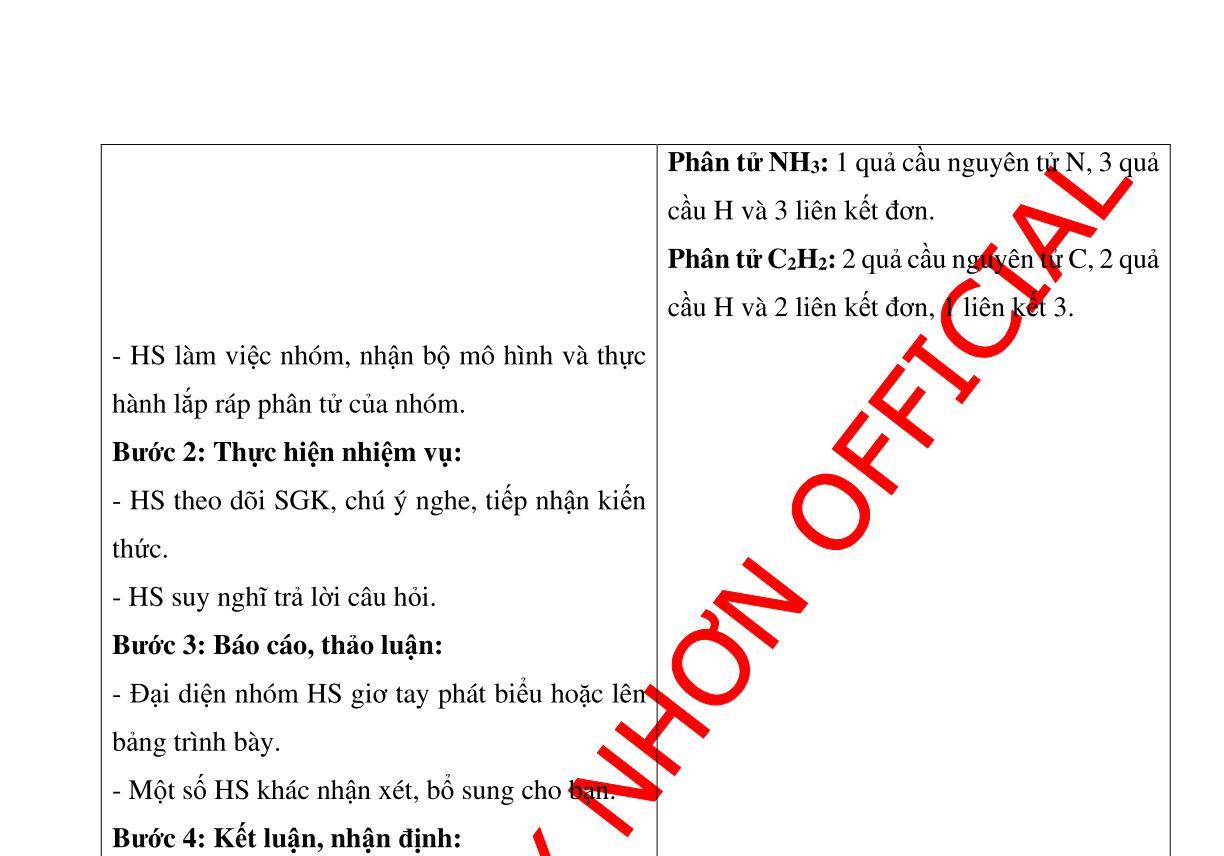
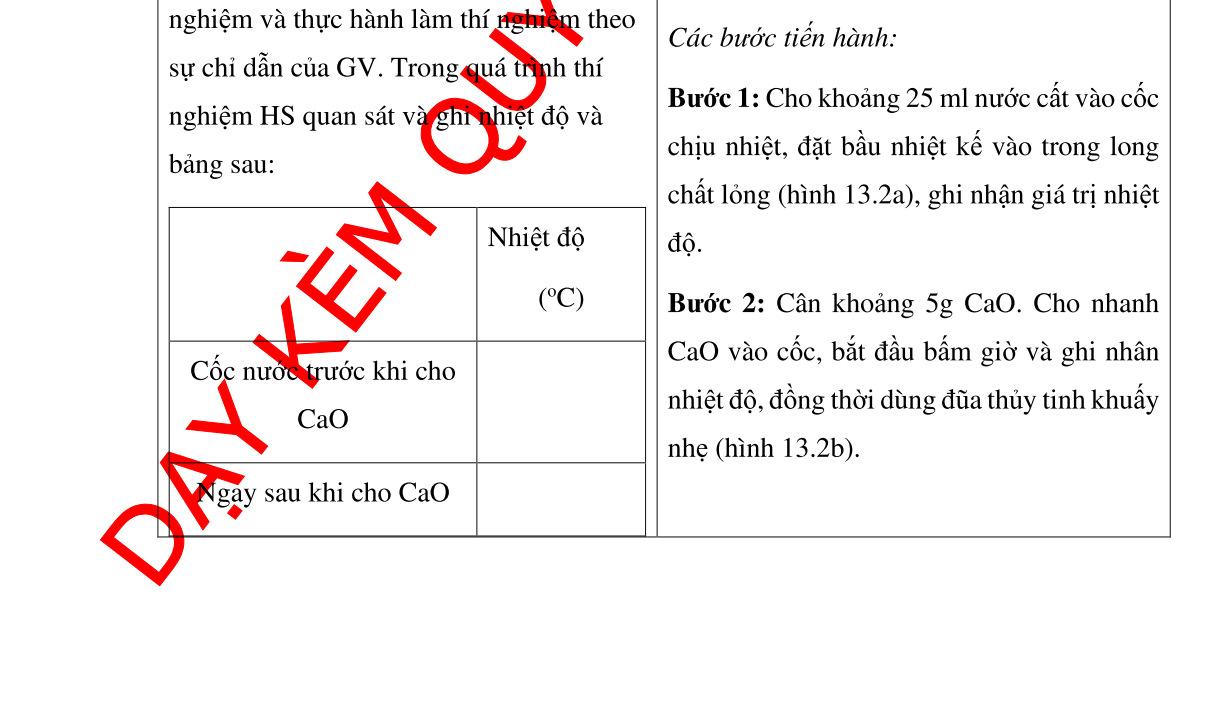
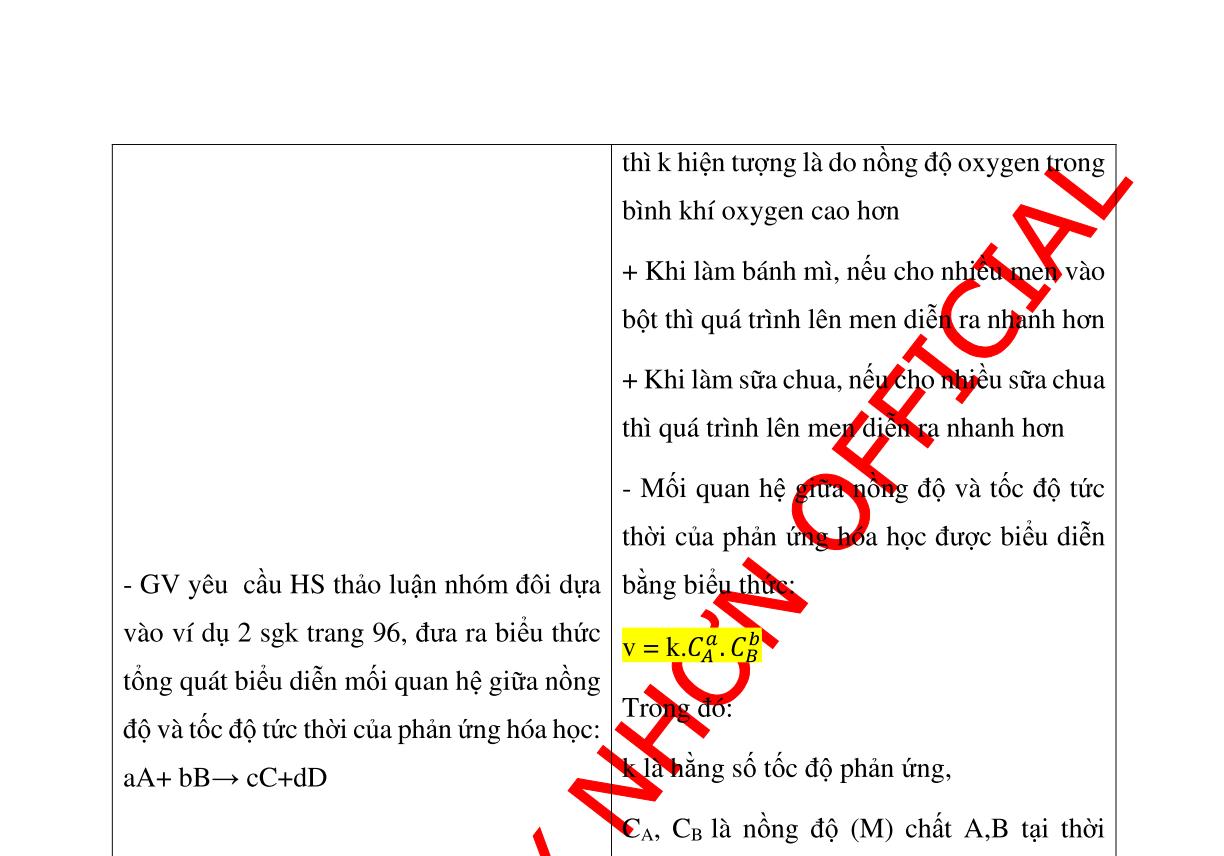
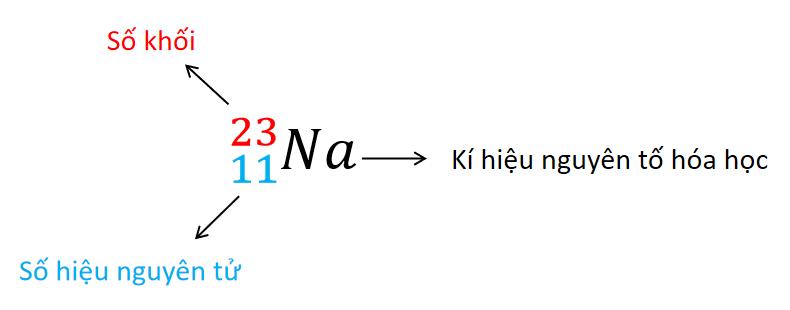SẢN PHẨM DỰ KIẾN
II. Vai trò của hóa học trong đời sống và sản xuất.
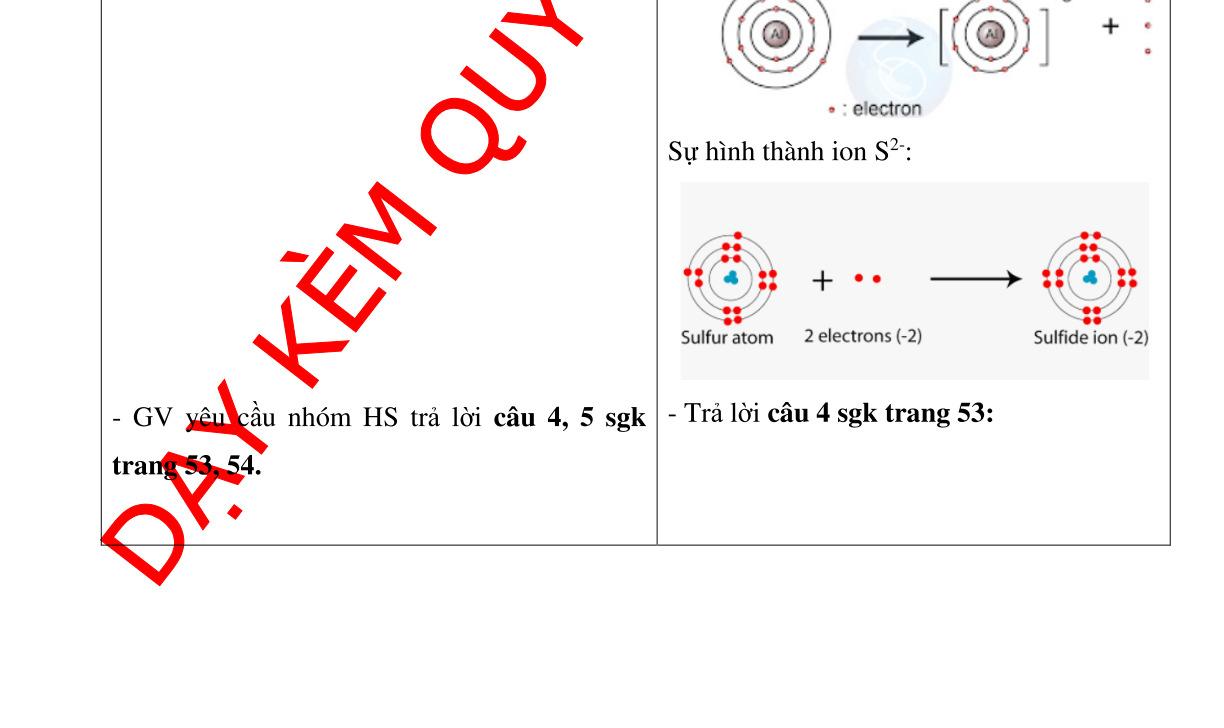
- Đáp án câu 4 sgk trang 7 :
GV tổ chức cuộc thi hùng biện theo nhóm với chủ đề: “Vai trò của hóa học trong đời sống và sản xuất”.
+ Nhóm 1: Thuyết trình về vai trò của hóa học đối với nhiên liệu.
+ Nhóm 2: Thuyết trình về vai trò của
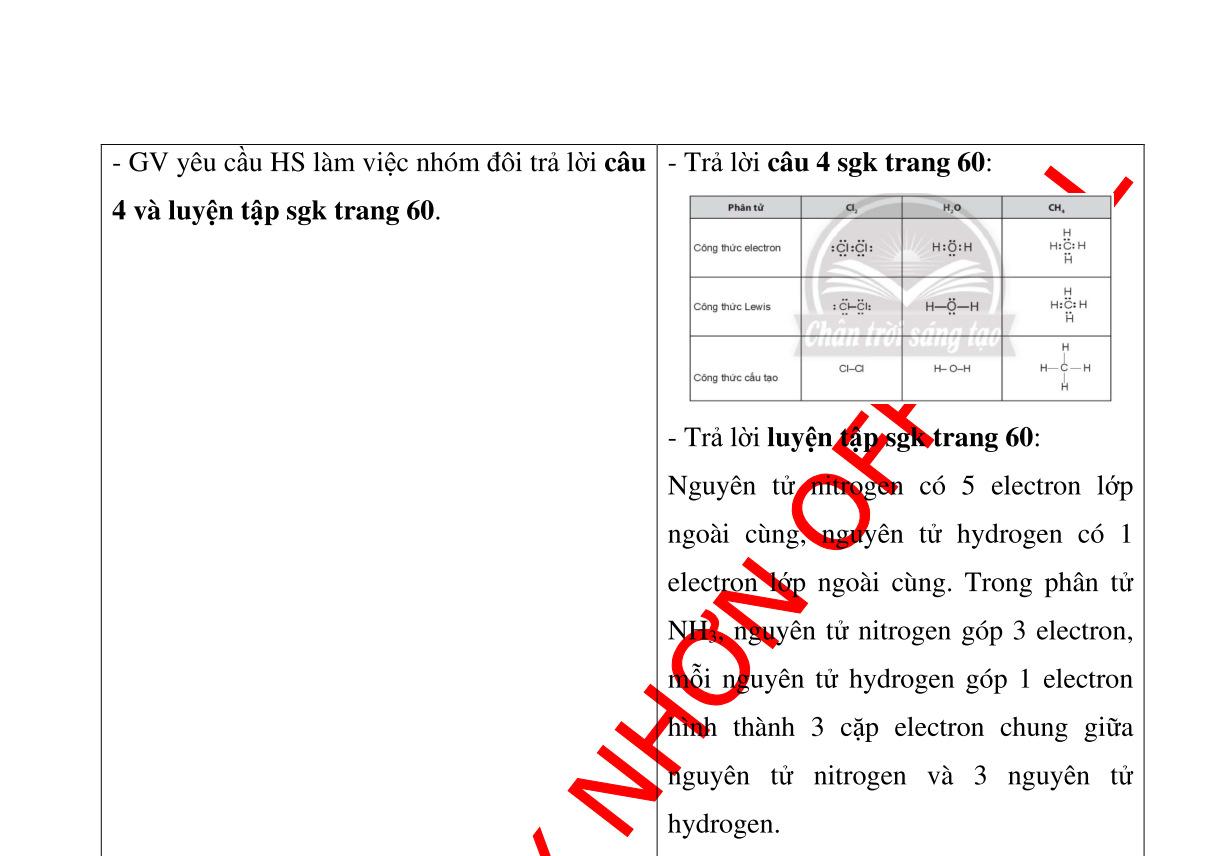
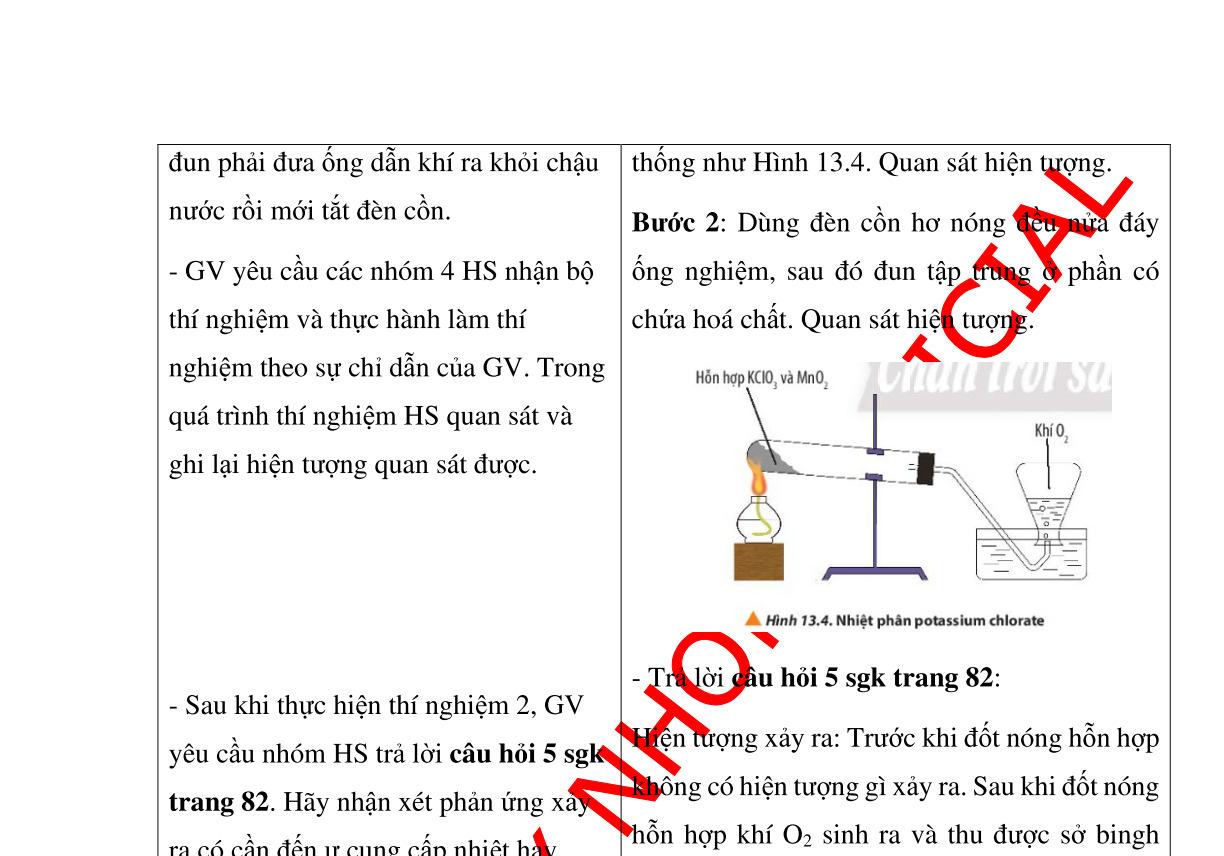
Hình 1.4: nhiên liệu; Hình 1.5: vật liệu; Hình 1.6: dược phẩm; Hình 1.7: vật tư y tế; Hình 1.8: mĩ phẩm; Hình 1.9: sản xuất nông nghiệp; Hình 1.10: nghiên cứu khoa học - Đáp án câu 5 sgk trang 8: + Đối với nhiên liệu: Để giải quyết vấn đề năng lượng cho tương lai, hóa học cùng các ngành khoa học khác đang triển khai theo hướng: Nghiên cứu sử sụng các loại nhiên liệu ít ảnh hưởng đến môi trường như dùng hydrogen (nhiên liệu sạch) làm nhiên liệu;
DẠYKÈMQUYNHƠNOFFICIAL
-
hóa học đối với vật liệu.
+ Nhóm 3: Thuyết trình về vai trò của hóa học đối với y tế.
+ Nhóm 4: Thuyết trình về vai trò của hóa học đối với cuộc sống.
+ Nhóm 5 Thuyết trình về vai trò của hóa học đối với nông nghiệp.
+ Nhóm 6: Thuyết trình về vai trò của hóa học đối với nghiên cứu khoa học.
=> GV đưa ra kết luận về vai trò của hóa học.
Bước 2: Thực hiện nhiệm vụ:
- HS hoạt động nhóm, phân công nhiệm vụ. - HS suy nghĩ, thảo luận làm nhiệm vụ được giao.
Bước 3: Báo cáo, thảo luận: - Đại diện nhóm HS giơ tay phát biểu hoặc lên bảng trình bày đáp án câu 4 - Đại diện từng nhóm lên thuyết trình về phần vai trò của hóa học - Một số HS khác nhận xét, bổ sung. Bước 4: Kết luận, nhận định:
nâng cao hiệu quả của các quy trình chế hóa, sử dụng nhiên liệu, quy trình tiết kiệm nhiên liệu; chế tạo vật liệu chất lượng cao cho ngành năng lượng như vật liệu chế tạo pin mặt trời có hiệu suất cao. Hóa học có vai trò cơ bản trong việc tạo ra nhiên liệu hạt nhân là yếu tố quan trọng nhấy trong việc phát triển năng lượng hạt nhân. - Đối với vật liệu: Hoá học kết hợp với các ngành khoa học trong lĩnh vực kĩ thuật vật liệu đang nghiên cứu và khai thác những vật liệu mới có trọng lượng nhẹ, độ bền cao và có công năng đặc biệt như: Vật liệu composite có độ bền, độ chịu nhiệt, ... cao hơn rất nhiều so với polymer nguyên chất; Vật liệu hỗn hợp chất vô cơ và hợp chất hữu cơ; Vật liệu hỗn hợp nano;... - Đối với y tế: Trong y học người ta sử dụng hoá học để tìm kiếm những loại thuốc, dược phẩm, vật tư y tế mới cho việc trị bệnh và nâng cao sức khoẻ con người. - Đối với cuộc sống: Hoá học có vai trong trong sản xuất nguyên liệu, nhiên liệu, vật liệu, lương thực - thực phẩm, mĩ phẩm,... nhằm thúc đẩy sản xuất, nâng cao chất lượng cuộc sống.
DẠYKÈMQUYNHƠNOFFICIAL
- GV nhận xét kết quả thảo luận nhóm, phần thuyết trình thái độ làm việc. - GV tổng quát lưu ý lại kiến thức trọng tâm và yêu cầu HS ghi chép đầy đủ vào vở.
- Đối với nông nghiệp: Hoá học nông nghiệp thường nhằm bảo tồn hoặc tăng độ phì nhiều của đất, duy trì hoặc cải thiện năng suất nông nghiệp và cải thiện chất lượng của cây trồng. - Đối với nghiên cứu khoa học: Hoá học đóng góp và thúc đẩy nghiên cứu khoa học thuộc lĩnh vực hoá học cũng như khoa học liên ngành.
=> Kết luận: Hóa học có vai trò quan trọng trong đời sống, sản xuất và nghiên cứu hóa học.
Hoạt động 3: Phương pháp học tập hóa học.
a) Mục tiêu: Trình bày được phương pháp học tập môn hóa học. b) Nội dung: HS thảo luận nhóm đôi và nhóm 4 thực hiện yêu cầu của GV để tìm hiểu kiến thức bài học. c) Sản phẩm: Đáp án câu 6, 7 trong sgk trang 9, sơ đồ phân loại các chất đã cho theo các tiêu chí khác nhau, k
DẠYKÈMQUYNHƠNOFFICIAL
Tổ chức thực hiện: HĐ CỦA GV VÀ HS SẢN PHẨM DỰ KIẾN Bước 1: Chuyển giao nhiệm vụ: - GV yêu cầu HS thảo luận nhóm đôi, III. Phương pháp học tập hóa học - Đáp
:
ết luận về phương pháo học tập hóa học. d)
án câu 6 sgk trang 9
quan sát hình 1.11 thảo luận câu hỏi 6, 7 sgk trang 9.
(1) Ôn tập và nghiên cứu bài học trước khi đến lớp: Kĩ năng này đặc biệt hiệu quả chô việc học hóa học. Đầu tiên, HS sẽ được thuyết trình hoặc trình bày sau khi đã nghiên cứu tài liệu. Thứ hai, khi đến lớp với việc đã làm quen trước với bài học, HS có thể theo dõi và hiểu được những gì GV đang giảng dạy. Nếu HS không hiểu các khái niệm tronh quá trình chuẩn bị bài, HS có thểđặt câu hỏi. Cuối cùng, thời gian trên lớp được sử dụng hiệu quả hơn cho việc học.
(2) Rèn luyện tư duy hoá học: Trên thực tế, có quá nhiều thông tin mới mà HS phải tiếp thu khi học hoá học, không nên cố gắng ghi nhớ tất cả các kiến thức. Đầu tiên hãy tập trung vào việc hiểu các khái niệm cơ bản. Khi bạn đã hiểu rõ về các nguyên tắc cơ bản, bạn có thểnghi nhớ các chỉ tiết sau đó. Ngoài ra, khi bạn nắm vững các nguyên tắc cơ bản của hoá học và hiểu được các khái niệm, bạn sẽ thấy dễ dàng hơn nhiều để ghi nhớ những kiến thức liên quan khác.
(3) Ghi chép: Các công thức và phương trình hoá học sẽ dễ nhớ và dễ hiểu hơn rất nhiều sau khi được viết ra; xem lại những ghi chú giúp HS xác định những gì đang làm và chưa
DẠYKÈMQUYNHƠNOFFICIAL
hiểu và chuẩn bị tốt cho các kì thi; HS có thể tham gia và đóng góp vào nhóm học tập của mình tốt hơn.
(4) Luyện tập thường xuyên: giúp HS kiểm tra sự hiểu biết kiến thức khi xem lại và làm bài tập, từ đó ghi nhớ và khắc sâu kiến thức hơn.
(5) Thực hành thí nghiệm: Khi nói đến việc học hoá học, không có gì thay thế được thực hành thí nghiệm và không có cách nào tốt hơn để học hoá học hiệu quả khi được làm việc trong phòng thí nghiệm hoá học, giúp HS củng cố sự hiểu biết và kiến thức về hoá học.
(6) Sử dụng thẻ ghi nhớ: giúp HS dễ ghi nhớ các ký hiệu khoa học, công thức và từ vựng một cách chính xác.
(7) Hoạt động tham quan, trải nghiệm: giúp HS trải nghiệm thực tế đối với các ngành nghề có liên quan đến môn Hoá học, giúp HS định hướng nghề nghiệp tương lai cho bản thân; . . .
(8) Sử dụng sơ đồ tư duy: giúp HS ghi nhớ thông tin một cách logic, sáng tạo và dễ dàng sử dụng những kiến thức đã học.
DẠYKÈMQUYNHƠNOFFICIAL
=> Từ đây, GV kết luận phương pháp học tập hóa học. - GV yêu cầu HS hoạt động nhóm 4 dựa vào kiến thức về phương pháp học tập, hoàn thành bài tập luyện tập và trình bày kết quả vào giấy A0: + Dựa vào các tiêu chí khác nhau, em hãy lập sơ phân loại các chất sau: oxygen, ethanol, iron (III) oxide, acetic acid, sucrose. Bước 2: Thực hiện nhiệm vụ:
- Đáp án câu 7 sgk trang 9:
- Phương pháp tìm hiểu lí thuyết: Ghi chép; Ôn tập và nghiên cứu bài học trước khi đến lớp; Rèn luyện tư duy hoá học.
- Phương pháp học tập thông qua thực hành thí nghiệm: Thực hành thí nghiệm; Rèn luyện tư duy hoá học.
- Phương pháp luyện tập, ôn tập: Luyện tập thường xuyên; Sử dụng thẻ ghi nhớ; Sử dụng sơ đồ tư duy.
- Phương pháp học tập trải nghiệm: Hoạt động tham quan, trải nghiệm; Thực hành thí nghiệm.
=> Kết luận: Phương pháp học tập hóa học nhằm phát triển năng lực hóa học, bao gồm
(1) Phương pháp tìm hiểu lí thuyết; (2) Phương pháp học tập thông qua thực hanh thí nghiệm; (3) Phương pháp luyện tập, ôn tập; (4) Phương pháp học tập trải nghiệm.
- Sơ đồ dựa vào thành phần của chất:
DẠYKÈMQUYNHƠNOFFICIAL
- HS theo dõi SGK, chú ý nghe, tiếp nhận kiến thức.
- HS phân công nhiệm vụ, thảo luận nhóm suy nghĩ trả lời câu hỏi, bài tập.
Bước 3: Báo cáo, thảo luận: - Đại diện nhóm HS xung phong phát biểu hoặc lên bảng thuyết trình.
- Một số HS khác nhận xét, bổ sung cho bạn.
Bước 4: Kết luận, nhận định:
- Sơ đồ dựa vào đặc điểm của chất:
Hoạt động 4: Phương pháp nghiên cứu hóa học. a) Mục tiêu: Trình bày được phương nghiên cứu hóa học. b) Nội dung:


DẠYKÈMQUYNHƠNOFFICIAL
- GV nhận xét kết quả thảo luận nhóm, phần thuyết trình thái độ làm việc. - GV tổng quát lưu ý lại kiến thức trọng tâm và yêu cầu HS ghi chép đầy đủ vào vở. HS thảo luận nhóm đôi và nhóm 4 thực hiện yêu cầu của GV để tìm hiểu kiến thức bài học. c) Sản phẩm: Đáp án câu 8, 9 sgk trang 10; kết luận về phương pháp nghiên cứu hóa học, đáp án bài tập vận dụng sgk trang 10. d) Tổ chức thực hiện:
HĐ CỦA GV VÀ HS SẢN PHẨM DỰ KIẾN
Bước 1: Chuyển giao nhiệm vụ:
- GV chia lớp thành 4 – 5 nhóm, đọc thông tin phương pháp nghiên cứu hóa học và ví dụ trong SGK, trả lời câu hỏi 8, 9 sgk trang 10 và câu hỏi luyện tập sgk trang 11.
=> Từ đây, GV kết luận về phương pháp nghiên cứu hóa học.
- GV yêu cầu HS hoạt động cá nhân, suy nghĩ trả lời bài tập vận dụng trang 11.
Bước 2: Thực hiện nhiệm vụ:
- HS theo dõi SGK, chú ý nghe, tiếp nhận kiến thức.
- HS suy nghĩ trả lời câu hỏi.
Bước 3: Báo cáo, thảo luận: - Đại diện nhóm HS giơ tay phát biểu hoặc lên bảng trình bày. - Một số HS khác nhận xét, bổ sung cho bạn.
Bước 4: Kết luận, nhận định: - GV nhận xét kết quả thảo luận nhóm, phần thuyết trình thái độ làm việc.
IV. Phương pháp nghiên cứu hóa học
- Đáp án câu 8 sgk trang 10: 3 phương pháp nghiên cứu có thể tiến hành độc lập hoặc bổ trợ lẫn nhau trong quá trình nghiên cứu. - Đáp án câu 9 sgk trang 10: + Phương pháp nghiên cứu lí thuyết: bước (1), (2) + Phương pháp nghiên cứu thực nghiệm: bước (2),(3) + Phương pháp nghiên cứu ứng dụng: bước (4)
=> Kết luận: + Phương pháp nghiên cứu hóa học bao gồm: nghiên cứu lí thuyết, nghiên cứu thực nghiệm và nghiên cứu ứng dụng
+ Phương pháp nghiên cứu hóa học thường bao gồm một số bước: (1) Xác định vấn đề nghiên cứu; (2) Nêu giả thuyết khoa học; (3) Thực hiện nghiên cứu (lí thuyết, thực nghiệm, ứng dụng
- Trả lời bài tập vận dụng trang 11: Việc nghiên cứu để tìm ra giải pháp nhằm giảm
DẠYKÈMQUYNHƠNOFFICIAL
- GV tổng quát lưu ý lại kiến thức trọng tâm và yêu cầu HS ghi chép đầy đủ vào vở.
C. HOẠT ĐỘNG LUYỆN TẬP
thiểu tác hại của mưa acid thuộc phương pháp nghiên cứu ứng dụng
a) Mục tiêu: HS củng cố lại kiến thức về đối tượng nghiên cứu, vai trò trong đời sống sản xuất và phương pháp học tập của môn hóa học b) Nội dung: HS vận dụng các kiến thức đã học giải quyết các bài tập về đối tượng nghiên cứu, vai trò trong đời sống sản xuất và phương pháp học tập của môn hóa học
c) Sản phẩm học tập: Câu trả lời của HS cho các bài tập luyện tập và bài tập trong sgk.
d) Tổ chức thực hiện: Bước 1: Chuyển giao nhiệm vụ: - GV tổng hợp các kiến thức cần ghi nhớ cho HS. - GV cho HS hoạt động nhóm đôi làm bài luyện tập và bài tập: Luyện tập 1 sgk T.7: Khi đốt cháy nến (được làm bằng paraffin), nến chảy ra ở dạng lỏng, thấm vào bấc, cháy trong không khí, sinh ra khi carbon dioxide và hơi nước. Cho biết giai đoạn nào diễn ra hiện tượng biến đổi vật lí, giai đoạn nào diễn ra hiện tượng biến đổi hóa học. Giải thích.
Luyện tập 2 sgk T.8: Kể tên một vài ứng dụng khác sgk của hóa học trong đời sống Bài tập 1 sgk T.12: Nội dung nào dưới đây không phải là đối tượng nghiên cứu của môn hóa học?
A. Thành phần cấu trúc của chất
DẠYKÈMQUYNHƠNOFFICIAL
B. Tính chất và sự biến đổi của chất
C. Ứng chụng của chất
D. Sự lớn lên và sinh sản của tế bào
Bài tập 3 sgk T.12: Cho các bước trong phương pháp nghiên cứu hóa học: Nêu giả thuyết khoa học; viết báo cáo; thảo luận kết quả và kết luận vấn đề; thực hiện nghiên cứu, Xác định vấn đề nghiên cứu. Hãy sắp xếp các bước trên vào sơ đồ dưới đây theo thứ tự để có quy trình nghiên cứu phù hợp.
Bước 2: Thực hiện nhiệm vụ:
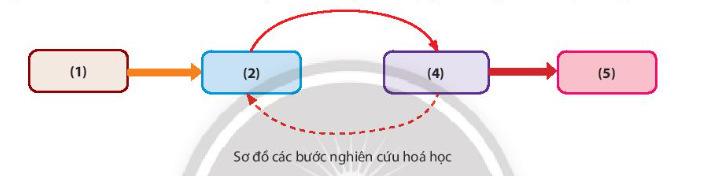
- HS suy nghĩ trả lời. - GV điều hành, quan sát, hỗ trợ.
Bước 3: Báo cáo, thảo luận:
- HS đại diện nhóm giơ tay phát biểu trả lời hoặc lên bảng trình bày.
Bước 4: Kết luận, nhận định:
- GV chữa bài, chốt đáp án.
- GV nhận xét thái độ làm việc, phương án trả lời của các học sinh, ghi nhận và tuyên dương.
Đáp án:
DẠYKÈMQUYNHƠNOFFICIAL
Luyện tập 1: Hiện tượng vật lý diễn ra ở giai đoạn nến chảy lỏng thấm vào bấc và giai đoạn nến lỏng chuyển thành hơi, trong giai đoạn này nếu (chất paraffin) chỉ biến đổi về trạng thái. Hiện tượng hóa học diễn ra ở giai đoạn nến cháy trong không khí, khi đó chất parafin đã biến đổi thành chất khác. Paraffin + Oxi → Khí carrbon đioxde + Nước.
Luyện tập 2: Hóa học ứng dụng trong các biện pháp giải thiểu tác hại của hiệu ứng nhà kính, mưa acid trong vấn đề môi trường, phân tích các thành phần của đá lấy từ mặt trăng trong lĩnh vực vũ trụ; …
Bài tập 1: D Bài tập 3:
(1) Xác định vấn đề nghiên cứu;
(2)Nêu giả thuyết khoa học;
(3)Thực hiện nghiên cứu;
(4)Viết báo cáo thảo luận kết quả và kết luận vấn đề.
D. HOẠT ĐỘNG VẬN DỤNG
a) Mục tiêu:
DẠYKÈMQUYNHƠNOFFICIAL
ọ
ự
ệ
ậ
ụ
ắ
ữ
b)
H
c sinh th
c hi
n làm bài tập v
n d
ng để n
m v
ng kiến thức.
Nội dung: HS vận dụng các kiến thức đã học giải quyết các bài tập vận dụng về đối tượng nghiên cứu, vai trò trong đời sống sản xuất và phương pháp học tập của môn hóa học.


DẠYKÈMQUYNHƠNOFFICIAL
d)
ứ
ự
ể
ệ
ụ Vậ
ụng
ừ
ớ
ứ
ậ
ố
ấ
tự tạo thẻ ghi nhớ một số nguyên tố trong 20 nguyên tố hóa học đầu tiên của bảng tuần hoàn. Bước 2: Thực hiện nhiệm vụ - HS làm việc cá nhân vận dụng 1, làm việc nhóm 4 vận dụng 2. - GV điều hành, quan sát, hỗ trợ. Bước 3 : Báo cáo, thảo luận - HS xung phong phát biểu. Các HS khác nhận xét. Đáp án :
c) Sản phẩm: đáp án vận dụng 1 và sản phẩm thẻ ghi nhớ 20 nguyên tố hóa học đầu tiên của bảng tuần hoàn.
Tổ ch
c th
c hiện: Bước 1 : Chuy
n giao nhi
m v
n d
1: T
sáng s
m em th
c d
y cho đến t
i đi ngủ, em sử dụng r
t nhiều chất trong sinh hoạt cá nhân, ăn uống, học tập, … Hãy liệt kê những chất đã sử dụng hằng ngày mà em biết. Nếu thiếu đi những chất ấy thì cuộc sống của em sẽ bất tiện như thế nào ? Vận dụng 2: Em cùng các bạn trong nhóm hãy
Vận dụng 1: Những chất đã sử dụng hằng ngày : kem đánh răng, muối, đường,…
Nếu thiếu những chất này thì chất lượng cuộc sống sẽ gặp nhiều khó khắn : không bảo vệ được hàm răng đẹp, hơi thở thơm tho; không có gia vị chế biến món ăn,…
Vận dụng 2 : Học sinh tự làm
Bước 4 : Kết luận, nhận định
- GV chữa bài, chốt đáp án. - GV nhận xét thái độ làm việc, sản phẩm, phương án trả lời của các học sinh, ghi nhận và tuyên dương.
* HƯỚNG DẪN VỀ NHÀ
- Ghi nhớ kiến thức trong bài.
- Hoàn thành bài tập 2 sgk trang 12 và đọc phần mở rộng sgk trang 11.
- Chuẩn bị bài 2 “Thành phần của nguyên tử”.
DẠYKÈMQUYNHƠNOFFICIAL
Ngày soạn: .../.../...
Ngày dạy: .../.../... BÀI 2: THÀNH PHẦN CỦA NGUYÊN TỬ (5 tiết)
I. MỤC TIÊU
:
1. Kiến thức: Học xong bài này, HS đạt các yêu cầu sau:
• Trình bày được thành phân của nguyên tử.
• So sánh được khối lượng của electron với protonvà neutron, kích thước của hạt nhân với kích thước của nguyên tử.
2. Năng lực
Năng lực chung:
• Năng lực tự chủ và tự học: Chủ động. tích cực tìm hiểu về cầu tạo nguyên tử
• Năng lực giao tiếp và hợp tác: Sử đụng ngôn ngữ khoa học để điển đạt về thành phân của nguyên tử (các loại hạt cơ bản tạo nên hạt nhân và lớp vỏ nguyên tử, điện tích và khối lượng mỗi loại hạt); Hoạt động nhóm một cách hiệu quả theo đúng yêu cầu của GV, đảm bảo các thành viên trong nhóm đều được tham gia và trình bày báo cáo.
• Năng lực giải quyết vấn đề và sáng tạo: Thảo luận với các thành viên trong nhóm nhằm giải quyết các vấn đề trong bài học để hoàn thành nhiệm vụ học tập.
DẠYKÈMQUYNHƠNOFFICIAL
Năng lực riêng:
• Năng lực nhận thức hóa học: Nêu được thành phân nguyên tử (các loại hạtcơ bản tạo nên hạt nhân và lớp vở nguyên tử, điện tích và khối lượng mỗi loại hạt).
• Tìm hiểu thể giới tự nhiên đưới góc độ hóa học: Nêu và giải thích được các thí nghiệm tìm ra thành phân của nguyên tử.
• Vận dụng kiến thức kĩ năng đã học: So sánh được khối lượng của electron với proton và neutron, kích thước của hạt nhân với kích thước của nguyên tử.
3. Phẩm chất
• Tham gia tích cực hoạt động nhóm phù hợp với khả năng của bản thân
• Cần thận, trung thực và thực hiện an toàn trong quá trình làm thí nghiệm.
• Có niềm say mê, hứng thú với việc khám phá và học tập hóa học.
II.
DẠYKÈMQUYNHƠNOFFICIAL
1. Đối với GV: SGK, Tài liệu giảng dạy, giáo án PPT,... 2. Đối với HS: SGK, vở ghi, giấy nháp, đồ dùng học tập (bút, thước...), bảng nhóm, bút viết bảng nhóm. III. TIẾN TRÌNH DẠY HỌC A. HOẠT ĐỘNG KHỞI ĐỘNG (MỞ ĐẦU) a) Mục tiêu: Sử dụng những câu hỏi gợi ý để giúp HS tiếp cận đến vấn đề của bài học. b) Nội dung: GV yêu cầu HS trả lời câu hỏi mở đầu liên quan đến bài học và dẫn dắt vào bài..
THIẾT BỊ DẠY HỌC VÀ HỌC LIỆU
c) Sản phẩm: HS trả lời câu hỏi mở đầu.
d) Tổ chức thực hiện:
Bước 1: Chuyển giao nhiệm vụ:
- Để nhìn được các vi khuẩn trong môi trường nuôi cấy thì các nhà khoa học dùng thiết bị gì?
- Làm thế nào để có thể phát hiện ra những vật thể rất nhỏ mà kính hiển vi quang học không nhìn thấy được?
Bước 2: Thực hiện nhiệm vụ
- HS quan sát và chú ý lắng yêu cầu và đưa ra đáp án.
Bước 3: Báo cáo, thảo luận:
- Các HS xung phong phát biểu trả lời.
Bước 4: Kết luận, nhận xét: - GV nhận xét, đánh giá và dẫn dắt vào bài: Vi khuẩn trong môi trường nuôi cấy, các nhà khoa học có thể dùng kính hiển vi để quan sát, tuy nhiên để phát hiện ra những vật thể vô cùng nhỏ bé như nguyên tử thì không thể dùng kính này được. Vậy các nhà khoa học đã phát hiện ra nguyên tử và các hạt cấu tạo nên nguyên tử như thế nào, ta cùng tìm hiểu: bài 2. Thành phần của nguyên tử.
B. HÌNH THÀNH KIẾN THỨC MỚI Hoạt động 1: Thành phần cấu tạo của nguyên tử.
a) Mục tiêu: mô tả được môm hình nguyên tử, nêu được thành phân nguyên tử theo mô hình này.
DẠYKÈMQUYNHƠNOFFICIAL
b) Nội dung: HS quan sát hình ảnh và video để trả lời các câu hỏi và kết luận về cấu tạo nguyên tử.
c) Sản phẩm: Lịch sử quá trình tìm thấy nguyên tử và thành phần cấu tạo nguyên tử, đáp án câu 1 sgk trang 13. d) Tổ chức thực hiện:
HĐ CỦA GV VÀ HS SẢN PHẨM DỰ KIẾN
Bước 1: Chuyển giao nhiệm vụ: - GV yêu cầu HS dựa vào sgk và trả lời câu hỏi: + Ai là người đầu tiên tìm ra nguyên tử? Tìm ra ở khoảng thời gian nào? Ông có chứng minh được nguyên tử có thật không? + “Atomos” theo tiếng Hy Lạp nghĩa là gì?
+ Đến khoảng thời gian nào các nhà khoa học mới chứng minh được nguyên tử là có thật.
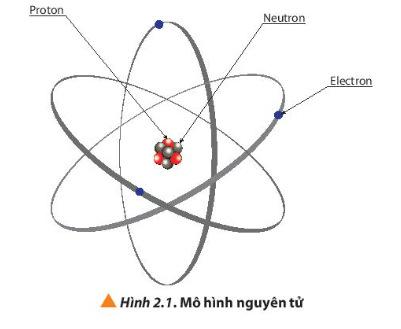
- GV yêu cầu HS quan sát hình 2.1, trả lời câu 1 sgk trang 13.
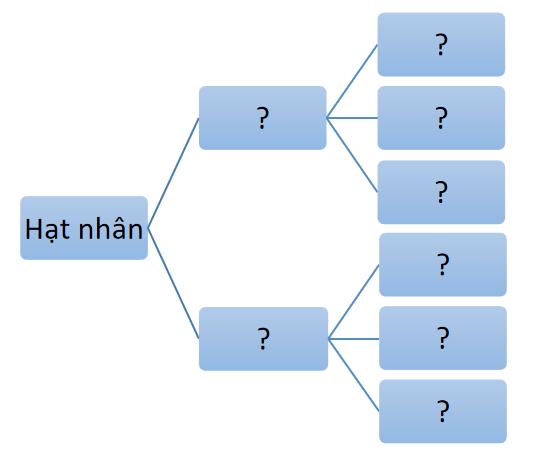
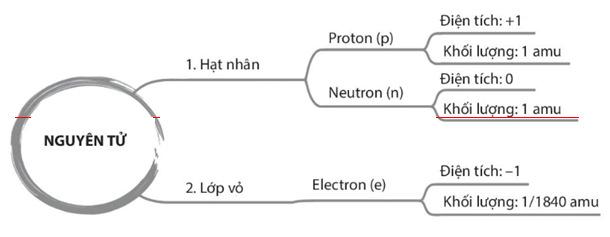
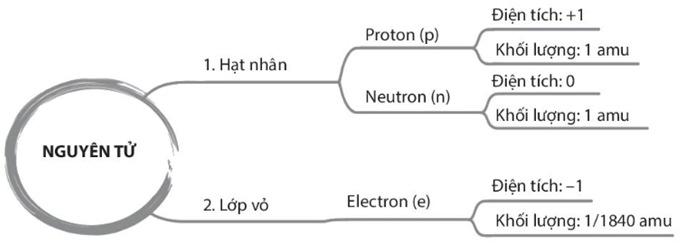
I. Thành phần cấu tạo nguyên tử.
+ Democritus là người đầu tiên tìm ra nguyên tử vào khoảng 400 năm TCN. Ông chỉ đưa ra quan điểm và khái niệm về nguyên tử, không chứng minh một cách khoa học được nguyên tử là có thật. + “Atomos” nghĩa là không thể phá hủy, không thể chia nhỏ hơn được nữa. => Nguyên tử vô cùng nhỏ bé + Đến cuối thế kỉ XIX, các nhà khoa học chứng minh được sự tồn tại của nguyên tử bằng thực nghiệm. - Trả lời câu 1 sgk trang 13: Nguyên tử gồm có proton, neutron và electron.
DẠYKÈMQUYNHƠNOFFICIAL
=> GV yêu cầu HS rút ra kết luận về cấu tạo của nguyên tử.
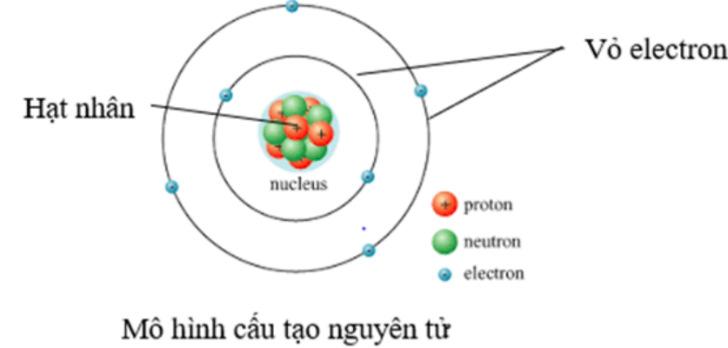
=> Kết luận: Nguyên tử gồm hạt nhân chứa proton, neutron và vỏ nguyên tử chứa electron.
Bước 2: Thực hiện nhiệm vụ: - HS theo dõi SGK, chú ý nghe, tiếp nhận kiến thức. - HS suy nghĩ trả lời câu hỏi. Bước 3: Báo cáo, thảo luận: - HS giơ tay phát biểu hoặc lên bảng trình bày. - Một số HS khác nhận xét, bổ sung cho bạn.
DẠYKÈMQUYNHƠNOFFICIAL
Bước 4: Kết luận, nhận định: - GV nhận xét kết quả thảo luận nhóm, phần thuyết trình thái độ làm việc. - GV tổng quát lưu ý lại kiến thức trọng tâm và yêu cầu HS ghi chép đầy đủ vào vở.
Hoạt động 2: Tìm hiểu thí nghiệm khám phá tia âm cực của Thomson
a) Mục tiêu: mô tả thí nghiệm của Thomson và kết luận được về sự tồn tại của electron
b) Nội dung: HS hoạt động theo nhóm, quan sát Hình 2.2 trong sgk, video minh họa và trả lời câu 2, 3, 4 sgk trang 14
c) Sản phẩm: Đáp án câu 2, 3, 4 sgk trang 14, đặc điểm của electron.
d) Tổ chức thực hiện:
HĐ CỦA GV VÀ HS
Bước 1: Chuyển giao nhiệm vụ: - GV chia lớp thành 4-5 nhóm, yêu cầu Hs quan sát hình 2.2 và quan sát video thí nghiệm, thảo luận trả lời câu 2, 3, 4 sgk trang 14:
SẢN PHẨM DỰ KIẾN
II. Sự tìm ra electron
- Trả lời câu 2 sgk trang 14: Màn huỳnh quang (màn phosphorus) sẽ phát sáng, cho phép xác định vị trí của chùm tia khi nó chạm vào phần cuối của ống âm cực. - Trả lời câu 3 sgk trang 14: Tia âm cực bản chất là các hạt manh điện tích âm (được phát ra từ cực âm của ống tia âm cực). Do đó, nó
DẠYKÈMQUYNHƠNOFFICIAL
2. Cho biết vai trò của màn huỳnh quang ở Hình 2.2
3. Quan sát hình 2.2 và video, giải thích vì sao tia âm cực bị hút về cực dương của trường điện.
4. Nếu đặt một chong chóng nhẹ trên đường đi của tia âm cực thì chong chóng sẽ quay. Từ hiện tượng đó, hãy nêu kết luận về tính chất của tia âm cực. + GV chiếu video thí nghiệm và thuyết minh (Video minh họa thí nghiệm từ 1:05 đến 1:59 : https://www.youtube.com/watch?v=F0I11R_IHg )
Thuyết minh: Nhà vật lí Thomson thực hiện thí nghiệm sử dụng ống thủy tinh chân không. Đặt cực âm và cực dương của nguồn điện cùng 2 tấm kim loại vào trong ống. Khi nguồn điện hoạt động đạt đến 15 kV xuất hiện một vệt thẳng. Sau đó tích điện âm và dương cho mỗi tấm kim loại, ta ông thấy vệt cong về phía kim loại tích điện dương. Vậy vệt sang đó là gì? Video đặt chong chóng tre: https://www.youtube.com/watch?v=yK_y LVgc4cw - GV yêu cầu HS
bị hút về cực dương của trường điện. - Trả lời câu 4 sgk trang 14: Chong chóng quay, chứng tỏ tia âm cực là chùm hạt vật chất có khối lượng và chuyển động với vận tốc rất lớn. => Chùm hạt đó chính là hạt electron
DẠYKÈMQUYNHƠNOFFICIAL
ế
ứ
trọng
rút ra ki
n th
c
t có khối lượng và mang điện tích âm, được gọi là electron (kí hiệu là e).
• Hạt electron có: - Điện tích qe= -1,602.10-19C ( coulomb) - Khối lượng: me = 9,11.10-28 g.
• Người ta chưa phát hiện được điện tích nào nhỏ hơn 1,602.10-19C nên nó được dùng làm điện tích đơn vị, điện tích của electron là -1.
+ Tia X đánh bật electron ra khỏi miếng kim loại và bám vào giọt dầu, lúc này giọt dầu sẽ được tích điện âm. Tấm kim loại mang điện tích dương sẽ hút giọt dầu điện theo lực hút tĩnh điện. Thay đổi cường độ điện trường sẽ làm lực hút này lớn hơn. => có thể kiểm soát tốc độ rơi bằng cách thay đổi cường độ điện trường.
+ Sau khi làm thí nghiệm, nhà vật lý đã nghiên cứu ra chính xác điện tích và khối lượng của electron.
DẠYKÈMQUYNHƠNOFFICIAL tâm về electron
ợ
ý
- GV yêu cầu HS
ả
ậ
ki
15, xem video
+ Tạ
ố
ủ
ọ
thể kiểm soát được khi
cường độ của điện trường. + Nhà vật lý đã nghiên cứu được điều gì sau khi làm thí nghiệm. Video: https://www.youtube.com/watch?v=UFiP Wv03f6g Bước 2: Thực hiện nhiệm vụ:
ế
ậ
ạ
theo g
i
trong sgk
th
o lu
n nhóm đôi đọc
ến thức phần mở rộng trong sgk trang
thí nghiệm trả lời câu hỏi:
i sao t
c độ rơi c
a các gi
t dầu có
thay đổi
=> K
t lu
n: • Trong nguyên tử tồn tại một loại h
- HS theo dõi SGK, chú ý nghe, tiếp nhận kiến thức.
- HS suy nghĩ trả lời câu hỏi. Bước 3: Báo cáo, thảo luận:
- Đại diện nhóm HS giơ tay phát biểu hoặc lên bảng trình bày.
- Một số HS khác nhận xét, bổ sung cho bạn. Bước 4: Kết luận, nhận định:
- GV nhận xét kết quả thảo luận nhóm, phần thuyết trình thái độ làm việc.
- GV tổng quát lưu ý lại kiến thức trọng tâm và yêu cầu HS ghi chép đầy đủ vào vở. Hoạt động 3: Tìm hiểu thí nghiệm của Rutherford
a) Mục tiêu: mô tả được thí nghiệm và xác nhận sự tồn tại của hạt nhân nguyên tử
b) Nội dung: HS hoạt động nhóm, quan sát các hình sgk, video; thảo luận trả lời câu hỏi, đưa ra kết luận.
c) Sản phẩm: Trả lời câu 5 sgk trang 16, kết luận về hạt nhân nguyên tử và đáp án bài luyện tập sgk trang 16.
d) Tổ chức thực hiện:
DẠYKÈMQUYNHƠNOFFICIAL
HĐ CỦA GV VÀ HS SẢN PHẨM DỰ KIẾN
Bước 1: Chuyển giao nhiệm vụ:
- GV chia lớp thành 4 – 5 nhóm giống hoạt động 2, yêu cầu Hs quan sát hình 2.3, 2.4 và quan sát video thí nghiệm, thảo luận trả lời câu hỏi 5 sgk trang 16.
+ GV chiếu video thí nghiệm và thuyết minh (Video minh họa thí nghiệm: https://www.youtube.com/watch?v=IQ1h _gdVlHg )
Thuyết minh: nhà vật lí Rutherford tiến hành bắn phá một chùm hạt alpha lên một lá vàng siêu mỏng và dùng màn huỳnh quang để theo dõi đường đi của chùm hạt. (coi nguyên tử có cấu tạo rỗng).
- GV yêu cầu HS rút ra kết luận về hạt nhân nguyên tử theo gợi ý trong sgk.
III. Sự khám phá hạt nhân nguyên tử
- Trả lời câu 5 sgk trang 16: Kết quả thí nghiệm cho thấy, ban đầu khi rời khỏi nguồn radium, chùm hạt đi theo đường thẳng. Lúc chạm tới lá vàng, phần lớn các hạt alpha đều xuyên thẳng qua, một phần đi lệch hướng ban đầu, có một số ít hạt bật lại phía sau khi chạm lá vàng. Giải thích: Do nguyên tử có cấu tạo rỗng nên hầu hết các hạt alpha đều có thểđi xuyên qua lá vàng. Một nguyên tử bao gồm phần lớn là không gian trống mà các hạt electron chuyển động trong đó, quanh một phân tử mang điện tích dương gọi là hạt nhân nguyên tử.
=> Kết luận:
• Nguyên tử có cấu tạo, gồm hạt nhân ở trung tâm và lớp vỏ là các electron chuyển động xung quanh hạt nhân.
- GV yêu cầu HS hoạt động nhóm đôi hoàn thành bài luyện tập sgk trang 16.
• Nguyên tử trung hòa về điện: Số đơn vị điện tích dương của các hạt nhân bằng số đơn vị điện tích âm của các electron trong nguyên tử.
- Trả lời bài luyện tập sgk trang 16:
DẠYKÈMQUYNHƠNOFFICIAL
Bước 2: Thực hiện nhiệm vụ:
- HS theo dõi SGK, chú ý nghe, tiếp nhận kiến thức. - HS suy nghĩ trả lời câu hỏi.
+ Điện tích e: -8
Bước 3: Báo cáo, thảo luận: - Đại diện nhóm HS giơ tay phát biểu hoặc lên bảng trình bày. - Một số HS khác nhận xét, bổ sung cho bạn.
Bước 4: Kết luận, nhận định: - GV nhận xét kết quả thảo luận nhóm, phần thuyết trình thái độ làm việc. - GV tổng quát lưu ý lại kiến thức trọng tâm và yêu cầu HS ghi chép đầy đủ vào vở.
+ Điện tích hạt nhân: +8 Hoạt động 4: Tìm hiểu sự xuất hiện proton và neutron a) Mục tiêu: mô tả được thí nghiệm và xác nhận sự tồn tại của hạt proton và hạt neutron b) Nội dung: HS nêu thí nghiệm tìm thấy và đặc điểm của hạt proton và neutron, đáp án bài luyện tập sgk trang 17. c) Sản phẩm: mô tả thí nghiệm, kết luận đặc điểm cuat proton và neutron, đáp án bài luyện tập sgk trang 17.
DẠYKÈMQUYNHƠNOFFICIAL
d) Tổ chức thực hiện:
HĐ CỦA GV VÀ HS
Bước 1: Chuyển giao nhiệm vụ:
- GV yêu cầu HS đọc sgk, nêu thí nghiệm tìm thấy proton và neutron: - GV yêu cầu HS đưa ra kết luận về cấu tạo của hạt nhân nguyên tử là loại hạt gì, điện tích và khối lượng của chúng. - GV yêu cầu HS làm việc cá nhân trả lời bài luyện tập sgk trang 17. Bước 2: Thực hiện nhiệm vụ: - HS theo dõi SGK, chú ý nghe, tiếp nhận kiến thức.
SẢN PHẨM DỰ KIẾN
III. Sự khám phá hạt nhân nguyên tử
- Năm 1919, khi bắn phá hạt nhân nguyên tủ nitrogen bằng các hạt alpha, Rutherford đã nhận thấy sự xuất hiện hạt nhân nguyên tử oxygen và một loại hạt mang một đơn vị điện tích dương (e0 hay +1), đó là proton - Năm 1932, khi dùng các hạt alpha để bắn phá hạt nhân nguyên tử beryllium, Chadwick đã nhận thấy có sự xuất hiện của một loại hạt có khối lượng xấp xỉ hạt proton nhưng lại không mang điện. Ông gọi chúng là neutron (kí hiệu là n) => Kết luận: Hạt nhân nguyên tử gồm hai loại hạt là protron và neutron. Proton mang điện tích dương (+1) và neutron không mang điện. Proton và neutron có khối lượng gần bằng nhau. - Trả lời bài luyện tập sgk trang 17: + Số proton: 11. + Số electron: 11.

DẠYKÈMQUYNHƠNOFFICIAL
- HS suy nghĩ trả lời câu hỏi.
Bước 3: Báo cáo, thảo luận: -HS giơ tay phát biểu hoặc lên bảng trình bày. - Một số HS khác nhận xét, bổ sung cho bạn. Bước 4: Kết luận, nhận định: - GV nhận xét kết quả. - GV tổng quát lưu ý lại kiến thức trọng tâm và yêu cầu HS ghi chép đầy đủ vào vở. Hoạt động 5: So sánh kích thước nguyên tử và hạt nhân nguyên tử. a) Mục tiêu: So sánh được kích thước của hạt nhân và nguyên tử. b) Nội dung: HS quan sát trực tiếp Hình 2.6 ở sgk và thảo luận nội dung câu 7 c) Sản phẩm: đáp án câu 7 sgk trang 17, kết luận về kích thước của hạt nhân, nguyên tử; đáp án phiếu học tập. d) Tổ
DẠYKÈMQUYNHƠNOFFICIAL
chức thực hiện: HĐ CỦA GV VÀ HS SẢN PHẨM DỰ KIẾN Bước 1: Chuyển giao nhiệm vụ: - GV yêu cầu HS thảo luận nhóm đôi
sát hình 2.6, trả lời câu 7 sgk
17: V. Kích thước và khối lượng nguyên tử -
ả lời
7
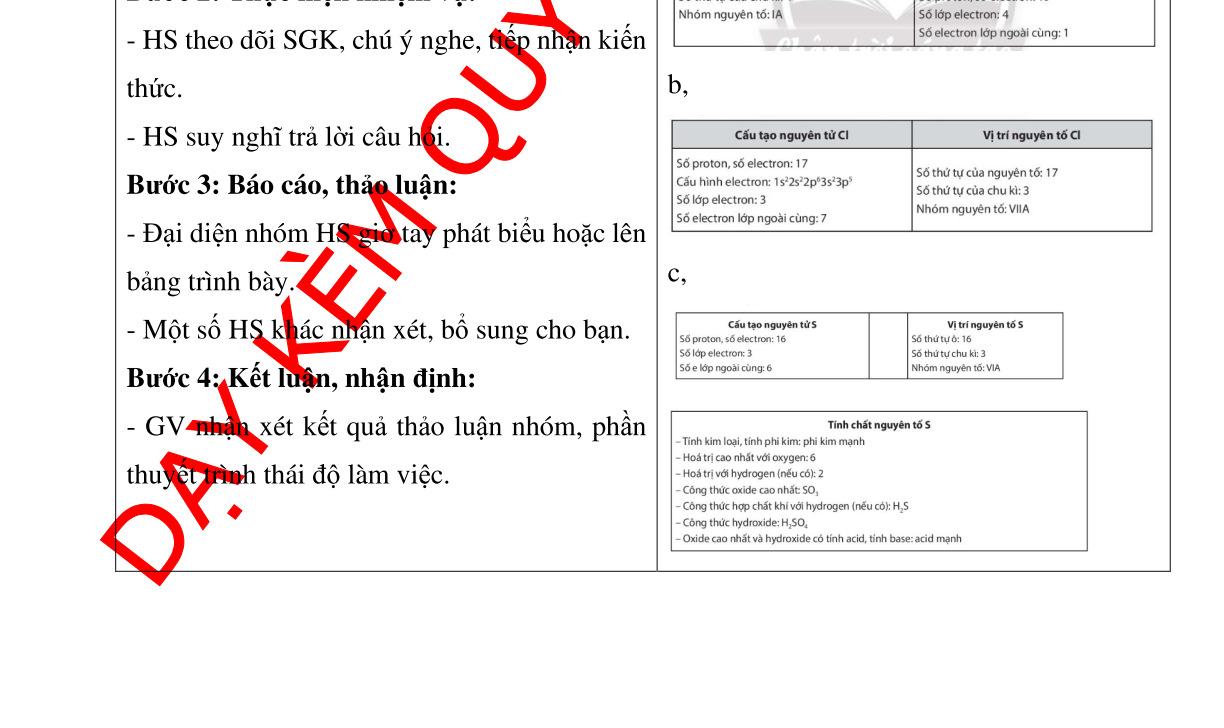
trang
:
quan
trang
Tr
câu
sgk
17
=> GV yêu cầu HS rút ra kết luận về kích thước của hạt nhân nguyên tử theo gợi ý SGK. - GV yêu cầu HS thảo luận nhóm 4 trả lời phiếu học tập: Phiếu học tập
Câu 1: Nếu hình hạt nhân là khối cầu có đường kính là 10 cm thì đường kính nguyên tử có độ dài là bao nhiêu?
Câu 2: Như ta đã biết, nguyên tử có kích thước vô cùng nhỏ bé, nếu sử dụng các đơn vị m hay mm không hợp lý. Em hãy đề xuất một vài đơn vị đo chiều dài phù hợp để biểu thị kích thước nguyên tử.
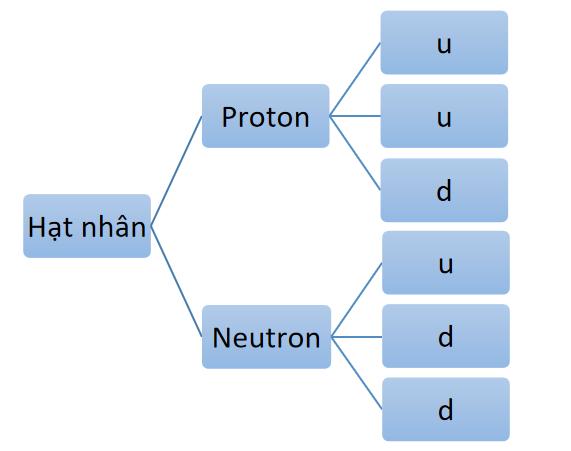
Câu 3: Hãy đọc phần mở rộng sgk trang 18 và hoàn thành sơ đồ cấu tạo của hạt
Đườ í ℎ ê ử Đườ í ℎℎạ ℎâ = 10 10 =10
Đường kính của nguyên tử gấp 10 000 lần đường kính hạt nhân. Do đó, lích thước của nguyên tử lớn hơn rất nhiều lần kích thước của hạt nhân. => Kết luận: Nếu em nguyên tử như một quả cầu, trong đó các electron chuyển động rất nhanh xung quanh hạt nhân thì nguyên tử thì nguyên tử đó có đường kính khoảng 10-10 m và đường kính của hạt nhân khoảng 10-14 m. Như vậy, đường kính của nguyên tử lớn hơn đường kính của hạt nhân khoảng 10 000 lần. - Đáp án phiếu học tập Câu 1: Nếu hạt nhân có đường kính là 10cm thì đường kính nguyên tử có độ dài 10.10000= 1.000.000 cm tương đương với 1km. Câu 2: Sử dụng đơn vị nanometer (nm) hay angstrom (Å) thường được dùng để biểu thị kích thước nguyên tử.
1mn=10-9m; 1Å = 10-10 m ; 1nm= 10Å

DẠYKÈMQUYNHƠNOFFICIAL
nhân sau: Em hãy dự đoán, liệu các hạt quark có được cấu tạo bởi các hạt nhỏ hơn không? Bước 2: Thực hiện nhiệm vụ:
- HS theo dõi SGK, chú ý nghe, tiếp nhận kiến thức. - HS thảo luận nhóm suy nghĩ trả lời câu hỏi.
Bước 3: Báo cáo, thảo luận: - Đại diện nhóm HS giơ tay phát biểu hoặc lên bảng trình bày.
Một số HS khác nhận xét, b
Câu 3: Sơ đồ cấu tạo hạt nhân
- Dự đoán: hạt quark vẫn chưa phải là loại hạt nhỏ bé nhất, chúng vẫn được cấu tạo bởi các loại hạt nhỏ hơn nữa.
DẠYKÈMQUYNHƠNOFFICIAL
-
ổ sung cho bạn. Bước 4: Kết luận, nhận định: - GV nhận xét kết quả thảo luận nhóm,
phần thuyết trình thái độ làm việc. - GV tổng quát lưu ý lại kiến thức trọng tâm và yêu cầu HS ghi chép đầy đủ vào vở. Hoạt động 6: Tìm hiểu sự xuất hiện proton và neutron
a) Mục tiêu: HS so sánh được khối lượng của hạt nhân và khối lượng của electron. Qua đó nhân định được thành phần nào quyết định khối lượng của nguyên tử.
b) Nội dung: HS hoạt động nhóm yêu cầu các nhóm quan sát Bảng 2.1 và thảo luận câu 8, bài luyện tập sgk trang 18.
c) Sản phẩm: Đáp án câu 8, bài luyện tập sgk trang 18 và kết luận về khối lượng của nguyên tử, hạt nhân, electron.
d) Tổ chức thực hiện:
HĐ CỦA GV VÀ HS SẢN PHẨM DỰ KIẾN
B
DẠYKÈMQUYNHƠNOFFICIAL
ước 1: Chuyển giao nhiệm vụ: - GV chi lớp thành 4 – 5 nhóm như hoạt động 2 và yêu cầu các nhóm quan sát Bảng 2.1, thảo luận câu 8 sgk trang 18
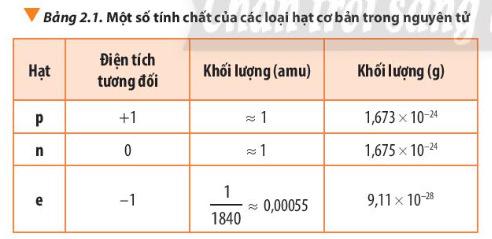
ước và khối lượng nguyên tử - Trả lời câu 8 sgk trang 18. ℎố ượ ℎố ượ = 1,67.10 9,11.10 ≈ 1840 Nhận xét: Khối lượng của proton lớn hơn rất nhiều so với khối lượng electron. Do đó khối lượng của hạt nhân lại càng lớn hơn gấp nhiều lần khối lượng của lớp vỏ nguyên tử.
V. Kích th
- GV yêu cầu HS rút ra kết luận khối lượng của nguyên tử do thành phần nào quyết định. - GV yêu cầu HS làm bài luyện tập sgk trang 18. Bước 2: Thực hiện nhiệm vụ: - HS theo dõi SGK, chú ý nghe, tiếp nhận kiến thức. - HS thảo luận nhóm suy nghĩ trả lời câu hỏi. Bước 3: Báo cáo, thảo luận: - Đại diện nhóm HS giơ tay phát biểu hoặc lên bảng trình bày. - Một số HS khác nhận xét, bổ sung cho bạn. Bước 4: Kết luận, nhận định: - GV nhận xét kết quả thảo luận nhóm, phần thuyế
DẠYKÈMQUYNHƠNOFFICIAL
t trình thái độ làm việc.
ết luận: Khối lượng
ủ
ử
ần
ủ
=> K
c
a nguyên t
g
bằng khối lượng hạt nhân do khối lượng c
a các electron không đáng kể so với khối lượng của proton và neutron. - Trả lời bài luyện tập sgk trang 18: mO = 8. 1,673. 10-24 +8. 1,675.10-24 + 8.10-28 = 2,679.10-23 (g). mO= 8.1 + 8.1 + 8.1/1840= 16,0043 (amu).
- GV tổng quát lưu ý lại kiến thức trọng tâm và yêu cầu HS ghi chép đầy đủ vào vở.
C. HOẠT ĐỘNG LUYỆN TẬP
a) Mục tiêu: HS củng cố lại kiến thức về các thành phần cấu tạo nên nguyên tử.
b) Nội dung: HS vận dụng các kiến thức đã học giải quyết các bài tập về thí nghiệm tìm ra các thành phần cấu tạo nguyên tử; bài tập về các loại hạt cấu tạo nên nguyên tử.
c) Sản phẩm học tập: Câu trả lời của HS cho các bài tập luyện tập và bài tập trong sgk.
d) Tổ chức thực hiện:
Bước 1: Chuyển giao nhiệm vụ:
- GV tổng hợp các kiến thức cần ghi nhớ cho HS.
- GV cho HS hoạt động nhóm đôi làm bài bài tập 1, 2, 3, 4 sgk trang 19
Bước 2: Thực hiện nhiệm vụ:
- HS suy nghĩ trả lời.
- GV điều hành, quan sát, hỗ trợ.
Bước 3: Báo cáo, thảo luận:
- HS đại diện nhóm giơ tay phát biểu trả lời hoặc lên bảng trình bày.
Bước 4: Kết luận, nhận định:
DẠYKÈMQUYNHƠNOFFICIAL
- GV chữa bài, chốt đáp án. - GV nhận xét thái độ làm việc, phương án trả lời của các học sinh, ghi nhận và tuyên dương. Đáp án: Bài tập 1: Kết quả thí nghiệm cho thấy hầu hết các loại hạt alpha đều xuyên thẳng qua lá vàng, nhưng có một số ít hạt đi lẹch hướng ban đầu và một số ít hạt bị bật lại phía sau khi gặp lá vàng. Như vậy, nguyên tử phải chứa phần mang điện dương có khối lượng lớn để có thể làm các hạt alpha bị lệch khi va chạm. Nhưng phần mang điện tích dương này lại phải có kích thước nguyên tử để phần lớn hạt alpha có thể xuyên qua khoảng cách giữa các phần mang điện tích dương của các nguyên tử vàng mà không bị lệch hướng. Điều đó chứng tỏ nguyên tử có cấu tạo rỗng.
Bài tập 2: Đáp án B Bài tập 3: a) proton, b) neutron, c) electron. Bài tập 4:
DẠYKÈMQUYNHƠNOFFICIAL
a)
ả
electron b)
D. HOẠT ĐỘNG VẬN DỤNG a) Mục tiêu: Học sinh thực hiện làm bài tập vận dụng để nắm vững kiến thức. b) Nội dung: HS làm việc nhóm hoàn thành bài vận dụng sgk trang 19. c) Sản phẩm: Sơ đồ tư duy mô tả cấu tạo nguyên tử và hệ thống hóa kiến thức bài học. d) Tổ chức thực hiện:
Kho
ng 1,1.10-27
0,0005486953 (g)
Bước 1 : Chuyển giao nhiệm vụ
- GV yêu cầu HS hoạt động nhóm đôi làm bài tập vận dụng sgk trang 19.
Bước 2: Thực hiện nhiệm vụ
- HS làm việc nhóm đôi thực hiện nhiệm vụ.
- GV điều hành, quan sát, hỗ trợ.
Bước 3 : Báo cáo, thảo luận
- HS xung phong phát biểu. Các HS khác nhận xét.
Đáp án :
Bước 4 : Kết luận, nhận định
DẠYKÈMQUYNHƠNOFFICIAL
- GV nhận xét nội dung và hình thức sơ đồ tư duy của từng nhóm.
- GV nhận xét thái độ làm việc, sản phẩm, phương án trả lời của các học sinh, ghi nhận và tuyên dương.
* HƯỚNG DẪN VỀ NHÀ
- Ghi nhớ kiến thức trong bài.
- Hoàn thành bài tập trong SBT.
- Chuẩn bị bài 3 “Nguyên tố hóa học”.
Ngày soạn: .../.../...
Ngày dạy: .../.../... BÀI 3. NGUYÊN TỐ HÓA HỌC (3 tiết)
I. MỤC TIÊU:
1. Kiến thức: Học xong bài này, HS đạt các yêu cầu sau: • Trình bày khái niệm nguyên tổ hóa học hộ hiệu nguyên tử và kí hiệu nguyên tử
DẠYKÈMQUYNHƠNOFFICIAL
ă
• Năng lực tự chủ và
ự
ọ
ng. tích cực tìm hiểu về nguyên tổ hóa học. “ • Năng lực giao tiếp và hợp tác: Sử đụng ngôn ngữ khoa học để điển đạt khái niệm về nguyên tố hóa học, số hiệu nguyên tử và kí hiệu nguyên tử, đồng vị,
• Phát biểu được khái niệm đồng vị, nguyên tử khối. 2. Năng lực N
ng lực chung:
t
h
c: Chủ độ
nguyên tử khối; hoạt động nhóm một cách hiệu quả đúng theo yêu câu của GV, đảm bảo các thành viên trong nhóm đều được tham gia và trình bày và báo cáo.
• Năng lực giải quyết vẫn đề và sáng tạo: Thảo luận với các thành viên trong nhóm nhằm giải quyết các vấn đề trong bài học để hoàn thành nhiệm vụ học tập.
Năng lực riêng:
• Năng lực nhận thức hóa học: Nêu được khái niệm về nguyên tổ hóa học, số hiệu nguyên tử và kí hiệu nguyên tử; khái niệm đồng vị, nguyên tử khối.
• Năng lực tìm hiểu thế giới tự nhiên dưới góc độ hóa học: Tìm hiểu ứng dụng của một số đồng vị của các nguyên tố trong tự nhiên.
• Năng lực tính toán: Vận đụng kiến thức kĩ năng đã học tính được nguyên tử khối trung bình (theo amu) đựa vào khối lượng nguyên tử và phân trăm số nguyên tử của các đồng vị theo phô khối lượng được cung cấp.
3. Phẩm chất
• Tham gia tích cực hoạt động nhóm phù hợp với khả năng của bản thân. • Cẩn thận trung thực và thực hiện an toàn trong quá trình làm thực hành. • Có niềm say mê. hứng thú với việc khám phá và học tậ
DẠYKÈMQUYNHƠNOFFICIAL
THIẾT BỊ DẠY HỌC VÀ HỌC LIỆU 1. Đối với GV: SGK, Tài liệu giảng dạy, giáo án PPT. 2. Đối với HS: SGK, vở ghi, giấy nháp, đồ dùng
ọc tập (bút, thước...), bảng nhóm, bút viết bảng nhóm.
p hóa học. II.
h

DẠYKÈMQUYNHƠNOFFICIAL
TIẾN
DẠ
ỌC A. HOẠT ĐỘNG KHỞI ĐỘNG (MỞ ĐẦU) a) Mục tiêu: Sử dụng những câu hỏi mở đầu để giúp HS tiếp cận đến vấn đề của bài học. b) Nội dung: GV yêu cầu HS trả lời câu hỏi mở đầu liên quan đến bài học và dẫn dắt vào bài… c) Sản phẩm: HS trả lời câu hỏi mở đầu. d) Tổ chức thực hiện: Bước 1: Chuyển giao nhiệm vụ: Kim cương và than chì có vẻ ngoài khác nhau. Tuy nhiên chúng đề được tạo thành từ một nguyên tố hóa học là nguyên tố carbon (C). Tại sao lại có sự khác biệt lớn như vậy? Bước 2: Thực hiện nhiệm vụ - HS quan sát và chú ý lắng yêu cầu và đưa ra đáp án. Bước 3: Báo cáo, thảo luận: - Các HS xung phong phát biểu trả lời. Bước 4: Kết luận, nhận xét:
III.
TRÌNH
Y H
- GV nhận xét, đánh giá và dẫn dắt vào bài: Kim cương và than chì đều được cấu tạo từ nguyên tố C tuy nhiên cấu trúc tinh thể kim cương khác với than chì nên vẻ ngoài lẫn tính chất của chúng khác nhau. Nếu chưa từng tìm hiểu về nguyên tố hóa học thì thật khó khăn để trả lời những câu hỏi như câu hỏi trên. Vì vậy ta cần phải biết nguyên tố hóa học là gì? Một nguyên tố hóa học có những đặc trưng cơ bản nào? Để trả lời cho những câu hỏi này ta cùng nhau đi tìm hiều bài: Bài 3. Nguyên tố hóa học.
B. HÌNH THÀNH KIẾN THỨC MỚI
Hoạt động 1: Tìm hiểu về điện tích hạt nhân.
a) Mục tiêu: Từ việc quan sát Hình 3.1 trong sgk, GV yêu cầu HS đếm số lượng từng loại hạt trong nguyên tử nitrogen. Qua đó sẽ xác định được điện tích hạt nhân nguyên tử.

b) Nội dung: HS thảo luận nhóm 4 trả lời câu 1 và 2 bài luyện tập sgk trang 20 và đưa ra kết luận dưới sự hướng dẫn của GV
c) Sản phẩm: Kết luận về điện tích hạt nhân, đáp án câu 1,2, bài luyện tập sgk trang 20. d) Tổ chức thực hiện:
DẠYKÈMQUYNHƠNOFFICIAL
HĐ CỦA GV VÀ HS
Bước 1: Chuyển giao nhiệm vụ:
- GV yêu cầu HS thảo luận nhóm 4 quan sát hình 3.1 trả lời câu 1 và 2 sgk trang 20
SẢN PHẨM DỰ KIẾN
I. Hạt nhân nguyên tử
- GV yêu cầu HS kết luận về mối liên hệ giữa số đơn vị điện tích hạt nhân, số hạt proton, số hạt electron (biết bài trước đã học nguyên tử là hạt trung hòa về điện). Điện tích hạt nhân có dấu “-“hay “+”?
- GV yêu cầu HS làm việc cá nhân trả lời bài luyện tập sgk trang 20.
- Mô hình nguyên tử Sodium (Na):
- Trả lời câu 1 sgk trang 20: p= 7 e= 7 n= 7 - Trả lời câu 2 sgk trang 20: Điện tích hạt nhân của nguyên tử nitrogen là +7. => Kết luận:
• Số đơn vị điện tích hạt nhân (Z) = số proton (P) = số electron (E)
• Điện tích hạt nhân = +Z - Trả lời bài luyện tập sgk trang 20: + Số đơn vị điện tích hạt nhân của sodium: 11 + Số electron của sodium: 11

DẠYKÈMQUYNHƠNOFFICIAL
Bước 2: Thực hiện nhiệm vụ:
- HS theo dõi SGK, chú ý nghe, tiếp nhận kiến thức.
- HS thảo luận nhóm hoặc cá nhân suy nghĩ trả lời câu hỏi.
Bước 3: Báo cáo, thảo luận: - Đại diện nhóm HS hoặc HS giơ tay phát biểu hoặc lên bảng trình bày.
- Một số HS khác nhận xét, bổ sung cho bạn.
Bước 4: Kết luận, nhận định: - GV nhận xét kết quả thảo luận nhóm, thái độ làm việc. - GV tổng quát lưu ý lại kiến thức trọng tâm và yêu cầu HS ghi chép đầy đủ vào vở.
Hoạt động 2: Tìm hiểu về số khối hạt nhân.
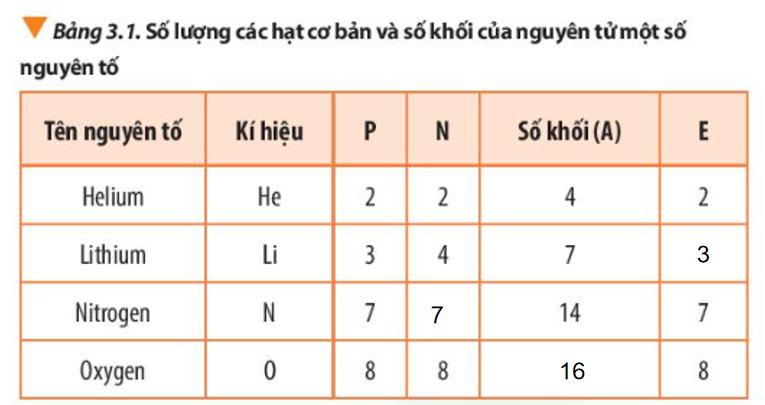
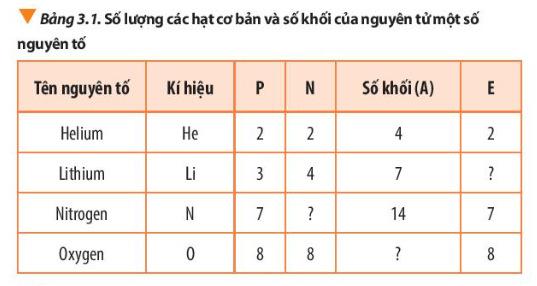
a) Mục tiêu: Từ việc quan sát Bảng 3.1 trong sgk, HS tìm ra mối liên hệ giữa số khối với proton và số neutron.
b) Nội dung: HS hoạt động nhóm quan sát bảng 3.1 thảo luận trả lời câu 3 sgk trang 21. c) Sản phẩm: Cách tính và kí hiệu số khối, đáp án câu 3 trang 21. d) Tổ chức thực hiện:
DẠYKÈMQUYNHƠNOFFICIAL
H
Đ C
Ủ
A
GV VÀ HS SẢN PHẨM DỰ KIẾN
Bước 1: Chuyển giao nhiệm vụ:
- GV yêu cầu HS đọc sgk, nêu cách tính và kí hiệu số khối. - GV yêu cầu HS thảo luận nhóm đôi hoàn thành câu 3 sgk trang 21 và nêu công thức tính số khối.
I. Hạt nhân nguyên tử
- Số khối bằng tổng số hạt proton và số hạt neutron trong hạt nhân, kí hiệu là A
- Trả lời câu 3 sgk trang 21:
Bước 2: Thực hiện nhiệm vụ:
- HS theo dõi SGK, chú ý nghe, tiếp nhận kiến thức. - HS suy nghĩ trả lời câu hỏi. - HS thảo luận nhóm hoặc cá nhân suy nghĩ trả lời câu hỏi.
Bước 3: Báo cáo, thảo luận: - Đại diện nhóm HS hoặc HS giơ tay phát biểu hoặc lên bảng trình bày.
- Một số HS khác nhận xét, bổ sung cho bạn.
* Công thức tính số khối : Số khối (A) = số proton (P) + số neutron (N)
DẠYKÈMQUYNHƠNOFFICIAL
Bước 4: Kết luận, nhận định: - GV nhận xét kết quả. - GV tổng quát lưu ý lại kiến thức trọng tâm và yêu cầu HS ghi chép đầy đủ vào vở. Hoạt động 3. Tìm hiểu về số hiệu nguyên tử Hoạt động 3: Tìm hiếu về sô hiệu nguyên tử.
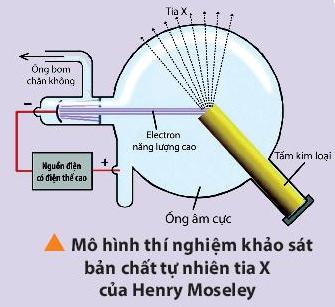
a) Mục tiêu: Từ dữ kiện cung cấp trong sgk, GV hướng dẫn HS mô tả thí nghiệm của Henry Moseley khảo sát bản chấy tự nhiên của tia X. Qua đó rút ra được kết luận về số hiệu nguyên tử đặc trung cho từng nguyên tổ hóa học.
b) Nội đung: GV yêu câu HS nghiên cứu thông tin trong sgk. hướng dẫn HS thảo luận câu 4 sgk trang 21, kêt luận vê số hiệu nguyên tử.
c) Sản phẩm: Mô tả và nhận xét thí nghiệm khảo sát bản chất tự nhiên của tia X khái niêm của số hiệu nguyên tử, đáp án câu 4 sgk trang 21.
d) Tổ chức thực hiện:
HĐ CỦA GV VÀ HS
PH
DẠYKÈMQUYNHƠNOFFICIAL
ệ
SẢN
ẨM DỰ KIẾN Bước 1: Chuyển giao nhiệm vụ: - GV yêu cầu HS đọc phần mở rộng, dựa vào mô hình thí nghiệm khảo sát bản chất tự nhiên của tia X, hãy mô tả thí nghiệm và nhận mối quan h
giữa số proton với các kim loại.
II. Nguyên tố hóa học - Nhà vật lí sử dụng một chùm tia electron có năng lượng cao để bắn vào các tấm kim loại khác nhau làm anode và thu được tia X. Ông phát hiện rằng bước sóng của tia X luôn không đổi với một kim loại nhất định và thay đổi khi
- GV đặt một số câu hỏi cho HS trả lời: a, Làm thế nào để phân biệt được từng công dân của nước Việt Nam b, Làm thế nào để phân biệt được HS trong từng lớp, từng trường? c, Làm thế nào để phân biệt được các hộ chiếu đi nước ngoài? d, Làm thế nào để phân biệt được các xe máy? e, Vậy đại lượng nào đặc trưng cho các nguyên tố, dùng để phân biệt các nguyên tố hóa học với nhau? - GV yêu cầu HS đọc sgk và trả lời câu hỏi: + Số hiệu nguyên tử quy ước bằng gì? Kí hiệu là gì ? + Dựa vào số hiệu nguyên tử ta có thể biết được số lượng các loại hạt nào?
thay anode bằng những kim loại khác. Điều này chứng tỏ rằng mỗi kim loại khác nhau sẽ có số proton khác nhau. - Đáp án a, Dùng số chứng minh thư nhân dân hoặc thẻ căn cước công dân. b, Dùng số thẻ học sinh c, Dùng số hộ chiếu d, dùng biển số xe e, Số hiệu nguyên tử (số proton)
+ Số hiệu nguyên tử được quy ước bằng số đơn vị điện tích hạt nhân. Kí hiệu là Z.
DẠYKÈMQUYNHƠNOFFICIAL
=> Hãy nêu kết luận khái niệm số hiệu nguyên tử.
- GV yêu cầu HS hoạt động cá nhân trả lời câu 4 sgk trang 21.
Bước 2: Thực hiện nhiệm vụ:
- HS theo dõi SGK, chú ý nghe, tiếp nhận kiến thức.
- HS suy nghĩ trả lời câu hỏi.
Bước 3: Báo cáo, thảo luận:
- HS giơ tay phát biểu hoặc lên bảng trình bày.
- Một số HS khác nhận xét, bổ sung cho bạn.
Bước 4: Kết luận, nhận định: - GV nhận xét kết quả, thảo luận nhóm, phần thuyết trình, thái độ làm việc.
- GV tổng quát lưu ý lại kiến thức trọng tâm và yêu cầu HS ghi chép đầy đủ vào vở.
+ Dựa vào số hiệu nguyên tử ta có thể biết: số proton trong hạt nhân nguyên tử và số electron trong nguyên tử. => Kết luận: • Số đơn vị điện tích hạt nhân của một nguyên tố được gọi là số hiệu nguyên tử (Z) của một nguyên tố đó. • Mỗi nguyên tố hóa học có một số hiệu nguyên tử - Trả lời câu 4 sgk trang 21: Điện tích hạt nhân: +6
DẠYKÈMQUYNHƠNOFFICIAL
ể
hóa học a) Mục tiêu: HS xác định số lượng từng
ại hạ
ử
ó
được điểm giống và
giữ
Hoạt động 4: Tìm hi
u khái niệm nguyên tố
lo
t trong các nguyên t
trong hình. Từ đ
so sánh
khác nhau
a các nguyên tử này để hiểu được khái niêm nguyên tế hóa học. b) Nội dung: GV chia lớp thành các nhóm 4 yêu câu các nhóm quan sát Hình 3.3 trong sgk và trả lời câu sgk trang 22.
c) Sản phẩm: Đáp án. nhân xét câu 5 sgk trang 22 và kết luận vẻ khái niêm nguyên tố hóa học. d) Tổ chức thực hiện:
HĐ CỦA GV VÀ HS SẢN PHẨM DỰ KIẾN
Bước 1: Chuyển giao nhiệm vụ: - GV chia lớp thành 4, 5 nhóm và yêu cầu các nhóm quan sát Hình 3.3 trong sgk và thảo luận câu 5 sgk trang 22. + Nôi dung thảo luận trình bày vào bảng sau: - GV yêu cầu HS nhận xét điểm giống và khác nhau về số lượng các hạt proton 2 nguyên tử của nguyên tố hydrogen. => GV yêu cầu HS đưa ra kết luận khái niệm nguyên tố hóa học. Bướ

DẠYKÈMQUYNHƠNOFFICIAL
c 2: Thực hiện nhiệm vụ: Khái niệ
ố
ọ
-
=> Nhận
ử
ủ
ố Hydrogen đều
=> Kết luận:
tố
ọc tậ
ợ
những
tử
ệ
m nguyên t
hóa h
c
Đáp án câu 5 sgk trang 22:
xét: 3 nguyên t
c
a nguyên t
có 1 proton.
Nguyên
hóa h
p h
p
nguyên
có cùng đi
n tích hạt nhân.
- HS theo dõi SGK, chú ý nghe, tiếp nhận kiến thức.
- HS suy nghĩ trả lời câu hỏi.
Bước 3: Báo cáo, thảo luận:
- Đại diện nhóm HS hoặc HS giơ tay phát biểu hoặc lên bảng trình bày.
- Một số HS khác nhận xét, bổ sung cho bạn.
Bước 4: Kết luận, nhận định:
- GV nhận xét kết quả thảo luận nhóm, phần thuyết trình thái độ làm việc.
- GV tổng quát lưu ý lại kiến thức trọng tâm và yêu cầu HS ghi chép đầy đủ vào vở. Hoạt động 5: Tìm hiểu kí hiệu nguyên tử
a) Mục tiêu: HS quan sát ví dụ để nêu được cách viết kí hiệu nguyên tử của một số nguyên tố.
b) Nội đung: GV đưa ra một số ví dụ cho HS quan sát. nhận xét và kết luận về cách viết kí hiệu nguyên tử. HS củng cố kiến thức và thực hành viết kí hiệu nguyên tử thông qua câu 6. bài luyên tập sgk trang 22. c) Sản phẩm: Cách viết kí hiệu nguyên tử. đáp án câu 6. bài luyện tập sgk trang 22. d) Tổ chức thực hiện: HOẠT ĐỘNG CỦA GV VÀ HS
DẠYKÈMQUYNHƠNOFFICIAL
SẢN PHẨM DỰ KIẾN
Bước 1: Chuyển giao nhiệm vụ:
- GV đưa ra một vài ví dụ về kí hiệu nguyên tử, yếu cầu HS nhận xét vị trí, cách viết của kí hiệu nguyên tố hóa học, số khối và số hiệu nguyên tử: Nguyên tử C: Nguyên tử Na: - GV yêu cầu HS kết luận kiến thức trọng tâm của bài: + Nêu ý nghĩa của kí hiệu nguyên tử + Trình bày cách viết tổng quát của kí hiệu nguyên tử:- GV yêu cầu HS hoạt động nhóm đôi trả lời câu 6 sgk trang 22. - GV yêu cầu HS hoạt động nhóm đôi hoàn thành bài luyện tập sgk trang 22 Bước 2: Thực hiện nhiệm vụ:
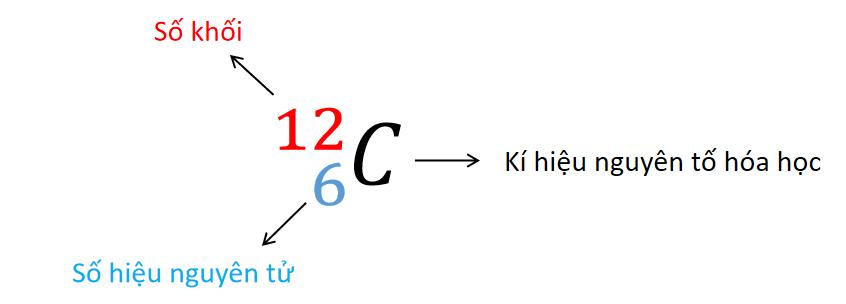
Kí hiệu nguyên tử
- Các chỉ số đặc trưng như số khối và số hiệu nguyên tử được viết bên trái kí hiệu nguyên tố hóa học. Số khối A được viết phía trên và số hiệu nguyên tử Z ở phía dưới.
=> Kết luận:

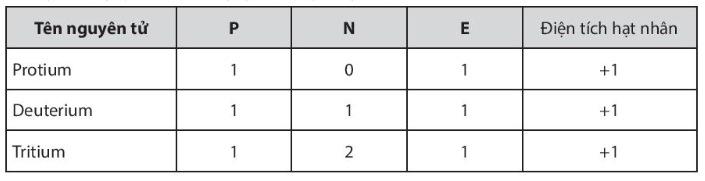
• Kí hiệu nguyên tử dùng để biểu thị nguyên tử của một số nguyên tố hóa học. • Cách viết tổng quát: - Trả lời câu 6 sgk trang 22: Kí hiệu nguyên tử cho biết: kí kiệu nguyên tố hóa học, số khối nguyên tử và số nguyên tử. Ngoài ra ta còn biết được số electron trong nguyên tử và tính được số neutron là: N = A – Z - Trả lời bài luyện tập sgk trang 22: a, Kí hiệu nguyên tử các nguyên tố trong hình 3.2 là: + Protium:
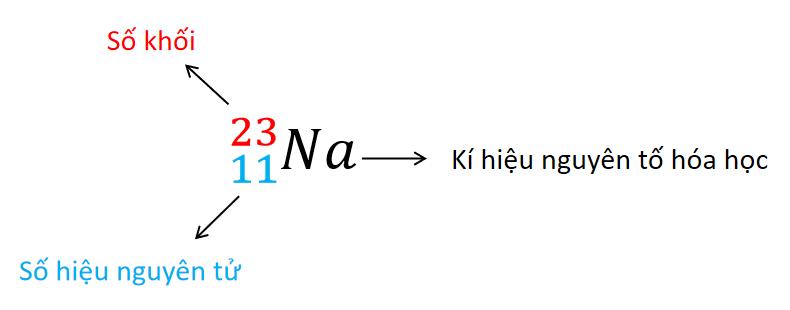
DẠYKÈMQUYNHƠNOFFICIAL
- HS theo dõi SGK, chú ý nghe, tiếp nhận kiến thức.
- HS suy nghĩ trả lời câu hỏi. Bước 3: Báo cáo, thảo luận: - Đại diện nhóm HS hoặc HS giơ tay phát biểu hoặc lên bảng trình bày. - Một số HS khác nhận xét, bổ sung cho bạn. Bước 4: Kết luận, nhận định:
- GV nhận xét kết quả thảo luận nhóm, phần thuyết trình thái độ làm việc. - GV tổng quát lưu ý lại kiến thức trọng tâm và yêu cầu HS ghi chép đầy đủ vào vở.
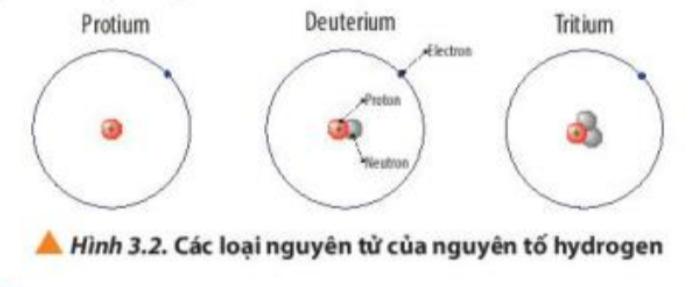
+ Deterium: + Tritium: b, Kí hiệu nguyên tử oxygen: Hoạt động 6: Tìm hiểu khái niệm đồng vị a) Mục tiêu: HS nêu được khái niệm đồng vị b) Nội dung: HS quan sát hình 3.2 trong sgk thảo luận trả lời câu 7 sgk trang 22 đưa ra kết luận khái niệm đồng vị, thực hành viết kí hiệu nguyên tử các đồng vị
DẠYKÈMQUYNHƠNOFFICIAL
d)
ứ
ự
HOẠT ĐỘ
S
Ế
thông qua bài luyện tập sgk trang 23. c) sản phẩm: Đáp án câu 7, bài luyện tập trang 22, kết luận khái niệm đồng vị.
Tổ ch
c th
c hiện:
NG CỦA GV VÀ HS
ẢN PHẨM DỰ KI
N
Bước 1: Chuyển giao nhiệm vụ:
- GV dẫn dắt vào hoạt động: Một của hang trái cây bán rất nhiều loại táo khác nhau. Những quả táo khác nhau có thể khác nhau về màu sắc, kích cỡ, mùi vị. Tương tự vậy một nguyên tố hóa học cũng có nhiều loại nguyên tử, gọi là các đồng vị. Vậy đồng vị là gì?
- GV chia lớp thành 4 - 5 nhóm như hoạt động 4, quan sát hình 3.2 , thảo luận và trả lời câu 7 sgk trang 22. - GV yêu cầu HS nêu khái niệm đồng vị: Protium, deuterium và tritium đều là đồng vị của hydrogen. Vậy đồng vị là gì ?
- GV yêu cầu HS hoạt động cá nhân hoàn thành bài luyện tập sgk trang 23. Bước 2: Thực hiện nhiệm vụ: - HS theo dõi SGK, chú ý nghe, tiếp nhận kiến thức. - HS suy nghĩ trả lời câu hỏi.
3. Đồng vị
- Trả lời câu 7 sgk trang 22.
3 nguyên tử của nguyên tố hydrogen đều có 1 proton và có số khối khác nhau nên số neutron khác nhau.

=> Kết luận: Các đồng vị của một nguyên tố là những nguyên tử có cùng số proton (P), cùng số hiệu nguyên tử (Z), nhưng khác nhưng khác nhau về số neutron (N). Do đó số khối (A) của chúng khác nhau.
- Trả lời bài luyện tập sgk trang 22: Kí hiệu nguyên tử của 2 đồng vị bền với dô khối 12 và 13 lần lượt là:
DẠYKÈMQUYNHƠNOFFICIAL
Bước 3: Báo cáo, thảo luận: - Đại diện nhóm HS hoặc HS giơ tay phát biểu hoặc lên bảng trình bày. - Một số HS khác nhận xét, bổ sung cho bạn.
Bước 4: Kết luận, nhận định: - GV nhận xét kết quả thảo luận nhóm, phần thuyết trình, thái độ làm việc. - GV tổng quát lưu ý lại kiến thức trọng tâm và yêu cầu HS ghi chép đầy đủ vào vở.
Hoạt động 7: Tìm hiểu nguyên tử khối
a) Mục tiêu: Nêu được khái niệm nguyên tử khối và tính toán được nguyên tử khối.
b) Nội dung: HS nghiên cứu nội dung sgk, thực hiện yêu cầu của gv và trả lời câu 8 sgk trang 23. c) Sản phẩm: Khái niệm và cách tính nguyên tử khối, đáp án câu 8 skg trang 23. d)
DẠYKÈMQUYNHƠNOFFICIAL
và
HĐ CỦ
GV
Bước 1: Chuyển giao
ệ
ụ: -
ầu
và
nguyên tử khối. 4. Nguyên tử khối và nguyên tử khối trung bình - Nguyên tử khối là khối lượng tương đối của nguyên tử. Khối lượng của một nguyên tử bằng tổng khối lượng của proton, neutron và electron trong nguyên tử đó. Do electron
Tổ chức thực hiện:
A
VÀ HS SẢN PHẨM DỰ KIẾN
nhi
m v
GV yêu c
HS đọc sgk, nêu khái niệm
cách tính
- GV yêu cầu HS thảo luận nhóm đôi trả lời câu 8 sgk trang 23 theo đơn vị amu.
- GV yêu cầu HS đưa ra kết luận nguyên tử khối cho ta biết điều gì về khối lượng nguyên tử. Bước 2: Thực hiện nhiệm vụ:
- HS theo dõi SGK, chú ý nghe, tiếp nhận kiến thức. - HS suy nghĩ trả lời câu hỏi. Bước 3: Báo cáo, thảo luận: - Đại diện nhóm HS hoặc HS giơ tay phát biểu hoặc lên bảng trình bày. - Một số HS khác nhận xét, bổ sung cho bạn. Bước 4: Kết luận, nhận định: - GV nhận xét kết quả th
có khối lượng không đáng kể nên coi khối lượng nguyên tử là khối lượng của protron và neutron. => Nguyên tử khối có giá trị bằng số khối. - Trả lời câu 8 sgk trang 23: Nguyên tử khối của Mg là: 12+12+ 12.0.00055 = 24,0066 (amu) ≈24( ) => Kết luận: Nguyên tử khối của một nguyên tử cho biết khối lượng của nguyên tử đó nặng gấp bao nhiêu lần đơn vị khối lượng nguyên tử (1 amu)
o
n nhóm, phần thuy
t trình thái độ làm việc.
DẠYKÈMQUYNHƠNOFFICIAL
ả
luậ
ế
- GV tổng quát lưu ý lại kiến thức trọng tâm và yêu cầu HS ghi chép đầy đủ vào vở. Hoạt động 8: Xác định nguyên tử khôi trung bình
a) Mục tiêu: Nêu được công thức tổng quát đề tính nguyên tử khôi từ các đông vị.
b) Nội dung: GV đưa ra ví dụ. HS quan sát rút ra công thức tính nguyên tử khối trung bình. vân dụng công thức làm câu 9 sgk trang 23. c) Sản phẩm: công thức tính nguyên tử khối trung bình. đáp án câu 9 sgk trang 23
d) Tố chức thực hiện:
HĐ CỦA GV VÀ HS
Bước 1: Chuyển giao nhiệm vụ: - GV đưa ra ví dụ cách tính nguyên tử khối trung bình, yêu cầu HS hoạt động nhóm 4, quan sát và rút ra công thức tính nguyên tử khối của nguyên tố X bất kì. VD1: Trong tự nhiên, chlorine có hai đồng vị là và có tỉ lệ % số nguyên tử tương ứng là 75,76% và 24,24%. Tính nguyên tử khối trung bình của chlorine. Giải: Gọi A1 và a1 lần lượt là số khối và % của
SẢN PHẨM DỰ KIẾN
- Công thức tính nguyên tử khối của nguyên tố X bất kì: = . + . +⋯+ . 100 Trong đó: là nguyên tử khối trung bình của X Ai là nguyên tử khối trung bình đồng vị thứ i A1 là tỉ lệ % số nguyên tử đồng vị thứ i.
DẠYKÈMQUYNHƠNOFFICIAL
Gọi A2 và a2 lần lượt là số khối và % của
Nguyên tử khối trung bình của chlorine là: = ( . )+( . ) 100 = (35.75,76)+(37.24,24) 100 =35,38( ) - GV yêu cầu HS thảo luận nhóm đôi, áp dụng công thức tính đồng vị, trả lời câu 9 sgk trang 23.
Bước 2: Thực hiện nhiệm vụ: - HS theo dõi SGK, chú ý nghe, tiếp nhận kiến thức. - HS suy nghĩ trả lời câu hỏi. Bước 3: Báo cáo, thảo luận:
- Đại diện nhóm HS phát biểu hoặc lên bảng trình bày.
- Một số HS khác nhận xét, bổ sung cho bạn.
Bước 4: Kết luận, nhận định: - GV nhận xét kết quả thảo luận nhóm, thái độ làm việc.
- Trả lời câu 9 sgk trang 23 Gọi A1 và a1 lần lượt là số khối và % của . Gọi A2 và a2 lần lượt là số khối và % của . Nguyên tử khối trung bình của copper là: = ( . )+( . ) 100 = (63. 69,15)+(65.30,85) 100 =63,617( )
DẠYKÈMQUYNHƠNOFFICIAL
- GV tổng quát lưu ý lại kiến thức trọng tâm và yêu cầu HS ghi chép đầy đủ vào vở.
C. HOẠT ĐỘNG LUYỆN TẬP
a) Mục tiêu: HS củng cố lại kiến thức về nguyên tố hóa học
b) Nội dung: HS vận dụng kiến thức đã học giải quyết bài tập về kí hiệu nguyên tử, mối liên hệ giữa các đại lượng đặc trưng cho nguyên tử, đồng vị.
c) Sản phẩm: Câu trả lời của HS cho các bài tập trong sgk.
d) Tổ chức thực hiện:
Bước 1: Chuyển giao nhiệm vụ:
- GV tổng hợp các kiến thức cần ghi nhớ cho HS.
- GV cho HS hoạt động nhóm làm bài bài tập 1, 3, 4 sgk trang 25
Bước 2: Thực hiện nhiệm vụ:
- HS suy nghĩ trả lời.
- GV điều hành, quan sát, hỗ trợ.
Bước 3: Báo cáo, thảo luận:
- HS đại diện nhóm giơ tay phát biểu trả lời hoặc lên bảng trình bày.
Bước 4: Kết luận, nhận định:
- GV chữa bài, chốt đáp án.
- GV nhận xét thái độ làm việc, phương án trả lời của các học sinh, ghi nhận và tuyên dương.
DẠYKÈMQUYNHƠNOFFICIAL
Đáp án: Bài tập 1: A= Z+N=16+16=32 => đáp án C Bài tập 3: Bài tập 4: Gọi A1, a1 lần lượt là số khối và % của 24Mg Gọi A2, a2 lần lượt là số khối và % của 25Mg Gọi A3, a3 lần lượt là số khối và % của 26Mg Áp dụng công thức tính nguyên tử khối trung bình ta có:

DẠYKÈMQUYNHƠNOFFICIAL
=>
+
+
=>
+
+
=>
+
T
= . + . + . 100 = 24. +25. +26.11 100 =24,32
24.a1 + 25.a2 = 2146 (1) Mà a1
a2
a3 =100 (%)
a1
a2
11= 100
a1
a2 = 89 (2)
ừ (1) và (2) ta có hệ 2 phương trình bậc nhất 2 ẩn:
24. a1+ 25. a2 = 2146 a1 + a2 = 89 Giải hệ ta có a1= 79, a2 = 10
Vậy 24Mg chiếm 79% số nguyên tử 25Mg chiếm 10 % số nguyên tử
D. HOẠT ĐỘNG VẬN DỤNG
a) Mục tiêu: Học sinh thực hiện làm bài tập vận dụng để nắm vững kiến thức. b) Nội dung : HS làm việc nhóm hoàn thành bài vận dụng sgk trang 24 c) Sản phẩm : Đáp án % đồng vị 13C, kết luận về việc sử dụng doping của vận động viên. d) Tổ chức thực hiện: Bước 1 : Chuyển giao nhiệm vụ - GV yêu cầu HS hoạt động nhóm đôi đọc phần mở rộng sgk trang 24 làm bài tập vận dụng sgk trang 24. Bước 2: Thực hiện nhiệm vụ - HS làm việc nhóm đôi thực hiện nhiệm vụ. - GV điều hành, quan sát, hỗ trợ. Bước 3 : Báo cáo, thảo luận - HS xung phong phát biểu. Các HS khác nhận xét. Đáp án : Ta có x + y = 100%
DẠYKÈMQUYNHƠNOFFICIAL
Theo công thức tính nguyên tử khối trung bình ta có : 12,0098 = . . => X = 99,02 % ; y = 0,98 %
Do đó, nghi ngờ vận động viên sử dụng doping vì % 13C của người đó ít hơn % 13C trong cơ thể bình thường.
Bước 4 : Kết luận, nhận định
- GV nhận xét thái độ làm việc, phương án trả lời của các học sinh, ghi nhận và tuyên dương.
* HƯỚNG DẪN VỀ NHÀ
- Ghi nhớ kiến thức trong bài.
- Hoàn thành bài tập trong sbt và bài tập 2 sgk trang 25.
- Chuẩn bị bài 4 “Cấu trúc lớp vỏ electron của nguyên tử”.
DẠYKÈMQUYNHƠNOFFICIAL
Ngày soạn: …/…/…
Ngày dạy: …/…/…
BÀI 4. CẤU TRÚC LỚP VỎ ELECTRON CỦA NGUYÊN TỬ (5 TIẾT)
I. MỤC TIÊU:
1. Kiến thức: Học xong bài này. HS đạt các yêu cầu sau:
• Trình bày và so sánh được mô hình của Rutherfoud — Bohr với mô hình hiện đại mô tả sự chuyển đông của electron trong từng nguyên tử.
• Nêu được khái niệm về orbital nguyên tử (AO). mô tả được hình đang của (AO). số lượng electron trong 1 AO.
• Trình bày được khái niệm lớp. phân lớp electron và mối quan hệ về số lượng phân lớp trong một lớp. Liên hệ được về số lượng AO trong một phân lớp.
• Viết được cấu hình electron của nguyên tử theo lớp. phân lớp electron và theo ô orbital khi biết số hiệu nguyên tử Z của 20 nguyên tế đầu tiên trong bảng tuân hoàn.
• Dựa vào đặc điểm cầu hình electron lớp ngoài cùng dự đoán được tính chất hóa học cơ bản (kim loại hay phi kim) của nguyên tế tương ứng.
DẠYKÈMQUYNHƠNOFFICIAL
2. Năng lực: - Năng lực chung:
Năng lực tự chủ và tự học: Chủ đông.
ực
ểu về
ầu
nguyên tử.
Năng
ự
•
tích c
tìm hi
c
trúc lớp vỏ
•
l
c giao tiếp và hợp tác: Sử đụng ngôn ngữ khoa học đẻ trình bảy và so sánh được mô hình của Rutherford— Borh với mô hình hiện đại mô tả sự
chuyển đông của electron trong nguyên tử: Hoạt đông nhóm một cách hiểu quả theo đúng yêu câu của GV. đảm bảo các thành viên tong nhóm đều được tham gia và trình bảy báo cáo.
• Năng lực giải quyết vẫn đề và sáng tạo: Thảo luận với các thành viên trong nhóm nhằm giải quyết các vấn đề trong bài học để hoàn thành nhiệm vụ học tập.
- Năng lực riêng:
• Năng lực nhân thức hóa học: Nêu được khái niêm orbital nguyên tử (AO). mô tả được hình dạng của (AO). số lượng electron trong 1 AO. Trình bày được khái niệm lớp. phân lớp. phân lớp electron và mối quan hệ về số lượng phân lớp trong một lớp. Liên hệ được về số AO trong một phân lớp.
• Năng lực tìm hiểu thể giới tự nhiên dưới góc độ hóa học: Trình bày và so sánh được mô hình của Rutherford— Borh (mô hình hành tính nguyên tử) với mô hình hiện đại mô tả sự chuyên động của electron trong nguyên tử, từ đó liên hệ với sự chuyển động các hành tinh trong hệ mặt trời.
• Vận dụng kiến thức kĩ năng đã học: Viết được cấu hình electron nguyên tử theo lớp. phân lớp electron và theo ô orbitalichi biết sồ hiệu nguyên tử Z của 20 nguyên tố đầu tiên trong bảng tuân hoàn các nguyên tế hóa học, dựa vào đặc điểm cầu hình electron lớp ngoài cùng của nguyên tử dự đoán được tính chất hóa học cơ bản (kim loại hay phi kim) của nguyên tổ tương ứng.
3. Phẩm chất:
• Tham gia tích cực hoạt đông nhóm phù hợp với khả năng của bản thân.
• Cẩn thận trung thực và thực hiện an toàn trong quá trình làm thực hành.
• Có niềm say mê, hứng thú với việc khám phá và học tập hóa học.
DẠYKÈMQUYNHƠNOFFICIAL
u. d) Tổ chức thực hiện: Bước 1: Chuyển giao nhiệm vụ: Khi lên xe bus, để thuận tiện cho việc đi lại trên xe, người quản lí xe thường sắp xếp những người lên trước vào hàng ghế trong cùng. Những người lên sau ngồi vào những hàng ghế kế tiếp cho đến hàng ghế sát cửa ra vào. Tương tự như vậy electron cũng được sắp xếp xung quanh sao cho có lợi về mặt năng lượng nhất. Em hãy dự đoán cách sắp xếp của electron trong nguyên tử
DẠYKÈMQUYNHƠNOFFICIAL
ấn đề của bài học. b) Nội dung: GV đặt vấn đề liên hệ với các tình huống trong thực tế c) Sản phẩm: HS trả lời câu hỏi mở đầ
Bước 2: Thực
ện
vụ - HS
sát và chú ý
ắng
Bước 3: Báo cáo, thảo luận: - Các HS xung phong phát biểu trả lời. Bước 4: Kết luận, nhân xét:
I. THIẾT BỊ DAY HỌC VÀ HỌC LIỆU 1. Đối với GV: SGK, Tải liêu giảng dạy, giáo án PPT. 2. Đối với HS: SGK, vở ghi, giấy nháp, đồ đùng học tập (bút, thước...), bảng nhóm, bút viết bảng nhóm. II. TIỀN TRÌNH DAY HỌC A. HOẠT ĐÔNG KHỞI ĐÔNG (MỞ ĐẦU) a) Mục tiêu: Sử dụng những câu hỏi mở đầu để giúp HS tiếp cận đến v
?
hi
nhiệm
quan
l
yêu cầu và đưa ra đáp án.
Mỗi bạn học sinh có dự đoán khác nhau. Vậy để xem bạn nào dự đoán chính xác nhất chúng ta cùng nhau tìm hiểu bài: Bài 4. Câu trúc lớp vỏ electron của nguyên tử.
B. HÌNH THÀNH KIẾN THỨC MỚI
Hoạt động 1. Sự chuyển động của electron trong nguyên tử
a) Mục tiêu: So sánh được mô hình nguyên tử Rutherford – Borh với mô hình nguyên tử hiện đại, nhận biết được sự chuyển động của electron trong nguyên tử theo sự phát triển của mô hình nguyên tử.
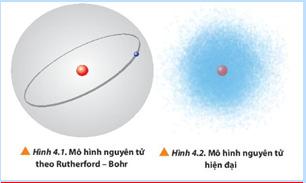
b) Nội dung: HS thảo luận nhóm 4 quan sát các hình 4.1 và 4.2 trong sgk, thảo luận trả lời câu 1 sgk trang 26. c) Sản phẩm: So sánh mô hình nguyên tử Rutherford – Borh với mô hình nguyên tử hiện đại, đáp án luyện tập sgk trang 26. d) Tổ chức thực hiện: HOẠT ĐỘNG CỦ
DẠYKÈMQUYNHƠNOFFICIAL
VÀ
DỰ
A GV
HS
KIẾN SẢN PHẨM Bước 1: Chuyển giao nhiệm vụ: - GV yêu cầu HS thảo luận nhóm 4 trả lời câu 1 sgk trang 26. 1. Hạt nhân nguyên tử Đáp án câu 1 sgk trang 26: So sánh: + Điểm giống nhau: Electron chuyển động xung quanh hạt nhân. + Khác nhau: => Kết luận: Theo mô hình nguyên tử Rutherford - Borh, các
electron chuyển động trên những quỹ đạo hình tròn hay bầu dục xác định xung quanh hạt nhân. Theo mô hình hiện đại, trong nguyên tử các electron chuyển động rất nhanh xung quanh hạt nhân không theo quỹ đạo nhất định, tạo thành đám mây electron. - Trả lời câu hỏi vận dụng sgk trang 27: Mô hình Rutherford – Borh được gọi là mô hình hành tinh nguyên tử tương tự như Mặt Trời.

DẠYKÈMQUYNHƠNOFFICIAL -
cầu
ạt
ờ
ỏi vận
Bước 2: Thực hiện nhiệm vụ: -
ế
- HS
ả
ậ
ặ
trả lờ
ỏ
Bước 3: Báo cáo, thảo luận: - Đại diện nhóm HS hoặc HS
ơ tay
biểu hoặc lên bảng trình
- Một số HS khác nhận xét, bổ
GV yêu
HS ho
động nhóm đôi trả l
i câu h
dung sgk trang 27
HS theo dõi SGK, chú ý nghe, tiếp nhận ki
n thức.
th
o lu
n nhóm ho
c cá nhân suy nghĩ
i câu h
i.
gi
phát
bày.
sung cho bạn. Bước 4: Kết luận, nhận định:
- GV nhận xét kết quả thảo luận nhóm, thái độ làm việc.
- GV tổng quát lưu ý lại kiến thức trọng tâm và yêu cầu HS ghi chép đầy đủ vào vở. Hoạt động 2: Tìm hiểu chung về orbital nguyên tử
a) Mục tiêu: Nêu được khái niệm orbital nguyên tử và vẽ được hình dạng của orbital s, p. b) Nội dung: HS thảo luận nhóm 4 quan sát các hình 4.3 và 4.4 trong sgk, thảo luận trả lời câu 2, 3, 4 sgk trang 27, kết luận khái niệm orbital và hình dạng orbital s, p. c) Sản phẩm: Đáp câu 2, 3, 4 sgk trang 27, d) Tổ chức thực hiện:
HO
ẠT ĐỘ
NG CỦA GV VÀ HS DỰ KIẾN SẢN PHẨM
Bước 1: Chuyển giao nhiệm vụ: - GV yêu cầu HS thảo luận nhóm 4 quan sát hình 4.3 và 4.4 trả lời các câu 2, 3, 4 sgk trang 27.
Tìm hiểu chung về orbital nguyên tử - Trả lời câu 2 sgk trang 27:
+ Giống nhau: đều là khu vực không gian xung quanh hạt nhân chứa electron nguyên tử. + Khác nhau: Orbital là khi vực không gian xung quanh hạt nhân mà tại đó xác suất có mặt ( xác xuất tìm
DẠYKÈMQUYNHƠNOFFICIAL
- GV giải thích thêm về xác suất tìm thấy electron:Ví dụ khi các quả táo chín trên cây rơi xuống đất, chúng sẽ tập trung nhiều ở khu vực nhất định dưới gốc cây. Vị trí xung quanh gốc cây mà số quả táo rơi xuống nhiều nhất được xem là tại đó có xác suất lớn nhất tìm thấy các quả táo.
thấy) electron khoảng 90%.


- Trả lời câu 3 sgk trang 27:
Khái niệm orbital bắt nguồn từ mô hình nguyên tiwr hiện đại.
- Trả lời câu 4 sgk trang 27:
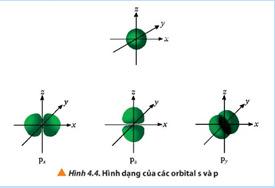
+ Giống nhau: Đều có số 8 nổi + Khác nhau: Các orbital định hướng khác nhau trong không gian.
Đáp án:
a, Các quả táo chín rơi xuống tập trung ở khu vực quanh gốc cây.
b, Khu vực chính giữa gốc cây và khu vực cách gốc cây quá xa sẽ không tìm thấy các quả táo rơi xuống. c, Vùng xung quanh hạt nhân một khoảng nhất định, nơi ta có thể tìm thấy electron với xác suất lớn. Ở vị trí hạt nhân nguyên tử hay cách hạt nhân quá xa, ta không thể tìm thấy electron.
=> Kết luận:
- GV yêu cầu HS thảo luận nhóm 4 trả lời
• Orbital nguyên tử (Atomic orbital, viết tắt là AO) là khu vực không gian xung quanh hạt
DẠYKÈMQUYNHƠNOFFICIAL
câu hỏi:
a, Quan sát hình trên và cho biết các quả táo chín rơi xuống tập trung ở khu vực nào?
b, Khu vực nào ở gốc cây sẽ không tìm thấy các quả táo rơi xuống? c, Hãy liên hệ với xác suất có măt các electron trong nguyên tử - GV nêu kết luận Bước 2: Thực hiện nhiệm vụ:
- HS theo dõi SGK, chú ý nghe, tiếp nhận kiến thức. - HS thảo luận nhóm hoặc cá nhân suy nghĩ trả lời câu hỏi. Bước 3: Báo cáo, thảo luận: - Đại diện nhóm HS hoặc HS giơ tay phát biểu hoặc lên bảng trình bày.
- Một số HS khác nhận xét, bổ sung cho bạn.
Bước 4: Kết luận, nhận định:
- GV nhận xét kết quả thảo luận nhóm, thái độ làm việc.
nhân nguyên tử mà tại đó xác suất tìm thấy electrn là lớn nhất ( khoảng 90%)
• Một số AO thường gặp: s, p, d, f.
• Các AO có hình dạng khác nhau: AO s có hình cầu, AO p có hình số 8 nổi, AO d và f có hình dạng phức tạp.
DẠYKÈMQUYNHƠNOFFICIAL
- GV tổng quát lưu ý lại kiến thức trọng tâm và yêu cầu HS ghi chép đầy đủ vào vở. Hoạt động 3: Tìm hiểu về lớp electron
- GV yêu cầu HS đưa ra kết luận nguyên tắc sắp xếp electron trong hạt nhân. - GV đưa ra ví dụ: các HS trong cùng 1
2. Lớp và phân lớp electron
- Trả lời câu 5 sgk trang 28
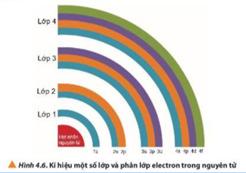
Các lớp electron được sắp xếp từ gần hạt nhân ra ngoài, được gọi tên bắt đầu từ chữ K đến Q (theo bảng chữ cái A, B, C,…) tương ứng với các lớp từ 1 đến 7.
- Trả lời câu 6 sgk trang 28
a) Mục tiêu: Gọi tên được các lớp electron và khái niệm lớp electron b) Nội dung: HS nghiên cứu nội dung trong sgk, quan sát hình ảnh và thảo luận nhóm trả lời câu hỏi, từ đó hình thành kiến thức về lớp electron. c) Sản phẩm: Đáp án câu 5, 6 sgk trang 28, kết luận về nguyên tắc sắp xếp electron trong hạt nhân. d) Tổ chức thực hiện: HOẠT ĐỘNG CỦA GV VÀ HS DỰ KIẾN SẢN PHẨM Bước 1: Chuyển giao nhiệm vụ: - GV nêu vấn đề: “Trong bảng tuần hoàn, lớp electron lớn nhất ứng với các nguyên tố đã biết là 7. Các electron trong nguyên tử được sắp xếp theo thứ tự từ lớp n = 1 đến n = 7” - GV yêu cầu HS thảo luận nhóm 4 quan sát hình ảnh và trả lời câu 5, 6 sgk trang 28.
Lực hút hạt nhân với electron lớp 1 là lớn nhất và lớp 7 là nhỏ nhất.
=> Kết luận:
DẠYKÈMQUYNHƠNOFFICIAL
lớp thường có số tuổi bằng nhau. Tương tự như vậy các electron trong cùng 1 lớp có năng lượng xấp xỉ nhau. Bước 2: Thực hiện nhiệm vụ:
- HS theo dõi SGK, chú ý nghe, tiếp nhận kiến thức. - HS thảo luận nhóm hoặc cá nhân suy nghĩ trả lời câu hỏi.
• Trong nguyên tử, các electron được sắp xếp thành từng lớp (kí hiệu K, L, M, N, O, P, Q) từ gần đến xa hạt nhân, theo thứ tự từ lớp n= 1 đến n=7.
Bước 3: Báo cáo, thảo luận: - Đại diện nhóm HS hoặc HS giơ tay phát biểu hoặc lên bảng trình bày. - Một số HS khác nhận xét, bổ sung cho bạn. Bước 4: Kết luận, nhận định:
- GV nhận xét kết quả thảo luận nhóm, thái độ làm việc. - GV tổng quát lưu ý lại kiến thức trọng tâm và yêu cầu HS ghi chép đầy đủ vào vở.
• Các electron trên cùng một lớp có năng lượng gần bằng nhau. Hoạt động 4. Tìm hiểu về phân lớp electron
a) Mục tiêu: Nêu được khái niệm phân lớp electron, cách phân loại phân lớp electron và số lượng orbital trong mỗi phân lớp.
DẠYKÈMQUYNHƠNOFFICIAL
b) Nội dung: HS quan sát hình ảnh và trả lời các câu hỏi trong sgk từ đó rút ra nhận xét, kết luận. c) Sản phẩm: Đáp án câu 7 sgk trang 28, kết luận về đặc điểm về phân lớp electron. d) Tổ chức thực hiện: HOẠT ĐỘNG CỦA GV VÀ HS
DỰ KIẾN SẢN PHẨM
Bước 1: Chuyển giao nhiệm vụ: - GV yêu cầu HS quan sát Hình 4.6 trong sgk và trả lời câu 7 sgk trang 28.
Phân lớp electron
- Trả lời câu 7 sgk trang 28: + Lớp 1 có 1 phân lớp: 1s. + Lớp 2 có 2 phân lớp: 2s, 2p. + Lớp 3 có 3 phân lớp: 3s, 3p, 3d. + Lớp 4 có 4 phân lớp: 4s, 4p, 4d, 4f. => Lớp n có n phân lớp: ns, np, nd, nf, ng, … => Kết luận: • Mỗi lớp electron phân chia thành các phân lớp, được kí hiệu bằng các chữ cái viết thường là s, p, d, f. Các electron thuộc các phân lớp s, p, d và f được gọi tương ứng
DẠYKÈMQUYNHƠNOFFICIAL
+ GV yêu cầu HS suy luận lớp n có bao nhiêu phân lớp electron? - GV yêu cầu HS đọc sgk nêu kết luận về đặc điểm của lớp và phân lớp electron. Bước 2: Thực hiện nhiệm vụ: - HS theo dõi SGK, chú ý nghe, tiếp nhận kiến thức.
- HS thảo luận nhóm hoặc cá nhân suy nghĩ trả lời câu hỏi.
Bước 3: Báo cáo, thảo luận:
- Đại diện nhóm HS hoặc HS giơ tay phát biểu hoặc lên bảng trình bày.
- Một số HS khác nhận xét, bổ sung cho bạn.
Bước 4: Kết luận, nhận định:
- GV nhận xét kết quả thảo luận nhóm, thái độ làm việc.
- GV tổng quát lưu ý lại kiến thức trọng tâm và yêu cầu HS ghi chép đầy đủ vào vở.
Hoạ
là các electron s, p, d và f.
• Các phân lớp s, p, s và f lần lượt có các số AO tương ứng là 1, 3, 5, 7.
• Các electron trên cùng một phân lớp có năng lượng bằng nhau. Với 4 lớp đầu (1, 2, 3, 4) số phân lớp trong mỗi lớp bằng số thứ tự của lớp đó.
DẠYKÈMQUYNHƠNOFFICIAL
động
ểu
ữ
ề
a)
b)
ộ
c) S
d) Tổ chức thực hiện: HOẠT ĐỘNG CỦA GV VÀ HS DỰ KIẾN SẢN
Ẩ
Bước 1: Chuyển giao nhiệm vụ: - GV
ầu
ả
t
5: Tìm hi
nguyên lí v
ng b
n
Mục tiêu: Nêu được nguyên lí vững bền Aubau (quy tắc Klechkovsky)
N
i dung: HS thảo luận nhóm và trả lời câu 8 sgk trang 29 và nêu nguyên lí vững bền.
ản phẩm: Nguyên lí bền vững và đáp án câu 8 sgk trang 29.
PH
M
yêu c
HS quan sát các hình 4.8, 4.9 trong sgk, th
o luận nhóm 4 trả lời câu 8 sgk trang 29. 5. Nguyên lí vững bền - Trả lời câu 8 sgk trang 29: Nhìn chung, năng lượng của các
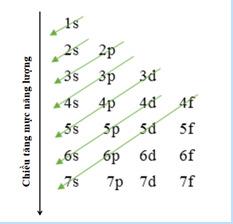
electron trên các AO ở trạng thái cơ bản tăng theo số lớp electrom. Tuy nhiên khi điện tích hạt nhân tăng có sự chèn mức năng lượng, mức 4s trở nên thấp hơn 3d, mức 5s thấp hơn 4d. => Kết luận: Nguyên lí vững bền: Ở trạng thái cơ bản, các electron trong nguyên tử chiếm lần lượt những orbital có mức năng lượng từ thấp đến cao: 1s 2s 2p 3s

DẠYKÈMQUYNHƠNOFFICIAL
ướng dẫn
ức năng lượng từ nhấp đến
viết các phân lớp theo chiều mũi
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p… - GV yêu cầu HS nêu nội dung của nguyên lí vững bền Bước 2: Thực hiện nhiệm vụ: - HS theo dõi SGK, chú ý nghe, tiếp nhận kiến thức.
=> GV h
HS cách viết các phân lớp có m
cao: Ta
tên:
3p 4s 3d 4p 5s 4d 5p …
- HS thảo luận nhóm hoặc cá nhân suy nghĩ trả lời câu hỏi.
Bước 3: Báo cáo, thảo luận:
- Đại diện nhóm HS hoặc HS giơ tay phát biểu hoặc lên bảng trình bày.
- Một số HS khác nhận xét, bổ sung cho bạn.
Bước 4: Kết luận, nhận định:
- GV nhận xét kết quả thảo luận nhóm, thái độ làm việc.
- GV tổng quát lưu ý lại kiến thức trọng tâm và yêu cầu HS ghi chép đầy đủ vào vở. Hoạt động 6: Tìm hiểu nguyên lí Pauli (Pau-li)
a) Mục tiêu: Nêu được khái niệm electron độc thân, electron ghép đôi và sự sắp xếp electron trên các orbital của nguyên tử. b) Nội dung: HS quan sát hình ảnh, đọc sgk, thảo luận nhóm hoàn thành nhiệm vụ và trả lời câu 9, 10 sgk trang 30. c) Sản phẩm: Đáp án câu 9, 10 sgk trang 30 và nội dung nguyên lí Pauli. d)
DẠYKÈMQUYNHƠNOFFICIAL
HOẠT ĐỘNG
ỦA GV VÀ
DỰ KIẾN SẢN PHẨM Bước 1:
ụ
-
Tổ chức thực hiện:
C
HS
Chuyển giao nhiệm v
:
GV yêu cầu HS quan sát các hình 4.8, 4.9 trong Nguyên lí Pauli (Pau-li) + Các AO được biểu diễn bằng các ô
sgk, thảo luận nhóm 4 trả lời câu 9,10 sgk trang
30. Các câu hỏi gợi ý:
+ Các AO được biểu diễn bằng gì?
+ Mỗi AO chưa tối đa mấy electron?
+ Electron độc thân là gì?
+ Electron ghép đôi là gì?
- GV yêu cầu HS nêu nội dung nguyên lí pauli:
+ Mỗi orbital chưa tối đa bao nhiêu electron?
+ Nhận xét chiều của các electron trong 1 ô lượng tử.
i thích thêm về chiều chuyển động tự
vuông gọi là ô lượng tử. + Mỗi AO chứa tối đa 2 electron + Electron đôc thân là chỉ có 1 electron đó trong 1AO
+ Electron ghép đôi là có 2 electron đó chứa trong 1AO.
- Trả lời câu 9 sgk trang 30: Trong một orbital, 2 electron có chiều quay ngược nhau - Trả lời câu 10 sgk trang 30:
6 electron ghép đôi, 2 electron độc thân.
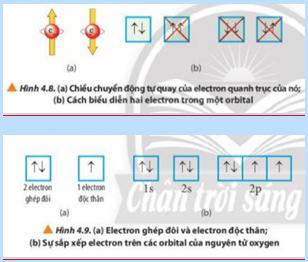
=> Kết luận: Nguyên lí Pauli: mỗi orbital chứa tối đa 2 electron và có chiều tự quay ngược nhau.
c
DẠYKÈMQUYNHƠNOFFICIAL
- GV giả
quay
ủa electron giống như Trái Đất. Ngoài việc Trái Đất quay xung quanh Mặt Trời, thì Trái Đất tự quay quanh chình nó. Tương tự vậy electron di
chuyển xung quanh hạt nhân không có qũy đạo xác định và electron cũng tự quay theo trục của nó.
Bước 2: Thực hiện nhiệm vụ:
- HS theo dõi SGK, chú ý nghe, tiếp nhận kiến thức.
- HS thảo luận nhóm hoặc cá nhân suy nghĩ trả lời câu hỏi.
Bước 3: Báo cáo, thảo luận:
- Đại diện nhóm HS hoặc HS giơ tay phát biểu hoặc lên bảng trình bày.
- Một số HS khác nhận xét, bổ sung cho bạn.
Bước 4: Kết luận, nhận định:
- GV nhận xét kết quả thảo luận nhóm, thái độ làm việc.
- GV tổng quát lưu ý lại kiến thức trọng tâm và yêu cầu HS ghi chép đầy đủ vào vở
Hoạt động 7: Xác định số AO và số electron tối đa trong một phân lớp và trong mỗi lớp
a) Mục tiêu: Xác định số AO và số electron tối đa trong một phân lớp và trong mỗi lớp.
DẠYKÈMQUYNHƠNOFFICIAL
Xác định số AO và số electron tối đa trong một phân lớp và trong mỗi lớp
- Trả lời câu 11 sgk trang 31: + Lớp n được chia thành n phân lớp. + Mỗi phân lớp có số lượng AO nhất định, lớp n có n2 AO + Mỗi AO chỉ chứa tối đa 2 electron. Do đó lớp n có tối đa 2n2 electron. - Trả lời câu hỏi luyện tập sgk trang 31: 2 phân lớp s: 4 electron 1 phân lớp p: 3 electron => N có tổng cộng 7 electron.

DẠYKÈMQUYNHƠNOFFICIAL
d)
ổ
ứ
thự
ệ
:
ẠT ĐỘNG
Ủ
DỰ KIẾN SẢN PHẨM Bướ
1:
ển
ệ
ụ: -
Câu
ỏ
gợi ý: Trong 4 lớp đầu tiên
+
ứ
+ Lớp thứ
+
b) Nội dung: HS thảo luận nhóm trả lời các câu hỏi trong sgk và từ đó hình thành kiến thức.
T
ch
c
c hi
n
HO
C
A GV VÀ HS
c
Chuy
giao nhi
m v
GV yêu cầu HS hoạt động theo nhóm đôi quan sát bảng 4.1, dựa vào các số liệu cho sẵn, trả lời câu 11 sgk trang 31.
h
i
thì:
Lớp th
n có bao nhiêu phân lớp electron?
n có bao nhiêu AO?
Mỗi AO có tối đa bao nhiêu electron, từ đó
suy ra số electron tối đa của mỗi lớp.
- GV yêu cầu HS thảo luận nhóm đôi hoàn thành câu hỏi luyện tập sgk trang 31
Bước 2: Thực hiện nhiệm vụ:
- HS theo dõi SGK, chú ý nghe, tiếp nhận kiến thức. - HS thảo luận nhóm hoặc cá nhân suy nghĩ trả lời câu hỏi.
Bước 3: Báo cáo, thảo luận:
- Đại diện nhóm HS hoặc HS giơ tay phát biểu hoặc lên bảng trình bày.
- Một số HS khác nhận xét, bổ sung cho bạn. Bước 4: Kết luận, nhận định: - GV nhận xét kết quả thảo luận nhóm, thái độ làm việc.
- GV tổng quát lưu ý lại kiến thức trọng tâm và yêu cầu HS ghi chép đầy đủ vào vở. Hoạt động 8: Tìm hiểu quy tắc Hund
a) Mục tiêu: Nêu được quy tắc Hund và cách phân bố các electron vào các ô lượng từ trong nguyên tử b) Nội dung: Thảo luận nhóm trả lời các câu hỏi trong sgk và từ đó hình thành kiến thức.
DẠYKÈMQUYNHƠNOFFICIAL
c) Sản phẩm: Đáp án câu 12, 13 sgk trang 31, và luyện tập sgk trang 31, quy tắc Hund.
HOẠT ĐỘNG CỦA GV
VÀ HS DỰ KIẾN S
Bước 1: Chuyển giao nhiệm vụ:
- GV yêu cầu HS quan sát Hình 4.10, dựa vào các số liệu cho sẵn, trả lời câu 12, 13 sgk trang 31.
Quy tắc Hund
ẢN PHẨM
- GV yêu cầu HS nêu quy tắc Hund theo sgk
- GV yêu cầu HS hoàn thành bài luyện tập sgk trang 31.
- Trả lời câu 12 sgk trang 31: + Trường hợp (a) không có electron độc thân vì các orbital đã chứa đầy electron. + Trường hợp (b) và (c), theo cách phân bố electron ở hai trường hợp này, số electron độc thân là nhiều nhất. - Trả lời câu 13 sgk trang 31:
Đầu tiên, điền các electron bằng mũi tên hướng lên theo chiều từ trái sang phải. Sau đó điền các electron bằng dấu mũi tên hướng xuống theo chiều từ trái sang phải sao cho tổng số mũi tên bằng số electron của nguyên tử.
=> Quy tắc Hund:
Trong cùng một phân lớp chưa bão hòa, các electron sẽ phân bố vào các orbital sao cho số electron độc thân
DẠYKÈMQUYNHƠNOFFICIAL
Bước 2: Thực hiện nhiệm vụ:
- HS theo dõi SGK, chú ý nghe, tiếp nhận kiến thức.
- HS thảo luận nhóm hoặc cá nhân suy nghĩ trả lời câu hỏi.
Bước 3: Báo cáo, thảo luận:
- Đại diện nhóm HS hoặc HS giơ tay phát biểu hoặc lên bảng trình bày.
- Một số HS khác nhận xét, bổ sung cho bạn.
Bước 4: Kết luận, nhận định:
- GV nhận xét kết quả thảo luận nhóm, thái độ làm việc.
- GV tổng quát lưu ý lại kiến thức trọng tâm và yêu cầu HS ghi chép đầy đủ vào vở.
Hoạt động 9. Tìm hiểu cách viết cấ
là tối đa.
- Trả lời bài luyện tập sgk trang 31:
Trường hợp (a) tuân theo quy tắc Hund.
Trường hợp (b) không tuân theo quy tắc Hund.
DẠYKÈMQUYNHƠNOFFICIAL
u hình electron nguyên tử a) Mục tiêu: Viết được cấu hình electron nguyên tử theo lớp, phân lớp electron và theo ô orbital. b) Nội dung: HS thảo luận nhóm trả lời các câu hỏi trong sgk và từ đó hình thành kiến thức. c) Sản phẩm: Đáp án câu 14 sgk trang 32, các bước viết cấu hình electron, đáp án. d) Tổ chức thực hiện:
HO
VÀ HS
Bước 1: Chuyển giao nhiệm vụ: - GV yêu cầu HS đọc thông tin trong sgk yêu cầu HS trả lời câu 14 sgk trang 32. - GV giới thiệu quy ước cách biểu diễn sự phân bố electron trên các phân lớp: - GV yêu cầu HS dựa vào sgk, nêu các bước viết cấu hình electron. - GV đưa ra ví dụ cách viết cấu hình electron nguyên tử của 1 nguyên tố và cấu hình electron theo ô orbital: + Nguyên tố Calcium ( Z=20)
Cách viết cấu hình electron nguyên tử - Trả lời câu 14 sgk trang 32: + Số proton, số elctron, số hiệu nguyên tử. + Số lớp, số phân lớp electron vào phan lớp của từng lớp. - Các bước viết cấu hình electron: + Bước 1: Xác định số electron của nguyên tử. + Bước 2: Các electron được phân bố theo thứ tự AO có mức năng lượng tăng dần, theo các nguyên lí và quy tắc phân bố electron trong nguyên tử. + Bước 3: Viết cấu hình electron theo thứ tự các phân lớp trong một lớp và theo thứ tự của các lớp electron.
Đáp án: - Nhóm 1: Nguyên tố C ( Z=6) Cấu hình electron của C : 1s22s22p2 Cấu hình electron của C theo orbital:
DẠYKÈMQUYNHƠNOFFICIAL
Bước 1: Ca có 20 electron Bước 2: Thứ tự mức năng lượng orbital: 1s 2s 2p 3s 3p 4s 3d .... (*) Điền 20 electron vào (*) sao cho thỏa mãn các nguyên lí, quy tắc: 1s22s22p63s23p64s2 Bước 3: Viết cấu hình electron: 1s22s22p63s23p64s2 Hoặc viết gọn là: [Ar]4s2 .
ẠT ĐỘNG CỦA GV
DỰ KIẾN SẢN PHẨM
Cấu hình electron theo ô orbital:
- GV chia lớp thành 4 – 5 nhóm tổ chức cuộc thi giữa các nhóm. Nhiệm vụ viết cấu hình electron nguyên tử và cấu hình electron theo ô orbital của một số nguyên tố:
+ Nhóm 1: Nguyên tố C (Z=6). + Nhóm 2: Nguyên tố Si (Z=14) + Nhóm 3: Nguyên tố F (Z=9) + Nhóm 4: Nguyên tố Cl (Z= 17) + Nhóm 5: Nguyên tố Na ( Z=11)

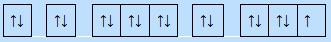
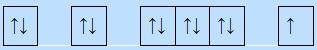
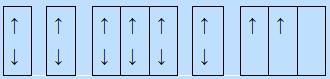
Nhóm nào viết chính xác trong thời gian ngắn nhất, nhóm đó thắng. - HS thảo luận nhóm 4 làm bài luyện tập sgk trang 32 Bước 2: Thực hiện nhiệm vụ: - HS theo dõi SGK, chú ý nghe, tiếp nhận kiến thức. - HS thảo luận nhóm hoặc cá nhân suy nghĩ trả lời câu hỏi.
- Nhóm 2: Nguyên tố Si (Z=14)
Cấu hình electron của Si: 1s22s22p63s23p2
Cấu hình electron của Si theo orbital:
- Nhóm 3:
Nguyên tố: F (Z = 9)
Cấu hình electron của Si: 1s22s22p5
Cấu hình electron của Si theo orbital: - Nhóm 4:
Nguyên tố Cl (Z=17)
Cấu hình electron của C: 1s22s22p63s23p5
Cấu hình electron của Si theo orbital:
- Nhóm 5:
DẠYKÈMQUYNHƠNOFFICIAL
Bước 3: Báo cáo, thảo luận: - Đại diện nhóm HS hoặc HS giơ tay phát
biểu hoặc lên bảng trình bày.
- Một số HS khác nhận xét, bổ sung cho bạn. Bước 4: Kết luận, nhận định:
- GV nhận xét kết quả thảo luận nhóm, thái độ làm việc. - GV tổng quát lưu ý lại kiến thức trọng tâm và yêu cầu HS ghi chép đầy đủ vào vở.
Nguyên tố Na (Z=11)
Cấu hình electron của C: 1s22s22p63s1
Cấu hình electron của Si theo orbital: - Trả lời câu luyện tập sgk trang 32: + Cấu hình electron của Al: 1s22s32p63s23p1
+ Cấu hình electron của Al theo orbital: => Al có 1 electron độc thân.
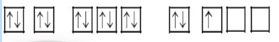
Hoạt động 10. Tìm hiểu đặc điểm cấu hình electron lớp ngoài cùng của nguyên tử
a) Mục tiêu: Nêu được tính chất cơ bản (kim loại hay phi kim) của nguyên tố khi biết đặc điểm cấu hình electron lớp ngoài cùng.
b) Nội dung: HS thảo luận nhóm trả lời các câu hỏi trong sgk và từ đó hình thành kiến thức. c) Sản phẩm: Đáp án câu 15 sgk trang 33, mối liên hệ giữa electron lớp ngoài cùng với tính chất của nguyên tố, đáp án câu vận dụng sgk trang 33. d) Tổ chức th
DẠYKÈMQUYNHƠNOFFICIAL
HO
D
ực hiện:
ẠT ĐỘNG CỦA GV VÀ HS
Ự KIẾN SẢN PHẨM Bước 1. Chuyển giao nhiệm vụ Đặc điểm cấu hình electron lớp ngoài
- Yêu cầu HS hoạt động nhóm 4 đọc sgk, trả lời các câu hỏi của GV và câu 15 sgk trang 33.
+ Nguyên tố mà nguyên tử có 1, 2, 3 electron lớp ngoài cùng thường là nguyên tố gì?
+ Nguyên tố mà nguyên tử có 5, 6, 7 electron lớp ngoài cùng thường là nguyên tố gì?
+ Nguyên tố mà nguyên tử có 8 electron lớp ngoài cùng thường là nguyên tố gì?
+ Nguyên tố mà nguyên tử có có 4 electron lớp ngoài cùng thường là nguyên tố gì?
- GV yêu cầu HS nêu kết luận từ cấu hình electron lớp ngoài cùng của nguyên tử, ta có thể dự đoán được gì? Bước 2: Thực hiện nhiệm vụ: - HS theo dõi SGK, chú ý nghe, tiếp nhận kiến thức. - HS thảo luận nhóm hoặc cá nhân suy nghĩ trả lời câu hỏi. Bước 3: Báo cáo, thảo luận: - Đại diện nhóm HS hoặc HS giơ tay phát biểu hoặc lên bảng trình bày. - Một số HS khác nhận xét, bổ sung cho bạn.
cùng của nguyên tử.
+ Nguyên tố mà nguyên tử có 1, 2, 3 electron lớp ngoài cùng thường là nguyên tố tính kim loại (trừ H, He,B).
+ Nguyên tố mà nguyên tử có 5, 6, 7 electron lớp ngoài cùng thường là nguyên tố phi kim.
+ Nguyên tố mà nguyên tử có 8 electron lớp ngoài cùng thường là nguyên tố khí hiếm (trừ He).
+ Nguyên tố mà nguyên tử có 4 electron lớp ngoài cùng có thể là nguyên tố kim loại, cũng có thể là nguyên tố phi kim.
- Trả lời câu 15 sgk trang 33:
Phosphorus có 5 electron lớp ngoài cùng là cơ sở để dự đoán phosphorus là nguyên tố phi kim.
=> Kết luận: Dựa vào số lượng electron lớp ngoài cùng của nguyên tử nguyên tố, có thể dự đoán một nguyên tố kim loại, phi kim hay khí hiếm.
- Trả lời vận dụng sgk trang 33: Dựa vào cấu hình electron của Li. Nhận thấy Li có 1 electron ở lớp ngoài cùng.
DẠYKÈMQUYNHƠNOFFICIAL
Bước 4: Kết luận, nhận định:
- GV nhận xét kết quả thảo luận nhóm, thái độ làm việc.
- GV tổng quát lưu ý lại kiến thức trọng tâm và yêu cầu HS ghi chép đầy đủ vào vở.
Từ đó có thể dự đoán Li là nguyên tố kim loại.
C. HOẠT ĐỘNG LUYỆN TẬP
a) Mục tiêu: HS củng cố lại kiến thức về cấu trúc lớp vỏ electron
b) Nội dung: HS vận dụng các kiến thức đã học giải quyết các bài tập về orbital, lớp, phân lớp electron, electron độc thân. c) Sản phẩm học tập: Câu trả lời của HS cho các bài tập trong sgk. d) Tổ chức thực hiện:
DẠYKÈMQUYNHƠNOFFICIAL
-
-
-
Bước 1: Chuyển giao nhiệm vụ: - GV tổng hợp các kiến thức cần ghi nhớ cho HS. - GV cho HS hoạt động nhóm 4 làm bài bài tập 1, 2, 3, 4 sgk trang 34 Bước 2: Thực hiện nhiệm vụ:
HS suy nghĩ trả lời.
GV điều hành, quan sát, hỗ trợ. Bước 3: Báo cáo, thảo luận:
HS đại diện nhóm giơ tay phát biểu trả lời hoặc lên bảng trình bày. Bước 4: Kết luận, nhận định:

DẠYKÈMQUYNHƠNOFFICIAL
4
1
O
6
D. HOẠT ĐỘNG VẬN DỤNG a) Mụ
b)
- GV chữa bài, chốt đáp án. - GV nhận xét thái độ làm việc, phương án trả lời của các học sinh, ghi nhận và tuyên dương. Đáp án: Bài tập 1: Phương án (1) Bài tập 2: Cấu hình electron: 1s22s22p4. Số hiệu nguyên tử 8. Bài tập 3: Bài tập 4: Cấu hình electron C 1s22s22p2
electron lớp ngoài cùng phi kim Na 1s22s22p63s1
electronn lớp ngoài cùng kim loại
1s22s22p4
electron lớp ngoài cùng kim loại
c tiêu: Học sinh thực hiện làm bài tập vận dụng để nắm vững kiến thức.
Nội dung : HS làm việc nhóm đôi hoàn thành bài tập vận dụng
c) Sản phẩm: đáp án chi tiết cho câu hỏi vận dụng về cấu hình electron, số hạt cơ bản của Fe.
d) Tổ chức thực hiện: Bước 1 : Chuyển giao nhiệm vụ - GV yêu cầu HS hoạt động nhóm đôi đọc phần mở rộng sgk trang 32, trả lời bài tập vận dụng:
Nguyên tử Fe có kí hiệu . Cho các phát biểu sau về Fe:
(1) Nguyên tử của nguyên tố Fe có 8 electron ở lớp ngoài cùng
(2) Nguyên tử của nguyên tố Fe có 30 neutron trong hạt nhân.
(3) Fe là một phi kim
(4) Fe là nguyên tố nhóm d Trong các phát biểu trên, phát biểu nào đúng, sai. Tại sao? Bước 2: Thực hiện nhiệm vụ - HS làm việc nhóm đôi thực hiện nhiệm vụ. - GV điều hành, quan sát, hỗ trợ
Do 2 electron lớp ngoài cùng nên Fe là kim loại. => (3) sai
DẠYKÈMQUYNHƠNOFFICIAL
Cấu
electron
•
ố
•
•
Bước 3 : Báo cáo, thảo luận - HS xung phong phát biểu. Các HS khác nhận xét. Đáp án :
hình
của Fe : 1s22s22p63s23p63d64s2
S
electron lớp ngoài cùng là 2 => (1) sai
N= A-Z = 56-26=30 => (2) đúng
• Electron cuối cùng điền vào phân lớp 3d nên Fe là nguyên tố nhóm d => (4) đúng
Bước 4 : Kết luận, nhận định.
- GV nhận xét thái độ làm việc, phương án trả lời của các học sinh, ghi nhận và tuyên dương.
* HƯỚNG DẪN VỀ NHÀ
- Ghi nhớ kiến thức trong bài.
- Hoàn thành bài tập trong sbt.
- Chuẩn bị bài “Bài 5. Cấu tạo bảng tuần hoàn các nguyên tố hóa học”.
DẠYKÈMQUYNHƠNOFFICIAL
Ngày soạn: .../.../...
Ngày dạy: .../.../... BÀI 5: CẤU TẠO BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌC
I. MỤC TIÊU:
1. Kiến thức: Học xong bài này, HS đạt các yêu cầu sau:
• Nêu được lịch sử phát minh định luật tuần hoàn và bảng tuần hoàn các nguyên tố hóa học
• Mô tả được cấu tạo của bảng tuần hoàn các nguyên tố hóa học và nêu được khái niệm liên quan (ô, chu kì, nhóm).
• Nêu được nguyên tắc sắp xếp của bảng tuần hoàn các nguyên tố hóa học (dựa theo cấu hình electron).
• Phân loại được các nguyên tố dựa theo cấu hình electron: nguyên tố s, p, d, f, dựa theo tính chất hóa học: Kim loại, phi kim, khí hiếm).
2. Năng lực
Năng lực chung:
• Năng lực tự chủ và tự học: Chủ động, tích cực tìm hiểu về cấu tạo bảng tuần hoàn các nguyên tố hóa học.
• Năng lực giao tiếp và hợp tác: Sử dụng ngôn ngữ khoa học để nêu được lịch
phát minh định luật tuần hoàn và bảng tuần hoàn các nguyên tố hóa học; Hoạt động nhóm một cách hiệu quả theo đúng yêu cầu của GV, đảm bảo các thành viên trong nhóm đều được tham gia và trình bày báo cáo.
DẠYKÈMQUYNHƠNOFFICIAL
sử
• Năng lực giải quyết vấn đề sáng tạo: Thảo luận với các thành viên trong nhóm nhằm giải quyết các vấn đề trong bài học để hoàn thành nhiệm vụ học tập.
Năng lực riêng:
• Năng lực nhận thức hóa học: Mô tả được cấu tạo của bảng tuần hoàn các nguyên tố hóa học và nêu được các khái niệm liên quan (ô, chu kì, nhóm); Nêu được nguyên tắc sắp xếp của bảng tuần hoàn (dựa theo cấu hình electron), nguyên tố s, p, d, f dựa theo tính chất hóa học: Kim loại, phi kim, khí hiếm).
• Tìm hiểu thế giới tự nhiên dưới góc độ hóa học: Nêu được lịch sử phát minh định luật tuần hoàn và bảng tuần hoàn các nguyên tố hóa học.
• Vận dụng kiến thức kĩ năng đã học: Phân loại được nguyên tố (dựa theo cấu kình electron: nguyên tố s, p, d, f, dựa theo tính chất hóa học: kim loại, phi kim, khí hiếm); xác định được vị trí của nguyên tố trong bảng tuần hoàn dựa vào cấu hình electron.
3. Phẩm chất:
Tham gia tích cực hoạt động nhóm phù hợp với khả năng của bản thân Chăm chỉ tích cực xây dựng bài, có trách nhiệm, chủ động chiếm lĩnh kiến thức theo sự hướng dẫn của GV.
Hình thành tư duy logic, lập luận chặt chẽ, và linh hoạt trong quá trình suy nghĩ.
II. THIẾT BỊ DẠY HỌC VÀ HỌC LIỆU
3. Đối với GV: SGK, Tài liệu giảng dạy, giáo án PPT, hình ảnh hoặc video giới thiệu đối tượng nghiên cứu, vai trò trong đời sống và phương pháp học tập hóa học.
DẠYKÈMQUYNHƠNOFFICIAL
III.
TIẾ
ẾN
- Trả lời câu 11 sgk trang 39:
Dựa vào cấu hình electron, ta có thể phân loại các nguyên tố như sau: + Khối nguyên tố s: Z=20 (kim loại) + Khối nguyên tố p: Z= 6 (phi kim), 8 ( phi kim), 18 (khí hiếm)
DẠYKÈMQUYNHƠNOFFICIAL
- GV yêu cầu HS nêu kết luận về phân loại nguyên tố
• Dựa vào cấu hình electron
• Dựa vào tính chất hóa học
=> Kết luận:
• Dựa vào cấu hình electron, người ta phân loại các nguyên tố thành nguyên tố s, nguyên tố p, nguyên tố d và nguyên tố f.
- GV yêu cầu HS hoạt động nhóm 4 trả lời câu luyện tập sgk trang 40. Bước 2: Thực hiện nhiệm vụ: - HS theo dõi SGK, chú ý nghe, tiếp nhận kiến thức.
• Dựa vào tính chất hóa học người ta phân loại các nguyên tố thành nguyên tố kim loại, nguyên tố phi kim và nguyên tố khí hiếm.
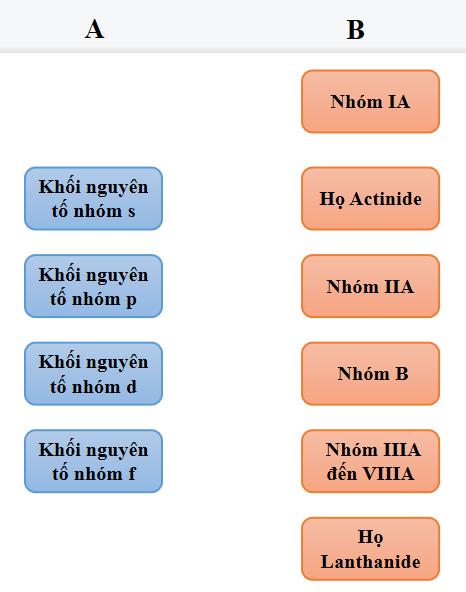
- Trả lời câu luyện tập sgk trang 40: a, Z= 7, 1s22s22p3 b, Nguyên tố p c, Phi kim.
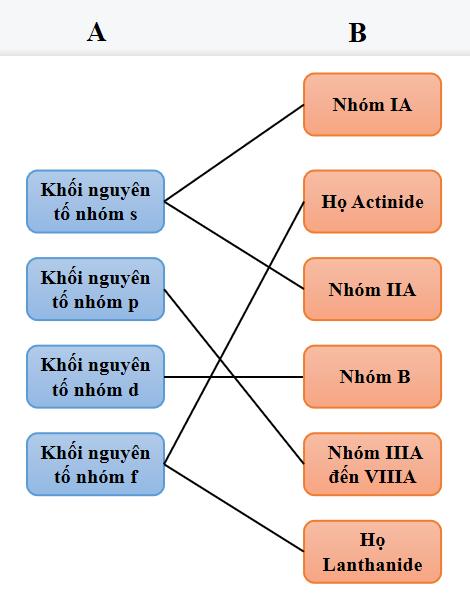
DẠYKÈMQUYNHƠNOFFICIAL
- HS suy nghĩ trả lời câu hỏi.
Bước 3: Báo cáo, thảo luận: - Đại diện nhóm HS giơ tay phát biểu hoặc lên bảng trình bày. - Một số HS khác nhận xét, bổ sung cho bạn.
Bước 4: Kết luận, nhận định: - GV nhận xét kết quả thảo luận nhóm, thái độ làm việc. - GV tổng quát lưu ý lại kiến thức trọng tâm và yêu cầu HS ghi chép đầy đủ vào vở. Hoạt động 6: Trình bày nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn.
a) Mục tiêu: Nêu nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn.
b) Nội dung: HS quan sát hình ảnh kết hợp đọc sgk, thảo luận nhóm, trả lời câu hỏi và hình thành kiến thức.
c) Sản phẩm: Đáp án câu 12 sgk trang 40, kết luận nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn.
d) Tổ chức thực hiện:
HĐ CỦA GV VÀ HS
Bước 1: Chuyển giao nhiệm vụ:
SẢN PHẨM DỰ KIẾN
DẠYKÈMQUYNHƠNOFFICIAL
- GV yêu cầu HS thảo luận nhóm đôi trả lời câu 12 sgk trang 40.
- Trả lời câu 12 sgk trang 40: Điện tích hạt nhân tăng từ trái sang phải trong một chu kì và tăng từ trên xuống dưới trong một nhóm.
- GV yêu cầu HS nêu nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn. + Thứ tự các ô nguyên tố + Chu kì + Nhóm - GV yêu cầu HS hoạt động cá nhân trả lời câu vận dụng sgk trang 40 Bước 2: Thực hiện nhiệm vụ: - HS theo dõi SGK, chú ý nghe, tiếp nhận kiến thức. - HS suy nghĩ trả lời câu hỏi. Bước 3: Báo cáo, thảo luận: - Đại diện nhóm HS giơ tay phát biểu hoặc lên bảng trình bày.
=> Kết luận: Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn:
• Các nguyên tố được xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử.
• Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp cùng một chu kì.
• Các nguyên tố mà nguyên tử có cấu hình electron tương tự nhau được xếp cùng một nhóm.
- Trả lời câu vận dụng sgk trang 40: Si nằm ở ô 14, chu kì 3 nhóm IVA.
DẠYKÈMQUYNHƠNOFFICIAL
- Một số HS khác nhận xét, bổ sung cho bạn.
Bước 4: Kết luận, nhận định: - GV nhận xét kết quả thảo luận nhóm, thái độ làm việc. - GV tổng quát lưu ý lại kiến thức trọng tâm và yêu cầu HS ghi chép đầy đủ vào vở.
C. HOẠT ĐỘNG LUYỆN TẬP
a) Mục tiêu: HS củng cố lại kiến thức về cấu tạo bảng tuần hoàn các nguyên tố hóa học. b) Nội dung: HS vận dụng các kiến thức đã học giải quyết các bài tập về. c) Sản phẩm học tập: Câu trả lời của HS cho các bài t
DẠYKÈMQUYNHƠNOFFICIAL
d) Tổ chức thực hiện: Bước 1: Chuyển giao nhiệm vụ: - GV tổng hợp các kiến thức cần ghi nhớ cho HS. - GV cho HS hoạt động nhóm 4 làm bài tập 1, 2, 3 sgk trang 42 Bước 2: Thực hiện nhiệm vụ: - HS suy nghĩ trả lời. - GV điều hành, quan sát, hỗ trợ. Bước 3: Báo cáo, thảo luận: - HS đại diện nhóm giơ tay phát biểu trả lời hoặc
ảng
ập trong sgk.
lên b
trình bày.
Bước 4: Kết luận, nhận định: - GV chữa bài, chốt đáp án.
- GV nhận xét thái độ làm việc, phương án trả lời của các học sinh, ghi nhận và tuyên dương.
Đáp án: Bài tập 1:
+ Z = 10 cấu hình electron: 1s22s22p6
ô thứ 10, chu kì 2, nhóm VIIIA Khí hiếm.
+ Z= 12 cấu hình electron: 1s22s22p63s2 Ô thứ 12, chu kì 3, nhóm IIA Kim loại.
Bài tập 2: Các nguyên tử có cùng số electron lớp ngoài cùng sẽ có tính chất hóa học tương tự nhau, do đó dãy các nguyên tố câu b và c thỏa mãn yêu cầu đề bài.
Bài tập 3: a, 1s22s22p63s23p6 b, 1s22s22p63s23p6
D. HOẠT ĐỘNG VẬN DỤNG
a) Mục tiêu: Học sinh thực hiện làm bài tập vận dụng để nắm vững kiến thức. b) Nội dung : HS làm việc nhóm đôi hoàn thành bài vận dụng
DẠYKÈMQUYNHƠNOFFICIAL
c) Sản phẩm: Đáp án chi tiết cho câu hỏi vận dụng về số hiệu nguyên tử, cấu hình electron và vị trí trong bảng tuần hoàn..
d) Tổ chức thực hiện: Bước 1 : Chuyển giao nhiệm vụ - GV yêu cầu HS làm bài tập vận dụng: Xác định vị trí nguyên tố chu (ô, chu kì và nhóm) của nguyên tố có: a, Số hiệu nguyên tử là 20, là nguyên tố giúp xương chắc khỏe, phòng ngừa những bệnh loãng xương, giảm tình trạng đau nhức và khó khăn trong vận động, làm nhanh lành các vết nứt gãy trên xương.
b, 9 electron, được sử dụng để điều chế một số dẫn xuất hydrocarbon, làm sản phẩm trung gian để sản xuất ra chất dẻo. c, 28 proton, được dùng trong việc chế tạo hợp kim chống ăn mòn. d, Số khối 52 và 28 neutron, dùng để chế tạo thép không gỉ. Bước 2: Thực hiện nhiệm vụ - HS làm việc nhóm đôi thực hiện nhiệm vụ. - GV điều hành, quan sát, hỗ trợ.
Bước 3 : Báo cáo, thảo luận - HS xung phong phát biểu. Các HS khác nhận xét.
Đáp án : a, Z = 20 ; cấu hình electron : [Ar] 4s2; vị trí : ô 20. Chu kì 3, nhóm IIA (nhóm 2) b, Z = 9 ; cấu hình electron : 1s22s22p5; vị trí: ô 9, chu kì 2, nhóm VIIA (nhóm 17)
DẠYKÈMQUYNHƠNOFFICIAL
c, Z = 28 ; cấu hình electron : [Ar] 3d34s2; vị trí : ô 28, chu kì 4, nhóm VIIIB (nhóm 10)
d, Z=24 ; cấu hình electron : [Ar] 3d54s1 ; vị trí ô 24, chu kì 4, nhóm VIB (nhóm 6)
GV giải thích thêm về cấu hình bão hòa hoặc bán bão hòa.
Do năng lượng phân lớp nd và (n+1)s chênh lệch nhau không nhiều, nên 1e ở phân lớp (n+1)s2 chuyển sang phân lớp nd4 hoặc nd9 để cho phân lớp nd đạt cấu hình bán bão hòa nd5, cấu hình bão hòa nd10 bền hơn.
Bước 4 : Kết luận, nhận định.
- GV nhận xét thái độ làm việc, phương án trả lời của các học sinh, ghi nhận và tuyên dương.
* HƯỚNG DẪN VỀ NHÀ
- Ghi nhớ kiến thức trong bài.
- Hoàn thành bài tập trong sbt, đọc phần đọc thêm sgk trang 41.
- Chuẩn bị bài “Bài 6. Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố, thành phần và một số tính chất của hợp chất trong một chu kì và nhóm.”
DẠYKÈMQUYNHƠNOFFICIAL
Ngày soạn: .../.../...
Ngày dạy: .../.../...
BÀI 6: XU HƯỚNG BIẾN ĐỔI MỘT SỐ TÍNH CHẤT CỦA NGUYÊN TỬ CÁC NGUYÊN TỐ, THÀNH PHẦN VÀ TÍNH CHẤT CỦA HỢP CHẤT TRONG MỘT CHU KÌ VÀ NHÓM (4 tiết)
I. MỤC TIÊU:
1. Kiến thức: Học xong bài này, HS đạt các yêu cầu sau:
• Giải thích được xu huownggs biến đổi bán kính nguyên tử trong một chu kì và trong một nhóm (nhóm A).
• Nhận xét và giải thích được xu hướng biến đổi độ âm điện và tính kim loại, phi kim của nguyên tử các nguyên tố trong một chu kì, trong một nhóm ( nhóm A)
• Nhận xét được xu hướng biến đổi thành phần và tính chất của acid / base của các oxide và các hydroxide thao chu kì. Viết được phương trình hóa học minh họa.
2. Năng lực Năng lực chung:
• Năng lực tự chủ và tự học: Chủ động, tích cực tìm hiểu về sự biến đổi tính chất
DẠYKÈMQUYNHƠNOFFICIAL
của nguyên tố, đơn chấ
• Năng lực giao tiếp và
ợ
hướng
ế
t, hợp chất trong bảng tuần hoàn.
h
p tác: Sử dụng ngôn ngữ khoa học để giải thích được xu
bi
n đổi bán kính nguyên tử trong một chu kì, trong một nhóm (nhóm A) (dựa theo lực hút tĩnh điện của hạt nhân với electrn ngoài cùng và dựa theo số lớp electron tăng trong một nhóm theo chiều từ trên xuống dưới);
Hoạt động nhóm một cách hiệu quả theo đúng yêu cầu của GV, đảm bảo các thành viên trong nhóm đều được hoàn thành nhiệm vụ học tập.
• Năng lực giải quyết vấn đề sáng tạo: Thảo luận với các thành viên trong nhóm nhằm giải quyết các vấn đề trong bài học để hoàn thành nhiệm vụ học tập.
Năng lực riêng:
• Năng lực nhận thức hóa học: Nêu được khái niệm bán kính nguyên tử, độ âm điện, tính kim loại, tính phi kim, tính acid /base của các oxide và hydroxide qua các phương trình hóa học của các phản ứng xảy ra.
• Tìm hiểu thể giới tự nhiên dưới góc độ hóa học: Nêu được lịch sử phát minh định luật tuần hoàn và bảng tuần hoàn các nguyên tổ hóa học.
3. Phẩm chất
• Tham gia tích cực hoạt động nhóm phù hợp với khả năng của bản thân
• Chăm chỉ tích cực xây dựng bài, có trách nhiệm, chủ động chiếm lĩnh kiến thức theo sự hướng dẫn của GV.
• Hình thành tư duy logic, lập luận chặt chẽ, và linh hoạt trong quá trình
DẠYKÈMQUYNHƠNOFFICIAL
ĩ. II. THIẾT BỊ DẠY HỌC VÀ HỌC LIỆU 5. Đối với GV: SGK, Tài liệu giảng dạy, giáo án PPT. 6. Đối với HS: SGK, vở ghi, giấy nháp, đồ dùng học tập (bút, thước...), bảng nhóm, bút viết bảng nhóm.
TIẾN TRÌNH DẠ
HỌC A. HOẠT ĐỘNG KHỞI ĐỘNG (MỞ ĐẦU)
suy ngh
III.
Y
a) Mục tiêu: Nêu vấn đề gợi mở kiến thức, tạo hứng thú học tập cho HS.
b) Nội dung: GV đưa ra câu hỏi mở đầu, HS dự đoán kiến thức.
c) Sản phẩm: Dự đoán của HS về
d) Tổ chức thực hiện: Bước 1: Chuyển giao nhiệm vụ: - GV nêu vấn đề:
Kim loại kiểm là các kim loại thuộc nhóm lA, bao gồm: lithium (LI), sodium (Na), potassium (K), rubidium (Rb), caesium (Cs), francium (Fr). Chúng phản ứng được với nước và giải phóng khí hydrogen. Vậy khả năng phản ứng với nước của các kim loại trên có giống nhau hay không? Dựa vào bảng tuần hoàn các nguyên tố hoá học, chúng ta có thể giải thích được xu hướng biến đổi tính chất hoá học cơ bản của nguyên tử các nguyên tố không?
Bước 2: Thực hiện nhiệm vụ - HS quan sát và chú ý lắng yêu cầu và đưa ra đáp án. Bước 3: Báo cáo, thảo luận: - Các HS xung phong phát biểu trả lời. Bước 4: Kết luận, nhận xét: - GV nhận xét, đánh giá và dẫn dắt vào bài: Bài 6. Xu hướng biến đổi một số tính chất của nguyên tố, đơn chất và hợp chất tong bản tuần hoàn các nguyên tố. B. HÌNH THÀNH KIẾN THỨC MỚI Hoạt động 1: Giải thích xu hướng biến đổi bán kính nguyên tử của các nguyên tố nhóm A.
DẠYKÈMQUYNHƠNOFFICIAL
a) Mục tiêu: Nhận xét được sự biến đổi bán kính nguyên tử trong một chu kì và trong một nhóm A. b) Nội dung: HS thảo luận nhóm trả lời câu hỏi trong sgk để hình thành kiến thức. c) Sản phẩm: Đáp án câu 1, 2 sgk trang 43, kết luận về xu hướng biển đổi tuần hoàn của bán kính hạt nhân.
d) Tổ chức thực hiện:
HĐ CỦA GV VÀ HS
Bước 1: Chuyển giao nhiệm vụ: - GV yêu cầu HS thảo luận nhóm 4 quan sát hình 6.1 sgk trang 43 trả lời câu 1,2 sgk trang 43.
SẢN PHẨM D
1. Bán kính nguyên tử.
Ự
KIẾN
- Trả lời câu 1 sgk trang 43: Bán kính nguyên tử của các nguyên tố trong mỗi chu kì từ trái qua phải nhìn chung giảm, tromg một nhom A từ trên xuống dưới nhìn chung tăng. - Trả lời câu 2 sgk trang 43: + Yếu tố gây ra: điện tích hạt nhân và số lớp electron. + Giải thích: Trong một chu kì, nguyên tử của các nguyên tố có cùng số lớp electron. Từ trái sang phải, điện tích hạt nhân nguyên tử tăng dần nên electron lớp ngoài cùng sẽ bị hạt nhân hút mạnh hơn, vì vậy bán kính nguyên tử của các nguyên tố có xu hướng giảm dần. Trong một nhóm, theo chiều từ
DẠYKÈMQUYNHƠNOFFICIAL
- GV yêu cầu HS kết luận về xu hướng biến đổi bán kính nguyên tử: + Trong một chu kì + Trong một nhóm - GV yêu cầu các nhóm 4 HS thảo luận trả lời câu luyện tập sgk trang 45. - GV yêu cầu HS đọc sgk nêu cách sắp xếp các nguyên tố hóa học trong bảng tuần hoàn các nguyên tố hiện nay.
trên xuống dưới, số lớp electron tăng dần nên bán kính nguyên tử có xu hướng tăng.
=> Kết luận: Bán kính nguyên tử của các nguyên tố nhóm
A có xu hướng biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân:
• Trong một chu kì, nguyên tử của các nguyên tố có cùng số lớp electron. Từ trái sang phải, điện tích hạt nhân nguyên tử tăng dần nên electron lớp ngài cùng sẽ bị hạt nhân hút mạnh hơn, vì vậy bán kính nguyên tử của các nguyên tố có xu hướng giảm dần.
• Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, số lớp electron tăng dần nên bán kính nguyên tử có xu hướng tăng dần.
- Trả lời câu luyện tập sgk trang 43:
Chiều tăng dần bán kính nguyên tử: O, N, Li, Na, K.
DẠYKÈMQUYNHƠNOFFICIAL
- GV yêu cầu HS đưa ra kết luận so sánh cách sắp xếp các nguyên tố hóa học của Mendeleev và hiện đại
Bước 2: Thực hiện nhiệm vụ:
- HS theo dõi SGK, chú ý nghe, tiếp nhận kiến thức.
- HS suy nghĩ trả lời câu hỏi.
Bước 3: Báo cáo, thảo luận:
- Đại diện nhóm HS giơ tay phát biểu hoặc lên bảng trình bày.
- Một số HS khác nhận xét, bổ sung cho bạn.
Bước 4: Kết luận, nhận định:
- GV nhận xét kết quả thảo luận nhóm, phần thuyết trình thái độ làm việc.
- GV tổng quát lưu ý lại kiến thức trọng tâm và yêu cầu HS ghi chép đầy đủ vào vở. Hoạt động 2: Giải thích xu hướng biến độ âm điện nguyên tử của các nguyên tố nhóm A.
a) Mục tiêu: Nhận xét được sự biến đổi độ âm điện nguyên tử trong một chu kì và trong một nhóm A.
b) Nội dung: HS thảo luận nhóm trả lời câu hỏi trong sgk để hình thành kiến thức.
DẠYKÈMQUYNHƠNOFFICIAL
c) Sản phẩm: Đáp án câu 3,4 và luyện tập sgk trang 44, 45 và kết luận xu hướng biến đổi tuần hoàn của độ âm điện các nguyên tố. d) Tổ chức thực hiện:
HĐ CỦA GV VÀ HS
2. Độ âm điện.
ẢN PHẨM DỰ KIẾN Bước 1: Chuyển giao nhiệm vụ: - GV yêu cầu HS đọc sgk, nêu khái niệm độ âm điện. - GV yêu cầu HS thảo luận nhóm 4 quan sát bảng 6.1 sgk trang 44 trả lời câu 3,4 sgk trang 44.
- Độ âm điện của một nguyên tử đặc trưng cho khả năng hút electron của nguyên tử đó khi tạo thành liên kết hóa học. - Trả lời câu 3 sgk trang 44:
+ Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, lực hút giữa hạt nhân với các electron lớp ngoài cùng tăng. Do đó, độ âm điện của nguyên tử các nguyên tố thường tăng dẫn.
+ Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, bán kính nguyên tử tăng nhanh, lực hút giữa hạt nhân với các electron lớp ngoài cùng giảm. Do đó, độ âm điện của các nguyên tố thường giảm dần.
- Trả lời câu 4 sgk trang 44:
+ Các khí hiếm tạo thành rất ít các hợp chất nên chúng không có giá trị độ âm điện
=> Kết luận:
DẠYKÈMQUYNHƠNOFFICIAL
S
- GV yêu cầu HS kết luận về xu hướng biến đổi độ âm điện nguyên tử: + Trong một chu kì + Trong một nhóm - GV yêu cầu các nhóm 4 HS thảo luận trả lời câu luyện tập sgk trang 45. - GV yêu cầu HS đọc sgk nêu cách sắp xếp các nguyên tố hóa học trong bảng tuần hoàn các nguyên tố hiện nay. - GV yêu cầu HS đưa ra kết luận so sánh cách sắp xếp các nguyên tố hóa học của Mendeleev và hiện đại Bước 2: Thực hiện nhiệm vụ:
Độ âm điện nguyên tử của các nguyên tố nhóm A có xu hướng biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân:
• Trong một chu kì, theo chiều tăng của điện tích hạt nhân, lực hút giữa hạt nhân với các electron lớp ngoài cùng cũng tăng. Do đó độ âm điện của nguyên tử các nguyên tố có xu hướng tăng dần.
• Trong một nhóm, theo chiều tăng của điện tích hạt nhân, bán kính nguyên tử tăng nhanh, lực hút giữa hạt nhân với các electron lớp ngoài cùng giảm.
Do đó, độ âm điện của nguyên tử các nguyên tố có xu hướng giảm dần. - Trả lời câu luyện tập sgk trang 45: Chiều tăng dần độ âm điện:
K < Na < Mg < Al
DẠYKÈMQUYNHƠNOFFICIAL
- HS theo dõi SGK, chú ý nghe, tiếp nhận kiến thức.
- HS suy nghĩ trả lời câu hỏi.
Bước 3: Báo cáo, thảo luận:
- Đại diện nhóm HS giơ tay phát biểu hoặc lên bảng trình bày.
- Một số HS khác nhận xét, bổ sung cho bạn.
Bước 4: Kết luận, nhận định:
- GV nhận xét kết quả thảo luận nhóm, phần thuyết trình thái độ làm việc.
- GV tổng quát lưu ý lại kiến thức trọng tâm và yêu cầu HS ghi chép đầy đủ vào vở. Hoạt động 3: Giải thích xu hướng biến đổi tính kim loại, tính phi kim của các nguyên tố nhóm A
a) Mục tiêu: Trình bày, giải thích được sự hình thành ion. Từ đó nêu được khái niệm tính kim loại, tính phi kim và giải thích được xu hướng biến đổi tính kim loại, tính phi kim.
b) Nội dung: HS quan sát hình ảnh kết hợp đọc sgk, thảo luận nhóm, trả lời câu hỏi.
c) Sản phẩm: Kết luận sự biến đổi của tính kim loại và phi kim, đáp án câu 5, 6 và luyện tập trang 46.
d) Tổ chức thực hiện:
DẠYKÈMQUYNHƠNOFFICIAL
HĐ CỦA GV VÀ HS SẢN PHẨM DỰ KIẾN
Bước 1: Chuyển giao nhiệm vụ:
- GV yêu cầu HS hoạt động nhóm 4 trả lời câu 5 sgk trang 45.
3. Tính kim loại, tính phi kim
- GV nêu vấn đề về tính kim loại và tính phi kim - GV yêu cầu HS thảo luận nhóm 4 trả lời câu 6 sgk trang 45. (Gợi ý, khả năng nhường nhận electron của nguyên tử phụ thuộc vào giá trị độ âm điện của chúng) - GV yêu cầu HS kết luận về xu hướng biến đổi tính kim loại, phi kim của các nguyên tố nhóm A theo chiều tăng điện tích hạt nhân:
- Trả lời câu 5 sgk trang 45: + Nguyên tử trung hòa về điện. Nguyên tử nhường bớt electron sẽ tạo hành phần tử có số đơn vị điện tích dương lớn hơn số điện tích âm nên phân tử này tích điện dương: Na nhường 1 electron sẽ tạo thành Na+ tích 1 điện tích dương + Nguyên tử nhận thêm một electron sẽ tạo thành phần tử có số đơn vị điện tích âm lớn hơn số đơn vị điện tích dương nên phần tử này mang điện tích âm: F nhận 1 electron tạo thành F tích 1 điện tích âm
+ Tính kim loại là tính chất của một nguyên tố mà nguyên tử dễ nhường electron để trở thành ion dương (cation)

+ Tính phi kim là tính chất của một nguyên tố mà nguyên tử dễ nhận electron để trở thành ion âm (anion)
- Trả lời câu 6 sgk trang 45: a, Đi từ đầu chu kì đến cuối chu kì, độ âm
DẠYKÈMQUYNHƠNOFFICIAL
+ Trong một chu kì
+ Trong một nhóm
- GV yêu cầu HS hoạt động nhóm đôi trả lời câu luyện tập sgk trang 46.
Bước 2: Thực hiện nhiệm vụ:
- HS theo dõi SGK, chú ý nghe, tiếp nhận kiến thức. - HS suy nghĩ trả lời câu hỏi.
Bước 3: Báo cáo, thảo luận:
- Đại diện nhóm HS giơ tay phát biểu hoặc lên bảng trình bày. - Một số HS khác nhận xét, bổ sung cho bạn.
Bước 4: Kết luận, nhận định:
- GV nhận xét kết quả thảo luận nhóm, phần thuyết trình thái độ làm việc.
- GV tổng quát lưu ý lại kiến thức trọng tâm và yêu cầu HS ghi chép đầy đủ vào vở.
điện tăng dần nên khả năng nhận electron của nguyên tử các nguyên tố tăng theo, khả năng nhường electron giảm dần. b, Đi từ đầu nhóm đến cuối nhóm, độ âm điện giảm dần nên khả năng nhận electron của nguyên tử các nguyên tố giảm theo, khả năng nhường electron tăng dần.
=> Kết luận: Tính kim loại, phi kim của các nguyên tố nhóm A có xu hướng biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân:
• Trong một chu kì, theo chiều tăng điện tích hạt nhân, lực hút giữa hạt nhân với các electron lớp ngoài cùng tăng. Do đó, tính kim loại của các nguyên tố giảm dần, tính phi kim tăng dần.
• Trong một nhóm, theo chiều tăng của điện tích hạt nhân, lực hút giữa hạt nhân với các electron lớp ngoài cùng giảm. Do đó tính kim loại của các nguyên tố tăng dần, tính kim kim giảm dần.
- Trả lời câu luyện tập sgk trang 46:
Tính kim loại: K > Na > Mg.
DẠYKÈMQUYNHƠNOFFICIAL
Hoạt động 4: Giải thích xu hướng biến đổi tính acid-base của oxide và hydroxide tương ứng cheo chu kì.
a) Mục tiêu: Nêu được các hợp chất hydroxide của kim loại và phi kim. Từ đó nhân xét tính acid-base của các oxide và hydroxide tương ứng.
b) Nội dung: HS quan sát hình ảnh kết hợp đọc sgk, thảo luận nhóm, trả lời câu hỏi.
c) Sản phẩm: Đáp án câu 7,8 và luyện tập sgk trang 46,47; kết luận xu hướng biến đổi tuần hoàn tính acid – base của oxide và hydroxide.
d) Tổ chức thực hiện: HĐ CỦA GV VÀ HS SẢN PHẨM DỰ KIẾN
Bước 1: Chuyển giao nhiệm vụ: - GV yêu cầu HS hoạt động nhóm 4 trả lời câu 7,8 sgk trang 46
4. Tính acid-base của oxide và hydroxide - Trả lời câu 7 sgk trang 46: 3 nguyên tố Na, Al và S cùng thuộc chu kì 3 + Khả năng phản ứng với acid: Na2O > Al2O3 > SO3 NaOH > Al(OH)3 > H2SO4 + Khả năng phản ứng với base: Na2O < Al2O3 < SO3 NaOH < Al(OH)3 < H2SO4 - Trả lời câu 8 sgk trang 46: Tính axit, tính base của oxide và hydroxide
DẠYKÈMQUYNHƠNOFFICIAL
- GV yêu cầu HS đưa ra kết luận về xu hướng biến đổi tĩnh acid – base của oxide và hydroxide tương ứng theo chu kì.
- GV yêu cầu HS thảo luận nhóm đôi trả lời câu luyện tập sgk trang 47
Bước 2: Thực hiện nhiệm vụ:
- HS theo dõi SGK, chú ý nghe, tiếp nhận kiến thức. - HS suy nghĩ trả lời câu hỏi.
Bước 3: Báo cáo, thảo luận:
- Đại diện nhóm HS giơ tay phát biểu hoặc lên bảng trình bày. - Một số HS khác nhận xét, bổ sung cho bạn.
Bước 4: Kết luận, nhận định: - GV nhận xét kết quả thảo luận nhóm, thái độ làm việc. - GV tổng quát lưu ý lại kiến thức trọng tâm và yêu cầu HS ghi chép đầy đủ vào vở.
biến đổi tường tự như tính kim loại, phi kim của các nguyên tố trong chu kì. => Kết luận: Trong một chu kì, theo chiều tăng hạt nhân, tính base của oxide và hydroxide tương ứng giảm dần, tính acid tăng dần. - Trả lời câu luyện tập sgk trang 47: Tính acid : HClO4 > H2SO4 > H3PO4 > H2SiO3
DẠYKÈMQUYNHƠNOFFICIAL
C. HOẠT ĐỘNG LUYỆN TẬP
a) Mục tiêu: HS củng cố lại kiến thức về xu hướng biến đổi bán kính nguyên tử, độ âm điện, tính kim loại/ phi kim và tính acid/ base trong bảng tuần hoàn các nguyên tố hóa học.
b) Nội dung: HS vận dụng các kiến thức đã học giải quyết các bài tập về xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố, thành phần, hợp chất trong một chu kì và nhóm.
c) Sản phẩm học tập: Câu trả lời của HS cho các bài tập trong sgk.
d) Tổ chức thực hiện: Bước 1: Chuyển giao nhiệm vụ:
- GV tổng hợp các kiến thức cần ghi nhớ cho HS.
- GV cho HS hoạt động nhóm làm bài tập 3, 4, 5 sgk trang 48
Bước 2: Thực hiện nhiệm vụ:
- HS suy nghĩ trả lời.
- GV điều hành, quan sát, hỗ trợ.
Bước 3: Báo cáo, thảo luận:
- HS đại diện nhóm giơ tay phát biểu trả lời hoặc lên bảng trình bày.
Bước 4: Kết luận, nhận định:
- GV chữa bài, chốt đáp án.
- GV nhận xét thái độ làm việc, phương án trả lời của các học sinh, ghi nhận và tuyên dương.
Đáp án:
DẠYKÈMQUYNHƠNOFFICIAL
Bài tập 3: Đáp án C
Bài tập 4: Fluorine là nguyên tố phi kim có độ âm điện lớn nhất, đứng đầu nhóm nguyên tố halogen nên Flouorine là nguyên tố có tính phi kim mạnh nhất.
Bài tập 5: - Hai đại lượng này tỉ lệ nghịch với nhau.
- Giải thích: Trong một nhóm A từ trên xuống dưới, theo chiều tăng dần điện tích hạt nhân, bán kính nguyên tử của các nguyên tố tăng, độ âm điện giảm.
D. HOẠT ĐỘNG VẬN DỤNG
a) Mục tiêu: Học sinh thực hiện làm bài tập vận dụng để nắm vững kiến thức. b)
DẠYKÈMQUYNHƠNOFFICIAL
Nội dung : HS làm việc nhóm hoàn thành bài vận dụng c) Sản phẩm : Đáp án chi tiết cho câu hỏi vận dụng về bảng tuần hoàn, tính kim loại, phi kim của nguyên tử nguyên tố. d) Tổ chức thực hiện: Bước 1 : Chuyển giao nhiệm vụ - GV yêu cầu HS trả lời câu vận dụng sgk trang 47
Bước 2: Thực hiện nhiệm vụ
- HS làm việc nhóm đôi thực hiện nhiệm vụ.
- GV điều hành, quan sát, hỗ trợ.
Bước 3 : Báo cáo, thảo luận
- HS xung phong phát biểu. Các HS khác nhận xét.
Đáp án : - Các nguyên tố tạo nên aspartame : C, H, O, N.
- Vị trí các nguyên tố :
+ H : ô số 1, chu kì 1, nhóm IA
+ C : ô số 6, chu kì 2, nhóm IVA
+ N : ô số 7, chu kì 2, nhóm VA
+ O : ô số 8, chu kì 2, nhóm VIA.
- Tính phi kim tăng dần : H < C < N < O => Tính phi kim mạnh nhất : O
Bước 4 : Kết luận, nhận định. - GV nhận xét thái độ làm việc, phương án trả lời của các học sinh, ghi nhận và tuyên dương.
* HƯỚNG DẪN VỀ NHÀ - Ghi nhớ kiến thức trong bài.
- Hoàn thành bài tập trong sbt, đọc phần đọc thêm sgk trang 41.
DẠYKÈMQUYNHƠNOFFICIAL
- Chuẩn bị bài “Bài 7. Định luật tuần hoàn – ý nghĩa của bảng tuần hoàn các nguyên tố hóa học.”
Ngày soạn: . . . /. . . /. . .
Ngày dạy: . . . /. . . /. . .
BÀI 5: CẤU TẠO BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌC
I. MỤC TIÊU:
1. Kiến thức: Học xong bài này, HS đạt các yêu cầu sau:
• Nêu được lịch sử phát minh định luật tuần hoàn và bảng tuần hoàn các nguyên tố hóa học.
• Mô tả được cấu tạo của bảng tuần hoàn các nguyên tố hóa học và nêu được khái niệm liên quan (ô, chu kì, nhóm).
• Nêu được nguyên tắc sắp xếp của bảng tuần hoàn các nguyên tố hóa học (dựa theo cấu hình electron).
• Phân loại được các nguyên tố dựa theo cấu hình electron: nguyên tố s, p,d, f; dựa theo tính chất hóa học: Kim loại, phi kim, khí hiếm)
2. Năng lực Năng lực chung:
• Năng lực tự chủ và tự học: Chủ
DẠYKÈMQUYNHƠNOFFICIAL
động, tích cực tìm hiểu về cấu tạo bảng tuần hoàn các nguyên tố hóa học. • Năng lực giao tiếp và hợp tác: Sử dụng ngôn ngữ khoa học để nêu được lịch sử phát minh định luật tuần hoàn và bảng tuần hoàn các nguyên tố hóa học;
Hoạt động nhóm một cách hiệu quả theo đúng yêu cầu của GV, đảm bảo các thành viên trong nhóm đều được tham gia và trình bày báo cáo.
• Năng lực giải quyết vấn đề và sáng tạo: Thảo luận với các thành viên trong nhóm nhằm giải quyết các vấn đề trong bài học để hoàn thành nhiệm vụ học tập. Năng lực riêng:
• Năng lực nhận thức hóa học: Mô tả được cấu tạo của bảng tuần hoàn các nguyên tố hóa học và nêu được các khái niệm liên quan (ô, chu kì, nhóm); Nêu được nguyên tắc sắp xếp của bảng tuần hoàn (dựa theo cấu hình electron: nguyên tố s, p, d, f; dựa theo tính chất hóa học: Kim loại, phi kim, khí hiếm).
• Tìm hiểu thế giới tự nhiên dưới góc độ hóa học: Nêu được lịch sử phát minh định luật tuần hoàn và bảng tuần hoàn các nguyên tố hóa học.
• Vận dụng kiến thức kĩ năng đã học: Phân loại được nguyên tố (dựa theo cấu hình electron: nguyên tố s, p, d, f; dựa theo tính chất hóa học: Kim loại, phi kim, khí hiếm); Xác định được vị trí của nguyên tố trong bảng tuần hoàn dựa vào cấu hình electron.
3. Phẩm chất
• Tham gia tích cực hoạt động nhóm phù hợp với khả năng của bản thân
• Chăm chỉ tích cực xây dựng bài, có trách nhiệm, chủ động chiếm lĩnh kiến thức theo sự hướng dẫn của GV.
• Hình thành tư duy logic, lập luận chặt chẽ, và linh hoạt trong quá trình suy nghĩ.
1. Đối với GV: SGK, Tài liệu giảng dạy, giáo án PPT, hình ảnh hoặc video giới thiệu đối tượng nghiên cứu, vai trò trong đời sống và phương pháp học tập hóa học.
DẠYKÈMQUYNHƠNOFFICIAL
II. THIẾT BỊ DẠY HỌC VÀ HỌC LIỆU
2. Đối với HS: SGK, vở ghi, giấy nháp, đồ dùng học tập (bút, thước. . . ), bảng nhóm, bút viết bảng nhóm.
III. TIẾN TRÌNH DẠY HỌC
A. HOẠT ĐỘNG KHỞI ĐỘNG (MỞ ĐẦU)
a) Mục tiêu: Nêu vấn đề gợi mở kiến thức, tạo hứng thú học tập cho HS. b) Nội dung: GV đưa ra câu hỏi mở đầu, HS dự đoán kiến thức. c) Sản phẩm: Dự đoán của HS về nguyên tắc sắp xếp nguyên tố trong bảng tuần hoàn. d) Tổ chức thực hiện: Bước 1: Chuyển giao nhiệm vụ: - GV nêu vấn đề: Cách đây hàng nghìn năm, người ta chỉ biết đến một số nguyên tố như đông (copper), bạc (silver) và vàng. Mãi đến năm 1700, cũng chỉ mới có 13 nguyên tố được xác định. Khi đó, các nhà khoa học nghi ngờ rằng vẫn còn nhiều nguyên tố bí ẩn khác chưa được khám phá. Bằng việc sử dụng các phương pháp hóa học hiện đại, chỉ trong một thập kỉ (1765- 1775) đã có thêm 5 nguyên tố được xác định. Trong đó có 3 khí không màu là hydrogen, oxygen và nitrogen. Tính đến năm 2016, tổng cộng đã có 118 nguyên tố hóa học được xác định. Trong bảng tuần hoàn, các nguyên tố được sắp xếp theo nguyên tắc nào và có mối liên hệ như thế nào với cấu hình electron nguyên tử của nguyên tố đó?
DẠYKÈMQUYNHƠNOFFICIAL
Bước 2: Thực hiện nhiệm vụ
- HS quan sát và chú ý lắng yêu cầu và đưa ra đáp án.
Bước 3: Báo cáo, thảo luận:
- Các HS xung phong phát biểu trả lời.
Bước 4: Kết luận, nhận xét: - GV nhận xét, đánh giá và dẫn dắt vào bài: Bài 5. Cấu tạo bảng tuần hoàn các nguyên tố hóa học.
B. HÌNH THÀNH KIẾN THỨC MỚI
Hoạt động 1: Tìm hiểu lịch sử phát minh định luật tuần hoàn và bảng tuần hoàn các nguyên tố hóa học.
a) Mục tiêu: Dự đoán nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn. Qua đó tìm hiểu lịch sử phát minh định luật tuần hoàn và bảng tuần hoàn các nguyên tố hóa học.
b) Nội dung: HS thảo luận nhóm trả lời câu hỏi trong sgk để hình thành kiến thức.
c) Sản phẩm: Đáp án câu 1, 2, 3, 4 sgk trang 36 và so sánh cách sắp xếp các nguyên tố hóa học của Mendeleev và hiện đại d) Tổ chức thực hiện:
HĐ CỦA GV VÀ HS
Bước 1: Chuyển giao nhiệm vụ: - GV chia lớp thành 4 – 5 nhóm, yêu cầu các nhóm
SẢN PHẨM DỰ KIẾN
DẠYKÈMQUYNHƠNOFFICIAL
quan sát các hình
và
ả
trả lời các câu hỏi 1,
.
5. 1, 5. 2
th
o luận
2, 3, 4 sgk trang 36
1. Lịch sử phát minh định luật tuần hoàn và bảng tuần hoàn các nguyên tố hóa học. - Trả lời câu 1 sgk trang 36: Mendeleev đã sắp xếp các nguyên tố thành các cột theo khối lượng nguyên tử tăng dần được đặt sau nguyên tố. Những nguyên tố
- GV yêu cầu HS đọc sgk nêu cách sắp xếp các nguyên tố hóa học trong bảng tuần hoàn các nguyên tố hiện nay. - GV yêu cầu HS đưa ra kết luận so sánh cách sắp xếp các nguyên tố hóa học của Mendeleev và hiện đại Bước 2: Thực hiện nhiệm vụ: - HS theo dõi SGK, chú ý nghe, tiếp nhận kiến thức.
chưa biết được đánh dấu hỏi phí trước giá trị khối lượng nguyên tử.
- Trả lời câu 2 sgk trang 36: Nguyên tử khối của iodine (I) là 127, của tellurium (Te) là 128 nhưng Te lại đứng trước I. Điều này trái với cách sắp xếp của Mendeleev.
- Trả lời câu 3 sgk trang 36: Các dấu chấm hỏi là những dự đoán của Mendeleev đối với các nguyên tố chưa tìm ra hoặc dự đoán về nguyên tử khối của các nguyên tố. - Trả lời câu 4 sgk trang 36: Sc (? = 45), Ga (? =68), Ge (? =70). - Trong bảng tuần hoàn các nguyên tố hóa học hiện nay, các nguyên tố được sắp xếp theo chiều tăng điện tích hạt nhân. → Kết luận: Năm 1896, nhà hóa học Mendeleev đã công bố bảng tuần hoàn các nguyên tố hóa học, trong đó các nguyên tố được sắp xếp theo chiều tăng dần của khối lượng nguyên tử. Bảng tuần hoàn hiện đại ngày nay được xây dựng trên cơ sở mối liên hệ giữa số hiệu nguyên tử và tính chất của nguyên tố, các nguyên tố được sắp xếp theo thứ tự tăng dần của điện tích hạt nhân.
DẠYKÈMQUYNHƠNOFFICIAL
- HS suy nghĩ trả lời câu hỏi.
Bước 3: Báo cáo, thảo luận:
- Đại diện nhóm HS giơ tay phát biểu hoặc lên bảng trình bày.
- Một số HS khác nhận xét, bổ sung cho bạn.
Bước 4: Kết luận, nhận định: - GV nhận xét kết quả thảo luận nhóm, phần thuyết trình thái độ làm việc.
- GV tổng quát lưu ý lại kiến thức trọng tâm và yêu cầu HS ghi chép đầy đủ vào vở.
Hoạt động 2: Tìm hiểu về ô số nguyên tố
a) Mục tiêu: Trình bày khái niệm ô nguyên tố và các thông tin của ô nguyên tố trong ô nguyên tố.
b) Nội dung: HS quan sát hình ảnh kết hợp đọc sgk, thảo luận nhóm, trả lời câu hỏi 5 sgk trang 38.
c) Sản phẩm: Khái niệm ô nguyên tố, đáp án câu 5, luyện tập sgk trang 38.
d) Tổ chức thực hiện: HĐ CỦA GV VÀ HS SẢN PHẨM DỰ KIẾN
Bước 1: Chuyển giao nhiệm vụ: - GV yêu
DẠYKÈMQUYNHƠNOFFICIAL
cầu HS thảo luận nhóm đôi, hoàn thành câu 5 sgk trang 38. 2. Bảng tuần hoàn các nguyên tố
ọc. - Trả lời
ỏ
5
15: + Số hiệu
tử: 13 + Kí hiệu
họ
+ Số oxi
+3 + Cấu
electron:
+ Độ âm
ệ
hóa h
câu h
i
sgk trang
nguyên
hóa
c: Al
hóa:
hình
[Ne] 3s23p1.
đi
n: 1,61
- GV yêu cầu HS đưa ra khái niệm ô nguyên tố: + Trong bảng tuần hoàn các nguyên tố hóa học, ô nguyên tố là gì?
+ Nêu mối liên hệ giữa số thứ tự của ô nguyên tố với số hiệu nguyên tử của nguyên tố hóa học.
- GV yêu cầu HS thảo luận nhóm đôi trả lời câu luyện tập sgk trang 38:
Quan sát hình 5. 3, cho biết số electron lớp ngoài cùng, số proton của nguyên tử aluminium.

Bước 2: Thực hiện nhiệm vụ:
- HS theo dõi SGK, chú ý nghe, tiếp nhận kiến thức.
- HS suy nghĩ trả lời câu hỏi.
Bước 3: Báo cáo, thảo luận:
- Đại diện nhóm HS giơ tay phát biểu hoặc lên bảng trình bày.
- Một số HS khác nhận xét, bổ sung cho bạn.
Bước 4: Kết luận, nhận định: - GV nhận xét kết quả thảo luận nhóm, phần thuyết trình thái độ làm việc. - GV tổng quát lưu ý lại kiến thức trọng tâm và yêu cầu HS ghi chép đầy đủ vào vở
+ Nguyên tử khối trung bình: 26,98.
→ Kết luận: Mỗi ô nguyên tố hóa học được xếp vào một ô trong bảng tuần hoàn các nguyên tố hóa học, gọi là ô nguyên tố. Số thứ tự của một ô nguyên tố bằng số hiệu nguyên tử của nguyên tố hóa học trong ô đó. - Trả lời luyện tập sgk trang 38: + Số electron lớp ngoài cùng: 3 + Số proton: 13
DẠYKÈMQUYNHƠNOFFICIAL
Hoạt động 3: Tìm hiểu về chu kì
a) Mục tiêu: Nêu được khái niệm về chu kì và đặc điểm của chu kì và xác định được chu kì dựa vào số lớp electron. b) Nội dung: HS quan sát hình ảnh kết hợp đọc sgk, thảo luận nhóm, trả lời câu hỏi. c) Sản phẩm: khái niệm chu kì, đặc điểm của chu kì trong bảng tuần hoàn, đáp án câu 6 và luyện tập sgk trang 38.
d) Tổ chức thực hiện: HĐ CỦA GV VÀ HS
Bước 1: Chuyển giao nhiệm vụ: - GV yêu cầu HS thảo luận nhóm đôi, hoàn thành câu 6 sgk trang 38.
SẢN PHẨM DỰ KIẾN
- Số lớp electron của nguyên tử các nguyên tố trong từng chu kì bằng nhau.

- GV yêu cầu HS đưa ra kết luận khái niệm và đặc điểm của chu kì: + Chu kì là gì? + Nêu mối liên hệ giữ số thứ tự chu kì và số lớp electron.
+ Quan sát bảng tuần hoàn sgk trang 37, hãy cho biết hiện tại bảng tuần hoàn có bao nhiêu chu kì? Nêu các chu kì bé và chu kì lớn (Coi chu kì bé có ≤ 8 nguyên tố, còn lại là chu kì lớn)
→ Kết luận:
Các nguyên tố có cùng số lớp electron trong cùng nguyên tử được xếp thành 1 hàng, gọi là chu kì. Số thứ tự của chu kì bằng số lớp electron của nguyên tử các nguyên tố trong chu kì. Bảng tuần hoàn gồm 7 chu kì: + Các chu kì 1, 2 và 3 là các chu kì nhỏ. + Các chu kì 4, 5, 6 và 7 là các chu kì lớn. - Trả lời câu luyện tập sgk trang 38: Z= 20
DẠYKÈMQUYNHƠNOFFICIAL
- GV yêu cầu HS làm việc cá nhân hoàn thành câu luyện tập sgk trang 38:
Dựa vào cấu hình electron, em hãy cho biết nguyên tố cố số hiệu nguyên tử là 20 thuộc chu kì nào trong bảng tuần hoàn.
Bước 2: Thực hiện nhiệm vụ:
- HS theo dõi SGK, chú ý nghe, tiếp nhận kiến thức.
- HS suy nghĩ trả lời câu hỏi.
Bước 3: Báo cáo, thảo luận:
- Đại diện nhóm HS giơ tay phát biểu hoặc lên bảng trình bày.
- Một số HS khác nhận xét, bổ sung cho bạn.
Bước 4: Kết luận, nhận định:
- GV nhận xét kết quả thảo luận nhóm, thái độ làm việc. - GV tổng quát lưu ý lại kiến thức trọng tâm và yêu cầu HS ghi chép đầy đủ vào vở.
Cấu hình electron là: 1s22s22p63s23p64s2 Nguyên tử của nguyên tố có 4 lớp electron nên thuộc chu kì 4. Hoạt động 4: Tìm hiểu về nhóm a) Mục tiêu: Nêu được khái niệm về nhóm và xác đị
DẠYKÈMQUYNHƠNOFFICIAL
nh được nhóm dựa vào số electron hóa trị. b) Nội dung: HS quan sát hình ảnh kết hợp đọc sgk, thảo luận nhóm, trả lời câu hỏi và hình thành kiến thức. c) Sản phẩm: khái niệm electron hóa trị, nhóm; đặc điểm của nhóm; khái niệm electron hóa trị, đáp án câu 7, 8 sgk trang 38. d) Tổ chức thực hiện:
HĐ CỦA GV VÀ HS
Bước 1: Chuyển giao nhiệm vụ:
- GV yêu cầu HS thảo luận nhóm 4, trả lời câu 7, 8 sgk trang 38. (gợi ý câu 7: Em hãy chú ý đến số lượng electron lớp ngoài cùng của các nguyên tố trong 1 nhóm).
SẢN PHẨM DỰ KIẾN
- Trả lời câu 7 sgk trang 38: Các nguyên tố trong cùng một nhóm có cấu hình electron tương tự nhau.
- Trả lời câu 8 sgk trang 38: Mỗi nhóm 1 cột, riêng nhóm VIIIB có 3 cột (cột 8, 9, 10).
- GV yêu cầu HS đọc sgk, tìm hiểu electron hóa trị là gì?
- Electron hóa trị là những electron có khả năng tham gia hình thành liên kết hóa học. Chúng thường nằm ở lớp ngoài cùng hoặc phân lớp ngoài cùng nếu phân lớp đó chưa bão hòa.
- GV yêu cầu các nhóm 4 HS thảo luận trả lời câu 9 sgk trang 39.
- Số electron hóa trị bằng số thứ tự nhóm A: 1 electron hóa trị - IA 2 electron hóa trị - IIA
…
- GV yêu cầu HS dựa vào đáp án các câu 7, 8, 9, đọc sgk nêu kết luận về nhóm: + Khái niệm về nhóm.
→ Kết luận:
+ Nhóm là tập hợp các nguyên tố mà nguyên tử có cấu hình electron tương tự nhau do đó
DẠYKÈMQUYNHƠNOFFICIAL
+ Mối liên hệ giữa số thứ thự nhóm A và số
electron ở lớp ngoài cùng.
Bước 2: Thực hiện nhiệm vụ:
- HS theo dõi SGK, chú ý nghe, tiếp nhận kiến thức.
- HS suy nghĩ trả lời câu hỏi.
Bước 3: Báo cáo, thảo luận:
- Đại diện nhóm HS giơ tay phát biểu hoặc lên bảng trình bày.
- Một số HS khác nhận xét, bổ sung cho bạn.
Bước 4: Kết luận, nhận định:
- GV nhận xét kết quả thảo luận nhóm, thái độ làm việc.
- GV tổng quát lưu ý lại kiến thức trọng tâm và yêu cầu HS ghi chép đầy đủ vào vở.
tính chất hóa học gần giống nhau và được
xếp theo cột.
+ Số thứ tự nhóm A bằng số electron ở lớp ngoài cùng của nguyên tử các nguyên tố trong nhóm.
Hoạt động 5: Phân loại nguyên tố dựa vào cấu hình electron và tính chất hóa học.
a) Mục tiêu: Phân loại được các nguyên tố dựa vào cấu hình electron và tính chất hóa học. b) Nội dung: HS quan sát hình ảnh kết hợp đọc sgk, thảo luận nhóm, trả lời câu hỏi và hình thành kiến thức. c) Sản phẩm: Đáp án câu 11 sgk trang 39, kết luận về phân loại các nguyên tố, đáp án luyện tập sgk trang 40.
DẠYKÈMQUYNHƠNOFFICIAL
HĐ CỦA
VÀ
SẢN
Ẩ
DỰ
ẾN
d) Tổ chức thực hiện:
GV
HS
PH
M
KI
Bước 1: Chuyển giao nhiệm vụ:
- GV yêu cầu HS hoạt động nhóm 4, thảo luận trả lời câu 11 sgk trang 39 và nhận xét mối liên hệ giữa khối các nguyên tố hóa học s, p, d, f và nguyên tố trong các nhóm bằng cách nối nội dung của cột A với cột B sao cho phù hợp:
- Trả lời câu 11 sgk trang 39:
Dựa vào cấu hình electron, ta có thể phân loại các nguyên tố như sau:
+ Khối nguyên tố s: Z=20 (kim loại)
+ Khối nguyên tố p: Z= 6 (phi kim), 8 (phi kim), 18 (khí hiếm)


- GV yêu cầu HS nêu kết luận về phân loại nguyên tố
+ Dựa vào cấu hình electron
+ Dựa vào tính chất hóa học
→ Kết luận:
+ Dựa vào cấu hình electron, người ta phân loại các nguyên tố thành nguyên tố s, nguyên tố p, nguyên tố d và nguyên tố f.
+ Dựa vào tính chất hóa học người ta phân loại các nguyên tố thành nguyên tố kim loại, nguyên tố phi kim và nguyên tố khí hiếm.
DẠYKÈMQUYNHƠNOFFICIAL
- GV yêu cầu HS hoạt động nhóm 4 trả lời câu luyện tập sgk trang 40.
Bước 2: Thực hiện nhiệm vụ:
- HS theo dõi SGK, chú ý nghe, tiếp nhận kiến thức.
- HS suy nghĩ trả lời câu hỏi.
Bước 3: Báo cáo, thảo luận:
- Đại diện nhóm HS giơ tay phát biểu hoặc lên bảng trình bày.
- Một số HS khác nhận xét, bổ sung cho bạn.
Bước 4: Kết luận, nhận định:
- GV nhận xét kết quả thảo luận nhóm, thái độ làm việc.
- GV tổng quát lưu ý lại kiến thức trọng tâm và yêu cầu HS ghi chép đầy đủ vào vở.
- Trả lời câu luyện tập sgk trang 40: a, Z= 7, 1s22s22p3 b, Nguyên tố p c, Phi kim.
Hoạt động 6: Trình bày nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn. a) Mục tiêu: Nêu nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn. b) Nội dung: HS quan sát hình ảnh kết hợp đọc sgk, thảo luận nhóm, trả lời câu hỏi và hình thành kiến thức. c) Sản phẩm: Đáp án câu 12 sgk trang 40, kết luận nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn. d) Tổ chức thực hiện: HĐ CỦA GV VÀ HS
ẢN PHẨM DỰ KIẾN Bước 1: Chuyển giao nhiệm vụ: - Trả lời câu 12 sgk trang 40:
DẠYKÈMQUYNHƠNOFFICIAL
S
- GV yêu cầu HS thảo luận nhóm đôi trả lời câu 12 sgk trang 40.
Điện tích hạt nhân tăng từ trái sang phải trong một chu kì và tăng từ trên xuống dưới trong một nhóm.
- GV yêu cầu HS nêu nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn.
+ Thứ tự các ô nguyên tố
+ Chu kì
+ Nhóm
- GV yêu cầu HS hoạt động cá nhân trả lời câu vận dụng sgk trang 40
Bước 2: Thực hiện nhiệm vụ:
- HS theo dõi SGK, chú ý nghe, tiếp nhận kiến thức.
- HS suy nghĩ trả lời câu hỏi.
Bước 3: Báo cáo, thảo luận:
- Đại diện nhóm HS giơ tay phát biểu hoặc lên bảng trình bày.
- Một số HS khác nhận xét, bổ sung cho bạn.
Bước 4: Kết luận, nhận định: - GV nhận xét kết quả thảo luận nhóm, thái độ làm việc.
→ Kết luận: Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn: + Các nguyên tố được xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử.
+ Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp cùng một chu kì. + Các nguyên tố mà nguyên tử có cấu hình electron tương tự nhau được xếp cùng một nhóm. - Trả lời câu vận dụng sgk trang 40: Si nằm ở ô 14, chu kì 3 nhóm IVA.
DẠYKÈMQUYNHƠNOFFICIAL
- GV tổng quát lưu ý lại kiến thức trọng tâm
và yêu cầu HS ghi chép đầy đủ vào vở.
C. HOẠT ĐỘNG LUYỆN TẬP
a) Mục tiêu: HS củng cố lại kiến thức về cấu tạo bảng tuần hoàn các nguyên tố hóa học.
b) Nội dung: HS vận dụng các kiến thức đã học giải quyết các bài tập về.
c) Sản phẩm học tập: Câu trả lời của HS cho các bài tập trong sgk.
d) Tổ chức thực hiện:
Bước 1: Chuyển giao nhiệm vụ:
- GV tổng hợp các kiến thức cần ghi nhớ cho HS.
- GV cho HS hoạt động nhóm làm bài tập 1, 2, 3 sgk trang 42
Bước 2: Thực hiện nhiệm vụ:
- HS suy nghĩ trả lời.
- GV điều hành, quan sát, hỗ trợ.
Bước 3: Báo cáo, thảo luận:
- HS đại diện nhóm giơ tay phát biểu trả lời hoặc lên bảng trình bày.
Bước 4: Kết luận, nhận định:
- GV chữa bài, chốt đáp án.
- GV nhận xét thái độ làm việc, phương án trả lời của các học sinh, ghi nhận và tuyên dương.
Đáp án: Bài tập 1:
+ Z = 10 cấu hình electron: 1s22s22p6 Ô thứ 10, chu kì 2, nhóm VIIIA
Khí hiếm.
+ Z= 12 cấu hình electron: 1s22s22p63s2
DẠYKÈMQUYNHƠNOFFICIAL
Ô thứ 12, chu kì 3, nhóm IIA
Kim loại.
Bài tập 2: Các nguyên tử có cùng số electron lớp ngoài cùng sẽ có tính chất hóa học tương tự nhau, do đó dãy các nguyên tố câu b và c thỏa mãn yêu cầu đề bài.
Bài tập 3: a, 1s22s22p63s23p6 b, 1s22s22p63s23p6
D. HOẠT ĐỘNG VẬN DỤNG
a) Mục tiêu: Học sinh thực hiện làm bài tập vận dụng để nắm vững kiến thức. b) Nội dung: HS làm việc nhóm đôi hoàn thành bài vận dụng. c) Sản phẩm: Đáp án chi tiết cho câu hỏi vận dụng về số hiệu nguyên tử, cấu hình electron và vị trí trong bảng tuần hoàn. . d) Tổ chức thực hiện: Bước 1: Chuyển giao nhiệm vụ - GV yêu cầu HS làm bài tập vận dụng: Xác định vị trí nguyên tố chu (ô, chu kì và nhóm) của nguyên tố có: a, Số hiệu nguyên tử là 20, là nguyên tố giúp xương chắc khỏe, phòng ngừa những bệnh loãng xương, giảm tình trạng đau nhức và khó khăn trong vận động, làm nhanh lành các vết nứt gãy trên xương. b, 9 electron, được sử dụng để điều chế một số dẫn xuất hydrocarbon, làm sản phẩm trung gian để sản xuất ra chất dẻo. c, 28 proton, được dùng trong việc chế tạo hợp kim chống ăn mòn. d, Số khối 52 và 28 neutron, dùng để chế tạo thép không gỉ.
Bước 2: Thực hiện nhiệm vụ - HS làm việc nhóm đôi thực hiện nhiệm vụ. - GV điều hành, quan sát, hỗ trợ.
DẠYKÈMQUYNHƠNOFFICIAL
Bước 3: Báo cáo, thảo luận - HS xung phong phát biểu. Các HS khác nhận xét.
Đáp án: a, Z = 20; cấu hình electron: [Ar] 4s2; vị trí: ô 20. Chu kì 3, nhóm IIA (nhóm 2) b, Z = 9; cấu hình electron: 1s22s22p5; vị trí: ô 9, chu kì 2, nhóm VIIA (nhóm 17) c, Z = 28; cấu hình electron: [Ar] 3d34s2; vị trí: ô 28, chu kì 4, nhóm VIIIB (nhóm 10)
d, Z=24; cấu hình electron: [Ar] 3d54s1; vị trí ô 24, chu kì 4, nhóm VIB (nhóm 6) GV giải thích thêm về cấu hình bão hòa hoặc bán bão hòa.
Do năng lượng phân lớp nd và (n+1)s chênh lệch nhau không nhiều, nên 1e ở phân lớp (n+1)s2 chuyển sang phân lớp nd4 hoặc nd9 để cho phân lớp nd đạt cấu hình bán bão hòa nd5, cấu hình bão hòa nd10 bền hơn. Bước 4: Kết luận, nhận định. - GV nhận xét thái độ làm việc, phương án trả lời của các học sinh, ghi nhận và tuyên dương.
* HƯỚNG DẪN VỀ NHÀ
Ghi nhớ kiến thức trong bài. Hoàn thành bài tập trong sbt, đọc phần đọc thêm sgk trang 41. Chuẩn bị bài “Bài 6. Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố, thành phần và một số tính chất của hợp chất trong một chu kì và nhóm. ”
DẠYKÈMQUYNHƠNOFFICIAL
Ngày soạn: . . . /. . . /. . .
Ngày dạy: . . . /. . . /. . .
BÀI 6: XU HƯỚNG BIẾN ĐỔI MỘT SỐ TÍNH CHẤT CỦA NGUYÊN TỬ
CÁC NGUYÊN TỐ, THÀNH PHẦN VÀ TÍNH CHẤT CỦA HỢP CHẤT TRONG MỘT CHU KÌ VÀ NHÓM (4 tiết)
I. MỤC TIÊU:
1. Kiến thức: Học xong bài này, HS đạt các yêu cầu sau:
• Giải thích được xu hướng biến đổi bán kính nguyên tử trong một chu kì và trong một nhóm (nhóm A).
• Nhận xét và giải thích được xu hướng biến đổi độ âm điện và tính kim loại, phi kim của nguyên tử các nguyên tố trong một chu kì, trong một nhóm (nhóm A)
• Nhận xét được xu hướng biến đổi thành phần và tính chất của acid / base của các oxide và các hydroxide thao chu kì. Viết được phương trình hóa học minh họa.
2. Năng lực Năng lực chung:
• Năng lực tự chủ và tự học: Chủ động, tích cực tìm hiểu về sự biến đổi tính chất của nguyên tố, đơn chất, hợp chất trong bảng tuần hoàn.
l
c giao ti
p và hợp tác: Sử dụng ngôn ngữ khoa học để giải thích được xu hướng biến đổi bán kính nguyên tử trong một chu kì, trong một nhóm (nhóm A) (dựa theo lực hút tĩnh điện của hạt nhân với electron ngoài cùng và dựa theo số lớp electron tăng trong một nhóm theo chiều từ trên xuống dưới);
DẠYKÈMQUYNHƠNOFFICIAL
• Năng
ự
ế
Hoạt động nhóm một cách hiệu quả theo đúng yêu cầu của GV, đảm bảo các thành viên trong nhóm đều được hoàn thành nhiệm vụ học tập.
• Năng lực giải quyết vấn đề và sáng tạo: Thảo luận với các thành viên trong nhóm nhằm giải quyết các vấn đề trong bài học để hoàn thành nhiệm vụ học tập. Năng lực riêng:
• Năng lực nhận thức hóa học: Nêu được khái niệm bán kính nguyên tử, độ âm điện, tính kim loại, tính phi kim, tính acid / base của các oxide và hydroxide qua các phương trình hóa học của các phản ứng xảy ra.
• Tìm hiểu thế giới tự nhiên dưới góc độ hóa học: Nêu được lịch sử phát minh định luật tuần hoàn và bảng tuần hoàn các nguyên tố hóa học.
• Vận dụng kiến thức kĩ năng đã học: Giải thích được xu hướng biến đổi bán kính nguyên tử trong một chu kì, trong một nhóm (nhóm A) (dựa theo lực hút tĩnh điện của hạt nhân với electron ngoài cùng và dựa theo số lớp electron tăng trong một nhóm theo chiều từ trên xuống dưới); Nhân xét và giải thích được xu hướng biến đổi độ âm điện và tính kim loại, phi kim của nguyên tử các nguyên tố trong một chu kì, trong một nhóm ( nhóm A); Nhận xét được xu hướng biến đổi thành phần và tính chất acid / base của các oxide và các hydroxide theo chu kì, viết được phương trình hóa học minh họa.
DẠYKÈMQUYNHƠNOFFICIAL
•
ự
• Chăm chỉ tích
ự
ự
•
ĩ.
THIẾT BỊ DẠY HỌ
3. Phẩm chất
Tham gia tích c
c hoạt động nhóm phù hợp với khả năng của bản thân
c
c xây dựng bài, có trách nhiệm, chủ động chiếm lĩnh kiến thức theo s
hướng dẫn của GV.
Hình thành tư duy logic, lập luận chặt chẽ, và linh hoạt trong quá trình suy ngh
II.
C VÀ HỌC LIỆU
1. Đối với GV: SGK, Tài liệu giảng dạy, giáo án PPT.
2. Đối với HS: SGK, vở ghi, giấy nháp, đồ dùng học tập (bút, thước. . . ), bảng nhóm, bút viết bảng nhóm.
III. TIẾN TRÌNH DẠY HỌC
A. HOẠT ĐỘNG KHỞI ĐỘNG (MỞ ĐẦU)
a) Mục tiêu: Nêu vấn đề gợi mở kiến thức, tạo hứng thú học tập cho HS. b) Nội dung: GV đưa ra câu hỏi mở đầu, HS dự đoán kiến thức. c) Sản phẩm: Dự đoán của HS về xu hướng biến đổi tính chất hoá học cơ bản của nguyên tử các nguyên tố. d) Tổ chức thực hiện: Bước 1: Chuyển giao nhiệm vụ: - GV nêu vấn đề: Kim loại kiềm là các kim loại thuộc nhóm lA, bao gồm: lithium (LI), sodium (Na), potassium (K), rubidium (Rb), caesium (Cs), francium (Fr). Chúng phản ứng được với nước và giải phóng khí hydrogen. Vậy khả năng phản ứng với nước của các kim loại trên có giống nhau hay không? Dựa vào bảng tuần hoàn các nguyên tố hoá học, chúng ta có thể giải thích được xu hướng biến đổi tính chất hoá học cơ bản c
DẠYKÈMQUYNHƠNOFFICIAL
ử
Bước 2: Thực hiện nhiệm vụ - HS quan sát và chú ý lắng yêu cầu và đưa ra đáp án. Bước 3: Báo cáo, thảo luận: - Các HS xung phong phát biểu trả lời. Bước 4: Kết luận, nhận xét: - GV nhận xét, đánh giá và dẫn dắt vào bài: Để có được một đáp án chính xác nhất chi câu hỏi mở đâu, chúng ta cùng đi tìm hiểu: Bài 6. Xu hướng biến đổi một số tính chất của nguyên tố, đơn chất và hợp chất trong bảng tuần hoàn các nguyên tố.
ủa nguyên t
các nguyên tố không?
B. HÌNH THÀNH KIẾN THỨC MỚI
Hoạt động 1: Giải thích xu hướng biến đổi bán kính nguyên tử của các nguyên tố nhóm A.
a) Mục tiêu: Nhận xét được sự biến đổi bán kính nguyên tử trong một chu kì và trong một nhóm A. b) Nội dung: HS thảo luận nhóm trả lời câu hỏi trong sgk để hình thành kiến thức. c) Sản phẩm: Đáp án câu 1, 2, câu luyện tập sgk trang 43, kết luận xu hướng biến đổi bán kính nguyên tử các nguyên tố trong bảng tuần hoàn. d) Tổ chức thực hiện: HĐ CỦA GV VÀ HS SẢN PHẨM DỰ KIẾN Bước 1: Chuyển giao nhiệm vụ: - GV yêu cầu HS thảo luận nhóm 4 quan sát hình 6. 1 sgk trang 43 trả lời câu 1,2 sgk trang 43.
1. Bán kính nguyên tử. - Trả lời câu 1 sgk trang 43:
Bán kính nguyên tử của các nguyên tố trong mỗi chu kì từ trái qua phải nhìn chung giảm, trong một nhóm A từ trên xuống dưới nhìn chung tăng. - Trả lời câu 2 sgk trang 43: + Yếu tố gây ra: điện tích hạt nhân và số lớp electron. + Giải thích: Trong một chu kì, nguyên tử của các nguyên tố có cùng số lớp electron. Từ trái sang phải, điện tích hạt nhân nguyên tử tăng dần nên electron lớp ngoài cùng sẽ bị hạt nhân hút mạnh hơn, vì vậy bán kính nguyên tử của các nguyên tố có xu hướng giảm dần. Trong một nhóm, theo chiều từ

DẠYKÈMQUYNHƠNOFFICIAL