

ẾU GIAO BTVN VÀ KIỂM TRA ĐÁNH GIÁ
CĐ1:Kimloạikiềmvàhợpchất

CĐ2:Kimloạikiềmthổ vàhợpchất.Nướccứng
CĐ3:Nhômvàhợpchất
CĐ4:Tổngônkimloạikiềm–kimloạikiềmthổ -nhôm
CHUYÊN ĐỀ 1: KIM LOẠI KIỀM VÀ HỢP CHẤT
KIẾN THỨC CẦN NHỚ
1.Nhómkimloạikiềm(nhómIA)
- Vị trí: Thuộc nhóm IA trong bảng tuần hoàn bao gồm: Li, Na, K, Rb, Cs, Fr* .
- Các kim loại kiềm có cấu trúc lập phương tâm khối, nhiệt độ nóng chảy, nhiệt độ sôi, khối lượng riêng, độ cứng thấp.
- Có tính khử mạnh: Tác dụng với phi kim, nước, axit.
Kim loại kiềm được bảo quản bằng cách ngâm trong dầu hỏa, riêng Li bảo quản bằng bọc nến.
- Điều chế bằng phương pháp điện phân nóng chảy muối clorua.
- Ứng dụng: Xesi (Cs) dùng làm tế bào quang điện; hợp kim liti – nhôm siêu nhẹ, dùng trong kĩ thuật hàng không.
2.Hợpchấtcủakimloạikiềm
Natrihiđroxit (NaOH)
- Xút ăn da, chất rắn, tan tốt trong nước → dd bazơ mạnh.
- Tác dụng với phi kim, oxit axit, axit, muối.
- Dùng để nấu xà phòng, sản xuất tơ nhân tạo, …
3.Mộtsố PTHHcầnnhớ
Natricacbonat (Na2CO3)
- Xôđa, chất rắn, tan tốt trong nước tạo dung
dịch có môi
trường kiềm.
- Sản xuất thủy tinh, bột giặt, …
Natrihiđrocacbonat (NaHCO3)
- Nabica, chất rắn, tan ít trong nước lạnh.
- Dễ bị nhiệt phân.
- Có tính lưỡng tính.
- Sản xuất thuốc giảm đau dạ dày, làm bột nở.
Kalinitrat (KNO3)
- Tinh thể, tan tốt trong nước.
- Dễ bị phân hủy.
- Sản xuất phân bón, thuốc nổ đen (KNO3, C, S)
BÀITẬPTỰ LUẬN
NaClNaNaONaOHNaHCONaCOCaCO → →→→→→ ←
(3)(4)(5)(6)(7) 2 3233
(1) ………………………………………………………………….……
(2) ………………………………………………………………….……
(3) ………………………………………………………………….……
(4) ………………………………………………………………….……
(5) ………………………………………………………………….……
(6) ………………………………………………………………….……
(7) ………………………………………………………………….……
Câu2: Ghép các chất ở cột B cho phù hợp vớ
CộtA
(1) Thuốc giảm đau dạ dày.
(2) Muối ăn.
(3) Xôđa.
(4) Xút ăn da.
(5) Chế tạo tế bào quang điện.
CộtB
(a) Cs.
(b) Na2CO3
(c) NaOH.
(d) NaCl.
(e) NaHCO3
1 - …….; 2 - ……..; 3 - ……..; 4 - ……..; 5 - ……..
Câu3: Các phát biểu sau đây đúng hay sai? Giải thích?
(1) Hợp kim liti – nhôm siêu nhẹ, được dùng trong kĩ thuật hàng không.
(2) Trong tự nhiên, các kim loại kiềm chỉ tồn tại ở dạng đơn chất
(3) Các kim loại kiềm đều mềm và nhẹ.
(4) Các kim loại kiềm đều có nhiệt độ nóng chảy rất cao.
(5) Các kim loại kiềm đều có tính khử mạnh.
(6) Các nguyên tử kim loại kiềm đều có cấu hình electron lớp ngoài cùng là ns1 .
(7) Từ Li đến Cs khả năng phản ứng với nước tăng dần.
(8) Na2CO3 là nguyên liệu chính dùng trong y học, công nghệ thực phẩm, chế tạo nước giải khát.
(9) Cho Na vào dung dịch CuSO4 thu được kết tủa màu đỏ.
(10) Thành phần của thuốc nổ đen là NaNO3, S, C.
BÀITẬPTRẮCNGHIỆM
1.Mức độ nhậnbiết(rấtdễ vàdễ)
Câu1. Cấu hình electron lớp ngoài cùng của nguyên tử kim loại kiềm là
A. ns2np2 B. ns2np1 C. ns1 D. ns2
Câu2.[QG.22-202] Ở trạng thái cơ bản, số electron lớp ngoài cùng của nguyên tử kim loại kiềm là
A. 1. B. 2. C. 3. D. 4. Câu3.[MH-2022] Kim loại nào sau đây thuộc nhóm IA trong bảng tuần hoàn?
A. Al. B. Na. C. Fe. D. Ba. Câu4.[QG.22-201] Kim loại nào sau đây là kim loại kiềm?
A. Mg. B. Ag. C. Cu. D. Na. Câu5.(MH.19): Kim loại nào sau đây là kim loại kiềm?
A. Na. B. Ca. C. Al. D. Fe. Câu6.(QG.16): Kim loại nào sau đây là kim loại kiềm?
A. Al. B. Li. C. Ca. D. Mg. Câu7.[MH2-2020] Kim loại nào sau đây là kim loại kiềm?
A. Cu. B. Na. C. Mg. D. Al Câu8.[QG.20-201] Kim loại nào sau đây là kim loại kiềm?
A. Mg. B. Na. C. Be. D. Fe. Câu9.[QG.20-202] Kim loại nào sau đây là kim loại kiềm?
A. K. B. Ba. C. Al. D. Ca. Câu10.[QG.20-203] Kim loại nào sau đây là kim loại kiềm?
A. Al. B. Mg. C. K. D. Ca. Câu11.[QG.20-204] Kim loại nào sau đây là kim loại kiềm?
A. Ca. B. Na. C. Zn. D. Ba. Câu12. Cho dãy các kim loại: Na, Al, Fe, K. Số kim loại kiềm trong dãy là
A. 4. B. 3. C. 1. D. 2. Câu13. Cấu hình electron của nguyên tử Na (Z=11)
A.
Câu14. Cation M+ có cấu hình electron lớp ngoài cùng 2s22p6 là:
A. Na+ B. Li+ C. Rb+ D. K+
Câu15. Công thức chung của oxit kim loại thuộc phân nhóm chính nhóm I là
A. R2O3. B. RO2. C. R2O. D. RO.
Câu16. Trong hợp chất, các kim loại kiềm có số oxi hóa là
A. +1. B. +2. C. +4. D. +3. Câu17.(QG.19-204). Trong phòng thí nghiệm, kim loại Na được bảo quản bằng cách ngâm trong chất lỏng nào sau đây?
A. Nước. B. Dầu hỏa. C. Giấm ăn. D. Ancol etylic.
Câu18. Cho dãy các kim loại: Na, Cu, Al, Cr. Kim loại mềm nhất trong dãy là
A. Cu. B. Al. C. Cr. D. Na.
Câu19. Cho dãy các kim loại: Cs, Cr, Rb, K. Ở điều kiện thường, kim loại cứng nhất trong dãy là
A. Cr. B. Rb. C. Cs. D. K. Câu20. Kim loại nào sau đây phản ứng được với dung dịch H2SO4 loãng?
A. Au. B. Ag. C. Na. D. Cu. Câu21.(QG.19-201). Kim loại nào sau đây tan trong nước ở điều kiện thường?
A. Cu. B. Fe. C. Na. D. Al. Câu22.[MH1-2020] Kim loại nào sau đây tan hết trong nước dư ở nhiệt độ thường?
A. Ag. B. Na. C. Mg. D. Al. Câu23. Kim loại phản ứng với nước ở nhiệt độ thường là
A. Fe. B. Cu. C. Be. D. K. Câu24.[MH-2021] Trong công nghiệp, kim loại nào sau đây được điều chế bằng phương pháp điện phân nóng chảy?
A. Na. B. Cu. C. Ag. D. Fe. Câu25. Điều chế kim loại K bằng phương pháp
A. dùng khí CO khử ion K+ trong K2O ở nhiệt độ cao
B. điện phân dung dịch KCl có màng ngăn
C. điện phân KCl nóng chảy
D. điện phân dung dịch KCl không có màng ngăn Câu26.[QG.21-201] Natri hiđroxit (hay xút ăn da) là chất rắn, không màu, dễ nóng chảy, hút ẩm mạnh, tan nhiều trong nước và tỏa ra một lượng nhiệt lớn. Công thức của natri hiđroxit là
A. Ca(OH)2. B. NaOH. C. NaHCO3. D. Na2CO3.
Trang3
Câu27.[QG.21-202] Natri clorua được dùng để làm gia vị thức ăn, điều chế natri, xút, nước Giaven. Công thức của natri clorua là
A. Na2CO3 B. NaCl. C. NaHCO3 D. KCl. Câu28.[QG.21-203] Natri cacbonat là hóa chất quan trọng trong công nghiệp thủy tinh, bột giặt, phẩm nhuộm, giấy, sợi. Công thức của natri cacbonat là
A. Na2CO3. B. NaHCO3. C. MgCO3. D. CaCO3. Câu29.[QG.21-204] Natri hiđrocacbonat là chất được dùng làm bột nở, chế thuốc giảm đau dạ
dày do thừa axit. Công thức của natri hiđrocacbonat là
A. NaOH. B. NaHS. C. NaHCO3. D. Na2CO3
Câu30.[QG.20-203] Tro thực vật được sử dụng như một loại phân bón cung cấp nguyên tố kali cho cây trồng do chứa muối kali cacbonat. Công thức của kali cacbonat là
A. KCl. B. KOH. C. NaCl D. K2CO3
Câu31.(M.15): Chất nào sau đây không phản ứng với dung dịch NaOH?
A. Cl2. B. Al. C. CO2. D. CuO.
Câu32.(C.07): Trong công nghiệp, natri hiđroxit được sản xuất bằng phương pháp
A. điện phân dung dịch NaCl, không có màng ngăn điện cực.
B. điện phân dung dịch NaNO3, không có màng ngăn điện cực.
C. điện phân dung dịch NaCl, có màng ngăn điện cực.
D. điện phân NaCl nóng chảy. Câu33. Chất có tính lưỡng tính là
A. NaOH B. KNO3 C. NaHCO3 D. NaCl
Câu34. Khi nhiệt phân hoàn toàn NaHCO3 thì sản phẩm của phản ứng nhiệt phân là
A. NaOH, CO2, H2 B. Na2O, CO2, H2O.
C. Na2CO3, CO2, H2O. D. NaOH, CO2, H2O. Câu35.(QG-2018): Chất nào sau đây tác dụng được với dung dịch KHCO3 ?
A. K2SO4. B. KNO3. C. HCl. D. KCl. Câu36.(204–Q.17). Dung dịch Na2CO3 tác dụng được với dung dịch nào sau đây?
A. Na2SO4 B. KNO3 C. KOH. D. CaCl2 Câu37.(201–Q.17). Dung dịch nào sau đây phản ứng với dung dịch HCl dư tạo ra chất khí?
A. Ba(OH)2. B. Na2CO3. C. K2SO4. D. Ca(NO3)2. Câu38.(QG-2018): Chất nào sau đây không tác dụng với dung dịch NaOH ?
A. FeCl2 B. CuSO4 C. MgCl2 D. KNO3 Câu39.[QG.20-201] Chất nào sau đây tác dụng với dung dịch NaHCO3 sinh ra khí CO2?
A. HCl. B. Na2SO4. C. K2SO4. D. KNO3. Câu40.[QG.20-202] Chất nào sau đây tác dụng với dung dịch KHCO3 sinh ra khí CO2?
A. HCl. B. K2SO4 C. NaCl. D. Na2SO4 Câu41.[QG.20-203] Chất nào sau đây tác dụng với dung dịch NaHCO3 sinh ra khí CO2?
A. NaCl. B. KNO3. C. KCl. D. HCl.
Câu42.[QG.20-204] Chất nào sau đây tác dụng với dung dịch KHCO3 sinh ra khí CO2?
A. HCl. B. KNO3 C. NaNO3 D. NaCl. 2.Mức độ thônghiểu(trungbình)
Câu43. Cặp chất không xảy ra phản ứng là:
A. dung dịch NaNO3 và dung dịch MgCl2. B. Na2O và H2O.
C. dung dịch AgNO3 và dung dịch KCl D. dung dịch NaOH và Al2O3
Câu44.(B.08): Phản ứng nhiệt phân không đúng là
Trang5
C. NH4Cl → ot NH3 + HCl. D. NaHCO3 → ot NaOH + CO2.
Câu45.(C.13): Dung dịch nào dưới đây khi phản ứng hoàn toàn với dung dịch NaOH dư, thu được kết tủa trắng?
A. Ca(HCO3)2. B. FeCl3. C. AlCl3. D. H2SO4.
Câu46.(C.11): Dãy gồm các kim loại đều có cấu tạo mạng tinh thể lập phương tâm khối là:
A. Na, K, Ca, Ba. B. Na, K, Ca, Be. C. Li, Na, K, Mg. D. Li, Na, K, Rb. Câu47. Cho các hiđroxit: NaOH, Mg(OH)2, Fe(OH)3, Al(OH)3. Hidroxit có tính bazơ mạnh nhất là
A. Al(OH)3. B. NaOH. C. Mg(OH)2. D. Fe(OH)3.
Câu48. Nhận xét nào sau đây không đúng?
A. Các kim loại kiềm đều mềm và nhẹ
B. Các kim loại kiềm đều có nhiệt độ nóng chảy rất cao.
C. Các kim loại kiềm đều có tính khử mạnh.
D. Các nguyên tử kim loại kiềm đều có cấu hình electron lớp ngoài cùng là ns1 .
Câu49.(B.12): Khi nói về kim loại kiềm, phát biểu nào sau đây là sai?
A. Các kim loại kiềm có màu trắng bạc và có ánh kim.
B. Trong tự nhiên, các kim loại kiềm chỉ tồn tại ở dạng hợp chất.
C. Từ Li đến Cs khả năng phản ứng với nước giảm dần.
D. Kim loại kiềm có nhiệt độ nóng chảy và nhiệt độ sôi thấp.
Câu50.(A.14): Phát biểu nào sau đây là sai?
A. Các kim loại kiềm có bán kính nguyên tử lớn hơn so với các kim loại cùng chu kì.
B. Các kim loại kiềm có màu trắng bạc và có ánh kim.
C. Các kim loại kiềm có nhiệt độ nóng chảy tăng dần từ Li đến Cs.
D. Các kim loại kiềm đều là kim loại nhẹ
Câu51.(A.14): Dẫn hỗn hợp khí gồm CO2, O2, N2 và H2 qua dung dịch NaOH. Khí bị hấp thụ là
A. CO2 B. O2 C. H2 D. N2
Câu52.(M.15): Cho dãy các chất sau: Cu, Al, KNO3, FeCl3. Số chất trong dãy tác dụng được với dung dịch NaOH là
A. 1.
B. 2. C. 4. D. 3.
Câu53. Trung hoà V ml dung dịch NaOH 1M bằng 100 ml dung dịch HCl 1M. Giá trị của V là
A. 400.
B. 200. C. 100. D. 300.
Câu54. Trung hoà 100ml dung dịch KOH 1M cần dùng V ml dung dịch HCl 1M. Giá trị của V là
A. 400 ml.
B. 200 ml. C. 300 ml. D. 100 ml.
Câu55.[QG.22-201] Cho 4,6 gam kim loại Na tác dụng với nước dư, sau phản ứng hoàn toàn thu được V lít khí H2 (đktc). Giá trị của V là
A. 1,12. B. 2,24. C. 3,36. D. 4,48. Câu56. Cho 0,69 gam một kim loại kiềm tác dụng với nước (dư). Sau phản ứng thu được 0,336 lít khí hiđro ( ở đktc). Kim loại kiềm là
A. Na B. K C. Rb D. Li. Câu57.(C.14): Hòa tan hết 4,68 gam kim loại kiềm M vào H2O dư, thu được 1,344 lít khí H2 (đktc). Kim loại M là
A. Rb. B. Li. C. K. D. Na. Câu58.(B.13): Khi hòa tan hoàn toàn m gam mỗi kim loại vào nước dư, từ kim loại nào sau đây thu được thể tích khí H2 (cùng điều kiện nhiệt độ và áp suất) là nhỏ nhất?
A. K. B. Na. C. Li. D. Ca. Câu59.(QG-2018): Cho 0,425 gam hỗn hợp X gồm Na và K vào nước dư, thu được 0,168 lít khí H2 (đktc). Khối lượng kim loại Na trong X là
A. 0,115 gam. B. 0,230 gam. C. 0,276 gam. D. 0,345 gam.
Câu60.(204–Q.17). Hòa tan hỗn hợp Na và K vào nước dư, thu được dung dịch X và 0,672 lít khí H2 (đktc). Thể tích dung dịch HCl 0,1M cần dùng để trung hòa X là
A. 150 ml. B. 300 ml. C. 600 ml. D. 900 ml. Câu61. Hấp thụ hoàn toàn 2,24 lít khí CO2 (ở đktc) vào dung dịch chứa 8 gam NaOH, thu được dung dịch X. Khối lượng muối tan có trong dung dịch X là
A. 5,3 gam. B. 10,6 gam. C. 21,2 gam. D. 15,9 gam. Câu62. Hấp thụ hoàn toàn 4,48 lít khí SO2 ( ở đktc) vào dung dịch chứa 16 gam NaOH thu được dung dịch X. Khối lượng muối tan thu được trong dung dịch X là:
A. 18,9 gam B. 23,0 gam C. 20,8 gam D. 25,2 gam. Câu63. Cho 0,02 mol Na2CO3 tác dụng với lượng dư dung dịch HCl thì thể tích khí CO2 thoát ra (đktc) là
A. 0,672 lít. B. 0,24 lít. C. 0,336 lít. D. 0,448 lít
Câu64.[MH-2022] Nhiệt phân hoàn toàn m gam NaHCO3, thu được Na2CO3, H2O và 3,36 lít CO2 (ở đktc). Giá trị của m là
A. 30,0. B. 25,2. C. 15,0. D. 12,6.
3.Mức độ vậndụng(khá)
Câu65.(B.14): Cho dãy chuyển hoá sau: X 22 COHO++ → Y NaOH + → X
Công thức của X là
A. NaHCO3 B. Na2O. C. NaOH. D. Na2CO3
Câu66.(C.07): Cho sơ đồ phản ứng: NaCl → (X) → NaHCO3 → (Y) → NaNO3. X và Y có thể là
A. NaOH và NaClO. B. Na2CO3 và NaClO.
C. NaClO3 và Na2CO3. D. NaOH và Na2CO3.
Câu67.(C.07): Có thể dùng NaOH (ở thể rắn) để làm khô các chất khí
A. NH3, SO2, CO, Cl2 B. N2, NO2, CO2, CH4, H2
C. NH3, O2, N2, CH4, H2.
Câu68.(B.09): Thực hiện các thí nghiệm sau:
(I) Cho dung dịch NaCl vào dung dịch KOH.
(II) Cho dung dịch Na2CO3 vào dung dịch Ca(OH)2
D. N2, Cl2, O2, CO2, H2.
(III) Điện phân dung dịch NaCl với điện cực trơ, có màng ngăn.
(IV) Cho Cu(OH)2 vào dung dịch NaNO3.
(V) Sục khí NH3 vào dung dịch Na2CO3.
(VI) Cho dung dịch Na2SO4 vào dung dịch Ba(OH)2
Các thí nghiệm đều điều chế được NaOH là:
A. II, III và VI. B. I, II và III. C. I, IV và V. D. II, V và VI.
Câu69.(B.08): Cho 1,9 gam hỗn hợp muối cacbonat và hiđrocacbonat của kim loại kiềm M tác dụng hết với dung dịch HCl (dư), sinh ra 0,448 lít khí (ở đktc). Kim loại M là
A. Na. B. K. C. Rb. D. Li.
Câu70.(B.13): Hòa tan hoàn toàn 24 gam hỗn hợp X gồm MO, M(OH)2 và MCO3 (M là kim loại có hóa trị không đổi) trong 100 gam dung dịch H2SO4 39,2%, thu được 1,12 lít khí (đktc) và dung dịch Y chỉ chứa một chất tan duy nhất có nồng độ 39,41%. Kim loại M là
A. Zn. B. Ca. C. Mg. D. Cu.
CHUYÊN ĐỀ
2:
KIM LOẠI KIỀM THỔ VÀ H
KIẾN THỨC CẦN NHỚ
1.Nhómkimloạikiềmthổ (nhómIIA)
- Vị trí: Thuộc nhóm IIA trong bảng tuần hoàn bao gồm: Be, Mg, Ca, Sr, Ba, Ra*
- Các kim loại kiềm thổ có nhiệt độ nóng chảy, nhiệt độ sôi, khối lượng riêng, độ cứng thấp chỉ hơn kim loại kiềm.
- Có tính khử mạnh: Tác dụng với phi kim, nước, axit.
- Điều chế bằng phương pháp điện phân nóng chảy muối clorua.
2.Hợpchấtcủakimloạikiềmthổ CanxihiđroxitCa(OH)2 Canxicacbonat(CaCO3) Canxisunfat(CaSO4)
- Ca(OH)2 còn gọi là vôi tôi, tan ít trong nước tạo thành dung dịch nước vôi trong.
- Tác dụng với oxit axit, axit, muối.
3.Nướccứng
- CaCO3 còn được gọi là đá vôi, là chất rắn màu trắng, không tan trong nước.
- Tác dụng với axit và bị nhiệt phân.
Thạch cao sống: CaSO4.2H2O.
Thạch cao nung: CaSO4.H2O (đúc tượng, bó bột khi gãy xương)
Thạch cao khan: CaSO4
- Nước cứng là nước có chứa nhiều ion Mg2+ và Ca2+. Nước chứa ít hoặc không chứa Mg2+ và Ca2+ là nước mềm.
Phânloại Nướccứngtạmthời Nướccứngvĩnhcửu Nướccứngtoànphần
Thànhphần Ca2+, Mg2+, HCO3 - Ca2+, Mg2+
4.Mộtsố PTHHcầnnhớ
CO3
, PO4
(Na2CO3, Na3PO4,…)
(1) …………………………………………………………………………………
(2) …………………………………………………………………………………
(3) …………………………………………………………………………………
(4) …………………………………………………………………………………
(5) …………………………………………………………………………………
(6) …………………………………………………………………………………
(7) …………………………………………………………………………………
(8) …………………………………………………………………………………
Câu2:
(a)
Trang7
là ……………………………………
(b) Kim loại kiềm thổ không tác dụng với nước ngay cả khi đun nóng là …………………………
(c) Vôi sống: ………..…. Đá vôi: …….………. Vôi tôi: …….……….
(d) Thạch cao sống: ……………… Thạch cao nung: …………….. Thạch cao khan: ……………
(e) Nước cứng là nước có chứa nhiều ion: ………………………………
(g) Nước cứng tạm thời có chứa các ion: ………………………………..
(g) Nước cứng vĩnh cửu có chứa các ion: ……………………………….
(g) Nước cứng toàn phần có chứa các ion: ……………………………….
Câu3:Cácphátbiểusau đúnghaysai?Giảithích?
(1) Nhóm kim loại kiềm thổ bao gồm các nguyên tố: Be, Mg, Cu, Sr, Ba, Ra.
……………………………………………………………………………………………………..
(2) Các kim loại nhóm kim loại kiềm thổ đều vừa có tính oxi hóa, vừa có tính khử
……………………………………………………………………………………………………..
(3) Ở nhiệt độ cao, tất cả các kim loại kiềm thổ đều phản ứng được với nước. ……………………………………………………………………………………………………..
(4) Cho kim loại Ba vào dung dịch H2SO4 loãng dư thu được kết tủa và khí không màu ……………………………………………………………………………………………………..
(5) Thạch cao nung (CaSO4.2H2O) dùng để đúc tượng, bó bột khi gãy xương. ……………………………………………………………………………………………………..
(6) Đá vôi có công thức là CaCO3 ……………………………………………………………………………………………………..
(7) Nước cứng là nước chứa nhiều ion HCO3 - và SO4 2……………………………………………………………………………………………………..
(8) Dùng dung dịch Na2CO3 để làm mất tính cứng của nước cứng toàn phần. ……………………………………………………………………………………………………..
(9) Nước tự nhiên thường có cả tính cứng tạm thời và tính cứng vĩnh cửu. ……………………………………………………………………………………………………..
(10) Cho dung dịch Ba(OH)2 vào dung dich (NH4)2SO4 thu được kết tủa và khí ……………………………………………………………………………………………………..
BÀITẬPTRẮCNGHIỆM
1.Mức độ nhậnbiết(rấtdễ vàdễ)
Câu1. Cấu hình electron lớp ngoài cùng của nguyên tử kim loại kiềm thổ là
A. Al. B. Ba. C. K. D. Fe. Câu8. Hai kim loại đều thuộc nhóm IIA trong bảng tuần hoàn là
A. Sr, K. B. Na, Ba. C. Be, Al. D. Ca, Ba. Câu9. Công thức chung của các oxit kim loại nhóm IIA là
A. R2O. B. RO2. C. RO. D. R2O3.
Câu10. Trong hợp chất, các kim loại kiềm thổ có số oxi hóa là
A. +1. B. +2. C. +4. D. +3.
Câu11.[MH2-2020] Ở nhiệt độ thường, kim loại nào sau đây tan hết trong nước dư?
A. Ba. B. Al. C. Fe. D. Cu Câu12.(Q.15): Ở điều kiện thường, kim loại nào sau đây không phản ứng với nước?
A. Ba. B. Na. C. Be. D. K. Câu13. Kim loại không phản ứng với nước ở nhiệt độ thường là
A. Fe. B. Na. C. Ba. D. K. Câu14.[QG.20-201] Chất nào sau đây tác dụng với dung dịch HCl sinh ra khí H2?
A. BaO. B. Mg. C. Ca(OH)2 D. Mg(OH)2 Câu15.[QG.20-202] Chất nào sau đây tác dụng với dung dịch H2SO4 loãng sinh ra khí H2?
A. Ca(OH)2 B. Mg(OH)2 C. Mg. D. BaO. Câu16.[QG.20-203] Chất nào sau đây tác dụng với nước sinh ra khí H2?
A. K2O. B. Ca. C. CaO. D. Na2O. Câu17.[QG.20-204] Chất nào sau đây tác dụng với nước sinh ra khí H2?
A. Na2O. B. Ba. C. BaO. D. Li2O. Câu18.[MH-2022] Kim loại Mg tác dụng với HCl trong dung dịch tạo ra H2 và chất nào sau đây?
A. MgCl2 B. MgO. C. Mg(HCO3)2 D. Mg(OH)2 Câu19. Trong công nghiệp, kim loại kiềm và kim loại kiềm thổ được điều chế bằng phương pháp
A. điện phân nóng chảy. B. điện phân dung dịch. C. thủy luyện. D. nhiệt luyện.
Câu20. Phương pháp thích hợp điều chế kim loại Ca từ CaCl2 là
A. nhiệt phân CaCl2 B. điện phân CaCl2 nóng chảy.
C. dùng Na khử Ca2+ trong dung dịch CaCl2. D. điện phân dung dịch CaCl2.
Câu21. Phương pháp thích hợp điều chế kim loại Mg từ MgCl2 là
A. nhiệt phân MgCl2. B. điện phân dung dịch MgCl2.
C. dùng K khử Mg2+ trong dung dịch MgCl2 D. điện phân MgCl2 nóng chảy Câu22. Phương pháp thích hợp điều chế kim loại Ca từ CaCl2 là
A. nhiệt phân CaCl2.
B. dùng Na khử Ca2+ trong dung dịch CaCl2.
A. ns2np2 B. ns2np1 C. ns1
D. ns2 Câu2.[QG.22-201] Ở trạng thái cơ bản, số electron lớp ngoài cùng của nguyên tử kim loại kiềm thổ là
A. 2. B. 4. C. 1. D. 3. Câu3.[QG.22-202] Kim loại nào sau đây là kim loại kiềm thổ?
A. Ag. B. Cu. C. Ca. D. Na. Câu4.[QG.21-201] Kim loại nào sau đây là kim loại kiềm thổ?
A. Al. B. Mg. C. Cu. D. Fe. Câu5.[QG.21-202] Kim loại nào sau đây là kim loại kiềm thổ?
A. Fe. B. Ca. C. Cu. D. Ag. Câu6.[QG.21-203] Kim loại nào sau đây là kim loại kiềm thổ?
A. Cu. B. Ca. C. Al. D. Na. Câu7.[QG.21-204] Kim loại nào sau đây là kim loại kiềm thổ?
Trang9
C. điện phân dung dịch CaCl2
D. điện phân CaCl2 nóng chảy. Câu23.[MH1-2020] Hiđroxit nào sau đây dễ tan trong nước ở điều kiện thường?
A. Al(OH)3. B. Mg(OH)2. C. Ba(OH)2. D. Cu(OH)2.
Câu24. Dung dịch nào sau đây dùng để phân biệt dung dịch NaCl với dung dịch Na2SO4?
A. KOH. B. BaCl2 C. KCl. D. NaOH.
Câu25. Nhiệt phân CaCO3 thu được sản phẩm khí là
A. O2 B. CO2 C. O3 D. CO.
Câu26. Sản phẩm tạo thành có chất kết tủa khi dung dịch Na2CO3 tác dụng với dung dịch
A. CaCl2. B. KCl. C. KOH. D. NaNO3.
Câu27. Sản phẩm tạo thành có chất kết tủa khi dung dịch Ba(HCO3)2 tác dụng với dung dịch
A. HCl. B. HNO3 C. KNO3 D. Na2CO3
Trang10
Câu28. Chất phản ứng được với dung dịch H2SO4 tạo ra kết tủa là
A. NaOH. B. Na2CO3. C. BaCl2. D. NaCl.
Câu29. Chất phản ứng được với dung dịch CaCl2 tạo kết tủa là
A. Mg(NO3)2 B. Na2CO3 C. NaNO3 D. HCl. Câu30.[QG.20-202] Canxi cacbonat được dùng sản xuất vôi, thủy tinh, xi măng. Công thức của canxi cacbonat là
A. CaCO3 B. Ca(OH)2 C. CaO. D. CaCl2
Câu31.(MH.19): Thành phần chính của đá vôi là canxi cacbonat. Công thức của canxi cacbonat là
A. CaSO3. B. CaCl2. C. CaCO3. D. Ca(HCO3)2.
Câu32.[MH2-2020] Thành phần chính của vỏ các loại ốc, sến, sò là
A. Ca(NO3)2 B. CaCO3 C. NaCl. D. Na2CO3
Câu33. Trong tự nhiên, canxi sunfat tồn tại dưới dạng muối ngậm nước (CaSO4.2H2O) được gọi là
A. Thạch cao sống. B. Đá vôi.
C. Thạch cao khan. D. Thạch cao nung.
Câu34.[QG.20-201] Canxi hiđroxit được sử dụng rộng rãi trong nhiều ngành công nghiệp. Công thức của canxi hiđroxit là
A. Ca(OH)2 B. CaO. C. CaSO4 D. CaCO3
Câu35. Canxi hiđroxit (Ca(OH)2) còn gọi là
A. thạch cao. B. đá vôi. C. thạch cao sống. D. vôi tôi. Câu36.(A.11): Hợp chất nào của canxi được dùng để đúc tượng, bó bột khi gãy xương?
A. Thạch cao nung (CaSO4.H2O). B. Đá vôi (CaCO3).
C. Vôi sống (CaO). D. Thạch cao sống (CaSO4.2H2O). Câu37.(QG.19-201). Chất nào sau đây được dùng để khử chua đất trong nông nghiệp?
A. CaO. B. CaSO4 C. CaCl2 D. Ca(NO3)2 Câu38.(C.14): Để khử chua cho đất người ta thường sử dụng chất nào sau đây?
A. Phèn chua. B. Thạch cao. C. Vôi sống. D. Muối ăn. Câu39.(203–Q.17). Muối nào sau đây dễ bị phân hủy khi đun nóng?
A. Ca(HCO3)2 B. Na2SO4 C. CaCl2 D. NaCl. Câu40.[MH1-2020] Nước chứa nhiều ion nào sau đây được gọi là nước cứng?
A. Ca2+, Mg2+ . B. Na+, K+ . C. Na+, H+ . D. H+, K+ . Câu41.[QG.22-201] Nước tự nhiên chứa nhiều những cation nào sau đây được gọi là nước cứng?
A. Na+, Al3+ . B. Na+, K+ . C. Al3+, K+ . D. Ca2+, Mg2+ . Câu42.[MH-2022] Tính cứng tạm thời của nước do các muối canxi hiđrocacbonat và magie hiđrocacbonat gây nên. Công thức của canxi hiđrocacbonat là
A. CaSO4 B. CaCO3 C. Ca(HCO3)2 D. CaO. Câu43.[QG.22-202] Chất nào sau đây có khả năng làm mềm được nước cứng vĩnh cửu?
A. CaCl2. B. Na2CO3. C. NaCl. D. Na2SO4. Câu44.(B.13): Một loại nước cứng khi đun sôi thì mất tính cứng. Trong loại nước cứng này có hòa tan những hợp chất nào sau đây?
A. Ca(HCO3)2, Mg(HCO3)2 B. Ca(HCO3)2, MgCl2 C. CaSO4, MgCl2. D. Mg(HCO3)2, CaCl2. Câu45. Dùng lượng vừa đủ chất nào sau đây để làm mềm nước có tính cứng tạm thời?
A. Ca(HCO3)2 B. CaCl2 C. Ca(NO3)2 D. Ca(OH)2
Câu46.(C.14): Để làm mềm nước có tính cứng vĩnh cửu có thể dùng dung dịch nào sau đây?
A. Na2CO3 B. CaCl2 C. KCl. D. Ca(OH)2
A. Na2CO3 và HCl. B. Na2CO3 và Na3PO4.
C. Na2CO3 và Ca(OH)2. D. NaCl và Ca(OH)2.
Câu48.(QG.19-203). Chất nào sau đây làm mềm được nước cứng có tính vĩnh cửu?
A. NaCl. B. Na2CO3 C. NaNO3 D. Na2SO4 Câu49. Chất làm mềm nước có tính cứng toàn phần là
A. CaSO4 B. NaCl C. Na2CO3 D. CaCO3 Câu50.[MH2-2020] Chất nào sau đây được dùng đề làm mềm nước cứng có tính cứng tạm thời?
A. CaCO3 B. MgCl2 C. NaOH. D. Fe(OH)2 Câu51.[QG.20-201] Chất nào sau đây được dùng để làm mềm nước có tính cứng tạm thời?
A. CaCl2. B. NaCl. C. NaNO3. D. Ca(OH)2. Câu52.[QG.20-202] Chất nào sau đây được dùng để làm mềm nước cứng có tính cứng vĩnh cửu?
A. HNO3 B. KCl. C. NaNO3 D. Na2CO3
Câu53.[QG.20-203] Chất nào sau đây được dùng để làm mềm nước có tính cứng vĩnh cửu?
A. HCl. B. KNO3 C. NaCl. D. Na3PO4.
Câu54.[QG.20-204] Chất nào sau đây được dùng để làm mềm nước có tính cứng tạm thời?
A. KNO3 B. MgCl2 C. KCl. D. Ca(OH)2
2.Mức độ thônghiểu(trungbình)
Câu55. Dãy gồm các kim loại đều phản ứng với nước ở nhiệt độ thường tạo ra dung dịch có môi trường kiềm là:
A. Na, Ba, K. B. Ba, Fe, K. C. Be, Na, Ca. D. Na, Fe, K.
Câu56. Cho dãy các kim loại: Na, K, Mg, Be. Số kim loại trong dãy phản ứng mạnh với H2O ở
điều kiện thường là
A. 3. B. 4. C. 2. D. 1.
Câu57. Cho dãy các kim loại: Fe, Na, K, Ca. Số kim loại trong dãy tác dụng được với nước ở nhiệt độ thường là
A. 4. B. 1. C. 3. D. 2.
Câu58. Cho dãy các kim loại: Ba, K, Cu, Fe. Số kim loại trong dãy phản ứng mạnh với H2O ở điều kiện thường là
A. 2. B. 1. C. 4. D. 3. Câu59.[MH-2021] Nung CaCO3 ở nhiệt độ cao, thu được chất khí X. Chất X là
A. CaO. B. H2. C. CO. D. CO2. Câu60. Cho dung dịch Na2CO3 vào dung dịch Ca(HCO3)2 thấy
A. có kết tủa trắng và bọt khí B. không có hiện tượng gì
C. có kết tủa trắng D. có bọt khí thoát ra Câu61.(201–Q.17). Chất nào sau đây tác dụng với Ba(OH)2 tạo ra kết tủa?
A. NaCl. B. Ca(HCO3)2. C. KCl. D. KNO3. Câu62.(202–Q.17). Ở nhiệt độ thường, Ba(HCO3)2 loãng tác dụng được với dung dịch nào sau đây?
A. KCl. B. KNO3. C. NaCl. D. Na2CO3. Câu63.(203–Q.17). Dung dịch nào sau đây tác dụng với dung dịch Ba(HCO3)2, vừa thu được kết tủa, vừa có khí thoát ra?
A. NaOH. B. HCl. C. Ca(OH)2 D. H2SO4 Câu64.(C.12): Phát biểu nào sau đây là đúng?
A. Trong hợp chất, tất cả các kim loại kiềm đều có số oxi hóa +1.
B. Tất cả các kim loại nhóm IIA đều có mạng tinh thể lập phương tâm khối.
C. Tất cả các hiđroxit của kim loại nhóm IIA đều dễ tan trong nước.
Câu47.(C.08): Hai chất được dùng để làm mềm nước cứng vĩnh cửu là Trang12
Trang11
D. Trong nhóm IA, tính khử của các kim loại giảm dần từ Li đến Cs.
Câu65.(C.14): Cho dung dịch Ba(HCO3)2 lần lượt vào các dung dịch sau: HNO3, Na2SO4, Ba(OH)2, NaHSO4. Số trường hợp có phản ứng xảy ra là
A. 1. B. 4. C. 2. D. 3. Câu66.(A.13): Dãy các chất đều tác dụng được với dung dịch Ba(HCO3)2 là:
A. HNO3, NaCl và Na2SO4. B. HNO3, Ca(OH)2 và KNO3.
C. NaCl, Na2SO4 và Ca(OH)2. D. HNO3, Ca(OH)2 và Na2SO4. Câu67.(QG.19-204). Đun nước cứng lâu ngày trong ấm nước xuất hiện một lớp cặn. Thành phần chính của lớp cặn đó là
A. CaCl2. B. CaCO3. C. Na2CO3. D. CaO. Câu68.(QG.19-202). Dung dịch nào sau đây được dùng để xử lý lớp cặn CaCO3 bám vào ấm đun nước?
A. Muối ăn. B. Cồn. C. Nước vôi trong. D. Giấm ăn. Câu69.(M.15): Để loại bỏ lớp cặn trong ấm đun nước lâu ngày, người ta có thể dùng dung dịch nào sau đây?
A. Giấm ăn. B. Nước vôi. C. Muối ăn. D. Cồn 700 Câu70.(A.11): Dãy gồm các chất đều có thể làm mất tính cứng tạm thời của nước là:
A. HCl, NaOH, Na2CO3 B. NaOH, Na3PO4, Na2CO3
C. KCl, Ca(OH)2, Na2CO3. D. HCl, Ca(OH)2, Na2CO3.
Câu71.(B.08): Một mẫu nước cứng chứa các ion: Ca2+, Mg2+, HCO3 -, Cl-, SO4 2-. Chất được dùng để làm mềm mẫu nước cứng trên là
A. Na2CO3. B. HCl. C. H2SO4. D. NaHCO3. Câu72.[QG.21-201] Cặp chất nào sau đây gây nên tính cứng vĩnh cửu của nước?
A. NaHCO3, KHCO3
B. NaNO3, KNO3
C. CaCl2, MgSO4 D. NaNO3, KHCO3 Câu73.[QG.21-202] Cặp chất nào sau đây gây nên tính cứng vĩnh cửu cho nước?
A. NaNO3, KNO3. B. NaNO3, KHCO3.
C. MgCl2, CaSO4 D. NaHCO3, KNO3 Câu74.[QG.21-203] Cặp chất nào sau đây gây nên tính cứng tạm thời của nước?
A. Na2SO4, KCl.
C. Na2SO4, K2SO4.
B. NaCl, KCl.
D. Mg(HCO3)2, Ca(HCO3)2.
Câu75.[QG.21-204] Cặp chất nào sau đây gây nên tính cứng tạm thời của nước?
A. Mg(HCO3)2, Ca(HCO3)2
C. KCl, NaCl.
B. Na2SO4, KCl.
D. NaCl, K2SO4.
Câu76. Cho m gam Mg phản ứng hết với dung dịch H2SO4 loãng (dư), thu được 3,36 lít khí H2 (đktc). Giá trị của m là
A. 7,2. B. 2,4. C. 4,8. D. 3,6. Câu77. Hòa tan hoàn toàn 14,40 gam kim loại M (hóa trị II) trong dung dịch H2SO4 loãng (dư) thu được 13,44 lít khí H2 (đktc). Kim loại M là
A. Ca. B. Mg. C. Be. D. Ba.
Câu78.[QG.20-201] Hòa tan hết 1,68 gam kim loại R (hóa trị II) trong dung dịch H2SO4 loãng thu được 0,07 mol H2. Kim loại R là
A. Zn. B. Fe. C. Ba. D. Mg. Câu79.[QG.20-202] Hòa tan hết 2,04 gam kim loại R (hóa trị II) trong dung dịch H2SO4 loãng, thu được 0,085 mol H2. Kim loại R là
A. Zn. B. Ca. C. Fe. D. Mg. Câu80.[QG.20-203] Hòa tan hết 1,8 gam kim loại R (hóa trị II) trong dung dịch H2SO4 loãng, thu được 0,075 mol H2. Kim loại R là
Trang13
A. Zn. B. Ba. C. Fe. D. Mg. Câu81.[QG.20-204] Hoà tan hết 1,2 gam kim loại R (hoá trị II) trong dung dịch H2SO4 loãng, thu được 0,05 mol H2. Kim loại R là
A. Mg. B. Fe. C. Ca. D. Zn. Câu82.[MH1-2020] Dẫn từ từ đến dư khí CO2 vào dung dịch chứa 0,01 mol Ca(OH)2. Sự phụ thuộc của khối lượng kết tủa (y gam) vào thể tích khí CO2 tham gia phản ứng (x lít) được biểu diễn như đồ thị:
Giá trị của m là
A. 0,20. B. 0,24. C. 0,72. D. 1,00.
Câu83. Cho 1,37 gam kim loại kiềm thổ M phản ứng với nước (dư), thu được 0,01 mol khí H2. Kim loại M là
A. Sr. B. Mg. C. Ba. D. Ca.
Câu84.(C.07): Cho một mẫu hợp kim Na-Ba tác dụng với nước (dư), thu được dung dịch X và
3,36 lít H2 (ở đktc). Thể tích dung dịch axit H2SO4 2M cần dùng để trung hoà dung dịch X là
A. 150 ml. B. 75 ml. C. 60 ml. D. 30 ml.
Câu85. Hấp thụ hoàn toàn V lít khí CO2 (đktc) vào dung dịch Ca(OH)2 dư, thu được 10 gam kết tủa. Giá trị của V là
A. 2,24. B. 4,48. C. 3,36. D. 1,12. Câu86.(B.13): Hấp thụ hoàn toàn 2,24 lít khí CO2 (đktc) vào 750 ml dung dịch Ba(OH)2 0,2M, thu được m gam kết tủa. Giá trị của m là
A. 29,55. B. 19,70. C. 9,85. D. 39,40. Câu87.[QG.21-201] Cho 12,6 gam MgCO3 tác dụng hết với dung dịch HCl dư, thu được V lít (đktc) khí CO2. Giá trị của V là
A. 4,48. B. 2,24. C. 1,12. D. 3,36. Câu88.[QG.21-202] Cho 15,9 gam Na2CO3 tác dụng hết với dung dịch HCl dư, thu được V lít (đktc) khí CO2. Giá trị của V là
A. 3,36. B. 4,48. C. 1,12. D. 2,24. Câu89.[QG.21-203] Cho 10,6 gam Na2CO3 tác dụng hết với dung dịch HCl dư, thu được V lít khí CO2. Giá trị của V là
A. 1,12. B. 3,36. C. 2,24. D. 4,48. Câu90.[QG.21-204] Cho 10 gam CaCO3 tác dụng hết với dung dịch HCl dư, thu được V lít (đktc) khí CO2. Giá trị của V là
A. 3.36. B. 4,48. C. 2,24. D. 1,12. 3.Mức độ vậndụng(khá) Câu91.[QG.22-202] Cho sơ đồ các phản ứng sau:
(1) X + Ba(OH)2 → Y + Z
(2) X + T → MgCl2 + Z
(3) MgCl2 + Ba(OH)2 → Y + T
Các chất X, T thỏa mãn sơ đồ trên lần lượt là
Trang14
A. MgSO4, NaCl. B. MgSO4, BaCl2. C. MgSO4, HCl. D. MgO, HCl. Câu92.[QG.22-204] Cho sơ đồ các phản ứng sau:
(1) X + Ba(OH)2 → Y + Z
(2) X + T → MgCl2 + Z
(3) MgCl2 + Ba(OH)2 → Y + T
Các chất Z, T thỏa mãn sơ đồ trên lần lượt là
A. MgSO4, BaCl2 B. BaSO4, BaCl2
C. H2SO4, BaCl2 D. BaSO4, MgSO4 Câu93.[QG.21-201] Cho sơ đồ chuyển hóa:
NaOH X + → Z Y + → NaOH X + → E Y + → CaCO3
Biết: X, Y, Z, E là các hợp chất khác nhau và khác CaCO3; mỗi mũi tên ứng với một phương trình hóa học của phản ứng giữa hai chất tương ứng. Các chất X, Y thỏa mãn sơ đồ trên lần lượt là
A. NaHCO3, Ca(OH)2. B. CO2, CaCl2.
C. Ca(HCO3)2, Ca(OH)2 D. NaHCO3, CaCl2 Câu94.[QG.21-202] Cho sơ đồ chuyển hóa:
XYXY 3NaOHZNaOHECaCO ++++ →→→→
Biết X, Y, Z, E là các hợp chất khác nhau và khác CaCO3; mỗi mũi tên ứng với một phương
trình hóa học của phản ứng giữa hai chất tương ứng. Các chất X, Y thỏa mãn sơ đồ trên lần lượt là
A. CO2, CaCl2. B. NaHCO3, CaCl2.
C. NaHCO3, Ca(OH)2. D. CO2, Ca(OH)2.
Câu95.[QG.21-203] Cho sơ đồ chuyển hóa:
XYXY 3NaOHZNaOHEBaCO ++++ →→→→
Biết: X, Y, Z, E là các hợp chất khác nhau và khác BaCO3; mỗi mũi tên ứng với một phương
trình hóa học của phản ứng giữa hai chất tương ứng. Các chất X, Y thỏa mãn sơ đồ trên lần lượt là
A. CO2, BaCl2.
B. Ba(HCO3)2, Ba(OH)2.
C. NaHCO3,BaCl2. D. NaHCO3, Ba(OH)2.
Câu96.[QG.21-204] Cho sơ đồ chuyển hóa: NaOH + → X Z + → Y NaOH + → X E + → Y BaCO3
Biết: X, Y, Z, E là các hợp chất khác nhau và khác BaCO3; mỗi mũi tên ứng với một phương trình hóa học của phản ứng giữa hai chất tương ứng. Các chất X, Y thỏa mãn sơ đồ trên lần lượt là
A. NaHCO3, BaCl2 B. NaHCO3, Ba(OH)2 C. CO2, Ba(OH)2 D. CO2, BaCl2 Câu97.[MH-2022] Cho sơ đồ chuyển hóa: ++++ ←←→→ FEEF 2 ZXBa(OH)YZ
Biết: X, Y, Z, E, F là các hợp chất khác nhau, mỗi mũi tên ứng với một phương trình hóa học của phản ứng xảy ra giữa hai chất tương ứng. Các chất E, F thỏa mãn sơ đồ trên lần lượt là
A. Na2SO4, NaOH. B. NaHCO3, BaCl2. C. CO2, NaHSO4. D. Na2CO3, HCl. Câu98.(QG.19-202). Cho các phản ứng sau theo đúng tỉ lệ mol:
(1) X ot → Y + CO2 (2) Y + H2O → Z
(3) T + Z → R + X + H2O. (4) 2T + Z → Q + X + 2H2O
Các chất R, Q thỏa mãn sơ đồ trên lần lượt là
A. KOH, K2CO3. B. Ba(OH)2, KHCO3. C. KHCO3, Ba(OH)2. D. K2CO3, KOH. Câu99.(QG.19-203). Cho sơ đồ các phản ứng theo đúng tỉ lệ mol:
(a) X ot → Y + CO2 (b) Y + H2O → Z
(c) T + Z → R + X + H2O (d) 2T + Z → Q + X + 2H2O
Các chất R, Q thỏa mãn sơ đồ trên lần lượt là:
A. NaHCO3, Ca(OH)2 B. NaOH, Na2CO3
C. Na2CO3, NaOH. D. Ca(OH)2, NaHCO3.
Câu100.(A.08): Từ hai muối X và Y thực hiện các phản ứng sau:
Hai muối X, Y tương ứng là
A. CaCO3, NaHSO4. B. BaCO3, Na2CO3.
C. CaCO3, NaHCO3. D. MgCO3, NaHCO3.
Câu101.(202–Q.17). Thực hiện các phản ứng sau:
(1) X + CO2 →Y (2) 2X + CO2 → Z + H2O
(3) Y + T →Q + X + H2O (4) 2Y + T → Q + Z + 2H2O
Hai chất X, T tương ứng là
A. Ca(OH)2, NaOH. B. Ca(OH)2, Na2CO3
C. NaOH, NaHCO3. D. NaOH, Ca(OH)2.
Câu102.(A.14): Cho các phản ứng xảy ra theo sơ đồ sau:
X1 + H2O ®iÖnph©n
→X2 + X3↑ + H2↑
cãmµngng¨n
X2 + X4
→ BaCO3↓ + K2CO3 + H2O
Hai chất X2, X4 lần lượt là:
A. NaOH, Ba(HCO3)2 B. KOH, Ba(HCO3)2
C. KHCO3, Ba(OH)2 D. NaHCO3, Ba(OH)2
Câu103.(201–Q.17). Cho các sơ đồ phản ứng sau:
(1) X1 + H2O ®iÖnph©ndungdÞch cãmµngng¨n
→X2 + X3↑+ H2↑
(2) X2 + X4 → BaCO3↓+ Na2CO3 + H2O
(3) X2 + X3 → X1 + X5 + H2O
(4) X4 + X6 → BaSO4↓ + K2SO4 + CO2↑ + H2O
Các chất X2, X5, X6 lần lượt là
A. KOH, KClO3, H2SO4. B. NaOH, NaClO, KHSO4.
C. NaHCO3, NaClO, KHSO4 D. NaOH, NaClO, H2SO4 Câu104.(QG.19-201). Cho sơ đồ các phản ứng sau:
(1) X1 + H2O ñieän phaân dung dòch coù maøng ngaên → X2 + X3 ↑ + H2 ↑
(2) X2 + X4 →BaCO3 + K2CO3 + H2O
(3) X2 + X3
(4) X4 + X6
→X1 + X5 + H2O
→BaSO4 + K2SO4 + CO2 + H2O
Các chất X5, X6 thỏa mãn sơ đồ trên lần lượt là:
A. KClO, H2SO4. B. Ba(HCO3)2, KHSO4.
C. Ba(HCO3)2, H2SO4 D. KClO, KHSO4 Câu105.(QG.19-204). Cho sơ đồ các phản ứng sau:
(1) X1 + H2O
Trang15
→ X2 + X3↑ + H2↑
ñieän phaân dung dòch coù maøng ngaên
Trang16
(2) X2 + X4 → CaCO3 + Na2CO3 + H2O
(3) X2 + X3 → X1 + X5 + H2O.
(4) X4 + X6 → CaSO4 + Na2SO4 + CO2 + H2O.
Các chất X5, X6 thỏa mãn sơ đồ trên lần lượt là
A. NaClO, H2SO4 B. Ca(HCO3)2, NaHSO4
C. Ca(HCO3)2, H2SO4. D. NaClO, NaHSO4.
Câu106.(B.10): Hòa tan hoàn toàn 2,45 gam hỗn hợp X gồm hai kim loại kiềm thổ vào 200 ml dung dịch HCl 1,25M, thu được dung dịch Y chứa các chất tan có nồng độ mol bằng nhau. Hai kim loại trong X là
A. Mg và Ca. B. Be và Mg. C. Mg và Sr. D. Be và Ca.
Câu107.(A.10): Cho 7,1 gam hỗn hợp gồm một kim loại kiềm X và một kim loại kiềm thổ Y tác dụng hết với lượng dư dung dịch HCl loãng, thu được 5,6 lít khí (đktc). Kim loại X, Y là
A. kali và bari. B. liti và beri. C. natri và magie. D. kali và canxi.
Câu108.(C.08): X là kim loại thuộc phân nhóm chính nhóm II (hay nhóm IIA). Cho 1,7 gam hỗn hợp gồm kim loại X và Zn tác dụng với lượng dư dung dịch HCl, sinh ra 0,672 lít khí H2 (ở đktc).
Mặt khác, khi cho 1,9 gam X tác dụng với lượng dư dung dịch H2SO4 loãng, thì thể tích khí hiđro sinh ra chưa đến 1,12 lít (ở đktc). Kim loại X là
A. Ba. B. Ca. C. Sr. D. Mg.
CHUYÊN ĐỀ 3: NHÔM VÀ HỢP CHẤT
KIẾN THỨC CẦN NHỚ
1.Nhôm
- Al (Z = 13): 1s22s22p63s23p1: Ô số 13, chu kì 3, nhóm IIIA.
- Nhôm dễ nhường 3e nên có tính khử mạnh và có SOH là +3 trong hợp chất.
- Nhôm có tính khử mạnh: Tác dụng với phi kim, axit, oxit bazơ và dung dịch kiềm.
- Điều chế bằng cách điện phân nóng chảy Al2O3 được lấy từ quặng boxit (Al2O3.2H2O) với xúc tác criolit (Na3AlF6).
2.Hợpchấtcủanhôm Nhômoxit(Al2O3) NhômhiđroxitAl(OH)3 NhômsunfatAl2(SO4)3
- Là chất rắn màu trắng, không tan trong nước, có tính lưỡng tính.
- Rubi (màu đỏ): Al2O3 có lẫn Cr2O3; Saphia (màu xanh): Al2O3 có lẫn TiO2 và Fe3O4.
- Là chất rắn, màu trắng, kết tủa dạng keo.
- Có tính lưỡng tính.
3.NhậnbiếtionAl3+ trongdungdịch
- Dùng dung dịch kiềm (OH-) để nhận biết muối nhôm (Al3+).
Hiện tượng: Phản ứng tạo kết tủa sau đó tan nếu kiềm dư.
Al3+ + 3OH→ Al(OH)3↓
Al(OH)3 + OH→ AlO2 - + 2H2O
4.Mộtsố PTHHcầnnhớ
(1) 2Al + 6HCl → 2AlCl3 + 3H2↑
(2) 2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
(3) 8Al + 3Fe3O4 ot → 4Al2O3 + 9Fe
(4) Al2O3 + 2NaOH → 2NaAlO2 + H2O
(5) Al(OH)3 + NaOH → NaAlO2 + 2H2O
(6) 2Al(OH)3 ot → Al2O3 + 3H2O
(7) NaAlO2 + CO2 + 2H2O → Al(OH)3↓ + NaHCO3
- Muối nhôm sunfat có ứng dụng nhiều nhất là phèn chua có công thức K2SO4.Al2(SO4)3.24H2O hay KAl(SO4)2.12H2O.
(8) NaAlO2 + HCl + H2O → Al(OH)3 ↓+ NaCl; Al(OH)3 + 3HCl → AlCl3 + 3H2O
BÀITẬPTỰ LUẬN
Câu1: Hoàn thành chuỗi phản ứng sau:
(1) (6) (3)(4)(5) 2333332 (2) (7) AlOAlAlClAl(NO)Al(OH)NaAlO
(1) …………………………………………… (5) ……………………………………………
(2) …………………………………………… (6) ……………………………………………
(3) …………………………………………… (7) ……………………………………………
(4) ……………………………………………
Câu2: Ghép các chất ở cột A và công thức ở cột B cho phù hợp: CộtA CộtB
(1) Quặng boxit.
(2) Rubi.
(3) Saphia.
(4) Phèn chua.
Trang17
(a) K2SO4.Al2(SO4)3.24H2O.
(b) Al2O3 lẫn TiO2 và Fe3O4.
(c) Al2O3 lẫn Cr2O3
(d) Al2O3.2H2O.
1 - …………; 2 - ………..; 3 - ………..; 4 - ………….; 5 - …………
Câu3: Các phát biểu sau đúng hay sai? Giải thích?
(1) Nhôm là kim loại thuộc chu kì 2, nhóm IIIA trong bảng tuần hoàn.
(2) Ở điều kiện thường kim loại Al bền trong nước và không khí do có màng oxit bảo vệ.
(3) Tất cả các nguyên tố nhóm IA, IIA, IIIA đều là kim loại.
(4) Trong các phản ứng hóa học, kim loại Al chỉ đóng vai trò là chất khử?
(5) Kim loại Al tan được trong dung dịch H2SO4 loãng, nguội.
(6) Kim loại Al có tính dẫn điện tốt hơn kim loại Cu.
(7) Cho các kim loại Na, Ca, Al, Fe, Cu có 2 kim loại tan tốt trong nước ở điều kiện thường
(8) Al(OH)3 phản ứng được với dung dịch HCl và dung dịch KOH.
(9) Cho NH3 dư vào dung dịch AlCl3 thu được kết tủa trắng keo, sau đó kết tủa tan dần.
(10) Phèn chua được dùng để làm trong nước đục có công thức K2SO4.Al2(SO4)3.24H2O.
BÀITẬPTRẮCNGHIỆM
1.Mức độ nhậnbiết(rấtdễ vàdễ)
Câu1. Cấu hình electron lớp ngoài cùng của nguyên tử nguyên tố Al (Z= 13) là
A. 3s23p3 B. 3s23p2 C. 3s23p1 D. 3s13p2
Câu2. Trong bảng tuần hoàn các nguyên tố hóa học, nguyên tố thuộc nhóm IIIA, chu kì 3 là
A. Mg. B. Al. C. Na.
D. Fe.
Câu3. X là một kim loại nhẹ, màu trắng bạc, được ứng dụng rộng rãi trong đời sống. X là
A. Fe. B. Ag. C. Cu. D. Al.
Câu4. Kim loại Al không phản ứng với dung dịch
A. NaOH loãng. B. H2SO4 đặc, nguội. C. H2SO4 đặc nóng. D. H2SO4 loãng.
Câu5.(QG-2018): Kim loại Al không tan trong dung dịch
A. HNO3 loãng. B. HCl đặc.
C. NaOH đặc. D. HNO3 đặc, nguội. Câu6. Kim loại nào sau đây phản ứng với dung dịch NaOH?
A. Fe. B. Ag. C. Al. D. Cu. Câu7.[QG.21-201] Ở nhiệt độ thường, kim loại Al tan hoàn toàn trong lượng dư dung dịch nào sau đây?
A. HCl. B. NaNO3. C. NaCl. D. KCl. Câu8.[QG.21-202] Ở nhiệt độ thường, kim loại Al hòa tan trong lượng dư dung dịch nào sau đây?
A. NaNO3. B. Na2SO4. C. KOH. D. KCl. Câu9.[QG.21-203] Ở nhiệt độ thường, kim loại Al tan hoàn toàn trong lượng dư dung dịch nào sau đây?
Trang19
Câu10.[QG.22-201] Kim loại Al tan hết trong lượng dư dung dịch nào sau đây sinh ra khí H2?
A. Na2SO4. B. NaNO3. C. NaCl. D. HCl. Câu11.[QG.22-202] Kim loại Al tác dụng với dung dịch chất nào sau đây sinh ra AlCl3?
A. HCl. B. NaCl. C. NaOH. D. NaNO3 Câu12.[QG.21-204] Ở nhiệt độ thường, kim loại Al tan hoàn toàn trong lượng dư dung dịch nào sau đây?
A. KCl. B. NaCl. C. NaOH. D. NaNO3
Câu13.[QG.22-202] Chất nào sau đây tác dụng với dung dịch NaOH sinh ra khí H2?
A. AlCl3. B. Al. C. Al2O3. D. Al(OH)3.
Câu14.[MH-2021] Sản phẩm của phản ứng giữa kim loại nhôm với khí oxi là
A. AlCl3 B. Al2O3 C. Al(OH)3 D. AI(NO3)3
Câu15. Ở nhiệt độ thường, kim loại Al tác dụng được với dung dịch
A. Mg(NO3)2. B. Ca(NO3)2. C. KNO3. D. Cu(NO3)2.
Câu16. Ở nhiệt độ cao, Al khử được ion kim loại trong oxit.
A. K2O. B. Fe2O3 C. MgO. D. BaO
Câu17.(MH.19): Kim loại nào sau đây có thể điều chế được bằng phản ứng nhiệt nhôm?
A. Na. B. Al. C. Ca. D. Fe. Câu18.(MH.19): Kim loại Al không tan được trong dung dịch nào sau đây?
A. NaOH. B. BaCl2 C. HCl. D. Ba(OH)2 Câu19. Nguyên liệu chính dùng để sản xuất nhôm là:
A. quặng manhetit B. quặng boxit C. quặng đôlômit. D. quặng pirit. Câu20.(Q.15): Quặng boxit được dùng để sản xuất kim loại nào sau đây?
A. Al. B. Cu. C. Na. D. Mg. Câu21.[MH-2021] Trong công nghiệp, quặng boxit dùng để sản xuất kim loại nhôm. Thành phần chính của quặng boxit là
A. Al2O3.2H2O. B. Al(OH)3.2H2O.
C. Al(OH)3.H2O. D. Al2(SO4)3.H2O. Câu22.[QG.22-201] Trong công nghiệp, nguyên liệu chính dùng để sản xuất nhôm là
A. quặng boxit. B. quặng manhetit.
C. quặng pirit. D. quặng đolomit. Câu23.(204–Q.17). Kim loại nào sau đây vừa phản ứng được với dung dịch HCl, vừa phản ứng được với dung dịch NaOH?
A. Fe. B. Al. C. Cu. D. Ag. Câu24.(203–Q.17). Ở nhiệt độ thường, kim loại X không tan trong nước nhưng tan trong dung dịch kiềm. Kim loại X là
A. Al. B. Mg. C. Ca. D. Na. Câu25.(QG.19-202). Chất nào sau đây có tính lưỡng tính?
A. Na2CO3. B. NaNO3. C. Al2O3. D. AlCl3. Câu26.[QG.21-201] Chất nào sau đây có tính lưỡng tính?
A. Na2O. В. KОН C. H2SO4 D. Al2O3 Câu27.[QG.21-204] Chất nào sau đây có tính lưỡng tính?
A. CaO. B. Al2O3. C. NaOH. D. HCl. Câu28.(QG.19-203). Dung dịch nào sau đây hòa tan được Al2O3?
A. NaCl. B. KNO3 C. HCl. D. MgCl2 Câu29. Hợp chất Al2O3 phản ứng được với dung dịch
A. NaOH. B. KCl. C. NaNO3 D. KNO3 Câu30.[QG.22-201] Chất nào sau đây tan hết trong dung dịch NaOH loãng, dư?
A. Al2O3. B. MgO. C. FeO. D. Fe2O3.
Câu31.(B.14): Các dung dịch nào sau đây đều tác dụng với Al2O3?
A. Na2SO4, HNO3 B. NaCl, NaOH. C. HNO3, KNO3 D. HCl, NaOH.
Câu32.[QG.21-202] Chất nào sau đây có tính lưỡng tính?
A. Al(OH)3. B. KCl. C. KOH. D. H2SO4.
Câu33.[QG.21-203] Chất nào sau đây có tính lưỡng tính?
A. AlCl3 B. Fe(OH)2 C. HCl. D. Al(OH)3
Câu34. Chất nào sau đây không có tính lưỡng tính?
A. Na2CO3. B. NaHCO3. C. Al2O3. D. Al(OH)3.
Câu35. Chất không có tính chất lưỡng tính là
A. Al2O3. B. NaHCO3. C. AlCl3. D. Al(OH)3.
Câu36. Chất phản ứng được với dung dịch NaOH là
A. Al2O3 B. MgO. C. KOH. D. CuO.
Câu37. Hợp chất Al(OH)3 tan được trong dung dịch
A. NaCl. B. NaOH. C. KNO3. D. KCl. Câu38.[MH2-2020] Chất nào sau đây có tính lưỡng tính?
A. NaNO3 B. MgCl2 C. Al(OH)3 D. Na2CO3 Câu39.[QG.20-201] Dung dịch nào sau đây hòa tan được Al(OH)3?
A. BaCl2. B. KCl. C. NaOH. D. KNO3. Câu40.[QG.20-202] Dung dịch nào sau đây tác dụng được với Al(OH)3?
A. NaNO3 B. CaCl2 C. KOH. D. NaCl. Câu41.[QG.20-203] Dung dịch nào sau đây tác dụng được với Al(OH)3?
A. KNO3. B. NaCl. C. NaOH. D. K2SO4 Câu42.[QG.20-204] Dung dịch nào sau đây tác dụng được với Al(OH)3?
A. KOH. B. KCl. C. NaNO3 D. Na2SO4 Câu43.(QG.19-201). Dung dịch chất nào sau đây hòa tan được Al(OH)3?
A. NaOH. B. KCl. C. MgCl2. D. NaNO3. Câu44.(QG-2018): Dung dịch chất nào sau đây hòa tan được Al(OH)3 ?
A. H2SO4 B. NaCl. C. Na2SO4 D. KCl. Câu45.(QG-2018): Chất nào sau đây tác dụng được với dung dịch HCl ?
A. MgCl2. B. BaCl2. C. Al(NO3)3. D. Al(OH)3.
Câu46.[MH1-2020] Công thức của nhôm clorua là
A. AlCl3 B. Al2(SO4)3 C. Al(NO3)3 D. AlBr3 Câu47.(A.11): Phèn chua được dùng trong ngành công nghiệp thuộc da, công nghiệp giấy, chất cầm màu trong ngành nhuộm vải, chất làm trong nước. Công thức hoá học của phèn chua là
A. Na2SO4.Al2(SO4)3.24H2O.
B. K2SO4.Al2(SO4)3.24H2O.
Câu50.[MH-2022] Nhôm bền trong không khí và nước do trên bề mặt của nhôm được phủ kín lớp chất X rất mỏng, bền. Chất X là
A. AlF3 B. Al(NO3)3 C. Al2(SO4)3 D. Al2O3
Câu51.[MH2-2020] Phản ứng nào sau đây là phản ứng nhiệt nhôm?
A. 3FeO + 2Al ot → 3Fe + Al2O3.
B. 2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
C. 2Al + 3H2SO4 → Al2(SO4)3 + 3H2.
D. 2Al + 3CuSO4 → Al2(SO4)3 + 3Cu.
Câu52.(C.07): Phản ứng hoá học xảy ra trong trường hợp nào dưới đây không thuộc loại phản ứng nhiệt nhôm?
A. Al tác dụng với Fe3O4 nung nóng. B. Al tác dụng với CuO nung nóng.
C. Al tác dụng với Fe2O3 nung nóng. D. Al tác dụng với axit H2SO4 đặc, nóng.
Câu53.(C.11): Dãy gồm các oxit đều bị Al khử ở nhiệt độ cao là:
A. FeO, MgO, CuO.
B. PbO, K2O, SnO.
C. Fe3O4, SnO, BaO. D. FeO, CuO, Cr2O3
Câu54.(A.12): Hỗn hợp X gồm Fe3O4 và Al có tỉ lệ mol tương ứng 1: 3. Thực hiện phản ứng nhiệt nhôm X (không có không khí) đến khi phản ứng xảy ra hoàn toàn thu được hỗn hợp gồm
A. Al, Fe, Fe3O4 và Al2O3 B. Al2O3, Fe và Fe3O4
C. Al2O3 và Fe. D. Al, Fe và Al2O3
Câu55. Cho dãy các chất: Al, Al(OH)3, Al2O3, AlCl3. Số chất lưỡng tính trong dãy là
A. 1. B. 4. C. 3. D. 2.
Câu56. Để phân biệt dung dịch AlCl3 và dung dịch KCl ta dùng dung dịch
A. NaOH. B. HCl. C. H2SO4 D. NaNO3
Câu57.(B.11): Phát biểu nào sau đây là sai?
A. Theo chiều tăng dần của điện tích hạt nhân, nhiệt độ nóng chảy của kim loại kiềm giảm dần.
B. Ở nhiệt độ thường, tất cả các kim loại kiềm thổ đều tác dụng được với nước.
C. Na2CO3 là nguyên liệu quan trọng trong công nghiệp sản xuất thuỷ tinh.
D. Nhôm bền trong môi trường không khí và nước là do có màng oxit Al2O3 bền vững bảo vệ
Câu58.[MH1-2020] Phát biểu nào sau đây sai?
A. Nhúng dây thép vào dung dịch HCl có xảy ra ăn mòn điện hóa học.
B. Nhôm bền trong không khí ở nhiệt độ thường do có lớp màng oxit bảo vệ.
C. Thạch cao nung có công thức CaSO4.2H2O.
D. Kim loại Na được bảo quản bằng cách ngâm chìm hoàn toàn trong dầu hỏa. Câu59.[MH2-2020] Phát biểu nào sau đây sai?
A. Cho viên kẽm vào dung dịch HCl thì kẽm bị ăn mòn hóa học.
B. Quặng boxit là nguyên liệu dùng để sản xuất nhôm.
C. (NH4)2SO4.Al2(SO4)3.24H2O.
D. Li2SO4.Al2(SO4)3.24H2O. Câu48.[MH-2022] Phèn chua được dùng trong ngành thuộc da, công nghiệp giấy, làm trong nước,.. Công thức phèn chua là
A. K2SO4.Al2(SO4)3.24H2O.
B. Al2O3.2H2O.
C. Đốt Fe trong khí Cl2 dư thu được FeCl3
D. Tính khử của Ag mạnh hơn tính khử của Cu.
Câu60.(A.07): Nhỏ từ từ cho đến dư dung dịch NaOH vào dung dịch AlCl3. Hiện tượng xảy ra là
A. có kết tủa keo trắng, sau đó kết tủa tan. B. chỉ có kết tủa keo trắng.
C. Al(NO3)3.9H2O.
D. Al(NO3)3.6H2O. Câu49.(QG.19-204). Vào mùa lũ, để có nước sử dụng, dân cư ở một số vùng thường sử dụng chất X (Có công thức K2SO4.Al2(SO4)3.24H2O) để làm trong nước. Chất X được gọi là
A. Phèn chua. B. Vôi sống. C. Thạch cao. D. Muối ăn.
2.Mức độ thônghiểu(trungbình)
Trang21
C. có kết tủa keo trắng và có khí bay lên. D. không có kết tủa, có khí bay lên.
Câu61.(C.10): Nhỏ từ từ dung dịch NaOH đến dư vào dung dịch X. Sau khi các phản ứng xảy ra hoàn toàn chỉ thu được dung dịch trong suốt. Chất tan trong dung dịch X là
A. AlCl3 B. CuSO4 C. Ca(HCO3)2 D. Fe(NO3)3 Câu62.(C.13): Phát biểu nào sau đây không đúng?
A. Trong công nghiệp, kim loại Al được điều chế bằng phương pháp điện phân Al2O3 nóng chảy.
B. Al(OH)3 phản ứng được với dung dịch HCl và dung dịch KOH.
Trang22
C. Kim loại Al tan được trong dung dịch HNO3 đặc, nguội.
D. Trong các phản ứng hóa học, kim loại Al chỉ đóng vai trò chất khử.
Câu63.(A.07): Trộn dung dịch chứa a mol AlCl3 với dung dịch chứa b mol NaOH. Để thu được kết tủa thì cần có tỉ lệ
A. a: b = 1: 4. B. a: b < 1: 4. C. a: b = 1: 5. D. a: b > 1: 4.
Câu64.(M.15): Trường hợp nào dưới đây thu được kết tủa sau khi phản ứng xảy ra hoàn toàn?
A. Cho dung dịch NaOH dư vào dung dịch AlCl3
B. Cho dung dịch AlCl3 dư vào dung dịch NaOH.
C. Cho CaCO3 vào lượng dư dung dịch HCl.
D. Sục CO2 tới dư vào dung dịch Ca(OH)2. Câu65.(201–Q.17). Trộn bột kim loại X với bột sắt oxit (gọi là hỗn hợp tecmit) để thực hiện phản ứng nhiệt nhôm dùng để hàn đường ra tàu hỏa. Kim loại X là
A. Fe. B. Cu. C. Ag. D. Al. Câu66. Cho 5,40 gam Al phản ứng hết với khí Cl2 (dư), thu được m gam muối. Giá trị của m là
A. 53,40. B. 40,05. C. 26,70. D. 13,35. Câu67.[MH-2021]Cho m gam Al phản ứng hoàn toàn với khí Cl2 dư, thu được 26,7 gam muối. Giá trị của m là
A. 2,7. B. 7,4. C. 3,0. D. 5,4. Câu68.(QG.19-204). Dùng Al dư khử hoàn toàn 4,8 gam Fe2O3 thành Fe bằng phản ứng nhiệt nhôm. Khối lượng Fe thu được là
A. 1,68. B. 2,80. C. 3,36. D. 0,84. Câu69.[QG.21-201] Hòa tan hết m gam Al trong dung dịch HCl dư, thu được 0,21 mol khí H2.
Giá trị của m là
A. 4,86. B. 5,67. C. 3,24. D. 3,78. Câu70.[QG.21-202] Hòa tan hết m gam Al trong dung dịch HCl dư, thu được 0,24 mol khí H2
Giá trị của m là
A. 3,24. B. 2,16. C. 4,32. D. 6,48. Câu71.[QG.21-203] Hòa tan hết m gam Al trong dung dịch HCl dư, thu được 0,12 mol khí H2.
Giá trị của m là
A. 4,86. B. 3,24. C. 1,62. D. 2,16. Câu72.[QG.21-204] Hòa tan hết m gam Al trong dung dịch HCl dư, thu được 0,18 mol khí H2. Giá trị của m là
A. 4,86. B. 2,16. C. 3,78. D. 3,24. Câu73.(203–Q.17). Cho 2,7 gam Al phản ứng hoàn toàn với dung dịch HCl dư, thu được V lít khí H2 (đktc). Giá trị của V là
A. 4,48. B. 2,24. C. 3,36. D. 6,72. Câu74. Hoà tan 5,4 gam Al bằng một lương dung dịch H2SO4 loãng (dư). Sau phản ứng thu được dung dịch X và V lít khí hidro ( ở đktc). Giá trị của V là:
A. 4,48 lít. B. 3,36 lít C. 2,24 lít. D. 6,72 lít.
Câu75. Hòa tan hoàn toàn 2,7 gam Al bằng dung dịch HNO3 (loãng, dư), thu được V lít khí NO (sản phẩm khử duy nhất, ở đktc). Giá trị của V là
A. 2,24. B. 4,48. C. 3,36. D. 1,12.
Câu76. Hòa tan hoàn toàn 7,8 gam hỗn hợp gồm Al và Mg trong dung dịch HCl dư, thu được
8,96 lít khí H2 (đktc) và dung dịch chứa m gam muối. Giá trị của m là
A. 22,0. B. 28,4. C. 36,2. D. 22,4.
Câu77. Cho m gam kim loại Al tác dụng với một lượng dư dung dịch NaOH, thu được 3,36 lít khí H2 (ở đktc). Giá trị của m là
Trang23
A. 10,8. B. 8,1. C. 5,4. D. 2,7 Câu78.[QG.20-201] Hòa tan hết 3,24 gam Al trong dung dịch NaOH thu được V lít khí H2 (đktc). Giá trị của V là
A. 2,688. B. 1,344. C. 4,032. D. 5,376. Câu79.[QG.20-202] Hòa tan hết 2,43 gam Al trong dung dịch NaOH, thu được V ml khí H2 (đktc). Giá trị của V là
A. 1008. B. 3024. C. 4032. D. 2016. Câu80.[QG.20-203] Hòa tan hết 0,81 gam Al trong dung dịch NaOH, thu được V ml khí H2 (đktc). Giá trị của V là
A. 448. B. 1344 C. 672. D. 1008. Câu81.[QG.20-204] Hoà tan hết 1,62 gam Al trong dung dịch NaOH, thu được V ml khí H2 (đktc). Giá trị của V là
A. 896. B. 672. C. 2016. D. 1344. Câu82.[MH2-2020] Hòa tan hoàn toàn 0,1 mol Al bằng dung dịch NaOH dư thu được V lít H2 (đktc). Giá trị của V là
A. 2,24. B. 5,60. C. 4,48. D. 3,36. Câu83.[MH1-2020] Để hòa tan hoàn toàn 1,02 gam Al2O3 cần dùng tối thiểu V ml dung dịch NaOH 1M. Giá trị của V là
A. 20. B. 10. C. 40. D. 5. Câu84.[MH-2022] Để khử hoàn toàn 16,0 gam Fe2O3 thành kim loại Fe ở nhiệt độ cao (không có oxi) cần tối thiểu m gam kim loại Al. Giá trị của m là
A. 8,1. B. 2,7. C. 5,4. D. 10,8. Câu85.(QG-2018): Cho 15,6 gam hỗn hợp X gồm Al và Al2O3 tác dụng với dung dịch NaOH dư, thu được 6,72 lít khí H2 (đktc). Khối lượng của Al2O3 trong X là
A. 2,7 gam. B. 5,1 gam. C. 5,4 gam. D. 10,2 gam. Câu86.(QG-2018): Cho 10,7 gam hỗn hợp X gồm Al và MgO vào dung dịch NaOH dư, sau khi phản ứng xảy ra hoàn toàn, thu được 3,36 lít khí H2 (đktc). Khối lượng MgO trong X là
A. 4,0 gam. B. 8,0 gam. C. 2,7 gam. D. 6,0 gam.
3.Mức độ vậndụng(khá)
Câu87.(B.13): Cho sơ đồ phản ứng: Al2(SO4)3 → X → Y→ Al. Trong sơ đồ trên, mỗi mũi tên là một phản ứng, các chất X, Y lần lượt là những chất nào sau đây?
A. NaAlO2 và Al(OH)3. B. Al(OH)3 và NaAlO2.
C. Al2O3 và Al(OH)3. D. Al(OH)3 và Al2O3.
Câu88.(B.07): Để thu được Al2O3 từ hỗn hợp Al2O3 và Fe2O3, người ta lần lượt:
A. dùng khí H2 ở nhiệt độ cao, dung dịch NaOH (dư).
B. dùng khí CO ở nhiệt độ cao, dung dịch HCl (dư).
C. dùng dung dịch NaOH (dư), dung dịch HCl (dư), rồi nung nóng.
D. dùng dung dịch NaOH (dư), khí CO2 (dư), rồi nung nóng.
Câu89.(B.09): Hoà tan m gam hỗn hợp gồm Al, Fe vào dung dịch H2SO4 loãng (dư). Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X. Cho dung dịch Ba(OH)2 (dư) vào dung dịch X, thu được kết tủa Y. Nung Y trong không khí đến khối lượng không đổi, thu được chất rắn Z là
A. hỗn hợp gồm BaSO4 và FeO.
C. hỗn hợp gồm BaSO4 và Fe2O3
Câu90.(QG-2018): Cho các sơ đồ phản ứng sau:
(a) X (dư) + Ba(OH)2 → Y + Z
(b) X + Ba(OH)2 (dư) → Y + T + H2O
B. hỗn hợp gồm Al2O3 và Fe2O3
D. Fe2O3
Trang24
Biết các phản ứng đều xảy ra trong dung dịch và chất Y tác dụng được với dung dịch H2SO4
loãng. Hai chất nào sau đây đều thỏa mãn tính chất của X ?
A. AlCl3, Al2(SO4)3 B. Al(NO3)3, Al2(SO4)3
C. Al(NO3)3, Al(OH)3. D. AlCl3, Al(NO3)3.
Câu91.[QG.22-201] Cho sơ đồ các phản ứng sau:
(1) Al2O3 + H2SO4 → X + H2O
(2) Ba(OH)2 + X → Y + Z
(3) Ba(OH)2 (dư) + X → Y + T + H2O
Các chất X, Z thỏa mãn sơ đồ trên lần lượt là
A. Al2(SO4)3, Al(OH)3. B. Al2(SO4)3, BaSO4. C. Al2(SO4)3, Ba(AlO2)2. D. Al(OH)3, BaSO4.
Câu92.[QG.22-203] Cho sơ đồ các phản ứng sau:
(1) Al2O3 + HCl → X + H2O
(2) Ba(OH)2 + X → Y + Z
(3) Ba(OH)2 (dư) + X → Y + T + H2O
Các chất Y, Z thỏa mãn sơ đồ trên lần lượt là
A. AlCl3, Ba(AlO2)2 B. Al(OH)3, BaCl2 C. AlCl3, Al(OH)3 D. AlCl3, BaCl2
Câu93.(QG-2018): Cho sơ đồ phản ứng sau: o 22243 COd−HOddHSOddNH ddNaOHd− 123435 XXXXXX + →→→→→ Biết X1, X2, X3, X4, X5 là các chất khác nhau của nguyên tố nhôm. Các chất X1 và X5 lần lượt là
A. AlCl3 và Al2O3 B. Al(NO3)3 và Al.
C. Al2O3 và Al. D. Al2(SO4)3 và Al2O3.
Câu94.(QG-2018): Cho kim loại M và các hợp chất X, Y, Z thỏa mãn các phương trình hóa học sau:
(a) 2M + 3Cl2 o → 2MCl3 (b) 2M + 6HCl → 2MCl3 + 3H2
(c) 2M + 2X + 2H2O → 2Y + 3H2 (d) Y + CO2 + 2H2O → Z + KHCO3
Các chất X, Y, Z lần lượt là:
A. KOH, KAlO2, Al(OH)3 C. NaOH, NaCrO2, Cr(OH)3
B. NaOH, NaAlO2, Al(OH)3. D. KOH, KCrO2, Cr(OH)3.
Câu95.(MH.19): Cho các phát biểu sau:
(a) Sục khí CO2 tới dư vào dung dịch NaAlO2, thu được kết tủa trắng.
(b) Nhỏ dung dịch Ba(HCO3)2 vào dung dịch KHSO4, thu được kết tủa trắng và có khí thoát ra.
(c) Dung dịch Na2CO3 làm mềm được nước cứng toàn phần.
(d) Thạch cao nung dùng để nặn tượng, bó bột khi gãy xương.
(e) Hợp kim liti – nhôm siêu nhẹ, được dùng trong kĩ thuật hàng không.
Số phát biểu đúng là
Trang25
CĐ4: TỔNG ÔN KIM LOẠI KIỀM – KIM LOẠI KIỀM THỔ – NHÔM 10 ĐIỀU THẦY BÌNH DẠY VỀ KLK – KLKT – NHÔM
1. Kim loại kiềm (IA): Li, Na, K, Rb, Cs, Fr.
2. Kim loại kiềm thổ (IIA): Be , Mg, Ca, Sr, Ba, Ra.
3. Tất cả kim loại kiềm và kiềm thổ (trừ Mg, Be) tan trong nước ở điều kiện thường. Mg tác dụng khi đun nóng, Be không tác dụng ở mọi điều kiện.
4. Để bảo vệ kim loại kiềm người ta thường ngâm trong dầu hỏa.
5. Al, Al2O3, Al(OH)3 vừa tác dụng được với axit, vừa tác dụng được với bazơ nhưng chỉ có Al2O3 và Al(OH)3 lưỡng tính.
6. Quặng đolomit: CaCO3.MgCO3; quặng boxit: Al2O3.2H2O; Criolit: Na3AlF6; phèn chua: K2SO4.Al2(SO4)3.24H2O.
7. Criolit là xúc tác quá trình điều chế Al có ba tác dụng: Giảm nhiệt độ nóng chảy của Al2O3, tạo hỗn hợp dẫn điện tốt, nhẹ nổi lên trên bề mặt ngăn cản Al sinh ra không bị oxi hóa bởi không khí.
8. Thạch cao sống: CaSO4.2H2O
Thạch cao nung: CaSO4.H2O (đúc tượng, bó bột khi gãy xương).
Thạch cao khan: CaSO4.
9. Na2CO3: Xôđa (Sản xuất thủy tinh, bột giặt, …); NaHCO3: Nabica (Sản xuất thuốc giảm đau dạ dày)
NH4HCO3: Bột nở; CaCO3: Đá vôi; CaO: Vôi sống; Ca(OH)2: Vôi tôi, dung dịch là nước vôi trong.
10. Nước cứng: Chứa nhiều Ca2+, Mg2+ .
- Nước cứng tạm thời: Ca2+, Mg2+, HCO3 -: làm mềm bằng cách đun nóng, dùng Ca(OH)2 vừa đủ, Na2CO3, Na3PO4
- Nước cứng vĩnh cửu: Ca2+, Mg2+, Cl-, SO4 2-: làm mềm bằng cách dùng dung dịch Na2CO3, Na3PO4
- Nước cứng toàn phần: Ca2+, Mg2+, HCO3 -, Cl-, SO4 2-: làm mềm bằng cách dùng dung dịch Na2CO3, Na3PO4.
- Nước trong tự nhiên phần lớn có tính cứng toàn phần.
1. Kim loại kiềm thuộc nhóm ………. Trong BTH, bao gồm: …………………………………
2. Kim loại kiềm thổ thuộc nhóm ………. Trong BTH, bao gồm: ……………………………..
3. Vị trí của nhôm trong bảng tuần hoàn là ……………………………………………….…….
4. Trong nhóm kim loại kiềm, kiềm thổ và nhôm thì kim loại không tác dụng với H2O ở điều kiện thường là ………………; kim loại không tác dụng với H2O ở mọi điều kiện là ………………
5. Phương pháp điều chế kim loại kiềm, kiềm thổ và nhôm là …………………………………
6. Hãy viết công thức hoặc tên gọi của các hợp chất trong bảng sau:
Têngọi Côngthức Têngọi Côngthức CaCO3. MgCO3 Thạch cao sống
Quặng Xivinit Thạch cao nung
Quặng Cacnalit Thạch cao khan
Quặng boxit CaCO3
Na3AlF6 Vôi sống
Xút Nabica
Xôđa Nước Gia – ven
7. Vai trò của criolit trong điều chế Al là …………………………………………………………
A. 3. B. 2. C. 5.8. Tại sai khi điều chế NaOH bằng phương pháp điện phân dung dịch NaCl phải có màng ngăn xốp: ……………………………………………………………………………………………………
9. Phương trình giải thích câu tục ngữ “nước chảy đá mòn”: …………………………………………………………………………………………………….
10. Phương trình giải thích sự hình thành thạch nhũ trong hang động: …………………………………………………………………………………………………….
11. Loại vật liệu dùng để đúc tượng, bó bột khi gãy xương là …………………………………...
12. Nước cứng là nước chứa nhiều ion …………………………………………………….……..
- Nước cứng tạm thời gồm các ion: ………………………………………….……………….…..
Làm mềm bằng cách: …………………………………………………………………………..…
- Nước cứng vĩnh cửu gồm các ion: ……………………………………………………….…...…
Làm mềm bằng hóa chất: ……………………………………………………………………....…
- Nước cứng toàn phân gồm các ion: …………………………………………………….…...…..
Làm mềm bằng hóa chất: ………………………………………………………………….……...
13. Hoàn thành các phương trình hóa học sau:
(1) ….Na + ….H2O → ……………………………………………………
(2) ….Mg + ….HNO3 → ………………+ …. N2O + ……………………
(3) ….Al + ….HNO3 loãng → ………………+ …. NH4NO3 + ……………
(4) ….Al + ….NaOH + ….. H2O → ………………………………………
(5) ….Al2O3 + ….NaOH →
(6) ….Al(OH)3 + ….NaOH → ……………………………………………
(7) ….NaAlO2 + ….HCl + ….H2O → ……………………………………
(8) ….NaAlO2 + ….CO2+ ….H
(9) ….Ca(HCO3)2 + ….NaOH dư →
(10) ….Ca(HCO3)2 o → ……………………………………………..
ĐỀ LUYỆNKIMLOẠIKIỀM–KIMLOẠIKIỀMTHỔ –NHÔM
Số câu:30–Thờigian45phút
Câu1. Cho dãy các kim loại: Na, Al, Fe, K. Số kim loại kiềm trong dãy là
A. 4. B. 3. C. 1. D. 2.
Câu2. Chất có tính lưỡng tính là
A. NaOH B. KNO3 C. NaHCO3 D. NaCl
Câu3. Khi nhiệt phân hoàn toàn NaHCO3 thì sản phẩm của phản ứng nhiệt phân là
A. NaOH, CO2, H2 B. Na2O, CO2, H2O.
C. Na2CO3, CO2, H2O. D. NaOH, CO2, H2O.
Câu4. X là một kim loại nhẹ, màu trắng bạc, được ứng dụng rộng rãi trong đời sống. X là
A. Fe. B. Ag. C. Cu. D. Al.
Câu5. Nguyên liệu chính dùng để sản xuất nhôm là:
A. quặng manhetit B. quặng boxit C. quặng đôlômit. D. quặng pirit.
Câu6. Chất không có tính chất lưỡng tính là
A. Al2O3. B. NaHCO3. C. AlCl3. D. Al(OH)3.
Câu7.(M.15): Cho dãy các chất sau: Cu, Al, KNO3, FeCl3. Số chất trong dãy tác dụng được với dung dịch NaOH là
A. 1. B. 2. C. 4. D. 3. Câu8.(A.11): Hợp chất nào của canxi được dùng để đúc tượng, bó bột khi gãy xương?
A. Thạch cao nung (CaSO4.H2O). B. Đá vôi (CaCO3).
C. Vôi sống (CaO). D. Thạch cao sống (CaSO4.2H2O).
Câu9.(B.13): Một loại nước cứng khi đun sôi thì mất tính cứng. Trong loại nước cứng này có hòa tan những hợp chất nào sau đây?
A. Ca(HCO3)2, Mg(HCO3)2. B. Ca(HCO3)2, MgCl2.
C. CaSO4, MgCl2 D. Mg(HCO3)2, CaCl2
Câu10. Cho dãy các kim loại: Ba, K, Cu, Fe. Số kim loại trong dãy phản ứng mạnh với H2O ở điều kiện thường là
A. 2. B. 1. C. 4. D. 3. Câu11.(C.13): Dung dịch nào dưới đây khi phản ứng hoàn toàn với dung dịch NaOH dư, thu được kết tủa trắng?
A. Ca(HCO3)2. B. FeCl3. C. AlCl3. D. H2SO4. Câu12.(203–Q.17). Dung dịch nào sau đây tác dụng với dung dịch Ba(HCO3)2, vừa thu được kết tủa, vừa có khí thoát ra?
A. NaOH. B. HCl. C. Ca(OH)2 D. H2SO4
Câu13.(A.11): Phèn chua được dùng trong ngành công nghiệp thuộc da, công nghiệp giấy, chất cầm màu trong ngành nhuộm vải, chất làm trong nước. Công thức hoá học của phèn chua là
A. Na2SO4.Al2(SO4)3.24H2O. B. K2SO4.Al2(SO4)3.24H2O.
C. (NH4)2SO4.Al2(SO4)3.24H2O. D. Li2SO4.Al2(SO4)3.24H2O.
Câu14.(C.11): Dãy gồm các oxit đều bị Al khử ở nhiệt độ cao là:
A. FeO, MgO, CuO. B. PbO, K2O, SnO.
C. Fe3O4, SnO, BaO. D. FeO, CuO, Cr2O3.
Câu15.(A.07): Nhỏ từ từ cho đến dư dung dịch NaOH vào dung dịch AlCl3. Hiện tượng xảy ra là
A. có kết tủa keo trắng, sau đó kết tủa tan. B. chỉ có kết tủa keo trắng.
C. có kết tủa keo trắng và có khí bay lên. D. không có kết tủa, có khí bay lên. Câu16.(B.08): Phản ứng nhiệt phân không đúng là
A. 2KNO3 → ot 2KNO2 + O2 B. NH4NO2 → ot N2 + 2H2O.
C. NH4Cl → ot NH3 + HCl. D. NaHCO3 → ot NaOH + CO2 Câu17. Cho 0,69 gam một kim loại kiềm tác dụng với nước (dư). Sau phản ứng thu được 0,336 lít khí hiđro ( ở đktc). Kim loại kiềm là:
A. Na B. K C. Rb D. Li. Câu18.(204–Q.17). Hòa tan hỗn hợp Na và K vào nước dư, thu được dung dịch X và 0,672 lít khí H2 (đktc). Thể tích dung dịch HCl 0,1M cần dùng để trung hòa X là
A. 150 ml. B. 300 ml. C. 600 ml. D. 900 ml. Câu19.(B.13): Hấp thụ hoàn toàn 2,24 lít khí CO2 (đktc) vào 750 ml dung dịch Ba(OH)2 0,2M, thu được m gam kết tủa. Giá trị của m là
A. 29,55. B. 19,70. C. 9,85. D. 39,40.
Trang27
Trang28
Câu20.(A.11): Hấp thụ hoàn toàn 0,672 lít khí CO2 (đktc) vào 1 lít dung dịch gồm NaOH 0,025M và Ca(OH)2 0,0125M, thu được x gam kết tủa. Giá trị của x là
A. 2,00. B. 1,00. C. 1,25. D. 0,75.
Câu21.(A.09): Dung dịch X chứa hỗn hợp gồm Na2CO3 1,5M và KHCO3 1M. Nhỏ từ từ từng giọt cho đến hết 200 ml dung dịch HCl 1M vào 100 ml dung dịch X, sinh ra V lít khí (ở đktc). Giá trị của V là
A. 4,48. B. 3,36. C. 2,24. D. 1,12.
Câu22.(A.14): Cho m gam hỗn hợp gồm Al và Na vào nước dư, sau khi các phản ứng xảy ra hoàn toàn, thu được 2,24 lít khí H2 (đktc) và 2,35 gam chất rắn không tan. Giá trị của m là
A. 3,70. B. 4,85. C. 4,35. D. 6,95. Câu23.(A.08): Nung nóng m gam hỗn hợp Al và Fe2O3 (trong môi trường không có không khí) đến khi phản ứng xảy ra hoàn toàn, thu được hỗn hợp rắn Y. Chia Y thành hai phần bằng nhau:
- Phần 1 tác dụng với dung dịch H2SO4 loãng (dư), sinh ra 3,08 lít khí H2 (ở đktc);
- Phần 2 tác dụng với dung dịch NaOH (dư), sinh ra 0,84 lít khí H2 (ở đktc). Giá trị của m là
A. 22,75 B. 21,40. C. 29,40. D. 29,43. Câu24.(B.09): Hoà tan m gam hỗn hợp gồm Al, Fe vào dung dịch H2SO4 loãng (dư). Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X. Cho dung dịch Ba(OH)2 (dư) vào dung dịch X, thu được kết tủa Y. Nung Y trong không khí đến khối lượng không đổi, thu được chất rắn Z là
A. hỗn hợp gồm BaSO4 và FeO. B. hỗn hợp gồm Al2O3 và Fe2O3
C. hỗn hợp gồm BaSO4 và Fe2O3 D. Fe2O3
Câu25.(B.09): Thực hiện các thí nghiệm sau:
(I) Cho dung dịch NaCl vào dung dịch KOH.
(II) Cho dung dịch Na2CO3 vào dung dịch Ca(OH)2
(III) Điện phân dung dịch NaCl với điện cực trơ, có màng ngăn.
(IV) Cho Cu(OH)2 vào dung dịch NaNO3.
(V) Sục khí NH3 vào dung dịch Na2CO3.
(VI) Cho dung dịch Na2SO4 vào dung dịch Ba(OH)2
Các thí nghiệm đều điều chế được NaOH là:
A. II, III và VI. B. I, II và III. C. I, IV và V. D. II, V và VI. Câu26.(201–Q.17). Cho các sơ đồ phản ứng sau:
(1) X1 + H2O ®iÖnph©ndungdÞch cãmµngng¨n →X2 + X3↑+ H2↑
(2) X2 + X4 → BaCO3↓+ Na2CO3 + H2O
(3) X2 + X3 → X1 + X5 + H2O
(4) X4 + X6 → BaSO4↓ + K2SO4 + CO2↑ + H2O
Các chất X2, X5, X6 lần lượt là
A. KOH, KClO3, H2SO4. B. NaOH, NaClO, KHSO4.
C. NaHCO3, NaClO, KHSO4 D. NaOH, NaClO, H2SO4
Câu27. Hỗn hợp X gồm Na, Ba, Na2O và BaO. Hòa tan hoàn toàn 21,9 gam X vào nước, thu được
1,12 lít khí H2 (đktc) và dung dịch Y, trong đó có 20,52 gam Ba(OH)2. Hấp thụ hoàn toàn 6,72 lít khí CO2 (đktc) vào Y, thu được m gam kết tủa. Giá trị của m là
A. 15,76. B. 39,40. C. 21,92. D. 23,64.
Câu28.[MH1-2020] Dẫn từ từ đến dư khí CO2 vào dung dịch chứa 0,01 mol Ca(OH)2. Sự phụ thuộc của khối lượng kết tủa (y gam) vào thể tích khí CO2 tham gia phản ứng (x lít) được biểu diễn như đồ thị:
Giá trị của m là
A. 0,20. B. 0,24. C. 0,72. D. 1,00. Câu29. Hòa tan hết m gam hỗn hợp X gồm Na, Na2O, K, K2O, Ba và BaO (oxi chiếm 8,75% về khối lượng) vào nước, thu được 400 ml dung dịch Y và 1,568 lít H2 (đktc). Trộn 200 ml dung dịch Y với 200 ml dung dịch hỗn hợp gồm HCl 0,2M và H2SO4 0,15M, thu được 400 ml dung dịch có pH = 13. Các phản ứng xảy ra hoàn toàn. Giá trị m gầngiátrị nàonhất sau đây?
A. 12. B. 14. C. 15. D. 13. Câu30.(A.10): Cho m gam NaOH vào 2 lít dung dịch NaHCO3 nồng độ a mol/l, thu được 2 lít dung dịch X. Lấy 1 lít dung dịch X tác dụng với dung dịch BaCl2 (dư) thu được 11,82 gam kết tủa.
Mặt khác, cho 1 lít dung dịch X vào dung dịch CaCl2 (dư) rồi đun nóng, sau khi kết thúc các phản
ứng thu được 7,0 gam kết tủa. Giá trị của a, m tương ứng là
A. 0,08 và 4,8. B. 0,04 và 4,8. C. 0,14 và 2,4. D. 0,07 và 3,2.
Trang29
CÁC DẠNG BÀI TẬP VỀ KLK – KLKT - NHÔM (LT)
Dạng1:Bàitoánkimloạikiềmvàkiềmthổ tácdụngvớinướcvàaxit
Dạng2:BàitoánCO2 tácdụngvớidungdịchkiềm(Đồ thị)
Dạng3:Bàitoánmuốicacbonattácdụngvớiaxit(Đồ thị)
Dạng4:Mộtsố bàitoánkhácvề muốicacbonat
Dạng5:Bàitoánnhômtácdụngvớidungdịchkiềm
Dạng6:Bàitoánvề phản ứngnhiệtnhôm
Dạng7:Bàitoánmuốinhômtácdụngvớidungdịchkiềm(Đồ thị)–Giảmtải
Dạng8:Bàitoánmuốialuminattácdụngvớidungdịchaxit(Đồ thị)–Giảmtải
Dạng9:BàitoántạohỗnhợpkếttủaAl(OH)3 vàBaSO4–Giảmtải
DẠNG1:KLKVÀKLKTTÁCDỤNGVỚINƯỚCVÀAXIT LÝ THUYẾT VÀ PHƯƠNG PHÁP GIẢI
- Hầu hết các KLK và KLKT (trừ Be, Mg) đều tác dụng với H2O ở điều kiện thường.
PTHH: M + nH2O → Mn+ + nOH+ n 2 H2↑ ⇒
2H OH n2n =
Bazơ sinh ra có thể phản ứng trung hòa bởi H+ hoặc tạo kết tủa với các cation kim loại.
PTHH: H+ + OH- → H2O ⇒
2H HOH nn2n +− ==
Cu2+ + 2OH- → Cu(OH)2↓
Fe3+ + 3OH- → Fe(OH)3↓
- Các KLK và KLKT đều tác dụng với dung dịch axit HCl, H2SO4 loãng.
PTHH: M + nH+ → Mn+ + n 2 H2↑⇒
2H H n2n + =
Nguyên tử khối: KLK: Li = 3; Na = 23; K = 39; Rb = 85,5; Cs = 133.
KLKT: Be = 9; Mg = 24; Ca = 40; Sr = 88; Ba = 137.
VÍDỤ MINHHỌA Câu1. Cho 13,7 gam Ba tác dụng với nước dư, sau phản ứng thu được V lít H2 (ở đktc). Giá trị của V là
A. 1,12 lít B. 2,24 lít C. 1,792 lít
D. 3,36 lít
Câu2.(MH2-2017): Cho 0,78 gam kim loại kiềm M tác dụng hết với H2O, thu được 0,01 mol khí
H2. Kim loại M là
A. Li. B. Na. C. K.
D. Rb.
Câu3.[QG.20-201] Hòa tan hết 1,68 gam kim loại R (hóa trị II) trong dung dịch H2SO4 loãng thu
được 0,07 mol H2. Kim loại R là
A. Zn. B. Fe. C. Ba. D. Mg. Câu4.(QG-2017) Hòa tan hỗn hợp Na và K vào nước dư, thu được dung dịch X và
0,672 lít khí H2 (đktc). Thể tích dung dịch HCl 0,1M cần dùng để trung hòa X là
A. 150 ml. B. 300 ml. C. 600 ml. D. 900 ml.
Câu5.(C.07): Cho một mẫu hợp kim Na-Ba tác dụng với nước (dư), thu được dung dịch X và 3,36 lít H2 (ở đktc). Thể tích dung dịch axit H2SO4 2M cần dùng để trung hoà dung dịch X là
A. 150ml. B. 75ml. C. 60ml. D. 30ml.
Câu6.(A.10): Hoà tan hoàn toàn 8,94 gam hỗn hợp gồm Na, K và Ba vào nước, thu được dung dịch X và 2,688 lít khí H2 (đktc). Dung dịch Y gồm HCl và H2SO4, tỉ lệ mol tương ứng là 4: 1.
Trung hoà dung dịch X bởi dung dịch Y, tổng khối lượng các muối được tạo ra là
A. 13,70 gam. B. 12,78 gam. C. 18,46 gam. D. 14,62 gam.
Câu7.(B.07): Cho 1,67 gam hỗn hợp gồm hai kim loại ở 2 chu kỳ liên tiếp thuộc nhóm IIA (phân nhóm chính nhóm II) tác dụng hết với dung dịch HCl (dư), thoát ra 0,672 lít khí H2 (ở đktc). Hai kim loại đó là
A. Be và Mg. B. Mg và Ca. C. Sr và Ba. D. Ca và Sr. Câu8.(C.12): Hoà tan hoàn toàn 1,1 gam hỗn hợp gồm một kim loại kiềm X và một kim loại kiềm thổ Y (MX < MY) trong dung dịch HCl dư, thu được 1,12 lít khí H2 (đktc). Kim loại X là
A. Li. B. Na. C. Rb. D. K. Câu9.(Q.15): Cho một lượng hỗn hợp X gồm Ba và Na vào 200 ml dung dịch Y gồm HCl 0,1M và CuCl2 0,1M. Kết thúc các phản ứng, thu được 0,448 lít khí (đktc) và m gam kết tủa. Giá trị của m là
A. 1,28. B. 1,96. C. 0,64. D. 0,98. Câu10.[MH-2021] Cho m gam hỗn hợp gồm Na, Na2O, K2O vào H2O dư, thu được 50 ml dung dịch X và 0,02 mol H2. Cho 50 ml dung dịch HCl 3M vào X, thu được 100 ml dung dịch Y có pH = 1. Cô cạn Y thu được 9,15 gam chất rắn khan. Giá trị của m gầnnhất với giá trị nào sau đây?
A. 4,0. B. 4,6. C. 5,0. D. 5,5.
Câu11. Cho 9,96 gam hỗn hợp gồm Na, Na2O, K2O vào H2O dư, thu được 100 ml dung dịch X và
V lít H2 (đktc). Cho 100 ml dung dịch HNO3 3M vào X, thu được 200 ml dung dịch Y có pH = 1.
Cô cạn Y thu được 25,72 gam chất rắn khan. Giá trị của V là
A. 0,112. B. 0,224. C. 0,672. D. 0,896.
Câu12. Hòa tan hết m gam hỗn hợp X gồm Na, Na2O, K, K2O, Ba và BaO (oxi chiếm 8,75% về khối lượng) vào H2O thu được 400 ml dung dịch Y và 1,568 lít H2 (đktc). Trộn 200 ml dung dịch Y với 200 ml dung dịch hỗn hợp gồm HCl 0,2M và H2SO4 0,15M, thu được 400 ml dung dịch có pH = 13. Các phản ứng xảy ra hoàn toàn. Giá trị m gầnnhất với giá trị nào sau đây?
A. 15. B. 14. C. 13. D. 12. Câu13. Hòa tan hoàn toàn a gam hỗn hợp X gồm Na, Na2O, K, K2O, Ba và BaO (trong đó khối lượng oxi là 80a 739 gam) vào nước dư. Sau phản ứng, thu được dung dịch Y gồm NaOH, KOH và Ba(OH)2 có tỉ lệ mol tương ứng là 4: 4: 3 và 0,896 lít khí H2 (đktc). Sục 4,928 lít khí CO2 (đktc) vào Y thu được b gam kết tủa. Giá trị của (a + b) là
A. 28,8. B. 24,4. C. 26,6. D. 27,7. Câu14.(A.13): Hỗn hợp X gồm Na, Ba, Na2O và BaO. Hòa tan hoàn toàn 21,9 gam X vào nước, thu được 1,12 lít khí H2 (đktc) và dung dịch Y, trong đó có 20,52 gam Ba(OH)2. Hấp thụ hoàn toàn 6,72 lít khí CO2 (đktc) vào Y, thu được m gam kết tủa. Giá trị của m là
A. 15,76. B. 39,40. C. 21,92. D. 23,64. Câu15. Cho 19,02 gam hỗn hợp Mg, Ca, CaO, MgO, MgCO3, CaCO3 tác dụng với dung dịch HCl vừa đủ, thu được 4,704 lít hỗn hợp khí (đktc) có tỉ khối so với H2 là 12,5 và dung dịch chứa 12,825 gam MgCl2 và m gam CaCl2. Giá trị của m là
A. 18,78. B. 19,425. C. 20,535. D. 19,98. BÀITẬPTỰ LUYỆN Câu16.(C.14): Hòa tan hết 4,68 gam kim loại kiềm M vào H2O dư, thu được 1,344 lít khí H2 (đktc). Kim loại M là
A. Rb. B. Li. C. K. D. Na. Câu17.[QG.20-202] Hòa tan hết 2,04 gam kim loại R (hóa trị II) trong dung dịch H2SO4 loãng, thu được 0,085 mol H2. Kim loại R là
A. Zn. B. Ca. C. Fe. D. Mg. Câu18.[QG.20-203] Hòa tan hết 1,8 gam kim loại R (hóa trị II) trong dung dịch H2SO4 loãng, thu được 0,075 mol H2. Kim loại R là
A. Zn. B. Ba. C. Fe. D. Mg.
Trang32
Câu19.[QG.20-204] Hoà tan hết 1,2 gam kim loại R (hoá trị II) trong dung dịch H2SO4 loãng, thu được 0,05 mol H2. Kim loại R là
A. Mg. B. Fe. C. Ca. D. Zn.
Câu20.(QG-2017) Hòa tan hoàn toàn hỗn hợp K và Na vào nước, thu được dung dịch X và V lít khí H2 (đktc). Trung hòa X cần 200 ml dung dịch H2SO4 0,1M. Giá trị của V là
A. 0,896. B. 0,448. C. 0,112. D. 0,224.
Câu21.(QG.18-202): Hòa tan hoàn toàn hỗn hợp gồm K và Na vào nước, thu được dung dịch X và V lít khí H2 (đktc). Trung hòa X cần 200 ml dung dịch H2SO4 0,1M. Giá trị của V là
A. 0,112. B. 0,224. C. 0,448. D. 0,896.
Câu22.(QG.18-204): Cho 0,425 gam hỗn hợp X gồm Na và K vào nước dư thu được 0,168 lít khí H2 (đktc). Khối lượng kim loại Na trong X là
A. 0,115 gam. B. 0,230 gam. C. 0,276 gam. D. 0,345 gam.
Câu23.(QG-2017) Hòa tan hoàn toàn 1,15 gam kim loại X vào nước, thu được dung dịch Y. Để trung hòa Y cần vừa đủ 50 gam dung dịch HCl 3,65%. Kim loại X là
A. Ca. B. Ba. C. Na. D. K. Câu24.(C.13): Hòa tan hết một lượng hỗn hợp gồm K và Na vào H2O dư, thu được dung dịch X và 0,672 lít khí H2 (đktc). Cho X vào dung dịch FeCl3 dư, đến khi phản ứng xảy ra hoàn toàn, thu được m gam kết tủa. Giá trị của m là
A. 2,14. B. 6,42. C. 1,07. D. 3,21. Câu25.(C.11): Để hoà tan hoàn toàn 6,4 gam hỗn hợp gồm kim loại R (chỉ có hóa trị II) và oxit của nó cần vừa đủ 400 ml dung dịch HCl 1M. Kim loại R là
A. Ba. B. Be. C. Mg. D. Ca. Câu26.(C.08): Hoà tan hết 7,74 gam hỗn hợp bột Mg, Al bằng 500 ml dung dịch hỗn hợp HCl 1M và H2SO4 0,28M thu được dung dịch X và 8,736 lít khí H2 (ở đktc). Cô cạn dung dịch X thu được lượng muối khan là
A. 38,93 gam. B. 103,85 gam. C. 25,95 gam. D. 77,86 gam.
Câu27. Cho m gam hỗn hợp X gồm Na, Na2O, Ba, BaO tác dụng với một lượng dư H2O, thu được 0,672 lít H2 (đktc) và 200 ml dung dịch Y. Cho Y tác dụng với 200 ml dung dịch chứa hỗn hợp gồm
HNO3 0,4M và HCl 0,1M, thu được 400 ml dung dịch Z có pH = 13. Cô cạn dung dịch Z thu được 12,35 gam chất rắn. Giá trị của m gầnnhất với giá trị nào sau đây?
A. 7,2. B. 6,8. C. 6,6. D. 5,4.
Câu28. Hòa tan hoàn toàn m gam hỗn hợp X gồm Na; K; Na2O; Ba và BaO (trong đó oxi chiếm
20% về khối lượng) vào nước, thu được 200 ml dung dịch Y và 0,336 lít khí H2. Trộn 200 ml dung dịch Y với 200 ml dung dịch HCl 0,8M thu được 400 ml dung dịch có pH = 13. Giá trị của m là
A. 6,8. B. 17,6. C. 6,4. D. 12,8
Câu29.(MH-2019): Hòa tan hoàn toàn m gam hỗn hợp X gồm Na, K2O, Ba và BaO (trong đó oxi chiếm 10% về khối lượng) vào nước, thu được 300 ml dung dịch Y và 0,336 lít khí H2. Trộn 300 ml dung dịch Y với 200 ml dung dịch gồm HCl 0,2M và HNO3 0,3M, thu được 500 ml dung dịch có pH = 13. Giá trị của m là
A. 9,6. B. 10,8. C. 12,0. D. 11,2. Câu30. Cho 30,8 gam hỗn hợp X gồm Fe, FeO, FeCO3, Mg, MgO và MgCO3 tác dụng vừa đủ với dung dịch H2SO4 loãng, thu được 7,84 lít (đktc) hỗn hợp khí Y gồm CO2, H2 và dung dịch Z chỉ chứa 60,4 gam hỗn hợp muối sunfat trung hòa. Tỉ khối của Y so với He là 6,5. Khối lượng của MgSO4 có trong dung dịch Z là
A. 38,0 gam. B. 33,6 gam. C. 36,0 gam. D. 30,0 gam.
DẠNG2:BÀITOÁNCO2 TÁCDỤNGVỚIDUNGDỊCHKIỀM
Dạng2.1:Bàitoán đồ thị CO2 tácdụngvớiCa(OH)2 (hoặcBa(OH)2)
LÝTHUYẾTVÀPHƯƠNGPHÁPGIẢI
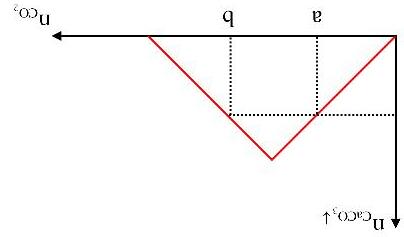
- Cho từ từ CO2 vào dung dịch chứa a mol Ca(OH)2 ban đầu tạo kết tủa:
(1) CO2 + Ca(OH)2 → CaCO3↓ + H2O
Sau đó kết tủa tan: (2) CO2 + CaCO3 + H2O → Ca(HCO3)2 - Đồ th
Trang33
Dáng đồ thị: Tam giác cân.
Khi phản ứng tạo ra lượng kết tủa nhỏ hơn lượng kết tủa cực đại thì có 2 giá trị của CO2 đều
thỏa mãn 2 2
= =−
COmin COmax OH
VÍDỤ MINHHỌA
↓ ↓
nn nnn
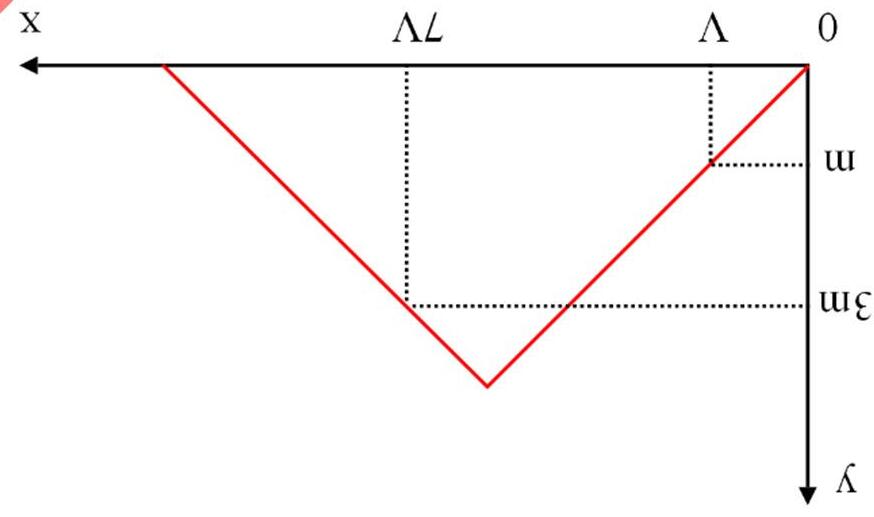
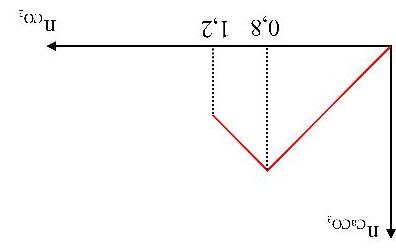
Câu1.(Sở HN-2017): Thổi từ từ khí CO2 đến dư vào vào dung dịch chứa 0,12 mol Ca(OH)2. Sự phụ thuộc của số mol kết tủa thu được vào số mol CO2 được biểu diễn theo đồ thị sau:
Mối quan hệ giữa a và b là
A. b = 0,24 – a. B. b = 0,24 + a. C. b = 0,12 + a. D. b = 2a.
Câu2. Sục CO2 vào dung dịch BaOH)2 ta qua sát hiện tượng theo đồ thị hình dưới đây:
Giá trị của x là
A. 0,5 mol B. 0,6 mol C. 0,7 mol D. 0,8 mol
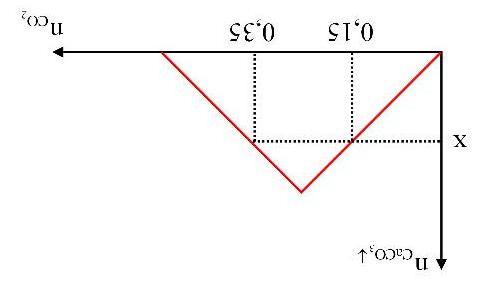
Câu3. Sục CO2 vào dung dịch Ba(OH)2 ta có kết quả theo đồ thị như hình dưới đây:
Giá trị của x là
Trang34
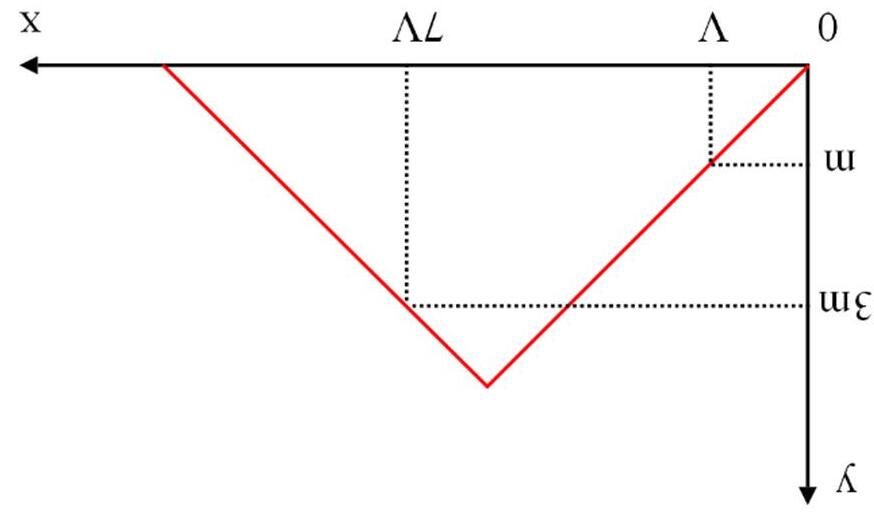
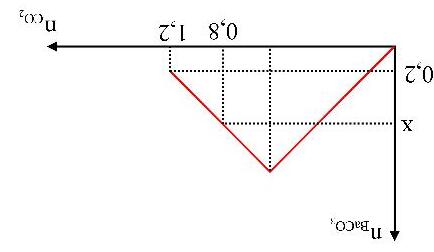
A. 0,10 mol. B. 0,15 mol. C. 0,18 mol. D. 0,20 mol. Câu4. Sục từ từ đến dư CO2 vào một cốc đựng dung dịch Ca(OH)2. Kết quả thí nghiệm được biểu diễn trên đồ thị như hình dưới đây:
Câu8. Sục từ từ đến dư CO2 vào dung dịch chứa V lít Ca(OH)2 0,05M. Kết quả thí nghiệm được biểu diễn trên đồ thị như hình dưới đây:
Khi lượng CO2 đã sục vào dung dịch là 0,85 mol thì lượng kết tủa đã xuất hiện là m gam. Giá trị của m là
A. 40 gam. B. 55 gam. C. 45 gam. D. 35 gam. Câu5.(MH.19): Dẫn từ từ đến dư khí CO2 vào dung dịch Ba(OH)2. Sự phụ thuộc của khối lượng kết tủa (y gam) vào thể tích khí CO2 tham gia phản ứng (x lít) được biểu diễn bằng đồ thị dưới đây.
Giá trị của V và x là
A. 5,0; 0,15. B. 0,4; 0,1. C. 0,5; 0,1. D. 0,3; 0,2.



Câu9. Sục CO2 vào dung dịch Ba(OH)2 ta có kết quả theo đồ thị như hình dưới đây:
Giá trị của m là
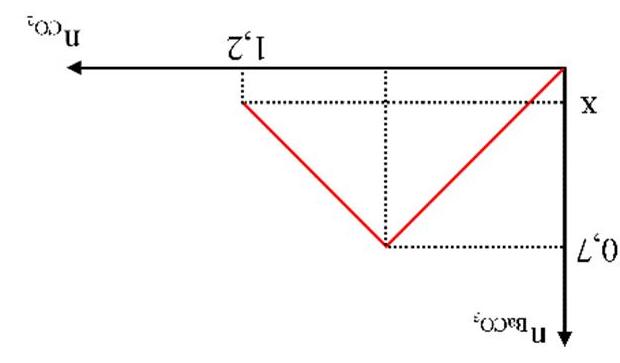
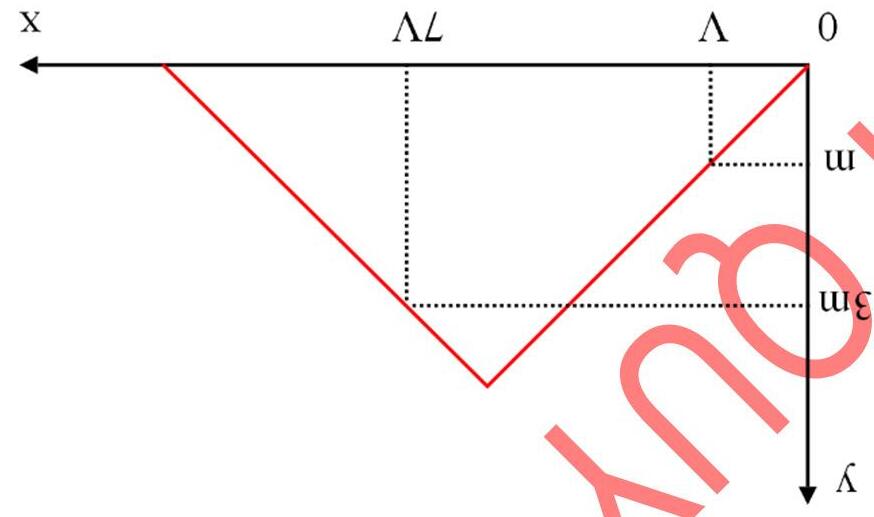
A. 19,70. B. 39,40. C. 9,85. D. 29,55. Câu6.[MH1-2020] Dẫn từ từ đến dư khí CO2 vào dung dịch chứa 0,01 mol Ca(OH)2. Sự phụ thuộc của khối lượng kết tủa (y gam) vào thể tích khí CO2 tham gia phản ứng (x lít) được biểu diễn như đồ thị:
Giá trị của x là
A. 0,55 mol. B. 0,65 mol. C. 0,75 mol. D. 0,85 mol.
Câu10. Sục CO2 vào dung dịch Ba(OH)2 ta có kết quả theo đồ thị như hình dưới đây
Giá trị của x là
A. 0,10 mol. B. 0,15 mol. C. 0,18 mol. D. 0,20 mol.
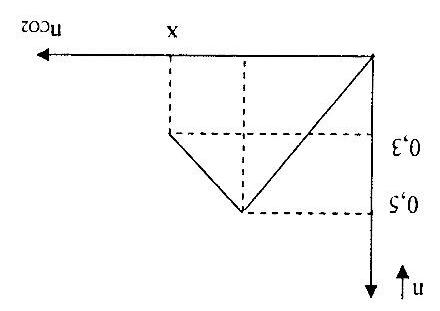
Câu11. Sục CO2 vào dung dịch Ba(OH)2 ta có kết quả theo đồ thị như hình dưới đây:
Giá trị của m là
A. 0,20. B. 0,24. C. 0,72. D. 1,00.
BÀITẬPTỰ LUYỆN
Câu7. Sục từ từ đến dư CO2 vào dung dịch chứa a mol Ca(OH)2. Kết quả thí nghiệm được biểu diễn trên đồ thị như hình dưới đây:
Giá trị của x là
A. 0,60 mol. B. 0,50 mol. C. 0,42 mol. D. 0,62 mol. Câu12. Sục CO2 vào 200 gam dung dịch Ca(OH)2 ta có kết quả theo đồ thị như hình dưới đây:
Giá trị của a và x là
A. 0,3; 0,1. B. 0,4; 0,1. C. 0,5; 0,1. D. 0,3; 0,2.


Trang35
Nồng độ phần trăm của chất tan trong dung dịch sau phản ứng là
A. 30,45%. B. 34,05%. C. 35,40%. D. 45,30%.
Trang36
Câu13. Sục từ từ khí CO2 vào dung dịch chứa Ca(OH)2, kết quả thí nghiệm được biểu diễn trên đồ thị sau:
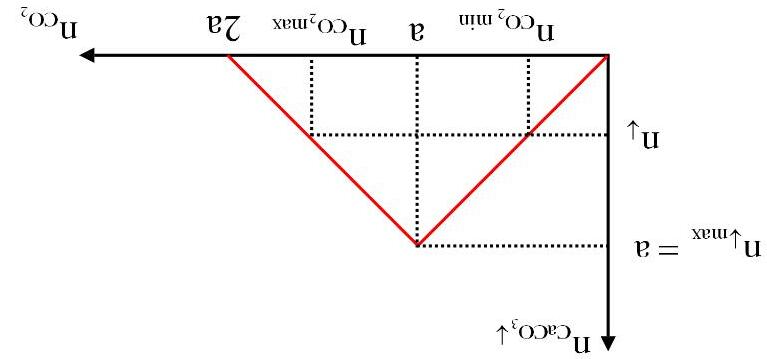
Dạng2.2:Bàitoán đồ thị CO2 tácdụngvớihỗnhợpNaOH,Ca(OH)2 LÝTHUYẾTVÀPHƯƠNGPHÁPGIẢI
- Cho từ từ CO2 vào dung dịch hỗn hợp chứa a mol Ca(OH)2 và b mol NaOH ban đầu tạo kết tủa:
(1) CO2 + Ca(OH)2 → CaCO3↓ + H2O
Kết tủa không đổi: (2) CO2 + NaOH → NaHCO3
Sau đó kết tủa tan: (3) CO2 + CaCO3 + H2O → Ca(HCO3)2
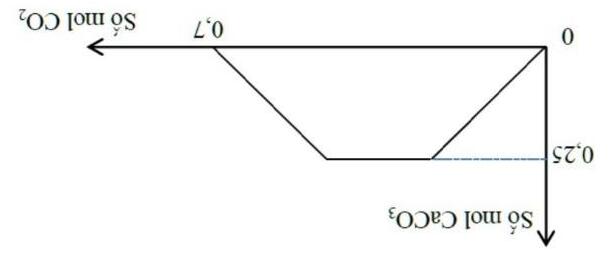
- Đồ thị biểu diễn sự phụ thuộc số mol kết tủa vào số mol CO2 như sau:
Tỉ lệ a: b là
Dáng đồ thị: Hình thang cân.
Khi phản ứng tạo ra lượng kết tủa nhỏ hơn lượng kết tủa cực đại thì có 2 giá trị của CO2 đều thỏa mãn 2 2 2
Trang37
= =−=+
COmin COmax NaOHCa(OH) OHOH
nn nnn(víinn2n) ↓ ↓
VÍDỤ MINHHỌA Câu1.(M.17–L3). Sục từ từ khí CO2 đến dư vào dung dịch gồm a mol NaOH và b mol Ca(OH)2. Sự phụ thuộc của số mol kết tủa CaCO3 vào số mol CO2 được biểu diễn theo đồ thị sau:
Tỉ lệ a: b tương ứng là
A. 4: 5. B. 2: 3. C. 5: 4. D. 4: 3.
Câu2. Sục CO2 vào dung dịch chứa Ca(OH)2 và NaOH ta thu được kết quả như hình dưới đây:
nCaCO3
Giá trị của b là
0,06 b
0,12 0 0,46 a
nCO2
A. 0,24. B. 0,28. C. 0,40. D. 0,32.
Câu3. Khi sục từ từ đến dư CO2 vào dung dịch có chứa 0,1 mol NaOH; x mol KOH và y mol Ba(OH)2, kết quả thí nghiệm thu được biểu diễn trên đồ thị sau:
nBaCO3 0,2 0 1,6 z
Giá trị của x, y, z lần lượt là
nCO2
A. 0,60; 0,40 và 1,50. B. 0,30; 0,60 và 1,40.

Trang38

C. 0,30; 0,30 và 1,20. D. 0,20; 0,60 và 1,25.
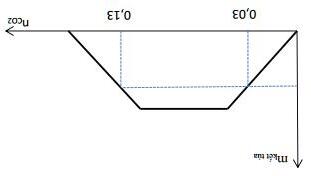
Câu4.(Q.16): Sục khí CO2 vào V lít dung dịch hỗn hợp NaOH 0,2 M và Ba(OH)2 0,1M. Đồ thị biểu diễn khối lượng kết tủa theo số mol CO2 như sau:
0,1
0,06
Giá trị của x là
0 x a a+0,5
Giá trị của V là
A. 300 B. 250 C. 400 D. 150
nCO2
A. 0,64. B. 0,58. C. 0,68. D. 0,62.
Câu9. Sục CO2 vào dung dịch chứa Ca(OH)2 và KOH ta thu được kết quả như hình dưới đây:
nCaCO3
BÀITẬPTỰ LUYỆN
Câu5. Sục từ từ đến dư CO2 vào dung dịch chứa 0,1 mol NaOH và 0,15 mol Ca(OH)2. Kết quả thí
nghiệm được biểu diễn trên đồ thị như hình dưới.
Giá trị của x là
Giá trị x, y, z, t lần lượt là
A. 0,15; 0,15; 0,25; 0,35. B. 0,1; 0,1; 0,25; 0,4.

C. 0,15; 0,15; 0,25; 0,4. D. 0,1; 0,1; 0,25; 0,35.
Câu6. Sục CO2 vào dung dịch hỗn hợp gồm Ca(OH)2 và KOH ta quan sát hiện tượng theo đồ thị hình dưới đây:
x
nCO2
0 0,5 0,15 0,45
A. 0,12. B. 0,11. C. 0,13. D. 0,10.
Câu10. Sục CO2 vào dung dịch chứa a mol NaOH và b mol Ba(OH)2 ta thu được kết quả như hình dưới đây:
nBaCO3
0,4
nCO2
0 0,4 1
Tỉ lệ a: b bằng
A. 3: 2. B. 2: 1. C. 5: 3. D. 4: 3.
Giá trị của x là
A. 0,12 mol. B. 0,11 mol. C. 0,13 mol. D. 0,10 mol.
Câu7. Dung dịch A chứa a mol Ba(OH)2 và m gam NaOH. Sục CO2 dư vào A ta thấy lượng kết tủa biến đổi theo hình dưới đây:
nBaCO3 a 0 1,3 a a+0,5
Giá trị của a và m là
nCO2
A. 0,4 và 20,0. B. 0,5 và 20,0. C. 0,4 và 24,0. D. 0,5 và 24,0.
Câu8. Sục CO2 vào dung dịch chứa Ca(OH)2 và NaOH ta thu được kết quả như hình dưới đây:
Trang39
ng2.3:Giảibàitoánbằngcáchviếtphươngtrình,bảotoànnguyêntố
LÝTHUYẾTVÀPHƯƠNGPHÁPGIẢI
- Khi CO2 tác dụng với dung dịch kiềm (NaOH, KOH, Ca(OH)2, Ba(OH)2) ta có thể viết
phản ứng xảy ra đồng thời:
CO2 + OH→ HCO3 - (1)
CO2 + 2OH→ CO3 2- + H2O (2)
Nếu dùng Ca(OH)2 hoặc Ba(OH)2 thì có thể có thêm phản ứng tạo kết tủa:
Ca2+ + CO3 2- → CaCO3↓ (3)
Ba2+ + CO3 2- → BaCO3↓ (4)
- Để xác định sản phẩm của phản ứng ta biện luận theo tỉ lệ T dưới đây:
n T n = T ≤ 1 1<T<2 T ≥ 2
OH CO
2
Sảnphẩm HCO3(CO2 dư nếu T < 1) HCO3 - và CO3 2- CO3 2(OH- dư nếu T > 2)

A. 29,55. B. 19,70. C. 9,85. D. 39,40. Câu9.(C.10): Hấp thụ hoàn toàn 3,36 lít khí CO2 (đktc) vào 125 ml dung dịch Ba(OH)2 1M, thu được dung dịch X. Coi thể tích dung dịch không thay đổi, nồng độ mol của chất tan trong dung dịch X là
A. 0,6M. B. 0,2M. C. 0,1M. D. 0,4M. Câu10.(B.14): Hấp thụ hoàn toàn 3,36 lít khí CO2 (đktc) vào dung dịch chứa 0,15 mol NaOH và 0,1 mol Ba(OH)2, thu được m gam kết tủa. Giá trị của m là
A. 14,775. B. 9,850. C. 29,550. D. 19,700. Câu11.(C.14): Hấp thụ hoàn toàn 6,72 lít khí CO2 (đktc) vào dung dịch chứa a mol KOH, thu được dung dịch chứa 33,8 gam hỗn hợp muối. Giá trị của a là
A. 0,4. B. 0,3. C. 0,5. D. 0,6.
Câu12.(A.07): Hấp thụ hoàn toàn 2,688 lít khí CO2 (ở đktc) vào 2,5 lít dung dịch Ba(OH)2 nồng độ a mol/l, thu được 15,76 gam kết tủa. Giá trị của a là
A. 0,032. B. 0,048. C. 0,06. D. 0,04.
- Khi phản ứng tạo ra lượng kết tủa nhỏ hơn lượng kết tủa cực đại thì có 2 giá trị của CO2 đều thỏa mãn
= =−
COmin COmax OH
2
2
VÍDỤ MINHHỌA
↓ ↓
nn nnn
Câu1. Cho 2,24 lít khí CO2 (đktc) vào 150 ml dung dịch NaOH 1M, sau phản ứng thu được dung dịch X chứa
A. Na2CO3
C. Na2CO3, NaHCO3.
B. NaHCO3
D. Na2CO3, NaOH.
Câu2. Cho 4,48 lít khí CO2 (đktc) vào 200 ml dung dịch Ca(OH)2 1M, sau phản ứng thu được sản phẩm muối có công thức là
A. CaCO3 B. Ca(HCO3)2
C. CaCO3, Ca(HCO3)2 D. CaCO3, Ca(OH)2
Câu3. Cho 4,48 lít khí CO2 (đktc) vào 150 ml dung dịch NaOH 1M, sau phản ứng thu được dung dịch X. Cô cạn dung dịch X thu được m gam chất rắn khan. Giá trị của m là
A. 12,6. B. 8,4. C. 16,8. D. 25,2. Câu4.(A.11): Hấp thụ hoàn toàn 0,672 lít khí CO2 (đktc) vào 1 lít dung dịch gồm NaOH 0,025M và Ca(OH)2 0,0125M, thu được x gam kết tủa. Giá trị của x là
A. 2,00. B. 1,00. C. 1,25. D. 0,75. Câu5.(C.12): Hấp thụ hoàn toàn 0,336 lít khí CO2 (đktc) vào 200 ml dung dịch gồm NaOH 0,1M và KOH 0,1M thu được dung dịch X. Cô cạn toàn bộ dung dịch X thu được bao nhiêu gam chất rắn khan?
A. 2,58 gam. B. 2,22 gam. C. 2,31 gam. D. 2,44 gam. Câu6. Sục V lít CO2 (đktc) vào 150 ml dung dịch Ba(OH)2 1M, sau phản ứng thu được 19,7 gam kết tủa. Giá trị của V là
A. 2,24 lít; 4,48 lít. B. 2,24 lít; 3,36 lít.
C. 3,36 lít; 2,24 lít. D. 22,4 lít; 3,36 lít.
BÀITẬPTỰ LUYỆN
Câu7. Cho 2,24 lít khí CO2 (đktc) vào 300 ml dung dịch NaOH 1M, sau phản ứng thu được dung dịch X chứa
A. Na2CO3 B. NaHCO3
C. Na2CO3, NaHCO3 D. Na2CO3, NaOH.
Câu8.(B.13): Hấp thụ hoàn toàn 2,24 lít khí CO2 (đktc) vào 750 ml dung dịch Ba(OH)2 0,2M, thu
được m gam kết tủa. Giá trị của m là
Trang41
DẠNG3:BÀITOÁNMUỐICACBONATTÁCDỤNGVỚIAXIT LÝ THUYẾT VÀ PHƯƠNG PHÁP GIẢI
TH1:MuốiCO32- tácdụngvớiH+
Nếu cho t
axit (H+) vào mu
cacbonat (CO
PTHH: (1) CO3 2- + H+ → HCO3(2) HCO3 - + H+ → CO2↑ + H2O ⇒
+ Nếu cho từ từ muối cacbonat (CO3 2-) vào axit (H+) thì PƯ tạo luôn khí CO2
PTHH: (3) CO3 2- + 2H+ → CO2↑ + H2O ⇒
tự:
COmax
HCO
+ Nếu trộn đồng thời muối cacbonat và axit mà axitthiếu thì lượng CO2 thu được nằm trong khoảng 2 COminV < 2COV < 2 COmaxV
TH2:MuốiHCO3 -,CO32- tácdụngvớiH+
+ Nếu cho từ từ axit (H+) vào hỗn hợp muối HCO3 - và CO3 2- thì PƯ xảy ra theo thứ tự (1), (2) với 333 HCOHCOb®HCO(1) n=n+n
+ Nếu cho từ từ hỗn hợp muối HCO3 -, CO3 2- vào axit (H+) mà axit thiếu thì phản ứng xảy ra
nn = nn
đồng thời với tỉ lệ 33
HCOp−HCOb® COp−COb®
2-233
- Đồ thị biểu diễn sự phụ thuộc của số mol CO2 vào mol H+ khi thêm từ H+ và muối cacbonat:
❖ ❖❖ VÍDỤ MINHHỌA
Trang42
Câu1. Cho từ từ từng giọt đến hết 100 ml dung dịch HCl aM vào 100 ml dung dịch Na2CO3 1M, thấy thoát ra 1,344 lít khí CO2 (đktc). Giá trị của a là
A. 1,6. B. 1,2. C. 0,6. D. 0,8.
Câu2. Hấp thụ hoàn toàn 1,12 lít CO2 (đktc) vào 150 ml dung dịch KOH 1M, thu được dung dịch X. Cho từ từ dung dịch HCl 2,5M vào X đến khi bắt đầu có khí sinh ra thì hết V ml. Giá trị của V là
A. 80. B. 40. C. 60. D. 100.
Câu3. Cho từ từ 300 ml dung dịch Na2CO3 1M vào 200 ml dung dịch hỗn hợp HCl 1M và H2SO4
0,5M thu được V lít khí (đktc). Giá trị của V là
A. 1,68 lít. B. 2,24 lít. C. 3,36 lít. D. 4,48 lít.
Câu4. Thêm từ từ đến hết dung dịch chứa 0,02 mol K2CO3 vào dung dịch chứa 0,03 mol HCl. Thể tích khí CO2 (đktc) thu được là
A. 0,448 lít. B. 0,224 lít. C. 0,336 lít. D. 0,112 lít. Câu5.(A.09): Dung dịch X chứa hỗn hợp gồm Na2CO3 1,5M và KHCO3 1M. Nhỏ từ từ từng giọt cho đến hết 200 ml dung dịch HCl 1M vào 100 ml dung dịch X, sinh ra V lít khí (ở đktc). Giá trị của V là
A. 4,48. B. 3,36. C. 2,24. D. 1,12.
Câu6.(A.07): Cho từ từ dung dịch chứa a mol HCl vào dung dịch chứa b mol Na2CO3 đồng thời khuấy đều, thu được V lít khí (ở đktc) và dung dịch X. Khi cho dư nước vôi trong vào dung dịch X thấy có xuất hiện kết tủa. Biểu thức liên hệ giữa V với a, b là:
A. V = 22,4(a – b). B. V = 11,2(a – b).

C. V = 11,2(a + b). D. V = 22,4(a + b).
Câu7.(B.13): Cho 200 ml dung dịch Ba(OH)2 0,1M vào 300 ml dung dịch NaHCO3 0,1M, thu
được dung dịch X và kết tủa Y. Cho từ từ dung dịch HCl 0,25M vào X đến khi bắt đầu có khí sinh
ra thì hết V ml. Biết các phản ứng đều xảy ra hoàn toàn. Giá trị của V là
A. 80. B. 40. C. 160. D. 60. Câu8. X là dung dịch HCl nồng độ x mol/l. Y là dung dịch Na2CO3 nồng độ y mol/l. Nhỏ từ từ 100 ml X vào 100 ml Y, sau các phản ứng thu được V1 lít CO2 (đktc). Nhỏ từ từ 100 ml Y vào 100 ml X, sau phản ứng thu được V2 lít CO2 (đktc). Biết tỉ lệ V1:V2 = 4:7. Tỉ lệ x:y bằng
A. 11:4 B. 11:7 C. 7:5 D. 7:3
Câu9.(MH.19): Dung dịch X gồm KHCO3 1M và Na2CO3 1M. Dung dịch Y gồm H2SO4 1M và HCl 1M. Nhỏ từ từ 100 ml dung dịch Y vào 200 ml dung dịch X, thu được V lít khí CO2 và dung dịch E. Cho dung dịch Ba(OH)2 tới dư vào E, thu được m gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m và V lần lượt là
A. 82,4 và 1,12. B. 59,1 và 1,12. C. 82,4 và 2,24. D. 59,1 và 2,24. Câu10.(MH3.2017). Hấp thụ hết 4,48 lít khí CO2 (đktc) vào dung dịch chứa x mol KOH và y mol K2CO3, thu được 200 ml dung dịch X. Cho từ từ đến hết 100 ml dung dịch X vào 300 ml dung dịch HCl 0,5M, thu được 2,688 lít khí (đktc). Mặt khác, cho 100 ml dung dịch X tác dụng với dung dịch Ba(OH)2 dư, thu được 39,4 gam kết tủa. Giá trị của x là
A. 0,10. B. 0,20. C. 0,05. D. 0,30.

Câu11.[MH-2021]Hấp thụ hoàn toàn V lít khí CO2 vào dung dịch chứa a mol NaOH và 1,5a mol Na2CO3, thu được dung dịch X. Chia X thành hai phần bằng nhau. Cho từ từ phần một vào 120 ml dung dịch HCl 1M, thu được 2,016 lít khí CO2. Cho phần hai phản ứng hết với dung dịch Ba(OH)2 dư, thu được 29,55 gam kết tủa. Biết rằng các thể tích khí đều đo ở đktc. Giá trị của V là
và đến khi khí thoát ra vừa hết thì thể tích dung dịch HCl đã dùng là V2 lít.
là
A. 1: 3. B. 3: 4. C. 5: 6. D. 1: 2. Câu13. Cho từ từ dung dịch HCl vào dung dịch chứa a mol Na2CO3 và b mol NaHCO3. Số mol khí CO2 thu được phụ thuộc vào số mol HCl được biểu diễn theo đồ thị dưới đây:
Tỉ lệ của a: b bằng
A. 1: 3. B. 3: 4. C. 3: 1. D. 4: 3. Câu14. Cho từ từ dung dịch HCl vào dung dịch chứa a mol Na2CO3 và b mol NaHCO3. Số mol khí CO2 thu được phụ thuộc vào số mol HCl được biểu diễn theo đồ thị dưới đây:
Giá trị của x là
A. 0,25. B. 0,35. C. 0,375. D. 0,325.
BÀITẬPTỰ LUYỆN
Câu15. Thêm từ tư từng giọt đến hết dung dịch chứa 0,05 mol H2SO4 vào dung dịch chứa 0,06 mol Na2CO3. Thể tích khí CO2 (đktc) thu được là
A. 1,344 lít. B. 0,896 lít. C. 0,56 lít. D. 1,12 lít. Câu16. Dung dịch X chứa hỗn hợp gồm Na2CO3 1,5M và KHCO3 1M. Nhỏ từ từ 250 ml dung dịch HCl 1M vào 100 ml dung dịch X, sinh ra V lít khí (ở đktc). Giá trị của V là
A. 4,48. B. 3,36. C. 2,24. D. 1,12.
Câu17.(A.10): Nhỏ từ từ từng giọt đến hết 30 ml dung dịch HCl 1M vào 100 ml dung dịch chứa Na2CO3 0,2M và NaHCO3 0,2M, sau phản ứng thu được số mol CO2 là
A. 0,020. B. 0,030. C. 0,015. D. 0,010. Câu18.(MH2.17): Nhỏ từ từ 62,5 ml dung dịch hỗn hợp Na2CO3 0,08M và KHCO3 0,12M vào 125 ml dung dịch HCl 0,1M và khuấy đều. Sau các phản ứng, thu được V ml khí CO2 (đktc). Giá trị của V là
A. 224. B. 168. C. 280. D. 200. Câu19.(QG.17-202). Cho 26,8 gam hỗn hợp KHCO3 và NaHCO3 tác dụng với dung dịch HCl dư, thu được 6,72 lít khí (đktc) và dung dịch chứa m gam muối. Giá trị của m là
A. 19,15. B. 20,75. C. 24,55. D. 30,10. Câu20.(B.13): Cho 200 ml dung dịch Ba(OH)2 0,1M vào 300 ml dung dịch NaHCO3 0,1M, thu được dung dịch X và kết tủa Y. Cho từ từ dung dịch HCl 0,25M vào X đến khi bắt đầu có khí sinh ra thì hết V ml. Biết các phản ứng đều xảy ra hoàn toàn. Giá trị của V là
A. 1,12. B. 1,68. C. 2,24. D. 3,36. Câu12.(QG.18-201): Nung m gam hỗn hợp X gồm KHCO3 và CaCO3 ở nhiệt độ cao đến khối lượng không đổi, thu được chất rắn Y. Cho Y vào nước dư, thu được 0,2m gam chất rắn Z và dung dịch E. Nhỏ từ từ dung dịch HCl 1M vào E, khi khí bắt đầu thoát ra cần dùng V1 lít dung dịch HCl Trang44
Trang43
A. 80. B. 40. C. 160. D. 60.
Câu21.(M.15): Cho 115,3 gam hỗn hợp hai muối MgCO3 và RCO3 vào dung dịch H2SO4 loãng, thu được 4,48 lít khí CO2 (đktc), chất rắn X và dung dịch Y chứa 12 gam muối. Nung X đến khối lượng không đổi, thu được chất rắn Z và 11,2 lít khí CO2 (đktc). Khối lượng của Z là
A. 92,1 gam. B. 80,9 gam. C. 84,5 gam. D. 88,5 gam.
Câu22. Cho từ từ 100 ml dung dịch HCl 1,5 M vào 0,4 lít dung dịch X gồm Na2CO3 và KHCO3
thu được 1,008 lít CO2 (đktc) và dung dịch Y. Thêm dung dịch Ba(OH)2 dư vào dung dịch Y thu
được 29,55 gam kết tủa. Nồng độ mol/lit của Na2CO3 và KHCO3 trong dung dịch X lần lượt là
A. 0,0375 M và 0,05M. B. 0,1125M và 0,225M.
C. 0,2625M và 0,225M. D. 0,2625M và 0,1225M.
Câu23.(QG.18-202): Hấp thụ hoàn toàn 3,36 lít CO2 (đktc) vào dung dịch chứa a mol NaOH
và b mol Na2CO3, thu được dung dịch X. Chia X thành hai phần bằng nhau.
+ Cho từ từ phần một vào 120 ml dung dịch HCl 1M, thu được 2,016 lít CO2 (đktc).
+ Cho phần hai phản ứng hết với dung dịch Ba(OH)2 dư, thu được 29,55 gam kết tủa.
Tỉ lệ a: b tương ứng là:
A. 2: 5. B. 2: 3. C. 2: 1. D. 1: 2. Câu24. Cho m gam hỗn hợp X gồm Na, Na2O, Ba, BaO vào nước thu được dung dịch Yvà 3,36 lít khí H2 (ở đktc). Sục từ từ đến hết 0,35 mol CO2 vào dung dịch Y thu được dung dịch Z và 39,4 gam kết tủa. Cho từ từ đến hết 100ml dung dịch HCl 1M vào dung dịch Z, sau phản ứng thu được 0,05 mol CO2. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m là
A. 34,4. B. 43,2. C. 22,6. D. 56,3. Câu25. Cho từ từ dung dịch HCl vào dung dịch chứa 0,15 mol Na2CO3 và 0,1 mol KHCO3. Số mol khí CO2 thu được phụ thuộc vào số mol HCl được biểu diễn theo đồ thị dưới đây:
NaHCO3 + NaOH → Na2CO3 + H2O
2NaHCO3 + Ba(OH)2 → BaCO3 + Na2CO3 + 2H2O
Tỉ lệ x: y là
DẠNG4:MỘTSỐ BÀITOÁNKHÁCVỀ MUỐICACBONAT LÝTHUYẾTVÀPHƯƠNGPHÁPGIẢI
(1)Phản ứngnhiệtphânmuốicacbonat
- Các muối cacbonat kết tủa đều dễ bị nhiệt phân:
CaCO3 ot → CaO + CO2
MgCO3 ot → MgO + CO2
(2)Phản ứngnhiệtphânmuốihiđrocacbonat
- Hầu hết các muối hiđrocacbonat đều bị nhiệt phân:
Ca(HCO3)2 ot → CaCO3 + CO2 + H2O
NaHCO3 ot → Na2CO3 + CO2 + H2O
(3)Tínhlưỡngtínhcủamuốihiđrocacbonat
HCO3 - + H+ → CO2 + H2O
HCO3 - + OH→ CO3 2- + H2O
Trang45
VÍDỤ MINHHỌA
Câu1.(B.08): Nhiệt phân hoàn toàn 40 gam một loại quặng đôlômit có lẫn tạp chất trơ sinh ra 8,96 lít khí CO2 (ở đktc). Thành phần phần trăm về khối lượng của CaCO3.MgCO3 trong loại quặng nêu trên là A. 40%. B. 50%. C. 84%. D. 92%.
Câu2.(B.07): Nung 13,4 gam hỗn hợp 2 muối cacbonat của 2 kim loại hóa trị 2, thu được 6,8 gam chất rắn và khí X. Lượng khí X sinh ra cho hấp thụ vào 75 ml dung dịch NaOH 1M, khối lượng muối khan thu được sau phản ứng là
A. 5,8 gam. B. 6,5 gam. C. 4,2 gam. D. 6,3 gam.
Câu3.(M.15): Cho 200 ml dung dịch Ba(OH)2 0,6M vào 100 ml dung dịch chứa NaHCO3 2M và BaCl2 1M, thu được a gam kết tủa. Giá trị của a là
A. 29,55. B. 19,70. C. 39,40. D. 35,46.
Câu4.(A.10): Cho m gam NaOH vào 2 lít dung dịch NaHCO3 nồng độ a mol/l, thu được 2 lít dung dịch X. Lấy 1 lít dung dịch X tác dụng với dung dịch BaCl2 (dư) thu được 11,82 gam kết tủa. Mặt khác, cho 1 lít dung dịch X vào dung dịch CaCl2 (dư) rồi đun nóng, sau khi kết thúc các phản ứng thu được 7,0 gam kết tủa. Giá trị của a, m tương ứng là
A. 0,08 và 4,8. B. 0,04 và 4,8. C. 0,14 và 2,4. D. 0,07 và 3,2.
Câu5.(B.13): Hòa tan hoàn toàn 24 gam hỗn hợp X gồm MO, M(OH)2 và MCO3 (M là kim loại có hóa trị không đổi) trong 100 gam dung dịch H2SO4 39,2%, thu được 1,12 lít khí (đktc) và dung dịch Y chỉ chứa một chất tan duy nhất có nồng độ 39,41%. Kim loại M là
A. Zn. B. Ca. C. Mg. D. Cu.
Câu6.(B.14): Hỗn hợp X gồm hai muối R2CO3 và RHCO3. Chia 44,7 gam X thành ba phần bằng nhau:
- Phần một tác dụng hoàn toàn với dung dịch Ba(OH)2 dư, thu được 35,46 gam kết tủa.
- Phần hai tác dụng hoàn toàn với dung dịch BaCl2 dư, thu được 7,88 gam kết tủa.
- Phần ba tác dụng tối đa với V ml dung dịch KOH 2M.
Giá trị của V là A. 200. B. 70. C. 180. D. 110.
DẠNG5:BÀITOÁNNHÔMTÁCDỤNGVỚIDUNGDỊCHKIỀM
LÝTHUYẾTVÀPHƯƠNGPHÁPGIẢI
- Nhôm tan trong dung dịch kiềm theo phản ứng:
2Al + 2OH- + 2H2O → 2AlO2 - + 3H2↑ ⇒
3 nn
2 HAl
2 =
- Nếu cho hỗn hợp Al, Na cho vào nước thì phản ứng xảy ra theo thứ tự:
(1) Na + H2O → NaOH + 1 2 H2↑
(2) Al + NaOH + H2O → NaAlO2 + 3 2 H2↑
+ Chất rắn nếu còn dư sau phản ứng là Al 2
Bte HNan2n→=

+ Nếu Al hết 2
Bte NaAlH n3n2n→+=
VÍDỤ MINHHỌA
Câu1. Tính m hoặc V trong các trường hợp sau:
(a) Cho 5,4 gam Al tác dụng với lượng dư dung dịch NaOH, sau phản ứng thu được V lít H2 (đktc).
(b) [QG.20-201] Hòa tan hết 3,24 gam Al trong dung dịch NaOH thu được V lít khí H2 (đktc). Giá trị của V là
A. 2,688. B. 1,344. C. 4,032. D. 5,376.
Trang46
(c) Hòa tan m gam Ba vào nước dư thu được dung dịch X và 2,24 lít khí H2 (đktc). Cho lượng Al vừa đủ vào dung dịch X thì thu được V lít khí H2 (đktc).
(d) Hòa tan hỗn hợp X gồm Na, K, Ba vào nước dư thu được dung dịch Y và 3,36 lít khí H2 (đktc). Cho lượng Al vừa đủ vào dung dịch Y thu được V lít khí H2 (đktc).
Câu2.(A.14): Cho m gam hỗn hợp gồm Al và Na vào nước dư, sau khi các phản ứng xảy ra hoàn toàn, thu được 2,24 lít khí H2 (đktc) và 2,35 gam chất rắn không tan. Giá trị của m là
A. 3,70. B. 4,85. C. 4,35. D. 6,95.
Câu3.(A.08): Cho hỗn hợp gồm Na và Al có tỉ lệ số mol tương ứng là 1: 2 vào nước (dư). Sau khi các phản ứng xảy ra hoàn toàn, thu được 8,96 lít khí H2 (ở đktc) và m gam chất rắn không tan. Giá trị của m là
A. 10,8. B. 5,4. C. 7,8. D. 43,2.
Câu4.(B.07): Hỗn hợp X gồm Na và Al. Cho m gam X vào một lượng dư nước thì thoát ra V lít khí. Nếu cũng cho m gam X vào dung dịch NaOH (dư) thì được 1,75V lít khí. Thành phần phần trăm theo khối lượng của Na trong X là (biết các thể tích khí đo trong cùng điều kiện)
A. 39,87%. B. 77,31%. C. 49,87%. D. 29,87%.
Câu5.(A.11): Chia hỗn hợp X gồm K, Al và Fe thành hai phần bằng nhau.
— Cho phần 1 vào dung dịch KOH (dư) thu được 0,784 lít khí H2 (đktc).
— Cho phần 2 vào một lượng dư H2O, thu được 0,448 lít khí H2 (đktc) và m gam hỗn hợp kim
loại Y. Hoà tan hoàn toàn Y vào dung dịch HCl (dư) thu được 0,56 lít khí H2 (đktc).
Khối lượng (tính theo gam) của K, Al, Fe trong mỗi phần hỗn hợp X lần lượt là:
A. 0,39; 0,54; 1,40. B. 0,78; 1,08; 0,56.
C. 0,39; 0,54; 0,56. D. 0,78; 0,54; 1,12.
BÀITẬPTỰ LUYỆN Câu6.[QG.20-202] Hòa tan hết 2,43 gam Al trong dung dịch NaOH, thu được V ml khí H2 (đktc). Giá trị của V là
A. 1008. B. 3024. C. 4032. D. 2016. Câu7.[QG.20-203] Hòa tan hết 0,81 gam Al trong dung dịch NaOH, thu được V ml khí H2 (đktc). Giá trị của V là
A. 448. B. 1344 C. 672. D. 1008. Câu8.[QG.20-204] Hoà tan hết 1,62 gam Al trong dung dịch NaOH, thu được V ml khí H2 (đktc). Giá trị của V là
A. 896. B. 672. C. 2016. D. 1344. Câu9.[MH2-2020] Hòa tan hoàn toàn 0,1 mol Al bằng dung dịch NaOH dư thu được V lít H2 (đktc). Giá trị của V là
A. 2,24. B. 5,60. C. 4,48. D. 3,36.
Câu10.[MH1-2020] Để hòa tan hoàn toàn 1,02 gam Al2O3 cần dùng tối thiểu V ml dung dịch NaOH 1M. Giá trị của V là
A. 20. B. 10. C. 40. D. 5.
Câu11. Cho hỗn hợp X gồm 0,1 mol Na và 0,2 mol Al vào nước dư, sau phản ứng hoàn toàn thấy thoát ra V lít khí H2 (đktc). Giá trị của V là
A. 7,84. B. 1,12. C. 6,72. D. 4,48.
Câu12. Hòa tan m gam hỗn hợp X gồm Al và Na có tỉ lệ mol 2:1 vào nước dư, thu được 4,48 lít khí (đktc). Giá trị của m là
A. 7,3. B. 7,7. C. 6,15. D. 3,65. Câu13. Hòa tan m gam hỗn hợp X gồm Al và K vào nước dư. Sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch Y, 6,72 lít H2 (đktc) và còn lại 0,12m gam chất rắn không tan. Giá trị của m là
Trang47
A. 22,50. B. 17,42. C. 11,25. D. 8,71. Câu14. Thể tích H2 (đktc) tạo ra khi cho một hỗn hợp gồm (0,5 mol K; 0,2 mol Na; 1,2 mol Al) vào 2 lít dung dịch Ca(OH)2 0,1M đến phản ứng hoàn toàn là
A. 22,4 lít. B. 26,1 lít. C. 33,6 lít. D. 44,8 lít. Câu15.(C.13): Hỗn hợp X gồm Ba, Na và Al, trong đó số mol của Al bằng 6 lần số mol của Ba. Cho m gam X vào nước dư đến phản ứng hoàn toàn, thu được 1,792 lít khí H2 (đktc) và 0,54 gam chất rắn. Giá trị của m là
A. 3,90. B. 5,27. C. 3,45. D. 3,81.
Câu16.(A.13): Hỗn hợp X gồm Ba và Al. Cho m gam X vào nước dư, sau khi các phản ứng xảy ra hoàn toàn, thu được 8,96 lít khí H2 (đktc). Mặt khác, hòa tan hoàn toàn m gam X bằng dung dịch NaOH, thu được 15,68 lít khí H2 (đktc). Giá trị của m là
A. 16,4. B. 29,9. C. 24,5. D. 19,1. Câu17. Chia 39,9 gam hỗn hợp X ở dạng bột gồm Na, Al, Fe thành ba phần bằng nhau:
- Phần 1: Cho tác dụng với nước dư, giải phóng ra 4,48 lít khí H2 (đktc).
- Phần 2: Cho tác dụng với dung dịch NaOH dư, giải phóng ra 7,84 lít khí H2 (đktc).
- Phần 3: Cho vào dung dịch HCl dư, thấy giải phóng ra V lít khí H2 (các khí đo ở đktc). Giá trị của V là
A. 7,84. B. 13,44. C. 10,08. D. 12,32.
DẠNG6:BÀITOÁNVỀ PHẢN ỨNGNHIỆTNHÔM LÝTHUYẾTVÀPHƯƠNGPHÁPGIẢI
- Nhôm khử được các oxit kim loại (sau Al) ở nhiệt độ cao: Al + Oxit KL (sau Al) o → KL + Al2O3
VD: 2Al + Fe2O3 ot → 2Fe + Al2O3
8Al + 3Fe3O4 o → 9Fe + 4Al2O3
- Nếu hỗn hợp rắn sau phản ứng tác dụng với dung dịch kiềm (NaOH, KOH, …) tạo khí thì chứng tỏ có Al dư sau phản ứng.
VÍDỤ MINHHỌA Câu1.(QG.19-204). Dùng Al dư khử hoàn toàn 4,8 gam Fe2O3 thành Fe bằng phản ứng nhiệt nhôm. Khối lượng Fe thu được là
A. 1,68. B. 2,80. C. 3,36. D. 0,84. Câu2.(C.11): Nung hỗn hợp gồm 10,8 gam Al và 16,0 gam Fe2O3 (trong điều kiện không có không khí), sau khi phản ứng xảy ra hoàn toàn thu được chất rắn Y. Khối lượng kim loại trong Y là
A. 16,6 gam. B. 11,2 gam. C. 5,6 gam. D. 22,4 gam.
Câu3.(MH1.17): Nung hỗn hợp X gồm 2,7 gam Al và 10,8 gam FeO, sau một thời gian thu được hỗn hợp Y. Để hòa tan hoàn toàn Y cần vừa đủ V ml dung dịch H2SO4 1M. Giá trị của V là
A. 375. B. 600. C. 300. D. 400.
Câu4.(A.08): Nung nóng m gam hỗn hợp Al và Fe2O3 (trong môi trường không có không khí) đến khi phản ứng xảy ra hoàn toàn, thu được hỗn hợp rắn Y. Chia Y thành hai phần bằng nhau:
- Phần 1 tác dụng với dung dịch H2SO4 loãng (dư), sinh ra 3,08 lít khí H2 (ở đktc);
- Phần 2 tác dụng với dung dịch NaOH (dư), sinh ra 0,84 lít khí H2 (ở đktc). Giá trị của m là
A. 22,75 B. 21,40. C. 29,40. D. 29,43.
Câu5. Hỗn hợp X gồm 3,92 gam Fe; 16 gam Fe2O3 và m gam Al. Nung X ở nhiệt độ cao trong điều kiện không có không khí thu được hỗn hợp chất rắn Y. Chia Y thành 2 phần bằng nhau:
- Phần 1: Tác dụng với dung dịch H2SO4 loãng dư, thu được 4x mol H2.
Trang48
ần 2: Phản ứng với dung dịch NaOH dư, thu được x mol H2. (Biết các phản ứng đều xảy ra hoàn toàn). Giá trị của m là
A. 5,40. B. 3,51. C. 4,05. D. 7,02. Câu6.(B.10): Trộn 10,8 gam bột Al với 34,8 gam bột Fe3O4 rồi tiến hành phản ứng nhiệt nhôm trong điều kiện không có không khí. Hoà tan hoàn toàn hỗn hợp rắn sau phản ứng bằng dung dịch H2SO4 loãng (dư), thu được 10,752 lít khí H2 (đktc). Hiệu suất của phản ứng nhiệt nhôm là A. 80%. B. 90%. C. 70%. D. 60%.
Câu7.(QG.17-202). Thực hiện phản ứng nhiệt nhôm hỗn họp Al và Fe2O3 (trong điều kiện không có không khí), thu được 36,15 gam hỗn hợp X. Nghiền nhỏ, trộn đều và chia X thành hai phần. Cho phần một tác dụng với dung dịch NaOH dư, thu được 1,68 lít khí H2 (đktc) và 5,6 gam chất rắn không tan. Hòa tan hết phần hai trong 850 ml dung dịch HNO3 2M, thu được 3,36 lít khí NO (đktc) và dung dịch chi chứa m gam hỗn hợp muối. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m gần nhất với giá trị nào sau đây?
A. 113. B. 95. C. 110. B. 103.
Câu8.(A.14): Thực hiện phản ứng nhiệt nhôm hỗn hợp gồm Al và m gam hai oxit sắt trong khí trơ, thu được hỗn hợp rắn X. Cho X vào dung dịch NaOH dư, thu được dung dịch Y, chất không tan Z và 0,672 lít khí H2 (đktc). Sục khí CO2 dư vào Y, thu được 7,8 gam kết tủa. Cho Z tan hết vào dung dịch H2SO4, thu được dung dịch chứa 15,6 gam muối sunfat và 2,464 lít khí SO2 (ở đktc, là sản phẩm khử duy nhất của H2SO4). Biết các phản ứng xảy ra hoàn toàn. Giá trị của m là
A. 6,48. B. 5,04. C. 6,96. D. 6,29.
BÀITẬPTỰ LUYỆN
Câu9. Nung hỗn hợp X gồm 2,7 gam Al và 10,8 gam FeO, sau một thời gian thu được hỗn hợp Y.
Để hòa tan hoàn toàn Y cần vừa đủ V ml dung dịch H2SO4 1M. Giá trị của V là
A. 375. B. 600. C. 300. D. 400.
Câu10. Nung bột Fe2O3 với a gam bột Al trong khí trơ, thu được 11,78 gam hỗn hợp rắn X. Cho toàn bộ X vào lượng dư dung dịch NaOH, thu được 1,344 lít H2 (đktc). Biết các phản ứng đều xảy ra hoàn toàn. Giá trị của a là
A. 1,95. B. 3,78. C. 2,43. D. 2,56.
Câu11.(C.08): Đốt nóng một hỗn hợp gồm Al và 16 gam Fe2O3 (trong điều kiện không có không khí) đến khi phản ứng xảy ra hoàn toàn, thu được hỗn hợp rắn X. Cho X tác dụng vừa đủ với V ml dung dịch NaOH 1M sinh ra 3,36 lít H2 (ở đktc). Giá trị của V là
A. 150. B. 100. C. 200. D. 300. Câu12.(B.14): Nung hỗn hợp gồm 0,12 mol Al và 0,04 mol Fe3O4 một thời gian, thu được hỗn hợp rắn X. Hoà tan hoàn toàn X trong dung dịch HCl dư, thu được 0,15 mol khí H2 và m gam muối. Giá trị của m là
A. 32,58. B. 33,39. C. 31,97. D. 34,10. Câu13.(C.08): Đốt nóng một hỗn hợp gồm Al và 16 gam Fe2O3 (trong điều kiện không có không khí) đến khi phản ứng xảy ra hoàn toàn, thu được hỗn hợp rắn X. Cho X tác dụng vừa đủ với V ml dung dịch NaOH 1M sinh ra 3,36 lít H2(ở đktc). Giá trị của V là
A. 150. B. 100. C. 200. D. 300.
Câu14.(C.12): Nung hỗn hợp bột gồm Al và Fe2O3 (trong điều kiện không có oxi), thu được hỗn hợp chất rắn X. Chia X thành 2 phần bằng nhau:
- Cho phần 1 vào dung dịch HCl (dư) thu được 7,84 lít khí H2 (đktc);
- Cho phần 2 vào dung dịch NaOH (dư) thu được 3,36 lít khí H2 (đktc).
Biết rằng các phản ứng đều xảy ra hoàn toàn. Phần trăm khối lượng của Fe trong X là
A. 42,32%. B. 46,47%. C. 66,39%. D. 33,61%.
Câu15.(B.09): Nung nóng m gam hỗn hợp gồm Al và Fe3O4 trong điều kiện không có không khí.
Sau khi phản ứng xảy ra hoàn toàn, thu được hỗn hợp rắn X. Cho X tác dụng với dung dịch NaOH (dư) thu được dung dịch Y, chất rắn Z và 3,36 lít khí H2 (ở đktc). Sục khí CO2 (dư) vào dung dịch
Y, thu được 39 gam kết tủa. Giá trị của m là
A. 45,6. B. 48,3. C. 36,7. D. 57,0.
Câu16.(A.13): Hỗn hợp X gồm 3,92 gam Fe, 16 gam Fe2O3 và m gam Al. Nung X ở nhiệt độ cao trong điều kiện không có không khí, thu được hỗn hợp chất rắn Y. Chia Y thành hai phần bằng nhau. Phần một tác dụng với dung dịch H2SO4 loãng (dư), thu được 4a mol khí H2. Phần hai phản ứng với dung dịch NaOH dư, thu được a mol khí H2. Biết các phản ứng đều xảy ra hoàn toàn. Giá trị của m là
A. 3,51. B. 4,05. C. 5,40. D. 7,02. Câu17.(QG.15): Cho 7,65 gam hỗn hợp X gồm Al và Al2O3 (trong đó Al chiếm 60% khối lượng) tan hoàn toàn trong dung dịch Y gồm H2SO4 và NaNO3, thu được dung dịch Z chỉ chứa 3 muối trung hòa và m gam hỗn hợp khí T (trong T có 0,015 mol H2). Cho dung dịch BaCl2 dư vào Z đến khi các phản ứng xảy ra hoàn toàn, thu được 93,2 gam kết tủa. Còn nếu cho Z phản ứng với NaOH thì lượng NaOH phản ứng tối đa là 0,935 mol. Giá trị của m gầngiátrị nàonhất sau đây?
A. 2,5 B. 3,0 C. 1,0 D. 1,5 Câu18.(QG.18-201): Thực hiện phản ứng nhiệt nhôm hỗn hợp gồm Al và m gam hai oxit sắt trong khí trơ, thu được hỗn hợp chất rắn X. Cho X vào dung dịch NaOH dư, thu được dung dịch Y, chất không tan Z và 0,672 lít khí H2 (đktc). Sục khí CO2 dư vào Y, thu được 8,58 gam kết tủa. Cho Z tan hết vào dung dịch H2SO4 (đặc, nóng), thu được dung dịch chứa 20,76 gam muối sunfat và 3,472 lít khí SO2 (đktc). Biết SO2 là sản phẩm khử duy nhất của S+6, các phản ứng xảy ra hoàn toàn. Giá trị của m là
A. 7,28. B. 8,04. C. 6,96. D. 6,80.
DẠNG7:BÀITOÁNMUỐINHÔM(Al3+)TÁCDỤNGVỚIDUNGDỊCHKIỀM(OH-) (giảmtải)
Dạng7.1Bàitoán đồ thị muốinhôm(Al3+)tácdụngvớidungdịchkiềm(OH-)
LÝTHUYẾTVÀPHƯƠNGPHÁPGIẢI
- Khi cho từ từ dung dịch kiềm (OH-: NaOH, KOH, …) vào dung dịch chứa a mol Al3+ (AlCl3, Al(NO3)3, …) thì ban đầu phản ứng tạo kết tủa: (1) Al3+ + 3OH- → Al(OH)3↓
Sau đó kết tủa tan: (2) Al(OH)3 + OH- → AlO2 - + 2H2O
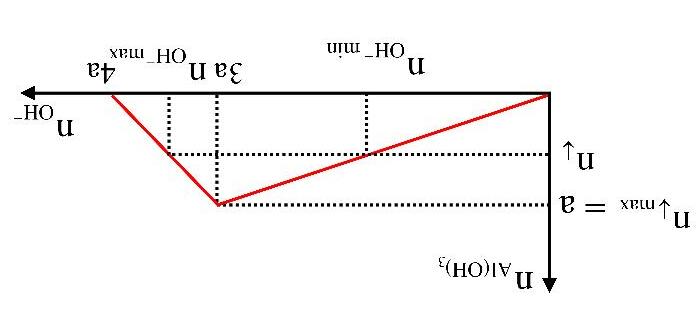
- Đồ thị biểu diễn sự phụ thuộc của số mol kết tủa Al(OH)3 vào số mol OH- biểu diễn theo đồ thị:
Dáng đồ thị: Tam giác lệch phải xuất phát từ gốc tọa độ.
Nếu lượng kết tủa thu được nhỏ hơn lượng kết tủa cực đại sẽ có 2 giá trị của OH- thỏa mãn:
VÍDỤ MINHHỌA
Câu1. Cho từ từ dung dịch NaOH đến dư vào dung dịch Al(NO3)3. Kết quả thí nghiệm được biểu diễn ở đồ thị dưới đây:
Trang49
Trang50
0,3
sè mol Al(OH)3 sè mol OH-
0 a b
Giá trị của a, b tương ứng là
A. 0,3 và 0,6. B. 0,6 và 0,9. C. 0,9 và 1,2. D. 0,5 và 0,9. Câu2. Cho 200 ml dung dịch Al2(SO4)3 tác dụng với dung dịch NaOH 1M nhận thấy số mol kết tủa phụ thuộc vào thể tích dung dịch NaOH theo đồ thị sau:
0 340
sè mol Al(OH)3 V (ml) NaOH 180
Nồng độ của dung dịch Al2(SO4)3 trong thí nghiệm trên là:
A. 0,125M. B. 0,25M. C. 0,375M. D. 0,50M. Câu3. Khi nhỏ từ từ đến dư dung dịch NaOH vào dung dịch AlCl3, kết quả thí nghiệm được biểu diễn trên đồ thị sau:



Tổng giá trị (x + y) bằng
A. 163,2. B. 162,3. C. 132,6. D. 136,2.
Câu6.(QG.18-201): Cho từ từ đến dư dung dịch Ba(OH)2 vào dung dịch chứa m gam hỗn hợp Al2(SO4)3 và AlCl3. Sự phụ thuộc của khối lượng kết tủa (y gam) vào số mol Ba(OH)2 (x mol) được
biểu diễn bằng đồ thị bên.
Giá trị của m là
A. 10,68. B. 6,84.
C. 12,18. D. 9,18.
Câu7.(QG.18-204): Nhỏ từ từ đến dư dung dịch Ba(OH)2 vào dung dịch chứa m gam hỗn hợp Al2(SO4)3 và Al(NO3)3. Sự phụ thuộc của khối lượng kết tủa (y gam) vảo số mol Ba(OH)2 (x mol)
được biểu diễn bằng đồ thị bên.
Giá trị cùa m là
A. 5,97. B. 7,26.
C. 7,68. D. 7,91.
Câu8.(MH.19): Cho V ml dung dịch NaOH 2M vào 200 ml dung dịch AlCl3 1M, sau khi các phản ứng xảy ra hoàn toàn thu được 3,9 gam kết tủa. Giá trị lớn nhất của V là
A. 175. B. 350. C. 375. D. 150.
Giá trị của x là
A. 0,84. B. 0,82. C. 0,86. D. 0,80. Câu4.(M.17–L1): Nhỏ từ từ dung dịch Ba(OH)2 0,2M vào ống nghiệm chứa dung dịch Al2(SO4)3. Đồ thị biểu diễn sự phụ thuộc khối lượng kết tủa theo thể tích dung dịch Ba(OH)2 như sau:

Câu9.(C.14): Cho 300 ml dung dịch NaOH 0,1M phản ứng với 100 ml dung dịch Al2(SO4)3 0,1M. Sau khi phản ứng xảy ra hoàn toàn, thu được a gam kết tủa. Giá trị của a là
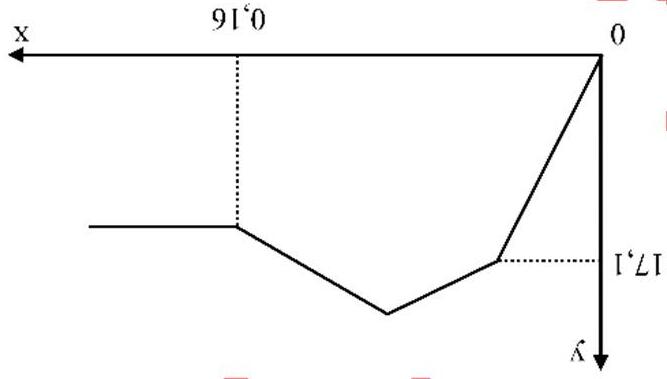

A. 2,34. B. 1,17. C. 1,56. D. 0,78.
Câu10.(C.07): Thêm m gam kali vào 300ml dung dịch chứa Ba(OH)2 0,1M và NaOH 0,1M thu
được dung dịch X. Cho từ từ dung dịch X vào 200ml dung dịch Al2(SO4)3 0,1M thu được kết tủa Y. Để thu được lượng kết tủa Y lớn nhất thì giá trị của m là
A. 1,59. B. 1,17. C. 1,71. D. 1,95.
BÀITẬPTỰ LUYỆN
Câu11. Khi nhỏ từ từ đến dư dung dịch NaOH vào dung dịch AlCl3,kết quả thí nghiệm được biểu diễn trên đồ thị sau:
Giá trị của V gầnnhất với giá trị nào sau đây?
A. 1,7. B. 2,1. C. 2,4. D. 2,5. Câu5. Nhỏ từ từ dung dịch Ba(OH)2 vào dung dịch hỗn hợp Al2(SO4)3 và AlCl3, thu được kết tủa có khối lượng theo số mol Ba(OH)2 như đồ thị: Trang52
Biểu thức liên hệ giữa x và y là
A. 3y – x = 1,24. B. 3y – x = 1,44. C. 3y + x = 1,44. D. 3y + x = 1,24.


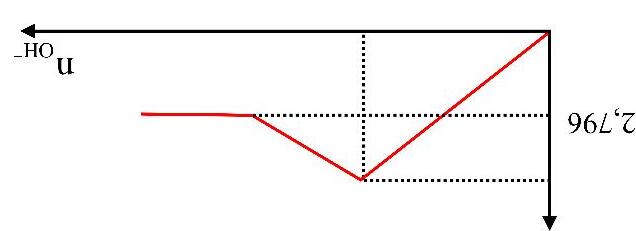
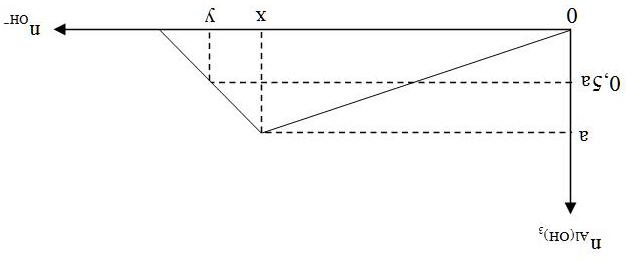
Câu12. Khi nhỏ từ từ đến dư dung dịch NaOH vào dung dịch AlCl3, kết quả thí nghiệm được biểu diễn trên đồ thị sau:
Câu16.(QG.18-202): Nhỏ từ từ đến dư dung dịch Ba(OH)2 vào
dung dịch gồm Al2(SO4)3 và AlCl3. Sự phụ thuộc của khối lượng kết tủa (y gam) vào số mol Ba(OH)2 (x mol) được biểu diễn bằng đồ thị
bên, khối lượng kết tủa cực đại là m gam.
Giá trị của m là
A. 10,11. B. 6,99.
C. 11,67. D. 8,55.
Câu17.(QG.18-203): Cho từ từ đến dư dung dịch Ba(OH)2 vào
dung dịch chứa m gam hỗn hợp Al(NO3)3 và Al2(SO4)3. Sự phụ
thuộc của khối lượng kết tủa (y gam) vào số mol Ba(OH)2 (x mol)
được biểu diễn trong đồ thị bên.
Giá trị của m là
T
ỉ lệ x: y là
A. 7: 8. B. 6: 7. C. 5: 4. D. 4: 5.
A. 7,68. B. 5,55.
C. 12,39. D. 8,55.
Câu18.(B.13): Thể tích dung dịch NaOH 0,25M cần cho vào 15 ml dung dịch Al2(SO4)3 0,5M để thu được lượng kết tủa lớn nhất là
A. 210 ml. B. 60 ml. C. 90 ml. D. 180 ml.
0,06
Câu13. Rót từ từ dung dịch Ba(OH)2 0,2M vào 150 ml dung dịch AlCl3 0,04M thấy lượng kết tủa phụ thuộc vào số ml dung dịch Ba(OH)2 theo đồ thị dưới đây: 0 b
sè mol Al(OH)3 V (ml) Ba(OH)2 a
Giá trị của a và b tương ứng là:
A. 45 ml và 60 ml. B. 45 ml và 90 ml.
C. 90 ml và 120 ml. D. 60 ml và 90 ml.
Câu19.(B.07): Cho 200 ml dung dịch AlCl3 1,5M tác dụng với V lít dung dịch NaOH 0,5M, lượng kết tủa thu được là 15,6 gam. Giá trị lớn nhất của V là
A. 1,2. B. 1,8. C. 2,4. D. 2. Câu20.(C.09): Hoà tan hoàn toàn 47,4 gam phèn chua KAl(SO4)2.12H2O vào nước, thu được dung dịch X. Cho toàn bộ X tác dụng với 200 ml dung dịch Ba(OH)2 1M, sau phản ứng thu được m gam kết tủa. Giá trị của m là
A. 7,8. B. 46,6. C. 54,4. D. 62,2.
sè mol Al(OH)3
Câu14. Cho 100 ml dung dịch AlCl3 1M pư với dung dịch NaOH 0,5M nhận thấy số mol kết tủa phụ thuộc vào thể tích dung dịch NaOH theo đồ thị sau: 0 680
V (ml) NaOH b
Giá trị của b là
A. 360 ml. B. 340 ml. C. 350 ml. D. 320 ml. Câu15. Nhỏ từ từ dung dịch Ba(OH)2 0,2M vào ống nghiệm chứa V lít dung dịch Al2(SO4)3 C (mol/l). Mối quan hệ giữa khối lượng kết tủa (gam) và số mol OH được biểu diễn bằng đồ thị sau:
Để lượng kết tủa không đổi thì thể tích dung dịch Ba(OH)2 nhỏ nhất cần dùng là A. 30 ml. B. 60 ml. C. 45 ml. D. 80 ml.
Trang53
Trang54
Dạng7.2Bàitoán đồ thị muốinhôm(Al3+)vàaxit(H+)tácdụngvớidungdịchkiềm(OH-) (giảmtải)

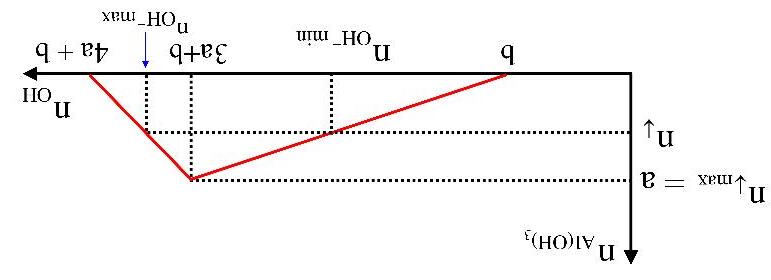

LÝTHUYẾTVÀPHƯƠNGPHÁPGIẢI
- Khi cho từ từ dung dịch chứa OH- (NaOH, KOH, …) vào dung dịch chứa a mol Al3+ (AlCl3, Al(NO3)3, …) và b mol H+ (HCl, HNO3, …) thì ban đầu xảy ra phản ứng trung hòa: (1) H+ + OH- → H2O
Sau đó tạo kết tủa: (2) Al3+ + 3OH- → Al(OH)3↓
Và kết tủa tan: (3) Al(OH)3 + OH- → AlO2 - + 2H2O
- Đồ thị biểu diễn sự phụ thuộc của số mol kết tủa Al(OH)3 vào số mol OH- biểu diễn theo đồ thị:
Giá trị của a là
A. 0,5. B. 1,5. C. 1,0. D. 2,0. Câu4.(QG.19-202). Hòa tan hoàn toàn m gam hỗn hợp gồm Al và Al2O3 trong 200 ml dung dịch
HCl 2M, thu được 1,68 lít khí H2 (ở đktc) và dung dịch X. Cho từ từ dung dịch NaOH 1M vào X, kết quả thí nghiệm được ghi ở bảng sau:
Thể tích dung dịch NaOH (ml) 340 470
Khối lượng kết tủa (gam) 2a a – 0,78
Dáng đồ thị: Tam giác lệch phải không xuất phát từ gốc tọa độ.
Nếu lượng kết tủa thu được nhỏ hơn lượng kết tủa cực đại sẽ có 2 giá trị của OH- thỏa mãn:
=+
Giá trị của m là
A. 1,65. B. 4,50. C. 3,30. D. 3,90.
Câu5.(A.08): Cho V lít dung dịch NaOH 2M vào dung dịch chứa 0,1 mol Al2(SO4)3 và 0,1 mol H2SO4 đến khi phản ứng hoàn toàn, thu được 7,8 gam kết tủa. Giá trị lớn nhất của V để thu được lượng kết tủa trên là
A. 0,45. B. 0,35. C. 0,25. D. 0,05.
Câu6.(C.10): Cho 1,56 gam hỗn hợp gồm Al và Al2O3 phản ứng hết với dung dịch HCl (dư), thu
VÍDỤ MINHHỌA
OHminH OHmaxHAl
↓ ↓
nn3n nn4nn −+ −++
3
Câu1. Cho từ từ V ml dung dịch NaOH 1M vào 200 ml dung dịch gồm HCl 0,5M và Al2(SO4)3 0,25M. Đồ thị biểu diễn khối lượng kết tủa theo V như hình dưới. Giá trị của a, b tương ứng là:
được V lít khí H2 (đktc) và dung dịch X. Nhỏ từ từ dung dịch NH3 đến dư vào dung dịch X thu được kết tủa, lọc hết lượng kết tủa, nung đến khối lượng không đổi thu được 2,04 gam chất rắn. Giá trị của V là
A. 0,448. B. 0,224. C. 1,344. D. 0,672.
sè mol Al(OH)3
V ml NaOH
A. 0,1 và 400. B. 0,05 và 400. C. 0,2 và 400. D. 0,1 và 300. a 0 b

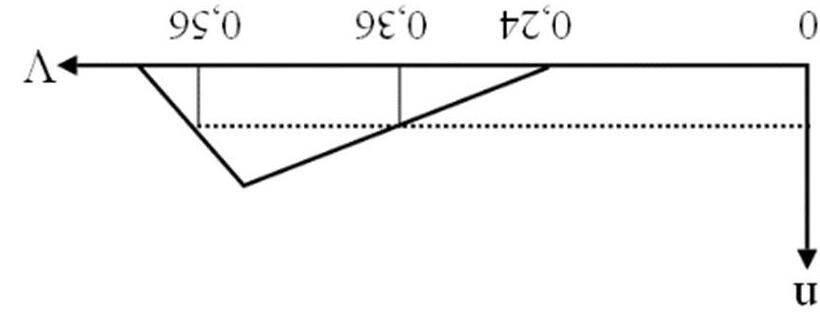
Câu2. Khi nhỏ từ từ đến dư dung dịch KOH vào dung dịch hỗn hợp chứa AlCl3 và HCl, kết quả thí nghiệm được biểu diễn trên đồ thị sau (số liệu tính theo đơn vị mol)
BÀITẬPTỰ LUYỆN Câu7.(A.14): Khi nhỏ từ từ đến dư dung dịch NaOH vào dung dịch hỗn hợp gồm a mol HCl và b mol AlCl3, kết quả thí nghiệm được biểu diễn trên đồ thị sau:
Tỉ số x: a có giá trị bằng
A. 3,6. B. 4,8. C. 4,4. D. 3,8. Câu3.(201–Q.17). Hòa tan hoàn toàn hỗn hợp Al và Al2O3 trong 200 ml dung dịch HCl nồng độ a mol/l, thu được dung dịch X. Cho từ từ dung dịch NaOH 1M vào X, lượng kết tủa Al(OH)3 (m gam) phụ thuộc vào thể tích dung dịch NaOH (V ml) được biểu diễn bằng đồ thị sau:
Trang55
Tỉ lệ a: b là
A. 4: 3. B. 2: 1. C. 1: 1. D. 2: 3. Câu8.(203–Q.17). Hòa tan hoàn toàn a gam hỗn hợp Al và Al2O3 vào dung dịch H2SO4 loãng, thu được dung dịch X và 1,008 lít khí H2 (đktc). Cho từ từ dung dịch NaOH 1 M vào dung dịch X, số mol kết tủa Al(OH)3 (n mol) phụ thuộc vào thể tích dung dịch NaOH (V lít)
được biểu diễn bằng đồ thị bên:
Giá trị của a là
A. 2,34. B. 7,95. C. 3,87. D. 2,43. Câu9. Cho từ từ đến dư dung dịch NaOH vào dung dịch X chứa hỗn hợp Al(NO3)3, HCl, HNO3
Kết quả thí nghiệm được biểu diễn trên đồ thị sau:
sè mol Al(OH)3
M
a 0 b 0,8
Giá trị của a là
A. 1,2. B. 1,25. C. 0,8. D. 1,5. Câu10.(QG.19-203). Hòa tan m gam Al vào dung dịch chứa 0,2 mol H2SO4 loãng thu được khí H2 và dung dịch X. Cho từ từ dung dịch NaOH 2M vào X, kết quả thí nghiệm được ghi ở bảng sau:
Thể tích dung dịch NaOH (ml) 140 240
Khối lượng kết tủa (gam) 2a + 1,56 a Cho giá trị của m và a lần lượt là
A. 5,4 và 1,56. B. 2,7 và 4,68. C. 5,4 và 4,68. D. 2,7 và 1,56. Câu11.(C.09): Nhỏ từ từ 0,25 lít dung dịch NaOH 1,04M vào dung dịch gồm 0,024 mol FeCl3; 0,016 mol Al2(SO4)3 và 0,04 mol H2SO4 thu được m gam kết tủa. Giá trị của m là
A. 2,568. B. 1,560. C. 4,128. D. 5,064
Câu12.(M.15): Dung dịch X gồm Al2(SO4)3 0,75M và H2SO4 0,75M. Cho V1 ml dung dịch KOH
1M vào 100 ml dung dịch X, thu được 3,9 gam kết tủa. Mặt khác, khi cho V2 ml dung dịch KOH
1M vào 100 ml dung dịch X cũng thu được 3,9 gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Tỉ
lệ V2: V1 là
A. 4: 3. B. 25: 9. C. 13: 9. D. 7: 3.
DẠNG8:BÀITOÁNMUỐIALUMINAT(AlO2 -)TÁCDỤNGVỚIAXIT(H+) (Giảmtải)
Dạng8.1Bàitoán đồ thị muốialuninat(AlO2 -)tácdụngvớiaxit(H+)
LÝTHUYẾTVÀPHƯƠNGPHÁPGIẢI
- Khi cho từ từ axit (H+: HCl, HNO3, …) vào dung dịch chứa a mol AlO2 - (NaAlO2, Ba(AlO2)2, …) thì ban đầu phản ứng tạo kết tủa:
(1) AlO2 - + H+ + H2O → Al(OH)3↓
Sau đó kết tủa tan: (2) Al(OH)3 + 3H+ → Al3+ + 3H2O
- Đồ thị biểu diễn sự phụ thuộc của số mol kết tủa Al(OH)3 vào số mol H+ như sau:
sè mol H+
A. 0,3 và 0, 2. B. 0,2 và 0,3. C. 0,2 và 0,2. D. 0,2 và 0,4. Câu2. Nhỏ từ từ dung dịch HCl vào dung dịch NaAlO2. Kết quả thí nghiệm được biểu diễn bằng đồ thị sau:
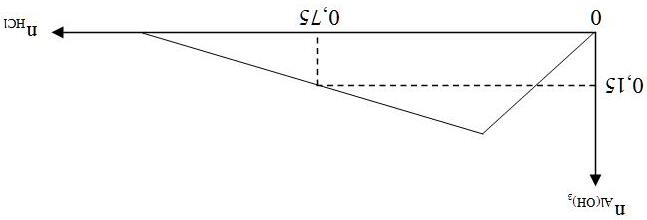
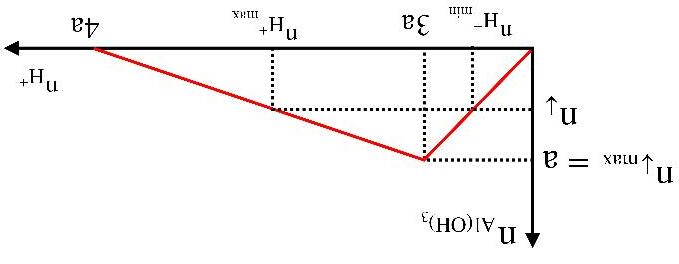

a
0
sè mol Al(OH)3 sè mol H+ 0,2 1,0
Từ đồ thị trên hãy cho biết khi lượng HCl cho vào là 0,85 mol thì lượng kết tủa thu được là bao nhiêu gam?
A. 19,5. B. 15,6. C. 23,4. D. 7,8. Câu3. Cho từ từ dung dịch HCl vào dung dịch NaAlO2. Kết quả thí nghiệm được biểu diễn bằng đồ thị sau:
Lượng kết tủa cực đại thu được trong thí nghiệm là bao nhiêu gam?
A. 23,4. B. 15,6 gam. C. 19,5 gam. D. 11,7 gam.
BÀITẬPTỰ LUYỆN
Câu4. Rót từ từ V(ml) dung dịch NaHSO4 0,1M vào 200 ml dung dịch NaAlO2 0,2M. Khối lượng kết tủa thu được phụ thuộc vào V được biểu diễn như hình dưới đây:
mAl(OH)3
Dáng đồ thị: Tam giác lệch trái xuất phát từ gốc tọa độ
Nếu lượng kết tủa thu được nhỏ hơn lượng kết tủa cực đại sẽ có 2 giá trị của H+ thỏa mãn:
VÍDỤ MINHHỌA
Vml NaHSO4
0
200 a
= =−
Hmin HmaxAlO
↓ ↓
nn n4n3n + +−
2
Câu1. Cho từ từ dung dịch HCl đến dư vào dung dịch NaAlO2. Kết quả thí nghiệm được biểu diễn
ở đồ thị dưới đây. Giá trị của a, b tương ứng là
Giá trị của a là:
A. 1000. B. 800. C. 900. D. 1200.
Câu5. Rót từ từ V(ml) dung dịch HCl 0,1M vào 200 ml dung dịch KAlO2 0,2M. Khối lượng kết tủa thu được phụ thuộc vào V được biểu diễn như hình dưới đây:
Trang58
mAl(OH)3
1,56
0
Giá trị của a và b là là:
Vml HCl a b
A. 200 và 1000. B. 200 và 800. C. 200 và 600. D. 300 và 800. Câu6. Rót từ từ V(ml) dung dịch HCl 0,1M vào 200 ml dung dịch KAlO2 x M. Khối lượng kết tủa thu được phụ thuộc vào V được biểu diễn như hình dưới đây:
0,2
Soá mol Al(OH)3 0,6 1,0 Soá mol HCl 0
0,4
A. 1: 3. B. 2: 3. C. 1: 1. D. 4: 3.
Câu2.(Sở HN-2018): Cho từ dung dịch HCl vào dung dịch chứa a mol Ba(AlO2)2 và b mol Ba(OH)2. Số mol Al(OH)3 tạo thành phụ thuộc vào số mol HCl được biểu diễn bằng đồ thị hình sau:
a
Giá trị của a và x là là:
0
mAl(OH)3 Vml HCl 200 1000
A. 1,56 và 0,2. B. 0,78 và 0,1. C. 0,2 và 0,2. D. 0,2 và 0,78.
Dạng8.2Bàitoán đồ thị muốialuninat(AlO2 -)vàbazơ (OH-)tácdụngvớiaxit(H+) (Giảmtải)
LÝTHUYẾTVÀPHƯƠNGPHÁPGIẢI
- Khi cho từ từ axit (H+: HCl, HNO3, …) vào dung dịch chứa a mol AlO2 - (NaAlO2, Ba(AlO2)2, …) và b mol OH- (NaOH, KOH, …) thì ban đầu xảy ra phản ứng trung hòa
(1) OH- + H+ → H2O
Sau đó PƯ tạo kết tủa: (2) AlO2 - + H+ + H2O → Al(OH)3↓
Và kết tủa tan: (3) Al(OH)3 + 3H+ → Al3+ + 3H2O
- Đồ thị biểu diễn sự phụ thuộc của số mol kết tủa Al(OH)3 vào số mol H+ như sau:
Tỉ lệ a:b tương ứng là:
A. 9: 4. B. 4: 9. C. 7: 4. D. 4: 7.
Câu3.(204–Q.17). Hòa tan hoàn toàn hỗn hợp X gồm
Al2O3 và Na vào nước, thu được dung dịch Y và x lít khí
H2 (đktc). Cho từ từ dung dịch HCl 1M vào Y, lượng kết tủa Al(OH)3 (m gam) phụ thuộc vào thể tích dung dịch
HCl (V ml) được biểu diễn bằng đồ thị sau:
Giá trị của x là
A. 10,08. B. 3,36. C. 1,68. D. 5,04.
Câu4.(QG.19-204). Hòa tan hoàn toàn m gam hỗn hợp Na và Al (tỉ lệ mol tương ứng là 5: 4) vào nước, thu được dung dịch X. Cho từ từ dung dịch HCl 1M vào X, kết quả thí nghiệm được ghi ở bảng sau:
Thể tích dung dịch HCl ( ml) 210 430
Khối lượng kết tủa ( gam) a a – 1,56

Dáng đồ thị: Tam giác lệch phải không xuất phát từ gốc tọa độ
Nếu lượng kết tủa thu được nhỏ hơn lượng kết tủa cực đại sẽ có 2 giá trị của H+ thỏa mãn:
=+ =+−
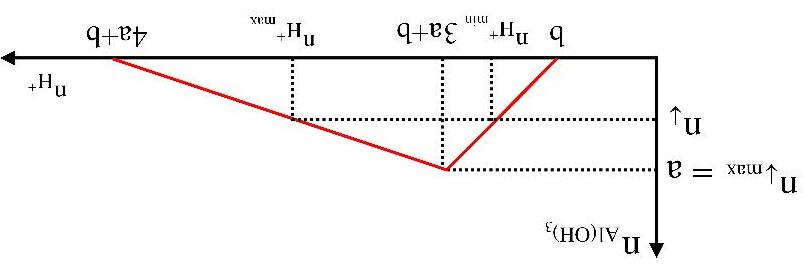
Giá trị của m là
A. 6,69. B. 6,15. C. 9,80. D. 11,15.
BÀITẬPTỰ LUYỆN
VÍDỤ MINHHỌA
HminOH HmaxOHAlO
↓ ↓
nnn nn4n3n +− +−−
2
Câu1. Nhỏ từ từ đến dư dung dịch HCl vào dung dịch chứa x mol NaOH và y mol NaAlO2. Kết quả thí nghiệm được biểu diễn bằng đồ thị bên. Tỉ lệ x: y là
Trang59
sè mol Al(OH)3 sè mol H+
x
Câu5. Khi nhỏ từ từ đến dư dung dịch HCl vào dung dịch hỗn hợp gồm a mol NaOH và b mol NaAlO2, kết quả thí nghiệm được biểu diễn bằng đồ thị sau: 0
1,0 2,4 1,2
Tỉ lệ a: b là
A. 2: 1. B. 3: 2. C. 4: 3. D. 2: 3.
Trang60
Câu6. Khi nhỏ từ từ V (lít) dung dịch HCl 0,1M vào 200 ml dung dịch gồm NaOH 0,1M và
Al(OH)3 (m gam) phụ thuộc vào thể tích dung dịch HCl (V ml) được biểu diễn bằng đồ thị sau:
nAl(OH)3
NaAlO2 0,1M. Kết quả thí nghiệm được biểu diễn bằng đồ thị như hình dưới đây: 0
Vdd HCl b a
Giá trị của a, b là
A. 0,4 và 1,0. B. 0,2 và 1,2. C. 0,2 và 1,0. D. 0,4 và 1,2.

Câu7. Khi nhỏ từ từ đến dư dung dịch HCl vào dung dịch hh gồm x mol Ba(OH)2 và y mol hoặc Ba(AlO2)2, kết quả thí nghiệm được biểu diễn trên đồ thị sau
Giá trị của a là A. 14,40. B. 19,95. C. 29,25. D. 24,60. Câu11.(QG.19-201). Hòa tan hoàn toàn m gam hỗn hợp gồm Na2O và Al2O3 (tỉ lệ mol tương ứng là 4:3) vào nước, thu đưuọc dung dịch X. Cho từ từ dung dịch HCl 1M vào X, kết quả thí nghiệm được ghi ở bảng sau:
Thể tích dung dịch HCl (ml) 300 600
Khối lượng kết tủa (gam) a a + 2,6
Giá trị của a và m lần lượt là
A. 15,6 và 55,4 B. 15,6 và 27,7 C. 23,4 và 56,3 D. 23,4 và 35,9
DẠNG9:BÀITOÁNTẠOHỖNHỢPKẾTTỦABaSO4 vàAl(OH)3 (giảmtải)
VÍDỤ MINHHỌA
Câu1.(MH1.17): Hỗn hợp X gồm Na, Ba, Na2O và BaO. Hòa tan hoàn toàn 21,9 gam X vào nước, thu được 1,12 lít khí H2 (đktc) và dung dịch Y chứa 20,52 gam Ba(OH)2. Cho Y tác dụng với 100 ml dung dịch Al2(SO4)3 0,5M, thu được m gam kết tủa. Giá trị của m là
A. 27,96. B. 29,52. C. 36,51. D. 1,50.
Giá trị của x và y lần lượt là
A. 0,05 và 0,15. B. 0,10 và 0,30. C. 0,10 và 0,15. D. 0,05 và 0,30.
Câu8. Cho từ từ dung dịch HCl vào dung dịch chứa a mol Ba(AlO2)2 và b mol Ba(OH)2. Kết quả thí nghiệm được biểu diễn trên đồ thị sau:
sè mol Al(OH)3 sè mol HCl
Tỉ lệ a: b là
A. 7:4 B. 4:7 C. 2:7 D. 7:2
Câu9. Cho 3 thí nghiệm
+ TN1: Cho từ từ dung dịch HCl đến dư vào dung dịch NaAlO2.
+ TN2: Cho từ từ dung dịch NaOH đến dư vào dung dịch AlCl3
+ TN3: Cho từ từ dung dịch NH3 đến dư vào dung dịch AlCl3.
Lượng kết tủa thu thu được trong các thí nghiệm được biểu diễn theo các đồ thị dưới đây.
Câu2. Hòa tan hoàn toàn m gam hỗn hợp Na, K, Ba, Al vào nước được dung dịch X và 8,512 lít H2 (đktc). Cho X phản ứng với 200 ml dung dịch H2SO4 1,25M và HCl 1M thu được 24,86 gam kết tủa và dung dịch Y chỉ chứa các muối clorua và sunfat trung hòa. Cô cạn Y thu được 30,08 gam chất rắn khan. Phần trăm khối lượng của Ba có trong hỗn hợp ban đầu là
A. 44,16% B. 60,04% C. 35,25% D. 48,15% Câu3.(QG.18-203): Hòa tan hoàn toàn m gam hỗn hợp X gồm Al; Na và BaO vào nước dư, thu được dung dịch Y và 0,085 mol khí H2. Cho từ từ đến hết dung dịch chứa 0,03 mol H2SO4 và 0,1 mol HCl vào Y, thu được 3,11 gam hỗn hợp kết tủa và dung dịch Z chỉ chứa 7,43 gam hỗn hợp các muối clorua và muối sunfat trung hòa. Giá trị của m là:
A. 2,79. B. 3,76. C. 6,50. D. 3,60. Câu4. Hòa tan hết m gam hỗn hợp X gồm Na, Na2O, K, K2O, Ba và BaO (oxi chiếm 8,75% về khối lượng) vào nước, thu được 400 ml dung dịch Y và 1,568 lít H2 (đktc). Trộn 200 ml dung dịch Y với 200 ml dung dịch hỗn hợp gồm HCl 0,2M và H2SO4 0,15M, thu được 400 ml dung dịch có pH = 13. Các phản ứng xảy ra hoàn toàn. Giá trị m gầngiátrị nàonhất sau đây?
A. 12. B. 14. C. 15. D. 13. BÀITẬPTỰ LUYỆN Câu5.(QG.18-202): Hỗn hợp X gồm Al, Ba, Na và K. Hoàn tan hoàn toàn m gam X vào nước dư, thu được dung dịch Y và 0,0405 mol khí H2. Cho từ từ đến hết dung dịch chứa 0,018 mol H2SO4 và 0,03 mol HCl vào Y, thu được 1,089 gam hỗn hợp kết tủa và dung dịch Z chỉ chứa 3,335 gam hỗn hợp các muối clorua và muối sunfat trung hòa. Phần trăm khối lượng kim loại Ba trong X là
®å thÞ C
®å thÞ A
®å thÞ B
Kết quả thí nghiệm 1, 2 và 3 được biểu diễn bằng đồ thị theo trật tự tương ứng:
A. Đồ thị A, B, C. B. Đồ thị B, C, A. C. Đồ thị C, B, A. D. Đồ thị A, C,B.
Câu10.(202–Q.17). Hòa tan hoàn toàn a gam hỗn hợp X gồm Al2O3 và Na2O vào nước, thu được dung dịch Y. Cho từ từ dung dịch HCl 1M vào Y, lượng kết tủa
Trang61
A. 43,32%. B. 37,78%. C. 29,87%. D. 33,12%. Câu6.(MH.18). Hòa tan hoàn toàn m gam hỗn hợp X gồm Ba, BaO, Al và Al2O3 vào nước (dư), thu được 0,896 lít khí (đktc) và dung dịch Y. Hấp thụ hoàn toàn 1,2096 lít khí CO2 (đktc) vào Y, thu được 4,302 gam kết tủa. Lọc kết tủa, thu được dung dịch Z chỉ chứa một chất tan. Mặt khác, dẫn từ từ CO2 và đến dư vào Y thì thu được 3,12 gam kết tủa. Giá trị của m là
A. 6,79. B. 7,09. C. 2,93. D. 5,99. Câu7.(QG.18-201): Hỗn hợp X gồm Al2O3, Ba, K (trong đó oxi chiếm 20% khối lượng của X).
Hòa tan hoàn toàn m gam X vào nước dư, thu được dung dịch Y và 0,022 mol khí H2. Cho từ từ đến
Trang62
hết dung dịch gồm 0,018 mol H2SO4 và 0,038 mol HCl vào Y, thu được dung dịch Z (chỉ chứa các muối clorua và muối sunfat trung hòa) và 2,958 gam hỗn hợp kết tủa. Giá trị của m là
A. 3,912. B. 3,600. C. 3,090. D. 4,422. Câu8.(QG.18-204): Hỗn hợp X gồm Al, K, K2O và BaO (trong đó oxi chiếm 10% khối lượng của X). Hòa tan hoàn toàn m gam X vào nước dư, thu được dung dịch Y và 0,056 mol khí H2. Cho từ từ đến hết dung dịch chứa 0,04 mol H2SO4 và 0,02 mol HCl vào Y, thu được 4,98 gam hỗn hợp kết tủa và dung dịch Z chi chứa 6,182 gam hỗn hợp các muối clorua và muối sunfat trung hòa. Giá trị của m là
A. 9,592. B. 5,760. C. 5,004
ĐỀ TỔNG ÔN LÝ THUYẾT
Câu1. Cấu hình electron lớp ngoài cùng của nguyên tử kim loại kiềm là
D. 9,596.
A. ns2np1 . B. ns1 . C. ns2 . D. ns2np2 .
Câu2. Cho các kim loại sau: Li, Na, Al, Ca. Số kim loại kiềm trong dãy là
A. 1. B. 3. C. 2. D. 4.
Câu3. Kim loại nào sau đây phản ứng mãnh liệt nhất với nước ở nhiệt độ thường?
A. Fe. B. Na. C. Mg. D. Al.
Câu4. Nguyên liệu chính để điều chế kim loại Na trong công nghiệp là
A. Na2CO3 B. NaOH. C. NaCl. D. NaNO3
Câu5. Người ta thường bảo quản kim loại kiềm bằng cách nào sau đây?
A. Ngâm trong giấm. B. Ngâm trong etanol.
C. Ngâm trong nước. D. Ngâm trong dầu hỏa.
Câu6. Dung dịch Na2CO3 tác dụng được với dung dịch nào sau đây?
A. Na2SO4 B. KNO3 C. KOH. D. CaCl2
Câu7. Chất nào sau đây khi tác dụng hết với lượng dư dung dịch NaHSO4 thì thu được dung dịch chứa hai muối?
A. MgO. B. KOH. C. Al. D. Ba(OH)2
Câu8. Trong các hợp chất, kim loại nhóm IIA có số oxi hóa là
A. +1. B. +3. C. +2. D. +4. Câu9. Nguyên tố hóa học nào sau đây thuộc nhóm kim loại kiềm thổ?
A. Natri. B. Bari. C. Nhôm. D. Kali.
Câu10. Dãy gồm các kim loại đều phản ứng với nước ở nhiệt độ thường thu được dung dịch có môi trường kiềm là
A. Na, Ba, K. B. Be, Na, Ca. C. Na, Fe, K. D. Na, Cr, K. Câu11. Dung dịch nào sau đây tác dụng với dung dịch Ba(HCO3)2, vừa thu được kết tủa, vừa có khí thoát ra?
A. NaOH. B. HCl. C. Ca(OH)2 D. H2SO4
Câu12. Phản ứng nào sau đây dùng để giải thích hiện tượng thạch tạo nhũ trong các hang động tự nhiên:
A. CO2 + Ca(OH)2 → CaCO3↓ + H2O. B. CaO + CO2 → CaCO3
C. Ca(HCO3)2 → CaCO3 ↓ + CO2↑ + H2O. D. CaCO3 + CO2 + H2O →Ca(HCO3)2.
Câu13. Hợp chất nào của canxi được dùng để đúc tượng, bó bột khi gãy xương?
A. Vôi sống (CaO). B. Thạch cao sống (CaSO4.2H2O).
C. Đá vôi (CaCO3).
D. Thạch cao nung (CaSO4.H2O).
Câu14. Nước có chứa các ion : Ca2+, Mg2+, HCO3 -, SO4 2- và Clgọi là
A. Nước có tính cứng vĩnh cữu.
C. Nước mềm.
B. Nước có tính cứng toàn phần.
Câu15. Nguyên tắc làm mềm nước cứng là
A. Cho nước cứng đi qua chất trao đổi cation, các ion Ca2+, Mg2+ sẽ bị hấp thụ và được trao đổi ion H+ hoặc Na+
B. Dùng dung dịch Na3PO4, Na2CO3... lọc bỏ kết tủa, ta thu được nước mềm.
C. Làm giảm nồng độ ion Ca2+, Mg2+ trong nước cứng bằng phương pháp hóa học hoặc phương pháp trao đổi ion.
D. Dùng dung dịch Ca(OH)2, lọc bỏ kết tủa, ta thu được nước mềm.
Câu16. Dãy gồm các chất đều có thể làm mất tính cứng tạm thời của nước là:
A. HCl, NaOH, Na2CO3. B. NaOH, Na3PO4, Na2CO3.
C. KCl, Ca(OH)2, Na2CO3. D. HCl, Ca(OH)2, Na2CO3.
Câu17. Cho mẫu nước cứng chứa các ion: Ca2+, Mg2+ , 3HCO . Hóa chất không có khả năng làm mềm mẫu nước cứng trên là
A. dung dịch Na2CO3. B. dung dịch Ca(OH)2 (vừa đủ).
C. dung dịch Na3PO4 D. dung dịch HCl.
Câu18. Vật liệu bằng nhôm khá bền trong không khí là do
A. nhôm không thể phản ứng với oxi. B. có lớp hidroxit bào vệ.
C. có lớp oxit bào vệ. D. nhôm không thể phản ứng với nitơ.
Câu19. Ở điều kiện thường, dãy gồm các kim loại hòa tan được trong dung dịch NaOH loãng là
A. Cr, Zn. B. Al, Zn, Cr. C. Al, Zn. D. Al, Cr. Câu20. Quặng nào sau đây có thành phần chính là Al2O3?
A. Hematit đỏ. B. Boxit. C. Manhetit. D. Criolit. Câu21. Cho phản ứng: 3332 aAlbHNOcAl(NO)dNOeHO +→++
Hệ số a, b, c, d, e là các số nguyên, tối giản. Tổng (a + b) bằng
A. 5. B. 4. C. 7. D. 6. Câu22. Hiện tượng nào đã xảy khi cho Na kim loại vào dung dịch CuSO4?
A. sủi bọt khí không màu và có kết tủa màu xanh.
B. bề mặt kim loại có màu đỏ, dung dịch nhạt màu.
C. sủi bọt khí không màu và có kết tủa màu đỏ.
D. bề mặt kim loại có màu đỏ và có kết tủa màu xanh.
Câu23. Nhận định nào sau đây là sai?
A. Dùng dung dịch Na2CO3 để làm mất tính cứng của nước nước cứng toàn phần.
B. Na2CO3 là nguyên liệu trong công nghiệp sản xuất thủy tinh, bột giặt, phẩm nhuộm, giấy, sợi,...
C. NaHCO3 được dùng trong công nghiệp dược phẩm (chế tạo thuốc đau dạ dày,...) và công nghiệp thực phẩm (làm bột nở,...).
D. NaOH là chất rắn, màu trắng, dễ nóng chảy, hút ẩm mạnh, tan nhiều trong nước và tỏa ra một lượng nhiệt lớn.
Câu24. Cho dãy chuyển hóa sau: 22 COHO NaOH XYX ++ + →→
Công thức của X là
A. NaOH. B. Na2CO3 C. NaHCO3 D. Na2O.
Câu25. Hiện tượng xảy ra khi sục từ từ đến dư khí CO2 vào dung dịch hỗn hợp NaOH và Ba(OH)2 là:
A. Dung dịch vẩn đục, độ đục tăng dần đến cực đại và không đổi một thời gian sau đó giảm dần đến trong suốt.
B. Ban đầu không có hiện tượng gì đến một lúc nào đó dung dịch vẩn đục, độ đục tăng dần đến cực đại sau đó giảm dần đến trong suốt.
D. Nước có tính cứng tạm thời. Trang64
Trang63
C. Ban đầu không có hiện tượng gì sau đó xuất hiện kết tủa và tan ngay.
D. Dung dịch vẩn đục, độ đục tăng dần đến cực đại sau đó giảm dần đến trong suốt.
Câu26. Cho hỗn hợp gồm Na2O, CaO, Al2O3 và MgO vào lượng dư, thu được dung dịch X và chất rắn Y. Sục khí CO2 đến dư vào X, thu được kết tủa là
A. Mg(OH)2. B. Al(OH)3. C. MgCO3. D. CaCO3.
Câu27. Cho sơ đồ phản ứng: Al2(SO4)3 → X → Y → Al. Trong sơ đồ trên, mỗi mũi tên là một phản ứng, các chất X, Y lần lượt là
A. NaAlO2 và Al(OH)3. B. Al2O3 và Al(OH)3.
C. Al(OH)3 và Al2O3 D. Al(OH)3 và NaAlO2
Câu28.(B.09): Hòa tan m gam hỗn hợp gồm Al, Fe vào dung dịch H2SO4 loãng (dư). Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X. Cho dung dịch Ba(OH)2 (dư) vào dung dịch X, thu được kết tủa Y. Nung Y trong không khí đến khối lượng không đổi, thu được chất rắn Z là
A. hỗn hợp gồm Al2O3 và Fe2O3 B. hỗn hợp gồm BaSO4 và FeO.
C. hỗn hợp gồm BaSO4 và Fe2O3 D. Fe2O3
Câu29. Cho sơ đồ sau: XYZ 2323 CaOCaClCa(NO)CaCO +++ →→→
Công thức của X, Y, Z lần lượt là:
A. Cl2, AgNO3, MgCO3 B. Cl2, HNO3, CO2
C. HCl, HNO3, Na2NO3. D. HCl, AgNO3, (NH4)2CO3.
Câu30. Lần lượt cho một mẫu Ba và các dung dịch K2SO4, NaHCO3, HNO3 và NH4Cl. Số trường hợp xuất hiện kết tủa là
A. 3. B. 4. C. 2. D. 1.
Câu31. Cho dãy các chất: KOH, Ca(NO3)2, SO2, SO3, NaHSO4, Na2SO3, K2SO4. Số chất trong dãy tạo thành kết tủa khi phản ứng với dung dịch BaCl2 là:
A. 4. B. 6. C. 3. D. 2.
Câu32. Ba dung dịch X, Y, Z thỏa mãn các điều kiện sau:
- X tác dụng với Y thì có kết tủa xuất hiện.
- Y tác dụng với Z thì có kết tủa xuất hiện.
- X tác dụng với Z thì có khí thoát ra.
X, Y, Z lần lượt là
A. Al2(SO4)3, BaCl2, Na2SO4
C. NaHCO3, NaHSO4, BaCl2.
B. FeCl2, Ba(OH)2, AgNO3
D. NaHSO4, BaCl2, Na2CO3.
Câu33.(QG.19-202). Cho các phản ứng sau theo đúng tỉ lệ mol:
(1) X ot → Y + CO2
(3) T + Z → R + X + H2O.
Các chất R, Q thỏa mãn sơ đồ trên lần lượt là
Y + H
2T + Z
Z
Q + X + 2H2O
A. KOH, K2CO3. B. Ba(OH)2, KHCO3. C. KHCO3, Ba(OH)2. D. K2CO3, KOH. Câu34.(QG.19-204). Cho sơ đồ các phản ứng sau:
(1) X1 + H2O ñieän phaân dung dòch coù maøng ngaên → X2 + X3↑ + H2↑
(2) X2 + X4 → CaCO3 + Na2CO3 + H2O
(3) X2 + X3 → X1 + X5 + H2O.
(4) X4 + X6 → CaSO4 + Na2SO4 + CO2 + H2O.
Các chất X5, X6 thỏa mãn sơ đồ trên lần lượt là
A. NaClO, H2SO4
C. Ca(HCO3)2, H2SO4.
B. Ca(HCO3)2, NaHSO4
D. NaClO, NaHSO4.
Câu35.(QG-2018): Cho sơ đồ phản ứng sau:
o 22243 COd−HOddHSOddNH ddNaOHd− 123435 XXXXXX + →→→→→ Biết X1, X2, X3, X4, X5 là các chất khác nhau của nguyên tố nhôm.
Các chất X1 và X5 lần lượt là
A. AlCl3 và Al2O3. B. Al(NO3)3 và Al. C. Al2O3 và Al. D. Al2(SO4)3 và Al2O3 Câu36.(QG.18-204): Cho kim loại M và các hợp chất X, Y, Z thỏa mãn các phương trình hóa học sau:
0 23 (a)2MCl 2M+3Cl → 32(b)3MCl3H 2M+6HCl →+
2 (c)2Y3H 2 2M+2X+2HO →+ 3(d)ZKHCO 22 Y+CO+HO →+
Các chất X, Y, Z lần lượt là:
A. KOH, KAlO2, Al(OH)3. B. NaOH, NaAlO2, Al(OH)3.
C. NaOH, NaCrO2, Cr(OH)3 D. KOH. KCrO2, Cr(OH)3
Câu37. Nhận định nào sau đây đúng?
(1) Dùng CaCO3 làm chất chảy loại bỏ SiO2 trong luyện gang.
(2) Dùng Mg để chế tạo các hợp kim nhẹ và bền như Đuyra,…
(3) Mg cháy trong khí CO2.
(4) Không dùng MgO để điện phân nóng chảy điều chế Mg.
(5) Dùng cát để dập tắt đám cháy có mặt Mg.
A. (1), (2), (3), (5). B. (2), (3), (5). C. (1), (2), (3), (4). D. (2), (3), (4). Câu38.(QG.17-202). Cho các phát biểu sau:
(a) Dùng Ba(OH)2 có thể phân biệt hai dung dịch AlCl3 và Na2SO4
(b) Cho dung dịch NaOH vào dung dịch AlCl3 dư, thu được kết tủa.
(c) Nhôm là kim loại nhẹ, màu trắng bạc, dẫn điện tốt, dẫn nhiệt tốt.
(d) Kim loại Al tan trong dung dịch H2SO4 đặc, nguội.
(e) Ở nhiệt độ cao, NaOH và Al(OH)3 đều không bị phân hủy.
Số phát biểu đúng là
A. 2.
B. 1. C. 4.
Câu39. Thực hiện các thí nghiệm sau:
(1) Cho kim loại K vào dung dịch HCl;
(2) Đốt bột Al trong khí Cl2;
(3) Cho Na2CO3 vào dung dịch BaCl2;
(4) Cho NaOH vào dung dịch Mg(NO3)2;
(5) Điện phân Al2O3 nóng chảy, có mặt Na3AlF6
Số thí nghiệm có phản ứng oxi hoá-khử xảy ra là
D. 3.
A. 2. B. 1. C. 3. D. 4. Câu40.(MH.19): Cho các phát biểu sau:
(a) Sục khí CO2 tới dư vào dung dịch NaAlO2, thu được kết tủa trắng.
(b) Nhỏ dung dịch Ba(HCO3)2 vào dung dịch KHSO4, thu được kết tủa trắng và có khí thoát ra.
(c) Dung dịch Na2CO3 làm mềm được nước cứng toàn phần.
(d) Thạch cao nung dùng để nặn tượng, bó bột khi gãy xương.
(e) Hợp kim liti – nhôm siêu nhẹ, được dùng trong kĩ thuật hàng không.
Số phát biểu đúng là
A. 3. B. 2. C. 5. D. 4. ______HẾT______
Trang65
Trang66
