Chuyên
Bài
Bài
Bài
Bài
Bài
Bài
Bài
Bài
Bài
Bài
Bài
Chuyên
Bài
Bài
Bài
Bài
Bài
Bài
Bài
Bài
Bài
Bài
Bài 5
Bài 6
Bài 7..............................................
Bài 8
Bài 9..........................................................................................................................126 Bài 10.............................................
Bài 11
Bài 12.............................................
Bài
Bài 14
Bài 15
Bài 16
Bài 17
Bài 18
Bài 19
Bài
Bài 21
Bài 22
Bài 23
Bài
Bài
Bài
Bài
Bài
Bài
Bài
Bài
Bài
Bài
Bài
Chuyên đề 1: Nguyên tử - Bảng tuần hoàn
Bài 1
1) Electron 3d1 có thể ứng với giá trị nào của 4 số lượng tử?
2) Ion X3+ có phân lớp electron ngoài cùng là 4d1. Viết cấu hình electron nguyên tử của X và cho biết vị trí của X trong bảng tuần hoàn các nguyên tố hóa học (chu kỳ, nhóm A, B)? Electron 4d1 của X3+ có thể ứng với những giá trị nào của 4 số lượng tử n, l, m và ms?
3) Electron cuối cùng trong nguyên tố A có các số lượng tử n = 2 ; m =1 ; ms = +1/2. Số electron độc thân của nguyên tố X ở trạng thái cơ bản thuộc phân lớp 4d hoặc 5s cũng bằng số electron độc thân của A. Có bao nhiêu nguyên tối X thỏa mãn dữ kiện trên, đó là những nguyên tố nào (có thể sử dụng bảng tuần hoàn các nguyên tố hóa học để trả lời)?
Electron của ion He+ ở trạng thái kích thích có giá trị số lượng tử chính bằng số lượng tử phụ của phân lớp chứa electron độc thân của nguyên tố X. Năng lượng của electron này ở He+ bằng năng lượng của electron ở trạng thái cơ bản của nguyên tử H. Xác định chính xác nguyên tố X.
1) Lý thuyết lượng tử dự đoán sự tồn tại của obitan g ứng với số lượng tử phụ l = 4.
a) Cho biết số electron tối đa của phân lớp g và giải thích.
b) Nguyên tử đầu tiên có electron ở phân lớp g thuộc nguyên tố có số hiệu nguyên tử bằng bao nhiêu?
2) Urani có cấu hình electron [Rn] 5f36d17s2. Trong nguyên tử urani có bao nhiêu electron chưa ghép đôi? Số oxi hoá cực đại của urani có thể là bao nhiêu?
3) Sắp xếp các electron có số lượng tử n, l, m, s tương ứng với những trường hợp sau theo thứ tự năng lượng giảm dần:
A (2, 1, 1, +1/2) B (1, 0, 0, -1/2) C (4, 1, -1, +1/2)
D (4, 2, -1, +1/2) E (3, 2, -1, +1/2) F (4, 0, 0, +1/2)
G (2, 1, -1, +1/2) H (3, 1, 0, +1/2)
Bài 3
Có thể viết cấu hình electron của Ni2+là: Cách 1: Ni2+ [1s22s22p63s23p63d8]; Cách 2: Ni2+ [1s22s22p63s23p63d64s2]. Áp dụng phương pháp gần đúng Slater (Xlâytơ) tính năng lượng electron của Ni2+ với mỗi cách viết trên (theo đơn vị eV). Cách viết nào phù hợp với thực tế? Tại sao?
Bài 5
Năng lượng ion hóa thứ nhất và thứ hai của Na và Mg theo eV (sắp xếp không theo thứ tự) là: 5,1; 7,6; 47,3; 15,0. Hãy điền các số liệu trên vào bảng sau và giải thích: Nguyên tố I1 I2 Na Mg 9 |
Cho bảng sau Nguyên tố Ca Sc Ti V Cr Mn Năng lượng ion hóa I2 (eV) 11,87 12,80 13,58 14,15 16,50 15,64
Hãy giải thích sự biến đổi năng lượng ion hóa thứ hai của các nguyên tố trong bảng.
a) Trong các hợp chất, magie tồn tại ở dạng Mg2+ mặc dù năng lượng ion hóa thứ hai của magie (15,035 eV) lớn gần gấp đôi năng lượng ion hóa thứ nhất (7,646 eV).
b) Titan tạo được các ion có điện tích khác nhau Ti2+, Ti3+ và Ti4+. Trong dung dịch hai ion Ti2+ và Ti3+ có màu còn Ti4+ không màu?
Bài 7
Câu hỏi này sẽ hỏi về sự làm lạnh bằng laser vốn là một kỹ thuật nhanh chóng và đầy hiệu lực để làm lạnh ion xuống nhiệt độ rất thấp. Như đã biết động năng trung bình của một phân tử phụ thuộc vào nhiệt độ được thể hiển ở biểu thức 3 2B EkT = , với kB là bằng số Boltzmann.
a) Nguyên tử canxi tồn tại ở trạng thái tự do ở 600 °C. Tính động năng trung bình của ion canxi và suy ra căn bậc hai momen và căn bậc hai vận tốc của một nguyên tử 40Ca , biết khối lượng phân tử là 39.96.
b) Các nguyên tử được đưa đến một thiết bị bắt ion ở đó chúng bị quang ion hóa và bắt giữ. Trong chiếc bẫy này chúng được bắn phá bằng tia laser có bước sóng 396.96 nm. Tính tần số, năng lượng và momen động lượng của một photon ở bước sóng này.
c) Các ion đi qua một thiết bị quang học tuần hoàn. Các ion hấp thụ photon từ chùm laser khi chúng di chuyển đến vị trí đối diện với ánh sáng (điều này có thể đạt được khi áp dụng hiệu ứng Doppler) và sau đó chúng lại phân rã một photon đến một vị trí ngẫu nhiên. Hiệu ứng chung của phương pháp này chính là để làm giảm phần nào nhiệt độ của ion. Tính toán sự biến đổi momen động lượng trung bình và vận tốc sau mỗi chu trình và số photon cần để các ion hấp phụ để đưa ion đến trạng thái nghỉ (Trong thực nghiệm quá trình này làm nhiệt độ giảm xuống khoảng 0.5 mK.)
d) Viết cấu hình electron của ion Ca+ ở trạng thái cơ bản, và tính momen obitan và momen từ spin của electron không cặp đôi.
e) Ở trạng thái kích thích thì dưới ảnh hưởng của tia laser làm lạnh thì electron không cặp đôi sẽ chuyển đến p có mức năng lượng thấp nhất. Tính momen obitan và momen từ spin của electron không cặp đôi trong trường hợp này.
f) Ở trạng thái kích thích này thì electron cũng đã gây ra một momen từ do quỹ đạo chuyển động của nó quanh hạt nhân. Spin của electron lúc này có thể định hướng cùng chiều hay ngược chiều với từ trường ngoài, và hai trạng thái đó sẽ khác nhau về mặt năng lượng. Kết quả là xuất hiện số lượng tử , j, đặc trưng co tổng momen từ của các điện tử trong phân tử có giá trị dao động từ
|
ls đến ls + , các giá trị này nguyên. Tính tất cả các giá trị j có thể có.
g) Trạng thái chuyển tiếp laser lạnh chính là đi xuống mức thấp hơn của hai mức này. Trạng thái chuyển tiếp bắt nguồn từ trạng thái cơ bản đến mức cao hơn có bước sóng laser là 393.48 nm. Tính sự chênh lệch năng lượng giữa hai mức gây ra do cấu hình ở trạng thái chuyển tiếp.
Bài 8
Đối với nguyên tử H và những ion chỉ có 1 electron thì năng lượng của các electron được xác định theo biểu thức = 2 nH 2 Z EE n , với EH = -2,178.10-18 J và
Z là số hiệu nguyên tử, n là số lượng tử chính. Xác định năng lượng ion hóa theo kJ/mol của nguyên tử H và những ion một electron sau: a) H b) He+ c) Li2+ d) C5+ ; e) Fe25+
Giải thích sự biến thiên của các giá trị năng lượng ion hóa khi đi từ nguyên tử H đến ion Fe25+
|
Kết quả tính Hóa học lượng tử cho biết ion Li2+ có năng lượng electron ở các mức En (n là số lượng tử chính) như sau: E1 = -122,400 eV; E2 = -30,600 eV; E3 = -13,600 eV; E4 = -7,650 eV.
a) Tính giá trị năng lượng trên theo kJ/mol (có trình bày chi tiết đơn vị tính).
b) Hãy giải thích sự tăng dần năng lượng từ E1 đến E4 của ion Li2+ .
c) Tính năng lượng ion hóa của ion Li2+ (theo eV) và giải thích.
Bài 10
Cho các ion sau đây: He+, Li2+, Be3+.
a) Áp dụng biểu thức tính năng lượng: En = -13,6(Z2/n2) (có đơn vị là eV); n là số lượng tử chính, Z là số điện tích hạt nhân, hãy tính năng lượng E2 theo đơn vị kJ/mol cho mỗi ion trên (trong đáp số có 4 chữ số thập phân).
b) Có thể dùng trị số nào trong các trị số năng lượng tính được ở trên để tính năng lượng ion hóa của hệ tương ứng? Tại sao?
c) Ở trạng thái cơ bản, trong số các ion trên, ion nào bền nhất, ion nào kém bền nhất? Tại sao?
1) Tần số của các vạch phổ thuộc dãy Lyman (bước chuyển electron từ n>1 về n=1) của nguyên tử hydro lần lượt là 2,466; 2,923; 3,083; 3,157; 3,197; 3,221; và 3,237x1015 Hz. Dựa vào các giá trị này hãy xác định năng lượng ion hóa của nguyên tử hydro.
2) Tính năng lượng ion hóa thứ nhất (kJ/mol) của các nguyên tử selen, biết khi chiếu chùm sáng đơn sắc có bước sóng 48,2 nm vào các nguyên tử selen ở trạng thái cơ bản và ở thể khí thì tạo ra chùm electron có vận tốc 2,371x106 m/s. Biết khối lượng của 1 electron bằng 9,109x10-31 kg.
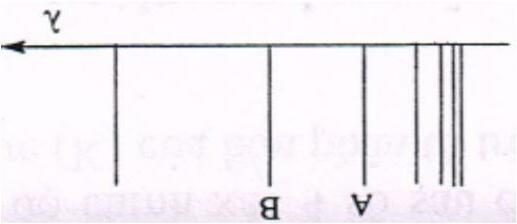
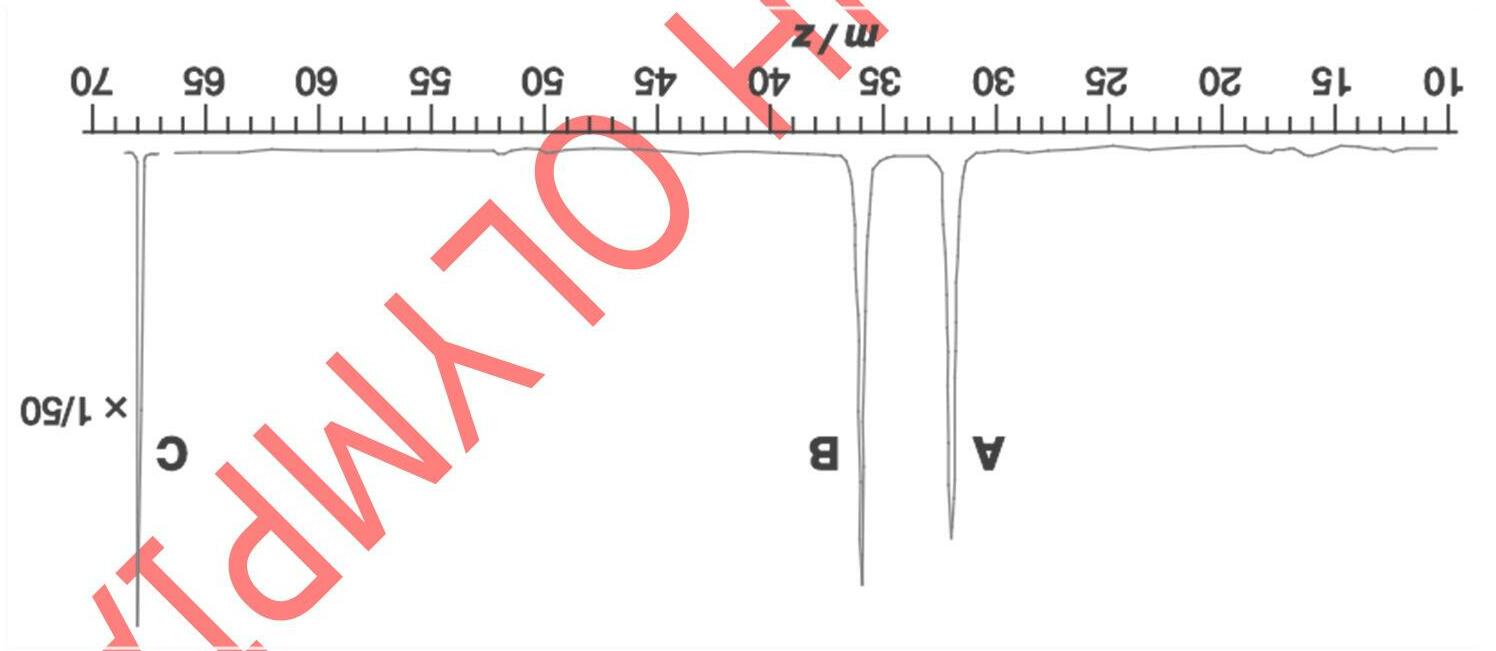
Trong một thí nghiệm, người ta ghi được phổ phát xạ (phổ vạch) đối với một ion giống hydro (chỉ chứa một electron) ở pha khí. Các vạch phổ của ion khảo sát được biểu diễn theo hình phổ đồ dưới đây:
Tất cả các vạch phổ thu được đều đặc trưng cho các bước chuyển từ trạng thái kích thích về trạng thái ứng với n = 3. Căn cứ vào các dữ kiện đã cho, hãy:
a) Cho biết bước chuyển electron nào ứng với vạch A và vạch B ghi trên phổ đồ?
b) Giả sử độ dài bước sóng λ = 142,5 nm ứng với vạch B. Tính độ dài bước sóng cho vạch A theo nm.
Năm 1888, Rydberg và Ritz đã phát hiện ra một công thức kinh nghiệm để xác định vị trí của các vạch phổ hydrogen bằng sự hấp thụ ánh sáng: =−λ 22 12
111 R nn λ - bước sóng, R - hằng số Rydberg, n1 và n2 - các số tự nhiên. Các dãy quang phổ dưới đây tương ứng với sự chuyển (nhảy) của electron từ các trạng thái n2 khác nhau đến trạng thái cho sẵn n1. Cho biết: h = 6.627∙10 34 J∙s, c = 3∙108 m∙s-1 Các dãy phổ n1 n2 λ, nm
Layman 1 3 ~100 1 121
Brackket 4 1456
Ballmer 3
1) Sử dụng dữ liệu từ bảng, tính hằng số Rydberg và hoàn thành bảng bằng cách bổ sung các dữ kiện còn thiếu.
Năm 1913, Bohr đã phát triển mô hình của ông về nguyên tử hydrogen. Mô hình này dựa trên giả thiết rằng nguyên tử có các quỹ đạo tròn ổn định, trong đó các electron có vị trí xác định mà không bức xạ năng lượng. Electron chuyển từ quỹ đạo n1 đến n2 sẽ kéo theo việc hấp thụ hoặc bức xạ ánh sáng (photon) có bước sóng xác định. Thế năng của electron trong trường tĩnh điện của hạt nhân là =− πε
2 n 0n
e E 4r e = 1.6∙10-19 C - điện tích cơ bản, ε0 = 8.85∙10-12 F/м - hằng số điện, rn - bán kính của orbital thứ n; và rn = a0n2, a0 - bán kính của quỹ đạo Bohr thứ nhất (bán kính Bohr). Cho biết giá trị động năng của nguyên tử hydrogen chỉ nhỏ bằng ½ và ngược dấu với thế năng của nó.
2) Dãy nào tương ứng với sự chuyển electron về trạng thái cơ bản?
3) Cho biết hằng số R, tính năng lượng của 1 mol nguyên tử hydrogen ở trạng thái cơ bản.
4) Tính bán kính Bohr a0 và khoảng cách cực tiểu giữa các quỹ đạo thứ 3 và thứ 2.
5) Tính năng lượng ion hoá của nguyên tử hydrogen.
6) Cho biết năng lượng tổng của phân tử H2 là -3070 kJ/mol (năng lượng được đo từ năng lượng của hạt nhân và các electron ở trạng thái nghỉ, nằm ở những vị trí cách xa nhau vô tận), tính năng lượng liên kết giữa các nguyên tử H trong phân tử này.
Bài 1
1) Năm 2011 được chọn là Năm Quốc tế Hóa học, là kỉ niệm 100 năm Marie Curie dành được giải Nobel Hóa học. Curie đã tìm được 2 nguyên tố hóa học và tên của 2 nguyên tố này là gì?
2) Tháng 10 năm 2009, nguyên tố thứ 117 đã được tổng hợp - đánh dấu cho việc tất cả các chỗ trống trong chu kì 7 của bảng tuần hoàn đã được lấp đầy. Nguyên tố thứ 117 được tổng hợp bằng cách bắn phá mục tiêu 249Bk bởi 48Ca, và tổng cộng thu được 6 nguyên tử của nguyên tố 117. Sau phân hạch, 1 trong các nguyên tử phân rã p lần α tạo thành 270Db còn 5 nguyên tử phân rã q lần α tạo thành 281Rg. Sử dụng kí hiệu nguyên tố 117 cho trong bảng tuần hoàn, viết các phương trình phản ứng hạt nhân.
3) Tỉ lệ giữa số nguyên tử triti và tổng số nguyên tử hiđro trong một mẫu nước sông là 8.10-18. Triti phân huỷ phóng xạ với chu kì bán huỷ bằng 12,3 năm. Tính số nguyên tử triti trong 10 gam nước sau 40 năm.
Bài 2
Có 3 chuỗi phóng xạ tự nhiên: chuỗi 238U92, chuỗi 235U92, và chuỗi 232Th90
1) Xác định có bao nhiêu hạt với số khối 4 có thể chứa trong các hạt nhân 238U92, 232Th90 và 235U92. Xác định biểu thức cho phép xác định số khối mỗi đồng vị của mỗi chuỗi.
2) Cho biết định nghĩa về số khối.
3) Chuỗi thorium có đồng vị 228Th90. Xác định chuỗi phân rã phóng xạ từ 232Th90 đến 228Th90, xác định tất cả các đồng vị xuất hiện trong chuyển hoá này.
4) Đề xuất trình tự thuận tiện nhất để cô lập đồng vị 228Th.
5) Một mẫu đồng vị tinh khiết 228Th (T1/2 = 1.9 năm) với độ phóng xạ a Bq được đặt vào một ống thuốc tiêm đã rút hết khí, đậy kín. Chuỗi 232Th kết thúc với các đồng vị chì bền vững. Một trong các dạng đồng vị Rn được tạo thành trong chuỗi chuyển hoá 228Th. Các đồng vị chì có thể là 206Pb, 207Pb và 208Pb. Các đồng vị Rn có thể là 219Rn (T1/2 = 3.92 giây); 220Rn (T1/2 = 54.5 giây); và 222Rn (T1/2 = 3.8 ngày). Sử dụng biểu thức ở 1, xác định các đồng vị của Pb và Rn tạo thành trong chuỗi thorium.
6) Giả sử rằng sau 30 ngày, cân bằng thế kỉ được thiết lập trong ống thuốc tiêm. Tính tỉ lệ áp suất riêng phần của các sản phẩm phân rã khí theo a.
7) Hai nguyên tố radium và polonium được Marie và Pierre Curie phát hiện khi nghiên cứu quặng uranium. Đồng vị nào sau đây của radium và polinium có thể tìm thấy trong quặng uranium:
226Ra, T1/2 = 1620 năm; 210Po, T1/2 = 0.15 giây; 225Ra, T1/2 = 14.8 ngày; 210Po, T1/2 = 138.4 ngày; 228Ra, T1/2 = 6.7 năm
8) Khi so sánh độ phóng xạ của quặng và các mẫu tổng hợp nhân tạo, M.Curie cho rằng quặng có chứa lượng nhỏ một đồng vị phóng xạ chưa biết. Cơ sở của giả định này là gì?
9) Những điều kiện mà các mẫu phải thoả mãn là gì?
10) Viết công thức của quặng uranium.
Chuyên
2: Hóa học hạt nhân
Bài 3
Có 3 chuỗi phóng xạ tự nhiên và 1 chuỗi phóng xạ nhân tạo. Sau các chuyển hóa phóng xạ alpha và beta, các chuỗi kết thúc với sự tạo thành các đồng vị bền. Giản đồ dưới đây biểu diễn một trong các chuỗi vậy:
Biết rằng trong chuỗi này, X4 = X1 (X là loại phân rã). Phân rã phóng xạ tuân theo quy luật động học phản ứng bậc nhất: dN/dt = -λN, trong đó λ là hằng số phân rã, N là số hạt nhân phóng xạ ở thời điểm t.
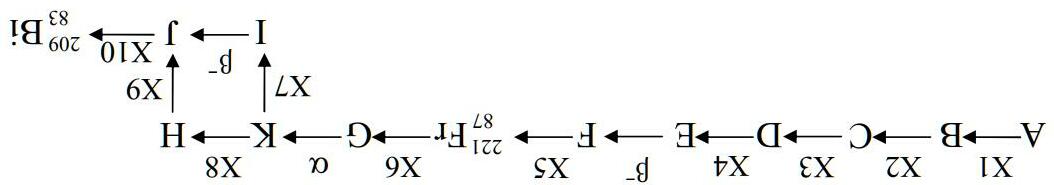
1) Xác định chu kì bán rã T1/2 của nguyên tố C, biết rằng trung bình thì mỗi giây có 1 trong số 7.24∙1012 nguyên tử C bị phân rã. Xác định nguyên tố C, sau đó là D, E, F - sử dụng các dữ kiện bổ sung sau: a) sau 500 năm, từ 1 gam C xảy ra phân rã α thì có 9.333∙10-6 mol helium được tạo thành; b) khối lượng nguyên tử của C lớn gấp 2.533 lần trị số điện tích hạt nhân.
Trong tự nhiên, chỉ có 7 khoáng chất của nguyên tố I được biết đến. Hai trong số chúng là IAsSx và I4Hg3SbxAs8S20, có hàm lượng I lần lượt là 60 % và 28.6 %.
2) Xác định các nguyên tố I và J, biết khối lượng nguyên tử của I lớn gấp 2.580 lần điện tích hạt nhân của nó.
3) Một mẫu phóng xạ nặng 3 gam chứa các đồng vị A1 (35 % về khối lượng, T1/2 = 2.1 ngày) và A2 (65 % về khối lượng, T1/2 = 4.4 ngày). Số khối của A1 lớn hơn 1 amu so với số khối của A, còn số khối của A2 ít hơn 3 amu so với A. Xác định đồng vị A - "tổ tiên" của chuỗi phóng xạ này, biết rằng sau 12 giờ kể từ khi điều chế thì độ phóng xạ của mẫu là 4.61∙105 Curie (1 Curie = 3.7∙1010 phóng xạ/giây). Độ phóng xạ của mẫu chứa nhiều đồng vị được tính theo tổng độ phóng xạ thành phần. Khối lượng nguyên tử của A lớn gấp 2.548 lần trị số điện tích hạt nhân.
4) Xác định các hạt nhân B, G, H, K
5) Lấy ví dụ về phương trình phản ứng hạt nhân của các phân rã alpha và beta.
6) Tính năng lượng liên kết các nucleon trong hạt nhân bismuth-209, theo 1 nucleon, đơn vị MeV.
Khối lượng chính xác của các vi hạt (amu) bằng: nguyên tử bismuth là 208.980, proton là 1.0072747, neutron là 1.0086658, electron là 5.4857937∙10-4; 1 eV = 1.602∙10-19 J, tốc độ ánh sáng trong phân không c = 2.99792458∙108 m/s, 1 amu = 1.66054∙10-27 kg.
Bài 4
Có một số kiểu phân rã phóng xạ: 1) Phân rã α; 2) Phân rã β ; 3) Phân rã β+ ; 4) Phân rã γ; 5) Bắt K (thâu tóm electron lớp K); 6) Sự tự phân hạch hạt nhân nặng (f); 7) Sự phân hạch neutron nhiệt của một số hạt nhân, chẳng hạn uranium-235, f (1n0)
1) Viết các quá trình hạt nhân dẫn đến sự bức xạ: a) electron; b) positron.
2) Viết chuỗi phương trình chuyển hóa từ 238U thành 239U94 trong lò phản ứng hạt nhân.
3) Hoàn thành 5 phương trình phân rã sau đây, chỉ rõ điện tích hạt nhân và số khối của các đồng vị tạo thành. Kiểu phân rã được ghi rõ trên mũi tên.
Xét quá trình phân hạch neutron nhiệt của uranium-235, viết phản ứng tổng quát, không cần phải chỉ rõ các đặc điểm cụ thể của phân mảnh X1 và X2. Viết phương trình cân bằng điện tích, kí hiệu điện tích các hạt nhân mảnh z1 và z2 và phương trình cân bằng khối lượng, kí hiệu số khối các mảnh khối A1 và A2 (bỏ qua độ hụt khối).
5) Xác định kiểu phân rã nào có tốc độ phân rã phụ thuộc vào trạng thái hóa học và số oxide hóa của nguyên tử phóng xạ.
6) Quá trình nào diễn ra trong nguyên tử ngay sau phân rã bắt K?
7) Có phải các quá trình diễn ra sau phân rã bắt K luôn kèm theo bức xạ các vi hạt?
8) So sánh chu kì bán huỷ trong hai trường hợp bắt K sau: a) số oxide hoá của nguyên tử phóng xạ bằng 0; b) số oxide hoá cực đại.
|
Sự phân hủy phóng xạ của 232 Th tuân theo phản ứng bậc 1. Nghiên cứu về sự phóng xạ của thori đioxit, người ta biết chu kì bán hủy của 232 Thlà 1,39.1010 năm. Hãy tính số hạt α bị bức xạ trong 1 giây cho 1 gam thori đioxit tinh khiết.
Cho: tốc độ ánh sáng c = 3.108 m.s-1; hằng số Planck h = 6,625.10-34 J.s; hằng số Avogađro NA = 6,022.1023 mol-1 .
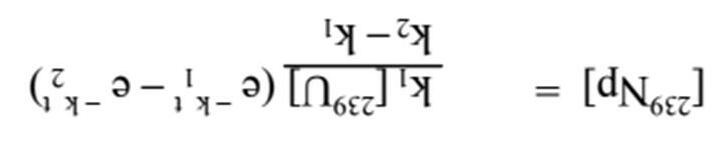
Bài 6
1) Phóng xạ 238U92 bức xạ các hạt alpha và beta, tạo thành 206Pb82 bền. i. Viết phương trình phản ứng hạt nhân tổng.
Một mẫu quặng uranium được tìm thấy có chứa 1.19 gam 238U92 và 1.03 gam 206Pb82. (Giả sử rằng ban đầu trong quặng không chứa chì.) ii.
a) Tính khối lượng helium bức xạ từ mẫu quặng.
b) Tính tuổi của quặng, biết cần 1 tỉ năm để ½ lượng 238U92 chuyển hoá thành 206Pb82.
2) 238U92 phân rã thành 239U qua sự hình thành một hạt nhân trung gian 239Np, các hằng số phóng xạ liên tiếp là k1 và k2.
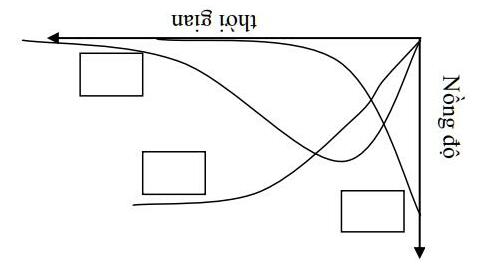
i. Viết phương trình tốc độ phân rã của cả 239U và 239Np. Nồng độ 239Np được xác định bởi biểu thức sau
ii. Đơn giản hoá biểu thức sử dụng các giá trị xấp xỉ phù hợp nếu biết chu kì bán huỷ của hai hạt nhân lần lượt là 23.5 phút và 2.35 ngày.
iii. Đồ thị sau biểu diễn nồng độ của U, Np và Pu dưới dạng hàm số của thời gian. Hãy cho biết mỗi đường cong tương ứng với tiểu phân nào.
iv. Xác định phát biểu sau là đúng hay sai: Tốc độ phân rã hạt nhân tăng xấp xỉ 2 lần khi nhiệt độ tăng lên mỗi 10 oC.
|
32P phân rã β với chu kì bán huỷ 14,28 ngày, được điều chế bằng phản ứng giữa nơtron với hạt nhân 32S.
a) Viết các phương trình phản ứng hạt nhân để điều chế 32P và biểu diễn sự phân rã phóng xạ của 32P.
b) Có hai mẫu phóng xạ 32P được kí hiệu là mẫu I và mẫu II. Mẫu I có hoạt độ phóng xạ 20 mCi được lưu giữ trong bình đặt tại buồng làm mát có nhiệt độ 10 oC. Mẫu II có hoạt độ phóng xạ 2 µCi bắt đầu được lưu giữ cùng thời điểm với mẫu I nhưng ở nhiệt độ 20 oC. Khi hoạt độ phóng xạ của mẫu II chỉ còn 5.10-1 µCi thì lượng lưu huỳnh xuất hiện trong bình chứa mẫu I là bao nhiêu gam? Trước khi lưu giữ, trong bình không có lưu huỳnh.
Cho: 1 Ci = 3,7.1010 Bq (1Bq = 1 phân rã/giây); số Avogađro NA = 6,02.1023 mol-1; hoạt độ phóng xạ A = λ.N (λ là hằng số tốc độ phân rã, N là số hạt nhân phóng xạ ở thời điểm t).
Bài 8
Đồng vị nhân tạo 60 27 Co được dùng trong y tế phân rã thành đồng vị bền là 60 28 Ni.
a) Viết các phương trình phản ứng hạt nhân xảy ra.
b) Biết chu kỳ bán hủy 60 27 Co thành 60 28 Ni là 5,33 năm. Hãy tính:
- Khối lượng 60 27 Co để có độ phóng xạ là 10Ci
- Sau khoảng thời gian t mẫu chất phóng xạ có tỉ lệ khối lượng 60 28 Ni so với 60 27 Co là 0,9 (coi trong mẫu không có sản phẩm trung gian). Tính t.
Cho: R = 0,082 L.atm.mol-1.K-1; Nhiệt dung nhiệt lượng kế là 8,36 kJ.độ-1; 1Ci = 3,7.1010 Bq
|
Phòng thí nghiệm có mẫu phóng xạ Au198 với cường độ 4,0 mCi/1g Au. Sau 48 giờ người ta cần một dung dịch có độ phóng xạ 0,5 mCi/1g Au. Hãy tính số gam dung môi không phóng xạ pha với 1g Au để có dung dịch nói trên. Biết rằng Au198 có t1/2 = 2,7 ngày đêm.
Bài 10 32P phân rã β với chu kỳ bán rã 14,26 ngày được ứng dụng nhiều trong y học, nông nghiệp, sinh học và hóa phân tích. Để xác định lượng axit H3PO4 được tạo ra trong bình phản ứng R mà không phải tách toàn bộ lượng H3PO4 ra khỏi R, một dung dịch chứa axit photphoric đã đánh dấu hoàn toàn (H3 32PO4 không chứa các đồng vị khác của P) có hoạt độ phóng xạ 394,6.10-4 μCi được đưa vào R. Sau khi khuấy trộn kỹ để chất đánh dấu phân bố đều trong toàn bộ dung dịch của R, một thể tích nhỏ của dung dịch được lấy ra khỏi R. Axit photphoric có trong thể tích nhỏ này được kết tủa định lượng dưới dạng Mg2P2O7 (magie pyrophotphat). Lượng kết tủa cân nặng 30,6 mg có hoạt độ phóng xạ 3,03.10-4 μCi.
a) Tính hoạt độ phóng xạ riêng của photpho trong dung dịch H3 32PO4 dùng để đánh dấu trước khi đưa vào bình phản ứng R.
b) Tính khối lượng photpho có trong kết tủa Mg2P2O7.
c) Tính hoạt độ phóng xạ riêng của P trong kết tủa.
d) Tính khối lượng axit photphoric ban đầu trong bình phản ứng R. Hoạt độ phóng xạ riêng ở đây được định nghĩa là hoạt độ phóng xạ của một đơn vị khối lượng chất phóng xạ.
Cho biết: 32P = 32; 1Ci = 3,7.1010 Bq (phân rã/s); 1μCi = 10-6Ci
Chụp cắt lớp phát xạ positron (PET - positron emission tomography) là kĩ thuật hình ảnh mới nhất trong y học dựa trên tính không bền của một số đồng vị. Các đồng vị C-11 và N-13 được sử dụng trong chẩn đoán ung thư và bệnh tim bằng kĩ thuật PET.
1) Viết phương trình phản ứng phân rã đồng vị C-11 và N-13
Phản ứng tổng hợp hạt nhân đồng vị C-11 và N-13 được tiến hành trong cyclotron. Một trong các đồng vị này thu được bằng cách chiếu dòng proton vào khí đơn chất A là tạp chất với hàm lượng dưới 0.5% của khí đơn chất B, từ đó tạo thành khí phóng xạ C có tỉ khối so với A là 1.54. Phương trình phản ứng hạt nhân: Đồng vị được chiếu xạ + p → đồng vị cần tổng hợp + 4He
2) Xác định các chất A C và viết phương trình phản ứng
Một trong những chất phóng xạ phổ biến nhất trong chẩn đoán hình ảnh PE có chứa đồng vị nX. Đồng vị này có thể thu được bằng cách chiếu deuteron vào neon.
Hợp chất phóng xạ Z chứa đồng vị nX và 39.78% carbon theo khối lượng được tổng hợp từ 1,3,4,6-tetra-o-acetyl-2-triflormethylsulfonyl-beta-Dmannopyranose theo sơ đồ sau:
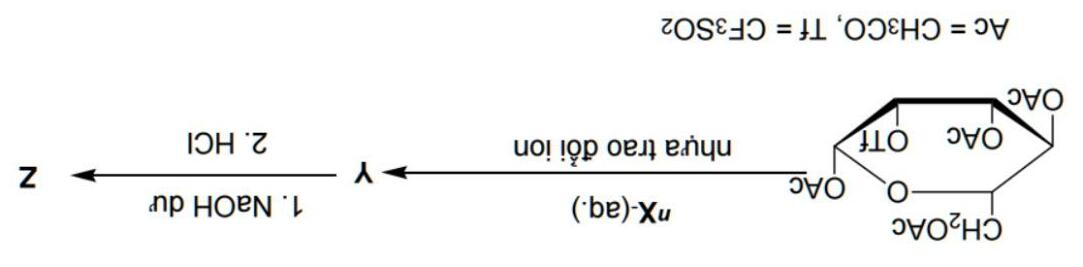
được dùng để tổng hợp chất Z. Độ phóng xạ riêng của mẫu chất ngay sau tổng hợp là 9.4 GBq (hiệu suất sản phẩm đạt 24% so với lý thuyết).
5) Tính thời gian tổng hợp mẫu chất phóng xạ Z theo sơ đồ trên (bằng phút)
3) Xác định đồng vị nX và viết phương trình phản ứng hạt nhân tổng hợp X.
4) Vẽ cấu trúc chất Y theo công thức chiếu Haworth và chất Z theo công thức chiếu Fischer, sử dụng các công thức viết tắt trên.
Chu kì bán rã của các đồng vị sử dụng trong chẩn đoán PET tương đối ngắn (ví dụ t1/2 nX là 110 phút). Vì vậy mẫu chất phóng xạ y tế phải được tổng hợp trong thời gian ngắn. Trong một thí nghiệm, sau khi điều chế thì độ phóng xạ riêng của dung dịch có chứa anion nX- là 56 GBq. Dung dịch này
|
Dẫn xuất của glucose, 2-deoxy-2-(18F)fluoro-D-glucose (FDG), là thuốc có phóng xạ để chẩn đoán bệnh ung thư phổ biến nhất, sử dụng phương pháp chụp cắt lớp bức xạ positron. Giai đoạn đầu tiên để điều chế FDG là tạo ra hạt nhân phóng xạ fluoro-18 bởi một phản ứng hạt nhân trong máy gia tốc. Giai đoạn tiếp theo là tổng hợp hóa chất phóng xạ. Fluorine-18 được đưa vào phân tử D-glucose bởi phản ứng thế nucleophile. Mỗi khi được tiêm vào cơ thể bệnh nhân, 2-deoxy-2-(18F)fluoro-D-glucose tích tụ trong các tế bào của khối u ác tính; quá trình này đi kèm với sự phân hủy fluorine-18. Hạt nhân phóng xạ này là nguồn bức xạ β+ hay position (phảnelectron). Positron tương tác với một elecron và triệt tiêu lẫn nhau - quá trình này có thể được thiết bị ghi lại và cho phép xác định chính xác kích thước lẫn loại u.
1) Hoàn thành các phương trình phản ứng hạt nhân sau:
a) 18O + 1 1H → …+ 18F
b) … + 2 1D → 18F + α
c) 19F + 2 1D → 20F + …
d) 16O + … → 18F + 1 1H + n
2) Cách thức phân rã của các hạt nhân nhẹ phụ thuộc vào tỉ lệ số neutron và proton của chúng. Nếu tỉ lệ này lớn hơn của một đồng vị bền thì hạt nhân phân rã β , còn nếu nhỏ hơn thì phân rã β+. Xác định loại phân rã của mỗi hạt nhân trong bảng: Hạt nhân 11С 20F 17F 14C Cách phân rã Khi phản ứng hạt nhân (a) được sử dụng để điều chế fluorine-18 thì chất dùng làm “bia” (mục tiêu) chiếu xạ là nước được làm giàu bởi H2 18O. Sử có mặt của nước thông thường, H2 16O, dẫn tới một phản ứng hạt nhân phụ với 16O, tạo thành đồng vị 17F. 3) Biết rằng trong năm phút sau khi hoàn thành sự chiếu xạ thì tỉ lệ độ phóng xạ của 18F và 17F là 105. Giả sử rằng thời gian chiếu xạ ngắn, độ phóng xạ của mỗi đồng vị tỉ lệ với hiệu suất phản ứng hạt nhân và
phần mol của cấu tử trong “bia” chiếu xạ. Tính phần khối lượng của H2 18O trong “bia” chiếu xạ. t1/2(18F) = 109.7 phút, t1/2(17F) = 65 giây. Tỉ lệ hiệu suất các phản ứng hạt nhân là / = 144.7.
4) Tính hiệu suất quá trình đánh dấu đồng vị của D-glucose bởi fluorine18, nếu độ phóng xạ ban đầu của mẫu fluorine-18 là 600.0 MBq và độ phóng xạ của 2-deoxy-2-(18F)fluoro-D-glucose thu được là 528.2 МBq. Thời gian tổng hợp là 3.5 phút.
5) Chu kì bán rã sinh học (qua các cơ quan bài tiết) 2-deoxy-2-(18F)fluoroD-glucose là 120.0 phút. Xác định độ phóng xạ (theo MBq) còn lại trong bệnh nhân sau 10 giờ kể từ khi tiêm FDG với cường độ 450.0 MB.
|
Một cuốn sách dành cho trẻ em xuất bản năm 1905 đã được bán đấu giá tại Mỹ. Nó là một cuốn sách phóng xạ. Các bức hình trong cuốn này này được in bởi loại mực phát sáng, chứa các muối radium và chúng có thể phát sáng trong bóng tối. Radium đã bị phân huỷ và cuốn sách không còn phát sáng nữa. (Science and Life, 2000, số 10, trang 55)
1) Ước lượng mức độ chính xác của bài báo trên. Xác định những đánh giá của bạn bằng tính toán cụ thể: Chu kì bán rã (T1/2) của 226Ra88 là 1620 năm. Giả sử rằng đã 100 năm trôi qua kể từ khi cuốn sách ra đời. Tính độ phóng xạ hiện tại của radium biết rằng vào năm 1905 thì nó bằng a phân rã/giây.
2) Tính khối lượng radium sulfate dùng để tạo ra cuốn sách này, theo đơn vị a.
3) Tính toán để xác định độ phóng xạ của cuốn sách đã thay đổi như thế nào trong 100 năm. Một chuỗi hạt nhân phóng xạ đã được tạo ra trong quá trình phân rã 226Ra88. Giả sử rằng một cân bằng thế kỉ đã được thiết lập giữa các hạt nhân của chuỗi trong khoảng thời gian này.
4) Cuốn sách đã trở nên nguy hiểm hơn hay ít đi với người đọc?
5) Xác định những nguyên nhân vì sao cuốn sách không còn phát sáng ở thời điểm hiện tại. Giả sử rằng nhà sản xuất đã sử dụng cùng loại vật liệu phát quang như trong những thí nghiệm của Rutherford khi nghiên cứu cấu trúc nguyên tử.
Bài 14
Uranium tự nhiên chứa khoảng 99,3% 238U92; 0,7% 235U92 (về khối lượng) cùng với lượng nhỏ các đồng vị phóng xạ là sản phẩm phân rã của các đồng vị trên, như 226Ra88, 210Po84 … Một mẫu quặng uranium có khối lượng 10 kg lấy từ mỏ Nông Sơn (Quảng Nam) có hoạt độ phóng xạ của 226Ra88 bằng 7,51.104 Bq.
a) Hoạt độ phóng xạ của 238U92, 210Po84, 235U92 và trong mẫu quặng nói trên bằng bao nhiêu ? Cho rằng có cân bằng thế kỉ giữa các đồng vị phóng xạ khởi đầu các họ phóng xạ tự nhiên và các con cháu của chúng. Cho chu kì bán rã của 238U92 bằng 4,47.109 năm, của 226Ra88 bằng 1620 năm, của 235U92 bằng 7,038.108 năm (1 năm có 365 ngày).
b) Những ước tính trung bình cho rằng sự phân hạch 1 kg 235U92 sinh ra 6,55.1010 kJ. Tính xem trong bao nhiêu kg, quặng uranium nói trên có chứa một lượng 235U92 mà sự phân hạch toả ra năng lượng bằng 1,82.108 kWh.
Trong những bản tin gần đây, có nhiều báo cáo về các thử nghiệm bom hạt nhân dưới lòng đất. Năng lượng giải phóng từ những quả bom hạt nhân này có thể đến từ phản ứng phân hạch của đơn chất uranium. Uranium tồn tại trong tự nhiên ở hai dạng đồng vị chính: 235U và 238U. Tuy nhiên, chỉ có 235U có thể xảy ra phản ứng phân hạch. Uranium tồn tại trong tự nhiên cần được làm giàu (thường sử dụng máy li tâm khí [như hình bên phải]) để làm tăng phần 235U trong mẫu trước khi sử dụng cho những mục đích như trên. Năng lượng giải phóng của một phản ứng hạt nhân được đo bằng kiloton (1 kiloton = 4.184 ∙ 1012 J). Khi 1 pound (0.45 kg) 235U (khối lượng nguyên tử tương đối = 235.0439) phân hạch hoàn toàn thì năng lượng giải phóng là 8.0 kiloton.
a) Tính năng lượng giải phóng trong phản ứng phân hạch 235U theo kJ mol-1 .
Khối lượng nguyên tử tương đối của uranium được tìm thấy trong vỏ Trái đất là 238.0289. Khối lượng nguyên tử tương đối của đồng vị 238U là 238.0507.
b) Giả sử chỉ có 235U và 238U, tính hàm lượng trong vỏ Trái đất của: i. 235U và ii. 238U.
Để sử dụng trong các vũ khí hạt nhân, một mẫu uranium phải chứa ít nhất 80 % đồng vị 235U. Do giá trị này cao hơn nhiều so với hàm lượng 235U tìm thấy trong vỏ Trái đất nên lượng 235U phải được làm giàu nhân tạo. Quá trình làm giàu đồng vị 235U được tiến hành bằng cách chuyển uranium thành uranium hexafluoride (UF6), là chất khí ở trên 57 oC. Hai dạng chứa đồng vị khác nhau của khí uranium hexafluoride (235UF6 và 238UF6) có thể được tách trong máy li tâm.
c) Tính chất nào của fluorine là then chốt để tách thành công 235UF6 và 238UF6 trong máy li tâm khí.
A. Đơn chất fluorine tồn tại ở dạng phân tử lưỡng nguyên tử.
B. Fluorine chỉ có duy nhất một đồng vị trong tự nhiên.
C. Fluorine có độ âm điện lớn nhất trong tất cả các nguyên tố.
D. Fluorine là chất khí ở nhiệt độ và áp suất thường.
E. Fluorine phản ứng mãnh liệt với đa số kim loại.
UF6 có dạng hình học bát diện.
d) UF6 có phải phân tử phân cực không?
e) 238UF6 nặng hơn 235UF6 bao nhiêu %? Trả lời theo % khối lượng của 235UF6.
Khi mẫu UF6 được làm giàu để đạt tới lượng đồng vị 235U đủ cao, cần phải chuyển trở lại thành kim loại uranium. Trước tiên, xử lí UF6 được xử lí với khí hydrogen để tạo thành uranium tetrafluoride. Sau đó, uranium tetrafluoride được đun nóng với magnesium để tạo thành kim loại uranium.
f) Viết phương trình của: i. phản ứng giữa uranium hexafluoride với hydrogen; ii. phản ứng giữa uranium tetrafluoride với magnesium.
Chuyển hóa quặng uranium thành UF6 là một quá trình phức tạp hơn. Uranium có thể được tìm thấy trong tự nhiên ở dạng oxide U3O8. Có một số cấu trúc tinh thể của U3O8 chứa tất cả cả các nguyên tử uranium ở hai số oxid hóa khác nhau. g) Xác định các số oxid hóa của uranium U3O8 nếu các giá trị này khác nhau:
i. 1 đơn vị. ii. 2 đơn vị.
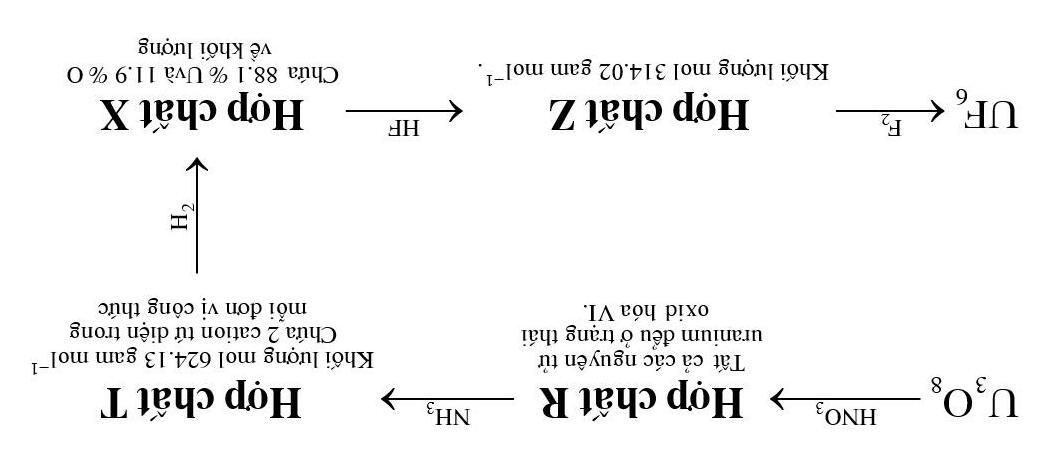
Chuyển hóa U3O8 thành UF6 được biểu diễn trong sơ đồ dưới đây (không phải tất cả các sản phẩm phụ đều được dẫn ra):
|
i. Hợp chất R được tạo thành bởi cation thẳng mang điện tích +2 và anion tam giác phẳng mang điện tích -1. Vẽ cấu trúc của cả hai ion trong R.
ii. Hợp chất T có cấu trúc phức tạp, có thể được xem là tạo thành từ
2 cation tứ diện giống nhau và một phần có tính anion. Vẽ cấu trúc cation tứ diện và xác định công thức phần có tính anion.
iii. Xác định công thức hợp chất X và Z.
Uranium là nguyên tố phóng xạ. Cả đồng vị 235U và 238U đều có phóng xạ alpha. Nguyên tử uranium chuyển thành nguyên tử của một nguyên tố khác bởi sự mất 1 hạt alpha. Hạt alpha là hạt nhân của nguyên tử helium.
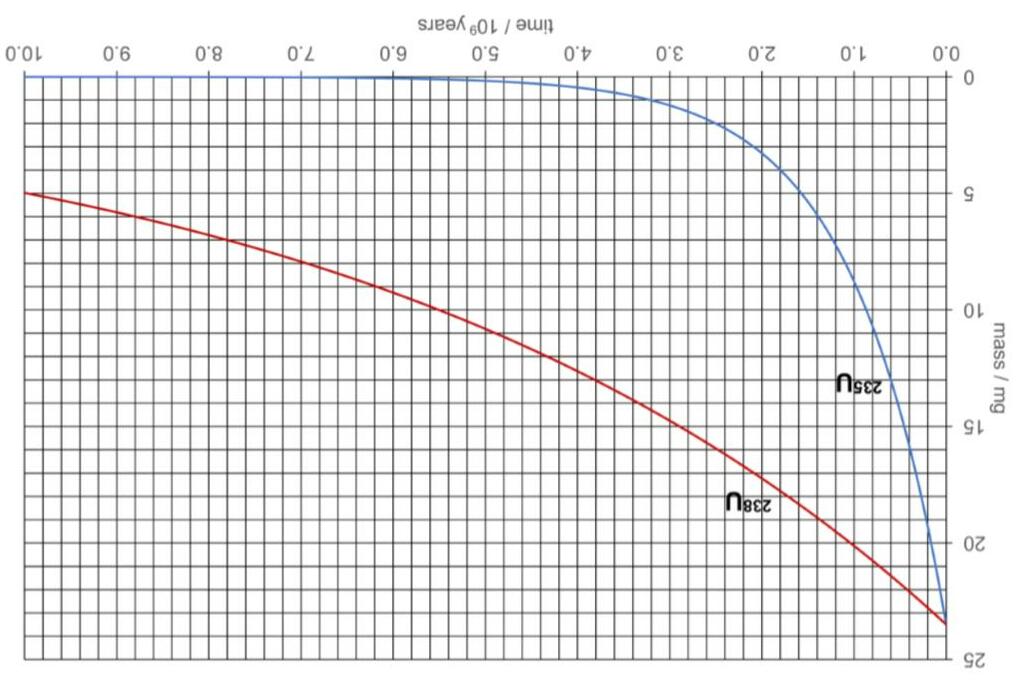
i) Viết phương trình phân rã phóng xạ của 235U và 238U.
235U phân rã nhanh hơn 238U. Nghĩa là một mẫu tồn tại trong tự nhiên của uranium không thể dùng để chế tạo bom nếu như không làm giàu trước. Tốc độ phân rã phóng xạ của một đồng vị có thể được đo bởi chu kì bán rã phóng xạ, t1/2. Đồ thị dưới đây biểu diễn lượng chất của các đồng vị uranium suy giảm theo thời gian.
Phương trình sau đây là liên hệ giữa số nguyên tử phóng xạ, N, còn lại sau thời gian t, với số nguyên tử ban đầu, N0. −λ = t 0 NNe trong đó λ= 1/2
ln2 t Giả sử rằng khi Trái đất được tạo thành, số nguyên tử 235U và 238U bằng nhau.
k) Ước lượng tuổi của Trái đất, sử dụng các kết quả tính toán ở những phần trước.
j) Sử dụng đồ thị, xác định chu kì bán rã của: i) 235U; ii) 238U.
|
G2: Phân rã phóng xạ Phân rã phóng xạ thường gồm một loạt các chuyển hoá, ví dụ 90Sr →90Y
→ X. Dãy phân rã như vậy được kết thúc bởi một hạt nhân (đồng vị) bền. Đồng vị đầu tiên của dãy được gọi là “hạt nhân mẹ”, còn các đồng vị còn lại gọi là “hạt nhân con”.
1) Xác định số hiệu nguyên tử và kí hiệu của đồng vị bền trong ví dụ trên. Cho biết chu kì bán huỷ của hạt nhân mẹ 90Sr là 28 năm, và của hạt nhân con 90Y là 28 giờ. Rõ ràng, T1/2 của hạt nhân mẹ lớn hơn rất nhiều so với hạt nhân con. Trong điều kiện này, cân bằng phóng xạ thế kỉ được thiết lập.
2) Viết dạng tổng quát của biểu thức cân bằng phóng xạ thế kỉ với i đồng vị.
3) Tính độ phóng xạ của mẫu trong trường hợp trên.
4) Độ phóng xạ thay đổi theo thời gian. Dự đoán chu kì bán hủy của dãy 90Sr.
Ở thời điểm t = 0, độ phóng xạ của hạt nhân con trong một mẫu bằng 0. Độ phóng xạ sẽ tăng với sự tích tụ các hạt nhân con 90Y. Độ phóng xạ của hạt nhân con sẽ biến đổi theo phương trình = 1− , trong đó là hằng số phân rã của hạt nhân con.
5) Xác định độ phóng xạ của mẫu (% so với độ phóng xạ cân bằng) ở thời điểm t = T1/2 của hạt nhân con.
6) Cần bao nhiêu chu kì bán huỷ để sự khác biệt giữa độ phóng xạ của mẫu và độ phóng xạ cân bằng thấp hơn 10-3?
7) Vẽ đồ thị biểu diễn sự thay đổi độ phóng xạ của hạt nhân mẹ trong 1 tháng.
8) Cần những giá trị thực nghiệm nào để tính T1/2 của hạt nhân mẹ?
9) Tính T1/2 của hạt nhân mẹ.
10) Sau bao nhiêu giờ, kể từ khi chuẩn bị, thì có thể tiến hành đo mẫu?
11) Zirconium được dùng để xây dựng các lò phản ứng hạt nhân. Một trong những phương pháp tốt nhất để thu được zirconium có độ tinh khiết cao “tinh chế iodine”. Quá trình này được thực hiện trong chân không. Ban đầu, nhiệt độ bình phản ứng được tăng lên 400 oC để thực hiện các phản ứng đốt cháy, sau đó dây kim loại được làm nóng tới 1400 oC. a) Quá trình này sử dụng các chất nào?
b) Những phản ứng nào xảy ra ở 400 oC?
c) Dây kim loại được làm nóng như thế nào?
d) Những phản ứng nào xảy ra ở 1400 oC?
12) Lấy hai ví dụ về các hợp chất có thể được làm sạch bằng phương pháp “tinh chế iodine”.
Một mẫu quặng urani tự nhiên có chứa 99,275 gam 238 92 U; 0,720 gam 235 92 U và 3,372.10-5 gam 226 88 Ra. Cho các giá trị chu kì bán hủy: t1/2( 235 92 U) = 7,04.108 năm, t1/2( 238 92 U) = 4,47.109 năm, t1/2( 226 88 Ra) = 1600 năm. Chấp nhận tuổi của Trái Đất là 4,55.109 năm.
a. Tính tỉ lệ khối lượng của các đồng vị 235 92 U / 238 92 U khi Trái Đất mới hình thành.
b. Nếu chưa biết chu kì bán huỷ của 238 92 U thì giá trị này có thể tính như thế nào từ các dữ kiện đã cho? ( 238 92 U có chu kì bán hủy rất lớn. Vì thế, chu kì bán hủy của nó không thể xác định bằng cách đo trực tiếp sự thay đổi hoạt độ phóng xạ mà dựa vào cân bằng phóng xạ, được thiết lập khi chu kì bán hủy của mẹ rất lớn so với chu kì bán hủy của các con cháu. Ở cân bằng phóng xạ thế kỉ, hoạt độ phóng xạ của mẹ và các con cháu trở thành bằng nhau. Hoạt độ phóng xạ là tích số của hằng số tốc độ phân rã với số hạt nhân phóng xạ).
Bài 17
Có thể ước tính sơ bộ tuổi của Hệ Mặt trời với giả định rằng đó là khi các nguyên tố nặng nhất được tạo thành. Các đồng vị 235U và 238U được tạo ra với lượng bằng nhau, và sau đó tỉ lệ của chúng thay đổi do khác biệt về tốc độ phân rã. Chu kì bán huỷ của 238U là 4.5 ∙ 109 năm, còn 235U là 7 ∙ 108 năm. Hiện nay, cứ 100 gam hỗn hợp đồng vị uranium thì có 99.3 gam 238U và 0.7 gam 235U.
(K. Keller, Hoá học phóng xạ. M: Atomizdat, 1978, trang 179)
1) So sánh tỉ lệ hiện nay giữa 238U và 235U theo gam và mol.
2) Ước tính tuổi của Hệ Mặt trời dựa vào chu kì bán huỷ của các đồng vị uranium.
3) Sử dụng quy luật phân rã phóng xạ, tính các giá trị N0 của mỗi đồng vị uranium trong quá khứ, từ thời điểm 4.5 ∙ 109 năm trước. Sử dụng câu trả lời ở ý 2 làm mốc thời gian cuối cùng. Thay vì No, bạn có thể tính giá trị no và thậm chí mo, do tỉ lệ khối lượng và khối lượng mol của các đồng vị uranium rất gần nhau. Bạn có thể thay N trong phương trình phân rã bởi giá trị được lựa chọn.
4) Biểu diễn đường phụ thuộc của giá trị với chỉ số “o” vào thời gian của mỗi đồng vị uranium trong cùng đồ thị. Giao điểm của các đường phụ thuộc tương ứng với tuổi của Hệ Mặt trời trên trục thời gian. Xác định giá trị thu được.
Thời gian lnno(238U) lnno(235U) lnmo(238U) lnmo(235U) 4.5∙109 0.84 0.26 199 60 -5∙109 0.91 0.42 214 90 5.5∙109 0.98 0.69 231 162 -6∙109 1.05 1.14 249 266
5) Viết công thức của quặng pitchblende mà Marie và Pierre Curie đã sử dụng để phân lập radium. Xác định số oxid hoá của tất cả các nguyên tử trong quặng.
6) Xác định cấu hình electron của các nguyên tử trong quặng, có xét đến số oxid hoá (chỉ viết các electron bên ngoài).
7) Các bình phản ứng hạt nhân cần uranium làm giàu bởi 235U. Viết công thức và cấu tạo của hợp chất được dùng để làm giàu uranium.
8) Để đảm bảo an toàn vận hành cho bình phản ứng hạt nhân, cần sử dụng chất hấp thụ neutron. Chất nào được dùng chất hấp thụ?
9) Xác định công thức hai chất được dùng để làm chậm neutron.
10) Viết phương trình của các phản ứng để thu được chất cần thiết cho quá trình làm giàu uranium từ pitchblende (sử dụng ít giai đoạn nhất).
11) Cho biết công thức và tên gọi của ion U(VI) bền nhất trong dung dịch nước.
18
Cacbon 14 được tạo thành từ nitơ do tác dụng của các nơtron (chậm) trong các tia vũ trụ, rồi đi vào cơ thể sinh vật qua quang hợp và lưu chuyển thực phẩm của động thực vật. 14C phân rã β với thời gian bán huỷ t1/2 = 5730 năm.
a) Viết các phương trình phản ứng hạt nhân biểu diễn quá trình hình thành và phân rã của 14C trong tự nhiên.
b) Sự phân tích cacbon phóng xạ trong các cơ thể sống cho giá trị hoạt độ phóng xạ riêng của cacbon là 230 Bq/kg cacbon.
c) Tỉ lệ đồng vị 14C/12C trong cơ thể sống bằng bao nhiêu? Trong một mẫu hoá thạch hữu cơ, tỉ lệ đồng vị của cacbon trong mẫu này là 14C/12C = 6.10-13 .
d) Tính hoạt độ phóng xạ của 1kg hóa thạch nói trên và cho biết tuổi của mẫu hóa thạch là bao nhiêu?
Cho: điện tích hạt nhân của C, N lần lượt bằng 6 và 7; N = 14; hoạt độ phóng xạ A = λ.N, trong đó λ là hằng số tốc độ phóng xạ, N là số hạt nhân phóng xạ; hoạt độ phóng xạ riêng AS là hoạt độ phóng xạ của một đơn vị khối lượng mẫu phóng xạ; 1 Bq = 1 phân rã/giây; số Avogadro NA = 6,02.1023 .
Cacbon-14, một đồng vị phóng xạ của nguyên tố cacbon, thường được dùng để xác định tuổi (niên đại) các mẫu cổ vật, địa chất, thủy văn. Chu kì bán hủy của 14C là t1/2 = 5730 năm. Song khi xác định niên đại mẫu vật trị thường được sử dụng lại là t1/2 = 5568 năm. 14C được tạo ra trong khí quyển từ nitơ của không khí dưới tác dụng của các tia vũ trụ. Nó đi vào cơ thể thực, động vât thông qua sự quang hợp hoặc dây chuyền thực phẩm. Hàm lượng cacbon phóng xạ trong cơ thể sống gần hằng định với độ phóng xạ 14C là 230 Bq trong 1 kg cacbon. Sau khi cơ thể sinh vật chết đi độ phóng xạ đó bắt đầu liên tục giảm xuống
1. Hãy viết phương trình phản ứng hạt nhân về sự tạo thành và phân rã 14C.
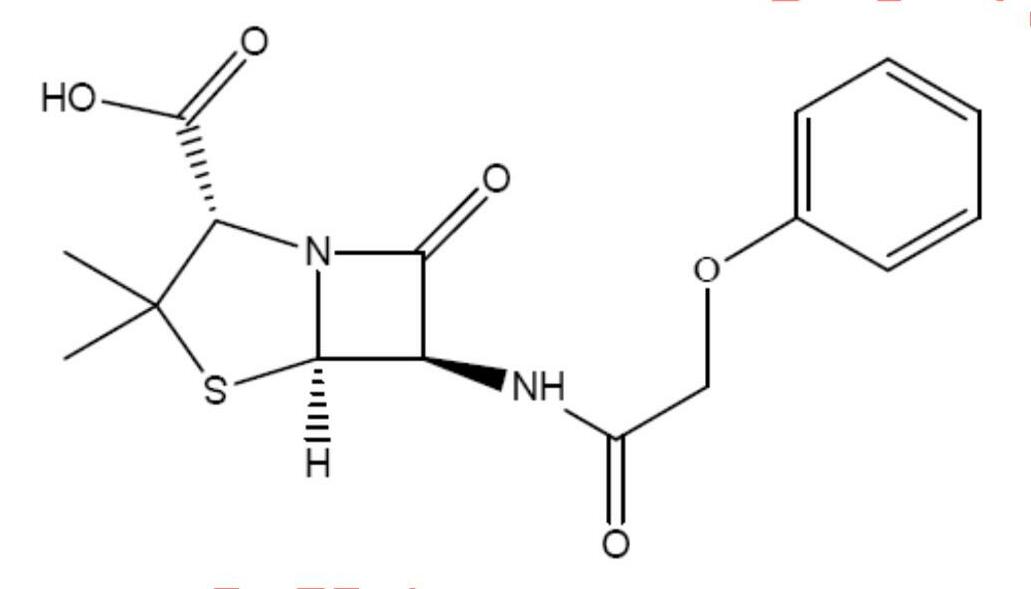
2. Một mẫu vải thời kim tự tháp của Ai cập có độ phóng xạ 14C là 480 phân rã trong 1 giờ trong 1 gam cacbon. Tính tuổi của mẩu vải đó. Người ta tìm thấy trong một kim tự tháp khác một chất bột màu trắng. Kết quả phân tích cho biết đó là phenoxymetylpenexilin nguyên chất (Penecllin V):
3. Nhà khảo cổ đã xác định tuổi của mẫu bột trắng trên theo định luật phân rã phóng xạ. Họ đã xác định được mẫu bột trắng đó bao nhiêu tuổi?
4. Hãy giải thích kết quả này. Thực tế, mẫu bột đó được tạo ra khi nào?
Ghi chú về tài liệu nguồn của các số liệu trên.
Phenoxymetylpenexilin thương mại được tao ra từ các vi sinh vật được cấy trong một môi trường chứa các hiđrat cacbon (lactozơ, glucozơ, xacarozơ), bột ngô nhão (cornsnteep liquor), các muối khoáng và axit phenoxyaxetic.
Để xác định được niên đại của chất bột màu trắng đó ta cần biết hàm lượng thích hợp cabon phóng xạ. Sự đo sắc kí- khối phổ cho kết quả 14C/ 12C tới 6,0.10-23 .
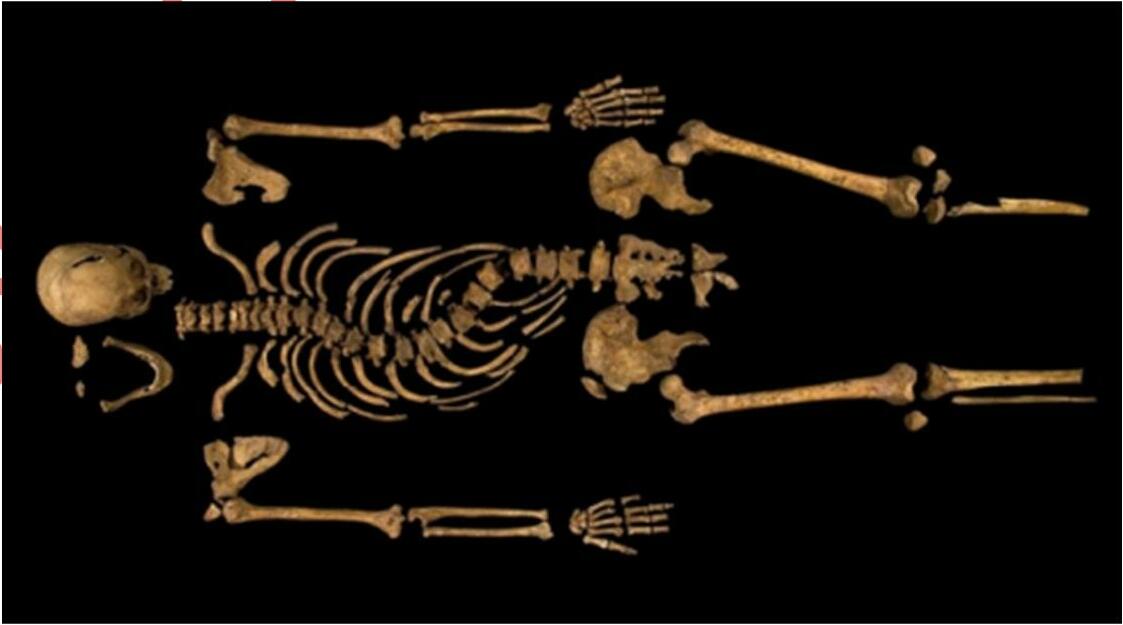
Vua Richard của xứ York đã chiến đấu trong vô vọng và bị giết vào năm 1485. Năm 2015, thi hài của ông đã được chôn cất tại Thánh đường Leicester, sau khi được tìm thấy dưới mảnh đất gần bãi đỗ xe Greyfriars vào năm 2012. Những mảnh xương đã được xác định niên đại từ hàm lượng carbon phóng xạ trong đó.
Những mảnh xương trong thi hài được xem là có khoảng 60 % hydroxyapatite (Ca5(PO4)3(OH)) về khối lượng, và phần còn lại chủ yếu là collagen, một loại protein, có thành phần chủ yếu là các gốc amino acid glycine H2NCH2COOH.
Trong quá trình xác định niên đại bộ hài cốt này bằng carbon phóng xạ, lấy 1.0 gam mẫu từ xương sườn để tiến hành phân tích. Trước tiên, cần xử lý để loại bỏ các thành phần vô cơ. a) Phương pháp nào sau đây hiệu quả nhất để loại bỏ các thành phần vô cơ không mong muốn và giữ lại các thành phần hữu cơ.
A. Rửa với nước, sau đó là với propanone.
B. Nung tới 400 oC.
C. Rửa với HCl loãng, sau đó là với NaOH loãng. Phần hữu cơ còn lại, là protein collagen, có thể được giả định là polyglycine (một polymer được tạo ra chỉ bởi glycine). Đốt cháy polymer này trong oxygen dư, rồi khử sản phẩm chứa carbon trở lại thành than chì bởi hydrogen.
b)
• Vẽ mắt xích của polyglycine.
• Viết phương trình phản ứng đốt cháy polyglycine có n mắt xích.
• Viết phương trình phản ứng tạo thành than chì từ sản phẩm chứa carbon.
• Tính khối lượng than chì thu được từ 1.0 gam mẫu xương. Phương pháp xác định niên đại carbon phóng xạ dựa vào sự tồn tại của 3 đồng vị carbon: 12C, 13C và 14C. Hai đồng vị nhẹ hơn thì bền, còn 14C có tính phóng xạ với chu kì bán rã 5568 năm. Hàm lượng chuẩn của 3 đồng vị này trong mẫu ở thời điểm xảy ra cái chết là 98.93 % - 1.07 % - 1.215×10-10 % c) Trong 2.0 mg mẫu phân tích ở thời điểm xảy ra cái chết, trung bình có bao nhiêu nguyên tử 14C phân rã mỗi ngày? Một kĩ thuật chính xác hơn, thay vì đếm tốc độ phân rã thực tế, là xác định tỉ lệ 12C, 13C và 14C bằng cách đếm số nguyên tử trong những khối lượng cụ thể bằng phổ khối.
Tỉ lệ 12C : 14C trong mẫu xương được xác định là 1:1.154×10-12 .
d) Sử dụng những dữ kiện này, xác định tuổi của bộ xương và từ đó xác định thời điểm qua đời của người đàn ông này. Thời điểm tiến hành thí nghiệm được sử dụng trong khoảng 2012-2016.
Cacbon tự nhiên chứa 2 đồng vị bền: 12C (98,9% khối lượng) và 13C (1,1% khối lượng) cùng lượng vết đồng vị phóng xạ 14C (phân rã β , chu kì bán rã
1 2 t = 5730 năm). Hoạt độ phóng xạ riêng của cacbon trong cơ thể sống là
230Bq.kg-1. Năm 1983, người ta tìm thấy một con thuyền cổ chìm ngoài khơi Đại Tây Dương. Cacbon trong gỗ của con thuyền này có hoạt độ phóng xạ riêng là 180Bq.kg-1 .
a) Tỉ lệ số nguyên tử giữa các đồng vị 13C/12C và 14C/12C trong cơ thể sống là bao nhiêu?
b) Cây để dùng làm gỗ đóng thuyền trên được đốn hạ vào năm nào?
c) Giả thiết, 180Bq.kg-1 là trị số trung bình của các giá trị đo được, còn sai số trung bình trong việc đo hoạt độ phóng xạ của cacbon trong mẫu gỗ nói trên là ±1,3%. Cho biết cây được đốn hạ trong khoảng thời gian từ năm nào đến năm nào?
Các đồng vị cơ bản và hàm lượng tự nhiên của chúng không chỉ giúp xác định giá trị khối lượng nguyên tử mà còn là cơ sở quan trọng để phân tích tuổi khoáng vật và nghiên cứu cơ chế phản ứng.
1) Biết rằng Cl có 2 đồng vị, 35Cl và 37Cl, với tỉ lệ hàm lượng là 0.75:0.25; Rb có 85Rb và 87Rb, và tỉ lệ hàm lượng là 0.72 và 0.28.
a) Viết công thức các phân tử RbCl với các thành phần đồng vị khác nhau ở trạng thái khí.
b) Tính số khối các phân tử này và tỉ lệ của chúng.
2) Xác định tuổi là một yêu cầu quan trọng trong địa chất học. Phương pháp Lu-Hf là một phương pháp mới, được đưa ra từ thập niên 1980 với sự phát triển của phổ phát xạ plasma và phổ khối. Lu có 2 đồng vị tự nhiên: 176Lu và 177Lu; Hf có 6 đồng vị tự nhiên với số khối từ 176181. 176Lu bị phân rã beta tạo thành 176Hf với chu kì bán hủy 3.716∙1010 năm. 177Hf là đồng vị bền và không có nguồn phóng xạ. Các nhà địa chất học nhận được một mẫu đá và lấy nhiều mẫu nhỏ từ các phần khác nhau của mẫu gốc để tiến hành phân tích. Dữ liệu từ hai nhóm như sau: tỉ lệ nguyên tử của mẫu 1, 176Hf/177Hf = 0.28630, 177Lu/177Hf = 0.42850; còn mẫu 2, 176Hf/177Hf = 0.28239, 177Lu/177Hf = 0.01470.
(Biết rằng với phản ứng bậc-nhất, mối liên hệ giữa nồng độ tiểu phân c và thời gian t là: == kt 0 0
c cce hayln-kt c , trong đó c0 là nồng độ ban đầu.)
a) Viết phương trình hạt nhân của phản ứng phân rã beta của 176Lu. b) Tính hằng số tốc độ phân rã 176Lu. c) Tính tuổi mẫu đá. d) Tính tỉ lệ 176Hf/177Hf khi đá được tạo thành.
Một trong các phương pháp xác định tuổi của các vật thể địa chất dựa vào phản ứng phân rã hạt nhân của đồng vị K-40. Đồng vị này chuyển hóa song song thành Ca-40 và Ar-40 với chu kì bán rã T1 = 1.47⋅109 năm và T2 = 1.19⋅1010 năm.
1) Viết phương trình các phản ứng hạt nhân. Để xác định tuổi của đá, người ta nung chảy nó trong chân không và xác định lượng argon sinh ra.
2) Vì sao sử dụng argon mà không phải calcium?
Trong phản ứng phân rã song song, khối lượng chất thay đổi theo thời gian theo phương trình: 12 (kk)tm(t)m(0)e−+ =⋅
trong đó k1 và k2 là các hằng số phân rã mỗi phản ứng song song, e ≈ 2.72 là cơ số của logarit tự nhiên. Hằng số tốc độ phản ứng liên hệ với chu kỳ bán rã theo phương trình: = ln2 k T
3) Tính chu kì bán rã tổng của K-40 của cả 2 phản ứng.
4) Trong các phản ứng song song, lượng chất phân rã trong một phản ứng nào đó tỉ lệ nghịch với chu kì bán rã tương ứng. Bao nhiêu nguyên tử trong số 100 nguyên tử K-40 bị phân hủy thành argon?
5) Cho rằng tuổi Trái đất là 5 triệu năm, hãy xác định thể tích argon ở điều kiện tiêu chuẩn được tạo thành từ kali trong suốt thời gian tồn tại của Trái đất. So sánh với thể tích argon trong khí quyển, biết rằng nồng độ argon trong không khí bằng 1%. Bao nhiêu phần argon có nguồn gốc phóng xạ? Hàm lượng kali-40 hiện tại là 0.0119 % tổng lượng kali. Phần trăm khối lượng của kali trong vỏ Trái đất là 1.5%. Khối lượng của vỏ Trái đất là 5⋅1022 kg. Thể tích của khí quyển Trái đất là 40 tỉ km3 .
6) Vào năm 1959 ở hèm núi Olduvai Gorge (Tanzania) người ta tìm thấy hài cốt của người nguyên thủy, tổ tiên xa xưa nhất của loài người hiện đại. Mẫu hài cốt được nung chảy. Từ 1000 g mẫu có chứa 3.24% kali theo khối lượng giải phóng ra 5.9⋅1015 nguyên tử argon. Xác định tuổi của hài cốt.
Hoá học đồng vị có nhiều ứng dụng hữu ích khác nhau trong các lĩnh vực khoa học và công nghiệp. Ví dụ, các đồng vị được dùng để nghiên cứu cơ chế, động học phản ứng, các quá trình xúc tác, sự khuếch tán, sự hấp phụ, … Trong lĩnh vực địa chất học, các đồng vị được ứng dụng để định tuổi đất đá và các vật thể khác, như đá thiên thạch. Một trong những phương pháp như vậy, sử dụng các đồng vị samarium và neodymium, được phát triển bởi Langmar vào năm 1974. Số mol 143Nd tăng lên, do 147Sm phân rã (T1/2 = 1.06∙1011 năm), từ giá trị số mol n0(143Nd) ban đầu - ở thời điểm hình thành vật thể. Số mol 144Nd không thay đổi trong thời gian này, cho phép xác định tuổi của mẫu phân tích bằng cách đo các tỉ lệ 143Nd/144Nd và 147Sm/144Nd bằng phổ khối lượng. Một thiên thạch có tên Moama đã được phát hiện tại Úc vào năm 1940. Các nhà nghiên cứu tinh rằng tuổi của mẫu thiên thạch này ngang với tuổi của hệ Mặt trời. Năm 1978, hai khoáng chất được chiết xuất từ Moamaplagioclase và pyroxene - đã được đem phân tích: Khoáng n(143Nd) / n(144Nd) n(147Sm) / n(144Nd) plagioclase 0.510 0.111 pyroxene 0.515 0.280
1) a) Viết phương trình phân rã của 147Sm; b) Xác định hằng số phân rã.
2) Xác định tỉ lệ n0(143Nd) / n0(144Nd) ở thời điểm tạo thành thiên thạch. Hãy nhớ rằng tỉ lệ n0(143Nd) / n(144Nd) trong cả hai khoáng chất này bằng nhau.
3) Tính tuổi thiên thạch Moama.
4) Nếu có thể, hãy dùng phương pháp Langmar để xác định tuổi của những loại đá được tạo thành từ 3-5 thiên nhiên kỉ trước công nguyên.
Chủ tịch Chính quyền Quốc gia Palestin, chủ nhân giải Nobel Hoà bình Y.
Arafat đã đột ngột qua đời vào năm 2004. Theo lời khẳng định của người vợ goá, thi thể Y. Arafat đã được khai quật vào năm 2012 và tách các mẫu mô để tiến hành phân tích. Kết quả cho thấy nguyên nhân cái chết của Y.
Arafat là do bị đầu độc phóng xạ bởi một chất chứa đồng vị X
Số hạt α bức xạ trong một đơn vị thời gian bởi 1.00 mg mẫu (T1/2 = 138.4 ngày) và 4.55 gam 226Ra (T1/2 = 1601 năm) là giống nhau.
1) Viết phương trình phân rã phóng xạ của đồng vị 226Ra.
2) Tính khối lượng mol của X.
3) Khi nào thì việc hành khai quật cơ thể của Y. Arafat (70 kg) sẽ trở nên vô nghĩa do sự giảm độ phóng xạ α riêng của mô sinh vật lên tới 0.3 Bq/kg không? Nếu biết
a) liều lượng gây tử vong tối thiểu của X là 1 μg; b) theo tiêu chuẩn, độ phóng xạ α riêng (Aα) của cơ thể người (70 kg) là 0.2 Bq/kg; giá trị này không thay đổi trong nhiều năm; c) một đồng vị không phóng xạ được tạo thành từ X khi phân rã α.
Tỉ lệ số neutron/proton (N/Z) trong X bằng 1.50.
4) Xác định X
Hơn 90 % lượng X được tạo ra ở Nga. Đồng vị 209Bi được dùng làm mục tiêu trong quá trình sản xuất 1 giai đoạn để tạo ra X.
5) Viết các phương trình có thể có (về mặt lí thuyết) của các phản ứng hạt nhân nếu khối lượng tổng của tất cả các hạt còn lại (trừ X và 209Bi) trong phản ứng là không vượt quá 1 amu. Một mẫu chất X có thể tích 1 cm3 (ρX = 9.2 g/cm3) giải phóng nguồn năng lượng đáng kể trên mỗi đơn vị thời gian (1210 W), ngang với một chiếc bàn ủi điện. Đây là nguyên nhân đằng sau tính kịch độc của X với các cơ thể sống.
6) Tính động lượng đầu (theo MeV) của hạt α được tạo thành từ phân rã của X, giả sử rằng động lượng chuyển hoá hoàn toàn thành nhiệt lượng (1 eV = 1.6∙10-19 J).
Tuổi của mẫu đá mà con tàu Apollo 16 lấy từ mặt trăng đã được xác định từ các dữ kiện về tỉ lệ 87Rb / 86Sr và 87Sr / 86Sr của các loại khoáng khác nhau có trong mẫu đá. Khoáng 87Rb / 86Sr 87Sr / 86Sr
A (Plagioclase) 0.004 0.699
B (Quintessence) 0.180 0.709
a) 87Rb phân rã β, viết phản ứng phân rã này. Chu kỳ bán hủy của phân rã này là 4.8 × 1010 năm.
b) Tính tuổi của mẫu đá. Bạn có thể giả sử rằng tỉ lệ 87Sr / 86Sr ban đầu là như nhau trong cả A và B, 87Sr lẫn 86Sr đều bền vững.
Bài 27
Poloni ( 210 84 Po) thuộc họ phóng xạ urani - radi có chu kỳ bán rã 138,38 ngày.
1) Tính khối lượng 210 84 Po có trong 1kg urani tự nhiên. Cho chu kỳ bán rã của 238 92 U bằng 4,47.109 năm và 238 92 U chiếm 99,28% khối lượng của urani tự nhiên.
2) 210 84 Po phân rã α, tạo thành đồng vị bền 206 82 Pb. Cho rằng hạt nhân 210 84 Po đứng yên, năng lượng phân rã chuyển hóa hoàn toàn thành động năng của hạt nhân chì và hạt α, làm cho hạt nhân 206 82 Pbchuyển động giật lùi với vận tốc vL, còn hạt α chuyển động về phía trước với vận tốc vα Biết khối lượng mol của 210 84 Po bằng 209,982864 g.mol-1; của 206 82 Pbbằng 205,974455 g.mol-1, của 4 2He bằng 4,00260325 g.mol-1. Tính tốc độ đầu của hạt α với độ chính xác đến hai chữ số có nghĩa.
3) Là nguồn phát α mạnh, 210 84 Pođã được đặt trong các tàu tự hành đổ bộ lên Mặt Trăng để tạo ra nguồn cung cấp năng lượng sưởi ấm các thiết bị trong những đêm Mặt Trăng lạnh giá. Tính công suất phát nhiệt ban đầu (ra Watt) của một nguồn chứa 1 g 210 84 Po. Cho rằng 100% động năng của các hạt α được hấp thụ để chuyển thành nhiệt.
4) Tính công suất phát nhiệt trung bình (J/s) trong thời gian 138,38 ngày của nguồn ban đầu chứa 1g 210 84 Po
|
Bài 1
1) Thực hiện phản ứng giữa hydroxylamine và nitrous acid với nguyên tử nitrogen đánh dấu đồng vị (N*) trong các môi trường khác nhau: NH2OH + HN*O2 → A + H2O NH2OH + HN*O2 → B + H2O Phản ứng dehydrate hóa A, B có thể tạo thành N2O, từ A tạo thành N*NO và NN*O, còn B chỉ tạo thành NN*O. Hãy xác định công thức Lewis của A và B.
2) Viết công thức Lewis và dạng hình học của các phân tử và ion sau: BCl3, CO2, NO2 +, NO2, IF3
Bài 2
Khi tổng nồng độ boron trong dung dịch boric acid và các muối của nó ≥ 0.4 mol L-1 thì không chỉ có sự tồn tại của các tetraborate ion B4O5(OH)4 2mà còn có các pentaborate ion với điện tích -1 và 2 triborate ion với điện tích -1 và -2. Trong các borate ion và những sản phẩm ngưng tụ với B(OH)4 , thì các nguyên tử boron được liên kết trong vòng lặp B-O-B.
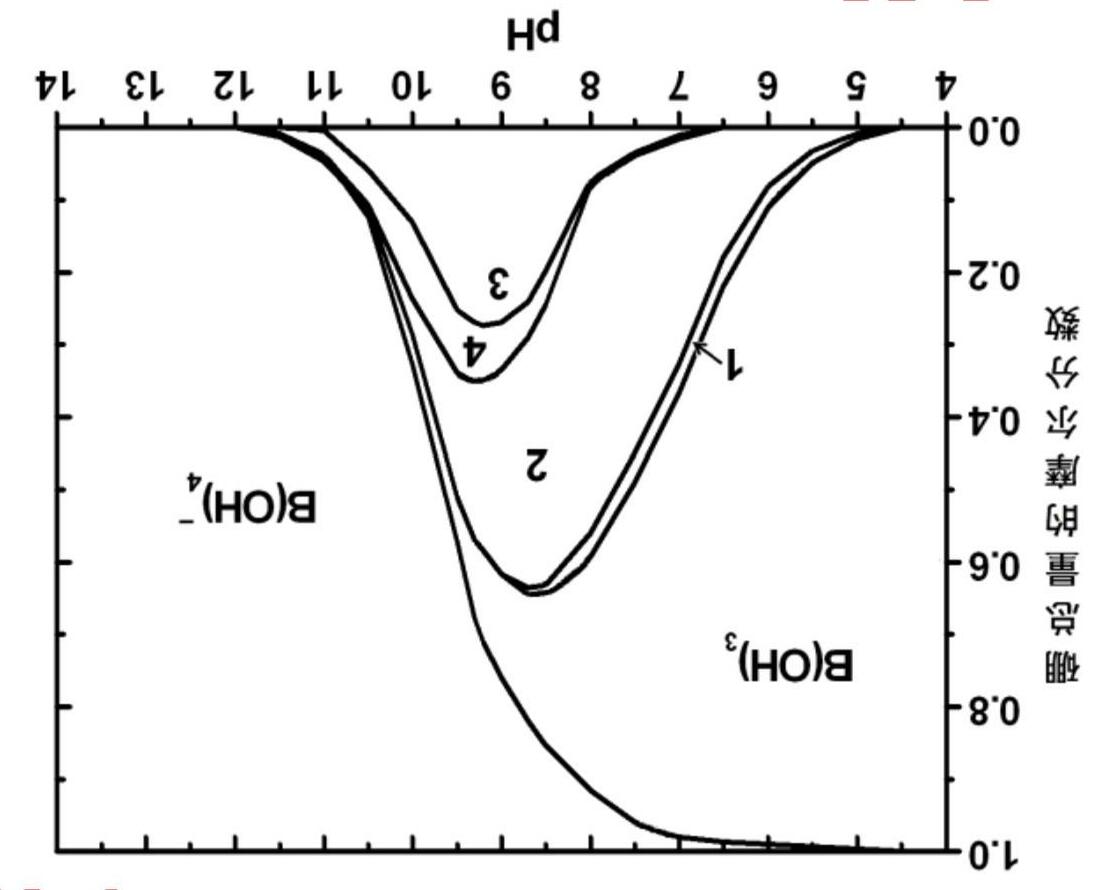
1) Trong pentaborate ion, chỉ có 3 loại boron với môi trường hóa học khác nhau. Hãy vẽ cấu trúc của ion này.
2) Đồ thị dưới đây của hệ boric acid-borate - có tổng nồng độ boron 0.4 mol L-1 - biểu diễn vùng tồn tại của các dạng polyborate ion 1, 2, 3, 4 theo pH.
|
Hãy xác định công thức của các polyborate ion 1 - 4. Chú ý: Lấy công thức B4O5(OH)4 2- làm ví dụ để biểu diễn công thức của 3 polyborate ion còn lại. Cho biết tốc độ ngưng tụ để tạo thành các tiểu phân này gần như là giống nhau. Phản ứng ngưng tụ không làm thay đổi số phối trí của các nguyên tử boron.
Chuyên đề 3: Cấu tạo phân tử - Liên kết hóa học
Phân tử NH3 có dạng hình chóp tam giác đều (nguyên tử N ở đỉnh hình chóp). Ion NH4 + có dạng hình tứ diện đều (nguyên tử N nằm ở tâm của tứ diện đều). Dựa vào sự xen phủ của các obitan, hãy mô tả sự hình thành các liên kết trong phân tử NH3 và ion NH4 +
Bài 4
1) Tại sao bo triclorua tồn tại ở dạng monome (BCl3) trong khi nhôm triclorua lại tồn tại ở dạng dime (Al2Cl6)?
2) Số phối trí của các nguyên tử bismuth trong Bi2Cl8 2- ion là 5 và các phối tử có tạo thành 1 hình tứ diện. Vẽ cấu trúc của ion và xác định trạng thái lai hóa của Bi.
Xe (C6H5)2Xe
I+ [I(C6H5)2]+
3) Xác định trạng thái lai hóa của các nguyên tử trung tâm trong các cấu trúc sau: FF F F F I [(C6H5)IF5]
Tò mò là một trong những động lực cố hữu để thúc đẩy sự phát triển của khoa học. P2O3 và P2O5 là hai hợp chất cổ điển, với cấu trúc đã được xác định. Dĩ nhiên, câu hỏi sau sẽ tự động nảy sinh: Còn hợp chất nào chứa oxygen và phosphorus ngoài chúng không? Kết quả là, các nhà hóa học đã tổng hợp và xác nhận sự tồn tại của các hợp chất khác tồn tại như những chất trung gian của các chất này.
1)
a) Viết công thức phân tử của 3 hợp chất trung gian như vậy.
b) Vẽ công thức cấu tạo của một phân tử với trục quay (đối xứng) bậc 2. Chia các liên kết P-O thành từng nhóm khác nhau về độ dài liên kết và đánh số các nhóm (những liên kết có độ dài bằng nhau thì đánh số giống nhau). So sánh góc liên kết của O-P(V)-O và OP(III)-O.
2) Khi phân tử NH3 tồn tại độc lập, góc liên kết H-N-H là khoảng 106.7o . Dưới đây là cấu trúc của [Zn(NH3)6]2+ ion và các giá trị góc liên kết HN-H đo được. Giải thích tại sao góc liên kết H-N-H trong phức chất lại tăng lên 109.5o .
Bài
Hiện tượng “vòng nâu” (brown ring) là một trong những cách để xác định ion NO3 . Cho dung dịch chứa cần kiểm tra vào ống nghiệp, thêm FeSO4 vào, trộn đều, sau đó nhỏ sulfuric acid đặc vào dọc theo ống nghiệm thì xuất hiện “vòng nâu” ở mặt phân cách của dung dịch. Tách lớp chất màu nâu, kết quả phân tích cho thấy công thức hóa học là [Fe(NO)(H2O)5]SO4 Hợp chất này thuận từ, moment từ là 3.8 μB (Bohr), và các electron không phân bố quanh ion trung tâm.
1) Viết phương trình phản ứng tạo thành “vòng nâu”.
2) Xác định cấu hình electron hóa trị, trạng thái spin (cao hay thấp) và số oxid hóa của ion trung tâm.
3) Độ dài liên kết N-O trong vòng nâu dài hay ngắn hơn liên kết N-O trong phân tử NO?
3) Sử dụng tính toán hóa lượng tử để dự đoán sự tồn tại của các hợp chất chưa biết là một trong những hướng phát triển của hóa học hiện đại. Tháng 2/2016, một số nhà khoa học đã dự đoán rằng tetraoxide của sắt có tồn tại và dạng hình học là tứ diện. Tuy nhiên, số oxid hóa của sắt trong phân tử này là +6, thay vì +8.
a) Viết cấu hình electron của sắt trong phân tử này.
b) Vẽ cấu trúc phân tử này, sử dụng các khối cầu biểu diễn nguyên tử.
1) Trong tinh thể ammonia, mỗi nguyên tử H trong phân tử ammonia lại tham gia tạo thành một liên kết hydrogen. Mỗi nguyên tử N liên kết với bao nhiêu nguyên tử hydrogen? Mỗi mol ammonia rắn có bao nhiêu mol liên kết hydrogen? Tinh thể ammonia sẽ chìm hay nổi trong ammonia lỏng?
2) P4S5 là một phân tử đa diện. Mặc dù các đa giác trong cấu trúc không phẳng nhưng vẫn tuân theo định luật Euler. Lớp vỏ cộng hóa trị của cả các nguyên tử thỏa mãn quy tắc bát tử và số oxid hóa của S là -2. Vẽ cấu trúc của phân tử.
Bài 8
a) Viết cấu hình electron của manganese. Đồ thị dưới đây biểu diễn 10 giá trị năng lượng ion hóa đầu tiên của Mn(g).
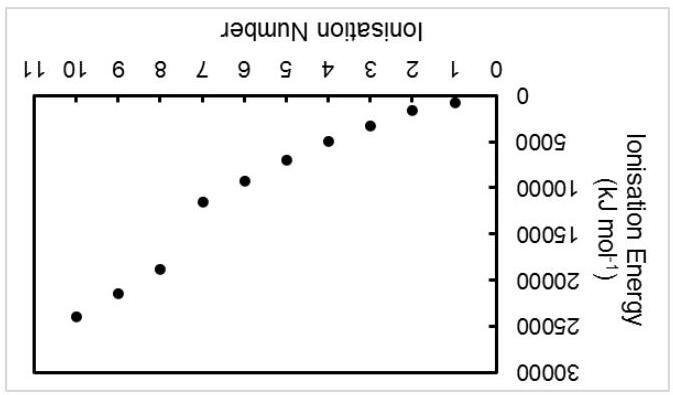
b)
i. Dự đoán số oxid hóa cao nhất có thể có của manganese trong các hợp chất.
ii. Giải thích ngắn gọn cho câu trả lời trên.
Potassium permanganate chứa MnO4 oxyanion, với các liên kết cộng hóa trị giữa manganese và oxygen.
c)
i. Vẽ công thức Lewis để biểu diễn các liên kết trong MnO4 ion, chỉ biểu diễn electron ở lớp vỏ ngoài của các nguyên tử.
ii. Dự đoán góc liên kết trong MnO4 .
|
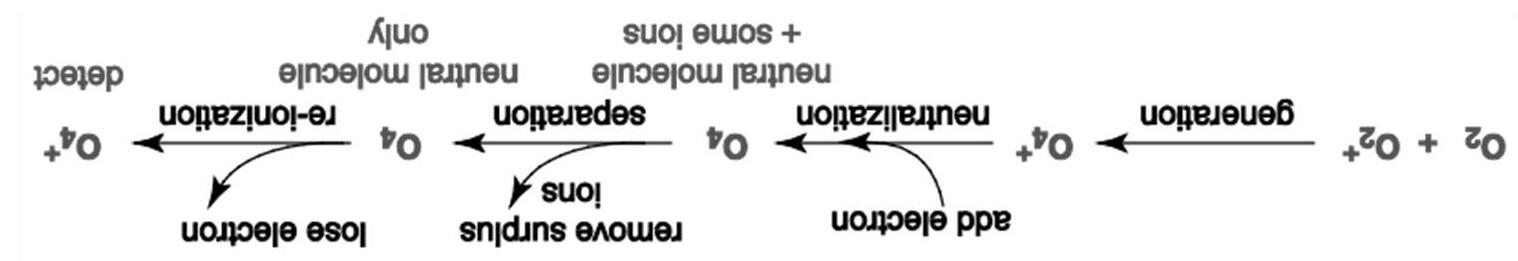
Một số loại nước uống thể thảo xuất hiện ở thị trường Mỹ được nhà sản xuất tuyên bố là có chứa oxygen hoà tan ở dạng phân tử O4. Thông tin từ website của một công ty tuyên bố rằng: Oxygen được làm bền bởi quá trình do chúng tôi sáng chế, trộn lẫn nước, oxygen và các chất khoáng với nhau, thay đổi phân tử O2 kém bền để tạo ra O4 bền hơn.
Bất chấp những tuyên bố có phần ảo tưởng của các nhà sản xuất, dạng bền nhất của oxygen vẫn là O2. Chất này được nhà Hoá học Thuỵ Điển Carl Wilhelm Scheele điều chế lần đầu tiên vào khoảng năm 1770 bằng cách nung nóng các chất khác nhau - gồm thuỷ ngân(II) oxide, bạc(I) carbonate, potassium nitrate, hoặc hỗn hợp sulfuric acid đặc và manganese(IV) oxide - và thu khí vào một quả bóng.
a) Viết các phương trình phản ứng trong quá trình tổng hợp oxygen của Scheele bằng cách nung nóng các chất hoặc hỗn hợp sau. Trong mỗi phương trình, hãy gạch chân nguyên tố bị khử.
i. mercury(II) oxide

ii. silver(I) carbonate
iii. potassium nitrate(V) [sản phẩm có chứa nitrate(III) ion]
iv. sulfuric acid đặc và manganese(IV) oxide.
Dưới đây là công thức Lewis của nitrate ion, NO3 . Có một số tiểu phân khác được xem là đẳng điện tử với NO3 . Các tiểu phân như vậy có dạng hình học giống với NO3 , có tổng số electron giống NO3 với các electron được sắp xếp tương tự, nhưng một hoặc nhiều hạt nhân đã bị thay thế bởi hạt nhân của các nguyên tố khác.
b) Sử dụng các kí hiệu như trên và chú ý mọi electron dư ra, dẫn tới biến đổi điện tích toàn phân tử, hãy xác định công thức phân tử và vẽ công thức Lewis của các tiểu phân đẳng điện tử với NO3 , trong đó nguyên tử nitrogen trung tâm đã bị thay thế bởi i. Carbon ii. Boron iii. Oxygen
c) Xác định công thức phân tử và tên gọi của các tiểu phân trung hoà điện, đẳng điện tử với NO2 .
Mặc dù công ty này cho rằng O4 của họ tồn tại ở dạng vòng lệch phẳng (puckered ring), nhưng các cấu trúc hình học khác cũng đã được đề xuất, gồm có cả một cấu trúc gọi là “chong chóng” (pinwheel - xem hình). Theo tính toán, cấu trúc phẳng có mức năng lượng cao hơn cấu trúc vòng lệch phẳng 83.9 kJ.mol-1. Trong mỗi cấu trúc, độ dài liên các liên kết đều bằng nhau. Theo tính toán, enthalpy tạo thành chuẩn của O4 chong chóng là 480.0 kJ.mol-1
d) Cho biết năng lượng hoạt hoá của quá trình phân li liên kết của O4 lệch phẳng thành 2O2 (g) là 48.7 kJ.mol-1, sử dụng giản đồ hoặc cách làm khác, tính năng lượng hoạt hoá của quá trình tạo thành vòng O4 lệch phẳng từ O2 (g).
Các nhà nghiên cứu có thể phát hiện phân tử O4 bằng sử dụng kĩ thuật phổ khối lượng trung hoà-ion hoá lại (NR-MS)1. Trong kĩ thuật này, các ion O4 + bền hơn một chút đã được tạo thành bởi va chạm giữa phân tử O2 và ion O2 +. Một số ion O4 + tạo thành đã được trung hoà bằng cách nhận thêm 1 electron. Mọi tiểu phân mang điện đều đã được loại bỏ khỏi hỗn hợp bởi sự lệch hướng, để lại một dòng phân tử O4 trung hoà điện. Sau đó, các phân tử này lại được ion hoá lại bằng cách loại bỏ 1 electron và mọi ion O4 + và sản phẩm phân huỷ của chúng đã được phát hiện. Quá trình này được tóm tắt như sau:
1 Neutralization-reionization mass spectrometry
Trong một thí nghiệm, ion O4 + đã được điều chế từ một hỗn hợp 16O2 và 18O2 tinh khiết. Ion tạo thành có công thức là 16O2 18O2 +. Dưới đây là khối phổ sau cùng:
gian để sau khi tạo thành nó di chuyển một khoảng cách trong thiết bị trước khi bị ion hoá lại.
g) Tính thời gian gần đúng (theo giây) để phân tử 18O4 di chuyển quãng đường 10.0 cm trong thiết bị nếu ban đầu nó được gia tốc đến động năng 4.00 keV. Cho biết: 1 eV = 1.602 × 10-19 J; Avogadro constant = 6.022 × 1023 mol-1 ; Động năng (k.e) của một hạt có khối lượng m đang di chuyển với vận tốc v được tính theo công thức k.e. = ½ m v2
e) Xác định công thức phân tử (chỉ rõ các đồng vị) của các ion A, B, C. f) (Những) dạng hình học nào sau đây của O4 là phù hợp nhất với dữ liệu từ kết quả đo NR-MS?
Các nhà nghiên cứu đã kết luận rằng phân tử O4 không bền, mà giả bền2 , nghĩa là nó tồn tại khá ngắn nhưng vẫn ở dạng phân tử. Thời gian tồn tại cực tiểu được tính từ thời gian bay của phân tử trung hoà, nghĩa là thời
[B7H7]2- có cấu trúc lưỡng tháp đáy ngũ giác (cấu trúc dưới đây, không biểu diễn các nguyên tử H) với 10 mặt tam giác. Có hai loại nguyên tử B; 2 trục (axial, kí hiệu ax) và 5 biên (equatorial, kí hiệu eq). Dạng arachno của lưỡng tháp đáy ngũ giác thì bị thiếu mất 2 đỉnh (nguyên tử).
Bài 11
a) Vẽ 1 công thức Lewis và cấu trúc ba chiều của mỗi tiểu phân 3 nguyên tử sau:
i. Cyanamide (NCN2-)
ii. Sulfur dioxide (SO2)
iii. Nitrogen dioxide (NO2)
iv. "Điện tích hình thức" là số electron hóa trị trong nguyên tử, trừ đi số electron không tham gia liên kết và số liên kết của nguyên tử trong công thức Lewis. Xác định điện tích hình thức trên các nguyên tử của SO2 trong ý ii.
b) Sắp xếp NCN2-, SO2 và NO2 theo thứ tự tăng dần góc liên kết.
c) Khi nhận thêm 2 proton thì cyanamide, NCN2-, tạo ra một sản phẩm trong đó có các nguyên tử nitrogen khác nhau. Vẽ công thức Lewis cho sản phẩm bạn đề xuất.
Trong cluster (cụm) [B4NH5]4-, 1 nguyên tử B đã bị thay thế bởi 1 nguyên tử N, được dự đoán có cấu trúc lưỡng tháp đáy ngũ giác dạng arachno. Vẽ cấu trúc tất cả các đồng phân có thể có của ion này. Lưu ý rằng nếu cả hai đỉnh bị mất đều ở vị trí biên thì chúng phải ở cạnh nhau.
d) Trong phân tử axetamit, 3 liên kết với nguyên tử nitơ đều nằm trong cùng một mặt phẳng. Vì sao?
|
Gần đây người ta tìm ra mội loại hợp chất mới, đầy hứa hẹn để là nhiên
liệu cho động cơ tên lửa đẩy. Hợp chất đó là amoni đinitroamit NH4N(NO2)2
a) Viết các công thức Lewis cho anion 22N(NO) và các dạng cộng hưởng bền nhất của nó. Giả thiết các nguyên tử trong anion này đều nằm trong một mặt phẳng.
b) Khi nổ, phân tử amoni đinitroamit NH4N(NO2)2 có thể bị phân hủy thành khí nitơ, hơi nước và khí oxi. Viết phương trình hóa học và tính hiệu ứng nhiệt của phản ứng đó.
Cho biết: Liên kết N H N N N=H N O N=O N≡N H O O=O Năng lượng (kJ.mol-1) 391 160 418 201 607 914 467 495
Bài 13
1) Hãy viết công thức Lewis của hai ion NO2 + và NO2 . Dựa vào thuyết lực đẩy của các cặp electron hóa trị (VSEPR), hãy xác định dạng hình học của hai ion này. So sánh độ bền liên kết giữa N và O trong hai ion trên.
2) Điền độ dài liên kết O-O của O2, KO2, BaO2, O2[AsF6] vào các ô trống tương ứng. Độ dài liên kết O O 112 pm 121 pm 128 pm 149 pm Hợp chất
3) Độ bền liên kết, độ bội liên kết và độ dài liên kết liên quan với nhau như thế nào? Hãy sắp xếp các chất CH3OH, HCHO, HCOO theo chiều tăng dần độ bền liên kết giữa cỏc nguyên tử C và O.
|
Thực nghiệm cho biết, NH3 phản ứng với BF3 tạo ra một chất rắn X duy nhất, có màu trắng.
a) Viết phương trình hóa học của phản ứng. Cho biết phản ứng đó thuộc loại nào. Tại sao?
b) Viết công thức Lewis của mỗi phân tử trong phản ứng trên. Cho biết dạng hình học của mỗi phân tử đó theo thuyết VSEPR (thuyết về sự đẩy giữa các cặp electron ở lớp vỏ hóa trị).
c) Dự đoán giá trị của góc liên kết trong phân tử chất X.
Bài 15
a) Ở nhiệt độ phòng CO2 là một chất khí, còn SiO2 là chất rắn có nhiệt độ nóng chảy rất cao?
b) Nitơ chỉ tạo được hợp chất NF3, nhưng không tạo được hợp chất NF5, trong khi đó photpho tạo được hợp chất PF3 và PF5? Cả NF3 và PF3 đều có cấu tạo tháp tam giác, còn PF5 có cấu tạo lưỡng chóp tam giác.
|
Cuối thế kỷ 19, người ta nhận thấy rằng khi phóng điện hoặc nung nóng cacbon monoxit đến khoảng 550oC thì thu được một hỗn hợp khí gọi là “oxicacbon”. Hợp chất cacbon suboxit (C3O2) được tìm ra vào năm 1873, C2O vào năm 1961, còn C2O2 thì mãi tới năm 2015 mới có bằng chứng thực nghiệm về nó. a) Đề nghị công thức Lewis và hình dạng phân tử cho C3O2. Biết rằng nó bền ở điều kiện thường và có momen lưỡng cực μ = 0.
b) Sắp xếp các chất C3O2, N2, NO và CO theo chiều tăng dần nhiệt độ sôi và giải thích ngắn gọn. Có thể dự đoán được thứ tự về nhiệt độ nóng chảy của các chất đó được không? Vì sao?
c) Khi cho cacbon suboxit phản ứng lần lượt với H2O, NH3 và HCl thì thu được các hợp chất bền có công thức phân tử tương ứng là C3H4O4, C3H6N2O2 và C3H2Cl2O2. Viết cơ chế phản ứng và công thức cấu tạo các chất thu được.
a) Dựa vào mô hình đẩy các cặp electron hóa trị (VSEPR) hãy biểu diễn cấu trúc các phân tử ClF3 và BF3. Cho biết phân tử nào phân cực, giải thích.
b) Dựa vào thuyết liên kết hóa trị (VB), hãy cho biết dạng hình học và từ tính của các phức chất [Ni(CO)4] và [Ni(CN)4]2-
c) Dùng thuyết liên kết hóa trị (VB) hãy cho biết cấu tạo, dạng hình học của CO2, NO2 và O3
1) Sử dụng mô hình về sự đẩy nhau của các cặp electron hóa trị (mô hình VSEPR), dự đoán dạng hình học của các ion và phân tử sau: BeH2, BCl3, NF3, SiF6 2-, NO2 +, I3
2) So sánh và giải thích khả năng tạo thành liên kết π của C và Si.
19
1. Cho chất N≡SF3 lỏng tác dụng với [XeF][AsF6], thu được sản phẩm là [F3SN-XeF][AsF6] (1). Ở trạng thái rắn, khi bị đun nóng, (1) chuyển thành [F4SN-Xe][AsF6] (2). Phản ứng của (2) với HF, thu được sản phẩm [F5SN(H)Xe][AsF6] (3), [F4SNH2][AsF6] (4) và XeF2
a) Sử dụng mô hình sự đẩy của các cặp electron hóa trị (VSEPR), đề xuất cấu trúc của anion 6 [AsF] , cation trong các hợp chất (1), (2), (3), (4) và cho biết (có giải thích) cation nào có liên kết giữa S và N ngắn nhất, dài nhất.
b) Cho biết trạng thái lai hóa của nguyên tử lưu huỳnh trong các hợp chất (1), (2), (3) và (4).
2. Sử dụng thuyết obitan phân tử (thuyết MO) để giải thích tại sao năng lượng ion hóa thứ nhất của phân tử nitơ (1501 kJ∙mol-1) lớn hơn năng lượng ion hóa thứ nhất của nguyên tử nitơ (1402 kJ∙mol-1).
|
Cho các phân tử: xenon điflorua (1), xenon tetraflorua (2), xenon trioxit (3), xenon tetraoxit (4), bo triflorua (5), trimetylamin (6), axetamit (7).
1) Vẽ cấu trúchình họcphân tử(cả các cặp electron tựdo (nếu có) của nguyên tử trungtâm)củacácchấttừ(1)đến(6).
2) Dự đoán góc liên kết ở mỗi phân tử nói trên.
3) Hãy đề xuất một phương pháp thích hợp để điều chế: xenon điflorua (1), xenon tetraflorua (2), xenon trioxit (3).
Các đại phân tử polymer không có cấu trúc cứng nhắc, mà chúng có tính linh hoạt nhờ khả năng xoay vòng của các mảnh cấu trúc quanh các liên kết đơn của mạch chính. Khoảng cách giữa các đầu mạch phân tử polymer có thể nhận giá trị bất kì từ 0 đến H - chiều dài của đại phân tử trong cấu dạng dài nhất (chiều dài biên). Dựa vào tất cả các cấu dạng có thể có của đại phân tử, có thể tính khoảng cách trung bình <h> giữa các đầu mạch.
1) Biểu diễn cấu trúc của một mắt xích polypropylene (PP). Dựa vào độ dài liên kết C-C (1.5 Å), hãy tính độ dài của mắt xích (l), có xét đến các góc hóa trị. Tính độ dài H của phân tử PP được kéo dài cực đại, tạo nên từ 1000 mắt xích.
Các đại phân tử thực có thể được mô tả theo nhiều mô hình khác nhau. Trong mô hình "chuỗi khớp nối tự do", các mắt xích là những thanh cứng, có thể được ghép nối theo mọi góc. Trong trường hợp này: <h> = ln (với l là chiều dài liên kết, n là số liên kết trong đại phân tử).
2) Tính khoảng cách trung bình giữa các đầu mạch trong phân tử PP được tạo thành từ 1000 mắt xích theo mô hình chuỗi khớp nối tự do. Trong các mô hình thực tế hơn, các mắt xích của đại phân tử không phải những khớp nối ở các góc ngẫu nhiên, mà tồn tại những giới hạn. Tuy nhiên, đại phân tử có thể được biểu diễn như một đường giao nhau tự do của các phân đoạn mà mỗi phân đoạn được tạo thành từ a monomer (đơn phân). Trong trường hợp này: <h> = LN (với L là chiều dài đoạn, N là số đoạn trong đại phân tử).
3) Lập biểu thức tính <h> trong mô hình chuỗi phân đoạn tự do theo chiều dài liên kết l và số mắt xích a trong phân đoạn.
4) Với một phân tử PP tạo nên từ 1000 mắt xích, giá trị <h> được xác định bằng thực nghiệm là 17.3 nm. Xác định độ dài của phân đoạn đại mắt xích và số monomer của nó.
Phiếu trả lời có chứa các giá trị a được xác định bằng thực nghiệm với 6 polymer: cellulose, polyethylene oxide, polystyrene, poly(γ-benzyl-Lglutamate), polyvinyl chloride, poly-p-benzamide.
5) Hãy điền vào các chỗ trống trong bảng (của Phiếu trả lời) cấu tạo của các monomer còn thiếu. Xác định polymer có cấu trúc cứng nhắc nhất. Chú ý rằng trong các điều kiện thực nghiệm thì poly(γ-benzyl-Lglutamate) tồn tại ở cấu dạng chuỗi xoắn α. [Bỏ qua câu hỏi này]
1) Ở trạng thái hơi, các nguyên tử của nguyên tố kim loại nhóm IA và nhóm IB có khả năng hình thành phân tử hai nguyên tử với các năng lượng liên kết như sau: Phân tử Cu2 Ag2 Au2 K2 Rb2 Cs2 Năng lượng liên kết (kJ.mol-1) 174,3 157,5 210 50,2 46,0 41,8
a) So sánh và giải thích độ bền liên kết trong các phân tử kim loại của nhóm IB với độ bền liên kết trong các phân tử kim loại của nhóm IA.
b) Giải thích sự khác nhau về quy luật biến đổi của các năng lượng liên kết trong mỗi dãy phân tử sau: Cu2 - Ag2 - Au2 và K2 - Rb2 - Cs2.
2) Sự phá vỡ các liên kết Cl-Cl trong một mol clo đòi hỏi một năng lượng bằng 243 kJ (năng lượng này có thể sử dụng dưới dạng quang năng). Hãy tính bước sóng của photon cần sử dụng để phá vỡ liên kết Cl-Cl của phân tử Cl2
1) Ion C2 2- tồn tại trong một số hợp chất, ví dụ CaC2
a) Viết cấu hình electron của phân tử C2 và ion C2 2- theo lý thuyết MO.
b) So sánh độ bền liên kết, độ dài liên kết của C2 và ion C2 2-. Giải thích.
c) So sánh năng lượng ion hóa thứ nhất (I1) của C2, C2 2- và nguyên tử C. Giải thích.
2) Vẽ giản đồ MO của CO và CN . Viết cấu hình electron, xác định độ bội liên kết, từ tính của chúng.
1) Vẽ giản đồ năng lượng các MO cho phân tử CO. Viết cấu hình electron, cho biết từ tính và số liên kết (chỉ rõ số liên kết σ và số liên kết π) của phân tử này.
2) So sánh năng lượng ion hóa của nguyên tử C, nguyên tử O và phân tử CO.
3) Cho biết tên của obitan HOMO và LUMO của phân tử CO. Biểu diễn hình dáng của các obitan này.
Trong quá trình trao đổi chất ở cơ thể người, oxi phân tử có thể chuyển thành anion O2 . Anion này là chất oxi hóa mạnh, có khả năng phá hủy tế bào. Tuy nhiên, một số loại enzym trong cơ thể người có tác dụng xúc tác để chuyển O2 - thành các chất không độc hại.
a) Đề xuất các phản ứng liên quan đến sự chuyển hóa O2 , biết rằng quá trình này xảy ra trong môi trường axit và đi qua một chất trung gian.
b) NO được biết là một chất khí độc, khi vào cơ thể người, nó dễ dàng kết hợp với O2 - để tạo thành anion X Anion này cũng là một tác nhân oxi hóa mạnh, có khả năng phá hủy protein, ADN và lipit, gây các bệnh về tim, bệnh Alzheimer, bệnh đa xơ cứng, … Vẽ giản đồ obitan phân tử của O2- và của NO.
c) Dựa trên giản đồ obital phân tử ở ý b), lập luận về sự hình thành X từ O2- và NO.
Hình dưới đây biểu diễn đường cong thế năng của các trạng thái electron cơ bản và kích thích của phân tử NaI trong phase khí. Một trong số chúng thể hiện tính chất cộng hóa trị và đường còn lại thể hiện tính ion.
Để tính năng lượng ion hóa, có thể dùng thuyết Bohr. Theo thuyết này thì biểu thức tính toán năng lượng của electron ở mức năng lượng thứ n sẽ là: () =− 2 eff 2 Z EeV13.6 n với Zeff là điện tích hạt nhân hiệu dụng
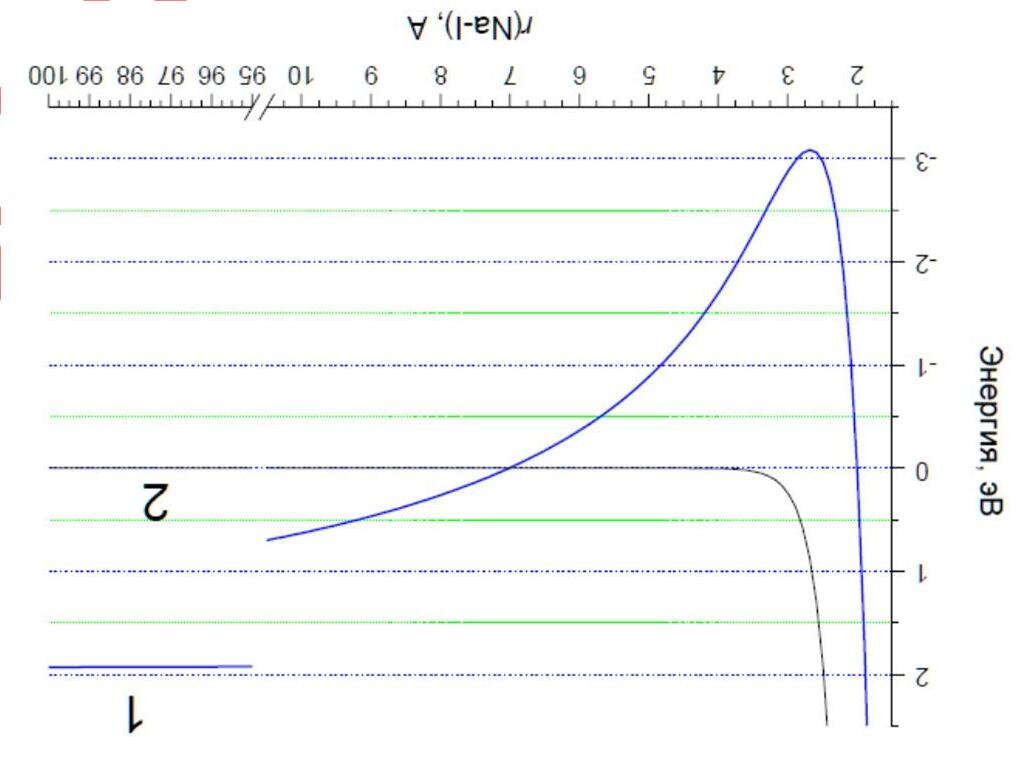
6) Tính năng lượng ion hóa của Na ở trạng thái cơ bản nếu biết Zeff(Na) = 1.84.
7) Sử dụng đồ thị hãy xác định năng lượng các trạng thái cộng hóa trị và ion ở khoảng cách rất xa, và với giá trị này hãy tính ái lực electron của iodine.
8) Tính độ âm điện tuyệt đối của nguyên tử iodine nếu biết rằng năng lượng ion hóa của nó là 10.5 eV.
1) Cho biết mỗi đường cong trên đồ thị tương ứng với tính chất nào (cộng hoá trị, ion)?
2) Tính khoảng cách cân bằng Na-I.
3) Vẽ cấu trúc Lewis các dạng cộng hoá trị và ion của NaI. Dùng dấu hoa thị (*) kí hiệu các electron thuộc về Na và dấu chấm cho các electron của I.
4) Tính bước sóng ánh sáng bị hấp thụ ở bước chuyển từ trạng thái cơ bản lên kích thích của NaI (1 eV = 8000 cm-1). Hơi NaI có màu gì?
5) Tính năng lượng cực tiểu để phân huỷ NaI ở trạng thái cơ bản thành các ion.
Độ bền tương đối của cấu trúc cộng hóa trị và ion của một phân tử AB phụ thuộc vào độ âm điện của hai nguyên tử A và B. Khái niệm độ âm điện tuyệt đối EN của một nguyên tố X được định nghĩa là bằng nửa tổng năng lượng ion hóa I và ái lực electron A: EN(X) = (I + A)/2 Trong đó I và A là hiệu ứng nhiệt của các phản ứng: X → X+ + e - I X + e → X + A
|
Số sóng (cm–1) là giá trị nghịch đảo của bước sóng, thường được sử dụng để làm thang đó năng lượng và bằng năng lượng của photon ở bước sóng tương ứng. Hình sau mô tả phổ phát xạ của khí Cl2 ở trạng thái kích thích tại 73448 cm–1. Phổ cho thấy một loạt các pic tuần tự nhau, và mỗi pic ứng với sự phát quang ở trạng thái dao động ứng với các số lượng tử v (= 0, 1, 2,...).
Tính gần đúng năng lượng chênh lệch giữa mức dao động cơ bản và mức dao động kế tiếp với nó trong phân tử Cl2, Ev, (kJ mol–1). Có thể chọn một cặp pic kế bên bất kỳ để tính toán.
73448
Sự dao động của một phân tử hai nguyên tử có thể xem gần đúng là dao động giãn và nén của một chiếc lò xo như chỉ ra ở hình 1. Độ mạnh của lò xo giả địn này được đặc trưng bởi hằng số lực , k, vốn có giá trị lớn với liên kết mạnh và nhỏ cho liên kết yếu. Sự phân tích dao động của phân tử hai nguyên tử bằng cơ học lượng tử cho thấy năng lượng dao động nhận những giá trị gián đoạn. Năng lượng dao động Ev được biểu diễn bằng phương trình: v hk1 Ev 22 =+ πµ h: Hằng số Planck Ở đây, v là lượng tử dao động, nhận các giá trị nguyên 0, 1, 2,…, và là khối lượng rút gọn của phân tử ( 12
111 μmm =+ : m1 và m2 là các khối lượng nguyên tử). Khi chiếu xạ phân tử bằng một nguồn phát xạ cường độ lớn như tia laser thì ánh sáng có năng lượng khác với tia phát xạ tới sẽ bị tán xạ; hiện tượng này được gọi là tán xạ Raman. Trong quá trình quang học này thì sự khác biệt năng lượng giữa ánh sáng tán xạ Raman và ánh sáng tia laser tới chính là năng lượng dao động của phân tử như chỉ ra ở hình II.
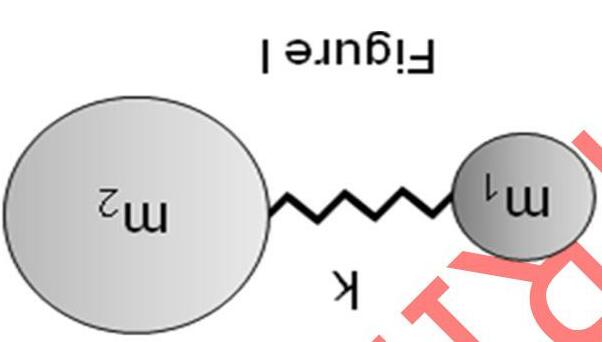
laser
v =
v =
a) Thu về tỉ lệ các khối lượng rút gọn của H2, N2, và O2. 1 2 = 22 HNO :: µµµ : a : b
b) Bước sóng λ (nm) và tần số (s-1 = Hz) được dùng để đặc trưng cho ánh sáng (phát xạ). Trong quang phổ, bước sóng (cm-1) ứng với số sóng trong mỗi cm thường được dùng hơn. Tính tần số và bước sóng của ánh sáng xanh lá cây ở 500 nm.
Tần số = c s-1
Số sóng = d cm-1
c) Sự chênh lệch năng lượng giữa v = 0 và v = 1 của H2 là 4160 cm-1. Xác định giá trị bước sóng của ánh sáng tán xạ Raman khi chiếu xạ H2 bằng ánh sáng laser ở 500 nm.
Bước sóng của ánh sáng tán xạ Raman = e nm
d) Cho rằng hằng số lực của O2 lớn gấp đôi H2, ước lượng sự chênh lệch năng lượng giữa v = 0 và v = 1 đối với O2. Tính giá trị của bước sóng Raman tán xạ khi chiếu xạ O2 bằng ánh sáng laser ở 500 nm.
Sự chênh lệch năng lượng = f cm-1
Bước sóng của ánh sáng tán xạ Raman = g nm
|
Phân ly quang hóa là quá trình trong đó mảnh phân tử sau khi hấp thụ một photon có năng lượng cao sẽ làm đứt gãy liên kết hóa học. Sự phá vỡ liên kết hóa học chính là một trong số những quá trình hóa học cơ sở được nghiên cứu nhiều và kỹ nhất.
Khi tiến hành nghiên cứu sự cắt đứt liên kết Cl–Cl bằng cách sử dụng kỹ thuật khối phổ thời gian bay thì một tia laser sẽ cho cắt ngang qua một tia gồm các phân tử Cl2, lúc này sự phân ly sẽ xảy ra ở điểm cắt nhau giữa các chùm tia. Một tia lasẻ thứ hai sẽ ion hóa các nguyên tử Cl này (vận tốc không bị ảnh hưởng) để cho chúng được từ trường dẫn đường chính xác đến một đầu dò nhạy qua quãng đường bay 40 cm.
Hình bên là ảnh của mảnh Cl được detector ghi lại. Lưu ý rằng nó chỉ là một hình chiếu hai chiều của một hình ảnh phân bố vận tốc ba chiều.
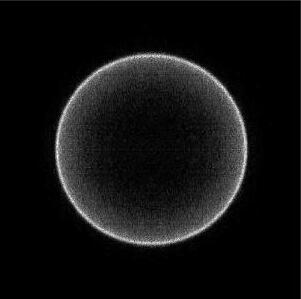
a) Khi áp một thế 3000 V để ion hóa nguyên tử Cl cho detector thì thời gian bay lúc này là bao nhiêu ? Lấy khối lượng của một nguyên tử Cl là 35 g mol–1 .
b) Hình ảnh trên ta thấy nguyên tử Cl như một vòng tròn do có sự bảo tồn năng lượng và momen. Đường kính ngoài của vòng là 12.68 mm. Như vậy vận tốc của mỗi nguyên tử Cl đạt được sau quá trình quang phân là bao nhiêu ?
c) Năng lượng liên kết trong Cl2 là 243 kJ mol–1. Sử dụng định luật bảo toàn năng lượng để xác định bước sóng của tia laser.
Phân tử lưỡng nguyên tử với các khối lượng nguyên tử m1 và m2 có thể xem là một trục quay cứng nhắc, nếu sự quay không ảnh hưởng đến khoảng cách liên nhân ở trạng thái cân bằng re. Trong cơ học lượng tử, năng lượng quay của một phân tử tính theo công thức Erot = BeJ(J+1), trong đó J = 0, 1, 2, … - số lượng tử quay; Be = ћ2/2I - hằng số quay; I = µre 2moment quán tính; µ= m1m2/(m1+m2) - khối lượng thu gọn của phân tử. Trong khí lí tưởng của các phân tử lưỡng nguyên tử, sự chiếm các mức năng lượng quay chịu khống chế của phân bố Boltzmann (NJ - số phân tử trên các mức ứng với số lượng tử quay J, N - tổng số phân tử trong khí)
2) a) Trên hệ trục đồ thị U(r), hãy xác định các điểm tương ứng với các thông số ε và r0.
b) Xác định khoảng cách xuyên hạt nhân cân bằng theo đơn vị của r0.
Đối với chất khí của các phân tử phân cực, có thể phát hiện phổ thuần túy dao động quay của nó.
() () + +− Je B
NBJJ1 ~2J1exp NkT 1) Xác định giá trị của J, tương ứng với mức năng lượng quay bị chiếm cao nhất bởi các phân tử N2 ở 298 K? I = 1.401∙10-46 kg∙m2? Thế Lennard-Jones được dùng để mô tả đường cong thế năng của các phân tử lưỡng nguyên tử: () ε
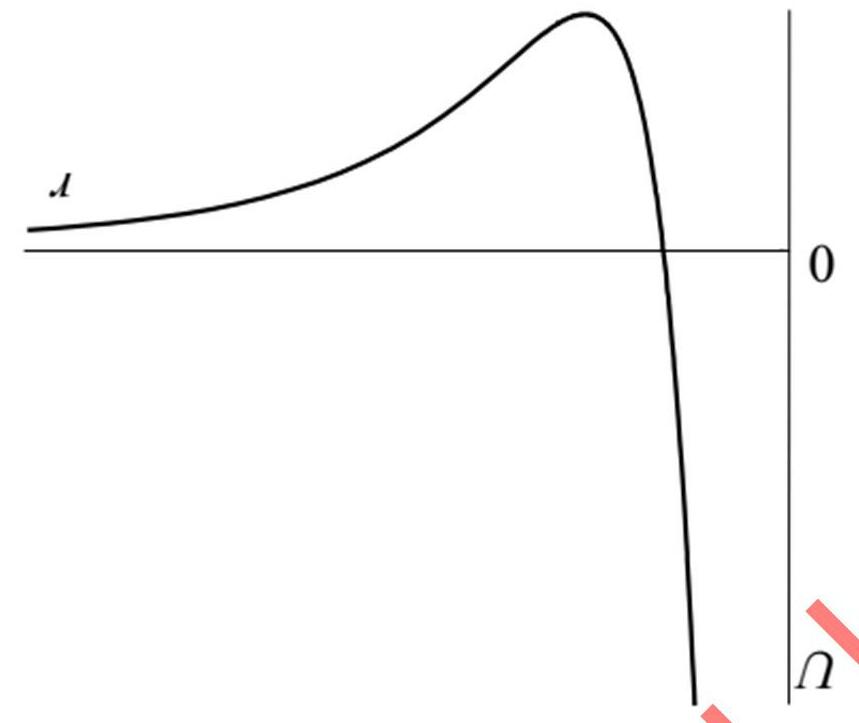
126 00 rr Ur=4rr trong đó r là khoảng cách hạt nhân, ε và r0 là các thông số đường cong. Mức năng lượng không tương ứng với tổng năng lượng của hai nguyên tử ở khoảng cách vô cực.
3) Tính tần số (Hz) của hai vạch đầu tiên trong phổ hấp thụ BrF. Be = 7.093∙10-24 J. Theo các quy tắc chọn lọc, chỉ có những bước chuyển J → J + 1 là có thể hấp thụ. Nếu ngoài sự quay còn xét đến sự dao động của phân tử thì năng lượng của nó bằng tổng Erot + Evib (k - hằng số lực, n = 0, 1, 2, … - số lượng tử quay) =ω+=+ µ ℏℏvib 1k1 Enn 22
4) Với phân tử 127I35Cl, k = 239 N/m, Be = 2.26∙10-23 J. Tìm bước sóng tại đó ánh sáng bị hấp thụ bởi các phân tử này tương ứng với sự chuyển từ trạng thái với J = 0, n = 0 lên trạng thái với J = 1, n = 1?
Ngược lại với tần số dao động, hằng số lực k không biến đổi bởi sự thay thế đồng vị.
5) Quan sát thấy vạch 1326 cm-1 trong phổ hồng ngoại của 79Br19F. Tính tần số (cm-1) của vạch tương ứng trong phổ hồng ngoại của 81Br19F. Các hằng số vật lí: Hằng số Planck h = 2pћ = 6.63∙10-34 J.s; tốc độ ánh sáng c = 3∙108 m/s; hằg số Avogadro NA = 6.02∙1023 mol-1; 1 a.m.u = 1.66∙10-27 kg, hằng số Boltzmann kB = 1.38∙10-23 J/K.
|
Năng lượng dao động của phân tử hai nguyên tử AB (khí) có độ dài liên kết không đổi được gọi là dao động tử điều hòa được xác định theo hệ thức =+ν ve 1 Evh 2 . Ở đây v = 0, 1, 2, 3... được gọi là số lượng tử dao động; h là hằng số Planck và νe là tần số của dao động tử điều hòa. = πµ e 1K v 2
Dao động của phân tử hai nguyên tử dạng A-B, có độ dài liên kết không đổi được gọi là dao động điều hòa. Tần số dao động của phân tử νdđ (s-1) được tính theo công thức dd 1k 2 ν= πµ (1). Trong đó k là hằng số lực (N/m), đặc trưng cho độ bền liên kết (k càng lớn liên kết càng bền); μ là khối lượng rút gọn của phân tử được tính theo công thức AB AB
Trong đó K là hằng số lực, μ là khối lượng rút gọn ( µ= + AB AB AB
mm mm , mA, mB là khối lượng của nguyên tử A và B).
Trường hợp phân tử AB là một dao động tử điều hòa và không kể đến chuyển động quay thì phổ dao động chỉ gồm một vạch duy nhất ứng với biến thiên năng lượng bằng hiệu hai mức năng lượng liền kề và do đó tần số của bức xạ bị hấp thụ bằng tần số của dao động tử, ta có:
∆E = Ev+1 - Ev = hν và ν = νe
Hãy tính năng lượng ε (kJ/mol) với độ chính xác 4 số sau dấu phẩy cho mỗi phân tử sau 12C16O, 12C18O, 13C18O. Biết hằng số lực (K) của bốn phân tử trên là như nhau và bằng 1901,9 Nm-1
mm mm µ= + (2). Năng lượng dao động của phân tử (Ev) bị lượng tử hóa, được tính theo công thức: dd 1 2v Ehvv =− (3)
Ở đây ν là các số lượng tử dao động (ν = 0, 1, 2...)
Khi nghiên cứu 1H35Cl và 1H79Br (pha khí) thực nghiệm cho thấy ứng với sự chuyển mức năng lượng ν = 0 lên ν = 1 chúng hấp thụ bức xạ có số sóng tương ứng là 2885 cm-1 và 2650 cm-1 .
Cho biết 1H = 1,0078; 35Cl = 34,97; 79Br = 78,92.
a) Xác định hằng số lực k đối với hai phân tử HCl và HBr nêu trên. b) So sánh độ bền của liên kết H – Cl và H – Br. Giải thích
|
Xem xét cơ học lượng tử của sự quay phân tử lưỡng nguyên tử, thu được một phương trình đơn giản của các mức năng lượng quay:
2 J0 2 h EJJ1BJJ1 8I
()()=+=+ π
Trong đó J = 0, 1, 2, 3, … là số lượng tử quay; h = 6.626∙10-34 J∙s là hằng số Planck; I = r0 2 là moment quán tính của phân tử; = m1m2/(m1 + m2) là khối lượng phân tử rút gọn; m1 và m2 là các khối lượng nguyên tử; r0 là khoảng cách liên nhân; B0 là hằng số quay, biểu diễn theo đơn vị năng lượng (J). Các bước chuyển quay chỉ xảy ra giữa những trạng thái kề nhau, dẫn tới sự bức xạ hoặc hấp thụ bước sóng điện từ. Các bước chuyển như vậy có thể được ghi lại dưới dạng phổ quay trong vùng vi sóng.
1. Rút ra công thức tổng quát để tính tần số hấp thụ trong phổ quay dành riêng cho phân tử lưỡng nguyên tử (mối liên hệ giữa tần số của bước chuyển và hiệu năng lượng được biểu diễn bởi phương trình Planck ℎ = ).
2. Đơn vị đặc biệt - centimerter ngược, cm-1 - được sử dụng trong quang phổ làm thước đo năng lượng. Mỗi centimeter ngược tương ứng với năng lượng của ánh sáng có bước sóng = 1 cm. Hãy biểu diễn 1 cm 1 theo J và J/mol.
3. Biết vị trí của 3 mũi (peak) hấp thụ liền kề trong phổ quay của HF là 82.19 cm-1; 123.15 cm-1 và 164.00 cm-1, hãy xác định: a) Hằng số quay (theo cm-1); b) Khoảng cách liên nhân trong phân tử HF.
4. Tính độ chuyển dịch đồng vị (theo cm-1) của các tần số hấp thụ HF đề cập ở ý 3 khi thay thế hydrogen bằng deuterium.
5. Năng lượng trung bình của chuyển động nhiệt ở nhiệt độ T bằng kT (k = 1.38∙10-23 là hằng số Bolzmann). Nếu năng lượng này thấp hơn năng lượng của sự chuyển tới mức năng lượng quay đầu tiên, tất cả các phân tử sẽ chiếm mức không và không quay. Xác định ngưỡng nhiệt độ mà ở dưới mức này thì các phân tử HF sẽ không có chuyển động quay.
Năng lượng Eo (J) của một electron trong trường hợp lực một hạt nhân được tính bằng biểu thức: µ =− ε
42 n 222 o E(J)eZ8hn
Trong đó, e là điện tích nguyên tố; Z là điện tích hạt nhân; o ε là hằng số điện; h là hằng số Planck; n là số lượng tử chính (n = 1, 2, 3…); µ(kg) là khối lượng rút gọn của hệ, được tính bằng biểu thức µ= (mhạt nhân .melectron) : (mhạt nhân + melectron).
a) Tính bước sóng λmax (nm) của dãy phổ Lyman khi electron chuyển từ n = 2 về n = 1 trong nguyên tử hiđro.
b) Tần số tương ứng vứi bước sóng λmax của dãy Lyman có sự khác biệt nhỏ giữa hiđro và đơteri (một đồng vị của hiđro, trong hạt nhân có một proton và một nơtron). Nguyên nhân là do sự khác biệt vầ khối lượng rút gọn giữa đơteri và hiđro. Hiệu ứng này gọi là sự chuyển dịch đồng vị. Tính sự khác việt về tần số ∆ν (Hz) của photon phát xạ khi electron chuyển từ n = 2 về n = 1 trong đơteri và hiđro.
c) Positroni là một hệ gồm một positron, là hạt có điện tích +1 và một electron. Khi electron chuyển từ n = 3 về n = 2, hệ bức xạ photon có bước sóng λ = 1312 nm. Tính khối lượng m (kg) của positron.
|
Chuyên
4: Hóa lượng tử
Bài 1 Nhiều hiện tượng Hóa học có thể được giải thích bằng các lí thuyết Vật lí. Một lí thuyết chủ đạo cho Hóa học là Cơ học lượng tử (CHLT). Lí thuyết (CHLT) là nền tảng vững chắc cho tính tuần hoàn hóa học xác định được bằng trực giác. Một trong những nền tảng của CHLLT là nguyên lí chồng chất trạng thái hay nguyên lí siêu vị trí: ″ Nếu một hệ lượng tử có thể được tìm thấy ở trạng thái nguyên chất 1 hoặc 2 được mô tả bằng hàm sóng tương ứng ψ1 hoặc ψ2 thì hệ đó cũng có thể được tìm thấy ở trạng thái hỗn hợp được mô tả bằng hàm sóng ψ = c1ψ1 + c2 ψ1; trong đó các hệ số c1, c2 đặc trưng cho tỉ lệ đóng góp của mỗi trạng thái nguyên chất ψ1, ψ2 vào trạng thái hỗn hợp ψ″ . Tổng hoặc hiệu của một số hàm sóng với hệ số ci thích hợp được gọi là hàm tổ hợp tuyến tính hay hàm siêu vị trí. Hệ lượng tử được khảo sát ở một trạng thái hỗn hợp cũng đồng thời tồn tại ở cả các trạng thái nguyên chất. Khi bạn hoàn thành một đo đạc nào đó về hệ này ở trạng thái hỗn hợp thì đo đạc này cũng chuyển hệ đến một trong các trạng thái nguyên chất. Ta không bao giờ biết chắc chắn trạng thái cuối cùng xác định của hệ mà chỉ có thể nói tới xác suất. Theo các định luật, xác suất tìm thấy hệ ở một trạng thái nguyên chất nào đó tỉ lệ với bình phương mođun của hệ số tương ứng: ρ1 c12 ; ρ2 c22 . Tất nhiên xác suất tìm thấy hệ đó cả trong hai trạng thái phải bằng 1: ρ1 + ρ2 = 1. Nguyên lí chồng chất trạng thái trên chỉ áp dụng cho hệ lượng tử, không áp dụng được cho hệ vĩ mô. Để minh họa vấn đề này, E. Srođingơ đã tưởng tượng ra một thí nghiệm thông minh như sau. Ta có máy đếm Geiger dùng để phát hiện các electron bay tới. Máy đếm này được nối với dụng cụ đục thủng tấm thủy tinh bằng chất độc khi electron bay tới máy đếm. Một con mèo còn sống được đặt sát tấm thủy tinh đó. Nếu có một electron bay tới, máy đếm được hạt này thì con mèo này sẽ bị nhiễm chất độc. Song nếu máy đếm không thực hiện được sự đo đạc và electron ở trạng thái hỗn hợp giữa được thu và không được thu thì con mèo ở vào
trạng thái siêu vị trí của sống và chết. Hiển nhiên đây là điều không có ý nghĩa: con mèo đó lại có thể đồng thời ở vào cả trạng thái sống và chết!
Trong Hóa học nguyên lí siêu vị trí đó được dùng trong thuyết lai hóa, cộng hưởng và thuyết obitan phân tử (MO).
Nguyên lí siêu vị trí trong thuyết lai hóa.
1. Một AO lai hóa sp3 là một tổ hợp tuyến tính của 1 AO-s với 3 AO-p: ψ 3 sp = c1ψs + c2ψp x + c3ψp y + c4ψp z
i)Nếu ta giả thiết cả 4 AO có lượng góp bằng nhau vào một AO lai hóa, giá tri tuyệt đối của mỗi hệ số từ c1 đến c4 bằng bao nhiêu?
ii)Hỏi tương tự như trên về các hệ số từ c1 đến c3 cho lai hóa sp2 .
Nguyên lí siêu vị trí trong thuyết MO.
MO trạng thái cơ bản của ion phân tử H + 2 có dạng: ψ = 1 2 ψ a s1 + 1 2 ψ b s1 .
Trong đó kí hiệu a, b chỉ các nguyên tử hiđro. Xác suất tìm thấy 1 e trong AO-1s của nguyên tử băng bao nhiêu?
Nguyên lí siêu vị trí trong thuyết cộng hưởng
2. Các liên kết cộng hóa trị có tỉ lệ nào đó đăc tính liên kết ion. Vậy hàm sóng của một phân tử hiđro halogenua có thể được biểu diễn bằng một tổ hợp tuyến tính của một hàm đặc trưng cho trạng thái ion (ψH + Hl ) và một hàm đặc trưng cho trạng thái cộng hóa trị (ψH:Hl): ψ HHl = ccov ψH:Hl + cion ψH + Hl
Trong quyển sách nổi tiếng ″Bản chất liên kết hóa học″ (1947) (″The Nature of the chemical bond″ ) L.Pauling cho biết liên kết trong phân tử HCl có 17% đặc tính ion. Hãy tính giá trị tuyệt đối của các hệ số ccov và cion cho HCl.
3. Một trong các hàm sóng của Benzen có thể được biểu diễn bằng một tổ hợp tuyến tính của các hàm tương ứng với hai cấu trúc Kekule và ba cấu trúc Đioa: Hãy tính phần đóng góp của hai cấu tạo Kekule vào cấu tạo của Benzen. Giả thiết một phân tử dao động giữa hai trạng thái nguyên chất ψ1và ψ2 vớI tần số ω. Ban đầu (t = 0) phân tử ở trạng thái nguyên chất thứ nhất, sau nửa chu kì (t = π/ω) nó chuyển sang trạng thái nguyên chất thứ hai.
4. Hãy tính các hệ số phụ thuộc thời gian của hàm sóng siêu vị trí của các trạng thái này mà hàm đó mô tả cấu trúc electron của phân tử. Hãy viết biểu thức hàm sóng tại thời điểm ¼ chu kì.
Một trong các định luật chủ yếu của CHLT cho liên hệ giữa độ bất định của vị trí, ∆x, với độ bất định của momen động lượng, ∆p, của hạt lượng tử: ∆x.∆p ≥ h/2; h là hắng số Planck nổi tiếng; h = 6,625.10-34J.s (hằng số Planck rút gọn ℏ = h/2π = 1.05.10-34J.s); momen động lượng p = mv (m là khối lương của vi hạt, v là vận tốc của vi hạt đó; nếu chặt chẽ hơn phải chú ý momen động lượng là một đai lượng vectơ: p = m v ).
1. Không cần tính, hãy xếp các hạt sau đây theo thứ tự tăng độ bất định cực tiểu (min) của tốc độ, ∆vmin:
a) Một e trong một phân tử H2; b) Một nguyên tử H trong một phân tử H2;
c) Một proton trong một hạt nhân nguyên tử cacbon; d) Một phân tử H2 trong một ống nano; e) Một phân tử O2 trong một phòng có bề rộng 5 m.
2. Hãy tìm số liệu ∆vmin cho hạt thứ nhất và hạt cuối cùng ở trên từ Sổ tay tra cứu hay Internet.
Để mô tả các trạng thái của electron π trong phân tử benzene, có thể sử dụng mô hình electron di chuyển tự do trong hình tròn bán kính r. Trong mô hình này các mức năng lượng của electron được mô tả bởi biểu thức: = ℏ22 n 2 e
n E 2mr
với ℏ = 1.05∙10-34 J∙s là hằng số Planck thu gọn, me = 9.11∙10-31 kg là khối lượng electron, n là số lượng tử chính (n = 0, 1, 2…). Với mỗi n (ngoại trừ n = 0) sẽ tồn tại hai mức năng lượng bằng nhau, mức n = 0 được coi là không suy biến.
1) Có bao nhiêu electron π trong phân tử C6H6?
2) Vẽ sự phân bố electron π trên các mức năng lượng trong phân tử benzene (sử dụng các nguyên lý như trong trường hợp điền electron vào các AO). Số lượng tử chính n ứng với HOMO của C6H6 ở trạng thái cơ bản là bao nhiêu? Có bao nhiêu electron độc thân trong phân tử C6H6?
3) Tính bán kính của khu vực chuyển động của các electron π trong phân tử C6H6, lưu ý rằng chênh lệch năng lượng giữa HOMO và LUMO vào khoảng 600 kJ/mol. Xác định độ dài liên kết C-C với giả thiết rằng khung σ của benzene nội tiếp trong đường tròn mà các electron π của benzene di chuyển.
4) [14] annulene là một hợp chất vòng phẳng có các liên kết đôi liên hợp. Xác định công thức phân tử và số electron π của nó. Liệu có thể xem hợp chất này có tính thơm không? Mô hình electron di chuyển trong vòng kín có thể áp dụng được vào hệ thống electron π của [14] annulene, giả sử chu vi đường tròn bằng độ dài các liên kết C-C tính được ở ý 3, xác định chênh lệch năng lượng (kJ/mol) giữa HOMO và LUMO trong [14] annulene.
Chuyển động của electron π dọc theo mạch cacbon của hệ liên hợp mạch hở được coi là chuyển động tự do của vi hạt trong hộp thế một chiều. Năng lượng của vi hạt trong hộp thế một chiều được tính theo công thức = 22 n nh E 8ma , trong đó n = 1, 2, 3...; h là hằng số Planck; m là khối lượng của electron, m = 9,1.10-31 kg; a là chiều dài hộp thế. Đối với hệ liên hợp, a là chiều dài mạch cacbon và được tính theo công thức a = (N+1)lC-C, ở đây N là số nguyên tử C, lC-C là độ dài trung bình của liên kết C – C. Ứng với mỗi mức năng lượng En nêu trên, người ta xác định được một obitan phân tử (viết tắt là MO – π) tương ứng, duy nhất. Sự phân bố electron π vào các MO – π cũng tuân theo các nguyên lý và quy tắc như sự phân bố electron vào các obitan của nguyên tử.
Sử dụng mô hình vi hạt chuyển động tự do trong hộp thế một chiều cho hệ electron π của phân tử liên hợp mạch hở Octatetraen, hãy:
a) Tính giá trị các năng lượng En (n = 1÷5) theo J. Biểu diễn sự phân bố các electron π trên các MO – π của giản đồ các mức năng lượng và tính tổng năng lượng của các electron π thuộc Octatetraen theo kJ/mol. Cho biết phân tử Ocatetraen có lC-C = 1,4Å.
b) Xác định số sóng ν (cm-1) của ánh sáng cần thiết để kích thích 1 electron từ mức năng lượng cao nhất có electron (HOMO) lên mức năng lượng thấp nhất không có electron (LUMO).
|
Cấu trúc điện tử của vật liệu ngưng tụ thường khác biệt so với các nguyên tử riêng rẽ. Ví dụ các mức năng lượng của mạch tựa hộp thế một chiều của các nguyên tử Na được minh họa ở hình 1. Ở đây chỉ biểu diễn mức 3s của Na. Khoảng cách giữa các mức năng lượng giảm khi tăng số nguyên tử Na (N). Với N lớn, khoảng cách các mức năng lượng trở nên nhỏ đến mức có thể bỏ qua được so với nhiệt năng và dãy các mức năng lượng 3s này có thể được xem như một “dải” các mức năng lượng (ảnh cuối của hình 1) . Các electron 3s của Na chiếm dải năng lượng bất định xứ trên toàn mạch dẫn đến tính kim loại. Như vậy các electron 3s có thể được xem như các hạt chuyển động tự do trong hộp thế một chiều. a) Năng lượng của hạt chuyển động tự do trong hộp thế một chiều được mô tả bởi biểu thức:
22
n 2 nh E 8mL = ( =n 1, 2, 3, ∙∙∙)





3
2
4 NaN
…
Với n là số lượng tử chính, h là hằng số Planck, m là khối lượng của electron và L là chiều dài mạch tựa hộp thế một chiều của Na. Cho rằng độ dài của mạch L = a0(N-1), với N là số các nguyên tử Na và a0 là khoảng cách liên nhân với nguyên tử gần nhất, tính năng lượng của mức bị chiếm cao nhất.
b) Cho rằng 1.00 mg Na tạo thành mạch tựa hộp thế một chiều với a0 = 0.360 nm. Tính hiệu năng lượng giữa mức không bị chiếm thấp nhất và mức bị chiếm cao nhất.
c) Nếu nhiệt năng ở nhiệt độ phòng có giá trị 25 meV, cần bao nhiêu nguyên tử Na để hiệu năng lượng giữa mức không bị chiếm thấp nhất
|
và bị chiếm cao nhất nhỏ hơn nhiệt năng (25 meV)? Tính số nguyên tử Na tối thiểu để hiệu năng lượng bằng nhiệt năng.
Các mức năng lượng trong polyen vòng có công thức CNHN có thể được tính bằng cách áp dụng công thức sau: E =α 2 β cos 2 k π N Với k = 0, ±1, ±2, ..., ±(N-1)/2 cho N lẻ, và k = 0, ±1, ±2, ..., N/2 cho N chẵn.
1) Tính các mức năng lượng của cation xicloheptratrienyl (ở dạng biểu thức α và β).
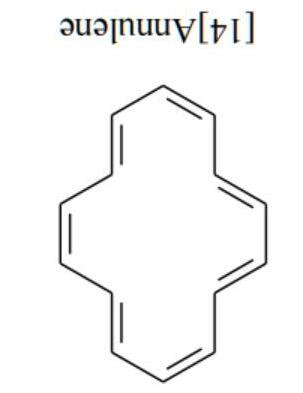
1) Bảng dưới cung cấp dữ liệu về các phân tử và ion dương lưỡng nguyên tử đồng hạch. Hãy điền vào các ô trống trong bảng. Xác định các vi hạt có cùng bậc liên kết và giải thích (định tính) tại sao năng lượng liên kết có khác biệt đáng kể?
2) Vẽ giản đồ MO của cation xicloheptatrienyl và gắn các giá trị năng lượng tương ứng vào giản đồ. Điền các electron π vào giản đồ này. Cho biết nó có tính thơm hay không.
3) Tính chênh lệch năng lượng giữa HOMO và LUMO, nếu biết β = -3.40 eV?
4) Tính số sóng của ánh sáng gây nên sự kích thích phân tử.
Annulene là các hydrocarbon vòng với hệ các liên kết đôi liên hợp. Trong tên gọi của các annulene, số nguyên tử carbon trong vòng được chỉ rõ bởi con số trong dấu ngoặc vuông:
Theo lí thuyết Hückel, các mức năng lượng của các π-electron đối với tất cả các annulene được biểu diễn theo phương trình:
∆==⋅⋅ λ A34hcN E,h6,6310Js
Trong đó α và β là các tham số của phân tử (α gọi là tích phân Coulomb, β là tích phân cộng hưởng, β < 0), N là số liên kết đôi trong annulene, n là mức năng lượng (n = 0, 1, …, N). Các mức với n = 0 và N = N là các suy biến đơn, còn lại là các suy biến kép.
2) Vẽ giản đồ các mức năng lượng của [6]annulene và vẽ sự phân bố electron theo mức năng lượng ở trạng thái cơ bản và kích thích thứ nhất.
3) Tính năng lượng cộng hưởng của [6]annulene (biểu diễn theo α và β).
4) Dưới đây là các hàm sóng được chuẩn hóa của [6]annulene theo xấp xỉ Hückel (ϕi nghĩa là 2pz-AO của nguyên tử carbon thứ i). Với mỗi hàm sóng, hãy xác định mức năng lượng n.
Bài 8
Vật liệu nano được ứng dụng rộng rãi trong nhiều lĩnh vực khác nhau. Một trong những vật liệu nano nổi tiếng là fulleren C60. Phân tử C60 có dạng cầu, được cấu tạo từ các nguyên tử C liên kết với nhau thành các vòng 5 hoặc 6 cạnh, trong đó mỗi nguyên tử C liên kết với 3 nguyên tử C khác. Để mô tả trạng thái các electron π của C60 có thể sử dụng mô hình hạt chuyển động tự do trong hình cầu bán kính r với các mức năng lượng tính theo công thức: = ħ . ( 1) Trong đó: L là số lượng tử obitan (L = 0, 1, 2, …). Với mỗi giá trị của L có (2L+1) obitan cùng năng lượng.
a) Xác định số electron π trong C60.
b) Tính bán kính r biết rằng hiệu năng lượng giữa HOMO và HOMO-1 (MO có năng lượng thấp hơn và liền kề với HOMO) của C60 ở trạng thái cơ bản là 296 kJ.mol-1 .
c) Xác định số electron độc thân trong C60 ở trạng thái cơ bản.
5) Trong phổ điện tử của [6]annulene, cực đại quan sát được ở 256 nm. Xác định giá trị β theo kJ/mol.
Cho biết: ∆==⋅⋅ λ A34hcN E,h6,6310Js
d) Thực nghiệm cho thấy C60 có tính nghịch từ. Để giải thích điều này, người ta cho rằng mức năng lượng của các obitan ứng với L > 2 sẽ tách thành các phân mức năng lượng. Mỗi phân mức có thể có 3, 4 hoặc 5 obitan. Đề xuất sự tách mức năng lượng của các obitan ứng với L = 5 để giải thích kết quả thực nghiệm.
e) Sử dụng mô hình tách các mức năng lượng ở ý d) dự đoán tính chất từ của K3C60 và K6C60 ở trạng thái cơ bản.
Ô mạng cơ sở, khối lượng riêng và các hằng số mạng của 4 hệ tinh thể được cho ở hình trên.
a) Xác định số lượng mỗi ion trong các ô mạng cơ sở.
b) Xác định số phối trí (CN - coordination number) của A và D trong tất cả các tinh thể.
1) Cho biết loại liên kết giữa các hạt ở nút mạng lưới trong mỗi loại tinh thể của các chất rắn sau: bạc; canxi oxit; kim cương; than chì (graphit) và iot.

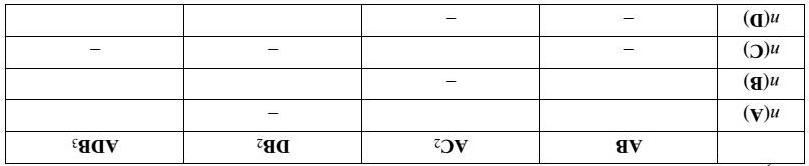
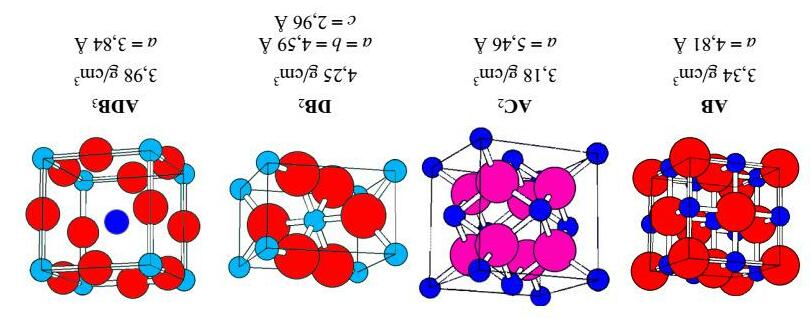
2) Phân loại các chất sau đây theo bản chất của lực tương tác giữa các đơn vị cấu trúc trong mạng tinh thể của chúng: Cu, kim cương, MgO, C6H12O6, I2, Pb, BN, NaH.
c) Tính khối lượng mol mỗi hợp chất. d) Xác định các nguyên tố A, D.
Silic có cấu trúc tinh thể giống kim cương
1) Tính bán kính nguyên tử silic. Cho khối lượng riêng của silic tinh thể bằng 2,33 g/cm3; khối lượng mol nguyên tử của Si bằng 28,1 g.mol-1
2) So sánh bán kính nguyên tử silic với cacbon (rC = 0,077nm) và giải thích
1) Thực nghiệm cho biết ở pha rắn, vàng (Au) có khối lượng riêng là 19,4g/cm3 và có mạng lưới lập phương tâm diện. Độ dài cạnh của ô mạng đơn vị là 4,070.10-10m. Khối lượng mol nguyên tử của Au là 196,97g/mol.
a) Tính phần trăm thể tích không gian trống trong mạng lưới tinh thể của Au.
b) Xác định trị số của số Avogadro.
2) Thực nghiệm cho biết đồng tinh thể có khối lượng riêng D = 8,93 g/cm3; bán kính nguyên tử đồng là 128 pm. Đồng kết tinh theo mạng tinh thể lập phương đơn giản hay lập phương tâm diện? Tại sao?
|
Kim loại M trong tự nhiên chủ yếu chỉ tồn tại dưới dạng hợp chất, chủ yếu là khoáng vật ortho silicate với công thức chung là Mx(SiO4)y, và còn ở dưới dạng oxit. Oxit của nó có nhiều dạng thù hình và thường có kiểu mạng tinh thể đơn tà biến dạng với số phối trí CNmetal = 7. Ở nhiệt độ cao hơn 1100°C thì mạng tinh thể của nó chuyển sang cấu trúc tứ phương. Ở nhiệt độ trên 2000°C thì nó lại mang cấu trúc lập phương biến dạng. Cấu trúc mạng lưới của kiểu tinh thể sau cùng tương tự như kiểu florit, trong đó ion kim loại tạo ô mạng lập phương tâm diện với hằng số mạng a0 = 507 pm. Anion oxit chiếm các hốc tứ diện. Cấu trúc này có thể được bền hóa ở nhiệt độ phòng bằng cách sử dụng CaO. Khối lượng riêng của oxit kim loại tinh khiết (cấu trúc lập phương) trong câu hỏi này là 6.27 g∙cm-3
1) Vẽ cấu trúc ô mạng cơ sở của oxit này.
2) Cho biết công thức thực nghiệm của oxit.
3) Cho biết số oxy hóa của kim loại trong oxit.
4) Số oxy hóa của kim loại trong oxit thì đồng nhất với số oxy hóa của kim loại trong khoáng silicat. Vậy công thức thực nghiệm của silicat là?
5) Ở trên đã đề cập đến kim loại nào? Tính toán chứng minh.
6) Viết cấu hình electron của kim loại.
7) Cho biết số phối trí của cation và anion trong oxit
8) Tính ái lực electron ∆EAH° của oxy (O(g) + 2 e → O2-(g)) dựa trên các dữ kiện nhiệt động học dưới đây:
9) ∆thăng hoaH°(M) = 609 kJ∙mol-1; In(M/Mn+) = 7482 kJ∙mol-1; ∆phân lyH°(O2) = 498 kJ∙mol-1; ∆tinh thểH°(M-oxit) = -10945 kJ∙mol-1; ∆sinhH°(M-oxit) =1100 kJ∙mol-1; Để sản xuất kim loại này cần dùng hai phản ứng. Ở phản ứng thứ nhất thì khoáng silicat sẽ được cacbo – clo hóa, tức là xảy ra phản ứng giữa silicat và cacbon trong khí quyển clo ở nhiệt độ cao. Như vậy sẽ tạo thành clorua kim loại (số oxy hóa của kim loại không đổ) cùng với cacbon oxit và silic tetraclorua. Ở phản ứng thứ hai sau khi loại bỏ sản phẩm phụ thì clorua kim loại bị khử bằng magie. Thủy phân clorua kim loại này sẽ cho oxit kim loại đã được mô tả kỹ ở trên. 10) Viết các phản ứng xảy ra trong quá trình điều chế kim loại. 11) Viết phương trình phản ứng thủy phân clorua kim loại này.
Người ta đã biết một dãy các phức halogenua bền của kim loại M với các số phối trí lần lượt là 6, 7 và 8. Giờ chúng ta sẽ xem xét một phức phối trí 6 [MCl2F4]m+/-, trong đó kim loại có số oxy hóa giống như những chất đã được nói ở trên.
12) Xác định điện tích và tên gọi của ion phức này.
13) Với ion phức này thì có thể có bao nhiêu đồng phân (bao gồm đồng phân cấu tạo và lập thể)? Vẽ cấu trúc của một cặp đối quang. Hướng dẫn
1) Cấu trúc mạng tinh thể: Mn+ ; O2—
Công thức thực nghiệm của oxit: MO2
Số oxy hóa của kim loại: +IV
Công thức thực nghiệm của silicat: MSiO4
Tính toán xác định kim loại:
dm(atom)4.(M(metal)2M(O))
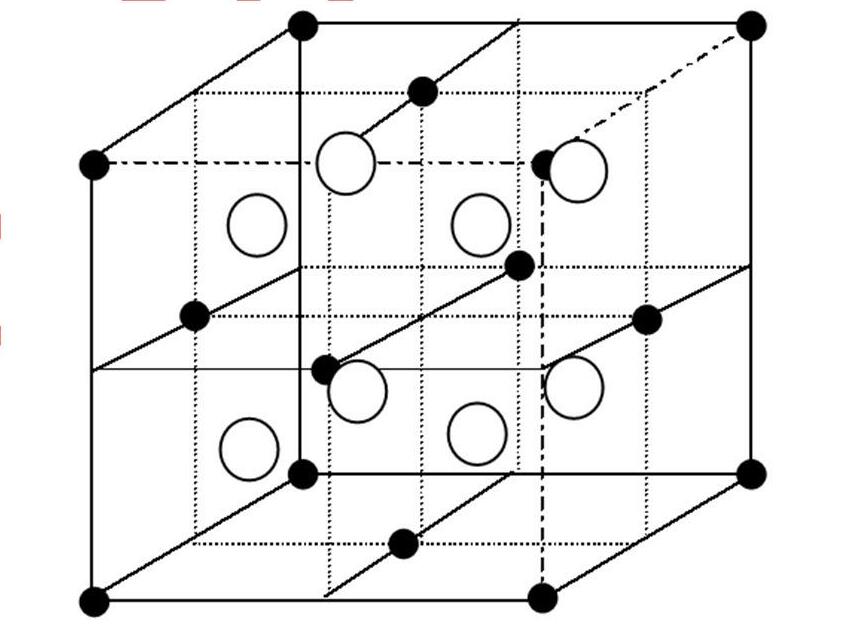
6.286.02210(50710) M(metal)2M(O)3291.22g/mol
Cấu hình electron của kim loại: [Kr]4d25s2
Số phối trí của cation: 8
phối trí của anion: 4
8) Ái lực electron:
Chu trình Born-Haber: ∆=⋅∆−∆−∆−∆−∆ ∆=⋅−−−+−=
Bài 6
000000 EABsublIEGitterdiss 0 1 EA
H0.5(HHHHH) H0.5(1100609748210945498)628kJ.mol
9) Phản ứng điều chế:
ZrSiO4 + 4C + 4 Cl2 → ZrCl4 + SiCl4 + 4 CO
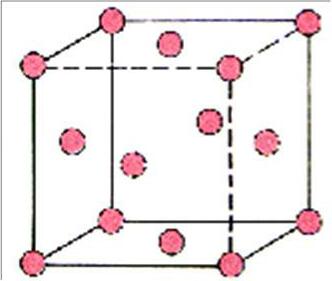
ZrCl4 + 2 Mg → Zr + 2 MgCl2
10) ZrCl4 + 2 H2O → ZrO2 + 4 HCl
11) Điện tích ion phức: -2
Tên ion phức: diclorotetraflorozirconat-(IV)
12) Tổng số đồng phân: 6
Cấu trúc của cặp đối quang:
Máu trong cơ thể người có màu đỏ vì chứa hemoglobin (chất vận chuyển oxi chứa sắt). Máu của một số động vật nhuyễn thể không có màu đỏ mà có màu khác vì chứa một kim loại khác (X). Tế bào đơn vị (ô mạng cơ sở) lập phương tâm diện của tinh thể X (hình dưới), có cạnh bằng 3,62.10-8 cm. Khối lượng riêng của nguyên tố này là 8920 kg/m3 .
a) Tính thể tích của các nguyên tử trong một tế bào và phần trăm thể tích của tế bào bị chiếm bởi các nguyên tử.
b) Xác định nguyên tố X.
|
Đơn chất X ở điều kiện thường tồn tại ở dạng tinh thể bền với ô mạng cơ sở dạng lập phương được biểu diễn như trong hình 1. Hằng số mạng a (chiều dài của ô mạng cơ sở) là a = 5,4309 Å (1 Å = 10-10 m) và khối lượng riêng là 2,329 gam/cm3
Khí hydrogen ở nhiệt độ phòng dễ “hòa tan” vào một số kim loại cụ thể, ví dụ như palladium. Ô mạng cơ sở của palladium có dạng lập phương, được biểu diễn như hình dưới. Tâm của cả các nguyên tử palldium đặt ở các đỉnh và các tâm mặt của hình lập phương (các nguyên tử được xem như những quả cầu cứng). Khối lượng riêng của palladium là 12.02 gam/cm3, khối lượng mol là 106.4 gam/mol.
Hình 1 Hình 2
1) Xác định tên gọi của loại cấu trúc này. Xác định số phối trí của các nguyên tử trong đó.
2) Cấu trúc này được tạo ra bởi hai mạng lập phương tâm diện lồng vào nhau. Hãy xác định các nguyên tử trong mỗi mạng lập phương tâm diện.
3) Trong ô mạng lập phương đặc khít, các khối cầu giống nhau chiếm khoảng 74 % thể tích không gian. So sánh giá trị này với phần thể tích bị chiếm bởi các nguyên tử trong ô mạng ở hình 1. Giải thích tại sao các tinh thể cộng hóa trị của phi kim không có dạng sắp xếp đặc khít.
4) Xác định chất X. Nhờ tính chất vật lí nào mà X được sử dụng rộng rãi và trong lĩnh vực nào?
5) Hình 2 là ô mạng cơ sở của một loại tinh thể vô cơ khác. Cụ thể, đó là tinh thể khoáng chất ZA, khối lượng riêng 4,090 gam/cm3 và hằng số mạng 5,4093 Å. Hàm lượng một trong các nguyên tố là 32,9 %. Xác định chất ZA, tên khoáng chất và loại cấu trúc.
1) Tính số nguyên tử palladium trong 1 ô mạng cơ sở, độ dài cạnh (a) và bán kính của các nguyên tử palladium (r) theo pm (1 pm = 10-12 m).
2) Giả sử rằng các nguyên tử là những quả cầu cứng, tính bán kính nguyên tử cực đại có thể vừa khít với các khoảng trống (hốc) giữa các nguyên tử palladium trong mạng tinh thể.
3) Khoảng cách liên nhân trong các phân tử H2 là 74 pm và bán kính của nguyên tử H là 54 pm. Hydrogen trong mạng tinh thể palladium tồn tại ở dạng nào - nguyên tử, phân tử hay cả hai?
4) Tính số nguyên tử hydrogen cực đại có thể lấp vào ô mạng cơ sở palladium.
5) Về mặt lí thuyết, mỗi thể tích palladium rắn có thể hòa tan tối đa bao nhiêu thể tích khí hydrogen (ở 1 atm và 25 oC).
6) Giả sử rằng cân bằng được thiết lập giữa hydrogen khí và hydrogen tan trong palldium, hãy dẫn ra phương trình sự phụ thuộc của nồng độ nguyên tử hydrogen trong palladium vào áp suất khí hydrogen trên palladium rắn ở nhiệt độ không đổi.
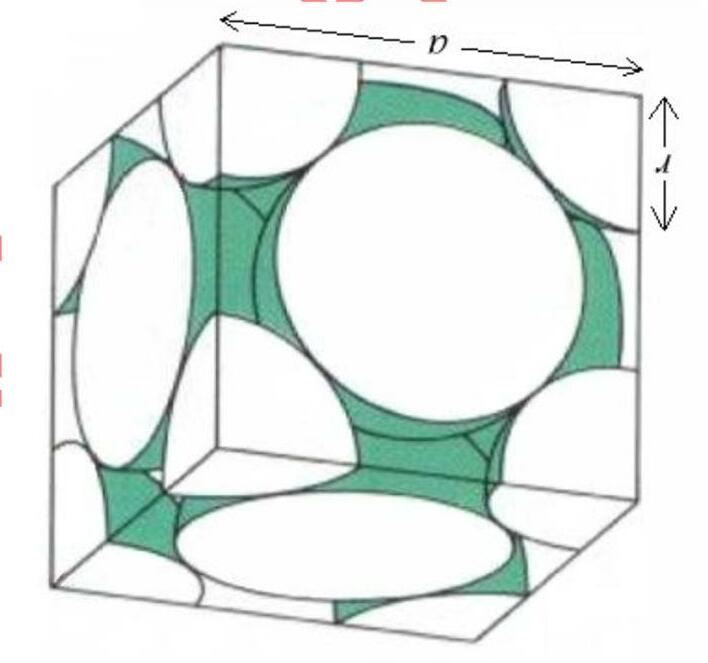
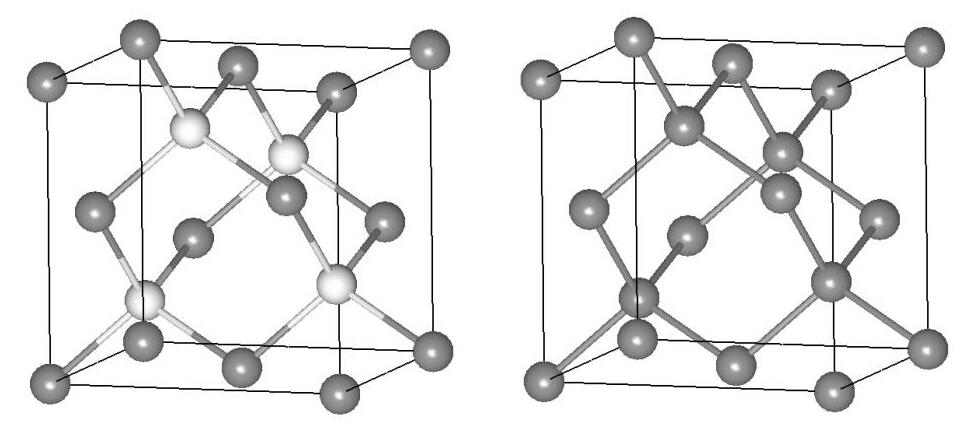
Cacbon dioxit rắn còn gọi là “Nước đá khô”. “Nước đá khô” có cấu trúc tinh thể phân tử và ô mạng cơ sở có cấu trúc lập phương tâm diện chứa các phân tử cacbon dioxit.
a) Tính khối lượng riêng của “Nước đá khô”, ρ, khi độ dài các cạnh biên (tổng dài và rộng) của ô mạnh lập phương “Nước đá khô” là 0.56 nm.
b) Tính số phân tử cacbon dioxit, N, trong ô mạng lập phương “Nước đá khô” kích thước 20 cm × 10 cm × 5.0 cm.
Bài 10
Dưới đây là cấu trúc tinh thể của một oxide kim loại. Trong đó, các quả cầu nhỏ biểu diễn nguyên tử kim loại, còn các quả cầu lớn biểu diễn nguyên tử oxygen, các đường kẻ biểu diễn ô mạng cơ sở của tinh thể này.
a) Xác định các số phối trí của kim loại (m) và oxygen (n). b) Xác định số nguyên tử kim loại (p) và oxygen (q) trong ô mạng cơ sở. c) Xác định công thức oxide, kí hiệu kim loại là M.
|
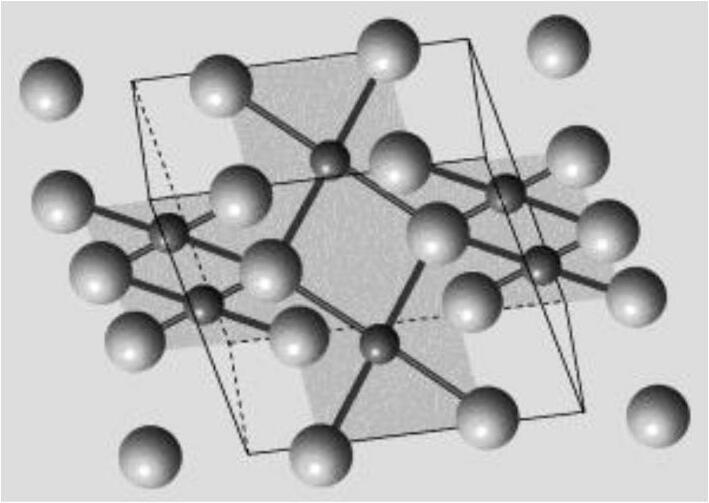
Kim loại X tồn tại trong tự nhiên dưới dạng khoáng vật silicát và oxit. Oxit của X có cấu trúc lập phương với hằng số mạng a = 507pm, trong đó các ion kim loại nằm trong một mạng lập phương tâm diện, còn các ion O2chiếm tất cả các lỗ trống (hốc) tứ diện. Khối lượng riêng của oxit bằng 6,27 g/cm3
1) Vẽ cấu trúc tế bào đơn vị (unit cell) của mạng tinh thể của oxit;
2) Xác định thành phần hợp thức của oxit;
3) Xác định số oxi hoá của X trong oxit;
4) Cho biết công thức hoá học của silicat tương ứng (giả thiết Xm(SiO4)n);
5) Xác định khối lượng nguyên tử của X và gọi tên nguyên tố đó.
Cho M là một kim loại hoạt động. Oxit của M có cấu trúc mạng lưới lập phương với cạnh của ô mạng cơ sở là a = 5,555 Å. Trong mỗi ô mạng cơ sở, ion O2- chiếm đỉnh và tâm các mặt hình lập phương, còn ion kim loại chiếm các hốc tứ diện (tâm của các hình lập phương con với cạnh là a/2 trong ô mạng). Khối lượng riêng của oxit là 2,400 g/cm3
a) Tính số ion kim loại và ion O2- trong một ô mạng cơ sở.
b) Xác định kim loại M và công thức oxit của M
c) Tính bán kính ion kim loại M (theo nm) biết bán kính của ion O2- là 0,140 nm
Kết quả nhiễu xạ tia X cho thấy MgCl2 khan là một hệ tinh thể tam tà (ba nghiêng) với cấu trúc xếp lớp, các chloride ion sắp xếp theo mạng lập phương đặc khít (ccp) còn các nguyên tử magnesium chiếm các hốc bát diện. Ảnh chiếu dọc theo trục thẳng đứng của các chloride ion được cho dưới đây. Các thông số của ô mạng lập phương là: a = 363.63 pm; c = 1766.63 pm; khối lượng riêng ρ = 2.35 gam∙cm-3
Bài 14
CuCl kết tinh dưới dạng lập phương tâm mặt (kiểu NaCl)
a) Tính số phân tử CuCl chứa trong một ô mạng cơ sở này.
b) Xác định bán kính ion Cu+ .
Cho: hằng số Avogađro NA = 6,022.1023 mol-1; Khối lượng riêng của CuCl, D = 4,136 g.cm-1; bán kính ion Cl , Cl r = 1,84 o A
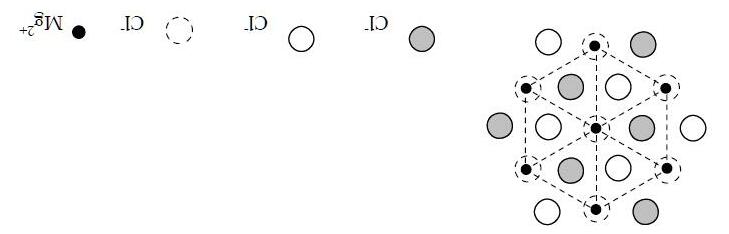
1) Sử dụng các kí tự A, B, C để kí hiệu các lớp Cl và a, b, c để kí hiệu các lớp Mg2+ để biểu diễn cấu trúc 3 lớp bằng phương pháp xếp chồng.
2) Tính số đơn vị MgCl2 trong một ô lục phương.
3) Giả sử tất cả các hốc bát diện trong tinh thể được lấp đầy bởi các Mg2+ ion, tinh thể thuộc kiểu cấu trúc gì?
|
Xét ô mạng cơ sở CsCl.
a) Mỗi loại ion (Cs+; Cl ) có mạng tinh thể Bravais kiểu gì: lập phương đơn giản (P); lập phương tâm khối (I); lập phương tâm mặt (F)?
b) Tính số ion mỗi loại có trong một ô mạng cơ sở.
c) Số phối trí của Cs+ và Cl là bao nhiêu?
d) Trong một thí nghiệm, khi chiếu chùm tia X có bước sóng λ = 1,542 Å vào tinh thể CsCl, người ta thấy rằng có sự phản xạ bậc 1 từ mặt (100). Góc của chùm tia X với mặt (100) là θ = 10,78o. Tính khối lượng riêng của tinh thể CsCl theo g⋅cm−3 .
e) Tính bán kính ion của Cs+ theo Å, biết bán kính ion của Cl là 1,81 Å.
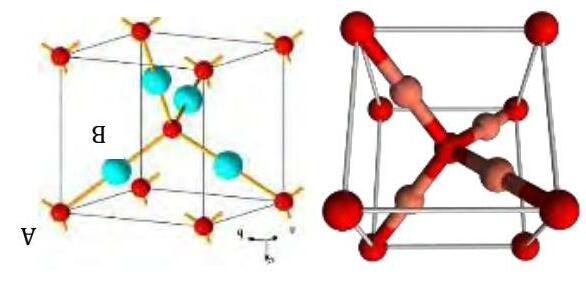
Một trong những vật liệu đầu tiên được sử dụng trong lĩnh vực điện tử thể rắn là copper(I) oxide đỏ. Ngày nay, vai trò của nó đã được làm mới, dưới dạng thành phần không độc và giá thành rẻ trong pin năng lượng mặt trời
Hai hình trên mô tả ô mạng lập phương tâm khối của tinh thể Cu2O. Hằng số mạng của cấu trúc này là 427,0 pm. 1)
a) Nguyên tử nào (A hay B) là đồng? Cấu trúc nào (lập phương đơn giản, lập phương tâm diện, lập phương tâm khối, kim cương) được tạo thành bởi các nguyên tử A; và cấu trúc nào được tạo thành bởi các nguyên tử B? Xác định số phối trí của các nguyên tử. b) Tính các khoảng cách O-O, Cu-O, Cu-Cu cực tiểu trong cấu trúc. c) Tính khối lượng riêng của copper(I) oxide.
Khiếm khuyết thường xuất hiện trong tinh thể này là hiện tượng thiếu một số nguyên tử đồng, trong khi mạng lưới oxygen không thay đổi. Nghiên cứu một mẫu tinh thể như vậy thì thấy có 0,2 % số nguyên tử đồng có số oxid hóa +2.
2) Tính phần trăm số tâm Cu thông thường bị trống trong mẫu tinh thể. Xác định giá trị x trong công thức thực nghiệm Cu2-xO của tinh thể.
Bằng phương pháp nhiễu xạ tia X, người ta đã ghi được các kết quả sau: Ở 20 oC, NH4Cl kết tinh theo mạng lập phương với hằng số mạng a = 3,88 Å và khối lượng riêng d = 1,5 g/cm3 . Ở 250 oC, NH4Cl kết tinh theo mạng lập phương với hằng số mạng a = 6,53 Å và khối lượng riêng d = 1,3 g/cm3 .
Từ các dữ kiện trên hãy cho biết:
a) Kiểu mạng Brave (Bravais) của các tinh thể hình thành ở 20oC và 250oC.
b) Khoảng cách N – Cl theo Å cho từng kiểu mạng tinh thể đã xác định ở ý a).
Bài 17
Cấu trúc tinh thể hợp chất cacbua (carbide) của kim loại kiềm thổ MC2 (M = Mg, Ca, Sr và Ba) được nghiên cứ trong hai thập kỷ gần đây. Kết quả nhiễu xạ tia X cho thấy: ở nhiệt độ phòng, tinh thể của chúng có cấu trúc kiểu NaCl biến dạng. Các cation M2+ tạo thành mạng lập phương tâm diện biến dạng theo môt trục tinh thể (trục z, hình vẽ), còn anion chiếm tất cả các hốc bát diện của mạng này. Trong mạng tinh thể của MC2 (M = Ca, Sr, Ba), các anion định hướng song song với phương biến dạng. Với mạng tinh thể của MgC2: trong một lớp vuông góc với phương biến dạng, các anion song song với nhau và song song với trục x hoặc trục y (hình vẽ); các anion ở hai lớp kế tiếp thì vuông góc với nhau.
1) Vẽ ô mạng tinh thể của MgC2 và CaC2. Chú ý rằng, trong mỗi mạng tinh thể MC2, môi trường phối trí của các cation M2+ hoàn toàn tương đồng.
2) Dựa trên các thông số thực nghiệm trong bảng sau, xác định số lượng nguyên tử C phối trí với ion Mg2+ và Ca2+ trong khoảng cách giới hạn 3Å. MC2 Khối lượng riêng ρ (g.cm 3) Tỉ số c/a Độ dài liên kết C C (Å)
MgC2 2,065 0,9025 1,215 CaC2 2,207 1,1619 1,200
3) Độ dài liên kết C-C trong mạng tinh thể BaC2 là 1,186 Å. Giải thích sự khác biết giữa các giá trị độ dài liên kết C-C trong các hợp chất MC2 (M = Mg, Ca, Ba).
4) Ở nhiệt độ cao, tinh thể MC2 (M = Ca, Sr, Ba) chuyển sang trạng thái tinh thể mới với kiểu cấu trúc NaCl chuẩn. Nhiệt độ chuyển pha của CaC2, SrC2 và BaC2 lần lượt là 490oC, 370oC và 250oC. Trong khi đó, tinh thể MgC2 phân hủy ở 497oC và không chuyển pha. Giải thích hiện tượng này.
|
Bất chấp cái tên có ý nghĩa là “người sắt”, thực tế thì bộ giáp của siêu anh hùng trong truyện tranh Iron Man lại được làm từ hợp kim của titanium và vàng. Tháng 7/2016, các nhà nghiên cứu đã tìm thấy một hợp chất titanium-vàng có công thức Ti3Au cứng hơn titanium tinh khiết (khoảng 4 lần) và đa số các loại thép cứng nhất. Nhờ tính tương hợp sinh học nên hợp kim này cũng lí tưởng để làm các khớp háng và khớp gối nhân tạo, hoặc các loại vít và mô cấy để điều trị nứt xương. Gần đây, lớp mỏng titanium nitride, TiN, đã được sử dụng để tăng độ cứng của titanium. Hợp chất này làm cho titanium có màu vàng (gold) đẹp và Iron Man hẳn có thể lựa chọn để làm cho bộ giáp của mình trông “bảnh chọe” hơn. Các lớp TiN mỏng thường được điều chế bởi kĩ thuật lắng đọng phase hơi hóa học, trong đó TiN được tạo thành trên chất nền được nung nóng trên 320 oC trong khí quyển titanium(IV) chloride và ammonia. Dưới đây là phương trình chưa cân bằng của phản ứng này: aTiCl4(g) + bNH3(b) → cTiN(s) + dHCl(g) + eN2(g) a)
i. Xác định số oxid hóa của titanium trong titanium nitride, TiN.
ii. Nguyên tố nào đã bị oxid hóa trong phản ứng trên.
iii. Nguyên tố nào đã bị khử trong phản ứng trên.
iv. Cân bằng phương trình trên.
Để tạo các hợp kim titanium-vàng, hai nguyên tố đã được nung nóng cùng nhau theo các tỉ lệ phù hợp, trong khí quyển argon trơ.
b) Giả sử rằng để chế tạo bộ giáp của Iron Man cần 40 kg hợp kim Ti3Au, tính khối lượng của titanium và vàng cần thiết.
Ứng với công thức Ti3Au, có hai dạng hợp kim (gọi là dạng α và β). Sự sắp xếp các nguyên tử theo các dạng này được biểu diễn theo ô mạng cơ sở. Một ô mạng được xác định bằng nhiễu xạ tia X cho thấy sự sắp xếp các nguyên tử tạo thành cấu trúc khối khi các ô mạng xếp chồng lên nhau.
Các ô mạng của α- và β-Ti3Au đều là những khối lập phương. Độ cứng của hợp kim tùy thuộc vào số tương tác (liên kết) của mỗi nguyên tử và chiều dài các liên kết.
Dưới đây là ô mạng của dạng α được biểu diễn theo 2 góc nhìn. Ô mạng cơ sở có 1 nguyên tử vàng nằm ở tâm của mỗi góc của khối lập phương,
và 1 nguyên tử titanium nằm ở tâm mỗi mặt. Chiều dài cạnh lập phương là 4.15 Å.
e) Trong cấu trúc khối của β-Ti3Au được tạo ra bằng cách xếp chồng các ô mạng cơ sở, các nguyên tử tittanium được bao quanh bởi các nguyên tử vàng và các nguyên tử titanium khác. Tuy nhiên, bây giờ có hai loại khoảng cách giữa các nguyên tử titanium: với các nguyên tử kế cận (nearest neighbour) và các nguyên tử kế cận tiếp theo (nextnearest).
i. Có bao nhiêu nguyên tử titanium quanh mỗi nguyên tử vàng?
ii. Có bao nhiêu nguyên tử vàng quanh mỗi nguyên tử titanium?
iii. Có bao nhiêu nguyên tử kế kế cận và kế cận tiếp theo quanh mỗi nguyên tử titanium?
f)
Trong cấu trúc khối của α-Ti3Au tạo thành bằng cách xếp chồng các ô mạng cơ sở với nhau, các nguyên tử titaniym được bao xung quanh bởi các nguyên tử vàng và các nguyên tử titanium khác. c)
i. Có bao nhiêu nguyên tử titanium quanh mỗi nguyên tử vàng?
ii. Có bao nhiêu nguyen tử vàng quanh mỗi nguyên tử titanium?
iii. Có bao nhiêu nguyên tử titanium quanh mỗi nguyên tử vàng?
d)
i. Tính độ dài khoảng cách Ti-Au.
ii. Tính khoảng cách ngắn nhất giữa 2 nguyên tử titanium. Dạng β cũng có 1 nguyên tử vàng ở tâm mỗi góc của khối lập phương, và cũng có 1 nguyên tử ở tâm của khối lập phương. Chiều dài cạnh lập phương là 5.09 Å. Các nguyên tử titanium được sắp xếp thành từng cặp trên mỗi mặt, với khoảng cách của mỗi cặp đúng bằng ½ chiều dài cạnh lập phương. Cặp Ti-Ti được sắp xếp ở tâm mặt, song song với một trong các cạnh của khối lập phương. Các cặp Ti-Ti trên các mặt kề nhau của khối lập phương được tạo thành các góc vuông.
i. Tính khoảng cách Ti-Au.
ii. Tính khoảng cách giữa một nguyên tử titanium với nguyên tử liền kề tiếp theo của nó.
|
Một tinh thể đại phân tử thu được từ dung dịch urea và oxalic acid. Kết quả nhiễu xạ tia X cho thấy: tinh thể thuộc hệ đơn tà, các thông số mạng: a = 505.8 pm, b = 1240 pm, c = 696.4 pm, β = 98.13o. Hai phân tử trong tinh thể tạo thành cấu trúc không gian hai chiều bởi liên kết hydrogen. Khối lượng riêng của tinh thể là D = 1.614 gam cm-3
1) Tính tỉ lệ các phân tử oxalic acid và urea trong tinh thể.
2) Vẽ cấu trúc hóa học biểu diễn các liên kết hydrogen trong tinh thể.
Bài 20
Những năm gần đây, có sự đột biến trong nhu cầu indium cho các màn hình cảm ứng và hiển thị. Do sự khan hiếm, thậm chí có những lo ngại rằng nguồn cung toàn cầu sắp cạn kiệt, nên giá của nguyên tố này đã tăng vọt. Nguyên tố này chủ yếu được sử dụng cho các loại kính dẫn điện trong suốt ITO, indium tin oxide.
a) Indium(III) oxide có thể được tạo thành bằng cách đun nóng indium(III) hydroxide. Viết phương trình phản ứng.
Kính ITO 90% indium(III) oxide, 10% tin(IV) oxide, về khối lượng. Như chiếc iPad ở trên có khoảng 27 mg kính ITO trong màn hình cảm ứng của nó.
b)
i. Tính khối lượng indium có trong kính ITO của màn hình iPad.
ii. Hàm lượng indium của kính ITO của màn hình cảm ứng được lấy khoảng 700 mg/m2. Cho biết khối lượng riêng của kính ITO khoảng 7.15 g/cm3, tính độ dày kính ITO trong màn hình cảm ứng.
Indium(III) oxide có thể tồn tại ở dạng cấu trúc tinh thể lập phương dạng bixbyite. Vị trí của các indium ion gần giống ô mạng cơ sở của cấu trúc lập phương tâm diện (FCC) như trong hình trên. Trong cấu trúc FCC, các ion được đặt ở các góc của khối lập phương và tâm của các mặt.
c) Tính số indium ion thực tế có trong khối lập phương. Bạn sẽ cần chú ý đến tỉ lệ chiếm chỗ của mỗi ion trong khối lập phương.
d) Các oxide ion chiếm các vị trí nằm hoàn toàn bên trong khối lập phương. Xác định có bao nhiêu oxide ion có trong ô mạng lập phương trên.
e) Khi nung indium(III) oxide tới 700 oC trong không khí thì khối lượng của nó giảm 11.5 %. Xác định công thức phân tử hợp chất tạo thành.
|
f) Khi nung indium(III) oxide ở 630 oC trong ammonia thì các sản phẩm tạo thành là nước và một bán dẫn. Đề xuất công thức của bán dẫn.
Bài 21 Giai đoạn đầu thế kỉ 17 là bước chuyển với nền kinh tế Thuỵ Điển khi họ mất quyền kiểm soát các mỏ bạc ở Nauy nhưng lại sát nhập được các vùng đất Baltic (gồm Tartu và Riga) vào lãnh thổ. Để đáp ứng nhu cầu tiền mặt cho chiến tranh, vua Thuỵ Điển đã quyết định khai thác các nguyên liệu thô từ khu mỏ lớn Falun để sản xuất các đồng xu bằng đồng có giá trị gần với các đồng xu bằng bạc. Những đồng xu bằng đồng đầu tiên được phát hành vào năm 1624, với khối lượng mỗi đồng lên tới 19.7 kg và có kích thước chiếm tới 2205 cm3 Đồng có cấu trúc mạng tinh thể lập phương tâm diện (fcc) với hằng số mạng 361.5 pm. Trong tự nhiên, đồng tồn tại dưới dạng các khoáng sulphide, ví dụ như chalcopyrite (chứa 35 % khối lượng là đồng), chalcocite (chứa 80 % khối lượng).
1) Xác định công thức hoá học của quặng chalcopyrite và chalcocite. Ngày nay, đồng thậm chí còn được chiết xuất từ những loại quặng chỉ có hàm lượng đồng nhỏ cỡ 0.60 %.
2) Viết các phương trình phản ứng xảy ra trong quá trình chiết xuất đồng từ một loại quặng chứa chalcocite, biết rằng sản phẩm trung gian là đồng(I) oxide.
3) Tính khối lượng quặng cần thiết để sản xuất lượng đồng đủ chế tạo một đồng xu Thuỵ Điển. Đồng(I) oxide là hợp chất màu nâu đỏ, có trong thành phần của một số loại sơn chống gỉ. Khi trộn với chalcocite, đồng(I) oxide bị khử, tạo thành đơn chất đồng và sulphur dioxide. Cho các dữ kiện sau (Lưu ý: s = rắn; g = khí)
Hợp chất (và trạng thái) Cu2O(s) Chalcocite(s) Cu(s) SO2(g)
Enthalpy tạo thành chuẩn, kJ.mol-1
-168.6 -79.5 -296.8 Entroly chuẩn, kJ.mol-1 93.1 120.9 33.2 248.2
|
Nhiệt độ nóng chảy, oC 1232 1130 1084
Enthalpy thăng hoa, kJ.mol-1 13
4) Tính năng lượng Gibbs của phản ứng khử đồng(I) oxide ở điều kiện chuẩn (25 oC).
5) Hoàn thành bảng sau bằng cách chỉ rõ dấu của các hàm nhiệt động trong phản ứng khử đồng(I) oxide.
Nhiệt độ 0 oC 500 oC 1000 oC
Dấu của ∆H
Dấu của ∆S
Dấu của ∆G
6) Tính năng lượng Gibbs của phản ứng khử đồng ở nhiệt độ 1100 oC.
Nhà hoá học trẻ Grzegorz quyết định tái sử dụng các đồng tiền xu. Ông chế tạo một bình điện phân, sử dụng đồng xu Thuỵ Điển và một sợi dây đồng gần như tinh khiết làm điện cực, đồng(II) nitrate là chất điện giải.
7) Đồng xu Thuỵ Điển được dùng làm điện cực nào (anode/ cathode)? Viết bán phản ứng tương ứng.
8) Cần bao nhiêu giờ để tái chế hoàn toàn đồng xu Thuỵ Điển nếu thực hiện quá trình điện phân bằng dòng điện 1.00 A?
9) Ngày nay, đồng được sử dụng để sản xuất cáp mạng internet. Tính chiều dài của một sợi cáp đồng đường kính 0.1 mm có thể được tạo ra từ đồng xu Thuỵ Điển.
10) Tính số đồng xu cần để tạo ra lượng đồng đủ cho sợi cáp dài 600 km (bằng khoảng cách từ Tallinn đi qua Riga, đến Vilnius). Ngày nay, đồng được dùng thường là nguyên liệu tái chế. Một phương pháp để tái chế đồng là hoà tan vào nitric acid. Acid này phản ứng với đồng theo hai hướng dưới đây.
11) Hoàn thành các phương trình phản ứng oxid hoá-khử sau:
(1) Cu + HNO3 = NO +
(2) Cu + HNO3 = NO2 + Các báo cáo khoa học chỉ ra rằng việc oxid hoá hoàn toàn carbon monoxide có thể được thực hiện ở nhiệt độ phòng với xúc tác đồng(II) oxide không có chất mang. Đồ thị dưới đây biểu diễn logarit tự nhiên của tốc độ phản ứng oxid hoá dưới dạng hàm số của 1/T, trong đó T là nhiệt độ tính theo Kelvin (K).
12) Sử dụng các dữ kiện trong đồ thị, tính năng lượng hoạt hoá của phản ứng oxid hoá carbon monoxide.
13) Enthalpy của phản ứng đốt cháy hoàn toàn carbon (ở trạng thái graphite rắn) là -393 kJ.mol-1, còn enthalpy hình thành chuẩn của carbon monoxide là -111 kJ.mol-1. Vẽ giản đồ năng lượng của phản ứng oxid hoá carbon monoxide và chỉ ra sự chênh lệch năng lượng ở các vị trí cần thiết (∆E, ∆H)
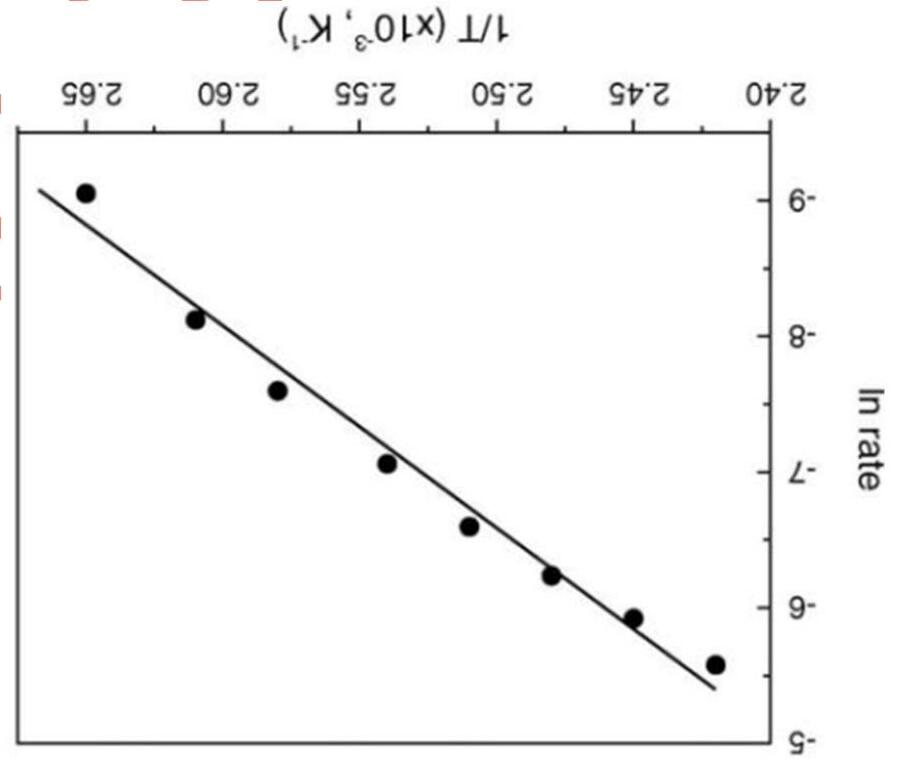
Ngày nay, đồng vẫn được sử dụng để sản xuất tiền xu. Một nhà hoá học trẻ quyết định xác thực điều này bằng cách phân tích đồng 2 EUR bằng nhiễu xạ tia X. Dưới đây là giản đồ nhiễu xạ thu được:
|
Sử dụng phương trình Bragg
Trong đó d là khoảng cách giữa các mặt nhiễu xạ (nm); λ là bước sóng của tia X (trong trường hợp này là 0.15408 nm); 2θ là góc nhiễu xạ và Trong đó d là khoảng cách giữa các mặt nhiễu xạ (nm); a là hằng số mạng; h, k, l là các chỉ số Miller. Đối với mạng tinh thể lập phương tâm diện (fcc), chỉ xuất hiện các peak nhiễu xạ khi tất cả chỉ số Miller là đều số chẵn hoặc đều là số lẻ.
14) Xác định trong giản đồ nhiều xạ (các) peak tương ứng với đồng và xác định ít nhất một bộ chỉ số Miller ứng với mỗi peak.
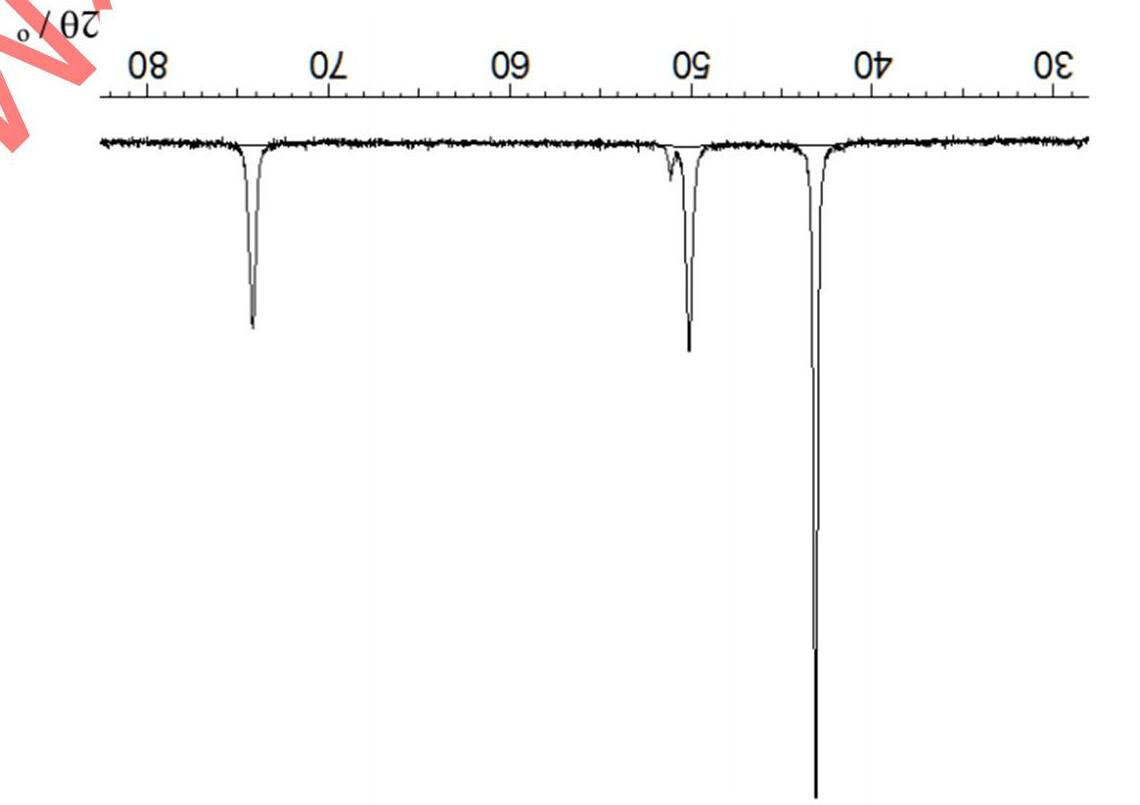
Bài 22
Điện phân dung dịch sodium acetate thu được hỗn hợp các khí X và Y ở anode. Các khí này được dẫn qua dung dịch nước vôi trong vừa điều chế và X bị hấp thụ hoàn toàn, tạo thành kết tủa trắng. Làm lạnh khí Y tinh khiết về 90.23 K thì các tinh thể không màu được kết tinh. Kết quả nhiễu xạ tia X cho thấy tinh thể thuộc kiểu mạng lập phương tâm khối, có hằng số mạng a = 530.4 pm, Z = 2, khối lượng riêng ρ = 0.669 g cm-3. Sau khi làm lạnh, tinh thể bị chuyển thành hệ đơn tà (một nghiêng), a = 422.6 pm, b = 562.3 pm, c = 584.5 pm, β = 90.41o
a) Xác định công thức phân tử của X. Viết phương trình phản ứng giữa X với nước vôi.
b) Biết phân tử Y trục quay bậc 3. Xác định cấu trúc của Y.
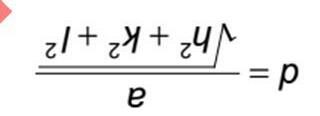
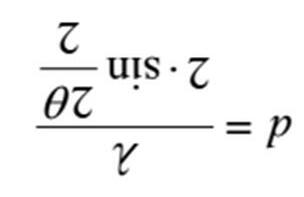
c) Viết phương trình bán phản ứng anode khi điện phân dung dịch sodium acetate.
d) Xác định số phân tử Y trong ô mạng cơ sở đơn tà.
e) Trong quá trình làm lạnh, tinh thể bị chuyển thành tinh thể đơn tà với mức độ đối xứng thấp. Giải thích ngắn gọn nguyên nhân.
Năm 1929, nhà hoá học kiệt xuất người Mỹ Linus Pauling đã công bố 5 quy tắc để xác định cấu trúc của các tinh thể ion:
(1) khoảng cách ngắn nhất giữa các ion được xác định bởi tổng bán kính ion, trong khi đó số phối trí thì xác định dựa vào tỉ lệ của chúng;
(2) tổng điện tích của cation quanh mỗi anion bằng điện tích của anion;
(3) độ bền của cấu trúc giảm đáng kể bởi sự có mặt các cạnh và mặt kế cận trong đa diện phối trí (CP); (4) các cation nhỏ và có hoá trị lớn có xu hướng không chung anion; (5) số CP với cấu trúc khác nhau có xu hướng đạt giá trị cực tiểu. Nhiều hợp chất lưỡng nguyên tố dạng A+B tạo ra các mạng tinh thể với cấu trúc I, II (độ bền của các hợp chất trong các dạng I, II phù hợp với lí thuyết Pauling).
Biến thiên nội năng là 2.98 kJ/mol, biến thiên entropy là -10 J/(mol K) (xem các giá trị này là hằng số).
3) Chọn ra những nguyên nhân về sự phù hợp của quy tắc (5) với I và II: a) cân bằng nhiệt động trong tinh thể; b) các CP với khoảng cách giữa các cation khác nhau sẽ không tạo thành mạng; c) các CP với số phối trí khác nhau không thể tạo thành mạng chung; d) sự ưu tiên của CP có liên quan đến sự đối xứng của các orbital A+ e) năng lượng bề mặt tối thiểu trong đồ thị G(p, T, A+, B ) là duy nhất.
4) Với I và II, hãy tính tỉ lệ Rmin/Rmax với các ion mà tại đó sự tiếp xúc của các ion cùng loại được quan sát thấy (cấu trúc đặc khít hơn thì bền hơn, những điều kiện khác bằng nhau):
a) trên đoạn [0;1] của đồ thị Rmin/Rmax, đánh dấu các vùng bền của I và II;
b) xác định các số phối trí ứng với các điểm đầu của mỗi đoạn.
5) Đề xuất lời giải thích cho các quy tắc (3), (4). Trong mỗi trường hợp, sự làm giảm tính bền được xác định bởi a) lực đẩy giữa các cation, b) lực đẩy giữa các anion?
6) Fe3O4 có cấu trúc spinel ngược: 1/3 số cation có số phối trí bằng 4, các cation còn lại (FeII và FeIII - bằng nhau) có phối trí bát diện. Với ví dụ này, hãy đưa ra một hoặc hai lời giải thích hợp lí cho sự sai lệch với mỗi quy tắc của Pauling.
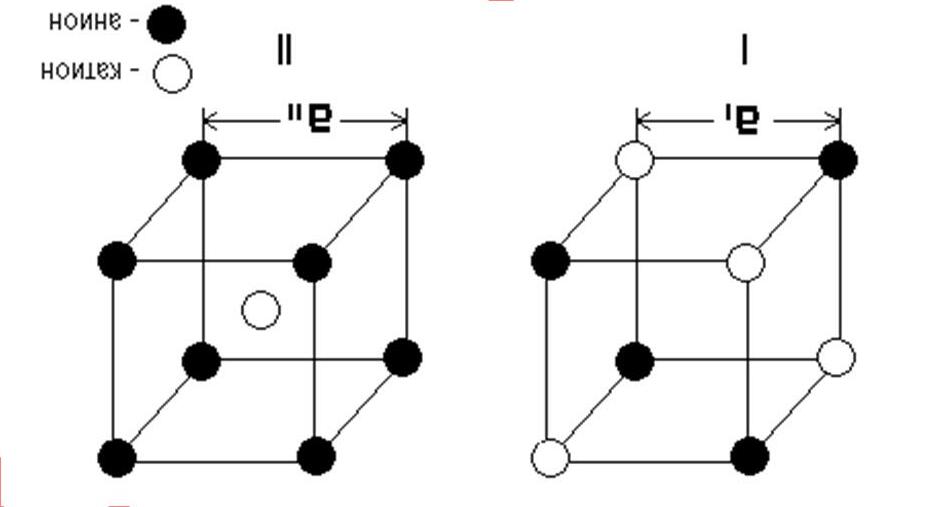
1) Tính khối lượng riêng của CsF. Để tính được, hãy xác định: a) các thông số mạng a(I) và a(II), biết bán kính ion của các cation và anion;
b) số phân tử trong ô mạng cơ sở của cấu trúc I, II.
c) xác định biểu thức tính khối lượng riêng của cesium fluoride với các cấu trúc I, II (viết kết quả theo đơn vị kg/m3).
Sử dụng các giá trị sau: R(F ) = 1.33 Å; R(Cs+) = 1.67 Å; 1 Å = 10-10 m; M(CsF) = 0.1519 kg/mol; NA = 6.022 ∙ 1023 mol-1
2) Tính áp suất (Pa) tại đó sự chuyển đổi đa hình CsF(II) → CsF(I) diễn ra ở 25 oC, sử dụng các giá trị khối lượng riêng tính được và
∆=∆+∆−∆= IIIIIIIIIIII GUpVTS0
|
Cấu trúc các tinh thể được khảo sát dựa vào nghiên cứu ảnh nhiễu xạ, là kết quả của sự tán xạ tia X của các mặt phẳng nguyên tử trong mạng tinh thể. Mô hình nhiễu xạ tia X chứa một bộ tín hiệu hẹp, tương ứng với phương trình Bragg-Wolf: λ = 2dsinθ với λ là bước sóng, d là khoảng cách giữa các mặt, θ là góc nhiễu xạ.
Trong trường hợp các ô mạng lập phương, với họ mặt phẳng, d có thể được biểu diễn bởi 3 số tự nhiên h, k, l (mỗi chỉ số này thể hiện số hằng số mạng nằm giữa họ mặt phẳng này trên các trục x, y, z) và hằng số mạng lập phương a phù hợp với phương trình sau:
1N d N
RR t 2RR + = +
() XO YO
Cấu trúc bền với t = 1.00 ± 0.20. Chọn các cặp cation khi kết hợp với nhau trong oxide sẽ tạo thành một hợp chất thuộc kiểu cấu trúc này. Bán kính ion của các cation tính theo đơn vị Å; RO = 1.40 Å): Ba2+ (1.35) và Ni2+ (0.73); La3+ (1.26) và Mn3+ (0.65); Zn2+ (0.74) và Ti4+ (0.61); Ag+ (1.13) và Nb5+ (0.66).
22 hkl 222
= =++ a hkl
Thiết lập mô hình nhiễu xạ tia X nghĩa là tìm các chỉ số hkl ứng với các giá trị 2θ của mỗi peak để tính hằng số mạng a. Ví dụ, bảng sau đây chứa dữ liệu của mô hình nhiễu xạ tia X đã được thiết lập (λ = 1.54060 Å):
2θ 20.722 29.470 36.301 42.164 47.426 52.277 61.154 h,k,l 1,0,0 1,0,0 1,1,1 2,0,0 2,1,0 2,1,1 2,2,0
1) Tính hằng số mạng a theo Å.
2) Ô mạng cơ sở (lập phương) của một trong những kiểu cấu trúc phổ biến nhất trong các oxide hỗn hợp được cho dưới đây: Xác định công thức đơn giản nhất của kiểu cấu trúc này (BaaTibOc, trong đó a, b, c là các số tự nhiên tối giản).
3) Năm 1926, nhà địa hóa học người Na Uy Victor Goldshmidt đã đề xuất tiêu chí định lượng để dự đoán tính bền của các kiểu cấu trúc của các oxide hỗn hợp XaYbOc:
4) Nhiều hợp chất thuộc loại này có khiếm khuyết (biến dạng). Các cấu trúc có thể tạo thành qua sự biến dạng của cấu trúc lập phương được cho trong bảng (a, b, c là các thông số; α, β, γ là các góc của ô mạng cơ sở: Cấu trúc Lập phương (ban đầu)
a = b = c; α = β = γ = 90o
a = b < c; α = β = γ = 90o
a = b < 0.7c; α = β = 90o γ = 120o
a ≠ b ≠ c α = β = γ = 90o
Tứ phương Lục phương Hình thoi Đơn tà Mối liên hệ giữa a, b, c và α, β, γ
a ≠ b ≠ c α = β = 90o γ > 90o
a) Xét hợp chất chứa Ba2+, Ti4+ (BaaTibOc). Chọn kiểu cấu trúc có thể tạo thành bằng cách kéo căng mạng dọc theo các vector sau:
• (1;0;0)
• (1;1;0)
• (1;1;1)
b) Nghiên cứu nhiễu xạ tia X của hợp chất ở ý 1 sau khi ủ cho thấy có sự tách thành 2 peak của cực đại tương ứng với hkl là (100) trong mạng lập phương ban đầu. Kiểu cấu trúc biến dạng nào đã được tạo thành qua quá trình ủ?
1) Giá trị 2θ với các peak trong mô hình nhiễu xạ thực nghiệm của hợp chất K2Na[AlF6] (λ = 1.54056 Å) được cho sau đây:
2θ 18.918 21.879 31.159 38.353 44.599 48.817 50.166
2θ 55.367 59.040 64.899 68.253 69.352 73.720 77.961
|
• Xác định mô hình nhiễu xạ tia X và tính hằng số mạng.
• Xác định kiểu kết cấu định tâm của mạng lập phương của K2Na[AlF6].
Biết rằng mô hình nhiễu xạ tia X của
• mạng tâm khối chỉ có các peak với h + k + l = 2p;
• mạng tâm diện chỉ có các peak với h + k = 2n, k + l = 2m, h + l = 2t, trong đó p, n, m, t là các số tự nhiên.
Bài 25
Sàng phân tử là các tinh thể (tự nhiên hoặc tổng hợp) aluminosilicate ngậm nước dạng zeolite. Có hàng tá loại sàng phân tử mà phổ biến nhất là các zeolite kiểu A, X, Y và mordenite. Tất cả các khung cấu trúc đều có công thức phân tử dạng Mm[AlpSiqOn(p+q)]∙xH2O.
1) Bán kính của các ion Si4+, Al3+, O2- lần lượt là 41 pm, 50 pm, 140 pm. Bằng tính toán, hãy cho biết các ion Si4+ và Al3+ trong các tinh thể aluminosilicate chiếm các hốc đa diện nào?
2) Tính giá trị n trong công thức trên. Biết M là ion +2, xác định mối liên hệ giữa m và p.
3) Kết quả nhiễu xạ tia X cho thấy độ dài liên kết Si-O là 160 pm. Dữ kiện này nói lên điều gì?
4) Giải thích các hiện tượng sau: a) tỉ lệ silicon/nhôm (đôi khi là SiO2/Al2O3) càng cao thì sàng phân tử càng bền; b) tỉ lệ silicon/nhôm tối thiểu không bé hơn 1.
5) Sàng phân tử tổng hợp kiểu A của muối sodium có cấu trúc thuộc hệ tinh thể lập phương, với thông số ô mạng cơ sở thông thường là a = 2464 pm. Công thức ô mạng cơ sở là Na96[Al96Si96O384]∙xH2O. Đun nóng 811.5 gam sàng phân tử này ở 1.101325∙105 Pa và 700 oC trong 6 giờ để loại hoàn toàn nước kết tinh. Thu được 798.6 lít hơi nước (xem như là khí lí tưởng). Tính khối lượng riêng (D) của sàng phân tử.
Có một nhóm oxide hỗn hợp sở hữu tính chất bất thường: mật độ nhiệt không bị giảm. Cấu trúc lí tưởng của nhóm oxide này là tinh thể lập phương, với ô mạng cơ sở như hình dưới. Trong hình này, tâm bát diện là nguyên tử zirconium, đặt ở các góc và mặt của ô mạng cơ sở; tâm tứ diện là các nguyên tử tungsten. Các bát diện và tứ diện nối với nhau bởi 1 đỉnh chung (nguyên tử oxygen). Số oxid hóa của zirconium và tungsten đều bằng với số nhóm của chúng trong bảng tuần hoàn.
1) Xác định số nguyên tử zirconium và tungsten trong ô mạng cơ sở. 2) Viết công thức hóa học của oxide hỗn hợp này.
3) Xác định các môi trường hóa học (loại) của nguyên tử oxygen trong tinh thể. Chúng là những loại nào và số lượng mỗi loại trong ô mạng cơ sở.

4) Biết hằng số mạng a = 0.916 nm. Tính khối lượng riêng của tinh thể theo gam cm-3 .
Bài
Tính chất hoá học của kim loại chuyển tiếp tungsten có những điểm tương đồng nhất định với nguyên tố nhóm chính sulfur (lưu huỳnh) do cả hai nguyên tử này đều có 6 electron hoá trị. Cả hai nguyên tử đều đạt tới trạng thái oxide hoá tối đa là +6 khi phản ứng với các nguyên tố có độ âm điện lớn như fluorine hay oxygen.
Trong khi tungsten(VI) fluoride được dùng trong công nghiệp bán dẫn thì các oxide của nó lại được dùng để sản xuất cửa sổ điện sắc - loại cửa sổ này sẽ biến đổi màu sắc khi điện áp được đặt vào, ví dụ như những cánh cửa sổ máy bay dưới đây.
Trong tự nhiên, tungsten chủ yếu tồn tại ở dạng tungstate anion, WO4 2, ion tương tự sulfate, SO4 2-. Một trong những khoáng vật chứa tungsten phổ biến nhất là scheelite, chứa calcium tungstate, CaWO4. a) Vẽ công thức cấu tạo, chỉ rõ các liên kết trong WO4 2- ion và dự đoán góc liên kết O-W-O.
Xử lí quặng scheelite với dung dịch sodium carbonate, thu được dung dịch sodium tungstate và một muối màu trắng, không tan. Thêm hydrochloric acid vào dung dịch sodium tungstate thì thu được tungstic acid, chất này khi đun nóng tạo thành tungsten(VI) oxide. Oxide này bị khử bởi hydrogen, tạo thành kim loại tungsten tinh khiết. b)
• Viết phương trình phản ứng giữa scheelite với dung dịch sodium carbonate.
• Viết phương trình phản ứng giữa sodium tungstate với hydrochloric acid và đề xuất cấu trúc của tungstic acid.
• Viết phương trình phản ứng tạo thành tungsten(VI) oxide từ tungstic acid.
• Viết phương trình phản ứng tạo thành kim loại tungsten.
Trong các cửa sổ điện sắc, một điện áp được đặt vào giữa một lớp tungsten(VI) oxide trong suốt với một nguồn ion như muối lithium, và phản ứng sau diễn ra với một số lithium ion được hợp nhất vào cấu trúc của oxide: WO3 + xLi+ + xe → LixWO3 Sản phẩm LixWO3, được gọi là cấu trúc giả đồng (tungsten bronze) và màu sắc phụ thuộc vào giá trị của x. Giá trị này biến đổi trong khoảng từ 0 đến 1, và giá trị điển hình, cho màu xanh đen là x = 0.3.
c)
• Xác định số oxide hoá của tungsten khi x = 1.
• Xác định số oxide hoá trung bình của tungsten khi x = 0.3. Cả hai đơn chất lưu huỳnh và tungsten đều phản ứng với khí fluorine tạo thành các hexafluoride. SF6 và WF6 đều là chất khí ở nhiệt độ và áp suất thường. WF6 là khí nặng nhất trong những điều kiện này. WF6 rất độc và phản ứng nhanh với nước tạo thành hai chất. Ngược lại, SF6 trơ với nước và không độc.
d) Giả sử không khí chỉ được tạo thành bởi khí nitrogen, hãy tính tỉ khối của SF6 và WF6 so với không khí.
e) Tính khối lượng riêng thực của khí WF6 theo gam.cm-3 ở 298 K và áp suất chuẩn.
f) Đề xuất phương trình phản ứng giữa WF6 với nước.
Xét phương trình phản ứng trong phase khí sau: SF6(g) + 4H2O(g) → H2SO4(g) + 6HF(g)
g)
• Dự đoán biến thiên entropy chuẩn của phản ứng này có dấu âm hay dương?
• Sử dụng dữ kiện dưới đây để tính biến thiên enthalpy chuẩn của phản ứng.
• Phát biểu nào sau đây là đúng khi nói về phản ứng giữa SF6 và nước:
A. SF6 bền về mặt động học và nhiệt động học.
B. SF6 bền về mặt động học nhưng không bền nhiệt động học.
C. SF6 không bền về mặt động học nhưng bền nhiệt động học.
D. SF6 không bền cả về mặt động học lẫn nhiệt động học.
Tên gọi “tungsten” thực chất là tên gọi cổ theo tiếng Thuỵ Điển của khoáng vật scheelite. Nó có nghĩa là đá (sten) nặng (tung) do scheelite được xem là nặng hơn so với các loại đá khác thường được tìm thấy cùng với nó.
Hình: Hai góc nhìn ô mạng cơ sở của scheelite, CaWO4; các giá trị hằng số mạng: 0.524 ∙ 0.524 ∙ 1.137 cm; góc nhìn bên phải có được khi quay góc nhìn bên trái 90o
Hình trên là ô mạng cơ sở của scheelite. Nghiên cứu phương pháp nhiễu xạ tinh thể tia X cho thấy sự sắp xếp các nguyên tử tạo thành một cấu trúc khối, trong đó các ô mạng được xếp chụm vào nhau. Một số nguyên tử nằm hoàn toàn trong các đường biên của ô mạng cơ sở, trong khi một số khác nằm ở các góc, cạnh hoặc mặt, chỉ có các phần (fractions) thuộc mỗi ô mạng cơ sở.
h) Dựa vào số fractions của các nguyên tử trong mỗi ô mạng cơ sở, hãy tính tổng số nguyên tử tungsten, calcium và oxygen trong 1 ô mạng. i) Sử dụng kết quả ở ý h, và kích thước của ô mạng, hãy tính khối lượng riêng của “đá nặng” scheelite theo gam cm-3 .
|
6) Cần sử dụng Li2O, Li2O2, Na2O2, BaO2 tinh khiết cho các thí nghiệm này. Đề xuất phương pháp tổng hợp các hợp chất này trong phòng thí nghiệm.
7) Viết phương trình phản ứng tổng hợp các chất II - IV.
Các mẫu đơn phase II - IV được điều chế bằng cách nung các hỗn hợp của các oxide (và peroxide) với thành phần khác nhau trong khí quyển oxygen. Thành phần của các hỗn hợp đầu, điều kiện nung, và tính chất của các sản phẩm được cho trong bảng dưới đây Tất cả các hỗn hợp đầu đều có chứa một oxide tối màu I, có cấu trúc mạng tâm diện (a = 0.54223 nm). Khối lượng riêng bằng 11.21 gam/cm3. Hợp chất II tan trong LiOH 2 M tạo thành một dung dịch màu xanh lục thẫm. Thành phần hỗn hợp nhi ệt độ, oC
Thông số mạng d, gam/cm3 Chất m, mg a, nm b, nm c, nm
Li2O I
thời gian, giờ Δw, % sản phẩ m
65 23 2 400 16 6.8 II 0.52 1 1.4 61 5.33
Li2O2 BaO2 I
41 30 6 24 3
420 16 5.9 III 0.86 37 6.98
Na2 O2 BaO2 I
82 35 4 24 8
450 15 3.5 IV 0.85 90
1) Xác định công thức của oxide I.
2) Xác định công thức các hợp chất II - IV.
3) Xác định số oxide hoá của các nguyên tố trong hợp chất IV.
4) Ai được xem là người phát hiện ra các hợp chất thuộc nhóm này?
5) Chúng được phát hiện vào thời điểm nào (đưa ra đáp án với độ chính xác cỡ ¼ thế kỉ)?
|
Một số oxide phức tạp có cấu trúc spinel trong đó các oxygen ion tạo thành mạng tinh thể lập phương chặt khít với 8 hốc tứ diện và 4 hốc bát diện ứng với một đơn vị cấu trúc XY2O4. Các ion X2+ chiếm 1/8 số hốc tứ diện và các ion Y3+ chiếm một nửa số hốc bát diện trong cấu trúc spinel “thường”. Vị trí của các ion sẽ thay đổi trong cấu trúc spinel “ngược”, ion X2+ và một nửa số ion Y3+ chiếm một nửa số hốc bát diện, còn một nửa số ion Y3+ còn lại chiếm hốc tứ diện. Các spinel thường dùng làm chất nhuộm màu xi măng (như Tenar xanh dương - CoAl2O4) và vật liệu có từ tính.
1) Tính số phân tử có trong một ô mạng cơ sở spinel.
2) Vẽ các vùng ứng với phase spinel trong các giản đồ phase hệ ba cấu tử ZnO-CoO-Al2O3, MgO-CoO-Al2O3 và MgO-Cr2O3-Al2O3.
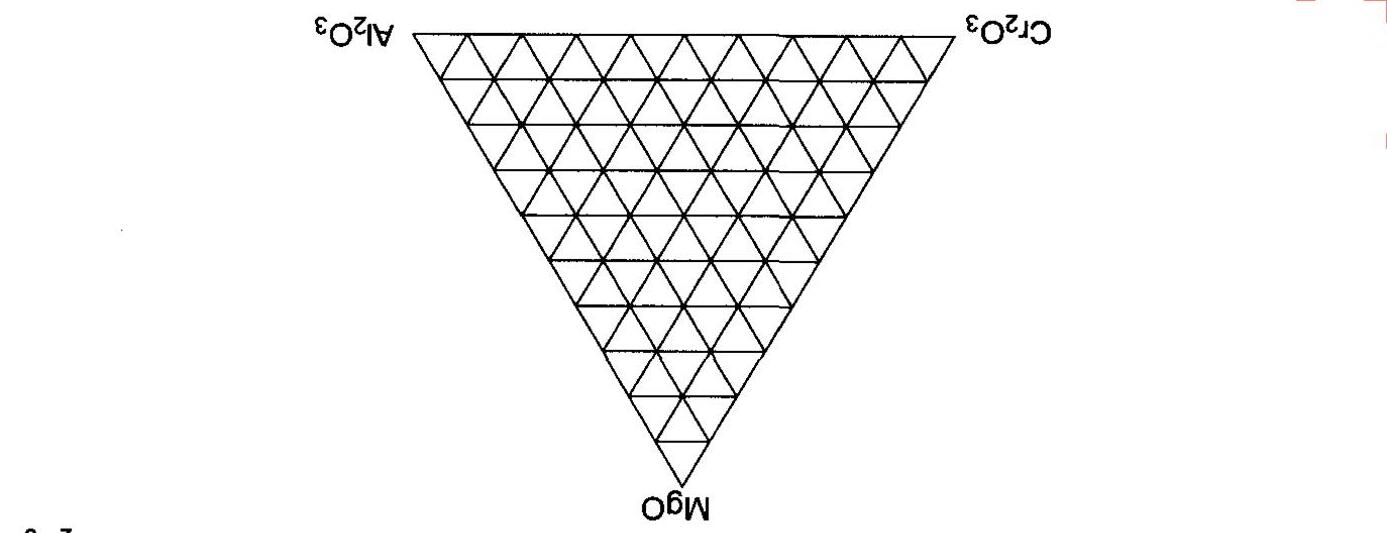
trong chromium ion (còn khoáng leucosapphiere Al2O3 không có màu). Dựa vào giản đồ trên, tìm vùng ứng với ruby. Có bao nhiêu elctron độc thân, nguyên nhân tạo màu ruby, trong ion chromium?
5) Một loại đá quý lớn màu đỏ nằm ở đỉnh chiếc vương miện do Jeremia
Posier chế tạo và đã được Nữ hoàng Nga Catherine đội. Suốt một thời gian dài, chiếc vương miện này cho là làm từ ruby. Các nghiên cứu sau này cho thấy loại đá là spinel lạ. Hãy vẽ vùng tương ứng với thành phần của loại đá này vào giản đồ ở trên.
6) Xác định số electron độc thân của cobalt ion. Xác định dạng đa diện phối trí của ion cobalt (tứ diện hay bát diện) trong spinel CoAl2O4.
7) Dung dịch rắn của CoO chiếm 7 % số mol trong ZnO (có cấu trúc lục phương ZnS, kiểu wurtzite) cho màu xanh lá cây (Xanh Rinmann). Vậy dung dịch rắn của CoO và MgO với cấu trúc lập phương kiểu NaCl sẽ có màu nào? Xác định thành phần của chúng bằng cách dùng giản đồ phase.
8) Đề nghị thành phần của các chất nhuộm màu xi măng trắng, xanh đen và đỏ
a) Nếu chúng chỉ được tạo thành từ các chất có cấu trúc spinel; b) Nếu chúng được tạo thành từ các chất với cấu trúc bất kì. c) Các chất đang xét chỉ nằm trong số những chất có giản đồ phase được cho ở trên.
3) Viết công thức chung của phase spinel trong các hệ trên. Chỉ ra cấu trúc ứng với vùng nằm ở phần phân cách phase. Cho biết cấu trúc của các spinel tìm được thuộc kiểu nào (“thường” hay “ngược”)?
4) Màu sắc của spinel (và không chỉ spinel) được xác định bởi sự chuyển electron d-d của các ion trong hợp chất. Ví dụ màu của ruby (dung dịch rắn chứa 5 % Cr2O3, về số mol, trong Al2O3; có thành phần (Al1xCrx)2O3 (x ≤ 0.05)) được xác định bởi các sự chuyển d-d của electron
|
Kim loại trong câu hỏi này được điều chế bằng phương pháp điện phân. Sử dụng cường độ dòng 30000 A (Hiệu suất dòng điện 90%) trong 10 giờ thì thu được 90.6 kg kim loại này. Ở dạng tinh khiết thì mạng tinh thể của nó có dạng lập phương tâm khối. Khi nhiễu xạ bằng phương pháp phổ tia X bằng cách sử dụng hơi đồng X (λ = 154 pm) để chiếu xạ vào mặt phẳng (1 1 1) thì xác định được góc nhiễu xạ bậc một là 19.3°.
1) Kim loại được hỏi là kim loại nào ? Chứng minh bằng tính toán.
2) Tính hằng số mạng a0 của ô mạng cơ sở.
3) Tính khối lượng riêng của kim loại. Ở 750-800°C thì kim loại phản ứng với clo để sinh ra một chất rắn không màu, dễ hútẩm và tồn tại ở dạng dime qua hai cầu là hai nguyên tử clo. Chất này thuỷ phân cho ra một hydroxit lưỡng tính khó tan và phản ứng thủy phân giải phóng ra HCl(k). Hydroxit này có tính lưỡng tính và tạo được phức bát diện hydroxo ở pH cao.
4) Viết công thức cấu tạo của dime
5) Viết và cân bằng phản ứng thuỷ phân muối clorua này.
6) Viết công thức và gọi tên phức hydroxo đã đề cập ở trên. Nguyên tố X tạo ra nhiều khoáng chất có màu rất đẹp, thành phần các khoáng chất này có chứa một kim loại hóa trị hai và oxy gọi là các spinel. Trong một cấu trúc spinel điển hình thì ion oxit tạo mạng tinh thể lập phương tâm mặt với 12,5% số hốc tứ diện bị chiếm bởi kim loại M còn 50% số hốc bát diện bị chiếm bởi kim loại X. Các spinel được dùng làm chất màu trong sản xuất gốm sứ hay trong hóa phân tích vì các màu sắc của chúng. Một ví dụ về spinel là xanh Thénards, nó là một loại chất nhuộm với kim loại hóa trị hai ở đây là coban.
Dưới những điều kiện nhất định thì cũng tồn tại cấu trúc spinel "ngược", trong đó số hốc tứ diện và bát diện không thay đổi nhưng kim loại M ở đây chiếm hốc bát diện còn kim loại X chiếm hốc tứ diện theo tỉ lệ 1 : 1. So sánh tổng năng lượng bền hóa trường tinh thể của mỗi ion kim loại trong ô mạng cơ sở. Điều này là hoàn toàn cần thiết để có thể dự đoán được rằng cấu trúc spinel trong khoáng vật là cấu trúc spinel bình thường hay cấu trúc spinel ngược.
7) Trong mạng tinh thể lập phương tâm mặt có bao nhiêu hốc bát diện và tứ diện ?
8) Cho biết công thức thực nghiệm của xanh Thénards
9) Bằng tính toán hãy dự đoán cấu trúc spinel của khoáng sắt – crom là cấu trúc spinel bình thường hay spinel ngược (Fe2+: spin cao; Cr3+: spin thấp).
Bài 31 Ngọc hồng lựu Bohemian là một loại đá bán quý màu máu nổi tiếng của người Czech. Thành phần hóa học của ngọc hồng lựu tự nhiên được biểu diễn theo công thức hợp thức tổng quát A3B2(SiO4)3, trong đó AII là cation hóa trị 2 và BIII là cation hóa trị 3. Ngọc hồng lựu có ô mạng cơ sở lập phương chứa 8 đơn vị phân tử. Cấu trúc gồm 3 loại đa diện: cation AII chiếm vị trí thập nhị diện (12 mặt) (bao quanh bởi 8 nguyên tử O), cation BIII chiếm vị trí bát diện (bao quanh bởi 6 nguyên tử O) và SiIV bao quanh bởi 4 nguyên tử O sắp xếp thành một tứ diện. Khoáng hồng lựu phổ biến nhất là almandine với công thức Fe3Al2(SiO4)3, nó hằng số mạng a = 11.50 Å.
1) Tính khối lượng riêng lí thuyết của almandine. Ngọc hồng lựu Bohemian có công thức Mg3Al2(SiO4)3. Hợp chất tinh khiết không có màu và màu của khoáng tự nhiên đến từ các nhóm mang màucác cation kim loại chuyển tiếp thay thế cho các cation vật liệu chủ. Màu đỏ của ngọc hồng lựu đến từ các vi lượng CrIII ion trong các tâm bát diện và các FeII ion trong các tâm thập nhị diện.
2) Vẽ giản đồ tách mức năng lượng của các d-orbital bát diện (octahedral) [CrIIIO6]oct và điền các electron vào để hoàn thành cấu hình.
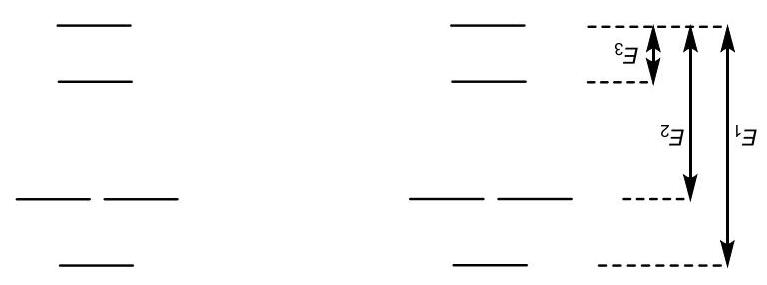
3) Xác định (các) nguyên tố chuyển tiếp hàng đầu tiên có (các) cation MIII đặt ở vị trí bát diện có tính nghịch từ theo trình tự sắp xếp spin thấp và thuận từ theo trình tự sắp xếp spin cao.
4) Giản đồ dưới đây biểu diễn sự tách mức d-orbital trong trường tinh thể thập nhị diện (dodecahedral). Điền các electron của nhóm tạo màu [FeIIO8]dod theo các trình tự sắp xếp sẵn có.
a) Trình tự spin cao. b) Trình tự spin thấp.
5) Dẫn ra các bất đẳng thức (ví dụ P < E1 + E2 + E3) của năng lượng ghép đôi (P) liên hệ với các năng lượng E1, E2, E3 với cả hai kiểu sắp xếp.
6) Giả sử rằng P > E3, xác định (các) nguyên tố kim loại chuyển tiếp có cation hóa trị hai MII đặt ở vị trí thập nhị diện có tính nghịch từ theo trình tự sắp xếp spin thấp và thuận từ theo trình tự sắp xếp spin cao.
Hình dưới đây biểu diễn các phổ hấp thụ (đã được giản lược) của 4 khoáng vật có màu: ngọc hồng lựu Bohemian màu đỏ máu, uvarovite xanh lục, sapphire xanh lam và citrine vàng-cam.
Màu của khoáng vật gây ra bởi 2 nhóm tạo màu: [Fe
O6]
và [Fe
Các ion trung tâm của cả hai nhóm tạo màu đều có cùng số electron chưa ghép đôi.
10) Vẽ giản đồ tách mức năng lượng d-orbital của cả hai nhóm tạo màu và điền electron vào. Trường tứ diện gây ra sự tách mức nhỏ hơn trường bát diện ( ∆=∆tetoct 4 9
). Đáng ngạc nhiên là với FeIII ion, năng lượng của bước chuyển d-d đầu tiên (mặc dù rất yếu) với nhóm tạo màu bát diện lại nhỏ hơn (11000 cm 1) so với tứ diện (22000 cm-1).
11) Tính giá trị của năng lượng ghép đôi (P) và năng lượng tách mức ∆oct và ∆tet. Giả sử rằng năng lượng ghép đôi trong cả hai nhóm tạo màu bằng nhau.
Ngọc hồng lựu tổng hợp YAG ((Yttrium Aluminium Garnet), được dùng trong quang điện tử, có công thức Y3Al5O12. Cấu trúc của nó được dẫn ra từ cấu trúc của ngọt hồng lựu A3B2(SiO4)3 bằng cách thay thế các ion YIII và AlIII vào các vị trí của A, B, Si.
12) Dựa vào hiểu biết của bạn về bán kính ion tương đối, xác định cation nào chiếm vị trí nào.
13) Để sử dụng trong công nghệ LED, YAG được biến tính bởi CeIII. Xác định các giá trị x và y trong công thức YAG trong đó 5 % nguyên tử yttrium bị thay thế bởi cerium.
7) Xác định phổ tương tứng với mỗi khoáng vật. 8) Nếu được chiếu sáng với ánh sáng xanh lục lam thì ngọc hồng lựu Bohemian sẽ có màu
☐ Đỏ. ☐ Xanh dương. ☐ Vàng-cam. ☐ Đen. ☐ Vàng. ☐ Lục lam. ☐ Tím. ☐ Trắng. Andradite là một loại khoáng hồng lựu khác, có công thức Ca3Fe2(SiO4)3 Sự thay thế kép các cation - TiIV cho FeIII ở vị trí bát diện và FeIII cho SiIV ở vị trí tứ diện (tetrahedral) - tạo thành schorlomite đen. Công thức của nó có thể được biểu diễn là Ca 3[Fe,Ti]oct 2([Si,Fe]tetO4)3
9) Tính phần trăm SiIV ion trong một mẫu schorlomite cần phải bị thay thế bởi FeIII, biết rằng 5 % Fe ion ở vị trí bát diện bị thay thế bởi TiIV .
Nếu bạn không tính ra kết quả, hãy sử dụng x = 2.25.
14) YAG biến tính bởi CeIII được điều chế bằng cách ủ hỗn hợp Y2O3, Al2O3, CeO2 trong khí quyển H2. Sử dụng công thức từ ý 13, hãy viết phương trình phản ứng với các hệ số tỉ lượng tối giản.
|
Việc biến tính cấu trúc YAG bởi các ion đất hiếm có thể sản xuất các laser với bước sóng bức xạ trong khoảng từ vùng tử ngoại đến vùng hồng ngoại giữa. Sơ đồ trên trình bày các bước chuyển năng lượng f-f đơn giản hóa của các ion đất hiếm được chọn.
15) Cation nào có bước chuyển tương ứng với bức xạ ánh sáng xanh dương?
☐ Er3+ ☐ Sm3+ ☐ Tm3+
Yb
Nd
16) Tính bước sóng bức xạ của ánh sáng này. 17) Theo truyền thuyết, Noah đã sử dụng một cây gậy có gắn đá hồng lựu để chiếu sáng trong suốt chuyến hành trình của mình. Giả sử rằng chỉ có hiệu ứng huỳnh quang, hãy xác định màu của ánh sáng laser bức xạ từ cây gậy của ông biết rằng viên đá là ngọc hồng lựu Bohemian màu đỏ máu.
☐ Đỏ. ☐ Xanh dương. ☐ Vàng-cam. ☐ Đen.
☐ Vàng. ☐ Lục lam. ☐ Tím. ☐ Trắng.
Gốm perovskit ABO3 kết tinh ở hệ tinh thể lập phương trong đó cation A chiếm vị trí các đỉnh, cation B chiếm vị trí tâm khối, còn anion O2- chiếm vị trí tâm tất cả các mặt của hình lập phương. Tinh thể một gốm perovskit ABO3 lý tưởng có thông số mạng bằng 0,41nm.
1) a) Xác định số phối trí của cation A, B và O2-
b) Tính bán kính của các cation A, B. Biết bán kính ion O2- = 0,14 nm.
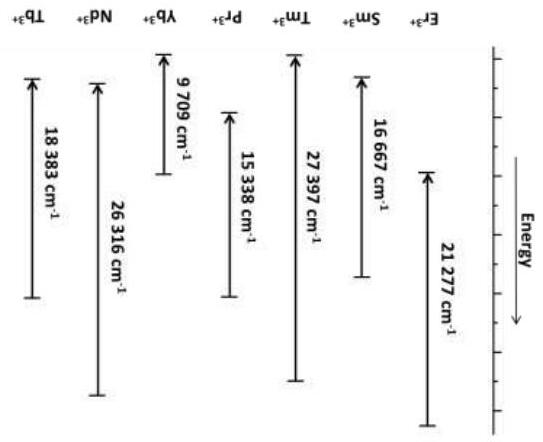
c) Xác định độ đặc khít trong tinh thể ABO3 ở trên.
2) Gốm perovskit manganit, có thành phần không hợp thức LaIIIMnO3+x được điều chế bằng cách nung ở nhiệt độ cao, trong không khí hỗn hợp La2O3 và MnO2 với tỉ lệ 1:2 theo số mol. Để xác định hàm lượng oxi trong manganit, người ta hòa tan 1,218 gam LaIIIMnO3+x trong dung dịch HCl có sẵn lượng dư KI. Lượng I2 sinh ra được chuẩn độ bằng dung dịch Na2S2O3 0,25M thấy hết 24,0 mL.
a) Viết các phương trình phản ứng xảy ra.
b) Xác định giá trị của x
c) Với cấu trúc ô mạng cơ sở mô tả ở trên, ion La3+ chiếm vị trí ở đỉnh (A) hay ở tâm khối (B)? Tại sao?
3) Tại nhiệt độ điều chế LaIIIMnO3+x ở trên, tồn tại cân bằng oxy hóa - khử dị ly: 2Mn3+ ⇌ Mn2+ + Mn4+ K = 10-4 Người ta giữ hỗn hợp phản ứng ở nhiệt độ thích hợp để cân bằng trên được thiết lập. Khi làm nguội sản phẩm, do tốc độ phản ứng ở pha rắn trở nên rất chậm nên nồng độ các ion không thay đổi. Do vậy manganit thu được sẽ có công thức chung −−+ IIIIVIIIIII 1abab3xLaMnMnMnO . Hãy xác định các giá trị của a và b trong công thức này.
M3XY là chất dẫn ion tốt, có cấu trúc phản-perovskite (anti-perovskite).
M là nguyên tố kim loại, còn X và Y là các phi kim. Tất cả chúng đều là nguyên tố của chu kì nhỏ. Số hiệu nguyên tử Z(X) < Z(M) < Z(Y). M3XY có thể được điều chế từ phản ứng các hợp chất lưỡng nguyên tố của M, X và M, Y ở 500 K, 3 MPa. Các nhà nghiên cứu đã phát triển phản ứng tổng hợp sau, có thể tiến hành ở áp suất thường: M + MXA + MY → M3XY + 1 2 A2(g)
A2 là chất không màu, không vị. Phản ứng tiêu thụ 0.93 gam M thì thu được 0.50 lít khí A2 ở 25 oC và 100 kPa. Cho biết hằng số khí R = 8.314 kPa L mol-1 K-1 .
1) Tính khối lượng mol của kim loại M
2) Xác định các nguyên tố A, M, X, Y
3) Viết phương trình phản ứng thủy phân M3XY
4) Tinh thể M3XY thuộc hệ lập phương. Biết X là đỉnh của một ô mạng thông thường, xác định vị trí (tọa độ) của M, Y
Hình 1a biểu diễn ô mạng cơ sở của barium titanate, kết tinh theo kiểu cấu trúc perovskite (ô mạng lập phương, a = 3.996 Å). Hình 1b biểu diễn ô mạng cơ sở của barium titanate với các nguyên tử loại A ở các đỉnh.
1) Gắn mỗi quả cầu trong hình với loại nguyên tử chính xác - Ba, Ti hay O? Xác định công thức của barium titanate, dựa vào cấu trúc ô mạng cơ sở của nó. Xác định số phối trí của các nguyên tử barium, titanium và oxygen, cũng như số oxid hóa của titanium.
2) Xác định bán kính cation Ti4+ trong perovskite, sử dụng bán kính O2ion là 1.40 Å.
3) Viết phương trình phản ứng tạo thành barium titanate từ barium carbonate và titanium dioxide. Các muối barium nào khác dễ dàng được nung kết với TiO2 để tạo thành barium titanate? Viết phương trình phản ứng.
4) Cấu trúc perovskite rất bền, không tan trong dung dịch loãng của các acid mạnh. Ở dạng phân tán đều, barium titanate chỉ có thể được hòa tan bằng cách đun sôi HCl đặc. Viết phương trình phản ứng. Tại sao barium titanate không tan trong nitric acid đặc?
5) Titanium cation trong perovskite có thể được thay thế bởi một cặp ion có số oxid hóa khác nhau, tạo thành các perovskite “kép”. Trong trường hợp này, nếu chênh lệch số oxid hóa của các ion lớn hơn hoặc bằng 3 thì các mảnh mà tại đó các ion khác nhau được đặt xen kẽ theo trật tự so le (trong hình 2, các bát diện của các màu khác nhau tương ứng với môi trường phối trí khác nhau của các ion). Với sự thay thế
|
như vậy, các bán kính ion cần phải gần với bán kính của titanium ion. Ước lượng xem với sự thay thế như vậy, hằng số của ô mạng sơ sở sẽ biến đổi xấp xỉ bao nhiêu lần?
6) Đề xuất ít nhất 2 cặp oxide mà trong phản ứng với BaO sẽ tạo thành perovskite “kép” mong muốn. Có thể tra cứu thông tin về bán kính ion để tham khảo.
Bài 35
Dung dịch rắn BaInxCo1-xO3-δ là vật liệu chức năng, có cả tính dẫn điện và dẫn ion, số oxid hóa của Co biến đổi tùy theo thành phần và điều kiện tổng hợp, còn In luôn là +3. Để xác định số oxid hóa của Co trong hợp chất BaIn0.55Co0.45O3-δ, cần xác định hàm lượng oxygen bằng cách tiến hành phân tích sau: Cân 0.2034 gam mẫu rồi thêm vào một lượng dung dịch KI vừa đủ cùng một lượng dung dịch HCl để hòa tan mẫu. Sau đó tiến hành chuẩn độ với dung dịch Na2S2O3 0.0500 mol/L, chỉ thị hồ tinh bột, thì dùng hết 10.85 mL chất chuẩn.
1) Viết phương trình phản ứng giữa BaIn0.55Co0.45O3-δ với KI và HCl.
2) Viết phương trình ion của phản ứng chuẩn độ.
3) Tính số oxid hóa của Co (SCo) và số oxygen thiếu hụt (δ) trong BaIn0.55Co0.45O3-δ.
Các dung dịch rắn được sử dụng rộng rãi trong công nghệ pin, cảm biến và nhiều thiết bị khác. Một dung dịch rắn vô cơ chứa các ion dương An+ , Bm+ và các ion âm X , trên 50.7o tạo thành cấu trúc bất trật tự (phase nhiệt độ cao) còn dưới 50.7o thì tạo thành cấu trúc trật tự (phase nhiệt độ thấp). Hai cấu trúc này được biểu diễn như trong hình. Trong hình, các quả cầu sáng màu là anion; các quả cầu tối màu ở phase nhiệt độ cao (bên trái) là cation hoặc lỗ trống; các quả cầu tối màu lớn ở phase nhiệt độ thấp (bên phải) là An+ ion, các quả nhỏ là Bm+ ion.
Bài 37 Cấu trúc ô mạng cơ sở của mạng tinh thể CaF2 cho ở hình dưới. Việc thêm vào một lượng nhỏ Y2O3 vào CeO2 (vốn có cấu trúc tinh thể kiểu CaF2) rồi đun nóng sẽ thu được dung dịch rắn có thành phần Ce1-xYxO2-y, trong đó các ion Ce4+ và Y3+ đều đặn phân bố và các hốc cation còn anion oxy sẽ vào các hốc anion. Ở đây hóa trị của ion ceri là +4 không đổi.
a) Xác định có bao nhiêu cation và anion hiện diện trong ô mạng CaF2 ?
a
b) Tính (%) số oxy so với các vị trí anion trong cấu trúc dung dịch rắn tổng hợp có tỉ lệ mol CeO2 : Y2O3 = 0.8 : 0.1.?
c) Tính số oxy có trong 1.00 cm3 dung dịch rắn này. Cho rằng thể tích ô mạng cơ sở a3 bằng 1.36 x 10-22 cm3 .
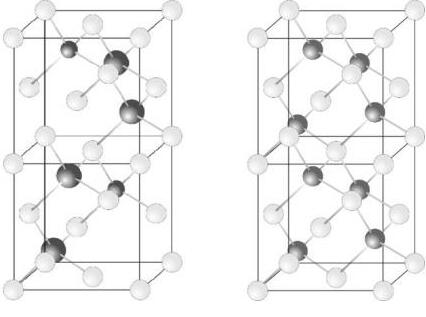
1) Xác định các giá trị m, n và công thức phân tử của dung dịch rắn.
2) Sự thay đổi nhiệt độ sẽ làm xảy ra sự chuyển đổi cấu trúc giữa hệ lập phương và hệ tứ phương. Cấu trúc phase tinh thể nào (nhiệt độ cao hay thấp) là hệ lập phương?
3) Xác định cấu trúc sắp xếp các ion âm và các loại lỗ trống được tạo thành. Xác định loại và tỷ lệ lỗ trống bị chiếm bởi các cation.
4) Phase nhiệt độ cao có độ dẫn điện cao, gây ra bởi sự dịch chuyển của ion nào? Giải thích ngắn gọn mối liên hệ giữa độ dẫn điện với cấu trúc.
12000 năm trước, Trái đất đã gặp một thảm họa khiến nhiệt độ giảm mạnh, dẫn tới sự đại tuyệt chủng của nền văn minh Clovis, Bắc Mỹ. Có một giả thuyết cho rằng thảm họa này là do một sao chổi chứa carbon đã va quẹt vào Trái đất. Năm 2010, nhiều nhóm nghiên cứu đã phát hiện thấy hàm lượng cao bất thường của nano kim cương lục giác ở khu vực Bắc Mỹ và Greenland - được xem là bằng chứng cho giả thuyết này.
1) Ô mạng cơ sở lập phương của kim cương được cho trong hình 7-1. Hãy vẽ các liên kết khác của 2 nguyên tử carbon được kí hiệu màu đen.
2) Hình 7.2 là các bộ khung carbon của kim cương lập phương và kim cương lục phương. Điểm khác biệt về mặt cấu dạng của chúng là gì?
3) Trong hình 7-3 là cấu trúc của zinc sulfide lục phương. Nếu các nguyên tử carbon thay cho sulfur và kẽm thì đó là kim cương lục phương. Dùng các đường kẻ nhỏ để vẽ ô mạng cơ sở của kim cương lập phương.
4) Ô mạng cơ sở của kim cương lục phương chứa bao nhiêu nguyên tử carbon?
Năm 2013, nhiều tờ báo đã đăng tải thông tin các nhà khoa học sẽ yêu cầu chính phủ cấm bán những quả bóng party chứa đầy helium bởi các ứng dụng mang tính khoa học của nó như là chế tạo nam châm siêu dẫnnghĩa là quá lãng phí khi dùng nó trong những bữa tiệc của lũ trẻ.
Helium hiện diện trong khí quyển Trái đất với nồng độ trung bình là 0.916 mg m-3 và thể tích khí quyển Trái đất xấp xỉ 4.2 ∙ 109 km3 .
a) Tính số mol helium trong khí quyển Trái đất.
b) Thể tích mặt cầu bán kính r là 4/3πr3. Giả sử các quả bóng party có hình cầu và bán kính 14 cm3, hãy tính số quả bóng có thể được lấp đầy bởi helium từ khí quyển Trái đất ở nhiệt độ và áp suất thường.
Helium rất kém hoạt động, với lớp vỏ ngoài bão hòa và năng lượng ion hóa cao nhất trong tất cả các nguyên tố. Năm ngoái (2017), kết quả sự hợp tác giữa 17 nhà nghiên cứu từ nhiều quốc gia đã mang đến đề xuất rằng hợp chất X (hợp chất của helium và sodium) đã được tạo thành ở áp suất cực kì cao (300 GPa).
Ô mạng cơ sở của tinh thể này được xác định bởi nhiễu xạ tia X. Xếp chồng các ô mạng cơ sở với nhau tạo thành một cấu trúc khối.
e) Sử dụng câu trả lời ở ý c và hằng số mạng của ô mạng cơ sở để tính khối lượng riêng của hợp chất X theo gam cm-3 .
Các tính toán với hợp chất X cho thấy rằng các nguyên tử sodium trong hợp chất X tồn tại ở dạng ion Na+. Các electron hóa trị của các nguyên tử sodium đã tạo thành các cặp và nằm trong các khoảng trống của cấu trúc tinh thể.
f) Bạn dự đoán điều nào sau đây về hợp chất X?
A. Chất rắn kim loại.
B. Chất rắn cộng hóa trị.
C. Chất rắn ion.
D. Chất dẫn điện.
E. Chất cách điện. Ở áp suất khí quyển, hợp chất X không bền, nó bị phân hủy thành hỗn hợp sodium và helium.
g) Viết phương trình phân hủy hợp chất X. Đồ thị dưới đây biểu diễn biến thiên năng lượng tự do của phản ứng phân hủy, ΔGdecomp, thay đổi như thế nào theo áp suất.
Ô mạng cơ sở của hợp chất X được biểu diễn trong hình trên, với các nguyên tử helium đặt ở các góc và tâm của các mặt của ô mạng cơ sở, còn các nguyên tử sodium được sắp xếp theo hình lập phương bên trong ô mạng. Một số nguyên tử nằm hoàn toàn trong 1 ô mạng, còn một số khác - nằm ở các góc, cạnh hoặc mặt - thì chỉ có 1 phần thuộc về mỗi ô mạng. c) Tính tổng số nguyên tử sodium và helium trong 1 ô mạng cơ sở.
d) Xác định công thức hợp chất X.
h) Tính áp suất cực kiểu mà tại đó sự tạo thành hợp chất X thuận lợi về mặt nhiệt động học.
|
Với sự ra đời các thiết bị thí nghiệm quy mô lớn (như máy bức xạ synchrotron và nguồn neutron), các công nghệ áp suất cao đóng vai trò ngày càng quan trọng trong việc nghiên cứu vật chất. Áp suất cao không chỉ khởi phát các quá trình chuyển phase trong vật liệu mà còn dẫn tới sự tạo thành các kiểu liên kết hóa học mới. Trong những năm gần đây, nhiều báo cáo về sự tạo thành các cấu trúc tinh thể mới trong điều kiện siêu áp đã được công bố.
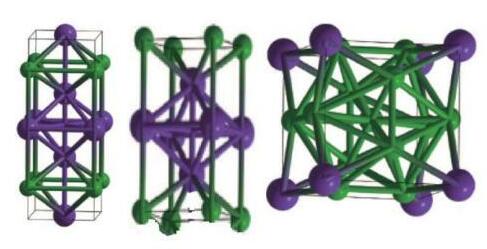
1) Tinh thể NaCl phản ứng với Na hoặc Cl2 trong những điều kiện áp suất cực kì cao (50 - 300 GPa) tạo thành các tinh thể mới, có công thức và cấu trúc khác nhau. Hình dưới đây biểu diễn các ô mạng cơ sở của 3 kiểu tinh thể (quả cầu lớn là nguyên tử chlorine, còn quả cầu nhỏ là sodium), gọi là các tinh thể A, B, C (theo chiều từ trái sang phải). Viết công thức phân tử của A, B, C.
2) Trong điều kiện siêu áp (300 GPa), kim loại sodium và helium có thể kết hợp với nhau tạo thành hợp chất. Trong cấu trúc này, các sodium ion được sắp xếp ở dạng lập phương đơn giản, tạo thành một hốc giữa các khối lập phương Na4 (như hình dưới đây). Các cặp electron (2e ) và nguyên tử hehlium được phân bố xen kẽ và lấp đầy tâm của khối lập phương.
a) Xác định số sodium ion trong ô mạng cơ sở.
b) Viết công thức phân tử (thể hiện được đặc trưng cấu trúc) của hợp chất này.
c) Nếu nguyên tử helium được đặt ở đỉnh ô mạng cơ sở, hãy chỉ ra vị trí của cặp electron trong ô mạng cơ sở.
d) Hằng số mạng a = 395 pm. Tính khoảng cách d của Na-He trong ô mạng cơ sở và khối lượng riêng ρ (theo đơn vị gam cm-1) của hợp chất này.
Bài 41
Tứ diện AX4 (A là nguyên tử trung tâm như silicon hoặc germanium; X là nguyên tử phối trí như oxygen, sulfur) là cấu trúc rất phổ biến trong các hợp chất vô cơ. Tư diện T1 tạo thành một dãy các “đại tứ diện” (T2, T3, …) như sau:
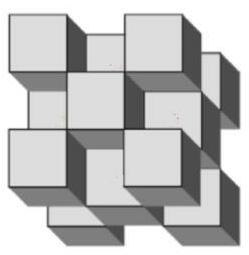
1) Công thức hóa học của T1, T2, T3 lần lượt là AX4, A4X10, A10X20. Xác định công thức đại tứ diện T4.
2) Xác định có bao nhiêu loại nguyên tử X khác nhau trong các đại tứ diện T3 và T4. Cho biết mỗi nguyên tử X liên kết với bao nhiêu nguyên tử A? Tính số nguyên tử X trong mỗi đại tứ diện trên.
3) Ở T1, T2, T3, T4, giả sử các cấu trúc đơn vị cùng liên kết với đỉnh (nguyên tử X ở đỉnh chỉ liên kết với hai nguyên tử A) tạo thành một cấu trúc ba chiều vô hạn. Xác định công thức phân tử của mắt xích trong cấu trúc 3 chiều này.
4) Điện tích mắt xích 3 chiều tạo thành đại tứ diện T3 có thể là +4, 0, -4. Chọn các ion Zn2+, In3+ hoặc Ge4+ để cùng S2- tạo thành mắt xích có công thức ứng với 3 điện tích khác nhau trên.
|
Magnesium hydride được điều chế bằng cách nhiệt phân alkyl magnesium. Hàm lượng hydrogen trong hydride là 7.6 %, khối lượng riêng của hydrogen là 0.101 gam cm-3 và khoảng cách liên nhân giữa magnesium và hydrogen là 194.8 pm. Bán kính cộng hóa trị của nguyên tử hydrogen là 37 pm và bán kính ion của Mg2+ là 72 pm.
1) Xác định dạng tồn tại của hydrogen trong hydride và giải thích ngắn gọn.
2) Trong những điều kiện nhất định, dùng máy mài bóng đề nghiền hydride trên với nickel kim loại, thu được hợp chất có công thức Mg2NiH4. Kết quả phân tích nhiễu xạ tia X cho thấy hợp chất này có cấu trúc lập phương và các đỉnh của ô mạng lập phương bị chiếm bởi các nguyên tử nickel. Số phối trí của tất cả các nguyên tử magnesium đều bằng nhau. Xác định vị trí của các nguyên tử magnesium trong ô mạng cơ sở Mg2NiH4.
3) Hằng số mạng của tinh thể Mg2NiH4 là 646.5 pm. Tính khoảng cách giữa các hạt magnesium và nickel trong tinh thể. Biết bán kính nguyên tử của magnesium và nickel là 159.9 pm và 124.6 pm.
4) Biết dung lượng lưu trữ của các vật liệu lưu trữ hydrogen được xác định số giữa khối lượng riêng của hydrogen trong vật liệu đó và khối lượng riêng của hydrogen lỏng. Tính dung lượng lưu trữ hydrogen của Mg2NiH4 (giả sử rằng hydrogen có thể được giải phóng hoàn toàn) và khối lượng riêng của hydrogen lỏng là 0.0708 gam cm-3).
Bài 43
Ở thung lũng Lavant, việc khai thác khoáng sản đang được mở rộng với sự tập trung vào kim loại Y. Y tồn tại trong một oxide Z (M = 45.88 gam/mol). Trong Z có 69.75 % oxygen và tỉ lệ số nguyên tử oxygen/kim loại = 1:1.
1) Xác định kim loại Y và giải thích bằng tính toán cụ thể.
Kim loại này có thể liên kết với với các anion của oxygen như O2-, O2 2- và O2 .
2) Xác định công thức phân tử của Z.
Kim loại Y có khối lượng riêng ρ = 0.534 gam.cm-3 và tồn tại trong một mạng tinh thể có a = 351 pm.
3) Tính toán để xác định kim loại Y thuộc dạng tinh thể lập phương nào. Có thể điều chế kim loại barium bằng cách dùng carbon khử barite (barium sulphate) (a). Trong số các sản phẩm có một hợp chất chứa nguyên tử carbon với số oxid hoá +4 và một sulphide kim loại. Xử lý sulphide với H2O và CO2 (b), sau đó ủ muối tạo thành (c). Cuối cùng, cho sản phẩm chứa kim loại tạo thành phản ứng với nhôm, thu được kim loại và nhôm oxide (d).
4) Viết các phương trình phản ứng tương ứng với bốn quá trình kể trên.
Oxide BaO tồn tại trong cùng một loại mạng tinh thể với sodium chloride.
5) Xác định số phối trí của các ion kim loại và oxide trong cấu trúc tinh thể.
Barium tạo ra nhiều oxide, một số ví dụ điển hình là BaO, BaO2, Ba(O2)2.
6) Viết phương trình phản ứng tạo thành ba oxide trên từ các đơn chất tương ứng. Khi sục ozone vào dung dịch của barium trong ammoniac lỏng sẽ tạo thành một ozonide kim loại màu nâu đỏ, rất kém bền. Ozonide này bị phân huỷ mạnh khi tiếp xúc với nước, tạo thành oxygen và dung dịch kiềm.
7) Viết phương trình phản ứng cho phản ứng giữa ozonide ion với nước, chỉ rõ số oxid hoá của các nguyên tử.
|
Để lưu trữ an toàn những lượng lớn hydrogen (ví dụ cho mục đích chế tạo các pin nhiên liệu), có thể dùng các hydride kim loại như Mg2NiH4. Hydride này có thể được tạo thành bằng cách trộn lẫn (nghiền thành hạt) magnesium hydride và đơn chất nickel.
8) Tính phần trăm khối lượng của hydrogen trong Mg2NiH4 Đơn giản hoá việc tính toán bằng giả thiết sau: Các nguyên tử nickel được sắp xếp trong mạng lập phương tâm diện của ô mạng cơ sở Mg2NiH4, còn các ion Mg nằm trong các hốc tứ diện. Mỗi nguyên tử nickel phối trí với 4 nguyên tử hydrogen xung quanh.
9) Biểu diễn tất cả các nguyên tử nickel (bỏ qua các nguyên tử hydrogen) dưới dạng các khối cầu và một ion magnesium (bạn có thể tuỳ chọn hình dạng, ví dụ như hình tam giác) vào ô mạng cơ sở sau. Chỉ ra hốc tứ diện chứa nguyên tử magnesium đã chọn bằng các đường nét đứt.
Bài
1) Dưới đây là cấu trúc tinh thể của calcit: Hình hộp trên có phải là ô mạng cơ sở của calcite không? Giải thích ngắn gọn.
2) Dưới đây là cấu trúc tinh thể lục phương của fluorapatite.
10) Có bao nhiêu hốc tứ diện và bao nhiêu hốc bát diện trong mỗi ô mạng cơ sở?
11) Tính số phân tử Mg2NiH4 có trong mỗi ô mạng. Dùng phương pháp nhiễu xạ tia X để nghiên cứu hydride kim loại. Khi sử dụng tia CuKα thì nhiễu xạ bậc một ở mặt (111) là một góc 11.92o .
12) Tính hệ số mạng a0 của ô mạng cơ sở.
13) Tính khối lượng riêng của bột Mg2NiH4 theo gam.cm-3
Đây là một hình chiếu trục c, hình tròn ở tâm là fluorine, các hình tròn khác là calcium, các tứ diện là phosphate (không biểu diễn các nguyên tử oxygen). Hãy sử dụng hình này làm cơ sở đễ vẽ hình chiếu trục c của ô mạng cơ sở fluorapatite. Nối các nguyên tử fluorine, các nguyên tử khác không cần hoàn thành.
3) Các hằng số mạng của một tinh thể là: a = 250.4 pm; c = 666.1 pm; γ = 120o; tọa độ các nguyên tử A là 0,0,1/2 và 1/3,2/3,0; tọa độ của các nguyên tử B là 1/3, 2/3, 1/2 và 0,0,0. a) Hãy vẽ ô mạng cơ sở (kí hiệu các nguyên tử A là "○", các nguyên tử B là "●").
b) Tính khoảng cách liên nhân cực tiểu giữa các nguyên tử A và B, kí hiệu là d(AB), trong tinh thể trên.
|
c) Tính dẫn nhiệt của các tinh thể cộng hóa trị là bởi dao động rung của các liên kết cộng hóa trị. Các thí nghiệm cho thấy, độ dẫn nhiệt của tinh thể theo hướng vuông góc với trục c cao gấp 20 lần so với hướng song song với trục c. Xác định mối liên hệ giữa cấu trúc tinh thể với độ dẫn nhiệt.
Bài 45
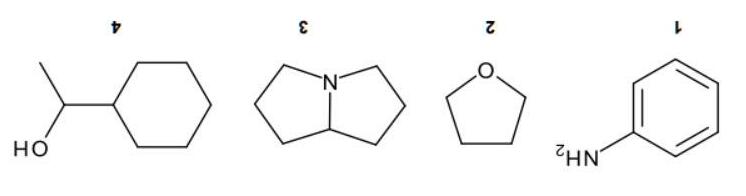
Phần A: Nước của sự kết tinh
Nước là phân tử phổ biến nhất trên bề mặt Trái đất. Nước chiếm phần lớn khối lượng của các cá thể vô sinh lẫn hữu sinh. Nước là chất lỏng ở nhiệt độ thường bởi các liên kết hydrogen liên phân tử. Một phân tử chứa H liên kết cộng hóa trị với một nguyên tử âm điện được gọi là donor (phần cho) của liên kết hydrogen, còn phân tử với nguyên tử giàu electron sẽ tạo liên kết hydrogen với nguyên tử H được gọi là acceptor (phần nhận).
1) Xác định những phân tử nào trong hình dưới đây có thể đóng vai trò donor và/hoặc acceptor.
a) Chỉ đóng vai trò acceptor. b) Chỉ đóng vai trò donor. c) Vừa là acceptor, vừa là donor. Liên kết hydrogen được biểu diễn bởi đường nét đứt (---) trong khi liên kết cộng hóa trị được biểu diễn bởi đường nét liền. Đối với một số hợp chất, liên kết hydrogen liên phân tử dẫn tới sự tạo thành một số mạng xốp, với kích thước hốc (lỗ trống) xác định. Một số mạng như vậy có thể được sử dụng để bắt (thu vào) chọn lọc các phân tử nhỏ như NH3, CH4, SO2, … trong khí quyển.
Xenon là một loại thuốc gây mê hiện đại đã được ứng dụng thành công trong phẫu thuật, điều này cho thấy nó có khả năng tương tác với các phân tử khác. Một thách thức nảy sinh là chi phí sản xuất xenon quá cao, cùng với đó là việc lưu trữ và vận chuyển. Điều thú vị là, Xe có thể được lưu trữ thuận nghịch trong các mạng ba chiều xốp của các phân tử như nước, quinol, … với cấu trúc được duy trì bởi các liên kết hydrogen. Sự hóa hơi chậm dung dịch p-quinol bão hòa với Xe tạo thành các tinh thể mạng phân tử p-quinol. Kết quả nhiễu xạ tia X các tinh thể này cho thấy 6 phân tử p-quinol được sắp xếp quanh 1 nguyên tử Xe. Các vòng phenyl
của p-quinol sắp xếp thành vòng tròn ở các vị trí xen kẽ trên và dưới của mặt phẳng. Sự sắp xếp này tạo thành các hốc lục phương trong cấu trúc.
Ô mạng cơ sở của các tinh thể p-quinol lưu-trữ-Xe được cho dưới đây. Hai phân tử p-quinol nằm ở tâm của hai mặt đối diện nhau, 8 phân tử nằm ở tâm các cạnh, và phần còn lại nằm trong khối mạng.
Các thông số mạng của ô mạng cơ sở trên là: a = 16.58 Å, b = 16.58 Å, c = 5.42 Å, α = β = 90°, γ = 120°.
4) Xác định khối lượng riêng của tinh thể (theo kg m-3), giả sử rằng tất cả các hốc lục phương trong tinh thể bị chiếm bởi các nguyên tử Xe.
5) Giả sử toàn bộ các hốc lục phương trong tinh thể bị chiếm bởi các nguyên tử Xe, tính thể tích của Xe được giải phóng từ 1 cm3 mạng phân tử p-quinol ở 298 K và 1 atm.
Phần B: Nước của quá trình kết tinh
Nước của quá trình kết tinh là lượng nước cần cho để các loại muối nhất định kết tinh từ dung dịch của chúng. Các nghiên cứu đã chỉ ra rằng nước của quá trình kết tinh tạo các liên kết với ion của muối và làm bền hóa cấu trúc tinh thể. Nước cũng tác động đến hình dạng và màu sắc của tinh thể. Các tinh thể xanh lơ CuCl2.2H2O khi đun nóng bị mất nước, tạo thành muối khan màu nâu. Ô mạng cơ sở cửa CuCl2 khan được cho dưới đây, trong đó mỗi nguyên tử đồng nằm trong phối trí vuông phẳng và tất cả các khoảng cách Cu-Cl bằng nhau.
Một góc nhìn của ô mạng này dọc theo trục c được cho ở dưới, với các nguyên tử C, O và Xe đã được kí hiệu (các nguyên tử H không được kí hiệu trong cấu trúc này).
2) Chỉ ra các liên kết hydrogen tạo thành các hốc lục phương trong cấu trúc ở trên.
3) Dựa vào ô mạng cơ sở ở trên, tính số phân tử p-quinol và số nguyên tử Xe có trong mỗi ô mạng cơ sở.
6) Sự sắp xếp ion này được bền hóa bởi
i) Mỗi Cu2+ ion được bền hóa bởi 2 Cl ion vuông góc với mặt phẳng CuCl4. ii) Mỗi Cl ion được bền hóa bởi 2 Cu2+ ion vuông góc với mặt phẳng CuCl4. iii) Cấu trúc này có sự sắp xếp các Cu2+ ion theo mạng FCC. iv) Các lớp Cl ion nằm cạnh nhau và được kẹp giữa các lớp Cu2+ . Khi CuCl2 tiếp xúc với hơi ẩm, nước thâm nhập vào khoảng không gian giữa các ion tạo thành CuCl2.2H2O. Các phân tử nước gây ra nhiều biến đổi như sự dịch chuyển các đơn vị Cu-Cl với nhau và làm thay đổi khoảng
|
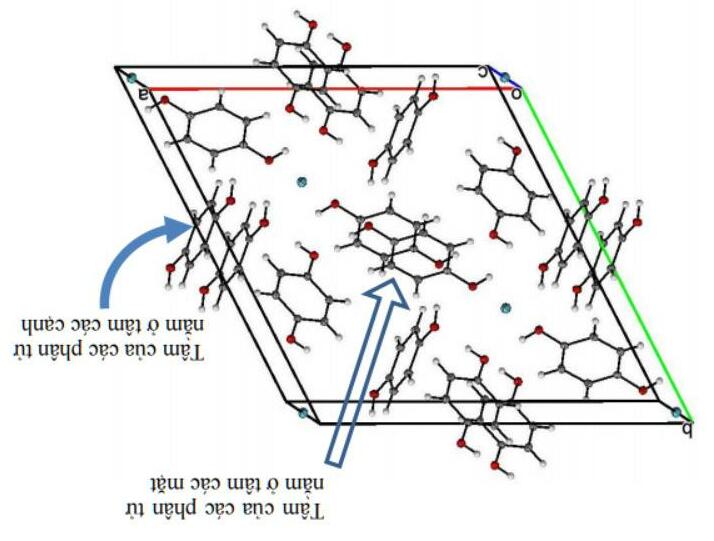
cách Cu-Cl. CuCl2.2H2O kết tinh theo mạng trực thoi tâm đáy, được bền hóa bởi các liên kết hydrogen. Các Cu2+ ion chiếm tất cả các đỉnh và tâm của hai mặt đối diện nhau.
Bảng dưới đây cho biết 4 vị trí mạng có thể có của các Cl ion đối với các
Cu2+ ion. Trong bốn mạng đã có, có 3 không quan sát thấy bởi một hoặc nhiều các nguyên do sau:
I. Các cấu trúc có thể có lực đẩy liên-ion cao, không thể được tối thiểu hóa hiệu quả bởi hai phân tử nước trên mỗi Cu2+ ion.
II. Ô mạng đã đưa ra không phải là ô cơ sở bởi nó không được lặp lại để tạo thành mạng tinh thể.
III. Tỉ lệ của Cu2+:Cl ion không phải là 1;2 trong mỗi ô cơ ở.
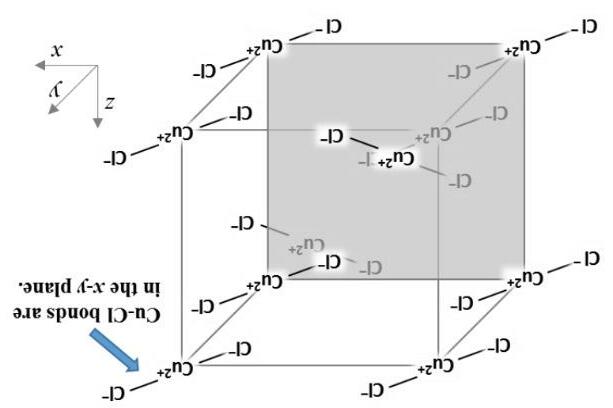
7) Xác định các mạng không thể quan sát được bằng cách dẫn ra các nguyên nhân chính xác (I, II, III) với từng cấu trúc. Trong mạng quan sát được, hãy chỉ ra các phân tử nước với các liên kết phù hợp với ion. Mạng phân tử Nguyên nhân không tồn tại
|
Các vật liệu có thể lưu trữ và giải phóng năng lượng bằng cách hấp thụ các phân tử nước là những hệ lưu trữ nhiệt đầy tiềm năng. Các muối như CuCl2.2H2O có thể bị dehydrate hóa bằng cách đặt trong ánh sáng mặt trời - một quá trình thu nhiệt. Các muối khan có thể để dùng để sưởi ấm một căn phòng do sự tiếp xúc với hơi nước. Các thiết bị trên cơ sở những muối này có thể được lặp đi lặp lại quá trình dehydrate và hydrate hóa. Trong nghiên cứu về vật liệu lưu giữ nhiệt năng, một sinh viên đã kiểm tra lượng nhiệt giải phóng khi CuCl2 khan tiếp xúc với nước. Cậu đã thêm 2.5 gam CuCl2 khan vào 50 mL nước (ban đầu ở 25 oC) trong một cốc polystyrene đậy kín và ghi nhận được mức tăng nhiệt độ là 3.2 oC.
8) Giả sử rằng cốc polystyrene là một hệ kín và cách nhiệt. Nhiệt dung riêng của nước (với các muối tan) là 4.18 J oC-1 gam-1, tính nhiệt lượng giải phóng (enthalpy của quá trình hydrate hóa) bởi CuCl2 khan theo kJ mol-1 .
9) Để sưởi ấm một căn phòng trong một tối mùa đông, cần sử dụng 6000 kJ năng lượng. Xác định lượng CuCl2 khan (tính theo kg) cần lưu giữ trong thiết bị có thể nạp lại để thu được nhiệt lượng như trên.
1) Ngay từ thế kỉ 19, con người đã biết sử dụng phản ứng của boride kim loại và carbon để tạo thành các boron carbide - được xem là những chất cứng nhất, chỉ sau kim cương và boron nitride. Công thức phân tử của hợp chất này được xác định vào thập niên 1930. Dưới đây là cấu trúc của đơn vị boron carbide được công bố vào năm 2007.
Hình ảnh này cho thấy toàn bộ các nguyên tử nằm trong ô mạng cơ sở, ngoại trừ “bộ 3 nguyên tử” (nguyên tử trung tâm và 2 nguyên tử nối với nó). Trong các nguyên tử còn lại của ô mạng cơ sở thì mỗi nguyên tử thuộc 1 khối đa diện B12 (các nguyên tử khác của khối đa diện không nằm trong ô mạng không được biểu diễn). Thanh ngắn cạnh nguyên tử biểu diễn liên kết với các nguyên tử khác. Nếu “bộ 3 nguyên tử” trên đều là carbon, hãy xác định công thức của boron carbide.
2) Trục quay của cấu trúc trên là gì? Nó có tâm đối xứng và mặt phẳng gương (mặt phẳng đối xứng) không? Nếu có, hãy xác định số lượng và vị trí trong hình.
3) Hình dạng của ô mạng cơ sở trên thuộc kiểu nào trong 7 hệ tinh thể được quy định bởi Hiệp hội Tinh thể Quốc tế (1983)?
Các hợp kim phức - loại hợp chất đặc biệt được đặc trưng bởi một ô mạng cơ sở có hơn 100 nguyên tử. Tinh thể của những hợp chất này chứa các cụm nguyên tử (cluster) làm bền hoá cấu trúc. Các tinh thể không thuộc cụm được gọi là nguyên tử “keo” (glue atom). Hợp chất X13Y4 có mạng tinh thể trực thoi (α = β = γ = 90°) với các hằng số mạng: a = 8.16 Å, b = 12.34 Å, c = 14.45 Å. Khối lượng riêng của hợp kim là 4018 kg/cm3. Các tinh thể của hợp chất này chứa các cụm kim loại 3 lớp A (xem hình, các lớp là k, m, n) và các nguyên tử “keo”. Mỗi ô mạng cơ sở chứa 2 cụm nguyên tử A và số nguyên tử “keo” không vượt quá 30.
1) Mỗi cụm đơn A có bao nhiêu liên kết Y-X-Y?
2) Tính số nguyên tử trong ô mạng cơ sở của X13Y4. 3) Xác định X13Y4, biết rằng khối lượng của các nguyên tử “keo” chiếm 12.27 % tổng khối lượng hợp chất. Hợp chất X13Y4 là xúc tác hiệu quả cho phản ứng hydrogen hoá các hydrocarbon chưa bão hoà. Quá trình then chốt của phản ứng trên là sự phân li các phân tử hydrogen trên bề mặt kim loại. Năng lượng hoạt hoá phân li trên bề mặt hợp chất này ở 300 K nhỏ hơn 45 % so với trên bề mặt kim loại X tinh khiết. Hệ số trước hàm mũ (A) trong cả hai quá trình phân li giống nhau; bên cạnh đó thì k(X13Y4) / k(X) = 5∙107.
4) Tính giá trị năng lượng hoạt hoá của quá trình phân li hydrogen trên các bề mặt X13Y4 và X
5) Tính hằng số tốc độ phân li hydrogen với X13Y4 ở 350 K nếu A = 105 mol/L.s.
Cho biết: R = 8.314 J/mol∙K, NA = 6.02∙1023 mol-1 .
Một số fullerene khi được biến tính bằng kim loại kiềm sẽ có trạng thái siêu dẫn. Trong các hợp chất này, các nguyên tử kim loại kiềm lấp đầy các lỗ trống trong mạng tinh thể lập phương tâm diện, được tạo ra bởi các phân tử fullerene.
a) Tính hằng số mạng (a) của tinh thể fullerene có khối lượng riêng 1.67 gam.cm-3 .
b) Tính bán kính phân tử fullerene, giả sử rằng khoảng cách giữa các khối cầu kề nhau trong phân tử, tức là độ dài liên kết C-C, là d = 1.42 Å.
c) Tính bán kính của các khối cầu (roct và rthd) lấp khít các hốc bát diện và tứ diện trong tinh thể fullerene. Gợi ý: Bán kính của một mặt cầu ngoại tiếp khối tứ diện được cho bởi công thức - trong đó t là chiều dài cạnh của khối tứ diện.
Hình vẽ dưỡi đây biểu diễn cấu trúc tinh thể lập phương tâm diện AnC60trong đó A là Li, N, K, Rb, Cs, còn n là một số nguyên.
d) Chứng minh rằng trong cấu trúc trên, n = 3. Chú ý rằng tất cả các hốc tứ diện và bát diện bị lấp đầy bởi các nguyên tử kim loại kiềm. Bảng dưới đây cho biết bán kính nguyên tử r(Ao), bán kính ion r(A+), enthalpy hoá hơi ΔHvap(A), năng lượng ion hoá IP(A) của các kim loại kiềm và thông số mạng của fulleride tương ứng.
r(A0) / Å r(A+) / Å ΔHvap(A) / kJ mol-1 IP(A) / kJ mol-1 a(AnC60) / Å
|
Li 1.52 0.76 136 520 -
Na 1.86 1.02 108 496 14.191
K 2.27 1.38 90 419 14.240
Rb 2.48 1.52 69 403 14.384
Cs 2.65 1.67 66 376 14.761
e) Tính giá trị rthd của fullerene bị biến tính bởi mỗi kim loại kiềm. So sánh các giá trị tính được với các giá trị r(Ao) và r(A+) trong bảng và chứng minh rằng các nguyên tử kim loại kiềm có mang điện.
f) Tính năng lượng mạng lưới (kJ.mol-1) của hợp chất Li3C60 bằng phương trình Kapustinskii ΔU = −107000∙ν∙|z+|∙|z |/(r+ + r ), trong đó v là tổng số ion trong công thức thực nghiệm; z+ và z là điện tích của từng ion; r+ và r là bán kính ion (theo pm). Giả sử: r+ + r ≈ rthd(Li3C60) + 4.31 Å
Chất siêu dẫn thuộc họ fulleride đầu tiên được công bố là K3C60. Tiếp đó là Rb3C60 và Cs3C60 được tổng hợp trong cùng một năm. Còn Na3C60 thì khó và cần nhiều thời gian hơn mới tổng hợp được. Riêng Li3C60 thì đến nay vẫn chưa tổng hợp được. Có một mối tương quan giữa enthalpy tạo thành và trình tự khám phá ra các hợp chất A3C60. g) Sắp xếp các A3C60 theo thứ tự tăng dần của giá trị tuyệt đối của enthaply tạo thành.
Oxit than đá (Graphite oxide: GO) là một hợp chất thu được bằng cách xử lý than đá với chất oxi hóa mạnh. Trong oxit than đá, các lớp cacbon tổ ong (hình 1) chứa các nhóm chức có oxi.
Hình 1a. Cấu trúc của than đá. Oxit than đá vẫn giữ nguyên cấu trúc lớp của than đá, nhưng khoảng cách giữa các lớp tăng gần gấp hai lần (~12 Å thay cho 6,69 Å của than đá). Một số các nguyên tử cacbon bị oxi hóa. Công thức mạng lưới phân tử của oxit than đá là COxHy, trong đó x và y phụ thuộc vào phương pháp oxi hóa. Trong những năm gần đây, oxit than đá thu hút sự quan tâm vì có thể coi nó là tiền thân (tiền chất) của graphene (là vật liệu nano cacbon cấu trúc không gian hai chiều, có chiều dày là kích thước nguyên tử, có tính chất điện đặc trưng). Sự tách lớp của oxit than đá cho các lớp mỏng oxit graphene.
Hình 1b. Một lớp đơn của mạng lưới tinh thể oxit than đá. Một vài nguyên tử oxi trong các nhóm chức được chỉ ra. Số lượng các nhóm chức trong oxit than đá phụ thuộc vào cách thức oxi hóa.
Quá trình khử các lớp của oxit than đá cho ra sản phẩm graphene.
1. Hãy nêu hai lý do giải thích tại sao oxit than đá là tiền chất phù hợp hơn để tạo ra graphene? So sánh oxit than đá với than đá trong quá trình sản xuất graphene? Theo bạn việc sản xuất graphene từ oxit than đá gặp vấn đề không phù hợp nhất là gì?
2. Mô hình về lớp đơn oxit than đá đơn giản nhất (mô hình Hoffman) được chỉ ra dưới đây:
Hình 2a. Mô hình Hoffman cho cấu trúc của oxit than Nó được giả sử rằng các nhóm chức chỉ bao gồm một loại, gọi là epoxy (O-) được tạo ra trong mặt phẳng cacbon giống như kết quả quá trình oxi hóa than đá.
• Tính giá trị x trong công thức COx của oxit than đá nếu 25% các nguyên tử cacbon trong oxit than đá vẫn giữ lai hóa sp2 .
• Giá trị x đạt lớn nhất trong mô hình Hoffman bằng bao nhiêu?
3. Một mô hình hiện đại của lớp đơn oxit than đá (mô hình Lerf-Klinowski) được chỉ ở hình 2b. Chỉ ra các nhóm chức chứa trong mô hình này? 4. Coi như tất cả các lớp oxit than đá giống như mô hình Lerf-Klinowski. Công thức thực nghiệm của vật liệu là CH0,22O0,46. Tính hàm lượng phần trăm số nguyên tử cacbon chưa bị oxi hóa. Chỉ ra giới hạn trên và giới hạn dưới? (coi như chỉ có các nguyên tử cacbon nằm trong mặt phẳng các hình lục giác).
Hình 2b. Mô hình Lerf - Klinowski cho cấu trúc của oxit than 5. Oxit than đá hấp thụ nước giữa các lớp của chúng. Đó là một trong các tính chất quan trong nhất của vật liệu này. Sự hấp thụ xảy ra do hình thành các liên kết hiđro giữa các phân tử nước và các nhóm chức: (hình 3). Nếu công thức thực nghiệm của oxit than đá là CH0,22O0,46 thì số phân tử nước ứng với một nguyên tử cacbon tối đa có thể bị hấp thụ là bao nhiêu? Tìm công thức thực nghiệm của oxit than đá ngậm nước trong trường hợp này? Sử dụng mô hình Lerf-Klinowski. Hãy chỉ xem xét các điểm nối trong hình 3 (một phân tử nước giữa hai phân tử oxi hoặc/và giữa hai nhóm OH)
Hình 3. Mạng lưới liên kết hiđro được tạo thành giữa các nhóm chức chứa oxy trong oxit than và nước.
Bài 1
1) Viết tất cả các đồng phân của phức chất [Co(bipy)2Cl2] với bipy là: N N
2) Monochlorobromo (aminoacetate) cobalt (III) ion có nhiều đồng phân và dưới đây là 1 trong số các đồng phân đó. Hãy biểu diễn tất cả các đồng phân dạng bát diện khác.
Bài 2 Phản ứng của FeCl2 với phenanthroline (phen) và hai mol K[NCS] cho một phức sắt (II) bát diện Fe(phen)2(NCS)2 (A). Ở nhiệt độ của nitơ lỏng thì A có momen từ là 0.0 B.M. nhưng lại có một momen từ gần 4.9 B.M ở nhiệt độ phòng. [Momen từ hiệu lực, μeff, đối với một phức chứa n electron không cặp đôi được cho bởi biểu thức: μeff = n(n2) + Manheton Bohr , B.M.]
N N
Phenanthroline
a) Vẽ các cấu trúc đồng phân có thể có của A b) Xác định số electron hóa trị chiếm các obitan d của A
c) Xác định cấu hình electron của các obitan d ứng với hai trường hợp nhiệt độ thấp và nhiệt độ cao để giải thích từ tính A [Trong hai trường hợp nên lưu ý đến momen từ hiệu lực]
d) Ý nào sau đây đúng cho trường hợp momen từ ở nhiệt độ thấp:
e) Ý nào sau đây đúng cho trường hợp momen từ ở nhiệt độ cao:
Ligand Hacac (B, C5H8O2) có cấu trúc như dưới đây. Xử lý với NH3 cho anion acac (C) mà ở đó liên kết C–O dài hơn trong B và phổ 1H NMR cho hai tín hiệu. Thêm 3 mol acac vào dung dịch nước FeCl3 cho một màu đỏ sáng của một phức bát diện (D) có thành phần C15H21O6Fe với momen từ hiệu lực là 5.9 B.M.
f) Vẽ cấu trúc anion acac (C) và vẽ các cấu trúc cộng hưởng để giải thích sự khác nhau về độ dài liên C–O trong B và C.
g) Vẽ cấu trúc của B và C và xác định trạng thái lai hóa của tất cả các nguyê tử carbon trong mỗi chất.
h) Vẽ các đồng phân có thể có của D và xác định cấu hình electron của obitan d dựa trên các kết quả momen từ.
1) Các Lewis acid và base có thể tạo thành các phức chất acid-base. Đánh giá tính acid của các Lewis acid trong hai phản ứng sau và sắp xếp theo thứ tự từ mạnh đến yếu.
F4Si N(CH3)3 + BF3 → F3B N(CH3)3 + SiF4
F3B N(CH3)3 + BCl3 → Cl3B N(CH3)3 + BF3
2) a) Vẽ cấu trúc của các phân tử BF3, N(CH3)3 và chỉ rõ trạng thái lai hóa của nguyên tử trung tâm. b) Vẽ cấu trúc của F3B-N(CH3)3, F4Si-N(CH3)3 và chỉ rõ trạng thái lai hóa của các nguyên tử Si, B.
1) BeCl2 là phân tử cộng hóa trị, có thể tồn tại ở dạng monomer, dimer hoặc polymer. Hãy vẽ cấu trúc của chúng và xác định trạng thái lai hóa của Be.
2) Các peroxide của Cr có số oxid hóa cao thì thường kém bền và dễ phân hủy, nhưng Cr(O2)2[NH(C2H4NH2)2] thì lại rất bền. Phức chất này vẫn giữ được những đặc trưng cấu trúc của Cr peroxide. Xác định cấu trúc hợp chất này, chỉ rõ số oxid hóa của Cr.
3) Một số hợp chất carbonyl kim loại có nhóm thế alkyl có thể tham gia vào các phản ứng chèn carbonyl với một số phối tử khác để tạo thành các phức chất acyl. Xác định cấu trúc sản phẩm phản ứng giữa Mn(CO)5(CH3) và PPh3. Chỉ rõ số oxid hóa của Mn.
Nhôm kết tinh ở theo mạng tinh thể lập phương, với các khối cầu xếp đặc khít và có thể được kí hiệu là fcc. Khối lượng riêng là ρ = 2,699 g/cm3 Nhôm có thể được cán thành lá, với độ mỏng 0,004 mm
1) Biểu diễn các khối cầu (nguyên tử Al) trong ô mạng cơ sở sau để chúng đạt được dạng lập phương đặc khít (cubic closest packing)
2) Tính hằng số mạng a theo ppm. Nhôm dễ tan trong dung dịch hydrochloric acid đặc, tạo thành các [Al(H2O)6]3+ ion. Ở nhiệt độ thường, nhôm có thể tan trong base mạnh, tạo thành các [Al(OH)4] ion. Trong cả hai trường hợp đều giải phóng hydrogen.
3) Xác định tên gọi hệ thống của hai ion trên.
4) Viết phương trình biểu diễn hai quá trình trên. Bauxite là nguồn nguyên liệu thô quan trọng để sản xuất nhôm. Quặng nhôm này chứa aluminium oxide-hydroxide AlOx(OH)3-2x. (0 <x <1).
Để chuyển bauxite thành aluminium oxide đủ tinh khiết, có thể dùng quá trình Bayer. Thêm sodium hydroxide vào bauxite ở nhiệt độ cao thì aluminium hydroxide bị tan dễ dàng, để lại bã không tan còn gọi là “bùn đỏ”. Thông thường thì ngoài Al2O3, bauxite được dùng trong công nghiệp còn chứa SiO2, Fe2O3, TiO2, P4O10, … 5) Hoàn thành các phương trình phản ứng sau của quá trình Bayer: Al2O3 + OH + → [Al(OH)4(H2O)2] SiO2 + OH → ( ) ( ) + → ↓ + [Al(OH)4(H2O)2]- → + OH + H2O Al(OH)3 → Al2O3 +
Aluminum oxide có nhiều dạng thù hình, chẳng hạn α-Al2O3 mặt thoi, bị biến tính bởi chromium, được gọi là “ruby”. Màu đỏ của ruby gây ra bởi các Cr3+ ion trong tinh thể. Ngoài việc được sử dụng làm đá quý trang sức, thì ruby tổng hợp, đơn tinh thể còn được dùng trong công nghệ laser. Hãy xét một thanh làm bằng ruby, dài 15,2 cm và đường kính 1,15 cm. Hàm lượng (m/m) Cr3+ ion là 0,050 %. Khối lượng riêng của nhôm là ρ = 4,05 g / cm3 .
6) Ước lượng số Cr3+ ion trong thanh ruby này. Các Cr3+ ion trong ruby tạo phối trí bát diện với 6 oxygen ion, dẫn tới sự tách mức năng lượng của các 3d-orbital. Các hình ảnh dưới đây biểu diễn dạng hình học của các 3d-orbital cùng các mức năng lượng bị tách.
7) Hãy cho biết mỗi orbital sau đây là t2g hay eg-orbital:
8) Điền các mũi tên (biểu diễn electron) vào giản đồ d-orbital của Cr3+ ion.
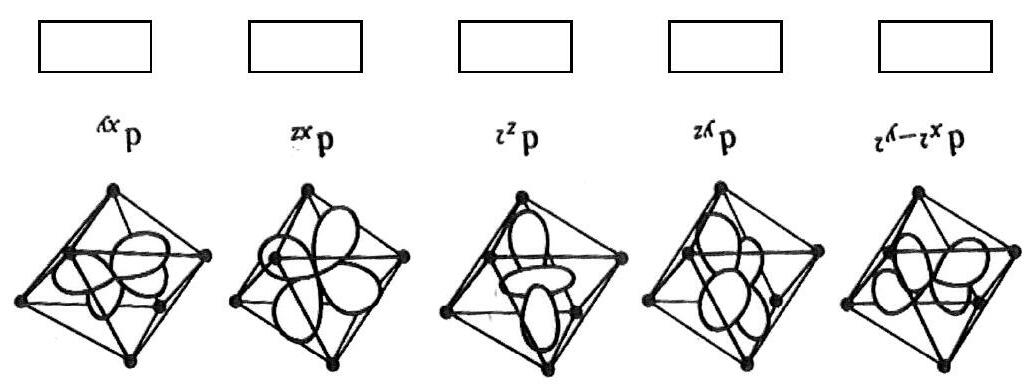
Nhôm có nhiều đồng vị, với cách phân rã và chu kì bán rã khác nhau. Trong số chúng, chỉ có 27Al là đồng vị bền. 24Al có chu kì bán rã khoảng 2,05 giây và bị phân rã +, sau đó là phân rã để tạo thành một hạt nhân bền.
9) Viết hai phương trình phản ứng hạt nhân của 24Al. Tuổi của xương người hoá thạch hoặc thiên thạch có thể được xác định gián tiếp bởi phương pháp SED (surface exposure dating - định tuổi qua tiếp xúc bề mặt). Phương pháp này dựa trên quá trình bắt electron bằng 26Al.
Phức chất của nitơ monoxit (NO) và kim loại chuyển tiếp d, hay phức chất nitrozyl, là hợp chất quan trọng trong hóa học phối trí hiện đại. Trong phức chất nitrozyl đơn nhân, NO tồn tại ở dạng NO+ hoặc NO
a) Biểu diễn liên kết giữa NO và nguyên tử kim loại M trong phức nitrozyl đơn nhân và xác định góc liên kết M–N–O. Cho biết NO+ và NO đều là phối tử đóng góp hai electron và phối trí với nguyên tử kim loại M qua nguyên tử N.
b) Trên phổ hồng ngoại của phức chất nitrozyl đơn nhân, số sóng đặc trưng của liên kết N–O xuất hiện trong vùng 1525–1690 cm-1 hoặc 16501950 cm-1. Xác định vùng số sóng tương ứng với từng dạng tồn tại của NO.
c) Trong dãy hợp chất K2[M(NO)X5] của kim loại chuyển tiếp M, số sóng của liên kết N–O tương ứng là 1912 cm-1, 1880 cm-1 và 1840 cm-1 khi X lần lượt là Cl, Br và I. Xác định M, biết trong dãy hợp chất trên, nguyên tử trung tâm M tuân theo quy tắc 18 electron và M thuộc chu kỳ 5.
d) Giải thích sự thay đổi số sóng của liên kết N–O trong phổ hồng ngoại của các hợp chất K2[M(NO)X5] nêu trên.
Aluminium hydride AlH3 có thể được tổng hợp từ phản ứng của AlCl3 với lithium aluminium hydride.
1) Viết phương trình phản ứng.
Aluminium hydride (đôi khi được gọi là alane) là chất rắn không màu, có thể tự bốc cháy. Nó tạo thành các chuỗi AlH3. Còn bây giờ, chúng ta chỉ tập trung vào AlH3 monomer (dạng đơn phân tử).
2) Xác định dạng hình học của AlH3 theo thuyết VSEPR (tứ diện, vuông phẳng, tam giác phẳng hay tháp tam giác?)
3) Dưới đây là một giản đồ MO trống của AlH3. Hãy điền các kí hiệu mũi tên (biểu diễn electron) vào giản đồ này. Xác định HOMO, LUMO và dự đoán tính chất từ.
MO(AlH3)
AlH3 tạo thành một sản phẩm cộng với trimethyl amine (kí hiệu NMe3): AlH3 + NMe3 → AlH3∙NMe3
4) Vẽ công thức chiếu Natta của sản phẩm cộng. Chỉ rõ các điện tích hình thức, nếu cần thiết.
|
Dưới đây là các orbital biên (LUMO của Lewis acid và HOMO của Lewis base) cùng với hai orbital phân tử mới được tạo thành từ sự tổ hợp hai orbital này, kèm theo các giá trị năng lượng (theo eV).
5) Điền AlH3 và NMe3 vào các ô tương ứng.
6) Vẽ các mũi tên biểu diễn cặp electron của Lewis base vào HOMO chính xác.
3,7eV
0,5eV -9,4eV -11,9eV
1) Xác định số oxid hóa và số phối trí của vanadium trước và sau phản ứng sau. Độ dài liên kết N-N thay đổi như thế nào?
Hãy thử ước lượng enthalpy tạo thành sản phẩm. Để đơn giản hóa, giả sử rằng sự chuyển các HOMO-electron sang MO mới là điều duy nhất chúng ta cần quan tâm.
7) Tính enthalpy phản ứng trên theo kJ/mol.
8) Tính bước sóng tương ứng với bước chuyển giữa MO liên kết và MO không liên kết.
2) Thí nghiệm nhiễu xạ đơn tinh thể đã xác nhận rằng 3 nguyên tử chromium trong phức chất [Cr3O(CH3CO2)6(H2O)3]Cl∙8H2O là tương đương nhau về mặt hóa học. Acetate là phối tử cầu và phân tử nước là phối tử đơn càng. Xác định cấu trúc của cation trong phức chất.
3) Trong các phức chất A, B thì O2 là phối tử liên kết với nguyên tử ion trung tâm. Công thức của A là [Co2O2(NH3)10]4+, độ dài liên kết O−O tương ứng là147 pm; công thức của B là Co(bzacen)PyO2, độ dài liên kết O−O tương ứng là 126 pm. Trong đó Py là (C5H5N), bzacen là [C6H5 C(O )=CH−C(CH3)=NCH2−]2. B có thể được dùng làm chất mang oxygen nhân tạo. Vẽ cấu trúc của A và B (cần xác định rõ mối liên hệ về mặt không gian giữa O−O và các ion kim loại), chỉ rõ số oxid hóa của Co trong A và B.
4) Vẽ cấu trúc của Al2(n-C4H9)4H2 và Mg[Al(CH3)4]2.
5) Thêm ammonia vào dung dịch chứa cis-Co (NH3)4(H2O)2]3+ tạo thành kết tủa chứa cobalt {Co[Co(NH3)4(OH)2]3}6+ - đây là một ion phức đa nhân với các nhóm hydroxyl đóng vai trò liên kết cầu. Vẽ cấu trúc của phức chất này.
1) Vẽ cấu trúc của phức chất trung hòa được tạo thành bởi muối sodium của of 2,4-pentanedione và Mn3+. Dùng kí hiệu O O để biểu diễn phức chất.
2) Moment từ của phức chất này là 4.9 Bohr. Xác định số electron chưa ghép cặp của nguyên tử Mn trung tâm.
3) Hợp chất trên có tính quang hoạt không? Tại sao?
4) Vẽ cấu trúc của 2,4-pentanedione anion. Biểu diễn kí hiệu các liên kết π giải tỏa electron.
5) Phức chất rắn A màu vàng cam có tên là hexamminecobalt(III) chloride, được tổng hợp bằng cách trộn cobalt dichloride, ammonia đặc, ammonium chloride và hydrogen peroxide và sử dụng carbon hoạt tính làm xúc tác. Các nghiên cứu về cơ chế phản ứng cho thấy rằng ban đầu phản ứng tạo thành Co(NH3)6 2+, sau đó xảy ra phản ứng thế phối tử, tạo thành ion phức hai tâm B4+ với một phối tử mới dưới dạng liên kết cầu. Tiếp đó là sự phá vỡ liên kết cầu, đồng thời 2 electron được chuyển sang phối tử, tạo ra 2 ion C2+. Cuối cùng, C2+ tham gia vào phản ứng thế phối tử trên bề mặt carbon hoạt hóa và kết hợp với các chloride ion tạo thành phức chất rắn A. Viết phương trình phản ứng tổng và vẽ cấu trúc của B4+ , C2+ .
Bài 10
Năm 1976, các thí nghiệm nhiễu xạ neutron đã chứng thực rằng trans[Co(en)2Cl2]2Cl∙HCl∙2H2O tạo thành từ 3 tiểu phân, A+ (chứa cobalt), Cl và X+. Tất cả các nguyên tử trong X đồng phẳng với 1 tâm đối xứng và 3 mặt phẳng gương vuông góc với nhau. Cho biết: en là kí hiệu của ethylenediamine.
1) Vẽ cấu trúc của A+ và xác định các đối quang của nó.
2) Xác định cấu trúc của X+ .
Ba hợp chất khác nhau của Cr(III) với H2O và ion clo (Cl –), có cùng thành phần 19,51% Cr; 40,57% H2O và 39,92% Cl.
+ Hợp chất thứ nhất có màu tím, tan nhanh trong nước tạo ion phức có điện tích 3+ và 3 ion Cl –. Tất cả các ion Cl – này kết tủa ngay thành AgCl khi thêm AgNO3 vào dung dịch.
+ Hợp chất thứ hai có màu xanh, tan nhanh trong nước tạo ion phức có điện tích 2+ và 2 ion Cl –. Cả hai ion này cho kết tủa AgCl.
+ Hợp chất thứ ba có màu lục, tan nhanh trong nước, tạo ion phức có điện tích 1+ và 1 ion Cl –. Ion này tạo kết tủa AgCl.
Viết công thức, gọi tên và vẽ cấu trúc của ba ion phức chất nêu trên. Giả sử trong trường hợp này ta chỉ xét đến các phức chất đơn nhân.
Bài 12
Bài tập này nói về 7 phức chất của nickel: cấu trúc, phản ứng và các phối tử của chúng. Mỗi phức chất được kí hiệu bởi một chữ cái như sau: A: [Ni(NH3)6]2+ B: [Ni(NO2)6]4- C: [Ni(OH2)6]2+
D: [Ni(NH3)2(OH2)4]2+ E: [Ni(en)(OH2)4]2+ F: [Ni(en)3]2+ G: [Ni(CO)4]
1) Dưới đây là tên gọi của một số phức chất. Nếu bạn tìm thấy tên của một số phức chất ở trên thì hãy điền vào ô trống các chữ cái tương ứng. hexaamminenickel(III) _____ hexaaquanickel(II) _____ hexaethylendiaminonickel(II) _____ hexanitratonickel(II) _____ diamminetetraaquanickel(II) _____ tetraaquaethylendiaminonickel(II) _____ tetracarbonylnickel(II) _______ tetracarbonylnickel(0) _____
Chúng ta hãy cùng tìm hiểu kĩ hơn về ba phức bát diện A, B, C.
2) Viết cấu hình electron hoàn chỉnh của nguyên tử trung tâm trong các phức chất trên.
3) Vẽ giản đồ biểu diễn sự tách mức năng lượng của các orbital d của Ni trong phức bát diện. Dự đoán tính chất từ.
Các nhà khoa học đã đo được giá trị năng lượng tách ΔO của các phức chất A, B, C. Bạn có thể xác định chúng trong bảng sau đây theo các đơn vị năng lượng khác nhau.
4) Bổ sung các giá trị ΔO còn thiếu và điền các chữ cái (A, B, C) tương ứng với các phức chất vào hàng đầu tiên. Phức chất
ΔO/cm 1 8500 10800
ΔO/eV 1.34 1.61
ΔO/kJ mol 1 101.68 155.51
5) Tính năng lượng bền hoá trường phối tử của phức chất có ΔO = 10800 cm-1 theo eV.
6) Trong tính toán này bạn không cần quan tâm tới năng lượng ghép cặp P, bởi
(i) … đây chỉ là một giá trị gần đúng, có thể bỏ qua P.
(ii) … bạn chỉ cần quan tâm đến P trong các orbital nằm ở mức năng lượng cao hơn các orbital khác.
(iii) … nguyên tử Ni trung tâm ở trong trường phối tử hình cầu có cùng số spin ghép cặp.
(iv) Tất cả đều sai. Phải tính đến P.
Hai cân bằng hoá học sau tồn tại trong dung dịch loãng ở 298 K (en = ethane-1,2-diamine)
(1) [Ni(OH2)6]2+ + 2 NH3 ⇌ [Ni(NH3)2(OH2)4]2+ + 2 H2O
(2) [Ni(OH2)6]2+ + en ⇌ [Ni(en)(OH2)4]2+ + 2 H2O
Cân bằng (1) có lnKc = 11.60 và ΔRH° = -33.5 kJ
và cân bằng (2) có ln Kc = 17.78 và ΔRH° = -37.2 kJ
7) Phức chất D [Ni(NH3)2(OH2)4]2+ hay E [Ni(en)(OH2)4]2+ bền về mặt nhiệt
động hơn? Tên gọi của hiệu ứng làm bền hoá là gì?
1. Hiệu ứng cặp trơ (inert-pair).
2. Hiệu ứng càng.
3. Cộng hưởng.
4. Hiệu ứng trans.
8) Tính entropy phản ứng ΔRS° của (1) và (2).
Cho cân bằng (3) như sau: [Ni(NH3)2(OH2)4]2+ + en ⇌ [Ni(en)(OH2)4]2+ + 2 NH3
9) Tính ΔRH, ΔRS° và ΔRG° của (3).


10) Phức chất D Ni(NH3)2(OH2)4]2+ có hai đồng phân lập thể. Hãy vẽ hai đồng phân đó dựa vào khung bát diện sau và xác định cấu hình của chung.
11) Vẽ đồng phân Λ của phức chất F [Ni(en)3]2+ dựa vào khung bát diện sau. en = Λ [Ni(en)3]2+ Cuối cùng, hãy nghiên cứu về phức nghịch từ G [Ni(CO)4] theo quan điểm của thuyết liên kết hoá trị VB Pauling.
12) Trong sơ đồ VB của phức chất G dưới đây
a) Hãy biểu diễn các electron (cặp electron) của nguyên tử Ni trung tâm bằng kí hiệu ↑ và ↑↓
b) Đánh dấu các orbital bị chiếm bởi các cặp electron từ phối tử bằng dấu X.
13) Xác định trạng thái lai hoá của nguyên tử trung tâm Ni trong phức chất G. Dự đoán dạng hình học của lai hoá này.
1) bát diện
2) tứ diện
3) vuông phẳng
4) lăng trụ tam giác
|
14) Một trong các giản đồ MO dưới đây biểu diễn đúng thứ tự mức năng lượng của các orbital phân tử của CO. Hãy xác định giản đồ đúng bằng
cách điền thêm các electron (bằng kí hiệu mũi tên) vào orbital. Xác định LUMO.
Bài 13
Các hợp chất đầu tiên được dùng để điều chế xúc tác dựa trên platinum thường là phức chất của kim loại này. Phổ biến nhất là platinum hydrochloric acid H2[PtCl6]. Tuy nhiên, trong trường hợp cần các phức chất platinum có tính cationic thì sự tồn tại của chlorine là không thuận tiện (có thể gây ngộ độc xúc tác), và thường sử dụng tetraamminplatinum (II) nitrate [Pt(NH3)4](NO3)2 (tan tốt trong nước). Chất này được điều chế theo sơ đồ 1: [ ] [ ]→→→→ 262333 NHClNHNH (dac)AgNO 4263432(NH)PtCl Pt(NH)(NO)ABC
Trước tiên, muối ammonium của platinum chloride bị khử bởi hydrazinium chloride (II), rồi cô lập muối phức A (52.30 % Pt), trong đó các nguyên tử platinum được bao xung quanh bởi 4 nguyên tử chlorine tạo thành 1 hình vuông. Sau đó, dung dịch muối này được xử lí với ammonia, tạo thành kết tủa của muối màu xanh lam Magnus B (65.02 % Pt), chứa cả phức chất cation và phức chất anion. Sau đó, xử lí với dung dịch ammonia đặc và cô lập muối C (58.39 % Pt). Từ chất này, thu được hợp chất mong muốn bằng cách xử lí với một lượng đẳng mol silver nitrate.
Tuy nhiên, với nhu cầu phòng thí nghiệm thì có một phương pháp hiệu quả và thuận tiện hơn để thu được muối mong muốn (sơ đồ 2): [ ] [ ]→→→ 23343 2NHNH NaNO(dac)+2NHNO 4263432 (NH)PtClPt(NH)(NO) DE
Trong trường hợp này, muối ammonium được đun sôi trong dung dịch sodium nitrite (lấy dư). NaNO2 thực hiện đồng thời 4 vai trò: loại bỏ các ammonium ion, khử Pt(IV) thành Pt(II), thế các phối tử Cl bởi NO2 và trung hòa H+ tạo thành. Ammonia được thêm vào dung dịch tạo thành của muối phức D, kết quả là hợp chất E tạo thành dưới dạng kết tủa. Chất này được tách ra rồi cho dung dịch ammonia đậm đặc cùng ammonium nitrate vào, và đun nóng hỗn hợp trong nồi áp suất. Sản phẩm tạo thành là muối phức cần điều chế trong ammonia.
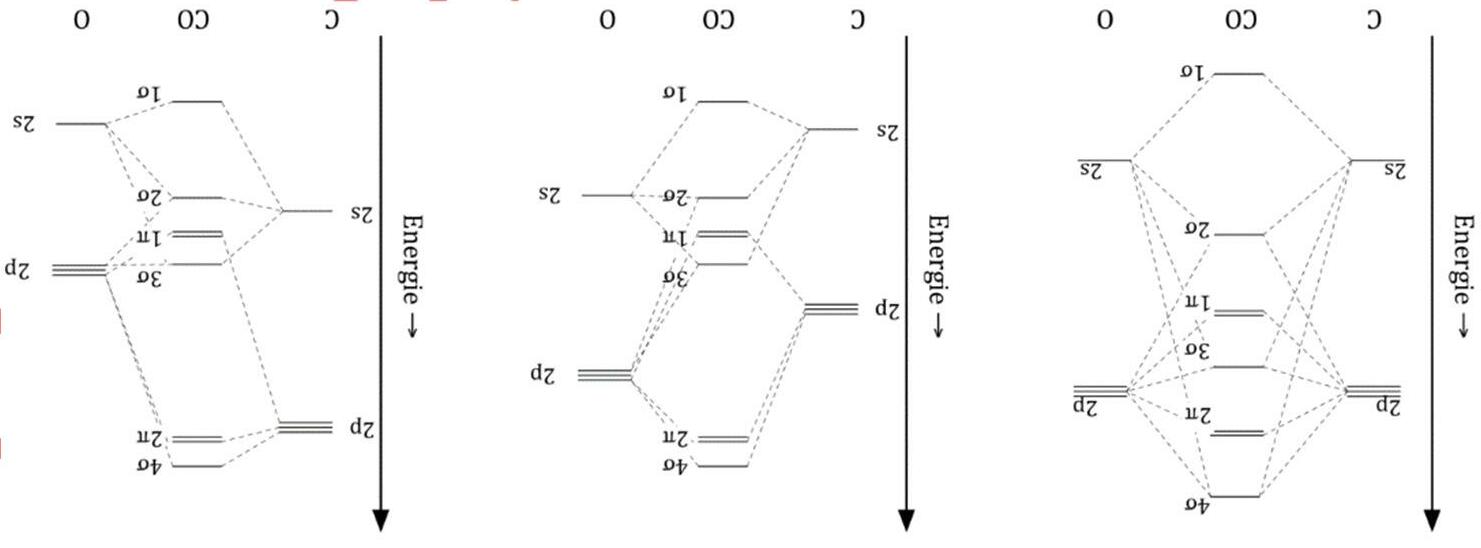
a) Cho biết tên các quá trình công nghiệp sử dụng các xúc tác chứa platinum (lấy ít nhất 2 ví dụ thích hợp).
b) Xác định công thức các chất A - C và viết các phương trình phản ứng trong sơ đồ 1 (4 phương trình).
|
c) Viết các phương trình phản ứng thể hiện các chức năng của sodium nitrate trong giai đoạn điều chế dung dịch D (sơ đồ 2) (4 phương trình).
d) Xác định công thức các chất D và E. Viết phương trình chuyển hóa D thành E cho trong sơ đồ 2.
Phức chất D tồn tại nhiều đồng phân - nghĩa là những hợp chất có công thức giống nhau nhưng cấu trúc khác nhau (bởi sự sắp xếp của các phối tử hoặc nguyên tử trong phối tử). Những khác biệt này cũng được thể hiện trong tên của các đồng phân.
a. trans-dinitrodiammineplatinum (II);
b. cis-dinitrodiammineplatinum (II);
c. trans-dinitrotodiammineplatinum (II);
d. cis-dinitritodiammineplatinum (II).
e) Biết rằng các ion phức Pt(II) có cấu trúc phẳng. Chất nào ở trên là phức chất E?
f) Viết phương trình chuyển hóa E thành [Pt(NH3)4](NO3)2.
g) Đun nóng muối phức [Pt(NH3)4](NO3)2 dẫn tới sự phân hủy chất này, kèm theo đó là sự tạo thành kim loại platinum. Viết phương trình phản ứng.
Bài14
A.ThuyếtPauling
Thêm dung dịch KOH vào dung dịch muối Co2+ thì xuất hiện một kết tủa màu xanh. Khi sử dụng nồng độ cao của KOH thì một phức spin cao với số phối trí 6 đã được tạo thành.
1) Viết và cân bằng phản ứng ion của sự tạo thành kết tủa và phức chất.
2) Tên hệ thống của phức là gì
3) Viết cấu hình electron của phức dưới dạng ô lượng tử và cho biết kiểu lai hóa của nguyên tố trung tâm
B.Thuyếttrườngtinhthể
Phức ion bis(terpyridyl)coban(II)-ion tồn tại ở nhiệt độ phòng, một phần là phức spin cao, còn một phần là phức spin thấp tùy thuộc vào ion cầu ngoại ClO4 /Cl /NCS /Br .
4) Viết công thức hình học ba chiều của phức!
5) Dựa vào thuyết trường tinh thể hãy vẽ giản đồ các mức năng lượng thể hiện phức spin cao và spin thấp
6) Tính momen từ (đơn vị là manheton Bohr) đối với hai loại phức này.
Xét phức sau: [Co(CN)6]3-, [Co(CO3)2(NH3)2] , [Co(CO3)3]3- và [Co(NO2)6]3. Màu sắc của các phức này là: xanh, vàng nhạt, cam và xanh da trời (sắp xếp không theo thứ tự)
7) Viết tên các phức và ghi màu tương ứng đối với phức đó và sử dụng bảng sau: côngthức tên màusắc
Ion xianua thường gặp trong phức chất ở dạng phối tử một càng. Trong bài này chúng ta sẽ khảo sát phức phối trí sáu của Co3+ với phối tử CN
a) Viết công thức và gọi tên phức.
b) Vẽ giản đồ sự tách mức năng lượng trong phân tử phức.
c) Phức này là phức spin cao hay spin thấp? Tính momen từ của phức ở đơn vị manheton Bohr.
d) Tính năng lượng bến hóa trường tinh thể LFSE! (Δo = 401 kJ/mol; P = 251 kJ/mol).
e) Khi thay thế ba phối tử bằng ba ion clo thì phức mới nhận được có tên gì và có công thức như thế nào?
f) Vẽ tất cả các đồng phân không đối quang có thể có của phức ở câu e). Thêm các tiếp đầu ngữ vào trước tên gọi để nhận biết.
Hướngdẫn
a) [Co(CN]6]3hexaxianocobantat(III)
b)
f) Cl Co Cl CN Cl
NC CN
NC CN fac mer
CN Co Cl Cl Cl
c) spin thấp; µ = 0
d) LFSE = -6.2/5 o + 2 P = -460 kJ/mol
e) [CoCl3(CN)3]3triclorotrixianocobantat(III)
|
Phức kali xiano K1 của nguyên tố A có momen từ đo được là µ = 3.8 B.M. Hợp chất này cho thấy một dải hấp thụ d-d ở 26700 cm-1. Sự khử ion A2O7 2- (có màu cam trong dung dịch nước) bằng etanol trong môi trường axit sẽ tạo thành ion trung tâm của phức xiano. Phức K1 này có thể bị khử bằng kali trong amoniac lỏng để tạo phức xiano K2, trong đó số phối trí không thay đổi. Khi thay thế toàn bộ các phối tử trong K2 bằng ammoniac thì momen từ của phức K3 thu được sẽ tăng đến giá trị µ = 4.9 B.M..
1) A là nguyên tố nào ?
2) Viết công thức và gọi tên phức K1
3) Vẽ sự chiếm cứ các mức năng lượng obitan d của K1 và xác nhận lại điều này bằng cách tính toán và so sánh với giá trị momen từ đã cho ở đề bài.
4) Tính năng lượng tách mức trường tinh thể ∆ (kJ/mol) với phức K1.
5) Nếu ion trung tâm không đổi còn phối tử lần lượt là H2O, Cl và F thì sự giảm mức năng lượng tách mức trường tinh thể ∆ sẽ như sau: 158 kJ/mol, 182 kJ/mol và 208 kJ/mol. Gắn từng giá trị này đố với các phối tử tương ứng.
6) Viết công thức và gọi tên phức K2.
7) Vẽ sự chiếm cứ các mức năng lượng obitan d của K2 và K3 và hãy chỉ ra trong mỗi trường hợp phức sẽ là spin cao hay spin thấp.
8) Phức với số oxy hóa thấp của ion trung tâm cho thấy một cấu trúc bát diện biến dạng. Tên của hiệu ứng gây ra sự kiện đó là gì?
9) Cho biết dạng hình học của phức A(acac)2?
Bài17
Trong phức chất, ion nitrit liên kết với nguyên tử kim loại trung tâm theo nhiều cách khác nhau.
a) Vẽ các kiểu liên kết có thể có của ion nitrit với nguyên tử kim loại trung tâm trong các phức chất đơn nhân.
Các dữ liệu về một số phức chất bát diện có chứa phối tử nitrit được cho trong bảng sau: Phức chất %m M
%m N
%m C
dN-O (Å) Góc ONO (o) Góc OMO (o)
[ML4(NO2)2] (1) 12,4 5 18, 03 51, 50 1,21 và 1,29 122 180
[MR2(NO2)]+ (2) 13,9 4 16, 83 57, 69 1,24 114,5 54 [MX4(NO2)2] (3) 26,6 1 38, 53 - 1,24 115Ở đây %m là khối lượng, d là độ dài liên kết; M là ion kim loại; L và R là các phối tử hữu cơ thông dụng chỉ chứa C, H và N; phối tử X chỉ chứa N và H. Trong phối tử L, R và X, các nguyên tử N đều tham gia phối trí.
b) Xác định công thức phân tử và vẽ cấu trúc các phức chất (1), (2) và (3).
|
Nhóm thiol trong protein có thể đóng vai trò như một phối tử. Các cụm (cluster) kim loại-lưu huỳnh có trong nhiều loại enzyme. Trong nghiên cứu về các phối tử chứa lưu huỳnh, các ion phức lưỡng nhân [M2(edt)4]2- (M = V, Mn, Fe) được tạo thành bởi một ion kim loại chuyển tiếp và ethanedithiol ion (-SCH2CH2S-, kí hiệu là edt2-). Chúng có cùng công thức chung nhưng khác về cấu trúc. Trong [V2(edt)4]2-, mỗi nguyên tử vanadium có 6 nguyên tử lưu huỳnh phối trí xung quanh, và có 3 trục đối xứng bậc hai vuông góc với nhau qua tâm của liên kết V-V. Khi kim loại là Mn và Fe, có 5 nguyên tử lưu huỳnh quanh M để tạo thành dạng hình học tháp tứ gíc, và các ion [M2(edt)4]2- có 1 tâm đối xứng.
1) Vẽ cấu trúc của [V2(edt)4]2- (bỏ qua các nguyên tử hydrogen).
2) Vẽ cấu trúc của [M2(edt)4]2- (M = Mn, Fe) (bỏ qua các nguyên tử hydrogen).
3) Viết cấu hình electron của vanadium trong [V2(edt)4]2-. Các kết quả kiểm tra từ tính cho thấy chất này nghịch từ, giải thích tại sao.
4) [Mn2(edt)4]2- có thể nhận được bởi phản ứng của dung dịch MnCl2 và dung dịch Na2(edt) trong không khí. Viết phương trình phản ứng.
Bài19Metalloporphyrin (porphyrin kim loại) có thể được xem là các phức chất tạo thành bởi một cation kim loại và porphyrin - phối tử thơm với 4 nguyên tử nitrogen. Nhờ có tính thơm nên các metalloporphyrin có tính phẳng và rất bền. Do các nguyên tử nitrogen cuar porphyrin chỉ chiếm 4 vị trí trong cầu phối trí của kim loại nên các metalloporphyrin có khả năng tạo thêm phối trí với 1 hoặc 2 phối tử nữa. Ví dụ, zinc porphyrin có thể liên kết với 1 hoặc 2 phân tử pyridine (xem hình bên phải; pyridine được kí hiệu là Py). Chú ý rằng các liên kết phối trí tạo thêm này vuông góc với mặt phẳng của vòng porphyrin. Tương tự, cũng có các dẫn xuất porphyrin khác nhau liên quan đến các hợp chất nguồn gốc tự nhiên như hemoglobin, vitamin B12 và chlorophyll.
1) Chỉ rõ các kim loại nào có mặt trong các phân tử: hemoglobin, vitamin B12 và chlorophyll.
Nếu một chất có phân tử chứa cả mảnh porphyrin và một phối tử thì sao? Chất như vậy có thể tự-tạo phối trí để tạo thành các phức chất đa nhân. Ví dụ, dẫn xuất của Zn-porphyrin và pyridine (para-ZnPP) được biểu diễn như dưới đây có thể tạo thành một phức bốn nhân. Chú ý rằng không có sức căng góc (gây ra bởi sự biến đổi các góc hóa trị): các liên kết phối trí vuông góc với mặt phẳng porphyrin, và các góc giữa các mảnh porphyrin, acetylene, và pyridine không thay đổi khi tạo phối trí.
|
2) Hợp chất được cho dưới đây (meta-ZnPP) cũng có khả năng tạo thành vòng tự-phối trí mà không có sức căng vòng. Xác định kích thước cực tiểu (nghĩa là số phân tử) trong vòng như vậy dựa vào giả định rằng: a) toàn bộ các nguyên tử kẽm và toàn bộ nguyên tử nitrogen của các vòng pyridine thuộc cùng một mặt phẳng và b) các vòng pyridine là những lục giác đều.
Bài20
Sắt là kim loại chuyển tiếp phổ biến nhất trong các cơ thể sống. Chúng ta sẽ cùng tìm hiểu về các protein chứa sắt, đóng vai trò quan trọng trong các phản ứng chuyển electron (ví dụ phản ứng oxidee hoá-khử) trong cơ thể sống.
Protein Fe-S là một nhóm protein quan trọng, chứa sắt và lưu huỳnh trong lõi của chúng. Chúng được phát hiện từ giữa thế kỉ trước và là nhóm protein phổ biến nhất trong các cơ thể sống. Trong phòng thí nghiệm, các cụm lõi Fe-S có thể được tổng hợp trong điều kiện thiếu oxygen. Những tính chất này khiến người ta tin rằng chúng là những cấu trúc sinh học quyết định sự hình thành nguồn gốc sự sống trên Trái đất trong thời điểm các môi trường kị khí phổ biến nhất.
Các phân tử như vậy có thể tạo thành không chỉ vòng, mà thậm chí là cả polymer phối trí. Ví dụ, một cặp ZnPP, ngoài tetramer (dạng tứ hợp), còn có thể tạo thành một chuỗi vô hạn, trong đó bộ khung của các liên kết phối trí được mở rộng theo một chiều (xem hình) và tạo thành polymer một chiều. Vẽ cấu trúc của dẫn xuất Zn-porphyrin-pyridine mà tự nó thì không phải là polymer nhưng có thể tạo thành polymer với một lưới hai chiều của các liên kết phối trí mà không có sức căng góc. Ngoài ra, hãy vẽ công thức polymer tạo thành bởi chất này.
Cụm lõi Fe-S đơn giản nhất được tìm thấy trong rubredoxin protein có chứa 1 nguyên tử sắt và 4 đơn vị cysteine amino acid [HOOCCH(NH2)CH2SH]. Năm 1981, Hagen và các cộng sự tại Mỹ đã tổng hợp thành công một analogue (chất tương tự) của rubredoxin, (Et4N)2[Fe(SPh)4], trong đó Et = -C2H5, Ph = -C6H5. (Trong các câu hỏi tiếp theo, hãy xem lưu huỳnh như một phối tử trường yếu.)
1) Dự đoán cấu trúc hình học, vẽ cấu tạo và moment từ của [Fe(SPh)4]2. Các cụm lõi Fe-S đơn giản tiếp theo được tìm thấy trong protein là 2Fe2S, 4Fe-4S và 3Fe-4S. Các cụm này có hai loại liên kết Fe-S và không có liên kết Fe-Fe.
a) 2Fe-2S: Cụm lõi này có 2 ion sulphide (S2-) và 4 phân tử cysteine còn lại liên kết với 2 nguyên tử sắt trung tâm. Hagen và cộng sự đã tổng hợp được một analogue của cụm này là [Fe2S2(SPh)4]2‒ từ [Fe(SPh)4]2‒ và đơn chất lưu huỳnh.
2) Hoàn thành phương trình phản ứng sau: [Fe(SPh)4]2‒ + S → [Fe2S2(SPh)4]2- + PhSSPh + …
3) Xác định cấu trúc của [Fe2S2(SPh)4]2b) 4Fe-4S: Cụm lõi này có 4 ion sulphide và 4 phân tử cysteine còn lại liên kết với 4 nguyên tử sắt trung tâm. Analouge, [Fe4S4(SPh)4]2- được tạo thành từ [Fe2S2(SPh)4]2- trong môi trường phản ứng thích hợp.
4) Hoàn thành phương trình phản ứng sau:
Fe2S2(SPh)4]2- → [Fe4S4(SPh)4]2- + …
5) Xác định cấu trúc của [Fe4S4(SPh)4]2- biết nó có dạng lõi lập phương.
6) Xác định số ion Fe(III) và Fe(II) trong Fe2S2(SPh)4]2- và [Fe4S4(SPh)4]2-
a) Fe(III) trong Fe2S2(SPh)4]2-: b) Fe(II) trong Fe2S2(SPh)4]2-:
c) Fe(III) trong [Fe4S4(SPh)4]2-: d) Fe(II) trong [Fe4S4(SPh)4]2-:
7) Sử dụng cấu trúc lập phương ở trên của [Fe4S4(SPh)4]2- làm tham chiếu, hãy xác định cấu trúc của [Fe3S4(SPh)3]2-, một chất tương đồng khác của protein Fe-S - được kí hiệu là 3Fe-4S.
Tại pH > 9, và có sẵn thiophenol dư, [Fe3S4(SPh)3]2- chuyển hoá thành một cấu trúc mạch thẳng có công thức [Fe3S4(SPh)3]3.
8) Xác định cấu trúc [Fe3S4(SPh)3]3-. Trong số các liên kết Fe-S trong những cụm lõi khác nhau ở trên, hãy cho biết liên kết Fe-S nào Bền nhất Kém bền nhất
a) C6H5S-Fe(III)
b) C6H5S-Fe(II) c) S-Fe(III) d) S-Fe(II)
a) C6H5S-Fe(III) b) C6H5S-Fe(II) c) S-Fe(III) d) S-Fe(II)
Nhìn chung, các hợp chất sắt thường có moment từ tính cao. Tuy nhiên, các cụm lõi Fe-S thì có moment từ rất thấp, thậm chí không có. Hiện tượng này được lý giải bởi sự định hướng spin ngược của các electron trong các nguyên tử kim loại liền kề, thuộc cùng một cụm lõi - tính chất này cũng được gọi là sự ghép cặp phản thiết từ.
9) Trong những cụm lõi nào sau đây (R = nhóm cysteine) có thể có sự ghép cặp phản thiết từ, dẫn tới moment từ bằng 0? a) [Fe2S2(SR)4]3‒b) [Fe2S2(SR)4]2‒c) [Fe4S4(SR)4]2‒Thế khử chuẩn của cặp [Fe2S2(SR)4]3‒/[Fe2S2(SR)4]2‒ (R = nhóm cysteine) thay đổi khi điện tích trên chuỗi peptide (trong phần mở rộng của protein) thay đổi qua quá trình proton hoá/deproton hoá của các nhóm chức khác nhau như nhóm -NH- của amide. Các sơ đồ giản lược sau đây biểu diễn hai phân bố điện tích khả dĩ trên chuỗi peptide quanh [Fe2S2(SR)4]3‒.
232 |
10) Trong hệ nào dưới đây, các nguyên tử sắt trung tâm khó bị oxid hoá hơn?
Trong chu trình hô hấp, O2 chuyển thành H2O. Quá trình này tạo thành superoxidee O2 , tiểu phân được cho là nguyên nhân gây ra sự lão hoá do phá huỷ các màng tế bào. Các tế bào trong cơ thể có một enzyme gọi là superoxidee dismutase (SOD), có khả năng chuyển O2 thành O2 bằng cách rút bớt 1 electron. SOD có chứa các ion kim loại chuyển tiếp 3d (A, B) ở số oxid hoá +2. Một số tính chất của A, B là
A B
Trạng thái oxid hoá +2 phối trí bát diện, có màu Có Không Các số oxid hoá khác +1 Không
11)A, B là những kim loại nào?
12) Ion nào trong số A2+ và B2+ có thể chuyển O2 thành O2?
|
Xúc tác A, tổng hợp vào năm 1965, được dùng cho phản ứng hydrogen hóa các olefin trong điều kiện êm dịu.
1) A là tinh thể màu tím, khối lượng phân tử 925.32, có tính nghịch từ. A được điều chế bằng cách đun hồi lưu RhCl3∙3H2O với lượng dư triphenylphosphine (PPh3) trong ethanol. Vẽ cấu trúc của A.
2) Cơ chế xúc tác của A được cho trong sơ đồ dưới đây (kí hiệu 16e và18e có nghĩa là xung quanh nguyên tử trung tâm có 16 và 18 electron). Xác định cấu trúc của D.
Bài22
Các phức chất ruthenium thu hút được nhiều sự quan tâm trong các lĩnh vực phát quang, quang điện tử, xúc tác và hóa sinh.
Các nhà nghiên cứu đã điều chế được phức Ru(II) với phối tử hỗn hợp, có công thức [Ru(bpy)n(phen)3-n](ClO4) (cấu trúc của phối tử được cho dưới đây). Kết quả phân tích nguyên tố cho thấy hàm lượng C, H, N lần lượt là 48.38 %; 3.06 % và 10.54 %. Phức chất này có tính nghịch từ.
3) Xác định số oxid hóa của các nguyên tử trung tâm của tất cả các phức chất trong sơ đồ.
4) Xác định trạng thái lai hóa của các nguyên tử trung tâm trong A, C, D, E
5) Dựa vào cấu hình electron của C và E, hãy cho biết chúng có tính thuận từ hay nghịch từ?
1)
a) Tính giá trị n trong công thức phân tử phức chất. b) Xác định kiểu lai hóa của nguyên thử ruthenium trung tâm. Một loại thuốc nhuộm gọi là “ruthenium đỏ” thường được sử dụng khi quan sát mẫu sinh học dưới kính hiển vi. Ruthenium đỏ có công thức [Ru3O2(NH3)14]Cl6, được tạo thành khi cho dung dịch [Ru(NH3)6Cl3 trong ammonia tiếp xúc với không khí. Ba nguyên tử ruthenium trong ruthenium đỏ có phối trí 6 và không có liên kết kim loại-kim loại.
2)
a) Viết phương trình phản ứng tạo thành cation của ruthenium đỏ. b) Vẽ cấu trúc cation trong ruthenium đỏ và xác định số oxid hóa của mỗi nguyên tử ruthenium.
c) Xác định kiểu lai hóa của cầu nguyên tử trong cation của ruthenium đỏ.
d) Đã xác định được rằng chiều dài liên kết Ru-O trong ruthenium đỏ là 187 pm, ít hơn rất nhiều so với liên kết đơn thông thường. Về vấn đề này, các nhà nghiên cứu cho rằng có 2 liên kết π đa tâm đã được tạo thành bởi sự xen phủ các orbital d và p giữa các nguyên tử trung tâm và nguyên tử cầu. Biểu diễn sự xen phủ orbital của 1 liên kết π đa tâm.
Oxid hóa ethanol bởi AAB (acetic acid bacteria - vi khuẩn acetic acid) là phương pháp hiệu quả để sản xuất acetic acid, tuy nhiên quy trình truyền thống này không đáp ứng được những yêu cầu của sản xuất công nghiệp. Thay vào đó, acetic acid được sản xuất công nghiệp từ methanol và carbon monoxide: CH3OH + CO → CH3COOH. Một số phức chất của các nguyên tố cột thứ 9 (Co, Rh, Ir) là xúc tác rất tốt cho phản ứng này. Dưới đây là mô tả về phản ứng tổng hợp trên theo phương pháp Monsanto, sử dụng hệ xúc tác Rh[CO]2I2-methyl iodide.
Bài24
Phản ứng của các muối kim loại chuyển tiếp trong alcohol với các hydrocarbon khi có mặt chất khử là phương pháp phổ biến để tổng hợp các hợp chất cơ kim, đóng vai trò quan trọng trong các chuyển hoá bởi xúc tác.
Năm 1964, G. Wilkinson đã tổng hợp các phức chất nghịch từ trung hoà A và B, sử dụng các phản ứng trong ethanol. Số phối trí (CN) của các nguyên tử kim loại trong A và B chỉ khác nhau 1 đơn vị:
bXCl3 + bCnH2n-4 + bYCl2 ethanol → A + bYCl2b (1)
bNa2ZCl6 + 2bCnH2n-4 + 5YCl2 ethanol →bB + 3YCl2b + 2bNaCl (2)
Hydrocarbon CnH2n-4 là sản phẩm khống chế nhiệt động của phản ứng vòng hoá alkadiene bởi xúc tác và có 2 mũi tín hiệu trong phổ 1H NMR ( = 2.36 và 5.57 ppm). Với hydrocarbon ban đầu và trong các phức chất A, B thì tỉ lệ hàm lượng (C) : (H) ≈ n. Hàm lượng X trong phức chất A là (X) = 41.73 %. Trong phức chất B thì (C) = (Z) = 1.619 (Y).
1) Xác định cấu trúc của các hydrocarbon và đưa ra ít nhất 2 cấu dạng bền của nó.
1) Trong chu trình xúc tác này, xảy ra phản ứng cộng oxid hóa với A và methyl iodide, tạo thành B. Xác định cấu trúc hình học của B và B1.
2) Xác định số oxid hóa và số electron xung quanh của nguyên tử Rh trong các hợp chất A và D.
3) Viết phương trình phản ứng tạo thành acetic acid từ E.
4) Quy trình Cativa để tổng hợp acetic acid sử dụng xúc tác [Ir(CO)2I2] . Chu trình xúc tác của hai quy trình Cativa và Monsanto tương tự nhau, nhưng các tiểu phân trung gian C, D (đều có ion Ir trung tâm) thì khác nhau: Từ B (có ion Ir trung tâm) thành C xảy ra phản ứng thế I bởi CO; còn từ C thành D có sự chuyển vị gốc methyl. Xác định công thức cấu tạo của C.
2) Xác định các kim loại chuyển tiếp X, Z. Các tính toán có độ chính xác tới 4 chữ số có nghĩa.
3) Xác định kim loại Y và mô tả vai trò của YCl2 trong các phản ứng (1), (2).
4) Xác định công thức của A, B. Xác định số oxide hoá, số phối trí của các nguyên tử kim loại và vẽ cấu trúc của hydrocarbon trong các hợp chất này.
5) Xác định lai hoá của X và Z trong các chất đầu và trong các phức chất.
6) Mô tả cấu trúc A, B theo thuyết trường tinh thể.
