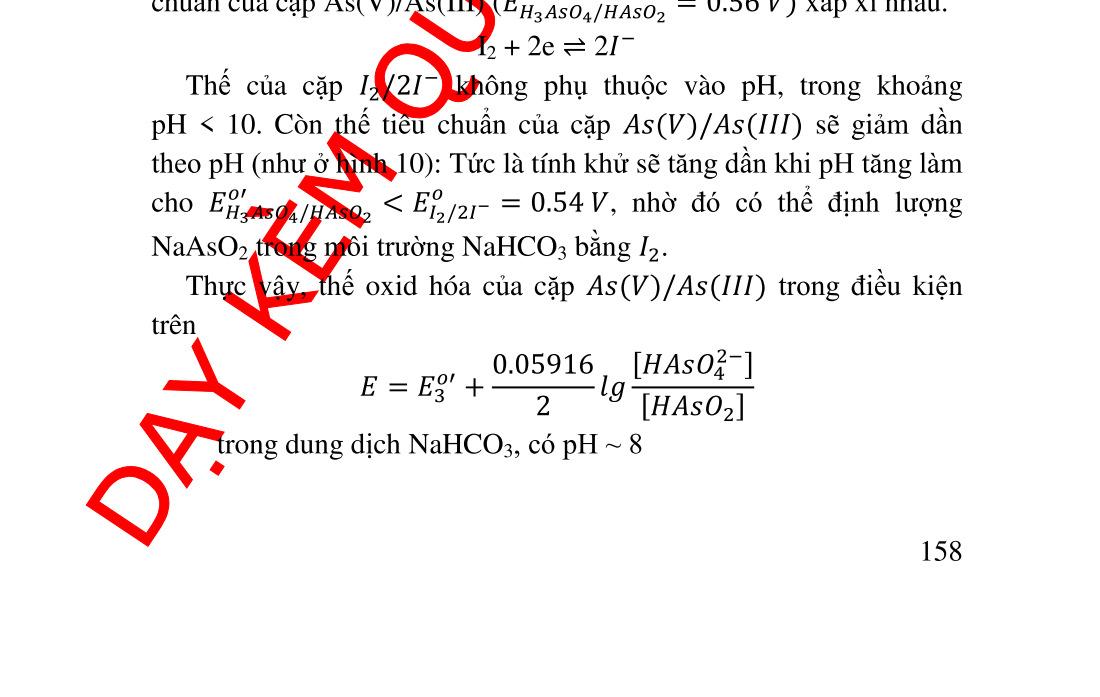CƠ SỞ LÝ THUYẾT HÓA PHÂN TÍCH Ths Nguyễn Thanh Tú eBook Collection CƠ SỞ LÝ THUYẾT HÓA PHÂN TÍCH PHẦN I CÂN BẰNG ION TRONG DUNG DỊCH, NGUYỄN THANH KHUYẾN, NGUYỄN THỊ XUÂN MAI HƯỚNG DẪN GIẢI 2022 WORD VERSION | 2023 EDITION ORDER NOW / CHUYỂN GIAO QUA EMAIL TAILIEUCHUANTHAMKHAO@GMAIL COM Hỗ trợ trực tuyến Fb www.facebook.com/DayKemQuyNhon Mobi/Zalo 0905779594 Tài liệu chuẩn tham khảo Phát triển kênh bởi Ths Nguyễn Thanh Tú Đơn vị tài trợ / phát hành / chia sẻ học thuật : Nguyen Thanh Tu Group vectorstock com/28062440
TP. Hồ Chí Minh, 9/2022.
DẠYKÈMQUYNHƠN OFFICIAL KHOA HÓA HỌC BỘ MÔN HÓA PHÂN TÍCH NGUYỄN THANH KHUYẾN NGUYỄN THỊ XUÂN MAI CƠ SỞ LÝ THUYẾT HÓA PHÂN TÍCH PHẦN I: CÂN BẰNG ION TRONG DUNG DỊCH
DẠYKÈMQUYNHƠN OFFICIAL MỤC LỤC 1. Chương 1. CÁC PHƯƠNG PHÁP VÀ VAI TRÒ CỦA HÓA HỌC PHÂN TÍCH....................................................................................................... 6 1.1. Các phương pháp hóa học phân tích............................................ 6 1.2. Các phương pháp tách ................................................................. 7 1.3. Các phương pháp phân tích định lượng....................................... 8 2. Chương 2. CÂN BẰNG TRONG DUNG DỊCH ..................................... 11 2.1. Nồng độ và hoạt độ.................................................................... 11 2.1.1. Nồng độ .............................................................................. 11 2.1.2. Hoạt độ ............................................................................... 13 2.2. Hằng số phân ly (hằng số không bền) ....................................... 17 2.3. Nồng độ ion AB......................................................................... 18 2.3.1. Nồng độ ABi tính theo [A] và [B] tự do............................. 18 2.3.2. Nồng độ ABi tính theo [A’] và [B] tự do .......................... 19 2.3.3. Thứ tự tương
Chương 3. ACID – BASE........................................................................ 33 3.1. Định nghĩa ................................................................................. 33 3.1.1. Định nghĩa Arrhenius ......................................................... 33 3.1.2.
nghĩa Brønsted........................................................... 33 3.1.3.
Lewis ............................................................... 35 3.2.
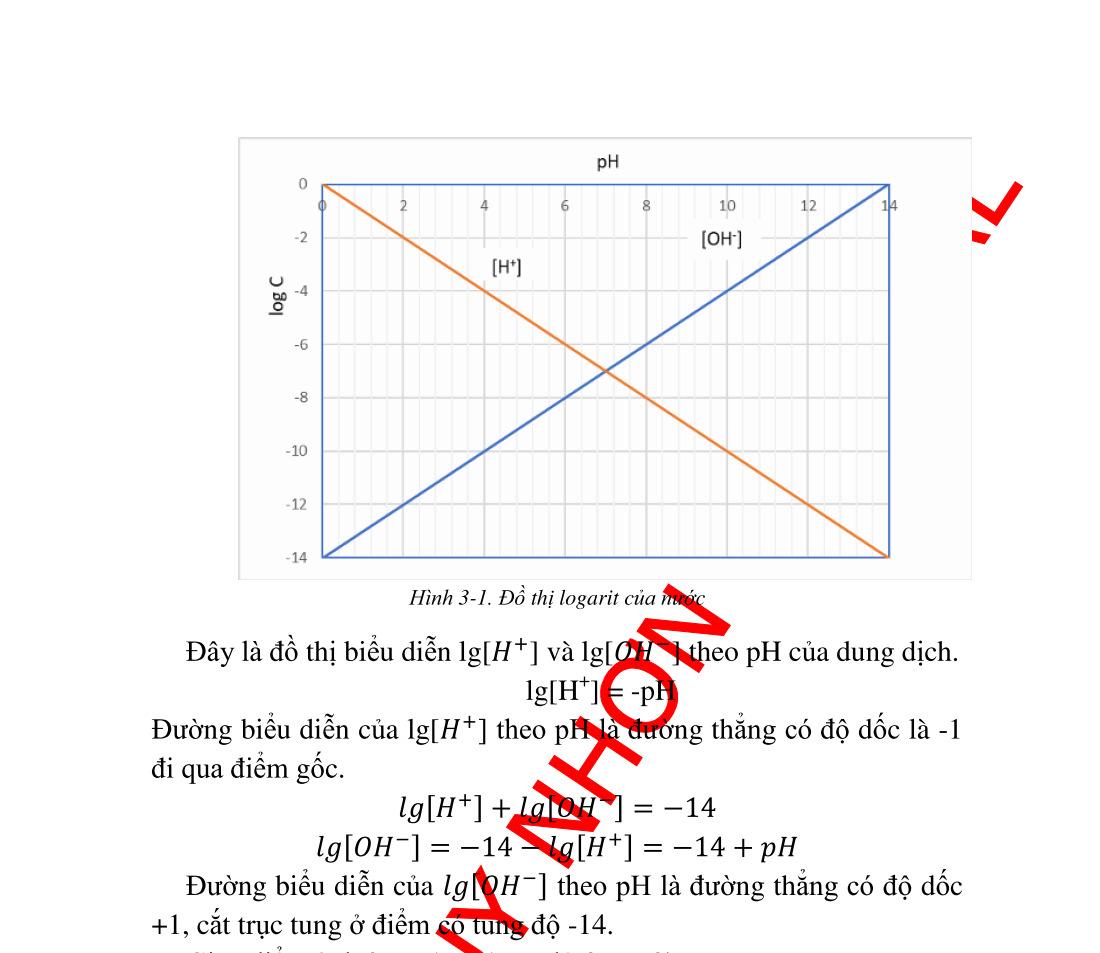
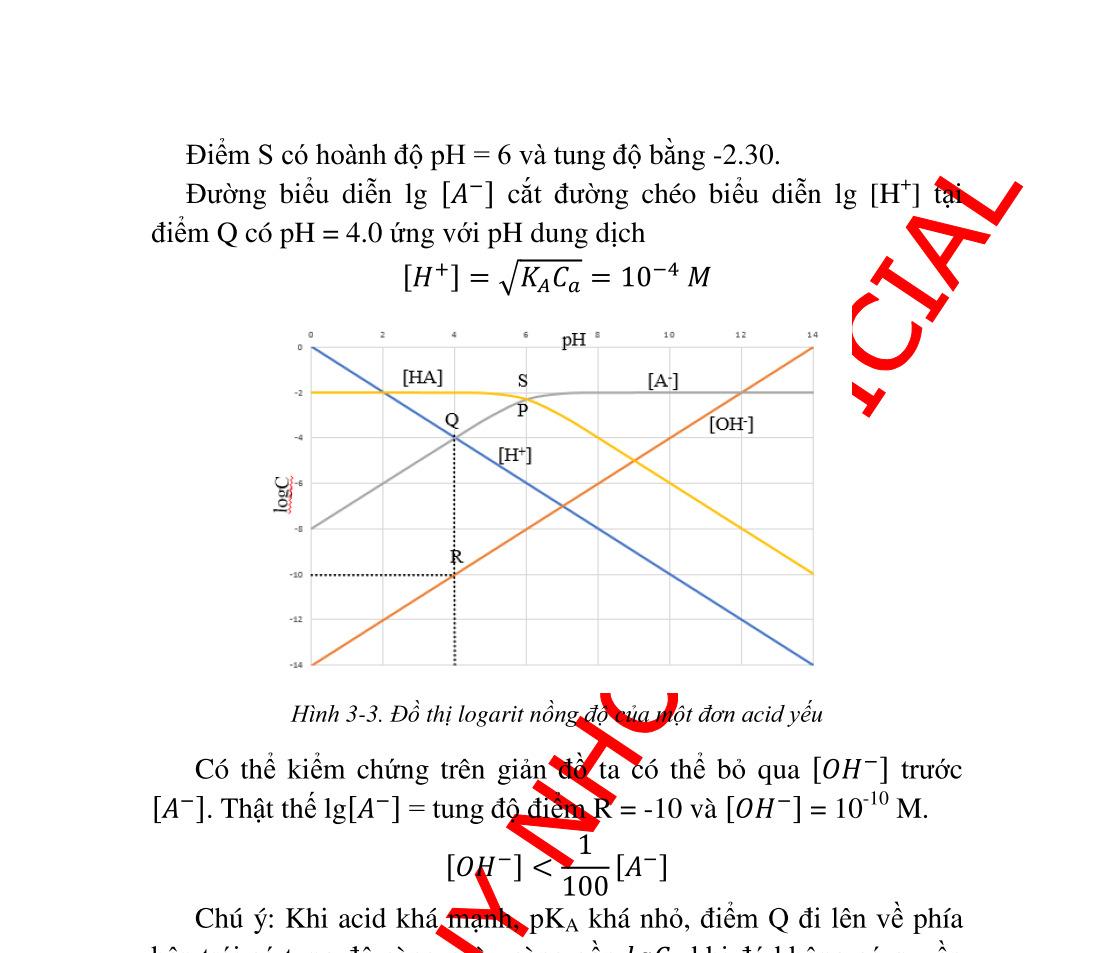
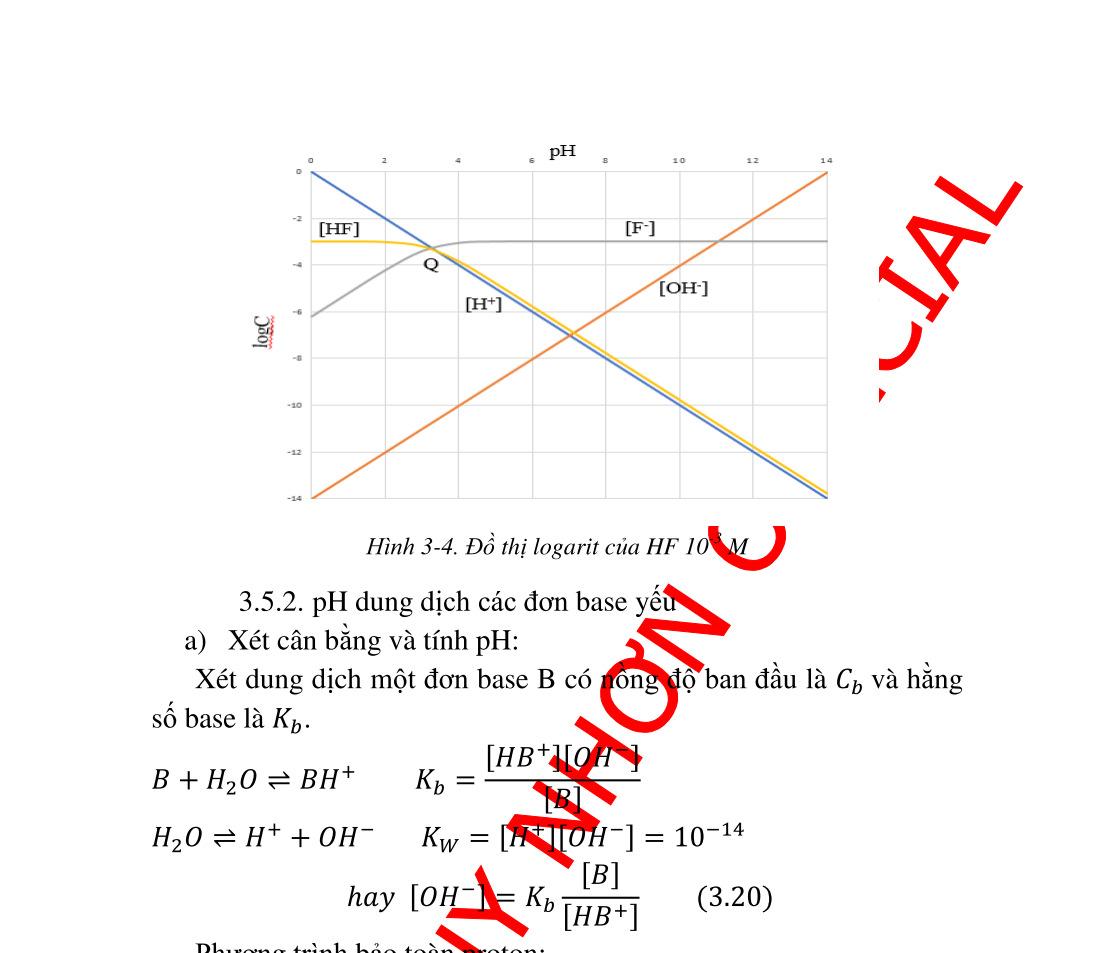
bằng trong nước thang pH............................................... 36 3.2.1. Tích số ion của nước. ......................................................... 36 3.2.2. Thang pH............................................................................ 36 3.3. Đôi acid base liên hợp thang acid base...................................... 38 3.3.1. Đôi acid base liên hợp ........................................................ 38 3.3.2. Thang Acid Base ............................................................. 39 3.4. pH dung dịch các acid và base thật mạnh.................................. 41 3.4.1. Dung dịch các acid rất mạnh .............................................. 41 3.4.2. Dung dịch các base rất mạnh.............................................. 44 3.5. pH dung dịch các đơn acid và đơn base .................................... 45 3.5.1. pH dung dịch các đơn acid ................................................. 45 3.5.2. pH dung dịch các đơn base yếu.......................................... 51 3.6. Đa acid yếu................................................................................ 54 3.6.1. Xét cân bằng đa acid yếu trong dung dịch nước ............... 54
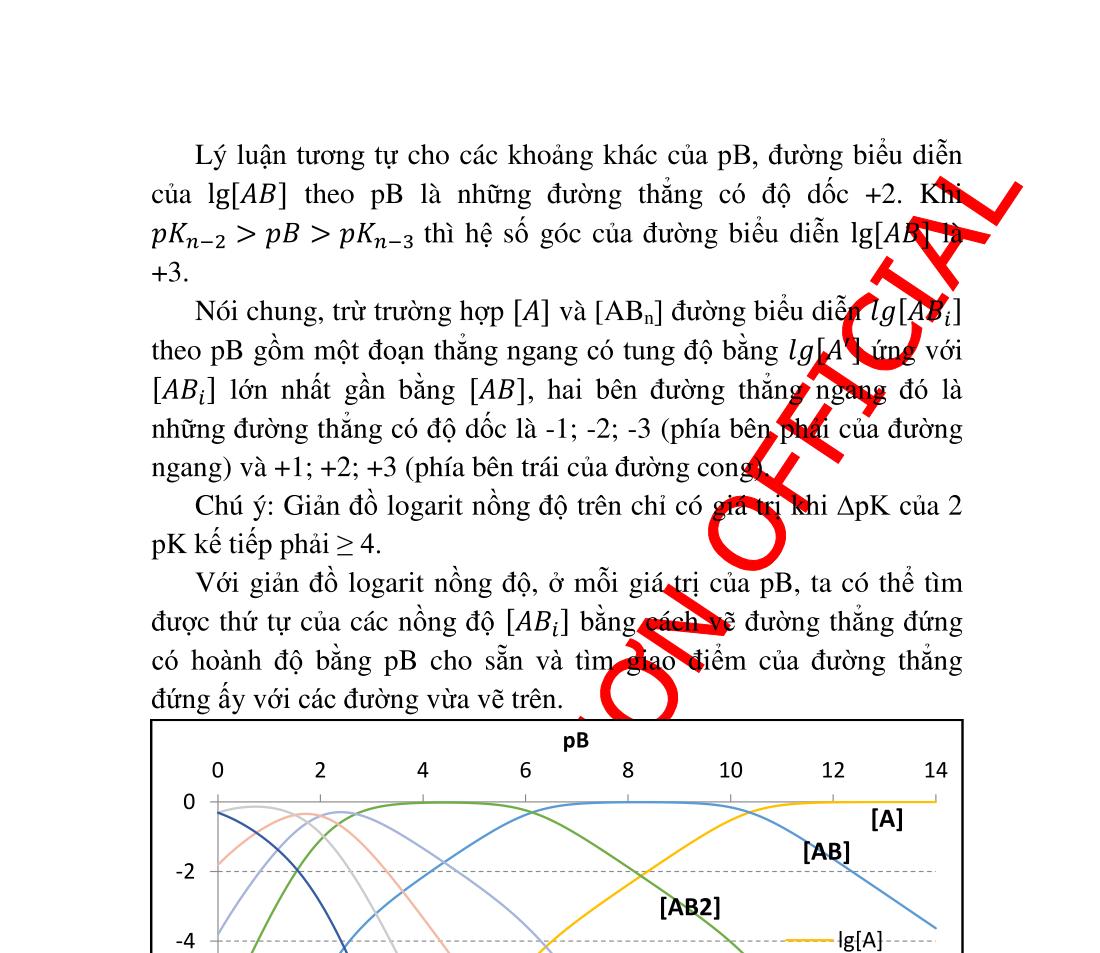
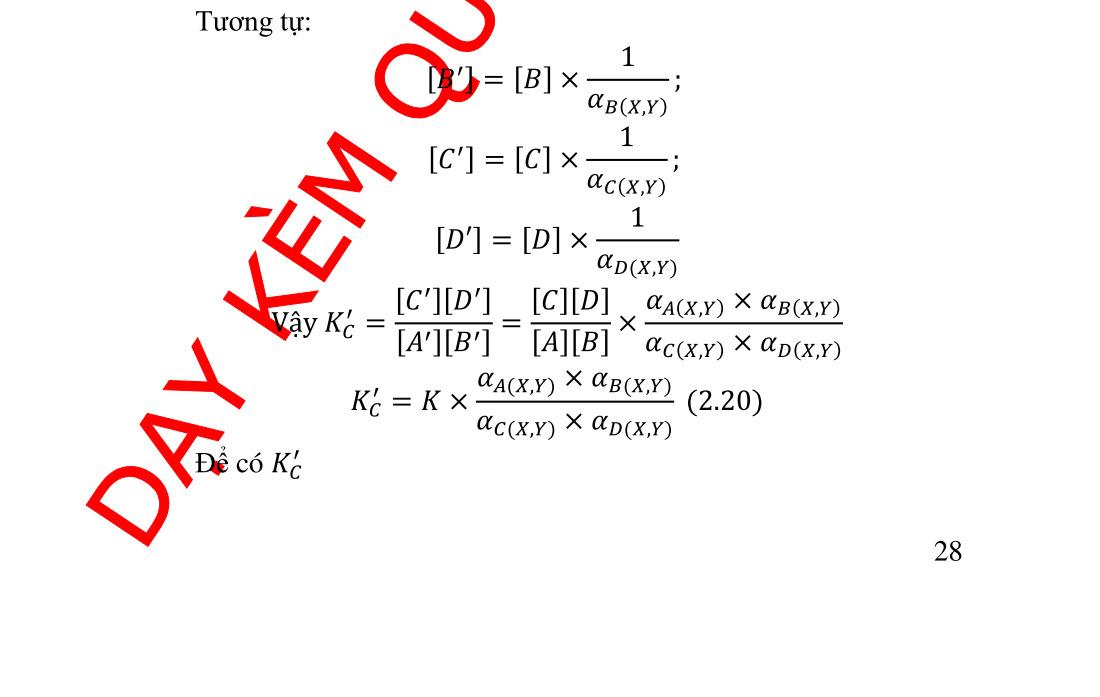
đối của ������ theo pB..................................... 21 2.3.4. Giản đồ logarit nồng độ...................................................... 22 2.4. Hằng số điều kiện ...................................................................... 25 2.4.1. Tính định lượng của một phản ứng .................................... 25 2.4.2. Ích lợi của hằng số điều kiện.............................................. 26 2.4.3. Cách tính hằng số điều kiện ............................................... 27 2.4.4. Sử dụng hằng số điều kiện ................................................ 30 3.
Định
Định nghĩa
Cân
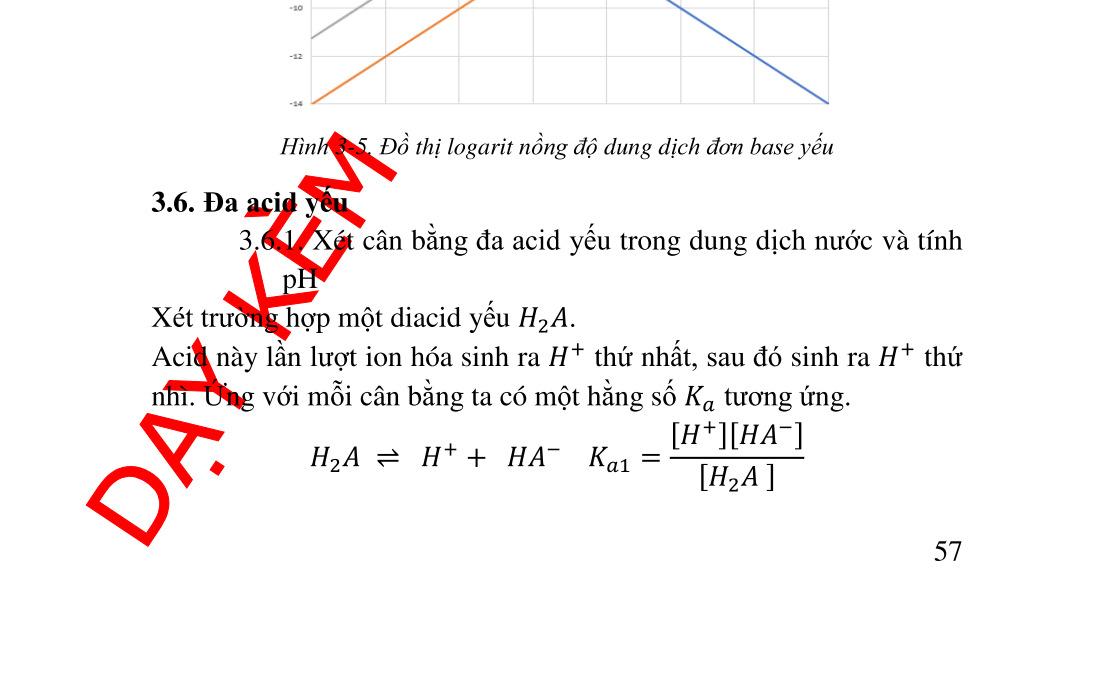
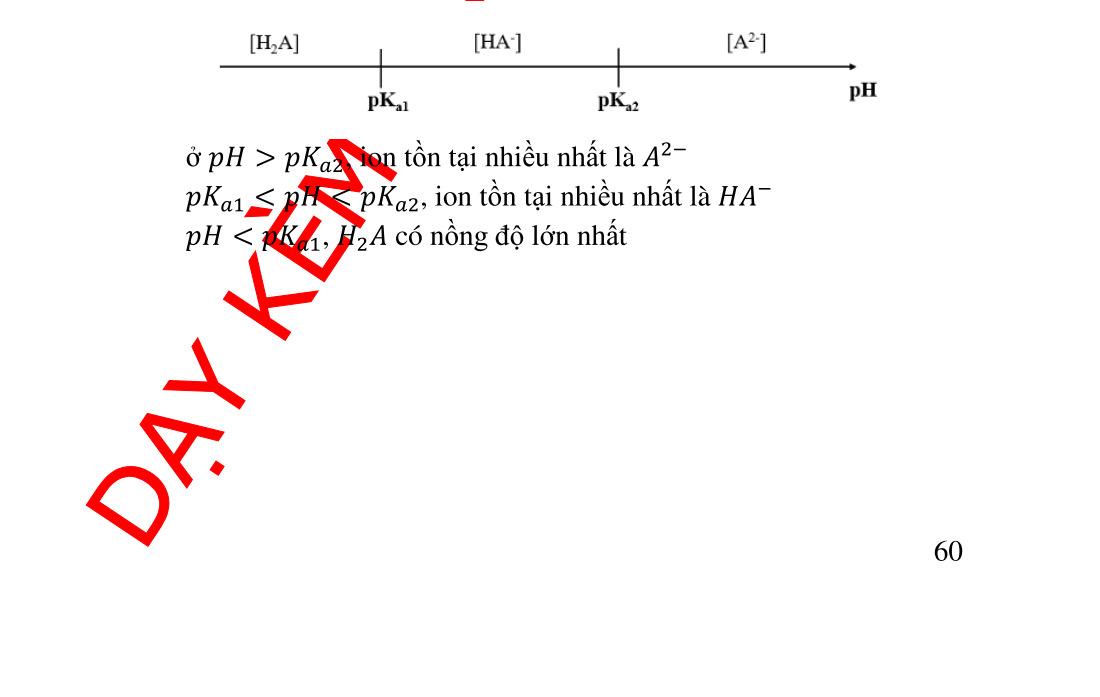
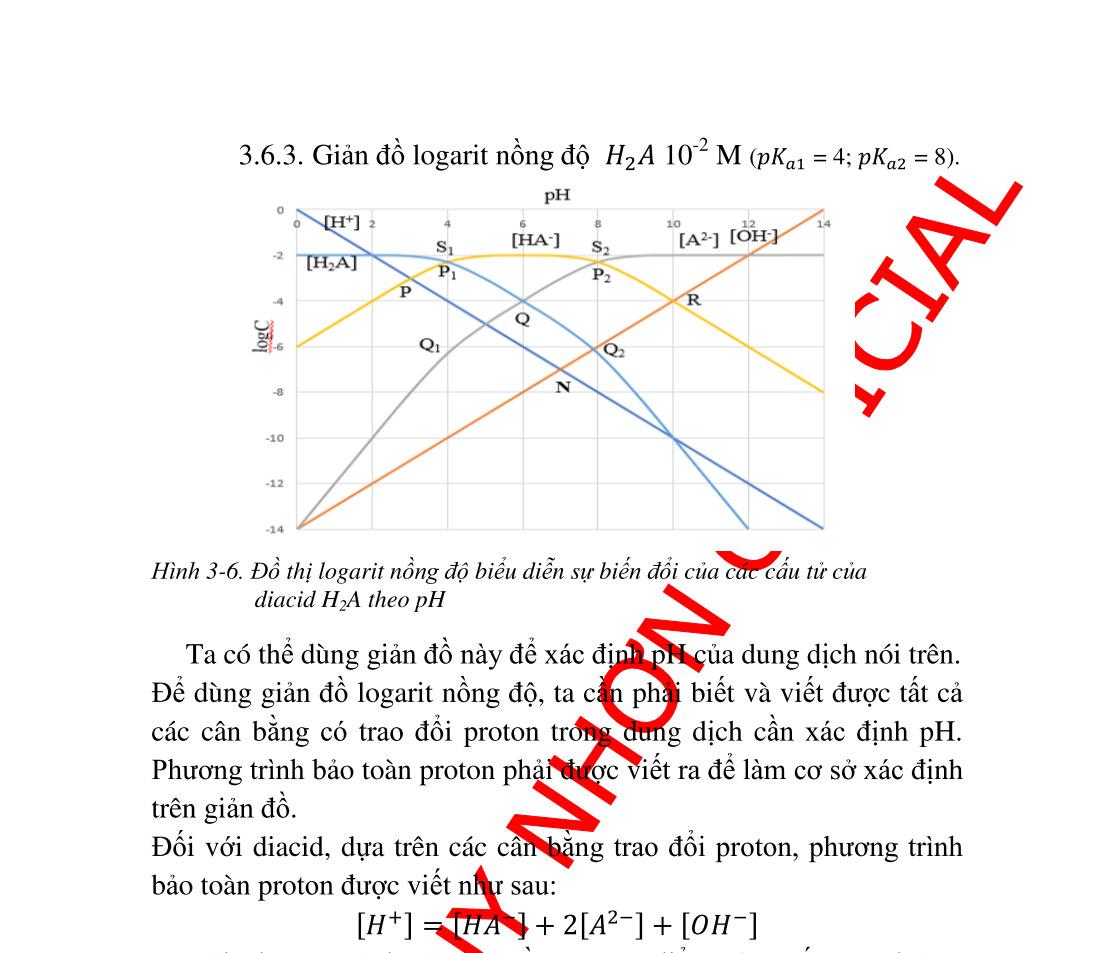
3.6.2. Nồng độ ion ������ ................................................................ 57 3.6.3. Giản đồ logarit nồng độ diacid .......................................... 58
3.7. Hỗn hợp nhiều acid.................................................................... 59 3.7.1. Hỗn hợp acid mạnh và acid yếu ......................................... 59 3.7.2. Hỗn hợp acid yếu ............................................................... 60
3.8. pH dung dịch muối .................................................................... 62
3.8.1. Muối được tạo thành từ acid mạnh và base mạnh.............. 62
3.8.2. Muối được tạo thành từ acid mạnh và base yếu ................. 62
3.8.3. Muối được tạo thành từ acid yếu và base mạnh ................. 63
3.8.4. pH dung dịch muối trung hòa............................................. 63 3.8.5. pH dung dịch muối có anion lưỡng tính............................. 64 3.8.6. Muối lưỡng tính: BHA ....................................................... 66
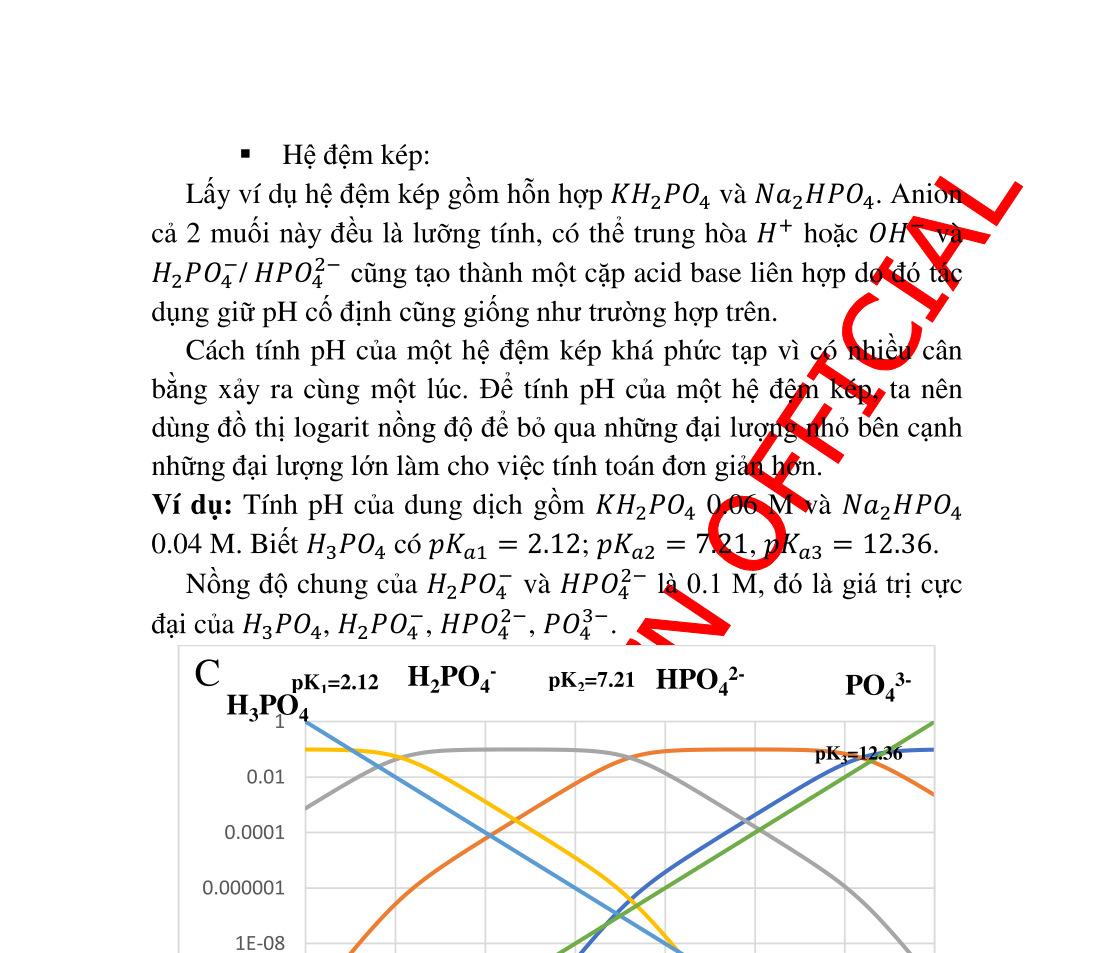
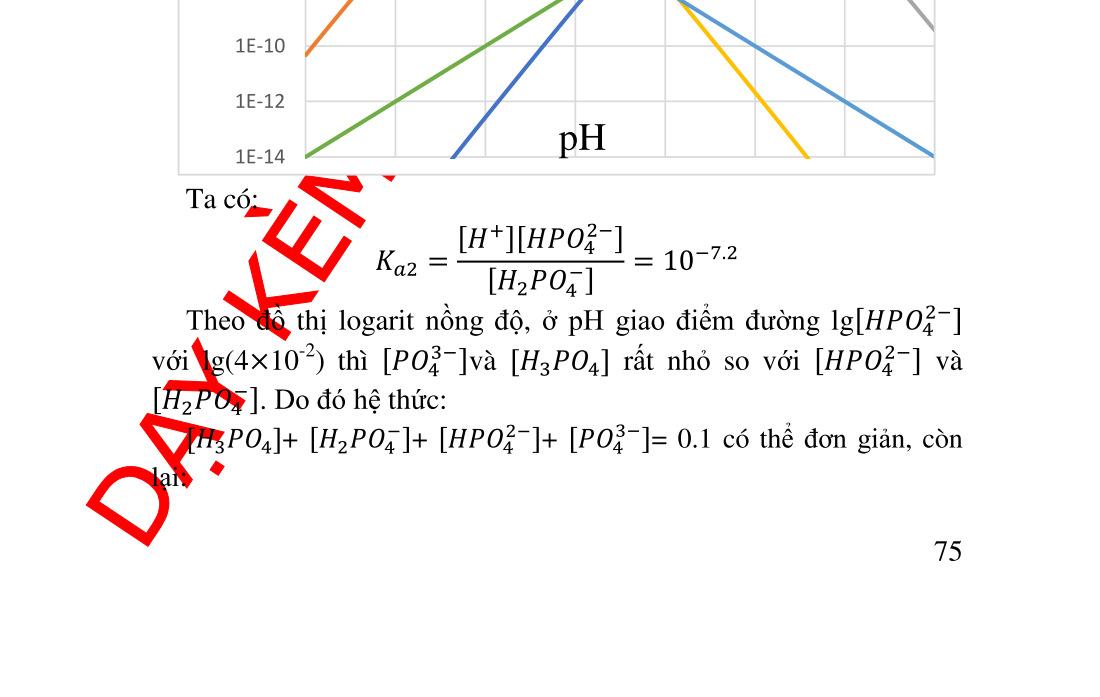
3.9. Hỗn hợp acid yếu và base liên hợp dung dịch đệm ................ 68 3.9.1. Xét cân bằng và tính pH:.................................................... 68 3.9.2. Chất đệm ............................................................................ 70
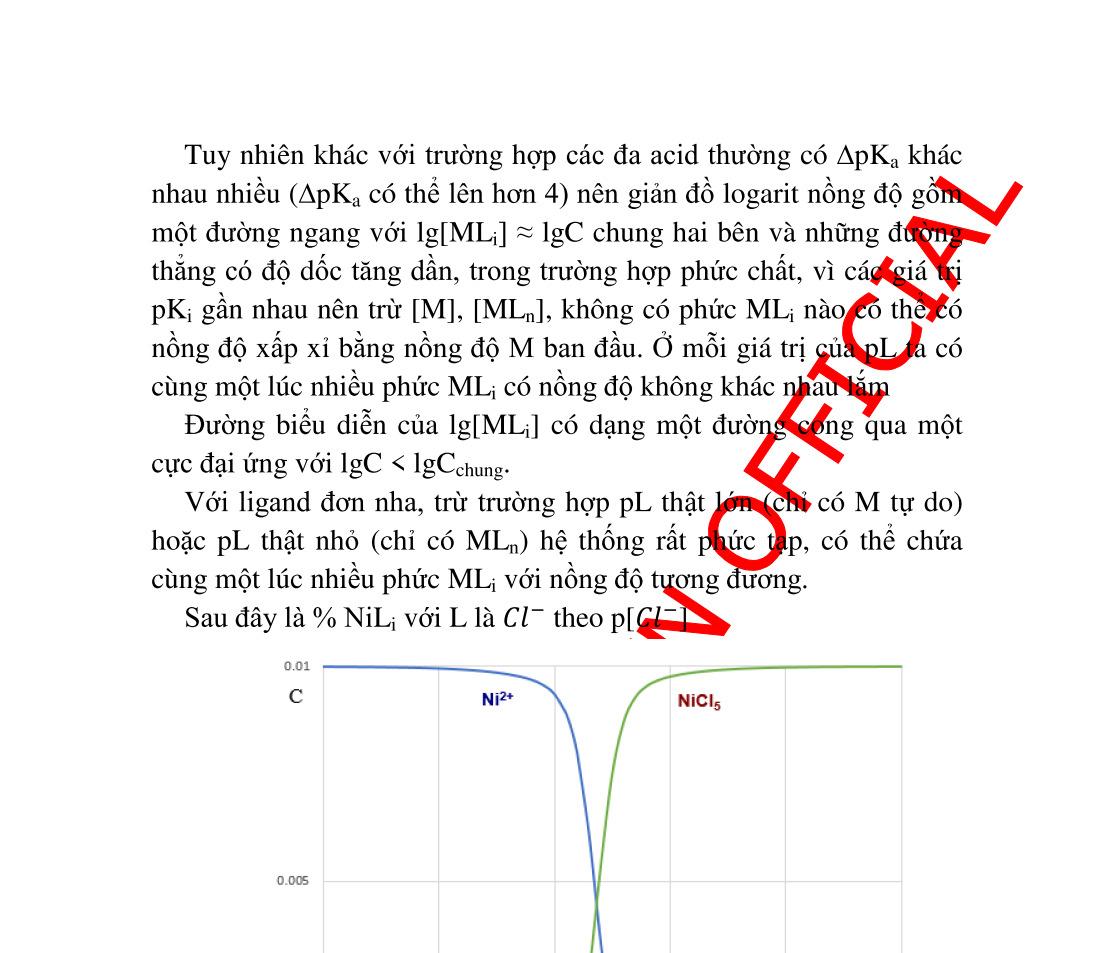
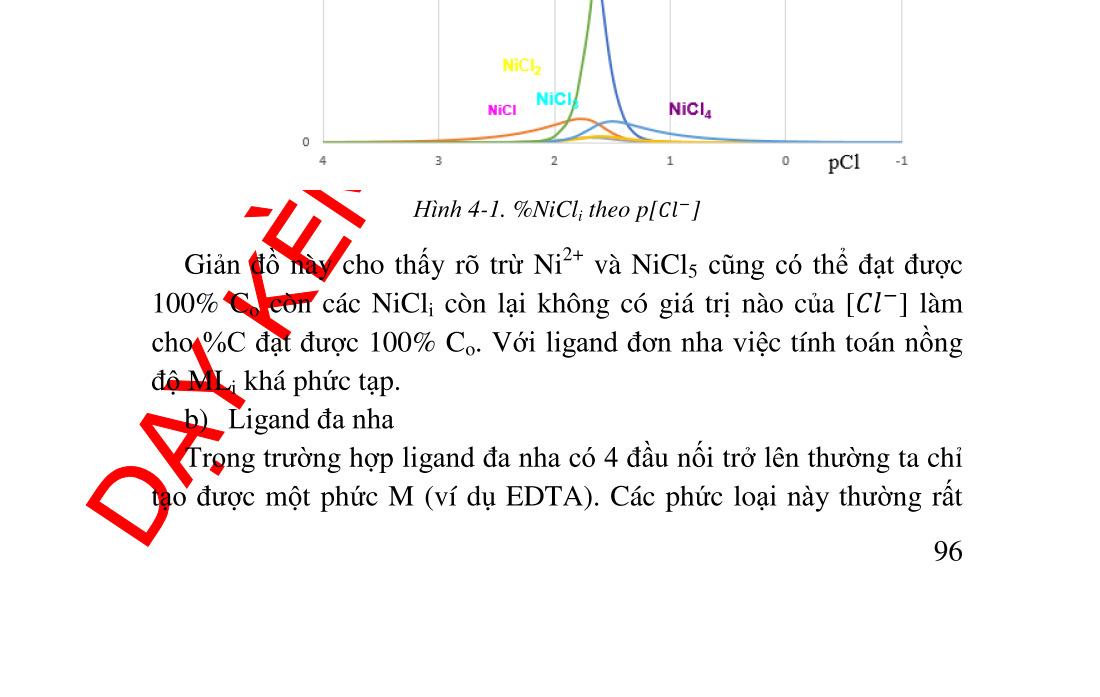
4. Chương 4. PHỨC CHẤT ......................................................................... 82 4.1. Đại cương .................................................................................. 82 4.1.1. Định nghĩa .......................................................................... 82 4.1.2. Cấu tạo ............................................................................... 82 4.1.3. Danh pháp .......................................................................... 84 4.2. Hằng số không bền (hằng số bền) của phức chất ...................... 85 4.3. Ảnh hưởng của pH trên độ bền của phức chất........................... 86 4.3.1. Khảo sát định tính .............................................................. 86 4.3.2. Khảo sát định lượng ........................................................... 87 4.4. Ảnh hưởng của các chấ
DẠYKÈMQUYNHƠN
OFFICIAL
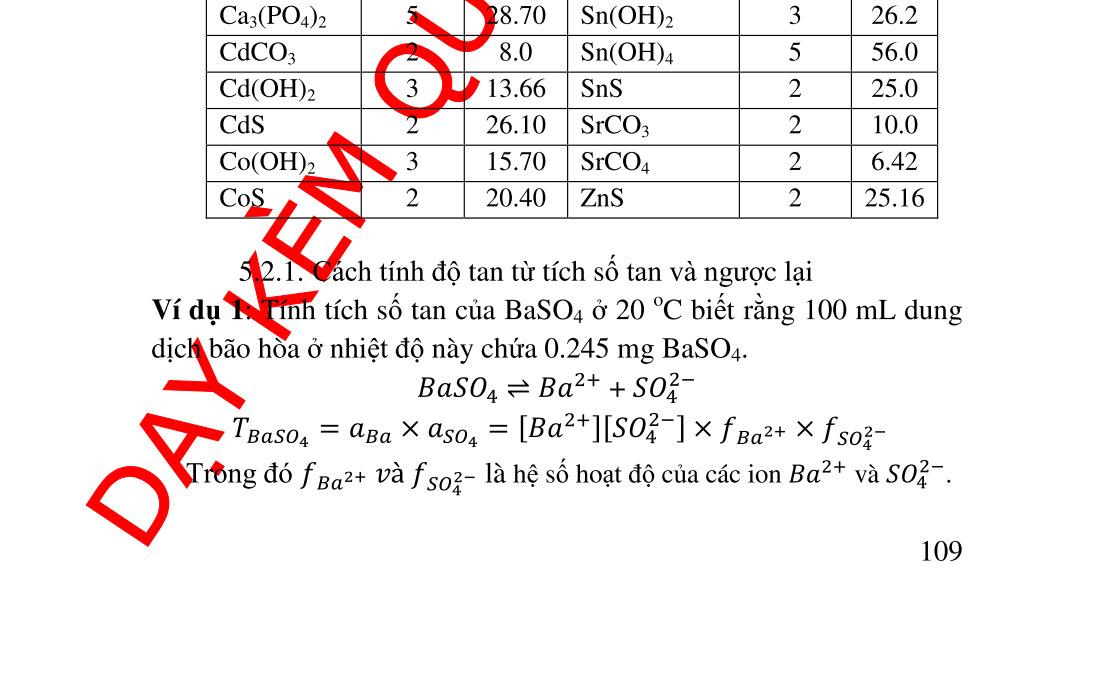
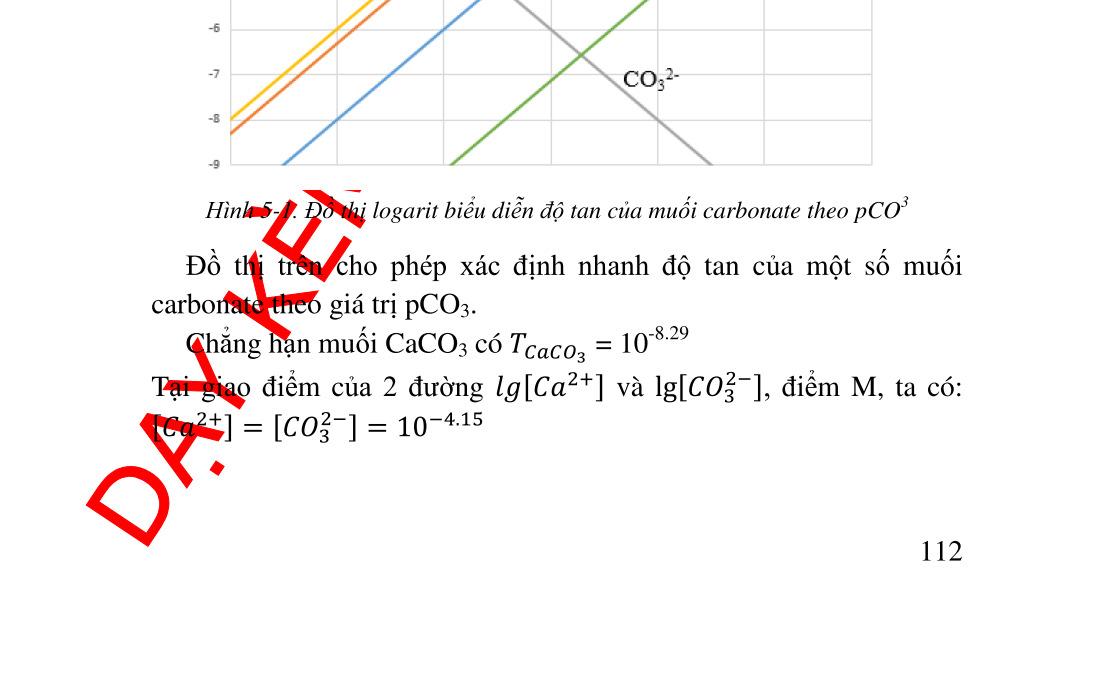
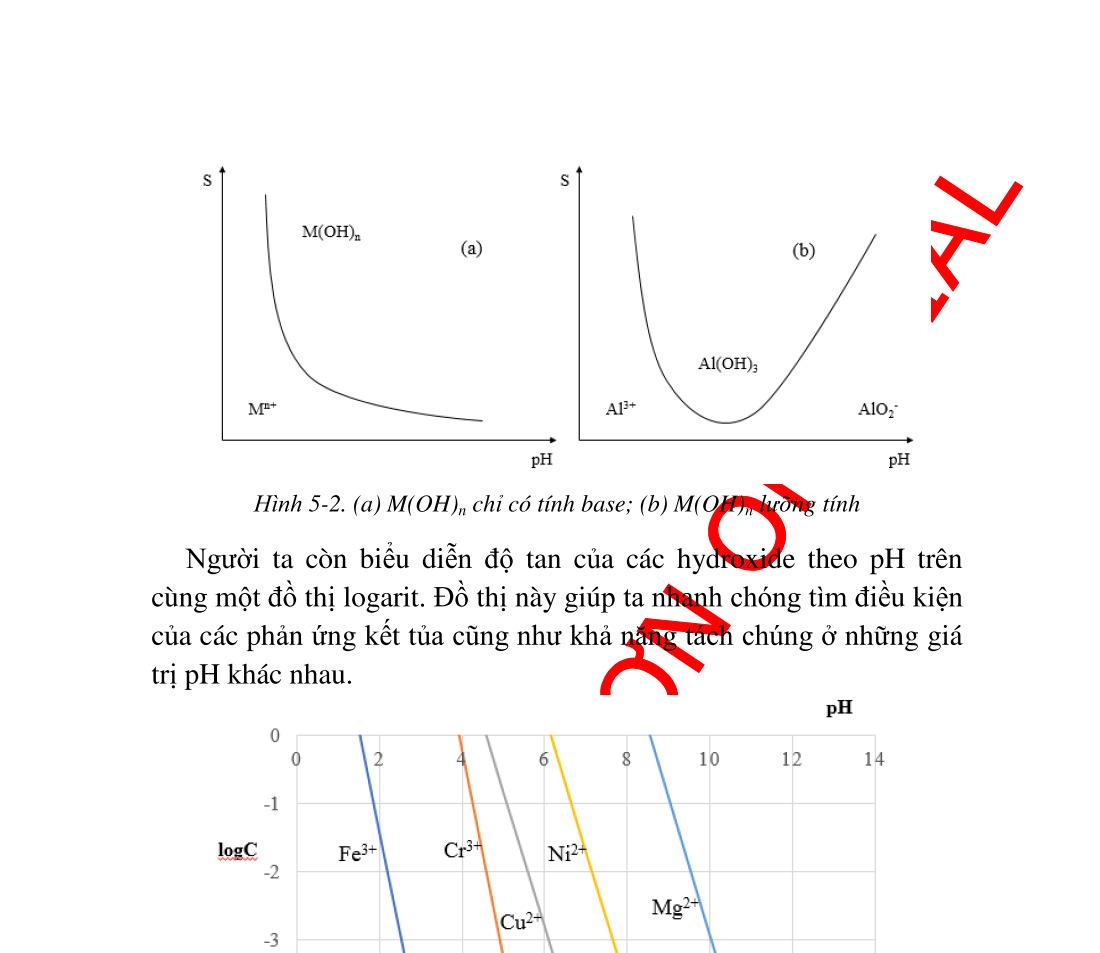
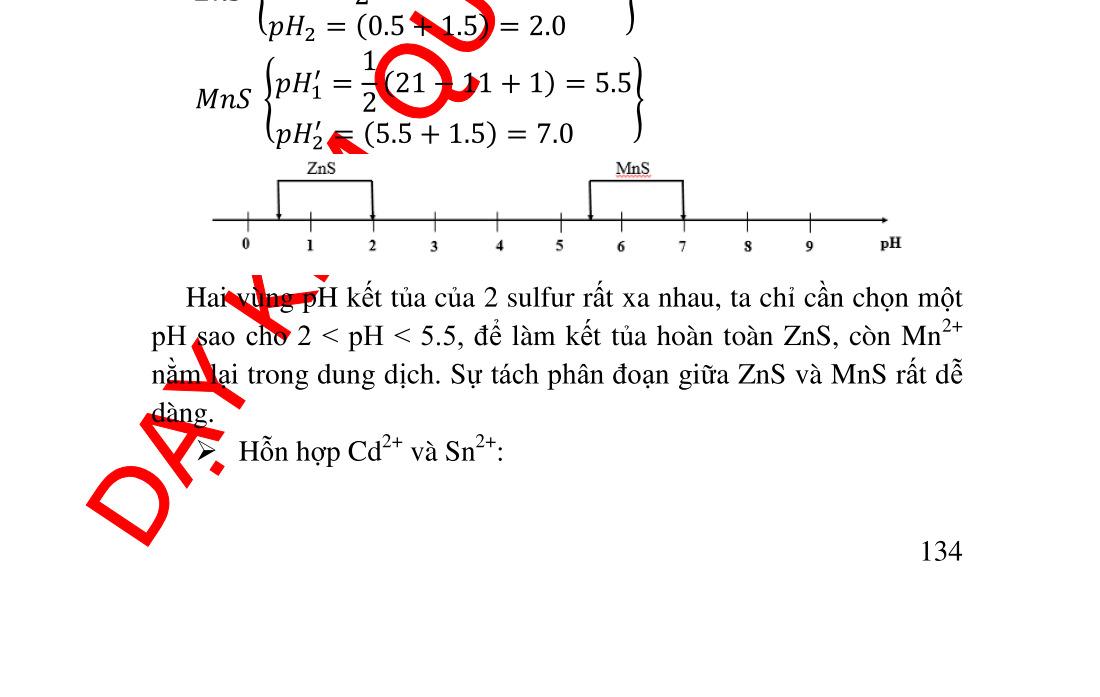
t tạo phản ứng khác .............................. 89 4.5. Nồng độ các ������ theo [L]......................................................... 90 4.5.1. Tính nồng độ ������ .............................................................. 90 4.5.2. Giản đồ logarit nồng độ...................................................... 91 4.6. Ứng dụng của phản ứng tạo phức trong hóa phân tích.............. 93 4.6.1. Ứng dụng trong hóa phân tích định tính............................. 93 4.6.2. Ứng dụng trong hóa phân tích định lượng ......................... 97 5. Chương 5. PHẢN ỨNG TẠO THÀNH CÁC HỢP CHẤT ÍT TAN ..... 102 5.1. Điều kiện tạo thành chất kết tủa quy luật tích số tan ............ 102 5.2. Tích số tan và độ tan................................................................ 103 5.2.1. Cách tính độ tan từ tích số tan và ngược lại ..................... 104 5.2.2. Đồ thị logarit nồng độ biểu diễn độ tan của các chất ít tan107 5.3. Các yếu tố ảnh hưởng đến độ tan của kết tủa .......................... 108 5.3.1. Ảnh hưởng của ion chung ................................................ 108 5.3.2. Ảnh hưởng của lực ion ..................................................... 109 5.3.3. Ảnh hưởng của pH lên độ tan........................................... 110
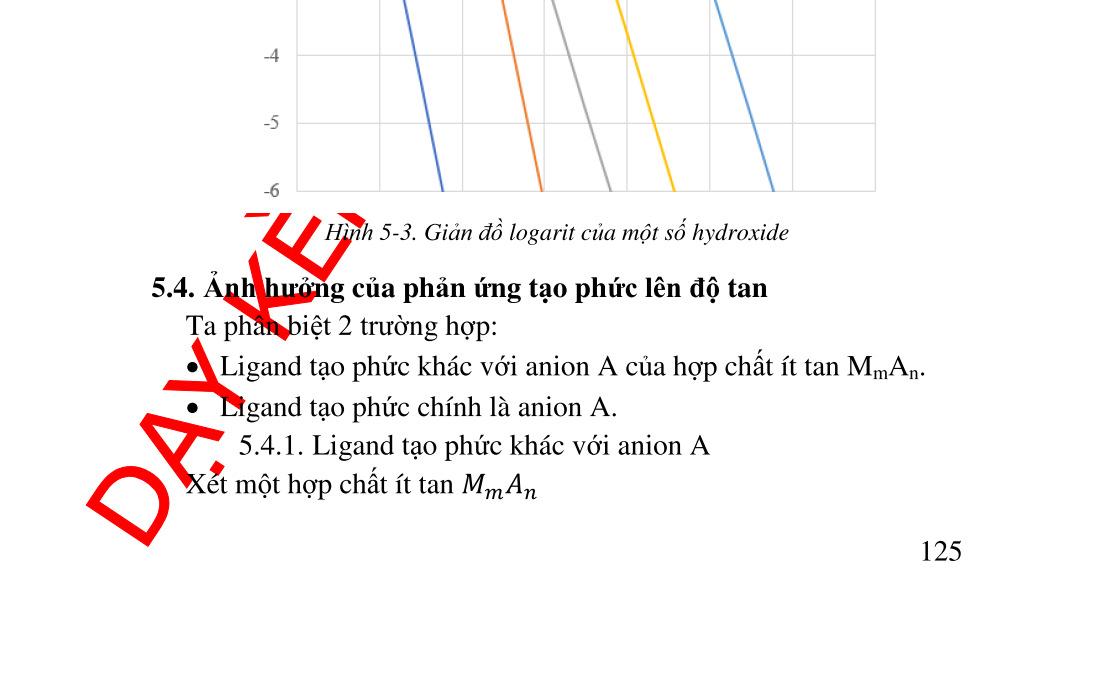
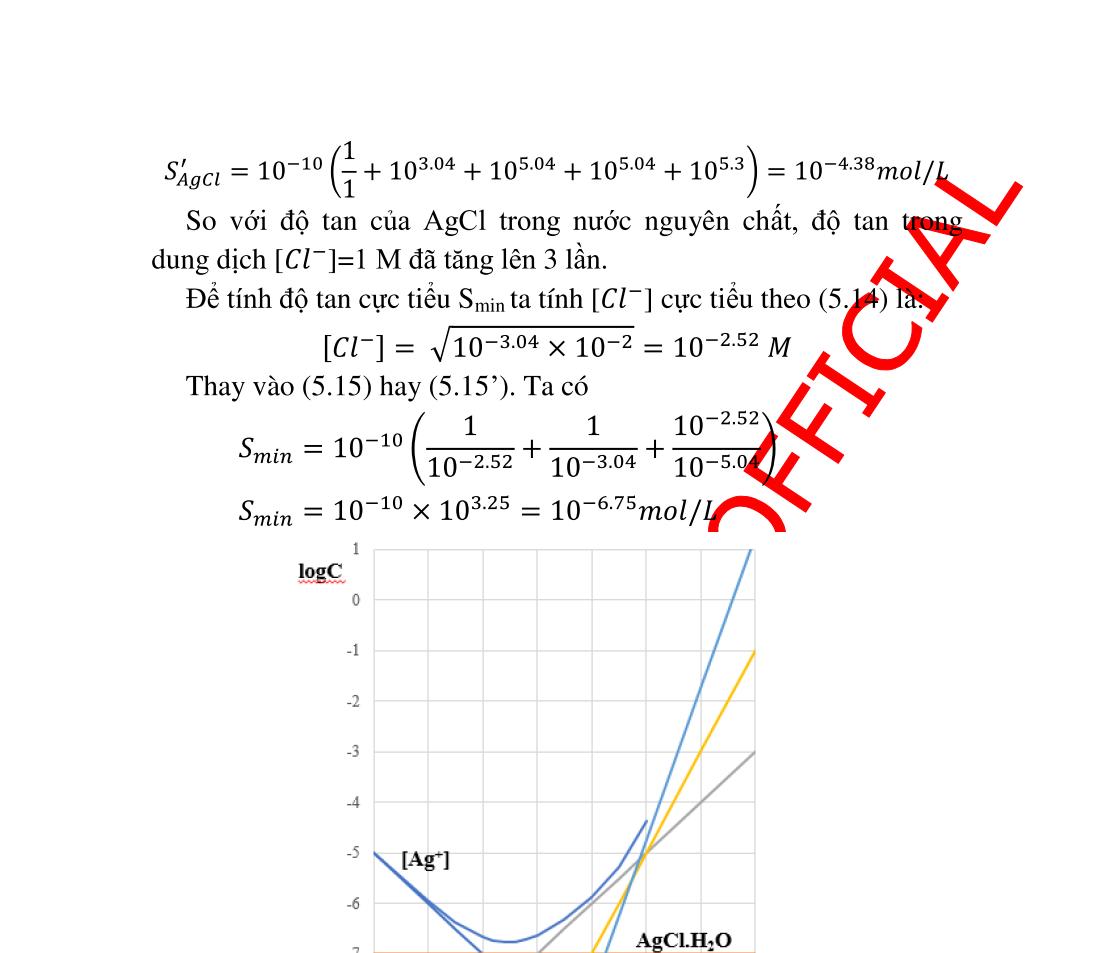
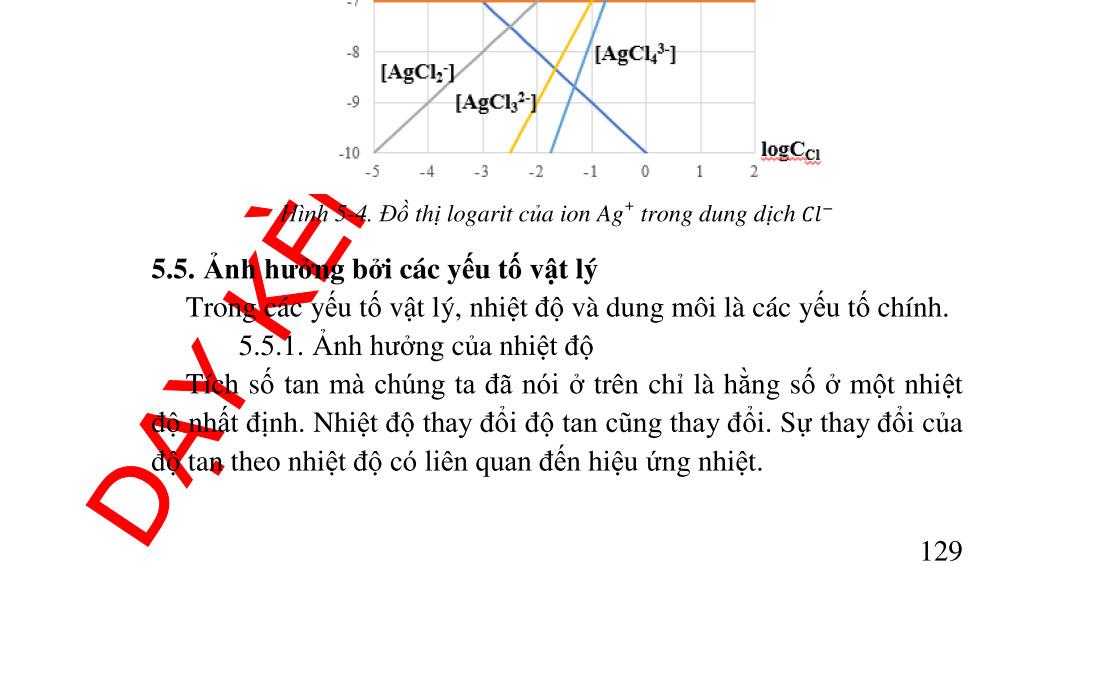
5.4. Ảnh hưởng của phản ứng tạo phức lên độ tan......................... 120 5.4.1. Ligand tạo phức khác với anion A ................................... 120 5.4.2. Ligand là anion A. Tính lưỡng tính.................................. 121 5.5. Ảnh hưởng bởi các yếu tố vật lý.............................................. 124 5.5.1. Ảnh hưởng của nhiệt độ ................................................... 124 5.5.2. Ảnh hưởng của bản chất dung môi................................... 125 5.6. Sự kết tủa phân đoạn ............................................................... 125 5.7. Sự nhiễm bẩn kết tủ
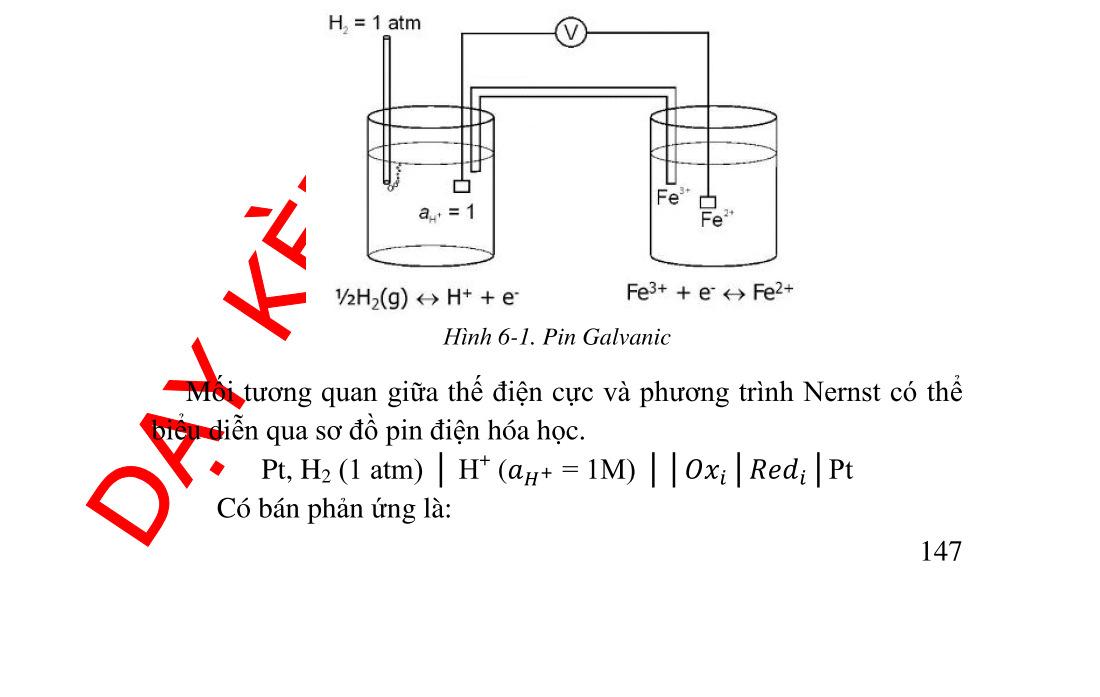
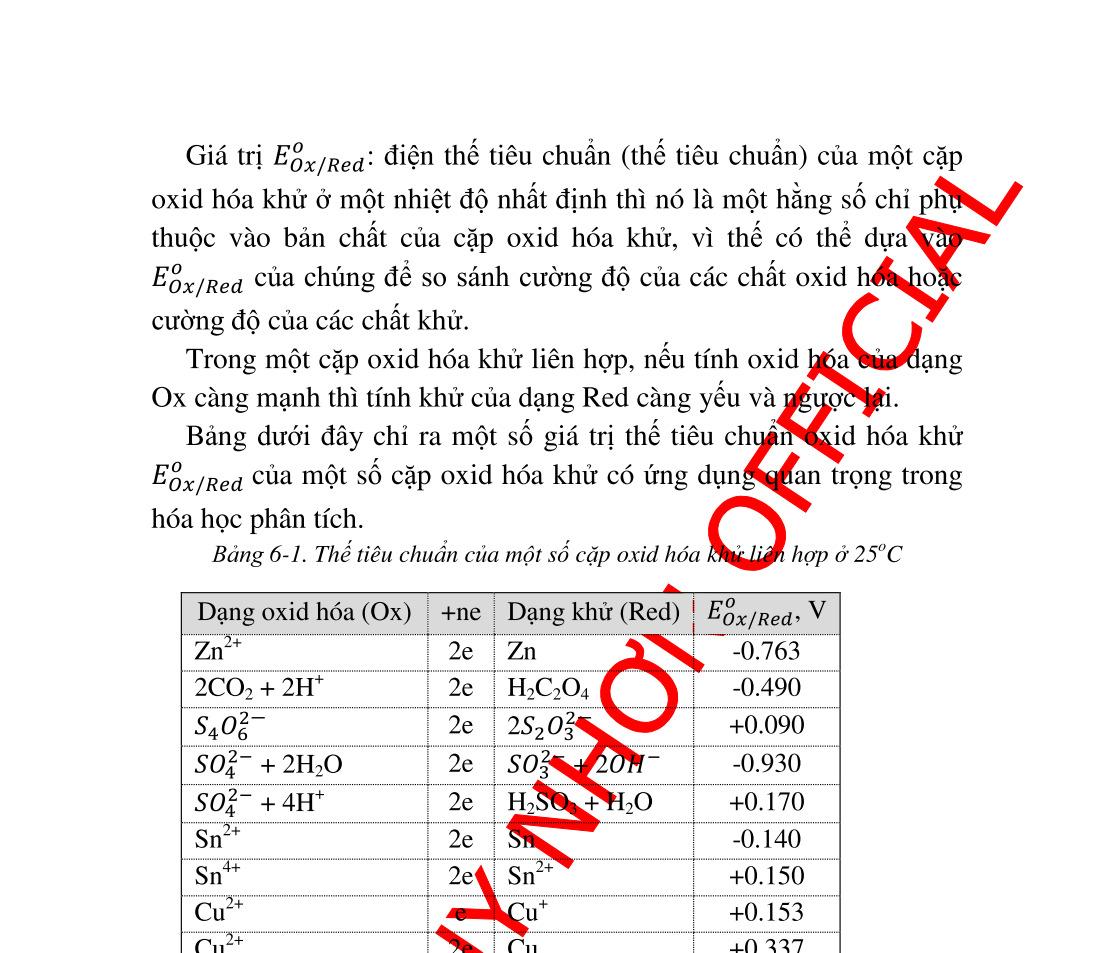
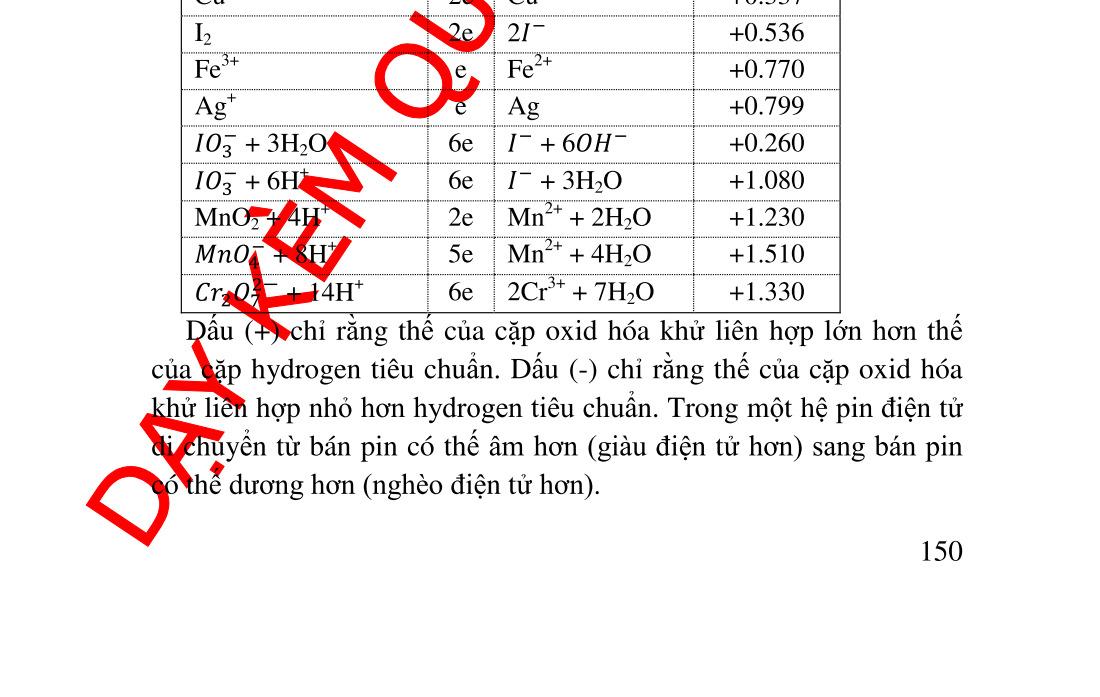
phương trình Nernst ................... 140 6.1.1. Điện thế điện cực.............................................................. 140 6.1.2. Điện thế tiêu chuẩn. Cường độ chất khử và chất oxid hóa143 6.2. Ảnh hưởng của pH trên cân bằng oxid hóa khử ...................... 145 6.2.1. Tác dụng của ����− đối với Mn+ ...................................... 145 6.2.2. Tác dụng của ��+ trên anion của cặp oxid hóa khử ........ 146
6.3. Ảnh hưởng của chất tạo phức.................................................. 152 6.4. Ảnh hưởng của phản ứng kết tủa............................................. 155 6.5. Điện thế của hỗn hợp chất oxid hóa và chất khử liên hợp....... 157 6.6. Chất oxid hóa và chất khử đa bậc............................................ 158 6.7. Tốc độ của phản ứng oxid hóa khử ......................................... 160 6.7.1. Chất xúc tác...................................................................... 160 6.7.2. Phản ứng cảm ứng............................................................
DẠYKÈMQUYNHƠN OFFICIAL
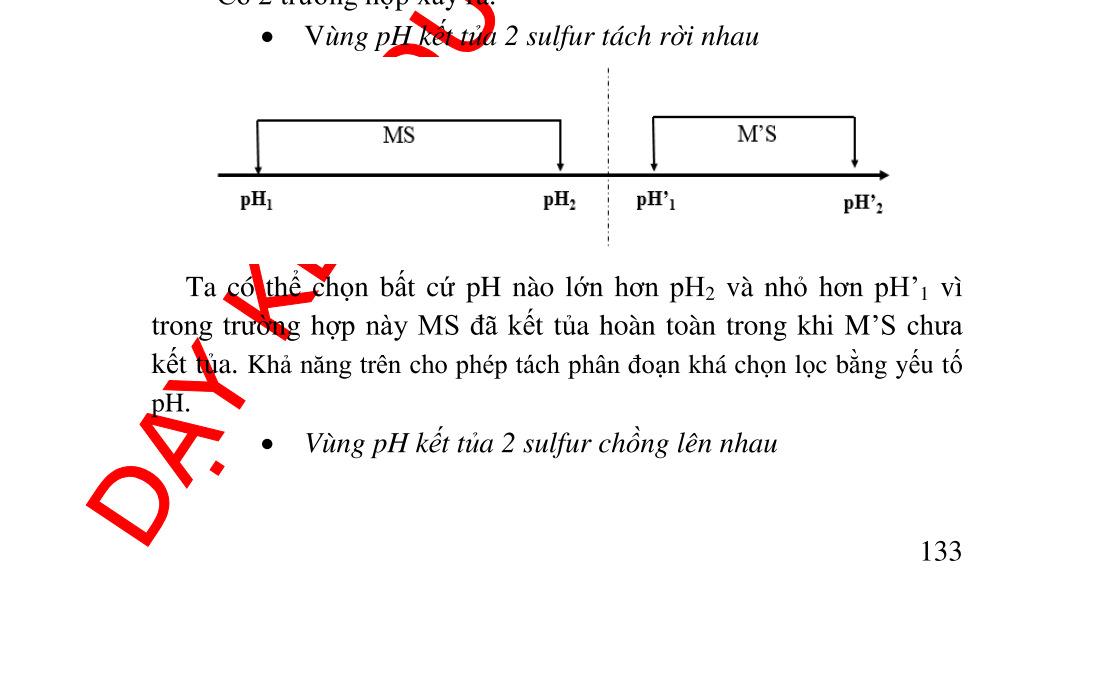
a và cách loại trừ...................................... 131 5.7.1. Sự nhiễm bẩn.................................................................... 131 5.7.2. Cách làm giảm độ nhiễm bẫn........................................... 132 5.8. Ứng dụng của phản ứng kết tủa............................................... 133 5.8.1. Ứng dụng trong hóa phân tích.......................................... 133 5.8.2. Ứng dụng trong kỹ thuật .................................................. 136 6. Chương 6. PHẢN ỨNG TRAO ĐỔI ELECTRON ............................... 140 6.1. Điện thế điện cực cân bằng,
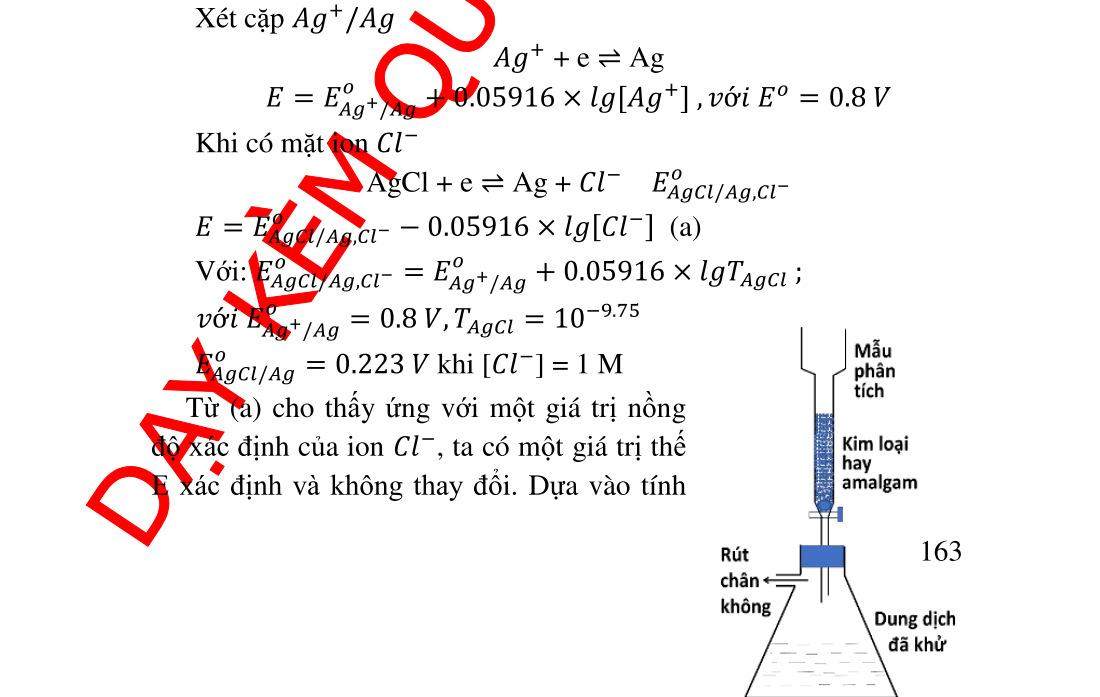
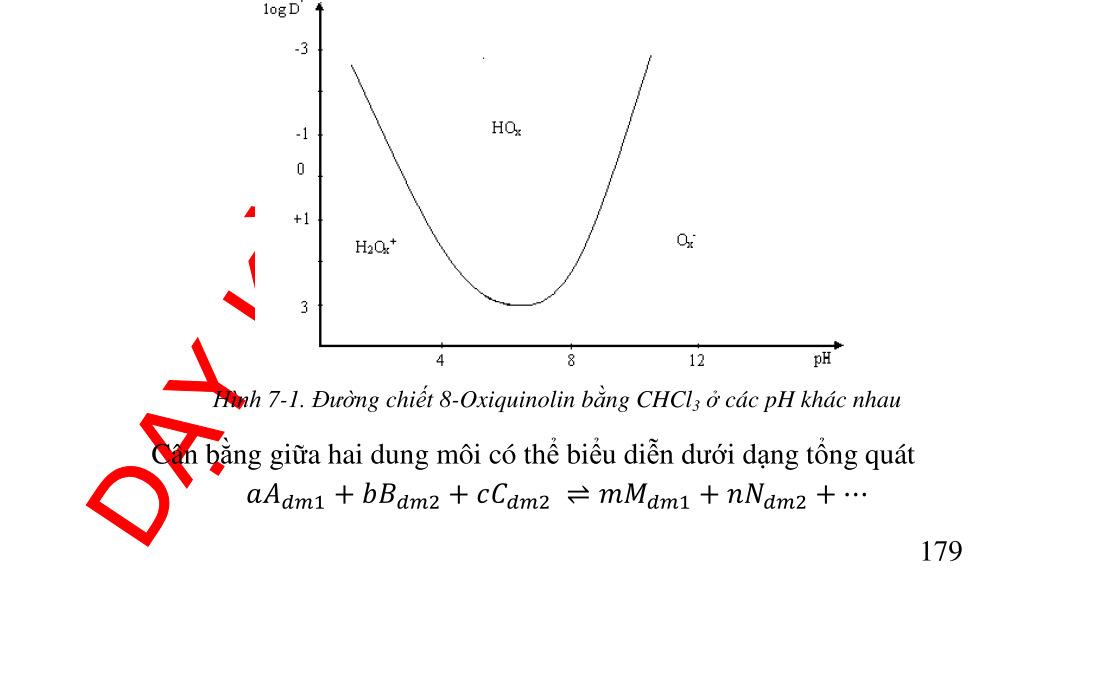
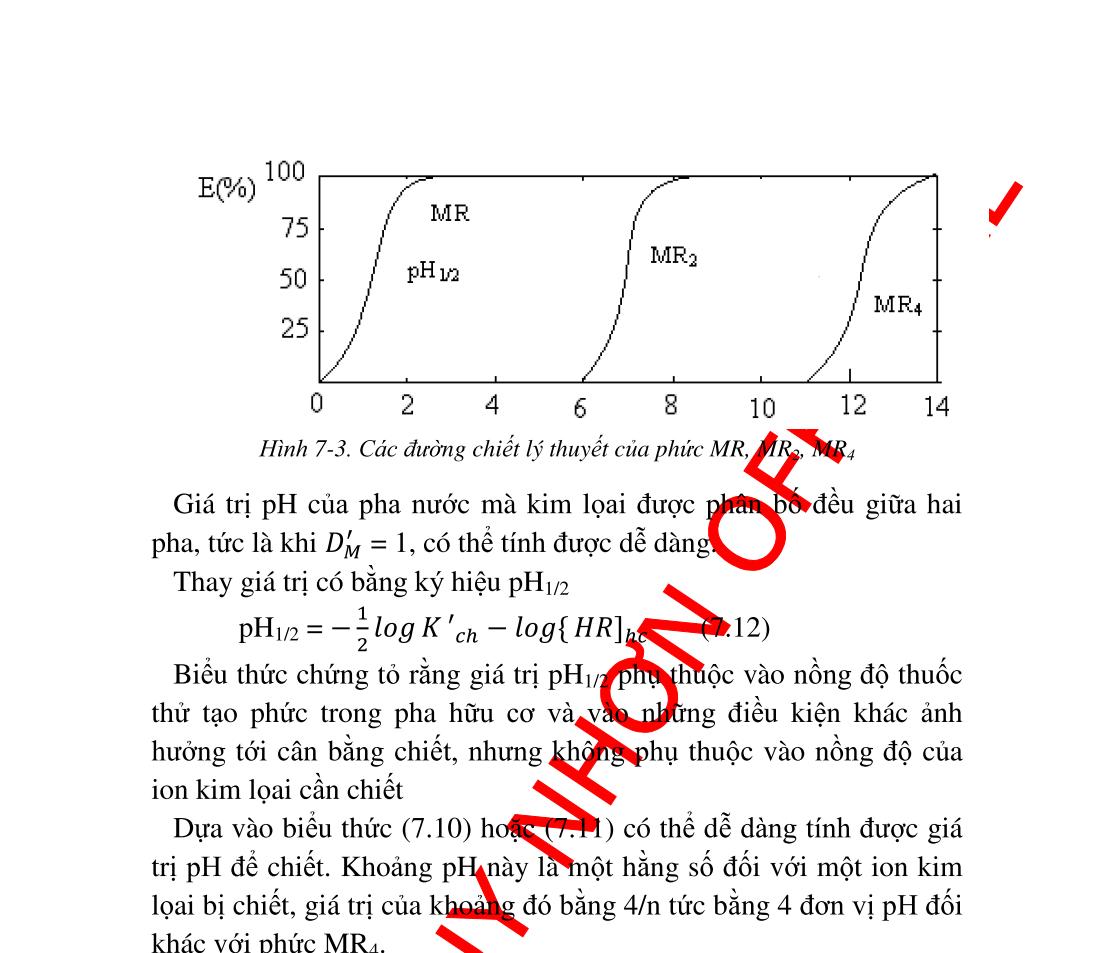
162 6.8. Ứng dụng phản ứng oxid hóa khử trong phân tích .................. 163 6.8.1. Ứng dụng trong hóa phân tích định tính........................... 163 6.8.2. Ứng dụng trong hóa phân tích định lượng ....................... 164 7. Chương 7. CÂN BẰNG GIỮA HAI DUNG MÔI KHÔNG TRỘN LẪN................................................................................................................ 170 7.1. Định nghĩa và khái niệm.......................................................... 170 7.2. Phân loại các hệ chiết .............................................................. 173 7.3. Ý nghĩa của phương pháp chiết ............................................... 174 7.3.1. Chiết các phức vòng......................................................... 175 7.3.2. Chiết các cặp ion liên hợp ................................................ 178 7.4. Giải chiết ................................................................................. 178 8. HƯỚNG DẪN GIẢI BÀI TẬP.............................................................. 179