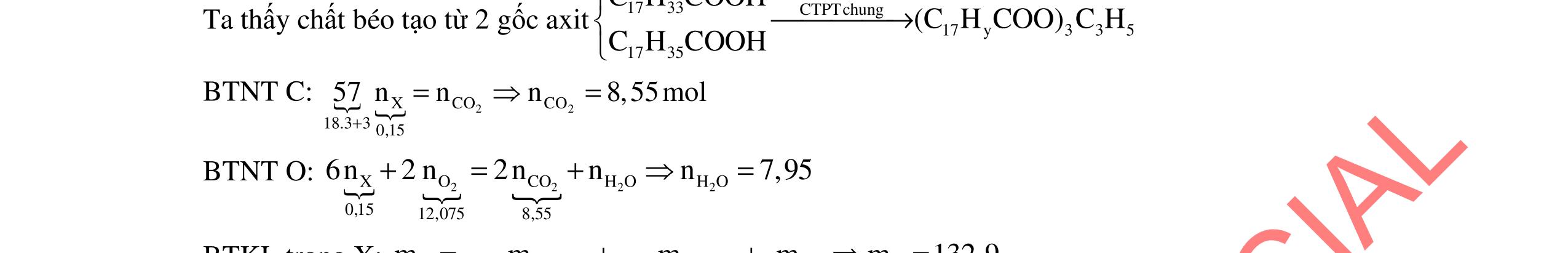
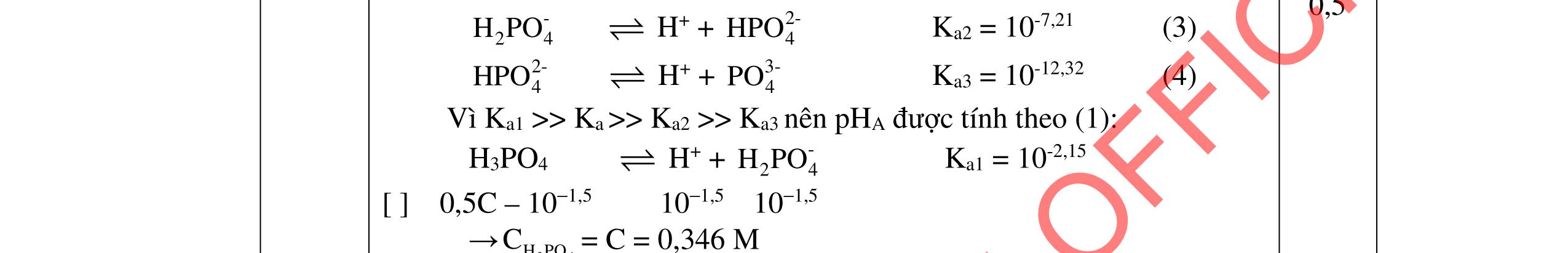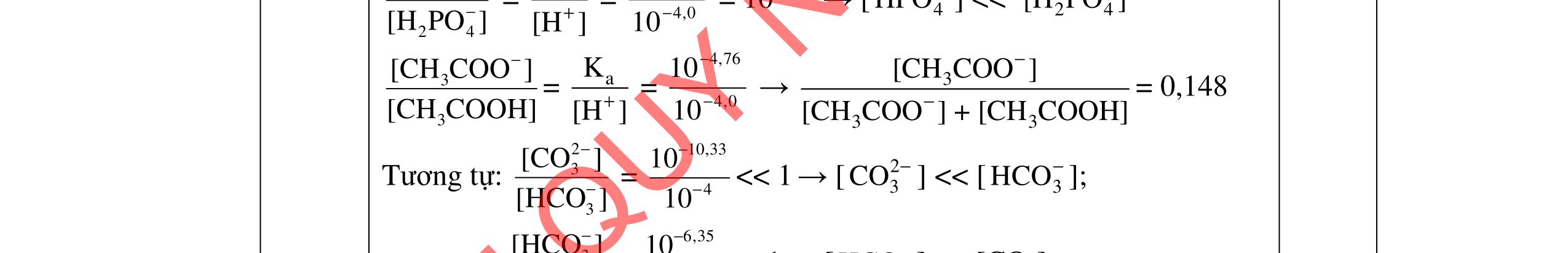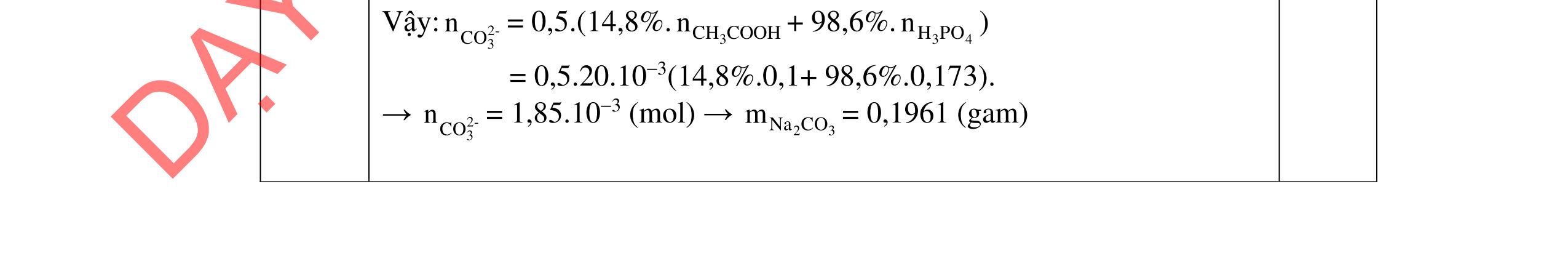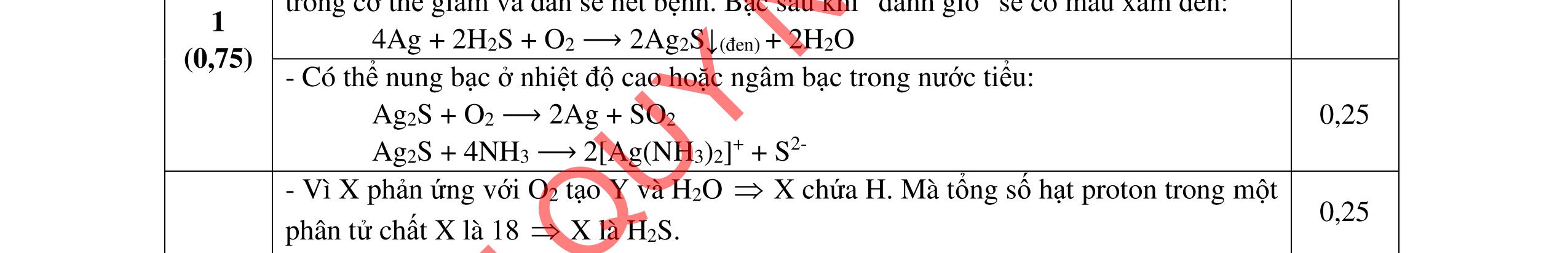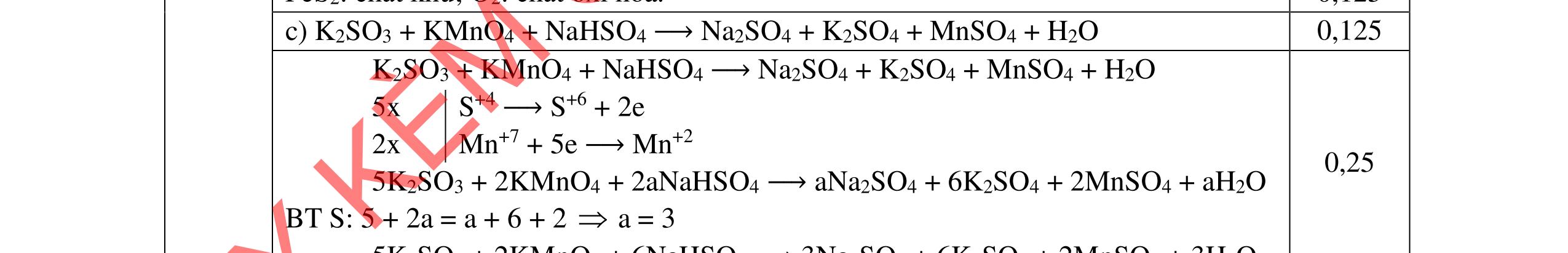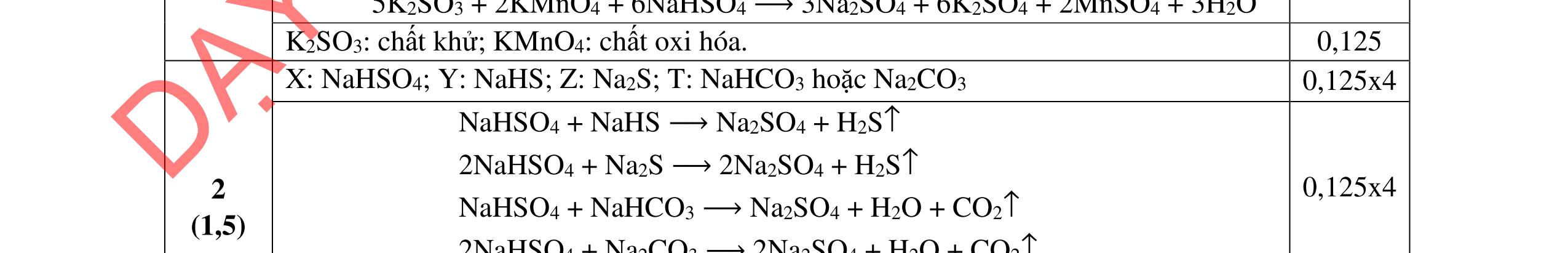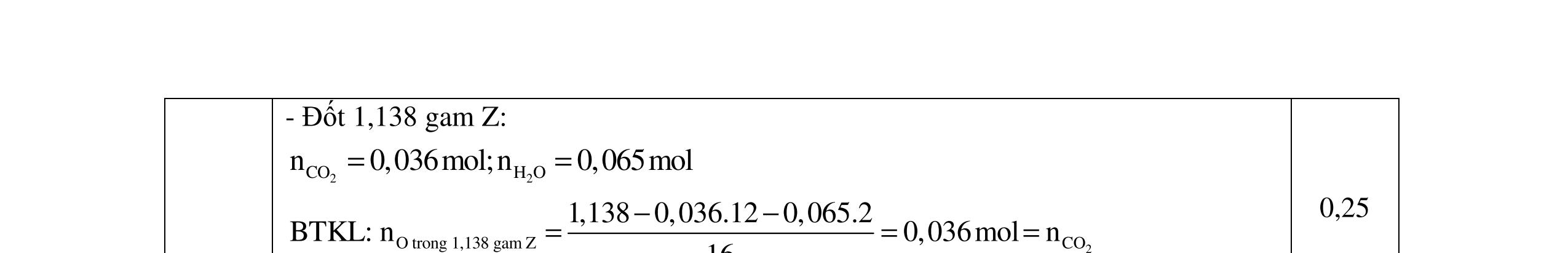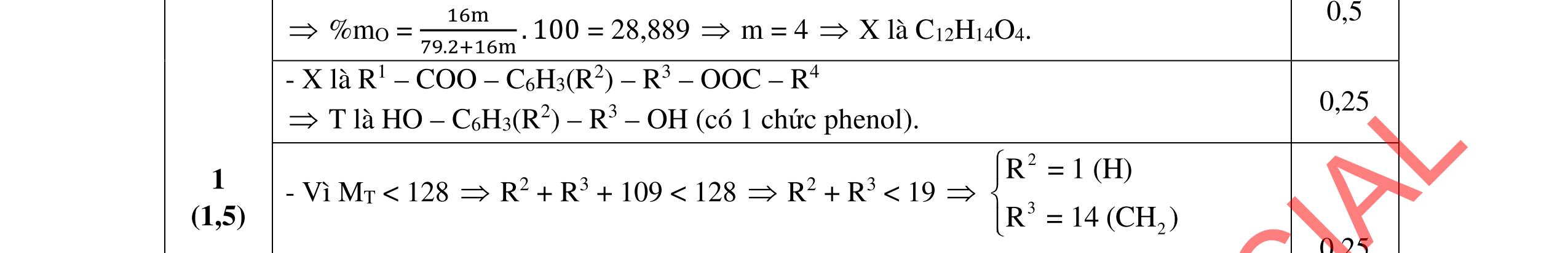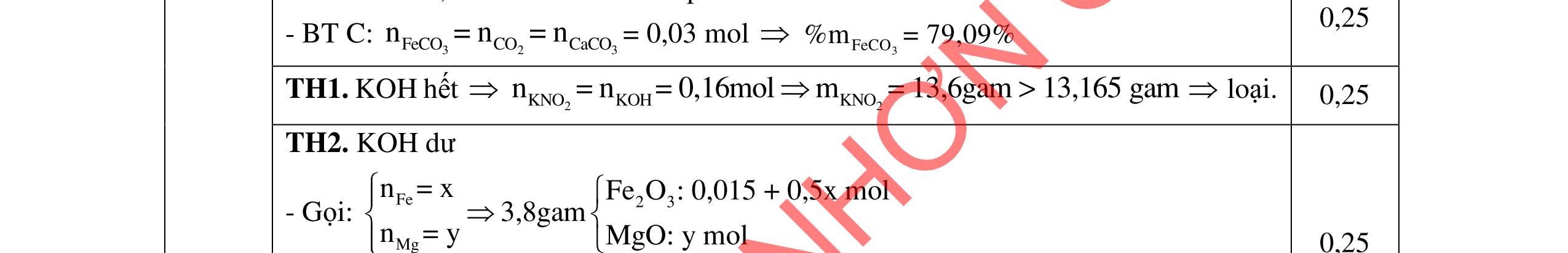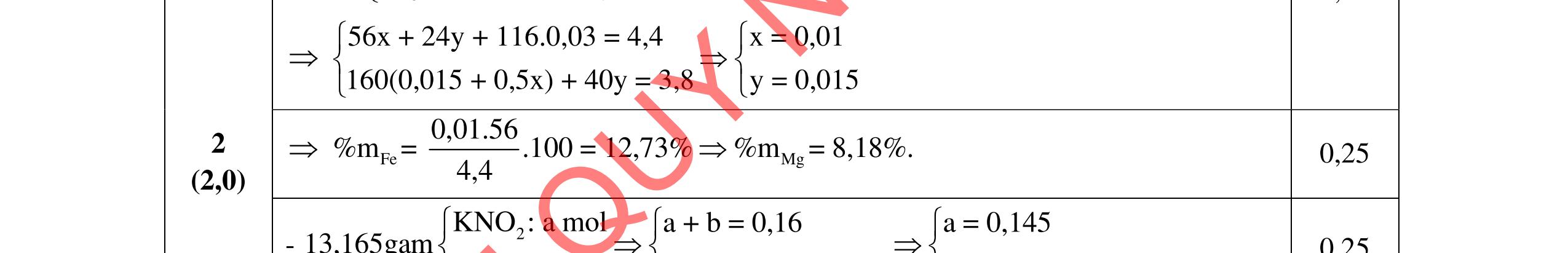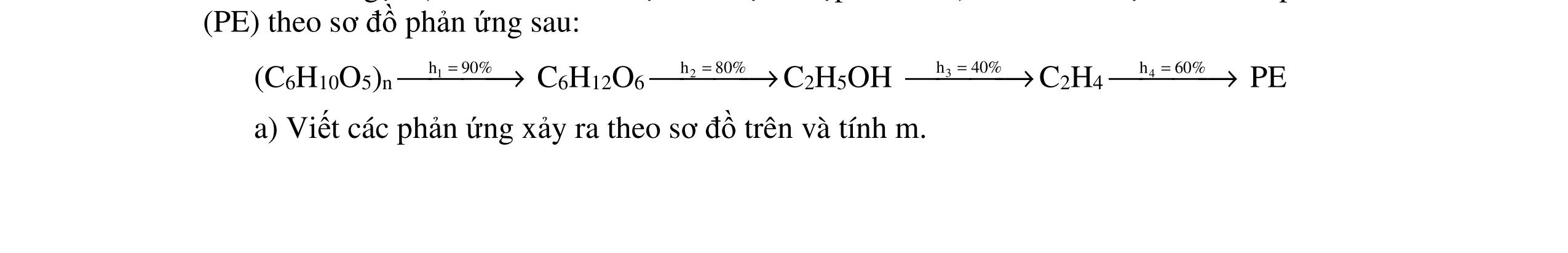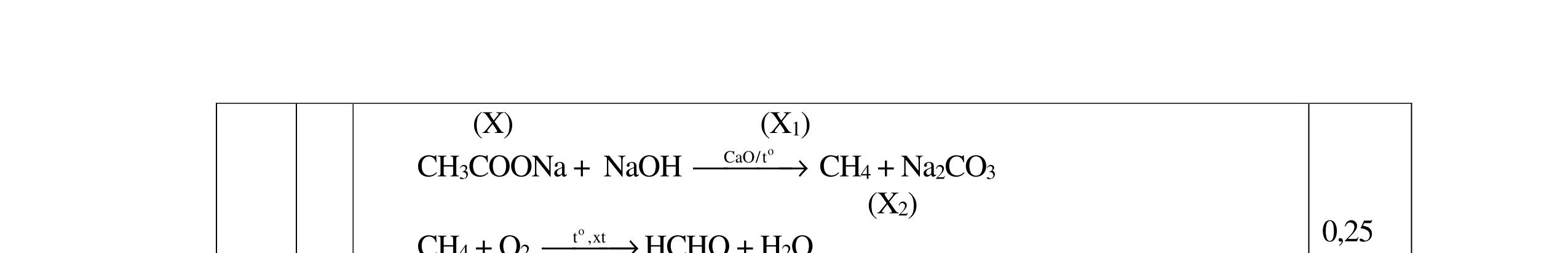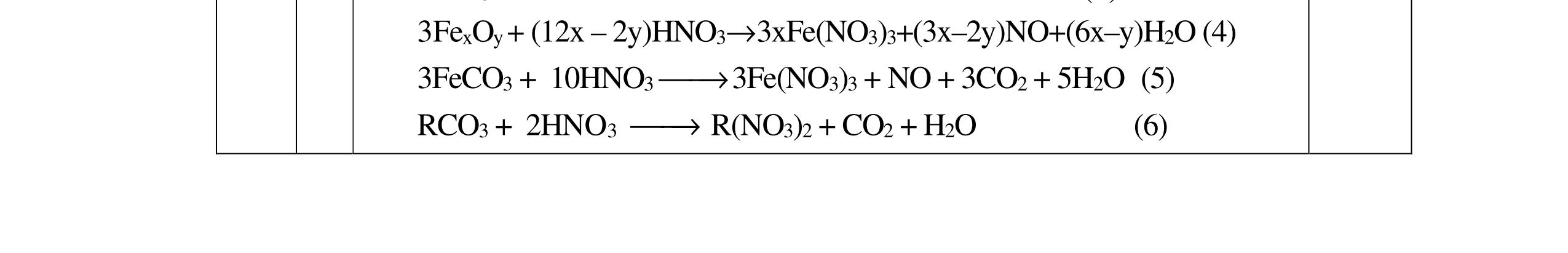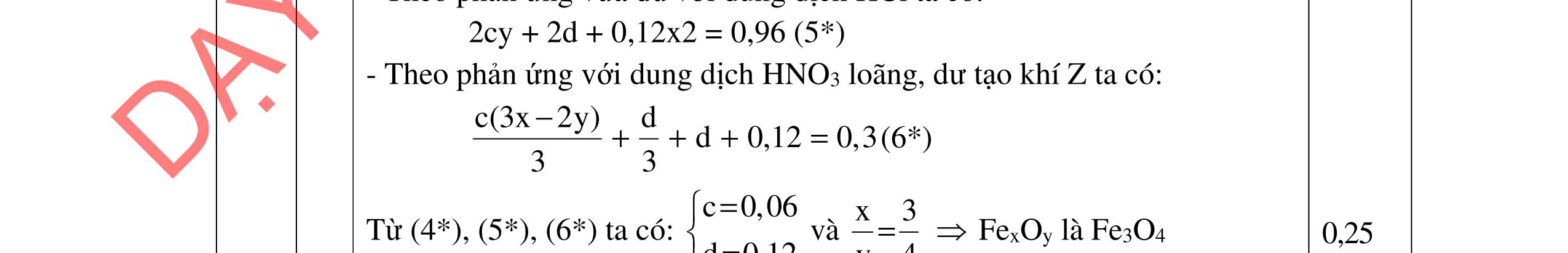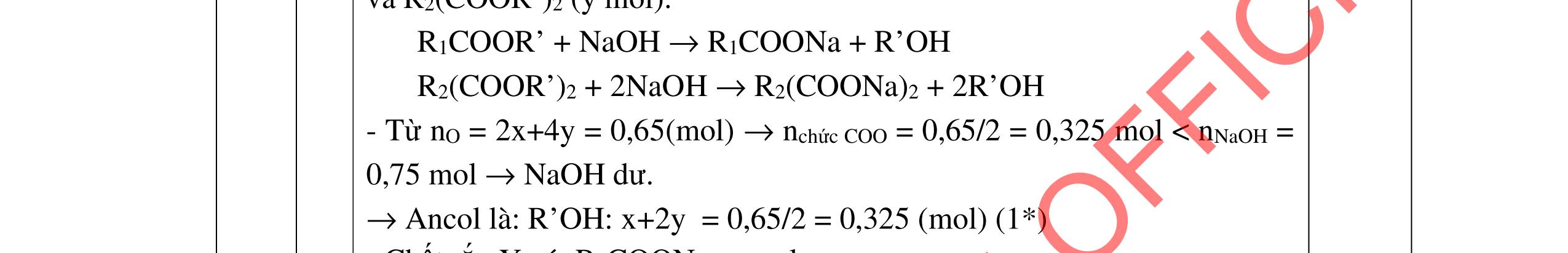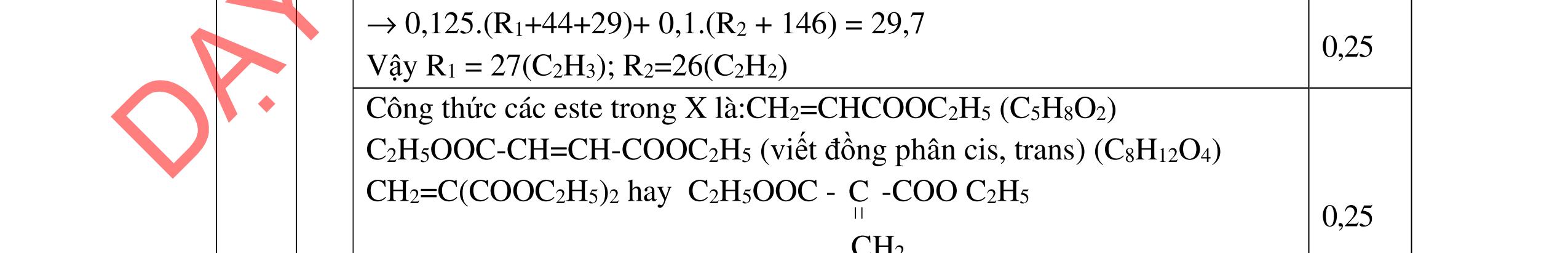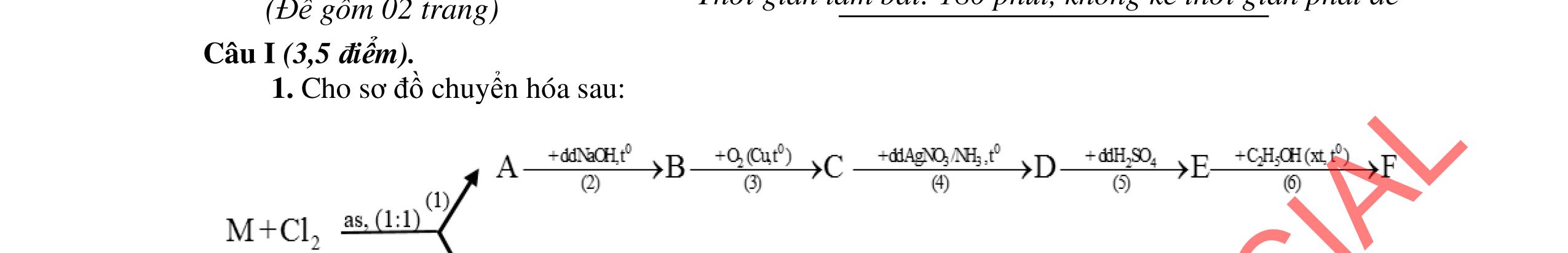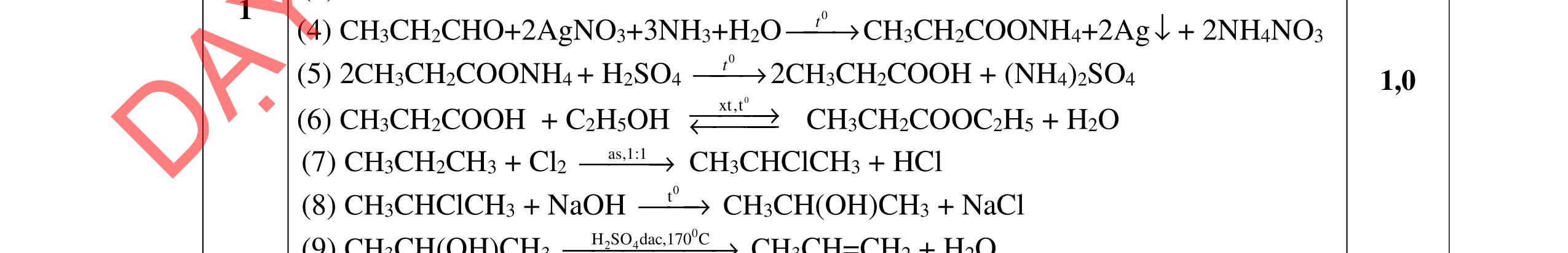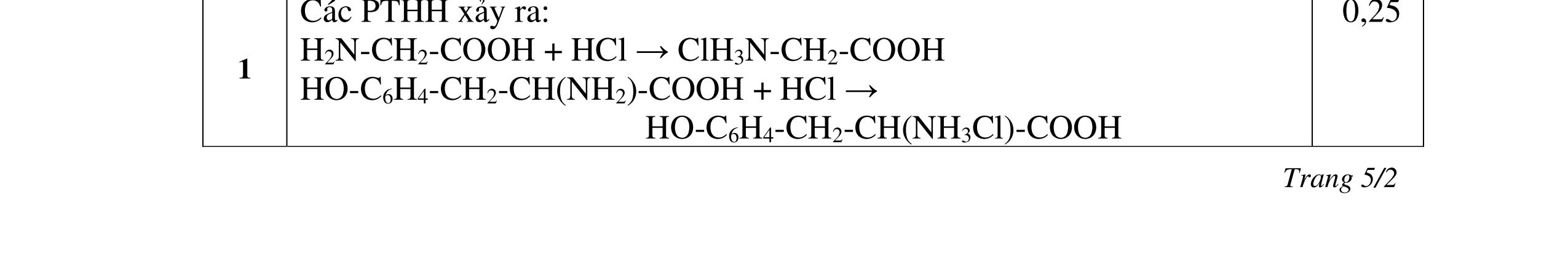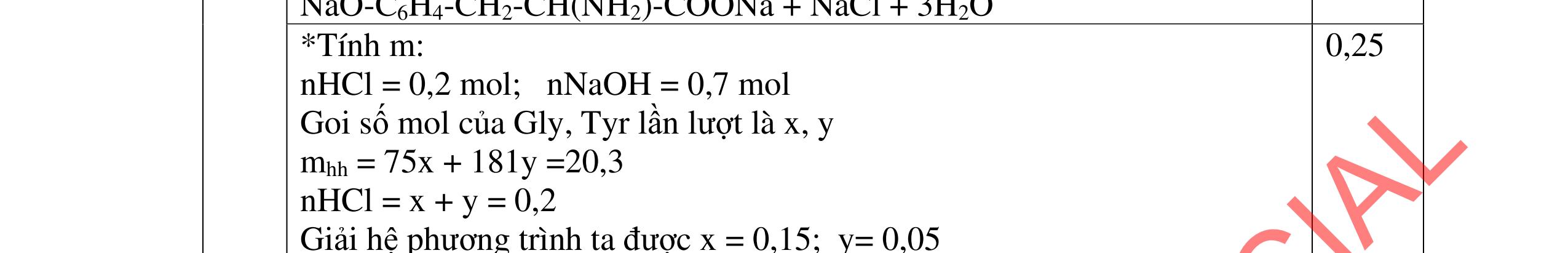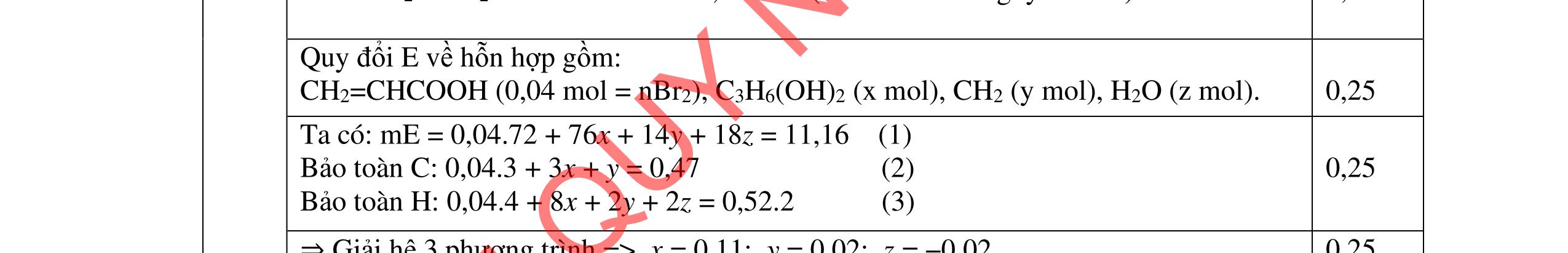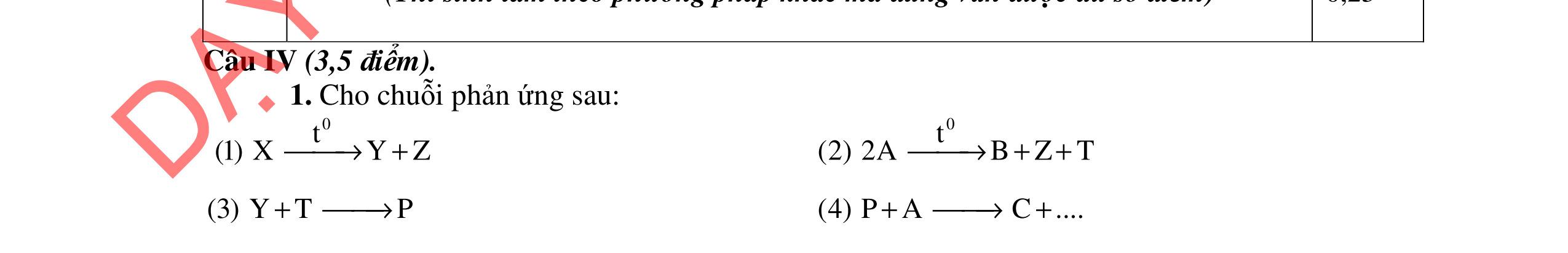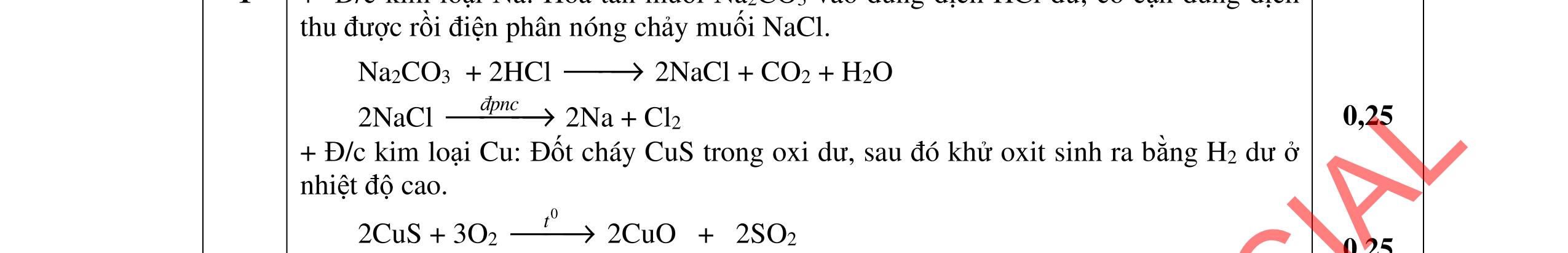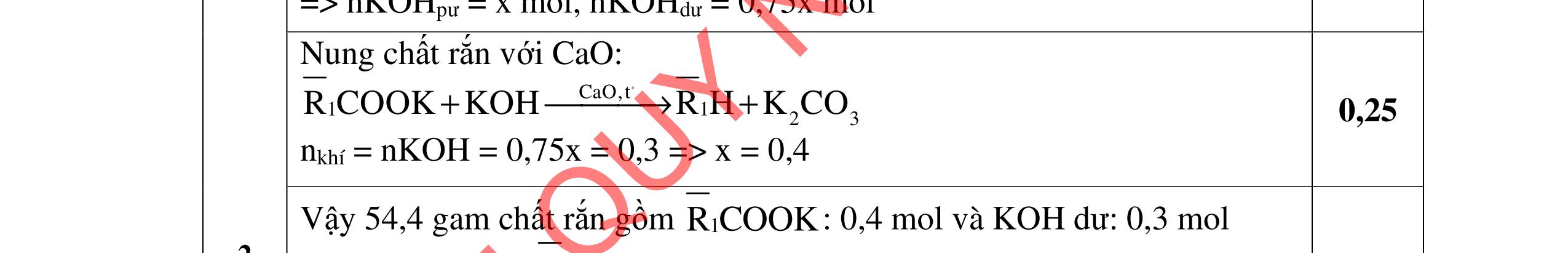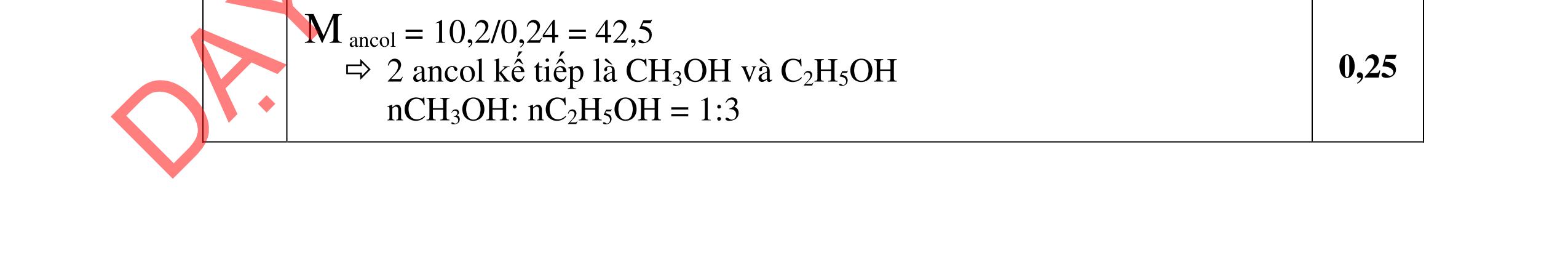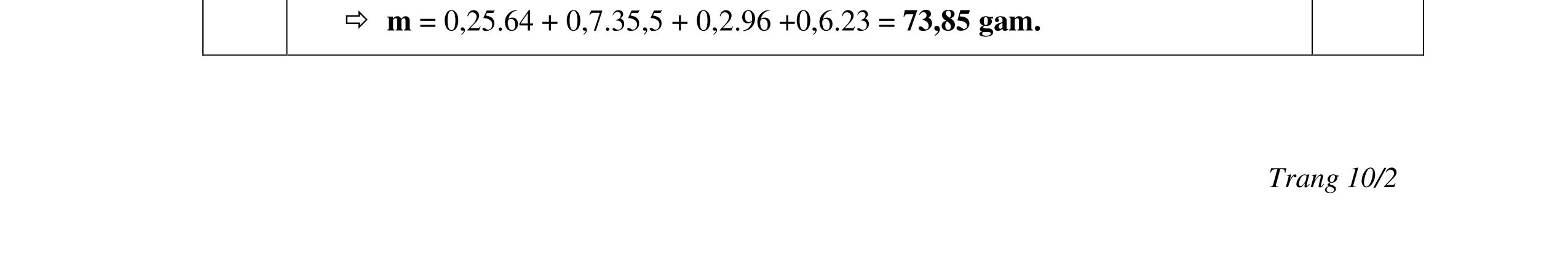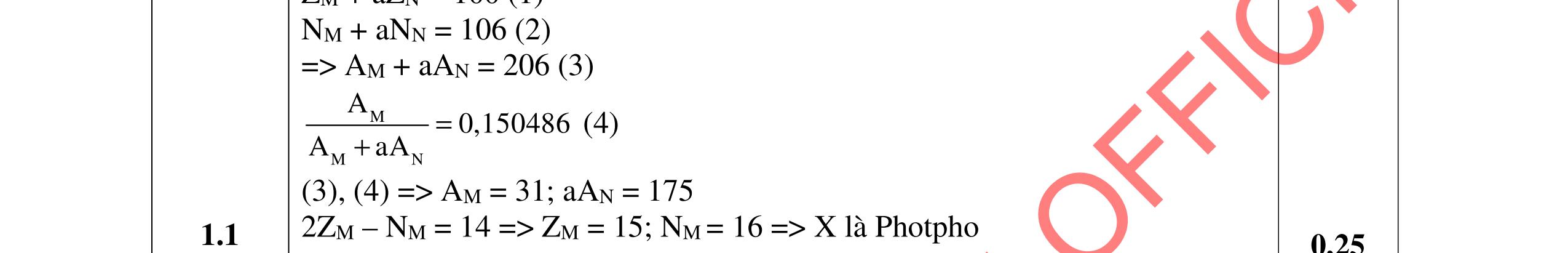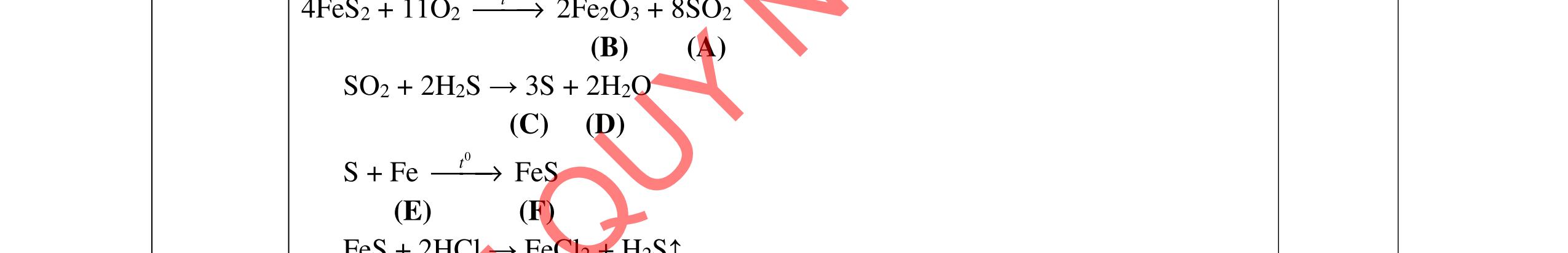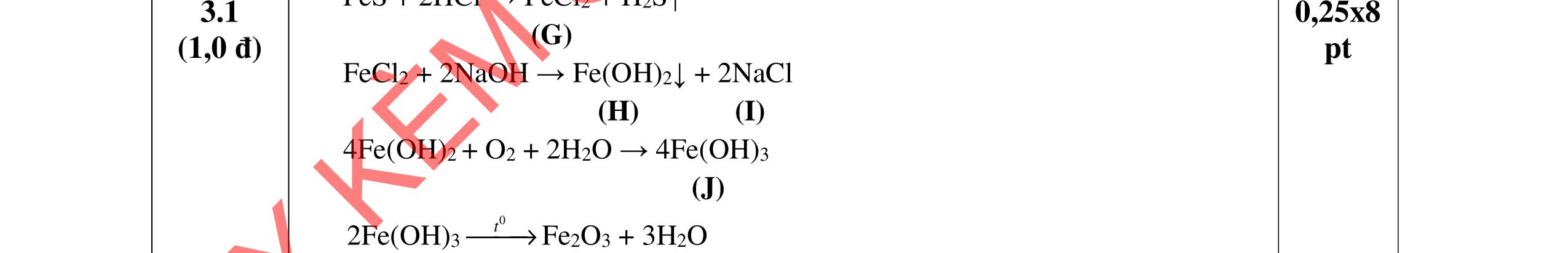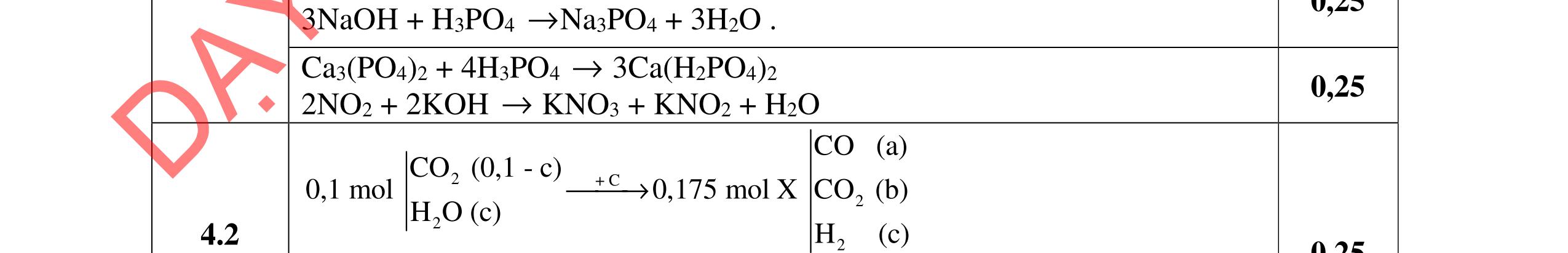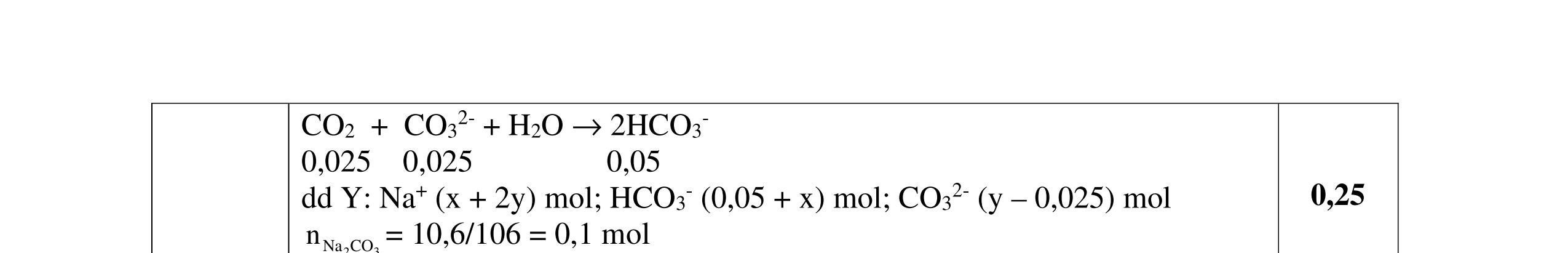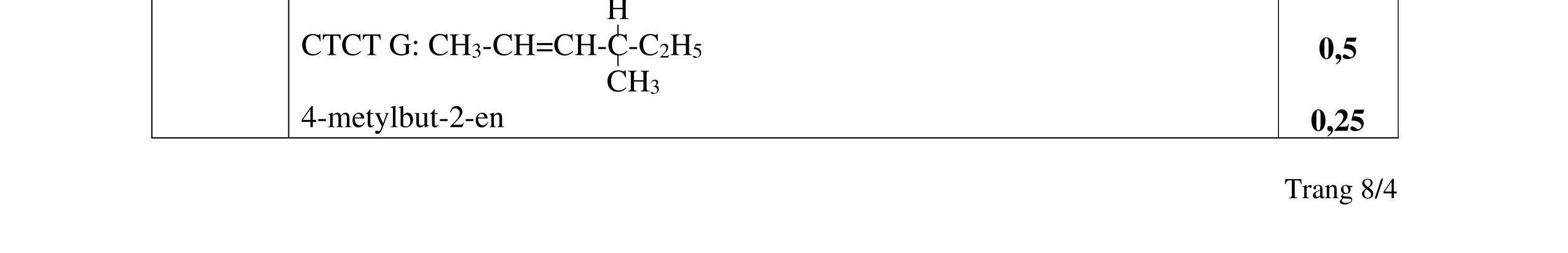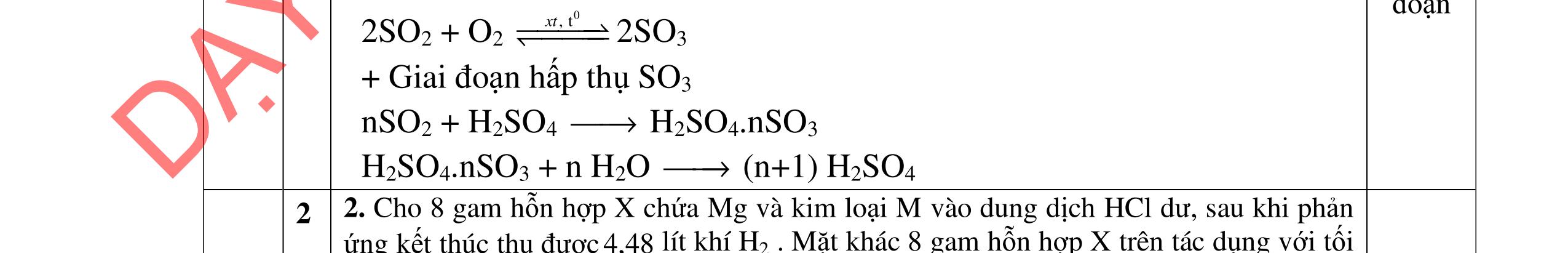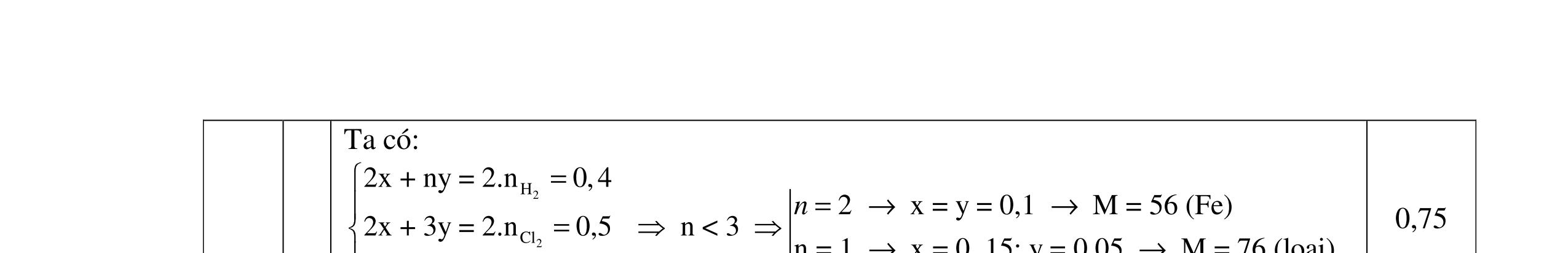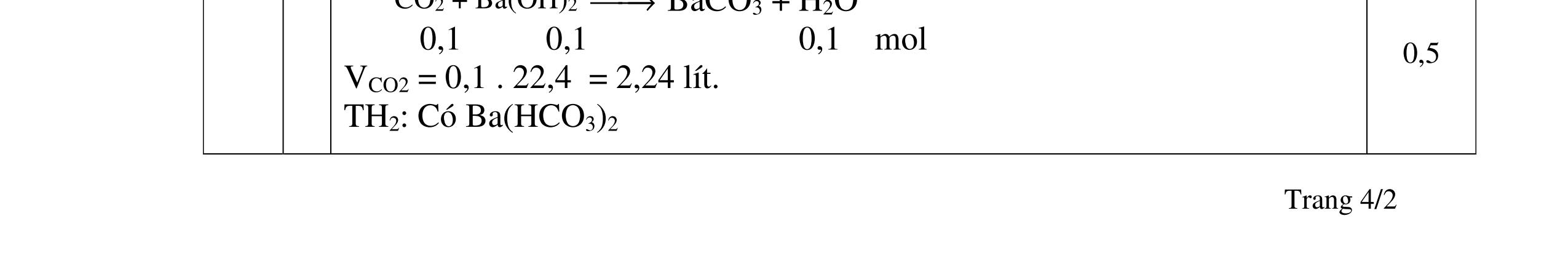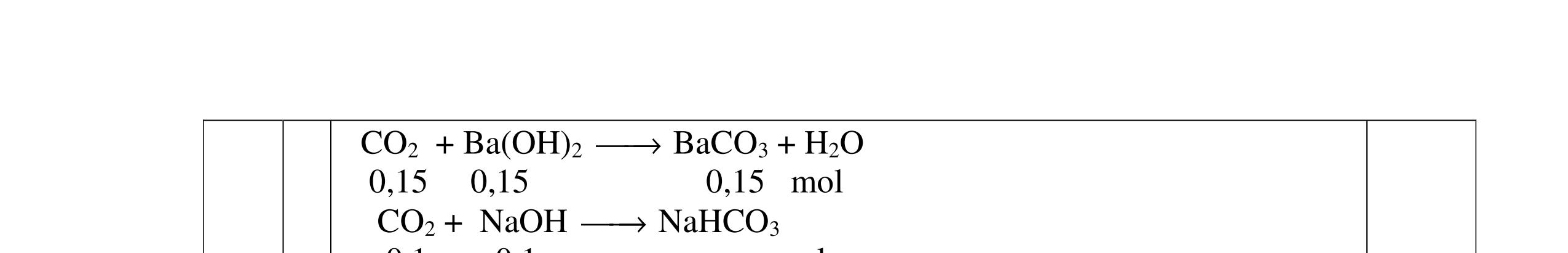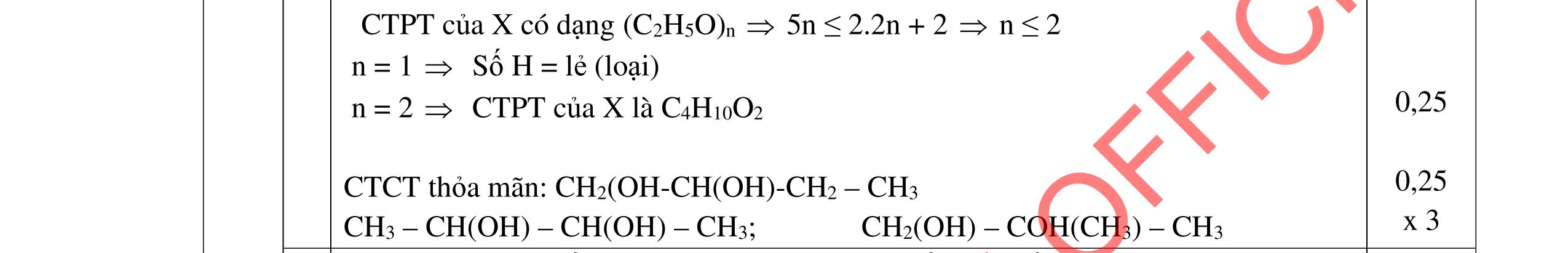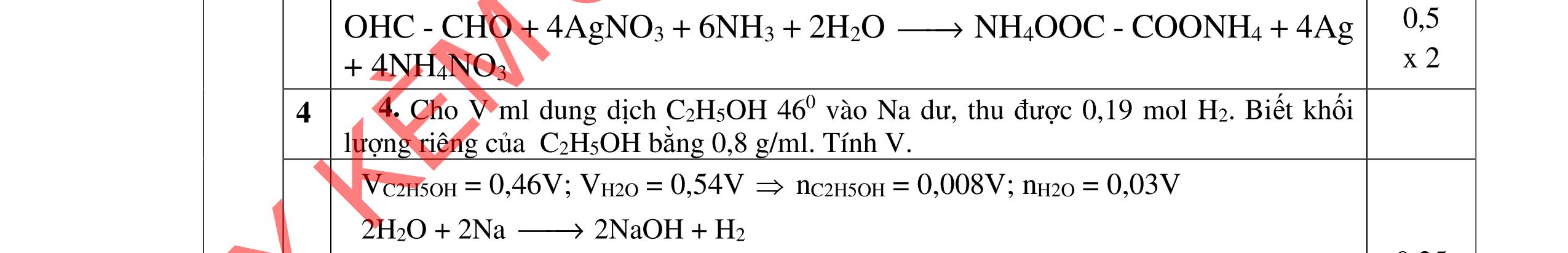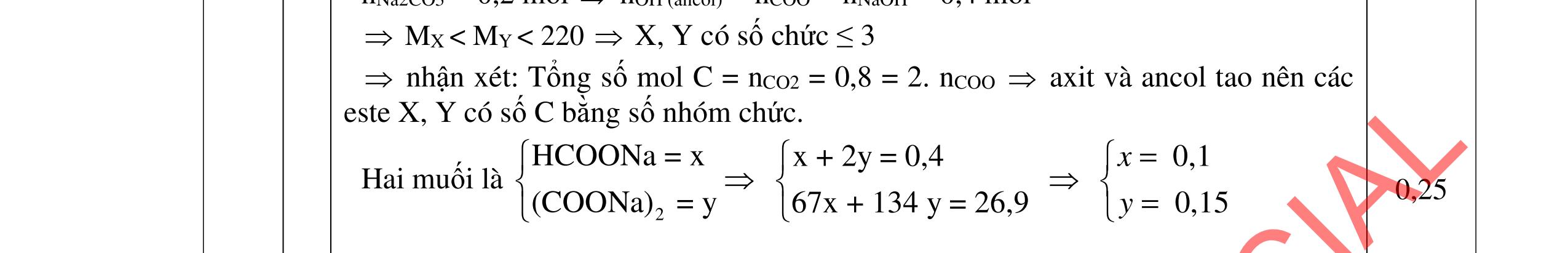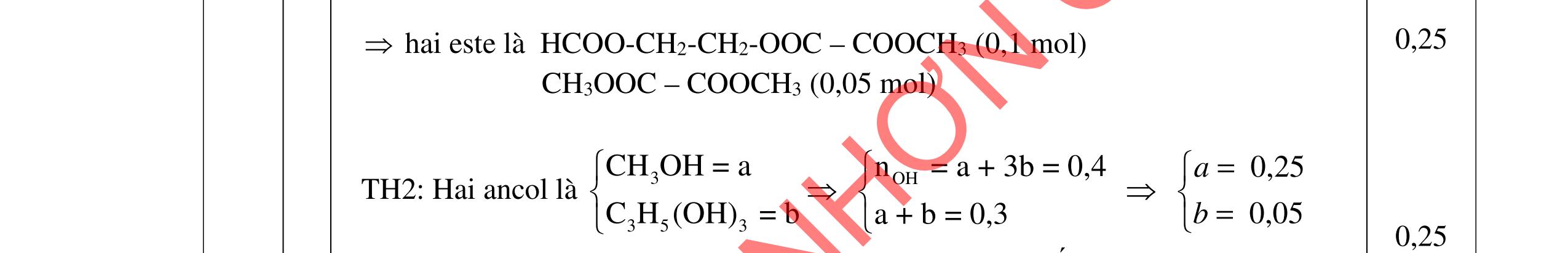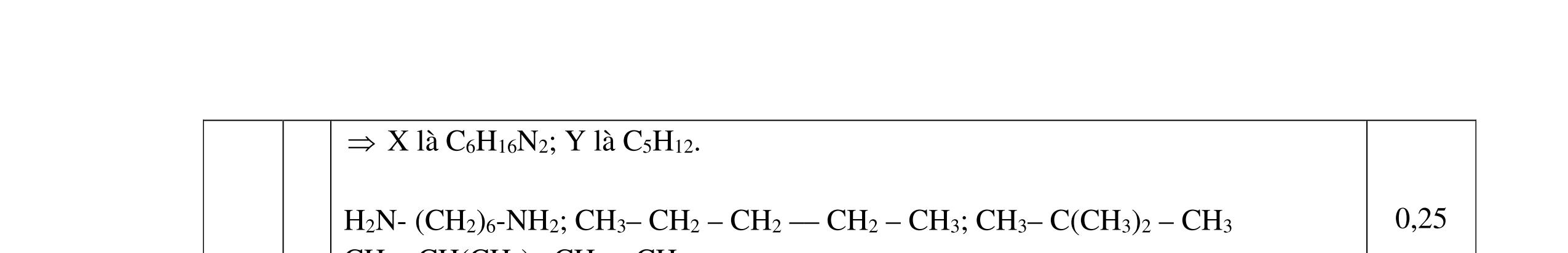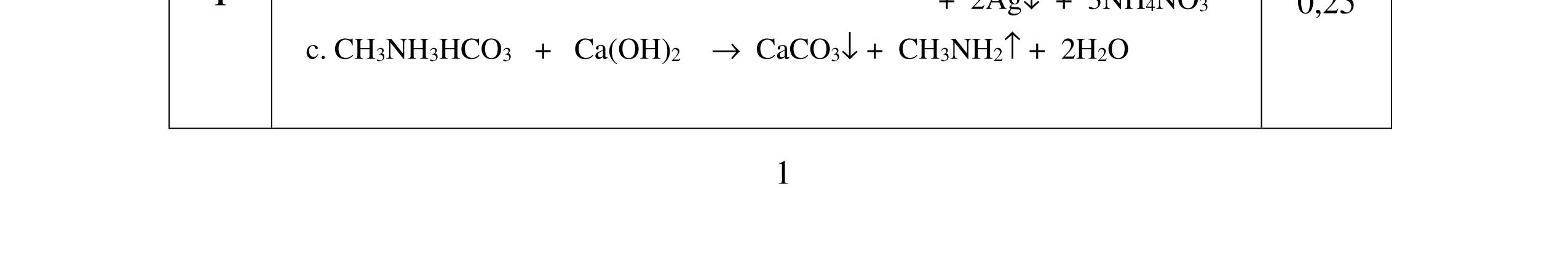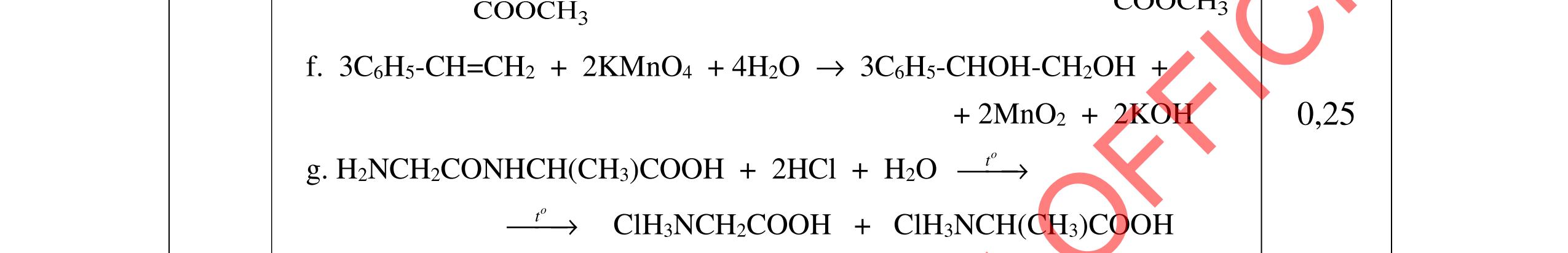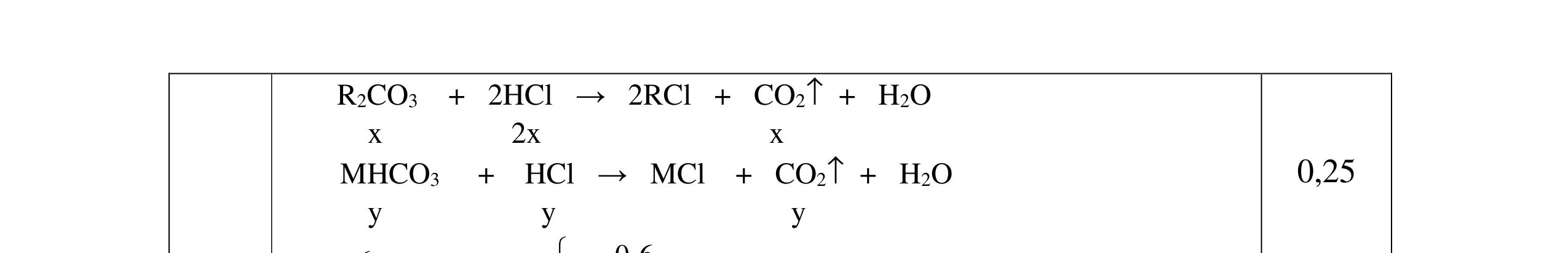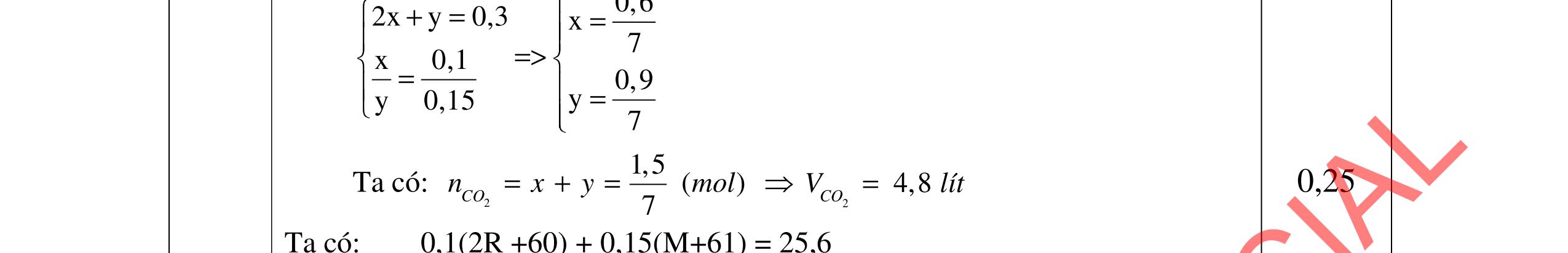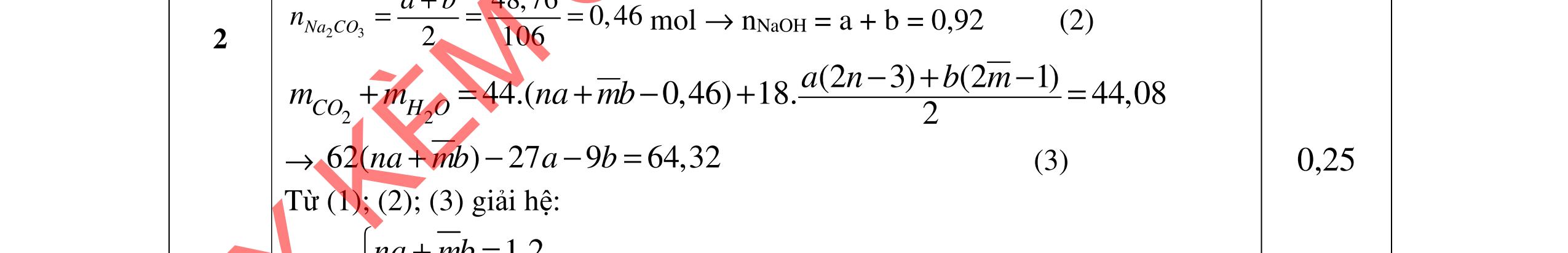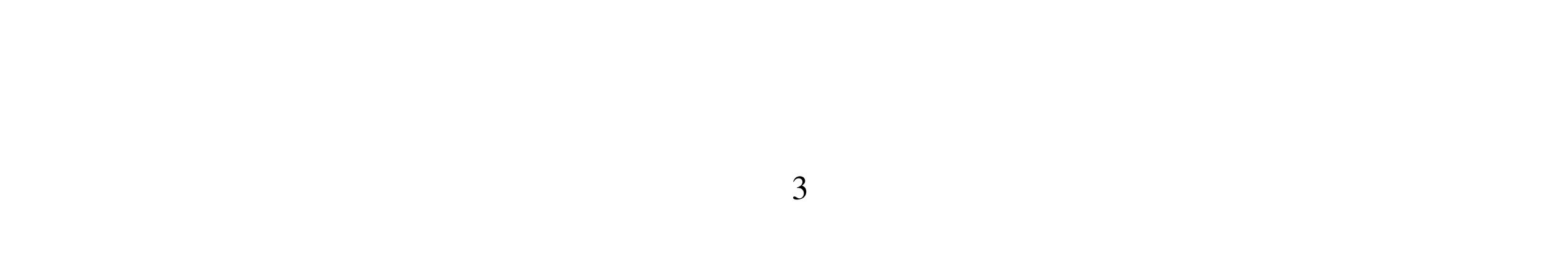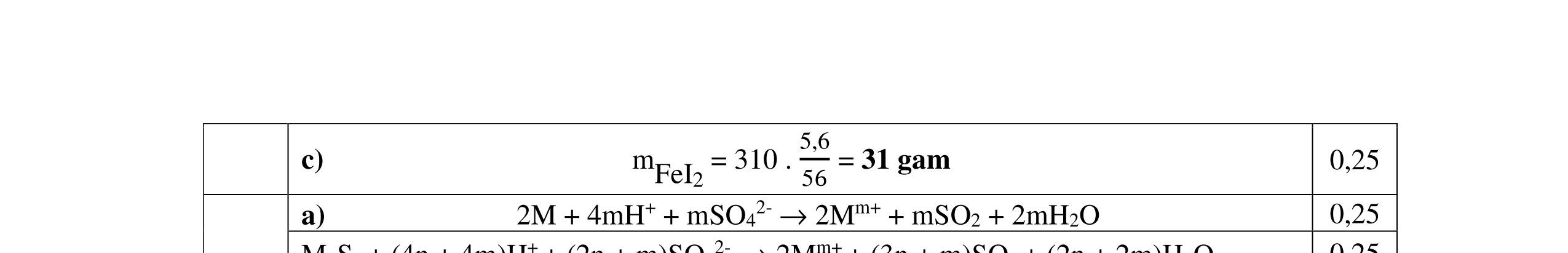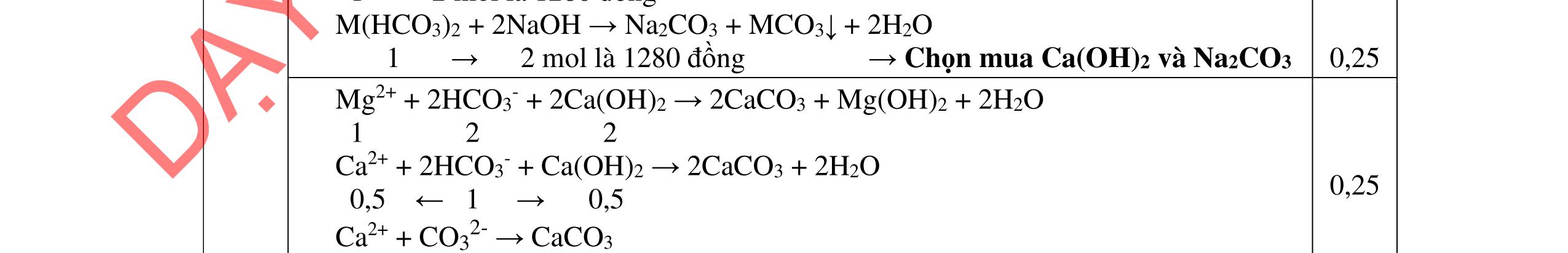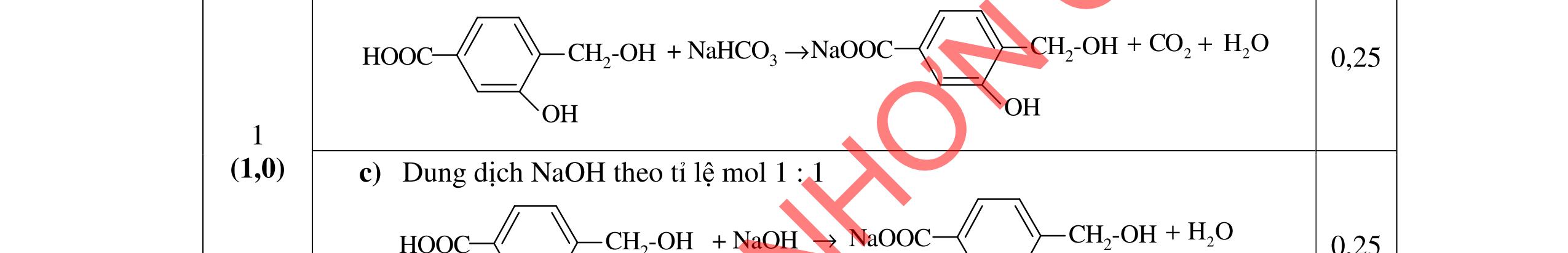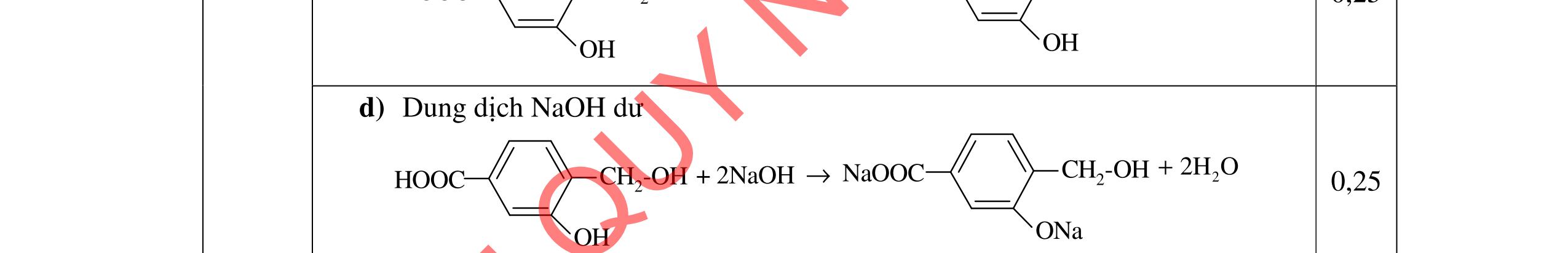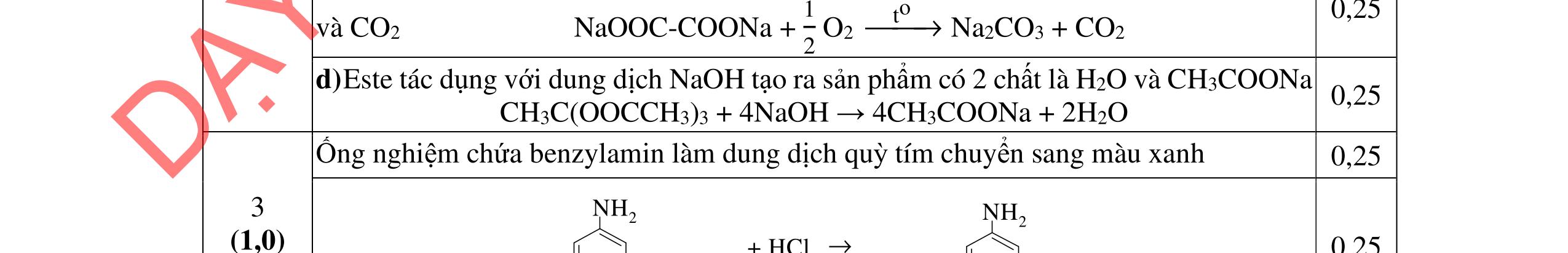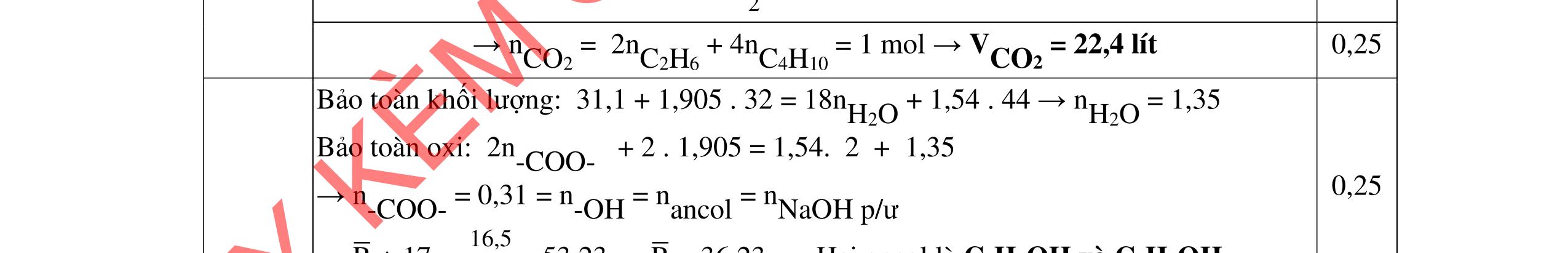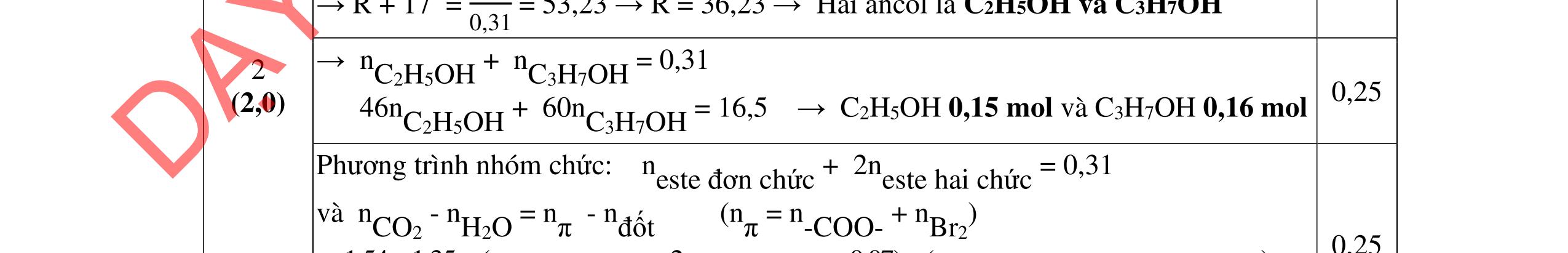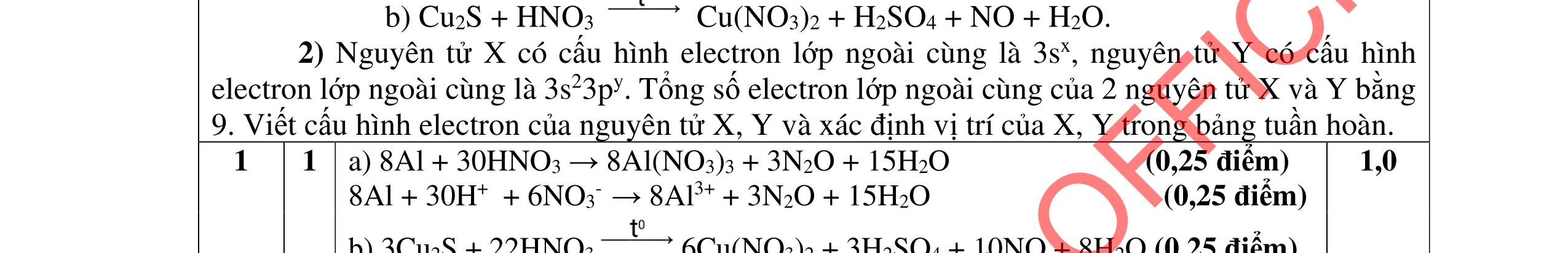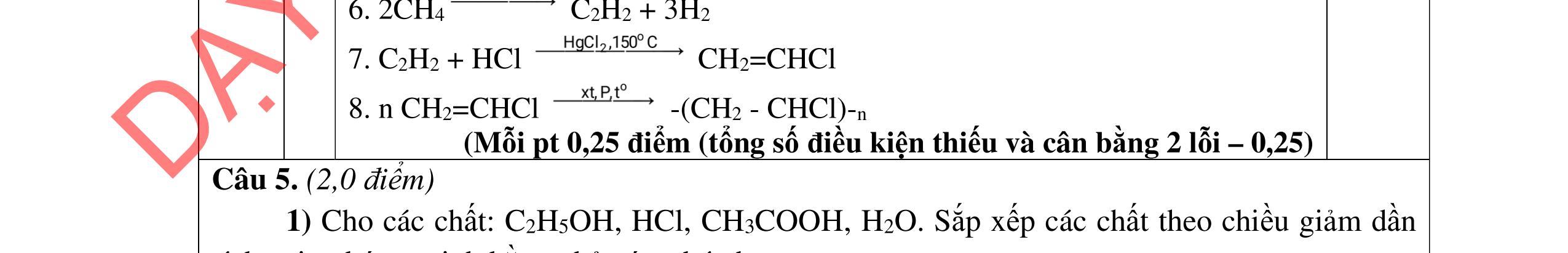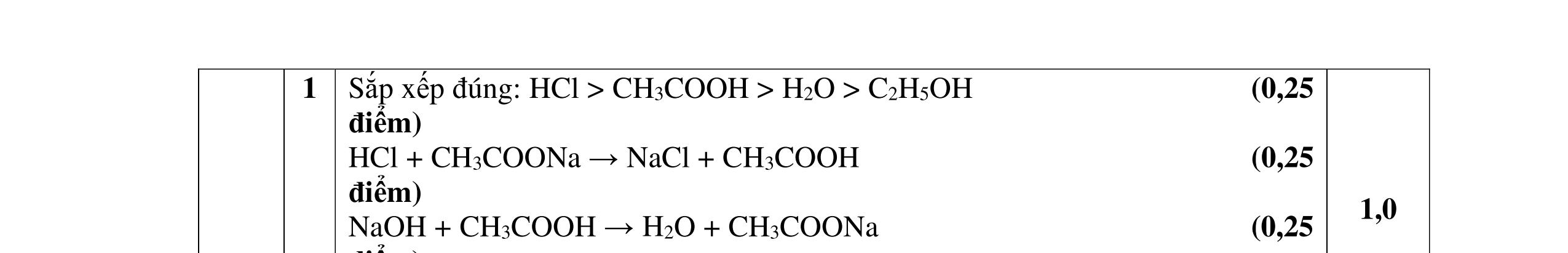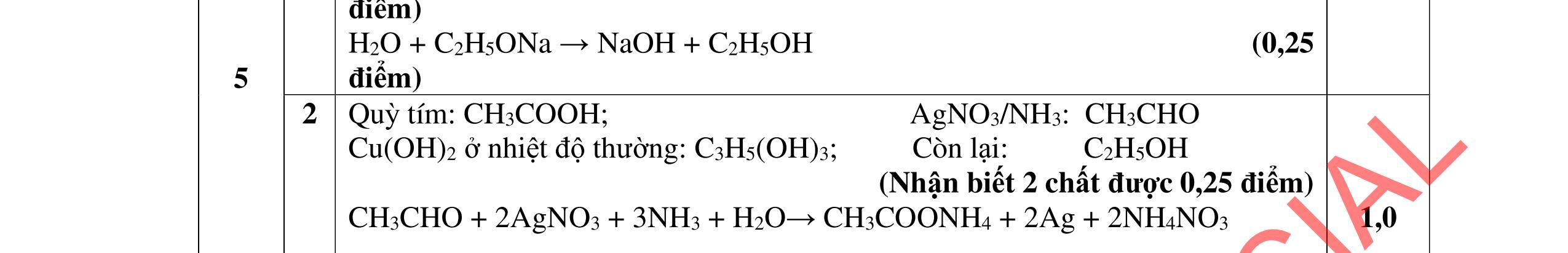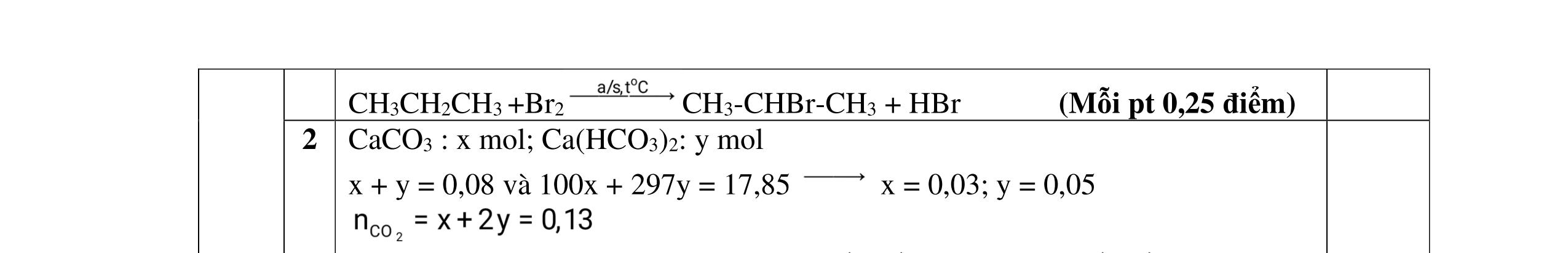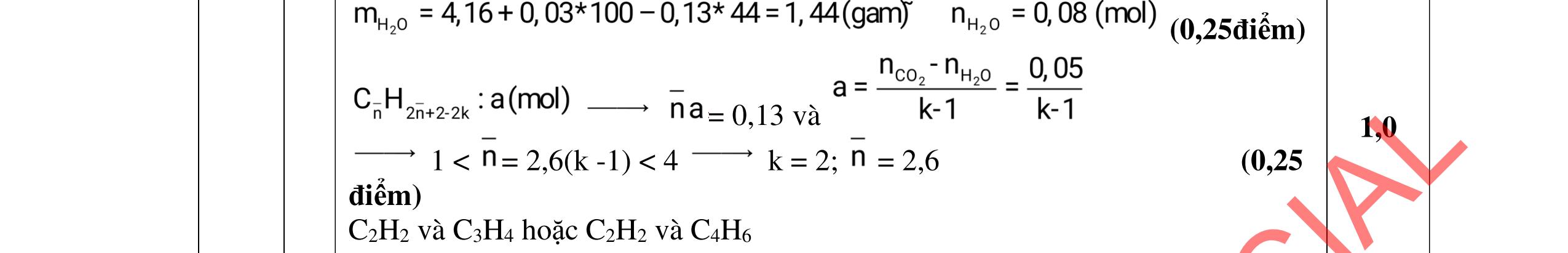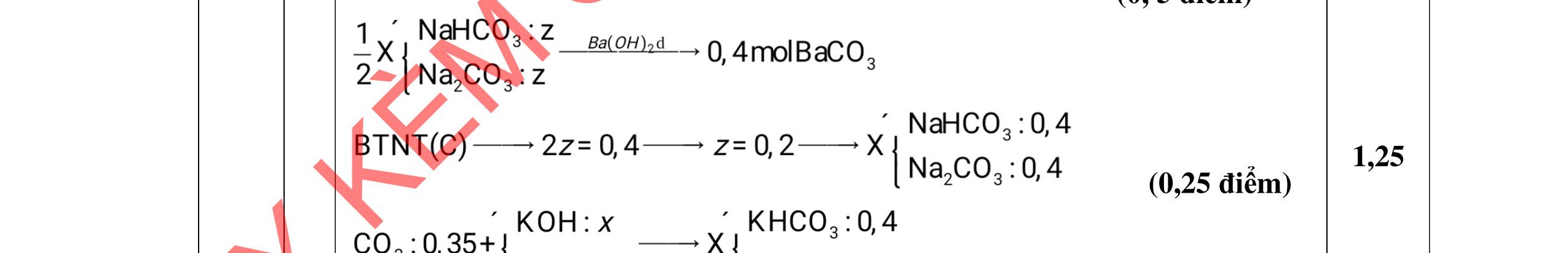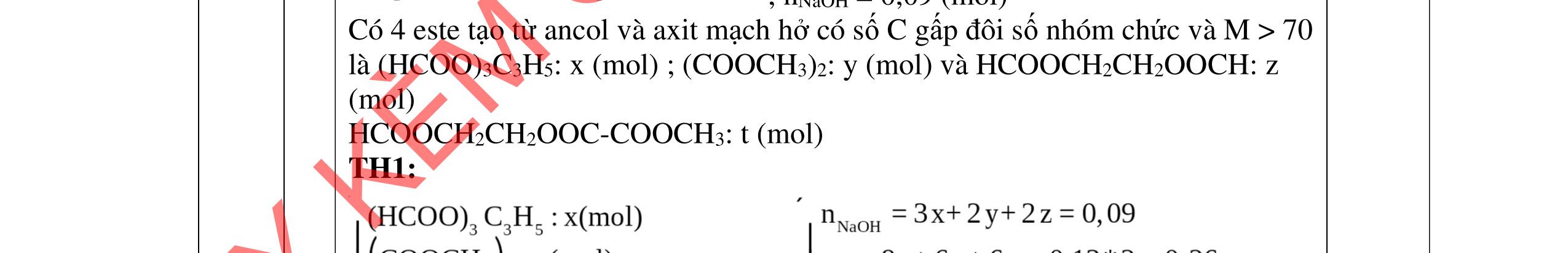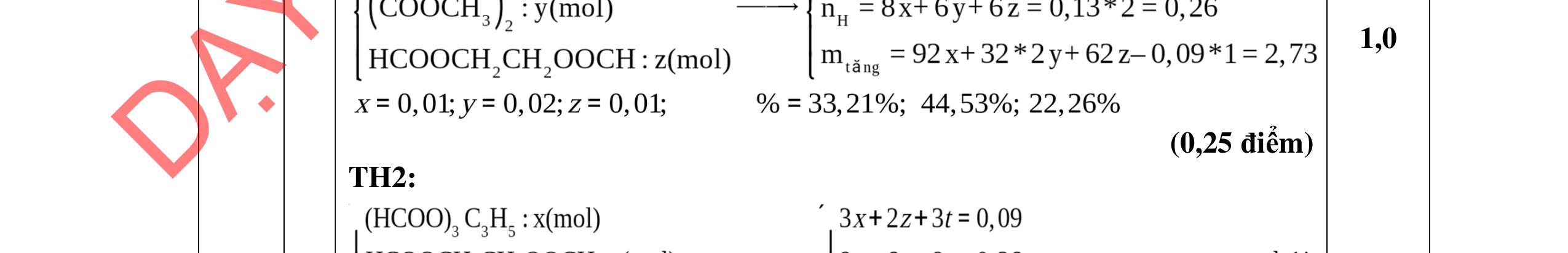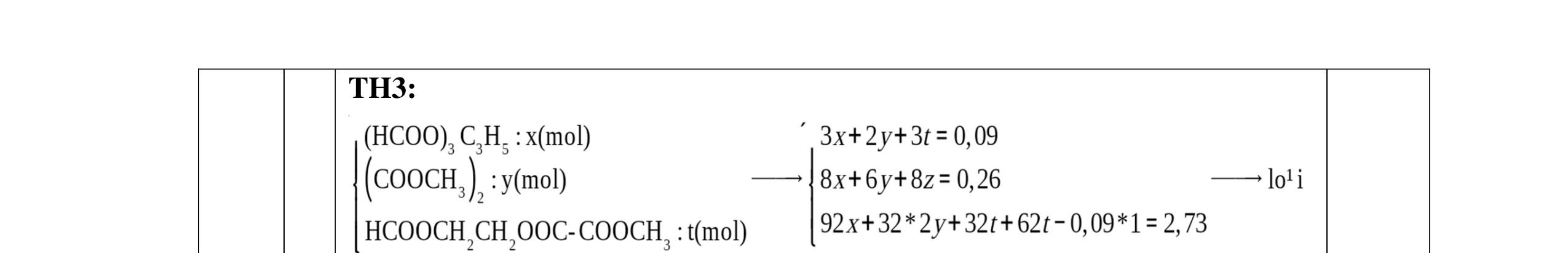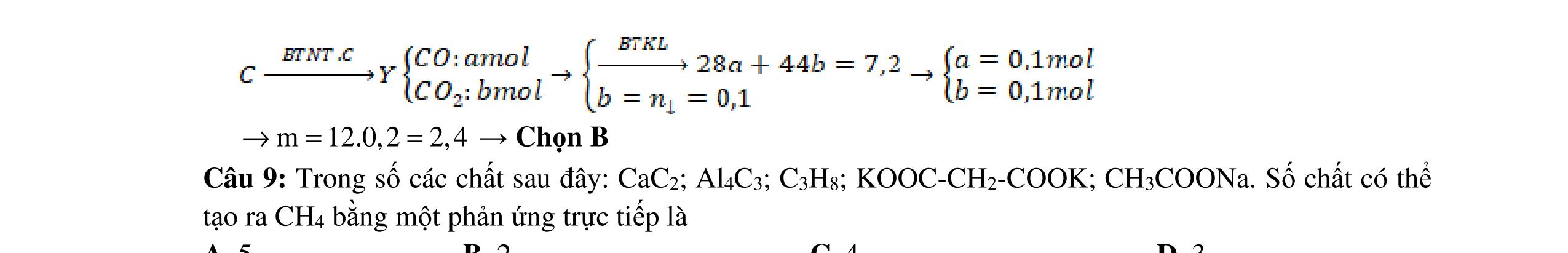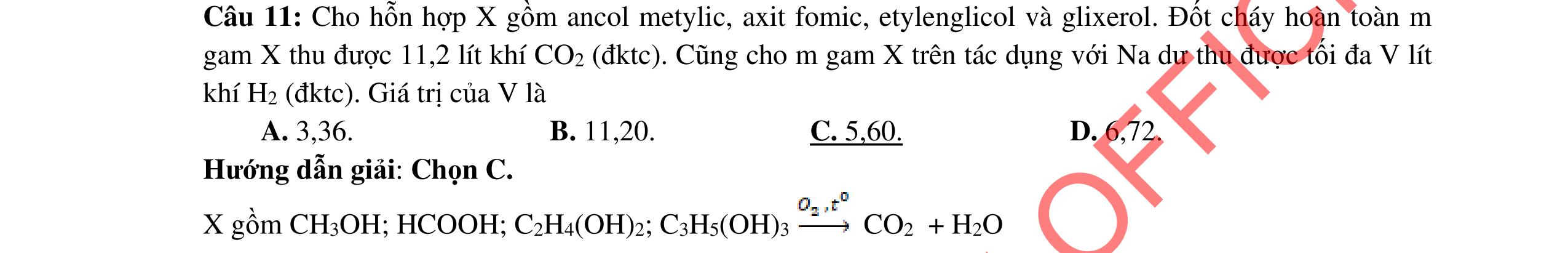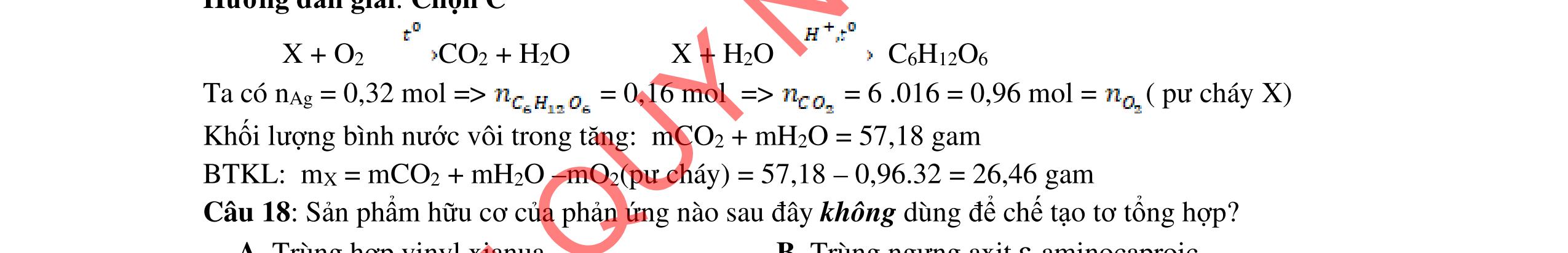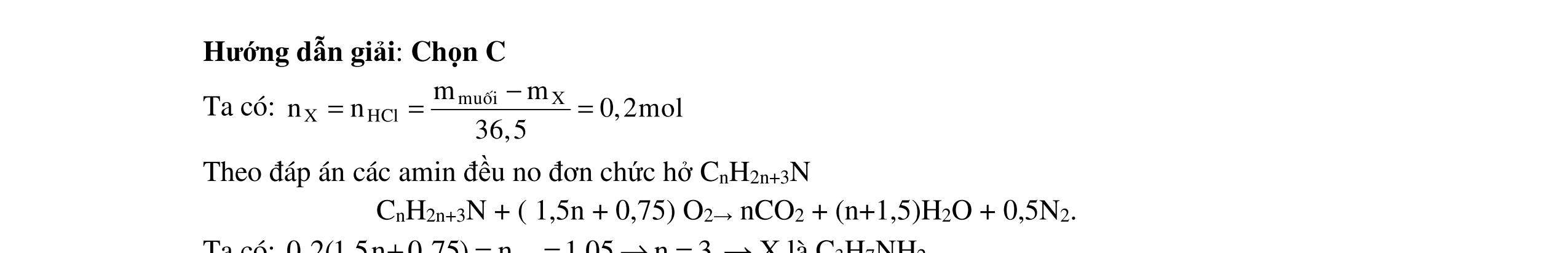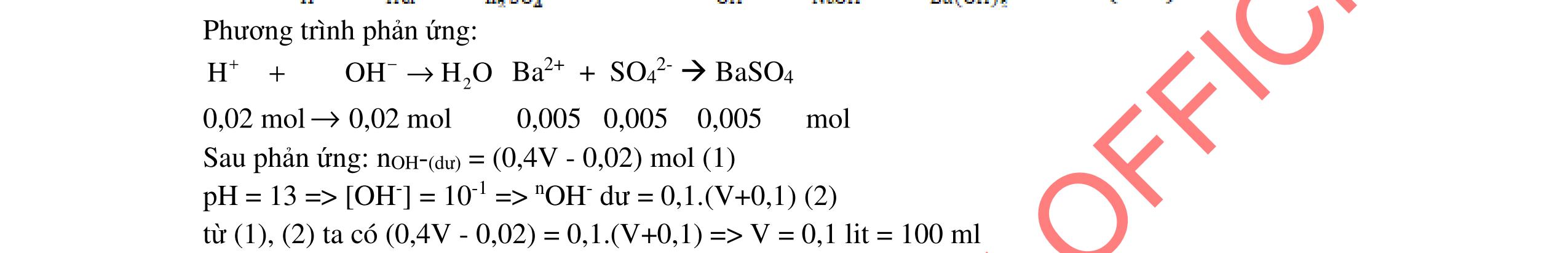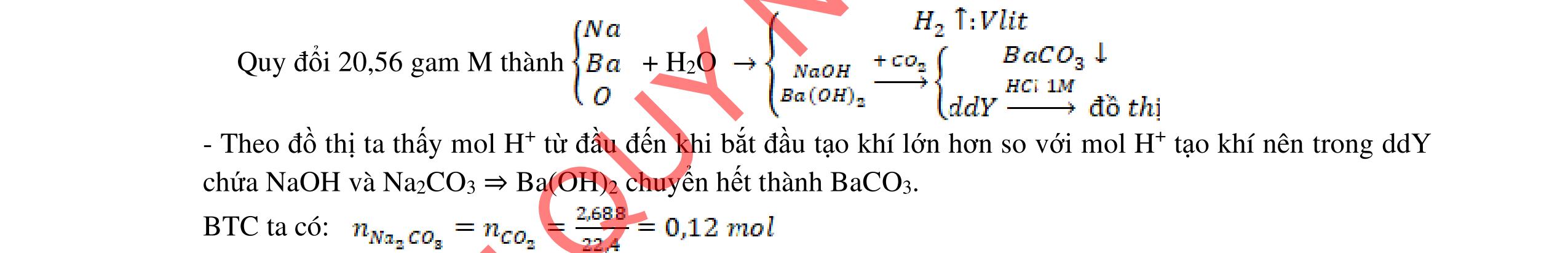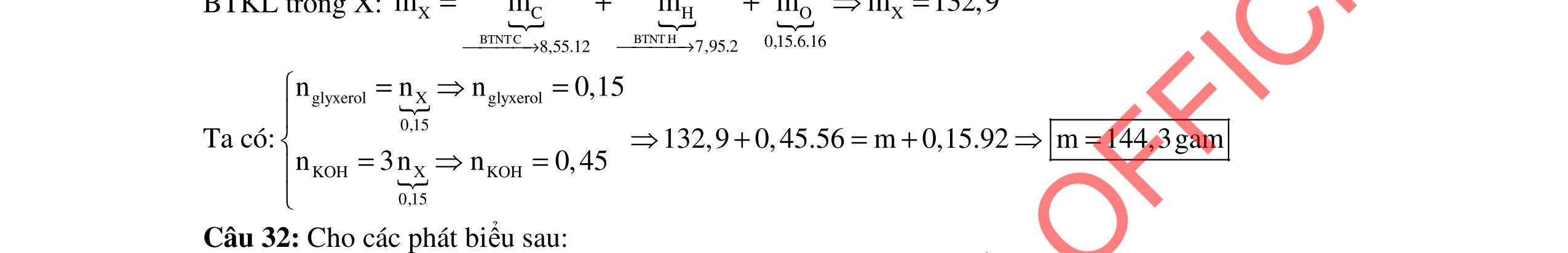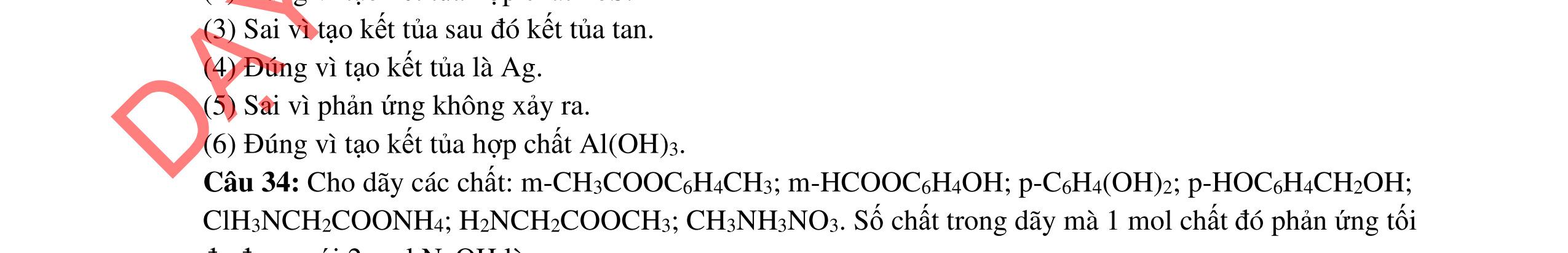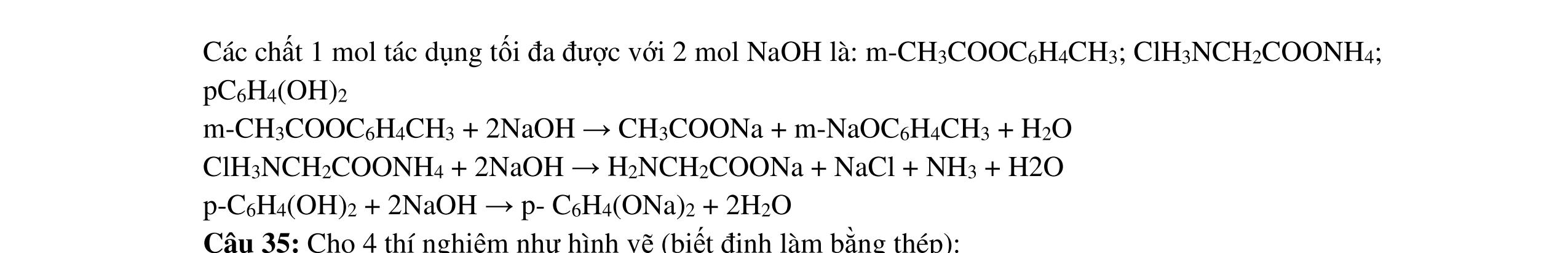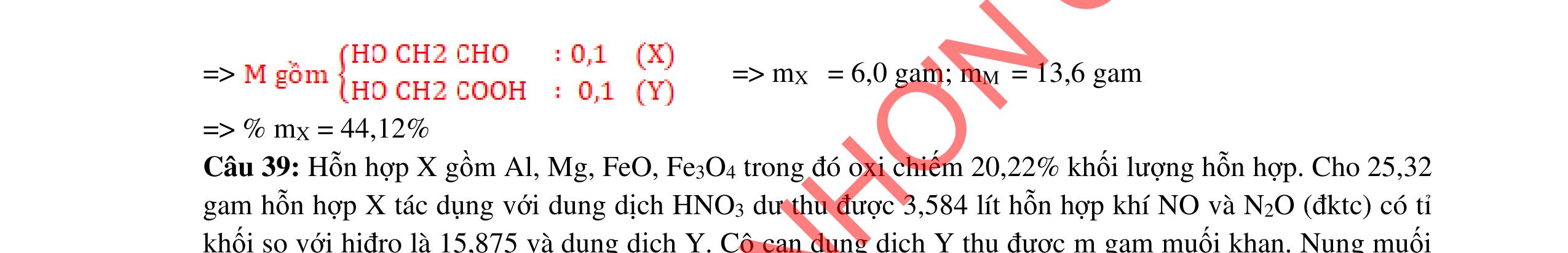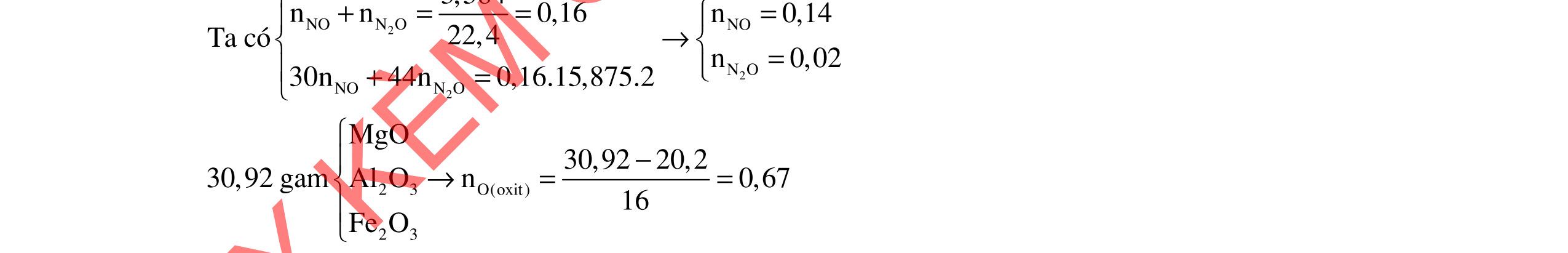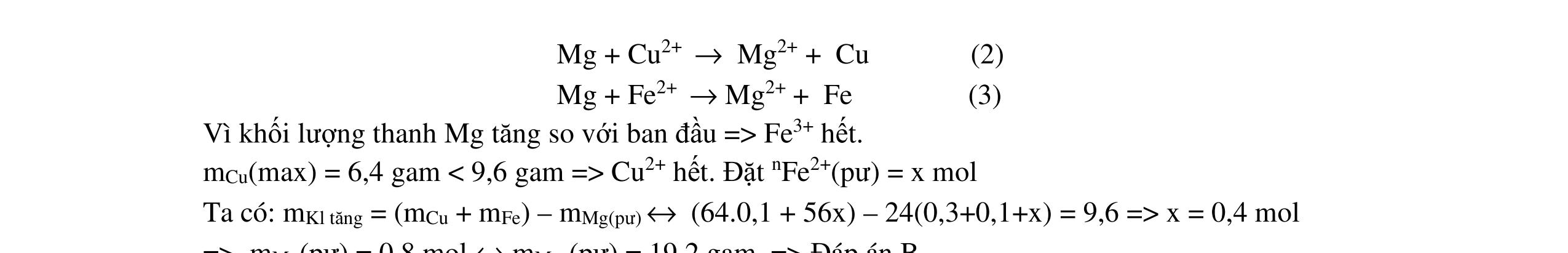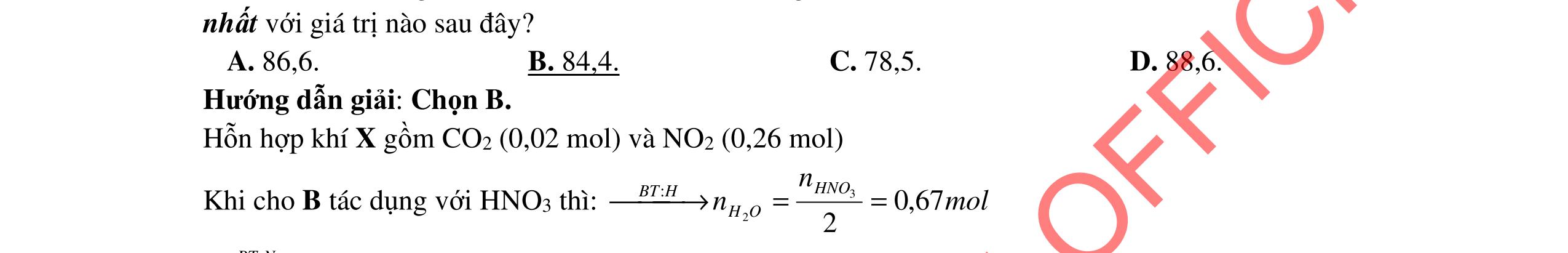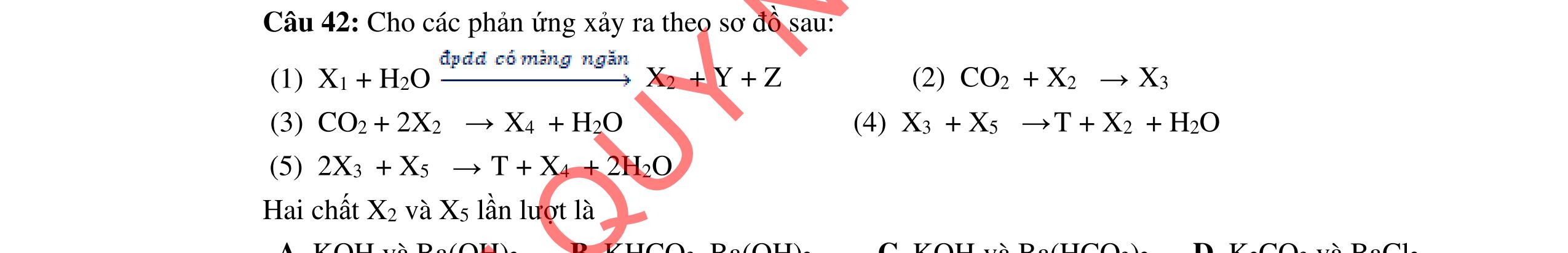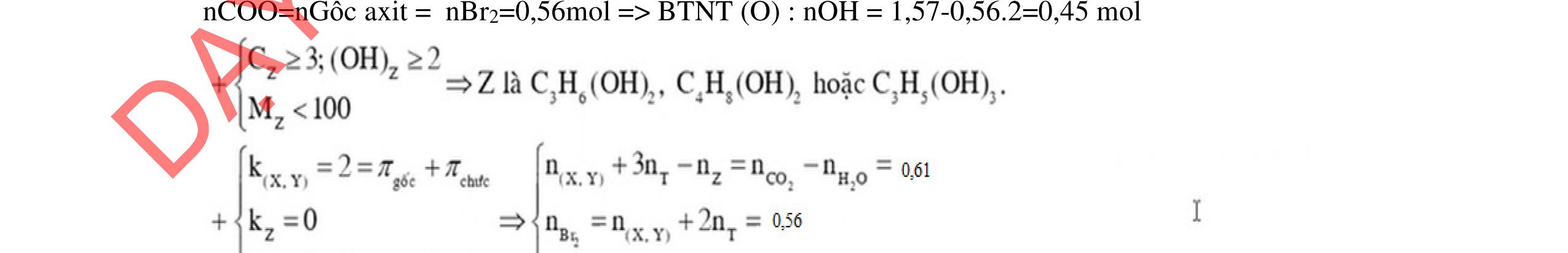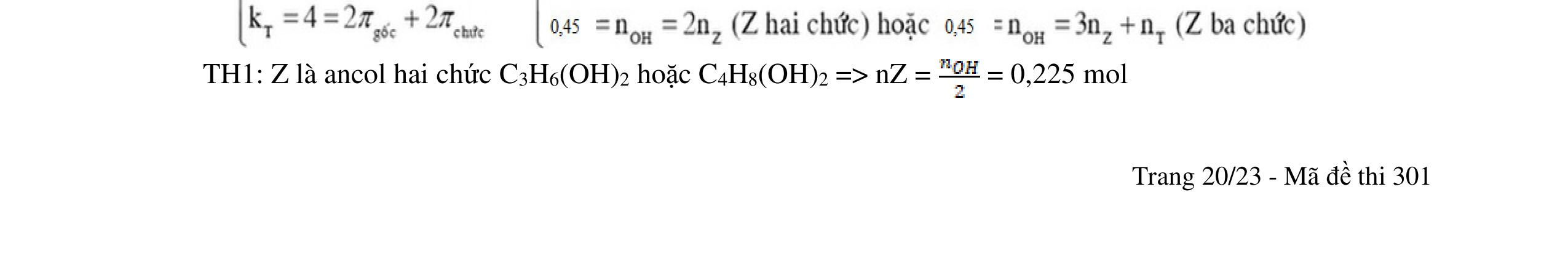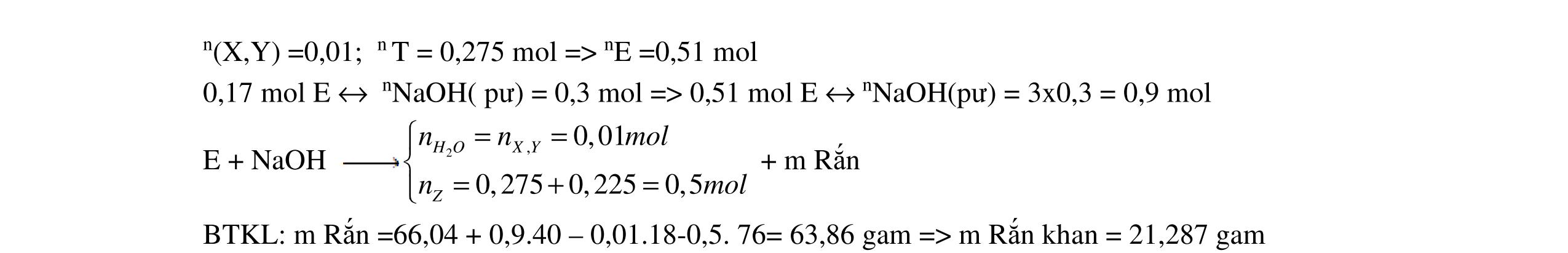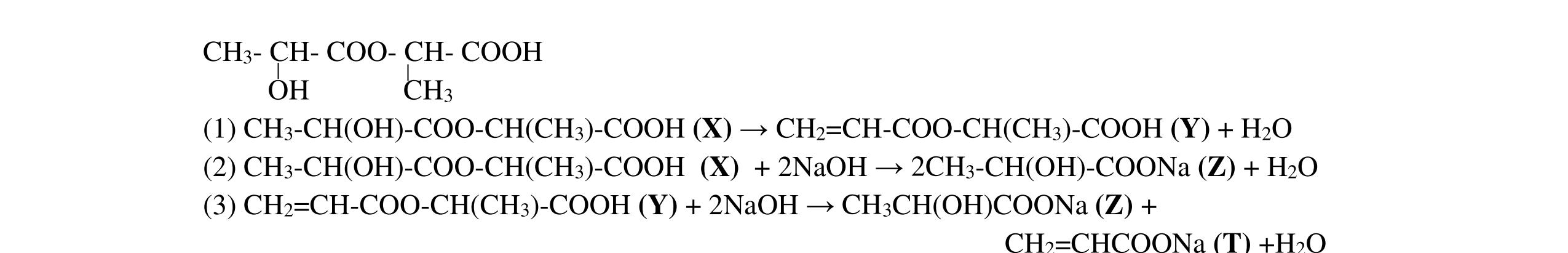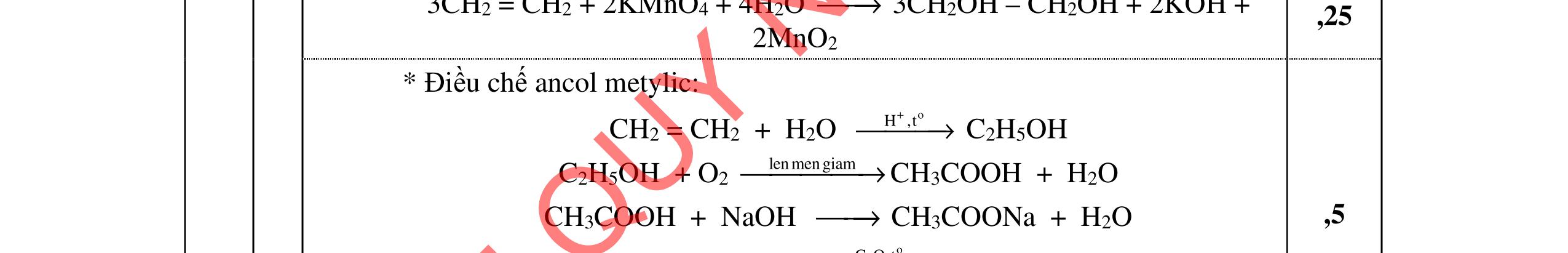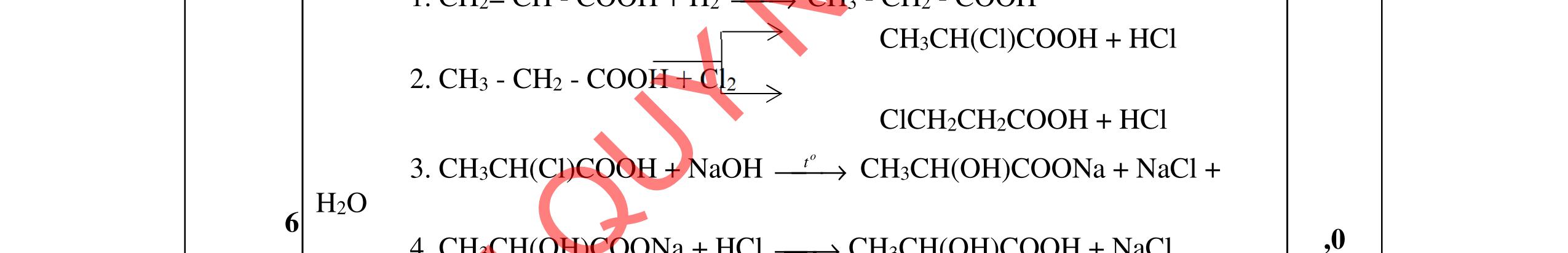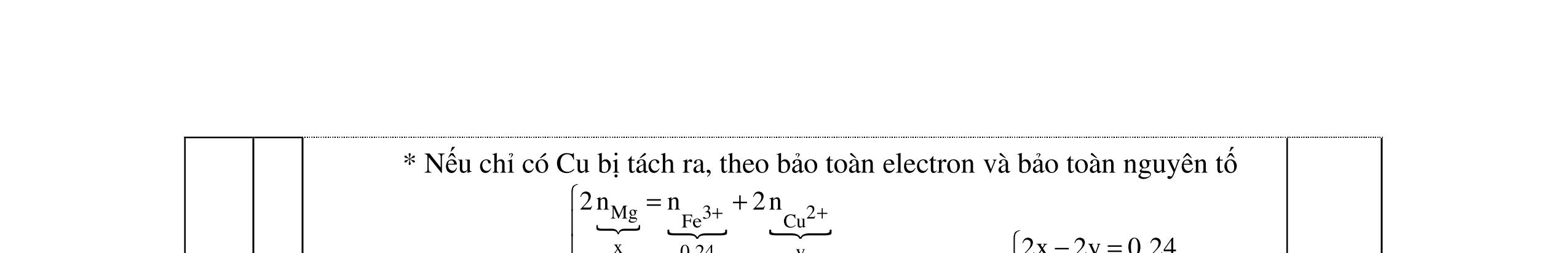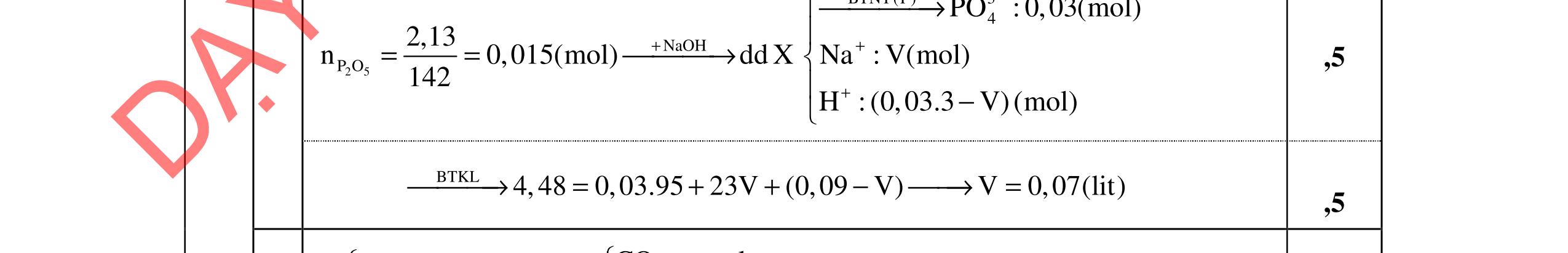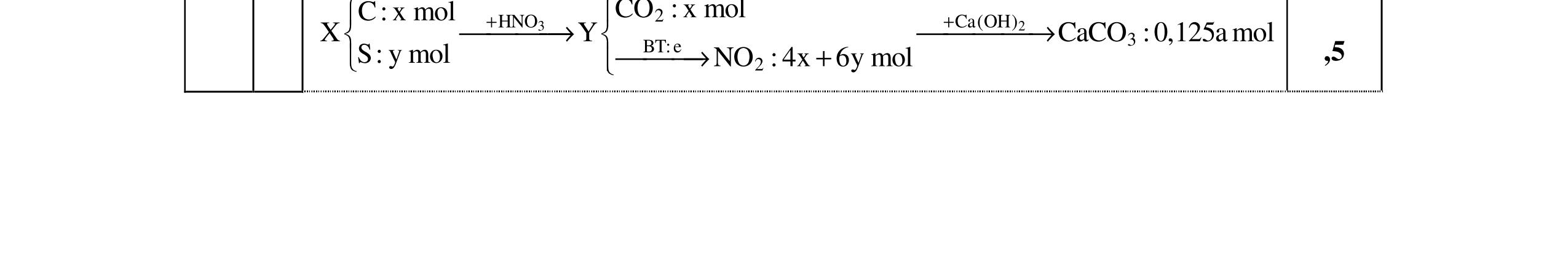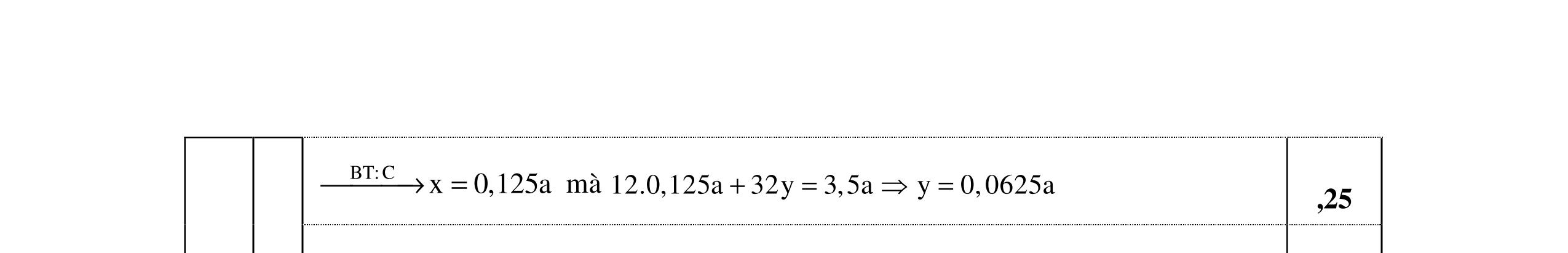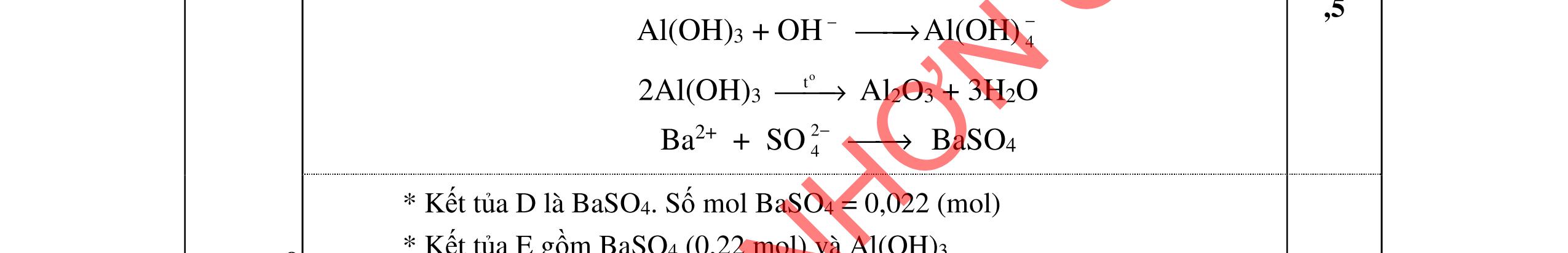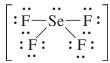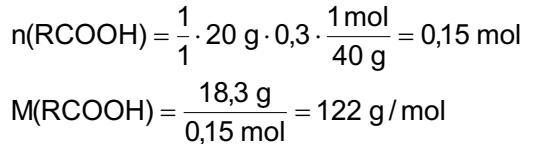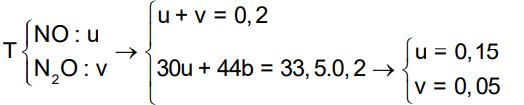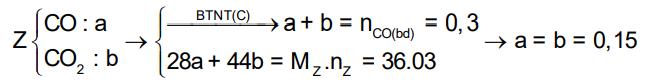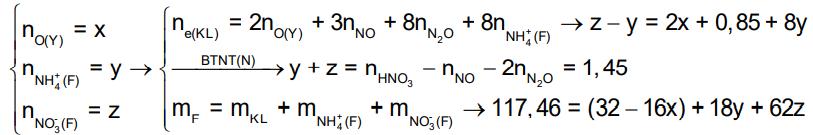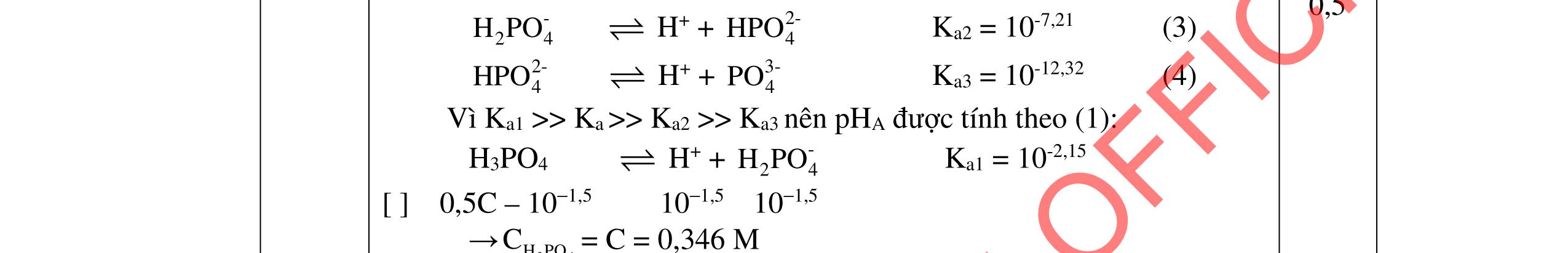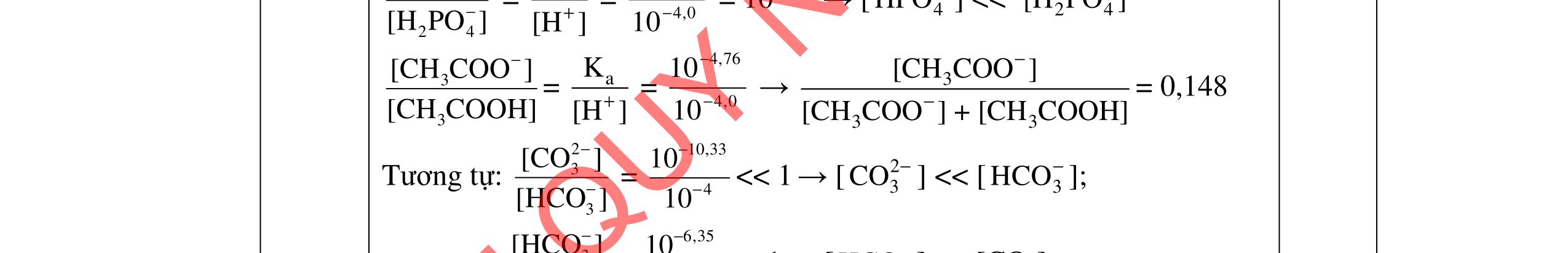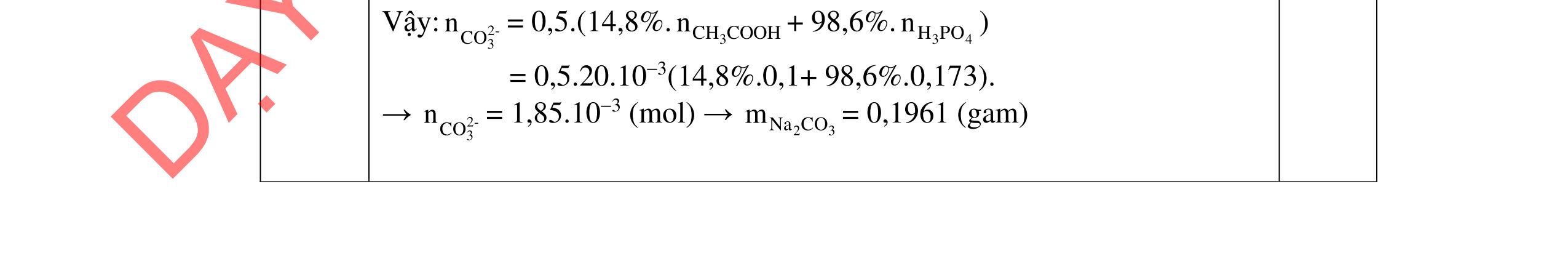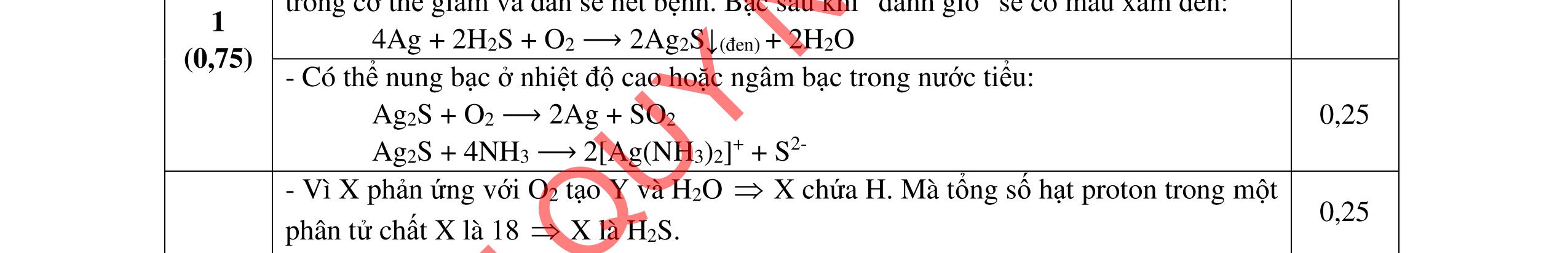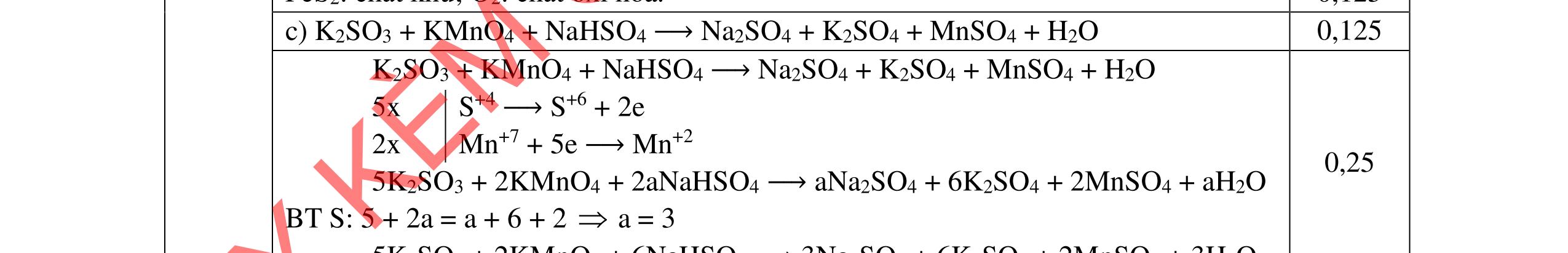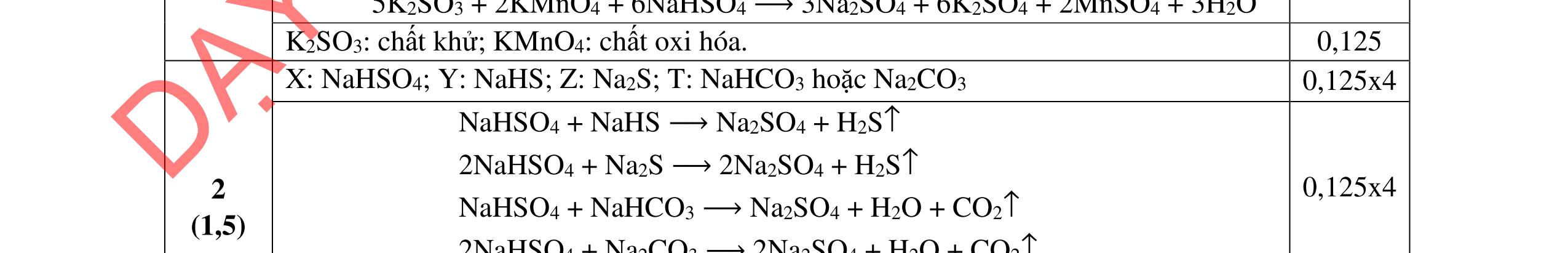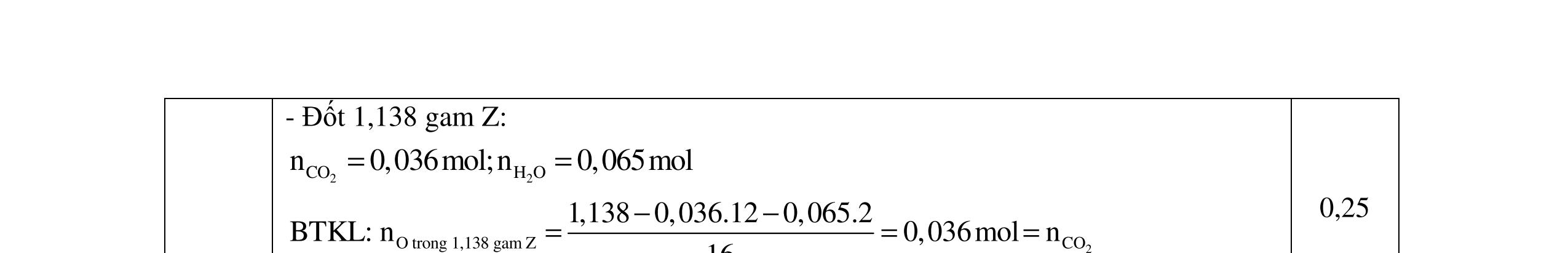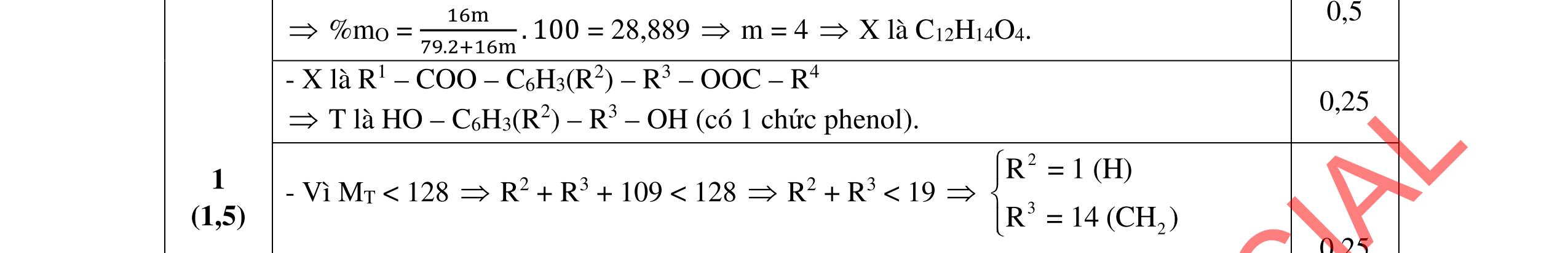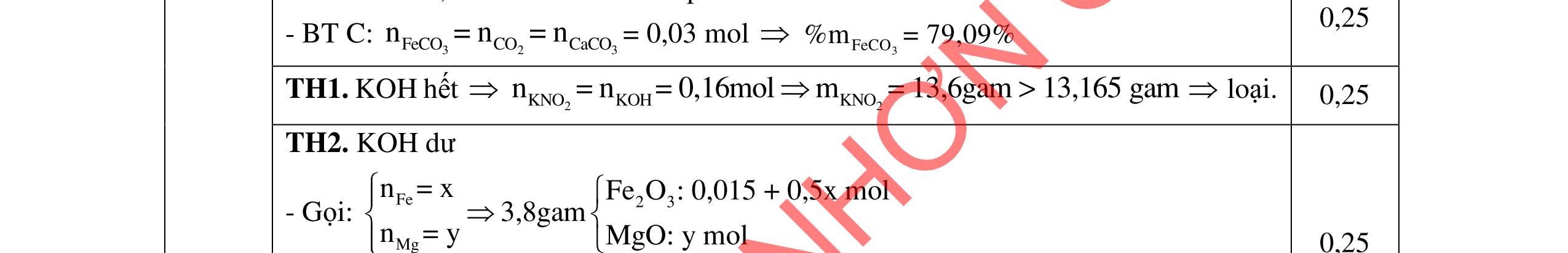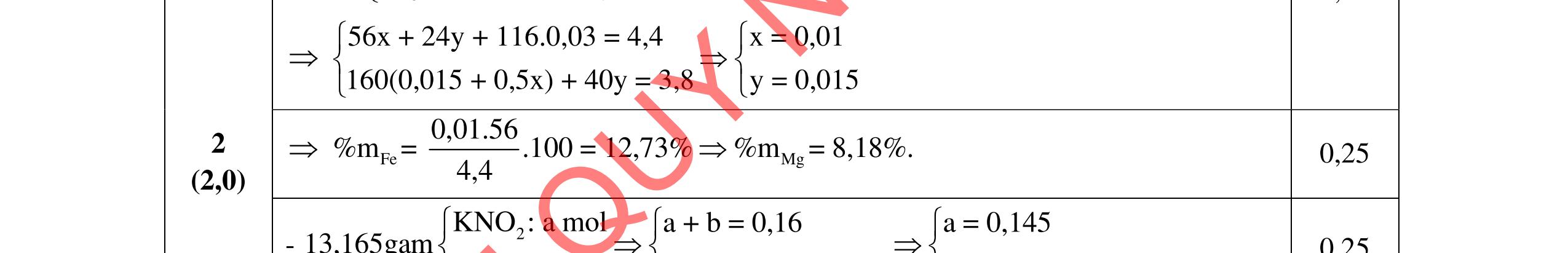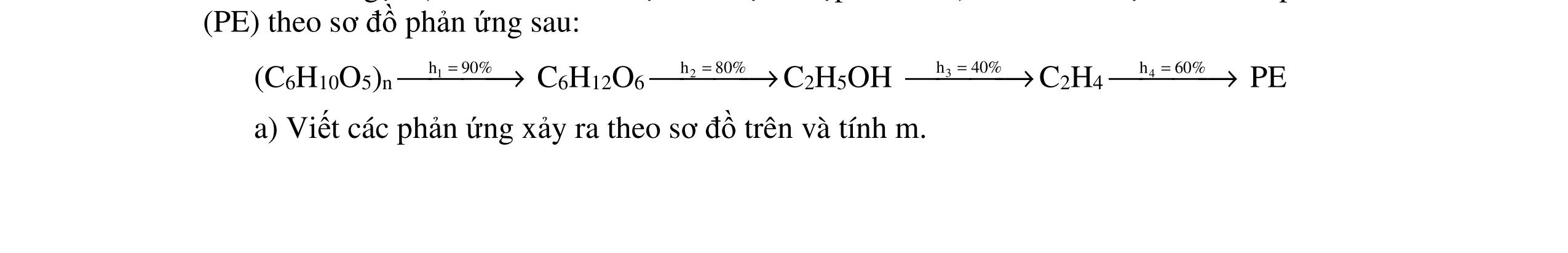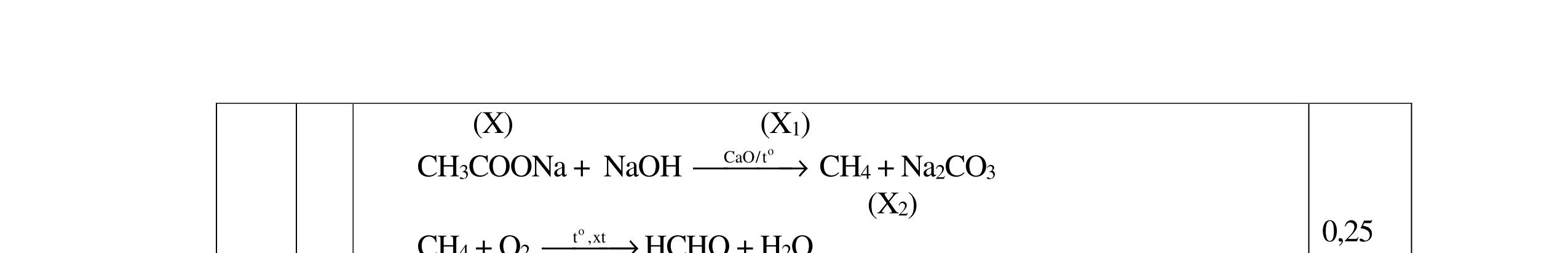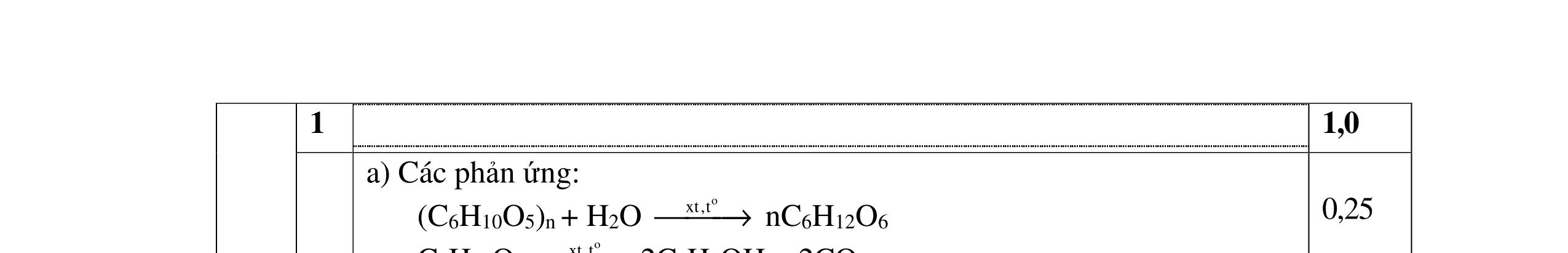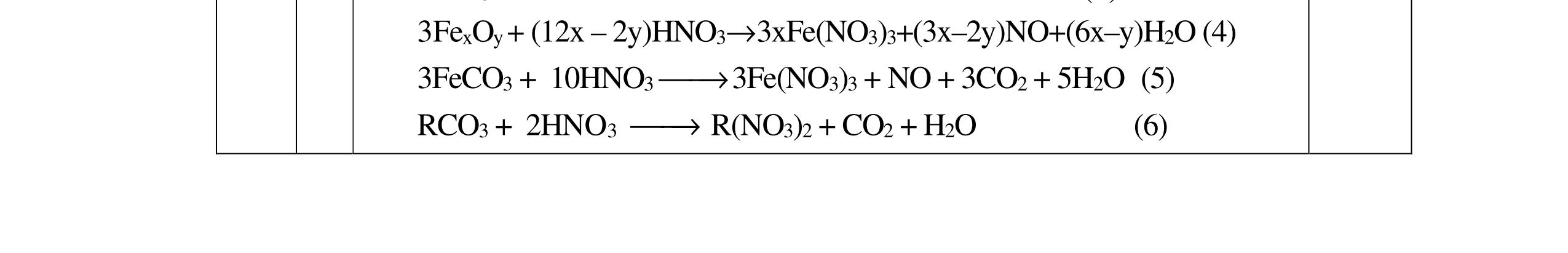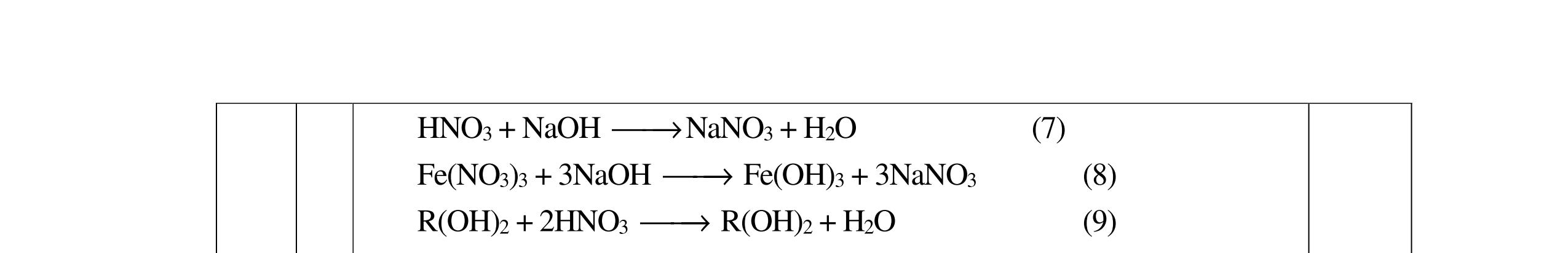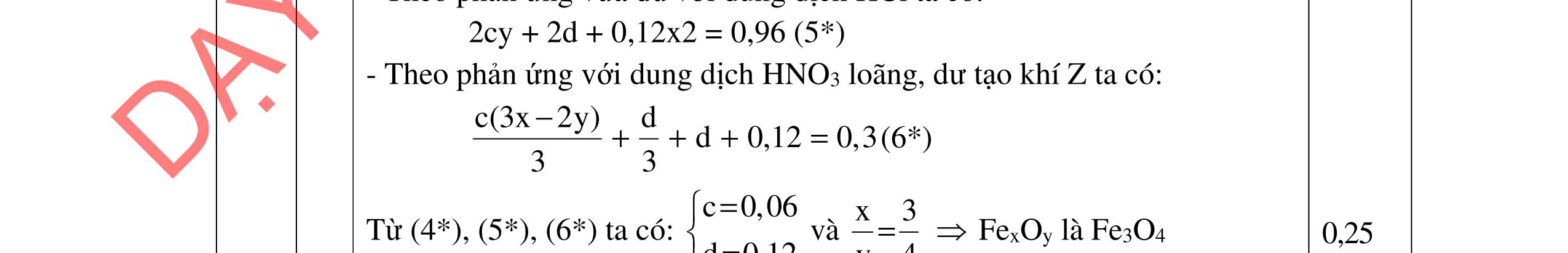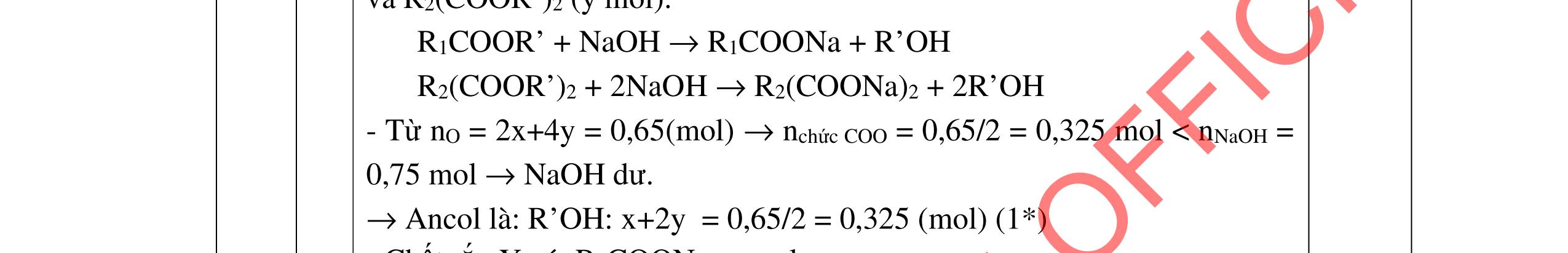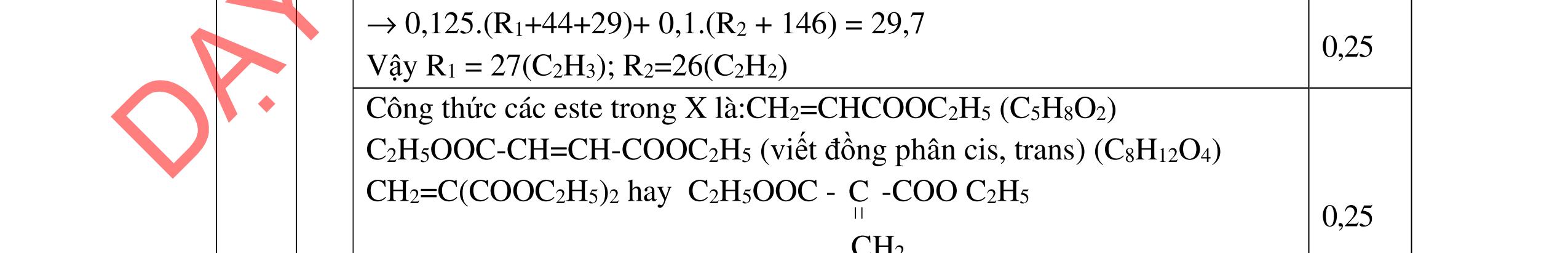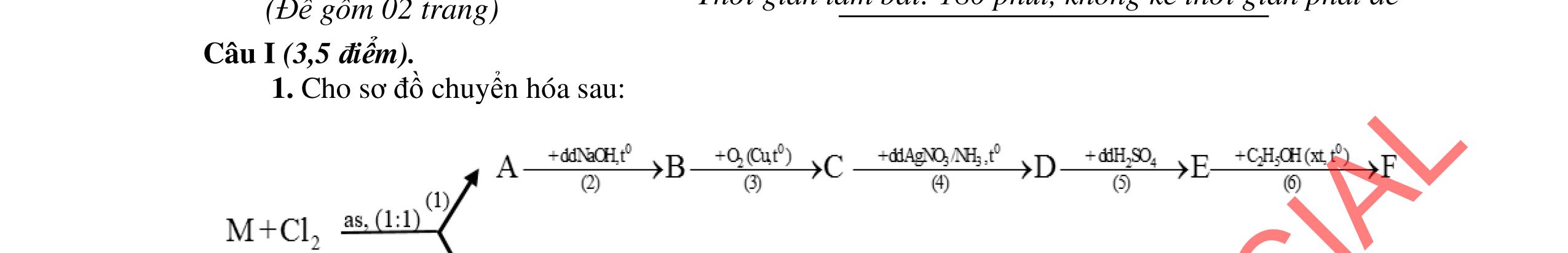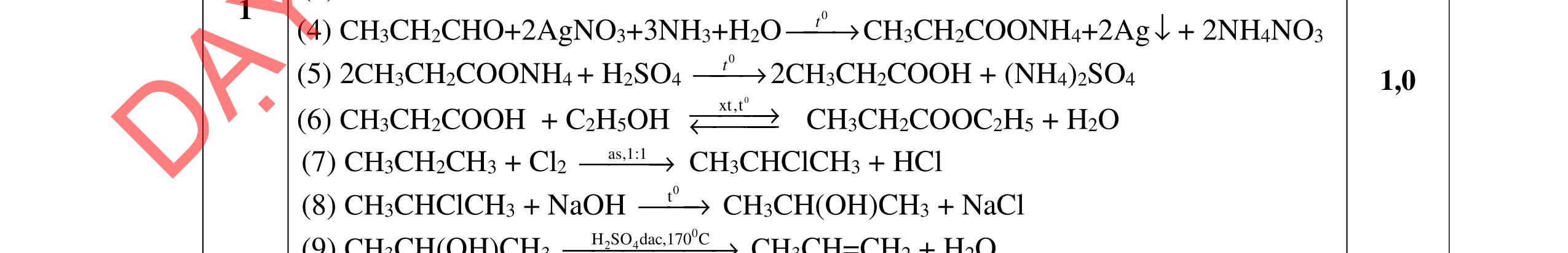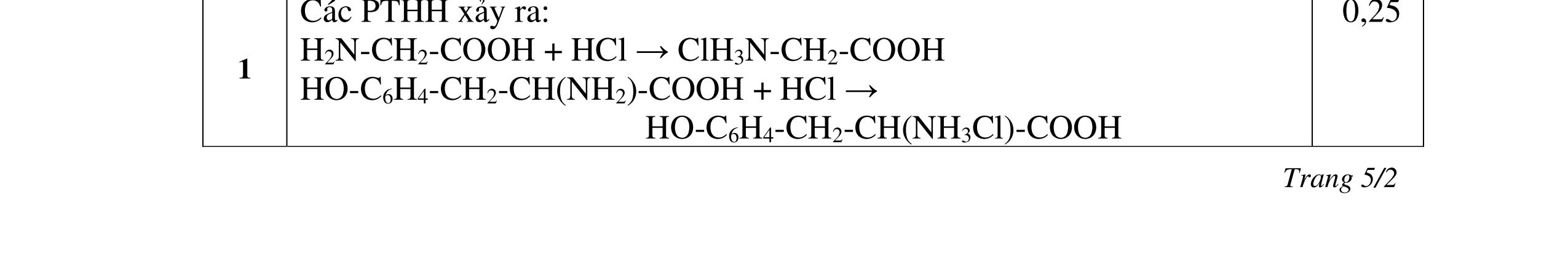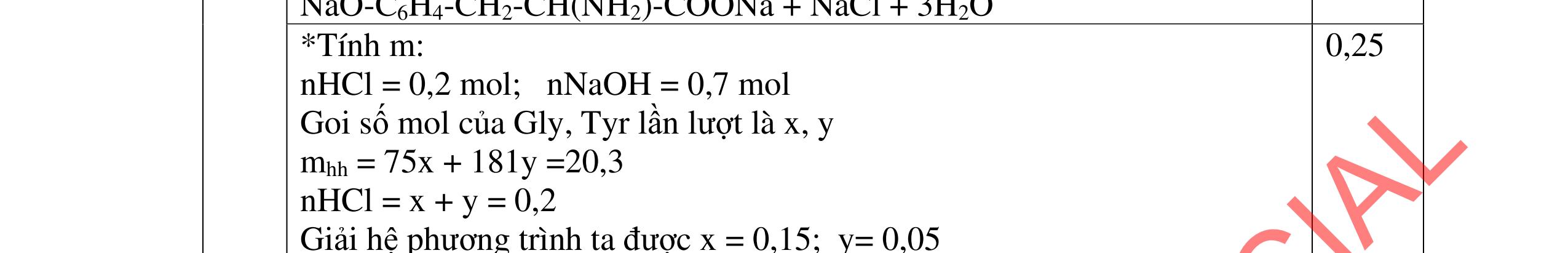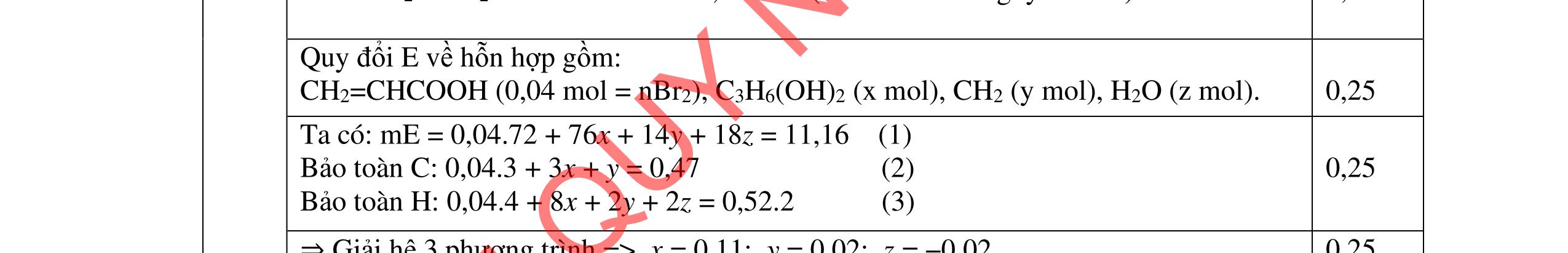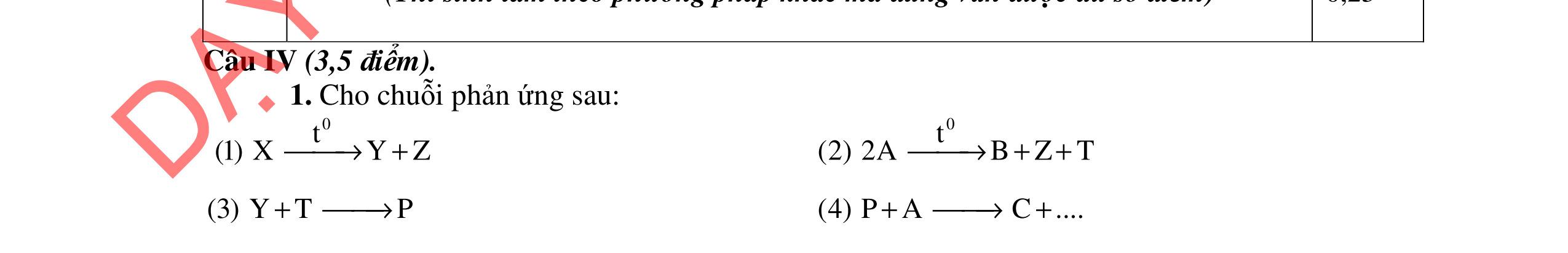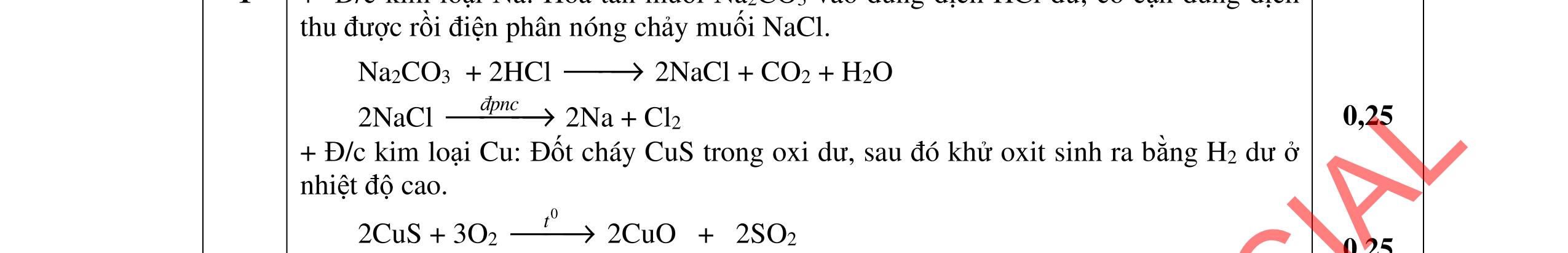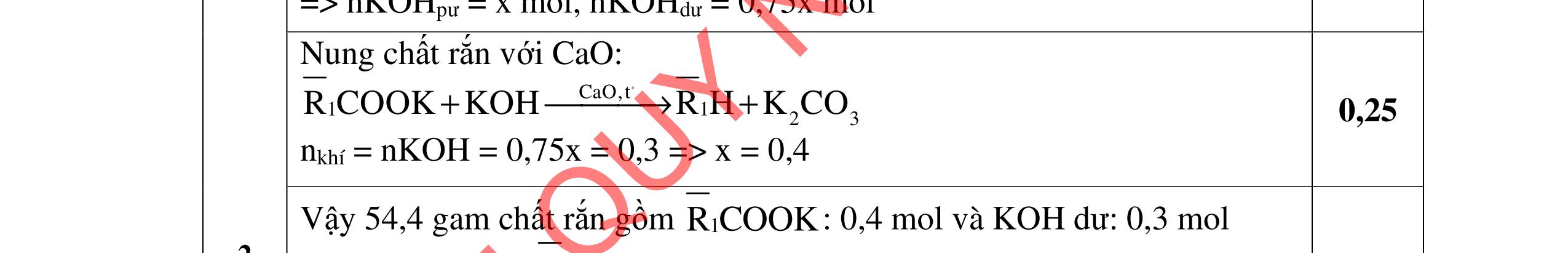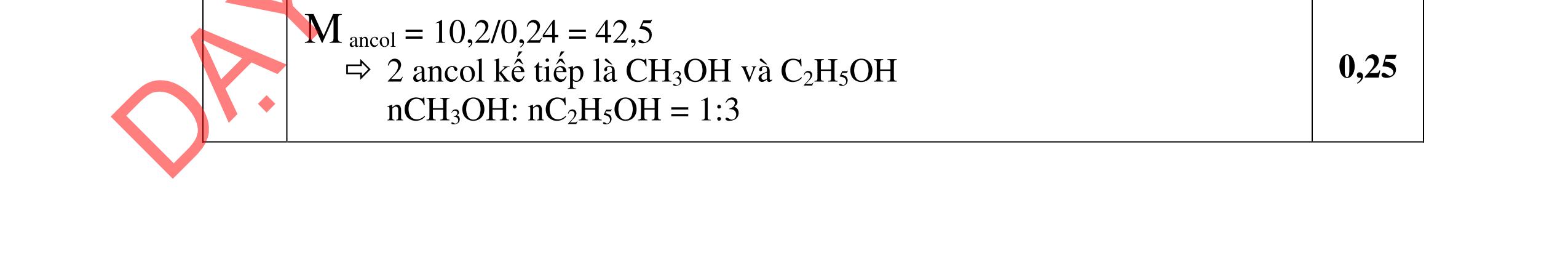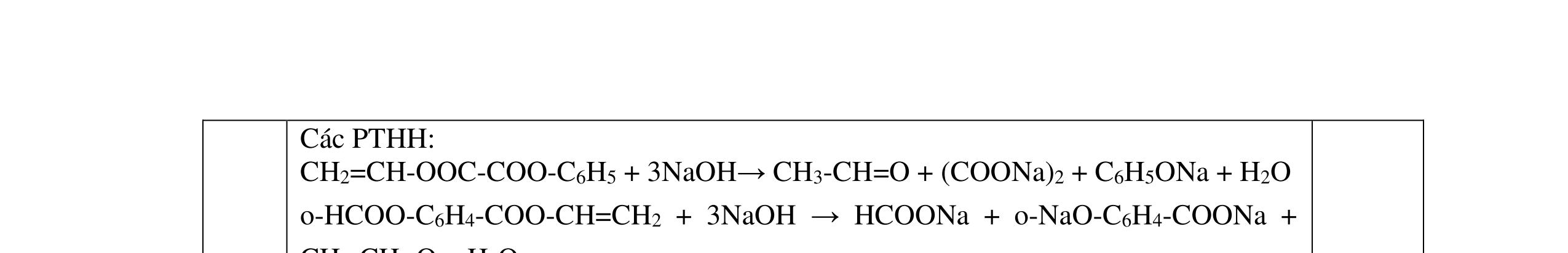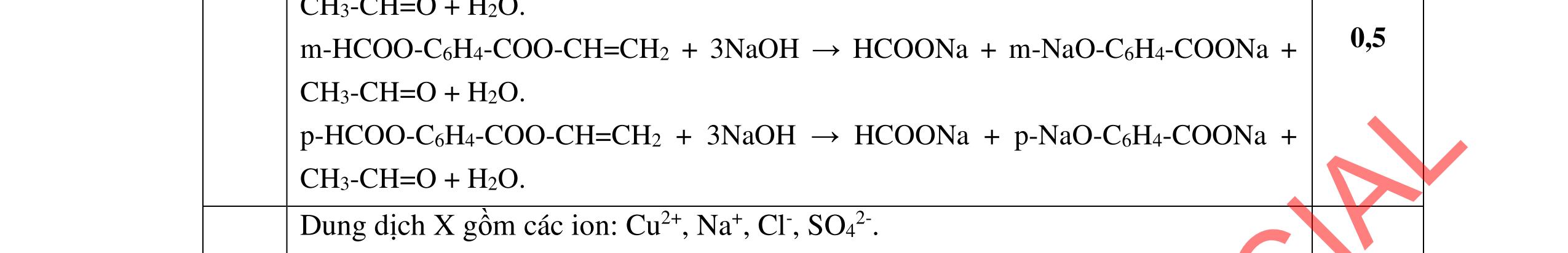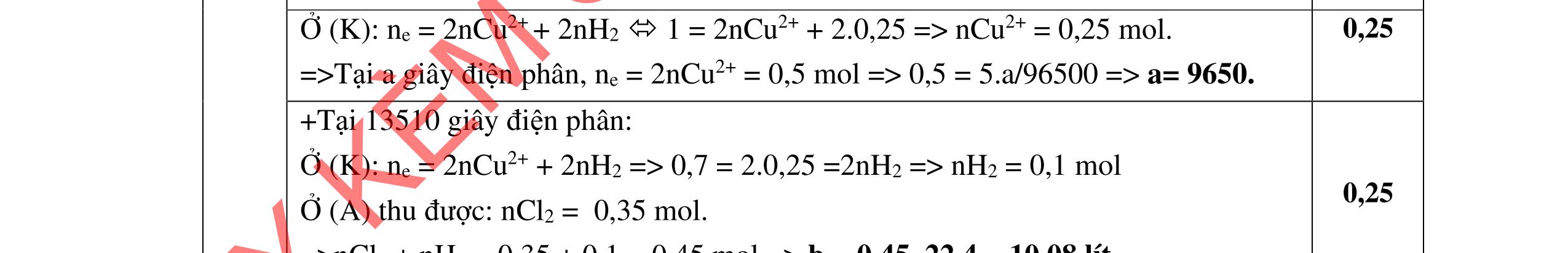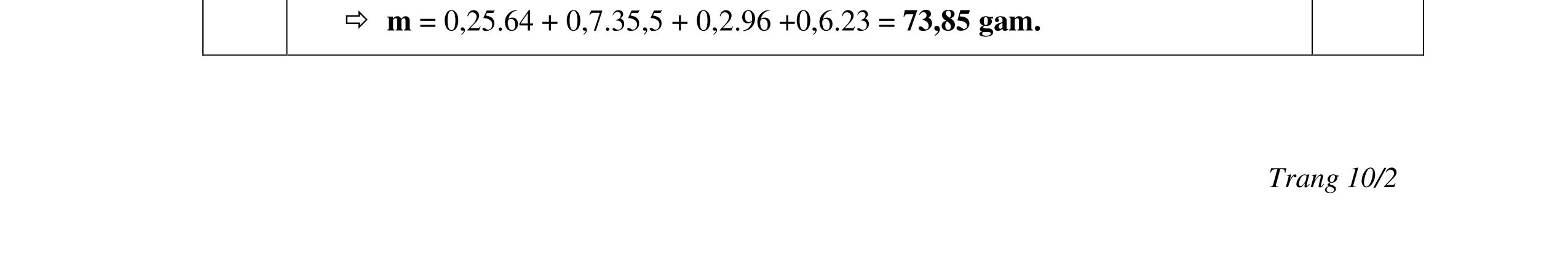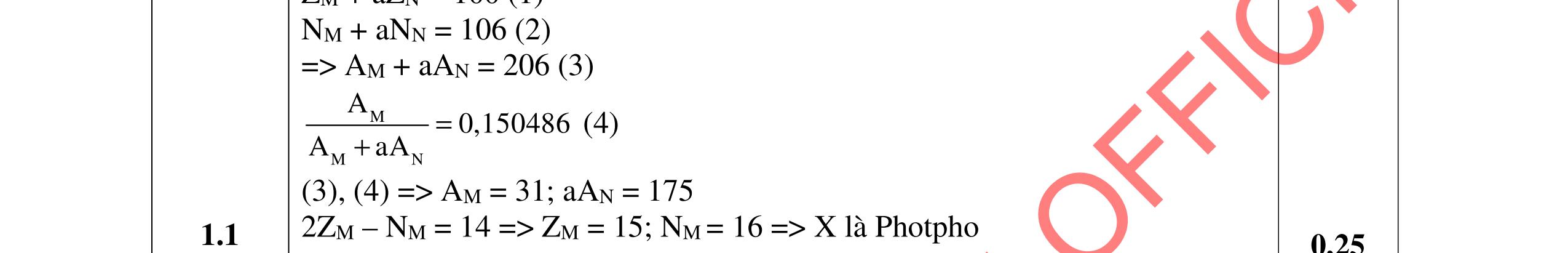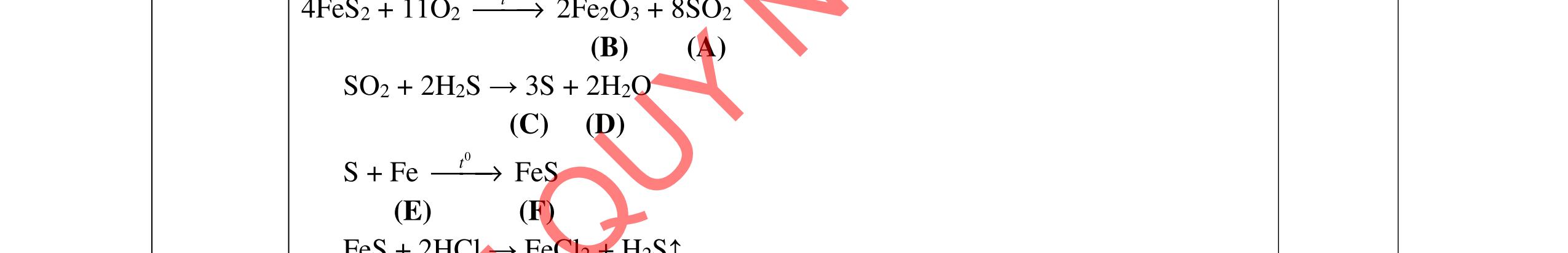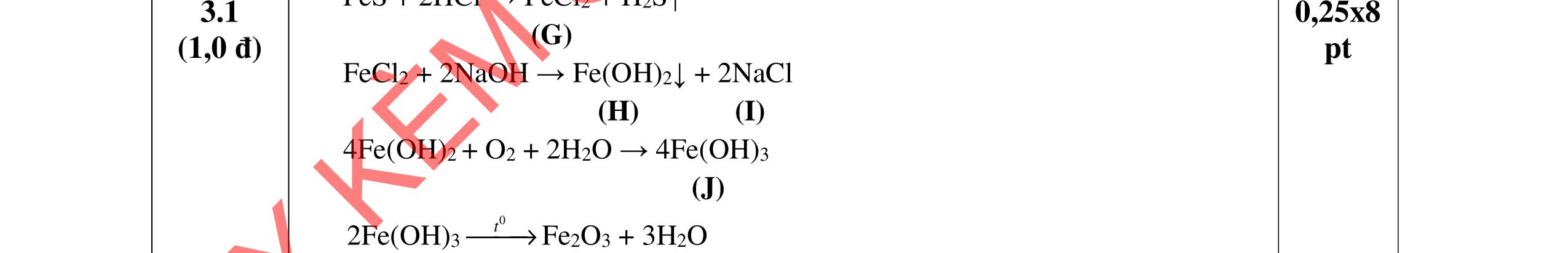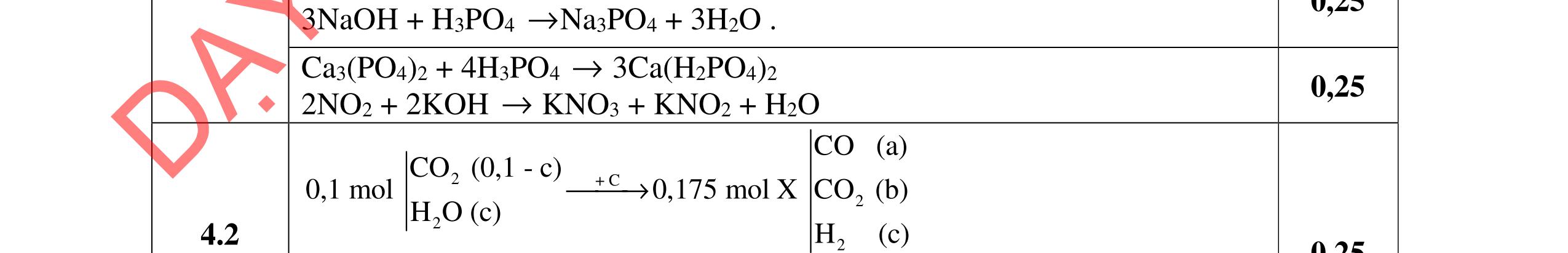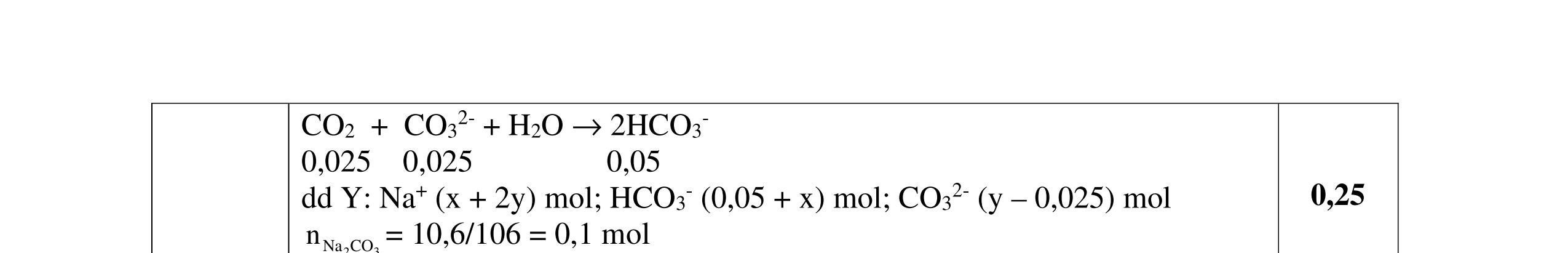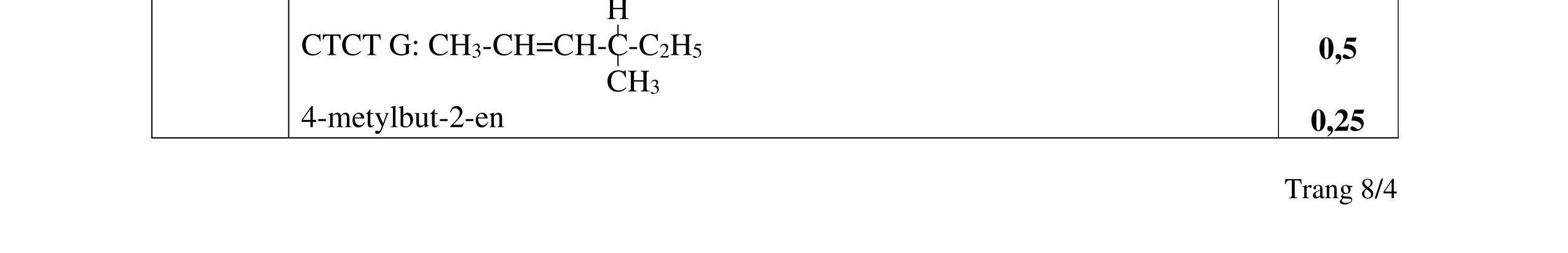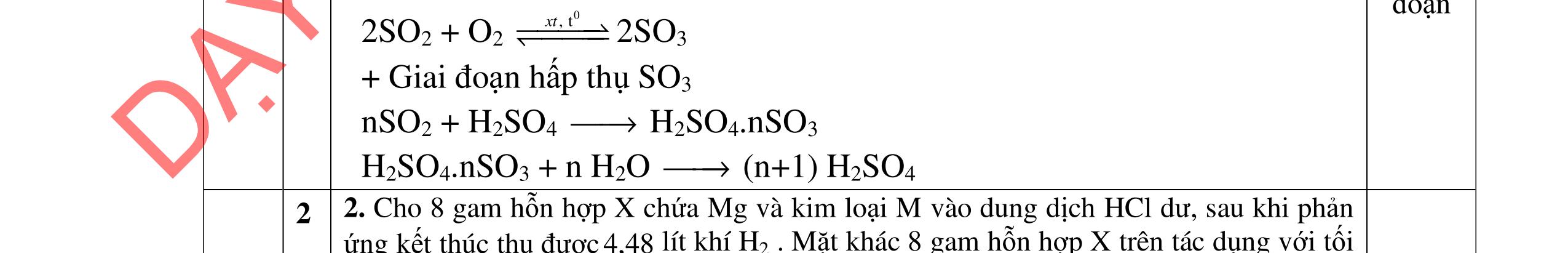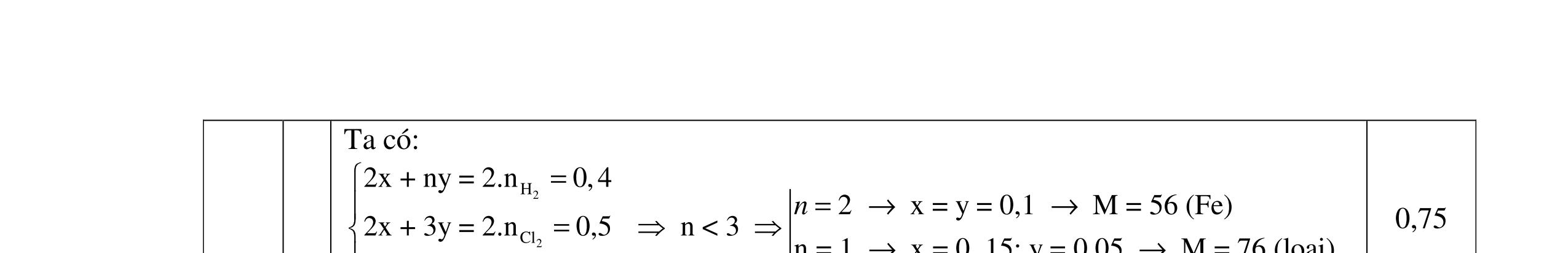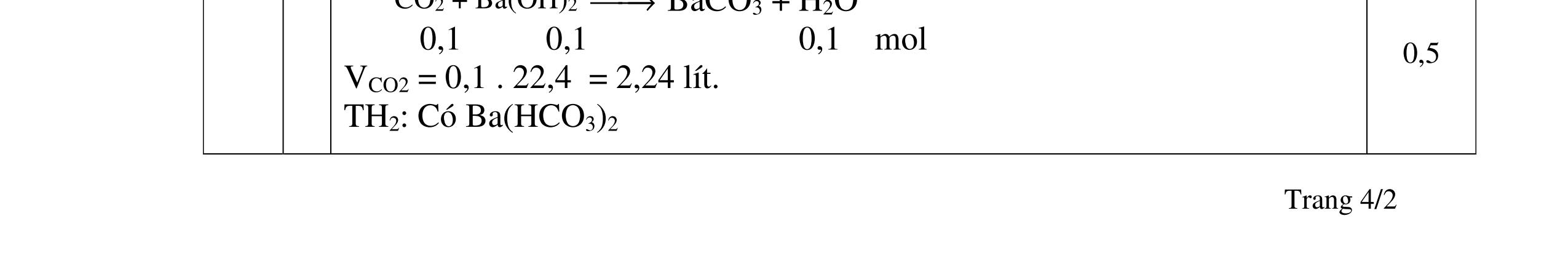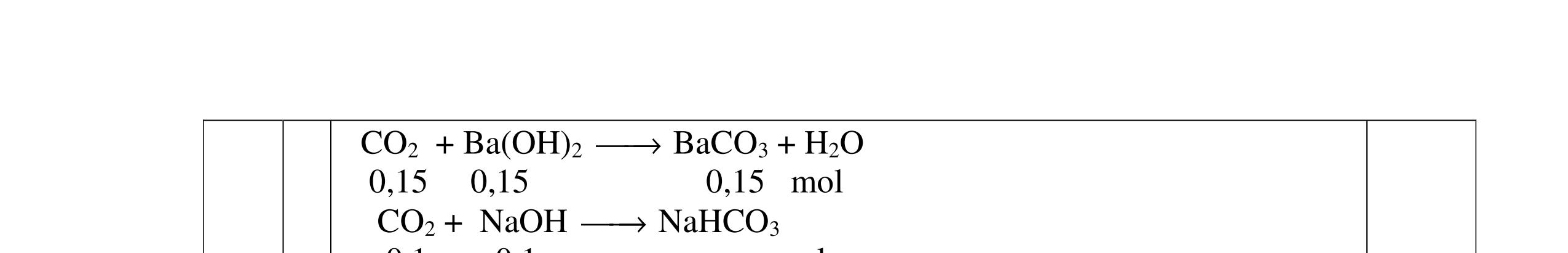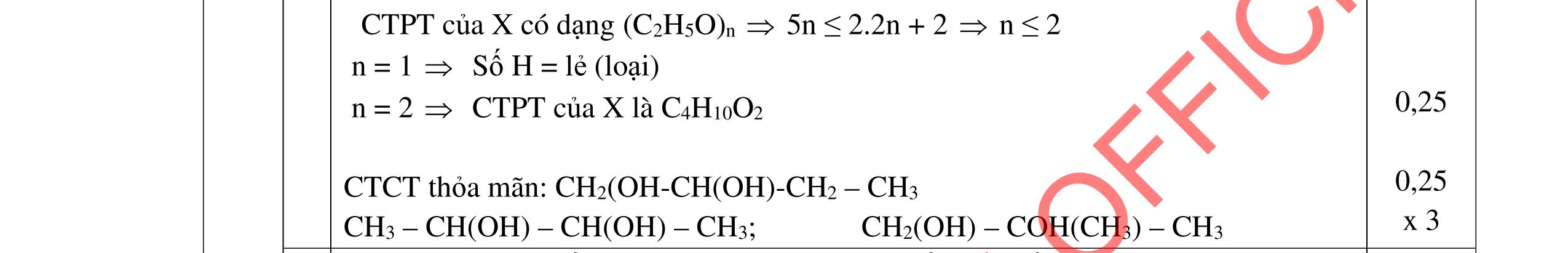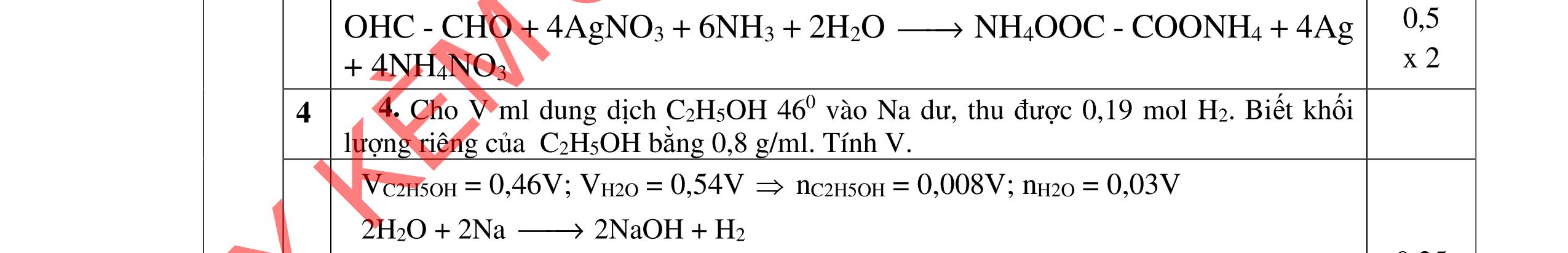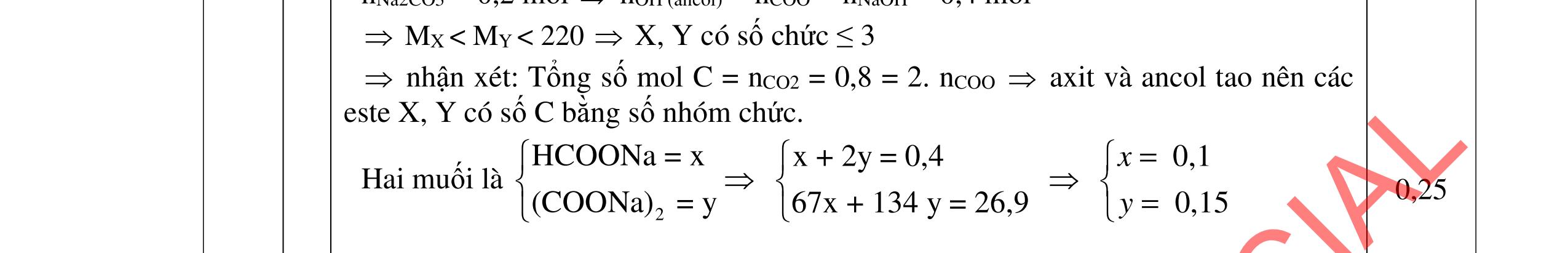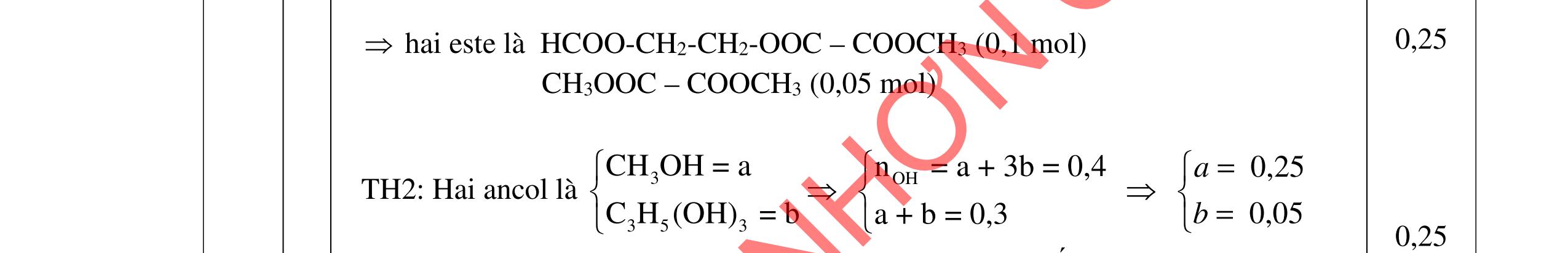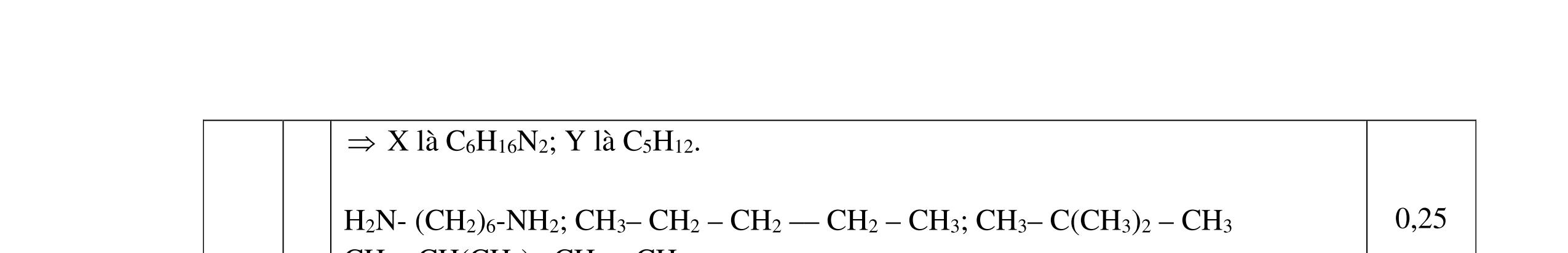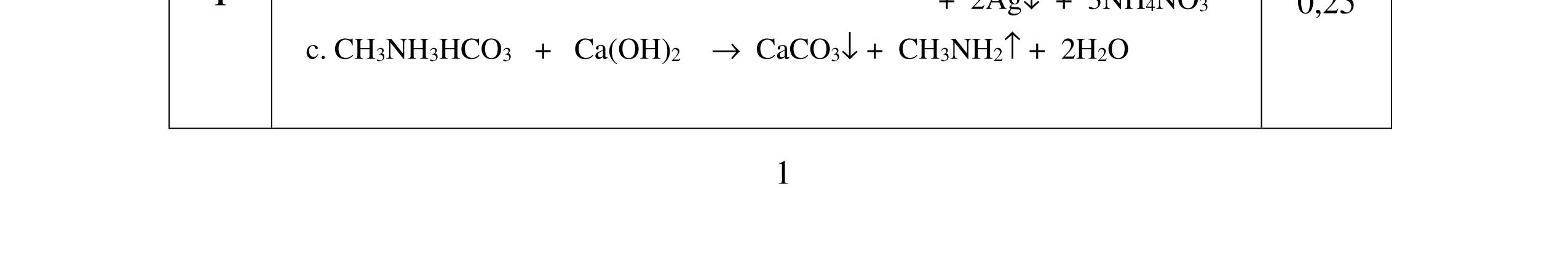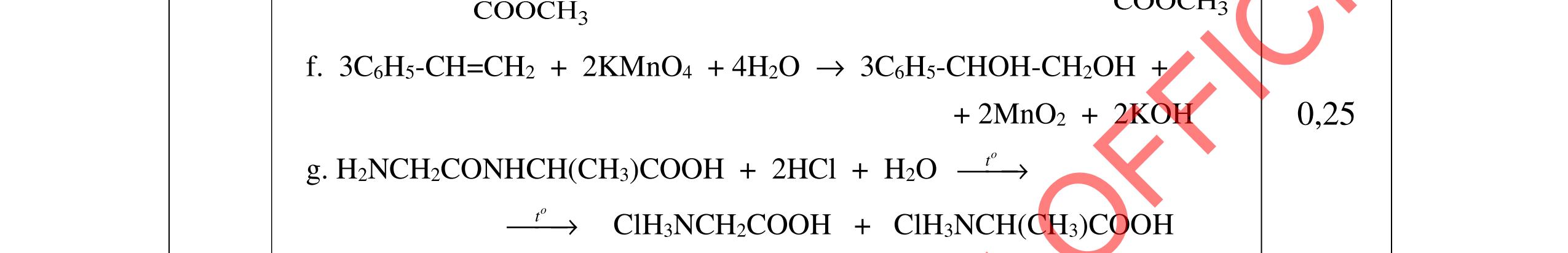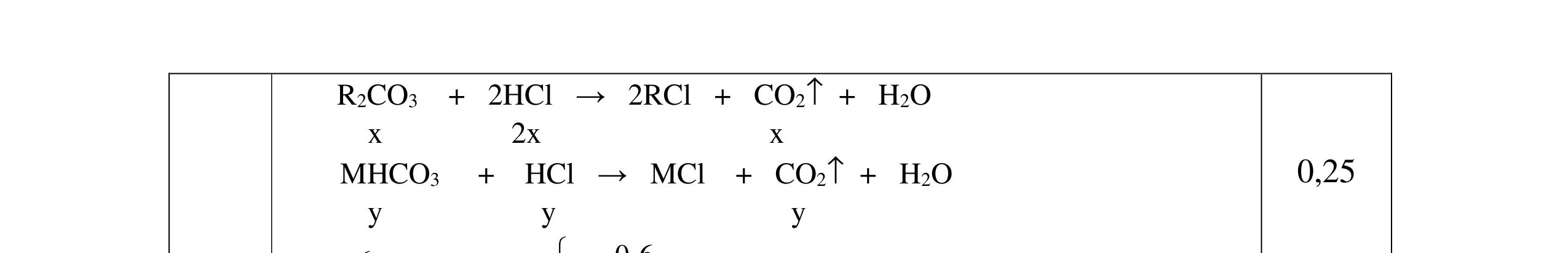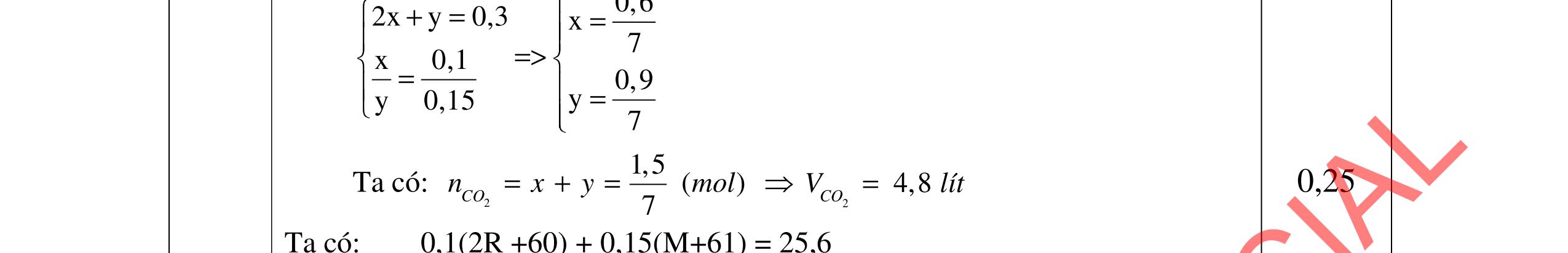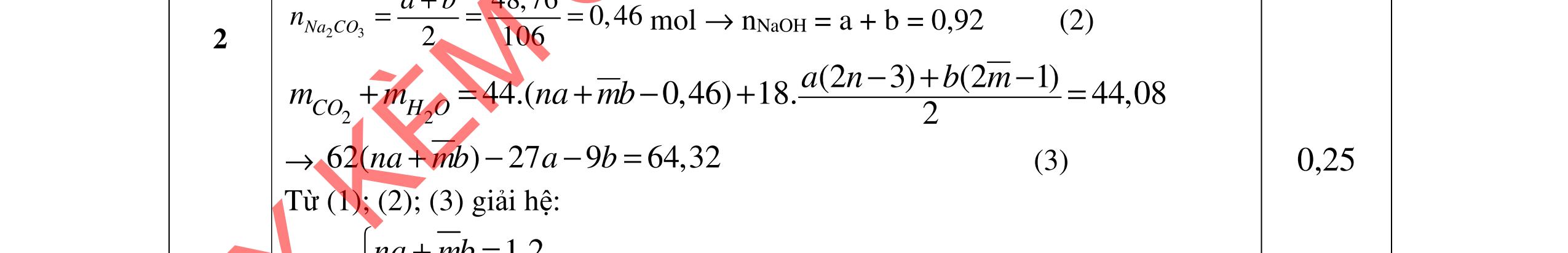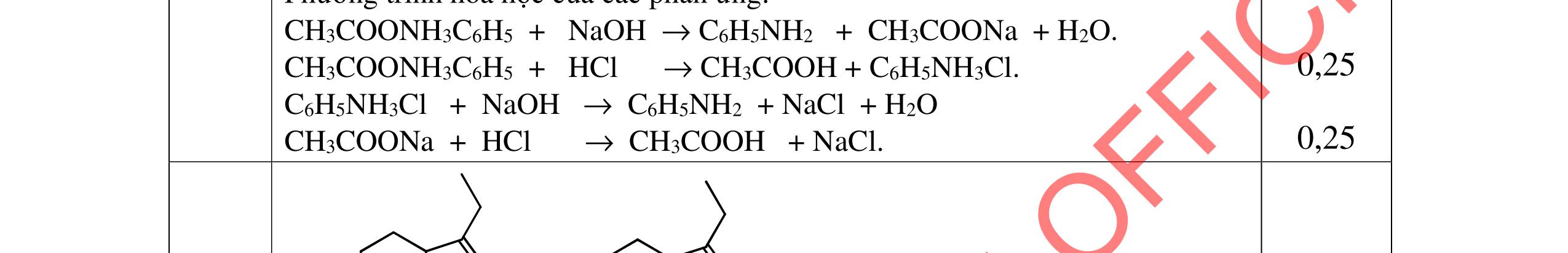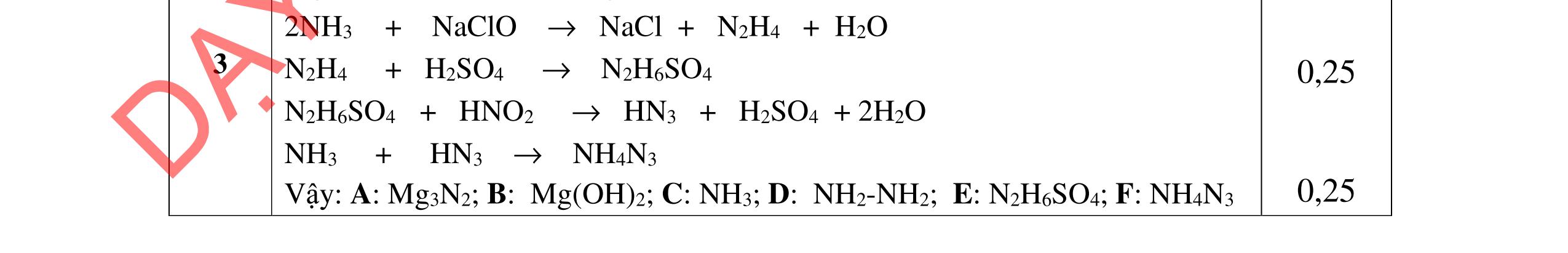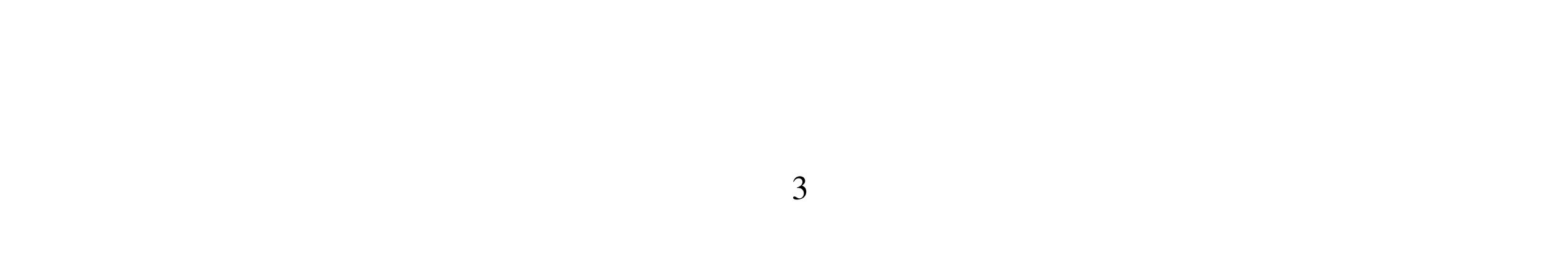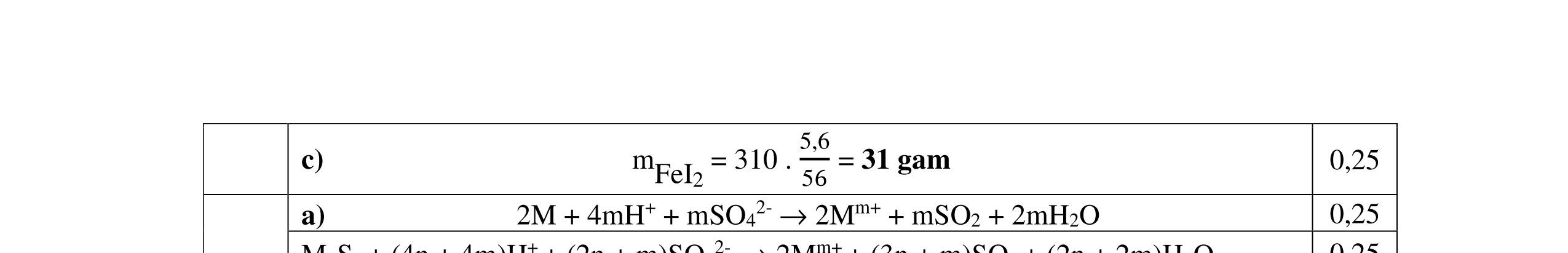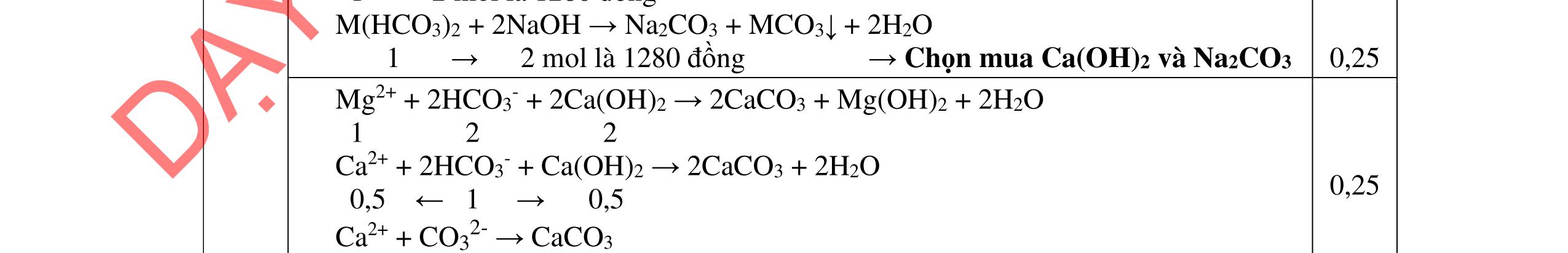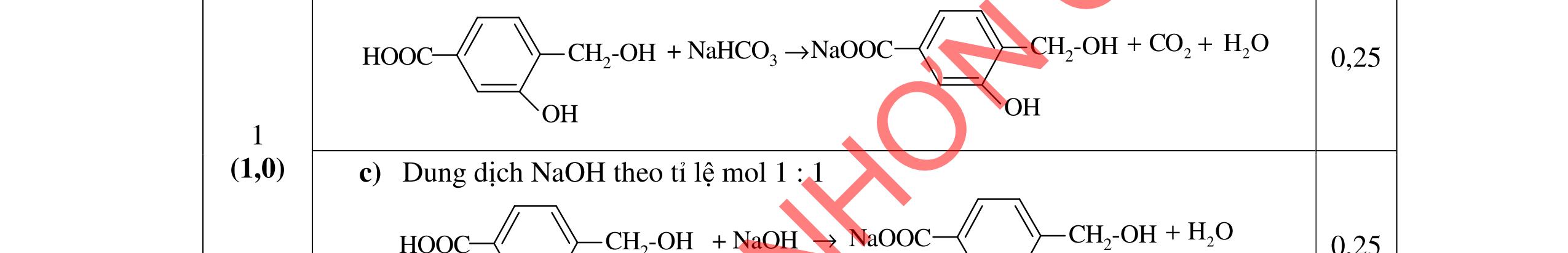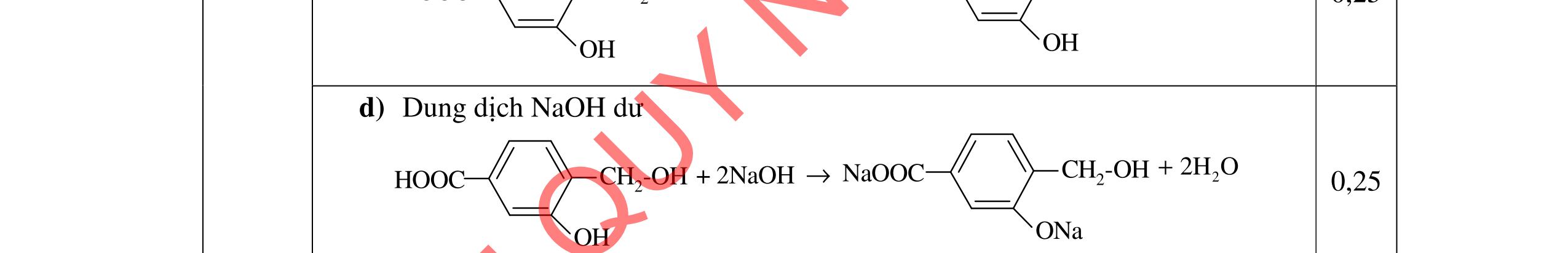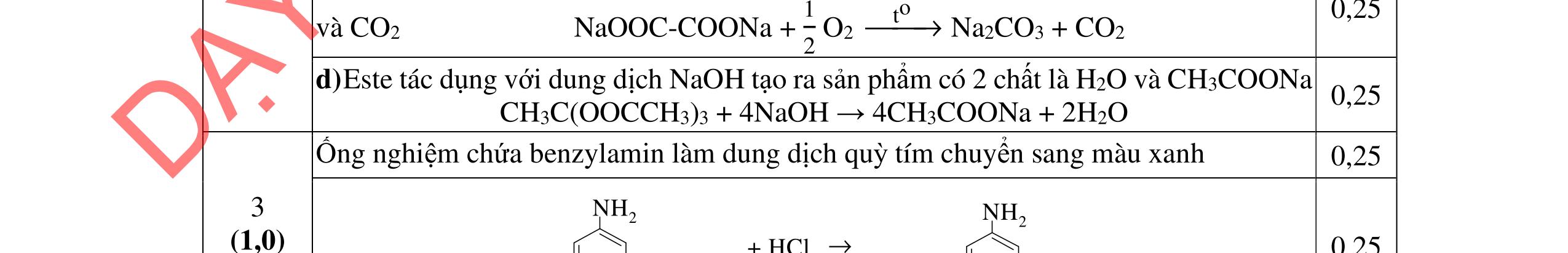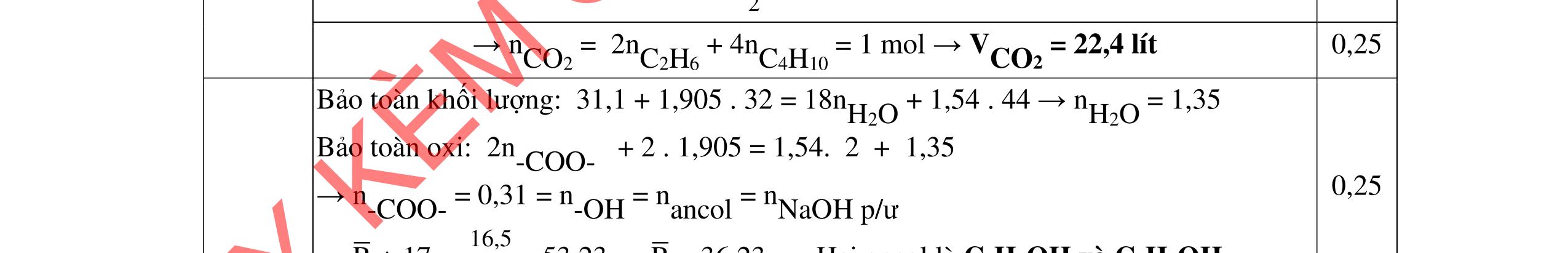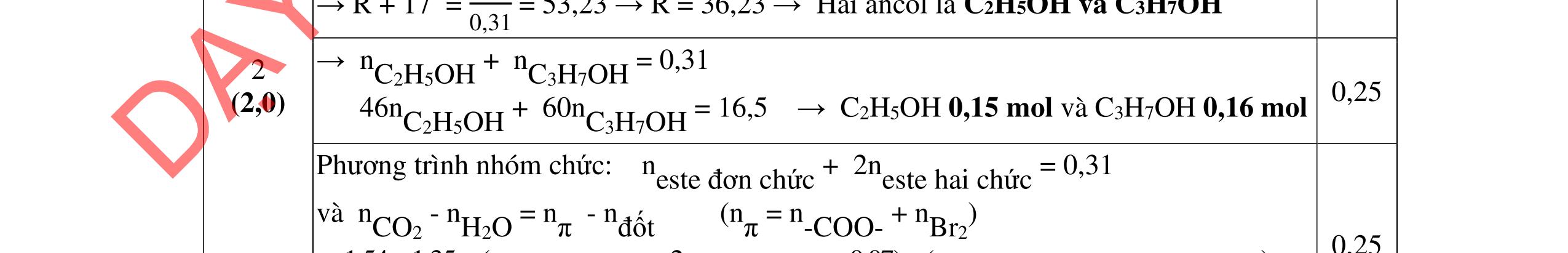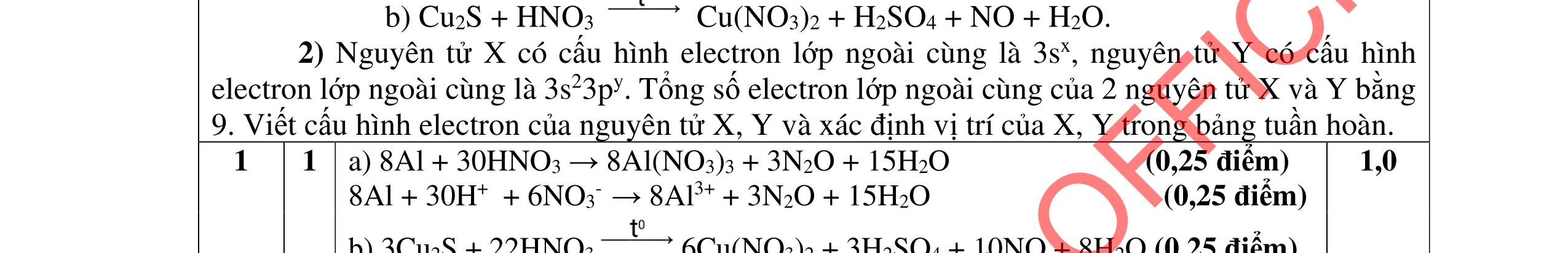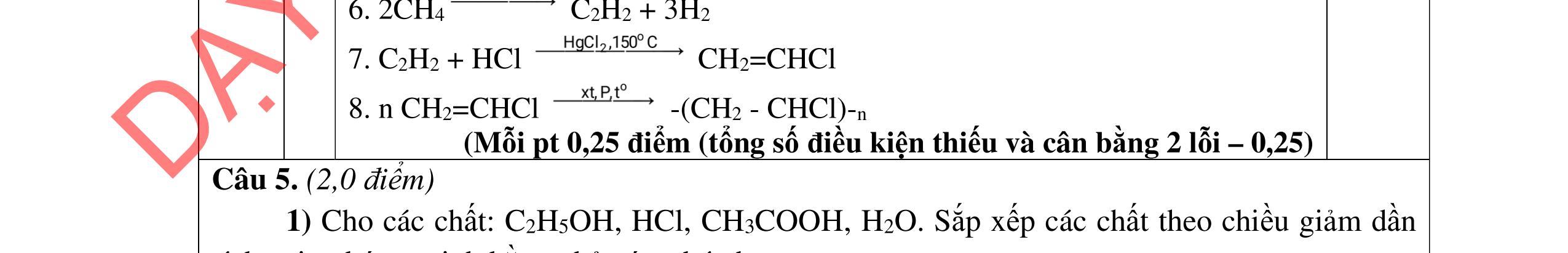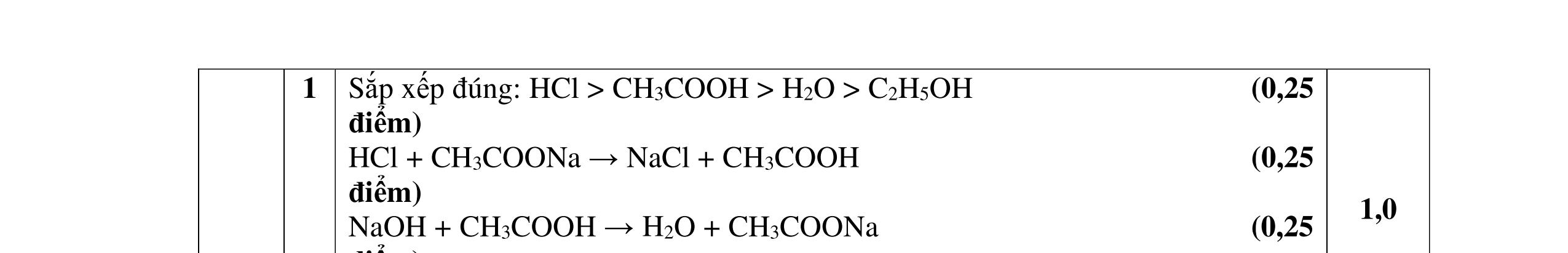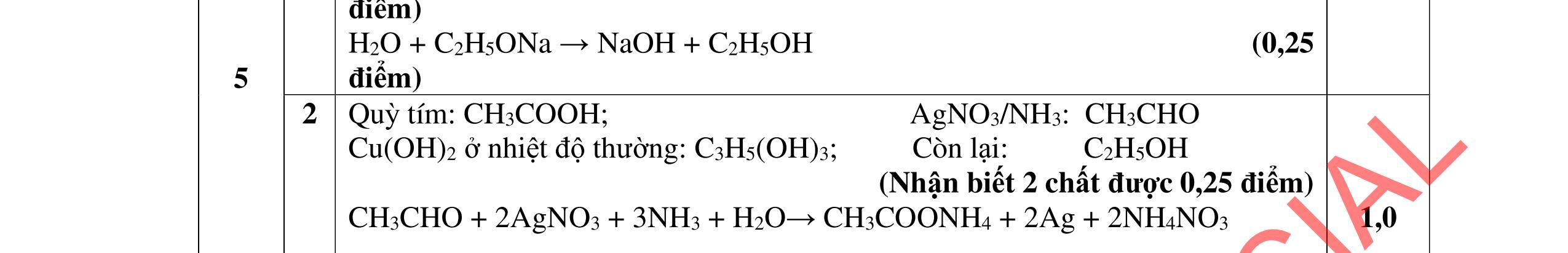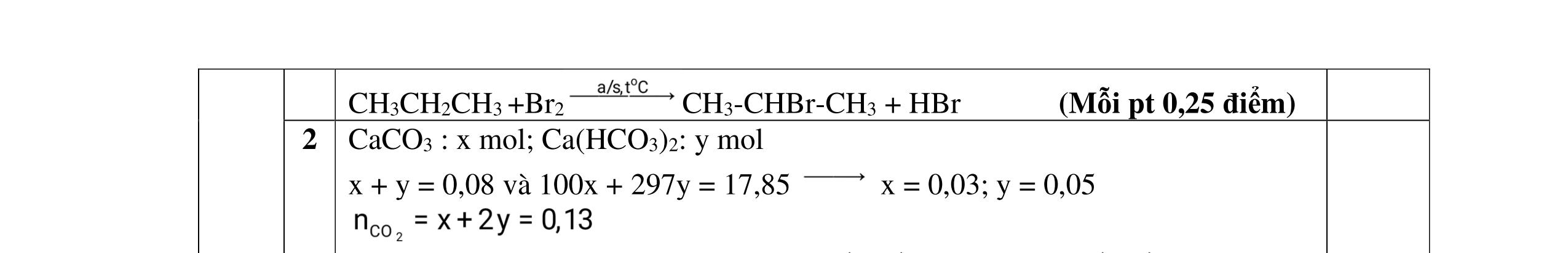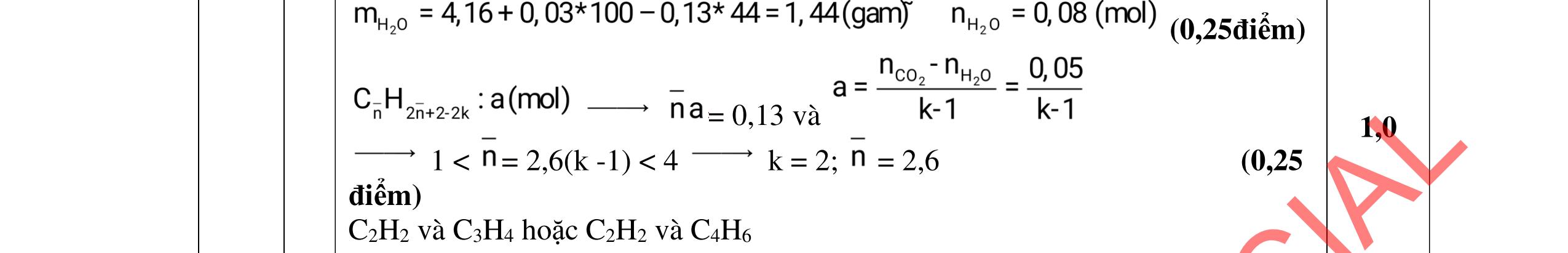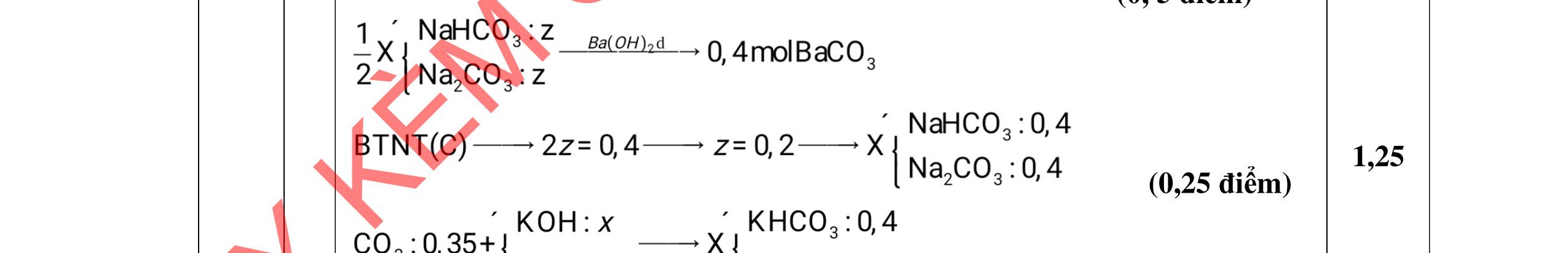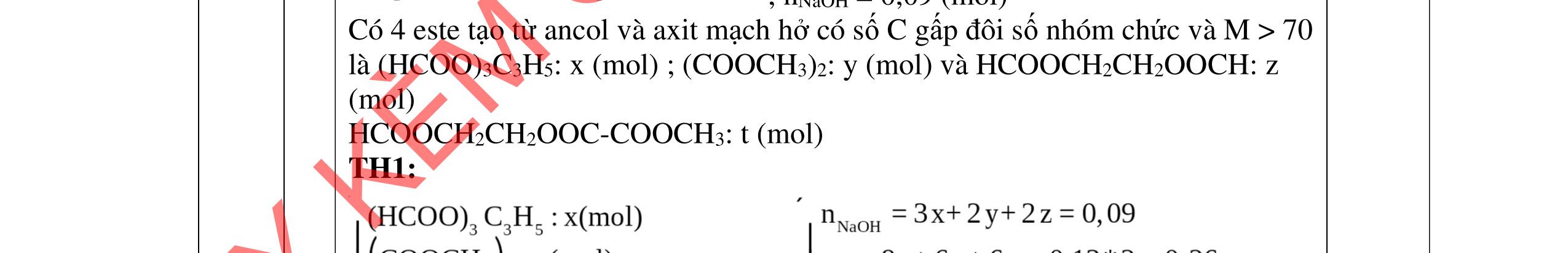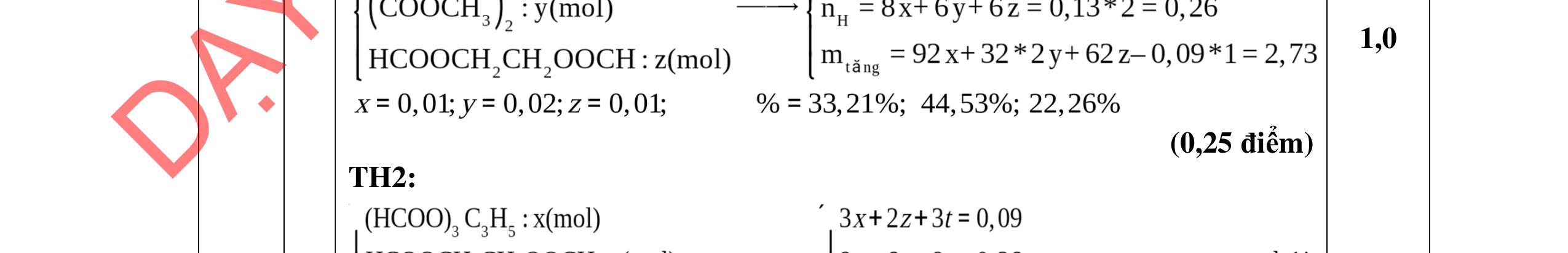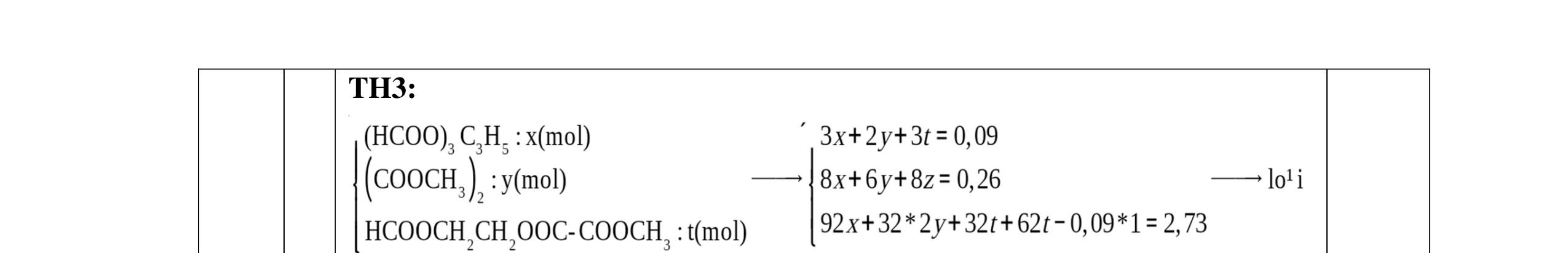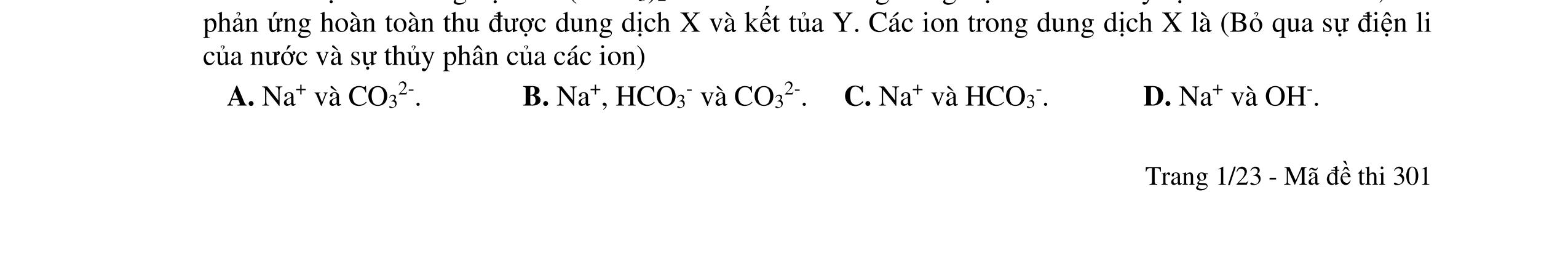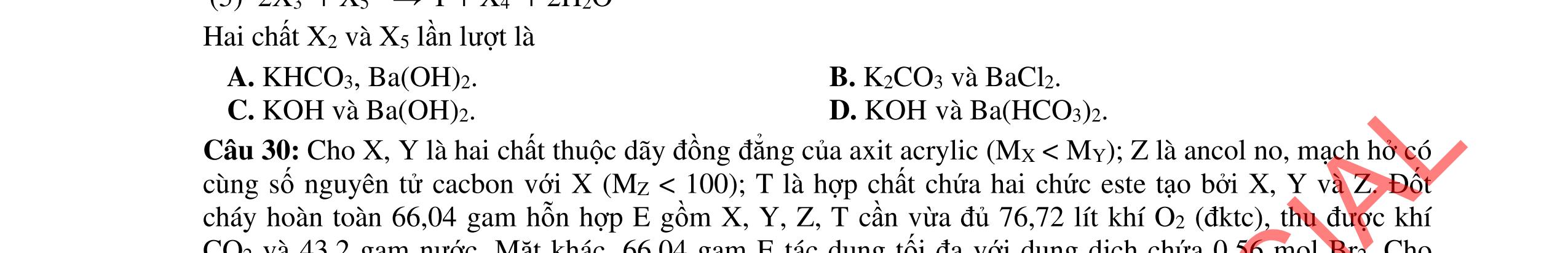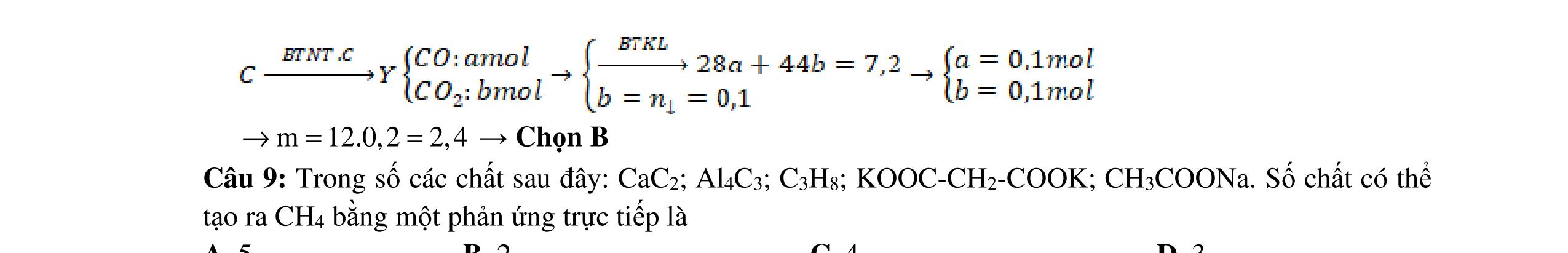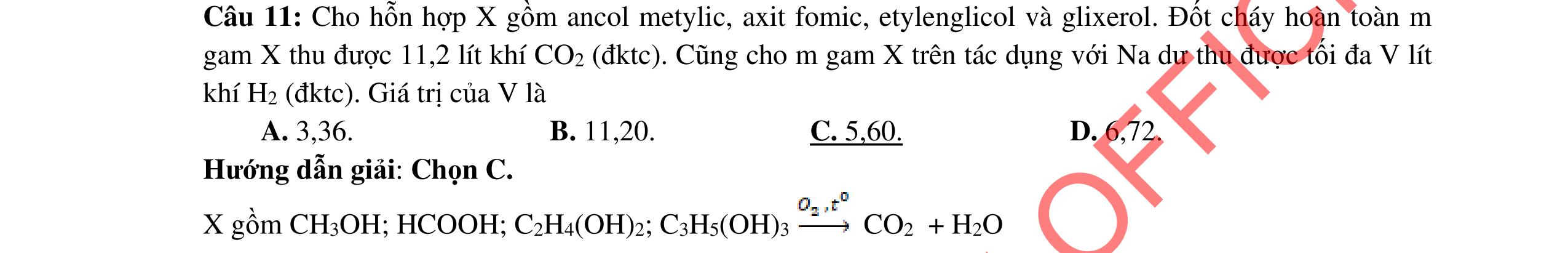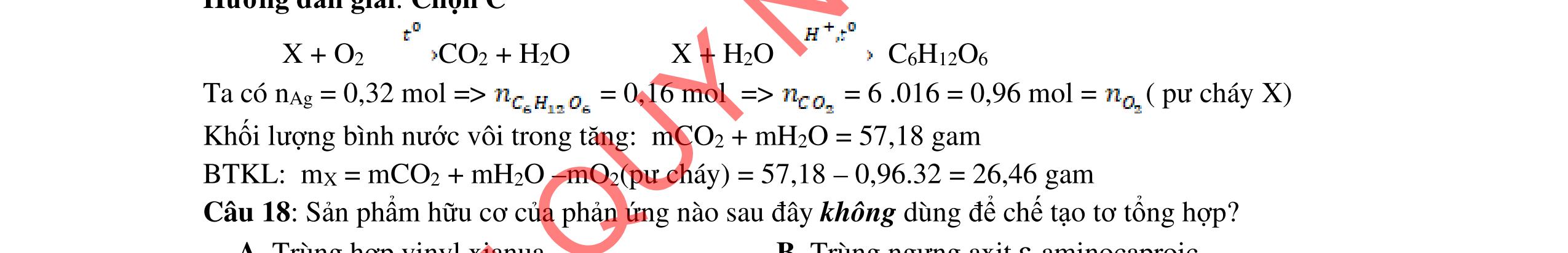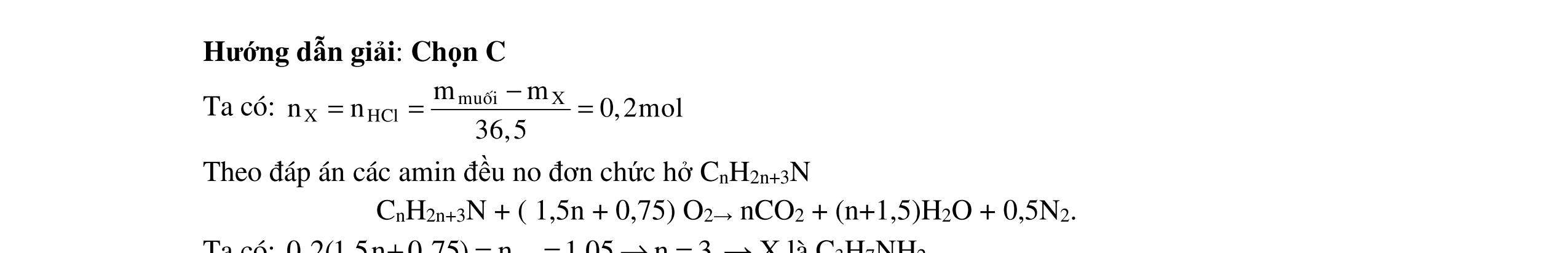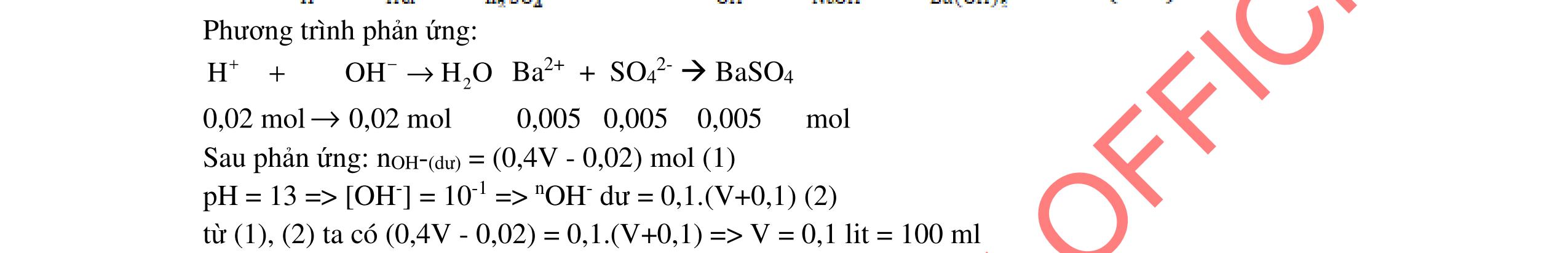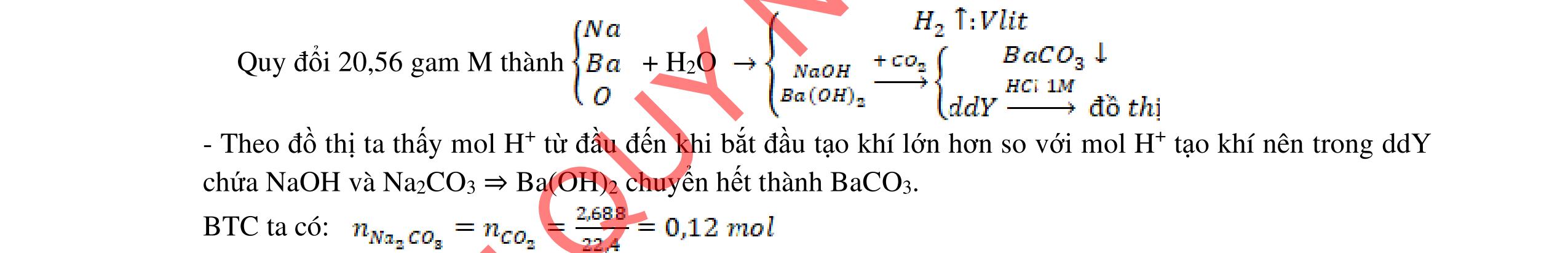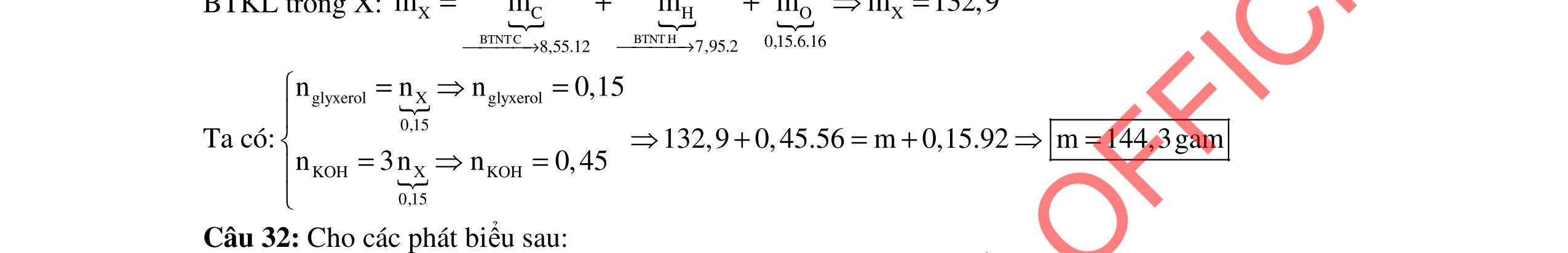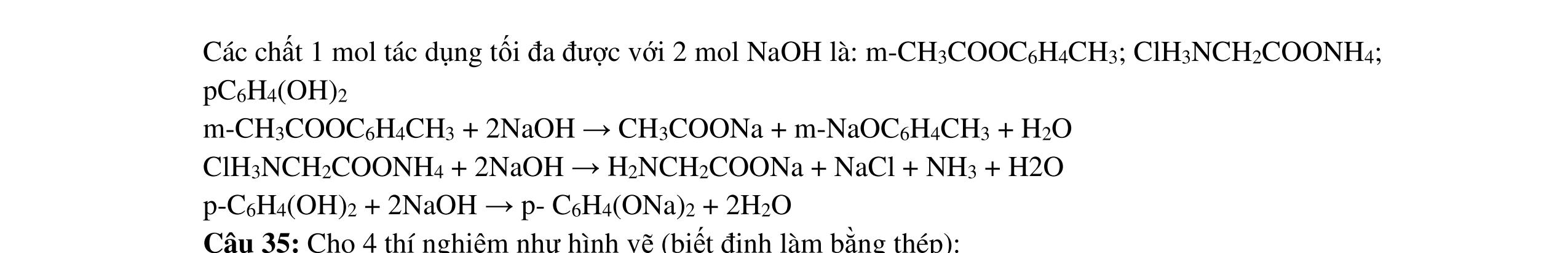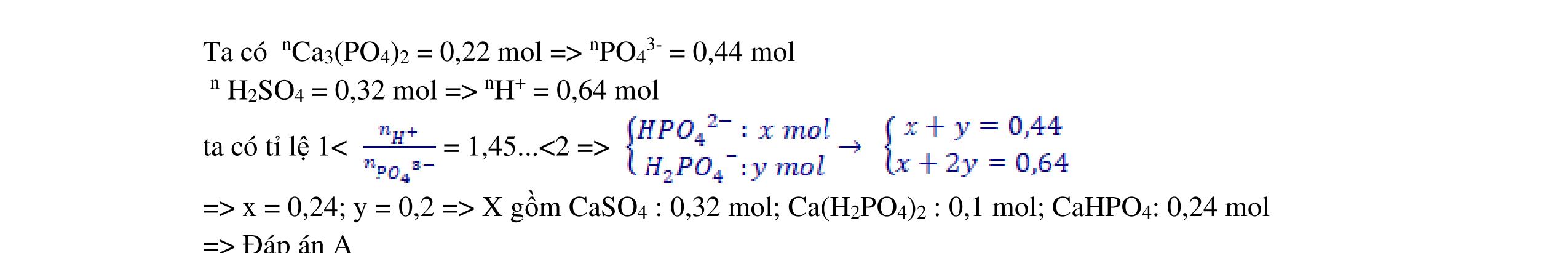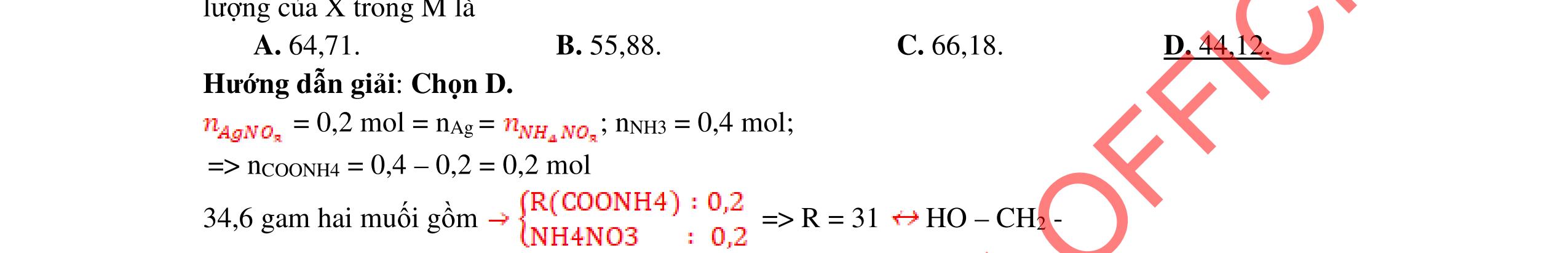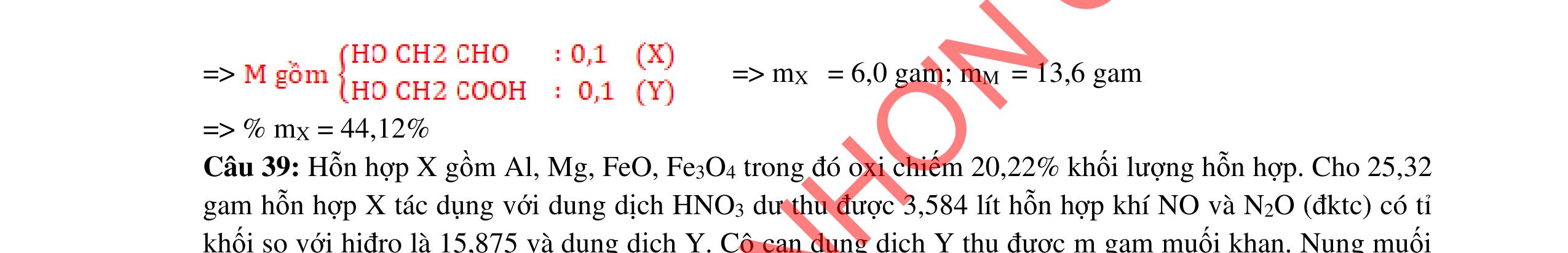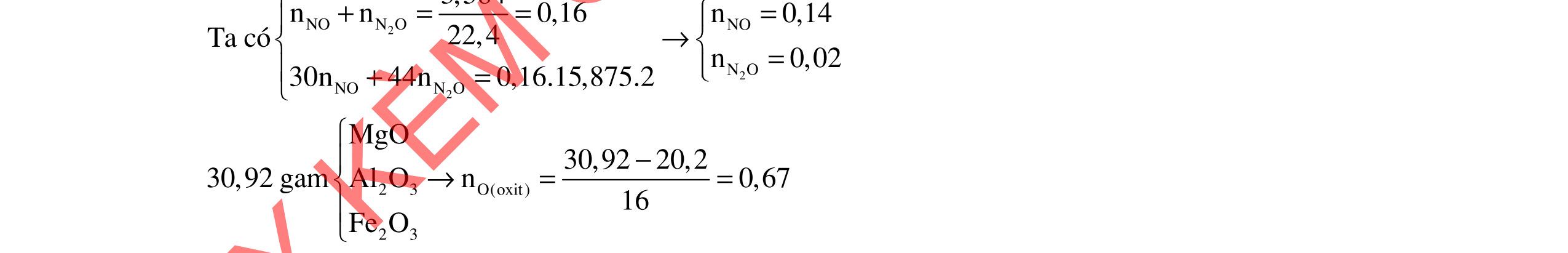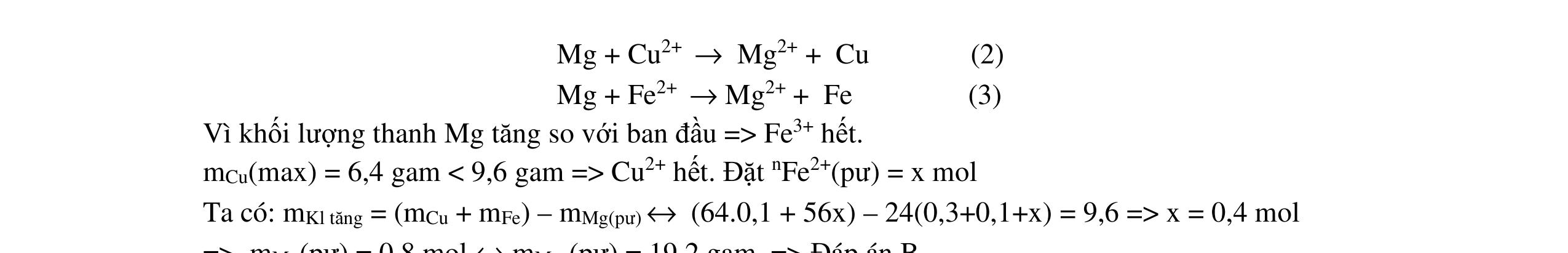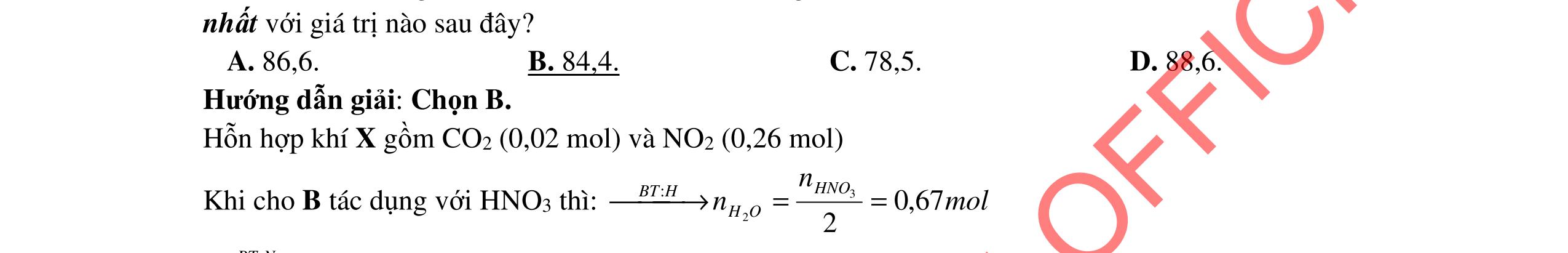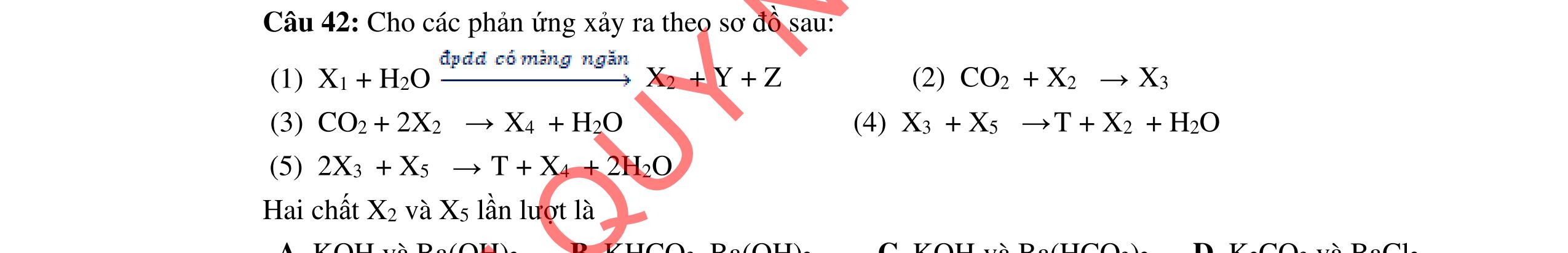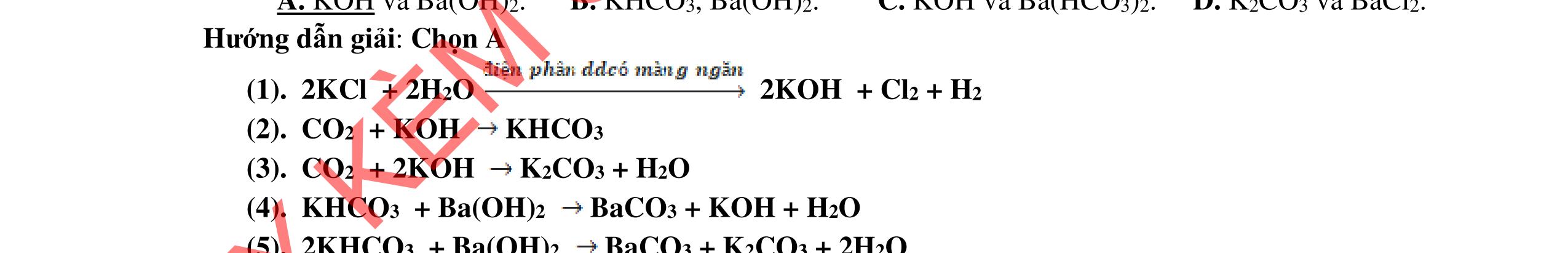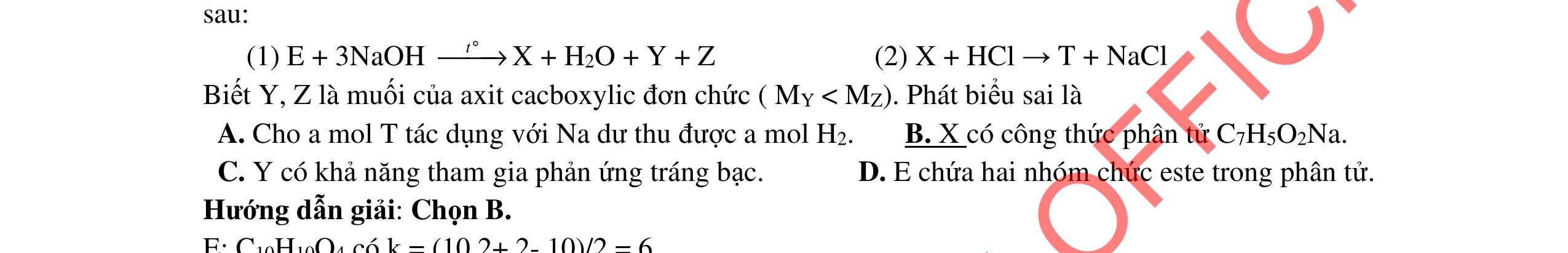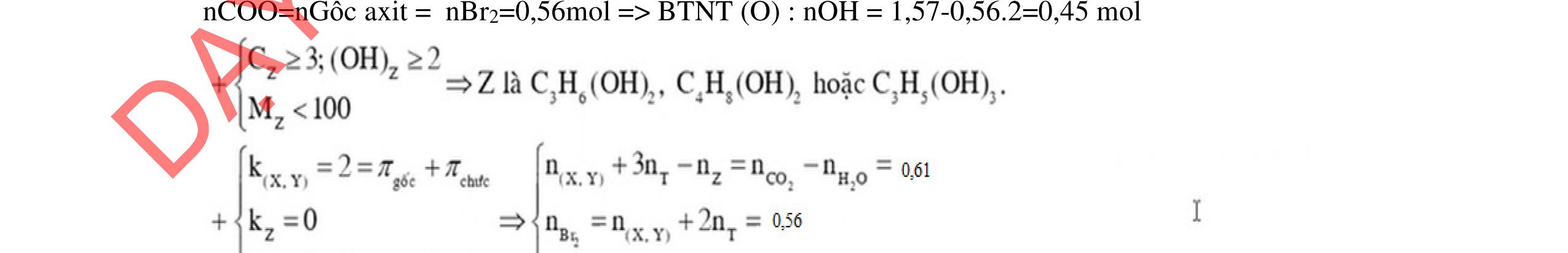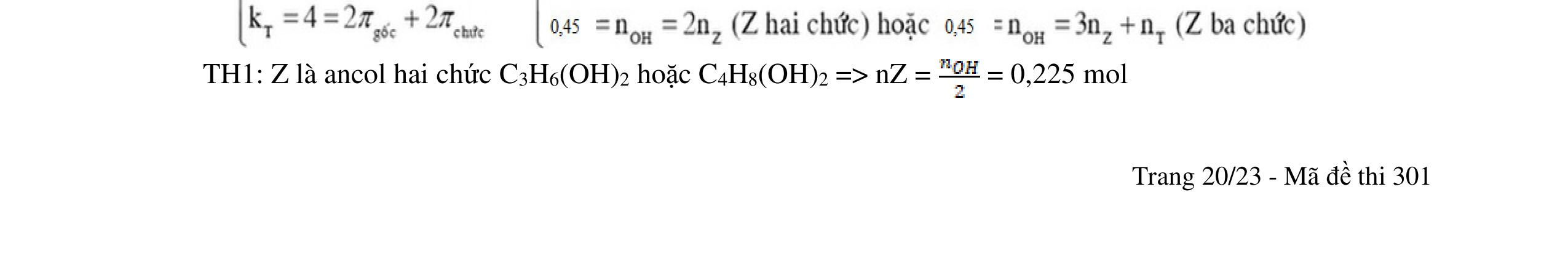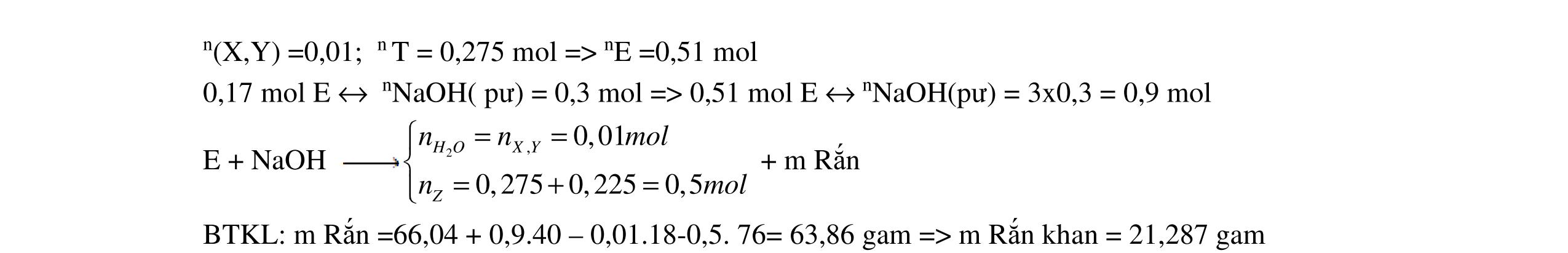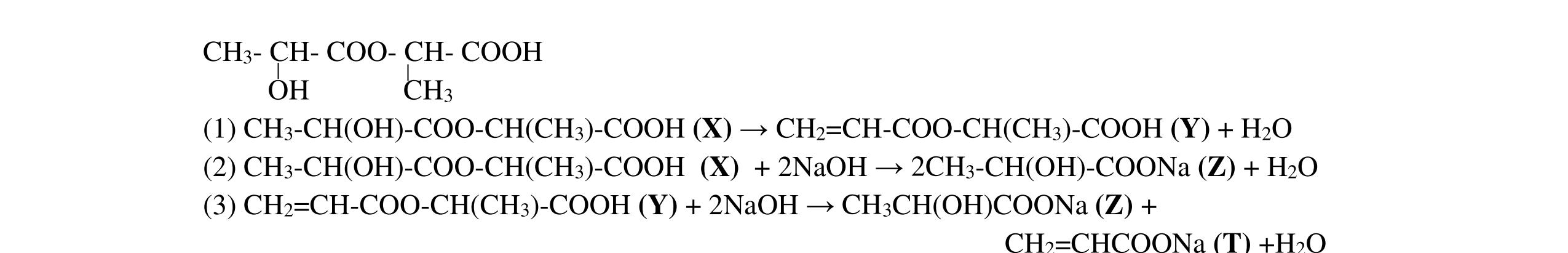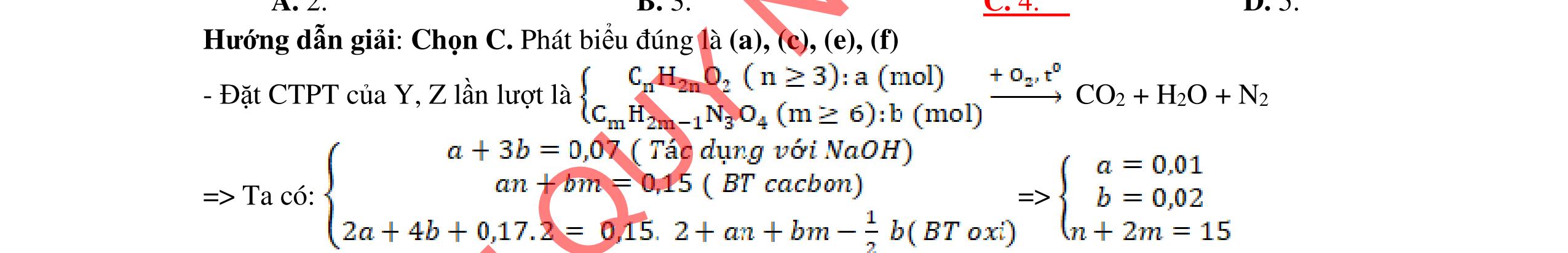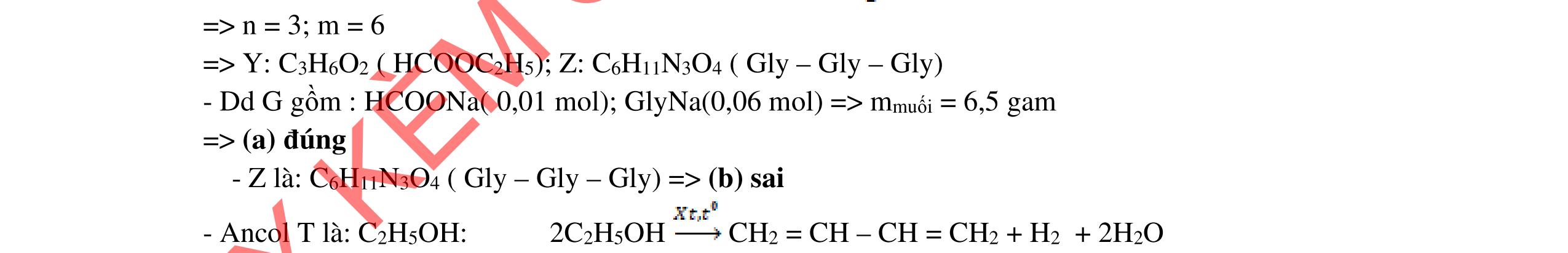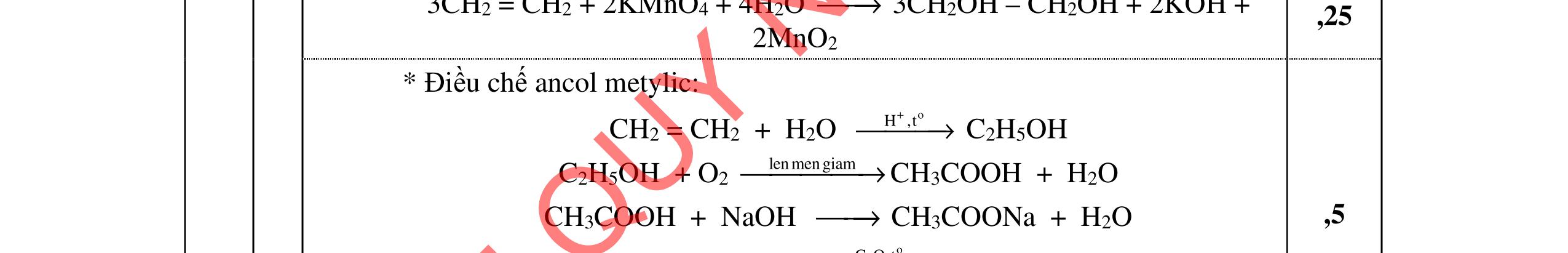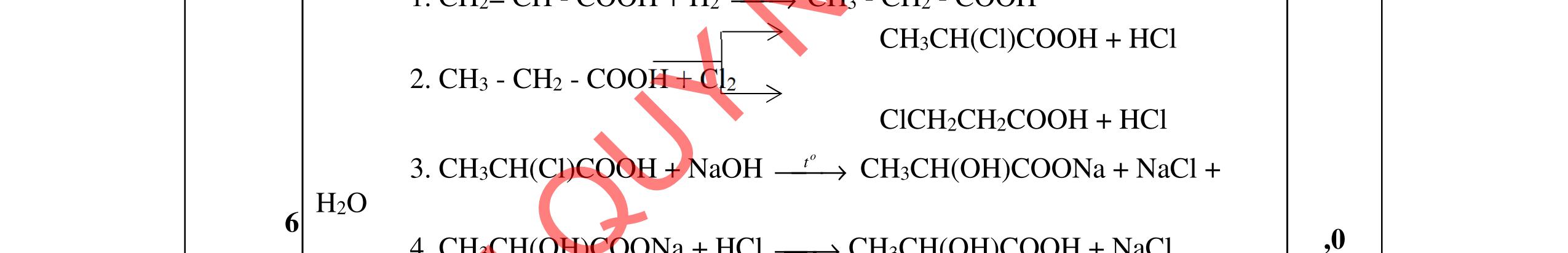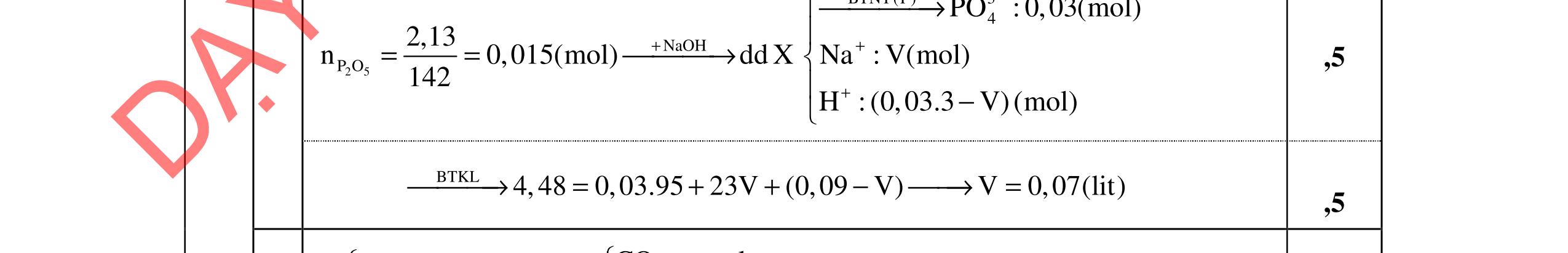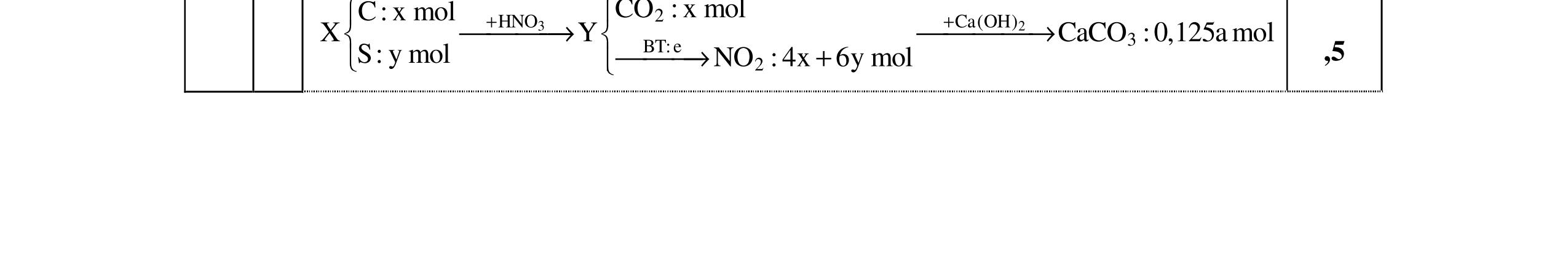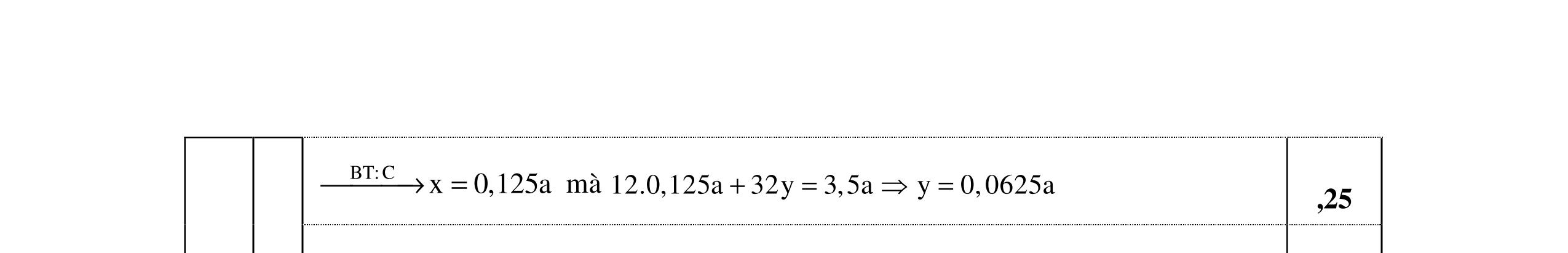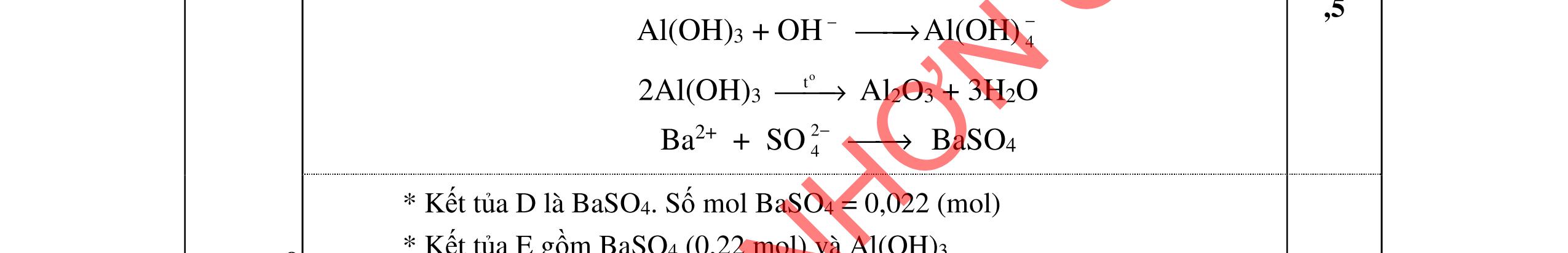ĐỀ THI CHỌN HỌC SINH GIỎI MÔN HÓA HỌC Ths Nguyễn Thanh Tú eBook Collection ĐỀ CHÍNH THỨC KỲ THI CHỌN HỌC SINH GIỎI LỚP 12 THPT CẤP TỈNH NĂM HỌC 2021 2022 MÔN HÓA HỌC Gồm 36 đề các tỉnh trên cả nước có đáp án (Prod. by Dạy Kèm Quy Nhơn) WORD VERSION | 2022 EDITION ORDER NOW / CHUYỂN GIAO QUA EMAIL TAILIEUCHUANTHAMKHAO@GMAIL.COM Hỗ trợ trực tuyến Fb www.facebook.com/DayKemQuyNhon Mobi/Zalo 0905779594 Tài liệu chuẩn tham khảo Phát triển kênh bởi Ths Nguyễn Thanh Tú Đơn vị tài trợ / phát hành / chia sẻ học thuật : Nguyen Thanh Tu Group vectorstock com/28062440
ĐỀ THI CHÍNH THỨC
ĐỀ THI CHỌN HỌC SINH GIỎI LỚP 12 NĂM HỌC 2021 - 2022
Môn thi: HÓA HỌC Thời gian làm bài: 180 phút Ngày thi: 22/02/2022 (Đề thi có: 02 trang)
Cho NTK các nguyên tố: H= 1; He = 4; C = 12; N = 14; 0= 16; Na = 23; Mg = 24; Al = 27; S = 32; K = 39; Ca = 40; Fe = 56; Cu = 64; Zn = 65; Ag = 108
Thí sinh được dùng bảng tuần hoàn các nguyên tố hóa học. Câu 1 (4 điểm).
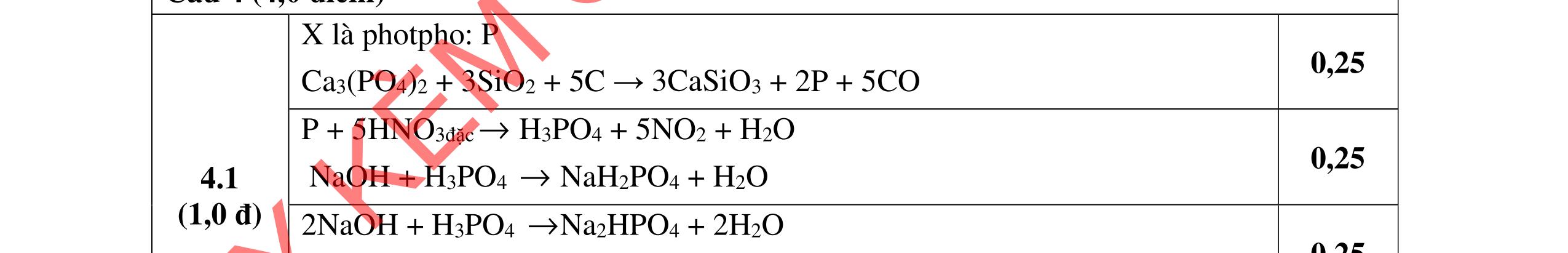
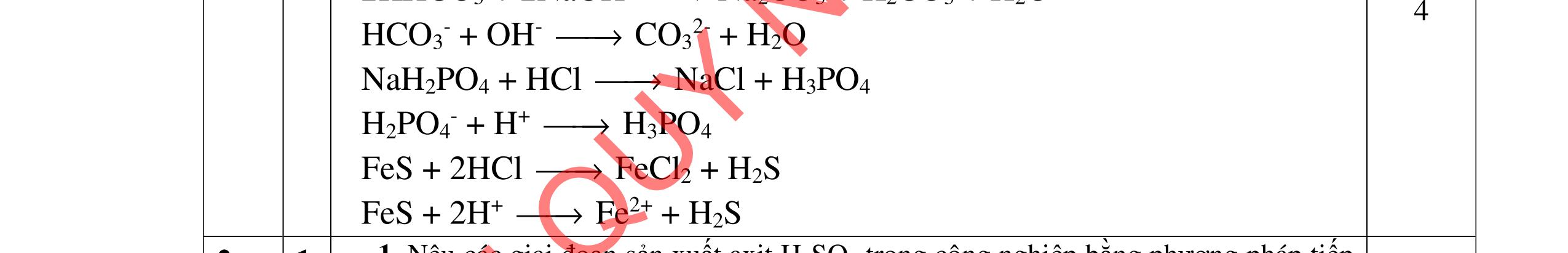
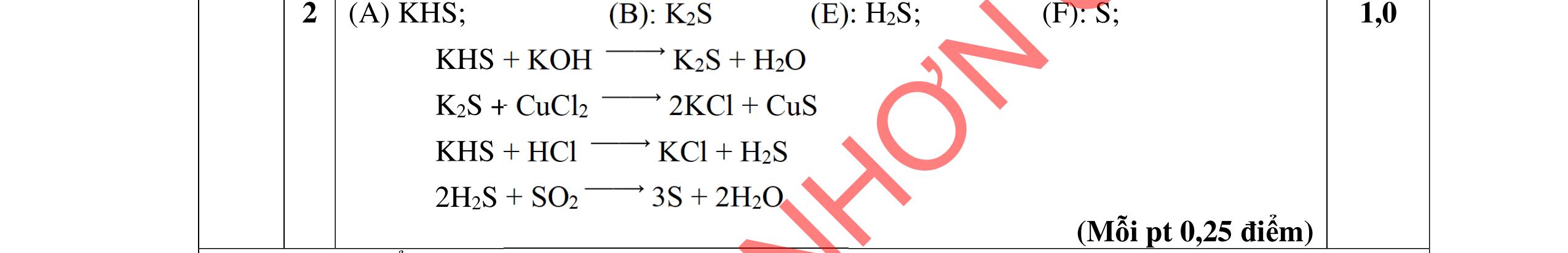
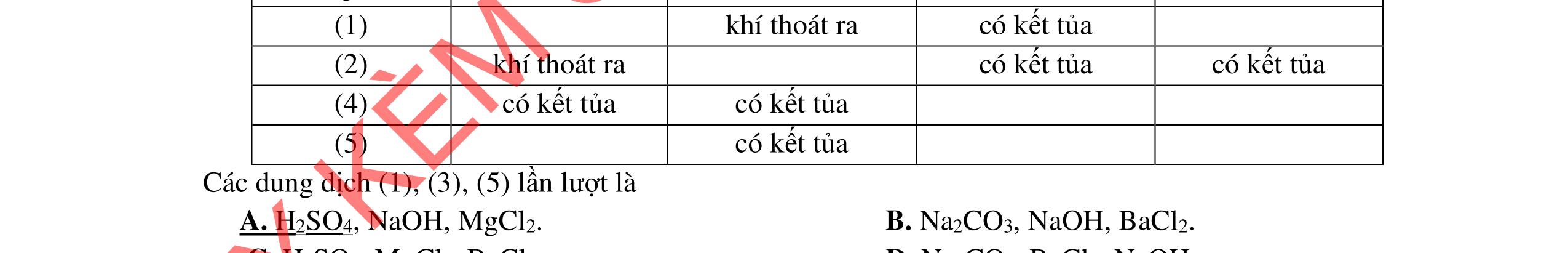
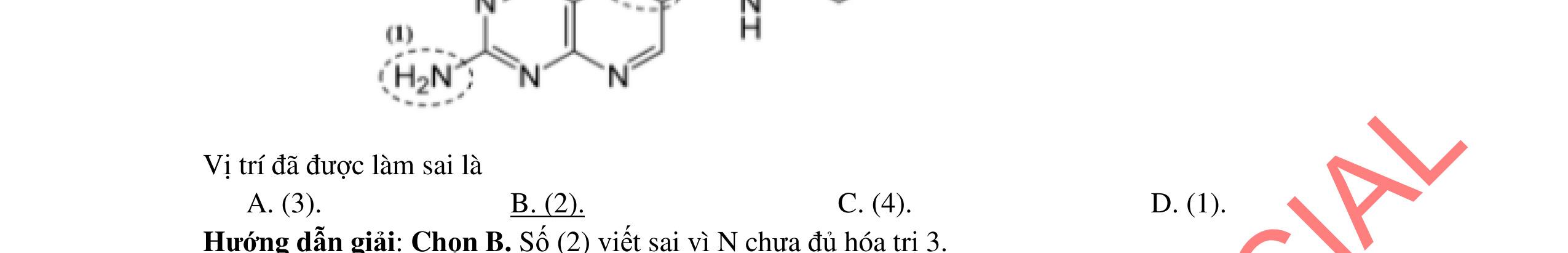
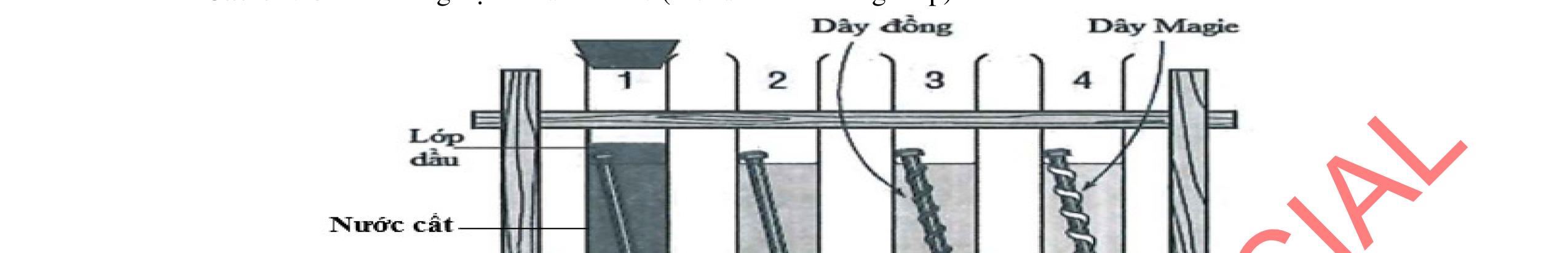
1.1. Có 5 ống nghiệm, mỗi ống nghiệm chứa 1 trong các dụng dịch sau: NaHSO4; Ba(HCO3)2; Ba(OH)2; KHCO3, Na2SO4. Người ta đánh số ngẫu nhiên từng ống nghiệm là X1, X2, X3, X4, Xs và tiến hành thí nghiệm cho kết quả như sau:
- Cho dung dịch X1 vào dung dịch X2 thấy vừa tạo kết tủa trắng, vừa có khí thoát ra.
- Cho dung dịch X2 vào các dung dịch X3, X4 đều có kết tủa.
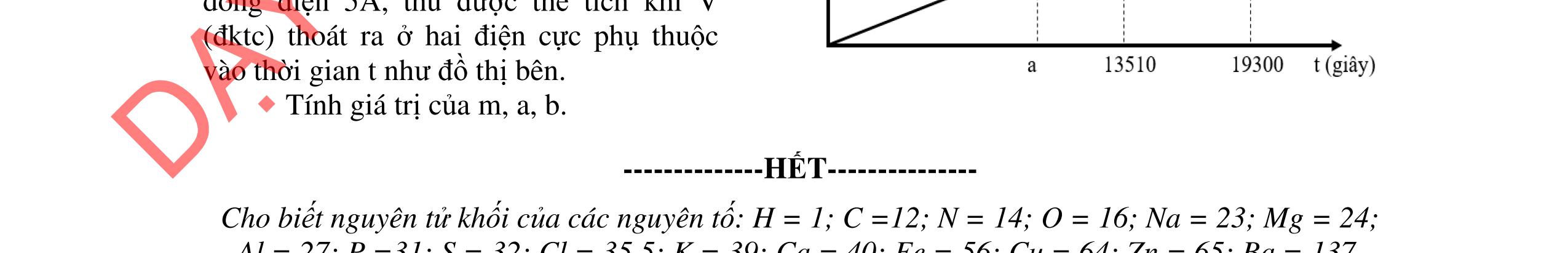
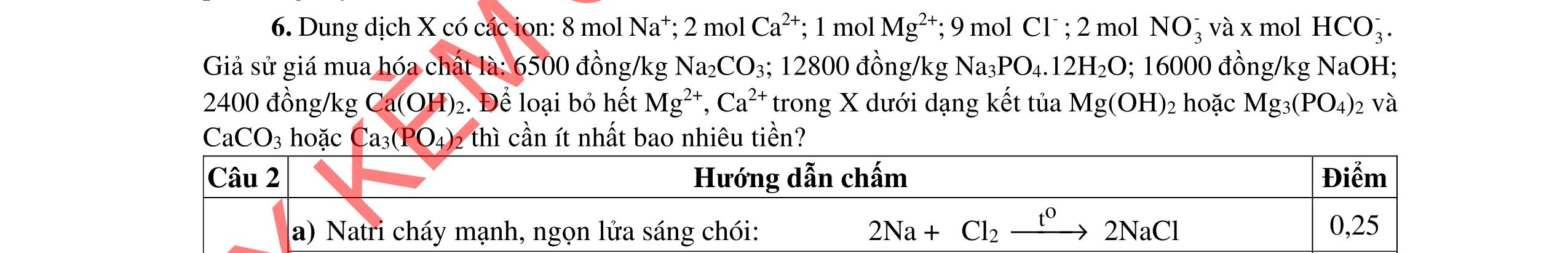
- Cho dung dịch X vào dung dịch X5 có kết tủa. Xác định các dung dịch X1, X2, X3, X4, X5? Viết phương trình phản ứng xảy ra. 1.2. Đốt cháy hoàn toàn 4,4 gam sunfua của kim loại M (công thức MS) trong oxi dư. Chất rắn sau phản ứng đem hòa tan trong một lượng vừa đủ dung dịch HNO3 37,8% thấy nồng độ phần trăm của muối trong dung dịch thu được là 41,72%. Khi làm lạnh dung dịch này thì thoát ra 8,08 gam muối rắn X. Lọc tách muối rắn X, thấy nồng độ phần trăm của muối trong dung dịch là 34,7%. Xác định công thức của muối rắn X.
Câu 2 (4 điểm).
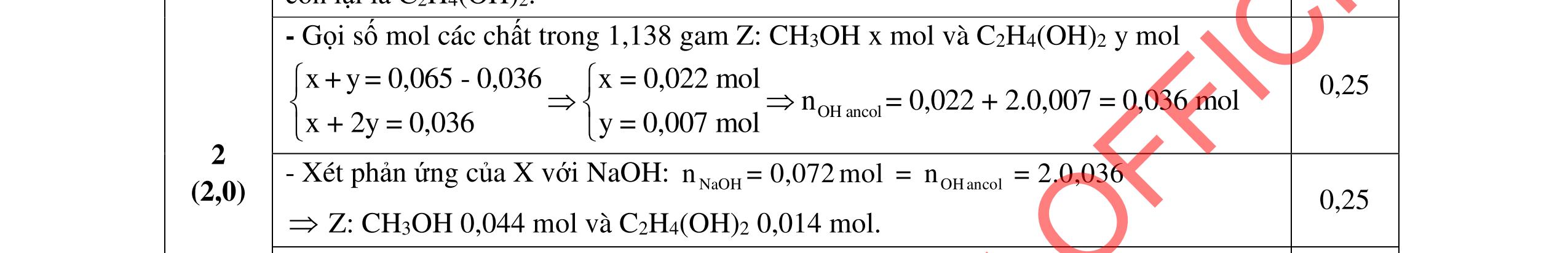
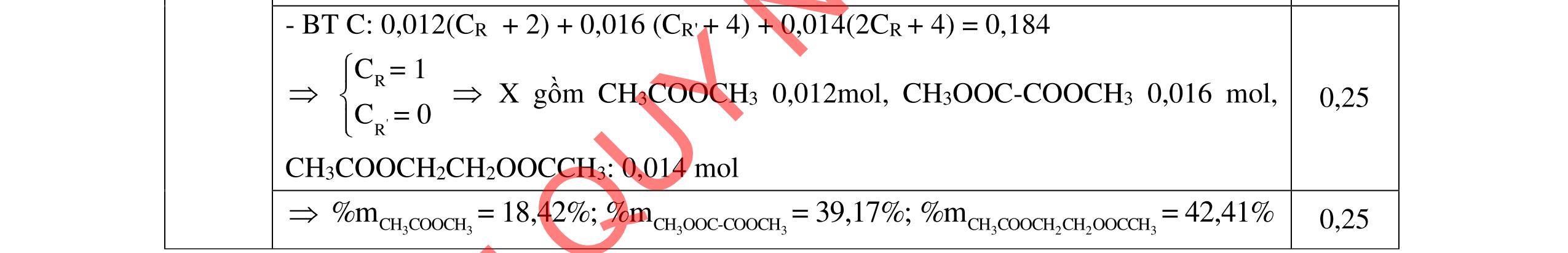
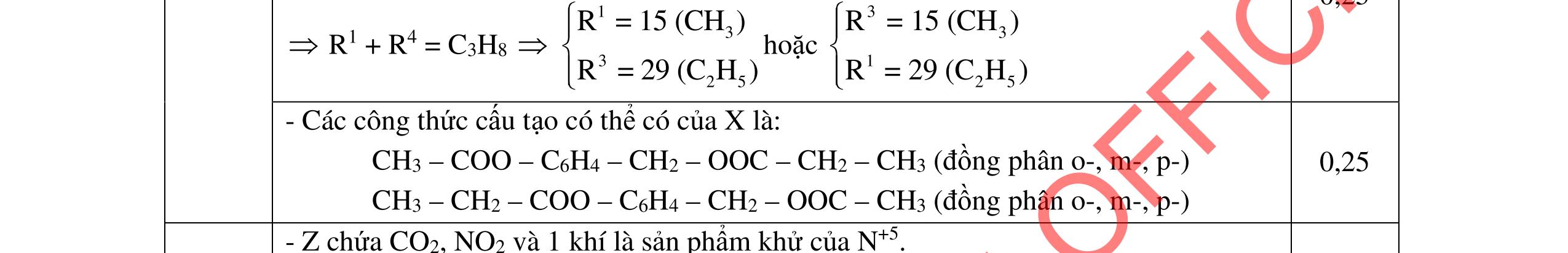
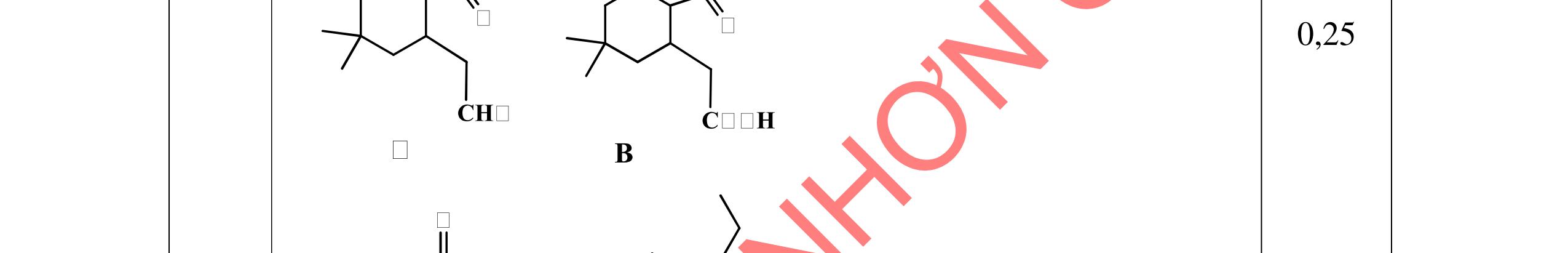
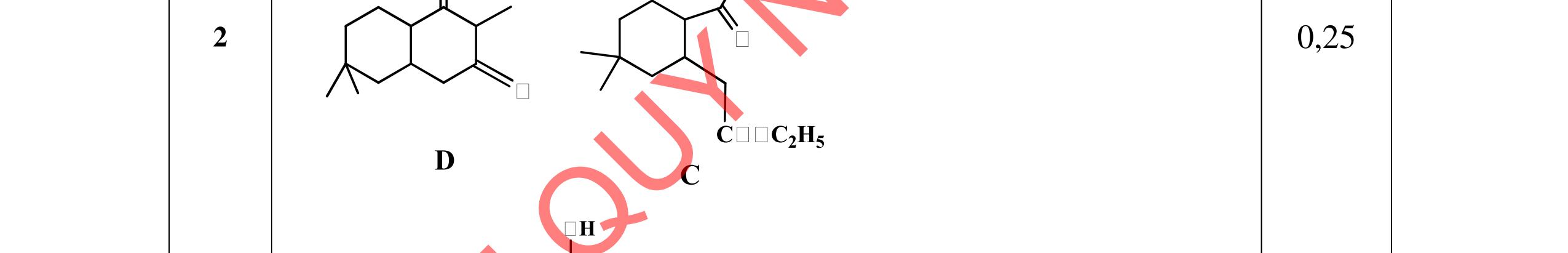
2.1. Các chất A, B, C, D đều mạch hở, có cùng công thức phân tử (C2H3O)n, là những hợp chất hữu cơ chỉ chứa một loại nhóm chức. Số nguyên tử cacbon nhỏ hơn 6. Biết:
- A, B cùng chức, tác dụng được với dung dịch NaOH và với Na kim loại, B có đồng phân hình học.
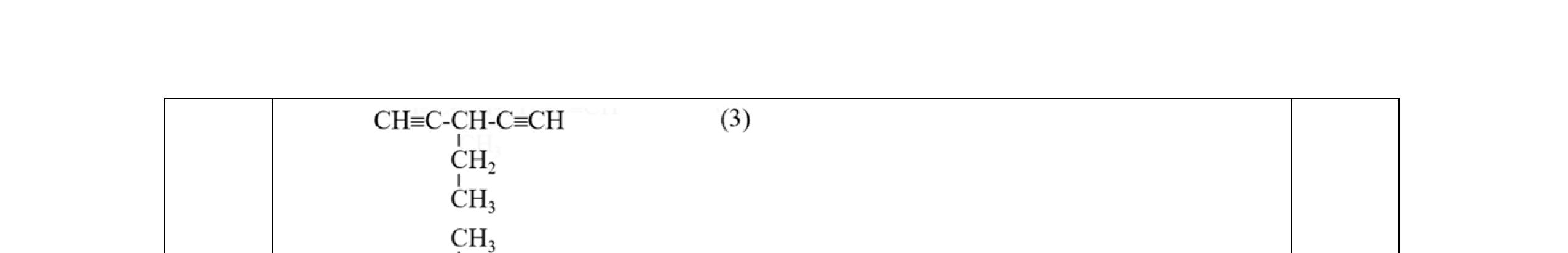
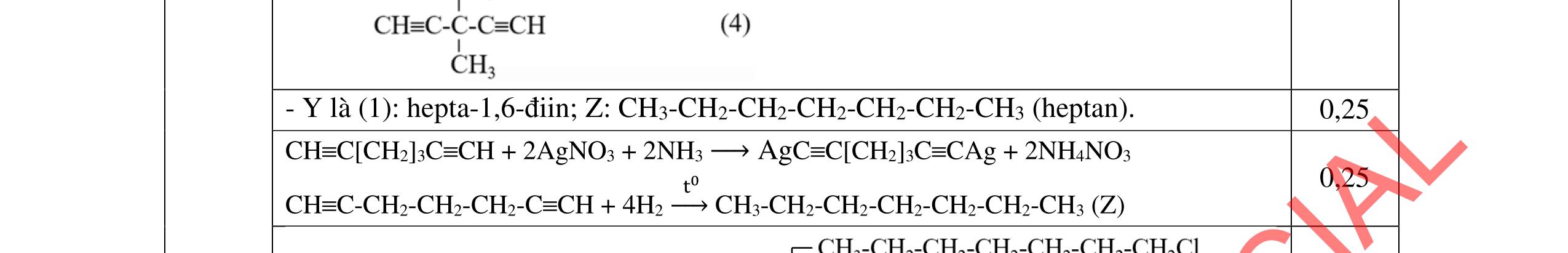
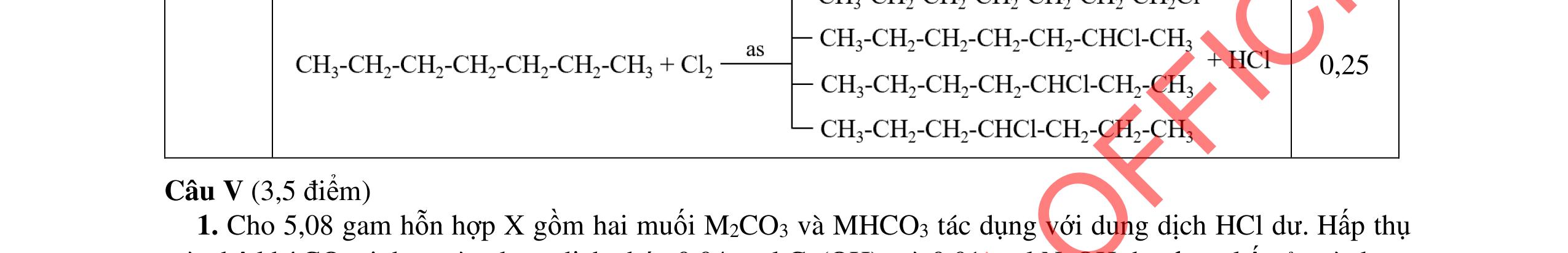
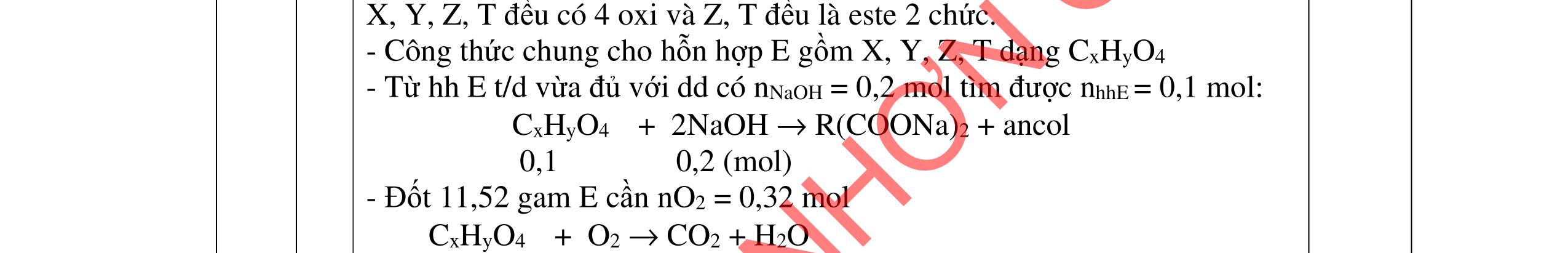
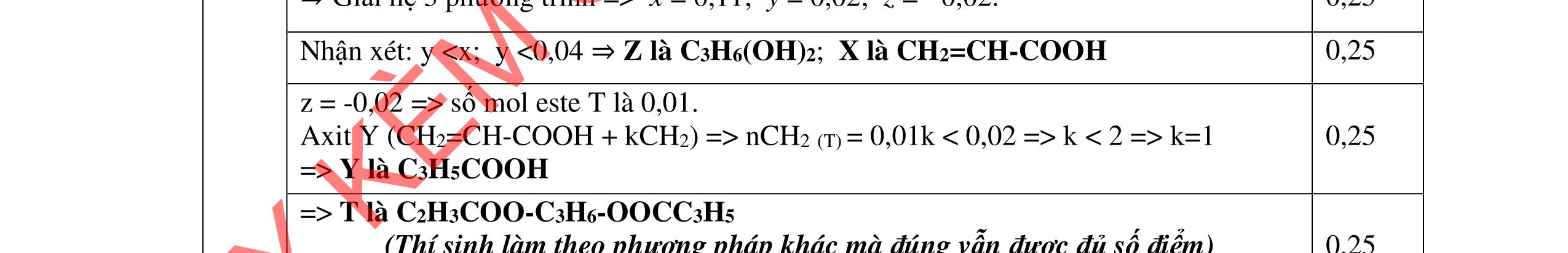
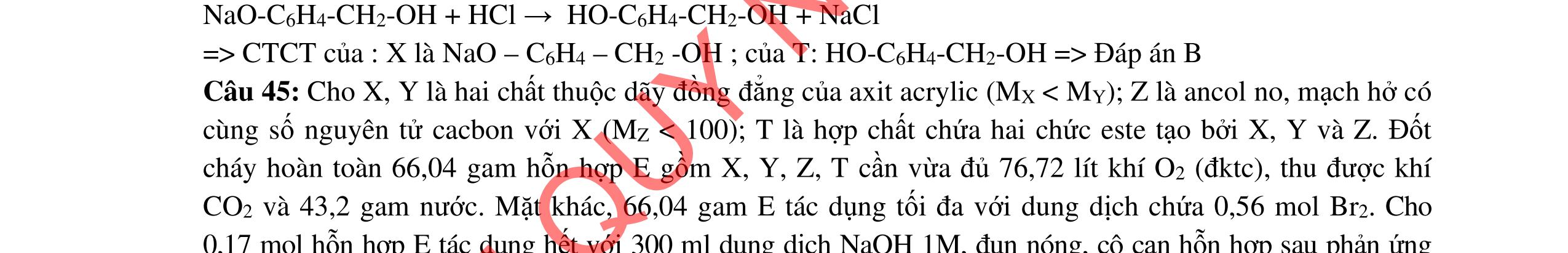
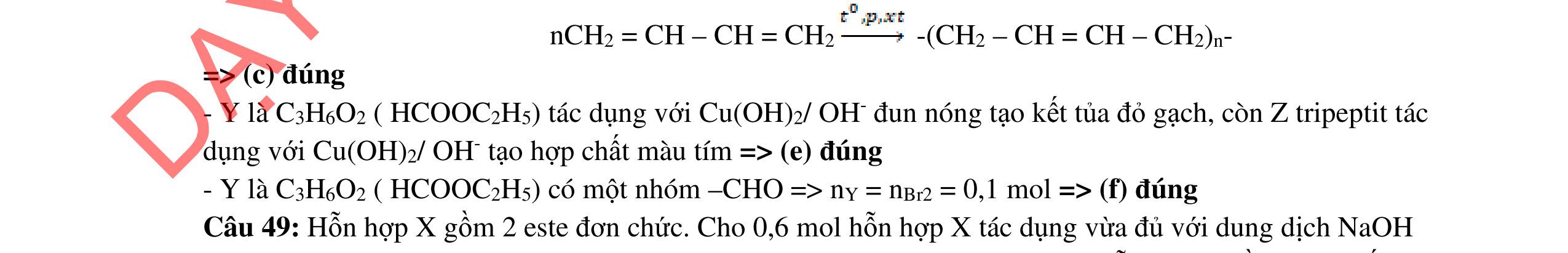
- C, D cùng chức, tác dụng được với dung dịch AgNO3 trong NH3 cho Ag kim loại. - C, D không phản ứng với dung dịch NaOH. Xác định công thức cấu tạo thu gọn của A, B, C, D và viết các phương trình hóa học xảy ra. 2.2. Hỗn hợp X chứa bốn hidrocacbon đều mạch hở và có công thức dạng CnH4 (n< 4). Đốt cháy 11,92 gam X với oxi vừa đủ thu được 0,86 mol CO2. Trộn 11,92 gam X với 0,24 mol H2, sau đó nung một thời gian (xúc tác Ni) thu được hỗn hợp khí Y có tỉ khối so với He bằng . Dẫn Y lần lượt qua bình 1 đựng dung dịch AgNO3/NH3 dư thu được m gam kết tủa, bình 2 chứa dung dịch brom dư thấy lượng brom phản ứng là 20,8 gam. Tính giá trị của m.
Câu 3 (4 điểm).
ẠYKÈMQUYNHƠNOFFICIAL
D3.1. Cho vào bát sứ nhỏ khoảng 1 gam mỡ (hoặc dầu thực vật) và 2 – 2,5 ml dung dịch NaOH 40%. Đun hỗn hợp sôi nhẹ và liên tục khuấy đều bằng đũa thủy tinh. Thỉnh thoảng thêm vài giọt nước cất để giữ cho thể tích của hỗn hợp không đổi. Sau 9 – 10 phút, rót thêm vào hỗn hợp 4 – 5 ml dung dịch NaCl bão hòa nóng, khuấy nhẹ. Để nguội và quan sát. Viết phương trình hóa học xảy ra? Nêu hiện tượng quan sát được? và giải thích vai trò của dung dịch NaCl bão hòa.
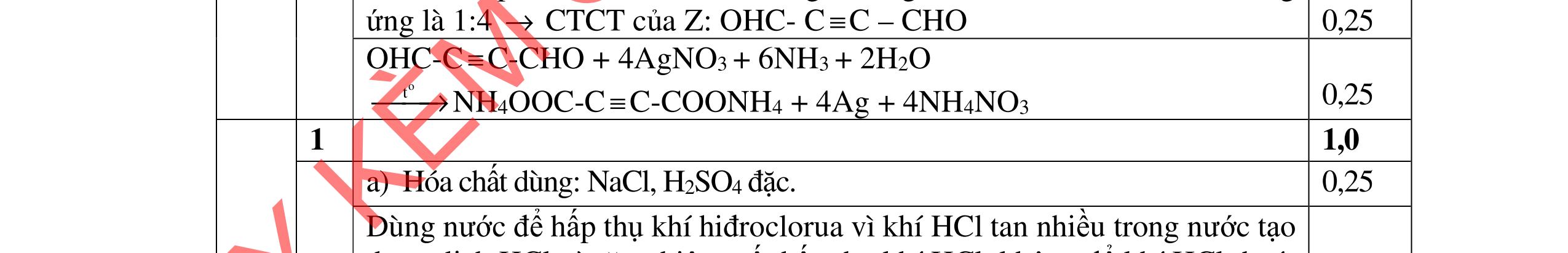
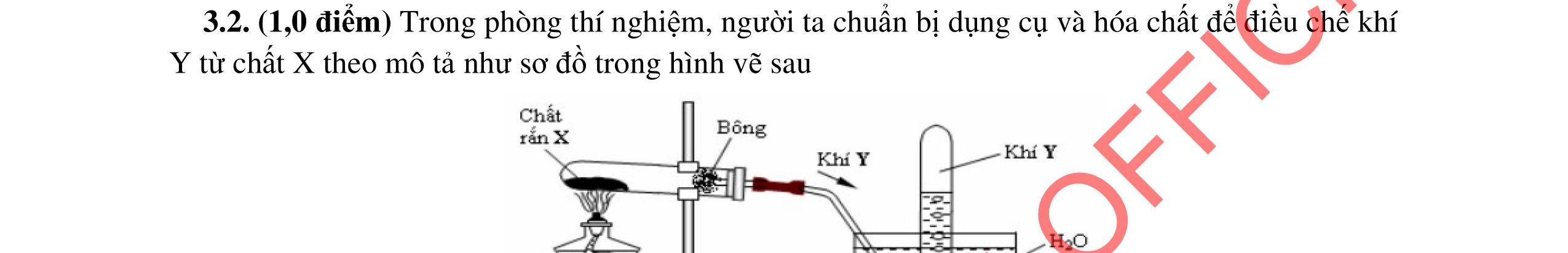
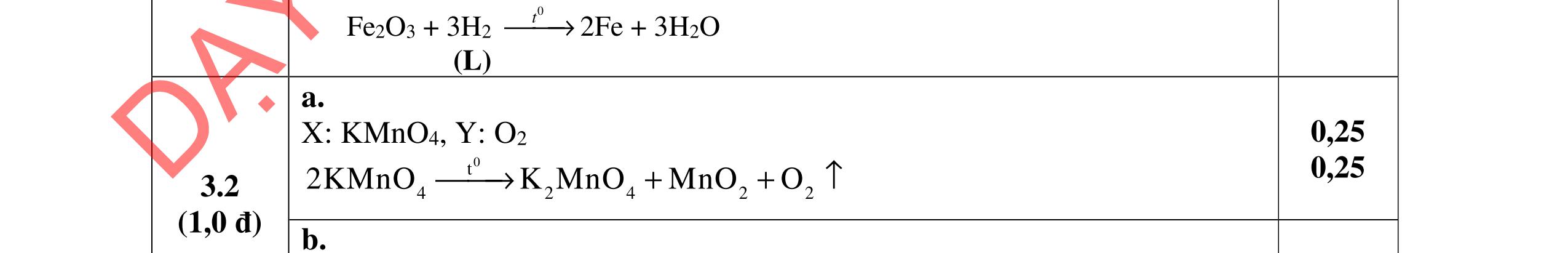
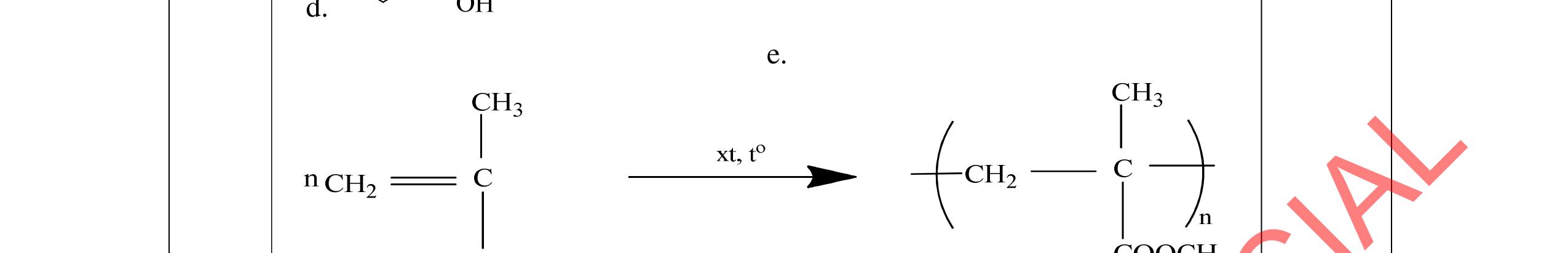
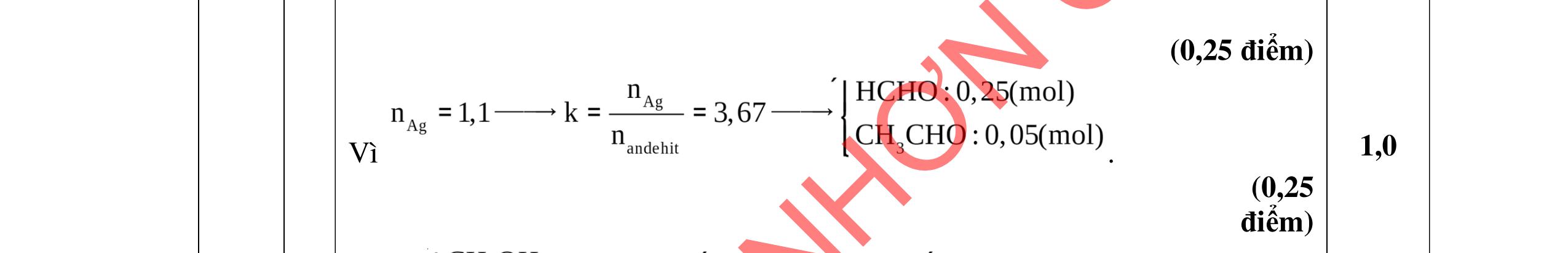
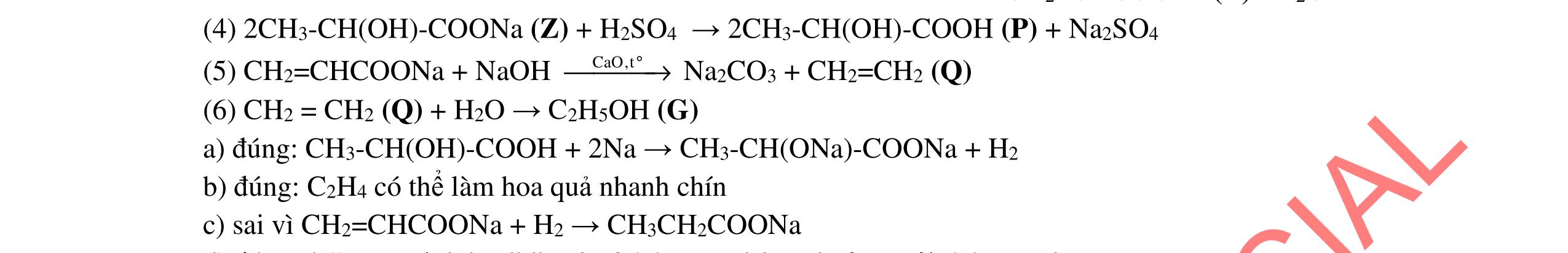
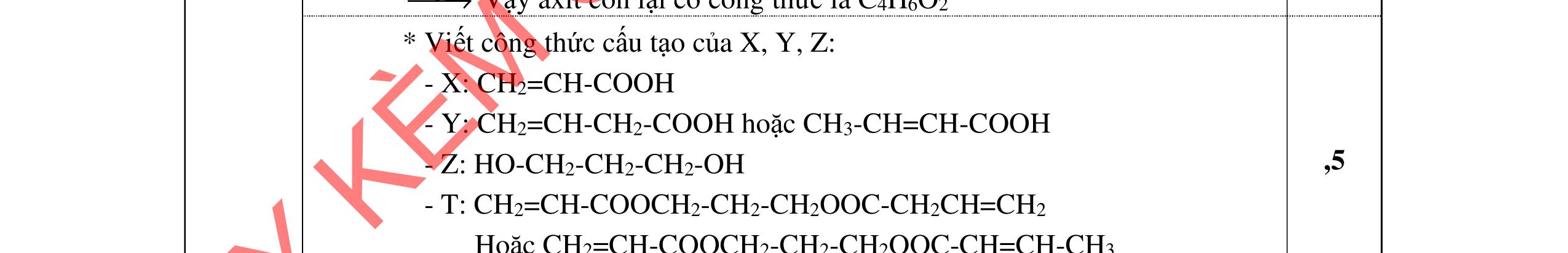
3.2. Chất hữu cơ X mạch hở, chỉ chứa một loại nhóm chức có công thức phân tử C4H6O4. Khi đun X với dung dịch HCl loãng thu được 2 chất hữu cơ Y và Z (MY < MZ) đều có phản ứng tráng gương. Xác định công thức cấu tạo thu gọn của X, Y, Z và viết các phương trình hóa học minh họa.
SỞ GIÁO DỤC VÀ ĐÀO TẠO TỈNH BÀ RỊA – VŨNG TÀU
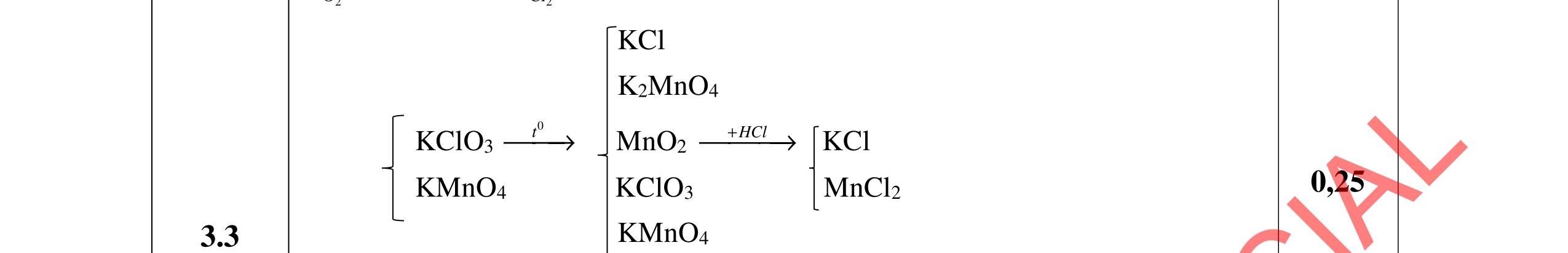
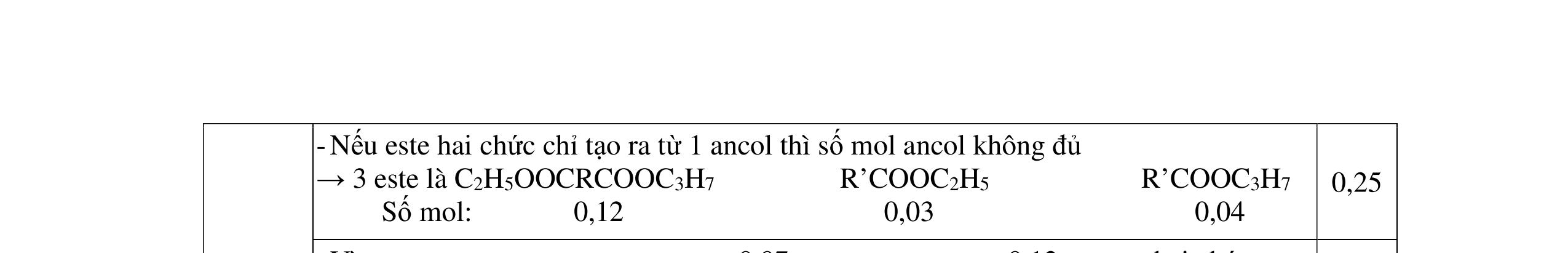
3.3. Cho m gam hỗn hợp X gồm 3 este đơn chức, mạch hở tác dụng với lượng vừa đủ dung dịch KOH đun nóng, sau phản ứng thu được dung dịch Y. Làm bay hơi Y thu được 85,3 gam hỗn hợp Z gồm 3 muối và phần hơi chứa 26,4 gam hai ancol là đồng đẳng kế tiếp nhau. Đốt cháy toàn bộ hỗn hợp X thu được 0,425 mol K2CO3, 1,625 mol CO2 và 0,975 mol H2O. a/ Tìm công thức cấu tạo các este. b/ Từ nhôm cacbua và các chất vô cơ có đủ hãy viết các phương trình phản ứng điều chế este có phân tử khối nhỏ nhất.
Câu 4.(4 điểm)
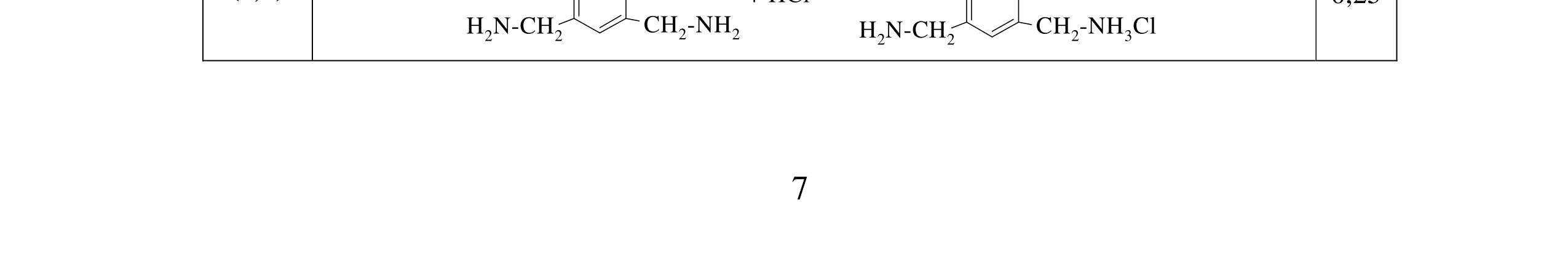
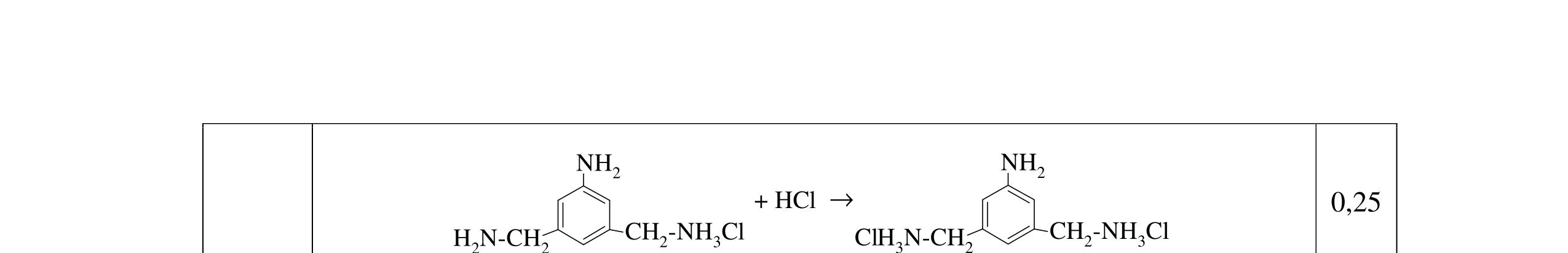
4.1. Tiến hành thí nghiệm theo các bước Bước 1: Nhỏ vài giọt anilin vào ống nghiệm chứa 5 ml nước cất, lắc đều Bước 2: Nhỏ tiếp dung dịch HCl đặc vừa đủ vào ống nghiệm
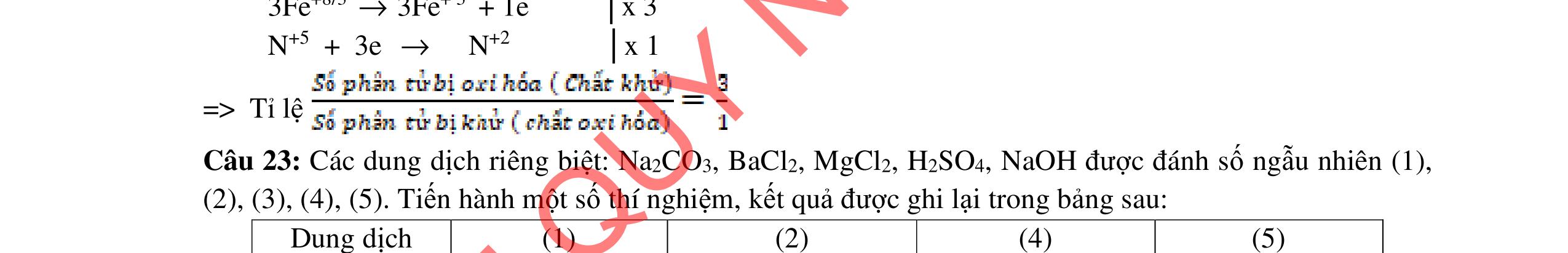
Bước 3: Cho tiếp lượng vừa đủ dung dịch NaOH loãng và đun nóng
a/ Nêu hiện tượng ở mỗi bước, có giải thích. b/ Nhúng quỳ tím vào dung dịch thu được sau mỗi bước, quỳ tím thay đổi như thế nào (có giải thích)?
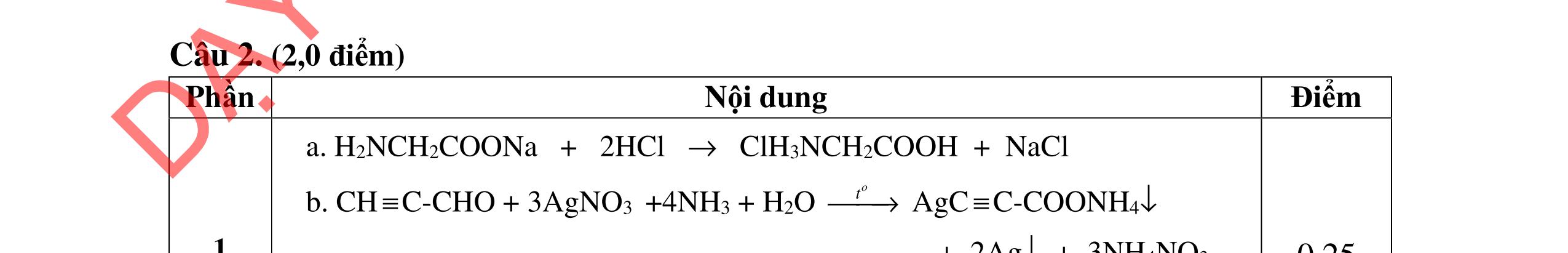
4.2. Cho các phương trình phản ứng sau: C9H22O4N2 (A) + NaOH → (B) + (C) + (G) + (X); (B) + 2HCl → (D) + (Z); (E) + HCl → (D); (E) → Tơ nilon-6 + (X); (C) + HCl → (I) + (Z); (I) + (F) → este có mùi chuối chín + (X) Xác định công thức cấu tạo của A, B, C, F.
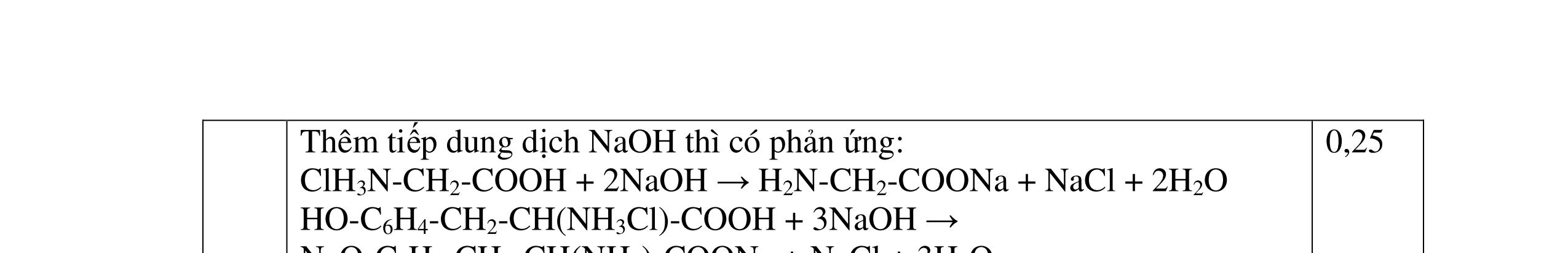
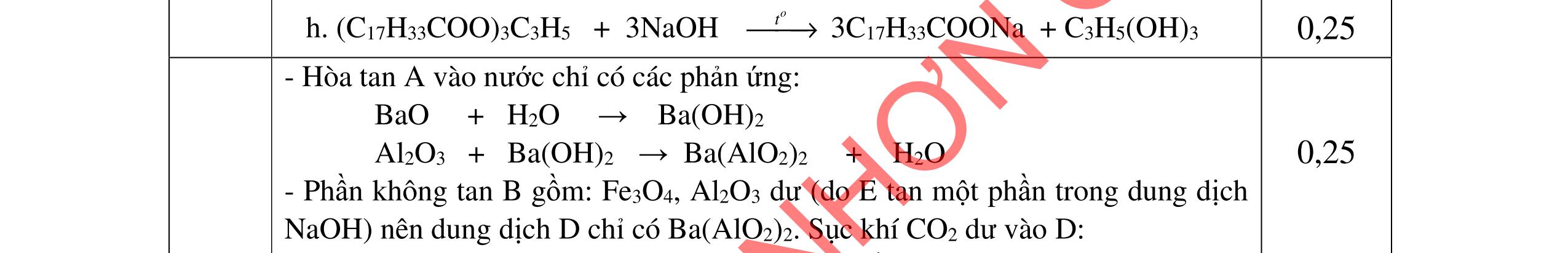
4.3. Hỗn hợp X gồm gly-lys và 0,03 mol amino axit Y mạch hở. Cho X tác dụng với dung dịch gồm 0,05 mol NaOH và 0,02 mol KOH đun nóng, thu được dung dịch Z. Dung dịch Z tác dụng vừa đủ với 80 ml dung dịch gồm HCl 1M và H2SO4 0,5M, thu được dung dịch T chứa 15,29 gam chất tan đều là muối. a/ Tìm công thức cấu tạo của Y. b/ Đốt cháy hoàn toàn lượng hỗn hợp X trên thu được hỗn hợp khí E. Dẫn hỗn hợp khí E vào 200 ml dung dịch Ca(OH)2 1M, sau phản ứng thu được dung dịch F. Hãy cho biết khối lượng dung dịch F tăng hay giảm so với khối lượng dung dịch Ca(OH)2 ban đầu?
Câu 5. (4 điểm)
5.1. Thân tàu biển được chế tạo bằng gang thép. Gang thép là hợp kim của sắt, cacbon và một số nguyên tố khác. Đi lại trên biển, thân tàu tiếp xúc thường xuyên với nước biển nên sắt bị ăn mòn, gây hư hỏng, thiệt hại về mặt kinh tế. Hãy nêu hai phương pháp bảo vệ thân tàu để hạn chế sự ăn mòn của vỏ tàu khi đi trên biển và giải thích?
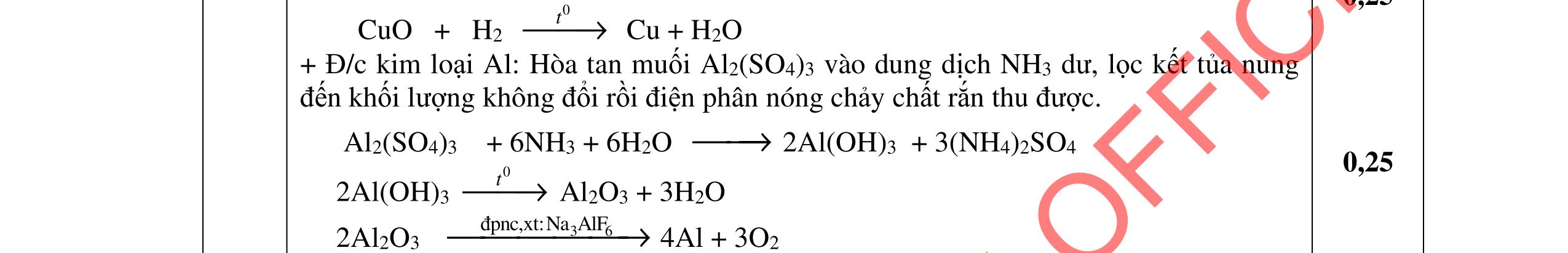
5.2. Tách riêng từng kim loại ra khỏi hỗn hợp gồm Ag, Fe, Cu (sao cho lượng kim loại thay đổi không đáng kể và phương pháp sử dụng không được trùng lập) và viết các phương trình phản ứng xảy ra.
ẠYKÈMQUYNHƠNOFFICIAL
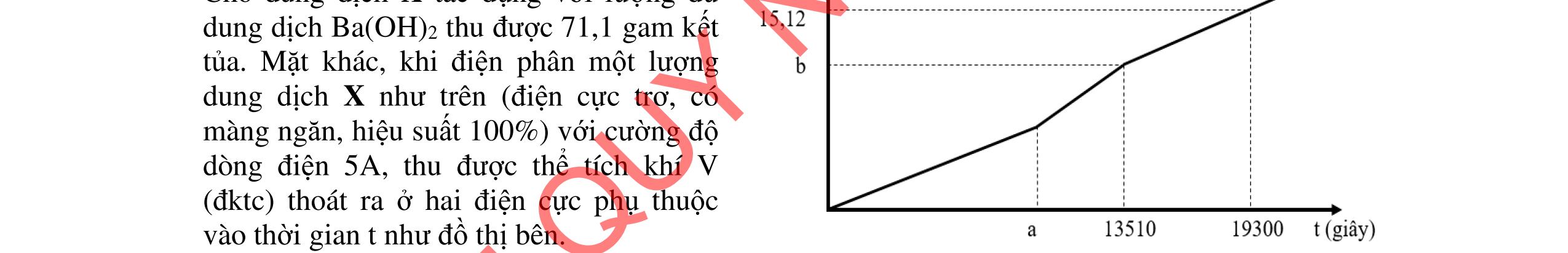
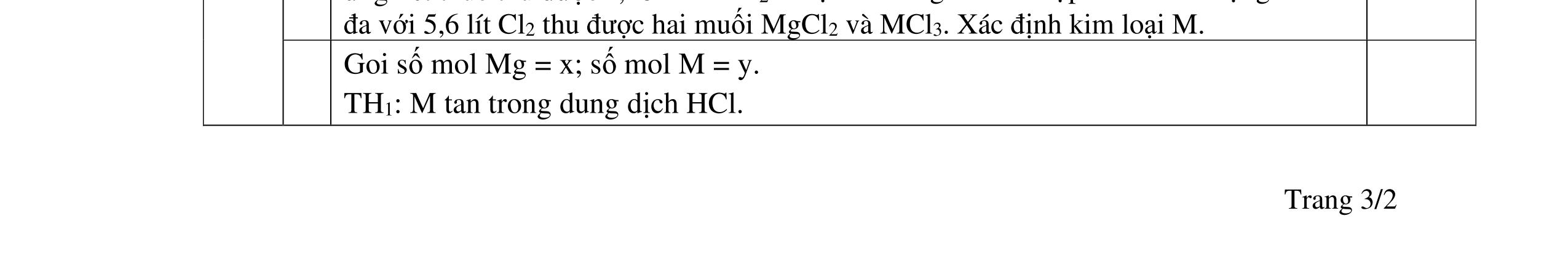
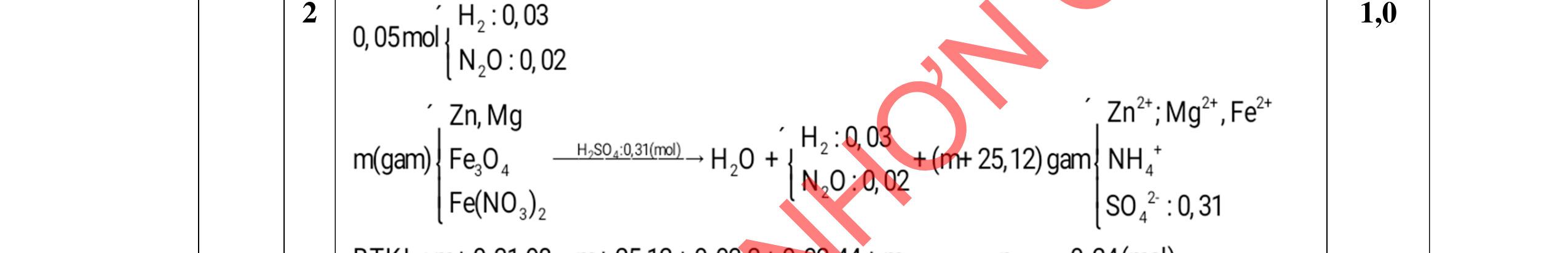
D5.3. Cho m gam X gồm Mg, Fe tác dụng hết với dung dịch HNO3 thu được dung dịch A chỉ chứa các muối và 1,792 lít ĐKTC hỗn hợp X gồm N2, NO, N2O, NO2 trong đó N2 và NO2 có % thể tích bằng nhau có tỉ khối của Z so với heli bằng 8,375 (không còn sản phẩm khử nào khác). Điện phân dung dịch A đến khi catot bắt đầu có kim loại bám thì dùng điện phân, thể tích khí thu được ở anot 0,224 lít đktc. Nếu cho m gam X vào dung dịch E chứa FeCl3 0,8M và CuCl2 0,6M thì thu được dung dịch Y và 7,52 gam rắn gồm 2 kim loại. Cho dung dịch AgNO3 dư vào Y thu được 29,07 gam kết tủa. a/ Tính m? b/ Nhúng thanh Mg vào dung dịch E, sau một thời gian lấy thanh Mg ra cân lại thì thấy khối lượng tăng thêm 1,2 gam. Tính khối lượng Mg đã phản ứng? …………HẾT…………
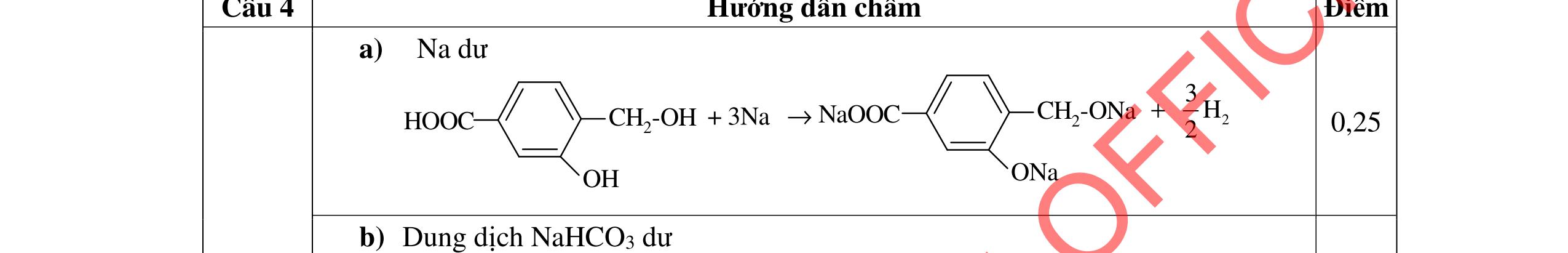
1.1. 2,0đ
Lập luận xác định: (X1) là NaHSO4; (X2) là Ba(HCO3)2; (X3) là Ba(OH)2; (X4) là Na2SO4 và (X5) là KHCO3
1,0
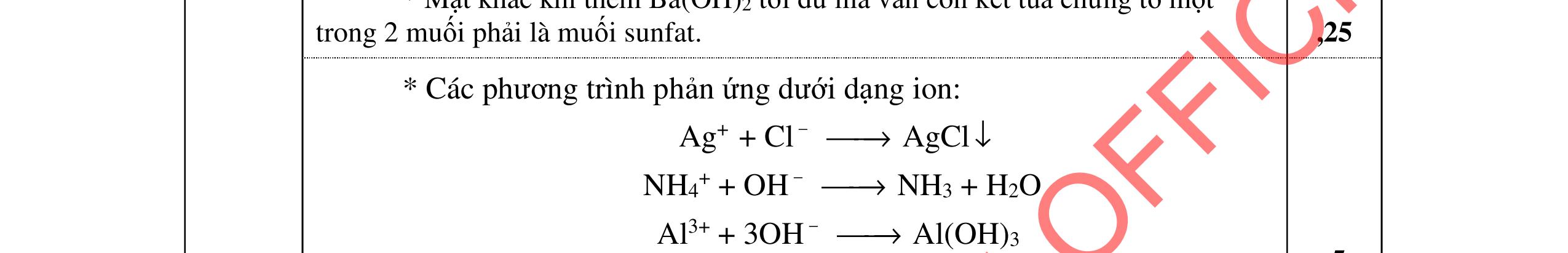
Các phương trình xảy ra: Ba2+ + 2HSO4 + 2HCO3 → BaSO4 + 2CO2 + SO4 2- + 2H2O 0,25
Ba2+ + OH + HCO3 → BaCO3 + H2O 0,25
PTHH: 2MS + (2 + 0,5n)O2 MzOn + 2SO2 x 0,5x(2+0,5n) 0,5x x M2On + 2nHNO3 2M(NO3)n + nH2O 0,5x xn х
Ta có: m ddHNO3 = , .100= BTKL: mM2On = x.(M + 32) + 32.0,5x.(2 + 0,5n) - 64x = xM + 8.xn
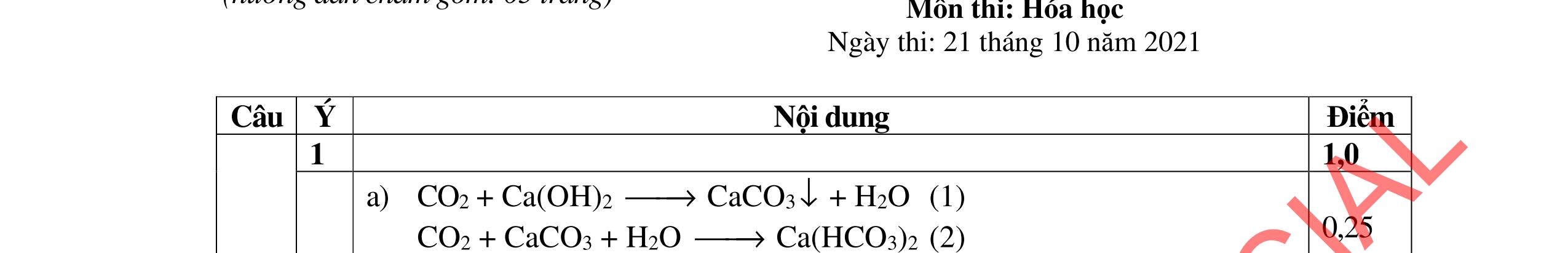
HƯỚNG DẪN CHẤM ĐỀ THI CHÍNH THỨC MÔN THI: HÓA HỌC (Hướng dẫn chấm gồm có 06 trang ) Câu Ý Nội dung Điểm Câu 1. 4,0 đ
0,25
BTKL: m ddM(NO3)n = + +8 = +
0,25 C% M(NO3)n = ( ) 100 = 41,72 M = 18,653n
Ba2+ + SO4 2- → BaSO4 0,25 Ba2+ + 2HSO4 + 2OH → BaSO4 + SO4 2 + 2H2O 0,25 1.2. 2,0 đ
0,25 Nghiệm thỏa mãn là n=3 và M = 56 (Fe). 0,25 x= nFeS = 0,05 mol m dd Fe(NO3)3 = , +0,0556 = 29 gam Sau khi làm lạnh: m dd Fe(NO3)3 = 29 8,08 = 20,92 gam
0,25 Đặt nFe(NO3)3 = y mol C% Fe(NO3)3 = , .100 = 34,7 => y = 0,03 mol 0,25
ẠYKÈMQUYNHƠNOFFICIAL
BT Fe: nFe(NO3)3 rắn = 0,05 - 0,03 = 0,02 mol mFe(NO3)3 rắn = 242.0,02 = 4,48 gam < 8,08 gam Muối rắn là muối ngậm nước
0,25 mH20 = 8,08 - 4,84 = 3,24 gam => nH2O = 0,18 mol
Ta có: nFe(NO3)3 rắn : nH2O = 0,02 : 0,18 = 1:9 Vậy công thức muối rắn là Fe(NO3)3.9H3O
0,25 Câu 2.1. - Theo giả thiết: 2n < 6 => n < 3 => n=2 (do số H là số chẵn) 0,25
SỞ GIÁO DỤC VÀ ĐÀO TẠO TỈNH BÀ RỊA – VŨNG TÀU ĐỀ THI CHỌN HỌC SINH GIỎI LỚP 12 NĂM HỌC 2021 - 2022
D
2.
4,0đ
2,0đ
=> A, B, C, D có CTPT: C4H6O
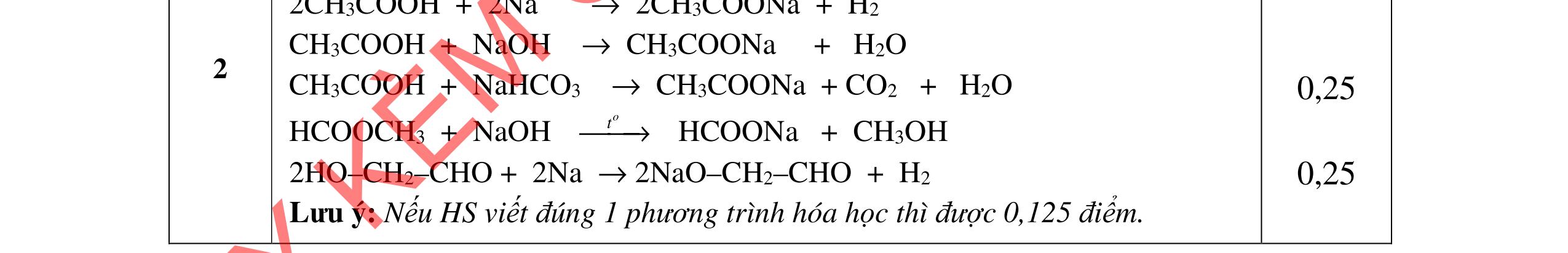
- A, B tác dụng với Na, NaOH => A, B là axit
=> CTCT của: (A) CH2=CH-CH2-COOH hoặc CH2=C(CH3)-COOH (B) CH3-CH=CH-COOH 0,25 0,25
PTHH: 2C3H5-COOH + 2Na → 2C3H5-COONa + H2 C3H5-COOH + NaOH → C3H5-COONa + H2O
- C, D tác dụng với dung dịch AgNO3 trong NH3 cho Ag kim loại => C, D là anđehit
=> CTCT của: (C) OHC-CH2-CH2-CHO; (D) OHC-CH(CH3)-CHO 0,25 0,25
PTHH: C2H4(CHO)2 + 4AgNO3 + 6NH3 + 2H2O C2H4(COONH4)2 + 4Ag + 4NH4NO3
Đặt nO2 = x mol; nH2O = y mol
BT O: 2x - y = 0,86.2 (1)
BTKL: 11,92 + 32x = 18y + 0,86.44 (2)
0,25
2.2. 2,0đ
Từ (1,2) => x = 1,26 và y = 0,8 mol 0,25
BT H => 4.nX = 2.0,8 => X = 0,4 mol
BTKL: mY= mX + mH2 = 11,92 + 0,24.2 = 12,4 gam
Ta có: MY = .4= => nY = 0,45 mol 0,25
=> nH2 dư = nY - nX = 0,05 mol
=> nH2 phản ứng = 0,24 - 0,05 = 0,19 mol 0,25
Do n < 4 => X gồm: CH4 (a mol); CH2=CH2 (b mol); CH3-C≡CH (c mol); CH2=C=CH2 (d mol) 0,25
=> X = a + b + c + d = 0,4 (3)
BT C: a + 2b + 3c + 3d = 0,86 (4) 0,25
BT mol pi: b +2c + 2d = 0,19 +0,13 + 2.nCH3-C≡CH dư (5) 0,25 Từ (3,4,5) => nCH3-C≡CH dư = 0,07 mol 0,25 CH3-C≡CH + AgNO3 + NH3 → CH3-C≡CAg + NH4NO3 0,07 0,07 mol => m = 0.07.147 = 10,29 gam 0,25
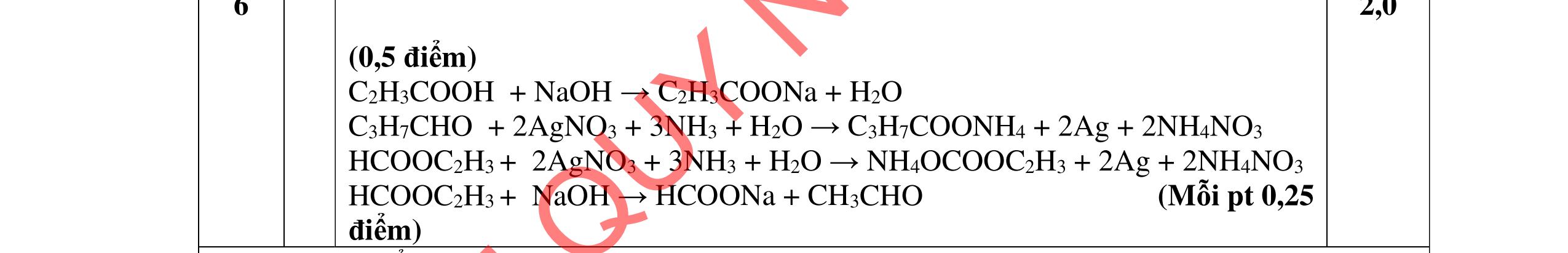
u thấy chất béo tan dần tạo dung dịch màu trắng| 0,25 sữa, có một ít xà phòng kết tinh màu trắng nổi lên. 0,25 - Sau khi thêm NaCl thì sự phân lớp rõ rệt hơn, chất rắn nổi lên nhiều hơn 0,25 - Vai trò của dung dịch NaCl bão hòa là tăng khối lượng riêng của dung 0,25 DẠYKÈMQUYNHƠNOFFICIAL
Câu 3. 4,0đ 3.1 1,0đ PTHH: (RCOO)3C3H5 + 3NaOH ot → 3RCOONa+ C3H5(OH)3 0,25 Hiện tượng: - Khi đun và khuấy đề
dịch và hạn chế độ điện ly của xà phòng, tạo sự tách lớp giữa xà phòng và chất lỏng. 3.2 1,0đ
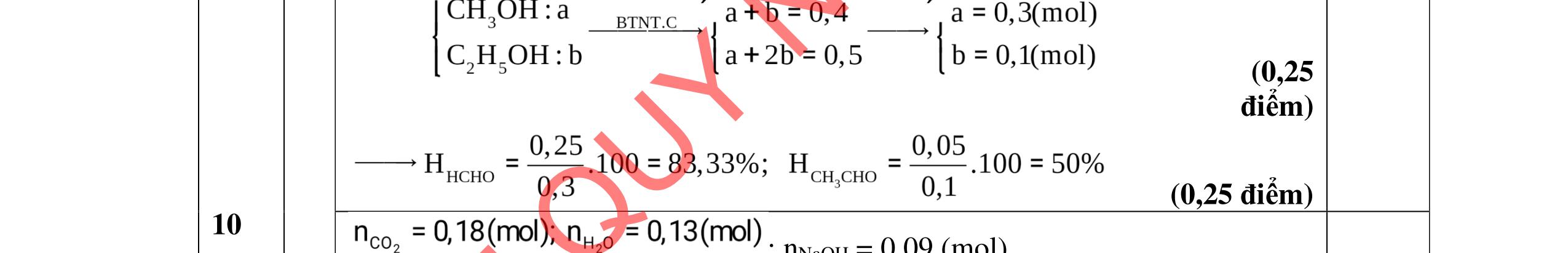
Vì X chỉ chứa một loại nhóm chức, khi đun nóng X với dung dịch HCl thu được 2 chất hữu cơ Y và Z (MY < MZ) đều có phản ứng tráng gương nên công thức cấu tạo của X, Y, Z là: (X): (HCOO)2CH-CH3; (Y): CH3CHO; (Z): HCOOH 0,25 PTHH: (HCOO)2CH-CH3 + H2O ⇄ 2HCOOH + CH3CHO 0,25 CH3CHO + 2AgNO3 + 3NH3 + H2O CH3COONH4 + 2Ag + 2NH4NO3 0,25 HCOOH + 2AgNO3 + 4NH3 + H2O (NH4)2CO3 + 2Ag + 2NH4NO3 0,25 3.3 2,0đ
YKÈMQUYNHƠNOFFICIAL
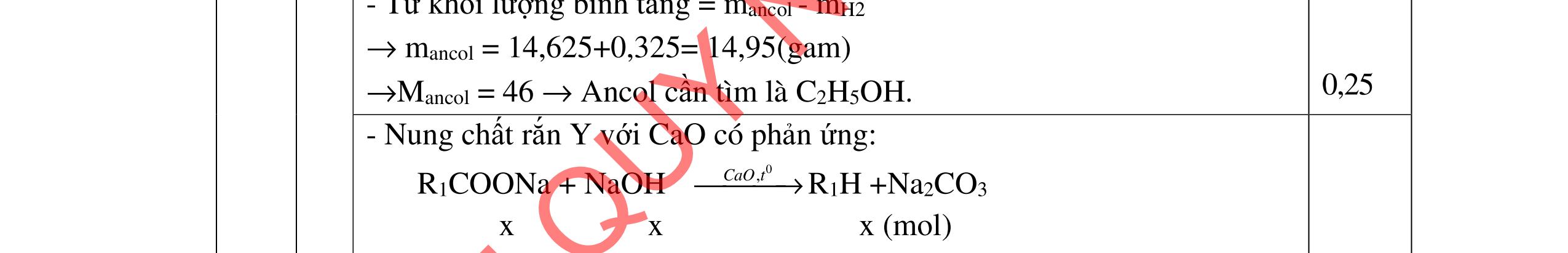
DẠ
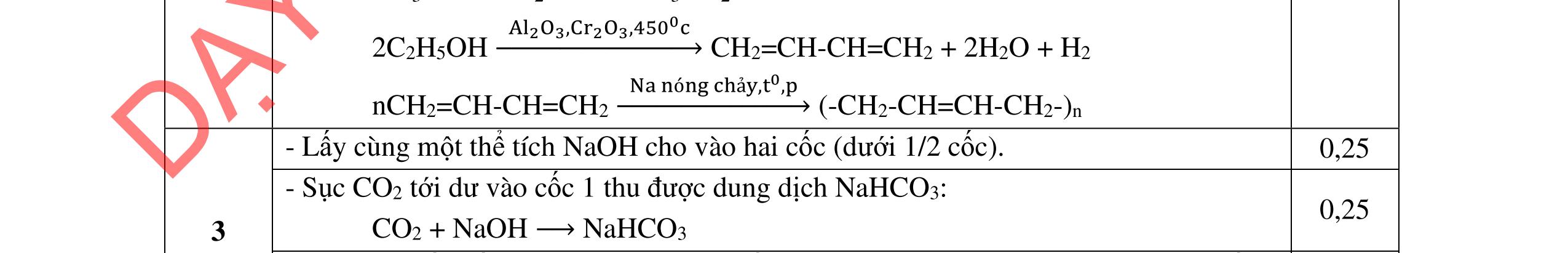
a/ Đốt muối có nK= 0,85 mol; 2,05 mol C và 0,975 mol H2O + TH1: không có este phenol nCOO- = 0,85 mol n ancol = 0,85 mol M ancol = 26,4/0,85 = 31 (loại) + TH2: có este phenol Quy đổi hh muối C6H5OK a HCOOK b CH2 c -H2 d a+b=0,85 6a +b+c=0,05 (bảo toàn C) 5a +b+2c -2d =0,975.2 (bảo toàn H) 132a+ 84b + 14c - 2d = 85,3 a = 0,1 mol; b = 0,75 mol; c = 0,7 mol; d = 0,35 n ancol = 0,75 - 0,1= 0,65 mol M ancol = 26,4/0,65 = 40,6 => 2 ancol CH3OH x mol và C2H5OH y mol x + y = 0,65 32x + 4y = 26,4 => x = 0,25; y = 0,4
Ta có 3 este: -COOC6H5: 0,1 (1) -COOCH3 : 0,25 (2) -COOC2H5: 0,4 (3)
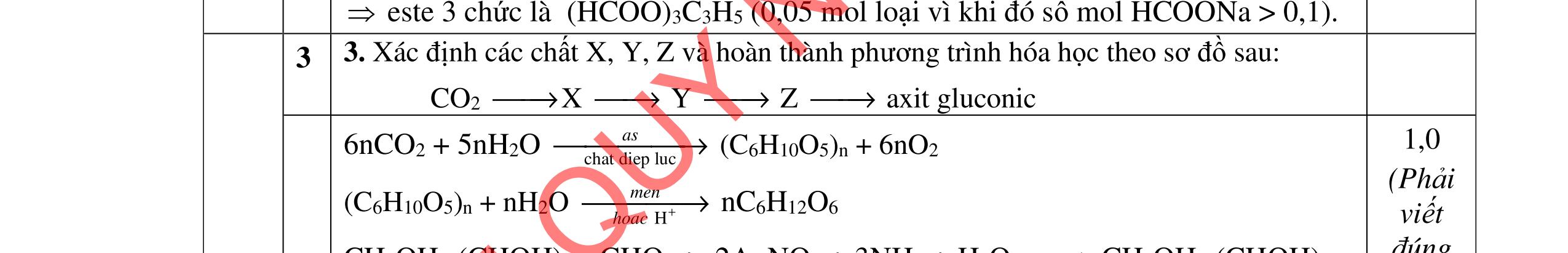
Bảo toàn pi 0,35 = 0,1. Số pi/1 + 0,25. Số pi/2 + 0,4. Số pi/ 3 Bảo toàn CH2
0,25 0,5 0,25 0,25
0,7 = 0,1. Số CH2 /1 + 0,25. Số CH2 /2 + 0,4. Số CHz / 3 pi = 1 = Số CH2 = 2
CT 3 este: C2H3-COOC6H5: 0,1
C2H3-COOCH3: 0,25 H-COOC2H5: 0,4
(Ra đúng CT3 este: 1,5đ) b/ Điều chế HCOOC2H5 Al4C3 + 12H2O → 3CH4 + 4Al(OH)3
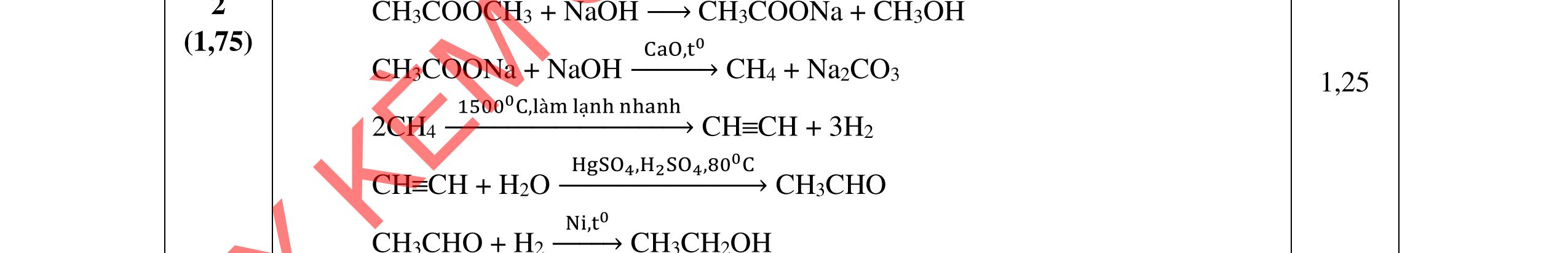
CH4 + O2 (xt) HCHO + H2O HCHO + 1/2O2 (xt) HCOOH
2CH4 (1500oC ; làm lạnh nhanh) C2H2 + 3H2
C2H2 + H2 (xt) C2H4 C2H4 + H2O (xt) C2H5OH
HCOOH + C2H5OH (H2SO4 đặc, to) ⇄ HCOOC2H5 +H2O.
a) - Ở bước 1 anilin hầu như không tan, nó tạo vẫn đục và lắng xuống đáy
- Ở bước 2 thì anilin tan dần thu được dd trong suốt
4.1 1,0đ
C6H5NH2 + HCl → C6H5NH3Cl (tan) - Kết thúc bước 3, anilin được tạo thành vấn đục và lắng xuống đáy
C6H5NH3Cl + NaOH → C6H5NH2 + H2O + NaCl
0,25 0,25 0,25 Câu 4 2đ
b) Nhúng quỳ tím vào dd thu được sau mỗi bước, quỳ tím thay đổi như thế nào? - Ở bước 1 và 3 quỳ tím không đổi màu vì anilin có tính bazo yếu Ở bước 2, quỳ tím hóa đỏ vì C6H5NH3 + + H2O → C6H5NH2 +H3O+
0,25 0,25 0,25 0,25 4.2 1,0đ
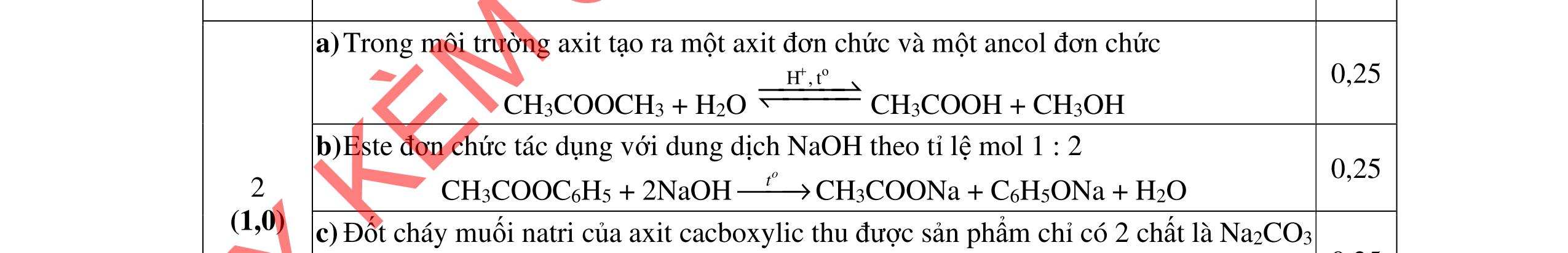
Công thức cấu tạo của A: CHCOONH3-[CH2]5-COONH3CH3 B: NH2- [CH2]5-COONa C: CH3COONa F: CH3CH(CH3)CH2CH2OH
YKÈMQUYNHƠNOFFICIAL
0,25 0,25 0,25 0,25 4.3 2,0đ
a) nH+ = 0,16 mol; nOH = 0,07 mol OH + H+ → H2O => nH+ phản ứng với hhX = 0,16 – 0,07 = 0,08 mol Y tối đa chỉ có 2 nhóm –NH2 + TH1: Y có 1 nhóm -NH2 Gly-lys + H2O + 3H+ → GlyH+ + lysH2 2+ ngly-lys = (0,09 - 0,03)/3=0,02 mol M ionYH+ = (15,29 - 0,05.23 - 0,02.39 - 0.08.35,5 - 0,04.96 - 0,02.760,02.148)/0,03=73,33 (loại). + TH2: Y có 2 nhóm –NH2 ngly lys = (0,09 0,03.2)/3=0,01 mol
0,25 0,25
DẠ
M ion YH2+ = (15,29 - 0,05.23 - 0,02.39 - 0,08.35,5 - 0,04.96 - 0,01.760,01.148)/0,03 = 148g/mol
MY = 146 g/mol
CT Y: C5H9(COOH)(NH2)2
b/ gly-lys: 0,01 mol C5H9(COOH)(NH2)2: 0,03 mol
nCO2 = 0,03.6 + 0,01. 8 = 0,26 mol nH2O = (0,03.14 + 0,01.17)/2 = 0,295 mol nOH /nCO2 = 0,4/0,26 =1,53
CaCO3 a mol và Ca(HCO3)2 b mol
Bảo toàn C: a+2b = 0,26
Bảo toàn Ca: a+b= 0,2 nCaCO3= 0,14 mol
Ta có: m CaCO3 - mCO2 - m H2O=0,14.100 - 0,26.44 - 0,295.18=2,75g.
Vậy khối lượng dung dịch tăng 2,75g
0,25 0,25 0,25 0,25 0,25 0,25 5.1 1,0đ
Hai phương pháp bảo vệ thân tàu: - Phương pháp bề mặt: Sơn phủ bề mặt thân tàu nhằm không cho gang thép của thân tàu tiếp xúc trực tiếp với nước biển. - Phương pháp điện hóa: vì ở phía đuôi tàu, do tác động của chân vịt, nước bị khuấy động mãnh liệt nên biện pháp sơn là chưa đủ. Do đó, phải gắn tấm kẽm vào đuôi tàu.
→ Khi đó sẽ xảy ra quá trình ăn mòn điện hóa.
Kẽm là kim loại hoạt động hơn sắt nên bị ăn mòn, còn sắt thì không bị mất mát gì.
Sau một thời gian miếng kẽm bị ăn mòn thì sẽ được thay thế theo định kì. Việc này vừa đỡ tốn kém hơn nhiều so với sửa chữa thân tàu.
0,25 0,25 0,25 0,25
DẠYKÈMQUYNHƠNOFFICIAL
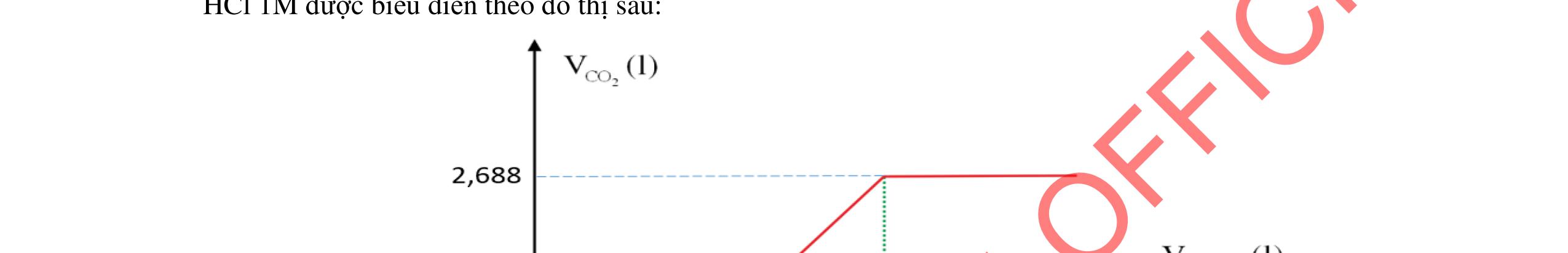
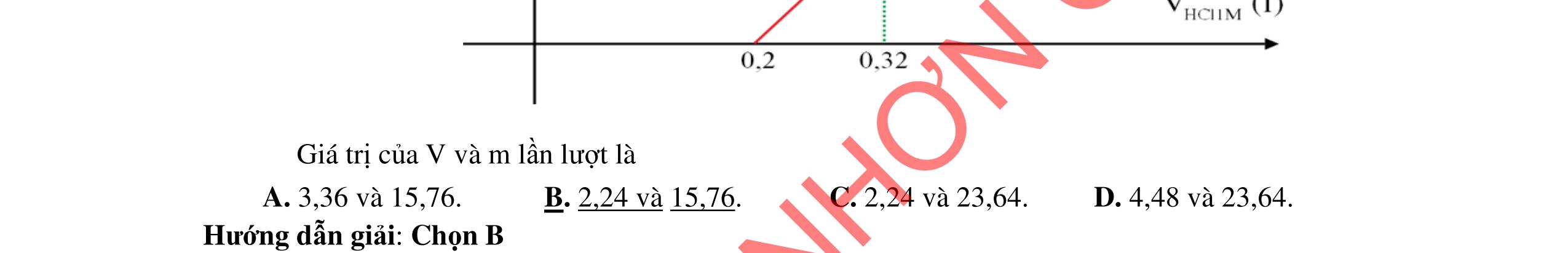
- Hoà tan hỗn hợp 3 kim loại trong dd HCl dư, tách được Cu, Ag không tan và dung dịch muối: Fe + 2HCI → FeCl2 +H2 Đpdd thu được Fe: 2HCI → H2 + Cl2 FeCl2 → Fe + Cl2 - Hỗn hợp Cu, Ag nung trong oxi đến phản ứng hoàn toàn thu được hỗn hợp rắn CuO và Ag. Hòa tan trong dung dịch HCl dư, lọc lấy Ag không tan CuO + 2HCl → CuCl2 + H2O Dung dịch thu được cho tác dụng với NaOH dư, lọc kết tủa nung đến khối lượng không đổi, dẫn luồng khí CO dư đi qua thu Cu. HCl + NaOH → NaCl + H2O CuCl2 + 2NaOH → 2NaCl + Cu(OH)2 Cu(OH)2 CuO + H2O CuO + CO Cu + CO2 Giả sử
2 2 O: a mol 2 N: 4a mol t 2 2
Câu 5
rïnghîp
+
→→
2
= +
ỉ
5.3 2,0đ Mg a mol; Fe b mol N2 và NO2 có % thể tích bằng nhau nên quy đổi hh khí về NO,
2O nNO + N2O =
nNO
30nNO
Dung dịch A gồm Mg2+;
Fe3+ + le → Fe2+ | 2H2O → 4e +
2 + 4H+ n Fe3+ = 0,04 mol Bảo toàn e:
+
Mg a mol
+ → ddY
ạ
Fe b mol
4,0đ 5.2 1,0đ DẠYKÈMQUYNHƠNOFFICIAL
2 2 2 CO:3x4y polime CH=CH–CN: x mol CH=CH HO:1,5x+ –CH 3y N:0,5x =CH:y a mol 4
+
+
2 O N BTNTO n=a=3,75.x+5,5.yn=4a=15.x+22.y 3x4y 0,1441 (3x4y)(1,5x3y)(0,5x15x22y) +
+++++
x = 0,66y
T
lệ mắt xích Butadien và Acrylonitrin là x : y ≈ 0,66 : 1 ≈ 2 : 3 0,25 0,25 0,25 0,25
N
0,08
= 0,06
+44n N2O = 0,08.33,5 = 26,8 n N2O = 0,02
Fe3+, Fe2+, NO3-
O
2a+ 2(b=0,04)
0,04.3 = 0,06.3 + 0,02.8
FeCl3 0,8x
+ 7,52g 2 kim lo
i
CuCl2 0,6x 0,25 0,25
2 kim loại là Cu, Fe => Mg hết ddY: Mg2+ : a mol ; Fe2+ : (1,8x -a) mol; Cl : 3,6x mol Bảo toàn kim loại: 56b + 0,8x.56+ 0,6x.64 = 56.(1,8x-a) +7,52 56a+ 56b - 17,6x = 7,52 Mg2+ a mol ; ddY: Fe2+ (1,8x –a); + dd AgNO3 Cl 3,6x Fe2+ + Ag+ → Ag + Fe3+ Cl + Ag+ → AgCl 29,07 = 3,6x.143,5 + (1,8x-a).108 -108a + 711x = 29,07 a = 0,06 mol; b = 0,09 mol; x=0,05 mol m= 0,06.24 +0,09.56 = 6,48g b/ dung dịch E chứa FeCl3 0,04 mol và CuCl2 0,03 mol Mg→ 2e + Mg2+ | Fe3+ + le → Fe2+ | Cu2+ + 2e → Cu | Fe2+ + 2e → Fe
Do thanh Mg tăng => Cu2+ bị khử → Cu. Giả sử Cu2+ hết
mMg thay đổi = 0,03.64 – 24.(0,03.2+ 0,04)/2 = 0,72g < 1,2g => Fe2+ bị khử k (mol) 0,03.64 + k.56 - 24.(0,03.2 + 0,04 + 2k)/2= 1,2g => k = 0,015 mol
mMg phản ứng = 24.(0,03.2 + 0,04 + 0,015.2)/2 = 1,56g
0,25 0,25 0,25 0,25 0,25 0,25
- Thí sinh có thể làm cách khác, nếu đúng vẫn đạt điểm tối đa trong mỗi câu. Nếu thiếu điều kiện hoặc thiếu cân bằng hoặc thiếu cả hai thì trừ một nửa số điểm của PTHH đó.
- Làm tròn đến 0,25 điểm. ………………………HẾT…………………….
YKÈMQUYNHƠNOFFICIAL
DẠ
Môn thi: Hoá học Ngày thi: 17 – 4 – 2022 (Đề thi gồm có 02 trang) Thời gian: 180 phút (Không kể thời gian giao đề)
Cho C = 12; H =1; O = 16; Fe = 56; Zn = 65; Cu =64; Cl = 35,5; S = 32; Ba=137; Ca = 40; N = 14; Be =9; Na = 23; K = 39; Li = 7; Ag = 108; Al = 27; P=31; Mg =24. Câu I (5,0 điểm) 1. (1,5 điểm) Cân bằng các phản ứng sau bằng phương pháp thăng bằng electron a. Cr2S3 + Mn(NO3)2 + K2CO3 →K2CrO4 + K2SO4 + K2MnO4 + NO + CO2 b. P + NH4ClO4 → H3PO4 + N2 + Cl2 + H2O c. FexOy + HNO3 → Fe(NO3)3 + NnOm + H2O
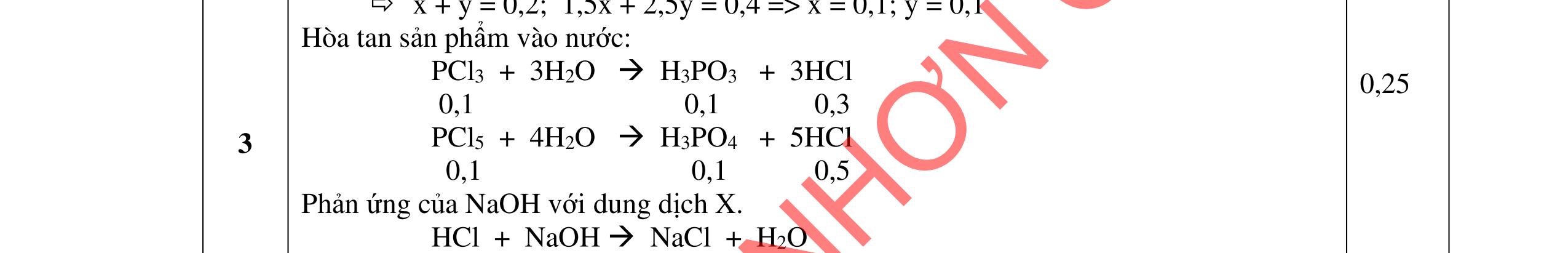
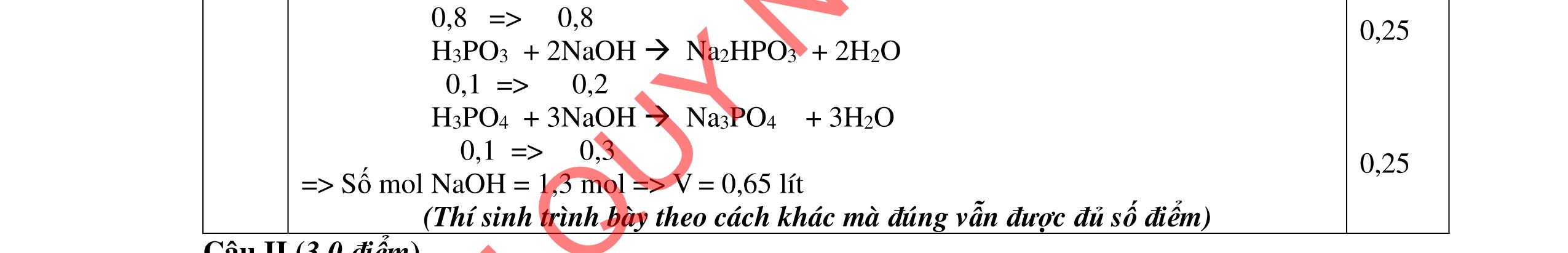
2. (1,5 điểm) Giả sử đồng vị phóng xạ U238 92 phóng ra các hạt α, β với chu kỳ bán hủy là 5.109 năm tạo thành 206 82 Pb . a. Có bao nhiêu hạt α, β tạo thành từ 1 hạt nhân U238 92 ? Viết phương trình phản ứng phân rả U238 92 ?
b. Một mẫu đá chứa 47,6mg U238 92 và 30,9mg 206 82 Pb , tính tuổi của mẫu đá đó.
3. (2,0 điểm)
Cho phản ứng: CO2 (k) + H2 (k) ⇄ CO (k) + H2O (k) (*) a. Hằng số cân bằng của phản ứng ở 8500C bằng 1. Nồng độ ban đầu của CO2 và H2 lần lượt là 0,2M và 0,8M. Tìm nồng độ các chất ở thời điểm cân bằng. b. Tính hằng số cân bằng của phản ứng ở 250C (Kp) ?
Cho biết: ∆H0 298 (kJ/mol) S0 298 (J/K.mol) H2 (k) 0 130,575 CO2 (k) 393,509 213,63 CO (k) 110,525 197,565 H2O (k) 241,818 188,716
Câu II (3,5 điểm)
1. (2,5 điểm)
Ion XYn 3- có tổng số hạt nơtron, proton, electron là 145, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 49. Số hạt mang điện trong nguyên tử X nhiều hơn số hạt mang điện trong nguyên tử Y là 14. Trong ion Y2- có tổng số hạt là 26, trong đó số hạt mang điện dương bằng số hạt không mang điện.
a. Xác định XYn 3b. Viết cấu hình electron của X? Xác định vị trí của X trong bảng tuần hoàn? c. Xác định bộ 4 số lượng tử của electron cuối cùng của nguyên tử X? 2. (1,0 điểm)
Hợp chất (SCN)2 được gọi là một trong các halogen giả vì nó có nhiều tính chất giống với halogen. Biết tính oxi hóa của (SCN)2 mạnh hơn I2 và yếu hơn Br2. Hãy hoàn thành các phương trình phản ứng sau:
DẠYKÈMQUYNHƠNOFFICIAL
a. NaSCN + Br2 →
b. NaI + (SCN)2 → c. MnO2 + H2SO4 + NaSCN → d. AgSCN + Br2 →
Trang 1/2 SỞ GIÁO DỤC & ĐÀO TẠO KỲ THI CHỌN HỌC SINH GIỎI LỚP 10, 11 CẤP TỈNH CÀ MAU
Ă
N
M HỌC 2021-2022
ĐỀ CHÍNH THỨC
Câu III (4,0 điểm)
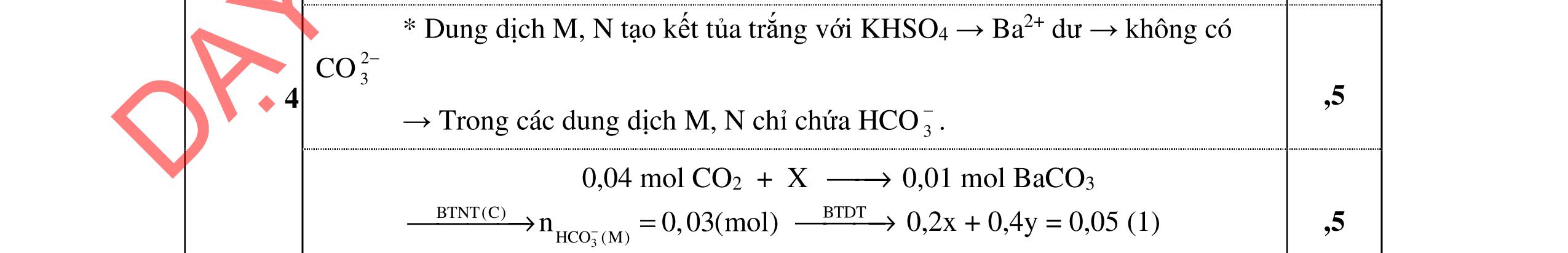
1. (3,0 điểm)
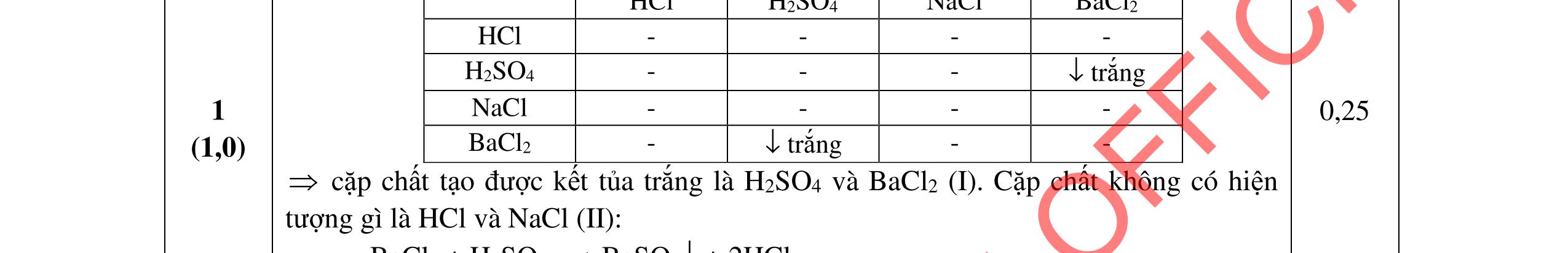
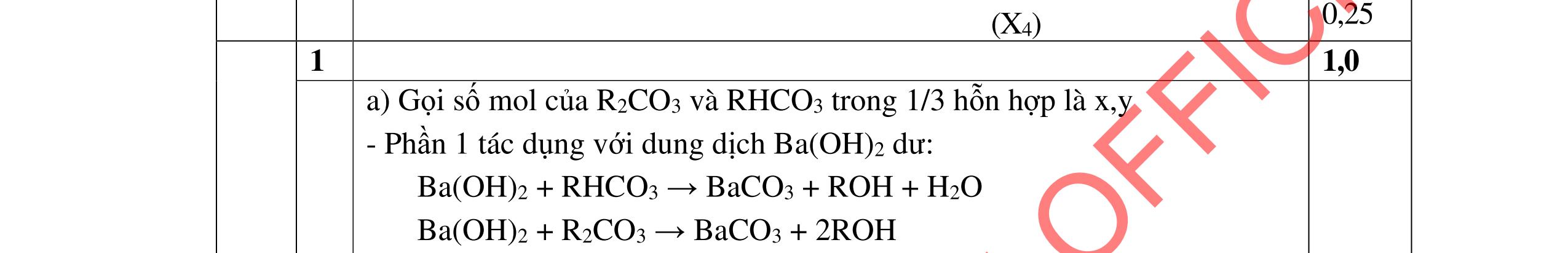
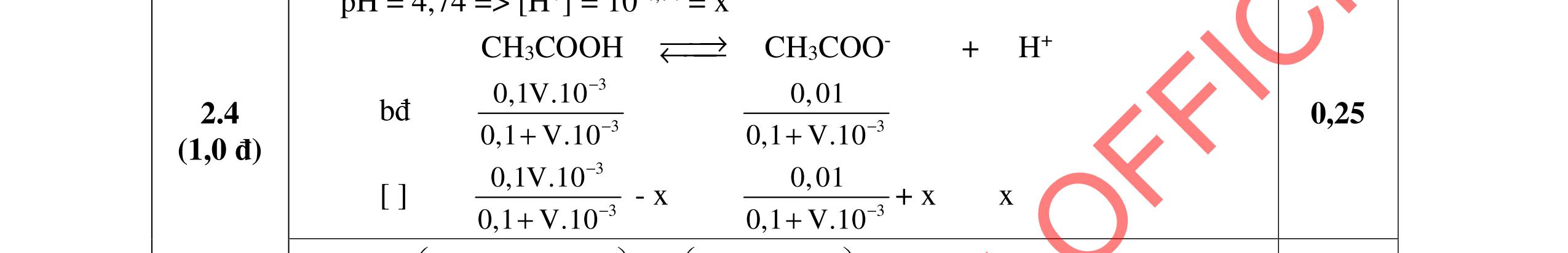
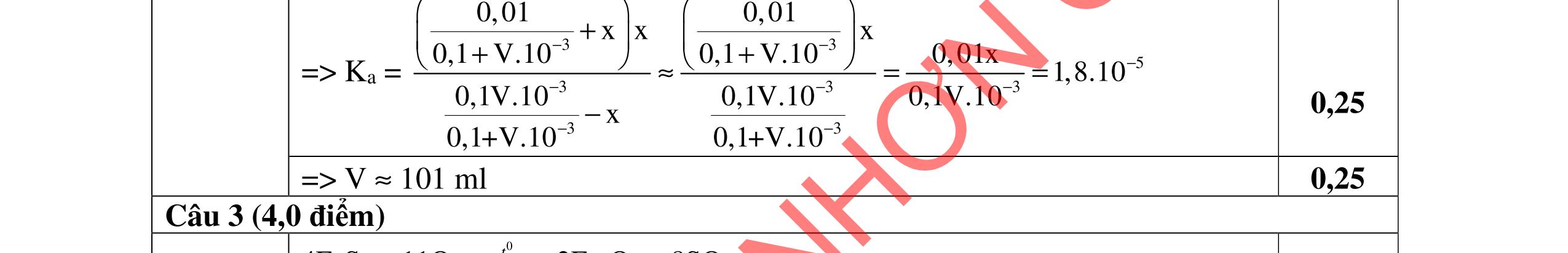
Cho dung dịch A: CaCl2 0,016M và dung dịch B: Na2CO3 0,016M
a. Tính pH của dung dịch B. b. Trộn 10 ml dung dịch A với 10 ml dung dịch B. Điều chỉnh để pH = 10. Có kết tủa CaCO3 và Ca(OH)2 tách ra không? Nếu có CaCO3 tách ra hãy tính độ tan của CaCO3 trong hỗn hợp thu được.
c. Tính thể tích dung dịch HCl 0,01M cần dùng để chuẩn độ 10 ml dung dịch B đến đổi màu phenolphtalein pH = 8.
Cho pKa (H2CO3) = 6,35; 10,33; log )( * + CaOH β = -12,6; KS1(Ca(OH)2) = 6,46.10-6; KS2(CaCO3) = 3,31.10-9
2. (1,0 điểm) Sắp xếp các chất có vòng benzen sau theo thứ tự giảm dần của lực bazơ: m-CH3C6H4NH2, p-CH3C6H4NH2, o-CH3C6H4NH2, p-O2NC6H4NH2, p-ClC6H4NH2. Giải thích? Câu IV (4,5 điểm) 1. (2,5 điểm)
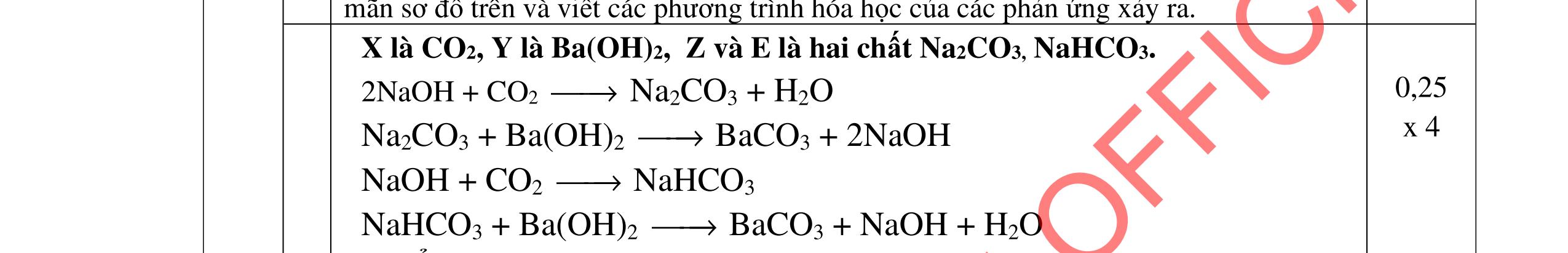
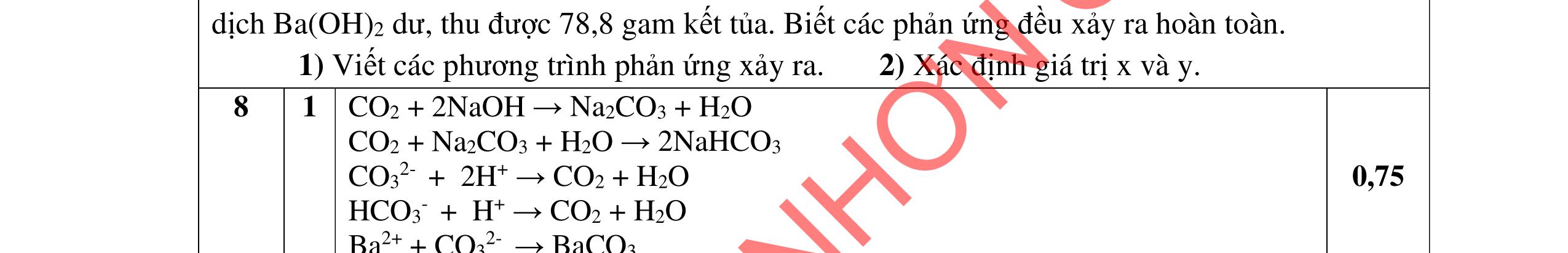
Cho m1 gam gồm Mg và Al vào m2 gam dung dịch HNO3 24%. Sau khi các kim loại tan hết thu được 8,96 lít hỗn hợp khí A gồm NO, N2O, N2 bay ra và dung dịch X. Thêm một lượng O2 vừa đủ vào A, sau phản ứng thu được hỗn hợp khí B. Dẫn B từ từ qua dung dịch NaOH dư thì có 4,48 lít hỗn hợp khí C bay ra. Tỉ khối của C so với H2 bằng 20. Nếu cho dung dịch NaOH vào X thì thu được lượng kết tủa lớn nhất là 62,2 gam và không có khí thoát ra. (Các thể tích khí đo ở điều kiện tiêu chuẩn).
a. Xác định m1 và m2 biết lượng HNO3 đã lấy dư 10% so với lượng phản ứng.
b. Xác định nồng độ phần trăm các chất trong dung dịch X. 2. (2,0 điểm)
Kết quả phân tích nguyên tố cho thấy hợp chất A chứa 55,81%C, 7,01% H, còn lại là oxi. A là chất lỏng rất ít tan trong nước, không có vị chua, không làm mất màu nước brom; 3,44 gam A phản ứng vừa đủ với 80 ml dung dịch NaOH 0,5M và tạo thành một hợp chất B có công thức phân tử C4H7O3Na. Khi đun nóng với dung dịch axit vô cơ, từ B lại tạo thành A.
a. Xác định công thức phân tử của A.
b. Từ công thức phân tử và tính chất của A, cho biết A thuộc loại hợp chất nào?
c. Viết công thức cấu tạo của A, B và phương trình hóa học của A với dung dịch NaOH đã nêu. Câu V (3,0 điểm)
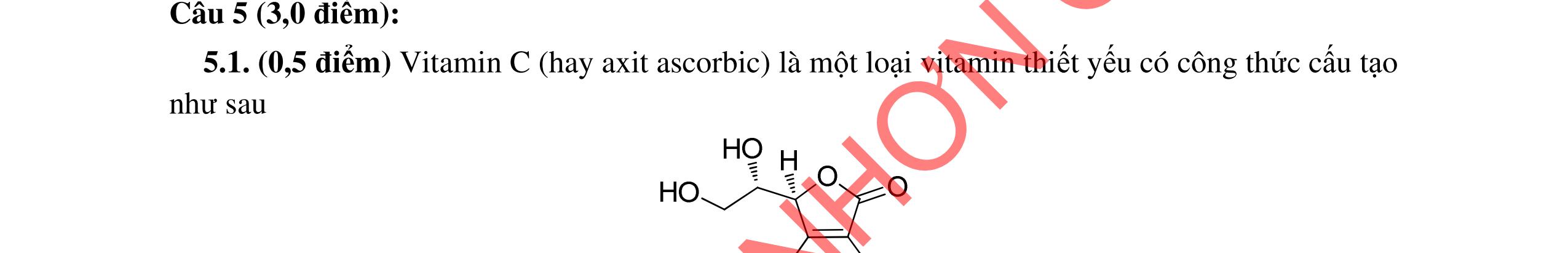
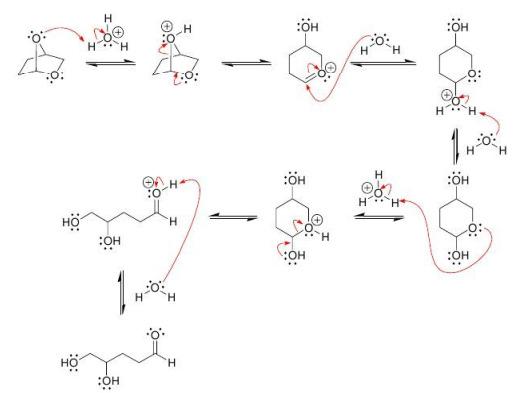
1. (1,5 điểm)
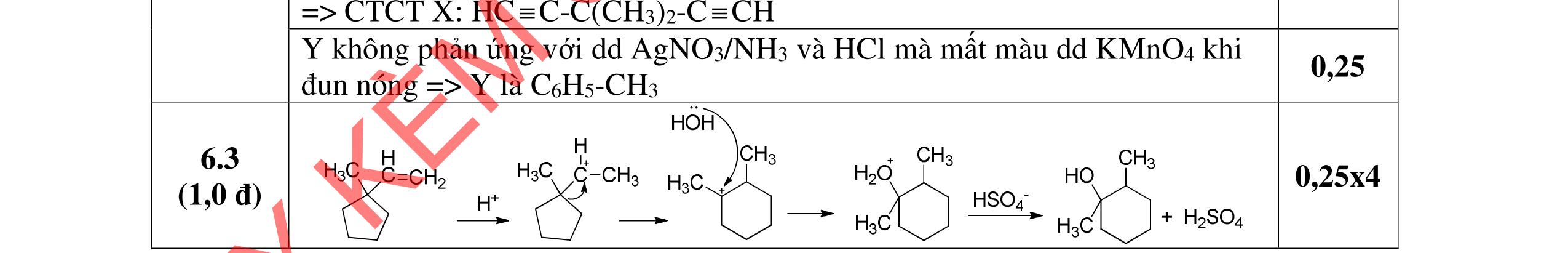
Chất A có công thức phân tử là C8H16O và có phản ứng iodofom nhưng không cộng được H2. Khi đun A với H2SO4 đặc ở 170oC ta thu được hỗn hợp X trong đó có ba chất B, C, D có cùng CTPT là C8H14, đều không có đồng phân hình học. Nếu ozon phân khử hoặc oxi hóa hỗn hợp X thì sản phẩm thấy xuất hiện xiclopentanon.
Trang 2/2
a. Xác định CTCT của A, B, C, D. b. Trình bày cơ chế chuyển A thành B, C, D. 2. (1,5 điểm) Xác định CTCT các chất X1, X2, X3, X4, X5, X6 ---------- HẾT ---------* Thí sinh không được sử dụng tài liệu. * Cán bộ coi thi không giải thích gì thêm. DẠYKÈMQUYNHƠ
NOFFICIAL
Môn thi: Hóa học Ngày thi: 17 – 4– 2022 (Hướng dẫn gồm 06 trang)
Câu I (5,0 điểm ) Đáp án Điểm cụ thể I.1. (1,5 điểm)
a. Cr2S3 + Mn(NO3)2 +K2CO3 → K2CrO4 + K2SO4 + K2MnO4 + NO + CO2
2Cr+3 → 2Cr+6 + 6e 3S–2 → 3S+6 + 24e
Cr2S3 → 2Cr+ 6 + 3S+ 6 + 30e x 1 (1) Mn+ 2 → Mn+ 6 + 4e
2N+ 5 + 6e → 2N+ 2 Mn(NO3)2 + 2e → Mn+ 6 + 2N+2 x 15 (2) Cộng (1) và (2)
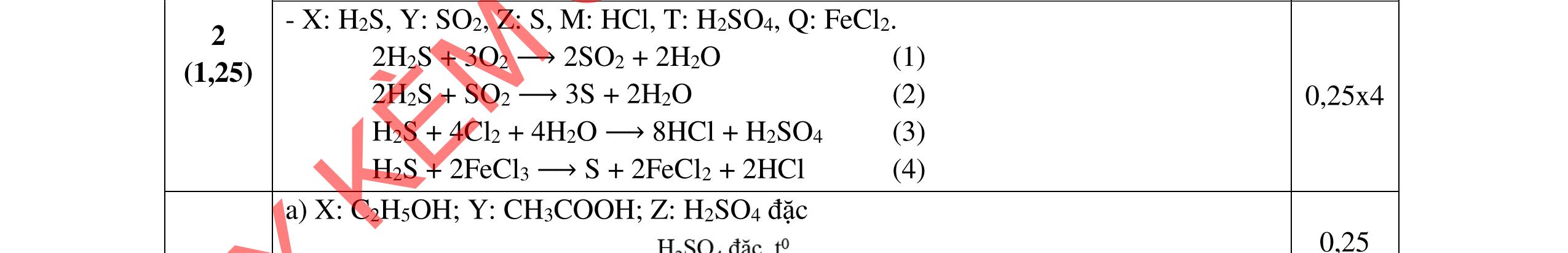
Cr2S3 + 15Mn(NO3)2 → 2Cr+ 6 + 3S+ 6 + 15Mn+ 6 + 30N+ 2 Hoàn thành: Cr2S3 +15Mn(NO3)2 +20K2CO3 →2K2CrO4+3K2SO4 +15 K2MnO4+30NO +20CO2 b. P + NH4ClO4 → H3PO4 + N2 + Cl2 + H2O
2N –3 → 2NO + 6e 2Cl+ 7 + 14e → 2ClO
2NH4ClO3 + 8e → 2NO + 2ClO x 5 PO → P+ 5 + 5e x 8
10NH4NO3 + 8PO → 8P+ 5 + 10NO + 10ClO + 16H2O
10NH4NO3 + 8P → 8H3PO4 + 5N2 + 5Cl2 + 8H2O c. FexOy + HNO3 → Fe(NO3)3 + NnOm + H2O xFe+2y/x → xFe+ 3 + (3x – 2y)e (5n – 2m) nN+ 5 + (5n – 2m)e → nN+ 2m/n (3x – 2y) x(5n –2m)Fe+2y/x + n(3x – 2y)N+ 5 → x(5n – 2m)Fe + 3 + n(3x – 2y)N+2m/n Hoàn thành: (5n – m)FexOy + (18nx – 6my – 2ny)HNO3 → x(5n 2m)Fe(NO3)3 + (3x 2y)NnOm + (9nx 3mx ny)H2O
Trang 3/2 SỞ GIÁO DỤC & ĐÀO TẠO ĐÁP ÁN VÀ HƯỚNG DẪN CHẤ
Ỳ THI CHỌN CÀ
Ấ
Ỉ
M K
MAU HSG LỚP 10,11 C
P T
NH NĂM HỌC 2021-2022
Mỗi pt cb
úng
bao nhiêu hạt α, β tạo thành từ 1 hạt nhân U238 92 ? + x + y Áp dụng : ĐLBT điện tích: 92 = 82 + x.2 + y (-1) (1) ĐLBT số khối : 238 = 206 + x.4 + y (0) (2) Từ (1) và (2) ta có ⇒ x = 8 ; y = 6 ⇒ Có 8 hạt α và 6 hạt β Phương trình : + 8 + 6 b. Cứ 1 mol U238 bị phân rã cho 1 mol 206 82 Pb nên 0,25 đ
đ 238 92 U → 206 82 Pb 4 2 He 0 1 e 238 92 U → 206 82 Pb 4 2 He 0 1 e ĐỀ CHÍNH THỨC DẠYKÈMQUYNHƠNOFFICIAL
đ
được 0,5 đ I.2. (1,5 điểm) a. Có
0,25
nU phân rã = nPb → 238206 Uphanra Pb m m = → 238 30,9238 206206 Pb Uphanra m m × × == = 35,7 mg Sự phân rã tương đương với phản ứng bậc 1 , ta có : Ta có : 0 ln. N kt N = → 9 1/20lnln5.1047,635,7 ln2ln247,6 tN t N + == = 4,0368.109 năm
I.3. (2,0 điểm) a. CO2 (k) + H2 (k) ⇄ CO (k) + H2O (k) (*) bđ 0,2 0,8 0 0 Pư x x x x [ ] 0,2-x 0,8-x x x K = [ ] [ ] [][] 2 22
0,5 đ 0,5 đ
COHO COH = ()() . 0,2.0,8 xx xx = 1 → x = 0,16 → [CO] = [H2O] = 0,16 M → [CO2] = 0,04M và [H2] = 0,64 M b. ∆H0 = -110,525 -241,818 - (-393,509) – 0 = 41,166 kJ/mol ∆S0 = 197,565 + 188,716 - 213,63 - 130,575 = 42,076 J/mol.K ∆G0 = ∆H0 298 – T.∆S0 = 41,166.1000 – 298.42,076 = 28,6274 kJ/mol ∆G0 = -RTlnK → K = 3 0 28,6274.10 6 8,314298 9,592.10 G RT ee −∆ × ==
. .
0,25 đ 0,25 đ 0,25 đ 0,25 đ 0,25 đ 0,25 đ 0,25 đ 0,25 đ
Câu II (3,5 điểm ) Đáp án Điểm cụ thể II.1. (2,5 điểm)
YKÈMQUYNHƠNOFFICIAL
proton nơtron X Z1 N1 Y Z2 N2 0,25 đ 0,25 đ 0,25 đ 0,25 đ 0,25 đ 0,25 đ 0,5 đ 0,5 đ II.2. (1,0 điểm) a. 2NaSCN + Br2 → (SCN)2 + 2NaBr b. 2NaI + (SCN)2 → 2NaSCN + I2 DẠ
0,25x4 = 1,0 đ
Trang 4/2
a. Theo đề ta có: (2Z1 + N1) + (2Z2 + N2)n + 3 = 145 (1) (2Z1 + 2nZ2) – (N1 + nN2) + 3 = 49 (2) 2Z1 – 2Z2 = 14 (3) 2Z2 + N2 + 2 = 26 (4) Z2 = N2 (5) (3), (4), (5) → Z2 = N2 = 8, Z1 = 15 (6) (1), (2) → 2Z1 + 2nZ2 = 94 (7) và N1 + nN2 = 48 (8) (6), (7), (8) → n = 4 và N1 = 16 X có Z1= 15, N1 = 16 → AX = 31 → X là Phốt pho (P) Y có Z2= 8, N2 = 8 → AY = 16 → Y là Oxi (O) XYn 3- là PO4 3b. Cấu hình eletron của 15P (X) : [Ne]3s23p3 Vị trí của X trong bảng tuần hoàn: ô 15, chu kì 3, nhóm VA. c. Electron cuối cùng của X có bộ 4 số lượng tử là: n = 3, l = 1, ml = +1, ms = +1/2.
c. MnO2 + 2H2SO4 + 2NaSCN → Na2SO4 + (SCN)2 + MnSO4 + 2H2O d. 2AgSCN + Br2 → 2AgBr + (SCN)2. Câu III (4,0 điểm) Đáp án Điểm cụ thể III.1. (3,0điểm)
a. CO 2 3 + H2O HCO 3 + OH (1) Kb1 = 10 3,67 HCO 3 + H2O (H2O + CO2) + OH (2) Kb2 = 10-7,65 Kb1 = 10-3,67 >> Kb2 = 10-7,65 Tính theo cân bằng (1) CO 2 3 + H2O HCO 3 + OH (1) Kb1 = 10-3,67 C0(M) 0,016 [ ] 0,016 – x x x x2/(0,016-x) = 10-3,67 x = 1,746.10-3 pOH = -log (1,746.10-3) = 2,76 pH = 11,24
CaOH C C = [] + H
+ Ca
*β = 10-2,6 << 1 C’Ca +2 = CCa +2 = 8.10-3 M
b. CCa +2 = CCO 2 3 = 8.10-3 M; pH = 10 Điều kiện kết tủa: C’Ca +2 . (C’OH )2 > KS1; C’Ca +2 .C’ CO 2 3 > KS2; C’: nồng độ các ion khi tạo kết tủa. C’OH = 10-4M; C’Ca +2 = ? Ca2+ + H2O CaOH+ + H+ *β = 10-12,6 CCa +2 = 8.10-3 M ' 2 +
CO 2 3 = ? pH ≅ pKa2 >> pKa1. Tính theo cân bằng:
2 3 + H2O HCO 3 + OH- (1) Kb1 = 10-3,67
(M) 8.10-3
8.10-3 – x x 10-4
x = 5,45. 10-3M
C’ CO 2 3 = 2,55.10-3M
Ca +2 . (C’OH )2 < KS1; C’Ca +2 .C’ CO 2 3 > KS2
chỉ có kết tủa CaCO3
ph
Trang 5/2
DẠYKÈMQUYNHƠ
C’
CO
C
C’
C’
Theo
ản ứng: Ca2+ + CO 2 3 → CaCO3 ↓ C (M) 8.10-3 8.10-3 C’ (M) - - 8.10-3 CaCO3 ↓ , pH = 10 CaCO3 ↓ Ca2+ + CO 2 3 KS2 = 3,31.10-9 C (M) S S CO 2 3 + H2O HCO 3 + OH- (1) Kb1 = 10-3,67 S = CCa +2 = [ ] +2 Ca và S = CCO 2 3 = [ ] 2 3 CO + [ ] 3 HCO = [ ] 2 3 CO (1 + [] OH K b1 ) S2 = CCa +2 . CCO 2 3 [ ] +2 Ca . [ ] 2 3 CO = [] 1 1 2 .1 + OHK S b = KS2 0,25 đ 0,25 đ 0,25 đ 0,25 đ 0,25 đ 0,25 đ 0,25 đ 0,25 đ 0,25 đ 0,25 đ
NOFFICIAL
trung hòa
chuẩn độ được 102,2% lượng CO 2 3
VHCl = 352,16 100.01,0 2,102.10.016,0 = ml
Lự
c baz
a các chất được sắp xếp theo thứ tự giảm dần sau: o-CH3C6H4NH2> p-CH3C6H4NH2> m-CH3C6H4NH2> p-ClC6H4NH2> p-O2NC6H4NH2 Giải thích: Nhóm CH3 là nhóm đẩy electron làm tăng mật độ eletron trên nguyên tử Nitơ → lực bazơ tăng, ở vị trí octo có ảnh hưởng mạnh nhất, vị trí para có ảnh hưởng mạnh hơn vị trí meta (do hiệu ứng octo và para) nên lực bazơ giảm dần theo dãy: o-CH3C6H4NH2 >p-CH3C6H4NH2> m-CH3C6H4NH2 (*) Nhóm NO2 có hiệu ứng –C, hút electron mạnh nhất làm giảm mật độ electron trên nguyên tử Nitơ →làm giảm mạnh lực bazơ. Nhóm Cl có hiệu ứng –I và +C làm giảm ít lực bazơ của NH2 hơn so với nhóm NO2, do vậy ta có thứ tự giảm dần lực bazơ sau: m-CH3C6H4NH2> p-ClC6H4NH2>p-O2NC6H4NH2 (**) Từ (*) và (**) ta có thứ tự các chất được sắp xếp theo lực bazơ giảm dần là: o-CH3C6H4NH2> p-CH3C6H4NH2> m-CH3C6H4NH2> p-ClC6H4NH2> p-O2NC6H4NH2
Tổng số mol electron kim loại cho: 2a + 3b (1) Các quá trình khử ion 3NO : 3NO + 4H+ + 3e → NO + 2H2O 2 3NO + 10H+ + 8e → N2O + 5H2O 2 3NO + 12H+ + 10e → N2 + H2O Khi thêm oxi vào A chỉ có NO phản ứng
n B qua dung d

Trang 6/2
[
HCO
Dẫ
ịch NaOH: 2NaOH +
+
S = [ ] 1 1 2 .1( + OHKK b S = 1,02.10-4 (M) c. pH = 8 < pHHCO 3 = 2 2 1 a a pKpK + = 8,45 +
quá 1 nấc TPGH: HCO 3 , H2CO3. 0,25 đ DẠYKÈMQUYNHƠ
] [ ] [] 022,0 1010 10 35,6 8 8 1 32 3 = + = + = + + a
KH H C COH
2,2% HCO 3 b
ị
0,25 đ 0,25 đ III.2. (1,0 điểm)
ơ củ
0,5 đ 0,5 đ Câu IV (4,5 điểm) Đáp án Điểm cụ thể IV.1. (2,5 điểm) a. Đặt nMg = a, nAl = b; nNO = x, 2 ; NO ny = 2 N nz = Các quá trình oxi hóa kim loại: Mg → Mg2+ + 2e Al → Al3+ + 3e
2NO2 → NaNO2
NaNO3
H2O
NOFFICIAL
nA = x + y + z = 8,96 0,4() 22,4 mol =
Tổng số mol electron nhận: 3x + 8y + 10z (2)
Hỗn hợp C gồm: N2 và N2O
nC = y + z = 4,48 0,2() 22,4 mol = (3) 44284428 20*240 0,2 C yzyz M yz ++ ==== + (4)
Từ (2), (3) và (4): x=0,2; y=0,15; z=0,05 (mol) Cho dung dịch NaOH vào dung dịch X được kết tủa cực đại:
Lượng kết tủa cực đại: 58a + 78b = 62,2 (5) Mặt khác: 2a + 3b = 3x + 8y + 10z 2a + 3b = 0,6 + 1,2 + 0,5 = 2,3 (6)
Từ (5) và (6): a=0,4; b= 0,5 (mol)
m1 = mMg + mAl = (24*0,4)+(27*0,5) = 23,1 (gam).
Số mol HNO3 cần dùng: 0,8 + 1,5 + 0,6 = 2,9 (mol)
Số mol HNO3 lấy dư 10%: 0,29 (mol)
Tổng số mol HNO3 đem làm thí nghiệm: 2,9 + 0,29 = 3,19 (mol). Khối lượng dung dịch HNO3: m2 = 3,19*63*100 837,375() 24 gam =
b. Khối lượng dung dịch X: 23,1 + 837,375 – (30*0,2+44*0,15+28*0,05)= 846,475 (gam) Dung dịch X chứa các chất tan: Mg(NO3)2: 0,4 mol, Al(NO3)3: 0,5 mol và HNO3: 0,29 mol. 32 148*0,4 %() *1006,994(%) 846,475 CMgNO == 33 213*0,5 %() *10012,582(%) 846,475 CAlNO == 3 0,29*63 % *1002,158(%) 846,475 CHNO ==
IV.2. (2,0 điểm) a. %O = 100 - (55,81 + 7,01) = 37,18% nNaOH = 0,08*0,5 = 0,04 (mol) Đặt công thức tổng quát của A là CxHyOz
0,25 đ 0,25 đ 0,25 đ 0,25 đ 0,25 đ 0,25 đ 0,25 đ 0,25 đ 0,25 đ
Trang 7/2
(x, y, z nguyên dương) x : y : z = %%% :: 12116 CHO = 55,817,0137,18 :: 12116 = 2 : 3 : 1 Công thức phân tử của A có dạng (C2H3O)n A không có vị chua ⇒ A không phải axit. A tác dụng với dung dịch kiềm tạo ra một hợp chất B: C4H7O3Na và A không làm mất màu nước brom. ⇒ A là este đơn chức mạch vòng ⇒ nA = nNaOH = 0,04 mol ⇒ MA 3,44 0,04 =86 (gam/mol) Công thức phân tử của A: C4H6O2
DẠYKÈMQUYNHƠNOFFICIAL
0,5 đ 0,5 đ 0,25 đ 0,25 đ
Câu V (3,0 điểm)
b. Công thức cấu tạo của A: CH2 CH2 CH2 O
CO c. PT CH2 CH2 CH2 O
CO + NaOH HOCH2CH2CH2COONa
0,25 đ 0,25 đ
Đáp án Điểm cụ thể V.1. (1,5điểm)
a.A có k = 1. A có phản ứng iodofom => A có –CHOH-CH3 hoặc –CO-CH3 A không phản ứng H2 => A không có: + C = C và –CO-CH3. + Vòng 3C hoặc 4C. Ozon phân khử hoặc oxi hóa X thì sản phẩm xuất hiện xiclopentanon => A có vòng 5 cạnh. A có thể là: Khi tách nước A thu được hỗn hợp X => A là (III). => Hỗn hợp X là: b.
0,75 đ 0,25 đ 0,25 đ 0,25 đ V.2. (1,5 điểm) 0,25x 6 CT =1,5 đ
ẠYKÈMQUYNHƠNOFFICIAL
Chú ý: * Nếu thí sinh làm bài không theo cách nêu trong đáp án mà vẫn đúng thì cho đủ điểm như hướng dẫn quy định. *Đối với phương trình phản ứng hóa học nào mà cân bằng hệ số sai hoặc thiếu cân bằng thì trừ đi nửa số điểm giành cho nó. Trong một phương trình phản ứng hóa học, nếu có từ một công thức trở lên viết sai thì phương trình đó không được tính điểm.
* Trong khi tính toán nếu nhầm lẫn một câu hỏi nào đó dẫn đến kết quả sai nhưng phương pháp giải đúng thì trừ đi nửa số điểm giành cho phần hoặc câu đó. Nếu tiếp tục dùng kết quả sai để giải các vấn đề tiếp theo thì không tính điểm cho các phần sau.
Trang 8/2
ẾT........................................
......................................... H
D
NĂM HỌC 2021 – 2022
MÔN: HÓA HỌC (Chuyên)
Thời gian làm bài 180 phút (không kể thời gian giao đề) Ngày thi: 18/02/2022
Số thứ tự (do giám thị ghi)
Số phách (do Chủ tịch hội đồng chấm ghi)
Họ tên và chữ ký
Giám thị 1 Giám thị 2
Thí sinh ghi đầy đủ thông tin vào các mục dưới đây:
1. Hội đồng thi: 2. Phòng thi: 3. Họ và tên thí sinh: 4. Học sinh trường: 5. Ngày sinh: / / 6. Số báo danh: 7. Chữ ký thí sinh:
HƯỚNG DẪN: Thí sinh đọc thật kỹ phần hướng dẫn này
1. Đề thi gồm 14 trang (đánh số từ trang 1 đến trang 14), trong đó có 2 phần: PHẦN TRẮC NGHIỆM gồm 24 câu và PHẦN TỰ LUẬN gồm 07 câu (từ câu I đến câu VII), thí sinh kiểm tra số trang và đề thi trước khi làm bài.
2 Không được vào làm bài vào TRANG PHÁCH vì đây là phách sẽ cắt mất.
3. Thí sinh làm bài trực tiếp vào đề thi:
- PHẦN TRẮC NGHIỆM: Thí sinh dùng bút chì đen tô đen đáp án câu trắc nghiệm tương ứng vào phiếu trả lời trắc nghiệm (ở phần trắc nghiệm).
- PHẦNTỰ LUẬN: Thí sinh chỉ được dùng bút một màu xanh hoặc đen hay tím để làm bài tự luận (không dùng mực màu đỏ), viết câu trả lời phần tự luận vào phần trống dưới câu hỏi, nếu không đủ chổ thì ghi vào PHẦN BỔ SUNG BÀI LÀM, trang 14). Nếu thí sinh làm bài sai, dùng thước gạch, không dùng bút tẩy.
D4. Thí sinh giữ gìn cẩn thận bài làm. Không ghi tên và làm ký hiệu riêng từ trang 1 đến trang 14.
5. Giám thị coi thi không giải thích gì thêm.
ẠYKÈMQUYNHƠNOFFICIAL
6 Thí sinh được sử dụng bảng hệ thống tuần hoàn các nguyên tố hóa học.
7. Cho nguyên tử khối của nguyên tố: H=1; C=12; N=14; O=16; S=32; Cl=35,5; Na=23; Mg=24; Al=27; K=39; Ca=40; Fe=56; Cu=64; Zn=65; Ag=108; Ba=137.
TRANG PHÁCH SỞ GIÁO DỤC VÀ ĐÀO TẠO
KỲ THI CHỌ
I CẤP TỈNH, LỚP 12
ĐỒNG NAI
N HỌC SINH GIỎ
ĐỀ CHÍNH THỨC
NĂM HỌC 2021 – 2022
MÔN: HÓA HỌC (Chuyên)
Thời gian làm bài 180 phút (không kể thời gian giao đề) Ngày thi: 18/02/2022
Điểm bài thi Họ tên và chữ ký
Số thứ tự (do giám thị ghi)
Số phách (do Chủ tịch hội đồng chấm ghi) Bằng số Bằng chữ Giám khảo 1 Giám khảo 2
I. PHẦN TRẮC NGHIỆM: (6,0 điểm) (Thí sinh tô trắc nghiệm vào phiếu trả lời trắc nghiệm bên dưới)
01.; / = ~ 07.; / = ~ 13.; / = ~ 19.; / = ~ 02.; / = ~ 08.; / = ~ 14.; / = ~ 20.; / = ~ 03.; / = ~ 09.; / = ~ 15.; / = ~ 21.; / = ~ 04.; / = ~ 10.; / = ~ 16.; / = ~ 22.; / = ~ 05.; / = ~ 11.; / = ~ 17.; / = ~ 23.; / = ~ 06.; / = ~ 12.; / = ~ 18.; / = ~ 24.; / = ~
Câu 1: Một mẫu đá chứa 0,688 mg 206Pb trên mỗi 1,000 mg 238U. Giả sử rằng ban đầu không có chì, toàn bộ 206Pb được tạo thành sau nhiều năm từ 238U và số hạt nhân trong giai đoạn trung gian của phân rã giữa 238U và 206U được bỏ qua. Biết chu kì bán hủy của 238U là 4,5.109 năm. Tuổi của mẫu đá là A. 1,489.109 năm. B. 4,523.109 năm. C. 2,428.109 năm. D. 3,797.109 năm.
Câu 2: Bằng thực nghiệm người ta đã thu được những số liệu của phản ứng giữa NO và H2 ở nhiệt độ 700oC như sau: 2NO(k) + 2H2(k) → 2H2O(k) + N2(k) Thí nghiệm [H2], M [NO], M Tốc độ ban đầu M.s 1 1 0,010 0,0250 v1 = 2,4.10 6 2 0,005 0,0250 v2 = 1,2.10 6 3 0,010 0,0125 v3 = 0,6.10 6 Giá trị của hằng số tốc độ phản ứng là A. 0,3840. B. 0,9600. C. 38,4000. D. 0,0096. Câu 3: Một pin điện hóa được thành lập bằng cách nhúng một thanh Pt vào một dung dịch A chứa 2 4SO ; H+ 0,50M; 2VO+ 0,15M; 2VO + 0,01M và nhúng một thanh Zn vào dung dịch B chứa Zn2+ 0,10M và 2 4SO . Nối hai dung dịch bằng cầu muối. Cho biết: 2 2
o VO/VO E1,001V; ++ = 2 o Zn/Zn E0,763V. + =− Sức điện động của pin ở 25oC là A. 1,863V. B. 0,242V. C. 1,828V. D. 1,845V.
Câu 4: Thực hiện các thí nghiệm sau:
ẠYKÈMQUYNHƠNOFFICIAL
(a) Cho hỗn hợp chứa x mol Mg và 1,2x mol Cu vào dung dịch chứa 2x mol FeCl3 và 1,25x mol Fe2(SO4)3 (b) Cho a mol FeSO4 vào dung dịch a mol KHSO4 và 0,75a mol NaNO3.
(c) Cho bột Fe3O4 vào dung dịch H2SO4 loãng.
(d) Cho 1,3x mol Fe và 0,5x mol Cu vào dung dịch chứa 3,8x mol AgNO3.
(e) Cho 2,4a mol Fe vào dung dịch chứa 6a mol HCl và 5a mol KNO3 (biết NO là sản phẩm khử duy nhất). Sau khi các phản ứng xảy ra hoàn toàn, số thí nghiệm thu được muối sắt(III) là A. 4. B. 2. C. 5. D. 3.
Trang 1 SỞ GIÁO DỤC VÀ ĐÀO TẠO
ĐỒNG NAI
KỲ THI CHỌN HỌC SINH GIỎI CẤP TỈNH, LỚP 12
D
Câu 5: Cho các phản ứng:
(1) CH4(k) + 2O2(k) → CO2(k) + 2H2O(l)
∆H1 = – 212,79 (kcal)
(2) CH3Cl(k) + 2 3 O2(k) → CO2(k) + H2O(l) + HCl(k) ∆H2 = – 164,0 (kcal)
(3) H2(k) + 2 1 O2(k) → H2O(l)
∆H3 = – 68,32 (kcal)
(4) 2 1 H2(k) + 2 1 Cl2(k) → HCl(k)
Tính hiệu ứng nhiệt của phản ứng sau: CH4(k) + Cl2(k) → CH3Cl(k) + HCl(k)
A. – 2,53 kcal. B. – 24,59 kcal. C. 63,65 kcal. D. 41,59 kcal.
Câu 6: Thực hiện các thí nghiệm sau:
(a) Cho hỗn hợp Na và Al (tỉ lệ mol 2 : 3) vào nước (dư).
(b) Cho hỗn hợp Cu và Fe2O3 (tỉ lệ mol tương ứng 2 : 1) vào dung dịch HCl (dư).
(c) Cho 1,2x mol kim loại Zn vào dung dịch chứa 2,5x mol FeCl3.
(d) Cho hỗn hợp Cu và NaNO3 (tỉ lệ mol tương ứng 3 : 2) vào dung dịch HCl loãng (dư).
(e) Cho dung dịch NaHCO3 tác dụng vào dung dịch BaCl2 đun nóng.
(f) Sục 3,2x mol khí CO2 vào dung dịch hỗn hợp chứa x mol Ba(OH)2 và 1,4x mol NaOH. Khi phản ứng trong các thí nghiệm trên kết thúc, có bao nhiêu thí nghiệm thu được chất rắn? A. 3. B. 2. C. 4. D. 1. Câu 7: Cho các phát biểu sau:
(1) Khí SO2 và NO2 gây ra hiện tượng mưa axit.
(2) Khí CO2 và CH4 gây ra hiệu ứng nhà kính.
(3) Dùng nước đá và nước đá khô để bảo quản thực phẩm (thịt, cá, …).
(4) Sử dụng hàn the (muối natri borat) để chế biến giò, bánh phở, bánh cuốn, bánh đúc không vi phạm vệ sinh an toàn thực phẩm.
(6) Khi thải ra khí quyển, teflon phá hủy tầng ozon.
∆H4 = – 22,06 (kcal)
(5) Các anion NO3 , PO4 3-, SO4 2- ở nồng độ cao gây ô nhiễm môi trường nước.
(7) Người ta thường dùng khí Cl2 để khử độc NH3 Số phát biểu không đúng là A. 3. B. 4. C. 2. D. 1.
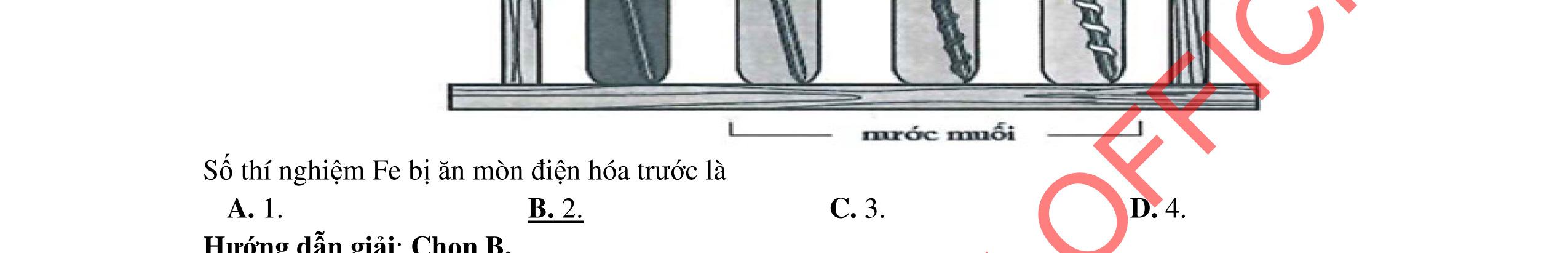
Câu 8: Tiến hành thí nghiệm theo các bước sau: Bước 1: Rót vào 2 ống nghiệm, mỗi ống khoảng 3 ml dung dịch H2SO4 loãng và cho vào mỗi ống một mẩu kẽm như nhau. Bước 2: Nhỏ thêm 2 – 3 giọt dung dịch muối CuSO4 vào ống nghiệm thứ nhất.
Cho các nhận định sau:
(a) Ở bước 1, xảy ra hiện tượng ăn mòn hóa học, lượng khí thoát ra từ mỗi ống nghiệm đều như nhau. (b) Ở bước 2, ống nghiệm thứ hai xảy ra sự ăn mòn điện hóa do Zn đẩy Cu2+ ra khỏi muối và tạo thành cặp điện cực Zn-Cu.
(c) Khi cho thêm vài giọt muối CuSO4 vào ống nghiệm thứ nhất, thấy bọt khí thoát ra nhanh hơn so với ống nghiệm thứ hai.
ẠYKÈMQUYNHƠNOFFICIAL
(d) Ở bước 2, có thể thay dung dịch CuSO4 bằng dung dịch MgSO4.
(e) Nếu thay mẩu kẽm bằng mẩu sắt thì tốc độ giải phóng khí sẽ chậm hơn.
(f) Ở bước 1, Zn bị khử thành Zn2+ Số nhận định đúng là
A. 5. B. 2. C. 3. D. 4.
Trang 2
D
Câu 9: Cho 9,2 gam hỗn hợp X gồm Mg và Fe vào dung dịch hỗn hợp AgNO3 và Cu(NO3)2, thu được chất rắn Y (gồm 3 kim loại) và dung dịch Z. Hòa tan hết Y bằng dung dịch H2SO4 (đặc, nóng, dư), thu được 6,384 lít khí SO2 (sản phẩm khử duy nhất của S+6 , ở đktc). Cho dung dịch NaOH dư vào Z, thu được kết tủa T. Nung T trong không khí đến khối lượng không đổi, thu được 8,4 gam hỗn hợp rắn. Biết các phản ứng xảy ra hoàn toàn. Thể tích dung dịch HNO3 1M tối thiểu cần dùng để hòa tan hết 9,2 gam hỗn hợp X là (biết NO là sản phẩm khử duy nhất)
A. 800,00 ml. B. 666,67 ml. C. 375,00 ml. D. 480,00 ml. Câu 10: Hòa tan hết m gam hỗn hợp E gồm Na, Na2O, Ba và BaO vào nước, thu được 0,15 mol khí H2 và dung dịch X. Sục 0,32 mol khí CO2 vào dung dịch X, thu được dung dịch Y chỉ chứa các ion 2 33Na,HCO,CO + và kết tủa Z. Chia dung dịch Y làm 2 phần bằng nhau: Cho từ từ đến hết phần 1 vào 200 ml dung dịch HCl 0,6M thấy thoát ra 0,075 mol khí CO2, coi tốc độ phản ứng của 2 3 3CO,HCO với H+ bằng nhau. Cho từ từ đến hết 200 ml dung dịch HCl 0,6M vào phần 2, thấy thoát ra 0,06 mol khí CO2 Các phản ứng xảy ra hoàn toàn, H2O phân li không đáng kể. Giá trị của m là A. 25,32. B. 24,68. C. 25,88. D. 24,66. Câu 11: Muối Epsom (MgSO4.nH2O) có nhiều lợi ích cho sức khỏe, thường được dùng để pha chế thuốc nhuận tràng, chất làm vườn như một loại phân bón cho cây, hay dung dịch khử khuẩn. Khi làm lạnh 110,0 gam dung dịch MgSO4 27,27% thấy có 12,30 gam muối Epsom tách ra, phần dung dịch bão hòa có nồng độ 24,56%. Biết độ tan của MgSO4 tại 800C và 200C lần lượt là 54,80 và 35,10. Số gam Epsom được tách ra khi làm lạnh 1857,6 gam dung dịch bão hòa MgSO4 từ 800C xuống 200C có giá trị gần nhất với giá trị nào sau đây? A. 767,50. B. 374,50. C. 857,50. D. 708,50.
Câu 12: Trong quá trình bảo quản, một mẩu muối FeSO4.7H2O (có khối lượng m gam) bị oxi hóa bởi oxi không khí tạo thành hỗn hợp X gồm các hợp chất của Fe(II) và Fe(III). Hòa tan toàn bộ X trong dung dịch loãng chứa 0,035 mol H2SO4, thu được 100 ml dung dịch Y. Tiến hành hai thí nghiệm với Y: Thí nghiệm 1: Cho lượng dư dung dịch BaCl2 vào 20 ml dung dịch Y, thu được 2,33 gam kết tủa. Thí nghiệm 2: Thêm dung dịch H2SO4 (loãng, dư) vào 20 ml dung dịch Y, thu được dung dịch Z. Nhỏ từ từ dung dịch KMnO4 0,03M vào Z đến khi phản ứng vừa đủ thì hết 18 ml. Giá trị của m và phần trăm số mol Fe(II) đã bị oxi hóa trong không khí lần lượt là A. 4,17 và 5%. B. 13,90 và 27%. C. 4,17 và 10%. D. 13,90 và 73%. Câu 13: Hỗn hợp E gồm axit béo X và triglyxerit Y. Cho m gam E tác dụng với dung dịch KOH (vừa đủ), thu được a gam glyxerol và dung dịch chỉ chứa một muối kali của axit béo. Mặt khác, nếu đốt cháy hết m gam E thì cần vừa đủ 13,79 mol O2, thu được 228,48 lit CO2 (đktc) và 148,68 gam H2O. Cho a gam glyxerol vào bình đựng Na dư, kết thúc phản ứng thấy bình đựng Na tăng thêm 14,24 gam. Phần trăm khối lượng của Y trong E là A. 10,68%. B. 89,32%. C. 28,48%. D. 33,50%. Câu 14: Xác định cấu tạo của sản phẩm hữu cơ Z (spc) trong chuỗi biến hóa sau: A. B. (H3C)3C CH2 C CH2 CH3
ẠYKÈMQUYNHƠNOFFICIAL
Trang 3
D
C. D.
Câu 15: Cho các phát biểu sau:
(a) Metyl-, etyl-, đimetyl-, trietylamin là những chất khí, dễ tan trong nước.
(b) Anilin là chất lỏng, ít tan trong nước, không màu, để lâu trong không khí sẽ chuyển sang màu hồng.
(c) Phản ứng giữa khí metylamin và khí hydroclorua làm xuất hiện khói trắng là metylamoni clorua.
(d) Dãy các amin sau được sắp xếp theo chiều tính bazơ giảm dần: metylamin; benzylamin; phenylamin; diphenylamin.
(e) Anilin dễ tham gia phản ứng thế hơn benzen do nguyên tử N trong -NH2 đẩy electron vào nhân benzen.
(f) Có thể phân biệt anilin và phenol bằng dung dịch NaOH.
Các phát biểu đúng là: A. (a); (b); (c); (f) B. (a); (c); (d); (e) C. (c); (d); (e); (f) D. (b); (c); (d); (e). Câu 16: Hỗn hợp A gồm tripeptit X, tetrapeptit Y, pentapeptit Z. Thủy phân hoàn toàn m gam A trong dung dịch chứa 20,07 gam NaOH (vừa đủ), kết thúc phản ứng thu được dung dịch B chứa 1,5m gam chất tan. Biết X, Y, Z đều mạch hở; được cấu tạo từ hai trong ba loại axit amin là glyxin, alanin, valin. Giá trị phù hợp với m là
A. 33,66. B. 34,02. C. 35,82. D. 37,44. Câu 17: Bradykinin có trình tự sau: Arg Pro Pro Gly Phe Ser Pro Phe Arg. Tất cả các đoạn peptit sẽ được tạo ra khi xử lý bradykinin với trypsin là:
A. Arg và Pro Pro Gly Phe Ser Pro Phe Arg.
B. Arg và Pro Pro Gly Phe Ser Pro Phe.
C. Arg Pro Pro Gly - Phe; Ser Pro Phe và Arg.
D. Arg ‑ Pro ‑ Pro ‑ Gly; Phe ‑ Ser ‑ Pro và Phe ‑ Arg.
Câu 18: Cho các phát biểu về hợp chất polime:
(1) Cao su thiên nhiên là polime của isoprene, các mắt xích đều có cấu hình cis.
(2) PVC, PS, cao su buna-N đều là chất dẻo.
(3) Đa số các polime không có nhiệt độ nóng chảy xác định, không tan trong các dung môi thông thường.
(4) Len, tơ tằm, tơ nitron kém bền nhiệt và không bị thủy phân trong môi trường axit và kiềm.
(5) Tơ olon, tơ nilon-6 thuộc loại tơ poliamit.
(6) Tơ lapsan, tơ visco, tơ axetat thuộc loại tơ nhân tạo, có nguồn gốc từ xenlulozơ Số phát biểu đúng là A. 2. B. 3. C. 4. D. 5 Câu 19: Tiến hành thí nghiệm với các chất X, Y, Z, T. Kết quả được ghi ở bảng sau: Mẫu thử Thí nghiệm Hiện tượng X Tác dụng với Cu(OH)2 trong môi trường kiềm Sản phẩm có màu tím Y Đun nóng với dung dịch NaOH (loãng, dư), để nguội. Thêm tiếp vài giọt dung dịch CuSO4.
DẠ
Dung dịch thu được có màu xanh lam Z Đun nóng với dung dịch axit H2SO4 (loãng). Sau đó, thêm tiếp dung dịch Na2CO3 đến khi không còn khí thoát ra. Tiếp theo, thêm dung dịch AgNO3 trong NH3, đun nóng nhẹ. Tạo kết tủa Ag T Tác dụng với dung dịch I2 loãng
YKÈMQUYNHƠNOFFICIAL
Thu được sản phẩm có màu xanh tím
Các chất X, Y, Z, T có thể lần lượt là:
A. Lòng trắng trứng, triolein, metyl axetat, hồ tinh bột.
B. Triolein, xenlulozơ, hồ tinh bột, lòng trắng trứng.
C. Vinyl axetat, lòng trắng trứng, triolein, hồ tinh bột.
D. Lòng trắng trứng, triolein, saccarozơ, hồ tinh bột.
Trang 4
Câu 20: Có các phát biểu sau:
(a) Mọi este mạch hở khi xà phòng hóa đều tạo ra muối và ancol.
(b) Phản ứng este hóa xảy ra chậm và thuận nghịch.
(c) Sacarozơ, tơ tằm, lông cừu là polime thiên nhiên.
(d) Cao su Buna - S có cấu trúc mạng không gian.
(e) H2SO4 đặc chỉ đóng vai trò chất hút nước trong phản ứng este hóa.
(f) Đun nóng xelulozơ trong dung dịch H2SO4 70%, sau khi phản ứng hoàn toàn được dung dịch dạng keo.
(g) Protein dạng sợi dễ dàng tan vào nước tạo thành dung dịch không màu.
(h) Vỏ bánh mì khi ăn sẽ ngọt hơn ruột bánh mì.
Có mấy phát biểu sai?
A. 7. B. 5. C. 6 D. 4
Câu 21: Cho các phản ứng hóa học sau:
(a) 2-metylpropan + Cl2 á á , : 1-clo-2-metylpropan + 2-clo-2-metylpropan (X1) (X2)
(b) buta-1,3- đien + Br2 : , 3,4-dibrombut-1-en + 1,4-đibrombut-2-en (X3) (X4)
(c) Toluen + HNO3 đặc đặ , o-nitrotoluen + p-nitrotoluen + m-nitrotoluen (X5) (X6) (X7) Sản phẩm chính trong các phản ứng trên là
A. X1, X3, X5 B. X2, X3, X6 C. X2, X4, X6 D. X1, X4, X5 Câu 22:X, Y là hai axit cacboxylic no, đơn chức, mạch hở, đồng đẳng kế tiếp (MX < MY), T là este tạo bởi X, Y với một ancol 2 chức Z Đốt cháy hoàn toàn 6,42 gam hỗn hợp M gồm X, Y, Z, T bằng lượng vừa đủ O2, thu được 0,23 mol CO2 và 4,14 gam H2O. Mặt khác 4,815 gam M phản ứng vừa đủ với 300 ml dung dịch KOH 0,2M, đun nóng. Phát biểu nào sau đây sai?
A. Thành phần % theo số mol của Y trong M là 12,5%
B. Tổng số nguyên tử hidro trong hai phân tử X, Y bằng 6.
C. Tổng số nguyên tử cacbon trong phân tử T bằng 5.
D. X làm mất màu nước brom.
Câu 23: Phản ứng nào không thể tổng hợp được ancol sau:
A. B. C. D.
YKÈMQUYNHƠNOFFICIAL
DẠ
Câu 24: Dienophile nào sau đây dễ tham gia phản ứng với buta-1,3-diene nhất: A. B.
Trang 5
II. PHẦN TỰ LUẬN: (14,0 điểm)
Câu I (2,0 điểm)
1. Cho các phân tử: IF3, SeF4, KrF4, IF5
a) Viết công thức cấu tạo Lewis cho từng phân tử
b) Dự đoán cấu trúc hình học phân tử và cho biết kiểu lai hoá của nguyên tử trung tâm trong mỗi phân tử.
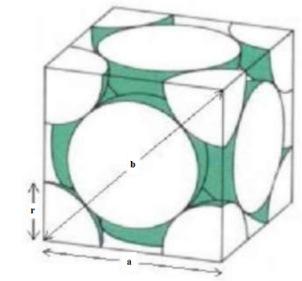
2. Mạng cơ sở của Paladium có dạng lập phương tâm mặt. Khối lượng riêng của Paladium là 12,02 g/cm3 , khối lượng mol là 106,4 g/mol.
a) Tính số nguyên tử trong một ô cơ sở, bán kính của các nguyên tử Paladium theo pm.
b) Tính bán nguyên tử cực đại có thể chui vào các hốc trong mạng tinh thể của Paladium.
YKÈMQUYNHƠNOFFICIAL
Trang 6 C. D.
DẠ
Câu II (2,0 điểm)
1. Cho dung dịch A gồm NH3 x (M) và HCOONa 0,2M; biết rằng pHA = 10,97.
a) Tìm x. b) Tính thể tích dung dịch HCl 0,25M cần thêm vào 100 ml dung dịch A để được dung dịch có pH = 4. Cho biết: a () + 4NH pK= 9,24 ; a HCOO()H pK= 3,75
YKÈMQUYNHƠNOFFICIAL
Pb +HO PbOH +H *β =10 CrO +HO 2CrO +2H K=10 ⇌ ⇌
Trang 7
2. Độ tan của chì cromat không chỉ phụ thuộc pH mà phụ thuộc vào các cấu tử có mặt trong dung dịch. a) Để xác định tích số tan của PbCrO4, người ta tiến hành hòa tan PbCrO4 trong dung dịch CH3COOH 1,000M. Bằng phương pháp phân tích khác, người ta đo được độ tan của PbCrO4 trong trường hợp này là S = 2,9.10−5 M. Hãy tính tích số tan Ksp của PbCrO4 b) Giả sử rằng PbCrO4 tan trong đất và đạt trạng thái cân bằng vào trong nước ngầm có pH = 6,00. Hãy tính các nồng độ cân bằng của các cấu tử: Pb2+; CrO4 2–; HCrO4 vàCr2O7 2–. Cho biết: + 3 32 43 a (CHCOOH)Pb(CHCOO) a (HCrO)Pb(CHCOO) pK =4,76;pK =6,5;lgβ =2,68;lgβ =4,08 2+++-7,8 2 2-2-+-14,64 2724 DẠ
Câu III (2,0 điểm)
1. Một trong những phương pháp phổ biến nhất để tổng hợp hiđro quy mô công nghiệp là sử dụng phản ứng: CH4 (k) + H2O (k) ⇌ 3 H2 (k) + CO (k)
a) Hằng số cân bằng của phản ứng trên ở 298K là KP, 298K = 1,45.10-25; ở 1580K là KP, 1580K =2,66.104. Coi entropy và entanpy không phụ thuộc vào nhiệt độ, tìm ΔHo và ΔSo của phản ứng.
b) Nạp vào bình phản ứng 1 mol CH4 và 1 mol H2O rồi nâng nhiệt độ lên 1100K. Khi cân bằng hình thành thì thấy áp suất trong bình phản ứng là 1,6 atm. Tính hiệu suất chuyển hóa của CH4
2. Trong một phản ứng bậc nhất tiến hành ở 270C, nồng độ chất đầu giảm đi một nửa sau 5000 giây. Ở 370C, nồng độ giảm đi 2 lần sau 1000 giây. Xác định:
Trang 8
ơ
ế
ủ
ả
ứng
ư
(1) N2O5 NO2 + NO3 (2) NO2 + NO3 NO2 + O2 + NO (3) NO + N2O5 3NO2 1 ' 1 k k ⇀ ↽ 2 k → 3k → DẠYKÈMQUYNHƠ
a) Thời gian để nồng độ đầu giảm tới ¼ ở 370C. b) Năng lượng hoạt hóa. 3. Đinitơ pentaoxit phân hủy tạo thành nitơ đioxit và oxy theo phương trình: 2N2O5 → 4NO2 + O2 C
ch
c
a ph
n
trên nh
sau:
NOFFICIAL
ẠYKÈMQUYNHƠNOFFICIAL
Trang 9 Sử dụng nguyên lý phỏng định trạng thái bền đối với NO và NO3 (nguyên lí nồng độ dừng hay nồng độ ổn định) hãy thiết lập biểu thức của tốc độ biến thiên . [ ] 25dNO dt D
Câu IV (2,0 điểm)
1. Cho 4,536 gam hỗn hợp chất rắn X gồm Mg, MgCO3 và Mg(NO3)2 (trong đó, nguyên tố oxi chiếm 28,57% về khối lượng hỗn hợp) vào dung dịch chứa 0,018 mol HNO3 và 0,246 mol KHSO4, khuấy đều cho các phản ứng xảy ra hoàn toàn, thu được dung dịch Y chỉ chứa các muối trung hòa có khối lượng 36,198 gam và hỗn hợp khí Z gồm N2O, N2, CO2 và H2 (trong đó số mol của N2O bằng số mol của CO2). Tính phần trăm về số mol của N2 trong Z.
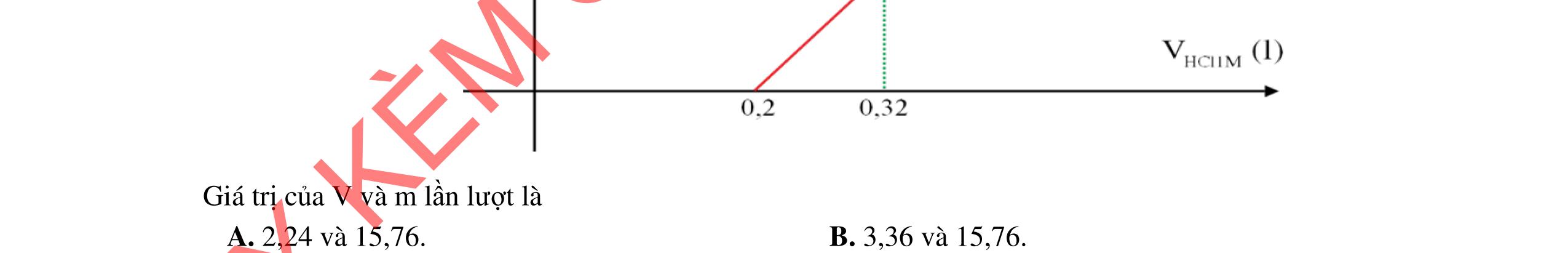
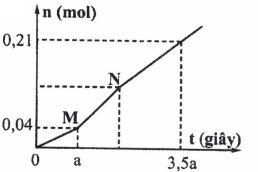
2. Hòa tan hoàn toàn m gam hỗn hợp CuSO4 và KCl vào nước, thu được dung dịch X. Tiến hành điện phân X với các điện cực trơ, màng ngăn xốp, dòng điện có cường độ không đổi. Tổng số mol khí thu được ở cả hai điện cực (n) phụ thuộc vào thời gian điện phân (t) được mô tả như đồ thị bên (gấp khúc tại điểm M, N). Giả sử hiệu suất điện phân là 100%, bỏ qua sự bay hơi của nước. Tìm m.
YKÈMQUYNHƠNOFFICIAL
Trang 10
DẠ
Câu V (2,0 điểm)
1. Viết cơ chế của các phản ứng sau: a) b)

2. Xác định cấu tạo của sản phẩm hữu cơ cuối cùng trong các chuyển hóa sau: a) b) c) d)
DẠYKÈMQUYNHƠNOFFICIAL
Trang 11
Câu VI (1,0 điểm)
Hỗn hợp E chứa hai peptit đều mạch hở gồm peptit X (C8H14O5N2) và peptit Y (C8H15O4N3) có tỉ lệ mol tương ứng 1 : 2. Đun nóng m gam hỗn hợp E với dung dịch NaOH vừa đủ. Sau khi kết thúc phản ứng thu được dung dịch Z có chứa muối của axit glutamic. Cô cạn cẩn thận dung dịch Z thu được 56,4 gam chất rắn khan.
a) Xác định cấu tạo của X và Y.
b) Xác định giá trị của m.
Câu VII (3,0 điểm)
ẠYKÈMQUYNHƠNOFFICIAL
Lịch sử của thuốc gây tê cục bộ bắt đầu với alkaloid cocaine, một chất được tách ra từ cây Erythroxylon coca ở Nam Mỹ. Cocaine đã được sử dụng trong y tế từ thế kỷ 19, nhưng vào đầu thế kỷ 20, nó đã bị cấm do tác dụng gây nghiện mạnh (ma túy). Khi cocaine bị thủy phân tạo thành ecgonine (hình bên) và hai chất có cấu trúc đơn giản: rượu no А và axit cacboxylic đơn chức thơm В. Khi oxi hóa không hoàn toàn một lượng rượu А nhất định có thể thu được 75,0 g aldehyde hoặc 115,0 g acid. Cần 20,0 g dung dịch NaOH 30,0% để trung hoà 18,3 g acid В.
a) Sử dụng phép tính, xác định công thức của rượu А và acid В, vẽ công thức cấu tạo của cocaine. Sử dụng cấu trúc của cocaine làm cơ sở, các nhà hóa học đã cố gắng điều chế các chất tương tự có tác dụng gây tê cục bộ không phải là ma túy. Một trong những chất tương tự đầu tiên được sử dụng cho đến nay là procaine. Có thể thu được chất này bằng phản ứng của axit p aminobenzoic với amino alcohol R2NCH2CH2OH trong đó %mN = 12%, và R là gốc hydrocarbon no.
Trang 12
Ecgonine D
b) Sử dụng phép tính, xác định công thức của amino alcohol R2NCH2CH2OH và vẽ công thức cấ
của propcaine. Anesthesiophore là nhóm hoạt động của một phân tử tạo ra tác dụng gây mê. c) Dựa trên sự giống nhau về cấu trúc của cocaine và procaine, hãy đề xuất cấu trúc tổng quát của anesthesiophore đối với cocaine và phần lớn các chất tương tự của nó.
DẠYKÈMQUYNHƠNOFFICIAL
Trang 13
tạo
u
PHẦN BỔ SUNG BÀI LÀM (nếu có)
YKÈMQUYNHƠNOFFICIAL
Trang 14
DẠ
ẠYKÈMQUYNHƠNOFFICIAL
Trang 15 ----------------------HẾT --------------------
D
ƠNOFFICIAL
Trang 16 ĐÁP ÁN TRẮC NGHIỆM
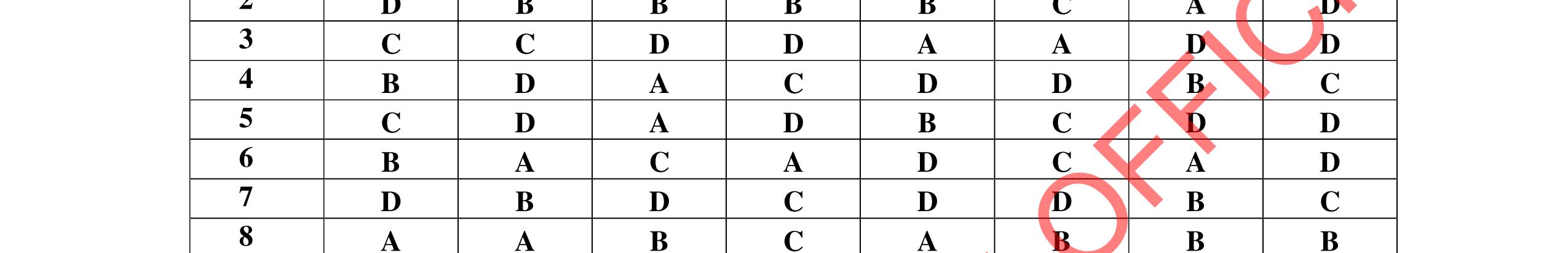
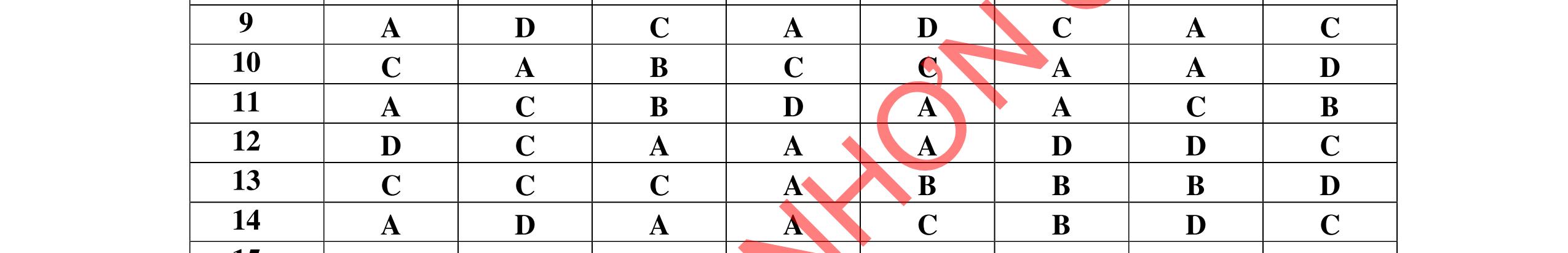
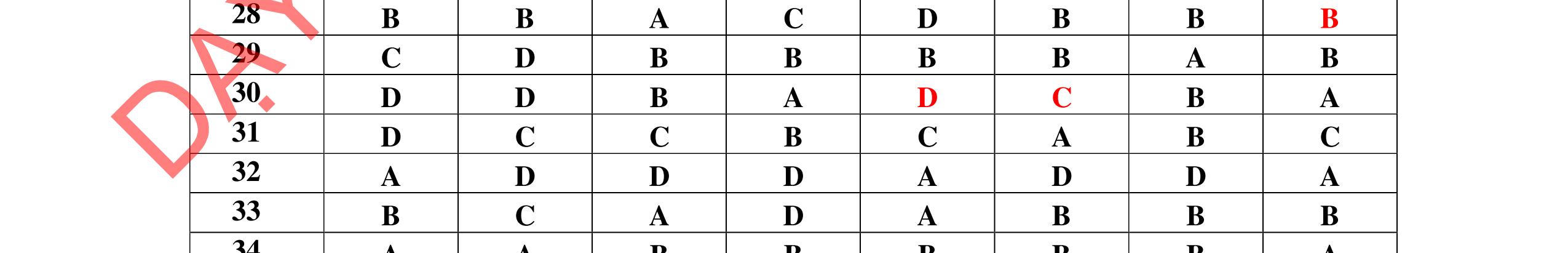
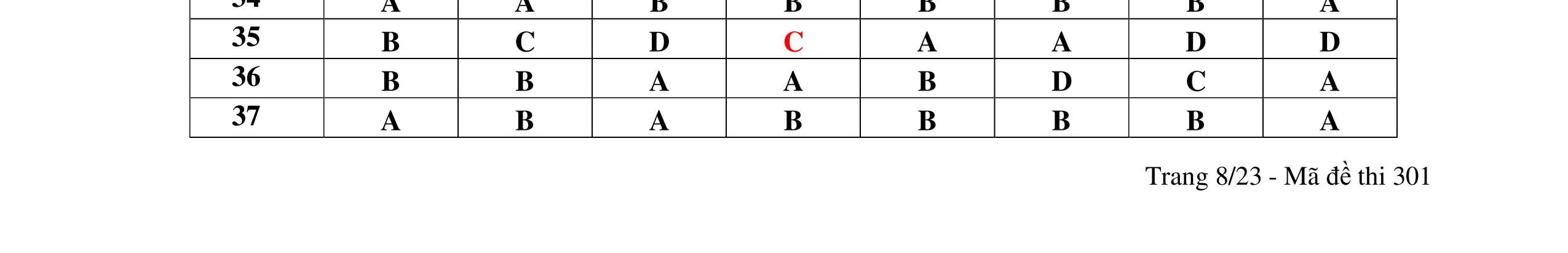
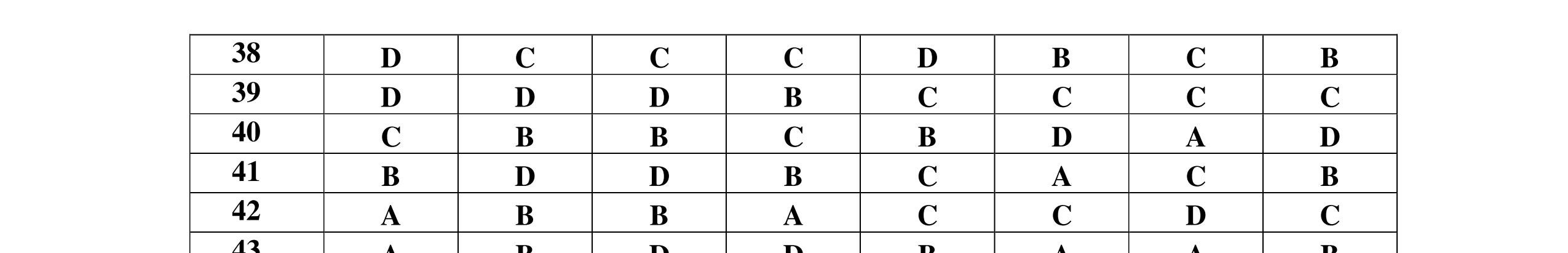
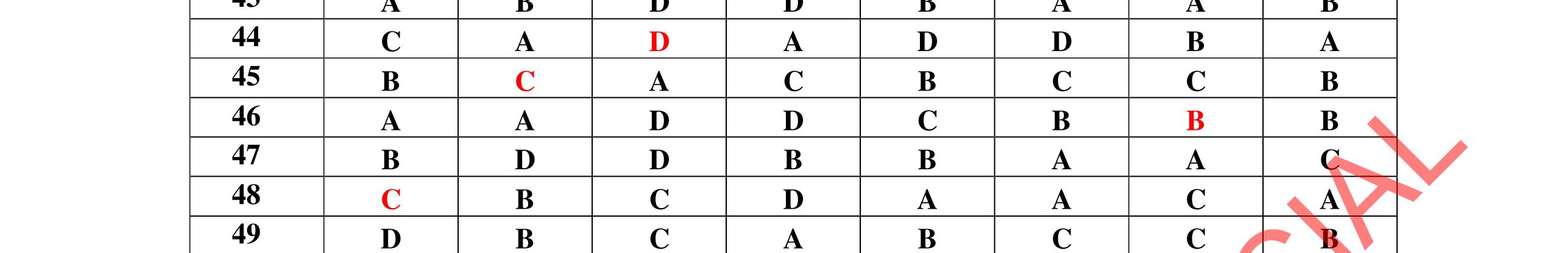
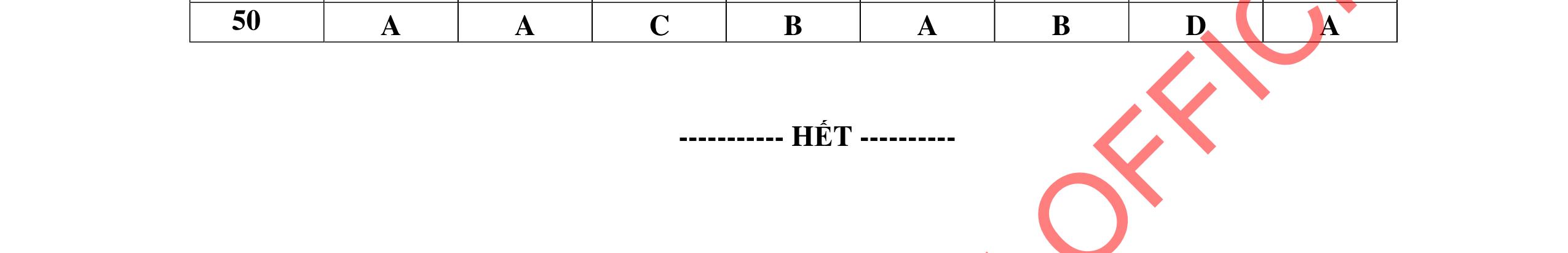
1D 2A 3C 4A 5B 6C 7C 8D 9B 10C 11A 12C 13B 14D 15C 16C 17A 18A 19D 20C 21D 22C 23B 24C DẠYKÈMQUYNH
Câu I (2,0 điểm)
1. Cho các phân tử: IF3, SeF4, KrF4, IF5
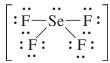

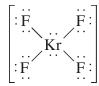
a) Viết công thức cấu tạo Lewis cho từng phân tử
b) Dự đoán cấu trúc hình học của các phân tử đó và cho biết kiểu lai hoá của nguyên tử trung tâm trong mỗi phân tử trên.
2. Mạng cơ sở của Paladium có dạng lập phương tâm mặt. Khối lượng riêng của Paladium là 12,02 g/cm3 , khối lượng mol là 106,4 g/mol.
a) Tính số nguyên tử trong một ô mạng cơ sở của Paladium, độ dài cạnh của ô mạng và bán kính của các nguyên tử Paladium theo pm.
b) Tính bán nguyên tử cực đại có thể chui vào các hốc trong mạng tinh thể của Paladium.
8,852/
Trang 17
Thể
ủ
ô
ơ
ở
A
V
N === V
==
==
DẠYKÈMQUYNHƠ
Câu I Nội dung Điểm 1 sp3d, chữ T sp3d, bập bênh sp3d2, vuông phẳng sp3d2, chóp đáy vuông 1,0 2 a. Thể tích của 1 mol nguyên tử Pd là 3 106,4
12,02 Pd M V cmmol ρ === Từ hình vẽ trên, có thể thấy tổng số nguyên tử Pd trong 1 ô cơ sở là : 11 6.8.4 28 +=
tích c
a
c
s
là : 23 23 8,852.4. .4 5,88.10() 6,022.10 Pd
V
m
ậy chiều dài cạnh củaô mạng cơ sở là : 23 8 3 3 5,88.103,89.10()389 aV cmpm
= = b. Từ hình vẽ trên ta cũng thấy đướng chéo của mặt lập phương là b với b=4r = 2 a . Suy ra 138 22 a r pm
0,5
NOFFICIAL
Trong mạng tinh thể Pd có các 8 hốc tứ diện và 4 hốc bát diện nằm tại tâm của hình lập phương và trung điểm các cạnh.
Bán kính tối đa nguyên tử có thể chui vào hốc tứ diện là : ()2 220 2(r)2(r).cos(1095) PdPdm Pdmrrr =+−+ suy ra rm =30,87pm
Bán kính tối đa có thể chui vào hốc bát diện là : 23892.138 57 22 m ar r pm == =
ẠYKÈMQUYNHƠNOFFICIAL
Trang 18
0,5
D
Câu II (2,0 điểm)
1. Cho dung dịch A gồm NH3 x (M) và HCOONa 0,2M; biết rằng pHA = 10,97. a) Tìm x. b) Tính thể tích dung dịch HCl 0,25M cần thêm vào 100 ml dung dịch A để được dung dịch có pH = 4. Cho biết: a () + 4NH pK= 9,24 ; a HCOO()H pK= 3,75
ượng sẽ tính ra được: CNH3 = 0,051M 3 + NH NH =10-5,24 << 1 [NH3] << [NH4 +]. HCl phản ứng hết với NH3 + ][ ][ HCOOH HCOO = 100,25 = 1,78 > 1 [HCOO ] > [HCOOH] HCl phản ứng một phần với HCOONa. 36,0 101 1][ 25,0 = + = HCOOH C HCOOH [HCOOH] = 0,36.0,2 = 0,072 (M) nHCl = nHCOOH + nNH4+ = 0,072.0,1 + 0,051.0,1 = 0,0123 (mol) VHCl = 0,0492 (l) = 49,2 (ml)
Pb +HO PbOH +H *β =10 CrO +HO 2CrO +2H K=10 ⇌ ⇌ Câu 2 Nội dung Điểm a. NH3 + H2O ⇌ NH4 + + OH KNH3 = 10-4,76 (1) HCOO + H2O ⇌ HCOOH + OH KHCOO- = 10-10,25 (2) H2O ⇌ H+ + OH Kw = 10-14 (3) pH = pKa + lg][ ][ A B 10,97 = 3,75 + lg ][ ][ HCOOH HCOO ][ ][ HCOOH HCOO = 107,22 + Nồng độ HCOOH trong dung dịch cân bằng rất thấp, chứng tỏ lượng HCOO bị thủy phân rất bé, không đáng kể, nên cũng không xét đến cân bằng của nước. Vậy độ pH của dung dịch chỉ phụ thuộc vào cân bằng (1). + Từ cân bằng (1), áp dụng định luật tác dụng khối l 3 + NH NH ][ ][ 4
0,5 0,5 DẠYKÈMQUYNHƠNOFFICIAL
Trang 19
2. Độ tan của chì cromat không chỉ phụ thuộc pH mà phụ thuộc vào các cấu tử có mặt trong dung dịch. a) Để xác định tích số tan của PbCrO4, người ta tiến hành hòa tan PbCrO4 trong dung dịch CH3COOH 1,000M. Bằng phương pháp phân tích khác, người ta đo được độ tan của PbCrO4 trong trường hợp này là S = 2,9.10−5 M. Hãy tính tích số tan Ksp của PbCrO4 b) Giả sử rằng PbCrO4 tan trong đất và đạt trạng thái cân bằng vào trong nước ngầm có pH = 6,00. Hãy tính các nồng độ cân bằng của các cấu tử: Pb2+; CrO4 2–; HCrO4 vàCr2O7 2–. Cho biết: + 3 32 43 a (CHCOOH)Pb(CHCOO) a (HCrO)Pb(CHCOO) pK =4,76;pK =6,5;lgβ =2,68;lgβ =4,08 2+++-7,8 2 2-2-+-14,64 2724 b. Ta có: + 4 = 9,24 + lg ][ ][ 4
KK.[H]2K.[H] [Pb]=[CrO]+[HCrO]+2[CrO]= + + [Pb]K[Pb]K.[Pb] 1,99.101,99.10.102.(1,99.10).(10) [Pb] [Pb]10.[Pb]10[Pb] [Pb]2,878.
=+ + = 7 10 (M) [CrO4 2-] = 6,915.10-8 (M) [HCrO4 ] = 2,187.10-7 (M) [Cr2O7 2-] = 2,087.10-12 (M)

0,5
0,5 D
Trang 20
2
b. + 2+2 sp sp sp 2+ 2- 24 4 27 2+ 2+ 2+2 a 1414614262 2+ 2+-6,52+ -14,642+2 2+
ẠYKÈMQUYNHƠNOFFICIAL
1. Một trong những phương pháp phổ biến nhất để tổng hợp hiđro quy mô công nghiệp là sử dụng phản ứng: CH4 (k) + H2O (k) ⇌ 3 H2 (k) + CO (k)
a) Hằng số cân bằng của phản ứng trên ở 298K là KP, 298K = 1,45.10-25; ở 1580K là KP, 1580K =2,66.104. Coi entropy và entanpy không phụ thuộc vào nhiệt độ, tìm ΔHo và ΔSo của phản ứng.
b) Nạp vào bình phản ứng 1 mol CH4 và 1 mol H2O rồi nâng nhiệt độ lên 1100K. Khi cân bằng hình thành thì thấy áp suất trong bình phản ứng là 1,6 atm. Tính hiệu suất chuyển hóa của CH4
2. Trong một phản ứng bậc nhất tiến hành ở 270C, nồng độ chất đầu giảm đi một nửa sau 5000 giây. Ở 370C, nồng độ giảm đi 2 lần sau 1000 giây. Xác định:
a) Thời gian để nồng độ đầu giảm tới ¼ ở 370C. b) Năng lượng hoạt hóa.
Đinitơ pentaoxit phân hủy tạo thành nitơ đioxit và oxy theo phương trình:
Trang 21 Câu III (2,0 điể
m)
n đối với NO và NO3 (nguyên
ồng
ừng
ồng
ổn đị
thiết lập biểu thức của tốc độ biến
. Câu 2 Nội dung Điểm 1 a. () ( ) kJkJ H H TT R H TK TK 20675,205 1580 298 314,8 1045,1 1066,2 ln )( )( ln 0 1 1 0 25 4 1 2 1 1 0 1 2 ≈ =∆ ∆ = ⋅ ∆ = 93,214 298 141700 205750 298 205750)1045,1ln(298314,8 ln 0 0 25 0 0 = =∆ ∆⋅−=⋅⋅⋅− ∆⋅−∆=− S S STHKRT b. 0 pu,1100K G2057501100214,9330673J30,7kJ ∆=−⋅=−=− 30673 8,3141100 p,1100K Ke 28,6 × = = CH4 (k) + H2O (k) 3 H2 (k) + CO (k) nban đầu 1 1 0 0 ncb 1-a 1-a 3a a Σn = 2(1+a) Pcb 1a 2(1a)p + 1a p 2(1a) + 3a p 2(1a) + a p 2(1a) + 0,5 1 ' 1 k k ⇀ ↽ 2 k → 3k → [ ] 25dNO dt DẠYKÈMQUYNHƠNOFFICIAL
3.
2N2O5 → 4NO2 + O2 Cơ chế của phản ứng trên như sau: (1) N2O5 NO2 + NO3 (2) NO2 + NO3 NO2 + O2 + NO (3) NO + N2O5 3NO2 Sử dụng nguyên lý phỏng định trạng thái bề
lí n
độ d
hay n
độ
nh) hãy
thiên
2
(3a)a2(1a)2(1a) K p 2(1a)2(1a)(1a)(1a) 4K 27a 1a K p 4(1a)(1a) p271a
33 4 2 2 P P 22 2
⋅⋅⋅+⋅⋅+ = ⋅+⋅⋅+⋅−⋅− ⋅ = ⋅= ⋅+− K = 28,6; p = 1,6 atm → a = 0,7501→ Hiệu suất 75,01%
a. 0 -4-1 27C 0,693 k = =1,39.10 s 5000 0 4-1 37C 0,693 k = =6,93.10 s 1000 1/4 -4
1a t = ln =2000(s) 6,93.10a/4 0,25 b. Năng lượng hoạt hóa E được tính theo biểu thức: 2 1
k E11 lg = .k2,303.RTT -4 -4 lg6,93.10E11 = .1,39.102,303.8,314300310 E = 124 kJ/mol 0,25 3
T T 12
3 d[NO] dt ' 1k ≈ d[NO] dt ≈ 25 d[NO] dt ' 1k ' 1k 3 2 ' 121 [] k k NO kkk = + 12 ' 312 [] () kk NO kkk = + 3 2
k k 25 d[NO] dt 1k 3 2
Áp dụng nguyên lí nồng độ ổn định đối với NO3 và NO: = k1.[N2O5] - .[NO2].[NO3] – k2.[NO2].[NO3] 0 (1) = k2.[NO2].[NO3] – k3.[NO].[N2O5] 0 (2) = - (k1.[N2O5] + k3.[NO].[N2O5] ) + .[NO2].[NO3] Từ (1) và (2) suy ra: k1.[N2O5] = ( + k2).[NO2].[NO3] k3.[NO].[N2O5] = k2.[NO2].[NO3] [NO2].[NO3] = .[NO].[N2O5] = - k1.[N2O5] - k3.[NO].[N2O5] + ..[NO].[N2O5] = k1.(-1 - + ).[N2O5] = 0,5
k kk +
k k 2 ' 12
' 1 ' 12
2.kkNO kk +
k kk + [ ] 1225 ' 12
ẠYKÈMQUYNHƠNOFFICIAL
Trang 22
3 2 P
0,5
D
Câu IV (2,0 điểm)

1. Cho 4,536 gam hỗn hợp chất rắn X gồm Mg, MgCO3 và Mg(NO3)2 (trong đó, nguyên tố oxi chiếm 28,57% về khối lượng hỗn hợp) vào dung dịch chứa 0,018 mol HNO3 và 0,246 mol KHSO4, khuấy đều cho các phản ứng xảy ra hoàn toàn, thu được dung dịch Y chỉ chứa các muối trung hòa có khối lượng 36,198 gam và hỗn hợp khí Z gồm N2O, N2, CO2 và H2 (trong đó số mol của N2O bằng số mol của CO2). Tính phần trăm về số mol của N2 trong Z.
2. Hòa tan hoàn toàn m gam hỗn hợp CuSO4 và KCl vào nước, thu được dung dịch X. Tiến hành điện phân X với các điện cực trơ, màng ngăn xốp, dòng điện có cường độ không đổi. Tổng số mol khí thu được ở cả hai điện cực (n) phụ thuộc vào thời gian điện phân (t) được mô tả như đồ thị bên (gấp khúc tại điểm M, N). Giả sử hiệu suất điện phân là 100%, bỏ qua sự bay hơi của nước. Tìm m.
Trang 23
Hướng
ẫn
ấ
Đ
ể
1 + + + ++= = + +++= = ++= +→ 2 4 2 4 quyñoåi 3 3 Mg:xmol
+ +
+== = + ++++== = = = ++ 2
2 2 2 2 2 2 4 2
NH
N
+ >
+ >>
2
++== + = = ++== +=++ = 2 44 Cl CuSOCuSO 2x3y0,040,21x0,04
0,04.22x4y0,28y0,03 0,28(0,042.0,03).22nn0,04mol m =
+
DẠYKÈMQUYNHƠNOFFICIAL
Câu 4
d
ch
m
i
m
K:0,246mol 2xy0,2460,246.2 x0,12 Ygoàm NH:ymol24x18y0,246.390,246.9636,198y0,006 SO:0,246mol Mg:0,12mol 62a60b0,12.24 XNO:amol CO:bmol
== =
2
NOCO N HCONNOH
H
nn0,009 4,536a0,018 16.(3a3b)4,536.28,57%b0,009n0,006(BTN) BTH:2n10n2n12n10nn0,264n0,012. 0,006 %n16,67% 0,009.20,0060,012 1,0 2 +
>
2
2 2 22 2 2 Thöùtöïoxihoùatreânanot:ClHO;Thöùtöïkhöûtreâncatot:CuHO. Ñoaïn(1)bieåudieãnkhíCl0,04mol Ñoädoác:(2)(3)(1)Ñoaïn(2)bieåudieãnkhíCl xmol, H xmol Ñoaïn(3)bieåudieãnkhíO ymol,H 2ymol
n0,08nKCl0,16mol
0,16.74,5
0,04.160 = 18,32. 1,0
Câu V: (2 điểm)
V.1 Viết cơ chế của các phản ứng sau: a. b. V.2 Xác định cấu tạo của sản phẩm hữu cơ cuối cùng trong các chuyển hóa sau: a. b. c. d.
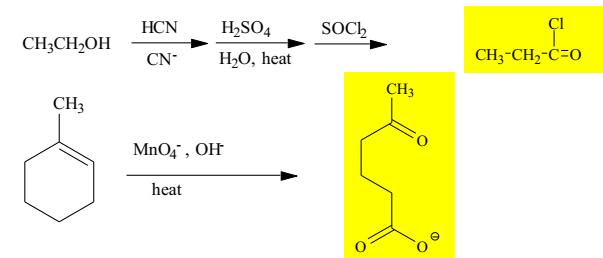
YKÈMQUYNHƠNOFFICIAL


Trang 24 PHẦN II - TỰ LUẬN
CÂU IV HƯỚNG DẪN CHẤM ĐIỂM IV.1 a. 0.5 DẠ
YKÈMQUYNHƠNOFFICIAL

Trang 25 b. 0.5 IV.2
0.25 x 4 DẠ
Câu VI: Hỗn hợp E chứa hai peptit đều mạch hở gồm peptit X (C8H14O5N2) và peptit Y (C8H15O
có tỉ lệ mol tương ứng 1 : 2. Đun nóng m gam hỗn hợp E với dung dịch NaOH vừa đủ. Sau khi kết thúc phản ứng thu được dung dịch Z có chứa muối của axit glutamic. Cô cạn cẩn thận dung dịch Z thu được 56,4 gam chất rắn khan.
VI.1 Xác định cấu tạo của X và Y.
VI.2 Xác định giá trị của m.
CÂU VI HƯỚNG D
VI.1 CT của X: Glu - ala hay Ala - glu CT của Y: Gly - ala - ala Hoặc Ala - gly - ala Hoặc Ala - ala - gly
Ẫ
N CHẤM ĐIỂM
0,5
VI.2 C8H14O5N2 là Glu-Ala = x mol và C8H15O4N3 là Gly-Ala2 = 2x mol. Tổng khối lượng ( Glu-Na + Ala-Na + Gly-Na ) = 191x + 555x + 194x = 56,4 x = 0,06 mol. m = 0,06.652 = 39,12 gam.
0,5
DẠYKÈMQUYNHƠNOFFICIAL
Trang 26
4N3
)
Câu VII: (3 điểm) Lịch sử của thuốc gây tê cục bộ bắt đầu với alkaloid cocaine, một chất được tách ra từ cây Erythroxylon coca ở Nam Mỹ. Cocaine đã được sử dụng trong y tế từ thế kỷ 19, nhưng vào đầu thế kỷ 20, nó đã bị cấm do tác dụng gây nghiện mạnh (ma túy). Khi cocaine bị thủy phân tạo thành ecgonine (hình bên) và hai chất có cấu trúc đơn giản: rượu no А và axit cacboxylic đơn chức thơm В. Khi oxi hóa không hoàn toàn một lượng rượu А nhất định có thể thu được 75,0 g aldehyde hoặc 115,0 g acid. Cần 20,0 g dung dịch NaOH 30,0% để trung hoà 18,3 g acid В. V.1 Sử dụng phép tính, xác định công thức của rượu А và acid В, vẽ công thức cấu tạo của cocaine. Sử dụng cấu trúc của cocaine làm cơ sở, các nhà hóa học đã cố gắng điều chế các chất tương tự có tác dụng gây tê cục bộ không phải là ma túy. Một trong những chất tương tự đầu tiên được sử dụng cho đến nay là procaine. Có thể thu được chất này bằng phản ứng của axit p-aminobenzoic với amino alcohol R2NCH2CH2OH trong đó %mN = 12%, và R là gốc hydrocarbon no. V.2 Sử dụng phép tính, xác định công thức của amino alcohol R2NCH2CH2OH và vẽ công thức cấu tạo của propcaine. Anesthesiophore là nhóm hoạt động của một phân tử tạo ra tác dụng gây mê. V.3 Dựa trên sự giống nhau về cấu trúc của cocaine và procaine, hãy đề xuất cấu trúc tổng quát của anesthesiophore đối với cocaine và phần lớn các chất tương tự của nó.

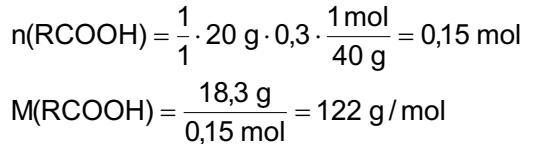
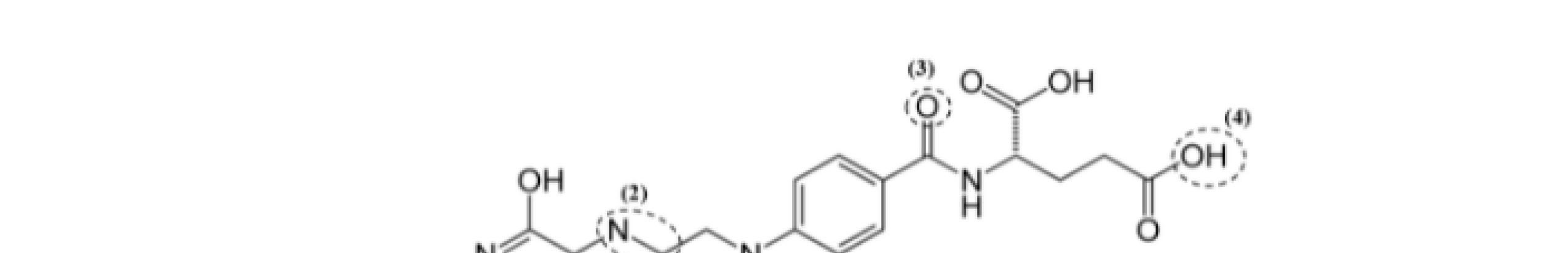
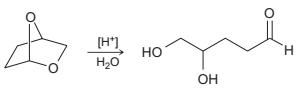
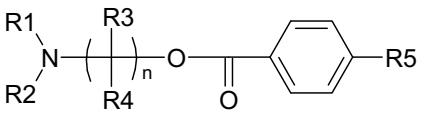
Trang 27
CÂU
V.1 A - Methanol CH3OH……………………………………………………………... ⇒ ⇒ R là vòng benzene ⇒B là acid benzoic C6H5COOH…………………………………………………. Cocainelàester2chứccủaecgoninevớimethanolvàacidbenzoic:…………… 0.5 0.5 0.5 V.2 R là nhóm etyl (C2H5) ⇒ Amino alcohol: (C2H5)2NCH2CH2OH…………….. 0.5 Ecgonine DẠYKÈMQUYNHƠNOFFICIAL
V HƯỚNG DẪN CHẤM ĐIỂM
Procaine là sản phẩm của phản ứng giữa p-amino benzoic acid và amino alcohol: 0.5
V.3 So sánh cấu trúc của procaine và cocaine cho thấy cấu trúc của anesthesiophore như sau: 0.5
ẠYKÈMQUYNHƠNOFFICIAL
Trang 28
D
SỞ GD&ĐT HÀ GIANG
ĐỀ
THI CHÍNH THỨC
(Đề thi gồm: 02 trang)
KỲ THI CHỌN HỌC SINH GIỎI CẤP TỈNH LỚ
NĂM HỌC 2021 - 2022 Môn thi: HÓA HỌC - THPT Thời gian: 180 phút (không kể thời gian phát đề)
Cho nguyên tử khối: H=1; C=12; N=14; O=16; P=31; Na=23; Mg=24; Al=27; K=39; Ba=137; Fe=56; Cu=64.
Câu 1 (4,0 điểm)
1. Cân bằng các phản ứng hóa học sau theo phương pháp thăng bằng electron:
a. Cl2 + H2S + H2O → HCl + H2SO4
b. Fe + HNO3 → Fe(NO3)3 + NxOy + H2O
2. Viết phương trình hóa học trong các trường hợp sau:
a. Phản ứng được dùng để khắc chữ trên thủy tinh.
b. Phản ứng dùng dung dịch KI chứng minh O3 hoạt động hơn O2.
3. Từ tinh bột (các chất vô cơ và điều kiện cần thiết có đủ), viết các phương trình hóa học điều chế: PE, etyl axetat.
Câu 2 (4,0 điểm)
1. Nêu hiện tượng và viết phương trình hóa học trong các thí nghiệm sau:
a. Cho dung dịch BaCl2 vào dung dịch KHSO4
b. Cho dung dịch Fe(NO3)2 vào dung dịch HCl loãng.
2. Hãy trình bày phương pháp hóa học làm sạch các chất sau:
a. HCl bị lẫn tạp chất H2S.
b. CO2 bị lẫn tạp chất SO2.
3. Ba chất hữu cơ X1, Y1, Z1 có cùng công thức phân tử C4H8O2, có đặc điểm sau:
+ X1 có mạch cacbon phân nhánh, tác dụng được với Na và NaOH. + Y1 được điều chế trực tiếp từ axit và ancol có cùng số nguyên tử cacbon.
+ Z1 tác dụng được với NaOH và tham gia phản ứng tráng bạc. Xác định các chất X1, Y1, Z1 và viết các phương trình phản ứng xảy ra. Câu 3 (5,0 điểm)
1. Xác định công thức cấu tạo các chất và viết phương trình hóa học theo sơ đồ: A (C6H8O4) + NaOH 0t → X + Y + Z X + H2SO4 E + Na2SO4 Y + H2SO4 F + Na2SO4 F 24 o HSO, 180C → R + H2O Cho biết E, Z đều cho phản ứng tráng gương, R là axit có công thức C3H4O2
ẠYKÈMQUYNHƠNOFFICIAL
→ →
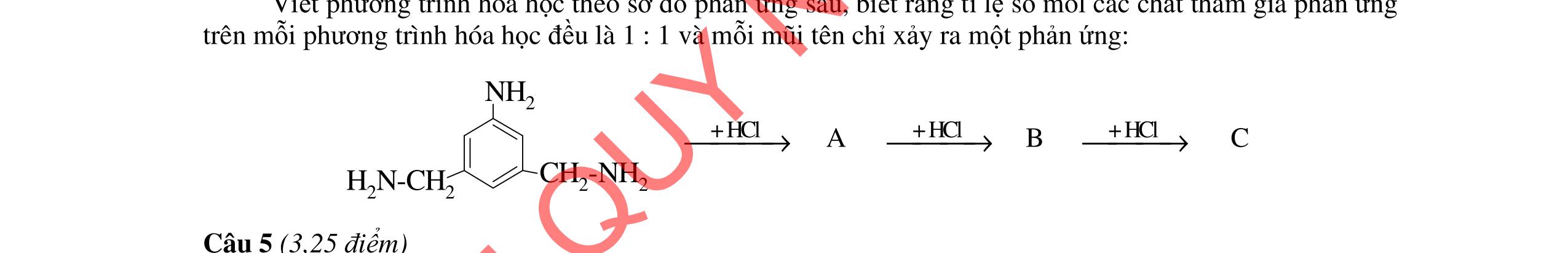
2. Cho X và Y là hai axit cacboxylic đơn chức, mạch hở (có một nối đôi C=C); Z là ancol no, mạch hở; T là este ba chức tạo bởi X, Y và Z. Chia 40,38 gam hỗn hợp E gồm X, Y, Z, T thành 3 phần bằng nhau. Đốt cháy hoàn toàn phần 1, thu được 0,5 mol CO2 và 0,53 mol H2O. Phần 2 cho tác dụng với dung dịch brom dư, thấy có 0,05 mol Br2 phản ứng. Phần 3 cho tác dụng với lượng vừa đủ dung dịch hỗn hợp gồm KOH 1M và NaOH 3M, cô cạn, thu được m gam muối khan. Tìm giá trị của m.
D3. Hỗn hợp X gồm 3 este (1 este đơn chức và 2 este hai chức) đều mạch hở và không phân nhánh (không chứa nhóm chức khác). Thủy phân hoàn toàn 22,1 gam X cần dùng 300 ml dung dịch NaOH 1M thu được hỗn hợp Y chứa 3 ancol đều no và hỗn hợp muối. Lấy toàn bộ hỗn hợp muối này đun nóng với vôi tôi xút thu được duy nhất một hiđrocacbon đơn giản nhất có thể tích là 6,272 lít (đktc). Mặt khác đốt cháy 22,1 gam X cần dùng 1,025 mol O2. Xác định công thức cấu tạo các este trong X, gọi tên và tính phần trăm khối lượng của các ancol có trong hỗn hợp Y.
Trang 1/2
P 12
Câu 4 (5,0 điểm)
1. Hấp thụ hoàn toàn 4,48 lít CO2 (đktc) vào 500 ml dung dịch hỗn hợp (NaOH 0,1M ; Ba(OH)2 0,2M) sinh ra m gam kết tủa. Tính giá trị m.
2. Hòa tan m gam CuSO4.3H2O vào nước được dung dịch X. Cho 14,8 gam hỗn hợp Y gồm Mg và Fe vào dung dịch X. Sau khi các phản ứng xảy ra hoàn toàn thu được chất rắn Z có khối lượng 21,6 gam và dung dịch T. Cho dung dịch T tác dụng với dung dịch NaOH dư, lọc lấy kết tủa rồi nung trong không khí đến khối lượng không đổi thu được hỗn hợp oxit có khối lượng 14,0 gam. Tính giá trị m.
3. Để m gam hỗn hợp E gồm Al, Fe và Cu trong không khí một thời gian, thu được 34,4 gam hỗn hợp X gồm các kim loại và oxit của chúng. Cho 6,72 lít (đktc) khí CO qua X nung nóng, thu được hỗn hợp rắn Y và hỗn hợp khí Z có tỉ khối so với H2 là 18. Hòa tan hoàn toàn Y trong dung dịch chứa 1,7 mol HNO3, thu được dung dịch chỉ chứa 117,46 gam muối và 4,48 lít (đktc) hỗn hợp khí T gồm NO và N2O. Tỉ khối của T so với H2 là 16,75. Tính giá trị của m.
Câu 5 (2,0 điểm)
1. Cho biết công thức VSEPR, dạng hình học, kiểu lai hóa của NO2 và BrF5.
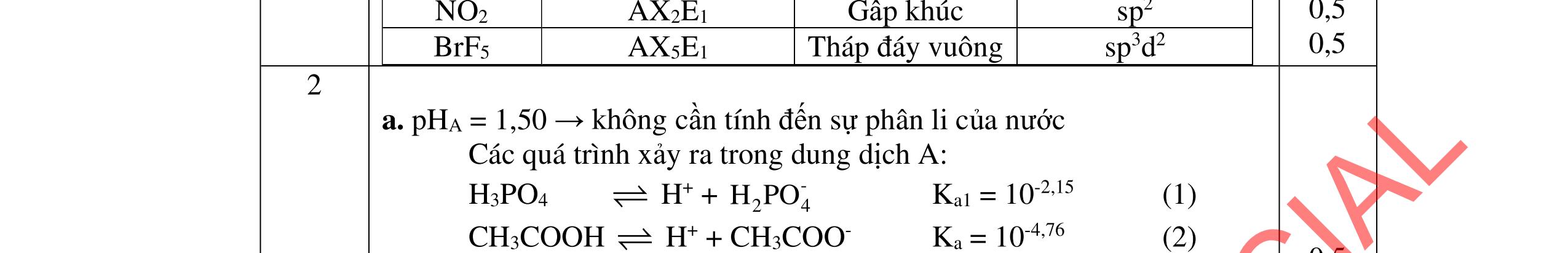
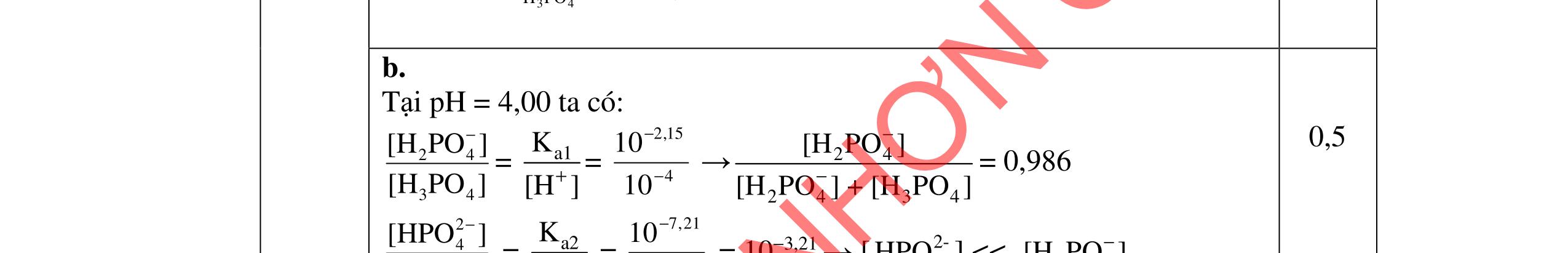
2. Trộn 10,00 mL dung dịch CH3COOH 0,20 M với 10,00 mL dung dịch H3PO4, thu được dung dịch A có pH = 1,50.
a. Tính 34HPOC trong dung dịch H3PO4 trước khi trộn.
b. Thêm từ từ Na2CO3 rắn vào dung dịch A cho đến pH = 4,0 thu được dung dịch B. Tính số gam Na2CO3 đã dùng.
Cho biết: H3PO4: pKa1 = 2,15; pKa2 = 7,21; pKa3 = 12,32; CH3COOH: pKa = 4,76; (CO2 + H2O) có pKa1 = 6,35; pKa2 = 10,33. --------------------- Hết ----------------------
Thí sinh không được sử dụng tài liệu. Giám thị không giải thích gì thêm. Họ tên thí sinh: Số báo danh: Chữ kí Giám thị 1 Chữ kí Giám thị 2
DẠYKÈMQUYNHƠNOFFICIAL
Trang 2/2
NĂM HỌC 2021 - 2022 (Hướng dẫn chấm gồm 06 trang)
HƯỚNG DẪN CHẤM Môn thi: HÓA HỌC - THPT A. Hướng dẫn chung Hướng dẫn chấm chỉ xác định những yêu cầu và mức điểm cơ bản, giám khảo cân nhắc từng trường hợp cụ thể để lượng hóa điểm một cách chính xác. Thí sinh làm bài theo cách khác mà đúng vẫn được điểm tối đa. B. Đáp án và thang điểm
Câu 1 (4,0 điểm)
1. Cân bằng các phản ứng hóa học sau theo phương pháp thăng bằng electron:
a. Cl2 + H2S + H2O → HCl + H2SO4

b. Fe + HNO3 → Fe(NO3)3 + NxOy + H2O
2. Viết phương trình hóa học trong các trường hợp sau:
a. Phản ứng được dùng để khắc chữ trên thủy tinh. b. Phản ứng dùng dung dịch KI chứng minh O3 hoạt động hơn O2. 3. Từ tinh bột (các chất vô cơ và điều kiện cần thiết có đủ), viết các phương trình Câu 1 HDC Điểm 1 a. 4Cl2 + H2S + 4H2O → 8HCl + H2SO4 4 x Cl2 0 + 2e → 2Cl1 x S-2 → S+6 + 8e 0,5 b. (5x-2y)
Trang 3/2 SỞ
Đ
P 12
GD&
T HÀ GIANG KỲ THI CHỌN HỌC SINH GIỎI CẤP TỈNH LỚ
Fe + (18x-6y) HNO3 → (5x-2y) Fe(NO3)3 + 3NxOy + (9x-3y)H2O 2 5 03 3xN +(5-2)e N (5-2)xFe Fe + 3e y x xxyx xy + + + → → 0,5 2 a. SiO2 + 4HF → SiF4 + 2H2O 0,5 b. 2KI + H2O + O3 → 2KOH + O2↑ + I2↓ 0,5 3 (C6H10O5)n + nH2O oH,t + → nC6H12O6 C6H12O6 menruou → 2C2H5OH + 2CO2 C2H5OH 24(dac) 170o HSO C → CH2=CH2 + H2O 1,0 C2H5OH + O2 mengiam → CH3COOH + H2O CH3COOH + C2H5OH 24(d) ac o HSO t → ← CH3COOC2H5 + H2O 1,0 Câu 2 (4,0 điểm) 1. Nêu hiện tượng và viết phương trình hóa học trong các thí nghiệm sau: a. Cho dung dịch BaCl2 vào dung dịch KHSO4. b. Cho dung dịch Fe(NO3)2 vào dung dịch HCl loãng. ĐỀ THI CHÍNH THỨC DẠYKÈMQUYNHƠNOFFICIAL
2. Hãy trình bày phương pháp hóa học làm sạch các chất sau:
a. HCl bị lẫn tạp chất H2S.
b. CO2 bị lẫn tạp chất SO2.
3. Ba chất hữu cơ X1, Y1, Z1 có cùng công thức phân tử C4H8O2, có đặc điểm sau:
+ X1 có mạch cacbon phân nhánh, tác dụng được với Na và NaOH.
+ Y1 được điều chế trực tiếp từ axit và ancol có cùng số nguyên tử cacbon.
+ Z1 tác dụng được với NaOH và tham gia phản ứng tráng bạc. Xác định các chất X1, Y1, Z1 và viết các phương trình phản ứng xảy ra.
Câu 2
HDC
1 a. Có kết tủa trắng xuất hiện trong dung dịch BaCl2 + 2KHSO4 BaSO4 + K2SO4 + 2HCl
b. Dung dịch chuyển sang màu vàng đồng thời có khí không màu thoát ra bị hóa nâu trong không khí. 3Fe2+ + 4H+ + NO3 3Fe3+ + NO + 2H2O 2NO + O2 2NO2
2 a. Sục hỗn hợp qua dung dịch Cu(NO3)2 dư trong HCl đặc H2S bị giữ lại. Cu(NO3)2 + H2S CuS + 2HNO3
Điểm
0,5
0,5
0,5 b. Sục hỗn hợp qua dung dịch chất oxi hóa mạnh (KMnO4, Br2...) SO2 bị giữ lại SO2 + Br2 + 2H2O 2HBr + H2SO4
0,5 0,5 0,5 0,5
0,5 3 X1 là CH3CH(CH3)-COOH, Y1 là CH3COOC2H5, Z1 là HCOOC3H7 CH3CH(CH3)-COOH + Na → CH3CH(CH3)-COONa + 1/2H2 CH3CH(CH3)-COOH + NaOH → CH3CH(CH3)-COONa + H2O CH3COOH + C2H5OH o , t 24HSO → ← CH3COOC2H5 + H2O HCOOC3H7 + 2[Ag(NH3)2]OH 0 t → H4NOCOOC3H7 + H2O + 3NH3 + 2Ag
3 (5,0 điểm)
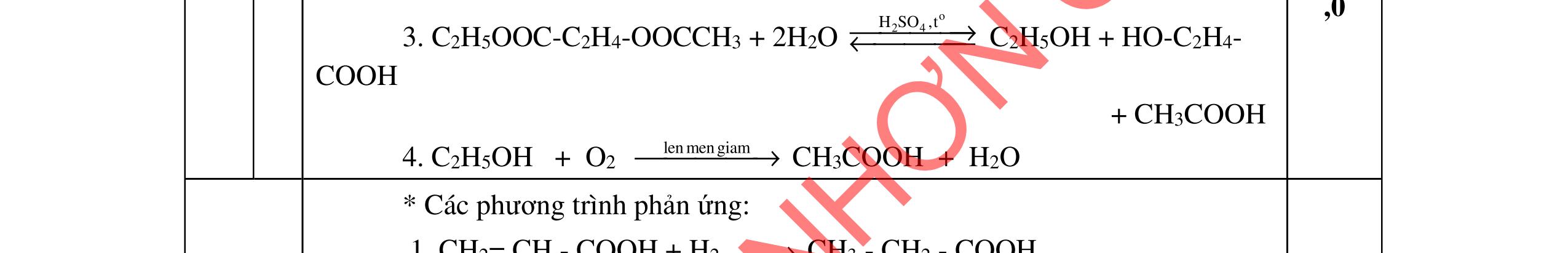
Xác định công thức cấu tạo các chất và viết phương trình hóa học theo sơ đồ: A (C6H8O4) + NaOH 0t
X + Y + Z X + H2SO4 E + Na2SO4 Y + H2SO4 F + Na2SO4
24 o HSO, 180C
R + H2O
biết E, Z đều cho phản ứng tráng gương, R là axit có công thức C3H4O2 2. Cho X và Y là hai axit cacboxylic đơn chức, mạch hở (có một nối đôi C=C); Z là ancol no, mạch hở; T là este ba chức tạo bởi X, Y và Z. Chia 40,38 gam hỗn hợp E gồm X, Y, Z, T thành 3 phần bằng nhau. Đốt cháy hoàn toàn phần 1, thu được 0,5 mol CO2 và 0,53 mol H2O. Phần 2 cho tác dụng với dung dịch brom dư, thấy có 0,05 mol Br2 phản ứng. Phần 3 cho tác dụng với lượng vừa đủ dung dịch hỗn hợp gồm KOH 1M và NaOH 3M, cô cạn, thu được m gam muối khan. Tìm giá trị của m.
ẠYKÈMQUYNHƠNOFFICIAL
D3. Hỗn hợp X gồm 3 este (1 este đơn chức và 2 este hai chức) đều mạch hở và không phân nhánh (không chứa nhóm chức khác). Thủy phân hoàn toàn 22,1 gam X cần dùng 300 ml dung dịch NaOH 1M thu được hỗn hợp Y chứa 3 ancol đều no và hỗn hợp muối. Lấy toàn bộ hỗn hợp muối này đun nóng với vôi tôi xút thu được duy nhất một hiđrocacbon đơn giản nhất có thể tích là 6,272 lít (đktc). Mặt khác đốt cháy 22,1 gam X cần dùng 1,025 mol O2. Xác định công thức cấu tạo các este trong X, gọi tên và tính phần trăm khối lượng của các ancol có trong hỗn hợp Y.
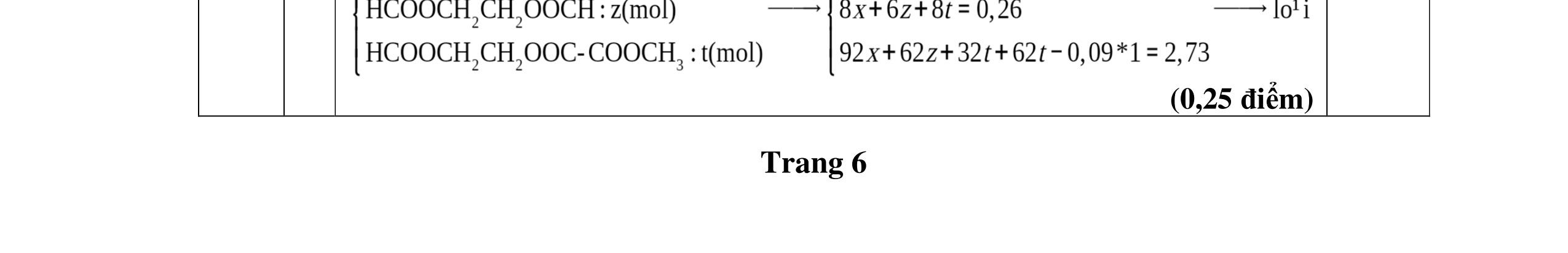
Trang4/2
Câu
1.
→
F
→
Cho
→ →
1
HCOOCH2CH2COOCH=CH2+NaOH 0t → HCOONa+HOCH2CH2COONa+ CH3CHO HCOONa + H2SO4 HCOOH + Na2SO4 HOCH2CH2COONa + H2SO4 HOCH2CH2COOH +Na2SO4 HOCH2CH2COOH HSO,o24180C → CH2=CH COOH + H2O
2 Quy E: CH2=CH-COOH, C3H5(OH)3: x mol, CH2: y mol và H2O: z mol nCH2=CH-COOH = n Br2 = 0,05 mol 2 2
= = = =−
mE= 0,05.72 +92x+14y+18z= 40,38/3= 13,46 x0,11 nCO0,05. 3 + 3x + y = 0,5 y0,02 z0,03 nHO = 0,05.2+ 4x + y + z=0,53
1,0
1,0
Hỗn hợp Y gồm: 3 25 242
CHCOONa x(mol) xy0,28x0,26 x2y0,3y0,02 CH(COONa) y(mol) CHO=nn0,05 (mol) CHO0,2 (mol)
+== CHCOOCH 0,2 mol CHCOOCHOOCCH 0,03 mol CHOOCCHCOOCH 0,02mol
+== −= → BTNT C: 0,05. n + 0,2m = 0,9 n6 m3 = = Este 2 chức đều có 6C
p X g
n h → → DẠYKÈMQUYNHƠNOFFICIAL
0,5 22,1 gam X (n-COO =0,3mol) + 1,025 mol O2 → CO2 a (mol) + H2O b (mol) CHOH 0,22 (mol) CHOH 0,02 (mol) CH(OH) 0,03(mol)
BTKLBTNT 12a2b22,10,3.32a0,9 (mol) 2ab0,3.21,025.2b0,85 (mol)
m 1 este no, đơn chức, mạch hở và
0,5
0,5 Bảo toàn mol các gốc axit ta có CTCT các este là: 3 3 324 3 25 2 3
Trang5/2
Điểm
Câu 3 HDC
+=− =
→ ⇔ +=+ = Hỗ
ợ
Do nCH2=CH-COOH > nCH2 ⇒ chỉ ghép CH2 vào axit Phản ứng vừa đủ ⇒ nOH- = nCH2=CH-COOH = 0,05 mol ⇒ nKOH = 0,0125 mol; nNaOH = 0,0375 mol Vậy: m = 0,05 ×71 + 0,02 ×14 + 0,0125×39 + 0,0375×23 = 5,18 gam ồ
1,0 3 Ta có: nNaOH = 0,3 mol Hidrocacbon đơn giản nhất là CH4, 4CH n0,28 (mol) = Muối có mạch không phân nhánh đun nóng với vôi tôi xút tạo ra CH4 là: CH3COONa và CH2(COONa)2 3 2 2 2 este 2 chức, no, mạch hở 22 4COHO n2n2 BTNTO m2m2
32.0,22
%m .100%71,69% 32.0,2246.0,0262.0,03 46.0,02 %m .100%9,37% 32.0,2246.0,0262.0,03 %m18,94%
CHOH CHOH CH(OH)
== ++ == ++ =
3 25 242
0,5
Câu 4 (5,0 điểm)
1. Hấp thụ hoàn toàn 4,48 lít CO2 (đktc) vào 500 ml dung dịch hỗn hợp (NaOH 0,1M ; Ba(OH)2 0,2M) sinh ra m gam kết tủa. Tính giá trị m.
2. Hòa tan m gam CuSO4.3H2O vào nước được dung dịch X. Cho 14,8 gam hỗn hợp Y gồm Mg và Fe vào dung dịch X. Sau khi các phản ứng xảy ra hoàn toàn thu được chất rắn Z có khối lượng 21,6 gam và dung dịch T. Cho dung dịch T tác dụng với dung dịch NaOH dư, lọc lấy kết tủa rồi nung trong không khí đến khối lượng không đổi thu được hỗn hợp oxit có khối lượng 14,0 gam. Tính giá trị m. 3. Để m gam hỗn hợp E gồm Al, Fe và Cu trong không khí một thời gian, thu được 34,4 gam hỗn hợp X gồm các kim loại và oxit của chúng. Cho 6,72 lít (đktc) khí CO qua X nung nóng, thu được hỗn hợp rắn Y và hỗn hợp khí Z có tỉ khối so với H2 là 18. Hòa tan hoàn toàn Y trong dung dịch chứa 1,7 mol HNO3, thu được dung dịch chỉ chứa 117,46 gam muối và 4,48 lít (đktc) hỗn hợp khí T gồm NO và N2O. Tỉ khối của T so với H2 là 16,75. Tính giá trị của m.
Câu 4 HDC Điểm
1 Viết các phản ứng: CO2 + 2OH → HCO3 HCO3 - + 2OH → CO3 2- + H2O CO3 2- + Ba2+ → BaCO3 Tính ra m= 9,85 g
2 Nếu Mg, Fe phản ứng hết trong dung dịch CuSO4 thì oxit phải chứa MgO, Fe2O3 và có thể có CuO. Như vậy, khối lượng oxit phải lớn hơn khối lượng kim loại. Nhưng theo giả thiết: moxit = 14 gam < mkim loại = 14,8 gam Vậy kim loại dư, CuSO4 hết. Nếu Mg dư thì dung dịch thu được chỉ là MgSO4 kết thúc phản ứng chỉ thu được MgO (trái với giả thiết) Mg hết, Fe có thể dư
0,5 0,5
0,5 Gọi số mol của Mg, Fe trong hỗn hợp Y lần lượt là x và y mol; số mol Fe đã phản ứng là z (z ≤ y) mol.
Mg + CuSO4 → MgSO4 + Cu x → x x x (mol) Fe + CuSO4 → FeSO4 + Cu z → z z z (mol)
ẠYKÈMQUYNHƠNOFFICIAL
DMgSO4 + 2NaOH → Mg(OH)2 ↓ + Na2SO4 x → x FeSO4 + 2NaOH → Fe(OH)2 ↓ + Na2SO4 z → z (mol)
Mg(OH)2 0t → MgO + H2O x → x (mol) 4Fe(OH)2 + O2 0t → 2Fe2O3 + 4H2O
0,5
Trang 6/2
z → z/2 (mol) Chất rắn Z gồm Cu (x+z) mol và có thể có Fe dư (y-z) mol.
Oxit gồm MgO và Fe2O3. 24x + 56y = 14,8 (1) 64(x+z) + 56(y-z) = 21,6 (2) 40x + 160.z/2 = 14 (3) 0,5
0,5
3 0,5 0,5 0,5 Giải ra: x=0,25; y=0,01; z=1,44 . 0,5 Câu 5 (2,0 điểm) 1. Viết dạng công thức VSEPR,
D
b. Thêm từ từ Na2CO3 rắn vào dung dịch A cho đến pH = 4,0, thu được dung dịch
B. Tính số gam Na2CO3 đã dùng.
Cho biết: H3PO4: pKa1 = 2,15; pKa2 = 7,21; pKa3 = 12,32; CH3COOH: pKa = 4,76; (CO2 + H2O) có pKa1 = 6,35; pKa2 = 10,33.
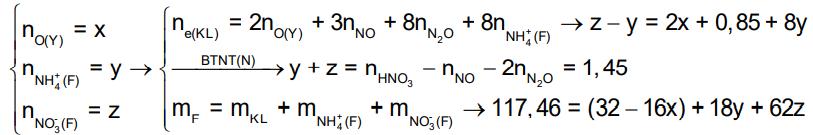
Trang 7/2
cho biết dạng
học, kiểu lai hóa củ
NO2 và BrF5. 2. Trộn
ị
3
ớ
ị
ị
Giải hệ (1), (2) và (3) ta được x = 0,15 mol, y = 0,2 mol, z = 0,1 mol. mMg= 0,15.24 = 3,6 gam; mFe = 0,2.56 = 11,2 gam. Số mol CuSO4 là x+z = 0,25 mol m = 0,25.214 = 53,5 gam Tính
hình
a
10,00 mL dung d
ch CH
COOH 0,20 M v
i 10,00 mL dung d
ch H3PO4, thu được dung d
ch A có pH = 1,50. a.
34HPOC trong dung dịch H3PO4 trước khi trộn.