Ths Nguyễn Thanh Tú eBook Collection

HỘI CÁC TRƯỜNG THPT CHUYÊN KHU VỰC
DUYÊN HẢI VÀ ĐỒNG BẰNG BẮC BỘ
HỘI THẢO KHOA HỌC LẦN THỨ XIII MÔN HÓA HỌC CHUYÊN ĐỀ
PHẦN I: MỞ ĐẦU ........................................................................................................................1
I. Lí do chọn đề tài .............................................. ..................1
II. Mục đích và nội dung nghiên cứu .......................................................................................2
III. Phương pháp nghiên cứu .................................................
NG MICHAEL ......................................................................3
1.1. Giới thiệu ..........................................................................................................................3
1.2. Cơ chế phản ứng ...............................................................................................................4
1.3. Các yếu tố ảnh hưởng đến phản ứng.................................................................................4
1.4. Phạm vi ứng dụng của phản ứng.......................................................................................4
1.5. Một số ứng dụng cụ thể của phản ứng trong tổng hợp dược phẩm ..................................6
CHƯƠNG 2: PHẢN ỨNG MANNICH ...................................................................................8
2.1. Giới thiệu ..........................................................................................................................8
2.2. Cơ chế phản ứng ................................................ ............8
2.3. Phạm vi ứng dụng của phản ứng.......................................................................................9
2.4. Một số ứng dụng cụ thể của phản ứng trong tổng hợp dược phẩm ................................12
CHƯƠNG 3: PHẢN ỨNG STORK ENAMINE...................................................................15
3.1. Giới thiệu ........................................................................................................................15
3.2. Cơ chế phản ứng ................................................ ..........15
3.3. Khái niệm enanmine .......................................................................................................16
3.4. Một số ứng dụng cụ thể của phản ứng trong tổng hợp dược phẩm ................................17
CHƯƠNG 4: PHẢN ỨNG DECACBOXYL HÓA ..............................................................19
4.1. Giới thiệu ........................................................................................................................19
4.2. Cơ chế phản ứng ................................................ ..........19
4.3. Phạm vi ứng dụng của phản ứng.....................................................................................19
4.4. Một số ứng dụng cụ thể của phản ứng trong tổng hợp dược phẩm ................................23
CHƯƠNG 5: PHẢN ỨNG NGƯNG TỤ ALDOL ................................................................25
5.1. Giới thiệu ........................................................................................................................25
5.2. Cơ chế phản ứng ................................................ ..........25
5.3. Các yếu tố ảnh hưởng tới phản ứng ................................................................................26
5.4. Một số ứng dụng cụ thể của phản ứng trong tổng hợp dược phẩm ................................27
CHƯƠNG 6: PHẢN ỨNG ĐÓNG VÒNG PERICYCLIC..................................................30
6.1. Giới thiệu chung về phản ứng đóng vòng pericyclic ......................................................30
6.2. Phản ứng đóng vòng Diels-Alder....................................................................................30
6.2.1. Giới thiệu................................................. ..............30
6.2.2. Cơ chế phản ứng.......................................................................................................32
6.2.3. Hóa lập thể của phản ứng Diels–Alder ....................................................................33
6.2.4. Các yếu tố ảnh hưởng tới phản ứng .........................................................................35
6.2.5. Một số ứng dụng cụ thể của phản ứng trong tổng hợp dược phẩm..........................36
6.3. Phản ứng cộng đóng vòng [2+2].....................................................................................38
6.3.1. Phản ứng cộng đóng vòng quang hóa [2+2] ............................................................38
6.3.2. Cơ chế phản ứng cộng đóng vòng quang hóa [2+2] ................................................39
6.3.3. Phản ứng cộng đóng vòng nhiệt [2+2] sử dụng xeten..............................................39
6.3.4. Một số ứng dụng cụ thể của phản ứng trong tổng hợp dược phẩm..........................41
6.4. Phản ứng vòng hóa electron.............................. ...........42
6.4.1. Giới thiệu................................................. ..............42
6.4.2. Cơ chế phản ứng.......................................................................................................43
6.4.3. Một số ứng dụng cụ thể của phản ứng trong tổng hợp dược phẩm..........................46
6.5. Giới thiệu sơ lược về phản ứng chuyển vị xich-ma ........................................................48
PHẦN III: HỆ THỐNG BÀI TẬP XÂY DỰNG KĨ NĂNG....................................................51
DẠNG 1: PHẢN ỨNG CỦA ENOL, ENOLATE.................................................................51
DẠNG 2: PHẢN ỨNG CỦA IMINE, ENAMINE................................................................62
DẠNG 3: PHẢN ỨNG ĐÓNG VÒNG DIELS-ALDER ......................................................67
DẠNG 4: PHẢN ỨNG ĐÓNG VÒNG QUANG HÓA[2+2] ...............................................72
DẠNG 5: PHẢN ỨNG VÒNG HÓA ELECTRON ..............................................................74
PHẦN IV: BÀI TẬP TỔNG HỢP DƯỢC PHẨM NÂNG CAO ............................................84
1. BÀI TẬP TRONG ĐỀ THI CHỌN HỌC SINH GIỎI QUỐC GIA .................................84
2. BÀI TẬP CHUẨN BỊ OLYMPIC HÓA HỌC QUỐC TẾ................................................86
3. BÀI TẬP TỔNG HỢP DƯỢC PHẨM SƯU TẦM...........................................................94
PHẦN V: ĐÁP ÁN BÀI TẬP TỔNG HỢP DƯỢC PHẨM NÂNG CAO............................107
PHẦN VI: KẾT LUẬN .............................................................................................................134
TÀI LIỆU THAM KHẢO ........................................................................................................135
I. Lí do chọn đề tài
PHẦN I: MỞ ĐẦU
Từ hàng ngàn năm nay, dược phẩm (hay còn gọi là thuốc) có tác dụng phòng, chữa bệnh đã trở thành một nhu cầu thiết yếu của cuộc sống con người. Cuộc sống ngày càng hiện đại hóa thì tốc độ già hóa nhanh, tình trạng ô nhiễm môi trường tăng, thu nhập được cải thiện, và sự quan tâm nhận thức đúng về các vấn đề sức khỏe ngày càng cao. Theo hãng nghiên cứu thị trường IMS Health dự báo chi tiêu cho dược phẩm bình quân đầu người tại Việt Nam vào khoảng 50 USD/người/năm vào năm 2020, tập trung vào hai loại chính:
Thứ nhất, dược phẩm dùng để điều trị bệnh, thường gặp như:
Thuốc kháng sinh Thuốc hạ sốt Thuốc giảm đau
Thứ hai, dược phẩm dùng phòng tránh một số bệnh lý và bổ sung các chất dinh dưỡng, vitamin cần thiết cho cơ thể (hay được gọi là thuốc bổ), ví dụ như:
Thuốc bổ vitamin Thuốc bổ canxi Thuốc bổ não Thuốc bổ máu







Các nghiên cứu trên thế giới về tổng hợp các hợp chất hữu cơ có hoạt tính sinh học cao ngày càng nhiều và được đầu tư mạnh mẽ.
Hóa học là bộ môn khoa học thực nghiệm, gắn kết lí thuyết với những vấn đề thực tiễn. Chính vì thế những năm gần đây, trong các đề thi học sinh giỏi quốc gia và quốc tế luôn có những câu hỏi liên quan đến nội dung tổng hợp dược phẩm dưới dạng sơ đồ điều chế trích từ các bài báo được công bố trên các tạp chí khoa học uy tín.
Tuy nhiên để hiểu và giải được một bài tập sơ đồ tổng hợp là việc khá khó khăn.
Mỗi sơ đồ bao gồm nhiều loại phản ứng từ đơn giản đến phức tạp, nhiều tác nhân phản ứng mà các em có khi chưa gặp. Nó đòi hỏi học sinh phải có kiến thức rộng, bao quát, hiểu rõ các cơ chế phản ứng thường gặp, các loại tác nhân và điều kiện phản ứng.
Việc sưu tầm và xây dựng hệ thống lí thuyết, các câu hỏi và bài tập trọng tâm về tổng hợp dược phẩm, nâng dần mức độ từ dễ đến khó là một việc cần thiết cho quá trình
ôn luyện thi học sinh giỏi các cấp.
Xuất phát từ vấn đề đã nêu ở trên, tôi chọn viết chuyên đề “Tổng hợp dược phẩm hữu cơ” nhằm tạo ra nguồn tài liệu về các phản ứng cơ bản tổng hợp dược phẩm, có chất
lượng để phục vụ công tác bồi dưỡng học sinh giỏi của bản thân, nhằm nâng cao thành tích đội tuyển của nhà trường và có thể trao đổi giao lưu với đồng nghiệp.
II. Mục đích và nội dung nghiên cứu
1. Nguyên cứu và hệ thống hóa lý thuyết về các phản ứng hữu cơ cơ bản trong tổng hợp dược phẩm.
2. Sưu tầm và hệ thống câu hỏi và bài tập theo từng dạng, từng đơn vị kiến thức và đáp án của từng bài tập giúp các em tự học, tự rèn luyện kĩ năng làm bài, kĩ năng vận dụng các kiến thức vào giải các bài tập có liên quan.
3. Chọn lọc sưu tầm một số bài tập tổng hợp dược phẩm hữu cơ trong các đề thi học sinh giỏi Olympic quốc gia và các nước quốc tế, các đề thi khu vực để thấy được mức độ yêu cầu vận dụng cao, từ đó đặt ra nhiệm vụ cho các giáo viên phải có kiến thức chuyên môn vững vàng, kĩ năng truyền đạt để giúp các em học sinh tiếp cận, vận dụng lí thuyết cơ bản vào giải quyết có hiệu quả những bài tập đòi hỏi tư duy cao, phức tạp.
III. Phương pháp nghiên cứu
- Nghiên cứu thực tiễn dạy học và bồi dưỡng HSG hóa học ở trường THPT chuyên.
- Nghiên cứu các tài liệu về phương pháp dạy học hóa học, các tài liệu về bồi dưỡng học sinh giỏi, các đề thi học sinh giỏi, . . .
- Thu thập tài liệu và truy cập thông tin trên internet có liên quan đến đề tài.
- Đọc, nghiên cứu và xử lý các tài liệu.
IV. Điểm mới của chuyên đề
- Chuyên đề đã xây dựng được hệ thống lí thuyết các phản ứng tổng hợp dược phẩm cơ bản có mở rộng và nâng cao đầy đủ.
- Chuyên đề đã hệ thống bài tập lí thuyết mức độ rèn luyện kỹ năng có phân loại rõ ràng các dạng bài để làm tài liệu phục vụ cho học sinh và giáo viên trường chuyên học tập, giảng dạy, ôn luyện, bồi dưỡng trong các kì thi học sinh giỏi các cấp và làm tài liệu học tập cho học sinh. Ngoài ra, chuyên đề còn là tài liệu tham khảo mở rộng và nâng cao cho giáo viên môn hóa học và học sinh trong các đội tuyển dự thi HSG.
Dược phẩm luôn là một nhu cầu không thể thiếu trong đời sống con người. Công nghệ tổng hợp các hợp chất hữu cơ có hoạt tính sinh học trong dược phẩm cần tới sự hiểu biết các phản ứng hữu cơ cơ bản, các quá trình chuyển hóa cơ bản và các phương pháp nối dài mạch carbon cũng như đóng vòng mạch carbon theo ý muốn. Sau một thời gian tìm hiểu kiến thức để viết chuyên đề, tôi xin hệ thống một số các phản ứng, quá trình cơ bản cần thiết có ứng dụng rất phổ biến trong công nghệ tổng hợp dược phẩm như sau:
CHƯƠNG 1: PHẢN ỨNG CỘNG MICHAEL
1.1. Giới thiệu
Phản ứng Michael hoặc phản ứng cộng Michael là quá trình cộng nucleophile của một carbanion hoặc nucleophile khác vào hợp chất carbonyl không no ở α, β có chứa một nhóm hút electron. Đây là phương pháp hữu hiệu để hình thành liên kết C-C.



- Nhóm R và R' trên nucleophile (chất cho Michael) đại diện cho các nhóm thế hút electron như nhóm acyl và xyano, làm cho hydro metylen bên cạnh có tính axit đủ để tạo thành carbanion khi phản ứng với bazơ (B:).

- Nhóm R" trên anken hoạt hóa (chất nhận Michael), thường là ketone, khiến hợp chất này trở thành enone, nhưng nó cũng có thể là nhóm nitro hoặc sulfonyl florua.
Ví dụ:
1.2. Cơ chế phản ứng
Quá trình phản ứng gồm nhiều bước, nhưng bước chậm là bước quyết định tốc độ phản ứng phụ thuộc khả năng phản ứng của chất cho và chất nhận, cũng như độ bazơ của xúc tác.
1.4.2. Phản ứng giữa Hα của xeton với α, β –xeton không no

Kết hợp phản ứng Michael và ngưng tụ aldol để tổng hợp vòng steran đi từ vinyl metyl xeton với xeton ba vòng chứa H hoạt động:
Phản ứng cộng Michael sau đó là sự ngưng tụ aldol được sử dụng để tạo một vòng gắn vào khung có sẵn. Quy trình này được biết đến như là phản ứng tạo vòng Robinson (sau nhà hóa học người Anh, Robert Robinson, người thắng giải Nobel Hóa Học vào năm 1947 cho việc nghiên cứu các hợp chất xuất hiện trong tự nhiên).
1.3. Các yếu tố ảnh hưởng đến phản ứng
Xúc tác thông dụng là các bazơ mạnh như MeONa, EtONa, t-BuOK,…trong ancol; có thể sử dụng dung dịch kiềm trong ancol như EtOH/NaOH hoặc NaNH2 trong dung môi trơ
Dung môi phổ biến là các ancol như MeOH, EtOH, t-BuOH,… Một số dung môi trơ là ete, dioxan hoặc benzen. Trường hợp dùng xúc tác là kim loại kiềm hoặc NaNH2 thì dung môi là loại aprotic không chứa proton.
Thường ở nhiệt độ cao tạo thuận lợi cho phản ứng theo chiều ngược nên phải tránh điều này. Khi sử dụng ankolat làm xúc tác, thông thường người ta tiến hành phản ứng ở nhiệt độ phòng với thời gian khuấy từ 20 đến 100 giờ , còn khi sử dụng amin bậc hai hoặc bậc ba làm xúc tác và dung môi là ancol thì phản ứng tiến hành ở trên nhiệt độ sôi của hỗn hợp nên thời gian chỉ còn từ 12 đến 40 giờ
1.4. Phạm vi ứng dụng của phản ứng
1.4.1. Phản ứng giữa Hα của dẫn xuất manolat với α, β –xeton không no
Kết hợp phản ứng Michael và Claisen để nối dài mạch cacbon của hợp chất, cũng như để điều chế đioxo este:
1.4.3. Phản ứng giữa Hα của dẫn xuất nitryl malonat với quinon
Dùng phản ứng Michael để điều chế trực tiếp các hợp chất nhân thơm thông qua quinon như là một chất nhận, lại vừa là chất khử. Trước hết, quinon phản ứng với chất cho trong dung dịch etanol của etyl axetat, hợp chất tạo thành tự thơm hóa, sau đó bị quinon còn dư oxy hóa thành chất nhận có cấu trúc quinon và tiếp tục phản ứng với phân tử thứ hai của chất cho để tạo ra hợp chất chứa hai mạch nhánh của nhân thơm:
1.4.4. Phản ứng giữa Hα của dẫn xuất malonat với acrylat
Dùng phản ứng Michael để tổng hợp axit glutamic đi từ α-axetamido malonat và metyl acrylat, sau đó đem thủy phân sản phẩm nhận được và đecacboxylic hóa:
1.5. Một số ứng dụng cụ thể của phản ứng trong tổng hợp dược phẩm
Ví dụ 1: Tổng hợp thuốc chống đông máu: Warfarin



Ikawa, M.; Stahmann, M. A.; Link, K. P.. "Studies on 4-Hydroxycoumarins. V. The Condensation of α,β-Unsaturated Ketones with 4-Hydroxycoumarin". Journal of the American Chemical Society. 1944, 66 (6): 902. doi:10.1021/ja01234a01
Ví dụ 2: Tổng hợp thuốc chống đông máu: Acenocoumarol
(Zheng Li et al., Synthesis of 4-arylethyl-6-arylpyrimidine-2-thiols through aza-Michael addition/nucleophilic addition/aromatization tandem reactions, Heterocyclic Communications (2018) Volume 24: Issue 1)
https://commons.wikimedia.org/wiki/File:Acenocoumarol_synthesis.svg




2.1. Giới thiệu
Phản ứng Mannich là phản ứng ngưng tụ giữa hợp chất có chứa H hoạt động (hydro mang tính axit) với aldehyde và amin hoặc amoniac, kết quả tạo nên hợp chất chứa nhóm
aminometyl và được gọi là bazơ Mannich. Phản ứng này được nhà hóa học người Đức Carl
Ulrich Franz Mannich phát hiện năm 1912.
Môi trường của phản ứng đa số là axit, nên sản phẩm tạo ra là dạng muối của amin.
Trong các tài liệu trước đây, phản ứng Mannich chỉ dành riêng cho phản ứng giữa hợp chất chứa H hoạt động với fomandehit và amin bậc nhất, bậc hai. Nhưng trong hóa học ngày nay, phạm vi sử dụng phản ứng Mannich được mở rộng ra cho cả các andehit khác, cũng như hợp chất có H hoạt động không chỉ có hợp chất chứa liên kết C-H mà cả liên kết N-H, S-H, Se-H, P-H. Phản ứng là sự alkyl amino hóa hợp chất chứa proton acid nối với hợp chất chứa nhóm carbonyl (thường là formaldehid) và một amin nhất cấp hoặc nhị cấp. Sản phẩm của phản ứng là một β-amino-carbonyl, còn được gọi là bazơ Mannich.
Phản ứng Mannich là phản ứng tạo nối carbon-carbon quan trọng, trong tự nhiên hàng loạt các hợp chất như peptid, nucleotid, các chất kháng sinh và các alkaloid (strychnin, quinin và atropin…) được tổng hợp theo phương pháp này. Trong ngành dược, phản ứng Mannich được sử dụng để tổng hợp nhiều loại thuốc chữa bệnh như rolitetracyclin (baz Mannich của tetracyclin), fluoxetin (thuốc giảm đau), tramadol và tolmetin (thuốc kháng viêm).
2.2. Cơ chế phản ứng
Phản ứng được khởi đầu với sự kết hợp của một amin với formaldehid tạo ra ion iminium
Do phản ứng xảy ra trong môi trường acid, nên giai đoạ
nhóm carbonyl (aldehid hoặc ceton) sẽ bị enol hóa.
Sau đó, sự cộng hợp của enol với ion iminium tạo ra sản phẩm với nối carboncarbon được hình thành (được gọi là bazơ Mannich).
Phản ứng Mannich bình thường chỉ xảy ra khi trong phản ứng tính nucleophile của amin mạnh hơn của hợp chất chứa hydro hoạt động, nếu không thành phần aldehid sẽ phản ứng với hợp chất chứa H hoạt động theo kiểu phản ứng aldol (điều này giải thích tại sao từ este malonat, formaldehid và dialkylamin không thể tạo ra bazơ Mannich tương ứng).
2.3. Phạm vi ứng dụng của phản ứng
Trong phản ứng Mannich, các hợp chất chứa C – H hoạt động khác nhau phản ứng với các anđehit và hợp chất amin khác nhau, do đó tạo ra một số lượng các hợp chất vô cùng lớn. Vì vậy, phản ứng Mannich được coi là một trong số các quá trình cơ bản thường được sử dụng trong công nghiệp hóa dược. Một số bazơ Mannich đã được sử dụng trực tiếp làm hoạt chất cho dược phẩm, nhiều chất khác được tiếp tục biến đổi thành các sản phẩm giá trị khác.
Phản ứng Mannich được sử dụng trong quá trình tổng hợp hữu cơ các hợp chất tự nhiên như peptide, nucleotide, kháng sinh và alkaloids (ví dụ: tropinone).




Phản ứng Mannich cũng được sử dụng trong quá trình tổng hợp các hợp chất dược liệu, ví dụ: rolitetracycline (cơ sở Mannich của tetracycline), fluoxetine (thuốc chống trầm cảm), tramadol, và tolmetin (thuốc chống viêm) và azacyclophanes. Phản ứng Mannich
được sử dụng để tổng hợp các amin alkyl, chuyển hydrocacbon không phân cực thành xà phòng hoặc chất tẩy rửa. Điều này được sử dụng trong một loạt các ứng dụng làm sạch, xử lý nhiên liệu ô tô và sơn epoxy. Các phương pháp tương tự của ete alkyl chuỗi phân nhánh
được thay thế thành polyetheramines được thực hiện thông qua một số phản ứng.
2.3.1. C-aminometyl hóa




Dẫn xuất phenol chứa C-H hoạt động cũng có thế aminometyl hóa, tùy thuộc vào tỉ lệ các thành phần tác nhân sử dụng trong phản ứng mà ta sẽ thu được các sản phẩm khác



nhau:
Các hợp chất dị vòng chứa C-H hoạt động cũng tham gia phản ứng Mannich. Ví dụ về điều chế gramin, nguyên liệu để tổng hợp triptamin, theo quy trình công nghiệp người ta cho indol tác dụng với formaldehit và dimetylamin:
2.3.2. N- aminometyl hóa
Một số amin đặc biệt chứa N–H hoạt động cũng có thể thực hiện phản ứng Mannich. Loại phản ứng này đặc biệt được sử dụng có hiệu quả để điều chế các dẫn xuất bisamin của metylen.
Phản ứng Aminometyl hóa cũng có thể thực hiện được trên một số dẫn xuất cacboxamit (amit): trường hợp trong hợp chất có chứa nhiều Hidro hoạt động từ các liên kết khác nhau ( vừa có C-H, vừa có N-H), tùy hoạt lực khác nhau của chúng mà cho sản phẩm có chứa nhóm aminometyl ở một hoặc tất cả các nhóm có Hydro hoạt động:
Các dẫn xuất của axit cacboxylic chứa C-H hoạt động cũng tham gia phản ứng
Mannich:
Yasareni Sumalatha et al.; A simple and efficient synthesis of hypnotic agent, zolpidem and its related substances, Arkivoc, Volume 2009, Issue 2, pp. 315-320




Ví dụ 3: Để điều chế dược phẩm chống sốt rét thuộc dẫn xuất của cloroquin có tên là Amidoquin và Amopyroquin, người ta cùng sử dụng phản ứng Mannich chuyển paxetamidophenol thành các dẫn xuất aminometyl tương ứng, sau đó cho các hợp chất này tác dụng với 4,7-đicloquinolin để được các hợp chất kể trên:
(Ş. Güniz Küçükgüzel et.al., Synthesis of Tolmetin Hydrazide–Hydrazones and Discovery of a Potent Apoptosis Inducer in Colon Cancer Cells, Arch Pharm, Volume348, Issue10, October 2015, Pages 730-742) Ví
Ví dụ 4: Fluoxetine được sử dụng để điều trị trầm cảm, các cơn hoảng loạn, rối loạn ám ảnh cưỡng chế, một rối loạn ăn uống nhất định (bulimia) và một dạng nghiêm trọng của hội chứng tiền kinh nguyệt (rối loạn tiền kinh nguyệt).

CHƯƠNG 3: PHẢN ỨNG STORK ENAMINE



3.1. Giới thiệu
Năm 1936, C. Mannich và H. Davidson công bố rằng với sự có mặt của chất loại nước (K2CO3 hoặc CaO), các amin bậc hai trải qua quá trình ngưng tụ dễ dàng với aldehyd hoặc ketone để thu được enamine. Vào thời điểm đó, phản ứng của enamines với các electrophile chưa được nghiên cứu, nhưng người ta đã xác định rằng enamines là các hợp chất không bền, trải qua quá trình thủy phân khi tiếp xúc với dung dịch axit loãng. Hai thập kỷ sau, vào năm 1954, G. Stork và đồng nghiệp đã phát hiện ra rằng phản ứng của enamines với các alkyl hoặc acyl halogenua sau đó được thủy phân bằng axit tạo thành một cách mới cho quá trình alkyl hoặc α-acyl hóa các hợp chất cacbonyl. Sự tổng hợp trên của G. Stork được gọi là phản ứng Stork enamine.
3.2. Cơ chế phản ứng
Rebeca Gracia, Encyclopedia of Toxicology (Second Edition), 2005
Gồm 3 giai đoạn:
+ Giai đoạn 1: Tạo enamine từ ketone
+ Giai đoạn 2: Enamine được cộng Michael vào hợp chất carbonyl chưa bão hòa α,β.
+ Giai đoạn 3: Thủy phân enamine mới để tạo aldehyde hoặc ketone.
3.3. Khái niệm enanmine
Enamine là một hợp chất chứa đơn vị cấu trúc sau:
Enamine được điều chế từ phản ứng của amine bậc 2 tác dụng với hợp chất carbonyl, có xúc tác axit.
Ví dụ:
Enamine dễ bị thủy phân trong môi trường axit, để tạo ra aldehyde hoặc ketone.


Enamine đóng vai trò là một nucleophile tham gia vào các quá trình alkyl hóa, acyl hóa hoặc cộng Michael tiếp theo.




3.4. Một số ứng dụng cụ thể của phản ứng trong tổng hợp dược phẩm
Ví dụ 1: Valencene là một hợp chất thiên nhiên cấu trúc sesquiterpene là thành phần tạo mùi thơm của trái cây họ cam quýt và các chất tạo mùi có nguồn gốc từ cam quýt.
G. Revial và cộng sự thực hiện phản ứng xeton 66 với (S)-67 với xúc tác p-TsOH mang lại chiral enamin 68, enamin này do được gắn với một trung tâm chiral, nhóm phenyl cồng kềnh chặn hướng tấn công phía dưới của enamin nên phản ứng cộng Michael với 69 ưu tiên mang lại sản phẩm 70 với hiệu suất 88% và dư lượng đối quang lên đến 91% [11].

Tương tự như vậy, khi xử lý xeton 71 với (R)- 67 sẽ mang lại chiral enamin 72 và bước tiếp theo là phản ứng Michael với 73 mang lại 74.
G. Revial et al., Enantioselective imine Michael reaction for the preparation of the (8′R,8a′S)-8,8a′-dimethyl1′,3′,4′,7′,8′,8a′-hexahydrospiro[1,3-dioxolane-2,2′(6′H) naphthalen ]-6′-one building block. A formal synthesis of (+)-valencenol, Tetrahedron: Asymm., 12, 1683-1671 (2001)
Ví dụ 2: Jatropholone A là một hợp chất hữu cơ có trong một số loài cây được sử dụng trong dân gian làm thuốc để chữa các bệnh khác nhau cho 80% dân số ở Châu Phi, Châu Á và Châu Mỹ Latinh. Chúng được dùng phổ biến để chữa đau bụng, đau răng, sưng tấy, viêm nhiễm, bệnh phong, kiết lỵ, rối loạn kinh nguyệt, chóng mặt, thiếu máu.
CHƯƠNG 4: PHẢN ỨNG DECACBOXYL HÓA






4.1. Giới thiệu Chúng ta gọi việc loại CO2 ra khỏi hợp chất axit cacboxylic là decacboxyl hóa. Quá trình đó biểu diễn trong sơ đồ tổng quát sau:
R−COOH → R−H + CO2
Phản ứng này chỉ có ý nghĩa và được sử dụng khi một hợp chất nào đó được điều chế ra thông qua hợp chất trung gian chứa nhóm cacboxyl mà hiệu quả hơn hẳn bất kì một phương pháp nào khác. Trong thực tế rất nhiều chất được điều chế ra một cách có hiệu quả thông qua phản ứng loại này vì bản thân nhóm cacboxyl có trong phân tử nhiều khi làm tăng khả năng phản ứng của các nhóm chức khác bên cạnh và bản thân nhóm cacboxyl hoặc nhóm tương đương của nó rất bền vững trong nhiều điều kiện khác nhau của phản ứng và tự nó không bị decacboxyl hóa. Decacboxyl hóa chịu ảnh hưởng rất lớn của nhiệt độ, của môi trường. Việc decacboxyl hóa phụ thuộc nhiều vào cấu trúc của phân tử, vào các nhóm chức khác nằm bên cạnh nhóm cacboxyl trong phân tử
4.2. Cơ chế phản ứng
Thông thường anion cacboxylat có khả năng làm mất CO2, do đó muối của các axit cacboxylic cũng có thể tự decacboxyl hóa hoặc trong môi trường nhất định, việc làm nóng cũng có thể giúp cho sự phân li của axit, như vậy CO2 cũng bị loại ra.
Một hoạt chất sinh học khác:
Với Me là metal (kim loại)
4.3. Phạm vi ứng dụng của phản ứng
Từ các axit dicacboxylic hoặc dẫn xuất của nó với việc nung nóng để loại ra một phân tử CO2 sẽ thu được xeton vòng, đặc biệt dễ thực hiện khi vòng đó là vòng 5, 6 hoặc 7 cạnh. Ví dụ như trường hợp axit ađipic hoặc axit pimelinic.
Nếu với trường hợp axit dicacboxylic nhưng không đóng vòng được thì axit monocacboxylic tạo thành, ví dụ khi nung nóng axit oxalic thu được axit fomic.
Trường hợp axit malonic hoặc dẫn xuất của nó thì nó decacboxyl hóa để tạo ra axit monocacboxylic.
Các axit mono hoặc poly α-phenyl cacboxylic cũng tạo điều kiện dễ dàng cho việc giải phóng CO2 khỏi phân tử. Ví dụ triphenylaxetic dễ dàng decacboxyl hóa để cho triphenylmetan.

Cấu trúc của phân tử có ảnh hưởng rất lớn đến khả năng decacboxyl hóa. Ở trường hợp các axit cacboxylic mạch thẳng, các nhóm thế ở vị trí α làm tăng khả năng decacboxyl hóa nếu như nhóm thế đó làm tăng khả năng phân li của axit.
Nhóm thế nitro ở vị trí α của axit béo khi được làm nóng, CO2 bị loại ra và nitro mạch thẳng tương ứng được hình thành:
Các α-halogenua cacboxylic axit cũng có xu hướng thực hiện việc decacboxyl hóa, phân tử lượng cũng như số nguyên tử của halogen càng tăng thì khả năng decacboxyl hóa cũng tăng, tricloaxetic mất CO2 ở trên 200oC, trong lúc đó triiotaxetic chỉ cần làm nóng nhẹ đã cho idoform và CO2.
Cũng tương tự như các axit α-halogenua cacboxylic, các hợp chất axit αnitrin cacboxylic cũng dễ dàng decacboxyl hóa để tạo nitrin tương ứng. Ví dụ: xianaxetic ở 165oC giải phóng CO2 và axetonitrin.
Các axit cacboxylic thơm cũng dễ dàng decacboxyl hóa. Khi nung nóng muối canxi benzoat với nước vôi trong thu được benzen và muối canxi cacbonat
Các axit dicacboxylic thơm trong môi trường như trên cũng dễ dàng loại đi một phân tử CO2. Khi cho muối canxi phtalat nung nóng với Ca(OH)2 ở 350oC cho axit benzoic.
Các α-aminoaxit phần nào bền vững hơn các axit α-halogenua nên CO2 được loại ra ở nhiệt độ cao hơn, quá trình này cũng được bazơ thúc đẩy (ví dụ Ba(OH)2).
Vị trí octo- hoặc para-hydroxy trong phân tử benzoic axit giúp cho việc tách loại CO2, nhưng hydroxyl ở vị trí meta không làm được điều đó, do không tạo được cấu tạo chelat hoặc β-γ-cacboxylic không no.





Các axit cacboxylic mạch thẳng chứa liên kết đôi ở vị trí α-β chỉ decacboxyl hóa khi sản phẩm tạo ra là dẫn xuất của ankyl.
Các axit cacboxylic mạch thẳng chứa liên kết ba, khi đun nóng với kiềm cũng giải phóng CO2 và dẫn xuất axetilen được tạo thành.
Cũng giải thích tương tự như các axit p- và o-hydroxy-benzoic, p- và oaminobenzoic axit cũng dễ dàng loại CO2 ra khỏi phân tử. Axit antranilic nung nóng ở 210oC hoặc đun nóng lâu trong nước cho aniline và giải phóng CO2.
Nếu trong phân tử axit benzoic có chứa nhiều nhóm thế hút điện tử thì decacboxyl hóa càng dễ dàng. Ví dụ axit trinitrobenzoic đun sôi trong nước cũng loại CO2 để tạo ra trinitrobenzen.
Trong hợp chất dị vòng nhân thơm có chứa nhiều nhóm cacboxylic thì ngoài tác dụng gần nguyên tử dị tố ra, tác dụng của nhóm hydroxy cũng có vai trò rất quyết định trong việc decacboxyl hóa. Ví dụ: 2-hydroxy-3,4-dicacboxyl-6-metylpyridin do ở vị trì thứ 2 của nhân pyridine có nhóm hydroxy mà dễ dàng loại được nhóm cacboxyl ở vị trí thứ 3.
Cũng tương tự với các trường hợp đã nêu, các axit cacboxylic thơm dị vòng cũng có thể decacboxyl hóa. Các axit pyridin-α-cacboxylic hoặc furan- αcacboxylic khi bị làm nóng cũng loại mất CO2
4.4. Một số ứng dụng cụ thể của phản ứng trong tổng hợp dược phẩm Các phản ứng decacboxyl hóa liệt kê ở trên đã được ứng dụng khá phổ biến trong quá trình tổng hợp chất hữu cơ và sản xuất hóa dược.
Ví dụ 1: Để tổng hợp thuốc sốt rét chloroquin người ta đã ngưng tụ 3-cloanilin với 2-oxosuccinat etyl để được dẫn xuất 4-hydroxy-7-clo-2etoxy-cacbonyl-quinin, sau đó este này được thủy phân để




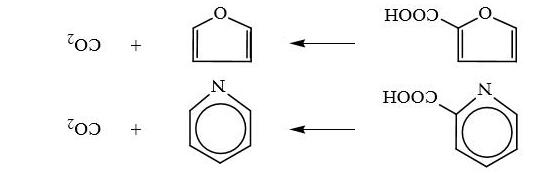

thành axit, kế đó là decacboxyl hóa nhóm cacboxylic để
Nếu trong một hợp chất thơm dị vòng chứa nhiều nhóm cacboxylic thì hóm cacboxyl ở gần nguyên tố dị tố nhất sẽ bị loại ra. Trường hợp axit α, β, γpyridintricacboxylic khi nung nóng trong anhidrit axetic sẽ loại ra CO2 và cho hợp chất tương ứng là axit pyridin-β, γ-dicacboxylic.
cho hợp chất trung gian quan trọng là 4-hydroxy-7-cloquinolin, chất này sau đó được chuyển đổi nhóm OH thành

clo để tạo ra 4,7-dicloquinolin trước khi ngưng tụ với mạch
nhánh amin để được chloroquin.
Các axit đa dị vòng nhân thơm cũng decacboxyl hóa như các trường hợp axit cacboxylic dị vòng nhân thơm nêu trên. Từ axit quinolin-α-cacboxylic dới tác dụng của nhiệt thu được quinolin.
Nếu trong một hợp chất vòng thơm có nhiều dị tố thì khả năng decacboxyl hóa càng tăng. Ví dụ: axit thiazol-2-cacboxylic với sự có mặt của một bazơ (quinolin) thì ngay ở nhiệt độ phòng cũng đã loại CO2 ra khỏi phân tử.
Ví dụ 2: Trong quá trình tổng hợp thuốc giảm đau Fentanyl người ta cũng điều chế
ra một hợp chất trung gian là este, sau đó với việc thủy phân và gia nhiệt trong dung dịch
HCl để thu được sản phẩm decacboxyl hóa, kế đó xeton này được ngưng tụ với aniline và
khử hóa sau đó là axyl hóa để được Fentanyl.

5.1. Giới thiệu
Phản ứng ngưng tụ carbonyl xảy ra giữa hai hợp phần carbonyl và bao gồm sự kết hợp của các bước cộng hợp nucleophil và bước thế α. Một hợp phần carbonyl được chuyển hóa thành ion enolat có tính nucleophil, và cộng hợp vào hợp phần thứ hai. Để thực hiện kiểu phản ứng này, ion enolat tham gia vào phản ứng thế α và hợp phần electrophil tham gia vào sự cộng hợp nucleophil. Tất cả các hợp chất carbonyl, bao gồm aldehyd, keton, ester, amid, acid anhydrid và nitril đều tham gia vào phản ứng ngưng tụ.







Ví dụ:
5.2. Cơ chế phản ứng
5.2.1. Cơ chế phản ứng với xúc tác bazơ
Giai đoạn 1: Bazơ ‒OCH3 xúc tác cho phản ứng aldol
Giai đoạn 2:
5.2.2. Cơ chế phản ứng với xúc tác axit
Giai đoạn 1:
Giai đoạn 2:
5.3. Các yếu tố ảnh hưởng tới phản ứng
5.3.1. Xúc tác
Xúc tác thường nhất của phản ứng aldol là các bazơ, ví dụ dung dịch metanol của NaOH hoặc KOH (xét về khả năng hòa tan thì KOH tốt hơn), cũng như dung dịch etanol của KOH. Trong một số trường hợp có thể dùng dung dịch nước – alcol của NaOH hoặc KOH. Nhưng nếu sử dụng xúc tác kiềm đặc nồng độ cao sẽ giúp cho quá trình phân hủy các sản phẩm aldol nên thường chỉ nên dùng ở tỷ lệ 2 đến 3% mol xúc tác trên 1 mol chất phản ứng, trong những trường hợp đặc biệt có thể dùng tới 5 đến 10% mol. Mặt khác kiềm cũng xúc tiến quá trình dehydrat hóa, do đó với mục đích điều chế sản phẩm cộng hợp aldol thì xúc tác hay sử dụng là các muối kim loại kiềm của các axit yếu như axit xyanhydric, axit photphoric, axit cacbonic. Trong trường hợp các aldehyde hoạt động mạnh, xúc tác thường hay được sử dụng là các amin bậc nhất, bậc hai, ví dụ: pyrolidin, pyperidin.
Xúc tác axit cũng được sử dụng nhưng khi sử dụng xúc tác loại này thường không thể phân lập được sản phẩm cộng aldol vì môi trường axit xúc tác này cho quá trình loại nước, hơn nữa trong nhiều trường hợp sản phẩm phụ nhận được là chất nhầy do kết quả
của quá trình polyme hóa. Vì thế xúc tác axit rất ít khi được sử dụng. Các xúc tác axit được sử dụng là khí HCl, đôi khi H2SO4 đặc, axit axetic, hoặc BF3
5.3.2. Dung môi
Dung môi được sử dụng nhiều nhất là metanol, etanol. Nhiều trường hợp dùng tetrahydrofuran, 1,2-dietoxyetan, dimetyl formamit và dimetyl sunfoxit. Trường hợp xúc tác là axit người ta dùng dung môi ete, benzen thay cho alcol để tránh việc tạo ra axetal.



5.3.3. Nhiệt độ

Phản ứng aldol thường được tiến hành ở nhiệt độ thấp, ít khi phải dùng tới nhiệt độ cao hơn hơn nhiệt độ phòng; nhưng đôi khi thực phải thực hiện ở nhiệt độ cao hơn (trên độ sôi của metanol hoặc etanol), khi đó sản phẩm loại nước tạo ra hợp chất cacbonyl không no la không thể tránh khỏi.
5.3.4. Thời gian phản ứng
Thông thường phản ứng thực hiện đến 5 giờ, đôi khi phải kéo dài tới 12 đến 20 giờ (ở những trường hợp phân tử có lực cản không gian lớn).
5.3.5. Tỷ lệ mol
Trong trường hợp đơn giản, tỷ lệ mol giữa thành phần của H hoạt động và thành phần chứa C=O hoạt động là 1:1, nhưng nếu là phản ứng giữa hai phân tử khác nhau có chứa nhóm cacbonyl thì luôn dùng dư lượng loại kém phản ứng, vì như thế sẽ loại được khả năng tự ngưng tụ (self-condensation). Phản ứng nên thực hiện trong luồng khí nitơ để tránh sự oxy hóa của các enolat và α,β –cacbonyl không no.
5.4. Một số ứng dụng cụ thể của phản ứng trong tổng hợp dược phẩm
Ví dụ 1: Trong quá trình tổng hợp toàn phần alcaloit papaverin (dược phẩm có tác dụng hạ huyết áp) người ta cũng sử dụng phản ứng aldol hóa để điều chế homoveratrylamin- một nguyên liệu chính trong quá trình tổng hợp đi từ vanilin:
R.S.Vardanyan, V.J.Hruby, Synthesis of Essential Drugs (2006), Pages 257-267


Ví dụ 2: Trong quá trình tổng hợp kháng sinh cloramphenicol bằng phương pháp hóa học, người ta đã sử dụng phản ứng aldol hóa của benzendehit với 2- nitroetanol để tạo ra sản phẩm trung gian 1-phenyl-2-nitropropandiol- 1, 3.
Ví dụ 3: Khi một hợp chất dicarbonyl được xử lí với base, thì phản ứng aldol nội phân tử xảy ra, dẫn tới sự tạo thành một sản phẩm vòng, thường là vòng năm cạnh hoặc sáu cạnh. Wortmannin là một chất chuyển hóa steroid của nấm Penicillium funiculum và Talaromyces wortmannii. Thuốc này hoạt động như một chất ức chế cộng hóa trị không đặc hiệu của enzyme phosphoinositide 3-kinase (PI3Ks). Wortmannin là một thuốc thử sinh học tế bào thường được sử dụng và trước đây đã được sử dụng để ức chế sửa chữa DNA, endocytosis qua trung gian thụ thể và tăng sinh tế bào.
Shigehisa, et. al. Tetrahedron 2006, 61, 5057-5065
Ví dụ 4: Sử dụng phản ứng ngưng tụ aldol để điều chế meprobamat (2-metyl-2propyl-1,3-propandiolkarbamat). Meprobamate được sử dụng ngắn hạn để điều trị triệu chứng lo lắng và căng thẳng. Meprobamate hoạt động trên một số trung tâm của não để giúp làm dịu hệ thần kinh.



Sơ đồ điều chế:
Fries FA, Moenkemeyer K, "Verfahren zur Herstellung von 2-Methyl-2-propylpropandiol-1,3", issued 15 November 1963, assigned to Huels Chemische Werke AG
CHƯƠNG 6: PHẢN ỨNG ĐÓNG VÒNG PERICYCLIC


6.1. Giới thiệu chung về phản ứng đóng vòng pericyclic
Phản ứng đóng vòng pericyclic trong chuyên đề này, tôi đề cập đến 2 nội dung chính gồm:
Loại 1: Phản ứng cộng đóng vòng
- Phản ứng cộng đóng vòng nhiệt [4 + 2] (phản ứng Diels-Alder)

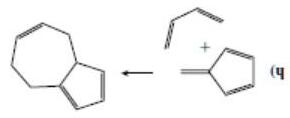
Một số hợp phần diene (ddien) và dienophile (đienophin) thường gặp:
- Phản ứng cộng đóng vòng quang hóa [2 + 2]:
- Phản ứng cộng đóng vòng nhiệt [2+2]:
Loại 2: Phản ứng vòng hóa electron
Ví dụ:
Phản ứng đóng vòng Diels-Adder nội phân tử có thể xảy ra khi bên trong nó vừa chứa hệ diene liên hợp và nối đôi C=C có khả năng tương tác với nhau.
Các phản ứng pericyclic này có một số đặc điểm đặc trưng như:
- Phản ứng trải qua một quá trình cùng lúc. Nghĩa là các các liên kết đồng thời biến đổi trong một bước duy nhất, vì vậy không xuất hiện trạng thái trung gian.
- Phản ứng liên quan sự di chuyển của electron trong một vòng kín.


- Phản ứng xảy ra qua một trạng thái chuyển tiếp vòng.
6.2. Phản ứng đóng vòng Diels-Alder
6.2.1. Giới thiệu
Năm 1928, hai nhà hóa học Đức Otto Diels và Kurt Alder phát hiện ra rằng các anken và ankin có một hoặc nhiều nhóm kéo electron có thể cộng vào đien liên hợp để tạo thành hợp chất vòng sáu cạnh và một nối đôi C=C.
Phản ứng đóng vòng Diels- Ander khi có dị tố thường là N, O.. trong hợp phần diene hoặc dienophil, khi đó sản phẩm thu được sẽ là các dị vòng 6 cạnh chứa dị tố, đây là phương pháp quan trọng đóng vòng 6 chứa dị tử:
6.2.2. Cơ chế phản ứng
Phản ứng Diels- Alder là phản ứng cộng đóng vòng đồng bộ kích thích bởi nhiệt với số electron là 4n+2; trong đó các liên kết cũ cắt đi và liên kết mới được hình thành liên tục, không có sự hình thành sản phẩm trung gian.


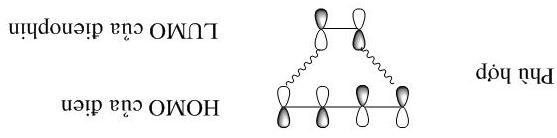


Quá trình cộng này xảy ra do sự tương tác cùng phía của mỗi phân tử thành vòng trung gian rồi hợp thành chất vòng, gọi là quá trình supra hay cộng cis. Phản ứng DielsAlder là phản ứng vòng đồng bộ quan trọng nhất.
EDG + EWG EDG EWG
t0
Diene Dienophil
EDG: electron-donating group (nhóm đẩy electron)
EWG: eletron- withdrawing group (nhóm hút electron)
- Khi đun nóng:
Hợp phần đien có giản đồ năng lượng các MO π như sau:
Hợp phần đienophin có giản đồ năng lượng các MO π như sau:
Hợp phần đien và đienophin sẽ xen phủ ở HOMO với LUMO c
Nếu đien xen phủ ở HOMO và đienophin xen phủ ở LUMO thì quá trình xen phủ diễn ra như sau:
Nếu đien xen phủ ở LUMO và đienophin xen phủ ở HOMO thì quá trình xen phủ vẫn diễn ra phù hợp như sau:
Như vậy phản ứng xảy ra ở điều kiện đun nóng.
- Khi chiếu sáng:
Hợp phần đien và đienophin sẽ xen phủ ở LUMO của mỗi hợp phần. Lúc đó, quá trình xen phủ của các AO diễn ra (nếu có) để hình thành liên kết như sau:
Như vậy dễ nhận thấy, phản ứng không được kích hoạt khi chiếu sáng.
6.2.3. Hóa lập thể của phản ứng Diels–Alder
Một trong những điểm nổi bật của phản ứng Diels–Ander là nó xảy ra rất đặc thù về mặt lập thể.
- Chỉ có dien dạng S–cis mới có thể tham gia được vào phản ứng Diels – Alder, còn cấu dạng trans không tham gia vào phản ứng này:
CH2 H H CH2
C C
CH2 H H
CH2 CH2 + C C CH2
CH2
CH2
cấu hình s-cis nối đôi cis, bền
CH2 H H2C H
C C
CH2 CH2 + C C
CH2
CH2 H CH2
H CH2 cấu hình s-trans nối đôi trans, rất căng

Vì phản ứng là cộng hợp cis nên cấu hình của đien và đienophin luôn được bảo toàn khi tạo thành sản phẩm.
∗ Cis-đienophin tạo ra dẫn xuất có các nhóm thể tồn tại ở cấu hình cis
6.2.4. Các yếu tố ảnh hưởng tới phản ứng
Các yếu tố ảnh hưởng tới phản ứng là xúc tác, dung môi, nhiệt độ, tỷ lệ mol giữa các chất tham gia phản ứng.
Xúc tác
Xúc tác axit Lewis có tác động mạnh đến hệ phản ứng về cả tốc độ lẫn chọn lọc lập thể hơn là hệ không có xúc tác.
∗ Trans-đienophin tạo ra dẫn xuất có các nhóm thể tồn tại ở cấu hình trans
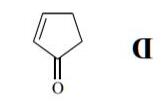
Phản ứng Diels-Alder của xyclopentađien tạo hợp chất vòng có cầu. Trong trường hợp đienophin có nhóm thế, phản ứng ưu tiên tạo sản phẩm endo (nhóm thế ở vị trí syn so với vòng lớn) hơn là exo (nhóm thế ở vị trí anti so với vòng lớn). Điều này được lý giải là phản ứng endo có trạng thái chuyển tiếp với các nhóm thế hút electron ở vị trí thuận lợi cho sự hình thành liên kết π.






CO2MeCO
2Me
Ví dụ về khả năng chọn lọc vùng khi có mặt xúc tác axit Lewis, đó là phản ứng của piperylen và metyl acrylat, sản phẩm chính ở vị trí ortho +
CO2Me
xt AlCl3 90%10%
không xt98%2%
Một ví dụ khác mô tả tác dụng tăng tính chọn lọc lập thể, đó là phản ứng giữa xyclopentađien và metyl acrylat. +
CO2Me CO2Me
H H
Không cóAlCl3, 0oC 88%12%
Có AlCl3,0oC
CóAlCl3, -80oC
Dung môi
96% 4% 98% 2%
CO2Me
Các dung môi được sử dụng trong phản ứng Diels – Alder thường là dung môi trơ, với vai trò làm chất pha loãng, mặt khác, với độ sôi của dung môi có thể điều khiển được
nhiệt độ phản ứng. Các dung môi thường hay dùng là dung môi ete, hexan, benzen, clobenzen, toluen, xylen, etyl axetat…
Nhiệt độ
Thông thường phản ứng khởi đầu trong khoảng 30oC đến 50oC và sau đó với nhiệt độ tỏa ra của phản ứng, phản ứng tiếp tục cho đến khi kết thúc. Có một số trường hợp, nhiệt độ khơi mào của phản ứng cần cao hơn (từ 50oC đến 250oC) trên nhiệt độ sôi của dung môi. Trường hợp các tác nhân có nhiệt độ sôi thấp phải tiến hành phản ứng trong thiết bị kín chịu áp lực.
Tỷ lệ mol
Phần lớn trong các phản ứng dùng thừa thành phần đienophin, đối với các chất dễ phản ứng thường được sử dụng theo tỷ lệ đien/ đienophin bằng 1/1.
6.2.5. Một số ứng dụng cụ thể của phản ứng trong tổng hợp dược phẩm
Ví dụ 1: Năm 1952, Woodward và các đồng nghiệp của ông đã mở ra con đường lịch sử tổng hợp steroid cortisone và cholesterol

Ví dụ 3: Tổng hợp hợp chất có hoạt tính sinh học bolivianine

Ví dụ 2: Tác dụng chính của thuốc Cortisone chính là giảm đi các phản ứng phòng vệ tự nhiên của cơ thể, giảm thiểu rõ rệt các triệu chứng sung tấy, đau nhức và dị ứng. Chính vì thế thuốc được sử dụng điều trị các bệnh về xương khớp, dị ứng, bệnh ngoài da, các bệnh liên quan đến rối loạn máu, ung thư



Ví dụ 4: Prostaglandin E2 (PGE2), còn được gọi là dinoproston được dùng cho mục đích y tế. Thuốc này có thể sử dụng trong trường hợp chảy máu sau khi sinh và dùng cho trẻ sơ sinh để giữ cho ống động mạch mở.

Ví dụ 5: Tổng hợp Kawain có hoạt tính sinh học tìm thấy trong cây lá lốt
6.3.2. Cơ chế phản ứng cộng đóng vòng quang hóa [2+2]
Cả hai hợp phần đều có giản đồ năng lượng MO π như nhau:
Trong điều kiện chiếu sáng, electron ở HOMO của một hợp phần bị kích thích lên LUMO, do vậy khi diễn ra phản ứng, các obitan ở LUMO của hai hợp phần sẽ xen phủ với nhau:
Như vậy quá trình xen phủ này có thể diễn ra.
Trong khi đó, nếu đun nóng, các obitan ở LUMO của hợp phần này sẽ xen phủ với HOMO của hợp phần kia, sự xen phủ này không phù hợp.
6.3. Phản ứng cộng đóng vòng [2+2]
6.3.1. Phản ứng cộng đóng vòng quang hóa [2+2]
Cộng đóng vòng [2+2] xảy ra theo kiểu 2π +2π tạo vòng bốn cạnh có thể mô tả theo sơ đồ dưới đây + hv

Ví dụ:
Do đó phản ứng cộng đóng vòng quang hóa [2 + 2] không diễn ra khi đun nóng.
6.3.3. Phản ứng cộng đóng vòng nhiệt [2+2] sử dụng xeten
a. Giới thiệu chung về xeten
- Xeten được biết đến là hợp chất hữu cơ dạng:
RCH=C=O (andoxeten);
R1R2C=C=O (xetoxeten).



- Xeten được hình thành nhờ ba cách phổ biến:

Cách 1: Khi cho clorua axit, chẳng hạn axetylclorua, tác dụng với amin bậc 3 sẽ
tách ra một hiđro, tiếp tục tách Cl‒ tạo ra dẫn xuất xeten:
Cách 2: Từ α- bromaxylbromua hoặc α-cloaxylclorua đun nóng với Zn
6.3.4. Một số ứng dụng cụ thể của phản ứng trong tổng hợp dược phẩm
Ví dụ 1: Axit alpha-truxillic và các dẫn xuất của nó có hoạt tính chống viêm chống
lại phản ứng đau do thần kinh hoặc bới formalin. Tổng hợp axit truxillic theo phản ứng đóng vòng quang hóa 2+2
Cách 3: Nhiệt phân axeton hoặc axit axetic thu được xeten đơn giản nhất CH2=C=O
- Phản ứng của xeten tập trung ở nhóm C=O, đó là phản ứng cộng nucleophile (Nu)

- Nếu không có Nu, dưới tác dụng của nhiệt xeten sẽ có xu hướng đime hóa, cộng đóng vòng để hình thành vòng 4 cạnh.
Yu-Ming Chi et. al.,Antinociceptive Activities of α-Truxillic Acid and β-Truxinic Acid
Derivatives, Biological and Pharmaceutical Bulletin, 2006, Volume 29 Issue 3 Pages 580-584
Ví dụ 2: (Trích đề thi HSGQG vòng 2-2014)
β- lactam là một loại thuốc kháng sinh. Hợp chất β- lactam F được tổng hợp theo sơ đồ dưới đây
m-ClC6H4OH CH2Br-COOMe Na2CO3
b. Đóng vòng 4 nhờ sử dụng xeten:
Đây là phương pháp đóng vòng 4 nhờ phản ứng đồng bộ, dưới tác dụng điều kiện phản ứng có sự hình thành xeten. Trong các cách tạo xeten ở trên thì phương pháp đi từ clorua axit dưới tác dụng amin là phổ biến hơn cả, hay dùng trong các quá trình thực hiện đóng vòng 4 cạnh, cũng có thể tiến hành phản ứng ngưng tụ nội phân tử của các dixeten. Hai nhóm xeten đime hóa nội phân tử và cho một dixeten hai vòng, chất này bị thủy phân tách CO2, cho một xeton vòng.
Ví dụ:
A 1.NaOH,t0 2.H+ B (COCl)2, DMF CH2Cl2 D PhCH2NH2 p-Br-C6H4-CHO CH2Cl2 E D Et3N/CH2Cl2 F
Trong sơ đồ trên, bước cuối cùng từ E tạo F nhờ phản ứng đóng vòng 2+2 qua xeten:
Ví dụ 3: Các alkaloid trong tự nhiên chứa cyclobutane đã được xác nhận là có tác dụng chống vi trùng, kháng khuẩn, chống ung thư và các hoạt động khác. Cấu trúc, nguồn gốc, quá trình sinh tổng hợp, quá trình photodimerization, và các hoạt động sinh học của một loạt các alkaloid chứa cyclobutan và các chất tương tự tổng hợp được chọn lọc của các alkaloid tự nhiên được xem xét.

Ứng dụng phản ứng đóng vòng quang hóa trong tổng hợp các alkaloid chứa vòng cyclobutane có nhiều ý nghĩa về hoạt tính sinh học để điều chế thuốc, ví dụ cấu trúc một số alkaloid sau:
Anastasia Sergeiko et. al., Cyclobutane-Containing Alkaloids: Origin, Synthesis, and Biological Activities, Open Med Chem J. 2008; 2: 26–37.



6.4. Phản ứng vòng hóa electron
6.4.1. Giới thiệu
Là quá trình đóng (hay mở vòng) pericyclic của các polien: một số liên kết π bị phá vỡ, một số liên kết π được hình thành, thay đổi vị trí để tạo liên kết σ mới, sản phẩm vòng không no mới
Phản ứng đóng mở vòng electron có thể diễn ra trong hai điều kiện là đun nóng hoặc chiếu sáng.
Phản ứng có tính đặc thù lập thể cao, tương ứng với hai điều kiện trên sẽ cho ra các sản phẩm cấu hình khác nhau. to hv cis trans
Các điều kiện cho phản ứng đồng bộ như sau:
Điều kiện kích thích Hướng quay hệ electron theo số eclectron π 4n 4n + 2
Nhiệt, đun nóng Cùng chiều Ngược chiều Ánh sáng Ngược chiều Cùng chiều
Quy tắc Woodward – Hoffmann thực tế là quy tắc chung, cho thấy phản ứng quang hóa ngược với phản ứng nhiệt: phản ứng quang hóa được phép thì phản ứng nhiệt bị cấm và ngược lại.
6.4.2. Cơ chế phản ứng
Trong phản ứng pericyclic, người ta chỉđể ý đến obitan chứa electron có năng lượng cao nhất (HOMO) và obitan không chứa electron có năng lượng thấp nhất (LUMO).
Nếu thực hiện bằng gia nhiệt, quan tâm đến HOMO.
Nếu thực hiện chiếu sáng, electron từ HOMO hấp thụ photon ánh sáng sẽ nhảy lên LUMO, khi đó LUMO có electron sẽ chuyển thành obitan có chứa electron có năng lượng cao nhất, tức là biến thành HOMO*.
Chúng ta cùng xét (2E,4Z,6E)-2,4,6-Octatrien thực hiện phản ứng pericyclic bằng cách gia nhiệt tạo thành cis-5,6-đimetyl-1,3-xiclohexađien.


Từ sơ đồ trên chúng ta thấy, để xen phủ được thì hai obitan ở C2 và C7 phải có cùng sựđối xứng (cùng màu), để đảm bảo điều này chúng phải xoay theo hai hướng ngược nhau, khi đó sự xen phủ xảy ra và hình thành liên kết giữa C2 và C7, việc xoay này làm cho nhóm CH3 ở C2 và C7 cùng 1 hướng, được đồng phân cis-5,6-đimetyl-1,3-xiclohexađien. Còn khi chiếu sáng (2E,4Z,6E)-2,4,6-Octatrien, tại sao lại thu được sản phẩm trans-5,6đimetyl-1,3-xiclohexađien?
Khi có chiếu sáng, phân tử hấp thụ photon ánh sáng, electron nhảy từ HOMO lên LUMO, lúc này LUMO có electron và là obitan có electron và có năng lượng cao nhất, trạng thái này gọi là HOMO*, như vậy bằng cách hấp thụ photon, LUMO đã biến thành HOMO*, hay nói cách khác HOMO* chính là LUMO.
Ở HOMO* của (2E,4Z,6E)-2,4,6-Octatrien, để có sự xen phủ của 2 obitan ở C2 và C7, hai obitan này phải được xoay cùng chiều để phù hợp tính đối xứng, khi liên kết được hình thành thì 2 nhóm Me sẽ ở vị trí đối nhau.


Tương tự, đun nóng 2E,3E-hexa-2,4-đien, ở trạng thái HOMO của phân tử này, hai obitan ở C2 và C5 không cùng tính đối xứng, để có sự xen phủ thì hai obitan này phải cùng tính đối xứng, có nghĩa rằng chúng phải được quay cùng chiều, khi đó 2 nhóm metyl sẽ ngược hướng nhau

Lưu ý rằng phản ứng pericyclic nói chung có tính thuận nghịch, trong điều kiên đun nóng hoặc có chiếu sáng, sản phẩm đóng vòng có thể mở vòng thành polien liên hợp.
6.4.3. Một số ứng dụng cụ thể của phản ứng trong tổng hợp dược phẩm
Ví dụ 1: Quá trình tổng hợp vitamin D3
Bước đầu tiên liên quan phản ứng mở vòng quang hóa của 7-dehydrocholesterol để tạo thành hợp chất tiền vitamin D3. Sự chuyển dịch [1,7] -hydride sau đó tạo thành vitamin D3.


Ví dụ 2:
Biosynthetic and Biomimetic Electrocyclizations. Chem. Rev., Volume 105, Issue 12, 2005, Pages 4757-4778 Christopher M. Beaudry, Jeremiah P. Malerich, and Dirk Trauner doi:10.1021/cr0406110



Mehta, G.; Rao, K. S. J. Am. Chem. Soc. 1990, 108, 8015.



Ví dụ 3: Tổng hợp aranotin, một oxepine tự nhiên, và các hợp chất liên quan của nó.

6.5. Giới thiệu sơ lược về phản ứng chuyển vị xich-ma
Phản ứng chuyển vị xich-ma là phản ứng vòng quang hóa trong đó có một liên kết
σ bị phá vỡ và một liên kết σ mới hình thành, đồng thời thời với sự chuyển dịch của các liên kết π
Trong phản ứng chuyển vị Claisen của dạng anlyl aryl ete, liên kết C=O hình thành làm phá vỡ hệ liên hợp thơm, nên sau đó sẽ xảy ra quá trình tautome hóa (cân bằng enol –cacbonyl) để hình thành lại hệ thơm này.
Tên gọi của phản ứng chuyển vị xich-ma được gọi dựa trên số nguyên tử cacbon của mỗi phần phân cắt bởi liên kết xich-ma bị phá vỡ và liên kết xich-ma hình thành. Ví dụ như phản ứng trên được gọi là chuyển vị xich-ma [3,3], còn phản ứng dưới đây gọi là chuyển vị xich-ma [1,5].
Chuyển vị 3-aza-Cope
Ví dụ 1: Chuyển vị allyl ester
Chuyển vị Cope
Chuyển vị Cope là phản ứng chuyển xich-ma [3,3] trong đó cả sáu nguyên tử tham gia trạng thái chuyển tiếp vòng đều là những nguyên tử cacbon. Chuyển vị Cope chuyển dời về phía tạo anken có bền hơn (có nhiều nhóm thế hơn).
Chuyển vị Claisen
Chuyển vị Claisen là phản ứng chuyển xich-ma [3,3] có sự tham gia của nguyên tử oxi. Chuyển vị Claisen xảy ra ở hợp chất dạng anlyl vinyl ete hoặc dạng anlyl aryl ete. Phản ứng này chuyển dòi theo hướng tạo liên kết C=O bền hơn liên kết C=C ban đầu. Ví dụ dưới đây là phản ứng chuyển vị Claisen của hợp chất dạng anlyl vinyl ete.
Robert E. Ireland and Richard H. Mueller, Journal of the American Chemical Society 1972, 94 (16), 5897-5898

Ví dụ 2: Citral (3,7-dimethyl-2,6-octadienal) là một aldehyde chưa no, thường được biết đến và ưa chuộng vì mùi dễ chịu, giống như chanh. Citral là thành phần chính của dầu vỏ trái cây họ cam quýt. Tinh dầu có thành phần citral đã được chứng minh là có đặc tính kháng khuẩn, kháng nấm và chống ký sinh trùng, biến citral thành chất bảo quản tự nhiên.







tổng hợp citral:
PHẦN III: HỆ THỐNG BÀI TẬP XÂY DỰNG KĨ NĂNG
Mục tiêu của hệ thống gồm 30 bài tập dưới đây để các em học sinh làm quen với
từng loại phản ứng cụ thể. Khi làm mỗi loại phản ứng, giáo viên nên yêu cầu học sinh xem lại cơ chế phản ứng. Học sinh khi học và làm các bài tập này sẽ giúp rèn kĩ năng như viết cấu tạo, cấu trúc phân tử, đọc cơ chế. Mức độ các bài tập (xác đinh sản phẩm, xác định chất ban đầu,…) phù hợp cho đối tượng học sinh bắt đầu học về các phản ứng hữu cơ. Và chỉ khi các em nắm chắc những kiến thức cơ bản thì mới vận dụng tốt để làm những bài tập nâng cao.
Suzuki, S.; Fujita, Y.; Noshida, T. Tetrahedron Lett. 1983, 24, 5737.

DẠNG 1: PHẢN ỨNG CỦA ENOL, ENOLATE

Ví dụ 3:
Brueggemann và các đồng nghiệp đã phát triển các phương pháp tổng hợp các cấu trúc ba vòng có cầu nối phức tạp bằng cách sử dụng phản ứng aza-Cope. Các cấu trúc azaba vòng này được tìm thấy trong họ Stemona alkaloid phức tạp, cũng như trong các loại thuốc có tiềm năng như một số chất ức chế miễn dịch.
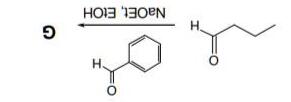
Câu 1: Phản ứng cộng Michael
Xác định sản phẩm các phản ứng sau:
Brueggemann, M.; McDonald, A. I.; Overman, L.E.; Rosen, M.D.; Schwink, L.; Scott, J.P. (2003). "Total Synthesis of (±)-Didehydrostemofoline (Asparagamine A) and (±)Isodidehydrostemofoline". J. Am. Chem. Soc. 125 (50): 15284–15285.








Hướng dẫn giải
- Yêu cầu HS nắm vững cơ chế phản ứng cộng Michael.
- Xem xét khả năng xảy ra phản ứng decacboxi hóa kèm theo nếu có.
- Phản ứng cộng Michael có:
+ Chất phản ứng là 1,3-dicarbonyl và carbonyl chưa bão hòa ở α,β + Sản phẩm là 1,5-dicarbonyl





























Câu 2: Phản ứng ngưng tụ aldol
Xác định sản phẩm các phản ứng sau:
Hướng dẫn giải
Phản ứng ngưng tụ aldol có:
- Chất phản ứng có aldehyde hoặc ketone.































- Sản phẩm là hợp chất carbonyl chưa bão hòa ở vị trí α,β

Câu 3: Phản ứng ngưng tụ Claisen
Xác định sản phẩm các phản ứng sau:
Hướng dẫn giải
Phản ứng ngưng tụ Claisen có:
- Chất phản ứng có ester và ester hoặc ester và ketone








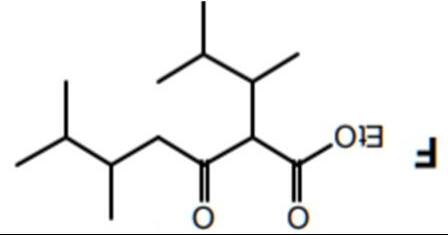


- Sản phẩm là hợp chất 1,3-dicarbonyl.

























Hướng dẫn giải

Câu 5: Xác định chất trong sơ đồ phản ứng ngưng tụ
Sơ đồ 1:
Sơ đồ 2:
a) Cho biết cấu tạo của các chất từ A đến G.
b) Giải thích sự hình thành của E.
Sơ đồ 2:
Câu 6: Xác định chất trong sơ đồ có phản ứng đóng vòng Robinson
Xác định cấu trúc chất cần tìm trong các sơ đồ sau:
a) COOEt
Hướng dẫn giải
Sơ đồ 1:
NaOEt, EtOH 2. HCl, EtOH





O NaOEt, EtOH A B
Trong đó A có công thức phân tử C14H16O2; E, F là đồng phân anome của nhau.
Hướng dẫn giải
a) Phản ứng đóng vòng Robinson xảy ra ở 2 giai đoạn liên tiếp tạo A, B.
b) Quá trình tạo A chính là phản ứng đóng vòng Robinson một lần, chú ý tới vị trí khép vòng.
Câu 8: Viết quá trình phản ứng ngưng tụ khi biết chất đầu và sản phẩm
Phản ứng sau xảy ra qua 2 bước tạo sản phẩm trung gian X, Y sau đó mới cho sản phẩm cuối Z. Biết Z có công thức phân tử là C8H9ON với tên thay thế là 3-metyl-4-oxoxiclohex-2-en-1-nitrin. Viết các phản ứng giải thích.
O OHCCN + EtONa EtOH C8H9ON


Hướng dẫn giải
Bước 1 là AN của enolat (nếu tạo enolat ở nhánh etyl thì sẽ gây cản trở không gian)
Câu 7: Viết cơ chế phản ứng cộng Michael
Sản phẩm sau được tạo thành thông qua 2 lần cộng Michael, viết cơ chế giải thích.
Z, C8H9ON
DẠNG 2: PHẢN ỨNG CỦA IMINE, ENAMINE





Câu 9: Xác định imine, enamine
a) Viết cấu tạo sản phẩm trong ô trống và cho biết đó là imine hay enamine?
Hướng dẫn giải a)
b) Viết sản phẩm các phản ứng nội phân tử sau
c) Viết sản phẩm phản ứng thủy phân imine, enamine trong môi trường ait
b)
Câu


































Hướng dẫn giải

DẠNG 3: PHẢN ỨNG Đ
VÒNG DIELS-ALDER
Câu 13: Xác định sản phẩm phản ứng Diels-Alder





















Câu 12: Xác định chất trong sơ đồ phản ứng ngưng

























Câu 15: Phản ứng retro Diels-Alder










Xác định chất A, B trong sơ đồ sau, dùng dấu mũi tên cong biểu diễn sự dịch chuyển electron khi phản ứng xảy ra:
Câu 16: Xác định sản phẩm của các phản ứng Diels-Alder nội phân tử sau:
Hướng dẫn giải
a)
O b)
Hướng dẫn giải a) O
CO2CH3
re-draw O O
1,3-dien dienophin
b) CO2CH3
1,3-dien dienophin

re-draw CO2CH3 CO2CH3
Câu 17: (Trích đề thi chọn HSGQG vòng 1 năm 2012)
Viết các tác nhân phản ứng, điều kiện phản ứng (nếu có) thay cho dấu chấm hỏi (?) và vẽ cấu trúc của các hợp chất hữu cơ A, B để hoàn thành sơ đồ chuyển hoá sau:
Hướng dẫn giải
Câu 18: (Trích đề thi chọn HSGQG vòng 1 năm 2015)
Cho các chất sau:
A1A2A3A4A5A6A7
Những chất nào phản ứng cộng được với anhiđrit maleic theo tỉ lệ mol 1:1 ở nhiệt độ cao? Vẽ công thức lập thể của sản phẩm thu được. Biết rằng phản ứng cộng đóng vòng có sự tham gia đồng thời của 4n+2 electron π (n = 1, 2,...) thì dễ xảy ra.
Hướng dẫn giải
Các chất A4, A5, A6 có thể đóng vòng với sự tham gia đồng thời 6 electron π, còn A7 đóng vòng với sự tham gia của 10 electron π.

e.
Hướng dẫn giải
Phản ứng cộng đóng vòng quang hóa [2 + 2] diễn ra theo kiểu cộng cis, do vậy ta có công thức cấu hình các sản phẩm như sau: e.
DẠNG 4: PHẢN ỨNG ĐÓNG VÒNG
QUANG HÓA[2+2]
Câu 20: Dự đoán cấu trúc sản phẩm phản ứng quang hóa:
OH
a.
O as C11H16O
O CH3COO c. C14H18O3
Hướng dẫn giải
Hóa lập thể của các chất phản ứng thường được tái sinh trong sản phẩm, xảy ra đồng thời theo cùng một cách sao cho tạo ra ít án ngữ không gian nhất. Vì vậy, sản phẩm có dạng cis ở vòng A/B và B/C. Những giữa vòng A và C lại có quan hệ trans, 2 nhóm -
COOMe sẽ phân bố về hướng ngược với nhóm Me- và H của phân tử thứ hai.
Câu 21: Viết cơ chế phản ứng sau:
Hướng dẫn giải
DẠNG 5: PHẢN ỨNG VÒNG HÓA ELECTRON
Câu 22: Xác định cấu trúc các sản phẩm :
Biết các phản ứng xảy ra tuân theo quy tắc Wood –Hoffmann
Điều kiện kích thích Hướng quay hệ electron theo số eclectron
4n 4n + 2
Nhiệt, đun nóng Cùng chiều Ngược chiều
Ánh sáng Ngược chiều Cùng chiều
Hướng dẫn giải
- Phản ứng a, b là phản ứng vòng hóa với ban đầu có 6 electron .
- Phản ứng c là phản ứng đóng vòng [2+2] dưới tác dụng của nhiệt độ
- Phản ứng d là phản ứng mở vòng (retro- Diels-Alder) dưới tác dụng của ánh sáng
Câu 23: Viết cấu tạo sản phẩm đóng mở vòng sau:
Hướng dẫn giải
Câu 24: Axit endriandric A là một hợp chất thiên nhiên, có trong một số loài thực
Vậy B là
B
H H Axit
endiandric D +
Xét hệ liên hợp vòng
Ph
COOH
Hãy xác định công thức cấu trúc của B, cơ chế của các phản ứng đóng vòng tử B đến axit endriandric A, hóa học lập thể của chúng.
Hướng dẫn giải
Tạo ra B: quay cùng chiều
Tạo ra axit D, E: quay ngược chiều, cis.
COOH Ph A Ph COOH H H Axit
D + Ph COOH H H Ph COOH Axitendiandric
E
Quay cùng chiều, sản phẩm trans
Quay ngược chiều, sản phẩm cis
H H R2 R1 H H Ph COOH H H E H H R2 R1 H H Ph COOH H H D Ph COOH H H Axitendiandric A Ph H H COOH H H Ph Dinxo-Ando
Câu 25: Chuyển vị nhiệt dưới đây được tiến hành qua hai phản ứng đóng vòng perixiclic liên tiếp. Hãy xác định chúng và giải thích cơ chế cho kết quả quan sát đượ
77
Hướng dẫn giải Đóng, sau mở vòng [2+2] liên tiếp.
Câu 26: Thực hiện phản ứng sau: to (X)


a) Trình bày cơ chế phản ứng, dùng dấu mũi tên cong mô tả sự chuyển dịch của các electron trong cơ chế.
b) Sản phẩm chính tạo ra có cấu hình như thế nào?
Hướng dẫn giải
a) Cơ chế phản ứng: hay
b) Xác định cấu hình sản phẩm chính:
Khi thực hiện phản ứng đóng vòng, hai electron của hai cacbon đầu mạch liên hợp
ở HOMO sẽ tham gia xen phủ cùng dấu. Chúng sẽ quyết định cấu hình sản phẩm chính.
Hai AO sẽ quay ngược chiều nhau (theo chiều kim đồng hồ) để xen phủ, tạo thành liên kết
σ Điều đó cũng dẫn đến sự hình thành đồng phân cis. to Me Me
Công thức cấu hình sản phẩm thu được:
Me Me Cis
Câu 27: Từ hiđrocacbon 5,5 – đimetylxiclopenta-1,3-đien (A), người ta tổng hợp được hai xicloankan C và D theo sơ đồ sau:
Xác định công thức cấu tạo của B, C, D.
Hướng dẫn giải B C D
Câu 28: Vẽ giản đồ MO để xác định các phản ứng sau đây là được phép hay bị cấm.
(d) Phản ứng cộng vòng [4+4] này được cho phép do sự xen phủ giữa LUMO kích
thích của đien này và HOMO của đien khác bảo toàn tính đối xứng obitan.
(e) Trong phản ứng vòng electron này, để tạo sản phẩm trans cần thực hiện đồng quay. Quá trình này được phép bảo toàn tính đối xứng obitan.
Hướng dẫn giải
(a) Phản ứng cộng vòng [6+2] này bị cấm do sự xen phủ giữa LUMO của trien và HOMO của anken không bảo toàn tính đối xứng obitan.
(b) Phản ứng cộng vòng [6+2] này được cho phép do sự xen phủ giữa LUMO kích thích của trien và HOMO của anken bảo toàn tính đối xứng obitan.
(c) Trong phản ứng vòng electron này, để tạo sản phẩm trans cần thực hiện đồng quay. Tuy nhiên, quá trình này bị cấm do không bảo toàn tính đối xứng obitan.
(f) Phản ứng chuyển vị xich-ma nhiệt [3,5] này là bị cấm do sự xen phủ giữa HOMO của gốc anlyl và HOMO của gốc pentađienyl là không bảo toàn đối xứng obitan.
(g) Phản ứng chuyển vị xich-ma nhiệt [3,3] này là bị cấm do sự xen phủ giữa HOMO của gốc metyl và HOMO của gốc pentađienyl là không bảo toàn đối xứng obitan.
Câu 29: Phân loại các phản ứng dưới đây theo phản ứng cộng vòng [x+y], phản ứng vòng electron, hoặc phản ứng chuyển vị xich-ma (i,j) và giải thích phản ứng đó được xảy ra trong điều kiện đun nóng hay chiếu sáng.










Câu 30: Đề nghị cơ chế cho phản ứng dưới đây
a)
b)
Hướng dẫn giải
a) Giai đoạn đầu là chuyển vị xich-ma [3,3], sau đó tautomer hóa tạo xeton bền
Gợi ý: Điều kiện đối với phản ứng cộng vòng, phản ứng vòng electron kiểu nghịch quay, và phản ứng chuyển vị xich-ma như sau:
Số cặp electron ở trạng thái chuyển tiếp
Điều kiện để phản ứng xảy ra
Lẻ Nhiệt
Chẵn Quang
Hướng dẫn giải
Câu Tên phản ứng Số cặp electron







tham gia phản ứng
Điều kiện phản ứng
a cộng vòng [6+2
4 (số chẵn) quang hóa
b chuyển vị xich-ma [1,5] 3 (số lẻ) nhiệt hóa
c chuyển vị xich-ma [1,7] 4 (số chẵn) quang hóa
d cộng vòng [6+2] 4 (số chẵn) quang hóa
e cộng vòng [2+2] 2 (số chẵn) quang hóa
f cộng vòng [6+4] 5 (số lẻ) nhiệt hóa
g chuyển vị xich-ma [3,7] 5 (số lẻ) nhiệt hóa
h cộng vòng [6+4] 5 (số lẻ) nhiệt hóa
b) Bước 1: mở vòng; bước 2: đóng vòng.
Hệ thống 35 câu bài tập sơ đồ tổng hợp dược phẩm mức độ vận dụng cao được sưu tầm và chia thành 3 phần như sau:
1. BÀI TẬP TRONG ĐỀ THI CHỌN HỌC SINH GIỎI QUỐC GIA
Câu 1: (Trích đề thi chọn HSGQG vòng 1- năm 2019)
Hợp chất Furoclausine-B (9) được phân lập từ các dược liệu truyền thống, có tác dụng chữa nhiều bệnh viêm nhiễm. Hợp chất 9 được tổng hợp toàn phần theo sơ đồ sau:
b) Vẽ công thức cấu tạo của chất 1 và các chất từ 3 đến 10.
Câu 3: (Trích đề thi chọn HSGQG vòng 1- năm 2018)
3.1. Atropin (C17H23NO3) là ancaloit thiên nhiên có độc tính, có tác dụng giãn cơ. Thủy phân atropin, thu được tropin, axit atropic và axit C6H5CH(CH2OH)COOH. Tropin là ancol không quang hoạt. Khi đehidrat hóa tropin, thu được tropiden.
a) Vẽ (không cần giải thích) công thức cấu tạo của tropin và atropin.
b) Đề xuất sơ đồ tổng hợp tropin từ MeNH2 và chất X.
c) Tropin phản ứng với Y, thu được benztropin là hoạt chất dùng để bào chế thuốc chữa trị bệnh Parkinson. Vẽ (không cần giải thích) công thức cấu tạo của benztropin.
Axit atropic Tropiden X Y
3.2. Vitamin B6 (kí hiệu K, chứa vòng pyridin) được tổng hợp theo sơ đồ sau:
Vẽ (không cần giải thích) công thức cấu tạo của các chất E, F, G, H, I và K.
Câu 4: (Trích đề thi chọn HSGQG vòng 1- năm 2017)
Vẽ công thức cấu tạo của các chất từ 1 đến 8.
Câu 2: (Trích đề thi chọn HSGQG vòng 1- năm 2019)
Peribysin (1) là hợp chất có hoạt tính sinh học, Hợp chất 1 được tổng hợp theo sơ đồ sau:
Hidrocacbon epizonaren (C15H24) được phân lập từ tinh dầu loài Silvia fruticosa Mill. Epizonaren được sử dụng công nghệ chất thơm. Con đường tổng hợp epizonaren như sau:
1. CH3MgBr
2. H2SO4, t0 (Epizonaren)
Vẽ công thức cấu tạo của chất A, B, C, D.
Câu 5: (Trích đề thi chọn HSGQG vòng 1- năm 2016)
a) Biết 2 là (E)-2-metylbut-2-enal. Từ các chất cung cấp không quá 2 nguyên tử cacbon, hãy đề xuất sơ đồ tổng hợp chất 2 có kèm điều kiện phản ứng.
Monastrol được dùng làm thuốc ức chế sự phân bào của các tế bào ung thư. Trong công nghiệp, monastrol được tổng hợp bằng cách sử dụng phản ứng đa tác nhân theo sơ đồ
hình sau:
Hãy đề xuất cơ chế để giải thích sự tạo thành sản phẩm phản ứng.
Câu 6: (Trích đề thi chọn HSGQG vòng 1- năm 2015)
Longifolen là một sesquitecpen có trong thành phần nhựa thông và tinh dầu của một số cây lá kim, được dùng trong công nghiệp hương liệu, mĩ phẩm,... Chất Y được sử dụng để tổng hợp longifolen. Từ xiclopentađien, chất Y được tổng hợp theo sơ đồ sau:
Câu 8: (Trích bài tập chuẩn bị ICHO 51 – năm 2019)
Oseltamivir là thành phần hoạt chất trong một loại thuốc kháng vi-rút (Tamiflu®)
được sử dụng để phòng ngừa và điều trị cúm A và B. Có một số cách để tổng hợp oseltamivir. Sơ đồ được đề xuất dưới đây (tổng hợp Karpf-Trussardi) dựa trên (-) - axit shikimic, đồng phân lập thể của 3,4,5- axit trihydroxycyclohex-1-thụt-1-cacboxylic, là tiền chất cho nhiều quá trình tổng hợp ở thực vật. Đầu tiên các bước được nghiên cứu trong vấn đề này. Một loạt các phản ứng (không được hiển thị) sau sự mở ra của epoxit E, và cuối cùng dẫn đến sự hình thành oseltamivir.
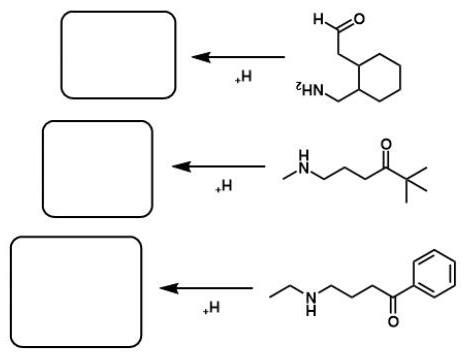
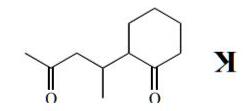
- Xác định các chất I, K và M.
- Xác định công thức cấu tạo của enamin X, biết X chứa vòng 6 cạnh.
2. BÀI TẬP CHUẨN BỊ OLYMPIC HÓA HỌC QUỐC TẾ
Câu 7: (Trích bài tập chuẩn bị ICHO 51 – năm 2019)
Cantharidin là một terpenoid mà một số loài bọ cánh cứng tiết ra. Một số sử dụng

thuốc đã được biết đến kể từ thời cổ đại, nhưng sự phân lập của nhà hóa học người Pháp P
Robiquet vào năm 1810 là một cột mốc quan trọng. Bây giờ nó được công nhận là một chất độc mạnh, đặc biệt là đối với ngựa và tình cờ là một thuốc để loại bỏ mụn cóc. Một số bước
tổng hợp vào năm 1951 bởi nhà hóa học Bỉ, G Stork được chỉ ra trong sơ đồ sau:
Xác định cấu trúc của các chất A, X, B, C, D, D’, D’’.


Câu 9: (Trích bài tập chuẩn bị ICHO 51 – năm 2019)
Testosterone là một hormone - hoạt chất sinh học có đặc tính báo hiệu và được tạo thành trong cơ thể sống. Nó được tìm thấy ở hầu hết các động vật có xương sống, cả ở cá thể đực và cái. Tác động của nó tới sức khỏe quan trọng đến nỗi testosterone được đưa vào danh sách các loại thuốc thiết yếu của Tổ chức Y tế Thế giới (WHO). Một số giai đoạn trong tổng hợp chính thức của phân tử được chỉ ra trong sơ đồ sau:
Xác định cấu trúc của các chất A, B, C, E, F, G.
Xác định cấu trúc của các chất A, B, B’, C, D, E và E’.
Câu 10: (Trích bài tập chuẩn bị ICHO 50 – năm 2018)
(-) Eremophilone, là một thành phần của một loại dầu có đặc tính chống viêm và thư giãn, được phân lập từ cây bụi Eremophila mitchellii của Úc (gỗ phật thủ).
Quá trình tổng hợp đối quang Emeophilone tinh khiết là một thách thức do cấu hình cis của hai nhóm metyl và hướng trục của nhóm isopropenyl. Quá trình tổng hợp hỗn hợp không đồng phân tương ứng 1 bắt đầu từ xeton 2, được phản ứng với etan-1,2-diol trong điều kiện axit để tạo ra hợp chất A, sau đó là quá trình khử chọn lọc với phức hợp borane – THF. Quá trình oxy hóa tạo ra chất trung gian borane tạo ra chất B. Quá trình oxy hóa nhẹ của nó tạo ra sản phẩm C, được phản ứng lập thể ở bước tiếp theo với λ5alkylidenephosphane (ylide) D thích hợp để tạo ra hợp chất 3. Sự khử của nó dẫn đến chất E, chất này phản ứng với butyl vinyl ete khi có mặt thủy ngân axetat để tạo ra hợp chất 4. Đun nóng hợp chất 4 dẫn đến sự sắp xếp lại thành hợp chất F, sau khi khử bảo vệ, tạo ra hợp chất điôxin G. Quá trình aldol hóa nội phân tử cuối cùng sử dụng thuốc thử H dẫn đến mạch vòng 5 là chất trung gian quan trọng trong quá trình tổng hợp hỗn hợp đồng phân lập thể Emeophilone (1).
a) Vẽ cấu trúc của sản phẩm và thuốc thử A – H. Bước quan trọng trong quá trình tổng hợp là sự sắp xếp lại nhiệt hóa của allylic vinyl ete 4, dẫn đến hợp chất F. Để phản ứng xảy ra, hợp chất 4 phải áp dụng định hướng I thích hợp để cho phép chuyển vị sigmatropic tiếp theo.
b) Vẽ hướng cần thiết của gốc vinyl ete allylic I trong hợp chất 4 cho phép chuyển hóa theo chiều hướng đáng kể. Sử dụng mũi tên cong để hiển thị dòng electron trong bước
sắp xếp hợp chất F. Tên của sự sắp xếp lại là gì? Lưu ý: không phải vẽ cấu trúc 3D. Sự sắp xếp lại này thường đòi hỏi nhiệt độ cao, nhưng đây không phải lúc nào cũng là một yêu cầu thiết yếu. Ví dụ, các este allylic, ví dụ: este 6, cũng có thể trải qua quá trình biến đổi này bằng cách xử lý đầu tiên với bazơ không nucleophin mạnh như lithium diisopropylamide (LDA) ở -78°C để tạo ra enolat tương ứng. Tiếp theo bẫy enolat với clorotrimetylsilan tạo ra silyl enol ete J. Khi được để ấm đến nhiệt độ phòng, chất J trải qua quá trình sắp xếp tự phát thành silyl este L được thế thông qua cấu trúc K.
c) Vẽ cấu trúc của J và L và định hướng K cho phép tiến hành phép chuyển bị sigmatropic. Sử dụng các mũi tên cong để hiển thị dòng electron trong bước sắp xếp lại thành hợp chất L. Lưu ý: không cần phải vẽ cấu trúc 3D.
Câu 11: (Trích bài tập chuẩn bị ICHO 49 – năm 2017)
Anatoxin-a (I) là một alkaloid amin bậc hai có độc tính cấp tính trên thần kinh có thể gây tử vong do liệt hô hấp. Hợp chất này được tạo ra bởi một số chi vi khuẩn lam khác nhau được tìm thấy trên khắp thế giới. Năm 2004, Jehrod B. Brenneman và Stephen F. Martin đã báo cáo tổng hợp ngắn gọn anatoxin-a từ D-metyl pyroglutamat có bán trên thị trường, được chuyển thành hợp chất A. Viết cấu trúc của các hợp chất B, C, F, H và I.
Câu 12: (Trích bài tập chuẩn bị ICHO 49 – năm 2017)
Trong quá trình tổng hợp sesquiterpene (± ±±)-illudin C, R. L. Funk chỉ ra chất C có thể được điều chế dựa trên tổng hợp ngắn được trình bày dưới đây (Aungst, Jr., R. A.; Chan, C.; Funk, R. L. Org. Lett. 2001, 3, 2611–2613.) Hợp chất C sau đó được tiếp tục trong quá trình tổng hợp như được minh họa. Vẽ cấu trúc đúng của A, B, C và D.
Câu 13: (Trích bài tập chuẩn bị ICHO 49 – năm 2017)
Trong các nghiên cứu về quản lý cơn đau, µ µµ-opioid là một protein đích quan trọng trong hệ thần kinh trung ương, tương tác với các phân tử nhỏ cụ thể và do đó có thể làm giảm đau ở bệnh nhân. Ngoài các hợp chất gốc trong thực vật được biết là có tác dụng giảm đau, các dẫn xuất tổng hợp cũng quan trọng không kém đối với nghiên cứu. Trong một đánh giá dược lý gần đây về mitragynine tổng hợp và các dẫn xuất, các ancaloit chính được tìm thấy trong loài thực vật Đông Nam Á Mitragyna speciosa (được gọi là Kratom ở Thái
Lan), (Kruegel, A. C.; Gassaway, M. M.;et al., Am. Chem. Soc. 2016, 138, 6754–6764.)
Sự tổng hợp ngắn gọn được minh họa trong sơ đồ dưới đây.
a) Vẽ công thức cấu tạo đúng của hợp chất A.
b) Xác định cấu trúc của các hợp chất B-D.
Câu 14: (Trích bài tập chuẩn bị quốc tế ICHO 45 - năm 2013)
Năm 1984, Emil Fischer đưa ra mô hình “chìa khóa-ổ khóa” mô tả tương tác giữa phân tử thuốc và phân tử chịu tác động của nó. Tương tác này chỉ có hiệu quả khi có sự tương thích về dạng hình học giữa phân tử thuốc và phân tử chịu tác động. Theo mô hình này, một loại thuốc phải có cấu dạng xác định với các nhóm thế ở vị trí thích hợp. Một trong các phương pháp để đạt được điều này là làm giảm bớt độ linh động của phân tử. Gần đây, một nhà hóa học người Ukraina đã công bố một công trình nghiên cứu về qui trình tổng hợp các amin I và J với bộ khung phân tử cứng nhắc theo sơ đồ sau đây:
Chất A được tổng hợp lần đầu tiên vào năm 1958 bởi J.D. Roberts và F.F. Caserio theo 2 sơ đồ sau
1) Hoàn thành các sơ đồ trên (có chú ý cấu trúc các chất), biết C và D là đồng phân của nhau, J có 2 mặt phẳng đối xứng. K là 1 hidrocacbon chỉ có một loại nguyên tử H, trong đó H chiếm 10%, N và O là các đồng phân của nhau, với C=22,9%; H=3,8%.
2)Một hợp chất rất thú vị W có thể được tổng hợp từ P theo sơ đồ sau:
a) Hãy cho biết cấu trúc các chất từ Q đến W.
b) Có thể tách W thành các đối quang được không?
Câu 15: (Trích bài tập Olympiad Hóa học Nga - Vòng 1- Lớp 11)
Tài liệu NCHO 2019 của tạp chí KEM
Hẳn là mỗi chúng ta đều đã từng rất khổ sở vì phải nhổ răng. Ngày nay, hẳn là chẳng có ai đồng ý làm điều này mà không cần gây tê. Trong nha khoa, gây tê cục bộ thường được sử dụng để giảm đau cho bệnh nhân. Một trong những loại thuốc đầu tiên được sử
dụng để thay thế cho các chất hướng thần1 là Novocaine. Về sau, Lidocaine (hydrochloride

của chất I), thuốc gây tê cục bộ đầu tiên thuộc nhóm amide, đã được sử dụng. So với Novocaine thì hiệu quả gây tê của Lidocaine mạnh hơn và kéo dài lâu hơn. Ngày nay, những loại thuốc này ít được sử dụng tại các phòng khám nha khoa hiện đại, bởi chúng đã
bị thay thế bởi Scandonest (hydrochloride của chất II), chất này an toàn hơn so với những thế hệ thuốc cũ và thậm chí có thể sử dụng để gây tê cho những bệnh nhân bị chứng tăng huyết áp hoặc trẻ em. Dưới đây là sơ đồ tổng hợp các loại thuốc đã được mô tả.
Câu 16: (Trích bài tập Olympiad Hóa học Nga - Vòng 2- Lớp 12)
Tài liệu NCHO 2019 của tạp chí KEM
Giải Nobel Hóa học thường được trao cho những khám phá hoặc phát minh. Tuy nhiên, ít nhất một lần, Ủy ban Nobell đã trao giải thưởng này cho toàn bộ những thành tựu của người đạt giải. Trong 30 năm, Robert burns Woodward đã thực hiện được khoảng 20 quy trình tổng hợp hợp chất thiên nhiên phức tạp - những chất mà trước đây tường chừng như không thể tổng hợp nổi, và ông cũng có đóng góp to lớn trong việc xác định cấu trúc của nhiều hợp chất. Trong bài phát biểu trao giải, Ủy ban luôn nhấn mạnh đến tính độc đáo của người chiến thắng, và tới lượt Woodward thì ông đã nhanh chóng hoàn thành quy trình tổng hợp toàn phần cephalosporin C, kháng sinh kiểu β-lactam, dành riêng cho lễ trao giải Nobel.
1) Viết công thức cấu tạo các hợp chất A-D và I-II, biết rằng I và II là các hợp chất tương tự nhau, chỉ khác về cấu trúc của nhóm thế Tuy nhiên, một trong những loại thuốc gây tê cục bộ hữu hiệu và phổ biến nhất ngày nay là Ultracain (hydrochloride của chất III)
- được sử dụng cùng với chất gây co mạch adrenaline - có hiệu quả gây tê kéo dài.
1) Một trong những tổng hợp toàn phần thành công nhất của Woodward là marasmic acid vào năm 1976. Trong bài này, bạn cần giải mã sơ đồ chuyển hóa được thực hiện bởi ông và cộng sự, để xác định cấu trúc các chất A-N. Biết rằng chất B chứa 1 vòng, chất L3 vòng.

2) Xác định công thức cấu tạo các hợp chất E-K và X.
3) Biết rằng chất E và sản phẩm methanol hóa của nó trong sulfuric acid (E’) được sử dụng rộng rãi trong công nghiệp.


Xác định công thức cấu tạo của E’ và giải thích tại sao các hợp chất này được sử dụng. Có thể sử dụng Ultracain để gây tê cho các bệnh nhân bị chứng tăng huyết áp không?
Woodward, cùng với một nhà hóa học lỗi lạc khác - Robert Robinson, dựa trên cấu trúc các sản phẩm thủy phân của penicillin, đã đề xuất được cấu trúc của kháng sinh này đầu tiên, chất này về sau đóng vai trò như nguyên liệu đầu của một trong các phương pháp tổng hợp cephalosporin C, là chất có cấu trúc hóa học liên quan. Một trong những kháng sinh phổ rộng bán tổng hợp phổ biến nhất thuộc nhóm này là amoxicillin [амоксициллин], được tổng hợp bằng cách gắn 2-amino-2-(4-hydroxyphenyl)acetyl chloride vào nhân 6APC.
2) Sơ đồ dưới đây cho biết các sản phẩm thủy phân của amoxicillin. Cũng như các nhà hóa học vĩ đại, bạn cũng cần phải dựa vào cơ sở các dữ kiện này để dự đoán cấu trúc của nó. Biết rằng, 6-APC chứa 2 vòng ngưng tụ với số nguyên tử trong mỗi vòng lớn hơn
3. Giả sử rằng trong cả hai trường hợp thủy phân đều không có sản phẩm hữu cơ nào khác ngoài những chất được chỉ ra trong sơ đồ
Câu 18: (Trích trong 100 bài tập hóa dược Chu Văn Phòng) Artemisinin và các dẫn xuất bán tổng hợp của nó là một nhóm thuốc dùng để chống lại bệnh sốt rét do Plasmodium falciparum. Nó được phát hiện vào năm 1972 bởi Tu Youyou, người đồng nhận giải thưởng Nobel Y học 2015 vì khám phá của cô. Các phương pháp điều trị có chứa dẫn xuất artemisinin (liệu pháp kết hợp artemisinin, ACT) hiện đang là phương pháp điều trị tiêu chuẩn trên toàn thế giới cho sốt rét do P. falciparum.
Chú ý: Ở giai đoạn điều chế chất H, tạo thành một hỗn hợp 2 đồng phân với tỉ lệ
1:1, hỗn hợp này được tiếp tục sử dụng mà không qua giai đoạn phân tách. Bởi vậy, chất I cũng được tạo thành ở dạng hỗn hợp 2 đồng phân, các chất này ở giai đoạn tiếp theo tạo ra cùng một sản phẩm J.
3. BÀI TẬP TỔNG HỢP DƯỢC PHẨM SƯU TẦM
Câu 17: (Trích trong 100 bài tập hóa dược Chu Văn Phòng)
Mycophenolate sodium là một loại thuốc ức chế miễn dịch được sử dụng để ngăn ngừa thải ghép sau ghép tạng và điều trị bệnh Crohn, cụ thể nó được sử dụng sau ghép thận, tim và gan. Nó được tổng hợp như sau:







Artemisinin được phân lập từ cây Artemisia annua, một loại thảo dược được sử dụng trong y học cổ truyền Trung Quốc. Đây là loài cây đặc thù ở Trung Quốc và các nước Đông Nam Á, do vậy đã có nhiều nhà khoa học đã tiến hành tổng hợp hóa học Artemisinin để không bị phụ thuộc vào nguồn nguyên liệu.
a) Lần đầu tiên được tổng hợp bởi Schmid and Hofheinz đi từ (–)-Isopulegol
Xác định cấu trúc các hợp chất chưa biết trong sơ đồ này. Biết trong chuyển hóa của chất (1) thu được chất (2) và (3) trong đó (2) là sản phẩm phụ nhưng được tách ra để tham gia chuyển hóa tiếp tạo Mycophenolate sodium.
b) 1 phần dãy tổng hợp Artemisinin theo Ravindranathan và đồng nghiệp
