Efecto de las levaduras y sus derivados en las aves de corral

Propiedades prebióticas y probióticas
Un prebiótico es un nutriente no digestible que afecta beneficiosamente al hospedador estimulando selectivamente el crecimiento y/o la actividad de una o un número limitado de bacterias en el intestino y, por tanto, potenciando su salud (Roto et al., 2015).
El uso de antimicrobianos como promotores del crecimiento (APC) en el comercio de ganado se ha restringido en varias naciones, por lo que ha aumentado el interés por encontrar sustitutos como los prebióticos y otros suplementos.
En un estudio realizado para evaluar las estrategias nutricionales utilizando prebióticos a base de levadura de melaza de la pared celular de levadura Saccharomyces cerevisiae y levadura autolizada en sustitución de APC sobre el rendimiento de los pollos de engorde, y el contenido de fósforo y nitrógeno en la yacija después de 41 días se concluyó que los prebióticos a base de levadura son capaces de sustituir los APC sin afectar al rendimiento del crecimiento. Además, esta suplementación dio lugar a un mayor rendimiento de pechuga (Forniezer et al., 2017).
Un método importante para afrontar estos retos es utilizar probióticos como alternativa a los quimioterápicos y los fármacos, actuando individualmente o en combinación con microbios beneficiosos que influyen de numerosas maneras en el hospedador y su rendimiento:
Represión de hongos patógenos mediante la producción de metabolitos antagonistas, la competencia por los sitios de adhesión, la competencia por los nutrientes y la modificación de la actividad enzimática de las bacterias patógenas.
Inmunoestimulación y mejora de la resistencia natural a las enfermedades transmisibles en el tracto alimentario y prevención del cáncer.
Asistencia nutricional, como la mejora de la digestibilidad de alimentos y piensos mediante la producción de exoenzimas como fitasa, amilasa, lactasa, etc., aumentando así la tasa de crecimiento.
Aumento de la producción y la calidad de la leche y de la carne, y mejora de la producción de huevos.
(Vohra et al., 2016)
En los últimos 20 años ha aumentado la preocupación por la seguridad, la calidad y la excelencia de los productos animales, así como por las cuestiones ecológicas. En consecuencia, la intención de los aditivos para piensos es avanzar en la eficacia digestiva y de fabricación reduciendo la aparición de patógenos y disminuyendo el efecto del ganado en el medioambiente.
9
Para lograr estos objetivos, un probiótico debe:
Superar los obstáculos en el intestino (hábitat ácido y alto contenido biliar del tubo digestivo).
Ser capaz de adherirse y colonizar el tubo digestivo.
Multiplicarse al máximo y tener una supervivencia prolongada.
(Merchan et al., 2020)
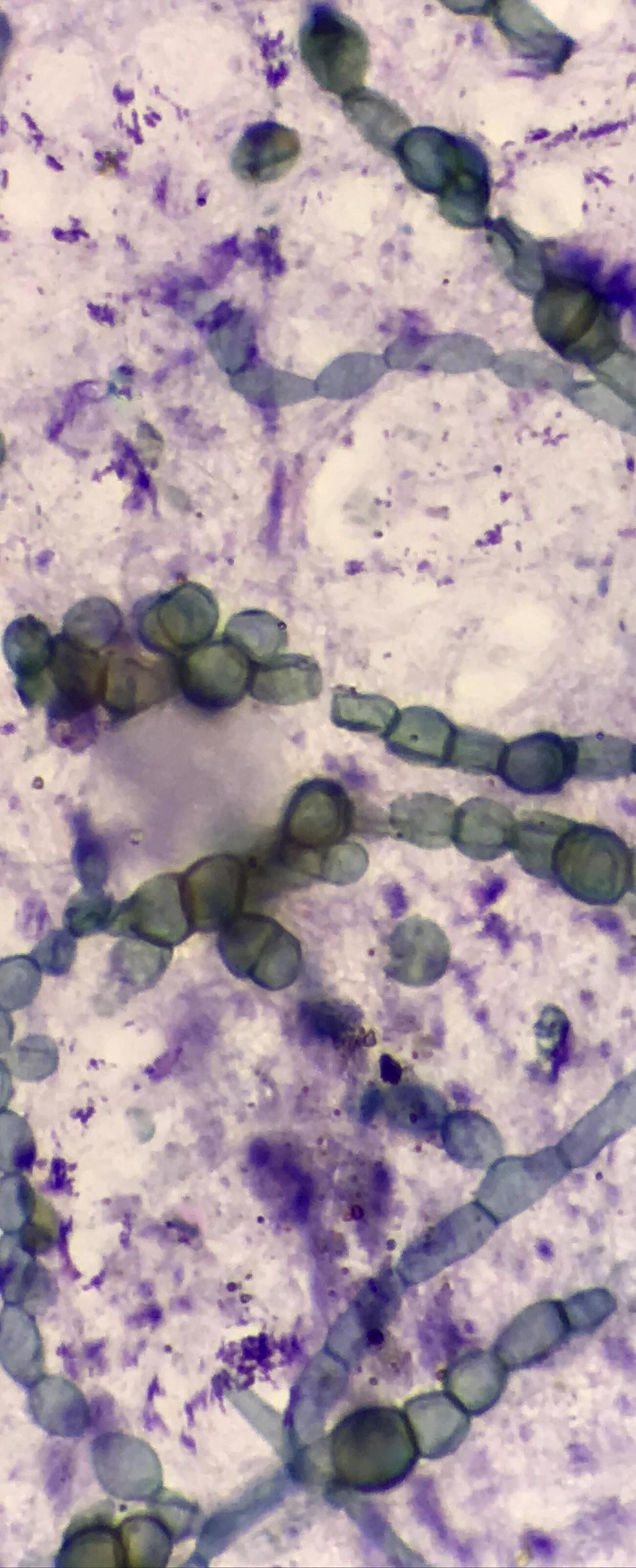
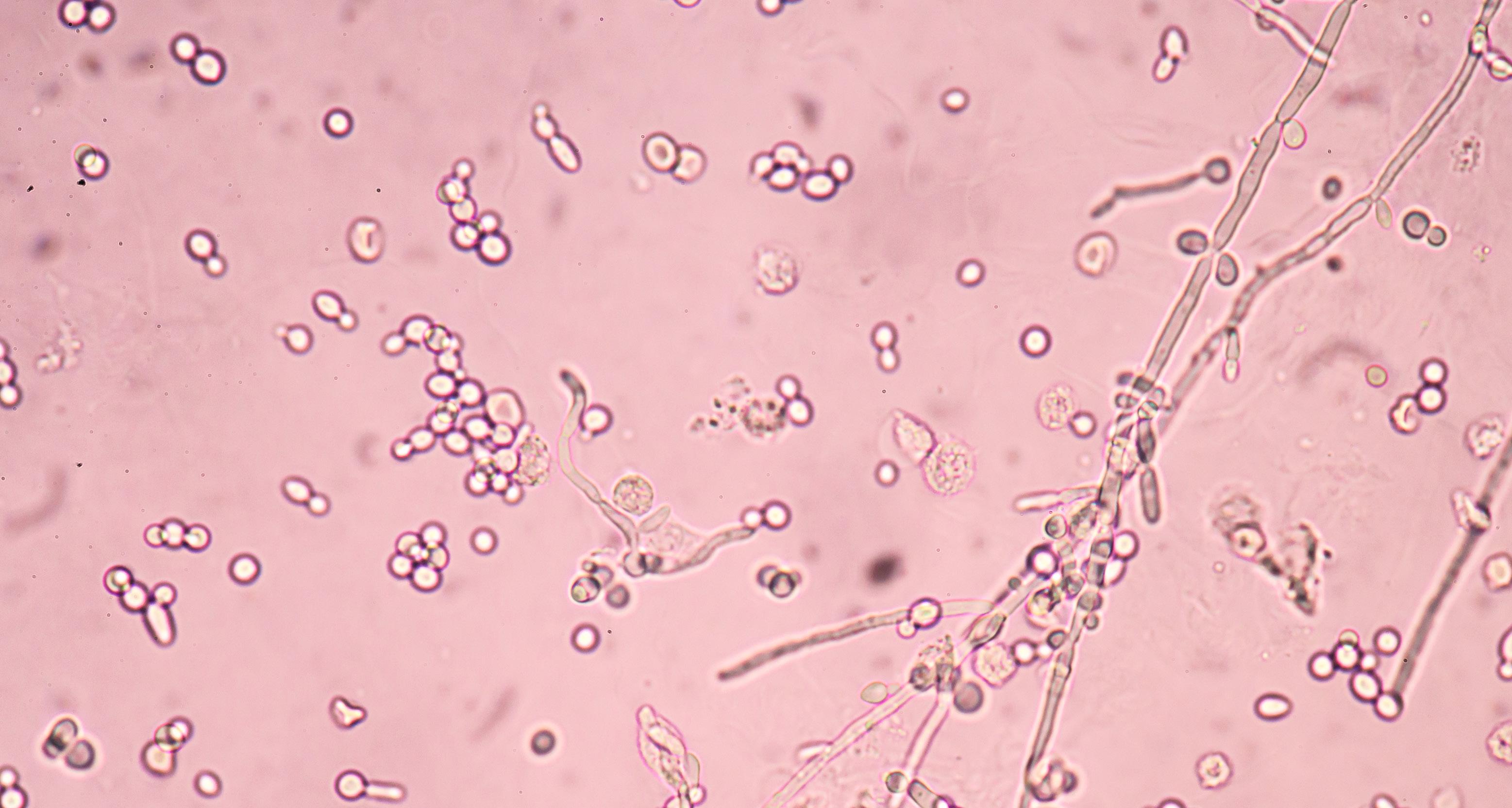
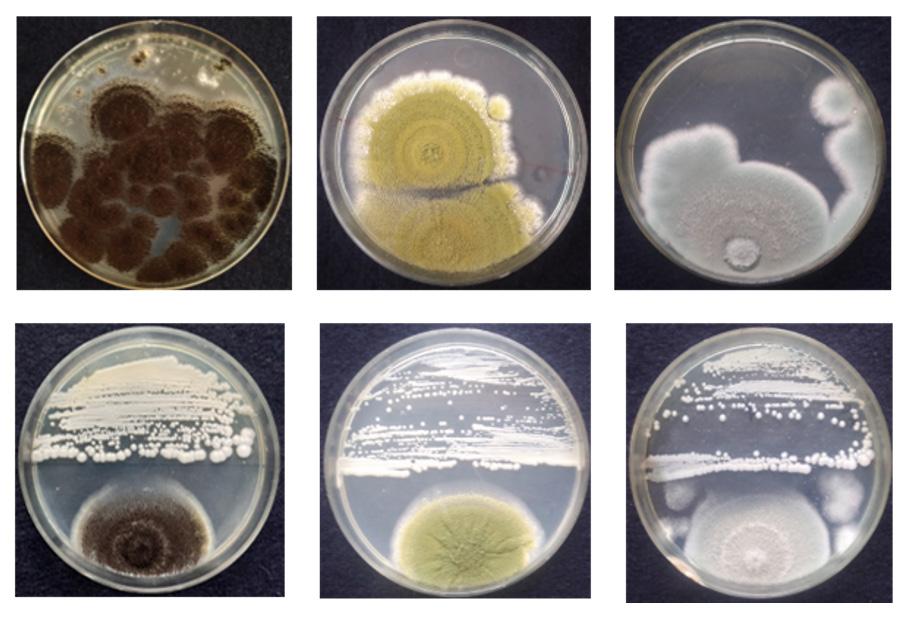
En la Tabla 1 se enumeran algunas de las levaduras probióticas aisladas de alimentos y productos fermentados (Figura 4)
Sl.no Aislado de levadura Fuente Referencia
1 Kluyveromyceslactis Lácteos Kumura et al., 2004
2 Kluyveromycesmarxianus Granos de kéfir Diosma et al., 2014
3 Saccharomycescerevisiae Granos de kéfir Diosma et al., 2014 Kluyveromyceslactis Granos de kéfir Gut et al., 2019
4 Saccharomycesunisporus Granos de kéfir Gut et al., 2019
5 Pichia kudriavzevii Chile guajillo fermentado Lara-Hidalgoetal.,2019
6 Saccharomycescerevisiae Matrices alimentarias Pennacchia et al., 2007
7 Kluyveromyceslactis Queso Zivkovicet al., 2015

8 Saccharomycescerevisiae Lácteos Zolfagharietal.,2020
9 Debaryomyceshansenii Pez cobia Reinoso et al., 2023

10
Tabla 1. Algunos de los probióticos de levadura de los que se tiene constancia a partir de diferentes fuentes.
Figura 4. Levaduras aisladas de varios alimentos/productos fermentados tradicionales como la pasta de mijo, la pasta de gramo verde, Neera, Toddy, Ragi ambli, vinos caseros, etc., y sus imágenes microscópicas.
Alternativas a los antibióticos
La necesidad de satisfacer la creciente demanda de los consumidores exige el uso de antibióticos preventivos para alcanzar la máxima producción.
Los antibióticos mejoran la seguridad alimentaria y el bienestar animal al combatir o erradicar patógenos. Sin embargo, debido a la preocupación por la resistencia a los antibióticos, es obligatorio limitar su uso en la producción de alimentos y animales. De ahí la necesidad de encontrar posibles alternativas a los antibióticos (Fathima et al., 2023).
El efecto de los productos derivados de la pared celular de la levadura, como los mananooligosacáridos (MOS), se ha evaluado en numerosos estudios in vivo para determinar sus efectos prebióticos en el rendimiento animal en presencia de infecciones víricas o bacterianas.
Las manoproteínas y sus regiones de carbohidratos ramificados son responsables del reconocimiento patógeno-hospedador y de la relación con el medio ambiente, y determinan la especificidad inmunológica de la levadura (Santovito, et al., 2018).
La búsqueda de fuentes alternativas de ingredientes locales para producir piensos de buena calidad en una investigación en curso en todo el mundo.
Varios estudios han demostrado los resultados de las células vivas de levadura y de los productos derivados de pared celular de levaduras (LEV) en la reducción de la incidencia de enfermedades infecciosas en animales de granja y en la mejora de su respuesta inmunitaria innata, lo que justifica su uso como método de sustitución activa.
En la actualidad, el interés de los investigadores y productores avícolas por identificar alternativas a los antibióticos adecuadas ha aumentado con la prohibición del uso de antibióticos en los piensos para pollos de engorde en algunas regiones del mundo y la creciente demanda de los consumidores de productos avícolas sin antibióticos.
Una de las alternativas propuestas son los productos derivados de las levaduras (Ahiwe et al., 2021).
Se ha confirmado que la suplementación dietética con LEV estimula la inmunidad innata sistémica de los pollos de engorde (Sadeghi et al., 2013), lo que sugiere el papel de la LEV en la regulación de la homeostasis inmunitaria (Alizadeh et al., 2016).
El efecto represivo de los productos de LEV contra la adhesión bacteriana infecciosa a la superficie mucosa del intestino se debe aparentemente a la capacidad de ciertas bacterias con fimbrias de unión a la manosa, como E. coli, Salmonella typhimurium y Salmonella typhi, de unirse a las manoproteínas dentro de las LEV (Tiago et al., 2012).
11
Propiedades inmunomoduladoras
Varios estudios han informado de que la respuesta inmunitaria de las aves de corral puede estimularse mediante la suplementación de derivados de levaduras.
Se evaluaron los efectos de la levadura entera Saccharomyces cerevisiae (HY), hidrolizada enzimáticamente, y de los pellets de pared celular de levadura (LEV) sobre los rasgos productivos.
También se examinaron las respuestas inmunitarias humorales frente al virus de la enfermedad de Newcastle, la histomorfología del intestino delgado y la microbiología de los pollos de engorde Ross 308, y los resultados mostraron que la LEV y la HY mejoraban el crecimiento y la eficacia alimentaria de los pollos de engorde. En vista de la mejora de los rasgos de producción y de las respuestas inmunitarias humorales, la LEV podría ser mejor que la HY como potenciador del rendimiento de los pollos de engorde (Muthuswamy et al., 2011).
Se realizó un estudio para evaluar el efecto del cultivo de levaduras (YC) como suplemento en dietas para pollos de engorde sobre el rendimiento, la digestibilidad, el desarrollo de la mucosa y las características inmunomoduladoras.
La levadura amplificó los niveles de anticuerpos contra el virus de la enfermedad de Newcastle, la actividad de la lisozima sérica y los niveles de IgM e IgA en el duodeno. Los resultados de esta investigación especifican que la YC como suplemento dietético a 2,5 g/kg mejoró el rendimiento del crecimiento (Gao et al., 2008)
12
Otro estudio evaluó las consecuencias de los componentes derivados de la levadura sobre los niveles séricos de anticuerpos, la expresión génica del ARNm de los receptores de reconocimiento de patrones, el rendimiento del crecimiento y las citocinas en los pollos de engorde.
En cuanto a la inmunidad humoral, el suplemento dietético de la LEV mejoró los niveles séricos de IgA en comparación con el grupo tratado con antibióticos. Además, el suplemento dietético de LEV mejoró la expresión de todas las citocinas y la expresión de IFN-γ aumentó en el grupo DDGS (suplementado con un 8% de granos secos de destilería con solubles) (Alizadeh et al., 2016

Propiedades antioxidantes
Las levaduras activas se utilizan ampliamente para mejorar la producción avícola y reducir los costes de alimentación.
Saccharomyces cerevesiae (SC) redujo significativamente la capacidad antioxidante total (TAC), la alanina aminotransferasa (ALT), el malondialdehído (MAD) y la aspartato aminotransferasa (AST) en comparación con el conjunto estándar, así como la mejora de la hemoglobina (Hgb), los glóbulos rojos (RBC), el volumen celular empaquetado (PCV), el índice fagocítico (PI), los heterófilos, los monocitos, los linfocitos y la inmunidad contra la gripe aviar y el virus de la enfermedad de Newcastle.
La suplementación con dietas normales o de baja densidad de SC (0,02% o 0,04%) mejoró las características antioxidantes, la inmunidad y el índice de producción de pollos de engorde sometidos a condiciones de estrés y agentes contagiosos (Attia et al., 2022
13
Otro estudio reveló que los subproductos del β-D-glucano provocaban la mejora del factor de necrosis tumoral α (TNF-α) liberado por los macrófagos murinos y un efecto sinérgico con la ciclofosfamida en el tratamiento del carcinoma pulmonar de Lewis y dos tipos de linfosarcoma en modelos murinos.

Los resultados muestran importantes actividades antioxidantes antigenotóxicas defensivas y antimutagénicas de los polisacáridos de levadura y sugieren su probable aplicación en la preclusión/ terapia antitumoral (Kogan et al., 2008).
Perspectivas de futuro
Hasta ahora, las evaluaciones de la aplicación máxima de adsorción de micotoxinas realizadas en la industria de la nutrición se han centrado principalmente en la aplicación de cepas probióticas naturales de Saccharomyces cerevisiae y BAL.
Cabe destacar que las estrategias de desarrollo de cepas adsorbentes de micotoxinas de alta eficacia y no contaminantes tienen amplias perspectivas de investigación.
La tecnología de manipulación genética es una de las posibilidades más prometedoras para mejorar la eficiencia de adsorción de micotoxinas después de la selección de cepas de adsorción eficaces, pero requiere la comprensión de los mecanismos moleculares a través de los cuales las levaduras actúan contra las micotoxinas (Walter et al., 2015).
Además de las técnicas de manipulación genética, los métodos de hibridación se consideran una estrategia potencialmente útil para mejorar numerosas características fisiológicas, ya que permite que las cepas revelen otras características fisiológicas que difieren de sus especies parentales (Luo et al., 2020).
14
Conclusiones
En la actualidad, las levaduras y sus componentes están despertando un enorme interés debido a su potencial como aditivos para piensos
Numerosas investigaciones y evaluaciones han demostrado que las levaduras y sus derivados pueden tener efectos beneficiosos sobre el crecimiento y el bienestar de los animales.
Las levaduras tienen características prometedoras como aditivo para piensos, erigiéndose como posible sustituto de los promotores de crecimiento antimicrobianos, los aglutinantes artificiales o químicos de micotoxinas, los conservantes químicos, etc. También sirven como prebióticos y probióticos que tienen efectos beneficiosos significativos en las aves de corral.
15
REFERENCIAS
Aazami, M. H., Nasri, M. H. F., Mojtahedi, M., & Mohammadi, S. R. (2018). In vitro aflatoxin B1 binding by the cell wall and (1→3)-β-D-glucan of Baker’s yeast. Journal of Food Protection, 81(4), 670–676. https://doi.org/10.4315/0362-028X.JFP-17-412
Adithi G, Rakesh Somashekaraiah, S. Divyashree, B. Shruthi, MY Sreenivasa* 2022. Assessment of probiotic and antifungal activity of Lactiplantibacillus plantarum MYSAGT3 isolated from locally available herbal juice against mycotoxigenic Aspergillus species. Food Bioscience. 102118. https://doi.org/10.1016/j.fbio.2022.102118
Ahiwe, E. U., Tedeschi Dos Santos, T. T., Graham, H., & Iji, P. A. (2021). Can probiotic or prebiotic yeast (Saccharomyces cerevisiae) serve as alternatives to in-feed antibiotics for healthy or disease-challenged broiler chickens?: a review. Journal of Applied Poultry Research, 30(3), 100164. https://doi.org/10.1016/j.japr.2021.100164
Attia, Y. A., Al-Khalaifah, H., Abd El-Hamid, H. S., Al-Harthi, M. A., Alyileili, S. R., & El-Shafey, A. A. (2022). Antioxidant Status, Blood Constituents and Immune Response of Broiler Chickens Fed Two Types of Diets with or without Different Concentrations of Active Yeast. Animals, 12(4). https://doi.org/10.3390/ani12040453
Chatterjee, R. N., & Rajkumar, U. (2015). an Overview of Poultry Production in India. Anim. Hlth, 54(2), 89–108
Choińska, R., Piasecka-Jóźwiak, K., Chabłowska, B., Dumka, J., & Łukaszewicz, A. (2020). Biocontrol ability and volatile organic compounds production as a putative mode of action of yeast strains isolated from organic grapes and rye grains. Antonie van Leeuwenhoek, International Journal of General and Molecular Microbiology, 113(8), 1135–1146.
Çelýk, K., Denlý, M., & Savas, T. (2003). Reduction of Toxic Effects of Aflatoxin B 1 by Using Baker Yeast ( Saccharomyces cerevisiae ) in Growing Broiler Chicks Diets Redução dos Efeitos Tóxicos da Aflatoxina B 1 , Utilizando-se Levedura de Panificação ( Saccharomyces cerevisiae ), na Dieta de. R. Bras. Zootec., 3(1979), 615–619.
Delali ,K.I., Chen ,O., Wang ,W., Yi ,L. , Deng ,L., &Zeng,K.(2021). Evaluation of yeast isolates from kimchi with antagonistic activity against green mold in citrus and elucidating the action mechanisms of three yeast: P. kudriavzevii, K. marxianus, and Y. lipolytica. Postharvest Biology and Technology. 176. https://doi.org/10.1016/j.postharvbio.2021.111495
Deepa ,N., Achar,P.,Sreenivasa,M,Y.,(2021)Current perspectives of biocontrol agents for managementof Fusarium verticilloides and its fumonisin in cereals-A review.Journal of fungi.7,776
Deepa ,N., Charith Raj, A, P., & Sreenivasa, M ,Y., ( 2016). Nested PCR method for the early detection of fumonisin producing Fusarium verticillioides in pure cultures, cereal samples and plant parts. Food Biotechnology. 30(1): 18-29
Deepa ,N,, Rakesh ,S., &Sreenivasa,m,Y,.(2018). Morphological, pathological and mycotoxicological variations among Fusarium verticillioides isolated from cereals. 3 Biotech 8:105 https://doi.org/10.1007/s13205-018-1136-z
Deepa ,N., Achar,P.,Sreenivasa,M,Y.,(2021)Current perspectives of biocontrol agents for managementof Fusarium verticilloides and its fumonisin in cereals-A review.Journal of fungi.7,776
Diosma, G., Romanin, D. E., Rey-Burusco, M. F., Londero, A., & Garrote, G. L. (2014). Yeasts from kefir grains: Isolation, identification, and probiotic characterization. World Journal of Microbiology and Biotechnology, 30(1), 43–53. https://doi.org/10.1007/s11274-013-1419-9
El-Naggar, M. A., & Thabit, T. M. (2014). Evaluation of β-d-Glucan biopolymer as a novel mycotoxin binder for fumonisin and deoxynivalenol in soybean feed. Foodborne Pathogens and Disease, 11(6), 433–438. https://doi.org/10.1089/fpd.2013.1711
Fathima, S., Shanmugasundaram, R., Sifri, M., & Selvaraj, R. (2023). Yeasts and yeast-based products in poultry nutrition. Journal of Applied Poultry Research, 32(2), 100345. https://doi.org/10.1016/j.japr.2023.100345
Faucet-Marquis, V., Joannis-Cassan, C., Hadjeba-Medjdoub, K., Ballet, N., & Pfohl-Leszkowicz, A. (2014). Development of an in vitro method for the prediction of mycotoxin binding on yeast-based products: Case of aflatoxin B1, zearalenone and ochratoxin A. Applied Microbiology and Biotechnology, 98(17), 7583–7596. https://doi.org/10.1007/s00253-014-5917-y
Fornazier,R., D. J. Rodrigues , V. Ribeiro J, L. F. T. Albino , F. C. Tavernari , H. S. Rostagno , D. Ladeira , & R. Hernandes(2017)Effects of yeast based prebiotics as replacers to antimicrobial growth promoters in broiles’ diets.ReuniãoAnual da Sociedade Brasileira de Zootecnia
Gao, J., Zhang, H. J., Yu, S. H., Wu, S. G., Yoon, I., Quigley, J., Gao, Y. P., & Qi, G. H. (2008). Effects of yeast culture in broiler diets on performance and immunomodulatory functions. Poultry Science, 87(7), 1377–1384. https://doi.org/10.3382/ps.2007-00418
Gut,A.K. , Vasiljevic,T. , Yeager,T. , & Donkor,O.N.,(2019). Characterization of yeasts isolated from traditional kefir grains for potential probiotic properties. Journal of Functional Foods, 58 , 56–66, https://doi.org/10.1016/j.jff.2019.04.046
16
Hooge, D. M. (2003). Dietary mannan oligosaccharide improves broiler performance. World Poultry, 19(4), 14–15.
Haque, M. A., Wang, Y., Shen, Z., Li, X., Saleemi, M. K., & He, C. (2020). Mycotoxin contamination and control strategy in human, domestic animal and poultry: A review. Microbial Pathogenesis, 142(February), 104095. https://doi.org/10.1016/j.micpath.2020.104095
Kogan, G., Pajtinka, M., Babincova, M., Miadokova, E., Rauko, P., Slamenova, D., & Korolenko, T. A. (2008). Yeast cell wall polysaccharides as antioxidants and antimutagens: Can they fight cancer? Neoplasma, 55(5), 387–393.
Kumura, H., Tanoue, Y., Tsukahara, M., Tanaka, T., & Shimazaki, K. (2004). Screening of dairy yeast strains for probiotic applications. Journal of Dairy Science, 87(12), 4050–4056. https://doi.org/10.3168/jds.S0022-0302(04)73546-8
Lara-Hidalgo, C. E., Dorantes-Álvarez, L., Hernández-Sánchez, H., Santoyo-Tepole, F., Martínez-Torres, A., Villa-Tanaca, L., & Hernández-Rodríguez, C. (2019). Isolation of Yeasts from Guajillo Pepper (Capsicum annuum L.) Fermentation and Study of Some Probiotic Characteristics. Probiotics and Antimicrobial Proteins, 11(3), 7464.
Luo, Y., Liu, X., Yuan, L., & Li, J. (2020). Complicated interactions between bio-adsorbents and mycotoxins during mycotoxin adsorption: Current research and future prospects. Trends in Food Science and Technology, 96(November 2019), 127–134. https://doi.org/10.1016/ j.tifs.2019.12.012
Magnoli, A. P., Poloni, V. L., & Cavaglieri, L. (2019). Impact of mycotoxin contamination in the animal feed industry. Current Opinion in Food Science, 29, 99–108 https://doi.org/10.1016/j.cofs.2019.08.009
Merchán, A. V., Benito, M. J., Galván, A. I., & Ruiz-Moyano Seco de Herrera, S. (2020). Identification and selection of yeast with functional properties for future application in soft paste cheese. LWT, 124. https://doi.org/10.1016/j.lwt.2020.109173
Muthusamy, K., Soundharrajan, I., Srisesharam, S., & Kim, D. (n.d.). applied sciences Probiotic Characteristics and Antifungal Activity of Lactobacillus plantarum and Its Impact on Fermentation of Italian Ryegrass at Low Moisture.
Sreenivasa,M,Y., M. T. Gonzalez – Jaen,M,T.,, Regina Sharmila Dass, A.P. Charith Raj, & G. R. Janardhana. (2008). PCR-based assay for the detection and differentiation of potential fumonisin producing F. verticillioides isolated from Indian maize kernels. Food Biotechnology, 22: 160-170.
Sreenivasa, M,Y., Regina Sharmila Dass, Charith Raj ,A,P.,& Janardhana,G,R.,. (2008). PCR-based detection of genus Fusarium and Fumonisin-producing isolates from freshly harvested Sorghum grains grown in Karnataka, India. Journal of Food Safety, 28: 236- 237
Nagaraja , H., Chennappa, G., Rakesh, S., Naik, M,K., Amaresh Y,S., and Sreenivasa, M. Y. , (2016). Antifusarial activity of Azotobacter nigricans against trichothecene-producing Fusarium species associated with cereals. Food Science and Biotechnology. 25(4): 1197- 1204. DOI 10.1007/s10068-016-0.
Oro, L., Feliziani, E., Ciani, M., Romanazzi, G., & Comitini, F. (2018). Volatile organic compounds from Wickerhamomyces anomalus, Metschnikowia pulcherrima and Saccharomyces cerevisiae inhibit growth of decay causing fungi and control postharvest diseases of strawberries. International Journal of Food Microbiology, 265, 18–22.
Parafati,L., Vitale,A., Restuccia,C., & Cirvilleri,G., (2016) Performance evaluation of volatile organic compounds by antagonistic yeasts immobilized on hydrogel spheres against gray, green and blue postharvest decays. Food Microbiology, doi: 10.1016/j.fm.2016.11.021
Pennacchia, C., Blaiotta, G., Pepe, O., & Villani, F. (2008). Isolation of Saccharomyces cerevisiae strains from different food matrices and their preliminary selection for a potential use as probiotics. Journal of Applied Microbiology, 105(6), 1919–1928. https://doi.org/10.1111/ j.1365-2672.2008.03968.x
Pfliegler, W. P., Pusztahelyi, T., & Pócsi, I. (2015). Mycotoxins - prevention and decontamination by yeasts. In Journal of Basic Microbiology (Vol. 55, Issue 7, pp. 805–818). Wiley-VCH Verlag. https://doi.org/10.1002/jobm.201400833
Ravindran.(2013). Poultry development review. Poultry genetics and breeding in developing countries
Reinoso, S.; Gutiérrez, M.S.; Domínguez-Borbor, C.; Argüello-Guevara, W.; Bohórquez-Cruz, M.; Sonnenholzner, S.; Nova-Baza, D.; Mardones, C.; Navarrete, P. (2023) Selection of Autochthonous Yeasts Isolated from the Intestinal Tracts of Cobia Fish (Rachycentron canadum) with Probiotic Potential. Journal of Fungi , 9, 274. https://doi.org/10.3390/jof9020274
17
Roto, S. M., Rubinelli, P. M., & Ricke, S. C. (2015). An introduction to the avian gut microbiota and the effects of yeast-based prebiotic-type compounds as potential feed additives. Frontiers in Veterinary Science, 2(SEP). https://doi.org/10.3389/fvets.2015.00028
Sadeghi, A. A., Mohammadi, A., Shawrang, P., & Aminafshar, M. (2013). Immune responses to dietary inclusion of prebiotic-based mannan-oligosaccharide and β-glucan in broiler chicks challenged with Salmonella enteritidis. Turkish Journal of Veterinary and Animal Sciences, 37(2), 206–213. https://doi.org/10.3906/vet-1203-9
Sampaio Baptista, A., Horii, J., Antonia Calori-Domingues, M., Micotti Da Glória, E., Mastrodi Salgado, J., & Roberto Vizioli, M. (2004). The capacity of manno-oligosaccharides,
Santovito, E., Greco, D., Logrieco, A. F., & Avantaggiato, G. (2018). Eubiotics for food security at farm level: Yeast cell wall products and their antimicrobial potential against pathogenic bacteria. Foodborne Patho
Sundu ,B., Hatta,U.& Chaudhry , A.S.,(2012). Potential use of beta mannan from copra mannan as afeed additives for broilers. World poultry science journal,68.
Sampaio Baptista, A., Horii, J., Antonia Calori-Domingues, M., Micotti Da Glória, E., Mastrodi Salgado, J., & Roberto Vizioli, M. (2004). The capacity of manno-oligosaccharides,
Shruthi, B. , N. Deepa , Rakesh Somashekaraiah , G. Adithi , S. Divyashree , M Y Sreenivasa. (2022) Exploring biotechnological and functional characteristics of probiotic yeasts: A review. Biotechnology Reports, 34. https://doi.org/10.1016/j.btre.2022.e00716
Shurson, G. C. (2018). Yeast and yeast derivatives in feed additives and ingredients: Sources, characteristics, animal responses, and quantification methods. Animal Feed Science and Technology, 235(November 2017), 60–76. https://doi.org/10.1016/j.anifeedsci.2017.11.010
Tiago, F. C. P., Martins, F. S., Souza, E. L. S., Pimenta, P. F. P., Araujo, H. R. C., Castro, I. M., Brandão, R. L., & Nicoli, J. R. (2012). Adhesion to the yeast cell surface as a mechanism for trapping pathogenic bacteria by Saccharomyces probiotics. Journal of Medical Microbiology, 61(PART 9), 1194–1207. https://doi.org/10.1099/jmm.0.042283-0
Vartiainen, S., Yiannikouris, A., Apajalahti, J., & Moran, C, A. (2020) Comprehensive Evaluation of the Efficiency of Yeast Cell Wall Extract to Adsorb Ochratoxin A and Mitigate Accumulation of the Toxin in Broiler Chickens. Toxins ,12(37), doi:10.3390/toxins12010037
Vohra, A., Syal, P., & Madan, A. (2016). Probiotic yeasts in livestock sector. Animal Feed Science and Technology, 219, 31–47. https://doi. org/10.1016/j.anifeedsci.2016.05.019
Walker et al., 1995)Walker, G. M., Mcleod, A. H., & Hodgson, V. J. (1995). Interactions between killer yeasts and pathogenic fungi. FEMS Microbiology Letters, 127(3), 213–222. https://doi.org/10.1016/0378-1097(95)00064-C
Zhang, H., Du, H., & Xu, Y. (2021). Volatile Organic Compound-Mediated Antifungal Activity of Pichia spp. and Its Effect on the Metabolic Profiles of Fermentation Communities. Applied and Environmental Microbiology, 87(9), 1–15. https://doi.org/10.1128/AEM.02992-20
Zhang, J., Xie, J., Zhou, Y., Deng, L., Yao, S., & Zeng, K. (2017). Inhibitory effect of Pichia membranaefaciens and Kloeckera apiculata against Monilinia fructicola and their biocontrol ability of brown rot in postharvest plum. Biological Control, 114, 51–58. https://doi.org/10.1016/j. biocontrol.2017.07.013
Zivkovic, M., Cadez, N., Uroic, K., Miljkovic, M., Tolinacki, M., Dousova, P., Kos, B., Suskovic, J., Raspor, P., Topisirovic, L., & Golic, N. (2015). Evaluation of probiotic potential of yeasts isolated from traditional cheeses manufactured in Serbia and Croatia. Journal of Intercultural Ethnopharmacology, 4(1), 12. https://doi.org/10.5455/jice.20141128051842
Zolfaghari,H. , Khezerlou,A., Ehsani,A., & Khosroushahi.A.Y.,(2020). Detoxification of Aflatoxin B1 by Probiotic Yeasts and Bacteria Isolated From Dairy Products of Iran Advance Pharmaceutical Bulletin,, 10(3), 482-487 ,doi: 10.34172/apb.2020.060
18