Monográfico
Salud

Monográfico
Salud
Con la colaboración
Universidad CEU Cardenal Herrera, Valencia
Universidad Politécnica de Madrid, Madrid
Universidad de Zaragoza - CITA, Zaragoza
IRTA, Centre de Recerca en Sanitat Animal (CReSA), Barcelona
Universidade de Santiago de Compostela, Lugo
IRTA, Mas de Bover, Tarragona
Estación Experimental del Zaidín (CSIC), Granada
Universidad de Murcia, Murcia
Con la participación
ADISSEO - INDUKERN
APC
BIOMIN - QUALIVET
DIAMOND V - QUALIVET
DELACON - BARENTZ Campi y Jové
DSM
HUVEPHARMA
ITPSA
FERRER Health Tech
LIPTOSA
PERSTORP
TROUW NUTRITION España
Una buena salud gastrointestinal es imprescindible para conseguir la excelencia en la producción animal porque un sistema digestivo sano conlleva una mayor y mejor digestibilidad de los nutrientes.
La nutrición a su vez ha representado siempre un factor clave para alcanzar eficiencia y rentabilidad productiva porque un buen uso de los ingredientes nutricionales permite alcanzar nuestro objetivo: maximizar el rendimiento de nuestros animales sanos.
De este modo, salud gastrointestinal y nutrición van siempre de la mano aunque actualmente, frente al reto de la obligada disminución del uso de antibióticos, la nutrición toma aún más protagonismo, siendo uno de los vectores que gestionado adecuadamente nos asegura la optimización de los resultados zootécnicos al mejorar la salud gastrointestinal de los animales de producción.
No debemos olvidar que, tanto en monogástricos como mucho más en rumiantes, las características de la dieta, su presentación física, su tratamiento en la planta de producción o sus posibles contaminaciones afectarán de un modo evidente no sólo a las condiciones del intestino de los animales, sino también a la población bacteriana, en términos de cantidad y perfil.
Este condicionante de relación entre dieta y población bacteriana es aún más importante en una situación de no uso de sustancias antibióticas.
Esta situación, ya experimentada desde la prohibición de los APCs, se complica mucho más con la progresiva restricción del uso de medicamentos en pienso o agua. No debemos perder de vista, por lo tanto, el impacto que nuestro alimento tendrá en las características de esta población bacteriana.
Para complicar aún más este tema, todos hablamos de población bacteriana, como si fuese fácil de comprender, cuando la realidad es que nuestro conocimiento de sus características, o incluso de sus componentes es, cuanto menos, limitado.
Por ello, la mejora del conocimiento de esta población, y el impacto que podemos tener sobre ella con las dietas será, posiblemente, uno de los factores de análisis y estudio más importante en los próximos años.
Este libro pretende reflejar los aspectos más remarcables sobre este amplísimo tema, por lo que hemos establecido 4 capítulos – fisiología gastrointestinal , etiología de las disbiosis y enfermedades ruminales, factores nutricionales que influyen la microbiota y estrategias para mejorar la salud gastrointestinal – dividiéndolos además, cada uno, en secciones dedicadas a monogástricos –porcino y avicultura – y rumiantes.
Todo el equipo técnico de nutriNews, espera que sus contenidos sean de su agrado.
EDITOR
AGRINEWS S.L.


Barcelona España,
Todos los derechos reservados ©, 2016
Fisiología del aparato digestivo de las aves
Carlos Garcés Narro y María Dolores Soler Sanchis
Dpto. de Producción y Sanidad Animal, Salud Pública Veterinaria y Ciencia y Tecnología de los Alimentos, Facultad de Veterinaria. Universidad CEU Cardenal Herrera Alfara del Patriarca, Valencia


Fisiología del sistema gastrointestinal en rumiantes
María Dolores Carro Travieso
Dpto. Producción Agraria, Universidad Politécnica, Madrid
Población microbiana del tracto gastrointestinal en porcino
Manuel Fondevila
Dpto. Producción Animal y Ciencia de los Alimentos, Instituto Agroalimentario de Aragón, Universidad de Zaragoza- CITA, Zaragoza



Salud intestinal y desajustes microbianos intestinales
Ignacio Badiola, Ana Pérez de Rozas, Verónica Martínez, Nuria Aloy, Judith González IRTA, Centre de Recerca en Sanitat Animal (CReSA), Campus de la Universitat Autònoma de Barcelona, Bellaterra
Etiología de trastornos ruminales
Cristina Castillo y Joaquín Hernández Departamento de Patoloxia Animal Universidade de Santiago de Compostela, Lugo
68...73
Factores nutricionales que influyen en la microbiota de las aves
Joaquim Brufau y Joan Tarradas IRTA, Mas de Bover, Tarragona
82...87
74...81
Factores nutricionales que influyen en la microbiota en rumiantes


David R. Yáñez-Ruiz y Alejandro Belanche Estación Experimental del Zaidin (CSIC), Granada
Factores nutricionales y microbiota en porcino
Guillermo Ramis Vidal y Silvia Martínez Miró Dpto Producción Animal, Facultad de Veterinaria, Murcia

90...97
La importancia de la salud intestinal en la producción libre de antibióticos
Chasity M. Pender1, Karin Naehrer2, Christine Hunger2, Wael Abdelrahman2, Ganapathi Raj Murugesan1
1BIOMIN America Inc., San Antonio, TX, USA
2BIOMIN Holding GmbH, Getzersdorf, Austria
98...105
Cómo estimular la resiliencia intestinal en la producción avícola

José Mª Ros
Business Development Manager Gut Health
Perstorp Feed & Food
106...113
El tratamiento enzimático del trigo favorece la producción de ácidos grasos de cadena corta en la microbiota cecal
Nadia Yacoubi a,b, Filip Van Immerseel b, Richard Ducatelle b, Estelle Devillard c Lamya Rhayat c, Estelle Nonnin y Luc Saulnier a a INRA, UR1268 Biopolymers Interactions Assemblies, BP 71627, F-44316 Nantes, France
b Department of Pathology, Bacteriology and Avian Diseases, Faculty of Veterinary Medicine, Ghent University, Salisburylaan 133, B-9820 Merelbeke, Belgium
c Adisseo France SAS, Centre of Expertise and Research in Nutrition, F-03600 Commentry, France
114...121
Salud intestinal y coccidiosis
¿cómo diagnosticar y controlar la enfermedad?
Equipo técnico de Huvepharma NV
122...131
La inflamación estéril en aves Implicaciones para los Complejos de Zinc
Paco Fernández López-Brea, DVM Responsable de Negocio Avícola en Zinpro para Europa y Sudáfrica
134...145
pH ruminal, acidosis y mecanismos de control
Pedro Sayalero
Responsable del Dpto. de Rumiantes Director Comercial de Trouw Nutrition
Rumiantes
146...157
Mejora de la fermentación ruminal y su efecto beneficioso sobre la metanogénesis
J.Crespo1 , M. Paniagua2
1Interquim, S.A. (Ferrer HealthTech)
2Quimidroga, S.A.
158...167
Mantenimiento de la salud ruminal y la grasa en la leche durante el estrés por calor
Ilkyu Yoon, Ph.D.
Director, Ruminant Research & Technical Support Diamond V
170...177
Mejorando la salud intestinal en porcino a través de la alimentación de la microbiota
Arie K. Kies1,2, Myrthe S. Gilbert2, y René Bonekamp1
1DSM Nutritional Products, Animal Nutrition and Health, Wageningen, the Netherlands
2Wageningen University and Research, Animal Nutrition Group, Wageningen, the Netherlands

178...185
Impacto de los antibióticos sobre la microbiota intestinal y alternativas nutracéuticas a su uso

Javier Estévez & Sergi Carné
Departamento Técnico e Innovación
Industrial Técnica Pecuaria, S.A. (ITPSA)
186...193
Nuevas aplicaciones de fitobióticos y nutracéuticos a la salud intestinal
López, I*1; Sujka, E1; López, C1; Nieto, R1 1 Lipidos Toledo S.A. (LIPTOSA)
194...201
Mejora de la salud y la integridad del tracto gastrointestinal con el uso de nuevos promotores de crecimiento
Richard Markus y Franz Waxenecker Departamento de Investigación y Desarrollo de BIOMIN
202...209
Efectos del estrés oxidativo y los procesos inflamatorios en lechones post-destete en la salud intestinal
Potencial de los fitógenos para mitigar estos efectos
Ester Vinyeta
Species Leader Swine Delacon Biotechnik GmbH, Steyregg, Austria
210...217
Optimizar el crecimiento del cerdo protegiendo la función de la mucosa intestinal en la fase post-destete
Javier Polo, Carmen Rodríguez, Luis da Veiga y Victor Deike APC Europe, S.A.


Carlos Garcés Narro y María Dolores Soler Sanchis Departamento de Producción y Sanidad Animal, Salud Pública Veterinaria y Ciencia y Tecnología de los Alimentos. Facultad de Veterinaria Universidad CEU Cardenal Herrera
Alfara del Patriarca (Valencia)
Elaparato digestivo de las aves es bastante simple, pero a la vez, muy eficiente en comparación con otras especies de interés ganadero.
La evolución fue cambiando las preferencias alimentarias, la morfología del tracto gastrointestinal y el metabolismo de las aves a la vez que estas fueron adquiriendo su capacidad para volar.
Las características de la estructura y la función de su aparato digestivo han obligado a las aves a consumir una dieta concentrada en nutrientes y de fácil digestión.
La fisiología del aparato digestivo está estrechamente vinculada con el metabolismo de los diferentes componentes de la dieta (carbohidratos, grasas, proteínas, etc.) y su óptimo funcionamiento es la clave para la obtención de las cantidades necesarias de nutrientes para el crecimiento o la puesta.

La correcta actividad del tracto digestivo puede verse afectada por factores tales como: la composición de la dieta, los sistemas de alimentación (ad libitum, alimentación intermitente) los cambios dietéticos (incorporación de enzimas exógenas, la adición de pre o probióticos, etc.).

Cabe destacar la importancia de algunos parámetros físicoquímicos implicados en el funcionamiento y la actividad microbiana del tracto gastrointestinal y su íntima relación con la alimentación.
Así, se observa que el tiempo de retención, el contenido de humedad y el pH están determinados, en gran medida, por los sistemas de alimentación y por el acceso a componentes estructurales (cereales enteros, fibras groseras, etc.).
A su vez, la digestión y la absorción de nutrientes en el intestino se ven afectadas por las condiciones fisicoquímicas, determinadas a su vez por varios factores como la viscosidad, el pH y la osmolaridad del quimo.
Anatómicamente, el tracto digestivo es un conjunto de órganos en forma de tubo alargado que comienza en el pico y termina en la cloaca (Figura 1)
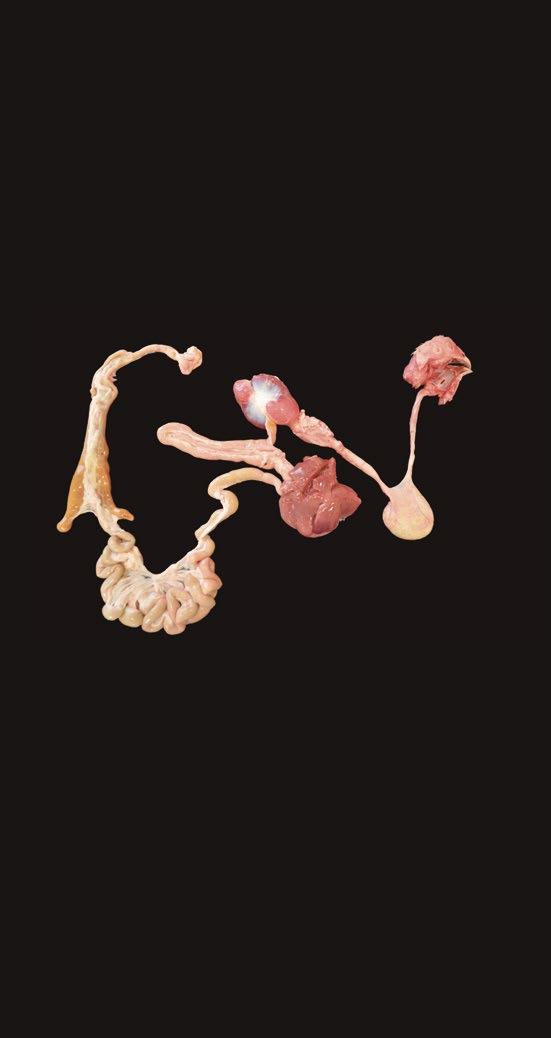
En íntima unión con él se encuentran glándulas como el hígado y el páncreas que intervienen en el metabolismo de los nutrientes produciendo jugos digestivos (bilis) y enzimas endógenas que se vierten en el canal digestivo y que tienen un papel fundamental en la digestión.
Tras la digestión, los nutrientes de los alimentos, se absorben a través de la pared del tubo digestivo y entran en el sistema circulatorio para su transporte al hígado u otras partes del organismo, mientras los productos de desecho y las partículas no digeridas se eliminan del cuerpo a través de la cloaca.
Intestino grueso Duodeno Páncreas Ciegos Mesenterio Ileon Yeyuno Hígado Buche Esófago Boca Moleja Proventrículo CloacaEl alimento se ingiere, hidrata y es desmenuzado en partículas más pequeñas, que son acidificadas y sufren la acción de las enzimas endógenas.
Los macronutrientes se descomponen en monosacáridos, dipéptidos y aminoácidos, ácidos grasos libres y monoglicéridos, que pueden ser absorbidos.
Sin embargo, en estas aves existen peculiaridades específicas, que incluyen un buche para el almacenamiento del alimento, un proventrículo (estómago glandular), una molleja (estómago mecánico), un par de ciegos y unos importantes movimientos de flujo y reflujo de la digesta.
La digesta se desplaza a lo largo del tracto digestivo mediante movimientos peristálticos y antiperistálticos.
Los movimientos peristálticos discurren a lo largo del tubo digestivo, constituyendo el sistema de propulsión que permite el avance de la digesta.
Los movimientos antiperistálticos ocurren en el sentido contrario, lo que provoca un retroceso de la digesta.
El proceso de reflujo juega en las aves un papel clave en la digestión, ya que está continuamente cambiando las características físicas y químicas de la digesta.
La ingestión en las aves está regulada por un complejo sistema en el que se ven implicados nutrientes, hormonas y neuropéptidos producidos por el sistema nervioso (central y periférico) que responden a cambios nutricionales y ambientales.

Asimismo, la palatabilidad del alimento podría jugar un importante papel en la ingestión de alimentos, pues se ha comprobado que, a pesar de la creencia de que las aves no son capaces de reconocer sabores, en realidad sí. Tienen receptores para los sabores amargo, ácido o umami y presentan mayor apetencia por unos más que por otros.
El control termostático de la ingestión también existe en estos animales, aunque no parece que sea uno de los reguladores primarios de la ingestión.
La secreción de saliva en la boca es escasa y la deglución de los alimentos se produce prácticamente en seco o con la ayuda de agua de bebida. La deglución se lleva a cabo mediante la lengua, que se adapta a la forma del pico.
El esófago es amplio y es capaz de distenderse de manera significativa. La secreción de moco por medio de las glándulas mucosas en el esófago ayuda a la lubricación de la superficie del epitelio y, por lo tanto, al tránsito de la ingesta.
El buche es una gran dilatación del esófago que actúa como un reservorio, proporcionando una capacidad de almacenamiento transitorio de los alimentos ingeridos. Su estructura es similar a la del esófago excepto que no presenta glándulas mucosas.
La capacidad de almacenamiento del buche puede variar dependiendo del sistema de alimentación.
Se puede observar un importante incremento del contenido del buche después del ayuno nocturno y antes de un periodo de oscuridad.
Cuando se lleva a cabo una alimentación intermitente o un cambio en el tipo de alimento también se produce un importante incremento transitorio de almacenaje del pienso en el buche.

No se cree que el buche tenga ningún papel nutricional directo, ya que no segrega enzimas y no se ha referenciado una absorción considerable. Sin embargo, en esta cavidad se produce un importante proceso de hidratación que puede ayudar al posterior proceso de molienda y digestión enzimática que se realiza en los siguientes tramos del tracto digestivo.
En cuanto al pH del buche, se han observado grandes variaciones en el mismo.
El proventrículo y la molleja se consideran los compartimentos estomacales verdaderos de las aves, analizándose en su conjunto en lo que respecta a la función digestiva.
En el proventrículo se secreta ácido clorhídrico (jugo gástrico) y pepsinógeno, que con el pH ácido se convierte en pepsina. Estas sustancias irán mezclándose con el contenido digestivo gracias a los movimientos musculares en la molleja.

El pH ácido desnaturaliza las proteínas alimentarias, permitiendo que la pepsina hidrolice parte de los enlaces peptídicos
La pepsina actúa a pH bajos (entre 2,5 y 4,8) inactivándose irreversiblemente a pH altos (a partir de 6)
La pepsina en aves tiene mayor actividad y estabilidad que en mamíferos
En la molleja se produce la contracción alterna de sus dos pares de músculos, con lo que las partículas de alimento se van desmenuzando gracias a la presión y al rozamiento con la mucosa endurecida de la molleja y las partículas ingeridas por el ave.
Con las contracciones de la molleja, parte del material gástrico es empujado hacia el duodeno y parte lo es hacia el proventrículo.
A medida que los músculos comienzan a relajarse, el proventrículo se contrae y retorna contenido a la molleja. Este ciclo de contracción y relajación tiene lugar hasta 4 veces por minuto.
Se ha estimado que el tiempo medio de retención del alimento en el proventrículo y la molleja varía entre media hora y dos horas.
Hay evidencias que sugieren que las partículas de pienso solo avanzarán hacia el intestino cuando sean lo suficientemente pequeñas como para dejar la molleja.
Cuando se añaden partículas groseras, se produce un aumento del volumen de la molleja y disminuye el pH de su contenido, facilitando un mayor grado de digestión antes de exponerse a la posterior degradación enzimática y a la superficie de absorción del intestino, lo que sugiere que los granos más gruesos son digeridos más completamente que los granos molidos.
El intestino delgado se divide anatómicamente en tres segmentos, el duodeno, el yeyuno y el íleon.
Tiene una serie de funciones de gran importancia puesto que en él se segregan enzimas digestivas, siendo este el lugar de la mayor parte de la digestión y la absorción de los alimentos.
En el extremo caudal del duodeno se encuentra la entrada de los conductos biliares y pancreáticos.
Como la llegada de los jugos pancreático y biliar se produce al final del duodeno, en toda la longitud de este se sigue produciendo parte de la digestión ácida que se inició en el proventrículo. No obstante, el pH de este tramo es superior al de la molleja, debido a los movimientos antiperistálticos que provocan el reflujo del quimo del yeyuno hacia el duodeno y que puede llegar incluso hasta el proventrículo.
El pH más elevado del yeyuno y el íleon permite que las enzimas secretadas por el páncreas se activen y puedan actuar en condiciones óptimas

El páncreas secreta enzimas principalmente implicadas en la digestión de:
Proteínas (tripsina, quimotripsina y carboxipeptidasa)
Grasas (lipasa pancreática)
Almidón (amilasa pancreática)
Ácidos nucleicos (nucleasas)
De hecho, aunque el pH óptimo de acción de las enzimas pancreáticas se encuentra en un entorno ligeramente alcalino, estas no se desnaturalizan en las condiciones ambientales ácidas de la molleja y el proventrículo cuando llegan a estos compartimentos fruto de los movimientos antiperistálticos y retoman su actividad catalítica al volver a su pH de acción.
Entre las enzimas pancreáticas, la tripsina:
Actúa sobre los enlaces peptídicos en que intervienen los grupos carboxilo de la lisina y la arginina.
Activa otra enzima pancreática, la quimotripsina, que tiene una actividad específica sobre los enlaces peptídicos de los aminoácidos aromáticos.
Activa la carboxipeptidasa, que ataca el final de la cadena peptídica de las proteínas, separando el aminoácido final.
La hidrólisis última de algunos péptidos no desdoblados se produce en el borde en cepillo de los enterocitos, gracias a la acción de peptidasas secretadas por el epitelio entérico.
La digestión de las grasas es llevada a cabo por la lipasa pancreática, que hidroliza los triglicéridos a monoglicéridos y ácidos grasos libres.
Otras lipasas, tales como las fosfolipasas hidrolizan los fosfolípidos a ácidos grasos libres y otros residuos lipofílicos.
Para que las lipasas sean efectivas, es necesaria la emulsión de los lípidos en forma de micelas, lo que sucede gracias a las sales biliares secretadas por el hígado.
La efectividad de la digestión de las grasas es mayor con los triglicéridos formados por ácidos grasos insaturados que con que los contienen saturados y también es mayor con los que contienen ácidos grasos de cadena corta que con los de cadena larga.
Otra enzima pancreática muy relevante en la digestión es la amilasa pancreática, que actúa atacando los enlaces α−1,4 de la amilosa y la amilopectina, las estructuras habituales del almidón, así como los enlaces α−1,4 de los polisacáridos derivados de la hidrólisis primaria de estas.
Como productos de la hidrólisis de la amilosa aparecen moléculas de maltosa y maltotriosa.
Sin embargo, la amilopectina, además de los enlaces α-1,4 posee enlaces α−1,6, que no pueden ser atacados por la amilasa pancreática, dando como resultado una serie de oligosacáridos ramificados y no ramificados.

La hidrólisis de las moléculas más simples, tales como la maltosa, sacarosa y los oligosacáridos con enlaces α-1,6 se lleva a cabo mediante las enzimas específicas en el borde en cepillo de los enterocitos.
Las células caliciformes de la mucosa intestinal secretan mucinas que se transforman en moco y que protegen el resto de las células entéricas.
Otros polisacáridos no amiláceos (arabinoxilanos, β-glucanos,…) no pueden ser hidrolizados por la amilasa ni las otras enzimas digestivas, incrementando la viscosidad de la digesta.

Un aumento en la viscosidad de la digesta puede :
Entorpecer la mezcla de nutrientes con las enzimas pancreáticas y las sales biliares en el intestino, así como el movimiento de nutrientes desde el lumen hasta la superficie de la mucosa, limitando la digestión y la absorción de los mismos.
Reducir la velocidad de mezcla y de tránsito, lo que puede disminuir la oxigenación luminal y, por lo tanto, permitir la proliferación microbiana.
Las células caliciformes son responsables de la lubricación del epitelio y de la difusión de las enzimas de las microvellosidades (borde en cepillo de los enterocitos) y son importantes en el mantenimiento de la integridad y la salud intestinal.
La absorción de nutrientes está condicionada por la altura e integridad de las vellosidades intestinales.
En el yeyuno y en el íleon las vellosidades tienen longitudes y anchuras diferentes.
La absorción de nutrientes está limitada principalmente por la facilidad con que las moléculas de digesta se acercan a los enterocitos.
Factores como las infecciones intestinales o algunos componentes de la dieta - como pectinas - pueden producir un aumento en la secreción de mucina que dificultará la absorción de nutrientes.
En el íleon comienza la absorción de agua y de minerales, que continúa durante el recorrido de la digesta por el intestino grueso, de manera que al llegar a la cloaca, las heces han disminuido de forma notable su contenido en humedad. Una alteración de la absorción de agua en estos segmentos del intestino provocará la excreción de heces excesivamente acuosas.
Mención especial merecen los ciegos, que se abren en la zona de transición del intestino delgado al grueso.
A los ciegos llega una parte de la digesta gracias a los movimientos antiperistálticos procedentes de la cloaca.
En estos se produce también la absorción de parte del agua de la digesta. Pero sobre todo, los ciegos son interesantes porque en ellos se realiza la fermentación de las partículas groseras que todavía no se han degradado en el tránsito intestinal.
Esta fermentación se produce por algunas poblaciones bacterianas y gracias a ellas, el animal obtendrá ácidos grasos de cadena corta y algunas vitaminas del complejo B.
La absorción de los productos de la fermentación se produce en los mismos ciegos o en el colon, aunque como el tiempo de permanencia de la digesta cecal es breve y el colon es muy corto, el aprovechamiento de la fermentación no es tan relevante como en las especies de herbívoros.
Los ciegos vacían su contenido dos o tres veces al día, produciendo heces blandas. La cantidad de descargas cecales y su aspecto (color y textura) indicarán si la digestión se está produciendo de forma normal o por el contrario, hay alguna alteración.

Las partes que componen el aparato digestivo de los rumiantes, clasificadas por Hofmann (1993) según su funcionalidad son:
a b c d
Porción cefálica con las glándulas anejas
Porción anterior - esófago y estómago
Porción media - intestino delgado y glándulas anejas
Porción posterior - intestino grueso y ano.
Los Consumidores de Gramíneas y Forrajes -CGF- están adaptados al consumo de forrajes, tienen un gran desarrollo del rumen, mayor tiempo de retención de la digesta y mayor actividad celulolítica

La estructura de algunas de estas partes varía según los hábitos de alimentación del rumiante considerado y se pueden diferenciar tres grandes grupos (Hofmann, 1989):
Los selectores de concentrado o ramoneadores (SC: ciervo mular, alce americano, corzo)
Los consumidores de gramíneas y forraje (CGF: vaca, oveja, muflón)
Los tipos intermedios (IN: cabra, ciervo común, bisonte).
Los Selectores de Concentrado -SC- son capaces de seleccionar dietas con bajo contenido en fibra y rápido ritmo de fermentación (p.e. hojas, frutos)
LA LENGUA
La porción cefálica y sus glándulas anejas de los rumiantes difieren considerablemente de la de otros mamíferos, ya que sus órganos prensileslabios, lengua, incisivos inferiores y lámina dental - están adaptados al tipo de dieta que consumen.

La lengua ocupa la mayor parte de la cavidad oral y su parte superior está cubierta de papilas cornificadas que facilitan la captación del pasto y los forrajes.
La lengua presenta características diferentes según el tipo de rumiante, ya que es carnosa y con forma de émbolo en los CGF y más fina y puntiaguda en los SC.
Todos los rumiantes carecen de incisivos superiores y solamente algunas especies de cérvidos poseen caninos superiores (Hofmann, 1993).
La función de estos dientes se realiza por una lámina dental formada por tejido conjuntivo fibroso cubierto por un epitelio cornificado.
La masticación reduce el tamaño de partícula de los alimentos, facilitando la acción de los microorganismos ruminales
Los rumiantes CGF ingieren alimento durante períodos prolongados, en los que mastican de forma breve, y posteriormente dedican largos períodos de tiempo a la rumia
Las especies SC ingieren menores cantidades de alimento, pero con mayor frecuencia, y realizan una masticación inicial intensa, seguida de períodos de rumia alternados con cortos períodos de ingestión
Como describió Kay en 1966, los rumiantes poseen varias glándulas salivares:
Parótidas que proporcionan más cantidad de saliva (40-50% del total)
Bucales
Mandibulares
Sublinguales
Cumple diferentes funciones:
Facilita la masticación y deglución
Ejerce una importante actividad tampón que contribuye a mantener el pH ruminal, aporta elementos necesarios para el crecimiento de los microorganismos ruminales (P, Mg, Cl, mucoproteínas, urea reciclada)
Tiene propiedades antiespumantes
La saliva de los rumiantes no contiene amilasa, pero contiene una lipasa salival que puede hidrolizar ácidos grasos de cadena corta, aunque parece que esta actividad es más relevante en los animales lactantes
(Church, 1993)
ESÓFAGO
El esófago es el tubo que conecta la faringe con el retículo-rumen y en los rumiantes está adaptado para permitir el tránsito del alimento en ambas direcciones.

El esófago posee dos esfínteres (craneal y caudal), cuya contracción y relajación facilitan los procesos de la rumia y el eructo.
RUMEN
El rumen es el compartimento de mayor capacidad en los animales adultos y su interior está recubierto por papilas rugosas a través de las cuales se realiza la absorción de algunos de los compuestos finales de la fermentación.
El rumen está habitado por una variada población microbiana, formada principalmente por bacterias, protozoos, hongos y arqueas metanogénicas, que vive en simbiosis con el animal hospedador.
Las bacterias constituyen la población microbiana ruminal más amplia (1010-1011/g).
Clasificación bacterias ruminales en función de:
El tipo de sustrato que fermentan y sus principales productos de fermentación, aunque la mayoría de las bacterias son capaces de fermentar varios sustratos.
El animal proporciona a los microorganismos un medio ambiente (temperatura, pH, anaerobiosis, nutrientes, etc.) adecuado para su mantenimiento y desarrollo, mientras que los microorganismos realizan la degradación y fermentación de los componentes fibrosos de los alimentos, sintetizan proteína microbiana de alta calidad y vitaminas del grupo B y pueden detoxificar algunos compuestos tóxicos de los alimentos.
Su nicho dentro del rumen, según estén asociadas a la fase líquida, a la fase sólida, al epitelio ruminal o a los protozoos y esporangios fúngicos (Zhou et al., 2015).
El grupo más abundante es el de las bacterias asociadas a la fase sólida. En animales alimentados con forrajes puede suponer hasta el 75-80% del total de las bacterias.
La amplia mayoría de las bacterias ruminales no han podido ser cultivadas, pero la aplicación de técnicas moleculares al estudio del ecosistema ruminal está proporcionando en los últimos años una descripción más completa de la comunidad bacteriana ruminal.
La concentración de protozoos (105106/g) en el rumen es menor a la de las bacterias, pero debido a su mayor tamaño (20-200 µm) pueden constituir hasta el 50% del nitrógeno microbiano total (Choudhury et al., 2015).
Los protozoos son capaces de degradar un amplio rango de sustratos y juegan un papel fundamental en la degradación de la fibra; aunque pueden almacenar grandes cantidades de almidón y ralentizar así la producción de ácidos que reduce el pH ruminal en animales que reciben dietas ricas en concentrados.
Los protozoos también son depredadores de bacterias, por lo que su reducción suele aumentar la síntesis de proteína bacteriana.

Los productos finales generados en su metabolismo son similares a los generados por las bacterias, pero destacan el hidrógeno y los ácidos acético y butírico.
Algunas arqueas metanogénicas viven asociadas a los protozoos para disponer de un acceso inmediato al hidrógeno generado y utilizarlo, junto con CO2 para producir metano.
Los hongos constituyen el grupo microbiano ruminal más desconocido, aunque se han identificado al menos 14 especies diferentes.
Poseen actividad celulolítica y tienen una importante participación en la degradación de tejidos vegetales lignificados, pero todavía no se conoce en profundidad su papel en la fermentación ruminal.
Las poblaciones microbianas ruminales varían en función de numerosos factores (tipo de dieta, edad, estado sanitario y estrés del animal, localización geográfica, fotoperiodo, etc,), pero también varían en gran medida entre animales del mismo rebaño y que reciben la misma dieta
Las arqueas metanogénicas han cobrado una gran importancia en los últimos años debido a que el metano es un gas de efecto invernadero que contribuye al calentamiento global
El retículo tiene una mucosa en forma de panal de miel que facilita la retención de objetos extraños y juega un papel importante en la regurgitación del bolo alimenticio.
El omaso presenta una serie de láminas y pilares musculares y su contracción contribuye a reducir el tamaño de partícula de los alimentos ingeridos pero a través de su mucosa también se produce una absorción de agua y ácidos grasos volátiles (AGV) producidos en el rumen.
El abomaso tiene una estructura y función similares a las del estómago de los animales no rumiantes.
Las glándulas abomasales secretan ácido clorhídrico, gastrina, mucina y pepsina, y en los animales jóvenes secretan renina.
Los microorganismos ruminales que llegan al abomaso no pueden sobrevivir debido al bajo pH y son digeridos.
El intestino de los rumiantes tiene una longitud considerable, pero la proporción de intestino delgado y grueso varía según el tipo de rumiante (Hofmann, 1993).
En los rumiantes SC el intestino grueso representa una mayor proporción (27-30%) que en los rumiantes SGF (18-20%), probablemente debido a que en ellos escapa del rumen una mayor cantidad de alimento sin fermentar

El proceso de digestión en el intestino delgado de los rumiantes es similar al de los animales no rumiantes, pero la composición de la digesta que llega al intestino difiere de la del alimento debido a los procesos de fermentación ruminal.
La digesta se mezcla con las secreciones intestinales y de las glándulas anejas (hígado y páncreas).
La secreción de enzimas amilolíticas y lipolíticas es menor en los animales rumiantes que en los no rumiantes, lo que se ha atribuido a las menores cantidades de almidón y lípidos que llegan a su duodeno al haber sido fermentados en el rumen.
Como consecuencia de la menor actividad amilolítica, la absorción de glucosa en los rumiantes es baja y en animales alimentados con dietas ricas en concentrado pueden alcanzar el intestino grueso cantidades importantes de almidón (Van Soest, 1994).
El intestino delgado de los rumiantes es muy eficiente en la absorción de aminoácidos, que tiene lugar fundamentalmente en el yeyuno e íleon. La digesta que llega al intestino grueso de los rumiantes ya ha sufrido la acción de las enzimas microbianas y del animal hospedador, pero es sometida de nuevo a la acción de la población microbiana existente fundamentalmente en el ciego y colon.
La población microbiana del intestino grueso es similar en su funcionalidad a la del rumen, aunque ha sido mucho menos estudiada
En el intestino grueso se produce principalmente una fermentación del almidón y carbohidratos estructurales, junto con una absorción de agua, minerales, amoníaco y AGV.
Asimismo, se genera metano, que contribuye entre un 5 y 15% al total del metano generado en la fermentación entérica.
A continuación se describe brevemente la degradación y fermentación ruminal de los principales principios inmediatos de los alimentos, así como su digestión intestinal.
Los hidratos de carbono ingeridos con la dieta son parcialmente degradados y fermentados por los microorganismos ruminales, generando como principales productos finales AGV, CO2, metano, H2O y ácido láctico.
Los hidratos de carbono se degradan en una primera fase hasta monosacáridos, que son transformados en piruvato.
Posteriormente el piruvato es fermentado y se generan AGV, ácido láctico, hidrógeno, CO2 y agua (Figura 1).
HIDRÓGENO Y CO 2
El hidrógeno y el CO2 son utilizados por las arqueas metanogénicas para generar metano.
La mayor parte de los gases producidos (CO2 y metano) son eliminados al exterior mediante el eructo.
Los ácidos acético y propiónico son absorbidos de forma pasiva a través de la pared ruminal y transportados por la vía porta hasta el hígado.
El ácido butírico es también absorbido, pero en su paso a través de la pared ruminal una gran parte del mismo se transforma en β-OH-butirato.
Adicionalmente, parte de los AGV producidos pasan junto con la digesta al abomaso e intestino delgado.
Los hidratos de carbono estructurales que no son fermentados en el rumen pasan al tracto digestivo posterior y pueden ser fermentados en el intestino grueso y generar AGV que son absorbidos. Sin embargo, esta producción suele ser cuantitativamente poco importante comparada con la que se genera en el rumen.
Pectinas
Celulosa
Almidón
Ácidos urónicos
Hemicelulosas
Pentosanas
Celobiosa
MONOSACÁRIDOS
Maltosa
Sacarosa
Fructanas
Figura 1. Esquema de la degradación ruminal de los hidratos de carbono (adaptado de Van Soest, 1994)
Oxalacetato
Los AGV también sirven como precursores para la síntesis de otros compuestos:
Acetil-CoA
Acetil-CoA
Lactato
H2 CO2 CO2
Succinato
El acético y β-OH-butirato se usan como para sintetizar ácidos grasos (principalmente en el tejido adiposo y la glándula mamaria).
CH4
Acrilil-CoA
Acetato Butirato

Propionato
El propiónico es utilizado por el hígado para sintetizar glucosa.
Los AGV mayoritarios (acético, propiónico y butírico) son la principal fuente de energía para los rumiantes, ya que pueden aportar entre el 70 y 80% de la energía total obtenida a partir de la dieta (Seal y Reynolds, 1993).

Los compuestos nitrogenados de los alimentos son degradados parcialmente por los microorganismos ruminales y utilizados para la síntesis de proteína microbiana (Figura 2).
Los principales productos finales de este proceso son proteína del alimento no degradada, proteína microbiana y amoníaco.
La proteína del alimento no degradada y la proteína microbiana abandonan el rumen y son posteriormente digeridas en el estómago e intestino delgado, liberando aminoácidos que serán absorbidos y transportados por la circulación sanguínea hasta los tejidos corporales.
Por otra parte, el amoníaco que no ha sido utilizado por los microorganismos es absorbido a través de la pared ruminal y transportado al hígado, donde se convierte en urea mediante el ciclo de la urea.
Parte de la urea puede regresar al rumen, a través del reciclado con la saliva o directamente a través de la pared ruminal, pero una gran parte se excreta en la orina.
Esta excreción de urea supone una pérdida nitrogenada y además contribuye a la contaminación medioambiental de las explotaciones ganaderas.
Los aminoácidos absorbidos pueden tener diferentes destinos en los tejidos corporales, como la síntesis proteica, la transformación en otro aminoácido, y la desaminación y uso del esqueleto carbonado para obtener energía (oxidación) o generar glucosa (aminoácidos glucogénicos)
Proteína verdadera
Nitrógeno no proteico
Oligopéptidos
Dipéptidos
Aminoácidos
ENERGÍA (fermentación de los carbohidratos) PROTEÍNA NO DEGRADADA
Figura 2. Esquema de la degradación ruminal de los compuestos nitrogenados y síntesis de proteína microbiana
NH3-N
Orina UreaLos triacilglicéridos de los vegetales consumidos por los rumiantes pueden ser hidrolizados por las lipasas de los microorganismos ruminales y generar glicerol y ácidos grasos libres, también denominados Ácidos Grasos No Esterificados (AGNE).
El glicerol puede ser fermentado a AGV y los AGNE son utilizados por los microorganismos ruminales para formar sus estructuras (lípidos microbianos) o pueden ser hidrogenados por las bacterias (Figura 3). Por ello, en el flujo de la digesta que llega al abomaso hay una mezcla de lípidos del alimento, lípidos microbianos, AGNE saturados y AGNE insaturados.
Los lípidos del alimento y lípidos microbianos son digeridos en el intestino delgado, absorbidos y posteriormente se forman en triacilglicéridos que son empaquetados en lipoproteínas transportadas por la circulación sanguínea hasta los tejidos. Asimismo, se produce una absorción de AGNE.
En los tejidos, los triacilglicéridos pueden ser utilizados como fuente de energía tras su hidrólisis por las lipasas tisulares, pero sus componentes también pueden ser utilizados como precursores para la síntesis de grasa – lipogénesis -, especialmente en el tejido adiposo, el hígado y la glándula mamaria.
Digestión de lípidos microbianos
Absorción y formación de triacilglicéridos (empaquetados en lipoproteínas)
Absorción de AG libres (AGNE)
Manuel Fondevila
Dpto. Producción
Animal y Ciencia de los Alimentos, Instituto Agroalimentario de Aragón, Universidad de Zaragoza- CITA



Eltracto gastrointestinal porcino aloja una población de microorganismos simbióticos, anaerobios y microaerófilos, cuya diversidad participa de forma esencial en la salud y bienestar del animal, además de en la utilización de nutrientes.
Se han citado más de 500 especies bacterianas, alcanzando una concentración celular mayor que la del hospedador.
Su principal sustrato procede de la dieta, aunque las secreciones endógenas y células de descamación pueden ser nutrientes para algunas especies bacterianas.
Las situaciones alimentarias que modifiquen el ambiente pueden favorecer temporalmente el desequilibrio microbiano por la entrada de especies, que en otras condiciones no mantendrían una concentración destacable, o por la proliferación de un tipo microbiano existente que compita favorablemente con el resto de la microbiota.
El tracto gastrointestinal es un microecosistema estable, que mantiene el equilibrio cualitativo y cuantitativo entre especies.
Cuando las condiciones ambientales del tracto se modifican, el equilibrio se desplaza hacia los tipos de organismos más eficientes .
Al recuperar las condiciones iniciales también lo hacen las mismas especies a una concentración similar, restableciendo el clímax de la población más estable
A lo largo del tracto gastrointestinal, e incluso en focos localizados de cada tramo, se forman y mantienen microhabitats de composición muy diversa en el lumen o asociados a la mucosa intestinal de cada tramo en función de las condiciones ambientales, en términos de respuesta inmune, presencia de receptores, velocidad de tránsito, disponibilidad de nutrientes, pH y potencial redox.


A su vez, la biodiversidad de estos micronichos ejerce un papel específico sobre la propia composición bacteriana, la capacidad de

Las bacterias, patógenas o no, desarrollan mecanismos de permanencia en el tracto digestivo:

Multiplicación a mayor ritmo que el tránsito digestivo
Alta capacidad de motilidad
Adhesión a los enterocitos mediante fimbrias que se fijan en receptores específicos
Esta capacidad de fijación está mediatizada por las interacciones sinérgicas y antagónicas con otras especies como con el hospedador.
RESPUESTA INMUNE antígenos producidos por m.o. comensales potencian la respuesta frente a patógenos
Por ejemplo, la leche materna ingerida durante la lactación tiene lisozima como factor antiséptico, además de factores bacteriostáticos y anti-adhesivos específicos contra
EXCLUSIÓN COMPETITIVA

Adhesión de comensales a la mucosa excluye a patógenos
COMPETICIÓN POR NUTRIENTES
En situaciones patológicas, los cambios que se producen en las especies predominantes afectan especialmente a la población adherida al epitelio intestinal, siendo sustituida por patógenos que se establecen en el tracto, y su contacto directo con la mucosa genera reacciones alérgicas que desencadenan procesos diarreicos.
ENMASCARADO los receptores intestinales son ocupados por adhesinas de comensales y ocultos para patógenos y toxinas
PROCESO PATOLÓGICO
Patógenos fijados en mucus y receptores celulares producen enterotoxinas
El tracto digestivo del cerdo se coloniza a su paso por el canal del parto, implantándose una microbiota similar a la vaginal, y posteriormente una flora similar a la cecal de la madre, influida por el medio ambiente (Conway 1996).

Las primeras colonizadoras son bacterias como Escherichia coli y Streptococcus spp., para en los primeros días aparecer y dominar especies de Bifidobacterium y Lactobacillus (Konstantinov et al., 2004).
El establecimiento de bacterias aerobias y facultativas permite la reducción de la concentración de oxígeno, favoreciendo la implantación y desarrollo de especies anaerobias de los géneros Prevotella, Clostridium, Ruminococcus, Enterococcus y Enterobacter.
Dominan los organismos de los Phyla Firmicutes (54%), Bacteroidetes (39%) y Proteobacteria (4%), con presencia de Spirochaetes y Tenericutes inferior al 1% Pajarillo et al., 2014a.
El cambio de la naturaleza del alimento, y por tanto de la digesta, unido al descenso abrupto del nivel de ingestión en la primera semana postdestete afectan notablemente a la concentración y la biodiversidad de la microbiota digestiva tarda más de 3 semanas en estabilizarse.
Conforme avanza la edad del animal y la alimentación láctea es sustituida por una dieta sólida basada en vegetales, la población inicial va siendo desplazada progresivamente por anaerobios estrictos, con un aumento notable de biodiversidad y modificación de las proporciones de cada Phylum (60% Bacteroidetes, 36% Firmicutes, 2% Spirochaetes, 1% Proteobacteria y 1% Tenericutes) según Pajarillo et al., 2014a.
La microbiota digestiva cambia con la edad, aumentando respecto al destete la presencia de los géneros Anaerobacter, Oscillibacter y Sarcina, y disminuyendo las de Prevotella, Lactobacillus, Megasphaera, Faecalibacterium y Dialister (Kim et al., 2015; TABLA 1)
En el cerdo adulto, un 90% de la población pertenece a los Phyla Firmicutes y Bacteroidetes, con un 9% de organismos del género Prevotella (Pedersen et al., 2013).
Sobre un total de 171 géneros; entre ellos, 15 incluyen el 59% de las secuencias.
Las especies bacterianas dominantes en distintos tramos del tracto digestivo del cerdo se presentan en la TABLA 1.

El ambiente en los distintos tramos, especialmente el pH, la concentración de oxígeno y el ritmo de tránsito del alimento, condiciona las características de la microbiota en cada uno de ellos.
ESTÓMAGO

El último tramo del intestino delgado alberga una concentración importante de población microbiana, capaz de fermentar hasta un 18% de los polisacáridos estructurales, actividad limitada fundamentalmente por el rápido ritmo de tránsito.
En este tramo, el Phylum Firmicutes engloba prácticamente la totalidad de las especies, dominando los géneros Anaerobacter, Turicibacter Lactobacillus, Streptococcus y Sarcina (Looft et al., 2014).
El intestino grueso, con un volumen de 8 a 10 litros, un tiempo de retención de la digesta entre 20 y 38 horas (Yen 2001) y una baja concentración de oxígeno, actúa como cámara de fermentación microbiana, dado que su ambiente (pH entre 6,0 y 7,0) favorece la proliferación de bacterias anaerobias estrictas como Prevotella, Oscillibacter, Eubacterium, Fusobacterium, Propionibacterium, Clostridium y Selenomonas.
Aunque con variabilidad individual, la biodiversidad de las comunidades microbianas de cada uno de los tramos del tracto digestivo responde a unas características ambientales determinadas.
Sin embargo, a partir de heces de cerdos de 15 semanas de razas Landrace, Yorkshire y Duroc, Pajarillo et al. 2014b, sugieren además diferencias a nivel de género en función de la raza del hospedador.

La microbiota digestiva influye en la estructura, función y madurez del tracto digestivo.
Independientemente del papel simbiótico de algunas de las especies implantadas, la población microbiana en su conjunto compite por nutrientes con el hospedador:
Hasta el 6% de la energía neta ingerida se pierde en fermentación microbiana de lactosa y almidón en el estómago e intestino delgado, produciendo lactato.
Por el contrario, del 6 al 20% de las necesidades energéticas totales del cerdo adulto se satisfacen con los productos de fermentación del último tramo del íleon y del intestino grueso.
Hasta un 50% de los polisacáridos estructurales vegetales y la práctica totalidad de pectinas y carbohidratos de reserva que alcanzan este tramo son fermentados (Bach-Knudsen y Canibe 2000) produciendo ácidos grasos volátiles (AGV), acetato, propionato y butirato.
Estos AGV son parcialmente absorbidos y metabolizados, además de estimular la motilidad, los procesos de absorción y la masa tisular, especialmente el butírico, uno de los sustratos energéticos preferentes para las células de la mucosa intestinal (Sakata e Inagaki 2001), mientras que el propiónico ejerce su papel gluconeogénico a nivel hepático.
Las bacterias acidolácticas (Lactobacillus, Bifidobacterium, Streptococcus) contribuyen a reducir el número de patógenos y su virulencia mediante competición por nutrientes, producción de bacteriocinas y otros compuestos antagonistas, competición por lugares de adhesión en la mucosa y estímulo de la respuesta inmune.
Directamente, la actividad metabólica de estas especies produciendo lactato disminuye el pH del medio hasta niveles no tolerables para E. coli y otros patógenos como Clostridium difficile y Salmonella typhimurium.
intestinal que promueva la proliferación de este tipo de bacterias contribuirá a reducir el riesgo de colonización por enterobacterias potencialmente patógenas.
Los antígenos bacterianos papel destacado en la proliferación y el desarrollo del tejido linfoide asociado al tracto digestivo, como demuestra la inmadurez del sistema inmunitario y la susceptibilidad a la infección de animales gnotobióticos (animales con una microbiota conocida, que se han obtenido a partir de animales libres de microorganismos).
No obstante, los mecanismos mediante los cuales los microorganismos estimulan la función del tejido linfoide, poco conocidos, se desencadenan probablemente a partir de la ingestión de antígenos bacterianos por las células M que circundan las placas de Peyer.
del sistema inmunitario adaptativo. Por otra parte, el concepto de exclusión competitiva se basa en que, garantizando unas condiciones ambientales adecuadas para el desarrollo y fijación en el epitelio intestinal de especies bacterianas simbióticas, se evita la proliferación y adhesión de especies patógenas, y se mantiene un correcto estado sanitario.
El intestino de los animales es un sistema complejo. Por un lado, se debe facilitar la entrada de los diferentes elementos necesarios para el mantenimiento de la homeostasis del animal. Por otro lado, se debe contener los factores agresivos que pueden comprometer la salud de los animales

En el sistema digestivo se ha establecido una simbiosis trascendental entre el animal y la gran diversidad de microorganismos, que participan tanto en el proceso de la digestión, como en el mantenimiento y maduración de diferentes estructuras del intestino, en especial la mucosa intestinal y el sistema inmunitario asociado a la mucosa intestinal.
 IRTA, Centre de Recerca en Sanitat Animal (CReSA), Campus de la Universitat Autònoma de Barcelona
Ignacio Badiola, Ana Pérez de Rozas, Verónica Martinez, Nuria Aloy, Judith González
IRTA, Centre de Recerca en Sanitat Animal (CReSA), Campus de la Universitat Autònoma de Barcelona
Ignacio Badiola, Ana Pérez de Rozas, Verónica Martinez, Nuria Aloy, Judith González
Algunos microorganismos son capaces de producir sustancias antibacterianas, especialmente ácidos grasos volátiles y bacteriocinas que, junto con la capacidad de competir por ciertos sustratos o la de interaccionar con diferentes moléculas de adsorción, minimizan el riesgo de colonización por agentes con potencial patógeno o reducen los efectos negativos de la infección.

En la producción animal, los problemas infecciosos del sistema digestivo son una de las principales causas de pérdidas económicas.
Su control, basado en la mayoría de casos en la utilización de antimicrobianos, está relacionado con el aumento del riesgo de aparición de resistencias que pueden comprometer tanto la terapéutica animal como la humana.


Sin descartar, ni mucho menos, el uso de los antimicrobianos para el tratamiento de agentes patógenos, el favorecer poblaciones bacterianas con efecto “positivo” o el restablecer el equilibrio en la microbiota intestinal rotos por diferentes condiciones de estrés, son dos objetivos que, en los últimos años, se viene persiguiendo para ayudar a reducir la prevalencia y la severidad de diferentes infecciones intestinales o de diversos cuadros de disbiosis digestivas.


Cambio de alimentación
Destete en el caso de mamíferos
Reagrupación de animales o clareo
Cambios bruscos de temperatura
Fallos en los sistemas de suministro de agua
Entrada de diferentes patógenos
El interés por controlar de una forma más “fisiológica” los problemas infecciosos digestivos, choca con el desconocimiento de los componentes de la microbiota intestinal implicados en la “salud intestinal”.
La "salud intestinal" depende también de la composición del pienso y del estatus fisiológico del animal. Habría que reformular qué perfil de microbiota intestinal se asocia a un "estado de salud". (Frese et al., 2015).

En nuestro grupo de trabajo hemos observado, tanto en cerdos, aves y
*Torrallardona et al., 2003; Badiola et al., 2004a y b; Nicodemus et al., 2004; Castillo et al., 2006a y b; Gomez-Conde et al., 2006; Andrés-Elias et al., 2007; Castillo et al., 2007; Chamorro et al., 2007; Gómez-Conde et al., 2007; Roca-Canudas et al., 2007; Torrallardona et al., 2007a y b; Gidenne et al., 2008; Gomez-Conde et al., 2009; Willamil et al., 2009; Chamorro et al., 2010; Badia et al., 2012; Torrallardona et al., 2012a y b; Willamil et al., 2012; Gibert et al., 2013; Roca et al., 2014: Rodrigues et al., 2016
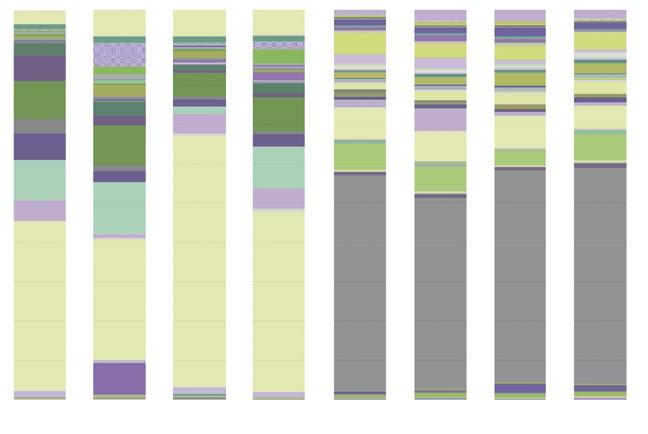
En la Figura 1 pueden verse los perfiles de microbiota ileal y cecal de cerdos alimentados con diferentes cereales y suplementados, o no, con enzimas, analizados con sistemas de secuenciación masiva (Ion Torrent).
Observamos como el perfil de la microbiota varía según el tipo de cereal y el uso de enzimas en la dieta.

La utilización de diferentes fuentes de hidratos de carbono, en especial la fuente de almidón y la fuente de polisacáridos no amiláceos (PNA), tienen repercusión en los perfiles de la microbiota intestinal, así como en la predisposición a problemas infecciosos digestivos.

Los PNA solubles son hidratos de carbono altamente fermentables que aumentan la viscosidad de la digesta y disminuyen el contacto entre substratos y enzimas digestivos, lo que puede perjudicar el desarrollo de la microbiota digestiva natural.
La fácil fermentación bacteriana de los PNA solubles sin digerir favorece el crecimiento de la microbiota intestinal
Los diferentes componentes de la microbiota pueden ser beneficiosos o prejudiciales en función de
Tipo y concentración que llegue a las porciones distales del intestino
Especie
Edad del animal
Estado del sistema inmunitario asociado a la mucosa intestinal
Un alto nivel de fracciones no digeridas será más perjudicial en aves que en cerdos, por las distintas características de viscosidad intestinal (unas 100 veces mayor en aves que en cerdos), y en animales jóvenes más que en animales adultos (Santomá y Pontes, 2005).

Como apuntan Pluske y cols. (2003), la fracción soluble de los polisacáridos no amiláceos puede provocar, en especial en aves, el aumento de la viscosidad de la digesta que se asocia a la reducción de la digestibilidad de los nutrientes y de la absorción de los mismos.
En cerdos, el aumento de la viscosidad reduce la velocidad de tránsito de la digesta a través del intestino delgado, lo que proporcionaría más tiempo para que potenciales patógenos, como Escherichia coli o Clostridium spp, puedan proliferar.
En un estudio anterior, Pluske y cols. (1998) demostraron el efecto de la fuente de hidrato de carbono en la aparición o no de manifestaciones clínicas de disentería porcina.
Pluske y cols. (1998) encontraron correlación directa entre la entrada de carbohidratos rápidamente fermentables al intestino grueso con la aparición de signos clínicos de disentería.
En este estudio los cuadros de disentería, frecuentes en los animales alimentados con pienso formulado a base de arroz cocido y suplementado con polisacáridos no amiláceos solubles (goma de guar) o con almidón resistente (Novelose), desaparecían cuando la suplementación del pienso base se hizo con polisacáridos no amiláceos insolubles (cascarilla de avena).
El efecto positivo de inclusión de la cascarilla de avena, en piensos de lechones basados en arroz cocido o maíz cocido, sobre la incidencia de cuadros diarreicos, también ha sido observado en estudios realizados por Mateos y cols. (2006)

Ciertos oligosacáridos, ricos en fructosa, se han usado para aumentar selectivamente el número de Bifidobacterium spp. en el intestino grueso, incremento que se asocia a la inhibición de la colonización por ciertos patógenos (Gibson et al., 1995).
La colibacilosis postdestete es una enfermedad del intestino delgado producida por cepas de Escherichia coli enterotoxigénicas, caracterizada por la aparición de diarrea hipersecretoria debida a la liberación de enterotoxinas bacterianas específicas.

En el intestino delgado, las fimbrias de Escherichia coli se unen a los receptores de glicoproteínas que se expresan en la membrana de las células que revisten las vellosidades intestinales.
La fimbria más común asociada con la colibacilosis postdestete es la K88, también denominada F4.
El receptor para K88 desaparece a las pocas semanas tras el destete, por lo que el periodo crítico de esta infección viene determinado por la expresión de dicho receptor.
La colonización del intestino delgado y la diarrea generalmente tiene lugar entre los días 4 y 14 tras el destete (Bertschinger, 1999).
La infección por Escherichia coli se asocia a cambios significativos en el perfil de microbiota (Hermann-Bank et al., 2015).

Los PNA, especialmente su fracción soluble, tienen un carácter antinutritivo en aves debido a su impacto negativo sobre la digestión y la absorción de nutrientes tales como el almidón, lípidos y proteína
No obstante, los mecanismos mediante los cuales los PNA empeoran la productividad en pollos de engorde no son conocidos (Mateos et al., 2002). La prevalencia y gravedad de lesiones compatibles con enteritis, especialmente en pollos de engorde, pueden disminuirse por la adición de diferentes enzimas, en especial los que favorecen la digestibilidad de los polisacáridos no amiláceos.
Tanto el tipo de cereal como la proteína presente en la dieta tienen un impacto directo sobre la proliferación y excreción de Escherichia coli hemolíticas en el tracto gastrointestinal de lechones (Pluske et al., 2003).

Cuando la incidencia de desórdenes digestivos es alta, con blandeos en porcino y enteritis necrótica u otras enteritis en pollos, se recomienda reducir el nivel de proteína de la dieta y aumentar el uso de aminoácidos sintéticos (Mateos et al., 2002; Pérez y Gasa, 2002).
Se está prestando relativamente poca atención a la digestión y metabolismo de la proteína por las bacterias intestinales de los cerdos, en especial en relación con la colibacilosis.
Se sabe que un grupo de bacterias, entre las que se encuentran Bacteroides spp., Clostridium spp., Enterobacterium spp., Lactobacillus spp. y Streptococcus spp., poseen la habilidad de producir diaminas, tales como la putrescina, cadaverina, histamina y tiramina, por decarboxilación de ciertos aminoácidos (tirosina, triptófano y lisina) y ruptura de poliaminas (Gaskins, 2001).
Porter y Kenworthy (1969), trabajando con lechones destetados de tres semanas de edad, comprobaron que la excreción urinaria de aminas estaba asociada a la diarrea postdestete, encontrando niveles más altos de putrescina y cadaverina.
Los metabolitos secundarios bacterianos resultantes de la fermentación de la proteína de la digesta son producidos en mayor cantidad en medio ácido. Ácido que puede resultar de la rápida fermentación de polisacáridos no amiláceos solubles y, posiblemente, del almidón.
Podría existir interacción entre la concentración/tipo de la proteína y los polisacáridos no amiláceos con la etiopatogenia de la colibacilosis postdestete.
A este respecto, Aumaitre y cols. (1995) sugirieron que la adición apropiada de fuentes de PNA insolubles podría reducir los problemas de colibacilosis postdestete, y Bolduan y cols. (1988) comprobaron que la producción de diaminas en el colon se reduce linealmente con el incremento del contenido en fibra bruta del pienso para lechones destetados.
Finalmente, y sólo a modo de pincelada, no podemos dejar de mencionar que la utilización de diferentes antibióticos por vía oral, bien en el pienso bien en el agua de bebida, puede suponer alterar el equilibrio de la microbiota intestinal, llegando a producir cuadros de disbiosis.
La utilización de amoxicilina puede asociarse a la reducción importante de Lactobacilos y Bifidobacterias, junto al incremento de Bacteroidetes y de Enterobacterias, desequilibrio que puede conllevar la aparición de enteritis por Clostridium difficile (Hawrelak y Myers, 2004), uno de los patógenos digestivos emergentes en porcino. El restablecer el equilibrio en la microbiota ayuda a solucionar los problemas de Clostridium difficile (Lawley et al., 2012).

Además, este tipo de antimicrobianos reducen la producción de ácidos grasos de cadena corta (SCFAs), importantes metabolitos secundarios bacterianos, tanto desde el punto de vista del balance energético, como desde el punto de vista de la salud intestinal, ya que tienen actividad antimicrobiana y ayudan al mantenimiento de la estructura de la mucosa intestinal.
En cambio la utilización de macrólidos, tetraciclinas o flouroquinolonas suelen producir cambios menores en la composición de la microbiota intestinal, y por lo tanto tienen poca capacidad de producir disbiosis intestinal (Hawrelak y Myers, 2004; Kim et al., 2012). No obstante, en la capacidad de producir cuadros de disbiosis, la dosis y la duración del tratamiento son las dos variables principales.


Cristina Castillo y Joaquin Hernández
Departamento de Patoloxia Animal
Universidade de Santiago de Compostela, Lugo

Lasalteraciones que afectan al rumen han sido motivo de numerosos estudios, analizando aquellos factores que condicionan su aparición.
Dentro del rumen se producen dos procesos diferenciados:
Las fermentaciones de los principios nutritivos
El desplazamiento de los productos allí alojados
Atendiendo a criterios didácticos, los trastornos ruminales pueden clasificarse en dos clases:
1 2
Alteraciones motoras
Alteraciones fermentativas
Un proceso que se inicia por alteración de un componente, siempre terminará afectando al otro, de manera que en la mayoría de las situaciones clínicas ambos mecanismos aparecerán interrelacionados
¿Qué condiciones se deben dar en el medio retículo-ruminal para ejercer sus funciones?
En la Tabla 1 presentamos los diferentes procesos que se incluyen en cada una de las clases.
Ser un ecosistema abierto y continuo: tiene que haber una entrada continua de nutrientes así como una salida permanente de desechos y microorganismos muertos
Tener un aporte constante de sustratos: para el mantenimiento de la población microbiana
Tiempo de retención: el contenido ruminal debe permanecer el tiempo suficiente para permitir la acción microbiana, favorecido por la conformación del rumen, el pequeño diámetro del orificio retículo ruminal así como la motricidad ruminal
Medio acuoso: necesario para que tengan lugar las reacciones bioquímicas de los microorganismos
Anaerobiosis
Osmolaridad: Una fermentación normal se lleva a cabo entre 260 y 340 mOsm. Su aumento inhibe la digestión de la fibra y altera la rumia
pH: Oscila entre 5.5 y 7.0
Temperatura: Dada la elevada actividad metabólica su temperatura es 1 o 2 grados superior a la temperatura corporal. Su variación afectará a la funcionalidad
Como se puede apreciar, en la bibliografía es frecuente encontrar el término indigestión que genéricamente hace referencia a la alteración (morfológica y/o funcional) del sistema retículo-ruminal.
A su vez, la misma se divide en primarias y secundarias.
INDIGESTIONES PRIMARIAS
Timpanismo gaseoso Paraqueratosis
Trastornos motores
Timpanismo espumoso Indigestión vagal
Rumenitis/reticulitis Hernia diafragmatica
Trastornos fermentativos
Acidosis/Alcalosis ruminal Indigestión simple
INDIGESTIONES SECUNDARIAS
Inactividad motora Reflujo abomasal
Inactividad bioquímica
Tabla 1. Principales trastornos motores y fermentativos que tienen lugar en el rumen
Los procesos bioquímicos ocurren porque la población ruminal está constituida por:

630 especies constituyendo el 50% de la masa microbiana


30 tipos diferentes de protozoos
PARÁSITOS
14 a 15 tipos
Como dato curioso podemos señalar que los protozoos aparecen en una concentración que puede variar desde los 20 a 200 mil por ml de líquido ruminal, lo que supone un peso variable desde 20 a 1100 mg por cada 100 ml
Por otro lado, la población bacteriana oscila desde 1 a 10 mil millones por ml de líquido ruminal, variando su peso desde 300 a 1600 mg por cada 100 ml de líquido.
Podemos señalar que dos animales no presentarán las mismas poblaciones (cualitativa y cuantitativamente hablando), por lo que sus cambios pueden ser capaces de modificar el perfil fermentativo, mejorando o empeorando la productividad de los animales.
HONGOS
5 a 7 tipos
LEVADURAS & VIRUS
Dada la funcionalidad que tienen estos elementos, la principal causa de la modificación del patrón fermentativo radica en la alimentación que reciben los animales, incluyendo aquí tanto aspectos cuantitativos como cualitativos, directos e indirectos.
Pese a estar encuadrado en alteraciones motoras, recordemos que el equilibrio ruminal pasa porque el pH se mantenga dentro de unos límites fisiológicos aceptables.
Comenzando por los trastornos motores:
Para muchos autores no es una enfermedad en sí misma, sino un signo de otra enfermedad que no suele presentarse en animales menores de cinco semanas de vida, y cuya aparición en terneros se asocia a la obstrucción del cardias (por asfixia, tétanos), del esófago (actinobacilosis o neoplasias), e incluso indigestión vagal.
En animales muy jóvenes se puede presentar:
El problema radica en la acumulación de gas que es atrapado por la excesiva cantidad de espuma, pudiendo, en caso extremos, llegar a comprometer la vida del animal por la posible compresión diafragmática.
Otra característica es que suele ser recidivante, debido a que la presencia de espuma estimula los receptores de tensión de umbral alto de la pared ruminal, en vez de los receptores de tensión de umbral bajo, ocasionándose una inhibición de la motilidad en vez de un aumento de la contracción, lo que contribuiría a reducir la retención de espuma.
Cuando la leche en exceso escapa de la gotera esofágica alcanzando el rumen, el cual en este momento presenta un ambiente aeróbico, siendo entonces sometida a una descomposición por las bacterias proteolíticas.
Como secuela de una bronconeumonía que cursa con inflamación de los nódulos linfáticos mediastínicos, los cuales comprimen el esófago o al propio nervio vago.
Dentro de este apartado, aunque de forma secundaria como señalamos en la tabla inicial, el acúmulo de gas y/o espuma puede deberse a causas nutricionales por:
Una ración inadecuada, en la que la cantidad de forraje sea demasiado elevada, impidiendo el correcto movimiento de las paredes ruminales. Pudiéndose dar en cuanto al forraje, por la ingesta de forraje de leguminosas fresco, por ingesta de heno de alfalfa, por ingesta de pradera de trigo en invierno o por exceso de ingesta de concentrados en terneros en crecimiento. En el caso de las leguminosas, las especies más peligrosas son alfalfa (Medicago sativa), el trébol rojo (Trifolium pratenses) y trébol blanco (Trifolium repens).
Carencias en calcio y en potasio. En primer lugar, la hipocalcemia ocasiona una debilidad y/o incapacidad de contracción del músculo liso de la pared ruminal, mientras que la hipopotasemia produce una debilidad en la contracción muscular, lo que conduce a un estasis ruminal.



A excepción del retículo-pericarditis traumática, dónde es un cuerpo extraño el causante del problema, son los factores nutritivos los desencadenantes de la aparición de la patología motriz
Un excesivo aporte de carbohidratos no estructurales provocará un descenso del pH en rumen, lesionando la mucosa con la consiguiente pérdida de las papilas ruminales, evolucionando hacia un endurecimiento por excesiva producción de queratina (paraqueratosis) y disminuyendo la superficie de forma irreversible.


En terneros jóvenes, esta paraqueratosis se ha visto también asociada a la presencia de tricobezoares formados por la ingesta de pelo y que ocurre por autolamidos usualmente asociados a problemas de ectoparásitos, como piojos y ácaros.
De ahí que nunca se deberían descartar el origen parasitario del problema sin haber comprobado la existencia de un programa sanitario completo.
INDIGESTIÓN VAGAL
Puede presentarse como una dificultad en el tránsito por alteración a dos niveles:
Por obstrucción de la comunicación retículoomasal, asociado a una hipermotilidad ruminal o secundario a un timpanismo gaseoso.
Por estenosis pilórica debida a un desplazamiento o presencia de úlceras en el abomaso
INDIGESTIÓN SIMPLE
Es el proceso más común, asociado a la alimentación recibida.
Desde un punto de vista genérico las causas del mismo pueden sintetizarse en:
Un cambio brusco de alimentación (cualitativa) con la consecuente inadaptación a la misma
Otras condiciones (peritonitis, abscesos de pared ruminal o gestación) pueden propiciar esta patología, también conocida como Síndrome de Hoflund.
Tradicionalmente ha estado asociado a disfunción del nervio vago; pero en la actualidad se sabe que concurren más factores, no estando clara la patogenia del proceso.
HERNIAS DIAFRAGMÁTICAS
No son procesos muy habituales en ganado vacuno, si bien pueden aparecer de forma adquirida a otros procesos como pueden ser traumatismos, gestación e incluso un timpanismo agudo o bien ser congénitos.
Un cambio brusco en la cantidad pero no en el tipo de alimento recibido
Ingesta de compuestos que interfieren con el patrón de fermentación.
Esta última causa suele aparecer cuando los animales ingirieren forrajes alterados (mohosos o muy calientes, fríos, parcialmente fermentados, descompuestos o agrios). En cualquier caso, se trata de procesos autolimitativos en el tiempo.
Como señalábamos anteriormente, las indigestiones pueden ser también secundarias a otros procesos, como aquellos derivados de la inactividad motora, caracterizados por la disminución o desaparición del ciclo normal de contracciones primarias motivado por diferentes mecanismos:
Descenso de estímulos excitatorios de los centros gástricos
Aumento de los estímulos inhibitorios de los propios centros
Depresión de los propios centros
Alteración de la inervación vagal
Otras causas metabólicas o ambientales ?
En la Tabla 2 se ponen algunos de las situaciones que intervienen en la génesis del proceso. Si nos enfocamos en los cambios en los desórdenes secundarios fermentativos incluiríamos los cambios de flora ruminal.
Las causas están íntimamente relacionadas con cambios, tanto cualitativos como cuantitativos, de las dietas, señalando aspectos como la cantidad de proteínas, de carbohidratos e incluso de fibra.
En relación a las bacterias celulolíticas, además de predominar en dietas con alto contenido en fibra, deberíamos tener en cuenta la longitud de la misma, pues este último parámetro determina su tránsito o su retención dentro de los preestomagos. Además, la ingesta de forraje de mala calidad conduce hacia una pérdida de la actividad de la flora ruminal, que ocurre cuando animales ingieren excesiva cantidad de paja o de heno, cuando sufren anorexia o cuando presentan carencias nutricionales.
ALTERACIONES MOTORAS SECUNDARIAS EJEMPLOS
Inhibición excitatoria de centros gástricos Anorexia (disminuye llenado ruminal), disminución masticación (inhibe contracciones secundarias), disminución ingesta agua y fibra
Activación de la actividad inhibitoria de centros gástricos
Timpanismo gaseoso, distención ruminal y abomasal, desplazamiento de abomaso, acidosis ruminal, abcesos pared ruminal
Depresión de centros gastricos Endotoxemia, fiebre, hipokalemia, hipocalcemia
Inhibición vagal Lesiones neurológicas. Compresiones tumorales
Otras Baja temperatura ambiental, fiebre de la leche, hipocalcemia, hiperglucemia
Tabla 2. Mecanismos y algunos ejemplos de causas de alteraciones motoras secundarias
La producción avícola actual ha alcanzado una alta eficiencia productiva gracias a la capacidad genética de las estirpes en uso, la composición nutricional de las dietas y los tratamientos terapéuticos.
Esta eficiencia está hoy comprometida por la necesidad de producir aves sin la incorporación de antibióticos promotores de crecimiento en las dietas (Europa) y, en un futuro muy cercano, su restricción como preventivo terapéutico en otras zonas geográficas importantes en la producción avícola mundial.

Con estas condiciones, es esencial incrementar el conocimiento sobre la afectación de los factores nutricionales y de la composición de la dieta tanto en la microbiota (beneficiosa y patógena) como también en la estructura gastrointestinal
El desarrollo de metodologías intervencionistas capaces de dirigir y generar una microbiota beneficiosa y un sistema digestivo sano será clave en el futuro inmediato de la producción avícola
El objetivo de estas líneas es exponer algunos argumentos que permitan visualizar la importancia de algunos ingredientes de la dieta en la salud intestinal y la prevención de enfermedades entéricas.
Aunque el sistema digestivo es dinámico e interactivo, existen diversas estrategias para alcanzar estos objetivos.
El uso de ingredientes concretos, y sobre todo de aditivos tales como probióticos, prebióticos, extractos de plantas o enzimas, nos está permitiendo intervenir de forma dirigida sobre la microflora y la estructura intestinal. Existe una importante interacción entre la composición de la dieta y la prevalencia de Enteritis Necrótica (NE) producida por Clostridium perfringens y Coccidias.
A continuación, se describe la afectación de tres ingredientes habituales en la dieta que intervienen en esta interacción entre composición e infección alterando la microbiota intestinal y la salud del pollo

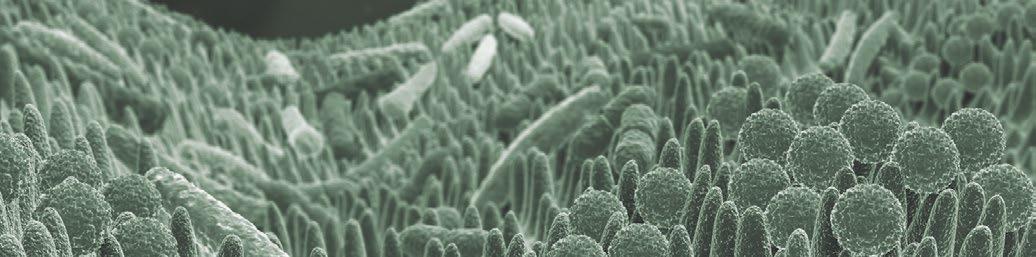
Figura 1. Microscopia electrónica de la superficie epitelial en pollos.
La figura a muestra un epitelio con una estructura en zig-zag sana tras una dieta con maíz.
La figura b muestra un epitelio intestinal con una estructura en zig-zag desestructurada tras una dieta con centeno (Francesch et al., 1999).


El cereal puede modificar la microbiota y la integridad del tracto digestivo, especialmente en la fase inicial de la vida del pollo.

Los animales alimentados a base de trigo, cebada, centeno y avena desarrollan más NE que los pollos alimentados con maíz (Branton et al., 1987, 1997; Kalhusdal., 1996, Ridell & Kong., 1992) (Fig. 1).
La proliferación de C. perfringens es motivada por elevados contenidos de polisacáridos no provenientes del almidón (NSP, por sus siglas en inglés) presentes en los cereales citados anteriormente. En consecuencia, C. perfringens tiene menor capacidad de proliferación en las dietas basadas en maíz que en las de trigo (Annet et al., 1992).
Además, estos compuestos incrementan la viscosidad del bolo alimenticio reduciendo la capacidad de digestión e incrementando la ratio de tránsito intestinal
Estas condiciones predisponen a un incremento de NE y a una mayor susceptibilidad a desarrollar coccidiosis (Williams., 2005) (Fig. 2).
En consecuencia, es imprescindible la utilización de una correcta preparación enzimática que permita reducir la viscosidad, mejorar la disponibilidad de nutrientes y reducir la incidencia de NE (Brufau & Francesch., 2011).
Mejora de la digestibilidad
Enzimas Maíz
Proteína animal Glicina & metionina
Harina de pescado
Zn elevado
Trigo
Alta viscosidad Na elevado
K elevado
Cereales sin maíz
Baja capacidad de humedad
Figura
son potencialmente importantes la red de factores fisiopatológicos, medicinales, nutricionales y de crianza.
Aquellos con flechas y círculos azules son beneficiosos en el control de la enfermedad.
Los que tienen flechas rojas y cuadros de color claro indican un alto riesgo de enfermedad.
Las principales relaciones de alto riesgo se muestran mediante flechas naranjas de doble línea
AGP, promotor del crecimiento antibiótico; CIA, anemia infecciosa de pollo; CEP, producto de exclusión competitiva; Cp, Clostridium perfringens; IBD, enfermedad bursal infecciosa; MD, enfermedad de Marek; NE, enteritis necrótica. (Williams, et al., 2005).
Alto consumo de agua
Infecciones microbianas
Cama húmeda
Centeno & cebada
pH elevado
Almidón
α-toxina

Enteritis necrótica
Alta densidad
Ventilación
pobre
Bebedores con fugas
Contaminación de esporas
Rápida recogida de bajas
1. El síndrome intercurrente coccidiosis-NE:Antibióticos promotores de crecimiento
Resistencia antibiótica
CEPs & Lactobacillus

Anticoccidios ionóforos
Alta concentración de Clostridium
Perfringens
Intususcepción
Obstrucción intestinal
Parásitos
Coccidiosis
Atrofia de las vellosiddes
Proteína cruda elevada
Pérdidas de proteína
Daño intestinal
Anticoccidios sintéticos
Sacarosa & fructosa
Glucosa & lactosa
Baja absorción
Inmunosupresión
Vitamina A
Oocistoticidas
Acidificación de la cama
pH bajo Ácidos orgánicos en la dieta
CIA, IBD, MD
Se & vitamina E
Vacunas
Tripsina
Alimentación temprana
Consumo de yacija
Dieta alta en fibra
Trigo entero
Cambio de dieta
La proteína es el segundo ingrediente habitual de la dieta en aves, tanto sea animal como vegetal.
La secuenciación de C. perfringens demostró que no tiene capacidad de síntesis de la mayoría de aminoácidos, pero es capaz de descomponer proteínas mediante enzimas hidrolíticas propias (Shimizu et al., 2002).


Se ha demostrado que algunos aminoácidos, tales como glicina o la metionina, presentes en mayor cantidad en la proteína animal, pueden estimular el crecimiento de C. perfringens y la producción de alfa-toxina induciendo enteritis necrótica en pollo (Shojadoost et al., 2012).

Debido a las diferentes concentraciones de aminoácidos, se ha observado que la capacidad de proliferación de la bacteria usando proteína vegetal es inferior que con proteína animal (Drew et al,. 2004). Por lo tanto, la fuente de proteína usada en las dietas tiene una afectación directa sobre el desarrollo de NE.

El tercer componente de la dieta que puede influir en la aparición de NE por C. perfringens son las grasas.
La inclusión de grasas animales tiende a mejorar el peso corporal final comparado con los aceites vegetales no saturados. Aun así, tras un desafío con C. perfringens, se observó que este bacilo puede afectar la digestión y absorción de grasas animales a través de la desconjugación de sales biliares.

Aunque, se ha demostrado que la incidencia de C. perfringens se reduce significativamente en los pollos alimentados con aceite de soja en comparación con grasa animal (Knarreborg et al., 2002).
La interacción entre el patógeno y el origen de la grasa no afecta de forma determinante el rendimiento del animal, cabe resaltar los cambios significativos observados en la fermentación gastrointestinal (disminución del pH) apreciados con el consumo de grasa animal en animales infectados con C. perfringens
Por otro lado, la acidificación digestiva que se produce sugiere efectos indirectos del patógeno sobre la actividad y densidad de la microbiota indígena beneficiosa ( Józefiak et al., 2014 ).
Actualmente existe un gran interés en investigar y conocer la influencia de la aplicación de componentes y/o aditivos, tales como probióticos, prebióticos, aceites esenciales, ácidos orgánicos y enzimas, sobre la microbiota del intestino de las aves.
Aunque se conocen sus propiedades en la mejora del rendimiento del animal, sus efectos de protección de la microbiota beneficiosa, estructura gastrointestinal y su capacidad de inducir una respuesta inmunitaria dirigida aún no se conocen con detalle.

La microbiota ruminal constituye una comunidad microbiana diversa, y altamente específica en relación a sus funciones metabólicas, que son esenciales para el desarrollo, salud y nutrición del rumiante (Morgavi et al., 2010).
Los principales microorganismos del rumen se clasifican en bacterias, protozoos, arqueas metanogénicas, hongos y virus (Figura 1).

Bacteria

~1.000 especies 1010 a 1011cel/ml

Se estima que en el ecosistema ruminal existen más de 2.000 especies distintas (Denget al., 2008), pertenecientes filogenéticamente a los dominios Bacteria, Archaea y Eucarya.

La mayor parte de estos microorganismos no han sido aún cultivados pero la aplicación de técnicas moleculares ha permitido estimar que, por ejemplo, las bacterias ruminales representan más de 10000 filotipos (Yu et al., 2006).



Hongos
~30 especies <105 cel/ml
La microbiota ruminal es dinámica y puede verse afectada por diversos factores, tales como la dieta, la especie o la edad del animal, la zona geográfica en la que se asienta una determinada explotación ganadera o la estación del año (Zhou et al., 2010).
Protozoos
~40 especies <105 cel/ml
Arqueas
metanogénicas
~14 especies <106 a 108 cel/ml
La importancia de la composición de la microbiota ruminal viene determinada por su relación directa con alteraciones metabólicas (como acidosis) y con la eficiencia productiva del animal
Figura 1. Principales microorganismos del rumenDiversos trabajos desarrollados en la última década han mostrado la relación directa que existe entre la composición de la microbiota ruminal y la eficiencia productiva del animal rumiante.

En particular, en el ganado vacuno de leche (Ben Shabat et a., 2016) se ha demostrado que animales con una producción lechera mayor en relación a la ingestión de alimento (1.62 vs. 1.32 kg leche/kg ingesta), la población microbiana es muy distinta, lo que genera un patrón de fermentación ruminal más eficiente (mayor propionato y butirato y menos metano, Figura 2).

Por tanto, existe un componente genético importante que determina la composición de la microbiota; sin embargo, con estrategias alimenticias adecuadas se puede también modular la composición microbiana hacia una situación de mayor eficiencia.
En este capítulo nos centraremos en tres aspectos fundamentales que potencialmente pueden modular la microbiota del rumen:
Tipo de ingredientes en la dieta
Empleo de aditivos alimentarios
Intervenciones en edades tempranas del animal
El factor ambiental más importante que determina el tipo de microbiota del rumen es el sustrato que los microorganismos tienen para fermentar, es decir, la dieta que el animal recibe.

En un estudio reciente que analizó a nivel mundial la composición de la microbiota ruminal de 32 especies de rumiantes en 35 países distintos de los 5 continentes se evidenció que por encima de la especie animal y la localización geográfica, la dieta es el factor principal (Henderson et al., 2015).
Debido a su mayor abundancia y diversidad filogenética y metabólica, las bacterias son el grupo de microorganismos ruminales que responden de manera más clara a los cambios en la composición de la dieta en comparación con protozoos, arqueas y hongos ruminales.
Esto explica por qué en la mayoría de los estudios del microbioma ruminal el esfuerzo se centra en entender los cambios que se producen sobre la población de bacterias
En animales alimentados con dietas a base de forraje los grupos Ruminoccoccus y Bacteroides son más abundantes, ya que contienen un repertorio genético muy amplio de degradación de polisacáridos complejos Por otro lado, las dietas con un contenido en concentrado prevalecen los grupos Prevotella y Succinivibrionaceae, que son los mayores productores de succinato y propionato
Aunque, el ecosistema ruminal es muy redundante, es decir, tiene un amplio rango de microorganismos que llevan a cabo la misma función, los animales con eficiencias digestivas mayores tienen una población bacteriana menos diversa (Ben Shabat et al., 2016) así como una menor concentración de protozoos ruminales
Esto puede estar relacionado sin duda con el tipo de alimentación que se emplea en los sistemas de producción intensiva, que no desarrollan el potencial evolutivo de los rumiantes en cuanto a su capacidad de degradar material lignocelulósico.
A este respecto, los hongos ruminales son especialistas en la digestión de sustratos lignocelulosícos.
Por su parte los protozoos ruminales generalmente digieren carbohidratos sencillos, sin embargo algunos géneros concretos como Epidinium, Polyplastron y Eudiplodinium poseen una considerable actividad endoglucanasa, lo que fomenta una mejor digestión de carbohidratos estructurales en el rumen.
La mayoría de los protozoos ruminales y en especial los Entodiniomorfos son depredadores de bacterias ya que estas últimas representan su principal fuente de proteína (Belanche et al., 2012a).



Por contrario los protozoos Holotricos poseen una menor capacidad predatoria pero una mayor implicación en la producción de metano entérico (Belanche et al., 2015).
Como consecuencia de ello, la completa eliminación de los protozoos del rumen (defaunación) se ha demostrado que posee efectos positivos sobre la eficiencia de utilización de la proteína dietética, así como sobre las emisiones de metano, si bien la digestión de la fibra puede verse ligeramente comprometida (Newbold et al., 2015).
Por lo tanto, la reducción de los niveles de protozoos ruminales que frecuentemente se observa en los animales más eficientes (Belanche et al 2012b), así como la modificación de las proporciones de los diferentes grupos protozoarios, podría explicar tales diferencias en su eficiencia.
Ingestión materia seca
Crecimiento medio diario
Producción de lana
Digestbilidad total materia orgánica
Digestibilidad total proteína bruta
Digestiblidad total FND
Digestibilidad total FAD
Excreción de N urinario
Excreción de N fecal
Balance de N
Balance energético
Producción de calor
Emisiones de metano
Emisiones de dióxido de carbono
Eficiencia energética mantenimiento (Km)
Eficiencia energética engorde (Kf)
Flujo duodenal de N no amoniacal
Flujo duodenal de N microbiano
Flujo duodenal de ácidos grasos saturados
Flujo duodenal ácidos grasos monoinsaturados
Flujo duodenal ácidos grasos poliinsaturados
Figura 3. Efecto de la defaunación ruminal sobre los parámetros productivos
Eficiencia de síntesis de proteína microbiana
Parámetros de producción animal Tamaño medio del efectoCompuesto Mecanismo de acción Efecto
Aceites esenciales Desestabilización de membranas microbianas e intercambio iónicos
Inhibición de arqueas metanogénicas (flavonoides)
Taninos Formación de complejos con proteínas que impiden su degradación
Saponinas Reducción de la población de protozoos
Organosulfurados Alteración de la síntesis de lípidos de arqueas metanogénicas
3-nitrooxypropanol Inhibición de la actividad de la methyl coenzima reductasa
Levaduras tipo Saccharomyces cerevisiae
Incremento de la actividad de bacterias consumidoras de lactato
Reducción de la desaminación en el rumen y mejora la síntesis de proteína microbiana
En los últimos años y, especialmente tras la prohibición en Europa del uso de los antibióticos en la dieta del ganado como promotores del crecimiento, se ha estimulado la búsqueda de aditivos que modulen la actividad ruminal y puedan emplearse como sustitutos de los antibióticos.
Existe una gran diversidad de compuestos en el mercado o en desarrollo.
Reducción de la producción de metano
Incremento del flujo de proteína al rumen. Reducción de la producción de metano
Incremento de la síntesis de proteína microbiana
Reducción de la producción de metano
Entre los derivados de plantas se encuentran: flavonoides, saponinas, taninos, aceites esenciales (puros o combinados) y compuestos organosulfurados
Entre los compuestos de síntesis se puede destacar: ácidos grasos, ionóforos, halogenados y otros compuestos de producción aún experimental
Los probióticos más empleados en nutrición de rumiantes son las levaduras (tanto activadas mediante cultivo o pre-activadas), fundamentalmente Saccharomyces cerevisiae
Reducción de la producción de metano
Amortiguación bajada de pH ruminal, incremento degradación de la fibra
En la tabla adjunta se incluyen los factores principales que ejercen los compuestos más conocidos sobre la microbiota y fermentación ruminal.
En contraposición a la resistencia del ecosistema microbiano a ser alterado de manera sustancial en el animal adulto (Weimer et al., 2010), el animal pre-rumiante ofrece una oportunidad de intervención durante el proceso primero de colonización tras el nacimiento.
La rumia requiere aproximadamente 2 meses en establecerse de manera funcional en el rumiante joven El desarrollo del rumen consta de 3 procesos paralelos e interconectados (Yáñez-Ruiz et al., 2015):

Desarrollo del órgano per se, del epitelio y de su masa muscular
Desarrollo de la funcionalidad en relación a su la fermentación anaerobia y la actividad enzimática
La colonización microbiana por bacterias, protozoos, hongos, virus y arqueas
El rumen es colonizado en la primera semana de vida, mucho antes de que comience la ingesta de alimento sólido, y que alcanzan concentraciones similares a las del rumen adulto tras el primera mes de vida (Yáñez-Ruiz et al., 2015).
Esta colonización tan temprana representa una oportunidad de intervención en cuanto a la ocupación de distintos nichos ecológicos y la tolerancia inmunitaria del animal a los microorganismos que colonizan, asumiendo que hasta que el ecosistema se coloniza y estabiliza hay una ventana de tiempo con una alta plasticidad que permita cierta manipulación y, sobre todo, que los cambios producidos permanezcan en el animal adulto (Figura 4).
Modulación de la colonización microbiana durante el desarrollo del rumen

Aditivos Probióticos
Animal más eficiente
Figura 4. Concepto de programación microbiana del rumen Intervención nutricionalEl grupo de investigación de la Estación Experimental del Zaidín ha descrito recientemente que el patrón de colonización microbiana es muy distinto en animales criados en lactancia natural (con la madre) y artificial (con lactoreemplazante) (Abecia et al., 2014).
Estas diferencias se deben fundamentalmente a la presencia de un animal adulto que actúa como fuente de inóculo microbiano (la madre) o, en contraposición, la ausencia de contacto con animales adultos en el caso de aislamiento tras el nacimiento.
Por tanto, cualquier estrategia de intervención en edades tempranas debe considerar ambos sistemas, puesto que el alcance y persistencia de los efectos pueden variar significativamente.
Así, hemos descrito recientemente el potencial de:
Empleo de aditivos inhibidores de la actividad de las arqueas metanogénicas (como bromoclorometano) durante el pre y postdestete y el efecto beneficioso que tiene en la ganancia media diaria de crías de caprino (Abecia et al., 2013). Esto se debe a que parte de la energía que no se pierde como metano se redirige a la síntesis de propionato que es energéticamente más eficiente para el animal.
Uso de cultivos vivos de levaduras hasta los 3 meses de edad para reducir la incidencia de acidosis cuando los animales alcancen la edad adulta y su etapa productiva y sean sometidos a dietas acidóticas (Abecia et al., comunicación personal). La administración de levaduras en el rumen ejerce un efecto positivo sobre algunas bacterias consumidoras de lactato como Selenomonas ruminantium y Megasphaeara elsdenii (Pinloche et al. 2013) lo que alivia las caídas bruscas del pH ruminal (Figura 5).
Los trabajos de administración de levaduras en animales jóvenes promueve una mejor respuesta del animal adulto por el recuerdo que ya existe en el rumen al haber sido administrado en etapas anteriores.
Figura 5. Efecto de administración de levaduras en edades tempranas sobre la disminución del pH ruminal en cabras lecheras, simulado in vitro
Actualmente estamos evaluando el uso de líquido ruminal como probiótico para programar el desarrollo microbiológico y fisiológico del ecosistema ruminal a un sistema de producción especifico (forraje vs concentrado).

En los cerdos, como en la mayoría de las especies, la microbiota está en equilibrio entre los microbios saprófitos y los microbios patógenos... y mientras este equilibrio se mantenga, los patógenos tendrán muchas trabas para ejercer su efecto patogénico.

Cuando se rompe este equilibrio nos encontramos ante una disbiosis, palabra que significa literalmente, según sus raíces latinas, un “fallo en la vida”.
Cuando hablamos de lechones, estos desequilibrios en los componentes de la flora intestinal suele conducir a la aparición de enfermedades graves cuyo principal síntoma es la diarrea.
Hay diversos factores que pueden producir una disbiosis.
Se sabe que en la proporción y cantidad de bacterias intestinales influyen:



El estado del sistema inmune del cerdo
El estrés
La presión de infección de patógenos
La competencia por sustratos tales como los aminoácidos o los minerales
Algunos de los factores nutricionales incluidos en la dieta
Hoy, no nos queda más remedio que entender cómo estos últimos modulan la microbiota, puesto que hasta ahora las enfermedades digestivas de los lechones se paliaban o prevenían en gran medida mediante la adición de antibióticos o minerales como el cinc a la dieta (Hampson, 1994).
La flora habitual de los lechones, se compone tanto de bacterias:
Gram positivos como Streptococcus, Lactobacillus, Bifidobacterium, Peptostreptococcus, Ruminococcus, Clostridium y Escherichia
Estas herramientas antimicrobianas van a ir desapareciendo por motivos de salud pública y medioambiental y por tanto, nuestras estrategias profilácticas tendrán que cambiar rápidamente en el medio-corto plazo.
Una de las mejores opciones que se nos presenta es introducir factores nutricionales que modulen la actividad y cantidad de microbiota presente, y así evitar que proliferen los patógenos.
Gram negativos como Fusobacterium, Bacteroides, Selenomonas, Butyrivibrio y Prevotella
Revisemos algunos factores nutricionales que afectan al equilibrio en esta microbiota, sabiendo que, sin duda, los más importantes son las proteínas y los carbohidratos, o lo que es lo mismo:
Es bien conocido que las características cuantitativas y cualitativas de la proteína incluida en la dieta puede conducir a una proliferación de bacterias proteolíticas patogénicas, sobre todo de los géneros Bacteriorides, Clostridium y Escherichia
Pese a que la mayoría de las proteínas tanto exógenas como endógenas se degradan en las porciones más proximales del tracto gastrointestinal, siempre una parte de ellas llega hasta zonas más distales y allí se metabolizan.
Este fenómeno se agudiza cuando la dieta tiene un exceso de proteína o pocos hidratos de carbono disponibles
De hecho, hace más de 35 años que se sabe que dietas ricas en proteína predisponen a los lechones a padecer diarrea relacionada con E. coli
Esta degradación de proteínas en el intestino produce diversos metabolitos como los ácidos grasos de cadena ramificada o sustancias potencialmente tóxicas como amoniaco, aminas, índoles y fenoles.
Una de las formas de controlar la disponibilidad de proteína en el tracto gastrointestinal podría ser seleccionando fuentes de proteína muy digestibles como la caseína o proteínas de origen animal.
Aunque en diversos estudios se demuestra que la proteína de soja sigue siendo una de las mejores en cuanto a control de microbiota, probablemente porque la harina de soja no solo tiene un alto contenido en proteína, sino también en carbohidratos fermentables, hecho que normalmente es infravalorado.

Con respecto a los carbohidratos, su fermentación supone la principal fuente de energía en el intestino y se sabe que la adición de ciertos tipos de almidones resistentes, polisacáridos no amiláceos y oligosacáridos no digestibles mejora la proliferación de bacterias beneficiosas en el intestino.

El resultado es que, además, aumenta la producción de ácidos grasos de cadena corta como acético, propiónico o butírico que se pueden usar como fuente de energía por el cerdo, pero que también tienen un efecto antimicrobiano selectivo sobre ciertos patógenos.
Su producción proporciona un ambiente ligeramente ácido en el lumen intestinal controlando la proliferación de bacterias ácido-sensibles como Salmonella y E. coli
Estos géneros juegan un papel clave en la inhibición de la colonización por bacterias patógenas por un mecanismo conocido como exclusión competitiva, lo que ocurre por una competición más eficaz por los nutrientes o los lugares de adhesión.
El origen de los carbohidratos también es importante. Se sabe que la inclusión de materias primas como el arroz cocinado con proteínas de origen animal o vegetal, disminuye de manera muy importante la prevalencia de diarreas por E. coli en lechones al destete.

En definitiva, según Lange et al. (2010), el uso de carbohidratos no digestible fermentables (como la pulpa de remolacha o los fructooligosacáridos) parece ser la estrategia más prometedora para modular la microbiota beneficiosa en el cerdo.
La inclusión de carbohidratos fermentables a una dieta, aun siendo rica en carbohidratos fermentables de origen cereal, puede controlar cualquier potencial efecto negativo que se derive de la variación del nivel o fuentes de proteína sobre la composición o actividad bacteriana en el intestino, promoviendo la proliferación de bacterias beneficiosas, sobre todo de Lactobacillus y Bifidobacterium.
Figura 3. Efecto de la defaunación ruminal sobre los parámetros productivosLa cantidad de fibra puede influir en la proliferación de bacterias y la salud intestinal.
La fibra dietética puede regular selectivamente las bacterias intestinales, estimulando el crecimiento de bifidobacterias y lactobacilos e inhibiendo el crecimiento de E. coli y Clostridium.
En concordancia, Heinritz et al. (2016) demuestran que dietas pobres en fibra ayudan a la proliferación de Clostridium y Bacterioides en intestino delgado y ciego.
La grasa, aunque desde luego no es el factor que más influencia tiene en la microbiota de los cerdos, potencialmente puede ejercer algún efecto modulador, observándose una mayor cantidad de bacterias del género Bacterioides en el colon de cerdos alimentados con dietas ricas en grasa.
Simbióticos
La fuente de fibra también es clave, así:
La fibra procedente de salvado de trigo reducen la presencia de E. coli y por tanto la prevalencia de diarreas al destete
Otras fibras como la de guisante no reduce el número de E. coli pero sí su adhesión y por tanto aumenta la excreción fecal de la bacteria
La fibra de soja contiene cierto elementos fácilmente metabolizables que podría favorecer la proliferación de E. coli
Modulación de la microbiota
Efectos sobre el huésped
Probióticos Prebióticos (por ej. AGCC)


Dieta
Tratamiento del huésped
Preventiva Curativa
Homeostasis del huésped
Disbiosis del huésped
Patógenos Comensales
Comensales
Carga microbial del huésped

La microbiota del animal puede modificarse añadiendo a la dieta elementos digestibles o no digestibles.
Adaptado de Montalbán-Arques et al. (2015)
Patógenos
Figura 1. Carga microbiana del animal en estado de salud y de disbiosis.Las opiniones de los consumidores y legisladores han evolucionado en los últimos años con respecto al uso de antibióticos, y los productores avícolas cada vez más aumentan el número de animales criados sin antibióticos.
Mientras docenas de países ya han prohibido el uso de antibióticos promotores del crecimiento, muchos lugares donde su uso no está prohibido han visto un aumento en la demanda de productos libres de antibióticos.
El objetivo de este artículo es discutir el desafío principal al que enfrentan los productores para implementar programas libres de antibióticos, prevenir la enteritis necrótica y ofrecer soluciones potenciales para ayudarles en una transición exitosa.
Las soluciones se centrarán en mejorar la salud intestinal para prevenir la enteritis necrótica.
Los programas estándares libres de antibióticos (ABF, por sus siglas en inglés) prohíben el uso de varios agentes antibacterianos, incluyendo los antibióticos promotores de crecimiento, los antibióticos terapéuticos y los ionóforos
Los programas de alimentación que incluyen antibióticos promotores del crecimiento (AGPs, según sus siglas en inglés) los contienen de manera continuada a niveles bajos (sub terapéuticos) para mejorar el rendimiento, la salud de los lotes y la uniformidad de la manada, reducir las infecciones bacterianas y los desafíos subclínicos.
Los antibióticos terapéuticos se utilizan para tratar enfermedades bacterianas al impedir el crecimiento bacteriano patógeno, siempre que se utilicen a niveles recomendados y el patógeno no sea resistente.
El tratamiento de los brotes clínicos acorta la duración de la enfermedad y reduce la propagación de las bacterias, disminuyendo la mortalidad.
Los ionóforos son una clase de antibióticos utilizados únicamente con el propósito de prevenir la coccidiosis: un factor predisponente bien conocido para la enteritis necrótica.
Eliminar los antibióticos en los programas de ABF genera preocupaciones lógicas en los productores con respecto al rendimiento, la uniformidad de los lotes y la incidencia de la enfermedad, particularmente sobre la enteritis necrótica y otros patógenos bacterianos.
Además, dado que los animales tratados con un antibiótico deben ser eliminados del programa, la decisión de no tratar las aves puede provocar problemas de salud y bienestar, e incluso aumentar la mortalidad por enfermedad.
1
La infección por coccidios, resultante de un brote de enfermedad natural o de la introducción a niveles bajos a través de la vacunación con vacuna viva, puede dañar el epitelio intestinal, permitiendo la fuga de proteínas plasmáticas al lumen intestinal. Un rico sustrato nutritivo que C. perfringens puede aprovechar para su proliferación y para intoxicar el ave.

Esto hecho puede reducir el rendimiento productivo y predisponer a las aves a padecer enteritis necrótica.
Al eliminar los ionóforos, la gestión de la coccidiosis debe basarse en los coccidiostáticos, o en las vacunas viva contra la coccidiosis, o más probablemente, en una rotación entre los dos
2La dieta constituye un factor de riesgo clave que tiene un fuerte impacto en la incidencia de enteritis necrótica en pollos de engorde.
Micotoxinas
Como la que se encuentra en las proteínas animales -harina de carne y hueso, o harina de pescado- no pueden ser digeridos eficientemente y absorbidos en la parte superior del tracto intestinal.
La proteína no digerida se acumula en la porción inferior del tracto intestinal, pudiendo actuar entonces como sustrato para el crecimiento de patógenos.
La fermentación de la proteína produce subproductos tóxicos tales como aminas tóxicas y amoníaco, que provocan el aumento del pH intestinal y estimulan la proliferación de bacterias patógenas.


Harina de pescado
La reducción de la absorción de estos nutrientes y la pérdida de proteínas plasmáticas en el lumen debido al proceso patológico que sufre la ave resulta en un aumento de la concentración de proteína en el lumen intestinal, lo que proporciona un perfecto sustrato para la proliferación de C. perfringens.
Metabolitos tóxicos de hongos producidos por los mohos comunes que se encuentran en muchos componentes de las dietas de las aves de corral —pueden reducir directamente la integridad intestinal y generar la disminución de la absorción y la digestión de nutrientes presentes en la dieta, al aumentar la permeabilidad de la barrera intestinal. Además, las micotoxinas también afectan negativamente a la inmunidad y tienen una fuerte correlación con las infecciones entéricas (Tabla 1).
Afectados solo por Cp – + 20 ± 2,6b
Afectados por Cp + DON + + 47 ±3.0b
Afectados solo por DON + – 0 ±0.0
Control negativo – – 0 ±0.0
Tabla 1. Impacto de DON en el porcentaje de aves afectadas por enteritis necrótica (EN) Grupo DON C.perfringens (Cp) % de animales con EN lesionesEl período inmediato post-incubación es un momento crítico para el desarrollo del tracto intestinal de un polluelo.
Los cambios que ocurren durante este periodo dependen enteramente de una colonización microbiana apropiada.
Probióticos 1
La aplicación de cepas probióticas vivas específicas para aves de corral en la cría, e inmediatamente después de su desplazamiento a la granja, proporciona una oportunidad ideal para que las bacterias beneficiosas colonicen el tracto digestivo antes de que los pollos estén expuestos a bacterias y hongos potencialmente patógenos en la granja comercial, ayudando al desarrollo del tracto digestivo y protegiéndolos contra las infecciones entéricas (Tabla 2).

Control negativo 0.29b 0/50 (0%) 1.00b
Control positivo 1.33a 13/50 (26%) 3.42a
Probiótico 0.29b 3/50 (16%) 1.90b
Tabla 2. Efecto de los probióticos sobre el grado de lesiones, la mortalidad y recuento de UFC de C.perfringens en aves sometidas a enteritis necrótica en un desafío experimental
Grado de lesiones Mortalidad Log10 UFC/g2 3
Una forma de reducir el crecimiento y la actividad patógena es limitar su acceso a las proteínas, una fuente nutritiva clave.
Muchos productores cambian a una dieta totalmente vegetal, por ejemplo.
Otro opción es aumentar la digestibilidad de los nutrientes para que sean absorbidos y utilizados por las aves en lugar que por los patógenos.
En este sentido, los aditivos fitogénicos con la combinación correcta de aceites esenciales, extractos de plantas y hierbas son capaces de aumentar la actividad enzimática digestiva endógena, en particular las proteasas, para que el ave tenga mayor capacidad de descomponer y absorber proteínas y otros nutrientes, aprovechandolos y haciéndolos inaccesibles ya para los patógenos (Figura 1).
La mejora en la utilización de nutrientes se traduce en un mayor rendimiento y una mejor eficiencia de conversión alimenticia (Tabla 3).
Los probióticos y los aditivos fitogénicos, con o sin el uso de coccidiostáticos o vacunas, ayudarán a aliviar los efectos negativos de la coccidiosis.
Se ha demostrado que reducen el desprendimiento de ooquistes, la gravedad de las lesiones intestinales y los efectos adversos en el rendimiento, demostrando su estatus como prometedoras "alternativas anticoccidiales".
La contaminación por micotoxinas también plantea una grave amenaza para la producción de ganado y aves a nivel mundial.
Dado los numerosos efectos nocivos de las micotoxinas, es esencial un programa adecuado de gestión del riesgo de micotoxinas. Con el uso de enzimas que biotransforman las micotoxinas se preserva la integridad intestinal.
Los principales retos a los que se enfrentan los productores al pasar a sistemas ABF (sistemas libre de antibióticos) inciden sobre la salud intestinal y la prevención de la coccidiosis y la enteritis necrótica.
Cambiar a un programa ABF (sistemas libre de antibióticos) requiere un cambio de paradigma
No hay una solución única que pueda actuar como un sustituto de los antibióticos.
Serán necesarios numerosos ajustes para obtener el éxito y un programa de salud intestinal consistente debe ser un componente esencial para acometer los objetivos productivos
 José Mª Ros
Business Development Manager Gut Health Perstorp Feed & Food
José Mª Ros
Business Development Manager Gut Health Perstorp Feed & Food
El incuestionable progreso de la industria avícola se explica por el aumento de la demanda global asociada al desarrollo económico y al imparable progreso de la mejora de los resultados productivos que no dejan de ser impactantes.
En los datos de la Tabla 1, se puede observar la evolución y mejora de los resultados productivos en la avicultura de carne.
El peso vivo de los pollos a las 6 semanas de vida ha aumentado un 122% en relación con los pesos de 1970
El índice de conversión se ha reducido cerca del 30% mientras que el rendimiento de pechuga es casi el doble
El rendimiento de canal también ha sido incrementado en un 16,8%
Un incremento del rendimiento de canal supone que el desarrollo de los tejidos que demandan nutrientes (músculos y huesos) ha sido superior al de los órganos que aportan nutrientes (cardio-respiratorio y digestivo)
El pollo moderno ha aumentado enormemente su capacidad de crecimiento, ya que ganan mucho más peso y más rápidamente, pero sus sistemas digestivo y respiratorio son proporcionalmente menores
Esto supone que los órganos que se encargan de proporcionar los medios para el crecimiento han tenido que incrementar muy significativamente su rendimiento, implicando un sobreesfuerzo que necesariamente se traduce en una mayor propensión a disfunciones y patologías - ascitis, estrés térmico, problemas entéricos-.

El sistema digestivo es particularmente complejo ya que, además de ser el responsable de digestión y absorción de nutrientes, es el principal órgano inmunitario y actúa como barrera frente agentes físico-químicos o microbianos potencialmente patógenos
El el sistema digestivo, la resiliencia, o capacidad de recuperación de los tejidos tras las agresiones, es un factor clave para una producción eficiente y competitiva de las manadas.
El tracto digestivo sufre el paso constante de un alimento que digiere y absorbe, pero del que debe protegerse porque, además de nutrientes, es portador de toxinas y patógenos.

La misma estructura físico-química del pienso puede ser un factor de agresión para la mucosa intestinal en función del tamaño y dureza de sus partículas o las características y concentración de alguno de sus componentes.

Pero además, las muy elevadas exigencias productivas sobre las aves, su altísima especialización, la progresiva limitación del uso de antibióticos y la presión económica sobre la eficiencia y la rentabilidad convierten al sistema digestivo en un elemento muy vulnerable y clave para una producción avícola económicamente viable.
Herramientas como:
Vacunas
Programas de bioseguridad
Instalaciones con control ambiental
Reducen de forma muy significativa los riesgos para la salud de las aves pero, a pesar de todo ello, el digestivo sigue siendo el sistema con mayor carga de agresiones sobre su integridad física y funcional
Por este motivo el concepto de salud digestiva está ocupando rápidamente un mayor espacio en los debates técnicos de la producción ganadera en general, pero muy particularmente en la avicultura.
El equilibrio entre desarrollo y maduración del tracto digestivo, microbiota y sistema inmunitario está permanentemente amenazado por patógenos, toxinas, y factores ambientales o de manejo

La salud intestinal, y por tanto, la capacidad de obtener unos óptimos resultados productivos, está condicionada por distintos elementos que, en condiciones óptimas, interactúan en favor de una óptima condición digestiva:
Desarrollo y maduración de todo el tracto digestivo
Microbiota
Sistema inmunitario.
La capacidad de prevenir, resolver y/o recuperar a las aves frente a cualquiera de estas amenazas (resiliencia) es un factor esencial para el éxito de las explotaciones ya que la pérdida del equilibrio en la salud digestiva implica pérdidas en los resultados productivos y por lo tanto de su rentabilidad y competitividad.
Es conocido que los ácidos acético, propiónico y butírico están presente de forma natural en el intestino de mamíferos, aves y peces.
Son subproductos de la fermentación de la fibra digestible y azúcares no solubles, a los que se les conoce por ser una excelente fuente de energía para enterocitos y colonocitos, pero también por su capacidad bactericida y/o bacteriostática frente a enteropatógenos. Ambos aspectos estan estrechamente relacionados con la capacidad de desarrollo y autodefensa de sistema digestivo.
in amación y estatus oxidativo
A este respecto, de estos 3 ácidos grasos de cadena corta (AGCC), el butírico ha sido el más estudiado por haber demostrado, de forma muy consistente, que interviene de activamente en otros numerosos procesos fisiológicos que favorecen el desarrollo sano y equilibrado de este sistema.
Control de la inflamación
Equilibrio de la microbiota
Regulación de la respuesta inmune
Favorecer la reparación de los tejidos lesionados
Factores que intervienen de forma directa en la resistencia y la capacidad de recuperación tisular frente a las agresiones.
motilidad intestinal
absorción de nutrientes
Ácido butírico
energía para colonocitos síntesis de mucus producción de citoquinas control de patógenos
proliferación, diferenciación y maduración celular control del efecto barrera intestinal
En la Figura 1, basada en una revisión de bibliografía técnica del INRA, se enumeran efectos demostrados del ácido butírico a nivel intestinal.
regulación de la apoptosis
 Figura 1. Efectos de ácido butírico a nivel intestinal (Basado en Guilloteau et al., INRA 2010)
Figura 1. Efectos de ácido butírico a nivel intestinal (Basado en Guilloteau et al., INRA 2010)
Se puede considerar los AGCC, y en particular al ácido butírico, como un mecanismo de defensa natural desarrollado por los animales superiores en simbiosis con la flora intestinal para proteger el sistema digestivo, estructura esencial para la vida de los primeros, y ecosistema para la segunda.
Brevemente comentamos algunos de los efectos positivos del ácido butírico sobre aspectos clave de la salud intestinal.
El ácido butírico es una excelente fuente de energía para enterocitos y colonocitos.
Su presencia se asocia al rápido desarrollo de las vellosidades intestinales y recuperación de lesiones.
Butírico añadido en broilers desafiados con Eimerias o con modelos de enteritis necrótica han demostrado una menor incidencia de lesiones y mejores resultados productivos (Antogiovanni, 2005; van Driessche, 2015).

1Así mismo, la inclusión de butírico en la dieta, también se asocia con una mayor actividad de las células caliciformes, secretoras de mucus que establece una barrera físicoquímica frente a los patógenos presentes en la luz intestinal (Barceló, 2000; Manzanilla, 2006).
Por último, también se ha demostrado el papel de refuerzo de las uniones entre enterocitos (tight-junctions), reduciendo la permeabilidad de la mucosa y por tanto, las posibilidades de que agentes patógenos o toxinas atraviesen la pared intestinal y entren en el sistema circulatorio (Huuskonen, 2004; Hou, 2015).

El intestino está en un estado de inflamación permanente como resultado del contacto e intercambio constante con elementos externos. Esto supone un coste energético para las aves que repercutirá en una menor eficiencia productiva y los procesos inflamatorios se exacerban como respuesta a la presencia de posibles agresores (Eimerias, E. coli, Clostridios, toxinas, etc)


El ácido butírico ha demostrado tener un activo papel modulador de la inflamación mediante el control de la liberación de citoquinas pro-inflamatorias (Andoh, 1999; Li, 2015; Zhang, 2011)
La modulación de la respuesta inflamatoria permite reducir el impacto económico.
Evita la reducción de capacidad de absorción de nutrientes
Disminuye el consumo extra de energía asociado a la respuesta inflamatoria
Facilita la recuperación de la normalidad tras las agresiones
El ácido butírico tiene un papel relevante en la respuesta inmunitaria al favorecer una respuesta rápida a nivel local.
Protección de la mucosa intestinal mediante la activación de péptidos de defensa en la luz intestinal y macrófagos (Raquib, 2006; Zeng, 2013)
Regulación de la proliferación de linfocitos (Hou, 2014; Cavagliery, 2003)
La producción de citoquinas antiinflamatorias
Otro papel de defensa importante del ácido butírico es el refuerzo de la barrera intestinal mediante el incremento de la expresión de las proteínas encargadas de las uniones entre los enterocitos (Tight junctions) que dificultan el paso de patógenos y toxinas a tejidos y sistema circulatorio. (Peng, 2009; Hou, 2015).

El ácido butírico desencadena una respuesta a nivel local y para obtener el mayor beneficio, debe ser suministrado de forma que llegue de la forma más eficiente posible al intestino.
Los productos basados en ácidos recubiertos han sido la forma más eficiente de suministrar butírico, pero recientemente están disponibles en el mercado los glicerol-ésteres de ácido butírico, conocidos comúnmente como butirinas.
Las butirinas, y más concretamente las tributirinas son la fuente de ácido butírico de liberación específica en el intestino más concentrada. Son moléculas muy estables frente a los procesos de fabricación del pienso y al pH gástrico, que liberan el ácido butírico al entrar en contacto con las lipasas digestivas en el intestino.

A pesar de ser productos relativamente nuevos en el mercado, la investigación sobre sus modos de acción y efectos ya es muy concluyente y nos permite disponer de un conocimiento muy detallado sobre sus diversos mecanismos de acción

Nadia Yacoubi a,b, Filip Van Immerseel b, Richard Ducatelle b , Estelle Devillard c, Lamya Rhayat c , Estelle Nonnin & Luc Saulnier a
a INRA, UR1268 Biopolymers Interactions Assemblies
b Department of Pathology, Bacteriology and Avian Diseases, Faculty of Veterinary Medicine, Ghent University
c Adisseo France SAS, Centre of Expertise and Research in Nutrition
Enel trigo, el contenido en polisacáridos no amiláceos (NSP, por sus siglas en inglés) se sitúa entre el 12 y el 16% de la materia seca
El endosperma amiláceo NSP se compone básicamente de arabinoxilanos (AX), los cuales representan el 70% de las paredes celulares (Saulnier et al., 2012).
Los Arabinoxilanos se componen de una columna lineal de β-(1,4)- unidos a residuos de D-xilosa que están parcialmente substituidos por α-L-arabinosa unidos a través de O-2 y/o O-3 (Izydorczyk and Biliaderis, 1995).
Está bien demostrado que los NSP del endosperma del grano de los cereales ejercen un efecto antinutricional a través de cambios en la viscosidad debida a las propiedades otorgadas por su fracción soluble.
Las enzimas que degradan los polisacáridos no amiláceos (Enzimas-NSP) constituyen una categoría de aditivos seguros que mejoran la ganancia media diaria (GMD) y el índice de conversión (IC) en broilers (Mathlouthi et al., 2002a; b; Choct et al., 2004; Wang et al., 2005; Walk et al., 2011).
Las enzimas-NSP como las endo-1,4-β–xilanasas y endo-1,3(4)-β-glucanasas se están usando ampliamente, tanto individualmente como en combinación para reducir la viscosidad del contenido intestinal y potenciar el valor nutricional de las dietas a base de cereales. (Choct et al., 2004; Mathlouthi et al., 2002b).
Las Enzimas-NSP también incrementan la concentración de ácidos grasos de cadena corta (SCFA, por sus siglas en inglés) en el ciego (Choct et al., 1999) y modifican la composición de la microbiota (Van der Wielen et al., 2000).
Dado que no se explica claramente en la literatura cuáles son los sustratos liberados por las Enzimas-NSP que contribuyen favorablemente a incrementar la producción de ácidos grasos de cadena corta en el ciego (SCFA), se realizó este estudio con el objetivo de entender los efectos beneficiosos de las Enzimas-NSP, aislando polisacáridos no amiláceos solubles de trigo tratado o no con un complejo multienzimático (MEP).
Los polisacáridos no amiláceos solubles, se separaron según su tamaño en sub-fracciones de alto peso molecular (HMw) y bajo peso molecular (LMw) mediante técnicas cromatográficas.
Estas fracciones se caracterizaron según su composición química y características físico-químicas y su patrón de producción de ácidos grasos de cadena corta (SCFA) se determinó in vitro usando microbiota cecal de broilers.

Preparación multi-enzimática (MEP), obtenida por fermentación de Talaromyces versatilis sp.nov. (previamente denominado Penicillium funiculosum), en su forma líquida.
Este complejo multienzimático contiene principalmente xilanasa (5500 U/mL) y glucanasa (7500 U/mL).
El cultivar de trigo (Barok) , cosechado en 2012, se obtuvo en Francia y el Fructo-oligosacárido (FOS) en
El diagrama de flujo para el aislado de las fracciones de trigo se describe en la figura 1.
Tratamiento del grano
Lavados sucesivos con H2O/Etanol 70% /Hipoclorito sódico (NaOCl 4%)/ H2O) - Enjuague y secado a 40ºC
Molienda del grano a 0,5 mm
Extracción del agua
1/3, w/w, trigo/agua, 6 h a 40ºC
Centrifugación
Calentamiento del supernadante a 95ºC
Centrifugación
Fracción soluble en agua (WSF)
Precipitación en etanol
1/5 v/v, WSF/ etanol 96% a 4 ºC, 16 h
Centrifugación
Fracción insoluble en etanol (EIF)
Fraccionamiento del EIF –Fltración con Sephacryl S300 Gel
Fracción con alto peso molecular insoluble en etanol (HMw)
Fracción de bajo peso molecular insoluble en etanol (LMw)
Fracción soluble en etanol (ESF)
Figura 1. Diagrama de flujo para el procedimiento de separación de la fracción soluble en agua (WSF), fracción soluble en etanol (ESF), fracción insoluble en etanol (EIF), fracción con alto peso molecular insoluble en etanol (HMw) y fracción de bajo peso molecular insoluble en etanol (LMw).
Mediante Cromatografía de Gases (GLC), método Englyst y Cummings (1988), se determinó la composición en azúcares neutros del material inicial y las fracciones aisladas.
El contenido en proteína se determinó por método Kjeldahl (N x 6.25).
La reducción en azúcares finales en las fracciones HMw y LMw se determinaron como acetato de alditol por GLC como se describe por Courtin et al. (2000). La relación de la reducción de Xilosa sobre el total de Xilosa medida en las muestras permite calcular el grado medio de polimerización (DP) de la columna de xilano.
Se agrupó el contenido cecal de 10 broilers machos de 4 semanas de edad alimentados con una dieta de trigo sin aditivos y se utilizó como inóculo.
Se llevaron a cabo dos réplicas biológicas por lote en condiciones anaeróbicas a 38°C durante 24 h y por triplicado (Williams et al., 2005).
La concentración de SCFA en el líquido supernadante se determinó por cromatografía de gases, tal y como describieron Schafer (1994) y Zao et al.(2006).
Las concentraciones de ácido láctico se determinaron utilizando el kit D/L-Lactic acid (ref 023, Biosentec, Toulouse, France).
Se utilizó ANOVA para analizar los datos (IBM® SPSS® Statistics 22.0 software).
Los resultados están expresados como medias. Significancia estadística P ≤ 0.05.
de las fracciones de trigo
La composición química de las fracciones de trigo producidas con (MEP-tratado) y sin (No tratado) tratamiento enzimático se muestra en la tabla 1.
POR LA MICROBIOTA CECAL
La producción de SCFA y ácido láctico se cuantificó y analizó estadísticamente (Figura 2).
Tabla 1. Rendimiento, composición, peso molecular medio (Mw), viscosidad intrínseca y grado de polimerización de la columna de xilano (DP) de la fracción insoluble en etanol de alto peso molecular (HMw), fracción insoluble en etanol de bajo peso molecular (LMw) preparado con y sin degradación enzimática.
(SCFA) y
fracciones de trigo a 38°C durante 24h, bajo condiciones anaeróbicas, utilizando el contenido cecal como inóculo bacteriano. Se utilizaron como control un medio no suplementado (NC) y un medio suplementado con fructo-oligosacáridos (FOS). HMW:
la fermentación de
La muestra no tratada sub-fracción HMw contenía mayoritariamente arabinosa y xilosa de los Arabinoxilanos con un elevado peso molecular medio (Mw), viscosidad intrínseca y grado de polimerización medio del xilano comparado con la fracción MEP-HMw tratada.
Parte del Arabinoxilano se recubrió en la fracción LMw y reveló una disminución en el grado medio de polimerización (DP) como resultado de la acción de la endoxilanasa.
El tratamiento del grano con la preparación multienzimática (MEP) aumentó la solubilización de los arabinoxilanos y redujo su peso molecular (Mw).
Los fructo-oligosacáridos (FOS) utilizados como control positivo en la fermentación in vitro son oligosacáridos prebióticos conocidos por su capacidad de estimular el crecimiento de la microbiota beneficiosa (Laparra and Sanz, 2010).
De modo interesante, se vio que las fracciones MEPtratadas y especialmente la fracción LMw parecen tener un impacto similar en el crecimiento de la microbiota cecal e incluso un mayor impacto en la proporción de butirato.
Ambas fracciones LMw contenían una elevada proporción de glucosa que explica parcialmente en incremento de la concentración de SCFA (ácidos grasos de cadena corta) entre las fracciones HMw y las LMw, tal y como habían descrito anteriormente Persi et al.,(2002) y Wang et al.,(2004).
Sin embargo, los grupos MEP-tratados LMw produjeron significativamente más SCFA, en particular butirato, que las muestras no tratadas, lo que posiblemente sea debido a su contenido en Arabinoxilanos. El butirato juega un rol importante en la salud intestinal (Guilloteau et al., 2010) y es una fuente importante de energía para las células del epitelio gastrointestinal ya que incrementa su proliferación y diferenciación (Manzanilla et al., 2006; Mariadason et al., 1999). También disminuye la proliferación de linfocitos en monogástricos in vitro (Kyner et al., 1976; Cavaglieri et al., 2003).
La proliferación de bacterias butirogénicas en el ciego es conocida por su efecto protector contra las bacterias patógenas (Andoh et al., 1999; Fernández-Rubio et al., 2009; Guilloteau et al., 2010).
La combinación enzimática utilizada en este estudio solubilizó mayores cantidades de arabinoxilanos menos ramificados que estimularon la microbiota cecal

El tratamiento enzimático permitió solubilizar más polisacáridos y disminuir su peso molecular
Diversos estudios tanto in vitro como in vivo demostraron que los arabinoxilanos poliméricos son fermentados tres veces más lentamente que el almidón y producen mayoritariamente acetato, propionato y butirato (Lan et al., 2005; Lin et al., 2011; Rycroft et al., 2001).
Dependiendo de la polimerización y los grados de substitución de los Arabinoxilanos, la proporción y la cantidad de SCFA puede variar (Broekaert et al., 2011). Varios autores estudiaron el efecto de añadir Arabinoxilanos (AX) o arabinoxilo-oligosacáridos (AXOS) a dietas de monogástricos y vieron que los oligosacáridos con un grado de polimerización inferior a 5 contribuían a la proliferación de bacterias beneficiosas y mejoraba la diversidad en la microbiota (Van Craeyveld et al., 2008; Sanchez et al., 2009; Damen et al., 2011).
En este estudio, las fracciones AX producidas después de la degradación enzimática del trigo muestran claramente un mayor grado de polimerización (DP) que los AXOS que lo que indica la literatura existente.
Sin embargo, el tratamiento MEP incrementó de forma clara la proporción de la fracción AX con reducida peso molecular (Mw) lo que supuso un efecto beneficioso sobre la microbiota cecal ya que estimuló la producción de butirato.
La reducción de Mw comparado a muestra no tratada AX tiene un impacto en la fermentación y sus productos, pero también elimina el posible efecto negativo de las propiedades viscosas de los AX.
El mayor impacto se observó en el grupo MEP-tratados LMw aunque debido a su menor grado de polimerización (DP) y probablemente a un menor grado de substitución de la arabinosa del xilano, la producción de SCFA se vio favorecida, particularmente acetato y butirato.
Estos resultados sugieren que la acción beneficiosa de la MEP en el rendimiento del pollo está mediada por la solubilización y el efecto despolimerizador de la endoxilanasa de los arabinoxilanos (AX) del trigo.
Este trabajo también indica que una despolimerización extensa de los AX no es necesaria para favorecer la producción de butirato en la microbiota cecal.
Experimentos in vivo en los que se han utilizado AX con cadenas de longitud media sin inducir viscosidad, muestran que se pueden establecer cambios en la microbiota en pollos. Este hecho debería ayudarnos a entender los mecanismos de los efectos beneficiosos de las enzimas en la salud digestiva y el rendimiento del animal.
La coccidiosis, una enfermedad parasitaria en pollos, sigue siendo una de las preocupaciones más universales y más importantes en la producción de pollos.

El parásito invade el tracto gastrointestinal, causando daño tisular que puede conducir a:
Enfermedad clínica que cursa con diarrea, deterioro de la salud intestinal e incluso mortalidad de los infestados
Enfermedad subclínica, que genera una marcada disminución en el rendimiento productivo
Con el fin de minimizar los daños causados por este parásito, las medidas preventivas, como la inclusión de fármacos anticoccidiales en los piensos, son una práctica habitual en la producción de pollos de engorde en todo el mundo.
En este artículo ofrece una visión general de la enfermedad, así como de las herramientas de control disponibles actualmente en el mercado.
La coccidiosis es causada por un parásito protozoario género Eimeria que se replica en el intestino de los pollos


2 3 4
El parásito tiene un ciclo de vida directo: después de la ingestión oral de ooquistes por parte del pollo, se produce la multiplicación en las células intestinales, que resulta en un número exponencial de nuevos parásitos excretados en las heces
Dependiendo de la especie, la ingestión de sólo un oocisto esporulado infeccioso llevará a la excreción de miles o incluso cientos de miles de nuevos ooquistes
Además, un oocisto esporulado es muy resistente a la limpieza y desinfección, y ésta es una de las razones por las que la coccidiosis siempre está presente
Los oocistos son excretados y en la yacija esporularán (a la temperatura, humedad y condiciones de oxígeno adecuadas), lo que los convertirá en infecciosos, tras lo cual pueden infectar nuevos pollos
En los pollos se describen 7 especies diferentes de Eimeria. Pueden diferenciarse por medio de:
ESPECIFICIDAD DE HUÉSPED
MORFOLOGÍA
APARICIÓN Y LOCALIZACIÓN DE LAS LESIONES
MACROSCÓPICAS QUE CAUSAN

Las diferentes especies de Eimeria y sus características más típicas se resumen en la Tabla 1.
El tiempo entre la ingestión y la excreción del parásito dependerá de la especie, pero se dará, en general, entre 4 y 7 días.
Dependiendo de la “presión de infección”, es decir, de las especies presentes y el número de parásitos infecciosos en el gallinero, tardará aproximadamente ésta 3 semanas en alcanzar el pico de infección.

Esto significa que alrededor de los 18 a 28 días de edad del pollo, la coccidiosis se puede diagnosticar en la mayoría de las granjas comerciales
Desde lesiones redondeadas blanquecinas hasta presencia extensa de las mismas
Desde petequias hasta lesiones sanguinolentas
Sin lesiones macroscópicas típicas
Necrosis y lesiones sanguinolentas

Desde sangrado en la pared cecal hasta hemorragias en el ciego
Son las especies más comunes en pollos de engorde de 5-6 semanas de edad
No causan lesiones macroscópicas típicas y la prevalencia de estas especies no siempre es muy clara
Se pueden encontrar
E. acervulina E. mitis E. brunetti E. maxima E. praecox E. necatrix E. tenellaLa coccidiosis se puede diagnosticar reconociendo los signos clínicos, comprobando las lesiones intestinales de las aves y determinando los ooquistes en los excrementos de las mismas.
La coccidiosis clínica se caracteriza por enteritis, la cual puede dar como resultado:
La coccidiosis causa daño a las células intestinales y la inflamación del tejido intestinal, lo que puede causar un desequilibrio de la flora intestinal normal haciendo que las aves sean más vulnerables a otras enfermedades como Salmonella o Clostridium perfringens
Las complicaciones frecuentemente observadas de la coccidiosis son disbacteriosis y / o enteritis necrótica

Diarrea Yacija húmeda Mal funcionamiento general del lote
Eimeria tenella puede causar excrementos sanguinolentos típicos (potencialmente con alta mortalidad), que fácilmente será reconocidos por el granjero
Además de la coccidiosis clínica, la leve multiplicación del parásito en el intestino tendrá un impacto negativo en la reabsorción de los nutrientes, lo que conduce a un empeoramiento del crecimiento y del índice de conversión alimenticia.
Ésta ,denominada "coccidiosis subclínica", sigue siendo una de las enfermedades económicas más importantes.
La evaluación de la gravedad de la infección en el lote de pollos de engorde se puede realizar por la presencia de lesiones intestinales causadas por las diferentes especies en el período en que se produce la coccidiosis (en general, entre los 18 y los 28 días de vida).
En 1970 se describió un sistema de puntuación de lesiones que va desde cero (sin lesiones) hasta cuatro (lesiones máximas), para las diferentes especies (Johnson y Reid, Experimental Parasitol, 1970).
EXPERIMENTAL PARASITOL



Este sistema todavía se utiliza en todo el mundo para evaluar la gravedad de la infección: a mayor puntuación, mayor es el impacto.
Otra forma de cuantificar las infecciones por coccidiosis es contar microscópicamente el número de ooquistes excretados en las muestras fecales recogidas.
El número de ooquistes por gramo (OPG) dependerá de muchos factores como el método de muestreo, las especies presentes y el tiempo de muestreo.
Es necesaria la diferenciación entre especies de las muestras recogidas.
Los ooquistes son distintos en tamaño y forma (ver Tabla 1 página anterior), pero debido a la superposición de algunas especies, se requiere experiencia para diferenciarlas microscópicamente.
Todos estos factores dificultan la interpretación de los resultados OPG.
Las restricciones de este método son las puntuaciones más bajas de E. maxima.
Las pequeñas hemorragias puntuales causadas por E.maxima también pueden observarse sin la presencia del parásito y, por lo tanto, se requiere la confirmación microscópica (detección de ooquiste de E. maxima raspados mucosos).
Además, E. mitis, aunque bastante patógena, no causa lesiones macroscópicas y por lo tanto no puede ser diagnosticada con la puntuación de la lesión sola.
Además, la correlación entre los niveles de OPG y la gravedad de la infección es menos directa, lo que hace que este método sea menos útil para el diagnóstico individual en la propia granja.
También en algunos mercados existen productos de combinación, que contienen un ionóforo y un producto químico
Dado que la coccidiosis está siempre presente, debe existir un sistema eficaz de prevención de la enfermedad para limitar sus efectos negativos.
La inclusión de anticoccidiales en la alimentación o la vacunación contra la coccidiosis se han convertido en una parte esencial de la gestión en la producción avícola.
En todo el mundo, la inclusión de productos anticoccidiales en la alimentación es el método más utilizado en la producción de pollos de engorde y pavos.
Los anticoccidiales se pueden dividir en dos categorías:
Coccidiostatos ionóforos
Productos químicos de síntesis
Una de las principales características de los ionóforos es su lenta inducción a la resistencia, hecho que contrasta con los productos químicos donde la resistencia puede desarrollarse más rápidamente
Además, los ionóforos también tienen una actividad antibacteriana adicional, que se percibe como beneficiosa. Los productos químicos suelen tener un efecto mayor sobre los parásitos y, en general, tienen un amplio margen de seguridad.
Para salvaguardar la eficacia de los diferentes productos disponibles es importante evitar el desarrollo de resistencia
El desarrollo de la resistencia se puede evitar alternando entre diferentes productos y categorías de productos, principio de "rotación".
La frecuencia de esta rotación dependerá de la presión de infección en la granja y de la sensibilidad de las especies de Eimeria en la manada.
Desafortunadamente, la sensibilidad de las cepas de Eimeria para los diferentes productos no puede medirse in vitro por técnicas de laboratorio, sino que sólo puede determinarse mediante complicados y costosos estudios de infección en aves vivas.
La forma más práctica de evaluar la eficacia de los productos en el campo es mediante el marcado de lesión como se ha descrito anteriormente.
La monitorización de la coccidiosis por puntuación de la lesión observada es una herramienta para evitar brotes debidos a una severa resistencia de la enfermedad, pero también para evaluar si el rendimiento de las aves no se ve demasiado afectado por la coccidiosis subclínica.
El control de la coccidiosis por anticoccidiales puede basarse en el uso de un producto para todo el crecimiento (programa completo o directo) o una combinación de diferentes productos (programa shuttle(*) o dual).
Otro método para prevenir la coccidiosis es la vacunación de las aves. Las vacunas en el mercado son vacunas vivas que causan, dependiendo de la vacuna, más o menos daño intestinal
La vacunación se utiliza comúnmente en aves reproductoras dado su grado de protección durante toda la vida contra las diferentes especies de Eimeria y el costo justificado más alto al tratarse del valor económico de estas aves.
También, en muchos países europeos la vacunación es una práctica usual en pollos de largo periodo de engorde y en ponedoras.
En Europa, el número de pollos de engorde vacunados para la coccidiosis es todavía muy bajo. Hecho que contrasta con los EE.UU., donde la vacunación de pollos de engorde se aplica cada vez más como parte usual dentro un programa de rotación con anticoccidiales.
Con mayor frecuencia, los productos químicos o los productos combinados químicos/ionóforos se incluirán en el pienso de arranque, seguidos por anticoccidiales ionóforos en las etapas de crecimiento/acabado.
*Shuttle: se refiere al uso de dos o más productos durante el crecimiento
En Europa para disminuir la población resistente en las aves de corral repoblando las granjas con las cepas sensibles de la vacuna se usan más comúnmente las vacunas vivas atenuadas que están disponibles
La coccidiosis sigue siendo una de las enfermedades más importantes en la producción intensiva de aves de corral. El daño causado por la enfermedad puede ser:
DE MANERA DIRECTA
Por su grado de mortalidad, la diarrea que causa y la disminución del rendimiento del ave.
DE MANERA INDIRECTA
Generando otras enfermedades como la enteritis necrótica o disbacteriosis.

El control de la coccidiosis es una herramienta útil para evaluar la presión de la enfermedad y la eficacia de los productos anticoccidiales en el pienso.
La implementación del programa adecuado con los mejores productos sigue siendo un reto para todos los productores avícolas.

Paco Fernández López-Brea, DVM
Responsable de Negocio Avícola en Zinpro para Europa y Sudáfrica
Lascondiciones tales como el estrés por calor, la pechuga de madera, la condronecrosis bacteriana, los hematomas en las canales y la fragilidad vascular pueden compartir patologías subyacentes comunes como la inflamación estéril y una de sus consecuencias, la potencial disfunción de la barrera gastrointestinal (GI).
La inflamación estéril se produce cuando los tejidos han sido dañados en ausencia de patógenos y, a su vez, contribuye a un posterior daño tisular adicional.
Son cuatro los tipos de agresiones que pueden inducir la inflamación estéril:
2
Las sustancias intracelulares se vierten en el espacio extracelular.
Cuando se detectan fuera de la célula, estas sustancias, llamadas Alarminas o Patrones Moleculares Asociados al Peligro (DAMPs), activan la respuesta inflamatoria.
3
Trauma mecánico, Problemas químicos y ambientales, tales como el calor y el estrés por frío, Estrés metabólico, La hipoxia y la isquemia, es decir, la falta de oxígeno (la más importante). Cuando se produce daño celular, la estructura de la membrana celular se altera. 1
Cuando se reconoce a los DAMPs o, en su caso, a los Patógenos Asociados a los Patrones Moleculares de Peligro (PAMPs), las células inmunes (y otras) comienzan la inflamación, produciendo mediadores lipídicos, radicales libres y citoquinas pro inflamatorias, junto con otras sustancias.
El proceso de inflamación estéril genera reacciones mediadas por un factor de transcripción - Factor Nuclear Kappa B, (NF-кB), y pueden resultar en la muerte celular, la liberación de todos los contenidos de la célula y retroalimentar a la inflamación estéril en un circulo vicioso.
Los factores de transcripción, son proteínas que se encuentran en situación inactiva, hasta que determinados eventos celulares las liberan.
Tras ocurrir esto, emigran al núcleo de la célula, se unen a la cadena de ADN acoplándose a los genes que codifican y, mediante la RNA Polimerasa transcriben un RNA mensajero que emigrará a los ribosomas donde se producirán las proteínas diana. En el caso del NF-кB, serian las citoquinas pro inflamatorias.
Uno de los puntos débiles en el cuerpo, y quizás por ello, el órgano más importante vinculado al sistema inmune, es el intestino.
De este modo, el intestino se considera un punto débil por varias razones:
Sólo una única capa de células separa el interior del cuerpo de los antígenos potenciales en el lumen.
Las uniones estrechas, que son pequeños complejos de proteínas son muy sensibles a los efectos de estrés y son las únicas estructuras en el intestino que garantizan la impermeabilidad (parcial) entre los enterocitos.
La luz intestinal es un paraíso bacteriano, con una temperatura ideal, actividad de agua perfecta y un suministro de nutrientes fácilmente disponible.
Por si fuera poco, existe un problema hidráulico potencial dentro de las vellosidades: la tensión del oxígeno es mayor en la base de la vellosidades (Cripta) que en su parte más alta, que es donde la absorción de nutrientes tiene lugar.
Cualquier efecto desencadenante de hipoxia, desestructurará la organización celular de los enterocitos de la vellosidad y, por lo tanto, facilitará la entrada de fragmentos de bacterias Gram-negativas (Lipopolisacáridos, LPS o Endotoxinas) en el cuerpo, induciendo una inflamación sistémica, (por ejemplo, la vasoconstricción intestinal podría inducir este problema).
Sistema Inmunitario Torrente sanguíneo Microbiota ToxinasEl estrés por calor y la disfunción de la barrera intestinal ya fueron estudiados en humanos por Lambert. Durante el estrés por calor, se redistribuye la sangre desde las vísceras hasta los vasos periféricos para aumentar la irradiación de calor.
El resultado en el intestino, es una perfusión inadecuada de las vellosidades que inicia una cadena de eventos que comienzan con la hipoxia y la alteración de la absorción de nutrientes, progresando hacia un aumento de la permeabilidad del intestino y dando como resultado, en última instancia, una inflamación sistémica.
En un estudio desarrollado en la Universidad de Iowa, en el que futuras cerdas reproductoras fueron sometidas a estrés por calor durante siete días, se produjo un daño significativo de las vellosidades intestinales con una disminución simultánea del 46 por ciento en el consumo de pienso. (Pierce et al., 2013).
Aquí se demostró claramente que cuando hay estrés por calor, aumenta significativamente la permeabilidad intestinal, y la penetración de endotoxinas en el individuo.
Esto se debe a que las mitocondrias de los enterocitos, debido a la falta de oxígeno, comienzan a producir energía en anaerobiosis, incrementando exponencialmente la producción de radicales libres ligados al oxigeno (ROS), que van a fundamentalmente desestructurar las Uniones Estrechas (Tigth junctions), facilitando la entrada de antígenos (LPS y otros) entre un enterocito y el anexo (lo que llamamos vía paracelular).
En otro estudio realizado por el mismo equipo científico con Estrés por Calor Agudo (que evaluaba los efectos de complejo de aminoácidos de zinc vs sulfato de zinc en cerdas en crecimiento), las cerdas consumieron un 80% menos de pienso después de 12 horas de estrés por calor.
Además, la resistencia transepitelial al paso de la electricidad, se redujo en un 52% en los cerdos estresados por calor en comparación con los cerdos térmicamente neutros.
Cuando los animales consumieron Zinc biodisponible, el efecto del estrés por calor se mitigo significativamente.
Si controlamos los radicales libres,… evitamos su efecto destructivo sobre los tejidos y aceleramos la regeneración de zonas lesionadas.
Esto se traduce en una mejor calidad de canales avícolas, con menos severidad e incidencia de hematomas, arañazos, pododermatitis, condronecrosis bacteriana, etc.
Unos de los productos mas dañinos de la inflamación es la producción de radicales libres a nivel mitocondrial.
Las células controlan de forma natural la producción de radicales libres a través de tres enzimas: la Superóxido Dismutasa (SOD), la Catalasa (CAT), y la Glutatión Peroxidasa (GPX).

Para que las células produzcan estas tres enzimas, el factor de transcripción Nrf2 debe ser activado, proceso para el cual es necesario el Zinc intracelular
Esta activación es fundamental para controlar la inflamación, así como para controlar sus efectos secundarios a corto y a largo plazo, tales como: la fragilidad vascular, una mayor dificultad para que las aves cicatricen sus heridas y arañazos, evitar la penetración de bacterias vía intestinal dentro del ave en el caso de la condronecrosis bacteriana.
Podriamos considerar el Nrf2 como el antagonista natural del pro inflamatorio NF-кB.
Condronecrosis
(Robert
Wideman et al. 2015)En broilers de rápido crecimiento, es frecuente que algunos vasos sanguíneos del cartílago de crecimiento colapsen, creando áreas necróticas a su alrededor, llamadas focos osteocondróticos.
Pueden colapsar por presión o por un exceso de radicales libres debidos a un elevado crecimiento, por lo que estaríamos en un típico caso de inflamación estéril.
Si el animal sufre algún estrés concomitante que sea capaz de aumentar su permeabilidad intestinal, tendremos una translocación de bacterias desde el lumen intestinal hasta la sangre, y finalmente de ésta hasta los focos osteocondróticos, lo que desencadenara la patología conocida como Condronecrosis Bacteriana
CONDRONECROSIS BACTERIANA CON OSTEOMIELITIS Y COJERA
EN POLLOS (Robert F. Wideman, Jr. 2015
University of Arkansas, Division of Agriculture)
Un caso inicial de inflamación estéril a nivel de cartílago, se complica ulteriormente con presencia de patógenos a nivel óseo.
Bacteria en el aire
Translocación bacteriana
Microbioma intestinal
Sacos aéreos o epitelio respiratorio
Drenaje vascular o linfático Bacteriemia polimicrobiana
Distribución hematógena
Epitelio intestinal
Estrés
Inmunosupresión
Placa gruesa de crecimiento proximal
Crecimiento rápido
Estrés mecánico (osteocondrosis)
Osteomielitis
Está demostrado en medicina humana que dietas de rápida disponibilidad de nutrientes, muy procesadas, incrementan la permeabilidad del intestino (Dandona et al. 2009).
Muchas dietas de broilers y pavos son similares a un "Fast Food", ya que tienen elevada densidad energética, están muy procesados, expandidos, etc… Recordemos que los broilers comen cada dos horas dichas dietas.
En el caso de los broilers, teniendo en cuenta las dietas muy energéticas que se les administra, el estrés nutricional resultante, la producción de radicales libres y el posterior aumento de la fragilidad vascular podrían ser la causa subyacente del aumento de hematomas en las canales.
Para poder profundizar en el tema de los hematomas en las canales, los investigadores compararon puntuaciones de hematomas en las canales de broilers que consumían dietas suplementadas con sulfato de zinc o una combinación de sulfato de zinc y un complejo biodisponible de Zinc.

Un porcentaje significativamente mayor de los broilers alimentados con el complejo de zinc tenían puntuaciones hematoma de 0 (sin hematoma presente) y notablemente reducida la severidad de grados 1 y 2 (hematomas leves y moderados).
Estos hallazgos sugieren que los complejos de zinc podrían proteger los Endotelios
Vasculares de los radicales libres y el estrés nutricional, aunque se necesita más investigación.
La experiencia con la diabetes humana apoya la responsabilidad del exceso de glucosa y la producción de radicales libres en los problemas vasculares.
Estos datos podrían tener una importantísima repercusión en medicina humana, donde los problemas vasculares son causantes directos e indirectos de una gran parte de la mortalidad de los adultos.
Causas externas
Otros no clasificados
Riñones y organos reproductivos
Piel
Malformaciones congenitas
Afecciones perinatales
Sistema digestivo
Respiratorio
Circulación
Meningitis, Alzeheimer, sitema nervioso
Transtorno mentales
Diabetes y endocrinas
Sangre
Cáncer
Infecciones
Se ha demostrado que, sólo por tener deficiencia de zinc, se produce inflamación sistémica. (H. Summersgill et al. 2013).

Por tanto, cuando los pollos son deficientes en Zinc, estarán en un estado pro inflamatorio.
Hay que tener cuidado también con las fuentes que incluimos en la alimentación, ya que cuando adicionamos un óxido como principal fuente de Zinc, la absorción será apenas de un 5% y el resto saldrá de nuevo por la cloaca.
En estos casos veremos una mayor incidencia de problemas de piel en matadero, problemas de inmunidad en los animales en granja y peor índice de conversión en el campo, así como mayor incidencia de patologías.
El zinc es activo en muchos aspectos para combatir y controlar la inflamación.
La inflamación estéril se desencadena siguiendo el daño sobre los tejidos sin que sea necesaria la presencia de patógenos.
La inflamación estéril parece ser inducida por varios tipos de estrés, incluidos los factores de estrés asociados a la disfunción de la barrera gastrointestinal.
La inflamación estéril, está relacionada con muchos problemas del pollo y pavo, tales como la condronecrosis, hematomas en canal, muerte súbita, mala calidad de la piel, peor índice de conversión, etc.
El zinc juega muchos papeles importantes a la hora de ayudar al cuerpo a protegerse contra la inflamación estéril.

Pedro Sayalero
Responsable del Dpto. de Rumiantes Director Comercial de Trouw Nutrition
Lacapacidad del rumiante para producir ácidos grasos volátiles (AGV) en el tiempo, determinará el pH del rumen.
Cuando el rumiante ingiere alimentos ricos en hidratos de carbono proporciona al ecosistema ruminal un sustrato para la fermentación y el pH empieza a descender.
El pH del rumen, sin embargo, no es únicamente una cuestión de producción de AGV, éste se ve afectado por otros factores como: flujo de saliva
acidez alimento
adaptación microbiana
flujo de agua a través de la pared ruminal
La saliva actúa como un amortiguador a través de la acción de los componentes como el sodio, bicarbonatos y fosfatos (Van Soest, 1994).
flujo de agua en el tracto digestivo inferior
absorción de AGV
Todos estos factores juntos determinan en última instancia la acidez del rumen.
Según Firkins (1997), el efecto total de tampón de la saliva es relativamente pequeño, aunque Gabel et al. (2002) calcula que la entrada de saliva en el rumen se estima que es responsable de la neutralización de 15 a 20% de los AGVs producidos
Ambos autores coinciden en que, aunque marginal, la contribución de la saliva puede ser la diferencia de pH ruminal para estar en el lado bueno o malo.
Debe tenerse en cuenta que este sistema tampón está casi completamente desencadenado por la cantidad de fibra dietética física y no por la concentración de AGV en el rumen (Oetzel, 2007)

Las bacterias fibrinolíticas, que digieren la fibra, por ejemplo, tienen un pH óptimo entre 6,0 a 6,4 y muestran una menor actividad cuando el pH cae por debajo de 6,0.
El ácido láctico es un ácido relativamente fuerte en comparación con otros AGVs y tiene una tasa de absorción en el rumen de 10 a 20 veces más baja que otros AGVs.
El ácido láctico normalmente sólo está presente en pequeñas cantidades en el fluido ruminal debido a un equilibrio (delicado) entre bacterias productoras de lactato (Streptococcus bovis) y bacterias utilizadoras de lactato (Megasphera elsdenii y Streptococcus ruminantium).
Cuando el suministro de hidratos de carbono fermentables es alto y persiste en el tiempo, este equilibrio se desplazará, porque la tasa de crecimiento de las bacterias productoras de lactato es más alta que para las bacterias que lo utilizan.
Adicionalmente, el crecimiento de las bacterias lactato-utilizadoras es inhibido cuando el pH disminuye de 5,0 (Garry, 1996, Oetzel, 2007 y Allen, 1997).
Y si en estas condiciones los carbohidratos fermentables siguen disponibles, la situación empeorará y la concentración de lactato aumentará en el rumen
Cuando el pH ruminal desciende por debajo de 5,0 empiezan a crecer puros productores de lactato (Lactobacillus), lo que agrava aún más la situación, que puede resultar en completa atonía del rumen - falta de tensión muscular normal-, donde la absorción de ácidos se reduce para evitar cambios dramáticos en el equilibrio sistémico ácido-base.
pH 5,0
En esta perspectiva, la adaptación es un aspecto importante para manejar la población microbiana, ya que son necesarias alrededor de 4 a 6 semanas antes de que la población microbiana esté totalmente adaptada a una nueva dieta (Nordlund et al, 1995).

En la práctica, esto significa que para las dietas de transición (adaptación a cebadero, por ejemplo) se recomiendan materias primas similares.
Los microbios pueden entonces desarrollarse en los sustratos que se van a consumir en mayor medida en el futuro.
Las dietas deben ser formuladas en base a los parámetros RFC / TFC, RFP / PTF (carbohidratos de fermentación rápida/ carbohidratos totales, proteína de fermentación rápida/ total) y la NDF (Fibra Neutro-Detergente, por sus siglas en inglés) para maximizar la fermentación, asegurando al mismo tiempo la salud del rumen.
La gestión de la microflora ruminal es un aspecto importante que ayuda a controlar la acidosis del rumen
El epitelio del rumen es una membrana semi-permeable que separa el fluido ruminal del resto del fluido corporal.
La osmolaridad del fluido ruminal se define principalmente por los AGVs y las sales disueltas, y para éstas el Na y el K son los minerales más importantes.
La osmolaridad se regula dentro de un rango estrecho (Russel, 1993).
Cuando aumenta el flujo de agua, éste se “lleva” más cantidad de AGVs para el tracto digestivo inferior, disminuyendo la cantidad de AGV que tiene que ser absorbida en el rumen.
Se ha demostrado que también había almidón transportado junto con AGVs al tracto digestivo inferior a causa de una mayor tasa de paso. Este almidón se digiere y se absorbe como glucosa.
Se ha publicado sobre la producción de leche, de grasa de la leche, y sobre la relación acetato: propionato cuando el bicarbonato de sodio (NaHCO3) se añade a una dieta. Curiosamente, se ha demostrado que la concentración de bicarbonato no aumenta en el fluido ruminal, debido al hecho de que la concentración de CO2 es constante en el rumen (saturación) (Russell, 1993).

Así, cuando se introduce NaHCO3 en la dieta, la concentración de bicarbonato permanece igual y la capacidad de amortiguación del rumen no va a aumentar.

Surge entonces la pregunta:
por qué hay efecto positivo en la adición de NaHCO3 a una dieta cuando la capacidad de buffer en el rumen no se incrementa
Esto puede explicarse por un aumento del nivel de Na+ en el fluido ruminal:
Si se añade NaHCO3 a una dieta, éste fácilmente pasa a la solución y se agrega Na+ y HCO3-para el fluido ruminal.
El epitelio ruminal es la ruta principal para la absorción de AGV y la absorción de AGV es un importante regulador de pH ruminal
Sin embargo, no es únicamente la absorción de los AGVs del rumen al epitelio lo más importante. Igualmente importante son los procesos de transporte a través de la célula epitelial y (AGV) en el metabolismo de la célula misma, todos han de tener lugar pero la integridad celular debe mantenerse.


Esta mayor concentración de Na+ aumenta la osmolaridad, “tirando” de agua y diluyendo la concentración de H+.
Esto, además, estimula los procesos de absorción a través del epitelio, junto a los efectos descritos anteriormente.
La absorción de AGV se lleva a cabo en las papilas ruminales que proporcionan una superficie enorme
La mayoría de la absorción de AGV tiene lugar a través de transporte activo.
Este proceso consume mucha energía e implica, entre otros, la secreción de bicarbonato de la célula epitelial en el fluido ruminal (Gabel, 1990 en Gabel et al., 2002).
pH cae
AGVs empiezan a disociarse, facilitando la absorción pasiva de AGVs a través de la pared ruminal, eliminando así un ión hidrógeno libre del fluido.
Debe tenerse en cuenta que los AGVs difieren en su tasa de absorción fraccional
A pH de 7, ácido acético, propiónico y butírico son absorbidos a tasas similares

Cuando el pH disminuye, los AGVs con una mayor masa molecular tendrán una mayor absorción fraccional
La investigación demostró que:
7,2 4,5
Absorción de ácido acético constante
Ácido propiónico y butírico aumentaron aproximadamente el doble y el triple de su velocidad de absorción, respectivamente (Dijkstra et al., 1993)

Las células epiteliales ruminales no están protegidas por el moco (Sehested et al., 1999), lo que hace que sean muy sensibles al daño químico por ácidos
Se ha demostrado que el epitelio del rumen tiene una sensibilidad al pH que es comparable a la de los microorganismos ruminales (Gabel et al., 2002).
La vulnerabilidad del epitelio a la acción del ácido depende mucho de la adaptación
Cuando la adaptación ha tenido lugar, el epitelio ruminal:
Tendrá irrigación sanguínea
suficiente para el transporte de AGVs.
Habrá incrementado la capacidad de absorción de AGVs.
Se ampliará por el aumento de tamaño de las papilas y aumento del número de células epiteliales.
Por lo tanto, se puede concluir que un pH ruminal bajo lleva a daño del epitelio ruminal (rumenitis, erosión, paraqueratosis, ulceración).
Cuando esta situación se prolonga en el tiempo, dará lugar a problemas crónicos de salud.
Cuando los AGVs son absorbidos en la célula, pueden ser metabolizados, dependiendo del tipo de AGVs
Por otro lado, el dióxido de carbono se produce a partir de la oxidación completa de los ácidos grasos volátiles.
El metabolismo del acetato y propionato en la célula es marginal, mientras que el butirato se metaboliza en las células epiteliales, de hasta 95% (Gabel et al., 2002).
El catabolismo de butirato en la célula proporciona a la célula energía y conduce a la formación de cuerpos cetónicos en el caso de la oxidación incompleta.
Estos cuerpos cetónicos son posteriormente transportados hacia la sangre siendo fuente de energía y precursores de ácidos grasos (Gabel et al., 2002).
Este metabolismo (parcial) es un mecanismo intracelular para prevenir pH intracelular bajo.

La absorción de AGV en realidad aumenta la presión sobre la salud intracelular por la disminución del pH intracelular:
Directamente a través de la absorción pasiva
Indirectamente por el intercambio AGVs/HCO3
Además, los cuerpos cetónicos producidos en la célula tienen que ser transportados fuera del rumen, ya que también disminuyen el pH intracelular y afectan a la osmolaridad intracelular
La investigación demostró que la célula está equipada con mecanismos tales, como la presencia de un transportador específico en el lado de la sangre que transporta los cuerpos cetónicos y los protones fuera de la célula (Gabel et al., 2002).
Una visión general de estos procesos se da en la Figura 1
Figura
Modelo esquemático del transporte transepitelial de AGVs (VFA-= disociado VFA; HVFA = asociado VFA, AE = anión intercambiador; NHE = Na + / H + de cambio del sistema; CA = anhidrasa carbónica; MCT1 = protón ligado al transportador monocarboxilasa (adaptado de Gabel et al., 2002).

Junto al transporte de AGVs fuera de la célula epitelial, las células del epitelio ruminal tienen otro mecanismo para mantener el pH intracelular dentro del intervalo deseado.
Este mecanismo, denominado intercambiador de protones, hace que los H+ se intercambien con otros cationes tales como Na+, Ca2+, Mg2+.
Tomado en cuenta la solubilidad ruminal, Na+ será el principal catión involucrado en el intercambio con H +.
La suma de la concentración de Na y K en el rumen es sin embargo constante.
Los niveles más altos de K llevan a disminuir los niveles de Na, que es negativo para los procesos de transporte de hidrógeno fuera del rumen a través del epitelio del ruminal.
Esto también fue confirmado por la investigación; Mooney y Allen (2005) observaron que el pH se correlacionó positivamente con el aumento de concentraciones ruminales de Na y K y negativamente con las concentraciones de Cl, este último a un nivel menor.
La correlación negativa con cloruro posiblemente podría explicarse por el hecho de que el cloruro compite con VFA- para la absorción, reduciendo el
J.Crespo1 , M. Paniagua2
1Interquim, S.A. (Ferrer HealthTech)
2Quimidroga, S.A.
Actualmente la contaminación atmosférica y los gases de efecto invernadero, debido a su acción sobre el calentamiento global, están recibiendo la atención de la Administración y de la comunidad científica.
La actividad ganadera intensiva supone, en sí misma,una fuente de contaminación para el medio ambiente, siendo reconocida su contribución en la emisión de estos gases con efecto invernadero.
El gas metano (CH4), incluyendo el procedente de los procesos de digestión y de fermentación entérica de los animales, es considerado uno de los principales gases con efecto invernadero.

Aunque la emisión que se produce de este gas metano es relativamente pequeña, cuando se expresa en CO2 equivalente sus valores se magnifican.
De manera global, el 55% del total del metano producido proviene de los sectores agrícola-ganaderos, destacando el papel de los animales domésticos. Dentro de éstos, es el ganado vacuno, con un 74,2% de estas emisiones (en CO2 equivalente), el principal productor y emisor de dicho gas.
55% del total del metano producido proviene de los sectores agrícolaganaderos
equivale a 21 kg de CO2
88% tiene un origen ruminal y el resto es producido a nivel intestinal
Los rumiantes mantienen un estrecho vínculo con los microorganismos que habitan su rumen.
Se establece una relación simbiótica mediante la cual el animal aporta nutrientes y un medio ruminal adecuado para la supervivencia de los microorganismos ruminales y la fermentación de los alimentos.
De este modo, los microorganismos tienen la capacidad de digerir/fermentar la fibra, sintetizando proteína microbiana y AGVs en rumen, que constituyen la fuente principal de proteína y energía para el animal.
En determinadas ocasiones, esta relación simbiótica no es totalmente eficiente, produciéndose pérdidas de energía en forma de metano y, desde el punto de vista proteico, pérdidas de nitrógeno (N) en forma de N amoniacal.
Recordando lo explicado en el capítulo de fisiología, durante la fermentación ruminal, los hidratos de carbono ingeridos en la dieta son metabolizados a glucosa en el rumen, y ésta a piruvato. Es decir, son parcialmente degradados y fermentados por los microorganismos ruminales, generando como principales productos finales AGV, CO2, metano, H2O y ácido láctico.
Los aspectos fundamentales que se deben considerar como objetivos a modular para hacer más eficiente la fermentación microbiana ruminal son:
Aumentar la degradación de la fibra y el almidón
Estimular la producción de AGVs, especialmente de propionato
Inhibir la producción de metano
Controlar la concentración de lactato y el pH ruminal
El metano se produce en el rumen y el intestino grueso de los animales por un grupo de arqueas - Archaea - conocidos colectivamente como metanogénicos, que pertenecen al filo euriarqueotasphylum Euryarcheota.
Las bacterias metanogénicas utilizan el hidrógeno y el dióxido de carbono producido durante la fermentación de los carbohidratos, es decir, durante el proceso de síntesis de los AGV (ver, figura 1).
Todos los metanógenos poseen la coenzima F420, que es un cofactor necesario para enzimas como la hidrogenasa y formiato deshidrogenasa.
Además, otra coenzima característica de los metanógenos es la coenzima M o ácido 2-mercaptoetanosulfónico, que se metila para producir metano.
Fórmula del ácido 2-mercaptoethanesulfonico
La producción de metano tiene relación directa no sólo con la cantidad de carbohidratos fermentados en el rumen, sino además con la relación entre los diferentes ácidos grasos volátiles (AGV) producidos, pues estos últimos condicionan la producción de hidrógenos, y por tanto, de metano.
De hecho, se han publicado ecuaciones basadas en la estequiometría de la fermentación, que predicen la formación de metano según las diferentes cantidades de AVG, como la propuesta por Most et al., 2000:
De la fórmula se deduce que si conseguimos aumentar el propionato tendremos un efecto negativo sobre la síntesis de metano,pues compite por el hidrógeno con el anhídrido carbónico a nivel ruminal.
Por otro lado, claramente se puede deducir de la fórmula que el factor que más influye en la metanogénesis es la síntesis de acetato.
La cantidad de acetato es el factor más importante a la hora de considerar la metanogénesis
Los flavonoides son derivados de la benzo-L-pirona que se encuentran en diversas frutas, verduras y semillas, y que poseen propiedades anti-inflamatorias, antioxidantes y antimicrobianas (Harborne y Williams, 2000).
El efecto de extractos de plantas que contienen flavonoides sobre la fermentación ruminal ha sido estudiado in vivo (Brou- discou y Lassalas, 2000; Yaghoubi et al., 2007), observando que promueve cambios en el pH, en la proporción de propionato y en la degradación de proteínas.
Los resultados obtenidos y su variabilidad (Broudiscou et al., 2000, Broudiscou y Lassalas, 2000) justifican la necesidad de seguir investigando las propiedades de los flavonoides.
Balcells et al. (2012) demostró que un extracto de cítricos rico en sustancias flavonoides de naranja amarga (Citrus aurantium) y pomelo (Citrus paradisi), ejerció una actividad favorable en el ambiente ruminal cuando se les proporcionó a un grupo de novillas una ración alta en concentrado, bajo condiciones experimentales inducidas de acidosis.

En estudios realizados anteriormente, se ha evidenciado que la adición de extractos de plantas ricas en compuestos secundarios como saponinas, taninos, aceites esenciales, y también flavonoides reducen la producción de CH4 ruminal (Patra y Saxena, 2010).
Teniendo en cuenta estos precedentes, se realizó un ensayo (A.R. Seradj y J.Balcells, 2014) para analizar el impacto de una mezcla de extractos cítricos (BF) sobre la fermentación ruminal, la producción de metano y la población microbiana.
En este estudio se identificó a su vez la actividad específica de los componentes flavonoides puros de BF en condiciones in vitro, utilizando líquido ruminal de novillas en crecimiento alimentadas con dietas ricas en concentrado.
Se testaron en un sistema de incubación in vitro (Theodorou et al., 1994) los efectos de la mezcla de extractos cítricos y sus componentes en flavonoides puros (Hesperidina, HS, Isonaringina, IN, Naringina, NG, Neoeriocitrina, NE, Neohesperidina, NH y Poncirina, PC) en la fermentación ruminal frente a un control (CTR) a 200 (µg/g) de materia seca (MS) del sustrato incubado.
La concentración de metano se calculó por cromatografía de gases, a partir de la proporción del pico respecto al área, usando un gas estándar (CH4; 99,995% de pureza, C45, Carburos Metálicos, España) como referencia.
Se inyectaron manualmente diferentes volúmenes de la mezcla patrón (0.1, 0.3, 0.5, 0.7 y 0.9 ml) en el cromatógrafo de gases para obtener una curva estándar.
La concentración de AGV y su perfil molar se determinaron por cromatografía de gases según la técnica propuesta por Jouany (1982), utilizando una columna capilar (BP21, 30 mx 0,25 mm ID x 0,25 m, DE, USA).
El ADN de las muestras se extrajo usando un QIAamp DNA Stool Mini Kit (Qiagen Ltd., West Sussex, Reino Unido) siguiendo las instrucciones del fabricante.
Para cuantificar el número de bacterias y de arqueas hidrogenotróficas metanogénicas (HMA, por sus siglas en inglés) se utilizó un PCR en tiempo real (qPCR), que se expresó como la concentración de ADN cuyo resultado se expreso en Log10 del número de copias del gen por gramo de muestra.

La abundancia relativa de Streptococcus bovis, Selenomonas ruminantium y Megasphaera elsdenii respecto a las bacterias totales y HMA, se determinó utilizando iniciadores de PCR específicos (Øvreås y Torsvik, 1998; Denman et al., 2007).
Se obtuvo la abundancia relativa de Methanosarcina spp. (arquea metanógena acetoclástica que sintetiza metano a partir del acetato) dentro de las arqueas totales.
Diferentes superíndices (a,b,c,d) significan difencias estadísticas (P<0.05) entre tratamientos . Mezcla de extractos cítrico (BF), Hesperidina (HS), Isonaringina (IN), Naringina (NG), Neoeriocitrina (NE, Neohesperidina (NH), Poncirina (PC) y Control (CTR)
Tabla 1. Valores estimados de la producción de gas acumulado (a; mL / g de MS), valores de producción de gas (b; mL / h), y reducción de la producción de gas (h) obtenidos en medios de cultivo utilizando el líquido ruminal de cuatro novillas alimentadas con dietas concentradas, suplementada con BF, sus componentes flavonoides o sin suplementación (control - CTR); junto con los valores de producción de metano (mL / g de MS) y a las 12 h post incubación.
La adición de BF o cualquiera de sus componentes flavonoides al medio de cultivo redujo la producción de gas acumulada (P <0,01), excepto para NE y PC.
La producción de metano (mL/g MS, a las 12 h después de la incubación) también se redujo (P <0,01) con la suplementación de flavonoides, excepto para NG y NE, que no difirió del CTR.

Cuando se expresó la producción de metano a las 12 h de incubación en relación con la concentración de AGV (Tabla 3), no se observaron cambios en comparación con el CTR excepto para NH (P <0,05).
También se calculó la proporción de CH4 dentro de la producción total de gas (v / v): NE registró la mayor proporción de metano en el gas producido (P <0,01), mientras que BF y PC disminuyeron (P <0,01) la concentración de metano en relación con el CTR.
BF y los compuestos flavonoides suplementados, con excepción de HS, modificaron el perfil de AGV en comparación con CTR, reduciendo (P <0,01) la proporción molar de acetato e incrementando (P <0,01) la del propionato.
(a,b,c,d) significan difencias estadísticas (P<0.05) entre tratamientos . Mezcla de extractos cítrico (BF), Hesperidina (HS), Isonaringina (IN), Naringina (NG), Neoeriocitrina (NE, Neohesperidina (NH), Poncirina (PC) y
Tabla 3. Efectos de la mezcla de flavonoides y sus componentes sobre la cuantificación absoluta de las bacterias totales y los metanógenos hidrogenotróficos, y la cuantificación relativa de Streptococcus bovis, Selenomonas ruminantium, Megasphaera elsdenii, metanógenos hidrogenotróficos y Methanosarcina Spp.

La adición de sustancias flavonoides no cambió la concentración total de bacterias en relación con el CTR.


La concentración de HMA se redujo (P <0,01) con BF y sus principales componentes flavonoides (NG y NH), mientras que el resto de sustancias flavonoides no mostraron ningún efecto significativo en comparación con el CTR.
Los flavonoides no afectaron la cuantificación relativa de las bacterias productoras de lactato S. bovis, aunque sí mejoró con NE en relación con el CTR (0,096 vs 0,010; P <0,05).
La cuantificación relativa de la especie consumidora de lactato M.elsdenii se incrementó (P <0,01) por adición de flavonoides, excepto para IN, HS y NE.
Los flavonoides produjeron una clara inhibición en la abundancia relativa de HMA (P <0,01), siendo más pronunciada con BF, NH y NG.
La abundancia relativa de Metanosarcina (como arqueas metanogénicas acetoclásticas) se redujo mediante la adición de PC, NH, NG y BF (P <0,05).
del
"The effect of Bioflavex®and its pure flavonoid componentson in vitro fermentation parameters and methane productionin rumen fluid from steers given high concentrate diets"

A.R.
bAnimal Nutrition Institute, Estación Experimental del Zaidín (CSIC), Profesor Albareda 1, 18008 Granada, Spain
cInterquim S. A. (Ferrer Health Tech), Sant Cugat, Barcelona, Spain dDepartamento de Producción Animal y Ciencia de los Alimentos, Universidad de Zaragoza, Miguel Servet 177, 50013 Zaragoza, Spain
Resultados ensayo, extraídos del artículo: Seradja, L. Abeciab, J. Crespoc, D. Villalbaa, M. Fondevilad, J. Balcellsa, aDepartament Producció Animal, ETSEA, Agrotecnio Center, Alcalde Rovira Roure 191, 25198 Lleida, SpainLos resultados obtenidos en este estudio concuerdan con los diferentes efectos in vitro mostrados por los flavonoides sobre la fermentación microbiana ruminal y reportados por Broudiscou et al. (2000).


En este estudio, la adición de flavonoides no modificó la concentración total de AGV en relación con el CTR, pero redujo significativamente la proporción molar de acetato y aumentó la de propionato, y se correlacionó negativamente con la producción de CH4.
La adición de flavonoides puede modificar específicamente el ecosistema microbiano ruminal.

Enlas vacas que sufren estrés por calor con frecuencia se reduce la grasa de la leche (MFD, por sus siglas en inglés que significan Depresión de la Grasa en la Leche) y los investigadores todavía no comprenden cómo ocurre este fenómeno. No obstante, parece ser posible influir sobre la MFD a través de la ración y ayudar a reducir sus efectos optimizando la función ruminal.
Para comprender cómo puede el estrés por calor llevar a la Depresión de la Grasa en la Leche (MFD), debemos revisar la síntesis de grasa láctea en vacas lecheras y los mecanismos que pueden provocar la MFD durante el estrés por calor.

Los ácidos grasos para la síntesis de grasa láctea tienen su origen en dos fuentes.
LOS ÁCIDOS GRASOS
Los ácidos grasos de cadena larga (de más de 16 átomos de carbono por molécula) provienen de la captación de ácidos grasos circulantes ya formados, de la grasa de la ración absorbida en el tracto digestivo y de los ácidos grasos no esterificados (NEFA) procedentes de la movilización de las reservas corporales de grasa.
Los ácidos grasos (4 a 8 carbonos) y los de cadena media (10 a 14) tienen su origen en la glándula mamaria por la síntesis de novo.
Los ácidos grasos de 16 carbonos pueden tener cualquiera de los dos orígenes.
Para una vaca bien alimentada, se estima que entre un 4 y un 8% de los ácidos grasos de la leche proceden de la movilización de la grasa corporal (es decir, los NEFA).
No obstante, la contribución de esta fuente puede aumentar de forma progresiva a medida que el balance energético se reduce (Bauman y Griinari, 2001), como ocurre en vacas bajo estrés por calor.
Hay dos posibles mecanismos para la reducción de la grasa en la leche durante el estrés por calor:

La hidrogenación de los ácidos grasos volátiles, inhibiendo la síntesis de grasa láctea de novo
Los lipopolisacáridos ruminales, limitando el suministro de sustratos y la síntesis de grasa láctea de novo
La biohidrogenación de los ácidos grasos insaturados en el rumen produce ácidos grasos saturados. La depresión de la grasa láctea (MFD) ocurre por cambios en la biohidrogenación ruminal de los ácidos grasos insaturados y la salida fuera del rumen de determinados compuestos intermedios de la biohidrogenación (como trans-10, cis-12 CLA) (Bauman y Griinari, 2001)

Siguiendo la teoría de la biohidrogenación, la MFD necesita:
Sustratos para la formación de potentes inhibidores de la síntesis de grasa láctea (como el ácido linoleico y otros ácidos grasos poli-insaturados)
Un ambiente ruminal alterado que afecte a la biohidrogenación (como una ración alta en concentrados y baja en fibra que sea baja en fibra efectiva) y
Estos compuestos intermedios de biohidrogenación interfieren con la expresión de genes relacionados con la síntesis de grasa, de forma que reducen la síntesis de la grasa láctea en la glándula mamaria.
Una tasa de biohidrogenación alterada causada por ciertos alimentos que aumentan la tasa de paso de los compuestos intermedios de la biohidrogenación fuera del rumen.
“TEORÍA DE LA BIOHIDROGENACIÓN”
Además, la velocidad de salida de los alimentos del rumen puede aumentar la salida del rumen de compuestos intermedios de la biohidrogenación.
Por ejemplo, durante el estrés por calor, la alteración de la ruta de biohidrogenación puede ser provocada por:
Aumento de la cantidad de grasa insaturada
Ácido Linoléico (cis-9, cis-12 18:2)
Ácido ruménico (cis-9, trans-11 CLA)
Por lo tanto, esta teoría identifica cómo ciertos alimentos pueden representar un factor de riesgo para la MFD. (fig. 1) 1 3
Ácido vaccénico (trans-11 18:1)
Ácido esteárico (18:0)
Inhibición del último paso/ alteración tasa de biohidrogenación
2
Alteración del ambiente ruminal
Fermentabilidad del almidón
La adición a la dieta de grasa suplementaria al tratar de mantener el consumo de energía, Un pH ruminal bajo, una condición a la que están predispuestas la vacas con estrés por calor
El resultado es un aumento en el riesgo a la bajada de la grasa en la leche.
trans-10, cis-12 CLA
trans-10 18:1
Ácido esteárico (18:0)
El otro mecanismo posible para la depresión de grasa en la leche (MFD) durante el estrés por calor es la concentración de lipopolisacáridos ruminales (LPS), que son componentes de la membrana externa de las bacterias Gram-negativas que se liberan cuando estas bacterias mueren.
Las investigaciones muestran que cuando el pH ruminal se reduce, aumentan las concentraciones ruminales de LPS.
Además, a medida que la concentraciones de LPS aumentan, se reduce la concentración de grasa en la leche.
Zebeli y Ametaj (2009) mostraron de una forma patente que las concentraciones de LPS ruminales aumentaban con la cantidad de cereales en la dieta y encontró una fuerte relación negativa entre los LPS ruminales y el contenido en grasa en la leche (fig 2)
Esta correlación se puede deber a la habilidad de los LPS para inducir la producción de insulina en el páncreas (Waldron et al., 2006).
La mayor circulación de insulina y el incremento de sensibilidad a la insulina en las vacas con estrés por calor puede reducir la movilización de grasa corporal
Figura 2. Correlación entre los lipopolisacáridos (LPS) ruminales y el contenido en grasa en la leche. Adaptado de Zebeli y Ametaj (2009)Esta situación puede ocurrir incluso si las vacas con estrés por calor están bajo un balance energético negativo debido a la reducción en el consumo de alimentos y un aumento en la demanda de mantenimiento (Baumgard y Rhoads, 2013).
También la falta de NEFAs plasmáticos, que son unos precursores importantes de la grasa de la leche, durante el estrés por calor (Baumgard y Griinari, 2001), puede contribuir al bajo contenido en grasa de la leche.
Otros efectos negativos de los LPS sobre la producción de ácidos grasos que han sido observados son:
Reducción en la actividad de la lipoproteinlipasa (López Soriano y Williamson, 1994)
Reducción de la expresión de la lipoproteinlipasa y la proteína de transporte de ácidos grasos (Feingold et al., 2009)
Efecto supresor sobre las enzimas relacionadas a la síntesis de novo de ácidos grasos en el tejido mamario (Dong et al., 2011)
Las investigaciones hasta la fecha han ayudado a explicar cómo la bajada de grasa durante el estrés por calor está relacionada con una mala salud ruminal.
Dado que existe esta relación, la optimización del funcionamiento ruminal puede ayudar a mantener el contenido de grasa en la leche y la eficiencia de producción de las vacas lecheras durante el estrés por calor.
Estudios realizados por Diamond V muestran que se pueden minimizar los efectos negativos del estrés por calor optimizando la función ruminal.
Los resultados de producción lechera en 9 estudios en 4 países (Israel, Portugal, Arabia Saudita y EE.UU.) durante los meses de verano muestran un aumento sistemático de la producción lechera cuando las vacas reciben suplementación con su producto de fermentación (Fig 3).
En estos mismos estudios, el contenido en grasa de la leche era más elevado o tendía a ser más elevado en 8 de los 9 estudios (Fig 4), indicando que no ocurrió una dilción de la grasa al aumentar el volumen de leche con estos productos.

La acidosis ruminal subaguda (SARA) es un riesgo para las vacas con estrés por calor.
Se puede originar SARA por:
Incremento de la tasa de respiración
Reducción en el consumo de alimento (causada por la reducción de la rumia y de la producción de saliva)
Alteración del comportamiento en el consumo de alimentos ( como la selección, consumo desmedido, etc.)
Para producir condiciones ruminales similares a las que experimentan las vacas bajo estrés por calor se han realizado estudios de inducción de SARA.
En dicho estudio, Li et al. (2012) mostraron que las vacas que recibían suplementación con el producto mantuvieron niveles más bajos de LPS (Fig. 5), que se asocian con una comunidad bacteriana ruminal
estabilizada (Li et al., 2013)
Otra prueba se realizó en el Centro de Investigación e Innovación de Diamond V en Cedar Rapids, Iowa, durante los meses de verano de 2013 (Junio a Septiembre) con 8 vacas Jersey secas con cánulas ruminales.
En esta prueba se observó que el producto puede mantener un nivel más bajo de LPS ruminales cuando las vacas estuvieron expuestas a una temperatura ambiente y humedad elevadas (Fig. 6, datos no publicados)
Mantener los LPS bajos puede mantener concentraciones de insulina circulantes más bajas y permitir la movilización de grasa corporal durante el estrés por calor.
También puede permitir el suministro de NEFA como precursor para la síntesis de grasa láctea por la glándula mamaria.
Los niveles de LPS ruminales más bajos podrían también minimizar la producción de mediadores inducidos por LPS que inhiben la actividad de enzimas clave para la síntesis de novo de ácidos grasos.
Fig. 5. Efecto del producto de fermentación* en la concentración de lipopolisacáridos (LPS) ruminales (Unidad de Endotoxina/ml) bajo un desafío de acidosis ruminal subaguda (SARA). Adaptado de Li et al. (2012)
Fig 6. Efecto del producto* en la concentración de lipopolisacáridos ruminales (LPS) (Unidad de endotoxina/ml) bajo un desafío de estrés por calor
LPS RUMINAL (EU/ML) LPS RUMINAL (EU/ML)El estrés por calor causa cambios fisiológicos y de comportamiento en vacas lecheras.
Estos cambios pueden repercutir en condiciones ruminales subóptimas, provocando la producción de compuestos intermedios de la biohidrogenación de los ácidos grasos y LPS que inhiben la síntesis de grasa láctea en la glándula mamaria.
La optimización de las condiciones ruminales puede minimizar el impacto negativo del estrés por calor en la grasa de la leche y mantener la eficiencia de producción en vacas lecheras

 Arie K. Kies & René Bonekamp
Arie K. Kies & René Bonekamp
DSM Nutritional Products, Animal Nutrition and Health
Myrthe S. Gilbert Wageningen University and Research, Animal Nutrition GroupLos sustratos no absorbidos inicialmente incluyen materiales hemicelulósicos y celulósicos y proteína indigestible, además de secreciones endógenas, como las aportadas por el mucus.
La diversidad de los sustratos y de las especies microbianas existentes en el tracto digestivo es el resultado de un gran número de productos de la fermentación (Willing and van Kessel, 2010) que pueden ser beneficiosos o perjudiciales para el animal.
ALGUNOS METABOLITOS POTENCIALMENTE BENEFICIOSOS
ALGUNOS METABOLITOS POTENCIALMENTE PERJUDICIALES
La microbiota tiene un papel muy importante en el tracto intestinal del ganado porcino, donde los microorganismos pueden digerir los sustratos que no son absorbidos por los cerdos.
Ácidos grasos de cacena corta (AGCC), por ejemplo, BUTIRATO
ÁCIDO LÁCTICO
VITAMINAS
IÓN AMONIO (NH4 +)
AMINAS BIÓGENAS
Compuestos biológicamente activos sintetizados a partir de la degradación microbiana de los aminoácidos, potencialmente tóxicos, como son la cadaverina, putrescina y la histamina.
La microbiota está implicada en los fenómenos de exclusión de patógenos, en la función de barrera intestinal y en la inmunidad
La microbiota intestinal del cerdo tiene un papel fundamental en la fisiología del cerdo:
Contribuye a la digestión y absorción de nutrientes
Participa en la inmunidad (el 70% de todas las células inmunitarias están asociadas al intestino) y mantenimiento de la fisiología digestiva
Aporta beneficios para el hospedador
Contribuye a la construcción de la barrera del epitelio intestinal
Contribuye al desarrollo y la función del sistema inmune del cerdo
Compite con poblaciones de microbios patógenos para evitar su desarrollo (resistencia a la colonización)
Es fácilmente modificable por la dieta
Uno de los retos más importantes en producción animal consiste en influenciar la actividad de la microbiota intestinal y los metabolitos que se producen de manera que se favorezca una mayor salud intestinal
Medio intestinal
De esta forma podría:
Mejorarse la salud y el bienestar animal
Reducir la necesidad de la aplicación de tratamientos antibióticos
Mejorar el rendimiento de los animales
Esta tarea, sin embargo, no es sencilla ya que existen muchos factores que influyen sobre la microbiota, y como consecuencia, en la salud intestinal (Figura 1).
Existen, por tanto, muchas preguntas a las que es necesario dar respuesta, entre las que es importante destacar:
¿Qué concentraciones y combinaciones de metabolitos son beneficiosos o perjudiciales para la salud animal?
¿Qué microbiota produce estos metabolitos?
Nutrición
Microbiota (Epi)genética
Interacciones entre nutrición-microbiota-células intestinales
Fermentación microbiana
¿Cómo podemos influir en la composición de esta microbiota y en su actividad?
Efecto
del tejido de la mucosa
Digestión Absorción de nutrientes
Compentencia inmunitaria sistémica de la mucosa
Moduladores
Recientemente se han desarrollado nuevas tecnologías analíticas utilizadas en la microbiómica y en metabolómica, que constituyen herramientas importantes a utilizar para poder realizar un estudio detallado y preciso de la microbiota y sus metabolitos, así como el impacto de las posibles estrategias nutricionales y de incorporación de aditivos mejoradores sobre la salud animal.
Crecimiento
Susceptibilidad a factores de estrés
Óptimo rendimiento
Fuente: Arie K. Kies, Mari Smits. Understand the gut, the new metabolic way. DSM Swine Master Class, September, 2016 FIG 1. FACTORES QUE INFLUYEN EN EL MICROBIOTA Y LA SALUD INTESTINALEs importante destacar que la actividad microbiana es, probablemente, incluso más importante que la composición microbiana per se, aunque obviamente, están estrechamente relacionadas.

Por ejemplo, la producción de AGCC como el butirato es considerada beneficiosas para la salud intestinal (Moquet et al., 2016).
El butirato se produce en grandes cantidades por algunos tipos de bacterias del género Clostridium Sin embargo, muchas de sus especies, por ejemplo, Clostridium perfringens, son consideras patógenas

Por otro lado, los microorganismos pertenecientes al género Lactobacilli normalmente son considerados como bacterias beneficiosas, aunque no producen butirato, debido a la producción de ácido láctico.
Algunas variables como son las características del medio intestinal o la genética también son factores que influencian estas características.
El resultado es que la actividad microbiana ideal realmente podría ser específica para cada explotación.
Como consecuencia de lo expuesto, no resulta sencillo dar una respuesta simple a las preguntas anteriores y, por tanto, tampoco a la cuestión “¿cómo alimentar a la microbiota intestinal?”
Mientras tanto, el desarrollo de una composición microbiana estable mediante la puesta en marcha de estrategias nutricionales específicas parece ser la mejor alternativa para los productores de porcino
En otras palabras, no se puede simplificar en bacterias
“buenas” o “malas”
Los microorganismos pueden alimentarse de diferentes sustratos, como la fibra (por ejemplo, celulosa, hemicelulosa y pectinas) y la proteína.
La composición de la fibra en la dieta de los cerdos puede ser modificada para estimular el crecimiento de determinados microorganismos y para “dirigir” la actividad microbiana en la dirección deseada.
La elección del cereal, por ejemplo, tiene una clara influencia sobre la composición ileal de la microbiota en los cerdos.
En un estudio realizado con cebada como cereal de base, se observó un aumento del número de Lactobacilli y Bifidobacteria, pero en un menor nivel de microorganismos productores de butirato (Weiss et al.,2016).


Los altos niveles de β-glucanos en la cebada parecen ser beneficiosos en los cerdos contagiados con Salmonella typhimurium (Pieper et al.,2016)
Y en otro estudio, las dietas con altos niveles de β-glucanos y de almidón resistente produjeron, en general, mayores niveles de AGCC y ácido láctico, y menores niveles de amonio (NH4+).
Otros autores concluyeron que la cebada rica en β-glucanos podría mejorar la salud intestinal en cerdos (Jha et al.,2010). Esto puede resultar un poco contradictorio tiendo en cuenta que los β-glucanos, en general, son considerados responsables de los problemas de viscosidad. De hecho, Pluske et al. señalan que la presencia de PNA en dietas de lechones es perjudicial para el crecimiento y estimula la proliferación de E. coli en el intestino delgado (Pluske et al.,2002).
Se pueden encontrar, por tanto, resultados inconsistentes relativos al efecto de la nutrición en la composición de la microbiota (Rist et al.,2013)
La fermentación de la proteína podría tener un efecto negativo sobre la composición microbiana e incrementar la respuesta inflamatoria de la mucosa.

La suplementación en la dieta con carbohidratos fermentables podría mejorar algunos de los efectos de la fermentación de la proteína (Pieper et al.,2012). Esto pone de manifiesto la complejidad de la interacción de los efectos de la fermentación de las proteínas y los carbohidratos no digeridos en la función intestinal.

Debido a que los organismos pueden tener necesidades nutricionales muy distintas (Madigan et al.,2015), la suplementación en el pienso con sustratos específicos podría influir sobre el balance microbiano.
Por ejemplo, se ha observado que la riboflavina (B2) estimula el crecimiento de los microorganismos productores de butirato Faecalibacterium prausnitzii (Duncan et al.,2003), uno de los microorganismos más abundantes en el colon de los humanos.
Ya que este microorganismo necesita acetato para su crecimiento (Duncan et al.,2002), su número podría también verse influenciado por la fermentación del almidón resistente a las bifidobacterias amilolíticas.
Existen posibilidades de estimular de Faecalibacterium prausnitzii, bacteria beneficiosa.
Siendo altamente sensible al oxígeno, F. prausnitzii podría también verse beneficiado en algunos casos por la actividad antioxidante, por ejemplo, de la cisteína o la vitamina E (Khan et al.,2014).
Este tipo de procesos y mecanismos demostrados, en ocasiones en nutrición humana, están siendo
Actualmente se utilizan con éxito diversos ingredientes en los piensos, muchos de ellos registrados en la UE, que afectan de forma positiva a la composición de la microbiota beneficiosa como son:s:
Probióticos
Prebióticos
Ácidos orgánicos
Enzimas
Fitoquímicos
Aceites “esenciales”
Ácidos grasos poliinsaturados tipo Omega-3
La estabilidad microbiana en el intestino de los cerdos es esencial para la salud y la producción.
Aunque la actividad de la microbiota en el medio intestinal, como la producción de butirato o de ácido láctico, puede parecer más importante que la propia composición de microbiana, ambas están altamente relacionadas.
Dado que aún no se conoce con exactitud cual es la actividad microbiana ni la composición de la microbiota ideales, no se puede precisar la forma más adecuada de alimentar a dicha microbiota. Las modernas técnicas nos van a permitir investigarlo.
Su empleo, ya sea de forma individual o a través de mezclas sinérgicas de los mismos, ha demostrado su eficacia para promover también una mayor salud animal, aún cuando los resultados experimentales obtenidos pueden ser variables, probablemente debido a la interacción e influencia de otros factores como son el propio medio intestinal y la genética (Pluske et al.,2002; Humeet al.,2006;Wlodarska et al.,2015)
Mientras tanto, existen diferentes herramientas nutricionales eficaces para promover la salud intestinal a través de la alimentación y la modificación de la microbiota, incluyendo el uso de diferentes tipos de fibras, pre y probióticos, enzimas, vitaminas, ácidos orgánicos y aceites “esenciales”, siendo de vital importancia obtener más conocimientos sobre las composiciones de los metabolitos en el intestino y sus potenciales efectos beneficiosos o perjudiciales para que, en el futuro, este tipo de estrategias nutricionales se apliquen cada vez de forma más efectiva.
 Javier Estévez & Sergi Carné Departamento Técnico e Innovación. Industrial Técnica Pecuaria, S.A. (ITPSA)
Javier Estévez & Sergi Carné Departamento Técnico e Innovación. Industrial Técnica Pecuaria, S.A. (ITPSA)
La actividad antimicrobiana de los antibióticos hace que presenten efectos, ampliamente documentados, sobre las poblaciones microbianas comensales del tracto gastrointestinal de los animales (Rettedal et al.,2009 ; Kim et al.,2012). Aunque los mecanismos subyacentes no son totalmente conocidos, la explicación de los efectos promotores del crecimiento (Antibiotic Growth Promoters, AGP) de algunos de estos fármacos a dosis subterapéutica en piensos, parecen ser la inhibición de infecciones subclínicas y la reducción de la carga bacteriana intestinal.
Entre otros efectos los fármacos a dosis subterapeutica provocan:
La reducción de la competencia con la microbiota por los nutrientes de la dieta; puesto que se estima que el consumo de energía neta por parte de la microbiota comensal es del 6% en el cerdo (Suiryanrayna y Ramana,2015)

La reducción de la activación de respuestas inmunes intestinales inducidas por las interacciones microorganismo-hospedador
El descenso en la producción de productos derivados del metabolismo microbiano con efectos inhibidores sobre el crecimiento o sobre la función intestinal (Gaskins et al.,2002; Brüssow et al., 2015)
Debido a las mejoras productivas obtenidas, el uso de AGP era una práctica extendida en el sector porcino de la Unión Europea (UE) hasta su prohibición en 2006, y lo sigue siendo en muchos países del resto del mundo
No obstante, la tendencia global actual es la reducción del uso de estos fármacos con esta finalidad, dada la generación de resistencias, que suponen un gran desafío y un problema grave para la salud humana (Karaiskos et al., 2016).
Si no se implementan estrategias alternativas, la retirada de los antibióticos como AGPs, se acompaña habitualmente de problemas productivos importantes, yendo al empeoramiento de los parámetros productivos de los cerdos en fase de crecimiento/engorde, hasta la aparición de patologías infecciosas, que conducen a un menor número de cerdos destetados por cerda y una mayor mortalidad postdestete (Stein, 2002).
El deterioro del estatus sanitario implica un mayor consumo de antibióticos con finalidades terapéuticas y un aumento en la inclusión de compuestos como el óxido de cinc (ZnO) en las dietas (Hayes et al., 2002) con las implicaciones medioambientales y de salud pública que ello implica.
Durante los últimos años han surgido múltiples estudios sobre alternativas al uso de estos fármacos en el pienso, y han ido apareciendo distintos productos en el mercado, postulados como alternativa a los AGP.
Las alternativas planteadas, no sólo focalizan su interés en la reducción de patógenos intestinales y la modulación de la microbiota comensal, sino que también buscan tener un efecto sobre otros factores que afectan la salud intestinal (Figura 1)
Microorganismos Dieta Mucosa intestinal
Patógenos Microbiota
Productos enzimáticos Composición de la dieta

Reducción de patógenos
β-galactomananos vegetales Ácidos orgánicos
1-monoglicéridos
Extractos vegetales
Péptidos antimicrobianos
Promoción de un perfil beneficioso de la microbiota
Prebióticos, incluyendo ßGMH
Probióticos
Figura 1. Esquema de los principales factores, interrelacionados, que influyen sobre la salud intestinal, y de su relación con distintas alternativas nutracéuticas, según sus principales mecanismos de acción (Suiryanrayna et al., 2015; Huang et al.,2015; Ducatelle et al., 2015; Gibson y Roberfroid, 1995; de Lange et al., 2010; Okubo et al., 1994;Tsiloyiannis et al, 2001; Ferrara et al., 2016; Allen et al.,2014; Wang et al., 2016; Wang et al., 2016; Gallois et al., 2009)
Sistema inmune
β-galactomananos vegetales hidrolizados (ßGMH)
Otros prebióticos
Probióticos
Plasma porcino
β-galactomananos vegetales hidrolizados (ßGMH)
Ácidos grasos volátiles
1-monoglicéridos
El sistema inmune o la función barrera intestinal son factores inherente al propio animal y otros están vinculados a la dieta, como el aprovechamiento de los nutrientes o la acción sobre factores antinutricionales, como sería el caso de los productos enzimáticos.
Salud intestinal Monográfico Salud gastrointestinal & nutriciónUnas de las sustancias antimicrobianas postuladas y utilizadas como sustitutos al uso de antibióticos son los ácidos orgánicos de cadena corta y media.
Éstos no solo previenen el descenso del valor nutricional del pienso causado por la contaminación microbiológica del mismo, tal y como ocurre en el caso de los ácidos formico y propiónico, sino que pueden causar mejoras directas de los parámetros productivos, gracias entre otras causas a:
La reducción de la carga microbiana del tracto gastrointestinal (al igual que sucede en el caso de los AGP)
El aumento de síntesis endógena de enzimas digestivas
El cambio en la composición de la microbiota intestinal
Es sabido que los ácidos orgánicos reducen las bacterias patógenas, como coliformes, Clostridium spp. y Listeria spp., sin afectar a las bacterias acido-lácticas beneficiosas del género Lactobacillus spp. y Bifidobacterium spp. (Suiryanrayna et al., 2015).
Los ácidos grasos y sus sales también se utilizan como aditivos por sus efectos sobre la salud intestinal, como es el caso del butirato sódico, favorecedor de la proliferación del epitelio intestinal
Una evolución tecnológica de los ácidos orgánicos son los 1-monoglicéridos, que consisten en el éster de un ácido orgánico y glicerol en posición 1, y que presentan distintas eficacias antimicrobianas en función de la longitud de la cadena del ácido graso (Batovska et al., 2009).
Como ventaja sobre los ácidos orgánicos, la actividad de los 1-monoglicéridos no se ve tan afectada por el pH del medio, lo que les permitiría actuar en tramos posteriores del tracto gastrointestinal.
Otros productos empleados como sustitutos de los antibióticos son los compuestos fitogénicos o fitobióticos.
Éstos contienen sustancias activas derivadas del metabolismo secundario de las plantas (terpenoides, compuestos fenólicos, glicósidos, alcaloides y flavonoides, entre otras moléculas)(Yang et al.,2015; Díaz-Sánchez et al.,2015) que pueden presentar propiedades antivirales, antifúngicas, antiinflamatorias y antioxidantes, además de antibacterianas (Yang et al., 2015)

Los probióticos y prebióticos son productos cuyo objetivo suele ser la modificación de la composición y/o función de la microbiota comensal, uno de los pilares de la salud intestinal, y han sido propuestos como productos alternativos a los AGP.
Los probióticos son microorganismos vivos incluidos en la dieta capaces de aportar beneficios para la salud del hospedador (Ducatelle et al., 2015).
No obstante, el modo de acción no ha sido totalmente dilucidado para muchos fitobióticos, y esto, junto con la elevada variabilidad de eficacia, entre otras limitaciones (Yang et al.,2015), hace que aún sean necesarios estudios que consideren la inclusión de algunos de estos productos en el pienso
Aunque la estabilización de la microbiota es uno de los beneficios que aportan, pueden presentar otros, yendo desde la producción de sustancias antimicrobianas y la exclusión competitiva de patógenos, hasta la regulación de las respuestas inmunes.
A pesar de la existencia de publicaciones que afirman encontrar mejoras en los parámetros productivos de animales alimentados con probióticos, son muchos los estudios que no hallan resultados concluyentes, en gran parte, por las diferencias existentes entre cepas.

Los efectos de los probióticos parecen ser más patentes en condiciones de infección experimental, obteniendo frecuentemente resultados beneficiosos significativos sobre los parámetros productivos (Ducatelle et al., 2015).
Los prebióticos son ingredientes en base a fibra digestible, sobre todo soluble, que favorecen el crecimiento o la función de determinadas poblaciones de la microbiota comensal, aportando beneficios sobre la salud del hospedador (Gibson y Roberfroid, 1995)
β-galactomananos vegetales
Fructo-oligosacáridos (FOS)
Galactooligosacáridos (GOS)
Arabinoxilanooligosacáridos (AXOS)
Xilooligosacáridos (XOS)
Oligosacáridos de la familia rafinosa (ROS)
Los β-galactomananos vegetales hidrolizados (βGMH), surgidos recientemente, podrían clasificarse dentro de los prebióticos, puesto que son capaces de promover el crecimiento de determinadas bacterias ácidolácticas beneficiosas del género Lactobacillus (Brufau et al. 2016a). Se trata de polímeros de manosa con ramificaciones de galactosa que son sometidos a procesos tecnológicos de hidrólisis para la obtención de cadenas de menor tamaño y mayor eficacia de acción.
A diferencia de otros prebióticos, los βGMH no sólo centran su efecto en la promoción de bacterias beneficiosas, sino también sobre el resto de aspectos influyentes sobre la salud intestinal

Esta función barrera puede verse comprometida bajo distintas condiciones como, por ejemplo, la infección por enterobacterias patógenas (Salmonella spp., Escherichia coli, etc.) (Brufau et al., 2016b).
AActúan activamente sobre bacterias patógenas, como Salmonella spp y Escherichia coli enterotoxigénico (ETEC), bloqueando sus fimbrias (Badia et al., 2012) que constituyen uno de sus principales mecanismos de adhesión al epitelio (Sharon y Lis, 1993) y promoviendo su eliminación en las heces sin capacidad infectiva.
βGMH tienen efectos sobre la función barrera intestinal. La función barrera permite el control del paso de moléculas a través del epitelio intestinal hacia el medio interno, evitando la entrada incontrolada de antígenos, patógenos y tóxicos, a la vez que permite mantener las funciones fisiológicas, como es la de absorción de nutrientes.
La disfunción de la barrera aumentaría el paso de antígenos, causando la inducción de respuestas inflamatorias que comprometerían la salud intestinal, el rendimiento productivo y el bienestar de los animales.
Los βGMH revierten los efectos negativos que ejerce la infección por enterobacterias sobre la función barrera del intestino, produciéndose cambios en la estructura de las uniones estrechas entre células epiteliales, promoviendo la producción de moco intestinal protector y, en definitiva, reduciendo la permeabilidad epitelial (Brufau et al., 2016; Badia et al., 2014).
Los βGMH también actúan sobre el sistema inmune de los animales, mostrando efectos inmunomoduladores tanto en estados de infección por enterobacterias, como en condiciones fisiológicas, modulando la expresión de la proteína C reactiva (proteína de fase aguda), citoquinas proinflamatorias y receptores de tipo toll (TLR) en distintos ensayos experimentales (Badia et al., 2012; Badia et al., 2014; Badia et al., 2012).
BEn resumen, en los últimos años se han propuesto múltiples herramientas nutracéuticas para contrarrestar, al menos parcialmente, la retirada del uso de antibióticos como AGP y la reducción en la inclusión de ZnO.
La mayoría de estas estrategias centran su objetivo en la mejora de la salud intestinal del animal, corroborando la importancia que tiene ésta en el rendimiento productivo, el estado sanitario y el bienestar de los animales.
CAsimismo, también existe una función protectora frente a procesos inflamatorios subclínicos en el animal, los cuales consumen energía inicialmente destinada a producción, y que también afectan a la eficiencia de absorción intestinal de nutrientes.
En este sentido, es necesario trabajar en la definición de los modos de acción de estas herramientas nutricionales, lo que permitirá optimizar los rendimientos productivos y a la vez mantener unos elevados estándares de seguridad alimentaria.

López, I, Sujka, E, López, C & Nieto, R
Lipidos Toledo S.A. (LIPTOSA)
Sustancias de origen vegetal con efectos beneficiosos sobre la salud derivados de su actividad antibacteriana
Nutracéuticos
Productos de origen natural con propiedades biológicas activas beneficiosas para la salud y con capacidad preventiva y/o terapéutica definida.
En ambos casos se trata de productos de origen natural que se emplean con el objetivo de mejorar el estado sanitario y conseguir una mejora de los índices productivos.
Como principales fitobióticos y nutracéuticos empleados en la producción animal destacan:
Plantas medicinales Extractos de plantas Aceites esenciales
Son aquellos vegetales que contienen en todas o algunas de sus partes principios activos con acción terapéutica o mejoradora de la salud
Los extractos son la fracción no volátil que contiene los principios activos, obtenidos normalmente por extracción
Los aceites esenciales son una fracción volátil que aportan a la planta el aroma característico y son extraídos normalmente destilación.
Los principales principios activos son derivados del metabolismo secundario de la planta, sintetizados como un mecanismo de defensa frente a agresiones externas tales como hongos, enfermedades bacterianas, etc.
Como principios activos destacan los:
Heterósidos
Polifenoles
Terpenoides
Alcaloides
Mucilagos
El empleo de sustancias de origen vegetal en la medicina humana se remonta al inicio de la agricultura.
La medicina moderna ha demostrado la eficacia de estos principios y ha asumido muchos de ellos.
La medicina tradicional está siendo en muchos aspectos complementada por la medicina natural.
La aplicación a la sanidad animal de fitobióticos y nutracéuticos es más reciente.
Su uso se inició en la acuicultura y se está generalizando en todas las especies animales.
La necesidad de encontrar alternativas al uso de antibióticos ha hecho que su uso en los últimos años se esté generalizando.
La utilización de fitobióticos y nutracéuticos se debe fundamentalmente a su efecto en la función intestinal.
Los fitobióticos se emplean para evitar la aparición de disbiosis mediante su actividad bactericida y/o bacteriostática y por su efecto en las secreciones enzimáticas y estructura intestinal.
Entre las principales propiedades terapéuticas de los aceites esenciales y extractos de plantas, cabe destacar sus funciones:
Antiséptica
Bactericida
Expectorante
Antiinflamatoria
Carminativa
Eupéptica
La búsqueda de sustitución de antibióticos promotores de crecimiento hace que se incida especialmente en la investigación de productos con alta capacidad bactericida y/o bacteriostática.
El mecanismo de acción bacteriostática o bactericida de los extractos naturales y aceites de plantas aún no es bien conocido. Se considera que su acción se debe a la presión que ejercen sobre la membrana celular dando lugar a desequilibrios que comprometen el equilibrio osmótico y que acaban con la lisis de la bacteria.
La eficacia in vitro de los aceites esenciales y extractos de plantas ha sido demostrada en numerosas investigaciones y es uno de los criterios principales en la actualidad de selección en el desarrollo de combinaciones simbióticas

Una de las principales características de los aceites y extractos de plantas es la sinergia con otros productos orgánicos empleados comúnmente en alimentación animal.
Otra línea abierta de investigación es su efecto de mejora de secreciones digestivas y funcionamiento de enzimas a nivel intestinal.
Los fitobióticos actúan incrementando las secreciones pancreáticas y mejorando el funcionamiento de amilasas y lipasas a nivel intestinal.

La acción combinada de ácidos y aceites esenciales ha demostrado tener un efecto sinérgico.
Los extractos y aceites permiten una mejor penetración del ácido a través de las membranas bacterianas, incrementando la permeabilidad y permitiendo al ácido actuar de forma disociada a nivel intestinal (Figura 1).
El incremento de secreción de enzimas digestivas a nivel pancreático se produce de modo significativo cuando se combinan dosis adecuadas de ácidos orgánicos con determinados aceites esenciales, lo que conduce a una mejor actividad intestinal y a una mejor integridad de la mucosa.
El aumento de la actividad enzimática es inferior, cuando se utilizan ácidos orgánicos y aceites esenciales individualmente.
Otra de las propiedades que justifica el empleo de aceites esenciales es su actividad inmunomoduladora
Sobre los inconvenientes del uso de estos principios destaca su posible toxicidad cuando se usan a dosis inadecuadas. Se considera que la toxicidad de los extractos naturales y aceites esenciales es más reducida cuando se encuentran sin purificar.
Desde el punto de vista tecnológico, se requiere de sistemas de protección que reduzcan su volatilidad.

La salud e integridad del tracto gastrointestinal es clave en la productividad de los animales. Se define como la funcionalidad óptima del intestino.
Un tracto digestivo saludable será aquel, que mantenga su funcionalidad estructural, bioquímica y además tenga una población microbiana equilibrada.
El tracto gastrointestinal en el animal es la principal barrera que se encuentran los microorganismos para acceder al organismo.
El tracto gastrointestinal como la principal puerta de entrada del sistema inmunológico
El tracto gastrointestinal cumple dos funciones básicas:
Absorción y asimilación de nutrientes
Principal barrera protectora contra enfermedades bacterianas y víricas en los animales
Tradicionalmente el equilibrio de la flora patógena y saprofita se ha mantenido con la ayuda del empleo de antibióticos.
Las exigencias normativas en los países industrializados, acompañado de las demandas de alimentos de riesgo sanitario cero, por parte del consumidor han hecho que sea necesario abrir líneas de investigación novedosas.

Los fitobióticos y nutraceúticos han pasado en los últimos años a ser una herramienta imprescindible dentro de la alimentación animal.

Una alteración de la integridad intestinal repercutirá en una menor absorción de nutrientes y su menor aprovechamiento.
Las proteínas absorbidas se requerirán para lograr una recuperación de la integridad y al mismo tiempo habrá un desvío de la energía producida hacia la reparación
Diversos factores pueden alterar la integridad del intestino tanto infecciosos como no infecciosos, coccidios, parásitos, pero también malas dietas o mala presentación de la dieta, abuso del uso de antibióticos, etc.
Efectos positivos de los fitobióticos
Estos efectos pueden explicarse por:
La activación de la ingesta de alimento
La secreción de enzimas digestivas
La estimulación del sistema inmune
La modulación de la microflora intestinal
Efectos anti-bacterianos
Propiedades anti-inflamatorias
Los polifenoles suelen utilizarse en alimentación animal debido a su poder antioxidante dirigido a contrarrestar el estrés oxidativo ante situaciones de gran actividad metabólica o frente a procesos infecciosos e inflamatorios a nivel intestinal.

Otros efectos positivos de algunos extractos de plantas son derivados de su actividad sobre órganos relacionados con el aparato digestivo.
Muchos fitobióticos y nutraceúticos trabajan sobre el hígado mediante su actividad hepatoprotectora como es el caso del extracto de alcachofa y silimarina.
AlcachofaComo consecuencia de la mejora de la integridad intestinal derivada del uso de fitobióticos y nutraceúticos cabe esperar, además de menor incidencia de enfermedades digestivas, una mejora de los parámetros productivos
 Silimarina
Silimarina
Utilizando extractos botánicos en producción animal se han observado fundamentalmente mejoras en índice de conversión alimenticia y rendimientos zootécnicos.
Planta Nombre Científico Sustancia Activa Propiedades
Ajo Allium vulgare Alicina Estimulante digestivo, antiséptico
Anís Illicum verum Anethole Estimulación digestiva.
Canela Cinnamomum zeylanicum Phtalides Estimulante digestivo, estimulante apetito, antiséptico



Capsicum Capsicum annum Capsacin Antidiarreico, anti-inflamatorio, estimulante tónico

Clavo Syzigium aromaticum Eugenol Antiséptico, estimulante digestivo, estimula apetito
Laurel Laurus nobilis Cineol Antiséptico, estimulante digestivo, estimula apetito
Menta Menta peperita Menthol Antiséptico, estimulante digestivo, estimula apetito

Orégano Origanum vulgare Carvacrol Antimicrobiano, antiséptico, estimulante digestivo, antioxidante


Romero Rosemarinus officinalis Cineole Estimulante digestivo, antiséptico, antioxidante


Tomillo Thymus vulgaris Thymol Estimulante digestivo, antiséptico, antioxidante
Adaptado de Charis, K (2000)

La mayoría de las combinaciones fitobióticas actuales se comercializan basándose en sus propiedades organolépticas dentro del grupo funcional “aromatizantes” definidos por el Reglamento (CE) 831/2003 del Parlamento Europeo y del Consejo de 22 de septiembre de 2003 sobre los aditivos en la alimentación animal (DO L 268 de 18.10.2003) como “sustancias cuya adición a los piensos aumenta su aroma o palatabilidad”.
No existe un apartado en la legislación que facilite el uso de estos productos con fines sanitarios.
La Agencia Europea de Seguridad Alimentaria publicó en 2010 un documento que sirviese como guía para evaluar específicamente la seguridad de estos productos en las solicitudes de autorización de estos productos para su uso como aditivos organolépticos o zootécnicos en la alimentación animal (FEEDAP, 2010).
Se hacen necesario para llegar a la autorización con fines sanitarios y/o zootécnicos una mayor investigación y estudio del conocimiento de su mecanismo de acción, dosis óptima de uso, eficacia y repetitividad de resultados e inocuidad, así como su trazabilidad y estabilidad y estandarización de sistemas de producción.
No obstante, en 2010 y 2012 se autorizaron como “aditivos zootécnicos” varios preparados formados por mezclas de aceites esenciales, extractos vegetales o especias destinados a aves y cerdos.
No obstante, el alto potencial de este grupo de productos tanto con fines productivos como sanitarios en la industria de la producción y alimentación animal se demuestra en la cada vez mayor investigación de las empresas privadas y centros de investigación en el conocimiento de estos productos.
 Richard Markus y Franz Waxenecker Departamento de I+D, Biomin
Richard Markus y Franz Waxenecker Departamento de I+D, Biomin
Lospatógenos se han convertido en uno de los desafíos relacionados con la salud intestinal y el rendimiento a combatir dadas las mayores exigencias impuestas a la producción porcina moderna.
El tracto gastrointestinal (TGI) es un sistema muy complejo que acoge alrededor del 70-80% del sistema inmunológico total, y juega un papel crucial en el rendimiento futuro de los animales.
Tendencias
El mayor rendimiento estándar sanitario de los animales en comparación con los animales que se enfrentan a desafíos patogénicos puede explicar, en parte, por qué el uso sub-terapéutico de los antibióticos (AGP) sigue siendo generalizado en muchos países.
Sin embargo, la presión legisladora, la demanda de los consumidores y las preocupaciones sobre la salud relacionadas con la resistencia a los antibióticos han llevado a muchos productores a adoptar estrategias de reducción de antibióticos o de alimentación libre de antibióticos.
En 32 países ya se han impuesto al menos una prohibición a nivel nacional para los promotores del crecimiento antimicrobiano y alrededor de 35 tienen un requisito de receta veterinaria.
Y, en algunas áreas, se han hecho esfuerzos como la prohibición en 2006 de la Unión Europea sobre el uso de antibióticos como promotores del crecimiento en la alimentación animal.
Un metanálisis realizado con más de 1.000 ensayos con ganado porcino entre 1950 y 1985 mostró mejoras en la ganancia diaria media (GMD) y en el índice de conversión (IC) del 16,4 por ciento y 6,9 por ciento, respectivamente, en lechones.
Un nuevo estudio de Teillant y Laxminarayan (2015) corrobora estos hallazgos, pero revela que, desde el año 2000 los antibióticos en el pienso provocan sólo respuestas menores en los indicadores de rendimiento de cerdos según las diferentes etapas de producción.
Los autores sugieren varias posibles explicaciones:
1 2
los AGP pueden tener un impacto reducido cuando la nutrición animal, la higiene, la genética y el estado de salud de los animales son óptimos.


la resistencia a los antibióticos puede desempeñar un papel en la disminución de la eficacia de AGPs.
Esto coincide con un aumento en los niveles de dosis recomendados de antibióticos subterapéuticos en las últimas décadas.
1986
1986
Dritz, 2002 Dritz, 2002 Van Lunen, 2003
Los microorganismos presentes en el agua, los piensos y el medio ambiente de la naves ejercen un impacto en el TGI, condicionando la rentabilidad de la granja.
La secuenciación es también una herramienta importante para mapear los procesos inflamatorios y la mucosa y la integridad epitelial con el fin de explorar el potencial antiinflamatorio y protector del intestino de los nuevos aditivos utilizados en piensos.
Soo-Je et al. (2014) aplicaron métodos de pirosecuenciación a base de genes rRNA 16S de alto rendimiento para estudiar la distribución de las bacterias mayoritarias en el intestino del cerdo y encontraron que esta distribución está asociada con la calidad de la carne en cerdos.
Como afirmaba Eder et. Alabama (2013), en un ensayo in vitro con células Caco-2 después de desafiar las células con TNF-α, los fitogenéticos fueron capaces de disminuir los niveles de ARNm de genes Nf-кb objetivo (IL-1, ICAM-1, MCP-1 ).
Hoy en día, las tecnologías emergentes de genómica, transcriptómica, proteómica y metabolómica, conocidas como tecnologías ómicas.
Éstas permiten un profundo conocimiento del metabolismo celular de organismos vivos, y estas tecnologías permiten estudiar tanto la microbiota intestinal como el tejido huésped, dado que ambos influyen tanto en la salud como en el rendimiento de los animales.
Hecho que se considera como un efecto antiinflamatorio de los aditivos alimentarios fitogénicos.
Eder y Gessner (2016) demostraron este efecto también in vivo cuando analizaron diferentes partes del TGI y observaron menor inflamación en el tejido cuando usaron fitogénicos en pienso.
Hecho que se explica por la regulación negativa de los genes objetivo de Nf-кb y la regulación positiva de genes objetivo de Nrf2(*) .
(*) El factor de transcripción Nrf2 es responsable de la actividad anti-oxidativa al aumentar el nivel de expresión de sus genes diana (CYP1A1, HO-1, UGT1A1).

comprobar
Una parte importante del TGI ejerce de función barrera, formada por las células epiteliales conectadas entre sí juntas y cubiertas por el moco producido por las células caliciformes.
Según Antonissen (2014), las micotoxinas, en particular el metabolito desoxinivalenol producido por Fusarium, son capaces de aumentar la permeabilidad de la capa epitelial intestinal.

Hecho que puede explicarse por la menor regulación de los genes que codifican las proteínas Claudina 1 y Ocludina de la unión estrecha transmembrana, por lo que se reduce la interconexión de las células epiteliales intestinales.
En consecuencia, el riesgo de translocación para-celular de patógenos aumenta y puede ser un precursor para la aparición de enteritis necrótica y otras enfermedades infecciosas.
Greiner et al. (2011) observaron un efecto en las células inmunitarias, así como en la expresión de citoquinas y las proteínas de unión E-cadherina y Ocludina al alimentar a lechones con dietas cocontaminadas con desoxinivalenol y fumonisina.
Según observó Antonissen(2015), la composición de la mucina duodenal puede ser influenciada por la presencia de micotoxinas.
Mountzouris (2016) reporta una mayor expresión de MUC-2 intestinal en presencia de fitogénicos, lo que indica que en cierta medida la capa de moco, la función de barrera de TGI también puede ser influenciada positivamente por los aditivos alimentarios fitogénicos (PFA, por sus siglas en inglés).
Cuando se ve dañada la función de barrera del TGI - capa de moco más delgada, vellosidades más cortas, uniones estrechas destruidas- , las bacterias patógenas la pueden atravesar y llegar al corriente sanguíneo, además de disminuir el metabolismo y el crecimiento del animal.
Una pregunta relevante es si las bacterias multirresistentes..., que no pueden ser controladas por los promotores del crecimiento antibióticos, pueden ser influenciadas por nuevos promotores del crecimiento (NGPs)
Las tecnologías ómicas también se usan para estudiar las resistencias a los antibióticos, secuenciando el microbioma intestinal.
Roth (2014) observó en muestras fecales de lechones que un producto en base a ácido redujo significativamente la resistencia a la ampicilina y la multirresistencia de E.coli aTetraciclina + Estreptomicina + Sulfametoxazol - .
Cuando la salud intestinal se ve perjudicada por la desnutrición o por la presencia de bacterias o compuestos tóxicos, el huésped tratará de restaurar la condición óptima a través de una respuesta inmune.
Tales mecanismos de defensa requieren energía y nutrientes, los cuales compiten con la demanda de nutrientes del animal para su mantenimiento y crecimiento.
Klasing (2007) ha observado una pérdida de productividad de hasta el 10% del uso de los nutrientes durante una respuesta en fase aguda que, de otro modo, habría ido sido destinada a crecimiento.
Otros investigadores han estimado que:
Webel et al.,1998: este coste de nutrientes es 1,3 veces el de mantenimiento
Sandberg et al., 2007: un coste diario de 0,27 g de proteína ideal por kg de peso corporal.
Liu et al (2003) midieron en una prueba de desafío el impacto de un lipopolisacárido (LPS) en el rendimiento en lechones destetados.
Debido al desafío, los marcadores de inflamación como el cortisol, la PGE2 y la IL-1β fueron 3 a 4 veces más altos en los grupos con LPS mientras que el IGF-1 se redujo en alrededor del 45%.
Este hecho dio como resultado una caída del 13% en la ganancia diaria promedio (ADG) en el grupo con LPS.
A continuación resumimos los resultados obtenidos en nueve ensayos de cerdos realizados en varios países alrededor del mundo, en los que se pusieron a prueba AGP (siglas en inglés de Promotores de Crecimiento Antibióticos) y NGP (siglas en inglés de Nuevos Promotores de Crecimiento - fitogénicos y productos basados en ácidos orgánicos).
Las pruebas se realizaron en diversas etapas de producción y se pudo observar que cada grupo NGP tuvo un mejor rendimiento en términos de IC y GMD comparado con el grupo AGP (Figuras 2 y 3).
En otros siete ensayos se midieron los efectos de antibióticos y aditivos fitogénicos (PFA, por sus siglas en inglés) , observando que los PFA proporcionaron una mejora del 5,47% en el IC en comparación con AGPs.
En siete ensayos de antibióticos y aditivos fitogénicos, los cerdos que recibieron PFA tuvieron una ganancia media diaria de 6% más de promedio a los que recibieron AGP.
En dos ensayos en los que se pusieron en prueba antibióticos y productos basados en ácidos orgánicos, se pudo observar que los cerdos que recibieron acidificantes tuvieron una ganancia media diaria de 10,8% más de promedio que los que recibieron AGP.
Figura 2. Media de IC obtenidos en las nueve pruebas realizadas en cerdos Figura 3. Media de resultados de GMD en las nueve pruebas realizadas en cerdosLos ensayos anteriores indican que el rendimiento a través de la mejora de la salud del TGI puede mantenerse con el uso de los nuevos promotores del crecimiento (NGP) y que estos pueden ser considerados una herramienta importante en las estrategias de reducción de antibióticos.
El objetivo de los NGP debe ser siempre la prevención de enfermedades y no su tratamiento.
La especie, la fase de producción, las condiciones de la granja, la dosificación del producto y las consideraciones sobre el ROI (retorno de la inversión) influyen en la elección del aditivo para piensos.
Además, se ha demostrado que las combinaciones de aditivos funcionan con éxito en situaciones particulares para alcanzar objetivos específicos en la prevención de enfermedades causadas por bacterias patógenas específicas, micotoxinas, endotoxinas.

Este hecho significa que los aditivos para piensos como los fitogénicos, los productos orgánicos basados en ácidos, los probióticos y los desactivadores de las micotoxinas pueden desempeñar cada uno un papel en la producción futura como parte de una solución a medida para ayudar a los productores a alcanzar los objetivos de salud animal y rendimiento.

Efectos del los procesos inflamatorios en lechones post-destete en la salud intestinal
Potencial de los fitógenos para mitigar estos efectos

Ester Vinyeta, Species Leader Swine
Delacon Biotechnik GmbH, Steyregg, Austria
Loslechones neonatales experimentan varias situaciones de estrés, como el nacimiento, efecto de la jerarquía social de los lechones en camadas grandes, cambios abruptos en la dieta y retraso en la ingesta después del destete.
La falta de suministro de nutrientes en el periodo post-destete provoca la peroxidación lipídica y el daño del ADN en los enterocitos, aumenta la apoptosis celular y reduce la integridad intestinal, aumentando el riesgo de infecciones intestinales y de respuestas inflamatorias locales.
Dado que inflamación y estrés oxidativo están estrechamente relacionados y vinculados en posteriores desafíos tanto con patógenos como no patógenos, las soluciones nutricionales deberían abordar tanto los efectos antioxidantes como anti-inflamatorios.

En este artículo se discute el potencial de los extractos de planta o fitogénicos con un enfoque en sus actividades antioxidantes y anti-inflamatorias.
En la práctica, los lechones se destetan entre tres y cuatro semanas de edad y la ingesta energética diaria se reduce fuertemente después del destete hasta en un 80% (Figura 1) y no se recupera hasta pasados 10 - 14 días (Le Dividich et al., 2000).
El bajo suministro de nutrientes después del destete, entre otros factores de estrés, causa: peroxidación de los lípidos celulares, daño del ADN en los enterocitos, aumento de la apoptosis celular y reducción de la integridad intestinal.
En consecuencia, aumenta el riesgo de infecciones intestinales y las respuestas inflamatorias locales provocan un daño oxidativo adicional.
Leibbrandt et al. (3)
Le Dividich et al. (4,5,8)
Bark et al. (6) Noblet and Etienne (9) McCracken (7)
Periodo de pre-destete (días)
Periodo de post-destete (días)
El resultado final de las afecciones gastrointestinales son las diarreas post-destete.
Biswas (2016) concluyó que la inflamación y el estrés oxidativo son interdependientes y estrechamente vinculados a los procesos fisiopatológicos (Figura 2).
A medida que el factor causal a menudo no está claro (estrés oxidativo que resulta en la inflamación o viceversa), soluciones para la diarrea post-destete deben abordar tanto los efectos antioxidantes como los antiinflamatorios para aumentar su tasa de éxito.
Además del efecto en la restricción de nutrientes, el destete temprano es un factor de estrés importante en la vida del lechón.
Zhu et al. (2013) comparó los efectos del destete en lechones destetados a los 21 días con los destetados a los 25 días
El primer grupo mostró niveles elevados de cortisol sérico a los 25 días de edad (105 frente a 60 ng / ml de suero para los lechones destetados a los 21 y 25 días, respectivamente), niveles reducidos de antioxidantes celulares y aumento de la peroxidación lipídica (Tabla 1) resultando en un aumento del índice apoptótico de las células intestinales, acortamiento de las vellosidades y profundización de las criptas.
Estos datos fueron corroborados por Wei et al., (2016), quienes observaron un incremento en los contenidos de especies reactivas de oxígeno (ROS), una disminución de las enzimas superóxido dismutasa (SOD) y glutatión peroxidasa (GSH-Px) y el aumento de TBARS en la mucosa yeyunal, así como daño en la morfología intestinal (Tabla 1) en lechones destetados comparado con lechones pre-destete.
La concentración de indicadores de inflamación como el factor de necrosis tumoral (TNF-α), las interleucinas IL-1β e IL-6 en la mucosa yeyunal aumentaron después del destete, mientras que los niveles de proteínas ocluyentes (como zónula ocludens (ZO-1) y ocludina) se redujeron.
y la morfología en el tejido yeyunal de lechones destetados.
Sus resultados indican claramente una interrelación entre la oxidación y la inflamación alrededor del destete, induciendo la apoptosis celular y reduciendo la integridad intestinal.
La translocación bacteriana estimula la producción local de especies de oxígeno reactivo (ROS) y de nitrógeno (RNS) por los fagocitos para neutralizar los organismos invasores.
Las infecciones con cepas de E. coli enterotoxigénicas en lechones jóvenes dan lugar a una alta morbilidad y mortalidad, causando grandes pérdidas económicas.
La incidencia de diarrea neonatal en lechones depende de la ingesta de calostro y leche y de la concentración de anticuerpos presentes.
Estos radicales modulan quinasas proteínicas y lipídicas, fosfatasas, receptores de membrana, factores de transcripción (incluyendo factores nucleares (NF-kβ)), que a su vez regulan la expresión de citoquinas.
Song et al. (2016) indujeron la inflamación en los lechones después del destete a través de una inyección intraperitoneal con lipopolisacáridos (LPS) de E. coli.
Después del destete, la incidencia de diarrea aumenta debido a:
una brecha inmunológica (interrupción de la ingesta de anticuerpos a través de la leche),
cambios abruptos en la dieta, aumento del pH estomacal y cambios en la configuración enzimática y celular del intestino
Y, además, estos últimos cambios amplifican los efectos adversos del destete en la mucosa intestinal.
Este desafío de LPS provocó una respuesta inflamatoria (aumento de la expresión de TNF-α, IL-6 e IL-8) y estrés oxidativo (aumento del malondialdehído (MDA), disminución de la SOD y aumento de GSH-Px en sobrenadantes del yeyuno e íleon de lechones).
Demostraron que esta respuesta inflamatoria reduce la resistencia eléctrica de la mucosa intestinal y aumenta el transporte paracelular desde el lumen al flujo sanguíneo.

En una revisión reciente sobre el uso de plantas medicinales para los desafíos gastrointestinales y respiratorios, Ayrle (2016) identificó las plantas candidatas más prometedoras para prevenir o tratar:

enfermedades gastrointestinales, la inmunomodulación y la reducción de los procesos inflamatorios.
Las actividades descritas son principalmente antimicrobianas, antiadhesivas, antioxidantes, antiinflamatorias e inmunoestimuladoras.
En las líneas siguientes, se discute el potencial antioxidante y antiinflamatorio de los aceites esenciales de plantas y sus activos.



La suplementación de la dieta con aceites esenciales de plantas puede ser una estrategia para contrarrestar los efectos negativos del destete y de los desafíos infecciosos posteriores al destete, gracias a sus actividades antioxidantes y antiinflamatorias.
Tales actividades asociadas a los aceites esenciales de plantas han sido descritas en revisiones recientes.
Saleh (2010), Miguel (2010), Cássia da Silveira (2013), Zeng (2014). Cai et al. (2004) mostró una clara relación entre la capacidad antioxidante y el contenido en fenoles de los aceites esenciales (Figura 3).
Contenido total en fenoles(g equivalentes ácido gálico / 100g materia seca)
En el estudio de Saleh (2010), de un total de 248 aceites esenciales pertenecientes a 18 familias botánicas de flora medicinal, herbácea y salvaje, sólo se encontró que el 7% tenían actividades antioxidantes y poder de eliminación de radicales ROS / RNS, relacionadas con los terpenos (monoterpenos y sesquiterpenos) y componentes oxigenados (ej. fenoles).
Además, los aceites esenciales tienen una actividad antioxidante indirecta gracias a la regulación positiva de la producción intracelular de las enzimas antioxidantes, como SOD y GSH-Px (Franz et al., 2010), y esta actividad la muestran tanto los aceites esenciales fenólicos (ej. aceite de orégano y de tomillo) como los no fenólicos (ej. aceite de cúrcuma y de romero).
Además del potencial antioxidante, algunos aceites esenciales muestran gran actividad antiinflamatoria, como la manzanilla, eucalipto, romero, lavanda o milenrama (Miguel, 2010).
En su revisión, Miguel (2010) describió diferentes vías de respuesta antiinflamatoria y modulación a través de aceites esenciales y sus principales componentes activos.
Durante una respuesta inflamatoria, la permeabilidad del revestimiento endotelial de los vasos sanguíneos se incrementa y los fagocitos se mueven hacia el intersticio seguido de una explosión oxidativa en varias células (monocitos, neutrófilos, eosinófilos y macrófagos) y liberación de citoquinas proinflamatorias, como IL1- β, IL-6 y TNF-α (Figura 2).
Después de los estímulos inflamatorios, el ácido araquidónico se libera de las membranas celulares y se metaboliza a través de la lipoxigenasa (LOX) para producir leucotrienos o de la ciclooxigenasa-2 (COX2) para producir prostaglandina-E2 (PGE2), otro importante mediador inflamatorio.
En el caso de la milenrama (Achillea millefolia) Chou et al (2014) demostró que la actividad antioxidante del aceite esencial era el resultado de su actividad antiinflamatoria, suprimiendo las respuestas inflamatorias de macrófagos previamente estimulados con LPS.

Ruta metabólica Efectos
Metabolismo Araquidónico
Dependiendo de su composición química, pueden actuar en el metabolismo araquidónico y la producción de citoquinas, o modular la expresión génica pro-inflamatoria. Un resumen de las principales vías en la respuesta inflamatoria y ejemplos de aceites esenciales y componentes activos que modulan esta respuesta se da en la Tabla 2.
Aceites esenciales de plantas
Componentes activos
Una ingesta baja de nutrientes en los lechones post-destete como consecuencia del cambio abrupto de la dieta, junto con otros factores de estrés causa peroxidación lipídica celular, incremento de la apoptosis celular de los enterocitos y daño de la mucosa intestinal.
Ciclooxigenasa
COX2
Lipoxigenasa
LOX
Prostaglandina-E2
Amplificar el mecanismo del dolor
Mejorar la permeabilidad vascular
Aloe barbadensis
Illicium verum
Citrus bergamia
Cinamomum
zeylandicum
Eucalyptus
globulus
Juniperus comunis
Limonene
Acetato de Linall
Trans - \ betacarofileno
1,8-cineol
P-Cymene
timol
Eugenol
El riesgo de infecciones intestinales aumenta y las respuestas inflamatorias locales inician un daño oxidativo adicional. En conclusión, la oxidación celular y la inflamación son interdependientes.
Leucotrienos
Producción de citocinas
TNF-α
IL-1-β
IL-6
Marcadores proinflamatorios
Contracción
músculo liso de los vasos sanguíneos
Mejorar la permeabilidad vascular
Mediar la respuesta proinflamatoria
Torreya nucifera
Limonene
Δ-Careno
Α-pineno
Melaleuca
alternifolia
Cordia verbenacea
Artemisia fukudo
Taxandria fragans
Terpinen
Α-Humulene
Α-Thujone
1,8-Cineole
La suplementación de la dieta con una óptima combinación de aceites esenciales de plantas puede reducir eficazmente la oxidación celular gracias a su capacidad para eliminar los radicales libres y la regulación positiva de las enzimas antioxidantes, reducir la inflamación a través de un descenso en la producción de prostaglandinas y citoquinas y mejorar la integridad intestinal y la función de barrera.
Tabla 2. Aceites esenciales y sus actividades antiinflamatorias (según Miguel, 2010).La actividad antiinflamatoria de los aceites esenciales y sus componentes activos puede atribuirse a su actividad antioxidante, o a sus interacciones con las rutas de señalización en el proceso inflamatorio.
 Javier Polo, Carmen Rodríguez, Luis da Veiga y Victor Deike. APC Europe, S.A.
Javier Polo, Carmen Rodríguez, Luis da Veiga y Victor Deike. APC Europe, S.A.
Losproductores de cerdo saben lo crítico que es alcanzar la mejor nutrición, ambiente, salud y prácticas de manejo para ayudar a los cerdos durante la transición en los múltiples factores de estrés asociados al destete.

Se estima que un cerdo sin ganancia de peso durante la primera semana post-destete tarda 10 días más en llegar al peso de mercado.
Según Paredes y col.,
60-70% de la variación en el peso corporal al final de la crianza (63-64 días de edad) son debidos a:
La temporada del nacimiento El peso al nacer El peso al destete El peso corporal a las 6 semanas
30% de la variación en el peso hasta sacrificio con 110 kg lo explica:
El peso corporal al final de maternidad
La tasa de crecimiento durante las semanas 1 a 3 post-destete tiene un claro impacto en la evolución del cerdo hasta sacrificio
El plasma porcino secado por atomización (SDPP, por sus siglas en inglés) se usa ampliamente como una fuente de proteína en dietas de iniciación de cerdos por la mejor nutrición que aporta, y sus bien documentados efectos beneficiosos en el crecimiento y consumo en cerdos destetados.
La mejora observada en el rendimiento de cerdos post-destete alimentados con SDPP, puede estar relacionada con los efectos inmuno-moduladores que minimizan las disfunciones intestinales asociadas al estrés del destete y ayuda al cerdo a ser más resistente a posteriores condiciones de estrés que puedan producirse en su vida.
Una extensa revisión de 54 experimentos, comparando dietas con SDPP frente a dietas con otras proteínas especializadas fue realizada por Torrallardona (2010) y mostró que administrando SDPP durante las dos semanas iniciales post-destete, mejoraba significativamente la GMD (Ganancia Media Diaria) y el CMD (Consumo Medio Diario de Alimento) en comparación con el resto de proteínas testadas, sin importar la edad del cerdo al destete (Tabla 1).
A su vez, el SDPP ha demostrado que es una alternativa real y consistente a los antibióticos promotores del crecimiento y existe numerosa bibliografía científica al respecto (Polo y col., 2014; Torrallardona, 2010).
Además, el uso de SDPP no solo está limitado a las dietas de cerdos destetados, ya que se han descrito otras aplicaciones exitosas en otras etapas de la vida del cerdo.
Tabla 1. Mejora de crecimiento sobre las dietas control de lechones alimentados con plasma porcino atomizado durante dos semanas al destete.
n= número de pruebas *= P < 0.05. Significancia estadística de mejora sobre las dietas controles sin plasmaDiferentes estudios indican que la nutrición aportada por el SDPP en dietas de animales mejora la respuesta inmune a nivel mucosal y puede restaurar la respuesta inmunitaria a través de mecanismos interactivos entre el intestino y los sistemas inmunes.
La evidencia de que las proteínas de plasma en la dieta alteran el estado de citoquina tisular en animales sometidos a eventos inflamatorios inducidos por patógenos y/o estrés de producción, sugieren un mecanismo primario por el cual la dieta con proteínas de plasma restaura las funciones productivas de los animales y reduce los efectos nocivos de enfermedad u otros factores de estrés.
Estos cambios adversos, tanto de corto como de largo alcance que ocurren en el intestino, incluyen el aumento de la permeabilidad intestinal y una sensibilidad mayor a subsecuentes factores de estrés. Por tanto, la modulación de la salud intestinal durante el periodo inmediato al destete puede tener beneficios significativos en la salud y funcionalidad intestinal del cerdo a largo plazo, así como en un uso más eficiente de la energía que aporta la dieta al reducir la sobre-estimulación del sistema inmunitario del animal.
En un estudio publicado recientemente (Boyer y col., 2015), los autores querían probar los efectos tanto de los niveles como de la extensión de la suplementación con plasma secado por atomización (SDPP) durante el periodo inmediato al destete para comprobar si mejoraba la salud de la mucosa intestinal y la función de defensa en los animales cuando se enfrentaban posteriormente en otras fases productivas a factores de estrés típicos de la producción intensiva (estrés por transporte + infección) como normalmente ocurren durante la transición de la fase de criadero a la de engorde a los 50 días de edad.

Si la dieta no contiene un nivel lo suficientemente alto de plasma y si este no es proporcionado durante un periodo suficiente de tiempo, la habilidad de superar el estrés subsiguiente puede reducirse.
Se demostró que los cerdos que habían consumido SDPP al destete por un periodo adecuado (14 días al 5% de inclusión en la dieta) respecto a un grupo control sin plasma u otro grupo con sólo un 2.5% de plasma durante la primera semana del destete, mejoraban significativamente la permeabilidad intestinal y recuperaban más rápidamente la función de integridad intestinal tras someterlos al final de la crianza cuando consumían un pienso común sin SDPP a una disfunción de la barrera intestinal a consecuencia d someterlos a un estrés de transporte combinado con un desafío con Salmonella typhimurium.
Estos resultados demuestran que mantener correctamente la función normal intestinal durante el periodo inmediato al destete, mejora la habilidad de los cerdos para superar subsecuentes situaciones de estrés.
Además, estos datos demuestran que la habilidad para superar subsecuentes situaciones de estrés está relacionada con el nivel de plasma en la dieta.
En un estudio reciente (Pujols y col., 2016) se observó que la suplementación con SDPP en el pienso de iniciación durante los primeros 14 días post-destete mejoró el crecimiento de los cerdos (vacunación frente PCV2 y Mycoplasma (Mhyo)).
El efecto de un buen arranque del lechón permite mejorar el rendimiento del ciclo de crecimiento completo y contrarrestar o mitigar eventuales depresiones puntales de crecimiento como, por ejemplo, en la vacunación al destete.

Esta es una práctica común para prevenir o reducir los efectos negativos de esas infecciones. Sin embargo, la vacunación lleva asociada la estimulación del sistema inmune que puede provocar un cierto letargo y reducción en el crecimiento durante los inmediatos días posteriores a la vacunación.
Durante los primeros 7 días posteriores al destete y durante la vacunación, los cerdos alimentados con SDPP tuvieron una mejor eficiencia y desarrollo, independientemente de que recibieran o no la vacunación a los 3 días post-destete (Fig.1).
El estrés asociado al destete y a la vacunación, pueden resultar en un bajo desempeño post-destete.
< 0.05)
Fig. 1. Ganancia media diaria (GMD) de cerdos destetados vacunados (V+) o sin vacunar (V-) y alimentados con dieta control (C) o con SDPP (P) durante 14 días al destete. *SDPP vs. C (PPor otro lado, los resultados globales a terminación de ciclo, mostraron una menor mortalidad desde destete a matadero (0-145 días) en los cerdos que consumieron plasma durante los primeros 14 días post-destete respecto a los que consumieron la dieta control (3,9% vs 11% de mortalidad, respectivamente).

Asimismo, el peso de canal en los cerdos previamente alimentados con SDPP en la dieta de iniciación aumentó en promedio 2,2 kg comparado con los cerdos que no consumieron plasma en sus dietas de iniciación (Tabla 2).
Peso Carcasa caliente, Kg1
Los resultados demuestran la importancia de que los lechones tengan un buen arranque al destete y consigan recuperarse lo más rápidamente posible de las diferentes situaciones de estrés que acontecen en el animal durante este periodo tan crítico de su vida.
Una diferencia de tan solo 77 g/día de ingestión durante la primera semana post-destete puede significar 10 días más en cebadero, ésta es la demostración inequívoca de que asegurar un buen consumo de pienso en los primeros días después del destete puede tener un fuerte impacto económico en la producción de carne.
Esos resultados fueron independientes de que los cerdos estuvieran o no vacunados.
Akester A.R. 1986. Structure of the glandular layer and koilin membrane in the gizzard of the adult domestic fowl (Gallus gallus domesticus). Journal of Anatomy, 147: 1–25.
Alvarez A., Pérez H., Martín T.C., Quincosa J., Sánchez A. 2009. Fisiología animal aplicada. Editorial Universidad de Antioquía. 382 pp.
Angel R., Kim S.W., Jimenez-Moreno E. 2013. Velocidad de paso y pH intestinal en aves: implicaciones para la digestión y el uso de enzimas. XXIX Curso de especialización FEDNA.
Blanch A., Barroeta A. C., Baucells M. D., Puchal F. 1995.The nutritive value of dietary fats in relation to their chemical composition. Apparent fat availability and metabolizable energy in two-week-old chicks. Poultry Science, 74: 1335–1340.
Bolton W. 1965. Digestion in the crop of the fowl. British Poultry Science, 6: 97-102.
Cheeke, P.R., Dierenfeld, E.S. 2010. Comparative animal nutrition and metabolism. CAB International. Wallingford, UK. 352 pp.
Choct M., Annison G. 1992. Anti‐nutritive effect of wheat pentosans in broiler chickens: Roles of viscosity and gut microflora. British Poultry Science, 33: 821-834.
Choct M., Hughes R. J., Wang J., Bedford M. R., Morgan A. J., Annison G. 1996. Increased small intestinal fermentation is partly responsible for the anti‐nutritive activity of non‐starch polysaccharides in chickens. British Poultry Science, 37: 609-621.
Clemens E.T., Stevens C.E., Southworth M. 1975. Site of organic acid production and pattern of digesta movement in the gastrointestinal tract of geese. Journal of Nutrition, 105: 1341–1350.
Corpa, 2005. Imagen no publicada.
Duke G.E. 1986. Alimentary canal: anatomy, regulation of feeding, and motility. In: Sturkie PD, editor. Avian Physiology. Fourth ed. New York: Springer. pp. 269–288.
Edwards C.A., Johnson I.T., Read N.W. 1988. Do viscous polysaccharides slow absorption by inhibiting diffusion or convection? European Journal of Clinical Nutrition, 42: 307-312.
Fengler, A.I. and Marquardt, R.R., 1988. Water-soluble pentosans from rye. II. Effects on rate of dialysis and on the retention of nutrients by the chick. Cereal Chemistry, 65: 298-302.
Ganchrow J.R., Ganchrow D. 1987. Taste bud development in chickens (Gallus gallus domesticus). The Anatomical Record, 218: 88-93.
Guyonnet V., Çuscik F.T., Long P.L., Polanowski A., Travis J. 1999. Purification and partial characterization of the pancreatic proteolytic enzymes trypsin, chymotrypsin and elastase from the chicken. Journal of Chromatography A, 852 : 217–225.
Hetland H., Svihus B., Olaisen V. 2002. Effect of feeding whole cereals on performance, starch digestibility and duodenal particle size distribution in broiler chickens. British Poultry Science, 43: 416-23.
Jacob J., Pescatore T. 2013. Avian Digestive System. ASC-203. Cooperative Extension Service. University of Kentuky.
Jeurissen S.H.M., Lewis F., van der Klis J.D., Mroz Z., Rebel J.M.J., ter Huurne A.A.H.M. 2002. Parameters and Techniques to Determine Intestinal Health of Poultry as Constituted by Immunity, Integrity, and Functionality. Current Issues Intestinal Microbiology, 3: 1-14.
Kierszenbaum A.L. 2002. Histology and cell biology . Mosby. Missouri, USA. 619 pp
Klassing K.C. 1998. Comparative avian nutrition. CAB International. Wallingford, UK. 350 pp.
Kostka V. 1992. Chicken pepsin and the other avian aspartic proteinases. Scandinavian Journal of Clinical and Laboratory Investigation, 52:sup210, 121-125.
Krogdahl A. 1985. Digestion and Absorption of Lipids in Poultry. Journal of Nutrition, 115: 675-685.
Kudo K., Wakamatsu K., Nishimura S., Tabata S. 2010. Gustducin is expressed in the taste buds of the chicken. Animal Science Journal, 81: 666-672.
Lilburn M.S., Loeffler S. 2015. Early intestinal growth and development in poultry. Poultry Science, 94: 1569–1576.
National Research Council. 1987. Predicting feed intake of foodproducing animals. Narional Academy Press. Washington DC. 96 pp.
Noy Y., Sklan D. 1995. Digestion and Absorption in the Young Chick. Poultry Science, 74: 366-373.
Perry G.C. 2006. Avian Gut Function in Health and Disease. Poultry Science Symposium Series. Volume Twenty-eight. CAB International. Wallingford, UK. 384 pp.
Richards M. P., Proszkowiec-Weglarz M. 2007. Mechanisms regulating feed intake, energy expenditure, and body weight in poultry. Poultry Science, 86:1478–1490.
Rincón-Londoño N., Millán-Malo B., Rodríguez-García M. 2016. Analysis of thermal pasting profile in corn starch rich in amylose andamylopectin: Physicochemical transformations, part II. International Journal of Biological Macromolecules, 89: 43-53.
Roura E., Baldwin M.W., Klasing K.C. 2013. The avian taste system: Potential implications in poultry nutrition. Animal Feed Science and Technology, 180: 1– 9.
Slominski B.A., Meng X., Jia W., Guenter W., Jones O. 2006. The effect of lipase, amylase and protease addition on growth performance and nutrient digestion in young broiler chickens. XII European Poultry Conference. World Poultry Science Association (WPSA). 10-14 September 2006, Verona, Italia.
Svihus B. 2014. Function of the digestive system. Journal of Applied Poultry Research, 23: 306-314.
Svihus B., Sacranie A, Denstadli V, Choct M. 2010. Nutrient utilization and functionality of the anterior digestive tract caused by intermittent feeding and inclusion of whole wheat in diets for broiler chickens. Poultry Science, 89: 2617-2625.
Takahashi T., Goto M., Sakata T. 2004. Viscoelastic properties of the small intestinal and caecal contents of the chicken. British Journal of Nutrition, 91, 867–872.
Tancharoenrat P., Ravindran V., Zaefarian F., Ravindran G. 2014. Digestion of fat and fatty acids along the gastrointestinal tract of broiler chickens. Poultry Science, 93: 371–379.
Uni Z., Geyra Z., Ben-Hur H., Sklan D.2000. Small intestinal development in the young chick: crypt formation and enterocyte proliferation and migration. British Poultry Science, 41: 544–551.
Van Krimpen M.M., Kwakkel R.P., Van Der Peet-Schwering C.M., Den Hartog L.A., Verstegen M.W. 2011. Effects of dietary energy concentration, nonstarch polysaccharide concentration, and particle sizes of nonstarch polysaccharides on digesta mean retention time and gut development in laying hens. British Poultry Science, 52: 730-741.
Yamauchi K. 2001. Digestive organ. In: Japanese Association of Veterinary Anatomists (ed.), Veterinary Histology, 2nd edition, pp. 265–273. Gakusosha, Tokyo.
Yamauchi K. 2002 Review on chicken intestinal villus histological alterations related with intestinal function. Journal Poultry Science, 39: 229-242
Yamauchi K. 2007. Review of a histological intestinal approach to assessing the intestinal function in chickens and pigs. Animal Science Journal, 78: 356–370.
Zafrira Nitsan Z., G. Ben‐Avraham G. , Zipora Zoref Z., Nir I.1991. Growth and development of the digestive organs and some enzymes in broiler chicks after hatching. British Poultry Science, 32:3, 515-523
Choudhury P.K., Salem A.Z.M., Jena R., Kumar S., Singh, R. Puniya A.K. 2015. Rumen microbiology: an overview. En: Rumen Microbiology: From Evolution to Revolution. Puniya A.K., Singh R., Kamra D.N. (eds.). Springer, India. pp: 3-16.
Church D.C. 1993. Función y producción de saliva. En: El Rumiante. Fisiología Digestiva y de la Nutrición. Ed. D.C. Church. Acribia, Zaragoza. pp. 127-136.
Hofmann R.R. 1989. Evolutionary steps of ecophysiological adaptation and diversification of ruminants: a comparative view of their digestive system. Oecologia 78: 443-457
Hofmann R.R. 1993. Anatomía del conducto grasto-intestinal. En: El Rumiante. Fisiología Digestiva y de la Nutrición. Church D.C. (ed.). Acribia, Zaragoza, España. pp. 15-46.
Hofmann, R. R. 1988. Morphophysiological evolutionary adaptations of the ruminant digestive system. En: Comparative Aspects of Physiology of Digestion in Ruminants. Dobson A. (ed). Cornell Univ Press, Cornell, EEUU. pp 1-20.
Kay R. N. B. 1966. The influence of saliva on digestion in ruminants. World Rev. Nutr. Diet. 6: 292-325.
Seal, C.J., Reynolds, C.K. 1993. Nutritional implication of gastrointestinal and liver metabolism in ruminants. Nutr. Res. Rev. 6: 185-208.
Van Soest P.J. 1994. Nutritional Ecology of the Ruminant. 2nd edition. Cornell University Press, Ithaca, EEUU.
Zhou M., Chen Y., Guan L.L. 2015. Rumen bacteria. En: Rumen Microbiology: From Evolution to Revolution. Puniya A.K., Singh R., Kamra D.N. (eds.). Springer, India. pp: 79-96.
Bach-Knudsen K.E., Canibe N. (2000). Breakdown of plant carbohydrates in the digestive tract of pigs fed on wheat- or oat-based rolls. J. Sci. Food Agric. 80, 1253-1261.
Conway P.L. (1996). Development of intestinal microbiota. Gastrointestinal microbes and host interaction. En: Gastrointestinal microbiology, vol. 2, R.I. Mackie, B.A. White, Isaacson R.E. (eds.), Chapman & Hall, Londres, pp. 3-39.
Kim H.B., Borewicz K., White B.A., Singer R.S., Sreevatsan S., Tu Z.J., Isaacson R.E. (2011). Longitudinal investigation of the age-related bacterial diversity in the faeces of commercial pigs. Vet. Microbiol. 153, 124-133.
Kim H.B., Isaacson R.E. (2015). The pig gut microbial diversity: understanding the pig gut microbial ecology through the next generation high throughput sequencing. Vet. Microbiol. 177, 242-251.
Konstantinov S.R., Favier C.F., Zhu W.Y., Williams B.A., Kluss J., Souffrant W.B., de Vos W.M., Akkermans A.D.L., Smidt H. (2004). Microbial diversity studies of the porcine gastrointestinal ecosystem during weaning transition. Anim. Res. 53, 317-324.
Looft T., Allen H.K., Cantarel B.L., Levine U.Y., Bayles D.O., Alt D.P., Henrissat D., Stanton T.B. (2014). Bacteria, phages and pigs: the effect of in-feed antibiotics on the microbiome at different gut locations. ISME J. 8, 1566-1576.
Pajarillo E.A., Chae J., Balolong M.P., Kim H.B., Kang D. (2014a). Assessment of fecal bacterial diversity among healthy piglets during the weaning transition. J. Gen. Appl. Microbiol. 60, 140-146.
Pajarillo E.A., Chae J., Balolong M.P., Kim H.B., Seo K.S., Kang D. (2014b). Pyrosequencing-based analysis of fecal microbial communities in three purebred pig lines. J. Microbiol 52, 646-651.
Palmer C., Bik E.M., DiGiulio D.B., Relman D.A., Brown P.O. (2007). Development of the human infant intestinal microbiota. PLoS Biol 5, e177.
Pedersen R., Ingerslev H.C., Sturek M., Alloosh M., Cirera S., Christofersen B.O., Moesgaard S.G., Larsen N., Boye M. (2013). Characterisation of gut microbiota in Ossabaw and Gottingen minipigs as models of obesity and metabolic syndrome. PLoS ONE 8, e56612.
Sakata T., Inagaki A. (2001). Organic acid production in the large intestine: implication for epithelial cell proliferation and cell death.
En: Gut environment of pigs (A. Piva, K.E. Bach-Knudsen, J.E. Lindberg eds.), Nottingham University Press, Loughborough, UK, pp. 85-94.
Stewart C.S., Hillman K., Maxwell F., Kelly D., King T.P. (1993). Recent advances in probiosis in pigs: Observations on the microbiology of the pig gut. En: Recent advances in animal nutrition, P.C. Garnsworthy, D.J.A. Cole (eds.), Nottingham University Press, Nottingham, pp.197220
Yen J.T. (2001). Anatomy of the digestive system and nutritional physiology. En: Swine nutrition, 2nd ed., A.J. Lewis, L.L. Southern (eds.), CRC Press, Boca Raton, pp. 31-64.



Andres-Elias N, Pujols J, Badiola I, Torrallardona D (2007) Effect of nucleotides and carob pulp on gut health and performance of weanling piglets. Livestock Sci. 109(1-3 SI): 280-283.
Aumaitre A, Peiniau J, Madec F (1995) Digestive adaptation after weaning and nutritional consequences in the piglet. Pig News and Information 16: 73N-79N.
Badia R, Lizardo R, Martinez P, Badiola I, Brufau J (2012) The influence of dietary locust bean gum and live yeast on some digestive immunological parameters of piglets experimentally challenged with Escherichia coli. J. Anim. Sci. 90 Suppl 4:260-262.
Badiola I, Perez de Rozas AM, Roca M, Carabano R, Garcia J, Rosell J (2004a) The 16S r-DNA RFLP profile of total DNA of intestinal bacteria under pathological conditions. In: Proceedings of the 8th World Rabbit Congress, September 7-10, 2004, Pueblo, Mexico, pp.: 427-432.

Badiola I, Perez de Rozas AM, Roca M, Carabano R, Gomez M, Garcia J, de Blas, C (2004b) Characterization of the microbial diversity of rabbit intestinal tract by restriction fragment length polymorphism. In: Proceedings of the 8th World Rabbit Congress, September 7-10, 2004, Pueblo, Mexico, pp.: 746-751.
Bertschinger HU (1999) Postweaning Escherichia coli diarrhea and Edema disease. En: Diseases of Swine (Eds. B.E. Straw, S. D’Allaire, W.L. Mengeling y D.J. Taylor), pp. 441-454. 8th edition. Blackwell Science, Oxford, UK.
Bolduan G, Jung H, Schnable E, Schneider R (1988) Recent advances in the nutrition of weaner piglets. Pig News and Information 9: 381-385
Castillo M, Martin-Orue SM, Manzanilla EG, Badiola I, Martin M, Gasa J (2006a) Quantification of total bacteria, enterobacteria and lactobacilli populations in pig digesta by real-time PCR. Vet. Microbiol. 114(1-2): 165-170.
Castillo M, Martín-Orúe SM, Roca M, Manzanilla EG, Badiola I, Perez JF, Gasa J (2006b) The response of gastrointestinal microbiota to avilamycin, butyrate, and plant extracts in early-weaned pigs. J. Anim. Sci. 84(10): 2725-2734.
Castillo M, Skene G, Roca M, Anguita M, Badiola I, Duncan SH, Flint HJ, Martín-Orúe SM (2007) Application of 16S rRNA gene-targetted fluorescence in situ hybridization and restriction fragment length polymorphism to study porcine microbiota along the gastrointestinal tract in response to different sources of dietary fibre. FEMS Microbiol. Ecol. 59(1): 138-146.
Chamorro S, Gomez-Conde MS, Pérez de Rozas AM, Badiola I, Carabano R, de Blas JC (2007) Effect on digestion and performance of dietary protein content and of increased substitution of lucerne hay with soya-bean protein concentrate in starter diets for young rabbits. Animal 1(5): 651-659.
Chamorro S, de Blas C, Grant G, Badiola I, Menoyo D, Carabaño R (2010) Effect of dietary supplementation with glutamine and a combination of glutamine-arginine on intestinal health in twentyfive-day-old weaned rabbits. J. Anim. Sci. 88(1): 170-180.
Frese SA, Parker K, Calvert CC, Mills DA (2015) Diet shapes the gut microbiome of pigs during nursing and weaning. Microbiome. 3:28.
Gaskins HR (2001) Intestinal bacteria and their influence on swine growth. En: Swine Nutrition. (Eds. A. J. Lewis and L.L. Southern), pp. 585–608. CRC Press, Boca Raton, FL, USA.
Gisbert E, Castillo M, Skalli A, Andree KB, Badiola I (2013) Bacillus cereus var. toyoi promotes growth, affects the histological organization and microbiota of the intestinal mucosa in rainbow trout fingerlings. J. Anim. Sci. 91(6): 2766-2774.
Gibson GR, Beatty ER, Wang X, Cummings JH (1995) Selective stimulation of bifidobacteria in the human colon by oligofructose and inulin. Gastroenterology. 108(4): 975-982.
Gidenne, T.; Combes, S.; Licois, D.; Carabano, R.; Badiola, I.; Garcia, J (2008) The caecal ecosystem and the nutrition of the rabbit: interaction with digestive health. INRA Productions Animales 21(3): 239-249.
Gomez-Conde MS, Pérez de Rozas AP, Badiola I, Chamorro S, Mateos GG, de Blas JC, Garcia J, Carabano R (2006) Level of soluble fiber and medication influence the presence of intestinal pathogen microbiota in young rabbits. J. Anim. Sci. 84 (Suppl. 1): 343-343.
Gómez-Conde MS, García J, Chamorro S, Eiras P, Rebollar PG, Pérez de Rozas A, Badiola I, de Blas C, Carabaño R (2007) Neutral detergentsoluble fiber improves gut barrier function in twenty-five-day-old weaned rabbits. J. Anim. Sci. 85(12): 3313-3321.
Gomez-Conde, M. S.; Perez de Rozas, A.; Badiola, I.; Perez-Alba, L.; Blas, C. de; Carabano, R.; Garcia, J (2009) Effect of neutral detergent soluble fibre on digestion, intestinal microbiota and performance in twenty five day old weaned rabbits. Livestock Sci. 125(2/3): 192-198.
Hawrelak JA, Myers SP (2004) The causes of intestinal dysbiosis: a review. Altern. Med. Rev. 9(2):180-97.
Hermann-Bank ML, Skovgaard K, Stockmarr A, Strube ML, Larsen N, Kongsted H, Ingerslev HC, Mølbak L, Boye M (2015) Characterization of the bacterial gut microbiota of piglets suffering from new neonatal porcine diarrhoea. BMC Vet. Res. 11:139.
Kim HB, Borewicz K, White BA, Singer RS, Sreevatsan S, Tu ZJ, Isaacson RE (2012) Microbial shifts in the swine distal gut in response to the treatment with antimicrobial growth promoter, tylosin. Proc. Natl. Acad. Sci. 109(38):15485-15490.
Lawley TD, Clare S, Walker AW, Stares MD, Connor TR, Raisen C, Goulding D, Rad R, Schreiber F, Brandt C, Deakin LJ, Pickard DJ, Duncan SH, Flint HJ, Clark TG, Parkhill J, Dougan G. (2012) Targeted restoration of the intestinal microbiota with a simple, defined bacteriotherapy resolves relapsing Clostridium difficile disease in mice. PLoS Pathog.;8(10):e1002995.
Mateos GG, Lázaro R, Gracia MI (2002) Modificaciones nutricionales y problemática digestiva en aves. En: XVIII Curso de Especialización de la Fundación Española para el Desarrollo de la Nutrición Animal. Avances en Nutrición y Alimentación Animal. Barcelona. pp: 15-37.
Mateos GG, Martín F, Latorre MA, Vicente B, Lázaro R (2006) Inclusion of oat hulls in diets for young pigs based on cooked maize or cooked rice. Anim. Sci. 82: 57–63.
Nicodemus N, Perez-Alba L, Carabano R, de Blas C, Badiola I, Perez de Rozas A, Garcia J (2004) Effect of level of fibre and level of ground of fibre sources on digestion and ileal and caecal characterization of microbiota of early weaned rabbits. In: Proceedings of the 8th World Rabbit Congress, September 7-10, 2004, Pueblo, Mexico, pp.: 928-929.
Pérez JF, Gasa J (2002) Importancia de los carbohidratos de la dieta y de la utilización de aditivos sobre la salud intestinal en el ganado porcino. En: XVIII Curso de Especialización de la Fundación Española para el Desarrollo de la Nutrición Animal. Avances en Nutrición y Alimentación Animal. Barcelona. pp: 53-70.
Pluske JR, Durmic Z, Pethick DW, Mullan BP, Hampson DJ (1998) Confirmation of the role of rapidly fermentable carbohydrates in the expression of swine dysentery in pigs after experimental infection. J. Nutr. 128(10): 1737-1744.
Pluske JR, Pethick DW, Hampson DJ (2003) El impacto de la nutrición sobre desórdenes y enfermedades de tipo entérico en porcino. En: XIX Curso de Especialización de la Fundación Española para el Desarrollo de la Nutrición Animal. Avances en Nutrición y Alimentación Animal. Madrid. pp: 49-69.
Porter P, Kenworthy R (1969) A study of intestinal and urinary amines in pigs in relation to weaning. Res. Vet. Sci. 10(5): 440-447.
Roca-Canudas M, Anguita M, Nofrarias M, Majo N, Pérez de Rozas AM, Martin-Orue SM, Perez JF, Pujols J, Segales J, Badiola I (2007) Effects of different types of dietary non-digestible carbohydrates on the physico-chemical properties and microbiota of proximal colon digesta of growing pigs. Livestock Sci. 109(1-3 SI): 85-88.
Roca M, Nofrarías M, Majó N, Pérez de Rozas AM, Segalés J, Castillo M, Martín-Orúe SM, Espinal A, Pujols J, Badiola I (2014) Changes in Bacterial Population of Gastrointestinal Tract of Weaned Pigs Fed with Different Additives. BioMed Research International, vol. 2014, Article ID 269402, 13 pagesRodrigues et al., (2016)
Santomá G, Pontes M (2005) Nutrición, sanidad y patología en pollos y porcino. En: XXI Curso de Especialización de la Fundación Española para el Desarrollo de la Nutrición Animal. Avances en Nutrición y Alimentación Animal. Madrid. pp: 239-274.
Torrallardona D, Conde MR, Badiola I, Polo J, Brufau J (2003) Effect of fishmeal replacement with spray-dried animal plasma and colistin on intestinal structure, intestinal microbiology, and performance of weanling pigs challenged with Escherichia coli K99. J. Anim. Sci. 81(5): 1220-1226.
Torrallardona D, Badiola I, Broz J (2007a) Effects of benzoic acid on
Torrallardona D, Conde R, Badiola I, Polo J (2007b) Evaluation of spray dried animal plasma and calcium formate as alternatives to colistin in piglets experimentally infected with Escherichia coli K99. Livestock Sci. 109(1-3 SI): 303-306.
Torrallardona D, Andrés-Elias N, López-Soria S, Badiola I, CerdàCuéllar M (2012a) Effect of feeding different cereal-based diets on the performance and gut health of weaned piglets with or without previous access to creep feed during lactation. J. Anim. Sci. 90 Suppl 4:31-33.
Torrallardona D, Andrés-Elias N, López-Soria S, Badiola I, CerdàCuéllar M (2012b) Effect of feeding piglets with different extruded and nonextruded cereals on the gut mucosa and microbiota during the first postweaning week. J. Anim. Sci. 90 Suppl 4:7-9.
Willamil J, Badiola I, Torrallardona D, Geraert PA, Devillard E (2009) Effect Of Carbohydrolase Supplementation On Ileal Morphology And Gut Microbiota In Growing Pigs, Fed Different Cereal-Based Diets. In: Proceedings of the 2009 Conference on Gastrointestinal Function, Chicago, USA, April 20–22.
Willamil J, Badiola I, Devillard E., Geraert PA, Torrallardona D (2012) Wheat-barley-rye- or corn-fed growing pigs respond differently to dietary supplementation with a carbohydrase complex. J. Anim. Sci. 90(3):824-832.
Aschenbach J. R., G. B. Penner, F. Stumpff, Gäbel G. 2011. Ruminant Nutrition Symposium: Role of fermentation acid absorption in the regulation of ruminal pH. Journal of Animal Science. 89:1092-1107.
Banninka A., Gerrits W.J.J., France J., Dijkstra J. 2012. Variation in rumen fermentation and the rumen wall during the transition period in dairy cows. Animal Feed Science and Technology, 172(12):80-94.

Cannizzo C. 2009.Fermentative disturbs in dairy cow: subacute ruminal acidosis in field Conditions and metabolic inflammatory effects observed. Tesis doctoral. Universitá di Padova. Diponible en: http://paduaresearch.cab.unipd.it/1530/1/Tesi_dottorato_Chiara_ Cannizzo.pdf (fecha última consulta 2 de septiembre de 2016).
Devant M. 2008. Acidosis Ruminal y Timpanismo: ¿Qué sabemos realmente? Ponencia presentada en el XIII Congreso Internacional Anembe de Medicina Bovina. Salamanca. pp: 67-92.
Dijkstra J., Ellis J.L.,Kebreab E., Strathe A.B., López S., France J.y Banninke A. 2012. Ruminal pH regulation and nutritional consequences of low pH. Animal Feed Science and Technology, 172(1-2):22-33.
Nagaraja T.G. 2012. A microbiologist’s view on improving nutrient utilization in ruminants. (2012). En: 23rd annual Florida nutrition symposium proceeding. Gainesville, Florida. pp: 135–161.
Nagaraja T.G., Titgemeyer E.C. 2007. Ruminal acidosis in beef cattle: the current microbiological and nutritional outlook. Journal of Dairy Science: 90 (Suppl 1):E17-E38.
Nava Cuéllar C., Díaz Cruz A. 2001. Introducción a la digestión ruminal. Disponible en: http://www.produccion-animal.com.ar/informacion_ tecnica/manejo_del_alimento/79-introduccion_a_la_digestion_ ruminal.pdf (fecha última consulta 10 de septiembre de 2016).
Radostits O.M., Gay C.C., Hinchcliff K.W., Constable P.D. 2007. Veterinary Medicine — A Textbook of the Diseases of Cattle, Horses, Sheep, Pigs and Goats, Edición 10. Editorial Saunders, USA. pp: 457 -495
Rosenberger G. 1981..Exploración Clinica de los bovinos. Segunda edición. Editorial Hemisferio Sur. Argentina. pp : 410-436.
Schwartzkopf-Genswein K. S., Beauchemin K. A., Gibb D. J., Crews Jr. D. H., Hickman D. D., Streeter M., McAllister T. A. 2003. Effect of management on behavior and acidosis, behavior, ruminal acidosis and performance of feedlot cattle: A review. Journal of Animal Science 81(E. Suppl. 2):E149–E158.
Smith B.P. 2015. Large Animal Internal Medicine, 5th edición. Editorial Elsevier. USA. pp: 777-810
The MERCK Veterinary Manual (2012). Simple Indigestion in Ruminants. Disponible en: http://www.merckvetmanual.com/ mvm/digestive_system/diseases_of_the_ruminant_forestomach/ simple_indigestion_in_ruminants.html (fecha última consulta 20 de Agosto 206).
Wang Y ,Majak W, McAllister T.A. 2012. Frothy bloat in ruminants: Cause, occurrence, and mitigation strategies. Animal Feed Science and Technology, 172(1-2):103-114.
Yáñez-Ruiz D.R., Abecia L., Newbold C.J. 2015. Manipulating rumen microbiome and fermentation through interventions during early life: a review. Frontiers Microbiology. 6:1133.
Annet, C.B., Viste, J.R., Chirino-Trejo, M., Classen, H.L., Middleton, D.M., Simko, E., 2002. Necrotic enteritis: effect of barley, wheat, and corn diets on proliferation of Clostridium perfringens type A. Avian Pathol. 31: 598-601
Branton, S.L., Reece, F.N., Hagler, W.M. 1987. Influence of a wheat diet on mortality of broiler chickens associated with necrotic enteritis. Poult. Sci. 66: 1326-1330.
Branton, S.L., Lott, B.D., Deaton, J.W., Maslin, W.R., Austin, F.W., Pote, M., Keirs, R.W., Latour, M.A., Day, E.J. 1997. The effects of added complex carbohydrates or added dietary fiber on necrotic enteritis lesions in broiler chickens. Poult. Sci. 76: 24-28
Brufau J.; Francesch M. 2011. Effects of coccidiostatic vaccines and feed composition with emphasis on raw materials and enzyme usage. 18th European Symposium on Poultry Nutrition . Pages: 26-31
Drew, M.D., Syed, n.A., Goldade, B.G., Laarveld, B., Van Kessel, A.G. 2004. Effects of dietary protein source and level on intestinal populations of Clostridium perfringens in broiler chickens. Poult. Sci. 83: 414-420.
Józefiak, D; Kierończyk, B; Rawski, M; Hejdysz, M; Rutkowski, A; Engberg, RM; Højberg, O. (2014). Clostridium perfringens challenge and dietary fat type affect broiler chicken performance and fermentation in the gastrointestinal tract. Animal. 2014 8:6 , pp 912–922
Kaldhusdal, M. and Skjerve, E. 1996. Association between cereal contents in the diet and incidence of necrotic enteritis in broiler chickens in Norway. Preventive Veterinary Medicine 28: 1-16.
Knarreborg, A., Simon, M.A., Engberg, R.M., Jensen, B.B., Tannock, G.W. 2002. Effects of dietary fat source and subtherapeutic levels of antibiotic on the bacterial community in the ileum of broiler chickens at various ages. Appl. Environm. Microb. Dec.: 5918-5924.
Nakamura, M., Cook, J., Cross, W. 1978. Lecithinase production by Clostridium perfringens in chemically defined media. Applied Microbiology, 16: 1420 /1421.
Riddell, C., Kong, X.M. 1992. The influence of diet on necrotic enteritis in broiler chickens. Avian Diseases 36: 499-503.
Shimizu T, Ohtani K, Hirakawa H, Ohshima K, Yamashita A, Shiba T, Ogasawara N, Hattori M, Kuhara S, Hayashi H: Complete genome sequence of Clostridium perfringens, an anaerobic flesh-eater. Proc Natl Acad Sci U S A. 2002, 99: 996-1001. 10.1073/pnas.022493799.
Shojadoost B., Vince A.R., Prescott, J.F. 2012. The successful experimental induction of necrotic enteritis in chickens by Clostridium perfringens: a critical review. Vet research. 43:74
Williams, R.B. 2005. Intercurrent coccidiosis and necrotic enteritis of chickens: rational, integrated disease management by maintenance of gut integrity. Avi. Pathol. 34: 159-180.
Abecia L, Martín-García AI, Martínez G, Newbold CJ, Yáñez-Ruiz DR. 2013a. J Anim Sci. 91:4832-40
Abecia L, Waddams KE, Martínez-Fernandez G, Martín-García AI, Ramos-Morales E, Newbold CJ, Yáñez-Ruiz DR. 2014a. Archaea. 6;2014:841463.
Belanche A, de la Fuente G, Moorby JM, Newbold CJ. (2012a) Bacterial protein degradation by different rumen protozoal groups. Journal of Animals Sciences 90(12):4495–4504
Belanche A, Doreau M, Edwards JE, Moorby JM, Pinloche E, Newbold CJ. (2012b) Shifts in the Rumen Microbiota Due to the Type of Carbohydrate and Level of Protein Ingested by Dairy Cattle are Associated with Rumen Fermentation. Journal of Nutrition 142: 1684-1692
Belanche A, de la Fuente G, Newbold C.J. (2015). Effect of progressive inoculation of fauna-free sheep with holotrich protozoa and total-fauna on rumen fermentation, microbial diversity and methane emissions. FEMS Microbiology Ecology 91: 1-10Ben Shabat et al. 2016. Specific microbiome-dependent mechanisms underlie the energy harvest efficiency of ruminants. ISME J. 10:2958-2972.
Deng, W., D. Xi, H. Mao, y M. Wanapat. 2008. The use of molecular techniques based on ribosomal RNA and DNA for rumen microbial ecosystem studies: a review. Molecular Biology Reports 35(2):265274.
Henderson G, Cox F, Ganesh S, Jonker A, Young W; Global Rumen Census Collaborators., Janssen PH. 2015. Rumen microbial community composition varies with diet and host, but a core microbiome is found across a wide geographical range. Scientific Reports. 5:14567.
Morgavi DP, Forano E, Martin C, Newbold CJ. 2010. Microbial ecosystem and methanogenesis in ruminants. Animal. 4:1024-36.
Newbold CJ, de la Fuente G, Belanche A, Ramos-Morales E, McEwan NR. 2015. The Role of Ciliate Protozoa in the Rumen. Front Microbiol. 6:1313.
Pinloche E, McEwan N, Marden JP, Bayourthe C, Auclair E, Newbold CJ. 2013. The effects of a probiotic yeast on the bacterial diversity and population structure in the rumen of cattle. PLoS One. 8:e67824.
Weimer PJ, Stevenson DM, Mantovani HC, Man SL. 2010. Host specificity of the ruminal bacterial community in the dairy cow following near-total exchange of ruminal contents. J Dairy Sci. 93: 5902-12.
Yáñez-Ruiz DR, Abecia L, Newbold CJ. 2015. Manipulating rumen microbiome and fermentation through interventions during early life: a review. Frontiers Microbiology. 6:1133.
Yu, Z., M. Yu, y M. Morrison. 2006. Improved serial analysis of V1 ribosomal sequence tags (SARSTV1) provides a rapid, comprehensive, sequence based characterization of bacterial diversity and community composition. Environmental Microbiology 8(4):603-611.
Zhou, M., E. Hernandez-Sanabria, y L. L. Guan. 2010. Characterization of variation in rumen methanogenic communities under different dietary and host feed efficiency conditions, as determined by PCR-denaturing gradient gel electrophoresis analysis. Applied and Environmental Microbiology 76(12):3776-3786.
Becker PM, Wikselaar PG, Jansman AJ, et al. 2009. Pea dietary fiber for adhesion and excretion of enterotoxigenic E. coli K88 to prevent intestinal colonization. J Anim Sci 87, 172–189.

Hampson, D J. 1994. Postweaning Escherichia coli diarrhoea in pigs. Page 171–191 in Escherichia coli in Domestic Animals and Humans. C. L. Gyles, ed. CAB International, Wallingford, U.K.
Heinritz S N, E Weiss, M Eklund, T Aumiller, C ME Heyer, S Messner, A Rings, S Louis, S C Bischoff, R Mosenthin. (2016) Impact of a High-Fat or High-Fiber Diet on Intestinal Microbiota and Metabolic Markers in a Pig Model. Nutrients 2016, 8, 317; doi:10.3390/nu8050317
Molist F, Gómez DS, Gasa J, et al. 2009. Effects of dietary fibre on phsycochemical characteristics of digesta, microbial activity and gut maturation in early weaned piglets. Anim Feed Sci Technol 149, 346–353.
Montagne L, Cavaney F S, Hampson D J, Lallès JP, Pluske JR. 2004. Effect of diet composition in postweaning colibacillosis in piglets. Journal of Animal Science. 82:2364–2374
Rist VTS, Weiss E, Eklund M, Mosenthin R. 2013. Impact of dietary protein on microbiota composition and activity in the gastrointestinal tract of piglets in relation to gut health: a review. Animal, 7: 1067–1078
Rist VTS, Weiss E, Sauer N, Mosenthin R, Eklund M. 2014. Effect of dietary protein supply originating from soybean meal or casein on the intestinal microbiota of piglets. Anaerobe 25: 72-79
Montalban-Arques A, De Schryver P, Bossier P, Gorkiewicz G, Mulero V, Gatlin DM III and Galindo-Villegas J. 2015. Selective manipulation of the gut microbiota improves immune status in vertebrates. Front. Immunol. 6:512. doi: 10.3389/fimmu.2015.00512