















Edición
Jhon Edwar Garcia Rueda
Hecho en Colombia / Made in Colombia
Prohibida la reproducción sin autorización del Hospital Pablo Tobón Uribe
Mayo de 2024/ Medellin
Periodicidad anual
ISSN: 3028-3841(En Línea)
El contenido de la obra corresponde al derecho de expresión de los autores y no compromete elpensamiento institucional del Hospital Pablo Tobón Uribe.



“No hay mayor oportunidad, responsabilidad y obligación que pueda asumir el ser humano que la de ser médico. En el cuidado del sufrimiento (El médico) necesita habilidades técnicas, conocimiento científico y entendimiento del ser humano, el alto tacto, la simpatía y la comprensión son lo mínimos esperados por el paciente. El paciente como tal, no es una colección de síntomas, signos, desórdenes funcionales y emociones, es un SER HUMANO temeroso, con esperanzas y buscando ayuda, alivio y tranquilidad”.
Harrison’s Principles of Internal Medicine, 1950.
No hay mejor descripción del médico y su papel en nuestra sociedad, tampoco hay dudas que en los últimos 70 años el progreso de la medicina ha llevado al cambio de muchas prácticas clínicas, sin embargo y muy a pesar de estar a las puertas de la medicina genómica, medicina de precisión y lo que se espera de la inteligencia artificial en la salud con un paciente más informado, la interacción médico paciente es esencial en el ejercicio de la medicina.
El primer paso en nuestra práctica es el “diagnóstico” y está basado en definir un síntoma principal, que permita hacer una aproximación diferencial, se podría decir que es el arte basado en la ciencia, y que el médico usa para encontrar el mal que aqueja a su paciente, este simposio es precisamente una muestra de este aspecto fundamental, “El diagnóstico sindromático”.



El grupo de médicos generales presentan a la comunidad médica, el primer simposio y sus memorias, concebido pensando en los síndromes más frecuentes que enfrentan en su día a día y entregando información actualizada y práctica. Destaca su particular interés académico que va en la misma línea con uno de los aspectos misionales del hospital, que es la transmisión del conocimiento.
Como hospital nos sentimos muy orgullosos de este proyecto, que esperamos se perpetúe en el tiempo y pueda ser un referente permanente para ofrecer ayuda, alivio y tranquilidad a nuestros pacientes.
Carlos Alberto Cadavid G. Director MedicoHospital Pablo Tobón Uribe



“Lo
imposible sólo tarda un poco más”
Mario Benedetti



Esperamos que las memorias del I Simposio de Médicos Generales del Hospital Pablo Tobón Uribe puedan contribuir a la formación académica y práctica médica del personal de salud, sin nunca olvidar el humanismo que permita comprender al paciente no sólo como un ser que tiene un padecimiento y que sufre, sino también uno con sueños y esperanza.
Queremos agradecer de manera especial al Hospital Pablo Tobón Uribe que, con sus directivos, asesores, especialistas, jefes de departamento, médicos generales, equipo de mercadeo y demás personas apoyaron la creación del I Simposio Temas Clave para el Médico General.
Jhon Edwar García R.Médico
General de HospitalizaciónHospital Pablo Tobón Uribe


1. Manejo del dolor en el paciente oncológico por el médico general
Sara Cardona Henao, Laura Escobar Araque, Nora Helena Saldarriaga
2. Dolor abdominal en el paciente hospitalizado
Suad Karime Téllez Soleimán, Angélica María Ojeda Enríquez, Manuela Arbeláez Gómez, Sebastián Tabares
3. Enfoque del paciente con dolor torácico
María Camila Jiménez García, José Carlos Sánchez Vega, Yesid Alberto Saavedra………………………………………………………………………………
4. Detección temprana de deterioro: una experiencia de implementación de tecnología, inteligencia artificial y evidencia clínica para el cuidado de los pacientes adultos
5. Enfoque del paciente con neutropenia febril
Jhon Edwar García Rueda, Angélica María Bermúdez Flórez, Karen Yohana García Rueda, Isabel Cristina Ramírez Sánchez
6. Sedación para el médico no anestesiólogo
Mateo Correa Restrepo, David Díaz Lopera, Simón González González
7. Reacciones transfusionales Karen Jaramillo Osorio, Sergio Jaramillo Velásquez
8. Diabético hospitalizado
Juanita Sánchez Cano, Sara León Aldana, Juan Camilo Rodriguez Castrillón………
9. Disnea en el paciente hospitalizado
Jorge Alejandro Pamplona Tobón, David Osorio Álvarez, Natalia Zapata Hincapié
10. Enfoque del paciente con delirium
María José Avendaño Vega, Juliana María Velásquez Suárez
11. Toxicodermias: lo que debe saber el médico general
Laura Jaramillo Santacoloma, Luisa María Higuita Duque, Lina Vanessa Gómez……


12. Enfoque general del paciente intoxicado
Christian David Pérez Franco, Andrés Felipe Estrada Atehortúa
13. Enfermedad por reflujo gastroesofágico: no todo lo que arde es reflujo
Juan Esteban Hernández Abaunza, Gabriel Alonso Mosquera Klinger, Juliana Murillo Pérez……………………………………………………………………
14. Politrauma para el médico general
Mariana Restrepo Arias, Laura Camila Lopera Restrepo, David Alejandro Mejía Toro
15. Anatomía radiológica del carpo
Marcela Pérez Muñoz, Camilo González Gómez…………….…………………………..
16. Disnea en el paciente ortopédico
Simón
17. Enfoque del paciente quemado
Mariluz Laverde Manrique, Nicolas López Arboleda, José Ovidio
18. Enfoque del paciente con hematuria ioka de la Peña Lozano, Juan Luis Jaramillo Valencia, María Lucía Uribe Quintero…………………………………………………………………...
19. Enfoque del paciente con trauma ocular
Laura Nataly Higuita Duque, Laura María Velásquez Zora, Carlos Alberto Restrepo
20. Enfoque del paciente con deterioro neurológico
Juan Felipe Quintero Moreno, Leonardo Fabio Moreno Gómez………………………
21. Enfoque del paciente con primer episodio convulsivo
Juan Camilo Londoño Cuervo, Angela Beatriz Pérez…………………




PARA EL MÉDICO GENERAL

Sara Cardona Henao1 , Laura Escobar Araque1,Nora Helena Saldarriaga2
1.Médica general Universidad Pontificia Bolivariana, Médica general de urgencias Hospital Pablo Tobón Uribe.
2.Médica internista, subespecialista en dolor y cuidado paliativo Hospital Pablo Tobón Uribe.
Resumen
El dolor es el síntoma más común en los pacientes oncológicos y afecta considerablemente su calidad de vida, este requiere de una evaluación multidimensional detallada para lograr un control adecuado del mismo. En el presente capítulo se exponen conceptos básicos relacionados con la fisiopatología del dolor, la evaluación del dolor y se ahonda en los pilares fundamentales del manejo farmacológico, basados en la escalera analgésica de la organización mundial de la salud, con detalle en la adecuada formulación tanto de antiinflamatorios no esteroideos como de los opioides más frecuentemente utilizados en este tipo de pacientes; con sus respectivos efectos secundarios, dosis, titulación y equianalgesia. Además, se mencionan algunas opciones no farmacológicas de gran utilidad para complementar el manejo farmacológico.
Palabras clave
Dolor en cáncer; manejo del dolor; analgésicos opioides; cuidados paliativos.
Introducción
El cáncer es la segunda causa de muerte a nivel mundial1 y se calcula que 1 de cada 5 personas desarrollará cáncer a lo largo de su vida2. Se prevé que el número de defunciones por cáncer siga incrementándose; en los próximos 20 años la incidencia de casos aumentará en un 70%, por lo que se ha convertido en una de las principales causas de morbimortalidad en el mundo y en nuestro país.


Uno de los síntomas más prevalentes que experimentan los pacientes oncológicos es el dolor, el cual se define como: “Una experiencia sensorial y emocional desagradable asociada o similar a la asociada con daño tisular real o potencial.3” generando alteraciones tanto físicas como emocionales, que se traducen en disminución de la calidad de vida.
Actualmente existen numerosas barreras que impiden un adecuado manejo del dolor, desde la evaluación inadecuada del dolor, el desconocimiento, discrepancia entre percepción y realidad, hasta la renuencia de los médicos a administrar opioides4; por lo que el tratamiento del dolor constituye un reto para el personal de la salud.
Conocer su fisiopatología y opciones terapéuticas es de vital importancia, no sólo para médicos especialistas en oncología, cuidado paliativo o manejo del dolor crónico, sino para todos los médicos generales que se ven enfrentados a estos pacientes con dolor agudo y crónico, en los servicios de urgencias, hospitalización o consulta externa, siendo la puerta de entrada para su atención inicial, enfoque y manejo integral.
Epidemiología
En un metaanálisis del 2023, se identificó que el dolor en el paciente oncológico tiene una prevalencia del 44,5%, que puede aumentar hasta 54,6% en el paciente con cáncer avanzado, metastásico o terminal y se estima que el 30,6% tendrán dolor moderado o intenso5 .
Otro estudio publicado en 2022 por Roberto A. y colaboradores demuestra que, a pesar de que ha disminuido el porcentaje de pacientes con dolor tratados inadecuadamente, aún persiste un porcentaje alto, de hasta un 40%, que reciben un tratamiento analgésico inadecuado para la intensidad de su dolor6 .


Fisiopatología del dolor
El dolor es un mecanismo que alerta sobre la presencia de estímulos nocivos, esos estímulos son reconocidos por los nociceptores que se encuentran a nivel periférico y llevan la señal a las neuronas de la médula espinal y de ahí a la corteza cerebral por vía talámica. Existen 4 procesos que se generan para el reconocimiento del dolor: transducción, transmisión, modulación y percepción7
En la transducción, el estímulo doloroso inicia en las fibras sensoriales nociceptivas, son fibras aferentes, que llevan el estímulo a las neuronas de la médula espinal en el asta posterior. Estos nociceptores se encargan de diferenciar los estímulos inocuos de los estímulos nocivos, dependiendo del umbral de estimulación, cuando se genera un estímulo repetitivo los nociceptores tienden a sensibilizarse y bajan el umbral, contribuyendo al fenómeno de hiperalgesia. Además, cuando se activan los nociceptores se activa también el reflejo de retirada y una respuesta emocional ligada al dolor.
La transmisión se lleva a cabo en el asta posterior de la médula espinal, donde existen 2 tipos de neuronas las interneuronas que son el 90-95% y pueden ser inhibitorias o excitatorias y las neuronas de proyección 5% que son las que transmiten el estímulo a la corteza cerebral. Por otra parte, la modulación se da a través de un sistema descendente de fibras nerviosas, que tienen la función de regular, controlar o limitar la transmisión nociceptiva.
Por último, la percepción se da a nivel de la corteza cerebral, esta experiencia del dolor que percibe nuestro cerebro puede darse en presencia o no de un estímulo tisular nociceptivo, esto explica los términos de dolor no nociceptivo (neuropático o psicógeno) y dolor nociceptivo (inflamatorio)7 .


Evaluación del dolor
La evaluación del dolor se debe realizar de forma multidimensional, con detalle de las características, teniendo en cuenta la localización, los factores exacerbantes y aliviadores. Se puede además clasificar el dolor según duración, intensidad y etiología8
Según duración
● Dolor agudo: "la respuesta fisiológica y la experiencia a los estímulos nocivos que pueden volverse patológicos normalmente es repentino, está limitado en el tiempo y motiva los comportamientos para evitar lesiones tisulares reales o potenciales9”.
● Dolor crónico: un dolor continuo o recurrente, que dura más de 3 meses, o más allá del curso habitual de la lesión aguda, afecta negativamente el bienestar del individuo, no cumple ninguna función evolutiva, pero sí contribuye al desarrollo y persistencia de la discapacidad. El dolor crónico en el paciente oncológico varía en prevalencia y severidad según el tipo de cáncer y estadio de este, además de otras condiciones tales como las comorbilidades de los pacientes, personalidad, exposición a opioides de forma crónica, entre otras8,9
Según intensidad
Existen diversas escalas usadas para clasificar la intensidad, en adultos la más utilizada es la escala visual análoga, la cual cataloga el dolor según la puntuación de 1 a 10, siendo un dolor leve 1-3, moderado 4-6 y severo 7-1010
Según fisiopatología o etiología
● Nociceptivo: el cual es causado por daño tisular, ya sea somático (hueso) o visceral (hepático).
● Neuropático: generado por daño o lesión en el sistema nervioso periférico y/o central.


Mixto: cuando tiene manifestaciones de los dos anteriores10
La Organización Mundial de la Salud (OMS) en 1986 propone la escalera analgésica como una estrategia para el adecuado alivio del dolor en los pacientes oncológicos. Plantea normativas para el tratamiento del dolor, expone la importancia de uso de escalas numéricas para evaluar la intensidad del dolor y la efectividad del tratamiento con enfoque en la administración de tratamiento preventivo (analgésicos prescritos a intervalos regulares y no según necesidad) además de la adecuación de la medicación según intensidad del dolor, prefiriendo la vía oral sobre cualquier otra, siempre y cuando esté indicada y el paciente la tolere11,12,13

Nota: Elaboración propia basada en11
 Figura 1. Escalera analgésica
Figura 1. Escalera analgésica

Opcionesterapéuticas
Antiinflamatorios no esteroideos (AINES)
Los AINES son la primera línea de manejo de dolor leve a moderado agudo y en el manejo de dolor severo se utilizan como ahorradores de opioides por ciclos cortos, no más de 5 días.
Presentación
Los AINES constituyen un amplio grupo de medicamentos por lo que existen en todas las presentaciones (oral, intramuscular, intravenoso, gel, entre otras). Mecanismo de acción: inhibe la COX mediante la oxidación del ácido araquidónico impidiendo así que se convierte en prostaglandinas. Hay algunos AINES que son selectivos en inhibir solo la COX2.
Efectosadversos
Los efectos secundarios más frecuentes encontramos intolerancia gastrointestinal, distensión abdominal, náuseas, vómito, dolor abdominal, dispepsia, diarrea, entre otros. Dentro de los efectos secundarios graves se puede presentar sangrado gastrointestinal, fenómenos trombóticos por disfunción plaquetaria, falla renal o un efecto secundario muy poco frecuente que es agranulocitosis con el uso de Dipirona. En la tabla 1 se enuncian algunos de los AINES más comunes con sus dosis respectivas10,11,14


Tabla1. Antiinflamatorios noesteroideos
Acetaminofén
500-1000 mg cada 6 -8 horas
Dipirona 1-2 g cada 6-8 horas
Ibuprofeno
400-800 mg cada 8 horas
Dosis máximo 3 g al día
Dosis máxima 6 g al día
Máximo 800 mg cada 8 hora, considerar tomar con IBP* para reducir toxicidad gastrointestinal, evitar en paciente con sangrado y trombocitopenia
Naproxeno
500 mg cada 8-12 horas
Ketorolaco 30 mg cada 8-12 horas
Diclofenaco VO: 50 mg cada 8-12 horas IM-IV: 75 mg cada 12 horas
Dosis máxima 1500 mg día
Dosis máxima 90 mg día
Dosis máxima 150 mg día
Celecoxib
Etoricoxib
100-200 mg cada 12 horas
60-90 mg cada 24 horas
Dosis máxima 400 mg día
Dosis máxima 120 mg día
Nota: Elaboración propia basada en11,14 *IBP: inhibidor de bomba de protones
Los opioides son los medicamentos de elección en el dolor moderado a severo y el pilar en el tratamiento del dolor oncológico. Estos se dividen en 2 grupos grandes, opioides débiles y opioides potentes. A continuación, vamos a mencionar algunos de los opioides más utilizados.


Opioidesdébiles
Codeína
La codeína es un profármaco que se metaboliza por medio de las enzimas CYP2D6 convirtiéndose en morfina (aproximadamente un 10%), de donde proviene su efecto analgésico. Entre el 5 al 10% de las personas no metabolizan el profármaco, por lo que no logran beneficio analgésico; entre 1-2% son metabolizadores ultra rápidos por lo que existe mayor exposición al metabolismo activo, por ende, presentan mayor riesgo de toxicidad incluyendo depresión respiratoria, en ambos escenarios dependen de la etnia y sus variantes10,11. La dosis es 30-60 mg cada 4 horas, máximo 360 mg día. Tener precaución en enfermedad renal, hepática, embarazo, lactancia, antecedente de uso inadecuado de opioides.
Tramadol
El tramadol posee un mecanismo de acción dual, ya que actúa sobre los receptores Mu (µ), Kappa ( ), Delta (δ) y a nivel periférico inhibe la recaptación de serotonina y noradrenalina, existen múltiples presentaciones oral y parenteral, en combinación con AINES y acetaminofén10,14
La dosis es 50-100 mg cada 6 -8 horas, máximo 400 mg día. Tener precaución en antecedentes de convulsión o metástasis cerebral ya que disminuye el umbral convulsivo. Es seguro en la lactancia. Por su mecanismo de acción dual puede ser utilizado en el manejo del dolor neuropático.
Hidrocodona
La hidrocodona es un opioide semisintético derivado de la codeína, es un profármaco que por la vía del citocromo P450 se metaboliza en norhidrocodona e hidromorfona,


existen presentaciones en combinación con AINES y acetaminofén15,16 La dosis es 5-10 mg cada 6-8h, máximo 60 mg día.
Tapentadol
El tapentadol actúa sobre receptores µ a nivel central e inhibe la recaptación de noradrenalina a nivel periférico, lo que lo hace una muy buena opción de manejo en el dolor neuropático14,15. La dosis es 50 mg cada 12h, máximo recomendado 500 mg día.
Opioidespotentes
Morfina
La morfina oral es el tratamiento de elección para los pacientes con dolor severo, en especial los pacientes oncológicos, es un agonista del receptor opioide µ y un agonista débil del receptor . Existe variedad de presentaciones, pero en nuestro medio, está disponible en ampolla de 10 mg/ml, vial de 30 mg/ml o gotas 30 mg/ml.
La dosis recomendada para iniciar manejo es de 5-15 mg vía oral (V.O) o 2-5 mg intravenosa (I.V). No se recomienda en pacientes con falla renal puesto que se acumula un metabolito, morfina-6-glucurónido, lo que predispone a presentar en mayor medida efectos adversos14,16 .
Hidromorfona
La hidromorfona es un agonista del receptor µ opioide y un agonista débil del receptor δ, con propiedades farmacológicas similares a la de la morfina. Tiene una potencia 5 veces mayor que la de la morfina. Al metabolizarse produce en pequeñas cantidades hidromorfona-3-glucurónido, un metabolito con actividad neuroexcitatoria, se puede acumular en presencia de insuficiencia renal. Puede ser utilizado en enfermedad


hepática al no producir metabolitos tóxicos14. La dosis recomendada de inicio es de 1.25 mg cada 4 a 6 horas.
Buprenorfina
La buprenorfina es un agonista parcial de los receptores μ opioides. Este medicamento tiene un alto metabolismo de primer paso, por lo que no se administra por vía oral. Es considerado el opioide de elección en pacientes en diálisis, pues su excreción es a través de las heces, es seguro en ERC estadio 4 y 5. La buprenorfina además tiene la ventaja de tener un menor potencial de uso indebido, menos tolerancia analgésica, y menos estreñimiento en comparación con otros agonistas de los receptores μ14. La presentación de la buprenorfina en nuestro medio es en parches transdérmicos de 35 mcg/h, 52.5 mcg/h y 70 mcg/h, estos se cambian cada 72- 96 horas.
Fentanil
El fentanil es un agonista altamente soluble en lípidos de los receptores μ opioides, con un inicio de acción rápido y 90 veces más potente que la morfina. El fentanil no se utiliza para el control titulado del dolor, sino que se prefiere cuando ya se hace un control del dolor con otros opioides y se busca un mantenimiento de la analgesia. Con este medicamento se ha evidenciado menos efectos adversos como estreñimiento, náuseas, vómitos, somnolencia y retención urinaria11,15,16
Metadona
La metadona es un agonista µ de larga duración e inhibe el receptor N-Metil-D
Aspartato (NMDA), tiene una vida media larga (más de 27 horas) por lo que dificulta su titulación, se une a proteínas plasmáticas y se distribuye a tejidos, por lo que sus concentraciones no disminuyen abruptamente después de la suspensión. Sus características farmacológicas previenen desarrollo de tolerancia, favorecen su uso en el dolor neuropático y en paciente con antecedente de uso inadecuado de opioides 15,16 . La dosis es 2.5 -5 mg cada 8 -12 horas.


Efectos adversos de los opioides
Dentro de los más comunes encontramos las náuseas, emesis, constipación, aumento de reflujo gastroesofágico, boca seca, cefalea, sedación, confusión, mioclonías, retención urinaria, hipotensión postural, hiperalgesia inducida por opioides, alucinaciones y depresión respiratoria En ocasiones al disminuir la dosis del medicamento puede controlarse con mayor facilidad la incidencia de estos efectos, en especial aquellos relacionados con toxicidad del sistema nervioso central los cuales se dan por acumulación de metabolismos tóxicos. Respecto al resto de efectos la gran mayoría a excepción de estreñimiento desarrollarán tolerancia con el tiempo, es por esto, que todo paciente que inicia manejo con opioide debe recibir manejo con laxante concomitante de forma continua10,15,17,18
Titulación de opioides
La titulación de opioides para el manejo del dolor debe iniciarse con la menor dosis efectiva posible, considerando el tipo de dolor, su intensidad y etiología. Se recomienda comenzar con dosis bajas, por ejemplo, 1-3 mg de morfina IV o su equivalente en hidromorfona IV, y evaluar la intensidad del dolor cada 10 minutos. El objetivo es lograr una reducción del dolor del 50%. Si esta reducción no se alcanza, se puede repetir la dosis hasta lograr el alivio deseado.
Una vez que se ha reducido el dolor del paciente a la mitad, se suma la dosis total utilizada y se divide en 24 horas para mantener un control adecuado del dolor. En nuestro hospital, adoptamos un enfoque más cauteloso con dosis diarias que equivalen al 50-75% de la dosis total utilizada, distribuida en el transcurso de 24 horas. Siempre se debe tener en cuenta que los rescates del opioide utilizado deberían ser la mitad de la dosis administrada en cada intervalo de tiempo15


La rotación de opioides es cuando un opioide se sustituye por otro con el fin de mejorar la respuesta, ya sea para optimizar el control del dolor y/o reducir los efectos adversos. Para ello se requiere conocer las dosis de equianalgesia17 (Tabla 2).
Tabla 2.Equianalgesia de opioides, presentación farmacológica de los medicamentos y dosis recomendada.
Medicamento
Codeína -10
Tramadol -6 a -4
Tapentadol -3
Hidrocodona 10
Morfina 1
Oxicodona 1.5
Hidromorfona 5
Buprenorfina 60**
Fentanil 90
Menor a 100 mg: 5
Metadona
100 - 300
mg: 10 Mayor a 300
mg: 15
Nota: Elaboración propia basada en1
Tabletas 8 mg y 30 mg + acetaminofén o ibuprofeno
Ampollas: 50 mg y 100 mg Gotas 100 mg/ml
Tramadol con acetaminofén: 37.5/325 mg Tramadol con diclofenaco: 25/25 mg
Tabletas 50 mg y 100 mg
Hidrocodona con acetaminofén: 5/325 mg Hidrocodona con Ibuprofeno: 5/200 mg
Ampolla: 10 mg/ml, 30 mg/ml Gotas: 30 mg/ml
Tabletas liberación prolongada: 10 mg - 20 mg y 40 mg
Tabletas: 2.5 mg y 5 mg Ampolla: 2 mg/ml
Parche: 35 mcg/h, 52.5 mcg/h y 70 mcg/h
Parche: 25 mcg/h, 50 mcg/h, 75 mcg/h y 100 mcg/h
Tabletas: 10 mg y 40 mg
Dosis 60 mg cada 6 horas, máxima 360 mg VO/día.
Dosis máxima 400 mg al día
Dosis 50 mg cada 12 h
Dosis 10 mg cada 6 horas
Dosis inicial 5 mg cada 4 horas (morfina oral)
Dosis inicial 10 mg cada 12 h
Dosis inicial 1.25 mg cada 4 a 6 horas
Dosis un parche cada 7296 horas
Dosis un parche cada 72 horas
Dosis 2.5 cada 12 h



Intervencionismo analgésico
Corresponde al escalón cuatro de la escalera analgésica, se usa en casos de dolor refractario a manejo farmacológico, cuando hay inadecuado control del dolor a pesar de uso de coadyuvantes y escalonamiento terapéutico. Incluye bloqueos de nervios periféricos, bloqueos neurolíticos, cordotomia y analgesia intratecal15,19
Tratamiento nofarmacológico
Busca un abordaje desde el ámbito físico, psicosocial y espiritual; se recomienda en uso conjunto con la terapia farmacológica, existen múltiples alternativas dentro de las que se destaca la hipnosis, mindfulness, terapia cognitivo conductual, acupuntura, estimulación por ultrasonido, hielo o calor local20
Conclusión
El dolor es el síntoma más común en los pacientes oncológicos, afecta su calidad de vida y requiere de una evaluación multidimensional para lograr un adecuado control de este, es de crucial importancia que el médico general conozca la fisiopatología y esté capacitado para realizar un enfoque con manejo multimodal del dolor, conociendo las opciones terapéuticas tanto farmacológicas y no farmacológicas, con sus efectos secundarios asociados.


Referencias
1. Cancer [Internet]. Who.int. [citado el 15 de febrero de 2024]. Disponible en: https://www.who.int/health-topics/cancer
2. Global cancer burden growing, amidst mounting need for services [Internet]. Who.int. [citado el 15 de febrero de 2024]. Disponible en: https://www.who.int/news/item/01-02-2024-global-cancer-burden-growing--amidst-mount ing-need-for-services
3. Terminology [Internet]. International Association for the Study of Pain (IASP). International Association for the Study of Pain; 2021 [citado el 15 de febrero de 2024]. Disponible en: https://www.iasp-pain.org/resources/terminology/
4. Snijders R, Brom L, Theunissen M, van den Beuken-van Everdingen M. Update on prevalence of pain in patients with cancer 2022: A systematic literature review and meta-analysis. Cancers (Basel) [Internet]. 2023 [citado el 15 de febrero de 2024];15(3):591. Disponible en: http://dx.doi.org/10.3390/cancers15030591
5. Zuccaro SM, Vellucci R, Sarzi-Puttini P, Cherubino P, Labianca R, Fornasari D. Barriers to pain management : focus on opioid therapy. Clin Drug Investig. 2012 Feb;32 Suppl 1:11-9. doi: 10.2165/11630040-000000000-00000. PMID: 23389872.
6. Roberto A, Greco MT, Uggeri S, Cavuto S, Deandrea S, Corli O, et al. Living systematic review to assess the analgesic undertreatment in cancer patients. Pain Pract. 2022 ; 22(4):487-96.
7. del Arco J. Curso básico sobre dolor. Tema 1. Fisiopatología, clasificación y tratamiento farmacológico. Farm Prof (Internet) [Internet]. 2015 [citado el 10 de marzo de 2024];29(1):36–43. Disponible en: https://www.elsevier.es/es-revista-farmacia-profesional-3-articulo-curso-basico-sobre-dol or-tema-X0213932415727485
8. Portenoy RK, Mehta Z, Ahmed E. Cancer pain management: General principles and risk management for patients receiving opioids. UpToDate. 2023.


9. J.Mora, R.przkora, M.meroney, Chapter 02 Classification of Acute Pain and Chronic Pain Syndromes Practical Management of Pain
10. Fallon M, Giusti R, Aielli F, Hoskin P, Rolke R, Sharma M, Ripamonti CI; ESMO Guidelines Committee. Management of cancer pain in adult patients: ESMO Clinical Practice Guidelines. Ann Oncol. 2018 Oct 1;29(Suppl 4):iv166-iv191. doi: 10.1093/annonc/mdy152. PMID: 30052758.
11. World Health Organization. WHO guidelines for the pharmacological and radiotherapeutic management of cancer pain in adults and adolescents. World Health Organization. 2018.
12. Alonso Juan Pedro. El tratamiento del dolor por cáncer en el final de la vida: estudio de caso en un servicio de cuidados paliativos de la Ciudad Autónoma de Buenos Aires. Salud colectiva [Internet]. 2013 Abr [citado 19 de marzo 2024] ; 9(1):41-52.Disponible en: http://www.scielo.org.ar/scielo.php?script=sci_arttext&pid=S1851-82652013000100004& lng=es
13. Anekar AA, Hendrix JM, Cascella M. WHO Analgesic Ladder. StatPearls Publishing; 2023.
14. Swarm RA, Youngwerth JM, Agne JL, Anitescu M, Are M, Buga S, et al. NCCN Clinical Practice Guidelines in Oncology Adult Cancer Pain. 2024 feb.
15. Erazo-Muñoz M, Victoria-Mera M, Sarmiento G, Gómez M, Borda D, Mejía L, Barrero L. Guía de práctica clínica para el manejo del dolor oncológico en clínicas Colsanitas. Rev. Médica Sanitas [Internet]. 1 de abril de 2020 [citado 16 de marzo de 2024];23(2):77-93. Disponible en: //revistas.unisanitas.edu.co/index.php/rms/article/view/151
16. Bonilla, P. Uso de opioides en tratamiento del dolor: manual para Latinoamérica. 2a . ed.). Venezuela: Caracas : TIPS Imagen y Comunicación;2011.26-60 p.


17. Mercadante S, Bruera E. Opioid switching in cancer pain: From the beginning to nowadays. Critical Reviews in Oncology/ Hematology 2016;99:241–248. Disponible en: http://dx.doi.org/10.1016/j.critrevonc.2015.12.011
18. Stone P, Minton O. European Palliative Care Research collaborative pain guidelines. Central side-effects management: what is the evidence to support best practice in the management of sedation, cognitive impairment and myoclonus? Palliat Med. 2011 Jul;25(5):431-41. doi: 10.1177/0269216310380763. Epub 2010 Sep 24. PMID: 20870687.
19. García-Andreu Jorge. Manejo básico del dolor agudo y crónico. Anest. Méx. [revista en Internet]. 2017 [citado 2024 Mar 21] ; 29( Suppl 1 ): 77-85. Disponible en: http://www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S2448-87712017000400077 &lng=es
20. Martínez Sánchez LM, Martínez Domínguez GI, Gallego González D, Vallejo Agudelo EO, Lopera Valle JS, Grisales y J. Molina Valencia NV. Uso de terapias alternativas, desafío actual en el manejo del dolor [Internet]. Isciii.es. [citado el 21 de marzo de 2024]. Disponible en: https://scielo.isciii.es/pdf/dolor/v21n6/07_revision2.pdf






Suad Karime Téllez Soleimán1, Angélica María Ojeda Enríquez2, Manuela Arbeláez Gómez3 , Sebastián
Tabares Gil4
1. Médica general Pontificia Universidad Javeriana de Cali, Médica general de hospitalización Hospital Pablo Tobón Uribe.
2. Médica general Universidad Cooperativa de Colombia.
3. Estudiante de Medicina, Universidad Pontificia Bolivariana.
4. Cirujano general Hospital Pablo Tobón Uribe.
El dolor abdominal es un motivo de valoración frecuente durante la hospitalización de pacientes, independientemente de la causa de ingreso. Se debe hacer un abordaje del dolor, teniendo en cuenta el grupo de pacientes que se tiene en el servicio, sus antecedentes, así como los medicamentos frecuentemente utilizados durante su estancia hospitalaria. Se deben reconocer dos grupos de pacientes importantes, aquellos inmunocomprometidos, que corresponden a pacientes que reciben fármacos inmunomoduladores o quimioterapia, en relación con enfermedades inflamatorias/reumatológicas, neoplasias malignas, hematológicas o sólidas y pacientes trasplantados, así como los pacientes geriátricos. Estos pacientes tienen características propias que dificultan el diagnóstico y tratamiento, ya que generalmente las patologías se presentan de manera atípica. Además, existen patologías comúnmente abordadas durante las valoraciones de dolor abdominal como lo son la constipación y el íleo postoperatorio, la colecistitis aguda y los trastornos vasculares en el contexto de dolor abdominal no quirúrgico o en hallazgos incidentales en paciente asintomáticos.
Dolor abdominal, Hospitalización, Huésped Inmunocomprometido, íleo Paralítico


Introducción
El dolor abdominal es una causa de valoración frecuente durante la hospitalización de pacientes, independientemente de su motivo de consulta inicial. La cantidad de enfermedades que pueden generar como síntoma dolor abdominal es muy amplia, que incluye desde patologías infecciosas, aquellas con indicación quirúrgica inmediata y otras de manejo médico. Es importante considerar que el dolor puede darse no sólo por enfermedades de localización intraabdominal, sino también de origen extra abdominal. Se debe hacer una diferencia entre cuadros agudos o crónicos reagudizados, por lo que un interrogatorio detallado con un examen físico exhaustivo brinda información de importancia para orientar el diagnóstico y dirigir el tratamiento (Figura 1)1 .
La ubicación del dolor con los conocimientos sobre la semiología, anatomía, así como su inervación, permiten realizar el diagnóstico más orientado sobre la posible etiología del cuadro clínico1,2. Las características asociadas pueden incluir fiebre o escalofríos consistentes con una etiología infecciosa o inflamatoria, signos de hemorragia gastrointestinal alta o baja, distensión o cambios en el apetito y el peso. Un cambio en el hábito intestinal (estreñimiento, diarrea, sangrado rectal o expulsión de moco) puede indicar malignidad o inflamación3
En esta revisión se abordarán diferentes condiciones clínicas donde el dolor abdominal está presente, teniendo en cuenta población de pacientes específicos, enfocándose en los signos y síntomas, así como las ayudas diagnósticas que orientan hacia una patología específica.


Figura 1: Enfoque del dolor abdominal en el paciente hospitalizado.

Nota: Elaboración propia basada en3



Dolor abdominal en pacientes geriátricos
Durante las últimas décadas la población mayor a 65 años ha crecido aproximadamente un 15%, esto significa que en los servicios de hospitalización de todo el mundo se tiene una mayor proporción de pacientes entre la 7ma y 8va década de la vida. Después del dolor torácico y la dificultad para respirar, el dolor abdominal es el tercer síntoma principal más común en pacientes mayores de 65 años que acuden al servicio de urgencias, según la CDC4 .
Esta población tiene características propias que dificultan el diagnóstico y tratamiento. El enfrentamiento del médico ante el dolor abdominal debe ser diferente al de los pacientes más jóvenes. Se debe tener siempre en mente que estos pacientes se presentan tardíamente, con signos y síntomas atípicos5. Los síntomas de presentación más comunes asociados con el dolor abdominal en la población geriátrica son fiebre, náuseas o vómitos, hematemesis y anorexia6
Los signos vitales que inicialmente se encuentran alterados son la presión arterial sistólica y la frecuencia respiratoria. Los hallazgos del examen físico para tener en cuenta son la presencia de irritación peritoneal, la presencia de defensa voluntaria, así como ruidos intestinales anormales6 .
Los diagnósticos principales de dolor abdominal en esta población son apendicitis aguda, aneurisma aórtico abdominal y colecistitis aguda6. Otros diagnósticos comúnmente encontrados fueron la pancreatitis y la diverticulitis. La ecografía es la opción de elección para el diagnóstico de colecistopatías y pancreatitis, mientras la tomografía computarizada (TC) es preferida en contexto de apendicitis y diverticulitis, así como en otras sospechas diagnósticas como la obstrucción intestinal7
Es importante resaltar que con los diagnósticos más frecuentes en esta población se asociaron condiciones graves como presión arterial sistólica ≤90 mmHg, intubación necesaria o inserción de una vía central, procedimiento quirúrgico, ingreso en UCI o paro cardíaco5 .


La tasa de mortalidad más alta está en pacientes que presentan perforación gastrointestinal. Por esta razón se debe optimizar el diagnóstico y tratamiento en estos pacientes según su condición clínica.
Dolor abdominal en paciente inmunocomprometido
Un paciente inmunocomprometido es aquel que presenta un sistema inmunológico deteriorado o debilitado; esto altera la respuesta esperada ante infecciones. Ese grupo se compone de pacientes infectados por el virus de la inmunodeficiencia humana (VIH) que desarrollaron síndrome de inmunodeficiencia adquirida (SIDA), aquellos con neoplasias hematológicas malignas y quienes reciben fármacos inmunomoduladores o quimioterapia en relación con enfermedades inflamatorias/reumatológicas, así como pacientes trasplantados de órganos8
Este grupo de pacientes no suele presentar signos y síntomas específicos. Generalmente, se debe llegar a un diagnóstico confiable combinando la anamnesis, examen físico, antecedentes y evaluación por imágenes. La fiebre, la leucocitosis y la peritonitis pueden ser leves o estar ausentes, especialmente en pacientes con inmunodepresión grave.
En caso de diarrea, con o sin abdomen agudo, se debe realizar una prueba específica para Clostridium difficile y su toxina, ya que esta es una de las infecciones que representan riesgo clínico en esta población. Es principalmente una enfermedad de manejo médico, sin embargo, los pacientes con colitis fulminante que progresan a toxicidad sistémica requieren una intervención quirúrgica urgente9 .
En los pacientes trasplantados, la epidemiología del abdomen agudo varía según el tipo de trasplante, siendo la enfermedad de la vesícula biliar uno de los problemas más comunes después del trasplante de corazón y/o pulmón y la perforación intestinal por



divertículos siendo la enfermedad más común después de los trasplantes de riñón e hígado10
En los pacientes afectados por VIH, los cirujanos deben discriminar entre una enfermedad quirúrgica no relacionada y afecciones abdominales relacionadas principalmente con su enfermedad. La tuberculosis abdominal se ve frecuentemente como una coinfección11. La tomografía computarizada (TC) con contraste, siempre que sea posible, es el examen más confiable para diagnosticar enfermedad intraabdominal en pacientes inmunocomprometidos. El manejo de estos pacientes con abdomen agudo debe ser multidisciplinario9 .
Los pacientes inmunocomprometidos son una categoría heterogénea y difusa que con frecuencia acude al servicio de urgencias con enfermedades quirúrgicas agudas. El diagnóstico y el tratamiento en pacientes inmunocomprometidos suele ser complejo y debe ser multidisciplinario. En este grupo de pacientes, un diagnóstico erróneo o un retraso en la intervención quirúrgica puede llevar a un aumento de la morbilidad y la mortalidad.
Constipación e íleo post operatorio
La constipación o estreñimiento es una condición clínica en la que los pacientes presentan dificultad y menor frecuencia en las evacuaciones intestinales; su definición es subjetiva debido a que el personal médico la define según los Criterios Roma lll como la presencia de menos de tres evacuaciones intestinales por semana, sin embargo, los pacientes suelen asociarlo principalmente al esfuerzo defecatorio y la presencia de heces duras12 . Se estima que un 2 a un 27% de la población presenta este trastorno, siendo más frecuente en mujeres13 . Está frecuentemente asociado a los cambios en la dieta, factores fisiológicos y psicosociales.
El paciente hospitalizado presenta cambios en la alimentación, falta de actividad física interfiriendo en la motilidad intestinal, además se asocia a episodios de estrés al estar relacionado a un proceso de enfermedad12


Por otra parte, el íleo es un trastorno funcional que afecta la motilidad intestinal y que principalmente está asociado al uso de algunos fármacos (opioides, neurolépticos) y a procedimientos quirúrgicos dando lugar al íleo post operatorio, el cual suele ocurrir tras una intervención quirúrgica, presentándose en un 10% al 30% de los casos14 , este trae consigo un aumento en la estancia hospitalaria, así mismo aumentando la morbilidad del paciente.
El diagnóstico de íleo postoperatorio se realiza con la combinación de al menos dos de los siguientes cinco signos, después del cuarto día postoperatorio, sin mejoría: náuseas y vómitos, incapacidad para tolerar una dieta sólida o semilíquida, ausencia de flatos o deposiciones en 24 horas, distensión abdominal y evidencia radiológica de íleo14. La radiografía es la imagen de lección para detectar obstrucción intestinal e íleo adinámico, se realiza serie de abdomen que incluye: posición vertical, decúbito supino, con rayo horizontal y radiografía de tórax7 .
Dentro del manejo inicialmente se ordena reposo intestinal, con uso de procinéticos y antieméticos en caso de náuseas y emesis, así como la supresión de medicamentos como opioides. En caso de ser necesario, siempre individualizando al paciente, se podrá posicionar una sonda nasogástrica para descompresión abdominal. La cirugía no está indicada en un íleo paralítico verdadero en ausencia de perforación intestinal o isquemia1
Colecistopatías
La colecistitis aguda es una enfermedad inflamatoria aguda de la vesícula biliar que es causada por la obstrucción del conducto cístico por cálculos biliares en aproximadamente el 90%- 95% de las personas diagnosticadas. Con menos frecuencia,la colecistitis alitiásica, en la que se desarrolla una inflamación aguda de la vesícula biliar sin cálculos biliares, está presente en aproximadamente el 5% al 10% de las personas diagnosticadas con colecistitis aguda16


Esta patología se divide en colecistitis simple, colecistitis supurativa aguda, colecistitis gangrenosa y perforación de la vesícula biliar. Según la etiología, se pueden clasificar en mecánicas, químicas o bacterianas17. El cuadro clínico de estos pacientes se puede presentar con dolor abdominal en hipocondrio derecho persistente o intermitente y fiebre sin foco claro, generalmente se acompañan de signos inespecíficos como náuseas, vómitos e ictericia. Los signos al examen físico incluyen dolor a la palpación en el hipocondrio derecho, masa epigástrica derecha palpable, signo de Murphy positivo (+) e irritación peritoneal en algunos casos17
La colecistitis por colelitiasis ocurre con la obstrucción del conducto cístico, esto conduce al aumento de la presión intraluminal dentro de la vesícula biliar y, junto con la bilis sobresaturada de colesterol, inicia una respuesta inflamatoria aguda16. Por otro lado, en la colecistitis acalculosa la lesión por isquemia-reperfusión juega un papel importante, debido a que un suministro de sangre insuficiente en la arteria de la vesícula biliar provoca una necrosis isquémica de la pared de la vesícula17. Esta patología se puede producir con mayor frecuencia en pacientes con comorbilidades como diabetes mellitus, hipertensión arterial, aterosclerosis, vasculitis, accidente cerebrovascular e inmunodeficiencias.
Entre las ayudas diagnósticas, se presenta elevación de reactantes de fase aguda, aumento de bilirrubinas y de las enzimas hepáticas. La ecografía de hígado y vías biliares es la imagen de elección para realizar el diagnóstico. Los criterios diagnósticos son: signo de Murphy ultrasónico positivo, cálculos en la vesícula biliar, agrandamiento de la vesícula y engrosamiento de la pared de la vesícula16 .
La colecistitis aguda es principalmente un proceso inflamatorio, pero puede ocurrir una infección bacteriana secundaria de la vesícula biliar. En consecuencia, se deben administrar antibióticos para tratar organismos gramnegativos y anaerobios antes de la cirugía para proteger contra la sepsis y la infección de la herida.


Los antibióticos postoperatorios deben considerarse sólo en pacientes con signos de infección residual o sepsis16
El tratamiento estándar para la colecistitis aguda litiásica es la colecistectomía, a excepción de ciertas situaciones específicas, como en la colecistitis Tokio III en la escala de severidad, o en pacientes con alto riesgo quirúrgico, se utiliza la descompresión percutánea de la vesícula16. Los pacientes con mayor riesgo perioperatorio incluyen pacientes mayores con múltiples comorbilidades médicas y pacientes críticamente enfermos en el momento del diagnóstico. Por el contrario, para la colecistitis acalculosa, la opción preferida es el drenaje transhepático percutáneo de la vesícula biliar guiado por ecografía17
La pancreatitis aguda grave puede provocar complicaciones graves y poner en peligro la vida del paciente, con una tasa de mortalidad del 10% al 30%. Los cálculos biliares y el abuso de alcohol son los principales factores de riesgo de pancreatitis aguda. La pancreatitis es la complicación más frecuente tras la colangiopancreatografía retrógrada endoscópica18 .
La obstrucción del conducto pancreático, independientemente del mecanismo, conduce al bloqueo de la secreción pancreática, lo que conlleva a la lesión acinar debida a procesos autodigestivos que estimula una respuesta inflamatoria. En unos pocos casos la reacción es grave, con insuficiencia multiorgánica y sepsis. Se piensa particularmente que la sepsis es el resultado de una mayor propensión a la translocación bacteriana desde la luz intestinal a la circulación18 .
Las presentaciones de pancreatitis incluyen dolor abdominal epigástrico o difuso (80–95%), náuseas y vómitos (40–80%), distensión abdominal, fiebre, disnea, irritabilidad y alteración de la conciencia, con pirexia, baja saturación de oxígeno, taquipnea, taquicardia, hipotensión, defensa abdominal, íleo y/u oliguria19


Un diagnóstico de pancreatitis aguda requiere dos de tres criterios: (1) dolor abdominal compatible con pancreatitis, (2) amilasa o lipasa sérica tres o más veces el límite superior de lo normal y (3) hallazgos compatibles con pancreatitis en la tomografía computarizada abdominal19 .
Se han desarrollado muchos sistemas de puntuación que utilizan medidas clínicas y de laboratorio con o sin características de imagen para predecir la gravedad, varios de ellos diseñados para diferenciar la pancreatitis aguda leve de la grave, como en la
Clasificación Original de Atlanta, además se debe recordar el sistema de puntuación
APACHE II que evalúa y determina un porcentaje aproximado sobre la mortalidad19
En cuanto al tratamiento inicial, el oxígeno, la reanimación con líquidos intravenosos, la analgesia y la nutrición son fundamentales. No hay evidencia significativa en cuanto al reposo intestinal, el uso rutinario de antibióticos profilácticos y evitar el tratamiento con opiáceos. Sin embargo, los pacientes que desarrollan pancreatitis aguda moderadamente grave tienen un mayor riesgo de complicaciones infecciosas, asociadas con insuficiencia orgánica persistente o complicaciones locales.
La translocación bacteriana a través del intestino lesionado y una barrera de permeabilidad gastrointestinal defectuosa son consecuencia de la respuesta inflamatoria sistémica. La base del tratamiento son los antibióticos apropiados para la infección intraabdominal por gram negativos, por ejemplo, piperacilina-tazobactam o tigeciclina o una cefalosporina de tercera generación con metronidazol19
Trastornosvascularesabdominales:
Los trastornos de las venas mesentérica, porta y hepática como de sus respectivas arterias, tienen consecuencias clínicas importantes y pueden provocar insuficiencia hepática aguda, hepatopatía crónica, hipertensión portal no cirrótica, cirrosis y carcinoma hepatocelular20


La aterosclerosis es la etiología subyacente más común de las vasculopatías abdominales y la disección no aterosclerótica de la arteria mesentérica o renal, el aneurisma, la estenosis y la vasculitis son vasculopatías raras. Aunque estas patologías arteriales son poco frecuentes, son clínicamente muy importantes ya que entre el 20% y el 90% de los aneurismas de las arterias viscerales pueden romperse y requerir una intervención urgente21. La trombosis es otro hallazgo radiológico común, afectando principalmente a la arteria renal, seguido de la arteria celíaca y/o esplénica.
Las etiologías incluyen vasculitis sistémica o localizada, trastornos no inflamatorios como la displasia fibromuscular y mediolisis arterial segmentaria, y trastornos genéticos del tejido conectivo como el síndrome vascular de Ehlers-Danlos o el síndrome de Loeys-Dietz21 .
Por otro lado, con las mejoras en las técnicas de imagen abdominal y un aumento en su utilización, se ha detectado cada vez más la trombosis de la vena porta no cirrótica. Esto puede ser causado por múltiples etiologías subyacentes, como embarazo, traumatismo, cirugías, enfermedades autoinmunes, inflamación abdominal, infección abdominal, malignidad y estados de hipercoagulabilidad. La trombosis de la vena porta no cirrótica a menudo no produce síntomas inmediatos en ausencia de afectación de la vena mesentérica. Por lo tanto, la trombosis de la vena porta no cirrótica rara vez se detecta hasta que se descubre incidentalmente en las imágenes abdominales22
Sin embargo, en contexto de dolor abdominal en hospitalización, en paciente con enfermedad maligna o inflamatoria se puede detectar al realizar imágenes de control cuando no se resuelve su dolor abdominal. En el momento del diagnóstico de trastornos vasculares, se deben realizar paraclínicos entre los cuales se resaltan los reactantes de fase aguda. Alrededor del 54% y el 94% de los pacientes tenían niveles elevados de la velocidad de sedimentación globular y la proteína C reactiva, tanto en condiciones inflamatorias y no inflamatorias20,21


En cuanto a las imágenes diagnósticas, el angio-TC con cortes finos proporcionan una gran calidad de imagen de las arterias mesentérica y renal, siendo el estudio ideal en estos casos. En el caso de pacientes con alergias al contraste o en pacientes que necesitan vigilancia a largo plazo, se puede realizar una resonancia magnética21 .
En cuanto al tratamiento, depende del trastorno vascular detectado, se puede realizar embolización con espiral, angioplastia con stent, anticoagulación, resección abierta o revascularización quirúrgica y uso de esteroides como la prednisona. El tratamiento conservador, incluido el control del dolor y la observación se realiza en la mayoría de los casos, cuando el trastorno diagnosticado es incidental o cuando no tiene mayor significancia clínica dentro del diagnóstico principal del paciente21 .
Conclusión
El dolor abdominal es un síntoma frecuente en los pacientes en el servicio de hospitalización, debido a que puede estar asociado a múltiples causas como enfermedades de múltiples etiologías, trastornos de la motilidad, fármacos, infecciones y estar asociado a complicaciones postoperatorias. El abordaje de dolor abdominal se debe hacer inicialmente descartando las patologías que pueden poner en riesgo la vida del paciente, inicialmente descartar patologías quirúrgicas o que pueden llevar a un choque. Es importante individualizar según el grupo de pacientes que se presenten en el servicio, teniendo en cuenta la población geriátrica y los pacientes inmunocomprometidos. Es por esa razón que, un correcto enfoque clínico guiado con desarrollo de una anamnesis detallada, un examen físico completo, e individualizar la solicitud de ayudas imagenológicas con una sospecha diagnóstica clara, podrían brindar información fundamental para confirmar o descartar patologías que puedan ser las causantes de este síntoma que afecta de forma frecuente al paciente hospitalizado.


1. Ugarte MJ. Enfrentamiento del paciente con dolor abdominal. Revista Médica Clínica Las Condes [Internet]. 2021 Jul;32(4):457–65. Available from: https://linkinghub.elsevier.com/retrieve/pii/S0716864021000766
2. Cartwright SL, Knudson MP. Evaluation of acute abdominal pain in adults. Am Fam Physician. 2008;77(7):971–8.
3. Bates CM, Plevris JN. Clinical evaluation of abdominal pain in adults. Medicine (United Kingdom) [Internet]. 2013;41(2):81–6. Available from: http://dx.doi.org/10.1016/j.mpmed.2012.11.005
4. Center for Health Statistics N. Health, United States, 2014 (5/2015). 2014;
5. Treuer R. Acute Abdominal Pain in the Elderly. Revista Medica Clinica Las Condes [Internet]. 2017;28(2):282–90. Available from: http://dx.doi.org/10.1016/j.rmclc.2017.04.017
6. Dadeh A aishah, Uppakarnnuntakul W. Factors associated with serious abdominal conditions in geriatric patients visiting the emergency department. BMC Emerg Med. 2024;24(1):1–12.
7. Ilgar M, Akçiçek M, Ekmekyapar M. Causes of acute abdomen, preferred imaging methods, and prognoses in geriatric patients presenting to the emergency department with abdominal pain. Rev Assoc Med Bras. 2022;68(12):1726–9.
8. Coccolini F, Improta M, Sartelli M, Rasa K, Sawyer R, Coimbra R, et al. Acute abdomen in the immunocompromised patient: WSES, SIS-E, WSIS, AAST, and GAIS guidelines. World Journal of Emergency Surgery. 2021;16(1):1–21.
9. McKean J, Ronan-Bentle S. Abdominal Pain in the Immunocompromised Patient-Human Immunodeficiency Virus, Transplant, Cancer. Emerg Med Clin North Am [Internet]. 2016;34(2):377–86. Available from: http://dx.doi.org/10.1016/j.emc.2015.12.002
10. Turtay MG, Oguzturk H, Aydin C, Colak C, Isik B, Yilmaz S. A descriptive analysis of 188 liver transplant patient visits to an Emergency Department. Eur Rev Med Pharmacol Sci. 2012;16(SUPPL. 1):3–7.


11. Kuhlman JE, Fishman EK. Acute abdomen in AIDS: CT diagnosis and triage. 12. https://doi.org/101148/radiographics1042198633 [Internet]. 1990 Jul 1 [cited 2024 Feb16];10(4):621–34. Available from: https://pubs.rsna.org/doi/10.1148/radiographics.10.4.2198633
13. Longstreth GF, Thompson WG, Chey WD, Houghton LA, Mearin F, Spiller RC. Functional Bowel Disorders. Gastroenterology. 2006;130(5):1480–91.
14. Survey of Public Knowledge about Digestive Health and Diseases: Implications for Health Education on JSTOR [Internet]. [cited 2024 Feb 17]. Available from: https://www.jstor.org/stable/4628127
15. Venara A, Neunlist M, Slim K, Barbieux J, Colas PA, Hamy A, et al. Postoperative ileus: Pathophysiology, incidence, and prevention. J Visc Surg [Internet]. 2016;153(6):439–46. Available from: http://dx.doi.org/10.1016/j.jviscsurg.2016.08.010
16. Daniels AH, Ritterman SA, Rubin LE. Paralytic ileus in the orthopaedic patient. Journal of the American Academy of Orthopaedic Surgeons. 2015;23(6):365–72.
17. Gallaher JR, Charles A. Acute Cholecystitis: A Review. JAMA [Internet]. 2022 Mar 8 [cited 2024 Mar 28];327(10):965–75. Available from: https://jamanetwork.com/journals/jama/fullarticle/2789654
18. Fu Y, Pang L, Dai W, Wu S, Kong J. Advances in the Study of Acute Acalculous Cholecystitis: A Comprehensive Review. Dig Dis [Internet]. 2022 Jul 1 [cited 2024 Mar 22];40(4):468–78. Available from: https://pubmed.ncbi.nlm.nih.gov/34657038/
19. Lankisch PG, Apte M, Banks PA. Acute pancreatitis. In: The Lancet. Lancet Publishing Group; 2015. p. 85–96.
20. Szatmary P, Grammatikopoulos T, Cai W, Huang W, Mukherjee R, Halloran C, et al. Acute Pancreatitis: Diagnosis and Treatment. Drugs [Internet]. 2022 Aug 1 [cited 2024 Mar 28];82(12):1251. Available from: /pmc/articles/PMC9454414/
21. Simonetto DA, Singal AK, Garcia-Tsao G, Caldwell SH, Ahn J, Kamath PS. ACG Clinical Guideline: Disorders of the Hepatic and Mesenteric Circulation. American Journal of Gastroenterology [Internet]. 2020 Jan;115(1):18–40. Available from: https://journals.lww.com/10.14309/ajg.0000000000000486


22. Skeik N, Hyde JR, Olson SL, Thaler CM, Abuatiyeh W, Ahmed AK, et al. Nonatherosclerotic Abdominal Vasculopathies. Ann Vasc Surg [Internet]. 2019;60:128–46. Available from: https://doi.org/10.1016/j.avsg.2019.04.004
23. Naymagon L, Tremblay D, Mascarenhas J, Schiano T. Characteristics, anticoagulation, and outcomes of portal vein thrombosis after intra-abdominal surgery. Surgery (United States) [Internet]. 2021;169(5):1175–81. Available from: https://doi.org/10.1016/j.surg.2020.11.016





María Camila Jiménez García1 , José Carlos Sánchez Vega2 , Yesid Alberto Saavedra3
1.Médica general Universidad de Antioquia, Médica general de hospitalización Hospital Pablo Tobón Uribe.
2.Médico general Universidad de Antioquia.
3.Médico Internista, Universidad de Antioquia, Cardiólogo clínico Hospital Pablo Tobón Uribe.
Resumen
La definición de dolor torácico no se limita únicamente al significado del término “dolor”, es por ello que muchos autores prefieren el término “disconfort”. Es una causa frecuente de consulta al servicio de urgencias y las posibilidades diagnósticas son múltiples. Algunas pueden ser consideradas benignas, pero otras son potencialmente mortales, por lo que su rápido reconocimiento es primordial. Para ello, el médico debe estar familiarizado con el correcto abordaje semiológico de estos pacientes y con las ayudas diagnósticas más comunes, lo cual le permitirá orientar la búsqueda hacia diagnósticos precisos, evitando preocupaciones excesivas en los pacientes y sobrecostos en la atención. Así mismo, debe conocer las herramientas que se encuentran disponibles para predecir el riesgo de enfermedad coronaria, la cual termina siendo una de las entidades más temidas.
Palabras clave
Dolor torácico, electrocardiograma, estratificación de riesgo
Introducción
El dolor torácico es una de las causas más comunes de consulta al servicio de urgencias y aunque es la principal manifestación de los síndromes coronarios agudos (SCA), en la mayoría de los casos es explicado por entidades no cardiovasculares1,2


Se debe tener en cuenta que, a pesar de que se habla de “dolor”, los pacientes pueden referir como opresión, pesadez, presión o ardor. De igual manera, se puede manifestar en otras localizaciones como la parte superior del abdomen, espalda, hombros, cuello y mandíbula1
El dolor torácico agudo es aquel de nueva aparición o que representa un cambio en el patrón, la intensidad o duración en comparación con episodios anteriores en aquellos pacientes que presentan síntomas recurrentes. En contraste, el dolor torácico estable se presenta con síntomas crónicos que están asociados a factores desencadenantes constantes, como el esfuerzo o el estrés emocional1
El dolor torácico agudo presentado en el servicio de urgencias abre un abanico de posibilidades diagnósticas, que van desde entidades potencialmente mortales que requieren un manejo prioritario hasta causas más benignas que pueden ser manejadas en el entorno ambulatorio. El objetivo del presente capítulo será brindar las herramientas iniciales para que el médico que se enfrente a esta condición sea capaz de diferenciar entre ellas y realizar un adecuado abordaje clínico inicial.
Epidemiología
La prevalencia de por vida de dolor torácico agudo se ha estimado entre un 20 y 40%. La media de edad se sitúa entre 52 y 61 años, el 49 – 57% son hombres y la incidencia es mayor en pacientes de raza negra. Las tasas de mortalidad varían considerablemente según la causa subyacente, siendo, <1% en los dolores torácicos no específicos y hasta el 20% en patologías aórticas agudas3,4
Aunque existen diferencias según la población estudiada, se describe que de los pacientes que se presenta al servicio de urgencias con dolor torácico agudo, alrededor del 27% tendrán una causa cardiovascular, mientras que aproximadamente el 35% una


causa no cardiaca y casi la mitad (48%), se presenta con un dolor torácico no específico4. Las principales causas se resumen en la tabla 1
Tabla 1. Principales causas de dolor torácico
Causas cardiovasculares
Síndrome coronario agudo
Causas no cardiovasculares
Espasmoesofágico, esofagitis, reflujo gastroesofágico, úlcera péptica, colecistopatías, pancreatitis
Pericarditis aguda, derrame pericárdico Neumonía, bronquitis, asma
Miocarditis, cardiomiopatías
Crisis hipertensivas
Insuficiencia cardiaca aguda
Taquiarritmias
Disección aórtica
Síndromes aórticos agudos
Pleuritis, derrame pleural, neumotórax
Hipertensión pulmonar
Trauma torácico, fractura costal
Costocondritis
Herpes zoster
Daños discal en columna cervical o torácica
Embolismo pulmonar, infarto pulmonar Psicogénica
Contusión cardiaca
Nota: Elaboración propia adaptado de4
Caracterización semiológica del dolor torácico
El dolor torácico se define como toda sensación dolorosa o malestar localizada entre el diafragma y la fosa supraclavicular y, puede provenir de la estimulación de fibras de dolor visceral y somáticas. La estimulación de fibras de dolor visceral provenientes del corazón, vasos sanguíneos, esófago y pleura visceral producen síntomas pobremente localizados y a menudo difíciles de describir por parte del paciente. En contraste, las fibras somáticas dolorosas originadas en estructuras musculoesqueléticas, pleura parietal y dermis producen síntomas bien localizados y de fácil descripción5,6 .


Es importante entender estas diferencias que serán de utilidad clínica al momento de interpretar los síntomas reportados por los pacientes, siempre teniendo presente que estarán influenciados por factores como edad, nivel de educación, enfermedad mental, otras comorbilidades y diferencias culturales.
El enfoque implica una historia clínica detallada, examen físico completo, ayudas diagnósticas apropiadas (como electrocardiograma, análisis de sangre y pruebas de imagen) y, en función de los hallazgos, un plan de tratamiento específico que puede incluir medicamentos, intervenciones no farmacológicas y, en casos graves, procedimientos médicos o quirúrgicos urgentes. La prioridad es diferenciar entre causas benignas y potencialmente mortales del dolor torácico para garantizar una intervención oportuna y adecuada ya que una sospecha errónea de un proceso potencialmente peligroso puede dar lugar a consecuencias psicológicas y económicamente negativas para el enfermo y los sistemas de salud5,7 .
El médico debe obtener información sobre la ubicación precisa del dolor, su inicio, duración, irradiación, intensidad, calidad (opresivo, punzante, ardor, etc.), factores desencadenantes y cualquier síntoma asociado, como dificultad para respirar, sudoración, náuseas, entre otros. Adicionalmente, se debe indagar sobre antecedentes médicos relevantes, como enfermedades cardíacas, pulmonares, gastrointestinales, factores de riesgo cardiovascular, hábitos de vida y medicamentos actuales7. Las características semiológicas que ayudan en la diferenciación del origen del dolor torácico son descritas en la tabla 2
Es fundamental considerar un amplio rango de posibles causas de dolor torácico durante la evaluación, como se documentó en la tabla 1. A continuación se presentará un desglose semiológico de las principales características a tener en cuenta al momento de la evaluación y las patologías principalmente asociadas.


Inicio del dolor
El momento justo de aparición puede ayudar a limitar los diagnósticos diferenciales. El dolor que inicia de forma repentina, con alta intensidad desde su inicio se puede relacionar con disección aórtica aguda, neumotórax o embolia pulmonar8,9 .
La aparición abrupta de dolor está presente hasta en el 85% de los pacientes con disección aórtica aguda (DA)10. El dolor asociado con la embolia pulmonar (EP) puede comenzar repentinamente, pero suele empeorar con el tiempo11. En el caso del neumotórax no traumático, el dolor inicia con mayor frecuencia de manera repentina en reposo, sin ningún evento precipitante7
Por el contrario, el malestar causado por un síndrome coronario agudo (SCA), suele comenzar gradualmente y empeora con el esfuerzo. Mientras que, en la angina estable, el malestar ocurre sólo cuando la actividad crea una demanda de oxígeno que supera las limitaciones de suministro impuestas por una obstrucción fija. La angina inestable, por su parte, representa un cambio abrupto con respecto al funcionamiento basal, que puede manifestarse como malestar con niveles más bajos de ejercicio o inclusive en el reposo1,12 .
Tipo de dolor y ubicación
Los pacientes a menudo describen los síntomas de un SCA como malestar en lugar de dolor, ya sea de tipo opresivo, desgarrador, lancinante, constrictivo y se suele acompañar de sensación de muerte inminente. A pesar de la variabilidad individual, las molestias inducidas por la isquemia miocárdica suelen ser características y por tanto fundamentales para el diagnóstico1,12


Clásicamente, el dolor anginoso se caracteriza por ser opresivo, de localización retroesternal, se empeora con el esfuerzo físico y mejora con el reposo o con vasodilatadores coronarios. Por este motivo los rasgos con mayor probabilidad de estar relacionados con la isquemia se han descrito como típicos frente a atípicos. La presencia de los 3 componentes categoriza el dolor como “típico”, en caso de que sean sólo dos, se denominará “atípico” y si solo tiene una de las características será rotulado como “dolor no anginoso”. La isquemia es menos probable si el malestar es punzante, pleurítico o posicional1,3 .
Debe enfatizarse que sólo 15% de los pacientes se presentan con todas las características previamente enunciadas y que, en los pacientes diabéticos, la angina atípica cobra mayor relevancia y por lo tanto se debe tener un menor umbral para adelantar estudios adicionales en esta población4
La DA se presenta con mayor frecuencia con la aparición repentina de un dolor intenso, agudo, de carácter desgarrante o pulsátil. Puede ser migratorio siguiendo el sentido de la disección, localizado en la cara anterior del tórax, cuello y mandíbula cuando la DA compromete la aorta proximal o localizado en la zona interescapular y el abdomen si la DA es distal10
El dolor pleurítico aparece cuando la pleura es asiento de un proceso inflamatorio local (pleuritis, neumotórax, neoplasias) o propagado a la pleura desde el pulmón (neumonías, infarto pulmonar), por lo que, en función de la causa subyacente, se pueden encontrar otros síntomas, como pueden ser disnea, tos, expectoración, fiebre, etc. El dolor de tipo pleurítico suele ser punzante, de localización bien circunscrita, intermitente y que se empeora con la inspiración profunda13 .


El dolor torácico debido a EP depende en gran medida de la extensión de la embolia. En la EP masiva el dolor es retroesternal, opresivo y se acompaña de disnea, cianosis e inestabilidad hemodinámica, por lo que puede confundirse con el del SCA. El 30% de las EP producen infarto pulmonar, el cual se manifiesta por dolor de tipo pleurítico por irritación de la pleura, de comienzo agudo, acompañado a veces de disnea, fiebre y tos con expectoración hemoptoica11 .
Los pacientes con neumotórax refieren dolor torácico ipsilateral que inicialmente puede ser agudo y pleurítico pero que puede volver sordo y generar disnea intensa como consecuencia de una menor reserva pulmonar7,8 .
El dolor osteomuscular suele ser de tipo punzante, con frecuencia precordial y suele aumentar con los movimientos de la caja torácica y con la palpación sobre la zona afectada. Este también se ve agravado por la respiración por lo que puede ser confundido con el dolor pleurítico. Rara vez es intenso e incapacitante y suele mejorar con ciertas posturas, el calor local, analgésicos y el reposo. A menudo, el paciente relata antecedentes de traumatismo o actividad extenuante antes de desarrollar el dolor13,14 .
El dolor ardiente en el tórax y el epigastrio se asocia comúnmente con causas gastrointestinales. La rotura esofágica, considerada potencialmente mortal, puede causar dolor torácico y/o abdominal, que se puede presentar como dolor epigástrico, retroesternal o lateralizado al lado de la lesión, si la perforación es a nivel abdominal los pacientes presentan epigastralgia que se irradia a dorso y hombro izquierdo, junto con signos de irritación peritoneal típicamente6,7,15


Provocación/Paliación/síntomas asociados
Al igual que la presentación y características, los síntomas asociados pueden dar pistas que orienten hacia alguno de los múltiples diagnósticos diferenciales a los que nos enfrentamos.
Es bien sabido que la diaforesis, las náuseas y los vómitos acompañan con frecuencia al malestar torácico asociado con el SCA, pero no lo predicen. Los pacientes de edad avanzada con eventos isquémicos suelen tener quejas distintas al dolor torácico, tales como disnea, debilidad, alteración del estado mental o síncope. Los síntomas, como diaforesis y náuseas, también pueden ocurrir con dolor torácico no isquémico, incluida disección aórtica, embolia pulmonar, insuficiencia cardíaca aguda y espasmo esofágico4,7,14 .
La disnea acompaña con frecuencia a las causas pulmonares de dolor torácico y puede ser el síntoma predominante en la embolia pulmonar, el neumotórax y la neumonía. La taquipnea es común en la EP y puede ir acompañada de sibilancias y fiebre11 .
Las náuseas y los eructos acompañan con frecuencia a las causas gastrointestinales de dolor torácico, pero también pueden ocurrir en pacientes con infarto de miocardio inferior. La fiebre genera preocupación por causas infecciosas, pero también se asocia con pericarditis, miocarditis y, en raras ocasiones, infarto agudo de miocardio (IAM). Una fiebre leve puede acompañar a la EP, como ya se mencionó anteriormente7 .
El dolor de la DA, no disminuye de intensidad con los cambios de postura ni con los movimientos, pero aumenta de intensidad con los cambios de presión torácica. Según progrese la disección, el dolor puede ir acompañado de cortejo vegetativo, síncope, falla cardíaca debido a insuficiencia aórtica severa (en disecciones proximales), accidente vascular cerebral, paraparesia por isquemia medular, dolor abdominal por


isquemia de vísceras abdominales, signos de choque hipovolémico o taponamiento cardíaco10
El dolor del espasmo esofágico es la causa extracardíaca más confundida con el dolor de origen isquémico, debido a que tanto el esófago como la vesícula biliar comparten las mismas fibras sensitivas que el corazón. Además, es frecuente que el espasmo esofágico se alivie con fármacos antianginosos, como el nifedipino o la nitroglicerina sublingual, lo que aumenta todavía más la confusión entre estas dos entidades. Puede ser desencadenado por la ingesta de alimentos ácidos o picantes, el alcohol, las bebidas frías, la deglución y el estrés psicológico en el momento de la ingesta. Suele aliviarse con antiácidos7,16,17
Cuando la causa del dolor es el reflujo gastroesofágico, la pirosis es un síntoma acompañante constante. Especial atención se debe prestar a la coexistencia de dolor torácico agudo, vómitos y enfisema subcutáneo (tríada de Mackler) que es indicativo de perforación esofágica15,16
El malestar de la pericarditis suele manifestarse como dolor precordial/retroesternal de instauración relativamente rápida, aunque no brusca, intenso (no opresivo, sin cortejo vegetativo), que aumenta con movimientos torácicos, inspiración, decúbito y tos, y mejora en sedestación con el tronco inclinado hacia delante. Puede auscultarse un roce pericárdico en algunas ocasiones6,7,9. Así mismo, un número significativo de pacientes aquejan un cuadro infeccioso concomitante o en los días previos.
Examen físico
Un examen físico completo es fundamental en la evaluación del dolor torácico. Se deben medir los signos vitales, auscultar el corazón y los campos pulmones en busca de anormalidades, palpación del tórax en busca de sensibilidad, masas o deformidades,



y buscar posibles signos de emergencia como cianosis, hipotensión o compromiso respiratorio. Además, se deben evaluar otros sistemas, como el abdominal y musculoesquelético, para descartar posibles causas extratorácicas de dolor.
Tabla 2. Características del dolor torácico en las patologías potencialmente fatales
Síndrome coronario agudo
Retroesternalo precordial
Localización
Patrón creciente
Inicio
Tipo
Irradiación
Agravantes/ atenuantes
Disección aórticaaguda
Tóraxanterior (disección proximal) o región interescapular (disección distal).
Súbito,mayor intensidad al inicio
Opresivo, constrictivo Agudo desgarrante
Maxilarinferior, cuello hombro, brazos
Precipitado por el ejercicio, mejora con el reposo y vasodilatadores. En angina inestablepuede presentarse en reposo
Cuello, espalda, abdomen
Embolismo pulmonar
Retroesternal (masivo) o costado(émbolo pequeño)
Pericarditis aguda
Retroesternal
Súbito
Difuso, Pleurítico, en punzada en el costado (pequeño)
Hombrodellado comprometido
No mejora con loscambiosde posición ni con los movimientos Puede ser incrementadocon la respiración
Nota: Elaboración propia Adaptada de7
Súbito, se incrementa lentamente
Pleurítico
SimilaralSCA, bordes del músculo trapecio
Aumentaconla respiración, empeora al acostarse, mejora al sentarse o inclinarsehacia adelante


Ayudas diagnósticas iniciales
Electrocardiograma
El electrocardiograma de superficie (ECG) de 12 derivadas es un estudio fundamental en el abordaje del paciente con dolor torácico. Este debe ser tomado e interpretado en los primeros 10 minutos desde el contacto inicial con el paciente y debe hacerse de forma seriada para evaluar cambios dinámicos1. Adicionalmente, se deben tener presentes las indicaciones para obtener derivaciones especiales:
● Elevación del ST en cara inferior (derivaciones DII, DIII y aVF): se debe obtener derivaciones del lado derecho con el fin de descartar extensión del infarto al ventrículo derecho.
● Depresión del ST en derivaciones V1 y V2: se debe obtener derivaciones posteriores para descartar infarto en cara posterior.
● Electrocardiograma “no diagnóstico”: obtener derivaciones adicionales en búsqueda de alteraciones adicionales.
Es importante tener en cuenta que solo el 50% de los pacientes presenta hallazgos típicos de infarto agudo de miocardio en el ECG. No obstante, este puede documentar patrones de alto riesgo, incluyendo bloqueos en la conducción, que pueden reflejar obstrucción coronaria aguda y, así mismo, permite evaluar posibles diagnósticos diferenciales del SCA (tabla 3)18 .







Radiografía de tórax
Se considera otra ayuda primordial en el abordaje del paciente con dolor torácico, en especial para evaluar diagnósticos diferenciales como causas pulmonares, esofágicas, intratorácicas e incluso cardiacas diferentes a los síndromes coronarios agudos1,19 . Por esta razón, guías internacionales como las europeas de SCA y de falla cardiaca aguda recomiendan tomar una radiografía de tórax al momento de la presentación clínica.
Su rendimiento es variable según la entidad, así, por ejemplo, el 90% de los pacientes con disección aórtica aguda tiene alguna anomalía en la radiografía de tórax (ensanchamiento del mediastino, del botón aórtico o de la aorta ascendente o descendente, desviación de la tráquea, derrame pleural). En el caso de la embolia pulmonar, la radiografía de tórax puede ser normal, pero en algunos casos puede observarse atelectasias, elevación del hemidiafragma, derrame pleural, signo de la joroba de Hampton y signo de Westermark19,20
Por otro lado, puede ser el estudio diagnóstico en el caso de la neumonía y el neumotórax. Asimismo, es útil la sospecha de insuficiencia cardiaca aguda, rotura esofágica, derrame pleural, masa pulmonar, hernia hiatal, fracturas costales, entre muchas otras20
Biomarcadores cardiacos
Las enzimas cardiacas tienen gran valor diagnóstico y pronóstico en el contexto del paciente con dolor torácico. Son sumamente útiles en el abordaje del SCA, siendo incluso necesaria su alteración para hacer el diagnóstico del SCA sin elevación del ST. Si bien, se han estudiado múltiples enzimas en este escenario, actualmente las de elección son las troponinas cardiacas I y T de alta sensibilidad debido a su mayor capacidad para detectar lesión miocárdica precozmente1,3 .
Para su adecuada implementación se deben considerar dos aspectos relevantes: una elevación en la concentración de estas enzimas se considera significativa cuando



superan el límite superior de referencia del percentil 99, que varía según la prueba utilizada. Debe enfatizarse que las enzimas cardiacas pueden elevarse por muchas causas distintas al infarto tales como taquiarritmias, embolia pulmonar, insuficiencia cardiaca aguda, sepsis, accidente cerebrovascular, disección aórtica, contusión cardíaca, entre otras1,2
Escalas de predicción de dolor de origen coronario
Como ya se ha comentado, debido a la importancia clínica que tiene el SCA, al momento de enfrentarse a un paciente con dolor torácico se debe ser capaz de identificar rápidamente la enfermedad coronaria subyacente en caso de que exista.
Para lo cual, las herramientas de estratificación de riesgo clínico pueden ayudar a integrar síntomas, hallazgos en el ECG y biomarcadores en la estratificación del riesgo que tienen estos pacientes de padecer una enfermedad coronaria (EC).
Algunas de las escalas más utilizadas se resumen en la tabla 4. Aunque evalúen aspectos similares, se han encontrado diferencias entre sus desempeños, el cual además puede variar según la población estudiada.
Tabla 4. Principales escalas utilizadas para la predicción de enfermedad coronaria.
Escala
Modeloclínicodel consorcio de EAC
Diamond-Forrester
Parámetros evaluados
Edad, sexo, angina, diabetes mellitus, tabaquismo, hipertensión y dislipidemia. Puntuación de calcio coronario (si está disponible).
Clasificaciónsegún puntaje
<5%: probabilidad baja 5-70%: intermedia >70% alta.
Edad, sexo y características del dolor. <30%:probabilidad baja.
30-70%: intermedia >70% alta
HEART
SVEAT
Nota: Adaptado de21,22
Historia del dolor, ECG, edad, factores de riesgo, troponinas.
Síntomas,enfermedadvascular, ECG, edad, troponina I.
<4puntos: riesgobajo 4-6 puntos: moderado >6 puntos: alto
<4puntos: riesgobajo
4-6 puntos: moderado >6 puntos: alto



A pesar de que estas escalas o puntuaciones pueden servir como un apoyo para guiar la atención hacia el alta temprana o, por el contrario, la necesidad de estudios complementarios para descartar EC, no son una norma, no deben ser superiores al juicio clínico y se debe individualizar a cada paciente.
Conclusión
El dolor torácico puede ser la principal manifestación de una patología potencialmente fatal, por lo tanto, es fundamental conocer cuáles son las características semiológicas de cada una de las entidades que lo pueden causar.
Si bien el síndrome coronario agudo podría representar la causa más relevante debido a su epidemiología, es importante tener presente que no es la única y tampoco la más letal. El diagnóstico diferencial es un proceso complejo que requiere una evaluación cuidadosa de la historia clínica, el examen físico y las pruebas diagnósticas pertinentes; al hacer una integración de estos elementos es crucial considerar una amplia gama de posibles causas, desde trastornos cardíacos y pulmonares, hasta gastrointestinales y musculoesqueléticos, para determinar la causa subyacente del dolor torácico y guiar el tratamiento adecuado. Los médicos deben estar familiarizados con los diferentes diagnósticos diferenciales del dolor torácico y ser capaces de tomar decisiones rápidas y efectivas para garantizar la seguridad y el bienestar de los pacientes.



Referencias
1. Gulati M, Levy PD, Mukherjee D, Amsterdam E, Bhatt DL, Birtcher KK, et al. 2021
AHA/ACC/ASE/CHEST/SAEM/SCCT/SCMR Guideline for the Evaluation and Diagnosis of Chest Pain: A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. Circulation. 30 de noviembre de 2021;144(22):e368-454.
2. Ibanez B, James S, Agewall S, Antunes MJ, Bucciarelli-Ducci C, Bueno H, et al. 2017 ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation: The Task Force for the management of acute myocardial infarction in patients presenting with ST-segment elevation of the European Society of Cardiology (ESC). Eur Heart J. 7 de enero de 2018;39(2):119-77.
3. Dawson LP, Smith K, Cullen L, Nehme Z, Lefkovits J, Taylor AJ, et al. Care Models for Acute Chest Pain That Improve Outcomes and Efficiency: JACC State-of-the-Art Review. J Am Coll Cardiol. 14 de junio de 2022;79(23):2333-48.
4. Stepinska J, Lettino M, Ahrens I, Bueno H, Garcia-Castrillo L, Khoury A, et al. Diagnosis and risk stratification of chest pain patients in the emergency department: focus on acute coronary syndromes. A position paper of the Acute Cardiovascular Care Association. Eur Heart J Acute Cardiovasc Care. febrero de 2020;9(1):76-89.
5. Kelly BS. Evaluation of the elderly patient with acute chest pain. Clin Geriatr Med. mayo de 2007;23(2):327-49, vi.
6. Fallon EM, Rogues J. Acute Chest Pain: AACN Clin Issues Adv Pract Acute Crit Care. agosto de 1997;8(3):383-97.
7. Giraldo HJU, Bedoya DL, Morales DAM. Semiología del dolor torácico en patologías potencialmente fatales. Rev Médica Risaralda [Internet]. 26 de junio de 2011 [citado 2 de abril de 2024]; Disponible en: https://revistas.utp.edu.co/index.php/revistamedica/article/view/7599
8. Juan Ramón Soto S. Dolor torácico. Rev Médica Clínica Las Condes. 1 de septiembre de 2011;22(5):655.


9. Crespo Marcos D, Pérez-Lescure Picarzo FJ, Zambrano Castaño M. Dolor torácico. Pediatría Aten Primaria. marzo de 2010;12(45):95-107.
10. Isselbacher EM, Preventza O, Hamilton Black J, Augoustides JG, Beck AW, Bolen MA, et al. 2022 ACC/AHA Guideline for the Diagnosis and Management of Aortic Disease: A Report of the American Heart Association/American College of Cardiology Joint Committee on Clinical Practice Guidelines. Circulation. 13 de diciembre de 2022;146(24):e334-482.
11. Konstantinides SV, Meyer G, Becattini C, Bueno H, Geersing GJ, Harjola VP, et al. 2019 ESC Guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 21 de enero de 2020;41(4):543-603.
12. Anthony D. Diagnosis and screening of coronary artery disease. Prim Care. diciembre de 2005;32(4):931-46.
13. Soto-Campos J. Manual de diagnóstico y terapéutica en Neumología 3a Edición. 2016. 2016.
14. Chang AM, Hollander JE. Chest pain: Should we be scared or take a heart felt approach? Emerg Rev Soc Espanola Med Emerg. febrero de 2020;32(1):5-6.
15. Gómez-Escudero O, Coss-Adame E, Amieva-Balmori M, Carmona-Sánchez RI, Remes-Troche JM, Abreu Y Abreu AT, et al. Consenso mexicano sobre dolor torácico no cardiaco. Rev Gastroenterol México. julio de 2019;84(3):372-97.
16. Larraona JL, Castro M. Dolor torácico de origen esofágico. Rev Esp Enfermedades Dig. abril de 2007;99(4):239-239.
17. Diaz-Rubio M, Moreno-Elola-Olaso C, Rey E, Locke GR, Rodriguez-Artalejo F. Symptoms of gastro-oesophageal reflux: prevalence, severity, duration and associated factors in a Spanish population. Aliment Pharmacol Ther. 1 de enero de 2004;19(1):95-105.


18. Patrones electrocardiográficos de alto riesgo en pacientes con síndrome coronario agudo | Archivos Peruanos de Cardiología y Cirugía Cardiovascular [Internet]. [citado 2 de abril de 2024]. Disponible en: https://apcyccv.org.pe/index.php/apccc/article/view/82
19. Klein JS, Rosado-de-Christenson ML. A Systematic Approach to Chest Radiographic Analysis. En: Hodler J, Kubik-Huch RA, von Schulthess GK, editores. Diseases of the Chest, Breast, Heart and Vessels 2019-2022: Diagnostic and Interventional Imaging [Internet]. Cham (CH): Springer; 2019 [citado 2 de abril de 2024]. (IDKD Springer Series). Disponible en: http://www.ncbi.nlm.nih.gov/books/NBK553874/
20. Chawla A. Imaging in noncardiovascular thoracic emergencies: a pictorial review. Singapore Med J. noviembre de 2015;56(11):604-11.
21. Antwi-Amoabeng D, Roongsritong C, Taha M, Beutler BD, Awad M, Hanfy A, et al. SVEAT score outperforms HEART score in patients admitted to a chest pain observation unit. World J Cardiol. 26 de agosto de 2022;14(8):454-61.
22. Lee UW, Ahn S, Shin YS, Kim YJ, Ryoo SM, Sohn CH, et al. Comparison of the F and updated Diamond-Forrester scores for predicting obstructive coronary artery disease. Am J Emerg Med. 1 de mayo de 2021;43:200-4




PARA EL MÉDICO GENERAL
DETECCIÓN TEMPRANA DEL
DETERIORO: UNA EXPERIENCIA DE IMPLEMENTACIÓN DE TECNOLOGÍA,
INTELIGENCIA ARTIFICIAL Y EVIDENCIA CLÍNICA PARA EL CUIDADO DE LOS PACIENTES ADULTOS

DETECCIÓN TEMPRANA DEL DETERIORO: UNA EXPERIENCIA DE IMPLEMENTACIÓN DE TECNOLOGÍA, INTELIGENCIA ARTIFICIAL Y EVIDENCIA
CLÍNICA PARA EL CUIDADO DE LOS PACIENTES ADULTOS
Narly Viviana Gómez Rueda1
1.Especialista en Medicina Interna Universidad Pontificia Bolivariana, Jefe departamento Hospitalización, Hospital Pablo Tobón Uribe, Magíster Ciencias Clínicas, Estudiante de Maestría de Administración en Salud.
Los resultados en salud son uno de los elementos más importantes para la toma de decisiones tanto para los clínicos como para los pacientes. Por un lado, los clínicos, que tenemos claro el principio de “no hacer daño”, el servicio y la vocación por mejorar la calidad de vida de los pacientes, basamos nuestras decisiones en evidencia científica que involucra desenlaces como supervivencia, años libres de enfermedad y eventos adversos, entre otros. Por otro lado, los pacientes, eligen una institución de salud o un médico teniendo en cuenta estos mismos desenlaces, además de su experiencia de servicio.
La era digital y las redes sociales han proporcionado a los pacientes más y mejor información, lo que ha llevado a mayores niveles de exigencia. Por lo tanto, para las instituciones, además de contar con un personal calificado, con vocación y competencias de trabajo en equipo, es crucial articular el talento humano, la tecnología disponible y la evidencia de servicio para lograr resultados favorables.
Una vez ingresa un paciente a un hospital, existe el riesgo de presentar un deterioro, ya sea por su propia enfermedad, por infecciones, complicaciones intrahospitalarias, por eventos adversos prevenibles o no prevenibles1,2. El paro cardíaco no esperado y el deterioro del estado clínico son las principales causas de muerte en los pacientes hospitalizados3. En Estados Unidos se ha descrito que cerca de 290,000 pacientes


hospitalizados sufren paro cardíaco al año2 Las principales causas de paro cardíaco en esta población son el infarto de miocardio, la arritmia o insuficiencia cardíaca correspondientes al 50%-60%, seguidas de insuficiencia respiratoria causada por embolia pulmonar e hipoxemia que alcanzan hasta el 40%. En menor proporción las complicaciones vasculares neurológicas, la hemorragia y la sepsis2 .
Se estima que el paro cardíaco afecta a cerca del 4% de los pacientes hospitalizados4 Sin embargo, la incidencia de paradas cardíacas intrahospitalarias varía entre las instituciones y los diferentes países, fluctuando entre 1 y 9 a 10 por cada 1000 ingresos. Por ejemplo, el registro nacional danés, reportó una tasa de 1,8 por 1000 ingresos entre 2011 y 2017, mientras que en el Reino Unido se observó un rango de incidencia entre 1 y 1,6 por cada 1000 ingresos entre 2011 y 2021, según los los datos anuales de la Auditoría Nacional de Paros cardíacos (NCAA). Por otro lado, Estados Unidos reportó tasas de 10 paros cardíacos intrahospitalarios por cada 1000 ingresos5. Estas variaciones pueden ser explicadas por el envejecimiento de la población, la decisión de no intentar la reanimación cardiopulmonar, la infraestructura hospitalaria y la carga de enfermedad.
La identificación temprana de los pacientes en riesgo de deterioro ha sido una motivación constante a lo largo de los años1. En la literatura, se han descrito múltiples estrategias, incluyendo los equipos de respuesta rápida y los sistemas de alerta temprana. Ambas estrategias involucran variables fisiológicas y/o preocupaciones del equipo asistencial que generan una toma de decisiones para evitar desenlaces desfavorables, como paros cardiorrespiratorios, traslados a unidades de mayor complejidad o muertes prevenibles. Sin embargo, la evidencia en estos sistemas es controversial, con algunos estudios a favor y otros en contra. El reto no solo radica en la identificación temprana, sino también en la respuesta a la valoración, la articulación del equipo y la comunicación.


Las principales barreras en la aplicación de estas estrategias incluyen la jerarquía del llamado, la crítica de los médicos y el temor del personal de enfermería, la inoportunidad en la respuesta, la falta del seguimiento y las cargas asistenciales6
En la década de los noventa, en el Reino Unido, el Dr. Scubbe publicó uno de los primeros sistemas de alerta temprana denominado MEWS, por sus siglas Modified Early Warning Score6. En 2007, a través de un grupo de estudio del Instituto Nacional de Salud y Excelencia Clínica del Reino Unido (NICE), se elaboró un nuevo sistema de alerta temprana denominado NEWS, por sus siglas en inglés National Early Warning Systems, que finalmente evolucionó al NEWS 2 en 2012, incorporándolo en su red de hospitales, con una última actualización en el 2017. Esta última actualización representa una mejora en el registro de la saturación en pacientes con falla respiratoria hipercápnica, incluye el estado mental como predictor del deterioro clínico y una mejor detección de pacientes con sepsis6,7 .
El NEWS2 es un puntaje que emplea variables fisiológicas y, según el valor, proporciona un puntaje y, con ello, una estrategia de respuesta por niveles. Posee evidencia científica que favorece a una detección anticipada del deterioro hasta 24 horas antes del desenlace, incluso más temprano que la evidencia de la inestabilidad hemodinámica que activan los equipos de respuesta rápida6,7
El NEWS 2 es un sistema que emplea variables fisiológicas como la frecuencia cardíaca, la frecuencia respiratoria, el estado mental, la saturación, la presión arterial sistólica (Tabla 1). Según el resultado de cada variable, otorga un valor de 0 a 3 y clasifica el riesgo del paciente a partir de la suma de los valores obtenidos en cada variable. A partir del resultado, se genera una estrategia de respuesta de acuerdo con la gravedad, estimulando a enfermería a aumentar el monitoreo en salas de hospitalización, realizar una valoración y un criterio para realizar el llamado a un médico de la misma sala o activar los equipos de respuesta rápida para la llegada de personal con mayor experiencia (Tabla 2)6 .


Este sistema ha cobrado mayor relevancia entre el personal asistencial en épocas de pandemia, donde se incorporó como estrategia para anticipar el ingreso de los pacientes con infección por COVID a unidades de cuidado crítico, ya sea mediante un cálculo manual o través de calculadoras en línea8. Además, ha ido ganando más evidencia en escenarios como la sepsis, donde la reciente actualización de la campaña sobreviviendo a la sepsis lo recomienda como estrategia de identificación temprana con puntajes mayores a 5, que son comparables con otros puntajes, como el qSOFA9
Nota: Tomado de7 C, Confusión; V, Respuesta a estímulo verbal; D, Respuesta a estímulo doloroso; N, Sin respuesta a estímulo


Tabla 2. Respuesta clínica según puntaje NEWS 2
Puntaje NEWS Riesgo clínico Respuesta clínica
0 Bajo
1 a 4 Bajo
Un solo parámetro en 3
Bajo a medio
5 a 6 Medio
7 o más Alto
Nota:Tomado de7
Continuar cuidados de enfermería, signos vitales cada 12 horas
Continuar cuidados de enfermería, signos vitales cada 4-6horas
Respuesta urgente* en piso o sala, signos vitales cada hora
Respuesta urgente en piso o sala*, signos vitales cada hora
Respuesta emergente** Monitoreo continuo de signos vitales
*Respuesta por médico o equipo capacitado para atender pacientes con deterioro agudo.
** El equipo de respuesta rápida debe estar capacitado para el manejo crítico, incluyendo manejo de vía aérea.
Escenarios de evaluación del NEWS 2
La habilidad para discriminar los pacientes en riesgo de parada cardíaca, traslado no anticipado a unidades de cuidado intensivo y muerte en las siguientes 24 horas de tomados los signos vitales del sistema NEWS se ha evaluado en comparación con otros puntajes existentes. Las áreas bajo la curva para estos desenlaces fueron superiores a 0,8 para el NEWS 2 y para su desenlace combinado de 0,873 (0,866-0,879)10 . Por otra parte, el puntaje NEWS 2 ha sido evaluado en su capacidad de discriminación de pacientes en riesgo de presentar mortalidad y necesidad de cuidado crítico en diferentes escenarios hospitalarios. En pacientes adultos mayores con alteración del estado mental, el NEWS 2 predijo la mortalidad a 48 horas y 30 días y el requerimiento en unidad de cuidado intensivo con mayor precisión que el qSOFA11. De igual manera, en la predicción de requerimiento de cuidado crítico en pacientes con infección por


COVID-19, pacientes con enfermedad pulmonar obstructiva crónica y pacientes con sepsis8,12,13 .
En el ámbito prehospitalario, la escala fue valorada en un estudio observacional retrospectivo realizado en Canadá entre el 2015 y 2016, encontrando una capacidad de predecir resultados críticos del 66% y predicción de mortalidad del 92%14. En los servicios de urgencias, se ha evaluado su utilidad para establecer la presencia de sepsis. En un análisis retrospectivo publicado en el 2019 en un hospital de tercer nivel en Estados Unidos entre el 2014 y el 2015, encontró que el NEWS era el sistema de puntuación más preciso para la detección de la sepsis, con una mayor sensibilidad y especificidad, que la presencia de síndrome de respuesta inflamatoria sistémica o la escala qSOFA15 De igual manera, se realizó un estudio para predecir la mejor ubicación de los pacientes al egreso de la unidad de cuidados intensivos en las siguientes 24 horas. En este estudio de Estados Unidos en el 2019, se evidenció una discriminación razonable para la ubicación del alta de cualquier paciente de la unidad de cuidado intensivo, principalmente de unidades de cuidados coronarios16 .
Usos de la escala NEWS 2 en Colombia
La Asociación Colombiana de Medicina Critica y Cuidado Intensivo y la Asociación Colombiana de infectología recomendó el uso de la Escala NEWS 2 para la clasificación de la severidad de los pacientes con diagnóstico de infección por Covid-19 a través de consensos de expertos en la Pandemia17,18 .
En Colombia, se han realizado diferentes investigaciones relacionadas con el desempeño del NEWS2. Recientemente, se publicó un estudio observacional prospectivo para evaluar la reproducibilidad y validación del NEWS2 en las salas de emergencia para la predicción de mortalidad hospitalaria, mostrando correlación del puntaje mayor a 10 en pacientes con triaje 1, siendo una posible herramienta de apoyo al sistema de triaje existente19


Además, en un trabajo de grado de la Universidad de Rosario-Universidad CES se evaluó la correlación de la escala NEWS 2 con los días de estancia hospitalaria y mortalidad en una institución de cuarto nivel de atención en Bogotá. En este estudio, Cárdenas et al. no demostraron la correlación del NEWS 2 con los tiempos de estancia hospitalaria y la mortalidad; sin embargo, sí evidenciaron la facilidad de aplicación y utilidad para predecir el deterioro clínico en los servicios de urgencias y hospitalización20
Otro estudio observacional prospectivo multicéntrico en la ciudad de Bogotá evaluó el desempeño de la escala para predecir el traslado a Unidad de Cuidados Intensivos en pacientes con COVID-19, mostrando un bajo a moderado nivel de predicción en el paciente hospitalizado21. Mientras tanto, la escala fue validada en un Hospital de tercer nivel de complejidad en la ciudad de Manizales, encontrando una sensibilidad del 79%, especificidad del 75%, VPN del 87%, VPP del 63%, LR+ 3.1, LR- 0.28 y un AUC: 0.80, con un punto de corte de 4 puntos para predecir mortalidad, parada cardíaca y traslado a unidad de cuidado intensivo en las primeras 24 horas22
Experiencia Hospital Pablo TobónUribe
La seguridad de los pacientes hospitalizados es una prioridad. En las instituciones hospitalarias, detectar rápidamente el deterioro de un paciente representa un desafío constante. Es por eso que nuestro hospital ha dado un paso adelante al adoptar tecnología de vanguardia para abordar este desafío.
Recientemente, llevamos a cabo una renovación tecnológica en nuestras unidades de hospitalización adulto, implementando equipos de toma de signos vitales conectados a un sistema que utiliza la escala NEWS2 para detectar el deterioro del paciente de manera anticipada. Esta tecnología, con inteligencia artificial y respaldada por evidencia científica, nos permite responder proactivamente a los signos de deterioro hasta 24 horas antes de que ocurran eventos críticos.


La implementación de esta estrategia ha sido el resultado de tres años de evaluación, pruebas piloto, capacitación del personal y colaboración interdisciplinaria entre áreas clave del hospital. Desde ingeniería biomédica hasta el equipo clínico, tecnología de información e informática clínica, cada departamento ha desempeñado un papel crucial en este proceso.
La prueba piloto se realizó en 2019 en una unidad asistencial de 25 camas para evaluar la tecnología, con un seguimiento por tres meses, durante el cual no se registraron paradas cardíacas y se activaron 36 equipos de respuesta rápida. En esta prueba, se empleó el sistema MEWS, el cual se adaptó a los requerimientos de la institución.
Después de la adquisición de los equipos, la capacitación del personal y la elección del puntaje NEWS 2 como estrategia de detección temprana, se llevó a cabo la implementación en dos fases. La primera fase se realizó en cuatro unidades asistenciales, con un total de 76 camas. Durante un seguimiento de 109 días, se tomaron 12,385 signos vitales. El 84% de estos signos vitales se clasificaron como riesgo bajo (puntaje de 0-4), el 13% un riesgo intermedio (puntaje 5-6) y un 3% como riesgo alto (puntaje>7). Durante este período de seguimiento no se registraron paradas cardíacas.
La segunda fase de la implementación de la estrategia se completó en 13 unidades asistenciales, con un total de 276 camas. Se llevó a cabo un seguimiento de 180 días durante los cuales se tomaron 85,528 signos vitales. La clasificación del riesgo según el puntaje NEWS 2, proporcionó una proporción similar a la mencionada en la segunda fase. Sin embargo, durante este seguimiento, se registraron paradas cardíacas.
Nuestra alianza con Baxter® nos ha permitido ser pioneros en Colombia al integrar esta tecnología con conectividad y el sistema NEWS2, lo que ha llevado a una notable


reducción en la tasa de eventos críticos. Hemos logrado disminuir en un 46% la tasa de activación de códigos azules y en un 31% la tasa de activación de equipos de respuesta rápida en comparación con el año anterior a la implementación (Figura 1).
Figura 1. Activaciones de equipos de respuesta rápida vs activaciones de código azul

Nota: Elaboración propia. Tasa por cada 1000 egresos hospitalarios
Este logro no solo refleja nuestro compromiso con la seguridad del paciente, sino también nuestra capacidad para integrar tecnología, evidencia científica, comunicación y trabajo en equipo para mejorar nuestra práctica clínica diaria.
Mirando hacia el futuro, aspiramos a lograr la interoperabilidad del sistema con la historia clínica electrónica, lo que optimizará aún más la calidad de los datos y el tiempo de nuestros colaboradores.


En resumen, esta iniciativa representa un paso significativo hacia adelante en la mejora continua de la atención médica y la seguridad del paciente en nuestro hospital estando a la vanguardia de la transformación digital. Esta tecnología, no reemplaza el juicio clínico, pero sí constituye una herramienta adicional para la toma de decisiones que impactan la seguridad en la atención de pacientes.


Referencias
1. Jones DA, DeVita MA, Bellomo R. Rapid-response teams. N Engl J Med. 14 de julio de 2011;365(2):139-46.
2. Andersen LW, Holmberg MJ, Berg KM, Donnino MW, Granfeldt A. In-Hospital Cardiac Arrest: A Review. JAMA [Internet]. 3 de marzo de 2019 [citado 28 de marzo de 2024];321(12):1200. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6482460/
3. Allencherril J, Lee PYK, Khan K, Loya A, Pally A. Etiologies of In-hospital cardiac arrest: A systematic review and meta-analysis. Resuscitation. junio de 2022;175:88-95.
4. Sinha SS, Sukul D, Lazarus JJ, Polavarapu V, Chan PS, Neumar RW, et al. Identifying Important Gaps in Randomized Controlled Trials of Adult Cardiac Arrest Treatments: A Systematic Review of the Published Literature. Circ Cardiovasc Qual Outcomes [Internet]. noviembre de 2016 [citado 28 de marzo de 2024];9(6):749. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5339040/
5. Penketh J, Nolan JP. In-hospital cardiac arrest: the state of the art. Crit Care [Internet]. 6 de diciembre de 2022 [citado 28 de marzo de 2024];26:376. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9724368/
6. Elguea Echavarría PA, Prado Bush OA, Barradas Ambriz J. Implementación de una escala de gravedad para la activación del equipo de respuesta rápida: NEWS 2. Med Crítica [Internet]. 2019 [citado 28 de marzo de 2024];33(2):98-103. Disponible en: https://www.medigraphic.com/cgi-bin/new/resumen.cgi?IDARTICULO=87296
7. National Early Warning Score (NEWS) 2 [Internet]. RCP London. 2017 [citado 28 de marzo de 2024].Disponible en: https://www.rcplondon.ac.uk/projects/outputs/nationalearly-warning-score-news-2
8. Baker KF, Hanrath AT, Schim van der Loeff I, Kay LJ, Back J, Duncan CJ. National Early Warning Score 2 (NEWS2) to identify inpatient COVID-19 deterioration: a retrospective analysis. Clin Med [Internet]. marzo de 2021 [citado 28 de marzo de 2024];21(2):84-9. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8002770/


9. Dellinger RP, Rhodes A, Evans L, Alhazzani W, Beale R, Jaeschke R, et al. Surviving Sepsis Campaign. Crit Care Med [Internet]. abril de 2023 [citado 28 de marzo de 2024];51(4):431. Disponible en: https://journals.lww.com/ccmjournal/citation/2023/04000/surviving_sepsis_campaign.1.as px
10. Smith GB, Prytherch DR, Meredith P, Schmidt PE, Featherstone PI. The ability of the National Early Warning Score (NEWS) to discriminate patients at risk of early cardiac arrest, unanticipated intensive care unit admission, and death. Resuscitation. abril de 2013;84(4):465-70.
11. Tapsiz H, Yolcu S, Yilmaz N, Tunc M, Kaya A, Avci A. Comparison of national early warning score-2 and qSOFA in predicting the prognosis of older adults with altered mental status. Ir J Med Sci. junio de 2023;192(3):1355-9.
12. Moreno-Torres V, Royuela A, Múñez E, Ortega A, Gutierrez Á, Mills P, et al. Better prognostic ability of NEWS2, SOFA and SAPS-II in septic patients. Med Clin (Barc). 9 de septiembre de 2022;159(5):224-9.
13. Echevarria C, Steer J, Bourke SC. Comparison of early warning scores in patients with COPD exacerbation: DECAF and NEWS score. Thorax. octubre de 2019;74(10):941-6.
14. Lane DJ, Wunsch H, Saskin R, Cheskes S, Lin S, Morrison LJ, et al. Assessing Severity of Illness in Patients Transported to Hospital by Paramedics: External Validation of 3 Prognostic Scores. Prehosp Emerg Care. 2020;24(2):273-81.
15. Usman OA, Usman AA, Ward MA. Comparison of SIRS, qSOFA, and NEWS for the early identification of sepsis in the Emergency Department. Am J Emerg Med. agosto de 2019;37(8):1490-7.
16. Zaidi H, Bader-El-Den M, McNicholas J. Using the National Early Warning Score (NEWS/NEWS 2) in different Intensive Care Units (ICUs) to predict the discharge location of patients. BMC Public Health. 5 de septiembre de 2019;19(1):1231.
17. Colombian consensus recommendations for diagnosis, management and treatment of the infection by SARS-COV-2/ COVID-19 in health care facilitiesRecommendations from



expert´s group based and informed on evidence [Internet]. [citado 29 de marzo de 2024].Disponible en: https://repository.urosario.edu.co/items/cac63fc3-3da2-4148-874f79697c1c1c9d
18. Actualización de la Declaración de consenso en medicina critica para la atención multidisciplinaria del paciente con sospecha o confirmación diagnóstica de COVID-19ScienceDirect [Internet]. [citado 29 de marzo de 2024]. Disponible en: https://www.sciencedirect.com/science/article/pii/S0122726220300859?via%3Dihub
19. Vergara P, Forero D, Bastidas A, Garcia JC, Blanco J, Azocar J, et al. Validation of the National Early Warning Score (NEWS)-2 for adults in the emergency department in a tertiary-level clinic in Colombia. Medicine (Baltimore) [Internet]. 8 de octubre de 2021 [citado 29 de marzo de 2024];100(40):e27325. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8500632/
20. Cardenas LMB, Posso MFG, Gutierrez ÁMG, Gonzalez JCS. Correlación de la escala NEWS 2 con los días de estancia hospitalaria y mortalidad en una institución de cuarto nivel de atención en Bogotá.
21. Sprockel Díaz JJ, Araque Parra EC, Chaves Cabezas JJ, Cárdenas Rodríguez H, Montoya Rumpf RP, Angarita González E, et al. Puntuaciones de alerta temprana para la identificación del riesgo de empeoramiento clínico o muerte en pacientes hospitalizados por COVID-19. Acta Médica Colomb [Internet]. 9 de febrero de 2022 [citado 29 de marzo de 2024];47(3). Disponible en: http://www.actamedicacolombiana.com/ojs/index.php/actamed/article/view/2225
22. Gonzalez IFO. Validez de la escala NEWS 2, en una población de pacientes adultos que ingresan al servicio de urgencias, de una institución de III nivel en la ciudad de manizales.






Jhon Edwar García Rueda1 , Angélica María Bermúdez Flórez2 , Karen Yohana García Rueda3 , Isabel
Cristina Ramírez Sánchez4
1. Médico General Universidad de Antioquia, Médico general de Hospitalización, Hospital Pablo Tobón Uribe.
2. Médica General, Universidad de Antioquia
3. Estudiante Pregrado de Medicina, Corporación Universitaria Remington.
4. Médica Internista Infectóloga, Sección de Infectología, Departamento Medicina Interna, Hospital Pablo Tobón Uribe.
La neutropenia febril es una complicación de potencial etiología infecciosa derivada del tratamiento oncológico que representa alta morbilidad. Por lo general la fiebre es la única manifestación de infección, cuyo foco inicial puede ser endógeno a partir de la microbiota del paciente, o derivado de infecciones asociadas al cuidado de la salud. El abordaje inicial del paciente con neutropenia febril está encaminado a identificar los potenciales sitios de infección, tratar de obtener un aislamiento microbiológico que permita guiar la terapia y establecer el riesgo de complicaciones según escalas predeterminadas. El tratamiento antibiótico empírico inicial debe instaurarse dentro de la primera hora del diagnóstico, debe tener actividad bactericida y está basado en betalactámicos con actividad contra Pseudomonas aeruginosa. El desescalamiento de la terapia se realiza según el diagnóstico clínico y el perfil de susceptibilidad del aislamiento microbiológico cuando es posible, procurando reducir la exposición innecesaria a antibióticos de manera prolongada.
Neutropenia, fiebre, bacteriemia, infección


Introducción
En 1966 el Dr. Bodey realizó la primera descripción de 52 pacientes con diagnóstico de leucemia hospitalizados por fiebre y neutropenia, encontrando que el porcentaje de infecciones aumentaba cuando los neutrófilos disminuían a <1000 células/mm³ y cuando se encontraban en <500 células/mm³ el porcentaje de bacteriemias graves era mayor. Además, evidenció que el retraso en la instauración del tratamiento apropiado era un factor pronóstico, dado que la supervivencia en pacientes neutropénicos con bacteriemia por Pseudomonas aeruginosa pasaba del 74% al 46% cuando el inicio se retrasaba más de 24 horas1
En la actualidad, la neutropenia febril (NF) continúa siendo una complicación grave, se presenta con una frecuencia del 5% en los pacientes con terapia oncológica para tumores sólidos mientras que en pacientes con malignidad hematológica ocurre en el 80% de los casos2, principalmente en la quimioterapia de inducción de la remisión en las leucemias agudas, en los que representa una de las emergencias oncológicas más serias que alcanza una mortalidad hasta del 20%, y que puede aumentar hasta el 50% en los casos de sepsis y choque séptico3. Adicionalmente, ocasiona el retraso en la continuidad del manejo oncológico, lo que afecta directamente su potencial curativo4 .
La Sociedad de Enfermedades Infecciosas de América (IDSA, por sus siglas en inglés) define NF con una temperatura ≥38,3 °C, o ≥38 °C sostenida durante 1 hora con un recuento absoluto de neutrófilos (RAN) de <500 células/mm³ o un RAN < 500 células/mm³ esperable dentro de las próximas 48 horas5. La neutropenia profunda se refiere a un RAN <100 células/mm³ y se asocia con un mayor riesgo de infección cuando se prolonga por más de 7 días5,6 .
A continuación, se realiza una revisión de la literatura acerca del paciente con NF, con el fin de proporcionar al clínico una mejor comprensión de esta patología y facilitar el abordaje diagnóstico así como un tratamiento empírico inicial adecuado.


Fisiopatología
La neutropenia puede deberse a un efecto directo de la neoplasia hematológica sobre la producción de las células en la médula ósea, así como una consecuencia del tratamiento con quimioterapia de alta intensidad o radiación. El nadir del recuento de neutrófilos se espera alrededor de 10 a 14 días después de recibir la quimioterapia y la probabilidad de ocurrencia de NF es más alta durante el primer ciclo de inducción de la remisión de la malignidad7
Un efecto secundario del tratamiento antineoplásico es la mucositis, definida como una inflamación y ulceración de la mucosa que incluye la cavidad oral hasta la del recto. El daño de la mucosa en combinación con mecanismos de defensa mínimos del hospedero permite que la microbiota residente en el tracto gastrointestinal sufra translocación a sitios estériles, lo que ocasiona infección local y/o bacteriemia8 Por otra parte, el uso de dispositivos invasivos como catéteres venosos centrales genera riesgo de infecciones por bacterias gram positivas provenientes de la microbiota cutánea ó por transmisión horizontal7 .
En la mayoría de los pacientes la etiología infecciosa no logra determinarse, las infecciones microbiológicamente documentadas ocurren en el 30% de los episodios de NF y los patógenos bacterianos más frecuentes en nuestro medio son los bacilos gramnegativos entre los que se incluyen Klebsiella pneumoniae, Escherichia coli, Pseudomonas aeruginosa, Stenotrophomonas maltophilia, Serratia marcescens y especies de Enterobacter y Acinetobacter, con una incidencia de resistencia a los antibióticos que se ha incrementado a través de los años 7,9 . Staphylococcus coagulasa negativa, Staphylococcus aureus, Streptococcus del grupo viridans y algunas especies de Enterococcus5,7 son los cocos grampositivos más frecuentemente implicados en la NF. Las infecciones fúngicas invasivas deben considerarse en pacientes que cursan con neutropenias prolongadas 5, luego de exposición a antibióticos. Las más frecuentes son infecciones ocasionadas por Candida albicans y Candida no-albicans, así como especies de Aspergillus y Fusarium


Evaluación y diagnóstico
Debemos trazarnos como objetivos identificar los potenciales sitios de infección, microorganismos implicados y riesgo de complicaciones, para ello el abordaje inicial del paciente con neutropenia febril debe incluir un interrogatorio completo con énfasis en el tipo de malignidad, tiempo transcurrido desde la última quimioterapia, medicamentos usados como antibióticos profilácticos ó empíricos, esteroides o factores estimulantes de colonias10,11 .
La fiebre es la principal y en algunas veces la única manifestación de infección5, la ausencia de los síntomas típicos o signos de infección observados en pacientes no neutropénicos no puede usarse para excluir la posibilidad de ésta. Debido a la incapacidad de iniciar una respuesta inflamatoria, estos signos pueden ser muy sutiles o estar ocultos11,12. Por lo tanto, es necesario realizar un examen físico minucioso y detallado con énfasis en sitios que pudieran ocultar infección.
Los sitios anatómicos a tener en cuenta al momento de la evaluación son:
Cavidad oral, Las mucosas pueden verse afectadas por la quimioterapia por lo que siempre debe evaluarse la presencia mucositis, lesiones herpéticas, candidiasis oral y en algunos casos infecciones más graves como la gingivitis necrotizante causada por anaerobios. Se deben evaluar las piezas dentales buscando absceso periodontal o periamigdalino 13,14 .
Respiratorio, Interrogar síntomas de vía aérea superior como rinorrea, congestión nasal y escurrimiento posterior. La celulitis facial puede ser un signo de sinusitis, por lo que se debe solicitar tomografía de senos paranasales y valoración por otorrinolaringología, en caso de demostrar compromiso inflamatorio debe solicitarse nasosinuscopia y toma de muestras de ser posible, incluyendo gram, KOH, cultivo de aerobios y hongos.


Los síntomas de vía aérea inferior como disnea, tos y expectoración, así como la taquipnea e hipoxemia obligan a sospechar compromiso infeccioso tipo neumonía, el envío de radiografía de tórax es una herramienta útil pero un resultado normal no excluye diagnóstico, en caso de persistir con sospecha o deterioro clínico a pesar de antibioticoterapia empírica, se debe ordenar tomografía de tórax por su mayor sensibilidad5,13,14 .
Si el paciente tiene tos productiva debe tomarse muestra de esputo para gram, cultivo aerobios y si existe la posibilidad, realizar panel neumonía por PCR múltiple, en caso de hallazgos radiológicos sugestivos de neumonía. En caso de neumonía complicada y sin posibilidad de muestra microbiológica, debe optarse por solicitar broncoscopia y lavado broncoalveolar protocolizado que incluya gram, ZN, Xpert para Mycobacterium tuberculosis, cultivo aerobios, hongos, micobacterias y PCR para Pneumocystis jirovecii si el paciente tiene riesgo de dicha infección y los hallazgos radiológicos así lo sugieren.
Abdomen, En los pacientes con neutropenia febril los signos de abdomen agudo pueden ser sutiles o estar ausentes, por lo que se aconseja tener alta sospecha diagnóstica y realizar una evaluación minuciosa, si hay dolor con distensión abdominal debe solicitarse una tomografía contrastada de abdomen. Además, interrogar por síntomas como diarrea y considerar la posibilidad de infección por Clostridioides difficile, para ello solicitar toxinas A y B y glutamato deshidrogenasa (GDH), en caso de sospecha de diarrea bacteriana solicitar coprocultivo, hoy en día no está claro el rendimiento de los paneles moleculares en este escenario 13,14
Genitourinario, El citoquímico de orina en los pacientes neutropénicos puede ser difícil de interpretar dado que puede ser normal o sin piuria, el urocultivo no debe ser un examen de rutina, sólo se indica si se presentan síntomas sugestivos de infección urinaria, sonda vesical o en uroanálisis patológicos9,13


Examen genital, Evaluar presencia de úlceras o secreciones patológicas, una revisión minuciosa permite detectar descarga uretral y dolor local para toma de muestras para examen directo, gram y cultivo.
Neurológico, Síntomas como alteración del estado mental, convulsiones, déficit neurológico nuevo o que empeore, cefalea persistente en contexto de fiebre obliga al estudio con tomografía simple y contrastada de cráneo y/o resonancia magnética para definir punción lumbar, esta última no es un procedimiento de rutina, se puede considerar si hay sospecha de infección para estudio de citoquímico, gram, cultivo, tinta china, VDRL, considerar estudios para micobacterias, virus y antígeno de Cryptococcus Se debe resaltar que la inflamación meníngea y la pleocitosis pueden estar ausentes en pacientes neutropénicos con meningitis. Si el paciente presenta síntomas visuales como visión borrosa o escotomas, realizar fondo de ojo considerando una endoftalmitis candidiásica en fungemia.
Piel y anexos, Se debe realizar un examen detallado de la piel y sus anexos en búsqueda de signos sutiles que sugieran infección como eritema, brote, celulitis, úlceras, vesículas, paroniquia y en caso de ser posible tomar muestras para su estudio entre las que se deben incluir según cada caso cultivo, biopsia, test de Tzank5,13 En los anexos la paroniquia alrededor de onicomicosis debe alertar de una infección fúngica invasiva.
Perianal, El examen debe incluir la evaluación de la región perianal, en donde es necesario buscar la presencia de dolor, eritema o áreas induradas, evitando realizar tacto rectal por el riesgo de ocasionar bacteriemia secundaria al traumatizar la mucosa9,13,14


Dispositivos intravasculares, En el paciente oncológico debido a sus comorbilidades y a la facilidad de administración de quimioterapia en infusión continua es común encontrar catéteres de cámara implantable, catéter central colocado por vena periférica (PICC), catéteres de alto flujo. Estos pueden presentar complicaciones infecciosas locales (punto de inserción del catéter, el túnel, bolsillo), así como bacteriemia secundaria. Por lo tanto, es importante evaluar los sitios donde el paciente tiene accesos venosos, signos muy sutiles como un ligero eritema o sensibilidad en la zona de punción pueden ser la presentación de una infección bacteriana9,13,14. Se deben obtener dos sets de hemocultivos (hemocultivo aerobio y anaerobio), si el paciente tiene un catéter endovenoso, al menos una muestra debe tomarse a través del catéter y la otra de sangre periférica, en caso de catéteres multilumen, se debe obtener un cultivo de cada lumen. Es inusual encontrar pus en un paciente neutropénico, pero en caso de estar presente en el sitio de inserción del catéter, debe tomarse muestra para gram y cultivo pues es una muestra de valor microbiológico.
Los estudios iniciales incluyen hemograma, función renal, iones, función hepática y proteína C reactiva. Los hemocultivos deben ser el estudio inicial y potencialmente permitirán dirigir el tratamiento ante un posible aislamiento microbiológico, tomando al menos dos hemocultivos para aerobios y anaerobios de diferentes pliegues antecubitales. las bacteriemias se encuentran en el 10-25% de los episodios de neutropenia febril, en caso de que exista fiebre persistente después de iniciar los antibióticos empíricos, se pueden obtener 2 sets de hemocultivos (mediante catéter o periferia) en cada uno de los dos días siguientes. Las guías de la IDSA recomiendan la toma de dos sets de hemocultivos, cuatro hemocultivos de 10cc para tener la detección del 90-95% de los pacientes, cuando se aumenta la toma de muestras a 60cc puede aumentar la detección a 95-99% de los pacientes, se sugiere no tomar menos de 3 hemocultivos, la etiología infecciosa no se identifica en el 40-50% de los pacientes9,15 La terapia antimicrobiana empírica debe iniciarse inmediatamente después de que se obtienen los hemocultivos, la toma de las ayudas diagnósticas y demás paraclínicos no


debe retrasar el inicio del tratamiento debido a las altas tasas de mortalidad en pacientes con neutropenia febril y sepsis5,6 .
Clínicamente la sepsis podría diagnosticarse con la escala de evaluación de fallo orgánico secuencial -rápida- (qSOFA, por sus siglas en inglés) en el caso de presentar 2 o 3 parámetros positivos, sin embargo, la sensibilidad del qSOFA como diagnóstico de sepsis, mortalidad e ingreso a UCI es inferior comparado con la escala de la Asociación Multinacional de Tratamiento de Soporte en Cáncer (MASCC, por sus siglas en inglés) del que se hablará a continuación7 .
Si se evalúa el SOFA y qSOFA debe tenerse en consideración que en algunos pacientes oncológicos el estado neurológico puede afectarse por la infiltración tumoral. Además, en los pacientes con quimioterapia la función hepática, renal y recuento plaquetario son susceptibles de presentar alteración. Por lo tanto, estas escalas no deben tomarse como único criterio de sepsis en esta población7 . Siempre debe existir la premisa de que cualquier paciente con NF es potencialmente séptico16 .
Estratificación del riesgo
Una vez establecida la sospecha diagnóstica, es necesario estratificar el riesgo de complicaciones médicas del paciente con neutropenia febril, lo que nos brindará una aproximación en la terapéutica al definir dos grupos, los de alto y de bajo riesgo. Las principales escalas para evaluar el riesgo son el Multinational Association for Supportive Care in Cancer (MASCC) y el Clinical Index of Stable Febrile Neutropenia (CISNE)5,6 .
Índice MASCC
Esta es la herramienta más ampliamente usada, permite una estratificación rápida y objetiva, utiliza variables para identificar el riesgo de complicaciones, muerte, escenario de manejo (ambulatorio o intrahospitalario) y el tipo de terapia antibiótica (oral o intravenosa). En esta escala el valor máximo son 26 puntos, un mayor puntaje indica


mejor pronóstico. Los pacientes con una puntuación >21 son considerados de bajo riesgo ya que la tasa de complicaciones serias es de aproximadamente el 6% y la mortalidad del 1%, mientras que los pacientes con una puntuación <21 se consideran de alto riesgo dado que la tasa de complicaciones es del 39% y presentan un 14% de mortalidad5,12
Tabla1. Índice MASCC
Neutropenia febril asintomática o síntomas leves 5
Ausencia de Hipotensión (PAS >90 mmHg) 5
Ausencia de EPOC 4
Ausencia de neoplasia sólida oinfección fúngica invasiva previa 4
Ausencia de deshidratación que requiera fluidoterapia 3
Neutropenia febril consintomatología moderada 3
Paciente ambulatorio ( en el momento del episodio febril) 3
Edad <60 años 2
Nota: Tomado y traducido de las guías de práctica clínica de la Sociedad de Enfermedades Infecciosas de América (IDSA)5 .
Índice CISNE
Puntuación utilizada para predecir complicaciones graves en pacientes ambulatorios con tumores sólidos. No se recomienda en pacientes con falla orgánica, infección grave previa, descompensación clínica, sepsis o shock. Su uso principal es como predictor en pacientes de bajo riesgo. Clasifica a los pacientes según pronóstico: Muy alto riesgo (3 puntos) , intermedio (1-2 puntos) y bajo riesgo (0 puntos)6 .


Otros aspectos por considerar en pacientes de alto riesgo son:
1. Neutropenia febril profunda (<100 cel/mm³) por más de 7 días.
2. Insuficiencia hepática con transaminasas >5 veces.
3. Insuficiencia renal (depuración de creatinina <30ml/min).
4. Algunas condiciones como: inestabilidad hemodinámica, mucositis que interfiera con la deglución, síntomas gastrointestinales severos, alteraciones neurológicas, infección de catéteres, nuevos infiltrados pulmonares o hipoxemia2
Tabla2. Índice CISNE.
Estado funcional > 2 (grupo cooperativo este) 2
Hiperglucemia inducida por estrés 2
Enfermedad cardiovascular crónica 1
Mucositis >= 2 ( escala deinstituto nacional de cáncer) 1
monocitos <200/ml 1
Nota: Tomado y traducido de las guías de práctica clínica de la Sociedad Americana de Oncología Clínica (ASCO) y la Sociedad Americana de Enfermedades Infecciosas (IDSA)6 .
Tratamiento
En los pacientes con NF, las bacterias son responsables del 85-90% de las infecciones17, por lo que el manejo inicial se realiza con antibióticos bactericidas que incluyan actividad contra Pseudomonas aeruginosa, la escogencia del antibiótico depende de la epidemiología local, exposición previa a antibióticos, estabilidad hemodinámica y alergias reconocidas 15


El tratamiento debe iniciarse inmediatamente después de la toma de los hemocultivos; cuando se retrasa el inicio de este, las tasas de mortalidad aumentan hasta el 70%. Una cohorte retrospectiva demostró que cada hora de retraso de terapia antimicrobiana disminuye la sobrevida en 8%. Además, hay evidencia que la mortalidad de los pacientes con sepsis disminuye del 33% al 20% cuando el tiempo de inicio del antibiótico es menor a una hora comparado con un inicio mayor a esta duración18-20 .
Tratamiento en pacientes con bajo riesgo
En pacientes con bajo riesgo podría plantearse la opción de antibioticoterapia oral, estos deben tener la posibilidad de acceder fácilmente a un servicio de urgencias, incluso en menos de una hora si su condición clínica empeora. La primera dosis de antibiótico es preciso administrarla en un ambiente hospitalario y se debe realizar una observación durante al menos 4 a 6 horas, incluso algunos estudios optan por vigilancia las primeras 24 horas de terapia21 .
Una opción recomendada en el manejo ambulatorio podría ser una combinación de ciprofloxacina 750mg cada 12 horas y un betalactámico como amoxicilina/clavulanato
500/125mg cada 8 horas o 875/125mg cada 12 horas. Para pacientes con alergia a la penicilina se puede suministrar clindamicina 600 mg cada 6 horas en lugar de la amoxicilina/clavulanato. Los pacientes que reciben fluoroquinolonas como profilaxis no deben recibir terapia empírica inicial basada en éstas5,6. Pese a que el manejo ambulatorio es una conducta común en otras latitudes, en nuestro medio no es posible por las comorbilidades de los pacientes y la dificultad al rápido acceso en los servicios de salud tanto por el desplazamiento como por la infraestructura disponible.
Tratamiento antibiótico en pacientes de alto riesgo
Los pacientes de alto riesgo, MASCC <21 o CISNE ≥ 3, son candidatos a manejo hospitalario y antibioticoterapia intravenosa. Además, dentro de este grupo se encuentran aquellos pacientes con trasplante alogénico de progenitores


hematopoyéticos y los que desarrollan neutropenia febril durante la hospitalización, que cursan con insuficiencia renal o hepática, neumonía o infecciones complejas al momento de la presentación, mucositis grave (grado 3, 4) y pacientes clínicamente inestables5,13
Se debe iniciar un betalactámico como piperacilina tazobactam, cefepime, meropenem o imipenem en monoterapia (Tabla 1). En los pacientes alérgicos a la penicilina, la terapia alternativa es la combinación de aztreonam más vancomicina ó ciprofloxacina más clindamicina. Se prefiere el primer esquema por el incremento del riesgo de Clostridioides difficile que implica el segundo 5
Terapia empírica dirigida a Cocos gram positivos
La adición de vancomicina como agente contra cocos gram positivos no se recomienda de rutina como parte del régimen inicial, dado que no se ha asociado con beneficios clínicos significativos, cabe resaltar que la combinación de vancomicina más piperacilina/tazobactam puede asociarse a lesión renal aguda en determinados pacientes, por lo que se recomienda monitorizar estrechamente la función renal 5,13
El uso de la vancomicina debe considerarse en pacientes con sospecha de infección relacionada a catéter, bacteriemia por cocos gram positivos, infección de piel y tejidos blandos, neumonía o inestabilidad hemodinámica; en pacientes que reciben profilaxis con fluoroquinolonas y presentan mucositis grave se aconseja su uso por el riesgo de infecciones por estreptococos del grupo viridans tolerantes a penicilina 9,13. La terapia antimicrobiana, se modificará con base en los datos microbiológicos, en caso tal el uso empírico de vancomicina se podría finalizar después de 2 o 3 días si no hay evidencia de infecciones que requieran su continuidad9 .


Tabla 1. Régimen de tratamiento empírico en neutropenia febril.
Tratamiento antibiótico empírico
Piperacilina/Tazobactam
Meropenem
4.5g IV cada 6 horas
1g IV cada 8 horas
Imipenem 500mg IV cada 6 horas
Cefepime
2g IV cada 8 horas
Nota: Elaboración propia basado en5,6 . IV: intravenoso, g: gramos, mg: miligramos
Tiempo
En relación con la duración del tratamiento antimicrobiano, se define por el sitio de la infección, organismo causante, condición clínica del paciente y recuperación medular. Este es un tema de debate y hay recomendaciones variables en las diversas guías de neutropenia febril (Tabla 2). Las guías de la IDSA recomiendan que, en casos de fiebre de origen desconocido, se continúen con los antibióticos hasta que el RAN sea mayor de 500 células/mm³ o si el paciente continúa neutropénico y hay evidencia que el foco infeccioso esté controlado, podrían recibir profilaxis secundaria con fluoroquinolonas hasta que haya recuperación del recuento de neutrófilos o inclusive suspensión del antibiótico en ausencia de recuperación medular, esto debe ser individualizado 5,6 .
Los pacientes con diagnóstico de infección por sitio o patógeno deben recibir el tratamiento hasta que el RAN sea mayor de 500 células/mm³, pero se aconseja cumplir el número de días apropiado para cada infección documentada, se recomiendan entre 7 a 14 días en la mayoría de las infecciones no complicadas como piel o bacteriemias, 10 a 14 días en infecciones pulmonares y sinusitis bacterianas 5. Hoy en día, se plantea el uso de terapia acortada, en los casos en los que no se logró aislamiento microbiológico ni documentación de foco clínico, luego de 3 días de lograr defervescencia de la fiebre y estabilidad clínica del paciente, este abordaje debe ser individualizado con base en el riesgo del paciente y siempre aplicando las mismas conductas en caso de recurrencia de la fiebre.


Por último, es importante resaltar que la media de tiempo para la defervescencia de la fiebre después del inicio de la antibioticoterapia empírica en pacientes con malignidades hematológicas es de 3 a 5 días, mientras que en pacientes con tumores sólidos es de 2 días, por lo tanto, una persistencia de fiebre menor a este tiempo no siempre indica fallo en la terapia22 Por otra parte, la terapia antifúngica se debe considerar en pacientes de alto riesgo con fiebre persistente después de 4 a 7 días de antibiótico de amplio espectro sin encontrar un foco infeccioso evidente, pero se debe profundizar en el estudio para intentar el diagnóstico microbiológico 5,6,13 .
Infecciones porbacterias resistentes
Durante las últimas décadas viene ocurriendo un cambio en el espectro de infecciones en pacientes con NF, con un aumento en los microorganismos multirresistentes. Los factores de riesgo para las infecciones por estos son infección previa, colonización y tratamiento en un hospital con altas tasas de resistencia5 .
Las infecciones que causan de manera más frecuente son bacteriemias en el 24% e infección del tracto urinario en el 36% de los pacientes, los más frecuentemente implicados son Escherichia coli y Klebsiella pneumoniae productora de betalactamasa de espectro extendido (BLEE) y carbapenemasas25. Se ha demostrado que su presencia ocasiona terapia empírica inapropiada con tasas de mortalidad en los diferentes estudios que varían entre 45-67% frente a 14% en pacientes con bacteriemias causadas por bacterias no resistentes5,6,25 .
Infecciones fúngicas
Se debe tener a consideración las infecciones fúngicas en los pacientes con neutropenia febril de alto riesgo que presenten fiebre persistente o recurrente después de cuatro días de uso de antibioticoterapia empírica de amplio espectro. Los factores de riesgo descritos para presentar infección fúngica es la neutropenia mayor a 10 días, quimioterapia de inducción de la remisión en leucemias agudas, el uso de esteroides a


dosis altas y los pacientes sometidos a trasplante alogénico de progenitores hematopoyéticos 5,6 .
Las especies de Candida y Aspergillus representan los principales responsables de las infecciones fúngicas invasivas en los pacientes con neutropenia. Con la introducción de los azoles para la profilaxis se han aumentado las especies de Candida no-albicans resistente a azoles como C. krusei, C. tropicalis, C. glabrata y C. lusitanieae, estas colonizan el tracto gastrointestinal y sufren translocación cuando hay compromiso de la mucosa intestinal, mientras que Aspergillus spp. se adquiere por la inhalación de esporas que pueden depositarse tanto en el tracto respiratorio superior (senos paranasales) como en el inferior (bronquios, alvéolos)26 .
La aproximación diagnóstica de la infección fúngica invasiva (IFI) requiere de hemocultivos para hongos, e imágenes según la sospecha diagnóstica. En caso de sospecha de sinusitis fúngica invasiva, debe solicitarse tomografía de senos paranasales así como valoración por otorrinolaringología para inspección directa mediante nasosinuscopia con toma de muestras9,13. En caso de sospecha de infección invasiva, independiente de los síntomas debe solicitarse una tomografía de tórax, la presencia de nódulos pulmonares con o sin signo del halo (vidrio esmerilado alrededor del nódulo), lesiones cavitadas, o consolidaciones pueden sugerir compromiso micótico.
El estudio de la infección fúngica debe ser invasivo y requiere de nasosinuscopia con toma de muestras en caso de sinusitis, así como broncoscopia con lavado broncoalveolar (LBA) protocolizado en caso de infección pulmonar. Existen biomarcadores serológicos que sirven como herramientas para soportar un diagnóstico de IFI del tipo aspergilosis, en nuestro medio está disponible el galactomanan (producto de la pared del hongo que se libera a la sangre durante la infección), es detectable en suero y en el lavado broncoalveolar. Tiene sensibilidad del 58-65% y especificidad del 65-95%, se considera positivo por encima de 0.7 en suero y mayor a 1 en el LBA 9,13 .


El 1,3 Beta-D-Glucano es un biomarcador no específico, componente de la pared celular de hongos que incluyen especies de Candida, Aspergillus, Pneumocystis jirovecii y especies de Fusarium, se reporta una sensibilidad del 63-90% y una especificidad >95%5,9. Es de utilidad, sin embargo, no está presente en nuestro medio.
Con respecto al tratamiento, se debe tener en cuenta el uso de profilaxis antifúngica, en caso de que el paciente no la reciba y no se tenga un foco infeccioso aparente como compromiso nodular en la TAC de tórax, se recomienda iniciar con una equinocandina como Caspofungina sospechando la presencia de Candida spp. En caso de que exista compromiso pulmonar en la TAC de tórax como se describió previamente, se debe tener sospecha de una infección por mohos, por lo que se requiere fibrobroncoscopia con lavado broncoalveolar y está indicado el uso de azoles como Voriconazol, Posaconazol o Isavuconazol, si existe la sospecha de mucormicosis debe evitarse el voriconazol dado que no tiene actividad contra de este tipo de mohos 5,6,9,13,26
Conclusión
La NF es una complicación común con alta mortalidad en los pacientes con malignidad hematológica sometidos a quimioterapia. Es importante la implementación de escalas de estratificación como MASCC y CISNE, para evaluar y clasificar a los pacientes como bajo o alto riesgo y de acuerdo con estas proceder con el tratamiento indicado. Un interrogatorio completo, evaluación clínica exhaustiva con énfasis en sitios que pudieran ocultar infección, exámenes de laboratorio, toma de cultivos e imágenes son el abordaje apropiado para el diagnóstico. La mortalidad disminuye cuando se inicia la terapia antibiótica de manera temprana antes de la primera hora. En la actualidad, la resistencia bacteriana representa una dificultad en la escogencia de la terapia empírica, pues la terapia inapropiada afecta la mortalidad de manera significativa cuando hay infecciones por microorganismos multirresistentes, por ello es necesario establecer el riesgo de los pacientes en cuanto a exposición reciente a antibióticos o colonizaciones conocidas para ofrecer la mejor terapia inicial y luego ajustarla según los resultados. Las infecciones fúngicas representan una causa de neutropenia febril recidivante y


deben tenerse en cuenta en las neutropenias prolongadas, su estudio por lo general es invasivo y requiere de manejo multidisciplinario.
Tabla 2. Recomendaciones del tiempo de duración de la terapia antibiótica.
NCCN (2022) ESMO (2016) IDSA (2011) ECIL-4 (2011)
1. Documentación de infección C/M: duración basada en tipo de infección (piel y tejidos blandos 5-14 días, torrente sanguíneo 714 días)
2. Fiebre sin foco: duración hasta RAN >500 células/mm³ ó RAN <500 células/mm³ considere: -Suspender terapia -Desescalar a profilaxis -Continuar el tratamiento hasta que resuelva la neutropenia.
1. Document ación de infección C/M y FOD con RAN >500 células/mm³ y afebril por más de 48 horas considerar suspender terapia.
2. RAN <500 células/mm³ y afebril por 5-7 díasconsiderar suspender terapia.
1. Documentación de infección C/M y FOD, con RAN >500 células/mm³ yafebril por más de 48 horas considerar suspender terapia.
2. Si se completó el ciclo de tratamiento y está asintomático y RAN <500 células/mm³ se puede reanudar profilaxis con fluoroquinolonas orales hasta recuperación de RAN.
1.Documentación de infección C/M: Considerar suspender terapia si se cumplió al menos 7 días después de la erradicación de infección y el paciente persiste afebril más de 96 horas.
2 FOD: considerar suspender en pacientes estables por más de 72-96 horas y afebril >48 horas. Independiente de conteo de RAN.
Nota: Elaboración propia basado en5,6,13,23,24 FOD: fiebre de origen desconocido, C/M: clínica o microbiológica.



1. Enfoque general del paciente con neutropenia febril. Elaboración propia.



1. Rolston, K. V. I., & Bodey, G. P. (2006). Comment on: Empirical antibiotic monotherapy for febrile neutropenia: Systematic review and meta-analysis of randomized controlled trials [1]. In Journal of Antimicrobial Chemotherapy (Vol. 58, Issue 2). https://doi.org/10.1093/jac/dkl19
2. Rivas Llamas, J. R. (2016). Neutropenia febril: el punto de vista del hematólogo. In Gaceta Mexicana de Oncologia (Vol. 15, Issue 4). https://doi.org/10.1016/j.gamo.2016.07.005
3. Gould Rothberg, B. E., Quest, T. E., Yeung, S. C. J., Pelosof, L. C., Gerber, D E., Seltzer, J. A., ... & Kyriacou, D. N. (2022). Oncologic emergencies and urgencies: A comprehensive review. CA: A Cancer Journal for Clinicians, 72(6), 570-593.doi: 10.3322/caac.21727. Epub 2022 Jun 2. PMID: 35653456.
4. Lucas, A. J., Olin, J. L., & Coleman, M. D. (2018). Management and preventive measures for febrile neutropenia. P and T, 43(4).
5. Freifeld, A. G., Bow, E. J., Sepkowitz, K. A., Boeckh, M. J., Ito, J. I., Mullen, C. A., Raad, I. I., Rolston, K. v., Young, J. A. H., & Wingard, J. R. (2011). Clinical practice guideline for the use of antimicrobial agents in neutropenic patients with cancer: 2010 Update by the Infectious Diseases Society of America. In Clinical Infectious Diseases (Vol. 52, Issue 4). https://doi.org/10.1093/cid/cir073
6. Taplitz, R. A., Kennedy, E. B., Bow, E. J., Crews, J., Gleason, C., Hawley, D. K., Langston, A. A., Nastoupil, L. J., Rajotte, M., Rolston, K., Strasfeld, L., & Flowers, C. R. (2018). Outpatient management of fever and neutropenia in adults treated for malignancy: American Society of Clinical Oncology and Infectious Diseases Society of America Clinical practice guideline update. Journal of Clinical Oncology, 36(14). https://doi.org/10.1200/JCO.2017.77.6211


7. Martin Schmidt-Hieber, Daniel Teschner, Georg Maschmeyer & Enrico Schalk (2019): Management of febrile neutropenia in special consideration of the role of antimicrobial deescalation, Expert Review of Anti-infective Therapy, DOI: 10.1080/14787210.2019.1573670.
8. Zecha JAEM, Raber-Durlacher JE, Laheij AMGA, Westermann AM, de Lange J, Smeele LE. The Potential Contribution of Dental Foci and Oral Mucositis to Febrile Neutropenia in Patients Treated With Myelosuppressive Chemotherapy for Solid Tumors and Lymphoma. Front Oral Health. 2022 Jun 30;3:940044. doi: 10.3389/froh.2022.940044. PMID: 35846111
9. Stohs EJ, Abbas A, Freifeld A. Approach to febrile neutropenia in patients undergoing treatments for hematologic malignancies. Transpl Infect Dis. 2024 Feb 13:e14236. doi: 10.1111/tid.14236. PMID: 38349035.
10.Punnapuzha S, Edemobi PK, Elmoheen A. Febrile Neutropenia. [Updated 2023 Mar 30]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2024 Jan-. Available from: https://www.ncbi.nlm.nih.gov/books/NBK541102/
11.Barré S, McElwee J, Calhoun C, Weant KA, Maldonado A, Bell CM. Review of Hematological and Oncological Emergencies. Adv Emerg Nurs J. 2022 Apr-Jun 01;44(2):84-102. doi: 10.1097/TME.0000000000000399. PMID: 35476684.
12.Carmona Bayonas, A., Herrero Martínez, J. A., Martínez García, J., Marín Vera, M., Heras González, M., & Navarrete Montoya, A. (2006). Neutropenia febril: análisis de los factores pronósticos y el tratamiento adaptado al riesgo. Revisión crítica. Oncología (Barcelona), 29(5), 34-46.
13.Klastersky J, de Naurois J, Rolston K, Rapoport B, Maschmeyer G, Aapro M, Herrstedt J; ESMO Guidelines Committee. Management of febrile neutropaenia: ESMO Clinical Practice Guidelines. Ann Oncol. 2016 Sep;27(suppl 5):v111-v118. doi: 10.1093/annonc/mdw325.


14.Pizzo PA. Management of Patients With Fever and Neutropenia Through the Arc of Time: A Narrative Review. Ann Intern Med. 2019 Mar 19;170(6):389-397. doi: 10.7326/M18-3192. Epub 2019 Mar 12. PMID: 30856657
15.Dickter J, Logan C, Taplitz R. Neutropenia and antibiotics: when, what, how and why? Curr Opin Infect Dis. 2023 Aug 1;36(4):218-227. doi: 10.1097/QCO.0000000000000932. Epub 2023 Jun 12.
16.Barroso Sánchez, G., Quintero Sierra, Y., & Rivas Cruz, Y. C. (2020). Diagnóstico y tratamiento de la neutropenia febril en el paciente oncohematológico. Revista Cubana de Hematología, Inmunología y Hemoterapia, 36(4).
17.Manterola, A., Romero, P., Martínez, E., Villafranca, E., Arias, F., Domínguez, M. A., & Martínez, M. (2004). Neutropenia y fiebre en el paciente con cáncer. In Anales del Sistema Sanitario de Navarra (Vol. 27, pp. 33-43). Gobierno de Navarra. Departamento de Salud
18.Schimpff S, Satterlee W, Young VM, Serpick A. Empiric therapy with carbenicillin and gentamicin for febrile patients with cancer and granulocytopenia. N Engl J Med. 1971 May 13;284(19):1061-5. doi: 10.1056/NEJM197105132841904. PMID: 4994878.
19.Kumar A, Roberts D, Wood KE, Light B, Parrillo JE, Sharma S, Suppes R, Feinstein D, Zanotti S, Taiberg L, Gurka D, Kumar A, Cheang M. Duration of hypotension before initiation of effective antimicrobial therapy is the critical determinant of survival in human septic shock. Crit Care Med. 2006 Jun;34(6):1589-96. doi: 10.1097/01.CCM.0000217961.75225.E9. PMID: 16625125.
20.Gaieski DF, Mikkelsen ME, Band RA, Pines JM, Massone R, Furia FF, Shofer FS, Goyal M. Impact of time to antibiotics on survival in patients with severe sepsis or septic shock in whom early goal-directed therapy was initiated in the emergency department. Crit Care Med. 2010 Apr;38(4):1045-53. doi: 10.1097/CCM.0b013e3181cc4824. PMID: 20048677.
21. Freifeld AG, Sepkowitz KA. No place like home? Outpatient management of patients with febrile neutropenia and low risk. J Clin Oncol. 2011 Oct 20;29(30):3952-4. doi:15210.1200/JCO.2011.37.5758. Epub 2011 Sep 19.PMID:21931028.


22. Nucci M. How I Treat Febrile Neutropenia. Mediterr J Hematol Infect Dis. 2021 Mar 1;13(1):e2021025. doi: 10.4084/MJHID.2021.025.
23. Averbuch D, Orasch C, Cordonnier C, Livermore DM, Mikulska M, Viscoli C, Gyssens IC, Kern WV, Klyasova G, Marchetti O, Engelhard D, Akova M; ECIL4, a joint venture of EBMT, EORTC, ICHS, ESGICH/ESCMID and ELN. European guidelines for empirical antibacterial therapy for febrile neutropenic patients in the era of growing resistance: summary of the 2011 4th European Conference on Infections in Leukemia. Haematologica. 2013 Dec;98(12):1826-35. doi: 10.3324/haematol.2013.091025. Erratum in: Haematologica. 2014 Feb;99(2):400.
24. Baden LR, Swaminathan S, Angarone M, Blouin G, Camins BC, Casper C, Cooper B, Dubberke ER, Engemann AM, Freifeld AG, Greene JN, Ito JI, Kaul DR, Lustberg ME, Montoya JG, Rolston K, Satyanarayana G, Segal B, Seo SK, Shoham S, Taplitz R, Topal J, Wilson JW, Hoffmann KG, Smith C. Prevention and Treatment of Cancer-Related Infections, Version 2.2016, NCCN Clinical Practice Guidelines in Oncology. J Natl Compr Canc Netw. 2016 Jul;14(7):882-913. doi: 10.6004/jnccn.2016.0093. PMID: 27407129.
25. Kang CI, Chung DR, Ko KS, Peck KR, Song JH; Korean Network for Study of Infectious Diseases. Risk factors for infection and treatment outcome of extendedspectrum β-lactamase-producing Escherichia coli and Klebsiella pneumoniae bacteremia in patients with hematologic malignancy. Ann Hematol. 2012 Jan;91(1):115-21. doi: 10.1007/s00277-011-1247-7. Epub 2011 May 10.
PMID: 21556875.
26. Wingard JR, Leather HL. Empiric antifungal therapy for the neutropenic patient. Oncology (Williston Park). 2001 Mar;15(3):351-63; discussion 363-4, 367-9.
PMID: 11301832.




PARA EL MÉDICO GENERAL

Mateo Correa Restrepo1 , David Díaz Lopera2 , Simón González González3
1.Médico general Universidad de Antioquia, Médico general de sedación y consulta externa Hospital Pablo Tobón Uribe.
2.Médico general Fundación Universitaria San Martín, Médico general Clínica Central Fundadores Medellín.
3.Médico Anestesiólogo Hospital PabloTobón Uribe.
Resumen
Para el abordaje de la sedación por médico no anestesiólogo presentaremos la información con la siguiente estructura:
● Antes de la Sedación
o Elección del paciente: Criterios para seleccionar al paciente adecuado para la sedación.
o Preparación: Pasos necesarios para preparar al paciente y los insumos antes de proceder con la sedación.
● Durante la Sedación
o Medicamentos: Detalles sobre los fármacos utilizados durante el proceso de sedación.
o Manejo de Complicaciones: Estrategias para manejar posibles complicaciones que puedan surgir.
● Después de la Sedación
o Recuperación: cuidados post-sedación para asegurar una recuperación segura y efectiva del paciente.
Palabras clave
Sedación, anestesia, analgesia, vía aérea


Introducción
La sedación constituye para el médico una de las habilidades y herramientas básicas de la atención médica, tanto para la realización de procedimientos urgentes como programados, donde el dolor, la inquietud y/o la ansiedad del paciente, puede conllevar a eventos adversos, sufrimiento e insatisfacción con la atención médica. Por este motivo en este capítulo abordaremos los principales aspectos y recomendaciones para tener en cuenta al momento de realizar una sedación en mayores de 14 años.
Historia de la sedación
La sedación y anestesia son producto de la búsqueda del ser humano al alivio del dolor. Los primeros registros vienen de 4,000 años a.C., cuando en Mesopotamia, los sumerios utilizaron el Opio. Algunas de las primeras sustancias usadas fueron el aceite de vitriolo o ácido sulfúrico, luego conocido como Éter y el óxido nitroso o gas hilarante1
La historia de la anestesia está llena de anécdotas; incluyendo las historias de Horace Wells, el Dr. Cradwford W. Long y finalmente William Thomas Green Morton, quien el 16 de octubre de 1846, utilizó éter para anestesiar a Gilbert Abbot, al que el Dr. John C. Warren le extirpó un tumor del cuello, de ahí que esta fecha sea conocida como el día mundial del anestesiólogo. Algunas de estas anécdotas están reflejadas en el libro “El siglo de los cirujanos” de Jürgen Thorwald, cuya lectura recomendamos2
Criterios para sedación por anestesiólogo
Uno de los elementos fundamentales a la hora de realizar una sedación es la elección del paciente; en Colombia, la resolución de habilitación 3100 del 2019, menciona algunos de los escenarios en los que la sedacón debe ser realizada por anestesiólogo:


● Pacientes poco colaboradores
● Edades extremas
● Enfermedades graves (ASA III o mayor)
● Alteración de la consciencia
● Obesidad mórbida
● Apnea del sueño
● Embarazadas
● Abuso del alcohol o drogas
● Antecedentes de sedación fallida o de efectos adversos a algún medicamento utilizado en la sedación.
Algunos de estos escenarios se definen de manera subjetiva y por lo tanto es esencial que el médico realice una valoración integral de las características del paciente para determinar el riesgo de éste a tener complicaciones y de esta forma definir si la sedación debe ser realizada por un anestesiólogo. Sugerimos realizar la siguiente secuencia de evaluación:
Clasificación del paciente según el estado de salud
La clasificación de la American Society of Anesthesiologists (ASA) separa a los pacientes según su estado de salud y la presencia de enfermedades; paciente sano (ASA I), enfermedad sistémica leve (ASA II), enfermedad sistémica grave (ASA III), enfermedad sistémica grave que amenaza la vida constantemente (ASA IV), paciente moribundo (ASA V) y muerte encefálica (ASA VI), por lo tanto, sólo deben recibir sedación por médico general los pacientes ASA I y II, sin embargo, esta clasificación carece de criterios uniformes, lo que lleva a variabilidad y falta de precisión3 , por lo tanto es recomendable una valoración más integral de la condición clínica del paciente para definir la fragilidad del mismo y su capacidad funcional (METs).


Predictores de vía aérea y ventilación difícil
Para evaluar la vía aérea contamos con el test de Mallampati, la apertura oral, distancia tiromentoniana, esternomentoniana, movilidad atlanto-occipital y circunferencia del cuello, entre otras. Con frecuencia, el hallazgo de un solo signo positivo no clasifica a un paciente como vía aérea difícil, por lo que el uso combinado de los mismos como el de la escala LEMON puede resultar de gran ayuda. Adicionalmente para la evaluación de ventilación difícil podemos utilizar el acrónimo OBESE (tabla 1).
En caso de que el paciente no requiera sedación por anestesiólogo, se podría realizar una sedación por médico entrenado en la misma y podríamos continuar la preparación
así:
Lista de verificación pre-sedación
Es indispensable contar con una adecuada planificación para evitar complicaciones, o en caso de que estas ocurran, poder manejarlas de la mejor manera posible.5
Entre los elementos a tener en cuenta están:
● Identificación del paciente, historia clínica y valoración de la vía aérea
● Verificación del procedimiento arealizar
● Consentimiento informado: deben quedar claros los riesgos, beneficios del procedimiento y las posibles alternativas
● Ayuno
● Fuente de oxígeno
● Dispositivos de vía aérea: cánula nasal, cánula nasofaríngea u orofaríngea, cánula de Guedel, sistema Venturi, máscara de no reinhalación, dispositivo bolsaválvula-máscara (BVM), máscara laríngea y tubo orotraqueal
● Monitoreo hemodinámico: oximetría de pulso, cardioscopio y presión arterial no invasiva
● Carro de paros


Tabla 1. Acrónimos para valoración de vía aérea
Evaluación de vía aérea difícil
Look Examinar: Lesión o trauma
Evaluate Evaluar Regla 3 - 3 - 2:
Distancia interincisivos (< 3 traveses de dedo)
Distancia mentohioidea (< 3 traveses de dedo)
Distancia cartílago tiroides - suelo de la boca (< 2 traveses de dedo)
Mouth Apertura de la boca: Mallampati mayor o igual a 3
Obstruction Obstrucción de la vía aérea: Epiglotitis o abscesos amigdalinos
Neck Movilidad del cuello: Collarín o imposibilidad de extensión del cuello
Evaluación de ventilación difícil
O Obesidad
B Barba
E Edad > 55 años
S SAHO SAHOS
E Edéntulo
Nota: elaboración propia basado en la valoración preoperatoria de la vía aérea difícil4


● Medicamentos: tanto los usados para la sedación, sus antagonistas y los que sean necesarios para el procedimiento
● Personal entrenado: por lo menos dos profesionales, uno de ellos encargado de la sedación, el cual deberá contar con entrenamiento en sedación y en manejo de vía aérea
● Insumos del procedimiento que motiva la sedación: vendajes, yesos, endoscopio, etc
● Área de recuperación (Ámbitos ambulatorios)
Ayuno y riesgo de náuseas post sedación
El objetivo del ayuno es disminuir el riesgo de broncoaspiración. Las recomendaciones actuales de la ASA están resumidas en la tabla 2
Tabla 2.Tiempos deayuno
Tiempos de ayuno
Goma de mascar 0 horas
Líquidos claros* 2 horas
Líquidos con fibra o alimentos suaves** 6 horas
Comida 8 horas
*Líquidos claros: agua, té, café, líquidos sin fibra
**Alimentos suaves: alimentos bajos en grasas
Nota: elaboración propia basado en las recomendaciones de la sociedad americana de anestesiología6,7 .
También se deben tener en cuenta los factores de riesgo asociados a broncoaspiración:
● ASA IV
● IMC ≥ 40
● Vía aérea anormal


● Hiperémesis
● Enfermedad esofágica
● Obstrucción intestinal
● Necesidad de ventilación o vía aérea avanzada
Es importante aclarar que todos los pacientes con riesgo aumentado de broncoaspiración requieren sedación por anestesiología.
Las náuseas y el vómito son dos de las complicaciones más frecuentes en el estado postoperatorio, lo que lleva a la insatisfacción del paciente, recuperación prolongada, requerimiento de ingreso a hospitalización y aumento de los costos en los servicios de salud. En un consenso de expertos realizado en 2020, recomiendan el uso de la escala de Apfel simplificada (tabla 3), en la cual se engloban los principales factores de riesgo para presentar náuseas y vómito postoperatorio8, lo cual es una herramienta útil en el contexto de la sedación, teniendo en cuenta los factores propios del paciente.
Tabla 3. Escala simplificada de Apfel
Escala simplificada de Apfel
Factores del paciente Puntos Conducta
● Género femenino
● No tabaquismo
● Cinetosis o vértigo
● Antecedente de NVPO*
● < 50 años
0-1: bajo riesgo Vigilancia, no medidas farmacológicas
2-4: riesgo moderad o 1 a 2 intervenciones farmacológicas
(ondansetron,haloperidol,dexametasona)
4 o más: alto riesgo > de 2 intervenciones farmacológicas
(ondansetron + haloperidol + dexametasona)


*NVPO: náuseas y vómitos postoperatorios
Importante: Al usar dexametasona se debe diluir y pasar en infusión lenta por el riesgo de prurito perianal intenso
Nota: elaboración propia basado en el cuarto consenso para el tratamiento de náuseas y vómito postoperatorios8 .
Escala de sedación
Las escalas de valoración de la sedación miden de forma subjetiva la respuesta de los pacientes a la estimulación. Hay múltiples escalas para valorar el grado de sedación, entre ellas podemos encontrar la escala SAAS, Ramsay, RASS, MAAS.9 En este artículo recomendamos la escala propuesta por la ASA:
● Grado I: ansiólisis. Se caracteriza por una respuesta normal al estímulo verbal, sin afectar al paciente desde el punto de vista ventilatorio y hemodinámico
● Grado II: sedación consciente. En esta el paciente despierta ante un estímulo verbal o táctil y tampoco se afecta la ventilación ni la función cardiovascular
● Grado III: sedación profunda. Acá el paciente requiere un estímulo doloroso para responder y puede afectar la ventilación espontánea
● Grado IV: anestesia general. El paciente no responde a estímulos, no ventila de forma adecuada y puede verse afectada la función cardiovascular
Objetivos del procedimiento a realizar
Todos los procedimientos cuentan con unas características que van a definir el enfoque de la sedación, proponemos agrupar los procedimientos en tres grupos (tabla 4).
Objetivo ideal de la sedación
Se deben tener en cuenta los objetivos de la sedación e individualizar según el paciente y el procedimiento a realizar. De forma general los objetivos serán inconsciencia, amnesia, analgesia, inhibición de los reflejos autonómicos y relajación del músculo esquelético.
Por lo tanto, un medicamento perfecto para la sedación será aquel que logre de forma


rápida, una pérdida suave de la conciencia y analgesia, pero que al mismo tiempo sea rápidamente reversible y que adicionalmente posea un amplio margen de seguridad (no afecte ventilatoria ni hemodinámicamente al paciente y no tenga interacciones con medicamentos o comorbilidades).
Ya que no existe un medicamento perfecto, se realizan técnicas de anestesia balanceada para obtener ventajas de las propiedades favorables de cada agente mientras se minimizan sus efectos adversos10 .
Tabla 4. Tipos de procedimientos ensedación
Tipo de procedimiento
Noinvasivo +nodoloroso
Ejemplos
Estudiosdeimágenes (TAC/RMN)
Mínimamentedoloroso+alta ansiedad
Dolorosos +alta ansiedad
Estudiosendoscópicos
Punciónlumbar
Procedimientos dermatológicos
Paso desondas
Cardioversióneléctrica
Tubo atórax
Reduccionesosteoarticulares
Procedimientosurológicos
Procedimientos ginecológicos
Cateterismos
Objetivo
Ansiólisis
Catalepsia/inmovilidad
Ansiólisiso sedación
Catalepsia/inmovilidad
Analgesia leve
Sedación
Catalepsia/inmovilidad
Analgesia
Nota: elaboración propia basado en las características de los procedimientos frecuentemente realizados bajo sedación.


En la tabla 5 se resumen algunas de las consideraciones a tener en cuenta sobre algunos medicamentos ampliamente usados en la sedación.



El propofol pertenece al grupo de los anestésicos generales y cumple algunas de las características del medicamento perfecto para la sedación (inicio y finalización rápida del efecto, con pérdida de la conciencia y adicionalmente analgesia), sin embargo, puede afectar gravemente el patrón ventilatorio y hemodinámico del paciente por lo que debe ser usado únicamente por personal con el entrenamiento adecuado y específico para el propofol.
Antídotos específicos
El uso de estos medicamentos en sedación es excepcional debido a que el efecto de los medicamentos usados normalmente es corto.
Flumazenil
● Antagonista competitivo no específico del receptor de benzodiacepinas
● Indicado en depresión respiratoria
● Ampolla de 0.5 miligramos en 5 mililitros
● Dosis de administración: 0,01 mg/kg en intervalos de 1 minuto, es decir entre 0,2 a 1 mg dosis en adultos, máximo 3 mg/h
Naloxona
● Antagonista competitivo opioide
● Ampolla de 0.4 miligramos en 1 mililitro
● Diluir la ampolla en solución salina hasta 10 cc para obtener concentración de 40 mcg/ml
● Dosis de administración: 200 mcg en intervalos de 1 - 3 minutos, máximo 10 mg/día
Complicaciones
En la tabla 6 se reúnen algunas de las recomendaciones para el manejo inicial de las complicaciones en sedación.
Depresión respiratoria
Definida como apnea, hipoventilación o desaturación mayor a 15 segundos.


Normalmente mejora con la permeabilización de la vía aérea y administración de oxígeno, sin embargo, algunos pacientes pueden llegar a necesitar ventilación con presión positiva e incluso intubación orotraqueal.
Laringoespasmo
Definida como el espasmo de la glotis que lleva a obstrucción parcial o completa de la vía aérea; clínicamente se identifica como estridor y no mejora con las maniobras iniciales de permeabilización de la vía aérea; puede requerir ventilación con presión positiva, aumentar el grado de sedación y en ocasiones el uso de bloqueante neuromuscular como succinilcolina.
Broncoespasmo
Definida como la disminución de la luz de las vías respiratorias inferiores e identificada clínicamente como dificultad respiratoria, tos y sibilancias. Mejora con el uso de broncodilatadores nebulizados y el uso de corticoides IV.
Hipoxia
Definida como la disminución de la PO2 en sangre secundario a alteraciones de la oxigenación, en el contexto de la sedación secundaria a broncoespasmo, laringoespasmo o depresión respiratoria. Clínicamente identificable con cianosis, saturación de oxígeno baja, en casos graves sin corrección oportuna, lleva a bradicardia y parada cardiaca.
Anafilaxia
Definida como reacción alérgica grave y potencialmente fatal, habitualmente mediada por IgE, clínicamente identificada por el compromiso multisistémico (Piel y mucosas, Gastrointestinal, Cardiovascular, respiratorio), puede llevar a shock, hipoxemia, finalmente parada cardiaca y respiratoria. La piedra angular del tratamiento es la epinefrina IM a dosis de 0.5mg en adultos y 0.01mg/kg en niños, en ocasiones es necesario dosis repetidas e incluso infusión continua en casos refractarios.


Hipotensión arterial
Definida como la disminución de la presión arterial sistémica, lo que conlleva a una pérdida de la presión de perfusión tisular. Depende de muchos mecanismos reguladores. En el contexto de la sedación, es posible que ocurra secundario al uso de benzodiacepinas y opioides, reacciones anafilácticas o condiciones de base del paciente como patologías que no permitan la adecuada regulación de la presión arterial.
Tabla 6. Manejo de complicaciones de sedación
Complicación Manejo
● Estimular al paciente para que respire
● Permeabilizar vía aérea: maniobra frente-mentón, cánula naso uorofaríngea, subluxación mandibular, aspirar secreciones
Depresión
respiratoria o hipoxia
Laringoespasmo
● Administrar oxígeno: cánula nasal, sistema Venturi, máscara de no reinhalación
● Ventilación con presión positiva: BVM, aire rees
● Considerar la continuidad del procedimiento
● Intubación orotraqueal
● Considerar el uso de agentes antagonistas
● Suspender procedimiento
● Ventilación con presión positiva
● Aumentar el grado de sedación
● Succinilcolina: 0.6 mg/kg IV
● Intubación orotraqueal


● Suspender procedimiento
● Administrar oxígeno: cánula nasal, sistema venturi, máscara de no reinhalación
● Salbutamol + ipratropio nebulizados
Broncoespasmo
● Corticoide sistémico; Hidrocortisona 100-200 mg IV
● Considerar Mg IV (dosis única de 40 mg/kg (máximo 2 g) en infusión lenta (20 minutos))
● Intubación orotraqueal
● Suspender procedimiento
● Suspender alergeno
● Administrar oxígeno: cánula nasal, sistema venturi, máscara de no reinhalación
Anafilaxia
● Adrenalina IM 0.01 mg/kg máximo 0.5 mg
● LEV SS 0.9% 20 ml/kg
● Salbutamol nebulizado
● Intubación orotraqueal
● Posicionar en Trendelemburg
● LEV SS 0.9% en bolos de 500 cc (250 cc si riesgo de edema)
Hipotensión
● Epinefrina 20-30 mcg (2-3 cc de la dilución recomendada) y titular según respuesta
Epinefrina, ampolla de 1 mg/ml, diluir en 100 cc SS 0.9%, para obtener dilución de 10 mcg/ml
Nota: elaboración propia basada en los algoritmos de manejo de cada una de las complicaciones.


Escalas de recuperación
Una vez finalizado el procedimiento, se debe vigilar la recuperación del paciente hasta que cumpla criterios de alta. Estos criterios son:
● Signos vitales normales
● Adecuada hidratación
● Dolor controlado
● Ausencia de náuseas y vómito
● Nivel de conciencia normal
Algunas escalas adaptadas permiten evaluar estos ítems, como lo son la escala Aldrete y MPADSS14
Conclusiones
Para garantizar un proceso de sedación exitoso y seguro, es esencial comenzar con la selección cuidadosa del paciente, considerando todos los riesgos posibles. La preparación es clave, y eso incluye tener listos todos los insumos necesarios antes de iniciar.
Cada paciente es único, por lo que las dosis de los medicamentos deben ser personalizadas, tomando en cuenta tanto las características individuales del paciente como los detalles del procedimiento a realizar.
Durante el proceso, es crucial estar preparados para manejar cualquier complicación que pueda surgir, haciéndolo con eficiencia y efectividad. Y, por último, pero no menos importante, el alta del paciente debe ser manejada con el máximo cuidado para asegurar su bienestar y seguridad.


1. Carrillo-Esper R, Carrillo-Córdova DM, Carrillo-Córdova CA. Brief history of Anesthesiology. Revista mexicana de anestesiología. 2017;40(S1):347–9.
2. Thorwald J. El Siglo de Los cirujanos. Destino Ediciones; 2004:93-153.
3. López-Herranz P, Torres-Gómez G. Variabilidad de la clasificación del estado físico de la Sociedad Americana de Anestesiólogos entre los anestesiólogos del Hospital General de México. Revista Mexicana de Anestesiología. 2017;(3).
4. Garcia BC. Valoración preoperatoria de la Vía aérea difícil ¿Hay algo nuevo? [Internet]. AnestesiaR. 2015 [citado 2 de abril de 2024]. Disponible en: https://anestesiar.org/2015/valoracion-preoperatoria-de-la-via-aerea-dificil-hay-algo-nuev o/
5. Burbano-Paredes CC, Amaya-Guio J, Rubiano-Pinzón AM, Hernández-Caicedo ÁC, Grillo-Ardila CF. Clinical practice guideline for the management of sedation outside of operating room in patients over 12 years. Colomb J Anesthesiol [Internet]. 2017;45(3):224–38. Disponible en: http://dx.doi.org/10.1016/j.rcae.2017.03.006
6. Practice guidelines for moderate procedural sedation and analgesia 2018: A report by the American society of anesthesiologists task force on moderate procedural sedation and analgesia, the American association of oral and maxillofacial surgeons, American college of radiology, American dental association, American society of dentist anesthesiologists, and society of interventional radiology. Anesthesiology [Internet]. 2018;128(3):437–79. Disponible en: http://dx.doi.org/10.1097/ALN.0000000000002043
7. Joshi GP, Abdelmalak BB, Weigel WA, Harbell MW, Kuo CI, Soriano SG, et al. 2023 American society of anesthesiologists practice guidelines for preoperative fasting: Carbohydrate-containing clear liquids with or without protein, chewing gum, and pediatric fasting duration-A modular update of the 2017 American society of anesthesiologists practice guidelines for preoperative fasting. Anesthesiology [Internet]. 2023;138(2):132–51. Disponible en: http://dx.doi.org/10.1097/ALN.0000000000004381


8. Gan TJ, Belani KG, Bergese S, Chung F, Diemunsch P, Habib AS, et al. Fourth consensus guidelines for the management of postoperative nausea and vomiting. Anesth Analg [Internet]. 2020;131(2):411–48. Disponible en: http://dx.doi.org/10.1213/ANE.0000000000004833
9. Frade Mera MJ, Guirao Moya A, Esteban Sánchez ME, Rivera Álvarez J, Cruz Ramos AM, Bretones Chorro B, et al. Análisis de 4 escalas de valoración de la sedación en el paciente crítico. Enferm Intensiva [Internet]. 2009;20(3):88–94. Disponible en: http://dx.doi.org/10.1016/s1130-2399(09)72588-x
10. Eilers H, Yost S. General anesthetics. Basic & clinical pharmacology. 2018;
11. ClinicalKey [Internet]. Clinicalkey.es. [citado el 3 de abril de 2024]. Disponible en: https://www.clinicalkey.es/#!/content/drug_monograph/6-s2.0-403
12. ClinicalKey [Internet]. Clinicalkey.es. [citado el 3 de abril de 2024]. Disponible en: https://www.clinicalkey.es/#!/content/drug_monograph/6-s2.0-245
13. ClinicalKey [Internet]. Clinicalkey.es. [citado el 3 de abril de 2024]. Disponible en: https://www.clinicalkey.es/#!/content/drug_monograph/6-s2.0-333
14. Fang L, Wang Q, Xu Y. Postoperative discharge scoring criteria after outpatient anesthesia: A review of the literature. J Perianesth Nurs [Internet]. 2023;38(4):642-649.e1. Disponible en: http://dx.doi.org/10.1016/j.jopan.2022.11.008





Karen Jaramillo Osorio1 , Sergio Jaramillo Velásquez2
1.Médica General Universidad de Antioquia, Médica general del banco de sangre Hospital Pablo Tobón Uribe.
2.Jefe de Departamento de Laboratorio, Hospital Pablo Tobón Uribe.
Resumen
La práctica médica actualmente encuentra un gran soporte en la terapia transfusional, pudiendo con ello hacer intervenciones salvadoras de vida en contextos como traumatismos, cirugías o enfermedad tanto aguda como crónica, al recuperar la volemia perdida del paciente. Sin embargo, la transfusión sanguínea no está libre de reacciones adversas, las cuales son menester del médico general conocer para poderlas identificar a tiempo y tomar acciones frente a ella, evitando daños o incluso la muerte del paciente.
Palabras claves
Sangre, transfusión sanguínea, reacción a la transfusión, bancos de sangre.
Introducción
La transfusión de sangre es una práctica común que día a día salva muchas vidas y se define como la infusión ya sea de sangre total o sus respectivos componentes en el torrente circulatorio de cualquier paciente que haya tenido una pérdida de volumen sanguíneo producto de un traumatismo, enfermedad aguda o crónica, intervención quirúrgica o cualquier otra condición que afecte su respectiva volemia. Previo a cada proceso transfusional, se debe garantizar una adecuada compatibilidad ABO entre donante y receptor para evitar la aparición de reacciones adversas que pueden ser leves, moderadas e incluso graves que conllevan a daños irreversibles o la muerte1 .
Cada institución hospitalaria debe acogerse a los protocolos destinados para el manejo adecuado de dichas reacciones transfusionales, logrando con ello una pronta respuesta


La transfusión sanguínea es un procedimiento terapéutico en el que se administra un componente sanguíneo de un individuo a otro, posterior a un arduo proceso de campaña de donación y recolección de sangre, fraccionamiento de los hemocomponentes y realización de pruebas infecciosas en el banco de sangre, sin embargo, dicho proceso no está exento de riesgos como son las reacciones adversas asociadas a la transfusión6 .
Se conoce como reacción adversa transfusional a la respuesta indeseada e imprevista asociada a la transfusión de sangre o sus derivados, que se presenta durante o después de la transfusión y afecta la seguridad del paciente-receptor. Dichas reacciones pueden clasificarse como inmediatas si ocurren hasta las 24 horas post transfusión y tardías si se presentan en días, meses o incluso años posterior a la transfusión7 .
Adicionalmente, se pueden clasificar en primera instancia en reacciones transfusionales agudas no infecciosas y tardías no infecciosas, como se detalla en el cuadro siguiente. Es de aclarar que en la literatura también se aborda la clasificación de reacciones transfusionales de origen infeccioso, las cuales no se verán en este capítulo.
Tabla 1. Reacciones transfusionales agudas y tardías no infecciosas
Reaccionestransfusionales agudas no infecciosas
Reacciones febriles no hemolíticas
Reacciones alérgicas
Reacciones hemolíticas agudas
Hemólisis no inmune
Daño pulmonar agudo relacionado con la transfusión (TRALI)
Reaccionestransfusionales tardías no infecciosas
Reacciones hemolíticas tardías
Púrpura postransfusional
Enfermedad injerto contra huésped
Sobrecarga de hierro


Sobrecarga circulatoria relacionada conla transfusión (TACO)
Reacciones metabólicas
Reacciones hipotensoras
Nota: Información tomada y ajustada de Manuel de Hemovigilancia INS Colombia 2010.
Reacciones transfusionales agudas no infecciosas
1. Reacciones febriles no hemolíticas: es aquella en la que se presenta un incremento de la temperatura corporal en el paciente de más de un grado centígrado, comparada con la temperatura basal que tenía antes de iniciar la transfusión. Dicho aumento de temperatura puede acompañarse de otros síntomas como escalofrío, náuseas o vómitos, los cuales pueden aparecer hasta una hora post transfusión.
Dichas reacciones febriles no hemolíticas aparecen en el 0,5%-6% de transfusiones de glóbulos rojos y en el 1%-38% de plaquetas. Su fisiopatología se explica por la interacción que existe entre los anticuerpos del plasma del receptor y los antígenos que se encuentran en los linfocitos, granulocitos o plasma que se ha transfundido. Es por ello por lo que en los últimos años ha tomado auge el tema de hemocomponentes leucorreducidos para disminuir este tipo de reacciones, las cuales no afectan la vida del paciente, pero sí ponen de manifiesto la necesidad de descartar diagnósticos diferenciales como reacciones hemolíticas y contaminación bacteriana. Se recomienda el uso de antipirético, vigilancia y evaluar en conjunto si se reinicia la transfusión dada la clínica del paciente8
2. Reacciones alérgicas: se le conoce así a la aparición de cuadros de urticaria o ampollas que generalmente son eritematosas, pruriginosas y localizadas, especialmente en cuello y tórax superior que por lo general no se asocian con otra sintomatología y representan del 1% 3% de las reacciones transfusionales, siendo en


su mayoría cuadros leves y escasamente severos. Su manejo consiste en la suspensión temporal de la transfusión, administración de antihistamínico (de preferencia difenhidramina) y reiniciar la transfusión cuando haya cesado la alergia9
Sin embargo, si dicha reacción alérgica se presenta con hipotensión, pérdida de conciencia, shock, angioedema, obstrucción de la vía aérea, tos, disnea, arritmias e incluso paro cardiorrespiratorio, estamos frente a un escenario de anafilaxia el cual requiere manejo inmediato con administración de adrenalina para preservar la vida del paciente y se contraindica reiniciar la transfusión sanguínea9
3. Reacciones hemolíticas agudas: son aquellas que se presentan dentro de las primeras 24 horas de la transfusión e incluyen en su mayoría fiebre, escalofríos, náuseas, vómitos, taquicardia, disnea, sangrado, hemoglobinuria e hipotensión. Dentro de sus complicaciones tardías se encuentra la falla renal. Algunos pacientes cursan con sangrado inesperado propio de un cuadro de coagulación intravascular diseminada. La causa más común de esta reacción hemolítica aguda es la incompatibilidad ABO ya que los eritrocitos transfundidos interactúan con anticuerpos preformados en el receptor, lo que inicia la activación de la vía del complemento, citoquinas, factores de coagulación y los demás elementos de la respuesta inflamatoria sistémica, además de la liberación de gran cantidad de aminas vasoactivas lo que puede hacer que el paciente entre en un shock distributivo, sumado a la hipotensión que causa una respuesta simpática compensatoria y por ende vasoconstricción que puede agravar la isquemia de la circulación esplácnica, pulmonar, capilar y renal10
El objetivo terapéutico se dirige al manejo de la hipotensión y el mejoramiento de la perfusión renal, asegurando un adecuado gasto cardiaco y urinario, además de alertar de inmediato al banco de sangre para evitar que otro paciente se vea afectado de recibir un hemocomponente equivocado11 .
4. Hemólisis no inmune: se define como la lisis del glóbulo rojo, la cual puede suceder durante el almacenamiento o manipulación de los hemocomponentes, así


como durante su infusión. En la literatura se habla de una adecuada tolerancia por parte del paciente a los glóbulos rojos lisados, sin embargo, existen reportes de caso de daño renal, pulmonar, hemodinámico e incluso la muerte. Siempre se debe suspender la infusión y devolver los hemocomponentes al banco de sangre para su análisis. Es preponderante la medición de potasio sérico al paciente, electrocardiografía y asegurar un adecuado gasto urinario11 .
5. Daño pulmonar agudo relacionado con la transfusión (TRALI): se define como un síndrome clínico que se presenta como hipoxemia aguda y edema pulmonar no cardiogénico durante o inmediatamente después de la transfusión. El TRALI se ha atribuido a la presencia en primer lugar de anticuerpos en el plasma de la unidad transfundida que se dirigen contra los antígenos HLA o de granulocitos (neutrófilos) presentes en el receptor, y en segundo lugar se ha relacionado con mediadores lipídicos inflamatorios formados en una unidad transfundida que activan los neutrófilos del receptor y causan lesión capilar en pulmones. El tratamiento es de soporte posterior a la suspensión de la transfusión, y la mortalidad asociada se estima hasta en un 20%12
6. Sobrecarga circulatoria relacionada con la transfusión (TACO): debido a la sobrecarga de volumen que puede representar la transfusión sanguínea se pueden dar cuadros clínicos de edema pulmonar, sobre todo en niños y ancianos hasta en el 1%. Los síntomas de dicha sobrecarga incluyen disnea, cianosis, ortopnea, cefalea, ingurgitación yugular y falla cardiaca congestiva. Estos incrementos rápidos de volumen no son bien tolerados en pacientes con enfermedades cardiacas, pulmonares y renales13
7. Reacciones metabólicas: entre las que se destacan, a) Toxicidad por citrato: cuando se transfunden grandes cantidades de plasma, sangre o plaquetas, el citrato sérico se eleva y se une al calcio ionizado apareciendo la hipocalcemia apareciendo síntomas como excitabilidad neuronal, parestesias, temblor, tetania, espasmos, que son transitorias, pero pueden disminuir rápidamente con la suplencia de calcio.


b) Hipotermia: al recibir grandes cantidades de sangre fría se pueden desarrollar arritmias ventriculares, por lo que siempre se sugiere calentar la sangre antes de transfundirla. c) Hipercalemia e hipocalemia: si el tiempo de almacenamiento de la unidad es corto, la cantidad de potasio en cada unidad es de aproximadamente 0.5mEq, pero si el tiempo es largo este valor sube a 5-7mEq, lo cual en la mayoría de las veces no es significativo para el paciente13
8. Reacciones hipotensoras: definido como el descenso en aproximadamente 10 mmHg en la presión arterial sistólica o diastólica en ausencia de otros síntomas de reacciones transfusionales como fiebre, escalofríos, disnea o urticaria. Dicha hipotensión se resuelve rápidamente después del cese de la transfusión; sin embargo, si persiste por más de 30 minutos debe pensarse en otra causa9
Reacciones transfusionales tardías no infecciosas
1. Reacciones hemolíticas tardías: se presentan 24 horas post transfusión y se ha descrito hasta 2 semanas posterior a ella. Se dan por una respuesta amnésica a los aloantígenos eritrocitarios a los cuales el paciente estaba previamente sensibilizado. Son reacciones menos severas que las agudas y generan hemólisis generalmente extravasculares, evidenciadas en anemia, actividad de lactato deshidrogenasa elevada, disminución de haptoglobina leucocitosis y una prueba de antiglobulina directa positiva. Las futuras transfusiones de dicho paciente deben carecer del antígeno responsable de la reacción amnésica8 .
2. Púrpura postransfusional: se define como el inicio abrupto de trombocitopenia severa (< 10000/ul) por lo general una semana después de la transfusión. Se da porque los pacientes generan aloanticuerpos en respuesta a los antígenos plaquetarios presentes en la sangre transfundida, generando por un periodo de tiempo la destrucción de las plaquetas autólogas. La púrpura postransfusional es un cuadro autolimitado y la


plasmaféresis resulta útil al reducir la cantidad de anticuerpos antiplaquetarios circulantes6 .
3. Enfermedad injerto contra huésped: está asociada al injerto y expansión clonal de los linfocitos del donante en un receptor susceptible, al montar un ataque inmune contra los tejidos del receptor, donde incluyen las células hematopoyéticas y causan pancitopenia refractaria con sangrado y una predisposición marcada a las infecciones. En el 99% de los pacientes es una condición fatal y se presenta dentro de las tres semanas siguientes a la transfusión9 .
4. Sobrecarga de hierro: cada unidad de glóbulos rojos contiene aproximadamente 200 mg de hierro, lo cual en pacientes crónicamente transfundidos genera una acumulación progresiva del mismo sin la posibilidad fisiológica de su excreción, en especial en pacientes con hemoglobinopatías. Dicho almacenamiento empieza en el retículo endotelial, pero al saturarse, el depósito continúa en las células parenquimatosas13
Conclusiones
● La transfusión sanguínea es una práctica común en nuestro sistema hospitalario, salvadora de vidas y muy segura.
● Las reacciones adversas transfusionales son la respuesta indeseada e imprevista asociada a la transfusión de sangre o sus derivados, que se presenta durante o después de la transfusión y afecta la seguridad del paciente-receptor.
● Son reacciones adversas inmediatas si ocurren hasta las 24 horas post transfusión y tardías si se presentan en días, meses o incluso años posterior a la transfusión.
● Se hace indispensable un rápido y adecuado diagnóstico de las reacciones transfusionales para detener la transfusión y poder tomar medidas terapéuticas en caso de necesidad.
● Es importante realizar una adecuada verificación de donante y receptor para evitar reacciones adversas propias del error humano.


1. Abdallah R, Rai H, Panch SR. Transfusion Reactions and Adverse Events. Clin Lab Med. Bethesda [Internet]. 2021 [citado el 15 Feb 2024]; 41:669–96. Disponible en: https://doi.org/10.1016/j.cll.2021.07.009
2. Raval JS, Griggs JR, Fleg A. Blood Product Transfusion in Adults: Indications, Adverse Reactions, and Modifications. Am Fam Physician [Internet]. 2020 [citado el 15 Feb 2024]; 102(1):30–8. Disponible en: https://www.aafp.org/content/dam/brand/aafp /pubs/afp/issues/2020/0701/p30.pdf
3. Arbeláez G. Sistema de grupo sanguíneo ABO. Medicina y Laboratorio 2009. [citado el 15 Feb 2024]. Disponible en: https:// chrome-extension://efaidnbmnnnibpcajpcglclefindmkaj/https://www.medigraphic.com/pdf s/medlab/myl-2009/myl097-8c.pdf
4. Marrón M. Historia de la Transfusión sanguínea. Libro Historia de la anestesiología, Vol. 40. No. 3 julio-septiembre 2017 pp 233-238
5. Organización Mundial de la Salud. Disponibilidad y seguridad de la sangre. 2023. [citado el 15 Feb 2024]. Disponible en: https:// https://www.who.int/es/news-room/fact-sheets/detail/blood-safety-and-availability
6. Goel R, Tobian AAR, Shaz BH. Noninfectious transfusion-associated adverse events and their mitigation strategies. Blood New York [Internet]. 2019 [citado el 20 Feb 2024]; 133. Disponible en: https://doi.org/10.1182/blood-2018-10- 833988
7. Garraud O, Cognasse F, Laradi S, Hamzeh Cognasse H, Peyrard T, Tissot JD, et al. How to mitigate the risk of inducing transfusion associated adverse reactions. Transfusion Clinique et Biologique. Elsevier Masson SAS [Internet]. 2018 [citado el 21 Feb 2024]; 25:262–8. Disponible en: https://doi.org/10.1016/j.tracli.2018.07.006


8. Mowla SJ, Sapiano MRP, Jones JM, Berger JJ, Basavaraju S V. Supplemental findings of the 2019 National Blood Collection and Utilization Survey. Transfusion (Paris) [Internet]. 2021 [citado el 21 Feb 2024]; 61(2):S11–35. Disponible en: https://doi.org/10.1111%2Ftrf.16606
9. Klanderman RB, BosboomJJ, Migdady Y, Veelo DP, Geerts BF, Murphy MF, etal. Transfusion-associated circulatory overload a systematic review of diagnostic biomarkers. Transfusion [Internet]. 2019 [citado el 25 Feb 2024]; 59:765-805. Disponible en: https://doi.org/10.1111/trf.15068
10. Panch SR, Montemayor-Garcia C, Klein HG. Hemolytic Transfusion Reactions. Longo DL, editor. N Engl J Med [Internet]. 2019 [citado el 01 Mar 2024]; 381(2):150-62. Disponible en: http://www.nejm.org/doi/10.1056/NEJMra180 2338
11. Soler Noda G, Fernández Delgado ND. Eventos adversos en la práctica transfusional: reacción transfusional hemolítica inmune. Rev cubana Hematol Inmunol Hemoter [Internet]. 2022 [citado el 1 de marzo, 2024]. Disponible a partir de: https://revhematologia.sld.cu/index.php/hih/article/view/1499
12. Gehrie EA, Savani BN, Booth GS. Risk factors for hemolytic transfusion reactions resulting from ABO and minor red cell antigen incompatibility: From mislabeled samples to stem cell transplant and sickle cell disease. Blood Reviews. Churchill Livingstone [Internet]. 2021 [citado el 2 Mar 2024]; 45. Disponible en: https://doi.org/10.1016/j.blre.2020.100719
13. Semple JW, Rebetz J, Kapur R. Transfusion associated circulatory overload and transfusion-related acute lung injury. Blood [Internet]. 2019 [citado el 5 Mar 2024]; 133. Disponible en: https://doi.org/10.1182/blood-2018-10- 860809 9. Van den A





Juanita Sánchez Cano1 , Sara León Aldana2 , Juan Camilo Rodriguez Castrillon3
1.Médica General Universidad CES, Médica general de Hospitalización Hospital Pablo Tobón Uribe.
2.Estudiante Pregrado de Medicina, Universidad CES.
3.Especialista en Medicina Interna, Universidad Pontificia Bolivariana.
La hiperglicemia, definida como glicemia mayor o igual a 140mg/dL, es un fenómeno frecuente en el paciente hospitalizado con o sin diabetes secundario al estrés fisiológico provocado por la enfermedad aguda, cambios en la dieta o en la ingesta de alimentos, uso de medicamentos hiperglucemiantes, entre otros. Es fundamental su identificación y adecuado manejo; ya que se asocia a mayor morbimortalidad, desenlaces clínicos deletéreos y aumento de la estancia hospitalaria. Para su manejo, la terapia más estudiada y frecuentemente utilizada es la insulina, en diferentes esquemas, que deben ser seleccionados según las características y requerimientos de cada paciente. Se desaconseja el uso de esquema móvil de insulina como terapia aislada. El monitoreo se realiza a través de glucometrías usualmente antes de las comidas y de dormir. Es importante identificar los pacientes con alto riesgo de hipoglicemia, ya que esta es una de las principales barreras para alcanzar un adecuado control metabólico y expone al paciente a múltiples complicaciones y aumento de la mortalidad. El uso de corticoesteroides es frecuente en el contexto hospitalario y éste puede empeorar el control glicémico; por ende, es importante dar un manejo adecuado a la hiperglicemia en los pacientes que los reciban. Finalmente, es fundamental educar al paciente en el manejo de su diabetes, dar asesoría nutricional y estructurar un plan de egreso individualizado durante la hospitalización, lo que disminuye los días de estancia y las tasas de reingreso luego del alta hospitalaria.
Palabras clave
Diabetes Mellitus, hiperglucemia, hospitalización, insulina, esteroides, hipoglicemia.


Introducción
La Diabetes Mellitus es una enfermedad altamente prevalente que representa una elevada carga de morbimortalidad a nivel mundial y es un problema importante de salud pública. Según la Organización Panamericana de la Salud, la tasa de diabetes se ha triplicado en la región de las américas desde el año 1980, principalmente en países de ingresos medianos y bajos como Colombia. Para el año 2019, se estimó que aproximadamente 422 millones de personas en el mundo padecían de Diabetes tipo 2 y la tasa de mortalidad estandarizada por edad en la región, para este mismo año, fue de 20,9 defunciones por cada 100.000 habitantes y se estima que esta cifra aumentará a 642 millones para el año 20401, 2
La diabetes es una patología crónica que se asocia a complicaciones graves y frecuentemente discapacitantes como retinopatía diabética, enfermedad renal, neuropatía, infecciones, entre otras. Los pacientes que la padecen tienen hasta cuatro veces mayor riesgo de hospitalización, con estancias más prolongadas y mayor probabilidad de reingreso. Se ha reportado que el 30% de los pacientes hospitalizados en sala general tienen este diagnóstico3, 4 .
La hiperglucemia con o sin diabetes en hospitalización es un hallazgo frecuente que afecta aproximadamente el 40% de los pacientes hospitalizados no críticos, de los cuales entre el 12 al 25% no tenían antecedente de diabetes al ingreso4 . Este fenómeno es producto de cambios fisiológicos que se presentan durante la enfermedad aguda, especialmente en el metabolismo de la glucosa, el aumento de las hormonas contrarreguladoras, el uso de medicamentos como los corticosteroides y los cambios en la dieta. Así como la enfermedad favorece la hiperglicemia, esta a su vez tiene efectos sobre el proceso agudo al aumentar el estrés oxidativo y disminuir la función inmune5 .
El mal control glucémico durante la hospitalización se relaciona con desenlaces negativos y mayor morbimortalidad. Entre estas complicaciones se mencionan algunas


como el incremento de las infecciones nosocomiales o postoperatorias, menor recuperación neurológica luego de eventos cerebrovasculares y dificultad para la cicatrización de heridas. Además, se aumentan los días de estancia hospitalaria y se retrasan los procedimientos6
Este capítulo aborda una revisión de la literatura del manejo de la diabetes en el paciente hospitalizado, ya que como se mencionó es una enfermedad prevalente a la que la mayor parte del personal de salud se verá enfrentado. El manejo de la hiperglicemia en hospitalización es un pilar fundamental del cuidado de los pacientes para evitar las complicaciones derivadas del inapropiado control de ésta.
En este capítulo no se abordará el manejo del paciente diabético tipo 1 hospitalizado, ni la hiperglicemia en unidades de cuidado crítico, por lo que se recomienda consultar estos temas en la literatura.
Diagnóstico
La evaluación del paciente diabético o con sospecha de la enfermedad en el contexto hospitalario debe iniciar con un adecuado interrogatorio y evaluación física. En primer lugar, es importante conocer el tipo de diabetes que padece el paciente (por ejemplo, diabetes tipo 1 o tipo 2, gestacional, secundaria a medicamentos, etc.), indagar por la historia de complicaciones, el manejo ambulatorio y su control metabólico actual. En caso de que al paciente se le haya realizado una hemoglobina glicosilada (HbA1C) en los últimos 3 meses y este resultado esté disponible es fundamental solicitarlo, ya que este será el punto de partida para su manejo durante la hospitalización.
De lo contrario, el primer paso será realizar una glucometría al ingreso, para determinar el control glicémico o incluso en pacientes sin diabetes, de estar elevada podrá ser el parámetro inicial para realizar el diagnóstico en quienes no se hubiese identificado previamente2


Según la guía de la Sociedad Americana de Diabetes 2024, se debe realizar un test de HbA1C en todas las personas con antecedente de diabetes que no tengan un resultado reciente en los últimos 3 meses, o en quienes tengan hiperglicemia al ingreso, la cual se define como un valor > 140 mg/dl [> 7.8 mmol/L] al tomar la glucosa por micro método7 .
Una valor de HbA1c ≥ 6.5% [≥ 48 mmol/L] sugiere que el inicio de la diabetes precede a la hospitalización y su valor nos puede orientar hacia el grado de adherencia al manejo ambulatorio, la pertinencia de la terapia actual o la necesidad de ajustes de este, y a planificar el manejo durante la hospitalización y al egreso. Se ha visto que este test tiene una buena especificidad diagnóstica en el contexto hospitalario, pero pierde sensibilidad con respecto al ámbito ambulatorio por la frecuencia de anemia u otras condiciones que afectan sus medición durante la hospitalización5, 8, 9
Es importante recordar que el método para la medición de la HbA1c debe estar certificado por el programa de estandarización de HbA1c nacional y sus resultados deben ser interpretados con cautela, ya que condiciones como la falla renal, el uso de eritropoyetina, situaciones de alto recambio celular como las anemias hemolíticas o hemoglobinopatías, el embarazo, la hemodiálisis, el uso de transfusiones, la deficiencia de hierro y la anemia aplásica pueden alterar su precisión2. De igual manera, el test de glucosa en sangre capilar puede verse afectado por condiciones que alteren la perfusión, que son frecuentes en pacientes en unidades de cuidado crítico.
Antes de iniciar el manejo farmacológico de los pacientes con hiperglucemia es importante tener en cuenta las condiciones individuales del paciente para planificar su monitoreo, la toma de glucometrías y las metas del tratamiento.
Para el seguimiento del control glucémico en salas generales se utiliza la glucometría en el pulpejo de los dedos, la cual se debe realizar antes de cada comida principal (preferiblemente cuando esta sea servida o máximo 1 hora antes) y antes de dormir.


En pacientes con nutrición enteral o sin vía oral, se recomienda realizar glucometrías cada 4 a 6 horas y más frecuente (desde cada 30 minutos hasta 2 horas) si el paciente se encuentra con infusión de insulina7,9
Las metas de glicemia del paciente hospitalizado son un poco más laxas que en el contexto ambulatorio debido a los cambios en el tratamiento, las variaciones en la dieta del paciente y el contexto de enfermedad aguda. Existen algunas barreras durante la hospitalización para obtener las metas de glicemia, las cuales se mencionan a continuación:
● De la dieta: cambios en los horarios o en los alimentos, restricción de la ingesta vía oral por procedimientos o ayudas diagnósticas y uso de nutrición enteral o parenteral.
● Por medicamentos: cambios en el régimen o dosis de medicamentos, interacciones medicamentosas, uso de medicamentos que aumentan la resistencia a la insulina (especialmente esteroides).
● Del sistema o médicos: horarios variables en la administración de medicamentos, desconocimiento del personal sobre el manejo de hiper e hipoglicemia y falta de planificación para el egreso del paciente.
● Fisiológicos: enfermedad aguda y estrés fisiológico y alteración de la función renal, lo que afecta el metabolismo de medicamentos y aumenta el riesgo de hipoglicemia6,8
Para los pacientes no críticos, se recomiendan metas pre pradiales < 140 mg/dL [7.8 mmol/L] y < 180 mg/dL de glicemia al azar [10.0 mmol/L], siempre y cuando estos puntos de corte puedan alcanzarse de manera segura3. Es importante individualizar, ya que en situaciones donde existan condiciones de pobre pronóstico y expectativa de vida corta o edad avanzada se puede ser más flexible y tolerar mayores glicemias (alrededor de 200-250 mg/dL). Es importante evitar valores inferiores a 100 mg/dL [5.6 mmol/L],


ya que esto predice hipoglicemia en las próximas 24 horas y en caso de presentarlas, se debe evaluar de manera integral el contexto y el tratamiento del paciente para realizar los ajustes pertinentes7,9
Las personas con diabetes usuarios de dispositivos de monitoreo continuo de la glucosa pueden utilizarlo durante la hospitalización siempre y cuando sea clínicamente apropiado, apoyándose de las glucometrías como método confirmatorio de las hipoglicemias y para orientar los cambios en las dosis de tratamiento. Se recomienda este método para el monitoreo de los pacientes insulinodependientes con alto riesgo de hipoglicemia en caso de ser posible10 .
Manejo
La insulinoterapia es el método preferido y más utilizado para el manejo de hiperglicemia en los pacientes hospitalizados y en pacientes no críticos se administra vía subcutánea. Según las recomendaciones de la Asociación Americana de Diabetes, el punto de corte para el inicio o los ajustes de insulina y/o otras terapias hipoglucemiantes en el paciente hospitalizado no crítico con hiperglucemia persistente es a partir de glicemia ≥ 180 mg/dL [≥ 10.0 mmol/L] obtenida en dos ocasiones dentro de un período de 24 horas7 .
Actualmente el esquema más recomendado es el esquema intensivo, basal-bolo, que consiste en la administración de insulina basal una o dos veces al día, la cual puede ser de acción intermedia como NPH humana o una insulina análoga de acción prolongada (Glargina, Detemir o Degludec), combinada con una insulina análoga de acción rápida preferiblemente antes de las comidas (Lispro, Aspart o Glulisina) en pacientes con ingesta regular de alimentos. Este régimen se ha considerado el más fisiológico, efectivo y seguro. Los estudios han demostrado que el uso de insulina NPH/regular en proporción 70/30 en comparación con el uso de insulina de larga y corta acción no


presento diferencias en el control glucémico, sin embargo, el esquema de insulinas premezcladas presenta mayor tasa de hipoglicemia, principalmente en pacientes con baja ingesta calórica3, 11
El estudio RABBIT 2, donde se incluyeron 130 pacientes diabéticos tipo 2, comparó el uso del esquema basal-bolo vs. el uso de esquema móvil de insulina y demostró que el uso del esquema basal-bolo logró glicemias menores a 140 mg/dL en el 66% de los pacientes, mientras que el uso del esquema móvil solo lo alcanzó en el 38%; la diferencia promedio de glicemia en ambos grupos fue de 27 mg/dL. Además, a pesar de que se evidenció que los pacientes en esquema basal-bolo recibían mayores dosis de insulina, la tasa de hipoglicemia en ambos esquemas fue similar12. Un estudio similar denominado RABBIT 2 Surgery, el cual incluyó pacientes que fueron sometidos a procedimientos quirúrgicos, también demostró un mejor control glucémico con este esquema, además de menor duración de la estancia en la unidad de cuidado crítico, menor tasa de complicaciones como infección de la herida, neumonía, lesión renal aguda, y falla respiratoria. A diferencia del primer estudio, la tasa de hipoglicemia fue mayor en pacientes con el esquema basal bolo que con el esquema móvil (23.1% vs. 4.7%) lo que se atribuyó a la menor ingesta calórica de los pacientes quirúrgicos13
Dado el mayor riesgo de hipoglicemia al usar el esquema basal-bolo en pacientes quirúrgicos, con baja ingesta de alimentos o en aquellos pacientes con dosis bajas de insulina en casa, se podría utilizar sólo insulina basal con corrección prandial o esquema basal-plus, administrando una dosis prandial fija con la comida de mayor contenido calórico en el día. Las dosis de corrección se requieren generalmente con glicemias preprandiales ≥150 mg/dL y la dosis administrada se determina según el esquema utilizado ya que varía dependiendo de la sensibilidad o resistencia a la insulina y el riesgo de hipoglucemia (Tablas 1 y 2).


Tabla 1. Perfiles de sensibilidad a la insulina.
Sensibleala insulina
Condiciones
● Ancianos
● Enfermedad renal crónica avanzada
● Desnutrición
● Restricciones de la dieta.
Sensibilidad usual
● Glicemia al ingreso 140-200 mg/dL
● Dosis total diaria de insulina ambulatoria <80 U/día.
● No cumple criterios de sensible ni resistente.
Resistenteala insulina
● Glicemia al ingreso 201-400 mg/dL
● Sobrepeso u obesidad.
● Uso de esteroides
● Dosis total diaria de insulina ambulatoria >80U/día.
Nota:Tomado de8
Tabla 2. Dosis de esquema suplementario según sensibilidad a la insulina
Nota:Tomado de8


En general, el esquema móvil como única estrategia de manejo no se recomienda ya que se asocia con un mayor riesgo de episodios de hipoglucemia y excursiones hiperglucémicas. Eventualmente podría considerarse, sólo en pacientes con diabetes tipo 2 tratados con agentes orales o GLP1 y glicemia en metas al ingreso, sin factores de riesgo importantes para hipoglucemias9,14
Finalmente, la insulina en infusión se usa principalmente en el contexto del paciente critico en unidad de cuidados intensivos, ya que la vida media corta de la insulina intravenosa permite mayor flexibilidad para ajustes de la tasa de infusión en caso de cambios inesperados en la condición clínica del paciente9 .
Para la dosificación de la insulina subcutánea se realizan cálculos basados en el peso del paciente o en la dosis utilizadas en casa. Los pacientes que no han recibido insulina previamente, la dosis diaria inicial de insulina se calcula aproximadamente entre 0.4 a 0.5 U/Kg/día. En pacientes con edad avanzada o alteración de la función renal (Tasa de filtración glomerular menor a 45 mL/min por 1.73 m2), se recomienda iniciar con dosis ≤ a 0.3 U/Kg/día para disminuir el riesgo de hipoglicemia. Sin embargo, en las personas manejadas con insulina previo al ingreso se puede utilizar la dosis total diaria que se usaba en casa administrando el 50% como basal y el otro 50% dividido en tres partes iguales para su aplicación antes de las comidas principales. La dosis puede reducirse al 20 a 25% para prevenir hipoglicemia en quienes tienen baja ingesta calórica3,5,9
Como se evidencia en la siguiente tabla, las condiciones de base del paciente orientan la dosis de insulina total diaria ya que hace al paciente más sensible o resistente a la insulina.


Tabla 3. Dosis total diaria de insulina en pacientes con diabetes tipo 2.que no han recibido insulina.

Figura 1. Insulinoterapia inicial en pacientes con diabetes tipo 2 en el contexto hospitalario

Nota:Tomado de11


Se aconseja una vez se realizan modificaciones en la terapia insulina para pacientes que persisten hiperglucémicos o fuera de metas (excluyendo hipoglicemias), no realizar nuevos ajustes por lo menos antes de 48 horas de instaurados.
Finalmente, la insulina en infusión se usa principalmente en el contexto del paciente crítico en unidad de cuidados intensivos, ya que la vida media corta de la insulina intravenosa permite mayor flexibilidad para ajustes de la tasa de infusión en caso de cambios inesperados en la condición clínica del paciente9
Por otra parte, el uso de las terapias hipoglicemiantes no insulínicas en el paciente hospitalizado es controversial. Es importante evaluar los medicamentos formulados ambulatoriamente al ingreso para identificar contraindicaciones o continuarlos si es posible9,15
Recientemente se ha demostrado la seguridad y eficacia de los inhibidores de la DPP-4 en grupos especiales de pacientes diabéticos hospitalizados. Su uso con o sin insulina basal puede ser una forma sencilla y segura para manejar pacientes con hiperglicemia leve o moderada al ingreso. Estos medicamentos no aumentan el riesgo de hipoglucemia, sin embargo, algunos de ellos necesitan reducción de dosis si la función renal está comprometida, excepto la linagliptina14 .
En pacientes hospitalizados con diabetes y falla cardíaca se recomienda iniciar o continuar un inhibidor del cotransportador sodio-glucosa 2 (SGLT2) si no existen contraindicaciones. Estos medicamentos deben evitarse en casos de enfermedad severa, ya que aumentan la pérdida de calorías, el riesgo de deshidratación, la contracción del volumen. Además, se ha reportado cetoacidosis diabética euglucémica como efecto adverso. Estos fármacos se deben suspender 3 días antes de realizar procedimientos quirúrgicos7, 14
El uso de los GLP1 en el ámbito hospitalario es más debatido y se requieren más estudios para hacer una recomendación específica sobre su uso en este escenario.


Estos medicamentos se relacionan con náuseas, síntomas gastrointestinales y de manera general se recomienda suspenderlos en el contexto de enfermedad aguda grave10
Con respecto al uso de metformina existen diferentes posturas. Su administración en el paciente hospitalizado se ha relacionado con reportes y casos infrecuentes de acidosis láctica principalmente en quienes requieren estudios contrastados, sin embargo, la evidencia no es concluyente. Este medicamento favorece el control glucémico y no tiene riesgo de hipoglicemia, por lo que en pacientes estables se recomienda continuarlos de ser posible, en ausencia de procedimientos quirúrgicos o ayudas diagnósticas contrastadas planeadas. Si la tasa de filtración glomerular se encuentra entre 30 a 45 mL/min/1.73mt2 se sugiere reducir la dosis, y en TFG menor a 30 mL/min/1.73mt2 suspender el medicamento6,16
Las sulfonilureas aumentan el riesgo de hipoglucemia grave o prolongada. Por tanto, debido a lo impredecible que son los cambios en la ingesta durante la hospitalización, en general se recomienda descontinuarlos. Por otro lado, las tiazolidinedionas pueden predisponer a edema periférico o falla cardiaca, por lo que se deben suspender si hay sospecha de alguna afección cardiaca3,10 .
Finalmente, la terapia nutricional es otro pilar fundamental del manejo del paciente con hiperglicemia en la hospitalización. Su objetivo es ajustar la ingesta de calorías para alcanzar las demandas metabólicas y optimizar la glicemia. Se recomienda que a los pacientes se les realice una valoración nutricional en las primeras 24 horas desde el ingreso. La ingesta requerida diaria de energía en pacientes diabéticos se alcanza usualmente entre las 25-35 calorías/kg/día. En general, no existe un plan nutricional determinado para el manejo de hiperglicemia pues este se debe desarrollar de manera individualizada basado en las metas de tratamiento, los parámetros fisiológicos y el uso de medicamentos, sin embargo, es posible realizar conteo de carbohidratos, opción que puede ser adecuada para los pacientes que tengan entrenamiento en casa o usuarios de bombas de insulina3, 7


Plan ambulatorio
El tratamiento de la diabetes al egreso hospitalario debe ser planeado durante toda la hospitalización, teniendo en cuenta el control metabólico durante la estancia, la hemoglobina glicosilada, la presencia de hipoglicemias, los medicamentos utilizados y las consideraciones de la dieta. Se ha visto que esta estrategia logra reducir la estancia hospitalaria y la tasa de readmisiones. La educación en diabetes es un componente indispensable del cuidado médico y debe procurarse que el paciente comprenda su diagnóstico, metas de tratamiento, como manejar los episodios de hipoglicemia o hiperglicemia en casa, que medicamentos tomar y orientar un plan nutricional, de ser posible con conteo de carbohidratos17
Los ajustes farmacológicos previos al alta deben tener en cuenta los medicamentos formulados antes del ingreso, el riesgo cardiovascular, el estado renal, las metas de control esperadas, el riesgo de hipoglucemia, la respuesta a los ajustes durante la estancia y los niveles de HbA1c más recientes. En general, se realizan los cambios según la HbA1c del ingreso como se describe en la siguiente tabla2,7 .



La mayoría de los pacientes que presentaron hiper o hipoglicemia durante la hospitalización deben tener un control ambulatorio en 1 mes, sin embargo, si los medicamentos fueron modificados al egreso o si el control metabólico no era adecuado al momento del alta se debe asegurar una revisión idealmente en 1 o 2 semanas7
La hipoglicemia, definida como una glicemia de <70 mg/dL, es una complicación común de los pacientes hospitalizados, principalmente en aquellos que reciben tratamiento de para hiperglucemia. Su incidencia es entre el 1 y el 33% de los pacientes no críticos en manejo con insulina subcutánea9 .
Se puede presentar sin síntomas asociados o con síntomas autonómicos como palidez, visión borrosa, sudoración, mareo, entre otros. Los pacientes hospitalizados son vulnerables a presentar descensos en los niveles de azúcar de manera grave y prolongada, ya que por su condición de enfermedad se les dificulta identificar estos primeros signos y síntomas de advertencia18 .
La hipoglucemia se puede clasificar en 3 niveles según su gravedad, de los cuales los niveles 2 y 3 requieren intervención y corrección inmediata. Sin embargo, algunas fuentes también clasifican la hipoglicemia como grave (equivalente a nivel 3) cuando la glicemia se encuentra < 40 mg/dL3
Tabla 5. Clasificación de la hipoglicemia.
Niveles de hipoglucemia.
Nivel 1
Nivel 2
Nivel 3
Glicemia entre 54 y 69 mg/dL.
Glicemia menor a 54 mg/dL.
Alteración del estado mental y/o del funcionamiento físico que requiere asistencia de un tercero para la recuperación.
Nota:Tomado de7


Los principales factores de riesgo para presentar hipoglicemia son la edad avanzada, la falla renal, los cambios en la ingesta de alimentos, interrupción del monitoreo de glucosa, uso de algunos hipoglicemiantes orales, enfermedad grave, insulinoterapia previa y fallos en los ajustes de terapia cuando la glicemia tiende a disminuir o cuando los esteroides están siendo desmontados18 .
La hipoglucemia es una de las mayores barreras para obtener un control glucémico óptimo. En pacientes con diabetes un episodio grave aumenta el riesgo de desarrollar un evento subsecuente. En general, está relacionado con aumento de la estancia hospitalaria de hasta 2.8 días y con pobres desenlaces como eventos adversos cardiovasculares, entre ellos prolongación del intervalo QT, cambios de isquemia en el electrocardiograma, angina, arritmias, entre otros. Además, se ha visto que aumenta la mortalidad y según un estudio de cohorte retrospectivo de más de 2500 pacientes con diabetes hospitalizados en salas generales, esta fue significativamente mayor para los pacientes con al menos un episodio hipoglucémico < 50 mg/dL9,19 .
Un gran número de episodios de hipoglucemias son prevenibles ya que están asociados a iatrogenia, como la prescripción inapropiada de medicaciones hipoglicemiantes o el manejo y seguimiento inadecuado de los episodios de hipoglucemia. Es fundamental que los planes de tratamiento y el contexto del paciente sean revisados y ajustados como método preventivo siempre que se obtenga una glucemia en sangre menor a 70 mg/dL7
La estrategia utilizada para la corrección de hipoglucemia depende de la gravedad del episodio, del estado de consciencia y de la tolerancia a la vía oral del paciente. Si no hay alteración del estado de consciencia y el paciente puede comer, se deben administrar 15 a 30 gramos de azúcar vía oral y monitorizar la glucosa a los 15 minutos, para repetir la dosis en caso de que esta no hubiese aumentado más de 15 mg/dL. Si el paciente tiene alteración del estado de conciencia o se encuentra alerta pero no puede comer, se debe administrar un bolo de dextrosa (DAD) al 10% de 150-250 cc.


De persistir sin vía oral, debe considerarse el uso de infusión de dextrosa posterior como flujo metabólico. Finalmente, si el paciente se encuentra con compromiso del estado de consciencia y no cuenta con acceso venoso se debe administrar 1 mg de glucagón intramuscular y repetir en máximo 1 ocasión. Los controles de glucometrías deben realizarse cada 15 a 20 minutos hasta que la glicemia se encuentre mayor a 80 mg/dL, en caso de que esto no suceda se debe repetir la medida inicial3,7,18 .
Hiperglicemia o diabetes por esteroide
Los corticosteroides son un grupo de medicamentos ampliamente formulados por sus múltiples efectos terapéuticos, entre ellos funcionar como antiinflamatorios y moduladores del sistema inmune. Sin embargo, es importante reconocer que estos fármacos pueden ocasionar alteraciones a nivel hormonal y metabólico como la disminución de la sensibilidad periférica a la insulina, el aumento de la gluconeogénesis hepática, predisposición la resistencia a la insulina en el metabolismo de ácidos grasos y en el tejido adiposo e inhibición de la producción y secreción de insulina en el páncreas.
La prevalencia del uso de esteroides en el paciente hospitalizado se ha estimado entre el 10-15% de los pacientes, de los cuales el 56-86% de los casos pueden presentar hiperglucemia independiente de tener o no antecedente conocido de diabetes. Se ha estimado que hasta el 18.6% puede desarrollar diabetes. La presencia de hiperglucemia durante la hospitalización es un factor de riesgo para estancias prolongadas, complicaciones infecciosas, aumento de la mortalidad y resultados quirúrgicos no favorables7,20,21 .
La hiperglucemia inducida por esteroides se define como un aumento anormal en los niveles de glucosa después del uso de esteroides en pacientes con o sin diabetes preexistente y sus criterios diagnósticos no difieren con los de otros tipos de diabetes.


En los pacientes que no tienen antecedente de la enfermedad, la hemoglobina glicosilada permitirá diferenciar aquellos que tienen diabetes de novo o prediabetes de base, de quienes es un efecto solamente dependiente de los corticoides20.Los factores de riesgo para presentar hiperglicemia inducida por esteroides pueden ser propios del paciente o estar relacionados con los fármacos administrados.
Tabla 6. Factores de riesgo para desarrollar hiperglucemia por esteroides.
Factores del individuo. Factores farmacológicos.
● Antecedentedediabetes mellitus.
● Factores de riesgo para diabetes: obesidad, historia familiar de diabetes, antecedente de diabetes gestacional, condiciones étnicas,síndrome de ovario poliquístico.
● Glicemia en ayunas alterada o intolerancia aloscarbohidratos previa.
● Antecedentedehiperglucemia inducida por esteroides.
● Administración de otros medicamentosdiabetogénicos (Ej. Tacrolimus).
Nota:Tomado de2
● Potencia ydosisdel medicamento.
● Dosis diaria total queexceda los niveles fisiológicos: Hidrocortisona 20 mg, Prednisolona 5 mg, Metilprednisolona 4 mg, Dexametasona 0.75 mg, Betametasona 0.75 mg.
● Duración del tratamiento.
● Frecuencia de tratamiento.


A los pacientes con dosis superiores a 20 mg de prednisolona (o equivalentes) se les debe monitorear frecuentemente sus niveles de glucemia. Según la Asociación Americana de Diabetes, las metas de los niveles de glucosa en estos pacientes no difieren de aquellos con otro tipo de diabetes y se deben individualizar dependiendo de factores como las comorbilidades, el riesgo de hipoglucemia y la expectativa de vida. En general, las metas son de 140-180 mg/dL, sin embargo, se pueden buscar niveles entre110-140 mg/dL siempre y cuando sean tolerados sin aumentar el riesgo de hipoglucemia7,20
Para iniciar manejo con esteroides a altas dosis en paciente con antecedente de diabetes, es fundamental conocer la hemoglobina glicosilada de los últimos 3 meses, con el fin de evaluar el control metabólico previo. Sin embargo, en quienes tengan alto riesgo, pero no la padezcan no se recomienda su medición de manera rutinaria, sino que se hará vigilancia de las glucometrías y solo en caso de estar alteradas será necesario medir la hemoglobina glicosilada como se expuso previamente para excluir diabetes preexistente. El monitoreo en pacientes diabéticos debe realizarse cuatro veces al día y en quienes no tengan el antecedente mínimo una vez al día al iniciar los esteroides, en caso de que se encuentren niveles por encima de 200 mg/dl se debe aumentar a 4 veces al día7,20,21 .
El inicio de la terapia para reducir la glucosa en sangre se recomienda cuando la glucosa pre y post prandial exceda repetidamente los 140 mg/dL [7.8 mmol/L] o 200 mg/dL [11.1 mmol/L], respectivamente. Existe un mayor riesgo de hipoglucemia, especialmente cuando las dosis de esteroides se reducen o se omiten comidas.
Usualmente los glucocorticoides de acción intermedia como la prednisona alcanzan su pico en sangre entre las 4 y 6 horas luego de su administración. Bajas dosis de esteroide en la mañana tienden a elevar la glicemia al final de la mañana y en la tarde, por lo que el objetivo será controlar estos valores elevados para evitar la hipoglicemia en la noche y en ayunas7,8


La elección del esquema de insulina a usar dependerá de la vida media del esteroide y el esquema de dosificación. La insulina NPH puede ser una buena alternativa a las insulinas de larga acción, por su vida media y farmacocinética en este escenario.
Tabla 7. Corticoides, su vida media y pico de acción y dosis recomendada de insulina cuando se presentan hiperglucemias persistentes.
Vida media. Glucocorticoides. Pico de acción en plasma (min). Dosis inicial recomendada
Corta acción Hidrocortisona 10 0.1 UI/kg
Acción intermedia Prednisona/prednisolona, metilprednisolona. 60-180, 60 10mg: 0.1UI/kg
20mg:0.2UI/kg
30mg: 0.3UI/kg
Larga acción Dexametasona 60-120 0.3UI/kg
Nota:Tomado de20
En los pacientes que usaban previamente insulina, se recomienda aplicar la dosis de insulina en la mañana, aumentar la dosis total de insulina diaria y según los valores del monitoreo considerar ajustar las dosis de insulina de acción rápida antes del almuerzo y la comida.
Por último, es fundamental realizar los ajustes necesarios de insulina a medida que se titulan o desmontan los glucocorticoides. Una vez retirados completamente los medicamentos, los pacientes con diabetes inducida por esteroides pueden resolver su condición. Se recomienda realizar una prueba de tolerancia oral a la glucosa 6 semanas luego de terminados los medicamentos o un test de HbA1c a los tres meses, ya que algunos permanecerán con diabetes a mediano o largo plazo8


Manejo perioperatorio
En el período perioperatorio es importante realizar ajustes en el manejo y seguimiento de la hiperglicemia. En primer lugar, se debe estimar el riesgo cardiovascular para planear adecuadamente el procedimiento quirúrgico. Para procedimientos electivos, se recomiendan metas de HbA1c <8%10 . Los objetivos de glicemia no están claramente establecidos de manera perioperatoria, sin embargo, no deben ser muy estrictos dado el alto riesgo de hipoglicemia, se recomiendan de manera general valores entre 100-180 mg/dL. Los controles deben realizarse cada 2 a 4 horas si el paciente se encuentra sin vía oral y cada 1 a 2 horas durante el procedimiento. Además, en pacientes con insulina IV o aquellos en regímenes de insulina, pero con restricción de la vía oral debe considerarse la administración de líquidos endovenosos que contengan dextrosa7,22
En cuanto al manejo farmacológico, es importante realizar algunos ajustes para evitar las grandes excursiones en la glicemia durante el período de ayuno. En general se recomienda:7,22
● Suspender la metformina el día del procedimiento quirúrgico por el riesgo de hipovolemia, aumento de acidosis láctica e hipoxia tisular durante la cirugía.
● Descontinuar los SGLT-2 de 3 a 4 días previos al procedimiento por su asociación con hipovolemia y cetoacidosis diabética euglucémica.
● Suspender los agonistas del receptor GLP-1 y otros agentes orales el día del procedimiento. En caso de utilizar GLP-1 con dosificación semanal esta debe suspenderse desde la semana anterior.
● Administrar la mitad de la dosis de insulina NPH o el 75-80% de la dosis de insulina de las insulinas análogas de larga acción o ajustar las bombas de insulina según el tipo de diabetes y el criterio médico.
● Reducir el 25% de la dosis de insulina basal administrada en la noche del día anterior al procedimiento favorece lograr las metas de glucosa perioperatoria sin aumentar el riesgo de hipoglicemia.
● No administrar insulina prandial o correctiva mientras el paciente esté sin vía oral.


1. Carga de enfermedad por diabetes [Internet]. Paho.org. [citado el 20 de marzo de 2024]. Disponible en: https://www.paho.org/es/enlace/carga-enfermedad-por-diabetes
2. Román-Gonzalez A, Cardona A, Gutiérrez J, Palacio A. Manejo de pacientes diabéticos hospitalizados. Rev Fac Med. 1 de julio de 2018;66(3):385-92.
3. Razavi Nematollahi L, Omoregie C. Updates on the Management of Hyperglycemia in Hospitalized Adult Patients. Endocrines. 20 de julio de 2023;4(3):521-35.
4. Seisa MO, Saadi S, Nayfeh T, Muthusamy K, Shah SH, Firwana M, et al. A Systematic Review Supporting the Endocrine Society Clinical Practice Guideline for the Management of Hyperglycemia in Adults Hospitalized for Noncritical Illness or Undergoing Elective Surgical Procedures. The Journal of Clinical Endocrinology & Metabolism. 14 de julio de 2022;107(8):2139-47.
5. Malcolm J, Halperin I, Miller DB, Moore S, Nerenberg KA, Woo V, et al. In-Hospital Management of Diabetes. Canadian Journal of Diabetes. abril de 2018;42:S115-23.
6. Kodner C, Anderson L, Pohlgeers K. Glucose Management in Hospitalized Patients. Am Fam Physician. 15 de noviembre de 2017;96(10):648-54.
7. American Diabetes Association Professional Practice Committee. 16. Diabetes Care in the Hospital: Standards of Care in Diabetes-2024. Diabetes Care. 1 de enero de 2024;47(Suppl 1):S295-306.
8. Bernal E. Manejo del paciente diabético hospitalizado. En: XX Actualización en Medicina Interna. 20.a ed. Medellín: Universidad de Antioquia. Facultad de Medicina. Departamento de Medicina Interna; 2020. p. 143-57.
9. Lansang MC, Umpierrez GE. Inpatient hyperglycemia management: A practical review for primary medical and surgical teams. Cleve Clin J Med. mayo de 2016;83(5 Suppl 1):S34-43.


10. Korytkowski MT, Muniyappa R, Antinori-Lent K, Donihi AC, Drincic AT, Hirsch IB, et al. Management of Hyperglycemia in Hospitalized Adult Patients in Non-Critical Care Settings: An Endocrine Society Clinical Practice Guideline. The Journal of Clinical Endocrinology & Metabolism. 14 de julio de 2022;107(8):2101-28
11. Lansang MC, Umpierrez GE. Inpatient hyperglycemia management: A practical review for primary medical and surgical teams. Cleve Clin J Med. mayo de 2016;83(5 Suppl 1):S34-43.
12. Umpierrez GE, Smiley D, Zisman A, Prieto LM, Palacio A, Ceron M, et al.
Randomized Study of Basal-Bolus Insulin Therapy in the Inpatient Management of Patients With Type 2 Diabetes (RABBIT 2 Trial). Diabetes Care. 1 de septiembre de 2007;30(9):2181-6.
13. Umpierrez GE, Smiley D, Jacobs S, Peng L, Temponi A, Mulligan P, et al.
Randomized Study of Basal-Bolus Insulin Therapy in the Inpatient Management of Patients With Type 2 Diabetes Undergoing General Surgery (RABBIT 2 Surgery). Diabetes Care. 1 de febrero de 2011;34(2):256-61.
14. Inzucchi SE. Management of diabetes mellitus in hospitalized patients [Internet]. 2024 [cited 2024 Mar]. Available from: https://www.uptodate.com/contents/management-of-diabetes-mellitus-in-hospitalized-pat ients.
15. Builes-Montaño CE. Tratamiento de la Diabetes Mellitus con insulina en personas con enfermedades renal crónica terminal. En: XXI Actualización Medicina Interna. 21.a ed. Medellín: Universidad de Antioquia. Facultad de Medicina. Departamento de Medicina Interna; 2021. p. 191-7.
16. Chang LL, Umpierrez GE, Inzucchi SE. Management of Hyperglycemia in Hospitalized, Non–Critically Ill Adults. N Engl J Med. 15 de septiembre de 2022;387(11):1040-2.
17.Pasquel FJ, Lansang MC, Dhatariya K, Umpierrez GE. Management of diabetes and hyperglycaemia in the hospital. The Lancet Diabetes & Endocrinology. marzo de 2021;9(3):174-88.


18.McCall AL, Lieb DC, Gianchandani R, MacMaster H, Maynard GA, Murad MH, et al. Management of Individuals With Diabetes at High Risk for Hypoglycemia: An Endocrine Society Clinical Practice Guideline. The Journal of Clinical Endocrinology & Metabolism. 15 de febrero de 2023;108(3):529-62.
19. Brodovicz KG, Mehta V, Zhang Q, Zhao C, Davies MJ, Chen J, et al. Association between hypoglycemia and inpatient mortality and length of hospital stay in hospitalized, insulin-treated patients. Current Medical Research and Opinion. febrero de 2013;29(2):101-7.
20.Aberer F, Hochfellner DA, Sourij H, Mader JK. A Practical Guide for the Management of Steroid Induced Hyperglycaemia in the Hospital. JCM. 16 de mayo de 2021;10(10):2154.
21. Barker HL, Morrison D, Llano A, Sainsbury CAR, Jones GC. Practical Guide to Glucocorticoid Induced Hyperglycaemia and Diabetes. Diabetes Ther. mayo de 2023;14(5):937-45.
22. Khan N, Ghali W, Cagliero E. Perioperative management of blood glucose in adults with diabetes mellitus [Internet]. 2023 [cited 2024 Mar]. Available from: https://www.uptodate.com/contents/perioperative-management-of-blood-glucose-in-adult s-with-diabetes-mellitus?search=perioperative+management+of+blood+glucose&source =search_result&selectedTitle=1~150&usage_type=default&display_rank=1#H36402071 72





Jorge Alejandro Pamplona Tobón1 , David Osorio Álvarez2 , Natalia Zapata Hincapié3
1.Médico General, Universidad CES. Médico general de Hospitalización Hospital Pablo Tobón Uribe.
2.Médico General, Universidad CES. Médico general de apoyo especialidad cirugía plástica, Clínica CES.
3.Médica Internista, Universidad Pontificia Bolivariana. Jefe Sección Medicina Interna, Hospital Pablo Tobón Uribe.
Resumen
La disnea es una condición muy prevalente que se presenta en todos los servicios de hospitalización. Ésta se define como una experiencia subjetiva de dificultad para respirar. Su evaluación puede representar un reto para el médico ya que al ser un síntoma varía según cada paciente, y puede estar presente en múltiples patologías de diferentes sistemas como el cardiovascular, respiratorio, incluso manifestación de alteraciones a nivel central o metabólicas. Sin embargo, se pueden utilizar diferentes signos clínicos que, sumados a una construcción juiciosa de la historia clínica, pueden orientar la evaluación clínica para llegar a un diagnóstico y así poder ofrecer un tratamiento para aquella condición que se manifiesta en disnea. En el siguiente capítulo se definirá que es la disnea y se ofrecerán diferentes claves que ayudarán al evaluador a enfocar el diagnóstico dentro del marco de las patologías más frecuentes que se pueden presentar en el ámbito hospitalario.
Palabras Clave
Disnea, sistema cardiovascular, sistema respiratorio, dificultad respiratoria.


Introducción
El término "disnea" viene del griego "dyspnoia" que significa etimológicamente la dificultad para respirar. La American Thoracic Society (ATS) define este término como una experiencia subjetiva de incomodidad respiratoria que consiste en sensaciones cualitativamente distintas cuya intensidad es variable. Tal experiencia se debe a interacciones entre múltiples factores fisiológicos, psicológicos, sociales y ambientales, y puede inducir respuestas fisiológicas y conductuales secundarias1-3
Como lo define la ATS, es un síntoma que depende de la percepción subjetiva de cada paciente, sin embargo, se puede hacer uso de diferentes signos medibles que otorgan objetividad y orientan al evaluador sobre la posible etiología, para así realizar un diagnóstico y poder ofrecer un manejo adecuado. Según su temporalidad se puede considerar como disnea aguda, si se presenta de horas a días y crónica si se presenta en un periodo mayor de cuatro a ocho semanas. En casos específicos se presenta una agudización de síntomas crónicos4 .
El enfoque de esta condición requiere un abordaje juicioso de todos los elementos de la historia clínica para así tratar aquello que aqueja al paciente. En este capítulo se hará énfasis en aspectos clave que ayuden a orientar al lector en determinar la etiología y tratamiento de la dificultad respiratoria en el paciente hospitalizado.
Fisiopatología
La disnea es la manifestación de un disbalance en la homeostasis del cuerpo principalmente atribuible al sistema cardiovascular o al sistema respiratorio. Teniendo también en cuenta las alteraciones metabólicas, desórdenes neuromusculares o causas psicógenas1. Si bien hay múltiples mecanismos involucrados que pueden conducir a la sensación de "hambre de aire" y el aumento del trabajo respiratorio, es importante


ilustrar los mecanismos fisiopatológicos más comunes que pueden desencadenar en la disnea1-3
La sensación de falta de aire se deriva del aumento de la necesidad de respirar por estímulos que perciben los quimiorreceptores, como la disminución de la concentración de oxígeno y el exceso de dióxido de carbono, acidemia, inflamación del intersticio pulmonar y alteraciones vasculares. En el aparato respiratorio también hay mecanorreceptores sobre todo en la vía aérea, pulmones y pared torácica que perciben cambios como la tensión y la relajación de los músculos de la pared torácica. Estas señales aferentes se envían al tallo y a la corteza sensorial para luego enviar una respuesta por vía eferente para realizar cambios en el sistema respiratorio y cardiovascular que ayude a corregir el desbalance5,6
El paciente percibe las señales aferentes como disnea y el clínico utiliza los signos derivados de la respuesta a estos estímulos para enfocar el diagnóstico y guiar el tratamiento.
Importancia
La disnea es uno de los síntomas más comunes a los que se puede enfrentar el médico a la hora de evaluar un paciente tanto en un contexto ambulatorio como intrahospitalario.
El 90% de los pacientes con disnea tienen una etiología sea respiratoria o cardiovascular, siendo los principales: asma, insuficiencia cardiaca, síndrome coronario agudo, enfermedades pulmonares obstructivas crónicas, neumonía y desórdenes psicológicos1,2 .


La evaluación de este síntoma en los pacientes hospitalizados juega un papel fundamental en su evolución intra y extrahospitalaria, ya que se ha demostrado que la presencia de disnea en los pacientes es en sí un predictor de mayor mortalidad en comparación a los pacientes que no reportan este síntoma al ingreso de la hospitalización7 .
Evaluación e historia clínica
El paciente hospitalizado puede utilizar los siguientes términos para referirse a disnea: "me falta el aire", "me ahogo", "no puedo respirar", "estoy asfixiado", entre otros. El reconocimiento de este síntoma es el primer paso para una adecuada evaluación de este. Posterior al reconocimiento del síntoma es importante determinar el grado de "urgencia" haciéndose preguntas clave que permitan enfocar la condición del paciente, como lo son: ¿hace cuánto tiempo comenzaron los síntomas?, ¿hay algún desencadenante claro?, ¿qué tan severos son los síntomas?, ¿esta condición es antigua o de reciente aparición?2,8
Se deben identificar los "signos de alarma" que nos pueden indicar que el paciente tiene una condición que amenace la vida y requiera del traslado a una unidad de alta dependencia. Dentro de estos signos clínicos, podemos evidenciar: hipotensión (presión arterial menor de 90 mmHg), taquipnea (mayor de 20 respiraciones por minuto), alteración del estado mental, bajo oxígeno en la sangre, cianosis (coloración violácea en mucosas o piel), estridor (sólido fuerte al respirar), dificultad y esfuerzo ventilatorio, desviación de tráquea, ausencia de ruidos pulmonares, arritmia inestable, dolor torácico, entre otras2,8
En caso de identificar una de las condiciones previamente mencionadas en el paciente hospitalizado, se debe proceder rápidamente a estabilizar al paciente y trasladarlo a


una unidad de alta dependencia para una vigilancia estrecha y tratar la condiciones que amenacen la vida2
Una vez se estabilice al paciente o se descarte la necesidad de estas medidas, se puede evaluar la disnea del paciente. Lo primero que se debe determinar es si el síntoma se origina de novo o es secundaria a una patología de base de origen cardiovascular, pulmonar, neuromuscular, o psicológico cuyos síntomas se estén empeorando2. A la hora de hablar en el contexto de un paciente hospitalizado, es aún más relevante evaluar el motivo por el cual está hospitalizado y contrastarlo con el nuevo síntoma que presenta el paciente. Dentro de las diversas etiologías que pueden desencadenar la disnea, se hará énfasis en las causas respiratorias y cardiovasculares más comunes como se muestra en la tabla 1.
Tabla 1. Principales causas de disnea aguda en paciente hospitalizado.
Sistema respiratorio
Sistema cardiovascular
Atelectasiaspulmonares
Neumonía nosocomial
EPOC exacerbada
Derrame pleural
Insuficienciacardiacaagudizada
Tromboembolismo pulmonar
Nota: Elaboración propia. EPOC: Enfermedad pulmonar obstructiva crónica.
En la historia clínica deben quedar registradas todas las características del síntoma que se está evaluando. Se debe ampliar en las características del síntoma, preguntando sobre su inicio, insidioso o súbito; duración, severidad, síntomas asociados como tos seca o con esputo, náuseas, fiebre, cefalea, dolor torácico pleurítico o anginoso; y establecer antecedentes relevantes que orienten hacia patologías del sistema respiratorio, cardiovascular u otro, teniendo en cuenta las causas no respiratorias como


la anemia, trastorno metabólico o intoxicación.
Se debe evaluar establecer claramente el motivo de hospitalización del paciente y evaluar la relación de este con la aparición de la disnea, por ejemplo, en el caso de un paciente hospitalizado por una enfermedad pulmonar obstructiva crónica descompensada que inicia nuevamente con disnea, fiebre y malestar general, se podría sospechar infección pulmonar.
En el examen físico se deben buscar claves que ayuden al clínico a esclarecer el diagnóstico y dejarlo consignado en la historia clínica. Se deben considerar los signos vitales como la temperatura, la frecuencia cardiaca, frecuencia respiratoria, saturación de oxígeno, presión arterial y dolor. La taquipnea y desaturación puede indicar hipoxia, la taquicardia es un signo común en tromboembolismo pulmonar (TEP) y la temperatura elevada puede encontrarse en los casos de neumonía. Palpar y auscultar el tórax y abdomen son parte importante del examen físico. En la auscultación de tórax se pueden identificar crépitos, roncus y estertores, además de aumento o disminución de los ruidos respiratorios. En la palpación en tórax puede haber hallazgos de enfisema subcutáneo y en la percusión matidez o timpanismo. La inspección en cuello es relevante para identificar ingurgitación yugular o signos de sobrecarga que se asocia con el edema en las extremidades inferiores, como en el paciente con falla cardiaca descompensada2,8
En el ejemplo mencionado previamente acerca del paciente con enfermedad pulmonar obstructiva crónica (EPOC) que comienza con fiebre y disnea, los hallazgos de taquicardia, taquipnea, desaturación, aumento del esfuerzo respiratorio, auscultación con crépitos y estertores, percusión mate, pueden orientar más hacia el diagnóstico. En la tabla 2 se muestra como hay claves clínicas que pueden orientar a ciertas patologías2,8



Ayudas diagnósticas
Aun cuando la historia clínica es esencial para acercarse a determinar la etiología del episodio de disnea, el uso de ayudas diagnósticas está indicado a la hora de esclarecer impresiones diagnósticas. Cada vez que se solicite alguna ayuda diagnóstica, debe estar orientada hacia un fin. Se parte de una historia clínica completa y un examen físico adecuado para elegir la ayuda diagnóstica indicada. Como se describe en la tabla 3, se muestra una guía para la elección de cada ayuda diagnóstica según los diagnósticos diferenciales que se tratan en este capítulo.


Tabla 3. Ayudas diagnósticas
Ayuda Diagnóstica Información general Principales usos
Radiografía de tórax Útil para el abordaje inicial de la mayoría de patologías de origen pulmonar. Puede dar pistas sobre el tamaño del corazón. Tiene baja exposición a radiación.
Tomografía axial computarizada.
Puede ofrecer una imagen más detallada que la radiografía de sistema cardiorrespiratorio que orienta y confirma el diagnóstico en algunas patologías. Es menos disponible que otras ayudas imagenológicas y puede aportar más radiación al paciente.
Ultrasonografía Ideal para un abordaje inicial de causas potencialmente mortales en pacientes inestables. Hay diferentes protocolos que permiten que se pueda utilizar para un diagnóstico de patologías tanto del sistema respiratorio como cardiovascular. No tiene radiación pero varía según el observador.
Electrocardiograma Principal ayuda diagnóstica para el enfoque de disnea de origen cardiaco. Es rápido y ampliamente disponible.
Dímero - D Es un derivado de la actividad fibrinolítica, tiene alto valor predictivo negativo para descartar ciertas patologías en caso de ser negativo.
Troponinas Marcador serológico de daño miocárdico. Se utiliza para enfocar diagnóstico hacia patología cardiaca o para predecir mayor peores desenlaces en algunas patologías.
Hemograma completo Exámen ampliamente disponible en la mayoría de servicios de hospitalización, puede aportar información valiosa sobre la hemoglobina y hematocrito; además puede indicar en algunos casos infección.
Neumonía
Atelectasias
Derrame pleural
Neumotórax
Neumonía
Atelectasias
Derrame pleural
Neumotórax
TEP Falla cardiaca
Falla cardiaca
Taponamiento cardiaco
Derrame pleural
IAM Falla cardiaca TEP
TEP
IAM TEP
Neumonía Anemia
Gases arteriales Puede aportar información valiosa sobre la oxigenación del paciente (PaO2) y enfocar trastornos ácido - base. Trastornos ácidobase
Nota: Elaboración propia basada en8 EPOC: enfermedad pulmonar obstructiva crónica; IAM: infarto agudo de miocardio; TEP: tromboembolismo pulmonar; PaO2: presión arterial de oxígeno.


Enfoque
Teniendo en cuenta los elementos los antecedentes del paciente, su motivo de hospitalización, la adecuada evaluación de las características de la disnea y los síntomas asociados, se puede orientar el examen físico para construir una sospecha diagnóstica y en caso de ser necesario, realizar ayudas diagnósticas pertinentes que aclaren el diagnóstico, para poder ofrecer un tratamiento específico. En la tabla 4 se resume el enfoque del paciente en el contexto de hospitalización basado en las etiologías discutidas en este capítulo.
Tabla 4. Enfoque de la disnea en paciente hospitalizado.




AngioTAC: angiografía por tomografía axial computarizada; BNP: péptido natriurético cerebral; ECG: electrocardiograma; NT-proBNP: N-terminal propéptido natriurético cerebral; PCR: proteína C reactiva; TAC: tomografía axial computarizada; DX: Diagnósticas . Nota: Elaboración propia.


Causas pulmonares
Atelectasia
Generalidades
Más común en período postoperatorio, asociado con factores relacionados con intervenciones como ventilación mecánica, posición del pacientes y anestésicos9-12 , se a hasta en el 90% de paciente anestesiados12, y hasta en un 75% en paciente a los que se les realiza bloqueo neuromuscular11
Tienen mayor riesgo de presentar atelectasias10-13 .
- Permanecer en decúbito o semirrecostado
- Edades tempranas, especialmente bebés y menores de 3 años
- Edad avanzada por mayor prevalencia de comorbilidades
- Hipertensión abdominal
- Fumadores
- Aspiración crónica
- Comorbilidades (condiciones que aumenten exceso de moco): bronquitis, alteraciones diafragmáticas, inflamación pulmonar y/o edema, fibrosis quística, obesidad (Índice de masa corporal >25 kg/m2).
Clínica
Puede variar desde asintomático hasta síndrome de dificultad respiratoria (SDRA)9 Los síntomas aparecen usualmente con atelectasias masivas y agudas (11). Los típicos síntomas son dolor pleurítico, tos y disnea9,11. En cuanto a las postoperatorias, la presentación clínica típica es el conjunto de fiebre, taquipnea, taquicardia e incapacidad para realizar inspiración profunda14 , caso de fiebres altas pueden indicar infección activa y progresión a neumonía11 .
El examen físico usualmente es normal, aunque puede incluir:11,14
- Estertores basales.
- Murmullo vesicular disminuido o ausente en área afectada según grado de compromiso bronquial.


- Matidez localizada (el colapso pulmonar completo puede producir hiperresonancia en lado no afectado).
- Disminución de excursión de hemidiafragma.
- Disminución de frémito táctil o vocal.
- Desviación traqueal ipsilateral.
- Cianosis en casos severos.
Diagnóstico
Sospechar en paciente con signos de hipoxemia y otros hallazgos sugestivos de atelectasia, teniendo en cuenta los factores de riesgo descritos. El diagnóstico típico es con imagen, usualmente el primer recurso es la radiografía de tórax, encontrando elevación del hemidiafragma, desplazamiento de cisuras interlobares, apilamiento de la vasculatura pulmonar en el lóbulo afectado, con expansión compensatoria en el lóbulo no afectado, desplazamiento mediastínico o hiliar hacia el área de atelectasia, signo de la silueta (desaparición del límite aire-tejido entre el pulmón y la estructura adyacente si el pulmón densamente atelectásico se opone a otra estructura), opacificación del segmento o lóbulo, sobreinflación compensatoria del pulmón no afectado, enfisema en el pulmón adyacente a la atelectasia10,12
El diagnóstico definitivo se realiza con tomografía computarizada (TAC)12 .
Tratamiento
Hacer énfasis en estrategias de prevención y tratamiento temprano para revertir atelectasias. La meta es restaurar la capacidad funcional residual, se debe tener en cuenta la causa de la atelectasia y tratarla, además de las comorbilidades11,12 .
Se debe buscar restaurar la permeabilidad de la vía aérea combinando succión (en vía aérea ocluida con secreciones), terapia respiratoria (que combine respiración profunda, tos asistida y percusión torácica), cambios posturales y en casos severos en que la tos o la succión directa no restaura la permeabilidad se puede recurrir a la broncoscopia (en atelectasias de todo el pulmón)11,12. Existen medicamentos coadyuvantes como


mucolíticos (N-acetilcisteína, ambroxol), broncodilatadores, salino hipertónico, entre otros12
● Derramepleural
Generalidades
Se ha reportado una incidencia de hasta 1,5 millones de personas por año en Estados Unidos15 .
Las causas comunes incluyen falla cardíaca, malignidad (cáncer de pulmón y de mama son los más comunes), neumonía bacteriana, tuberculosis, cirrosis, embolismo pulmonar, infecciones virales, postoperatorio de cirugía cardíaca, pancreatitis y pericarditis constrictiva15-17 .
Clínica
Varía según la etiología, pero los pacientes pueden cruzar desde asintomáticos hasta cursar con disnea, tos o dolor pleurítico, tener en cuenta síntomas asociados como fiebre, hemoptisis o pérdida de peso15,16
Los hallazgos al examen físico pueden incluir:15,16 .
- Matidez a la percusión
- Disminución o ausencia de frémito táctil
- Disminución o abolición de murmullo vesicular
- Disminución de frémito vocal y/o resonancia
Diagnóstico
La radiografía de tórax usualmente es suficiente para confirmar la presencia de derrame16. En urgencias cobra utilidad la ecografía en el punto de atención (PoCUS).
Una vez diagnosticado por imagen se inicia búsqueda activa de etiología del derrame pleural, realizando aspiración pleural guiada por ecografía (si es seguro), con análisis de líquido pleural que incluya: conteo celular diferencial, citología, proteínas, lactato


deshidrogenasa (LDH), glucosa, pH y microbiología (tinciones según sospecha, cultivos y antibiograma). Se pueden indicar pruebas adicionales del líquido pleural si estudios iniciales no son concluyentes o si se sospechan condiciones específicas, incluyendo adenosina desaminasa (ADA), albúmina, triglicéridos, colesterol, péptido natriurético cerebral (BNP), creatinina y nitrógeno ureico en sangre (BUN). Los criterios de Light pueden ayudar a diferenciar el derrame exudativo del trasudativo. Los análisis de sangre de rutina para derrames pleurales incluyen proteína sérica total y lactato deshidrogenasa, proteína C reactiva, hemograma completo, pruebas de función renal y hepática y albúmina16
Considerar la TAC si la aspiración diagnóstica no se puede realizar de manera segura, en caso de derrame pleural exudativo no diagnosticado/sospecha de malignidad, o en caso de infección pleural complicada, la tomografía por emisión de positrones (PET-CT) en diagnóstico de malignidad pleural en pacientes con TAC sospechosa o características clínicas y hallazgos histológicos negativos, o si el muestreo invasivo no es una opción16
La toracoscopia o biopsia pleural percutánea en sospecha de derrame maligno y otras pruebas no son concluyentes. Finalmente, la broncoscopia diagnóstica puede estar indicada para pacientes con hemoptisis o sospecha de obstrucción bronquial17 .
Tratamiento
Aspiración de grandes volúmenes puede ayudar a aliviar síntomas relacionados a derrames grandes, en caso de pacientes con dificultad respiratoria significativa o descompensación hemodinámica realizar toracocentesis emergente. Posterior a esto se realiza manejo específico según causa de base15 .
● Neumoníanosocomial
Generalidades
Definida como la neumonía adquirida a las 48 horas o más después de la admisión hospitalaria en pacientes no ventilados.


Es la segunda infección nosocomial más frecuente en los Estados Unidos (USA), después de la infección del tracto urinario (ITU), encontrándose en 5-10 pacientes de cada 1000 ingresos hospitalarios19. La incidencia puede ir desde <1% de todos los ingresos, hasta el 8-10% de los ingresos de pacientes geriátricos21. La prevalencia de los agentes etiológicos varía según el hospital, las infecciones bacterianas más comunes son Klebsiella pneumoniae, Enterobacter, Escherichia coli y Serratia, Staphylococcus aureus (>50% en USA son meticilino resistentes), Pseudomonas aeruginosa, especies de Acinetobacter, Haemophilus influenzae, Streptococcus pneumoniae, Legionella pneumophila, entre otros. Las infecciones fúngicas son más comunes en inmunocomprometidos, y en el caso de la infecciones virales el 70% son por influenza, parainfluenza, adenovirus y virus sincitial respiratorio (VSR), las tasas de infecciones por SARS-CoV-2 aún no son claras25
Clínica
Usualmente se presentan con fiebre de novo, expectoración purulenta o aumento de secreciones, tos de novo o empeoramiento, disnea y/o taquipnea, desaturación con aumento de los requerimientos de oxígeno, y alteración del estado de conciencia en ≥ 70 años.
Al examen físico se evaluará:19-20
- Signos vitales: fiebre o hipotermia, hipotensión o alteración del estado de consciencia (puede indicar sepsis), hipoxemia, taquipnea y aumento del trabajo respiratorio.
- A la auscultación pulmonar: estertores, crépitos, roce pleural.
Diagnóstico
El Centro para el Control y la Prevención de Enfermedades (CDC) establece los siguientes criterios diagnósticos para neumonía:20
· Imagen:
Requiere 2 radiografía de tórax seriadas con al menos uno de los siguientes hallazgos infiltrados, consolidación, cavitación, sean nuevos y persistentes o progresivos y


persistentes (en paciente sin enfermedad pulmonar o cardíaca de base es aceptable 1 sola imagen).
Signos y síntomas:
Requiere al menos 1 de los criterios clínicos + 2 o más de los criterios pulmonares.
· Clínicos:
Fiebre >38° C, leucopenia (<4,000 glóbulos blancos) o leucocitosis (>12,000), y para >70 años la alteración del estado de conciencia sin otra causa.
Criterios pulmonares:
- Expectoración purulenta de novo o cambio en las características del esputo o aumento de secreciones respiratorias.
- Tos o empeoramiento de tos, disnea o taquipnea.
- Estertores o crépitos.
- Empeoramiento de intercambio gaseoso como desaturación, aumento de requerimientos de oxígeno o aumento de la ventilación.
Laboratorio
Se recomienda realizar hemograma completo, panel metabólico básico (función renal y ionograma), de ser posible obtener muestra de tracto respiratorio inferior (muestra de esputo o hisopado) para tinción gram y cultivos, tomar hemocultivos en caso de sepsis (<20% de las neumonías nosocomiales tienen hemocultivos positivos).
Considerar gases arteriales en caso de falla ventilatoria inminente. Otras ayudas a considerar son los antígenos urinarios y PCR para virus respiratorios.
La tomografía de tórax se realiza usualmente si hay una patología pulmonar de base o si se sospechan complicaciones como empiema o absceso pulmonar.
Tratamiento
Se debe seleccionar el manejo antibiótico empírico basados en la epidemiología local, la severidad de la enfermedad y los factores de riesgo para organismos multidrogorresistentes (MDR), y en caso de obtener cultivo de esputo o hemocultivos desescalar terapia según aislamientos18 .


- Para paciente con bajo riesgo de mortalidad (sin choque séptico inminente o necesidad de ventilación mecánica):
- Iniciar manejo con 1 antibiótico que cubra S. aureus meticilino sensible, Pseudomonas y gram negativos, como piperacilina/tazobactam, cefepime, levofloxacina o un carbapenémico.
- En caso de factores de riesgo para S. aureus meticilino resistente añadir vancomicina o linezolid.
- Para pacientes con alto riesgo de mortalidad o que ya han recibido antibiótico en los últimos 90 días, o que tiene factores de riesgo para infección por Pseudomonas o microorganismos MDR.
- Considerar iniciar 2 de los siguientes (1 betalactámico + 1 no betalactámico)
- Betalactámicos: piperacilina/tazobactam, cefepime o ceftazidime, imipenem o aztreonam.
- No betalactámicos: levofloxacina o ciprofloxacina, aminoglucósidos como tobramicina o amikacina.
- Añadir sea vancomicina o linezolid segúnindicación.
La duración usual de la terapia es de 7 días.
● Exacerbación enfermedad pulmonar obstructiva crónica
Generalidades
La mortalidad intrahospitalaria de los pacientes con exacerbaciones de EPOC es aproximadamente del 2,5% en general; la mortalidad por todas las causas en los 5 años siguientes a la hospitalización puede llegar al 50%.
Clínica
Una exacerbación de EPOC se define como empeoramiento de las disnea y/o tos y aumento del esputo en los últimos 14 días. 22 También se puede acompañar de sibilancias23 .


En casos severos pueden tener uso de músculos accesorios, movimiento paradójico de la pared torácica, cianosis central, edema periférico, inestabilidad hemodinámica, signos de falla cardíaca derecha y alteración del estado de conciencia23
Diagnóstico
El diagnóstico es clínico y partiendo del diagnóstico de base de EPOC.
Los paraclínicos como tal ayudan a identificar la causa y severidad de la exacerbación e identificar diagnósticos diferenciales de origen cardíaco y pulmonar. Se pueden incluir:22,23
- Gases arteriales para evaluar la ventilación e hipoxemia.
- Hemograma completo, buscando leucopenia/leucocitosis.
- Proteína C Reactiva (PCR) para considerar infección concomitante.
- Panel metabólico para evaluar electrolitos y alteraciones de la glucemia.
- Radiografía de tórax para descartar nuevos infiltrados.
- Electrocardiograma (ECG) para descartar eventos isquémicos.
- N-terminal propéptido natriurético cerebral (NT-proBNP) o BNP para diferenciar falla cardíaca de exacerbación de EPOC.
Tratamiento
- Agonistas beta-2 de acción corta (SABA) con o sin anticolinérgicos como broncodilatadores iniciales preferidos.
- Iniciar corticosteroides (orales o intravenosos), como prednisolona 40 mg/día por vía oral. La Iniciativa Global para la Enfermedad Pulmonar Obstructiva (GOLD) recomienda una duración de ≤5 días.
- Usar antibióticos en pacientes específicos:
- Pacientes hospitalizados con EPOC con esputo purulento y 1 o más de los siguientes síntomas: aumento de la disnea o de la producción de esputo.
- Considerar iniciarlo en exacerbaciones graves.
- Usualmente se usan por 5 días.


Se selecciona el antibiótico basado en el patrón local de resistencia bacteriana; el tratamiento inicial suele ser una aminopenicilina con ácido clavulánico, un macrólido o una tetraciclina22
Se recomienda la administración de suplementos de vitamina D en pacientes hospitalizados por exacerbación que presenten una deficiencia grave (< 10 ng/mL [< 25 nmol/L])22
Terapiasadicionales:22
- Oxígeno suplementario (cánula nasal, venturi, máscara de no reinhalación).
- Terapiarespiratoria.
- Ventilación mecánica no invasiva (VMNI) en pacientes con gases arteriales con presión parcial arterial de dióxido de carbono (PaCO2) ≥45-48,8 mm Hg, acidosis respiratoria (pH ≤ 7.35), en pacientes con disnea severa con uso de músculos accesorios y movimiento abdominal paradójico y en frecuencias respiratorias mayores a 24 respiraciones por minuto.
Causas Cardiovasculares
● Insuficienciacardíacaaguda
Generalidades
La insuficiencia cardíaca aguda es la causa principal de ingreso hospitalario en pacientes >65 años en países occidentales. La incidencia y prevalencia de falla cardíaca aumenta con la edad25-27 .
Los pacientes con insuficiencia cardíaca descompensada presentan o una insuficiencia cardíaca recién diagnosticada o una descompensación de una insuficiencia cardíaca crónica.
La insuficiencia cardíaca aguda puede deberse a una amplia variedad de causas, entre las que se incluyen las siguientes: disfunción del ventrículo izquierdo secundario a arritmias; sobrecarga de volumen; complicaciones del infarto de miocardio (como ruptura de la pared libre, comunicación interventricular o regurgitación mitral aguda por rotura del músculo papilar); o relacionadas con la medicación (como el exceso de betabloqueo)25-28


Clínica
Los síntomas de la insuficiencia cardíaca aguda se deben a anomalías hemodinámicas que provocan congestión (presentación más frecuente) y/o bajo gasto cardíaco. Los más frecuentes son:25-27
- Disnea paroxística nocturna.
- Ortopnea.
- Disnea de esfuerzo.
- Edema de miembros inferiores.
- Bendopnea.
- Otros: fatiga y ganancia de peso, tos, aumento de perímetro abdominal.
Usualmente en falla cardíaca aguda los pacientes presentan disnea de novo o empeoramiento de ella y fatiga que limita la tolerancia al ejercicio (esfuerzo)24-27 .
Diagnóstico
Sospechar insuficiencia cardiaca aguda en pacientes con síntomas como disnea y/o fatiga, y hallazgos en la exploración como distensión venosa yugular, hipotensión o presión de pulso estrecha, ruido cardiaco S3, estertores y/o edema, que den lugar a evaluación médica nueva en el caso de pacientes hospitalizados, sospechando principalmente en aquellos con diagnóstico previo de falla cardíaca o en aquellos con factores de riesgo para ella24 .
Se deben identificar los posibles factores desencadenantes de la insuficiencia cardiaca aguda, como disfunción ventricular izquierda nueva o agravada, incumplimiento de la medicación y/o la dieta, sobrecarga de volumen, exposición a fármacos, arritmia, valvulopatía y/o hipertensión no controlada24-27 .
Paraclínicos
Se recomienda laboratorios iniciales con hemograma completo, bioquímica sérica, perfil lipídico, pruebas de función hepática, estudios de hierro, hormona estimulante del tiroides y análisis de orina para identificar factores precipitantes y


complicantes y para guiar el tratamiento (considerar la obtención de lactato si se sospecha hipoperfusión).
· Nivel de BNP o de NT-proBNP, especialmente si el diagnóstico es incierto; los niveles más altos aumentan la probabilidad de un diagnóstico de insuficiencia cardiaca, pero los niveles pueden estar elevados debido a otras causas.
ECG de 12 derivaciones para optimizar el manejo y para descartar un posible síndrome coronario agudo como causa potencial de insuficiencia cardiaca u otras causas de insuficiencia cardiaca como arritmias.
· Radiografía de tórax para evaluar edema pulmonar y descartar enfermedad pulmonar de base como posible causa no cardiaca de disnea.
· Ecocardiograma transtorácico para evaluar la función y la estructura cardiaca (especialmente si no se posee uno reciente).
Otros estudios de imagen como resonancia magnética cardiaca, o tomografía cardiaca para evaluar la fracción de eyección ventricular izquierda cuando el ecocardiograma es insuficiente.
· Arteriografía coronaria en susceptibles de revascularización cuando isquemia se sospeche como causa de descompensación.
Tratamiento
- Administrar oxígeno suplementario cuando la saturación de oxígeno por pulsioximetría sea < 90% o presión parcial de oxígeno en sangre arterial (PaO2) < 60 mm Hg.
- Diuréticos de asa (como furosemida 40 mg intravenosa en bolo inicialmente; la dosis inicial debe ser aproximadamente el doble de la dosis diaria habitual del paciente) para tratar los síntomas de sobrecarga.
- Comprobar los electrolitos séricos y la función renal al inicio; volver a comprobar la química sanguínea (especialmente potasio, BUN y creatinina sérica) tras el inicio y los cambios de dosis de diuréticos y/o inhibidores del sistema reninaangiotensina-aldosterona (SRAA).
- Para pacientes que requieren medidas adicionales para promover la diuresis: considerar intensificación de diuresis usando dosis más altas de diuréticos de asa o la


adición de un segundo diurético, reservar la adición de un diurético tiazídico a los que no respondan a dosis moderadas o altas de diuréticos de asa para reducir las anomalías electrolíticas.
- Considerar los vasodilatadores (nitroglicerina o nitroprusiato) como complemento de los diuréticos para aliviar la disnea en ausencia de hipotensión sistémica.
- En casos de disnea significativa a pesar del oxígeno suplementario y la diuresis agresiva:
- Considerar la ventilación con presión positiva no invasiva en pacientes con dificultad respiratoria (frecuencia respiratoria > 25 respiraciones por minuto, saturación de oxígeno por pulsioximetría < 90%).
- Soporte inotrópico:
- Considerar en pacientes con presión arterial sistólica < 90 mm Hg y evidencia de hipoperfusión que no responde al tratamiento estándar (incluyendo una provocación con líquidos).
- Considerar inotrópicos y/o vasopresores en pacientes con bajo gasto cardíaco y evidencia de órganos hipoperfundidos como puente a otras medidas como soporte circulatorio mecánico o trasplante cardíaco.
- Las consideraciones de tratamiento tras la estabilización inicial de la insuficiencia cardiaca aguda se basan en iniciar o continuar el tratamiento óptimo para insuficiencia cardíaca que incluya betabloqueador, un inhibidor del sistema renina-angiotensina, como un inhibidor del receptor de angiotensina-neprilisina, un inhibidor de la enzima convertidora de angiotensina (IECA) o un antagonista del receptor de angiotensina (ARA-II). Además de los antagonistas de los receptores de mineralocorticoides y los inhibidores del cotransportador sodio-glucosa 2 (SGLT2)25,26
● Tromboembolismopulmonar
Generalidades
El tromboembolismo pulmonar representa una obstrucción mecánica de 1 o más ramas de la vasculatura pulmonar, por un coágulo sanguíneo procedente de una trombosis


venosa profunda (TVP). Otros tipos de émbolos menos frecuentes son los émbolos sépticos, los émbolos de aire venoso, los émbolos tumorales y los émbolos grasos29
La incidencia anual de TEP es de aproximadamente 60 por 100.000. Los factores de riesgo de tromboembolia venosa (TEV), incluyen TEV previa, trombofilia, cirugía, cáncer, embarazo, inmovilización, traumatismo, obesidad y acceso venoso central29 .
La prevención de la TEV, es de vital importancia tanto en pacientes médicos como quirúrgicos.
Clínica
Los síntomas pueden ser inespecíficos, incluso algunos pacientes pueden ser asintomáticos. Los síntomas usuales son:29
- Disnea súbita
- Taquipnea
- Dolor pleurítico
- Tos
- Fiebre
- En casos graves
- Otros menos comunes: hemoptisis, dolor/edema en pierna, síncope (36).
Diagnóstico
Sospechar en pacientes con disnea, taquipnea, taquicardia, dolor torácico pleurítico, tos y/o fiebre y realizar una anamnesis y evaluación centradas en descartar factores de riesgo para TEP29 .
La evaluación y diagnóstico varía en función de si el paciente se presenta hemodinámicamente estable o inestable29
- Sospecha de TEP con hipotensión sostenida:
- En los pacientes inestables, se debería realizar angiografía por tomografía computarizada (angioTAC) urgente o una ecocardiografía transtorácica a pie de cama para evaluar la disfunción o sobrecarga del ventrículo derecho.


- Sospecha de TEP sin hipotensión sostenida:
- Evaluar la probabilidad pretest de TEP (ej. escala deWells)
- Si la probabilidad clínica es alta: realizar angioTAC. Considerar la gammagrafía de ventilación/perfusión (V/Q). No realizar prueba de dímero D.
- Si la probabilidad clínica es baja: evaluar los criterios de exclusión de embolia pulmonar (PERC), si cumple todos los criterios PERC, la probabilidad es baja y no es necesario realizar más pruebas; si no cumple los 8 criterios PERC, realizar una prueba de dímero D.
- Si la probabilidad clínica es intermedia, realizar un dímero D ajustado a la edad. Resultados de la prueba del dímero D en pacientes de riesgo bajo o intermedio. Si el dímero D es negativo, no es necesario realizar más pruebas, si es positivo y la probabilidad clínica de TEP es baja o intermedia, realizar angioTAC o considerar gammagrafía pulmonar V/Q
Luego del diagnóstico se debe realizar la estratificación del riesgo incluyendo el índice de severidad del embolismo pulmonar (PESI), presencia de inestabilidad hemodinámica, signos de falla ventricular derecha y troponinas elevadas y según esto se definirá el manejo del paciente29
Se puede considerar realizar hemograma completo, tiempo de tromboplastina parcial (TPT) y tiempo de protrombina (TP)/INR para establecer los valores hematológicos basales antes del tratamiento anticoagulante, a menos que la inestabilidad hemodinámica requiera un tratamiento anticoagulante inmediato29
Dado que la presencia de una trombofilia diagnosticable no suele modificar la duración ni la intensidad de la anticoagulación, las pruebas de trombofilia deben evitarse en la mayoría de los pacientes con TEV (incluida la TEV no provocada). Los pacientes con TEV no provocada deben someterse a pruebas de detección de cáncer según la edad29 .


Tratamiento
Pacientesestables:
- Administrar anticoagulante sin retraso mientras se esperan los resultados de las pruebas diagnósticas en pacientes con probabilidad clínica alta o intermedia. Considerar no administrarlo en baja sospecha clínica mientras se esperan los resultados de las pruebas diagnósticas, siempre que los resultados de las pruebas se esperen en 24 horas.
- Una vez diagnosticado continuar o iniciar anticoagulante según el caso, en el ámbito hospitalario se prefiere iniciar con heparinas de bajo peso molecular (HBPM) según la disponibilidad, además se prefieren las HBPM y fondaparinux en lugar de heparina no fraccionada (HNF).
- Para el egreso se recomienda el uso de anticoagulantes orales directos (DOAC) en lugar de antagonistas de la vitamina K (AVK), si no hay contraindicaciones.
Pacientes de alto riesgo con inestabilidad hemodinámica como choque o hipotensión:
- Tratar el choque si está indicado.
- Iniciar HNF intravenosa en pacientes con TEP de alto riesgo con shock o hipotensión.
- Terapiatrombolítica:
- Trombólisis sistémica, no se recomienda en la mayoría de los pacientes sin hipotensión, se recomienda en pacientes sin alto riesgo hemorrágico hemodinámicamente inestables y se debe considerar en pacientes de riesgo intermedio-alto si aparecen signos clínicos de descompensación hemodinámica.
- Trombólisis dirigida por catéter, sugerida en pacientes con TEP agudo hipotensivo en caso de alto riesgo hemorrágico, trombólisis sistémica fallida y/o shock con probabilidad de muerte antes de que la trombólisis sistémica haga efecto. Se sugiere como alternativa al tratamiento quirúrgico si la trombólisis sistémica está contraindicada o ha fracasado.


- Embolectomía pulmonar quirúrgica: en caso de choque o hipotensión y existe contraindicación para la trombolisis o ésta ha fracasado. Considerar en TEP de riesgo intermedio con evidencia clínica de mal pronóstico y en TEP de riesgo intermedio-alto si el riesgo de hemorragia previsto con la trombolisis es alto.
- Posterior a la estabilización se definirá anticoagulación a largo plazo.
- Filtros de vena cava: no se usan de forma rutinaria si se utiliza un anticoagulante, se considera si la anticoagulación está contraindicada y en caso de recurrencia de TEP a pesar de anticoagulación adecuada29
Conclusión
El paciente hospitalizado tiene alto riesgo de presentar múltiples signos y síntomas, patologías y complicaciones durante su estancia hospitalaria adicional al motivo de su hospitalización. La disnea es un síntoma muy prevalente en estos pacientes, sobre todo si presentan comorbilidades cardiovasculares o del sistema respiratorio. El paciente puede referir dificultad para respirar y este síntoma puede indicar muchas patologías y su abordaje puede ser difícil, sin embargo, por medio de una adecuada historia clínica y un examen físico detallado, se puede llegar a simplificar su abordaje. Es responsabilidad del clínico reconocer los signos y síntomas que presenta el paciente que refiere disnea para realizar un abordaje y tratamiento adecuado.


Referencias
1. Parshall MB, Schwartzstein RM, Adams L, Banzett RB, Manning HL, Bourbeau J, et al. An official American Thoracic Society statement: Update on the mechanisms, assessment, and management of Dyspnea. American Journal of Respiratory and Critical Care Medicine. 2012 Feb 15;185(4):435–52. doi:10.1164/rccm.201111-2042st
2. Coccia, C.B. et al. (2015) ‘Dyspnoea: Pathophysiology and a clinical approach’, South African Medical Journal, 106(1), p. 32. doi:10.7196/samj.2016.v106i1.10324.
3. Baron R.M. Dyspnea. Loscalzo J, & Fauci A, & Kasper D, & Hauser S, & Longo D, & Jameson J(Eds.), [2022] Harrison's Principles of Internal Medicine, 21e. McGraw-Hill Education.https://accessmedicine.mhmedical.com/content.aspx?bookid=3095§ionid= 2635464 95
4. Laviolette L, Laveneziana P. Dyspnoea: A multidimensional and multidisciplinary approach. European Respiratory Journal. 2014 Feb 13;43(6):1750–62. doi:10.1183/09031936.00092613
5. Schwartzstein RM. Approach to the patient with dyspneaKing TE, Dieffenbach P, editors. [Internet]. 2023 [cited 2024 Feb 20]. Available from: https://www.uptodate.com/contents/approach-to-the-patient-with-dyspnea?search=Appr oach+to+the+patient+with+dyspnea&source=search_result&selectedTitle=1~150&usage _type=default&display_rank=1
6. Rao AB, Gray D. Breathlessness in hospitalised adult patients. Postgraduate Medical Journal. 2003 Dec 1;79(938):681–5. doi:10.1093/postgradmedj/79.938.681
7. Stevens JP, Dechen T, Schwartzstein RM, O’Donnell CR, Baker K, Banzett RB.
Association of dyspnoea, mortality and resource use in hospitalised patients. European Respiratory Journal. 2021 Mar 2;58(3):1902107. doi:10.1183/13993003.02107-2019
8. DeVos E, Jacobson L. Approach to adult patients with acute dyspnea. Emergency Medicine Clinics of North America. 2016 Feb;34(1):129–49. doi:10.1016/j.emc.2015.08.008
9. Zeng C, Lagier D, Lee JW, Vidal Melo MF. Perioperative Pulmonary Atelectasis: Part I. Biology and Mechanisms. Anesthesiology. 2022 Jan 1;136(1):181-205. doi: 10.1097/ALN.0000000000003943. PMID: 34499087; PMCID: PMC9869183.


10. Lagier D, Zeng C, Fernandez-Bustamante A, Vidal Melo MF. Perioperative Pulmonary Atelectasis: Part II. Clinical Implications. Anesthesiology. 2022;136(1):206-236. doi:10.1097/ALN.0000000000004009
11. Marini JJ. Acute Lobar Atelectasis. Chest. 2019;155(5):1049-1058. doi:10.1016/j.chest.2018.11.014
12. Duggan M, Kavanagh BP,Warltier DC. Pulmonary Atelectasis. Anesthesiology. 2005 Apr 1;102(4):838–54. doi:10.1097/00000542-200504000-00021
13. Woodring JH, Reed JC. Types and mechanisms of pulmonary atelectasis. Journal of Thoracic Imaging. 1996;11(2):92–108. doi:10.1097/00005382-199621000-00002
14. Gibb KA, Carden DL. Atelectasis. Emergency medicine clinics of North America.. 1983 Aug;1(2):371-8. PMID: 6394292.
15. Saguil A, Wyrick K, Hallgren J. Diagnostic approach to pleural effusion. American family physician. 2014 Jul 15;90(2):99-104. PMID: 25077579.
16. Porcel JM, Light RW. Pleural effusions. Disease-a-Month. 2013 Feb;59(2):29–57. doi:10.1016/j.disamonth.2012.11.002
17. Roberts ME, Rahman NM, Maskell NA, Bibby AC, Blyth KG, Corcoran JP, et al. British Thoracic Society Guideline for pleural disease. Thorax. 2023 Jul;78(Suppl 3):s1-s42. doi: 10.1136/thorax-2022-219784. PMID: 37433578.
18. Kalil AC, Metersky ML, Klompas M, Muscedere J, Sweeney DA, Palmer LB, et al. Management of adults with hospital-acquired and ventilator-associated pneumonia: 2016 clinical practice guidelines by the Infectious Diseases Society of America and the American Thoracic Society. Clinical Infectious Diseases. 2016 Jul 14;63(5). doi:10.1093/cid/ciw353
19. American Thoracic Society, Infectious Diseases Society of America. G1. Guidelines for the management of adults with hospital-acquired, ventilator-associated, and healthcare-associated pneumonia. American Journal of Respiratory and Critical Care Medicine. 2005 Feb 15;171(4):388–416. doi:10.1164/rccm.200405-644st
20. Centers for Disease Control and Prevention (CDC). National Healthcare Safety Network (NHSN) Patient Safety Component Manual. CDC 2020 Jan PDF


21. Rothan‐Tondeur M, Meaume S, Girard L, Weill‐Engerer S, Lancien E, Abdelmalak S, et al. Risk factors for nosocomial pneumonia in a geriatric hospital: A control‐case one‐center study. Journal of the American Geriatrics Society. 2003 Jul;51(7):997–1001. doi:10.1046/j.1365-2389.2003.51314.x
22. Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global Strategy for Prevention, Diagnosis and Management of COPD: 2023 Report.
23. Evensen AE. Management of COPD exacerbations. American family physician. 2010 Mar 1;81(5):607-13. Erratum in: American family physician. 2010 Aug 1;82(3):230. PMID:20187597
24. Heart Failure Society of America; Lindenfeld J, Albert NM, Boehmer JP, Collins SP, Ezekowitz JA, et al. HFSA 2010 comprehensive heart failure practice guideline. Journal of Cardiac Failure. 2010 Jun;16(6). doi:10.1016/j.cardfail.2010.04.004
25. Heidenreich PA, Bozkurt B, Aguilar D, Allen LA, Byun JJ, Colvin MM, et al. 2022 AHA/ACC/HFSA guideline for the management of heart failure. Journal of the American College of Cardiology. 2022 May 3;79(17). doi:10.1016/j.jacc.2021.12.012
26. McDonagh TA, Metra M, Adamo M, Gardner RS, Baumbach A, Böhm M, et al. 2021 ESC guidelines for the diagnosis and treatment of acute and chronic heart failure. European Heart Journal. 2021 Aug 27;42(36):3599–726. doi:10.1093/eurheartj/ehab368
27. Allen LA, O'Connor CM. Management of acute decompensated heart failure. CMAJ : Canadian Medical Association journal = journal de l'Association medicale canadienne. 2007 Mar 13;176(6):797-805. doi: 10.1503/cmaj.051620.
28. Hollenberg SM, Warner Stevenson L, Ahmad T, Amin VJ, Bozkurt B, Butler J, et al. 2019 ACC Expert Consensus Decision Pathway on Risk Assessment, Management, and Clinical Trajectory of Patients Hospitalized With Heart Failure: A Report of the American College of Cardiology Solution Set Oversight Committee. Journal of the American College of Cardiology. 2019 Oct 15;74(15):1966-2011.
29. Konstantinides SV, Meyer G, Becattini C, Bueno H, Geersing G-J, Harjola V-P, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). European Respiratory Journal. 2019 Aug 31;54(3):1901647. doi:10.1183/13993003.01647-2019





1.Médica general Universidad de Antioquia, Médica general de urgencias Hospital Pablo Tobón Uribe.
2.Psiquiatra Universidad Nacional de Colombia, Psiquiatra de enlace Pontificia Universidad Javeriana, Psiquiatra Hospital Pablo Tobón Uribe.
El delirium es un síndrome común y subdiagnosticado en la práctica clínica, representa un desafío diagnóstico debido a su variedad de manifestaciones clínicas, con un impacto negativo en el pronóstico del estado salud-enfermedad del paciente y altos costos en el sistema de salud. Esta revisión busca dar una visión global de los aspectos clave del delirium con el fin de tener herramientas prácticas para mejorar la detección temprana y su manejo efectivo.
Delirium tremens, delirio, síndrome cerebral orgánico no psicótico, trastorno mental orgánico.
Introducción
El delirium es el síndrome psiquiátrico más común que se encuentra en pacientes en salas de hospitalización general, se asocia con un aumento significativo de la morbilidad y la mortalidad, estancias hospitalarias prolongadas, declinación significativa en la recuperación de la funcionalidad y mayor riesgo de deterioro cognitivo, que se traduce en una disminución en la calidad de vida tanto del paciente como de los cuidadores y mayores costos a los sistemas de salud. Por tanto, es crucial la difusión del tema para un mejor entendimiento y la implementación de estrategias preventivas


interdisciplinarias (involucrando al personal médico, enfermeros, familiares, cuidadores, entre otros) con el fin de prevenir o reducir la incidencia del delirium y mejorar el pronóstico del paciente.
Definición
Aulo Cornelio Celso (25 A.C) fue la primera persona en usar el término delirium (deriva del latín de que significa "lejos de", lira "surco en un campo" y ium, latín para singular, y literalmente significa "un salir de la pista arada; una locura"), descrito como "una locura que es aguda y ocurre con fiebre; los griegos la llaman frenitis y no siempre es reversible" (Celsus, 1814, Capítulo XVIII, p. 115).
No fue sino hasta el siglo XIX que el término “frenitis” fue reemplazado por “delirium” y desde entonces ha venido sufriendo modificaciones en el tiempo, para finalmente referirse a un síndrome agudo o subagudo caracterizado por alteración de la atención, la conciencia, memoria, lenguaje, orientación, alteración perceptual, cambios en la actividad psicomotora, alteración del ciclo sueño-vigilia, síntomas que tienden a fluctuar de gravedad durante el día, representando un cambio significativo en el nivel basal de funcionamiento cognitivo y conductual del paciente.
Hoy en día es el manual diagnóstico y estadístico de los trastornos mentales (DSM) 5 TR quién pauta las características esenciales para hacer diagnóstico de este (tabla 1).

Tabla1. CriteriosDSM-5
Delirium DSM-5 TR
A. Una alteración de la atención (p. ej., capacidad reducida para dirigir, centrar, mantener o desviar la atención) y la conciencia (orientación reducida al entorno).
B. La alteración aparece en poco tiempo (habitualmente unas horas o pocos días), constituye un cambio respecto a la atención y conciencia iniciales y su gravedad tiende a fluctuar a lo largo del día.
C. Una alteración cognitiva adicional (p. ej., déficit de memoria, de orientación, de lenguaje, de la capacidad visoespacial o de la percepción)
D. Las alteraciones de los Criterios A y C no se explican mejor por otra alteración neurocognitiva preexistente, establecida o en curso, ni suceden en el contexto de un nivel de estimulación extremadamente reducido, como sería el coma.
E. En la anamnesis, la exploración física o los análisis clínicos se obtienen evidencias de que la alteración es una consecuencia fisiológica directa de otra afección médica, una intoxicación o una abstinencia por una sustancia (p. ej., debida a un consumo de drogas o a un medicamento), una exposición a una toxina o se debe a múltiples etiologías.
Nota: Tomado de la Asociación Americana de Psiquiatría, Guía de consulta de los criterios diagnósticos del DSM 5-TR1

Siempre se debe especificar a qué es debido (intoxicación por sustancias, abstinencia de sustancias, inducido por medicamentos, debido a otras afecciones médicas o a etiologías múltiples), el tiempo de evolución de los síntomas (agudo o persistente) y las alteraciones del comportamiento psicomotor asociadas (hiperactivo, hipoactivo o mixto).
Epidemiología
La prevalencia e incidencia del delirium dependen del entorno y de la edad de los pacientes26. Los estudios reportan prevalencia de uno de cada cinco pacientes ingresados en hospitales generales27 .
En los servicios de urgencias, la prevalencia es de aproximadamente el 10% en los adultos mayores3, con una mayor prevalencia entre los residentes de hogares geriátricos. La mayor incidencia se encuentra en los pacientes que reciben atención en la unidad de cuidados intensivos, que están en estado postoperatorio o que están recibiendo cuidados paliativos, llegando a ser del 80 % o superior. En las salas de atención general hay reportes de prevalencia hasta del 10%27 . Sin embargo, el diagnóstico sigue pasando desapercibido en la mayoría de los casos durante la atención clínica de rutina (60-80%), principalmente debido al diagnóstico insuficiente y a la falta de documentación2
Pronóstico
Entre los pacientes hospitalizados el desarrollo del delirium se asocia con un aumento en la duración de la estancia hospitalaria, mayores complicaciones incluyendo desarrollo de enfermedades mentales como la depresión y el trastorno de estrés postraumático, menores tasas de recuperación en la funcionalidad, alteración en la calidad de vida, mayor riesgo de reingreso hospitalario y mayores tasas de mortalidad al alta e incluso a los 24 meses de seguimiento4,23
Algunos investigadores han estimado que alrededor del 40% de los pacientes que experimentan delirium desarrollan algún tipo de deterioro cognitivo y presentan más riesgo de requerir institucionalizacion24-26 .


Patogénesis
En vista de la compleja causalidad multifactorial del delirium, cada episodio individual probablemente tenga un conjunto único de mecanismos neurobiológicos que contribuyen a su patogénesis, que se complementan en lugar de competir. Por lo tanto, es probable que no se descubra una sola causa o mecanismo para el delirium. Acá se exponen las teorías actuales en la neuropatogénesis del delirium25:
Edad: hipótesis de envejecimiento neuronal
Junto con el envejecimiento, viene una disminución de la reserva fisiológica que nos hace vulnerables al estrés físico y a la enfermedad. Múltiples estudios han encontrado que la edad avanzada es un factor de riesgo independiente para el delirium entre los pacientes adultos mayores hospitalizados, con tasas del 3% para aquellos menores de 65 años, del 14% para el grupo de 65 a 74 años, y alcanza un 36% para pacientes de 75 años o más (P < .0001)4
Hay datos que sugieren una relación bidireccional entre el delirium y el deterioro cognitivo, especialmente entre los adultos mayores, siendo la demencia en este grupo el factor de riesgo más significativo para el desarrollo de delirium5 y el delirium, y a su vez, el delirium uno de los factores que incrementa notablemente el riesgo de experimentar deterioro cognitivo posterior, incluyendo la demencia6
Inflamación: hipótesis neuroinflamatoria
El delirium es la manifestación del sistema nervioso central (SNC) de un estado de enfermedad sistémica que ha cruzado la barrera hematoencefálica. Esta teoría propone que los procesos inflamatorios periféricos (por ejemplo, infecciones y cirugía) inducen la activación de células parénquimas cerebrales, que expresan citoquinas inflamatorias y otros mediadores inflamatorios en el SNC (por ejemplo, proteína C-reactiva, interleucina [IL]-6, factor de necrosis tumoral alfa, IL‐1RA, IL-10 e IL-8), para conducir a la disfunción neuronal y sináptica junto con los síntomas neuroconductuales y cognitivos


posteriores característicos del delirium7
Oxidación: hipótesis del estrés oxidativo
El cerebro es particularmente susceptible a las especies reactivas del oxígeno y de nitrógeno debido a su alto contenido de lípidos en las vainas de mielina, así como a su elevada tasa de metabolismo oxidativo y baja capacidad antioxidante. La evidencia indica que el estrés oxidativo y las deficiencias antioxidantes pueden intensificar el daño cerebral, contribuyendo a la disfunción cerebral y manifestándose como delirium8-11
Glucocorticoides: hipótesis neuroendocrina
En circunstancias normales, el estrés activa el eje hipotalámico-hipofisario-adrenal (HPA), lo que promueve la liberación de glucocorticoides (GC) de la corteza suprarrenal, incluido el cortisol. La función fisiológica glucocorticoide es ayudar al cuerpo a hacer frente a las demandas impuestas por eventos estresantes, facilitando la adaptación fisiológica y conductual, y manteniendo la homeostasis.
La hipótesis neuroendocrina sugiere un exceso de GC. Estos niveles elevados perjudican la capacidad de supervivencia de las neuronas después de múltiples insultos metabólicos, lo que resulta en una vulnerabilidad generalizada en las neuronas cerebrales, también conocida como "respuesta al estrés aberrante"25 .
Existe una amplia evidencia científica que respalda la idea de que la exposición repetida o prolongada al estrés y los niveles elevados de GC pueden tener un impacto adverso en la función cerebral, provocando lesiones neuronales y desencadenando psicopatologías9, incluso, se ha demostrado que el uso de esteroides exógenos se ha asociado con el desarrollo de varios trastornos neuropsiquiátricos, incluidos el delirium, la depresión, la manía, la psicosis y el deterioro cognitivo, afectando hasta al 60% de los pacientes que reciben tratamiento con corticoesteroides10


Sueño: hipótesis de la desregulación de la melatonina o del ciclo circadiano El reloj interno de 24 horas (patrón circadiano) se mantiene mediante factores ambientales, principalmente la exposición a la luz, que influye en la secreción de melatonina. La privación del sueño puede desencadenar déficits de memoria25 .
Para la mayoría de los pacientes hospitalizados, el sueño es generalmente de mala calidad, secundario a trastornos del sueño, dolor, ansiedad, enfermedades agudas y molestias ambientales como el ruido, una cama incomoda, luces brillantes, y un entorno desconocido. La mala calidad del sueño durante la hospitalización se ha asociado a resultados adversos en los adultos mayores relacionado a menor participación en actividades de autocuidado y rehabilitacion11. Se ha identificado como la acumulación de deuda de sueño puede ser un factor desencadenante del delirium25
Por otro lado, la melatonina tiene un rol importante en múltiples funciones corporales: tiene un efecto cronobiótico, regula el ciclo de sueño-vigilia y ayuda a restablecer las alteraciones del ritmo circadiano; tiene una amplia actividad antioxidante, antiinflamatoria y algunos efectos antinociceptivos y analgésicos e incluso hay datos que sugieren que los receptores de melatonina parecen ser importantes en los mecanismos de aprendizaje y memoria25. También inhibe la agregación de la proteína beta amiloide y previene la hiperfosforilación de la proteína tau, importantes en Alzheimer.
Finalmente, todas las hipótesis concluyen en un cambio a nivel de los neurotransmisores; los más asociados con delirium son la liberación excesiva de norepinefrina, dopamina, y/o glutamato, disponibilidad reducida en la acetilcolina y/o melatonina25
Etiología y factores de riesgo
En la mayoría de las ocasiones la etiología del delirium es múltiple. Múltiples factores son relacionados con riesgo de delirium, factores que son propios del paciente y no modificables, también llamados factores predisponentes como la edad, el estado


cognitivo basal y la presencia de morbilidades crónicas incluyendo trastornos psiquiátricos preexistentes. Y factores precipitantes (potencialmente modificables) como infecciones, intoxicación, alteraciones metabólicas, deshidratación, medicamentos nuevos, cambios en los hábitos intestinales, entre otros. Es importante valorar como en pacientes con altos factores predisponentes cualquier factor precipitante puede convertirse en un gran factor de riesgo28. En la tabla 2se exponen algunos ejemplos.
Tabla 2. Factores predisponentes y precipitantes en delirium
Factorespredisponentesy
precipitantes para el delirium
Edad
Funcionamiento cognitivo
Trastornospsiquiátricos
Aislamiento y privación sensorial
Restricciones e inmovilidad
Observaciones
Mayores de 65 años
Déficitscognitivosbasales.
Historia previa de delirium
El trastorno depresivo, la esquizofrenia, el trastorno bipolar, el trastorno por uso de alcohol u otras sustancias psicoactivas.
El aislamiento social disminuye la estimulación cognitiva.
Deficiencias sensoriales, como la disminución de la agudeza visual y auditiva.
El uso de restricciones físicas u otros dispositivos invasivos como tubos endotraqueales, dispositivos y tecnologías de asistencia cardíaca y pulmonar, líneas intravenosas, catéteres de vejiga, dispositivos de compresión de piernas neumáticas intermitentes, yesos y dispositivos de tracción.


Anormalidades electrolíticas y desequilibrio de líquidos
Alteraciones electrolíticas; hipovolemia (deshidratación, sangrado y emesis); hipervolemia (sobrecarga de volumen por suplementación excesiva de líquidos)
Trastornos y lesiones neurológicas
Deficiencias (nutricionales)
Neoplasias del sistema nervioso central, abscesos, accidente cerebrovascular, sangrado intracraneal, meningitis, encefalitis, vasculitis, esclerosis múltiple, epilepsia, enfermedad de Parkinson, hidrocefalia de presión normal, lesión cerebral traumática, lesión axonal difusa, síndrome paraneoplásico.
Desnutrición, baja ingesta calórica, trastornos de malabsorción, hipovitaminosis: deficiencias de cobalamina (B12), folato (B9), niacina, tiamina.
Estados agudos de intoxicación y abstinencia de sustancias
Alcohol u otras sustancias psicoactivas, opioides, sedantes o hipnóticos. Abstinencia principalmente alcohol, hipnóticos o sedantes.
Otras toxinas, incluyendo el envenenamiento por dióxido de carbono y monóxido, disolventes, exposición a metales pesados (por ejemplo, plomo, manganeso y mercurio), insecticidas, pesticidas, venenos y biotoxinas (veneno animal).
Síndrome neuroléptico maligno, hipertermia, quemaduras graves, síndrome serotoninérgico.
Hipertermia


Trastornos endocrinos, uso de corticosteroides exógenos (síndrome de Cushing), hiperglucemia/hipoglucemia, porfiria, hiperpituitarismo/hipopituitarismo, síndrome carcinoide.
Hipnóticos/sedantes (agentes GABAérgicos, como benzodiacepinas, hipnóticos z, barbitúricos y propofol), anticonvulsivos, analgésicos (opioides, ketamina y medicamentos antiinflamatorios no esteroideos), antihistamínicos (generalmente de primera generación y bloqueadores de la H2), antibióticos (por ejemplo, fluoroquinolonas, anfotericina-B, gentamicina, vancomicina, tobramicina, piperacilina, clindamicina, ampicilina), agentes cardíacos y pulmonares (por ejemplo, digitálicos, warfarina, agentes simpaticomiméticos, diuréticos, antiarrítmicos y antihipertensivos), agentes psicotrópicos relajantes, esteroides, agonistas de la dopamina, antidepresivos tricíclicos, litio, otros antidepresivos (ejemplo, paroxetina), antipsicóticos, agentes anticolinérgicos, agentes inmunosupresores y agentes antivirales.
Anemia, anoxia, hipoxia y bajos estados de perfusión/oxigenación
Cualquier estado que pueda contribuir a la disminución de la oxigenación (por ejemplo, insuficiencia pulmonar o cardíaca, hipotensión, anemia, hipoperfusión, complicaciones intraoperatorias, hipoxia, anoxia, envenenamiento por monóxido de carbono y shock)


Infecciones
Estímulos nocivos (dolor)
Neumonía, infecciones del tracto urinario, sepsis, infecciones virales, malaria, absceso cerebral, VIH/SIDA, entre otras.
Los datos sugieren que tanto el dolor como los medicamentos utilizados para el tratamiento del dolor se han asociado con el desarrollo del delirium. La presencia de dolor postoperatorio es un predictor independiente del delirium después de la cirugía. Por otro lado, el uso de agentes opioides ha estado implicado en el desarrollo del delirium.
Puntuaciónde Apache (severidad de la enfermedad)
Fallo de órgano
Desórdenes metabólicos
La evidencia muestra que la probabilidad de transición al delirium aumenta drásticamente por cada punto adicional en la puntuación de gravedad de Apache II
Insuficiencia terminal de órganos (por ejemplo, la insuficiencia hepática, cardíaca y renal)
Trastornos metabólicos: acidosis, alcalosis, hiperamonemia, reacciones de hipersensibilidad, trastornos de la glucosa (por ejemplo, hipoglucemia o hiperglucemia) y trastornos ácido-base. Otros trastornos a tener en cuenta incluyen la impactación fecal y la retención urinaria
Trauma
Trauma y lesiones físicas, golpe de calor, hipertermia e hipotermia, quemaduras graves, procedimientos quirúrgicos
Nota: Elaboración propia basado en12


Presentación clínica
El delirium tiene un inicio agudo en la mayoría de los casos, aunque en algunas ocasiones su instauración puede ser subaguda, con un curso fluctuante. Los síntomas se agrupan en tres dominios nucleares: el primer dominio es el cognitivo (consta de la atención, la orientación, la capacidad visuoespacial y la memoria), el segundo dominio es el pensamiento de orden superior (involucra la función ejecutiva, el curso del pensamiento, la comprensión y el lenguaje), y el tercer dominio el circadiano (se refiere al ciclo sueño-vigilia y a la actividad motora). Adicional a los síntomas que componen los dominios nucleares se pueden encontrar síntomas psicóticos (ilusiones, alucinaciones, ideas o interpretaciones delirantes), afectivos (labilidad, incongruencia), y sueños vívidos26
Según la actividad motora se clasifica en delirium hiperactivo, hipoactivo y mixto. En los pacientes enfermos de mayor edad, el delirium de tipo hipoactivo es el más común (65%), el menos reconocido y el de peor pronóstico (estancia hospitalaria prolongada, mayor morbilidad y mortalidad), en comparación con el hiperactivo (25%) o mixto (10%)14. Cuando las características de los síntomas en su inicio y evolución son conformadas por formas atenuadas recibe el nombre de delirium subsindrómico26
Criterios diagnósticos, escalas y herramientas
Muchos estudios han demostrado que el delirium es un diagnóstico que se pasa desapercibido, se diagnóstica de manera tardía o no se detecta hasta el 50% de los casos en algunos escenarios clínicos15, es por ello por lo que como personal en salud es importante estar atentos a los cambios que presentan los pacientes y tener un alto nivel de sospecha en especial en poblaciones de riesgo.
La Clasificación internacional de las enfermedades en su undécima edición (CIE-11) y el manual diagnóstico y estadístico de los trastornos mentales (DSM 5) son las dos clasificaciones más importantes para realizar diagnóstico de delirium. Siendo el DSM-5 (Tabla 1) la clasificación más aceptada y utilizada en la práctica clínica.


En la práctica clínica existen escalas y otras herramientas para el tamizaje y evaluación del delirium por personal con entrenamiento y sin entrenamiento, en la Tabla 3 se enumeran algunas disponibles, es importante no olvidar que las evaluaciones clínicas seriadas han demostrado ser más efectivas que cualquier herramienta de tamizaje16
Tabla 3. Escalas y herramientas diagnósticas endelirium
Escalas y herramientas
Delirium Rating Scale -Revised-98 (DRS-98)
Confusion Assessment Method (CAM)
Escala Cognitiva para el Delirium (ECD)
Delirium Diagnostic Tool-Provisional (DDT-Pro)
The 4 AT – Rapid Clinical Test For Delirium
Nota: elaboración propia basada en16
En cuanto a los diagnósticos diferenciales, cabe mencionar que hay una línea delgada entre algunas condiciones psiquiátricas y neurológicas que hacen del diagnóstico de delirium todo un reto clínico, tal como la demencia, accidentes cerebrovasculares, estatus epilépticos no convulsivos, episodios depresivos, episodios de manía o la esquizofrenia. Es por ello por lo que una adecuada anamnesis, evaluación clínica, y la solicitud de ayudas diagnósticas (según el contexto) es fundamental para un adecuado abordaje del paciente.
Tratamiento
Al revisar la literatura, se destacan 5 componentes para el tratamiento y la prevención del delirium, siempre recalcando que la prevención es la medida terapéutica esencial:


1. Reconocer al paciente en riesgo:
Teniendo en cuenta todo lo previamente mencionado incluyendo las características del paciente, factores precipitantes, de riesgo y condiciones médicas con el fin de evitar retrasos en el tratamiento que aumenten la morbilidad y mortalidad en los pacientes17 .
2. Implementar técnicas de prevención:
Los pacientes con factores de riesgo para desarrollar delirium son aquellos con quienes se debe estar más atento en implementar medidas no farmacológicas antidelirium18
Técnicas de prevención no farmacológicas: han demostrado reducir hasta en un 40% la aparición de delirium19 .
● Cognición-Orientación: implementar actividades de estimulación cognitiva incluyendo calendarios, relojes, reorientación verbal continua, entre otros. Permitir el acompañamiento de familiares o amigos; incluir espacios con ventanas con entrada de luz natural.
● Movilidad temprana: minimizar el uso de equipos de movilización apoyándose de la terapia física.
● Audición: algunos pacientes requieren de remoción de tapones de cerumen. En casos seleccionados, hacer uso de dispositivos de amplificación auditiva.
● Visión: no retirar gafas o equipos de ayuda visual. Estimular la visión con ayudas acordes al estado del paciente: libros de letra grande, teclados de teléfono grandes e iluminados.
● Preservación del ciclo vigilia sueño: buscar estrategias de reducción del ruido en la unidad donde se encuentre hospitalizado el paciente. Apoyarse en el uso de tapones de oídos en las noches, bebidas calientes, té, música o masajes de relación.
● Hidratación: fomentar el consumo de líquidos y alimentos.
● Hacer chequeo de la conciliación de medicamentos: valorar medicamentos asociados con delirium y polifarmacia.
● Manejo del dolor: buscar la mejor opción del control del dolor, con el menor riesgo deliriogénico posible.


Técnicas de prevención farmacológicas
No hay evidencia que respalde el uso de medicamentos como forma de prevención para el delirium; hay estudios sobre prevención con haloperidol a bajas dosis, pero hay controversia en los resultados, por lo que no se recomienda en forma rutinaria. Sin embargo, en los escenarios relacionados con la unidad de cuidados intensivos, los estudios han demostrado que la dexmedetomidina reduce la incidencia al compararla con otros medicamentos de acción sedante; otros medicamentos que se han estudiado pero su uso sigue siendo muy discutido, son:13,20,21,26
Antagonistas del glutamato y moduladores de canales de calcio: la Gabapentina, Carbamazepina, Amantadina, Memantina y Ácido valproico tienen un efecto deliriolítico a través de la modulación de los canales de calcio sensibles al voltaje, el antagonismo de los receptores del ácido N-metil-D-aspártico (NMDA), la activación de los receptores alfa-2 espinales y la atenuación de los potenciales de acción dependientes del sodio.
● Ketamina: se ha estudiado en escenarios post cirugía cardíaca, en donde se sugiere que un efecto antiinflamatorio puede ser responsable, al menos en parte, del efecto neuroprotector de la ketamina en este entorno.
● Melatonina y agonistas de la melatonina: los estudios han encontrado que los pacientes que recibieron melatonina experimentaron una menor incidencia estadísticamente significativa de delirium.
● Inhibidores de la acetilcolinesterasa: la Rivastigmina y el Donepezilo se han propuesto como medicamentos que pueden impactar en la prevención del delirium, sin embargo, no se ha demostrado una reducción en la prevalencia o incidencia de este y los efectos secundarios han sido mayores que los beneficios.


3. Mejorar la detección y tamizaje:
Es crucial tener un profundo entendimiento del tipo de paciente al que nos enfrentamos, se debe realizar una adecuada historia y examen físico especificando los factores precipitantes y predisponentes, y valorar cuales podemos modificar. Esto se logra a través de una capacitación continua, el uso de herramientas de evaluación objetivas (tabla 3) y la disponibilidad de personal entrenado para lograr un diagnóstico oportuno
4. Tratamiento o corrección de problemas médicos subyacentes y factores potencialmente reversibles:
Abordar de manera integral implica considerar la corrección de desequilibrios electrolíticos, tratamiento de infecciones, manejo de insuficiencias orgánicas, atención a la falta de sueño, control del dolor, evaluación y tratamiento de trastornos metabólicos y endocrinológicos, manejo de intoxicaciones o abstinencia de sustancias o medicamentos.
5. Tratamiento de todas las formas de delirium:
Aunque el fundamento principal del delirium implica identificar y tratar de manera precisa las etiologías, en muchos casos, se requiere de intervenciones farmacológicas.
Cabe resaltar que a la fecha no hay ningún medicamento aprobado por la administración de medicamentos y alimentos (FDA) para el tratamiento dedelirium13-21-22:
● Antipsicóticos: durante mucho tiempo se ha reconocido a este grupo de medicamentos como tratamiento para el delirium, siendo el Haloperidol su principal representante. También han sido estudiados la quetiapina, risperidona, aripiprazol y olanzapina, manteniendo una eficacia similar al Haloperidol (sin lograr ser superior a este). Se recomienda utilizar las dosis mínimas posibles y titular lentamente las dosis. Con los antipsicóticos se debe tener precaución por riesgo de prolongación del segmento QT (las guías recomiendan interrumpir el uso de antipsicóticos si el QTc aumenta más del 25 % del valor basal o superior a 500 milisegundos) y la aparición de


taquicardia ventricular de torsade de pointes (incidencia menor al 0.27%). El rango de dosis diaria de haloperidol es de 0,25-10 mg, quetiapina es de 12,5-300 mg, risperidona 0,5-3 mg y olanzapina 1,25-20 mg26
● Alfa-2 agonistas: el uso de Dexmedetomidina ha demostrado reducir la prevalencia del delirium en pacientes en la unidad de cuidados intensivos, siendo una alternativa al uso de benzodiacepinas o Propofol, principalmente en estados postoperatorios.
● Valproato: parece ser eficaz, pero tiene pocos estudios.
● Melatonina y agonistas de la melatonina: se ha encontrado que es efectiva al tratar el delirium en estados postoperatorios que no responde a los antipsicóticos o las benzodiacepinas. Además, es importante tener en cuenta que la falta de sueño puede llevar a delirium, por lo que, si al apoyarse con los protocolos de higiene del sueño no es suficiente, la Melatonina es en este caso, la mejor opción terapéutica.
● Benzodiacepinas: generalmente son sobre prescritas y su uso se debe limitar a los pacientes que experimentan delirium relacionado con la abstinencia de un agente depresor del sistema nervioso central (por ejemplo, alcohol, barbitúricos, benzodiazepinas), o cuando otros agentes más apropiados han fallado y el nivel de agitación y la necesidad de control del comportamiento supera los efectos potencialmente perjudiciales de las benzodiacepinas.
Conclusiones
● El delirium es un trastorno neuropsiquiátrico común pero subestimado en los pacientes hospitalizados, y conlleva un impacto significativo en los resultados clínicos y la calidad de vida de los pacientes.
● La identificación y manejo tempranos del delirium son fundamentales para mitigar sus efectos sobre el estado salud-enfermedad del paciente.
● La clínica es la piedra angular para el diagnóstico de delirium, sin embargo,


● apoyarse en las escalas de diagnóstico es útil, en especial para el delirium hipoactivo y subsindrómico.
● Se han propuesto diversas estrategias de prevención y manejo, tanto farmacológicas como no farmacológicas, con apoyo interdisciplinario por parte de todos los agentes en contacto con el paciente.
● Aún hay mucho por investigar para comprender mejor los mecanismos subyacentes del delirium, desarrollar intervenciones más eficaces y mejorar los resultados clínicos de los pacientes afectados por este trastorno, pero hablar del tema permite fomentar conciencia acerca del mismo y mejorar la capacitación entre los profesionales de la salud para mejorar la detección, prevención y manejo del delirium.


1. Americana De Psiquiatría A. Guía de consulta de los criterios diagnósticos del DSM
5. Arlington, VA, Asociación Americana de Psiquiatría; 2013.
2. Inouye SK, Westendorp RGJ, Saczynski JS. Delirium in elderly people. Lancet [Internet]. 2014;383(9920):911–22. Disponible en: http://dx.doi.org/10.1016/S0140-6736(13)60688-1
3. Han JH, Zimmerman EE, Cutler N, Schnelle J, Morandi A, Dittus RS, et al. Delirium in older emergency department patients: recognition, risk factors, and psychomotor subtypes. Acad Emerg Med [Internet]. 2009;16(3):193–200. Disponible en: http://dx.doi.org/10.1111/j.1553-2712.2008.00339.x
4. Pendlebury ST, Lovett NG, Smith SC, Dutta N, Bendon C, Lloyd-Lavery A, et al. Observational, longitudinal study of delirium in consecutive unselected acute medical admissions: age-specific rates and associated factors, mortality and re-admission. BMJ Open [Internet]. 2015;5(11):e007808. Disponible en: http://dx.doi.org/10.1136/bmjopen-2015-007808
5. Elie M, Cole MG, Primeau FJ, Bellavance F. Delirium risk factors in elderly hospitalized patients. J Gen Intern Med [Internet]. 1998;13(3):204–12. Disponible en: http://dx.doi.org/10.1046/j.1525-1497.1998.00047.x
6. Rockwood K, Cosway S, Carver D, Jarrett P, Stadnyk K, Fisk J. The risk of dementia and death after delirium. Age Ageing [Internet]. 1999;28(6):551–6. Disponible en: http://dx.doi.org/10.1093/ageing/28.6.551
7. Cerejeira J, Firmino H, Vaz-Serra A, Mukaetova-Ladinska EB. The neuroinflammatory hypothesis of delirium. Acta Neuropathol [Internet]. 2010;119(6):737–54. Disponible en: http://dx.doi.org/10.1007/s00401-010-0674-1
8. Berr C, Balansard B, Arnaud J, Roussel AM, Alpérovitch A. Cognitive decline is associated with systemic oxidative stress: the EVA study. Etude du Vieillissement Artériel. J Am Geriatr Soc [Internet]. 2000;48(10):1285–91. Disponible en: http://dx.doi.org/10.1111/j.1532-5415.2000.tb02603.x


9. Vyas S, Rodrigues AJ, Silva JM, Tronche F, Almeida OFX, Sousa N, et al. Chronic stress and glucocorticoids: From neuronal plasticity to neurodegeneration. Neural Plast [Internet]. 2016;2016:6391686. Disponible en: http://dx.doi.org/10.1155/2016/6391686
10. Kusljic S, Manias E, Gogos A. Corticosteroid-induced psychiatric disturbances: It is time for pharmacists to take notice. Res Social Adm Pharm [Internet]. 2016;12(2):355–
60. Disponible en: http://dx.doi.org/10.1016/j.sapharm.2015.05.012
11. Farasat S, Dorsch JJ, Pearce AK, Moore AA, Martin JL, Malhotra A, et al. Sleep and delirium in older adults. Curr Sleep Med Rep [Internet]. 2020;6(3):136–48. Available from: http://dx.doi.org/10.1007/s40675-020-00174-y
12. Maldonado JR. Delirium pathophysiology: An updated hypothesis of the etiology of acute brain failure. Int J Geriatr Psychiatry [Internet]. 2018;33(11):1428–57. Disponible en: http://dx.doi.org/10.1002/gps.4823
13. Maldonado JR. Acute brain failure. Crit Care Clin [Internet]. 2017;33(3):461–519. Disponible en: http://dx.doi.org/10.1016/j.ccc.2017.03.013
14. Khurana V, Gambhir IS, Kishore D. Evaluation of delirium in elderly: A hospital‐based study. Geriatr Gerontol Int [Internet]. 2011;11(4):467–73. Disponible en: http://dx.doi.org/10.1111/j.1447-0594.2011.00710.x
15. Kean J, Ryan K. Delirium detection in clinical practice and research: Critique of current tools and suggestions for future development. J Psychosom Res [Internet]. 2008;65(3):255–9. Disponible en: http://dx.doi.org/10.1016/j.jpsychores.2008.05.024
16. Bigatello LM, Amirfarzan H, Haghighi AK, Newhouse B, Del Rio JM, Allen K, et al. Effects of routine monitoring of delirium in a surgical/trauma intensive care unit. J Trauma Acute Care Surg [Internet]. 2013;74(3):876–83. Disponible en: http://dx.doi.org/10.1097/ta.0b013e31827e1b69
17. Heymann A, Radtke F, Schiemann A, Lütz A, MacGuill M, Wernecke KD, et al. Delayed treatment of delirium increases mortality rate in intensive care unit patients. J Int Med Res [Internet]. 2010;38(5):1584–95. Disponible en: http://dx.doi.org/10.1177/147323001003800503


18. Hshieh TT, Yue J, Oh E, Puelle M, Dowal S, Travison T, et al. Effectiveness of multicomponent nonpharmacological delirium interventions: A meta-analysis. JAMA Intern Med [Internet]. 2015;175(4):512. Disponible en: http://dx.doi.org/10.1001/jamainternmed.2014.7779
19. Inouye SK, Bogardus ST Jr, Charpentier PA, Leo-Summers L, Acampora D, Holford TR, et al. A multicomponent intervention to prevent delirium in hospitalized older patients. N Engl J Med [Internet]. 1999;340(9):669–76. Disponible en: http://dx.doi.org/10.1056/nejm199903043400901
20. Serafim RB, Bozza FA, Soares M, do Brasil PEAA, Tura BR, Ely EW, et al. Pharmacologic prevention and treatment of delirium in intensive care patients: A systematic review. J Crit Care [Internet]. 2015;30(4):799–807. Disponible en: http://dx.doi.org/10.1016/j.jcrc.2015.04.005
21. Overshott R, Karim S, Burns A. Cholinesterase inhibitors for delirium. Cochrane Libr [Internet]. 2008; Disponible en: http://dx.doi.org/10.1002/14651858.cd005317.pub2
22. Lonergan E, Luxenberg J, Areosa Sastre A. Benzodiazepines for delirium. Cochrane Libr [Internet]. 2009; Disponible en: http://dx.doi.org/10.1002/14651858.cd006379.pub3
23. Siddiqi N, House AO, Holmes JD. Occurrence and outcome of delirium in medical in-patients: a systematic literature review. Age Ageing [Internet]. 2006;35(4):350–64. Disponible en: http://dx.doi.org/10.1093/ageing/afl005
24. Jackson JC, Gordon SM, Hart RP, Hopkins RO, Ely EW. The association between delirium and cognitive decline: A review of the empirical literature. Neuropsychol Rev [Internet]. 2004;14(2):87–98. Disponible en: http://dx.doi.org/10.1023/b:nerv.0000028080.39602.17
25. Maldonado J. Delirium: Neurobiology, Characteristics, and Manangment. Fogel BS, Greenberg DB, editors. Psychiatric care of the medical patient. 3a ed. United Sates of America: Oxford: 2015. P 823-908.
26. Franco JG. Delirium. Rincon HG, Velásquez JD, Franco JG, editores. Fundamentos de psiquiatría de enlace. Primera edición. Medellín, Colombia: CIB: 2023.p. 223-239.


27. Ryan DJ, O’Regan NA, Caoimh RÓ, Clare J, O’Connor M, Leonard M, et al. Delirium in an adult acute hospital population: predictors, prevalence and detection. BMJ Open [Internet]. 2013;3(1):e001772. Available from: http://dx.doi.org/10.1136/bmjopen-2012-001772
28. Leentjens AF, Meagher DJ. Delirium. Levenson JL, editors. The American Psychiatric Association Publishing. Textbook of psychosomatic medicine and consultation-liaison psychiatry. 3a ed. 2019. Chapter 26.





Laura Jaramillo Santacoloma1 , Luisa María Higuita Duque2 , Lina Vanessa Gómez3
1.Médica general Universidad CES, Médica general de Hospitalización Hospital Pablo Tobón Uribe.
2.Médica General, Universidad CES.
3.Jefe Sección Dermatología, Hospital Pablo Tobón Uribe.
Resumen
Las toxicodermias, o reacciones cutáneas adversas a medicamentos, son respuestas no intencionadas a fármacos, que incluyen desde respuestas cutáneas leves como el exantema morbiliforme y la urticaria; hasta reacciones severas e incluso letales como el síndrome de Stevens Johnson o el síndrome de hipersensibilidad inducido por drogas. Es fundamental la identificación del agente causal para el manejo y la prevención de futuros eventos.
Palabras clave
Reacción Adversa a Medicamentos, Erupciones por Medicamentos, Sistema de Registro de Reacción Adversa a Medicamentos
Introducción
Una reacción adversa por medicamentos (RAM) es definida por la Organización Mundial de la Salud como “cualquier respuesta nociva y no intencionada a un medicamento, la cual ocurre a dosis habitualmente utilizadas en humanos, para prevenir, diagnosticar o tratar una enfermedad, o para modificar cualquier función biológica”. Afectan el 10-20% de los pacientes hospitalizados y aproximadamente al 7% de la población general1,2 .
Existen varios factores de riesgo para presentar una RAM, se incluye sexo femenino, inmunosupresión y dermatomiositis. Así mismo, se ha visto una asociación con alelos


del complejo mayor de histocompatibilidad específicos como importantes factores de riesgo genéticos en las reacciones cutáneas graves, especialmente el HLA-B* 1502 para el Síndrome de Stevens Johnson/Necrólisis Epidérmica Tóxica (SSJ/NET) causado por carbamazepinas en asiáticos; y el HLA-B* 5701 para la reacción a fármacos con eosinofilia y síntomas sistémicos o “Drug reaction with Eosinophilia and Systemic Symptoms” (DRESS) causado por Abacavir3 .
La piel es uno de los órganos más frecuentemente afectados, se ha documentado que hasta un 35% de todas las RAM tienen manifestaciones cutáneas4. Las reacciones cutáneas adversas a medicamentos o también conocidas como toxicodermias, están mediadas por mecanismos inmunitarios o no inmunitarios3; tienen una amplia forma de presentación y un espectro de complicaciones y pronósticos que van desde ninguna secuela a largo plazo hasta una morbilidad y mortalidad significativa1 .
Debido a su alta frecuencia, morbilidad y potencial de mortalidad, es de suma importancia que los médicos de atención primaria tengan la capacidad de reconocer los signos y síntomas de las reacciones más graves para que se realice un manejo adecuado.
Epidemiología
Los datos disponibles a nivel mundial son limitados debido a que en la mayoría de las ocasiones estas reacciones no son reportadas, sin embargo, se estima que las RAM tienen una incidencia del 15% al 20% en pacientes hospitalizados, y las reacciones cutáneas a medicamentos corresponden al 35%3,4; esto lleva a un aumento en la morbilidad y mortalidad, en la estancia hospitalaria y los costos de la atención en salud.
Las reacciones cutáneas medicamentosas se asocian con mayor frecuencia a los antibióticos, agentes neurológicos y analgésicos; en un estudio observacional realizado en Suiza, durante 20 años, se encontró que los medicamentos principalmente


implicados son la penicilina, las sulfamidas y los antiinflamatorios no esteroideos (AINES)5. Se propone como mnemotecnia para recordar las drogas más frecuentemente implicadas la triple AAA (antibióticos-analgésicos-anticonvulsivantes4
Respecto a la presentación clínica, se ha visto que el exantema morbiliforme es el tipo más común, equivaliendo a un 40% de todas las reacciones; en segundo lugar, se encuentran las reacciones urticariformes en un 5,9%3,6 .
En el año 2012 fue publicado un estudio observacional descriptivo retro-prospectivo en pacientes hospitalizados que presentaron reacciones cutáneas a medicamentos en el Hospital Pablo Tobón Uribe de Medellín, Colombia; en este se destaca que el exantema maculopapular y la urticaria fueron los cuadros clínicos más frecuentes (76,3% y 13,6% respectivamente), lo cual coincide con los datos disponibles en la literatura científica a nivel mundial7 . Las reacciones graves o complicadas como el Síndrome de Stevens-Johnson (SSJ) fueron raras (0,6%-2%)7. La edad de presentación fue variable, comprometiendo todos los grupos etarios, pero siendo más frecuente en pacientes mayores de 18 años (75%) 7. En cuanto a los medicamentos principalmente implicados en las reacciones cutáneas, se encontró que los antibióticos fueron responsables de más de la mitad de los casos (54,4%). El segundo lugar fue ocupado por los analgésicos (22,5%), seguidos por los anticonvulsivantes (8,9%)7 .
Patogénesis
Las reacciones cutáneas adversas a medicamentos están mediadas por mecanismos inmunitarios o no inmunitarios3. En las reacciones inmunomediadas hay respuestas de hipersensibilidad al medicamento utilizado, dependen de la respuesta del paciente y son dosis independientes; estas pueden ser, mediadas por IgE, citotóxicas, mediadas por inmunocomplejos o mediadas por las células T3; Por otro lado, las no inmunomediadas son efecto directo del fármaco, dosis dependiente y la mayoría de las


veces, predecible. Solo 5% a 10% de todas las toxicodermias son inmunomediadas, la mayoría (75%-80%) son secundarias a efectos no inmunomediados6
Tabla 1. Reacciones a fármacos mediadas por el sistema inmune
Reacciones a fármacos dependientes de IgE
Reacciones a fármacos citotóxicas
Urticaria,angioedemay anafilaxia
Sonanticuerposcontraun antígenofijo.Unejemplo serían las petequias secundarias a trombocitopenia inducida porfármaco
Reacciones a fármacos dependientes de inmunocomplejos
Reacciones a fármacos mediadas por células
Nota: Adaptado de3
Vasculitis
Erupcionesexantemáticas fijas y liquenoides, síndrome de hipersensibilidadinducido por drogas, SSJ/NET, pustulosis exantemática generalizadaaguda


Tabla 2. Reacciones a fármacos por mecanismos no inmunitarios
Sobredosis
Efectos secundarios a fármacos
Toxicidad acumulada
Exageración de las acciones farmacológicas de la medicación por consecuencia de un error en la prescripción, exceso deliberado o no por parte del paciente o de una alteración de la absorción, el metabolismo o la excreción
Efectos tóxicos o no deseados que no pueden separarse de las acciones deseadas del medicamento
Exposición prolongada a una medicación o a sus metabolitos
Efectos del metotrexate en ancianos con disminución de la función renal
Toxicidad diferida
Interacciones fármacofármaco
Efecto tóxico dependiente de la dosis que aparece meses o años después de suspender la medicación
Interacciones entre dos o más fármacos administrados de forma simultánea por diferentes mecanismos
Alopecia y mucositis por fármacos antineoplásicos
Acumulación de minociclina o amiodarona en el interior de la piel puede causar pigmentación cutánea
Carcinomas escamocelulares y queratosis palmo plantares por exposición a arsénico
El calcio absorción tetraciclinas disminuye de la las


Alteraciones del metabolismo
Reagudización de la enfermedad
Nota: Adaptado de3
Cambios cutáneos por sus efectos en el estado nutricional o metabólico del paciente
Algunos fármacos pueden reagudizar enfermedades cutáneas preexistentes
Abordaje clínico y diagnóstico
Pelagra causada por isoniacida, o xantomas eruptivos secundarios a la hipertrigliceridemia grave causada por el bexaroteno
Andrógenos en pacientes con acné vulgar o el litio en pacientes con psoriasis
Al momento de evaluar al paciente que cursa con una toxicodermia es fundamental tener en cuenta los siguientes aspectos:
1. Identificar el agente sospechoso causal (basarse en los reportes epidemiológicos, recordar la mnemotecnia AAA)
2. Determinar la relación nexo causal (tiempo transcurrido entre la administración y la reacción)
3. Caracterizar el tipo de reacción clínica (no complicada o grave)
4. Determinar la necesidad de solicitud de ayudas diagnósticas
Agente sospechoso: la historia clínica se debe orientar hacia la identificación del fármaco, incluyendo información exhaustiva del evento, posibles desencadenantes, fármaco, hierba o formulación homeopática, químicos por exposición laboral o pasatiempo. De cada fármaco sospechoso es indispensable establecer la relación causal con la reacción, existen herramientas como la Escala de Naranjo para orientar la identificación del posible agente causal (Tabla 3)8


Tabla 3. Escala de Naranjo
Pregunta
¿Existen informespreviosconcluyentes acercadeestareacción?
El acontecimiento adverso ¿apareció́ despuésdeque se administraraelfármaco sospechoso?
La reacción adversa ¿mejoró al interrumpirse el tratamiento o cuando se administró́ unantagonista específico?
¿Reapareció́ la reacción adversa cuando se volvió́ aadministrarelfármaco?
¿Hay otras causas (distintas de la administración del fármaco) que puedan por símismashaberocasionado lareacción?
¿Se ha detectado el fármaco en sangre (o en otros humores) en una concentración cuyatoxicidad es conocida?
¿Aumentó la gravedad de la reacción al aumentar ladosiso disminuyóal reducirla?
¿Había sufrido el paciente una reacción similar al mismo fármaco o a fármacos análogosenalgunaexposición previa?
¿Se confirmó el acontecimiento adverso mediantepruebasobjetivas?
Puntuación total
Nota: Adaptada de8 . Resultado: segura ≥9; probable ≤8 a ≥5; posible ≤4 a ≥1; improbable=0.


Relación nexo causal: el tiempo desde el inicio de la administración del medicamento hasta el desarrollo de una reacción cutánea varía según el subtipo de RAM de compromiso cutáneo (Figura 1). Los fármacos nuevos, iniciados entre los últimos tres meses, especialmente en las últimas seis semanas, son agentes potencialmente causales para la mayoría de las erupciones cutáneas1,9. Sin embargo, a menudo los pacientes han estado expuestos a múltiples medicamentos y crear un “cuadro de medicamentos” que detalla las fechas de todos los medicamentos tomados es útil para identificar a los culpables más probables1 .
Figura 1. Tiempo típico de las erupciones farmacológicas en relación con el tiempo transcurrido desde el inicio del fármaco.

Nota: Adaptado de1
Tipo de reacción clínica: las toxicodermias se pueden clasificar según su gravedad (Figura 2), en no complicadas y complicadas; las más comunes son las primeras, dentro de las cuales en el 95% de los casos se presentan como erupción exantemática y urticaria; las complicadas o graves, suelen presentarse en el 2% de los casos, incluyen la Pustulosis Exantemática Generalizada Aguda (PEGA), SSJ/NET y el DRESS1 .


Figura 2. Algoritmo de enfoque para sospecha de reacción cutánea adversa a medicamentos.

Nota: Elaboración propia
A) No complicadas
● Erupción exantemática por medicamentos
También llamado exantema morbiliforme, son las reacciones cutáneas asociadas a medicamentos más comunes que hay, representan hasta el 80% de las reacciones en los adultos y el 35% en niños, presentándose en el 1-5% de la primera exposición del fármaco10,11. Los fármacos implicados más comúnmente incluyen betalactámicos, sulfonamidas y medicamentos antiepilépticos10 .
Clínicamente se trata de máculas y pápulas eritematosas que confluyen formando placas, suele comenzar en la cabeza y el cuello, y se extienden progresivamente y de forma simétrica a las extremidades y el tronco, puede acompañarse de prurito y febrícula, y en raras ocasiones puede haber compromiso de mucosas10,11 .


Estas reacciones tienden a tener un inicio repentino entre cuatro días y tres semanas después de la administración del fármaco y desaparecen a las pocas semanas de suspender el fármaco, dejando en ocasiones una hiperpigmentación postinflamatoria con descamación asociada10,11
El manejo de la erupción exantemática por medicamentos es de soporte, el prurito puede ser manejado con esteroides tópicos, emolientes y antihistamínicos orales. Para evitar la hiperpigmentación postinflamatoria, se debe ser muy cuidadoso con la aplicación juiciosa del protector solar y evitar la exposición directa al sol7 Al tratarse de una reacción no grave la elección de suspender el fármaco causante debe hacerse de forma individual11
● Urticaria y angioedema
Las toxicodermias urticariales se caracterizan por la presencia de habones, y en ocasiones pueden acompañarse de angioedema; ambos causados por activación de los mastocitos que lleva a vasodilatación y liberación de histamina12,13. Se ha visto que representa aproximadamente el 5% de todas las toxicodermias10,12
La urticaria causada por fármacos suele ser aguda, es decir, aquella que dura menos de seis semanas8, equivaliendo a un 7 a 9,2% de las urticarias agudas, y es principalmente causada por AINES y antibióticos, especialmente los betalactámicos10,12 . En cuanto a la urticaria crónica, los medicamentos principalmente asociados son los inhibidores de la enzima convertidora de angiotensina (IECA) y los AINES12
Respecto al tratamiento, lo primordial es la suspensión del fármaco causal y de moléculas que puedan causar una reacción cruzada10,13. Para el manejo farmacológico, se debe iniciar un antihistamínico de segunda generación, hasta cuatro veces la dosis diaria recomendada, que bloquean el receptor H1, desplazando así el equilibrio hacia el estado inactivo del receptor10, 13 .


Los corticosteroides sistémicos intravenosos u orales son eficaces para la urticaria aguda y para el control rápido de los brotes graves de la urticaria crónica, sin embargo, la terapia con esteroides sistémicos se debe limitar a un máximo de 10 días usando la dosis efectiva más baja10,13
● Otras reacciones adversas a medicamentos no complicadas
Reacciones acneiformes
Representan aproximadamente el 1% de las reacciones cutáneas a fármacos. Se caracteriza por pápulas y pústulas foliculares pruriginosas, suele ser un exantema monomorfo, y no suelen haber comedones, a menos que sea causada por andrógenos. Se localiza especialmente en la cara y la región superior del tronco3,9. Esta reacción se presenta entre una y dos semanas después del inicio del tratamiento, aunque esto depende del fármaco implicado3,9 .
Esta reacción se asocia principalmente al uso de corticoesteroides, andrógenos, isoniazida, litio y fenitoína. En la mayoría de los pacientes que toman inhibidores del receptor del factor de crecimiento epidérmico, como el gefitinib, erlotinib, o cetuximab), se han evidenciado reacciones acneiformes, con una incidencia de hasta el 81,6%3,9
Las lesiones son clínica e histológicamente indistinguibles de las del liquen plano idiopático; sin embargo, las reacciones farmacológicas liquenoides a menudo aparecen inicialmente como lesiones eccematosas con un tono púrpura y afectan grandes áreas del tronco. Se han asociado al uso de los betabloqueantes, la penicilamina y los IECA, especialmente el captopril3. También se han informado erupciones similares al liquen plano con antagonistas del factor de necrosis tumoral (TNF)-α (infliximab, etanercept y adalimumab). El período de latencia varía según el medicamento causal, sin embargo, puede ir hasta tres años después del inicio de este3 .


La vasculitis inducida por fármacos representa aproximadamente el 10% de las vasculitis cutáneas agudas, comprometiendo principalmente vasos pequeños y suele afectar a vasos pequeños3,9. Se caracteriza por pápulas purpúricas, que clásicamente se encuentran en las extremidades inferiores. También puede haber lesiones pseudo urticariales, ampollas hemorrágicas o necrosis. La afectación sistémica es poco común, pero puede haber fiebre, mialgias, artralgias o cefalea; así mismo, puede haber compromiso hepático, nefritis, hemorragia intestinal o neuropatía periférica3,9
Los medicamentos que más se asocian a las vasculitis incluyen propiltiouracilo, hidralazina, alopurinol, analgésicos, minociclina, entre otros3,9. Se han descrito desencadenantes más recientes como el rituximab y el levamisol, que se suele usar como adulterante de la cocaína9 .
Dentro de estas reacciones, se abarcan entidades como el exantema fijo medicamentoso, la dermatosis ampollosa IgA lineal, la pseudoporfiria, el penfigoide ampolloso por medicamentos, el pénfigo por fármacos y por supuesto, el SSJ/NET, del cual se hablará más adelante3,9
B) Toxicodermiascomplicadas ograves
Según la OMS las toxicodermias graves son las que pueden llevar a la muerte o resultar en una discapacidad persistente o significativa, o que ponen en peligro la vida, por lo que requieren manejo intrahospitalario; dentro de las que se encuentran el Síndrome de Stevens-Johnson y Necrólisis Epidérmica Tóxica, DRESS y la PEGA14 .
● Síndrome de Stevens-Johnson y Necrólisis Epidérmica Tóxica
Son emergencias dermatológicas, caracterizadas por necrólisis epidérmica y descamación generalizada. Se considera que tanto el SSJ como la NET comparten la misma fisiopatología, la cual no ha sido bien descrita, se cree que son reacciones de


hipersensibilidad tipo IV, mediadas por células T. Se diferencian según el área de superficie corporal afectada: si se afecta <10% se clasifica como SSJ, entre el 10-30% se clasifica como SSJ/NET superpuestos y > 30% se clasifica como NET15,16
En cuanto a la epidemiología de estas entidades, la incidencia del SSJ es de 8 a 9 casos por millón por año, mientras que la de la NET es entre uno y dos casos por millón por año, siendo más afectadas las mujeres que los hombres, en una relación de 1,5:1, con tasas de mortalidad de 4,8 a 9% para el SSJ, 19,4 a 29% para el SSJ/NET y de 14,8 a 48% para la NET15
Los principales factores de riesgo asociados incluyen malignidades hematológicas, el VIH, las infecciones fúngicas sistémicas, la enfermedad hepática y renal. Además, se ha visto un mayor riesgo de presentarlas en edades entre 1 y 10 años y en mayores de 70 años17 .
Las manifestaciones clínicas suelen iniciar en las primeras 8 semanas luego de haber iniciado el medicamento culpable, con un tiempo medio de tres a cuatro semanas17. El compromiso cutáneo está precedido en uno a tres días por síntomas prodrómicos como fiebre, malestar general, odinofagia y tos en la mayoría de los casos. Subsecuentemente inicia el compromiso en mucosas y cutáneo el cual es generalizado, iniciando en el rostro, tronco y miembros superiores. Típicamente se presentan máculas eritematosas o lesiones tipo diana atípicas, que progresan y generan lesiones eritematosas confluentes con un centro oscuro, y ampollas flácidas con signo de Nikolsky positivo, el cual consiste en realizar presión en un área de piel aparentemente sana, si se da una ruptura de la unión dermoepidérmica se considera positivo16
La mayoría de los pacientes presentan compromiso de las mucosas, usualmente dos o más de ellas en el 80% de los casos15, siendo la mucosa oral la más comprometida. El compromiso ocular también es frecuente, evidenciándose hiperemia conjuntival, epífora y fotofobia, pero puede progresar a úlcera corneal, uveítis anterior y desprendimiento epidérmico completo de la superficie ocular15,16, 17 .


En cuanto a la etiología, los medicamentos son la causa principal del cuadro clínico, sin embargo, hasta en el 30% de los casos, no se logra identificar el fármaco causal16 Por otro lado, las infecciones, principalmente por Mycoplasma pneumoniae, han sido ampliamente descritas, especialmente en niños, incluso sin exposición previa a un medicamento4,15,16. La infección por virus del herpes simple también se ha descrito en varios casos de SSJ, principalmente en niños4 .
Los medicamentos más comúnmente implicados son los antiepilépticos (lamotrigina, fenitoína, carbamazepina, ácido valproico y fenobarbital), los AINEs, el alopurinol, los antibióticos (trimetoprim-sulfametoxazol, aminopenicilinas, tetraciclinas y cefalosporinas) y los anticuerpos monoclonales (nivolumab y pemprolizumab)15 .
Para que se logre un buen manejo se requiere una adecuada historia clínica, teniendo en cuenta que los síntomas pueden iniciarse hasta cuatro semanas después de haber usado el medicamento, si con la historia clínica no se logra identificar se pueden utilizar escalas de causalidad como el Algoritmo de causalidad de fármacos para la NET (ALDEN) y la Herramienta de causalidad de Liverpool15 .
El tratamiento es multifacético, se divide en no farmacológico y farmacológico, el primero consiste principalmente en identificar y retirar el agente causante, luego estabilizar al paciente mediante líquidos intravenosos con ajuste de alteraciones hidroelectrolíticas, control de temperatura ambiental, nutrición, prevención y manejo de infecciones, analgesia y cuidado de las heridas; no se recomiendan los antibióticos profilácticos.
Los fármacos utilizados en el manejo adyuvante son los corticoesteroides como prednisona 0,5 - 1 mg/kg/día o pulso de metilprednisolona 1 mg/kg/día por tres días combinados con inmunoglobulina intravenosa 3g/kg dividido en tres días; o monoterapia con ciclosporina 2,5-5 mg/kg/día por 7 a 10 días y luego una reducción gradual de la dosis; inhibidores del TNF alfa y plasmaféresis15 Sin embargo, se debe tener en cuenta


que el manejo con esteroides sistémicos es controversial, ya que confieren riesgo de complicaciones, especialmente de infecciones, incluyendo sepsis por Cándida17 . Conocer el pronóstico es también importante en el manejo de estos pacientes, puede guiar al profesional de la salud en cuanto a las medidas a implementar y a definir si se requiere ingreso a unidad de quemados o unidad de cuidados intensivos15 Se propusieron los criterios SCORTEN para predecir la mortalidad (tabla 5), se tienen en cuenta 7 factores de riesgo independientes: edad, malignidad, taquicardia, grado de desprendimiento epidérmico, valores séricos de glucosa, bicarbonato y urea. El valor va de 0 a mayor o igual a 5, y la probabilidad de muerte va aumentando con el puntaje. Es más acertado a partir del tercer día de hospitalización, por lo que se recomienda realizarlo en el primer y el tercer día17
Tabla 5. Score para Necrólisis Epidérmica Tóxica (SCORTEN), cálculo de mortalidad prevista.
superficie corporal comprometida Desprendimiento epidérmico inicial >10% de la superficie corporal
Nota: Adaptado de17


● Síndrome de hipersensibilidad a fármacos con eosinofilia y síntomas sistémicos - DRESS
Es una reacción cutánea grave a medicamentos, caracterizada por erupción cutánea, fiebre, linfadenopatías, alteraciones hematológicas, compromiso sistémico Se asocia con alta morbimortalidad a corto y largo plazo18
El riesgo estimado de la población es del 0,9 a 2 por 100,000 pacientes al año. Para los medicamentos de alto riesgo la incidencia es entre 1 en 1000 y 1 en 10,000 exposiciones a medicamentos. Generalmente, no hay predilección en el sexo, y la edad media es de 47,8 años17
La patogenia exacta es desconocida, sin embargo, se han propuesto varios mecanismos subyacentes, incluyendo una alteración específica del metabolismo de los fármacos y mecanismos inmunitarios que implican al complejo mayor de histocompatibilidad y de interleuquinas como la IL-5, que tiene un papel en la aparición de los eosinófilos3. También interviene en la patogenia del DRESS, la reactivación viral de virus del herpes simple 6 (VHH-6), virus de Epstein Barr (EBV) y citomegalovirus (CMV)3,18
El inicio de las manifestaciones clínicas es retardado, normalmente se da en dos a tres semanas luego de la exposición al medicamento, pero se puede dar hasta luego de tres meses16,17. La presentación clásica inicia con fiebre que puede preceder al exantema morbiliforme hasta por dos semanas16; este usualmente afecta más del 50% de la superficie corporal total, y puede ser de tipo maculopapular en el 85% de casos, como pústulas, púrpura, placas infiltradas, lesiones tipo diana, habones, dermatitis exfoliativa, lesiones tipo eczema y lesiones liquenoides17,18


El edema facial se observa en la mayoría de los casos, en ocasiones acompañado de eritema facial pruriginoso que respeta la región periorbitaria. El compromiso de la mucosa como queilitis, erosiones orales o tonsilitis se presenta en hasta el 50% de los casos. Los síntomas persisten por varias semanas después de haber suspendido el medicamento responsable17
Otras características requeridas son las linfadenopatías y el compromiso interno de los órganos, las anormalidades hepáticas son comunes y se han visto hasta en el 80% de los casos, con elevaciones de las aminotransferasas (dos veces el valor normal), también nefritis intersticial, compromiso pulmonar con disnea, tos y neumonitis eosinofílica, y carditis, la cual puede ser fatal16. Estos hallazgos pueden ser complicaciones tardías y requieren seguimiento periódico3
La eosinofilia se presenta en hasta el 60 al 70% de los pacientes; otras anormalidades hematológicas son leucocitosis, linfocitosis o linfocitopenia, presencia de linfocitos atípicos o trombocitopenia17 .
Los medicamentos que más se asocian a esta reacción son el alopurinol, los anticonvulsivantes, las sulfonamidas y los antibióticos; además, según la literatura, las manifestaciones clínicas varían dependiendo del medicamento utilizado, por ejemplo, el alopurinol se asocia a una reacción más grave y al compromiso hepático y renal; mientras que la carbamazepina se asocia con compromiso hepático, linfadenopatías y linfocitos atípicos; y la vancomicina se asocia más frecuentemente con compromiso renal e incluso la muerte18
El diagnóstico se basa en la combinación de los hallazgos clínicos y paraclínicos16,18
Los exámenes de laboratorio básicos a solicitar son hemoleucograma, panel metabólico completo y uroanálisis para revelar alteraciones hematológicas y si hay compromiso


hepático o renal; también estudios de coagulación, enzimas cardíacas, VIH, eritrosedimentación y PCR para estimar la gravedad de la enfermedad17 .
Para la confirmación del diagnóstico existen varios criterios, sin embargo, los más utilizados son los de El Registro Europeo de Reacciones Adversas Cutáneas Graves a Medicamentos y Recolección de Muestras Biológicas (RegiSCAR) (Tabla 5)3 .
Tabla 5: Sistema de puntuación RegiSCAR para el síndrome de DRESS.
Sistema de puntuación RegiSCAR para el síndrome de DRESS
Criterio No
Hipereosinofilia periférica
1500 o ≥ 20%
Afectación cutánea
● Extensión de erupción cutánea > 50%
● Erupción cutánea indicativa de DRESS
● Biopsia indicativade DRESS
Afectación de órganos internos


≥ 3 paraclínicos sanguíneos para excluir otro diagnóstico (Anticuerpo antinuclear, hemocultivos, serología para virus de la hepatitis A, B y C, y Chlamydia y Mycoplasma).
Puntuación: < 2, no hay caso; 2-3, caso posible; 4-5, caso probable; >5, caso cierto
Nota: Adaptado de3
El manejo se basa en suspender el medicamento sospechoso. Los casos leves pueden ser manejados con esteroides tópicos de alta potencia y antihistamínicos de segunda generación, pero la mayoría de los pacientes van a requerir el uso de corticoesteroides sistémicos. En los casos en que hay compromiso significativo renal o pulmonar se indica prednisona oral 1 mg/kg o su equivalente de forma diaria, con disminución gradual por 6 a 8 semanas. En casos de reincidencia se usa ciclosporina u otros medicamentos inmunosupresores17 .
La mortalidad estimada es entre 2 y 10% y típicamente resulta por hepatitis fulminante para la cual el único tratamiento efectivo es el trasplante. Otras causas pueden relacionarse con la reactivación del VHH-6, EBV o por secuelas autoinmunes como diabetes mellitus tipo 1, compromiso tiroideo y lupus eritematoso sistémico17 .
● Pustulosis exantemática generalizada aguda - PEGA
Esta entidad se caracteriza por la aparición súbita de cientos de micro pústulas no foliculares, estériles, sobre base eritematosa; inician en el rostro y regiones intertriginosas, con rápido compromiso de todo el cuerpo; pueden estar precedidas de


prurito y eritema, con edema facial y acral. El compromiso de la mucosa se da en aproximadamente el 20% de casos, cuando se presenta se limita a una sola superficie mucosa, usualmente la oral19 .
Las manifestaciones sistémicas ocurren en el 17 al 20% de pacientes, con presencia de fiebre, leucocitosis, eosinofilia, hipocalcemia, neutrofilia, elevación de PCR y de transaminasas17 Su incidencia es de uno a cinco casos por millón por año, la mayoría de los casos se dan entre los 27 y 74 años, con edad media de 56 años. Tiene una mortalidad del 2 al 5%17
El inicio de los síntomas frecuentemente se da en las primeras 48 horas después de haber utilizado el medicamento, pero puede tardar hasta 11 días. El cuadro clínico es típicamente autolimitado, con el retiro del medicamento culpable los síntomas suelen resolverse en una semana16,17
El diagnóstico diferencial más importante es la psoriasis pustulosa, donde las pústulas suelen ser más generalizadas, con una duración más prolongada, mayor compromiso de las articulaciones, y la histología muestra pústulas epidérmicas y/o subcorneales con papilomatosis y acantosis19
Los medicamentos son la causa más común, principalmente los antibióticos betalactámicos, también aminopenicilinas, quinolonas, sulfonamidas, fluconazol, ketoconazol, terbinafina, diltiazem e hidroxicloroquina, sin embargo, algunos casos se han atribuido a infecciones agudas, mordedura por araña y reacción al contraste yodado intravenoso17,19 .
Para el diagnóstico se propusieron los criterios de EuroSCAR (Tabla 6) los cuales se basan en tres categorías, morfología, curso clínico y hallazgos histológicos consistentes con PEGA. Los puntos se dan según si el hallazgo es o no compatible con PEGA17


Tabla 6. Escala creada por el EuroSCAR Study Group para PEGA.
Morfología
Pústulas
Típicas +2
Compatibles +1
Insuficiente 0
Eritema
Típico +2
Compatible +1
Insuficiente 0
Distribución
Típica +2
Insuficiente 0
Descamación postpústulas
Si +1 No o insuficiente 0
Curso
Compromiso de mucosas
Inicio agudo (< 10 días)


Continuación Tabla 6
Resolución en el intervalo de 15 días
Si No -4
Fiebre ≥ 38 °C
Si +1
No 0
Recuento de polimorfonucleares > 7.000/mm
Si +1
No 0
Histología
Sugerente de otra enfermedad -10
No representativa o sin histología 0
Exocitosis de polimorfonucleares +1
Pústulas subcorneales o intraepidérmicas con o sin espongiosis
o pústulas asociadas o no a edema papilar, no especificadas de otra manera +2
Pústulas espongiformes, subcorneales o intraepidérmicas con edema papilar
+3
Interpretación: ≤ 0 no es un caso de PEGA; 1-4 caso posible; 5-7 caso probable; 8-12 caso definitivo.
Nota: Adaptado de19


El manejo, igual que en todas las reacciones cutáneas por medicamentos, se basa en la identificación y suspensión del medicamento culpable; una vez este se retira los síntomas suelen resolverse19. Se da manejo de soporte, con antipiréticos, esteroides tópicos como betametasona o clobetasol, esteroides sistémicos, antihistamínicos de segunda generación y ciclosporina17,19. En la tabla 7 se describen las principales diferencias entre las toxicodermias graves.
Tabla7.Toxicodermiasgraves.
SSJ/NET DRESS PEGA
Tiempo de aparició n 1-3 semanas 2-6 semanas 48 horas - 21 días
Duración 1-3 semanas Prolongado 1 semana, autolimitado
Clínica Fiebre,Nikolsky+, mucositis
Laboratorios Linfopenia
Neutropenia
Compromiso visceral
Nefritis tubular y necrosis traqueobronquial
Fiebre, edema facial,adenopatías, lesiones en piel
Eosinofilia
Neutrofilia
Hepatitis, nefritis intersticial, neumonitis, miocarditis,tiroiditis
Fiebre,eritema, pústulas
Neutrofilia
Eosinofilia
Hasta en el 20% de los casos
Criterios/Score SCORTEN RegiSCAR EuroSCAR
Tratamiento
Corticoesteroides tópicos/sistémicos InmunoglobulinaIV
Nota: Elaboración propia
Corticoesteroides tópicos/sistémicos Emolientes
Corticoesteroides tópicos/sistémicos
Emolientes


Conclusión
Las reacciones adversas cutáneas a medicamentos son una entidad común, cuyo espectro es amplio, y varía desde leve y autolimitadas, hasta graves con compromiso orgánico e incluso la muerte.
Existen factores que influyen en el desarrollo de estas reacciones como son la edad avanzada, malignidades concomitantes, factores genéticos y la inmunosupresión. Es de vital importancia reconocer estas entidades, e identificar y suspender el fármaco causal, para brindar un manejo adecuado según cada caso.


1. Swanson L, Colven RM. Approach to the patient with a suspected cutaneous adverse drug reaction. Medical Clinics of North America. 2015 Nov;99(6):1337–48. doi:10.1016/j.mcna.2015.06.003
2. Franceschini F, Bottau P, Caimmi S, Cardinale F, Crisafulli G, Liotti L, et al. Mechanisms of hypersensitivity reactions induced by drugs. Acta biomedica. 2019;90:44–55. doi:https://doi.org/10.23750%2Fabm.v90i3-S.8160
3. Laurence Valeyrie-Allanore, Gace Obeid, Jean Revuz. Reacciones a fármacos. Dermatología Bolognia. Cuarta edición. p. 348-374.
4. Harr T, French LE. Toxic epidermal necrolysis and Stevens-Johnson Syndrome. Orphanet Journal of Rare Diseases. 2010 Dec;5(1). doi:10.1186/1750-1172-5-39
5. Huniker Th, Künzi U ‐P., Braunschweig S, Zehnder D, Hoigné R. Comprehensive Hospital Drug Monitoring (CHDM): Adverse skin reactions, a 20‐year survey. Allergy. 1997 Apr;52(4):388–93. doi:10.1111/j.1398-9995.1997.tb01017.x
6. Al Aboud DM, Hafsi. W, Nessel TA. Cutaneous Adverse Drug Reaction. StatPearls. 2023 Nov
7. Trujillo MC, Vásquez LA. Características Clínicas y epidemiológicas de las toxicodermias en pacientes hospitalizados del hospital Pablo Tobón Uribe, Medellín, Colombia, 2007-2009. Revista de la Asociación Colombiana de Dermatología y Cirugía Dermatológica. 2012 Jul 1;20(3):231–6. doi:10.29176/2590843x.234
8. Zambernardi A, Label M. Reacciones cutáneas adversas a medicamentos: Cómo identificar El Desencadenante. Actas Dermo-Sifiliográficas. 2018 Oct;109(8):699–707. doi:10.1016/j.ad.2018.02.017
9. Shear NH, Knowles SR. Cutaneous Reactions to Drugs. En: Goldsmith LA, Katz SI, Gilchrest BA, Paller AS, Leffell DJ, Wolff K. eds. Fitzpatrick's Dermatology in General Medicine, 8e. The McGraw-Hill Companies; 2012.
10. Crisafulli et al. Acta Biomed 2019; Vol. 90, Supplement 3: 36-43


11. Nguyen EmilyD, Gabel CK, Yu J. Pediatric drug eruptions. Clinics in Dermatology. 2020 Nov;38(6):629–40. doi:10.1016/j.clindermatol.2020.06.014
12. Antia C, Baquerizo K, Korman A, Bernstein JA, Alikhan A. Urticaria: A comprehensive review. Journal of the American Academy of Dermatology. 2018 Oct;79(4):599–614. doi:10.1016/j.jaad.2018.01.020
13. Kolkhir P, Giménez-Arnau AM, Kulthanan K, Peter J, Metz M, Maurer M. Urticaria. Nature Reviews Disease Primers. 2022 Sept 15;8(1). doi:10.1038/s41572022-00389-z
14. Grando LR, Schmitt TA, Bakos RM. Severe cutaneous reactions to drugs in the setting of a general hospital. Anais Brasileiros de Dermatologia. 2014 Sept;89(5):758–62. doi:10.1590/abd1806-4841.20142997
15. Frantz R, Huang S, Are A, Motaparthi K. Stevens–Johnson Syndrome and toxic epidermal necrolysis: A review of diagnosis and management. Medicina. 2021 Aug 28;57(9):895. doi:10.3390/medicina57090895
16. Duong TA, Valeyrie-Allanore L, Wolkenstein P, Chosidow O. Severe cutaneous adverse reactions to drugs. The Lancet. 2017 Oct;390(10106):1996–2011. doi:10.1016/s0140-6736(16)30378-6
17. Owen CE, Jones JM. Recognition and management of severe cutaneous adverse drug reactions (including drug reaction with eosinophilia and systemic symptoms, Stevens-Johnson syndrome, and toxic epidermal necrolysis). Medical Clinics of North America. 2021 Jul;105(4):577–97. doi:10.1016/j.mcna.2021.04.001
18. Cardones AR. Drug reaction with eosinophilia and systemic symptoms (dress) syndrome. Clinics in Dermatology. 2020 Nov;38(6):702–11. doi:10.1016/j.clindermatol.2020.06.008
19. Sidoroff A, Halevy S, Bavinck JN, Vaillant L, Roujeau J. Acute generalized exanthematous pustulosis (AGEP) – a clinical reaction pattern. Journal of Cutaneous Pathology. 2001 Mar;28(3):113–9. doi:10.1034/j.1600-0560.2001.028003113.x





ENFOQUE DEL PACIENTE INTOXICADO EN EL SERVICIO DE URGENCIAS
Christian David Pérez Franco1 , Andrés Felipe Estrada Atehortúa2
1. Médico general Universidad de Antioquia, Médico general de urgencias Hospital Pablo Tobón Uribe.
2. Médico especialista en urgencias. Urgentólogo Hospital Pablo Tobón Uribe, especialista en gerencia de IPS. Magíster en epidemiología CES. Docente facultad EIA.
Resumen
El enfoque en urgencias de todo paciente implica una historia clínica acuciosa, rigurosa y enfocada en los detalles debido que de esto depende el éxito de un correcto diagnóstico, identificación del tóxico/xenobiótico.
La condición del paciente es un estado dinámico que requiere enfocarse de forma pragmática en el soporte respiratorio/ventilatorio, circulatorio/hemodinámico para luego de forma simultánea empezar a preparar todos los componentes más específicos del manejo como: descontaminación, antídotos, entre otros.
Palabras clave
Intoxicación, envenenamiento, toxinas, urgencias médicas.
Importancia del problema: epidemiología
En EE. UU se registraron 2 millones de exposiciones toxicológicas durante el 2019, en el que 57.5 % eran de jóvenes adultos. La mayoría intencionadas. La muerte y desenlaces graves fueron raros (<2 %)1 .
- La muerte se asocia más al uso de múltiples sustancias en la misma intoxicación1 .
- La mayoría de los intentos suicidas en Colombia son por xenobióticos (Sustancia natural o sintética ajena al cuerpo humano)


- Es un motivo de consulta predominante en el servicio de urgencias, que hasta el 50 % de las veces tiene un manejo incorrecto, por lo que se requiere de una capacitación y entrenamiento periódico para mejorar los desenlaces duros (Mortalidad, morbilidad)2 .
Introducción
Este artículo tiene como objetivo dar unos puntos clave y un enfoque pragmático de la valoración del paciente en urgencias sobre todo en el ámbito de urgencias.
A pesar de que la mayoría de los conceptos se pueden extrapolar, se tiene como principal objetivo esta revisión la población adulta >18 años, no embarazadas.
Al ser un problema común y dada la baja disponibilidad de expertos en toxicología, es claro que se requiere de un entrenamiento y un abordaje pragmático y sistemático que permita a los primeros respondedores frente a una intoxicación desde la baja a la alta complejidad para mejorar la atención y disminución de errores en el manejo del paciente intoxicado.
El inicio de la valoración en el servicio de urgencias va a implicar el enfoque sistemático y acucioso que permitirá no pasar de largo, ni de forma temporal los requerimientos de un paciente intoxicado. Este es el conocido protocolo: ABDCE
1 Valoración primaria: soporte
1.1 Vía aérea soporte respiratorio/ventilatorio: A y B
- Se debe realizar una evaluación de estas variables para definir los siguientes escenarios:
1.2 Requerimiento de ventilación mecánica invasiva (VMI)
a.El abordaje general será con la secuencia de intubación rápida (SIR)1 . **Siempre se debe considerar naloxona en depresión respiratoria como parte del manejo solo si no tiene una indicación clara de asegurar la vía aérea (De lo contrario este no aplicaría).
** Premedicación: Atropina es útil en intoxicación por inhibidores de colinesterasa



**Inductores: Fentanil, midazolam pueden producir hipotensión. Etomidato para pacientes con hipotensión/choque.
** Relajantes musculares: Si hay preocupación por la hiperkalemia en los inhibidores de colinesterasas usar un relajante no despolarizante (ejm rocuronio)3
b.Hay otras estrategias que, si bien no son el objetivo del capítulo, pero es importante conocerlas, son: secuencia de intubación retardada. Intubación despierto, oxigenación apneica1 .
c. Uso del ventilador: Es algo más avanzado, sin embargo, tener en cuenta los modos especiales para síndrome de dificultad respiratoria del adulto (SDRA), edema pulmonar o toxicidad directa. Hay que recordar que existe una alcalosis respiratoria protectora a mantener (Ejm: Intoxicación por inhibidores de la fosforilación y salicilatos)1 .
1.3 No requiere VMI
- Sobre todo, en el escenario de broncoespasmo por irritantes pulmonares se requiere soporte.
a. Intoxicación con monóxido de carbono: Tiene evidencia cánula nasal de alta velocidad. BI-PAP/CPAP1 .
1.4 Soporte cardiovascular/hemodinámico: C
- Siempre tener accesos venosos así el paciente esté asintomático por el rápido deterioro hemodinámico que pueden tener este grupo de pacientes3 .
- Se realiza una valoración del estado de perfusión, compromiso hemodinámico y definir si estamos frente a un paciente con: crisis hipertensiva, choque o sin alteración
1.5 Crisis hipertensiva:
- No se ha establecido un valor diferente en el paciente intoxicado sin embargo podemos extrapolar el valor predefinido para este tipo de crisis independiente de su causa (>180/100-110 mmHg). En ese orden de ideas una vez se detecte el manejo es:


a.Benzodiazepinas de primera línea. Posterior se utiliza el antihipertensivo que más se acople al mecanismo de acción. Evitar betabloqueador en intoxicación con cocaína1 .
1.6 Choque/Hipotensión:
Se define como > 2 signos de hipoperfusión.
a.Líquidos endovenosos y vasopresor van a ser la primera línea. Norepinefrina es el de elección en intoxicación que no genere bradicardia. Siempre que sea posible utilizar guía con ultrasonido (Depresión cardiaca y vasoplejía)1. Si se necesita un efecto cronotrópico positivo como en intoxicación por calcio antagonistas, beta bloqueadores y bloqueadores alfa 2 centrales, el de elección es la dopamina.
b.En bradicardia, podría utilizarse una prueba con atropina o glucagón1
1.7 Déficit neurológico y exposición: D y E.
- Es importante recordar que frente a la alteración del estado neurológico, sobre todo en depresión del estado mental no explicada por los toxicos o cuando el paciente presenta focalización neurológica, se debe realizar TAC simple de cráneo para descartar causas orgánicas (Sobre todo neurovasculares) potencialmente morbimortales3. No olvidar que hay múltiples diagnósticos diferenciales y causas como enfermedades sistémicas, convulsiones, psiquiátricas, metabólicas, cardiovasculares, trauma, infecciones4
- En contexto de la alteración neurológica hay dos escenarios a destacar: Sobre excitación, disminución de la función.
1.8 Agitación:
- Primera línea: benzodiazepinas. No usar diazepam intramuscular (Absorción efecto, erráticos). Midazolam es superior a Lorazepam5
- Segunda línea: los antipsicóticos (Haloperidol) son generalmente seguros, tener cuidado porque pueden disminuir el umbral convulsivo, empeorar el síndrome


serotoninérgico, síndrome neuroléptico maligno, abstinencia alcohólica. La olanzapina aumenta el riesgo de depresión respiratoria por BZD5 .
- Tercera línea: anestésicos disociativos como la ketamina podría usarse en 3ra línea (Cuidado con el síndrome adrenérgico)
- No utilizar antihistamínicos de primera generación por alto riesgo de prolongar el QT (Ejm: colinérgicos)5
1.9 Convulsiones:
- Primera línea las BZD, segunda barbitúricos y tercera acido valproico. Se pueden utilizar de forma universal3
1.10 Depresión del sistema nervioso central:
- Existen antídotos como flumazemil para la intoxicación por BZD sin embargo se debe estar seguro que no es usuario crónico, porque podría causar un síndrome de abstinencia fatal; así mismo la fisostigmina se utiliza para los inhibdores de colinesterasa, no tienen que darse de forma empírica en el paciente con toxicidad indiferenciada6
1.11 Existen otras medidas a tener en cuenta para revertir alteración neurológica:
- Dextrosa para hipoglicemia según glucometría. Naloxona para revertir el compromiso respiratorio por opioides (De no estar disponible considerar la Intubación orotraqueal)1 .
- La exposición de toda la piel es necesaria para disminuir la posible absorción de tóxicos por vía cutánea. Además de que permite la evaluación de manifestaciones dermatológicas como en intoxicación de monóxido de carbono, inductores de metahemoglobina y algunos metales1 .
1.12 Otros
1.13 Glucemia:
- Siempre vigilarla como complemento del soporte. Realizar ajustes de hipoglucemia o


hiperglucemia. No hay datos de que requiera un ajuste particular con los tóxicos.
1.14 Temperatura: Es fundamental el manejo de este.
a. La hipertermia es una urgencia que requiere manejo. Aplicación de compresas frías o hielo han demostrado ser efectivos. La meta es enfriar <20 minutos. La hipertermia maligna recurrente no es muy frecuente, igual se debe vigilar5 .
2 Valoración secundaria: identificación de la intoxicación
Hay que recordar que las intoxicaciones son estados dinámicos que implican una alta sospecha y vigilancia para tener la oportunidad de interactuar con las variables de manejo. Siempre velar por que los ítems de la valoración primaria estén controlados.
Se debe realizar una historia clínica completa con el fin de encontrar la sustancia que implicó la intoxicación para hacer un manejo específico. Así mismo si esto no es posible buscar patrones de alteración primero dentro de los sistemas del cuerpo para luego formar síndromes/patrones toxicológicos que nos permitan hacer un abordaje sindromático y brindar un mejor manejo de soporte y uso de antídotos.
Además, es fundamental que se analice el contexto, debido a que no es lo mismo, por ejemplo: que el paciente estuvo fumigando arroz, quitando maleza o en una fiesta electrónica. Esto nos da pistas sobre los tóxicos.
2.1 Alteración signos vitales:
- Siempre realizar seguimiento y toma adecuada de signos vitales. Sus patrones nos indican una gran cantidad de sustancias, pero que nos pueden dar pistas significativas sobre qué tipo de sustancia es la etiología.


2.2 Compromiso sistémico:
Órgano – sistema
Oftalmológico
Otorrino
Piel y tegumento
Neurológico
Hallazgo clínico y posible causa tóxica
Midriasis: adrenérgico, anticolinérgicos, serotoninérgico Miosis: Opioides, colinérgicos, agonistas alfa 2 (Clonidina, imidazoles)
Nistagmus horizontal: Bloqueo de canales de sodio Oftalmoplejía: accidente Elapídico, toxina botulínica, tetrodotoxin
Déficit visual: alcoholes tóxicos, cáusticos, quinina
Anosmia: vasoconstrictores intranasales, sulfuro de hidrógeno, zinc
Disgeusia: quimioterapéuticos, cáusticos, radiación.
Tinitus: Salicilatos, antiinflamatorios no esteroideos, quinina, quimioterapéuticos (platinos)
Pérdida auditiva: opioides, aminoglucósidos, quimioterapéuticos (platinos)
Color: azul (metahemoglobinemia), cereza (monóxido de carbono, cianuro), amarillo (hepatotóxico, caroteno)
Ampollas: quimioterapéuticos, cáusticos
Dermatitis química: cáusticos, tintes para el cabello, níquel
Vasculitis: Levamisol contaminado, AINES, cefalosporinas, fenitoína.
Otras reacciones: amiodarona, 5 fluorouracilo, antiinflamatorios no esteroideos, nitrofurantoína, fenitoína, trimetoprim sulfametoxazol, levamisol, cefalosporinas, entre otros.
Depresión sistema nervioso central: opioides, sedantes –hipnóticos, beta agonistas, washout por cocaína o estimulantes
Excitabilidad del sistema nervioso central: adrenérgicos y estimulantes, anticolinérgicos, abstinencia por estimulantes o depresores.
Psicosis: esteroides, estimulantes
Parkinsonismo: Monóxido de carbono, cianuro, antagonistas de dopamina, abstinencia de agonista dopaminérgicos.
Parálisisascendente: Tetrodotoxina, saxitoxina.
Parálisis descendente: accidente Elapídico, toxina botulínica
Parálisis generalizada: agentes colinérgicos
Neuropatía periférica: solventes, alcaloides, ciguatoxina.


Cardiovascular Soplos: alcaloides del ergot, feniletilaminas, MDMA. Falla cardiaca: ciclofosfamida, taxanes, antraciclinas, esteroides anabólicos, cocaína, etanol, alacranes
Derrame pericárdico: anticoagulantes, isoniazida, carbamazepina, inmunomoduladores (TNF alfa, sulfasalazina)
Pulmonar
Gastrointestinal
Broncoespasmo: Colinérgicos, irritantes pulmonares como cloro y amonio, cáusticos
Rigidez del tórax: fentanil, hipertermia maligna, tétano. Debilidad en tórax: Neurotoxinas, colinérgicos.
Dolor abdominal epigástrico: Cáusticos, antiinflamatorios no esteroideos, quimioterapéuticos, etanol, alcoholes tóxicos, fluoroacetato de sodio, acetaminofén, entre otros.
Diarrea: quimioterapéuticos, hongos, colinérgicos, serotoninérgicos
Hepatopatía: acetaminofén, quemadores de grasa, té verde, amatoxina
Genitourinario
Priapismo: antidepresivos, prazosina, cocaína, nitrato de amilo o sildenafilo
Retención urinaria: anticolinérgicos, antihistamínicos, antipsicóticos, opioides
Color de la orina: Lechosa por propofol, naranja por fluoresceína, piridoxina y rifampicina, roja por Hidroxocobalamina, azul por azul de metileno.
Nota: Elaboración propia adaptado de


2.3Toxidromes y otros patrones
Toxidrome
Colinérgico muscarínico
Colinérgico nicotínico
Anticolinérgico
Clínica
Miosis, hipotensión, bradicardia, sialorrea, epífora, diaforesis, aumento del peristaltismo.
Midriasis, fasciculaciones, taquicardia, hipertensión y agitación.
Agitación, taquicardia, hipertensión, aumento de temperatura, hipertermia, midriasis, convulsiones y arritmias.
Simpaticomimétic o No tiene la sequedad marcada del anticolinérgico
Serotoninérgico
Sedante hipnótico
Agitación, taquicardia, hipertensión, diaforesis, temblor, hipertermia, alucinaciones, midriasis, hiperreflexia, convulsiones, arritmias y aumento del peristaltismo.
Depresión del SNC, depresión respiratoria, bradicardia, hipotensión, hipotermia
Opioide
Síndrome neuroléptico maligno
Miosis puntiforme, depresión del sensorio, depresión respiratoria, ausencia de peristaltismo, hipotensión y bradicardia
Alteraciones del sensorio, hiperactividad adrenérgica, rigidez e hipertermia.
Nota: Elaboración propia adaptado de1
Posible xenobiótico
Inhibidores de colinesterasa (carbamatos, organofosforados, sarín y fisostigmina).
Neonicotinoides
Descongestionantes (fenilpropanolamina, efedrina y pseudoefedrina).
Cafeína, y nicotina.
Cocaína,3,4metilendioxipiroval erona (MDPV)
Feniletilaminas, interacciones medicamentosas entre opioides, ISRS, ADT, antidepresivos duales, IMAOs, linezolid, hierba de San Juan y antipsicóticos atípicos
Alcohol, benzodiazepinas, barbitúricos, agonistas GABA
Heroína, oxicodona, metadona, fentanilo, tramadol, buprenorfina y morfina.
Haloperidol, levomepromazina, risperidona, suspensión de bromocriptina, levodopa carbidopa.


Otros patrones
Alucinógeno
Síndrome de abstinencia
Hipertermia
Cardiovascular
Hipoxia celular
Gastrointestinal
Neuropatíaperiférica.
Clínica Posible xenobiótico
Signos vitales normales, alucinaciones alteración del sensorio, desorientación, pánico.
Lo contrario al mecanismo del medicamento que se discontinuo.
Elevación temperatura con daño multiorgánico
LSD, hongos.
Agentes GABA A y B, neurolépticos, opioides, cocaína, cannabinoides
Toxicidad serotoninérgica, neuroléptico maligno, anticolinérgico, abstinencia, salicilatos
Hipotensión bradicardia. con o sin Antihipertensivos, antiarrítmicos
Cianosis, disnea, hemoptisis,
Dolor abdominal, diarrea profusa (Puede tener sangre), choque hipovolémico
Sensitiva/motor
Amonio, cloro, oxido nítrico, cianuro, fluoroacetato de sodio, sulfato de hidrogeno
Arsénico, hongos shiga, colchicina, irritantes, toxina
Pesticidas, metales pesados, veneno elapido, botulismo,
Convulsivo Bupropión, simpaticomiméticos, ketamina, salicilatos
Dolor orofaríngeo
Hemolisis no inmunomediada
Síntomas de hemolisis masiva: Ictericia, palidez, cansancio
Nota: Elaboración propia adaptado de1
Paraquat, cáusticos
Arsénico, cobre,


Siempre recordar mantener los diagnósticos diferenciales no toxicológicos.
Se deberá realizar una evaluación del riesgo basada criterio clínico que sea resultado de múltiples factores como el estado del paciente, información obtenida, identificación del síndrome, epidemiología y uso de sustancias7
- Frente a la falta de información siempre se debe pensar en el peor escenario posible en pro del paciente7 .
3 Valoración terciaria: ayudas diagnósticas
Las ayudas diagnósticas nos pueden dar información útil para el enfoque6,8,9 .
- Electrólitos.
- Hemoleucograma: Mielotoxicidad por metotrexato, colchicina
- Perfil hepático: hepatotoxicidad por acetaminofén.
- TP/INR: cumarínicos, superwarfarínicos.
- Creatin cinas CPK: rabdomiólisis
- Tamización de drogas de abuso: Tienen un uso muy cuestionable por el tiempo extenso que pueden permanecer ciertas drogas recreacionales. No debería usarse de rutina ya que en la mayoría de los casos no cambian las conductas.
- Test de metalespesados
- Radiografía simple de abdomen: Mulas por el látex, metales pesados,
- Rayos x de abdomen o TAC de abdomen (si se sospechan complicaciones): “Mulas”.
3.1 Gases arteriales/venosos:
- Nos dan información sobre el estado ácido base de importancia. Se pueden solicitar venosos debido a que se quiere averiguar sobre este último.
a. Anión gap Aumentado: acrónimo de causas de este es CAT MUDPILES6 .
- Cianuro o monóxido de carbono
- Acetaminofén (masivo), aspirina o cetoacidosis alcohólica
- Tolueno
- Metanol, metformina


- Uremia
- Cetoacidosis diabética
- Paraldehído o propilenglicol
- Hierro, isoniazida o ibuprofeno
- Acidosis láctica
- Etilenglicol
- Salicilatos
3.2 Electrocardiograma (EKG)
Segmento afectado Hallazgo en el EKG Tóxicos
QRS Prolongación QRS, bloqueo de rama derecho, R terminal en AvR
QT Prolongación. Resultado de bloqueo de canales de potasio o hipocalcemia. Puede llevar a torsade de Pointes.
Antidepresivos tricíclicos, difenhidramina, ciclobenzaprina, bupropión
Antipsicóticos, loperamida, antieméticos, varios antibióticos (Azitromicina), diuréticos, insulina, etilenglicol.
Elevación del ST Consistente con infarto agudo al miocardio Cocaína
Patrón de brugada
Patrón de brugada
Bloqueadores de canales de sodio, loperamida, litio.
Depresión del ST Depresión del ST Digoxina
Onda T Picuda
Hiperkalemia por: Diuréticos ahorradores de potasio, EICA/ARA II, gas arsino, fluorida.
Arritmias Taquicardia ventricular bidireccional Digoxina
Bloqueo a uriculo ventriculares
Signos de bloqueo en canales de sodio: S en DI, R en AvR, S sobre R.
Nota: Elaboración propia adaptado de1
Agonistas beta (Clonidina, imidazoles), beta antagonistas, calcioantagonistas no dihidropiridínicos (Diltiazem, verapamilo), bloqueadores de canales de calcio, organofosforados.


4.1 Absorción
4.2 Inhalatorio: Poner oxígeno para desplazar tóxico y requiere mantener vía aérea permeable. Muchos de los tóxicos orales pueden ser volátiles e inhalarse.
4.3 Ocular: Si no conocemos el pH del xenobiótico usar tirilla. Si es un ácido fuerte lavar con agua por 30 min y si es una base fuerte (Cal y cemento) lavado 2 horas1 .
4.4 Parenteral: Si hay forma, por ejemplo, en inyección muscular de metales como mercurio, se puede extraer en cirugía el contenido. No succionar veneno1
4.5 Cutáneo: Se utiliza agua como medida general. Retirar ropa que perpetue la exposición. Recordar lavar en sitios olvidados como retroauricular, pliegues, periumbilical1
4.6 Gastrointestinal: Ha venido siendo reevaluado en los últimos años, incluso siendo motivo de controversia, sobre todo por los resultados heterogéneos y que no impactan tanto en desenlaces fuertes como mortalidad, complicaciones y estancia hospitalaria.
Modalidades:
a. Lavado orogástrico: 250 ml de salino por tubo orogástrico.
Indicaciones: Sustancias corrosivas que impliquen alta letalidad o que sea refractario a otros manejos y que lleven menos de 1 hora de la ingesta.
Contraindicaciones: riesgo de sangrado o perforación gastrointestinal por cirugía reciente. Tampoco está indicado cuando hay alteración del sensorio y riesgo de compromiso de vía aérea1 .
b. Uso de carbón activado: Se usa en intoxicaciones por sustancias con alto potencial de daño, dosis de 1gr/kg vía oral si el paciente tiene sonda nasogástrica, administrarlo mejor por esta vía, vigilar dolor abdominal y deposiciones, no tiene indicación en intoxicaciones por metales pesados1 .


c. Irrigación intestinal: 1-2L/h o 25 ml/kg/h de Polietilenglicol por vía nasogástrica. Indicaciones: Múltiples tabletas, “mulas” o múltiples paquetes en tracto gastrointestinal, intoxicación por metales pesados como mercurio y plomo. Contraindicaciones: alteraciones hidroelectrolíticas, Íleo paralítico o vómito intratable1
4.7 Eliminación
4.8 Corpórea:
a. Diálisis intestinal: Se utilizan técnicas de uso de múltiples ocasiones de carbón activado para sustancias con circulación recirculación entero-entero o enterohepática (Ejm: Carbamazepina, teofilina). Evitar asociar el carbón con catárticos como el sorbitol que pueden afectar los electrólitos3 .
b. Alcalinización de la orina: Hace que los tóxicos que son débilmente ácidos queden en una trampa iónica para ser eliminados (Ejm: Fenobarbital, salicilatos)1 No se recomienda la acidificación para bases débiles como fenciclidina o anfetaminas por el riesgo de mioglobinuria/rabdomiólisis3 .
c. Emulsiones lipídicas: Indicado en intoxicaciones con compromiso neurológico y cardiovascular refractario a medidas de primera línea. Para anestésicos locales, bloqueadores de canales de calcio, antidepresivos tricíclicos.
4.9 Extracorpórea
a. Hemodiálisis: Indicado cuando existen condiciones como bajo peso molecular, baja unión a proteínas, pequeño volumen de distribución, alta solubilidad en agua1 .
b. Hemoperfusión con carbón: Para moléculas grandes o que tengan avidez por el carbón. Sin embargo, difícil logísticamente, poca estandarización y disponibilidad en nuestro medio1
c. Transfusiones con recambio: Para niños en quienes no se pudo lograr hemodiálisis1
d. Plasmaféresis: Remueve grandes moléculas y unidas a proteínas que la hemodiálisis no pudo1 .
5 Antídotos
- Existen pocos antídotos para la gran cantidad de intoxicaciones, pero mejoran morbilidad y mortalidad6
- La mayoría son seguros, pero hay que tener cuidado con errores de posología que aumentan el riesgo de complicaciones6 .


Antídotos para intoxicaciones
Sustancia o tóxico
Opioides
Benzodiacepinas
Acetaminofén
Inhibidores de colinesterasa
Bloqueadores de canales de sodio
Calcio antagonistas y beta bloqueadores
Alcoholes tóxicos, fluoroacetato de sodio
Cianuro
Antidepresivos tricíclicos, bupropión, beta
bloqueadores, bloqueadores de canales de calcio, anestésicos locales, entre otros.
Bromadiolona
Bloqueadores de canales de potasio
Calcio antagonistas y beta bloqueadores
Choque refractario a terapia estándar, cianuro, metahemoglobinemia
Inhibidores de colinesterasa
Monóxido de carbón
Hierro
Arsénico
Digoxina, colchicina
Antidepresivos tricíclicos
Warfarina
Nota: Elaboración propia adaptado de3
Antídoto
Naloxona
Flumazenil
N acetil cisteína
Atropina
Bicarbonato
Gluconato de calcio
Alcohol etílico 96 %
Nitrito de sodio, Tiosulfato de sodio
Emulsiones lipídicas
Fitomenadiona
Sulfato de magnesio
Glucagón
Dosis altas de insulina – hiperinsulinemia
Azul de metileno
Fisostigmina
Oxigeno
Desferoxamina
Dimercaprol
Fragmentos FAB
Bicarbonato de sodio
Vitamina K y concentrados de protrombina


6
Manejos avanzados
Aunque no son el objetivo del capítulo es importante mencionarlos y que existen como medidas:
6.1ECMO (membrana de oxigenación extracorpórea veno arterial): Indicado para soporte de choque cardiogénico refractario mientras se resuelve el choque1 .
6.2Membrana de oxigenación extracorpórea veno venosa: Se puede utilizar para falla respiratoria grave refractaria1 .
6.3 Hipotermia terapéutica: Posterior a paro cardíaco1
6.4 Soporte hepático artificial: Falla hepática, se puede utilizar ejemplo la diálisis con albúmina como medida avanzada1
7 Disposición
7.1 Unidad de cuidado intensivo
- Si están inconscientes requieren vigilancia
- Críticamente enfermos que requieran intubación orotraqueal/ventilación mecánica invasiva y el uso de vasopresores10
- Alteraciones electrocardiográficas, acidosis metabólica o riesgo de deterioro de su estado respiratorio, circulatorio, hemodinámico y metabólico1
7.2 Observación
- Asintomáticos: Los pacientes asintomáticos son de preocupación especial por el rápido deterioro que pueden tener. Siempre se debe tener especial cuidado con intoxicación por Acetaminofén, fluoroacetato de sodio, Paraquat, anticoagulantes, medicamentos de presentación retard, Hierro, mulas, accidente Elapídico1,6
- Farmacobezoar es un término que hace referencia a un bolo de secreciones, moco y medicamentos cuando se ingieren en forma masiva. Pueden hacer las veces de una “bomba de infusión” que va liberando el medicamento perpetuando la intoxicación.
- El período de observación depende del mecanismo de acción de la sustancia y sus potenciales efectos, de su vida media y de la dosis ingerida. Hay casos donde se debe esperar hasta 24 horas, por su efecto retardado (Ejm: Nuevos antidepresivos por


su riesgo tardío de arritmias y convulsiones como bupropión, citalopram y venlafaxina)1
Recordar que se debe esperar para cada sustancia al menos que hayan pasado 3 a 5 vidas medias de la misma para dar un alta segura1
- No cumpla criterios anteriores y se hayan resuelto las alteraciones clínicas y paraclínicas. No olvidar hacer una adecuada evaluación del estado mental del paciente e intervenir el riesgo de auto-heteroagresión.
Conclusiones
1. La historia clínica completa acompañada del examen físico son herramientas fundamentales no solo para la identificación o diagnóstico, sino para guiar el manejo.
2. Es fundamental ser sistemáticos en la historia clínica y no dejar pasar por alto los pequeños detalles, puesto que estos son la clave del diagnóstico y consiguiente manejo.
3. Hay que tener un alto umbral de sospecha en los pacientes asintomáticos y recordar que existen manifestaciones tardías de toxicidad.
4. Las intoxicaciones son estados dinámicos que implican una alta vigilancia para tener la oportunidad de interactuar con las variables de manejo.


1. Parris MA, Calello DP. Found Down: Approach to the Patient with an Unknown Poisoning. Emerg Med Clin North Am. 2022;40(2):193-222.
2. Dart RC, Goldfrank LR, Erstad BL, Huang DT, Todd KH, Weitz J, et al. Expert Consensus Guidelines for Stocking of Antidotes in Hospitals That Provide Emergency Care. Ann Emerg Med [Internet]. 2018;71(3):314-325.e1. Disponible en: http://dx.doi.org/10.1016/j.annemergmed.2017.05.021
3. Thompson TM, Theobald J, Lu J, Erickson TB. The general approach to the poisoned patient. Disease-a-Month [Internet]. 2014;60(11):509-24. Disponible en: http://dx.doi.org/10.1016/j.disamonth.2014.10.002
4. Völk S, Koedel U, Pfister HW, Schwankhart R, Op Den Winkel M, Mühlbauer K, et al. Impaired consciousness in the emergency department. Eur Neurol. 2019;80(3-4):179-86.
5. Gosselin S, Hoffman RS. The Management of Agitated Toxidromes. Emerg Med Clin North Am. 2022;40(2):223-35.
6. Al-Jelaify M, Alhomidah S. The Individualized Management Approach for Acute Poisoning. Adv Pharmacol Pharm Sci. 2021;2021.
7. Daly FFS, Little M, Murray L. A risk assessment based approach to the management of acute poisoning. Emerg Med J. 2006;23(5):396-9.
8. Eldridge DL, Holstege CP. Utilizing the laboratory in the poisoned patient. Clin Lab Med. 2006;26(1):13-30.
9. Bechtel L, Holstege CP. Utilizing the Toxicology Laboratory in the Poisoned Patient. Emerg Med Clin North Am. 2022;40(2):431-41.
10. Mégarbane B, Oberlin M, Alvarez JC, Balen F, Beaune S, Bédry R, et al. Management of pharmaceutical and recreational drug poisoning. Ann Intensive Care [Internet]. 2020;10(1). Disponible en: https://doi.cesproxy.elogim.com/10.1186/s13613-020-00762-9




ENFERMEDAD POR REFLUJO
NO TODO LO QUE ARDE ES REFLUJO

ENFERMEDAD POR REFLUJO GASTROESOFÁGICO: NO TODO LO QUE ARDE ES REFLUJO
Juan Esteban Hernández Abaunza1 , Gabriel Alonso Mosquera Klinger2 , Juliana Murillo Pérez3
1.Médico general Universidad de Antioquia, Médico general líder de procesos ambulatorios Hospital Pablo Tobón Uribe, Centro de Excelencia en Enfermedad Inflamatoria Intestinal Hospital Pablo Tobón Uribe, Docente Universidad EIA.
2.Médico Internista, Gastroenterólogo Pontificia Universidad Javeriana, Fellowship Ultrasonido endoscópico, Gastroenterólogo Hospital Pablo Tobón Uribe, Centro de Excelencia en Enfermedad Inflamatoria Intestinal HPTU. Docente Universidad EIA.
3.Médica Internista Universidad de Antioquia, Internista Hospital Pablo Tobón Uribe, Docente Universidad EIA.
Resumen
La Enfermedad por Reflujo Gastroesofágico es una patología muy común en la práctica médica tanto del médico general como del especialista. Recientemente se actualizó su definición considerando la presencia de evidencia concluyente de patología relacionada con el reflujo mediante endoscopia y/o monitorización anormal del reflujo en presencia de síntomas problemáticos compatibles. La fisiopatología convencional considera una incompetencia de la barrera antirreflujo en la unión esofagogástrica que de acuerdo con su gravedad condiciona la presentación de la enfermedad. Sin embargo, está cada vez más claro que muchas presentaciones de ERGE representan fenotipos distintos con cofactores predisponentes únicos y una fisiopatología fuera de este paradigma que a su vez condiciona el tratamiento y la respuesta a este. El pilar del tratamiento son los inhibidores de bomba de protones que juegan un papel importante incluso en la estrategia diagnóstica, pero de acuerdo con el fenotipo hay otras estrategias terapéuticas disponibles, incluso nuevas terapias en proceso de entrar al mercado.
Palabras clave
Reflujo Gastroesofágico, Esofagitis, Pirosis, Inhibidores de la Bomba de Protones


Introducción
La enfermedad por reflujo gastroesofágico (ERGE) es un trastorno debido al flujo retrógrado del ácido hacia el esófago asociado a síntomas típicos que deterioran la calidad de vida de los pacientes. La ERGE es un diagnóstico clínico común en la práctica del médico general y del especialista y entender su patogénesis es complejo pero necesario; hemos entendido en los últimos años que no todos los pacientes se comportan igual, las causas son múltiples y según el fenotipo dependerá el manejo y la respuesta a los medicamentos. Consideramos que la ERGE debe abordarse como un trastorno más allá del ácido y que la presencia de síntomas típicos también puede significar la presencia de otros trastornos.
Epidemiología
En los adultos, la prevalencia global de ERGE es alta y está aumentando. Existe reporte de varios estudios poblacionales. La prevalencia más alta de síntomas de ERGE se produjo en un estudio centroamericano (19,6%), mientras que la prevalencia más baja se observó en Asia (10,0%; 23 estudios), particularmente en el sudeste asiático (7,4%; 18 estudios)1. En Colombia tenemos un estudio de 2016 que describe que la prevalencia estimada de síntomas de reflujo fue del 11,98 % (IC 95%: 11,05-12,97). En el análisis por ciudades, Barranquilla presentó la frecuencia más alta (16,22%; IC 95%: 14,58-18,01) y Bogotá́ , la más baja (10,75; IC 95%: 9,30-12,38). Para los síntomas evaluados con el cuestionario GERDQ, la prevalencia estimada fue: pirosis, 13,6% (IC 95%: 12,50-14,60); regurgitación, 16,9% (IC 95%: 15,74-17,99); epigastralgia, 16,67% (IC 95%: 15,54-17,80): nauseas, 11,4% (IC 95%: 10,46-12,35); dificultad para dormir por presentar pirosis o regurgitación, 8,17% (IC 95%: 7,36-8,97); y consumo de medicamentos adicionales a los formulados por el médico, 6,68% (IC 95%: 6,01-7,35).
El sexo femenino, el vivir en Barranquilla o Medellín y el presentar una comorbilidad se asociaron estadísticamente con la presencia de reflujo2


Definición
¿Cómo se define la Enfermedad por Reflujo Gastroesofágico?
La definición de la Enfermedad por Reflujo Gastroesofágico (ERGE) no ha sido fácil, por lo que en varios consensos de expertos se han hecho esfuerzos para definirla, abarcando los elementos clínicos clave y teniendo en cuenta el advenimiento de nuevas tecnologías tanto para el diagnóstico como para el tratamiento. Una de las definiciones que más peso ha tenido en épocas recientes, es la del consenso de Montreal realizado en 2006 que define la ERGE como “el reflujo del contenido del estómago hacia el esófago que causa molestias, síntomas y/o complicaciones3. Sin embargo, esta definición no contempla la descripción de las complicaciones y hay que señalar que no todos los síntomas “problemáticos o molestos” están relacionados con reflujo de contenido estomacal y los síntomas por sí solos son insuficientes para realizar el diagnóstico. Es por eso por lo que recientemente el consenso de Lyon 2.0, publicado en 2024, dice que la definición moderna de ERGE requiere evidencia concluyente de patología relacionada con el reflujo mediante endoscopia y/o monitorización anormal del reflujo (utilizando los umbrales del consenso de Lyon) en presencia de síntomas problemáticos compatibles4 .
Así podemos concluir que la ERGE es una condición que se desarrolla cuando la regurgitación del contenido gástrico genera síntomas y/o complicaciones asociadas; el diagnóstico puede estar basado en la presencia de síntomas típicos y/o atípicos, evidencia de reflujo gastroesofágico mediante estudios diagnósticos y evidencia de compromiso de mucosa esofágica (hallazgos histológicos)5 .
Fisiopatología
¿Por qué se presenta el Reflujo Gastroesofágico?
En condiciones normales, encontramos en la unión gastroesofágica una sinergia entre el esfínter esofágico inferior (EEI) y el diafragma crural, un hiato estrecho y una presión normal de dicho esfínter. De igual manera existe un reflujo fisiológico necesario y que


consiste en la presencia de relajaciones transitorias del EEI para la ventilación selectiva de gases, un reflujo relacionado con este mecanismo, confinado al esófago distal y uno con un aclaramiento de ácido rápido6
Clásicamente se ha considerado que el reflujo se da por un exceso de ácido y algún grado de disfunción del esfínter esofágico inferior (EEI)7. Pero más allá de ese único argumento, y teniendo en cuenta que hasta el 50% de los pacientes con ERGE podrían experimentar poco o ningún alivio con la supresión farmacológica del ácido, existen otros factores fundamentales en la fisiopatología atribuibles a la composición del reflujo y a factores a nivel del esófago como los aspectos estructurales, mecánicos, bioquímicos y fisiológicos (Fig 1).
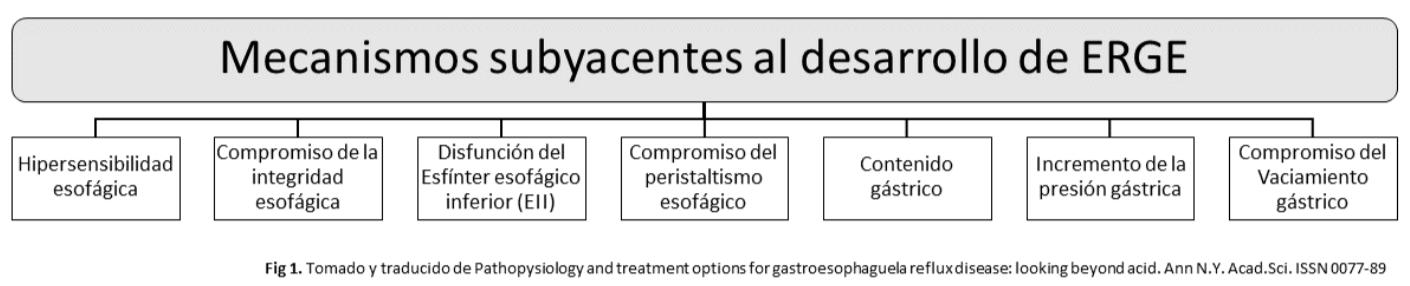
La fisiopatología de la ERGE es multifactorial, incluyendo la formación del bolsillo ácido, el vaciamiento gástrico anormal y la falla de la barrera antirreflujo y el diafragma crural.
Adicionalmente las características del reflujo y los mecanismos de aclaramiento esofágico afectan la extensión del daño de la mucosa. Además de la integridad de la mucosa, los mecanismos periféricos, centrales y psicológicos son fundamentales para la percepción de los síntomas1,7
Factores Gástricos
Quizás más importante que el contenido total de ácido gástrico sea su ubicación con respecto a la unión esofagogástrica. Se ha demostrado que hay una zona de jugo gástrico muy ácido debajo de la unión esofagogástrica, que no se ve afectada por el efecto buffer de las comidas y que se ha denominado bolsillo ácido (Fig. 2). Esta área


es la fuente del reflujo ácido posprandial y se extiende de 2 a 3 cm abarcando el cardias a través de la unión escamocolumnar. En pacientes con ERGE, se extiende hacia el EEI y el esófago distal (hasta 6 cm por encima de la unión escamocolumnar), especialmente en aquellos pacientes con grandes hernias hiatales. Sólo el 30% de los pacientes con ERGE presentan un vaciamiento gástrico anormal pero cuando está presente puede modificar el reflujo posprandial, se ha descrito una alteración de la acomodación gástrica de la comida y una relajación fúndica posprandial prolongada1 .
Es una zona de altas presión entre el estómago y el esófago compuesta principalmente por el EEI, el diafragma crural y la válvula de aleta gastroesofágica, que está sostenida por el ligamento frenoesofágico y las fibras del cabestrillo gástrico del cardias gástrico. La mayoría de las relajaciones transitorias del esfínter esofágico inferior (RTEEI) ocurre en las primeras 2 horas postprandiales, en este periodo se presentan la mayoría de los episodios de reflujo. La tasa de RTEEI es similar en individuos sanos y pacientes con ERGE, sin embargo, en individuos sanos, sólo el 30% de las RTEEI se acompañan de reflujo ácido en comparación con el 65% en pacientes con ERGE y esofagitis leve. En los pacientes con esofagitis por reflujo más grave y/o hernia hiatal hay una mayor proporción de reflujo durante la ausencia de presión basal del EEI y las RTEEI inducidas por la deglución. Adicionalmente, los pacientes con hernia hiatal pueden tener una alteración del aclaramiento de ácido esofágico debido a flujo retrógrado temprano desde el saco de hiato al esófago inmediatamente después de la relajación del EEI1,7
Características del reflujo
- Reflujo ácido: se considera cuando el pH del reflujo es <4. Los pacientes con ERGE tienen una mayor tasa y proporción de reflujo ácido y de reflujo ácido puro-líquido (sin gas). Es más probable que se produzcan pirosis y regurgitación cuando la caída del pH es grande, la extensión proximal del reflujo es alta y el aclaramiento de volumen y ácido se prolongan. Además, la sensibilización del esófago se produce por episodios previos de reflujo ácido.


- Reflujo débilmente ácido: débilmente ácido o no ácido puede provocar síntomas, particularmente regurgitación, en pacientes con síntomas típicos de ERGE que utilizan un IBP y con menos frecuencia, pirosis o dolor torácico. También podría estar implicado en el daño persistente de la mucosa en pacientes con Esófago de Barrett (EB) y en aquellos con esofagitis que no responden a una dosis doble de tratamiento con IBP.
- Reflujo biliar: El contenido gástrico incluye ácidos biliares como los ácidos cólico y desoxicólico. Se ha demostrado que la mayoría de los eventos de reflujo biliar ocurren en un entorno de reflujo ácido. La gravedad del reflujo ácido y duodenogastroesofágico (incluido el reflujo biliar) aumenta gradualmente desde individuos sanos hasta pacientes con esofagitis, observándose los valores más altos en pacientes con EB. La relación entre el reflujo biliar anormal y la persistencia de síntomas de ERGE a pesar del tratamiento con IBP es controvertida, ya que también se ha evidenciado en pacientes que responden a los IBP.
- Reflujo de gases: La presencia de gas aumenta la percepción de eventos de reflujo. Los eructos supra gástricos, son producto del aire que entra y sale del esófago rápidamente sin llegar al estómago, se detectan comúnmente en pacientes con síntomas de ERGE y se asocian mecánicamente con un aumento del reflujo ácido1 .
Volumen, extensión proximal y distensión esofágica
Los indicadores indirectos del volumen de reflujo son la extensión proximal del pH o los cambios de impedancia. Los estudios de pH impedanciometría han demostrado que los episodios de reflujo sintomático alcanzan una extensión proximal mayor que los eventos de reflujo asintomáticos. Los episodios de reflujo asociados con regurgitación tuvieron una extensión proximal mayor que los episodios de reflujo asociados con pirosis. Se ha sugerido que la distensión esofágica inducida por el reflujo es fundamental para la percepción de los síntomas, especialmente en pacientes con ERGE refractaria1,7


Aclaramiento esofágico
La duración de la exposición de la mucosa esofágica al reflujo depende de la eficacia de los mecanismos de eliminación del mismo y de la presencia de hernia hiatal. El proceso implica una eliminación rápida del volumen inicial mediante peristaltismo, seguida de una eliminación química gradual mediante la llegada de saliva rica en bicarbonato y las degluciones posteriores6
Cuando el reflujo llega al esófago y los mecanismos de eliminación fallan, la mucosa esofágica queda expuesta al contenido gástrico. Se habla de distintos mecanismos relacionados con la exposición al ácido que causan daño sobre la mucosa y que pueden llevar a pérdida de la integridad de la misma: citotoxicidad epitelial, daño del DNA, mutaciones (metaplasia y displasia) y dismotilidad esofágica, varios de ellos relacionados con la presencia de citoquinas proinflamatorias (IL-6, IL-8, INF-gamma, radicales libres, entre otros), la actividad de los ácidos biliares y la pepsina. Los mecanismos de defensa están determinados por la severidad del daño de la mucosa inducido por el reflujo8 .
El hallazgo endoscópico de inflamación de la mucosa es lo que se conoce como esofagitis y se presenta solo en un tercio de los pacientes con síntomas de reflujo como pirosis y regurgitación, lo que significa que la mayoría de los pacientes con síntomas de reflujo tendrán una endoscopia con una mucosa macroscópicamente normal, determinante al abordaje terapéutico1. Las erosiones del esófago distal son el hallazgo endoscópico de mayor correlación con ERGE y la clasificación de Los Ángeles (LA) permite clasificar la esofagitis erosiva en cuatro niveles de gravedad: A, B, C y D, con muy buena correlación con la pHmetría esofágica de 24 horas, alta concordancia inter observador (kappa = 0,8-0,9) y ha sido validada en varias poblaciones4 .


Comorbilidad psiquiátrica e hipervigilancia
Un componente final del dolor esofágico es la modulación psico-neuro-inmunológica.
Muchos pacientes con pirosis informan que el estrés psicológico empeora sus síntomas. Se sabe que el estrés agudo reduce los umbrales de dolor a la perfusión ácida esofágica. Las comorbilidades psicosociales también determinan la gravedad de los síntomas de ERGE y la respuesta al tratamiento. La hipervigilancia esofágica es un fenómeno que comprende procesos cognitivos y afectivos, como atención específica a las sensaciones esofágicas, aumento de la ansiedad sobre los síntomas y el dolor esperado y pensamientos catastróficos sobre las consecuencias de los síntomas1 .



Síntomas
Los síntomas típicos de ERGE incluyen pirosis y regurgitación. La pirosis es el síntoma más común de ERGE y se describe como una sensación de ardor retroesternal que asciende desde el epigastrio hasta el cuello. La regurgitación es el retorno sin esfuerzo del contenido gástrico hacia la boca, a menudo acompañada de un sabor ácido o amargo. Aunque tanto la pirosis como la regurgitación son síntomas importantes de ERGE, la génesis de estos síntomas no es la misma y los enfoques de diagnóstico y tratamiento varían según el síntoma que predomine. El dolor torácico, indistinguible del dolor cardíaco, puede presentarse junto con pirosis y regurgitación o como único síntoma de ERGE4
La pirosis y la regurgitación siguen siendo los síntomas más sensibles y específicos de la ERGE, aunque su presencia no confirma el diagnóstico. Una revisión sistemática encontró una sensibilidad variable de la pirosis y la regurgitación para la esofagitis erosiva (EE) (30%–76%), con una especificidad entre el 62% y el 96%9 Por tanto, la sola presencia de pirosis o regurgitación no son suficientes para hacer el diagnóstico, pero cuando están presentes hacen mucho más probable el diagnóstico de ERGE.
Las manifestaciones extraesofágicas de la ERGE pueden incluir síntomas laríngeos y pulmonares como ronquera, aclaramiento de la garganta y tos crónica y afecciones como laringitis, faringitis, erosiones dentales y fibrosis pulmonar (reportes anecdóticos).
Sin embargo, estos síntomas y condiciones tienen poca sensibilidad y especificidad para el diagnóstico de ERGE. Los diagnósticos de ERGE mediante síntomas extraesofágicos solos o por su respuesta a los IBP no son confiables debido a la escasa sensibilidad y especificidad. También se ha propuesto que la ERGE pudiera exacerbar el asma. Este tipo de síntomas son un desafío para los pacientes y los médicos porque, aunque pueden ser el resultado de ERGE, también pueden deberse a muchas otras causas; incluso en los pacientes con ERGE establecida previamente, puede resultar difícil establecer que el reflujo es la causa de estos problemas extraesofágicos10


El dolor torácico se incluye comúnmente como un síntoma de ERGE. Con frecuencia se ve que se utiliza una prueba de IBP para el diagnóstico de dolor torácico presuntamente relacionado con ERGE. Sin embargo, la evidencia alrededor del tratamiento del dolor torácico no cardíaco con IBP ha encontrado que la mejoría de los síntomas con una prueba con IBP es efectiva sólo en pacientes con esofagitis erosiva o monitorización anormal del pH10
Es importante mencionar que ni la frecuencia, ni la gravedad de los síntomas, ni ambas pueden predecir con precisión la presentación fenotípica de la ERGE o la gravedad de la esofagitis erosiva. Lo mismo aplica para la distinción de los fenotipos de ERGE y los diferentes trastornos funcionales que tienen la pirosis como síntoma predominante6
Fenotipos del Reflujo: Lo nuevo en el abordaje
Sin duda, uno de los aportes más importantes al enfoque de la ERGE en los últimos 5 años, es la clasificación por fenotipos de la enfermedad, dado que la ERGE no se define solo por la presencia de pirosis y no todos los pacientes son iguales en su presentación. Cada vez es más claro que las diferentes presentaciones de esta enfermedad representan fenotipos distintos con cofactores predisponentes únicos y una fisiopatología fuera del paradigma de la disfunción del EEI y el exceso de ácido y que a su vez pueden tener un abordaje terapéutico distinto. A continuación, se describen los fenotipos de la ERGE:
1. Enfermedad por reflujo gastroesofágico no erosivo (ERNE o NERD por sus siglas en inglés): Este fenotipo hace referencia a los pacientes con síntomas típicos de reflujo, que tienen exposición anormal real al ácido según los criterios de Lyon (Tiempo de exposición ácida >6%) y ausencia de lesiones erosivas o endoscopia negativa6 Representan del 60 al 70% de los pacientes con ERGE.


Los determinantes fisiológicos del aumento de la sensibilidad esofágica (que explicarían la presencia de síntomas) se centran en la integridad de la mucosa y las vías neurales del dolor. En los pacientes con ERNE, aunque por definición hay ausencia de erosiones, se han identificado espacios intercelulares dilatados por microscopía electrónica, aumento de las asas capilares y menor impedancia de la mucosa1 .
La hipótesis es que el aumento de la permeabilidad de la mucosa facilita la exposición de raíces nerviosas sensitivas subepiteliales al reflujo lo que las hace más vulnerables a la quimio estimulación, particularmente en el esófago proximal. En los criterios de Roma IV, se ha definido como el “verdadero ERNE” sobre la base de la exposición anormal al ácido esofágico. Cuando esta condición no existe, estamos ante la presencia de un fenotipo diferente (que sería el de hipersensibilidad o la pirosis funcional)6 .
2. ERGE con hipersensibilidad / Pirosis Funcional: Tanto la hipersensibilidad como la pirosis funcional hacen parte de los fenotipos no erosivos de la enfermedad por reflujo gastroesofágico y pueden definirse por la presencia de síntomas típicos inducidos por el reflujo a pesar de una exposición esofágica normal al ácido a diferencia del ERNE donde hay una prueba diagnóstica que sí demuestra una exposición alterada.
Los pacientes con estos fenotipos no erosivos pueden desarrollar síntomas no solo por la exposición al ácido en el esófago, sino también por una mayor percepción del dolor a través de mecanismos tanto periféricos como centrales donde hay una transmisión del dolor acelerada y potenciada y una inhibición descendente atenuada. En consecuencia, el estrés y la ansiedad aumentan la respuesta central a los estímulos esofágicos. La implicación de todo esto es que los pacientes con esófago hipersensible y pirosis funcional tienen menor respuesta a la terapia anti secretora.
Dada la predisposición a la sensibilización al dolor esofágico, las terapias dirigidas a la percepción de la pirosis como los antidepresivos tricíclicos, los inhibidores de la recaptación de serotonina, la gabapentina y terapias no farmacológicas como la terapia


cognitivo conductual, la acupuntura, la meditación y el ejercicio pueden beneficiar algunos de estos pacientes6 .
3. Esofagitis erosiva de bajo grado (en la clasificación de Los ángeles A): La esofagitis grado A se considera un hallazgo inespecífico, ya que puede ser encontrada en hasta 7,5% de pacientes sanos8. La fisiopatología de la esofagitis de bajo grado implica un deterioro menos grave de la unión gastroesofágica con respecto a la enfermedad de alto grado. De hecho, en la literatura reciente se ha restado importancia al hallazgo de esofagitis LA grado A debido a la posibilidad de remisión espontánea, la baja probabilidad de progresión a cambios inflamatorios más graves, esófago de Barrett y adenocarcinoma esofágico. Análisis adicionales han sugerido una respuesta más sólida a los IBP (>90%) que con grados más altos de esofagitis. Esto es consistente con los hallazgos de tiempos de exposición al ácido más bajos y una fisiología antirreflujo menos afectada. Teniendo en cuenta estas condiciones, el Consenso de Lyon 2.0 continúa considerando que la esofagitis grado A no es un hallazgo definitivo de ERGE y se requiere de más estudios para definir su presencia6 .
4. Esofagitis erosiva de alto grado (Los Ángeles B, C o D): Los consensos modernos siempre han considerado que la esofagitis de grados C y D de LA, el esófago de Barrett demostrado por biopsia y la estenosis péptica son concluyentes para el diagnóstico de ERGE4. La esofagitis grado B, C y D es muy poco frecuente en pacientes sanos.
Lo nuevo en el consenso de Lyon 2.0 publicado en 2024, es la inclusión de la presencia de la esofagitis grado B como un hallazgo concluyente de ERGE, dado que en el consenso previo se había considerado como un hallazgo de bajo grado o borderline, por la variabilidad inter observador en su descripción endoscópica. La recurrencia de la esofagitis (B, C y D) durante el tratamiento con IBP optimizado es indicativa de ERGE refractaria4 .


5. Esófago de Barrett (EB): Hace referencia a un cambio metaplásico del esófago distal, en el cual el epitelio escamoso normal es reemplazado por un epitelio columnar especializado con células caliciformes y endoscópicamente evidenciado por cambios epiteliales superiores a 1 cm1. Este cambio metaplásico se asocia con la ERGE y se puede presentar entre el 5% y el 12%. Es la única lesión precursora conocida del adenocarcinoma de esófago, un cáncer con una incidencia en rápido aumento en los últimos 40 años en los Estados Unidos y otros países occidentales11 . Se ha estimado que el 5,6% de los adultos en Estados Unidos tienen esófago de Barrett. El riesgo absoluto de adenocarcinoma esofágico es bajo en el esófago de Barrett sin displasia, pero considerablemente mayor en presencia de displasia12. El EB se presenta más hombres caucásicos, lo que sugiere una susceptibilidad genética y/o protección hormonal.
De manera similar a la esofagitis de alto grado, los pacientes con EB son relativamente menos sensibles a la exposición al ácido esofágico en comparación con otros fenotipos de ERGE, lo que se correlaciona con la escasez o ausencia de síntomas de reflujo informados por muchos pacientes con EB y por aproximadamente el 50% de los pacientes con adenocarcinoma de esófago6. Estos pacientes deben recibir IBPs de forma indefinida y la vigilancia propuesta en las guías es realizar endoscopia de seguimiento a los 5 años en los EB sin displasia menores de 3 cm, a los 3 años en los EB sin displasia mayores de 3 cm y para los EB indefinidos para displasia sugieren una revisión por un segundo patólogo experto gastrointestinal y repetir la endoscopia y las biopsias a los 6 meses. Aquellos con displasia de bajo grado, alto grado y adenocarcinoma temprano deben ser derivados al algoritmo de manejo del EB relacionado con neoplasia11,12
6. Síndrome de dolor torácico por reflujo: El dolor torácico relacionado con la ERGE representa otro fenotipo en el que establecer la causalidad no suele ser fácil. Los diagnósticos diferenciales del dolor torácico son múltiples, siendo el reflujo la causa


última sólo en una minoría. Cuando está presente, las características clínicas del dolor
torácico esofágico pueden ser indistinguibles de las de la enfermedad coronaria. El mejor escenario, y a menudo difícil, de establecer la causalidad es registrar el reflujo ácido simultáneamente con la aparición del dolor torácico durante una pHmetría. Un estudio de 177 pacientes evaluados por dolor torácico no cardíaco con pHmetría informó una exposición esofágica anormal al ácido en un 35%, siendo más común en sexo masculino, la edad avanzada y la raza caucásica. Además, la pHmetría anormal fue más común en pacientes con pirosis, regurgitación y hernia hiatal. En otras palabras, es más probable que un síntoma esofágico atípico sea atribuible a ERGE cuando los síntomas típicos también están presentes, lo que a su vez tendrá impacto en la respuesta al tratamiento con IBP, siendo mayor en los pacientes con dolor torácico con síntomas típicos que en aquellos sin síntomas típicos (NNT 2 Vs NNT 17), teniendo en cuenta que los estudios definieron buena respuesta con una reducción del 50% del dolor6. Este umbral reducido de respuesta a los IBP sugiere que la hipersensibilidad esofágica puede ser un cofactor importante en la génesis del dolor torácico esofágico.
También hay datos que muestran que los pacientes con dolor torácico esofágico pueden tener alterada la integridad de la mucosa esofágica, exponiendo aferentes sensoriales a estímulos luminales. En particular, Roma IV distingue el dolor torácico funcional del dolor torácico atribuible a ERGE con o sin hipersensibilidad esofágica6 .
7. ERGE con regurgitación dominante: Este fenotipo tiene respuesta reducida al tratamiento en comparación con la enfermedad con predominio de pirosis, explicado porque los mecanismos que producen la regurgitación son distintos. Específicamente, la falla grave de la unión gastroesofágica con o sin hernia hiatal facilita el flujo de contenido gástrico hacia el esófago en un volumen suficiente para que se perciba el movimiento del líquido dentro del esófago o que el reflujo entre a la hipofaringe y se pueda saborear. Esto puede ocurrir independientemente de la presencia de ácido y se


acentúa en decúbito. La regurgitación molesta (que ocurre 3 a 7 días por semana) es común en la ERGE y puede generar trastorno del sueño en hasta 60% de estos
pacientes. Los metaanálisis de ensayos de tratamiento han demostrado que el tratamiento con IBP es entre un 10% y un 20% menos eficaz para aliviar la regurgitación que para aliviar la pirosis. Por otro lado, la funduplicatura quirúrgica o endoscópica y el tratamiento con dispositivo LINX (que es una cuerda magnética que se aplica sobre el esfínter esofágico inferior) producen disminución de los episodios de regurgitación ácida y han demostrado en ensayos controlados aleatorios ser más eficaces que los IBP para aliviar la regurgitación6
Un importante diagnóstico diferencial de la ERGE con predominio de regurgitación es la rumiación y se distinguen clínicamente porque si bien la regurgitación suele ser ácida, posprandial y provocada por acciones como agacharse o levantar objetos, la rumiación por lo general es suave, ocurre mientras se come y es provocada por la sobrecarga subconsciente de la unión gastroesofágica con tensión de la musculatura abdominal. Esto puede detectarse manométricamente mediante aumentos abruptos de la presión intragástrica y fisiológicamente mediante aumentos transitorios del tono de los músculos de la pared abdominal. Aunque aparentemente es un síndrome diferente a la ERGE, el síndrome de rumiación se superpone con ERGE en posición vertical porque ambos se asocian con una inversión del gradiente de presión esofagogástrica que da como resultado un flujo de contenido gástrico hacia el esófago. Por otro lado, la rumiación no responde a los IBP, dado que es completamente independiente de la secreción de ácido gástrico. Se trata de manera óptima con la combinación de terapia cognitivo-conductual y el aprendizaje de la técnica de la respiración diafragmática. Otras opciones terapéuticas son el baclofeno y la funduplicatura, rara vez indicada. Finalmente, la gastroparesia se asocia comúnmente con pirosis y regurgitación, que se correlacionan con la gravedad del deterioro del vaciamiento gástrico6 .
8. Reflujo laringofaríngeo y tos crónica: El abordaje de las aparentes manifestaciones extraesofágicas de ERGE es un desafío. Las preguntas críticas que


deben tenerse en cuenta son: (1) ¿Tiene el paciente reflujo anormal y cómo se puede detectar? (2) ¿El reflujo está causando el síntoma extraesofágico? (3) ¿Por qué mecanismo ocurre esto? Es poco común que el reflujo sea la causa dominante de síndromes extraesofágicos en pacientes sin síntomas esofágicos típicos y lo más probable sea uno de los múltiples cofactores causales. La medición del pH es más útil cuando es normal, excluyendo el reflujo como causa, que cuando es positiva, dejando esa puerta abierta, ya que existe una tendencia a sobre tratar a estos pacientes, ya sea con IBP o cirugía antirreflujo6
Se ha intentado adaptar la pHmetría como método de estudio para estos síntomas colocando el sensor de pH en la hipofaringe o cerca de ella con condiciones técnicas cuestionables y baja concordancia y se ha intentado medir la pepsina en saliva como indicador indirecto de reflujo con muy baja sensibilidad (38%) y especificidad (60%) para diferentes entre fenotipos, por lo que a pesar de sus limitaciones teóricas, son la pHmetría convencional y la pH/impedanciometría las únicas pruebas validadas para la aplicación clínica10
Un tratamiento eficaz implica un enfoque multidisciplinario destinado a identificar cofactores causales y tratamientos complementarios. Respecto al manejo quirúrgico, no existen datos de alta calidad que respalden su eficacia en estos síndromes10 .
Hay registros anecdóticos de pacientes con reflujo que desarrollan fibrosis pulmonar, bronquiectasias, tos crónica, asma o disfunción laríngea, sin embargo, la ERGE como contribuyente a estos síndromes extraesofágicos no ha demostrado ser un real problema. Una excepción a la regla es la presencia de ERGE en pacientes con trasplante de pulmón, que, a pesar de las dificultades para establecer su causalidad, tiene consideraciones importantes en relación con nueva enfermedad pulmonar primaria y lesión del aloinjerto asociada a la exposición al ácido incluso con tratamiento con IBP, lo que hace que algunos de estos pacientes que van a ser trasplantados de pulmón, sean llevados previamente a funduplicatura de forma preventiva6 .



Diagnósticos Diferenciales: porque no todo lo que arde es reflujo.
Los síntomas de la ERGE son inespecíficos y pueden superponerse o confundirse con los de otros trastornos como la rumiación, la acalasia, la esofagitis eosinofílica (EoE), la hipersensibilidad al reflujo, la enfermedad funcional, la enfermedad cardíaca o pulmonar y la hernia paraesofágica. Por eso ante la presencia de síntomas de reflujo, es necesario hacer un abordaje integral del paciente, estableciendo un fenotipo que permita sospechar la presencia de estas otras causas que en muchas ocasiones terminan siendo tratadas como reflujo por un tiempo considerable sin un estudio adecuado.
Diagnóstico De Erge: ¿Cómo Se Hace?
No existe un estándar de oro para el diagnóstico de ERGE. Por tanto, el diagnóstico se


basa en una combinación de presentación de síntomas, evaluación endoscópica de la mucosa esofágica, monitorización del reflujo y respuesta a la intervención terapéutica.
La pirosis y la regurgitación son los síntomas más sensibles y específicos de la ERGE, sin embargo, su presencia no asegura el diagnóstico. La mayoría de las declaraciones y directrices de consensos recomiendan el tratamiento con un IBP como “prueba” diagnóstica en pacientes con síntomas típicos de pirosis y regurgitación, bajo la premisa de que una respuesta a un IBP establece el diagnóstico de ERGE. Aunque se trata de un enfoque práctico y eficaz, está limitado por una sensibilidad combinada del 78% y una especificidad de sólo el 54% (utilizando la endoscopia y la monitorización del pH como estándar de referencia) según un metaanálisis y un estudio prospectivo13
El American College of Gastroenterology en su última guía publicada en 2022 recomienda que, ante la presencia de pirosis, regurgitación, en ausencia de signos y síntomas de alarma, con una frecuencia e intensidad que comprometan la calidad de vida, se realice una prueba con IBP durante 8 semanas antes de la primera comida. Cabe señalar que la dosis aprobada para esta prueba por parte de la FDA es una sola dosis al día y no dos como es común verlo en la práctica diaria. Si el paciente responde satisfactoriamente, el diagnóstico de ERGE es probable y la propuesta es suspender el IBP, vigilar y si los síntomas recurren, se recomienda llevar al paciente a una endoscopia digestiva superior sin IBP en las 2 a 4 semanas previas para proceder según los hallazgos9,14
Una endoscopia digestiva superior normal o una esofagitis grado A de la clasificación de LA son indicativas de realizar estudios de monitoria para reflujo (pH impedanciometría) nuevamente sin terapia y en caso de que estos estudios sean normales se debe considerar otras causas para los síntomas14 . El consenso de Lyon 2.0 confluye en el concepto de la prueba terapéutica con IBP por 8 semanas y sugiere las pruebas de monitoria que se deberían realizar de acuerdo con los síntomas referidos (Fig.4)15 .



De acuerdo con los parámetros actualizados en el consenso de Lyon 2.0, la presencia de una esofagitis grado B, C o D, una estenosis o un esófago de Barret son evidencia concluyente de ERGE y debe iniciarse tratamiento y manejo según corresponda15 .
Ayudasdiagnósticas
Las ayudas diagnósticas de las que disponemos para apoyar el diagnóstico de ERGE son variadas. En primer lugar, la endoscopia digestiva superior que permite evidenciar la presencia o ausencia de esofagitis erosiva (clasificación de Los Ángeles), hernia hiatal, esófago de Barrett, estenosis y lesiones neoplásicas tempranas o avanzadas que expliquen los síntomas, pero también permite observar hallazgos endoscópicos que sugieran diagnósticos diferenciales (esofagitis eosinofílica, acalasia, neoplasias etc.)6. Para evaluar a los pacientes con síntomas de ERGE extraesofágicos se han utilizado pruebas de impedancia de pH multicanal, pruebas de pH tradicionales con


catéter y pruebas de pH inalámbricas. La prueba de monitoreo del reflujo que utilizan pH impedanciometría pueden detectar reflujo ácido (pH <4), débilmente ácido (pH 4-7) y no ácido (pH >7), y determinar el alcance del reflujo proximal, lo que puede ser importante en la evaluación de la enfermedad extraesofágica.
El objetivo de esta revisión no es describir detalles técnicos de los métodos de monitoreo del reflujo, sin embargo, es importante mencionar el concepto de Tiempo de Exposición Ácida (TEA) que hace referencia al tiempo, expresado en porcentaje en un estudio de 24 horas en el que la mucosa esofágica está en contacto con el ácido estomacal. En condiciones normales, se pueden presentar hasta 40 episodios de reflujo en un día con un TEA menor de 4%. Cuando se cumplen estas dos condiciones, se considera que estamos frente a evidencia en contra de la presencia de ERGE.
Si hay un TEA <4% y se asocia a la presencia de síntomas, cumple con criterios de hipersensibilidad al reflujo (trastorno funcional). Por el contrario, la presencia de un TEA mayor de 6% con más de 80 episodios de reflujo al día, es una evidencia consistente de la presencia de reflujo que, unido a la presencia de síntomas y otros hallazgos ya descritos, confirma el diagnóstico de ERGE. Queda una zona gris, en donde aún hay dudas por aclarar y son los pacientes que tienen un TEA entre 4% y 6% y entre 40 y 80 episodios de reflujo donde se requiere unir más evidencia para apoyar o descartar la presencia de ERGE. La combinación de TEA >4 % y >80 episodios de reflujo/día con un régimen antisecretor optimizado es evidencia de ERGE refractaria (Fig. 5)15
Tratamiento
El tratamiento de la enfermedad consiste en la combinación de la modificación en conductas y estilos de vida, el tratamiento farmacológico en incluso manejo quirúrgico.



Medidas no farmacológicas
Los cambios en los estilos de vida son transversales a todos los fenotipos de la ERGE e incluyen: pérdida de peso, abandonar el tabaquismo, evitar comer 2 a 3 horas antes de dormir, evitar los medicamentos que el paciente perciba como detonantes de los síntomas y elevar la cabecera de la cama, en caso de que haya síntomas nocturnos14 .
La columna vertebral del tratamiento farmacológico para la ERGE son los medicamentos dirigidos a la neutralización o reducción del ácido gástrico. Entre ellos están los antiácidos, H2RA (bloqueadores H2) e IBP. Los antiácidos se utilizan exclusivamente para el alivio de los síntomas a demanda y hay poca evidencia que favorezca a un tipo sobre otro. Existe evidencia de que los alginatos pueden tener una potencial eficacia en el alivio de los síntomas y en nuestro país contamos con varias


presentaciones disponibles14
Inhibidores de bomba de protones
Sin duda, hoy los Inhibidores de Bomba de protones, son el pilar del tratamiento en reflujo y son los medicamentos prescritos con mayor frecuencia y que demuestran un alivio consistentemente superior de la acidez y la regurgitación, así como una mejor curación en comparación con los H2RA. Se recomienda que se prescriban 30 a 60 minutos antes de las comidas, en lugar de antes de dormir para mejorar los síntomas14 .
Los estudios sobre el tratamiento de la ERGE suelen durar sólo de 8 a 12 semanas, en parte porque el alivio de los síntomas y la curación parecen alcanzar su punto máximo en ese período. Las tasas de curación de esofagitis erosiva (EE) no son lineales; por lo tanto, los médicos y los pacientes deben comprender que el alivio y la curación de los síntomas pueden no ser rápidos. Los IBP se asocian con una mayor tasa de alivio "completo" de los síntomas (normalmente evaluado a las 4 semanas) en pacientes con EE (70%-80%) en comparación con los pacientes con la llamada ERNE, en los que el alivio de los síntomas se aproxima al 50%-60%14
La terapia de mantenimiento con IBP debe administrarse en pacientes con complicaciones de ERGE, incluida EE grave (LA grado C o D) y esófago de Barrett. Para los pacientes sin EE o esófago de Barrett que continúan teniendo síntomas cuando se suspende el tratamiento con IBP, se puede considerar la terapia a demanda en la que los IBP se toman sólo cuando se presentan los síntomas y se suspenden cuando se alivian. Dos tercios de los pacientes con enfermedad no erosiva que responde a los IBP mostrarán una recaída sintomática cuando se suspendan los IBP. Con esofagitis grado C de LA, casi el 100% recaerá en 6 meses.
La recurrencia del EE después de la interrupción puede ocurrir en tan solo 1 a 2 semanas, particularmente en pacientes con EE previo grado C de LA18. Los pacientes con EE grado C o D de LA deben permanecer en tratamiento con IBP a largo plazo para


mantener la curación. Se recomienda y es lógico el uso de la dosis efectiva más baja, pero debe individualizarse. Un área de controversia se relaciona con la interrupción abrupta de los IBP y la posible hipersecreción ácida de rebote, lo que resulta en un aumento de los síntomas de reflujo. Aunque se ha demostrado que la hipersecreción de ácido rebote ocurre en controles sanos, faltan pruebas sólidas de un aumento de los síntomas después de la retirada abrupta de IBP14 .
Aunque los IBP son eficaces para curar la EE, no funcionan en algunos pacientes, especialmente aquellos con esofagitis de alto grado. Aproximadamente entre el 10 y el 30 % de los pacientes con esofagitis de grado C/D de Los Ángeles (LA) no lograron la remisión endoscópica con 8 semanas de tratamiento con IBP, mientras que entre el 20 y el 30 % de ellos tuvieron esofagitis persistente o recidivante a pesar de uso mantenido de IBP.
Nuevas terapias: Bloqueadores de ácido competitivos con el potasio, los P-CABs
Los bloqueadores de ácido competitivos de potasio (P-CABs) son nuevos agentes antisecretores que se unen competitivamente al sitio de unión del potasio de la bomba de protones (H+, K+, ATPasa). Debido a sus propiedades farmacéuticas, proporcionan un efecto inhibidor del ácido más potente y prolongado que el de los IBP16
Vonoprazán, tegoprazán, fexuprazán, revaprazán y keverprazán son P-CABs que actualmente se utilizan en la práctica clínica y que muy pronto algunos de ellos entrarán en el mercado colombiano, hasta ahora tienen un uso más difundido en Asia, pero desde noviembre de 2023 el vonoprazam ya tiene aprobación por la FDA. Una revisión sistemática con metaanálisis en red, publicada en marzo de 2024 demostró que vonoprazán q.d. fue significativamente superior a 30 mg de lansoprazol q.d. y 20 mg de omeprazol q.d. en la prevención del fracaso del tratamiento, mientras que no se encontraron diferencias significativas en las comparaciones mixtas entre 20 mg de vonoprazán q.d. y otros IBP. Sin embargo, 20 mg de vonoprazan q.d. redujeron el riesgo absoluto de fracaso del tratamiento entre un 11% y un 21% en comparación con otros IBP17 .


Aún quedan dudas por despejar, pero se espera que sean una muy buena opción alterna al uso de IBPs como terapia de primera línea para la supresión ácida.
En la siguiente tabla, se describe algunas características importantes de los medicamentos disponibles en nuestro medio para el manejo del reflujo:


 Puntos de Buena Práctica Clínica
Puntos de Buena Práctica Clínica
Como conclusión de esta revisión, queremos citar algunos puntos de buena práctica que consideramos, resumen el manejo y el proceder adecuado desde el punto de vista clínico con nuestros pacientes, entendiendo la importancia de conocer previamente la fisiología y los fenotipos de la ERGE10:
1. Diseñar un plan para estudiar los síntomas sugestivos de ERGE, la selección de la terapia (explicando los riesgos y beneficios y el plan de manejo a largo plazo, incluyendo la posibilidad de disminución y retiro, en un modelo de decisión compartido con el paciente.
2. Educar a los pacientes en relación con los mecanismos del reflujo y las estrategias no farmacológicas: control de peso, estilos de vida y conductas dietarías, estrategias de relajación y hacer consciente la relación del eje intestino cerebro con los síntomas de reflujo.
3. Ser enfático en la seguridad IBP para el tratamiento del ERGE
4. En pacientes con síntomas típicos: pirosis, regurgitación y dolor torácico no cardíaco, sin signos de alarma, dar una prueba terapéutica con una dosis diaria de IBP durante 4 a 8 semanas. Si no hay respuesta adecuada, la dosis puede aumentarse a dos veces al día. Cuando la respuesta es efectiva se debe disminuir el IBP a la menor dosis efectiva.
5. Si se continúan los IBP en un paciente con ERGE no probado, se debe evaluar la indicación y dosis del medicamento después de 12 meses de iniciado, solicitar una endoscopia y una pHmetría inalámbrica sin IBP para definir si es necesario continuar la terapia a largo plazo.
6. En pacientes con síntomas típicos que no responden a la prueba con IBP o cuando hay signos de alarma, se debe realizar una endoscopia, si no hay reflujo erosivo (clasificación igual o mayor a Los Ángeles B) o esófago de Barret ≥3 cm, se debe realizar una pHmetría inalámbrica sin IBP para confirmar en fenotipo de reflujo o descartar reflujo.


7. La evaluación endoscópica del reflujo incluye los hallazgos de esofagitis erosiva (clasificación de Los Ángeles), hernia hiatal (clasificación de Hill), tamaño de la hernia hiatal y revisión del esófago de Barrett.
8. Hacer una prueba objetiva de reflujo, sin medicación en pacientes con síntomas extraesofágicos aislados y sospecha de que la etiología sea por reflujo.
9. En pacientes sintomáticos con ERGE probado, se debe considerar una pH impedanciometría de 24 con IBP para definir el mecanismo de los síntomas esofágicos persistentes a pesar de la terapia.
10. Personalizar la terapia adjunta de acuerdo con el fenotipo del ERGE, en lugar de usar estos medicamentos de forma empírica. La terapia adjunta incluye: antiácidos (alginato), antagonistas H2 al momento de dormir, baclofeno para regurgitación o eructos, procinéticos para gastroparesia.
11. Ofrecer tratamiento neuromodulador y/o remitir a terapia conductual para hipnoterapia, terapia cognitivo conductual, respiración diafragmática y estrategias de relajación en pacientes con pirosis funcional o reflujo asociado a hipervigilancia, hipersensibilidad o trastornos conductuales.
12. En pacientes con ERGE probado, la funduplicatura laparoscópica y dispositivo LINX, las incisiones transorales son opciones quirúrgicas y endoscópicas efectivas en pacientes seleccionados.
13. En pacientes con ERGE probado, el bypass gástrico es una terapia efectiva en pacientes con obesidad y una opción de terapia de salvamento en pacientes no obesos, mientras que el sleeve gástrico puede empeorar el reflujo.
14. Los candidatos a procedimientos invasivos antirreflujo deben tener evidencia patológica de ERGE, exclusión de acalasia y evaluación de la función peristáltica del esófago.


Referencias
1. Fass R, Boeckxstaens GE, El-Serag H, Rosen R, Sifrim D, Vaezi MF. Gastrooesophageal reflux disease. Nat Rev Dis Primers. 2021 Jul 29;7(1):55.
2. Páramo Hernández DB, Albis R, Galiano MT, Mendoza de Molano B, Rincón R, Pineda Ovalle LF, et al. Prevalencia de síntomas del reflujo gastroesofágico y factores asociados: una encuesta poblacional en las principales ciudades de Colombia. Rev Colomb Gastroenterol. 2017 Feb 24;31(4):337.
3. Vakil N, Van Zanten S V., Kahrilas P, Dent J, Jones R, Bianchi LK, et al. The Montreal definition and classification of gastroesophageal reflux disease: A global evidence-based consensus. Vol. 101, American Journal of Gastroenterology. 2006.
4. Gyawali CP, Yadlapati R, Fass R, Katzka D, Pandolfino J, Savarino E, et al. Updates to the modern diagnosis of GERD: Lyon consensus 2.0. Gut. 2024 Feb;73(2):361–71.
5. Hani A, Galindo A, Leguizamo A, Maldonado C. Guía de práctica clínica para la enfermedad por reflujo gastroesofágico. Rev Colomb Gastroenterol [Internet]. 2015;30(1):1–8. Available from: http://www.redalyc.org/articulo.oa?id=337744269002
6. Katzka DA, Pandolfino JE, Kahrilas PJ. Phenotypes of Gastroesophageal Reflux Disease: Where Rome, Lyon, and Montreal Meet. Clinical Gastroenterology and Hepatology. 2020 Apr;18(4):767–76.
7. Sharma P, Yadlapati R. Pathophysiology and treatment options for gastroesophageal reflux disease: looking beyond acid. Ann N Y Acad Sci. 2021 Feb 4;1486(1):3–14.
8. Candia R. Herramientas para la interpretación de informes endoscópicos: clasificaciones y escalas en endoscopía digestiva. Rev Med Chil. 2020 Jul;148(7):992–1003.
9. Numans ME, Lau J, deWit NJ, Bonis PA. Short-Term Treatment with Proton-Pump Inhibitors as a Test for Gastroesophageal Reflux Disease. Ann Intern Med. 2004 Apr 6;140(7):518.


10. Chen JW, Vela MF, Peterson KA, Carlson DA. AGA Clinical Practice Update on the Diagnosis and Management of Extraesophageal Gastroesophageal Reflux Disease: Expert Review. Clinical Gastroenterology and Hepatology. 2023 Jun;21(6):1414-1421.e3.
11. Shaheen NJ, Falk GW, Iyer PG, Souza RF, Yadlapati RH, Sauer BG, et al. Diagnosis and Management of Barrett’s Esophagus: An Updated ACG Guideline. American Journal of Gastroenterology. 2022 Apr;117(4):559–87.
12. Maret-Ouda J, Markar SR, Lagergren J. Gastroesophageal Reflux Disease. JAMA. 2020 Dec 22;324(24):2536.
13. Kahrilas PJ, Hughes N, Howden CW. Response of unexplained chest pain to proton pump inhibitor treatment in patients with and without objective evidence of gastrooesophageal reflux disease. Gut. 2011 Nov 1;60(11):1473–8.
14. Katz PO, Dunbar KB, Schnoll-Sussman FH, Greer KB, Yadlapati R, Spechler SJ. ACG Clinical Guideline for the Diagnosis and Management of Gastroesophageal Reflux Disease. American Journal of Gastroenterology. 2022 Jan;117(1):27–56.
15. Rusu RI, Fox MR, Tucker E, Zeki S, Dunn JM, Jafari J, et al. Validation of the Lyon classification for GORD diagnosis: acid exposure time assessed by prolonged wireless pH monitoring in healthy controls and patients with erosive oesophagitis. Gut. 2021 Dec;70(12):2230–7.
16. Inatomi N, Matsukawa J, Sakurai Y, Otake K. Potassium-competitive acid blockers: Advanced therapeutic option for acid-related diseases. Pharmacol Ther. 2016 Dec 1;168:12–22.
17. Zhuang Q, Chen S, Zhou X, Jia X, Zhang M, Tan N, et al. Comparative efficacy of PCABs versus proton pump inhibitors for Grade C/D esophagitis: A systematic review and network meta-analysis. American Journal of Gastroenterology. 2024 Mar 22;




PARA EL MÉDICO GENERAL

Mariana Restrepo Arias1 , Laura Camila Lopera Restrepo2 , David Alejandro Mejía Toro3
1.Médica general Universidad Pontificia Bolivariana. Médica general de Urgencias Hospital Pablo Tobón Uribe.
2.Médica general Universidad de Antioquia. Médica general de urgencias Hospital Pablo Tobón Uribe.
3.Cirujano general, Cirujano de trauma y emergencias Hospital Pablo Tobón Uribe y Hospital San Vicente Fundación Medellín, Docente Universidad de Antioquia y Universidad Pontificia Bolivariana.
El politrauma es una importante causa de morbilidad y mortalidad a nivel mundial, principalmente en la población joven. Es importante realizar un abordaje y tratamiento temprano de los pacientes que ingresan a servicio de urgencias con esta patología, con el fin de impactar en el pronóstico a corto y largo plazo. La revisión primaria y secundaria, planteada por el Advanced Trauma Life Support (ATLS), permite una evaluación sistemática y completa al momento de enfrentarse a un paciente politraumatizado. Se propone un orden, mediante la mnemotecnia XABCDE, para detectar de manera temprana lesiones amenazantes de la vida por sistemas (X= control de la hemorragia externa con riesgo de exanguinación; A= vía aérea y restricción de la movilidad cervical; B= ventilación y respiración; C= circulación y control de la hemorragia; D= déficit neurológico/evaluación neurológica; E= exposición y control del ambiente) e iniciar un manejo de estas, mientras se alcanza la estabilización del paciente.
Este capítulo tiene como objetivo exponer los aspectos más relevantes a la hora del enfoque y tratamiento de esta patología para el médico general en el servicio de urgencias, dando claridad a la revisión sistemática y detallada de cada área corporal, con énfasis en aquellas lesiones amenazantes para la vida en la población adulta.
Palabras clave
Traumatismo múltiple; Politrauma; Índices de Gravedad del Trauma


Introducción
El término politrauma se introdujo en la literatura médica desde la década de los 60´s en el siglo pasado, y desde ese momento viene en construcción una definición, entendiéndose ahora como una enfermedad. Inicialmente, cuando se comenzó a hablar de politrauma, el enfoque estaba centrado en regiones anatómicas, considerando las lesiones craneales, torácicas o abdominales como determinantes para el diagnóstico de este1 .
Sin embargo, con la introducción de diferentes escalas o índices de severidad para la evaluación del trauma, esta definición fue modificándose; es por esto que, hasta hace algunos años, una de las definiciones más acogidas consistía en un puntaje del ISS (Injury severity score) > 15 o >16. No obstante, durante los últimos años y gracias al entendimiento de los fenómenos fisiopatológicos que suceden subsecuentes a un politraumatismo, esta definición ahora está ajustada, no solo a regiones anatómicas, sino a parámetros fisiológicos del paciente como la edad, el estado hemodinámico, el estado ácido base y la coagulopatía2,3
Es entonces, a través de esta evolución histórica de múltiples definiciones, como se llega a la que hoy es la definición más aceptada para politrauma, entendido la gravedad de esta patología y cómo las variables fisiológicas deben entenderse como signos de alarma en este tipo de pacientes:
Puntaje AIS >2 (Abbreviated Injury Scale) con al menos uno de los siguientes parámetros4:
- Hipotensión: presión arterial sistólica (PAS) <90 mmHg.
- Acidosis : una base exceso ≤-6
- Alteración del estado de conciencia: una puntuación en la escala de coma de Glasgow (ECG) <8


- Edad > 70 años
- Coagulopatía: INR (international normalized ratio) >1.4 o un tiempo parcial de tromboplastina ( TPT) >40 segundos.
Con respecto a lo anterior, es importante que el médico general esté familiarizado con esta definición, dado que la identificación temprana es el primer paso para el enfoque adecuado y manejo del paciente politraumatizado. Bien se sabe que en Colombia, sin tener cifras exactas, por sus características estructurales, económicas y sociodemográficas, la mayoría de los pacientes politraumatizados reciben la atención inicial por el médico general, previo a la valoración y manejo por especialidades como medicina de urgencias, cirugía general y ortopedia. El objetivo de este capítulo es exponer de una manera práctica y sencilla, cuáles son aquellos aspectos que se deben tener presentes en la atención, por parte del personal de la salud que labora en los servicio de urgencias, del paciente politraumatizado.
Epidemiología
Cuando se habla de la epidemiología de una enfermedad o de una condición, indirectamente se está refiriendo al impacto que tiene esa condición en la población; hablando propiamente de trauma, está descrito que es la sexta causa de muerte en el mundo y la primera en personas menores de 35 años. Sin dejar de lado que, aunque la incidencia sea más baja en la población mayor, la mortalidad puede llegar a ser el doble debido a las comorbilidades y condiciones fisiológicas de esta5
En el 2022 en Colombia, con respecto a las muertes accidentales, el politraumatismo fue responsable de un total de 1151 casos (29.92%), siendo los hombres la población más comprometida con un total de 951 casos en comparación con las mujeres (200 casos). Adicionalmente, se identificó un aumento en la morbimortalidad en la población anciana y los casos de politrauma en el contexto de violencia6 .


También es importante entender que no solo es exponer cuántas personas mueren debido a traumatismo mayor, sino también en qué momento se presentan el mayor número de muertes, dado que esto da lugar a plantear cuáles pueden ser esas intervenciones en politrauma que reduzcan la mortalidad. Se presenta una distribución trimodal de la mortalidad en el politrauma: el momento inmediato, que es donde ocurren cerca del 50% de las muertes; es en el lugar del accidente y se trata principalmente de lesiones que comprometen el cerebro, médula espinal, grandes vasos y corazón7
En el segundo momento, para las 3-4 horas posteriores al trauma, la mortalidad representa cerca de un 30% y está dada principalmente por hemorragias intracraneales o lesiones toracoabdominales graves; es este momento uno de los que actualmente tiene el foco de atención para disminuir la mortalidad. Finalmente, hay un tercer momento, que es la mortalidad tardía que se presenta días o semanas posteriores al trauma, donde los esfuerzos están enfocados principalmente a reducir el riesgo de sepsis o falla multiorgánica7,8
Revisión primaria y secundaria
El abordaje inicial de todo paciente politraumatizado que ingresa a un servicio de urgencias se debe realizar de manera ordenada, sistemática y completa, permitiendo una detección y tratamiento temprano de lesiones tiempo dependientes, con el fin de impactar de manera positiva en el pronóstico de estos pacientes. Con respecto a lo anterior, el Colegio Americano de Cirujanos en su curso Advanced Trauma Life Support (ATLS), divide la evaluación del paciente en revisión primaria y secundaria, cada una con sus anexos9 .
La revisión primaria es la base de la atención inicial del paciente, la cual tiene como objetivo el reconocimiento y manejo de las lesiones amenazantes de la vida, siguiendo un orden con la mnemotecnia XABCDE, donde X significa control de la hemorragia


externa con riesgo de exanguinación, A significa vía área y restricción de la movilidad cervical, B es respiración y ventilación, C es circulación y control de la hemorragia, D de discapacidad/valoración neurológica, y E de exposición y control del ambiente9,10
De forma práctica, cada elemento del ABCD (no cumple con la E) se puede evaluar de forma simultánea y rápida al solicitar al paciente su nombre y relato de los hechos, ya que una respuesta clara y adecuada requiere del funcionamiento mínimo de cada sistema. Pero, se aclara que esto no debe reemplazar la evaluación sistemática y completa, la cual se mencionará más adelante9,11 .
Los anexos de la revisión primaria consisten en la monitorización completa de signos vitales, ayudas diagnósticas rápidas, y el sondaje urinario y gástrico. Sin embargo, se debe tener en cuenta que la realización de esto no debe retrasar la estabilización, tratamiento, ni traslado del paciente a un mayor nivel de complejidad, en caso de requerirlo9,11 .
La monitorización de signos vitales (presión arterial, saturación de oxígeno, monitoreo electrocardiográfico, y cuando aplique, la capnografía) se debe instaurar idealmente desde el momento en que se entra en contacto con el paciente. Esto, junto con el examen físico completo, permite diagnosticar de manera oportuna patologías graves e iniciar un tratamiento adecuado, además de evaluar la respuesta a la reanimación9 .
Las ayudas diagnósticas consisten en radiografías (principalmente tórax y pelvis), idealmente portátiles, ya que se pueden realizar simultáneamente con la reanimación. Otro componente es la ecografía con el Focused Assessment with Sonography for Trauma (FAST) y el Extended Focused Assessment with Sonography for Trauma (eFAST), los cuales permiten identificar rápidamente neumotórax, hemotórax y sangrado intraabdominal; ambas evalúan la ventana subxifoidea, hepatorrenal, esplenorrenal, pélvica, pero agregando al eFAST la ventana pulmonar9,12 .


Con respecto a laboratorios, se solicita hemograma, hemoclasificación, función renal, gases arteriales, lactato, pruebas de coagulación, y si se requiere, tóxicos en orina; sin embargo, los resultados pueden tardar y su espera no debe retrasar el manejo y traslado del paciente. Se resalta la utilidad de los gases arteriales, ya que su resultado se puede obtener en pocos minutos, brinda información objetiva sobre el estado ácido base del paciente, oxigenación, ventilación, y perfusión (lactato); todo esto permitiendo una detección temprana del choque con el inicio oportuno de la terapia transfusional, además de predicción de mortalidad10,11,13,14
El paso de una sonda vesical ayuda a evaluar el gasto urinario; sin embargo, está contraindicada cuando el paciente tiene lesión uretral, la cual se sospecha si se presenta sangrado por meato urinario, equimosis perineal, estigmas de trauma en pene, próstata elevada o no palpable. La sonda gástrica permite una descompresión de la cámara gástrica, lo cual disminuye el riesgo de broncoaspiración y ayuda a la detección de sangrado en vía digestiva (sangre ingerida o por trauma); recordar que si se sospecha fractura de base de cráneo se debe insertar vía oral9,11
Finalmente, se debe tener en cuenta que la revisión primaria debe repetirse periódicamente y en el momento en que el estado del paciente cambie. Una vez completada, al alcanzar la estabilización del paciente e iniciar el tratamiento de lesiones identificadas, se puede pasar a la revisión secundaria. Sin embargo, también es en este momento donde se debe definir si el paciente requiere de un traslado a un mayor nivel de complejidad para recibir un manejo definitivo, siempre y cuando ya se hayan iniciado las maniobras de reanimación y estabilización9,11 .
La revisión secundaria consiste en un examen físico cefalocaudal exhaustivo, verificando y corrigiendo errores en el ABCDE, una historia clínica completa y la reevaluación constante de los signos vitales; tiene como objetivo la detección de otras


condiciones que impacten de manera negativa en el pronóstico del paciente, aumentando la morbimortalidad11,15
La información requerida para una historia clínica completa se basa en indagar por alergias, uso de medicamentos, antecedentes personales/embarazo, ayuno, eventos relacionados con el trauma y el lugar donde ocurrió; esto puede resumirse con la mnemotecnia AMPLE, por sus siglas en inglés (Allergies, Medications, Past illnesses/Pregnancy, Last meal, Events/Environment related to the injury). En muchas ocasiones, esta información no podrá ser brindada por el paciente, y es aquí donde se requiere del apoyo de la familia y/o el personal de atención prehospitalaria (APH). Conocer el mecanismo de trauma permite predecir lesiones ocultas9,11,15
En la revisión secundaria, la idea es examinar al paciente por segmentos corporales y de forma completa (tabla 1).
Tabla 1. Evaluación de segmentos corporales y sus consideraciones
Segmento corporal Consideraciones
Heridas en cuero cabelludo
Fracturas: crepitación, depresiones, deformidades
Hematomas
Cabeza
Maxilofacial
Evaluación ocular: retirar lentes de contacto, pupilas (tamaño, reactividad), movimientos oculares (presencia de atrapamiento), agudeza visual, trauma penetrante
Signos de fractura de base de cráneo: equimosis mastoidea (signo de Battle), equimosis periorbitaria (ojos de mapache), rinoliquia, otorragia
Palpación deestructuras óseas Evaluar la apertura oral Lesiones en cavidad oral
Sangrados que inestabilizan al paciente o comprometan la vía aérea
Fracturas que comprometan la vía aérea
Fracturas de la porción media de la cara: sospechar fractura de la lámina cribosa


Restricción de la movilidad: trauma por encima de las clavículas o en politrauma*
- Tomografía decolumnacervical
- Sensibilidad en la columna cervical Enfisema
subcutáneo
Desviación de la tráquea Fractura
laríngea
Cuello
Tórax
Carótidas: palpar, auscultar en busca de soplos. Marca del cinturón de seguridad. Penetrante o cerrado (trombosis, disección)
- Angiotomografia cervical (ideal), doppler, angiografía
Lesión esofágica: esofagoscopia, esofagograma, esofagotomografía
Lesiones penetrantes**
Parálisis aislada de una extremidad: sospecha de lesión del plexo braquial
Anterior y posterior: inspección, palpación, percusión, auscultación
Simetría dela expansión torácica Enfisema
subcutáneo
Hematoma Trauma penetrante
Taponamientocardíaco
Radiografía de tórax: neumotórax y/o hemotórax, fracturas, contusiones pulmonares, ensanchamiento mediastinal (sospecha de lesión de grandes vasos) Tomografía contrastada de tórax (al estabilizar al paciente)
Toracostomía (instauración, vigilancia)


Inspección anterior y posterior, palpación Presencia de signos de irritación peritoneal Hematomas, equimosis, heridaspenetrantes FAST
Abdomen
Tomografía contrastada de abdomen (imágen ideal; en pacientes estables, examen físico no confiable)***
Extremidades
Equimosis en alerones ilíacos, pubis, periné, labios mayores o escroto
Dolor a la palpación en el anillo pélvico Pulsos
periféricos (lesión vascular)
Sangrado uretral, tacto rectal (sangrado, próstata, tono del esfínter)
Radiografía de pelvis
Heridas Luxaciones
Síndrome compartimental
Pulsos periféricos de forma bilateral Lesiones
ligamentarias
Lesión vascular: angitomografía, angiografía, doppler Radiografía y/o tomografía de extremidades
Evaluar región dorsal del paciente si aún no se ha realizado
Nota: Elaboración propia basado en9
*Criterios de The National Emergency X-Radiography Utilization Study (NEXUS) o Canadian C-Spine Rule (CCR)
**Las lesiones penetrantes no se exploran manualmente
***Alteración del estado de conciencia, lesiones distractoras
 Pelvis
Pelvis

Los anexos de la revisión secundaria consisten en ayudas diagnósticas especializadas que permiten identificar lesiones no detectadas previamente e instaurar su manejo. Entre estas se puede encontrar: la tomografía axial computarizada (TAC) simple de cráneo, columna cervical y toracolumbar, contrastado de tórax y abdomen, radiografía de extremidades, estudios ecográficos, entre otros. Es importante aclarar que al momento de realizar los estudios el paciente se encuentra hemodinámicamente estable y se completó el examen físico, con el objetivo de realizar el traslado al sitio de la ayuda diagnóstica seguro y sin complicaciones9
El paciente politraumatizado debe reevaluarse constantemente. Las lesiones inadvertidas tienen una frecuencia que va entre el 0.6% al 65% en la literatura, las cuales, si no se diagnostican y manejan a tiempo, pueden concluir en complicaciones a corto y largo plazo, e incluso la muerte. Esto ocurre por falencias en el examen físico, una historia clínica incompleta, interpretación errónea de ayudas diagnósticas, y la aparición de nuevas condiciones simultáneamente al realizar la revisión primaria y secundaria11,16
Con respecto a lo anterior, se ha planteado el término de “revisión terciaria”, la cual consiste en una nueva anamnesis, examen físico completo, y valoración de imágenes, 24 horas después del trauma, llevando a una reducción entre 39-57% de lesiones no diagnosticadas. En un estudio observacional prospectivo, realizado entre el 2012 y 2013 en São Paulo, reportó que el 7.7% de nuevas lesiones se diagnosticaron durante la revisión terciaria y las extremidades inferiores fueron el sitio anatómico más común comprometido (61.4%)11, 6
Tener en cuenta que la revisión primaria y secundaria, en la mayoría de los casos, se realiza simultáneamente, dependiendo de la cantidad de personal; sin embargo esto no debe interferir con la revisión primaria, ya que esta es la prioridad9 .


Abordaje del paciente politraumatizado: enfoque y manejo sistemático
A: vía aérea y control cervical
El manejo de la vía aérea comienza con verificar su permeabilidad y detectar sonidos anormales; un paciente que se encuentra alerta, responde adecuadamente, sin estridor, sin abundantes secreciones, tiene una vía aérea permeable. El objetivo de esta valoración es permeabilizar la vía aérea y definir si requiere asegurarse mediante la intubación9,11
La lengua es lo primero que obstruye la vía aérea; es por esto que un paciente que no cuente con las características previamente mencionadas, el paso inicial es realizar maniobras de permeabilización: frente-mentón o subluxación mandibular; se recomienda esta última como la primera opción, ya que se debe sospechar la lesión de columna cervical en todo paciente politraumatizado hasta que se demuestre lo contrario y, por lo tanto, limitar su movilización. También se cuenta con dispositivos que permiten/facilitan la permeabilización de la vía aérea; la cánula orofaríngea (Guedel) se usa en pacientes inconscientes (en un paciente consciente aumenta el riesgo de broncoaspiración por presencia del reflejo nauseoso), y la nasofaríngea en el paciente consciente, la última contraindicada en pacientes con sospecha de fractura de base de cráneo (compromiso de la lámina cribosa)9,11 .
Otras causas de obstrucción de la vía aérea son los cuerpos extraños y las secreciones (sangrado, vómito); contar con un sistema de succión facilita la permeabilización de la vía aérea en el contacto inicial y previo a la intubación. Recordar verificar la presencia de prótesis dental, la cual debe ser retirada11 .
Se debe asegurar una adecuada administración de oxígeno dependiendo de los requerimientos de cada caso; idealmente administrar la mayor fracción inspirada de oxígeno (FiO2), siendo una buena opción la máscara de no reinhalación, y disminuirla progresivamente si la condición y evolución del paciente lo permiten9,11,17


De forma paralela, se define si el paciente requiere de una vía aérea avanzada. Entre las indicaciones de intubación se encuentran: ECG menor o igual a 8, quemadura de vía aérea, hematoma expansivo del cuello, lesiones maxilofaciales o en cuello que tengan riesgo de obstruir la vía aérea, paciente combativo o agitado a pesar de tratamiento farmacológico, choque hemorrágico grave, riesgo de broncoaspiración, lesión medular cervical con insuficiencia respiratoria (completa, o incompleta en C5 y/o arriba de esta), y paro cardiorrespiratorio11,17,18
Antes de asegurar la vía aérea, tener presente que debe manejarse como una vía aérea difícil, ya que en ocasiones no se contará con el tiempo suficiente para evaluar todos los predictores de dificultad en la laringoscopia. Recordar que no solo se encuentran factores anatómicos en estos predictores, sino también fisiológicos; por lo anterior, se recomienda corregir la hipoxemia, hipercapnia y estabilizar hemodinámicamente al paciente antes de intervenir la vía aérea; de no hacer esto, puede empeorar el choque e incluso el paciente entrar en paro cardiorrespiratorio19,20
Es importante que la persona con mayor experiencia en el manejo de vía aérea se encargue de esta tarea; antes de realizar una intubación, aplicando la secuencia de intubación rápida, se debe estar preparado y tener todos los elementos requeridos para el éxito del procedimiento (monitorización, inmovilización cervical, tubos con 3 diferentes calibres, guía rígida, dispositivos supraglóticos, aspirador y sistema de succión, fuente de oxígeno, medicamentos y, en caso de contar con el recurso, dispositivos para realizar cricotiroidotomía)9,18,20 .
La manera de preoxigenar al paciente va a depender de su estado de conciencia (cánula nasal, máscara de no reinhalación), esto permitiendo aumentar el tiempo de apnea; recordar permeabilizar la vía aérea y aspirar secreciones. La meta es una saturación por encima de 94% durante 3 minutos previo a la intubación20


Con los medicamentos se busca inconsciencia (inducción) y bloqueo neuromuscular (parálisis). Con respecto a los inductores, el Etomidato y la ketamina son los más usados9,18,20:
- El Etomidato tiene un inicio de acción rápido, no afecta la presión intracraneal (PIC) y tiene un efecto mínimo hemodinámico. Se administra en dosis de 0.3 mg/kg intravenoso (IV). Las dificultades con este medicamento son la falta disponibilidad y el riesgo de supresión adrenal.
- La ketamina tiene un efecto analgésico, es de rápida acción y aumenta las cifras tensionales, siendo una buena opción en pacientes en choque.
La dosis recomendada es de 1.5 mg/kg IV. Este medicamento se ha evitado en pacientes con sospecha con trauma craneoencefálico por el aumento de la PIC; sin embargo, en diferentes revisiones sistemáticas y estudios no se ha demostrado un efecto negativo de la ketamina en este tipo de pacientes, y esto no es una contraindicación para el uso del medicamento.
Dentro de los relajantes musculares, la succinilcolina se usa como primera opción por su rápido inicio de acción y corta duración; esto permite que, en los casos de un intento fallido de intubación, se pueda ventilar al paciente hasta que se revierta su efecto; la dosis es de 1.5 mg/kg IV (usualmente 100 mg). Tener en cuenta que debe usarse con cuidado en pacientes con traumas por aplastamiento, quemaduras y lesiones eléctricas (riesgo de hiperkalemia), enfermedad renal crónica, parálisis, enfermedades neuromusculares, donde se prefiere el rocuronio, a dosis de 1.2 mg/kg IV, teniendo en cuenta que su efecto es más prolongado que la succinilcolina (aproximadamente 1 hora)9,18,20 .
La manipulación de la vía aérea debe realizarse con restricción de la movilidad cervical hasta que se haya descartado una lesión. Al momento de intubar al paciente, se debe evitar realizar tracción con el fin de no causar una hiperextensión del cuello; esto se logra con una posición neutra de la cabeza y aplicando la estabilización manual en


línea, para la cual debe retirar la porción anterior del collar cervical hasta que se confirme la colocación adecuada del tubo. No olvidar que muchos pacientes al momento de accidentarse llegan con el casco puesto, y este debe retirarse entre dos personas, la primera encargada de realizar la estabilización e inmovilización cervical, y la segunda retirar el casco de manera cuidadosa9,21 .
B: respiración y ventilación
La valoración inicial completa y rápida de la ventilación y respiración en el paciente politraumatizado, nos permite intervenir de manera oportuna aquellas lesiones torácicas que amenazan la vida. Posterior al aseguramiento de la vía aérea, el siguiente paso es garantizar que el paciente tenga una adecuada ventilación9
Dentro de los parámetros a evaluar en este punto, hay que realizar una inspección torácica, evaluando si el paciente tiene respiración espontánea, si la expansión de la caja torácica es simétrica o no, la frecuencia y profundidad de los movimientos respiratorios; valorar la integridad del tórax y los daños en los tejidos blandos, que indiquen de posibles lesiones intratorácicas. Adicionalmente, realizar la auscultación de los ruidos cardiopulmonares, y en simultáneo, dar suplementación de oxígeno al paciente de acuerdo a las intervenciones previas en la vía aérea22
En la valoración de este punto, existen en general 5 lesiones amenazantes para la vida que se describen en la tabla 2, su diagnóstico y el manejo inicial de cada una de estas23 .
Tabla 2. Lesiones amenazantes de la vida que detectadas en la B
Neumotórax a tensión
Disnea, hipotensión, abolición del murmullo vesicular en el lado afectado, Desviación traqueal, ingurgitación yugular, hiperresonancia, asimetría torácica.
Descompresión Toracostomía. con aguja en el 5 espacio intercostal con línea axilar anterior.


Neumotórax abierto
Hemotórax masivo
Disnea, dolor torácico, taquipnea, disminución del MV, herida soplante
1.500 ml de sangre, 200 ml/h por 2-4 horas o > ⅓ de la volemia del paciente.
Matidez, abolición del MV, choque
Hipotensión, ruidos
Taponamiento cardíaco
cardíacos alejados, desviación traqueal, ingurgitación yugular, choque
Apósito oclusivo que cubra la herida, fijarlo en 3 bordes
Reposición volumen (transfusión)
Toracostomía
Sutura de la herida Toracostomía
Toracotomía
Mantener laprecarga (manejo con Toracotomía, esternotomía o ventana pericárdica
Tórax inestable
Fractura de 2 o más costillas, en 2 o más segmentos
Disnea, dolor intenso, estigmas externos de trauma, crepitación, movimiento paradójico del tórax
Nota: Elaboración propia basada en9
Oxigenoterapia
Analgesia
Seguimiento de la contusión pulmonar. Reconstrucción costal.
*Se debe usar una aguja de gran calibre, en general 10 - 16 G. Triángulo de seguridad: borde anterior del músculo dorsal ancho, el borde lateral del músculo pectoral mayor, base de la axila y la línea mamilas (5to espacio intercostal).
** Se describe en la literatura como el último recurso, dada la poca experiencia con este procedimiento y el riesgo de complicaciones.
Se puede complementar la valoración de la ventilación y respiración con ayudas diagnósticas, tales como gases arteriales, radiografía de tórax y en un paciente estable,


la TAC contrastada de tórax. Sin embargo, con la creciente disponibilidad del FAST en los servicios de urgencias y con un personal de salud cada vez más capacitado para usarlo, se ha convertido en una herramienta útil como complemento de la valoración del tórax10,12 .
C: circulación con control de la hemorragia
El choque hemorrágico es la principal causa de morbimortalidad prevenible en trauma. Un paciente politraumatizado e hipotenso tiene una hemorragia (choque hipovolémico) hasta que se demuestre lo contrario. Se deben obtener 2 accesos venosos de gran calibre (16G o 18G), siendo este el momento práctico para la toma de paraclínicos previamente mencionados9,11 .
Para realizar una valoración completa de la circulación se tiene en cuenta el estado de conciencia, frecuencia cardíaca, pulsos (de forma bilateral) y la perfusión cutánea. Una hipoperfusión cerebral secundaria a hipovolemia genera ansiedad, confusión, somnolencia o estupor, la hipotensión genera pulsos rápidos y débiles, como también la pérdida de pulsos periféricos. Para tener un pulso carotídeo se espera tener una presión arterial sistólica (PAS) por encima de 60 mmHg; en caso de ausencia de este, se deben iniciar maniobras de reanimación cardiopulmonar9,11
El paciente puede presentar sangrado externo que se detecta con la inspección, y la primera medida es realizar presión directa y constante sobre las heridas; existen otras medidas como el torniquete, el cual se debe usar idealmente sólo en casos extremos, siendo esta una medida más usada en el ambiente prehospitalario y/o cuando se realiza el traslado de los pacientes. Este se aplica 5 cm proximal a la herida, se aplica una presión de 250 mmHg en miembro superior y 300 mmHg en miembro inferior, medida que se puede instaurar máximo por 2 horas o hasta que se controle el sangrado24


Así mismo, se debe tener sospecha de lesiones o sangrados ocultos (tórax, abdomen, pelvis, extremidades); en pacientes con choque hipovolémico, sin sangrados externos y con sospecha de fractura de pelvis, se recomienda aplicar la fronda pélvica hasta confirmar su compromiso y definir manejo definitivo. Se puede complementar la valoración con ayudas diagnósticas como rayos x portátiles, eFAST, TAC contrastadas, siempre y cuando su realización no limite la estabilización del paciente9,11,24
Es importante realizar una detección rápida del choque y definir el grado de este con el objetivo de guiar la terapia inicial. El ATLS clasifica en 4 clases la hemorragia según signos y síntomas, demostrando que al presentar pérdida ≥15% de la volemia se manifiestan las medidas fisiológicas compensatorias del choque (taquicardia). Esto permite iniciar medidas de reanimación tempranas para evitar la progresión del choque:9,24
- Clase I: pérdida ≤15% (750 cc). Sin alteración en signos vitales; sin embargo, puede presentar leve taquicardia. Déficit de bases de 0 a -2 mEq/L. Se reanima con 1-2 litros de líquidos endovenosos y sin urgencia de iniciar hemoderivados9,11
- Clase II (choque leve): pérdida del 15-30% de la volemia (750 a 1500 cc). La PAS puede permanecer intacta, mientras que la presión arterial diastólica (PAD) presenta un aumento, llevando a una disminución de la presión de pulso. Hay compromiso del sistema nervioso central (SNC) dado por ansiedad. Déficit de bases de -2 a -6 mEq/L. En algunos casos, posteriormente se puede requerir de hemoderivados; sin embargo, la mayoría de los pacientes se estabilizan con una adecuada reanimación hídrica9,11
- Clase III (choque moderado): pérdida del 31 al 40% (1500 a 2000 cc) de la volemia. Hay hipotensión (compromiso de la PAS), taquicardia, taquipnea, compromiso de la diuresis, compromiso del estado de conciencia (caída de la ECG, confusión), acidosis. Déficit de bases de -6 a -10 mEq/L. Requiere de reanimación con líquidos endovenosos, hemoderivados, y parar la hemorragia (tratamiento dirigido a la causa)9,11 .
-


- Clase IV (choque grave): pérdida >40% de la volemia (>2000 cc). Taquicardia marcada (>140), hipotensión, bradicardia (fase final), disminución del gasto urinario, marcado compromiso del estado de conciencia, piel fría y pálida. Déficit de bases ≤-10 mEq/L. Requiere reanimación agresiva (protocolo de transfusión masiva), tratamiento quirúrgico emergente9,11 .
Reanimación control-daño
La reanimación control-daño es el conjunto de medidas destinadas al control y manejo de la hemorragia secundaria al trauma. Los principios de esta son:25
- Evitar/controlar la hipotermia.
- Minimizar la pérdida de sangre.
- Alcanzar una presión baja-normal antes de la hemostasia definitiva (hipotensión permisiva).
- Minimizar la administración de cristaloides.
- Usar protocolos de transfusión masiva.
- Evitar retrasos en el manejo quirúrgico o angiográfico.
- Transfundir hemoderivados.
- Obtener medidas funcionales de la coagulación para guiar la reanimación (tromboelastografía, tromboelastometría).
- Administrar medicamentos complementarios para promover la hemostasia.
Inicialmente se deben administrar líquidos endovenosos isotónicos, tibios, a dosis de 1 litro (máximo 1.5 litros); tener en cuenta que grandes cantidades de estas sustancias pueden llevar a una hemodilución y aumentar la coagulopatía de forma dosis dependiente. Es por esto que se debe identificar tempranamente los pacientes candidatos a hemoderivados, y los que requieran de un protocolo de transfusión masiva14,24 .


El protocolo de transfusión masiva consiste en la administración de hemoderivados (glóbulos rojos empaquetados, plaquetas, plasma fresco congelado), y sus complementos (calcio, ácido tranexámico, concentrado de complejo de protrombina) en un paciente con choque hemorrágico. En la literatura se encuentran diferentes. definiciones de transfusión masiva, como es la administración de >10 unidades de glóbulos rojos en 24 horas, el reemplazo completo de la volemia en 24 horas, transfusión de >4 unidades en una hora, o reemplazo del 50% del volumen total de sangre en 3 horas. El objetivo de la transfusión masiva es la prevención y tratamiento de la coagulopatía inducida por trauma14,24 .
Existen diferentes escalas o puntajes que permiten predecir de forma temprana el requerimiento de transfusión masiva. El índice de choque es el resultado de la división de la frecuencia cardíaca y la presión arterial sistólica (IC=FC/PAS), con un valor normal entre 0.5 a 0.7; un puntaje ≥1 se correlaciona con aumento en la mortalidad y requerimiento de transfusión masiva. Una de las escalas que se mencionan en la literatura es la Assessment of Blood Consumption score (ABC por sus siglas en inglés), la cual tiene en cuenta la frecuencia cardíaca ≥120 latidos por minuto, PAS ≤90 mmHg, mecanismo penetrante y un FAST positivo ( a cada una se le da valor de un punto); un ABC ≥2 tiene una sensibilidad del 75% y especificidad del 86% para predecir una transfusión masiva10,14,24
La transfusión de componentes sanguíneos se debe realizar de forma balanceada, siendo una relación 1:1:1 (glóbulos rojos: plaquetas: plasma fresco congelado) la más recomendada, ya que ha demostrado disminuir la tasa de mortalidad secundaria a sangrado en las primeras 24 horas. Usando esta relación resulta en un 25% el hematocrito, la actividad de los factores de coagulación en un 62%, 50x109/L la concentración de plaquetas, y 75 mg/dL la concentración de fibrinógeno14,24,25


Los componentes sanguíneos se almacenan con citrato (anticoagulante), el cual es un quelante del calcio y puede llevar a una hipocalcemia y progresión de la coagulopatía
cuando se aplica el protocolo de transfusión masiva, convirtiéndose la hipocalcemia grave (calcio iónico <0.9 mmol/L) en un factor de riesgo de mortalidad; sin embargo, también se ha demostrado que la hipercalcemia (>1.25 mmol/L) aumenta la mortalidad y es por esto que se encuentran diferentes posturas en la literatura sobre la recomendación de cuál es el momento para reponer el calcio (empíricamente vs con niveles de laboratorio). La guía de práctica clínica de reanimación control daño de The Joint Trauma System sugiere administrar 1 g de cloruro de calcio o 3 g de gluconato de calcio intravenoso en pacientes con choque hemorrágico durante o inmediatamente después de la primera unidad de sangre y después de cada 4 unidades de hemoderivados administrados o con niveles <1.2 mmol/L, monitorizando el calcio iónico14
El ácido tranexámico es un medicamento que se usa con el objetivo de disminuir mortalidad en pacientes con trauma; es por esto que se recomienda su uso en pacientes con hemorragia en sitios no compresibles, frecuencia cardíaca >120 latidos por minutos y PAS <90 mmHg, teniendo mayor beneficio al administrarse en las primeras 3 horas del trauma. La dosis de este medicamento es de 1g intravenoso en bolo (pasar en 10 minutos) y continuar a una infusión de 1g en 8 horas14,24,25
La reanimación hipotensiva (o hipotensión permisiva) consiste en la administración de líquidos endovenosos y/o sangre mínima necesaria para lograr cifras tensionales por debajo de lo normal hasta llevar al paciente a un tratamiento definitivo del sangrado. Se ha demostrado que esta estrategia disminuye el requerimiento transfusional y se asocia con menor mortalidad. En general, la meta de presión arterial sistólica es de 80 a 90 mmHg. Este enfoque de tratamiento está contraindicado en pacientes con neurotrauma, embarazadas y ancianos24,25


D: déficit neurológico (evaluación neurológica)
La valoración neurológica de los pacientes se debe realizar de forma rápida y sistemática. La ECG es un puntaje ampliamente conocido y útil para brindar un panorama del estado neurológico del paciente; en conjunto con la valoración del tamaño y reactividad pupilar permite sospechar o identificar posibles lesiones del SNC
En este punto es importante valorar también si hay signos o síntomas que sugieran trauma raquimedular, valorando si se presenta un nivel sensitivo y/o motor, estigmas de trauma en columna, a su vez que el tono del esfínter anal.
El estado neurológico del paciente puede estar alterado por otras condiciones que no impliquen por sí mismas una lesión del SNC, como la hipoglicemia, la hipoxia, el consumo de alcohol u otros tóxicos. Sin embargo, se asume que la alteración neurológica está relacionada con daño del SNC hasta que se demuestre lo contrario.
En este apartado es pertinente la solicitud de exámenes complementarios como glucometría, tóxicos y si la estabilidad del paciente lo permite, imágenes9 .
Dentro del manejo médico que se encuentra la terapia hiperosmolar para el manejo de la hipertensión intracraneana; esta debe sospecharse en pacientes con ECG <9, pupilas midriáticas no reactivas, focalización, caída progresiva de la ECG (2 puntos). El manitol en una presentación al 20% (20g en 100 cc, 0.2g en 1 cc) se administra a una dosis de 1g/kg en bolo rápido y puede repetirse cada 6 horas; no se recomienda su uso en pacientes hipotensos ya que es un diurético osmóticos. La otra opción es la solución salina al 3%, a dosis de 0.1 a 1 cc/kg/h en infusión continua, o 0.1 a 4 cc/kg/dosis cada 4-6 horas; esta sí se puede usar de manera segura en pacientes hipotensos. Sin embargo, no se ha demostrado una diferencia significativa entre estas dos sustancias con respecto a la disminución de la presión intracraneana9


Es imprescindible que se retiren las prendas de vestir del paciente hasta que quede completamente expuesto con el fin de buscar lesiones que hayan pasado desapercibidas en la valoración inicial. Adicionalmente, no olvidar que la hipotermia hace parte de la triada letal, y es por esto que se debe manejar la hipotermia (si el paciente ya viene con ella) o prevenir que la desarrolle durante su estancia en la sala de urgencias. Dentro de las estrategias de control de la temperatura está el uso de mantas térmicas, calentadores externos e infusión de líquidos endovenosos a una temperatura de 39°C9
¿Y la sigla “X”?
Recientemente se ha descrito en la literatura, la introducción de la sigla " X" que hace referencia al control de la hemorragia externa con riesgo de exanguinación. En cuanto a causa de mortalidad en el paciente politraumatizado, el choque hemorrágico y las lesiones de la vía aérea son los dos principales agentes causales, y es por esto que el control de la hemorragia externa, con torniquete o vendaje compresivo (previo o simultáneamente al manejo de la vía aérea) está indicado en estos pacientes.
Conclusiones
El manejo y la definición de politrauma están evolucionando constantemente y, actualmente, no solo los parámetros anatómicos cobran importancia sino también la fisiología del paciente.
El politrauma debe ser entendido y manejado como una enfermedad, que en caso de no identificarse tempranamente, puede llevar a complicaciones a corto y largo plazo, e incluso la muerte.


La valoración inicial del paciente que ingresa al servicio de urgencias es simultánea a la instauración de medidas y/o tratamiento de patologías que amenazan la vida.
La detección temprana de paciente que requiera de hemoderivados hace parte del manejo del choque en el paciente politraumatizado, realizando un manejo oportuno de la coagulopatía que hace parte de la tríada letal en estos pacientes.
La mayoría de lesiones que se presentan en el escenario de trauma requerirán de un manejo quirúrgico; sin embargo, es responsabilidad del médico que realiza el abordaje inicial la reanimación y estabilización del paciente y, en caso de requerirlo, un traslado seguro a un mayor nivel de complejidad.


Referencias
1. Tscherne H. [The treatment of the seriously injured at an emergency station]. Der Chirurg. 1966 Jun;37(6):249-252. PMID: 5995039.
2. Van Ditshuizen JC, Sewalt CA, Palmer CS, Van Lieshout EMM, Verhofstad MHJ, Den Hartog D. The definition of major trauma using different revisions of the abbreviated injury scale. Scand J Trauma Resusc Emerg Med. 2021;29(1):71. doi: 10.1186/s13049-021-00873-7. PMID: 34044857.
3. Pape HC, Lefering R, Bucher N, Peitzman A, Leenen L, Marzi I, et al. The definition of polytrauma revisited: An international consensus process and proposal of the new 'Berlin definition’. J Trauma Acute Care Surg. 2014 Nov;77(5):780-786. doi: 10.1097/TA.0000000000000453. PMID: 25494433.
4. Pape HC, Moore EE, McKinley T, Sauaia A. Pathophysiology in patients with polytrauma. Injury. 2022 Jul;53(7):2400-2412. doi: 10.1016/j.injury.2022.04.009. Epub 2022 May 14. PMID: 35577600.
5) World Health Organization. Preventing injuries and violence: an overview. [Internet]. World Health Organization 2022 [cited 2024 Feb 25]. Available from: https://iris.who.int/bitstream/handle/10665/361331/9789240047136-eng.pdf?sequence= 1
6. Instituto Nacional de Medicina Legal y Ciencias Forenses Grupo Centro de Referencia Nacional sobre Violencia. Forensis 2022 Datos para la vida. Instituto Nacional de Medicina Legal y Ciencias Forenses; 2023. Número 1, volumen 24. ISSN 2145-0250. Available from: https://www.medicinalegal.gov.co/documents/20143/989825/Forensis_2022.pdf
7. Milan M. Management of multiple trauma patients [Internet]. Duebendorf: AOSPINE, Fiore N [cited 2024 Feb 29]. Available from: https://www.aolatam.org/ftp/edudatabase/open-files/Management_of_multiple_trauma_p atient_new.pdf.


8. Alberdi F, García I, Atutxa L, Zabarte M; Trauma and Neurointensive Care Work Group of the SEMICYUC. Epidemiology of severe trauma. Med Intensiva. 2014 Dec;38(9):580-588. English, Spanish. doi: 10.1016/j.medin.2014.06.012.
9. American College of Surgeons. Advanced trauma life support. 10th edition. Chicago: American College of Surgeons, Committee on Trauma; 2018.
10. Petrosoniak A, Hicks C. Resuscitation Resequenced: A Rational Approach to Patients with Trauma in Shock. Emerg Med Clin North Am. 2018 Feb;36(1):41-60.
11. Duarte Garcés AA, Morales Uribe CH. Atención inicial del paciente politraumatizado. En: Morales Uribe CH, editor. Trauma. 2° edición. Medellín: Editorial Universidad de Antioquia; 2016. p. 103-113.
12. Giraldo Restrepo JA, Serna Jiménez TJ. Examen FAST y FAST extendido. Rev Colomb Anestesiol. 2015; 43(4):299-306.
13. Wutzler S, Maegele M, Wafaisade A, Wyen H, Marzi I, Lefering R. Risk stratification in trauma and hemorrhagic shock: Scoring systems derived from the TraumaRegister DGU (®). Injury. 2014;45 Suppl 3: 29-34.
14. Moore SA, Raval JS. Massive transfusion: a review. Ann Blood [Internet]. 2022 [cited 2024 Mar 24];7:18. Available from: https://aob.amegroups.org/article/view/6956/html.
15. Galvagno SM Jr, Nahmias JT, Young DA. Advanced Trauma Life Support® Update 2019: Management and Applications for Adults and Special Populations. Anesthesiol Clin. 2019 Mar;37(1):13-32.
16. Zamboni C, Yonamine AM, Faria CE, Filho MA, Christian RW, Mercadante MT. Tertiary survey in trauma patients: avoiding neglected injuries. Injury. 2014 Nov;45: 14-17. doi: 10.1016/S0020-1383(14)70014-2.
17. Jain U, McCunn M, Smith CE, Pittet JF. Management of the Traumatized Airway. Anesthesiology. 2016 Jan;124(1):199-206. PMID: 26517857.
18. Mayglothling J, Duane TM, Gibbs M, McCunn M, Legome E, Eastman AL, et al. Emergency tracheal intubation immediately following traumatic injury: an Eastern Association for the Surgery of Trauma practice management guideline. J Trauma Acute Care Surg. 2012 Nov;73(5):333-340. doi: 10.1097/TA.0b013e31827018a5.


19. Kovacs G, Sowers N. Airway Management in Trauma. Emerg Med Clin North Am. 2018 Feb;36(1):61-84. doi: 10.1016/j.emc.2017.08.006.
20. Brown CVR, Inaba K, Shatz DV, Moore EE, Ciesla D, Sava JA, et al. Western Trauma Association critical decisions in trauma: airway management in adult trauma patients. Trauma Surg Acute Care Open. 2020 Oct;5(1):e000539. doi: 10.1136/tsaco-2020-000539.
21. Jiménez Madiedo, Carolina, Tinoco Suárez, Gabriel Ricardo y Navarro Vargas José Ricardo. Estado del arte: Utilidad de la inmovilización cervical en trauma. Revista Colombiana de Anestesiología. 2004;XXXII(1):43-53. [cited 2024 Mar 24]. ISSN: 0120-3347. Available from: https://www.redalyc.org/pdf/1951/195117833006.pdf
22. Pape HC, Moore EE, McKinley T, Sauaia A. Pathophysiology in patients with polytrauma. Injury. 2022 Jul;53(7):2400-2412. doi: 10.1016/j.injury.2022.04.009.
23. Edgecombe L, Sigmon DF, Galuska MA, Angus LD. Thoracic Trauma. 2023 May 23. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2024 Jan. PMID: 30521264.
24. Pitotti C, David J. An evidence-based approach to nonoperative management of traumatic hemorrhagic shock in the emergency department. Emerg Med Pract. 2020 Nov;22(11):1-24. Epub 2020 Nov 1. PMID: 33105073.
25. Cannon JW, Khan MA, Raja AS, Cohen MJ, Como JJ, Cotton BA, et al. Damage control resuscitation in patients with severe traumatic hemorrhage: A practice management guideline from the Eastern Association for the Surgery of Trauma. J Trauma Acute Care Surg. 2017 Mar;82(3):605-617. doi: 10.1097/TA.0000000000001333.





Marcela Pérez Muñoz 1 , Camilo González Gómez 1
1. Médico general Universidad CES, Médico general de urgencias Hospital Pablo Tobón Uribe.
Resumen
El carpo está conformado por 8 huesos que se articulan entre sí y representa la unión entre la muñeca y la mano. Las radiografías simples son una ayuda diagnóstica ampliamente disponible y útil para valorar las lesiones óseas a este nivel. Incluyen la proyección posteroanterior y lateral de muñeca, así como la serie de escafoides que aporta proyecciones adicionales. La interpretación de la radiografía de muñeca puede ser un reto para el médico general debido a la cantidad de huesos pequeños que se interponen entre sí.
El reconocimiento de la anatomía radiológica normal y la familiarización con hallazgos que indican patología es de gran ayuda para la detección oportuna de las lesiones óseas en el carpo.
Palabras clave
Anatomía. Radiología. Huesos del Carpo. Articulación de la Muñeca
Introducción
El carpo está conformado por 8 huesos, divididos en una fila proximal y distal. La primera está compuesta por el escafoides, semilunar (lunado), piramidal (triquetral) y pisiforme. La fila distal comprende el trapecio, trapezoide, grande (capitado) y ganchoso (hamartal)1. Las dos filas se mueven de forma independiente, pero están unidas a través del escafoides y la compleja estructura ligamentaria del carpo2



Nota:Tomado de3
Las fracturas del carpo representan el 8% de las fracturas de la mano, por lo que son raras en comparación con las de los metacarpianos o falanges. De estas, el hueso afectado en mayor medida es el escafoides3
La radiografía simple representa la ayuda diagnóstica inicial a la hora de evaluar lesiones a nivel de la muñeca y la mano. Es altamente disponible, rápida y económica, permitiendo evaluar alteraciones secundarias a trauma, masas, infección o representaciones locales de enfermedades sistémicas, por ejemplo, las degenerativas4,5 .
 Figura 1. Anatomía ósea de la muñeca.
Figura 1. Anatomía ósea de la muñeca.

Radiografía de muñeca
Es la principal radiografía para evaluar el carpo. Uno de los principios básicos de las radiografías es incluir al menos 2 proyecciones, para lograr una perspectiva tridimensional de las estructuras observadas6. Las proyecciones estándar de la radiografía de muñeca son la posteroanterior (PA) y lateral; ocasionalmente se acompaña también de una oblicua4
El primer paso para una adecuada identificación de los hallazgos radiográficos es una buena técnica en las imágenes6. La figura 2 muestra la forma adecuada de posicionar el miembro superior para la toma de las proyecciones PA y lateral, respectivamente.
Nota: A. Proyección PA. B. Proyección lateral. Tomado de4
1. Proyección PA
Debe incluir desde el radio y la ulna distal hasta los dos tercios proximales de los metacarpianos4 .
Se debe observar una distancia simétrica entre los huesos del carpo, de 1-2 mm4. Las superficies articulares del carpo se alinean en 3 arcos, llamados las líneas de Gilula (figura 4)
 Figura 2. Técnica de las radiografías de muñeca.
A. B.
Figura 2. Técnica de las radiografías de muñeca.
A. B.

La primera línea delimita la superficie proximal del escafoides, lunado y triquetral. La segunda, pasa por la superficie distal de estos 3 huesos. La tercera, sigue la curvatura de la superficie proximal del capitado y el ganchoso5. Cuando se pierde la integridad de estos arcos se debe sospechar fractura, luxación o inestabilidad del carpo4 .
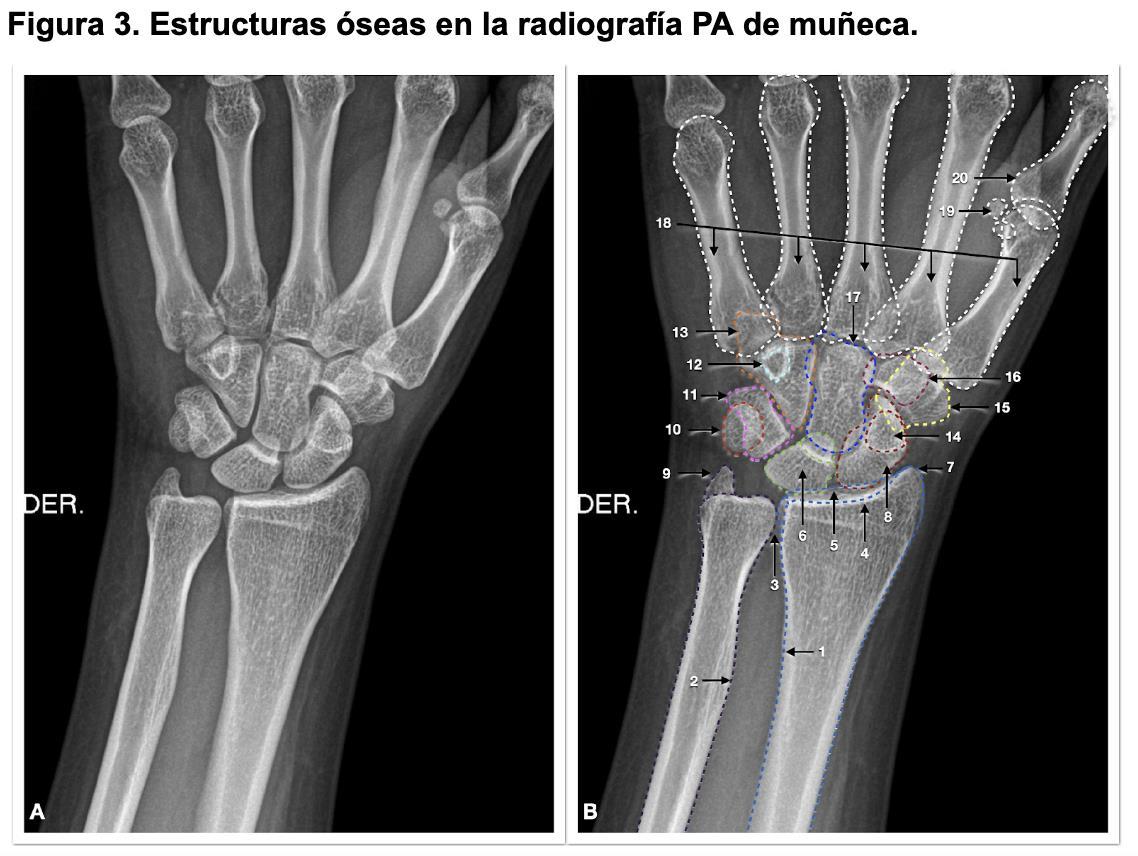
Nota: Imagen cortesía del Dr. Salvador Gómez Bermúdez, departamento de ortopedia Hospital Pablo Tobón Uribe. 1. Diáfisis del radio; 2. Diáfisis de la ulna; 3. Articulación radioulnar distal; 4. Borde volar del radio distal; 5. Borde dorsal del radio distal; 6. Lunado; 7. Apófisis estiloides del radio; 8. Escafoides; 9. Apófisis estiloides de la ulna; 10. Pisiforme; 11. Triquetral; 12. Gancho del ganchoso; 13. Ganchoso; 14. Polo distal del escafoides; 15. Trapezio; 16. Trapezoide; 17. Capitado; 18. Metacarpianos; 19 Sesamoideo; 20. Falange proximal del 1 dedo.



Nota:Tomado de4
2. Proyección lateral
Debe observarse una alineación entre el capitado, el lunado y el radio distal. Si se dibujara una línea a través del capitado, esta debería pasar por el centro del semilunar y de la superficie articular distal del radio4 .
 Figura 4. Líneas de Gilula.
Figura 4. Líneas de Gilula.

Figura 5. Alineación entre el capitado, lunado y escafoides en la radiografía lateral de muñeca.

Nota:Tomado de4
La radiografía lateral presenta un reto por la cantidad de huesos superpuestos, pero aporta una gran cantidad de información acerca de la integridad ósea del carpo7. A continuación, una radiografía normal esquematizando las diferentes estructuras visualizadas.


Figura 6. Estructuras óseas en la radiografía lateral de muñeca.

Nota: Imagen cortesía del Dr. Salvador Gómez Bermúdez, departamento de ortopedia Hospital Pablo Tobón Uribe. B. Estructuras marcadas: 1. Capitado; 2. Gancho del ganchoso; 3. Pisiforme; 4. Lunado; 5. Ulna distal; 6. Tubérculo de Lister; 7. Ganchoso. C. Estructuras marcadas: 1. Trapezoide; 2. Trapecio; 3. Escafoides; 4. Borde volar del radio; 5. Fosa del lunado; 6. Pared dorsal del radio; 7. Apófisis estiloides del radio.; 8. Triquetral.
Serie de escafoides
Está diseñada para exponer una mayor superficie del escafoides y permitir una mejor visualización de cada una de sus superficies8 Los principales signos clínicos que deben motivar la obtención de la serie de escafoides son el dolor en la tabaquera anatómica, en el tubérculo del escafoides y dolor con la compresión longitudinal del pulgar8 .


Esta serie radiográfica comprende 4 proyecciones4:
1. PA de muñeca con desviación cubital: su objetivo es exponer una mayor longitud del escafoides
Figura 7. PA con desviación cubital.
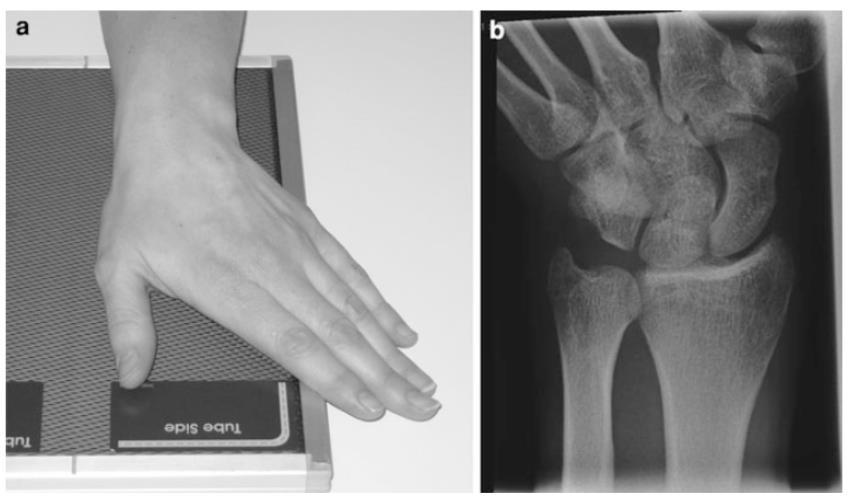
Nota:Tomado de4
2. Oblicua en 45 grados de pronación: permite una mejor valoración de la porción distal del escafoides, el trapecio, trapezoide y la base del 1 y 2 metacarpiano


Figura 8. Oblicua en 45 grados de pronación.

Nota:Tomado de4
3. Oblicua en 45 grados de supinación: demuestra el pisiforme y su articulación con el piramidal. También permite valorar el gancho del ganchoso y la base del 4 y 5 metacarpiano
Figura 9. Oblicua en 45 grados de supinación.

Nota:Tomado de4


4. Lateral: útil en la valoración de la superficie dorsal del radio distal y la alineación del eje entre el radio, semilunar y grande.
Radiologíapatológica
1. Fractura del escafoides
Son las más comunes dentro de los huesos del carpo, representando aproximadamente el 75% de los casos. De estas, la mayoría ocurre en el tercio medio o cintura del escafoides9 .
Ya que usualmente no son desplazadas, suelen pasar desapercibidas fácilmente en las radiografías, especialmente si no se cuenta con las proyecciones adicionales del test de escafoides9 . La figura 10 evidencia una fractura de la cintura del escafoides oculta en la radiografía PA, pero que se hace evidente con la proyección PA con desviación cubital.
Figura 10. Fractura de la cintura del escafoides.

Nota: Tomado de9 (A) Proyección PA. (B) Proyección PA con desviación cubital haciendo evidente la fractura.


Las fracturas desplazadas deben motivar a buscar otras lesiones asociadas en el carpo, como luxación perilunar o inestabilidad del carpo por fracturas en el capitado y piramidal9 .
2. Fractura del piramidal
Las fracturas del piramidal son las siguientes en frecuencia, con un porcentaje del 15 al 20%. La forma más común es una avulsión en la superficie dorsal, evidente en la proyección lateral9 .
Figura 11. Fractura del piramidal.
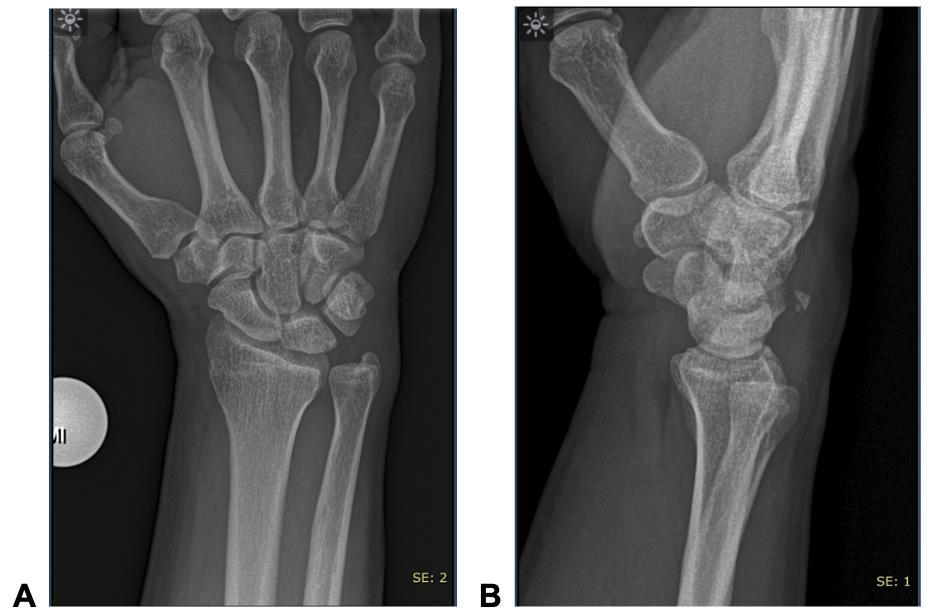
Nota: Imágenes cortesía del Dr. Salvador Gómez Bermúdez, departamento de ortopedia Hospital Pablo Tobón Uribe. A. Proyección PA de muñeca donde la fractura es poco evidente. B. Proyección lateral de muñeca mostrando fractura avulsiva del piramidal, conocido como el signo del “pooping duck”


3. Fractura del ganchoso
Son poco comunes, pero dentro de la fila distal del carpo son las que ocurren con mayor frecuencia. Se puede afectar el gancho o el cuerpo10
Figura 12. Fractura del gancho del ganchoso.

Nota: Tomado de10. Discontinuidad en la cortical del anillo formado por el gancho del ganchoso, demostrando una fractura a este nivel.
4. Luxación perilunar
Se caracteriza por una alineación anormal del grande con respecto al semilunar, mientras que el semilunar permanece en línea con el radio. En la proyección PA, el grande está desplazado dorsal al semilunar, generando un ligero sobrelapamiento; adicionalmente el semilunar adquiere una apariencia triangular. Sin embargo, los hallazgos son más evidentes en la lateral4 .
Suele estar acompañada de otras fracturas del carpo, especialmente fractura desplazada de la cintura del escafoides9


13. Luxación perisemilunar y fractura desplazada de escafoides

Nota:Tomado de12 .
En otra variación de las luxaciones semilunares, el semilunar está desplazado hacia anterior/volar, dejando vacía la concavidad radial. Es menos frecuente que la luxación mencionada previamente y suele ser un hallazgo aislado.
 Figura
Figura

Figura 14. Luxación perilunar en radiografía lateral.
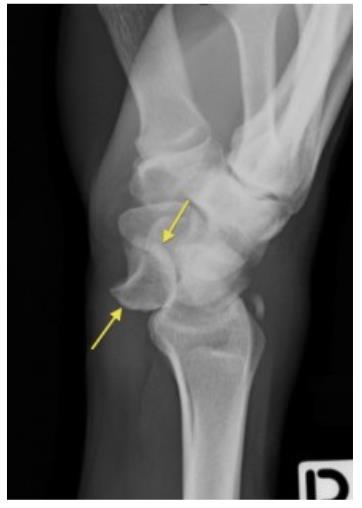
Nota:Tomado de12 .
5. Disociación escafolunar
Se caracteriza por un daño ligamentario causado por un trauma en extensión forzada, por lo que el polo distal del escafoides rota en dirección volar. En la proyección PA se identifica un ensanchamiento de la distancia escafolunar, conocido como signo de Terry Thomas. El escafoides parece más acortado, y su polo distal adquiere una apariencia “en anillo”4 .



Nota: Imagen cortesía del Dr. Salvador Gómez Bermúdez, departamento de ortopedia
Hospital Pablo Tobón Uribe.
Nota: Imagen cortesía del Dr. Salvador Gómez Bermúdez, departamento de ortopedia
Hospital Pablo Tobón Uribe.
Conclusión
La identificación radiográfica de lesiones del carpo representa un reto en la práctica diaria del médico general debido a la complejidad de su anatomía. Familiarizarse con los hallazgos normales y algunos normales es importante para el reconocimiento oportuno de las patologías a este nivel.
Agradecimientos
Al doctor Salvador Gómez Bermúdez, ortopedista especialista en cirugía de la mano, por su orientación y aporte de imágenes de su archivo personal.
 Figura 15. Signo de Terry Thomas.
Figura 15. Signo de Terry Thomas.

1. Kijima Y, Viegas SF. Wrist Anatomy and Biomechanics. J Hand Surg 2009;34A;1555-63.
2. Surbhi Panchal-Kildare, Kevin Malone. Skeletal Anatomy of the Hand. Hand Clin. 2013;(29):459-71.
3. Olivia Boeddrich, Anna Lena Sander, Thomas Lustenberger, Ingo Marzi, Johannes Frank, Maika Voth, et al. Epidemiology of carpal fractures: is it only about the scaphoid? Eur J Trauma Emerg Surg. 2023;49(3):1499-503.
4. Davies AM, Grainger AJ, James SJ. Imaging of the hand and wrist: techniques and applications. Berlin: Springer; 2013. (Medical radiology. Diagnostic imaging).
5. Anil K. Bhat, Bhaskaranand Kumar, Ashwath Acharya. Radiographic imaging of the wrist. Indian J Plast Surg. 2011;44:186-96.
6. Schreibman, Ken L., Gilula, Louis A., Freeland, Alan, Yin, Yuming. IMAGING OF THE HAND AND WRIST. Orthopedic Clinics of North America. 1997;28(4):537-82.
7. Matthew R. Minor, Liem T. Bui-Mansfield, Bradley J. Carra. Systematic Checklist Approach to the Radiographic Interpretation of the Injured Wrist to Avoid Common Diagnostic Errors. Contemporary Diagnostic Radiology. 2015;38(20).
8. Schubert HE. Scaphoid Fracture. Review of diagnostic tests and treatment. Can Fam Physician. 2000;1825-32.
9. Rogers LF. Imaging Skeletal Trauma. 4th edition. Chapter 4: TheWrist. 2015.
10. Jayden Spencer, Suzanne L. Hunt, Chuanwu Zhang, Carissa Walter, Brian Everist. Radiographic signs of hook of hamate fracture: evaluation of diagnostic utility. Skeletal Radiol. 2019;48:1891-8.
11.Steinburg BD, Plancher KD. Clinical anatomy of the wrist and elbow. Clin Sports Med 1995;14(2):299–313
12. Perilunate dislocation [Internet]. Radiology. St. Vincent’s University Hospital. Disponible en: http://www.svuhradiology.ie/case-study/perilunate-dislocation





1.Médico General Universidad CES, Médico general de Hospitalización Hospital Pablo Tobón Uribe.
Resumen
La disnea es una complicación común pero subestimada en el paciente ortopédico hospitalizado con consecuencias significativas para la morbimortalidad, recuperación postoperatoria y costos para el sistema. Se busca revisar los factores de riesgo asociados con la disnea en este grupo de pacientes, incluyendo la inmovilización prolongada, factores de riesgo propios del paciente y presencia de comorbilidades. Se discuten las posibles etiologías de la disnea en pacientes ortopédicos, que van desde complicaciones pulmonares agudas como embolismo pulmonar hasta condiciones crónicas subyacentes. Además, se examinan las estrategias de manejo, que incluyen medidas preventivas como la movilización temprana y la profilaxis antitrombótica, así como intervenciones terapéuticas dirigidas a la causa subyacente de la disnea.
Palabras Clave
Disnea, Embolia Pulmonar, Síndrome de Dificultad Respiratoria
Introducción
La disnea, definida como una sensación subjetiva de dificultad para respirar, es un síntoma común y que puede presentarse en una amplia variedad de condiciones médicas. La subjetividad de este síntoma hace difícil su identificación y cuantificación, haciendo que en algunos casos pase desapercibida o no se le preste la suficiente atención a este síntoma.
Comúnmente asociada a trastornos cardiacos y pulmonares, pero no exclusiva de estas etiologías. Es una entidad a la que poco se le presta atención en el paciente ortopédico, a pesar su importancia clínica en la morbimortalidad, recuperación postoperatoria e impacto en los costos médicos. La inmovilización prolongada, la cirugía ortopédica y


las comorbilidades subyacentes de una población cada vez más envejecida pueden predisponer a estos pacientes a desarrollar disnea durante su estancia hospitalaria. Es de ahí que nace la importancia de una valoración detallada del paciente, sus antecedentes y un adecuado enfoque inicial. Las ayudas diagnósticas y el tratamiento debe estar individualizado y basado en la etiología de base. Esto último sin ignorar la importancia que juega la prevención en la mayoría de las patologías que se discutirán más adelante.
Tromboembolismo Pulmonar
El tromboembolismo pulmonar (TEP) hace referencia a la obstrucción mecánica de una o más ramas de las arterias pulmones por migración de trombos desde otras partes del cuerpo. En un 90-95% de los casos los trombos se originan en el sistema venosos de las extremidades inferiores, no obstante también puede ser secundaria a embolismos grasos, embolismo tumorales, émbolos sépticos, embolismos por cemento, entre otras etiologías que no son el foco central de esta revisión1 .
Como principal etiología, y la que se discutirá en este apartado, se tienen los coágulos venosos. Estos últimos se desarrollan trombos debido a la estasis venosa, la lesión endotelial y la hipercoagulabilidad sistémica (Triada de Virchow)2. Estos trombos pueden desprenderse y viajar a través de la circulación venosa hasta llegar al árbol pulmonar. Esto genera una oclusión parcial o completa, aumentando la resistencia vascular pulmonar e impidiendo el adecuado intercambio gaseoso. Esto llevará a una disminución del gasto cardiaco, aumento del espacio muerto alveolar, cortocircuito derecha-izquierda y trastornos ventilación-perfusión.
Se estima una incidencia anual entre 29-78 por cada 100.000 personas, aumentando a medida que el paciente va envejeciendo. Los estudios no han evidenciado diferencias en la incidencia entre hombres y mujeres, excepto en mujeres jóvenes por el uso de


anticonceptivos orales. Cada año se producen más de 300.000 muertes en Estados Unidos, siendo la tercera causa de muerte de origen cardiovascular y la principal causa de muerte prevenible en los pacientes hospitalizados. Hasta un 75% de los TEP se producen en la comunidad, siendo solo el 25% asociados a hospitalización. La tendencia de envejecimiento de la población, y por consiguiente mayor contacto con los servicios de salud, ha generado que la incidencia del TEP en hospitalización esté en aumento, pasando 23 por cada 100.000 personas a 65 por cada 100.0001,2 .
Los factores de riesgo para el paciente hospitalizado son similares a la población general, esto se clasifican en como mayores o menores, en función al nivel de riesgo protrombótico. Entre los factore de riesgo mayores para tromboembolismo pulmonar varios corresponden a la población de pacientes hospitalizados por ortopedia, entre ellos fracturas de miembros inferiores, politraumatizados y reemplazos articulares (prótesis cadera y rodilla). Pero también el reposo en cama (mayor a 3 días), común en el paciente ortopédico, resalta entre los factores de riesgo para el desarrollo de trombos. Hasta un 40% de pacientes con TEP no se logra identificar factores de riesgo al momento del diagnóstico2-4
En los pacientes con TEP agudo el síntomas más frecuente será la disnea, siendo el signo más frecuente la taquipnea. El paciente puede presentar otros síntomas menos específicos como dolor pleurítico, síncope, tos y hemoptisis. La inestabilidad hemodinámica es poco habitual, pero indica TEP centrales o masivos. La hipoxemia es frecuente pero aproximadamente un 40% de los pacientes tendrá una saturación de oxígeno (SaO2) normal2
Al momento de abordar estos pacientes, entendiendo la variabilidad de presentaciones clínicas y la poca especificidad de algunos hallazgos, entre en juego la probabilidad pre test. La combinación de síntomas y hallazgos clínicos permiten clasificar los pacientes con sospecha de TEP en tres categorías de riesgo (bajo, moderado y alto), que se a su vez se correlacionan con un aumento de la prevalencia de tromboembolismo


confirmados. Se puede esperar confirmación del TEP en aproximadamente el 10% de los pacientes con bajo riesgo, 30% en moderado riesgo y 65% de los pacientes con alto riesgo5. Existen múltiples formas de evaluar esta probabilidad pre test, pero las dos más usadas son los criterios de Geneva y Wells.
Tabla 1. Probabilidad de embolia pulmonar según escala Wells
Nota:Tomado de2
El uso de ayudas diagnósticas se debe individualizar, teniendo en cuenta el contexto del paciente y la probabilidad pre test. La radiografía de tórax es generalmente anormal, pero estos hallazgos son poco específicos. Algunos de los hallazgos relacionados con TEP son atelectasias, efusión pleural y elevación del diafragma. A pesar de la poca utilidad de la radiografía de tórax para el diagnóstico de TEP, nos ayuda a descartar


otras causas de disnea o dolor torácico. El dímero D se encuentra elevado en presencia de tromboembolismo agudo. Su valor predictivo negativo es alto por lo cual un valor normal o bajo hace poco probable el diagnóstico de TEP o TVP. Por otro lado, su valor predictivo positivo es bajo, por lo cual su medición no es de utilidad para el diagnóstico por sí sola de tromboembolismo. El dímero D puede ser usado, en combinación con la probabilidad clínica (riesgo bajo o moderado), para excluir la enfermedad sin necesidad de otros estudios. Finalmente, la angiotomografía es la imagen de elección para el diagnóstico del tromboembolismo pulmonar, teniendo una especificidad del 96% y una sensibilidad el 83%2. Su uso debe ir ligado de la probabilidad pre test, presentando mejor rendimiento con paciente con riesgo intermedio o alto de presentar tromboembolismo.
El pilar fundamental del tratamiento del tromboembolismo pulmonar se basa en la anticoagulación. En los pacientes con riesgo intermedio o alto se debe iniciar la anticoagulación mientras se esperan los resultados de los estudios solicitados. Se prefieren las heparinas de bajo peso molecular (HBPM) o el fondaparinux por encima de la heparina no fraccionado (UNF). Esto dado a su menor riesgo de sangrados mayores y menor riesgo de trombocitopenia inducida por heparinas6. Adicionalmente, ni las HBPM ni el fondaparinux requiere seguimiento mediante laboratorios. Las heparinas no fraccionadas en su mayoría se reservan para pacientes con inestabilidad o riesgo de inestabilidad que serán llevados a terapia de reperfusión, o aquellos pacientes con insuficiencia renal (TFG <30 ml/hr).
La fibrinolisis no se recomienda de rutina y se reserva para pacientes sin factores de riesgo para sangrado e inestables hemodinámicamente. Al momento de definir el manejo a largo plazo, los anticoagulantes directos (direct oral anticoagulants, DOACS) son preferidos por encima de los agonistas de la vitamina K por su farmacocinética y biodisponibilidad más predecible. En el contexto del paciente ortopédico se debe definir el motivo de la trombosis para definir la duración de la anticoagulación.


La prevención durante la estancia hospitalaria es fundamental para disminuir la morbimortalidad y los tiempos de hospitalización. Como parte de las buenas prácticas clínicas se debería definir el riesgo de tromboembolismo en todo paciente que ingresa al servicio de hospitalización. Inicialmente se deben identificar aquellos factores de riesgo no modificables que generan un mayor riesgo de eventos embólicos a los pacientes. Entre estos se encuentran la edad del paciente (>55 años), patologías previas (cáncer, enfermedad renal, enfermedades hematológicas, obesidad), antecedente personal o familiar de tromboembolismo venoso, fracturas miembros inferiores, reposo en cama >3 días, entre otros2,7 .
Se han creado varias herramientas para identificar rápidamente a los pacientes que requieren tromboprofilaxis, entre ellas se cuenta Escala de Riesgo Tromboembólico de Padua y el Score de Caprini, este último siendo ideal para el paciente quirúrgico. Al momento de elegir la estrategia de prevención trombótica, se debe tener en cuenta el riesgo de sangrado del paciente, esto para determinar si el paciente se beneficia de tromboprofilaxis farmacológica y/o mecánica.
Entre los medicamentos que han mostrado efectividad en la prevención de la trombosis venosa se incluyen las heparinas no fraccionadas, heparinas de bajo peso molecular y los anticoagulantes directos. La selección del agente debe ser individualizada, basada en la función renal, otros antecedentes patológicos y los protocolos propios de cada institución.


Factores de Riesgo para sangrado con el uso de anticoagulantes
Ancianos
Mujeres
Diabetes
Hipertensión
Cáncer activo
Alcoholismo
Enfermedad hepática
Enfermedad renal crónica
Úlcera péptica
Evento cerebrovascular previo o hemorragia intracraneal
Nota:Tomado de8
Sangrado activo
Alteraciones en la coagulación
Síndrome de embolismo graso
El síndrome de embolismo graso (Fat embolism syndrome, FES) hace referencia a una entidad rara, pero potencialmente fatal del paciente ortopédico. Este ocurre clásicamente en pacientes después de un trauma o en pacientes llevados a cirugías ortopédicas que implican la manipulación intramedular, por liberación de microgotas de grasa desde la médula ósea o tejidos adiposos lesionados durante el procedimiento.
En la mayoría de pacientes con fracturas se puede encontrar partículas de grasa en la circulación sistema, pero son pocos los que progresan a síndrome de embolismo graso.
La patogénesis aún no se entiende por completo. Se han propuesto dos mecanismos, uno mecánico y otro bioquímico. Se comprende una contribución de ambos mecanismos, con un componente obstructivo vascular y una respuesta inflamatoria al émbolo graso.


A pesar de que es común encontrar grasa circulante en los pacientes ortopédicos, el síndrome de embolismo es una entidad relativamente poco frecuente. Se estima una incidencia para pacientes con trauma mayor o fracturas de huesos largos entre el 0.9 y el 12.8%. Entre 4.8 y 7.5% en pacientes con fracturas femorales bilaterales y hasta 11% en pacientes llevados a fijación intramedular9. Aproximadamente un 95% de los pacientes con esta entidad presentó fracturas de miembros inferiores, siendo los sitios más afectados la tibia y el fémur; y con mayor frecuencia en fracturas cerradas. Se estima una incidencia entre todas las fracturas de solo un 0.17% de los pacientes. Los estudios son limitados, pero se ha evidenciado mayor prevalencia en hombres y en mayor frecuencia en la población entre 10 y 40 años10
Clínicamente se describe una tríada que incluye insuficiencia respiratoria progresiva, alteraciones neurológicas (80-85%) y lesiones petequiales en piel (20-50%)10 , la triada completa se presenta en menos del 50% de los casos. Los síntomas respiratorios son los primeros en aparecer, típicamente presentándose a las 12-72 horas después de la lesión desencadenante11. Los cambios neurológicos se presentan simultáneamente o poco después del inicio de los síntomas respiratorios. Las lesiones petequiales aparecen de forma tardía entre 3-5 días después de la injuria inicial. Los síntomas respiratorios pueden ser insidiosos y poco específicos, generalmente manifestándose como disnea, taquipnea e hipoxemia. Algunos artículos describen que hasta el 50% con síndrome de embolismo graso desarrollan insuficiencia respiratoria con necesidad de ventilación mecánica12. Los síntomas neurológicos son los más prevalentes, generalmente iniciando después de los síntomas pulmonares. Inicialmente el paciente se puede presentar con agitación y confusión, similar al delirium, pero puede progresar a déficits focales (20%), afasia, convulsiones y coma. Se pueden evidenciar síntomas de motoneurona superior, como debilidad, espasticidad, clonus e hiperreflexia. En caso de embolismo graso cerebral hasta el 20% puede presentar convulsiones11 .


Los síntomas cutáneos, clásicamente descrito como un brote petequial, presente en el 20-50% de los pacientes10,11. Presenta una distribución típica en cabeza, cuello, tórax, axilas, espacio subconjuntival y mucosa oral. Característicamente solo se encuentra en la región anterior del cuerpo. Otros síntomas no específicos son taquicardia, taquipnea, hipotensión, fiebre, anuria u oliguria. Se estima que la mortalidad ronda el 5-20%, siendo la insuficiencia respiratoria y la insuficiencia cardiaca derecha las principales causas de muerte10. Los casos leves o moderados tienen un excelente pronóstico, presentando resolución clínica e imagenológica completa en pocas semanas.
No se cuenta con criterios diagnósticos universalmente aceptados o laboratorios confirmatorios para esta entidad. Tanto Guard, Lindeque y Schonfeld intentaron estandarizar los criterios para el diagnóstico del embolismo graso, pero estos son basados en estudios pequeños y carecen de validación prospectiva10. No se cuentan con paraclínicos específicos para embolia grasa, pero algunos hallazgos comunes incluyen anemia, trombocitopenia y elevación de marcadores inflamatorios. Se pueden observar glóbulos grasos en sangre y orina, aunque estos son hallazgos poco específicos. Se ha propuesto el lavado broncoalveolar como una ayuda, evidenciando un aumento de macrófagos llenos de grasa (>30% macrófagos alveolares) en los pacientes con embolia grasa9,10
Las imágenes diagnósticas se deben individualizar. La radiografía de tórax suele ser la primera imagen realizada en estos pacientes. Los hallazgos son pocos específicos, pero pueden incluir opacidades difusas bilaterales. Puede ser usada para realizar diagnósticos diferenciales y seguimiento de este síndrome. La tomografía tórax de alta resolución (TCAR) es la imagen de elección ante la sospecha de embolismo graso. El hallazgo más frecuentemente descrito son opacidades en vidrio esmerilado irregulares y consolidaciones con engrosamiento interlobulillar en patrón “crazy paving”9 Adicionalmente, se puede observar una demarcación entre las áreas afectadas y de


pulmón sano, lo que podría ser reflejo de la variación de la perfusión pulmonar al momento del evento. Los hallazgos clínicos y la extensión de los hallazgos imagenológicos tienen un pico a las 48 horas del evento trombótico13
No existe un tratamiento específico para el embolismo graso, es una entidad generalmente autolimitada y con resolución completa de los síntomas. El tratamiento de estos pacientes se basa en manejo de soporte e identificación temprana de las complicaciones. Una revisión sistemática de 124 casos de embolismo graso evidencio, se observó que aquellos pacientes que recibieron glucocorticoides tuvieron una tasa de mortalidad menor (9.1%) en comparación con aquellos pacientes que no los recibieron (34.2%)14
Como en la mayoría de las condiciones mencionadas en este capítulo, la prevención es la clave. La prevención del embolismo graso consiste en la inmovilización temprana, reducción de la fractura y fijación interna o externa. Un estudio prospectivo aleatorizado en el cual se incluyeron 178 pacientes, en el cual se comparó la fijación quirúrgica temprana (menos de 24 horas) vs tardía (más de 48 horas), se evidencio que el grupo que fue intervenido tempranamente presentó una tasa cinco veces menor de complicaciones pulmonares, incluido el embolismo graso15 .
En todos los casos se debe evaluar la condición del paciente y en aquellos que no sea posible llevar a una fijación definitiva de la fractura, se deberían considerar opciones de fijación percutánea hasta que la condición clínica permite un manejo definitivo16
Algunos estudios han evaluado la utilidad de los glucocorticoides para la prevención del embolismo graso, pero aún hace falta suficiente evidencia para recomendar su uso de rutina.


Conclusión
La disnea en el paciente ortopédico hospitalizado es un signo que requiere un abordaje individualizado, multidisciplinario. La disnea, sin importar su causa, es una complicación frecuente y generalmente subestimada pero significativa en estos pacientes, con impacto en la morbimortalidad, la recuperación postoperatoria y los costos médicos. Entre las etiologías de la disnea en el paciente ortopédico siempre se debe considerar el tromboembolismo pulmonar, y menos frecuente la embolia grasa. Lo anterior sin dejar de lado otras posibles etiologías como son las patologías cardiacas y pulmonares propias del paciente. Un adecuado interrogatorio y un buen conocimiento del contexto clínico del paciente nos deben llevar a individualizar el abordaje del paciente y guiar la toma de decisiones.
En cuanto al tromboembolismo pulmonar, es importante reconocer los factores de riesgo de esta entidad, especialmente los ligados al paciente ortopédico, como la inmovilización prolongada, cirugías realizadas al paciente y las lesiones vasculares. La evaluación clínica y el uso de herramientas de estratificación de riesgo como los criterios de Geneva y Wells son fundamentales para orientar la sospecha diagnóstica y el manejo terapéutico. Siempre que se diagnostique esta entidad se debe iniciar el manejo anticoagulante elegido basado en las condiciones propias de cada paciente. La prevención es la clave, reduce costos, morbimortalidad y estancia hospitalaria. Se cuenta con herramientas y protocolos para identificar aquellos pacientes que ingresan a los servicios de hospitalización que requieren tromboprofilaxis, sea mecánica o farmacológica.
Por otro lado, el síndrome de embolismo graso es una entidad menos frecuente, pero potencialmente grave en el paciente ortopédico; especialmente después de traumatismos o cirugías ortopédicas. La identificación temprana de los factores de riesgo, como la inmovilización prolongada y la manipulación intramedular, es crucial para la prevención de esta complicación.


El manejo del FES se centra en el soporte y la monitorización de las complicaciones. La prevención es central, favoreciendo la inmovilización, fijación temprana y étnicas quirúrgicas que reduzcan el riesgo de émbolos grasos siendo. Los glucocorticoides son una herramienta en estudio para el tratamiento y la prevención, por el momento sin suficiente evidencia para recomendarlos de rutina.
En resumen, el abordaje de la disnea en el paciente ortopédico hospitalizado requiere un enfoque preventivo, diagnóstico y terapéutico integral. En el cual se involucren la diversas especialidades médicas y se consideren las características individuales de cada paciente. El abordaje individualizado, la prevención y un tratamiento oportuno son pilares fundamentales para mejorar los resultados clínicos y la calidad de vida de estos pacientes.


Referencias
1. J.A. Barberà Mir, I. Blanco Vich, R. Rodríguez-Roisin, D. Jiménez Castro. Enfermedades vasculares del pulmón. En: Farreras Rozman Medicina Interna. 19a ed. España: Elsevier; 2020. p. 724-35.
2. Konstantinides SV, Meyer G, Becattini C, Bueno H, Geersing GJ, Harjola VP, et al. 2019 ESC Guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 21 de enero de 2020;41(4):543-603.
3. Rogers MAM, Levine DA, Blumberg N, Flanders SA, Chopra V, Langa KM. Triggers of hospitalization for venous thromboembolism. Circulation. 1 de mayo de 2012;125(17):2092-9.
4. Anderson FA, Spencer FA. Risk factors for venous thromboembolism. Circulation. 17 de junio de 2003;107(23 Suppl 1):I9-16.
5. Ceriani E, Combescure C, Le Gal G, Nendaz M, Perneger T, Bounameaux H, et al. Clinical prediction rules for pulmonary embolism: a systematic review and meta-analysis. J Thromb Haemost JTH. mayo de 2010;8(5):957-70.
6. Cossette B, Pelletier ME, Carrier N, Turgeon M, Leclair C, Charron P, et al. Evaluation of bleeding risk in patients exposed to therapeutic unfractionated or low-molecular-weight heparin: a cohort study in the context of a quality improvement initiative. Ann Pharmacother. junio de 2010;44(6):994-1002.
7. American Association of Orthopedic Surgeons and American College of Chest Physicians Guidelines for Venous Thromboembolism Prevention in Hip and Knee Arthroplasty Differ: What Are the Implications for Clinicians and Patients?ScienceDirect [Internet]. [citado 18 de febrero de 2024]. Disponible en: https://www.sciencedirect.com/science/article/abs/pii/S0012369209601434
8. Qaseem A, Chou R, Humphrey LL, Starkey M, Shekelle P, for the Clinical Guidelines Committee of the American College of Physicians. Venous Thromboembolism Prophylaxis in Hospitalized Patients: A Clinical Practice Guideline


From the American College of Physicians. Ann Intern Med. noviembre de 2011;155(9):625-32.
9. Newbigin K, Souza CA, Torres C, Marchiori E, Gupta A, Inacio J, et al. Fat embolism syndrome: State-of-the-art review focused on pulmonary imaging findings. Respir Med. abril de 2016;113:93-100.
10. Rothberg DL, Makarewich CA. Fat Embolism and Fat Embolism Syndrome. J Am Acad Orthop Surg. 15 de abril de 2019;27(8):e346-55.
11. Godoy DA, Di Napoli M, Rabinstein AA. Cerebral Fat Embolism: Recognition, Complications, and Prognosis. Neurocrit Care. diciembre de 2018;29(3):358-65.
12. Aggarwal R, Banerjee A, Soni K dev, Kumar A, Trikha A. Clinical characteristics and management of patients with fat embolism syndrome in level I Apex Trauma Centre. Chin J Traumatol. junio de 2019;22(3):172-6.
13. Ross AP. The fat embolism syndrome: with special reference to the importance of hypoxia in the syndrome. Ann R Coll Surg Engl. marzo de 1970;46(3):159-71.
14. He Z, Shi Z, Li C, Ni L, Sun Y, Arioli F, et al. Single-case metanalysis of fat embolism syndrome. Int J Cardiol. 15 de diciembre de 2021;345:111-7.
15. Bone LB, Johnson KD, Weigelt J, Scheinberg R. Early versus delayed stabilization of femoral fractures. A prospective randomized study. J Bone Joint Surg Am. marzo de 1989;71(3):336-40.
16. Akhtar S. Fat Embolism. Anesthesiol Clin. 1 de septiembre de 2009;27(3):533-50.





Mariluz Laverde Manrique1,Nicolas López Arboleda2,José Ovidio Herrera Montoya3
1.Médica general Universidad Pontificia Bolivariana, Médica general de Urgencias Hospital Pablo Tobón Uribe.
2.Médico general Pontificia Universidad Javeriana de Cali, Médico general de urgencias Hospital Pablo Tobón Uribe.
3.Médico Universidad de Antioquia, Cirujano Plástico maxilofacial y de la mano Universidad de Antioquia, Cirujano Plástico miembro de número de la sociedad colombiana de cirugía plástica, Cirujano Plástico Hospital Pablo Tobón Uribe.
Resumen
Las quemaduras son lesiones traumáticas comunes altamente prevenibles, su clasificación y manejo depende de su extensión, etiología y profundidad; pueden producir gran morbilidad y gracias a los avances en el manejo, cada vez menos mortalidad; por esto es esencial que un médico general tenga el conocimiento, la competencia y la confianza para realizar un adecuado manejo de un paciente quemado, principalmente en las primeras 24 horas posteriores al trauma. Este capítulo tiene como objetivo proporcionar información acerca del enfoque inicial del paciente quemado en el servicio de urgencias desde la perspectiva del médico general.
Palabras clave
Quemaduras, enfoques, líquidos, quirúrgico.
Introducción
En la actualidad el tratamiento adecuado en las primeras horas de un paciente gravemente quemado, afecta significativamente el resultado a largo plazo. Por lo tanto es esencial que el paciente sea tratado adecuadamente inmediatamente después de la


lesión. Hoy en día la complejidad, el costo, la intensidad y el carácter de atención multidisciplinaria que un paciente quemado requiere, han llevado al desarrollo de los centros especializados para el manejo del paciente quemado; los cuales han contribuido a la disminución de la morbimortalidad asociada a este tipo de trauma, optimizando los resultados a largo plazo de estos pacientes5. A pesar de esto, el tratamiento adecuado de un paciente con quemadura térmica no debería limitarse a un centro especializado en quemados; debido a que existen consecuencias psicológicas, físicas, económicas y sociales que repercuten tanto en el sistema de salud como en el paciente y su entorno. Esto indica que todos los médicos debemos tener la capacidad de manejar de manera idónea un paciente bajo el contexto de una quemadura.
Es esencial que un médico general tenga el conocimiento, la competencia y la confianza para realizar un adecuado manejo de un paciente quemado principalmente en las primeras 24 horas posteriores al trauma. Este capítulo tiene como objetivo proporcionar información acerca del enfoque inicial del paciente quemado en el servicio de urgencias viéndolo como un paciente politraumatizado y no simplemente como un paciente con un compromiso estético de la piel.
Epidemiología
Las quemaduras constituyen a nivel mundial un problema de salud pública; cada año provocan aproximadamente 180.000 muertes6. Se estima que el 1% de la población mundial sufrirá una quemadura grave en algún momento de su vida2 .
En Estados Unidos alrededor de 450.000 personas reciben atención médica por quemaduras, de los cuales 45.000 personas son hospitalizadas y 4000 mueren anualmente por esta causa5. Los casos de quemaduras están disminuyendo en los países de altos ingresos gracias a las normas implementadas en campañas educativas


y de seguridad. Por el contrario, en los países de medianos y bajos ingresos las quemaduras siguen siendo una causa importante de ingreso hospitalario y de muerte por traumatismo especialmente en la población pediátrica1,2 .
Según los datos de la American Burn Association (ABA) en estados unidos aproximadamente el 71% de los pacientes con quemaduras son hombres, 17% son niños menores de 5 años, el 67% de los casos reportados presentaron quemaduras de <10% de la superficie corporal quemada (SCQ), 65% de los pacientes presentaron quemaduras en el hogar, el 4% murieron a causa de estas lesiones y el 96% de los pacientes tratados en centros especializados en quemados sobrevivieron5 .
En Sudamérica y por ende en Colombia las causas más frecuentes de quemaduras son prevenibles debido a que la mayoría corresponden a incidentes domésticos, industriales y laborales5. Los agentes más frecuentes son quemaduras por líquidos calientes principalmente en la edad infantil, seguido de llamas directas y electricidad en accidentes laborales2 .
En Medellin, Colombia entre los años 1994 a 2004 ingresaron a la unidad de quemados del Hospital Universitario San Vicente de Paúl (HUSVP) 2319 pacientes de los cuales el 66,8% eran de sexo masculino con una proporción 2:1 hombre a mujer y el 62,9% tenían menos de 15 años, teniendo como edad promedio 18.1 años. El principal agente causal fueron los líquidos calientes (45.9%), seguido por las quemaduras por llamas (38.5%). Presentan una tasa de mortalidad que oscila entre el 4.2 y el 12.2%2 El promedio de superficie corporal total (SCT) quemada fue del 26,9%, siendo el peor grado de la quemadura de II grado profundo en el 45%, y de III grado en 47% y la estancia hospitalaria media fue de 26,9 días. En 2004 el 40,4% de los pacientes requirieron cirugía y el 13,4% de los pacientes presentaron complicaciones. Las áreas más afectadas son cabeza, tórax y extremidades. De todos los pacientes ingresados el 87% presentaron complicaciones asociadas y la mortalidad secundaria a este tipo de quemadura fue del 30%2 .


Definición
Según la American Burn Association (ABA) una quemadura se define como un daño a la piel y los tejidos subyacentes causado por calor, productos químicos o electricidad5 .
Es una lesión aguda de la piel u otros órganos causado por el contacto térmico con líquidos calientes, sólidos calientes, llama u otro trauma agudo como el producido por la radiación, radioactividad, electricidad, fricción o contacto químico1; es decir que se genera por una cambio brusco de temperatura o por exposición a otros medios generando una lesión total o parcial de las células.
Clasificación de las quemaduras
Existen varias maneras de clasificar las quemaduras: por la etiología, por la profundidad, por la localización13
Tabla 1. Clasificación de quemaduras según su profundidad
Grado Espesor Compromiso Características Curación
Primer grado
Epidermis. No Eritema, dolor, Espontánea hay flictenas superficie seca, en 2 a 4 días no pérdida de sustancia.
Parcial
Segundo Parcial de Flictenas, Espontánea grado dermis (Hasta ampollas con en 2 a 3 superficial dermis papilar). exudación y semanas. Flictenas en dolor. Buen Pueden dejar las primeras 3 a 24 horas llenado capilar cicatriz pigmentada


Segundo grado profundo
Tercergrado
Cuarto grado
Total
Parcial de dermis (Hasta dermis reticular). Formación de cicatrices, compromiso funcional
Toda la dermis + tejido celular subcutáneo. Secuelas funcionales
Lo anterior + zonas rojo oscuro y zonas pálidas, pérdida de sensibilidad Tardanhasta9 semanas. Pueden dejar cicatriz hipertrófica
Quinto grado
Piel, músculo, fascia, hueso, órganos internos
Significa pérdida de una parte corporal o requiere amputación
Necrosis, carbonización tisular. No duelen por destrucción de terminaciones nerviosas.
Manejo quirúrgico.
No reepiteliza y puede generar grandes retracciones de cicatriz.
Variable Manejo quirúrgico.
No reepiteliza
Manejo quirúrgico.
Nota:Tomadode13


Según etiología o mecanismo de producción:
● Se clasifica en quemaduras térmicas, químicas, eléctricas, fricción y radiación; es importante aclarar que dentro de las quemaduras térmicas la quemadura por líquidos espesos se comporta como quemadura por llama5
Tabla 2. Según la profundidad espesor parcial y espesor total
Características
Perfusión tisular
Permeabilidad capilar
Espesor parcial
Vasoconstricción inicial que causa una hipoperfusión transitoria
Aumento de la permeabilidad después de una lesión de los vasos dérmicos
Espesor total
Oclusión vascular que provoca una hipoperfusión
Aumenta después de una lesión de vasos dérmicos y subdérmicos permeables
Formación de edema
Cambios intersticiales
Nota: Tomado de1
En dermis y unión entre epidermis y dermis En dermis y subdermis
Pérdida de matriz intersticial en áreas quemadas con integridad tisular mantenida en dermis no quemada
Pérdida de integridad intersticial y daño a los componentes de la matriz, ácido hialurónico y colágeno


Según la localización:
● La parte del cuerpo comprometida constituye un factor de riesgo muy importante para evaluar la gravedad de una quemadura. Se debe prestar especial atención a quemaduras en cara, mano, zonas periarticulares, periné, circunferenciales de una extremidad, cuello o del tórax o vía aérea por inhalación.
Al mismo tiempo las quemaduras mayores son aquellas quemaduras que alcanzan el mayor o igual al 25% de la SCQ debido a que se encuentran asociadas a un aumento de la permeabilidad capilar y con un déficit intravascular en las primeras 24 asociadas a choque5
Fisiopatología
La piel es un órgano de vital importancia que actúa como barrera protectora aislando el organismo del medio que lo rodea, pesa aproximadamente 5 kg, mide 2 metros y se constituye como el órgano más extenso del cuerpo. Entre sus funciones se encuentran la de barrera, el mantenimiento del balance de líquidos y electrolitos, la función inmunológica, la conservación de la temperatura y la protección del organismo frente a la radiación ultravioleta y los patógenos; está compuesta por 2 estructuras: la epidermis y la dermis 3 .
En cuanto a la fisiopatología de las quemaduras se debe de tener en cuenta que las quemaduras producen necrosis coagulativa tanto de la epidermis como de tejidos profundos; y la profundidad va a depender de la duración de la exposición y de la temperatura a la cual se exponga la piel15
Se debe de tener en cuenta que la lesión producida por una quemadura se va a dividir en 3 zonas, conocidas como zonas de jackson6,15:
● Zona de coagulación: Es la zona central donde se encuentra el daño inmediato e irreversible
●


● Zona de estasis: Es la zona que se encuentra alrededor del área de coagulación, tiene un grado moderado de lesión debido a un aumento de la permeabilidad vascular y una disminución de la perfusión, lo que lleva a isquemia. Esta zona se puede recuperar al restituir la perfusión o también se puede empeorar generando necrosis si no hay un adecuado manejo.
● Zona de hiperemia: Es la zona más periférica, se da una importante vasodilatación, tiene el tejido viable que no se encuentra en riesgo de necrosis y se recupera fácilmente.
Las quemaduras se asocian con una liberación masiva de mediadores de la inflamación hacia la circulación, generando una respuesta inflamatoria sistémica. Los mediadores inflamatorios producen aumento de la permeabilidad vascular, extravasación del líquido al intersticio y edema; se debe tener en cuenta que secundario al edema se puede presentar un síndrome compartimental; además la extravasación del líquido puede generar también hipovolemia que lleva a la disminución de la perfusión y del aporte de oxígeno a los tejidos. Este disbalance y pérdida progresiva de líquido intravascular e hipovolemia lleva a que sea necesario una reanimación hídrica agresiva. El paciente quemado clínicamente se presenta como un choque estéril que en algunos casos puede progresar a falla orgánica múltiple. Por lo tanto las quemaduras tienen la capacidad de alterar los sistemas corporales en proporción directa con la extensión5
Manejo del paciente quemado
● Tratamiento prehospitalario:
Lo principal es detener la causa del daño, retirar la ropa caliente o impregnada de químicos, irrigar y cubrir con sábanas limpias, realizar ABC primario, suministrar oxígeno, acceder a una vía venosa y controlar el sangrado5


● Manejo en el servicio de Urgencias:
El enfoque inicial del paciente quemado se realiza igual que cualquier otro tipo de trauma, con el ABCDE primario.
A. Vía aérea: Verificar que se encuentre permeable, evaluar obstrucción y signos de quemadura de la vía aérea (disfonía, estridor, quemadura de cara o vibrisas nasales, ceniza en lengua, entre otras) que hagan sospechar lesión directa en la epiglotis o lesión subglótica en el parénquima; retirar cuerpos extraños visibles, maniobra de hiperextensión cervical, uso de dispositivos orofaríngeos o nasofaríngeos, administración de oxígeno suplementario y evaluar la necesidad de intubación orotraqueal9,10
B. Respiración y ventilación: Se debe vigilar el patrón respiratorio, si es restrictivo realizar escarotomia y tener en cuenta 3 causas que pueden comprometer la ventilación las cuales son: hipoxia secundario a lesión por inhalación o trauma en tórax relacionado o no con trauma térmico, intoxicación por monóxido de carbono cuando hay exposición a humo en lugares cerrados la cual se debe manejar con oxígeno al 100% o determinar requerimiento de intubación orotraqueal y lesiones de la vía aérea inferior por inhalación de humo que se complican con neumonía o edema pulmonar9,10 .
Indicaciones de intubación temprana según ABLS (American Burn Life Support)10:
● Signos de obstrucción de la vía aérea
● Extensión de la quemadura (SCT > 40% -50%)
● Quemaduras faciales extensas y profundas
● Quemaduras en la boca
● Edema significativo del cuello o tórax por quemadura circunferencial o riesgo de edema
● Disfagia


● Signos de compromiso respiratorio: incapacidad para eliminar las secreciones, la fatiga respiratoria, mala oxigenación o ventilación
● Disminución del nivel de conciencia con ECG menor o igual a 8
C. Circulación y reanimacion hidrica: Determinar lesiones que amenacen la vida y puedan llevar a choque, evaluar perfusión de extremidades y definir si requiere fasciotomía o escarotomia, garantizar mínimo 2 accesos venosos de gran calibre, iniciar manejo con líquidos endovenosos para evitar choque hipovolémico secundario a extravasación de líquidos al espacio intersticial y vigilar diuresis.
El manejo de reanimación con líquidos endovenosos se realiza con cristaloides en las siguientes indicaciones:
● Adultos con quemaduras >20% de SCT
● Niños con quemaduras >10% de SCT
● Quemaduras eléctricas
● Quemaduras de vía aérea
● Edades extremas
● Pacientes con enfermedad cardiaca, pulmonar o renal previa
La guia ISBI (International society for burn injury) del 2016 recomienda iniciar lactato de ringer entre 2-4 cc/kg/SCT en las primeras 24 horas evitando la sobrehidratación y garantizando un gasto urinario de 0.3 a 0.5ml/kg/h en adultos y 1 ml/kg/h en niños9, la guia American Burn Association (ABA) 2018 recomienda el manejo con líquidos endovenosos según las siguientes características10:
● >13 años: 2 cc/kg/SCTQ
● <13 años: 3cc/kg/SCTQ
● <30kg: 3cc/kg/SCTQ y LEV de mantenimiento
● Eléctricas 4cc/kg/SCTQ


Con las nuevas recomendaciones de las últimas guías, ha cambiado el manejo de los líquidos endovenosos en el paciente quemado y por ello el uso de la fórmula de Parkland: 4 ml x Kg de peso x %SCQ que consiste en pasar del total de la fórmula el 50% en las primeras 8 horas y el otro 50% en las siguientes 16 horas, se ha dejado exclusivamente para paciente con quemaduras eléctricas y paciente gran quemado para evitar complicaciones asociadas a la sobrecarga hídrica8-11
D. Déficit neurológico: El estado mental del paciente puede evaluarse fácilmente mediante la escala de coma de Glasgow (Glasgow Coma Scale, GCS) que utiliza mediciones verbales, motoras y oculares; si el paciente tiene alteración neurológica se debe considerar lesiones asociadas como intoxicación por monóxido de carbono, abuso de sustancias, hipoxia o enfermedades preexistentes5,10 .
E. Exposición y control de temperatura: Exponga y desnude completamente al paciente buscando lesiones importantes asociadas y detener el proceso de quemado retirando accesorios, ropa y si hay algún material adherido a la piel enfriar el material con agua, nunca con hielo y retirarlo; evitar la hipotermia ya que reduce el flujo sanguíneo a la zona dañada y puede profundizar la lesión9,10 .
Al examinar una quemadura se debe determinar la extensión y la profundidad de la misma; la extensión se calcula conociendo la superficie corporal total quemada, para la cual existen diferentes métodos entre los cuales están: Regla de los 9, método palmar y la gráfica de Lund-Browder12,17 .


Gráfica método palmar y regla de los 9:
Nota:Tomado de9
Gráfica de Lund–Browder modificada
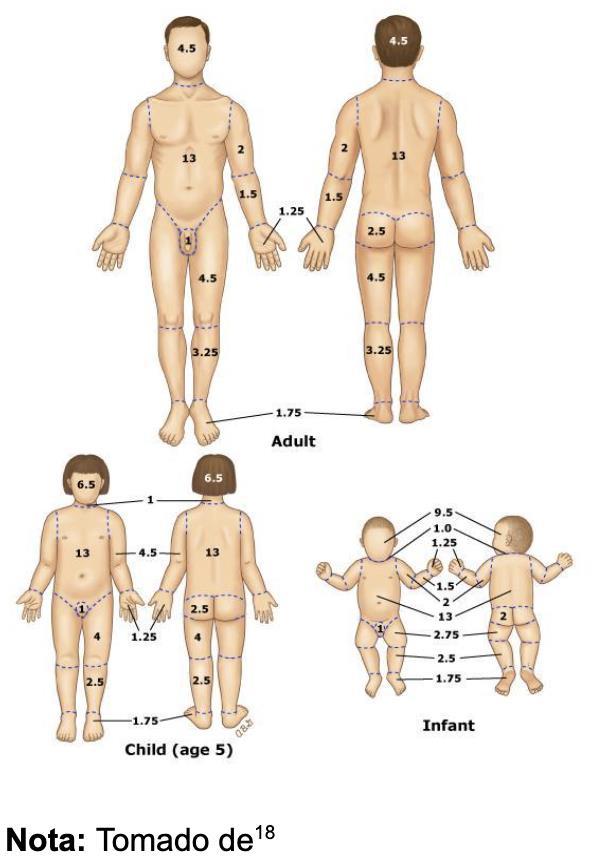


Indicaciones y órdenes al ingreso a urgencias del paciente:
1. Trasladar a observación
2. Aislamiento de contacto y gotas
3. Control de signos vitales y peso del paciente
4. Retirar ropa y prendas quemadas
5. Definir necesidad de Oxígeno suplementario (si tiene quemadura de vía aérea o más de 50% de SCT quemada)
6. Analgesia de preferencia opioides: Morfina 0.1-0.2mg/kg/dosis, Meperidina 1-2mg/kg/dosis
7. LEV segun SCT quemada y las recomendaciones mencionadas anteriormente
8. Antihistamínico: Difenhidramina IV
9. Profilaxis gástrica con IBP
10.Definir necesidad de profilaxis antitetánica
11.Definir necesidad de manejo antibiótico, este NO se usa de rutina, se debe considerar sólo en quemaduras muy extensas, niños desnutridos, pacientes con quemadura que tuvo contacto con aguas estancadas/río o paciente con infecciones del tracto respiratorio y urinario.
12.Paso de sonda nasogástrica o vesical según sea el caso
13.Definir que paraclínicos requiere
14.Curación inicial: Lavado y desbridamiento en urgencias con SSN 0.9% y aplicación de agente tópico: Sulfadiazina de plata 1%, Nitrofurazona 0.2%, Vaselina, Solución salina, Bacitracina o uso de apósitos especiales y posterior cobertura con vendaje de preferencia en quemaduras pequeñas: Hidrofibra de plata, hidrocoloide, apósitos de adherencia bacteriana
15.Definir necesidad de realizar fasciotomía, escarotomía o escarectomía
16. Solicitar valoración por cirugía plástica según los criterios mencionados a continuación.


Indicación de manejo hospitalario5,12:
Pacientes < 10 años o > 50 con quemaduras de 2do y 3er grado de > 10% SCQ
Paciente con quemadura de 2do y 3er grado de > 20% SCQ de otras edades
Quemaduras de tercer grado con > 2% de SCTQ
Tercer gradoenadelante
Lesiones por electricidad de alto voltaje incluyendo las producidas por rayos
Lesiones pulmonares por inhalación
Paciente con comorbilidades
Asociada a politraumatismo
Compromiso de áreas críticas
Quemaduras químicas graves
Lesiones circulares en extremidades o tórax
Quemaduras en pacientes que requieren soporte social, psicológico o rehabilitación
Indicaciones de valoración por cirugía plástica5:
Pacientes con quemaduras de tercer grado con > 2% de SCTQ
Pacientes entre 10 y 50 años con quemaduras de 2do grado con > 15% SCTQ
Pacientes < 10 años o > 50 con quemaduras > 10% SCTQ
Quemaduras de 2do grado > 20% SCTQ
Quemadura eléctrica de alto voltaje
Quemadura en vía aérea, área especial (cara, manos, pies, genitales, periné o articulaciones)
Quemaduras químicas graves
Quemadura asociada a trauma mayor
Valoraciónsecundaria
En la valoración secundaria se debe de realizar una anamnesis más a fondo, tener el peso del paciente, determinar cuáles paraclínicos requiere el paciente, monitorización


continua del paciente, determinar si el paciente requiere manejo en UCI o en sala general de acuerdo al estado hemodinámico del paciente, vigilar si el paciente se encuentra respondiendo a la reanimación, realizar una valoración del inicio de la dieta de manera temprana y de protector gástrico, uso de profilaxis antitetánica y anti trombótica, control glucémico, analgesia, antibióticos, curación de las quemaduras y soporte psicosocial5 .
Paraclínicos:
● En el paciente que presenta quemadura eléctrica se debe realizar de manera inicial un electrocardiograma para determinar el compromiso que pueda tener a nivel cardiaco. Si el electrocardiograma inicial no presenta alteración, el paciente no requiere electrocardiogramas periódicos.
● Para todos los pacientes que requieren manejo hospitalario se debe solicitar función renal y hemograma.
● Se utilizan dietas altamente hipercalóricas e hiperproteicas y pobres en grasa en pacientes que requieren volúmenes metabólicos excesivos.
● Se utiliza protector gástrico con el propósito de disminuir y prevenir las úlceras de Curling.
● Se debe realizar profilaxis antitetánica de acuerdo a esquema de vacunación del paciente
● En cuanto al uso de antibióticos de manera profiláctica no se encuentran indicados porque favorecen la selección bacteriana resistente. Al mismo tiempo no requiere la toma de cultivos en zonas afectadas.
● En cuanto al manejo analgesico se debe individualizar de acuerdo a cada paciente, pero se debe de tener en cuenta que en la mayoría de los casos se utilizan opioides.
● Manejo del prurito con antihistamínico.


Signos de alarma que indican complicación de una quemadura5:
● Aparición de exudado purulento
● Signos inflamatorios e infecciosos alrededor de la lesión
● Profundización de la quemadura
● Manejo quirúrgico y no quirúrgico
Para el manejo no quirúrgico en el servicio de urgencias el médico general debe de estar en la capacidad de realizar:
● Desbridamiento mecánico
● Lavado por irrigación
● Drenaje de ampollas
● Aplicación de agente tópico: Sulfadiazina de plata 1%, Nitrofurazona 0.2%, Vaselina, Solución salina, Bacitracina4 .
● Uso de apósitos especiales y posterior cobertura con vendaje de preferencia en quemaduras pequeñas: Hidrofibra de plata, hidrocoloide, apósitos de adherencia bacteriana.
● En cuanto al manejo quirúrgico nos encontramos la escarotomía, fasciotomía, escarectomía, cantotomía lateral, manejo de defectos de cobertura con injertos y/o colgajos y amputación en los casos requeridos. Se debe de tener en cuenta que el manejo es individualizado y definido por el cirujano tratante4,5,16
Escarotomía
La escarotomía longitudinal temprana es el procedimiento mediante el cual se realiza una incisión tangencial longitudinal; se utiliza en situaciones donde el paciente presenta quemaduras profundas (espesor total) circunferenciales de extremidades y tórax las cuales pueden producir compromiso vascular y respiratorio por retracción de las escaras y presión interna por el edema. En estos casos es preciso un tratamiento


quirúrgico de urgencia. En algunas situaciones no se logra la recuperación del flujo sanguíneo por lo cual es necesario realizar una fasciotomía con el propósito de evitar un síndrome compartimental. Se debe de tener en cuenta que el médico general puede realizar si lo requiere el paciente una escarotomía. En cuanto a la fasciotomía es únicamente un manejo realizado por el cirujano especialista11 .
Sitios de incisión de una escarotomía.

Nota:Tomado de11
 Figura
Figura

Escarectomía
La escara se comporta como un tejido desvitalizado que continúa produciendo una respuesta inflamatoria, predispone el crecimiento de infecciones y retrasa la cicatrización, por lo que la sobrevida, morbilidad, estancia hospitalaria y secuelas se ven afectadas drásticamente; las recomendaciones para la escarectomía en las áreas generales son las quemaduras de espesor total que se deben desbridar e idealmente estar cubiertas con injerto de piel en 7 a 10 días. El tiempo entre el desbridamiento o escarectomía y la cobertura con injertos de piel, es de una semana. Este período puede variar según las características del lecho a injertar, el deterioro del paciente o la presencia de infección. Cuando al ingreso las quemaduras tienen una profundidad no definida, se debe hacer una nueva valoración de las mismas 7 días después y en esa segunda evaluación, se determina que quemaduras posiblemente tardarán más de 3 semanas en cicatrizar; este grupo es el que se beneficiará de la escarectomía y el tratamiento con injertos de piel. Existe igualmente un período intermedio luego de 10 a 14 días, en donde se puede hacer una revaloración de las zonas dudosas y en aquellos lugares donde está disponible, además del juicio clínico, la flujometría láser, puede contribuir a tomar decisiones, cuando este examen muestra zonas de mayor profundidad e isquemia (pobre perfusión tisular).
En las áreas especiales como la cara, cuello, pliegues de flexión, manos, pies o dedos, se considera que si luego de 14 días no hay una cicatrización completa o avanzada, se debe hacer una escarectomía y una cobertura definitiva con injertos de piel parcial para garantizar un resultado funcional y estético superior. La única limitante de la escarectomía tangencial, es el sangrado. Se estima que por cada 1% de SCT que es desbridada, se pierden 100 cc de sangre, por lo que se debe planear con el equipo de anestesia y reanimación el procedimiento para evitar una hipovolemia, que nos traiga complicaciones adicionales5,17 .


Conclusión
En la actualidad el adecuado enfoque del paciente quemado que acude al servicio de urgencias ha contribuido a la disminución de la morbilidad y mortalidad asociada a esta causa. Desde el enfoque como médico general se debe partir que son lesiones traumáticas comunes y prevenibles por lo cual es fundamental que el médico general tenga el conocimiento, la competencia y la confianza para realizar un adecuado manejo desde el primer nivel de atención.
Las quemaduras son lesiones traumáticas y el enfoque inicial se realiza igual que cualquier otro tipo de trauma, identificando las lesiones potencialmente graves, realizando reanimación hídrica adecuada y un manejo inicial de la herida para disminuir el riesgo de infección y la morbimortalidad en estos pacientes; sin dejar de considerar que el manejo posterior en salas de cuidado crítico o unidades de quemados y el abordaje quirúrgico de la quemadura, contribuyen a que haya un adecuado desenlace.


Referencias
1. Peck MD. Epidemiology of burns throughout the world. Part I: Distribution and risk factors. Burns [Internet]. 2011;37(7):1087–100. Disponible en: http://dx.doi.org/10.1016/j.burns.2011.06.005
2. Hoyos, M. Gonzales N. Diaz M. Epidemiological and clinical profile of burn victims. Hospital Universitario San Vicente de Paul. Medellín 1994-2004. Burns 2006,; 32: 1044-1051
3. Chu, David. Capitulo 7. Desarrollo y estructura de la piel. En Wolff, Goldsmith, Katz. Fitzpatrick Dermatología en Medicina General. Séptima edición. Madrid, España. Editorial Medica Panamericana. 2008. Pag 57-73.
4. Bezuhly M, Fish JS. Acute burn care. Plast Reconstr Surg [Internet]. 2012;130(2):349e–58e. Disponible en: http://dx.doi.org/10.1097/prs.0b013e318258d530
5. American College of Surgeons. Lesiones termicas. En: Advanced trauma life support, ATLS®, Soporte vital avanzado en Trauma. 10° ed. 633 N. Saint Clair. 2018. p. 169-184.
6. Quemaduras [Internet]. Who.int. [citado el 19 de febrero de 2024]. Disponible en: https://www.who.int/es/news-room/fact-sheets/detail/burns
7. Fraulin FOG, Illmayer SJ, Tredget EE. Assessment of cosmetic and functional results of conservative versus surgical management of facial burns. J Burn Care Rehabil [Internet]. 1996;17(1):19–29. Disponible en: http://dx.doi.org/10.1097/00004630-199601000-00007
8. Blumetti J, Hunt JL, Arnoldo BD, Parks JK, Purdue GF. The parkland formula under fire: Is the criticism justified? J Burn Care Res [Internet]. 2008;29(1):180–6. Disponible en: http://dx.doi.org/10.1097/bcr.0b013e31815f5a62
9. ISBI Practice Guidelines Committee, Ahuja RB, Gibran N, Greenhalgh D, Jeng J, Mackie D, et al. ISBI practice guidelines for burn care. Burns [Internet]. 2016;42(5):953–1021. Disponible en: http://dx.doi.org/10.1016/j.burns.2016.05.013


10. Update PM 2018. Advanced burn life support course [Internet]. Ameriburn.org. Disponible en: https://ameriburn.org/wp-content/uploads/2019/08/2018-abls-providermanual.pdf
11. Cancio LC. Initial assessment and fluid resuscitation of burn patients. Surg Clin North Am [Internet]. 2014;94(4):741–54. Disponible en: http://dx.doi.org/10.1016/j.suc.2014.05.003
12. Bettencourt AP, Romanowski KS, Joe V, Jeng J, Carter JE, Cartotto R, et al. Updating the burn center referral criteria: Results from the 2018 eDelphi consensus study. J Burn Care Res [Internet]. 2020;41(5):1052–62. Disponible en: http://dx.doi.org/10.1093/jbcr/iraa038
13. Kagan R, Peck M, Ahrenholz D, Hickerson W, Holmes J 4th, Al E. Surgical management of the burn wound and use of skin substitutes: an expert panel white paper. J Burn Care Res. 2013;34(2):e60–79.
14. Rae L, Fidler P, Gibran N. The Physiologic Basis of Burn Shock and the Need for Aggressive Fluid Resuscitation. Crit Care Clin. 2016;32(4):491–505.
15. Ramírez, C. E., Ramírez B., C. E., González, L. F., Ramírez, N., & Vélez, K. (2010). Fisiopatología del paciente quemado. Revista de la Universidad Industrial de Santander Salud, 42(1), 55–65. http://www.scielo.org.co/scielo.php?script=sci_arttext&pid=S0121-08072010000100007
16. Gacto-Sanchez, P. (2017). Surgical treatment and management of the severely burn patient: Review and update. Medicina Intensiva, 41(6), 356–364. https://doi.org/10.1016/j.medin.2017.02.008
17. Sheridan, R. L., & Chang, P. (2014). Acute burn procedures. The Surgical Clinics of North America, 94(4), 755–764. https://doi.org/10.1016/j.suc.2014.05.014
18. Sánchez Correa, F., Menchaca, P., & Rostion, C. G. (2014). Manejo inicial del niño quemado: lo que el médico general debe saber. Rev. pediatr. electrón.




PARA EL MÉDICO GENERAL
ENFOQUE DEL PACIENTE CON

ENFOQUEDEL PACIENTE CON HEMATURIAPARA EL MÉDICO GENERAL
Ioka de la Peña Lozano1 , Juan Luis Jaramillo Valencia2 , María Lucía Uribe Quintero3
1.Médica general Universidad Pontificia Bolivariana, Médica general de urgencias Hospital Pablo Tobón Uribe.
2.Médico Universidad Pontificia Bolivariana, Urólogo Universidad CES, Coordinador de urología pregrado UPB, Docente postgrado urología Universidad CES.
3. Médica general Universidad CES, Médica general de urgencias Hospital Pablo Tobón Uribe
Resumen
Hematuria se refiere a la presencia de sangre en la orina, dentro de las causas más frecuentes se presentan infección de las vías urinarias, inflamación de la vejiga, cálculos, anormalidades anatómicas y en pacientes mayores, neoplasia del tracto urinario o hiperplasia prostática, siendo las neoplasias de las causas más frecuentes de la hematuria. El riesgo de malignidad urológica se incrementa en los hombres mayores de 35 años, con antecedentes de tabaquismo y exposición medioambiental. El diagnóstico requiere intervenciones de laboratorio al igual que imagenológicas, siendo la cistoscopia y la urotomografía las mejores herramientas para el diagnóstico cuando la sospecha es de causa urológica. En esta revisión realizamos un abordaje completo de lo que se requiere saber para el manejo y enfoque diagnóstico de las hematurias en urgencias.
Palabras Clave
Hematuria Macroscópica, Hematuria Microscópica, Diagnóstico, Factores de riesgo
Definición
Hematuria se refiere a la presencia de sangre en la orina, con una prevalencia del 2.1-31.4% en la población.


Las causas varían según la edad y el sexo, entre las más comunes se presentan infección de las vías urinarias, inflamación de la vejiga, cálculos, anormalidades anatómicas y en mayores, neoplasia del tracto urinario o hiperplasia prostática3 .
Las pruebas de tira reactiva detectan la actividad de la peroxidasa de hemoglobina usando bencidina, que produce un cambio de color sobre el papel amarillo de la tira, esta reacción puede producirse con otras globinas como la mioglobina, causando una gran cantidad de falsos positivos, por lo cual siempre es necesario un estudio microscópico para confirmar la presencia de hematuria, solo una tira reactiva no hace el diagnóstico de hematuria1 .
Esta condición se clasifica de acuerdo a la visibilidad y tiempo de duración durante la micción. La hematuria macroscópica, se refiere a la sangre presente a simple vista en la orina (orina roja o marrón) y la microscópica es más un signo de laboratorio que un síntoma y se refiere a la presencia de 3 o más eritrocitos por campo de alto poder en la orina observada en el sedimento al microscopio en una muestra de orina recolectada adecuadamente el cual a menudo se encuentra como un hallazgo incidental.
Se clasifica como inicial, terminal o total de acuerdo al momento que se presenta, en general se sospecha una causa uretral si se presenta inicialmente, origen del trígono vesical, el cuello de la vejiga o la próstata si es terminal y cualquier origen si es total2
Debe distinguirse de la pigmenturia o pseudohematuria, que se refiere a la orina hematúrica por causas diferentes a la sangre, como mioglobina, porfiria, alimentos o medicamentos como fenazopiridina al igual que debe diferenciarse del sangrado menstrual o postparto en mujeres.

 Enfoque clínico
Enfoque clínico
Es necesaria una anamnesis y examen físico completo para detectar el origen de la hematuria, ya que este nos permitirá esclarecer correctamente posibles factores de riesgo relacionados, síntomas asociados y acompañantes que pueden orientar de manera más certera el diagnóstico.
Es importante que durante este interrogatorio se incluyan aspectos importantes como: edad, sexo, historia de hematuria macroscópica y estado general. al igual que es importante indagar acerca de:
● Antecedente de trauma o manipulación de las vías urinarias que pueden sugerir trauma reciente de las mismas.
● Síntomas irritativos urinarios o piuria pueden ocurrir en infección urinaria pero también pueden ser sugestivas de una neoplasia maligna en vejiga.
● Síntomas obstructivos urinarios como vacilación o goteo pueden indicar hiperplasia prostática benigna.
● Dolor en fosa renal o flanco unilateral irradiado a región lumbar puede indicar un cálculo en la vía urinaria.
● Procedimientos quirúrgicos recientes en la vía urinaria
● Medicamentos que el paciente esté tomando especialmente anticoagulantes.
● Actividades extenuantes o ejercicio vigoroso reciente.
● Infección de las vías respiratorias recientes puede estar relacionado con glomerulonefritis postinfecciosa, enfermedad antimembrana basal o nefritis hereditaria.
A lo cual se suma la importancia de reconocer ciertos factores que deben llevar a sospechas de posible origen maligno, como lo son1:


Tabla 1. Factores asociados a posible origen maligno
Género masculino
Edad mayor de 35 años
Historial de tabaquismo pasado o actual
Exposición ocupacional o de otro tipo a sustancias químicas o colorantes (bencenos o aminas aromáticas)
Abuso de analgésicos
Historia de hematuria macroscópica
Historia de trastorno o enfermedad urológica.
Historia de síntomas miccionales irritativos.
Historia dela irradiación pélvica.
Historia de infección crónica del tracto urinario
Exposición a agentes cancerígenos conocidos o quimioterapia como como agentes alquilantes
Historia de cuerpo extraño permanente crónico
Nota: Tomadode2 .
Al ser una patología con mucha frecuencia encontrada en los servicios de atención, existen más de 100 causas de la hematuria y se pueden clasificar según el lugar de proveniencia del sangrado. Para efectos prácticos se pueden dividir en: renales, de vías urinarias, hematológicas o de origen a esclarecer. En esta revisión daremos prioridad al enfoque de las hematurias provenientes de la vías urinarias ya que los sangrados provenientes de forma extra renal corresponden a más del 60% de las causas de hematuria ,y de éstas más del 5% corresponden a la presencia subyacente de malignidad sea esta vesical o prostática6


Tabla 2. Origen y causas de hematuria.
Origen
Renal
Ureteral
Vesical
Prostática y uretral
Renal, sistema
colector superior e inferior
Falsa hematuria
Causas
Masas renales malignas: carcinoma de células renales, carcinoma de células transicionales
Sangrados glomerulares: enfermedad de alport , nefropatía por IgA ,Fabry, LES, vasculitis
Necrosis papilar por enfermedad de células falciformes
Enfermedad estructural: enfermedad poliquística renal, espongiosis de la médula, Hidronefrosis
Alteraciones hidroelectrolíticas: hipercalciuria. Hiperuricosuria
Trombosis de vena renal o embolismos de la arteria, infarto renal, síndrome cascanueces
Masas renales benignas: absceso, angiomiolipoma, oncocitoma
Malformaciones arteriovenosas
Infección urinaria alta tipo pielonefritis
· Urolitiasis
Condiciones postquirúrgicas
Malignidad
· Pólipo fibroepitelial
· Carcinoma de células escamosas, carcinoma de células transicionales
Cistitis
Radiación
· Litiasis vesical
Hematuria ex vacuo
Cáncer de próstata
· Hiperplasia prostática benigna
Divertículo uretral
Procedimientos prostáticos
· Paso de sonda vesical traumática
· Infecciones: tuberculosis, Schistosomiasis, virales o bacterianas
Urolitiasis
Trauma
Instrumentación de vía urinaria
· Inducida por ejercicio
· Pigmenturia
Medicamentos
Menstruación
Hemospermia
Masturbación
Alimentos
Nota: Elaboración propia basada en 8-10


Diagnóstico
El diagnóstico de la hematuria y su origen para posterior definición del tratamiento requiere de la combinación de una anamnesis con la recopilación de la mayor cantidad de información del paciente: edad sexo, factores de riesgo, viajes recientes, exposiciones químicas, fármacos, historia familiar , desencadenantes etc.
Posteriormente se requiere un diagnóstico de laboratorio que como parte crucial para la aproximación diagnóstica certera en un paciente con hematuria debe basarse en una adecuada recolección del espécimen de la orina, siendo este uno de los pasos que mayor cantidad de falsos positivos afloran en el enfoque del paciente con hematuria. Es importante tener en cuenta ciertos pasos que ocurren en el laboratorio que podrían ayudar a evaluar y detectar con mayor facilidad las causas de la hematuria.
La realización de citoquímico de orina que en los pasos tiene la centrifugación de la orina en la cual se evalúa la presencia de sobrenadante posteriormente se procede a la realización de evaluación de este a través de una cintilla urinaria lo que genera una reacción positiva con el grupo HEME dando positivo para el posible diagnóstico de hematuria. Como previamente se mencionó existen unos valores específicos para la definición de microhematuria gracias a la valoración de la orina bajo el microscopio (3 o más GR CAP)** y la hematuria macroscópica se evalúa sin el requerimiento de este paso bioquímico; la evaluación del sedimento urinario también nos orienta a la forma de los glóbulos rojos (crenados, con formas anómalas, presencia de cristales o de agrupaciones eritrocitarias).
Posteriormente se dispone de las valoraciones imagenológicas que se deben realizar siempre teniendo en cuenta las posibles causas de la hematuria que se tiene en mente, teniendo en cuenta que la mayoría de las imágenes no se utilizan para los seguimientos de hematuria glomerular.


Cuando se confirma la presencia de microhematuria, se debe realizar una historia clínica y examen físico enfocado en los factores de riesgo de malignidad previamente mencionados, en un paciente sin factores de riesgo se debe confirmar este hallazgo con un nuevo uroanálisis en 6 semanas, al confirmar la presencia de glóbulos rojos en la orina se debe realizar estudios imagenológicos, si es un paciente de bajo riesgo con ecografía de vías urinarias y si se trata de un paciente con factores de riesgo para malignidad con tomografía y cistoscopia con posterior remisión a urología3
● Urografía tomográfica (CTU): pacientes con función renal adecuada, con hematuria sin explicación clara a pesar de otras imágenes y con alto riesgo de malignidad. En donde la fase de excreción del medio de contraste es la que más información brinda al observar defectos de llenado en la vía urinaria.
● Pielografía intravenosa: imagen de elección para la clasificación de lesiones en el urotelio
● Pielografía retrógrada: requiere la realización bajo anestesia y en salas quirúrgicas.
● Urotac: menores de 35 años, sin factores de riesgo de malignidad, sospechosos de urolitiasis.
● Ecografía de vías urinarias. Imagen de elección para las mujeres en embarazo o en quienes tienen factores de bajo riesgo de malignidad o no se cuente con disponibilidad para la Urotomografía.
● Urografía por RMN (MRU): normalmente se utiliza para aquellos pacientes con gran disminución de la función renal o alergias graves a contraste.
● Cistoscopia: es el examen de elección para la evaluación y estudio imagenológico de la mayoría de las hematurias que lo requieren. Esta debe ser realizada en todos los adultos que cumplen los criterios para hematuria en cuya evaluación son mayores de 35 años o cuentan con factores de riesgo para malignidad3


Para el enfoque práctico de este capítulo se decidió la realización de una lista de chequeo que facilitara la toma de decisiones en el caso de un paciente que se presenta al servicio de urgencias con hematuria.
Paso 1: Asegurarse de una toma correcta del espécimen de orina para la disminución de confusores durante el diagnóstico.
Paso 2: Solicitud de citoquímico de orina, gram de orina y lectura del sedimento urinario.
Paso 3: Al asegurarse de la presencia de 3 o más glóbulos rojos en el campo evaluado de la orina.
Paso 4: Garantizar que no existan posibles falsos positivos como: hemólisis intravascular o rabdomiólisis, al igual que la presencia de semen en la orina puede generar resultados falsamente positivos
Paso 5: Contexto de presentación de la hematuria.
● Asociada a dolor agudo en flanco con distribución usual: sospecha de posible urolitiasis, para el diagnóstico realización de Urotac simple o ecografía de vías urinarias.
● Presencia de síntomas urinarios irritativos: realización de gram de orina, urocultivo y definir la presencia de nitritos para el inicio posible de tratamiento antibiótico.
● Infecciones respiratorias recientes: nefropatía por IgA, glomerulonefritis postinfecciosa, vasculitis, enfermedad anti membrana basal glomerular.
● Historia familiar: enfermedad poliquística renal y anemia de células falciformes.
● Síntomas de vías urinarias bajas (LUTS): vacilación, chorro débil relacionado con hiperplasias prostáticas
● Historia reciente de ejercicio extenuante o trauma de vías urinarias.
● Uso de fármacos anticoagulantes o fármacos posiblemente inductores de nefritis.


● Viajes o residencia en áreas endémicas de Schistosoma haematobium o M.tuberculosis
● Asintomática: definir la presencia de signos clínicos relacionados con hematurias
Posterior a esto definir la necesidad de remisión a nefrología en caso de que presente sangrado de características glomerulares y si no se relaciona con estas causas remisión al urólogo para la realización de urografía o cistoscopia.
Paso 6: definir especialidad tratante del paciente posterior a estas evaluaciones definir si remisión a urología o nefrología para el seguimiento de la hematuria.
Paso 7: Tras la identificación de estas causas definir otras paraclínicos a realizar:
● Imagenológicos: urotomografía, cistoscopia, UROTAC, ecografía de vías urinarias
● ¿Marcadores moleculares? Son estrategias que en algunos casos se han intentado utilizar como parte del análisis de los pacientes con episodios de hematuria sin causa clara, pero que aún no hay fiabilidad de los mismos ni su distribución o estudios está lo suficientemente distribuida como para la realización de estos de rutina ni para su implementación en la práctica diaria.
Manejo de hematuria en el servicio de urgencias:
La hematuria macroscópica aguda es un una consulta frecuente en el servicio de urgencias, en general no representa una verdadera emergencia excepto si causa anemia significativa o cuando existan coágulos que obstruyan el uréter o el flujo de salida de la vejiga, por lo cual se recomienda el siguiente abordaje:
1. Confirmar hematuria: mediante un citoquímico de orina con sedimento para excluir otros diagnósticos.
2. Analizar si hay anemia o shock: en este caso definir la causa y tratarla.


3. Evaluar si el paciente presenta obstrucción del flujo de salida de la vejiga: la hematuria macroscópica con presencia de coágulos, puede causar retención aguda de orina, el cual requiere un manejo rápido con una sonda urinaria de 3 vías de calibre 20 Fr o más para evitar obstrucción de la misma y realizar irrigación vesical manual infundiendo 60ml de solución salina o agua esteril y retirando la misma cantidad de líquido, repitiendo el proceso hasta obtener orina clara. En el caso de persistencia de coágulos a pesar de irrigación vesical se recomiendo consultar a un urólogo11
Conclusión
La hematuria es un motivo de consulta común en el paciente adulto, se refiere a la presencia de sangre en la orina y puede ser causado por múltiples etiologías. Para el médico general es indispensable la realización de una adecuada anamnesis y examen físico para enfocar la posible causa, evaluar los factores de riesgo de malignidad y definir qué pacientes deben ser remitidos para evaluación por urología o nefrología. En caso de una retención aguda de orina en contexto de hematuria macroscópica se debe realizar manejo con sonda urinaria en el servicio de urgencias.


1. Ingelfinger, J.R. (2021) Hematuria in adults, Nejm. Available at: https://www.nejm.org/doi/full/10.1056/NEJMra1604481
2. Boorjian, S.A., Raman, J.D. and Barocas, D.A. ‘Evaluation and Management of Hematuria’, in Basics of Urologic Surgery
3. Rodney Davis, Jones, J.S. and Barocas, D.A. (2012) Diagnosis, Evaluation and Follow-Up of AsymptomaticMicrohematuria (AMH) in Adults: AUA Guideline, www.jurology.com. Available at: https://www.auajournals.org/doi/epdf/10.1016/j.juro.2012.09.078.
4. Del Río Mayor, C. and Sánchez Martín, E. (2022) Una hematuria en atención primaria, Med Integral Available at: https://www.elsevier.es/es-revista-medicina-integral-63-articulo-una-hematuria-atencionprimaria-13038576#:~:text=La%20hematuria%20se%20define%20como,puede%20deb er%20a%20otras%20causas.
5. O'Connor OJ, McSweeney SE, Maher MM. Imaging of hematuria. Radiol Clin North Am 2008; 46:113.
6. Jimbo M. Evaluation and management of hematuria. Prim Care. 2010 Sep;37(3):461-72, vii. doi: 10.1016/j.pop.2010.04.006. Epub 2010 Jun 20. PMID: 20705193.
7. Ahmed Z, Lee J. Asymptomatic urinary abnormalities. Med Clin North Am 1997;81:641–52.
8. Mariani AJ, Mariani MC, Macchioni C, Stams UK, Hariharan A, Moriera A. The significance of adult hematuria: 1,000 hematuria evaluations including a risk-benefit and cost-effectiveness analysis. J Urol. 1989 Feb;141(2):350-5. doi: 10.1016/s0022-5347(17)40763-4. PMID: 2492350.
9. Mohr DN, Offord KP, Owen RA, Melton LJ 3rd. Asymptomatic microhematuria and urologic disease. A population-based study. JAMA. 1986 Jul 11;256(2):224-9. PMID: 3723707.


10. Mark A Perazella, MD, FACPMichael P O'Leary, MD, MPH. Etiology and evaluation of hematuria in adults Available at: https://www.uptodate.com/contents/etiology-and-evaluation-of-hematuria-in adults?search=hematuria%20en%20adutos&source=search_result&selectedTitle=1%7E 150&usage_type=default&display_rank=1#H7
11. Preminger, G.M. and Eyre, A.J. Management of acute gross hematuria in adults, UpToDate Available at: https://www.uptodate.com/contents/management-of-acute-gross-hematuria-in-adults?se arch=hematuria&source=search_result&selectedTitle=6~150&usage_type=default&displ ay_rank=5 (Accessed: 31 March 2024).









ENFOQUE DEL PACIENTE CON TRAUMA OCULAR
1.Médica general Universidad Pontificia Bolivariana, Médica general de hospitalización Hospital Pablo Tobón Uribe.
2.Médica general Universidad del Norte, Médica general de urgencias Hospital Pablo Tobón Uribe.
3.Médico oftalmólogo Universidad Pontificia Bolivariana, Jefe del servicio de oftalmología Hospital Pablo Tobón Uribe.
Resumen
El trauma ocular es una de las consultas más frecuentes en el servicio de urgencias sobre todo en la población masculina y en el ambiente laboral y requiere un enfoque inicial y manejo por el médico general que impactará en el pronóstico del paciente. De acuerdo a la clasificación de BETT (Birmingham eye trauma terminology), el trauma ocular se clasifica en abierto o cerrado, todos los pacientes deben tener un examen oftalmológico completo para clasificar el tipo de lesión y posterior a esto definir cuál es el tratamiento más adecuado.
Palabras clave
Hemorragia del ojo, traumatismos oculares, lesiones oculares penetrantes, dolor ocular.
Introducción
Las lesiones traumáticas del globo ocular son comunes en el departamento de urgencias y son una importante causa de morbilidad en el mundo pues es una de las principales causas de discapacidad sobre todo en el ambiente laboral.
La OMS reporta que aproximadamente ocurren 55 millones de lesiones oculares anualmente en el mundo, resultando en aproximadamente 23 millones de individuos con alteración visual por lo menos en uno de sus ojos. De estas lesiones,
 Laura Nataly Higuita Duque1 , Laura María Velásquez Zora2 , Carlos Alberto Restrepo3
Laura Nataly Higuita Duque1 , Laura María Velásquez Zora2 , Carlos Alberto Restrepo3

aproximadamente el 70% ocurren en hombres y se presentan en su mayoría en el ambiente laboral.
Las lesiones oculares significativas pueden llevar a pérdida visual permanente y es aquí donde radica la importancia del adecuado enfoque por parte del médico general, rápido reconocimiento y manejo temprano por oftalmología de este tipo de traumas.
Este capítulo busca ser una guía de enfoque y manejo inicial para el médico general, quien es el que toma las decisiones al ingreso del paciente y es esto lo que finalmente creará mayor impacto en el pronóstico visual.
Enfoque clínico
Debe incluir todo lo requerido para la clasificación del trauma ocular.
1. Agudeza visual: debe ser evaluada en cada ojo por separado, en todos los pacientes de forma inicial, idealmente con corrección si la requiere.
2. Evaluación externa: evaluar los párpados en búsqueda de equimosis, laceraciones, ptosis traumática, enoftalmos o exoftalmos1 .
3. Movimientos oculares: tener en cuenta los pares craneales y la posibilidad de atrapamiento muscular en fracturas de la órbita.
4. Integridad de la córnea: se evalúa su transparencia y se realiza tinción con fluoresceína para descartar trauma penetrante mediante el fenómeno de Seidel (salida de humor acuoso que barre la tinción).
5. Evaluación pupilar: no solo la reacción pupilar que ayudaría a evaluar la función neurológica, sino también, la posición, la forma, el tamaño. Es útil para identificar si hay trauma penetrante al estar desviada (corectopia) dirigiéndose al lugar de la herida penetrante.
6. Evaluación del segmento anterior: evaluar la presencia de cuerpos extraños, hemorragias, siempre evaluar los fondos de saco realizando eversión de los párpados.
7. Evaluación del segmento posterior: mediante el fondo de ojo.


Una vez terminada la valoración inicial se realiza la clasificación del trauma.
Actualmente se usa la clasificación internacional de Birmingham o clasificación BETT y de acuerdo a esto se define el manejo del paciente2
Figura 1. Clasificación internacional de Birmingham (BETT).
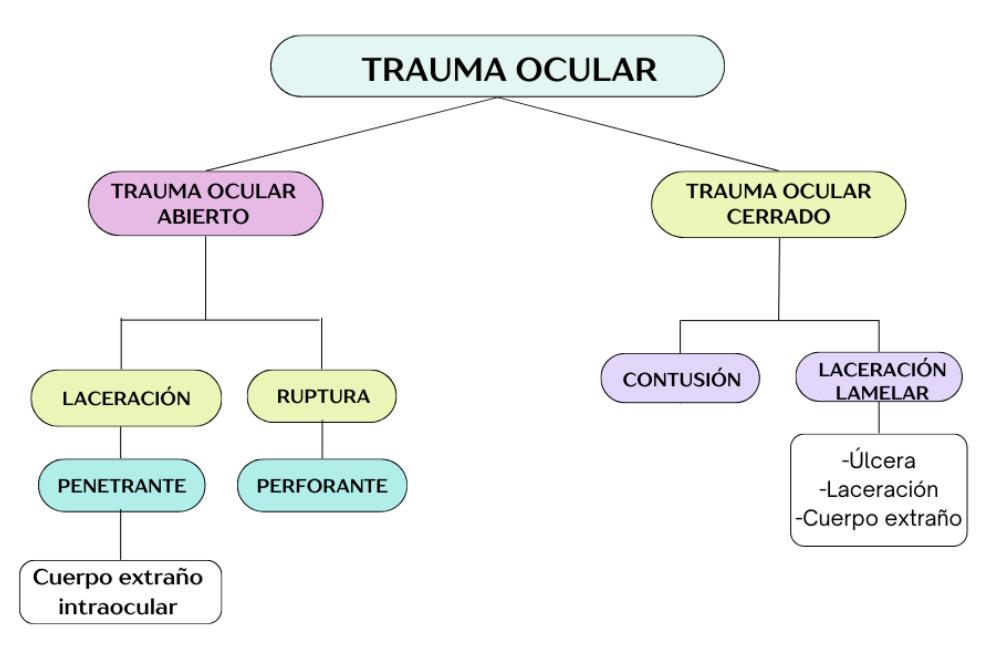
Nota: elaboración propia basado en2
Traumaocular abierto
Es el trauma en que hay una pérdida de la continuidad del globo ocular que puede generar incluso una salida de su contenido. Este tipo de trauma tiene un impacto grande en el pronóstico de los pacientes y requiere intervención urgente, pues, en caso de que no sea manejado de manera oportuna se incrementa el riesgo de infecciones, complicaciones retinales y pérdida de la visión corregible3


En cuanto ala clasificación de BETT, los pacientes pueden tener:
-Ruptura: herida abierta generada por traumas contusos de alta energía que llevan a compresión del ojo, generando aumento de la presión intraocular súbita hasta que una de las paredes cede, generalmente en el área de mayor debilidad (cicatrices quirúrgicas o detrás de la inserción de los músculos extraoculares).
-Laceración: estas son generadas por objetos cortantes, con herida directa en el lugar del impacto. Estas a su vez pueden ser:
● Perforantes: tienen orificio de entrada y de salida que es generado por el mismo objeto. Estas usualmente tienen mal pronóstico porque generan mucho daño a nivel anatómico.
● Penetrantes: son heridas que tienen un orificio de entrada pero no de salida por lo que se pueden asociar a cuerpo extraño intraocular. Asociado al cuerpo extraño intraocular este tipo de heridas tiene mal pronóstico por riesgo de infección o toxicidad química si la composición del material es de hierro o cobre4
Diagnóstico
El diagnóstico es clínico mediante la valoración de los puntos mencionados anteriormente. Es de suma importancia tener en cuenta el Test de Seidel para identificar un trauma ocular abierto en caso de que no sea clínicamente evidente. Los signos que deben hacer sospechar un trauma abierto son: prolapso de tejidos intraoculares, deformidad evidente, corectopia hacia la herida (la pupila mira la herida), elementos de la cámara posterior en la cámara anterior y disminución de la presión intraocular5 .


Tratamiento
En este tipo de trauma se deben evitar todas las maniobras que aumenten la presión ocular ( como toma de presión ocular, manipulación ocular, ecografía) para no facilitar salida de contenido ocular. También debe evitarse aplicar sustancias que puedan ingresar al ojo y facilitar la toxicidad ocular.
Todos los pacientes deben ser remitidos al oftalmólogo para que haga el manejo definitivo, sin embargo, las medidas iniciales son trabajo del médico general.
Se recomienda:
● Adecuada analgesia y antiemético en caso de ser necesario.
● Profilaxis antitetánica: dependiendo del antecedente de inmunización del paciente.
● Profilaxis antibiótica: para evitar complicaciones infecciosas; idealmente se administra antibiótico intravenoso y de amplio espectro, el más utilizado es la ciprofloxacina por su buena penetración en el vítreo.
● No se deben administrar colirios o ungüentos oftálmicos en el trauma abierto, pues pueden generar toxicidad al tener contacto con el interior del ojo.
● Oclusión con material rígido si se tiene disponible o realizar uno con el material disponible. No debe realizar ningún tipo de compresión al ojo6
Posterior a estas medidas iniciales se remite al paciente al especialista.
Trauma cerrado
Hablamos de traumatismo cerrado cuando hay ausencia de lesiones que comprometan el espesor total de la pared ocular, por lo que no existe comunicación directa entre el medio externo y las estructuras intraoculares. Según la clasificación BETT (Birmingham eye trauma terminology), propuesta con el fin de unificar la terminología usada para describir los tipos de trauma ocular, el cerrado se divide en laceración lamelar y contusión7 .


● Laceración lamelar: Herida que afecta parcialmente el grosor de la pared ocular. A esta categoría pertenecen las laceraciones conjuntivales y las abrasiones corneales.
1. Laceración conjuntival: La conjuntiva es la capa traslúcida que cubre la superficie interna del párpado y la superficie escleral. La laceración conjuntival corresponde a una herida que daña su espesor por completo, pueden ser pequeñas y superficiales (< 1 cm) las cuales no requieren ser suturadas y suelen resolverse espontáneamente. Se recomienda el uso de colirios antibióticos (tobramicina 0.3% 1 gota cada 3-4 horas) y lubricantes oculares8 .
2. Abrasión corneal: La córnea es un tejido transparente y avascular que da la mayor parte de poder refractivo del ojo. Está inervada por la rama oftálmica del trigémino y es uno de los tejidos más sensibles del cuerpo debido a la gran densidad de terminaciones nerviosas que presenta.
Está compuesta por 5 capas, la más externa es el epitelio; cuando ésta se ve afectada, se produce una abrasión corneal. Esto puede ocurrir con agresiones simples como frotarse los ojos con los dedos, uñas, contacto accidental con brochas de maquillaje, herramientas, ramas, hojas, entre otros. También pueden ser consecuencia de extracción o desprendimiento espontáneo de cuerpos extraños previamente alojados en la superficie corneal, como trozos de metal, madera, vidrio o material vegetal.
Los pacientes suelen cursar con dolor, lagrimeo, fotofobia y blefaroespasmo. Si hay compromiso del eje visual, incluso pueden presentar disminución de la agudeza visual. El diagnóstico se realiza con el examen con luz azul cobalto en conjunto con tinción con fluoresceína, esto permitirá la identificación de la lesión al observar la tinción fluorescente en la zona ulcerada.


El tratamiento está basado en lograr el cierre de la úlcera y prevenir que se infecte, con lubricantes oculares y antibióticos tópicos. La oclusión ocular está indicada para mejoría de la sintomatología en los casos en que la abrasión supere el 20-30% de la superficie de la córnea.
Se debe considerar remisión a Oftalmología cuando hay presencia de opacidades corneales, hipopion, defectos epiteliales grandes, o ausencia de mejoría en 3-4 días, también si hay cuerpos extraños que no se puedan retirar o disminución de agudeza visual de más de 2 líneas en la carta de Snellen9 .
● Contusión ocular: Trauma secundario a impacto con objeto contundente que no compromete las paredes oculares, pero que por su energía puede generar lesiones internas en el ojo.
1. Hifema: Presencia de sangre en la cámara anterior, en la mayoría de los casos es secundario a trauma, por ruptura de los vasos del iris o su raíz.
Se clasifica según el porcentaje que ocupa en la cámara anterior y entre mayor volumen ocupe, mayor será el riesgo de aumento de la PIO (presión intraocular) y por consiguiente daño del nervio óptico.
Es importante descartar las lesiones corneales asociadas. Por lo general, el tratamiento es médico, con reposo relativo para que la sangre se precipite hacia la región inferior por gravedad, esteroides tópicos para manejar la inflamación (como prednisolona oftálmica 1% 1 gota cada 4 horas) y midriáticos para evitar que se formen sinequias (por ejemplo tropicamida oftálmica 1 gota cada 6 horas).
El manejo quirúrgico está indicado en hifema total, PIO no controlada y en caso de resangrados10 . Todoslos pacientes requieren remisión a Oftalmología.


1.Uveítis traumática: Es una inflamación de la capa vascular del ojo, compuesta por el iris, el cuerpo ciliar y la coroides, luego de contusión del globo ocular. Los síntomas son:
● Dolor ocular.
● Fotofobia.
● Visiónborrosa.
En el examen visual con oftalmoscopia directa podemos evidenciar inyección conjuntival, miosis y en la lámpara de hendidura se puede evidenciar la presencia de células y efecto flare (turbidez del humor acuoso). El manejo es sintomático, con ciclopléjicos inicialmente durante 7 a 10 días.
Ante ausencia de mejoría, es posible usar acetato de prednisolona para disminuir la inflamación8 , teniendo presente que se debe tener precaución con el uso de esteroides en caso de defecto del epitelio corneal.
1. Catarata traumática: Se da por alteración de las proteínas cruzadas del cristalino debido al trauma, incluso puede estar asociada a subluxación del cristalino por alteración de las fibras zonulares10. El paciente puede manifestar alteración de la agudeza visual. Puede ser difícil de identificar en ausencia de dilatación pupilar, en una habitación oscura o con dilatación; se observará una coloración blanca o marrón del cristalino que impedirá la visualización del fondo de ojo.
Siempre requiere valoración por Oftalmología.
2. Hemorragia vítrea: Es consecuencia de la ruptura de un vaso sanguíneo de la retina con posterior penetración de material hemático a la cavidad vítrea que es avascular. El paciente puede referir:
● Miodesopsias
● Disminución de la agudeza visual.


Con el oftalmoscopio directo es posible encontrar ausencia o disminución del reflejo rojo, sin embargo el examen puede ser normal en un ojo que no esté dilatado. Es necesaria la derivación a Oftalmología pues puede haber desprendimiento de retina concomitante, que se detecta a través de ecografía ocular8
Si no hay desprendimiento, el tratamiento es conservador, con reposo relativo y dormir con la cabecera de la cama elevada para lograr la absorción del sangrado.
3. Desprendimiento de retina: La retina es una capa de fotorreceptores que convierten las imágenes en información interpretable para el cerebro. Cuando hay un desprendimiento se separa la retina neurosensorial del epitelio pigmentario y de la coroides, de donde recibe su nutrición.
El paciente puede presentar:
● Miodesopsias y fotopsias
● Pérdida visual
● Escotomas.
Requieren valoración y tratamiento prioritario por Oftalmología.
El pronóstico dependerá del área de afectación y si hay compromiso de la mácula o la retina central10 .
Conclusiones
● El trauma ocular es una causa frecuente de consulta al servicio de urgencias, se presenta principalmente en el ámbito laboral por falta de uso de elementos de protección personal.
● El papel del médico general es vital, pues el pronóstico visual del paciente depende del enfoque inicial.


● Los pacientes con trauma ocular requieren una valoración inicial completa que permita realizar la clasificación BETT y de esta manera definir el manejo inicial.
● En el trauma ocular abierto se deben evitar todo tipo de maniobras que aumenten la presión intraocular.
● En el contexto del trauma ocular no se debe olvidar administrar antibióticos profilácticos que deben ser intravenosos en caso de que se trate de trauma abierto.
● No olvidar la importancia de la analgesia.
● Idealmente todos los pacientes deben ser valorados por oftalmología.


1. Ko AC, Satterfield KR, Korn BS, Kikkawa DO. Eyelid and Periorbital Soft Tissue Trauma. Facial Plast Surg Clin North Am [Internet]. el 1 de noviembre de 2017 [citado el 30 de marzo de 2024];25(4):605–16. Disponible en: https://pubmed.ncbi.nlm.nih.gov/28941512/
2. Kuhn F, Morris R, Witherspoon CD, Heimann K, Jeffers JB, Treister G. A standardized classification of ocular trauma. Ophthalmology [Internet]. el 1 de febrero de 1996 [citado el 30 de marzo de 2024];103(2):240–3. Disponible en: http://www.aaojournal.org/article/S0161642096307100/fulltext
3. Traumatismos oculares. Golpes, contusiones y perforaciones en el ojo. [Internet]. [citado el 27 de marzo de 2024]. Disponible en: https://icrcat.com/enfermedades-oculares/traumatismos-oculares/
4. Velasquez LF. Capítulo trauma ocular II Simposio Residentes de Oftalmología UPB. En: Simposio residentes de oftalmologia. 2019. p. 1–24.
5. Romaniuk VM. Ocular Trauma and Other Catastrophes. Emerg Med Clin North Am. el 1 de mayo de 2013;31(2):399–411
6. Alberto Llerena Rodríguez J, Roberto Alejandro Guerra García I, Dra Diley Pérez García I, Raúl Rúa Martínez I Hospital Militar Central II, Díaz Soto L, Habana L. Manejo del traumatismo ocular a globo abierto. Revista Cubana de Oftalmología [Internet]. 2012 [citado el 27 de marzo de 2024];25(2):536–44. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0864-21762012000400006&lng= es&nrm=iso&tlng=es
7. Kuhn F, Morris R, Witherspoon CD, Mester V. The Birmingham Eye Trauma Terminology system (BETT). J Fr Ophtalmol [Internet]. 2004 [citado el 30 de marzo de 2024];27(2):206–10. Disponible en: https://pubmed.ncbi.nlm.nih.gov/15029055/
8. Bord SP, Linden J. Trauma to the Globe and Orbit. Emerg Med Clin North Am. el 1 de febrero de 2008;26(1):97–123.


9. WIPPERMAN JL, DORSCH JN. Evaluation and Management of Corneal Abrasions. Am Fam Physician [Internet]. el 15 de enero de 2013 [citado el 30 de marzo de 2024];87(2):114–20. Disponible en: https://www.aafp.org/pubs/afp/issues/2013/0115/p114.html
10. Micieli JA, Easterbrook M. Eye and Orbital Injuries in Sports. Clin Sports Med [Internet]. el 1 de abril de 2017 [citado el 30 de marzo de 11. 2024];ji36(2):299–314. Disponible en: http://www.sportsmed.theclinics.com/article/S0278591916301144/fulltext









1.Médico general Universidad Tecnológica de Pereira, Médico general de hospitalización Hospital Pablo Tobón Uribe.
2.Médico neurólogo. Hospital Pablo Tobón Uribe.
Uno de los escenarios clínicos retadores para los médicos es el deterioro neurológico agudo dada la heterogeneidad de etiologías que pueden manifestarse en el contexto urgente de manera similar. Su abordaje sistemático guiado por una historia clínica permite realizar un adecuado ejercicio de razonamiento clínico juicioso. La alteración del estado de conciencia, es uno de los componentes complejos de evaluar, pero acompañado de una reevaluación en el tiempo logra diferenciar las posibles causas reversibles y no reversibles que lo acompañan. Algunas herramientas semiológicas que se desarrollan en el presente texto, involucran la capacidad de observación y algunas maniobras simples que el examinador debe de correlacionar, ya que los patrones respiratorios, movimientos oculares y la evaluación de las pupilas, pueden dar rápidamente información acerca de si hay una lesión orgánica establecida o hay un componente sistémico que necesita ser intervenido y/o apoyado por las ayudas diagnósticas pertinentes. Asimismo la focalización neurológica puede estar presente en diferentes condiciones urgentes donde el tiempo, los síntomas y signos que lo acompañan ayudan a guiar los diagnósticos diferenciales. El objetivo del presente artículo es establecer un abordaje práctico y sistemático que permita al médico tener conceptos clave que pueda aplicar en su práctica clínica en búsqueda de maximizar la posibilidad de preservar la funcionalidad y la recuperación neurológica de los pacientes.
Palabras clave
Neurología, Exploración Física, Trastornos de la Conciencia, Urgencias Médicas.


Introducción
Se ha descrito en estudios observacionales que alrededor del 5% de los pacientes que consultan a un servicio de urgencias tienen alteración del estado de conciencia1, las causas pueden ser primarias que afectan el sistema nervioso o secundarias como las infecciosas, metabólicas, tóxicas, traumáticas y psiquiátricas. La búsqueda activa de ciertos signos o síntomas neurológicos en el paciente que se deteriora agudamente, permite al médico orientar las posibles etiologías e intervenir de manera temprana, de allí la importancia de resaltar aspectos semiológicos que guiarán las siguientes decisiones clínicas en el paciente urgente. En las siguientes páginas se enuncian aspectos claves y prácticos con los cuales el médico puede guiar el enfoque diagnóstico.
Evaluación neurológica
El examen neurológico de urgencia consiste en lograr establecer el tipo de alteración e inferir la posible etiología que lo genera. Dentro de las principales manifestaciones está la alteración del estado de conciencia y alteración focal, la cual se define como un déficit a nivel del cerebro, la médula espinal y/o los nervios periféricos donde puede haber cambios en la fuerza muscular, sensibilidad, tono muscular, funciones mentales superiores o la coordinación motora que guíen al clínico al diagnóstico apropiado.
El dinamismo de la situación clínica durante el evento de la emergencia conlleva a la necesidad de una evaluación seriada, para detectar el posible deterioro o mejoría con las conductas realizadas. Morris y Marshal propusieron unos criterios en el contexto del trauma craneoencefálico que pueden ser útiles: caída espontánea de dos o más puntos en la escala de Glasgow, disminución de la reactividad pupilar, desarrollo de anisocoria, deterioro del estado neurológico suficiente para requerir intervención médico o quirúrgica, otras descritas son el deterioro de la presión intracraneana, nuevos hallazgos tomográficos, cambio en la presión sistólica y deterioro sistémico2 .


El abordaje sistemático del paciente con deterioro neurológico agudo permite tener un orden con el cual lograr estabilizar el paciente, mientras se van evaluando las situaciones que amenazan la vida (Tabla 1)
Tabla 1. Abordaje esquemático propuesto del deterioro neurológico agudo.
Primer
Realizar unarevisión primaria: ABCDE.
Tomar 2 accesos venosos. Considerarcausasreversibles
- Intubación orotraqueal si la escala de Glasgow es menor de 8 puntos.
- Lograr saturación mayor al 93%.
- Lograrpresión arterial media mayor a 70 mmHg.
- Descartar glicemia menor de 60 mg/dL.
Considerarpatologíassistémicas que amenazan la vida
- Paro cardiorrespiratorio
- Choque.
- Insuficiencia respiratoria
Considerar patologías neurológicas queamenazan la vida, algunas:
- Hipertensión endocraneal
Tercero
- Traumatismo
- Mielitis cervical
- Miopatía
- Miastenia


Valoración neurológica:
- Mecánica respiratoria
- Respuesta pupilar
Cuarto
Quinto
- Respuesta ocular
- Respuesta motora
- Evaluar estado de conciencia
Ayudas diagnósticas y laboratorios Ayudas diagnósticos a solicitar*
- Tomografía decráneosimple
- Punción lumbar
Solicitar otras ayudas diagnósticas:resonancia, electroencefalograma.
Evaluar la necesidad de*:
- Electrolitos
- Azoados
- Hemograma
- Función hepática, renal
- Tamizaje toxicológico
- Gases arteriales
Nota: Elaboración propia. *Según el contexto clínico.
Conciencia
La conciencia se define como el estado pleno de conocimiento de sí mismo y su relación con el medio que lo rodea. Tiene dos aspectos fundamentales, el contenido que se define como la sumatoria de todas las redes neuronales que se involucran en actividades corticales con funciones como la percepción, atención, memoria, función ejecutiva y motivación. Por otra parte, el nivel hace referencia a la sustancia reticular activante ascendente (SRAA) fundamental para mantener el estado de alerta/vigilia, allí se oscila entre un máximo con interacción completa con el ambiente y uno mínimo: el coma. Cuando se afecta el nivel de conciencia pueden estar comprometidos los sistemas de mantenimiento de la alerta en el tronco cerebral y el diencéfalo o un daño cortical difuso3


La conciencia tiene niveles básicos según Plum y Posner3:
Alerta: capacidad para entrar en contacto con su medio externo y consigo mismo, el estado en el cual estamos despiertos.
Somnolencia: persona que tiene menos contacto con su medio, se despierta fácilmente ante estímulos verbales, aunque puede rechazar o ignorar otros.
Estupor: estado de mayor deterioro del estado de conciencia, responde a estímulos más intensos, repetitivos y/o dolorosos, el paciente puede responder con ruidos, palabras o con movimientos.
Coma: es la pérdida total de respuesta a estímulos externos, puede presentar reflejos de liberación medular4 .
Superficial: El paciente no responde ante estímulos verbales, pero sí responde ante estímulos dolorosos con movimientos de:
-Decorticación (corteza cerebral): extensión hipertónica del cuerpo con flexión de los miembros superiores hacia el tórax.
-Descerebración (lesión en el tallo): extensión hipertónica del cuerpo con extensión de las extremidades superiores en pronación forzada y flexión tónica de las muñecas.
Profundo: No hay respuesta ante estímulo verbal o doloroso pero tiene signos vitales.
Una herramienta útil es la escala de coma de Glasgow (GCS) modificada donde se evalúa la apertura ocular (4 items), respuesta verbal (5 ítems) y la respuesta motora (6 items) (enlace: https://www.glasgowcomascale.org/).
En pacientes que estén en coma o con intubación orotraqueal se validó la escala Full Outline of UnResponsiveness FOUR (apertura ocular, respuesta motora, respuesta del tronco cerebral, respuesta respiratoria)5. La respuesta al tronco hace referencia al reflejo corneal, respuesta visual a la amenaza y los movimientos oculares: espontáneo, reflejo oculocefálico (ojos de muñeca) y el vestíbulo ocular, adicionalmente está el reflejo de la tos y el nauseoso.


Una mnemotecnia práctica es el AVDI, A: alerta, V: voz (somnolencia), D: dolor (estupor), I: inconsciencia (coma).
Las etiologías del coma se pueden dar por causas estructurales (compresión mecánica, bloqueo del sustrato, hidrocefalia) y no estructurales (tóxicos, metabólicos)4 . Resaltar también la presencia del delirium, como una de las condiciones que genera “nublamiento” de la conciencia, inatención, desorientación parcial en tiempo y espacio, adormecimiento de día y agitación nocturna, puede alteración de la sensopercepción y alucinaciones. Los criterios de la escala CAM (Confusion assessment method) pueden ser de ayuda consta de 4 criterios que evalúan: Curso agudo y fluctuante del estado mental, la dificultad para prestar atención o inatención, el pensamiento desorganizado o incoherente y la alteración del nivel de conciencia6 .
Patrones respiratorios
Bradipnea: respiración superficial y lenta que indica intoxicación farmacológica, insuficiencia de la musculatura respiratoria o hipotiroidismo.
Cheyne Stokes: Se debe a una hipersensibilidad en el centro del respiratorio ante los cambios de presión de CO2. Se manifiesta posterior a un período de apnea con aumento de ventilaciones rápidas y profundas luego va decayendo hasta una nueva apnea.
Etiología: ancianos, sueño y grandes altitudes. Lesiones corticales difusas, lesiones diencefálicas bilaterales, uremia, anoxia, insuficiencia cardíaca congestiva.
Hiperventilación neurogénica central: Respiración rápida y profunda. Se puede encontrar en lesiones mesencefálicas, cetoacidosis diabética (respiración de Kussmaul), acidosis láctica, hipoxia.
Respiración apnéustica: se presenta en lesión del tegmento lateral del puente, la características es la apnea en espiración.


Respiración atáxica o de Biot: Respiración irregular de período de hiperventilación, apnea, respiración. Indica lesión dorsomedial del bulbo. Algunos autores lo denominan “anarquía” de los movimientos respiratorios7
Párpados y reflejo corneal
El parpadeo espontáneo demuestra que la vía del SRAA ubicado en la protuberancia está indemne. En pacientes en estupor o en coma hay contracción de los músculos orbiculares, su ausencia bilateral demuestra afección del nervio facial, mientras que la resistencia a la apertura ocular con cierre rápido de los ojos suele ser voluntaria o por blefaroespasmo. Además la ptosis palpebral puede señalar lesiones hemisféricas o del tronco cerebral. Por otro lado, la respuesta corneal bilateral positiva dada por el cierre de párpado y desviación del ojo hacia arriba demuestra que no hay lesión en las vías segmentarias del tronco cerebral desde el mesencéfalo hasta la parte inferior de la protuberancia.
Movimientos oculares
Se debe valorar la posición primaria de los ojos, los globos oculares pueden estar en línea media o posición espontánea; tener desviación conjugada vertical en las lesiones que generan presión sobre la región tectal como las masas pineales y las hemorragias talámicas3
Ante la presencia de una desviación lateral puede reflejar una lesión frontal ipsilateral o ubicarse entre la formación reticular y la región frontal. Destaca que si la desviación ocular sostenida mira hacia el lado parético la lesión se localiza en la protuberancia y si mira hacia el lado sano, la lesión sugiere lesión hemisférica. A su vez, la desviación no conjugada/asimétrica puede indicar daño del nervio craneal oculomotor (III par) o el abductor (VI par) a nivel del tronco cerebral. La presencia de desviación no conjugada vertical (skew deviation) se debe a una lesión de la médula oblongada anterolateral, el puente, el sistema vestibular o el vestíbulo-cerebelo3


El robbing o roving ocular es el movimiento lento, horizontal y conjugado que necesita la integridad de los pares craneales III y VI, su presencia indica etiología metabólica o daño cortical bilateral. El bobbing se presenta en lesiones pontinas y se manifiesta como sacudidas oculares hacia abajo rápidas que regresan lentamente a la línea media ocular, también se ha descrito en pacientes con hidrocefalia obstructiva y encefalopatía metabólica3
Movimientos oculocefálicos: Se producen por el giro brusco de la cabeza a derecha e izquierda o bien hacia arriba y abajo. Se inhibe con la mirada fija hacia un punto. Los “ojos de muñeca” están presentes cuando los núcleos oculomotores, oculovestibulares y sus conexiones internucleares están intactas. En el coma de origen metabólico o por lesiones estructurales hemisféricas bilaterales, los ojos se desplazan conjugadamente en dirección opuesta. Se alteran en lesiones del tronco cerebral3 .
Movimientos oculovestibulares: se alteran con lesiones del tronco y se realizan si éstos son anormales, previa verificación de que no exista perforación timpánica. El agua fría genera desviación de los ojos hacia el lado irrigado y se presenta nistagmo8, mientras que el agua caliente genera movimiento de los ojos hacia el oído irrigado, destacar que en lesiones del tallo cerebral se queda con la mirada fija.
Pupilas
La funcionalidad del reflejo pupilar tiene un complejo control entre el sistema simpático y parasimpático con respecto al comportamiento frente a la luz. Este reflejo es resistente ante una noxa metabólica, en cambio una lesión estructural resultará en compromiso de la funcionalidad. Destacar que las pupilas en el paciente en coma estarán hiporeactivas con respecto al paciente despierto3
Las pupilas simétricas, pequeñas y reactivas: tiene origen diencefálico, por un coma metabólico, intoxicación por benzodiacepinas, opioides (“pupilaspuntiformes”) o daño pontino donde se interrumpe las vías descendentes simpáticas.


Las pupilas simétricas fijas y pequeñas: lesión mesencefálica.
Pupilas simétricas, fijas y grandes: lesión mesencefálica tectal por anoxia, atropina, hipotermia y muerte encefálica.
Pupilas puntiformes, fijas: lesión protuberancial.
Pupila pequeña y reactiva: Reflejan el síndrome de Claude Bernard-Horner, que genera parálisis de la primera neurona de la vía simpática que inerva la pupila, acompañado de anhidrosis y ptosis.
Pupila dilatada unilateral y arreactiva (anisocoria): compromiso por herniación uncal del lóbulo temporal comprometiendo el tercer par craneal, otra alternativa es un aneurisma de la arteria comunicante posterior. Un diferencial importante puede ser debido a fármacos ipratropio, tropicamida o una fractura del piso de la órbita3,8,9 .
Otros escenarios a destacar es que durante una crisis epiléptica, una o ambas pupilas tendrán una pobre reacción a la luz. Además el efecto paradójico donde al iluminar una pupila la contralateral se dilata, indica daño en el tracto óptico contralateral y se denomina defecto pupilar aferente.
La ausencia del reflejo fotomotor se encuentra relacionado con la neuritis óptica o la parálisis del tercer par craneal como en el compromiso vascular, traumático o tumoral adyacente al acueducto de Silvio, también se observa midriasis bilateral en intoxicación por cocaína, anfetaminas y anticolinérgicos. La ausencia unilateral del reflejo, es consecuencia de una hernia uncal, aneurisma de la arteria carótida supraclinoidea o de la comunicante posterior. A su vez la pupila de Argyll Robertson se caracteriza por ausencia del reflejo fotomotor pero se conserva el reflejo de acomodación, sin reducción de la agudeza visual o miosis.
Evaluación motora
En el paciente con deterioro neurológico se busca evaluar la respuesta motora general del paciente observando la posición en reposo buscando asimetrías, cambios en el tono


uni o bilateral y movimientos anormales. Destaca la presencia de movimientos involuntarios, que incluyen crisis epilépticas, movimientos mioclónicos de uno varios segmentos debido a trastornos metabólicos (uremia, estado hiperglucémico hiperosmolar) y tóxicos. La asterixis/flapping que puede presentarse en la encefalopatía metabólica o tóxica3 .
Es importante también buscar déficits motores que ayuden a identificar la lesión neurológica topográficamente10 ,(tabla 2). Se debe observa el movimiento espontáneo o al estímulo doloroso (presión supraorbitaria, esternal, base de las uñas con el lapicero), la respuesta apropiada frente al dolor es empujar hacia el estímulo para quitarlo, retiro brusco del miembro estimulado, o movimiento del cuerpo en sentido contrario. La respuesta inapropiada puede ser la ausencia o la rigidez de decorticación o descerebración, definidas previamente.
La característica de la respuesta motora (flexora o extensora) es indicativa del nivel o grado de afectación, el compromiso unilateral puede mostrar lesión de la vía piramidal o si es bilateral la lesión está a nivel del tronco encefálico. Las respuestas motoras ausentes o fláccidas puede señalar denervación o sección medular3 .


Tabla 2. Descripción de algunos déficits neurológicos focales como síntoma principal y la manifestación clínica de algunos diagnósticos diferenciales.
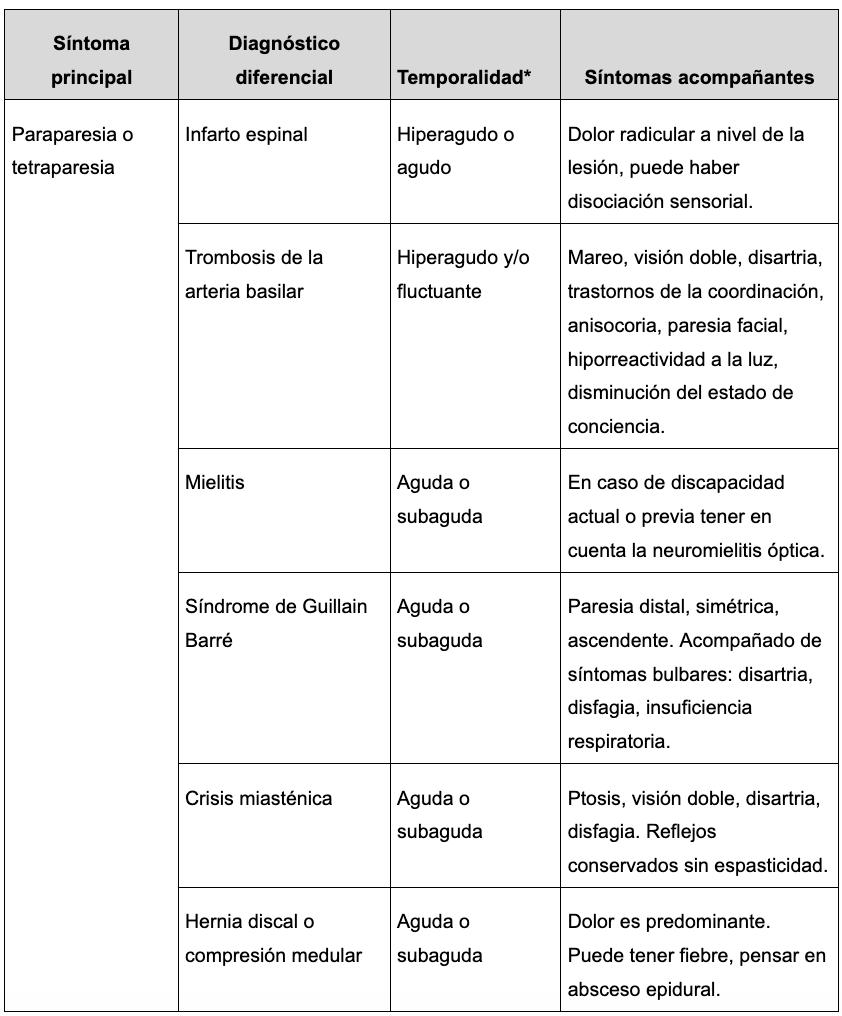


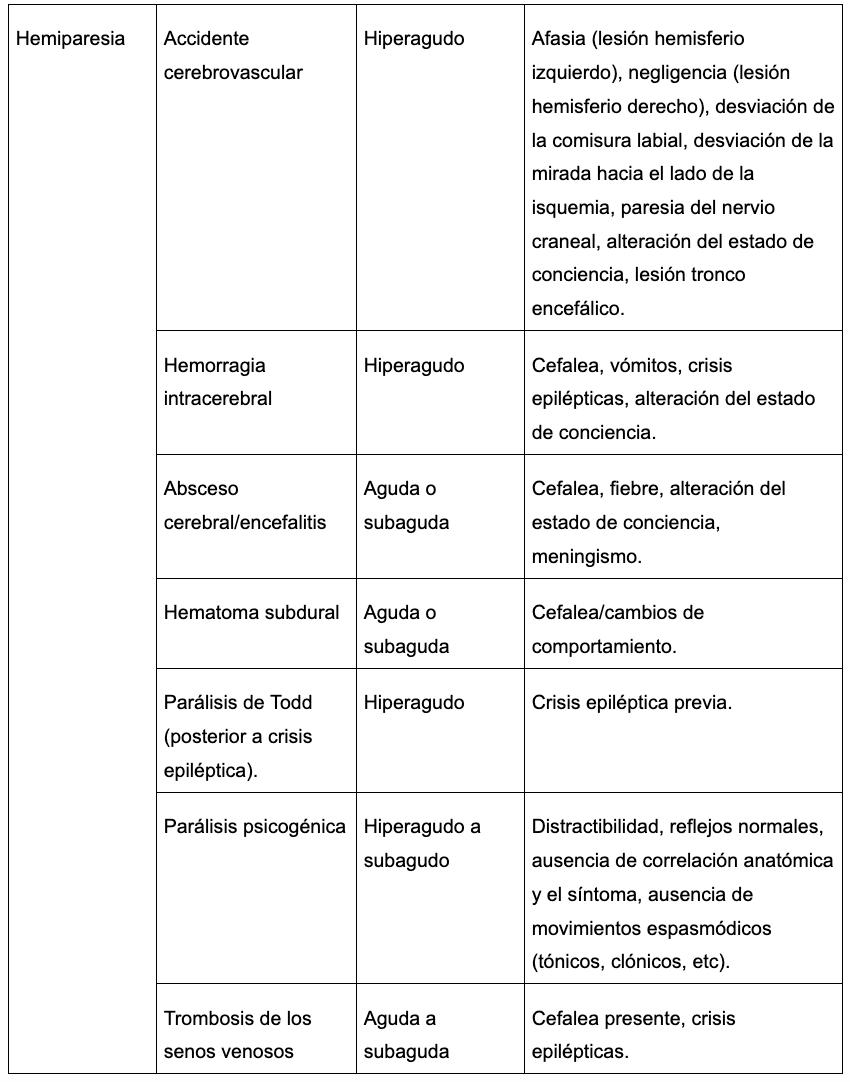



Conclusión
La alteración neurológica aguda es un desafío clínico dinámico, que necesita de un abordaje sistémico y de conceptos claves que permiten identificar de manera temprana factores etiológicos que afectan al sistema nervioso, con el fin de maximizar la posibilidad de preservar las funciones y la recuperación neurológica de los pacientes. El pronóstico es difícil de determinar porque es multifactorial y depende de la enfermedad, del grado de afectación encefálica y del adecuado manejo inicial.


1. Völk S, Koedel U, Pfister HW, Schwankhart R, Op den Winkel M, Mühlbauer K, et al. Impaired Consciousness in the Emergency Department. Eur Neurol. 2018;80(3–4):179–86.
2. Morris GF, Juul N, Marshall SB, Benedict B, Marshall LF. Neurological deterioration as a potential alternative endpoint in human clinical trials of experimental pharmacological agents for treatment of severe traumatic brain injuries. Executive Committee of the International Selfotel Trial. Neurosurgery. 1998 Dec;43(6):1369–72; discussion 1372-1374.
3. Posner JB, Saper CB, Schiff ND, Claassen J. Plum and Posner’s Diagnosis and Treatment of Stupor and Coma. Oxford University Press; 2019. 521 p.
4. Edlow JA, Rabinstein A, Traub SJ, Wijdicks EFM. Diagnosis of reversible causes of coma. Lancet Lond Engl. 2014 Dec 6;384(9959):2064–76.
5. Wijdicks EFM, Bamlet WR, Maramattom BV, Manno EM, McClelland RL. Validation of a new coma scale: The FOUR score. Ann Neurol. 2005 Oct;58(4):585–93.
6. Oh ES, Fong TG, Hshieh TT, Inouye SK. Delirium in Older Persons. JAMA. 2017 Sep 26;318(12):1161–74.
7. Castro P de. Paciente con alteración de conciencia en urgencias. An Sist Sanit Navar. 2008;31:87–97.
8. Brazis PW, Masdeu JC, Biller J. Localization in Clinical Neurology. 8th edition. Lippincott Williams & Wilkins; 2022. 721 p.
9. Le Guennec L, Marois C, Demeret S, Wijdicks EFM, Weiss N. Toxic-metabolic encephalopathy in adults: Critical discussion and pragmatical diagnostic approach. Rev Neurol (Paris). 2022;178(1–2):93–104.
10. Dohmen C, Bösel J. [Acute focal neurological deficits in the emergency room]. Nervenarzt. 2017 Jun;88(6):616–24.









Juan Camilo Londoño Cuervo1 , Angela Beatriz Pérez2
1. Médico general Fundación Universitaria San Martín, Médico general de hospitalización Hospital Pablo Tobón Uribe.
2. Médica Neuróloga-Epileptóloga Hospital Pablo Tobón Uribe.
El primer evento convulsivo es un motivo de consulta común en los servicios de urgencias, que se ve en aumento con la progresión de la edad. El abordaje diagnóstico y terapéutico está enfocado en definir si se está frente a una crisis provocada o no provocada. Las principales causas de una convulsión sintomática aguda son trastornos metabólicos (glucosa, sodio, potasio, calcio, magnesio, nitrógeno ureico) y sus precipitantes sistémicos. También podrían existir crisis sintomáticas agudas en el contexto de una condición neurológica aguda como ECV, meningitis, etc. Estas últimas deben diferenciarse de las crisis sintomáticas remotas.
Las crisis no provocadas deben estar asociadas con la evaluación del riesgo de recurrencia y con esto definir entonces los criterios para iniciar el manejo con medicamentos anticrisis.
Este artículo pretende describir los conceptos generales de la presentación de una crisis, enumerar las causas corregibles y presentar un esbozo del tratamiento dirigido de ellas, incentivar a iniciar manejo anticrisis en los pacientes con indicación de tratamiento a mediano o largo plazo.
Palabras Clave
Convulsión, estatus epiléptico, crisis convulsiva


Epidemiología
Las convulsiones son un motivo de consulta común en el servicio de urgencia, representan alrededor de 1-2% de las consultas, donde aproximadamente el 25% serán el primer episodio convulsivo. Pueden afectar al 8-10% de la población durante el transcurso de la vida, pero solo el 2-3% de la población desarrollará epilepsia. Las convulsiones agudas sintomáticas corresponden al 25-34% de los primeros eventos convulsivos1, más del 40% de estas ocurren en pacientes con lesiones neurológicas agudas, que no tienen diagnóstico de epilepsia2 .
El primer evento ictal tiene una presentación bimodal en lo grupos etarios: el primer pico de incidencia es durante el primer año de vida, decae durante la niñez y en la vida adulta comienza a ascender, logrando el segundo pico en mayores de 80 años2. los mayores de 65 años representan el 31,7% de todos los pacientes y al menos la mitad de estos tenían una convulsión no provocada3. En los pediátricos no hay datos acerca del riesgo que genera la edad para la presentación de un evento ictal, sin embargo, se destaca que la causa principal en los pacientes pediátricos es la idiopática y es más común el diagnósticos de síndrome epilépticos 3 .
La incidencia de una convulsión sintomática aguda en mayores de 60 años es de 0.5-1 por cada 1000 pacientes, la incidencia aumenta linealmente con el paso de la edad.
Para lo cual en mayores de 75 años la incidencia es de 1-3 casos por cada 1000 pacientes, representan dos a seis veces más comparado con el adulto joven. Por otro lado, para los jóvenes la incidencia de convulsión aguda sintomática es de 29-39 por cada 100.000 persona año1 .
La incidencia de una crisis aguda sintomática, es significativamente más baja comparada con la incidencia de una crisis no provocada, la cual tiene una incidencia entre 42-61 casos por 100.000 personas año2. La principal causa de convulsión


sintomática aguda en el adulto mayor es la ECV. Hasta el 33% de los pacientes pueden presentar una convulsión sintomática aguda dentro de sus manifestaciones iniciales y representa el 71.5% de las convulsiones no provocadas.3
Las convulsiones sintomáticas agudas pueden debutar como un estado epiléptico en el 22% de los pacientes con ECV, 15% por alteraciones metabólicas, 13% hipoxia, infecciones sistémicas el 7%, trauma el 3%, neuroinfección 3% y hasta el 25% de pacientes con antecedentes de evento sintomático remoto4. El estado epiléptico es aquella crisis tónico -clónica bilateral que sobrepasa los 5 minutos de duración o crisis focal que supera los 10 minutos5, amerita un abordaje terapéutico y diagnóstico específico que sobrepasa los intereses de este capítulo.
Definiciones
Una crisis se define como la manifestación aguda y repentina de la descarga eléctrica hipersincrónica de redes neuronales en la corteza cerebral2; la crisis puede ser focal si se origina en una zona en específica de la corteza o generalizada si compromete toda su extensión. Puede ser la presentación clínica de un evento neurológico agudo y a nivel práctico, para determinar el enfoque y abordaje diagnóstico de cada paciente se debe diferenciar la convulsión provocada de la no provocada.
Convulsión aguda sintomática, también llamada convulsión provocada o desencadenada, se refiere a aquella manifestación tónico-clónica bilateral o focal en presencia de una causa o enfermedad sistémica que lo pueda desencadenar y que está relacionada en el tiempo cercano. Estas causas sistémicas están dentro del espectro de compromisos metabólicos, degenerativos, abstinencia o consumo agudo de sustancias psicoactivas, trastornos neurológicos agudos, dentro de las cuales se encuentran los eventos cerebrovasculares, tumores cerebrales, encefalitis, encefalopatía o trauma encefálico1,6 .


El tiempo necesario desde que ocurre el daño cerebral y puede aparecer el evento ictal, no está completamente definido y depende de la causa subyacente7. En la ECV, TEC, encefalopatía hipóxica y cirugía intracraneal hasta 7 días, hematoma subdural 7 días, infección aguda del SNC 7 días y la enfermedad metabólica grave durante las primeras 24 horas1
Las convulsiones provocadas pueden recurrirse durante la fase aguda de la enfermedad pero deben desaparecer al resolverse el evento agudo precipitante; tienen un bajo riesgo para desarrollar epilepsia, comparado con las convulsiones no provocadas. Se tiene en cuenta como insulto precipitante inicial los pacientes con antecedentes de: antecedentes de ECV, hemorragia cerebral (34,7%), TEC (34,7%), lesión neurológica preexistente o un trastorno neurológico progresivo y neuroinfección (30,6%)3,7
Los eventos ictales no provocados se definen como crisis en las cuales no se documentó una causa clara subyacente6. Los pacientes con convulsiones agudas sintomáticas tienen 80% menos de probabilidad de experimentar un segundo evento de convulsión no provocada comparado con individuos con una convulsión remota sintomática3
Tanto los eventos no provocados como los remotos sintomáticos tienen un alto riesgo de recurrencia, comparado con el evento agudo sintomático. Es acá donde se debe pensar qué pacientes tienen riesgo de epilepsia. La epilepsia es una condición neurológica frecuente y se define como la predisposición a tener eventos ictales de manera recurrente. Es importante tener en cuenta que en algunos casos, el primer evento ictal puede corresponder a una crisis en el contexto de epilepsia.


La última definición de epilepsia según La Liga Internacional contra la Epilepsia (ILAE por sus siglas en inglés) incluye8:
- Dos convulsiones no provocadas con más de 24 horas de diferencia entre ellas
- Una convulsión no provocada con una probabilidad de futuras convulsiones similares mayor al riesgo general de recurrencia (mayor al 60%) en los próximos 10 años.
- Diagnóstico de un síndrome epiléptico específico.
Los determinantes de riesgo de recurrencia son8:
- Crisis remota sintomática
- Lesiones estructurales en neuroimagen que predisponen a recurrencia de la convulsión (lesión cortical).
- Actividad potencialmente epileptiforme en el electroencefalograma.
- Convulsión nocturna durante el sueño.
Abordaje clínico
El interrogatorio inicial debe estar orientado inicialmente a identificar la semiología del evento paroxístico, documentar si cumple las características de una crisis focal o generalizada o inclinarla hacia los diferentes diagnósticos diferenciales que se expondrán más adelante en el texto.
Posterior a ello, se debe definir si es verdaderamente el primer evento ictal o si antes en el transcurso de la vida ya se habría presentado otra crisis, interrogando por manifestaciones previas como convulsiones durante el sueño, mioclonías, automatismos, auras, movimientos rítmicos, pérdidas inexplicables del tono postural, ruidos respiratorios durante el sueño (grito ictal) o ausencias en los tiempos de vigilia7,9


-Crisis focales sin pérdida de consciencia: previamente llamadas convulsiones parciales simples. La manifestación inicial es dependiente y característica de la zona cerebral afectada, si tiene origen en la corteza occipital: luces, fotopsias, anopsias; Corteza motora: movimientos rítmicos de la mandíbula, rostro, extremidades o un comportamiento Jacksoniano, corteza parietal causan distorsión de la percepción del espacio, lóbulo frontal causa trastornos del discurso/habla6 .
Posterior a la crisis, los pacientes pueden retornar completamente a su estado neurológico basal o experimentar un periodo de función neurológica alterada, que dependerá de la zona donde se origine la convulsión, por ejemplo si el origen es la corteza motora, pueden presentar una parálisis de Todd, también están descritas, debilidad o afasias7
-Crisis focales con pérdida de la consciencia: Tipo de convulsión más común en el adulto, previamente llamadas convulsiones parciales complejas, en donde hay pérdida del estado de consciencia desde el inicio o en el transcurso de la crisis. Pueden tener estado de alerta pero no hay conexión con el medio, sin adecuada respuesta a los estímulos. Según la zona donde se inicie la crisis puede acompañarse de automatismos oroalimentarios y/o manuales, síntomas sensitivos, autonómicos, psíquicos, etc.
Posterior al evento pueden reportar: confusión, cefalea, somnolencia, cambios de comportamiento con irritabilidad o agresividad.
Normalmente duran menos de 3 minutos, se presentan con estado postictal, cefalea, somnolencia, agresividad6. Las crisis focales tienen la capacidad de pueden propagarse y convertirse en crisis tónico clónicas bilaterales (convulsiones generalizadas secundarias), es importante que tanto el paciente como el evaluador identifique el inicio focal de la crisis, para hacer un abordaje diagnóstico más adecuado7 .


-Crisis generalizadas motoras: también llamadas tónico clónicas generalizadas, Gran mal, convulsiones motoras mayores; semiológicamente comienzan con pérdida de la consciencia de manera abrupta, gritos o sonidos involuntarios, rigidez muscular generalizada (fase tónica), versiones cefálicas y oculares (va en contralateral al lóbulo de inicio de la convulsión), cianosis, temblor fino distal (fase clónica), mordedura de la lengua (típicamente la mordedura lateral se ha relacionado con que se trate de un evento ictal) y sialorrea. La fase postictal inicial una vez los movimientos clónicos cesan, caracterizado por un sueño profundo, respiración lenta y profunda y recuperación gradual del estado de consciencia, es común la confusión y la agresividad en esta fase7 .
La mayoría de las convulsiones no provocadas se presentan como crisis focales con pérdida del estado de conciencia, los síntomas focales suelen ser sutiles y cortos lo que los hace poco perceptibles para los evaluadores iniciales6
-Crisis generalizadas no motoras: corresponden a las ausencias, son crisis que se caracterizan por pérdida de contacto con el medio, pocos automatismos orales o palpebrales y eléctricamente se caracterizan por actividad de punta onda lenta generalizada en el electroencefalograma.
Dentro de la semiología de la crisis, con el fin de apoyar si es un evento ictal se debe interrogar acerca del estado postictal, que puede estar presente tanto en las crisis focales como generalizadas, una fase donde han cesado las manifestaciones motoras, se puede encontrar confusión, recuperación de la consciencia de la manera progresiva, focalizaciones neurológicas relacionadas con el sitio de origen de la crisis, estado de hiperactividad, agitación o combatividad secundario a la desorientación, cefalea, parálisis de Todd, afasias, psicosis, tos o rinorrea hialina. Su duración típicamente es


menos de un día, en promedio alrededor de 10-15 minutos, pero se han documentado casos de duración hasta de dos meses en pacientes con deterioro cognitivo de base10
Causas de convulsiones
Convulsiones sintomáticas agudas:
- ECV isquémico, Hemorragia cerebral, principalmente lobar, hematoma subdural, hemorragia subaracnoidea, trombosis de senos durales, TEC, eclampsia, Encefalopatía posterior reversible (PRES), encefalopatía anóxica encefalopatía hepática 1,2 .
- Encefalitis viral, Meningitis bacteriana, Encefalitis autoinmune2
- Trastornos
Metabólicos: Hipoglicemia, Hiperglicemia, Hiponatremia, hipokalemia, Hipocalcemia, Hipomagnesemia, Uremia, Hipertiroidismo, trastornos del metabolismo de las porfirinas1,7
- Abstinencia de sustancias psicoactivas, Alcohol (7-48 horas posterior a última ingesta), Benzodiacepinas y Barbituricos1 .
- Intoxicaciones, envenenamientos, Sobredosis: Cocaína, Anfetaminas, Fenilciclidina1 .
En la tabla 1 se destacan las principales causas secundarias de crisis aguda sintomática y sus hallazgos orientadores al interrogatorio, examen físico y paraclínica1 .
Tabla 1: Manifestaciones de causas secundarias de eventos ictales
Causa sistémica Hallazgos al Interrogatorio
Enfermedad renal aguda o crónica, subdiálisis, sepsis
Hiperkalemia
Hallazgos al examen físico o laboratorios
Arritmias de complejos anchos, T picudas, prolongación de QRS, taquicardia


Alcoholismo crónico
Consumo/abstinencia de sustancias
Consumo diario/copioso de alcohol, cese de consumo entre las últimas 7-72 horas
Hepatomegalia, Ictericia, Ascitis, eritema palmar, ginecomastia
Hipocalcemia
Hipomagnesemia
Dependencia y abuso de sustancias, consumo reciente, cese del consumo en últimas 24 horas7
Somnolencia, midriasis, agitación psicomotora, hipertermia, temblor fino, hiperreflexia. Psicosis. Pruebas toxicológicas séricas o en orina.
Nitrógeno Ureico elevado
Encefalopatía
Hepática
Antecedentes de cirugía reciente de TiroidesyParatiroides, falla renal, Hipoparatiroidismo, Pancreatitis 7
Irritabilidad, agitación, confusión, mioclonías, tetania.
Encefalopatía, alteraciones del estado de consciencia, prurito
Antecedentes de enfermedad renal, Mioclonías7
Ascitis, ictericia, alteración del estado de conciencia progresiva, cirrosis de base, hepatocarcinoma, constipación
Calcio sérico menor de 5.0 mg/dl 1
Magnesio sérico menor de 0.8mg/dl1
BUN mayor de 100 mg/dl1


Enfermedad renal crónica mal compensada o aguda.
Trastornos Hidroelectrolíticos múltiples. Complicaciones durante la diálisis, síndrome de desequilibrio, confusión, cefalea, contracturas musculares, depresión del estado de conciencia7
Eclampsia1
Gestación mayor de 20 semanas, Hipertensión crónica de base, Hipertensión gestacional documentada.
Nota: Elaboración propia basada en1,7
Convulsiones no provocadas
Hipertensión arterial, edemas, dolor abdominal, cefalea, fotopsias, petequias o hemorragias.
Trombocitopenia, LDH elevada, Proteinuria, transaminasas elevadas.
Causas generalmente por trastornos genéticos, estructurales, metabólicos primarios del sistema nervioso central, inmunes, infecciosos o desconocidos. En los niños predominan las causas genéticas, metabólicas o estructurales congénitas. En el adulto se destacan las alteraciones vasculares adquiridas, enfermedades degenerativas y neoplásicas. Cerca del 60% de los pacientes no se documentara causa a pesar de un abordaje diagnóstico completo1 .
Las principales causas de epilepsias focales en adultos incluyen1:
Epilepsia mesial del lóbulo temporal: 80% inicia con episodios convulsivos en la adolescencia pero se diagnostica en la vida adulta.
ECV
Tumores primarios o metastásicos
Malformaciones vasculares
Infección cerebral previa.


TEC
Demencia neurodegenerativa como la Enfermedad de Alzheimer, Parkinson o
Demencia por Cuerpos de Lewy
Diagnóstico diferenciales en los adultos1:
Síncope
Ataque isquémico transitorio
Migraña
Ataque de pánico o ansiedad
Eventos paroxísticos no convulsivos
Amnesia global transitoria (rara en menores de 50 años)
Cataplejía con Narcolepsia
Trastornos del movimiento paroxísticos
Trastornos del sueño
Tabla2. Características semiológicasde los diagnósticosdiferenciales




Nota: Elaboración propia basada en6,10


Se han descrito algunas ayudas diagnósticas relacionadas con los eventos epilépticos, la prolactina sérica se puede ver aumentada posterior a un evento convulsivo tónico-clónica bilateral con alta especificidad y moderada sensibilidad, al igual que la CPK podría ayudar a aumentar la probabilidad postest de un evento convulsivo solo si está elevada, tiene alta especificidad y moderada sensibilidad, otras pruebas que se han relacionado han sido el lactato sérico, el Anión GAP elevado, leucocitosis, cortisol sérico, LDH y Enolasa específica de neutrófilos, sin embargo, ningún estudio de laboratorio confirma o descarta el diagnóstico y no se recomienda su uso de rutina1
Neuroimagen
Dentro del abordaje inicial, la neuroimagen toma un papel protagónico pues está enfocada a descartar o documentar causas secundarias que ameriten tratamiento inmediato, se recomienda a todo paciente con primer evento convulsivo la realización de una tomografía axial computarizada (TAC) simple de cráneo1, su utilidad es descartar sangrado y definir la valoración oportuna por Neurocirugía, los demás hallazgos relevantes que son observables en la TAC de cráneo son edema cerebral, lesiones/masas ocupantes de espacio, signos de hipertensión endocraneana (desviación de línea media, herniaciones cerebrales, compresión de las cisternas perimesencefálicas). Es importante destacar que la Neuroimagen inicial puede ser normal en un 10-22% de los pacientes con primer episodio convulsivo y con examen neurológico normal1 .
La neuroimagen a elegir dependerá de la causa central que se esté pensando, se destaca entonces que la resonancia debe ser la elección cuando se piensa en trombosis de senos durales, PRES, encefalitis viral en el contexto agudo, sin embargo, ambulatoriamente, si el estado del paciente lo permite, debe ser usada para documentar focos epileptogénicos (esclerosis mesangial temporal, tumores, malformaciones corticales, infartos cerebrales)1


La punción lumbar no hace parte de los estudios mandatorios en un paciente con primer evento convulsivo, se debe realizar dependiendo de la sospecha de neuroinfección o enfermedades autoinmunes del SNC, pacientes inmunosuprimidos y se debe realizar posterior a la neuroimagen1 .
Tratamiento
Durante la valoración inicial del evento ictal, posterior al cese de la convulsión, al identificar una crisis aguda sintomática, la principal medida es revertir la causa subyacente, corregir los trastornos metabólicos, cada una de ellas con abordaje diferente que se resumirá en la tabla 3. Es importante destacar aquí que no hay indicación en inicio de manejo anticonvulsivo.
Tabla 3. Tratamiento agudo de causas metabólicas
Causas Secundarias
Hipoglicemia
Hiperglicemia
Hiponatremia
Tratamiento
Dextrosa al 10% bolos de 150-200 ml, glucometría de control a los 15 minutos11,12
Expansión volumétrica, diagnóstico de crisis
hiperglucémica según corresponda
Cetoacidosis diabético o Estado hiperosmolar
hiperglicémico11
Solución Salina Hipertónica al 3%, preferiblemente por acceso central, 100-150 ml con sodio de control en 20 minutos, hasta lograr ascenso de Sodio sérico en 5 mEq/L se pueden administrar hasta 3 bolos13


Hipokalemia
Hipocalcemia
Encefalopatía posterior reversible (PRES)
Bolos de cloruro de Potasio de 40 – 80 mEq por acceso central, control de potasio si ha recibido entre 60-80 mEq.
Paciente con enfermedad renal crónica requiere la mitad de la dosis14
Bolos de Gluconato de calcio de 3 gr durante 10 minutos, repetir a necesidad, infusión de mantenimiento 0.8-1.5 mEq/min con control de calcio sérico en 6 horas14
Labetalol bolos de 10-20 mg, máximo 80 mg, infusión de mantenimiento 1-3 mg/min.
Nicardipino: Infusión de 5 mg/h
Alternativa: Nitroprusiato 0,3-0,5 mcg/mg/min
Metas de presión arterial: reducción del 25% de la presión inicial 15,16
Corrección de coagulopatías o revertir anticoagulantes según sea el caso
Antihipertensivos:
No hay indicación clara para algún medicamento en específico
Hemorragia intracerebral
Se extrapola el uso del labetalol desde el contexto de Emergencia Hipertensiva.
Contraindicación de Nitroprusiato por aumento de la presión intracraneana
Metas de presión arterial PAS menor de 130 mmHg y PAD menor de 80 mmHg para disminuir recurrencias del sangrado.15,17
Nota: Elaboración propiabasada en11-17


El tratamiento agudo del estado epiléptico convulsivo es un abordaje multimodal enfocado en menguar rápidamente la crisis, una serie de pasos, tiempo dependiente y escalonada que sobrepasa los intereses de la revisión actual.
Los pacientes con convulsiones provocadas por una causa estructural aguda como el ECV, TEC o PRES, a pesar que no hay indicaciones precisas para ellos, los consensos de expertos recomiendan iniciar anticonvulsivo con una posterior reevaluación en 3 meses con RNM cerebral, EEG y con ello definir el riesgo de recurrencia para desmonte o continuidad del medicamento9 .
Las indicaciones de inicio de manejo anticonvulsivo se pueden resumir en aquellos que cumplan con definición de epilepsia como se mencionó previamente, además cabe resaltar que los pacientes con semiología sugestiva de crisis focal con o sin generalización secundaria deben ser tratados como una convulsión no provocada, allí la prescripción de anticonvulsivo debe ser esencial3 .
Las convulsiones no provocadas en el adulto mayor de 50 años tienen mayor riesgo de recurrencia dado que pueden tener más causas estructurales como etiología de la crisis, se han documentado tasas del 27% de recurrencia a un año luego un primer evento de convulsión generalizada no provocada con estudios normales3 .
Los anticonvulsivos se pueden clasificar como de amplio espectro, pueden ser usados en epilepsias focales o generalizadas, son entonces el Ácido Valproico, Levetiracetam, Lamotrigina y Topiramato.
El espectro estrecho, deben ser usados para epilepsias focales, son la Fenitoína, Carbamazepina, Oxcarbazepina y Lacosamida.


Tabla 4. Dosificación de anticonvulsivos
Medicamento
Levetiracetam
Acido Valproico
Ampollas 500 mg/5ml
Tabletas de 500 mg y 1000 mg
Jarabe 100mg/ml
Ampollas
500mg/5ml
Cápsulas de 250 mg, 500 mg
1000-3000 mg al día divididos en 2 dosis 10-15 mg/kg/dosis
Lamotrigina
Topiramato
Jarabe 250mg/5ml
Tabletas de 25, 50,100 y 200 mg
500-4000 mg al día divididos en 2-3 dosis 10-20 mg/kg/día
Niñosylactantes 10-15 mg/kg/día
200-600 mg divididos al día en 2 dosis 5-15 mg/kg/día
Tabletas de 25, 50 y 100mg 100-400 mg al día dividido en 2 dosis 5-9 mg/kg/día
Ampollasde250 mg/5 ml
200-300 mg al día dividido en 2-3 dosis 15-20 mg/kg/dosis
Fenitoína
cápsulasde100 mg
Jarabe 125mg/5ml


Tabletas de 200 y 400mg
Carbamazepina
Oxcarbazepina
Lacosamida
Jarabe al 2%
Tabletas de 300 mg y 600 mg
Tabletas de 50, 100, 150 y 200 mg
Nota: Elaboración propia
Conclusiones
600-1200 mg al día divididos en 3 dosis 10-20 mg/kg/día
600-2400 mg al día divididos en 2 dosis
100-400 mg al día divididos en 2 dosis
El paciente con primer episodio convulsivo, tanto en el servicio de urgencias como en salas de hospitalización es un reto diagnóstico dado las diferentes causas subsecuentes que deben abordar, el interrogatorio completo, un examen físico riguroso son la base del ejercicio diagnóstico, identificar de manera temprana los diagnósticos diferenciales es prioridad para el médico general.
Como segundo paso, descartar causas corregibles en el contexto agudo, se debe interrogar acerca de causas metabólicas y enfermedades del sistema nervioso central, hacer el tratamiento oportuno dirigido, estabilización de las constantes vitales y evitar recurrencia temprana dentro del espectro de presentación de las enfermedades sistémicas.
Identificar riesgo de recurrencia con base en la neuroimagen, antecedentes cerebrovasculares y crisis nocturnas son esenciales para definir el inicio del anticonvulsivo. Será trabajo de Neurología y la especialidad en Epilepsia definir estudios electrofisiológicos, identificar aquellos pacientes con síndromes epilépticos específicos, así como el tratamiento y seguimiento a largo plazo.


1. Catarina Franco A, Parreira S, Bentes C, Pimentel J. Management of a first unprovoked epileptic seizure in adolescence and adulthood. Epileptic Disord. agosto de 2021;23(4):537-51.
2. Mauritz M, Hirsch LJ, Camfield P, Chin R, Nardone R, Lattanzi S, et al. Acute symptomatic seizures: an educational, evidence‐based review. Epileptic Disord. febrero de 2022;24(1):26-49.
3. Bergey GK. Management of a First Seizure. Contin Minneap Minn. febrero de 2016;22(1 Epilepsy):38-50.
4. Betjemann JP, Lowenstein DH. Status epilepticus in adults. Lancet Neurol. 2015;14(6):615-24.
5. Trinka E, Cock H, Hesdorffer D, Rossetti AO, Scheffer IE, Shinnar S, et al. A definition and classification of status epilepticus – Report of the ILAE Task Force on Classification of Status Epilepticus. Epilepsia. 2015;56(10):1515-23.
6. Schachter SC. Evaluation and management of the first seizure in adults. UpToDate Httpwww Uptodate ComSist Oppdatert2017-02-21 [Internet]. 2022 [citado 14 de marzo de 2024]; Disponible en: https://www.uptodate.com/contents/evaluation-and-management-of-the-first-seizure -in-adults
7. Shih T, Schmader KE. Seizures and epilepsy in older adults: Etiology, clinical presentation, and diagnosis. Walth MA UpToDate [Internet]. 2022 [citado 13 de marzo de 2024]; Disponible en: https://medilib.ir/uptodate/show/2223
8. Fisher RS, Acevedo C, Arzimanoglou A, Bogacz A, Cross JH, Elger CE, et al. ILAE Official Report: A practical clinical definition of epilepsy. Epilepsia. abril de 2014;55(4):475-82.
9. Calle Lopez Y. Enfoque del paciente con epilepsia. En: XXIX Curso de Actualizacion en Conocimiento Medicos.


10. Leibetseder A, Eisermann M, LaFrance WC, Nobili L, Von Oertzen TJ. How to distinguish seizures from non‐epileptic manifestations. Epileptic Disord. diciembre de 2020;22(6):716-38.
11. American Diabetes Association Professional Practice Committee. 16. Diabetes Care in the Hospital: Standards of Care in Diabetes 2024. Diabetes Care. 11 de diciembre de 2023;47(Supplement_1):S295-306.
12. Cryer PE. Hypoglycemia in adults with diabetes mellitus. Walth MA Mass U S [Internet]. 2020 [citado 24 de marzo de 2024]; Disponible en: https://medilib.ir/uptodate/show/1805
13. Sterns RH, Emmett M, Forman J. Overview of the treatment of hyponatremia in adults. UpToDate Ed Post TW UpToDate Walth MAAccessed March 20 2016 [Internet]. 2022 [citado 24 de marzo de 2024]; Disponible en: https://www.uptodate.com/contents/overview-of-the-treatment-of-hyponatremia
14. Kraft MD, Btaiche IF, Sacks GS, Kudsk KA. Treatment of electrolyte disorders in adult patients in the intensive care unit. Am J Health Syst Pharm. 2005;62(16):1663-82.
15. Mancia G, Kreutz R, Brunström M, Burnier M, Grassi G, Januszewicz A, et al. 2023 ESH Guidelines for the management of arterial hypertension The Task Force for the management of arterial hypertension of the European Society of Hypertension: Endorsed by the International Society of Hypertension (ISH) and the European Renal Association (ERA). J Hypertens. diciembre de 2023;41(12):1874.
16. Fischer M, Schmutzhard E. Posterior reversible encephalopathy syndrome. J Neurol. 1 de agosto de 2017;264(8):1608-16.
17. 2022 Guideline for the Management of Patients With Spontaneous Intracerebral Hemorrhage: A Guideline From the American Heart Association/American Stroke Association [Internet]. [citado 24 de marzo de 2024]. Disponible en: https://www.ahajournals.org/doi/epub/10.1161/STR.0000000000000407


“Aunque el miedo tenga más argumentos, elige siempre la esperanza”
Séneca


