EduQ
Societat Catalana de Química - Filial de l’Institut d’Estudis Catalans
Reflexió sobre art, composició i estructura
Claudi Mans
Els qüestionaris com a recurs docent en l’aprenentatge autònom. Resultats d’una prova pilot en un curs de Química bàsica
Francesc Centellas Masuet, Sergi Garcia Segura i Enric Brillas Coso
Treball de laboratori per tractar en el batxillerat les dificultats conceptuals en la cinètica de les reaccions químiques
Ángel Luis Torres Climent i Vicent F. Soler Selva

Educació Química EduQ
Octubre 2012, número 13
Consell editor
Editors
Fina Guitart, INS Jaume Balmes, Barcelona/CESIRE-CDEC
Aureli Caamaño, INS Barcelona Congrés, Barcelona
Editors associats
Mercè Izquierdo, Universitat Autònoma de Barcelona
Montserrat Tortosa, INS Ferran Casablancas, Sabadell
Col·laboradors de seccions
Josep Corominas, Escola Pia, Sitges
Pere Grapí, INS Joan Oliver, Sabadell
Èric Jover, Universitat de Barcelona
Claudi Mans, Universitat de Barcelona
Àngel Messeguer, Consell Superior d’Investigacions Científiques (CSIC)
Antoni Planas, Institut Químic de Sarrià, Universitat
Ramon Llull
Neus Sanmartí, Universitat Autònoma de Barcelona
Rosa M. Tarin, educació primària, CESIRE-CDEC
Consell assessor
Antoni Alcázar, INS Serrat i Bonastre, Barcelona
Ramón Canela, Universitat de Lleida
Carles Furió, Universitat de València
Andoni Gárritz, UNAM, Mèxic
Marcelo Giordan, Universidad de São Paulo, Brasil
Carme González, Universitat de Barcelona
Roser Gorchs, Universitat Politècnica de Catalunya
Gisela Hernández, UNAM, Mèxic
Manuela Hidalgo, Universitat de Girona
María Jesús Martín-Díaz, IES Tres Cantos, Madrid
Isabel Martins, Universidad de Aveiro, Portugal
Conxita Mayós, Departament d’Ensenyament, Barcelona
Magda Medir, Universitat Rovira i Virgili, Tarragona
Rosa M. Melià, INS Infanta Isabel, Barcelona
Eduardo Mortimer, Universidad Federal Minas Gerais, Brasil
José Maria Oliva, Revista Eureka, Cadis
María Fátima Paixão, Instituto Politécnico, Castelo Branco, Portugal
Teresa Pigrau, educació primària, CESIRE-CDEC
Teresa Prieto, Universidad de Málaga
Tura Puigvert, INS Alexandre Satorras, Mataró Mario Quintanilla, Pontifícia Universidad Católica de Chile
Andrés Raviolo, Universidad de Bariloche, Argentina
Imma Ros, Col·legi de Llicenciats de Catalunya, Barcelona
Núria Ruiz, Universitat Rovira i Virgili, Tarragona
Marta Segura, Escola Pia Diputació, Barcelona
Miquel Solà, Universitat de Girona
Societat Catalana de Química (SCQ) http://scq.iec.cat/scq/index.html
President: Romà Tauler filial de l’
Institut d'Estudis Catalans (IEC) Barcelona. Catalunya. Espanya
Impressió: Gráficas Rey ISSN: 2013-1755
D. L.: B-35770-2008
ÍNDEX
Conceptes i models químics
Reflexió sobre art, composició i estructura
Claudi Mans
Recerca en didàctica de la química
Els qüestionaris com a recurs docent en l’aprenentatge autònom. Resultats d’una prova pilot en un curs de Química bàsica
.10

Francesc Centellas Masuet, Sergi Garcia Segura i Enric Brillas Coso
Treball pràctic al laboratori
Treball de laboratori per tractar en el batxillerat les dificultats conceptuals en la cinètica de les reaccions químiques
Ángel Luis Torres Climent i Vicent F. Soler Selva
Assajos fisicoquímics en el laboratori de grau mitjà de química
Jordi Masip, Paz Gómez i Elena Andrés
Química i societat
La preparación de un perfume como herramienta didáctica para abordar contenidos curriculares del ámbito de la química en enseñanza media
Fiorella Silveira Segui
A química das tintas e dos pigmentos. Um tema gerador para o ensino e a problematização de aspectos científico-humanísticos .
Welington Francisco i Wilmo Ernesto Francisco Junior
Química en pequeñas dosis: los tintes
Javier Medina Fernández, Paz Posse Hernanz
y Carmen Guerra Retamosa
Noves tecnologies
Simulació de la gestió del laboratori amb un LIMS
Marta Costa Vidal
Ressenyes
Imatges de portada: Alumnes de l’escola Sant Felip Neri de Barcelona atenent les explicacions de Marc Boada, durant la visita a l’exposició «Els elements químics, joies imprescindibles», a l’Institut d’Estudis Catalans.

Editorial
Un número amb el desig de captar nous lectors
Continuem amb il·lusió l’edició d’aquesta revista,gràcies al suport de la Societat Catalana de Química, la Secretaria Científica i la Secció de Ciència i Tecnologia de l’Institut d’Estudis Catalans,i presentem el darrer número de l’any 2012 amb el desig que el seu contingut sigui del vostre interès i que gaudiu amb la seva lectura.
El número conté vuit articles emmarcats en seccions diverses: «Conceptes i models químics», «Recerca en didàctica de la química», «Treball pràctic al laboratori» (2), «Química i societat» (3)i «Noves tecnologies».
L’article «Reflexió sobre art, composició i estructura»,de Claudi Mans, pren la tècnica artística d’Ursus Wehrli, artista suís poc conegut al nostre país que descompon i reorganitza obres d’art,i la relaciona amb la química. L’autor constata que la informació subministrada per la fórmula empírica d’una substància és insuficient per comprendre’n completament les propietats, i que per a aquesta comprensió cal saber visualitzar les substàncies a diferents nivells, des del macroscòpic fins a l’atomicomolecular.
Francesc Centellas, Sergi Garcia i Enric Brillas,del Departament de Química Física de la Universitat de Barcelona, en l’article «Els qüestionaris com a recurs docent en l’aprenentatge autònom. Resultats d’unaprova pilot en un curs de Química bàsica», presenten els resultats d’una recerca i comparen els resultats de diferents grups d’alumnes que han utilitzat uns nous qüestionaris en línia dissenyats per millorar la comprensió dels continguts de l’assignatura Química bàsica II i propiciar el treball autònom dels alumnes.
L’article «Treball de laboratori per tractar en el batxillerat les dificultats conceptuals en la cinètica de les reaccions químiques»,dels autors Ángel Luis Torres i Vicent F. Soler, dels instituts Joanot Martorell i Sixto Marco d’Elx, respectivament,aporta una reflexió sobre les dificultats dels alumnes en la cinètica química i sobre la influència de diferents factors, com la velocitat de reacció, a partir d’un treball experimental de la reacció entre el magnesi i l’àcid clorhídric que utilitza sensors de captació de dades.
En l’article «Assajos fisicoquímics en el laboratori de grau mitjà», Jordi Masip, Paz Gómez i Elena Andrés,professors de l’INS Provençana de l’Hospitalet de Llobregat, descriuen la planificació i els treballs pràctics que es realitzen en un crèdit d’assajos físics i fisicoquímics del cicle formatiu de grau mitjà de laboratori. Els autors comenten els resultats obtinguts pels alumnes, les principals dificultats, la proposta d’avaluació del crèdit i el treball cooperatiu basat en grups d’experts.
Fiorella Silveira,en l’article «La preparación de un perfume como herramienta didáctica para abordar contenidos curriculares del ámbito de la química en enseñanza media», pre-
sentauna de les activitats que es realitzen al museu Espacio Ciencia de Montevideo. En el desenvolupament del taller,els alumnes preparen el seu propi perfum i aprenen sobre la composició i els mètodes d’elaboració de perfums, com ara el procés de l’enfleurage. L’autora aporta suggeriments per a possibles vincles curriculars i comenta l’avaluació de l’activitat per part del professorat.
L’article «A química das tintas e dos pigmentos. Um tema gerador para o ensino e a problematização de aspectos científico-humanísticos»,de Welington Francisco y Wilmo Ernesto Francisco Junior,de les universitats federals de Tocantins i d’Alagoas (Brasil),analitza la química de les pintures i els pigments com un fil conductor que abasta temes històrics, composicions, processos de fabricació i impactes ambientals. Els autors focalitzen en els pigments, les resines i els dissolvents que contenen les pintures pertal de promoure un aprenentatge científic de caràcter més humanístic.
Javier Medina Fernández, Paz Posse Hernanz i Carmen Guerra Retamosa,del Parque de las Ciencias de Granada, expliquen una de les activitats d’un conjunt de demostracions que es realitza al museu amb l’objectiu d’acostar la química als visitants. L’article «Química en pequeñas dosis: los tintes» introdueix el lector al món del color i la síntesi química a través d’un recorregut en el temps sobre la utilització d’alguns colorants, l’extracció de pigments vegetals i les relacions entre llum i color.
L’article «Simulació de la gestió del laboratori amb un LIMS»,de Marta Costa,de l’INS Montilivi de Girona,presenta l’experiència realitzada en aquest centre educatiu en el marc d’un projecte que utilitza un LIMS, eina informàtica per a la gestió de dades de laboratori seguint criteris de qualitat.L’autora presenta i discuteix la implementació del sistema amb finalitats educatives en l’àmbit de la química amb alumnes del cicle formatiu de grau superior de laboratori d’anàlisi i control de qualitat.
Com sempre, i de manera especial en aquests moments de consolidació de la revista, usagrairem que la doneu a conèixer entre el professorat de química i els professionals relacionats amb la divulgació científica en aquest àmbitper tal de contribuir a la seva difusió.


Reflexió sobre art, composició i estructura
Thought about art, composition and structure
Claudi Mans / Universitat de Barcelona. Facultat de Química. Departament d’Enginyeria Química
resum

Es compara la tècnica artística d’Ursus Wehrli amb l’anàlisi química, i es constata que la informació subministrada per l’anàlisi elemental (la fórmula empírica) és insuficient per comprendre completament les propietats d’una substància: cal saber visualitzar qualsevol objecte o substància a diferents nivells d’ampliació, des del visible a ull nu fins al nivell atomicomolecular. També es mostra el diferent grau de complexitat que hi ha entre la matèria inert i la matèria biològica.
paraules clau
Composició, estructura, art, microscòpia, Wehrli.
abstract
The artistic technique of Ursus Wehrli is compared with the chemical analysis, and it is realized that the information supplied by the elemental analysis (empirical formula) is not sufficient to fully understand the properties of a substance: it is necessary to know how to visualize any object or substance at different levels of extension, from the naked eye to the level of atoms and molecules. The different degree of complexity between inert and biologic matter is also shown.
keywords
Composition, structure, art, microscopy, Wehrli.
Anàlisi artística i anàlisi química
L’artista suís Ursus Wehrli (n. 1969) és poc conegut aquí. Almenys ho era per a mi, fins que vaig veure un llibret amb les seves obres (Wehrli, 2002; Wehrli, 2006). Fa una tasca que es podria anomenar«de desconstrucció». Agafa una pintura i la descompon en els components elementals, que després reordena i torna a compondre en una ordenació diferent. Aquesta tècnica, que és fàcil de descriure, a la pràctica no és tan fàcil de fer, i resulta impossible en certs casos. Un dels quadres de Miró de la sèrie «Les constel·lacions», aquí reproduït (Chant du rossignol à minuit et la pluie matinale, 1959),no plantejacap problema, perquèmolts

quadres de Mirósón un conjunt d’unitats monocromàtiques fàcils d’identificar i d’aïllar del conjunt (fig. 1i2).
L’any 1957, Picassova analitzar i recompondre LasMeninas de Velázquez a la sensacional sèrie de quadres homònimaque es pot contemplar al seu museu de Barcelona. Les va «simplificar»i transformar. En clau d’humor, Harris(2004)va fer el mateix amb el retrat d’Einstein, que es va convertir en la portada d’un dels seus llibres d’acudits sobre la ciència (fig. 3).
Però el que pretén Wehrli no és simplificar els elements del quadre, sinó reordenar-los. A les fig.4 i 5 es representa una altra de les intervencions de Wehrli sobre un quadre de Kandinski. Wehrli no es limita a descompondre i recompondre.Els quadres puntillistes de Seurat els recompon ambtots els puntets de colors posats dins d’un sac. En altres ocasions, suprimeix elements, com en el cas del quadre La chambre de Van Gogh à Arles (1888), quereelabora per mostrar només la cambra amb el llit i res més. O en el cas de la pintura de Pieter Bruegel Het Gevecht tussen
Carnival en Vasten (El combat entre en Carnaval i na Quaresma), del 1559, tan plena de gent, que Wehrli repinta però buidade persones, i només es queda amb les cases del poble i amb la resta dels elementsinanimats (Wehrli, 2002). Amb la mateixa idea d’ordenar la realitat, actualment Wehrli no només reforma quadres, sinó queva evolucionant cap a la fotografia d’objectes reals abans i després d’ordenarlos. Per exemple, ha reordenat un plat de sopa de lletres o un pàrquing (vegeu el web http://www.kunstaufraeumen.ch). Vegem ara la façana del Col·legi d’Aparelladors i Arquitectes Tècnics de Barcelona que va decorar Joan Brossa l’any1993, abans que Wehrli ordenés sopes de lletres. És al carrer del Bon Pastor, número 5,de Barcelona, a tocarde la Diagonal, entre els carrers d’Aribau i de Muntaner (fig. 6). Brossa usa per a les lletres una ideaanàloga a la que després farà servir Wehrli per als elements d’una pintura: fa una anàlisi del nom de la institució i el condensa d’unamanera més simplificada.Del nom «COL·LEGI D’APARELLADORSI

ARQUITECTES TÈCNICS DE BARCELONA», passa a l’ordenació «AAAAAABCCCCCDDDEEEEEEEGIIIILLLLLNNOOOPQRRRRSSSTTTU» escrita sobre la mateixa façana de l’edifici,d’esquerra a dreta i de baix a dalt. Si s’hagués tractat del Col·legi de Químics, Brossa hauria pogut fer una broma tècnica i condensar-ne el nom encara una mica mésfent «A6BC5D3E7GI4L5N2O3PQR4S3T3U». Ésla mateixa informació, però més ordenada i compacta, i també menys explicativa que el nom original, que no es pot deduir fàcilment de la compactació. Hi ha jocs de paraules que es basen en aquest procediment, com ara, en certa manera, Scrabble. Per cert, Brossa, al’encàrrec del disseny de la façana, no es va conformar a fer la transformació del nom de l’entitat, sinó que també va posar una llagosta gegantina al terrat de l’edifici que es veu clarament des del carrer. I al paviment de la vorera de la Diagonal, a la confluència amb el carrer de Muntaner, hi ha una peça del mateix Brossa que assenyala l’edifici del qual parlem (fig. 6). Analitzem una mica més aquestes compactacions fetes



pels artistes perquè ens han de servir per trobar-hi la relació amb la química. El quadre de la fig. 1 té els mateixos elements que el de la fig. 2, i el nom del Col·legi té les mateixes lletres que la seva enumeració i compactació, però no són el mateix. Podríem dir, en terminologia química, que la fig.2 és el resultat de l’anàlisi quantitativa de la fig. 1, i que la «fórmula»compacta de les lletres del Col·legi és l’anàlisi quantitativa del nom. En tots dos casos,hem aconseguit una forma alternativa de donar-ne la informació, més compacta i més fàcil d’usar, però que no ens dóna tota la informació de l’original.
El mecanisme d’anàlisi pel qual passem de la realitat a una forma més compactano sol ser un mecanisme reversible. A partir de la fig. 2,podríem pintar infinits quadres, tots ells amb els mateixos elements, dels quals la fig.1 és només un dels possibles. A partir de la fórmula compacta de les lletres podríem construir un gran conjunt d’anagrames, que són paraules gramaticalment vàlides usant les mateixes lletres que la primera.
Fem-ne ara una analogia amb la química. Les analogies són procediments didàctics que, a vegades, ajuden a comprendre una matèria,si comprenem el funcionament d’una altra matèria i les
lleis de transformació d’una matèria a l’altra.
Agafem unafórmula empírica, com arala de la sacarosa, C12H22O11. Dónauna certa informació, però no molta. El motiu fonamental de la limitació és que una mateixa fórmula empírica pot correspondre a diverses substàncies, diversos isòmers, de propietats molt diferents. Per exemple, en un cas molt simple, la fórmula empírica CH obtinguda de les anàlisis elementals tant pot valer per a l’etí C2H2 com per a C6H6. I aquesta darrera fórmula, al seu torn, tant és vàlida per al benzè com per al’1,3,5-hexatriè CH2 = CH-C= C-CH= CH2 i

per a altres compostos isòmers amb els enllaços no saturats en altres ordenacions, amb ramificacions, amb un o dos triples enllaços, etc., que, d’altra banda, no necessàriament corresponen a substàncies reals existents.
Ara que ja hem vist, amb les analogies artístiques, les relacions no unívoques entre composició i estructura, aprofundim-hi una mica més.
Composició, estructura i nivells de descripció
Quanen tantes ocasionses diu que «tot és química», probablementes destaca massa el fet obvi que la matèria (tota la matèria)pot ser descrita en termes de substàncies químiques, de molècules, d’elements i àtoms, sense anar més enllà de la composició.L’afirmació anterior és força ambigua, perquè també són ambigus els conceptes molècula, element i àtom; de fet, d’àtoms n’hi ha pocs,a la Terra, tal com ja vaig tenir l’ocasió d’explicar en un article anterior (Mans, 2009). En tot cas, la descripció d’una substància ha d’incloure no només la composició, sinó també l’estructura, és a dir, la distribució dels àtoms a l’espai. Només en alguns casos simples podem, a partir de la informació de la composició, preparar la substància corresponent. Per
exemple, podem imitar una aigua mineraldeterminada a partir de la composició que figura a l’etiqueta simplement barrejant les sals amb aigua en les quantitats indicades i n’obtindríem una aproximació molt bona. Però, en molts casos, encara que tinguem la composició quantitativa d’una barreja, ens cal més informació que la composició química i d’ingredients per fabricar la substància original o per anticipar-ne les propietats. Conèixer només la composició d’un aliatge no permet fabricar-lo. Cal també la informació dels processos de foneria, dels cicles de temperatura de cocció, de refredament, recuita o trempper arribar a tenir l’estructura interna desitjada i, una vegada coneguda aquesta estructura, relacionar-la amb les propietats del material. El mateix, però a una altra escala, succeeix amb qualsevol plàstic o fins i tot amb qualsevol salsa, com ara la maionesa.
Per això cal insistir quetot professor (i tot alumne) hauria de tenir una visualització tan completa com fos possible dels diferents nivells de descripció de qualsevol substància, des del macroscòpic fins al microscòpic i l’atomicomolecular. Aquest recorregut va, de gran a petit,de l’objecte a les substàncies que el componen com a barreja; després,ales diverses estructures que podem trobaren cadascuna de les substàncies, i, finalment, als components químics darrers, amb les estructures pròpies depenent de la seva naturalesa.És especialment interessant el fet de veure les enormes diferències que hi ha entre uns objectes, unes substàncies i unes altres al mateix nivell de descripció, i també les enormes diferències que hi ha a la mateixa substància en observar-la (o en imaginar-nos que l’observem)a diferents nivells d’ampliació.
En aquest sentit, és important el fet de distingir entre els dos modes o nivells d’estructures que hi ha en tota substància complexa.En un primer nivell es troba l’estructura de la barreja dels components, que,en molts casos, és un sistema dispers típic, interpretable mitjançant les forces moleculars febles de Van der Vaals o els enllaços d’hidrogen. En un segon nivell de descripció hi ha l’estructura de cadascun dels components de la barreja, que,en molts casos,són substàncies pures l’estructura de les quals vindrà descrita mitjançant els enllaços covalents, metàl·lics o iònics. Aquesta distinció no és estrictament vàlida per als organismes vius, tal com veurem més endavant.
Imaginem una ampolla d’aigua amb gas. Consta de l’aigua amb gas, el gas de sobre del líquid, el tap, l’ampolla i l’etiqueta. Dues substàncies i tres objectes.Provem de descriure analíticament i estructural cadascun d’aquests components.
Pel que fa a l’aigua amb gas, és unasubstància en fase líquida, una solució, homogènia a ull nu i al microscopi, composta (és una barreja, un cop més l’ambigüitat dels termes) per aigua, algunes molècules dissoltes de CO2 sense reaccionar i ions solvatats de diferents sals, com ara HCO3 , CO32−, Na+, Ca2+, Mg2+, H3O+, OH imolts d’altres, depenent de la procedència de l’aigua i del grau de precisió de l’anàlisi que li fem.
El gas que hi ha sobre el líquid consta de vapor d’aigua, CO2 i, probablement,N2 i O2, segons com s’hagi envasat. L’aigua amb gas només conté bombolles momentàniament, en el moment d’obrir l’ampolla o bé si la remenem. La presència de bombolles és una situació no estacionària i evoluciona cap a un estat menys energètic, que pot ser la redissolució de la bombolla a l’aigua o
bé el despreniment de la bombolla cap a la superfície. La fig.7 representa els diferents nivells d’observació per a una aigua amb gas que va desprenent bombolletes.
El tap i l’ampolla són objectes fets de dos plàstics diferents: substàncies homogènies a ull nu, però que són barreges complexes. Cadascun d’ells està compost (són barreges) per un bon conjunt de substàncies més o menys «pures»: polímer (PVC i PET, respectivament), pigments, plastificants, colorants, càrregues inorgàniques i additius diversos. El fet de qualificar de pur un polímer té una part de falsedat, perquè és una massa de macromolècules similars entre si però de diferents longituds i,probablement,amb tota mena d’isòmers. Un cop més, la terminologia vàlida per a un context no és prou adequada per a un altre context.
L’etiqueta sol serun paper imprès i enganxat a l’ampolla. El paper/objecteestà fet de paper/substància, que veiem homogènia, però a una escala microscòpica en veuríem força bé alguns dels components: fibres decel·lulosa(una macromolècula amb algunes característiques dels polímers d’abans, però també amb notables diferències), partícules de caolí i de càrrega minerali altres substàncies no distingibles al microscopi.L’etiqueta està impresa i les tintes són tambébarreges de dissolvents, olis, pigments i tensioactius. Finalment, l’etiqueta està unida a l’ampolla amb un adhesiu, que potser està compost(és una barreja)per undissolvent, un polímer i diversos additius. De totes aquestes substàncies,no se’n distingiria cap estructura al microscopi òptic.
Naturalment,podem aprofundir molt més en el detall de la descripció de cadascuna de les substàncies del sistema que

Figura 7.Aigua amb gas, a quatre nivells d’ampliació. A ull nu,s’hi aprecien algunes bombolles. L’observació microscòpica del líquid i del gas no permet observar estructures de cap tipus. Un hipotètic microscopi molecular permetria veure els ions de l’aigua amb gas, solvatats i envoltats de molècules d’aigua, i les molècules del gas independents entre elles. Font: Mans (2010).
tenim a tots els nivells. En totes les descripcions, ens trobem al nivell de les substàncies químiques, cadascuna de les quals es pot descriure en termes de molècules, d’ions, d’estructures covalents o metàl·liques tridimensionals, d’àtoms, etc.La fig.8 representa els diferents nivells de descripció de la llet, més complexa que l’aigua amb gas, en tractar-se d’una emulsió.
I encara és més difícil fer el mateix recorregut en el cas de la matèria viva. Tu mateix, lector (un «objecte»viu), tens un cos constituït(compost o format, cap terme és prou específic) per òrgans,corresponents a diferents sistemes. Cada òrgan de cadascun d’aquests sistemes(per exemple, el digestiu) és un objec-

Figura 8. Llet sencera, a tres nivells d’ampliació. El microscopi permet veure les fases components de l’emulsió: la fase aquosa contínua, la fase greixosa dispersa en gotetes i les micel·les càlciques, disperses a la fase contínua. El nivell molecular permetria veure l’estructura de cadascuna de les fases components de l’emulsió: les micel·les de caseïnat de calci, les molècules de greix i la dissolució aquosa de lactosa. Font: Mans (2010).
te individualitzat. El fetge està constituït per milions de cèl·lules hepàtiques i d’altres tipus, cadascuna de les quals tambées pot descriure com un objecte individualitzat amb entitat pròpia.
I una cèl·lula hepàtica, al seu torn, és un objecte format per una membrana, un citoplasma amb molts orgànuls i un nucli(tots són encara objectes individualitzables). I el nucli conté objectes, com ara els cromosomes. I, finalment, arribem al nivell de les molècules: cada cromosoma es pot imaginar com una gran molècula d’ADN enrotllada segons una complexa pauta. Al seu torn, la membrana cel·lular és un conjunt de molècules de fosfolípids juxtaposades i el citoplasma és una dispersió col·loïdalconstituï-
da per una dissolució aquosa (aigua, sals, glucosa i diverses macromolècules)que, a més a més, conté en dispersió petits objectes: orgànuls com els ribosomes, elslisosomes, els mitocondris, el reticle endoplasmàtic o l’aparell de Golgi, i cadascun d’ells també es pot resoldre en termes de molècules.
Comparant les estructures del món no viu idel món vivent, el que es podria anomenar genuïnament químicaquímica comença a escales i dimensions superiors al món no viu. Al món vivent, la química no és la ciència rellevant fins que no s’arriba a les estructures moleculars, macromolècules molt complexes on la conformació és determinant: aquest és el món de la biologia
molecular. La continuïtat estructural al món viu es manté al llarg del recorregut com una sèrie d’objectes progressivament més petits, i només al final es resol en molècules.
Les consideracions anteriors són, naturalment,molt simplificades. Al món vivent també visualitzem la química a les substàncies que bescanvien la informació i els aliments entre òrgans i orgànuls en forma de molècules molt més simples que les estructurals. Per exemple, la respiració involucra molècules com el CO2, l’O2 i el vapor d’aigua. La fotosíntesi genera glucosa C6H12O6 mitjançant complicats mecanismes. El reconeixement dels gustos o de les olors té lloc mitjançant molècules que no solen ser molt grans. L’òxid nítric NO va ser considerat Molècula de l’Any 1992 per la revista Science pel seu paper fisiològic, reconegut no fa gaires anys. Però, pel que fa a les estructures vives, la seva complexitat, en termes generals, és molt més considerable que al món no viu.
La comparació de les dimensions dels diferents objectes i estructures pot ser molt útil a l’hora d’agafar una idea visual de les magnituds que corresponen als diferents nivells de descripció. Fa uns anys,la pel·lícula Potencias de diez (Eames i Eames,1977), que també existeix en format llibre (Eames, Morrison i Morrison,1984), va esdevenir una aproximació visual molt clara al món macroscòpic i microscòpic de forma progressiva, precisament des de la imatge de la pell d’una persona cap a allò infinitament gran o petit. Un altre exemple molt similar, però produïtaquí i centrat a la plaça de Catalunya de Barcelona, es pot veure a Dígits (2006). Una variant més recent, en dibuixos però potser més clara i amb exemples de tots els camps comentats a cada dibuix, es pot
trobar a Huang i Huang(2012), on es pot gaudir d’una visió general de les escales de l’Univers des d’allò infinitament gran (1027 m) fins a allò infinitament petit (10−35 m).
Assumir una correcta perspectiva de la realitat(el que vulgui dir realitat) és, però, difícil, ja que les escales logarítmiques o exponencials se solen reduir a escales lineals en la percepció humana i solem projectar l’experiència i les sensacions a la nostra escala com si fossin aplicables a escales molt més grans o petites. Malgrat això, els recursos citats ens poden ajudar a ubicar-nos a l’Univers, que és, segons diuen,un de tants dins del Multivers (Hawking i Mlodinow, 2010).
Però això ja no és química.
Conclusions
Una analogia artística inicial ens ha permès reflexionar sobre el fet que la composició química d’una substància, que ens dóna una informació quantitativa valuosa, no ens permet conèixer per si sola la seva estructura. Cada substància no té una única estructura,sinó diverses, que depenen, per a cada substància, del nivell d’observació que estiguem usant: el macroscòpic, el microscòpic o l’atomicomolecular. En el cas de la matèria vivent, trobem progressivament una seqüència d’objectes continguts en d’altres (òrgans, cèl·lules i components cel·lulars) que no es resolen en estructures químiques complexes fins al nivell molecular, les quals són estudiades per la biologia molecular.
La visualització de la continuïtat entre nivells d’observació i descripció és una eina útil per a la comprensió de l’estructura i les propietats de qualsevol substància o matèria viva o inanimada, alhora que de la química que les ha fet possibles.
Referències
Dígits (2006) Barcelona: Lavinia TV. <http://www.youtube.com/wat ch?v=9JUpIa4ncWg> [Consulta:gener 2013].
EAMES, C.; EAMES, R. (1977). Potencias de diez.S. ll.: s. n. <http://www.youtube.com/wat ch?v=fbCwkfrKuaw&feature=r elated> [Consulta: gener2013].
EAMES, R.; MORRISON, P.; MORRISON, P. (1984). Potencias de diez. Barcelona: Labor.
HARRIS, S. (2004). Einstein simplified. Nova Brunsvic: Rutgers University Press.
HAWKING, S.; MLODINOV, L. (2010). El gran disseny. Barcelona: Columna.
HUANG, C.; HUANG, M. (2012). Scale of the Universe <http://static.flabber.net/files/ scale-of-the-universe-2.swf> [Consulta: gener 2013].
MANS, C. (2009). «Element Al». Educació Química, 3: 56-60.
—(2010). Sferificaciones y macarrones. Barcelona: Ariel.
WEHRLI, U. (2002). Kunst Aufräumen Zuric: Kein & Aber AG. [Trad. anglesa: Tidying up art.Munic: Prestel Verlag, 2003].
—(2006) Noch mehr Kunst Aufräumen. Zuric: Kein & Aber AG.

Claudi Mans
És catedràtic emèrit d’enginyeria química al Departament d’Enginyeria Química de la Facultat de Química de la Universitat de Barcelona. A més de diferents tasques al servei de la Universitat, es dedica principalment a la divulgació de la química, especialment en allò més relacionat amb la vida quotidiana, mitjançant llibres, articles, conferències, cursos i blocs.
A/e: cmans@ub.edu
Els qüestionaris com a recurs docent en l’aprenentatge autònom. Resultats d’una prova pilot en un curs de Química bàsica
Tests as an educational tool for promoting autonomous learning. Results of a pilot experience in a course of Basic Chemistry
Francesc Centellas Masuet i Sergi Garcia Segura / Universitat de Barcelona. Departament de Química Física / Grup d’innovació docent QISU: Química a la Interfase Secundària-Universitat
Enric Brillas Coso / Universitat de Barcelona. Departament de Química Física
resum

En aquest article es presenten uns nous qüestionaris en línia dissenyats per millorar la comprensió dels continguts de l’assignatura Química bàsica II i, alhora, propiciar el treball autònom dels estudiants. En el grup pilot que ha disposat dels qüestionaris, els resultats acadèmics dels estudiants que els han realitzat diverses vegades han estat millors que els dels alumnes que no els han utilitzat amb regularitat. Els resultats acadèmics del grup pilot també han estat millors que els de cursos anteriors.
paraules clau
Recerca docent, innovació docent, qüestionaris, química general, grau de química.
abstract
New online tests intended to improve understanding of the contents and promoting the autonomous work of students in a Basic Chemistry II experimental course are presented in this paper. The academic results of students who completed the questionnaires several times during the semester were better than those students who didn’t use them regularly. Globally, academic failure of the present course was also less than in previous courses.
keywords
Educational research, educational innovation, questionnaires, general chemistry, degree in chemistry.
Objectiu
En aquest article es presenta un nou recurs didàctic que s’ha implementat, amb caràcter de prova pilot, en un grup de l’assignatura Química bàsica II del primer any del grau de química de la Universitat de Barcelona. Aquest recurs, que essencialment ha consistit en la preparació i publicació de diversos qüestionaris destinats a ser contestats en línia, ha estat con-
cebut perquè els estudiants puguin treballar de manera autònoma el significat dels conceptes i els continguts dels diferents temes de què consta l’assignatura,a fi d’interpretar-los i incorporar-los millor i poder-los aplicar amb més solvència a la resolució de casos i problemes. Un cop presentat el nou recurs, se’n valorarà la influència en els resultats acadèmics dels estudiants i se’n trauran conclusions.
Introducció
A conseqüència dels acords per a la convergència europea en matèria d’educació superior, actualment la universitat espanyola es troba immersa en un procés d’adaptació que, entre altres aspectes, comporta canvis molt importants en els rols del professor i de l’estudiant. A hores d’ara, l’ensenyament universitari ja ha assumit la disminució del pes de la docència tradicional i, en els
plans docents de les assignatures del nous graus, s’ha substituït una part de les classes magistrals per altres activitats en què l’alumnat té una participació més activa. A més a més, el professorat ha assumit que es fa necessària la seva implicació directa en el procés d’aprenentatge de l’estudiant i, en conseqüència, que cal fer servir totes les eines i estratègies que el fan possible (Jiménez i Núñez,2009; Martí i Orgaz,2011; Lagana et al., 2009).
En l’actual grau de química de la Universitat de Barcelona,s’ha tornat a incorporar aquella química general que molts llicenciats vàrem cursar en la nostra època d’estudiants. Això s’ha fet, mantenint la semestralitat de l’ensenyament, mitjançant dues assignatures: Química bàsica I i Química bàsica II. En la primera es tracten, essencialment, els models i les propietats estructurals de la matèria,mentre que en la segona es tracten els sistemes físics i químics en equilibri termodinàmic, l’electroquímica i la cinètica química. Coincidint amb el nou paradigma acadèmic (adequació als criteris de l’EEES i nou pla d’estudis),ja fa tres anys que la taxa d’èxit acadèmic en el primer curs del nostre grau de química ha superat àmpliament la de l’antiga llicenciatura i, a més, ara l’estudiant adquireix una visió més general de la química, que anirà ampliant i perfilant en els cursos superiors. Obtenir uns resultats acadèmics millors no implica, però, que no es puguin millorar encara més (Sadurní i Purrá, 2012). En el cas de l’assignatura Química bàsica II, una part important de l’actual fracàs acadèmic té l’origen en un desconeixement del llenguatge químic, una equivocada concepció dels conceptes bàsics de la química, una buida memorització de les equacions i una incorrecta aplicació de tot
plegat a la resolució d’exercicis i problemes. A més a més, o relacionat amb això, sovint es constata també una actitud poc participativa dels estudiants a l’aula, així com una preocupant disminució del treball personal a mesura que avança el curs, en bona part dels estudiants. Fruit de les constatacions abans esmentades i amb la finalitat de treballar al costat de l’estudiant al llarg del seu aprenentatge, en un dels grups de Química bàsica II (amb cinquanta-un alumnes matriculats) i amb caràcter de prova pilot, l’organització docent de l’assignatura ha atorgat un major pes específic a l’avaluació contínua (i en un futur proper de ben segur encara caldrà atorgar-li un pes major) implantant, uns dies després d’haver estat presentats a l’aula els continguts de cada capítol i fets els corresponents seminaris de problemes, sis proves de seguiment. Per propiciar l’aprenentatge autònom i millorar el procés d’ensenyament-aprenentatge, abans de realitzar cada prova de seguiment, s’ha posat a disposició de l’estudiant un qüestionari en línia pensat i dissenyat per facilitar la consolidació dels conceptes i els continguts presentats en el tema i aplicar-los adequadament a la resolució de casos i problemes. Si bé els autors no han trobat antecedents en una assignatura de primer any del grau de química, val a dir que una estratègia similar s’ha implementat amb èxit en algunes assignatures de laboratori. En aquestes assignatures, abans de realitzar qualsevol experiment, l’estudiant ha de contestar adequadament un qüestionari previ on ha d’acreditar la comprensió dels aspectes necessaris per assolir els objectius experimentals. Addicionalment,i atesa la no obligatorietat de respondre els qüestionaris, al llarg del curs i en
diverses ocasions s’ha insistit en (o, si es vol, s’ha fet apologia de) la necessitat del treball personal continu per obtenir uns millors resultats acadèmics finals.
Els qüestionaris: característiques i objectius específics
Els objectius específics que s’han considerat a l’hora de dissenyar els qüestionaris han estat els següents:
–Reforçar la docència impartida a l’aula i millorar la comprensió dels conceptes i els altres continguts de l’assignatura.
– Utilitzar els continguts dels temes a la resolució de casos i problemes.
– Promoure el treball autònom de l’estudiant al llarg de tot el curs i col·laborar a responsabilitzar l’estudiant del propi aprenentatge.
– Habituar l’estudiant a l’ús del llenguatge i l’argot químics.
– Conèixer els punts febles del procés d’ensenyament-aprenentatge per poder-hiimplementar mesures correctores.
Cada un dels sis qüestionaris (segon principi de la termodinàmica, equilibris físics, equilibris químics, equilibris àcid-base, equilibris iònics i electroquímica) tenen entre quinze i vint-i-cinc preguntes tancades del tipus cert/fals, de resposta múltiple o de resposta numèrica (taula 1),i cada una de les preguntes conté una detallada retroacció per tal que, tant si la resposta és correcta com si no ho és, l’estudiant pugui consolidar els coneixements o bé corregir els errors (fig. 1).
A diferència d’altres tipus de qüestionaris, com ara els destinats a l’avaluació (Ruiz i Cadenato, 2008) o a l’acreditació de coneixements previs abans de realitzar una pràctica de laboratori (Ramírez, Ruiz i Casado,2012), l’alumne no està obligat a fer-los i disposa d’un temps il·limitat per respondre les preguntes planteja-
Qüestionaris
Segonprincipi
Equilibris
Equilibris iònics
Electroquímica


des. La puntuació obtinguda no té cap incidència directa en la qualificació final de l’alumne. En tots els qüestionaris, les preguntes es formulen de forma seqüencial i ordenada,de manera que les primeres tenen com a finalitat ajudar a consolidar els conceptes de
cada tema,mentre que les darreres exemplifiquen l’aplicació dels continguts a la resolució d’exercicis i problemes.
Cada qüestionari es publica al campus virtual de l’assignatura un cop finalitzada la presentació del tema a l’aula i resta obert fins
que té lloc la prova de seguiment. Tots ells tornen a obrir-se uns deu dies abans de la prova parcial i de la prova final de l’assignatura. Mentre resten oberts, l’alumne pot contestar els qüestionaris tantes vegades com vulgui.
Resultats i discussió
En la fig.2 es presenta el nombre d’accessos efectius als qüestionaris de cada tema. S’ha considerat que un accés és efectiu quan l’alumne respon les preguntes formulades i dóna per acabat el qüestionari. Complementant aquesta informació, a la fig.3 es representa el nombre d’alumnes que han realitzat cada qüestionari almenys una vegada i el dels que l’han realitzat més d’un cop al llarg de tot el curs. El primer qüestionari (segon principi de la termodinàmica) ha estat el que més vegades s’ha realitzat,mentre que el nombre d’accessos als qüestionaris restants disminueix gradualment a mesura que avança el curs. El primer qüestionari ha estat resolt, almenys una vegada, per gairebé la totalitat dels estudiants matriculats (96 %),si bé aquest percentatge cau fins al 69 % en el cas del darrer qüestionari del curs. El nombre d’estudiants que han realitzat els qüestionaris més d’una vegada també disminueix a mesura que avança el curs,i passa del 76 % en el cas del primer qüestionari al 24 % en el cas del darrer. Al llarg del curs, els estudiants han dedicat unes 169 hores a la resolució dels qüestionaris (de mitjana, unes 3,3 hores per alumne matriculat). Per valorar la utilitat dels qüestionaris,s’ha comparat la qualificació mitjana obtinguda en el primer intent de resolució amb la qualificació mitjana obtinguda en els intents posteriors. Els valors obtinguts es representen en la fig.4. Addicionalment, en la
taula 2 s’ha comparat la qualificació mitjana obtinguda en les preguntes pròpies de cada tema en totes les proves escrites realitzades amb el nombre d’alumnes que han resolt els qüestionaris d’aquests temes, una vegada o més d’una vegada,i amb les qualificacions obtingudes en cada cas. La comparació s’ha fet agrupant els tres primers temes (amb els qüestionaris més utilitzats pels estudiants) i els tres posteriors (amb una menor utilització). Finalment, en la fig.5 s’han representat les qualificacions globals finals dels alumnes del grup pilot amb les obtingudes pels alumnes del curs anterior (2010-2011), amb el mateix professor i el mateix nombre d’alumnes (cinquantaun),però sense qüestionaris.
Les dades presentades en la fig.4 mostren que la realització dels qüestionaris comporta una clara millora en la comprensió i l’aplicació dels continguts dels temes presentats a l’aula. Aquesta millora, però, no es tradueix de manera automàtica en una qualificació més alta en les proves escrites. Les dades presentades en la taula 2 palesen que la nota mitjana de les preguntes dels tres primers temes de l’assignatura en totes les proves escrites realitzades és clarament superior a la nota mitjana dels altres tres temes. Atès, però, que no es constaten grans diferències en el total d’alumnes que fan almenys una vegada els qüestionaris dels tres primers temes o bé els dels tres següents, ni en les qualificacions obtingudes en la resolució de cadascun d’aquests grups de qüestionaris, se suggereix que el fet de realitzar els qüestionaris
2



Figura 4. Qualificació mitjana obtinguda en la primera resolució de cada qüestionari i qualificació mitjana dels intents posteriors.
més d’una vegada al llarg del curs és la variable que té una més clara influència en la millora de les qualificacions finals de l’alumne.
De les dades presentades en la fig.5 es desprèn que el nombre d’alumnes del grup pilot (amb qüestionaris) que han acreditat haver assolit els objectius de l’as-

Taula 3. Resultats de l’enquesta contestada pels estudiants
Nombre d’alumnes que responen l’enquesta 49 alumnes (51 matriculats)
Valoració de l’organització docent 8,7 (sobre 10)
Valoració de la utilitat dels qüestionaris 7,8 (sobre 10)
Valoració de la utilitat de les retroaccions 9,7 (sobre 10)
Idoneïtat de les preguntes 9,1 (sobre 10)
signatura és gairebé un 18 % superior al dels alumnes del curs anterior (sense qüestionaris).
Aquest fet és especialment rellevant si es té present que quasi un 25 % dels alumnes del curs 20102011 va obtenir una qualificació final de notable, excel·lent o matrícula d’honor.
Amb la finalitat de complementar les dades sobre la utilitat dels qüestionaris, abans de realitzar l’última prova de seguiment del curs, es va lliurar als alumnes una breu enquesta perquè valoressin (del 0 al 10), amb caràcter voluntari i de forma anònima, la idoneïtat de l’organització docent de l’assignatura, la utilitat dels qüestionaris, la idoneïtat de les preguntes formulades (nombre i grau de dificultat) i la utilitat de les mateixes. Els resultats d’aquesta enquesta es presenten de manera resumida en la taula 3.
Conclusions
Quan es valora la utilització dels qüestionaris, es constata que els estudiants els fan servir cada
cop menys a mesura que avança el curs. Malgrat això, és evident que han estat usats de manera prou satisfactòria i que han contribuït de manera notable al fet que l’estudiant es responsabilitzi del propi aprenentatge i dediqui més temps a consolidar els continguts de l’assignatura. De mitjana, cada un dels estudiants matriculats ha dedicat unes 3,3 hores a la resolució dels qüestionaris. Aquest temps, que en alguns alumnes ha arribat fins a les 10,2 hores, no impedeix de cap manera la dedicació a les altres assignatures del curs, ni impossibilita o dificulta (els qüestionaris poden resoldre’s en línia a través del campus virtual) que l’estudiant pugui realitzar les altres activitats que, en l’àmbit personal, vulgui fer. A partir de les respostes de l’enquesta d’opinió contestada pels mateixos estudiants, es constata que l’organització docent de l’assignatura, la utilitat dels qüestionaris, la idoneïtat de les preguntes (nombre i grau de dificultat) i la incorporació en elles d’unes detallades retroac-
cions reben una valoració força alta (notable alt o excel·lent). Resulta evident que els qüestionaris han col·laborat a reforçar la docència impartida a l’aula (la nota mitjana del primer intent de resolució és notablement més baixa que la nota mitjana obtinguda en els intents posteriors) i que milloren la comprensió dels conceptes i els continguts dels temes, així com la seva aplicació a la resolució d’exercicis i problemes. Es comprova que els resultats obtinguts en les proves escrites de l’assignatura són millors en els estudiants que han realitzat els qüestionaris diverses vegades al llarg del curs (taula 2) i que el percentatge d’estudiants que aproven l’assignatura en aquesta cohort és notablement més alt (74,2 %) que en el grup d’estudiants que han realitzat algun qüestionari tan sols una vegada (38,4 %).
Atesa l’especificitat dels qüestionaris i del grup pilot, no ha estat possible comparar els resultats assolits amb els d’altres experiències, per bé que si es comparen els resultats finals dels alumnes del grup amb els del curs anterior,es constata que el nombre d’estudiants que acrediten haver assolit els objectius de l’assignatura és un 18 % superior. En aquest sentit,cal indicar que la prova escrita final, amb un pes del 70 % en l’avaluació contínua de l’estudiant, ha estat preparada majoritàriament a partir de preguntes (exercicis i problemes) proposades pels altres professors de l’assignatura, sense una participació directa del professor del grup en què s’han implementat els qüestionaris amb caràcter de prova pilot.
D’altra banda, l’anàlisi de les respostes que els estudiants han donat a les diferents preguntes dels qüestionaris un cop finalitzada la presentació de cada tema a l’aula ha permès identificar
alguns punts febles en el procés d’ensenyament-aprenentatge i, per tant, implementar mesures correctores abans de la realització de la prova parcial i la prova final de l’assignatura. Molt sovint, els punts febles identificats es poden relacionar amb la persistència d’idees prèvies errònies, amb una subsidència més perllongada del que, d’entrada, hauria suposat el professor.
Coneguts els bons resultats obtinguts en el grup pilot, en el proper curs acadèmic tots els professors de l’assignatura Química bàsica II han decidit fer servir els qüestionaris en els respectius grups. El proppassat mes de juliol, els resultats d’aquest article varen poder ser presentats en una comunicació oral als assistents del Congrés Nacional d’Innovació Docent en Química (INDOQUIM 2012), celebrat a la Facultat de Química de la Universitat de Barcelona. Fruit d’aquesta comunicació, altres professors d’assignatures de primer curs de la nostra Facultat també adaptaran els qüestionaris presentats a les característiques de les seves

Francesc Centellas Masuet
És professor titular de química física a la Facultat de Química de la Universitat de Barcelona, on porta a terme la seva activitat docent i de recerca. És cap de projectes del Laboratori d’Electroquímica de Materials i del Medi Ambient (LEMMA), grup de recerca consolidat que desenvolupa nous tractaments químics i electroquímics per eliminar contaminats emergents en aigües. És coordinador del grup d’innovació docentQISU: Química a la Interfase Secundària-Universitat.
A/e: facentellas@ub.edu
assignatures i a les necessitats del seu alumnat.
Agraïments
Els autors volen agrair al president i al Comitè Organitzador d’INDOQUIM 2012 les facilitats donades a l’hora de presentar la innovació docent descrita en aquest article,i als nombrosos docents de química de l’Estat espanyol inscrits al Congrés, els comentaris i suggeriments tramesos.
Referències
JIMÉNEZ, G.; NÚÑEZ, E. (2009).
«Cooperación online en entornos virtuales en la enseñanza de la química». Educación Química, 20(3): 314-319.
LAGANA, A.; MANUALI, C.; FAGINAS, N.; GERVASI, O.; CROCHIANTI, S.; RIGANELLI, A.; SCHANZE, S. (2009). Innovative methods in teaching and learning Chemistry in higher education. Cambridge: RSC Publishing,p. 153-190.
MARTÍ, C.P.; ORGAZ, N. (2011). «El cuestionario como herramienta de autoevaluación en el proceso de aprendizaje de la

Enric Brillas Coso
És llicenciat (1974) i doctor (1977) en química per la Universitat Autònoma de Barcelona. Catedràtic de química física de la Universitat de Barcelona des del 1987. Ha impartit més de noranta cursos de química teòrica i experimental. Ha dirigit setze tesis doctorals, ha publicat uns dos-cents cinquanta articles, sis llibres i deu capítols de llibre i ha presentat unes cent vuitanta contribucions a congressos. A/e: brillas@ub.edu
asignatura Contabilidad Financiera y Analítica». Revista de Educación en Contabilidad, Finanzas y Administración de Empresas, 2: 51-66.
RAMÍREZ, F.J.; RUIZ, M.C.; CASADO, J. (2012). «Laboratorio de química física:Empleo de cuestionarios previos como herramienta de preparación».
A: BARBOSA, J.[et al.] [ed.]. 7ª Reunión de Innovación Docente en Química. Barcelona: J. Barbosa Torralbo, p. 25-26.
RUIZ, R.; CADENATO, A.M. (2008). «Experiencia del uso de cuestionarios de aprendizaje autónomo o formativos combinados con cuestionarios de evaluación o sumativos».
A: 8ª Jornada sobre Aprendizaje Cooperativo y 1ª sobre Innovación en la Docencia. Lleida: GAM Imprenta Digital, p. 161-169.
SADURNÍ, A.; PURRÁ, M. (2012). «Propuesta de estudiantes para la mejora de la evaluación continuada». A: BARBOSA, J.[et al.] [ed.]. 7ª Reunión de Innovación Docente en Química. Barcelona: J. Barbosa Torralbo,p. 21-22.

Sergi Garcia Segura
És llicenciat en química i enginyer superior en ciència dels materials. És investigador del grup Laboratori d’Electroquímica de Materials i del Medi Ambient (LEMMA) de la Facultat de Química de la Universitat de Barcelona, on realitza la tesi doctoral. És responsable dels seminaris de problemes de l’assignatura Química bàsica II i membre actiu delgrup d’innovació docent QISU:Química a la Interfase Secundària-Universitat.
A/e: sergigarcia@ub.edu
Treball de laboratori per tractar en el batxillerat les dificultats conceptuals en la cinètica de les reaccions químiques
Laboratory work for high school students dealing with misconceptions in the kinetics of a chemistry reaction
Ángel Luis Torres Climent / IES Joanot Martorell d’Elx
Vicent
F. Soler Selva / IES Sixto Marco d’Elx
resum

L’objectiu de l’article és reflexionar sobre les dificultats que es presenten en interpretar la cinètica química quan ocorre una reacció irreversible. S’estudia la reacció heterogènia entre el magnesi i l’àcid clorhídric en solució aquosa. Es reflexiona sobre la influència de diferents factors en la velocitat de la reacció; a més, s’estudien els ordres de la reacció i la constant cinètica. Es presenta un treball pràctic que es podria vincular a l’ensenyament de la química del batxillerat.
paraules clau
Idees prèvies, cinètica, treball pràctic de laboratori, estequiometria.
abstract
The aim of this article is to reflect on the difficulties in chemical kinetics when an irreversible reaction is ongoing. The heterogeneous reaction between magnesium and hydrochloric acid in an aqueous solution is carried out. The influences of different factors on this reaction speed are analyzed, also we find out the reaction order and the kinetic constant. We present a practical work that could be linked to teaching high school chemistry.
keywords
Misconceptions, kinetics, laboratory practical work, stoichiometry.
Introducció
La metodologia més freqüent per a l’aprenentatge dels càlculs cinètics és la resolució de llapis i paper a l’aula, que, tot i que és necessària i fins i tot imprescindible, creiem que pot ser completada amb una proposta que ajude l’alumne a reflexionar sobre les idees alternatives que té. Hom sap que els càlculs amb les quantitats de les substàncies implicades en un procés químic són ineludibles en el laboratori i la planta química, i el fet de comprendre els aspectes cinètics d’u-
na reacció química és fonamental per determinar la viabilitat d’un procés.
Al nostre parer, calen més publicacions que mostren estratègies a seguir per corregir les idees alternatives que molts alumnes de batxillerat manifesten en tractar la cinètica química, tot i que hi ha nombrosos treballs sobre qüestions relacionades amb l’equilibri i el desplaçament de l’equilibri químic. Sánchez Piso et al. (2002), després de revisar vuitanta-quatre articles publicats en revistes nacio-
nals i internacionals, van concloure que, deixant de banda les innovacions dels llibres de text, la recerca publicada sobre l’ensenyament de la cinètica no sol tractar els problemes d’aprenentatge, i pocs autors proposen seqüències de formació per al professorat. D’altra banda, autors com Martínez Torregrosa et al. (2012) suggereixen que el treball pràctic es plantege com una investigació dirigida.
La taula 1 arreplega les dificultats conceptuals més freqüents que poden presentar els
alumnes i proporciona alguna referència on es poden trobar enunciades aquestes dificultats.
Els conceptes que són el resultat de la nostra pròpia experiència d’ensenyament no inclouen refe-
Taula 1. Dificultats conceptuals dels alumnes en estequiometria i cinètica química
Estequiometria
a) Ajustar una equació química.
rència, tot i que s’indica que es recullen al currículum de la Comunitat Valenciana (CV).
b) Interpretar la informació que proporciona una equació química i transferir-la a una prova real en el laboratori.
c) Pensar que l’equilibri entre gasos es pot obtenir en un recipient obert.
d) Reconèixer el reactiu limitant en un procés químic.
e) Fer càlculs en sistemes en els quals intervenen dissolucions.
f) Creure que la reacció es produeix en dos compartiments separats: un per als reactius i un altre per als productes.
g) Relacionar erròniament coeficients estequiomètrics amb concentracions en equilibri.
h) Pensar que,quan s’aconsegueix l’equilibri, productes i reactius tenen la mateixa concentració.
i) Fer càlculs erronis utilitzant les lleis volumètriques de Gay-Lussac, les hipòtesis d’Avogadro i el concepte quantitat de substància
j) No entendre que l’estat del sistema en reacció depèn del temps.
Referència
CV
CV
Sierra et al. (2008)
CV
Johnstone et al. (1977)
Johnstone et al. (1977)
Hackling i Garnett (1985)
Sierra et al. (2008)
CV
Ben-Zvi et al. (1987)
Cinètica química Referència
k) No entendre el concepte velocitat de reacció i ser incapaçde proposar formes de quantificar-la.
l) Atribuir a la massa, i no a la concentració, influència en la velocitat d’una reacció.
m) Atribuir a la quantitat de substància, i no a la concentració, influència en la velocitat d’una reacció.
n) Incapacitat per apreciar que certes substàncies poden mantindre pràcticament constant la seua concentració durant la reacció.
CV
Wheeler i Kass (1978)
Sierra et al. (2008)
Wheeler i Kass (1978)
o) No identificar els factors dels quals depèn la velocitat d’una reacció. Concentració. Superfície específica. Temperatura. CV
p) Pensar erròniament que la velocitat de la reacció directa s’incrementa a mesura que la reacció avança.
q) Pensar erròniament que, com més ràpida o lenta és una reacció, més gran o xicoteta serà la quantitat de producte format.
r) Incapacitat per diferenciar entre velocitat i progrés de la reacció.
Cinética química... (s. d.)
Cinética química... (s. d.)
Wheeler i Kass (1978) Banerjee (1991)
s) Confondre ordre de reacció amb molecularitat en escriure les equacions cinètiques. CV
t) Incloure automàticament els coeficients estequiomètrics en l’equació de velocitat. Boujaoude (1993)
u) No poder obtenir l’equació de velocitat a partir de dades experimentals. Boujaoude (1993)
v) Pensar que la constant de velocitat i la velocitat de reacció són el mateix.
w) Buscar una relació entre els coeficients estequiomètrics, les concentracions i els ordres de velocitat.
Cinética química... (s. d.)
Hackling i Garnett (1985) Boujaoude (1993)
x) No percebre que el fet de dur a terme la reacció a una temperatura o una altra influirà en la pressió final assolida. Johnstone et al. (1977)
y) Aplicar el principi de Le Chatelier per predir el comportament de la velocitat d’una reacció. Banerjee (1991
L’estudi de la cinètica de reaccions està inclòs en el currículum de batxillerat («Currículum del batxillerat de la Comunitat Valenciana», 2002),però,específicament,el de les reaccions heterogènies no hi figura, al contrari que el dels equilibris heterogenis. No obstant això,existeixen interessants treballs que estudien la cinètica de reaccions heterogènies,com el de Tortosa et al. (2007),que utilitza la reacció entre el carbonat càlcic i l’àcid clorhídric; també de la reacció que hem utilitzat nosaltres destacaríem dos treballs: el de Birk i Walters (1993), adreçat a estudiants universitaris, i el d’Apari-
cio i Lozano (2004), proposat per a estudiants de batxillerat. Nosaltres, de tots dos, hem implementat el primer fent servir un dispositiu diferent i adaptant-lo al batxillerat amb una metodologia d’investigació dirigida. S’ha emprat un equipament de laboratori assistit per ordinador, cada vegada més freqüent en els centres de segona ensenyança.
Preguntes formulades als alumnes
Hem inclòs en cada qüestió els identificadors de les dificultats conceptuals de la taula 1 amb les quals està relacionada. Òbviament,som conscients que
Material – Balança (±0,001 g)– Proveta de 50 mL – Cinta de magnesi (amplària:3 mm)– Ordinador personal – Dissolució d’àcid clorhídric 2 mol/L– Regle (100 mL), 1 mol/L (500 mL) i – Sensor de pressió i temperatura 0,5 mol/L (100 mL)–Programari de captació de dades – Erlenmeyers– Tap de goma amb orifici – Llima(on ajusta el sensor) – Pipeta de 25 mL– Tisores


Talleu un tros de cinta de magnesi de 2 cm de llarg (60 mm2). Escateu la superfície de la cinta de magnesi. Com que la reacció és exotèrmica, per mantenir-la a temperatura constant, introduïu el matràs en un bany d’aigua de gran volum. Afegiu 50 mL d’àcid clorhídric 2 mol/L en el matràs. Introduïu el matràs en el bany (fig.1). Activeu el sensor de pressió i temperatura; ràpidament,afegiu el tros de cinta de magnesi i tanqueu l’Erlenmeyer. Atureu l’enregistrament de dades una vegada estabilitzada la pressió. Encara que la quantitat d’hidrogen format no és gran, cal allunyar-se de fonts d’ignició en destapar el matràs,a causa de la inflamabilitat del gas; el professor aprofitarà l’avinentesa per parlar de les mesures de seguretat al laboratori.
no totes elles s’aconseguiran eliminar amb el desenvolupament de cada activitat, ni tan sols amb la totalitat de l’activitat proposada, però creiem que és una informació útil per al professor que condueix les activitats, i el porta a ell mateix i als estudiants a reflexionar sobre les dificultats en l’ensenyament i l’aprenentatge dels conceptes involucrats.
Activitats prèvies
1. Escriure l’equació que representa la reacció química entre el magnesi metall i l’àcid clorhídric en dissolució aquosa. Identificador: a).
2. Quina massa de magnesi i quin volum d’una dissolució d’àcid clorhídric serien necessaris per reaccionar? Identificadors: b), d) i e).
3. Si es mesclen 0,029 g de magnesi amb 50 mL d’àcid clorhídric 2 mol/L, quina serà la composició final? Identificadors: b), c), d), e), f), g), h)i i).
Estequiometria. Pressió parcial de l’hidrogen i concentració d’àcid clorhídric
4. Quina quantitat d’hidrogen s’obtindrà amb 0,029 g (60 mm2) de magnesi i 50 mL d’àcid clorhídric 2 mol/L? Quina pressió teòrica assolirà l’hidrogen? Compareu els valors teòrics i experimentals. Identificadors: b), c), d), e), f), g), h) i i).
5. Quina pressió teòrica assolirà l’hidrogen amb 0,028 g de magnesi i 50 mL d’àcid clorhídric 1 mol/L? I amb 50 mL d’àcid clorhídric 0,5 mol/L? Identificadors: b), c), d), e), f), g), h) i i).
6. Dibuixa una gràfica aproximada de la concentració d’àcid clorhídric enfront del temps quan reaccionen 0,028 g de magnesi amb 50 mL d’àcid clorhídric 0,5 mol/L. Identificadors: j) i n).
7. Proposeu expressions per calcular el nombre de mols d’hi-
2. Planificació dels assaigs
drogen, el nombre de mols i la concentració d’àcid clorhídric. Introduïu-les en el programa i representeu les gràfiques. Identificadors: b), d), e), f), g), h) i i).
Estudi cinètic. Velocitat de reacció
8.Com es podria quantificar la velocitat de la reacció? Identificadors: j) i k).
9.Enuncieu hipòtesis sobre els factors que influeixen en la velocitat. Identificadors: k), l), m), o), r) i y).
10. Proposeu una expressió per a la llei de velocitat de la reacció. Identificadors: s), t), v) i w).
Es provaran les hipòtesis plantejades fent els assaigs indicats a la taula 2.
Amb la mesura de la pressió, es pot determinar la velocitat inicial,ja que,durant els primers instants, l’evolució de la pressió de l’hidrogen presenta un pendent constant. A més, en aquests primers instants, la superfície del magnesi és pràcticament constant i igual al valor inicial, ja que està començant a ser atacat per l’àcid i la concentració d’àcid és gairebé igual al valor inicial,perquè ha reaccionat molt poca quantitat en comparació amb el gran excés inicial.
Influència de la concentració de HCl i superfície de magnesi
11. Realitzeu els assaigs 1, 2 i 3 de la taula 2. Determineu la velocitat inicial de reacció. Enuncieu les conclusions. Identificadors: o), p), q) i r).
L’equació de la velocitat per a aquesta reacció haurà de respondre a l’expressió (1):

En prendre logaritmes,quedaria (2):
Influència de la temperatura
17. Realitzeu els assaigs 2 i 4 de la taula 2 a temperatures diferents en el bany. Enuncieu les conclusions. Identificadors: o), x) i y).
Realització de l’activitat
12. Obteniu l’ordre b respecte de l’àcid clorhídric. Identificadors: s), t), u) i w).
13. Realitzeu els assaigs 2, 5 i 6 de la taula 2. Determineu la velocitat inicial. Enuncieu les conclusions. Identificadors: o), p), q) i r).
14. Obteniu l’ordre a respecte de la superfície de magnesi. Identificadors: s), t), u)i w).
15. Determineu la constant de velocitat. Identificador: v).
16. Realitzeu els assaigs 2 i 7 de la taula 2 amb el magnesi tallat en nombres de fragments diferents. Determineu la velocitat inicial. Enuncieu les conclusions. Identificador: o).
Cada alumne pot fer tots els assaigs proposats.En aquest cas, caldran unes vuit sessions d’una hora cada una. Una altra possibilitat que hem experimentat consisteix a repartir els assaigs entre els alumnes i, en acabar, fer una posada en comú. Cal que els alumnes estiguen familiaritzats amb l’ús del sensor de pressió i temperatura, per a la qual cosa és suficient dedicar-hi uns minuts d’una classe, en el cas de no haver-ne après l’ús en altres experiències.
Reflexió sobre les possibles respostes a les preguntes plantejades
Activitat 1
Mg(s)+ 2 HCl(aq) → MgCl2(aq) + H2(g) ↑ Activitat 2
Cada mol de magnesi que reacciona ho fa amb 2 mol d’àcid clorhídric. 1 mol de magnesi

Figura 2. Evolució de la concentració d’àcid clorhídric en reaccionar 0,028 g de magnesi amb 50 mL d’àcid clorhídric 1 mol/L.

Figura 3. Tram de la pressió enfront del temps per determinar la velocitat inicial en la reacció de 0,028 g de magnesi i 50 mL d’àcid clorhídric 1 mol/L.
fa 24,31 g de magnesi. El volum de dissolució d’àcid clorhídric que cal perquè continga 2 mol d’àcid clorhídric dependrà de la concentració de la dissolució. Alguns alumnes tenen dificultats per entendre la informació de l’equació química i traslladar-la a una situació real en la qual han de decidir quines quantitats calen,sobretot en el cas de l’àcid clorhídric, que es té en forma de dissolució.
Activitat 3
La proporció que es planteja (0,1 mol HCl / 0,0012 mol Mg) =
(83,3 mol HCl / mol Mg) és major que la proporció estequiomètrica (2 mol HCl / mol Mg). Per tant,l’àcid clorhídric estaria en excés i el reactiu limitant seria el magnesi. Les composicions finals,si la conversió és completa,serien les següents: magnesi, 0;àcid clorhídric,0,098 mol;clorur de magnesi, 0,0012 mol,i hidrogen,0,0012 mol.
Activitat 4
La quantitat final d’hidrogen seria de 0,0012 mol. Si suposem que el gas hidrogen presenta un comportament de gas ideal, la
temperatura absoluta del gas és igual a la temperatura del bany (292 K) i el volum de l’hidrogen, V = volum del matràs + volum del tub de silicona −volum de dissolució (122 + 2 −50 = 74 mL). La pressió teòrica és de 39.517 Pa i l’experimental va ser de 40.530 Pa (una desviació d’un 2 %).
Activitat 5
No tots els alumnes s’adonen que,en haver-hi la mateixa quantitat de reactiu limitant(magnesi), encara que utilitzem àcid més concentrat,el progrés de la reacció serà el mateix i la pressió d’hidrogen aconseguida,també. L’anàlisi dels resultats dels assaigs 1, 2 i 3 permet que comproven aquest fet.
Activitats 6 i 7



La concentració d’àcid clorhídric (fig.2) canvia molt poc durant la reacció a causa de l’excés d’aquest enfront del magnesi en la mescla inicial.
Activitat 8

La pressió de l’hidrogen es pot calcular restant a la pressió total la inicial. Si l’evolució de la pressió de l’hidrogen és lineal, la velocitat instantània és constant i igual a la mitjana (fig. 3).
Activitat 9
Els alumnes solen proposar una concentració d’àcid clorhídric tal que,a major concentració, major velocitat. Quant al magnesi, hi ha respostes en les
quals consideren que no influeix o que depèn de la massa d’aquest (en els dos sentits, a major massa, major velocitat,i a l’inrevés), i, fins i tot, que influeix la concentració. Són escasses les respostes que atorguen influència a la superfície del magnesi utilitzat. És important fer avinent als alumnes que la velocitat d’una reacció no s’ha de correlacionar d’immediat amb el temps invertit. La reacció pot tardar més a finalitzar si s’empra una major quantitat del reactiu limitant, encara que haja transcorregut a la mateixa velocitat (al mateix ritme de consum).
La temperatura és un factor apuntat majoritàriament.Els alumnes suggereixen que,a major temperatura, més ràpida és la reacció, encara que si s’indica que la reacció és exotèrmica, hi ha respostes que suggereixen, erròniament, que una temperatura major reduirà la velocitat de la transformació. En aquests casos, els alumnes confonen velocitat amb progrés de la reacció,ja que, en les reaccions exotèrmiques, com més gran serà la temperatura, menor serà la seua constant d’equilibri,però s’aconseguirà més ràpidament.
El grau de divisió també apareix en algunes de les respostes. Si als alumnes se’ls pregunta què ocorrerà si es fan diversos trossos d’un únic tros major de cinta de magnesi, llavors responen, erròniament, que la velocitat augmentarà.
Activitat 10

Algunes respostes apuntaran que b és 2 i que a és 1, però és important destacar als alumnes que el valor dels ordres parcials de reacció s’ha de determinar experimentalment. També apareixen respostes que no inclouen el
Taula 3. Influència de la concentració d’àcid clorhídric en la velocitat
Assaig [HCl] (mol/L) v (Pa/s)
Assaig S Mg (mm2) v (Pa/s)
±0,7 R = 1
±0,1 R = 1
±1 R = 1

valor de la superfície de magnesi amb arguments com ara que, en ser constant, està inclosa en la constant de velocitat.
En aquest punt és molt important que els alumnes aprenguen a dissenyar correctament una investigació i que valoren la importància d’exercir un control de variables correcte perquè puguen extraure conclusions vàlides. El professor apuntarà que seria convenient fer sèries diferents d’assaigs (taula 2), on es puguen estudiar la influència de la concentració de l’àcid clorhídric (assaigs 1, 2 i 3), la temperatura (assaigs 2 i 4), la superfície de magnesi participant (assaigs 2, 5 i 6) i el nombre de trossos de
magnesi,però mantenint constant la resta de les variables per evidenciar només l’efecte de la variable que es vol estudiar.
Activitat 11
En el valor de la velocitat,s’ha inclòs la desviació estàndard del pendent de la pressió enfront del temps i el coeficient de correlació del tram utilitzat per a la determinació del pendent.
Alguns alumnes s’imaginen una relació de proporcionalitat directa entre la concentració de l’àcid clorhídric i la velocitat de la reacció. Les dades no ens confirmen aquesta idea alternativa. També convé destacar que,encara que el ritme de consum del mag-

nesi siga diferent segons la concentració d’àcid clorhídric, l’extensió de la reacció és la mateixa, perquè s’observa que s’aconsegueix una pressió total final igual (coeficient de variació de l’1 %).
Activitat 12
Si es representa logv enfront de log [HCl], s’obtindrà una recta el pendent de la qual és el valor de l’ordre respecte de l’àcid clorhídric. L’equació ajustada dóna un valor per al pendent igual a 2,2 ± 0,2.
Activitat 13
En aquesta ocasió, simplement observant els resultats, els alumnes sí comproven que és certa la seva hipòtesi de proporcionalitat directa entre la velocitat de la reacció i la superfície de magnesi.
Activitat 14
En representar logv enfront de logS, s’obtindrà una línia recta el pendent de la qual és el valor
de l’ordre respecte de la superfície de magnesi. S’obté un resultat igual a 0,97 ± 0,04.En aquest cas, l’ordre de reacció coincideix pràcticament amb la molecularitat indicada per l’equació,la qual cosa ens fa pensar que la reacció és elemental i el mecanisme queda descrit per l’equació química plantejada. És important portar els alumnes a reflexionar sobre el fet que els resultats experimentals no sempre coincideixen amb els teòrics o els del llibre de text, i que aquests solen estar expressats seguint un model sota unes condicions que no sempre s’aconsegueixen reproduir al laboratori escolar.
Activitat 15
Essent a = 0,97i b = 2,2, la constant de velocitat de la reacció estudiada a 19 oC pren el valor de 13 ±1 (Pa ·L2) / (s ·mm2 ·mol2). És important fer avinent als alumnes que la constant k és la constant de velocitat de la reacció i que no s’ha de confondre amb la constant d’equilibri: Kc o Kp
Activitat 16
Segons la fig.5, la velocitat inicial és molt semblant, 749 ± 2 Pa/s,i aquest resultat pot sorprendre els alumnes, ja que solen esperar una major velocitat, indicatiu que no van interioritzar que a major superfície específica d’un sòlid, major velocitat. Efectivament,si haguérem comparat la velocitat utilitzant magnesi en cinta i magnesi en pols, la velocitat hauria sigut major en el segon cas, però,en haver assajat un nombre de trossos que suposen una superfície total exposada de magnesi quasi igual, la velocitat resulta pràcticament la mateixa.
Activitat 17
En observar els resultats de la taula 5,els alumnes veuen com la temperatura augmenta la velocitat de la reacció i haurien de ser capaços de dir que això es deu al fetque augmenten l’agitació i l’energia dels ions H+ de la dissolució, augmentant els xocs eficaços amb els àtoms de la superfície de magnesi.
Conclusions
Creiem que la seqüència didàctica d’aquesta proposta permet introduir conceptes i evidenciar i reflexionar per modificar moltes de les idees alternatives de l’alumnat de batxillerat sobre l’estequiometria (reactiu limitant, càlculs amb reactius en dissolució, etc.) i cinètica química (concepte i mesura de la velocitat d’una reacció química, factors que modifiquen la velocitat, ordre de reacció, constant de velocitat, etc.). Considerem que el treball pràctic presentat, o amb les adaptacions que el professor considere oportunes, pot ser útil per modificar dificultats conceptuals dels alumnes en l’estequiometria i la cinètica química i pot ser complementari, però en absolut excloent, respecte d’altres estratègies,com la
resolució de problemes o les explicacions teòriques. Fóra convenient d’estudiar en el futur el grau de permanència dels canvis en les idees alternatives aconseguits mitjançant el treball experimental. Així mateix, el tractament dels càlculs estequiomètrics no s’ha estès a transformacions reversibles; per tant,fóra convenient de completar el present treball en un futur.
La seqüència didàctica d’aquesta proposta permet introduir conceptes i evidenciar i reflexionar per modificar moltes de les idees alternatives de l’alumnat de batxillerat sobre l’estequiometria (reactiu limitant, càlculs amb reactius en dissolució) i cinètica química (concepte de la velocitat d’una reacció, factors que la modifiquen, ordre de reacció, constant de velocitat)
Referències
APARICIO, A.; LOZANO, M.T. (2004). Concentració i velocitat de reacció [en línia]. Barcelona:Centre d’Experimentació i Documentació en Ciències i Tecnologia. <http://phobos.xtec.cat/cdec/i mages/stories/WEB_antiga/rec ursos/pdf/nntt_fiq/pdf.quimic a/reaccio.pdf>; <http://phobos.xtec.cat/cdec/i mages/stories/WEB_antiga/rec ursos/pdf/nntt_fiq/pdf.quimic a/preaccio.pdf> [Consulta: 6 febrer 2013]
BANERJEE, A. C. (1991). «Misconceptions of students and teachers in chemical equilibrium». International Journal of Science Education, 13(4): 487-494.
BEN-ZVI, R.; EYLON, B.-S.; SILBERSTEIN, J. (1987). «Students visualisation of a chemical reaction». Education in Chemistry, 24(4): 117-120.
BIRK, J. P.; WALTERS, D. L. (1993). «Pressure measurements to determine the rate law of the magnesium–hydrochloric acid reaction». Journal of Chemical Education, 70(7): 587-589.
BOUJAOUDE, S. (1993). «Student’s systematic errors when solving kinetic and chemical equilibrium problems».
A: Annual Meeting of the National Association for Research in Science Teaching. Atlanta: NARST. Cinética química: ¿quién es más rápido? Análisis didáctico (s. d.) [en línia]. Mèxic: Universidad Autónoma Nacional de México. <http://www.cneq.unam. mx/cursos_diplomados/diplo mados/medio_superior/ dgire2006-2007/11_porta/cinetica/analisis_didactico. htm> [Consulta: 25 juny 2012] «Currículum del batxillerat de la Comunitat Valenciana»(2002). Decret 50/2002, de 26 de març.
HACKLING, M. W.; GARNETT, P. J. (1985). «Misconceptions of chemical equilibrium». European Journal of Science Education, 7(2): 205-214.
JOHNSTONE, A. H.; MACDONALD, J. J.; WEBB, G. (1977). «Chemical equilibrium and its conceptual difficulties». Education in Chemistry, 14(6): 169-171.
MARTÍNEZ TORREGROSA, J.; DOMÈNECH, J. L.; MENARGUES, A.; ROMO,G. (2012). «La integración de los trabajos prácticos en la enseñanza de la química como investigación dirigida». Educación Química, 23(1): 112-126.
SÁNCHEZ PISO, J.; DOMÍNGUEZ, J. M.; GARCÍA-RODEJA, E. (2002). «Revisión de la investigación sobre la enseñanza de la cinética química».Adaxe.Revista de Estudios y Experiencias Educativas, 18: 171-190.
SIERRA, J. L.; GARCÍA, A. M.; BOSQUE, J. M.; OLMO, M.; BLANC, M. R.; ALÉS, F.; GÁMIZ, L. (2008). «Aprendiendo sobre el equilibrio químico mediante investigación dirigida con laboratorios virtuales».A: Actas de los XXIII Encuentros de Didáctica de las Ciencias Experimentales Almeria: Universidad de Almería.
TORTOSA, M.;SÁEZ, M.; PINTÓ, R. (2007). «Experimentos en tiempo real para los cursos de ciencias en secundaria».
A: MEMBIELA, P.[ed.]. Experiencias innovadoras de utilización de las NTIC en actividades prácticas en ciencias. Vigo: Educación Editora, p. 145-163.
WHEELER, A. E.; KASS, H. (1978). «Student misconceptions in chemical equilibrium». Science Education, 62(2): 223-232.

Ángel Luis Torres Climent És llicenciat en química, màster en gestió de residus orgànics i professor de Física i química a l’IES Joanot Martorell d’Elx. És també coautor de diferents llibres i ha publicat articles sobre didàctica de la física i la química.
A/e: angeltorresfq@yahoo.es

Vicent F. Soler Selva És llicenciat en física i catedràtic de física i química a l’IES Sixto Marco d’Elx. Ha publicat treballs sobre didàctica i història de la ciència.
A/e: vicent.f.soler@gmail.com
Assajos fisicoquímics en el laboratori de grau mitjà de química
Physicochemical tests in the laboratory of intermediate level chemistry
Jordi Masip, Paz Gómez i Elena Andrés / INS Provençana (l’Hospitalet de Llobregat) / Generalitat de Catalunya. Departament d’Ensenyament
resum

En aquest article es descriu i es reflexiona sobre la planificació i la realització d’un crèdit d’assajos físics i fisicoquímics del cicle formatiu de grau mitjà de laboratori. Es descriuen els assajos i es comenten els resultats obtinguts pels alumnes i les seves dificultats. S’explica com la metodologia utilitzada en el desenvolupament de la part experimental permet assolir els continguts procedimentals del crèdit. Es fan servir metodologies basades en la construcció de coneixement de manera guiada, juntament amb el treball per experts i el treball cooperatiu. Es presenta la planificació del crèdit, inclosa la proposta d’avaluació.
paraules clau
Treball cooperatiu, grups d’experts, assajos físics i fisicoquímics, cicle formatiu, laboratori.
abstract
This paper describes and discusses the planning and execution of a physical and physicochemical credit testing of an intermediate laboratory VET course. We describe the tests and discuss the results obtained by the students and the difficulties encountered. We also explain how the methodology used in developing the experimental procedures achieves the contents of the credit. Methodologies for constructing knowledge are used in guidance of experts and cooperative work. The planning is also presented, including the credit assessment proposal.
keywords
Cooperative work, group of experts, physical and physicochemical tests, VET course, laboratory.
Introducció
L’objectiu d’aquest article és donar a conèixer una proposta metodològica per tal de desenvolupar les competències professionals en l’àmbit dels assajos de laboratori que han d’assolir els alumnes de grau mitjà de laboratori (fig. 1). La proposta pretén fer més similar al món laboral la realització dels assajos en un centre de formació. En l’article es descriuen alguns dels assajos que els alumnes realitzen al llarg del crèdit i se’n comenten els resultats i les dificultats.
Els alumnes del crèdit,generalment,són majors d’edat, fa temps que han deixat d’estudiar, tenen poques nocions de química i no disposen de grans coneixements teòrics i pràctics amb relació als assajos físics i fisicoquímics. En definitiva, busquen aconseguir una titulació tècnica que els permeti trobar una millor feina. També hi ha alumnes que provenen de l’ESO i d’un batxillerat no acabat, amb la qual cosa el grup és bastant heterogeni. Malgrat tot, la seva actitud i motivació davant els estudis fa que superin les dificultats inicials del
llenguatge químic i de la por a la manipulació.
1. Competències professionals.
Contextualització
El cicle de grau mitjà de laboratori, de la família professional química, conté deu crèdits associats a diferents mòduls professionals i diverses unitats de competència que capaciten l’alumne per treballar com a tècnic en molts tipus de laboratoris. Aquest cicle formatiu està regulat per la LOGSE (annex al Decret 307/1995, de 7 de novembre; Orientacions per al desplegament del currículum, 1997), té un durada d’un curs acadèmic i actualment està pendent la publicació al DOGC del nou currículum segons la LOE (Llei Orgànica 2/2006, de 3 de maig), que l’amplia a dos cursos.
Dins d’aquest marc normatiu, s’observa que els assajos físics i fisicoquímics tenen una gran rellevància, al mateix nivell que en el cas d’altres tipus d’anàlisis més conegudes, com ara les proves microbiològiques i les anàlisis químiques generals.
En el currículum del crèdit d’assajos físics i fisicoquímics s’especifica que,durant el curs, els alumnes hauran d’assolir les competències professionals (fig. 1) en assajos de resistència mecànica, assajos tèrmics, elèctrics, òptics, assajos fisicoquímics i assajos metal·logràfics, els quals s’han distribuït en dues sessions setmanals de dues hores cadascuna.






























Metodologia
El crèdit d’assajos fisicoquímics té un ampli ventall d’assajos, motiu pel qual,en els centres de formació professional, per falta d’equipaments (Guia d’equipaments de la família professional química, 2000), alguns d’ells s’han d’explicar de manera teòrica o bé per mitjà de visites externes a empreses. El professorat ha establert una metodologia diferent per a les diferents unitats didàctiques programades en el crèdit. En aquest article es tractarà la unitat didàctica 4 (UD4), majoritàriament pràctica, el contingut de la qual es presenta a la fig.2, on es mostren els nuclis d’activitat (NAi) i activitats (Ai) establerts en la programació didàctica.
L’objectiu, pel que fa als continguts conceptuals, és la construcció de coneixement de manera estructurada i la seva transferència i aplicació en la part pràctica i en altres unitats del crèdit.
Per tal de treballar els continguts procedimentals,es proposa de fer una «roda de pràctiques» (fig. 3), la qual respon fonamentalment a l’objectiu que els alumnes adquireixin un major grau d’autonomia en els aspectes procedimentals i manipulatius, alhora que permet la realització de la part pràctica quan no es disposa del material i els instru-













ments necessaris per fer simultàniament la mateixa pràctica amb tot el grup.
Les diferents pràctiques dissenyades per a la UD4es duen a terme per parelles, la manera habitual de treball en el laboratori del nostre centre. La parella que realitza en primer lloc una pràctica actua com a responsable i, per tant, adquireix el rol d’«experta» (Gómez, 2011). Mitjançant l’adjudicació del rol d’expert al primer grup que realitza la pràctica, es va transferint la informació d’aquest grup al següent. Per tant,els mateixos alumnes s’ajuden els uns als altres quan van rotant de pràctica, alhora que tenen sempre com a referència la parella experta.
El professorat ha elaborat dos documents de treball pràctic pera l’alumnat, els quals inclouen preguntes per relacionar els resultats amb la part conceptual de cada assaig i són a l’abast dels alumnes a l’espai virtual del crèdit: – Instruccions per desenvolupar cada pràctica (Azaustre et al., 2007).
– Formularis per realitzar un informe de cada pràctica,que els alumnes després lliuraran al professorat.
El grup expert de cada pràctica prepara per a tots els altres grups les dissolucions necessàries


























































i les mostres problemade les quals es determina alguna propietat. D’aquesta manera,es minimitzen els reactius necessaris i els residus generats durant les pràctiques.
La seqüenciació de l’activitat pràctica és la següent:
– Es construeix una taula d’assignació de pràctiques setmanal per a cada parella d’alumnes i se li assigna a cada parella el rol d’experta en el primer treball pràctic que realitza.
– Cada grup,setmanalment i segons l’assignació esmentada al punt anterior,realitza una de les pràctiques de la roda. En aquesta part, l’alumnat assoleix les capacitats manipulatives i procedimentals del crèdit.
– També setmanalment, els alumnes elaboren i lliuren al professorat un informe de la pràctica realitzada, que serà avaluat.
– Al final,l’alumne haurà de realitzar un parell de pràctiques, escollides pel professorat, seguint el procediment establert, alhora que donarà el valor de la propietat mesurada amb les xifres significatives i les unitats adients (avaluació final).
Assajos realitzats durant el crèdit
A continuació,es mostren alguns assajos de la programació seguint la nomenclatura de la fig. 2.Els objectius de tots els assajos estan relacionats amb les competències professionals que han d’assolir els alumnes del cicle formatiu de grau mitjà de laboratori.
NA1. Assajos químics
Els assajos químics que es realitzen en aquest crèdit són la determinació del pH i de la conductivitat. Són assajos que focalitzen la correcta utilització dels aparells, ja que en altres crèdits s’aprofundeix més en els conceptes químics involucrats.
NA1.A1. pH
L’objectiu d’aquesta pràctica és el calibratge, l’ús i el manteniment de pHmetres analògics i digitals. Així, doncs, es mesura el pH de solucions preparades pels alumnes i de productes comercials d’ús quotidià.
L’alumne observa les diferències en el valor del pH de les diferents dissolucions, com ara un vinagre concentrat i un altre de diluït, sals neutres i àcides i/o bàsiques, etc.
NA2.A2. Conductivitat
De la mateixa manera que en el cas anterior, l’objectiu d’aquesta pràctica és l’ús, el calibratge i el manteniment de conductímetres de diferents models, a més de trobar el valor de la concentració d’una mostra problema a partir de la seva conductivitat. Per tant, l’alumnat ha de mesurar la conductivitat de solucions patró, elaborar una taula de conductivitats de diferents patrons i, a partir de la interpolació en la recta de calibratge, trobar la concentració desconeguda. A la fig. 4 es mostren alguns dels resultats obtinguts pels alumnes.
Els alumnes partien de la hipòtesi que si mesuraven diverses vegades la mateixa mostra amb el mateix aparell, el resultat
seria el mateix, però van comprovar que no era així, la qual cosa es va convertir en una manera pràctica d’introduir conceptes de qualitat com ara sensibilitat, exactitud i precisió en la mesura
Amb aquestes pràctiques, els alumnes, a més de la part manipulativa, assoleixen continguts conceptuals relacionats amb els paràmetres de qualitat de les mesures amb aparells, a banda dels conceptes relacionats amb els electròlits de manera experimental.
NA2. Assajos físics
NA2.A1. Densitat
Els assajos de densitat es divideixen en dos tipus generals: la densitat de sòlids i la densitat de líquids (fig.5). No es realitzen densitats de gasos,ja que només es requereixen en les indústries productores de gasos.
A1.1. Densitat de líquids
Tot seguit, s’explica i es dóna el resultat d’una anàlisi de densitat d’un líquid amb el mètode de determinació de densitat més precís. En aquest mètode es fan servir el picnòmetrei la balança analítica.
Per dur a terme la pràctica, a l’alumne se li proporciona una mostra problema de concentració desconeguda i, a partir de la
determinació de la densitat de diferents dissolucions de concentracions ja conegudes,pot interpolar en una recta de calibratge el valor de la concentració de la mostra problema (fig. 6).
NA2.A2. Viscositat
En aquesta pràctica, es programen i es realitzen dos tipus d’assajos de viscositat:la determinació de la viscositat estàtica o relativa, d’una banda, i la determinació de la viscositat dinàmica o absoluta, de l’altra. En els primers,la força que fa fluir el líquid és la gravetat, mentre que en els segons ho fa un motor. Per calcular la viscositat estàtica,es mesura el temps de caiguda del líquid, mentre que la viscositat dinàmica la calcula directament l’aparell. La fig. 7mostra la llista d’assajos de viscositat realitzats.
A continuació,es fa una breu descripció de cadascun dels assajos.
A2.1. Assaig amb Cannon-Fenske
Aquest aparell (fig. 9) determina la viscositat relativa per mitjà dela mesura del temps que tarda un líquid a passar per dues marques. Aquest temps depèn de la fluïdesa del líquid i del capil·lar de l’aparell. S’utilitza en la indústria per determinar la viscositat de líquids molt fluids. Com que la viscositat depèn de la temperatura, de la concentració i del producte o material en qüestió, es van plantejar tres tipus de pràctiques:
– Mesura de la viscositat d’un líquid a diferents temperatures.
– Mesura de la viscositat d’alcohols primaris de diferent cadena lineal (taula 1).
– Mesura de la viscositat d’una mateixa dissolució a diferents concentracions.
En la taula 1 es mostra un exemple dels resultats obtinguts pels alumnes.
Així, doncs,els alumnes relacionen la viscositat amb la fór-
mula molecular de la substància que mesuren. Tal com es pot veure en la taula 1,una dificultat que es troben els alumnes a l’hora de donar un resultat és com cal establir correctament les xifres significatives, tot i que aquest és un aspecte que es tracta contínuament al llargdel curs. Els alumnes tenen la idea prèvia que com més decimals tingui el número,més exacte serà el resultat. En un altre crèdit del cicle formatiu, però, s’explica el con-
Taula 1. Resultats de l’assaig amb Cannon-Fenske
cepte xifra significativad’una mesura com els dígits que es coneixen no afectats per l’error. Es considera, doncs, que les xifres significatives d’un número són les que tenen significat o bé aporten alguna informació. Les xifres no significatives, d’altra banda, apareixen com a resultat de càlculs i no tenen cap significat.En aquest cas,les dades de partida per fer els càlculs tenen tres xifres significatives, motiu pel qual el resultat s’hauria de donar amb tres xifres significatives.
A2.2. Assaig amb Engler
Aquest aparell (fig. 8) està dissenyat per determinar la viscosi-
tat d’olis industrials o líquids d’alta viscositat. Actualment,encara s’utilitza en la indústria i els resultats es donen en graus Engler, unitat de mesura específica per a l’aparell.Per determinar la viscositat Engler,es realitza l’assaig per duplicat:un assaig amb el líquid problema i un altre assaig amb aigua destil·lada. Es mesura el temps de caiguda de 200mL de fluid problema i de 200 mL d’aigua destil·lada (els dos a la mateixa temperatura). El quocient dels dos temps dóna el valor de viscositat en graus Engler. En la taula 2 es mostren els resultats obtinguts pels alumnes amb dos tipus d’olis diferents.
En aquesta pràctica,els alumnes no han tingut cap tipus de dificultat i han vist clarament que la temperatura està relacionada amb la viscositat del fluid.
A2.3. Assaig amb copa Ford
El viscosímetre anomenat copa Ford (fig.9) es va dissenyar per mesurar la viscositat de les pintures. L’aparell és un recipient amb un orifici al fons per a la sortida del fluid, de diferents diàmetres normalitzats. Es mesura el temps que triga el fluid des que comença a caure fins a la primera ruptura del fil del fluid. El temps que tarda,en segons, correspon a la viscositat copa Ford,que s’expressa en graus Din. En el resultat, cal indicar la copa Ford utilitzada en funciódel diàmetre del forat de sortida (copa Ford 1, copa Ford 4).
En la taula 3 es mostren els resultats obtinguts pels alumnes per a una mostra de sabó.
3. Resultats de l’assaig amb copa Ford
Els alumnes han fet l’assaig amb diferents fluids (sabó, oli de gira-sol, etc.) i han observat que en alguns casos no s’observava la ruptura del fil. Mentre que alguns grups consideraven que l’aparell no funcionava, d’altres van concloure que caliautilitzar una copa Ford amb un diàmetre


de pas diferent. Per tant, han arribat a reflexionar sobre el tipus d’aparell més adequat en funció del producte del qual es vol mesurar la viscositat.
A2.4. Assaig amb reòmetre
A diferència de la resta dels aparells, el reòmetre (fig. 10) mesura la força rotacional necessària per fer fluir la substància problema. A partir de la represen-
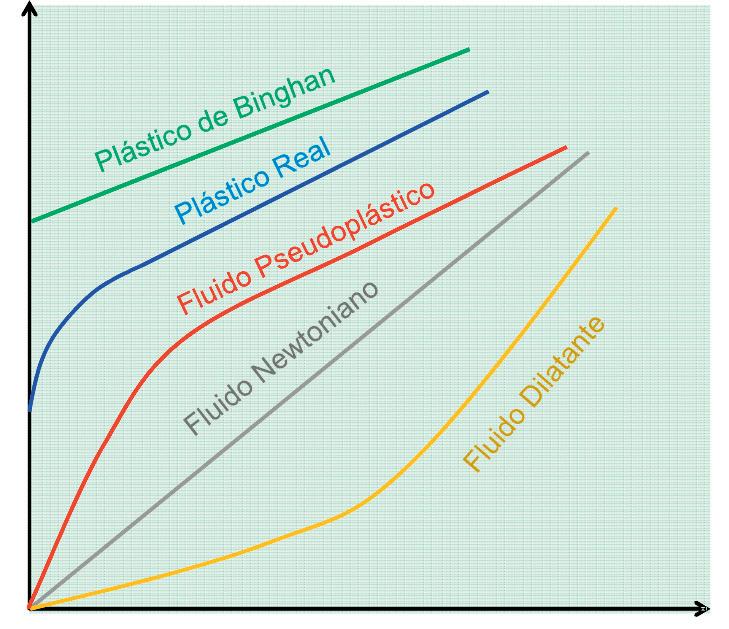


tació de les dades de la velocitat de gir i de la força parell motor, l’alumne podrà identificar, sobre la base de la variació de la viscositat, si es tracta d’un fluid newtonià o no newtonià.
A la fig. 11es mostren els resultatsobtinguts i la taula comparativa a partir dela qual els alumnes treuen conclusions del tipus de fluid que analitzen.
Tal com es pot observar en la fig.11, els alumnes disposen d’una gràfica entre el material del campus virtual que han de comparar amb les gràfiques que els han donat les diferents mostres.
A partir d’aquí,han de determinar quin tipus de fluid és la maionesa, la farina de blat de moro o el quètxup, productes que coneixen prou bé. La comparativa amb la fig. 12estableix que la farina de blat de moro és un fluid dilatant,no newtonià.
NA2.A3. Mètodes òptics
Els mètodes òptics a estudiar són molts i molt diversos. En aquest cicle formatiu, estan distribuïts en dos crèdits diferents. Els mètodes òptics que es treballen en el crèdit que analitzem, i que són molt utilitzats en el control de qualitat de productes, són els no espectroscòpics. Entre els que es tracten al crèdit 2,hi ha la polarimetria i la refractometria. En aquest article s’explica només l’assaig de refractometria.
A3.1. Refractometria
El refractòmetre (fig.13) mesura l’índex de refracció de la substància i els graus Brix. Els alumnes realitzen mesures a diferents temperatures per poder estudiar les variacions de l’índex de refracció en funció d’aquesta. Una altra activitat que es realitzaconsisteix a calcular el percentatge d’alcohol o de sucre d’una mostra a partir de la interpolació de la recta de calibratge, elaborada fent mesures d’índex
% propanol
Índex de refracció
0 1,3993
20 1,3958
40 1,3923
60 1,3888
80 1,3853
100 1,3825
Índex de refracció: n-butanol / n-propanol
y = -0,0002x + 1,3992 R = 0,99885
Índex de refracció n-propanol (%)
de refracció amb solucions patró de concentració coneguda.
En la fig.14 es mostren els resultats d’una activitat més complexa:la determinacióper refractometria del percentatge d’un alcohol en una barreja de dos alcohols.
Mitjançant la realització del mateix assaig però amb reactius o amb productes de la mateixa família, l’alumnat pot arribar a interpretar la matèria i la relació que existeix entre l’estructura atòmica (món microscòpic) i la propietat que es mesura (món macroscòpic). Alguns exemples poden ser els següents:
– Índex de refracció d’alcohols lineals: relació entre el nombre d’àtoms de carboni de la molècula i l’índex de refracció.
– Índex de refracció a diferents concentracions d’un mateix reactiu: relació entre la concentració i l’índex de refracció.
Aquests equips són analògics, de manera que els alumnes han de tenir prou habilitat a l’hora de trobar el valor de l’índex de refracció a l’escala que es veu a l’ocular. Quan no dipositen bé la mostra en el prisma,els resulta difícil d’enfocar i, per tant, treure un valor d’índex de refracció. D’aquesta manera,l’a-
Índex de refracció
Lineal (Índex de refracció)

lumnat aprèn la importància de dipositar acuradament la mostra itambé s’ha d’esforçar a rentar bé el prisma després de col·locarhi cada patró,si no vol obtenir lectures errònies en els patrons següents o en la mateixa mostra.
Proposta d’avaluació L’avalució de la part pràctica representa un cinquanta per cert del total de la nota de la unitat didàctica i consisteix en tres parts: l’informe de la pràctica, el diari de laboratorii la tasca desenvolupada en el laboratori. Els criteris d’avaluació dels informes comprenen una part general i una part específica de cada assaig. Inclouen les dades recollides i els resultats a partir del tractament d’aquestes dades. Els alumnes han de raonar la validesa dels resultats i interpretar-los; d’aquesta manera, es promou la utilització de programes informàtics per al tractament i la presentació de dades que, d’altra banda, necessitaran en el seu futur àmbit laboral. Malgrat que tots o gairebé tots els alumnes estan molt informatitzats, coneixen molt poc les tècniques de representació gràfica. Per aquest motiu s’han incorporat a la part pràctica unes nocions bàsiques de full de càlcul, per tal que els
ajudin en la detecció de possibles errades en la recollida de dades i en la interpretació de resultats.
Diari de laboratori
El primer criteri d’avaluació del diari és que els alumnes el vagin omplint cada dia a mesura que realitzen les pràctiques (fig.15).La resta dels criteris està relacionada amb la manera d’omplir el diari, en el qual es demanen dades que els alumnes recullen durant les pràctiques o bé dades dels reactius i els materials utilitzats, o també dades de caire més general,com ara la data de realització de l’assaig, etc.
Treball individual durant la realització de la part procedimental
Les pautes que s’han seguit per avaluar com treballen els alumnes en el laboratori es divideixen en tres parts bàsiques: la primera està relacionada amb la seguretat i la higiene, és a dir, es comprova que l’alumne treballa amb bata, amb els cabells recollits, amb el calçat i els pantalons adequats i que utilitza correctament els EPI (equips de protecció individualitzada),com ara les ulleres de seguretat i els guants (fig. 16).
D’altra banda, també es fan preguntes per saber si l’alumne


entén el procediment de la pràctica i si hi aplica coneixements procedimentals d’altres crèdits del cicle. Així, per exemple, si es demana en un punt del procediment de fer una dissolució, l’alumne haurà d’aplicar coneixements de cursos anteriors i mostrar la seva competència en aspectes concrets.
Així mateix, també es té en compte la cura del seu lloc de treball i del material que ha fet servir (tot ha de quedar net i en el seu lloc).
Conclusions
Entenem que,tot i que la primera finalitat del treball pràctic realitzat pels alumnes en el labo-
ratori en aquest crèdit d’assajos físics i fisicoquímics sigui l’aprenentatge manipulatiu i el reforç dels principis teòrics en els quals es basen les diferents tècniques analítiques, un objectiu clau és fer rèpliques dels assajos, comparar les dades obtingudes, comparar-les també amb dades de referència, etc., per tal d’apropar el treball pràctic als requisits del món laboral, on aquests aspectes són d’una importància cabdal.
L’alumnat desenvolupa competències sobre la naturalesa de la ciència i el treball professional:
– Interpretar el resultat.
– Decidir si el resultat és o no és possible(el professional que realitza un assaig és el primer a
observarun resultat i ha de ser capaç de distingir i raonar si aquest és possible o no).
– Unir el treball pràctic en el centre amb el treball pràctic en una empresa (valoració per part de l’empresa de la tasca de l’alumnat de manera que es posi de manifest el paper determinant d’aquesta tasca).
Es va preguntar als alumnes el seu parer en relació amb la metodologia de treball utilitzada i què els semblava el nou tipus d’organització i el treball per grups d’experts.
El grup d’alumnes pot comparar les diferències respecte de la metodologia utilitzada en altres crèdits en els quals tot el grup ha de fer alhora la mateixa pràctica.
A més, en el grup hi ha alumnes repetidors que poden establir comparacions amb la metodologia emprada durant el curs anterior, en el qual no s’utilitzaven els grups d’experts.En el cas de l’assaig de la viscositat d’un fluid amb un reòmetre, per exemple, com que només es disposa d’un aparell, el treball pràctic es feia de manera demostrativa amb tot el grup davant l’aparell, mentre que amb la roda de pràctiques cada parella ha hagut d’utilitzar l’aparell (fig. 17).
Podem concloure que,respecte dels cursos anteriors, les metodologiesdels grups d’experts i de la ronda de pràctiques han comportat els avantatges i desavantatges següents,segons el punt de vista del professorat i de l’alumnat:
Avantatges:
– Major autonomia per part dels alumnes.
– Major interrelació entre els alumnes.
– Augment de l’autoestima dels alumnes en tenir el grau d’experts.
– Millora de la comprensió de les instruccions de treball.
– Aprendre a col·laborar i ajudar la resta del grup.
– Augment del grau d’implicació i compromís dels alumnes.
– Presa de consciència de la limitació dels recursos en els centres.
– Tots els alumnes poden utilitzar tots els aparells (no es fan demostracions pràctiques al grup sencer).
– El professorat deixa de tenir tots els alumnes demanant ajut al mateix temps.
Desavantatges:
– Per al professorat, és complicada la posada en marxa de diferents pràctiques al mateix temps.
– El professorat ha de coordinar molt bé el temps de cada pràctica.
– Cal fomentar la implicació dels alumnes, sobretot per al seu rol d’experts.
– Desconfiança envers els experts.
Després de l’experiència viscuda, els professors consideren que la nova metodologia de la UD4 és una pràctica més enriquidora,ja que han observat que els alumnes aconsegueixen tenir una major autonomia i un major grau de manipulació en el laboratori.

És professor tècnic de formació professional(especialitat de laboratori) en el Departament de Química de l’INS Provençana de l’Hospitalet de Llobregat. És llicenciat en ciències químiques per la Universitat de Barcelona. Ha treballat durant prop de vint anys a la indústria, en el sector tèxtil i de serveis, com a cap de producció, gestió de qualitat i gestió de residus urbans i industrials.
A/e: jmasip25@xtec.cat
Agraïments
Els autors volen expressar el seu agraïmentd’unamanera molt especial a tots els alumnes delcicle de grau mitjà de laboratori, ja que, sense el seu treball, el seu esforç i la seva col·laboració i implicació, el treball dels autors no tindria cap sentit. Cal agrair-los també les observacions, els comentaris i les maneres d’aprendre, ja que tots plegats millorem contínuament. I s’ha d’agrair especialment a aquells alumnes que han participat en aquest article la tasca feta realitzant part de les fotografies que s’hi poden veure.
A Miquel Villalobos, que durant tants cursos ha format el professorat de la família química i ens ha involucrat en la seva manera de treballar en el laboratori.
Al grup de metodologies de l’Institut de Ciències de l’Educació de la Universitat Autònoma de Barcelona, per transmetre la sensibilització en altres maneres de treballar al’aula, com és el cas de l’aprenentatge basat en problemes, el treball col·laboratiu i els grups d’experts.

Paz Gómez Jorge
És professora d’ensenyament secundari (especialitat d’anàlisi i química industrial) a l’INS Provençana. És llicenciada en ciències químiques i diplomada en estudis avançats del programa de doctorat «Didàctica de les ciències i les matemàtiques» per la Universitat de Barcelona. És coordinadora de l’equip de química i col·laboradora en altres grups de l’Institut de Ciències de l’Educació de la UAB.
A/e: pgomez13@xtec.cat
Referències
AZAUSTRE, M.; MARTÍNEZ, L.; MOLINA, A. (2007). Recursos de la família professional química d’anàlisi i control. Crèdit 3: Assaigs físics. Barcelona: Generalitat de Catalunya. Departament d’Ensenyament.
<http://www.xtec.cat/web/rec ursos/famprof/quimica>
GÓMEZ, P. (2011).«El treball amb grups d’experts en el mòdul d’anàlisi instrumental d’un cicle formatiu de grau superior». Educació Química EduQ, 11: 17-25.
<http://blocs.iec.cat/scq/publi cacions/educacio-quimicaeduq-2/educacio-quimicaeduq/>
Orientacions per al desplegament del currículum: Cicle formatiu de grau mitjà. Laboratori (1997). Barcelona: Generalitat de Catalunya.Departament d’Ensenyament.
Guia d’equipaments de la família professional química: Laboratori d’assaigs físics (2000). Barcelona: Generalitat de Catalunya. Departament d’Ensenyament. <http://www.xtec.cat/web/rec ursos/famprof/quimica>

Elena Andrés González
És professora d’ensenyament secundari (especialitat d’anàlisi i química industrial) en el Departament de Química del’INS Provençana de l’Hospitalet de Llobregat. És llicenciada en ciències ambientals per la Universitat Autònoma de Barcelona i màster en qualificació pedagògica per l’Institut de Ciències de l’Educació de la Universitat de Barcelona.
A/e: eandre2@xtec.cat
La preparación de un perfume como herramienta didáctica para abordar contenidos curriculares del ámbito de la química en enseñanza media
La preparació d’un perfum com a eina didàctica per a abordar continguts curriculars de l’àmbit de la química en l’ensenyament mitjà
The preparation of perfume as a didactic tool to tackle curricular contents from the chemistry field of high school education
Fiorella
Silveira Segui / Laboratorio Tecnológico del Uruguay. Espacio Ciencia
resumen

En este artículo se explica el desarrollo de uno de los talleres del museo Espacio Ciencia en el que los alumnos aprenden sobre la historia y la química del perfume y ponen a prueba los sentidos para preparar y envasar su propia formulación. El artículo se centra en el proceso de extracción de aceites esenciales llamado enfleurage e informa acerca de la evaluación por parte de los profesores que asistieron al taller, a la vez que establece posibles vínculos con los programas de los cursos de química de enseñanza secundaria.
palabras clave
Divulgación, selección de solventes, química de los perfumes, enfleurage
resum
En aquest article s’explica el desenvolupament d’un dels tallers del museu Espacio Ciencia en què els alumnes aprenen sobre la història i la química del perfum i posen a prova els sentits per preparar i envasar la seva pròpia formulació. L’article se centra en el procés d’extracció d’olis essencials anomenat enfleurage i informa sobre l’avaluació per part dels professors que van assistir al taller, al mateix temps que estableix possibles vincles amb els programes dels cursos de química d’ensenyament secundari.
paraules clau
Divulgació, selecció de solvents, química dels perfums, enfleurage
abstract
This article explains the development of one of the Espacio Ciencia museum workshops, in which students learn about the history of perfume and test their senses to prepare and package their own perfume formula. The article focuses on the process of extraction of essential oils called enfleurage and reflects on the evaluation by teachers who attended the workshop while establishing possible links to secondary school chemistry programs.
keywords
Cientific literacy, history and chemistry of perfumes, solvent selection, enfleurage

Introducción
Los perfumes que encontramos en el mercado son líquidos, pero no siempre fueron así. En la Antigüedad, los perfumes se preparaban mezclando grasas con esencias aromáticas. Los griegos utilizaban un aroma para cada parte del cuerpo. En la Edad Media, los árabes descubrieron el alcohol y los perfumes comenzaron a prepararse disolviendo aceites y resinas aromáticas en alcohol, y observaron que de esta manera los aceites alcanzaban su plenitud aromática. El rey Felipe II de Francia concedió a los perfumistas, en 1190, el reconocimiento de su profesión. Se fijaron los lugares de venta de perfumes y se comenzó a percibir la utilidad social de estas sustancias. Fue entonces cuando se empezaron a crear escuelas donde se formaron los primeros aprendices y oficiales de esta profesión.El primer perfume famoso elaborado con alcohol fue la llamada agua de la reina de Hungría, también llamada agua de Hungría, que era el preferido de la reina consorte de Hungría, Isabel Lokietek (siglo XIV). En el siglo XVI,los perfumes se expandieron por toda Europa. Catalina de Médici llevó el perfu-
me de Italia a Francia y este país pasó a ser el «imperio de los perfumes». En el siglo XVIII,la reina de Francia, María Antonieta, importó de la corte de Inglaterra la costumbre de bañarse todos los días y de usar el perfume no para encubrir un mal olor, sino por razones sensuales, para atraer y excitar. El perfume, historia de un asesino es una película alemana del año 2006 basada en la novela homónima escrita por Patrick Süskind y ambientada en la Francia del siglo XVII (fig. 1).
A comienzos del siglo XX,Ernest Beaux presentó a la modista Coco Chanel varias muestras numeradas de perfume. Coco eligió la número 5 y el perfume Chanel n.º 5fue el primero en contener esencias sintéticas.
La química de los perfumes es muy compleja. Los perfumes son, desde el punto de vista químico, soluciones. Están formados por solutos que provienen de productos naturales: los aceites esenciales. Debido a su naturaleza, estos están en constante transformación. Es por esta razón que el aroma de los perfumes cambia con el tiempo. Los aceites esenciales se extraen utilizando varias técnicas. La destilación es una de
las más utilizadas (Devereux, 1993).
En la Antigüedad se utilizaba un método llamado enfleurage, que consiste en extraer los aceites esenciales utilizando grasa animal o vegetal. Los pétalos de flores como la rosa, la lavanda o el jazmín son colocados sobre una capa de grasa, repitiendo el procedimiento varias veces para que la grasa se sature de los aceites esenciales. Posteriormente, se extraen los aceites de la grasa utilizando alcohol.
Conocer la química de los perfumes es esencial para los perfumistas, quienes deben tener en cuenta varios factores a la hora de preparar una mezcla que guste a los consumidores (Winter, 1944).
Un taller sobre el perfume
Primeros pasos en el desarrollo del taller
Espacio Ciencia (fig. 2) es el museo de ciencia y tecnología del Laboratorio Tecnológico del Uruguay. Año tras año lo visitan más de cincuenta y cinco mil alumnos y docentes (en un país que tiene una población de tres millones de habitantes) de todas las ramas de la enseñanza con el objetivo






de motivar a sus alumnos a aprender ciencias. Se ofrecen desde hace diecisiete años visitas guiadas a grupos de estudiantes y desde hace algunos años, talleres temáticos, y es un referente para el sistema educativo.
El perfume es un tema de la vida cotidiana que permite ser abordado desde diferentes disciplinas y que abre la puerta a trabajar contenidos curriculares de la asignatura de Química desde una perspectiva lúdica.
El taller «El perfume» se ofrece a estudiantes de enseñanza media. Los talleres son espacios donde los alumnos adquieren un rol activo en la construcción de los conocimientos, trabajan en equipo y elaboran estrategias para la resolución de situaciones problema. Para realizar el taller, dividimos el grupo clase en cuatro.
La primera actividad del taller consiste en completar una línea del tiempo con tarjetas que contienen información y anécdotas acerca del perfume (fig. 3 y 4). La línea del tiempo está dividida en cuatro épocas de la historia: Edad Antigua, Edad Media, Edad Moderna y Edad Contemporánea. Cada equipo tendrá una porción de la historia y todas las tarjetas que completan la línea, y deben seleccionar las tarjetas que completan una determinada época. Para finalizar, cada equipo deberá compartir la información, de forma oral, con el resto de los equipos. Las anécdotas son, sin duda, lo que más llama la atención a los jóvenes y un recurso didáctico muy bueno para captar su atención desde el comienzo de la actividad.
La actividad continúa pasando de la historia a la práctica con la selección de solventes para preparar un perfume. Cada equipo dispondrá de una bandeja con cinco frascos que contienen vinagre, acetona, alcohol, hipoclorito

de sodio disuelto en agua y glicerina (fig. 5). Se seleccionan estas sustancias porque poseen aromas fácilmente reconocibles por los alumnos, ya que seguramente les son familiares. Además, son sustancias de bajo coste y fáciles de conseguir. La consigna es utilizar el olfato para seleccionar los frascos que utilizarán para preparar un perfume. Se espera que los alumnos seleccionen los frascos que contienen alcohol y glicerina. El alcohol es el solvente utilizado en la industria de los perfumes y la glicerina se utiliza en la industria cosmética como humectante. En los perfumes, la glicerina cumple la función de fijador, ayudando a que el perfume permanezca en la piel por más tiempo. Prácticamente todos los alumnos reconocen los aromas de los frascos. Sin dudas, los que son más penetrantes, como la acetona y el alcohol, son reconocidos casi de inmediato. Si bien los varones reconocen el aroma de la acetona, les da trabajo nombrarla, y dicen que es «algo para quitar el esmalte de uñas», mientras que las chicas conocen bien su nombre. Con respecto al resto de los frascos, la glicerina es identificada por su
viscosidad, ya que esta substancia se utiliza generalmente en cursos anteriores para estudiar esta propiedad de manera práctica. El hipoclorito de sodio y el vinagre, si bien no poseen aromas tan intensos, son reconocidos por los alumnos debido a su utilización en la vida cotidiana.
A continuación se habla a los alumnos del enfleurage y del procedimiento para extraer aceites esenciales. El enfleurage, método muy antiguo, les llama mucho la atención. Se emplea para extraer el aceite esencial de la rosa, el jazmín o la lavanda colocando pétalos de estas flores sobre grasa. Debido a que el procedimiento demanda mucho tiempo, no es posible realizar todas las partes del proceso, por lo que los alumnos observan un enfleurage preparado con hojas de lavanda.
Se anima a los alumnos a preparar su propio enfleurage poniendo en práctica el procedimiento que se explica en esta sección del taller. Surgen algunas dudas por parte de los alumnos, como, por ejemplo, qué grasa utilizar, si debe ser animal o vegetal. También preguntan sobre cómo controlar algunos factores,
especialmente la temperatura y la luz, y si es necesario guardarlo en algún lugar específico de la casa.
Los aceites esenciales: ¿qué son y cómo se obtienen?
¿Cuáles son los componentes aromáticos de un perfume? ¿De dónde se extraen? ¿Cómo se procede? Estas son algunas de las preguntas que respondemos para dar a conocer los aceites esenciales y su importancia en la fabricación de los perfumes. A continuación se presentan dos métodos de extracción de aceites esenciales.
Un método ampliamente utilizado para extraer aceites esenciales es la destilación. Consiste en calentar un líquido hasta que sus componentes más volátiles pasan a la fase vapor y, a continuación, enfriar el vapor para recuperar dichos componentes en forma líquida por condensación (Alegría et al., 2007).
El objetivo principal de la destilación es separar los componentes deuna mezcla aprovechando sus distintos puntos de ebullición. Si la diferencia de volatilidad (y, por lo tanto, en el punto de ebullición) entre los dos componentes es grande, puede realizarse fácilmente la separación completa en una destilación simple. Si los puntos de ebullición difieren ligeramente, no se puede conseguir la separación total mediante este tipo de destilación. Para separar los aceites esenciales del material vegetal, se utiliza generalmente la hidrodestilación, comúnmente llamada destilación por arrastre de vapor. El material vegetal entra en contacto directo con agua, en una especie de cocimiento, utilizando una plancha para calentar.
En el vegetal, los aceites esenciales se almacenan o se sitúan en glándulas, conductos, sacos, pelos glandulares o, simplemen-
te, reservorios dentro del vegetal, por lo que conviene hacer un desmenuzamiento del material a destilar para exponer esos reservorios a la acción del vapor de destilación. Al ser el espesor del material muy pequeño, la vaporización y la destilación son más efectivas y se acelera el proceso.
Por lo que respecta a las partes de la planta a destilar, las flores, hojas y partes blandas o delgadas pueden utilizarse sin ningún tratamiento previo. Las semillas o frutos deben ser triturados con rodillos lisos. Las raíces, tallos y otros materiales leñosos se cortan en trozos pequeños o en astillas. Se calienta la muestra durante varias horas, manteniendo la temperatura en torno a los 120 ºC; de esta manera, el agua, junto con los aceites esenciales, pasa a la fase vapor, llegando al refrigerante, donde son condensados y recogidos en un Erlenmeyer. Las dos fases se separan por decantación (Devereux, 1993).
En el sistema por absorción en frío se usa grasa, y difiere del procedimiento por maceración en que no es el perfume el que se disuelve directamente en la grasa por ósmosis, sino la parte aromática de las flores, que, volatilizándose, satura el aire del ambiente en la cámara donde se efectúa la operación, y la grasa, entonces, lo toma del aire, porque, teniendo ella una mayor afinidad que el aire por el perfume, lo absorbe tan pronto como se manifiesta su presencia (Segovia, 1958).
En la industria se utilizan bastidores de madera en cuyo fondo se fija una chapa fina de metal estañado. Se colocan varios de estos bastidores unos sobre otros en compartimientos especiales bien cerrados. Sobre la chapa estañada se extiende una capa de grasa de no más de 1 cm de espesor, y sobre la grasa se depositan con delicadeza las flores prolijamente repartidas en toda la


superficie. La grasa empleada para este procedimiento debe ser de la llamada grasa de riñonada, de vaca o de oveja, debido a que es la grasa más fina y delicada del animal. Algunos perfumistas suelen dar mayor solidez con el agregado de pequeñas cantidades de cera blanca pura. Nunca se deben emplear grasas minerales o parafina por ser perjudiciales. Se dejan las flores en contacto con la grasa durante una semana. Se retiran los pétalos marchitos y se sustituyen por otros nuevos. Luego se deja este preparado por una semana más (fig. 6).
Pasadas estas dos semanas, la grasa se encuentra saturada de los aceites esenciales de la flor y se llama concrète. Por último, se coloca la grasa que contiene el aceite esencial en un recipiente con alcohol. Se dejan en contacto por una semana, agitándolos varias veces al día, y se filtran descartando la grasa. El aceite esencial, al tener mayor afinidad por el alcohol, se disuelve en el mismo; finalmente, se evapora el alcohol para obtener la esencia. De 1.000 kg de flores, se obtienen de 180 g a 200 g de esencia (Segovia, 1958).
Últimos pasos en la preparación del perfume
El último paso previo a la preparación del perfume es seleccionar los aceites esenciales que se utilizarán para preparar el perfume. Los alumnos disponen de frascos con esencia de rosa, lila, madera, pachuli, eucalipto y limón. La instrucción es seleccionar un aceite esencial que será la base y del cual colocarán ocho gotas en un tubo de ensayo, y luego agregar siete gotas más de otro aceite esencial elegido (Zilliken, 2004). Es importante agitar muy bien después de cada adición. Una vez colocadas las quince gotas, se agrega alcohol hasta completar cincuenta gotas. Para finalizar, se agregan dos gotas de glicerina. Trasvasamos el perfume a un perfumero y ya está listo (fig. 7).
Según la bibliografía de referencia, un perfume contiene más de un 22 % de aceites esenciales. En esta actividad, los alumnos colocan un total de quince gotas de aceites esenciales y el volumen final es de cincuenta gotas,
de manera que el porcentaje en volumen es de un 30 % en aceites esenciales. Por lo tanto, concluimos que se ha preparado un perfume.
¿Qué aprenden los alumnos durante el taller?
Los alumnos aprenden a poner a prueba su creatividad y sus sentidos. Conocen las notas de los perfumes, los compuestos químicos presentes en los aceites esenciales. Aprenden a diferenciar un perfume de un agua de colonia, qué es el soluto y qué es el solvente de una solución, e incluso cuál es el perfume más caro del mundo.
La mayoría de los alumnos, antes de realizar el taller, desconoce cuál es la diferencia, desde el punto de vista químico, entre una colonia y un perfume. Solo saben que un perfume es mucho más costoso que una colonia.
En el taller se muestran algunos frascos con el objetivo de que los alumnos observen las etiquetas y se les anima a clasificar los frascos que tienen en sus casas utilizando la concentración y la siguiente categorización (Zilliken, 2004):
– Perfume: más de un 22 % de aceites esenciales.
– Agua de perfume: entre un 15 % y un 22 % de aceites esenciales.
– Agua de colonia: entre un 8 % y un 15 % de aceites esenciales.
– Colonia: menos de un 8 % de aceites esenciales.
Una propuesta para retomar los contenidos del taller en el aula
Para finalizar, sugerimos a los alumnos preparar un juego que puede resultar muy útil para retomar los contenidos trabajados en el taller al regresar al aula.
Se puede fabricar un juego de memoria de aromas cortando
veinte cuadrados. Luego se toman dos cuadrados y se perfuman con el contenido de uno de los perfumes preparados. Se repite el procedimiento con otros perfumes diferentes. Una vez que están todos perfumados, se colocan sobre la mesa. El juego comienza tomando un par de cuadrados yoliéndolos hasta lograr que coincidan los aromas. Gana el que junta más pares iguales. Para validar los aciertos, se sugiere formar un grupo jurado que posea habilidades para reconocer los diferentes aromas. Los alumnos reciben la propuesta con mucho entusiasmo y los docentes les solicitan, como tarea domiciliaria, traer los cuadrados para perfumarlos entre todos en clase. Esta dinámica permite conocer los perfumes que han preparado los diferentes alumnos, a la vez que pone a prueba nuevamente el olfato identificando los aceites esenciales que se encuentran en cada perfume.
La opinión de los docentes En Espacio Ciencia se realizan encuestas de todas las actividades del programa educativo (fig. 8).
La encuesta se emplea para evaluar los diferentes talleres que impartimos y cada docente marca el taller en el que participó para calificarlo en base a su experiencia.
Del análisis de las encuestas del año 2012 se desprenden los siguientes datos:
– Los docentes evalúan la modalidad del taller: excelente, 40 %; muy bueno, 50 %; bueno, 10 %.
– El interés de los alumnos: muy interesados, 60 %; interesados, 40 %.
– Recomendaría el taller a un colega: 100 % afirmativo.
– Utilizarían los contenidos en clase: 100 % afirmativo.
Además de planificar las actividades específicas de los talleres para que docentes y alumnos se sientan satisfechos y aprovechen su participación en el taller, uno de los objetivos educativos es que los docentes puedan utilizar esta forma de trabajo en el aula. El equipo de educación facilita que los profesores que realizan el taller con sus alumnos en Espacio Ciencia puedan diseñar y poner en práctica talleres temáticos para trabajar con sus alumnos de manera lúdica, y puedan también explorar otras formas alternativas de enseñar los diferentes conceptos. Mediante esta metodología se trabajan no solo contenidos conceptuales, sino también contenidos procedimentales y actitudinales, en la medida que se favorece el espíritu crítico y el trabajo en equipo.
Se formulan y nombran alcanos, alquenos, alquinos, alcoholes, aldehídos, cetonas, ácidos carboxílicos, etc. Los docentes de química encuentran a menudo muchas dificultades para trabajar con este tipo de compuestos de manera experimental, ya que el empleo de solventes orgánicos está limitado por razones de seguridad
Vinculación con los contenidos curriculares de los programas de química
La enseñanza media en Uruguay se divide en dos ciclos: uno básico y obligatorio llamado ciclo básico único (CBU) y otro superior llamado bachillerato. Comprende edades que van desde los doce a los dieciocho años. El programa
de tercer año del CBU de la enseñanza de la química a nivel medio aborda, entre otros, el estudio de los sistemas materiales (Lahore et al., 1999). Se trabaja con los conceptos sistema heterogéneo y sistema homogéneo. Los sistemas homogéneos se subclasifican en cuerpos puros y soluciones. También se trabajan las diferentes maneras de expresar la concentración de una solución: %, v/v y g/L (Alegría et al., 2007).
El perfume es una solución química: los solutos son los aceites esenciales y la glicerina, y el solvente es el alcohol. Así pues, el taller brinda la posibilidad a los docentes de química de introducir o reafirmar estos conceptos de manera práctica. Además, se establecen conexiones con la vida cotidiana, formulando preguntas a los alumnos sobre qué soluciones conocen de su vida cotidiana, cuáles son los solutos y los solventes, en qué proporción se presentan, etc.
Por otra parte, en el programa de primer año de bachillerato se trabaja la nomenclatura y formulación de los compuestos orgánicos. Se formulan y nombran alcanos, alquenos, alquinos, alcoholes, aldehídos, cetonas, ácidos carboxílicos, etc. Los docentes de química encuentran a menudo muchas dificultades para trabajar con este tipo de compuestos de manera experimental, ya que el empleo de solventes orgánicos está limitado por razones de seguridad, especialmente en actividades que impliquen cambios de temperatura o presión. Los aceites esenciales son compuestos orgánicos, por lo que esta actividad permite a los alumnos y docentes trabajar con fórmulas de aceites esenciales, reconociendo y nombrando grupos funcionales presentes en los mismos. Es una buena alternativa para comenzar la unidad didáctica
que trabaja estos temas. En los cursos superiores se retoman y profundizan los conceptos trabajados en estos cursos.
Nota
Puede conocerse Espacio Ciencia, las actividades que en él se desarrollan y la oferta educativa en http://www.latu.org.uy/espaciociencia
Referencias
ALEGRÍA,M. [et al.] (2007). Química: Estructura, comportamiento y transformaciones de la materia
Buenos Aires: Santillana.
DEVEREUX,C. (1993). Kit de la aromaterapia. Barcelona: Martínez Roca.
LAHORE, A. [et al.] (1999). Química Montevideo: Monteverde.
SEGOVIA, M. A. (1958). 100 industrias explicadas. Buenos Aires: Hobby.
WINTER, F. (1944). Perfumería moderna. Barcelona: Gustavo Gili.
ZILLIKEN, M. (2004). Perfume science Providence: Thames and Kosmos.

Fiorella Silveira Segui
Es profesora de química del Consejo de Educación Secundaria (Montevideo, Uruguay) desde el año 2001. Está en curso de obtener la maestría en Educación en Química por la Universidad de la República Oriental del Uruguay. Es coordinadora de Espacio Ciencia (Laboratorio Tecnológico del Uruguay). Ha desarrollado talleres lúdico-didácticos para niños y jóvenes. Es integrante de la Comisión Organizadora de la Semana de la Ciencia y la Tecnología en Uruguay. C. e. fsilveir@latu.org.uy, fiorellasil@gmail.com
A química das tintas e dos pigmentos. Um tema gerador para o ensino e a problematização de aspectos científico-humanísticos
La química de les pintures i dels pigments com a fil conductor per a l’ensenyament i aspectes problemàtics de la investigació científica i humanística
Chemistry of paints and pigments as a guiding theme for teaching. Problematic aspects of scientific and humanistic investigation
Welington Francisco / Universidade Federal do Tocantins. Campus de Gurupi
Wilmo Ernesto Francisco Junior / Universidade Federal de Alagoas. Campus de Arapiraca
resumo

As tintas e os pigmentos fazem parte de nossa vida desde a pré-história, quando os povos primitivos as usavam para decoração de cavernas e rochas. No entanto, com o passar dos tempos, tanto as tintas como os pigmentos se tornaram produtos bastante comercializados e úteis na e para a sociedade. Neste artigo, o objetivo é discutir a química das tintas e dos pigmentos como um tema gerador, abarcando questões históricas, composições, processos de fabricação e impactos ambientais, enfatizando um caráter científico de cunho mais humanístico.
palavras chave
Tintas, pigmentos, tema gerador, educação científica humanística.
resum
Les pintures i els pigments estan presents en la nostra vida des de la prehistòria, quan en la civilització primitiva s’utilitzaven per a la decoració en coves i minerals sòlids. No obstant això, durant l’evolució del món, les pintures i pigments han transformat una gran quantitat de productes comercialitzats i útils per a la societat. En aquest article, l’objectiu és analitzar la química de pintures i pigments com un fil conductor que abasta temes històrics, composicions, processos de fabricació i impactes ambientals, amb èmfasi en un caràcter científic humanista.
paraules clau
Pintures, pigments, fil conductor, educació científica humanística.
abstract
Paints and pigments have been present in our life since prehistory when primitive civilizations used them to decorate caves and solid minerals. However, during the evolution of the world, paints and pigments have transformed a lot of commercial and useful products for society. In this article, the goal is to discuss chemistry of paints and pigments as a guiding theme: covering historical issues, compositions, manufacturing processes and environmental impacts, and emphasizing a scientific humanist nature.
keywords
Paints, pigments, guiding theme, humanistic science education.
A tinta é uma mistura de vários insumosque juntos passam por um processo de cura (reações químicas que transformam a estrutura polimérica linear em estrutura polimérica tridimensional), formando assim um filme opaco e aderente. Esse filme formado tem como finalidades a proteção superficial de materiais contra a corrosão, identificação de problemas em tubulações e embelezamento de peças, acessórios e ambientes (Fazenda, 2009).
Na sua formulação, a tinta geralmente apresenta uma parte sólida que forma a película aderente no material a ser pintado (resinas ou veículos), imersa em um componente líquido, na maioria das vezes volátil (solventes orgânicos e às vezes água), sendo considerada também uma emulsão.Um terceiro componente importante são os pigmentos, que conferem a coloração para as tintas. Em algumas formulações são adicionados os aditivos, que auxiliam desde o processo de armazenamento até a formação do filme.
Os pigmentos são definidos como um particulado sólido, orgânico ou inorgânico, que seja insolúvel no substrato que será incorporado. Ademais, os pigmentos não podem reagir quimicamente com o material que ele será disperso (Bondioli, Manfredini e Oliveira, 1998). Podem ser conhecidos também como corantes e possuem como principal característica proporcionar a cor por dispersão mecânica no meio. É exatamente pela produção de cores, por meio dos pigmentos, é que as tintas se tornaram tão atrativas esteticamente.
Desta forma, o estudo das tintas e dos pigmentos permite debater diferentes conceitos químicos, tais como propriedades de substâncias, tipos de ligações químicas, forças intermoleculares, reações químicas dentre outras,
possibilitando uma profícua aproximação da relação CTS (CiênciaTecnologia-Sociedade) com os conhecimentos científicos. É nesse sentido que este trabalho visa debater a química das tintas e dos pigmentos, incluindo um breve histórico, seus componentes, sua produção e os seus impactos ambientais, levando em conta uma perspectiva científica de cunho mais humanística (Santos, 2008), que almeja problematizar uma formação mais social e crítica dos estudantes, fornecendo uma fonte para auxiliar o trabalho de professores do ensino médio e futuros professores (licenciandos).
A história das tintas
Acredita-se que as pinturas rupestres sejam os primeiros registros de utilização das tintas pela humanidade. Geralmente, essas pinturas expressavam hábitos triviais como cenas de pesca e caça, de guerra e até mesmo de sexo, onde a população utilizava, na verdade, pigmentos de origem inorgânica finamente triturados como: hematita (Fe2O3, óxido férrico) para a cor vermelha; goethita (FeO(OH), óxido ferroso com água de constituição) para o amarelo;para a coloração branca a caulinita [Al2Si2O5(OH)4] e para
a coloração preta a pirolusita (MnO2, óxido de manganês) (Mello e Suarez, 2012).
No Egito, o uso das tintas e dos pigmentos tinha essencialmente a função artística, sendo empregadas na decoração das pinturas de sarcófagos ou papiros de manuscritos e paredes. Na região eram empregados diversos pigmentos naturais como nas pinturas rupestres, no entanto, os egípcios foram os primeiros a desenvolverem os pigmentos sintéticos de coloração azul, que eram empregados nos preparados das tintas. O pigmento Azul do Egito (CaCuSi2O6) foi produzido a partirda calcinação de uma mistura de sílica (SiO2), óxidos de cobre (CuO e Cu2O) e sais de cálcio (p. e. CaCl2). Para ligar esses pigmentos naturais, os egípcios usavam goma arábica, clara e gema de ovo, gelatina e/ou cera de abelha. (Fazenda, 2009).
No Oriente, tanto os chineses quanto os japoneses utilizavam uma série de pigmentos naturais para inventar diversas cores. Além desses pigmentos, surgiu a primeira tinta de escrever, conhecida como nanquim (tinta-da-china), empregada em manuscritos datados de 2000 a. C. A primeira composição da tinta nanquim era uma dispersão de partículas de
Figura 2. Estruturas químicas de pigmentos sintetizados: 1 – verde de ftalocianina; 2 – amarelo Hansa; 3 – anil Índigo; 4 – púrpura de anilina.
carbono em água. Atualmente, o nanquim é preparado com nanopartículas de carbono esferoidais, conhecidas como negro de fumo, que é uma dos tipos de carvão mais puros. Ele é produzido a partir da combustão parcial dos gases metano (CH4) ou acetileno (C2H2), de acordo com as equações descritas abaixo:
CH4 (g) + O2 (g) → 2H2O (g) + C (fuligem)
2CH≡CH (g) + O2 (g) → 2H2O (g) + 4C (fuligem)
As civilizações gregas e romanas também contribuíram para a evolução das tintas. Nessa época surgiu a técnica conhecida como afresco, que utilizava como veículo umtipo de argamassa constituída de cal (CaO, óxido de cálcio), areia (composição básica de SiO2, óxido de silício) e água. Com a argamassa ainda fresca eram misturados os pigmentos, os mesmos usados pelos egípcios, e o produto era aplicado diretamente sobre paredes, colunas, estátuas, etc. Após a evaporação da água,gerava uma camada dura que mantinha a coloração inicial (Mello e Suarez, 2012).
Na época renascentista, cresceu o interesse pelo uso de óleos vegetais na produção de vernizes e tintas. Durante esse período cada artista era seu próprio fabricante de pigmentos e ligantes. Artistas como Rembrandt e Cuyp, ambos holandeses do século XVII e Leonardo da Vinci, usavam ligantes a base de vernizes de
óleos de linhaça (Linum usitatissimum) ou cânhamo (Cannabis ruderalis)para produzir essas tintas, conhecidas como tintas a óleo. Uma das principais propriedades das tintas a óleo é sua estabilidade frente à umidade e demais intempéries. Tal propriedade está relacionada com o processo químico de polimerização das duplas ligações presentes nas cadeias carbônicas dos ácidos graxos dos óleos vegetais de linhaça e cânhamo em contato com o oxigênio da atmosfera. Os principais ácidos graxos encontrados nos óleos de linhaça e cânhamo estão descritos na fig. 1. Porém, só foi a partir da Revolução Industrial que a tinta passou a ser desenvolvida como conhecemos hoje. O uso de resinas a base de copal (resinas duras, vítreas e extraídas de certas árvores da floresta tropical) e âmbar despontaram na Revolução Estadunidense e, em 1790, foram construídas as primeiras fábricas de vernizes na França, Alemanha e Áustria. No entanto, foi na Grã-Bretanha e na Holanda que despontou o emprego de produtos sintéticos na produção das tintas e que começou a fazer parte de estudos científicos.
Os primeiros resultados concretos destas revoluções foram às sínteses de novos pigmentos, como a púrpura de anilina, o branco de titânio (TiO2, óxido de titânio), o negro de fumo (supracitado), o anil de índigo, o amarelo Hansa, o azul da Prússia ([Fe(CN)6]4-), o verde ftalocianina
dentre outros (fig. 2), que substituíram os pigmentos a base de metais pesados de alta toxicidade, tais como o vermelho de chumbo (Pb3O4, cinábrio (HgS), amarelo de Nápoles [Pb3(SbO4)2] e o branco de prata (2PbCO3.Pb(OH)2). Ademais, surgiram diferentes resinas sintéticas como as epóxi, as acrílicas, as alquídicas, as vinílicas, as celulósicas, as de poliésteres etc, que serão discutidas adiante. Dentro dos aspectos históricos apresentados podem-se desenvolver muitas atividades. Primeiramente, poderia ressaltar a importância da evolução dos processos para fabricação e utilização das tintas, problematizando o valor das tintas em cada época e o que seus usos (como as pinturas nas cavernas, os escritos nos sarcófagos) representam nos dias atuais enquanto patrimônio históricocultural da humanidade. Questões disparadoras do debate poderiam ser: «Quem tem acesso a essas informações?», «As pessoas que não trabalham diretamente com esses aspectos têm como buscar esse conhecimento?», «E onde buscar?», «Por que estes desenhos e grafias são tão valiosos para a sociedade?», «Onde buscar tais informações e relatos?», «Será que existem essas decorações no Brasil?». Na era renascentista, o interesse em utilizar a tinta para questões artísticas está relacionado ao pensamento filosófico vigente da época. Nesses aspectos, podem-se desenvolver atividades interdisciplinares envolvendo a literatura, a filosofia e a história. Perguntas do tipo «O que levou a mudança tal abrupta na utilização das tintas?», «Que influências esse novo pensamento fez para a época e para as futuras?», «E em relação ao melhoramento das tintas, será que a nova visão alavancou estudos futuros?», podem ser orienta-
doras de debates. Cabe destacar aqui questões relacionadas à contaminação por chumbode vários pintores ainda no século XX Exemplo disso é caso de Cândido Portinari, morto poucos anos depois de finalizar sua grande obra Guerra e Paz, que se encontra na sede da ONU em Nova York, realizada quando o artista já se encontrava debilitado.
Componentes da tinta
O avanço tecnológico refletiu diretamente no desenvolvimento das tintas, cuja composição sofreu várias alterações e cada vez mais novos componentes surgem com diferentes funções. No entanto, a composição atual das tintas possui matérias-primas básicas que são empregadas em todos os tipos de tintas. Os componentes básicos são: as resinas, os pigmentos e os solventes. Contudo, será dado um destaque maior nas resinas que são os compostos responsáveis pelas propriedades gerais das tintas.
Resinas
As resinas, também conhecidas como veículos, compõem a parte líquida da tinta, juntamente com o solvente. A principal função das resinas é a formação das películas, as quais são responsáveis pelas propriedades físico-químicas das tintas, como resistência, brilho, secagem, aderência dentre outras. Essa película é formada por meio do processo de cura, que nada mais é que a polimerização das resinas, em uma estrutura tridimensional, após a evaporação dos solventes. Esses solventes em sua maioria são compostos orgânicos voláteis de diferentes classes orgânicas (fig. 3). O tipo de solvente deve ser compatível com as propriedades das resinas e os pigmentos, sobretudo, em termos de solubilidade e dispersão. Muitos estudos, sobretudo nos próprios centros



de pesquisa das indústrias, destacam a importância das tintas a base de água para diminuir o uso excessivo de solventes orgânicos. Um bom exemplo são as tintas látex.
No período da Revolução Industrial e consequentemente com os avanços tecnológicos disponíveis, foi possível o desenvolvimento de variadas resinas sintéticas com diferentes funções e aplicações. Destacam-se hoje em dia:
Resinas alquídicas (RA) e resinas de poliésteres (RP)
São polímeros produzidos a partir da reação química entre um ácido e um álcool, chamada de reação de esterificação (fig. 4).
A diferença é que as resinas alquídicas são produzidas a partir de óleos vegetais e as resinas de poliésteres não. As RA apresentam como vantagem o baixo custo na fabricação, porém, possuem baixa resistência química. São usadas em tintas que secam por oxidação ou polimerização com calor. As RP são empregadas para a fabricação de primers e acabamentos de cura à estufa, ou seja, formação de plásticos. Tais resinas são empre-
gadas na proteção de veículos, edifícios e mobiliários.
É salutar que a equação descrita acima segue um mecanismo de reação do tipo substituição nucleofílica, onde o nucleófilo (par de elétrons livres no átomo de oxigênio do álcool) ataca o centro reativo do ácido carboxílico (carbono ligado à dupla ligação com o oxigênio). Ressalta-se ainda que a produção dessas resinas é proveniente de uma reação de equilíbrio que necessita ser catalisada por ácido ou por base. No primeiro caso, é importante que os químicos responsáveis pela síntese retirem o produto formado constantemente para diminuir sua concentração no equilíbrio e, consequentemente, a reação tem seu equilíbrio deslocado para a formação dos produtos, uma vez que isso é de interesse no ponto de vista industrial. Já no caso da catálise básica, o equilíbrio é deslocado para o produto na etapa final da reação, favorecendo novamente a formação do produto de interesse. Reação semelhante a essa em outros processos industriais são as sínteses de biocombustíveis, que utilizam como reagentes os óleos vegetais e o glicerol.


5.
da reação de substituição nucleofílica entre a epicolidrina e o bisfenol A para produzir a resina epóxidica.


Resinas epóxidicas
Também conhecidas como resinas epóxi, essas resinas são polímeros caracterizados pela presença de grupos glicidila em sua estrutura molecular. São sintetizadas a partir da reação de polimerização por condensação entre a epicolidrina e o bisfenol A (fig. 5). Sua principal característica é a forte adesão às superfícies que serão pintadas, sendo utilizados em pinturas protetoras de navios, tambores, latas de conserva etc.
Resinas acrílicas
São polímeros de adição produzidos a partir do monômero metacrilato de metila (fig. 6). São consideradas resinas nobres, pois oferecemexcelentes resistências químicas, graças às ligações carbono-carbono que são muito mais resistentes do que ligações ésteres presentes em resinas alquídicas e de poliésteres. Seu custo é mais elevado devido suas melhores propriedades e são utilizadas
principalmente em vernizes automotivos, apresentando excelentes resistências químicas e mecânicas, além de excelente brilho.
Resinas vinílicas
São polímeros obtidos de acetato de vinila com outros monômeros, sendo a reação realizada em meio à emulsão com a água (fig. 7). Sua principal aplicação é na produção das tintas látex usada na pintura de residências em geral.
Pigmentos
Os pigmentos são compostos insolúveis nas resinas, ficando dispersos nela. São os responsáveis pela coloração das tintas e pela estimulação dos clientes pela variedade de cores. São chamados de pigmentos tintoriais e devem apresentar como qualidade principal a retenção da cor durante um longo período. Os pigmentos são classificados de acordo com sua origem (natural
ou sintético), composição química (orgânicos ou inorgânicos), preparação e uso. Geralmente, os pigmentos orgânicos apresentam tons mais brilhantes e um poder de coloração maior. Em contrapartida, os pigmentos inorgânicos apresentam maior estabilidade química e térmica (Bondioli, Manfredini e Oliveira, 1998).
Alguns pigmentos possuem propriedades anticorrosivas como o zarcão (mistura de tetróxido de chumbo – Pb3O4, contendo de 1 % a 2 % de PbO ou plumbato de chumbo Pb2PbO4) e cromato de zinco (ZnCrO4), conhecido como o primer (Gentil, 2007). Além dos pigmentos orgânicos apresentados na fig.2, são utilizados ainda pigmentos inorgânicos como: o dióxido de titânio (TiO2) e óxido de zinco (ZnO) para a obtenção da coloração branca, óxido de ferro (FeO) para a coloração preta, verde de cromo (Cr2O3) para a zcor verde, pó de alumínio (Al, metalizado) dentre outros (Gentil, 2007).
No entanto, o que vale destacar é como esses pigmentos apresentam essas cores. No caso dos pigmentos orgânicos a coloração surge devido à absorção da luz branca (radiação eletromagnética) pelos grupos cromóforos (partes da substância que apresenta ligações duplas em um sistema conjugado) das substâncias em certos comprimentos de onda e consequentemente a reflexão da cor complementar à absorção. Nos pigmentos inorgânicos a cor surge por causa da transferência de carga entre o doador e o receptor. Quando o pigmento absorve a luz branca, elétrons livres presentes no doador (na maioria dos casos o átomo de oxigênio) ficam excitados e são transferidos aos orbitais d (níveis mais energéticos) dos metais de transição que estão ligados ao oxigênio. Quando esses elétrons retornam ao estado fundamental (baixa energia), ocorre à reflexão de uma cor característica
que está relacionada com a energia liberada.
Ao abordar tais conhecimentos científicos, podem-se montar atividades sobre interações intermoleculares, funções orgânicas, propriedades e reações de compostos orgânicos e inorgânicos, solubilidade e iniciar algumas discussões no caráter CTS com ênfase nas condições humanas como:
– O que influenciou nas mudanças das resinas naturais para as sintéticas? Como foram debatidas essas questões? Será que a sociedade (consumidores) participou ou fora excluída?
– O que aconteceu com os preços das tintas com esse conhecimento tecnológico incluído? Ainda existem tintas que utilizam resinas vegetais? Quais?
– Qual a importância de ter diferentes resinas para compor as tintas? No que elas influenciaram e influenciam a qualidade das tintas?
– Se essas mudanças não fossem pensadas, quais consequências poderiam ser enfrentadas pela humanidade?
– O que realmente difere as tintas à base de água ou à base de solvente orgânico? A qualidade mudou? Se sim, o que foi feito para buscar a qualidade futura?
– Houve uma diminuição no impacto ambiental? Os detentores desta tecnologia mostraram resultados favoráveis?
– Esse investimento gerou aumento nos preços? Qual o impacto na sociedade?
Para problematizar a utilidade dos pigmentos, questionamentos do tipo «Por que os fabricantes usam e abusam das cores?», «O que essa “mágica” ajuda em marketing e vendas do produto?», poderiam ser uma alternativa. Atividades voltadas para pesquisas e projetos também podem ser aplicadas. Um exemplo seria propor uma pesquisa de comparação das variedades de cores na época
dos avôs dos estudantes com a situação atual, traçando assim um paralelo entre as necessidades sociais e humanas de uma época e outra; ou realizar uma pesquisa de campo para saber o que as cores influenciam os consumidores, na hora da compra de um.
Aspectos e impactos ambientais causados pelas tintas
Tanto o uso quanto a produção das tintas são indispensáveis hoje em dia. Seja para embelezar um determinado local, proteção de materiais ou para fins econômicos pessoais ou sociais. No entanto, muitos dos componentes empregados na produção das tintas são altamente tóxicos e podem levar a danos ambientais, caso não se tome os devidos cuidados com os descartes, armazenamentos ou produção.
Além desses fatores, existem outros não menos importantes que incluem o consumo de água, ás vezes excessivo, e o uso de fontes de energia indiscriminado. Quanto ao uso da água, quem sofre o maior impacto ambiental são os aquíferos subterrâneos, pois a exagerada perfuração desses poços leva a uma grande diminuição do nível de água. Com isso, há um aumento gradativo dos custos, principalmente no bombeamento das águas e na produção.
Em relação às fontes de energia, muitas das fábricas de tintas utilizam óleo diesel, óleo combustível ou gás natural para a geração de calor nas operações. Estes tipos de fontes de energia contribuem bastante para o aquecimento global, uma vez que liberam grandes quantidades de monóxido de carbono (CO2) e outros óxidos derivados de nitrogênio (NOx) e enxofre (SOx), além de compostos particulados na atmosfera (Guia técnico ambiental..., 2006).
Dentro dos componentes tóxicos, irritantes ou corrosivos podem-se citar as resinas, os pig-
mentos e os solventes. Estes podem interferir no meio ambiente de diversas formas, sendo a principal delas a emissão de compostos voláteis para a atmosfera. Esses compostos são emitidos nas etapas de combustão incompleta, na limpeza dos equipamentos ou mesmo quando ocorrer vazamentos das embalagens, durante a produção das tintas.
Os efluentes líquidos são outro tipo de impacto ambiental. A maior fonte de emissão de efluentes é a lavagem entre os lotes de cores. Geralmente é utilizado água, algum solvente orgânico ou até mesmo hidróxido de sódio (NaOH). Esses efluentes contêm altas concentrações de resíduos sólidos e solventes que, geralmente são jogados no solo ou nas águas, sem nenhum tratamento prévio.
Os efeitos causados pelos efluentes dependem do tipo de poluente que está agregado. Quando esse poluente for óleos e graxas, eles afetam a transferência de oxigênio da atmosfera para o meio hídrico devido à baixa solubilidade destas substâncias na água, trazendo sérios danos a vida aquática. Quando o poluente são os solventes, eles poluem diretamente solos e águas, alterando o pH. Essa alteração pode levar a mortes de vegetação e animais, provocando uma cadeia de impactos ambientais. Em relação aos pigmentos e aditivos, a maioria deles apresenta metais pesados na composição. Estes metais pesados são extremamente tóxicos e cancerígenos, levando a grandes prejuízos ambientais e consequentemente à sociedade. A melhor forma de combatê-los é substituindo-os por outras substâncias.
Todas essas questões podem fazer parte de um projeto de pesquisa, organizado e mediado não apenas pelo professor de química, mas como um projeto pedagógico da escola que inclua também a
participação dos licenciando, pois permitirá uma maior aproximação e uma experiência fidedigna para esses futuros professores. Esse projeto pode ser guiado sob as diretrizes da chamada química verde, que visa à utilização de técnicas químicas e metodologias que reduzem ou eliminam o uso de solventes e reagentes potencialmente tóxicos, ou a geração de produtos e subprodutos que são nocivos à saúde humana ou ao ambiente.Incluir tais atividades na escola pode proporcionar um aprendizado mais crítico sobre os impactos ambientais provocados pelos produtos industrializados e informar sobre doze princípios que regem a química verde:
1°Prevenção.
2°Eficiência atômica.
3°Síntese segura.
4°Desenvolvimento de produtos seguros.
5°Uso de solventes e auxiliares seguros.
6°Busca pela eficiência de energia.
7°Uso de fontes de matéria-prima renováveis.
8°Evitar a formação de derivados.
9°Catálise.
10°Produtos degradáveis.
11°Análise em tempo real para a prevenção da poluição.
12°Química intrinsecamente segura para a prevenção de acidentes.
Vale ressaltar que o uso das tintas é sem dúvida importante para a sociedade, contudo, o que está em projeção aqui é a formação dos estudantes com uma visão científica humanística. Assim, os estudantes não podem simplesmente tomar decisões do tipo: «as tintas são prejudiciais para o ambiente» ou «temos que parar de usá-las». É fundamental que as atividades desenvolvidas propiciem a manifestação de habilidades e competências que lhes permitam avaliar as possibilidades e possíveis soluções para os impac-
tos ambientais, percebendo a importância desse conhecimento tecnológico, mas associado às condições humanas em todos os pontos de vistas.
Considerações finais
Sem dúvida, as tintas fazem parte da vida desde tempos remotos. A evolução nos processos de fabricação e na composição está diretamente atrelada às novas tecnologias, equipamentos, máquinas e matéria-prima de melhor qualidade. No entanto, é importante salientar que estes conhecimentos e as diversas aplicações devem condizer com a necessidade e a realidade da humanidade, pois só assim a ciência pode ser mais bem compreendida.
Portanto, este artigo buscou apresentar a química das tintas como um tema gerador, apresentando diversos apontamentos com o intuito de promover um aprendizado científico com caráter mais humanístico. Assim, espera-se que este texto possa auxiliar professores de química e licenciandos em química (futuros professores) para que, sempre que possível, estimulem a educação científico-humanística em suas aulas, problematizando o papel dos avanços tecnológicos para a sociedade e a melhoria das condições humanas, contribuindo para que os estudantes possam pensar mais criticamente a ciência enquanto propulsora destes avanços.
Referências
BONDIOLI, F.; MANFREDINI, T.; OLIVEIRA, A. P. N. (1998). «Pigmentos inorgânicos: Projeto, produção e aplicação industrial». Cerâmica Industrial, 3(4): 13-17.
FAZENDA, J. M. R. (2009). Tintas: Ciência e tecnologia.São Paulo: Blucher.
FREIRE, P. (2011). Pedagogia do oprimido. Rio de Janeiro: Paz e Terra. GENTIL, V. (2007). Corrosão. Rio de Janeiro: José Olympio.
Guia técnico ambiental tintas e vernizes: Série P+L (2006). São Paulo: CETESB. Secretaria do Meio Ambiente.
MELLO, V.M.; SUAREZ, P.A. Z.(2012). «As formulações de tintas expressivas através da história». Revista Virtual de Química, 4(1): 2-12.
SANTOS, W. L. P. (2008). «Educação científica humanística em uma perspectiva freireana: Resgatando a função do ensino de CTS». Alexandria, 1(1): 109-131.

Welington Francisco É mestre, licenciado e bacharel em Química pelo Instituto de Química de Araraquara–UNESP. Atualmente é professor assistente da Universidade Federal do Tocantins (UFT,Campus de Gurupi), do colegiado de ciências exatas e biotecnológicas. Suas principais áreas de atuação são instrumentos metodológicos de ensino/aprendizagem e ensino de química. E-mail: welington@uft.edu.br

Wilmo E. Francisco Junior É bacharel/licenciado em Química, mestre em Biotecnologia e doutor em Química pelo Instituto de Química de Araraquara–UNESP e mestre em Educação pela Universidade Federal de São Carlos. Foi professor da Universidade Federal de Rondônia e atualmente é professor da Universidade Federal de Alagoas. Suas principais áreas de atuação são educação em ciências (química), experimentação, leitura e escrita.
E-mail: wilmojr@bol.com.br
Química en pequeñas dosis:
los tintes
Química en petites dosis: els tints
Chemistry in small doses: dyes
Javier Medina Fernández, Paz Posse Hernanz y Carmen Guerra Retamosa / Área de Ciencias y Educación. Parque de las Ciencias (Granada)
resumen

Este artículo explica la actividad «Los tintes», que forma parte de «Química en pequeñas dosis», un espacio permanente en el que se realizan pequeñas demostraciones y experimentos que se acompañan de curiosidades y utilidades relacionadas con el mundo de la química. La actividad introduce al visitante del museo en el fascinante mundo del color y de la síntesis química, a través de un recorrido en el tiempo sobre la utilización de algunos tintes o colorantes, la extracción de pigmentos vegetales y las relaciones luz y color, y tiene también entre sus objetivos el apoyo a la comunidad educativa.
palabras clave
Divulgación, tintes, extracción pigmentos vegetales, luz y color.
resum
Aquest article explica l’activitat «Els tints», que forma part de «Química a petites dosis», un espai permanent on es realitzen petites demostracions i experiments que s’acompanyen de curiositats i utilitats relacionades amb el món de la química. L’activitat introdueix el visitant del museu en el fascinant món del color i de la síntesi química, a través d’un recorregut en el temps sobre la utilització d’alguns tints o colorants, l’extracció de pigments vegetals i les relacions llum i color, i té també entre els seus objectius el suport a la comunitat educativa.
paraules clau
Divulgació, tints, extracció pigments vegetals, llum i color.
abstract
This article explains the activity Dyes, part of Chemistry in small doses, a permanent space where small demonstrations and experiments with explanations about curiosities and utilities related to the world of chemistry are explained. The activity of the museum introduces visitors to the fascinating world of colour and chemical synthesis, through a journey in time on the use of certain dyes or colorants, the extraction of plant pigments and light and colour relationships, and also has supporting the educational community as one of its objectives.
keywords
Popular science, dyes, extraction of pigments of plants, light and colour.
Introducción «Química en pequeñas dosis» se planteó, dentro de la celebración del Año Internacional de la Química(AIQ) 2011, como una actividad que pretendía introducir a los visitantes en el mundo de la historia de la química, a partir de unas sencillas experiencias acom-
pañadas de personajes históricos, polémicas científicas, anécdotas y curiosidades que articulan el discurso en torno a la demostración. Se trata de una actividad dedicada al público general del museo con el objetivo de poner de manifiesto que la química es uno de los motores más impor-

Figura 1. Espacio «Química en pequeñas dosis».



tantes del bienestar de la sociedad actual. La actividad fue diseñada por el Departamento de Educación y Actividades y constaba de cuatro sesiones que se desarrollan en el hall del museo (fig. 1) en un horario definido.
Las experiencias propuestas fueron: preparación de una muestra de gel de baño (fig. 2), extracción de pigmentos (fig. 3), fabricación de un circuito impreso (fig. 4) y determinación de vitamina C (fig. 5). Dichos experimentos son perfectamente extrapolables al contexto de la educación formal y podríanadaptarse para ser incorporados al desarrollo curricular desde distintas disciplinas: ciencias de la naturaleza, biología, tecnología, física y química de secundaria y conocimiento del medio en la educación primaria. Se trata, por tanto, de una aproximación interdisciplinar. Actualmente se siguen haciendo las cuatro actividades que se diseñaron con motivo del
AIQ 2011 y se ofrecen al público en general.
En este artículo se presentala actividad «Los tintes»,que forma parte de«Química en pequeñas dosis», queobtuvo el primer premio en la categoría de demostraciones de química en la onceava edición de Ciencia en Acción.
Química en pequeñas dosis: los tintes
Objetivo, desarrolloehilo conductor de la actividad
El objetivo de este centro de interés con enfoque CTS es reflexionar sobre la química del color a partir de la historia de los tintes, por su importancia económica y el papel que jugaron en la industria textil dentro de la revolución industrial.En el desarrollo de la actividad, se realiza una experiencia de laboratorio de extracción de pigmentos fotosintéticos que ejemplifica la presencia de compuestos responsables

del color en los vegetales y una técnica para su extracción y separación.
La actividad se desarrolla siguiendo un discurso interactivo y con soporte audiovisual y se estructura con un hilo conductor que sigue la evolución del tiempo, quese acompaña de una serie de imágenes,algunas de las cuales aparecen en este artículo. Es lo suficientemente versátil como para adaptarse al perfil del visitante, permitiendo hacer hincapié en los aspectos más anecdóticos, científico-técnicos o históricos, según sus intereses.
Se empieza con una pequeña charla en la que sepregunta a los visitantes sobre el color de su ropa, de su pelo y acerca del precio de la ropa en función de su color. Introducimos términos tales como matices, tonos, sombras, profundidad… todo aquello que despierta «la pasión por el color», pero ¿somos conscientes de la cantidad de compuestos químicos que hay detrás de nuestro universo en color?
A continuación, el discurso explica para qué son y para qué se utilizan los tintes, así como los pasos seguidos desde el empleo de productos naturales hasta la síntesis de substancias con esta finalidad. Se explican las ideas que se exponen en los siguientes párrafos.
Los tintes sirven para dar a un objeto, generalmente un tejido, un color distinto al que tenía. Son
substancias capaces de teñir las fibras vegetales y animales.Hay tintes naturales y otros de origen sintético. Se han usado desde los tiempos más remotos, empleándose para ello diversas materias procedentes de vegetales (cúrcuma, índigo natural, etc.) y de animales (cochinilla, moluscos, etc.) así como distintos minerales.
La utilización de sustancias naturales como tintes se remonta a miles de años. Antes del 3000 a. C., los chinos conocían las técnicas de extracción y preparación. Los tintes se obtenían principalmente de las hojas, raíces y cortezas de las plantas. La mayoría de estos tintes no se adherían permanentemente a las fibras, que tenían que ser pretratadas con «mordientes», substancias usadas en tintorería para fijar los colores a las fibras.
La síntesis de los primeros colorantes permitió la accesibilidad de todos los colores a todas las clases sociales, permitiendo así lo que podríamos denominar como la democratización del color
Este tema permite, además, señalar las implicaciones medioambientales de la síntesis de este tipo de compuestos, haciendo hincapié en la ambivalencia de la mayoría de los avances científico-tecnológicos. El problema de la contaminación ambiental asociada a la industria de los colorantes es bastante conocido,

Extracción de pigmentos fotosintéticos
Material
– Mortero
– Tijeras
– Embudo
– Gradilla con tubos de ensayo
– Placas de Petri
– Papel de filtro
– Material biológico: hojas de diferentes vegetales
– Alcohol
Procedimiento

1.Se trocean hojas de vegetales con las tijeras sobre un mortero.
2.Se cubren con alcohol y se trituran hasta lograr una buena homogeneización, para que el alcohol esté bien coloreado (fig. 6).
3.Se filtra el contenido del mortero sobre un vaso de precipitado.
4.Se vierte el filtrado en una placa de Petri y se coloca sobre ella un rectángulo de papel de filtro doblado por la mitad formando un ángulo.
5. Se espera hasta que el alcohol y los pigmentos vayan ascendiendo por el papel, produciéndose la separación cromatográfica.
La cromatografía es una técnica de separación que se basa en las diferentes velocidades de desplazamiento de los componentes de una mezcla en una fase estacionaria (en este caso, el papel) al ser arrastrado por una fase móvil. Permite así separar los distintos componentes.
aunque tal vez lo sea menos el número de especies que se salvaron a partir de la síntesis en el laboratorio de determinados colorantes.
Por otro lado, se explica que las substancias que dan colores diversos a los vegetales son los pigmentos fotosintéticos, que uno de ellos es la clorofila, res-

ponsable del color verde de las plantas, que tiene un papel importante en la fotosíntesis y se encuentra el los cloroplastos, en el interior de las células vegetales.Estos pigmentos son insolubles en agua pero solubles en disolventes como el alcohol o la acetona, y se realiza un experimento de extracción de pigmen-



tos. Al romper las células vegetales en el mortero, los pigmentos que se hallaban encerrados en los cloroplastos, en el interior de las células, pasan al alcohol. En numerosas ocasiones, uno de los pigmentos es más abundante y enmascara a los demás, que no se pueden observar. La separación se produce en la hoja de papel de filtro colocada sobre la placa, ya que estos se desplazan a distinta velocidad, permitiendo así la formación de distintas bandas. En la disolución extraída del vegetal tendremos, como mínimo, tantos pigmentos como bandas coloreadas aparezcan en la cromatografía.
El índigo y la púrpura de Tiro: desde sus orígenes hasta su síntesis En el discurso expositivo de la actividad, se dedica especial atención al índigo y a la púrpura de Tiro, tintes de origen vegetal y animal, respectivamente. Se explican desde las leyendas de su descubrimiento en la Antigüedad hasta su proceso de síntesis, y se comentan las fórmulas químicas de las substancias que contienen.
Losprimeros tintes presentaban muchos problemas: dificultad de obtención, escaso rango de colores, que se iban perdiendo en los lavados y estropeándose al sol, etc.El azul fue un color muy buscado, puesto que, a diferencia del rojo o el amarillo,
no es muy frecuente en las plantas.
La Indigofera tinctoria (fig. 7), característica de climas tropicales y subtropicales, era una de las plantas de las que se podía obtener el azul. El índigo también se producía en zonas más templadas a partir de la Isatis tinctoria
Las hojas frescas de estas plantas no son azules, pero, después de una fermentación alcalina, seguida de una oxidación, aparece el color azul (fig. 8 y 9). La extracción del tinte se sigue realizando en la actualidad en el coloreado de «prendas ecológicas». El precursor del índigo es el indican, que tras la fermentación básica se transforma en indoxol, el cual reacciona con el oxigeno del aire y produce el índigo (fig. 10, 11 y 12).
El índigo era una sustancia valiosa, pero el más caro de todos era la púrpura de Tiro, la cual fue usada por los fenicios en la ciudad de Tiro. En algunas culturas este color estaba restringido por ley al rey o el emperador.
Se conocen distintas leyendas que hacen referencia al descubrimiento de la púrpura de Tiro. Una de ellas cuenta que Herades, el dios fenicio protector de Tiro, paseaba con su perro cuando observó que el morro de este se coloreó de morado al morder una concha,y así nació el conocido tinte púrpura de Tiro.La mitología griega y romana atribuyen el
descubrimientoa Helena, cuando se encontraba paseando por la playa de Troya, donde permanecía cautiva. Helena hizo que le tiñeran un vestido con el color del que había quedado teñido su perro al morder un molusco,y se convirtió en la persona que por vez primera lució la que sería la más distinguida de las vestimentas.
La púrpura de Tiro se obtenía de la secreción de un molusco gasterópodo perteneciente al género Murex (fig.13). Del compuesto secretado (fig. 14) se obtiene por oxidación la púrpura de Tiro (fig. 15),un dibromo derivado del índigo (fig. 12). El bromo se encuentra raramente en plantas o animales terrestres, si bien es abundante, como el cloro y el yodo, en el agua




del mar. Por eso no es sorprendente encontrar bromo incorporado en compuestos de fuentes marinas.
Se estima que se necesitaban nueve mil especímenesdel molusco gasterópodo del género Murex para hacer 1 g de púrpura de Tiro, por lo que el procedimiento era muy lento y costoso. Además del increíble color que generaba la tintura, una vez fijada a un tejido su color no desmejoraba con el tiempo, sino que con el paso de los años iba adquiriendo un color más puro y apreciado. El potente tinte, que valía más que su peso en oro, se utilizó desde al menos el 1600 a. C. en Creta, donde las altas capas sociales lo adoptaron como símbolo aristocrático. Existen pruebas arqueológicas de esta «actividad química» en la costa oriental del Mediterráneo.
La producción y exportación de púrpura comenzó alrededor del 1200 a. C., alimentada por la expansión fenicia en el Mediterráneo. En el siglo III a. C., la púrpura de Tiro era más valiosa que el oro: solamente un 1 kg costaba tres veces el salario anual de un panadero romano.
La púrpura de Tiro coloreó las togas y vestiduras ceremoniales de los senadores romanos, los faraones egipcios y la nobleza y realeza europeas. Hacia el 400d. C. el molusco estaba en peligro de extinción.La milenaria receta de la púrpura de Tiro se perdió en Occidente en 1453, cuando el
Imperio otomano conquistó Constantinopla.
En 1856 se redescubrió este tinte, cuando Félix Henri de LacazeDuthiers, un zoólogo francés, vio a un pescador tiñendo su camisa con este molusco. En 1909, el químico austriaco Paul Friedländer, mientras trabajaba en las propiedades químicas del tinte, vio que, a pesar de su diferente color, las estructuras químicas del índigo y de la púrpura de Tiro eran muy similares (fig. 12 y 15) y descubrió el principal componente químico de este colorante, el6,6’dibromoíndigo, una sustancia que había sido sintetizada previamente, en1903. No obstante, nunca ha sido sintetizada comercialmente.
El índigo (fig. 12)y la púrpura de Tiro (fig. 15)seobtuvieron a partir de productos naturales durante siglos, y no fue hasta finales del siglo XIX que una forma sintética de índigo estuvo disponible.En 1865, el químico alemán Johann Friedrich Adolf von Baeyer empezó a investigar la estructura del índigo.En 1880 pudo sintetizarlo a partir de materiales accesibles. Sin embargo, tuvieron que pasar unos diecisiete años hasta que la BASF lo preparara por otra ruta diferente que lo hiciera comercialmente viable. Este fue el principio del declive de la industria del índigo natural, que cambió la forma de vida de aquellos que dependían del cultivo y la extracción del índigo natural (fig. 16).
El índigo también está presente en la isatide o glasto (Isatis tinctoria), una variedad de la familia de las coles. La isatide, un tinte muy popular entre los celtas y los vikingos, se está utilizando ahora en los cartuchos de tinta para impresoras, ya que es menos perjudicial para el medio ambiente que los tintes sintéticos azules.El índigo sintético es muy sólido, no destiñe y es muy utilizado (fig. 17). Se usa fundamentalmente para teñir jeans, aunque hoy millones de vaqueros se tiñen con un denim índigo predesteñido.
Otros tintes sintéticos
A principios del siglo XVIII, los tintes sintéticos cambiaron las viejas prácticas de los artesanos. El primero de los tintes fue el ácido pícrico, que producía un intenso color amarillo pero que tenía el «pequeño inconveniente» (como muchos compuestos nitro-

Figura 16. Representación de centro de producción de índigo. Publicado por Dutertre a mediados del siglo XVII.

actualidad.
Tabla
1. Relación entre la luz absorbida y el color observado
λ de la luz absorbida (nm) Zona del espectro visible
400-430 Violeta, añil Amarillo
430-470 Azul Naranja
470-500 Azul, verde Rojo
500-520 Verde Púrpura
520-540 Verde, amarillo Violeta
540-590 Amarillo Añil
590-610 Naranja Azul
610-700 Rojo Verde
genados) de ser explosivo.La alizarina estuvo disponible en 1868 y el índigo, del que se habla en el apartado anterior, en 1880. En 1856, William Henry Perkin revolucionó la industria del tinte. Perkin era estudiante de química en la London’s Royal College of Chemistry e intentaba sintetizar la quinina, compuesto empleado en la cura y prevención de la malaria. Ninguno de sus intentos tuvo éxito, pero en uno de sus ensayos produjo una sustancia negra que, al disolverse en etanol, dio lugar a una solución púrpura que utilizó para teñir seda. Tras varias pruebas, comprobó la solidez del color y, consciente de que el color púrpura era escaso y caro y que su producto era comercialmente viable, envió una muestra a una compañía escocesa, que le respondió que si el proceso de tintado no encarecía la mercancía, era uno de los productos más interesantes que había salido al mercado. Con la ayuda económica de su padre, Perkin patentó su descubrimiento y montó una fábrica para producir el colorante a costes razonables. En 1859, el morado irrumpió en el mundo de la moda. Se convirtió en el color favorito de Victoria Eugenia, y la reina Victoria inauguró la Exposición Universal de Londres en 1862 vestida de morado.
El descubrimiento de Perkin tuvo enormes consecuencias. Procesos similares condujeron a más de dos mil tintes sintéticos derivados de la anilina o del alquitrán, que reemplazaron con gran eficacia a la industria milenaria de extracción de tintes a partir de productos naturales. Al tratarse de un nuevo procedimiento, Perkin tuvo que diseñar nuevos aparatos y procesos, desde grandes recipientes de vidrio para reemplazar a los metálicos, que eran atacados por los ácidos, pasando por dispositivos de enfriamiento que evitaran el sobrecalentamiento durante las reacciones, a la vez que evitaban, explosiones y escapes de gases tóxicos.
El negocio de los tintes fue el precursor de la industria química orgánica que produce fármacos, explosivos, pinturas, plásticos, pesticidas...
La supremacía de esta industria fue liderada por Alemania, que desarrolló la ciencia y la tecnología en la que se basaba gracias a la estrecha colaboración entre las universidades y la industria.
El descubrimiento y la explotación de los tintes ha dado lugar a la creación y el desarrollo de las grandes compañías químicas de la actualidad.
El descubrimiento de Perkin tuvo enormes consecuencias. Procesos similares condujeron a más de dos mil tintes sintéticos derivados de la anilina o del alquitrán, que reemplazaron con gran eficacia a la industria milenaria de extracción de tintes a partir de productos naturales
Estructura, luz y color
Los tintes son compuestos orgánicos coloreados que se incorporan a las fibras textiles y dan color por absorción de luz visible. La propiedad colorante está condicionada por la presencia en la molécula de grupos funcionales, llamados cromóforos (chromos = ‘color’; foros = ‘portador’), que determinan el color. Si se cambia un grupo funcional por otro, se obtiene otro color u otro tono; así mismo, una diferente posición del grupo funcional en la molécula puede dar un color distinto. Hay grupos llamados auxocromos (auxo = ‘aumentar’; chromo = ‘color’), que por si solos no producen color; sin embargo, cuando se encuentran en conjugación de un cromóforo, aumentan la intensidad del color. La estructura molecular permite la absorción de ciertas longitudes de onda del visible, y el color depende de las longitudes de onda reflejadas. Si todas son absorbidas, ninguna se refleja y, por tanto, el tejidolo veremos negro; si ninguna es absorbida, todas son reflejadas, por lo que el tejido se verá blanco. La tabla 1 muestra los intervalos de longitud de onda correspondientes a las zonas del espectro visible y el color observado cuando un compuesto absorbe luz de estos intervalos de longitud de onda.
No resulta extraño que en la Antigüedad se sintiesen fascinados por el color púrpura. A diferencia de otros colores similares (violeta, morado, magenta o granate), la púrpura no es un color espectral, sino una mezcla de distintas tonalidades de rojo, azul, violeta y negro. Las tonalidades púrpuras son colores extraespectrales; de hecho, la púrpura no estaba presente en la rueda de color de Newton, aunque actualmente, en las ruedas modernas, se encuentra entre el rojo y el violeta (rojo-violeta, concretamente en la coordenada 1.640.099 de la gama cromática HTML). Puesto que las tonalidades púrpura solo se producen por dicha mezcla, debido a variaciones en la distribución de los conos receptores de azul y de rojo en la retina humana, entre unas personas y otras existe distinta sensibilidad a la hora de percibir la púrpura. Ante un mismo color púrpura, unas personas lo percibirán más cercano al azul; otras, al violeta, y otras, al rojo. Eso

Javier Medina Fernández
Es director del Área de Ciencias y Educación del Parque de las Ciencias de Granada.Licenciado en Biología por la Universidad de Granada y máster en Gestión Ambiental. Ha realizado investigaciones diversas, estudios de impacto medioambiental y proyectos de gestión de espacios naturales. Es autor de artículos de comunicación científica y guías didácticas, y coordinador de numerosas exposiciones en colaboración con museos internacionales.
explicaría por qué este color ha despertado tanta fascinación a lo largo de la historia y el hecho que la atracción ejercida por este color no haya sido igual en todas las personas y que no exista acuerdo entre los estudiosos de la teoría del color a la hora de clasificarlo.
Algunas consideraciones finales
Ante el éxito de la actividad, una vez finalizado el Año Internacional de la Química,desde el Departamento de Educación y Actividades nos planteamos modificar la actividad transformándola en un taller dedicado al público escolar. Se mantendría el mismo hilo conductor como contexto, de manera que el discurso histórico seguiría siendo el eje central de la actividad, pero haciendo hincapié en los contenidos curriculares, y el trabajo experimental lo realizarían los alumnos trabajando en grupo.
Al dar a conocer la actividad al profesorado ha contado con

Paz Posse Hernanz
Es jefa del Departamento de Educación y Actividades del Parque de las Ciencias de Granada. Licenciada en Pedagogía por la Universidad Complutense de Madrid. Ha diseñado numerosas actividades, talleres, materiales y programas educativos y guías didácticas del museo.Ha publicado artículos sobre recursos educativos, museografía y comunicación científica,y ha participado como docente en cursos del máster de Museología dela Universidad de Granada.
gran aceptación, por ser considerada un buen recurso, adaptable a las aulas en función del objetivo de aprendizaje y el nivel de los alumnos, siempre aprovechando su enfoque CTS e interdisciplinar. Por este motivo se han presentado y discutido en este artículo los diversos aspectos de esta actividad.
Bibliografía
GARFIELD, S. (2000). Mauve: How one man invented a color that changed the World. Londres: Faber and Faber.
LONDON, S. J.(1988) Química orgánica. Barcelona: Reverté. LE COUTER,P.; BURRESON, J. (2004). Napoleon’s buttons: How 17 molecules changes History. Nueva York: Tarcher.
JOSELEVICH, M. (2011). «La química está en todos lados. ¿También en la pintura?». Química Viva, 10(3): 253-266.
Parque de las Ciencias. Granada: Consorcio Parque de las Ciencias (30 octubre 2012). <http://www.parqueciencias.com>

Carmen Guerra Retamosa
Profesora de física y química de secundaria. Licenciada en Ciencias Químicas por la Universidad de Córdoba.Experta universitaria en «Ciencia, Tecnología y Sociedad» por la UNED y máster en Museografía Interactiva por la Universidad de Barcelona.Es autora de recursos educativos, ha impartido cursos de formación y coordinado proyectos de innovación e investigación educativa. Actualmente trabaja en el Parque de las Ciencias como técnico de educación y actividades.
Simulació de la gestió del laboratori amb un LIMS
LIMS: simulation laboratory management
Marta Costa Vidal / INS Montilivi (Girona)
resum

Un LIMS (laboratory information management system) és una eina informàtica usada per gestionar la informació generada en un laboratori seguint criteris de qualitat. En aquest article es presenta i es discuteix la implementació d’un LIMS amb finalitats educatives en l’àmbit de la química. L’experiència es realitza en el marc d’un projecte que ha inclòs l’elaboració de material docent per treballar a l’aula amb alumnes del cicle formatiu de grau superior de laboratori d’anàlisi i control de qualitat. El projecte en qüestió forma part dels projectes d’innovació en la formació professional concedits pel Ministeri d’Educació i Ciència.
paraules clau
Formació professional, LIMS, qualitat, gestió, simulació, laboratori.
abstract
A LIMS (laboratory information management system) is a tool used to manage the information generated in a laboratory following quality criteria. This paper presents and discusses the implementation of a LIMS for educational purposes in the field of chemistry. The experience takes place within the framework of a project that included the development of teaching materials for the classroom to work with students of higher vocational training courses of laboratory analysis and quality control. The project in question is part of the innovation projects in vocational training awarded by the Ministry of Education and Science.
keywords
Vocational education training, LIMS, quality, management, simulation, laboratory.
Introducció i context d’aplicació
L’experiència detallada en el present article se situa en l’àmbit de la formació professional de la família química, concretament, en el cicle formatiu de grau superior de laboratori d’anàlisi i control de qualitat. Atès el caràcter professionalitzador que caracteritza aquests estudis, al llarg de dos cursos acadèmics els alumnes realitzen diferents assignatures, que en el llenguatge curriculars’anomenen mòduls professionals i que els han de permetre adquirir les capacitats necessàries per poder treballar en diferents tipus de laboratoris d’anàlisi. La majoria delsmòduls professionals es basen en pràctiques de laboratori
(mostreig, anàlisis químiques i instrumentals, assajos químics i fisicoquímics, assajos microbiològics i biotecnològics), tot i que
també n’hi ha d’altres més teòrics (anglès, formació i orientació laboral, emprenedoria i empresa, qualitat i seguretat).Entre els

mòduls cursats, centrem l’experiència en un d’essencialment teòric com és el de qualitat i seguretat en el laboratori, més concretament,dins la unitat formativa de qualitat.
S’ha de tenir en compte que el fet de formar alumnes en un centre educatiu en l’àmbit de la qualitat és una tasca amb molta càrrega teòrica i poc aplicada, ja que actualment la implantació de normes de qualitat inclou,bàsicament,una gestió documental molt exhaustiva, una organització empresarial ben definida i implicació per part de la direcció. Aquests termes són difícils de reproduir en un institut de formació professional, i és per això que el projecteque ens ocupa proposa una alternativa que aplica un tipus de programa cada vegada més implantat en el món empresarial del sector químic. Mitjançant un LIMS (laboratory information management system), es pretén formar els alumnes de formació professional en la gestió de la qualitat d’una manera més pràctica, això és, simulant situacions reals a l’aula que permetin fer un seguiment de la traçabilitat del procés global de gestió de
les mostres, les analítiques i els informes (entre altres etapes).
Al llarg d’aquest article, s’explicarà i es reflexionaràsobrela iniciativa d’utilització d’un LIMS al mòdulde qualitat i seguretat en el laboratori, sobre el material docent elaborat per treballar amb el programa a l’aula isobre l’intercanvi de coneixements i experiències entre els alumnes dels dos centres implicats en el projecte, mitjançant una visita a un centre deformació professional de Pamplona (fig. 1).En aquest sentit, val a dir que,simultàniament a la implantació del LIMS a l’INS Montilivi de Girona,se’n va realitzar també la implantació en un centre col·laborador de Pamplona, el CIP Donapea.
La sigla LIMS engloba diferents tipus de programes informàtics que s’utilitzen per gestionar tota la informació de treball d’un laboratori,tant la generada pel mateix laboratori com la rebuda de l’exterior

LIMS (laboratory information management system)
La sigla LIMS engloba diferents tipus de programes informàtics que s’utilitzen per gestionar tota la informació de treball d’un laboratori,tant la generada pel mateix laboratori com la rebuda de l’exterior. De fet, és una aplicació al camp de la química industrial d’un altre tipus de sistemes ja usats en el món empresarial, com araels ERP (enterprise resource planning),que s’usen per gestionar sistemes de vendes, finances, fabricació, inventaris, etc.Així,doncs,un LIMS és una eina informàtica que té l’objectiu final d’evitar l’error humà durant la manipulació de dades i informació.
És un sistema de treball fortament jerarquitzat: cada usuari té encomanades unes tasques segons el perfil que se li hagi assignat.La fig. 2mostra un exemple de la jerarquització de tasques: l’administratiu del laboratori només pot fer tasques d’administració (donar d’alta clients, facturació, etc.), mentre que l’analista pot realitzar les mateixes tasques que l’administratiu,però,a més a més, pot

les tasques realitzades pel client.
entrar els resultats de les analítiques que realitza. Finalment, el cap de laboratori, atès que és el màxim responsable, té els mateixos privilegis que els altres perfils més uns altres d’específics (gestió d’instrumental, organització de tasques a realitzar, verificació de resultats, etc.).
Un dels avantatges més clars que té la implantació d’un LIMS a l’empresa és la mínima manipulació de dades per part dels treballadors: els instruments de mesura estan directament connectats al programa i,per tant, l’analista només dóna l’ordre de mesura a l’aparell, i sovint ni tan sols hade teclejar les dades obtingudes. En un centre educatiu,aquesta és la part més difícil d’assolir, ja queés la més complicada,tècnicament parlant. Per realitzar les pràctiques de laboratori,tenim diferents tipus d’instrumental químic;per exemple, en el nostre institut, tenim un cromatògrafde gasos, diversos espectrofotòmetres (VIS,UV i IR), potenciòmetres, etc. Els aparells, normalment,són de cases comercials diverses,i molts d’ellstenen programari propi. El fet d’acoblar el llenguatge de l’aparell al LIMS és el més complicat, informàticament parlant, iens va semblar que aquest era l’àmbit menys químic de tot el projecte. Per això vam optar per la simulació a l’aula.
Tal com es pot veure al final de l’article, no s’esmenten referències bibliogràfiques sobre LIMS, sinó llocs web d’interès. Això es deu alfet que és difícil trobar llibres sobre el tema,i encara més en espanyol o en català. Aquest és un àmbit de treball molt basat en la tecnologia, de manera que la major part de la informació es troba als webs de les mateixes cases comercials que n’ofereixen o bé en butlletins electrònics, en els qualses pot veure i rebre informació actualitzada i bastant contrastada.
El programa usat enelnostre projecte és BikaLIMS3.0, de BikaLabSystem. Atesa l’amplíssima oferta del mercat,la tria del programa es va fonamentar bàsicament en dues característiques que es van considerar prioritàries:
– És un programa dels anomenats opensource (o lliures), de manera que es pot instal·lar a qualsevol ordinador, i durant el temps desitjat,sense costos de llicències.
– És un programa dels anomenats web-based, fet que permet usar-lo en qualsevol ordinador connectat al servidor,independentment de la ubicació.Per fer un símil en l’àmbit educatiu, podríem dir que funciona de manera semblant a un entorn Moodle, per exemple.
Al llarg del curs 2011-2012,es van realitzar diverses reunions de coordinació i seguiment del projecte entre el professorat de Pamplona i el de Girona, de la mateixa manera que es va contractar un expert informàtic, especialista en la implantació de LIMS, per a la formació i l’assessorament del professorat implicat. L’expert també va contribuir a la traducció del programa a l’espanyol i al català, ja que al principi només estava disponible en anglès.
Elaboració de material docent i treball a l’aula
Un dels reptes més importants del projecte no només era la implantaciódel LIMSal centre docent, sinó també l’elaboració de material didàctic per treballar a l’aula amb els alumnes.

Disseny del laboratori
Elaboració de documentació
Gestió de la informació
Organigrama.
Nombre de departaments.
Equips disponibles.
Tipus de mostres de treball.
Tipus d’anàlisis a realitzar.
Disseny i realització de PNT d’anàlisis.
Disseny i realització de PNT d’aparells.
Disseny dels plans de treball i organització de tasques.
Disseny dels plans de manteniment dels aparells.
Enviament d’una mostra.
Recepció i codificació de les mostres (el sistema permet treballar amb codis de barres).
Assignació de les anàlisis a un analista.
Realització de les anàlisis.
Verificació dels resultats dins els estàndards prèviament establerts.
Enviament dels informes de resultats.
Facturació dels serveis realitzats.
El plantejament del material elaborat és el següent: atès que el LIMS és un sistema de treball jerarquitzat, sovint el laborant no coneix tot l’abast del programa perquè té accés només a una petita part d’aquest; tanmateix, el fet de treballar en un entorn virtual ens permet simular situacions que es puguin donar al lloc de treball assignant diferents perfils (cap de laboratori, analista o client, per exemple) en funció de la tasca a realitzar.
Un altre avantatge és que podem donar a la simulació l’abast desitjat, dins l’aula o fora de l’aula. Des del moment en què dos centres educatius tenen implantat cadascun el seu LIMS, cada centre pot actuar com un laboratori d’anàlisiindependent. Això permet que cada laboratori pugui ser client de l’altre, de manera que augmentila gestió de la informació rebuda i,per tant, també la tasca que han de realitzar a l’aula els alumnes. La taula 1 mostra exemples d’alguns
dels aspectes que es poden treballar a l’aula des del punt de vista del LIMS. La sigla PNT significa pla normalitzat de treball
La manera de treballar a l’aula en l’àmbit del LIMS ha estat la següent:
– Explicació teòrica del que es pretén treballar enla sessió: realització d’analítiques i càlculs associats, elaboració d’informes, disseny d’analítiques, etc.
– Assignació de diferents rols a diferents grups d’alumnes idistribució en parelles de treball, cadascuna amb un ordinador.El professor distribueix els rols de cadascú dins el programa. L’alumne sempre entrarà a la sessió del LIMS amb el mateix usuari i la mateixa contrasenya.
– Tot seguit, es proporciona l’exercici a realitzar, en format paper, per tal que cada grup el treballi al seu ritme. Al llarg de la sessió, en determinats moments, caldrà que cada alumne entri a la seva sessió LIMS i realitzi una tascadeterminada. És a dir, al llarg de la sessió,els dos alumnes de la parella de treball tenen assignades tasques diferents, però si no les fan seqüencialment, no podran finalitzar el que se’ls ha encomanat.
– Aproximadament,la durada de cadascun dels exercicis és d’una hora, inclòs un petit debat durant els darrersminuts per tal de comentar aspectes que no han quedat clars o que es consideren importants.
A la fig. 6es mostra la visualització d’un fragment de la pantalla de treball amb el LIMS.
Aquest és el format en el qual l’analista ha d’entrar les dades de les anàlisis encomanades pel client. Un cop verificats els resul-


tats per part del responsable, l’informe de resultats s’enviarà per correu electrònic al client.
Requisitstècnics
En el moment de plantejar-se la instal·lació del programa, cal tenir en compteuns detalls mínims.BikaLIMS 3.0 utilitza Plone com a entorn (framework) subjacent. Plone és un gestor de continguts web (CMS, content management system) desenvolupat en llenguatge de programació Python i requereix Zope com a servidor d’aplicacions web. Actualment (febrer de 2013), BikaLIMS 3.0 encara està en fase de desenvolupament,tot i que el codi es troba allotjat a Github (https://github.com/institutmontilivi/ Bika-LIMS). Des d’aquí se’n pot descarregar la versió instal·lada en el servidor de l’INS Montilivi, que conté algunes modificacions afegides per adaptar el programa a les necessitats docents.
Pel que fa a les necessitats de maquinari, en principi,no és d’esperar que el sistema requereixi un servidor especialment potent,ja que les dades que es manipulen són bàsicament numèriques i no gaire pesades, en termes de quantitat d’informació a transmetre. A l’hora de treballar amb els alumnes,cal
disposar d’una aula d’informàtica amb accés a Internet.
El BikaLIMS 3.0 és una aplicació força lleugera quant a interfície gràfica, per la qual cosa no hi hauria d’haver problemes de lentitud per motius d’amplada de banda. Se n’ha comprovat un ús correcte sense retards en la càrrega de la interfície per a una connexió a Internet amb una velocitat de baixada de 15 Mb/s i una velocitat de pujada de 5 Mb/s.
En el cas dels alumnes, ha suposat una nova manera de treballar a l’aula, i no ha suposat cap dificultat el fet d’aprendre a manejar el programa LIMS, sinó un al·licient en la unitat formativa de qualitat
Conclusions i valoració dels resultats
Tal com s’ha dit, l’experiència descrita té poc més d’un curs acadèmic de vida. Per a qualsevol projecte educatiu,és un temps molt curt, però,tot i això,l’experiència ha estat valorada molt positivament tant per part del professorat com per part dels alumnes.
En el cas del professorat, ha implicat un contacte i intercanvi d’experiències amb un centre educatiu de característiques similars de Navarra. Les reunions i els cursos de formació en LIMS ens han servit no només per elaborar el material docent acordat, sinó també per conèixer el funcionament de la formació professional en una comunitat autònoma diferent a la nostra.
En el cas dels alumnes, ha suposat una nova manera de treballar a l’aula. De fet, actualment ells estan bastant més immersos en les noves tecnologies del que nosaltres (com a mínim,l’autora de l’article) som capaços d’abastar. Per tant,per als alumnes no ha suposat cap dificultat el fet d’aprendre a manejar el programa LIMS, sinó un al·licient en la unitat formativa de qualitat.
Des del punt de vista acadèmic, hem valorat molt positivament l’experiència, ja que creiem que ha servit per consolidar i exemplificar conceptes àmpliament aplicats en el món empresarial,però, d’una banda,difícils de reproduir en un centre educatiu, i de l’altra,difícils d’explicar a alumnes que, en la majoria dels casos, no han tingut cap experiència laboral en el ram de la química.
En conclusió, tot i que les valoracions realitzades són positives, tenim molt clar que l’experiència no es pot quedar aquí i que hem de continuar treballant per solucionar i millorar aspectes que, al llarg del primer curs d’aplicació, no han acabat de funcionar.
Altres àmbits d’aplicació
El que s’ha descrit fins ara és el treball a l’aula en l’àmbit de la simulació, però durant el present curs estem encetant una segona fase. Per aprofitar l’abast de gestió que permet el programa BikaLIMS3.0, hem iniciat la implanta-
ció d’una segona instància del programa, amb accés restringit només per al professorat, per a la gestió de l’instrumental que tenim en el Departament de Química de l’institut. Així,doncs, tenim dues versions de LIMS en el servidor: l’una, per usar-la virtualment amb els alumnes;l’altra, per gestionar, de manera real, l’instrumental.
La raó d’instal·lar dues instàncies del programa és molt clara. Com a bon programa que ha d’assegurar la qualitat i traçabilitat, una norma bàsica del LIMS és que qualsevol manipulació d’informació realitzada queda registrada i no es pot eliminar. A l’empresa,aquesta característica és molt útil,perquè no permet cap engany ni manipulació. En l’àmbit docent, però, representa un inconvenient: cada any tenim el LIMS més carregat d’exercicis i proves fets pels alumnes de cursos anteriors. Així,doncs, cada curs acadèmic el LIMS es reinicia (podríem fer un símil amb el reinici d’un curs Moodle) amb la informació bàsica que permet aprofitar i perfeccionar el material de classe elaborat durantel curs anterior. Aquesta informació bàsica es troba continguda en un arxiu tipus full de càlculi es pot ampliar o modificar abans de carregar-la en el LIMS.
En canvi,a la instància que s’utilitza per a la gestió d’instrumental,els alumnes no hi tindran accés i s’utilitzarà de manera contínua per fer un seguiment de la gestió dels instruments de l’institut. Creiem que serà una eina molt útil per emmagatzemar tota la informació referent a cadascun dels aparells que, a causa dela seva edat o de la variació del personal docent, sovint costa de recopilar. Aquesta informació pot anar des de l’any d’adquisició de l’aparell fins ales dades tècniques, passant pel PNT d’ús, el PNT de manteniment, el
calendari d’operacions de manteniment pendents de realitzar, les reparacions realitzades i el seu cost, etc.
D’altra banda, un aspecte que no hem desenvolupat gaire és la part de la facturació. De fet, el preu del material, dels reactius i dels equips manipulats pels alumnes sovint els sorprèn molt. Així,doncs, la facturació de les analítiques mitjançant el LIMS podria ser una bona eina per quantificar econòmicament tot el que es manipula i la mateixa feina realitzada en el laboratori per part dels alumnes. Com a proposta, creiem que,en aquest cas,seria bo comptar amb la col·laboració de professors de l’àrea de formació i orientació laboral.
Finalment, m’agradaria animar altres centres que imparteixin cicles de formació professional de la família química a adherir-se al projecte iniciat. Des del començament, aquesta ha estat la nostra idea: crear una xarxa de centres, cadascun amb el seu LIMS, per col·laborar simulant situacions d’enviament i d’anàlisi de mostres virtuals. Com més centres hi hagi en aquesta xarxa,més semblant serà la simulació a una situació de gestió real. De fet, una de les tasques de l’expert informàtic contractat va ser redactar unes instruccions d’instal·lació per facilitar la tasca a qualsevol centre que es vulgui adherir al projecte. Val a dir que els professorsque hem treballat amb el programa som bàsicament químics,i hem après molta informàtica sobre la marxa, però ens ha estat indispensable la col·laboració de la coordinació TIC del nostre centre.
Cal esmentar també que el material elaborat i l’experiència adquirida es posarà a disposició de qualsevol centre interessat que contacti amb l’autora d’aquest article.
M’agradaria animar
altres centres que imparteixin cicles de formació professional de la família química a adherir-se al projecte iniciat
Nota
El projecte descrit en l’article ha estat finançat pel Ministeri d’Educació i Ciència i pel Fons Social Europeu, is’inclou dins els projectes d’innovació convocats en la Resolució de 5 d’abril de 2011 per ser executats al llarg del curs 2011-2012.
Llocs web d’interès
Butlletí electrònic sobre LIMS: http://www.limsfinder.com/. BikaLabSystem: http://www.bikalabs.com
Enllaç al LIMS instal·lat al’INS Montilivi (Girona): http://lims.iesmontilivi.net:8888/
Enllaç al LIMS instal·lat al CIP Donapea (Pamplona): http://donapealims.educacion.navarra.es:30680/ Plone
Pàgina oficial de Plone: https://plone.org
Pàgina oficial de Zope: http://zope.org

Marta Costa Vidal
És professora de pràctiques (especialitat en laboratori) al Departament de Química de l’INS Montilivi (Girona). És llicenciada en ciències químiques (1996) per la Universitat de Gironai té un màster en gestió del medi ambient (1999).
A/e: mcosta27@xtec.cat
RESSENYES
«Els elements químics, joies imprescindibles»
Exposició feta amb ocasió de la cloenda de l’Any Internacional de la Química 2011 a l’Institut d’Estudis Catalans

Figura 1. Grup d’alumnes de l’Escola Pia de Terrassa, amb la seva professora, després de la visita guiada per Marc Boada.
La proclamacióper part de la UNESCO de l’any 2011 com aAny Internacional de la Química(AIQ2011)explica que l’Institut d’Estudis Catalans (IEC), mitjançant la Secció de Ciències i Tecnologiai la Societat Catalana de Química (SCQ), organitzésnombroses activitats per celebrar tal efemèride. La revista Educació Química EduQ n’ha fet unaàmplia referència, particularment als números corresponents a l’any 2011.
La primera activitat es va fer durant l’any 2010 i tenia una doble finalitat. D’una banda, fer conèixer que l’AIQ 2011 era proper,i de l’altra, palesar als joves que la química és una ciència molt propera a la vida quotidiana. Així, l’IEC va organitzar un concurs entre els estudiants de químicaper obtenir les imatges del calendari de l’any 2011, «Quins elements!». La ressenya que en va ferF. Guitart a Educació Química EduQ, 10: 58-59, dóna detalls del concurs i del calendari.
Tot just començat l’any 2011,es va celebrar a l’IEC l’acte inaugural de l’AIQ2011. Un resum del mateix, així com de laconferència impartida pel professor Agustí Lledós, «Vull ser químic... per fer què?», ha estat publicat en aquesta revista (F. Guitart, Educació Química EduQ, 8: 58). De les diferents activitats que seguiren l’acte inaugural,voldria assenyalar-ne dues: l’exposició «Marie Curie, 18671934», que ha estat oberta al públic al claustre de l’IEC al llarg del 2011 ique posteriorment ha estat itinerantpels centres d’ensenyament de Catalunya (P. González Duarte, Educació Química EduQ, 10: 4-10), i tambéla publicació de la versió catalana del llibre Els elements: Una exploració visual de tots els àtoms coneguts de l’Univers, de Theodore Gray (A. Caamaño, Educació Química EduQ, 9: 58-59).
Precisament el contingut rigorós, el to divulgatiu i l’espectacularitat de les fotografies del llibre esmentatés el que ens va animar a preparar una exposició sobre els elements químicsque havia d’unirla Setmana de la Ciència amb lacloenda del’AIQ2011. Els tres comissaris de l’exposició (Marc Boada, Joaquim Sanz i jo mateixa) som especialistes en diferents camps mútuament complementaris. M. Boada és divulgador científic, té una àmplia experiència en museística i disposa d’una extensa col·lecció d’elements i objectes relacionats amb els mateixos. J. Sanz és professor i director del Museu Valentí Masachs de la Universitat Politècnica de Catalunya a Manresa;aquestmuseu disposa d’una àmplia col·lecció de minerals d’una extraordinària bellesa.El meu interès per les ciències experimentals, per la química inorgànica
en particular i per la divulgació científica ha estat constant al llarg dels molts anys de ser professora de química a la Universitat Autònoma de Barcelona. Amb aquest bagatgei el suport de l’IEC—tant respecte de la utilització dels seus espais i infraestructurescom del finançament econòmic—l’exposició va estar oberta al públic del 21 de novembre al 15de desembre de2011. Al llarg d’aquestes setmaneses varen fer nombroses visites guiades a ambdues exposicions:«Els elements químics, joies imprescindibles», per part deM. Boada, i «Marie Curie, 1867-1934»,per partde P. González Duarte. Tal com mostren la coberta i la fig. 1,els alumnes varen seguir atentament les explicacions i varen passar una bona estona. També el públic adult en va gaudir(fig.2).
Considerant l’exposició «Els elements químics, joies imprescindibles», objecte d’aquesta ressenya, voldria indicar que el títol escollit té una doble intencionalitat. D’una banda, estableix que els elements químics sónl’eix central de l’exposició,i de l’altra, mitjançant el subtítol, es vol matisar que el valor dels elements químics és molt alt,tant que podem considerar-los«joies», però, a diferència de les tradicionals, aquestes no són supèrflues, sinó «imprescindibles». L’exposició s’organitzava en diverses taules (fig. 2) on, per a cada element, se’n mostrava la forma elemental, el mineral que més freqüentment s’usa com a matèria primera per obtenir-lo en estat pur i diversos objectes de la vida quotidiana en els quals l’element en qüestió és protagonista. En tots els casos,uns cartellets donaven l’explicació corresponent. En total, s’hi mostraven seixanta-cinc elements, atès que motius de manca d’estabilitat a l’aire o de poca abundància feien difícil de presentar el conjunt dels tres ítems (element, mineral i aplicacions) per a la totalitat dels noranta elements que ens permeten explicar tot el que ens envolta. Penjats a la paret, al voltant de les taules on s’exposaven els elements,hi havia diversos plafons. Tres d’aquests corresponien a diferents tipus de taules periòdiques: la forma semillarga tradicional, en la qual es mostren els símbols i els noms dels elements;una altra menys habitual, en la qual a cada casella es mostra l’element en estat pur o bé algun objecte íntimament relacionat amb l’element, i, finalment, una d’artística. Com a taula periòdica convencional,es va escollir l’editadaper la SCQ;com a taula menys convencional però especialmentatractiva,es va escollir la que T. Gray inclou en el seu llibre Els elements:Una exploració visual de tots els àtoms coneguts de l’Univers, i com a exemple del tercer tipus,es va seleccionar la de l’artista Eugènia Balcells (http://www.eugeniabalcells.com/intinerancia/Eugenia%20Balce lls%20Intinerancia_CAT_%284.5Mb%29.pdf),en la qual a cada casella es mostra l’espectre d’emissió de l’element gasós.
A banda de les taules periòdiques, cinc plafons addicionals que també estaven penjats a la paretpretenien emmarcar els objectius de l’exposició i aportar-ne informació complementària. Els títols d’aquestsplafons varen ser els següents: «Joies imprescindibles», «Els elements i com s’ordenen en la taula periòdica», «Quant de cada element, com els trobem a la Terra?», «Imprescindibles per viure més i millor», «Res en excés: ús i abús, reciclatge». A tall d’exemple, tot seguit es dóna el text de dos d’aquests plafons:
Quant de cada element, com els trobem a la Terra?
Els elements que trobem a la Terra presenten abundàncies molt diferents. Els elements de pes atòmic baix són molt més abundants que els elements de pes atòmic elevat, sotmesos a una inestabilitat nuclear creixent. De fet, 9 elements constitueixen el 98,3% dels àtoms de l’escorça terrestre. I,en canvi, 81 elements formen l’1,7 % restant! Això no vol dir que no siguin importants. Quantitat i qualitat no sempre van lligades! Així, un humà d’uns 70 kg només necessita 72 mg de coure, però sense aquesta quantitat no podria viure!
Si considerem l’Univers, l’escorça terrestre, l’atmosfera i els humans,veurem que els elements que predominen també són lleugers, però en cada cas són diferents.
Res en excés: ús i abús, reciclatge
El desenvolupament tecnològic comporta un ús cada cop més important dels recursos. D’una banda, els elements químics no poden defugir aquesta tendència. De l’altra, la recerca progressa trobant aplicacions importants per a elements fins ara menys coneguts. Les reserves mundials dels elements són limitades i,al ritme de consum actual,s’esgotaran aviat. S’imposa una nova manera d’entendre’n l’ús. Alguns, com l’or, s’han reciclat sempre. Actualment,el ferro, el coure o l’alumini es recuperen majoritàriament. Amb això es redueix el consum d’energia i es minimitzen els impactes de la seva extracció. Per a molts elements,encara no hi ha una via clara de recuperació i,per tant, la moderació en el consum és l’única alternativa.
D’altra banda,en el cas dels elements que es troben preferentment en determinades regions del pla-
La tendència de la major part dels elements per reaccionar entre ells explica que molt sovint els trobem a la Terra formant minerals. Aquestes bellíssimes combinacions químiques, gairebé sempre cristal·lines i que s’han format al llarg de milions d’anys, es classifiquen segons la composició.
Els diferents tipus de minerals que existeixen al nostre planeta són la principal font d’obtenció dels 90 elements, cosa que consisteix senzillament a trencar els compostos químics que formen el mineral per aconseguir separar l’element d’interès. Ho anomenem química extractiva i és una de les activitats industrials que demanen més esforços i és també fonamental per a la nostra qualitat de vida. Què faríem avui sense coure, alumini, ferro, zinc... i tants d’altres?
neta, l’aparició de noves aplicacions augmenta significativament el valor econòmic del mineral i,en paral·lel,es generen tensions comercials i polítiques que poden acabar en conflicte. Un lamentable exemple d’això és l’anomenada guerra del coltan (abreviació de columbita i tantalita), un conflicte armat que va produir 5,4 milions de víctimes a la República Democràtica del Congo (RDC, antic Zaire) durant la segona meitat del segle XX. En aquest cas,els elements buscats eren el niobi i el tàntal, utilitzats en la indústria electrònica per a laminiaturització dels condensadors en aparells com ara els telèfons mòbils. La RDC, amb diamants, or, coure, coltan i altres recursos, és un dels països potencialment més rics de l’Àfrica, però la seva història recent és un exemple de mort i corrupció on unes fonts privilegiades de riquesa són per a la seva població una veritable maledicció.

Just a la sortida de l’exposició,es trobava la conclusió següent, que espero i desitjo que compartissin tots els visitants:
«Al llarg d’aquest recorregut,hem volgut mostrar que els elements químics, les unitats bàsiques de la Terra i dels seus habitants, poden ser considerats des de dos
punts de vista complementaris. D’una banda, els elements químics i els seus compostos ens fan viure més i millor. De l’altra, els elements i els minerals on es troben tenen una bellesa indiscutible. Per tot això, mereixen ser considerats com a joies imprescindibles»
Pilar González Duarte
El atomismo en química: Un nuevo sistema de filosofía química de John Dalton
Ed. d’Inés Pellón González
La representación de lo invisible: Tabla de los diferentes rapports observados en la química entre diferentes sustancias de Etienne-François Geoffroy
Ed. de Pere Grapí
Servei de Publicacions de la Universitat d’Alacant, 2012


La nova col·lecció «Clàssics de Química»,dirigida per Antonio García Belmar i editada pel Servei de Publicacions de la Universitat d’Alacant, té com a objectiu produir edicions de textos clàssics de la ciència a l’abast de tots els públics interessats en la cultura científica i la seva història. Els principals trets distintius de la col·lecció, els quals constitueixen també els principals trets distintius d’aquests dos primers volums, són la traducció anotada dels textos originals, els estudis introductoris fets per historiadors de la química i les guies de lectura.
L’acostament als textos històrics es fa a través de dos tipus de textos: els escrits per autors les idees dels quals van ser clau en la història de la química i els que els historiadors han realitzat sobre ells. La traducció dels textos clàssics va a càrrec d’historiadors de la química espanyols que, a més, preparen estudis introductoris destinats a oferir als lectors les claus històriques i biogràfiques necessàries per situar els textos en els contextos científic, social i cultural en els quals van sorgir. La guia de lectura que s’inclou al final té com a objectiu servir de guia al lector interessat a aprofundir en la biografia i les idees del científic tractat.
El primer llibre de la col·lecció, El atomismo en química: Un nuevo sistema de filosofía químicade John Dalton,inaugura la col·lecció d’una manera molt encertada. Es tracta d’una selecció de textos extrets del llibre Un nuevo sistema de filosofía,de John Dalton,que es va publicar en dos volums. El volum 1 constava de dues parts que van aparèixer l’any 1808 i el1810,respectivament, i el volum 2, el 1827. El projecte va quedar incomplet,ja que Dalton no va publicar la part final que havia anunciat. La primera part del volum estava dividida en tres capítols:el primer, sobre la calor (o calòric);el segon,sobre la constitució dels cossos,i l’últim,sobre la síntesi química. En aquest últim capítol és on hi ha exposada la teoria que ha fet història.
Els textos del llibre El atomismo en química: Un nuevo sistema de filosofía química van precedits per una introducció d’Inés Pellón, professora de la Universitat del País Basc i autora de nombrosos treballs sobre John Dalton i la seva teoria atòmica. L’estudi es completa amb un article d’Alan Rocke, professor de la Case Western Reserve University de Cleveland (Ohio), un dels principals especialistes en la química del segle XIX, que analitza els orígens de la teoria atòmica de Dalton. El llibre finalitza amb una guia de lectura i una bibliografia.
El segon llibre de la col·lecció, La representación de lo invisible:Tabla de los diferentes rapports observados en la química entre diferentes sustancias de Etienne-François Geoffroy, aborda un text de l’esmentat autorintroduït per un text de Pere Grapí, professor d’ensenyament secundari, docent i investigador associat a la Universitat Autònoma de Barcelona, alhora que autor de nombrosos treballs sobre la teoria de les «afinitats»químiques al segle XVIII L’assaig final d’Ursula Klein, professora de la Universitat de Constança i investigadora de l’Institut Max Plank d’història de la ciència, revela un interessant secret amagat durant molt temps entre les files i columnes d’aquesta famosa taula.
En aquest llibre és interessant destacar que l’interès per les afinitats químiques propi del segle XVIII va ser utilitzat en el segle següent com a metàfora de les relacions amoroses per Johann Wolfgang Goethe a la novel·la romàntica Les afinitats electives, publicada el 1809, una mostra més de les profitoses interrelacions entre ciència i literatura.
Unes vegades es troben com a amics i vells coneguts que ràpidament s’uneixen i s’ajunten sense alterar els uns als altres, el mateix que es barregen l’aigua i el vi. No obstant això, d’altres s’obstinaran a romandre estranys, sense possibilitat d’unió ni fins i tot barrejant-los o fregantper mitjans mecànics, el mateix que l’oli i l’aigua.
J.W. GOETHE, Les afinitats electives (1809)
En conclusió, la nova col·lecció «Clàssics de Química» és una excel·lent iniciativa que se suma a altres de similars relativament recents,com ara la col·lecció «Clàssics de la Química»que publica la Societat Catalana de Química des del 2004 i en la qual ja han aparegut textos històrics de G. N.Lewis, D.I. Mendeléiev, Van’t Hoff, Le Bel, E. Frankland i A. Avogadro.
En recomanem la lectura i esperem amb interès els nous títols.
Aureli Caamaño Editor d’Educació Química EduQ
NORMES DE PUBLICACIÓ
Preparació dels manuscrits
Els articles han de fer referència a qualsevol dels temes de les seccions de la revista per a qualsevol nivell d’educació, des de primària fins a l’educació universitària. Han de ser inèdits i han d’estar escrits en català, tot i que també es publicaran articles en castellà, francès, portuguès, italià i anglès, si l’autoria és de persones de fora de l’àmbit de la llengua catalana.
Els treballs han de ser escrits amb un espaiat d’1,5 i han de tenir el nombre de caràcters amb espais especificat en cadascuna de les seccions de la revista. El text ha d’estar en format Microsoft Word i lletra Times New Roman de cos 12.
La primera pàgina ha de contenir el títol del treball, el nom o noms dels autors i el centre o centres de treball, un resum de 500 caràcters (incloent-hi espais) i cinc paraules clau. El títol, el resum i les paraules clau han d’anar seguits de la seva versió en anglès.
Els articles han d’anar acompanyats de fotografies i imatges en color que il·lustrin el contingut del text. L’article haurà de contenir fotografies en color del treball a l’aula, dels muntatges dels experiments o altres fotografies relacionades amb el contingut. També han de contenir gràfics, esquemes, dibuixos i treballs o produccions dels alumnes que il·lustrin i facin més comprensible el contingut del text. Les il·lustracions han de portar títol (peu d’imatge) i cal indicar on cal situar-les dins l’article. Les fotografies i imatges s'han d'enviar en arxius separats en format tif o jpeg (resolució mínima: 300 píxels/polzada) i, si es tracta de gràfics, en Excel o Corel Draw.
L’article ha d’estar estructurat en diferents apartats. Els autors han de seguir les normes recomanades per la IUPAC a l’hora d’anomenar els composts químics i utilitzar el Sistema Internacional d’Unitats. És convenient el fet d’assenyalar 3 o 4 frases de l’article que es destacaran amb una lletra més gran i de color en l’article maquetat.
Les referències bibliogràfiques han d’anar al final del text, escrites com els exemples següents:
Per a llibres:
VILCHES, A.; GIL, D.(2003). Construyamos un futuro sostenible: Diálogos de supervivencia. Madrid: Cambridge University Press. Citació en el text: (Viches i Gil, 1994).
Per a articles:
SARDÀ, A.; SANMARTÍ, N.(2000). «Ensenyar a argumentar científicament: un repte de les classes de ciències». Enseñanza de las Ciencias, 18:3, 405-422.
Citació en el text: (Sardà i Sanmartí, 2000).
Per a altres exemples, consulteu un número recent de la revista. Al final de l’article ha de constar una breu ressenya professional i una fotografia de les persones autores de l’article. Cada ressenya ha de contenir el nom i cognoms, càrrec, centre de treball, camp principal en el qual desenvolupa la seva tasca i correu electrònic (màxim de 400 caràcters amb espais). Cal enviar els arxius de les fotografies de carnet dels autors en format tif o jpeg (resolució mínima: 300 píxels/polzada).
Enviament d’articles
Els articles han de ser enviats per correu electrònic a un dels editors de la revista:
Aureli Caamaño (acaamano@xtec.cat).
Fina Guitart (jguitar3@xtec.cat).
Mercè Izquierdo (merce.izquierdo@uab.es).
Montserrat Tortosa (mtortosa@xtec.cat).
Cal enviar també l’adreça postal dels autors o la del centre de treball per poder enviar-los el número de la revista en què han participat.
Revisió dels articles
Els articles seran revisats per tres experts. Els articles revisats i enviats als autors hauran de ser retornats als editors en el termini màxim de 10 dies. Sempre que sigui possible les proves de maquetació seran enviades als autors abans de la seva publicació.
SECCIONS
ACTUALITAT QUÍMICA
Aspectes importants que facilitin als docents de la química el fet d’estar al dia i conèixer les implicacions de la química en els temes actuals. Fonts acreditades d’informació per ajudar a construir criteris i opinions fonamentades en la ciència. (Límit: 20.000)
PROJECTES CURRICULARS
Articles que acostin els docents de la química als projectes curriculars del nostre o d’altres països. El contrast entre els currículums de química en les diferents etapes i països enriqueix els docents i els proporciona una visió d’altres sistemes educatius. (Límit: 25.000)
INNOVACIÓ A L’AULA
Articles que descriguin l'experimentació de noves activitats per a la l’aula. La innovació és una font de millora en la manera d’ensenyar dels docents. La secció pretén ser un espai adequat per compartir experiències d’aula. (Límit 20.000)
CONCEPTES I MODELS QUÍMICS
Articles per posar al dia el professorat en l’actualització de continguts. També inclou aquells articles que tractin la construcció de models a l’aula centrats en l’evolució de les idees dels alumnes i que mostrin exemples d’activitats de modelització. (Límit: 20.000)
ESTRATÈGIES I RECURSOS DIDÀCTICS
Articles diversos amb la finalitat de mostrar o presentar materials didàctics. Pretén ser un recull de recursos i d’estratègies per tal que el professorat pugui adaptar-les a la seva tasca docent. (Límit: 25.000)
TREBALL PRÀCTIC AL LABORATORI
El treball pràctic al laboratori ha estat sempre un aspecte clau en l’ensenyament i l’aprenentatge de la química. Aquesta secció pretén donar cabuda a articles referits a treballs pràctics innovadors, atractius i amb caràcter investigador. (Límit: 20.000)
NOVES TECNOLOGIES
Articles relacionats amb la utilització de les noves tecnologies en l’ensenyament-aprenentatge de la química amb l’objectiu de millorar aprenentatges i competències dels alumnes. L’ús eficaç de les TIC és un aspecte clau i d’actualitat en la docència. (Límit: 20.000)
HISTÒRIA I NATURALESA DE LA QUÍMICA
Divulgació d’articles dins l’àmbit de la història i la naturalesa de la química per acostar als docents aquesta temàtica sovint poc coneguda pel professorat. (Límit: 25.000)
QUÍMICA I SOCIETAT
Articles amb relacions ciència-tecnologia-societat, presència de la química en la vida quotidiana i aspectes d’alfabetització científica per a la formació dels alumnes com a ciutadans. Contextos en què la química pot ser rellevant i l’ensenyament de la química en context. (Límit: 25.000)
QUÍMICA I EDUCACIÓ AMBIENTAL
Articles que facin palesa l’estreta relació entre la química i els aspectes del medi ambient, així com temàtiques mediambientals d’actualitat des d’una vessant química. Pretén destacar la utilització de la química d’una manera respectuosa amb el medi i l’educació per a la sostenibilitat. (Límit:25.000)
RECERCA EN DIDÀCTICA DE LA QUÍMICA
Articles de didàctica de la química de caràcter divulgatiu. La secció pretén aportar, d’una manera planera i entenedora, propostes i estratègies didàctiques basades en el resultat de la investigació. (Límit: 25.000)
FORMACIÓ DEL PROFESSORAT
Secció amb aportacions de diferents models de formació del professorat, en el nostre o en altres països. Aspectes de la formació adreçats a millorar la tasca del professorat de química i a contribuir al seu desenvolupament professional. (Límit: 25.000)
TREBALLS DE RECERCA DELS ALUMNES
En aquesta secció, els alumnes seran els autèntics protagonistes. Es publicaran articles descriptius dels treballs de recerca dels alumnes dins l’àmbit de la química. (Límit: 20.000)
QUÍMICA I ALTRES CIÈNCIES
Articles amb una visió global de les ciències experimentals i de caire interdisciplinari. També articles d’altres ciències però que incloguin aspectes de la química. (Límit: 20.000)
LLENGUATGE I TERMINOLOGIA
Reflexions i consideracions didàctiques entorn de les normatives i de l’ús de la terminologia química. Propostes per treballar activitats de comunicació amb un especial èmfasi en el llenguatge i en la terminologia. (Límit: 20.000)


