 Societat Catalana de Química - Filial de l’Institut d’Estudis Catalans
Societat Catalana de Química - Filial de l’Institut d’Estudis Catalans
Educació Química 2021 número 28 Substància química A teaching-learning progression to introduce the concept of a substance L’elaboració del concepte de substància química al llarg de l’educació secundària. De les propietats d’una substància a la seva composició i estructura ¿Cómo progresan las ideas de los estudiantes sobre las relaciones estructura-propiedades?
Educació Química EduQ
Juny 2021, número 28
Editors
Fina Guitart, CESIRE, Departament d’Ensenyament, SCQ, Barcelona
Aureli Caamaño, SCQ, Barcelona
Pere Grapí, INS Joan Oliver, Sabadell
Consell Editor
Jordi Cuadros, IQS-URL, Barcelona
Josep Durán, UdG, Girona
Mercè Izquierdo, UAB, Barcelona
Claudi Mans, UB, Barcelona
Àngel Messeguer, CSIC, Barcelona
Neus Sanmartí, UAB, Barcelona
Amparo Vilches, UV, València
Consell Assessor
Consell Assessor Catalunya / Espanya
Joan Aliberas, INS Puig i Cadafalch, Mataró
Miquel Calvet, INS Castellar, Castellar del Vallès
Francesc Centellas, UB, Barcelona
Josep Corominas, Escola Pia, Sitges
Anicet Cosialls, INS Guindàvols, Lleida
Carlos Durán, Centro Principia, Màlaga
Xavier Duran, TV3, Barcelona
Josep M. Fernández, UB, Barcelona
Dolors Grau, UPC, Manresa
Paz Gómez, INS Provençana, l’Hospitalet de Llobregat
Elvira González, Centro de Ciencias, Bilbao
Pilar González Duarte, UAB, Barcelona
Ruth Jiménez, UAL, Almeria
Teresa Lupión, Centro de Recursos UMA, Màlaga
María Jesús Martín-Díaz, IES Jorge Manrique, Madrid
José María Oliva, UCA, Cadis
Gabriel Pinto, UPM, RSEQ, Madrid
Marta Planas, UdG, Girona
Anna Roglans, UdG, Girona
Núria Ruiz, URV, Tarragona
Olga Schaaff, Escola Rosa dels Vents, Barcelona
Marta Segura, Escola Pia Nostra Senyora, Barcelona
Romà Tauler, IDAEA-CSIC, Barcelona
Montse Tortosa, INS Ferran Casablancas, Sabadell
Gregori Ujaque, UAB, Barcelona
Nora Ventosa, ICMAB-CSIC, Barcelona
Josep Anton Vieta, UdG, Girona
Consell Assessor Internacional
María del Carmen Barreto, Universitat de Piura, Perú
Liberato Cardellini, U. Politecnica delle Marche, Itàlia Agustina Echeverría, Universitat Federal de Goiás, Brasil
Sibel Erduran, Universitat de Bristol, Regne Unit
Odilla Finlayson, Universitat de Dublín, Irlanda Lidia Galagowsky, Universitat de Buenos Aires, Argentina
Marcelo Giordan, Universitat de São Paulo, Brasil Èric Jover, Observatori de la Sostenibilitat d’Andorra Isabel Martins, Universitat d’Aveiro, Portugal
Eduardo Mortimer, Universitat de Minas Gerais, Belo Hori zonte, Brasil
Carlos Javier Mosquera, Universitat Distrital, Bogotà, Colòmbia Fátima Paixão, Castelo Branco, Portugal
Vincent Parbelle, Lycée La Martinière, Lió, França Ilka Parchmann, Universitat de Kiel, Alemanya Mario Quintanilla, Pontifícia Universitat Catòlica, Xile Santiago Sandi-Urena, Universitat de Costa Rica Vicente Talanquer, Universitat d’Arizona, EUA
Societat Catalana de Química (SCQ) http://blogs.iec.cat/scq/

President: Gregori Ujaque filial de l’ Institut d’Estudis Catalans (IEC) Barcelona. Catalunya. Espanya
Impressió: Gráficas Rey ISSN: 2013-1755
Dipòsit Legal: B-35770-2008
ÍNDEX
Editorial
Monografia: «Substància química» 3 Aureli Caamaño, Pere Grapí i Fina Guitart
Monografia: Substància química A teaching-learning progression to introduce the concept of a substance . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 4
Philip Johnson
L’elaboració del concepte de substància química al llarg de l’educació secundària. De les propietats d’una substància a la seva composició i estructura 12 Aureli Caamaño
¿Cómo progresan las ideas de los estudiantes sobre las relaciones estructura-propiedades? 21 Vicente Talanquer
El perfil conceptual de sustancia: una herramienta para entender la heterogeneidad de pensamiento y habla en el aula 28 Raúl Orduña Picón, Hannah Sevian i Eduardo Fleury Mortimer
Estruturação de zonas do perfil conceitual de substância e suas implicações para a compreensão química em sala de aula 33 João Roberto Ratis Tenório da Silva, Edenia Maria Ribeiro do Amaral i Flávia Cristiane Vieira da Silva Ensino e aprendizagem do conceito de substância química como material puro por estudantes de ensino médio 39 Renata Rosa Dotto Bellas i José Luis de Paula Barros Silva
Com diferenciar els conceptes de substància elemental i element químic? El relat històric i l’experimentació. 46 Josep Duran i Fina Guitart
Intercanvi FEr MoTs amb els símbols químics: un joc per a un aprenentatge transversal 56 Santiago Álvarez Reverter
Experiments i idees amb CO2 - Ressenya 60 Fina Guitart
Enseñar química. De las sustancias a la reacción química - Ressenya 61 José Antonio Chamizo
Drets d’autor i responsabilitats
La propietat intel·lectual dels articles és dels respectius autors. Els autors, en el moment de lliurar els articles a la revista Educació Química EduQ per sol·licitar-ne la publicació, ac cepten els termes següents:
1. Els autors cedeixen a la Societat Catalana de Química (filial de l’Institut d’Estudis Catalans) els drets de repro ducció, comunicació pública i distribució dels articles presentats per ser publicats a la revista Educació Química EduQ
2. Els autors responen davant la Societat Catalana de Química de l’autoria i l’originalitat dels articles presentats.
3. És responsabilitat dels autors l’obtenció dels permisos per a la reproducció de tot el material gràfic inclòs en els articles.
4. La Societat Catalana de Química està exempta de tota responsabilitat derivada de l’eventual vulneració de drets de propietat intel·lectual per part dels autors.
5. Els continguts publicats a la revista estan subjectes (llevat que s’indiqui el contrari en el text o en el material gràfic) a una llicència Reconeixement-No comercial-Sense obres derivades 3.0 Espanya (by-nc-nd), de Creative Commons, el text complet de la qual es pot consultar a http://creativecommons.org/licenses/by-nc-nd/3.0/es/deed.ca Així, doncs, s’autoritza el públic en general a reproduir, distribuir i comunicar l’obra sempre que se’n reconegui l’autoria i l’entitat que la publica i no se’n faci un ús comercial ni cap obra derivada.
6. La revista Educació Química EduQ no es fa responsable de les idees i opinions exposades pels autors dels articles publicats.
Protecció de dades personals
L’Institut d’Estudis Catalans (IEC) compleix el que estableix el Reglament general de protecció de dades de la Unió Europea (Reglament 2016/679, del 27 d’abril de 2016). De conformitat amb aquesta norma, s’informa que, amb l’ac ceptació de les normes de publicació, els autors autoritzen que les seves dades personals (nom i cognoms, dades de contacte i dades de filiació) puguin ser publicades en el corresponent volum de la revista Educació Química EduQ Aquestes dades seran incorporades a un tractament que és responsabilitat de l’IEC amb la finalitat de gestionar aquesta publicació. Únicament s’utilitzaran les dades dels autors per gestionar la publicació de la revista Educació Química EduQ i no seran cedides a tercers, ni es produiran transferències a tercers països o organitzacions interna cionals. Un cop publicada la revista Educació Química EduQ, aquestes dades es conservaran com a part del registre his tòric d’autors. Els autors poden exercir els drets d’accés, rectificació, supressió, oposició, limitació en el tractament i portabilitat adreçant-se per escrit a l’Institut d’Estudis Catalans (C. del Carme, 47, 08001 Barcelona), o bé enviant un correu electrònic a l’adreça dades.personals@iec.cat, en què s’especifiqui de quina publicació es tracta.
Presentació de la monografia: Substància química
El concepte de substància química és bàsica en la química i en el currículum de química d’educació se cundària; per aquest motiu aquest monogràfic es dedica a aquest concepte i a algunes relacions amb altres idees bàsiques en la composició i transformació de la matèria.
Tres dels articles se centren a oferir una proposta de progressió en l’aprenentatge del concepte de substàn cia a l’educació secundària; tres més ofereixen resul tats d’investigacions que incideixen en les maneres de pensar i raonar dels estudiants sobre les substàncies i les seves propietats i estructura, i el darrer article de la monografia aporta estratègies i activitats per a l’aula.
Philip Johnson, en el seu article «A teaching-learning progression to introduce the concept of a substance», proposa una seqüència d’aprenentatge basada en un model de partícules que esdevé atòmic i molecular i que implica començar per la modelització corpuscular de les substàncies en els seus diferents estats, sòlid, lí quid i gas, i no dels estats en general.
Aureli Caamaño, en el seu article «L’elaboració del con cepte de substància química al llarg de secundària. De les propietats d’una substància a la seva composició i estructura», fa una proposta de progressió del concep te de substància química a través del desenvolupa ment d’una sèrie de models basats en les idees d’ho mogeneïtat, identitat química, composició química elemental, estructura i interacció.
Vicente Talanquer, en el seu article «¿Cómo progresan las ideas de los estudiantes sobre las relaciones estruc tura-propiedades?», descriu les etapes a través de les quals progressa el raonament dels estudiants sobre les rela cions estructura-propietats de les substàncies a mesu ra que avancen en els seus estudis i assimilen diferents models químics sobre la composició i l’estructura de la matèria i fa una sèrie de recomanacions didàctiques per elaborar el concepte de substància.


Raúl Orduña Picón, Hannah Sevian i Eduardo Fleury Mortimer, en el seu article «El perfil conceptual de sus tancia: una herramienta para entender la heterogenei dad de pensamiento y habla en el aula», presenten la varietat de maneres de parlar i pensar (zones) sobre aquest concepte que els individus desenvolupen socialment i usen en contextos específics, i proposen com poden ser utilitzades pels docents.
João Roberto Ratis Tenório da Silva, Edenia Maria Ribei ro do Amaral i Flávia Cristiane Vieira da Silva, en el seu article «Estruturação de zonas do perfil conceitual de substância e suas implicações para a compreensão química em sala de aula», descriuen sis zones del perfil conceptual de substància i n’extreuen implicacions di dàctiques i per caracteritzar diferents maneres de pen sar dels estudiants sobre els àcids i les bases.

Renata Rosa Dotto Bellas i José Luis de Paula Barros Silva, en el seu article «Ensino e aprendizagem do conceito de substância química como material puro por estudantes do ensino médio», investiguen l’aprenentatge del con cepte de substància química com a material pur a partir de la teoria històrico-cultural i mostren com els estu diants aconsegueixen iniciar l’aprenentatge del criteri de puresa química i del significat químic de substància.
I per tancar el monogràfic, Josep Duran i Fina Guitart, en l’article «Com diferenciar els conceptes de substàn cia elemental i element químic? El relat històric i l’ex perimentació», utilitzen activitats amb experiments a microescala en relació amb les principals idees sobre la matèria al llarg del temps, en una proposta d’aprenen tatge amb sentit per donar resposta a reptes relacio nats amb els ODS en el context de la sostenibilitat.
En la secció d’intercanvi l’article «FEr MoTs amb els símbols químics: un joc per a un aprenentatge trans versal», de Santiago Álvarez Reverter, proposa l’ús dels símbols químics per construir paraules, que pot ser motivador per fer aprenentatges tant sobre la taula química com de llengua. El joc que proposa pot ser en grescador dins i fora de l’àmbit escolar.
Esperem que gaudiu de la lectura i que el número sigui del vostre interès. Desitgem que els articles siguin útils per a la vostra tasca docent i us aportin fonamentació i idees que reverteixin en l’ensenyament de la química a l’aula.
Editorial
Aureli Caamaño, Pere Grapí i Fina Guitart Editors d’Educació Química EduQ
Fina Guitart Aureli Caamaño Pere Grapí
DOI: 10.2436/20.2003.02.208 http://scq.iec.cat/scq/index.html
A teaching-learning progression to introduce the concept of a substance
Una progressió d’ensenyament-aprenentatge per introduir el concepte de substància
Philip Johnson / Consultor d’educació científica
4 ISSN 2013-1755, SCQ-IEC Educació Química EduQ número 28 (2021), p. 4-11
resum
Aquest article presenta una progressió d’ensenyament-aprenentatge que desenvolupa el concepte de substància fins al punt en què les reaccions químiques adquireixen sentit. Desenvolupar un model de partícules és fonamental per a la progressió, atès que aquest model no tan sols explica sinó que també permet predir fenòmens que d’altra manera són impensables per a molts estudiants (l’estat gasós i el canvi químic). La discussió posterior identifica maneres clau en què l’enfocament suggerit és fonamentalment diferent de la pràctica tradicional en l’ensenyament de la química, i com aquestes diferències ofereixen una resposta constructiva a les concepcions alternatives predominants.
paraules clau
Àtoms, partícules, progressió, reaccions, substàncies.
abstract
This article presents a progression which develops the concept of a substance to the point where chemical reactions make sense. A developing particle model is integral to the progression, since this not only explains but also allows predictions of phenomena that are otherwise inconceivable for many learners (the gas state and chemical change). Subsequent discussion identifies key ways in which the suggested approach is fundamentally different to long standing practice in chemistry education, and how these differences offer a constructive response to prevalent misconceptions.
keywords
Atoms, particles, progression, reactions, substances.
Introduction
The current Oxford English Dictionary defines chemistry as «the branch of science concerned with the substances of which matter is composed, the investiga tion of their properties and reactions, and the use of such reactions to form new substances». This definition seems straightforward, but its sense depends on understanding the meaning of substances. To the uninitiated, this is not at all obvious. Individual substances as the constituents of matter (stuff, in common lan-
guage) are not easily recognised from everyday observations. What is meant by a substance can be developed with increasing degrees of sophistication.
This article suggests a progression to develop the concept of a substance to the point where vari ous reactions can be recognised. The progression is informed by the body of research into learners’ thinking (Tsaparlis & Sevian, 2013). Paying attention to learners’ perspectives helps to identify necessary steps which are easily taken for granted by those already
familiar with the content. An important feature of the progression is the interplay between a developing particle model and learners’ conceptions of macroscopic observations. Discussion then considers how the progression differs from what are assumed to be long standing practices in chemistry education. It will be argued that these differences address well known misconceptions. The discussion closes with comments on implementing the progression in the classroom.
A progression to develop the concept of a substance
Stage 1: Kinds of stuff
Objects and naming kinds of stuff
Distinguishing between an object and the stuff allows naming kinds of stuff. E.g., chopping up a wooden table destroys the table (the object) but each of the pieces is still wood (the stuff). Different objects can be made of the same stuff. Alternatively, the same object can be made of different kinds of stuff. Kinds of stuff are recognised by certain properties.
Families of stuff
Names such as wood and metal refer to families, where members share characteristic properties. Oak and beech are kinds of wood. Copper and gold are kinds of metal.
Some properties depend on the kind of stuff only and some depend on the object as well
Common salt tastes the same for all pieces. A ball of plasticine sinks in water, but the same amount in a boat shape can float. For a beam bridging a gap, how much it bends under a load depends on the kind of stuff, the amount (thickness) and its cross-sectional shape.
Stage 2: Substances and states
Objects/pieces/drops are samples of stuff.
Melting behaviour can identify a pure sample of a substance
On heating, pieces of some kinds of stuff change to liquid at a certain temperature, known as its melting point. Below this temperature the sample is in the solid state and above in the liquid state. At melting point, the sample changes from solid to liquid if gaining energy, or from liquid to solid if losing energy. Melting point only depends on the kind of stuff (not the object).
A well-defined melting point indicates a pure sample of a substance. Different substances have different melting points. Other kinds of stuff change from solid to liquid over a range of temperatures (e.g. butter). These are mixtures of substances.
A basic particle model to explain melting
There are three components; substance particles, hold and energy of movement. Substance particles are extremely small and do not have the properties of what is seen. They are unlike anything we know. Substance particles have an inherent ability to hold on to their own kind. Particles of different substances have different abilities to hold, ranging from very low to very high. (Initially, holds between particles of different substances are not considered.) Movement could be vibrating, rotating or travelling. Heating a sample gives the particles more energy for movement. Movement energy is connected to the temperature of a sample. Usually, heating results in rising temperature.
Holding ability and energy of movement act in opposition: hold restricts movement and energy promotes. The state of a substance sample depends on the balance between them. If holding ability dominates, the particles are held close together in fixed places, with movement restricted to vibration. This is the solid state.
If hold and energy are more equal, the particles are still close together, but not in fixed places. The particles are able to rotate and travel from place to place as well. This is the liquid state.
Raising the temperature of a sample doesn’t affect holding ability, but increases movement energy. Melting is when the particles have enough energy to overcome the hold partially and start moving around. The scenario
plays in reverse for liquid state changing to solid state on losing energy. Individual particles do not change so the substance doesn’t change. Across different substances, the higher the ability to hold, the higher the melting point. Mixtures don’t melt sharply because different kinds of particles interfere with each other.
(At this stage our model does not explain why temperature stays the same during change of state.)
Using the particle model to predict the gas state
What might happen on contin ued heating of the liquid state? If particles gain more energy, could they overcome the hold completely and separate from each other?
Seal a little water (0.5 ml) in a flat, transparent roasting bag. Place in a pre-heated oven at 200 OC. Very quickly, the bag inflates until all drops of water have disappeared. The space inside is clear- like air. Remove the bag and it collapses immediately, misting up on the inside. Water can change between the liquid and gas states. For boiling water, the large bubbles are water in the gas state.
Pure samples of substances have a well defined boiling point. Above this temperature a pure sample is in the gas state. At boiling point a sample changes from liquid to gas if gaining energy or from gas to liquid if losing energy. For the gas state, particles are far apart. Since the particles are the substance there is empty space (nothing) in-between. Individual particles do not change so it is still the same substance.
Substances with low holding ability have low melting and boiling points. Those with boiling points below room temperature exist in the gas state at room temperature.
Crystals
Pure samples of substances in the solid state form crystals.
Aprenentatge de conceptes i models A teaching-learning progression to introduce the concept of a substance número 28 5
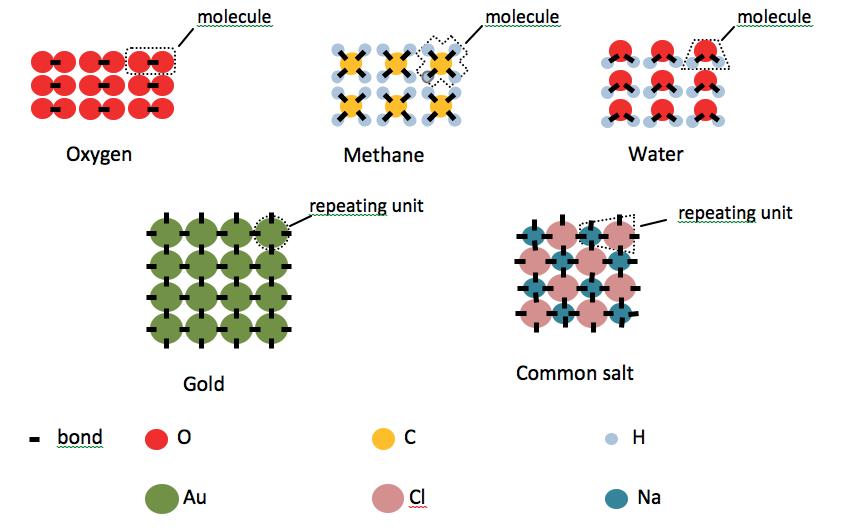
Figure 1. Atom structures of five substances.
Shapes derive from the ordered arrangement of substance particles. The faster they form within a sample the smaller their individual size. If very small, the sample is a powder. When a sample in liquid state solidifies, crystals interlock (e.g. in lumps of metal and blocks of ice).
Stage 3:
Substances mixing
Samples of substances can dissolve in water to form a solution
Individual particles of the dissolved substance are mixed amongst the water particles. Whether the added substance sample starts in the solid, liquid or gas states, the solution particle arrangements are essentially the same. The intrinsic motion of particles means mixing is spontaneous.
Solubility is how much will dissolve in a certain amount of water. Solubilities of different substances range from extremely low to unlimited. For practical purposes, those with extremely low solubilities are regarded as being ‘insoluble’. For many substances solubility increases
with temperature, for others it goes down and some are hardly effected.
Air has a low solubility, which decreases with temperature. Tiny bubbles appearing when cold water is first heated are air coming out of solution.
(At this stage our model cannot explain different solubilities. How particles of different substances hold on to each other is part of the explanation.)
A sample of a substance in the liquid state evaporates into the air, spontaneously
Evaporation is different to boiling. Boiling creates a pure sample in the gas state (the bubbles) and happens at a certain temperature. Evaporation results in a mixture of the substance and air particles and takes place at any temperature between melting and boiling.
Samples of substances in the gas state mix spontaneously
Air is a mixture of substances which have boiling points well below room temperature. We often refer to air without distin-
guishing between substances. Dissolved air has more oxygen than normal air.
Developing the energy component of our particle model to reconcile evaporation and boiling
If boiling is when particles have enough energy to overcome the hold, how can they separate at lower temperatures for evaporation? At any moment, particles don’t have the same energy because amounts are exchanged in collisions. There is a range of energies. To simplify, we can think of low, medium and high energy categories. Temperature relates to the distribution across the categories. At a higher temperature more of the particles have high energy and fewer have low energy.
In a non-boiling sample of water, high energy particles at the surface can overcome the hold and escape. Simultaneously, lower energy water particles are ejected by hits from high energy air particles (energy is transferred). Water particles at the surface leave individually, some helped by air particles. For boiling, the water
6 Educació Química EduQ número 28
particles act alone. Making the space for some water to be in the gas state (a bubble), needs a number of particles simultaneously overcoming the hold to move apart and push outwards. At a certain temperature there are enough particles with high enough energy to do this.
For evaporation, our model explains how surface area and temperature affect the rate of particles leaving. Recognising the possibility of water particles returning explains the effect of a breeze. Observed evaporation is the difference between rates of leaving and returning. A breeze reduces the rate of return.
Stage 4: Substances undergoing chemical changes
Developing our particle model with the ideas of atoms and bonds
Substance particles are made of atoms. There are different kinds of atom. Most atoms have the ability to form holds called bonds. These are usually strong. Atoms can bond with their own kind and other kinds. Fig. 1 shows some examples. All are in the solid state. Atom kinds are identified by a letter symbol. There are two kinds of struc ture. For oxygen, water and methane, atoms are bonded in groups called molecules. There are no bonds between atoms in different molecules. These are molecular structures. For gold and common salt there are no mol ecules. Atoms are bonded continu ously. These are giant structures. In all cases atoms are bonded throughout in a set way. This is why each is one substance. For molecular structures the molecule defines the substance. For giant structures the repeating unit of the pattern defines the substance. The two types of structure explain the wide range of melting and boiling points.
For molecular structures the arrangement and movement of
molecules gives the state. There are relatively weak holds between molecules. These strengthen with more atoms per molecule. Sub stances with 2-5 atoms per molecule are usually in the gas state at room temperature. Water is an exception. The hold between water molecules is strong enough to raise its boiling point above room temperature. More generally, molecules with O-H bonds have quite strong inter-molecular holds (water has two per molecule).
With giant structures, each atom is held in place by bonds to other atoms. Bonds are usually strong to very strong so this gives giant structures high to very high melting points. (Mercury with relatively weak bonds is a notable exception.) When common salt melts the atoms are able to move around individually, but the bonds mean one kind of atom always surrounds the other. Atoms of the same kind are never right next to each other. (This is to explain why melted salt isn’t a mixture.) For the gas state, energies are so high that the bonds can only hold two atoms (of different kinds) together at a time.
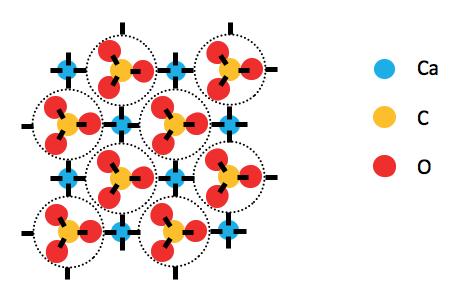
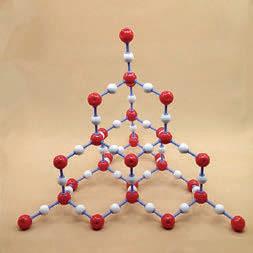
Some giant structures are more complex: e.g. calcium carbonate (fig 2). The groups of one C atom and 3 O atoms are like molecules but they cannot exist on their own as a substance. They have to be bonded to another atom, like Ca, in a giant structure.
The same kind of atom can make more than one substance. For example O atoms can bond in pairs to make oxygen, or in threes to make ozone. Ozone and oxygen are different substances. They have different melting and boiling points. Just the three kinds, C, O and H, can make an almost unlimited number of substances.
Using the idea of atoms to predict the possibility of substances changing into different substances Sometimes, when substances
encounter each other, bonds between atoms re-arrange. The old substances (reactants) cease to exist and new substances (prod ucts) are created. This is known as chemical change. The process is called a chemical reaction. For example, fig. 3 shows calcium and water changed to calcium hydrox ide and hydrogen.
Some reactions occur by just putting substances in contact. Some only occur if the reactants are heated to a higher temperature. Some only occur if one or all of the reactants are dissolved in water. Once started, many reactions give out energy. Some take in energy.
Observations depend on the states of reactants and products at the temperature of the reaction, and whether they stay separate or mix. Reactions that release a lot of energy can get hot enough to give out light as well. For reactions in water, the solubilities of the substances are important. Prod ucts with high solubility will be in solution. Those with very low solubility will either appear as a precipitate (if in the solid state), a separate layer of liquid, or bubbles (if in the gas state). Products with medium solubility will be part in and part out of solution, depend ing on the amount of water.
Decomposition on heating a substance
Some substances undergo chemical change when heated by themselves. For example, calcium carbonate changes to calcium oxide (a giant structure) and carbon dioxide (molecular). We say it decomposes. This happens at a temperature before melting.
Calcium carbonate doesn’t have a melting point, but it is still a substance. Common sugar decomposes at a temperature just above its melting point.
Differences to customary practice
Fundamental differences to customary practice relate to the
Aprenentatge de conceptes i models A teaching-learning progression to introduce the concept of a substance número 28 7
notion of substance particles, the role of particle theory in learning, and the importance of distinguishing between elements and compounds.
Substance particles
Introducing a particle model for substances gives particles an identity which is independent from sample state and necessitates accounting for different melting and boiling points. In contrast, customary practice begins by categorising room temperature samples into solids, liquids and gases. (There is no distinction between substances and mixtures of substances. This, itself, is unsatisfactory since some mixtures have intermediate properties.) When particles are introduced they are identified by these categories. Thus, the particles of solids are called solid particles, those of liquids are liquid particles and those of gases are gas particles
Learners can come to think that solids, liquids and gases are three separate types of stuff, each with its own type of generic particle (a common misconception). Quite literally, solid particles are solid, liquid particles are liquid and gas particles are gas (whatever that is). If indi vidual particles have the observable macroscopic characteristics, the model is not explaining the state and can seem pointless. When stuff melts the individual particles simply melt. The key point about the particle model is that we don’t need to say what the individual particles are like as stuff
In the substance approach, holding ability is pivotal. It determines the strength of hold when particles are close together and hence the state according to movement energy. (Inherent holding ability doesn’t change when particles are further apart and forces are weaker.) In the solids, liquids and gases approach learners can easily think that the type of stuff determines the strengths of forces. Forces are
Figure 2. Calcium carbonate.
strong in solids because the stuff is a solid, and so on. In this view, ideas of forces don’t challenge the notion of three types of stuff and play a subservient role.
The solids, liquids and gases approach with its generic solid, liquid and gas particles does not distin guish between pure samples of substances and mixtures. There fore, boiling and evaporation below boiling point are both defined as a change to gas. Yes, particles separate in both cases, but why boiling needs a specific tempera ture and evaporation doesn’t is unexplained and confusing to learners. How can heating water to 100 OC or leaving it alone give the same result? The substance approach recognises that they don’t. Boiling gives a pure sample in the gas state, evaporation gives a mixture. Evaporation into the air is treated as a mixing phenom enon, similar to dissolving. We do not say salt changes to liquid when it dissolves. In the substance approach, changes of state are for pure sample to pure sample, only. The particle model explanations for the factors affecting rates of dissolving parallel those for evaporation (where stirring is equivalent to a breeze).
Identifying particles with
substances means that different shapes and sizes for different substance particles can be used in diagrammatic representations of the states and mixtures. (Shapes can anticipate outlines of atom arrangements defining substances, as picked out in fig. 1.) For want of a reason to choose otherwise, the solids, liquids and gases approach normally uses circles. Non-circular shapes make it much easier to represent liquid state disorder while keeping particles close together because they can show random orientations (just using ovals makes a big difference). In the solid, liquid and gas approach, diagrams tend to put circles too far apart for the liquid state. Learners can then think spacing is the key difference between solid and liquid rather than movement (particles become closer when ice melts). Misleading emphasis on spacing in the liquid state can also be encouraged by talk of saturated solutions which gives a sense of filling up the space.
Role of particle theory in learning
Customary practice presumes gases are a known category of stuff, to be explained by particle theory. However, learners find gases to be very mysterious and are far from thinking they are stuff
8 Educació Química EduQ número 28
in the same way that solids and liquids are stuff. For gases, most learners don’t have a conception of what the particle theory is supposed to be explaining. In the absence of knowing water can change to a body of gas, many students say the bubbles in boiling water are air. They can say air because the bubbles look like air, without knowing what air is.
Longitudinal evidence (Johnson, 2005) suggests that particle ideas are the means by which learners can begin to think about gases as being stuff. Therefore, the sug gested progression uses the particle model to predict the possibility of the gas state. Seeing a drop of water changing to a large, clear volume in the gas state is a vital experiment. It opens the door to understanding that samples of gases are substances just as much as a lump of iron. A gas sample just happens to be above its boiling point at room temperature. Water in the gas state is like most other substances in the gas state, which is why the bubbles in boiling water look like air! The suc cessful prediction vindicates the model and illustrates testing of models in scientific practice.
Learners are also mystified by chemical change. Even when
appearances and properties change markedly, learners do not see this as a change of substances. Take the example in fig. 3. For many the white powder is either calcium in a different form or a mixture of calcium and water (two substances). Few would say a new substance that isn’t calcium or water (Johnson and Tymms 2010). Longitudinal evidence (Johnson 2005) suggests that ideas of atoms are the means by which learners come to accept chemical change as a phenomenon. Therefore, the suggested progression introduces ideas of atoms and predicts the possibility of chemical change before looking at examples. If we stop to consider, it is a big deal to say that new means not existing before. Learners need reasons to believe substances can go out of and come into existence.

Customary practice usually introduces structures and types of bonding together. Considering structures first explains the wide range of holding abilities and gives something for types of bonding to build on, later. By including complex giant struc tures, the model covers substanc es commonly encountered in school chemistry.
Overall, there is no attempt to explain how ideas of substance particles and atoms arose. The justification is in the power of the model to explain.
Elements and compounds
The suggested progression makes no mention of elements and compounds. Clearly, the distinction between atom structures made from one kind of atom and those made from two or more kinds could be made. However, for the purposes of explaining chemical change this is unnecessary. All are substances as defined by their atom structures, equally. (When the distinction is made I would call them elementary substances and compound substances.)
That the same kind or kinds of atom can make more than one atom structure, i.e. more than one substance, is very important. It emphasises the distinction between single atoms that are not substances (except the rare gases) and bonded atom structures that are substances. Furthermore, the properties of substances must derive from the way atoms are bonded together, not what they are like individually. This prepares the ground for the next stage of
Aprenentatge de
i models
conceptes
A teaching-learning progression to introduce the concept of a substance número 28 9
Figure 3. A chemical change: calcium and water changing to calcium hydroxide and hydrogen.
the progression: ideas of atomic structure and types of bonding.
Atoms have been named after one of the substances made from the kind, usually the first to be discovered. Presumably, oxygen atoms would be called ozone atoms if ozone had come first (and had been called ozone). Unfortunately, having the same name for a kind of atom and an elementary substance conflates the very important distinction. If we say water is made of hydrogen and oxygen we are talking about atoms. However, if learners take hydrogen and oxygen to mean substances, that sounds like a mixture. If we say water is made from hydrogen and oxygen we could be talking about atoms (as in a molecule) or substances (as in a reaction). Atoms bond, substances react. Sense can be made if one already knows, but it is easy to see how learners could become quite confused. As exemplified in the suggested progression, I would recommend using names for substances and letter symbols to identify atoms. Then, one has to think about which to use and the meaning is much clearer.
The common term, pure substance, also doesn’t help. Taken literally, this implies substances can be pure or impure which encour ages the misconception of ele ments being pure and compounds being mixtures. The suggested progression always refers to pure samples of substances.
Implementation
From a young age, children learn to recognise kinds of stuff by look, smell, taste, and manipulation (how heavy, stretchy and bendy). Stage 1 formalises these experiences and takes them further. Investigating various properties with an increasing degree of sophistication gives plenty to do.
Stage 2 requires judgment on when to introduce particle ideas. A short duration, small-scale study with 9-10 year olds using the substance approach gave encouraging results (Johnson and Papageorgiou, 2011). Longitudinal evidence (Johnson, 2005) has shown how learners’ understand ing of the particle model devel ops over multiple interventions spanning years (ages 11-14, in a substance-based approach). Learners need time take aspects on board until they can relin quish all thoughts of individual particles being like the macro scopic substance. With the initial focus on melting, new experi ments, demonstrations and videos featuring a range of substances are needed. Candle wax is pure enough to exhibit sharp melting at a low enough point for investigation with a hot water bath. Chocolate provides a contrast. Lead is readily melted and poured out to re-solidify (‘freeze’) almost instantly (on a thick metal plate).Three burners together can melt common salt (large crystals work best).
In addition to supporting the interpretation of the mixing aspects in chemical reactions, Stage 3 provides an opportunity to consolidate the particle model. Much familiar content can be used to develop the ideas: e.g. separation techniques, with an eye on the purity of resulting samples. Ways of growing crystals can be investigated. Also, how evaporated water in air starts to separate from the mixture on cooling, at a temperature which depends on the concentration of water. As well as mists, exploration of mixtures could extend to others where substances do not mix at the level of individual particles; such as gels, pastes, emulsions, foams, and smoke. If felt appropriate, the idea of energy distribution could be left
until later. It doesn’t sit on a direct line to interpreting observations surrounding chemical change, though is the basis for understanding rates of reaction. If desired, the discussion can develop the idea of pressure within a body of gas and how boiling point depends on the external pressure.
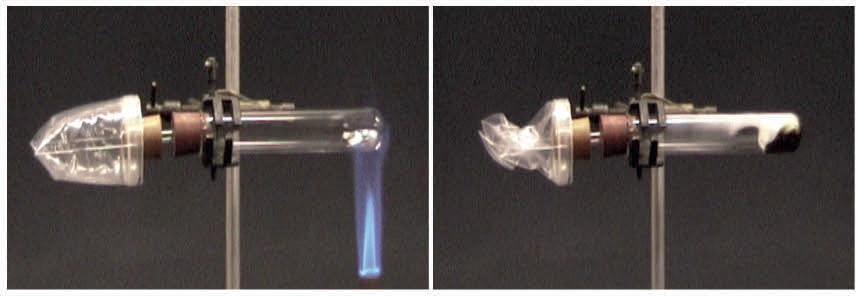
Stage 4 can follow when learners are ready, probably around ages 13- 14. Here examples should be chosen to illustrate different combinations in terms of numbers of substances, their states or in solution and whether heating is needed to start the reaction. Different ways of making the same substance challenges learners’ propensity to think of products as either reactants in a different form or in a mixture. For all reactions, I would recommend starting and finishing with separate pure samples of all substances involved (as in fig. 3). Most customary school experiments actually don’t. Often, reactants are not seen before solutions are made and some products are not recovered from solution. Oxygen is taken from the air unnoticed. Fig. 4 shows oxygen in a bag. As the magnesium reacts the bag collapses. Formulae and balanced equations stem naturally from bonded atom structure representations of chemical reactions.
Stuff and Substance: Ten key practicals in chemistry (Johnson, 2011) is a free downloadable resource directed at developing the concept of a substance.
Finally, while showing the power of the developing particle model, it is important to recognise what it cannot account for, yet. We still need to explain why temperature stays the same during changes of state, why there is such a range of solubilities and different temperature
10 Educació Química EduQ número 28
effects, and, indeed, why chemical reactions happen. Ultimately, these require the idea of entropy (Johnson, 2018).
Conclusion
This article opened with a definition of chemistry. It seems uncontroversial to suggest that a basic understanding of this definition should be the main, initial goal of chemistry educa tion. Without an understanding of substances that recognises the possibilities of three states, mixing and chemical change, how else could the stock of chemical knowledge make sense? The suggested progression plots a route to achieve this goal. Other routes could be devised, but melting behaviour provides a readily accessible, outward sign of purity to build on. It is difficult to think of a suitable alternative. Crystals are not always obvious. Solubility doesn’t discriminate. From melting the course is essentially set by the hierarchical relationship between ideas. Rather than being a constraint, the suggested progression invites chemistry education to explore suitable ways of teaching the ideas with a free choice of stimu lating activities and content. This might mean adapting old experi ments or finding new ones that better illustrate certain features. With ideas having primacy,
assimilating certain pieces of information is of much lesser importance. The pacing can be adjusted to suit the learners. Of course, there is always the danger of learners developing misconcep tions. However, compared to customary practice, the progres sion offers a constructive response to many prevalent misconceptions and may even prevent some arising. With an introductory curriculum based on the suggest ed progression, I believe there is good reason to have high expecta tions of learners.
References
Johnson, P. (2005). «The development of children’s concept of a substance: A longitudinal study of interaction between curriculum and learning». Research in Science Education, vol. 35, no. 1, p. 41-61.
Johnson, P. (2011). Stuff and Substance: Ten key practicals in chemistry. Gatsby Science Enhancement Programme. [On line] <https://www.stem.org. uk/elibrary/resource/29586> (date of last access: 18.03.2021)
Johnson, P. (2018). «An accessible approach to understanding en tropy and change». School Science Review, vol. 99, no. 368, p. 69-76.
Johnson, P.; PaPageorgiou, G. (2010). «Rethinking the introduction of particle theory: A
substance-based framework». Journal of Research in Science Teaching, vol. 47, no. 2, p. 130-150.
Johnson, P.; Tymms, P. (2011). «The emergence of a learning progression in middle school chemistry relating to the concept of a substance».
Journal of Research in Science Teaching, vol. 48, no. 8, p. 849-984.
TsaParlis, G.; sevian, H. (ed.), (2013). Conceptions of matter in science education. New York and London: Springer, Dordrecht, Heidelberg.
Philip Johnson
He graduated with a chemistry degree from Imperial College and taught chemistry for thirteen years in 11-18 UK comprehensive schools before joining Durham University School of Education. He is now retired. He began researching into the development of students’ understanding in chemistry while teaching in schools and continues to do so. He conducted a three year longitudinal study for his PhD, awarded by Durham.
Email: p.m.johnson@durham.ac.uk

Aprenentatge de
i models
conceptes
A teaching-learning progression to introduce the concept of a substance número 28 11
Figure 4. Magnesium reacting with oxygen.
DOI: 10.2436/20.2003.02.209 http://scq.iec.cat/scq/index.html
L’elaboració del concepte de substància química al llarg de l’educació secundària. De les propietats d’una substància a la seva composició i estructura
12 ISSN 2013-1755, SCQ-IEC Educació Química EduQ número 28 (2021), p. 12-20
The elaboration of the concept of chemical substance throughout secondary education. From the properties of a substance to its composition and structure
Aureli Caamaño / Societat Catalana de Química
resum

El concepte de substància química és un dels conceptes bàsics del currículum de química de l’educació secundària. La construcció d’aquest concepte es realitza a partir de conceptes com homogeneïtat, propietat característica, identitat química, composició elemental, estructura i interacció. El present article presenta una proposta de progressió d’aprenentatge del concepte de substància química mitjançant l’elaboració d’una sèrie de models macroscòpics, mesoscòpics, atomicomoleculars i electrònics.
paraules clau
Substància química, espècie química, entitat química, estructura química, interacció.
abstract
The concept of chemical substance is one of the basic concepts of the chemistry curriculum in secondary education. The construction of this concept is based on concepts such as homogeneity, characteristic property, chemical identity, elemental composition, structure and interaction. This article presents a proposal for the progression of learning of the concept of chemical substance by developing a series of macroscopic, mesoscopic, atomicomolecular and electronic models.
keywords
Chemical substance, chemical specie, chemical entity, chemical structure, interaction.
Introducció
El concepte de substància química és un dels conceptes centrals de la química, junta ment amb el concepte de canvi químic. Molts autors (Raviolo, Garritz & Sosa, 2011; Johnson, 2014) han assenyalat aquesta importància i han defensat que l’ensenyament de la química hauria de parar més atenció a aquest concepte. Una sèrie de
treballs plantegen progressions dels aprenentatges del concepte de substància química (Johnson, 2014; Talanquer, 2020; Caamaño & Marchán, 2021). La terminolo gia emprada per tal de diferen ciar termes com substància, substància química, substància pura, espècie química, element químic, substància elemental, substància composta i producte químic també ha rebut especial
atenció (Caamaño, 2015; Fernán dez-González, 2015; Kermen, 2021).
L’objectiu d’aquest article és aprofundir en la progressió de l’aprenentatge del concepte de substància química al llarg de l’educació secundària, parant atenció al procés de construcció del model macroscòpic i de models submicroscòpics successius, des del model mesoscòpic
cineticocorpuscular fins al model mesoscòpic electrònic.
Materials i substàncies
La idea de material com un tipus de matèria que presenta unes propietats característiques és un punt de partida per arribar al concepte de substància.
Materials heterogenis i homogenis
Els materials es poden classificar en homogenis (presenten una sola fase) i heterogenis (presenten més d’una fase), tot i que molts tenen un caràcter intermedi –presenten homogeneïtat a ull nu, però no si són observats a través d’un micros copi. Aquests últims materials els anomenem dispersions i presenten una fase dispersa i una fase dispersant. Les fases són les parts homogènies d’un material que tenen propietats físiques uniformes. Poden ser sòlides, líquides o gasoses.
Materials formats per una o diverses
substàncies
En els materials heterogenis és fàcil percebre que estan formats per diferents fases. Cada fase es caracteritza per ser sòlida, líquida o gasosa. Aquestes fases poden estar formades per un o més components o substàncies
En els materials homogenis no és fàcil decidir si estan formats per una única substància o per diverses substàncies. L’aparença de l’aigua pura i d’una solució de sal comuna en aigua és idèntica, però una destil·lació ens mostra que la solució salina està formada per dos compo nents o substàncies: aigua i sal.
Significat quotidià de substància versus el significat de substància química
Un dels primers aspectes que cal treballar és la diferència entre el significat de substància a la vida quotidiana i en química. A la vida quotidiana s’entenen com a substància molts materials que en realitat són mescles de substàn-
cies; per exemple, es considera que l’aire, l’aigua mineral, el vi, l’oli o la cera d’una espelma són substàncies. En tots aquests casos, es pot mostrar experimentalment, aplicant mètodes de separació, que es tracta de materials homogenis formats per diverses substàncies. Per tant, una primera definició de substància química seria que és un material homogeni que no es pot separar en diverses substàncies quan se li apliquen mètodes físics de separació, com l’evaporació, la destil·lació, la cristal·lització, la sublimació, la cromatografia, etc.
La caracterització macroscòpica de les substàncies químiques
Les substàncies químiques s’obtenen a partir de mescles mitjançant mètodes de separació i després se’ls aplica generalment un procés de purificació.
La puresa d’una substància química es caracteritza per la constància de la temperatura de fusió o d’ebullició
La constància de la temperatura de canvi d’estat ha estat durant molt temps el criteri més utilitzat en la determinació de la puresa d’una substància. Actualment, també s’apliquen mètodes cromatogràfics i espectroscòpics per identificar les impureses d’una substància amb un gran poder de resolució.
La puresa de les substàncies químiques és un concepte ideal
A la pràctica, tota substància conté petites quantitats d’altres substàncies; per tant, la idea d’una substància pura és una abstracció que utilitzem com un concepte o model ideal en química (Fernández-González, 2015). Aquest fet es fa evident quan parlem de diferents graus de puresa d’una substància química.
Una substància química té unes propietats característiques que permeten identificar-la
Una substància química es caracteritza per tenir propietats intensives (densitat, temperatura de fusió, temperatura d’ebullició, solubilitat, etc.) que són pròpies de cada substància. Tanmateix, el valor d’aquestes propietats varia en variar la temperatura o la pressió. Per exemple, la densitat d’una substància varia amb la temperatura; les temperatures de fusió i d’ebullició d’una substància varien amb la pressió. Per tant, per identificar una substància a través de les seves propietats caldrà especificar les condicions de pressió i temperatura en les quals es mesuren.
D’altra banda, les propietats característiques d’una substància varien apreciablement quan la substància canvia d’estat. Per exemple, la densitat d’una substància líquida és generalment més petita que la de la substància en estat sòlid i la d’una substància gasosa pot ser mil vegades més petita que si es troba en estat líquid.
La conservació de la identitat de les substàncies amb els canvis físics
La variació de les propietats característiques d’una substància en canviar d’estat físic pot posar en dubte la conservació de la seva identitat. Com podem estar segurs que el vapor d’aigua i l’aigua líquida són la mateixa substància, si no tenen les mateixes propietats?
Un primer argument a favor de la conservació de la identitat de les substàncies amb els canvis físics és que aquests presenten reversibilitat. L’aigua líquida es pot congelar, però escalfant-la obtenim de nou aigua líquida. La sal comuna es dissol en aigua, però evaporant l’aigua obtenim de nou la sal. Aquesta reversibilitat ens fa pensar que la identitat de la substància es manté amb el canvi, tot i que variïn l’aspecte físic i les propietats de la substàn-
Aprenentatge de conceptes i models L’elaboració del concepte de substància química al llarg de l’educació secundària número 28 13
Qüestió clau
Per què cada substància química té unes propietats característiques diferents a les d’altres substàncies?
Explicació
Se suposa que les substàncies presenten propietats diferents perquè estan formades per partícules diferents. Per tant, podem pensar que la identitat d’una substància rau en el fet d’estar constituïda per un determinat tipus de partícules. Aquesta és una explicació que evidentment s’haurà de revisar i completar.
Per què les propietats de les substàncies són diferents en els estats sòlid, líquid i gasós?
Quina és la naturalesa de les forces atractives entre les partícules?
Per explicar aquestes diferències construïm un model cineticocor puscular de les substàncies per a cada estat, imaginant com estan distribuïdes les partícules a l’espai, quin tipus de moviment tenen i quines interaccions s’estableixen entre elles. Aquestes interaccions suposem que són forces atractives que disminueixen amb la distàn cia.
Hi ha evidències experimentals del comportament elèctric de la matèria que ens permeten fer la hipòtesi que deuen ser interaccions elèctriques i que, per tant, són forces que disminueixen amb la distància (Martínez Torregrosa et al., 2020). Tanmateix, de moment, podem desenvolupar el model sense conèixer la naturalesa d’aquestes forces.
Per què es conserva la massa en els canvis d’estat?
Per què és necessari aportar energia per a la fusió d’una substància?
Com s’explica que la temperatura es mantingui constant durant la fusió i l’ebullició d’una substància, malgrat que s’aporta energia tèrmica?
Per què tenen punts de fusió i d’ebullició diferents les substàncies?
Per què considerem que es manté la identitat de les substàncies en canviar d’estat físic, malgrat que les seves propietats varien?
La conservació de la massa s’explica si suposem que les partícules de cada substància tenen una massa determinada i invariable.
Quan una substància es fon augmenta la separació entre les seves partícules i aquest procés implica «vèncer» les forces d’atracció entre elles. El valor de l’energia que s’aporta en la fusió ens permet estimar la intensitat de les forces d’atracció entre les partícules.
Tota l’energia que es proporciona s’utilitza per separar les partícules de la substància, és a dir, per augmentar l’energia potencial relativa al tipus d’interacció que existeix entre elles.
Els diferents punts de fusió o d’ebullició de les substàncies s’expliquen en termes de la diferent intensitat de les forces d’atracció entre les seves partícules. Com més intenses són aquestes forces, més alta serà la temperatura de fusió.
La persistència de la identitat de les substàncies en els canvis físics s’explica argumentant que les partícules que formen les substàncies no es modifiquen en els canvis físics, tot i que varia la seva posició relativa, el tipus de moviment que tenen i la intensitat de les interaccions entre elles.
Quadre 1. Elaboració del model cineticopuscular de substància química.
cia. Tanmateix, alguns canvis químics també són reversibles, malgrat que varia la naturalesa de les substàncies.
El model cineticocorpuscular de les substàncies
El primer model submicroscò pic de substància química que
construïm a l’escola és el model cineticocorpuscular. En aquest model considerem que les subs tàncies estan formades per partícules molt petites que tenen massa, estan en constant movi ment i interaccionen entre elles (s’exerceixen forces atractives). A més, se suposa que aquestes
partícules són diferents en cada substància: tenen diferent massa i poden exercir entre elles forces d’atracció de diferent intensitat. Aquest model ha de poder explicar la sèrie de fets que acabem de descriure, és a dir, ha de poder respondre la sèrie de qüestions que es plantegen en el quadre 1.
14
EduQ
28
Educació Química
número
La composició elemental de les substàncies: substàncies compostes i substàncies elementals
A diferència dels canvis físics de les substàncies, hi ha canvis que sí que impliquen canvis en la naturalesa de les substàncies. Quan escalfem fortament les substàncies, fem passar corrent elèctric a través d’elles o posem en contacte dues substàncies o les seves solucions podem observar canvis que atribuïm a processos de transformació d’unes substàncies en altres de diferents (Rodríguez-Arteche & Martínez-Aznar, 2019; Izquierdo, Merino & Marzábal, 2021).
Aquestes transformacions les anomenem reaccions químiques.
La interpretació macroscòpica d’una reacció química requereix identificar les substàncies que reaccionen i les que es formen (Caamaño & Corominas, 2020). Aquesta interpretació no és senzilla, entre altres coses perquè moltes vegades hi intervenen substàncies gasoses no visibles i perquè els alumnes tendeixen a considerar que els canvis de propietats que s’observen es poden produir sense que canviï la identitat de les substàncies. Per exemple, el canvi de coloració i de textura de la superfície del ferro quan s’oxida s’atribueix a un canvi de propietats del ferro.
Substàncies compostes i substàncies elementals
Entre les diferents reaccions que poden sofrir les substàncies n’hi ha unes que poden aportar informació sobre la seva composició. Es tracta de les reaccions de descomposició. De la mateixa manera que escalfar materials homogenis ens ha portat a constatar que podien estar formats per diferents substàncies, un escalfament fort de les substàncies o el pas del corrent elèctric a través d’elles ens permet arribar a la conclusió que
hi ha substàncies que es poden descompondre en altres de més simples i substàncies que no es poden descompondre. Les primeres les anomenen substàncies compostes o compostos i les segones, substàncies elementals
Substàncies elementals i elements químics
Per mitjà de la descomposició i la formació de l’aigua, Lavoisier va mostrar que estava formada per les substàncies simples hidrogen i oxigen. Lavoisier va identificar les substàncies elementals (corps simples en la seva terminologia) hidrogen i oxigen com els elements constitutius de l’aigua. Tanmateix, si pensem com formen part l’hidrogen i l’oxigen del compost aigua, és evident que no pot ser de la mateixa manera que com estan presents en l’hidrogen gas i en l’oxigen gas; altrament no hi hauria diferència entre l’aigua i una mescla d’hidrogen i oxigen. Això ens obliga a establir una diferència entre els conceptes de substància elemental i element. De moment, podem considerar com a element químic el tipus de matèria que constitueix cada substància elemental, a l’espera de poder formular una definició més precisa basada en un model atomicomolecular. D’altra banda, la «reversibilitat» de la reacció de descomposició i formació de l’aigua ens permet inferir que els elements d’un compost són unitats estables que es conserven en les reaccions químiques.
Els compostos tenen una composició elemental constant
El coneixement de la composició elemental (en % en massa) d’un compost s’obté mitjançant el procés d’anàlisi (descomposició) o mesurant les masses de combinació de les substàncies elementals en la reacció de formació del compost. Proust va observar la
composició constant dels elements que formen un compost i ho va expressar a través de l’enunciat que es coneix com a llei de les proporcions definides o llei de Proust. D’aquesta manera la composició elemental constant va passar a ser una característica fonamental de la definició d’una substància química i un dels fets en què es va fonamentar el primer model atomicomolecular de les substàncies.
Un primer model atomicomolecular de les substàncies: àtoms i molècules
L’explicació de l’existència de substàncies elementals i compostes, de la composició elemental fixa dels compostos i del canvi químic en general requereix modificar el model corpuscular de les substàncies, fent hipòtesis sobre la diferent naturalesa de les partícules que formen les substàncies elementals i les substàncies compostes (Caamaño, 2019).
Aquesta modificació pot fer-se amb una hipòtesi similar a la que va fer el químic anglès John Dalton quan va exposar la seva teoria atòmica de la matèria.
Dalton va suposar que si una substància elemental no es pot descompondre és perquè està formada per partícules indivisibles (àtoms). Per explicar que un compost es pogués descompondre en substàncies elementals va suposar que estava format per «àtoms compostos» (que ara en diem molècules) que en trencar-se proporcionaven els àtoms que formaven les substàncies elementals. Per tant, suposem que la unió entre els àtoms que formen una molècula és molt forta.
Dalton va considerar que les substàncies elementals estaven formades per àtoms iguals i que els compostos estaven constituïts per molècules d’àtoms diferents. Una de les primeres modifica-
de conceptes
número 28
models 15 L’elaboració del concepte de substància química al llarg de l’educació secundària
Aprenentatge
i
cions que cal fer en aquest model és acceptar que les substàncies elementals també poden estar formades per molècules d’àtoms iguals
En la terminologia de Dalton element és tant la substància elemental com el tipus d’àtom que forma aquesta substància elemental. Aquesta ambigüitat o polisèmia del terme element encara perdura actualment, tot i que la recomanació és evitar-la. Substància elemental és un terme macroscòpic que fa referència a un tipus de substància, mentre que element (un tipus d’àtom) és un terme abstracte que té un caràcter atòmic o mesoscòpic (Caamaño, Guitart & Grapí, 2019).
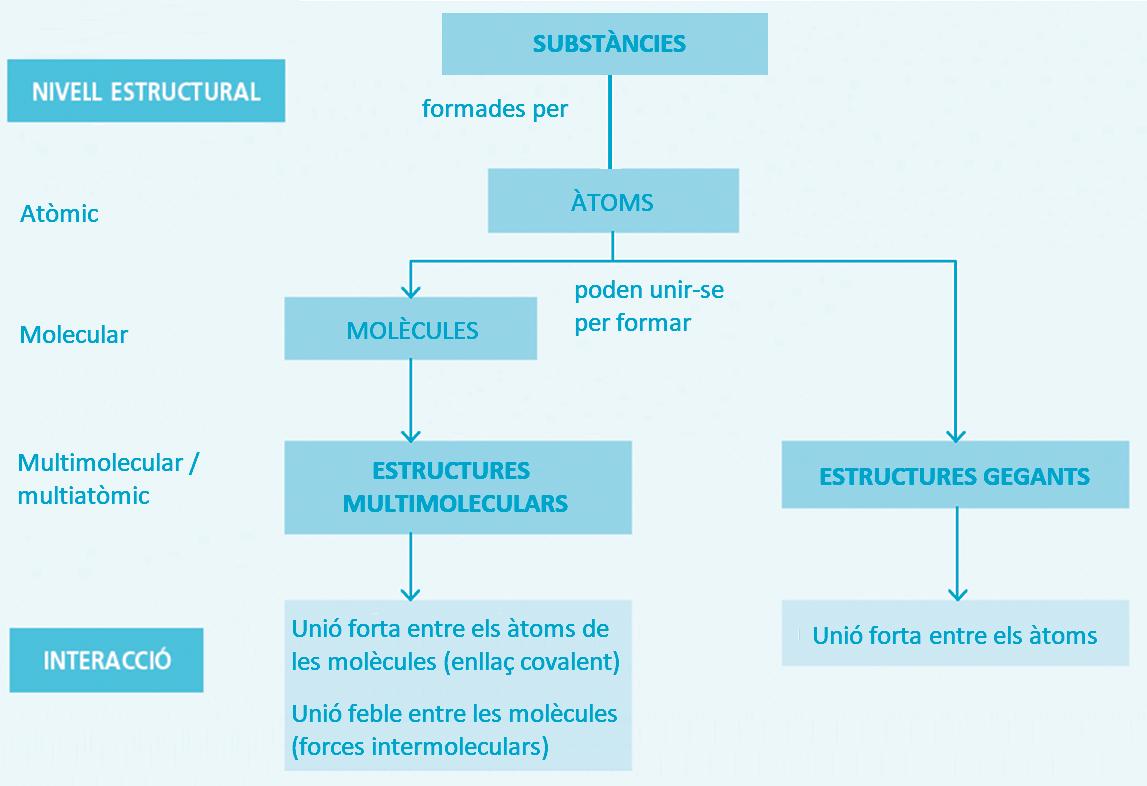
El model mesoscòpic: estructures multimoleculars i estructures gegants
La següent modificació que cal fer en el model de Dalton és adonar-se que els àtoms es poden
unir d’una altra manera que no condueix a la formació de molècules, sinó a estructures ininterrompudes d’àtoms fortament units entre ells que s’anomenen estructures gegants. Aquestes estructures poden existir tant en les substàncies elementals com en els compostos.
Així doncs, hi ha substàncies formades per àtoms lliures (els gasos nobles), substàncies formades per molècules (que podrien estar en qualsevol estat) i substàncies formades per àtoms, que formen part d’estructures gegants, que només podrien existir de forma ordenada en estat sòlid).
El pas següent en la modelització de l’estructura de les substàncies és preguntar-se com estan organitzats a nivell mesoscòpic els àtoms o les molècules i quines interaccions existeixen entre ells en les estructures multiatòmiques o multimoleculars (fig. 1).
Fent hipòtesis sobre la intensitat de la interacció entre els àtoms i entre les molècules
Hi ha un conjunt de substàncies que a temperatura ambient són gasos, líquids o sòlids de baixa temperatura de fusió. D’aquest fet podem deduir que són substàncies en què les forces d’atracció entre les partícules són febles. Quin tipus de partícules poden ser? D’acord amb l’estructura que hem suposat que té un gas en el model cineticocorpuscular només poden estar formades per àtoms o molècules lliures. Per tant, arribem a la conclusió que les forces intermoleculars han de ser febles en les substàncies moleculars. A partir d’ara inclourem en aquesta categoria els gasos nobles, com si estiguessin formats per molècules monoatòmiques.
Per contra, la intensitat de les unions entre els àtoms que formen les molècules ha de ser molt forta, ja que es mantenen
16 Educació Química EduQ número 28
Figura 1. Estructures de les substàncies: estructures multimoleculars i estructures gegants (multiatòmiques).
inalterades durant els canvis d’estat. Com que els àtoms que formen una molècula es troben a una distància mitjana fixa, anomenarem enllaç el tipus d’unió que les manté unides. Aquests tipus d’enllaços els anomenem enllaços covalents, perquè expliquen la valència o capacitat de combinació dels àtoms per formar molècules i perquè, com veurem més endavant, es produeixen entre àtoms d’elements no metàl·lics.
Un altre grup de substàncies es caracteritzen per ser substàncies sòlides d’alta temperatura de fusió. Per explicar-ho, podem suposar que estan formades per estructures gegants amb àtoms units per forces o unions molt intenses. La interacció entre els àtoms en aquestes estructures podria ser de la mateixa intensitat que la interacció que manté units els àtoms en una molècula, i, fins i tot, de la mateixa naturalesa, però això encara no ho sabem.
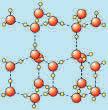
Tres tipus d’estructures gegants
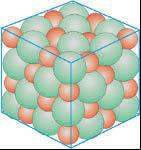
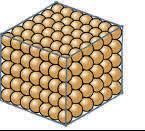
Tanmateix, quan indaguem les propietats de substàncies sòlides amb punts de fusió molt alts, és a dir, substàncies que considerem formades per estructures gegants, ens trobem amb diferències molt apreciables (Pinto, 2016). D’acord amb aquestes diferències de propietats, podem establir tres grups de substàncies amb estructures gegants:
— Sòlids diamantins. Sòlids molt durs, amb punts de fusió elevadíssims, insolubles i que no condueixen el corrent elèctric ni en estat sòlid ni líquid, com el diamant i el diòxid de sílice.
— Sòlids salins. Sòlids durs, però fràgils, que no condueixen el corrent elèctric en estat sòlid, però sí en estat líquid o en solució aquosa, com per exemple el clorur de sodi.
— Sòlids metàl·lics. Sòlids, en general, de gran densitat, dúctils i
mal·leables, amb lluentor metàl lica, que condueixen l’electricitat en estat sòlid i líquid. Són metalls.
Tres tipus de partícules: àtoms, molècules i ions, i quatre tipus d’interaccions
Aquesta diferència de propietats tan notable ens obliga a establir tres models diferents d’estructura gegant amb partícules i/o interaccions diferents (Caamaño, 2019; Taber, 2016).
Els sòlids diamantins els imaginem formats per la unió d’àtoms per enllaços com els que existeixen en una molècula, és a dir, per enllaços covalents; per això els anomenem sòlids covalents. No disposem encara d’una explicació de l’enllaç covalent.
Els sòlids salins, com el clorur de sodi, que condueixen el corrent elèctric en estat líquid, els imaginem formats per àtoms amb càrrega (ions) de signe contrari. Per això els anomenem sòlids iònics. La interacció entre els ions és de tipus electrostàtic. De forma genèrica, l’anomenem enllaç iònic
Els sòlids metàl·lics els imaginem formats per àtoms units en estructures molt compactes, però no podem construir de moment un model que expliqui la seva mal·leabilitat i conductivitat elèctrica. Tanmateix, anomenem enllaç metàl·lic la interacció existent entre els àtoms en aques ta estructura, malgrat que encara no la puguem explicar.
Notem que hem hagut de suposar l’existència d’una nova partícula: els ions. Per tant, hem establert ja tres tipus de partícules o entitats químiques a escala submicroscòpica: els àtoms, les molècules i els ions. I quatre tipus d’interaccions: forces intermoleculars, enllaços covalents, enllaç iònic i enllaç metàl·lic. La fig. 2 mostra les partícules que formen les estructures multimoleculars i les estructures gegants i el tipus d’interacció entre elles.
Formes al·lotròpiques: un mateix element forma substàncies elementals diferents
La modelització de l’estructura de les formes al·lotròpiques d’un element constitueix un dels millors exemples en què es pot evidenciar que el concepte de substància està associat a l’estructura i no tan sols a la composició química. El carboni diamant i el carboni grafit estan tots dos formats per àtoms de carboni, però les seves propietats són molt diferents perquè són diferents la seva estructura i el tipus d’interacció entre alguns dels seus àtoms. Són, per tant, dues substàncies elementals diferents, malgrat estar formades pel mateix tipus d’àtom.
Revisió electrònica dels models de molècula, estructura multimolecular i estructura gegant
El pas següent és modelitzar l’estructura interna de l’àtom a partir de les evidències experimentals disponibles, que s’inicien amb el descobriment de la primera partícula subatòmica, l’electró, i prossegueixen amb la caracterització dels protons i neutrons en el nucli.
Un cop hem elaborat un model per a l’estructura interna de l’àtom (Caamaño, 2018), que imaginem format per un nucli positiu (protons i neutrons) i electrons negatius distribuïts en capes, és possible interpretar des d’una perspectiva electrònica la càrrega elèctrica dels ions, la formació d’ions, l’enllaç covalent, la polaritat i geometria de les molècules, la interacció existent en els sòlids metàl·lics –entre ions positius i electrons de valència lliures– i les forces intermoleculars i els enllaços d’hidrogen. Així doncs, la modelització a nivell subatòmic o electrònic dels àtoms possibilita l’elaboració de models dels diferents tipus d’enllaç i la revisió de la modelització molecu-
17 L’elaboració del concepte de substància química al llarg de l’educació secundària
número 28
Aprenentatge
i
de conceptes
models
Figura 2. Estructura de les substàncies. Estructures multimoleculars i estructures gegants: covalents, iòniques i metàl·liques.
lar i mesoscòpica (multiatòmica i multimolecular) fetes amb anterioritat (Caamaño, 2016a; 2016b) (fig. 3).
El coneixement de l’estructura interna de l’àtom també permet interpretar les valències químiques dels elements, establir una nova definició d’element químic en funció del nombre atòmic, explicar l’existència d’isòtops i la periodici tat de les propietats de les substàn cies elementals i dels àtoms en termes de la seva estructura electrònica (Caamaño, Guitart & Grapí, 2019), així com el comporta ment químic de les substàncies elementals i dels compostos.
També és possible progressar en la modelització dels diferents tipus de reaccions químiques
(Caamaño [coord.], 2021) –reaccions àcid-base, reaccions d’oxidacióreducció i reaccions de precipitació–, i abordar la modelització de diferents famílies de substàncies, com les substàncies àcides i bàsiques; les substàncies oxidants i reductores, etc.
Substàncies químiques, espècies químiques i entitats químiques
Al principi les substàncies, després d’un procés d’obtenció i purificació, eren caracteritzades per una anàlisi elemental i la determinació de les seves propie tats físiques i químiques. Les noves tècniques de determinació de l’estructura de les substàncies han permès caracteritzar-les per l’estructura, és a dir, identificar les
espècies químiques que les constitueixen. D’aquesta manera el concepte de substància química s’ha anat desplaçant cap al d’espècie química (Chamizo, 2017).
La IUPAC (2015) defineix espècie química de la manera següent: «Un conjunt d’entitats moleculars químicament idèntiques que poden tenir el mateix conjunt de nivells d’energia molecular en l’escala de temps d’un experiment o observa ció. El terme s’aplica per igual a un conjunt d’entitats atòmiques químicament idèntiques o a un conjunt d’unitats estructurals en una xarxa cristal·lina.»
La definició de la IUPAC d’espècie química, en referir-se a un conjunt d’entitats moleculars atòmiques o iòniques, se situa en
18 Educació Química EduQ número 28
SUBSTÀNCIA
Forces intermoleculars
Enllaços d’hidrogen (en el cas de l’aigua)
Estructura i partícules
Tipus d’interacció
Enllaç covalent (forces electrostàtiques entre els electrons compartits i els nuclis)
Enllaç iònic (forces electrostàtiques entre els ions)

Enllaç metàl·lic (forces electrostàtiques entre els ions positius i els electrons de valència deslocalitzats)
Figura 3. Estructures multimoleculars i estructures gegants (covalents, iòniques i metàl·liques): partícules constituents i natu ralesa de la interacció entre elles.


un nivell estructural mesoscòpic. Aquest conjunt d’entitats ha de ser suficientment nombrós perquè les propietats físiques i espectroscòpiques del conjunt siguin detectables, tot i que no tant com perquè l’espècie sigui perceptible a simple vista. El terme espècie química no sempre té correspondència a nivell macroscòpic. Qualsevol substància està formada per espècies químiques, però no totes les espècies químiques es poden presentar en forma de substància; per exemple, podem parlar de l’espècie química «io sodi(s)» o «io sodi(aq)», però no de la substància «io sodi» (Caamaño, 2015).



En un article publicat recentment, Kermen (2021) estableix les definicions que s’han adoptat per als termes de substància química, espècie química i entitat química en el currículum de química francès.
Les espècies químiques poden ser atòmiques, moleculars, aniòniques, catiòniques i iòniques. Per exemple, la substància química sacarosa està formada per l’espècie molecular sacarosa; el clorur de sodi està format per l’espècie química iònica (NaCl(s)), que a l’hora està constituïda per les espècies químiques catiòniques (Na+(s)) i aniòniques (Cl (s)).
Les molècules de sacarosa, i els ions Na+ i Cl són entitats quími-

ques. Així, doncs, les entitats químiques són els àtoms, les molècules i els ions, que hem estat anomenant partícules al llarg de l’article.
A tall de conclusió
Al llarg d’aquest article hem presentat com es poden construir models de substància química que, partint d’un model macroscòpic basat en les propietats, permeten avançar en el coneixement de l’estructura de les substàncies fent hipòtesis sobre la naturalesa de les seves partícules constitutives, el seu moviment i les seves interaccions, seguint la seqüència de progressió següent:
Aprenentatge
i models
de conceptes
19 L’elaboració del concepte de substància química al llarg de l’educació secundària número 28
Sofre(s) / Aigua(s) Diamant / Diòxid de silici(s) Clorur de sodi(s) Coure(s)
S8 Molècules H2O Àtoms
Si i àtoms O Ions sodi (Na+) i ions clorur (Cl ) Ions coure (Cu2+) i electrons de valència deslocalitzats
Multimolecular Gegant covalent Gegant iònica Gegant metàl·lica Molècules
CÀtoms
model mesoscòpic cineticocorpuscular; model macroscòpic basat en la composició química elemental; model atomicomolecular; model mesoscòpic (estructures multimoleculars i estructures gegants: covalents, iòniques i metàl·liques); model subatòmic o electrònic dels àtoms; ions i molècules, i model estructural mesoscòpic electrònic.
En aquest recorregut hem parat atenció a conceptes com homogeneïtat, propietat caracte rística, canvi d’estat, identitat química, reacció química, compo sició elemental, estructura i interacció, que juguen un paper important en aquest procés de construcció. Al final hem fet una consideració sobre com els nous mètodes de determinació de l’estructura de les substàncies por ten al concepte d’espècie química, que es pot situar en un nivell intermedi entre els de substància química i entitat química.
Referències
Caamaño, A. (coord.) (2021). «Tipos de reacción química». Alambique, núm. 103.
Caamaño, A. (2015). «Una reflexión conceptual y lingüística en torno a las diferentes denominaciones de las sustancias químicas». Alambique, núm. 82, p. 9-16.
— (2016a). «Un enfoque para vencer errores y ambigüedades. Enlace químico y estructura de las sustancias en secundaria». Alambique, núm. 86, p. 8-18.
— (2016b). «Secuenciación didáctica para el aprendizaje de los modelos de enlace». Alambique, núm. 86, p. 39-45.
— (2018). «Los modelos atómicos escolares ¿Recreación de los modelos históricos o creación de modelos propios?». Alambique, núm. 93, p. 7-17.
— (2019). «La teoría atómico-molecular en secundaria. Modelización progresiva basada en
evidencias experimentales». Alambique, núm. 97, p. 8-18. Caamaño, a.; Corominas, J. (2020). «Modelització macroscòpica dels canvis físics i químics. Un diàleg constant entre observació, interpretació, experimentació i argumentació». Educació Química EduQ, núm. 27, p. 19-26. Caamaño, a.; guiTarT, F.; graPí, P. (2019). «L’ensenyament del concepte d’element químic i de la taula periòdica a l’educació secundària». Educació Química EduQ, núm. 25, p. 32-40.
Caamaño, a.; marChán, I. (2021). «La progresión en el aprendizaje de los conceptos de sustancia y reacción química en secundaria». Alambique, núm. 103, p. 8-15.
Chamizo, J. A. (2017). «La cuarta revolución química (19451966). De las sustancias a las especies químicas». Educación Química, núm. 28, p. 202-2010.
Fernández gonzález, Manuel (2015). «Reflexiones epistemológicas sobre el concepto de sustancia pura». Alambique, núm. 82, p. 24-31.
izquierdo, m.; merino, C.; marzábal, A. (2021). «¡La reacción química emociona! La importancia del lenguaje en la modelización del cambio químico». Alambique, núm. 103, p. 16-22.
Johnson, P. (2014). «An evidencebased approach to introductory chemistry». School Science Review, vol. 95, núm. 353, p. 89-97.
Kermen, I. (2021). «Espèce chimique, entité chimique, substance chimique? Reflexion critique autour du glossaire d’accompagnement des programmes de chimie 2019». Bulletin de l’union des professeurs de physique et de chimie, vol. 115, núm. 1030, p. 29-41.

marTínez Torregrosa, J.; álvarez, J. F.; limiñana, r.; menargues, a.; niColás, C.; rey, a.; rosa, s.; savall, F. (2020). «Enseñanza
sobre gases, líquidos y sólidos. Una progresión hacia la estructura de todas las cosas». Alambique, núm. 101, p. 8-15.
PinTo, G. (2016). «Identificación y comprensión de la estructura y el tipo de enlace». Alambique, núm. 86, p. 28-33.
raviolo, a.; garriTz, a.: sosa, P. (2011). «Sustancia y reacción química como conceptos centrales en química. Una discusión concep tual, histórica y didáctica». Revista Eureka de Divulgación y Enseñanza de las Ciencias, vol. 8, núm. 3, p. 240-254.
rodríguez arTeChe, i.; marTínez aznar, M. M. (2019). «¿Qué ocurre en esta reacción? De indagar a modelizar». Alambique, núm. 97, p. 27-34.
Taber, K. S. (2016). «Enlace químico y estructura atómico-molecular en secundaria». Alambique, núm. 86, p. 19-27.
Talanquer, V. (2020). «La progresión de los aprendizajes sobre la composición, estructura y transformación química de la materia». Educació Química EduQ, núm. 27, p. 4-11.
Aureli Caamaño Ros
És doctor en química per la Universitat de Barcelona (UB) i graduat en humanitats per la Universitat Pompeu Fabra (UPF). Ha estat catedràtic de física i química de secundària i ha impartit nombrosos cursos de formació del professorat a Espanya i Llatinoa mèrica. És coordinador i coautor del llibre Enseñar Química. De las sustancias a la reacción química i coeditor de les revistes Alambique i Educació Química EduQ
A/e: aurelicaamano@gmail.com
20 Educació Química EduQ número 28
¿Cómo progresan las ideas de los estudiantes sobre las relaciones estructura-propiedades?
How do students’ ideas about structure-property relationships progress?
resumen
La investigación educativa en enseñanza de la química en los últimos 40 años ha revelado que el razonamiento de los estudiantes sobre las relaciones que existen entre la estructura submicroscópica de las sustancias y sus propiedades macroscópicas observables cambia significativamente durante su paso por la escuela. En este artículo se presenta una descripción y análisis de los cambios más notables en esta área y de sus consecuencias en el diseño de actividades de aprendizaje que ayuden a los estudiantes a progresar en sus ideas.
palabras clave Aprendizaje, composición, estructura, propiedad, progresión de aprendizajes.
abstract
Research in chemical education in the last 40 years has shown that student reasoning about the relationships between the submicroscopic structure of substances and their macroscopic observable properties changes significantly with schooling. This paper describes and analyzes major changes in this area and discusses their relevance in the design of instructional activities that foster progression in student understanding.
keywords

Learning, composition, structure, property, learning progression.
Introducción
Los estándares educativos en los Estados Unidos y otras partes del mundo enfatizan la importancia de desarrollar formas de razonar que ayuden a los estudiantes a darle sentido a las propiedades y comportamientos de los sistemas que los rodean (NRC, 2007). Para alcanzar este objetivo, se recomienda identificar conceptos y formas de pensar transversales que se aplican en contextos variados para generar explicaciones y construir argumentos y justificaciones. Las relaciones «estructura-propiedad» (o su análogo «estructura-fun-
ción» en biología) encapsulan una de estas formas transversales de pensar que nos ayuda a utilizar conocimientos sobre la composición y estructura submicroscópica de las sustancias para explicar y predecir sus propiedades y comportamientos observables a nivel macroscópico (Talanquer, 2018; 2020).
Los resultados de diversas investigaciones sobre el aprendizaje en química en los últimos 40 años (Cooper & Stowe, 2018) proporcionan información que permite inferir cómo las ideas de los estudiantes sobre relaciones estructura-propiedades típica-
mente progresan a medida que avanzan en sus estudios. En esta contribución se resumen y organizan resultados importantes en esta área para resaltar las dificultades que la mayoría de los estudiantes enfrentan para construir y utilizar estas relaciones de manera normativa (de acuerdo a las normas aceptadas en química) y productiva, y las estrategias de enseñanza que favorecen el aprendizaje significativo en esta área.
Progresiones de aprendizaje
Una progresión de aprendizaje es una propuesta de organización
DOI: 10.2436/20.2003.02.210 http://scq.iec.cat/scq/index.html 21 ISSN 2013-1755, SCQ-IEC Educació Química EduQ número 28 (2021), p. 21-27
Vicente Talanquer / Department of Chemistry and Biochemistry, University of Arizona, Tucson AZ, 85745 US
de contenidos, actividades de aprendizaje y evaluaciones que favorece la comprensión de una idea central en una disciplina (Duschl, Maeng & Sezen, 2011). Estas progresiones se construyen con base en resultados de investigaciones educativas sobre las ideas y formas de razonar de los estudiantes en cierta área. La progresión toma en cuenta las ideas iniciales comunes de los alumnos (lo que define el nivel más bajo de la progresión) y describe estrategias para avanzar en la comprensión y formas de razonar en dirección del concepto científico que se quiere que los estudiantes construyan (lo que define el nivel más alto de la progresión).
El objetivo central de este trabajo no es presentar una progresión de aprendizaje completa para desarrollar el pensamiento de los estudiantes sobre relaciones estructura-propiedades, sino resumir resultados de investigaciones existentes en esta área que puedan facilitar el trabajo docente. En particular, en este artículo se organizan y discuten ideas que los maestros deben considerar en el diseño y secuenciación de actividades de aprendizaje y evaluaciones que ayuden a los estudiantes a conectar información sobre la composición y estructura de las sustancias a nivel submicroscópico y sus propiedades físicas y químicas observables.
El razonamiento estructura-propiedades en química
El razonamiento químico se sustenta en una variedad de modelos que conectan las propiedades de un sistema de interés con la composición y estructura de sus componentes (Talanquer, 2018; 2020). Estos modelos representan sistemas a múltiples escalas (ver fig. 1), desde el nivel macroscópico hasta el nivel
electrónico (Talanquer, 2011), y relacionan las propiedades de un sistema en una escala con las propiedades y comportamiento de los componentes en una subescala. Por ejemplo, las propiedades de un jabón líquido para lavar platos (nivel macroscópico multi-componente) se pueden explicar en términos de las propiedades del agua y del surfactante que lo componen, y de las interacciones entre ellas (nivel macroscópico uni-componente). De manera análoga, las propiedades físicas de cada una de estas sustancias se pueden explicar con base en las interacciones dinámicas entre las partículas que las componen (nivel corpuscular), y la naturaleza de tales interacciones se puede relacionar con la composición y estructura de las diferentes partículas a nivel molecular.
Las relaciones estructura-propiedades en química se construyen utilizando razonamiento asociativo o razonamiento mecanístico dependiendo de los objetivos que se tengan (fig. 2). En ocasiones estas relaciones se expresan de manera automática como asociaciones directas entre una propiedad del sistema y una característica de sus componentes. Por ejemplo, la temperatura de ebullición de un líquido se relaciona con fuerzas intermoleculares entre las partículas que lo constituyen. En otras situaciones se requiere construir historias causales, o mecanismos, que conectan el comportamiento de los componentes en una subescala con las propiedades observadas en la siguiente escala. En estas explicaciones se asume que estas propiedades «emergen» de las
Figura 1. Diferentes escalas en las que se construyen relaciones estructura-propie dades en química.

Educació Química EduQ número 28 22
interacciones dinámicas entre los componentes. Esto es, se trata de propiedades que son resultado de dichas interacciones y no están presentes en los componentes individuales (Talanquer, 2008).
Dada la naturaleza del razona miento que se requiere para construir relaciones estructurapropiedades, cabe esperar que los estudiantes de química tengan dificultades para generarlas y utili zarlas de manera normativa y productiva. El análisis de los resultados de investigaciones educativas en esta área sugiere que las dificultades son distintas dependiendo del tipo de sistema o fenómeno bajo análisis. En particular podemos distinguir dos grandes casos. Situaciones en las que se busca explicar propiedades intrínsecas de las sustancias y situaciones en las que el interés se centra en explicar su comporta miento cuando interaccionan con otros materiales. En las siguientes secciones se discuten de manera separada cada uno de estos casos.
Progresión en el razonamiento sobre propiedades intrínsecas de las sustancias
Aunque las ideas de los estudiantes sobre el origen de las propiedades de las sustancias cambian con su aprendizaje en química, el razonamiento en esta área tiende a estar guiado por un esquema cognitivo en el que se asume que las propiedades observables resultan de la presencia de componentes con esas mismas propiedades. La naturaleza de los componentes que se invocan varía de una etapa educativa a otra, pero el esquema persiste. Se trata de un esquema en el que el razonamiento se centra en el análisis de la «composición» de un sistema, ignorando las características estructurales de los componentes y las variadas interacciones entre ellos. Sin embargo, el razonamiento de
Figura 2. Tipos de razonamiento utilizados en la construcción de relaciones estruc tura-propiedades.
los estudiantes progresa en otras áreas y tiende a avanzar a través de las siguientes etapas:
I. Eclecticismo intuitivo
Los estudiantes jóvenes tienden a razonar de manera variable sobre diferentes tipos de sustancias. En algunos casos asumen que ciertas sustancias tienen propiedades intrínsecas, como el agua que se asume inherentemente líquida. Las propiedades de muchos materiales se explican entonces asumiendo la presencia de componentes que les otorgan las propiedades observadas. Por ejemplo, el alcohol es líquido porque contiene agua y el cobre es rojizo porque contiene sustancias que son rojas (Ngai, Sevian & Talanquer, 2014). En esta etapa, muchos estudiantes tienden a «sustancializar» las propiedades observables atribuyéndoles características materiales (por ejemplo, las sustancias más calientes contienen más calor).
II. Macro-composicionismo
A medida que los estudiantes ganan experiencia trabajando con distintos materiales y reciben
más información sobre ellos, es común que construyan asociaciones simples entre las propiedades de las sustancias y su origen, historia, uso o comportamiento. Por ejemplo, en la escuela los estudiantes aprenden que se requiere oxígeno para producir fuego, y que el aluminio y la plata son metales brillantes. Este conocimiento frecuentemente se combina con un esquema aditivo para dar sentido a las propiedades de los materiales y explicarlas. Por ejemplo, en esta etapa es común que los estudiantes piensen que las sustancias inflamables contienen oxígeno y que todos los compuestos de aluminio y plata, como el cloruro de plata, deben ser sustancias con brillo (Talanquer, 2013).
III. Corpuscularismo
Cuando los estudiantes aprenden que las sustancias están constituidas por pequeñas partículas (o corpúsculos), las relaciones estructura-propiedades que construyen se modifican. Sus explicaciones empiezan a hacer referencia a las propiedades inherentes de las partículas que conforman a los distintos mate-
¿Cómo
Aprenentatge de conceptes i models
progresan las ideas de los estudiantes sobre las relaciones estructura-propiedades?
número 28 23
riales. Sin embargo, las propiedades de estas partículas comúnmente se infieren de las propiedades macroscópicas observables de las sustancias bajo análisis. Por ejemplo, los estudiantes pueden pensar que las partículas de cobre son rojizas y maleables como este metal (Kind, 2004). Las partículas se conciben como pequeños pedazos del material. Las relaciones estructura-propiedades que los estudiantes construyen en esta etapa tienden a basarse en razonamiento asociativo y no mecanístico.
IV. Composicionismo atómico
Cuando los estudiantes reconocen a los átomos como componentes básicos de la materia, sus explicaciones sobre las propiedades de las sustancias se centran en el número y características de los átomos presentes en ellas, sin prestar mucha atención a características estructurales (Talanquer, 2008; 2013). Su razonamiento se guía por la composición elemental de las sustancias y no por el análisis de su estructura submicroscópica. Asumen, por ejemplo, que ciertos tipos de átomos tienen características inherentes que son heredadas por las sustancias que los contienen (los átomos de hidrógenos son ácidos). A medida que los estudiantes avanzan en sus estudios pueden reconocer otras propiedades atómicas (como electronegatividad), pero su análisis continúa basándose en la asociación directa entre estas características atómicas y las propiedades observadas (por ejemplo, sustancias con átomos más electronegativos son más reactivas). En esta etapa, muchos alumnos conceptualizan a las sustancias como mezclas de átomos sin considerar los efectos que diferentes tipos de enlaces y fuerzas intermoleculares tienen sobre sus propiedades.
V. Composicionismo funcional
En cursos más avanzados de química, los estudiantes comienzan a construir relaciones estructura-propiedades prestando atención a la presencia de ciertos grupos de átomos (grupos funcionales) que se asocian con ciertas propiedades (Graulich, 2015). Por ejemplo, la presencia de grupos -OH en moléculas de alcoholes puede asociarse de manera normativa con la formación de puentes de hidrógeno y puntos de ebullición más altos. Sin embargo, otros estudiantes pueden conside rar de manera incorrecta que la presencia de este grupo es indicativa de propiedades básicas. La atención a grupos funcionales es un paso importante en el reconocimiento de elementos estructurales que afectan a las propiedades de los materiales.
VI.
Interaccionismo estructural
Los resultados de investigaciones existentes sugieren que pocos estudiantes terminan sus cursos de química desarrollando una visión interaccionista estructural en la que se entiende que las propiedades observables emergen de las interacciones dinámicas entre partículas, y que la naturaleza de tales interacciones depende no sólo de la composición sino también de la estructura de tales partículas. Por ejemplo, pocos alumnos comprenden que las transiciones de fase en compuestos moleculares son fenómenos cooperativos cuyas características dependen de interacciones entre moles de moléculas y que, a su vez, la magnitud y alcance de tales interacciones está determinada por la naturaleza y distribución de los átomos en dichas moléculas. El razonamiento de una gran mayoría de estudiantes permanece limitado no sólo por la atención centrada en aspectos composicionales y la suposición de que
los componentes de un sistema tienen características intrínsecas que de manera aditiva determinan las propiedades observables, sino también por una conceptualización determinista, estática y homogénea del mundo submicroscópico, como se discute en la siguiente sección.
Progresión en el razonamiento sobre el comportamiento de las sustancias
Algunas propiedades de las sustancias, como su solubilidad en agua y su reactividad, se manifiestan a través de cambios que resultan de la interacción con otros materiales. Aunque el razonamiento de los estudiantes en estas áreas progresa con sus estudios, sus ideas comúnmente se guían por un esquema cognitivo en el que se asume que los eventos observados resultan de las acciones de un agente activo con cierta intencionalidad o propósito. Los efectos causados por este agente se consideran proporcionales a sus propiedades, como su tamaño y su peso, o a su proximidad en el espacio y tiempo (Talanquer, 2006). Esta forma de pensar se conoce como «causalismo centralizado» y tiende a avanzar a través de las siguientes etapas:
I. Causalismo centralizado a nivel macro En ausencia de conocimientos básicos de física y química, las explicaciones de los estudiantes sobre el comportamiento de las sustancias son variables y dependen del tipo de proceso bajo análisis. Procesos que ocurren de manera espontánea sin la acción de un agente visible normalmente se atribuyen a la disposición natural o necesidad del sistema de alcanzar cierto estado (Talanquer, 2006). Por ejemplo, las sustancias calientes se enfrían porque buscan el equilibrio
Educació Química EduQ número 28 24
térmico. Si un agente causal es identificado, el comportamiento observado se atribuye a sus acciones. Por ejemplo, la sal se disuelve en agua porque este líquido la «funde».
II. Causalismo centralizado a nivel multi-partículas
Cuando los estudiantes comienzan a construir explicaciones utilizando el modelo corpuscular, sus explicaciones frecuentemente se basan en la acción directa de ciertos componentes o en la atribución de intencionalidad o tendencias en el comportamiento de las partículas que conforman un sistema. Por ejemplo, la disolución de sal en agua se explica considerando la acción de las partículas de agua sobre las partículas de sal, pero la difusión de un colorante en agua se puede explicar por la tendencia del colorante a distribuirse homogéneamente en el líquido (Talanquer, 2013). En esta etapa se incrementa la aplicación de razonamiento mecanístico en función de colisiones, atracciones y repulsiones entre partículas, pero se atribuye más influencia a las partículas más grandes, más pesadas, más rápidas o con una mayor carga eléctrica.
III. Causalismo centralizado a nivel atómico
Diversos estudios han mostrado que cuando los estudiantes utilizan modelos atómicos para generar relaciones estructurapropiedades, es frecuente que se refieran a las necesidades o intenciones de los átomos (Taber, 1998). Por ejemplo, se asume que los átomos pierden o ganan electrones con el fin de ganar estabilidad o adquirir un octeto en la capa de valencia (forma de explicar que muchas veces es introducida y reforzada por los docentes de químicas). Algunos átomos se conciben como más
activos que otros, por ejemplo átomos con una electronegatividad más alta o con mayor radio atómico o con más masa.
IV. Estabilismo energético
En clases de química es común construir explicaciones que se basan en la comparación de la estabilidad de distintas especies considerando su energía potencial relativa. Los estudiantes tienden a reducir estas explicaciones a argumentos teleológicos basados en la tendencia natural de los átomos o moléculas a buscar la estabilidad o minimizar su energía (Taber, 1998). Este tipo de argu mentos evitan el razonamiento mecanístico y lo sustituyen por el razonamiento asociativo que relaciona ciertas características composicionales o estructurales con estabilidad. Por ejemplo, las partículas cargadas eléctricamen te se consideran menos estables que las neutras, o las moléculas con enlaces más fuertes son menos reactivas. Este tipo de asociaciones son muy productivas en el pensamiento químico, pero frecuentemente limitan el razona miento de los estudiantes que desconocen las causas que las justifican. Es común que los estudiantes ignoren interacciones
entre distintas variables y la naturaleza probabilística del comportamiento químico hasta que alcanzan la etapa de interac cionismo estructural descrita en la sección anterior.
Implicaciones para la enseñanza
Los resultados de las investiga ciones en educación química resumidos en este artículo sugie ren que la progresión en el razonamiento de los estudiantes sobre relaciones estructura-pro piedad ocurre gradualmente a medida que avanzan en sus estudios y asimilan diferentes modelos químicos sobre la composición y estructura de la materia (Talanquer, 2018). Su razonamiento está guiado por esquemas cognitivos intuitivos que persisten de una etapa a otra. Estos esquemas le dan prioridad al análisis de la composición sobre la estructura de los componentes de un sistema, le atribuyen intencio nalidad al comportamiento de estos componentes, y asumen relaciones directas entre las propiedades de entidades a nivel submicroscópico y las propiedades macroscópicas observables.
El razonamiento de los estudiantes es asociativo en la mayoría de las etapas analizadas
Figura 3. Etapas en la progresión del razonamiento sobre relaciones estructurapropiedades.
¿Cómo
Aprenentatge de conceptes i models
progresan las ideas de los estudiantes sobre las relaciones estructura-propiedades?
número 28 25
(resumidas en la fig. 3), y pocos alumnos desarrollan la capacidad de utilizar el razonamiento mecanístico para generar explicaciones. La construcción de este tipo de explicaciones es compleja y demanda la diferenciación e integración de conceptos definidos a diferentes escalas.
El análisis del aprendizaje de estudiantes trabajando con currículos alternativos en química indica que proyectos que involucran a los estudiantes de manera activa en el desarrollo, aplicación y evaluación de modelos (modelización) para hacer predicciones, generar explicaciones y construir argumentos en distintos contextos promueven la progresión del razonamiento usando relaciones estructura-propiedades (Cooper et al., 2012). De manera similar, intervenciones educativas que consistentemente requieren que los estudiantes construyan explicaciones mecanísticas sobre las propiedades y el comportamiento de sistemas relevantes tienen efectos positivos significativos en esta área (Sevian & Talanquer, 2014).
El análisis de las etapas en la progresión del razonamiento de los estudiantes sobre relaciones estructura-propiedad que se presenta en la fig. 3 sugiere una secuencia de aprendizaje que mejor apoye la construcción de conocimientos en esta área. En particular, es recomendable seguir una secuencia que comience con el análisis de propiedades distinti vas de las sustancias a nivel macroscópico y gradualmente motive la construcción de distin tos modelos submicroscópicos sobre estructura de los materiales a diferentes escalas que permitan explicar y predecir las diferencias observadas (ver fig. 4). De manera más específica se propone:
a) Involucrar a los estudiantes en el análisis y discusión de
Figura 4. Secuencia propuesta en la enseñanza de relaciones estructura-propiedad.
resultados experimentales sobre propiedades macroscópicas de las sustancias que sirven para distinguirlas e identificarlas. Estas propiedades diferenciantes (como puntos de ebullición y fusión, densidad, viscosidad, solubilidad en agua) son propiedades intensivas con valores definidos para cada tipo de sustancia en condiciones de temperatura y presión especificadas.
b) Motivar la construcción del modelo corpuscular de la materia para explicar las diferencias en propiedades macroscópicas diferenciantes con base en diferencias en las interacciones dinámicas existentes entre las partículas que constituyen a cada sustancia (por ejemplo, sustancias constituidas por partículas que interaccionan más fuertemente tendrán puntos de ebullición más altos).
c) Involucrar a los estudiantes en el análisis y discusión de resultados experimentales que dan información sobre propiedades distintivas de las partículas que constituyen a las distintas sustancias (como masa y composición elemental de las partículas) y utilizar este análisis para motivar la construcción de modelos atómicos sencillos que diferencien sustancias con base en la composición atómica de las partículas constituyentes.
d) Involucrar a los estudiantes en el análisis y discusión de resultados experimentales que dan información sobre propiedades distintivas de cada tipo de átomo (como naturaleza eléctrica, radio atómico, energía de ionización) y utilizar este análisis para motivar la construcción de modelos atómicos a nivel electrónico que diferencien a los átomos con base en la distribución interna de sus electrones.
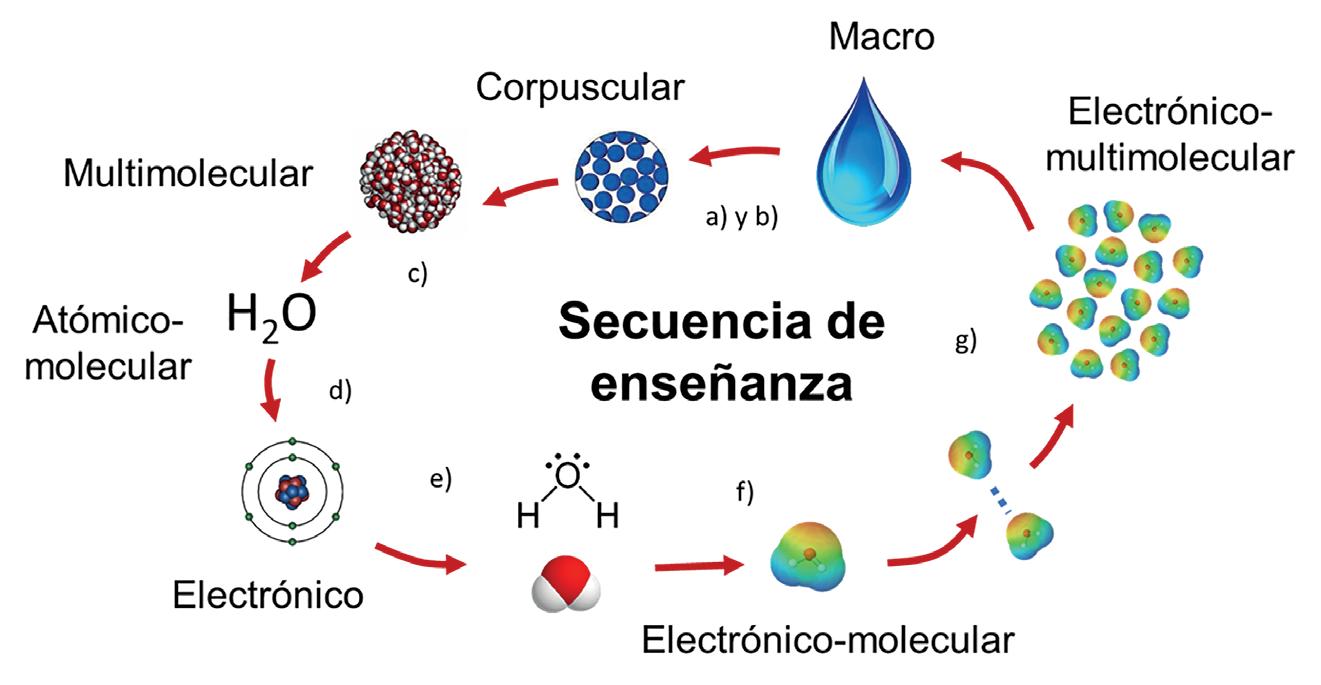
e) Involucrar a los estudiantes en el análisis y discusión de resultados experimentales que dan información sobre la conecti vidad y distribución espacial de las unidades submicroscópicas básicas en sistemas moleculares, iónicos y metálicos (como absor ción de radiación infrarroja y de rayos X, conductividad eléctrica) y utilizar este análisis para motivar la construcción de modelos estruc turales sobre estas sustancias.
f) Involucrar a los estudiantes en el análisis y discusión de resultados experimentales que dan información sobre la distribu ción de electrones en sistemas moleculares, iónicos y metálicos (como comportamiento observado en la presencia de objetos con carga eléctrica) y utilizar este análisis para motivar la construc ción de modelos sobre distribución de carga a nivel submicroscópico.
g) Utilizar modelos estructura-
Educació Química EduQ número 28 26
les y de distribución de carga a nivel submicroscópico para inferir diferencias en las interacciones existentes entre las partículas que constituyen a diferentes sustancias, y usar estas inferencias para explicar y predecir diferencias en propiedades macroscópicas observadas.
La secuencia de enseñanza que se propone se basa en el uso sistemático de datos experimentales para guiar la construcción de modelos más sofisticados sobre la estructura de la materia y el uso de esos modelos para explicar y predecir las observaciones. La secuencia se inicia en el nivel macro y gradualmente transita a través de las distintas escalas submicroscópicas representadas en las fig. 1 y 4, para eventualmente integrar los conocimientos adquiridos sobre modelos químicos a diversas escalas en la explicación y predicción de las propiedades físicas y químicas macroscópicas de las sustancias. En general, el aprendizaje de los estudiantes se facilita a través de actividades en las que analizan datos, identifican patrones, construyen y aplican modelos de sistemas a diferentes escalas, representan sus ideas en múltiples formas (dibujos, diagramas, gráficas), construyen argumentos de manera colaborativa y generan explicaciones de múltiples sistemas en diversos contextos. Durante este trabajo es deseable que los estudiantes hagan públicas sus ideas, las analicen y discutan colectivamente, y reciban retroalimentación formativa frecuente sobre sus formas de pensar.
Referencias
CooPer, m m.; sTowe, R. (2018). «Chemistry education research-From personal empiricism to evidence, theory, and informed practice». Chemical Reviews, n.º 118, p. 6053-6087.
CooPer, m m.; underwood, s m.; hilley, C. z.; KlymKowsKy, M. W. (2012). «Development and assessment of a molecular structure and properties learning progression». Journal of Chemical Education, n.º 89, p. 1351-1357.
dusChl, r.; maeng, s.; sezen, A. (2011). «Learning progressions and teaching sequences: a review and analysis». Studies in Science Education, vol. 47, n.º 2, p. 123-182. grauliCh, N. (2015). «Intuitive judg ments govern students’ answering patterns in multiple-choice exercises in organic chemistry». Journal of Chemical Education, n.º 92, p. 205-211. Kind, V. (2004). Beyond appearances: students’ misconceptions about basic chemical ideas, 2nd ed., Londres: Royal Society of Chemistry. También disponible en línea en: <https://edu.rsc.org/resources/ beyond-appearances/2202. article> [Consulta: 7 mayo 2021]. naTional researCh CounCil (NRC). (2007). Taking science to school: learning and teaching science in grades K-8. Washington, DC: National Academies Press. ngai, C.; sevian, h.; Talanquer, v (2014). «What is this substance? What makes it different? Mapping progression in students’ assumptions about chemical identity». International Journal of Science Education, n.º 36, p. 2438-2461. sevian, h,; Talanquer, V. (2014). «Rethinking chemistry: a learning progression on chemical thinking». Chemistry Education Research and Practice, n.º 15, p. 10-23.
Taber, K. S. (1998). «An alternative conceptual framework from chemistry education». International Journal of Science Education, n.º 20, p. 597-608.
Talanquer, V. (2006). «Common sense chemistry: a model for understanding students’
alternative conceptions». Journal of Chemical Education, vol. 83, n.º 5, p. 811-816.
— (2008). «Students’ predictions about the sensory properties of chemical compounds: Additive versus emergent frameworks». Science Education, n.º 92, p. 96-114.
— (2011). «Macro, submicro, and symbolic: the many faces of the chemistry “triplet”». International Journal of Science Education, vol. 33, n.º 2, p. 179-195.
— (2013). «How do students reason about chemical substances and reactions?».
En: TsaParlis, g.; sevian, h. (ed.). Concepts of matter in science education. Dordrecht: Springer, p. 331-346.
— (2018). «Progression in reasoning about structure-property relationships». Chemistry Education Research and Practice, n.º 19, p. 998-1009.
— (2020). «La progresión de los aprendizajes sobre la composición, estructura y transformación química de la materia». Educació Química EduQ, n.º 27, p. 4-11.
Vicente Talanquer
Es profesor en la Universidad de Arizona. Autor o coautor de más de diez libros de primaria y secundaria y de más de cien artículos arbitrados de investigación en educación química y pensamiento docente. Su trabajo se centra en el estudio de las formas de razonamiento de los estudiantes y de los profesores de química.
C. e.: vicente@arizona.edu

¿Cómo
Aprenentatge de conceptes i models
progresan las ideas de los estudiantes sobre las relaciones estructura-propiedades?
número 28
27
El perfil conceptual de sustancia: una herramienta para entender la heterogeneidad de pensamiento y habla en el aula
Conceptual profile of substance: a tool to understand the heterogeneity of thinking and speech in the classroom
Raúl Orduña Picón / Department of chemistry, University of Massachusetts Boston, Boston, MA, USA
Hannah Sevian / Department of chemistry, University of Massachusetts Boston, Boston, MA, USA
Eduardo Fleury Mortimer / Faculdade de Educaçao, Universidade Federal de Minas Gerais, Belo Horizonte, Brasil
resumen
El perfil conceptual de sustancia es un modelo que representa la variedad de maneras de hablar y pensar (zonas) sobre este concepto que los individuos socialmente desarrollan y usan en contextos específicos. En este artículo se presentan las zonas que componen el perfil conceptual de sustancia y una propuesta sobre cómo este modelo puede ser utilizado por los docentes para identificar el pensamiento de sus estudiantes y apoyarlos en expandir sus formas de pensar y hablar sobre la sustancia.
palabras
clave Sustancia, polisemia, perfil conceptual, habla y pensamiento, heterogeneidad.

abstract
Conceptual profile of substance is a model that represents the diversity of ways of speaking and thinking (zones) about that concept which individuals socially develop and use in specific contexts. This paper presents the zones that constitute the conceptual profile of substance, and a proposal for how this model of heterogeneity of speech and thinking can be used to identify students’ thinking and support them in extending their ways of speaking and thinking about substance.
keywords
Substance, polysemy, conceptual profile, speech and thinking, heterogeneity.
Introducción
La química como tecnociencia (Chamizo, 2013) es una disciplina fundamentada en el concepto de sustancia. Los químicos tratan a la sustancia como una entidad teórica y/o empírica para llevar a cabo la práctica de la química. Empero, los profesionales de la química no son las únicas personas que generan y usan una variedad de perspectivas para en-
tender esta idea central; los estudiantes de química conciben este concepto a través de múltiples maneras dependiendo las experiencias que hayan tenido dentro y fuera del aula (Amaral, Silva & Sabino, 2018; Orduña Picón, Sevian & Mortimer, 2020). Por ejemplo, a partir de las experiencias en el aula, una alumna puede pensar que la sustancia es una clase de materia que está consti-
tuida por muchas partículas; sin embargo, a partir de la experiencia de visitar un supermercado y leer con atención las sustancias presentes en una pasta dental, ella puede definir sustancia como un material con una función específica para llevar a cabo una acción. Con base en la heterogeneidad de formas de habla y pensamiento sobre la sustancia, se asume que este concepto es poli-
28
SCQ-IEC Educació Química
número
http://scq.iec.cat/scq/index.html
ISSN 2013-1755,
EduQ
28 (2021), p. 28-32 DOI: 10.2436/20.2003.02.211
sémico; es decir, el concepto de sustancia presenta una variedad de significados dependiendo del contexto en el que es usado.
De acuerdo con la importancia del concepto de sustancia y su variedad de significados, Vogele zang (1987: 243) cuestiona: «¿Qué aspectos del concepto de sustancia son importantes para hacer dicha idea algo útil en el contexto de la química escolar? La respuesta de pende del uso que se le da a este concepto». La respuesta a esta pre gunta representa un reto para los profesores de química que involu cra la construcción de una pers pectiva crítica en los estudiantes para discernir el uso de determina das formas de pensar y hablar sobre la sustancia, la cual puede generarse a través de la concienti zación de los poderes relativos y limitaciones de cada una de estas dependiendo del contexto.
Este artículo presenta el perfil conceptual de sustancia (Orduña Picón, Sevian & Mortimer, 2020) como una herramienta didáctica para identificar, entender y usar las diversas formas de pensar y hablar sobre este concepto que existen en la clase de química. El principal objetivo de esta contribu ción es ofrecer los fundamentos de un enfoque didáctico sobre la en señanza y aprendizaje del concep to de sustancia para que los profe sores reconozcan las ventajas que implica tener diferentes formas de pensar y hablar en el aula.
La teoría del perfil conceptual
La teoría del perfil conceptual (Mortimer, 1995; Mortimer & ElHani, 2014) se basa en la premisa de que las personas presentan diferentes formas de ver y concep tualizar el mundo para dar senti do a las experiencias que viven en distintos contextos. Los perfiles conceptuales son modelos que representan esa variedad de ma neras de pensar sobre un concepto polisémico que los individuos so
cialmente desarrollan y usan en contextos específicos. Los perfiles conceptuales están constituidos por distintas zonas. Cada una de las zonas que constituyen un per fil conceptual de un concepto dado representa modos de pensar particulares que están relaciona dos con una forma de hablar espe cífica. Con base en esta teoría, un individuo puede desarrollar social mente nuevas zonas independien tes a las ya existentes en su perfil conceptual porque las ya existen tes no representan ningún obstá culo para las que emergen; es de cir, hay una heterogeneidad de zonas relativas de un mismo con cepto que coexiste en un mismo individuo. Las zonas del perfil con ceptual se estabilizan mediante compromisos ontológicos, episte mológicos y axiológicos construi dos socialmente que dan forma a las maneras de pensar y hablar de cada individuo en diferentes con textos. Los compromisos ontológi cos están relacionados con las entidades y/o procesos que son considerados como parte de la realidad, los compromisos episte mológicos están asociados con las distintas formas para justificar la existencia de tales entidades y/o procesos y los compromisos axio lógicos tienen que ver con los jui cios evaluativos y/o afectivos so bre tales entidades y/o procesos.
El valor de la teoría del perfil conceptual para la enseñanza se centra en brindar a los docentes la oportunidad de identificar las zo nas que los estudiantes desarro llan y usan más fácilmente y, con base en esta identificación, apoyar a los estudiantes a diferenciar cada una de las zonas y determi nar los contextos en donde cada una de las zonas tiene un valor relativo para la explicación y reso lución de problemas. También, los docentes pueden introducir nue vas zonas y ayudar a los estudian tes a fortalecer el uso de estas a través del aprendizaje formal.
El perfil conceptual de sustancia
A partir de la exploración de textos relacionados con la historia y filosofía de la química, de artícu los sobre el pensamiento químico de los estudiantes, de entrevistar a diversos estudiantes y profesores de química y de capturar las inte racciones de estos profesores y alumnos en el aula, Orduña Picón, Sevian y Mortimer (2020) han pro puesto un perfil conceptual de sus tancia, el cual está compuesto de seis zonas: sensorialista, esencialis ta, funcionalista, naturalista/artifi cialista, composicionista e interac cionista. Una versión general de este perfil conceptual se muestra en la tabla 1; a continuación, sin embargo, se ofrece una descripción más detallada de las zonas.
La zona sensorialista está esta bilizada por el compromiso ontoló gico de ver a las cosas u objetos como sustancias. Con base en ideas aristotélicas, la sustancia es considerada como un objeto con creto que puede ser clasificado de acuerdo con su especie y propieda des. El compromiso epistemológico que justifica la idea de que las sustancias pueden ser entendidas como objetos/cosas se basa en determinar la identidad de una sustancia o las diferencias que existen entre una sustancia y otra a través de observar características superficiales (color, forma, tamaño, etc.). El compromiso axiológico que estabiliza esta manera de ver a las sustancias es el juicio evaluativo que considera a las sustancias como algo concreto y tangible (Or duña Picón, Sevian & Mortimer, 2020). De acuerdo con estos com promisos, la zona sensorialista se basa en entender a las sustancias como distintas clases de objetos/ cosas que presentan característi cas perceptibles, las cuales pueden ser observadas por los sentidos o distintos instrumentos.
La zona esencialista está onto lógicamente estabilizada a través de entender a las sustancias como
Aprenentatge de conceptes i models El perfil conceptual de sustancia: una herramienta para entender la heterogeneidad de pensamiento y habla en el aula
número 28
29
Zona
Descripción
SensorialistaLas sustancias son consideradas clases distintas de cosas con diferentes propiedades perceptibles (forma, color, textura, masa, olor, volumen, sabor, etc.) que se identifican mediante los sentidos o instrumentos.
Esencialista
La sustancia es vista como la entidad básica que le da a un objeto su determinación, forma, definición e inteligibilidad, y que persiste a través de distintas transformaciones. Es una combinación de materia (de qué está hecho algo) y forma (lo que determina ser una sustancia).
FuncionalistaLa sustancia se define como algo que puede hacer una acción dada o puede usarse para realizar una determinada acción.
NaturalistaArtificialista
La sustancia es vista como un tipo de material que ocurre naturalmente en la tierra (es una entidad que tiene una existencia independiente del acto de percepción y su nombre) y es descubierta por científicos, o puede ser comprendida como un material que se produce en laboratorios/industrias de química y es elaborado bajo un proceso particular por los químicos.
ComposicionistaLas sustancias son vistas como: 1) Los constituyentes subyacentes de todas las cosas; 2) Un sistema hecho de material(es), elemento(s), compuesto(s), etc., que está involucrado en métodos de síntesis y descomposición, o 3) Un sistema estático que tiene componentes pequeños (moléculas, átomos, iones, partículas, etc.), los cuales son todos iguales; las sustancias tienen estructuras y propiedades fijas.
Interaccionista
La sustancia es considerada como un sistema dinámico con propiedades físicas estables que surgen a partir de las interacciones de un número considerable de sus componentes (moléculas, átomos, iones, partículas, etc.) y propiedades químicas asociadas con partículas individuales, las cuales surgen de interacciones entre componentes subatómicos.
la integración de ‘materia’ y ‘for ma’. Aristóteles consideraba que la ‘forma’ era la ‘sustancia primaria’, la esencia de las cosas, la entidad básica que persiste a lo largo del cambio. El compromiso epistemo lógico que estabiliza la zona esen cialista es el suponer u observar la presencia de propiedades subya centes (esencias) que le dan identi dad a un material; por ejemplo, cuando los alumnos observan los vapores rojos producidos por la reacción de cobre con ácido nítrico y piensan que esos vapores son la esencia del cobre (Talanquer, 2006). El compromiso axiológico se basa en juzgar si algo es o tiene sustancia porque tiene la integra ción materia-forma (por ejemplo, la sustancia de un párrafo), o que algo es persistente e inmutable porque sus cualidades están pre sentes a pesar del cambio (por ejemplo, los vapores rojos que se producen en la reacción de cobre y ácido nítrico los cuales son vistos
como la esencia del cobre). Por lo tanto, la zona esencialista se basa en concebir a la sustancia como la entidad básica o un conjunto de cualidades que le otorgan la deter minación, definición e inteligibili dad a una entidad; estas cualida des persisten a través del cambio.
La zona funcionalista se encuentra estabilizada por el compromiso ontológico de concebir a una sustancia como un sistema que es definido con base en lo que esta puede hacer o el uso que se da para cumplir cierto fin. El concepto de sustancia puede ser visto como una entidad que tiene poderes, habilidades y/o funciones (Schummer, 1998). El compromiso epistemológico relacionado con esta zona se basa en realizar u observar acciones posibles de llevar a cabo con las sustancias (por ejemplo, beber agua). Precisamente, esta evaluación de los usos y/o habilidades de una sustancia como algo bueno/malo,
útil/inútil, peligroso/benéfico, es la base para el compromiso axiológico relacionado con esta zona. De acuerdo con lo anterior, la zona funcionalista se basa en definir sustancia como un material que puede hacer o puede ser usado para realizar cierta acción. La zona naturalista/artificialis ta tiene como compromiso ontoló gico la clasificación de las sustan cias como materiales generados por transformaciones químicas o encontrados en la naturaleza (Schummer, 2003). El compromiso epistemológico asociado a esta zona consiste en practicar o cono cer procesos de obtención de sus tancias. Esta zona está axiológica mente estabilizada por el compromiso de evaluar las fuen tes y prácticas por las cuales se obtienen las sustancias. Está el caso de evaluar a las sustancias como «buenas» si estas vienen directamente de la naturaleza, pero como «malas» si vienen de un
Tabla 1. Un resumen de las zonas del perfil conceptual que constituyen el perfil conceptual de la sustancia (Orduña Picón, Sevian & Mortimer, 2020).
Educació
28
Química EduQ número
30
proceso de síntesis en un laborato rio químico. De acuerdo con estos compromisos, la zona naturalista/ artificialista se relaciona con pen sar en la sustancia como un mate rial que se encuentra en la natura leza y es descubierto por los científicos y/o como un material que es producido en la industria o laboratorio por medio de procesos creados por los químicos.
La zona composicionista está estabilizada por el compromiso ontológico de concebir a las sus tancias como entidades materiales que componen a los objetos. Las sustancias son también vistas como entidades que son constitui das por otras sustancias o partícu las (Chang, 2011). El compromiso epistemológico que justifica el pensamiento de entender a la sus tancia como el componente de los materiales y/o como un sistema constituido de partículas es la práctica de la química relacionada con la síntesis y descomposición de sustancias. Axiológicamente, la zona composicionista está estabili zada por el compromiso que surge a partir de los juicios afectivoevaluativos que una persona hace sobre el tipo de componentes que constituyen a una sustancia. Por ejemplo, una persona puede pen sar que el metano es un gas muy peligroso porque tiene cuatro áto mos de hidrógeno en su estructu ra, lo cual hace que este gas sea explosivo. Con base en estos com promisos, la zona composicionista consiste en ver a la sustancia como: 1) el componente subyacen te de todos los materiales (bloque de construcción) y/o 2) un sistema formado por materiales, elemen tos, compuestos y/o mezclas de compuestos/elementos; una sus tancia está involucrada en méto dos de descomposición y/o síntesis y/o 3) un sistema estático que tie ne partes pequeñas (moléculas, átomos, iones, partículas, etc.) que son iguales y tienen estructuras y propiedades fijas y pueden combi
narse de formas simples y defini das para formar otras sustancias.
La zona interaccionista tiene como compromiso ontológico la idea de que las sustancias son sistemas dinámicos que están envueltos en transformaciones reversibles e irreversibles que ocu rren en diferentes escalas de tiem po (Whitehead, 1978). Las propie dades de las sustancias son entendidas como relacionales y emergentes a partir de la interac ción de una sustancia con otra sustancia y/o con el ambiente. El compromiso epistemológico que estabiliza esta zona está relaciona do con el modelar, sintetizar y transformar sustancias tomando en consideración las interacciones que ocurren en el nivel macroscó pico y submicroscópico los cuales representan procesos continuos. El compromiso axiológico que estabi liza esta forma de pensar consiste en evaluar las características de las interacciones de las sustan cias/partículas y los procesos que ocurren en un sistema (rápidos, lentos, favorecidos, no favorecidos, espontáneos, no espontáneos, etc.). De esta manera, la zona inte raccionista tiene como base el entender a la sustancia como un sistema dinámico con propiedades físicas estables, las cuales surgen a partir de las interacciones de un número considerable de sus com ponentes (moléculas, átomos, io nes, partículas, etc.), y con propie dades químicas relacionadas con partículas individuales, las cuales emergen de interacciones entre componentes subatómicos.
Implicaciones para la enseñanza y comentarios finales
Las formas de pensar y hablar sobre la sustancia reportadas en este artículo deben ponerse en diálogo en las aulas de química para comprender lo multifacética que es la práctica de la química. Aprender dialógicamente involucra conocer distintas formas de
pensar (de la química y de las experiencias fuera del aula) para determinar la relativa validez de cada una de estas ideas y no su inherente poder (Mortimer y Wertsch, 2003). Así que, las seis zonas del perfil conceptual de sustancia pueden ser mediadoras poderosas para comprender distintos fenómenos a partir de la concientización del repertorio de diferentes formas de pensar y hablar sobre la sustancia; así como, también, del relativo poder explicativo que cada una de ellas tiene para resolver un problema en un contexto específico.
A partir de su característica polisémica, el concepto de sustan cia es una idea central que debe enseñarse, aprenderse y usarse para entender distintos temas en la clase de química. Para ilustrar qué zonas del perfil conceptual de sus tancia pueden ser mediadoras para la enseñanza y aprendizaje de di versos temas en la clase de quími ca, se toma como ejemplo la ense ñanza y aprendizaje del fenómeno de solubilidad, una propiedad que puede emplearse para determinar la identidad de una sustancia.
Como primera actividad, los estudiantes pueden clasificar sus tancias para predecir si una sustan cia se disolverá en diferentes disolventes y en qué medida. Dos categorías de clasificación pueden ser iónicas y moleculares. Para clasificar a las sustancias sólidas, los estudiantes pueden usar su forma de pensar sensorialista en aras de identificar si los sólidos tienen bordes afilados o una textu ra suave. También, los estudiantes pueden usar su forma de pensar composicionista para considerar la celda unitaria de una sustancia iónica o la estructura cristalina de una sustancia molecular para pen sar cómo su composición puede relacionarse con la solubilidad que presenta en diferentes disolventes. La zona esencialista puede ser una forma productiva de pensar para
Química i societat
Aprenentatge de conceptes i models
El
perfil conceptual de sustancia: una herramienta para entender la heterogeneidad de pensamiento y habla en el aula
número 28
31
determinar si una sustancia mole cular es polar o no polar. Los estu diantes pueden observar la compo sición y estructura de una sola molécula para comparar cualitati vamente los momentos dipolares de esta con diferentes moléculas. También, los estudiantes pueden usar su zona interaccionista para pensar «qué tanto» una sustancia se disolverá en otra sustancia con siderando factores energéticos y entrópicos de la energía potencial interna entre las moléculas y el número de configuraciones dife rentes que pueden adoptar estas en estado sólido y acuoso.
Con base en el perfil conceptual de sustancia, los docentes pueden identificar e interpretar cómo los estudiantes hablan y piensan sobre este concepto para evaluar: 1) las zonas que ellos mayormente desarrollan y usan para dar sentido a las experiencias que tienen en el aula de química y 2) diversos contextos que pueden promover la expansión del perfil conceptual de sustancia de los estudiantes. Por lo tanto, esta alternativa didáctica puede ayudar a los docentes a entender que la heterogeneidad de pensamiento y habla sobre la sustancia representa una condición trascendental para el aprendizaje y uso de la práctica de la química.
Referencias
amaral, E. M. R.; silva, J. R.; sabino, J. D. (2018). «Analysing process of conceptualization for students in lessons on substance from the emergence of conceptual profile zones». Chemistry Education Research and Practice, vol. 19, p. 1010-1028.
Chamizo, J. A. (2013). «Technochemis try: one of the chemists’ ways of knowing». Foundations of Chemis try, vol. 15, n.º 2, p. 157-170.
Chang, H. (2011). «Compositionism as a dominant way of knowing in modern chemistry». History of Science, vol. 49, n.º 3, p. 247-268.
morTimer, E. F. (1995). «Conceptual change or conceptual profile change?». Science & Education, vol. 4, p. 267-285. morTimer, E. F.; el hani, C. N. (2014). Conceptual profiles: A theory of teaching and learning scientific concepts. Vol. 42. Dordrecht: Springer & Business Media. morTimer, e. F.; werTsCh, J. V. (2003). «The architecture and dynamics of intersubjectivity in science classrooms». Mind, Culture and Activity, vol. 10, n.º 3, p. 230-244. orduña PiCón, R.; sevian, H.; morTi mer, E. F. (2020). «Conceptual profile of substance. Represen ting heterogeneity of thinking in chemistry classrooms». Science & Education, vol. 29, p. 1317-1360. sChummer, J. (1998). «The chemical core of chemistry. A conceptual approach». HYLE – International Journal of the Philosophy of Chemistry, vol. 4, p. 129-162. — (2003). «The notion of nature in chemistry». Studies in History and Philosophy of Science, vol. 34, p. 705-736. Talanquer, V. (2006). «Commonsense chemistry: a model for understanding students’ alternative conceptions». Journal of Chemical Education, vol. 83, n.º 5, p. 811-816. vogelezang, M. J. (1987). «Develop ment of the concept of ‘chemi cal substance’ – some thoughts and arguments». International Journal of Science Education, vol. 9, n.º 5, p. 519-528.
whiTehead, A. N. (1978). A: griFFin; D. R.; sherburne, D. W. (ed.). Process and reality. An essay in cosmology Nova York: The Free Press.
ción en Educación Química por la Universidad de Massachusetts Bos ton e investigador especialista en la Universidad de California Irvine. Autor de artículos arbitrados de investigación en educación quími ca. Su trabajo se centra en las múl tiples formas de pensamiento de los estudiantes de ciencia.

C. e.: raul.ordunapicon001@umb.edu
Hannah Sevian
Profesora-investigadora en la Uni versidad de Massachusetts Boston. Autora o coautora de más de cin cuenta artículos arbitrados de in vestigación en educación química y una serie de libros de educación secundaria. Su trabajo se centra en el estudio de las formas de en señar y aprender química desde la perspectiva de la justicia social. C. e.: Hannah.Sevian@umb.edu

Profesor de educación en la Universidad Federal de Minas Gerais e investigador del CNPQ (Consejo Nacional de Desarrollo Científico y Tecnológico). Hizo su doctorado en Educación Científica en la Universidad de São Paulo. Su investigación se centra en el aprendizaje de las ciencias, los perfiles conceptuales y el discurso en el aula. C. e.: mortimer@dedalus.lcc.ufmg.br
 Raúl Orduña Picón Candidato a doctor en investiga
Eduardo Fleury Mortimer
Raúl Orduña Picón Candidato a doctor en investiga
Eduardo Fleury Mortimer
Educació Química EduQ número 28 32
Estruturação de zonas do perfil conceitual de substância e suas implicações para a compreensão química em sala de aula
João Roberto Ratis Tenório da Silva / Universidade Federal de Pernambuco
Edenia Maria Ribeiro do Amaral / Universidade Federal Rural de Pernambuco
Flávia Cristiane Vieira da Silva / Universidade Federal Rural de Pernambuco
resumo
O objetivo deste trabalho é consolidar e ressignificar zonas já propostas para o perfil de substância e analisar as implicações de diferentes modos de pensar sobre substância para o ensino e aprendizagem desse e outros conceitos relacionados. Perfis conceituais são modelos de estruturação da heterogeneidade do pensamento e da linguagem e podem contribuir para ampliar as discussões em aulas de ciências. A estruturação de temas e categorias para as zonas do perfil conceitual de substância contribuiu para ressaltar cuidados no ensino do conceito e para compreender modos de pensar sobre ácidos e bases.
palavras-chave
Perfil conceitual, substância, temas e categorias, ensino de química.
abstract
The objective of this work is to consolidate and (re)signify zones of the conceptual profile for substance and analyze implications of different ways of thinking for the teaching and learning on substance and related concepts. Conceptual profiles are models of structuring the heterogeneity of thinking and language and can contribute to broaden discussions in science classes. The structuring of themes and categories for the zones of the conceptual profile of substance contributed to highlight features in the teaching of the concept and to understand ways of thinking about acids and bases.
keywords
Conceptual profile, substance, themes and categories, chemistry teaching.
Introdução
A heterogeneidade de modos de pensar sobre o conceito de substância, estruturada na perspectiva de perfis conceituais, tem sido objeto de estudo em vários trabalhos da literatura em Educação em Ciências (Silva, 2011, Silva & Amaral, 2013, Silva, 2017, Amaral, Silva & Sabino, 2018, Orduña Picón et al., 2020). Os autores apresentam distintos olhares para o conceito de
substância e propõem diferentes zonas na constituição de perfis conceituais. Neste trabalho, o nos so objetivo é consolidar e ressignificar zonas já propostas para o perfil de substância, com base no trabalho de Amaral, Silva e Sabino (2018), e analisar as implicações dessas zonas para a compreensão de ácidos e bases.
Com base na premissa de que somos parte de um mundo hetero gêneo e multiforme, no qual podem
DOI: 10.2436/20.2003.02.212 http://scq.iec.cat/scq/index.html
ser manifestadas diferentes formas de ver, conceituar e compreender a realidade, fatos e fenômenos ao nosso redor (Schutz, 1954), temos trabalhado com a teoria dos perfis conceituais aplicada ao ensino e aprendizagem de ciências (Morti mer & El-Hani, 2014). Com perfis conceituais, estruturamos a heterogeneidade de pensamento e de linguagem em zonas que devem ser representativas de diferentes modos de pensar sendo cada uma

33
Educació
ISSN 2013-1755, SCQ-IEC
Química EduQ número 28 (2021), p. 33-38
delas caracterizada por distintos compromissos epistemológicos, ontológicos e axiológicos. Diferentes modos de pensar são identificados considerando que, quando cons troem sentidos e significados sobre um conceito, os sujeitos mobilizam ideias e concepções em distintos domínios genéticos: sociogenético, ontogenético e microgenético (Wertsch, 1985). Para a proposição de perfis conceituais, esses domí nios são buscados na construção de dados a partir de fontes diversas: ideias emergentes no desenvolvi mento histórico do conceito, concepções prévias ou alternativas que os estudantes apresentam sobre o conceito, e sentidos e significados atribuídos ao conceito pelos estudantes em situações de interação.
A partir de um perfil conceitual de substância proposto por Amaral, Silva e Sabino (2018), buscamos consolidar, ressignificar e reorgani zar diferentes modos de pensar sobre substância usando como base a ideia de matriz semântica. Sepúlveda (2010), Reis (2018) e Pimentel (2019) propuseram ideias de matrizes epistemológica e semântica como formas de organi zar diferentes modos de pensar sobre um conceito, considerando relações entre temas epistemológi cos ou semânticos (sentidos e significados), categorias e compro missos epistemológicos, ontológicos e axiológicos. Na proposta aqui apresentada, focamos apenas nas definições de temas semânticos e categorias para cada zona do perfil conceitual de substância, buscando apontar algumas implicações que elas podem ter para o ensino e aprendizagem desse conceito e de conceitos subjacentes, tal como o de ácidos e bases.
Temas semânticos e categorias para zonas do perfil conceitual de substância matriz
O perfil conceitual de subs tância foi inicialmente proposto
por Silva (2011), Silva e Amaral (2013) com cinco zonas: genera lista, essencialista, substancia lista, racionalista e relacional. Em trabalhos posteriores, reformulações foram feitas, por exemplo, a zona generalista foi ampliada, a zona essencialista foi excluída e foi proposta a zona utilitarista/pragmática (Silva, 2017; Sabino & Amaral, 2018; Amaral, Silva & Sabino, 2018). Silva F. e Amaral (2020) apontaram a possibilidade de uma zona empírica para o perfil de substância, a partir da análise dos dados referentes aos diferentes modos de pensar sobre ácidos e bases. A partir das mudanças propostas nesses trabalhos recentes, reorganiza mos os diferentes modos de pensar sobre substância a partir de temas semânticos e catego rias que compreendem cada zona do perfil conceitual de substância, conforme mostrado no quadro 1.
No quadro 1, os temas e categorias possibilitaram melhor estruturação e clareza dos diferen tes modos de pensar que consti tuem as zonas do perfil de subs tância. Consideramos que essa estruturação pode contribuir para o planejamento de um ensino mais amplo e significativo deste conceito e na compreensão das relações de modos de pensar substância com a compreensão de classes de substâncias, tal como ácidos e bases, mas que também podem se estender a óxidos, sais, álcoois, combustíveis e outros. Podemos apontar algumas dessas implicações com relação a cada zona do perfil (tabela 1):
Para ilustrar algumas das implicações que diferentes modos de pensar sobre substância podem trazer para os processos de ensino e aprendizagem desse conceito e de conceitos relacionados, mostra remos um exemplo aplicado ao conceito de ácidos e bases.
Abordagem do conceito de ácidos e bases com base no perfil conceitual de substância Segundo Kopnin (1996), conceitos científicos formam um sistema específico, um reflexo de algo universal que possibilita a compreensão de interrelações de conteúdo –fatos essenciais (propriedades, relações)– e volume, conjunto de objetos (pluralidade, classe, grupo), que se estende ao conteúdo do conceito. Sobre o conceito de substância, consideramos que ele apresenta relações e propriedades que lhe conferem a existência de classes, por exemplo, ácidos e bases, e aqui buscamos identificar convergências encontradas nos diferentes modos de pensar sobre esses conceitos.
F. Silva (2017) realizou um amplo estudo sobre modos de pensar os conceitos de ácidos e bases, usando fontes secundárias da história da ciência, a literatura sobre concepções dos estudantes, investigação em sala de aula e em uma comunidade de prática. Os resultados mostraram que diferentes modos de pensar sobre ácidos e bases guardavam uma relação estreita com as zonas do perfil conceitual de substância, que foram adequadas para esse uso específico (Silva & Amaral, 2020). Neste artigo, dada a limitação de espaço e buscando ilustrar algumas dessas relações, apresentaremos ideias que emergiram em um curso de formação do PIBID (Programa Institucional de Bolsas de Iniciação à Docência), do qual participavam licenciandos de Química.
Em uma das etapas do curso, os licenciandos foram solicitados a expressar suas concepções sobre ácidos e bases, considerando diversos contextos nos quais esses conceitos podem ser aplicados. As respostas do licenciandos apon tam para relações com zonas do perfil conceitual de substância
e Educació Química EduQ número 28 34
ZONA GENERALISTA
Tema semântico: substância considerada como entidade concreta ou abstrata que pode se constituir como princípio/essência presente indiscriminadamente em todas as coisas.
Categorias Definição
Substância como um objeto da filosofia clássica.
Substância como essência das coisas ou dos materiais.
A substância se constitui como objeto filosófico para qualificar as coisas. Ela é parte de um mundo idealizado.
A substância é imaterial, se manifesta na essência de cada coisa. É também compreendida a partir das qualidades dos materiais, que parecem possuir essência substancial. Pessoas associam substância à qualidade ou aos atributos do material - um alimento tem “sustança” por «qualidades» que fortalecem o organismo.
Aprenentatge de conceptes i models
35
Substância como constituinte dos materiais.
ZONA UTILITARISTA/PRAGMÁTICA
A substância tem materialidade, de forma não discriminada ou caracterizada, compõe todas as coisas do Universo. A compreensão de substância é generalizada na ideia de composição dos materiais, mas sem qualquer identificação ou caracterização.
Tema semântico: substância compreendida a partir de suas aplicações ou dos efeitos que pode causar, mas não são necessariamente identificadas nos produtos.
Categorias Definição
Substâncias como algo funcional e útil para o desenvolvimento e práticas sociais.
Substâncias como algo que causa benefícios e danos à vida e ao ambiente.
A compreensão da substância ocorre com base na aplicação de produtos em contextos diversos –industrial, farmacêutico, cotidiano e outros.
A substância está presente nos materiais e sua compreensão se limita à atribuição de possíveis benefícios ou danos causados pelo uso de materiais ou produtos. Assim, substâncias químicas («química») causam danos à vida ou ao ambiente (agrotóxicos e outros), ou trazem benefícios (nutrientes, fármacos e outros)
número 28
ZONA SUBSTANCIALISTA
Tema semântico: Substâncias estão contidas nos materiais ou são o próprio material, e suas propriedades são atribuídas às partes ou ao todo indistintamente, em um processo de substancialização que se encontra disperso na linguagem química.
Categorias Definição
Substância contida nas partes e no todo, indistintamente, como algo abstrato.
Substância contida nas partes e no todo, indistintamente, como algo material.
ZONA EMPÍRICA
A essência das partes ou do todo se substancializam. O que é essencial é a substância oculta (Bachelard, 1987), e ela se torna a identidade da parte e do todo. A qualidade dos materiais ganha identidade pelas substâncias que estão na sua essência. O material pode ser a própria substância.
A substância está contida no todo como uma parte, mas também pode ser considerada como o todo material. As partes e o todo de um mate rial se substancializam, então as propriedades podem ser atribuídas às partes e ao todo indistintamente (átomos de ouro são dourados?).
Tema semântico: Substâncias são constituintes dos materiais, podem ser extraídas ou sintetizadas, e apresentam propriedades bem definidas que lhes conferem identidade.
Categorias
Substâncias identificadas pelas suas propriedades físicas e químicas, quando separadas dos materiais.
Definição
A compreensão da substância, extraída dos materiais por procedimentos técnicos, está associada à determinação de suas propriedades físicas e químicas, tais como, densidade, ponto de ebulição e outros.
Estruturação de zonas do perfil conceitual de substância e suas implicações para a compreensão química em sala de aula
ZONA RACIONALISTA
Tema semântico: Substância compreendida a partir de representações e do modelo atômico e suas propriedades explicadas por arranjos de átomos e moléculas.
Categorias Definição
Substâncias identificadas por arranjos de diferentes moléculas e átomos que explicam suas propriedades.
Substâncias identificadas de forma representativa por fórmulas químicas ou desenhos de estruturas.
ZONA RELACIONAL
A substância é material e constituída por arranjos específicos de átomos e moléculas. A compreensão da substância é consequência da aplicação do modelo atômico que explica a constituição da matéria e o seu comportamento.
As substâncias se deslocam do plano da materialidade para a representação e são identificadas a partir da linguagem química. A compreensão da substância ocorre a partir da representação formal e simbólica dos seus constituintes e de suas estruturas.
Tema semântico: Substâncias consideradas como um devir ou modelo, com propriedades que dependem das condições e interações em que elas se encontram.
Categorias Definição
Substância material com propriedades que variam com o meio e as interações a que são submetidas.
Substância como modelo que estrutura a compreensão química dos materiais.
As substâncias são materiais, e suas propriedades são determinadas na relação com o meio e as condições de interação. As propriedades não necessariamente determinam sua identidade e variam com as condições e interações com outras substâncias.
Pela sua manifestação variável e relacional a substância ganha um estatuto de modelo explicativo e como tal tem ontologia abstrata. Dessa forma, o conceito de substância se constitui como modelo para compreensão da composição dos diversos materiais na Natureza.
Quadro 1. Temas semânticos e categorias a partir de zonas do perfil de substância.
de categorias apresentadas no Quadro 1. Uma pergunta feita aos licenciandos foi: Em que situações ou com que finalidade você lida com ácidos? E com as bases? E alguns apresentaram as seguintes respostas: Em situações do cotidiano, com alimentos, produtos estéticos e de limpeza (A1); Lido com ácido e base no dia a dia, por exemplo, desde o café da manhã (primeira refeição) até o último lanche da noite (última refeição): leite, café, suco, refrigerante, etc. (...) (A2) Nas respostas de A1 e A2, percebe mos que ácidos e bases parecem ser reconhecidos como algo presente em diferentes produtos e situações cotidianas, sem qual quer especificação de composição ou distinção de propriedades (zona utilitarista/pragmática). Podemos ressaltar que A1 se refere a produtos de limpeza que comu mente são relacionados às bases,
enquanto A2 se refere especifica mente ao consumo de alimentos, e parece estar implícito um aspecto de sabor mais ácido (suco) ou neutralizante (leite) de cada um dos alimentos. Dessa forma, as respostas sugerem que ao abordar contextos, os modos de pensar se tornam mais generalizados.
Outra pergunta feita aos licenciandos foi: O que você entende por ácido? O que você entende por base? Uma resposta representativa de vários licenciandos foi: Ácido é uma substância que tem em determinadas situações um comportamento ácido. Também pode ser entendida do ponto de vista químico como doador de prótons e receptor de elétrons. Base é uma substância que em determinadas situações se comporta como base, do ponto de vista químico é
doador de elétrons e receptor de prótons (A3). É interessante ressaltar que para A3, os ácidos e bases são compreendidos a partir do comportamento das substâncias em “determinadas situações” o que poderia nos levar a refletir sobre uma concepção pautada em propriedades empíricas (zona empírica) ou mesmo em uma perspectiva relacional, uma vez que o licenciando se refere às condições nas quais esse comportamento pode se manifestar (zona relacional). Em seguida, ele usa um modelo teórico para explicar o comportamento dessas substâncias (zona racionalista). Isso se repete na resposta de A4: Um ácido pode ser uma substância que em meio aquoso libera H+ e a base OH . Ou simplesmente ácido é aquele que libera H+ e base é aquele que recebe (A4 – zona racionalista).
EduQ número 28 36
Educació Química
Zonas
Zona Generalista
Possíveis implicações para o ensino e aprendizagem
Modos de pensar generalistas podem ser discutidos em aulas de química com o objetivo de apontar a importância de identificação e caracterização das substâncias presentes nos materiais, evidenciando as distinções entre eles.
Zona Utilitarista/ PragmáticaA
compreensão da funcionalidade ou utilidade de produtos associada a substâncias de forma superficial e generalizada, sem caracterização de propriedades, pode limitar o entendimento sobre o uso desses produtos. O ensino poderá promover um conhecimento mais específico sobre a composição de produtos, propriedades das substâncias componentes, e a avaliação tanto dos usos adequados quanto de riscos e benefícios que eles podem causar.
Zona Substancialista
Modos de pensar substancialistas aparecem principalmente no uso da linguagem química e repercutem dificuldades de distinguir materiais, substâncias, elementos químicos e as propriedades de cada um. Essas distinções podem ser enfatizadas no ensino e no uso da linguagem química.
Zona Empírica
Zona Racionalista
A definição de substância suportada unicamente na determinação de propriedades físicas e químicas pode limitar a compreensão dos fenômenos. No ensino, a discussão pode ser ampliada pela compreensão das propriedades empíricas a partir da constituição atômico-molecular das substâncias.
Da mesma forma, a compreensão da substância a partir de modelos atômicos e moleculares não deve prescindir de articulação entre as dimensões macroscópicas e atômico-moleculares. As representações de substâncias com uso de linguagem química simbólica ou imagética devem ser cuidadosamente discutidas nos seus significados.
Zona Relacional
A compreensão da substância com propriedades variáveis e como modelo químico não é fácil de ser encontrada em sala de aula, no entanto, pode contribuir para que os estudantes tenham uma visão mais complexa dos fenômenos estudados.
Tabela 1. Possíveis implicações para o processo de ensino e aprendizagem.
Ainda com relação à pergunta anterior, é interessante ressaltar a seguinte resposta de A5: Depende da situação, no contexto científico ácidos e bases são tratados de forma diferentes, pois existem muitas definições, elas podem aceitar ou doar pares de elétrons, ou doarem e aceitarem prótons, ou ainda podem atuar apenas em meio aquoso. No entanto, na aplicação do cotidiano compreendo pelo senso comum que ácidos são substâncias «azedas» e bases substâncias adstringentes. É interessante perceber que o licenciando parece consciente de
que as compreensões para os ácidos e bases podem variar com o contexto ao qual estão se referindo. Nota-se, assim, uma relação entre as formas de falar que emergem na sala de aula e os contextos nos quais tais ideias ganham sentido. A emergência desses diferentes modos de pensar e formas de falar nas discussões em aulas pode favorecer a criação de um ambiente em que ideias são discutidas de forma ampla, democrática e dialógica, favorecendo a construção de novos significados.
Diante do exposto, primeiramente podemos constatar que as zonas do perfil conceitual de substância contribuíram para caracterizar diferentes modos de pensar sobre ácidos e bases, ainda que adequações sejam feitas quando temos um conjunto maior de concepções e situações analisadas. E finalmente, consideramos que tanto para discutir sobre substância, como um conceito mais abrangente, quanto para discutir sobre ácidos e bases, classes de substância, a abordagem de diferentes modos de
Aprenentatge de conceptes i models
Estruturação
de zonas do perfil conceitual de substância e suas implicações para a compreensão química em sala de aula
número
28 37
pensar aponta para um enriquecimento da compreensão dos conceitos e consequentemente a promoção de aprendizagens mais significativas.
Considerações finais
As zonas propostas para o perfil conceitual de substância mostram potencialidade para tornar mais claros significados e sentidos atribuídos ao conceito, o que pode facilitar a discussão de professores e estudantes sobre esse conceito de forma plural e diversa na sala de aula. A proposição de temas semânticos e categorias contribui para um melhor entendimento de como as zonas se constituem e podem ser caracterizadas e/ou aplicadas em situações de ensino e aprendizagem, o que pode facilitar o uso de perfis conceituais no planejamento e proposição de estratégias de ensino por professores de química/ ciências.
Referências
amaral, e m r.; da silva, J. r r. T.; sabino, J. d (2018). Analysing processes of conceptualization for students in lessons on substance from the emergence of conceptual profile zones. Chemistry Education Research and Practice, vol. 19, num. 4, p. 1010-1028.

baChelard, G. (1987). A filosofia do não: filosofia do novo espírito científico. Lisboa: Presença.
KoPnin, P. V. (1966). Lógica dialéctica (No. 04; BC150, K6.).
morTimer, E. F.; el hani, C. N. (ed.) (2014). Conceptual profiles: A theory of teaching and learning scientific concepts (Vol. 42). Springer Science & Business Media.
PiCón, r o.; sevian, h.; morTimer, e F. (2020). «Conceptual Profile of Substance». Science & Education, vol. 29, num. 5, p. 1317-1360.
sChuTz, A. (1954). «Concept and theory formation in the social
sciences». Collected papers I Dordrecht: Springer, p. 48-66. silva, J. R. R. T. (2011). Um perfil conceitual para o conceito de substância (Dissertação de mestrado, Recife, Brasil: Universidade Federal Rural de Pernambuco). silva, J. R. R. T.; do amaral, E. M. R. (2013). «Proposta de um perfil conceitual para substância». Revista Brasileira de Pesquisa em Educação em Ciências, vol. 13, num. 3, p. 53-72. silva, F. C. V. (2017). Análise de diferentes modos de pensar e formas de falar o conceito de ácido/ base em uma experiência social mente situada vivenciada por licenciandos em química (Tese de Doutorado, Recife: Universidade Federal Rural de Pernambuco). silva, F. C. v d.; amaral, e. (2020). «Articulando conhecimentos científicos e práticos sobre ácidos/bases: uma análise de formas de falar e modos de pensar de licenciandos em química e cabeleireiras». Ensaio Pesquisa em Educação em Ciências (Belo Horizonte), vol. 22, num. 3. werTsCh, J. V. (1985). Vygotsky and the social formation of mind Cambridge MA: Harvard University Press.
ciado em Química e Mestre em Ensino das Ciências pela Univer sidade Federal Rural de Pernam buco (UFRPE) e doutor em Psicologia Cognitiva pela Univer sidade Federal de Pernambuco. Email: joaoratistenorio@gmail.com
João Roberto Ratis Tenório da Silva Docente da Universidade Federal de Pernambuco (UFPE), no Centro Acadêmico do Agreste, Núcleo de Formação Docente e professor permanente do Programa de pós-graduação em Educação em Ciências e Mate mática (PPGECM/UFPE). Licen
Edenia Maria Ribeiro do Amaral Professora do Departamento de Química da UFRPE, atua no Programa de Pós-Graduação em Ensino de Ciências e Matemática (PPGEC) e no Programa de Mestrado Profissional em Química em Rede Nacional (PROFQUI), possui graduação em Engenharia Química e mestrado em Ciências e Tecnologias Energéticas Nucleares (UFPE), doutorado em Educação (UFMG) e pós-doutorado no CSSME, Universidade de Leeds (UK) e na UMass-Boston (USA).
Email: edeniamramaral@gmail.com
Flávia Cristiane Vieira da Silva Professora da Universidade Federal Rural de Pernambuco (UFRPE) - Unidade Acadêmica de Serra Talhada (UAST). Doutora em Ensino das Ciências pela UFRPE. Possui graduação em Licenciatura Plena em Química pela UFRPE. Tem experiência na área de Química, com ênfase em Ensino de Química.

Email: flavia.cristianevs@gmail.com

Educació Química EduQ número 28 38
Ensino e aprendizagem do conceito de substância química como material puro por estudantes de ensino médio
Teaching and learning the concept of chemical substance as pure material by high school students
Renata Rosa Dotto Bellas / Universidade do Estado da Bahia José Luis de Paula Barros Silva / Universidade Federal da Bahia
resumo
Em vista das concepções espontâneas do termo substância apresentadas por estudantes do ensino médio, investigamos como o ensino fundamentado na teoria histórico-cultural contribui para a aprendizagem do conceito de substância química como material puro. Diálogos de aula foram gravados em áudio, transcritos e analisados. Os resultados mostram como os estudantes iniciaram a aprendizagem do critério de pureza química e do significado químico de substância, empregando-os adequadamente.
palavras-chave Substância química; pureza química; ensino-aprendizagem de conceitos; teoria histórico-cultural; ensino médio.
abstract
In view of spontaneous conceptions of the term substance presented by high school students, we investigate how teaching based on historical-cultural theory contributes to learning of the concept of chemical substance as pure material. Class dialogues were audio recorded, transcribed and analyzed. Results show how students started to learn the criterion of chemical purity and the chemical meaning of the substance, using them properly.
keywords

Chemical substance; chemical purity; teaching-learning of concepts; historical-cultural theory; high school.
Introdução
Considerando que os materiais são compostos por substâncias químicas, a compreensão da composição e da transformação dos materiais –eixos de sistematização do conhecimento químico–passa pelo entendimento do conceito químico de substância (Silva et al., 2007).
Vários dos ingredientes de produtos industrializados utilizados corriqueiramente –medicamentos, cosméticos, alimentos
DOI: 10.2436/20.2003.02.213 http://scq.iec.cat/scq/index.html 39
ISSN 2013-1755, SCQ-IEC Educació Química EduQ número 28 (2021), p. 39-45
etc.– são substâncias químicas, o que confere ao seu conceito uma grande relevância social e reforça a importância do seu ensino na educação básica.
Entretanto, livros didáticos de Química introduzem o termo substância química sem lhe dar destaque e os critérios de conceituação variam de livro para livro (Bellas et al ., 2019), minimizando sua relevância para o entendimento da Química pelos estudantes.
Por outro lado, foi identificado que professores em formação inicial apresentam dificuldades e insegurança em explicitar o significado químico de substância e o seu sistema conceitual (Bellas, 2018). Tal fato pode influenciar no ensino médio criando um círculo vicioso no ensino e na aprendizagem do conceito de substância química.
Este trabalho tem por objetivo investigar as contribuições do ensino fundamentado na teoria
histórico-cultural para a aprendizagem do conceito de substância química como material puro por estudantes do ensino médio.
Ensino e aprendizagem de conceitos em perspectiva histórico-cultural
Todo ser humano possui uma interioridade e uma exterioridade que se que relacionam parcialmente por meio de conceitos, pois a linguagem (exterior) organiza, delimita e realiza o pensamento verbal (interior) (Vigotski, 2009; Benveniste, 1976). Assim, o processo comunicativo entre humanos faz uso de signos (termos conceituais, expressões várias) que têm significados (conceitos) como conteúdos.
Os seres humanos têm a possibilidade de se desenvolver intelectualmente ao longo da vida e cabe à escola um papel relevante nesse processo, contribuindo para que os estudantes aprimorem e/ou transformem seus modos de interagir entre si e com o mundo. Realizando atividades planejadas que considerem as potencialidades dos estudantes, professores os orientam e auxiliam com a intenção de que atinjam o domínio autônomo dos conteúdos de ensino: trata-se do processo de instrução –entendida como articulação de ensino e aprendizagem– o qual também pressupõe a ativa participação de cada estudante nas atividades (Vigotski, 2009; Prestes, 2012).
Durante a instrução de dado conteúdo, professor/a e estudantes interagem na realização das atividades de ensino. Os signos chegam aos estudantes a partir do/a professor/a, dos livros didáticos, dos colegas, por meio dos órgãos dos sentidos. As sensações consideradas mais rele vantes são integradas em percepções, as quais são correlacionadas a outras percepções para formar conceitos e pensamentos que são
cotejados com os registros de experiências anteriores na memória. Quando as informações são conhecidas e há coincidência, ocorre seu reconhecimento. Quando as informações são novas, total ou parcialmente desconhecidas, o trabalho de criação das novas conceituações é mais complexo e demorado, exigindo maior colaboração entre as partes envolvidas na instrução (Luria, 1991). Caso os estudantes não consigam interpretar os signos recebidos, estes são percebidos apenas como sensações vazias de conteúdo.
No processo de ensino, as atividades realizadas conjuntamente por professor/a e estudantes podem ser interiorizadas por cada estudante, ou seja: percebidas, sistematizadas em conceitos e pensamentos e memorizadas para uso futuro, possibilitando modificações graduais de comportamento. Desse modo, cada estudante vai aprendendo as diversas operações envolvidas pelas atividades de ensino e se desenvolvendo até chegar ao ponto de realizá-las independentemente de professores e colegas (Vigotski & Luria, 2007).
Conceitos são aprendidos para satisfazer as necessidades dos seres humanos solucionarem problemas nascidos da sua interação com o mundo e de se comunicar com outros. Um conceito, ou significado, constitui o conteúdo de um signo, ao qual se encontra vinculado. O modo mais comum de aprender conceitos é pela vivência cotidiana da ativida de comunicativa, durante a qual ocorre a interiorização de situações de uso apropriado de novos termos com seus respectivos conteúdos. Por exemplo: os conceitos de casa, dor e chuva são aprendidos desse modo e, por isso, denominados conceitos espontâneos.
Outro modo de aprender conceitos é por meio da instrução
explícita e justificada do seu emprego. Cabe ao/à professor/a chamar a atenção dos estudantes para as características do conceito em foco, explicar cada uma e concretizá-las em exemplares do conceito. Assim, o/a professor/a vai explicitando o alcance e os limites de seu emprego, auxiliando os estudantes na criação das novas sistematizações e interiorizações. Os conceitos aprendidos desse modo são denominados científicos.
O conceito de substância química Entendemos substância química como «material puro que apresenta composição constante em transi ções de fase e propriedades físicas com valores característicos sob condições especificadas, cuja representação é feita por sua fórmula química» (Bellas et al., 2019: 20). Trata-se de um conceito científico, de uso restrito, embora o termo substância, sem adjetivo justaposto, apresente outros significados mais amplos (Ferreira, 1999; Silva & Amaral, 2016)
Como se pode notar, este conceito faz parte de um sistema conceitual complexo, relacionado a vários outros conceitos, tanto em nível material macroscópico (pureza química, composição química, transições de fase, propriedades físicas mensuráveis), quanto microscópico (elementos químicos, átomos, mo léculas). Apesar de abstrato, em razão da generalidade inerente a todo conceito, apresenta exemplares concretos, accessíveis pelos sentidos. Substâncias químicas são produzidas pela purificação de misturas e alguns dos processos empregados para tal podem ser realizados em laboratórios escolares simples e serem observados a olho nu.
Considerando que os estudantes do ensino médio são adolescentes e, por isso, se encontram na transição do pensamento
Educació Química EduQ número 28 40
factual ao pensamento conceitual (Vigotski, 2009), entendemos que a instrução acerca da substância química pode ser mais adequadamente iniciada pela característica da pureza química, ou seja, pelo conceito de substância química como material puro, dada a sua maior proximidade com a experiência concreta.
Admitimos que os estudantes do ensino médio já conhecem as expressões material, substância, pureza e material puro, assim como conceitos espontâneos que lhes são relacionados. Cabe à instrução introduzir a expressão pureza química e seu correspondente conceito científico, estabelecendo as diferenças de utilização do conceito de substância química em relação ao conceito espontâneo de substância.
Descrição da experiência didática
O ensino do conceito químico de substância ocorreu em uma turma com 29 (vinte e nove) estudantes do 1º ano do ensino médio de uma escola pública da cidade de Salvador, Bahia, Brasil. A professora tinha formação em Licenciatura em Química e ministrava a disciplina há mais de dez anos na instituição. Uma de nós (Bellas) atuou como observadora participante. Os estudantes eram jovens entre 15 e 16 anos de idade, participantes ativos das aulas e concordaram em participar da pesquisa.
A sequência de ensino foi discutida, combinada com a professora e ocorreu dentro do planejamento da escola, em aulas de cinquenta minutos, duas vezes na semana e distribuídas em quatro etapas. Na primeira etapa, foram discutidos conhecimentos dos estudantes prévios ao ensino e os conceitos de pureza química e substância química; em seguida, foram introduzidos critérios de identificação de substância química e mistura, assim como
métodos de separação de misturas empregando experiências de laboratório; na terceira etapa, um texto elaborado por nós com a finalidade de sistematizar os conceitos estudados, foi lido e discutido em aula; por fim, foi proposto um conjunto de problemas para serem resolvidos por grupos de 4-5 estudantes em aula, sendo discutidos posteriormente por todos.
As aulas foram registradas em áudio, os diálogos foram transcritos e analisados buscando identificar relações entre ações realizadas pela professora durante o ensino –dar a perceber, chamar à atenção, exemplificar, incentivar a discussão, empregar conceitos etc.– e a aprendizagem dos novos conceitos pelos estudantes.
Identificação das ideias prévias dos estudantes
De início, identificamos que os estudantes desconheciam o conceito de substância química e empregavam o termo substância com o sentido de material. Material puro era entendido como material limpo; não misturado; que não contém química; que não sofreu mudanças. Coerentemente, pureza material significava limpeza; ausência de mistura; ausência de química; sem alteração. Inversamente, material impuro era entendido como: contaminado, sujo; misturado; composto por substâncias; que contém química. Tais conceitos também foram empregados no caso específico da água potável. Os estudantes desconheciam o tratamento d’água.
Discussão das diferentes concepções de pureza
Tendo por base essas constatações, o passo seguinte consistiu em discutir diferentes concepções de pureza. O argumento desenvolvido pela professora consistiu em
mostrar que a água de fontes naturais, considerada pura (segundo os estudantes: sem química, inalterada), era submetida a uma série de processos químicos e físicos –filtração inicial, adição de coagulante, decantação, segunda filtração, adição de cloro (bactericida), flúor (anticárie) e cal (controle de acidez)– a fim de tornar-se pura no sentido de própria para o consumo humano. Para tanto, foi apresentado e discutido um vídeo acerca do tratamento d’água para a obtenção de água potável (https://www.youtube.com/watch?v=P2ShcHsEGts)
Com tal atividade, a professora chamava os estudantes à atenção para a polissemia do termo pureza e para as diferenças entre os critérios que estabelecem dois de seus conceitos: a água natural é pura por não ter sido submetida à ação humana; e a água potável é pura por estar adequada à ingestão por seres humanos, ou seja: isenta de sólidos em suspensão e de bactérias. Também foi importante fazer os estudantes perceberem que, para a água se tornar potável é necessário alterar a água natural (considerada sem química) pela adição de produtos químicos com os quais não se encontra normalmente misturada.
O raciocínio envolvido na compreensão dessa argumentação é complexo e requer uma variedade de experiências de uso do conceito de pureza de modo explícito para que os estudantes possam reconhecer suas diferenças e interiorizar a polissemia da expressão pureza material. Por isso, a professora também discutiu a pureza do ar atmosférico e do solo.
A noção do ar atmosférico como mistura de substâncias químicas –oxigênio, nitrogênio, gás carbônico e outros gases– é introduzida no ensino fundamental e essa infor
41
número 28
Recerca en didàctica de la química Ensino e aprendizagem do conceito de substância química como material puro por estudantes de ensino médio
mação anterior serviu de base para a discussão do exemplo.
No caso do solo, além dos estudos escolares anteriores, a discussão teve como base a experiência empírica dos estudantes: alguns dos diferentes componentes do solo são visíveis a olho nu e, inclusive, podem ser separados manualmente. Assim, os conceitos de mistura e substância química adquiriam maior concretude. (Embora os materiais que podem ser separados visual ou manualmente em uma amostra de solo não sejam, neces sariamente, substâncias químicas, servem como análogos para a compreensão deste conceito.)
Na sequência, foi introduzida uma terceira acepção de pureza, a pureza química, como ausência de mistura: um material é quimicamente puro se é constituído por apenas um tipo de material ou apenas uma substância. Em outras palavras: um material é quimicamente puro se não está misturado (reunido) com outros materiais (Bellas et al., 2019). Parte dos estudantes veiculava concepções de pureza similares, facilitando a interiorização do conceito de pureza química.
Substância química definida como material quimicamente puro
Substância química foi, então, definida como material quimicamente puro. Por isso, nem a água natural nem a água potável são substâncias químicas, já que, nos dois casos, a água se encontra reunida a outros materiais. Logo, são misturas.
O diálogo seguinte mostra a maior aprendizagem dos estudan tes em relação à situação anterior:
P: Por exemplo, o solo é um tipo de material?
E02: É.
P: É uma substância só?
E07: São várias.
P: O solo é um material puro ou impuro?
E04: Impuro.
P: Por quê?
E04: Porque tem várias substâncias.
O termo substância, que havia sido empregado pelos estudantes com o sentido genérico de material, ia ganhando especificidade como substância química, material puro.
O comportamento da temperatura de uma substância química durante a ebulição
Uma vez que as sensações não são critérios confiáveis para distinguir substância química e mistura, foi introduzido o comportamento da temperatura de uma amostra líquida durante a ebulição como critério empírico. Foram realizadas experiências de ebulição de água e de solução de água com sal. Durante a vaporização, os estudantes percebiam o que ocorria com a água e, também, a constância da sua temperatura de ebulição:

E3: Olha a fumaça, é a vaporização.
E15: O nível da água está descendo.
E8: Porque a temperatura não está mudando mais.
Observações análogas ocorreram para a vaporização da solução salina e para a variação da sua temperatura de ebulição.
As experiências de laboratório constituíam novidade e prenderam a atenção dos estudantes. As percepções visuais e manipulações deram concretude ao discurso da professora e favoreceram a interiorização dos critérios de identificação de substância química e mistura. Esta afirmativa se apoia no fato de que os estudantes souberam aplicar os critérios adequadamente na resolução de um problema proposto pela professora:
P: Temos dois béqueres, um com uma substância (material puro) e outro com uma mistura (material impuro).
Já que a gente não pode identificar a olho nu, pelo cheiro, pelo paladar, pois a gente sabe que as propriedades organolépticas não são confiáveis na identificação de uma substância e que existem materiais que nem cheiro
Figura 1. Estudante observando o comportamento da temperatura de ebulição da água.
28 42
Educació Química EduQ número
perceptível têm, então qual é a propriedade que a gente está utilizando para saber se o material é uma substância ou se é uma mistura?
E07: Está fervendo.
Pesquisadora: Certo, mas eu vou ferver os dois materiais. E o que vai nos indicar...
E18: A temperatura.
Pesquisadora: Que temperatura é essa?
E14: De ebulição.
P: Por que é confiável utilizar a temperatura de ebulição para identificar se o material é uma substância ou mistura? Se for uma substância, o que acontece com a temperatura durante a passagem do estado líquido para o gasoso?

E10: Fica constante.
P: E no caso da mistura?
E21: Vai variar.
O fato de vários estudantes terem contribuído para a solução do problema indica a incompleteza dos conhecimentos individuais, mas, também, atitude colaborativa e engajamento na discussão.
Separação de misturas para produzir substâncias
O passo seguinte consistiu em apresentar processos de separação de misturas para produzir subs tâncias. Os estudantes não tinham ideia de como realizá-la e alguns consideravam-na impossível. Foi realizada a vaporização de uma solução de água e sal contida em um béquer até a secura (fig. 2).
Então se promoveu a discussão do experimento observado visando sistematizar o pensamento dos estudantes:
P: E se eu quiser separar a água e o sal de cozinha, como é que eu faço?
E05: Coloca pra [sic] ferver.
P: E se eu colocar para ferver, o que é que vai acontecer?
E06: O sal vai ficar lá embaixo na panela.
P: E a água?
E06: Vai evaporar.
P: Água e sal é um material puro ou impuro?
E17: Impuro.
P: Então se eu fizer a vaporização eu vou purificar a água e purificar o sal?
E17: Vai sim.
P: O que é material puro?
E23: Que tem uma única substância.
P: E o que é material impuro?
E23: Mistura de várias substâncias. Novamente, notamos a elaboração de um pensamento coletivo, com os colegas se auxiliando mutuamente, do qual, podemos inferir que os estudantes compreenderam a experiência como uma separação da água e do sal da mistura original, tornando-os materiais puros, o que deu força ao conceito químico de substância.
Resolução de problemas
Na sequência, foi lido e discutido um texto elaborado por nós com a finalidade de sistematizar os conceitos estudados e foram propostos problemas a serem resolvidos coletivamente por grupos de 4 ou 5 estudantes, incentivando sua interação e
colaboração na busca de soluções. Um dos problemas apresentava um rótulo fictício de água mineral contendo sua composição química em termos de bicarbonatos de sódio, potássio, cálcio e magnésio, óxido de silício e, adicionalmente, pH e temperatura da fonte. O texto da questão era: Observe o rótulo abaixo e responda: A água mineral é pura? Por quê? Todos os grupos concordaram em que a (suposta) água mineral não era pura com base no critério de pureza química:
Equipe 1 - Dependendo do nosso ponto de vista sim. Mais para os químicos ela é considerada impura, pois contém várias composições.
Equipe 5 - Não, pois é misturada com várias outras substâncias.
Equipe 6 - Impura, pois tem várias substâncias nela.
Equipe 7 - Quimicamente não é pura, porque contém sais minerais.
As equipes 1 e 7 destacaram o critério químico, donde se pode inferir que o distinguiam de
Figura 2. Separação do sal durante a ebulição da mistura de água e sal.
Recerca en didàctica de la química Ensino e aprendizagem do conceito de substância química como material puro por estudantes de ensino médio
número 28
43
outros critérios de pureza. A Equipe 1 foi além, confrontando a pureza química com outro tipo de pureza, embora não o tenha explicitado. Uma inspeção das discussões anteriores nos possibilita inferir que se trata da pureza atribuída às coisas naturais.
Outro problema propunha: O ouro 18 quilates (18 kt) contém 75% de ouro e 25% de prata, cobre ou bronze. Uma aliança de ouro 18 K apresenta em sua embalagem a frase: Aliança de ouro puro. Esta frase está correta? Explique
Nesse caso, todas as equipes também responderam negativamente à pergunta e justificaram suas respostas com base no critério químico de pureza: Equipe 3 – Não. Porque juntamente com o ouro contem 25% de prata ou bronze, o que torna um material impuro.
Equipe 5 – Está incorreta, pois o ouro foi misturado com prata e bronze. Equipe 6 – Não. Porque 25% dele contém algumas misturas. Equipe 7 – A frase não está correta quimicamente falando pois tem outras substâncias.
Podemos inferir que os estudantes reconheceram as situações propostas pelos problemas como similares ou análogas às situações de instrução. Suas respostas empregaram adequadamente os termos substância e mistura, revelando a interiorização e a aprendizagem.
Conclusões
Em nosso entender, tal aprendizagem é a etapa inicial do processo de compreensão do conceito de substância química:
«Quando uma palavra nova, ligada a um significado, é aprendida pela criança, o seu desenvolvimento está apenas começando; no início ela é uma generalização do tipo mais elementar que, à medida que a criança se desenvolve, é substituí da por generalizações de um tipo cada vez mais elevado, culminando
o processo em verdadeiros concei tos» (Vigotski, 2009, p. 246).
Para que cada estudante se desenvolva em relação ao conceito de substância química, faz-se necessário empregá-lo em situações diversas, de modo que, adquira valor na sua interação com o mundo e com os outros seres humanos. O ensino da Química possibilita tais situações pois, conforme lembramos no início deste artigo, o estudo da composição e da transformação dos materiais passa pelo conceito químico de substância.
A fig. 3, abaixo, apresenta um esquema do desenvolvimento conceitual dos estudantes durante a experiência didática.
Ao relacionarem material puro a material limpo, sem alterações e/ou sem química, os estudantes demonstraram, inicialmente, a predominância de concepções espontâneas quanto a ideia de pure za material. Com a instrução, ao discutir a pureza do ponto de vista químico, os estudantes consegui ram classificar os materiais em mistura ou substância a partir deste critério. Água potável, água natural, ar e solo, que antes foram exempli ficados como tipos de materiais puros, passaram a ser entendidos como misturas químicas. A diferen ciação no uso dos termos e a construção de novos significados demonstram a aprendizagem e, consequentemente, o desenvolvi mento conceitual dos estudantes durante a experiência didática.
Pelo exposto, notamos que a professora criou condições para a percepção de aspectos do conceito, chamou à atenção dos estudantes para os pontos relevantes, apresen tou exemplos, estimulou o emprego dos termos/conceitos e sua memo rização, possibilitando o reconheci mento de situações análogas às da instrução pelos estudantes, o emprego do termo substância com significado de material puro, a utilização adequada do critério de
pureza química. Ou seja: podemos concluir que o ensino fundamenta do da teoria histórico-cultural contribuiu para a aprendizagem do conceito de substância química como material puro por estudantes do ensino médio.
Os resultados mostram uma aprendizagem inicial de emprego dos termos substância química (ou, simplesmente, substância) e mistura e dos correspondentes conceitos químicos em situações variadas, criando condições para o reconhecimento de materiais como puros ou impuros.
Denominamos tal aprendizagem como inicial porque constitui uma base necessária para os estudantes avançarem no estudo da Química, tanto nos aspectos macroscópicos quanto microscópicos, os quais não podem se desenvolver sem o domínio da linguagem adequada.
Conforme apontamos mais acima, o conceito de substância química é complexo, de modo que seu ensino e aprendizagem não se resumem ao aqui apresentado. Por isso, torna-se importante investigar o ensino e a aprendizagem dos demais aspectos deste importante conceito químico.
Referências
bellas, R. R. D. (2018). Conceitos de substância atribuídos por licenciandos em química: Uma análise histórico-cultural (Tese de doutorado). Universidade Federal da Bahia.
bellas, R. R. D.; queiroz, I. R. L.; lima, L. R. F. C.; silva, J. L. P. B. (2019). O conceito de substância química e seu ensino.
Química Nova na Escola, vol. 41, num. 1, p. 17-24.
benvenisTe, E. (1976). Problemas de linguística geral. São Paulo: Nacional/Edusp Ferreira, A. B. H. (1999). Novo
Aurélio século XXI: o dicionário da língua portuguesa (3ª ed.) Rio de Janeiro: Nova Fronteira.
Educació Química EduQ número 28 44
Figura 3. Desenvolvimento conceitual dos estudantes durante a experiência didática.
luria, A. R. (1991). Curso de psicologia geral (2ª ed.) Rio de Janeiro: Civilização Brasileira.
PresTes, Z. (2012). Quando não é quase a mesma coisa: Traduções de Lev Semionovitch Vigotski no Brasil Campinas: Autores Associados.
silva, J. L. P. B.; moradillo, E. F; Cunha, M. B. M.; doTTo, R. R.; dourado, P. V. (2007). A composição no ensino de química. In Atas do VI Encontro Nacional de Pesquisa em Educação em Ciências. Florianópolis, SC: Abrapec. Também disponível online em: <http://abrapecnet. org.br/atas_enpec/vienpec/ CR2/p70.pdf> [Consulta: 4 janeiro 2021].
silva, J. R. R. T; amaral, E. M. R. (2016). Concepções sobre substância: relações entre contextos de origem e possíveis atribuições de sentidos. Química Nova na Escola, vol. 38, num. 1, p. 70-78.
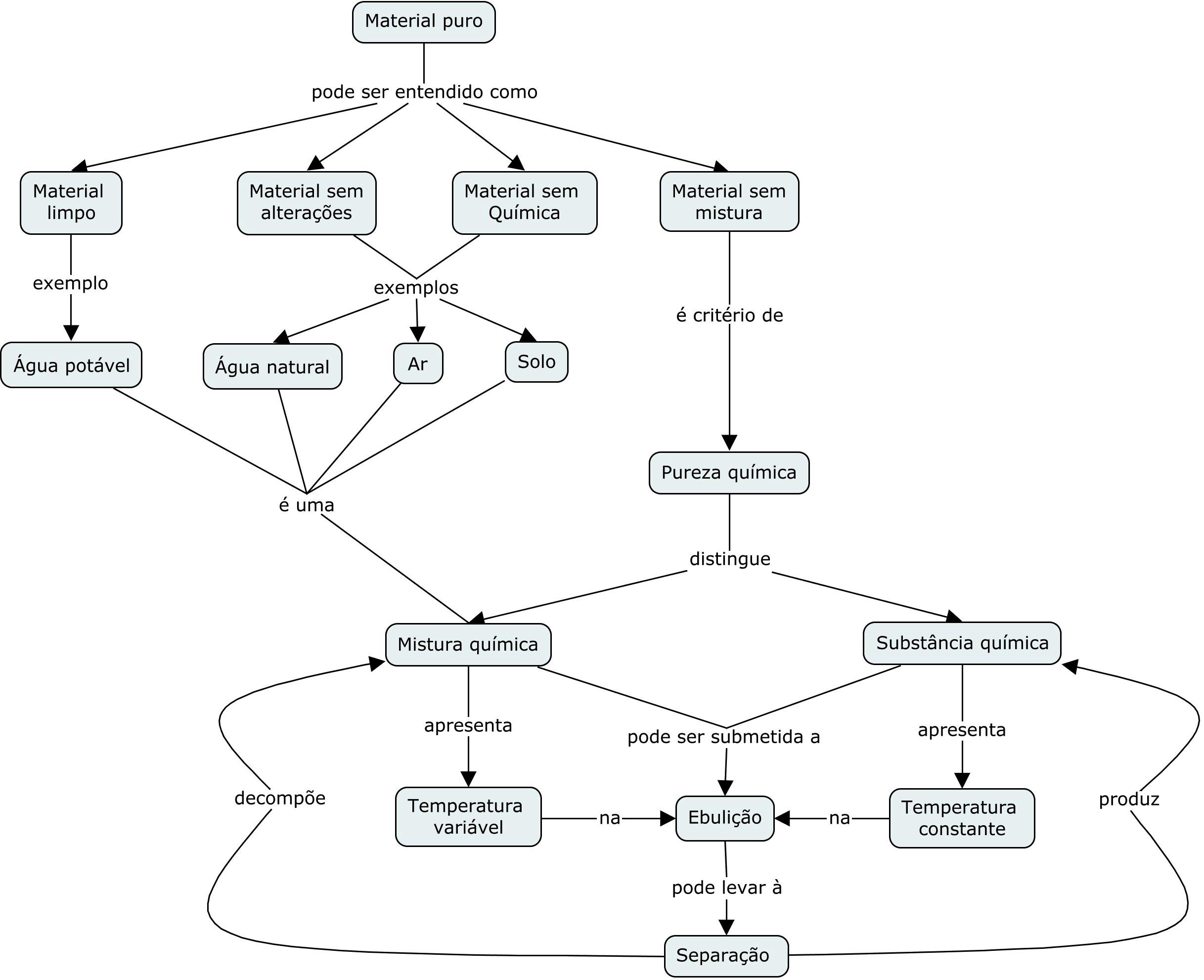
vigoTsKi, L. S. (2009). A construção do pensamento e da linguagem (2ª ed.).
São Paulo: WMF Martins Fontes. vigoTsKi, L. S.; luria, A. R. (2007).
El instrumento y el signo en el desarrollo del niño. Madrid: Infancia y Aprendizaje.
de ensino de ciências, atua no ensino da química e na investigação do ensino e da aprendizagem de conceitos científicos.
Email: renatarosadotto@hotmail.com
Renata Rosa Dotto Bellas É licenciada em química e doutora em ensino, filosofia e história das ciências pela Universidade Federal da Bahia (UFBA)/ Universidade Estadual de Feira de Santana. Professora Assistente da Universidade do Estado da Bahia (UNEB). Tem experiência na área


José Luis P. B. Silva É químico e doutor em química pela Universidade Federal da Bahia (UFBA). Professor titular de físico-química aposentado da UFBA. Tem como campo princi pal de investigação o ensino e a aprendizagem de conceitos químicos, com o aporte da história e da filosofia da química. Email: joseluis@ufba.br
45
número 28
Recerca en didàctica de la química Ensino e aprendizagem do conceito de substância química como material puro por estudantes de ensino médio
Com diferenciar els conceptes de substància elemental i element químic? El relat històric
i l’experimentació
How to distinguish the concepts of elemental substance and chemical element? The historical account and the experimental work
Josep Duran / Departament de Química. Universitat de Girona Fina Guitart / CESIRE, Departament d’Educació i Facultat d’Educació, Universitat de Barcelona
resum

El significat atribuït als conceptes de substància, element i àtom al llarg de la història ha estat clau en el procés de modelització de la composició de la matèria i les seves transformacions. L’article proposa l’ús del relat històric i la realització d’experiments senzills generadors de preguntes i d’evidències en una seqüencia-progressió per construir coneixement a partir d’una situació d’aprenentatge en el context de la sostenibilitat, per apoderar l’alumnat en la presa de decisions i l’elaboració d’arguments basats en la transformació de les substàncies i la conservació dels elements i dels àtoms.
paraules clau Substància, element, relat històric, experimentació, situació d’aprenentatge.
abstract
The meaning attributed to the concepts of substance, element, and atom throughout history has been a key piece in the process of modeling the composition of matter and its transformations. The article proposes the use of the historical account and the realization of simple experiments that generate questions and evidence in a sequenceprogression to build knowledge from a learning situation in the context of sustainability, to empower students in making decisions and developing arguments based on the transformation of substances and the conservation of elements and atoms.
keywords
Substance, element, historical account, experimentation, learning scenario.
Introducció
Des de l’inici de les civilitzacions, els éssers humans han volgut comprendre l’entorn i intervenir-hi i donar resposta a la pregunta «de què està fet el món material?». Les explicacions elaborades al llarg de la història han estat sovint vinculades a la paraula element amb diferents significats. Primer amb un significat filosòfic sense evidències
experimentals, i més endavant amb el significat de substància elemental que no es pot descompondre en altres de més simples, o bé amb significats d’entitats abstractes associades a un determinat tipus de matèria.
Les societats actuals s’enfron ten a problemàtiques socials i mediambientals rellevants generades per l’exhauriment de recursos naturals per manca d’un
consum responsable i d’una gestió sostenible que incorpori l’economia circular, en la qual es recuperen i revaloritzen els residus i es minimitzen els seus impactes. Per actuar amb criteri i base científica en aquestes problemàtiques els ciutadans han de comprendre què canvia i què es manté en les transforma cions de les substàncies, i els con ceptes de substància i element
46 ISSN 2013-1755, SCQ-IEC Educació Química EduQ número 28 (2021), p. 46-55
http://scq.iec.cat/scq/index.html
DOI: 10.2436/20.2003.02.214
esdevenen clau per a una alfabe tització científica ciutadana. Els humans continuem intervenint en l’entorn i cal apoderar l’alum nat per a la presa de decisions i actuacions en situacions comple xes i en l’elaboració d’arguments basats en les idees i models bàsics de la química.
Els conceptes de substància i element continuen sent clau per comprendre el món i actuar en ell. Tot i així, l’alumnat té dificul tats per donar significat a aquestes paraules a causa de la polisèmia del mot element, la manca de diferenciació entre els nivells macroscòpic i submicros còpic i la manca de perspectiva històrica (Caamaño, Guitart & Grapí, 2019). Aquest article pretén contribuir a donar sentit als aprenentatges sobre les transfor macions de les substàncies i la conservació dels elements i els àtoms en els canvis químics, i destaca la importància de la utilització del terme substància elemental a nivell macroscòpic, i la paraula element, o element químic, com a entitat abstracta que perdura en els canvis químics.
El relat històric i la construcció de coneixement
Com s’ha construït al llarg de la història el coneixement sobre les substàncies, els elements i els àtoms? El procés és difícil de simplificar, ja que la progressió no ha estat lineal; sovint hi ha aportacions de persones en diferents moments i llocs, i la comunicació, compartició de coneixements i publicació de resultats en temps passats no tenia la immediatesa a la qual estem acostumats avui en dia.
Els tres subapartats següents presenten un relat històric, sintetitzat en una línia del temps (fig. 1), en el qual es recullen les aportacions de la construcció de coneixement entorn dels significats de les

paraules element, substància elemental i àtom des de Tales (600 aC) fins a Schrödinger (1926).
vers estava fet d’una combinació de diversos elements: terra, que representava el sòlid; aigua,
47
número 28
Figura 1. Esquema de les idees seleccionades sobre composició de la matèria al llarg del temps.
De la Grècia clàssica a Boyle
De què està feta la matèria? A Milet, una ciutat a prop del mar Egeu, fa més de dos mil cinc-cents anys, Tales, el fundador de la filosofia occidental, es va fer aquesta pregunta. Segons ell, si la matèria s’anava esmicolant, al final no es podria trencar més. A aquesta peça simple que en forma altres de més complexes la va anomenar «element». Tales va suposar que l’element de què estava fet l’Univers era l’aigua.
Aviat altres pensadors van proposar que potser no hi havia un sol element, sinó que l’Uni-
que representava el líquid; aire, que representava el gas, i foc, que representava el canvi. Demòcrit, filòsof presocràtic grec, 400 aC va proposar que tot està format d’àtoms, tots iguals substancialment i indivisibles, i de buit. Aquests àtoms eterns es poden combinar de diverses formes per representar el canvi.
Fins a mitjans del segle xvi, els humans sabien molt poc dels elements. Encara ningú de manera conscient no havia aïllat cap substància elemental ni ningú havia combinat substàncies elementals per formar compostos.
Com diferenciar els conceptes de substància elemental i element químic? El relat històric i l’experimentació
Estratègies didàctiques
I és que el pensament deductiu, útil per exemple en matemàtiques, no era suficient per explicar fenòmens naturals. Calia un altre mètode basat en l’observació, la mesura i l’experimentació, característic de la ciència.
Robert Boyle, al segle xvii, es va replantejar la pregunta de Tales des del punt de vista de la ciència. En el llibre El químic escèptic (Boyle, 1661) apareix per primer cop la paraula químic, i introdueix la idea d’element com el que anomenem substàncies elementals: «Jo vull anomenar elements allò que els alquimistes anomenen principis; certs cossos perfectes sense mesclar, primitius i simples, que no estan formats per cap altre cos...». El que s’havien considerat elements no s’ajusten a la definició d’element de Boyle: per exemple a simple vista es veu que la terra està formada per diferents partícules. Però força substàncies conegudes fins aleshores es poden considerar substàncies elementals. Al mercuri i al sofre dels alquimistes, s’hi poden afegir les que apareixen a les escriptures, com l’or, la plata, el coure, el ferro, el plom, l’estany, el carboni i l’antimoni (Malé & Vieta, 2019). L’or, el sofre, el carboni –la plata i el coure en menor mesura– es troben a la natura com a substàncies elementals. A l’edat de coure, fa 7.000 anys, ja s’obtenia coure a partir de certs minerals. Amb posterioritat a Boyle es van aïllar diversos metalls fent servir tècniques metal·lúrgiques.
En la segona meitat del segle xviii, molts científics van dedicar esforços a aïllar i descobrir gasos, com és el cas dels tres anglesos citats a continuació. Henry Cavendish, l’any 1766, va obtenir un gas inflamable a partir de ferro i àcid clorhídric; Joseph Priestley va trobar resposta a com i per què es cremen les substàncies amb el descobriment, l’any 1774, d’un gas
que encenia una estella incandes cent, obtingut per descomposició de l’òxid de mercuri, i Daniel Rutherford, el 1772, va aïllar el nitrogen, un gas present a l’aire, després d’haver eliminat l’oxigen mitjançant una combustió.
Dels elements de Lavoisier als àtoms de Dalton
A finals del segle xviii Antoine Laurent Lavoisier, considerat per molts el pare de la química, va posar nom als gasos obtinguts per Cavendish, Rutherford i Priestley. Anomenà oxigen el gas que va descobrir Priestley, i azot –nitro gen– el gas descobert per Ruther ford, i els va considerar els gasos presents a l’aire. En combinar amb oxigen el gas inflamable descobert per Cavendish es formava aigua, per això el va anomenar hidrogen, generador d’aigua.
Lavoisier va aportar a la química una definició de substàn cia elemental, a la qual anomena va «cos simple», com una substàn cia que no es pot descompondre en altres de més simples per cap procés químic. En el seu llibre Traité élémentaire de Chimie (Lavoisier, 1789) fa una llista de trenta-tres elements, separats en metalls i no metalls i entre els quals encara s’hi troben «calor» i «llum» i alguns òxids de metalls dels quals no s’havia pogut obtenir la substància elemental amb els mitjans de l’època. Va elaborar una teoria per explicar la formació de compostos a partir dels anomenats cossos simples.
El professor anglès John Dalton, a principis del segle xix, va reprendre el nom d’àtom. En el seu llibre A new System of chemical Phylosophy (Dalton, 1808-1827) va proposar que la matèria estava formada per àtoms diferents per a cada element, indestructibles i indivisibles i que es mantenien invariables en les reaccions químiques, en les quals els àtoms es recombinaven. Va comparar la
massa dels elements que intervenien en les reaccions i va estimar els pesos atòmics relatius, tot proposant un pes atòmic 1 per a l’hidrogen. Les idees de Dalton expliquen per què les substàncies reaccionen en proporcions fixes per formar el mateix compost i també que si aquestes substàncies formen més d’un compost, la relació entre les proporcions és de nombres enters, llei de les proporcions múltiples del mateix Dalton. Els àtoms de Dalton, més que unitats mínimes de composició de la matèria, eren unitats mínimes de combinació. Dalton no va considerar que algunes substàncies elementals estaven formades per entitats de dos àtoms, idees que posteriorment la hipòtesi d’Avogadro va contribuir a modificar.
L’italià Alessandro Volta, nascut al segle xix, va inventar la pila, i es van començar a fer experiments amb l’electricitat. L’any 1800, amb dos elèctrodes connectats a una pila i submergits en aigua lleugerament àcida, els anglesos William Nicholson i Anthony Carlisle van observar l’aparició de bombolles a cada elèctrode. L’experiment desmentia que l’aigua era una substància elemental, ja que es podia descompondre en altres substàncies més simples: hidrogen i oxigen. L’electricitat va permetre aïllar els elements que es trobaven en compostos com la calç, la magnèsia, la barita, l’alúmina i la sílice, que Lavoisier no havia aïllat però que havia intuït. Malgrat això, encara no hi havia cap prova que demostrés que una substància era elemental, més enllà de no haver trobat la forma de descompondre-la.
La caracterització dels elements. Més enllà dels àtoms indivisibles L’any 1860 va marcar un abans i un després en la identificació dels elements. Els alemanys
48 Educació Química EduQ número 28
Gustav Kirchoff i Rober Bunsen van inventar l’espectroscopi, amb el qual van analitzar la llum de les flames obtingudes en cremar substàncies, i van obtenir el que s’anomenà espectre. Bunsen i Kirchoff van interpretar aquests resultats i van proposar que cada element havia de tenir un espectre diferent, únic, una mena de codi de barres que l’identifica. L’espectroscòpia permet identificar la presència dels mateixos elements en diferents compostos, i identificar-ne de nous. És un mètode ràpid i eficaç per determinar la presència d’un element, fins i tot si aquest es troba formant part d’un compost.
L’any 1869, el rus Dmitri Ivànovitx Mendéleiev, després de diverses propostes d’altres científics, va enunciar la llei periòdica, la qual li va permetre ordenar els 63 elements coneguts en una taula que esdevindria una icona de la ciència. Va predir l’existència d’elements que encara no s’havien descobert, però no va predir l’existència dels gasos nobles, descoberts anys més tard per espectroscòpia. Entre ells l’heli, que es va trobar abans fora de la terra que al nostre planeta, en un estudi de la corona solar durant un eclipsi.
Al final del segle xix, l’anglès J. J. Thomson va realitzar un descobriment que redefiniria el concepte i model d’àtom indivisible de Dalton. Va estudiar el comportament d’uns raigs que es formaven en un tub de vidre al buit al qual es connectaven uns elèctrodes d’alt voltatge. Es van anomenar raigs catòdics perquè anaven del càtode cap a l’ànode. En va deduir el seu caràcter corpuscular i la càrrega negativa. Més tard, aquestes partícules que formaven part dels àtoms es van anomenar electrons.
El posterior descobriment del nucli atòmic per Rutherford, la inclusió de la quantització de
l’energia proposada per Bohr l’any 1913 i, finalment, el descobriment de noves partícules i el desenvolupament de la física quàntica amb les contribucions de Schrödinger, l’any 1926, han portat al model quàntic o model atòmic actual.
Les activitats experimentals
Les activitats experimentals que es proposen tenen en comú que es realitzen a microescala o mil·liescala, és a dir en quantitats de l’ordre dels micromols o dels
molt bé amb una lupa digital. Amb un escuradents se separa el granet de malaquita que no ha reaccionat i s’hi afegeix un clau galvanitzat (recobert de zinc).
Apareix una massa esponjosa de color marró molt visible també amb la lupa digital. La reacció entre l’hidroxicarbonat de coure (II) i l’àcid clorhídric forma clorur de coure (II) (aq), diòxid de carboni i aigua. En la reducció de la solució d’ions coure (II) amb zinc s’obté metall coure.
a) b)
Figura 2. Obtenció de coure a partir de la malaquita: a) Addició d’HCl (aq) a la malaquita; b) Formació de coure en afegir-hi un clau zincat (font: pròpia).
mil·limols (Corominas, 2011; Mayssoun, Fuertes & Duran, 2018; Worley, 2018). Aquesta tècnica utilitza material senzill i en petites quantitats, la qual cosa comporta la reducció del cost, del temps, dels riscos i dels residus generats, i per tant promou el consum responsable i el respecte al medi.
Experiència 1. Extracció del coure de la malaquita
El coure es pot obtenir a partir de minerals com la calcopirita (CuFeS2) o la malaquita (Cu2(CO3) (OH)2). L’experiment ens porta uns mil·lennis enrere i simula l’obtenció de coure a partir d’un dels seus minerals: la malaquita.
Es col·loca un granet molt petit de mineral de malaquita sobre una làmina de plàstic i s’hi afegeixen unes gotes d’àcid clorhídric HCl 2M. La solució es torna de color blau i apareix un bombolleig que es pot observar


Experiència 2. Obtenció d’hidrogen i d’oxigen
Lavoisier va posar nom als gasos hidrogen i oxigen, que havien descobert Cavendish i Priestley respectivament, i hi va continuar experimentant. Tot seguit s’obtenen aquests gasos.
Sobre una làmina de plàstic es col·loca un fragment de cinta de magnesi al qual afegim unes gotes de vinagre o àcid clorhídric diluït. S’observa l’aparició d’un bombolleig de gas hidrogen. Sobre una altra làmina de plàstic es col·loca un trosset de llesca de patata crua i s’hi afegeixen unes gotes d’aigua oxigenada a sobre. S’observa el despreniment de bombolles de gas oxigen. L’hidrogen es forma per reacció de magnesi amb un àcid, i la sal formada queda en dissolució. L’oxigen, per descom posició de l’aigua oxigenada en oxigen i aigua.
didàctiques
28 49
Estratègies
Com diferenciar els conceptes de substància elemental i element químic? El relat històric i l’experimentació número
a) b)
Figura 3. Obtenció d’hidrogen i d’oxigen: a) Obtenció d’hidrogen: cinta de magnesi amb gotes d’un àcid diluït; b) Obtenció d’oxigen: aigua oxigenada sobre un trosset de patata (font: pròpia).
Experiència 3. Anàlisi quantitativa de la reacció entre el magnesi i l’oxigen
Els nombrosos experiments quantitatius que van portar a enunciar la llei de les proporcions fixes i la interpretació que en va fer Dalton, s’exemplifiquen investigant la relació de masses de magnesi i el seu òxid en dos experiments de combustió amb masses de magnesi diferents.
Es retiren els plàstics dels taps corona i es pesen dos taps i el filferro. S’introdueixen uns 0,2 g de cinta de magnesi entre els dos taps, com si fos un entrepà, i es lliga amb un filferro de níquel, que resisteix sense fondre. Es pesa el conjunt (filferro, taps i magnesi) i es col·loca sobre un triangle de ceràmica refractària i s’escalfa durant uns 10 minuts a la flama del Bunsen. Un cop refredat, es torna a pesar. Es repeteix l’experiment amb una altra massa de cinta de magnesi,
per exemple d’uns 0,3 o 0,4 g. Es resta la massa dels taps i del filferro en totes les pesades (Microchem UK, 2018). Es constata que la relació entre la massa de magnesi i la del seu òxid té el mateix valor en els dos experiments. Això indica que la proporció de magnesi que conté l’òxid és fixa. Cal utilitzar una balança de sensibilitat el centigram.





Experiència 4. Electròlisi de l’aigua
La primera electròlisi de l’aigua va posar de manifest que un corrent elèctric produeix una reacció química i va iniciar la ciència de l’electroquímica. En connectar els elèctrodes de la pila de Volta (tot just inventada) a l’aigua amb un electròlit dissolt es va observar despreniment d’hidrogen i oxigen en cadascun dels elèctrodes, oxigen al pol positiu i hidrogen al pol negatiu.

S’utilitzen un got petit de plàstic, una pila de 9 V, dues xinxetes o dos claus de cap ample, i aigua amb una mica de carbonat de sodi dissolt. Es forada el got amb les xinxetes o claus, procurant que la distància entre ells sigui adequada per adaptar-hi la pila, i s’hi afegeix la solució. Es connecta la pila i s’observa l’aparició d’un gas en cadascun dels elèctrodes.
Figura 5. Electròlisi de l’aigua (font: pròpia).
Experiència 5. Espectroscòpia i colors a la flama
L’invent de l’espectroscopi l’any 1860 va permetre identificar els elements pel seu espectre a partir de l’anàlisi de les llums de colors de l’assaig a la flama, ja observats molt temps abans. Actualment, les línies de l’espectre s’expliquen per l’emissió de radiació de determinades longituds d’ona originada pel salt d’electrons excitats des de nivells alts a nivells més baixos.
Colors a la flama. Es dissolen sals de metalls com sodi, liti,
50
Educació Química EduQ número 28 a) b) c)
Figura 4. Formació d’òxid de magnesi: a) Cinta de magnesi; b) Escalfament; c) Cinta de magnesi recoberta d’òxid de magnesi (font: pròpia).
coure o potassi en etanol (els clorurs i els nitrats es dissolen bé) i s’introdueix la dissolució dins d’un polvoritzador. Es ruixa la flama d’un Bunsen o d’un encenedor de cuina i s’observen els colors i s’identifiquen els elements metàl·lics presents. És una manera impactant d’observar flames de colors!
Espectroscòpia. Amb els espectroscopis casolans s’enfoquen llums com el rètol taronja o vermell d’una farmàcia, un focus halogen o el fluorescent de l’aula i se n’observa l’espectre. Podeu trobar a internet diverses maneres de construir espectroscopis casolans en forma de capsa i en forma de tub.
s’estira l’èmbol i s’introdueix un clau pel forat. Es pesa la xeringa dins la qual s’ha fet el buit. Amb una bombona d’heli (es pot aconseguir a les botigues de festes) s’omple la xeringa sense que hi hagi sobrepressió i es pesa.
Cal utilitzar una balança de sensibilitat el centigram. Es fa servir l’equació dels gasos per calcular la massa molar de l’heli.
La massa calculada és més gran que la de l’heli perquè les bombo nes d’inflar globus contenen un 92 % d’heli, la resta és aire. La massa molar de l’heli posa de manifest que el gas heli està format per àtoms, no per molècules diatòmiques com altres gasos.
tació i l’enfocament de les ciències centrat en la presa de decisions sobre problemes de la vida diària i la pràctica científica per al desenvolupament de competències; així com en les principals idees i progressions d’aprenentat ge dels conceptes abordats.
L’aprenentatge basat en el context pretén donar sentit i connectar els aprenentatges amb la vida i la societat, és imprescindible en un enfocament competencial i dona significat i funcionalitat als aprenentatges.
L’alumnat adquireix coneixements i competències per satisfer una necessitat d’aprendre guiat per preguntes en relació amb el context (Gilbert, 2006).
Experiència 6. L’heli. Àtoms i no molècules
L’heli va ser identificat per primera vegada a l’espectre de la llum solar l’any 1868, però no va ser fins gairebé trenta anys després que es va aïllar a partir de minerals a la terra i se’n va poder determinar la massa atòmica relativa.
Es fa un forat a l’èmbol d’una xeringa de 100 mL de manera que es pugui mantenir fix l’èmbol de la xeringa en un volum d’uns 80 mL. Es connecta una clau de tres vies a la xeringa i es tanca la clau i


Fonamentació de la proposta d’aprenentatge
La proposta d’aprenentatge en la qual s’integren el relat històric i les activitats experimentals descrites es fonamenta en alguns dels enfocaments didàctics avalats per la recerca educativa com l’aprenentatge de les ciències basat en el context, l’enfocament indagació-modelització-argumen
L’ensenyament de les ciències basat en la modelització parteix del model inicial de l’alumnat i inclou activitats orientades a l’ava luació i la revisió progressiva dels models que es van construint. El cicle de modelització s’inicia amb una situació i preguntes proble matitzadores que orienten l’alumnat a expressar el seu model i idees inicials, posar-lo a
 Figura 6. Demostració de flames de colors (font: pròpia).
Figura 6. Demostració de flames de colors (font: pròpia).
didàctiques
28 51
Estratègies
Com diferenciar els conceptes de substància elemental i element químic? El relat històric i l’experimentació número
Figura. 7. Determinació de la massa atòmica relativa de l’heli (font: pròpia).
prova, estructurar-lo per arribar a un model final consensuat i transferir-lo (Couso et al., 2020).
L’elaboració de models de diferent grau de complexitat permet als alumnes generar explicacions de fenòmens, fer prediccions i transfe rir-los a noves situacions. Aquest procés s’efectua a través de pregun tes que promouen la indagació, pràctica científica que permet verificar prediccions i contrastar hipòtesis, proporcionar dades i proves i generar preguntes per avançar en la construcció del model (Guitart & Lupión, 2021). Els models que l’alumnat elabora en el marc de la matèria i les seves transformacions van des del més senzill, a nivell macroscòpic, cap a nivells submicroscòpics, progressivament més complexos, corpuscular, atòmic-molecular i subatòmic o electrònic (Talanquer, 2011).
L’ensenyament de les ciències per a la presa de decisions parteix de situacions problemàtiques de la vida diària i pràctiques científiques com l’argumentació per al desen volupament de competències. Implica l’alumnat de forma individual i col·lectiva en assump tes relacionats amb la ciència, i els convida a posicionar-se i a interve nir sobre problemes que els afecten a nivell individual, social i global, de manera responsable, amb iniciativa i amb autonomia personal (Blanco et al., 2018).
Les progressions d’aprenentatge són conjectures de com organitzar millor la construcció d’idees centrals en una disciplina, i es basen en resultats de la recerca educativa sobre els coneixements previs i les maneres de pensar dels estudiants (Duncan & Gotwals, 2015). Típicament, les progressions d’aprenentatge es representen com una seqüència d’etapes, que comença amb les idees inicials comunes dels estudiants («àncora baixa») i que acaba amb el concepte que els estudiants han de construir
(«àncora alta»). Haurien d’incloure la seqüència d’experiències i possibles maneres de posar de manifest el progrés de l’alumnat (Duschl, Maeng & Sezen, 2011).
En les progressions d’aprenentatge dels conceptes de substància i transformació química Talanquer (2020) proposa el nivell macroscòpic i corpuscular a la franja d’edat 12-14 i reserva l’escala atòmica i subatòmica a la franja d’edat 15-17. Caamaño & Marchán (2021) proposen una seqüència d’idees bàsiques com que un element és el tipus de matèria que constitueix cada substància elemental, que en descompondre un compost es poden conèixer els elements que el constitueixen, que la composició en % en massa de cada element en els compostos és constant, que els elements es conserven durant les reaccions químiques, i que els elements es desplacen entre substàncies en reaccions de descomposició, formació, desplaçament i doble desplaçament d’un element.
A l’ESO és freqüent abordar primer la idea de substància elemental i després la d’element en el marc de la teoria atòmica de Dal
ton. Sovint s’incorpora una visió d’element com a entitat abstracta que es conserva en els canvis químics, d’acord amb la visió de Mendeléiev, i també el concepte d’element com una classe d’àtoms amb una massa relativa determi nada (Caamaño, Guitart & Grapí, 2019). Aquesta idea d’àtom caracte ritzat només per la massa relativa s’anomena àtom màssic o àtom químic, creat pels químics i que pren sentit en els canvis químics i l’ensenyament bàsic de la química. Aquesta idea d’àtom és anterior al model d’àtom amb estructura interna i a la definició d’element format per àtoms amb un mateix nombre atòmic (Aliberas, Izquierdo & Guitart, 2014).
Disseny de la proposta d’aula Aquesta proposta s’adreça a alumnat dels darrers cursos de l’ESO i planteja un enfocament competencial a partir de reptes relacionats amb els Objectius de Desenvolupament Sostenible (ODS), en especial a l’ODS 12, Producció i consum responsables. Per donar sentit als aprenentat ges i vincular-los amb sabers per a la vida s’inicia la proposta d’aula en un escenari en el context de
Figura 8. Taula periòdica dels 90 elements de la natura que ho constitueixen tot: (font: EuChemS <https://ja.cat/rZfcI>).
52
EduQ número
Educació Química
28
l’actual augment de consum d’alguns recursos que genera problemàtiques rellevants a nivell social i mediambiental en relació amb els anomenats elements en perill (fig. 8). A partir de notícies d’actualitat o de textos adaptats que tractin problemàtiques associades a algun d’aquests elements i que puguin interpel·lar l’alumnat, es demana treballar cooperativament i escollir-ne algun per cercar informació de les substàncies en què es troba a la natura, les transformacions per obtenir substàncies i materials en què es fa servir i els impactes derivats de l’augment del seu ús. En aquestes activitats inicials es comparteixen objectius i es posen en comú les preguntes a les quals
Seqüència d’activitats
Extracció del coure de la malaquita (E1). Primeres idees científiques d’element, Boyle, s. xvii
es vol donar resposta a la vegada que es posen de manifest les idees prèvies dels alumnes que són el punt de partida dels aprenentatges. Com podem tenir elements disponibles encara que les substàn cies que el contenen hagin esdevin gut deixalles després del seu ús? Què passa amb els elements i les substàncies en els processos de reciclatge? La proposta incorpora la personalització dels aprenentatges i la metacognició, així com activi tats de regulació que concreten els criteris d’avaluació.
El repte és elaborar i comuni car propostes de millora argumen tades sobre la gestió de recursos que tinguin en compte principis de l’economia circular i de sostenibili tat, així com la presa de decisions
Preguntes que orienten el procés
A nivell de composició, què diferencia una substància composta com la malaquita d’una d’elemental com el coure? D’on prové el coure que es forma a partir de la malaquita?
a nivell individual i col·lectiu. L’elaboració d’arguments reque reix l’estructuració de les idees que han de mobilitzar els coneixe ments sobre els conceptes de substància, element, conservació i canvi construïts en aquesta proposta d’aprenentatge al llarg de les activitats, i que es mostra a la taula 1. En la seqüència d’activi tats l’alumnat ha d’elaborar hipòtesis i explicacions, primer a nivell macro i després submicro, amb el fil conductor de què ha canviat i què s’ha mantingut.
L’experiment amb l’heli complementa la proposta com a exemple del descobriment de l’element abans que el de la substància, ja que l’element va ser descobert en la radiació solar per
Progressió d’idees (explicacions nivells macro i submicro)
Un element és el tipus de matèria que constitueix cada substància elemental.
Obtenció d’hidrogen i d’oxigen (E2). L’experimentació amb gasos, Lavoisier, s. xviii
Per què l’oxigen i l’hidrogen són substàncies elementals, i què els diferencia de les compostes? D’on prové el tipus de matèria que forma part del gas hidrogen / oxigen? Electròlisi de l’aigua (E4).
Descobriment de substàncies elementals per electròlisi, s. xix
Anàlisi quantitativa de la reacció entre el magnesi i l’oxigen (E3). Aportacions de Dalton i Mendeléiev, s. xix
Quines substàncies elementals s’espera obtenir quan l’aigua es descompon mitjançant l’electricitat? Per què s’anomenen elementals?
Influeix la massa de magnesi en la relació entre la quantitat de magnesi i d’òxid format? Per què? Què indica aquest fet respecte a la composició en massa de les substàncies? I respecte a la relació entre àtoms?
Les substàncies elementals estan formades per un sol tipus de matèria (element) a diferència de les compostes, constituïdes per més d’un tipus de matèries diferents.
Els tipus de matèria que formen les substàncies es conserven en les reaccions químiques.
Els tipus de matèria es desplacen entre substàncies en les reaccions [desplaçament d’un element, descomposició, formació (E3)].
Les substàncies elementals no es poden descompondre en altres de més simples (nivell macro).
Nota: Aquestes idees i la formulació de les preguntes corresponents també es poden incloure a E3.
Les substàncies compostes tenen una composició fixa, és a dir, un mateix percentatge de cada tipus de matèria (nivell macro).
Les substàncies elementals estan formades per àtoms d’un mateix element. Els àtoms es conserven en els canvis químics. Les relacions entre àtoms en les substàncies compostes és de nombres enters (submicro – atòmic).
Espectroscòpia i colors a la flama (E5). L’espectroscòpia en la identificació i el descobriment d’elements, s. xix
Com es pot identificar un element sense aïllar la substància elemental? De què està format un element a nivell submicro – atòmic? Com es poden interpretar els espectres a nivell submicroscòpic – electrònic?
Els elements, que es troben tant en substàncies elementals com en substàncies compostes, estan formats per un tipus d’àtoms que es diferencien dels altres pel seu espectre atòmic (submicro – atòmic). Els canvis de nivell energètic dels electrons dels àtoms originen les ratlles dels espectres atòmics (nivell submicro – electrònic).
Taula 1. Proposta de seqüenciació d’activitats, de preguntes i de progressió d’idees.
didàctiques
Estratègies
Com diferenciar els conceptes de substància elemental i element químic? El relat històric i l’experimentació
número 28 53
espectroscòpia molt abans que s’hagués pogut aïllar la substància a la Terra, per la seva escassetat en recursos terrestres. A més, actual ment és un dels elements en perill, ja que pot escapar realment de la Terra quan s’utilitza per inflar globus. Aquest element sí que pot desaparèixer de la Terra!
Els arguments basats en ciència que l’alumnat hauria de ser capaç d’elaborar en la part final de la proposta haurien d’incorporar idees com que els elements que hi ha al planeta són limitats, formen part de tot i es conserven si no canvien les substàncies o quan d’unes substàncies se’n formen unes altres. Els elements i els àtoms no desapareixen, però quan les substàncies que els contenen esdevenen deixalles, es dispersen, deixen d’estar a l’abast i poden generar impactes sobre el medi i les persones. També podrien incloure arguments basats en mètodes de separació de les substàncies de les mescles, desenvolupats en propostes d’aula anteriors. A banda de la necessitat de reduir el consum i de reutilit zar, reciclar permet tornar a incorporar elements i àtoms al cicle i estalviar recursos. Els avenços en coneixements sobre la matèria i els canvis, ja iniciats per
científics de segles passats, contribueixen a través de la investigació i la innovació actuals a la cerca de solucions sostenibles.
Al final de la proposta es demana transferir els aprenen tatges a altres contextos, com per exemple les problemàtiques derivades de l’augment de les emissions de CO2, amb explicacions sobre què canvia i què es conserva quan la matèria orgànica es crema i els impactes que origina.
Consideracions finals
En el disseny de seqüències didàctiques en general s’ha posat èmfasi en què ensenyar, com ensenyar i a qui s’adreça la proposta, per conèixer les idees prèvies i les dificultats d’aprenentatge. Els currículums per competències requereixen la incorporació del per a què aprendre per tal de donar sentit i funcionalitat als aprenentatges. Cal expressar el que es vol que els alumnes aprenguin, tenint en compte per a què es vol que ho aprenguin, sense deixar de banda la planificació d’activitats que proposen a l’alumnat pensar, fer, comunicar i sentir (Couso, 2013).
Tanmateix, moltes propostes d’aula no contemplen de manera explícita, ni com a punt de
partida, el per a què, que esdevé l’autèntic motor d’aprenentatge. Aquesta proposta integra el per a què i el què per aconseguir que els aprenentatges adquireixin sentit i siguin competencials i profunds, sense deixar de banda el com i a qui s’adreça. La figura 9 mostra els elements del disseny de propostes d’aula i pretén emfatitzar la necessitat d’un context i d’una demanda o repte.
Bibliografia
aliberas, J.; izquierdo, m.; guiTarT, F. (2014). «Com es veuen els àtoms a la llum d’una espelma i com es compliquen més i més». Educació química EduQ, núm. 19, p. 4-9.
blanCo, a.; esPaña, e.; FranCo, a. J.; rodríguez mora, F. (2018). «Competencias y prácticas científicas en problemas de la vida diaria». Alambique. Didáctica de las Ciencias Experimentales, núm. 92, p. 45-51. boyle, R. (1661). The sceptical chymist: or chymico-physical doubts & paradoxes. Londres. Disp. en línia a: <https:// archive.org/details/scepticalchymis00BoylA/mode/2up> [Ed. en castellà: boyle, R. (2017). El químico escéptico (trad.: N. Pérez-Galdós). Barcelona:
54 Educació Química EduQ número 28 QUI Competències i continguts (conceptes, procediments, actituds i valors) necessaris per donar resposta a la demanda o repte en context Demanda o repte en context proposat a l’alumnat per donar sentit als aprenentatges (comunicació, presa de decisió argumentada, acció, elaboració d’un objecte...) PER A QUÈ QUÈ COM Metodologies innovadores centrades en l’alumnat Regulació dels aprenentatges i metacognició Cicle d’aprenentatge, modelització, indagació Connexions interdisciplinàries Disseny universal de l’aprenentatge (DUA) Personalització dels aprenentatges Emocions. Teories de construcció del coneixement Recerca en pedagogia i didàctiques específiques Figura 9. Elements del disseny de situacions d’aprenentatge amb sentit.
Crítica.]
Caamaño, a.; guiTarT, F.; graPí, P. (2019). «L’ensenyament del concepte d’element químic i de la taula periòdica a l’educació secundària». Educació química EduQ, núm. 25, p. 32-40.
Caamaño, a.; marChán, I. (2021). «La progresión en el aprendizaje de los conceptos de sustancia y reacción química en secundaria». Alambique Didáctica de las Ciencias Experimentales, núm. 103, p. 7-15.
Corominas, J. (2011). «Química dels gasos a petita escala. “Química talla S”». Educació química EduQ, núm. 9, p. 38-43.
Couso, d (2013). «La elaboración de unidades didácticas competenciales». Alambique. Didàctica de las Ciencias Experimentales, núm. 74, p. 12-24.
Couso, d.; Jiménez liso, m r.; reFoJo, C.; saCrisTán, J. A. (coord.) (2020). Enseñando Ciencia con Ciencia. Madrid: FECYT & Fundacion Lilly; Penguin Random House, cap. 2.2.
dalTon, J. (1808-1827). A new System of chemical Phylosophy Manchester: R. Bickerstaff. Vol. 1 disp. en línia a: <https:// archive.org/details/newsystemofchemi01daltuoft>; vol. 2 disp. en línia a: <https:// archive.org/details/newsystemofchemi02daltuoft>. [Ed. en castellà: dalTon, J. (2012). El atomismo en química: Un nuevo sistema de filosofía química de John Dalton (trad.: I. Pellón). Alacant: Servei de Publicacions de la Universitat d’Alacant.] dunCan, r g.; goTwals, a W. (2015). «A tale of two progressions: on the benefits of careful comparisons». Science Education, núm. 99, p. 410-416. dusChl, r.; maeng, s.; sezen, a (2011). «Learning progressions and teaching sequences: A review and analysis». Studies in Science Education, vol. 47, núm. 2, p. 123-182. gilberT, J. K. (2006). «On the nature
of “context” in chemical education». International Journal of Science Education, vol. 28, núm. 9, p. 957-976.
guiTarT, F.; luPión, T. (2021). «Formación de precipitados y reacciones de precipitación. Estrategias de contextualización y de modelización». Alambique. Didàctica de las Ciencias Experimentales, núm. 103, p. 45-50.
lavoisier, A. L. (1789). Traité élémentaire de chimie. París: Cuchet. Disp. en línia a: <https://gallica.bnf.fr/ ark:/12148/btv1b8615746s/f15. image>. [Ed. en català: lavoi sier, A. L. (2003). Tractat elemental de química (trad.: M. Artís; A. Nieto-Galan). Barcelona: Institut d’Estudis Catalans.] malé, J.; vieTa, P. A. (2019) «La Bíblia té química: en els cent cinquanta anys de la taula periòdica de Mendeléiev». Revista de la Societat Catalana de Química, núm. 18, p. 62-81. mayssoun, C.; FuerTes, C.; duran, J. (2018). Microscale techniques in chemical. Synthesis practical subject. Congrés Internacional de Docència Universitària, CIDUI. Girona. miCroChem UK (2018). «It is not the experiment in the book!» Back to the indestructible crucible and more [en línia]. <https:// microchemuk.weebly.com/3blog-is-this-supposed-to-happen/it-is-not-the-experimentin-the-book-back-to-the-indestructible-crucible-and-more>
Talanquer, V. (2011). «Macro, submicro, and symbolic: the many faces of the chemistry “triplet”». International Journal of Science Education, vol. 33, núm. 2, p. 179-195.
— (2020). «La progresión de los aprendizajes sobre la composición, estructura y transformación química de la materia». Educació Química EduQ, núm. 27, p. 4-11.
worley, B. (2018). «“In a little you can see a lot”: the impact of practical microscale chemistry on chemical education». Educació Química EduQ, núm. 24, p. 58-62.
Estratègies
Josep Duran

Professor titular de química a la Universitat de Girona i doctor en química per la mateixa universitat, on desenvolupa recerca en l’àmbit de la catàlisi. Ha participat en nombrosos projectes de millora de la qualitat docent universitària i és un referent en comunicació i divulgació científica. Treballa per a l’establiment de ponts amb l’ensenyament de la química a secundària i per promoure les vocacions científiques dels estudiants.
A/e: josep.duran@udg.edu
Fina Guitart
Doctora en química per la UB i catedràtica de física i química de secundària, amb una trajectòria professional vinculada al desenvo lupament del professorat, tant en la formació permanent en progra mes de formació del Departament d’Educació, com en la inicial, al màster de formació del professorat de l’especialitat de física i química de la UB. Participa en equips de treball per promoure la innovació i la recerca educatives a les aules.

A/e: jguitar3@xtec.cat
55
número 28
Com diferenciar els conceptes de substància elemental i element químic? El relat històric i l’experimentació
didàctiques
DOI: 10.2436/20.2003.02.215 http://scq.iec.cat/scq/index.html
FEr MoTs amb els símbols
químics: un joc per a un aprenentatge transversal
Making Words with Chemical Symbols: a game for a transversal learning
Santiago Álvarez Reverter / Departament de Química Inorgànica i Orgànica, Universitat de Barcelona
56
ISSN 2013-1755, SCQ-IEC Educació Química EduQ número 28 (2021), p. 56-59
resum
L’ús dels símbols químics per construir paraules pot ser alhora un joc i una eina per reforçar l’aprenentatge tant de la llengua com de la taula periòdica. Aquest article analitza les possibilitats d’un llenguatge elemental que fa servir tan sols paraules elementals, és a dir, paraules escrites exclusivament amb símbols químics. Es donen exemples d’activitats amb el llenguatge elemental, com fer palíndroms, redactar la carta d’un restaurant o escriure un poema.
paraules clau
Símbols atòmics, llenguatge, palíndroms, taula periòdica.
abstract
The use of atomic symbols to make words may be both a game and a learning tool of language and of the periodic table. This work analyses the possibilities of an elemental language in which only elemental words are used, i.e., words made up exclusively by chemical symbols. Examples of activities that can be carried out in this context are proposed, such as making palindromes, elaborating the menu of a restaurant or writing a short poem.
keywords
Atomic symbols, language, palindromes, periodic table.
Introducció
Un moment! Abans de començar a llegir assegura’t que tens una taula periòdica i un diccionari a mà. Necessitaràs la llista dels símbols i els noms dels 118 elements coneguts a dia d’avui. Perquè el que aquí es proposa és fer un passeig lúdic pel vocabulari català, emprant com a alfabet els símbols dels elements químics dins del context de l’aprenentatge tant de la química com de la llengua i d’altres disciplines. Per exemple, pots escriure la paraula biobibliogràfic fent servir tan sols símbols químics? Pots intentar-ho amb o sense l’ajuda d’una taula, o bé pots continuar llegint i trobar la solució unes línies més avall.
Escriure paraules amb símbols químics és un joc que podem estirar fins a bastir un llenguatge –un subconjunt de la llengua natural– en què substituïm les lletres de l’alfabet per aquests símbols. Quines possibilitats i quins continguts tindria aquest llenguatge elemental? Comencem per establir unes regles senzilles:
1) S’ha d’emprar el mínim nombre possible de símbols per fer una paraula. Es permet repetir un mateix símbol en una paraula, tantes vegades com calgui.
2) Tan sols s’accepten paraules que es puguin trobar en un diccionari català o les seves derivades, com femenins, plurals, formes verbals, etc.

3) Es pot afegir un accent o un apòstrof al símbol d’un element quan sigui necessari. Per exemple, T’eSTiMo.
4) La ce trencada es pot utilitzar en lloc de la lletra c en un símbol, com en puça (plutoni-calci). De forma semblant, dues eles consecutives es poden acceptar com una ela geminada, com en al lusió (alumini-luteci-silici-oxigen).
Amb aquestes regles podem escriure, per exemple, la paraula biobibliogràfic amb deu símbols, Bi-O-Bi-B-Li-Og-Rà-F-I-C. Podem trobar una altra solució, B-I-OBi-B-Li-Og-Rà-F-I-C, però aquesta no compleix la regla d’emprar el mínim nombre de símbols.
Quina capacitat té aquest siste ma per generar paraules correctes, beneïdes pel diccionari? En una primera aproximació, podem fer combinacions de dos, tres... fins a deu o més símbols. Un càlcul de combinacions amb repeticions diu que amb s símbols per paraula i comptant amb e elements (118 ac tualment), podem fer nS paraules d’acord amb l’expressió [1].
de paraules (105), una cent mil lèsima part de les possibles com binacions de lletres! No és estrany, doncs, que en aquest estudi s’hagi aconseguit fer un diccionari de poc més de 9.000 paraules elementals, sense comptar derivades o noms propis. És clar que la proporció de combinacions aprofitables és mol tíssim més petita en el llenguatge elemental que en el natural.
[1]
Naturalment, si utilitzem un sol símbol (e = 118, s = 1), tenim 118 opcions. Si descartem les que no formen una paraula, ens en queden tan sols 30 (taula 1). En el cas concret de les paraules d’un sol símbol, per exemple, són vàlides les interjeccions (xe! i eu!) i els noms de lletres (ce, cu, u), però no els prefixos (bi, co, in).
Taula 1. Paraules monosimbòliques.
La taula periòdica imposa al gunes limitacions sistemàtiques al llenguatge elemental. La primera neix de l’absència de les lletres J i Q entre els símbols químics. A més, hi ha divuit símbols que no es troben en cap paraula catalana, si des cartem acrònims (FM, freqüència modulada), abreviatures (NB, nota bene), prefixos i unitats (dB, deci bels). En alguns casos perquè les regles ortogràfiques ho prohibei xen: Mc (davant de c sempre n), Mg (davant de g sempre n), Nb (davant de b sempre m), Np (davant de p sempre m). En d’altres perquè no encaixen amb la fonètica catalana: Bk, Cd, Db, Fm, Hf, Hg, Hs, Kr, Lr, Nh, Pd, Sg, Zn, Zr.
hipoteca), Cf (becfí), Cm (francmaçó, francmaçònic, paracmàstic), Cn (cincnervis, icnèumon, icnogràfic, ocnàcies, picnogònids, picnòspora), Cs (escacs, fics, ics, saltabarrancs, i plurals de paraules acabades en c), Dy (lady, però no body ni brandy, que escrivim bodi i brandi), Gd (amigdalitis), Md (circumdar), Mt (comtal, comtat, femtar, femtós, vescomtal, vescomtat, i el prefix femto-), Pm (capmàs, capmassar-se), Rh (rho, interhalogen); Sb (bisbal, bisbat), Sn (besneula, gesneriàcies), Sr (basraloc, basralocus), Tb (futbolí, futbolista, futbolístic, ratbuf, sotbatre), Tc (centcames, postconciliar), Th (perthita, smithsonita), Tl (motlo, motlura, ratlla), Tm (ístmic, istmitis, setmesó, tmesi, vuitmesó), W (clown, kiwi, lawrenci, lawsona, lawsonita, wagnerista, whisky), Yb (playback).
En sentit contrari, moltes pa raules «normals» no són vàlides en el llenguatge elemental i per això el diccionari elemental és molt més limitat que el diccionari normal. Penseu, per exemple, en els mots que fan referència al temps: no són vàlids dia, setmana, mes, any, lustre, dècada, segle ni mil·lenni. Les estacions poden només ser hivern o estiu; dels mesos de l’any ens queden sols gener i febrer, i tots els dies de la setmana desapareixen.
Ca Fe
El nombre de combinacions creix espectacularment a mida que augmenta el nombre de sím bols. Així, amb deu símbols podem fer uns 100 bilions (2.01 x 1014) de combinacions. Si permetem paraules d’entre un i deu símbols, hauríem de sumar tants termes de tipus [1] com valors diferents pot tenir s. El mateix succeeix amb el llenguatge natural, que amb un alfabet de 26 lletres permetria 4,63 x 1010 combinacions de fins a dotze lletres, mentre que els càl culs més generosos ens diuen que tenim a penes centenars de milers
Figura 1. Algunes paraules fetes amb elements de la taula periòdica.
Taula 2. Símbols que formen una síl·laba.
També tenim dificultats per descriure els colors. D’entre les nombroses paraules de què ens servim per descriure’ls, sols unes
Hi ha un bon grapat d’elements que apareixen en molt poques paraules, o en paraules que no es poden escriure completes amb símbols químics. Aquests són Bh (tan sols a subhasta i sub-
poques són elementals: ambre, blanc, blau, castany, escarlata, lila, ocre i salmó. En canvi, perdem tots aquests colors: anyil, beix, bordeus, caqui, carmesí, fúcsia, granat, gris, groc, magenta, marró, morat, negre,
AlCeGeLaNi Pa Ta AsCuHeLiNoRe Te
Au EsHoNaOSeU BeEuINeOsSiXe
Recursos didàctics
número 28 57 AlBaCuGeLaNiPu Ta AmBeErHeLiNoRa Te ArBiEsHoLuORe Ti AsCaEuIMoOsRuU AtCe Fe InNa Pa SeXe Au CoGaIrNe Po Si
FEr MoTs amb els símbols químics: un joc per a un aprenentatge transversal
pistatxo (o festuc), porpra, robí, rosa, sèpia, siena, safrà, taronja, turquesa, vermelló, verd, vermell i violeta
El fet que hi hagi catorze lletres que es corresponen amb símbols químics, ens dona força flexibilitat per fer paraules. També ajuda que uns quants símbols siguin síl·labes comunes (taula 2) i que altres síl labes es puguin formar per combi nació de dos símbols (bo, cra, fi, nu, pla...). En altres ocasions un símbol pot estar a cavall entre dues síl labes, com Nd en cendra, Rf en sur fista, Rg en allargat o Sb en bisbat
Elements gramaticals
Per norma, els substantius i els adjectius apareixen al diccionari en masculí i singular, i fins ara hem dei xat de banda els femenins i plurals. Veiem, doncs, com una paraula en femení o en plural pot formar part del llenguatge elemental. Per passar al femení no podem emprar la lletra a tal qual, ja que no és un símbol químic. Això no obstant, disposem d’alguns símbols acabats en a que ens fan una mica menys feixuga la feina: Ba, Ca, Ga, La, Na, Pa, Ra i Ta. Per exemple, es pot passar de CaTa Là a CaTaLaNa, de PoLíTiC a PoLíTi Ca i, amb algun retoc addicional, de CeC a CeGa i d’O-Br-Er a O-B-Re-Ra. Els plurals en català, majoritària ment, acaben en S, Es o Os. Així, de PaRe fem PaReS, d’ONa, ONEs, i de GaS, GaSOs. Una excepció són les paraules que acaben en -ca, per a les quals el plural acaba en -ques, ter minació prohibida en el llenguatge elemental per la presència de la cu. Pel que fa a les conjuncions, conservem bé, car, i, ni, o, però, si i sinó, però ens quedem sense ans, ara, com, mentre, mes, perquè, puix i sia. Quant als articles, conservem tots els indefinits gràcies a l’urani. En canvi, dels articles definits tan sols tenim el singular femení, el lantà. Si això ens enutja, tenim a mà interjeccions per exclamar-nos alerta!, au!, bravo!, ca!, caram!, coi!, cony!, fosca!, hola!, mosca!, noi!, oi!, perfecte!, res!, tira!, uf!, vinga! o visca!
Sufixos i prefixos
La tasca de generar paraules elementals es veu facilitada per uns quants sufixos i prefixos. Entre els primers trobem, per exemple -al (cerebral), -am (paperam), -at (concubi nat), -atge (muntatge), -ció (inanició), -ista (internista), ístic (cabalístic), -os (mocós), -tiu (negatiu) i -ura (provatu ra). Entre els sufixos prohibits tenim -tia (per exemple en vertebroplàstia), però en canvi disposem de -tic i -tica (vertebroplàstic). També tenim a l’abast un bon assortit de prefixos: bes- (besneta), bi-, bio-, cata- (catacrac), hiper-, homo-, in-, infra-, mono-, nano-, neo-, neumo-, omni-, pan-, para-, peri-, pico-, piro-, pre-, pro-, psico-, poli-, pos-, post- (seguit d’a, e, i), pre-, pro-, re-, sobre-, socio-, sub-, super-, supra-, tera-, uni-, vice- i xeno-. Això no obstant, hi ha uns quants prefixos prohibits, com per exemple anti-, auto-, contra-, deci-, endo-, ex-, hetero-, hidro-, histo-, intra-, kilo-, lito-, mega-, mili-, micro-, multi-, neuro-, pluri-, proto-, semi-, seudo-, tele-, tras- i ultra-
Verbs, adverbis i preposicions
Dels verbs, imprescindibles, tenim els infinitius en les tres con jugacions (argó, erbi i iridi), sempre que l’arrel sigui també elemental. Amb els participis tenim més res triccions, ja que perdem tots aquells acabats en t, si bé conservem els acabats en -és, ós i òs. Els gerundis sí que no tenen remei, tots acaben en nt. Això sí, gràcies al sofre, el seleni i l’einsteini conservem els verbs re flexius: rentar-se, creure’s, es pentina Escassegen, a més, els adverbis elementals: allí, allà, bé, arran, on, prop, poc, no. Molts són prohibits: com, així, els acabats en -ment, aquí, ençà, dalt, lluny, enllà, pertot, enlloc, avall, molt, ara. Igualment passa amb les preposicions. Unes quan tes són vàlides: amb, arran, cap, fins, per, pro, salvat, sens, sense, sobre, sota, i d’altres no ho són: a, contra, dalt, damunt, davall, de, des, devers, devora, dintre, davant, en, entre, en vers, excepte, malgrat, mitjançant, sots, ultra, tret, via
Paraules amb molts elements
Quines són les paraules que contenen més símbols químics? Si ens limitem a les que apareixen en un diccionari, d’entre més de 9.000 paraules que es poden escriure com una seqüència de símbols atòmics, el rècord actual el té nacionalsocialista, amb catorze símbols. La segueixen, amb un símbol menys, nacionalsin dicalista, supercalifragilístic, supersubs tancial, consubstanciació i un mineral, carbonatofluorapatita. La major part d’elles encara poden afegir un o dos símbols més per formar el plural.
Un poc més enrere hi ha algu nes paraules de dotze i onze sím bols, gairebé totes amb un prefix i un sufix que contribueixen a la seva llargària, com ara sobresatu ració o hispanoamericanista. Deveu haver observat que els afixos sobre-, ció-, hispano- i -ista afegeixen entre tres i cinc elements a una paraula. Aquest patró es repeteix dins del grup més abundant de paraules amb deu símbols, entre els quals trobem freqüentment els prefixos super-, hiper-, sobre-, sub- i pre-, i tam bé els sufixos -ció, -ismo i -ista. Entre aquestes paraules llargues trobem expressions tan sonores com tinti nabulació (al diccionari!), sensaciona lista, passamuntanyes o constantinopo lità. Amb prefixos i sufixos podem prendre una paraula relativament curta, com ara proteccionista, de deu símbols, i allargar-la fins als quinze per addició d’un prefix i forma ció del plural: hiperproteccionistes També podem allargar paraules jugant amb les formes verbals. Per exemple, el verb classificar, amb set símbols, pot incorporar-ne quatre més afegint-hi un prefix i passant al condicional preclassificaries
Llenguatge elemental, gastronomia i poesia
Les limitacions del llenguatge elemental dificulten sens dubte la redacció de textos elaborats. En aquesta secció es mostra que aquestes limitacions ens ajuden a enriquir el nostre vocabulari, són
58 Educació Química EduQ número 28
semblants a les que afrontem per fer un menú o escriure un poema i s’assemblen també als entrebancs amb què es trobaven els escriptors surrealistes que empraven l’escriptura automàtica.
Comencem amb un exercici senzill, o potser no, consistent a elaborar la carta d’un restaurant o un exemple gràfic d’un plat, tal i com es veu a la fig. 2.
tenia Raymond Queneau de la poesia es reflecteix de manera excel·lent en un fragment del seu poema «Pour un art poètique» (Queneau, 1948):
Ben col·locades ben triades poques paraules fan una poesia basta estimar les paraules per escriure un poema no sempre se sap el que es diu quan neix la poesia llavors s’ha de cercar el tema per titular el poema.
Conclusions
Figura 2. Un plat d’un menú construït a partir de la taula periòdica.
Com a exercici per posar a prova els límits del llenguatge elemental, vet aquí un petit poema, del qual es prega no jutjar la qualitat literària. La seva gestació és un procés una mica ardu, però molt gratificant, en el qual s’intenta articular amb paraules una idea. En imposar la restricció que siguin paraules elementals, se n’han de descartar algunes que ens venen al cap i buscar sinònims o perífrasis que compleixin les regles. Si tampoc funciona, s’acaba modificant el sen tit de la frase, com pot succeir també quan s’escriu un poema amb el llenguatge normal, per imposició de la rima o de la mètrica. Al final, com en l’escriptura automàtica dels sur realistes (Éluard & Soupault, 1920), el text cobra vida pròpia i s’acaba imposant a les idees de l’autor.
L’analogia d’aquesta escriptura elemental amb la visió que
Renaixença
Brises bufeu, amb cura i pocapoc. No espanteu boscos ni prats. Canteu una cançó atonal. Escalfa’m Helios! Fora la neu! Reculi la fosca, allarga’t claror.
Nota. Diccionaris útils per a aquest joc: un de català per fer cerques de paraules amb un de terminat símbol (Institut d’Estudis Catalans, 2019), un de sinònims (Jané, 2017), un de conjugacions dels verbs (Enciclopèdia Catalana, 2021) i un de variants dialectals (Institut d’Estudis Catalans, 2018).
Bibliografia
Tal com es deia al principi, aga feu paper i llapis, tingueu a mà una taula periòdica i un bon diccionari, i passeu una estona entretinguda construint paraules, frases i fins i tot textos elementals. Pel camí segur que millora el vostre conei xement tant dels símbols químics com del vocabulari i l’ortografia.
A més de les opcions aquí proposades, es poden imaginar nombroses variants de jocs amb el llenguatge elemental. Proveu-ho, per exemple, amb els noms d’amics i familiars, dels éssers mitològics o de personatges bíblics o històrics. Proveu també de refrescar els conei xements de geografia i descompon dre en símbols químics els noms de països i de les seves capitals, de muntanyes o rius. Podreu descobrir, per exemple, que tan sols dues de les quaranta-una comarques cata lanes tenen noms elementals.
–Franci-urani-iode-urani!–
Broteu fonts, no cesseu de cantar Renaixerà arreu la fauna i la flora. Sentireu raucar els babaus cantar les aus. Atrapa insectes la teranyina, als parabrises esclaten els moscards,
floreixen brucs hipèrics i estepes. Alça’t, cuc! No reptis. Fes la cobra, balla un so caribeny amb flautes violins, pandero i bongó. Febrer, confós, es retira.
éluard, P.; souPaulT, P. (1920). Les champs magnétiques. París: Au sans pareil. enCiCloPèdia CaTalana (2021). Conjugador català [en línia]. <https://www.enciclopedia. cat/conjugador-catala> insTiTuT d’esTudis CaTalans (2018). Diccionari català-valencià-balear [en línia]. <https://www.enciclo pedia.cat/conjugador-catala> insTiTuT d’esTudis CaTalans (2019). Diccionari de la llengua catalana [en línia]. <https://dlc.iec.cat> Jané, A. (2017). Diccionari de sinònims [en línia]. <https://sinonims.iec.cat/sinonims.asp> queneau, R. (1948). L’instant fatal, poèmes. París: Gallimard.
Santiago Álvarez Reverter

Catedràtic emèrit de química inorgànica de la Universitat de Barcelona. Ha desenvolupat la seva recerca majoritàriament sobre forma i enllaç en els compostos de coordinació, i també ha publicat diversos articles d’assaig sobre les relacions entre química, història i cultura. Ha publicat els llibres De dones, homes i molècules i 150 anys de taules periòdiques a la Universitat de Barcelona, aquest últim coeditat amb el Prof. Claudi Mans, i ha col·laborat amb altres autors en el llibre 100 curiositats sobre els elements i la taula periòdica
Recursos didàctics FEr MoTs amb
símbols
un
per
aprenentatge transversal número 28 59
els
químics:
joc
a un
RESSENYES DE LLIBRES
Francesc Molins
Experiments i idees amb CO2 Hamburg: Schaukel Verlag, 2021
Experiments i idees amb CO2 és un llibre que explora les propietats del diòxid de car boni i els fenòmens on aquesta substàn cia té un paper clau. Els experiments que proposa són variats i majoritàriament es poden fer amb materials assequibles. Alguns són sor prenents o bé responen a preguntes interessants. De cada experiment se’n busca el com i el perquè per tal d’explorar les propietats del CO2 i les seves conse qüències en el món.

El llibre s’estructura en vuit capítols, el primer dels quals es dedica a qüestions pràctiques i de seguretat, sempre del tot necessàries tractant-se d’un llibre en el qual es proposa experimentació, i especialment per tractar-se d’experiments que es poden fer a casa i que, en alguns casos, utilitzen productes que requereixen cura en la seva manipulació.
Un primer bloc d’experiments, al capítol 2 del lli bre, descriu diverses maneres casolanes d’obtenir CO2, i incorpora algunes explicacions basades en el model cinètic de la matèria. Endinsa el lector en el món dels gasos i dels àtoms i de la diversitat i quantitat de mo lècules que aquests poden formar, i explica el perquè d’algunes reaccions químiques atenent als electrons més externs dels àtoms.
El segon bloc d’experiments, que s’inicia pregun tant quant pesa el CO2, presenta experiments per pe sar l’aire i altres gasos. Proposa esbrinar si un gas és més dens o més lleuger que l’aire i planteja reptes com explicar per què els gasos més pesants que l’aire no cauen a l’atmosfera, i calcular el gruix que tindria la capa del CO2 contingut a l’atmosfera si aquest se situés en una capa sobre la superfície de la Terra.
El bloc següent, que l’autor anomena el poder pe netrador del CO2, està dedicat a experiments que po sen en relleu la solubilitat del CO2 en aigua o en com aconseguir introduir aquest gas dins d’una bombolla. Proposa experimentar l’efecte de la temperatura i l’addició de sals dissoltes a l’aigua en la solubilitat dels gasos. Acaba amb qüestions i explicacions entorn de la solubilitat, l’equilibri, l’atzar, l’espontaneïtat dels processos i l’entropia.
El quart bloc d’experiments, capítol 5 del llibre, porta per títol l’acidesa del CO2. Descriu la preparació d’indicadors casolans d’origen vegetal i proposa, entre d’altres, experiments per constatar que el CO2 es dis sol en les solucions bàsiques com una solució de bi carbonat, que ataca lentament alguns metalls com el ferro i que és capaç d’actuar com a creador i destruc tor de roca, formant carbonat de calci o dissolent car bonat de calci.
El bloc anomenat foc i CO2 presenta experiments que ens porten a interpretar què és una flama, com funciona una brasa, i a raonar el perquè dels diferents colors dels estels, i de les combustions en els proces sos del metabolisme dels éssers vius. Proposa predir les calories dels aliments i l’efecte de dormir en una habitació tancada, i també dur a terme reaccions amb l’aigua de calç, un bon indicador de presència de CO2, per identificar-lo en la combustió d’una espelma, en la fermentació del most o en el propi alè.
No és menys interessant el sisè bloc d’experi ments, dedicat a la calor radiant i el CO2, en el qual els primers experiments evidencien fenòmens de transferència de calor i la capacitat del CO2 per ab sorbir la radiació calorífica. També conté unes expli cacions sobre l’espectroscòpia d’infraroig, la radiació calorífica a l’atmosfera i les vibracions a les molècu les de CO2
El darrer bloc d’experiments, capítol 8 del llibre, està dedicat al CO 2 en el món vegetal. Presenta un recull d’experiments sobre la influència de la llum en el creixement de les plantes, i l’obtenció d’evidèn cies sobre la necessitat del CO2 per al seu creixe ment, i la producció d’oxigen en la fotosíntesi. Entre d’altres, proposa investigar les cendres de vegetals, i extraure la clorofil·la de les fulles i detectar la seva fluorescència.
L’autor del llibre, Francesc Molins, ha estat profes sor de química i de física a Ulm, Oxford i Würzburg. És un físic-químic que adreça el llibre a la gent jove i cer ca desvetllar el seu interès pel món natural. Conside rem que el llibre presenta idees i recursos que poden ser útils i inspiradors per al professorat.
Fina Guitart Coeditora de la revista Educació Química EduQ
ISSN 2013-1755, SCQ-IEC Educació Química EduQ número 28 (2021), p. 60 60
RESSENYES DE LLIBRES
aureli caaMaño / (coord.)
Enseñar química. De las sustancias a la reacción química Barcelona: Graó, 2020
La característica más distintiva de la educación científica es que, en una exten sión no compartida con ningún otro campo creativo o del saber, se transmite a través de los libros de texto escritos especialmente para los estudiantes.
Cada libro que busca ser utilizado en un determinado curso compite, ya sea en profundidad o en detalles pedagógicos, pero prácticamente nunca en estructura conceptual... Los libros de texto no abordan los problemas que los científicos profesio-
El llibre, coordinat pel professor Aureli Caamaño i pu blicat per l’editorial Graó, està integrat per una intro ducció inèdita sobre l’estructura conceptual de la quí mica i el seu ensenyament i cinc capítols en què s’incorporen vint-i-nou textos prèviament publicats en cinc monogràfics d’Alambique. Els títols s’indiquen a continuació: 1) Substància química. Un concepte bà sic del currículum de química 2) La teoria atomicomo lecular de la matèria: fonament de la química 3) Inda gar sobre les reaccions químiques en contextos quotidians 4) Modelitzar l’àtom en l’educació secun dària i 5) Enllaç químic i estructura: el repte d’integrar els diferents nivells estructurals.
El llibre proposa, contra el que indica Kuhn a l’epí graf, una estructura conceptual diferent. Ho diu el ma teix coordinador quan indica a la introducció:
«[...] la estructura conceptual de la química obliga a arti cular los contenidos de los currículos de química desde la doble perspectiva de la conceptualización macroscópica y submicroscópica, y su enseñanza y aprendizaje requie re hacer uso de formas representacionales que implican el uso de un lenguaje icónico, gráfico y simbólico.»

Aquesta «declaració de principis» vertebra la resta del llibre. Sense fronteres excloents el primer i el tercer capítols apel·len al món macroscòpic, a la vida quoti diana i als experiments. Els seus noms són els que identifiquen el títol del llibre. El capítol 1 tracta de les substàncies químiques, mentre que el capítol 3 tracta sobre les reaccions químiques. És clar que l’ensenya ment de la química ha de realitzar-se a través d’expe
nales enfrentan o la variedad de técnicas que la experiencia les ha mostrado que son capaces de utilizar para resolverlos.
En su lugar, los libros de texto exhiben una colección de problemas-solución que los científicos profesionales han aceptado como paradigmáticos, pidiéndosele a los alumnos que, ya sea con lápiz y papel o en el laboratorio, los resuelvan utilizando los métodos y/o sustancias que han mostrado con anterioridad en sus páginas.
T. Kuhn (1963, p. 350-351)
riments, ja sigui en laboratoris o en cuines, però enca ra és més clar que l’experiment és insubstituïble i ha d’assumir-se com a extraordinari. Ja en una monogra fia per a l’Organización de Estados Americanos en el llunyà 1969, el distingit professor espanyol Francisco Giral, refugiat a Mèxic el 1939, indicava:
«Si los profesores engañan a los alumnos enseñándoles en teoría lo que no se puede hacer en la práctica, si los alumnos engañan a los profesores demostrando perfec tamente cálculos teóricos sin poder llevar a la práctica las reacciones, si las autoridades docentes engañan a los dirigentes de la sociedad cumpliendo con una enseñanza teórica barata sin poder gastar lo que hace falta para una enseñanza práctica, si los administradores públicos en gañan a los encargados de dar enseñanza exigiendo que sea barata sin aportar los recursos adecuados, entonces, todo lo anterior y todo lo demás sobra. En cuanto a la enseñanza de la química, el engaño mayor en que se pue de incurrir es el de creer que se puede aprender química en el pizarrón o en el papel sin la experimentación co rrespondiente. Mientras no se tenga una conciencia clara, por parte de todos, de que la química se aprende mane jando experimentalmente las sustancias químicas será muy difícil progresar en serio. Esa manipulación experi mental debe ir combinada con el estudio teórico en la mayor armonía posible, y debe quedar perfectamente claro, sin que ninguno nos llamemos a engaño, que sólo con lecciones teóricas no se puede enseñar química.»
La claredat de la diferència entre el món material i el món de les idees, que tan vehementment defensa Gi ral, és i ha estat fonamental en l’ensenyament de la
p. 61-62
61
ISSN 2013-1755, SCQ-IEC Educació Química EduQ número 28 (2021),
química. En l’era del coronavirus, on la vida en les pantalles ocupa i ocuparà més temps en els joves, pre cisar la diferència entre els dos mons és imprescindi ble. Tal com van indicar els químics-pedagogs-filòsofshistoriadors G. Bachelard i W. Jensen en les dècades dels anys setanta al noranta, Caamaño apunta, en la introducció del llibre, sobre «el grau de realitat ontolò gica dels conceptes», un assumpte que potser hauria pogut quedar més clar en la construcció del text en si.
Ha estat decisió del coordinador encarar el lector després de cada un dels capítols «macroscòpics», l’1 i el 3, amb un altre i amb altres que cerquen modelitzar el nostre món quotidià. En el capítol 2 això es fa amb l’omnipresent teoria atomicomolecular, que aquí tam bé podria ser corpuscular. Sobre corpuscles, àtoms i molècules s’ha reconegut que el seu millor aprenen tatge requereix una aproximació històrica (Chamizo & Garritz, 2014). Finalment, els capítols 4 i 5 tracten dels models dels àtoms i de les molècules i les estructures gegants. Una altra seqüència d’aquests mateixos capí tols podria haver concretat d’una manera més con tundent la premissa de la doble perspectiva que s’anunciava a la introducció.
El currículum en la seva totalitat és una concre ció d’un projecte cultural que es desenvolupa en un context institucional específic i que es modifica indi
vidualment i col·lectivament com a conseqüència del treball quotidià a les aules i els laboratoris (Cha mizo & Pérez, 2017). És clar que per esperar tenir èxit amb una proposta curricular s’han d’atendre els di versos nivells i/o actors: objectius clars, instal lacions i materials educatius apropiats, professors ben capacitats i alumnes dedicats. I és aquí on la present obra és important, ja que presenta una in dispensable alternativa sobre l’ensenyament de la química que tot el professorat d’aquesta assignatura hauria de conèixer.
José Antonio Chamizo Universidad Nacional Autónoma de México
Referències
Chamizo, J. a.; Pérez, Y. (2017). «Sobre la enseñanza de las ciencias naturales». Revista Ibero-americana de Educación, núm. 74, p. 23-40.
Chamizo, J. a.; garriTz, A. (2014). «Historical teaching of molecular and atomic structure». A: maTThews, M. (ed.). International Handbook of research in History Phi losophy and Science Teaching. Dordrecht: Springer.
Kuhn, T. (1963). «The function of dogma in scientific research». A: Crombie, A. C. (ed.). Scientific Change Londres: Heineman.
In memoriam
A Gisela Hernández, con cariño y admiración
El pasado 17 de febrero falleció en Ciudad de Méxi co nuestra colega y amiga Gisela Hernández Milán por causa del Covid-19. Gisela fue profesora titular de la Facultad de Química de la Universidad Autónoma de México por más de cuarenta años y subdirectora de la revista Educación Química desde sus inicios. Formó par te del Consejo Asesor de la revista Educació Química EduQ desde sus orígenes y fue coautora de algunos ar tículos publicados en la revista. También formó parte del Consejo Asesor de las revistas Alambique y Química Nova na Escola. Fue presidenta de la Academia Mexica na de Profesores de Ciencias Naturales de octubre de 1996 a octubre de 2002, en cuyo marco organizó dos convenciones nacionales.
En los últimos veinte años participó en programas de actualización y formación de profesores de nivel bachillerato y licenciatura de la República de México, con énfasis en la didáctica de la química, y escribió libros de texto y de laboratorio para el nivel secunda rio y superior. También publicó un gran número de artículos sobre la enseñanza de la química. Durante el período 2016-2020 formó parte de los órganos so ciales de la Asociación Iberoamericana-CTS.
Todos sus amigos/as y colegas la recordaremos siempre con cariño y admiración.
Educació Química EduQ número 28 62
NORMES DE PUBLICACIÓ
Preparació dels manuscrits
Els articles han de fer referència a qualsevol dels temes de les seccions de la revista per a qualsevol nivell d’educació, des de primària fins a l’educació universitària. Han de ser inèdits i han d’estar escrits en català, tot i que també es publicaran arti cles en castellà, francès, portuguès, italià i anglès, si l’autoria és de persones de fora de l’àmbit de la llengua catalana.
Els treballs han de tenir una extensió màxima de 25.000 ca ràcters sense espais i han de ser escrits amb un espaiat d’1,5 i han de tenir el nombre de caràcters amb espais especificat en cadascuna de les seccions de la revista. El text ha d’estar en format Microsoft Word i lletra Times New Roman de cos 12.
La primera pàgina ha de contenir el títol del treball, el nom o noms dels autors i el centre o centres de treball, un resum de 500 caràcters (incloent-hi espais) i cinc paraules clau. El títol, el resum i les paraules clau han d’anar seguits de la seva versió en anglès. Cal enviar també l’adreça postal dels autors o la del centre de treball per poder enviar-los el número de la revista en què han participat.
Els articles han d’anar acompanyats de fotografies i imatges en color que il·lustrin el contingut del text. L’article haurà de contenir fotografies en color del treball a l’aula, dels muntatges dels experiments o altres fotografies relacionades amb el con tingut. També han de contenir gràfics, esquemes, dibuixos i tre balls o produccions dels alumnes que il·lustrin i facin més comprensible el contingut del text. Les il·lustracions han de portar títol (peu d’imatge) i cal indicar on cal situar-les dins l’article. Les fotografies i imatges s’han d’enviar en arxius sepa rats en format .tif o .jpeg (resolució mínima: 300 píxels/pol zada) i, si es tracta de gràfics, en Excel o Corel Draw.
L’article ha d’estar estructurat en diferents apartats. Els au tors han de seguir les normes recomanades per la IUPAC a l’hora d’anomenar els composts químics i utilitzar el sistema internacional d’unitats. És convenient el fet d’assenyalar 3 o 4 frases de l’article que es destacaran amb una lletra més gran i de color en l’article maquetat
Les referències bibliogràfiques han d’anar al final del text, es crites com els exemples següents: Per a llibres: VILCHES, A.; GIL, D. (2003). Construyamos un futuro sostenible: Diálo gos de supervivencia. Madrid: Cambridge University Press. Citació en el text: (Viches i Gil, 1994).
Per a articles: SARDÀ, A.; SANMARTÍ, N. (2000). «Ensenyar a argumentar científi cament: un repte de les classes de ciències». Enseñanza de las Ciencias, vol. 18, núm. 3, p. 405-422. Citació en el text: (Sardà i Sanmartí, 2000).
Per a documents digitals (webs): OCDE (2006). PISA 2006 [en línia]: Marco de la evaluación. Conoci mientos y habilidades en Ciencias, Matemáticas y Lectura. París: OCDE. <http://www.oecd.org/dataoecd/59/2/39732471.pdf>
[Consulta: 11 setembre 2013].
Per a altres exemples, consulteu un número recent de la re vista.
Al final de l’article ha de constar una breu ressenya profes sional i una fotografia de les persones autores de l’article. Cada ressenya ha de contenir el nom i cognoms, càrrec, centre de treball, camp principal en el qual desenvolupa la seva tasca i correu electrònic (màxim de 400 caràcters amb espais). Cal en viar els arxius de les fotografies de carnet dels autors en format .tif o .jpeg (resolució mínima: 300 píxels/polzada). Enviament d’articles
Els articles han de ser enviats per correu electrònic a l’adreça següent: EduQ@iec.cat Revisió dels articles
Els articles seran revisats per tres experts. Els articles re visats i enviats als autors hauran de ser retornats als edi tors en el termini màxim de 10 dies. Sempre que sigui possible, les proves de maquetació seran enviades als autors abans de la seva publicació.
SECCIONS
ACTUALITZACIÓ
DE CONTINGUTS
Articles que revisen i posen al dia continguts propis de la disciplina o en relació amb altres àmbits del coneixement, i que faciliten i promouen un ensenyament actualitzat de la química.
APRENENTATGE DE CONCEPTES I MODELS
Articles que tracten sobre conceptes i models químics, des del punt de vista de les concepcions alternatives dels alumnes i les dificultats d’a prenentatge conceptuals, així com les estratègies didàctiques per a l’ela boració i l’aplicació dels models químics a l’aula.
CURRÍCULUM, PROJECTES I UNITATS
Presentació i anàlisi dels currículums de química de diferents països, de projectes curriculars i unitats i seqüències didàctiques.
DIVULGACIÓ DE LA QUÍMICA
Articles que presenten temes d’actualitat química amb caràcter divulga tiu i que posen de manifest les relacions de la química amb la societat i altres àmbits del coneixement o bé presenten activitats i experiències de caràcter divulgatiu de la química adreçades a l’alumnat o al públic en general.
ESTRATÈGIES DIDÀCTIQUES
Presentació i anàlisi d’enfocaments i estratègies didàctiques per a l’ense nyament i l’aprenentatge de la química: modelització, indagació, resolu ció de problemes, treball cooperatiu, avaluació, etc.
FORMACIÓ DEL PROFESSORAT
Propostes i investigacions sobre la formació inicial i en actiu del profes sorat de química i ciències en general que contribueixin al seu desenvo lupament professional.
HISTÒRIA I NATURALESA DE LA QUÍMICA
Articles sobre la història i la naturalesa de la química i sobre l’interès di dàctic d’aquestes disciplines en l’ensenyament de la química. Activitats per treballar aspectes de la naturalesa de la ciència.
INNOVACIÓ A L’AULA
Articles que descriuen la planificació i l’experimentació a l’aula d’expe riències didàctiques de caràcter innovador. La secció pretén ser un espai per compartir experiències d’aula.
LLENGUATGE, TERMINOLOGIA I COMUNICACIÓ
Articles relacionats amb l’aprenentatge de les habilitats comunicatives (llegir, escriure i parlar) en relació amb l’aprenentatge de la química. I també sobre el llenguatge i la terminologia científics.
NOVES TECNOLOGIES
Articles relacionats amb la utilització de les noves tecnologies en l’ense nyament de la química: simulacions, ús d’Internet, mitjans audiovisuals, laboratoris virtuals, experiències amb equips de captació de dades, etc.
QUÍMICA EN CONTEXT
Articles que presenten contextos rellevants –de la vida quotidiana, tec nològics, industrials, socials, mediambientals, de salut o culturals– que puguin ser presos com a punt de partida per a un ensenyament de la química en context i per promoure l’alfabetització científica.
QUÍMICA, EDUCACIÓ AMBIENTAL I SOSTENIBILITAT
Articles que facin palesa l’estreta relació entre la química i els aspec tes del medi ambient, i temàtiques mediambientals d’actualitat des d’una vessant química, així com propostes educatives per a la sosteni bilitat.
RECERCA EN DIDÀCTICA DE LA QUÍMICA
Articles que difonguin investigacions didàctiques d’utilitat per a la mi llora de l’ensenyament de la química. Descripció i resultats d’experièn cies didàctiques que hagin estat avaluades de forma qualitativa o quantitativa.
RECURSOS DIDÀCTICS
Articles que presentin qualsevol tipus de recurs i material didàctic per a l’ensenyament de la química. Poden incloure, entre d’altres, audiovi suals, jocs, visites, textos dels mitjans de comunicació, etc.
TREBALL EXPERIMENTAL
Articles sobre diferents tipus de treballs pràctics experimentals: demos tracions, experiències interpretatives, aprenentatge de tècniques, inves tigacions, etc.
TREBALLS DE RECERCA DELS ALUMNES
Articles descriptius de treballs de recerca dels alumnes dins l’àmbit de la química. En aquesta secció, els alumnes són els autèntics protago nistes.
Properes monografies
Filosofia de la química 30 números d’EduQ




 Societat Catalana de Química - Filial de l’Institut d’Estudis Catalans
Societat Catalana de Química - Filial de l’Institut d’Estudis Catalans

































 Raúl Orduña Picón Candidato a doctor en investiga
Eduardo Fleury Mortimer
Raúl Orduña Picón Candidato a doctor en investiga
Eduardo Fleury Mortimer



















 Figura 6. Demostració de flames de colors (font: pròpia).
Figura 6. Demostració de flames de colors (font: pròpia).