ГДЗ Хімія 10 клас Григорович 2023 (2018) Параграфи §1 – 19 (ст. 1 - 118) shkola.in.ua
§ 1. Повторення початкових понять про органічні речовини Контрольні запитання
1. Назвіть спільні властивості органічних речовин. Основні спільні властивості органічних речовин включають: Склад елементів: Органічні речовини складаються переважно з атомів вуглецю (С) та водню (H). Деякі органічні сполуки можуть містити також атоми кисню (O), азоту (N), фосфору (P), сірки (S) та інших елементів. Ковалентні зв'язки: Між атомами у молекулах органічних сполук переважно
формуються ковалентні зв'язки. Ковалентний зв'язок є дуже міцним і відповідає за стабільність молекул.
Ненасиченість: Деякі органічні сполуки можуть мати подвійні або потрійні зв'язки між атомами вуглецю, що робить їх ненасиченими вуглеводнями. Це призводить до більшої хімічної активності та реакційної здатності. Молекулярна різноманітність: Органічні речовини можуть утворювати велику кількість різноманітних молекул, оскільки атоми вуглецю можуть з'єднуватися в ланцюги, кільця та інші складні структури.
Горючість: Більшість органічних речовин є горючими і можуть згорати у наявності кисню з утворенням води, вуглекислого газу і тепла. Хімічна реактивність: Органічні речовини можуть брати участь у різних хімічних реакціях, включаючи синтез, гідроліз, окиснення, естерифікацію та інші.
2. Які вуглеводні називають насиченими, а які — ненасиченими? Наведіть приклади.
вуглеводні, які містять тільки одинарні зв'язки між атомами вуглецю, називаються насиченими вуглеводними. Такі сполуки мають максимальну кількість атомів водню, яка може бути приєднана до атомів вуглецю відповідно до їхньої валентності. Приклад насиченого вуглеводню: Метан (CH4) - це найпростіший насичений вуглеводень, який складається з одного атома вуглецю та чотирьох атомів водню. Вуглеводні, які містять подвійні або потрійні зв'язки між атомами вуглецю, називаються ненасиченими вуглеводнями. Ці сполуки мають меншу кількість атомів водню порівняно з насиченими вуглеводнями. Приклади ненасичених вуглеводнів: Етен (етилен) (C2H4) - містить подвійний зв'язок між двома атомами вуглецю. Етин (ацетилен) (C2H2) - містить потрійний зв'язок між двома атомами вуглецю.
3. Як змінюються температури плавлення й кипіння алканів зі збільшенням числа атомів Карбону в молекулі? Поясніть чому.
Температури плавлення і кипіння алканів збільшуються зі збільшенням числа атомів вуглецю в молекулі. Це пов'язано зі зміною молекулярної маси і збільшенням взаємодії між молекулами, що впливає на стан речовини.
shkola.in.ua
Існує кілька факторів, які впливають на температури плавлення і кипіння алканів зі збільшенням числа атомів вуглецю: Молекулярна маса: Зі збільшенням кількості атомів вуглецю в молекулі зростає
молекулярна маса алканів. Молекулярна маса має прямий вплив на міжмолекулярні сили, такі як ван-дер-Ваальсові сили, які виникають між молекулами. Поверхнева площа: Зі збільшенням числа атомів вуглецю збільшується і поверхнева площа молекули. Більша поверхнева площа може спричинити більше контактів між молекулами, що збільшує силу притягання між ними.
Взаємодія між молекулами: Зі збільшенням числа атомів вуглецю збільшується складність молекули, і це може призвести до більш сильної взаємодії між молекулами. Більші молекули можуть мати більше точок контакту, де взаємодіють міжмолекулярні сили.
Таким чином, зі збільшенням числа атомів вуглецю в молекулі алканів, збільшується молекулярна маса, поверхнева площа та взаємодія між молекулами, що призводить до підвищення температур плавлення і кипіння. Ця тенденція помітна в багатьох
гомологічних рядах алканів, де температури збільшуються зі зростанням кількості
атомів вуглецю у молекулах.
4. Схарактеризуйте фізичні властивості й застосування перелічених у параграфі сполук.
Етен використовують для добування інших цінних продуктів хімічної промисловості: по- ліетилену, вибухових речовин, антифризів, етанолу тощо.
Етин використовують в ацетиленових паль- никах, а також для добування синтетичного каучуку, лакофарбових матеріалів, синтетич- них барвників, етанової кислоти тощо. У побуті використовують не чистий етанол, а спиртовмісні засоби: рідини для миття вікон, склоочисні рідини, антифризи для авто- мобілів, лосьйони, парфуми тощо. Метанол у побуті взагалі не використовують через його отруйність. Застосування гліцеролу насамперед ґрунту- ється на його гігроскопічності. Завдяки їй він пом’якшує шкіру, що використовують у шкіряному виробництві та для виготовлення косметичних засобів. Гліцерол додають до кондитерських виробів, щоб вони довше не черствіли, та до газованих напоїв як підсо- лоджувач. Через в’язкість та низьку темпе- ратуру плавлення гліцерол використовують для виготовлення гальмівних рідин та анти- фризів.
Розбавлену етанову кислоту використовують у харчовій промисловості та побуті (столовий оцет). Концентрований розчин та безводну кислоту використовують у промисловості для виготовлення штучних волокон, лікарських препаратів, синтетичних барвників тощо.
Завдання для засвоєння матеріалу
5. Складіть повні й скорочені структурні формули пентану та гексану.
Пентан (C5H12) та гексан (C6H14) - це алкани з п'ятьма і шістьма атомами вуглецю відповідно.
Повна структурна формула пентану: CH3 - CH2 - CH2 - CH2 - CH3 Повна структурна формула гексану: CH3 - CH2 - CH2 - CH2 - CH2 - CH3 Скорочена структурна формула пентану: CH3(CH2)3CH3 Скорочена структурна формула гексану: CH3(CH2)4CH3
У скороченій формулі кожний молекулярний фрагмент (група CH2) повторюється в дужках зі змінною кількістю повторень вздовж ланцюга. Такі формули є зручними для представлення довгих вуглеводневих ланцюгів в більш компактному вигляді.
6. Які хімічні властивості характерні для метану, етену, етину, етанолу та
етанової кислоти? Відповідь підтвердьте рівняннями реакцій.
shkola.in.ua
Метан (CH4):
Горіння: CH4 + 2O2 → CO2 + 2H2O
Гідроліз: CH4 + H2O → CO + 3H2
Хлорування: CH4 + Cl2 → CH3Cl + HCl
Етен (етилен) (C2H4):
Горіння: C2H4 + 3O2 → 2CO2 + 2H2O
Аддиція галогенів (хлору чи брому): C2H4 + X2 (X = Cl, Br) → CH2XCH2X (X = Cl, Br)
Полімеризація: (C2H4)n → (-CH2-CH2-)n
Етин (ацетилен) (C2H2):
Горіння: 2C2H2 + 5O2 → 4CO2 + 2H2O
Гідратція: C2H2 + H2O → C2H4 + CO
Додавання галогенів (хлору чи брому): C2H2 + X2 (X = Cl, Br) → C2H2X2 (X = Cl, Br)
Етанол (C2H5OH):
Горіння: C2H5OH + 3O2 → 2CO2 + 3H2O
Окиснення: C2H5OH + 2[O] → CH3CHO + H2O
Етерифікація: C2H5OH + CH3COOH → CH3COOC2H5 + H2O
Етанова кислота (CH3COOH):
Нейтралізація з лугами: CH3COOH + NaOH → CH3COONa + H2O
Естерифікація: CH3COOH + C2H5OH → CH3COOC2H5 + H2O
Гідроліз естерів: CH3COOC2H5 + H2O → CH3COOH + C2H5OH
Комплексні завдання
7. Обчисліть відносну густину за повітрям метану, етану, етену, етину та
випарів етанолу. У якого із цих газів густина менша за повітря, а в якого більша?
Для обчислення відносної густини за повітрям використовується формула: Відносна густина = Густина газу / Густина повітря
Mr(CH4) = Ar (C)+4Ar(H)=12+4*1=16
Mr (повітря)=29
D повітря (CH4)=Mr(C2H4)/Mr повітря=16/29=0,55;
Mr(C2H6)=30
D повітря(C2H6)=30/29=1,03;
Mr(C2H4)=28
D повітря(С2Н6)=0.98;
Mr(C2H2)=26
D повітря(С2Н2)=0,87;
Mr(C2H5OH)=46
D повітря(C2H5OH)=1,58.
Густина сухого повітря=0.622.
З отриманих значень можна зробити такі висновки:
Гази з відносною густиною менше 1 (менша за густину повітря) будуть підійматися
повітрі. У цьому випадку це метан та випари етанолу. Гази з відносною густиною більше 1 (більша за густину повітря) будуть опускатися у повітрі. У цьому випадку це етан, етен та етин.
8. Складіть рівняння реакції повного згоряння пропану. Який об’єм кис- ню необхідний для спалювання пропану об’ємом 5,6 л (н.у.)? Який об’єм вуглекислого газу при цьому утвориться?
shkola.in.ua
Рівняння реакції повного згоряння пропану (C3H8) з киснем (O2) має вигляд: C3H8 + 5O2 → 3CO2 + 4H2O За цим рівнянням видно, що одна молекула пропану (C3H8) спалюється з п'ятьма молекулами кисню (O2).
Для знаходження об'єму кисню, необхідного для спалювання 5,6 л пропану, ми спочатку визначимо кількість молей пропану, що присутня в 5,6 л при нормальних умовах (н.у.), а потім знаходимо кількість молей кисню, необхідного для повного згоряння цієї кількості пропану.
Знаємо, що 1 моль будь-якого газу займає 22,7 л при н.у.
у
1 моль пропану (C3H8) займає 22,7 л при н.у. Тому, для знаходження кількості молей пропану (C3H8) в 5,6 використаємо пропорцію: 5,6 л : 22,7 л = х моль : 1 моль
х = 5,6 л * (1 моль / 22,7 л) ≈ 0,246 моль Тепер, оскільки між пропаном та киснем в реакції 1:5, необхідна кількість кисню (O2)
для згоряння 0,246 моль пропану: Кількість кисню = 0,246 моль * 5 = 1,23 моль Тепер ми знаємо, що для спалювання 5,6 л пропану необхідно 1,23 моль кисню. Для знаходження об'єму вуглекислого газу (CO2), що утвориться, використаємо знову пропорцію:
1,23 моль CO2 утворюється при повному згорянні 0,246 моль пропану
х моль CO2 утвориться при повному згорянні 5,6 л пропану
х = 1,23 моль * (5,6 л / 0,246 моль) ≈ 28 л Таким чином, утвориться близько 28 л вуглекислого газу при повному згорянні 5,6 л пропану при нормальних умовах.
9. Обчисліть об’єм етину (н. у.), необхідний для знебарвлення бромної води масою 200 г, в якій масова частка брому становить 2 %.
V(C₂H₂) = 280 мл.
C₂H₂ + 2Br₂ ⟹ C₂H₂Br₄
m(Br₂) = 0,02 · 200 г = 4 г
n(Br₂) = 4 г / 160 г/моль = 0,025 моль
n(C₂H₂) = 0,5 · 0,025 моль = 0,0125 моль
V(C₂H₂) = 0,0125 моль · 22,4 л/моль = 0,28 л = 280 мл.
V(C₂H₂) = 280 мл - Це об'єм етину (C₂H₂), який потрібно
використовувати для
знебарвлення бромної води, і він становить 280 мл або 0.28 л.
C₂H₂ + 2Br₂ ⟹ C₂H₂Br₄ - Це хімічне рівняння реакції між етином (C₂H₂) та бромом (Br₂), де етин реагує з двома молекулами брому, утворюючи тетраброметан (C₂H₂Br₄).
m(Br₂) = 0,02 · 200 г = 4 г - Це розрахунок маси брому (Br₂) в бромній воді, який виходить як 4 г, знаючи, що масова частка брому становить 2% від маси бромної води.
n(Br₂) = 4 г / 160 г/моль = 0,025 моль - Це розрахунок кількості молей брому (Br₂) в бромній воді, використовуючи його молекулярну масу (160 г/моль). n(C₂H₂) = 0,5 · 0,025 моль = 0,0125 моль - Це розрахунок кількості молей етину (C₂H₂), яка потрібна для реакції з бромом. Оскільки в реакції масове відношення між етином і бромом 1:2, то кількість молей етину дорівнює половині кількості молей брому.
shkola.in.ua
V(C₂H₂) = 0,0125 моль · 22,4 л/моль = 0,28 л = 280 мл - Це розрахунок об'єму етину (C₂H₂) за нормальних умов (н.у.), який потрібно використовувати для реакції з бромом. Використовуючи ідеальний газовий закон (V = nRT/P), де n - кількість молей, Rуніверсальна газова стала, T - температура і P - тиск, знаходимо об'єм етину. Завдання з розвитку критичного мислення 10. Проаналізуйте молекулярні формули перших представників ряду алканів та сформулюйте визначення таких понять: гомологічний ряд, го- мологи, гомологічна різниця. Гомологічний ряд - це ряд органічних сполук, у якому кожна сполучена молекула містить однакову функціональну групу та відрізняється від попередньої або наступної сполученої молекули на один гідрофобний (CH2) блок. У випадку алканів, гомологічний ряд включає різні члени, де кожен наступний член відрізняється від попереднього на CH2 групу.
Гомологи - це сполуки, які належать до одного гомологічного ряду. У випадку алканів, гомологами є сполуки, які мають однакову функціональну групу (в даному випадкуодиничний зв'язок між атомами вуглецю) та відрізняються від інших гомологів на один CH2 блок.
Гомологічна різниця - це різниця в масі між двома послідовними гомологами в гомологічному ряді. У випадку алканів, гомологічна різниця становить масу гідрофобного блоку CH2. Наприклад, у гомологічному ряду алканів гомологічна різниця між послідовними членами становить 14 г/моль (маса CH2). 11. Зобразіть структурну формулу бутану. На ній дужками позначте групу (або групи) атомів, що називають гомологічною різницею. Скільки та- ких груп у молекулі бутану?
Структурна формула бутану (C4H10) має вигляд:
молекулі бутану (C4H10) є дві групи атомів, що називають гомологічною різницею. Гомологічна різниця виникає між послідовними членами гомологічного ряду алканів, і в даному випадку, гомологічна різниця в структурі бутану - це масивний блок CH2, який можна виділити так: CH3
H - C - H
Таким чином, у молекулі бутану є дві групи атомів, що називають гомологічною різницею, і це CH2 блок, який повторюється між послідовними членами гомологічного ряду алканів.
shkola.in.ua
12. Що спільного та які існують відмінності у складі та будові молекул ета- нолу й етанової кислоти? Молекули етанолу (C2H5OH) і етанової кислоти (CH3COOH) мають спільний етановий (C2H4O) блок, що складається з двох атомів вуглецю і чотирьох атомів водню. Проте, існують деякі відмінності у їхньому складі та будові, а також у хімічних властивостях: Склад: Етанол (спирт) містить одну гідроксильну (-OH) групу і одну алкільну групу (етильний радикал), тобто в ньому є одна гідроксильна група. Етанова кислота (уксусна кислота) містить дві гідроксильні (-OH) групи і одну карбоксильну (-COOH) групу. Тобто в ньому є дві гідроксильні групи.
| H - C - H | C | H - C - H | H В
H
|
| C |
| H
H - C - H
Назва:
Етанол (C2H5OH) відомий як спирт або етиловий спирт. Етанова кислота (CH3COOH) відома як уксусна кислота.
Хімічні властивості:
Етанол має властивості спирту, він може використовуватись як розчинник, а також
вживається у харчовій промисловості та як напій.
Етанова кислота є слабкою органічною кислотою, вона має гострий запах та смак. Вона також використовується як розчинник, а також в харчовій промисловості та
приготуванні різноманітних страв.
Кислотні властивості:
Етанол має слабкі кислотні властивості, але в обмеженій кількості може утворювати етанольну кислоту (CH3COOH) під дією кислот або кислих оксидів. Етанова кислота, як і будь-яка інша карбонова кислота, має виражені кислотні властивості та утворює солі з основами.
§2. Теорія будови органічних сполук Контрольні запитання
13. Поясніть суть терміна «хімічна будова»: Хімічна будова відноситься до атомного і молекулярного складу речовини. Вона визначає, з яких елементів складаються атоми, як вони пов'язані між собою у молекулах та які взаємодії відбуваються між атомами і молекулами. Хімічна будова включає такі основні поняття:
1. Атоми: Якщо говорити про хімію, то атом - це основна одиниця будови речовини.
Кожен елемент має свій унікальний тип атома з визначеною кількістю протонів, нейтронів і електронів.
2. Молекули: Молекули складаються з атомів, з'єднаних хімічними зв'язками.
Молекули можуть бути складені з атомів одного типу (як у молекулі кисню O2) або з різних типів атомів (як у молекулі води H2O).
3. Хімічні зв'язки: З'єднання атомів у молекули здійснюється за допомогою хімічних зв'язків. Вони можуть бути ковалентними (коли атоми ділять електрони) або іонними (коли атоми обмінюються електронами).
4. Хімічні формули: Хімічна формула речовини показує склад і кількість атомів різних елементів у молекулі. Наприклад, хімічна формула води - H2O, що означає, що вона складається з двох атомів водню і одного атома кисню.
14. Перелічіть основні експериментальні й теоретичні передумови виникнення сучасної теорії будови органічних сполук: Сучасна теорія будови органічних сполук має свої коріння в експериментальних і теоретичних дослідженнях, які почалися в XIX столітті. Основні експериментальні й теоретичні передумови для виникнення сучасної теорії будови органічних сполук включають:
Експериментальні передумови:
shkola.in.ua
1. Синтез органічних сполук: В XIX столітті хіміки почали успішно синтезувати
органічні сполуки шляхом реакцій між неорганічними сполуками. Ці експерименти довели, що органічні сполуки не потребують "життєвої сили" для своєї формації, а їх можна отримати з неорганічних речовин.
2. Вивчення хімічних властивостей органічних сполук: Експериментальне вивчення властивостей органічних сполук, таких як відношення реактивності, здатність до
утворення похідних, властивості розчинення тощо, допомогло зрозуміти хімічну природу органічних речовин.
3. Вивчення структури органічних сполук: Застосування різноманітних аналітичних
методів, таких як спектроскопія, дозволило вивчати структуру органічних
молекул, що відіграло важливу роль у виробленні теоретичних пояснень для
спостережуваних властивостей.
Теоретичні передумови:
1. Теорія валентності: Теорія валентності, яка була розроблена в кінці XIX століття, допомогла пояснити те, як атоми утворюють хімічні зв'язки між собою. Вона надала підґрунтя для розуміння молекулярної структури органічних сполук.
2. Концепція спільних електронних пар: Ця концепція, розроблена Гілбертом
Льюїсом в 1916 році, пояснює утворення ковалентних зв'язків між атомами. Вона зробила величезний внесок у розумінні будови органічних молекул.
3. Механізм реакцій: Дослідження механізмів хімічних реакцій, які включають
утворення та розрив хімічних зв'язків в молекулах, дозволили зрозуміти, як відбуваються реакції між органічними сполуками.
4. Концепція функціональних груп: Визначення функціональних груп, які мають специфічні властивості та впливають на хімічну поведінку органічних сполук, стало основою для класифікації і розуміння великої кількості органічних сполук. 15. сформулюйте постулати теорії будови органічних сполук. Розкрийте їхнє значення для розуміння характеристик, властивостей та можливих закономірностей для органічних сполук.
Теорія будови органічних сполук включає декілька постулатів, які становлять основу для розуміння характеристик, властивостей та закономірностей органічних сполук. Основні постулати теорії будови органічних сполук наступні:
1. Постулат про валентність: Органічні молекули складаються з атомів, які формують хімічні зв'язки, дотримуючись принципу валентності. Кожен атом може утворити певну кількість зв'язків з іншими атомами, визначену його валентністю. Цей постулат допомагає зрозуміти, які атоми можуть утворювати зв'язки і яка кількість зв'язків може бути утворена.
2. Постулат про функціональні групи: Функціональні групи - це атоми або групи атомів, які мають специфічні хімічні властивості та функції. Вони визначають характеристики і поведінку молекул, що містять їх. Розпізнавання функціональних груп у молекулі дозволяє зрозуміти можливі реакції, які вона може пройти та її реактивність.
3. Постулат про строємні ізомери: Органічні сполуки можуть мати однакову хімічну формулу, але відрізнятися в просторовому розташуванні атомів. Це призводить до утворення строємних ізомерів - сполук, які мають різний будову, але однаковий хімічний склад. Цей постулат розкриває значення просторової структури молекул для їх хімічних властивостей.
shkola.in.ua
4. Постулат про хімічні реакції: Хімічні реакції органічних сполук базуються на розриві і формуванні хімічних зв'язків між атомами. Із знанням хімічної будови молекул та механізмів реакцій можна прогнозувати, які нові сполуки можуть утворитися під час реакцій та яким чином ці реакції будуть протікати.
16. Які вчені зробили внесок у становлення теорії хімічної будови? У становленні теорії хімічної будови органічних сполук зробили значний внесок багато вчених протягом століть. Ось декілька імен і внесок деяких вчених, які здійснили
важливі відкриття та відіграли важливу роль у розвитку теорії будови органічних
сполук:
1. Фрідріх Верле (1803-1882): Німецький хімік, який розвинув ідею тетраедричної
будови атомів у вуглецевих сполуках та ввів поняття хімічної валентності.
2. Александр Бутлеров (1828-1886): Російський хімік, який запропонував концепцію
ізомерії і вивчав реакції органічних сполук.
3. Дмитро Іванович Менделєєв (1834-1907): Російський хімік, відомий своєю
роботою з систематизації хімічних елементів у таблицю Менделєєва, що мало важливе значення для розвитку органічної хімії.
4. Еміль Фішер (1852-1919): Німецький хімік, який здійснив вагомий внесок у синтез органічних сполук та вивчення амінокислот.
5. Якобус Генрих ван 'т Гофт (1852-1911): Нідерландський хімік, який вивчав теплохімічні властивості органічних сполук і вніс вагомий внесок у теорію хімічних реакцій.
6. Лінус Полінг (1901-1994): Американський хімік, який здійснив важливі дослідження у галузі структури і взаємодії молекул органічних сполук, отримавши Нобелівську премію з хімії.
7. Роберт Каррот (1911-1973): Американський хімік, який досліджував хімічні зв'язки та структури органічних молекул, що стало основою для розвитку теорії валентності.
8. Річард Р. Ернест (1912-2005): Американський хімік, який розробив методи аналізу структури органічних сполук за допомогою спектроскопії та співавтор Тьюбінгенської хімічної бази даних.
9. Доротея Годдел (1926-2018): Американська хімік, яка розробила методи аналізу органічних сполук за допомогою ядерного магнітного резонансу (ЯМР).
17. Як за структурною формулою сполуки визначити валентність елементів у її складі?
За структурною формулою органічної сполуки можна визначити валентність елементів у її складі, спираючись на правила валентності та розміщення зарядів на атомах у молекулі. Основні кроки для визначення валентності елементів у складі сполуки:
1. Розгляньте структурну формулу сполуки: Структурна формула показує, які атоми містяться в молекулі і як вони пов'язані між собою. Зверніть увагу на типи хімічних зв'язків (ковалентні, іонні) між атомами.
2. З'ясуйте кількість атомів і їх тип: Підрахуйте, скільки атомів кожного типу (елемента) міститься в молекулі.
3. Визначте суму валентності всіх атомів: Для кожного атома врахуйте його валентність, що вказана в таблиці валентностей. Помножте кількість атомів кожного типу на їхні валентності і знайдіть суму.
4. Врахуйте наявність іонних зарядів: У деяких сполуках можуть присутні іонні заряди, що змінюють валентність атомів. У цьому випадку потрібно врахувати заряди атомів і відповідно коригувати їх валентності.
shkola.in.ua
5. Валентність - це ціле число: Зазвичай валентність елемента є цілим числом, оскільки вона показує, скільки зв'язків атом утворює з іншими атомами. Однак, у деяких випадках, особливо при взаємодії атомів перехідних металів або у спеціальних реакціях, валентність може бути нецілим числом.
18. Дайте визначення явища ізометрії. Які речовини називають ізомерами? Чи тільки в органічних сполук можуть бути ізомери?
Визначення ізомерії: Ізомерія - це явище, коли дві або більше речовин мають однаковий хімічний склад (тобто однакову молекулярну формулу) і різні хімічні та фізичні властивості через різний спосіб розташування атомів у молекулах. Ізомерами називаються речовини, які мають однаковий хімічний склад (тобто однакову
молекулярну формулу), але відрізняються в просторовому розташуванні атомів у молекулі. Це означає, що атоми можуть бути розташовані різним чином, утворюючи різні структури. Ні, ізомерія може виникати не тільки в органічних сполуках. Ізомерами можуть бути речовини з різних класів хімічних сполук. В органічній хімії ізомери дуже поширені через велику різноманітність зв'язків та структур, що можуть утворюватися між атомами вуглецю. Але ізомерія може відбуватися і в неорганічних сполуках, якщо вони містять різні просторові аранжування атомів. Завдання для засвоєння матеріалу
19. Знаючи валентності Карбону, Оксигену і Гідрогену, складіть структурну формулу будь-якої органічної сполуки, що містить атоми цих елементів. Давайте створимо структурну формулу для метану, органічної сполуки, яка містить атоми вуглецю, кисню і водню. Валентність атомів:
• Вуглець (С) має валентність 4.
• Оксиген (O) має валентність 2.
• Водень (H) має валентність 1. Структурна формула метану (CH4):


В метані вуглець (C) утворює чотири одиночних ковалентних зв'язки з атомами водню (H). Кисень (O) в цій сполуці не використовується, але його валентність дорівнює 2, що дає можливість утворити два ковалентних зв'язки. Таким чином, структурна формула метану показує, як атоми водню (H) зв'язані з вуглецем (C), утворюючи молекулу метану.
20. Для наведених карбонових ланцюгів складіть розгорнуту структурну формулу відповідного вуглеводню. Знайдіть серед них формули гомологів та ізомерів.
shkola.in.ua
Ізомери б), г) Гомологи б), е) а),г),д),є),ж)
C-C-C (Карбоновий ланцюг з трьома зв'язаними атомами вуглецю) Розгорнута структурна формула вуглеводню (алкану) для даного ланцюга:
Цей вуглеводень може бути представлений молекулою пропану (C3H8), яка є гомологом (належить до одного гомологічного ряду) ізомером етану. 2) С=С-С (Карбоновий ланцюг з двома зв'язаними атомами вуглецю і подвійним зв'язком) Розгорнута структурна формула вуглеводню (алкену) для даного ланцюга:
H H H
H - C = C – H

Цей вуглеводень може бути представлений молекулою пропену (C3H6), яка також є гомологом та ізомером пропану, але відрізняється наявністю подвійного зв'язку між вуглецевими атомами. Пропен та пропан - це два ізомери.
21. Порівняйте структурні формули двох молекул:
а) СН3-СН3 та СН3-СН2-СН3;
б) СН3-СН3 та СН3-СН2-ОН. Що в них спільного і в чому полягають
відмінності?
а) Порівняння молекул CH3-CH3 та CH3-CH2-CH3:
1. CH3-CH3 (етан): Це молекула етану, яка складається з двох атомів вуглецю, пов'язаних одинарним зв'язком. Кожен атом вуглецю має три атоми водню, які приєднані до нього.
H H

| | |
| | H - C - C - H | H shkola.in.ua
2. CH3-CH2-CH3 (пропан): Це молекула пропану, яка має три атоми вуглецю, пов'язаних одинарними зв'язками. Кожен атом вуглецю має три атоми водню, крім крайніх, які мають по два атоми водню.
H H H
H - C - C - C - H
Спільне: Обидві молекули містять тільки атоми вуглецю та водню. Кількість атомів кожного типу вуглецю та водню однакова в обох молекулах. Відмінності: Відмінність полягає у довжині карбонового ланцюга та кількості атомів вуглецю. В етані карбоновий ланцюг містить два атоми вуглецю, тоді як у пропані він містить три атоми вуглецю. Це призводить до різниці у вигляді та фізичних властивостях молекул. б) Порівняння молекул CH3-CH3 та CH3-CH2-OH:
1. CH3-CH3 (етан): Це та сама молекула етану, яку ми вже розглядали раніше.
2. CH3-CH2-OH (етанол або спирт): Це молекула етанолу, яка містить два атоми вуглецю, з'єднані одинарним зв'язком. Один атом водню приєднаний до другого атома вуглецю, а також є гідроксильна група (-OH), що приєднана до другого атома вуглецю.
H H H
|
H - C - C - O - H
| H H Спільне: Обидві молекули містять атоми вуглецю та водню. Вони мають однакову кількість атомів вуглецю і водню. Відмінності: Відмінність полягає в наявності гідроксильної групи (-OH) в молекулі етанолу. Ця група робить етанол розчинним у воді і надає йому хімічних та фізичних властивостей, які відрізняються від властивостей етану. 22. Зобразіть структурні формули всіх можливих карбонових ланцюгів, що складаються: а) з п’яти атомів Карбону; б) із шести атомів Карбону. Для карбонових ланцюгів, що складаються з п'яти атомів карбону, можливі дві основні структури: лінійна (акіклична) та циклічна (циклічна).
а) Лінійна (акіклична) структура:В лінійній структурі всі п'ять атомів карбону розташовані в одній ланцюжку.
H - C - C - C - C - H
б) Циклічна (циклічна) структура:У циклічній структурі атоми карбону утворюють кільце.
1. Закритий п'ятикутник (цикл з п'ятьма атомами вуглецю):
shkola.in.ua
2. Закритий чотирикутник та бічна група (-CH3):
| | |
| | H
H
|
|
|
H \ C / \ H C / H
3. Закритий чотирикутник та бічна група (-CH2-CH3): H H
4. Закритий трикутник та бічна група (-CH2-CH2-CH3):
Ці структурні формули представляють всі можливі карбонові ланцюги, які складаються з п'яти атомів карбону. Для карбонових ланцюгів, що складаються з шести атомів карбону, також можливі дві основні структури: лінійна (акіклична) та різні типи циклічних (циклічних) ланцюгів. б) Лінійна (акіклична) структура:В лінійній структурі всі шість атомів карбону розташовані в одній ланцюжку.
H - C - C - C - C - C - H
Циклічні (циклічні) структури:
1. Закритий шестикутник (цикл з шістьма атомами вуглецю):
2. Закритий п'ятикутник та бічна група (-CH3):
3. Закритий п'ятикутник та бічна група (-CH2-CH3):
H
\ \ C
H
--- C / H
\
\ C --- C \ H
\
H
C / \ H C \ H
H \ C / \ H C / C \ H
H \ C / \ H C / C \ H
shkola.in.ua
4. Закритий чотирикутник та дві бічні групи (-CH3): H H
5. Закритий чотирикутник та бічна група (-CH2-CH3): H H
6. Закритий трикутник та три бічні групи (-CH3): H \ C / \ H C \ C / H
Ці структурні формули представляють всі можливі карбонові ланцюги, які складаються з шести атомів карбону.
Завдання з розвитку критичного мислення
23. Як ви вважаєте, чому хімічне оточення атомів у молекулі може суттєво
впливати на реакційну здатність речовин? Як можна пояснити факт, описаний
у другому постулаті?
shkola.in.ua
Я вважаю, що хімічне оточення атомів у молекулі може суттєво впливати на реакційну здатність речовин через їх електронну структуру. У молекулах атоми займають певні енергетичні рівні, так звані орбіталі, які характеризують їх електронні конфігурації. Коли молекула вступає в реакцію, атоми можуть обмінюватись електронами або ділити їх, щоб утворити більш стабільну електронну конфігурацію. Факт, описаний у другому постулаті, стосується того, що атоми у молекулі займають визначені квантові стани (орбіталі) з визначеними енергіями. Це означає, що електрони
H \
/
C
\ H C / C / H
\ \ C C \ / C--C / H
\ \ C C \ / C--C / H
молекулі можуть знаходитись лише у певних енергетичних станах, а не будь-де. Під час реакції атоми можуть переходити з одного квантового стану на інший, але лише якщо зміни в енергії відповідають квантовим переходам. Це важливо для розуміння того, як реакції відбуваються на молекулярному рівні. Реакційна здатність речовин залежить від того, як легко атоми можуть переходити
одного електронного стану на інший під час реакції. Зміна електронних конфігурацій може призводити до утворення нових хімічних зв'язків, розриву старих зв'язків та утворення нових реакційних продуктів.
Таким чином, хімічне оточення атомів в молекулі грає важливу роль у реакційній
здатності речовин, оскільки впливає на їх електронну структуру та здатність
переходити з одного електронного стану на інший під час реакції.
24. Як ви вважаєте, чому властивості метану й етану подібні, а метану й метанолу суттєво відрізняються? Чи не суперечить це другому постулату?
Я вважаю, що властивості метану і етану подібні, тому що вони мають однаковий тип хімічного зв'язку між атомами вуглецю, а саме одинарний зв'язок C-C. Обидва молекули мають також насичені вуглеводневі ланцюги. Оскільки вони мають схожу будову, їх хімічні властивості в основному залежать від типу і кількості атомів, які несуть насичення (водень) та можуть піддаватись хімічним реакціям з іншими речовинами.
Проте, метан та метанол суттєво відрізняються у своїх властивостях, незважаючи на те, що обидва молекули складаються з одного атома вуглецю і зв'язаного з чотирма атомами водню. Головна причина цієї різниці полягає в наявності гідроксильної групи (-OH) у молекулі метанолу, яка відсутня у метані. Гідроксильна група робить метанол більш поларною молекулою порівняно з неполярним метаном. Таким чином, метанол має здатність до утворення водневих зв'язків і більше взаємодіє з іншими речовинами, що робить його більш реакційним порівняно з метаном. Метан же залишається менш реакційним через відсутність гідроксильної групи та меншу полярність.
Щодо другого постулату, цей факт не суперечить йому. Другий постулат говорить про квантові стани атомів у молекулі і можливість переходів між ними під час реакцій. В цьому контексті різниця у властивостях метану та метанолу може пояснюватись різницею в розподілі електронних зарядів та здатністю молекул переходити між квантовими станами в ході реакцій.
25. Як за допомогою методів аналізу і синтезу визначити хімічну будову речовини? Чи обов’язково завжди застосовувати обидва методи? Відповідь поясніть.
shkola.in.ua
За допомогою методів аналізу і синтезу можна визначити хімічну будову речовини. Метод аналізу використовується для розкриття складу речовини, тобто дізнатися, з яких елементів складається дана речовина і які пропорції між цими елементами. Один із таких методів - спектроскопія, де вивчається взаємодія речовини з різними типами випромінювання (наприклад, видимим світлом, ультрафіолетовим або інфрачервоним випромінюванням). Цей метод дозволяє ідентифікувати характерні паттерни або "підписи" речовини, що допомагають встановити хімічні зв'язки та склад молекул. Метод синтезу, натомість, полягає в створенні нових речовин шляхом контрольованої реакції між вихідними речовинами. Цей процес дозволяє зрозуміти, які зв'язки утворюються під час реакцій і яку хімічну структуру мають продукти реакцій.
в
з
Також, часто методи аналізу використовуються для перевірки чистоти і складу продуктів синтезу. Знання хімічної будови речовини дуже важливе для розуміння її властивостей, поведінки і використання у різних областях. Чи обов'язково застосовувати обидва методи? Ні, не завжди обов'язково застосовувати обидва методи. Вибір методу аналізу або синтезу залежить від конкретної задачі і мети дослідження. Наприклад, якщо нам потрібно з'ясувати, з яких елементів складається певна речовина, то буде використовуватись метод аналізу, такий як спектроскопія або хроматографія. А якщо ми хочемо отримати новий продукт або розробити новий матеріал, то ми будемо застосовувати метод синтезу. Однак, часто комбінація обох методів допомагає глибше зрозуміти хімічну природу речовини і дозволяє здійснити більш повний аналіз її властивостей та структури. Таким чином, використання методів аналізу і синтезу у поєднанні допомагає досягти більш глибокого розуміння хімії речовини. Міні-проекти
26. У додаткових джерелах інформації знайдіть відомості про історію становлення теорії будови органічних сполук. Як вплинула ця теорія на розвиток органічної хімії? Чи погоджуєтеся ви з твердженням, що вплив цієї теорії на розвиток органічної хімії можна порівняти з від-криттям Періодичного закону для розвитку науки взагалі? За допомогою додаткових джерел інформації, я дізнаюся, що історія органічної хімії розпочалася в давні часи з вивчення хімічних реакцій у живих організмах та сполук, які отримували з них. Перші органічні сполуки були вивчені у складі рослинних і тваринних організмів, і сам термін "органічна хімія" походить з початкової ідеї, що ці сполуки пов'язані з організмами живої природи. Проте, у XVIII-XIX століттях були відкриті деякі неорганічні сполуки, які були схожими з органічними, що привело до появи думки про "вітрильну теорію" - твердження, що органічні сполуки можуть формуватися тільки в живих організмах. Однак у XIX столітті були проведені експерименти, які спростували вітрильну теорію. Провідними ученими того часу, такими як Фрідріх Веллер, Егберт Кантенс, Жерар і Колін-Жозеф Берцеліус, були зроблені важливі відкриття щодо хімічної будови органічних сполук. Наприклад, у 1828 році Веллер синтезував мочовину з неорганічних сполук, демонструючи, що органічні сполуки можуть бути синтезовані штучно. Ці відкриття спричинили розвиток нової теорії будови органічних сполук, яка була заснована на концепції валентності та теорії зв'язку. Ця теорія дозволила краще розуміти будову молекул органічних сполук, включаючи зв'язки між атомами та їх властивості. З часом розвиток органічної хімії перейшов у нову фазу, включаючи дослідження функціональних груп та хімічні реакції, що їх впливають.
Вплив теорії будови органічних сполук на розвиток органічної хімії можна порівняти з відкриттям Періодичного закону для розвитку науки взагалі. Теорія будови органічних
shkola.in.ua
сполук стала основою для подальших досліджень і відкриттів у цій галузі хімії. Вона забезпечила уніфікацію знань та систематизацію інформації про будову молекул органічних сполук, що дозволило встановити закономірності та зробити передбачення стосовно їх властивостей та реакцій. Таким чином, теорія будови органічних сполук суттєво вплинула на розвиток органічної хімії, дозволяючи зробити великі прориви в дослідженні органічних сполук та розумінні їх хімічних властивостей. Вплив цієї теорії на розвиток органічної хімії можна порівняти з відкриттям Періодичного закону для розвитку науки взагалі,
оскільки обидва вони були ключовими проривами у своїх галузях, що змінили спосіб, яким хіміки та науковці розуміють світ. Відкриття Періодичного закону Дмитром Менделєєвим дало основу для організації хімічних елементів за зростанням їх атомних мас. Це спростувало безладність у хімічних властивостях елементів та дало систематичний підхід до розуміння зв'язку між ними. Таке класифікування елементів дозволило зрозуміти, що властивості елементів залежать від їх атомної структури, а не випадкові. Це сприяло розвитку хімії, привело до відкриття нових елементів і взагалі сильно вплинуло на розвиток наукового підходу до досліджень. Так само, теорія будови органічних сполук надала органічній хімії новий рівень зрозуміння. Ця теорія пояснила, як атоми вуглецю можуть утворювати різні типи зв'язків з іншими атомами та функціональними групами, що сприяло розумінню хімічних реакцій та структури органічних сполук. Вплив теорії будови органічних сполук на розвиток органічної хімії був фундаментальним, дозволив вивчати нові класи сполук, розробляти синтетичні методи та застосовувати їх у різних індустріальних галузях та медицині. Отже, обидва відкриття - Періодичний закон і теорія будови органічних сполуквеликою мірою сприяли розвитку хімії та науки загалом. Вони дали систематичність та логічний підхід до вивчення хімічних явищ, що дозволило зробити прориви в розумінні структури та властивостей речовин. Вплив цих теорій на розвиток органічної хімії та загального наукового підходу можна порівняти, оскільки обидва вони дали надзвичайно цінні знання, які використовуються і досліджуються досі, надаючи основу для подальшого розвитку науки. 27. У додаткових джерелах інформації знайдіть основні положення атомно-молекулярного вчення. Як ви вважаєте, яке значення має це вчен-ня для розвитку науки взагалі й органічної хімії зокрема? Атомно-молекулярне вчення є одним із фундаментальних принципів хімії і базується на ідеї, що речовина складається з найдрібніших одиниць - атомів і молекул. Основні положення атомно-молекулярного вчення включають:
1. Атом - найменша частинка речовини, яка має хімічні властивості того самого елементу.
2. Атоми одного елемента ідентичні за своїми хімічними властивостями, атоми різних елементів мають різні хімічні властивості.
3. Атоми можуть об'єднуватися у молекули, які представляють найменші частинки речовини з унікальними хімічними властивостями.
4. У хімічних реакціях атоми переносяться, розміщуються переформуванням зв'язків і створенням нових молекул. Атомно-молекулярне вчення має велике значення для розвитку науки взагалі та органічної хімії зокрема. Основні принципи атомно-молекулярного вчення дозволяють розуміти будову речовини на найдрібнішому рівні, що є фундаментальним для розуміння хімічних процесів та реакцій.
shkola.in.ua
В органічній хімії атомно-молекулярне вчення використовується для розуміння будови органічних сполук та їх хімічних властивостей. Воно допомагає вивчати молекулярні зв'язки, реакції та структуру органічних сполук, а також розвивати нові методи синтезу та аналізу. Відкриття та розвиток атомно-молекулярного вчення сильно вплинули на розвиток органічної хімії як окремої галузі науки. Крім того, атомно-молекулярне вчення має важливе значення для розвитку науки взагалі. Воно є фундаментом для інших наук, таких як фізика, біологія,
матеріалознавство, технології та багато інших галузей, де вивчається структура і взаємодія матерії на молекулярному рівні. Отже, атомно-молекулярне вчення є ключовим принципом хімії, яке допомагає розкрити та зрозуміти будову речовини на найдрібнішому рівні. Воно має велике значення для розвитку науки взагалі та органічної хімії зокрема, дозволяючи вивчати, прогнозувати і контролювати хімічні реакції, розробляти нові матеріали та технології для різних галузей науки і промисловості. 28. У додаткових джерелах знайдіть інформацію про застосування мето-дів аналізу і синтезу для ідентифікації речовин та визначення їхньої хімічної
будови.
Методи аналізу використовуються для визначення складу речовини, структури її молекул і властивостей. Ось деякі з них:
1. Спектроскопія: Це широкий клас методів, включаючи ЯМР (ядерний магнітний резонанс), ІЧ (інфрачервону спектроскопію), УФ-видиму спектроскопію та інші. Ці методи дозволяють визначити хімічні зв'язки, функціональні групи і молекулярні властивості речовин.
2. Хроматографія: Це метод розділення змішаних речовин на компоненти. Газова хроматографія, рідина-хроматографія та інші варіанти цього методу дозволяють ідентифікувати речовини за їх рухомими властивостями в стовпчиках або на паперовій стрічці.
3. Мас-спектрометрія: Цей метод дозволяє визначити масу окремих атомів і молекул, що допомагає встановити хімічні формули та склад речовин. З іншого боку, методи синтезу використовуються для створення нових речовин шляхом хімічних реакцій. Деякі з них включають:
1. Органічний синтез: Цей метод використовується для отримання органічних сполук, таких як ліки, пластики, хімічні реактиви та інші корисні речовини.
2. Неорганічний синтез: Цей метод застосовується для створення неорганічних сполук, таких як пігменти, кераміка та інші матеріали. Застосування методів аналізу і синтезу дуже важливе для хімії загалом. Вони допомагають зрозуміти хімічні властивості речовин, визначати їхню складну структуру і здійснювати контроль над хімічними реакціями. В органічній хімії ці методи особливо важливі, оскільки дозволяють вивчати будову та властивості органічних сполук, розробляти нові методи синтезу та аналізу, що має велике значення для медицини, промисловості та інших галузей науки. Таким чином, методи аналізу і синтезу є невід'ємною частиною розвитку науки, включаючи хімію, і допомагають зробити багато важливих відкриттів і розробок.
§3. Класифікація органічних сполук Контрольні запитання
29. За якими ознаками класифікують органічні сполуки? Органічні сполуки класифікуються за різними ознаками, які включають:
shkola.in.ua
1. Вид зв'язку: Органічні сполуки містять вуглецевий каркас, утворений вуглецевими атомами, які з'єднані з іншими атомами водню, кисню, азоту та інших елементів.
2. Функціональна група: Це атом або група атомів, що знаходяться в молекулі сполуки і визначають її хімічні властивості та реакції. Наприклад, альдегідна, кетонна, карбоксильна групи тощо.
3. Властивості: Органічні сполуки можуть бути насиченими (алкани) або ненасиченими (алкени, алкіни), ароматичними сполуками тощо, залежно від наявності подвійних або потрійних зв'язків між атомами вуглецю.
4. Кількість атомів вуглецю: Органічні сполуки можуть класифікуватися за кількістю атомів вуглецю у молекулі, наприклад, моно-, ді-, три-, багатоатомні сполуки.
5. Реакційна активність: Залежно від типу функціональних груп та молекулярної
структури, органічні сполуки можуть бути більш чи менш реактивними.
30. На які групи або класи розділяють органічні сполуки за різними класифікаційними ознаками?
Органічні сполуки можуть бути розділені на різні групи або класи залежно від різних класифікаційних ознак. Основні класифікаційні ознаки та відповідні групи органічних
сполук включають:
1. За типом функціональної групи:
- Алькани (парафіни): містять тільки одинарні зв'язки між атомами вуглецю.
- Алкени (олефіни): містять щонайменше один подвійний зв'язок між атомами вуглецю.
- Алкіни (індивідуальні ацетиленові сполуки): містять щонайменше один потрійний зв'язок між атомами вуглецю.
- Ароматичні сполуки: містять ароматичні кільця, такі як бензольне кільце.
- Аміни: містять азотний атом, який з'єднаний з аліфатичними або ароматичними групами.
- Алдегіди: містять альдегідну функціональну групу -CHO.
- Кетони: містять кетонну функціональну групу >C=O.
- Карбонові кислоти: містять карбоксильну функціональну групу -COOH. 2. За наявністю кільцевої структури:
- Аліциклічні сполуки: містять ациклічний вуглецевий каркас без кільцевої структури.
- Циклоалкани: містять насичені кільця вуглецевих атомів (циклопарафіни).
- Циклоалкени: містять один або більше подвійних зв'язків у кільцевій структурі (циклоолефіни).
- Ароматичні сполуки: містять стабільний ароматичний кільцевий каркас, наприклад, бензольне кільце.
3. За кількістю атомів вуглецю:
- Моноатомні органічні сполуки: містять лише один атом вуглецю, наприклад, метан (CH4).
- Діатомні органічні сполуки: містять два атоми вуглецю, наприклад, етан (C2H6).
- Тріатомні органічні сполуки: містять три атоми вуглецю, наприклад, пропан (C3H8).
- Багатоатомні органічні сполуки: містять більше трьох атомів вуглецю, наприклад, бутан (C4H10) та більш складні сполуки.
Завдання для засвоєння матеріалу 31. Найпростіша органічна сполука — метан CH4. До яких груп органічних
сполук можна його віднести (за різними ознаками)? Метан (CH4) належить до різних груп органічних сполук залежно від різних ознак: 1. За типом функціональної групи: Метан є алканом, оскільки він містить тільки одинарні зв'язки між атомами вуглецю і водню. Усі алкани мають загальну молекулярну формулу CnH2n+2, де n - кількість атомів вуглецю. В метані n = 1, тому його формула CH4.
shkola.in.ua
2. За наявністю кільцевої структури: Метан є ациклічною сполукою, оскільки він не має кільцевої структури. Він складається з одного атома вуглецю, який з'єднаний з чотирма атомами водню.
3. За кількістю атомів вуглецю: Метан входить до групи моноатомних органічних
сполук, оскільки містить лише один атом вуглецю.
4. За властивостями: Метан є ненасиченою органічною сполукою, оскільки у ньому немає подвійних або потрійних зв'язків між атомами вуглецю. Також він є аліфатичною сполукою, тобто не містить ароматичних кільцевих структур. Таким чином, метан (CH4) відноситься до групи алканів, є ациклічною сполукою, містить один атом вуглецю і є ненасиченою та аліфатичною органічною сполукою.
32. Які з ланцюгів, наведених у завданні 20 на с. 17, є розгалуженими, неозгалуженими, циклічними?
а, б, в, д – нерозгалужені
г – циклічні
е, є, ж – розгалужені
33. Дано структурні формули трьох вуглеводнів: CH3–CH3, CH2=CH2, CH≡CH. Запропонуйте ознаки для класифікації цих речовин.
Для класифікації вуглеводнів CH3–CH3, CH2=CH2, CH≡CH можна використовувати різні ознаки:
1. За типом функціональної групи:
- CH3–CH3: Цей вуглеводень має тільки одинарні зв'язки між атомами вуглецю і водню, тому він належить до групи алканів.
- CH2=CH2: У цьому вуглеводні є один подвійний зв'язок між атомами вуглецю, що вказує на його відношення до алкенів.
- CH≡CH: Тут міститься один потрійний зв'язок між атомами вуглецю, що робить його алкіном.
2. За наявністю кільцевої структури:
- У всіх трьох вуглеводнях немає кільцевої структури. Вони є ациклічними сполуками.
3. За кількістю атомів вуглецю:
- CH3–CH3: Містить два атоми вуглецю, тому належить до групи діатомних
вуглеводнів.
- CH2=CH2: Містить два атоми вуглецю, також належить до діатомних вуглеводнів.
- CH≡CH: Містить два атоми вуглецю, тому також є діатомним вуглеводнем. 4. За властивостями:
- Усі три вуглеводні є насиченими, тобто не містять подвійних або потрійних зв'язків між атомами вуглецю. Отже, за цими ознаками:
- CH3–CH3 - алкан, ациклічна сполука, діатомний вуглеводень, насичений.
-
-
CH2=CH2 - алкен, ациклічна сполука, діатомний вуглеводень, насичений.
CH≡CH - алкін, ациклічна сполука, діатомний вуглеводень, насичений.
34. Визначте, до яких груп органічних сполук за різними ознаками можна
shkola.in.ua
віднести: а) етанол C2H5OH; б) етанову кислоту CH3COOH; в) етин C2H2; г) етанамін C2H5NH2. а) Етанол C2H5OH:
- За типом функціональної групи: Етанол містить гідроксильну функціональну групуOH, що робить його сполукою алкоголів.
- За наявністю кільцевої структури: Етанол є ациклічною сполукою, оскільки не має кільцевої структури.
- За кількістю атомів вуглецю: Етанол містить два атоми вуглецю, тому він є діатомним вуглеводнем.
- За властивостями: Етанол є насиченою органічною сполукою, тобто не містить подвійних або потрійних зв'язків між атомами вуглецю. б) Етанова кислота CH3COOH:
- За типом функціональної групи: Етанова кислота містить карбоксильну
функціональну групу -COOH, тому вона відноситься до групи карбонових кислот.
- За наявністю кільцевої структури: Етанова кислота є ациклічною сполукою, оскільки
не має кільцевої структури.
- За кількістю атомів вуглецю: Етанова кислота містить два атоми вуглецю, тому вона є діатомним вуглеводнем.
- За властивостями: Етанова кислота є насиченою органічною сполукою, тобто не містить подвійних або потрійних зв'язків між атомами вуглецю. в) Етин C2H2:
- За типом функціональної групи: Етин містить потрійний зв'язок між атомами вуглецю, що вказує на його відношення до алкінів.
- За наявністю кільцевої структури: Етин є ациклічною сполукою, оскільки не має кільцевої структури.
- За кількістю атомів вуглецю: Етин містить два атоми вуглецю, тому він є діатомним вуглеводнем.
- За властивостями: Етин є ненасиченою органічною сполукою, тобто містить потрійний зв'язок між атомами вуглецю. г) Етанамін C2H5NH2:
- За типом функціональної групи: Етанамін містить аміногрупу -NH2, що робить його сполукою амінів.
- За наявністю кільцевої структури: Етанамін є ациклічною сполукою, оскільки не має кільцевої структури.
- За кількістю атомів вуглецю: Етанамін містить два атоми вуглецю, тому він є діатомним вуглеводнем.
- За властивостями: Етанамін є амфотерною сполукою, тобто може діяти як лужний
амін та кислий амін. Отже, за цими ознаками: а) Етанол C2H5OH - алкогол, ациклічна сполука, діатомний вуглеводень, насичений.
б) Етанова кислота CH3COOH - карбонова кислота, ациклічна сполука, діатомний
вуглеводень, насичений.
в) Етин C2H2 - алкін, ациклічна сполука, діатомний вуглеводень, ненасичений.
г) Етанамін C2H5NH2 - амін, ациклічна сполука, діатомний вуглеводень, амфотерний. 35. Складіть формули спирту, карбонової кислоти та аміну з найменшим можливим числом атомів Карбону. Найменшим можливим числом атомів вуглецю у спирті, карбоновій кислоті та аміні є один атом вуглецю. Такі сполуки мають назви: метанол, метанова кислота та метанамін.
shkola.in.ua
1. Спирт (метанол): його хімічна формула - CH3OH.
2. Карбонова кислота (метанова кислота або метаноїнова кислота): хімічна формулаHCOOH.
3. Амін (метанамін або метанамінова кислота): хімічна формула - CH3NH2.
36. Складіть повну й скорочену структурні формули, а також молекулярну формулу
будь-якої сполуки, молекули якої містять: а) три атоми Карбону та один подвійний
зв’язок C=C; б) чотири атоми Карбону та один потрійний зв’язок С≡С; в)
циклічний ланцюг із шести атомів Карбону та одну групу –ОН; г) розгалужений карбоновий ланцюг із п’яти атомів Карбону та один подвійний зв’язок С=С; д) три атоми Карбону, один з яких у складі альдегідної групи; е) циклічний ланцюг із трьох атомів Карбону та одну аміногрупу –NH2.
а) Сполука з трьома атомами вуглецю та одним подвійним зв’язком C=C:
Повна структурна формула: H2C=CH2
Скорочена структурна формула: CH2=CH2
Молекулярна формула: C2H4
б) Сполука з чотирма атомами вуглецю та одним потрійним зв’язком С≡С: Повна структурна формула: HC≡CCH
Скорочена структурна формула: C≡CCH
Молекулярна формула: C3H2
в) Сполука з циклічним ланцюгом із шести атомів
Повна структурна формула: HO–CH2–CH2–CH2–CH2–CH2–OH Скорочена структурна формула: C6H12O
Молекулярна формула: C6H12O
г) Сполука з розгалуженим карбоновим
атомів вуглецю та одним подвійним зв’язком С=С: Повна структурна формула: CH3–CH=CH–CH2–CH3 Скорочена структурна формула: CH3CH=CHCH2CH3 Молекулярна формула: C5H10 д) Сполука з трьома атомами вуглецю, один з яких у складі альдегідної групи: Повна структурна формула: HCHO Скорочена структурна формула: CHO Молекулярна формула: C2H2O
е) Сполука з циклічним ланцюгом із трьох атомів вуглецю та однією аміногрупою –
NH2:

Повна структурна формула: NH2–CH2–CH2 Скорочена структурна формула: C3H8N
Молекулярна формула: C3H8N
37. Серед наведених структурних формул сполук укажіть: вуглеводні, циклічні сполуки, спирт, карбонову кислоту, амін.
shkola.in.ua
а) вуглеводні, б) спирт, в) циклічні, г) вуглеводні, д) амін, е) карбонові кислоти 38. Формула найпростішого аміну — CH3NH2. Складіть розгорнуту струк-турну формулу аміну, який містить на один атом Карбону більше. Розгорнута структурна формула аміну, який містить на один атом вуглецю більше, буде наступною: CH3–CH2–NH2 У цій структурній формулі додано один атом вуглецю (СН3-CH2-) до найпростішого аміну CH3NH2, що утворює більш розгалужену молекулярну структуру.
вуглецю та однією групою –ОН:
ланцюгом
із п’яти
§4. Виведення молекулярної формули речовини за масовими частками елементів Завдання для засвоєння матеріалу
39. Визначте молекулярну формулу оксиду, в якому масова частка Хрому
становить 52 %.
Для визначення молекулярної формули оксиду, у якому масова частка хрому становить
52%, спростимо задачу, припускаючи, що масова частка інших елементів в оксиді
незначна. Таким чином, маса хрому буде складати 52% від загальної маси сполуки.
Задано:
Масова частка хрому (Cr) = 52%
Крок 1: Припустимо, що маса всього оксиду становить 100 г. Тоді маса хрому в
цьому оксиді буде:
Маса хрому = (Масова частка хрому / 100) * Загальна маса сполуки
Маса хрому = (52 / 100) * 100 г = 52 г
Крок 2: З'ясуємо масу кисню (O) в сполуці. Загальна маса оксиду - маса хрому:
Маса кисню = Загальна маса сполуки - Маса хрому
Маса кисню = 100 г - 52 г = 48 г
Крок 3: Знайдемо кількість молекул кожного елемента, використовуючи їх маси
та атомні маси:
1 моль Cr = 52 г
1 моль O = 16 г
Кількість молекул Cr = (Маса Cr) / (Атомна маса Cr) = 52 г / 52 г/моль = 1 моль
Кількість молекул O = (Маса O) / (Атомна маса O) = 48 г / 16 г/моль = 3 моль Крок 4: Запишемо молекулярну формулу оксиду, використовуючи отримані
кількості атомів кожного елемента: Молекулярна формула оксиду: CrO3 Отже, молекулярна формула оксиду, в якому масова частка хрому становить 52%, - CrO3.
40. Визначте молекулярну формулу оксиду, в якому масова частка Феруму становить 70 %.
Для визначення молекулярної формули оксиду, в якому масова частка заліза (Fe) становить 70%, ми будемо діяти аналогічно попередній задачі.
Задано:
Масова частка заліза (Fe) = 70%
Крок 1: Припустимо, що маса всього оксиду становить 100 г. Тоді маса заліза в
цьому оксиді буде:
Маса заліза = (Масова частка заліза / 100) * Загальна маса сполуки
Маса заліза = (70 / 100) * 100 г = 70 г
Крок 2: З'ясуємо масу кисню (O) в сполуці. Загальна маса оксиду - маса заліза:
Маса кисню = Загальна маса сполуки - Маса заліза
Маса кисню = 100 г - 70 г = 30 г
shkola.in.ua
Крок 3: Знайдемо кількість молекул кожного елемента, використовуючи їх маси та атомні маси:
1 моль Fe = 70 г
1 моль O = 16 г
Кількість молекул Fe = (Маса Fe) / (Атомна маса Fe) = 70 г / 70 г/моль = 1 моль
Кількість молекул O = (Маса O) / (Атомна маса O) = 30 г / 16 г/моль ≈ 1.875 моль
(округлимо до 3 знаків після коми)
Крок 4: Переведемо кількість молекул кисню до цілого числа, розділимо на
найбільший спільний дільник:
3.0 ≈ 1.875 (кількість молекул O)
3.0 / 1.875 ≈ 1.6
Тепер помножимо кількість атомів кожного елемента на 5 (для того, щоб усі
числа стали цілими):
Кількість молекул Fe = 1 * 5 = 5
Кількість молекул O = 1.6 * 5 = 8
Крок 5: Запишемо молекулярну формулу оксиду, використовуючи отримані
кількості атомів кожного елемента:
Молекулярна формула оксиду: Fe5O8
Отже, молекулярна формула оксиду, в якому масова частка заліза становить 70%, - Fe5O8.
41. Визначте молекулярну формулу сполуки Нітрогену з Оксигеном, у якій масова частка Оксигену становить 63,2 %.
Масова частка всіх елементів у сполуці повинна складати 100%.
Масова частка Нітрогену (N) = 100% - Масова частка Оксигену (O) = 100% - 63,2% = 36,8%
Приблизна атомна маса Нітрогену (N) ≈ 14
Числове відношення Оксигену (O) = 63,2% / 16 ≈ 3.95 Числове відношення Нітрогену
(N) = 36,8% / 14 ≈ 2.63
Знайдемо найменший спільний множник числових відношень: Множник числових відношень ≈ 4 Помножимо отримані коефіцієнти на множник, щоб отримати цілі числа: Числове відношення Оксигену (O) = 3.95 * 4 ≈ 16 Числове відношення Нітрогену (N) = 2.63 * 4 ≈ 11 Отже, молекулярна формула сполуки Нітрогену та Оксигену буде N11O16. Проте, цю формулу не можна залишити у такому вигляді, оскільки нам потрібно мати цілі числа. У даному випадку молекулярна формула буде NO2.5. Оскільки не можна мати дробовий коефіцієнт у молекулярній формулі, то спрощено молекулярна формула сполуки з Нітрогеном та Оксигеном - це NO2. 42. Визначте молекулярну формулу вуглеводню, в якому масова частка Карбону становить 81,82 % Припустимо, маса вуглеводню 100 грамів, оскільки масова частка Карбону (С) в даному вуглеводні становить 81,82%.Тепер, щоб знайти масу Карбону і Гідрогену в цьому вуглеводні, можна скористатися масовими частками елементів.
Масова частка Гідрогену (Н) = 100% - Масова частка Карбону (С) = 100%81,82% = 18,18%
Тепер розрахуємо масу Карбону (С) і Гідрогену (Н):
Маса Карбону (С) = 81,82% з 100 г = (81,82 / 100) * 100 г = 81,82 г
Маса Гідрогену (Н) = 18,18% з 100 г = (18,18 / 100) * 100 г = 18,18 г
shkola.in.ua
Тепер переведемо масу Карбону і Гідрогену в молекулярні співвідношення, використовуючи їх атомні маси.
Атомна маса Карбону (С) ≈ 12 г/моль
Атомна маса Гідрогену (Н) ≈ 1 г/моль
Число молекул Карбону (С) = Маса Карбону (С) / Атомна маса Карбону (С) ≈
81,82 г / 12 г/моль ≈ 6.82 моль
Число молекул Гідрогену (Н) = Маса Гідрогену (Н) / Атомна маса Гідрогену (Н) ≈ 18,18 г / 1 г/моль ≈ 18.18 моль
Тепер поділімо кожне число молекул на найменший спільний дільник, щоб
отримати цілі числа:
Найменший спільний дільник ≈ 6.82
Число молекул Карбону (С) ≈ 6.82 моль / 6.82 ≈ 1 моль
Число молекул Гідрогену (Н) ≈ 18.18 моль / 6.82 ≈ 2.67 моль
Тепер заокруглимо число молекул Гідрогену до найближчого цілого числа (2.67 ≈ 3).
Отже, молекулярна формула вуглеводню, в якому масова частка Карбону
становить 81.82%, це C1H3.
43. Визначте молекулярну формулу вуглеводню, що містить 82,76 % атомів Карбону за масою, якщо його молярна маса дорівнює 58 г/моль.
1. Знайдемо масову частку Гідрогену (Н) в цьому вуглеводню:
Масова частка Гідрогену (H) = 100% - Масова частка Карбону (С) = 100% -
82,76% = 17,24%.
2. Тепер знайдемо масу Карбону (С) та Гідрогену (Н) у 100 г вуглеводню:
Маса Карбону (С) = 82,76 г (відсоток атомів Карбону в 100 г вуглеводню) Маса Гідрогену (H) = 17,24 г (відсоток атомів Гідрогену в 100 г вуглеводню)
3. Розрахуємо кількість молей Карбону (С) та Гідрогену (Н) у вуглеводні, використовуючи їх атомні маси:
Атомна маса Карбону (С) ≈ 12 г/моль
Атомна маса Гідрогену (H) ≈ 1 г/моль Кількість молей Карбону (С) = Маса Карбону (С) / Атомна маса Карбону (С) ≈ 82,76 г / 12 г/моль ≈ 6,895 моль Кількість молей Гідрогену (H) = Маса Гідрогену (H) / Атомна маса Гідрогену (H)
≈ 17,24 г / 1 г/моль ≈ 17,24 моль
4. Поділімо кількість молей Карбону (С) та Гідрогену (H) на найменший спільний дільник, щоб отримати цілі числа:
Найменший спільний дільник ≈ 6,895 (округлимо до 6.9)
Кількість молей Карбону (С) ≈ 6,9 моль / 6,9 ≈ 1 моль
Кількість молей Гідрогену (H) ≈ 17,24 моль / 6,9 ≈ 2,5 моль
5. Запишемо молекулярну формулу вуглеводню: Молекулярна формула вуглеводню: C1H2.5
Оскільки молекула не може містити дробовий коефіцієнт, ми помножимо кожний атом Гідрогену (H) на 2, щоб отримати ціле число: Молекулярна формула вуглеводню: C1H5 Отже, молекулярна формула вуглеводню, яке містить 82,76% атомів Карбону за масою та має молярну масу 58 г/моль, це C1H5.
44. Визначте молекулярну формулу вуглеводню з молярною масою 78 г/моль, у якому масова частка Карбону становить 92,3 %. У цій задачі нам відомо, що вуглеводень має молярну масу 78 г/моль та масову частку Карбону (C) 92,3%.
Спершу знайдемо масову частку Гідрогену (H) Масова частка Гідрогену (H) = 100% - Масова частка Карбону (C) = 100% - 92,3% = 7,7%.
Тепер використаємо ці масові частки, щоб знайти маси Карбону та Гідрогену в 100 г вуглеводню:
shkola.in.ua
Маса Карбону (C) = 92,3 г (відсоток Карбону в 100 г вуглеводню)
Маса Гідрогену (H) = 7,7 г (відсоток Гідрогену в 100 г вуглеводню)
Тепер розрахуємо кількість молей Карбону та Гідрогену в даному вуглеводні,
використовуючи їх атомні маси:
Атомна маса Карбону (C) ≈ 12 г/моль
Атомна маса Гідрогену (H) ≈ 1 г/моль
Кількість молей Карбону (C) = Маса Карбону (C) / Атомна маса Карбону (C) ≈ 92,3 г / 12 г/моль ≈ 7,69 моль
Кількість молей Гідрогену (H) = Маса Гідрогену (H) / Атомна маса Гідрогену (H) ≈ 7,7 г / 1 г/моль ≈ 7,7 моль Тепер поділімо кількість молей Карбону та Гідрогену на їх найбільший спільний дільник, щоб отримати цілі числа: Найбільший спільний дільник ≈ 7,69 (округлено до 7,7) Кількість молей Карбону (C) ≈ 7,7 моль / 7,7 ≈ 1 моль Кількість молей Гідрогену (H) ≈ 7,7 моль / 7,7 ≈ 1 моль Тепер запишемо молекулярну формулу вуглеводню: Молекулярна формула вуглеводню: C1H1 Але така формула не відповідає типовому вигляду вуглеводнів. Вони мають зазвичай більше атомів водню. Оскільки молекула не може містити одномолекулярний вуглеводень (який складається лише з одного атома вуглецю та одного атома водню), ми мусимо виправити формулу. Для цього помножимо кожний атом на відповідну кількість, щоб забезпечити більше атомів Гідрогену. Зробимо кількість атомів Гідрогену рівною 2: Молекулярна формула вуглеводню: C1H2 Отже, молекулярна формула вуглеводню з молярною масою 78 г/моль та масовою часткою Карбону 92,3% - це C1H2.
45. Визначте молекулярну формулу органічної речовини з молярною ма-сою 45 г/моль, у якій масова частка Нітрогену становить 31,11 %, Кар-бону — 53,33 %, усе інше — Гідроген.
У цій задачі ми маємо молярну масу органічної речовини - 45 г/моль, масові частки атомів Нітрогену (N) - 31,11%, Карбону (C) - 53,33%, а все інше - Гідроген (H) Для знаходження масової частки Гідрогену (H) можемо скористатися тим, що масові частки всіх елементів у сполуці повинні складати 100%. Масова частка Гідрогену (H) = 100% - Масова частка Нітрогену (N) - Масова частка Карбону (C)
Масова частка Гідрогену (H) = 100% - 31,11% - 53,33% = 100% - 84,44% = 15,56% Тепер можемо знайти маси Нітрогену, Карбону і Гідрогену в 100 г органічної речовини: Маса Нітрогену (N) = 31,11 г (відсоток Нітрогену в 100 г органічної речовини)
Маса Карбону (C) = 53,33 г (відсоток Карбону в 100 г органічної речовини) Маса Гідрогену (H) = 15,56 г (відсоток Гідрогену в 100 г органічної речовини)
shkola.in.ua
Тепер розрахуємо кількість молей Нітрогену, Карбону і Гідрогену в даній органічній речовині, використовуючи їх атомні маси: Атомна маса Нітрогену (N) ≈ 14 г/моль
Атомна маса Карбону (C) ≈ 12 г/моль
Атомна маса Гідрогену (H) ≈ 1 г/моль
Кількість молей Нітрогену (N) = Маса Нітрогену (N) / Атомна маса Нітрогену (N) ≈
31,11 г / 14 г/моль ≈ 2,22 моль
Кількість молей Карбону (C) = Маса Карбону (C) / Атомна маса Карбону (C) ≈ 53,33 г / 12 г/моль ≈ 4,44 моль Кількість молей Гідрогену (H) = Маса Гідрогену (H) / Атомна маса Гідрогену (H) ≈ 15,56 г / 1 г/моль ≈ 15,56 моль
Тепер поділімо кожну кількість молей на найбільший спільний дільник, щоб отримати цілі числа: Найбільший спільний дільник ≈ 2,22 (округлено до 2.2)
Кількість молей Нітрогену (N) ≈ 2,2 моль / 2,2 ≈ 1 моль
Кількість молей Карбону (C) ≈ 4,44 моль / 2,2 ≈ 2 моль Кількість молей Гідрогену (H) ≈ 15,56 моль / 2,2 ≈ 7 моль Запишемо молекулярну формулу органічної речовини, враховуючи кількість атомів кожного елементу: Молекулярна формула органічної речовини: C2H7N 46. Визначте молекулярну формулу органічної речовини з молярною ма-сою 90 г/моль, у якій масова частка Оксигену становить 71,11 %, Кар-бону — 26,67 %, усе інше — Гідроген.
У цій задачі ми маємо молярну масу органічної речовини - 90 г/моль, масові частки атомів Оксигену (O) - 71,11%, Карбону (C) - 26,67%, а все інше - Гідроген (H). Спершу знайдемо масову частку Гідрогену (H), використавши той факт, що масові частки всіх елементів у сполуці повинні складати 100%: Масова частка Гідрогену (H) = 100% - Масова частка Оксигену (O) - Масова частка Карбону (C)
Масова частка Гідрогену (H) = 100% - 71,11% - 26,67% = 100% - 97,78% = 2,22% Тепер можемо знайти маси Оксигену, Карбону і Гідрогену в 100 г органічної речовини: Маса Оксигену (O) = 71,11 г (відсоток Оксигену в 100 г органічної речовини)
Маса Карбону (C) = 26,67 г (відсоток Карбону в 100 г органічної речовини)
Маса Гідрогену (H) = 2,22 г (відсоток Гідрогену в 100 г органічної речовини) Тепер розрахуємо кількість молей Оксигену, Карбону і Гідрогену в даній органічній речовині, використовуючи їх атомні маси: Атомна маса Оксигену (O) ≈ 16 г/моль
Атомна маса Карбону (C) ≈ 12 г/моль
Атомна маса Гідрогену (H) ≈ 1 г/моль Кількість молей Оксигену (O) = Маса Оксигену (O) / Атомна маса Оксигену (O) ≈ 71,11
г / 16 г/моль ≈ 4,44 моль
Кількість молей Карбону (C) = Маса Карбону (C) / Атомна маса Карбону (C) ≈ 26,67 г / 12 г/моль ≈ 2,22 моль
Кількість молей Гідрогену (H) = Маса Гідрогену (H) / Атомна маса Гідрогену (H) ≈ 2,22
г / 1 г/моль ≈ 2,22 моль Тепер поділімо кожну кількість молей на найбільший спільний дільник, щоб отримати цілі числа:
shkola.in.ua
Найбільший спільний дільник ≈ 2,22 (округлено до 2,2) Кількість молей Оксигену (O) ≈ 4,44 моль / 2,2 ≈ 2 моль
Кількість молей Карбону (C) ≈ 2,22 моль / 2,2 ≈ 1 моль Кількість молей Гідрогену (H) ≈ 2,22 моль / 2,2 ≈ 1 моль Запишемо молекулярну формулу органічної речовини, враховуючи кількість атомів кожного елементу: Молекулярна формула органічної речовини: C1H1O2
Оскільки молекула не може містити одномолекулярний вуглеводень (який складається лише з одного атома вуглецю та одного атома водню), можливо варто помножити кількість атомів Оксигену (O) на 2, щоб забезпечити більше атомів Оксигену: Молекулярна формула органічної речовини: C1H1O2 Отже, молекулярна формула органічної речовини з молярною масою 90 г/моль, у якій масова частка Оксигену становить 71,11%, Карбону — 26,67%, а все інше — Гідрогенце C1H1O2.
47. Певна речовина містить Карбон (62,1 %), Гідроген (10,3 %) та Оксиген.
Визначте її молекулярну формулу.
У цій задачі маємо речовину, яка містить Карбон (C) - 62,1%, Гідроген (H) - 10,3%, а також Оксиген (O) - решта, тобто масова частка Оксигену складає:
Масова частка Оксигену (O) = 100% - Масова частка Карбону (C) - Масова частка Гідрогену (H)
Масова частка Оксигену (O) = 100% - 62,1% - 10,3% = 100% - 72,4% = 27,6%
Тепер можемо записати масові частки всіх трьох елементів:
Масова частка Карбону (C) = 62,1%
Масова частка Гідрогену (H) = 10,3%
Масова частка Оксигену (O) = 27,6% Тепер, щоб знайти молекулярну формулу, нам потрібно визначити кількість атомів кожного елементу в молекулі.
Для цього припустимо, що ми маємо 100 г речовини (це не змінить співвідношення масових часток елементів).
Тоді маси Карбону, Гідрогену та Оксигену в 100 г речовини будуть: Маса Карбону (C) = 62,1 г (62,1% від 100 г) Маса Гідрогену (H) = 10,3 г (10,3% від 100 г) Маса Оксигену (O) = 27,6 г (27,6% від 100 г) Тепер розрахуємо кількість молей Карбону, Гідрогену та Оксигену в даній речовині, використовуючи їх атомні маси: Атомна маса Карбону (C) ≈ 12 г/моль Атомна маса Гідрогену (H) ≈ 1 г/моль
shkola.in.ua
Атомна маса Оксигену (O) ≈ 16 г/моль Кількість молей Карбону (C) = Маса Карбону (C) / Атомна маса Карбону (C) ≈ 62,1 г / 12 г/моль ≈ 5,175 моль Кількість молей Гідрогену (H) = Маса Гідрогену (H) / Атомна маса Гідрогену (H) ≈ 10,3 г / 1 г/моль ≈ 10,3 моль Кількість молей Оксигену (O) = Маса Оксигену (O) / Атомна маса Оксигену (O) ≈ 27,6 г / 16 г/моль ≈ 1,725 моль Тепер поділімо кожну кількість молей на їх найбільший спільний дільник, щоб отримати цілі числа: Найбільший спільний дільник ≈ 1,725 (округлити до 1,73) Кількість молей Карбону (C) ≈ 5,175 моль / 1,73 ≈ 3 моль Кількість молей Гідрогену (H) ≈ 10,3 моль / 1,73 ≈ 6 моль Кількість молей Оксигену (O) ≈ 1,725 моль / 1,73 ≈ 1 моль Запишемо молекулярну формулу органічної речовини, враховуючи кількість атомів кожного елементу: Молекулярна формула органічної речовини: C3H6O 48. Певна речовина містить Карбон (77,4 %), Гідроген (5,83 %) та Нітроген. Визначте її молекулярну формулу.
цій задачі маємо речовину, яка містить Карбон (C) - 77,4%, Гідроген (H) - 5,83%, а також Нітроген (N) - решта, тобто масова частка Нітрогену складає:
Масова частка Нітрогену (N) = 100% - Масова частка Карбону (C) - Масова частка Гідрогену (H)
Масова частка Нітрогену (N) = 100% - 77,4% - 5,83% = 100% - 83,23% = 16,77%
Тепер можемо записати масові частки всіх трьох елементів:
Масова частка Карбону (C) = 77,4%
Масова частка Гідрогену (H) = 5,83%
Масова частка Нітрогену (N) = 16,77%
Тепер, щоб знайти молекулярну формулу, нам потрібно визначити кількість атомів
кожного елементу в молекулі.
Для цього припустимо, що ми маємо 100 г речовини (це не змінить співвідношення
масових часток елементів).
Тоді маси Карбону, Гідрогену та Нітрогену в 100 г речовини будуть:
Маса Карбону (C) = 77,4 г (77,4% від 100 г)
Маса Гідрогену (H) = 5,83 г (5,83% від 100 г)
Маса Нітрогену (N) = 16,77 г (16,77% від 100 г)
Тепер розрахуємо кількість молей Карбону, Гідрогену та Нітрогену в даній речовині, використовуючи їх атомні маси:
Атомна маса Карбону (C) ≈ 12 г/моль
Атомна маса Гідрогену (H) ≈ 1 г/моль Атомна маса Нітрогену (N) ≈ 14 г/моль Кількість молей Карбону (C) = Маса Карбону (C) / Атомна маса Карбону (C) ≈ 77,4 г / 12 г/моль ≈ 6,45 моль
Кількість молей Гідрогену (H) = Маса Гідрогену (H) / Атомна маса Гідрогену (H) ≈ 5,83 г / 1 г/моль ≈ 5,83 моль Кількість молей Нітрогену (N) = Маса Нітрогену (N) / Атомна маса Нітрогену (N) ≈ 16,77 г / 14 г/моль ≈ 1,2 моль Тепер поділімо кожну кількість молей на їх найбільший спільний дільник, щоб отримати цілі числа: Найбільший спільний дільник ≈ 1,2 Кількість молей Карбону (C) ≈
моль /
≈
shkola.in.ua
моль Кількість молей Гідрогену (H) ≈ 5,83 моль / 1,2 ≈ 4,86 моль Кількість молей Нітрогену (N) ≈ 1,2 моль / 1,2 ≈ 1 моль Запишемо молекулярну формулу органічної речовини, враховуючи кількість атомів кожного елементу: Молекулярна формула органічної речовини: C5H4N 49. Визначте молекулярну формулу спирту, в якому масова частка Карбону становить 64,86 %, а Гідрогену — 13,51 %. У цій задачі маємо спирт, в якому масова частка Карбону (C) становить 64,86%, а Гідрогену (H) - 13,51%.
Спершу знайдемо масову частку Оксигену (O), використавши той факт, що масові частки всіх елементів у сполуці повинні складати 100%: Масова частка Оксигену (O) = 100% - Масова частка Карбону (C) - Масова частка Гідрогену (H) Масова частка Оксигену (O) = 100% - 64,86% - 13,51% = 100% - 78,37% = 21,63% Тепер можемо записати масові частки всіх трьох елементів: Масова частка Карбону (C) = 64,86%
У
6,45
1,2
5,4
Масова частка Гідрогену (H) = 13,51%
Масова частка Оксигену (O) = 21,63%
Тепер, щоб знайти молекулярну формулу, нам потрібно визначити кількість атомів кожного елементу в молекулі.
Для цього припустимо, що ми маємо 100 г спирту (це не змінить співвідношення
масових часток елементів).
Тоді маси Карбону, Гідрогену та Оксигену в 100 г спирту будуть:
Маса Карбону (C) = 64,86 г (64,86% від 100 г)
Маса Гідрогену (H) = 13,51 г (13,51% від 100 г)
Маса Оксигену (O) = 21,63 г (21,63% від 100 г)
Тепер розрахуємо кількість молей Карбону, Гідрогену та Оксигену в даному спирті, використовуючи їх атомні маси:
Атомна маса Карбону (C) ≈ 12 г/моль
Атомна маса Гідрогену (H) ≈ 1 г/моль
Атомна маса Оксигену (O) ≈ 16 г/моль
Кількість молей Карбону (C) = Маса Карбону (C) / Атомна маса Карбону (C) ≈ 64,86 г / 12 г/моль ≈ 5,405 моль
Кількість молей Гідрогену (H) = Маса Гідрогену (H) / Атомна маса Гідрогену (H) ≈ 13,51 г / 1 г/моль ≈ 13,51 моль
Кількість молей Оксигену (O) = Маса Оксигену (O) / Атомна маса Оксигену (O) ≈ 21,63 г / 16 г/моль ≈ 1,352 моль Тепер поділімо кожну кількість молей на їх найбільший спільний дільник, щоб отримати цілі числа: Найбільший спільний дільник ≈ 1,352 (округлити до 1,35) Кількість молей Карбону (C) ≈ 5,405 моль / 1,35 ≈ 4 моль Кількість молей Гідрогену (H) ≈ 13,51 моль / 1,35 ≈ 10 моль Кількість молей Оксигену (O) ≈ 1,352 моль / 1,35 ≈ 1 моль Запишемо молекулярну формулу спирту, враховуючи кількість атомів кожного елементу: Молекулярна формула спирту: C4H10O 50. У сполуці масою 3,1 г міститься 0,6 г атомів Карбону, 2,4 г атомів Окси-гену і Гідроген. Визначте молекулярну формулу речовини.
Для розв'язання цієї задачі нам потрібно визначити кількість молей атомів Карбону, Оксигену та Гідрогену в сполуці.
Маса Карбону (C) = 0,6 г
Маса Оксигену (O) = 2,4 г
Записуємо атомні маси елементів: Атомна маса Карбону (C) ≈ 12 г/моль
Атомна маса Оксигену (O) ≈ 16 г/моль
Атомна маса Гідрогену (H) ≈ 1 г/моль
shkola.in.ua
Тепер розрахуємо кількість молей Карбону, Оксигену та Гідрогену в даному сполуці: Кількість молей Карбону (C) = Маса Карбону (C) / Атомна маса Карбону (C) ≈ 0,6 г / 12 г/моль ≈ 0,05 моль Кількість молей Оксигену (O) = Маса Оксигену (O) / Атомна маса Оксигену (O) ≈ 2,4 г / 16 г/моль ≈ 0,15 моль Тепер візьмемо решту маси сполуки і припустимо, що це маса Гідрогену (H): Маса Гідрогену (H) = Загальна маса сполуки - Маса Карбону (C) - Маса Оксигену (O) Маса Гідрогену (H) = 3,1 г - 0,6 г - 2,4 г = 0,1 г
Кількість молей Гідрогену (H) = Маса Гідрогену (H) / Атомна маса Гідрогену (H) ≈ 0,1 г / 1 г/моль ≈ 0,1 моль Тепер поділімо кожну кількість молей на їх найбільший спільний дільник, щоб отримати цілі числа: Найбільший спільний дільник ≈ 0,05 (округлити до 0,05) Кількість молей Карбону (C) ≈ 0,05 моль / 0,05 ≈ 1 моль Кількість молей Оксигену (O) ≈ 0,15 моль / 0,05 ≈ 3 моль Кількість молей Гідрогену (H) ≈ 0,1 моль / 0,05 ≈ 2 моль Запишемо молекулярну формулу речовини, враховуючи кількість атомів кожного елементу: Молекулярна формула речовини: C1H2O3 Міні-проекти 51. У додаткових джерелах знайдіть інформацію про сучасні методи визначення елементного складу речовин. Сучасні методи визначення елементного складу речовин є важливим інструментом для наукових досліджень, промисловості, медицини та багатьох інших галузей. Деякі з них використовуються для якісного визначення присутності конкретних елементів, тоді як інші
дозволяють точно виміряти їх кількість.
Ось деякі сучасні методи визначення елементного складу речовин:
1. Атомно-абсорбційна спектроскопія (ААС): Цей метод базується на поглинанні світла атомами елементів в газовому стані. Змінюючи довжину хвилі світла, можна визначити кількість конкретних елементів у зразку.
2. Атомно-емісійна спектроскопія (АЕС): Цей метод вимірює енергію світла, яке випромінюють атоми елементів під час нагрівання. Це дозволяє визначити наявність та
кількість певних елементів.
3. Мас-спектрометрія: Цей метод дозволяє вимірювати масу окремих атомів та молекул у зразку. Аналізується розподіл мас, що дозволяє визначити елементний склад.
4. Ядерний магнітний резонанс (ЯМР) спектроскопія: Цей метод використовує магнітне поле для вивчення взаємодії ядер атомів з магнітним полем. Дозволяє визначити взаємодію атомів та встановити їх елементний склад.
5. Електронна мікроскопія з енергодисперсійною рентгенофлуоресцентною спектроскопією (EDS): Цей метод використовується у мікроскопах для аналізу поверхні зразків. Він дозволяє вимірювати енергію рентгенівського випромінювання, що дозволяє визначити елементний склад речовини.
Ці методи постійно розвиваються, стають більш точними та швидкими, що дозволяє вченим та інженерам здійснювати нові дослідження та розвивати нові технології. Вони є важливим інструментом для досягнення нових знань та забезпечення сталого розвитку.
§ 5. Алкани: ізомерія та номенклатура Контрольні запитання
shkola.in.ua
52. За якими ознаками класифікують вуглеводні? Уважно розгляньте схе-му класифікації вуглеводнів на с. 28. Які сполуки виділяють серед вуг-леводнів? Які їхні характерні ознаки? Назвіть перших представників цих класів сполук. Вуглеводні класифікують за декількома ознаками: 1. Кількість атомів вуглецю: Вуглеводні можуть бути розділені на тривалі, насичені та ненасичені, залежно від кількості вуглецевих атомів у молекулі.
- Тривалі вуглеводні: Містять велику кількість вуглецевих атомів у молекулі, наприклад, алкани.
- Насичені вуглеводні: Містять тільки одинарні зв'язки між атомами вуглецю, наприклад, алкани.
- Ненасичені вуглеводні: Містять подвійні або потрійні зв'язки між атомами вуглецю, наприклад, алкени та алкіни. 2. Тип зв'язку між атомами вуглецю: Вуглеводні можуть бути класифіковані на аліфатичні та ароматичні сполуки.
- Аліфатичні вуглеводні: Містять лінійні або розгалужені ланцюжки атомів вуглецю.
- Ароматичні вуглеводні: Мають кільцеву або ароматичну структуру, зокрема, бензольне кільце.
Щодо сполук, що виділяються серед вуглеводнів, основні класи включають:
1. Алкани:
- Характерні ознаки: Складаються з одинарних зв'язків між атомами вуглецю та мають насичену структуру (тобто кожен вуглецевий атом насичений воднем).
- Перший представник: Метан (CH4).
2. Алкени:
- Характерні ознаки: Містять принаймні один подвійний зв'язок між атомами вуглецю, що робить їх ненасиченими.
- Перший представник: Етен (етилен, C2H4).
3. Алкіни:
- Характерні ознаки: Містять принаймні один потрійний зв'язок між атомами вуглецю, також є ненасиченими.
- Перший представник: Етін (етин, C2H2).
4. Ароматичні вуглеводні:
- Характерні ознаки: Мають ароматичну структуру, основану на бензольному кільці (шестикутне кільце з атомами вуглецю, що чергуються з одинарними та подвійними зв'язками).
- Перший представник: Бензол (C6H6). Зазначені перші представники є найпростішими з кожного класу вуглеводнів. У природі та промисловості існує велика кількість різних вуглеводнів з різними складнішими структурами, які грають важливу роль у нафтовидобуванні, виробництві палив, хімічних реакціях та інших сферах життя.
53. Яка ізомерія характерна для алканів? Наведіть приклади ізомерів се-ред алканів.
Для алканів характерна структурна ізомерія. Структурна ізомерія означає, що молекули мають однакову хімічну формулу, але відрізняються у способі розміщення атомів у молекулі. Зміна структури може включати розгалужені ланцюжки, різні розташування функціональних груп або обмін позицій атомів. Приклади структурних ізомерів серед алканів:
1. Бутан (C4H10):
shkola.in.ua
- Нормальний бутан (бутан): CH3-CH2-CH2-CH3
- Ізобутан (метилпропан): (CH3)3-C-Н
2. Пентан (C5H12):
- Нормальний пентан: CH3-CH2-CH2-CH2-CH3
- 2-Метилбутан: CH3-CH(CH3)-CH2-CH3
- 2,2-Диметилпропан: (CH3)3C-CH2-CH3
3. Гексан (C6H14):
- Нормальний гексан: CH3-CH2-CH2-CH2-CH2-CH3
- 2-Метилпентан: CH3-CH(CH3)-CH2-CH2-CH3
- 3-Метилпентан: CH3-CH2-CH(CH3)-CH2-CH3
- 2,2-Диметилбутан: (CH3)2C(CH3)2
- 2,3-Диметилбутан: CH3-CH(CH3)-CH(CH3)-CH3
Таким чином, хімічна формула для всіх зазначених сполук - C4H10, C5H12 та C6H14, але їхні структури відрізняються. Кожна з цих структур має вплив на хімічні, фізичні
реактивні властивості сполук.
54. Який порядок складання назв алканів за систематичною номенклатурою?
Систематична номенклатура для найпростіших алканів базується на Міжнародній углеводній номенклатурі (IUPAC - International Union of Pure and Applied Chemistry).
Цей підхід забезпечує однозначний спосіб називання алканів на основі їхньої хімічної структури. Основний порядок складання назв алканів наступний:
1. Вибір головного ланцюжка: Знайдіть найбільший неперервний ланцюжок вуглецевих атомів у молекулі. Цей ланцюжок буде головним ланцюжком.
2. Нумерація атомів вуглецю: Присвойте номери атомам вуглецю у головному ланцюжку так, щоб номера були найменшими можливими для атомів, на яких знаходяться функціональні групи або гідроксильні групи. Нумерація починається з того кінця ланцюжка, де назва алкану має найменший номер. 3. Встановлення префікса: Префікс визначає кількість вуглецевих атомів у головному ланцюжку. Залежно від кількості вуглецевих атомів, можуть використовуватися такі префікси:
- 1 вуглецевий атом: мет-
- 2 вуглецеві атоми: ет-
- 3 вуглецеві атоми: проп-
- 4 вуглецеві атоми: бут-
- 5 вуглецевих атомів: пент-
- 6 вуглецевих атомів: гекс-
- 7 вуглецевих атомів: гепт-
- 8 вуглецевих атомів: окт-
- 9 вуглецевих атомів: нон-
- 10 вуглецевих атомів: дек-
4. Встановлення суфікса: Суфікс вказує на присутність алкану у сполуці. Для алканів суфікс -ан.
5. Вказання замісників: Якщо у молекулі присутні замісники (інші функціональні групи або гідроксильні групи), вони названі перед іменем алкану. Замісники вказуються за допомогою префіксів та номерів атомів вуглецю, на яких вони розташовані.
6. Запис назви: Замісники та ім'я головного ланцюжка записуються разом у алфавітному порядку. Якщо є декілька однакових замісників, то їх повторюють у круглих дужках із зазначенням кількості. Приклади назв алканів:
shkola.in.ua
1. CH3-CH2-CH2-CH3: Бутан
2. CH3-CH(CH3)-CH2-CH3: 2-Метилбутан
3. CH3-CH2-CH(CH3)-CH3: 2,2-Диметилпропан
4. CH3-CH(CH3)-CH2-CH2-CH3: 3-Метилпентан
5. CH3-CH2-CH(CH3)-CH(CH3)-CH3: 2,3-Диметилбутан Це основний порядок складання назв алканів за систематичною номенклатурою, який дозволяє однозначно ідентифікувати структуру різних алканів.
та
55. Як називають замісник, утворений: а) з метану; б) етану; в) пропану?
Для назви замісника, утвореного з різних алканів, застосовується додатковий префікс, який вказує на кількість вуглецевих атомів у молекулі замісника. Далі наведено
приклади назв замісників, утворених з метану (CH4), етану (C2H6) та пропану (C3H8): а) Замісник з метану (CH4) - метил:
- CH3- (метилова група)
Наприклад: Метан (CH4) має замісник метил, утворений відповідною метиловою групою (CH3-).
б) Замісник з етану (C2H6) - етил:
- CH3-CH2- (етилова група)
Наприклад: Етан (C2H6) має замісник етил, утворений етиловою групою (CH3-CH2-).
в)
Замісник з пропану (C3H8) - пропил:
- CH3-CH2-CH2- (пропилова група)
Наприклад: Пропан (C3H8) має замісник пропил, утворений пропиловою групою (CH3-CH2-CH2-).
Завдання для засвоєння матеріалу
56. Скільки хімічних зв’язків C–C та C–H у молекулах: а) етану; б) 2-метилпропану; в) бутану? Для обчислення кількості хімічних зв'язків C–C та C–H у молекулах алканів, давайте розглянемо кожний зазначений вами приклад: а) Етан (C2H6):
- Хімічні зв'язки C–C: 1 (між двома атомами вуглецю).
- Хімічні зв'язки C–H: 6 (між атомами вуглецю та атомами водню). б) 2-Метил-пропан (C4H10):
- Хімічні зв'язки C–C: 4 (один між атомами вуглецю у головному ланцюжку, і три між атомами вуглецю у метильній групі).
- Хімічні зв'язки C–H: 10 (дев'ять між атомами вуглецю та атомами водню у головному ланцюжку, і один між атомами вуглецю та атомом водню у метильній групі). в) Бутан (C4H10):
- Хімічні зв'язки C–C: 4 (між чотирма атомами вуглецю).
- Хімічні зв'язки C–H: 10 (між десятьма атомами вуглецю та атомами водню). 57. Серед наведених вуглеводнів визначте, які з них є насиченими: C7H14, C2H2, C8H8, C6H6, C10H22. Насичені вуглеводні є алканами, що містять лише одинарні зв'язки між атомами вуглецю. Давайте перевіримо наведені вуглеводні та визначимо, які з них є насиченими:
1. C7H14: Цей вуглеводень має хімічну формулу C7H14. Давайте перевіримо, чи має він лише одинарні зв'язки між атомами вуглецю:
C-C-C-C-C-C-C Оскільки маємо лише одинарні зв'язки (суцільні лінії), то C7H14 є насиченим алканом.
shkola.in.ua
2. C2H2: Цей вуглеводень має хімічну формулу C2H2. Перевіримо, чи має він лише одинарні зв'язки між атомами вуглецю:
C≡C Вуглеводень C2H2 містить потрійний зв'язок між атомами вуглецю, тому він є ненасиченим і не є алканом.
3. C8H8: Цей вуглеводень має хімічну формулу C8H8. Перевіримо, чи має він лише одинарні зв'язки між атомами вуглецю:
C=C-C=C-C=C-C=C
Вуглеводень C8H8 містить подвійні
зв'язки між атомами вуглецю, тому він є ненасиченим і не є алканом.
4. C6H6: Цей вуглеводень має хімічну формулу C6H6. Перевіримо, чи має він лише одинарні зв'язки між атомами вуглецю:
C=C-C=C-C=C
Вуглеводень C6H6 містить подвійні
зв'язки між атомами вуглецю, тому він є ненасиченим і не є алканом.
5. C10H22: Цей вуглеводень має хімічну формулу C10H22. Перевіримо, чи має він лише одинарні зв'язки між атомами вуглецю:
C-C-C-C-C-C-C-C-C-C
Оскільки маємо лише одинарні зв'язки (суцільні лінії), то C10H22 є насиченим алканом.
Отже, серед наведених вуглеводнів насиченими (алканами) є C7H14 та C10H22, а C2H2, C8H8 та C6H6 є ненасиченими.
58. Складіть структурні формули всіх алканів з п’ятьма та сіма атомами Карбону в молекулі. Назвіть їх. Складіть структурні формули всіх алканів з п'ятьма та сіма атомами вуглецю в молекулі: Алкани з п'ятьма атомами вуглецю (пентани):
1. Назва: Пентан (n-пентан)
Структурна формула: CH3-CH2-CH2-CH2-CH3
2. Назва: 2-Метилбутан
Структурна формула: CH3-CH(CH3)-CH2-CH3
3. Назва: 2,2-Диметилпропан
Структурна формула: (CH3)2C(CH3)2
Алкани з сімома атомами вуглецю (гептани):
1. Назва: Гептан (n-гептан)
Структурна формула: CH3-CH2-CH2-CH2-CH2-CH2-CH3
2. Назва: 2-Метилпентан Структурна формула: CH3-CH(CH3)-CH2-CH2-CH2-CH3
3. Назва: 3-Метилпентан Структурна формула: CH3-CH2-CH(CH3)-CH2-CH2-CH3
4. Назва: 2,2-Диметилбутан Структурна формула: (CH3)2C(CH3)2
5. Назва: 2,3-Диметилбутан Структурна формула: CH3-CH(CH3)-CH(CH3)-CH3
59. Яка молекулярна формула алкану з 14 атомами Карбону? Молекулярна формула алкану з 14 атомами вуглецю може бути знайдена за допомогою загальної формули для алканів: CnH2n+2, де "n" - кількість вуглецевих атомів у молекулі.
Для алкану з 14 атомами вуглецю (n = 14), молекулярна формула буде:
shkola.in.ua
C14H2(14)+2 = C14H30
Отже, молекулярна формула алкану з 14 атомами вуглецю - C14H30.
60. Складіть молекулярну формулу алкану, молекули якого містять: а) 18 ато-мів Карбону; б) 36 атомів Гідрогену.
Для складання молекулярної формули алкану, який містить певну кількість атомів вуглецю (C) та гідрогену (H), можна скористатись загальною формулою для алканів: CnH2n+2, де "n" - кількість вуглецевих атомів у молекулі.
а) Алкан з 18 атомами вуглецю: n = 18
Молекулярна формула: C18H2(18)+2 = C18H38
б) Алкан з 36 атомами водню:
H = 36



Щоб знайти "n" (кількість вуглецевих атомів), можна скористатись загальною
формулою та переписати її у вигляді "n = (H - 2) / 2":
n = (36 - 2) / 2 = 34 / 2 = 17
Молекулярна формула: C17H2(17)+2 = C17H36
Отже, молекулярна формула алкану з 18 атомами вуглецю - C18H38, а з 36 атомами водню - C17H36.
61. Укажіть, які з наведених структурних формул відповідають одним і тим самим сполукам:
Відповідь: г, д, е
62. Серед наведених структурних формул знайдіть формули ізомерів та гомологів.
Відповідь: гомологи: а, б, е
ізомери: д, в, г
63. Складіть назви всіх речовин, структурні формули яких наведено в цьому параграфі.
64. Складіть назви сполук за наведеними структурними формулами.
shkola.in.ua
shkola.in.ua


65. Складіть структурні формули: а) 3-метилпентану; б) 2,3-диметилгексану; в) 2,4дихлоропентану; г) 1,2-дибромоетану; д) 2,2,3-триметилпен-тану; е) 3-етил-2,5-
диметилгексану; є) 3,3-діетилпентану; ж) 2,2,3,3-те-траметилбутану.
Давайте складемо структурні формули для кожного з наведених алканів:
а) 3-метилпентан:
Структурна формула: CH3-CH(CH3)-CH2-CH2-CH3
б) 2,3-диметилгексан: Структурна формула: CH3-CH(CH3)-CH2-CH(CH3)-CH2-CH3
в) 2,4-дихлоропентан: Структурна формула: CH3-CH(Cl)-CH2-CH(Cl)-CH3
г) 1,2-дибромоетан:
Структурна формула: Br-CH2-Br
д) 2,2,3-триметилпентан:
Структурна формула: (CH3)3C-CH2-CH2-CH3
е) 3-етил-2,5-диметилгексан:

Структурна формула: CH3-CH(CH3)-CH2-CH(CH3)-CH2-CH2-CH3
є) 3,3-діетилпентан:
Структурна формула: CH3-CH2-CH(CH3)-CH2-CH2-CH3
ж) 2,2,3,3-тетраметилбутан:
Структурна формула: (CH3)3C-CH(CH3)-CH(CH3)-CH3
Будь ласка, зверніть увагу, що в назвах розгалуженості позначаються числовими префіксами (наприклад, 2-метил, 3-етил) та вказується положення замісників у головному вуглеводневому ланцюжку. На структурних формулах явно видно розміщення груп атомів у молекулі. 66. За наведеними моделями молекул алканів складіть їхні скорочені структурні формули та назви.
shkola.in.ua
67. Із наведених сполук випишіть окремо: а) ізомери гексану; б) гомологи гексану. 2-метилпентан, 2-метилбутан, 2,2-диметилбутан, 3-метилпентан, бутан, 2хлоропропан.
а) Ізомери гексану:
1. 2-Метилпентан: CH3-CH(CH3)-CH2-CH2-CH3
2. 3-Метилпентан: CH3-CH2-CH(CH3)-CH2-CH3
б) Гомологи гексану:
1. Бутан: CH3-CH2-CH2-CH3
Гомолог гексану з 4 вуглецевими атомами.
2. 2-Метилбутан: CH3-CH(CH3)-CH2-CH3
Інший гомолог гексану з 4 вуглецевими атомами.
3. 2,2-Диметилбутан: (CH3)3C-CH3
Інший гомолог гексану з 4 вуглецевими атомами.
4. 2-Хлоропропан: CH3-CHCl-CH3
Гомолог гексану з 3 вуглецевими атомами.
68. Серед наведених хлоропохідних етану визначте ті, що можуть існувати у
вигляді кількох ізомерів:
C2H5Cl, C2H4Cl2, C2H3Cl3, C2H2Cl4, C2HCl5, C2Cl6. Складіть структурні формули та назви всіх можливих ізомерів.
Для визначення того, які хлоропохідні етану можуть існувати у вигляді кількох ізомерів, давайте перевіримо, скільки у них можливих розміщень хлорових атомів на вуглецевих атомах.
1. C2H5Cl: Цей хлоропохідний етану має один хлоровий атом. Структурна формула: CH3-CH2-Cl Назва: Хлоретан
2. C2H4Cl2: Цей хлоропохідний етану має два хлорових атома. Структурна формула: CH2Cl-CH2Cl Назва: 1,2-Дихлоретан
3. C2H3Cl3: Цей хлоропохідний етану має три хлорових атома. Структурна формула: CHCl2-CH2Cl Назва: 1,1,2-Трихлоретан
4. C2H2Cl4: Цей хлоропохідний етану має чотири хлорових атома.
Структурна формула: C(Cl)2=CH-Cl
Назва: 1,1,1,2-Тетрахлоретан
5. C2HCl5: Цей хлоропохідний етану має п'ять хлорових атомів. Структурна формула: C(Cl)2=CH-Cl
Назва: 1,1,1,1,2-Пентахлоретан
6. C2Cl6: Цей хлоропохідний етану має шість хлорових атомів.
Структурна формула: C(Cl)2=CH-Cl
Назва: 1,1,1,1,1,2-Гексахлоретан
shkola.in.ua
Таким чином, хлоропохідний етану C2H5Cl має один ізомер, C2H4Cl2 має один ізомер, C2H3Cl3 має один ізомер, а C2H2Cl4, C2HCl5 та C2Cl6 не мають можливих ізомерів.
Комплексні завдання
69. Хлоропохідна насиченого вуглеводню має відносну молекулярну масу 237. У цій сполуці масова частка Хлору становить 89,9 %, Карбону 10,1 %. Визначте її молекулярну формулу.
Дано:
Mr (CxCly) = 237 г/моль;
ω (C CxCly) = 10,1 %;
ω (Cl CxCly) = 89,9 %.
Визначити:
x, y – формулу сполуки.
Рішення:
Знайдемо молярні маси кожного елемента у поєднанні через пропорції:
237 г/моль - 100%
x г/моль - 10,1%
x = 23,9 ≈ 24 (г/моль) – вуглецю у поєднанні.
237 г/моль - 100%
y г/моль - 89,9%
y = 213 (г/моль) – хлору у поєднанні.
Тепер отримані числа розділимо на відповідні молярні маси елементів, щоб одержати
число атомів того чи іншого елемента з'єднання:
Вуглець:
24 ÷ 12 = 2.
Хлор:
213 ÷ 35,5 = 6.
Таким чином, ми отримуємо сполуку C₂Cl₆ – гексахлоретан.
Відповідь: C₂Cl₆.
Завдання з розвитку критичного мислення
70. Запропонуйте алгоритм для складання формул усіх можливих ізомерів алканів. На які моменти слід звернути особливу увагу? Складання формул усіх можливих ізомерів алканів може бути завданням, що вимагає уважності та методичного підходу. Ось алгоритм, який може допомогти вам у цьому процесі:
1. Визначте кількість вуглецевих атомів (n) у молекулі алкану.
2. Виберіть основний ланцюжок вуглецевих атомів для будівлі молекули алкану. Зазвичай це найдовший ланцюжок.
3. Розташуйте вуглецеві атоми в основному ланцюжку лінійно (ланцюжкові ізомери) та зрозгалуженостями (розгалужені ізомери).
4. З’ясуйте, де можливо розташування замісників (наприклад, метильних груп CH3) на основному ланцюжку або його гілках.
5. Розташуйте хлорові атоми (або інші замісники) на відповідних вуглецевих атомах відповідно до їхніх масових часток та можливості існування молекули з таким розташуванням.
6. Зверніть увагу на симетричність та еквівалентність атомів у молекулі, оскільки це може призводити до ізомерів.
7. Звірте отримані структурні формули зі сполученням валентності та створіть назви для кожного ізомеру відповідно до систематичної номенклатури.
shkola.in.ua
Особливу увагу слід звернути на: - Кількість вуглецевих атомів у молекулі, яка визначає можливу довжину ланцюжка. - Розташування замісників, яке може змінюватися на різних атомах ланцюжка, що призводить до різних ізомерів. - Масову частку замісників (наприклад, хлору), яка може впливати на кількість та розташування замісників у молекулі.
Важливо бути уважним та дотримуватись логіки, роблячи всі можливі комбінації
розташування атомів у молекулі алкану, щоб знайти всі можливі ізомери.
71. Студент помилково назвав сполуку 1,1,1-триметилетан. Якою має бути назва цієї сполуки?
Назва "1,1,1-триметилетан" містить помилку. Правильна назва цієї сполуки - "2,2,3триметилбутан".
Давайте розберемо це: 1. Число "1,1,1" вказує на положення замісника в ланцюжку вуглецевих атомів. У назві "1,1,1-триметилетан" це означало б, що замісник (метильна група, CH3) прикріплений до першого вуглецевого атома в ланцюжку. Проте, таке положення замісника не є правильним для молекули з трьома метильними групами.
2. Правильна назва - "2,2,3-триметилбутан" - вказує, що третя метильна група (CH3) прикріплена до третього вуглецевого атома в ланцюжку. Отже, правильна назва цієї сполуки - "2,2,3-триметилбутан".
72. Як ви вважаєте, чому ізомери мають різні хімічні та фізичні властивості?
Ізомери мають різні хімічні та фізичні властивості через відмінності у їхній молекулярній структурі, що впливає на їхню взаємодію з іншими речовинами та фізичні явища. Ось декілька причин, які пояснюють різницю властивостей ізомерів: 1. Молекулярна структура: Ізомери мають різні атомні та молекулярні структури, включаючи розміщення та послідовність атомів у молекулі. Це може впливати на положення та тип хімічних зв'язків, що веде до різної хімічної стійкості та реактивності. 2. Розмір та форма молекули: Різний розмір та форма молекул можуть впливати на міжмолекулярні силові взаємодії, такі як ван-дер-Ваальсові сили. Це може призводити до різних температур плавлення та кипіння, а також розчинність у різних речовинах. 3. Полярність та поляризованість: Розташування та тип функціональних груп у молекулі може впливати на її полярність та поляризованість. Ізомери з різними полярними
характеристиками можуть взаємодіяти з розчинниками, кислотами або основами порізному.
4. Конформація: У деяких ізомерів може бути можливість змінювати їхню конформацію, тобто структурні форми молекули при однаковій хімічній структурі. Різні конформації можуть впливати на взаємодію молекул з оточуючими середовищем.
5. Реакції та взаємодії: Різна хімічна структура ізомерів може визначати їхню здатність до участі в різних хімічних реакціях та взаємодії з іншими хімічними речовинами. Таким чином, різниця в молекулярній структурі між ізомерами призводить до відмінностей у їхніх хімічних та фізичних властивостях, що зроблює їх унікальними речовинами з різними застосуваннями.
Міні-проект
shkola.in.ua
73. Диметилмеркурій — органічна сполука, в якій два метильні залишки сполучаються з атомом Меркурію. Ця речовина становить значну екологічну загрозу для живих організмів, особливо мешканців водойм. Знайдіть інформацію, як ця сполука впливає на живі істоти. В яких місцевостях поширена ця сполука? Чи є загроза для вашої місцевості? Диметилмеркурій (CH3HgCH3) - це органічний сполук, яка відома своїм високим токсичним впливом на живі організми, зокрема на нервову систему. Ця речовина може бути дуже небезпечною, і її токсичні властивості роблять її небажаною в природних середовищах.
Ось деякі важливі аспекти щодо токсичності диметилмеркурію:
1. Токсичність для нервової системи: Диметилмеркурій може проникати через гематоенцефалічний бар'єр, що означає, що він може проникати до центральної нервової системи. Висока експозиція диметилмеркурію може призвести до серйозних неврологічних проблем, включаючи втрату пам'яті, зниження інтелектуальних
здібностей, тремор і навіть летальний результат.
2. Біологічна накопичуваність: Диметилмеркурій має тенденцію накопичуватися в
живих тканинах, особливо в печінці і нирках, що може призводити до хронічного
навантаження на організм.
3. Водойми: Однією з основних шляхів забруднення диметилмеркурієм є викиди у водойми або річки. Там він може аккумулюватися в рибі та інших водних організмах, що призводить до токсичного впливу на тварин і людей, які харчуються цими організмами.
4. Відстань поширення: Хоча диметилмеркурій є токсичною речовиною, він зазвичай не поширений в широких масштабах у природних середовищах. Він може з'являтися як наслідок промислових діяльностей, таких як виробництво або використання ртуті. Щодо загрози для вашої місцевості, важливо звернутися до даних про забруднення навколишнього середовища у вашому регіоні. Якщо ви мешкаєте недалеко від промислових джерел або водойм, які можуть бути забруднені диметилмеркурієм, то може існувати певний ризик. Рекомендується ознайомитися з даними місцевих органів з охорони довкілля та екологічних організацій, щоб з'ясувати рівень та наявність диметилмеркурію у вашому районі та вжити заходів для мінімізації ризику впливу на здоров'я та довкілля.
§6. Алкани: фізичні й хімічні властивості Контрольні запитання
74. Схарактеризуйте фізичні властивості алканів. Як змінюються температури плавлення й кипіння алканів у гомологічному ряду? Поясніть чому. Фізичні властивості алканів залежать від їхньої молекулярної структури та міжмолекулярних сил, що діють між ними. Основними фізичними властивостями алканів є температура плавлення та кипіння. Температура плавлення: - Температура плавлення алканів збільшується зі збільшенням молекулярної маси алканів.
- У гомологічному ряду алканів температура плавлення зазвичай збільшується при переході від менших до більших алканів.
Температура кипіння:
shkola.in.ua
- Температура кипіння алканів збільшується зі збільшенням молекулярної маси та довжини ланцюжка алканів. - У гомологічному ряду алканів температура кипіння також зазвичай збільшується при переході від менших до більших алканів. Причина зміни температур плавлення й кипіння алканів у гомологічному ряду пов'язана зі зміною молекулярної маси та довжини ланцюжка: 1. Збільшення молекулярної маси: Зі збільшенням молекулярної маси атоми стають важчими, що призводить до збільшення міжмолекулярних взаємодій. Такі молекули мають більше енергії, необхідної для подолання міжмолекулярних сил і переходу з рідкого або твердого стану у газоподібний стан, що підвищує температуру кипіння.
2. Довжина ланцюжка: Збільшення довжини ланцюжка алкану також збільшує контактну поверхню між молекулами. Це призводить до більш сильного зв'язку між ними, збільшуючи температуру кипіння. Отже, температури плавлення й кипіння алканів у гомологічному ряду залежать від молекулярної маси та довжини ланцюжка, а також від типу і сили міжмолекулярних взаємодій. Такі зміни у властивостях алканів у гомологічному ряду є характерною
рисою для цієї класу органічних сполук.
75. Які типи реакцій характерні для алканів? Чим це зумовлено? Відповідь
проілюструйте прикладами.
Для алканів, як насичених вуглеводнів, характерними є тільки дві основні типи реакцій: горіння (окислення) та реакції зі слабкими електрофілами.
1. Горіння (окислення): Алкани можуть піддаватися повному окисленню у наявності достатньої кількості кисню. Це визначальна реакція для алканів, де вони займаються з киснем, утворюючи вуглекислий газ (CO2) та воду (H2O). Процес горіння є енергетично вигідним, і тому алкани служать як важливі джерела енергії.
Приклад горіння метану (CH4):
CH4 + 2O2 → CO2 + 2H2O
2. Реакції зі слабкими електрофілами: Алкани можуть утворювати адіційні реакції з електрофільними реагентами, такими як халкогени (хлор, бром) або сильні кислоти, якщо вони мають умовно позитивну дільницю. В таких реакціях електрофільний агент додається до алкану, замінюючи один з водневих атомів на атом іншого елемента. Приклад реакції хлору з метаном (хлорування): CH4 + Cl2 → CH3Cl + HCl Ці типи реакцій характерні для алканів через їхню насиченість (всі зв'язки між вуглецевими атомами - одинарні) та стабільність. Відсутність подвійних або потрійних зв'язків у молекулах алканів робить їх менш реактивними порівняно з іншими класами органічних сполук, такими як алкени та алкіни. Тому алкани виявляють відносну стійкість у порівнянні з іншими класами органічних сполук, що зумовлює обмеженість типів реакцій, які вони можуть здійснювати. 76. Які хімічні зв’язки в молекулах алканів розриваються під час: а) галогенування; б) крекінгу?
shkola.in.ua
а) Галогенування алканів відбувається під час реакції з галогенами, такими як хлор (Cl2) або бром (Br2). Під час цієї реакції відбувається заміщення одного або декількох водневих атомів в молекулі алкану на атоми галогену. При цьому, розриваються водневі зв'язки у молекулі алкану.Простіше кажучи, реакція галогенування відбувається через заміщення водневих атомів галогенними атомами в молекулі алкану. Наприклад, при галогенуванні метану (CH4) хлором (Cl2), може утворитися хлорметан (CH3Cl): CH4 + Cl2 → CH3Cl + HCl б) Крекінг (розщеплення) алканів - це процес термічного розкладання довгих ланцюжків алканів на більш короткі фрагменти. У цьому процесі розриваються зв'язки між вуглецевими атомами у молекулі алкану, утворюючи короткі алканові ланцюги та алкенові або алкінові з'єднання. Наприклад, у крекінгу децилбутану (C10H22), довгий алкановий ланцюг розщеплюється на два коротких ланцюги - бутан (C4H10) та пентен (C5H10): C10H22 → C4H10 + C5H10 Крекінг є важливим процесом у нафтопереробній промисловості, де довгі алканові ланцюги, які містяться у важких нафтопродуктах, розщеплюються на більш цінні легкі вуглеводні, такі як бензин або етилен.
77. Яке згоряння (повне чи неповне) відбувається під час горіння парафі- нової свічки? За якою ознакою можна зробити такий висновок?
Під час горіння парафінової свічки відбувається неповне згорання. Це можна зрозуміти за допомогою спостережень за пламенем свічки.Парафінові свічки складаються з парафіну, який є насиченим вуглеводнем. Під час горіння свічки, парафін реагує з киснем повітря, ідеальним результатом такої реакції має бути повне згорання, де усі вуглецеві атоми парафіну з'єднуються з киснем, утворюючи лише вуглекислий газ (CO2) та воду (H2O):
C25H52 + 38O2 → 25CO2 + 26H2O
Однак, під час горіння свічки зазвичай утворюються дим, кількість дыму залежить від умов згоряння. Це свідчить про неповне згорання, коли частина парафіну згорає не повністю, і утворюються дрібні вуглецеві частинки, які складаються у дим.
Неповне згорання може бути викликане різними факторами, такими як недостатня кількість кисню, недостатня температура горіння, або обмежена доступність повітря. Це часто спостерігається у замкнених приміщеннях або при низькій вентиляції.
Особливості неповного згорання в парафінових свічках призводять до утворення диму, брудних стін та стелі, і важкого дихання в замкненому приміщенні. Щоб уникнути цього, важливо використовувати свічки у добре провітрюваних приміщеннях та забезпечити достатню кількість кисню для повного згорання парафіну.
Завдання для засвоєння матеріалу 78. Поясніть, чому алкани є малополярними речовинами. Алкани є малополярними речовинами через хімічну природу їхніх зв'язків і молекулярну структуру. Алкани складаються з послідовності вуглецевих атомів, до яких приєднані атоми водню. Усі зв'язки між вуглецевими атомами в алканах є одинарними зв'язками (C-C), а між вуглецевими та водневими атомами є також одинарні зв'язки (C-H).
shkola.in.ua
Такі одинарні зв'язки не мають заряду і не створюють досить сильних дипольних моментів, які характерні для більш складних хімічних зв'язків, наприклад, подвійних або потрійних зв'язків. Це означає, що у молекулах алканів немає значних нерівномірних розподілів електронної щільності, і вони не проявляють великої полюсності.Відсутність значних дипольних моментів у молекулах алканів робить їх малополярними речовинами. Це означає, що алкани слабко взаємодіють з іншими полярними речовинами, такими як вода, і майже не розчиняються в них. Замість цього, алкани краще розчиняються в неполярних розчинниках, таких як бензин, нафта, етер, ацетон та інші органічні розчинники, які мають подібну малополярну природу.Ця малополярність алканів також впливає на їх фізичні властивості, такі як температури плавлення та кипіння, розчинність та поведінку у різних середовищах. 79. Якщо в калюжу на вулиці потрапить крапля бензину, то що ми спостерігатимемо? Відповідь поясніть. Якщо в калюжу на вулиці потрапить крапля бензину, то ми спостерігатимемо, що крапля бензину швидко розтікається по поверхні калюжі, утворюючи тонкий плівок.Це відбувається через особливу фізичну властивість бензину - його низька поверхнева напруга. Поверхнева напруга - це сила, яка діє на молекули на поверхні рідини та спричиняє утворення поверхневого шару. Бензин має низьку поверхневу напругу порівняно з багатьма іншими рідинами, такими як вода.Тому, коли крапля бензину потрапляє на поверхню калюжі, молекули бензину швидко розповсюджуються по поверхні, утворюючи тонкий плівок. Цей плівок легко розтікається, і бензин швидко розгладжується по всій поверхні калюжі.Такий ефект може спостерігатися також із
багатьма іншими малополярними рідинами, такими як нафта, етер, ацетон тощо. Це важливий аспект при розумінні поведінки рідин на різних поверхнях і може викликати інтересні явища, такі як змочування та капілярна дія. 80. Складіть реакції горіння гексану з виділенням: а) вуглекислого газу; б) чадного
газу; в) вуглецю.
а) Реакція горіння гексану з виділенням
C6H14 + 19O2 → 6CO2 + 7H2O
вуглекислого газу (CO2):
б) Реакція горіння гексану з виділенням чадного газу (СО):
2C6H14 + 19O2 → 12CO + 14H2O
в) Реакція горіння гексану з виділенням вуглецю (С):
2C6H14 + 13O2 → 12CO + 14H2O
81. Складіть рівняння реакцій взаємодії етану кількістю речовини 1 моль із хлором кількістю: а) 1 моль; б) 2 моль; в) 3 моль.
а) Реакція взаємодії 1 моля етану з 1 молем хлору:
C2H6 + Cl2 → C2H5Cl + HCl
б) Реакція взаємодії 1 моля етану з 2 молями хлору:
C2H6 + 2Cl2 → C2H4Cl2 + 2HCl
в) Реакція взаємодії 1 моля етану з 3 молями хлору:
C2H6 + 3Cl2 → C2H3Cl3 + 3HCl
82. Складіть рівняння реакцій бромування: а) етану; б) бутану; в) 2-метил- бутану; г) 2,2-диметилбутану. Назвіть продукти реакцій. а) Реакція бромування етану:
C2H6 + Br2 → C2H5Br + HBr
Продукти реакції: брометан (етилбромід) та водень бромистий. б) Реакція бромування бутану:
C4H10 + 2Br2 → C4H9Br + HBr + Br2
Продукти реакції: бутанбромід (ізобутілбромід) та водень бромистий. в) Реакція бромування 2-метилбутану: C5H12 + Br2 → C5H11Br + HBr Продукти реакції: 2-метилбутанбромід (ізопропілбромід) та водень бромистий. г) Реакція бромування 2,2-диметилбутану:
C6H14 + Br2 → C6H13Br + HBr
Продукти реакції: 2,2-диметилбутанбромід (нейзо-пентилбромід) та водень бромистий. 83. Під час промислового хлорування пропану отримують суміш ізомерних дихлоропропанів. Складіть їхні формули. Під час промислового хлорування пропану можуть утворюватися наступні ізомери дихлоропропану:
1,2-дихлоропропан:
CH3—CH—CH3
1,3-дихлоропропан:
CH3 CH2 CH2Cl
Cl |
| Cl
Cl |
shkola.in.ua
1,1-дихлоропропан: Cl
CH3—C—CH3
У залежності від умов реакції, можуть утворюватися різні ізомери дихлоропропану з різним розташуванням хлору на вуглецевих атомах. Оскільки у пропані є два однакові водневі атоми, можливі різні комбінації хлору на цих атомах, що призводить до утворення різних ізомерів.
84. Укажіть число структурних ізомерів сполуки із загальною формулою C4H9Cl. Для сполуки з загальною формулою C4H9Cl можуть існувати 5 структурних ізомерів:
1. 1-хлоробутан: CH3 CH2 CH2 CH2Cl
2. 2-хлоробутан: CH3—CHCl—CH2 CH3
3. 2-метил-1-хлоропропан: CH3 CH(CH3) CH2Cl
4. 2-метил-2-хлоропропан: CH3 C(CH3)2—CH2Cl
5. 1-метил-2-хлоропропан: CH3 CH(CH3) CH2Cl
мають різні розташування хлору на вуглецевих атомах, що дозволяє утворити різні структурні форми однієї і тієї ж хімічної формули. 85. Складіть рівняння реакцій: а) ізомеризації бутану; б) крекінгу бутану з утворенням сполук з однаковою довжиною карбонового ланцюга. а) Реакція ізомеризації бутану: Під час ізомеризації бутану між молекулами бутану відбувається перенесення гідрогенового атома від одного вуглецевого атома до іншого, утворюючи ізомери. Реакція відбувається в наявності каталізаторів, таких як алюміній хлорид (AlCl3) або кислоти.
б) Реакція крекінгу бутану з утворенням сполук з однаковою довжиною карбонового ланцюга:
Крекінг - це процес розщеплення довгих вуглеводневих ланцюгів на більш короткі, більш насичені і менш насичені сполуки. Під час крекінгу бутану може утворюватися етан і етен:
C4H10 → C2H6 + C2H4
У цій реакції бутан розщеплюється на молекули етану (C2H6) і етену (C2H4), які мають однакову довжину карбонового ланцюга.
shkola.in.ua
86. Складіть усі можливі рівняння реакцій крекінгу гептану, за аналогією крекінгу гексану, описаного в цьому параграфі (с. 45). Крекінг гептану (C7H16) може утворити різні сполуки шляхом розщеплення довгих вуглеводневих ланцюгів на більш короткі, більш насичені і менш насичені сполуки. У результаті крекінгу гептану можуть утворюватися, наприклад, етан (C2H6) і пропен (C3H6). Отже, рівняння реакцій крекінгу гептану будуть наступними: 1. Крекінг гептану на етан і пропен: C7H16 → C2H6 + C3H6
|
|
Cl
Ці ізомери
2. Крекінг гептану на етан і пропан:
C7H16 → C2H6 + C3H8
3. Крекінг гептану на бутан і пропен:
C7H16 → C4H10 + C3H6
4. Крекінг гептану на бутан і пропан:
C7H16 → C4H10 + C3H8
5. Крекінг гептану на ізобутан і пропен:
C7H16 → C4H10 + C3H6
6. Крекінг гептану на ізобутан і пропан:
C7H16 → C4H10 + C3H8
Таким чином, крекінг гептану може утворити різні комбінації більш коротких і більш насичених сполук, таких як етан, пропен, бутан і ізобутан, залежно від умов реакції та каталізаторів.
87. Під час очищення стічних вод, що містять домішки органічних речовин, методом бродіння виділяється газ із відносною густиною за киснем 0,5, що використовують на водоочисних станціях як пальне. Який це газ?
Газ із відносною густиною за киснем 0,5, що виділяється під час очищення стічних вод методом бродіння, це метан (CH4). Метан є основним компонентом природного газу та біогазу, який утворюється під час бродіння органічних речовин, таких як стічні води, в умовах відсутності кисню. Збираючи та очищуючи метан, його можна використовувати як пальне, що дозволяє використовувати його як відновлювану енергію та знижувати негативний вплив на навколишнє середовище. Комплексні завдання 88. Обчисліть об’єм хлорометану, що утвориться під час взаємодії метану об’ємом 11,2 л (н. у.) із хлором. Для знаходження об'єму хлорометану, що утвориться під час взаємодії метану з хлором, спочатку записуємо реакцію хлорування метану: CH4 + Cl2 → CH3Cl + HCl З цього рівняння видно, що 1 молекула метану (CH4) реагує з 1 молекулою хлору (Cl2) та утворює 1 молекулу хлорометану (CH3Cl) та 1 молекулу кислоти хлоридної (HCl). Тепер обчислимо кількість молекул хлору та хлорометану в заданому об'ємі метану. 1 моль газу при нормальних умовах (н. у.) займає об'єм приблизно 22,7 літра.
Кількість молекул метану:
n(CH4) = 11,2 л / 22,7 л/моль ≈ 0,493 моль
Кількість молекул хлору:
n(Cl2) = 0,493 моль (за реакцією стехіометрії)
Кількість молекул хлорометану:
n(CH3Cl) = 0,493 моль (за реакцією стехіометрії) Оскільки 1 моль газу містить приблизно 6,02 x 10^23 молекул, то можемо знайти
кількість молекул хлорометану: Кількість молекул хлорометану ≈ 0,493 моль x 6,02 x 10^23
молекул/моль ≈ 2,96 x 10^23
shkola.in.ua
молекул Отже, об'єм хлорометану, що утвориться під час взаємодії метану об'ємом 11,2 л (н. у.) із хлором, буде такий же, як об'єм метану, тобто 11,2 л (н. у.). 89. Під час крекінгу газуватого октану об’ємом 1 л утворилися два про- дукти реакції об’ємом по 1 л. Відносні густини за воднем обох про- дуктів реакції приблизно однакові. Складіть рівняння цієї реакції.
Задача полягає в знаходженні реакційного рівняння для крекінгу газуватого октану, знаючи, що утворилися два продукти реакції об'ємом по 1 л, а їхні відносні густини за воднем приблизно однакові. Згідно з умовами задачі, октан розщеплюється на два продукти, які мають однаковий об'єм (1 л) та приблизно однакову відносну густину за воднем. Оскільки відносні
густини за воднем газів пропорційні до їхніх молекулярних мас, то молекулярні маси
цих двох продуктів повинні бути приблизно однакові.
Один з можливих варіантів реакційного рівняння може мати такий вигляд: C8H18 (октан) → C4H10 (бутан) + C4H8 (бутен)
У цій реакції октан (C8H18) розщеплюється на бутан (C4H10) і бутен (C4H8), при чому молекулярні маси бутану та бутену приблизно однакові. Реакція відповідає умовам задачі, оскільки об'єм обох продуктів однаковий (1 л) та відносні густини за воднем також близькі, оскільки бутан та бутен мають схожі молекулярні маси. 90. Під час крекінгу газуватого гексану об’ємом 1 л утворилися два продукти реакції. Одного з продуктів утворилося також 1 л, а другого — у два рази більше. Відносні густини за повітрям обох продуктів реакції приблизно однакові. Складіть рівняння цієї реакції.
Задача полягає в знаходженні реакційного рівняння для крекінгу газуватого гексану, знаючи, що утворилися два продукти реакції, об'єми яких становлять 1 л та 2 л відповідно, а їхні відносні густини за повітрям приблизно однакові. Згідно з умовами задачі, гексан розщеплюється на два продукти, які мають об'єми 1 л та 2 л, а також мають приблизно однакову відносну густину за повітрям. Оскільки відносні густини газів пропорційні до їхніх молекулярних мас, то молекулярна маса першого продукту має бути приблизно вдвічі меншою за молекулярну масу другого продукту. Один з можливих варіантів реакційного рівняння може мати такий вигляд: C6H14 (гексан) → C3H8 (пропан) + C3H6 (пропен) У цій реакції гексан (C6H14) розщеплюється на пропан (C3H8) та пропен (C3H6), при чому молекулярна маса пропану більше вдвічі, ніж молекулярна маса пропену. Реакція відповідає умовам задачі, оскільки об'єм першого продукту (пропану) 1 л, об'єм другого продукту (пропену) - 2 л, і відносні густини за повітрям обох продуктів приблизно однакові, оскільки молекулярні маси пропану та пропену вдвічі відрізняються. 91. Обчисліть масу моногалогенопохідної речовини, що утвориться під час взаємодії пропану об’ємом 5,6 л (н. у.) з бромом. Для знаходження маси моногалогенопохідної речовини, що утвориться під час взаємодії пропану з бромом, спочатку записуємо реакцію галогенування пропану: C3H8 + Br2 → C3H7Br + HBr З цього рівняння видно, що 1 молекула пропану (C3H8) реагує з 1 молекулою брому (Br2) та утворює 1 молекулу моногалогенопохідної речовини (C3H7Br) та 1 молекулу кислоти гідроброму (HBr).
shkola.in.ua
Тепер обчислимо кількість молекул пропану та молекул моногалогенопохідної речовини в заданому об'ємі пропану. 1 моль газу при нормальних умовах (н. у.) займає об'єм приблизно 22,7 літра. Кількість молекул пропану:
n(C3H8) = 5,6 л / 22,7 л/моль ≈ 0,247 моль Кількість молекул моногалогенопохідної речовини:
n(C3H7Br) = 0,247 моль (за реакцією стехіометрії)
Оскільки молекулярна маса моногалогенопохідної речовини C3H7Br відповідає сумі молекулярних мас пропану (C3H8) та брому (Br2), то маса моногалогенопохідної
речовини дорівнює сумі мас пропану та брому:
Маса моногалогенопохідної речовини = маса пропану + маса брому
Тепер знайдемо масу моногалогенопохідної речовини:
Маса пропану:
Маса пропану = маса 1 молюкули пропану x кількість молекул пропану
Маса пропану ≈ 44,1 г/моль x 0,247 моль ≈ 10,9 г Маса брому:
Маса брому = маса 1 молюкули брому x кількість молекул брому
Маса брому ≈ 159,8 г/моль x 0,247 моль ≈ 39,5 г
Маса моногалогенопохідної речовини = 10,9 г + 39,5 г ≈ 50,4 г Отже, маса моногалогенопохідної речовини, що утвориться під час взаємодії пропану об'ємом 5,6 л (н. у.) з бромом, дорівнює приблизно 50,4 г. Завдання з розвитку критичного мислення 92. «Не існує нездійсненних реакцій. А якщо реакція не відбувається, то просто ще не винайдений відповідний каталізатор»,— писав М. Д. Зелінський. Як ви розумієте ці слова? Як їх можна проілюструвати з ви- користанням матеріалу цього параграфа?
Цитата М. Д. Зелінського вказує на те, що в принципі всі реакції можливі, але іноді вони можуть бути дуже повільними або не відбуватися взагалі без наявності певного каталізатора. Каталізатор - це речовина, яка прискорює реакцію, знижуючи енергію активації, але при цьому сама не споживається і залишається незмінною після реакції. Проілюструємо цю ідею на прикладі реакції горіння алканів. Алкани, як вуглеводні, можуть згорати в повітрі з утворенням CO2 і H2O, але без наявності каталізатора, такої як платина або родий, реакція буде повільною, і згорання відбудеться при високій температурі.
Наприклад, реакція горіння бутану може бути представлена рівнянням:
C4H10 + 6.5O2 → 4CO2 + 5H2O
Без каталізатора реакція буде відбуватися повільно, а при наявності каталізатора, такої як платина, реакція буде прискорена, і згорання відбудеться при значно нижчій
shkola.in.ua
температурі. Таким чином, знання про ролі каталізаторів допомагає зрозуміти, що всі реакції, які мають термодинамічну можливість відбутися, можуть бути здійснені, але вони можуть вимагати певних умов або каталізаторів для їх прискорення або спрямування. 93. Чи можна виявити появу метану в шахті органолептичним способом, тобто за запахом, смаком або іншими ознаками? Так, метан, який є основним складовим природного газу, має характерний запах. Висока концентрація метану може бути виявлена органолептичним способом, особливо якщо його концентрація в повітрі перевищує нормальні значення. Запах метану можна описати як безбарвний, безсмаковий газ з характерним "гнилим" або "безпечним" запахом, який часто асоціюється з запахом гнилої речовини або літніх гнилих яблук. Однак, важливо зазначити, що при низьких концентраціях метану запах може бути менш відчутним або навіть не помітним. Тому для надійного виявлення метану в шахті та інших приміщеннях рекомендується використовувати спеціальні газові детектори, які здатні точно виявити наявність метану в повітрі навіть за низьких концентрацій і попередити про можливі небезпечні ситуації, пов'язані з його накопиченням.
94. Проаналіуйте графіки на малюнку 6.2. За значеннями температур плавлення та кипіння визначте проміжки, на яких наведено дані для газуватих, рідких та твердих алканів. Для будь-якого гомологічного ряду справедливим є тверження, що зі збільшенням
числа атомів Карбону в молекулі підви- щуються температури плавлення й кипіння речовин. Газуваті та рідкі алкани — безбарвні речовини, а тверді алкани — білого кольору (парафін). Рідкі алкани мають специфічні вуглеводневі або квіткові запахи. Усі алкани — неполярні сполуки, тому вони майже нерозчинні у воді, а тверді — жирні на дотик: алкани належать до аліфатичних сполук (від грец. aleiphar — жир). Рідкі алкани легші за воду, у разі змішування з водою суміш розшаровується. Оскільки алкани є неполярними речовинами, вони добре змішуються один з одним і розчиняють інші неполярні сполуки, тому алкани та їхні суміші часто використовують як органічні розчинники.
95. Проаналізуйте графік на малюнку 6.3. Що свідчить про те, що алкани легші за воду? Як ви вважаєте, чому в алканів із числом атомів Карбо- ну в ланцюзі більшим за 10 густина майже однакова? Алкани легші за воду через різницю у молекулярній будові та масі. Головними компонентами молекул алканів є вуглець і водень, атому карбону має більшу масу порівняно з атомом водню. Приблизно 12 грамів карбону має масу 1 моль, тоді як 1 грам водню має масу 1 моль. Оскільки густина речовини залежить від маси одного молекулярного або атомного відсотку речовини, то у алканів масова частка вуглецю є значно вищою, ніж у води. Тому алкани мають меншу густину, ніж вода, і стільки легші за неї.
Щодо густини алканів з більшим числом атомів вуглецю, як правило, густина залишається майже однаковою через принцип упаковки молекул. Алкани мають лінійну молекулярну структуру, і більші алкани мають довгі ланцюги з вуглецевими атомами. Приблизно після 10-го атома вуглецю, молекули алканів набувають дуже подібної форми та довжини.
У молекулах алканів наявні лони водню (H-) та карбону (С-). Ці лони мають схожий радіус, тому при наявності довгих ланцюгів вуглецевих атомів, молекули утворюють щільну паковану структуру, що призводить до подібних густин. Це пояснює відносну однаковість густини для алканів із числом атомів вуглецю, більшим за 10. 96. Поясніть, чому парафін не займеться, поки частина його не розплавиться, а гас перед запаленням потрібно підігріти або розпилити його з пульверизатора. Парафін, який є мінеральною олією або воском, не займеться при нормальних умовах поки частина його не розплавиться, оскільки його температура запалювання (температура, при якій речовина може почати горіти) вища за температуру навколишнього середовища. Горіння речовини відбувається тільки при наявності трьох основних компонентів, відомих як "трикутник горіння": паливо, кисень (або інший окиснювач) та джерело тепла або запалювач.
shkola.in.ua
У випадку парафіну, поки він залишається у твердому стані, він не може постачати паливо для займання, оскільки його частинки мають недостатньо енергії для початку реакції горіння. Але якщо частинка парафіну розплавиться та перейде в рідкий стан, то вже матиме достатню енергію для горіння, і якщо є джерело тепла або запалювач, процес горіння розпочнеться. Що стосується газових парафінів (наприклад, бутан або пропан), то їх можна легко запалити, оскільки вони уже перебувають у газоподібному стані, і мають набагато
нижчу температуру запалювання, ніж парафін у твердому стані. Це пояснює необхідність підігрівання або розпилення гасу перед запаленням, оскільки для горіння в газоподібному стані потрібна лише відповідна температура або запалювач. 97. У мірний циліндр налили воду та гексан. Через певний час дві ріди- ни розшарувалися. Як можна довести, який із шарів рідин є водою, а який — гексаном, використовуючи тільки воду?
Для того, щоб довести, який із шарів рідин є водою, а який - гексаном, можна
використати властивість розчинення певних речовин у воді. Одна з характеристик розчинення - це щільність речовини у воді. Гексан, будучи немісцим у воді, має меншу щільність, ніж вода. Тому якщо ви помітите, що один з шарів рідини має меншу щільність і легше плаває на поверхні
іншого шару, то цей шар є гексаном.
З іншого боку, вода має велику щільність, і якщо ви помітите, що один з шарів має більшу щільність і занурюється під інший шар, то цей шар є водою. Таким чином, використовуючи тільки воду та знаючи властивість розчинення речовин у воді, ви можете встановити, який шар рідини є гексаном, а який - водою. 98. Як ви вважаєте, чи існує залежність ступеня згоряння алканів (повне або часткове) від доступу кисню та довжини карбонового ланцюга? Чи може метан під час горіння утворювати кіптяве полум’я? Чи може октан горіти безбарвним (синім) полум’ям? Відповідь поясніть. Ступінь згоряння алканів (повне або часткове) дійсно залежить від доступу кисню та довжини карбонового ланцюга.
shkola.in.ua
- Повне згоряння відбувається, коли алкани згоряють у наявності достатньої кількості кисню, при чому продуктом реакції є лише вуглекислий газ (CO2) і вода (H2O). Це реакція окиснення, яка звільняє багато енергії. Умовно її можна представити на прикладі згоряння метану: CH4 + 2O2 -> CO2 + 2H2O - Часткове згоряння відбувається в тих випадках, коли кисню не вистачає для повного окиснення алканів. Внаслідок цього утворюються вуглеводневі сполуки з неповним окисненням, такі як оксиди вуглецю (СО, С2Н4, С3Н6 тощо) або сажа. Щодо кіптявого і безбарвного полум'я: - Метан (CH4) може горіти у кіптявому полум'ї, коли його згоряння проходить при недостатньому доступі кисню. Відоме явище, коли метан горить у кіптявому полум'ї, називається "метановим кіптявим полум'ям" або "свічка Девіса". Це спричинене тим, що при недостатньому кисню утворюється значна кількість частково окиснених вуглеводневих сполук, які знаходяться у газовому стані та розплавленому вуглеводневому диму. - Октан (C8H18) горить з безбарвним (синім) полум'ям, як і більшість алканів з великим карбоновим ланцюгом. Це пов'язано з тим, що горіння октану та інших великих алканів відбувається при повному згорянні за участю достатньої кількості кисню. У результаті горіння утворюються вуглекислий газ (CO2) та вода (H2O), і синій колір полум'я викликаний присутністю спектральних ліній відповідних сполук у зоряній плазмі горіння.
Отже, ступінь згоряння та колір полум'я під час горіння алканів залежать від наявності кисню та довжини карбонового ланцюга. 99. Молекули алканів не поглинають видиме світло, внаслідок чого вони безбарвні. Але тверді алкани, зокремапарафін, вазелін тощо, білі. Як можна пояснити цей факт?
Біле забарвлення твердих алканів, таких як парафін і вазелін, пов'язане зі спрошченим розсіюванням світла в їхніх молекулярних структурах. Молекули алканів не поглинають видиме світло, що дозволяє йому проходити через ці речовини без поглинання окремих довжин хвиль. Проте, коли світло проходить через тверді алкани, які представлені в молекулярному кристалічному вигляді, воно зіштовхується з молекулами і дифрагує, тобто розсіюється в різні напрямки. Це явище називається розсіюванням Релея, і воно може спричиняти розсіювання світла в усіх напрямках, включаючи його відбиття назад. В результаті, коли світло зіштовхується з молекулами алканів у твердому стані, воно розсіюється у різних напрямках, що призводить до рівномірного розподілу світла у всіх видимих частках спектру. У наслідок такого розсіювання світла в усіх напрямках, тверді алкани, такі як парафін і вазелін, виглядають білими. Це явище подібне до розсіювання світла на молоках або хмарах, що також мають білий колір через розсіювання світла у багато напрямках
своїх мікроскопічних структурах.
Міні-проект 100. У кабінеті хімії разом з учителем виконайте експериментальний проект. Під час роботи дотримуйтеся правил безпеки. Увага! Дослід проводити тільки у витяжній шафі.
За певних умов алкани можуть горіти (окиснюватися) без полум’я. На керамічну плитку налийте трохи парафіну з палаючої свічки й одразу, поки він не застиг, насипте на нього гіркою порошок хром(III) оксиду так, щоб парафін просочив оксид тільки знизу, а верхній шар лишився сухим. Піднесіть до вершини гірки палаючий сірник, і почнеться рясне виділення диму.
на своїх спостереженнях, поясніть склад диму. Поясніть, чому утворюється дим із таким складом.
Склад диму, який утворюється під час цього експерименту, може бути пояснений так: 1. Червона кіптява фаза: Оксид хрому(III) (Cr2O3) при нагріванні утворює крім оксиду хрому(III) й крейдяний порошок внаслідок розкладу парафіну (віск). Розклад парафіну може бути представлений рівнянням:
2CnH2n+2 -> nC + (n+1)H2
Де C - вуглець у чорному кольорі, H2 - водень. Ця кіптява фаза є проявом деструктивної окислюючої дії оксиду хрому(III) на парафін.
2. Синя кіптява фаза: Синій колір диму свідчить про утворення сажі з частинок оксиду хрому(III) та попелу, що залишилися після розкладу парафіну. Сажа містить частинки згорілого органічного матеріалу та неокисленого оксиду хрому(III).
Під час експерименту оксид хрому(III) виступає в ролі окислювача, тобто він приймає електрони від парафіну, що призводить до його деструкції і утворення продуктів реакції у вигляді вуглецю (чорний колір) і водню (прозора газова фаза). Також утворюється сажа, яка містить частинки неокисленого оксиду хрому(III) та вуглецю.
shkola.in.ua
§7. Виведення молекулярної формули речовини за загальною формулою гомологічного ряду та густиною або відносною густиною Завдання для засвоєння матеріалу 101. Виведіть формулу для обчислення молярної маси алкенів, алкінів, аренів та спиртів.
1. Молярна маса алкенів (CnH2n):
у
Ґрунтуючись
Молярна маса алкену (M) = маса атома вуглецю (mC) * кількість атомів вуглецю (n) + маса атома водню (mH) * кількість атомів водню (2n).
2. Молярна маса алкінів (CnH2n-2):
Молярна маса алкіну (M) = маса атома вуглецю (mC) * кількість атомів вуглецю (n) +
маса атома водню (mH) * кількість атомів водню (2n-2).
3. Молярна маса аренів (залежить від структури арени):
Молярна маса арени (M) = сума мас атомів вуглецю (mC), водню (mH) та додатково мас атомів підставок (якщо вони є).
4. Молярна маса спиртів (CnH2n+1OH):
Молярна маса спирту (M) = маса атома вуглецю (mC) * кількість атомів вуглецю (n) + маса атома водню (mH) * кількість атомів водню (2n+1) + маса атома кисню (mO).
102. Визначте молекулярні формули для таких речовин:
а) алкан, М = 44 г/моль; б) алкен, М = 70 г/моль; в) алкін, М = 54 г/моль; г) арен, М = 92 г/моль; д) спирт, М = 74 г/моль.


shkola.in.ua
103. Визначте молекулярну формулу алкену, відносна густина якого за вуглекислим газом дорівнює 2,55.
Дано
CxHy
y = 2x
D(CO2) = 2.55
Розвʼязання:
Mr(CxHy) = D(CO2)M(CO2) = 2.55 * (12 + 2 * 16) = 2.55 * 44 = 112

Mr(CxHy) = xAr(C) + yAr(H) = 12x + y = 12x + 2x = 14x = 112
14x = 112
x = 8
y = 2 * 8 = 16
C8H16
Відповідь: C8H16
104. Визначте молекулярну формулу арену, відносна густина якого за метаном дорівнює 6,625.
M(УВ)=М(CH4)×D=16×6.625=106г/моль
Арени (ароматичні вуглеводні) – органічні сполуки, що мають загальну формулу
СnH2n-6, де n дорівнює 6 або більше 6.
СnH2n-6=106
12n+2n-6=106
14n=106+6
n=112÷14
n=8
Відповідь:
C8H10
105. Визначте молекулярну формулу вуглеводню, масова частка Карбону в якому становить 0,75, а відносна густина його випарів за повітрям дорівнює 0,552.
М(С)=12г/моль
М(Н)=1г/моль
106.Визначте молекулярну формулу вуглеводню, масова частка Карбону в якому становить 80 %, а його густина за нормальних умов дорівнює 1,342 г/л.
M(вуглеводню)=1,342*22,4=30г/моль
M(C)=30*80/100=24г/моль
n(C)=24/12=2
n(H)=(30-24)/1=6
C2H6
shkola.in.ua
106. За даними хімічного аналізу, кількісний склад речовин А та Б приблизно
однаковий. Речовина А містить: Карбон — 51,89 %, Гідроген — 9,73 %, Хлор — 38,38 %. Відносна густина випарів речовини Б за повітрям приблизно у два рази
більша, ніж у речовини А. Визначте речовини А та Б. Чи має ця задача
однозначну відповідь?
Запишемо кількісний склад речовини А, використовуючи відсоткові співвідношення:
Карбон (C) - 51,89%
Гідроген (H) - 9,73%
Хлор (Cl) - 38,38%
Тепер давайте знайдемо відносну густину випарів речовини Б відносно повітря: Відносна густина речовини Б = 2 * відносна густина речовини А.
Відносна густина речовини А = (масова частка C + масова частка H + масова частка Cl) / 100.
Відносна густина речовини А = (51,89 + 9,73 + 38,38) / 100 = 99%.
Відносна густина речовини Б = 2 * 99% = 198%.
Тепер давайте знайдемо можливі речовини, які можуть мати такі відносні густини. Відносна густина випарів хлору (Cl2) за повітрям дорівнює приблизно 2,5. Це єдина речовина з відносною густиною наближеною до 198%. Отже, можлива речовина Б - це хлор (Cl2). Що стосується речовини А, то відповідь не є однозначною, оскільки існує багато речовин, кількісний склад яких може відповідати вказаним відсотковим співвідношенням Карбону, Гідрогену та Хлору. Таким чином, ми не можемо однозначно визначити речовину А з заданим складом. 108.Визначте молекулярну формулу вуглеводню, масова частка Карбону в якому становить 85,7 %, а відносна густина його випарів за повітрям дорівнює 1,93.
Дано:
ω(С) = 85,7% або 0,857
Dпов.(СₙНₓ) = 1,93
Знайти:
Мол. ф-лу СₙНₓ - ?
Пояснення:
М(пов.) = 29 г/моль
М(СₙНₓ) = Dпов.(СₙНₓ)*M(CₙHₓ) = 1,93*29 г/моль = 56 г/моль
Знаходимо масу та кількість атомів Карбону:
m(C) = 56 г*0,857 = 48 г
n(C) = m(C)/M(C) = 48 г/12 г/моль = 4 моль
Знаходимо масу та кількість атомів Гідрогену:
m(H) = m(CₙHₓ) - m(C) = 56 г - 48 г = 8 г
n(H) = m(H)/M(H) = 8 г/1 г/моль = 8 моль
shkola.in.ua
Співвідношення атомів Карбону та Гідрогену становить:
n(C):n(H) = 4:8, тобто формула С₄Н₈
Н₃С-СН=СН-СН₃;
СН₂=СН-СН₂-СН₃
Відповідь: С₄Н₈
109. Визначте молекулярну формулу речовини, в якій масова частка Кар- бону становить 80 %, Гідрогену — 20 %, а відносна густина за воднем дорівнює 15.
Щоб визначити молекулярну формулу речовини, нам необхідно з'ясувати, яка кількість атомів кожного елемента (Карбону та Гідрогену) міститься в одній молекулі цієї
речовини.
Масова частка Карбону (C) у речовині становить 80%, а Гідрогену (H) - 20%.
Оскільки масові частки елементів відносяться до 100%, можемо припустити, що
речовина складається з 100 грамів.
Тепер перетворимо масові частки в грами.
Маса Карбону (C) = 80% * 100 г = 80 г
Маса Гідрогену (H) = 20% * 100 г = 20 г
Тепер нам потрібно знайти кількість молей для Карбону та Гідрогену. Для цього використаємо періодичну таблицю, де маси атомів подані в г/моль.
Маса атома Карбону (C) ≈ 12,01 г/моль
Маса атома Гідрогену (H) ≈ 1,01 г/моль
Кількість молей Карбону (C) = Маса Карбону / Маса атома Карбону = 80 г / 12,01 г/моль ≈ 6,66 моль
Кількість молей Гідрогену (H) = Маса Гідрогену / Маса атома Гідрогену = 20 г / 1,01 г/моль ≈ 19,8 моль
Тепер нам необхідно знайти співвідношення числа атомів Карбону та Гідрогену в одній молекулі. Для цього поділимо кількість молей на найменший спільний дільник: Співвідношення числа атомів Карбону до Гідрогену ≈ 6,66 моль / 6,66 ≈ 1 Співвідношення числа атомів Гідрогену до Карбону ≈ 19,8 моль / 6,66 ≈ 3 Отже, структурна формула молекули виглядатиме як C1H3, де 1 - кількість атомів Карбону, а 3 - кількість атомів Гідрогену.
110. Визначте структурну формулу вуглеводню, масова частка Карбону в якому
81,82 %, а густина дорівнює 1,964 г/л.
M = 32*1,375=44;
MC=44*0,8182=36;
NC=36/12=3; MH=44-36=8; NH=8/1=8;
Формула С3Н8 - пропан
111. Масова частка Карбону у вуглеводні становить 85,7 %. Густина його випарів за повітрям дорівнює 1,45. Визначте число атомів Карбону в одній молекулі цього вуглеводню. Ми знаємо, що масова частка карбону (C) у цьому вуглеводні становить 85,7%, а густина його випарів за повітрям дорівнює 1,45 г/л. Для того, щоб знайти число атомів карбону (C) в одній молекулі цього вуглеводню, нам спочатку необхідно знайти молекулярну масу цього вуглеводню. Молекулярна маса (М) може бути визначена як: Молекулярна маса (М) = (кількість атомів C * атомна маса C) + (кількість атомів H * атомна маса H)
shkola.in.ua
Масова частка карбону (C) у вуглеводні дорівнює 85,7%. Припустимо, що маса зразка складає 100 г, тоді масова кількість C у зразку буде 85,7 г. Тепер, давайте знайдемо масове співвідношення між C та H. Масове співвідношення С до H = 85,7 г / 12,01 г/моль ≈ 7,13 Оскільки відношення ближче до цілого числа, ми можемо припустити, що в молекулі вуглеводню є 7 атомів водню (H).
Тепер ми можемо знайти кількість атомів карбону (C) в молекулі:
Кількість атомів C = (Масова кількість C) / (Масове співвідношення С до H) ≈ 85,7 г / 7,13 ≈ 12,02
Заокруглимо
значення
до цілого числа, тому кількість атомів карбону (C) в одній молекулі цього вуглеводню дорівнює 12.
Отже, у даному вуглеводні 12 атомів карбону (C) в одній молекулі
112. Визначте молекулярну формулу вуглеводню, в якому масова частка Карбону становить 88,2 %, а густина його випарів за нормальних умов дорівнює 3,036 г/л.
Ми знаємо, що масова частка карбону (C) в цьому вуглеводні становить 88,2%, а масова частка водню (H) може бути знайдена як (100% - 88,2%) = 11,8%. Також, нам відомо, що густина його випарів за нормальних умов дорівнює 3,036 г/л. Для того, щоб знайти молекулярну формулу вуглеводню, нам потрібно знайти молекулярну масу цього вуглеводню. Молекулярна маса (М) може бути визначена як: Молекулярна маса (М) = (кількість атомів C * атомна маса C) + (кількість атомів H * атомна маса H) Тепер, нам необхідно знайти кількість атомів карбону (C) та водню (H) в молекулі. Для того, щоб знайти відповідні коефіцієнти для C та H, давайте розглянемо масову частку кожного елемента у відсотках і переведемо її в масову кількість.
1. Масова частка С = 88,2%
Масова кількість С = 88,2 г (припустимо, що маса зразка складає 100 г, щоб зручніше обчислювати)
2. Масова частка H = 11,8% Масова кількість H = 11,8 г Тепер давайте знайдемо масові співвідношення між С та H. Масове співвідношення С до H = 88,2 г / 12,01 г/моль ≈ 7,34 Масове співвідношення H до C = 11,8 г / 1,01 г/моль ≈ 11,68 Оскільки масове співвідношення H до C ближче до цілого числа, ми припускаємо, що в молекулі вуглеводню є 11 атомів водню (H). Тепер ми можемо знайти кількість атомів карбону (C) в молекулі: Кількість атомів C = (Масова кількість C) / (Масове співвідношення H до C) ≈ 88,2 г /
11,68 ≈ 7,54
Згідно цього розрахунку, кількість атомів карбону приблизно 7,54.
Тепер, знаючи кількість атомів карбону (C) і водню (H) в молекулі, ми можемо записати молекулярну формулу вуглеводню.
Молекулярна формула: C7H11
113. Визначте молекулярну формулу вуглеводню, в якому масова частка Карбону
становить 88,09 %, а густина його випарів за нормальних умов дорівнює 7,5 г/л.
Дано:
W(C)=88,09%
ρ(CxHy)=7,5г/л
shkola.in.ua
Знайти: СхНу-?
Mr(CxHy)=ρ*Vm=7,5*22,4=168г/моль
W=Ar*n/Mr
0,8809=12*x/168
12x=148
x=12 - атомів С
y=168-12*12=168-144=24
C12H24
§8. Виведення молекулярної формули речовини за масою, об’ємом або кількістю речовини реагентів або продуктів реакції Завдання для засвоєння матеріалу
114. Складіть у загальному вигляді рівняння реакцій горіння: а) алканів; б) алкенів; в) алкінів.
а) Реакція горіння алканів: Алкан + Оксиген -> Вуглекислий газ + Вода Загальне рівняння: CnH2n+2 + (3n+1)/2 O2 -> n CO2 + (n+1) H2O
де "n" - кількість атомів вуглецю в молекулі алкану.
б) Реакція горіння алкенів: Алкен + Оксиген -> Вуглекислий газ + Вода Загальне рівняння:CnH2n + n O2 -> n CO2 + n H2O де "n" - кількість атомів вуглецю в молекулі алкену.
в) Реакція горіння алкінів:
Алкін + Оксиген -> Вуглекислий газ + Вода Загальне рівняння:CnH2n-2 + (3n-1)/2 O2 -> n CO2 + H2O де "n" - кількість атомів вуглецю в молекулі алкіну. 115. Укажіть число атомів Карбону, що містяться у складі однієї молекули алкану, на спалювання 3 л якого витрачається кисень об’ємом 15 л.
Дано:
V (алкану) = 3 л
V (O2) = 15 л
Знайти:
N (C) - ?
Рішення:
1) CnH2n+2 + (1,5n+0,5)O2 = nCO2 + (n+1)H2O;
2) 3 л CnH2n+2 - 15 л O2;
1 л CnH2n+2 - (1,5n+0,5) л O2;
3 * (1,5n+0,5) = 1 * 15; n = 3
3) C3H8 - пропан.
Відповідь: Число атомів C становить 3
116. Для повного згоряння невідомого вуглеводню об’ємом 0,4 л витратили кисень об’ємом 1 л. Після закінчення реакції і приведення об’ємів газів до початкових умов об’єм газуватих продуктів становив 0,8 л. Визначте молекулярну формулу вуглеводню.
Реакція повного згоряння вуглеводню має вигляд: CₙH₂ₙ + (3n + 1)/2 O₂ -> n CO₂ + n H₂O Тут "n" представляє кількість молекул вуглеводню, яку необхідно знайти. Масова частина кисню (О₂) в реакції не задана, але ми знаємо, що об'єм кисню (O₂) дорівнює 1 л.
Кількість молекул кисню (О₂) = Об'єм кисню / Об'єм 1 мол кисню = 1 л / 22,4 л/моль ≈ 0,0446 моль
shkola.in.ua
CₙH₂ₙ + 0,0446 O₂ -> n CO₂ + n H₂O За умовою, об'єм вуглеводню (CₙH₂ₙ) дорівнює 0,4 л, а об'єм продуктів (CO₂ + H₂O) після реакції дорівнює 0,8 л.
Об'єм вуглеводню / Об'єм продуктів = 0,4 л / 0,8 л = 0,5
n = Об'єм вуглеводню / Об'єм продуктів = 0,5 Таким чином, молекулярна формула вуглеводню дорівнює C₂H₂.
117. Визначте молекулярну формулу вуглеводню, під час згоряння якого отримали вуглекислий газ масою 6,6 г та воду масою 2,7 г. Відносна густина
його випарів за воднем становить 42.
Дано:
m(CO₂) = 6,6
m(H₂O) = 2,7 г
CxHy + O₂ = CO₂ + H₂O
1 моль х моль у/2 моль
Знайдемо масу сполуки :
D(Н₂) = 42
Знайти: CxHy-?
Mr(CxHy) = D(Н₂) * М(Н₂) = 42 * 2 = 84 г/моль
Визначимо кількість речовин
n(CO₂) = m(CO₂)/ М(CO₂) = 6,6/44 = 0,15 моль
n(С) = n(CO₂) = 0,15 моль
n(H₂O) = 2,7/18 = 0,15 моль
n(H) = 0,15 * 2 = 0,3 моль
n(С) : n(H) = 0,15 : 0,3 = 1 : 2
Маємо простішу формулу СН₂
М(СН₂) = 12 + 1 * 2 = 14 г/моль
k = Mr(CxHy)/М(СН₂) = 84 : 14 = 6 Отже молекулярна формула вуглеводню: С₆Н₁₂ - гексен
118. Під час згоряння вуглеводню кількістю речовини 0,05 моль утворилися
вуглекислий газ та вода масами 11 г та 5,4 г відповідно. Установіть
молекулярну формулу вуглеводню.
СxHy+O2=CO2+H2O
M(CO2)=44г/моль
M(H2O)=18г/моль
n(CO2)=11/44=0,25моль
n(H2O=5,4/18=0,3моль
nСхНу:nСО2:nН2О=0,05:0,25:0,3=1:5:6
СxHy+O2=5CO2+6H2O
С5Н12-пентан 119. Визначте молекулярну формулу вуглеводню, якщо під час спалювання його кількістю речовини 0,1 моль утворюється вода масою 5,4 г і вуглекислий газ об’ємом 8,96 л (н. у.).
Дано:
n (CxHy) = 0,1 моль ;
m (H₂O) = 5,4 г ;
V (CO₂) = 8,96 л.
x, y (формулу) — ?
Розв’язання:
n (H₂O) = 5,4 г : 18 г/моль = 0,3 (моль).
n (CO₂) = 8,96 л : 22,4 л/моль = 0,4 (моль).
n (C) = n (CO₂) ; n (H) = 2n (H₂O), відповідно ⇒
n (C) = 0,4 (моль); n (H) = 0,3 · 2 = 0,6 (моль).
m (C) = 0,4 моль · 12 г/моль = 4,8 (г).
m (H) = 0,6 моль · 1 г/моль = 0,6 (г).
shkola.in.ua
m (CxHy) = 4,8 + 0,6 = 5,4 (г).
M (CxHy) = 5,4 г : 0,1 моль = 54 (г/моль).
C : H = : = 0,4 : 0,6 = 4 : 6 = 2 : 3.
C₂H₃. її молярна маса = 27 г/моль, а нам потрібно 54
г/моль.
отже істинна формула: C₄H₆.
120. Під час спалювання вуглеводню масою 4,4 г отримали вуглекислий
масою 13,2 г і воду масою 7,2 г.
повітрям 1,517. Визначте молекулярну формулу
Дано:
- Маса вуглеводню = 4.4 г
- Маса вуглекислого газу (CO2) = 13.2 г
- Маса води (H2O) = 7.2 г
вуглеводню.
- Відносна густина випарів вуглеводню за повітрям = 1.517
Розв'язок:
1. Маса кисню = Маса води = 7.2 г
2. Маса вуглецю = Маса вуглекислого газу - Маса кисню = 13.2 г - 7.2 г = 6 г
3. Кількість молей вуглецю = Маса вуглецю / Атомна маса вуглецю
≈ 6 г / 12 г/моль (атомна маса вуглецю) = 0.5 моль Кількість молей водню = Маса води / Атомна маса водню
≈ 7.2 г / 1 г/моль (атомна маса водню)
= 7.2 моль
4. Для вуглеводню загальна кількість молей = 0.5 моль + 7.2 моль = 7.7 моль Співвідношення атомів вуглецю до водню буде 0.5 : 7.2
5. Знаходимо найближчі цілі співвідношення, щоб отримати молекулярну формулу: Співвідношення 1 : 14, або можна поділити на 0.5: 14/0.5 = 28 Таким чином, молекулярна формула вуглеводню C1H2 Відповідь: Молекулярна формула вуглеводню - С1H2. 121. Під час спалювання вуглеводню утворилися вуглекислий газ об’ємом 8,96 л (н. у.) та вода масою 7,2 г. Густина випарів вуглеводню 1,25 г/л. Визначте молекулярну формулу і вкажіть на особливості будови молекул речовин цього класу.
Позначимо невідомий вуглеводень за G.
V(G) = 1 л ==> n(G) = 1/22.4 = 0.045 моль
M(G) = 1.25/0.045 = 28 г/моль
CO2 ==> C
8.96/22.4 = x/12
x = 4.8 г
H2O ==> 2H
7.2/18 = y/2
y = 0.8 г
CxHy
12x = 4.8
y = 0.8
x = 0.4 x5
y = 0.8 x5
shkola.in.ua
x = 2 y = 4
H2C=CH2 — етилен, особливість будови полягає у наявності подвійного зв'язку, що не є характерним для алканів. Загальна формула будови речовин цього класу (алкенів): CnH2n.
газ
Відносна густина випарів цього вугле- водню за
122. Під час згоряння вуглеводню кількістю речовини 0,1 моль отримали
вуглекислий газ об’ємом 13,44 л (н. у.) та воду масою 12,6 г. Визначте
молекулярну формулу вуглеводню.
Дано:
- Кількість речовини вуглеводню = 0,1 моль
- Об'єм вуглекислого газу = 13,44 л (н.у.)
- Маса води = 12,6 г
Розв'язок:
1. Знайдемо кількість молекул вуглекислого газу (CO2): Кількість молекул CO2 = Кількість речовини вуглеводню = 0,1 моль
2. Знайдемо кількість молекул води (H2O):
Маса води = 12,6 г
Маса молекули H2O = 18 г/моль Кількість молекул води = Маса води / Маса молекули H2O = 12,6 г / 18 г/моль ≈ 0,7 моль
3. Знайдемо кількість молекул водню (H) та вуглецю (C) у вуглеводні:
Загальна кількість молекул вуглекислого газу (CO2) = Кількість молекул вуглецю (C) у вуглеводні Загальна кількість молекул води (H2O) = 2 * Кількість молекул водню (H) у вуглеводні Отже, Кількість молекул вуглецю (C) = 0,1 моль Кількість молекул водню (H) = 0,7 моль / 2 = 0,35 моль
4. Знаходимо емпіричну формулу вуглеводню: Емпірична формула вуглеводню: CH2
5. Знаходимо молекулярну формулу вуглеводню: Кількість молекул вуглеводню = Кількість речовини вуглеводню = 0,1 моль Молекулярна формула вуглеводню: C10H20
123. Під час згоряння органічної речовини масою 2,175 г утворилися вуглекислий газ та вода масою 4,95 г та 2,025 г відповідно. Відносна густина випарів речовини за повітрям дорівнює 2. Визначте молекулярну фор- мулу речовини. Дано:
m (CxHyOz) = 2,175 г;
m (CO₂) = 4,95 г;
m (H₂O) = 2,025 г;
D (возд.) = 2.
x,y,z — ?
Розв’язок:
n (CO₂) = 4,95 г ÷ 44 г/моль = 0,1125 (моль).
n (H₂O) = 2,025 г ÷ 18 г/моль = 0,1125 (моль).
n (C в CxHyOz) = n (CO₂) ⇒ 0,1125 (моль).
n (H в CxHyOz) = 2n (H₂O) ⇒ 0,225 (моль).
m (C в CxHyOz) = n · M= 0,1125 моль · 12 г/моль = 1,35 (г).
shkola.in.ua
m (H в CxHyOz) = n · M = 0,225 моль · 1 г/моль = 0,225 (г).
2,175 г - 1,575 г = 0,6 (г).
n (O в CxHyOz) = m ÷ M = 0,6 г ÷ 16 г/моль = 0,0375 (моль).
C : H : O = 0,1125 : 0,225 : 0,0375 | ÷ 0,0375
C : H : O = 3 : 6 : 1
C₃H₆O.
M (C₃H₆O) = 3 · 12 + 6 + 16 = 58 (г/моль).
M (повітря) = 29. D = M (газа) ÷ M (повітря).
M (CxHyOz) = 29 г/моль · 2 = 58 (г/моль)
Відповідь: C₃H₆O.
124. Під час хлорування
вуглеводню масою 1,44 г добуто дихлоропохідну
речовину масою 2,82 г. Визначте вуглеводень.
Дано:
- Маса вуглеводню = 1,44 г
- Маса дихлоропохідної речовини = 2,82 г
Розв'язок:
1. Знайдемо масу хлору, який був використаний у реакції:
Маса хлору = Маса дихлоропохідної речовини - Маса вуглеводню
Маса хлору = 2,82 г - 1,44 г = 1,38 г
2. Знайдемо кількість молекул хлору (Cl2), який був використаний у реакції:
Маса хлору (Cl2) = 1,38 г
Атомна маса хлору = 35,5 г/моль (число, близьке до атомної маси Cl)
Кількість молекул хлору = Маса хлору / Атомна маса хлору ≈ 1,38 г / 35,5 г/моль ≈ 0,039 моль
3. Знайдемо кількість молекул вуглеводню (CnHm), який був використаний у реакції: Для того, щоб здійснити хлорування, хлор молекулярно додається до вуглеводню: CH4 + Cl2 -> CH3Cl + HCl
Збільшення маси вуглеводню дорівнює масі дихлоропохідної речовини, тобто маса доданого хлору: Збільшення маси вуглеводню = Маса доданого хлору = 1,38 г При додаванні маси хлору, маса вуглеводню збільшується на масу молекули хлору, яка дорівнює 2 * Атомна маса хлору: Збільшення маси вуглеводню = 2 * Атомна маса хлору * Кількість молекул вуглеводню Збільшення маси вуглеводню = 2 * 35,5 г/моль * Кількість молекул вуглеводню
1,38 г = 2 * 35,5 г/моль * Кількість молекул вуглеводню Кількість молекул вуглеводню = 1,38 г / (2 * 35,5 г/моль) ≈ 0,019 моль
4. Знаходимо емпіричну формулу вуглеводню:
Емпірична формула вуглеводню: CH2
125. Під час хлорування алкану масою 0,114 г добуто дихлоропохідну речо- вину масою 0,183 г. Визначте вуглеводень. Дано:
- Маса алкану = 0,114 г
- Маса дихлоропохідної речовини = 0,183 г
Розв'язок:
1. Знайдемо масу хлору, який був використаний у реакції: Маса хлору = Маса дихлоропохідної речовини - Маса алкану Маса хлору = 0,183 г - 0,114 г = 0,069 г
shkola.in.ua
2. Знайдемо кількість молекул хлору (Cl2), який був використаний у реакції: Маса хлору (Cl2) = 0,069 г Атомна маса хлору = 35,5 г/моль (число, близьке до атомної маси Cl) Кількість молекул хлору = Маса хлору / Атомна маса хлору ≈ 0,069 г / 35,5 г/моль
0,00194 моль
3. Знайдемо кількість молекул алкану (CnHm), який був використаний у реакції: Для того, щоб здійснити хлорування, хлор молекулярно додається до алкану: CnH2n+2 + Cl2 -> CnH2nCl + HCl
≈
Збільшення маси алкану дорівнює масі дихлоропохідної речовини, тобто маса
доданого хлору:
Збільшення маси алкану = Маса доданого хлору = 0,069 г
При додаванні маси хлору, маса алкану збільшується на масу молекули хлору, яка
дорівнює 2 * Атомна маса хлору:
Збільшення маси алкану = 2 * Атомна маса хлору * Кількість молекул алкану
Збільшення маси алкану = 2 * 35,5 г/моль * Кількість молекул алкану
0,069 г = 2 * 35,5 г/моль * Кількість молекул алкану
Кількість молекул алкану = 0,069 г / (2 * 35,5 г/моль) ≈ 0,00194 моль
4. Знаходимо емпіричну формулу алкану: Емпірична формула алкану: C1H4
§9. Алкени й алкіни: гомологічні ряди, ізомерія, номенклатура
Контрольні запитання
126. Які вуглеводні називають ненасиченими? У чому полягає головна їх відмінність від насичених вуглеводнів? Ненасичені вуглеводні - це такі вуглеводні, у молекулах яких є подвійні або потрійні зв'язки між атомами вуглецю. Ці подвійні або потрійні зв'язки роблять молекули вуглеводнів менш насиченими з воднем атомами, порівняно з насиченими вуглеводними, де всі зв'язки між атомами вуглецю є одинарними.Головна відмінність між ненасиченими і насиченими вуглеводними полягає в наявності подвійних або потрійних зв'язків у молекулах ненасичених вуглеводнів. Ці подвійні або потрійні зв'язки створюють відкриті місця для додаткових атомів у молекулі. Через це ненасичені вуглеводні можуть реагувати з іншими речовинами та утворювати нові хімічні зв'язки, що дозволяє їм бути більш хімічно активними.Прикладом ненасиченого вуглеводню є етен (C2H4) з одним подвійним зв'язком і пропин (C3H4) з одним потрійним зв'язком. Проте, насиченими вуглеводнями є, наприклад, метан (CH4) з одним одинарним зв'язком або етан (C2H6) з двома одинарними зв'язками. 127. Чому перші члени гомологічних рядів алкенів та алкінів містять по два атоми Карбону, а не по одному? Перші члени гомологічних рядів алкенів та алкінів містять по два атоми вуглецю, оскільки така структура дозволяє цим речовинам досягти максимальної стійкості та забезпечити наявність необхідних хімічних валентних зв'язків.
128. Які види структурної ізомерії характерні для алкенів та алкінів? Наве- діть приклади ізомерів. Для алкенів та алкінів характерні два види структурної ізомерії: цінова (позиційна) і геометрична (конфігураційна).
1. Цінова (позиційна) ізомерія: Цінові ізомери мають однаковий молекулярний склад, але відрізняються взаємним розміщенням атомів у молекулі. Тобто, вони мають різне розташування функціональних груп або подвійних/потрійних зв'язків у молекулі. Приклад цінової ізомерії для алкенів: - Бут-1-ен (C4H8) і бут-2-ен (C4H8). У першому випадку подвійний зв'язок знаходиться між першим і другим атомами вуглецю, а у другому випадку - між другим і третім атомами вуглецю.
2. Геометрична (конфігураційна) ізомерія: Геометричні ізомери мають однакову послідовність атомів, але вони розташовані інакше у просторі через обмеженість обертання навколо подвійного зв'язку. Приклад геометричної ізомерії для алкенів:
shkola.in.ua
- З-бут-2-ен (C4H8) і Е-бут-2-ен (C4H8). У цих ізомерах дві метильні (CH3) групи знаходяться по різні боки подвійного зв'язку у З-бут-2-ен і по протилежних боки у Ебут-2-ен. Аналогічно, і для алкінів, типи ізомерії (цінова та геометрична) відповідають зазначеним вище означенням, але враховуються для трипійних зв'язків.
Завдання для засвоєння матеріалу
129. Складіть молекулярні формули алкену та алкіну, молекули яких містять по 6 атомів Карбону.
Молекулярні формули алкену та алкіну з 6 атомами вуглецю: Алкен: C6H12 (Наприклад, гекс-1-ен) Алкін: C6H10 (Наприклад, гекс-1-ін) 130.Складіть структурні формули найпростіших алкену й алкіну з розгалуженим
карбоновим ланцюгом. Назвіть їх за систематичною номенклатурою
Алкен: 2-метилбут-2-ен Структурна формула: CH3-CH=C(CH3)-CH3
Алкін: 2,3-диметилбут-2-ін Структурна формула: CH3-C≡C-CH(CH3)-CH3
131.Складіть структурні формули сполук: а) бут-1-ен; б) бут-2-ин; в) пент-2-ен; г) 4-метилпент-2-ин; д) 2,3,5-триметилгепт-2-ен; е) 2,3,5-триметилгекс-3-ен; є) 2,4дибромо-3,5-диметилгекс-3-ен; ж) 3-бромо-2,4-диметилпент-2-ен; з) 3-бромо-4метилгекс-2-ен; и) 3-бромо-4-метилпент-2-ен; і) 3,3-диметилбут-1-ин; к) 1,3дибромо-3- метилбут-1-ин; л) 1,4-дихлоробут-2-ин; м) 4,4-дибромопент-2-ин.
а) Бут-1-ен: CH2=CH-CH2-CH3
б) Бут-2-ін: CH3-C≡C-CH3
в) Пент-2-ен: CH3-CH=CH-CH2-CH3
г) 4-метилпент-2-ін: CH3-C≡C-CH2-CH(CH3)-CH3
д) 2,3,5-триметилгепт-2-ен: CH3-C(CH3)=C(CH3)-CH2-CH2-CH2-CH3
е) 2,3,5-триметилгекс-3-ен: CH3-CH2-C(CH3)=C(CH3)-CH2-CH3


є) 2,4-дибромо-3,5-диметилгекс-3-ен: CH3-C(CH3)=C(Br)-CH(Br)-CH2-CH2-CH3
ж) 3-бромо-2,4-диметилпент-2-ен: CH3-C(CH3)=CH-CH(Br)-CH2-CH3
з) 3-бромо-4-метилгекс-2-ен: CH3-CH2-C(CH3)=CH-CH2(Br)-CH3
и) 3-бромо-4-метилпент-2-ен: CH3-C(CH3)=CH-CH(Br)-CH2-CH3
і) 3,3-диметилбут-1-ін: HC≡C-CH(CH3)-CH3
к) 1,3-дибромо-3-метилбут-1-ін: HC≡C-CH(Br)-CH2-CH3
л) 1,4-дихлоробут-2-ін: CH3-C≡C-CH(Cl)-CH3
м) 4,4-дибромопент-2-ін: CH3-C≡C-CH2-CH(Br)-CH3
shkola.in.ua
132. За наведеними моделями молекул складіть скорочені структурні формули сполук та їхні назви. 133. Складіть назви сполук за структурними формулами:
А. 3,3,5-триметилгепт-5-ен
Б. 4-етил-3,5-диметилгепт-3-ен
В. 4,5,7-триметил-нон-4-ен
Г. 2,3,5-триметилгепт-2-ен
Д. 3-бромо-4-метилгекс-2-ен
Е. 3-бромо-2,4-диметилпент-2-ен
134. Складіть усі можливі структурні ізомери сполук із подвійним зв’язком: а)
C5H10; б) C4H7Cl; в) C4H6Br2. Назвіть їх.
а) C5H10:
Сполука з подвійним зв'язком C5H10 має формулу C5H10 і має два структурні ізомери:
1. Пент-1-ен (1-пентен): CH3-CH2-CH=CH-CH3
2. Пент-2-ен (2-пентен): CH3-CH=CH-CH2-CH3
б) C4H7Cl:
Сполука з подвійним зв'язком C4H7Cl має формулу C4H7Cl і має три структурні ізомери:
1. Бут-1-ен-3-іл хлорид (1-бутен-3-іл хлорид): CH2=CH-CH2-CH2-Cl
2. Бут-2-ен-3-іл хлорид (2-бутен-3-іл хлорид): CH3-CH=CH-CH2-Cl
3. Бут-1-ен-2-іл хлорид (1-бутен-2-іл хлорид): CH3-CH2-CH=CH-Cl
в) C4H6Br2:
Сполука з подвійним зв'язком C4H6Br2 має формулу C4H6Br2 і має два структурн ізомери:
1. 1,2-дібромбут-2-ен: CH2=CH-CH2-Br Br
2. 3,4-дібромбут-1-ен: CH3-CH=CH-Br Br
Комплексні завдання
135. У скільки разів густина газуватого пропену більша за густину етену (н. у.)?
пропен C3H6 M= 3•12+6•1=42 г/моль
етен C2H4 M= 2•12+4•1=28г/моль
M(C3H6):N(C2H4)= 42: 28 = 1.5 : 1
густина газуватого пропену більша за густину етену 1.5 разів
136. Визначте молекулярну формулу сполук: а) алкену з молярною масою 84 г/моль; б) алкіну з молярною масою 68 г/моль; в) алкену з густиною 1,875 г/л. а) Для алкенів загальна формула - CnH2n. Для того, щоб знайти "n" (кількість атомів вуглецю), можемо скласти рівняння:
84 = 12n + 2n
shkola.in.ua
84 = 14n
Розв'язавши рівняння, отримаємо:
n = 84 / 14
n = 6
Тому молекулярна формула алкену буде C6H12. б) Для алкінів загальна формула - CnH2n-2. Для того, щоб знайти "n" (кількість атомів вуглецю), можемо скласти рівняння:
68 = 12n + 2(n-2)
68 = 12n + 2n - 4
68 = 14n - 4
Розв'язавши рівняння, отримаємо:
14n = 68 + 4
14n = 72
n = 72 / 14

n = 5
Тому молекулярна формула алкіну буде C5H8. в) Для алкенів густина зазвичай виражається в г/л. Густина алкенів, які мають загальну формулу CnH2n, виражається в масі 28 г/моль.
Молекулярна формула алкену буде визначатися наступним чином:
Густина = маса / об'єм
Маса молекули буде рівна масі атомів вуглецю та водню в молекулі, тобто 12n + 2n = 14n. Тоді:
1.875 г/л = 28 г/моль / об'єм
Об'єм = 28 г/моль / 1.875 г/л
Об'єм = 14.93 л/моль
Тепер можемо вирахувати "n":
14.93 л/моль ≈ 1.067
Таким чином, молекулярна формула алкену буде C1H2.
137. Установіть формулу вуглеводню, в якому масова частка Карбону становить 85,7 %, а відносна густина його випарів за гелієм дорівнює 28.
shkola.in.ua
Відповідь: С8Н16. Завдання з розвитку критичного мислення 138. Чому назва вуглеводню «пентин» не зовсім коректна? Назва "пентин" не зовсім коректна, оскільки "пентин" використовується для позначення алкіну з п'ятьма атомами вуглецю (C5H8), а не вуглеводню загалом. Вуглеводні - це клас органічних сполук, що складаються лише з атомів вуглецю і водню, і можуть
містити одинарні, подвійні або потрійні зв'язки між атомами вуглецю. Таким чином, назва "пентин" відноситься лише до одного з типів вуглеводнів - алкінів, а не до всього класу.
139. Чи існують сполуки з назвами: а) 1,4,4-трибромобут-2-ен; б) 3-метил- 1хлоробут-2-ин; в) 2,4-диметилбут-2-ен? Відповідь поясніть. а) 1,4,4-трибромобут-2-ен - Ця назва вказує на сполуку, яка має 4 атоми вуглецю і містить три атоми брому. Назва "бут-2-ен" вказує на те, що є присутнім подвійний зв'язок між другим і третім атомами вуглецю. Оскільки сполука має три атоми брому, така сполука не існує, оскільки бром в сполуках часто формує тільки один атом в одній молекулі.
б) 3-метил-1-хлоробут-2-ин - Ця назва вказує на сполуку, яка має 4 атоми вуглецю і містить один атом хлору. Назва "бут-2-ин" вказує на те, що є присутнім потрійний
зв'язок між другим і третім атомами вуглецю. Оскільки сполука містить тільки один атом хлору, інші атоми вуглецю в сполуці не можуть мати жодних інших підстановок. Таким чином, така сполука не існує. в) 2,4-диметилбут-2-ен - Ця назва вказує на сполуку, яка має 4 атоми вуглецю і містить два метильних групи (-CH3). Назва "бут-2-ен" вказує на те, що є присутнім подвійний зв'язок між другим і третім атомами вуглецю. Така сполука існує і може мати таку структуру: CH3 | CH3 - C = C - CH2 - CH3 | CH3
Таким чином, сполука з назвою 2,4-диметилбут-2-ен існує.
§10. Етен та етин: хімічні властивості Контрольні запитання 140. Які хімічні властивості характерні для ненасичених вуглеводнів? Ненасичені вуглеводні мають наявність подвійних або трійних зв'язків між атомами вуглецю. Це
надає їм хімічні властивості, такі як додаткова реакційна активність, можливість додавання газу і водню та сприяння полімеризації.
141. За допомогою яких реакцій можна довести, що етен чи етин — це ненасичені сполуки? Щоб довести, що етен (C2H4) чи етин (C2H2) є ненасиченими сполуками, можна використати такі реакції:
1. Реакція з хлором: Ненасичені вуглеводні можуть додавати молекули хлору, утворюючи одночасно заміщені та незаміщені хлористі похідні. Наприклад, етен з реакцією з хлором утворює 1,2-дихлоретан (C2H4Cl2).
2. Реакція з бромом: Етен та етин також можуть реагувати з бромом, утворюючи хлористі похідні. Наприклад, етин з реакцією з бромом утворює 1,2-диброметан (C2H2Br2).
shkola.in.ua
3. Дегідрування: Ненасичені вуглеводні можуть піддаватися дегідруванню, в результаті чого вони втрачають молекули водню і утворюють алкени чи алкіни. Наприклад, етен може бути отриманий із етану (насичена сполука) внаслідок дегідрування.
142. Поясніть, чому за однакового об’єму етин приєднує у два рази більше одню за етен.
Об'єм газу, який реагує у хімічній реакції, визначається кількістю молекул цього газу, а не його масою чи молекулярною формулою. В обох випадках етен (C2H4) та етин
(C2H2) мають один атом вуглецю в своїй молекулі. Однак, відмінність полягає в кількості атомів водню:
1. Етен має 4 атоми водню (C2H4).
2. Етин має 2 атоми водню (C2H2).
Коли взаємодіє однаковий об'єм етену та етину, він приєднує у два рази більше молекул водню в разі етину, оскільки етин має вдвічі менше атомів водню у своїй молекулі. Це можна пояснити стехіометричними співвідношеннями та реакційними механізмами, які дозволяють одному етиновому молекулі зв'язуватися з двома молекулами водню, а етенові - лише з однією молекулою водню.
143. Складіть рівняння реакцій взаємодії етену й етину: а) з воднем; б) гідроген бромідом; в) хлором.
а) Взаємодія з воднем (гідрогенізація):
1. Етен з воднем утворює етан:
C2H4 + H2 -> C2H6
2. Етин з воднем утворює етен:
C2H2 + H2 -> C2H4
б) Взаємодія з гідроген бромідом:
1. Етен з гідроген бромідом утворює 1,2-диброметан:
C2H4 + HBr -> CH2BrCH2Br
2. Етин з гідроген бромідом утворює 1,1-диброметан: C2H2 + HBr -> CHBr=CBr
в) Взаємодія з хлором:
1. Етен з хлором утворює 1,2-дихлоретан: C2H4 + Cl2 -> CH2ClCH2Cl
2. Етин з хлором утворює 1,2-дихлоретин: C2H2 + Cl2 -> ClC≡CCl
Завдання для засвоєння матеріалу
144. У який спосіб можна відрізнити метан від суміші етану з етеном? Складіть
відповідні рівняння реакцій.
Для відрізнення метану (CH4) від суміші етану (C2H6) з етеном (C2H4), можна
використати реакцію окислення з хлором або бромом. Метан не реагує з хлором або бромом при нормальних умовах, тоді як етан та етен реагують і утворюють хлоровані або бромовані похідні.
Рівняння реакцій окислення з хлором:
1. Метан:
CH4 + Cl2 -> немає реакції
2. Етан:
C2H6 + Cl2 -> CH3CH2Cl + HCl
3. Етен:
C2H4 + Cl2 -> CH2ClCH2Cl
Рівняння реакцій окислення з бромом:
shkola.in.ua
1. Метан:
CH4 + Br2 -> немає реакції
2. Етан:
C2H6 + Br2 -> CH3CH2Br + HBr
3. Етен:
C2H4 + Br2 -> CH2BrCH2Br
Як бачимо, метан не проявляє реакції з хлором або бромом, тоді як етан та етен утворюють хлоровані або бромовані похідні. Використовуючи ці реакції, можна відрізнити метан від суміші етану з етеном. 145. Історична назва алкенів — олефіни — пішла від того, що етен із хлором
утворює олієподібний продукт («масло голландських хіміків», відкрите 1795 року). Складіть рівняння цієї реакції. Ця реакція відома як реакція хлорування або хлорування етену. Рівняння реакції хлорування етену:
C2H4 + Cl2 -> CH2ClCH2Cl У результаті цієї реакції етен (C2H4) реагує з хлором (Cl2) і утворює дихлоретан, який є олієподібним продуктом і привів до виникнення назви "олефіни" для алкенів.


146. Складіть рівняння реакцій взаємодії етину кількістю речовини 1 моль із хлором кількістю речовини 2 моль та назвіть продукт реакції.
Для реакції взаємодії етину (C2H2) з хлором (Cl2) можемо записати таке рівняння: C2H2 + 2 Cl2 -> C2H2Cl4
Продуктом реакції є тетрахлоретан (C2H2Cl4). У цій реакції одна молекула етину (1 моль) реагує з двома молекулами хлору (2 молі) і утворюється одна молекула тетрахлоретану (1 моль).
147. Складіть рівняння реакції для здійснення перетворень за схемою:
Комплексні завдання
148. Яку масу хлоропропану можна добути з пропену об’ємом 11,2 л (н. у.)?
149. Обчисліть об’єм кисню, необхідний для повного згоряння бут-2-ену об’ємом 180 л.

shkola.in.ua
150. Обчисліть об’єм водню, з яким взаємодіє: а) етен масою 7 г; б) етин об’ємом 5,6 л (н. у.).
Дано: Розв'язання:
m(C2H4) = 7 г
V(C2H4) (н.у.) = 5,6 л
а) Запишемо рівняння реакції: C2H4 + H2 → C2H6.
Обчислимо кількість речовини етену за формулою: n(C2H4) = m(C2H4) = 7 г = 0,25 моль.
M(C2H4) 28 г/моль
V1(H2), V2(H2) — ?
За рівнянням реакції: n(C2H4) : n(H2) = 1 : 1, отже, n(H2) = 0,25 моль.
Обчислимо об’єм водню за формулою: V1(H2) = Vm · n(H2) = 22,4 л/моль · 0,25 моль = 5,6 л.
б) Запишемо рівняння реакції: C2H2 + 2H2 → C2H6.
За рівнянням реакції: V(C2H2) : V
: а) 5,6 л; б) 11,2 л.
151. Обчисліть масу продукту реакції
пропіну об’ємом 11,2 л (н. у.) із надлишком хлору.
При повній взаємодії 1 молекула пропіну С3Н4 приєднує 4 атоми хлору (по потрійному зв'язку).
С3Н4 + 2Сl2 = C3H4Cl4 З рівняння реакції слід, що 1 моль пропіну приєднує 2 моля хлору.
11,2 л пропіну - це 0,5 моль (при н. у.) або по масі - це 20 г 0,5 моль пропіну приєднає 1 моль хлору або масою 71 г Разом маса продукту реакції 20+71= 91 г
152. Обчисліть масу дихлороетану, що можна добути гідрогенгалогенуван- ням етину об’ємом 16,8 л (н. у.).
n(c2H4)=V/Vm
n=16.8 / 22.4=0.75 моль n (Cl2)=22.4/22.4=1моль
CH2=CH2+Ci2=CICH2=CICH2
mC2H4C12=0,75*188=141
153. На бромування етену витрачено 100 г розчину з масовою часткою брому 6,4 %. Обчисліть масу продукту реакції.
Br₂ + C₂H₄ ⇒ C₂H₄Br₂
160 -- 188
6,4 -- x
160x = 188*6,4
x = 188*6,4/160 = 7,52
x = 7,52
154. Суміш метану й етену об’ємом 0,56 л (н. у.) пропустили крізь розчин брому масою 160 г з масовою часткою 2 %. Обчисліть об’ємну частку етену в суміші.
Дано:
V(C2H6) = 0,56 л
m(р-нBr) = 160 г
w(Br) = 2%
Найти: w(C2H4) - ?
C2H4 + Br2 = C2H4Br2
М(С2Н4) = 12 * 2 + 1 * 4 = 28 г/моль
М(Br2) = 80 * 2 = 160 г/моль
Знайдемо масу Брома у розчині
2) = 1 : 2, отже V(H2) = 2V(C2H2) = 2 · 5,6 л = 11,2 л. Відповідь
(H
взаємодії
shkola.in.ua
m(Br) = m(р-нBr) * w(Br) : 100% = 160 * 2% : 100% = 3,2 г
Обчислимо кількість речовини Брому:
n(Br) = m(Br)/М(Br2) = 3,2/160 = 0,02 моль
Знайдемо масу етену С2Н4
m(С2Н4) = n(Br) * М(С2Н4) = 0,02 * 28 = 0,56 г
Порахуємо кількість речовини С2Н4
n(C2H4) = V(C2H6) /Vm = 0,56 : 22,4 = 0,025 моль
Знайдемл кількість метану в суміші
n(CH4) = n(C2H4) - n(Br) = 0,025 - 0,02 = 0,005 моль
Знайдемо масу метана
m(CH4) = 0,005 * 16 = 0,08 г
m(суміші) = m(С2Н4) + m(CH4) = 0,56 + 0,08 = 0,64г
Обчислимо об'ємну частку етену в суміші.
w(C2H4) = m(С2Н4)/m(суміші) * 100% = 0,56/0,64 * 100% = 87,5%
155. Для приєднання до алкену масою 8,4 г знадобилося 0,15 моль водню.
Визначте формулу алкену.
Дано:
m(CnH2n)=8,4 г
n(H2)=0,15 моль
Формула-?
Розвязання:
CnH2n+H2 кат >CnH2n+2
З рівняння реакції бачимо, що з 1 моль алкену вступає в реакцію 1 моль водню, тобто n(CnH2n)=n(H2)
Знаходимо молярну масу алкена:
8,4г-- 0,15моль
X г 1моль
X=8,4/0,15=56 г/моль
M(СnH2n) = 56 г/моль
14n=56
n=4
Формула алкену C4H8
156. Суміш етену, пропану й пропену об’ємом 1 л під час реакції приєднує хлор масою 3,55 г. Який об’єм водню може приєднати 1 л такої суміші?
Дано:
- Суміш етену, пропану й пропену об'ємом 1 л.
- Реакція приєднання хлору до цієї суміші масою 3,55 г. Розв'язання:
1.Молекулярна маса хлору (Cl2) = 2 * атомна маса хлору = 2 * 35,45 г/моль = 70,9 г/моль Молекулярна кількість хлору = Маса хлору / Молекулярна маса хлору = 3,55 г / 70,9 г/моль ≈ 0,05 моль
shkola.in.ua
2. В реакції приєднання хлору до етену (C2H4) маса хлору, яка приєднується до одного молекули етену, дорівнює масі одного атома хлору, тобто приблизно 35,45 г/моль. В реакції приєднання хлору до пропану (C3H8) маса хлору, яка приєднується до одного молекули пропану, дорівнює масі двох атомів хлору, тобто приблизно 2 * 35,45 г/моль = 70,9 г/моль.
В реакції приєднання хлору до пропену (C3H6) маса хлору, яка приєднується до одного молекули пропену, дорівнює масі двох атомів хлору, тобто приблизно 2 * 35,45 г/моль = 70,9 г/моль.
Маса етену (C2H4) в суміші: 0,05 моль * 35,45 г/моль = 1,7725 г
Маса пропану (C3H8) в суміші: 0,05 моль * 70,9 г/моль = 3,545 г
Маса пропену (C3H6) в суміші: 0,05 моль * 70,9 г/моль = 3,545 г
3. Знаходимо масу всієї суміші:
Маса всієї суміші = Маса етену + Маса пропану + Маса пропену = 1,7725 г + 3,545 г + 3,545 г ≈ 8,8625 г
4. Знаходимо молекулярну кількість всієї суміші: Маса всієї суміші / Молекулярна маса = 8,8625 г / (2 * 12,01 г/моль + 8 * 1,01 г/моль) ≈ 8,8625 г / (24,02 г/моль + 8,08 г/моль) ≈ 8,8625 г / 32,1 г/моль ≈ 0,275 моль
5. Знаходимо об'єм 1 молі суміші при н. у.:
Об'єм 1 молі газу при н. у. = 22,4 л
Об'єм 0,275 моль суміші = Об'єм 1 молі газу * Кількість молей суміші = 22,4 л * 0,275 ≈ 6,16 л
Відповідь: Об'єм водню, який може приєднати 1 л такої суміші етену, пропану і пропену при н. у., становить приблизно 6,16 л.
§11. Бензен — найпростіший ароматичний вуглеводень Контрольні запитання
157. Які речовини відносять до ароматичних?Речовини, які відносять до ароматичних, це сполуки, що містять ароматичні (циклічні) вуглеводневі кільця, такі як бензен (C6H6) та його похідні. Такі речовини характеризуються стійким, характерним ароматом і відіграють важливу роль в органічній хімії та синтезі різних сполук. 158. Поясніть, чому структурні формули бензену зображають по-різному. Так, якщо побудувати структурні формули бензену, вони можуть зображатися по-різному залежно від того, які зв'язки між атомами вуглецю та водню будуть виділені. Бензен (C6H6) має шість атомів вуглецю, розташованих на рівномірному шестикутному кільці, та шість атомів водню, приєднаних до цього кільця. Через особливості хімічної зв'язування в бензені, всі зв'язки між атомами вуглецю однакові та рівні, і ця сполука має додатковий стійкий ароматичний характер. Існує кілька способів зображення структурної формули бензену:
1. Класичний варіант, де кожний атом вуглецю та водню окремо позначаються буквою або символом (наприклад, H - атом водню, С - атом вуглецю)
shkola.in.ua
2. Спрощений варіант, де атоми вуглецю позначаються точками, а атоми водню не показуються:
H / \ H - C - H \ / H
. / \ . - C - . \ / .
3. Кільцевий варіант, де кільце бензену зображується як круг знаків для атомів вуглецю, а атоми водню не показуються:
159. Схарактеризуйте фізичні властивості бензену.
1. Бензен - безбарвна рідина з характерним ароматом.
2. Його густина приблизно 0,88 г/см³.
3. Температура кипіння бензену складає приблизно 80,1°C.
4. Це досить летка речовина, яка випаровується легко при нормальних умовах.
5. Бензен є добрим розчинником для багатьох органічних речовин, так як має неполярні властивості.
6. Він має велику теплоємність та добре проводить тепло.
7. Бензен не є розчинником для багатьох неорганічних речовин.
8. Це ненасичена сполука, що має кільцеву структуру.
160.До яких вуглеводнів подібний бензен за хімічними властивостями: до насичених чи ненасичених? Відповідь поясніть. Бензен за хімічними властивостями подібний до ненасичених вуглеводнів. Це пояснюється тим, що у бензені спостерігається плоска кільцева сполука з внутрішніми подвійними зв'язками між атомами вуглецю. Хоча він не має такого насиченого характеру, як нафта або природні гази, бензен все ще відноситься до ненасичених сполук через наявність подвійних зв'язків в його молекулі.
161. Складіть повну (розгорнуту) структурну формулу хлоробензену. Структурна формула хлоробензену виглядає наступним чином:
162. Схарактеризуйте галузі застосування бензену. Галузі застосування бензену включають:
1. Паливна промисловість: Бензен є важливим компонентом бензину, який використовується як паливо для автомобілів та інших транспортних засобів.
2. Петрохімічна промисловість: Бензен є важливою сировиною для виробництва пластмас, синтетичних волокон, гуми, пестицидів та багатьох інших хімічних речовин.
3. Фармацевтична промисловість: Бензен використовується у виробництві деяких лікарських речовин та препаратів.
shkola.in.ua
4. Виробництво розчинників: Бензен є складовою частиною багатьох органічних розчинників, які використовуються в різних галузях, включаючи фармацевтику, хімічну промисловість та лакофарбову продукцію. 5. Синтез хімічних сполук: Бензен є важливим вихідним матеріалом для синтезу різних хімічних сполук, таких як фарби, фарбники, пестициди, ароматизатори тощо. Завдання для засвоєння матеріалу 163. Складіть рівняння реакції неповного згоряння бензену з утворенням
вуглецю.
2C6H6 + 9O2 -> 4C + 6H2O
● / \ ● - ● - ● \ / ●
H |
| H
H--C--Cl
164. Серед наведених формул речовин визначте ароматичні сполуки: Відповідь: а) толуол (метилбензен), в) бензен (бензол)
165. Складіть рівняння бромування бензену. Які каталізатори для цього можна
застосовувати?
Рівняння бромування бензену виглядає наступним чином: C6H6 + Br2 -> C6H5Br + HBr
У цій реакції одна молекула бензену (C6H6) реагує з молекулою брому (Br2) за утворення продукту бромбензену (C6H5Br) та молекули водню бромиду (HBr). Щодо каталізаторів, для реакції бромування бензену зазвичай використовують легкі каталізатори, такі як алюмінієвий хлорид (AlCl3) або железо(III) хлорид (FeCl3). Ці каталізатори допомагають активувати молекули брому та бензену, сприяючи їх взаємодії та утворенню продукту бромбензену.
Комплексні завдання
166. Обчисліть відносну густину випарів бензену за повітрям та воднем.
D(газу₁)=M(газу)÷M(газу₁)
Щільність бензолу повітрям:
D(повітря)=M(C₆H₆)÷M(повітря)
D(повітря)=78г./моль÷29г./моль=2,689 Щільність бензолу водню:
D(H₂)=M(C₆H₆)÷M(H₂)

D(H₂)=78г./моль÷2г./моль=39

167. Обчисліть масу хлоробензену, що можна добути з бензену масою 15,6 г.
168. Обчисліть масу дихлоробензену, що можна добути з бензену, якщо під час реакції втрачено хлор об’ємом 44,8 л (н. у.).
shkola.in.ua
169. До водного басейну об’ємом 500 тис. м3 помилково потрапили промислові викиди з умістом бензену. Обчисліть об’єм бензену (густина 0,88 г/л), що потрапив у басейн, якщо його концентрація у воді басей- ну становить максимально допустиму. За нормативами, гранично до- пустима концентрація бензену у воді (ГДК) — 0,05 г/л.
Завдання з розвитку критичного мислення 170. Уявіть ситуацію: ви зайшли в лабораторію і побачили, що бензен у склянці перебуває у твердому стані. Про що це свідчить?
Бензен при нормальних умовах (температурі та тиску) має рідку або газоподібну фазу. Тому, якщо ви бачите бензен у склянці у твердому стані, це може свідчити про те, що температура навколишнього середовища значно нижча за його нормальну температуру замерзання.Така ситуація може виникнути, наприклад, якщо лабораторія дуже холодна або бензен був охолоджений спеціально для вивчення його властивостей у твердому стані. У твердому стані молекули бензену будуть влаштовані в регулярній кристалічній ґратці замість хаотичного руху, який характерний для рідкої або газоподібної фази. 171. У двох пробірках містяться дві безбарвні рідини: бензен і гексен. Як можна відрізнити вміст цих пробірок, маючи в наявності бром та залізний порошок? Ви можете відрізнити бензен від гексену за допомогою реакції бромування. Ця реакція допоможе вам виявити наявність або відсутність подвійних зв'язків у рідині.Бром додається до молекули з подвійним зв'язком, утворюючи аддукт. У випадку бензену, який має ароматичну систему зв'язків, реакція буде гальмованою та буде виділятися більше тепла, ніж в реакції з алкенами. Залізний порошок може використовуватися як каталізатор для реакції.Отже, якщо ви додаєте бром до пробірки з бензеном, ви можете помітити, що реакція пройде менш інтенсивно, і може виділитися більше тепла. У випадку з гексеном, реакція бромування буде більш енергійною та інтенсивною, і може не вимагати застосування каталізатора.Це дасть вам змогу відрізнити бензен від гексену, спостерігаючи різницю в реакціях бромування з цими двома рідинами.
Міні-проекти 172. У додаткових джерелах знайдіть інформацію про застосування бензену та його похідних. Поясніть, на яких фізичних або хімічних властивостях ґрунтується їх застосування.

1. Паливо: Бензен використовується як компонент бензину в автомобільній індустрії. Його висока октанова число сприяє покращенню пального влаштування та зниженню стуку двигуна.
shkola.in.ua
2. Петрохімічна промисловість: Бензен є важливою сировиною для виробництва різноманітних хімічних продуктів, таких як пластмаси, синтетичні волокна, гума, пестициди, фарби, лаки тощо.
3.Фармацевтика: Бензен і його похідні використовуються як реагенти та сировинні речовини для синтезу лікарських речовин, антибіотиків та інших фармацевтичних продуктів.
4. Ароматизатори та ароматичні речовини: Бензен має приємний запах, і його похідні використовуються як ароматизатори у харчовій та парфумерній промисловості.
5.Розчинники: Бензен і його похідні є ефективними органічними розчинниками для багатьох речовин, і їх використання знаходиться у лакофарбовій, хімічній та інших
галузях.
Властивості: ароматичність, електронні властивості, леткість та розчинність, подвійні зв'язки, пластичність. 173. Використовуючи аркуш паперу і скотч, зробіть заготовку та складіть з неї
тетраедр — він буде основою для моделювання молекул. Ато- ми Гідрогену можна виготовити у вигляді кульок із пластиліну. Вико- ристовуючи заготовки, складіть моделі відомих вам молекул: метану, етену, етину, бензену тощо, спираючись на наведені малюнки.
§12. Методи одержання вуглеводнів. Взаємозв’язок між вуглеводнями Завдання для засвоєння матеріалу
174. Складіть рівняння реакцій для здійснення перетворень за схемами:
а) C2H4 → C2H6 → C2H4 → C2H5OH;
C2H4 + H2 → C2H6
C2H6 → C2H4 + H2
C2H4 + H2O → C2H5OH
б) CH4 → C2H2 → C2H4 → C2H2 → CH3CHO;
CH4 → C2H2 + 2H2
C2H2 + H2 → C2H4
C2H4 → C2H2 + 2H2
2C2H2 + 2H2O → CH3CHO
в) CH4 → C2H2 → C6H6 → C6H5Cl.
CH4 → C2H2 + 2H2
3C2H2 → C6H6
C6H6 + Cl2 → C6H5Cl + HCl

г) CaC2 → C2H2 →C6H6 → C6H5NO2;
CaC2 + 2H2O → C2H2 + Ca(OH)2
3C2H2 → C6H6
C6H6 + HNO3 → C6H5NO2 + H2O
д) C → CH4 → C2H2 → C2H6.
C + 2H2 → CH4
CH4 → C2H2 + 2H2
C2H2 + 2H2 → C2H6
175. Розшифруйте ланцюги та складіть рівняння реакцій, за допомогою яких можна здійснити перетворення:
shkola.in.ua
Комплексні завдання
176. Обчисліть об’єм етину (н. у.), необхідний для добування бензену об’є- мом
22,16 мл (густина 0,88 г/см3).
m (С6H6) = V · p = 22.16 · 0.88 = 19.5г

Реакція протікає за рівних умов: 400°С, вуглець.
3С2Н2 → С6H6 xл 19.5г
3•22.4л/моль 78 г/моль
х = (3 • 22.4 • 19.5): 78 = 16.8л
177. Обчисліть об’єм водню (н. у.), необхідний для добування етану кількістю речовини 0,2 моль з: а) етену; б) етину.
Завдання з розвитку критичного мислення
178. Хіміками було витрачено багато зусиль для синтезу метану з простих речовин. Одержання метану з вуглецю та водню було відкрито лише 1897 року, а за 40 років до того (1856 року) П. М. Бертло добув метан під час пропускання сірковуглецю (карбон дисульфід) разом із гідроген сульфідом через трубку з розпеченою міддю. Складіть рівняння реакції одержання метану за методом Бертло.
CS2 + 4H2S + 4Cu → CH4 + 4CuS + 2H2O
179. Складіть схему одержання бензену з кальцій карбонату.
CaCO3-->CaO >CaC2 >C2H2 >C6H6
180. Як ви вважаєте, чому реакцію Зелінського називають тримеризацією?
shkola.in.ua
Реакцію Зелінського називають тримеризацією через особливу характеристику цієї реакції, а саме, вона призводить до формування більш важкої молекули шляхом об'єднання трьох молекул однієї речовини. У цій реакції одну молекулу олефіну (алкену) сполучають з двома молекулами формальдегіду (метаналь), щоб утворити більш складний продукт - алдол.
Ця реакція досить специфічна, і її назва "тримеризація" вказує на об'єднання трьох молекул в одну. Назва "реакція Зелінського" походить від імені хіміка Юліуса Зелінського, який вперше дослідив і описав цю реакцію у 1890-х роках. Отже, назва "тримеризація" відображає ключову особливість реакції Зелінськогоз'єднання трьох молекул в більш важку сполуку.
§13. Спирти: класифікація, ізомерія та номенклатура Контрольні запитання 181. Яку групу атомів називають характеристичною? Яка характеристична група у спиртів? Групу атомів, яка визначає хімічні властивості та класифікує певний клас сполук, називають характеристичною групою.У спиртах характеристичною групою є гідроксильна група (-OH), яка приєднана до насиченого вуглецевого атома. Ця група визначає специфічні хімічні властивості спиртів і дозволяє їх класифікувати як
сполуки з цією функціональною групою.
182. Наведіть загальну формулу, що відображає хімічну будову насичених
одноатомних спиртів. CnH2n+2OH
де "n" - кількість вуглецевих атомів у молекулі спирту.
183. Дайте визначення класу спиртів. Які спирти відносять до одноатомних, а які — до багатоатомних?
Спирти - це клас органічних сполук, які містять гідроксильну (-OH) функціональну групу, приєднану до насиченого вуглецевого атома. Головна ознака спиртівприсутність гідроксильної групи, яка надає їм специфічні хімічні властивості. До одноатомних спиртів відносяться ті спирти, в молекулах яких присутні один вуглецевий атом. Приклад такого спирту - метанол (CH3OH). До багатоатомних спиртів відносяться спирти, в молекулах яких містяться більше одного вуглецевого атома. Приклади багатоатомних спиртів включають етанол (C2H5OH), пропанол (C3H7OH), бутанол (C4H9OH) та багато інших. 184. Які види ізомерії характерні для спиртів? У тексті параграфа знайдіть
формули двох спиртів, що є ізомерами.
Для спиртів характерні такі види ізомерії:
1. Структурна ізомерія: Спирти можуть мати різні структурні форми, в яких атоми водню та гідроксильної групи розташовані в інших молекулярних позиціях.
2. Цепова ізомерія: Різні розміщення вуглецевого ланцюга можуть призводити до утворення цепових ізомерів у спиртах.
3. Позиційна ізомерія: Різне розташування гідроксильної групи на вуглецевому ланцюзі також може призводити до утворення позиційних ізомерів.
4. Функціональна ізомерія: Інші функціональні групи, крім гідроксильної, можуть бути приєднані до вуглецевого ланцюга, що призводить до утворення функціональних ізомерів.
Приклади ізомерії для спиртів:
1. Пропан-1-ол і пропан-2-ол:Це структурні ізомери, в яких гідроксильна група приєднана до різних вуглецевих атомів.
2. Бутан-1-ол і бутан-2-ол: Це також структурні ізомери, в яких розміщення гідроксильної групи відрізняється.
185. Скільки існує спиртів складу C3H8O? Складіть їхні структурні формули.
Спирти складу C3H8O можуть мати різні структурні форми залежно від розташування атомів водню та гідроксильної групи. Ось всі можливі ізомери для цього складу:
shkola.in.ua
1. Пропан-1-ол (нормальний пропан-ол): CH3CH2CH2OH
2. Пропан-2-ол (ізопропан-ол): CH3CH(OH)CH3 Отже, існують два ізомери спиртів складу C3H8O. Завдання для засвоєння матеріалу
186. Випишіть молекулярні формули, що можуть відображати склад молекул
насичених одноатомних спиртів: а) C5H10O; б) C6H12O6; в) C6H12O; г)
C2H4O; д) C2H6O2; е) C2H6O.
CnH2n+1 OH
a)C5H10O = C5H9OH
б)C6H12O6 = не може , бо має 6 атомів оксигену
г)C6H12O = C6H11OH
д)C2H4O = C2H3OH
е)C2H6O2 = не може , бо має 2 атомів оксигену Відповідь: Треба виписати лише а , в , г , д . 187. Запишіть формули спиртів у такому порядку: метанол, етанол, бута- нол, пропанол, пентанол. Поясніть: а) чи є цей запис гомологічним рядом спиртів; б) чи є речовини із цими формулами гомологами. CH3OH, C2H5OH, C4H9OH, C3H7OH, C5H11OH. а) наведені сполуки є членами гомологічного ряду спиртів; б) так, ці речовини гомологи, бо входять до одного гомологічного ряду спиртів. 188. Складіть структурну формулу будь-якого спирту з 10 атомами Гідрогену в молекулі.
Структурна формула спирту з 10 атомами водню в молекулі може виглядати наступним
чином:
CH3-CH2-CH2-CH2-CH2-OH Ця формула відображає молекулу спирту, в якій є п'ять вуглецевих атомів, вздовж яких розташовані п'ять атомів водню та гідроксильна група (-OH), яка вказує на присутність спиртового фрагмента.
189. В яких випадках формули відображають одну й ту саму сполуку?
а) CH3–CH2–CHOH–CH3; б) CH3–CHOH–CH2–CH3; в) CH3–CH2–CH2–OH;


г) HO–CH2–CH2–CH2–CH2–CH3; д) CH3–CH2–CH2–CH2–CH2–OH; е) CH3–CH2–OH; є) CH3–CHOH–CH3; ж) C2H5CHOHC3H7; з) CH3–CH(CH3)–CH2OH.
Серед наведених формул сполук випишіть окремо формули: а) гомологів; б) ізомерів.
а), б) - бутан-2-ол, з) - бутан-1-ол
г), д) - пентан-1-ол
в) - пропан-1-ол, є) - пропан-2-ол
shkola.in.ua
190. Складіть структурні формули спиртів: а) пентан-2-ол; б) 2-метилпентан- 1ол; в) 3-етилпентан-2-ол; г) 3-хлоробутан-2-ол. а) Пентан-2-ол: CH3CH2CH(OH)CH2CH3
б) 2-метилпентан-1-ол: CH3CH(OH)CH(C2H5)CH2CH3
в) 3-етилпентан-2-ол: CH3CH(OH)CH2CH2CH(C2H5)CH3
г) 3-хлоробутан-2-ол: CH3CHClCH(OH)CH3
191. Складіть назви спиртів зі структурними формулами:
а. 3-етилпентан-2-ол
б. 3-метилбутан-1-ол
в. 2,3-диметилбутан-1-ол
192. Складіть усі можливі формули структурних ізомерів спиртів зі скла- дом:
C4H10O; б) C5H12O; в) C4H9OBr.
а) C4H10O:
1. Бутан-1-ол (нормальний бутан-ол): CH3CH2CH2CH2OH
2. Бутан-2-ол (ізобутан-ол):CH3CH(OH)CH2CH3
б) C5H12O:



1. Пентан-1-ол (нормальний пентан-ол): CH3CH2CH2CH2CH2OH
2. Пентан-2-ол (ізопентан-ол): CH3CH(OH)CH2CH2CH3
3. Пентан-3-ол: CH3CH2CH(OH)CH2CH3
в) C4H9OBr:
1. Бутан-1-ол: CH3CH2CH2CH2OH
2. Бутан-2-ол: CH3CH(OH)CH2CH3
3. Бутан-3-ол: CH3CH2CH(OH)CH3
193. Для кожної моделі молекул запишіть скорочену структурну формулу та складіть назву речовини (блакитна кулька — атом Брому).
shkola.in.ua
Комплексні завдання
194. Якщо в приміщенні розбилася склянка з етанолом, то як переважно
поширюватимуться його випари: уздовж підлоги чи здійматимуться вгору? Відповідь підтвердьте розрахунками. Зважаючи на фізичні властивості етанолу та принципи розподілу газів у повітрі, можна стверджувати, що випари етанолу переважно будуть здійматися вгору. Ось розрахунки та пояснення:
а)
1. Високий паровий тиск: Етанол має високий паровий тиск при кімнатних температурах, що означає, що його молекули швидко випаровуються у повітря.
2. Молекулярна маса: Молекулярна маса етанолу досить низька, що робить його молекули досить легкими. Це допомагає їм підніматися вгору.
3. Закон Дальтона: Закон Дальтона стверджує, що кожний газ в суміші створює свій власний частковий тиск, який додається до загального тиску. Частковий тиск газу пропорційний його концентрації.
4. Рідина на поверхні: При розламу склянки етанол буде налитий на підлогу. Оскільки він має високий паровий тиск, його молекули швидко випаровуватимуться з поверхні рідини.
5. Концентрація випарів: Внаслідок високого парового тиску та швидкого випаровування, концентрація випарів етанолу над рідиною буде великою.
6. Змішування з повітрям: Оскільки випари етанолу мають більшу концентрацію і вони легкі, вони будуть змішуватися з повітрям і підніматися вгору через нагрівання і відсутність перешкод.
Таким чином, фізичні властивості етанолу сприяють тому, що випари будуть переважно здійматися вгору, розповсюджуючись у повітрі приміщення.
195. Визначте молекулярну формулу насиченого одноатомного спирту з молярною масою 88 г/моль.
Згадуємо формулу спиртів: CnH(2n+2)O
З - 12г/моль, Н - 1г/моль. O - 16г/моль
Можна скласти рівняння:
12n + 2n + 2 + 16 = 88
14n = 70
n = 5
Це пентанол чи його ізомери.
Структурна формула:
CH3-CH2-CH2-CH2-CH2-OH 196. Визначте молекулярну формулу одноатомного спирту, в якому масова частка Карбону становить 52,22 %, а Гідрогену — 13,00 %.
Відповідь:
C2H5OH
Пояснення:
Формула спирту
CxHyOz, де z=1 (він одноатомний)
Знайдемо масову частку кисню
w(O)=100-52,22-13,00=34,78
Знайдемо співвідношення кількостей елементів x:y:z=4,35:13:2,17
Розділимо все на 2,17 x:y:z=2:6:1
shkola.in.ua
C2H6O
Або у більш звичній формулі спиртів C2H5OH
197. Визначте молекулярну формулу спирту, в якому масова частка Карбо-
становить 60,00 %, а Оксигену — 26,66 %.
1. Значення масової частки карбону (C) в спирті = 60,00%
2. Значення масової частки кисню (O) в спирті = 26,66%
ну
3. Залишок масової частки, яка не припадає на C та O: 100% - (60,00% + 26,66%) = 13.34%
Зараз ми можемо припустити, що інші елементи, крім C та O, це водні атоми (H), оскільки у спиртах молекулярні формули мають загальну структуру CnH2n+1OH.
4. Масова частка водню = 13.34%
5. Тепер давайте поділим кожну масову частку на відповідну атомну масу:
- C: 60.00% / 12.01 g/mol = 4.997
- H: 13.34% / 1.01 g/mol = 13.207
- O: 26.66% / 16.00 g/mol = 1.666
6. Давайте подивимось на співвідношення цих чисел. Воно найбільше приближається до пропорційності C:H:O = 5:13:2.
7. Тепер ми можемо обрати найменший цілий коефіцієнт для цього співвідношення, щоб виразити кількість атомів у молекулі спирту. Це буде 5:13:2.
8. За молекулярною формулою спирту CnH2n+1OH, ми встановлюємо, що n (кількість вуглецевих атомів) = 2.
9. Тоді молекулярна формула спирту буде C2H5OH. Отже, молекулярна формула спирту, в якому масова частка карбону становить 60,00%, а кисню — 26,66%, є C2H5OH (етанол). Завдання з розвитку критичного мислення
198. Укажіть, за якими ознаками спирти CH3–CH2–OH та CH2=CH–CH2–OH можна віднести до: а) однієї групи спиртів (до якої?); б) до різних груп спиртів (до яких?).
а) Ознаками, за якими спирти CH3–CH2–OH (етанол) та CH2=CH–CH2–OH (аліловий спирт) можна віднести до однієї групи спиртів (первинних спиртів), є: 1. Функціональна група:Обидва спирти мають одну і ту ж саму функціональну групу гідроксильної (-OH) групи, яка приєднана до насиченого вуглецю (етанол) або до вуглецю з подвійним зв'язком (аліловий спирт).
2. Східність в реакціях:Обидва спирти проявляють схожі реакції, характерні для первинних спиртів, наприклад, окиснення до відповідних альдегідів та карбонових кислот.
б) Ознаками, за якими спирти CH3–CH2–OH та CH2=CH–CH2–OH можна віднести до різних груп спиртів (первинних та алілових спиртів), є:
1. Структура: Хімічна структура цих спиртів відрізняється: в одному випадку (етанол) маємо насичений вуглець, а в іншому (аліловий спирт) - подвійний зв'язок між вуглецевими атомами.
2. Реактивність: Хімічні властивості можуть відрізнятися через наявність подвійного зв'язку в аліловому спирті, який може впливати на його реакційну поведінку порівняно з етанолом.
§14. Насичені одноатомні спирти: фізичні та хімічні властивості, методи добування Контрольні запитання
shkola.in.ua
199. Схарактеризуйте фізичні властивості спиртів. Поясніть вплив водневого зв’язку на фізичні властивості спиртів. Фізичні властивості спиртів включають температуру кипіння, температуру плавлення, розчинність у розчинниках, в'язкість та щільність. Водневий зв'язок між гідроксильною групою спиртів сприяє підвищенню температури кипіння та плавлення, збільшенню розчинності у воді, підвищенню в'язкості та може впливати на щільність.
200. Як у гомологічному ряду насичених одноатомних спиртів змінюється: а) агрегатний стан за звичайних умов; б) температура кипіння; в) розчинність у воді; г) розчинність у бензені?
а) Агрегатний стан за звичайних умов від газу до рідини.
б) Температура кипіння збільшується зі зростанням молекулярної маси.
в) Розчинність у воді зменшується зі збільшенням молекулярної маси.
г) Розчинність у бензені збільшується зі зростанням молекулярної маси.
201. Поясніть, чому спирти не змінюють забарвлення індикаторів. Спирти, які є слабкими кислотами, мають водневі атоми, зв'язані з оксигеном (гідроксильною групою -OH). Ці гідроксильні групи можуть утворювати водневі зв'язки з молекулами води або іншими спиртами, але вони не здатні надавати іонних властивостей, які були б необхідні для зміни кольору багатьох індикаторів. Більшість індикаторів змінюють свій колір через зміну розрідженості чи кислотнолужного середовища. У більшості випадків для зміни кольору індикатору потрібно наявність іонів в розчині, що викликають іонізацію індикатору та його забарвлення.
Так як спирти не виділяють значну кількість іонів в розчині, забарвлення індикаторів в них не спостерігається або спостерігається лише слабке змінне забарвлення. 202.Схарактеризуйте хімічні властивості та методи одержання спиртів. Складіть відповідні рівняння хімічних реакцій на прикладі етанолу.
Хімічні властивості спиртів включають можливість заміщення гідроксильної групи, утворення ефірів, окиснення до карбонових кислот, взаємодію з лужними металами та інші реакції.
Методи одержання спиртів включають:
1. Гідратація алкенів:Взаємодія водню та алкенів в присутності каталізатора призводить до утворення спирту. Наприклад, етен гідратується до етанолу: C2H4 + H2O → C2H5OH
2. Водні реакції з алдегідами та кетонами:Алдегіди та кетони можуть бути звідси обернено перетворені на спирти. Наприклад, ацетальдегід може перетворитися в етанол: CH3CHO + H2 → CH3CH2OH
3. Редукція карбонільних сполук: Карбонільні сполуки можуть бути зменшені до спиртів за допомогою реактивів, які надають водні атоми. Наприклад, ацетон може бути зменшений до ізопропілового спирту: (CH3)2CO + 2H2 → (CH3)2CHOH
4. Ферментація: Під дією дріжджів глюкоза може перетворитися на етанол та вуглекислоту:
C6H12O6 → 2C2H5OH + 2CO2
Отже, етанол (етиловий спирт) може бути одержаний через гідратацію етену (алкена) або зменшення ацетальдегіду.
Завдання для засвоєння матеріалу
203. Складіть рівняння реакцій для перетворень:
а) C2H5OH → C2H4; б) C2H5OH → C2H5ONa; в) C2H4 → C2H5OH; г) C3H7OH
shkola.in.ua
→ C3H6; д) C3H7OH → C3H7ONa; е) C2H5OH → C2H5Cl.
а) C2H5OH → C2H4:
CH3CH2OH → CH2=CH2 + H2O
б) C2H5OH → C2H5ONa:
CH3CH2OH + Na → CH3CH2ONa + H2
в) C2H4 → C2H5OH:
CH2=CH2 + H2O → CH3CH2OH
г) C3H7OH → C3H6: CH3CH2CH2OH → CH2=CHCH3 + H2O
д) C3H7OH → C3H7ONa:
CH3CH2CH2OH + Na → CH3CH2CH2ONa + H2
е) C2H5OH → C2H5Cl:
CH3CH2OH + HCl → CH3CH2Cl + H2O
204. Складіть рівняння реакції: а) дегідратації пропан-1-олу; б) реакції пропан-1олу з бромоводнем. За яких умов відбувається ця реакція?
а) Дегідратація пропан-1-олу:
CH3CH2CH2OH → CH3CH=CH2 + H2O
б) Реакція пропан-1-олу з бромоводнем:
CH3CH2CH2OH + HBr → CH3CH2CH2Br + H2O
Ця реакція відбувається за каталізу концентрованим сернокислотою (H2SO4) у тепловому середовищі.
205. Складіть рівняння реакцій для здійснення перетворень за схемами:
а) C2H6 → C2H4 → C2H5OH → C2H5Cl;
б) метан → ? → етан → етен → етанол → вуглекислий газ;
в) кальцій карбонат → кальцій карбід → етин → етен → етанол.
А)C2H6 ->(Pt, t°)->C2H4+H2
C2H4+H2O->(H2SO4)C2H5OH
C2H5OH+HCl->(h2so4 конц)C2H5Cl+H2O
Б)CH4+Cl2->(hv)CH3Cl+HCl
2CH3Cl+2Na->C2H6+2NaCl
C2H6->(Pt. t°)С2H4+H2
C2H4+H2O->(H2SO4)C2H5OH
C2H5OH+3O2->(t°)2CO2+3H2O
В)CaCO3+4C->(1900°C)CaC2+3CO
CaC2+H2O->Ca(OH)2+C2H2
C2H2+H2 ->(Pd, BaSO4)C2H4
C2H4+H2O->(H2SO4)=C2H5OH
Комплексні завдання 206. Обчисліть об’єм водню (н. у), що виділиться під час дії металічного калію на метанол масою 24 г.

shkola.in.ua
207. Обчисліть об’єм етену (н. у.), що можна добути з етанолу масою 11,5 г. Яку масу бромної води з масовою часткою брому 2 % можна знебар- вити цією
кількістю газу?
C₂H₅OH (етанол) → C₂H₄ (етен) + H₂O (вода)
Молярна маса етанолу (C₂H₅OH) = 2 * маса вуглецю + 6 * маса водню + маса кисню +
маса водню = 2 * 12.01 g/mol + 6 * 1.01 g/mol + 16.00 g/mol + 1.01 g/mol = 46.07 g/mol
Молярна маса етену (C₂H₄) = 2 * маса вуглецю + 4 * маса водню = 2 * 12.01 g/mol + 4 *
1.01 g/mol = 28.05 g/mol
Молі = маса / молярна маса = 11.5 g / 46.07 g/mol ≈ 0.2492 моль Оскільки кожна молекула етанолу дає одну молекулу етену, ми отримаємо ту саму кількість молей етену.
об'єм етену (н. у.), що можна добути з етанолу масою 11.5 г, становить близько 5.99 л. C₂H₄ + Br₂ → C₂H₂Br₂ + HBr
Молярна маса бромної води (Br₂ + H₂O) = маса брому + маса кисню + 2 * маса водню = 2 * 79.90 g/mol + 16.00 g/mol + 2 * 1.01 g/mol = 159.81 g/mol
Масова частка брому в бромній воді = (маса брому / маса бромної води) * 100% = (2 * 79.90 g / 159.81 g) * 100% ≈ 50%
Так як масова частка брому в бромній воді становить 50%, нам потрібно поділити масу бромної води на два, щоб отримати масу брому:
Маса брому = 11.5 g / 2 = 5.75 g Отже, для знебарвлення об'єму етену (н. у.), що можна добути з етанолу масою 11.5 г, потрібна близько 5.75 г бромної води з масовою часткою брому 2%. 208. Обчисліть масу солі, що утворюється під час взаємодії натрію з етанолом масою 23 г. Дано: m(Na)=23г.
----------------------------
m(C₂H₅ONa)- ?
Рішення:
1. Визначимо молярную масу натрію:
M(Na)=23г./моль
2. Визначимо кількість речовини в 23г. натрію : n(Na)=m(Na)÷M(Na)= 23г.÷23г./моль=1моль
3. Запишемо рівняння реакції:
2C₂H₅OH+2Na=2C₂H₅ONa+H₂ а) за рівнянням реакції: n(Na)=2моль n(C₂H₅ONa)=2моль б) за умовою завдання: n₁(Na)=1моль n₁(C₂H₅ONa)=1моль
4.Визначимо молярну масу етилат натрію : M(C₂H₅ONa)=5x12+5+16+23=104г./моль
shkola.in.ua
5. Визначимо масу етилат натрію кількістю речовини 1моль: m((C₂H₅ONa)= n₁(C₂H₅ONa)×M(C₂H₅ONa)=1моль×104г./моль=104г.
6. Відповідь: під час взаємодії натрію з етанолом масою 23г. утворюється сіль етилат натрію масою 104г.
209.Під час взаємодії метанолу з надлишком натрію виділився водень об’ємом 2,24 л (н. у.). Обчисліть масу спирту, що вступив у реакцію.
2CH3OH + 2Na → 2CH3ONa + H2
M (CH3OH) = 12 + 1 × 3 + 16 + 1 = 32 г/моль
Складемо пропорцію:
X / 2 × 32 = 2,24 × 22,4
X / 64 = 2,24 × 22,4
X = 2,24 × 64 / 22,4 = 6,4 г
m (CH3OH) = 6,4 г.
210. Під час взаємодії натрію з розчином етанолу в бензені масою 200 г ви- ділився
водень об’ємом 56 мл (н. у.). Обчисліть масову частку спирту в цьому розчині.
Дано:
m р-ну = 200 г
V(H2) = 56 мл = 0,056 л
Знайти:
ω(C2H5OH) - ?
Розв'язання:
1) 2C2H5OH + 2Na → 2C2H5ONa + H2↑;
2) n(H2) = V(H2) / Vm = 0,056 / 22,4 = 0,0025 моль;
3) n(C2H5OH) = n(H2) * 2 = 0,0025 * 2 = 0,005 моль;
4) m(C2H5OH) = n * M = 0,005 * 46 = 0,23 г;
5) ω(C2H5OH) = m * 100% / m р-ну = 0,23 * 100% / 200 = 0,115%.
Відповідь: Масова частка C2H5OH становить 0,115%.
211. Складіть рівняння реакцій горіння метанолу, етанолу й пропанолу. У скільки разів будуть розрізнятися об’єми газуватих продуктів реакції, отриманих під час горіння цих спиртів?
1. Горіння метанолу (CH₃OH):
CH₃OH + 1.5 O₂ → CO₂ + 2 H₂O
2. Горіння етанолу (C₂H₅OH):
C₂H₅OH + 3 O₂ → 2 CO₂ + 3 H₂O
3. Горіння пропанолу (C₃H₇OH):
C₃H₇OH + 4.5 O₂ → 3 CO₂ + 4 H₂O
Для метанолу:
1 об'єм метанолу + 1.5 об'єму кисню → 1 об'єм вуглекислого газу + 2 об'єми води Для етанолу:
1 об'єм етанолу + 3 об'єми кисню → 2 об'єми вуглекислого газу + 3 об'єми води Для пропанолу:
1 об'єм пропанолу + 4.5 об'єми кисню → 3 об'єми вуглекислого газу + 4 об'єми води У молекулі метанолу один атом водню, у молекулі етанолу - два атоми водню, у молекулі пропанолу - три атоми водню. Тобто:
- Метанол: 1 об'єм газу
- Етанол: 2 об'єми газу (у 2 рази більше)
- Пропанол: 3 об'єми газу (у 3 рази більше)
shkola.in.ua
212. Обчисліть об’єм гідроген броміду, необхідного для взаємодії з етано- лом
масою 11,5 г.
Дано: маса етанолу (C2H5OH) = 11.5 г
Розрахунок:
1. Знайдемо кількість молей етанолу:
Молярна маса етанолу (C2H5OH) = 46.07 г/моль
Кількість молей етанолу = маса / молярна маса = 11.5 г / 46.07 г/моль ≈ 0.25 моль
2. Знаючи балансовану реакцію взаємодії етанолу з гідроген бромідом (HBr): C2H5OH + HBr → C2H5Br + H2O 3. З балансованої реакції видно, що одна молекула етанолу взаємодіє з однією молекулою гідроген броміду. Відповідь:
Об'єм гідроген броміду, необхідний для взаємодії з етанолом масою 11.5 г, визначається кількістю молей етанолу і дорівнює об'єму газу за нормальних умов (н. у.), оскільки молекула газу займає певний об'єм: Об'єм газу (н. у.) = кількість молей * об'єм молекули газу = 0.25 моль * 22.4 л/моль ≈ 5.6 л Отже, об'єм гідроген броміду, необхідного для взаємодії з етанолом масою 11.5 г, приблизно 5.6 л.
213. Обчисліть об’єм кисню, необхідний для згоряння: а) 230 г етанолу; б) 5 моль метанолу.
Дано:
Маса етанолу (C2H5OH) = 230 г Розв'язок:
1. Знайдемо кількість молей етанолу: Молярна маса етанолу (C2H5OH) = 46.07 г/моль Кількість молей етанолу = маса / молярна маса = 230 г / 46.07 г/моль ≈ 4.99 моль (округлимо до 5 моль)
2. Знаючи балансовану реакцію згоряння етанолу в кисні: C2H5OH + 3O2 → 2CO2 + 3H2O
3. З балансованої реакції видно, що 1 моль етанолу згорає з 3 молями кисню. Для пункту (а):
Кількість молей кисню = 3 * 5 моль = 15 моль
4. Відомо, що об'єм 1 молі газу за нормальних умов (н. у.) дорівнює 22.4 л. Відповідь:
Об'єм кисню, необхідний для згоряння 230 г етанолу, дорівнює 15 моль * 22.4 л/моль ≈ 336 л.
Дано:
Кількість молей метанолу (CH3OH) = 5 моль Розв'язок:
1. Знаючи балансовану реакцію згоряння метанолу в кисні:
CH3OH + 1.5O2 → CO2 + 2H2O
2. З балансованої реакції видно, що 1 моль метанолу згорає з 1.5 молями кисню. Для пункту (б): Кількість молей кисню = 1.5 * 5 моль = 7.5 моль
3. Відомо, що об'єм 1 молі газу за нормальних умов (н. у.) дорівнює 22.4 л. Відповідь:Об'єм кисню, необхідний для згоряння 5 моль метанолу, дорівнює 7.5 моль * 22.4 л/моль ≈ 168 л.
shkola.in.ua
214. Дегідратацією етанолу було добуто 0,448 л етену (н. у.). Обчисліть масу
спирту, що вступив у реакцію.
C2H5OH=C2H4+H2O
M(C2H5OH)=46г/моль
n(C2H4)=0,448/22,4=0,02моль
n(C2H5OH):n(C2H4)=1:1
n(C2H5OH)=0,02моль
m(C2H5OH)=0,02*46=0,92г
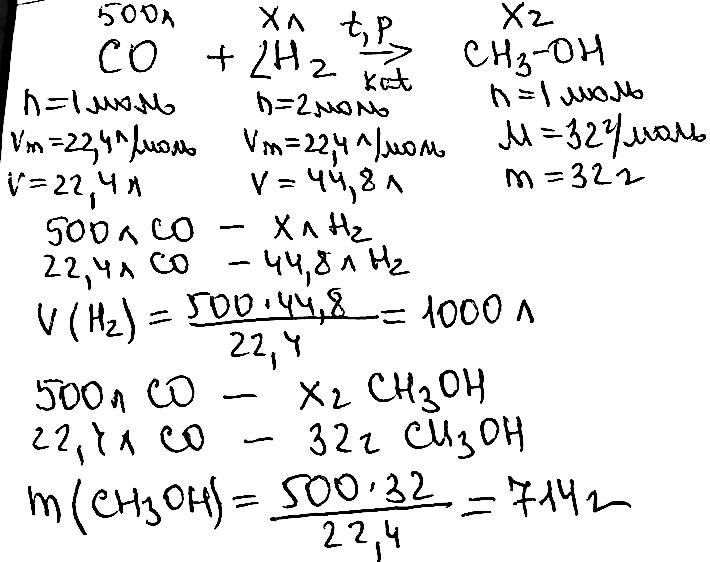
215. Під час взаємодії одноатомного
спирту масою 3,7 г з натрієм виділився водень об’ємом 560 мл (н. у.). Визначте молекулярну формулу спирту.
1) Загальна формула одноатомних спиртів: СnH(2n+1)OH
2) Рівняння реакції: СnH(2n+1)OH + Na = СnH(2n+1)ONa + 0,5H₂
3) Знаходимо молярну масу спирту: М(СnH(2n+1)OH) = 12n + 2n + 1 + 16 + 1 = (14n + 18) г/моль

4) За рівнянням реакції складаємо пропорцію:
(14n + 18) г спирту ------------------ 11,2 л Н₂
3,7 г спирту ------------------ 0,56 л Н₂
0,56 * (14n + 18) = 3,7 * 11,2
7,84n + 10,8 = 41,44
7,84n = 31,36
n = 4
Формула спирту: С₄Н₉ОН - бутанол
216. Під час спалювання одноатомного насиченого спирту кількістю речо- вини 0,1 моль було витрачено 10,08 л кисню (н. у.). Визначте молеку- лярну формулу цього спирту.
217. Метанол у промисловості добувають реакцією сполучення карбон(II) оксиду з воднем. Складіть рівняння цієї реакції. Обчисліть об’єм вод- ню, необхідний для взаємодії з 500 л чадного газу. Яку масу метанолу при цьому можна добути?
shkola.in.ua
Завдання з розвитку критичного мислення
218. Складіть схему перетворень, за якою можна добути етанол з кальцій карбіду. Складіть відповідні рівняння реакцій.
кальцій карбід → етин → етен → етанол
CaC2 → C2H2 → C2H4 → C2H5OH
CaC2 + 2H2O = C2H2 + Ca(OH)2
C2H2+H2=C2H4
C2H4+H2O=C2H5OH
219. Як ви вважаєте, у який спосіб реалізується водовідіймаюча дія речовин: кальцій оксиду, кальцій хлориду (безводного), сульфатної кислоти (концентрованої), фосфор(V) оксиду? В якому випадку від бувається хімічна взаємодія (яка саме), а в якому — фізико-хімічна (яка саме)? Чи впливає на це можливість утворення молекулами водневого зв’язку?
Водовідійма дія речовин може реалізуватися через хімічні та фізико-хімічні процеси.
1. Кальцій оксид (вапняк) має водовідійму дію через хімічну реакцію з водою:
CaO + H2O → Ca(OH)2
Тут відбувається хімічна реакція, в результаті якої утворюється гідроксид кальцію.
2. Кальцій хлорид (безводний) може реагувати з вологою або водою, утворюючи розчин з хлоридом кальцію. Ця реакція також є хімічною.
3. Сульфатна кислота (концентрована) має водовідійму дію через хімічну реакцію: H2SO4 + H2O → H2SO4
Тут реакція також є хімічною, і утворюється концентрований розчин кислоти.
4. Фосфор(V) оксид може реагувати з водою, утворюючи фосфорну кислоту:
P4O10 + 6H2O → 4H3PO4
Ця реакція також є хімічною. Можливість утворення молекулами водневого зв'язку може впливати на характер реакції, зокрема на її швидкість та інтенсивність. 220.Що ми спостерігатимемо, якщо наллємо невелику порцію метанолу в склянку: а) з водою, б) октаном? Відповідь поясніть.
а) Якщо метанол (CH3OH) налити в склянку з водою, то спостерігатимемо утворення однорідного розчину. Метанол є розчинником у воді, і вони змішуються, утворюючи однорідний розчин.
б) Метанол не змішується з октаном (C8H18), оскільки ці речовини мають різні хімічні властивості та полярності. Складніше молекули октану не взаємодіють з менш складними молекулами метанолу. Тому в склянці з октаном і метанолом ми бачитимемо дві несумісні рідини, які не змішуються між собою. 221. На практиці реакцію спиртів з гідроген галогенідами проводять в умовах якомога меншої кількості води в реакційній суміші. Для цього в колбі
змішують концентровану сульфатну кислоту, спирт і галогенід. Складіть рівняння реакції добування бромоетену з етанолу, калій броміду та сульфатної кислоти.
shkola.in.ua
C2H5OH + KBr + H2SO4 → C2H3Br + KHSO4 + H2O 222. Використовуючи значення електронегативностей елементів, порівняйте полярність зв’язків C–H і O–H. Молекули яких речовин — спиртів чи вуглеводнів — більш полярні? Як це позначається на фізичних властивостях цих речовин?
За значенням електронегативності, кисневий атом (O) є більш електронегативним порівняно з вуглецевим атомом (C) та водневим атомом (H). Це означає, що зв'язок O–H є більш полярним, ніж зв'язок C–H. Молекули спиртів (R–OH) мають гідроксильну (-OH) групу, яка містить полярний
зв'язок O–H. Це робить молекули спиртів більш полярними порівняно з молекулами вуглеводнів (R–H), де відсутні полярні групи. Більша полярність молекул спиртів веде до важливого ефекту: спирти здатні до формування водневого зв'язку між молекулами. Це збільшує точку кипіння та температуру плавлення спиртів порівняно з вуглеводнями. Також, спирти є більш
розчинними у воді через здатність до взаємодії за допомогою водневого зв'язку, що робить їх гідрофільними.
223. Спирти практично не проводять електричного струму, тоді як луги, що також містять гідроксильну групу, у розплавленому стані або у водному розчині проводять електричний струм. Чим це можна пояснити?
Це явище можна пояснити різницею у способах проведення електричного струму між спиртами та лугами.
У спиртах, гідроксильна (-OH) група присутня, але спирти не іонізуються або слабко іонізуються в воді. Іонізація в спиртах обмежена, і тому вони не мають вільних іонів для проведення електричного струму.
У лугах, таких як натрій гідроксид (NaOH) або калій гідроксид (KOH), гідроксильна (OH) група також присутня. Проте, вони легко іонізуються у воді на іони гідроксиду (OH-) та металу (Na+ або K+). Ці іони можуть вільно переміщуватися в розплавленому стані або у водному розчині, створюючи струмопровідність. Отже, різниця в провідності електричного струму між спиртами та лугами обумовлена різною здатністю іонізації та утворення вільних іонів в розчині. 224.Як ви вважаєте, чим можна пояснити, що спирти виявляють слабкі кислотні властивості? Слабкі кислотні властивості спиртів можна пояснити за допомогою рівноваги між іонізованою та неіонізованою формами молекул спирту в розчині. Гідроксильна (-OH) група в молекулах спиртів може віддати протон (H+) до розчину, утворюючи іон гідроксиду (OH-). Проте, ця реакція є рівноважною, і більша частина гідроксильних груп залишається у неіонізованому стані. Слабкі кислотні властивості спиртів обумовлені низькою здатністю їх гідроксильних груп віддавати протони. У порівнянні з більш сильними кислотами, які легко віддають протони, гідроксильні групи спиртів менше здатні до іонізації. Це робить спирти слабкими кислотами.
§15. Обчислення за хімічними рівняннями, якщо реагент містить домішки Завдання для засвоєння матеріалу
225. Обчисліть об’єм етену, який можна добути з технічного етанолу масою 250 г, що містить 8 % домішок.
shkola.in.ua
CH3CH2OH H2SO4/H2O CH2=CH2 w=m/m(всього)*100%
m=w*m(всього)=92%*250/100%=230г
n(CH3CH2OH) m/M=230/46=5моль
n(CH2=CH2)=n(C2H5OH)=5 моль V(CH2=CH2)=n*V(внизу m)=5*22?4=112л В-дь:112л.
226. Природний газ об’ємом 1 м3 (н. у.), що містить 10,4 % домішок азоту (за об’ємом), піддали піролізу. Обчисліть максимальний об’єм етину, що можна добути.
227. Під час згоряння технічного бензену масою 1 г утворився вуглекислий газ масою 2,64 г. Обчисліть масову частку домішок у бензені.
Дано:
m(C6H6 технічного) = 1 г
О2
m(CO2) = 2,64 г
Знайти : W(домішок у C6H6)-?
Розв'язання
x г 2,64 г
2C6H6 + 15O2 = 12CO2 +6H2O
2*78= 156 г 12*44=528 г =
m(чистого C6H6) = = 0,78 г



m(домішок) = 1г - 0,78 г = 0,22 г
Знаємо масу домішок. Щоб дізнатися їх масову частку складемо пропорцію:
1 г = 100%
0,22 г = х%
W(домішок) = = 22%
228. З вуглецю масою 1 кг добуто метан об’ємом 1,792 м3 (н. у.). Обчисліть масову частку домішок у вуглецю.
масова частка домішок = (маса домішок/маса вуглецю) х 100%
shkola.in.ua
Щільність метану становить 0,717 кг/м3 за нормальних умов. маса метану = об'єм метану x щільність метану маса метану = 1,792 м3 х 0,717 кг/м3 = 1,28 кг маса домішок = маса вуглецю - маса метану маса домішок = 1 кг – 1,28 кг = 0,72 кг масова частка домішок = (маса домішок/маса вуглецю) х 100% масова частка домішок = (0,72 кг/1 кг) x 100% = 72%. Так масова частка домішок у вуглецю становить 72%.
229. Із глюкози масою 1,1 кг добуто етанол об’ємом 0,69 л (густина 0,8 г/см3).
Обчисліть масову частку домішок у глюкозі.
230. Технічний кальцій карбід масою 1,6 г залили надлишком води. Під час пропускання утвореного газу крізь розчин брому в реакцію вступив бром масою 7,2 г. Обчисліть масову частку домішок у технічному кальцій карбіді.
CaC2+2H2O->C2H2+Ca(OH)2
C2H2+Br2->C2H2Br2
m(CaC)=1,6г

m(Br2)=7,2г



1. Знайдемо, скільки С2Н2 прореагувало з бромом: m(C2H2)=m(Br2)×M(C2H2)÷M(Br2)=7,2г×26г/моль÷160г/моль=1,17г.
2. Знайдемо, скільки практично мало прореагувати СаС2, щоб виділилося 1,17г С2Н2: m(СаС2)=m(C2H2)×M(СаС2)÷M(C2H2)=1,17г×64г/моль÷26г/моль=2,88г - це маса чистого кальцій карбіду. В умові дана маса кальцій карбіду з домішками, і вона менша за масу чистого, а так бути не може, тому не зрозуміло, як розв'язувати задачу. 231. Обчисліть масу технічного бензену з масовою часткою домішок 6,4 % для добування бромобензену масою 565,2 г.
Дано:
W(домішок у C6H6) = 6,4%
Br2
m(C6H5Br) = 565,2 г
Знайти: m(технічного C6H6) Розв'язання:
x г 565,2 г
C6H6 + Br2 = HBr + C6H5Br
78 г 157 г
m(чистого C6H6) = = 280,8 г
Ми знайшли масу чистого бензену, а нам потрібно знайти масу бензену з домішками(тобто, технічного). Нехай, маса чистого бензену - це 100%
W(технічного C6H6) = W(чистого C6H6) + W(домішок) = 100% + 6,4% = 106,4%.
Складемо пропорцію:
280,8 г = 100%
х г = 106,4%
m(технічного C6H6) = = 298,7712 г
=
shkola.in.ua
232. Технічний етанол містить 4 % домішок. Обчисліть масу зразка такого етанолу, якщо під час його згоряння утворився вуглекислий газ масою 0,9183 г.
Міні-проекти 233.Дізнайтеся з відкритих джерел інформації про хімічні або харчові виробництва, що є у вашій місцевості: яку продукцію вони випускають, яку сировину використовують та приблизні обсяги виробництва. Уявіть, що ви працюєте головним технологом на цьому підприємстві та контролюєте аналітичну лабораторію. Змоделюйте ситуацію, за якої в лабораторії припустилися помилки у визначенні вмісту корис- ної речовини в сировині (у більший або в менший бік). Оцініть, як це відіб’ється на прибутках вашого підприємства.
§16. Багатоатомні спирти. Гліцерол Контрольні запитання 234.Наведіть молекулярну, розгорнуту та скорочену структурні формули гліцеролу.
Молекулярна формула гліцеролу: C3H8O3 Розгорнута структурна формула гліцеролу: HO–CH2–CH(OH)–CH2OH Скорочена структурна формула гліцеролу: CH2OH
CH2OH
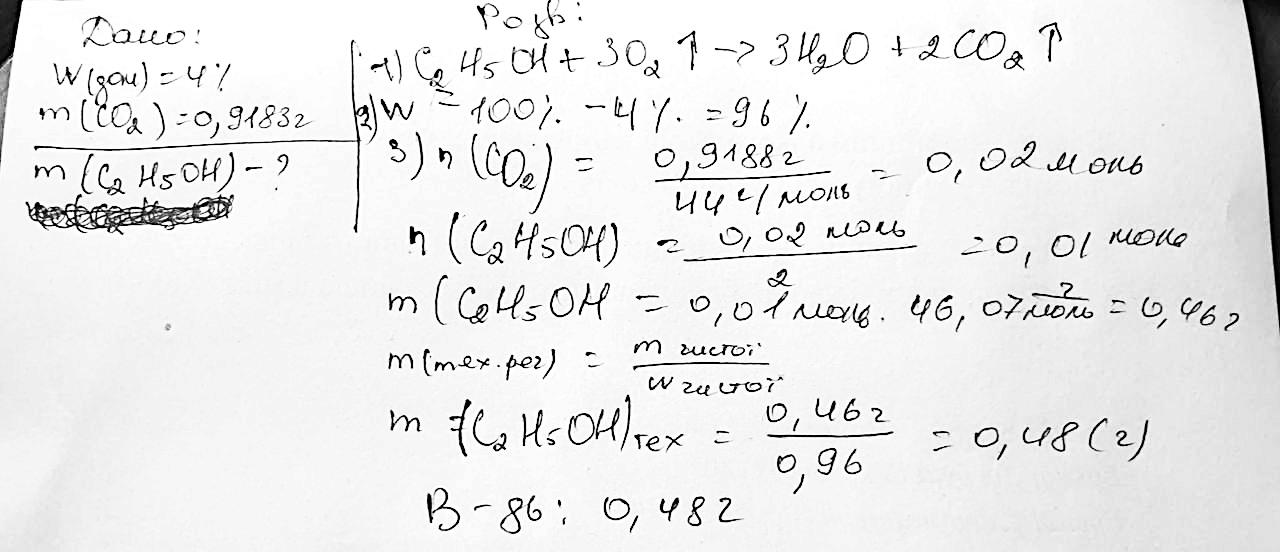
235. За якою ознакою речовини відносять до багатоатомних спиртів? Речовини відносять до багатоатомних спиртів, якщо в їхній молекулі присутня більше одного гідроксильного (OH) функціонального групи.
236. Схарактеризуйте фізичні властивості гліцеролу. Чим вони відрізняються від властивостей одноатомних спиртів? Чим це зумовлено? Гліцерол є багатоатомним спиртом, і його фізичні властивості відрізняються від властивостей одноатомних спиртів, таких як метанол, етанол і пропанол. Точка кипіння та плавлення: Точка кипіння гліцеролу вища порівняно з більшостю одноатомних спиртів, оскільки у нього більше атомів і більше міжмолекулярних сил, таких як водневі зв'язки. В'язкість та щільність: Гліцерол є густою та в'язкою рідиною, оскільки молекула має більше атомів та гідроксильних груп, які можуть взаємодіяти між собою. Водорозчинність: Гліцерол розчиняється у воді, але менш високо, ніж одноатомні спирти, через більшу гідрофобну (водонепритягнутість) частину молекули.
|
| CHOH
shkola.in.ua
Реакції окиснення: Гліцерол може бути більш стійким до окиснення порівняно з одноатомними спиртами, оскільки у нього більше можливих місць для окиснення. 237. Схарактеризуйте хімічні властивості гліцеролу та складіть відповідні
рівняння реакцій.
Гліцерол має ряд хімічних властивостей, які включають гідроліз, окиснення, естерифікацію та інші.
1. Гідроліз: Гліцерол може претерпівати гідроліз, де гідроксильні групи реагують з
молекулами води, утворюючи гліцерин та трьохолчані кислоти. Рівняння:
C3H8O3 + 3H2O → C3H5(OH)3 + 3H2O
2. Окиснення: Гліцерол може бути окислений до гліцерінової кислоти, гліколевої
кислоти та інших сполук. Окиснення може відбуватися за участю кисню або окислювачів.
Рівняння (за участю кисню):
C3H8O3 + O2 → 3H2O + C3H4O4
3. Естерифікація: Гліцерол може реагувати з кислотами для утворення гліцеридів (естерів гліцеролу) - це основні компоненти жирів та оливкової олії.
Рівняння:
C3H8O3 + 3RCOOH → C3H5(OCOR)3 + 3H2O
4. Реакції з галогенами: Гліцерол може реагувати з галогенами (наприклад, бромом) та утворювати бромгліцероли.
Рівняння:
C3H8O3 + 3Br2 → C3H5Br3O3 + 3HBr
5. Етерифікація:Гліцерол може реагувати зі спиртами у реакції етерифікації, утворюючи гліцериди.
Рівняння:
C3H8O3 + 3ROH → C3H5(OR)3 + 3H2O 238. У чому виявляються кислотні властивості спиртів? Порівняйте кислотні властивості одно- та багатоатомних спиртів. Кислотні властивості спиртів проявляються у здатності їхніх гідроксильних (OH) груп взаємодіяти з лужними речовинами, утворюючи солі - алкоксиди. Процес цієї взаємодії називається нейтралізацією. Одноатомні спирти, такі як метанол (CH3OH) та етанол (C2H5OH), мають слабкі кислотні властивості. Їхні гідроксильні групи здатні нейтралізуватися лужними речовинами, утворюючи алкоксиди.
shkola.in.ua
Багатоатомні спирти, такі як гліцерол (C3H8O3) та більш складні спирти, мають більш виражені кислотні властивості. У них є кілька гідроксильних груп, які можуть здійснювати нейтралізацію з лужними речовинами, утворюючи солі. Порівнюючи кислотні властивості одноатомних та багатоатомних спиртів, можна сказати, що багатоатомні спирти зазвичай мають більш виражені кислотні властивості через наявність декількох гідроксильних груп. Це зумовлено тим, що багатоатомні спирти можуть взаємодіяти з більшою кількістю лужних частинок, утворюючи більше
алкоксидних солей.
239. Напишіть молекулярні формули етиленгліколю і гліцеролу. Похідними яких вуглеводнів вони є?
Молекулярні формули:
1. Етиленглікол: C2H6O2
2. Гліцерол: C3H8O3
Етиленглікол є похідним етану (C2H6), а гліцерол є похідним пропану (C3H8). Завдання для засвоєння матеріалу 240.Які з наведених формул речовин відповідають багатоатомним спиртам? Відповідь: б, г Пояснення: багатоатомні спирти містять кілька гідроксильних груп (ОН) в) речовина є двоосновною карбоновою кислотою, оскільки містить у складі дві карбоксильні групи - СООН
а) одноатомний спирт, тому що у складі містить тільки одну -ОН групу
241. Чим за складом відрізняються багатоатомні спирти від одноатомних?
Зобразіть структурну формулу спирту, молекула якого містить три атоми Карбону і два атоми Оксигену.
Багатоатомні спирти містять більше одного атома вуглецю в молекулі, в той час як одноатомні спирти містять лише один атом вуглецю. Структурна формула спирту з трьома атомами вуглецю і двома атомами кисню (C3H8O2) може мати вигляд: H |
H-C-O-C-H
H H У цій молекулі трьохатомний ланцюг вуглецю (C3) з'єднаний з двома атомами кисню (O) через один атом водню (H). 242. У двох пробірках містяться дві рідини — етанол і гліцерол. Як можна їх розрізнити? Складіть план проведення досліду. Для розрізнення етанолу і гліцеролу можна використати властивість гліцеролу утворювати піну у присутності води і спірту. Ось план проведення досліду:
1. Підготовка пробірок:
- Додати декілька крапель етанолу у першу пробірку.
- Додати декілька крапель гліцеролу у другу пробірку.
2. Додавання води:
- Додати декілька крапель води до обох пробірок.
3. Спостереження за утворенням піни:
shkola.in.ua
- У присутності води, гліцерол може утворювати піну, тоді як етанол зазвичай не утворює піну. Якщо у другій пробірці з гліцеролом утвориться піна після додавання води, це буде свідчити про наявність гліцеролу. У першій пробірці з етанолом піна не утвориться, що допоможе відрізнити дві рідини. Комплексні завдання 243. Обчисліть об’єм водню (н. у.), що виділиться під час взаємодії натрію з гліцеролом масою 69 г.
|
|
244. Обчисліть масову частку домішок у технічному гліцеролі, якщо під час взаємодії його зразка масою 35 г із натрієм виділився водень об’ємом 11,76 л (н. у.).
m(C3H8O3 с прим)=35 г
V(H2)=11,76 л
Розвязок:
2CH2(OH)-CH2(OH)-CH2(OH)+6Na→
2CH2(ONa)-CH2(ONa)-CH2(ONa)+3H2
x г 11,76 л
2C3H8O3 + 6Na → 2C3H5O3Na3 + 3H2
2*92 г/моль 3*22,4 л/моль
m(C3H8O3)=x=(11.76*92*2)/(22.4*3)=32.2 г
m=35-32,2=2,8 г
w=2,8/35=0.08=8%
245. Обчисліть об’єм вуглекислого газу (н. у.), що виділиться під час згоряння гліцеролу масою 78,2 г.
2C3H8O3+7O2=6CO2+8H2O
n(CO2)=3n(C3H8O3)

n(C3H8O3)=78.2/92
V(CO2)=(78.2/92)*3*22.4=57,12 л
246. Обчисліть відносну молекулярну масу двохатомного спирту, якщо під час взаємодії його зразка масою 3,8 г із натрієм виділився водень об’ємом 1,12 л (н. у.)?
В реакції з двоатомним спиртом натрій заміщатиме два атоми водню, які і виділятимуться. Мольне співвідношення спирту і водню рівне, тому 3,8/(1,12/22,4)=76 г/моль
247. Обчисліть масову частку Натрію в речовинах, що утворилися під час реакції
натрію з метанолом та з гліцеролом. Яка залежність (пряма, зворотна)
shkola.in.ua
спостерігається між масовою часткою металічного елемента й атомністю спирту?
Для реакції натрію з метанолом (CH3OH), відомо, що молекула метанолу містить 1 атом вуглецю, 4 атоми водню та 1 атом кисню. Під час реакції натрій замінює водень, утворюючи натрієву сіль (натрієвий метанолат) та виділяючи водень.
Для реакції натрію з гліцеролом (C3H8O3), молекула гліцеролу містить 3 атоми вуглецю, 8 атомів водню та 3 атоми кисню. Під час реакції натрій замінює водень, утворюючи натрієву сіль (натрієвий гліцеролат) та виділяючи водень.
Тепер обчислимо масову частку натрію в цих реакціях.
Для реакції з метанолом:
Маса натрію = 23 г/моль
Маса метанолу = 32 г/моль
Масова частка натрію = (Маса натрію / Маса метанолу) * 100% = (23 / 32) * 100% ≈ 71.88%
Для реакції з гліцеролом:
Маса натрію = 23 г/моль
Маса гліцеролу = 92 г/моль
Масова частка натрію = (Маса натрію / Маса гліцеролу) * 100% = (23 / 92) * 100% ≈ 25% Залежність між масовою часткою металічного елемента (натрію) і атомністю спирту є зворотною. Це означає, що при збільшенні атомної маси спирту (гліцеролу), масова частка натрію утворених солей зменшується. Завдання з розвитку критичного мислення 248.Використовуючи матеріал параграфа, проілюструйте прикладами ключову ідею цього параграфа.
Заголовок параграфу: §16. Багатоатомні спирти. Гліцерол Ключова ідея параграфу: У цьому параграфі розглядаються спирти, які містять більше одного атома вуглецю в молекулі. Основною речовиною, яка виступає як приклад для розгляду, є гліцерол. Приклади ключової ідеї: 1. Гліцерол (пропан-1,2,3-тріол) є багатоатомним спиртом, молекула якого містить три гідроксильні групи (OH) та три атоми вуглецю. Він відрізняється від одноатомних спиртів, таких як етанол чи метанол, своєю складною молекулярною структурою.
2. Гліцерол є найпростішим представником багатоатомних спиртів. Він використовується в різних галузях, зокрема у фармацевтичній промисловості, косметології та харчовій промисловості.
3. У молекулі гліцеролу може відбуватися взаємодія з різними речовинами, яка може призводити до утворення гліцеридів, які є складовими частинами жирів та олій.
4. Порівняно з одноатомними спиртами, гліцерол має більшу масу та більше гідроксильних груп, що може впливати на його фізичні та хімічні властивості. Отже, параграф §16 зосереджується на вивченні багатоатомних спиртів на прикладі гліцеролу, аналізує їхню структуру, властивості та можливі застосування в різних галузях.
248. Використовуючи матеріал параграфа, складіть рівняння реакції взаємодії етиленгліколю з натрієм та купрум(II) гідроксидом. Реакція взаємодії етиленгліколю (етандіолового алкоголю) з натрієм та купрум(II)
гідроксидом може мати такий вигляд: а) Взаємодія етиленгліколю з натрієм:
HOCH2CH2OH + 2Na → HOCH2CH2ONa + H2 б) Взаємодія етиленгліколю з купрум(II) гідроксидом:
shkola.in.ua
HOCH2CH2OH + Cu(OH)2 → HOCH2CH2OCu + 2H2O
250.Під час взаємодії суміші гліцеролу з одноатомним насиченим спиртом масою 15,6 г з натрієм виділяється водень об’ємом 3,08 л (н. у). Ця суміш такої самої маси взаємодіє зі свіжодобутим купрум(II) гідроксидом масою 2,45 г. Визначте молекулярну формулу одноатомного спирту в цій суміші. Багатоатомні спирти взаємодіють з купрум(II) гідроксидом у стехіометричному співвідношенні 2:1.
Для визначення молекулярної формули одноатомного спирту в цій суміші ми можемо використовувати дані про виділений об'єм водню при реакції з натрієм та масу купрум(II) гідроксиду, що взаємодіє з сумішшю гліцеролу та одноатомного спирту. 1. Обчислимо кількість молей водню, виділеного при реакції з натрієм:
Молярний об'єм водню за нормальних умов (н. у.) = 22.4 л/моль
Кількість молей водню = об'єм / молярний об'єм = 3.08 л / 22.4 л/моль ≈ 0.1375 моль
2. Розрахуємо кількість молей гліцеролу, що взаємодіє з натрієм: Співвідношення водню та гліцеролу у реакції з натрієм: 3:1 Кількість молей гліцеролу = кількість молей водню * (1 / 3) ≈ 0.0458 моль
3. Розрахуємо масу гліцеролу: Маса гліцеролу = кількість молей * молярна маса = 0.0458 моль * 92.1 г/моль ≈ 4.23 г
4. Знайдемо масу одноатомного спирту в суміші: Маса одноатомного спирту = загальна маса суміші - маса гліцеролу = 15.6 г - 4.23 г ≈ 11.37 г
5. Розрахуємо кількість молей одноатомного спирту: Кількість молей одноатомного спирту = маса / молярна маса = 11.37 г / (12.01 г/моль + 16.00 г/моль) ≈ 0.583 моль
6. Знаючи кількість молей та масу одноатомного спирту, можемо знайти його молекулярну масу:
Молекулярна маса одноатомного спирту = маса / кількість молей ≈ 11.37 г / 0.583 моль
≈ 19.49 г/моль
Знаючи молекулярну масу, ми можемо приблизно визначити, що це етанол (C2H5OH). Міні-проекти 251. У додаткових джерелах знайдіть інформацію про застосування етиленгліколю та гліцеролу. У чому полягає промислове значення цих речовин? Дайте розгорнуту відповідь. Етиленгліколь та гліцерол є важливими хімічними сполуками з численними промисловими застосуваннями. Етиленгліколь (етандіоловий спирт):
• Антифриз і теплоносій: Використовується як основна складова антифризів та теплоносіїв для автомобільних систем охолодження та опалення.
• Виробництво пластмас: Входить в склад поліефірних смол, що застосовуються у виробництві пластикових бутылок, контейнерів, фільмів та інших виробів.
• Фармацевтика: Використовується у виробництві лікарських препаратів та косметичних засобів.
• Виробництво волокон та текстилю: Застосовується для виробництва поліефірних волокон та тканин.
• Хімічна промисловість: Використовується як розчинник та компонент у виробництві фарб, лаків, смол, косметики та інших хімічних продуктів.
Гліцерол (пропандіоловий спирт):
• Косметична та фармацевтична промисловість: Використовується у виробництві косметичних засобів, м'яких милах, лікарських препаратах, зубних пастах та інших продуктах.
• Харчова промисловість: Застосовується як підсилювач смаку та консервант у харчових продуктах, а також як компонент у виробництві карамелі, шоколаду, кондитерських виробів тощо.
shkola.in.ua
• Виробництво пластмас та поліуретанів: Використовується як мономер для синтезу поліуретанів та пластиків.
• Медична та лабораторна діяльність: Використовується як розчинник для медичних препаратів, антисептичних розчинів, реагентів та інструментів.
• Папірна промисловість: Застосовується як компонент виробництва паперу для підвищення його прочності та м'якості. Узагальнюючи, етиленгліколь та гліцерол мають значиме промислове значення у різних галузях, включаючи автомобільну і хімічну промисловість, фармацевтику, косметологію, харчову та інші галузі. 252. Нітрогліцерин як вибухівку часто згадують у художніх творах. Пере- гляньте запропоновані художні твори та схарактеризуйте: а) небезпе- ки роботи
транспортування нітрогліцерину за к/ф «Плата за страх» (реж. Анрі-Жорж Клузо) та «Легенда Зорро» (реж. Мартін Кемпбел); б) процес синтезу нітрогліцерину за романом Ж. Верна «Таємничий острів» та к/ф «Бійцівський клуб» (реж. Девід Фінчер).
§17. Фенол Контрольні запитання
253. Наведіть молекулярну та розгорнуту структурну формули фенолу. Молекулярна формула фенолу: C6H6O Розгорнута структурна формула фенолу:
молекулі шість атомів вуглецю (C6), шість атомів водню (H6) та один атом кисню (O).
shkola.in.ua
254. Схарактеризуйте фізичні властивості фенолу. Чим вони відрізняються від властивостей спиртів? Чим це зумовлено? Фенол має ряд характерних фізичних властивостей: Точка плавлення та кипіння: Точка плавлення фенолу вища порівняно з багатьма спиртами, так як він утворює міжмолекулярні водневі зв'язки. Точка кипіння також вища, що обумовлюється цими водневими зв'язками. Водорозчинність: Фенол розчиняється у воді в обмежених кількостях, але значно менше водорозчинний, ніж більші спирти. Це зумовлено наявністю гідроксильної групи, яка може утворювати водневі зв'язки з молекулами води. Запах та колір: Фенол має характерний сильний запах, який відрізняється від беззапахових більшості спиртів. Він також має блакитний колір, коли його розчинено в воді.
й
H | H - C
C - H | C / \ H - C C - H | C | H - C - H | O У
-
цій
Токсичність: Фенол є токсичним сполукам, що може викликати подразнення шкіри, очей та дихальних шляхів. Ця токсичність обумовлена його специфічною структурою та взаємодією з живими тканинами.
255. Схарактеризуйте хімічні властивості фенолу.
Фенол має такі хімічні властивості: Кислотні властивості: Фенол виявляє слабкі кислотні властивості через наявність
гідроксильної групи. Взаємодія з лугами утворює солі - фенолати.
Окиснення: Фенол піддається окисненню, утворюючи фенольні альдегіди та кетони.
Нітрація: Він може бути нітрований за участі азотної кислоти, утворюючи
нітрофеноли.
Етерифікація: Фенол може бути ацетильований, утворюючи ацетофенон.
Електрофільна підстановка: Він зазнає ароматичної підстановки з електрофільними агентами.
Утворення діазонієвих солей: Фенол може бути перетворений на діазонієві солі. Утворення ефірів: Він утворює ароматичні ефіри.
256. У чому виявляються кислотні властивості фенолу? Порівняйте кислотні властивості фенолу та спиртів. Кислотні властивості фенолу виявляються через присутність гідроксильної групи (–OH) в його молекулі. Фенол може взаємодіяти з лугами, такими як натрій гідроксид або калій гідроксид, утворюючи фенолатні солі (фенолати). Реакція проходить за рівнянням: C6H5OH + NaOH → C6H5ONa + H2O Порівнюючи кислотні властивості фенолу та спиртів, можна відзначити, що фенол виявляє сильніші кислотні властивості, ніж спирти, оскільки спостерігається більший зміщення рівноваги в бік утворення іонів фенолату при реакції з лугами. Це зумовлено великою стабільністю отриманого аніону, який має можливість додаткового стабілізуватися за рахунок резонансу в ароматичному кільці. У спиртах така можливість відсутня, тому їх кислотні властивості слабкі порівняно з фенолом. 257. Схарактеризуйте взаємний вплив бензенового ядра та гідроксильної групи у фенолі. Як цей вплив позначається на хімічних властивостях фенолу? Взаємний вплив бензенового ядра і гідроксильної групи у фенолі визначає особливості хімічних властивостей цієї сполуки. Гідроксильна група в фенолі підсилює активність бензенового ядра через подібність до карбоксильної групи, яка використовується в карбонільних сполуках. Це призводить до підвищеної реакційної здатності фенолу порівняно зі звичайним бензеном.
shkola.in.ua
Гідроксильна група також робить фенол більш поларним, забезпечуючи можливість утворення водневого зв'язку з іншими молекулами. Це позитивно впливає на розчинність фенолу в воді, а також на його взаємодію з іншими сполуками. Завдяки гідроксильній групі фенол може взаємодіяти з лугами та утворювати фенолатні іони, проявляючи кислотні властивості. Також фенол може взаємодіяти з електрофільними реагентами (наприклад, нітратними кислотами), що призводить до введення заміщених груп на бензенове ядро. Отже, взаємний вплив бензенового ядра і гідроксильної групи робить фенол більш активним і реакційним порівняно зі звичайним бензеном та дозволяє реалізувати різноманітні хімічні перетворення. 258. Опишіть якісні реакції на фенол. Якісні реакції на фенол допомагають виявити його наявність та властивості. Ось декілька характерних якісних реакцій на фенол:
Реакція з FeCl3: Фенол утворює інтенсивно забарвлені комплекси з розчином хлориду заліза(III). Реакція може бути використана для виявлення наявності фенолу – розчин хлориду заліза(III) змінює колір зі світло-жовтого на фіолетовий.
Бромування: Фенол збромований з водним розчином брому або хлору при кімнатній
температурі, утворюючи білі або кремові відклади бромованих продуктів.
Азотнокислотний тест: Реакція фенолу з нітратною кислотою при наявності
концентрованої сульфатної кислоти призводить до утворення жовто-помаранчевого
сплаву.
Взаємодія з лугами: Фенол реагує з лугами (наприклад, натрій гідроксидом)
утворюючи фенолатні іони та воду. Ацетатний тест: Фенол реагує з ацетангідридом в присутності концентрованої
сульфатної кислоти, утворюючи ацетат фенілу з характерним запахом.
259.Схарактеризуйте небезпечність потрапляння фенолу в навколишнє середовище. Фенол є небезпечною речовиною для навколишнього середовища і здоров'я людей. Основні небезпечні аспекти пов'язані з його токсичністю та певною стійкістю у середовищі. Деякі можливі небезпечні наслідки потрапляння фенолу в навколишнє середовище включають: Токсичність для людей: Фенол може бути токсичним для дихальних шляхів та шкіри людини. Вдихання парів фенолу може спричинити подразнення дихальних шляхів, головний біль, запаморочення, нудоту та інші неприємні симптоми. Контакт зі шкірою може призвести до подразнення та висипань.
Токсичність для водних організмів: Викиди фенолу у водні середовища можуть
негативно вплинути на водних організмів, так як він може бути токсичним для них. Водорозчинний фенол може спричинити забруднення водойм та вплинути на екосистеми.
Забруднення грунту: Невідповідне використання або неправильне зберігання фенолу може призвести до забруднення грунту. Це може вплинути на якість ґрунту та рослинний світ.
Шкідливий вплив на повітряний склад: Викиди фенолу у повітря можуть впливати на якість повітря, спричиняючи забруднення повітря і можливо впливаючи на кліматичні параметри. Стійкість у середовищі: Фенол може залишатися в навколишньому середовищі на тривалий час, що може призвести до накопичення в різних екосистемах.
Завдання для засвоєння матеріалу
260. Серед наведених структурних формул визначте формули сполук, що
належать до фенолів.
Відповідь: б,в
261. Із переліку речовин — CH3OH, CH4, C3H5(OH)3, C6H5OH — виберіть ті, що взаємодіють: а) з Na; б) NaOH; в) Br2; г) розчином Br2.
а) CH3OH (метанол)
shkola.in.ua
б) CH3OH (метанол), C3H5(OH)3 (гліцерол), C6H5OH (фенол)
в) C6H5OH (фенол)
г) C6H5OH (фенол)
262. Складіть рівняння реакції, що ілюструють відмінності у хімічних
властивостях фенолу та: а) етанолу; б) бензену. Відповідь поясніть.
а) Реакція фенолу з натрієм (Na):
C6H5OH + Na → C6H5ONa + 1/2H2
Етанол (C2H5OH) у такій реакції не взаємодіє з натрієм. б) Реакція фенолу з бромною водою (Br2/H2O): C6H5OH + Br2 → C6H5Br + HBr + H2O Бензен (C6H6) у такій реакції не взаємодіє з бромною водою. Відмінності в хімічних властивостях обумовлені присутністю гідроксильної групи (OH) у фенолі, яка надає йому більш активні кислотні та реакційні властивості порівняно
з бензеном, а також здатністью до нуклеофільної підстановки в молекулі, що відрізняє його від етанолу.
Комплексні завдання
263. До розчину фенолу додали бромну воду, утворився осад масою 49,65 г.
Обчисліть масу фенолу, що вступив у реакцію.
Дано:
m(C6H3Br3O) = 49,65г.
Знайти: m(C6H5OH) - ?
Рішення:
Складемо УХР за умовою завдання:
C6H5OH + 3Br2 = C6H3Br3O + 3HBr
Знайдемо кількість речовини 2,4,6-трибромфенолу:
n(C6H3Br3O) = m / M = 49,65 / 331 = 0,15 моль
M(C6H3Br3O) = 331 г/моль
Складемо пропорцію з УХР для знаходження кількості речовини фенолу:
n(C6H3Br3O): n(C6H5OH) = 1:1; n(C6H5OH) = 0,15 моль Знайдемо масу фенолу:
m(C6H5OH) = n * M = 0,15 * 94 = 14,1 р.
M(C6H5OH) = 94 г/моль
Відповідь: 14,1 р.
264.Обчисліть масу розчину натрій гідроксиду з масовою часткою лугу 4%, необхідного для нейтралізації розчину фенолу масою 200 г із масовою часткою
0,705 %.
Дано:
w(NaOH) = 4 % = 0,04
m(р-нC6Н5OH) = 200г
w(C6Н5OH) = 0,705
Найти: m(р-нуNaOH) - ?
Знайдемо масу C6Н5OH в розчині:
m(C6Н5OH) = m(р-нC6Н5OH) * w(C6Н5OH) = 200 * 0,795 = 141 г
Знайдемо кількість речовини C6Н5OH у розчині:
М(C6Н5OH) = 12 * 6 + 1 * 6 + 16 = 94 г/моль
n(C6Н5OH) = m(C6Н5OH) /М(C6Н5OH) = 141/91 = 1,5 моль
Складемо РХР:
shkola.in.ua
C6Н5OH + NaOH = C6H5ONa +H2O
З РХР бачимо, що n(NaOH) = n(C6Н5OH) = 1,5 моль
Знайдемо масу NaOH :
m(NaOH) = n(NaOH) * М(NaOH) = 1,5 * 40 = 60 г
Обчислимо масу розчину NaOH:
m(р-нуNaOH) = m(NaOH) /w(NaOH) = 60/0,04 = 1500 г
264. Зразок фенолу масою 47 г змішали з розчином калій гідроксиду масою 953 г. У результаті утворився розчин з дуже лужним середовищем. Обчисліть масу солі в утвореному розчині.
266.Зразок технічного фенолу масою 1 г розчинили в надлишку розчину лугу. Крізь отриманий розчин пропустили вуглекислий газ до припи- нення виділення осаду. У результаті утворився осад масою 0,95 г. Обчисліть масову частку домішок у технічному фенолі. Для вирішення задачі використовуємо рівняння хімічної реакції між фенолом і натрієвим гідроксидом:
C6H5OH + NaOH → NaC6H5O + H2O Молекулярна маса фенолу (C6H5OH) дорівнює 94,11 г/моль, тому 1 г фенолу містить 0,0106 моль фенолу.

shkola.in.ua
З огляду на те, що в розчин додали надлишок натрієвого гідроксиду і до припинення виділення осаду пропустили вуглекислий газ, можна припустити, що утворився натрієвий феноксид (NaC6H5O), який з розчину вийшов у вигляді осаду: NaC6H5O + CO2 → C6H5OH + NaHCO3 Молекулярна маса NaC6H5O дорівнює 144,11 г/моль, тому 1 г фенолу міг бути розчинений в 6,94 г NaC6H5O. Маса утвореного осаду дорівнює 0,95 г, що відповідає масі 0,0066 моль фенолу (0,95 г / 144,11 г/моль). Тому маса фенолу, який не утворив осаду, дорівнює різниці між масою фенолу, який був доданий у розчин (1 г) та масою фенолу, який утворив осад (0,0066 моль x 94,11 г/моль = 0,62 г). Отже, маса фенолу, який залишився у розчині, дорівнює 0,38 г.
Масова частка домішок у технічному фенолі може бути розрахована за допомогою
формули: масова частка домішок = (маса домішок / загальна маса) x 100%
Загальна маса розчину складає 1 г + маса надлишку натрієвого гідроксиду, яку не можна точно визначити з умови задачі. Проте, оскільки натрій та гідроксид гідроксидується повністю воді, можна припустити, що маса натрієвого гідроксиду була більшою за масу фенолу, тобто загальна маса розчину була більшою за 1 г. Отже, можемо припустити, що маса домішок у технічному фенолі дорівнює масі розчину (більшої за 1 г), мінус маса фенолу, який був доданий до розчину (1 г): маса домішок = загальна маса розчину - маса фенолу = > 1 г - 1 г = 0 г Таким чином, масова частка домішок у технічному фенолі дорівнює 0% (тобто, він є чистим за умови задачі).
267. Розчин фенолу в пропанолі масою 10 г із масовою часткою фенолу 1,41 % змішали з розчином калій гідроксиду. Крізь утворений роз- чин пропустили вуглекислий газ. Обчисліть максимальну масу осаду, що може утворитися під час пропускання газу.
Дано: Розчин фенолу (10 г, 1,41% фенолу), розчин калій гідроксиду, пропускання вуглекислого газу.
Розв'язок:
Маса фенолу в розчині: 0,141 г.
Реакція: C6H5OH + KOH → C6H5OK + H2O
Утворення калій карбонату: C6H5OK + CO2 → C6H5OH + K2CO3
Маса калій карбонату = маса фенолу = 0,141 г Максимальна маса осаду: 0,141 г. Відповідь: Максимальна маса осаду - 0,141 г. Завдання з розвитку критичного мислення 268. Запропонуйте хімічний спосіб розділення суміші етанолу та фенолу. Одним з можливих хімічних способів розділення суміші етанолу та фенолу є використання розчинників із відмінними розчинними властивостями для цих речовин. Оскільки фенол має більшу кислотність і може утворювати солі з лужними розчинниками, такими як натрій гідроксид (NaOH), то основний принцип розділення полягає у використанні цієї реакції. Один із можливих способів:
1. Додайте до суміші етанолу та фенолу розчин натрій гідроксиду (NaOH). Це призведе до утворення натрій феноксиду та натрій етанолату:
C6H5OH + NaOH → C6H5ONa + H2O
C2H5OH + NaOH → C2H5ONa + H2O
2. Оскільки натрій феноксид має більшу розчинність у воді, ніж натрій етанолат, розчинність етанолу у воді зменшиться після цієї реакції.
3. Розчин, що утворився, може бути підігрітий, щоб випарувати залишковий етанол та інші компоненти.
4. Натрій феноксид, який розчинився в воді, може бути виділений нейтралізацією кислотою або осадженням за допомогою кислоти, що приведе до повернення фенолу у його неоскільки розчинну форму.
shkola.in.ua
Цей процес дозволяє розділити етанол та фенол, використовуючи їх різні реакції з лужним розчинником та різну розчинність їх продуктів утворення у воді. 269. У додаткових джерелах знайдіть інформацію про застосування фенолу та продуктів його переробки.
Фенол (C6H5OH) є хімічною сполукою, яка має декілька важливих застосувань та може бути перероблений на різні продукти. Ось деякі з них:
Виробництво пластмас і синтетичних матеріалів: Фенол використовується у виробництві багатьох пластмас, таких як бакеліт, який був одним з перших синтетичних
пластмас. Він входить до складу багатьох синтетичних матеріалів, які використовуються в електроніці, автомобільній промисловості та інших галузях.
Виробництво ліків: Фенол є важливою сировиною для виробництва різноманітних
лікарських препаратів, таких як анальгетики, антисептики, протизапальні засоби тощо.
Аграрний сектор: Фенол може бути використаний для виготовлення пестицидів та гербіцидів, які застосовуються у сільському господарстві для захисту рослин від шкідників та бур'янів.
Продукти для догляду за шкірою: Фенол може входити до складу деяких косметичних і засобів для догляду за шкірою, так як він має антисептичні та антимікробні
властивості.
Виробництво красильних речовин: Фенол може використовуватися як сировина для виробництва різних красильних речовин, що застосовуються в текстильній та інших галузях.
Виробництво синтетичних смол: Фенол може бути використаний у виробництві синтетичних смол для лакофарбової та підлогової промисловості.
Продукти для виробництва фарб і лаків: Фенол використовується у виробництві деяких видів фарб та лаків, що мають високу стійкість до впливу навколишнього
середовища.
Загалом, фенол та його похідні мають широкий спектр застосувань в різних галузях, включаючи хімічну, фармацевтичну, текстильну, аграрну та інші промисловості.
shkola.in.ua
Міні-проекти 270. Фенол та подібні до нього сполуки, зокрема природні поліфеноли, можна виявити в розчині за допомогою ферум(III) хлориду. Ця реакція є якісною для виявлення сполук, у молекулах яких є гідроксильні групи, сполучені з бензеновим ядром (так званий «фенольний гідроксил»). Для реакції застосовують дуже розбавлений розчин ферум(III) хлориду світло-жовтого кольору. Під час змішування його з розчином, що містить «фенольний гідроксил», частіше розчин набуває темно-синього забарвлення. Перевірте на вміст поліфенолів харчові продукти рослинного та тваринного походження. У додаткових джерелах інформації знайдіть, які саме сполуки з «фенольним гідроксилом» можуть міститися у цих продуктах. Реакція виявлення фенолів та подібних сполук з використанням ферум(III) хлориду (FeCl3) є досить популярним методом у хімічному аналізі. Вона базується на тому, що фенольні групи в молекулах сполук здатні утворювати комплекси з іонами Fe3+, що призводить до зміни кольору розчину. Поліфеноли - це клас хімічних сполук, які містять більше однієї фенольної групи в молекулі. Вони поширені в рослинних продуктах та мають важливе значення як антиоксиданти та біологічно активні речовини. Деякі продукти рослинного та тваринного походження, які можуть містити поліфеноли, включають: Рослинні продукти:
• Чай: Зелений чай та чорний чай містять катехіни - поліфеноли, які можуть реагувати з FeCl3.
• Виноград та виноградні вироби: Виноград містить резвератрол, який також є поліфенолом.
• Фрукти та овочі: Багато фруктів та овочів, таких як ягоди, яблука, груші, помідори тощо, містять поліфеноли.
Тваринні продукти:
• Какао та шоколад: Какао містить катехіни та інші поліфеноли.
• Червоне м'ясо: Певні поліфеноли можуть бути знайдені в червоному м'ясі, особливо якщо тварина була харчована рослинною їжею.
§18. Альдегіди
Контрольні запитання
271. Наведіть загальні молекулярну та структурну формули альдегідів. Напишіть структурні формули метаналю, етаналю, пропаналю та бутаналю.
Загальна молекулярна формула альдегідів: CnH2nO. Структурні формули: Метаналь (формальдегід):
Молекулярна формула: CH2O
Структурна формула: HCHO
Етаналь (ацетальдегід):
Молекулярна формула: C2H4O
Структурна формула: CH3CHO Пропаналь (пропіональдегід):
Молекулярна формула: C3H6O Структурна формула: CH3CH2CHO
Бутаналь (бутіральдегід):
Молекулярна формула: C4H8O Структурна формула: CH3CH2CH2CHO
272. Які види ізомерії характерні для альдегідів?
Відповідь проілюструйте прикладами. Для альдегідів характерні такі види ізомерії: Структурна (скелетна) ізомерія: Молекули мають різний порядок розташування атомів у вуглецевому скелеті. Наприклад:
• Метаналь (формальдегід): HCHO
• Етаналь (ацетальдегід): CH3CHO Функціональна (групова) ізомерія: Молекули мають різні функціональні групи, але однакову молекулярну формулу. Наприклад:
• Метаналь (формальдегід): HCHO
• Метиловий ефір: CH3OCH3
Таутомерія: Молекули мають різні розташування протонофункцій у молекулі (напр., гідроксилу і водневого атома). Наприклад:
• Метаналь (формальдегід): HCHO
• Гідроксиметан: CH2(OH)2
273.У чому полягає особливість складання назв альдегідів у порівнянні з алканами та спиртами?
shkola.in.ua
Особливість складання назв альдегідів полягає в тому, що вони названі на основі назви відповідних алканів, але з внесенням певних змін у назву, щоб відобразити присутність функціональної групи альдегіду - групи CHO (альдегідної групи). Зазвичай назва альдегіда формується шляхом заміни закінчення "-ан" у назві відповідного алкану на закінчення "-аль". При цьому, атом водню в альдегідній групі не враховується при нумерації вуглецевого ланцюга, оскільки альдегідна група має вищий пріоритет.
Наприклад:
- Алкан: метан - Альдегід: метаналь Ця особливість складання назв альдегідів враховує їхню функціональну групу та підкреслює її присутність в молекулі.
274.Схарактеризуйте фізичні властивості альдегідів. Поясніть, чому в альдегідів температури кипіння нижчі за спирти з таким самим чис- лом атомів Карбону в молекулі.
Фізичні властивості альдегідів визначаються їхньою молекулярною структурою та взаємодією молекул.
Температури кипіння альдегідів зазвичай нижчі, ніж відповідних спиртів з таким самим числом атомів в молекулі. Це пояснюється декількома факторами:
1. Форма молекули: У молекулах альдегідів відсутня асоційована система водневих зв'язків, яка характерна для спиртів. Водневі зв'язки в спиртах можуть створювати додаткові силові взаємодії між молекулами, що вимагає більшої енергії для розриву і призводить до вищих температур кипіння.
2. Полярність: Спирти мають водневі зв'язки, які зумовлюють полярність молекул і сприяють більшому зчепленню молекул у рідині. У випадку альдегідів полярність
менше виражена, і молекули менше взаємодіють між собою.
3. Форма молекули: Молекули альдегідів можуть мати більш "струмкову" форму, яка менше сприяє зчепленню молекул у рідині.
4. Молекулярна маса: Альдегіди часто мають меншу молекулярну масу, ніж відповідні спирти з таким самим числом атомів, що також може впливати на їхні температури кипіння.
Таким чином, наявність водневих зв'язків та інші фактори призводять до вищих температур кипіння спиртів порівняно з альдегідами зі схожим числом атомів Карбону в молекулі.
Завдання для засвоєння матеріалу
275. Визначте, до яких класів можуть належати речовини з формулами: C2H4O, C2H6O, CH2O, C2H4, C2H6O2. Розглянемо дані формули:
1. C2H4O - Ця формула може вказувати на етаналь або ацеталь (два можливих ізомери).
2. C2H6O - Ця формула вказує на етанол.
3. CH2O - Ця формула вказує на формальдегід.
4. C2H4 - Ця формула вказує на етен.
5. C2H6O2 - Ця формула може вказувати на етан-1,2-діол (етиленгліколь) або етан-1,2діол (етанол).
Отже, речовини з даною формулою можуть належати до класів: альдегіди (формальдегід), алкени (етен), алкоголі (етанол, етиленгліколь), ацетали (етаналь або ацеталь).
276. Серед наведених речовин визначте ті, що належать до альдегідів: Відповідь: а, б, в
shkola.in.ua
277. Ванілін виділяють із бобів ванілі плосколистої і часто використовують у кондитерській справі. За структурною формулою ваніліну визначте, до яких відомих вам класів органічних сполук можна його віднести. Ванілін має структурну формулу C8H8O3. З даною структурною формулою ванілін можна віднести до класу фенольних сполук або ароматичних альдегідів. 278. Складіть усі можливі структурні формули альдегідів складу: а) C4H8O; б) C4H7OCl.
а) Для формули C4H8O можуть бути наступні структурні формули альдегідів:
1. CH3CHO
2. CH3CH2CHO
б) Для формули C4H7OCl можуть бути наступні структурні формули альдегідів:
1. CH3CH2CHClCHO
2. CH3CHClCH2CHO
3. CH3CH2CCl2CHO
279. Складіть назви альдегідів за систематичною номенклатурою:
2-бромпропаналь
3-метилбутаналь
2-метил-3,2-дихлорбутаналь
2,3-диметил-3-хлорпентаналь
280. Поясніть, чому етаналь та етанол називають похідними насичених вуглеводнів. Етаналь та етанол називають похідними насичених вуглеводнів, оскільки вони є похідними від вуглеводнів, а саме від етану (насиченого вуглеводню). Вони мають спільний вуглеводневий каркас (запускаючись від молекулярної структури етану) і внесені в нього функціональні групи альдегіду (у випадку етаналу) і гідроксильної групи (у випадку етанолу). Таким чином, вони є похідними насичених вуглеводнів, де один або декілька атомів водню були заміщені функціональними групами.
Комплексні завдання
281. Визначте молекулярну формулу альдегіду з молярною масою 44 г/моль.
M(R-COH)=44г./моль
R-12+16+1=44
R=44-12-16-1
R=15
R→CH₃
M(CH₃COH)=12+3+12+16+1=44г./моль

Вiдповiдь: Mолекулярна формула альдегіду CH₃COH. Це пропаналь.
282. Визначте молекулярну формулу альдегіду, в якому масові частки: а) Карбону — 40 %, Оксигену — 53,3 %, Гідрогену — 6,66 %; б) Карбону — 54,54 %, Гідрогену — 9,09 %.
shkola.in.ua
282. Визначте молекулярну формулу органічної речовини, якщо густина її випарів за воднем дорівнює 29, а масові частки Карбону — 62,1 %, Оксигену — 27,58 %. Складіть її назву за систематичною номенклатурою.


shkola.in.ua
Завдання з розвитку критичного мислення
283. Вуглеводневий залишок (гідрофобна частина) в етаналю більший, ніж у
метаналю. Як ви вважаєте, чому при цьому етаналь у воді розчиняється
за метаналь?
Етаналь (ацетальдегід) має більший вуглеводневий залишок (гідрофобну частину)
порівняно з метаналем (формальдегідом). Однак, не тільки вуглеводневий залишок
визначає розчинність сполук у воді. Важливу роль грають і інші фактори, такі як здатність до водневих зв'язків та полярність.
Етаналь має карбонільну групу (С=О), яка може утворювати водневі зв'язки з молекулами води через кисневі атоми. Це підвищує його розчинність у воді. Метаналь, хоча і має карбонільну групу, має меншу можливість утворювати водневі зв'язки через відсутність додаткового вуглеводневого залишку, який би підсилював здатність до водневих зв'язків.
Отже, хоча етаналь має більший вуглеводневий залишок, його здатність утворювати водневі зв'язки і його полярність дозволяють йому розчинятися краще у воді порівняно з метаналем.
285.Порівняйте температури кипіння й плавлення та розчинність у воді спиртів і альдегідів за таблицями 8 (с. 85) та 9 (с. 113). Виявіть закономірності та поясніть їх. Температури кипіння і плавлення, а також розчинність спиртів і альдегідів у воді, визначаються їхньою молекулярною структурою та взаємодіями між молекулами. Температури кипіння і плавлення:
• Спирти: Температури кипіння спиртів зазвичай вищі ніж температури відповідних альдегідів з такою ж кількістю атомів вуглецю. Це пов'язано з наявністю гідроксильної (-OH) групи в молекулі спиртів, яка може утворювати водневі зв'язки. Водневі зв'язки в спиртах між молекулами вимагають більшої енергії для зламання під час кипіння, тому температури кипіння спиртів вищі. Розчинність у воді:
• Спирти: Спирти можуть утворювати водневі зв'язки з молекулами води за рахунок гідроксильної групи. Це робить їх розчинними у воді. Якщо молекули спирту мають короткий вуглеводневий залишок, то вони є більш розчинними, оскільки гідрофільність гідроксильної групи переважає над гідрофобністю вуглеводневого залишку.
• Альдегіди: Альдегіди можуть утворювати водневі зв'язки лише за рахунок карбонільної групи, яка менш ефективно взаємодіє з молекулами води, ніж гідроксильна група в спиртах. Тому розчинність альдегідів у воді менша порівняно з розчинністю спиртів. Закономірності:
• Зі збільшенням довжини вуглеводневого залишку температури кипіння і плавлення спиртів та альдегідів збільшуються.
• Спирти з коротким вуглеводневим залишком зазвичай добре розчиняються у воді.
286. Як ви вважаєте, чому альдегідна група може утворюватися тільки кінцевим атомом Карбону головного ланцюга і не може розташовуватися всередині головного карбонового ланцюга?
Альдегідна група (-CHO) утворюється на кінцевому атомі вуглецю головного ланцюга молекули органічного сполуку через хімічну реакцію окислювання відповідного алкану
краще
shkola.in.ua
або алкену. Ця характеристика випливає з особливостей молекулярної будови та реакційної активності альдегідної групи. Альдегідна група включає карбонільний кисень (O=C) та гідроген (H). Кількість валентних електронів атомів у вуглеводневих сполуках обмежена, і тому головний
ланцюг органічного сполуку має обмежену кількість можливих валентних зв'язків.
Утворення альдегідної групи вже всередині головного карбонового ланцюга потребувало би "відщеплення" одного атома водню від вуглецю, що призвело б до додаткової двохвалентності та порушення структури молекули. Оскільки атоми вуглецю у головному ланцюгу органічної сполуки мають вже максимальну кількість зв'язків з воднем і іншими атомами вуглецю, утворення альдегідної групи всередині головного ланцюга є неможливим без суттєвих структурних змін і порушень валентно сті атомів. Такі зміни порушують структуру сполуки та її хімічну стійкість, тому альдегідні групи не розташовуються всередині головного карбонового ланцюга, а утворюються на його кінці. Ця обмежена можливість утворення альдегідної групи спричинена хімічними і структурними характеристиками органічних молекул та валентністю атомів.
§19. Етаналь: хімічні властивості та методи добування Контрольні запитання
287. Схарактеризуйте хімічні властивості та методи одержання альдегідів на прикладі етаналю. Етаналь (ацетальдегід)
одним із найпростіших альдегідів. Його хімічні властивості
методи одержання можна описати наступним чином: Хімічні властивості етаналю: Окиснення: Етаналь може піддаватися окисненню, перетворюючись в оцтову кислоту (уксусну кислоту). Наприклад:
C2H4O + O2 → CH3COOH
Утворення гідратів: Етаналь може утворювати гідрати, тобто сполуки, в яких молекула альдегіду взаємодіє з молекулою води, утворюючи гідроксигрупу. Гідрат етаналу називається ацеталдегідом:
C2H4O + H2O → CH3CHOH
Полімеризація: Етаналь може утворювати полімери, наприклад, паралдегід, який складається з повторюваних одиничних блоків етаналу. Методи одержання етаналю: Окиснення етанолу: Етанал можна одержати шляхом окиснення етанолу. Ця реакція може бути проведена каталітично (з використанням каталізаторів, наприклад, паладієвого порошку) або хімічно (з використанням окисників, таких як хромова кислота або калій дихромат).
CH3CH2OH + [O] → CH3CHO + H2O
Дегідрація етанолу: Етанал може бути одержаний також шляхом дегідрації етанолу високою температурою у наявності каталізаторів. У цьому випадку етанол перетворюється на етен (етилен), який потім окислюється до етаналу.
CH3CH2OH → CH2=CH2 + H2O
CH2=CH2 + [O] → CH3CHO
shkola.in.ua
Гідроліз ацеталдегіду: Гідроліз ацеталдегіду (гідрату етаналу) може також призвести до утворення етаналу. Цей метод використовує взаємодію ацеталдегіду з концентрованою сульфатною кислотою, при якій відбувається відщеплення молекули води.
CH3CHOH + H2SO4 → CH3CHO + H2O Завдання для засвоєння матеріалу 288. Поясніть, як за допомогою одного реактиву можна визначити, в якій із двох пробірок міститься етаналь, а в якій — гліцерол.
є
та
Для визначення, в якій із двох пробірок міститься етаналь, а в якій — гліцерол, можна використовувати реакцію альдегідів з толуолфенілгідразоном (2,4динітрофенілгідразином). Ця реакція є характерною для альдегідів і дає можливість виявити присутність етаналу. Гліцерол в такій реакції не взаємодіє.
У реакції з толуолфенілгідразоном альдегід утворює відповідний толуолфенілгідразон, який має характерну жовтувату оранжеву або червону відтінків відновленого сполуку. Гліцерол не дає такої реакції. Реакційне рівняння для утворення толуолфенілгідразону з етаналу:
CH3CHO + C6H5NHNH2 → C6H5NHN=CHNHNHC6H5 + H2O Отже, за допомогою реакції з толуолфенілгідразоном можна визначити наявність етаналу в пробірці.
289. Складіть рівняння реакцій для здійснення перетворень за схемами: а) етен → етанол → етаналь → етанова кислота; б) метанол → метаналь → метанова кислота. а) Рівняння реакцій для здійснення перетворень з етену до етанової кислоти:
1. Етен до етанолу: CH2=CH2 + H2O → CH3CH2OH
2. Етанол до етаналу: CH3CH2OH + [O] → CH3CHO + H2O
3. Етаналь до етанової кислоти: CH3CHO + [O] → CH3COOH
б) Рівняння реакцій для здійснення перетворень з метанолу до метанової кислоти:
1. Метанол до метаналь: CH3OH + [O] → CH2O + H2O
2. Метаналь до метанової кислоти: CH2O + [O] → HCOOH
У реакціях [O] позначає окислювач (часто кисень) та може включати реагенти, що сприяють окисненню вуглеводнів до відповідних функціональних груп. Комплексні завдання 290.Обчисліть масу пропаналю, що прореагував з амоніачним розчином аргентум(І) оксиду, якщо при цьому утворилося срібло масою 43,2 г.
Дано:
m ( Ag ) = 43,2 г
Знайти:
m ( C2H5–COH ) - ? Рішення:
1) Обчислюємо кількість речовини срібла, за формулою:
n = m / M
( M ( Ag ) = 108 г/моль )
n ( Ag ) = 43,2 / 108 = 0,4 моль
2) Запишемо рівняння реакції:
shkola.in.ua
C2H5–COH + Ag2O > C2H5–COOH + 2Ag
Співвідношення коефіціентів пропаналю та срібла — 1 : 2, тобто кількість речовини пропаналю буде у два рази меньша, ніж у срібла:
n ( C2H5-COH ) = 0,4 : 2 = 0,2 моль
3) Обчислюємо масу пропаналю, за формулою:
m = n • M
( M ( C2H5-COH ) = 12 • 3 + 1 • 6 + 16 = 58 г/моль )
m ( C2H5-COH ) = 0,2 • 58 = 11,6 г Відповідь: m ( C2H5-COH ) = 11,6 г
290. Обчисліть об’єм етену, необхідний для одержання етаналю масою 330 г.
292.Обчисліть масу етанолу, одержаного відновленням етаналю масою 154 г. CH3CHO + H2 - - - - - > C2H5OH
n(CH3CHO) =154/44= 3,5 моль
n(C2H5OH) =n(CH3CHO)=3,5 моль
m(C2H5OH) =3,5 *46=161 г


293. У реакції срібного дзеркала утворилося срібло масою 1,08 г. Обчисліть масу етаналю, що вступив у реакцію.
294.Під час взаємодії 0,5 моль етину з водою утворився альдегід. Обчисліть масу срібла, що виділиться під час окиснення цієї кількості альдегіду амоніачним розчином аргентум(І) оксиду.
Гідратація етину (ацетилену) з отриманням етаналю
shkola.in.ua
С2H2 + H2O [H+, Hg+] = CH3COH З рівняння реакції випливає, що з моль етину утворюється моль етаналю, відповідно з 0,5 моль етину утворюється 0,5 моль етаналю.
Реакція взаємодії етаналю та аміачного розчину оксиду срібла протікає за рівнянням, згідно з якою на кожну міль реагенту етаналю припадає 2 моль срібла, а на 0,5 моль – 1 моль.
СН3СOH + 2[Ag(NH3)2]OH = CH3COONH4 + H2O + 3NH3 + 2Ag
Знайдемо масу срібла помноживши кількість моль срібла на молярну масу срібла (108 г/моль)
m(Ag)=1*108=108 грам
Відповідь: маса срібла, виділеного під час окислення альдегіду, отриманого з етину
кількістю 0,5 моль дорівнює 108 грам.
295. Під час окиснення етанолу витрачено купрум(II) оксид масою 12 г. Обчисліть масу утвореного альдегіду.
C2H5OH+CuO >CH3COH+Cu+H2O
n(CuO)=12/80=0,15моль
m(альдигіду)=0,15×44=6,6г
В: маса альдегіду 6,6 грам
296. Технічний кальцій карбід містить 20 % домішок. Обчисліть масу етаналю, що можна добути з 0,8 кг такого карбіду.
Дано:
ω(домішок) = 20%
V(HC≡CH) = 56 л
--------------------------------
Знайти: m(CaC₂) - ?
Рішення:
1) Для початку ми запишемо цю реакцію Велера, саме за такою реакцією ми знайдемо масу карбіду кальцію: CaC₂ + 2H₂O → HC≡CH + Ca(OH)₂
2) Для початку ми знайдемо кількість речовини у ацетилену, а потім у карбіду кальцію:
Vm = 22,4 л/моль
n(HC≡CH) = V(HC≡CH)/Vm = 56 л / 22,4 л/моль = 2,5 моль ⇒ n(CaC₂) = n(HC≡CH) = 2,5 моль
3) Тепер знаходимо масу карбіду кальцію з домішками:
M(CaC₂) = 40+12×2 = 40+24 = 64 гр/моль
m(CaC₂)прим. = n(CaC₂) × M(CaC₂) = 2,5 моль × 64 гр/моль = 160 гр
4) Далі ми спочатку знайдемо масову частку у карбіду кальцію, а потім масу чистої речовини у карбіду кальцію: ω(CaC₂) = 100% - ω(домішок) = 100% - 20% = 80% m(CaC₂) = m(CaC₂)прим. × ω(CaC₂)/100% = 160 гр × 80%/100% = 160 гр × 0,8 = 128 гр Відповідь: m(CaC₂) = 128 гр.
shkola.in.ua