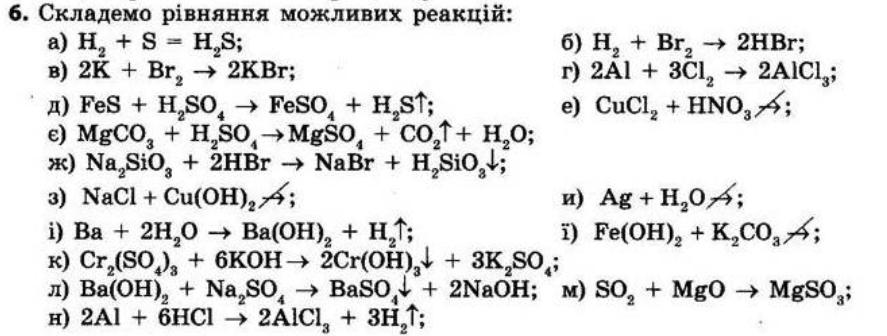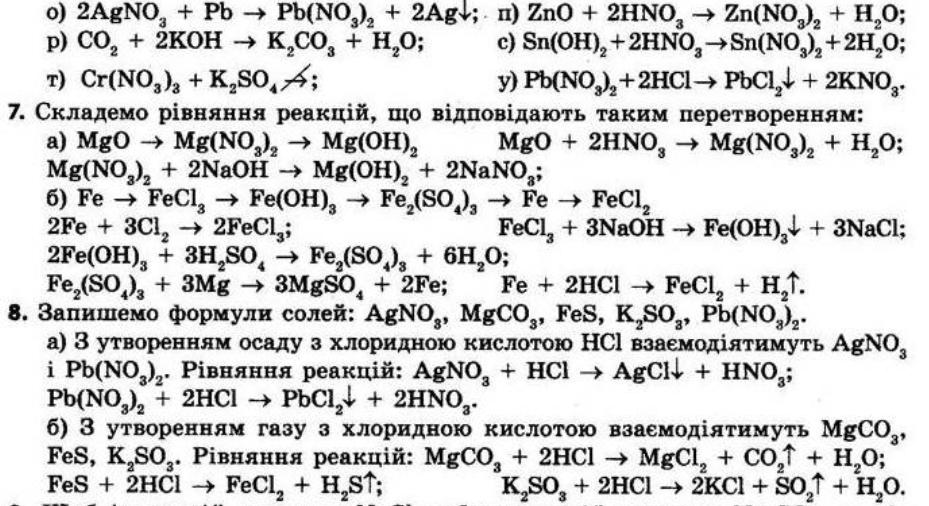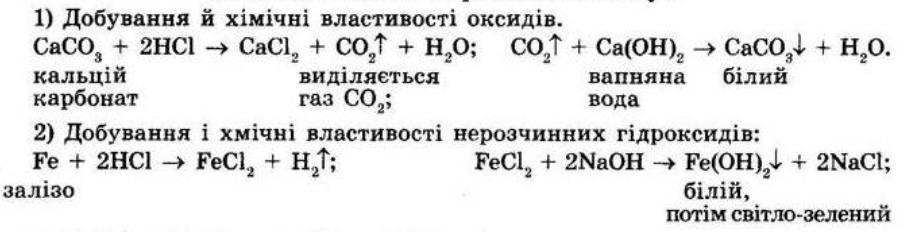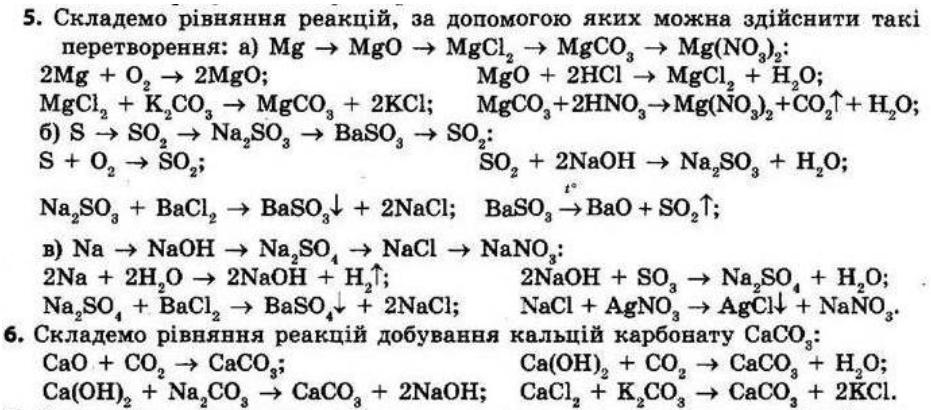ГДЗ Хімія 8 клас Григорович
Повторення найважливіших
§ 1. Найважливіші хімічні поняття
Контрольні запитання
2021
питань курсу хімії 7 класу
1. Поясніть класифікацію відомих вам груп речовин.
за чистотою (чисті речовини та суміші),
за складом (прості та складні),
за формою існування елементів у вільному стані (метали і неметали),
за наявністю Карбону у сполуках (органічні і неорганічні),
за можливістю спостереженням виявити окремі компоненти суміші (однорідні і
неоднорідні) тощо.
2. Що означає індекс у хімічній формулі?
Індекс показує число атомів певного елемента або груп атомів в молекулі (або формульній одиниці).
Наприклад: Н5 - 5 атомів гідрогена.
3. У чому полягає різниця між поняттями: а) «хімічний елемент» і «проста речовина»; б) «проста речовина» і «складна речовина»; в) «складна речовина» і «суміш речовин»? а) «хімічний елемент» і «проста речовина» Хімічний елемент це певний вид атомів, тобто поняття застосовується для класифікації атомів, а проста речовина ― метал чи неметал ― утворена цим певним видом атомів, тобто хімічним елементом, тому проста речовина є формою існування хімічного елемента у вільному стані. Хімічний елемент може утворювати не одну, а декілька простих речовин — алотропних модифікацій, які відрізняються одна від одної за будовою або складом молекул. Наприклад, атоми Карбону утворюють декілька простих речовин: алмаз, графіт, фулерен, які відрізняються за розташуванням атомів один щодо одного, а атоми Оксигену утворюють дві алотропні
модифікації:
кисень (O2) і озон (O3), які
відрізняються
за складом молекул.
4. Наведіть приклади елементів, що виявляють: а) сталу валентність; б) змінну валентність.
а) сталу валентність - К, Ва, Mg, Ca, Zn б) змінну валентність - Cu, Fe, S, C
5. Які оксиди називають кислотними, а які — оснóвними? Наведіть приклади.
Оксиди, яким відповідають кислоти, називають кислотними.
Оксиди, яким відповідають основи, називають основними. Оксид Р2O5 — кислотний, йому відповідає кислота Н3РO4 Оксид CuO — основний, йому відповідає основа Cu(OH)2 6. Які речовини утворюються під час взаємодії з водою кислотних оксидів, а які — під час взаємодії оснóвних? Сформулюйте їх
shkola.in.ua
та наведіть приклади. Гідрати кислотних оксидів — це кислоти, а гідрати основних оксидів — основи. Кислоти складаються з атомів Гідрогену та кислотного залишку, наприклад: H2SO3, H3PO4 Основи складаються з атомів металічного елемента та гідроксильної групи OH, наприклад: NaOH, Fe(OH)2 Завдання для засвоєння матеріалу
1. Складіть формулу силікатної кислоти, якщо її молекула складається з двох атомів Гідрогену, одного атома Силіцію та трьох атомів Оксигену. H2SO3
визначення
2. Із наведеного переліку випишіть назви неметалічних елементів: Гідроген, Аурум, Йод, Плюмбум, Аргентум, Сульфур, Меркурій. Гідроген, Йод, Сульфур.
У довгому варіанті Періодичної системи є ламана лінія, проведена від Бору до Астату, ліворуч від неї перебувають металічні елементи, а праворуч — неметалічні.
3. Складіть формули сполук, утворених елементами: а) H і Al; б) C(IV) і S(II); в) Pb(IV) і O; г) Zn і Br(I); д) C(IV) і F; е) Fe(II) і O; є) Cl(IV) і O; ж) Cu(I) і O; з) Au(III) і Cl(I). У дужках указана валентність, яку виявляє елемент у цій сполуці. a) AlH3 б) CS2 в) PbO2 г) ZnBr2 д) CF4 е) FeO є) ClO2 ж) Cu2O з) AuCl3 4. Складіть формули оксидів: магній оксид, ферум(ІІ) оксид, фосфор(V) оксид, плюмбум(IV) оксид, купрум(I) оксид, хром(III) оксид, манган(VII) оксид.
магній оксид MgO
ферум (ІІ) оксид FeO
фосфор (V) оксид P2O5
плюмбум (ІV) оксид PbO2
купрум (І) оксид Cu2O
хром (ІІІ) оксид Cr2O3
манган (VIІ) оксид Mn2O7
5. Визначте валентності елементів у наведених оксидах, складіть їхні
назви: K2O, CaO, P2O3, NO2, I2O5, SO3, Cl2O7
К2O — K (I) і O (II), калій оксид
CaO — Ca (II) і O (II) кальцій оксид
Р2O3 — P (III) і O (II), фосфор (III) оксид
NO2 — N (IV) і O (II), нітроген (IV) оксид
I2O5 — I (V) і O (II), йод (V) оксид
SO3 — S (VI) і O (II), сульфур (VI) оксид
Сl2О7 — Cl (VII) і O (II), хлор (VII) оксид Наприклад, для сполуки P2O5. Значення валентності Оксигену II. Обчислюємо валентність всіх атомів Оксигену (5•2=10) і ділимо валентність всіх атомів Оксигену на число атомів Фосфору (10:2=5). Валентність Фосфору - V. Аналогічно для решти сполук.
6. Із наведеного переліку випишіть в окремі стовпчики формули: а) кислотних оксидів; б) оснóвних оксидів; в) кислот; г) основ. Mg(OH)2, Na2O, H2SiO3, N2O5, NaOH, CO2, SO3, H3PO4, CrО, Fe(OH)2, Cu2O, H2CO3, SiО2, HNO3, Cl2O7. Кислотні оксиди Основні оксиди Кислоти Основи
N2O5 CO2 SO3 SiO2; Cl2O7 Na2O; CrO; Cu2O H2SiO3; H3PO4 H2CO3; HNO3 Mg(OH)2; NaOH Fe(OH)2
7. Доберіть коефіцієнти: а) S + O2 = SO2
shkola.in.ua
Fe + S = FeS
2P + 3Cl2 = 2PCl3
б) 2BaO2 = 2BaO + 2O2↑
2H2O2 = 2H2O + O2↑
2N2O5 = 4NO2↑ + O2↑
8.Унаслідок взаємодії метану CH4 масою 8 г із киснем масою 32 г утворився вуглекислий газ масою 22 г. Складіть рівняння цієї реакції. Обчисліть, яка маса води утворилася в результаті цієї реакції.
Дано: m(CH4) = 8 г, m(O2) = 32 г, m(CO2) = 22 г
Знайти: m(Н2O) - ?
Розв'язання
СН4 + 2О2 → СО2 + 2Н2О
За законом збереження маси речовин у хімічних реакціях (маса речовин, що вступили в хімічну реакцію, дорівнює масі речовин, що утворилися в результаті реакції) маємо:
m(CH4) + m(O2) = m(CО2) + m(H2O), звідси
m(H2O) = m(CН4) + m(О2) - m(СO2) = 8 г + 32 г - 22 г = 18 г Відповідь: m(H2O) = 18 г
§ 2. Кисень та вода. Реакції розкладу, сполучення Контрольні запитання
1. Схарактеризуйте фізичні властивості кисню та води. За звичайних умов кисень — газ без кольору, смаку та запаху, малорозчинний у воді, густина трохи більша за густину повітря. Товстий шар рідкого кисню має яскраво-блакитне забарвлення. При кімнатній температурі вода — безбарвна рідина, у товстому шарі блідо-блакитна, густина дорівнює 1 г/см3 (при 4°С), практично не проводить електричний струм і погано проводить теплоту. При атмосферному тиску й температурі 0°С вона перетворюється на лід, а при 100°С кипить.
2. Чому лід завжди плаває на поверхні рідкої води? Густина льоду (0,9 г/cм3) менша за густину рідкої води (1 г/см3).
3. Які реакції називають реакціями сполучення, а які — розкладу? Реакції сполучення — це реакції, у яких з двох простих або складних речовин утворюється одна складна речовина. Реакції розкладу — це реакції, у яких з однієї складної речовини утворюється декілька інших речовин.
4. Наведіть рівняння реакцій, що характеризують хімічні властивості кисню.
1. Взаємодія кисню з простими речовинами (металами й неметалами):
2Mg + O2 = 2MgO
C + O2 = CO2↑
2. Взаємодія кисню із складними речовинами:
CH4 + 2O2 = CO2↑ + 2H2O
2H2S + 3O2 = 2SO2↑ + 2H2O
5. Наведіть рівняння реакцій взаємодії води з кислотними та оснóвними оксидами.
а) кислотними оксидами
SO2 + H2O = H2SO3
shkola.in.ua
N2O5 + H2O = 2HNO3 б) оснóвними оксидами
CaO + H2O = Ca(OH)2
K2O + H2O = 2KOH
Завдання для засвоєння матеріалу
1. Які з наведених оксидів взаємодіють із водою? Складіть відповідні рівняння реакцій. Na2O, CO2, SO3, Cr2О3, SiO2.
Na2O + H2O = 2NaOH
CO2 + H2O = H2CO3
SO3 + H2O = H2SO4
Усі кислотні оксиди (за винятком SiO2) реагують з водою, утворюючи кислоти. Більшість з основних оксидів з водою не взаємодіють, у реакцію вступають лише ті оксиди, гідратами яких є луги.
2.У результаті згоряння сірковуглецю CS2 витратився кисень масою 24 г і утворилися карбон(IV) оксид масою 11 г та сульфур(IV) оксид масою 32 г. Складіть рівняння цієї реакції та обчисліть масу сірковуглецю, що згорів. Відомо: m(О2)=24 г, m(СO2)=11 г, m(SO2)=32 г Знайти: m(CS2) - ?
Розв'язання
CS2 + 3О2 = СО2 + 2SO2 За законом збереження маси речовин у хімічних реакціях (маса речовин, що вступили в хімічну реакцію, дорівнює масі речовин, що утворилися в результаті реакції) маємо
m(CS2) + m(O2) = m(CO2) + m(SO2), звідси
m(CS2) = m(CO2) + m(SО2) - m(O2) = 11 г + 32 г - 24 г = 19 г Відповідь: m(CS2)=19 г
3. Доповніть схеми реакцій та назвіть продукти реакцій:
а) K2O + H2O = 2KOH — калій гідроксид;
б) SO2 + H2O = H2SO3 — сульфітна кислота;
в) BaO + H2O = Ba(OH)2 — барій гідроксид.
§ 3. Обчислення за формулами хімічних речовин Контрольні
запитання
1.Дайте визначення понять «відносна атомна маса» й «відносна молекулярна маса». Відносна атомна маса Ar — це відношення маси атома даного елемента до 1/12 маси атома Карбону. Відносна молекулярна маса Мr показує, у скільки разів маса молекули більша за 1/12 маси атома Карбону.
2. Що в цьому випадку означає слово «відносна»? Визначена порівнянням з іншою величиною — еталоном. Еталоном атомних і молекулярних мас є атомна одиниця маси (1а.о.м. = 1,66 • 10-24 г).
3.Для яких речовин використовують термін «молекулярна маса», а для яких — «формульна маса»?
Для речовин молекулярної будови використовують термін «молекулярна маса», а для речовин немолекулярної (йонної та атомної) будови — «формульна маса». Як обчислюють відносну молекулярну масу? Відносна молекулярна маса дорівнює сумі відносних атомних мас усіх хімічних елементів, що містяться у складі молекули, з урахуванням числа атомів кожного елемента.
shkola.in.ua
Для визначення відносної молекулярної маси речовини з формулою EхDу необхідно відносні атомні маси елементів E та D помножити на число їхніх атомів, відповідно на х та у, а потім підсумувати: Mr(ExDy)=x • Ar(E) + y • Ar(D). 4.Дайте визначення масової частки елемента в речовині. Наведіть формулу для її обчислення.
Масова частка елемента показує, яка частина маси речовини припадає на атоми даного елемента.
обчислюють як відношення атомної маси даного елемента з урахуванням числа його атомів у молекулі до відносної молекулярної маси речовини:
де ω(E) — масова частка хімічного елемента E, виражена в частках одиниці; n — число атомів елемента E, позначене індексом у формулі сполуки; Ar — відносна атомна маса елемента E; Mr — відносна молекулярна маса речовини.
Масова частка розчиненої речовини в розчині показує, яка частина маси розчину припадає на розчинену речовину.
Масову частку розчиненої речовини обчислюють за формулою: Завдання для засвоєння матеріалу 1. Обчисліть відносні молекулярні (формульні) маси таких речовин: хлор Cl2, сульфатна кислота H2SO4, сахароза C12H22O11, кальцій сульфат (гіпс) CaSO4, гідроген пероксид (перекис водню) H2O2, крейда CaCO3,
4)
Mr(CaCO3) = Ar(Ca) + Ar(C)
Mr((CuOH)2CO3) = 2
= 222
2. Обчисліть масові частки всіх елементів у сполуках: а) NO2; б) PbCl2; в) Na2CO3; г) H2SO4; д) Ba3(PO4) 2.
a) NO2
Mr(NO2)=Ar(N)+2•Ar(O)=14+2•16=46
ω(N)=Ar(N)/Mr(NO2)=14:46=0,304, або 30,4%
Масову частку Оксигену можна знайти так: ω(О)=100%-ω(N)=100%-30,4%=69,6%
або так: ω(О)=1-ω(N)=1-0,304=0,696
чи так: ω(О)=2•Ar(О)/Mr(NO2)=2•16:46=0,696, або 69,6%
Відповідь: ω(N)=0,304, або 30,4%; ω(О)=0,696, або 69,6%
6) РbСl2
Mr(PbCl2)=Ar(Pb)+2•Ar(Cl)=207+2•35,5=278
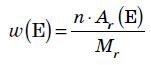
ω(Pb)=Ar(Pb)/Mr(PbCl2)=207:278=0,745, або 74,5%
ω(Cl)=100%-ω(Pb)=100%-74,5%=25,5%
shkola.in.ua
Відповідь: ω(Pb)=74,5%, ω(Cl)=25,5%
в) Na2CO3
Mr(Na2CO3)=2•Ar(Na)+Ar(C)+3•Ar(O)=2•23+12+3•16=106
ω(Na)=2•Ar(Na)/Mr(Na2CO3)=2•23:106=0,434, або 43,4%
ω(C)=Ar(C)/Mr(Na2CO3)=12:106=0,113, або 11,3%
ω(O)=100%-ω(Na)-ω(C)=100%-43,4%-11,3%=45,3%
Відповідь: ω(Na)=43,4%, ω(C)=11,3%, ω(O)=45,3%
Її
малахіт
3. Mr(Cl2) = 2 • Ar(Cl) = 2 • 35,5 = 71 Mr(H2SO4) = 2 • Ar(H) + Ar(S) + 4 • Ar(O) = 2 • 1 + 32 + 4 • 16 = 98 Mr(C12H22O11) = 12 • Ar(C) + 22 • Ar(H) + 11 • Ar(O) = 12 • 12 + 22 • 1 + 11 • 16 = 342
•
+ 2 • Ar(O) = 2 • 1 + 2 • 16 = 34
(CuOH)2CO
Mr(H2O2) = 2
Ar(H)
+ 4 • Ar(O) = 40 + 32 + 4 • 16 = 136
Mr(CaSO
= Ar(Ca) + Ar(S)
• Ar(O) = 40 + 12 + 3 • 16 = 100
+ 3
•
2 • Ar(H) + Ar(C) + 5 • Ar(O) = 2 • 64 + 2 • 1 + 12 + 5 • 16
Ar(Cu) +
г) H2SO4
Mr(H2SO4)=2•Ar(H)+Ar(S)+4•Ar(O)=2•1+32+4•16=98
ω(H)=2•Ar(H)/Mr(H2SO4)=2•1:98=0,02, або 2%
ω(S)=Ar(S)/Mr(H2SO4)=32:98=0,327, або 32,7%
ω(O)=100%-ω(H)-ω(S)=100%-2%-32,7%=65,3%
Відповідь: ω(H)=2%, ω(S)=32,7%, ω(O)=65,3%
д) Ва3(РO4)2
Mr(Ba3(PO4)2)=3•Ar(Ba)+2•Ar(P)+8•Ar(O)=3•137+2•31+8•16=601
ω(Ba)=3•Ar(Ba)/Mr(Ba3(PO4)2)=3•137:601=0,684, або 68,4%
ω(P)=2•Ar(P)/Mr(Ba2(PO4)2)=2•31:601=0,103, або 10,3%
ω(O)=100%-ω(Ba)-ω(P)=100%-68,4%-10,3%=21,3%
Відповідь: ω(Ba)=68,4%, ω(P)=10,3%, ω(O)=21,3%
ТЕМА 1. Будова атома. Періодичний закон і Періодична система хімічних елементів
§ 4. Перші спроби класифікації хімічних елементів Контрольні запитання
1.Назвіть відомі вам родини хімічних елементів і стисло схарактеризуйте одну з них. Лужні елементи, лужноземельні елементи, пніктогени, халькогени, галогени, інертні елементи.
Лужні елементи — у сполуках одновалентні, а основи, які вони утворюють, є лугами. Родина хімічних елементів це група хімічних елементів, що мають подібні властивості.
2.Визначте внесок Деберейнера, Ньюлендса та Меєра в класифікацію хімічних елементів.
Деберейнеру вдалося встановити певні закономірності у властивостях хімічних елементів і їхніх сполук. Ньюлендсом було вперше висунуто припущення про періодичність змін властивостей елементів. Мейер, аналізуючи дані своєї таблиці, спостерігав періодичну зміну властивостей елементів, і таке розташування відповідало валентностям елементів і збільшенню їхніх відносних атомних мас.
Чим цінні їхні відкриття?
Вони доповнили хімію новими класифікаціями про хімічні елементи, у яких, проте, не простежувався зв’язок між окремими їх групами
Чому вони не заслуговують на звання «закон»?
Ці відкриття не набули статусу закону, оскільки їх автори не змогли використати свої відкриття для формулювання загальних закономірностей і передбачення існування
нових хімічних елементів.
3.Укажіть, як називають елементи першої групи Періодичної системи: а) лужні;
б) лужноземельні; в) рідкісноземельні.
а) лужні
shkola.in.ua
4. Укажіть, як називають елементи сьомої групи Періодичної системи: а) халькогени; б) галогени; в) інертні.
б) галогени
Завдання для засвоєння матеріалу
1. Із наведеного переліку хімічних елементів випишіть окремо: а) лужні елементи; б) лужноземельні елементи; в) галогени; г) інертні елементи. Br, Na, Al, Ca, S, Xe, K, Cl, I, Li, Ba, Ne, Be, Rb, Sr, F, Fe, He, H.
а) лужні елементи
Na, K, Li, Rb
Елементи І групи — утворюють луги при взаємодії їх оксидів з водою.
б) лужноземельні елементи
Ca, Ba, Sr
Елементи ІІ групи — утворюють землі (так раніше називали оксиди), що у воді перетворюються на луги.
в) галогени
Br, Cl, I, F
Елементи VІI групи — утворюють cолі.
г) інертні елементи
Xe, Ne, He
Елементи VIIІ групи — є інертними, тобто не здатні вступати в хімічні реакції.
2.Використовуючи Періодичну систему на форзаці, складіть формули сполук із Гідрогеном: а) галогенів; б) халькогенів; в) пніктогенів. У цих сполуках усі елементи виявляють нижчу валентність.
а) галогенів (елементи VII групи, у сполуках виявляють нижчу валентність І (8-7=1))
HF, HCl, HBr, HI
б) халькогенів (елементи VI групи, у сполуках виявляють нижчу валентність ІІ (86=2)) H2O, H2S, H2Se, H2Te, H2Pо
в) пніктогенів (елементи V групи, у сполуках виявляють нижчу валентність ІІІ (8-5=3))
NH3, PH3, AsH3, SbH3, BiH3 3. Складіть у загальному вигляді формули оксидів і гідроксидів металічних елементів: а) лужних; б) лужноземельних. а) лужних (елементи I групи, у сполуках виявляють валентність І) Загальні формули: оксиду E2O, гідроксиду ЕОН
б) лужноземельних (елементи IІ групи, у сполуках виявляють валентність ІІ) Загальні формули: оксиду EO, гідроксиду Е(ОН)2 Використовуючи ці формули, складіть у загальному вигляді рівняння реакцій оксидів лужних і лужноземельних елементів із водою. а) Е2O + H2O = 2ЕOH б) ЕO + H2O = Е(OH)2
4.Знайдіть у Періодичній системі принаймні три приклади хімічних елементів, що доводять установлені Деберейнером закономірності у відносних атомних масах елементів. Йоган Деберейнер
запропонував
об’єднати деякі елементи в групи, що містили по три елементи (тріади), в межах цих тріад відносна атомна маса середнього елемента приблизно дорівнює середньому арифметичному мас двох інших.
1) Li, Be, B, закономірність Ar(Be) = (Ar(Li) + Ar(B)) : 2 = (7 + 11) : 2 = 9
2) Be, Mg, Ca, закономірність Ar(Mg) = (Ar(Be) + Ar(Ca)) : 2 = (9 + 40) : 2 = 24
3) C, N, O, закономірність Ar(N) = (Ar(C) + Ar(O)) :2 = (12 + 16) : 2 = 14
4) N, O, F, закономірність Ar(O) = (Ar(N) + Ar(F)) : 2 = (14 + 19) : 2 = 16
§ 5. Лужні елементи, галогени та інертні елементи Контрольні запитання
1. Назвіть спільні ознаки лужних елементів, галогенів та інертних елементів, завдяки яким їх виокремлюють у родини.
shkola.in.ua
Лужні елементи — активні металічні елементи, у сполуках виявляють валентність І. Прості речовини, утворені ними — лужні метали — активно взаємодіють з водою, галогенами та іншими речовинами.
Галогени — активні неметалічні елементи. Усі галогени здатні виявляти валентність
Прості речовини галогенів утворені двохатомними молекулами, виявляють високу хімічну активність, взаємодіють з багатьма речовинами. Інертні елементи — хімічно майже неактивні, не утворюють сполук з іншими
елементами, у простих речовинах існують у вигляді окремих атомів, у невеликих кількостях містяться в повітрі.
Кожна родина характеризується спільними властивостями як елементів, так і утворених ними сполук.
2. Перелічіть хімічні елементи-галогени, випишіть їхні символи у стовпчик, укажіть, металічні ці елементи чи неметалічні.
F — Флуор, неметалічний елемент
Cl — Хлор, неметалічний елемент
Br — Бром, неметалічний елемент
I — Йод, неметалічний елемент
At — Астат, неметалічний елемент
Ці хімічні елементи розташовані у VII групі головної підгрупи Періодичної системи і є неметалічними елементами.
3. Уміст Рубідію в земній корі майже такий самий, як і Купруму. Але, на відміну від останнього, Рубідій не утворює власних мінералів і, звичайно, руд. Запропонуйте пояснення цього факту.
Рубідій — лужний метал, а лужні метали мають високу хімічну активність, їхні сполуки є розчинними.
4. Елементи VIII групи Періодичної системи називають: а) інертними; б) галогенами; в) лужними.
а) інертними Завдання
для засвоєння матеріалу
1. Уявіть, що перед вами однакові за формою й розміром зразки літію і заліза. Як відрізнити ці речовини, ґрунтуючись лише на відмінностях їхніх фізичних властивостей?
Оскільки літій, на відміну від заліза, значно легший, дуже м'який і може різатися ножем, тому можна їх відрізнити, наприклад, зважуванням.
2. Складіть рівняння реакції взаємодії будь-якого з галогенів: а) із калієм; б) кальцієм;
в) алюмінієм; г) воднем.
а) з калієм Cl2 + 2K = 2KCl
б) кальцієм Cl2 + Ca = CaCl2
в) алюмінієм 3Cl2 + 2Al = 2AlCl3
г) воднем Cl2 + H2 = 2HCl
shkola.in.ua
3. Силіцій взаємодіє з хлором з утворенням вищого хлориду. Складіть формулу сполуки Силіцію з Хлором, якщо останній виявляє в цій сполуці валентність І. Силіцій елемент IV групи Періодичної системи, тому має вищу валентність IV. Формула вищого хлориду SiCl4
4. Калій за слабкого нагрівання бурхливо взаємодіє із сіркою, а розплавлений калій згоряє в атмосфері хлору. Складіть рівняння реакцій.
2K + S = K2S; 2K + Cl2 = 2KCl
І.
5. В якому оксиді лужних елементів масова частка Оксигену найбільша?
Дано: оксиди Li2O, Na2O, K2O, Rb2O, Cs2O, Fr2O Знайти: порівняти масові частки Оксигену - ?
Розв'язання
Mr(Li2O)=2•Ar(Li)+Ar(O)=2•7+16=30
ω1(О)=Ar(О)/Mr(Li2O)=16/30
Mr(Na2O)=2•Ar(Na)+Ar(O)=2•23+16=62
ω2(О)=Ar(О)/Mr(Na2O)=16/62
Mr(K2O)=2•Ar(K)+Ar(O)=2•39+16=94
ω3(О)=Ar(О)/Mr(K2O)=16/94
Mr(Rb2O)=2•Ar(Rb)+Ar(O)=2•85+16=186
ω4(О)=Ar(О)/Mr(Rb2O)=16/186
Mr(Cs2O)=2•Ar(Sc)+Ar(O)=2•85+16=186
ω5(О)=Ar(О)/Mr(Cs2O)=16/282
Не обчислюючи, міркуємо так: серед дробів з однаковими чисельниками більший є той, у якого менший знаменник, отже, масова частка Оксигену найбільша в Li2O. Відповідь: в Li2O
§ 6. Склад атомів: ядро та електрони
Контрольні запитання
1. Схарактеризуйте планетарну модель атома Резерфорда. Атом складається з позитивно зарядженого ядра,
частина маси атома, навколо якого по замкнутих орбітах обертаються негативно заряджені електрони.
2. Які частинки містяться у складі: а) атома; б) атомного ядра? Які в них заряд і маса? а) атома Електрони, протони і нейтрони. б) атомного ядра Протони і нейтрони.
3.Які в них заряд і маса?
Елементарна
частинка Заряд Маса
0 а.о.м. протон +1
електрон -1
1 а.о.м. нейтрон 0
shkola.in.ua
1 а.о.м.
4. Ядро атома: а) має негативний заряд; б) має позитивний заряд; в) не має заряду б) має позитивний заряд Як визначити число протонів у ядрі атома: а) за порядковим номером елемента в Періодичній системі; б) за номером періоду; в) за номером групи? а) за порядковим номером елемента в Періодичній системі; 5. Які характеристики атома вам відомі? Заряд ядра атома, число електронів, атомна маса. Як їх можна визначити?
в якому зосереджена основна
Ядро атома має позитивний заряд, величина якого визначається порядковим номером
елемента в Періодичній системі.
Кількість електронів в атомі також визначається порядковим номером елемента в
Періодичній системі.
Майже вся маса атома зосереджена в його ядрі, тому атомна маса дорівнює сукупній масі протонів і нейтронів.
6. Дайте визначення поняттям «атом» і «хімічний елемент».
Атоми — це найдрібніші електронейтральні частинки речовини, які складаються з позитивно зарядженого ядра й негативно заряджених електронів, що рухаються
навколо ядра.
Хімічний елемент — це різновид атома з певним зарядом ядра.
Завдання для засвоєння матеріалу
1. Ядро атома Гелію має заряд +2. Скільки електронів містить атом Гелію?
Два електрони, оскільки будь-який атом є електронейтральним, тому число протонів (заряд ядра атома) завжди дорівнює числу електронів.
2. Атом Карбону містить 6 електронів. Чому дорівнює заряд: а) атома Карбону; б) ядра атома Карбону?
а) Атом електронейтральний, тому його заряд дорівнює 0 б) +6
3. Визначте число протонів у ядрах і заряди атомів: а) Літію
Порядковий номер Літію 3, тому протонів 3, а заряд ядра +3 б) Сульфуру
Порядковий номер Сульфуру 16, тому протонів 16, а заряд ядра +16
в) Феруму
Порядковий номер Феруму 26, тому протонів 26, а заряд ядра +26 г) Плюмбуму
Порядковий номер Плюмбуму 82, тому протонів 82, а заряд ядра +82 Порядковий номер елемента вказує на число протонів, а число протонів в ядрі атома дорівнює заряду ядра зі знаком +. 4. Визначте заряд ядра, число електронів та масу атома, якщо атомне ядро містить: а) 8 протонів і 9 нейтронів Заряд ядра +8, бо дорівнює числу протонів у ядрі. Число електронів 8, бо дорівнює числу протонів.
Маса атома дорівнює сумі мас протонів і нейтронів, тому 8 а.о.м + 9 а.о.м.=17 а.о.м. Число протонів дорівнює порядковому номеру елемента (№8) — це Оксиген. 6) 25 протонів і З0 нейтронів
Заряд ядра +25, бо дорівнює числу протонів у ядрі. Число електронів 25, бо дорівнює числу протонів.
shkola.in.ua
Маса атома дорівнює сумі мас протонів і нейтронів, тому 25 а.о.м + 30 а.о.м.=55 а.о.м. Число протонів дорівнює порядковому номеру елемента (№25) — це Манган. в) 89 протонів і 117 нейтронів
Заряд ядра +89, бо дорівнює числу протонів у ядрі. Число електронів 89, бо дорівнює числу протонів.
Маса атома дорівнює сумі мас протонів і нейтронів, тому 89 а.о.м + 117 а.о.м.=206 а.о.м.
Число протонів дорівнює порядковому номеру елемента (№89) — це Актиній.
5. Опишіть суть експерименту Резерфорда з визначення будови атома. У 1909 р. здійснив експеримент, у якому бомбардував золоту фольгу позитивно
зарядженими альфа-частинками. Більшість із них, проходячи крізь фольгу, не
відхилялися від початкового напрямку, деякі трохи відхилялися, а невелика кількість альфа-частинок значно відхилялися від початкової траєкторії й іноді навіть летіли у зворотному напрямку.
§ 7. Хімічний елемент: нукліди
Контрольні запитання
1. Дайте визначення поняття «нуклід». Нуклід — це різновид атомів із певним числом протонів і нейтронів в ядрі.
2. Чим відрізняються стабільні й нестабільні нукліди? Стабільні нукліди, на відміну від нестабільних, існують протягом нескінченно довгого часу.
3. Наведіть приклади стабільних і нестабільних нуклідів. Усі "парні" елементи мають стабільні нукліди, а також більшість "непарних" із протонним числом меншим 84. Стабільними є нукліди Оксигену, Карбону. Хімічні елементи, що не мають стабільних нуклідів, називають радіоактивними. До них належать усі елементи, що розташовані в Періодичній системі за Бісмутом, а також Технецій і Прометій.
4. Як визначити число протонів, нейтронів та електронів у атомі? На число протонів у ядрі атома вказує порядковий номер елемента. Число нейтронів є різницею відносної атомної маси елемента і числом протонів (порядковий номер елемента). Число електронів дорівнює числу протонів, або порядковому номеру елемента. Завдання для засвоєння матеріалу 1. Ядро атома хімічного елемента містить два протони й один нейтрон. Запишіть позначення цього атома: укажіть хімічний символ, порядковий номер і масове число. За умовою число протонів Z=2 i число нейтронів N=1, тому масове число А = Z + N = 2 + 1= 3, отже, 3 2Не, порядковий №2, масове число А=3
2. Скільки протонів і нейтронів містять ядра:
17О : протонів Z=8, нейтронів N=17-8=9
14С : протонів Z=6, нейтронів N=14-6=8
137Cs : протонів Z=55, нейтронів N=137-55=82 Порядковий номер елемента вказує на число протонів (Z). Число нейтронів (N)=масове (нуклонне) число - число протонів (Z).
shkola.in.ua
3. Чим відрізняються за своїм складом ядра атомів нуклідів: а) Літію 6Li та 7Li; б) Урану 235U та 239U? а) Літію 6Li та 7Li Числом нейтронів, оскільки число протонів (порядковий номер) однакове, а різним є нуклонне число. б) Урану 235U та 239U Числом нейтронів, оскільки число протонів (порядковий номер) однакове, а різним є нуклонне число. 4. Який нуклід Натрію містить таке саме число нейтронів, що й нуклід 24Mg? Число нейтронів у нукліді 24Мg обчислимо як різницю між нуклонним числом (А=24) і числом протонів Z (показує порядковий номер елемента) N=А-Z=2412=12. Обчислимо нуклонне число Натрію, що містить таке саме число нейтронів: A=N+Z=12+11=23, отже, це нуклід 23Na.
5. Назвіть елементи, ядра атомів яких містять: а) 2 протони і 2 нейтрони; б) 15 протонів і 16 нейтронів; в) 35 протонів і 45 нейтронів. Напишіть позначення цих нуклідів.
а) 2 протони і 2 нейтрони За умовою Z=2 i N=2, тому нуклонне число A=Z+N=2+2=4, тому Гелій 4 2Не б) 15 протонів і 16 нейтронів За умовою Z=15 i N=16, тому нуклонне число A=Z+N=15+16=31, тому Фосфор 31 15Р
в) 35 протонів і 45 нейтронів. Напишіть позначення цих нуклідів. За умовою Z=35 i N=45, тому нуклонне число A=Z+N=35+45=80, тому Бром 8035Br 6. Із наведеного переліку виберіть: а) нукліди з однаковим нейтронним числом; б) нукліди з однаковим нуклоним числом. 168O , 146С , 147N, 126С , 157N
а) нукліди з однаковим нейтронним числом: Число нейтронів = нуклонне число-число протонів, тобто
16 - 8 = 8, 14 - 6 = 8, 14 - 7 = 7, 12 - 6 = 6, 15 - 7 = 8, тому маємо:
168O, 14 6С, 157N
б) нукліди з однаковим нуклонним числом У нукліді нуклонне число пишуть ліворуч угорі від символу хімічного елемента, тому маємо: 14 6С, 147N
7. Скільки різних видів молекул води може бути утворено з трьох нуклідів Гідрогену і трьох нуклідів Оксигену?
Три нукліди Гідрогену (1Н, 2Н, 3Н) і три нукліди Оксигену (16О, 17О, 18О)
Формула води — H2О. Значить, у молекулу можуть входити два будь-яких ізотопи атомів Гідрогену і один будь-який ізотоп атому Оксигену. Розглянемо можливі варіанти молекул води:
Відповідь: молекул води може бути вісімнадцять. 8. Відносна атомна маса Бору становить 10,81. Як ви вважаєте, які нукліди Бору трапляються у природі? Оскільки маси кожного протона і нейтрона дорівнюють приблизно 1 а.о.м., а маса електрона мізерна, то масове число (нуклонне число) кожного атома приблизно дорівнює його відносній атомній масі, округленій до цілих чисел, тому Бор існує у вигляді двох нуклідів 11 5В, 10 5В.
§ 8. Рух електронів у атомі. Електронні орбіталі Контрольні запитання
shkola.in.ua
1. Яка незвичайна властивість електрона відрізняє його від звичайних фізичних тіл? Подібно до інших частинок, електрон має певну масу й заряд, але під час руху виявляє властивості хвилі. Хвиля відрізняється від частинки тим, що її положення в просторі в певний момент часу не можна точно визначити, тому неможливо визначити, якою траєкторією рухається електрон в атомі.
2. У чому полягає двоїста природа електрона? Електрон виявляє подвійні властивості: одночасно виявляє властивості як частинки, так і хвилі.
3. Що називають: а) електронною хмарою; б) атомною орбіталлю?
а) електронною хмарою
1Н2 16О, 2Н2 16О, 3Н2 16О, 1Н2Н16О, 1Н3Н16О, 2Н3Н16О 1Н2 17О, 2Н2 17О, 3Н2 17О, 1Н2Н17О, 1Н3Н17О, 2Н3Н17О 1Н2 18О, 2Н2 18О, 3Н2 18О, 1Н2Н18О, 1Н3Н18О, 2Н3Н18О
Електронна хмара — це сукупність місць імовірного перебування електрона в атомі
певну мить.
б) атомною орбіталлю
Атомна орбіталь — це частина простору, де перебування електрона найімовірніше.
4. Яку форму мають s- і р-орбіталі? s-орбіталь має форму кулі (сферичну), а р-орбіталь — форму об'ємної вісімки (гантелеподібну).
Завдання для засвоєння матеріалу
1. Чим відрізняються s-орбіталі та p-орбіталі?
s-орбіталь має форму сфери, і на ній може розміститься тільки два електрони.
p-орбіталь має форму так званої "гантелі", і на ній може розміститься 6 електронів.
2. Як ви вважаєте, завдяки яким взаємодіям електрони притягуються до ядра й відштовхуються один від одного? Електростатичних.
3. Як ви вважаєте, чому атомні орбіталі мають саме таку форму? Про форму орбіталей ми знаємо завдяки математичним методам моделювання руху частинок, бо орбіталь побачити неможливо ані неозброєним оком, ані за допомогою сучасних приладів. У 1926 р. австрійський фізик Ервін Шредінгер вивів фундаментальне рівняння (рівняння шредінгера), яке описує рух електрона в атомі, що дозволило обчислити ймовірність перебування електрона в тій чи іншій частині простору, а отже, визначити форму орбіталей. Чим це зумовлене?
Зарядом і структурою ядра та запасом енергії в електроні.
§ 9. Структура електронної оболонки атома Контрольні
запитання
1. Що називають: а) енергетичним рівнем; б) енергетичним підрівнем?
а) енергетичним рівнем Енергетичний рівень — певна кількість орбіталей, що мають приблизно однакову енергію.
б) енергетичним підрівнем Енергетичний підрівень — певний тип орбіталі з відповідною кількістю електронів.
2. Які енергетичні підрівні є на першому, другому та третьому енергетичних рівнях? На першому енергетичному рівні є один s-підрівень, на другому енергетичному рівні — два підрівні: s- і p-підрівень, на третьому енергетичному рівні — три підрівні: s-, р- і d-підрівень.
shkola.in.ua
3. Зі скількох орбіталей складається кожен із відомих вам енергетичних підрівнів? S-підрівень складається з 1 орбіталі, р-підрівень — 3 орбіталей, d-підрівень — 5 орбіталей, f-підрівень — 7 орбіталей. Поділ на підрівні здійснено за формою атомних орбіталей електронів, що утворюють електронну оболонку атома. Завдання для засвоєння матеріалу
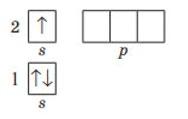
1. Зобразіть графічно структуру орбіталей в атомі для перших трьох енергетичних рівнів. Перший енергетичний рівень:
в
Другий енергетичний рівень:
Третій енергетичний рівень:
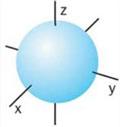
2. Як ви уявляєте просторове розташування однієї s-орбіталі та трьох p-орбіталей в атомі? Зобразіть це на малюнку, за початок координат прийміть центр атомного ядра. s-орбіталь у просторі сферична, в центрі координат розміщене ядро атома.
Три р-орбіталі розташовуються у просторі вздовж осей х, у, z і мають гантелеподібну форму (причому ядро атома міститься у місці звуження гантелі), тому їх ще називають Рх-, Ру-, Рz-орбіталями.
§ 10. Розподіл електронів в електронній оболонці атомів Контрольні запитання
1. Скільки електронів може максимально перебувати на одній електронній орбіталі?
Два електрони, що мають однакову енергію, але антипаралельні (протилежні) спіни.
2. Скільки електронів максимально може перебувати на s-підрівні?

Два електрони, бо має 1 орбіталь, на якій максимально може бути 2 електрони. p-підрівні?
Шість електронів, бо має 3 орбіталі, на якій максимально може бути 2 електрони. d-підрівні?
Десять електронів, бо має 5 орбіталів, на якій максимально може бути 2 електрони. 3. Який енергетичний рівень заповнюється раніше: перший чи другий? Відповідь поясніть.
Перший.


shkola.in.ua
Енергетичні рівні заповнюються за принципом найменшої енергії: електрони займають орбіталі послідовно, починаючи з першого енергетичного рівня, у порядку збільшення енергії рівня.
4. Чому в атомі Літію електрон, що міститься на другому електронному рівні, перебуває на s-орбіталі, а не на р-орбіталі? Згідно з принципом найменшої
кожний електрон розташовується в такий спосіб, щоб його енергія була найменшою, а s-орбіталь має меншу енергію, ніж р-орбіталь.
енергії
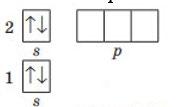
5. Як розподіляються електрони по орбіталях на р-підрівні? Електрон займає вільну орбіталь, а за відсутності вільної – утворює пару з іншим електроном у напів заповненій орбіталі. Іншими словами за правилом Хунда: у межах одного енергетичного підрівня електрони розподіляються по орбіталях таким чином, щоб число неспарених електронів було максимальним.
6. Скільки електронів міститься на зовнішньому енергетичному рівні атомів: а) Гелію;
б) Літію; в) Берилію; г) Бору; д) Карбону; е) Оксигену?
а) Гелію - Два електрони
б) Літію - Один електрон
в) Берилію - Два електрони
г) Бору - Три електрони

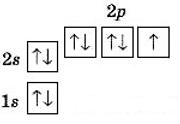
д) Карбону - Чотири електрони
е) Оксигену - Шість електронів
Для елементів головних підгруп на кількість електронів на зовнішньому
енергетичному рівні вказує номер групи, в якій розміщений елемент. Винятком є Гелій, атом має два електрони, але є елементом VIII групи Періодичної системи. 7. Скільки енергетичних рівнів зайнято електронами в атомах: а) Літію, Натрію, Калію; б) Берилію, Магнію, Кальцію; в) Флуору, Хлору, Брому? а) Літію, Натрію, Калію - Два, три, чотири енергетичні рівні б) Берилію, Магнію, Кальцію - Два, три, чотири енергетичні рівні в) Флуору, Хлору, Брому - Два, три, чотири енергетичні рівні Кількість енергетичних рівнів співпадає з номером періоду, в якому розміщений хімічний елемент. Завдання
для засвоєння матеріалу
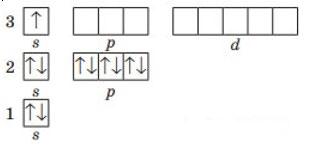
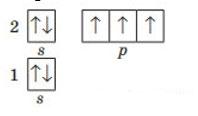
1. Складіть графічну електронну формулу Нітрогену, Флуору, Магнію, Алюмінію та Силіцію. Визначте число електронних пар та неспарених електронів на зовнішньому енергетичному рівні Нітроген
Флуор
електронних пар: 1 неспарених електронів: 3
електронних пар: 3 неспарених електронів: 1 Магній
Алюміній
shkola.in.ua
електронних пар: 1 неспарених електронів: 0
електронних пар: 1 неспарених електронів: 1
електронних пар: 1 неспарених електронів: 2
2. За числом орбіталей, що складають енергетичні рівні, визначте, скільки електронів може максимально міститися на другому і третьому енергетичних рівнях.
2-й енергетичний рівень містить одну s-орбіталь і три p-орбіталі, разом 4 орбіталі, а на кожній орбіталі максимально може міститися два електрони, тому всіх 4 • 2 = 8 електронів
3-й енергетичний рівень містить одну s-орбіталь, три p-орбіталі і п'ять d-орбіталей, разом 9 орбіталей, а на кожній орбіталі максимально може міститися два електрони, тому всіх 9 • 2 = 18 електронів Зверніть увагу, що третій енергетичний рівень заповнюється у елементів побічних підгруп, починаючи з 4 періоду.
3. Назвіть два хімічні елементи, в атомах яких повністю заповнені зовнішні енергетичні рівні. Гелій He, Неон Ne, Аргон Ar, Криптон Kr, Ксенон Xe, тобто в в атомах інертних елементів.
4. Скільки неспарених електронів в електронній оболонці атома Оксигену? Два неспарених електрони.
5. Атоми якого ще хімічного елемента другого періоду містять таке саме число неспарених електронів? Карбону
6. Зобразіть будову електронних оболонок атомів Нітрогену та Фосфору. Що спільного в будові електронних оболонок цих атомів і чим вони відрізняються? Нітроген 1s22s22p3, або [He]2s22p3
shkola.in.ua
Фосфор 1s22s22p63s23p3, або [Ne]3s23p3


Силіцій
Що спільного в будові електронних оболонок цих атомів?
Число електронів на зовнішньому енергетичному рівні (п'ять, з них, одна електронна пара і три неспарених електрони).
Чим вони відрізняються?
Числом енергетичних рівнів (два в атомі Нітрогену, три ― Фосфору).
7. Атоми яких елементів мають наведену електронну конфігурацію зовнішнього
електронного рівня:
a) 1s2 Гелій Не (1 номер періоду, s-елемент ― головна підгрупа, 2 група)
6) 2s2 Берилій Ве (2 номер періоду, s-елемент ― головна підгрупа, 2 група)
в) 2s22p4 Оксиген О (2 ― номер періоду, р-елемент ― головна підгрупа, 2 + 4 = 6 група)

г) 3s23p2 Силіцій Si (3 номер періоду, р-елемент ― головна підгрупа, 2 + 2 = 4 група)
д) 4s2 Кальцій Са (4 номер періоду, s-елемент ― головна підгрупа, 2 група) Пояснення. Перша цифра в запису електронної конфігурації вказує на номер періоду, в якому перебуває елемент, s- i p-елементи є елементами головних підгруп, а сума s- і релектронів дорівнює номеру групи.
8. Атом якого елемента другого періоду містить найбільше число: а) електронів;
б) неспарених електронів; в) електронних пар?
а) електронів; Неон Ne (10 електронів)
6) неспарених електронів; Нітроген N (3 неспарених електрони) в) електронних пар? Неон Ne (5 електронних пар)
§ 11. Періодичний закон Д. І. Менделєєва Контрольні запитання
1. Наведіть відомі вам формулювання Періодичного закону.
Властивості хімічних елементів, а також утворених ними простих і складних речовин перебувають у періодичній залежності від відносних атомних мас елементів. Властивості хімічних елементів, а також утворених ними простих і складних речовин перебувають у періодичній залежності від зарядів їхніх атомних ядер.
У чому полягає їх головна відмінність?
У зв'язку з відкриттям складної будови атома була змінено формулювання
періодичного закону.
shkola.in.ua
2. Які властивості елементів і їхніх сполук змінюються періодично? Вища валентність елементів (від I-VIIІ), характер простої речовини (від металів до неметалів), хімічний характер вищих оксидів (від основних через амфотерні до кислотних).
3. Що називають періодом хімічних елементів? Ряд хімічних елементів, розташованих у порядку зростання їхніх атомних мас, що починається з Гідрогену або лужного металічного елемента і закінчується інертним елементом, називають періодом.
4. Які періоди називають малими?
Перший (містить 2 елементи), другий і третій (містять по 8 елементів) періоди містять
до 8 елементів, тому їх називають малими.
великими?
П’ятий, шостий, сьомий періоди містять по 18 і більше елементів, тому їх називають
великими.
Чому їх називають саме так?
За кількістю розташованих елементів.
5. Як змінюється характер елементів у великих та малих періодах?
У великих періодах зміна властивостей відбувається значно повільніше: властивості сусідніх елементів у великих періодах відрізняються значно менше, ніж у сусідніх елементів малих періодів.
В малих періодах перехід від типового металічного елемента до типового
неметалічного елемента відбувається через сім елементів, а у великих періодах такий самий перехід відбувається через 17 або 31 елементи.
6. У якій частині кожного періоду розміщені елементи, що належать до родин: а) лужних елементів; б) галогенів; в) інертних елементів? а) лужних елементів
На початку кожного періоду, окрім першого (ліворуч Періодичної системи).
б) галогенів
На передостанньому місці кожного періоду (праворуч Періодичної системи). в) інертних елементів?
Наприкінці кожного періоду (наприкінці Періодичної системи).
7. Для яких хімічних елементів найхарактернішими є властивості: а) металічні; б) неметалічні? Наведіть приклади.
а) металічні
Для лужних елементів, вони розміщені у І групі Періодичної таблиці.
Приклади: Літій, Натрій, Калій, Рубідій, Цезій, Францій (радіоактивний елемент).
б) неметалічні
Для галогенів, вони розміщені у VIІ групі Періодичної таблиці.
Приклади: Флуор, Хлор, Бром, Йод, Астат (радіоактивний елемент).
Завдання для засвоєння матеріалу
1. Знайдіть у Періодичній системі елементи, що розміщені не за збільшенням їхньої відносної атомної маси. Поясніть ці факти, зважаючи на будову електронних оболонок атомів цих елементів.
№18 Аргон Ar(Ar)=40 і №19 Калій Ar(K)=39
№27 Кобальт Co Ar(Co)=58,93 i №28 Нікель Ar(Ni)=58,69
№52 Телур Ar(Te)=127,6 i №53 Йод Ar(I)=126,9
Які протиріччя з'являться, якщо їх розташувати згідно з їхніми атомними масами?
shkola.in.ua
Порушиться періодична зміна властивостей хімічних елементів, а також утворених ними простих і складних речовин.
Як змінюється характер оксидів елементів у періоді? У періоді характер оксидів змінюється від основного до кислотного. Проілюструйте рівняннями реакцій властивості оксидів Літію і Карбону.
Li2O + H2O = 2LiOH луг літій гідроксид
СO2 + H2O = H2CO3 карбонатна кислота Які речовини утворюються під час їх взаємодії з водою?
У періоді зліва направо послаблюються основні властивості і посилюються кислотні властивості гідратів. Продукти приєднання води до оксидів називають гідратами.
2. Як змінюється характер оксидів елементів у періоді?
У періоді характер оксидів змінюється від основного до кислотного. Проілюструйте рівняннями реакцій властивості оксидів Літію і Карбону.
Li2O + H2O = 2LiOH луг літій гідроксид
СO2 + H2O = H2CO3 карбонатна кислота
Які речовини утворюються під час їх взаємодії з водою?
У періоді зліва направо послаблюються основні властивості і посилюються кислотні властивості гідратів.
Продукти приєднання води до оксидів називають гідратами.
3. Складіть формули вищих оксидів елементів третього періоду. Укажіть характер цих сполук (кислотний чи оснóвний) та складіть рівняння реакцій цих оксидів із водою (якщо реакція відбувається).
Na2O NaOH
осн.
Na2O + H2O = 2NaOH
P2O5 + 3H2O = 2H3PO4
SO3 + H2O = H2SO4
Cl2O7 + H2O = 2HClO4
3;
2AlO3 амфотер.
4. Елемент у Періодичній системі має порядковий номер 16. Які властивості
виявляють його оксиди, що відповідають вищій і нижчій валентностям?
Елемент з порядковим №16 це Сульфур S, який утворює два оксиди
SO3 (валентність Сульфуру VI) та SO2 (валентність Сульфуру IV), які виявляють кислотні властивості, і їх гідратами є кислоти.
SO2 + H2O = H2SO3
SO3 + H2O = H2SO4
Чи утворює цей елемент летку сполуку з Гідрогеном? Утворює.
H2S сульфідна кислота.
5. Проаналізуйте місце в Періодичній системі елементів, що утворюють леткі сполуки з Гідрогеном (див. форзац 1). Елементи IV VII груп. Виявлення елементом яких властивостей свідчить про утворення ним летких сполук із Гідрогеном?
shkola.in.ua
Неметалічних властивостей, адже леткі сполуки з Гідрогеном утворюють тільки неметали.
6. До кінця 60-х років XIX століття два елементи — А і Б — вважали двовалентними металічними елементами та приписували їм неправильні атомні маси. Не знайшовши для них у Періодичній системі місця, що відповідало б їхнім властивостям, Д. І. Менделєєв збільшив у півтора раза значення їхніх атомних мас і уточнив валентність кожного з них. У цьому разі місце їм знайшлося. Хибні атомні маси, що
MgO Mg(OH)
осн. Al2O3
H
SiO2 H2SiO3 кисл. P2O5 H3PO4 кисл. SO3 H2SO4 кисл. Cl2O7 HCl кисл.
2
Al(OH)
приписувалися елементам, були такі: в елемента А — близько 60, а в елемента Б — трохи більше за 90. Знайдіть їм місце в Періодичній системі й назвіть ці елементи. Оскільки Ar(A)=60•1,5=90 > 89, тому цим елементом є Ітрій Y з порядковим №39 і Ar(Y)=89.
Оскільки Ar(Б)=90•1,5=135 < 137, тому цим елементом є Барій Ва з порядковим №56 i Ar(Ba)=137.
7. Для хімічних елементів, наведених у таблиці 4 на с. 56–57, запишіть електронну
конфігурацію зовнішнього енергетичного рівня атомів.
...2s1 ...2s2 ...2s2p1 ...2s2p2 ...2s2p3 ...2s2p4
Порівняйте характер змін властивостей елементів, зазначених у таблиці, зі зміною будови електронних оболонок атомів. У межах одного і того ж періоду металеві властивості послаблюються, а неметаличні посилюються, адже збільшуються заряди атомних ядер атомів, збільшується число електронів на зовнішньому енергетичному рівні атомів, радіус атомів зменшується.
§ 12. Періодична система хімічних елементів Контрольні запитання 1. Чим розрізняються короткий і довгий варіанти Періодичної системи? Вони відрізняються числом рядків, що відводяться на один період.
У довгому варіанті кожний період займає один рядок, а в короткому ― малі періоди розташовані в один рядок, а великі — у два. Тому у короткому варіанті 8 груп, які пронумеровані римськими цифрами від І до VIIІ, а у довгому ― 18, які позначаються цифрами з буквами А і В. У короткому варіанті розрізняють головну і побічну підгрупи за розміщенням елемента (ліворуч чи праворуч від центру клітинки), а в довгому ― головні підгрупи позначено літерою А, а побічні ― В. 2. Що називають періодом, групою, головною й побічною підгрупою?
Період — горизонтальний ряд хімічних елементів, що починається лужним елементом або Гідрогеном і закінчується інертним елементом.
Група хімічних елементів — це вертикальний стовпчик, що об’єднує елементи з подібними властивостями. Головна підгрупа — підгрупа, до якої належать елементи як малих, так і великих періодів.
Побічна підгрупа — підгрупа, до якої належать елементи лише великих періодів.
3. Як змінюються металічні та неметалічні властивості елементів у періодах? у
головних групах?
shkola.in.ua
У періоді при збільшенні порядкового номера елемента послаблюються металічні властивості і посилюються неметалічні. У головних підгрупах при збільшенні порядкового номера елемента посилюються металічні властивості елементів і утворених ними простих речовин, а неметалічні — послаблюються.
4. Чому групи елементів у короткому варіанті Періодичної системи необхідно розділяти на головні й побічні підгрупи?
Be B C N O
Li
Зазвичай в елементів однієї групи однакова вища валентність, яку вони виявляють у сполуках з Оксигеном — вона дорівнює номеру групи. Подібні властивості виявляють лише елементи, що належать до однієї підгрупи. Властивості елементів головної і побічної підгруп однієї групи можуть істотно відрізнятися. Наприклад, у VII групі є галогени — найтиповіші неметалічні елементи (головна підгрупа) і перехідні металічні елементи Манган, Технецій, Реній (побічна підгрупа). Завдання для засвоєння матеріалу
1. Назвіть хімічні елементи I групи Періодичної системи. Які з них належать до головної підгрупи, а які — до побічної?
До головної підгрупи І групи Періодичної системи хімічних елементів належать Літій Li, Натрій Na, Калій К, Рубідій Rb, Цезій Cs, Францій Fr.
До побічної — Купрум Cu, Аргентум Ag, Аурум Au. 2. У четвертому періоді, п’ятій групі, головній підгрупі Періодичної системи розміщений: а) Силіцій; б) Станум; в) Арсен; г) Стибій. У четвертому періоді, у п’ятій групі, у головній підгрупі розташований хімічний елемент в) Арсен As.
3. Які з наведених елементів належать до головних, а які — до побічних підгруп: Нітроген, Оксиген, Гідроген, Купрум, Ферум, Алюміній?
До головних підгруп належать елементи Нітроген N, Оксиген О, Гідроген Н, Алюміній Al.
До побічних підгруп належать елементи Ферум Fe, Купрум Cu. 4. Визначте в кожному наведеному ряду один хімічний елемент, що відрізняється від інших за місцем у Періодичній системі: а) H, He, Ne, Ar; б) Fe, Co, Ni, Ar; в) H, Li, Be, B; г) F, Cl, Br, Mn.
а) Не, Ne, Ar — VIII група, Н — І група; б) Fe, Co, Ni — VIII група, побічна підгрупа, 4 період; Ar — 3 період, VIII група, головна підгрупа;
в) Li, Be, В — елементи 2 періоду; Н — елемент 1 періоду;
г) F, СІ, Вг — VII група, головна підгрупа; Mn — VII група, побічна підгрупа.
5. Який хімічний елемент за властивостями подібний до Силіцію: а) Алюміній; б) Фосфор; в) Германій; г) Титан? Відповідь поясніть. До Силіцію за властивостями подібний в) Германій Ge, тому що це елементи однієї групи (IV група), однієї підгрупи (головної).
shkola.in.ua
6. Складіть формулу вищого оксиду та формулу леткої сполуки з Гідрогеном (якщо вона існує) для таких елементів: а) Магній; б) Силіцій; в) Реній; г) Осмій; д) Телур; е) Радій. а) Магній Вищий оксид MgO, летку сполуку з Гідрогеном не утворює б) Силіцій Вищий оксид SiO2, летка сполука з Гідрогеном SiH4 в) Реній Вищий оксид Re2O7, летку сполуку з Гідрогеном не утворює г) Осмій Вищий оксид OsO4, летку сполуку з Гідрогеном не утворює д) Телур Вищий оксид ТеO3, летка сполука з Гідрогеном Н2Те е) Радій. Вищий оксид RaO, летку сполуку з Гідрогеном не утворює Примітка: леткі сполуки з Гідрогеном утворюють тільки неметали.
7. У якого елемента сильніше виражені
металічні (або неметалічні) властивості: а) у Бору чи Алюмінію; б) в Арсену чи Нітрогену; в) в Арсену чи Стибію? а) у Бору чи Алюмінію
Металічні властивості в Алюмінію
б) в Арсену чи Нітрогену; Неметалічні властивості в Нітрогену в) в Арсену чи Стибію?
Неметалічні властивості в Арсену Відповідь обґрунтуйте.
Це елементи головних підгруп, а в головних підгрупах зі збільшенням атомної маси посилюються металічні властивості елементів, а неметалічні — послаблюються.
8. Знайдіть у Періодичній системі елемент, що розміщений у четвертому періоді та виявляє однакові валентності у вищому оксиді та у сполуці з Гідрогеном.
Це елементи головної підгрупи IV групи, наприклад, Германій Ge: GeO2 - валентність IV (номер групи) i GeH4 - валентність IV (правило: значення валентності неметалічних
елементів у сполуках з Гідрогеном становить різницю між числом 8 і номером групи, у якій розміщений елемент, тобто, 8 - 4 = 4, тому валентність IV).
9. Порядкові номери елементів А, Б, В дорівнюють відповідно n, n + 2, n + 4.
1) Якщо хімічний елемент А — найлегший галоген, то це Флуор F. Його порядковий
номер 9. Тоді хімічний елемент Б має порядковий номер 9 + 2 = 11. Це Натрій Na.
2) Якщо хімічний елемент В — інертний газ і його номер n + 4, то за два елемента від нього буде халькоген Б (порядковий номер n + 2), а елемент А буде елементом IV групи.
3) Якщо елементи А і Б належать до однієї групи, то це можливо у разі, якщо вони розташовані у побічній підгрупі VIII групи. Тоді елемент В буде металічним елементом побічної підгрупи II групи.
4) Ні, хоча б один із них (елемент А найімовірніше) не буде газом.
10. Елементи А і Б належать до I групи, а елемент В — до VII групи. Сполука елементів А і В розчинна у воді, а сполука елементів Б і В має білий колір і нерозчинна у воді. Якими елементами можуть бути А, Б і В? Елемент А може бути Калієм, елемент Б — Аргентумом, а елемент В — Хлором. Калій і Аргентум є елементами І групи, Хлор — VII групи. Сполука KCl розчинна у воді й забарвлює полум’я у фіолетовий колір, а сполука AgCl має білий колір і нерозчинна у воді. 11. Визначте в Періодичній системі елемент, єдиний оксид якого має відносну молекулярну масу 40 ± 1, а валентність не більшу за IV. Доведіть, що існує лише один такий елемент.
Невідомий елемент має сталу валентність I, II або III.
1) Нехай елемент виявляє в оксиді валентність І. Формула оксиду умовно Е2О. Обчислимо можливе значення відносної атомної маси такого елемента:
Mr(Е2О) = 2Ar(Е) + Ar(O);
40 = 2Ar(E) + 16;
2Ar(Е) = 24;
Ar(Е) = 12.
shkola.in.ua
Таке значення відносної атомної маси має Карбон С. Але цей елемент виявляє змінну валентність II і IV, що суперечить умові задачі. 2) Нехай елемент виявляє в оксиді валентність II. Формула його оксиду умовно ЕО. Обчислимо можливе значення відносної атомної маси такого елемента:
Mr(ЕО) = Ar(E) + 3Ar(О);
40 = Ar(Е) + 16;
Ar(Е) = 24.
Таке значення відносної атомної маси має Магній Mg й у нього стала валентність II.
3) Аналогічними розрахунками перевіримо чи може це бути тривалентний елемент.
Формула оксиду Е2О3.
Mr(Е2О3) = 2Ar(Е) + 3Ar(О); 40 = 2Ar(Е) + 3 · 16; 40 = 2Ar(Е) + 48.
Це неправильна рівність, отже, такого елемента не існує.
Відповідь: Магній.
12. Вищий оксид елемента, що утворює з Гідрогеном летку сполуку складу RH4, містить 53,3% Оксигену. Назвіть цей елемент.
Дано:
RH4 ω(O) = 53,3%
Розв'язання:
1) Летку сполуку з Гідрогеном складом RH4 утворює елемент IV групи, головної підгрупи. Формула його оксида RO2.
2) Обчислимо відносну молекулярну масу цього оксида.
ω(O) 0,533 R ?
Mr(RO2) = 2Ar(O) = 2 · 16 = 60.
3) Обчислимо відносну атомну масу елемента R і визначимо цей елемент: Mr(RO2) = Ar(R) + 2Ar(О). З цієї рівності Ar(R) = Mr(RO2) – 2Ar(О) = 60 – 2 · 16 = 28. Ar(R) = 28. Цей елемент — Силіцій Si.
Відповідь: Силіцій.
13. Елемент, вищий оксид якого відповідає формулі RO3, утворює сполуку з Гідрогеном, що містить 2,47% Гідрогену. Назвіть цей елемент.
Дано: Розв'язання:
RO3
ω(H) = 2,47%
R ?
1) В оксиді RO3 елемент R виявляє валентність VI. Отже, R знаходиться у VI групі, головній підгрупі й утворює з Гідрогеном летку сполуку складом
H2R.
2) Обчислимо відносну, молекулярну масу H2R:
Mr(H2R) = 2Ar(H) = 2 · 1 = 81.
ω(H) 0,0247
3) Обчислимо відносну атомну масу елемента R і визначимо цей елемент:
Mr(H2R) = 2Ar(H) + Ar(R).
З цієї рівності Ar(R) = Mr(H3R) – 2Ar(H) = 81 – 2 · 1 = 79.
Цей елемент — Селен Se. Відповідь: Селен.
shkola.in.ua
§ 13. Періодична система і будова електронних оболонок атомів Контрольні запитання 1. Чому перший період містить лише два хімічні елементи, а другий — вісім? Структура Періодичної системи повністю зумовлена принципами будови електронної оболонки атомів.
Перший енергетичний рівень містить один s-підрівень, а один s-підрівень містить 1 орбіталь. Одна орбіталь містить максимально два електрони, тому перший період містить лише два хімічні елементи: 1 Н – 2 Не. Другий енергетичний рівень містить s- і р-підрівень, а s-підрівень містить 1 орбіталь і р-підрівень ― 3 орбіталі, разом 4 орбіталі. Кожна орбіталь містить максимально два
електрони, отже, загальне число електронів буде вісім, тому другий період містить вісім хімічних елементів: 3 Li – 10 N.
Чим зумовлена місткість періодів Періодичної системи?
Місткістю відповідних енергетичних рівнів і підрівнів електронної оболонки атомів, адже число енергетичних рівнів, що заповнюються в атомі певного елемента, визначають за номером періоду Періодичної системи, у якому розташований цей хімічний елемент.
2. Число енергетичних рівнів, що заповнюються електронами, визначають: а) за номером періоду; б) за номером групи; в) за порядковим номером елемента. а) за номером періоду
3. Число електронів на зовнішньому енергетичному рівні визначають: а) за номером періоду; б) за номером групи; в) за порядковим номером. б) за номером групи
4. Як визначити максимальне число електронів, що може міститися на енергетичному рівні? За формулою 2n2, де n – номер енергетичного рівня.
5. Скільки елементів належить до четвертого й шостого періодів? Четвертий енергетичний рівень містить s-, р- та d-підрівень, а s-підрівень містить 1 орбіталь, р-підрівень ― 3 орбіталі, а d-підрівень ― 5 орбіталей, разом 9 орбіталей. Кожна орбіталь містить максимально два електрони, отже, загальне число електронів буде вісімнадцять, тому четвертий період містить вісімнадцять хімічних елементів: 19 К – 36 Kr.
Шостий енергетичний рівень містить s-, р-, d- та f-підрівень, а s-підрівень містить 1 орбіталь, р-підрівень ― 3 орбіталі, d-підрівень 5 орбіталей, а f-підріве― 7 орбіталей, разом 16 орбіталей. Кожна орбіталь містить максимально два електрони, отже, загальне число електронів буде тридцять два, тому четвертий період містить тридцять два хімічних елементів: 55 Cs – 86 Rn. Скільки електронів може містити четвертий енергетичний рівень? Обчислюємо за формулою: 2n2 , де n номер енергетичного рівня, тому 2 • 42 = 32 електрони.
6. Поясніть, чому Натрій і Калій є електронними аналогами. Натрій і Калій мають однакову кількість електронів на зовнішньому енергетичному рівні і відрізняються лише кількістю енергетичних рівнів, тобто, подібною є будова зовнішнього електронного рівня цих елементів.
7. За яким принципом елементи поділяють на s-, р-, d- та f-елементи?
shkola.in.ua
Який із підрівнів: s-, р-, d- чи f- заповнюється останнім, відповідно хімічний елемент буде відноситися до s-, р-, d- та f-елемента. Наведіть приклади d-елементів п’ятого періоду і f-елементів сьомого періоду. d-елементами є всі елементи побічних груп цього періоду, а f-елементами ― елементи родини актиноїди. Приклад d-елементів: Актиній Ас, Розерфордій Rf. Приклад fелементів: Нептуній Np, Уран U. 8. Скільки s- і р-елементів може містити один період?
Два s-елементи і шість р-елементів.
Відповідь поясніть. Те, що мова йде про s- і р-елементи, означає, що останніми заповнюються s- або рпідрівні, з них, s-підрівень містить одну орбіталь, а р-підрівень містить три орбіталі. Кожна
орбіталь містить максимально
два електрони, тому s-підрівень містить два електрони, тобто, два s-елементи, а р-підрівень ― шість електронів, тобто шість pелементів.
9. Як називають родини хімічних елементів, в атомах яких останнім заповнюється fпідрівень?
Дві родини елементів лантаноїди і актиноїди. Завдання для засвоєння матеріалу
1. Який рівень складається лише: а) із s-підрівня; б) s- та р-підрівнів; в) s-, р- та dпідрівнів?
а) із s-підрівня Перший рівень
б) s- та р-підрівнів Другий рівень
в) s-, р- та d-підрівнів Третій рівень
Як ви це визначили?
За правилом: число енергетичних підрівнів на енергетичному рівні дорівнює номеру цього рівня.
2. Які хімічні елементи є електронними аналогами Нітрогену?
Усі елементи V групи головної підгрупи, тобто Фосфор Р, Арсен As, Стибій Sb, Бісмут Bi, адже мають однакову кількість електронів на зовнішньому енергетичному рівні і відрізняються лише кількістю енергетичних рівнів, тобто подібною є будова зовнішнього електронного рівня цих елементів. Зобразіть електронну формулу атома одного з них. Фосфор 1s22s22p63s23p3 або [Ne]3s23p3
3. У чому полягає принципова відмінність у будові електронної оболонки атомів головних і побічних підгруп? У атомів елементів побічних підгруп заповнюються електронами d-, f-орбіталі.
4. Який енергетичний підрівень заповнюється електронами останнім: а) у s-елементів четвертого періоду; б) р-елементів п’ятого періоду; в) s-елементів третього
періоду; г) p-елементів другого періоду?

а) у s-елементів четвертого періоду 4s-підрівень
6) р-елементів п'ятого періоду 5р-підрівень
shkola.in.ua
в) s-елементів третього періоду 3s-підрівень
г) р-елементів другого періоду 2р-підрівень
4. Назвіть два елементи,
неспарених електронів.
електронів дорівнює числу
У Карбона і Літію в атомах число пар електронів дорівнює числу неспарених
електронів.
Карбон Літій
число пар
в атомах яких
1s22s1
2 пари електронів
2 неспарені електрони
1 пара електронів
1 неспарений електрон
6. Запишіть електронні формули атомів елементів з номерами 11 і 14.
11Na [Ne]3s1 або 1s22s22p63s1





14Si [Ne]3s23p2 або 1s22s22p63s23p2
7. Назвіть металічний та неметалічний елементи другого періоду, які на зовнішньому рівні мають один неспарений електрон. металічний Літій 1s22s1
неметалічний Флуор 1s22s22р5
8. Який енергетичний рівень заповнюється електронами в атомах елементів №3, 9, 16?
№3 другий енергетичний рівень, бо є елементом 2 періоду
№9 другий енергетичний рівень, бо є елементом 2 періоду
№16 ― третій енергетичний рівень, бо є елементом 3 періоду
Пояснення: номер періоду, в якому розміщений елемент, відповідає номеру енергетичного рівня.
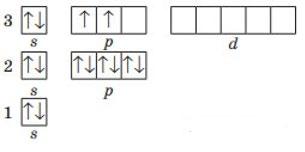
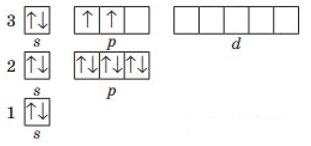
9. Складіть графічну електронну формулу елемента з порядковим номером 15. Складіть формули його вищого оксиду та гідратів цього оксиду. Зазначте хімічний характер оксиду та гідратів. Електронна будова Фосфору: 1s22s22р33s23p3 або [Ne]3s23p3
shkola.in.ua
Неметалічний елемент, бо є р-елементом. Формула вищого оксиду Р2О5, гідрату оксиду Н3РО4
1s22s22p2
10. Який елемент другого періоду є електронним аналогом елемента з порядковим номером 12?
Електронними аналогами є елементи, розміщені в одній групі і одній підгрупі.
Елемент №12 це Магній, розміщений в головній підгрупі ІІ групи, тому його електронним аналогом є елемент ІІ групи головної підгрупи, наприклад, №20 Кальцій чи №4 Берилій.
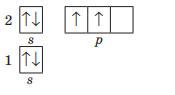
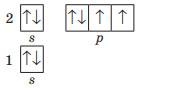
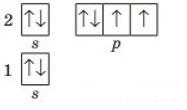
11. Складіть графічну електронну формулу атомів Силіцію, Бору та Аргону.
Силіцію Бору Аргону
12. Атому якого з елементів відповідає
a) 1s22s22p3 Нітрогену N
6) 1s22s22p63s23p6 Аргону Ar
кожна з наведених електронних формул:
в) 1s22s22p63s23p64s2 Кальцію Ca Пояснення. Сума електронів у записі електронної формули атома елемента чисельно дорівнює його порядковому номеру, тому знаходимо суму електронів і визначаємо відповідний елемент.
а) всього 7 електронів, бо 1s22s22p3: 2+2+3=7, №7 - це Нітроген;
б) всього 19 електронів, бо 1s22s22p63s23p6: 2+2+6+2+6=18, №18 - це Аргон; в) всього 20 електронів, бо 1s22s22p63s23p64s2: 2+2+6+2+6+2=20, №20 - це Кальцій.
13. Атоми яких елементів мають таку будову зовнішнього електронного шару:
a) 3s2Зр1 Алюміній
Електронна оболонка атома має 3 енергетичні рівні, тому елемент розміщений у 3 періоді. Атом має два s- і один р-електрони, разом 3 електрони, тому є елементом ІІІ групи головної підгрупи.
6) 3s23p3 Фосфор


Електронна оболонка атома має 3 енергетичні рівні, тому елемент розміщений у 3 періоді. Атом має два s- і три р-електрони, разом 5 електронів, тому є елементом V
shkola.in.ua
групи головної підгрупи.
в) 3s1 Натрій Електронна оболонка атома має 3 енергетичні рівні, тому елемент розміщений у 3 періоді. Атом має один s-електрон, тому є елементом І групи головної підгрупи. г) 4s2 Кальцій Електронна оболонка атома має 4 енергетичні рівні, тому елемент розміщений у 4 періоді. Атом має два s-електрони, тому є елементом ІІ групи головної підгрупи.
14. Що є спільним у будові атомів Берилію, Магнію та Кальцію?
Однакове число електронів на зовнішньому енергетичному рівні (два електрони), адже ці елементи є електронними аналогами і
в головній
групи. 15. Скільки електронів міститься на зовнішньому електронному рівні в атомів: а) Арсену; б) Стануму; в) Барію?
a) Арсену П'ять електронів, адже є елементом V групи
б) Cтануму Чотири електрони, адже є елементом IV групи в) Барію Два електрони, адже є елементом ІІ групи Пояснення: на кількість електронів на зовнішньому рівні атома для елементів головних підгруп вказує номер групи, в якій він розміщений.
§ 14. Будова електронних оболонок і властивості хімічних елементів Контрольні запитання
1. Чим зумовлені металічні та неметалічні властивості елементів? Числом валентних електронів в електронній оболонці атомів. Металічні елементи мають мале число валентних електронів, а неметалічні - велике.
2. Як визначити число валентних електронів в електронних оболонках атомів хімічних елементів головних підгруп? За номером групи, в якій розміщений елемент, бо валентні електрони – це електрони зовнішнього енергетичного рівня.
3. Чому атоми приймають або віддають електрони в хімічних реакціях? Бо прагнуть мати стійку електронну оболонку, яка є в атомі найближчого інертного елемента.
4. Чому інертні елементи не вступають у хімічні реакції? Мають надзвичайно стійку електронну оболонку атома (енергетичний рівень завершений, всі електрони спарені), що зумовлює їх хімічну інертність.
5. Які частинки називають йонами? Заряджені частинки, які утворюються внаслідок приєднання або віддавання атомом електронів.
6. Як змінюється сила притягання валентних електронів до ядра в періоді та підгрупі? У періоді за зростанням заряду ядер і зменшення радіуса, посилюється сила притягання ядром електронів зовнішнього енергетичного рівня, властивість віддавати електрони послаблюється, а приєднувати посилюється.
У групі головної підгрупи зростає радіус атома, а чим далі від ядра розташовані валентні електрони, тим менше вони притягуються до ядра, послаблюється зв'язок з зовнішнім енергетичним рівнем, здатність віддавати електрони посилюється, а здатність приєднувати електрони послаблюється.
7. Як змінюються металічні й неметалічні властивості елементів у групах і періодах Періодичної системи зі збільшенням порядкового номера? У групах зі збільшенням порядкового номера елементів металічні властивості
shkola.in.ua
посилюються, а неметалічні – послаблюються. У періодах зі збільшенням порядкового номера елементів металічні властивості послаблюються, а неметалічні – посилюються. Чим пояснюються такі зміни? Будовою електронних оболонок атомів. 8. Чим зумовлений радіус атомів?
розміщені
підгрупі ІІ
Радіус атомів повністю зумовлений числом енергетичних рівнів атома.
Як він змінюється в періодах і групах?
У періодах радіус атома зменшується, а у групах – зростає.
Завдання для засвоєння матеріалу
1. Випишіть із наведеного переліку окремо символи: а) атомів; б) катіонів; в) аніонів; г) молекул.
Na, Na+, О, O2, О2-, Fe, SO4 2-, Mg2+, HNO3, NO3-, NH4-, NO2.
а) атомів Na, O, Fe
6) катіонів Na+, Mg2+, NH4 +
в) аніонів O2-, SO42-, NO3-
г) молекул O2, NO2, HNO3
Пояснення: атоми електронейтральні частинки. Молекули складаються з атомів. Йони це заряджені частинки, утворені з атома приєднанням чи втратою електронів.
Катіони ― йони з позитивним зарядом, а аніони ― йони з негативним зарядом.
2. Запишіть електронну конфігурацію:
а) атома Хлору і йону Сl; 1s22s22p63s23p5 і 1s22s22p63s23p6
Атом Хлору, приєднуючи один електрон перетворюється на йон Хлору
б) атома Магнію і йону Мg2+. 1s22s22p63s2 і 1s22s22p6
Атом Магнію, втрачаючи два електрони перетворюється на йон Магнію.
3. Скільки протонів і електронів містить:
а) атом Алюмінію Протонів 13 і електронів 13 Пояснення: на число протонів в ядрі атома вказує порядковий номер Алюмінію (№13), а число протонів і електронів однакове (13).
6) йон Аl3+ ? Протонів 13 і електронів 10 Пояснення: на число протонів в ядрі атома вказує порядковий номер Алюмінію (№13), а йон утворюється внаслідок втрати атомом трьох електронів, тому число електронів у йоні рівне: 13 - 3 = 10 4. Атом якого елемента містить стільки електронів, скільки їх у йоні Na+? Атом Неону Ne Пояснення: йон Na+ містить 11 протонів (порядковий №11) і 10 електронів (11-1=10), бо утворюється з атома внаслідок втрати ним одного електрона. Стільки ж електронів містить атом Неону (порядковий номер №10).
5. Порівняєте електронну будову йонів S2-, Сl-, К+, Са2+ з будовою атома Аргону.
Однакова будова.
S2- 1s22s22p63s23p6.
Сl- 1s22s22p63s23p6.
К+ 1s22s22p63s23p6
Са2+ 1s22s22p63s23p6
Ar 1s22s22p63s23p6
shkola.in.ua
6. Скільки електронів бракує до завершення зовнішнього енергетичного рівня атомам: а) Оксигену; б) Хлору; в) Фосфору?
а) Оксигену Два електрони
б) Хлору Один електрон
в) Фосфору П'ять електронів
Пояснення: завершений енергетичний рівень містить 8 електронів. У атома Оксигену
на зовнішньому енергетичному рівні 6 електронів (збігається з номером групи для
елементів головних підгруп), йому до завершення бракує 2 (8-6=2) електрони, для Хлору 1 (8-7=1) електрон, для Фосфору 3 (8-5=3) електрони.
7. Йон певного елемента E+2 має таку саму електронну будову, що й атом Аргону.
Визначте цей елемент. Кальцій Са.
Пояснення: атом Аргону містить 18 електронів (число електронів = протонному числу = порядковому номеру елемента). Йон Е2+ утворюється внаслідок втрати атомом двох електронів. За умовою йон має таку саму будову, що й атом Аргону, тому атом елемента Е містить 18+2=20 електронів. Цим елементом є Кальцій Са. 8. За Періодичною системою визначте число електронів, яке максимально може віддавати та приєднувати в хімічних реакціях атом Фосфору.
Максимально може віддавати п'ять, а приєднувати три електрони.
Пояснення: атом Фосфору на останньому енергетичному рівні містить п'ять електронів (для елементів головних підгруп вказує номер групи), тому може максимально віддавати п'ять електронів або приєднувати три, щоб їхня електронна оболонка стала такою, як в атомів найближчого інертного елемента. 9. Чому істотно відрізняються за властивостями елементи головних підгруп I і VII груп? Поясніть відповідь із точки зору будови їхніх електронних оболонок. Суттєво відрізняють числом електронів на зовнішньому енергетичному рівні. Лужні елементи містять один електрон, а галогени сім. Прості речовини лужних елементів є типовими металами, а галогенів неметалами. 10. У чому полягає відмінність електронної оболонки йона Натрію від електронних оболонок: а) атома Натрію; б) атома Неону; в) йона K+? а) атома Натрію Йон Натрію містить на один електрон менше, ніж атом Натрію. б) атома Неону Різний заряд ядра атома (11 і 10). в) йона К+. Різний заряд ядра атома (11 і 19), різне число енергетичних рівнів (2 і 3). 11. Чому хімічні елементи Флуор і Хлор мають подібні властивості? Знаходяться в одній (VII) групі головної підгрупи, іншими словами є електронними аналогами.
§ 15. Характеристика хімічних елементів за їхнім місцем у Періодичній системі
будовою атома Контрольні
запитання
1. Від чого залежить радіус атома: а) від числа енергетичних рівнів; б) від числа протонів; в) від числа орбіталей? а) від числа енергетичних рівнів
2. Що спільного в будові зовнішньої електронної оболонки металічних елементів? На зовнішній електронній оболонці міститься не більше 4 електронів. неметалічних? Завдання для засвоєння матеріалу
shkola.in.ua
1. Який з хімічних елементів четвертого періоду виявляє найсильніші: а) металічні властивості; б) неметалічні властивості? а) металічні властивості Калій (порядковий номер №19)
6) неметалічні властивості? Бром (порядковий номер №35) Пояснення: в періоді із зростанням порядкового номера елемента металічні властивості послаблюються, а неметалічні посилюються. Галогени хімічно інертні.
й
2. Назвіть елемент головної підгрупи IV групи, у якого найсильніше виражені
неметалічні властивості. Карбон (№6)
Пояснення: в VI групі порядковий номер елемента Карбону є найменший, а в групі із спадання порядкового номера елемента неметалічні властивості посилюються.
3. Розташуйте наведені символи за порядком
посилення металічних властивостей елементів: а) Al, Na, Mg; б) Ca, Ba, Sr
а) Al, Na, Mg;
У періоді із спаданням порядкового номера елемента металічні властивості
посилюються, тому елементи треба розташувати в такій послідовності: Al (№13), Mg (№12), Na (№11).
б) Са, Ва, Sr.
У групі головної підгрупи із зростанням порядкового номера елемента металічні властивості посилюються, тому елементи треба розташувати в такій послідовності: Са (№20), Sr (№38), Ва (№56).
4. Схарактеризуйте хімічні елементи Берилій, Оксиген, Натрій та Фосфор за планом, наведеним у цьому параграфі (табл. 5).
Берилій Оксиген
Порядковий номер 4, 2-ий період, ІІ група, головна підгрупа
Заряд ядра +4, містить 4 протони, 5 нейтронів (9-4=5), 4 електрони.
Порядковий номер 8, 2-ий період, VI група, головна підгрупа
Заряд ядра +8, містить 8 протонів, 8 нейтронів (16-8=8), 8 електронів.
Електронна оболонка складається з 2 енергетичних рівнів. На зовнішньому рівні міститься одна електронна пара. Будова зовнішнього електронного рівня:
Електронна
р-елемент, неталічний, до
завершення електронного рівня приймає 2 електрони
Електронна оболонка складається з 2 енергетичних рівнів. На зовнішньому рівні міститься дві електронні пари і 2 неспарені електрони. Будова зовнішнього електронного рівня: Електронна формула: 1s22s22р4 s-елемент, металічний, для набуття електронної конфігурації найближчого інертного елемента втрачає 2 електрони
shkola.in.ua
Ar(Be)=9 Ar(O)=16
Вища валентність ІІ, формула вищого оксиду ВеО
Вища валентність: ІІ
―
Ве(ОН)2, основа ―
формула: 1s22s2
Леткої сполуки з Гідрогеном не Утворює
Н2О Металічні властивості виражені
сильніше, ніж у Бору, але слабше ніж у Літію і Магнію
Неметалічні властивості виражені
сильніше, ніж у Нітрогену і Сульфуру, але слабше, ніж у Флуору
Натрій Фосфор
Порядковий номер 11, 3-ий період, І група, головна підгрупа
Заряд ядра +11, містить 11 протонів, 12 нейтронів (23-11=12), 11 електронів.
Електронна оболонка складається з трьох енергетичних рівнів. На зовнішньому рівні міститься один неспарений електрон.
Будова зовнішнього електронного рівня:
Порядковий номер 15, 3-ий період, V група, головна підгрупа
Заряд ядра +15, містить 15 протонів, 16 нейтронів (31-15=16), 15 електронів.
Електронна оболонка складається з трьох енергетичних рівнів. На зовнішньому рівні міститься одна електронна пара і три неспарені електрони. Будова зовнішнього електронного рівня:
Електронна формула:
1s22s22р63s1
s-елемент, металічний, для набуття електронної конфігурації найближчого інертного елемента втрачає 1 електрон
Електронна формула: 1s22s22р63s23p3


р-елемент, неталічний, до завершення електронного рівня приймає 3 електрони
Ar(Na)=23 Ar(P)=31 Вища валентність І, формула вищого оксиду Na2О
Формула гідрату вищого оксиду NaОН, основа (луг)
Вища валентність V, формула вищого оксиду P2О5
Формула гідрату вищого оксиду
shkola.in.ua
H3PO4, кислота
леткої сполуки з Гідрогеном не утворює РН3 Металічні властивості виражені сильніше, ніж у Магнію і Літію, але слабше ніж Калію
Неметалічні властивості виражені сильніше, ніж у Силіцію і Арсену, але слабше, ніж у Сульфуру і
Нітрогену
5. Три елементи А, Б та В розміщені в одному періоді. В атомі елемента А число енергетичних рівнів у два рази менше, ніж число електронів на його зовнішньому
рівні. Елемент Б — найпоширеніший елемент у природі, з елементом А він утворює сполуку складу АБ2. Елемент В утворює луг. Ці елементи утворюють речовину складу В2АБ3. Назвіть усі елементи і складіть формули речовин, про які йдеться. Елемент А ― Карбон, Б ― Оксиген, В ― Літій (лужний елемент).
Сполука АБ2 СО2, В2АБ3 Li2СO3 Пояснення: це елементи другого періоду. Атом Карбону містить 2 енергетичні рівні, а число електронів на зовнішньому рівні 4, тому число енергетичних рівнів є у два рази менше. Оксиген є найпоширенішим елементом у природі, з Карбоном утворює сполуку СО2 вуглекислий газ. Літій є лужним елементом і з Карбоном і Оксигеном утворює речовину складу Li2CO3. 6. Як ви вважаєте, чому Гідроген іноді розташовують одночасно в першій і сьомій групах короткого варіанта Періодичної системи? Проста речовина має подібні властивості з галогенами.
§ 16. Значення Періодичного закону Контрольні запитання
1. Опишіть наукове значення Періодичного закону. Періодичний закон — фундаментальний закон природи, що дозволяє пояснити й передбачити властивості хімічних елементів та утворених ними сполук.
Чому спроби класифікації хімічних елементів, зроблені до Менделєєва, не можна вважати фундаментальними законами природи? Бо нікому з дослідників до Менделєєва не вдавалося, навіть із використанням певних знань про хімічні властивості, побудувати систему для всіх відомих на той час елементів, бо властивості багатьох елементів були визначені неправильно або не визначені взагалі, а закон має не тільки пояснювати виявлені факти, але й передбачати нові відкриття.
2. Яким чином Періодичний закон дозволяє передбачити властивості хімічних елементів та утворених ними хімічних сполук? Наведіть конкретні приклади. Властивості нових відкритих елементів — їх назвали Галієм і Германієм — практично збіглися з передбаченими Менделєєвим властивостями Екаалюмінію й Екасиліцію. 3. Поясніть, чому відкриття інертних газів поставило під сумнів справедливість Періодичного закону. Інертні гази не реагували із жодною речовиною і спроби добути сполуки інертних елементів з іншими елементами не мали результатів, тобто, з’явилися елементи з невизначеними валентностями, і їм не було місця в Періодичній системі.
Д.І.Менделєєв помістив їх між елементами груп галогенів і лужних елементів в окрему групу з номером 0 (у сучасній Періодичній системі вони розташовані у VIII групі).
shkola.in.ua
Таким чином періоди Періодичної системи одержали своє логічне завершення.
Завдання для засвоєння матеріалу 1. За Періодичним законом обчисліть значення відносних атомних мас Галію і Селену. Порівняйте отримані дані з наведеними в Періодичній системі хімічних елементів. Д.І. Менделєєв визначав властивості певного невідомого елемента як середні до властивостей елементів, оточуючих його в Періодичній системі.Так, ліворуч і праворуч від Галію розташовані відповідно Цинк та Германій, а зверху і знизу —
Алюміній та Індій. За методом Менделєєва, відносна атомна маса Галію має дорівнювати середньому арифметичному відносних атомних мас цих чотирьох елементів.
Ar(Ga) = (Ar(Zn)+Ar(Ge) + Ar(Al)+Ar(In)) : 4 = (65,41+72,64+26,982+114,82) : 4 = 69,96
Отримане число близьке до значення відносної атомної маси Галію (69,72)
Аналогічно обчислимо значення відносної атомної маси Селену.
Ar(Se) = (Ar(As)+Ar(Br) + Ar(S) + Ar(Te)) : 4 = (74,922+79,904+32,06+127,6) : 4 = 78,62
Отримане число близьке до значення відносної атомної маси Cелену (78,96)
2. Складіть формули сполук із Хлором тих елементів, існування яких було
передбачено Д. І. Менделєєвим (№ 21, 31, 32).
№21 - Скандій Sc, №31 - Галій Ga, №32 - Германій Ge.
Відповідь: ScCl2, GaCl3, GeCl4
3. Назвіть відомі вам прості речовини, молекули яких у газоподібному стані
є: а) одноатомними; б) двоатомними.
а) одноатомними
Інертні гази — гелій Не, неон Ne, аргон Ar, криптон Kr, ксенон Xe, радон Rn
б) двохатомними
Кисень O2, азот N2, водень H2, хлор Cl2, фтор F2, бром Br2, йод I2 5. Які порушення в закономірній зміні властивостей елементів другого періоду виникатимуть, якщо елемент Берилій помістити згідно з його колишнім (помилковим) значенням відносної атомної маси (13,5)? Берилій — металічний елемент, а у помилковому випадку розміщувався би серед неметалічних елементів. 6. Хімічні елементи А, Б і В належать до головних підгруп II, IV і VI груп відповідно. Хімічні елементи А і Б належать до одного періоду й утворюють один з одним дві сполуки: одна здатна горіти, а інша — ні. Сполуки цих трьох елементів поширені в природі й застосовуються у виробництві будівельних матеріалів. Назвіть ці елементи. Відповідь: Карбон, Оксиген і Кальцій Карбон С і Оксиген О - належать до одного (2) періоду, утворюючи сполуки СО — чадний газ, що здатний горіти і СО2 —вуглекислий газ, що не підтримує горіння. Сполука цих трьох елементів СаСО3 поширена у природі (входить до складу вапняка, крейди, мармуру) і застосовується у виробництві будівельних матеріалів. 7. Визначте в Періодичній системі елемент, вищий оксид якого має валентність не більшу за IV та відносну молекулярну масу (із точністю до одиниці): а) 94; б) 102. Доведіть, що існує лише одна правильна відповідь у кожному випадку. За умовою валентніть не більша за IV, тому визначаємо серед таких оксидів: R2O (І), RO (ІІ), R2O3 (ІІІ), RO2(IV).
а) 94
Mr(R2O)=2•Ar(R)+Ar(О), звідси Ar(R)=(Mr(R2O)-Ar(О)):2=(94-16):2=39 Таку відносну атомну масу має Калій.
shkola.in.ua
Mr(RO)=Ar(R)+Ar(О), звідси Ar(R)=Mr(RO)-Ar(О)=94-16=78 — не підходить
Mr(R2O3)=2•Ar(R)+3•Ar(О), звідси Ar(R)=(Mr(R2O)-3•Ar(О)):2=(94-3•16):2=23 — не підходить
Mr(RO2)=Ar(R)+2•Ar(О), звідси Ar(R)=Mr(R2O)-2•Ar(О)=94-2•16=62 — не підходить
Відповідь: Кальцій Са
б) 102
Mr(R2O)=2•Ar(R)+Ar(О), звідси Ar(R)=(Mr(R2O)-Ar(О)):2=(102-16):2=43 — не підходить
Mr(RO)=Ar(R)+Ar(О), звідси Ar(R)=Mr(RO)-Ar(О)=102-16=86 — не підходить.
Mr(R2O3)=2•Ar(R)+3•Ar(О), звідси Ar(R)=(Mr(R2O)-3•Ar(О)):2=(102-3•16):2=27 Таку відносну атомну масу має Алюміній.
Mr(RO2)=Ar(R)+2•Ar(О), звідси Ar(R)=Mr(R2O)-2•Ar(О)=102-2•16=70 — не підходить Відповідь: Алюміній Al Тема 2. Хімічний зв’язок і будова речовини
§ 17. Природа хімічного зв’язку
Контрольні запитання
1. Чому число відомих молекул набагато перевищує число існуючих хімічних елементів?
Молекула складається з двох або більшої кількості сполучених атомів, тобто
утворюється за рахунок комбінацій (об'єднання різної кількості атомів у різному порядку) вже існуючих хімічних елементів. Наприклад, маємо один хімічний елемент Оксиген і дві молекули (утворені різною кількістю атомів): молекула кисню О2 і озону О3.
2. За участю яких частинок утворюється хімічний зв'язок: б) електронів
3. Які взаємодії існують у молекулі водню? Взаємодії електронної природи. Електростатична взаємодія позитивно заряджених ядер і негативно заряджених електронів.
Як вони змінюються залежно від відстані між ядрами атомів?
У разі зближення атомів починають діяти сили притягання між ядром одного атома і електронами іншого атома, а також сили відштовхування між ядрами й електронами обох атомів. Відстань між ними зменшується доти, поки взаємне притягання не зрівноважиться відштовхуванням двох ядер, енергія системи в цьому випадку найменша.
4. Дайте визначення хімічного зв'язку. Завдяки чому він утворюється? Хімічний зв’язок — це взаємодія атомів, що зумовлює стійкість багатоатомних частинок (молекул, йонів). В його утворенні беруть участь кулонівські сили, носіями яких є електрони і ядра атомів. Хімічний зв’язок мають ті атоми, електронна конфігурація яких відрізняється від конфігурації атомів інертних елементів.
5. Чому одні атоми взаємодіють один з одним, а інші ні? Хімічна активність залежить від зовнішньої електронної оболонки атома. Якщо вона є завершеною, то елементи хімічно інертні. Якщо незавершеною, то під час утворення хімічного зв’язку атоми прагнуть змінити її до конфігурації найближчого інертного елемента, віддаючи або приєднуючи електрони.
6. Які існують типи хімічного зв'язку?
Ковалентний (полярний і неполярний), йонний, металічний, водневий.
shkola.in.ua
7. За яким правилом можна визначити атоми, що здатні утворити хімічний зв'язок? За правилом октету Льюїса (від латинського слова окто — вісім), оскільки атоми всіх інертних елементів (крім Гелію) містять на зовнішньому рівні по вісім електронів, а саме: атоми всіх елементів, окрім інертних, під час утворення хімічного зв’язку прагнуть змінити електронну оболонку до конфігурації найближчого інертного елемента, віддаючи або приєднуючи електрони. Завдання для засвоєння матеріалу
1. Скільки електронів не вистачає до октету атомам Нітрогену, Хлору, Сульфуру, Карбону, Флуору, Оксигену? Під словом «октет» розуміють наявність 8 електронів
на зовнішньому енергетичному рівні. В атомі Нітрогену на зовнішньому енергетичному рівні містяться 5 електронів, тому до октету йому бракує 3 електронів. В атомі Хлору на зовнішньому енергетичному рівні містяться 7 електронів, тому до октету йому бракує 1 електрона. Відповідно до цих міркувань, атому Сульфуру до октету не вистачає 2 електронів, атому Карбону — 4 електронів, атому Флуору — 1 електрона, атому Оксигену — 2 електронів. 2. До електронної конфігурації атомів яких інертних елементів прагнуть атоми Літію, Оксигену, Кальцію, Алюмінію, Хлору? Атоми цих елементів будуть віддавати чи приєднувати електрони в разі утворення хімічних зв'язків? Атоми металічних елементів прагнуть до електронної конфігурації атомів інертних елементів, які передують їм у Періодичний системі. Отже, атом Літію прагне до електронної конфігурації атома Гелію, атом Кальцію — до електронної конфігурації атома Аргону, атом Алюмінію — до електронної конфігурації атома Неону. При утворенні хімічних зв’язків атоми Літію, Кальцію та Алюмінію будуть віддавати електрони. Атоми неметалічних елементів прагнуть до електронної конфігурації атомів інертних елементів, які розміщуються в тому ж періоді. Отже, атом Оксигену прагне до електронної конфігурації атома Неону, атом Хлору — до електронної конфігурації атома Аргону. При утворенні хімічних зв’язків атоми Оксигену і Хлору будуть приймати електрони. 3. Визначте, скільки електронів можуть віддати для здобуття електронної конфігурації атомів інертного елемента атоми Літію, Магнію, Калію, Алюмінію, Фосфору, Хлору. Максимально атоми хімічних елементів можуть віддати ту кількість електронів, яка мститься на зовнішньому енергетичному рівні. Отже, атом Літію може віддати 1 електрон, атом Магнію — 2 електрони, атом Калію — 1 електрон, атом Алюмінію — 3 електрони, атом Фосфору — 5 електронів, атом Хлору — 7 електронів.
§ 18. Ковалентний зв’язок

shkola.in.ua
shkola.in.ua
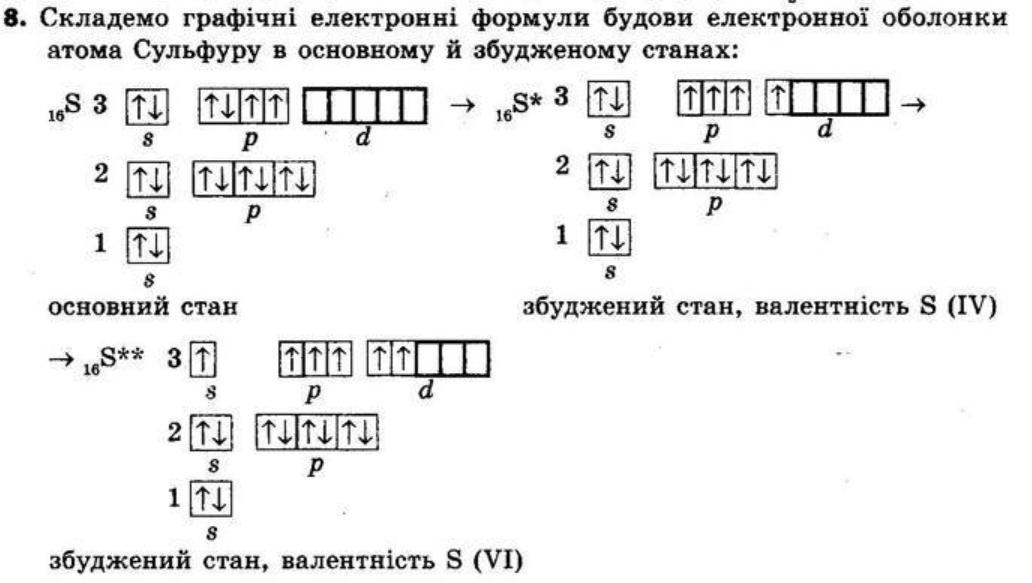


§ 19. Полярний і неполярний ковалентний зв’язок
1. Випишіть в окремі стовпчики формули речовин із полярним та неполярним зв’язком: Ковалентний зв’язок, утворений атомами однакових неметалічних елементів, називають неполярним. Ковалентний зв’язок, утворений атомами різних неметалічних елементів, називають полярним.
Формули речовин з ковалентним неполярним зв’язком
Формули речовин з ковалентним полярним зв’язком
S8, O2, F2, P4, N2 NH3, ClF3, NO3, NO
shkola.in.ua
2. Запишіть формули речовин за порядком збільшення полярності зв’язку в їхніх молекулах. Чим більшою є різниця електронегативностей атомів елементів у речовині, тим більш полярним є зв’язок. Запишемо формули речовин у порядку збільшення полярності зв’язку в їх молекулах: СН4, NH3, Н2О, HF. 3. Користуючись форзацом 1, обчисліть різницю між електронегативностями елементів у парах: Li–Cl, Be–Cl, B–Cl, C–Cl, N–Cl, O–Cl, F–Cl. Укажіть пару елементів із найбільш полярним і найменш полярним зв’язками.
Обчислимо різницю між електронегативностями елементів у парах:
а) Li — СІ, △ЕН = 3,5 – 1,0 = 2,5;
б) Be — СІ, △ЕН = 3,5 – 1,5 = 2,0;
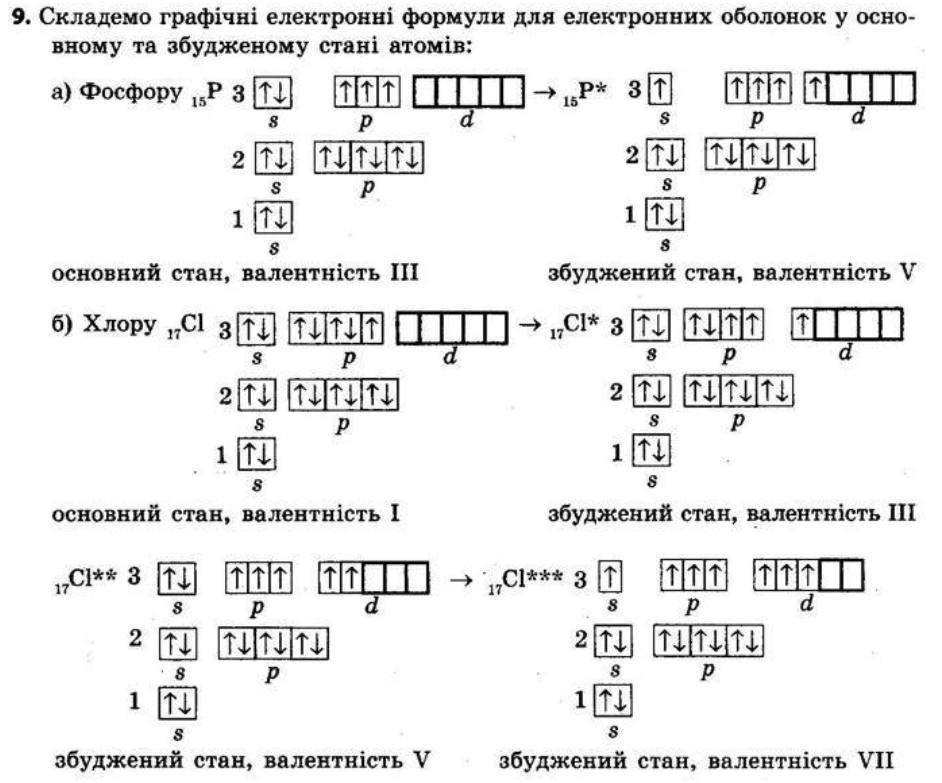
в) В — СІ, △ЕН = 3,5 – 2,0 = 1,5;
г) С — СІ, △ЕН = 3,5 – 2,5 = 1,0;
д) N — СІ, △ЕН = 3,5 – 3,0 = 0,5;
е) О — СІ, △ЕН = 3,5 – 3,5 = 0;
ж) F — СІ, ДЕН = 4,0 – 3,5 = 0,5.
Найбільш полярним є зв’язок Li — СІ, найменш полярним О — СІ.
4. Визначивши різницю електронегативностей (див. форзац 1), укажіть формулу
найполярнішої молекули. Обчислимо різницю електронегативностей для наведених формул речовин:
а) Н2, △ЕН = 2,1 – 2,1 = 0;
б) НСl, △ЕН = 3,5 – 2,1 = 1,4;
в) HF, △ЕН = 4,0 – 2,1 = 1,9;
r) ClF, △ЕН = 4,0 – 3,5 = 0,5;
д) Сl2, △ЕН = 3,5 – 3,5 = 0;
е) F2, △ЕН = 4,0 – 4,0 = 0.
Найполярнішою є молекула HF.
5. Серед наведених речовин виберіть сполуки з найбільшою та найменшою полярністю зв’язку.
Сполукою з найбільшою полярністю зв’язку є НСl, а з найменшою Сl2.
6. Визначте знак часткового заряду на атомі Хлору в молекулах HCl і ClF. Як ви вважаєте, у якій із цих молекул частковий заряд Хлору більший за абсолютною величиною?
У молекулі НСl більшу електронегативність має атом Хлору, тому на ньому виникає частковий заряд із знаком «мінус» –δ. У молекулі ClF атом Хлору має меншу електронегативність від атома Флуору, тому на ньому виникає частковий заряд із знаком «плюс» +δ.
7. Як змінюється в ряду H2O H2S H2Se H2Te полярність зв’язку? Чому?
В ряду Н2О, H2S, H2Se, Н2Те зменшується значення електронегативностей атомів О, S, Se, Те, тому зменшується й полярність зв’язку.
§ 20. Йонний
зв’язок
1. Чим принципово відрізняється ковалентний зв’язок від йонного? Ковалентний зв’язок утворюється між атомами неметалів, за рахунок об’єднання валентних електронів і утворення спільних електронних пар. Йонний зв’язок утворюється в речовинах, утворених елементами зі значною різницею електронегативностей. При утворенні йонного зв’язку відбувається повна передача електронів від атомів металічних елементів до атомів неметалічних елементів з утворенням протилежно заряджених йонів.
shkola.in.ua
2. Наведіть по дві формули сполук, у яких Оксиген утворює зв’язок: а) йонний; б) ковалентний. У сполуках Na2O, ВаО2 Оксиген утворює йонний зв’язок.
У сполуках Н2О, СО2 Оксиген утворює ковалентний зв’язок.
3. Випишіть із поданого переліку в окремі стовпчики формули сполук, у яких хімічний зв’язок: а) ковалентний неполярний; б) ковалентний полярний; в) йонний
H2, O2, N2, F2 HBr, CO2, CO, NO2, NH3, NF3, OF2 Na2O, CaO, KaN, MgF2
4. Зобразіть схему утворення йонів на прикладі:
а) калій флуориду KF; а) 2K + F2 = 2KF; K0 – e → K+; F0 + e → F–б) магній оксиду MgO; б) 2Mg + O2 = 2MgO; Mg0 – 2e → Mg2+; O0 + 2e → O2–
в) алюміній броміду AlBr3. в) 2Al + 3Br2 = 2AlBr3. Al0 – 3e → Al3+; Br0 + 1e → Br–
5. На малюнку зображена модель кристалу алюміній флуориду. Визначте, скільки йонів оточує кожний йон Алюмінію та йон Флуору.
Кожен йон Алюмінію оточує шість йонів Флуору, а кожен йон Флуору оточує два йони Алюмінію.
6. Поясніть, чому знання значення електронегативності елементів сполучених атомів дозволяє зробити висновок щодо типу хімічного зв’язку між ними. Якщо значення електронегативності одинакові — ковалентний неполярний зв’язок Якщо значення електронегативності близькі по значенню — ковалентний полярний зв’язок Якщо значення електронегативності різко відрізняються — йонний зв’язок
§ 21. Будова твердих речовин та їхні властивості Лабораторний дослід № 1
Речовина Цукор
Калій сульфат Силіцій(IV) оксид Розчинність у воді добре розчиняється добре розчиняється не розчиняється
Здатність до плавлення легко плавиться не плавиться не плавиться
Крихкість крихкий крихкий не крихкий Кристалічні ґратки молекулярні йонні атомні
1. Наведіть по одному прикладу твердих речовин, які під час нагрівання: а) розкладаються; б) плавляться; в) сублімують. Кальцій карбонат CaCO3 при нагріванні розкладається: CaCO3 = CaO + CO2; сірка при нагрівання плавиться, а йод — сублімує.
2. Поясніть, чому кварц SiO2 і вуглекислий газ CO2 мають зовсім різні фізичні властивості, незважаючи на подібний склад.
shkola.in.ua
Хоча кварц SiO2 і вуглекислий газ СО2 подібні за складом, вони мають різні кристалічні ґратки: кварц SiO2 — атомні кристалічні ґратки, вуглекислий газ СО2 — молекулярні. Тому вони мають зовсім різні фізичні властивості. 3. Із наведеного переліку випишіть окремо формули речовин із кристалічними ґратками: а) атомними; б) йонними; в) молекулярними.
зв’язок
зв’язок Йонний
Ковалентний неполярний
Ковалентний полярний
зв’язок
Речовини з атомними кристалічними ґратками
Речовини з йонними кристалічними ґратками Речовини з молекулярними кристалічними ґратками С (алмаз) CaBr2, CuO, NaNO3, Fe2(SO4)3 O2(тв.), Br2(тв.), HCl(тв.), CO2(тв.), H2O(тв.)
5. Білий фосфор плавиться за температури 44 °с, а червоний фосфор за значно вищої температури. який висновок можна зробити щодо типів їхніх кристалічних ґраток?
Білий фосфор і червоний фосфор мають молекулярні кристалічні ґратки.
6. Карборунд (силіцій карбід SiC) має температуру плавлення 2830 °С і за твердістю близький до алмазу. який тип його кристалічних ґраток?
Карборунд (силіцій карбід SiC) має атомні кристалічні ґратки про що свідчить значення його температури плавлення.
7. Ванілін безбарвна кристалічна речовина з приємним запахом. які кристалічні ґратки в нього? Запах мають речовини з молекулярними кристалічними ґратками.
8. Деяка безбарвна речовина добре розчиняється у воді й має високу температуру плавлення. Висловте припущення щодо типу її кристалічних ґраток. Чи має ця речовина запах?
Добру розчинність у воді й високу температуру плавлення мають речовини з йонними кристалічними ґратками. Запаху такі речовини, як правило, не мають.
ТЕМА 3. Кількість речовини. Розрахунки за хімічними формулами
§ 22. Кількість речовини. Моль одиниця кількості речовини. Число Авоґадро

shkola.in.ua
shkola.in.ua
§ 23. Молярна маса



shkola.in.ua


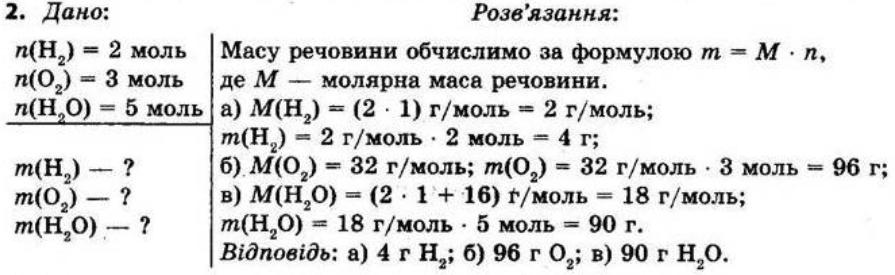
shkola.in.ua



shkola.in.ua



§ 24. Молярний об’єм

1. Який об’єм займають за нормальних умов: а) 2 моль азоту; б) 0,5 моль кисню; в) 0,25 моль фтору?
2. Скільки молекул міститься в гумовій кулі об’ємом 5,6 л (н. у.), заповненій воднем? Чи зміниться відповідь, якщо в умові завдання водень замінити на: а) азот; б) невідомий газ; в) водопровідну воду?


shkola.in.ua
2) Обчислимо число молекул H2 за формулою: N(H2) = NA · n = 6,02 · 1023 моль–1 · 0,25 моль = 1,505 · 1023.
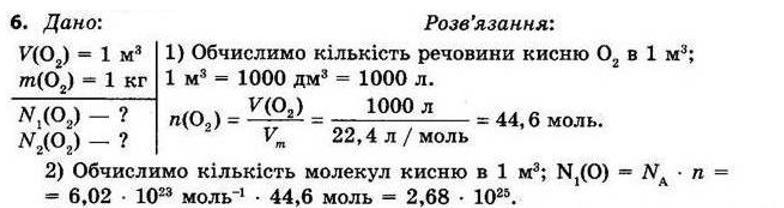

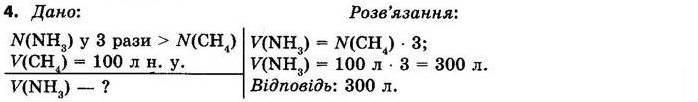

3) Відповідь не зміниться, якщо в умові задачі замінити водень на азот або невідомий газ, тому що за законом Авагадро однакові об’єми різних газів за однакових умов містять однакову кількість молекул. Відповідь зміниться, якщо в умові задачі замінити водень на водопровідну воду. 3. Визначте, який об’єм за нормальних умов займають: а) 5 моль метану CH4; б) 2 моль гідроген сульфіду H2S; в) 4,2 моль амоніаку NH3.
4. У якому об’ємі амоніаку NH3 міститься в 3 рази більше молекул, ніж у метані CH4 об’ємом 100 л (н. у.)?
5. Є два гази, узяті за нормальних умов: 10 л метану CH4 і 20 л хлору Cl2. У якому з них міститься більше молекул, а в якому більше атомів, і у скільки разів?
6. Скільки молекул кисню міститься за нормальних умов: а) в одному кубічному метрі; б) в одному кілограмі цієї речовини?
shkola.in.ua
7. Де міститься більше молекул амоніаку у 100 г або в 100 л (н. у.)?

8. Який об’єм займають за нормальних умов: а) 10 г водню; б) 10 моль водню?


9. У чотирьох однакових посудинах містяться однакові маси таких газів: амоніак NH3, азот N2, сірчистий газ SO2, кисень O2. У якій посудині міститься найбільше молекул?
shkola.in.ua
10. Порівняйте кількість молекул в 1 г амоніаку NH3 та в 1 г азоту. У якому зразку молекул більше й у скільки разів?

11. Обчисліть масу гідроген сульфіду H2S об’ємом 11,2 л за нормальних умов.
12. Маса 0,001 м3 газу (н. у.) дорівнює 1,25 г. Обчисліть масу однієї молекули цього газу.
13. Чи однакові маси та об’єми (за однакових умов) мають 1,5 моль CO2 і 1,5 моль O2? Відповідь підтвердьте розрахунками.

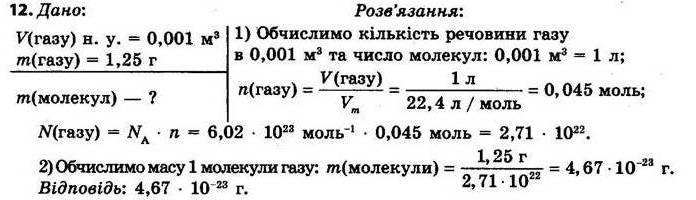
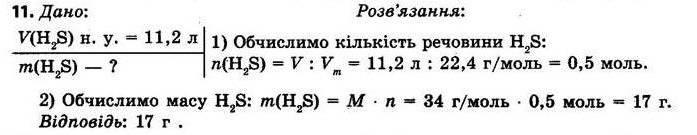

shkola.in.ua
14. На запитання: «Який об’єм займає 1 моль води за нормальних умов?», учень відповів: 22,4 л. Чи правильна ця відповідь? Поясніть.
За нормальних умов (t° = 0 °С, p = 101, 3 Па) вода є твердою речовиною. Газовий


закон Авогадро застосовують тільки для газів. Відповідь: ні.
§ 25. Відносна густина газів
shkola.in.ua
shkola.in.ua



ТЕМА 4. Основні класи неорганічних сполук



shkola.in.ua
§ 26. Класи неорганічних сполук
§ 27. Оксиди: фізичні властивості, поширеність та застосування

shkola.in.ua


shkola.in.ua



shkola.in.ua


§
28.
Хімічні властивості оксидів
shkola.in.ua



§
29. Розрахунки за рівняннями хімічних реакцій
shkola.in.ua
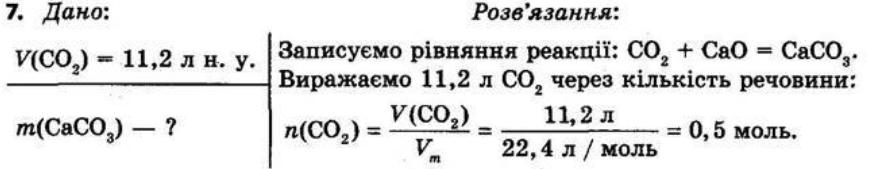


shkola.in.ua



§ 30. Основи: фізичні властивості, поширеність та застосування Контрольні запитання
1. Які основи називають лугами? Розчинні у воді основи називаються лугами.

2. Порівняйте фізичні властивості лугів та нерозчинних гідроксидів. Усі основи (луги та нерозчинні гідроксиди) є твердими речовинами, без запаху, не проводять електричний струм. Проте луги розчиняються у воді, милкі на дотик, їх розчини й розплави проводять електричний струм, а нерозчинні гідроксиди не розчиняються у воді. Залежно від металічного елемента, що утворює гідроксид, основи можуть бути різного кольору, але більшість гідроксидів — це білі речовини. Всі основи є речовинами з йонними кристалічними ґратками з відповідними фізичними властивостями.
shkola.in.ua
3. Наведіть приклади лугів та нерозчинних гідроксидів. Луги: калій гідроксид КОН, натрій гідроксид NaOH Нерозчинні гідроксиди: ферум (ІІ) гідроксид Fe(OH)2, ферум (ІІІ) гідроксид Fe(OH)3 4. Опишіть застосування кальцій гідроксиду та натрій гідроксиду. Кальцій гідроксид (гашене вапно) використовують в будівництві для приготування будівельних сумішей; суспензією кальцій гідроксиду у воді (вапняним молоком) навесні обмазують стовбури дерев, щоб захистити від мурах; суміш кальцій
гідроксиду разом з кальцій оксидом (негашеним вапном) використовують для очищення цукру на цукрових заводах. Натрій гідроксид (їдкий натр, або каустична сода) використовують у виробництві твердого мила, а також ліків, виготовлення скла, штучних барвників, паперу, синтетичних волокон та очищення нафти; 40%-й розчин натрій гідроксиду є засобом для очищення каналізаційних труб.
5. У складі основ обов’язково міститься: а) гідроксильна група;
6. Речовини KОН, Fe(ОН)2, NaОН називають: а) солями;
7. Напишіть формули основ, утворених елементами: Натрій, Калій, Ферум (III), Ферум (II), Кальцій, Барій. NaOH, KOH, Fe(OH)3, Fe(OH)2, Ca(OH)2, Ba(OH)2 Завдання для засвоєння матеріалу
1. Як ви вважаєте, формула якої речовини зайва в переліку: Ca(OH)2, KOH, Na2O, Cu(OH)2? До якого класу неорганічних сполук належить ця речовина?
У даному переліку зайвою є формула речовини Na2O. Ця речовина є оксидом.
2. Складіть хімічні формули оксидів та гідроксидів, утворених елементами:
Cu(II), Mn(II), Co(III), Li(I).
CuO і Cu(ОН)2; MnO і Mn(OH)2; Co2O3 і Co(OH)3; Li2O і LiOH.

3. Що називають: а) гашеним вапном; б) вапняною водою; в) вапняним молоком; г) їдким натром; д) каустичною содою; е) їдким калі? Гашеним вапном називають кальцій гідроксид Ca(OH)2. Його розчин у воді називають вапняною водою, а більш концентрований розчин Ca(OH)2 називають вапняним молоком. їдким натром і каустичною

натрій гідроксид NaOH. Їдкий калій — це назва калій гідроксиду KOH.
4. Твердий натрій гідроксид використовують у лабораторіях як осушувач. на якій властивості лугу ґрунтується його застосування? Гігроскопічність (поглинає вологу).
5. Обчисліть кількість речовини гідроксидів, що містяться: а) у 10 г натрій гідроксиду; б) 51,3 г барій гідроксиду; в) 15,45 г хром(III) гідроксиду.
shkola.in.ua
содою
називають
6. Порівняйте, у якому зразку міститься більше атомів Гідрогену: у купрум(II) гідроксиді масою 19,6 г чи в алюміній гідроксиді масою 11,7 г.
2) За формулою Cu(OH)2 визначаємо, що 1 моль Cu(OH)2 містить 2 моль атомів Гідрогену,
тоді 0,2 моль Cu(OH)2 міститимуть 0,4 моль атомів Гідрогену.


За формулою Al(OH)3 визначаємо, що 1 моль Al(OH)3 містить 3 моль атомів Гідрогену, тоді 0,15 моль Al(OH)3 міститимуть 0,15 моль · 3 = 0,45 моль атомів Гідрогену. Відповідь: в алюміній(ІІІ) гідроксиді.
7. Обчисліть масові частки металічних

елементів у натрій гідроксиді та калій гідроксиді. У якому гідроксиді масова частка металічного елемента більша? Обчислимо масові частки металічних елементів у натрій гідроксиді NaOH та калій гідроксиді КОН: § 31. Хімічні
лугів і нерозчинних гідроксидів Лабораторний дослід № 2
властивості
shkola.in.ua
shkola.in.ua



shkola.in.ua
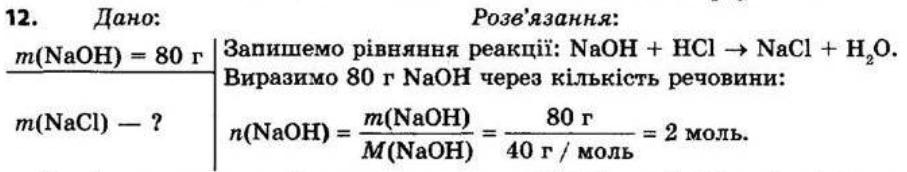



shkola.in.ua
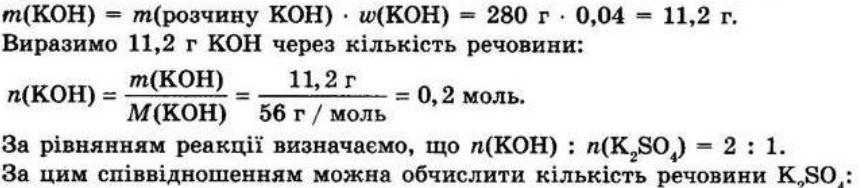
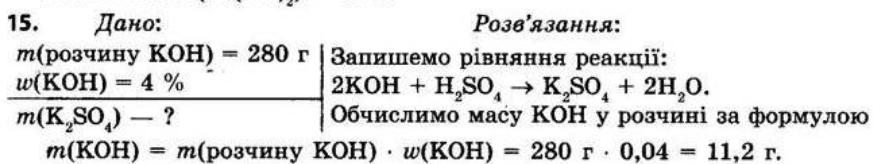


§ 32. Кислоти: фізичні властивості, поширеність та застосування

shkola.in.ua


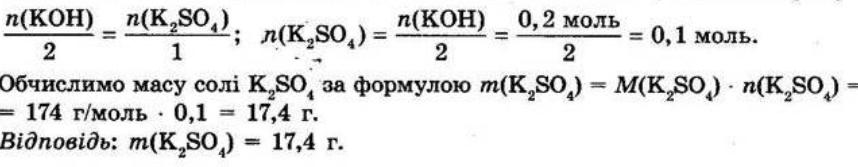
shkola.in.ua




§ 33. Хімічні властивості кислот Домашній експеримент
shkola.in.ua



§ 34. Ряд активності металів. Реакції заміщення Лабораторний дослід № 3



shkola.in.ua
shkola.in.ua



shkola.in.ua



shkola.in.ua

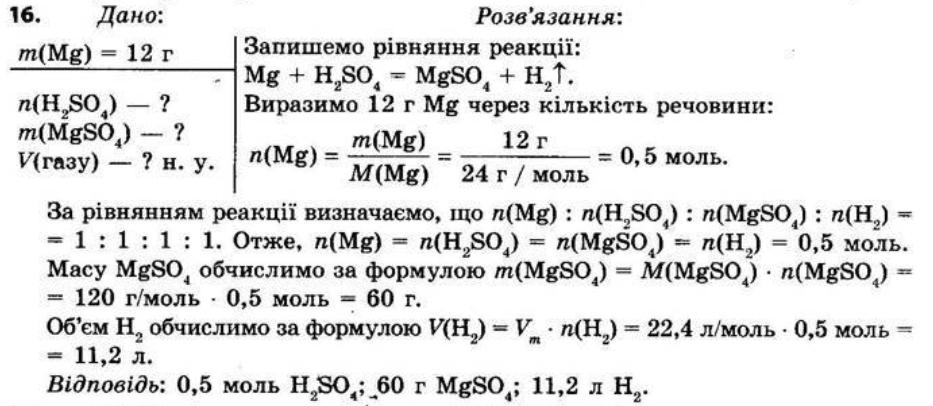

shkola.in.ua


Лабораторний дослід № 4
shkola.in.ua



§
35. Солі: фізичні властивості, поширеність та застосування
shkola.in.ua
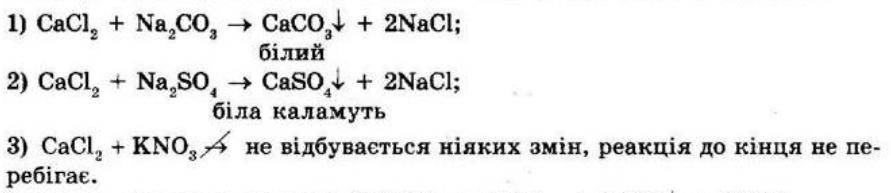

 § 36. Хімічні властивості солей Лабораторний дослід № 5
Лабораторний дослід № 6
§ 36. Хімічні властивості солей Лабораторний дослід № 5
Лабораторний дослід № 6
shkola.in.ua



shkola.in.ua
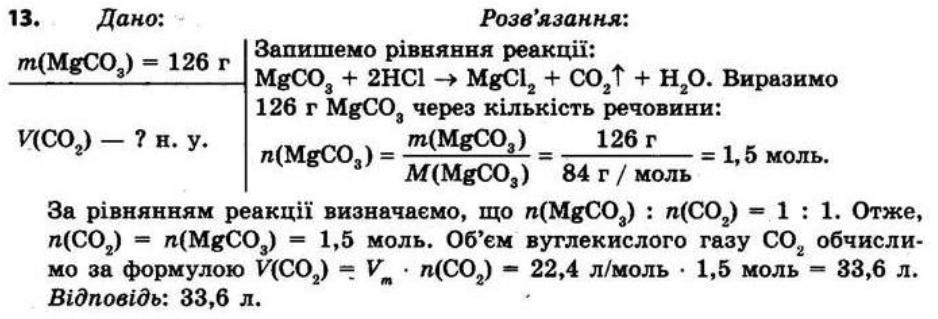


shkola.in.ua



§ 37. Амфотерні оксиди й гідроксиди
shkola.in.ua


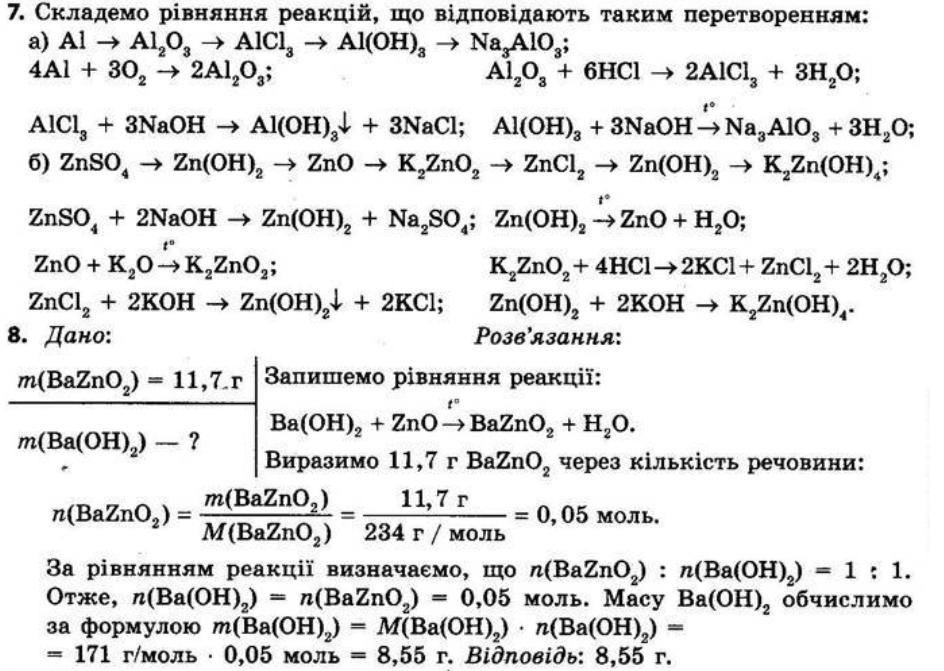 § 38. Способи добування оксидів
§ 38. Способи добування оксидів
shkola.in.ua




shkola.in.ua


shkola.in.ua
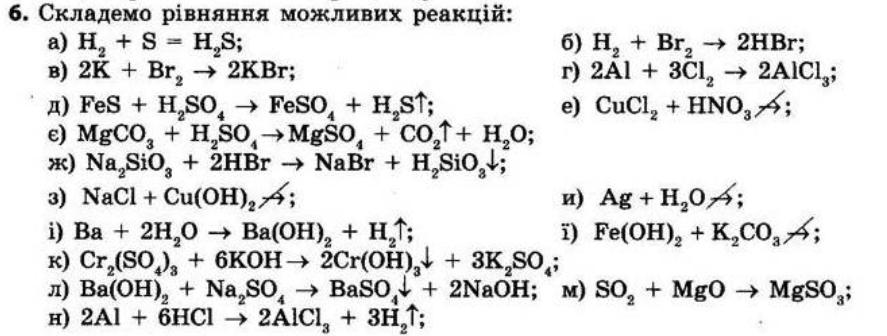


§
кислот,
39. Загальні способи добування
основ та солей
shkola.in.ua


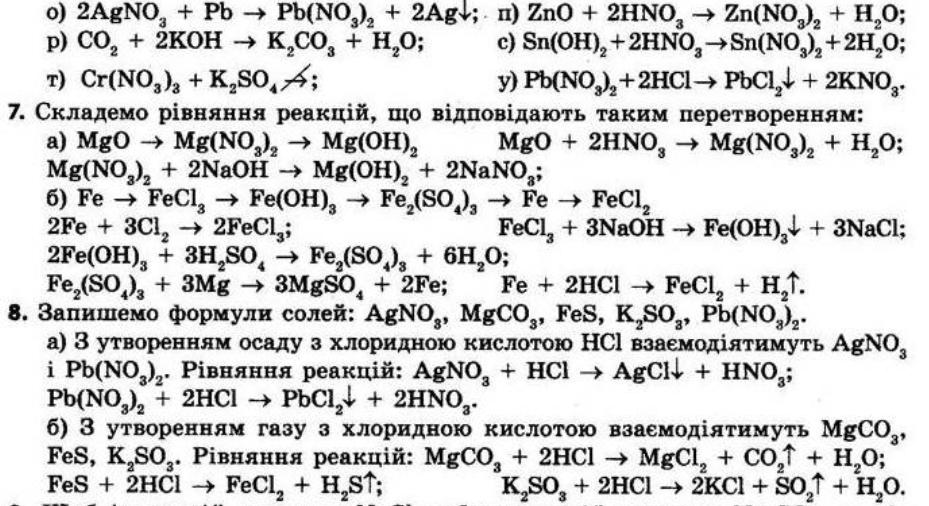
shkola.in.ua


Практична робота № 2
§ 40. Генетичні зв’язки між класами неорганічних сполук
1. Складіть формули таких речовин... Кальцій оксид СаО, калій оксид K2О, фосфор(ІІІ) оксид P2O3, барій оксид BaO, цинк оксид ZnO, сульфідна кислота H2S, карбонатна кислота Н2СО3, магній гідроксид Mg(OH)2, ферум(ІІ) гідроксид Fe(OH)2, силікатна кислота H2SiO3, купрум(ІІ) гідроксид Cu(ОН)2, літій гідроксид LiOH, калій гідроксид KOH, нікол(ІІ) сульфат NiSO4, алюміній гідроксид Al(OH)3, натрій фосфат Na3PO4, хлоридна кислота НCl, ортофосфатна кислота Н3РО4. 2. Із наведених формул речовин випишіть окремо формули та назви оксидів, кислот, основ і солей: Оксиди — бінарні сполуки елементів з Оксигеном, у яких Оксиген виявляє ступінь
окиснення –2. До оксидів належать CO2 — карбон(IV) оксид, SO3 — сульфур(VI) оксид. Кислоти — складні речовини, які складаються з атомів Гідрогену і кислотних залишків. До кислот належать НCl — хлоридна кислота, H2SO4 — сульфатна кислота, HBr — бромидна кислота, Н3РО4 — ортофосфатна кислота, H2SiO3 — силікатна кислота, H2S — сульфідна кислота, HI — йодидна кислота. Основи — складні сполуки, що містять металічні елементи та одну або кілька гідроксильних груп — ОН. До основ належать NaOH — натрій гідроксид, Са(ОН)2 — кальцій гідроксид, Cu(OH)2 — купрум(ІІ) гідроксид, Fe(OH)2 — ферум(ІІ) гідроксид, Mg(OH)2 — магній гідроксид, Zn(OH)2 — цинк гідроксид. Солі — складні сполуки, що містять металічні елементи й кислотні залишки. До солей належать K2SO4 — калій сульфат, CaBr2 — кальцій бромід, CuCO3 — купрум(ІІ) карбонат, AlРО4 — алюміній ортофосфат, CuSO4 — купрум(ІІ) сульфат, Ba(NO3)2 — барій нітрат, FeCl, — ферум(ІІІ) хлорид, Na2S — натрій сульфід, Al(NO3)3 — алюміній нітрат, Ва3(РО4)2 — барій ортофосфат.
shkola.in.ua
3. Невідомий оксид розчиняється у воді з утворенням розчину, що забарвлює лакмус у червоний колір. який висновок можна зробити щодо характеру властивостей цього оксиду? Чи буде він взаємодіяти з хлоридною кислотою, натрій гідроксидом, натрій хлоридом, кальцій оксидом? Відповідь обґрунтуйте.
Лакмус набуває червоного кольору в кислотному середовищі. Отже, у воді розчинили кислотний оксид. Кислотний оксид буде реагувати з натрій гідроксидом і кальцій оксидом. Наприклад:
SO2 + 2NaOH → Na2SO3 + Н2О; SO2 + CaO→ CaSO3.

4. Проілюструйте генетичний зв’язок між класами неорганічних речовин на прикладі магнію й сірки. Складіть відповідні рівняння реакцій. Магній при згорянні на повітрі утворює основний оксид MgO: 2Mg + О2 → 2MgO. MgO не приєднує воду й не утворює магній гідроксид Mg(OH)2. При горінні сірки утворюється кислотний оксид SO2, що реагує з водою з утворенням сульфітної
кислоти H2SO3: S → SO2 → H2SO3. Рівняння реакцій: S + О2 → SO2; SO2 + Н2O


→ H2SO3. При взаємодії основного оксиду MgO й кислоти H2SO3 утворюється сіль: MgO + H2SO3 → MgSO3 + Н2О.
shkola.in.ua
shkola.in.ua



§ 41. Розв’язування експериментальних задач Лабораторний дослід № 7


shkola.in.ua

shkola.in.ua



shkola.in.ua



shkola.in.ua


shkola.in.ua



Практична
робота № 3









































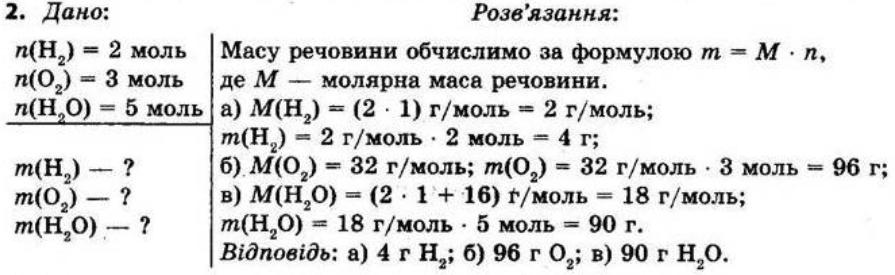
















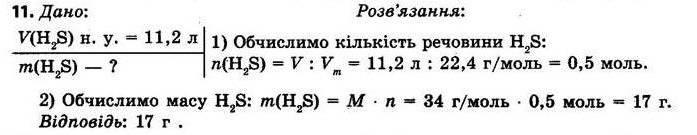




















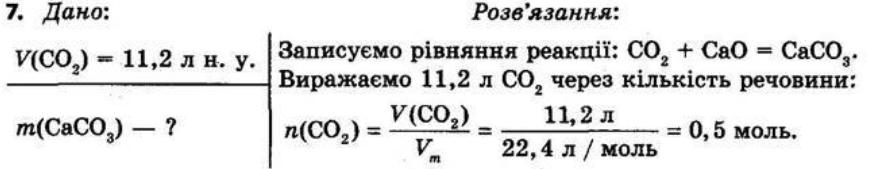














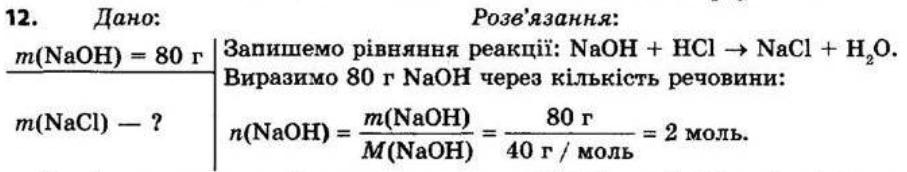



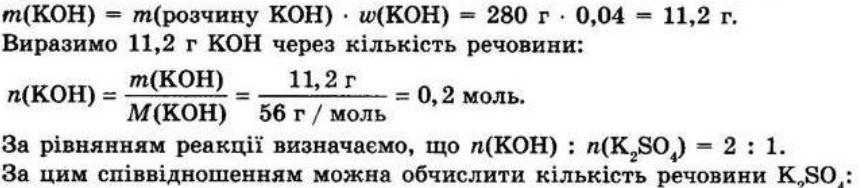
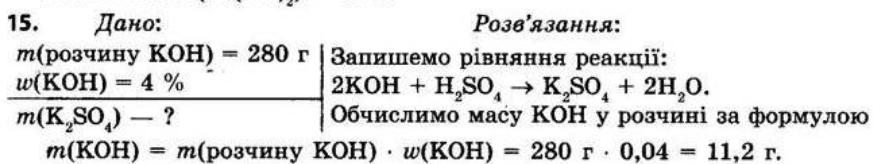





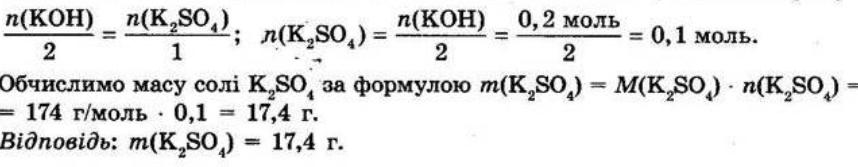

















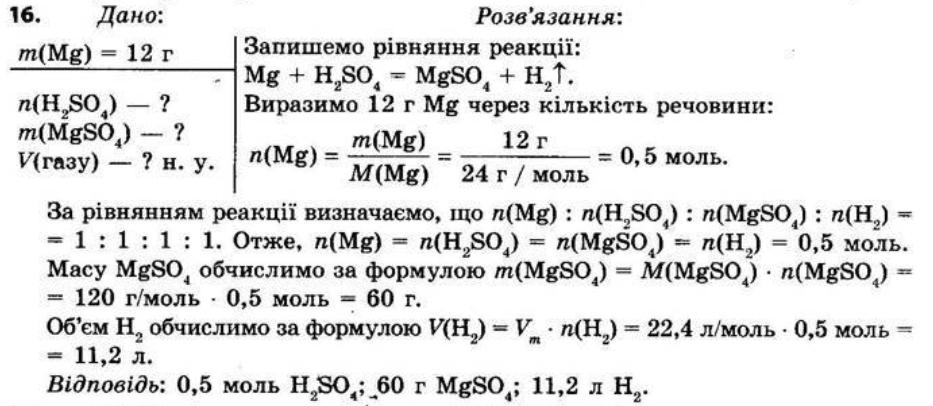

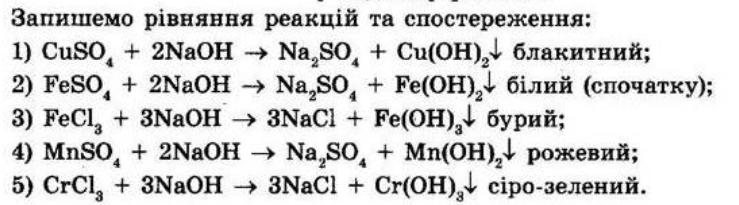





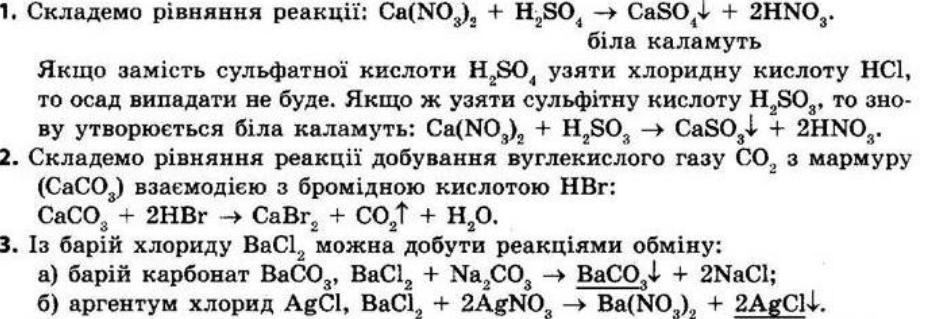
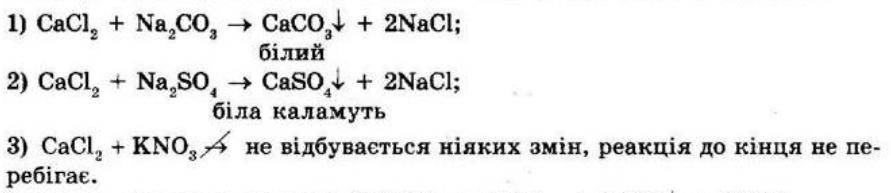

 § 36. Хімічні властивості солей Лабораторний дослід № 5
Лабораторний дослід № 6
§ 36. Хімічні властивості солей Лабораторний дослід № 5
Лабораторний дослід № 6



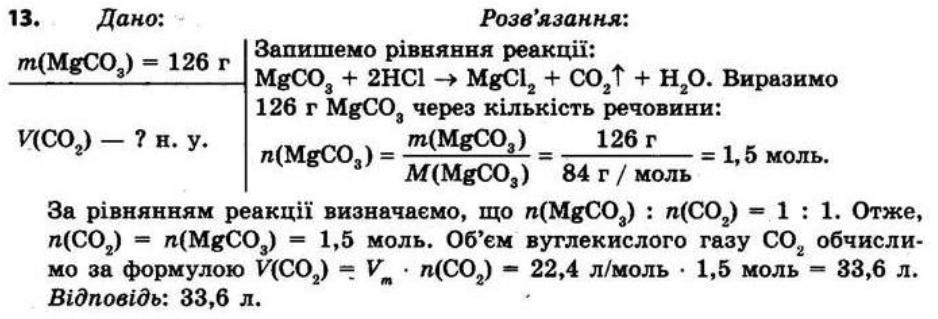







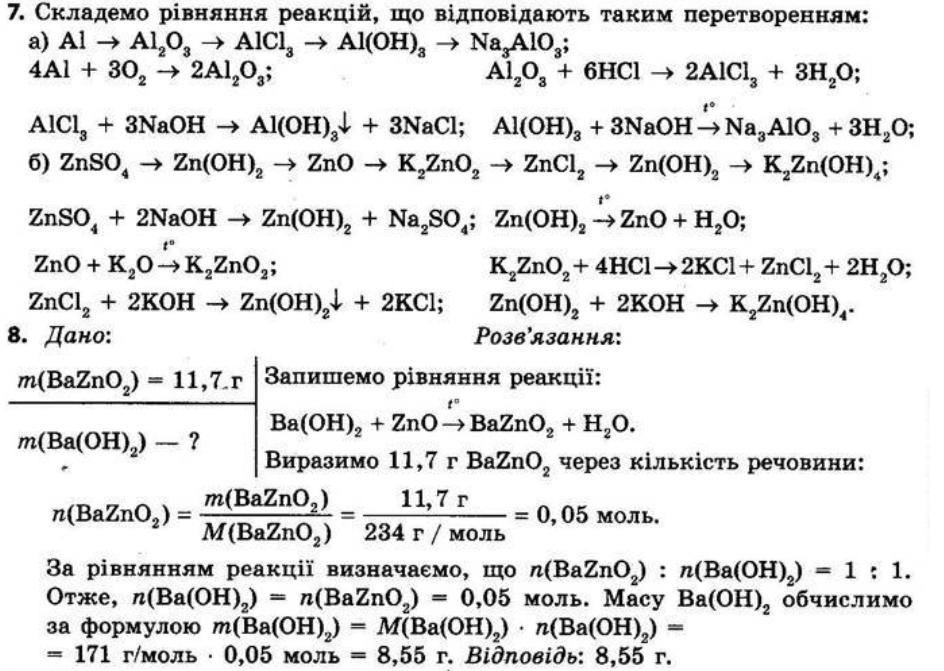 § 38. Способи добування оксидів
§ 38. Способи добування оксидів