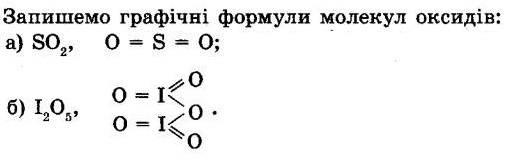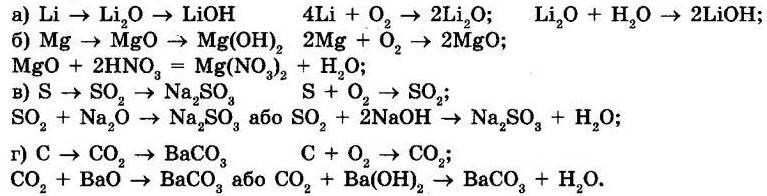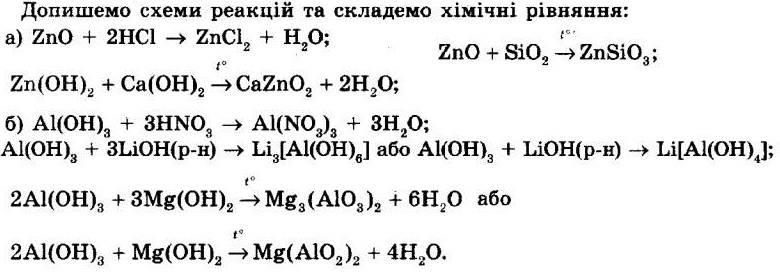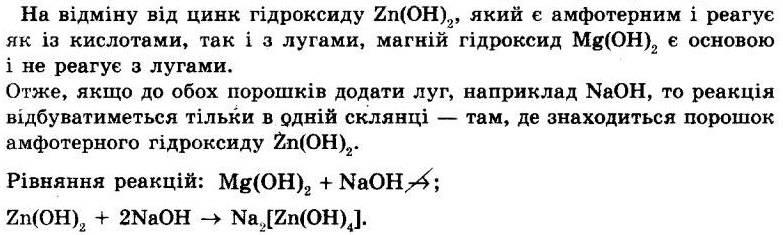ГДЗ Хімія 8 клас Попель 2021
Розділ 1. Періодичний закон. Періодична система хімічних елементів. Будова атомів
§ 1. Історичні відомості про спроби класифікації хімічних елементів
Сторінка 12
1.Що раніше вважали хімічним елементом і як визначають його нині?
Раніше вважали просту речовину, а сьогодні ― як вид атомів з певним зарядом ядра.
Давньогрецькі філософи вважали, що елементи це складові частини всіх речовин На їхню думку, існувало чотири «елементи»: вогонь, повітря, вода та земля. У XVII ст.
вчені Р. Бойль та М. В. Ломоносов припускали, що елемент це те, що є межею розкладання речовин (тобто атом). А.-Л. Лавуазье та Дж. Дальтон вважали елементом просту речовину. Д. І. Менделєєв під елементом розумів складники простих і складних тіл. На початку XX ст. було встановлено, що хімічний елемент це вид атомів з певним зарядом ядра. Це сучасне визначення елементу. 2.Виберіть ознаки, які були використані А.-Л. Лавуазьє, В. Деберайнером, Дж. Ньюлендсом, Л. Маєром для класифікації простих речовин і хімічних елементів: властивості простих речовин, поширеність елементів у природі, склад характерних сполук, значення відносних атомних мас, значення валентності елементів.
А.-Л. Лавуазье для класифікації обрав властивості простих речовин (поділ на метали та неметали). В. Деберейнер також подібність властивостей простих речовин (тріади елементів: Li, Na та К; Cl, Вг та I; Ca, Sr та Ba; Fe, Co та Ni; S, Se та Те). Дж. Ньюлендс значення відносних атомних мас (зі зростанням яких кожний восьмий елемент був подібним до першого «правило октав»). Л. Мейєр значення відносних атомних мас та валентності (таблиця з 28 хімічних елементів).
3.Охарактеризуйте розміщення елементів кожної тріади Деберайнера в періодичній системі Лужні метали: Li, Na та К елементи І групи головної підгрупи, 2, 3 та 4 періодів відповідно.
Галогени: СІ, Вг та І елементи VII групи головної підгрупи, 3, 4, та 5 періодів відповідно.
Лужноземельні метали: Ca, Sr та Ва елементи II групи головної підгрупи, 4, 5 та 6 періодів відповідно.
Тріада Феруму: Fe, Co та Ni елементи VIII групи побічної підгрупи 4 періоду. Халькогени: S, Se та Те елементи VI групи головної підгрупи, 3, 4 та 5 періодів відповідно.
4.Зіставте відносну атомну масу Брому з напівсумою відносних атомних мас Хлору і Йоду.
shkola.in.ua
4.Обчислимо відносну атомну масу Брому з напівсумою відносних атомних мас Хлору і Йоду, способом, запропонованим В. Деберейнером: Ar(Br) = (Ar(Cl) + Ar(I)) : 2 = (35,5 + 127) : 2 = 81,25 ≈ 81 а.о.м. Отже, значення відносної атомної маси брому (за даними періодичної системи Аr(Вг) = 79,9 ≈ 80 а.о.м.), дещо менше за півсуму відносних атомних мас Хлору і Йоду. 5.Порівняйте ряд елементів Дж. Ньюлендса з їх послідовністю в періодичній системі та назвіть відмінності.
У ряді елементів Дж. Ньюлендса Титан (Ті) розміщено між Хромом (Сг) та Манганом (Мn). У періодичній системі Титан передує Хрому.
§ 2. Періодичний закон
Сторінка 16-17
6. У фрагменті природного ряду елементів, який починається з Літію і закінчується Флуором, укажіть хімічний характер кожного елемента і тип його простої речовини. Який метал і який неметал серед цих простих речовин мають
бути найактивнішими в хімічних реакціях? Найактивніші - літій і флуор
7. Поясніть значення слова «періодичність». Які зміни у природі можна охарактеризувати цим словом? Зіставте за змістом слово «періодичність» зі словами «неперервність», «поступовість».
7. Періодичність означає «закономірна повторюваність». Приклади періодичних змін у природі: зміна дня та ночі; зміна пір року весни, літа, осені та зими; припливи та відпливи в морях та океанах. Неперервність означає «те, що триває безперестанно, постійно, без перерви». Поступовість означає «те, що відбувається без раптових змін, у певній послідовності, не відразу».
8. Періодичною чи поступовою є зміна максимальних значень валентності елементів у їх природному ряду?
3. Періодичною
Ряд хімічних елементів, складений за зростанням атомних мас, Д.І. Менделєєв назвав природним рядом, тобто таким, що існує незалежно від людини в самій природі. Зверніть увагу, що періоди Періодичної системи є лише фрагментами природного ряду.
Закономірності, виявлені в природному ряду елементів, привели вченого до відкриття у 1869 р. періодичного закону. Періодичність у хімії це повторення (але не копіювання) хімічного характеру елементів, особливостей будови атомів, складу, будови і властивостей речовин через певну кількість елементів у їх природному ряду. Відповідь проілюструйте прикладами. У межах кожного періоду (фрагменті природного ряду) спостерігаємо поступову зміну властивостей простих речовин, характеру сполук, вищої валентності хімічних елементів, що періодично повторюється у їх природному ряду.
Валентність I II III IV V VI VII
Елементи 2 періоду Li Be B C N O F
Елементи
3 періоду
Na Mg Al Si P S Cl
shkola.in.ua
9. Укажіть відмінність між сучасним формулюванням періодичного закону і тим, яке дав Менделєєв. У сучасному формулюванні: властивості елементів та іх сполук перебувають у періодичній залежності від величини заряду ядер їхніх атомів, а не від відносних атомних мас елементів, як сформулював Д.І.Менделєєв.
§ 3. Періодична система хімічних елементів
Сторінка 21-22
1. Що називають періодом і групою хімічних елементів?
Період це фрагмент природного ряду елементів від лужного елемента до інертного. Група стовпчик елементів у короткому варіанті періодичної системи або два
стовпчики в довгому варіанті.
2. Скільки періодів у періодичній системі? Порівняйте їх за кількістю елементів.
Періодів сім. Перший період містить 2 елементи, другий і третій по 8 елементів. Їх називають малими періодами.
Четвертий і п’ятий містять по 18 елементів. Шостий 32 елементи. Сьомий має поки що 29 елементів. Ці періоди називають великими. 3. Скільки груп у періодичній системі? Скільки підгруп має кожна група? Як їх називають і розрізняють?
Груп вісім. Кожна з груп складається з двох підгруп: головної (позначається літерою а) та побічної (позначається літерою b). Розрізнити елементи різних підгруп можна за розміщенням символів та забарвленням комірок. У короткому варіанті періодичної системи символи елементів головних підгруп зміщено вліво, а побічних вправо. Клітинки елементів головних підгруп забарвлені в рожевий або жовтий колір, а побічних у синій або зелений. 4. Укажіть групу періодичної системи, яка містить найбільше хімічних елементів. Назвіть їх кількість.
Найчисельнішою є III група: вона містить 37 хімічних елементів. Елементи (9) + лантаноїди (14) + актиноїди (14) = 37 5. Які відомості про елемент № 9 надає періодична система? Символ (або знак) F, порядковий номер 9, назва елемента флуор, назва простої речовини фтор ― це неметал, значення відносної атомної маси Ar(F)=19, дані про електронну будову атома.
6. Заповніть таблицю:
символ назва Порядковий номер період група підгрупа
7. Назвіть хімічні елементи, які перебувають: Для кожного елемента вкажіть порядковий номер.
а) у 2-му періоді, V групі; №7 - Нітроген (N)
б) у 5-му періоді, IV групі, головній підгрупі; №50 - Станум (Sn)
shkola.in.ua
в) у 4-му періоді, VII групі, побічній підгрупі; №25 - Манган (Mn) г) у 6-му періоді, VIII групі, побічній підгрупі. №76 - Осмій (Os), №77 - Іридій (Ir), №78 - Платина (Pt) 8. Серед наведених чисел укажіть ті, які відповідають порядковим номерам металічних і неметалічних елементів: 1, 6, 11, 16, 20, 30, 36. Металічні елементи: №11 Натрій (Na), №20 Кальцій (Са), №30 Цинк (Zn).
С Карбон 6 2 IV a As Арсен 33 4 V а Fe Ферум 26 4 VIII
b
Неметалічні елементи: №1 Гідроген (Н), №6 Карбон (С), № 16 Сульфур (S), №36 Криптон (Kr).
У довгому варіанті Періодичної системи є ламана лінія, проведена від Бору до
Астату, ліворуч від неї перебувають металічні елементи, а праворуч неметалічні. 9. За розміщенням у періодичній системі Брому, Магнію, Мангану, Селену вкажіть, металічним чи неметалічним є кожний елемент.
Бром (Вr) №35, 4 період, VII група, головна підгрупа, неметалічний.
Магній (Mg) №12, 3 період, II група, головна підгрупа, металічний.
Манган (Мn) №25, 4 період, VII група, побічна підгрупа, металічний.
Селен (Se) №34, 4 період, VI група, головна підгрупа, неметалічний. 10. Назвіть по два елементи, що найбільш подібні до: а) Стронцію; б) Фосфору; в) Стануму; г) Хлору. а) Стронцію - №20 Кальцій (Са) та №56 Барій (Ва);
б) Фосфору - №7 Нітроген (N) та №33 Арсен (As);
в) Стануму - №32 Германій (Ge) та №82 Плюмбум (Рb); г) Хлору - №9 Флуор (F) та №35 Бром (Вr). Подібні властивості виявляють елементи, що належать до однієї групи головної підгрупи. Подібними є металічні елементи побічних підгруп у великих періодах.
§ 4. Склад атомів Сторінка 26-27
1. Назвіть частинки, які містить атом. Чим вони різняться? Який склад атомного ядра?
Назвіть частинки, які містить атом. До складу атома входять заряджені та незаряджені частинки.
Нейтрони (незаряджені) та протони (позитивно заряджені, мають заряд +1) утворюють ядро.
Електрони (негативно заряджені, несуть заряд -1) рухаються навколо ядра.
Чим вони різняться? Зарядом (протони мають позитивний заряд, електрони
- негативний, нейтрони - не мають заряду) і масою. Який склад атомного ядра? Протони і нейтрони.
2. Яких частинок у будь-якому атомі однакова кількість? Кількість протонів та електронів в атомах є рівною.
3. Чи існують атоми, в яких немає: а) протонів? - не існують; б) електронів? - не існують; в) нейтронів? - існують. Наприклад, гідроген 1Н має число протонів N(p+)=1, нуклонне число A=1, тому число нейтронів N(n0)=A-N(p+)=1-1=0
4. Запишіть символи елементів Кобальту, Ауруму і Бісмуту разом із відповідними протонними і нуклонними числами.
shkola.in.ua
Кобальт5927Со
Аурум197 79Au
Бісмут20983Bi
Назва Символ Протонне число Нуклонне число
Кобальт Co
Аурум Au
27 59
197
79
5. Назвіть хімічний елемент, атом якого має найбільшу кількість електронів: Si, В, N, Cl.
Відповідь: Хлор (СІ) 17 електронів.
Порядковий номер хімічного елемента в Періодичній системі вказує на кількість
електронів: Si (14), В (5), N (7), Сl (17).
6. Укажіть у переліку хімічний елемент, в атомі якого міститься найменша кількість протонів: C, Mg, K, Ar.
Відповідь: Карбон (С) 6 протонів
Порядковий номер хімічного елемента в Періодичній системі вказує на кількість протонів: С (6), Mg (12), К (19), Аг (18).
7. Заповніть порожні клітинки в таблиці: Назва Символ Порядковий
номер (протонне число)
8. Укажіть хімічний елемент, атом якого має найбільшу кількість нейтронів: Sc, As, Mn. Відповідь: Арсен (As) 42 нейтрони. Кількість нейтронів в атомах можна обчислити, використавши значення відносних
атомних мас, за формулою: N(n0) =Ar - Z, де N(n0) - кількість нейтронів, Ar - відносна атомна маса, Z - порядковий номер елемента.
Отже, для:
Sc маємо N(n0) = 45 - 21 = 24
As маємо N(n0) = 75 - 33 = 42 Mn маємо N(n0) = 55 - 25 = 30
9. В атомі якого елемента містяться 24 нейтрони і 42 інші частинки? Відповідь: Sc - скандій Кількість нейтронів в атомах можна обчислити, використавши значення відносних атомних мас, за формулою: N(n0)=Ar-Z, де N(n0) ― кількість нейтронів, Ar ― відносна атомна маса, Z ― порядковий номер елемента. Отже, 24 = 45 ― 21, тобто Ar=45, а Z=21. Кількість протонів і електронів у атомі збігається з порядковим номером хімічного елемента, тому інших частинок 21+21=42. Отже, це Скандій Sc.
shkola.in.ua
§ 5. Сучасна модель атома Сторінка 34 1. Що таке орбіталь? Які форми мають s- і р-орбіталі? Порівняйте за змістом термін «орбіталь» і слово «орбіта». Орбіталь частина простору в атомі, де перебування електрона найімовірніше; s-орбіталь має форму кулі (сферичну), р-орбіталь має форму об'ємної вісімки (гантелі, причому ядро атома міститься у місці звуження гантелі).
Бісмут Bi 83 209
Нуклонне
Протонів
Цезій Cs 55 133 55 55 78 Алюміній Al 13 27 13 13 14 Кобальт Co 27 59 27 27 32
число
Електронів Нейтронів
2. Поясніть, як розміщені у просторі р-орбіталі одного атома. Чому в позначенні sорбіталі немає індексу (наприклад, sx)? р-орбіталі розміщені у просторі перпендикулярно одна до одної вздовж осей х, у та z, тому їх ще називають Рх-, Ру-, Рz-орбіталями.
В позначенні s-орбіталь не має індексу, тому що вона за осями х, у та z займає те саме положення (є однаковою за різними напрямками).
3. Установіть відповідність:
1 Ґ; 2 Г; 3 А, Б, В.



4. Назвіть характеристики, за якими один електрон може відрізнятися від іншого чи бути подібним до нього. Енергетичний рівень, тип орбіталі та спін.
shkola.in.ua
5. Енергія якої частинки менша: s-електрона на 1-му енергетичному рівні чи релектрона на 2-му енергетичному рівні? Відповідь поясніть. Енергія s-електрона на 1-му енергетичному рівні менша за р-електрона на 2-му енергетичному рівні, бо чим компактніша орбіталь і чим ближче до ядра перебуває електрон, тим його енергія менша.
6. Чи завжди енергія електрона 3-го енергетичного рівня більша, ніж електрона 2-го рівня? Чи зміниться відповідь, якщо порівнювати енергію електрона 4-го рівня і електрона 3-го рівня? Використайте схему 2.
Електрони 3-го енергетичного рівня завжди мають більшу енергію, ніж електрони 2-го енергетичного рівня. При порівнянні 3-го та 4-го енергетичних рівнів ситуація є дещо іншою. Електрони, що перебувають на d-орбіталі 3-го енергетичного рівня, мають
більшу енергію, ніж s-електрони 4-го енергетичного рівня. 7. Укажіть, який запис дає більше інформації про електрони, що містяться в атомі: електронна формула чи її графічний варіант. Чому? Більшу інформацію дає графічний варіант, тому що за розміщенням комірок можна умовно показати різницю в енергії між енергетичними рівнями та підрівнями. Дає інформацію не лише про кількість, але й розміщення: показує спарені чи неспарені електрони, наявність вакантних орбіталей.
8. Серед указаних підрівнів назвіть ті, які в атомі неможливі: 6p, 2d, 1p, 5s Неможливі: 2d (другий енергетичний рівень не має d-орбіталей), 1р (перший енергетичний рівень не містить р-орбіталей).
§ 6. Електронна будова атомів Сторінка 40-41
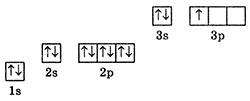
1. Атом елемента 2-го періоду на останньому енергетичному рівні має 6 електронів. Скільки серед них спарених електронів, а скільки неспарених? Чотири спарені електрони, два неспарені.
Цим атомом є Оксиген, електронна формула якого 1s22s22p4, а графічна має вигляд:
Із 6 електронів на останньому (2) енергетичному рівні є 2 s-електрони, які є спареними, та 4 р-електрони, з яких 2 р-електрони спарені і 2 р-електрони неспарені, разом є 4 спарених і 2 неспарених електрони. 2. Атоми яких елементів 2-го періоду мають один неспарений електрон, два неспарені електрони? Один неспарений електрон мають: Літій (Li), Бор (В), Флуор (F).
Два неспарені електрони мають: Карбон (С), Оксиген (О).
один неспарений електрон Літій - 3Li 1s22s1 Бор - 5B 1s22s22p1 Флоур - 9F 1s22s22p5
shkola.in.ua
два неспарені електрони Карбон - 6C 1s22s22p2 Оксиген - 8O 1s22s22p4




3. Визначте елемент, атом якого має таку електронну формулу: а) 1s2; Гелій
б) 1s22s22p63s1; Натрій в) [He]2s22p5; Флуор г) [Ne]3s1. Натрій Пояснення.



а) сума електронів у записі електронної формули атома елемента чисельно дорівнює його порядковому номеру, тому знаходимо суму електронів і визначаємо відповідний елемент. Всього 2 електрони, тому №2 — це Гелій; б) сума електронів у записі електронної формули атома елемента чисельно дорівнює його порядковому номеру, тому знаходимо суму електронів і визначаємо відповідний елемент. Всього 11 електронів, бо 1s22s22p61s1 : 2+2+6+1=11, №11 — це Натрій; в) електронна формула зовнішнього енергетичного рівня ...2s22p5. Заповнюється другий рівень, значить, елемент розташований у 2-му періоді. На зовнішньому рівні в нього 2+5=7 електронів, отже, елемент розташований у VІІ групі, це р-елемент, тому — в головній підгрупі. Шукаємо в Періодичній системі клітинку на перетині 2го періоду й VII групи. Цей елемент — Флуор; в) електронна формула зовнішнього енергетичного рівня ...3s1 . Заповнюється третій рівень, значить, елемент розташований у 3-му періоді. На зовнішньому рівні в нього 1 електрон, отже, елемент розташований у І групі, це s-елемент, тому — в головній підгрупі. Шукаємо в Періодичній системі клітинку на перетині 3-го періоду й I групи. Цей елемент — Натрій.
4. Назвіть два елементи, в атомах кожного з яких кількості всіх s- і всіх релектронів однакові. Оксиген 1s22s22p4 має 4 s-електрони і 4 р-електрони Магній 1s22s22p63s2 має 6 s-електронів і 6 р-електронів
5. Укажіть хімічний елемент, електронну будову атома якого описує така графічна формула:
shkola.in.ua
а) Aлюміній Аl Графічна формула містить три енергетичні рівні, значить, елемент розташований у 3му періоді. На останньому (3) енергетичному рівні є 2 s-електрони та 1 р-електрон, разом три зовнішні електрони, отже, елемент розташований у ІІІ групі, це р-елемент, тому в головній підгрупі. Шукаємо в Періодичній системі клітинку на перетині 3-го періоду й ІІІ групи. Цей елемент Алюміній Al. б) Сульфур S Графічна формула містить три енергетичні рівні, значить, елемент розташований у 3му періоді. На останньому (3) енергетичному рівні є 2 s-електрони та 4 р-
електрони, разом шість зовнішніх електронів, отже, елемент розташований у VІ групі, це р-елемент, тому в головній підгрупі. Шукаємо в Періодичній системі клітинку на перетині 3-го періоду й VІ групи. Цей елемент Сульфур S.
§ 7. Радіуси атомів Сторінка 43
1. Що таке радіус атома? Від яких чинників залежить його значення?
Це відстань від центра ядра до сферичної поверхні, якої торкаються орбіталі з електронами останнього енергетичного рівня.
Залежить від зарядів ядер (кількості електронів) і кількості енергетичних рівнів, на яких розміщені електрони.
2. Визначте в кожній парі елемент, атом якого має більший радіус і поясніть відповідь.
У парі Si Р: Силіцій Si, бо Si i P елементи одного періоду, причому у Р більший заряд ядра (кількість електронів), тому більша кількість електронів притягується до ядра сильніше і радіус атома Фосфора є менший. У парі F Br: Бром Br, бо F i Br елементи одної підгрупи, причому у Br більша кількість енергетичних рівнів, тому радіус атома атома Брома більший.
У парі Н Не: Гідроген Н, бо Н і Не елементи одного періоду, причому у Не більший заряд ядра (кількість електронів), тому електрони притягуються до ядра сильніше і радіус атома Гелія менший.
У парі Na Be: Натрій Na, бо Na i Be елементи різних груп, причому в Na більша кількість енергетичних рівнів, тому радіус атома Натрія більший. Радіуси атомів елементів залежать від зарядів ядер (кількості електронів) і кількості енергетичних рівнів. Радіуси атомів елементів у періоді зменшуються зліва направо, а у підгрупі зростають зверху донизу. 3. Проаналізуйте зміни радіусів атомів у рядах хімічних елементів Na K Ca, Na Mg Ca і вкажіть правильну відповідь: а) радіус атома Натрію більший, ніж атома Кальцію; б) радіуси атомів Натрію та Кальцію майже однакові; в) радіус атома Кальцію більший, ніж атома Натрію. б) радіус атома Алюмінію більший, ніж атома Берилію; У парі Al Be радіус атома Алюмінію більший, ніж Берилію, бо Al i Be елементи різних груп, причому в Al більша кількість енергетичних рівнів. 4. Назвіть елемент, атом якого, на вашу думку, має: а) найменший радіус; б) найбільший радіус. Відповіді обґрунтуйте. а) найменший радіус → Гелій Не, розміщений у верхньому правому куті Періодичної таблиці, бо має найменшу кількість енергетичних рівнів (=1) і найбільший заряд ядра (кількість електронів) серед елементів свого періоду. б) найбільший радіус → Францій Fr, розміщений у нижньому лівому куті Періодичної таблиці, бо має найбільшу кількість енергетичних рівнів (=7) і найменший заряд ядра (кількість електронів) серед елементів свого періоду. § 8. Періодичний закон і електронна будова атомів Сторінка 48
1. Поступово чи періодично змінюється зі зростанням порядкового номера хімічного елемента:
shkola.in.ua
а) загальна кількість електронів в атомі;
б) кількість електронів
а) поступово; б) періодично.
на зовнішньому енергетичному рівні?
2. Випишіть у стовпчик символи хімічних елементів, що починаються з літери N. Після кожного символу вкажіть назву і тип відповідного елемента (s, p, d- чи fелемент).
Символ Назва Тип елемента
N Нітроген р-елемент
Na Натрій s-елемент
Nb Ніобій d-елемент
Nd Неодім f-елемент
Ne Неон р-елемент
Ni Нікол d-елемент
No
Нобелій f-елемент
Np Нептуній f-елемент Клітинки елементів у періодичній системі мають певний колір — рожевий (sелементи), жовтий (р-елементи), синій (d-елементи), зелений (f-елементи).
3. Елементи яких типів мають такі електронні формули атомів:
а) 1s22s22p63s2; s-елемент
б) 1s22s22p1; p-елемент
в) 1s22s22p63s23p4? p-елемент Назва орбіталі, що заповнюється останньою, визначає назву електрона (елемента). Клітинки елементів у періодичній системі мають певний колір рожевий (s-елемент), жовтий (р-елемент), синій (d-елемент), зелений (f-елемент).
4. Не складаючи електронних формул, укажіть кількість електронів на останньому енергетичному рівні атомів Cl, Pb, As, Kr Сl три енергетичних рівня, Рb шість, As чотири, Кr чотири (за номером періоду).
Номер групи, в якій міститься s- чи р- елемент, вказує на кількість електронів на зовнішньому енергетичному рівні.
5. Назвіть кілька хімічних елементів, максимальне значення валентності яких дорівнює 7. Максимальне значення валентності дорівнює 7-ми для таких елементів: Хлор (Сl), Бром (Вr), Йод (І), тому що вони розташовані в VII групі, головній підгрупі періодичної
системи.
shkola.in.ua
6. Укажіть, які значення валентності може мати елемент, якщо електронна формула його атома: а) 1s22s22p63s23p3 - Три
На останньому (3) енергетичному рівні є 2 s-електрони, які є спареними, та 3 релектрони, які є неспареними, а на можливе значення валентності елемента вказує кількість неспарених електронів в його атомі, тому може бути валентність три; б) [Ne]3s23p5 - Один
На останньому (3) енергетичному рівні є 2 s-електрони, які є спареними, та 5 релектронів, з яких 4 р-електрони є спареними і 1 р-електрон є неспареним, а на можливе значення валентності елемента вказує кількість неспарених електронів в
атомі, тому може бути валентність один.
§ 9. Характеристика хімічного елемента Сторінка 52
1. За планом, наведеним у параграфі, охарактеризуйте: а) Літій; б) Оксиген; в) Алюміній; г) Сульфур.
а) 1. Літій міститься у 2 періоді, у І групі, головній підгрупі. Символ елемента Li. Назва простої речовини літій.
2. Відносна атомна маса Ar(Li) = 6,941.
3. Порядковий номер (протонне число)
3. До складу атома входять 3 протони та 3 електрони. Кількість нейтронів становить: 7 - 3 = 4.
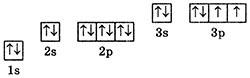
4. Електронна формула: 1s22s1 або [He]2s1. Графічний варіант:


5. Тип елемента: s-елемент. Металічний елемент (лужний метал).
6. Максимальне значення валентності дорівнює 1.
7. Проста речовина метал літій.
б) 1. Флуор міститься у 2 періоді, у VII групі, головній підгрупі. Символ елемента F. Назва простої речовини фтор.
2. Відносна атомна маса Ar(F) = 18,998.
3. Порядковий номер (протонне число) 9. До складу атома входять 9 протонів та 9 електронів. Кількість нейтронів становить: 19 - 9 = 10.
4. Електронна формула: 1s22s22p5 або [He]2s22p5. Графічний варіант:
5. Тип елемента: р-елемент. Неметалічний елемент (галоген).
6. Максимальне значення валентності дорівнює 7.
7. Проста речовина газоподібна речовина фтор.
в)
1. Алюміній міститься у 3 періоді, у III групі, головній підгрупі. Символ елемента Аl. Назва простої речовини алюміній.
2. Відносна атомна маса Аr(Аl) = 26,982.
3. Порядковий номер (протонне число) 13. До складу атома входять 13 протонів та
shkola.in.ua
13 електронів. Кількість нейтронів: 27 - 13 = 14.
4. Електронна формула: 1s22s22p63s23p1 або [Ne]3s23p1. Графічний варіант:
його
5. Тип елемента: р-елемент. Металічний елемент.
6. Максимальне значення валентності дорівнює 3.
7. Проста речовина метал алюміній.
г) 1. Сульфур міститься у 3 періоді, у VI групі, головній підгрупі. Символ
елемента S. Назва простої речовини сірка.
2. Відносна атомна маса Ar(S) = 32,06.
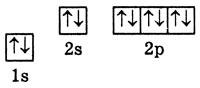
3. Порядковий номер (протонне число) 16. До складу атома входять 16 протонів та 16 електронів. Кількість нейтронів: 32 - 16 = 16.
4. Електронна формула: ls22s22p63s23p4 або [Ne]3s23p4. Графічний варіант:
5. Тип елемента: р-елемент. Неметалічний елемент.
6. Максимальне значення валентності дорівнює 6.
7. Проста речовина сірка (ромбічна та моноклінна).
2. У поданому переліку вкажіть хімічні елементи, для яких не можна визначити кількість нейтронів у ядрі атома за відносною атомною масою: Na, Cl, H, Al, Fe. Не можна визначити для тих, що представлені ізотопами, тобто для Cl, H, Fe. Перелік тих елементів, що не мають ізотопів дивись у п.3. плану вправи №1. 3. Назвіть кілька хімічних елементів, максимальні значення валентності яких не збігаються з номерами груп, де вони розміщені. Оксиген О (максимальна валентність II, група VI), Флуор (валентність I, група VII), Нітроген (максимальна валентність IV, група V).
4. Неметалічні елементи яких груп періодичної системи мають мінімальне значення валентності, що дорівнює
2? Назвіть ці елементи. Елементи VI групи Оксиген O, Сульфур S, Селен Se, Телур Te Мінімальне значення валентності неметалічних елементів обчислюється за правилом: 8 мінус номер групи, в якій перебуває елемент. Позначимо номер групи через х, тоді 8х = 2, звідси х = 6, отже, елементи VI групи.
5. У чому подібні водень і хлор проста речовина елемента VII групи? Чим відрізняється водень від натрію простої речовини елемента І групи? Подібність: прості речовини (гази) складаються з двохатомних молекул: Н2 i Cl2 Відрізняються: молекула водню двохатомна, а натрію ні. Водень неметал, газоподібна речовина, а натрій метал, тверда речовина.
§ 10. Періодичний закон, хімічний характер елементів і властивості простих речовин Сторінка 58
shkola.in.ua
1. У чому виявляється хімічний характер елементів? Хімічний характер елементів оцінюють за хімічними властивостями їхніх простих речовин. Розрізняють металічні та неметалічні елементи. 2. Укажіть хімічний характер елементів із зарядами ядер атомів +10, +12, +16, +20, +35. Оцініть здатність відповідних простих речовин до хімічних перетворень.
Металічні елементи із зарядами ядер атомів +12, +20 знаходяться в одній групі, тому хімічна активність їх простих речовин зростає із зростанням ядра атома елемента, тобто від магнію до кальцію.
Неметалічний елемент із зарядом ядра атома +10 належить до інертних елементів, утворені прості речовини інертні гази є хімічно пасивними (практично не реагують).
Неметалічні елементи із зарядами ядер атомів +16, +35 знаходяться відповідно в 3 і 4 періодах, тому хімічна активність цих неметалів зростає від брому до сульфуру. 3. Укажіть елемент 4-го періоду, який утворює: а) найбільш активний метал; б) найбільш активний неметал. Назвіть порядкові номери цих елементів і номери груп, у яких вони розміщені. Найактивнішим металом 4 періоду є Калій (К). Він розташований у І групі, головній підгрупі, №19. (хімічна активність металів в періоді посилюється справа наліво, тому найактивніші металічні елементи розташовуються на початку кожного періода.) Найактивнішим неметалом 4 періоду є Бром (Вг). Він розташований у VII групі, головній підгрупі, №35. (хімічна активність неметалів в періоді посилюється зліва направо, тому найактивніші неметалічні елементи розташовуються наприкінці кожного періода.)
4. У кожній парі визначте речовину із більшою хімічною активністю: а) літій натрій; б) калій кальцій; в) сірка селен; г) телур йод.
а) літій натрій; НАТРІЙ
б) калій кальцій; КАЛІЙ
в) сірка селен; СІРКА
г) телур йод. ЙОД
Літій, натрій, калій і кальцій — метали, а хімічна активність металів посилюється в періодах справа наліво, а в головних підгрупах —згори донизу, тому в хімічних реакціях натрій активніший від літію, а калій — від кальцію.
Сірка, селен, телур і йод — неметали, а хімічна активність неметалів посилюється в періодах зліва направо, а в головних підгрупах — знизу догори, тому в хімічних реакціях сірка активніша від селену, а йод — від телуру. 5. Прості речовини А і Б утворені елементами V групи періодичної системи. Одна із них є складником повітря, а інша має відносну молекулярну масу 124. Запишіть символи цих елементів і формули речовин А і Б. Проста речовина азот утворена хімічним елементом Нітрогеном N є складником повітря. Mr(P2O5)=124
Отже, символи елементів N і P, речовина P3N5
shkola.in.ua
§ 11. Періодичний закон і властивості складних речовин Сторінка 62
1. Чи містить періодична система інформацію про оксиди? Якщо так, то яку саме і який її варіант довгий чи короткий? Так, у нижній частині короткого варіанту періодичної системи можуть міститися загальні формули вищих оксидів елементів відповідних груп.
2. До якого типу оксидів, на вашу думку, належать оксид Рубідію, оксиди Йоду? Відповіді обґрунтуйте.
Металічний Рубідій утворює основний оксид, а неметалічний Йод кислотний.
3. Укажіть, у якої зі сполук у кожній парі основні /кислотні/ властивості мають
бути виражені більшою мірою:
а) Li2O чи Na2O; Na2O
Li (№3) i Na (№11) є металічними елементами одної групи, а основні властивості
вищих оксидів у головних підгрупах посилюються згори донизу.
б) SiO2 чи P2O5; P2O5
Si (№14) i P (№15) є неметалічними елементами одного періоду, а кислотні властивості вищих оксидів у періодах посилюються зліва направо.
в) KOH чи Ca(OH)2; KOH
К (№19) і Са (№20) є металічними елементами одного періоду, а основні властивості
гідратів оксидів у періодах посилюються справа наліво.
г) H2TeO4 чи H2SeO4 H2SeO4
Те (№52) і Se (№34) є неметалічними елементами одної групи, а кислотні властивості гідратів оксидів у головних підгрупах посилюються знизу вгору.
4. Напишіть формули вищих оксидів елементів 3-го періоду. Зіставте їх властивості, використавши наведені в параграфі відомості про сполуки, які походять від цих оксидів. Складіть таблицю вищих оксидів елементів 3-го періоду, подібну до таблиці 3.
Елемент Na Mg Al Si P S Cl Формула
оксиду Na2O MgO Al2O3 SiO2 P2O5 SO3 Cl2O7
Тип оксиду основний основний амфотерний кислотний кислотний кислотний кислотний
§ 12. Значення періодичного закону Сторінка 65
1. Чому періодичний закон сприяв відкриттю нових хімічних елементів? Через те, що при складанні періодичної системи (відповідно до властивостей уже відомих на той час 63-х хімічних елементів) у ній були залишені порожніми клітинки, які, як вважали, належать новим, ще не відкритим хімічним елементам. Це було підтверджено наступними відкриттями.
2. Знайдіть у періодичній системі елемент Менделевій, відкритий у 1955 р. Назвіть номери періоду і групи, де перебуває цей елемент. 7 період, III група.
3. Які можливі причини наявності подібних хімічних елементів в одному мінералі?
Подібна структура атомів, схожі властивості.
shkola.in.ua
4. Дізнайтеся з інтернету про те, які заклади вищої освіти, науково-дослідні інститути мають ім’я Менделєєва, які поштові марки і монети випущено на честь ученого, періодичного закону і періодичної системи. Зробіть повідомлення про результати свого пошуку на уроці хімії. Навчальні заклади, що названі на честь Д. І. Менделєєва: Російський хіміко-техноло-гічний університет ім. Д. І. Менделєєва (Москва, Росія); Новомосковський інститут РХТУ ім. Д. І. Менделєєва (Новомосковськ, Тульська область, Росія);
Тобольска державна соціально-педагогічна академія ім. Д. І. Менделєєва.
У 1984 році до 150-річчя з дня народження Д. І. Менделєєва у СРСР було випущено
ювілейний карбованець. Також були випущені поштові марки: у 1934, 1951, 1957, 1969
роках (СРСР), 2009 році (Росія). А також марки до 100-річчя відкриття періодичного закону у 1969 році (СРСР).
Розділ 2. Хімічний зв’язок і будова речовини
§ 13. Стійкість електронних оболонок. Йони Сторінка 73
1. Що спільного в електронній будові атомів інертних елементів?
Атоми інертних елементів мають на останньому рівні електронної оболонки по 8 електронів ( виняток Гелій 2 електрони). Така зовнішня оболонка є стійкою.
2. Яка частинка містить більше електронів:
а) атом;
Бо катіон - це заряджена частинка, яка утворюється з атома внаслідок втрати ним електрона. б) аніон.
Бо аніон - це заряджена частинка, яка утворюється з атома внаслідок приєднання ним електрона.
3. Укажіть, які з елементів Rb, Br, Sr, N здатні утворювати катіони, а які аніони. Визначте заряд йона кожного елемента і напишіть хімічні формули цих частинок.
Rb, Sr здатні утворювати катіони; Br, N аніони.
Катіон Rb+ Аніон Br- Катіон Sr2+ Аніон N3Елементи Rb i Sr металічні, атоми яких містять на зовнішньому енергетичному рівні 1 і 2 електрони відповідно. Атоми металічних елементів мають на зовнішньому енергетичному рівні від 1 до 3 електронів і здатні втрачати їх, перетворюючись на катіони. Запишемо схему перетворення цих атомів на катіони та електронні формули частинок:
Rb – e –→ Rb+;
атом Rb — 1s22s22p63s23p64s23d104p65s1, або [Kr]5s1
йон Rb+ — 1s22s22p63s23p64s23d104p6, або [Kr]
Sr – 2e– → Sr2+;
атом Sr — 1s22s22p63s23p64s23d104p65s2, або [Kr]5s2
йон Sr2+ — 1s22s22p63s23p64s23d104p6, або [Kr]
Елементи Br i N неметалічні, атоми яких містять на зовнішньому енергетичному рівні 7 і 5 електроныв відповідно. Атоми неметалічних елементів мають від 4 до 7
shkola.in.ua
електронів, здатні приєднувати додаткові електрони, перетворюючись на аніони. Запишемо схему перетворення цих атомів на аніони та електронні формули частинок:
Br + e– → Br-; атом Br — 1s22s22p63s23p64s23d104p5, або [Ar]4s23d104p5 йон Br- — 1s22s22p63s23p64s23d104p6, або [Kr] N
3e
N
атом N — 1s22s22p3
або [He]2s23p3 йон N3
1s22s22p6
+
–→
3;
,
—
, або [Ne]
4. Складіть електронні формули йонів Be2+, P3–, F– і K+ .
Йон
Електронні формули
Ве2+ 1s2, або [He]
P3– 1s22s22p63s23р6, або [Ar]
F– 1s22s22p6, або [Ne]
K+ 1s22s22p63s23p6, або [Ar]
5. Назвіть три катіони і два аніони, електронна будова яких така сама, що і йона F–.
Катіони: Na+, Mg2+, Al3+ Аніони: N3-, O2-
Йон F–має таку електронну будову 1s22s22s6, або [Ne], тому це можуть бути катіони атомів металічних елементів, що містяться в 3 періоді чи аніони атомів неметалічних елементів, що містяться в 2 періоді періодичної системи.
6. Який атом має таку саму електронну будову, що і йон Алюмінію? Атом Неону Складіть електронну формулу частинки та зобразіть її графічний варіант. Електронна формула йону Алюмінію 1s22s22p6, або [Ne]
7. Напишіть хімічні формули частинок, у яких електронна будова зовнішнього енергетичного рівня 3s23p6 .
Cl- S2- Р3- К+ Са2+ Таку електронну будову ...3s23р6 має атом Аргону, тому це можуть бути катіони атомів металічних елементів, що містяться в 4 періоді і аніони атомів неметалічних елементів, що містяться в 3 періоді періодичної системи.
8. В атомі якого елемента міститься на 2 електрони менше, ніж у йоні Магнію?
В атомі Оксигену (О).
Запишемо електронну будову йона Магнію 1s22s22p6 З електронної
формули
shkola.in.ua
бачимо, що йон Mg2+ містить 10 електронів (2+2+6=10), а атом невідомого елемента повинен містити 8 (10-2=8) електронів, а значить і протонів, тобто мати порядковий №8. Цим елементом є Оксиген.
9. Складіть електронну формулу частинки, яка має 16 протонів і 18 електронів. Назвіть цю частинку. 1s22s22p63s23p6, або [Ar] Аніон Сульфуру S2На число протонів вказує порядковий номер елемента, тому це атом Сульфуру (№16). Число електронів на 2 більше, ніж протонів, отже, атом прийняв два електрони і перетворився на аніон із зарядом -2. атом S — 1s22s22p63s23p4 , або [Ne]3s23p4 йон S2- — 1s22s22p63s23p6 , або [Ar] 10. Напишіть схеми утворення катіона й аніона Гідрогену із атома. атом H 1s1
Н -е - → Н+
катіон H+ 1s0
Атом Н +е- → Н- аніон аніон H- 1s2, або He
Яка частинка має найменший радіус катіон, аніон чи атом Гідрогену? Катіон Гідрогену Чому?
Розмір радіуса залежить від числа енергетичних рівнів і кількості електронів, а катіон Гідрогену це заряджена частинка, яка утворюється з атома внаслідок втрати ним електрона, тому радіус катіона Н+ найменший, а радіус аніона Н- майже не
відрізняється від радіуса атома Гідрогену.
11. Укажіть у поданому переліку частинку із найбільшим радіусом і найменшим радіусом: атом Ar, йони K+ , Са2+, Сl–. Відповідь обґрунтуйте.
Найбільший радіус у йона Cl, а найменший у йона Ca2+ Радіус катіона менший, а радіус аніона майже не відрізняється від радіуса
відповідного атома Ar.
§ 14. Йонний зв’язок.
Сторінка 79
Йонні сполуки
1. Який хімічний зв'язок називають йонним? Взаємодію між протилежно зарядженими йонами в речовині. 2. Укажіть хімічні формули, які належать йонним речовинам: СО2, О2, Аl2O3, NH3, Na2S, НСl, BaF2, Fe. Поясніть свій вибір. Взаємодію між протилежно зарядженими йонами в речовині називають йонним зв’язком. Сполуки, що складаються з йонів, називають йонними сполуками. До йонних сполук належить більшість оксидів металічних елементів, луги, сполуки лужних елементів із галогенами, Сульфуром тощо. Отже, у наведеному переліку йонними сполуками є Al2O3, Na2S, BaF2.
3. Напишіть формули йонів, із яких складаються:
а) Оксид ZnO складається з йонів Zn2+ і O2–; оксид Cr2O3 складається з йонів Cr3+ і O2
; в) основа LiOH складається з йонів Li+ і OH–; основа Ba(OH)2, складається з йонів Ba2+ і OH–.
4. Складіть формули сполук, утворених такими йонами:
а) Ag+ та О2; в) Al3+ та NO3; б) Sr2+ та ОН; г) Na+ та PО43.
а) Ag+ та О2→ Ag2О
б) Sr2+ та ОН→ Sr(ОН)2
в) Al3+ та NO3→ Al(NO3)3
г) Na+ та PО43→ Na3PО4
shkola.in.ua
5. Що таке кристалічні ґратки? Які частинки розміщені у вузлах кристалічних ґраток речовин CaS, Li3N, BaH2, KOH?
Модель внутрішньої будови кристалів.
CaS: катіони Кальцію Ca2+ i аніони Сульфуру S2Li3N: катіони Літію Li+ i аніони Нітрогену N3ВаН2: катіони Барію Ba2+ i аніони Гідрогену HКОН: катіони Калію K+ i аніони гідроксильної групи OH6. Яка сполука, на ваш погляд, має вищу температуру плавлення:
–
а) Li2O
Йони Li+ і О2- мають однакові заряди з йонами Na+ і О2-, але менші радіуси, тому міцність зв'язку між ними вища. Для того щоб розплавити літій оксид, необхідно
нагріти сполуку до більш високої температури, ніж натрій оксид. б) СаО
Йони Са2+ і О2- мають більші заряди і менші радіуси, ніж йони Са2+ і F-, тому міцність зв'язку між ними вища. Для того щоб розплавити кальцій оксид, необхідно нагріти
сполуку до більш високої температури, ніж кальцій фторид.
7. Обчисліть масові частки йонів у сполуках:
а) Mg3N2
Mr(Mg3N2)=3•Ar(Mg)+2•Ar(N)=3•24+2•14=100
ω(Mg2+)=3•Ar(Mg)/Mr(Mg3N2)=3•24:100=0,72, або 72%
ω(N3-)=2•Ar(N)/Mr(Mg3N2)=2•14:100=0,28, або 28%
або можна знайти ще так: ω(N3-)=1-ω(Mg2+)=1-0,72=0,28, або 28%
б) Mg(ОH)2
Mr(Mg(ОH)2)=Ar(Mg)+2•Ar(O)+2•Ar(H)= 24+2•16+2•1=58
ω(Mg2+)=Ar(Mg)/Mr(Mg(ОH)2)=24:58=0,414, або 41,4%
ω(OН-)=2•(Ar(O)+Ar(Н))/Mr(Mg(ОH)2)=2•(16+1):58=0,586, або 58,6%
або можна знайти ще так:
ω(OН-)=1-ω(Mg2+)=1-0,414=0,586, або 58,6%
§ 15. Ковалентний зв’язок
Сторінка 84
1. Який зв'язок називають ковалентним? Між якими частинками він реалізується?
Ковалентним зв’язком називають зв’язок між атомами, зумовлений утворенням
спільних електронних пар. Ковалентний зв’язок реалізується між двома атомами неметалічних елементів внаслідок утворення однієї, двох або трьох спільних електронних пар за рахунок неспарених електронів цих атомів.
2. Поясніть, чому не може брати участь в утворенні ковалентного зв’язку: Атом Магнію не може брати участь в утворенні ковалентного зв’язку, тому що це атом металічного елемента. Атом Неону не може брати участь в утворенні ковалентного зв’язку, тому що у нього немає неспарених електронів.
3. Серед наведених формул укажіть ті, які належать речовинам із ковалентним зв'язком: Br2, Н2О, NaBr, BaS, К2О, Ca3N2, NH3. Br2, Н2О, NH3 формули речовин із ковалентним зв’язком, тому що ковалентний зв’язок утворюється між атомами неметалічних елементів.
4. Запишіть спрощені та повні електронні формули, а також графічні формули молекул I2, SiH4 i SO3.
shkola.in.ua
Молекулярна формула Спрощена електронна формула
Повна електронна формула
Графічна формула
5. Розгляньте утворення ковалентного зв’язку внаслідок сполучення двох атомів Флуору в молекулу F2. Назвіть орбіталі, які зазнають перекривання. Опишіть особливості цього зв’язку. В атомі Флуору на зовнішньому енергетичному рівні 7 електронів, середяких один є неспареним. Обом атомам Флуору вигідно отримати по додатковому електрону, щоб завершити свій останні йенергетичний рівень. У результаті зближення атомів відбувається перекривання 2р-орбіталей атомів Флуору; із відповідних неспарених електронів формується спільна електронна пара. 6. Охарактеризуйте хімічний зв’язок у молекулі води. Складіть схеми утворення цієї молекули з атомів Гідрогену і Оксигену, використавши спрощені та повні електронні формули частинок. Зобразіть графічну формулу молекули води. В атомах Гідрогену містяться по одному s-електрону, а в атома Оксигену на зовнішньому енергетичному рівні ― шість електронів, з них, неспарені два релектрони, тому всім атомам вигідно отримати додаткові електрони, щоб завершити свої енергетичні рівні. У результаті зближення атомів перекриваються 1s-орбіталь кожного атома Гідрогену із 2р-орбіталлю атома Оксигену і утворюються спільні електронні пари із відповідних неспарених електронів.
Н.+.О.+.Н → H:O:H Н.+.О.+.Н → H:O:H

О H
│ H
shkola.in.ua
§ 16. Полярний і неполярний ковалентний зв’язок. Електронегативність елементів Сторінка 89
1. Чому на атомах, сполучених ковалентним зв’язком, можуть виникати невеликі заряди?
I2 I:I :I:I: .. .. I I SiH4 H H:Si:H H H H:Si:H H H │ H—Si—H │ H SO3 O=S=O ││ O
.. ..
Бо атоми елементів відрізняються електронегативністю. У молекулі на атомі більш електронегативного елемента з’являється надлишковий негативний заряд, а на атомі менш електронегативного елемента позитивний.
Який ковалентний зв’язок називають полярним, а який неполярним?
Ковалентний зв'язок, у якому одна чи кілька спільних електронних пар зміщені в бік одного з атомів, називають полярним зв'язком, а за відсутності такого зміщення неполярним зв'язком.
2. Серед наведених формул укажіть ті, що відповідають речовинам із йонним, ковалентним неполярним і ковалентним полярним зв’язком: HF, CO2, MgO, Li3N, Br2, BCl3. Поясніть ваш вибір. Йонний зв’язок утворюється між
Ковалентний зв’язок, у якому одна чи кілька спільних електронних пар зміщені в бік одного з атомів, називають ковалентним полярним зв’язком.
Речовинами з ковалентним полярним зв’язком є HF, CO2, NCl3
3. Що таке електронегативність хімічного елемента?
Властивість атома елемента зміщувати у свій бік електронну пару, спільну з іншим атомом, називають електронегативністю.
4. Як змінюється електронегативність елементів у періодах і головних підгрупах періодичної системи? У періодах електронегативність елементів зростає зліва направо, а в головних підгрупах знизу догори.
5. За даними таблиці 6 складіть ряд неметалічних елементів, у якому їхня електронегативність зменшується.
F O Cl, N S, C P, H В Si (4,0) (3,5) (3,0) (2,5) (2,1) (2,0) (1.8)

6. Використавши дані, наведені в таблиці 6, підкресліть у кожній із формул речовин символ найбільш електронегативного елемента... AlCl3, CF4, SO2, NaH, N2O3, LiOH, HCIO4.
7. Позначте заряди на атомах, використавши літеру δ, у таких молекулах: OF2, СH4, SiCl4. У якій молекулі зв’язок між атома ми найбільш полярний, а в якій найменш полярний?
shkola.in.ua
8. Укажіть правильне закінчення речення «Значення електронегативності Калію та Кальцію становлять відповідно …»: а) 0,8 і 1,0
9. Елементи в хімічних формулах сполук часто записують у порядку зростання їхньої електронегативності. Укажіть серед наведених формул такі, у яких дотримано цієї послідовності...
Послідовність запису елементів у порядку зростання їх електронегативності дотримано у формулах Na2CO3, SiO2, H2S, HNO3.
протилежно зарядженими
йонами. Це MgO, Li3N.
§ 17. Речовини молекулярної та атомної будови
Сторінка 95
1. Що називають міжмолекулярною взаємодією?
Явище притягання молекул одна до одної, хоча кожна є незарядженою частинкою. Чим вона зумовлена?
Силами міжмолекулярної взаємодії, так звані сили Ван-дер-Ваальса.
2. Сполука Х за звичайних умов перебуває у твердому стані, має запах, а за слабкого нагрівання плавиться. Молекулярною чи йонною є ця сполука? Який тип хімічного зв’язку в ній реалізований? Речовина X є молекулярною сполукою, тому що вона летка й легкоплавка. У ній реалізований ковалентний зв’язок.
3. У поданому переліку вкажіть речовини молекулярної будови: парафін, етиловий спирт, калій гідроксид, кальцій оксид, азот, олово, силіцій(IV) оксид. Поясніть свій вибір. Речовини молекулярної будови леткі, мають невисокі температури плавлення, можуть мати запах. Молекулярні речовини у будь-якому стані не проводять електричний струм.
У поданому переліку речовин парафін, етиловий спирт, азот є речовинами молекулярної будови.
4. Чи можна передбачити будову речовини (йонну, молекулярну, атомну) за її зовнішнім виглядом, агрегатним станом? Відповідь обґрунтуйте. Будова речовини та її властивості пов'язані, тому якщо відома будова можна спрогнозувати властивості, і навпаки, якщо відомі властивості, можна зробити висновок про будову. Наприклад, речовини атомної будови за звичайних умов перебувають у твердому агрегатному стані, а молекулярної будови у рідкому і газоподібному станах.
5. Установіть відповідність. Натрій гідрид NaH є речовиною йонної будови і має вищу за HCl температуру плавлення. Гідроген хлорид HCl є речовиною молекулярної будови. Для речовин
молекулярної будови характерні низькі температури плавлення. Отже, температура плавлення NaH +638 °С, а температура плавлення HCl дорівнює –114 °С. Відповідь: 1 а, 2 б.
6. Спробуйте пояснити, чому прості речовини галогени за звичайних умов перебувають у різних агрегатних станах: фтор F2 і хлор Cl2 гази, бром Br2 рідина, йод I2 тверда речовина. Бо мають однакову будову речовин за різної температури. Йод існує у вигляді молекулярних кристалів, у вузлах ґратки двохатомні молекули. Фтор, хлор і бром утворюють подібну будову за більш низьких температур.
shkola.in.ua
7. Хлороводень HCl і фтор F2 мають молекули приблизно однакової маси (підтвердьте це), але істотно різняться за температурами кипіння: –85 °С (HCl) та –188 °С (F2). У чому, на вашу думку, причина такої відмінності? Для підтвердження однакової маси молекул достатньо порівняти відносну
молекулярну масу.
Mr(HCl) = Ar(H) + Ar(Cl) = 35,5 + 1 = 36,1.
Mr(F2) = 2 • Ar(F) = 2 • 19 = 38. Чим міцніший хімічний зв'язок, що утримує частинки у вузлах кристалічних ґраток, тим міцніші кристали, тим твердіша речовина, тим вища температура її плавлення.
Обидві речовини мають молекулярну будову (у вузлах молекулярної ґратки розташовані молекули), але при ковалентному неполярному зв'язку у вузлах ґратки неполярні молекули (F2), що утримуються силами міжмолекулярної взаємодії, а при полярному зв'язку у вузлах ґратки полярні молекули (HCl), строго орієнтовані одна до одної своїми полюсами. Очевидно, що різним за міцністю є хімічний зв'язок:
ковалентний неполярний і ковалентний полярний. 8. Карборунд SiC сполука атомної будови. Спрогнозуйте фізичні властивості
речовини та перевірте ваше передбачення, відшукавши відповідну інформацію
інтернеті.
Будова (тип кристалічної ґратки залежить від характеру частинок, що утворюють кристал, і від типу хімічного зв'язку між ними) речовини визначає її властивості.
вузлах атомної ґратки розміщуються атоми, сполучені ковалентними зв'язками, які є міцними, тому сполука є твердою, має дуже високі температури плавлення і кипіння, нерозчинна у воді.
Розділ 3. Кількість речовини. Розрахунки за хімічними формулами § 18. Кількість речовини Сторінка 103
1. Із чим пов’язують кількість речовини в хімії? З кількістю найменших частинок речовини (атомів, молекул, груп атомів або йонів) в певній її порції. Назвіть одиницю вимірювання кількості речовини. Моль 2. Визначте кількості речовини атомів кожного елемента (усно):
а) в 1 моль брому Br2;
б) у 3 моль сірководню H2S;
в) в 1/3 моль фосфіну PH3.
Дано:
n(Br2) = 1 моль
n(H2S) = 3 моль
n(PH3) = 1/3 моль
n(Br) ?
n(H) ? n(S) ?
n(H) ? n(P) ?
Розв'язання:
1) В 1 моль будь-якої молекулярної
більше, ніж 1 моль атомів. Отже, в 1 моль Br2 міститься 2 моль атомів Брому.
2) В 1 моль H2S міститься 2 моль атомів Гідрогену і 1 моль атомів Сульфуру.
Отже, у 3 моль H2S міститиметься 3 · 2 = 6 моль атомів Гідрогену
і 3 · 1 = 3 моль атомів Сульфуру.
3) В 1 моль PH3 міститься 1 моль атомів
P і 3 моль атомів H.
Отже, в 1/3 моль PH3 міститься 1/3 моль атомів Р і 1 моль атомів Н.
3. Замість крапок вставте пропущені цифри: а) у 3 моль води H2O міститься 3 моль молекул, 6 моль атомів Гідрогену і З моль атомів Оксигену; б) у 0,5 моль сульфатної кислоти H2SO4 міститься 1 моль атомів Гідрогену, 0,5 моль Сульфуру, 2 моль Оксигену; в) у 2 моль йонної сполуки Ca(OH)2 міститься 2 моль йонів Са2+ і 4 моль йонів ОН
6 моль формульних одиниць.
4. Виконайте розрахунки і заповніть таблицю
або
в
У
речовини завжди міститься
–
shkola.in.ua
5. Визначте кількість речовини вуглекислого газу, в якій містяться (усно): а) 3,01 · 1023 молекул; б) 12,04 · 1023 атомів Оксигену.
6. Чи може 1 моль речовини містити більш ніж 6,02 · 1023 атомів? Відповідь поясніть і наведіть приклади.

6,02 · 1023 атомів відповідає 1 моль атомів. Але речовина може містити більше, ніж 1 моль атомів. Прикладом може бути задача № 133. Відповідь: може.
7. У якій кількості речовини кальцій хлориду CaСl2 міститься 3,01 · 1024 йонів Са2+? Скільки йонів Сl– у такій порції сполуки? (Усно.)

shkola.in.ua
8. Визначте кількість речовини метану СН4, у якій міститься стільки атомів, скільки їх перебуває:

а) в 1 моль оксиду P2O3; б) в 0,3 моль кислоти HNO3; в) у 2,5 моль оксиду СО.
9. У якій кількості речовини кухонної солі NaCl міститься стільки йонів, скільки їх перебуває:
а) в 0,2 моль оксиду СаО; б) у 2 моль оксиду Li2O; в) в 0,4 моль сполуки Na2S?
10. Назвіть співвідношення кількостей речовини елементів у речовинах із формулами СаО, MgF2, HClO4, Fe(OH)3.
За хімічною формулою сполуки можна визначити співвідношення в ній кількостей речовини елементів:
а) у формулі СаО n(Са) : n(О) = 1 : 1;
б) у формулі MgF2 n(Mg) : n(F) = 1 : 2;


shkola.in.ua
в) у формулі НСlO4 n(Н) : n(Сl) : n(О) = 1 : 1 : 4;
г) у формулі Fe(OH), n(Fe) : n(O) : n(Н) = 1 : 3 : 3.
11. Прокоментуйте хімічні реакції, використавши поняття «моль»:
а) S + 2Cl2 = SCl4;
б) N2 + 3H2 = 2NH3;
в) 2H2O2 = 2H2O + O2↑.
У рівняннях хімічних реакцій кількості речовин реагентів і продуктів відповідають (або пропорційні) коефіцієнтам перед формулами речовин. Отже:
а) S + 2Cl2 = SCl4
1 моль 2 моль 1 моль при взаємодії 1 моль сірки із 2 моль хлору утворюється
2 моль сульфур(IV) хлориду;
б) N2 + 3H2 = 2NH3
1 моль 3 моль 2 моль при взаємодії 1 моль азоту з 3 моль водню утворюється 2 моль амоніаку;
В) 2CO + O2 = 2СO2
2 моль 1 моль 2 моль при взаємодії 2 моль карбон(ІІ) оксиду з 1 моль кисню утворюється 2 моль карбон(ІУ) оксиду.
§ 19. Молярна маса Сторінка 108
1. Установіть відповідність...
У завданні дані значення трьох фізичних величин: відносної молекулярної маси CO2 (Mr(CO2)), маси CO2 (m(CO2)) і молярної маси (M(CO2)).
За своїм числовим значенням вони однакові, розрізняються за розмірністю: Mr не має розмірності, m вимірюється у грамах, M у г/моль. Отже, Mr(CO2) = 44, m(CO2) = 44 г, M(CO2) = 44 г/моль. Відповідь: 1 в, 2 а, 3 б.
2. Обчисліть молярні маси речовин із такими формулами...
Для того, щоб записати молярну масу будь-якої речовини, достатньо вказати значення відповідної відносної атомної, молекулярної або формульної маси і додати розмірність г/моль. Наприклад:
а) Mr(F2) = 2Ar(F) = 2 · 19 = 38; M(F2) = 38 г/моль;
б) Mr(H2O) = 2Ar(H) + Ar(O) = 2 · 1 + 16 = 18; M(H2O) = 18 г/моль;
в) Mr(SO2) = Ar(S) + 2Ar(O) = 32 + 2 · 16 = 64; M(SO2) = 64 г/моль;

г) Mr(Li2O) = 2Ar(Li) + Ar(O) = 2 · 7 + 16 = 30; M(Li2O) = 30 г/моль;
д) Mr(Mg3N2) = 3Ar(Mg) + 2Ar(N) = 3 · 24 + 2 · 14 = 100; M(Mg3N2) = 100 г/моль;
е) Mr(H2SO4) = 2Ar(H) + Ar(S) + 4Ar(O) = 2 · 1 + 32 + 4 · 16 = 98; M(H2SO4) = 98 г/моль;
є) Mr(CaCO3) = Ar(Ca) + Ar(C) + 3Ar(O) = 40 + 12 + 3 · 16 = 100; M(CaCO3) = 100 г/моль.
3. Назвіть молярні маси атомів і йонів, що мають такі формули: Cu, Ar, Br, Mg2+, S2–.
Міркуючи за аналогією до № 123, обчислимо молярні маси наведених атомів і йонів: M(Cu) = 64 г/моль; M(Ar) = 40 г/моль; M(Br) = 80 г/моль; M(Mg2+) = 24 г/моль; M(S2–) = 32 г/моль.
4. Маса сполуки, взятої кількістю речовини 0,2 моль, становить 12,8 г. Визначте молярну масу сполуки. (Усно.)
Відповідь: 64 г/моль.
shkola.in.ua
5. Обчисліть масу 0,25 моль магній фосфіду Mg3P2.


6. Маса якої сполуки більша вуглекислого газу СО2, взятого кількістю речовини 2 моль, чи сірчистого газу SO2 кількістю речовини 1,5 моль? (Усно.)
7. Яка кількість речовини міститься у 24 г магнію, 80 г брому, 200 г крейди? (Усно.)

shkola.in.ua
8. Де міститься найбільша кількість речовини, а де найменша: у 10 г кальцію, 16 г кисню чи 8 г натрій гідриду NaH? (Усно.)
9. Скільки молекул і атомів у 3,4 г амоніаку NH3? (Усно.)
n(NH3) = m(NH3) = 3,4 г = 0,2 моль.



M(NH3) 17 г/моль
2) Обчислимо число молекул NH3 у 0,2 моль його за формулою:
N(NH3) = NA · n(NH3), де NA (стала Авогадро) = 6,02 · 1023 моль –1;
N(NH3) = 6,02 · 1023 моль –1 · 0,2 моль = 1,204 · 1023.
3) Формула NH3 показує, що в 1 моль молекули NH3 міститься 1 моль атомів N і
3 моль атомів H, всього 1 + 3 = 4 моль атомів.
Отже, N(атомів) = 4 · N(NH3) = 4 · 1,204 · 1023 = 4,816 · 1023.
10. Де міститься більше молекул, атомів (усно):
shkola.in.ua
а) в 1 г вуглекислого газу СО2 чи в 1 г сірчистого газу SO2; б) у 2 моль води чи в 1 моль сульфатної кислоти H2SO4?
11. В 1 л мінеральної води «Боржомі» міститься 80 мг йонів Са2+, 55 мг йонів Mg2+. Кількість яких йонів у цій воді більша? (Усно.)
12. Обчисліть масу однієї молекули води в грамах, використавши молярну масу води і сталу Авогадро.


shkola.in.ua

§ 20. Молярний об’єм. Закон Авогадро
Сторінка 114
1. Що таке молярний об’єм речовини? Це об'єм 1 моль речовини.
Як можна його розрахувати? VM= M/ρ, де ρ ― густина, М ― молярна маса



2. Густина азоту становить 1,25 г/л. Обчисліть молярний об’єм газу.

3. Визначте молярну масу газу, якщо він має густину 1,43 г/л.
4. Обчисліть об’єми (усно):
а) водню, взятого кількістю речовини 10 моль; б) сірководню H2S масою 3,4 г; в) чадного газу СО масою 0,28 г.
shkola.in.ua
5. Людина за добу видихає разом із повітрям 500 л вуглекислого газу. Визначте масу цього об’єму газу.
6. Обчисліть молярну масу газу, якщо 60 г його займають об’єм 44,8 л. (Усно.)


7. Де міститься найбільше молекул в 1 л води, 1 л кисню чи 1 л водню? Відповідь поясніть.

shkola.in.ua
shkola.in.ua
8. Визначте співвідношення об’ємів однакових мас газів водню і метану СН4. § 21. Відносна густина газу Сторінка 120
1. Зіставте фізичні величини «відносна густина» і «густина». Густина ― це характеристика речовини, що показує яку масу має 1 м3 цієї речовини. Вимірюється в кг/м3 (г/см3). Відносна густина ― це відношення густини даної речовини до густини іншої речовини. Величина безрозмірна, бо отримується діленням величин однакової розмірності.


2. Чому для відносної густини газу не вказують умови тиск і температуру? Бо гази для порівняння беруться за одних і тих самих умов.
3. Визначте густину повітря за нормальних умов.
4. Обчисліть відносну густину за воднем газів із такими формулами: He, Ne, СН4, NН3, N2, CO, SiH4, SO2. (Усно.)
5. Назвіть два три гази, які важчі за повітря, і доведіть це. Важчими за повітря будуть гази, які мають відносну молекулярну масу більшу за 29 (відносну молекулярну масу повітря). Це можуть бути O2 (Mr = 32), СO2 (Mr = 44), Н2S (Mr = 34) тощо.
6. Газоподібна проста речовина має відносну густину за воднем 24. Визначте формулу речовини. (Усно.)


shkola.in.ua

7. Відносна густина газу А за повітрям становить 1,59. Обчисліть відносну молекулярну масу цього газу.
8. Існує газ, який легший за повітря в 1,7 раза. Важчий чи легший він за метан CH4 й у скільки разів?
9. Маса 2 л газу Х становить 3,75 г, а маса такого самого об’єму газу Y 2,32 г. Визначте густину газу Х, а також його відносну густину за газом Y.



shkola.in.ua
10. Один літр газу за нормальних умов має масу 1,96 г. Яка відносна густина цього газу за азотом?
Розділ 4. Основні класи неорганічних сполук § 22. Оксиди Сторінка 126
1. Які сполуки називають оксидами? Укажіть серед наведених хімічних формул ті, які відповідають оксидам: PbO, Cl2O7, Na2O, LiOH, SeO3, HClO. Оксиди це сполуки елементів з Оксигеном, у яких ступінь окиснення Оксигену становить –
2. Загальна формула оксидів EmOn Серед наведених формул оксидам відповідають PbO, Cl2O7, Na2O, K2O2, SeO3 2. Складіть хімічні формули оксидів Арсену (елемент буває три і п’ятивалентним) і Телуру (значення валентності елемента 4 і 6). Складемо хімічні формули оксидів:
1) Арсену (ступінь окиснення +3) As2O3;
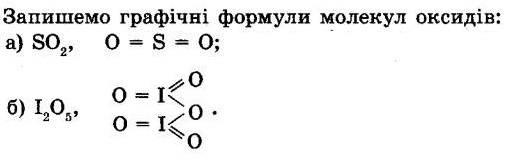

2) Арсену (ступінь окиснення +5) As2O5;
3) Телуру (ступінь окиснення +4) TeO2;
4) Телуру (ступінь окиснення +6) TeO3.
3. Запишіть хімічні формули оксидів, які містять катіони Калію, Барію, Алюмінію.
Катіон Калію має формулу K+, катіон Барію має формулу Ba2+ катіон Алюмінію має формулу Al3+.
Формули оксидів, які містять ці катіони, записуються так K2O, ВаО, Al2O3.
4. Зобразіть графічні формули молекул оксидів SО2 та I2O5.
shkola.in.ua
5. Запишіть формули сполук, що мають такі назви:
6. Дайте хімічні назви оксидам SrO, Mn2O3, N2O. Щоб дати назву оксиду, треба назвати елемент, який стоїть у формулі оксиду на першому місці, й додати слово «оксид». Якщо елемент, який утворює оксид, має змінну валентність, то значення валентності зазначається у дужках римською цифрою після назви елемента. Дамо назви оксидам: SrO стронцій оксид, Mn2O3 манган(ІІІ) оксид, Mn2O7 манган(VІІ) оксид, NO нітроген(ІІ) оксид, N2O5 нітроген(V) оксид.
7. Обчисліть масові частки елементів у сульфур(ІV) оксиді та сульфур(VI) оксиді.

8. Визначте масу: а) титан(IV) оксиду кількістю речовини 2 моль (усно); б) порції нітроген(ІІ) оксиду, в якій налічується 1023 молекул.

shkola.in.ua
9. Учні класу за 45 хвилин уроку видихають разом із повітрям 1,1 кг вуглекислого газу. Обчисліть об’єм, який займає цей газ за нормальних умов.
§ 23. Основи Сторінка 130


shkola.in.ua
1. Які сполуки називають основами? Запишіть загальну формулу основ, у складі яких є двозарядні катіони. Що таке луги? Основа сполука, яка складається з катіонів металічного елемента Men+ і гідроксиданіонів OH–. Загальна формула основ, до складу яких входять двозарядні катіони Me(OH)2. Луги розчинні у воді основи, утворені лужними і лужноземельними елементами. 2. Які сполуки називають основами? Запишіть загальну формулу основ, у складі яких є двозарядні катіони. Що таке луги? Основа сполука, яка складається з катіонів металічного елемента Men+ і гідроксиданіонів OH–. Загальна формула основ, до складу яких входять двозарядні катіони Me(OH)2. Луги розчинні у воді основи, утворені лужними і лужноземельними елементами.
3. Напишіть формули основ, що відповідають оксидам із такими формулами: K2O, VO, La2O3.
У формулах оксидів і у формулах основ, які їм відповідають, заряди катіонів металічних
елементів повинні
бути однаковими. Отже, оксиду K2O відповідає основа KOH; оксиду VO відповідає основа V(OH)2; оксиду La2O3 відповідає
основа La(OH)3.
4. Яка кількість речовини кожного йона міститься в 1 моль основ NaOH, Fe(OH)2?


1 моль NaOH містить 1 моль йонів Na+ і 1 моль гідроксид-аніонів OH–.
1 моль Fe(OH)2 містить 1 моль катіонів Fe2+ і 2 моль гідроксид-аніонів OH–.
5. Обчисліть масу 0,2 моль літій гідроксиду. (Усно.)
6. Скільки катіонів і аніонів міститься (усно): а) в 0,1 моль калій гідроксиду; б) в 1/2 моль магній гідроксиду? Назвіть масу кожного йона в цих порціях основ.
shkola.in.ua
7. У порції якої сполуки барій гідроксиду кількістю речовини 3 моль чи калій гідроксиду кількістю речовини 4 моль міститься більше йонів? Відповідь поясніть.
§ 24. Кислоти Сторінка 137

1. Наведіть означення кислоти. Що таке кислотний залишок? Кислота сполука, молекула якої містить один або кілька атомів Гідрогену, які можуть під час реакції заміщуватися на атоми (йони) металічного елемента. Частину молекули кислоти, сполучену з атомом (атомами) Гідрогену, називають кислотним залишком.
2. У формулах кислот H2Te, HNO2, H3AsO4 підкресліть кислотні залишки і вкажіть їхню валентність.
3. За якими ознаками класифікують кислоти? Розрізняють-безоксигенові кислоти (загальна формула HmE) та окси-геновмісні (Hm(EOn). За кількістю атомів Гідрогену в молекулі кислоти поділяють на однооснувні, двохоснувні, трьохосновні.
4. Запишіть формули кислот у відповідні стовпчики таблиці.
5. Складіть графічні формули молекул кислот HІ, HClO, H2TeO3.

shkola.in.ua
7. Установіть відповідність...
1 в, 2 а, 3 б.

8. Яка кількість речовини кожного хімічного елемента міститься (усно):
а) в 0,1 моль нітратної кислоти;
б) в 0,5 моль сульфатної кислоти?


а) 1 моль нітратної кислоти HNO3 містить 1 моль атомів Н, 1 моль атомів N і 3 моль атомів О. Відповідно 0,5 моль нітратної кислоти HNO3 міститимуть 0,5 моль атомів Н, 0,5 моль атомів N і 1,5 моль атомів О.
б) 1 моль сульфатної кислоти H2SO4 містить 2 моль атомів Н, 1 моль атомів S і 4 моль атомів О. Відповідно 0,5 моль сульфатної кислоти H2SO4 міститимуть 1 моль атомів Н, 0,5 моль атомів S і 2 моль атомів О.
9. Взято 6,2 г борної кислоти Н3ВО3. Визначте кількість речовини кислоти. (Усно.)
10.
масові частки хімічних елементів у фторидній кислоті. (Усно.)
shkola.in.ua
11. Існують дві оксигеновмісні кислоти з однаковими значеннями молярних мас 98 г/моль. Назвіть ці кислоти і напишіть їхні хімічні формули. Молярну масу 98 г/моль має сульфатна кислота H2SO4 й ортофосфатна кислота H3PO4. § 25. Солі Сторінка 142
1. Які сполуки називають солями? Чим солі схожі за складом з основами і чим відрізняються від них? Солі сполуки, до складу яких входять катіони металічних елементів та аніони кислотних залишків. Як і основи, солі у своєму складі містять катіони металічних елементів. На відміну від основ, катіони металічних елементів у
Обчисліть
складі солей пов’язані з аніонами кислотних залишків, а не з гідроксид-аніонами OH– як у складі основ.
2. Складіть формули солей, утворених такими йонами...
LiNO3, Li2CO3, Mg(NO3)2, MgCO3.
3. Запишіть у відповідні клітинки поданої
нижче таблиці формули йонів, які містяться в солях Al(NO3)3, BaBr2, K3PO4, Na2S.

4. Дайте назви солям, що мають такі формули...
Хімічна назва солі складається із двох слів. Перше слово є назвою металічного елемента, а друге походить від хімічної назви відповідної кислоти. Якщо металічний елемент утворює катіони з різними зарядами, то значення заряду катіона солі вказують після назви елемента римською цифрою в дужках. Запишемо назви наведених солей:
NaBr натрій бромід;
Al2S3 алюміній сульфід;
Li2SO4 літій сульфат;
CaSO3 кальцій сульфіт.
5. Складіть формули цезій йодиду, алюміній фториду, хром(ІІІ) сульфату, літій ортофосфату.
Для того, щоб скласти формулу солі, потрібно знати заряди катіона ц аніона, а також зважати на те, що сполука є електронейтральною. Для з’ясування значень зарядів йонів можна застосовувати таблицю розчинності неорганічних сполук (форзац II підручника).
Запишемо формули солей за їх назвами: цезій йодид CsI, алюміній фторид AlF3, хром(ІІІ) сульфат Cr2(SO4)3, літій ортофосфат Li3PO4. 6. Однакова чи різна кількість речовини аніонів міститься в 20 г СаСО3 і в 20 г СаBr2? (Усно.)
shkola.in.ua
7. У порції натрій сульфату міститься 0,5 моль SO42– йонів. Визначте кількість речовини і масу йонів Натрію в цій порції сполуки. (Усно.)
shkola.in.ua
8. Де міститься найбільша сумарна кількість йонів в 1 моль алюміній сульфату, 2 моль ферум(III) нітрату, 3 моль барій хлориду чи 4 моль літій фториду?
9. Для дослідів узяли однакові маси ферум(IIІ) ортофосфату, натрій хлориду та кальцій карбонату. Зіставте сумарні кількості йонів у цих порціях солей та виберіть правильну відповідь: а) найбільше йонів у порції ферум(III) ортофосфату; б) найбільше йонів у порції натрій хлориду; в) найбільше йонів у порції кальцій карбонату; г) у взятих порціях солей однакова кількість йонів.


§ 26. Будова, властивості та використання оксидів Сторінка 149
1. Яка зі сполук Cl2O чи Li2O за звичайних умов є газом і має запах? Поясніть свій вибір. Речовини молекулярної будови є леткими і можуть мати запах. Такою речовиною є хлор(І) оксид Cl2O. Літій оксид Li2O йонна сполука, а тому тверда й без запаху.
2. Серед наведених оксидів укажіть йонні речовини. Йонні речовини містять у своєму складі катіони металів. У наведеному переліку до них належать K2O і BaO.
3. Розмістіть формули оксидів Li2O, CuO, Cl2O7, MgO, SiO2, FeO і SO2 у відповідні клітинки таблиці:

shkola.in.ua
4. Назвіть усі основні оксиди, які реагують із водою. Запишіть два загальних рівняння таких реакцій, позначивши оксиди формулами М2О і МО. З водою реагують такі основні оксиди: літій оксид Li2O, натрій оксид Na2O, калій оксид К2О, рубідій оксид Rb2O, цезій оксид Cs2O, францій оксид Fr2O, кальцій оксид СаО, стронцій оксид SrO, барій оксид ВаО, радій оксид RaO. Рівняння реакцій у загальному вигляді.
Me2O + H2O → 2MeOH
MeO + H2O → Me(OH)2
5. Допишіть схеми реакцій і перетворіть їх на хімічні рівняння. Основні оксиди при взаємодії з водою утворюють основи, при взаємодії з кислотними оксидами утворюють солі, при взаємодії з кислотами утворюють солі та воду. Запишемо схеми реакцій та складемо хімічні рівняння: а) SrO + H2O → Sr(OH)2; MgO + Cl2O7 → Mg(ClO4)2; CaO + 2HNO3 → Ca(NO3)2 + H2O.
Кислотні оксиди при взаємодії з водою утворюють кислоти, при взаємодії з основними оксидами утворюють солі, при взаємодії з основами утворюють солі та воду.
Запишемо схеми реакцій та складемо хімічні рівняння:
б) SeO3 + H2O ⇒ H2SeO4; SiO2 + BaO ⇒ BaSiO3;
I2O5 + 2NaOH ⇒ 2NaIO3 + H2O.
6. Визначте, з якими речовинами правого стовпчика може реагувати кожна речовина лівого стовпчика, і наведіть відповідні хімічні рівняння. Основні оксиди (ВаО) реагують з кислотами, кислотними оксидами. Кислотні оксиди (Р2О5, СО2) реагують з лугами, основними оксидами. Напишемо відповідні рівняння реакцій:
а) BaO + 2HNO3 → Ba(NO3)2 + H2O; BaO + 2HBr → BaBr2 + H2O;
б) P2O5 + 6KOH → 2K3PO4 + 3H2O; P2O5 + 3CaO → Ca3(PO4)2;
в) CO2 + 2KOH → K2CO3 + H2O; CO2 + CaO → CaCO3.
7. Складіть рівняння реакцій, під час яких утворюється літій-ортофосфат, якщо реагентами є: а) два оксиди; б) оксид і кислота; в) оксид і основа.
а) 3Li2O + P2O5 → 2Li3PO4;
б) 2H3PO4 + 3Li2O → 2Li3PO4 + 3H2O; в) P2O5 + 6LiOH → 2Li3PO4 + 3H2O.
8. Напишіть рівняння реакцій, за допомогою яких можна здійснити такі послідовні перетворення:
shkola.in.ua
9. За матеріалами з інтернету підготуйте повідомлення про застосування вуглекислого газу. Діоксид вуглецю, вуглекислий газ, CO2 тривка хімічна сполука, поширена в природних газах, що містять його в кількості від декількох відсотків до практично чистого вуглекислого газу. Безбарвний, має кислуватий смак і запах. Є кінцевим продуктом окиснення вуглецю, не горить, не підтримує горіння і дихання. Токсична дія вуглекислого газу виявляється при його вмісті в повітрі 3-4 % і полягає в подразненні дихальних шляхів, запамороченні, головному болі, шумі у вухах, психічному збудженні, непритомному стані.
У народному господарстві діоксид вуглецю широко застосовується в хімічній промисловості при виробництві соди, сечовини тощо, а також у виробництві цукру, вина, пива, для виготовлення газової води і т. д. Широко відомі природні джерелу діоксиду вуглецю у вигляді мінеральних вод «Нарзан», «Боржом» та інші. Спресований твердий CO2 під назвою «сухий лід» застосовують для охолодження
м'яса, риби і інших харчових продуктів, що швидко псуються. Сухий лід значно більше, ніж звичайний, знижує температуру і при випаровуванні не залишає ніякої рідини.
§ 27. Розрахунки за хімічними рівняннями Сторінка 155
1. У наведених записах визначте відповідні значення х (усно)
2. Обчисліть кількість речовини фосфор(V) оксиду, яка утвориться після взаємодії 0,1 моль фосфору з достатньою кількістю кисню.

shkola.in.ua
3. Реакція відбувається за рівнянням А + 3Б = 2В + 3Г. Які кількості речовини В і Г утворяться, якщо прореагує: а) 0,1 моль А; б) 6 моль Б? (Усно.)


shkola.in.ua

4. Яка маса магній оксиду утворилася під час спалювання 12 г магнію? (Усно.)
shkola.in.ua
5. Визначте об’єм сірчистого газу SО2 (н. у.), який добуто після спалювання 16 г сірки. (Усно.)

6. Обчисліть масу кальцій нітрату, що утворився в результаті взаємодії 50 г 10%го розчину нітратної кислоти з кальцій оксидом.

shkola.in.ua
7. Визначте об’єм вуглекислого газу (н. у.), необхідний для повного перетворення 37 г кальцій гідроксиду на кальцій карбонат. 8. Після додавання надлишку води до суміші оксидів Фосфору(V) і Силіцію(ІV) утворилося 98 г ортофосфорної кислоти і залишилось 20 г твердої речовини. Обчисліть масу фосфор(V) оксиду та його масову частку в суміші оксидів.


9. Літій оксид масою 20 г додали у воду масою 180 г. Обчисліть масову частку лугу в утвореному розчині, якщо оксид повністю прореагував з водою.
shkola.in.ua
n(Li2O) = 20 г / 30 г/моль = 0,66 моль; M(Li2O) = 30 г/моль; n(H2O) = 180 г. / 18 г/моль = 10 моль; M(H2O) = 18 г/моль.

Визначимо брак і надлишок речовин:

Li2O не вистачає, ведемо всі розрахунки по ньому. H2O у надлишку Складемо пропорцію для визначення кількості речовини гідроксиду літія: n(Li2O) = 2n(LiOH), n(LiOH) = 1,32 моль.
Знайдемо масу гідроксида літія за формулою:
m(реч.) = n(реч.) * M(реч.)
m(LiOH) = 1,32 моль * 24 г/моль = 31,68 г. M(LiOH) = 24 г/моль
Обчислимо масову долю гідроксида літія у отриманому
ω(р.р) = m(р.р) / m(р-на), де m(р-на) = m(р.р) + m(р-ка).
m(р-на) = m(Li2O) + m(H2O) = 20 + 180 = 200 г.

розчині за формулою:
За законом збереження мас, маса продуктів дорівнює масі реагентів, тому отриманий розчин чисельно дорівнює початковому розчину, оскільки змін не відбулося (виділення газу, випад осаду).
ω(LiOH) = (31,68 г. / 200 г.) * 100% = 15,84 %
Відповідь: 15,84 %.
10. У результаті реакції 1,52 г суміші сірчистого і вуглекислого газів із барій оксидом утворилося 6,11 г суміші солей. Визначте маси газів у суміші.
shkola.in.ua
§ 28. Властивості та використання основ
Сторінка 163
1. Охарактеризуйте фізичні властивості основ. Основи тверді речовини йонної будови. Більшість основ не розчиняється у воді. Водорозчинні основи називають
лугами.
2. Опишіть, як індикатори змінюють забарвлення в розчині за наявності в ньому лугу. Індикатори речовини, що змінюють свій колір у залежності від середовища, в якому знаходяться. Найчастіше використовують чотири індикатори: універсальний індикатор, лакмус, метилоранж, фенолфталеїн. У лужному середовищі універсальний індикатор набуває синього кольору, лакмус також змінює свій колір на синій, метилоранж стає жовтим, а фенолфталеїн малиновим.
3. Наведіть приклади реакцій обміну, нейтралізації, розкладу за участю основ. Наведемо приклади різних типів реакцій за участю основ: а) реакція обміну це реакція між двома складними речовинами, які під час перебігу реакції обмінюються своїми складовими частинами. Наприклад, 2NaOH + CuCl2 → Cu(OH)2 + 2NaCl; б) реакція нейтралізації це реакція між основою та кислотою, у результаті якої утворюються сіль і вода.
Наприклад, KOH + HNO3 = KNO3 + H2O; в) реакція розкладу це реакція, у результаті перебігу якої з однієї складної речовини утворюється кілька нових речовин. Наприклад, 2Fe(OH)3 = Fe2O3 + 3H2O.
4. Допишіть схеми реакцій і складіть хімічні рівняння
а) 2KOH + N2O5 = 2KNO3 + H2O; 2NaOH + H2S = Na2S + 2H2O;
б) Ba(OH)2 + H2SO4 = BaSO4 + 2H2O; 2LiOH + NiCl2 = 2LiCl + Ni(OH)2;
в) Mg(OH)2 + SO3 = MgSO4 + H2O; 3Ca(OH)2 + 2H3PO4 = Ca3(PO4)2 + 6H2O; г) Ni(OH)2 + 2HNO3 = Ni(NO3)2 + 2H2O; 2Bi(OH)3 = Bi2O3 + 3H2O.
5. Складіть рівняння реакцій (якщо вони можливі) між основами (лівий стовпчик) і солями (правий стовпчик) Реакції між солями і основами можливі, якщо: а) основа є водорозчинною, тобто лугом; б) у результаті реакції утворюється нова розчинна у воді сіль та нерозчинна основа. Дані про розчинність солей і основ у воді беруть з «Таблиці розчинності кислот, основ і солей».
Серед наведених у лівому стовпчику основ одна є водонерозчинною це манган(ІІ) гідроксид Mn(OH)2, він не буде реагувати з солями.
Серед наведених у правому стовпчику солей одна є теж практично нерозчинною у воді це кальцій карбонат CaCO3; ця сіль не буде реагувати з лугами.
shkola.in.ua
Не будуть реагувати й калій гідроксид і натрій сульфат, тому що реакція між ними не перебігає практично до кінця, у результаті реакції не утворюється осад. Отже, напишемо можливі рівняння реакцій: 2KOH + Fe(NO3)2 = Fe(OH)2↓ + 2KNO3; Ba(OH)2 + Fe(NO3)2 = Fe(OH)2↓ + Ba(NO3)2; Ba(OH)2 + Na2SO4 = BaSO4↓ + 2NaOH.
6. Напишіть рівняння реакцій, за допомогою яких можна здійснити такі послідовні перетворення: а) Li2O → LiOH → Li2SO4; б) Ca(OH)2 → CaO → CaBr2.
7. Відшукайте в інтернеті інформацію про реактив, який називають вапняною водою, і його використання.
Кальцій гідроксид Са(ОН)2 (гашене вапно) сіруватий малорозчинний у воді порошок. При змішуванні надлишку гашеного вапна з водою утворюється суспензія
так зване «вапняне молоко». Після фільтрування вапняного молока отримують прозорий розчин кальцій гідроксиду, який називають вапняною водою. Вапняну воду використовують у лабораторній практиці для виявлення вуглекислого газу.
8. Визначте кількість речовини магній гідроксиду, яка прореагує із 12,6 г нітратної кислоти.
9. Обчисліть масу ферум(ІІ) гідроксиду, що утворюється внаслідок взаємодії 0,05 моль натрій гідроксиду з достатньою кількістю ферум(ІІ) сульфату.

shkola.in.ua


10. Визначте об’єм сірчистого газу (н. у.), необхідний для повного осадження йонів Барію (у складі нерозчинної солі) із розчину, який містить 34,2 г барій гідроксиду.


11. Обчисліть масу осаду, що утвориться в результаті взаємодії 70 г 4 %го розчину калій гідроксиду з достатньою кількістю розчину манган(ІІ) хлориду.

shkola.in.ua
12. На нейтралізацію 25,1 г суміші гідроксидів Натрію та Барію витратилося 25,2 г нітратної кислоти. Визначте масову частку натрій гідроксиду в початковій суміші речовин.
shkola.in.ua



§ 29. Властивості та використання кислот Сторінка 172
1. Назвіть характерні фізичні властивості кислот. Чим вони зумовлені? Усі кислоти мають молекулярну будову. Майже всі кислоти за звичайних умов є рідинами, мають низькі температури плавлення. Вони розчиняються у воді (крім кислоти H2SiO3). Ортофосфатна кислота Н3РО4, ортоборатна Н3ВО3, метасилікатна H2SiO3 тверді речовини. Хлоридна кислота НСl, сульфідна H2S, нітратна HNO3
леткі кислоти, мають запах. 2. Чи можна розрізнити за допомогою лакмусу, фенолфталеїну, універсального індикатора розчини кислоти і лугу? Якщо так, то як саме? Розчини кислоти і лугу можна розрізнити за допомогою індикаторів.
Розчини Індикатори універсальний індикаторний папірець
лакмус метил-оранж фенолфталеїн
розчин кислоти червоний червоний рожевий Безбарвний
розчин лугу синій синій жовтий Малиновий
3. Допишіть схеми реакцій і складіть хімічні рівняння.
а) Mg + 2HBr → MgBr2 + H2↑; BaO + 2HNO3 → Ba(NO3)2 + H2O;
2NaOH + H2S → Na2S + 2H2O або NaOH + H2S → NaHS + H2O
б) Li2O + H2SO4 → Li2SO4 + H2O;

Fe(OH)2 + 2HNO3 → Fe(NO3)2 + 2H2O;
shkola.in.ua
3K2SiO3 + 2H3PO4 → 2K3PO4 + 3H2SiO3↓.
4. Замість крапок напишіть формули кислотреагентів, продуктів реакцій і перетворіть схеми на хімічні рівняння.
а) Fe + 2HCl → FeCl2 + H2↑;
3Li2O + 2H3PO4 → 2Li3PO4 + 3H2O;
KOH + HNO3 → KNO3 + H2O;
б) 2Al + 3H2SO4 → Al2(SO4)3 + 3H2↑;
Cr(OH)2 + H2SO4 → CrSO4 + 2H2O; AgNO3 + HI → AgI + HNO3.
5. Напишіть рівняння реакцій (якщо вони відбуваються) між розбавленою
сульфатною кислотою і такими речовинами:
6. Для кожного перетворення складіть по два хімічних рівняння:
а) HCl → CaCl2
6) H2S → K2S
в) H3РO4 → Ba3(РO4)2
1) 2HCl + CaO → CaCl2 + H2O;

2) 2HCl + Ca(OH)2 → CaCl2 + 2H2O;
1) H2S + K2O → K2S + H2O;
2) H2S + 2KOH → K2S + 2H2O;
1) 2H3РO4 + 3Ba(OH)2 → Ba3(PO4)2 + 6H2O;
2) 2H3РO4 + 3BaCO3 → Ba3(PO4)2 + 3CO2↑ + 3H2O.
7. Щоб здійснити реакцію між натрій хлоридом і сульфатною кислотою, до твердої солі додають концентровану кислоту і нагрівають суміш. Поясніть, чому не використовують розчини сполук і для чого необхідне нагрівання. У такий спосіб добувають гідроген хлорид HCl, водний розчин якого є хлоридною кислотою. Рівняння реакції: NaClтв. + H2SO4 → NaHSO4 + HC↑.
8. За матеріалами з інтернету підготуйте повідомлення про використання фторидної (плавикової) кислоти.
Високочистий і технічний матеріал різних концентрацій знаходить застосування в багатьох галузях. Основні з них такі:
• - скляне виробництво (прозоре травлення кремнієвого скла, видалення шорсткості з поверхні кришталю);
shkola.in.ua
• - нафтохімія і гірничодобувний напрямок (обробка і очищення поверхонь, збільшення ефективності видобутку нафти шляхом вилучення асфальтових і парафінових відкладень, руйнування порід, що містять кремній);
• - хімія (виділення деяких металів, зокрема Та, Zr і Nb, каталіз низки хімічних процесів, зокрема при алкілуванні в реакції ізобутану та олефіну, а також виготовлення фторлону, холодильних агентів, фторовмісних кислот, боратів і фторидів, органічних сполук на основі F, штучних мастил і пластмас);
• - аналітична хімія (розчинення силікатних сполук);
• - алюмінієва промисловість (виготовлення алюмінію електролітичним методом і робота з ним);
• - металообробка (входить до складу композицій, призначених для травлення і
полірування, електрохімічної обробки сплавів і нержавіючої сталі, використовується при очищенні заготовок з металу від піску і керамічних домішок);
• - напівпровідникова галузь (очищення і травлення кремнію для
напівпровідників);
• - стоматологія та зуботехнічна справа (вилучення з внутрішнього боку протезів з кераміки лейциту, плюс виступає протравою і елементом металевого каркасу під керамічні коронки, що забезпечує надійну фіксацію); • - створення фільтрувальних систем.
Як бачимо, незважаючи на свою небезпеку, плавикова кислота у зв’язку з цінними фізичними і хімічними властивостями дуже важлива для різних галузей.

Використовуйте її з урахуванням всіх вимог безпеки зведете до мінімуму негативні наслідки, отримавши при цьому бажані результати роботи.
9. Визначте масу розчину сульфатної кислоти з її масовою часткою 5 %, необхідну для нейтралізації 8 г натрій гідроксиду. 10. Визначте масу розчину сульфатної кислоти з її масовою часткою 5 %, необхідну для нейтралізації 8 г натрій гідроксиду.
shkola.in.ua
§ 30. Амфотерні оксиди та гідроксиди
Сторінка 178

1. Які сполуки називають амфотерними? Назвіть дватри елементи, що утворюють такі сполуки. Деякі оксиди та гідроксиди металічних елементів виявляють як основні, так і кислотні властивості. їх називають амфотерними сполуками. Амфотерними є, наприклад, алюміній оксид Al2O3, берилій оксид ВеО, цинк оксид ZnO. Амфотерними гідроксидами є, відповідно, алюміній гідроксид Аl(ОН)3, берилій гідроксид Ве(ОН)2, цинк гідроксид Zn(ОН)2.
2. Укажіть формули продуктів перетворень за участю сполук Цинку й Aлюмінію та перетворіть схеми реакцій на хімічні рівняння.
shkola.in.ua
3. Допишіть схеми реакцій і складіть хімічні рівняння.
4. Напишіть рівняння реакцій берилій оксиду з барій гідроксидом під час нагрівання та розчином цієї основи.
5. Як би ви розпізнали білі порошки гідроксидів Магнію та Цинку, використавши відмінності в хімічних властивостях цих сполук?
6. Амфотерний гідроксид має молярну масу 103 г/моль. Назвіть цю сполуку.



shkola.in.ua
7. Визначте масу ферум (ІІІ) оксиду, яка містить стільки йонів, скільки молекул перебуває в 11 г карбон(IV) оксиду.

shkola.in.ua
8. Під час термічного розкладу 39 г алюміній гідроксиду утворилося 20 г алюміній оксиду. Чи повністю розклалася сполука?

9. Обчисліть масу плюмбум(ІІ) оксиду, яка прореагує із 200 г розчину натрій гідроксиду з масовою часткою лугу 10 %.
Дано:
mNaOH = 200 г
w(NaOH) = 10% = 0,1

Розв’язання
PbO + 2NaOH => Na2PbO2 + H2O
m(р-ни) = m(р-на) × w, mNaOH = 200 × 0,1 = 20 г, n = m/M
m(PbO) ? M(NaOH) = 1 × 23 + 1 × 16 + 1 × 1 = 40 г/моль

n(NaOH) = 20/40 = 0,5 моль
Складемо пропорцію, щоб знайти n(PbO). x кількість речовини (PbO):
x/1 = 0,5/2 > 0,5 = 2x > x = 0,25; n(PbO) = 0,25 моль
m = n×M; M(PbO) =1 × 207 + 1 × 16 = 223 г/моль
m(PbO) = 0,25 × 223 = 111,5 г
Відповідь: 111,5 г.
§ 31. Властивості та використання солей Сторінка 186
1. Охарактеризуйте фізичні властивості солей. Наведіть приклади розчинних, малорозчинних і нерозчинних у воді солей. Солі за звичайних умов є кристалічними речовинами. Вони здебільшого мають високі температури плавлення. Частина солей розчиняється у воді (NaCl, Ca(NO3)2, K2SO4 тощо), деякі є малорозчинними (MgF2, Ag2SO4, PbBr2), решта нерозчинні (AgCl, Ca3(PO4)2, BaSO4 тощо). Серед розчинних солей NaCl має солоний смак, MgSO4 гіркий. Солі Плюмбуму і Берилію солодкі, проте дуже отруйні.
2. Допишіть схеми реакцій і складіть хімічні рівняння.
3. Замість крапок напишіть формули солей і перетворіть схеми реакцій на хімічні рівняння:
shkola.in.ua
4. Складіть рівняння реакцій (якщо вони відбуваються) між такими сполуками: а) калій силікатом і нітратною кислотою; б) натрій сульфатом і магній нітратом;
в) купрум(ІІ) хлоридом і барій сульфатом; г) хром(ІІІ) сульфатом і натрій гідроксидом; д) калій сульфідом і меркурій(ІІ) нітратом.
5. Напишіть рівняння реакцій, за допомогою яких можна здійснити такі послідовні перетворення:
6. Напишіть рівняння реакцій, за допомогою яких можна здійснити такі послідовні перетворення:
shkola.in.ua



7. Чи вистачить 13 г цинкового порошку для повного перетворення 33,1 г плюмбум(ІІ) нітрату на свинець?
shkola.in.ua

8. Після занурення залізної пластинки у розчин купрум(ІІ) сульфату її маса збільшилася на 0,8 г. Яка маса міді виділилася на пластинці?
§ 32. Узагальнення знань про неорганічні речовини Сторінка 197

1. Запишіть формули оксидів Ag2O, PbO, BaO, ZnO, AI2O3, I2O5 і SO3 у відповідні стовпчики таблиці:
2. Установіть відповідність...
Манган (II) оксид MnO належить до основних оксидів; манган (IV) оксид MnO2 та манган (VII) оксид Mn2O7 до кислотних оксидів.
3. Із яких частинок складаються оксиди Кальцію, Алюмінію, Карбону? Оксиди Кальцію та Алюмінію переважно складаються з йонів металічних елементів Ca2+, Al3+ та йонів Оксигену O2–. Молекули оксидів Карбону складаються з атомів Карбону і Оксигену.
4. Наведіть по одному прикладу кислот, молекули яких містять два, три, чотири, п’ять, шість, сім і вісім атомів. Укажіть основність кожної кислоти.

Наведемо приклади кислот молекули яких містять:
а) два атоми HCl хлоридна кислота;
б) три атоми H2S сульфідна кислота;

в) чотири атоми HNO2 нітритна кислота; г) п’ять атомів HNO3 нітратна кислота; д) шість атомів H2CO3 карбонатна кислота; е) сім атомів H2SO4 сульфатна кислота; є) вісім атомів H3PO4 ортофосфатна кислота.
5. Запишіть хімічні формули двох амфотерних гідроксидів, які мають найменшу молярну масу.
До амфотерних гідроксидів належать Be(OH)2, Zn(OH)2, AI(OH)3, Fe(OH)3 тощо.
6. Виберіть у наведеному переліку формули солей і поясніть свій вибір...
До солей належать сполуки, які складаються з катіонів металічного елемента та аніонів кислотного залишку. У наведеному переліку це плюмбум(ІІ) йодид PbI2, магній флуорид MgF2, та натрій сульфід Na2S.
shkola.in.ua
7. Співвідношення мас Силіцію, Оксигену та Гідрогену в сполуці, утвореній цими елементами, становить 7 : 16 : 1. Виведіть хімічну формулу сполуки. До якого класу неорганічних сполук вона належить і чому? 8. Обчисліть об’єм газу хлороводню, який потрібно розчинити за нормальних умов в 1 л води, щоб виготовити хлоридну кислоту із масовою часткою HCl 20 %.
§ 33. Генетичні зв’язки між неорганічними речовинами
Сторінка 202
1. Чи можна схему 15 розширити, додавши несолетворний оксид? Відповідь обґрунтуйте.
Ні, не можна. Несолетвірні оксиди не мають відповідних гідроксидів (кислот або основ), не здатні до взаємоперетворень. Несолетвірні оксиди утворюють неметалічні елементи у нижчому ступені окиснення, наприклад, NO, N2О, CO, SiO.
2. Напишіть рівняння реакцій, у яких реагентами є лише літій, кисень, вода, а також продукти взаємодії між ними. Складіть схеми відповідних послідовних перетворень.
3. Запишіть кілька схем послідовних перетворень речовин, у яких першою речовиною є певний метал або неметал, другою сіль, а третьою основа чи кислота.
а) Запишемо схему послідовних перетворень речовин: метал → сіль → основа. Наприклад, Cu → CuCl2 → Cu(OH)2.
Складемо рівняння відповідних реакцій: Cu + Cl2 → CuCl2; CuCl2 + 2NaOH → Cu(OH)2 + 2NaCl.


shkola.in.ua
б) Запишемо схему послідовних перетворень речовин: неметал → сіль → кислота.
Наприклад, S → MgS → H2S.
Складемо рівняння відповідних реакцій: S + Mg → MgS; MgS + 2HCl → MgCl2 + H2S.
4. Чому нижня стрілка на схемі 15 спрямована лише в один бік?
Амфотерні гідроксиди не можна отримати з амфотерних оксидів за допомогою однієї реакції. На відміну від основних і кислотних оксидів, вони не взаємодіють з водою. Чи можна, маючи амфотерний оксид, добути відповідний амфотерний гідроксид?
У разі позитивної відповіді розкажіть, як би ви здійснили такий експеримент. Можна. Спершу треба подіяти кислотою і до утвореного розчину солі додати лугу. ZnO + HCl = ZnCl2 + H2O; ZnCl2 + 2NaOH = Zn(OH)2↓ + 2NaCl
5. Запишіть хімічні формули речовин у такі схеми перетворень:


6. Напишіть рівняння реакцій, які відповідають такій схемі перетворень:
7. Складіть рівняння реакцій, за допомогою яких можна здійснити такі послідовні перетворення речовин:
shkola.in.ua

8. Доберіть дві солі, які взаємодіють одна з одною в розчині з утворенням двох нерозчинних солей. Запишіть відповідне хімічне рівняння.
Прикладами двох солей, які взаємодіють одна з одною в розчині з утворенням двох нерозчинних солей можуть бути цинк сульфат ZnSO4 і барій сульфід BaS. Рівняння реакції: ZnSO4 + BaS → ZnS↓ + BaSO4.
9. Натрій масою 1,15 г повністю прореагував із водою, а продукт реакції із сульфатною кислотою. Обчисліть кількість речовини кислоти, витраченої на нейтралізацію цього продукту.
shkola.in.ua


10. Визначте масу алюміній оксиду, що утвориться під час нагрівання алюміній гідроксиду, добутого за реакцією 21,3 г алюміній нітрату із необхідною кількістю розчину лугу.
shkola.in.ua

§ 34. Неорганічні сполуки, довкілля і людина

Сторінка 212
1. Вам відомо, що вуглекислий газ взаємодіє з водою з утворенням карбонатної
кислоти. Чому цей газ не зараховують до оксидів, які зумовлюють появу кислотних опадів?
Бо масова частка вуглекислого газу у повітрі становить менше 0,1% та й карбонатна кислота є нестійкою і вже за звичайних умов розкладається на вуглекислий газ і воду:
H2CO3 = H2O + CO2↑
2. Як ви вважаєте, чи спричиняють кислотні дощі руйнування мармуру
(природний кальцій карбонат) і гіпсу (основа матеріалу кальцій сульфат)? Відповідь аргументуйте. Кислоти, що випадають у вигляді кислотних дощів, реагують із солями кальцій карбонату і кальцій сульфату, перетворюючи їх на інші солі:
CaCO3 + 2HNO3 = Ca(NO3)2 + H2O + CO2↑
CaCO3 + H2SO4 = CaSO4↓ + H2O + CO2↑
CaSO4 + H2SO4 = Ca(HSO4)2
3. Назвіть кілька сполук, які здатні взаємодіяти із сірчистим газом і можуть використовуватися для очищення газових викидів від цього оксиду. Кальцій карбонат (вапняк CaCO3) i кальцій оксид (вапно CaO):
CaCO3 + SO2 = CaCO3↓ + СO2↑
CaO + SO2 = CaCO3↓
4. Визначте масу крейди, яку потрібно взяти для нейтралізації 1 т промислових стічних вод, якщо масова частка в них сульфатної кислоти становить 0,49 %.
shkola.in.ua
5. У якому співвідношенні об’ємів необхідно змішувати кислий та лужний
промислові стоки для їх повної взаємної нейтралізації, якщо масова частка
хлороводню в одній рідині становить 0,73 %, а масова частка натрій гідроксиду
іншій 0,16 %? Припустіть, що густини обох рідин такі самі, що й води.

shkola.in.ua
в