
6 minute read
BIOWISSENSCHAFTEN
from ChemieXtra 12/2020
by SIGWERB GmbH
Nur im Gehirn wirksam
Ultraschall aktiviert Medikament
Advertisement
Forschende der ETH Zürich haben eine Methode entwickelt, mit der Medikamente im Hirn punktgenau freigesetzt werden können. Damit könnte es in Zukunft möglich werden, Psychopharmaka, Chemotherapeutika und andere Medikamente nur in jene Hirnregionen zu bringen, wo das aus medizinischen Gründen gewünscht ist. Die Methode soll künftig psychiatrische, neurologische und onkologische Behandlungen mit weniger Nebenwirkungen ermöglichen.
Fabio Bergamin ¹
Heute ist das praktisch nicht möglich – Medikamente gelangen über das Blut in das ganze Gehirn und den ganzen Körper, was in einigen Fällen die Ursache für Nebenwirkungen ist. Die neue Methode ist nicht-invasiv – die präzise Medikamentenfreisetzung im Gehirn wird von ausserhalb des Kopfs mit Ultraschall gesteuert. Dies berichten die Wissenschaftler unter der Leitung von Mehmet Fatih Yanik, Professor für Neurotechnologie, in der Fachzeitschrift «Nature Communications». Um zu verhindern, dass ein Wirkstoff seine Aktivität im ganzen Körper und im ganzen
¹ ETH Zürich
Wenn Medikamente nur in von Krankheit betroffene Hirnarealen verabreicht werden, lassen sich unerwünschte Nebenwirkungen verhindern.
Gehirn entfalten kann, werden bei der neuen Methode spezielle Träger eingesetzt, die den Wirkstoff in kugelförmige Lipidbläschen einpacken, die an gashaltigen, ultraschallempfindlichen Mikrobläschen befestigt sind. Diese werden ins Blut injiziert und gelangen so ins Gehirn.
Fokussierter Ultraschall
In einem zweistufigen Prozess nutzen die Wissenschaftler anschliessend fokussierten Ultraschall. Fokussierter Ultraschall kommt bereits heute in der Krebsmedizin zum Einsatz, um Krebsgewebe an genau definierten Punkten im Gewebe zu zerstören. Bei der neuen Anwendung arbeiten die Wissenschaftler allerdings mit weit geringerer Energie, welche das Gewebe nicht schädigt.
Medikamente mit Ultraschall anreichern In einem ersten Schritt reichern die Wissenschaftler mit Ultraschallwellen niedriger Energie am gewünschten Ort im Gehirn die Wirkstoffträger an. «Man kann sich das so vorstellen, dass wir mit Ultraschallpulsen am gewünschten Ort eine Art virtuellen Schallwellen-Käfigs erstellen. Von der Blutzirkulation angetrieben werden die Wirkstoffträger durch das ganze Gehirn gespült. Jene, die in den Käfig gelangen, fin-
Psychiatrische Behandlungen sind komplex Nicht für jedes Krankheitsbild gibt es ein geeignetes Medikament. Beispielsweise sind gegenwärtig Depressionen mit Antidepressiva oft nicht ausreichend behandelbar. Persönlichkeitsstörungen lassen sich medikamentös gar nicht erst behandeln.

den dort aber nicht mehr hinaus», erklärt ETH-Professor Yanik. In einem zweiten Schritt bringen die Forschenden an diesem Ort die Wirkstoffträger mit höherer Ultraschall-Energie zum Vibrieren. Reibungskräfte zerstören die Aussenmembran der Behälter, der Wirkstoff wird freigesetzt und an dieser Stelle vom Nervengewebe aufgenommen.
Wirkstoffe gut verpackt
Die Forschenden haben die Wirksamkeit der neuen Methode in Versuchen bei Ratten gezeigt. Sie kapselten dazu einen Neurohemmstoff in den Wirkstoffträgern ein. Damit ist es ihnen gelungen, ein spezifisches neuronales Netzwerk zu blockieren, das zwei Hirnareale miteinander verbindet. Die Wissenschaftler konnten in den Versuchen zeigen, dass nur spezifisch dieser eine Teil des Netzwerks blockiert wurde und das Medikament nicht im ganzen Gehirn wirkte. «Weil wir mit unserer Methode Medikamente dort im Körper anreichern können, wo ihre Wirkung erwünscht ist, reicht eine sehr viel geringere Dosis aus», sagt Yanik. Für ihr Experiment in Ratten benötigten sie beispielsweise 1300-mal weniger Wirkstoff als es herkömmlicherweise nötig wäre.
Gewebe bleibt intakt
Schon früher haben andere Wissenschaftler versucht, mit fokussiertem Ultraschall die Zufuhr von Medikamenten in bestimmte Hirnregionen zu verbessern. In jenen Ansätzen wurden die Wirkstoffe jedoch nicht lokal angereichert, sondern man schädigte die Blutgefässe lokal, um damit den Wirkstofftransport vom Blut ins Nervengewebe zu erhöhen. Dieser Ansatz kann langfristig jedoch schädliche Folgen haben. «In unserem Ansatz bleibt die physiologische Barriere von Blutkreislauf und Nervengewebe hingegen intakt», sagt Yanik. Die Wissenschaftler sind zurzeit daran, die Wirksamkeit ihrer Methode in Tiermodellen psychischer Erkrankungen und neurologischer Störungen zu testen, zum Beispiel um Angststörungen zu behandeln, sowie zur Behandlung von Hirntumoren an chirurgisch unzugänglichen Stellen. Erst wenn sich die Wirksamkeit und Vorteile der Methode bei Tieren bestätigt, können die Forschenden den Einsatz der Methode bei Menschen vorantreiben. Dieses Forschungsprojekt wurde vom EUFörderprogramm «Horizon 2020» finanziert.
Originalpublikation M.S. Ozdas et al., «Non-invasive molecularly-specific millimeterresolution manipulation of brain circuits by ultrasound-mediated aggregation and uncaging of drug carriers», Nature Communications (2020); DOI: 10.1038/s41467-020-18059-7
Kontakt ETH Zürich Rämistrasse 101 CH-8092 Zürich +41 44 632 42 44 desk@hk.ethz.ch www.ethz.ch/news


www.ramseyer.ch


Evolution in Echtzeit
Wie sich Erreger an ihre Wirte anpassen
Bakterien, die in tierische Zellen eindringen, um sich dort zu vermehren, sind in der Natur weit verbreitet. Wir kennen sie als Krankheitserreger von Menschen und Tieren. In der Umwelt findet man sie häufig innerhalb von Einzellern. Ein Forschungsteam um Matthias Horn am Zentrum für Mikrobiologie und Umweltsystemwissenschaften der Universität Wien konnte nun im Labor nachvollziehen, wie sich diese Bakterien im Laufe der Zeit an ihre Wirtszelle anpassen und immer infektiöser werden.
Im Labor des Zentrums für Mikrobiologie und Umweltsystemwissenschaften der Universität Wien wurden über 14 Monate hinweg so genannte Parachlamydien bei ihrer Evolution beobachtet, eine Gattung der Umweltchlamydien, wie sie in Wasser oder Erde vorkommen. Im Gegensatz zu ihren humanpathogenen Verwandten sind sie für den Menschen nicht infektiös. Sie leben in Einzellern und sind auf Nährstoffe ihrer Wirte angewiesen. Daher haben sie im Laufe der Zeit Mechanismen perfektioniert, um in Wirtszellen einzudringen und sich dort vermehren zu können.
Theoretische Vorhersagen im Labor bestätigt
Die Parachlamydien dienen den Forschenden als Modellsystem, um die Anpassungen wirtsabhängiger Bakterien zu untersuchen. Das dafür durchgeführte Evolutionsexperiment umfasste 500 Bakteriengenerationen, was einer Zeitspanne von etwa 15 000 Jahren beim Menschen entspricht. Um theoretische Vorhersagen zur Entwicklung von Infektiosität zu überprüfen, wurden die Bakterien unter zwei verschiedenen experimentellen Bedingungen im Labor gehalten. In einem Teil des Experiments waren die Bakterien auf eine häufige Infektion neuer Wirtszellen angewiesen, um zu überleben. Im anderen konnten sie sich auch dauerhaft innerhalb ein und derselben Wirtszelle vermehren. Die Ergebnisse zeigen: Können die Bakterien innerhalb einer Wirtszelle bleiben und dafür sorgen, dass sie bei der Zellteilung des Wirts auch in den Tochterzellen der Wirte weiterleben, verändert sich ihre Infektiosität nicht. Bakterien werden jedoch zunehmend infektiöser, wenn sie von
Bild: Patrick Arthofer
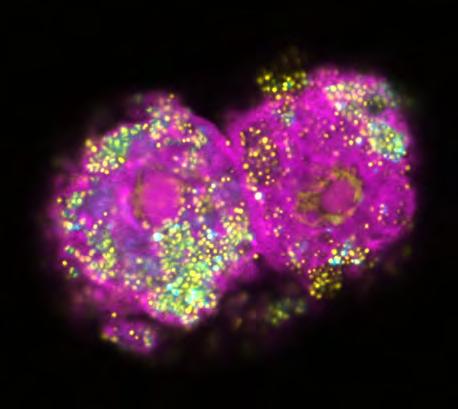
Parachlamydien sind in der Umwelt weit verbreitet, wo sie in Amöben leben. Die für den Menschen harmlosen Bakterien dienen als Modellsystem zur Untersuchung der Evolution von Infektiosität. Das fluoreszenzmikroskopische Bild zeigt zwei Amöbenzellen in Rosarot, die mit Parachlamydien (gelb/blau) infiziert sind.
Wirtszelle zu Wirtszelle wechseln müssen, um zu überleben.
Anpassungen der Bakterien auf molekularer Ebene
Die Forschenden um Matthias Horn und den Erstautor der Studie, Paul Herrera, gingen einen Schritt weiter in ihren Experimenten. Sie untersuchten die Gene der Bakterien zu Beginn des Evolutionsprozesses und verglichen diese mit den Genen nach 500 BakterienGenerationen. Dabei zeigte sich, dass sich die Gene der beiden Bakteriengruppen an 1161 Stellen deutlich unterscheiden. Diese genetischen Informationen alleine waren jedoch noch nicht ausreichend, um die Unterschiede in der Infektiosität zu erklären. Erst die anschliessende Analyse der Genexpression – also der Verwendung der knapp 2500 Gene während der Infektion – ergab: Die infektiösen Bakterien, die zwischen Wirtszellen wechseln müssen, zeigten Veränderungen bei der Expression von Genen für den Infektionsmechanismus und für bestimmte Stoffwechselwege, die für das Überleben ausserhalb der Wirtszellen wichtig sind. «Der Übertragungsweg spielt eine entscheidende Rolle bei der Entwicklung von Infektiosität wirtsabhängiger Bakterien. Der beobachtete Anstieg der Infektiosität beruht auf einer Vielzahl genetischer Unterschiede und starken Veränderungen in der Genexpression. Sie führen dazu, dass die Wirtszellen leichter infiziert werden und die Bakterien ausserhalb der Wirtszelle besser überleben können», resümiert Matthias Horn.
Originalpublikation Paul Herrera, Lisa Schuster, Cecilia Wentrup, Lena König, Thomas Kempinger, Hyunsoo Naa, Jasmin Schwarz, Stephan Köstlbacher, Florian Wascher, Markus Zojer, Thomas Rattei, Matthias Horn, «Molecular causes of an evolutionary shift along the parasitismmutualism continuum in a bacterial symbiont», Pnas (2020); DOI: 10.1073/pnas.2005536117
Kontakt Univ.Prof. Dr. Matthias Horn Department für Mikrobielle Ökologie Universität Wien Althanstrasse 14 A1090 Wien +43 1 4277 543 93 matthias.horn@univie.ac.at www.univie.ac.at











