Determinación de microplásticos en el pargo Lutjanus synagris a lo largo de la cadena de transformación: desde la captura hasta llegar a filete para consumo humano


El presente informe se encuentra conformado por dos secciones, la primera sección corresponde al estudio sobre la detección/trazabilidad de microplásticos en peces a través de su cadena de procesamiento: desde que es capturado hasta convertirse en producto para consumo humano. Por otro lado, la segunda sección presenta una revisión global sobre la región del Caribe, la cual tiene como objetivo señalar que el turismo masivo (una de las principales actividades económicas) si no es controlado o convertido en una economía azul, traerá más perdidas que beneficios debido a la contaminación plástica de los ecosistemas marinos
Para consulta de las infografías en el siguiente link:
El Caribe – El caracol rosa del Caribe https://mollusclabcommx.wordpress.com/el-caribe/
Determinación
Determinación de microplásticos en el pargo Lutjanus
synagris a lo largo de la cadena de transformación: desde la captura hasta llegar a filete para consumo humano.
Introducción
Producción de Plásticos
En la actualidad, la basura plástica se ha convertido en un problema ambiental de importancia global. En 1950 se tiene reportada una producción plástica de 1.5 millones de toneladas, en el año 2000 esta cifra estaba 193 Mton, ya en el año 2022 esta cifra era de 400.3 Mton, esta cifra se duplico en tan solo 22 años, se estima que esta producción podría llegar por encima de las 550 Mton en el 2030 (Fig. 1).

Fig.1 Producción de plástico desde 1950 hasta 2022 (Mton = Millones de toneladas). Statista. Production of Plastics Worldwide from 1950 to 2018. Available online: https://www.statista.com/statistics/282732/global-production-of-plastics-since-1950/
La producción de plásticos y por ende de sus desechos esta relacionada al crecimiento y estilo de vida de la población actual. Es un material de bajo costo, liviano, resistente y vérsatil, lo encontramos en todos los usos de la vida cotidiana, desde la vestimenta hasta
en productos de higiene y salud, otros sectores en los que se encuentran presentes son el embalaje, transporte, construcción, electrónica. Las características de estos los hacen indispensables en innovaciones tecnológicas trayendo consigo mejoras y comodidades (Plastic garbage Project, 2020).
El consumo masivo de plásticos, trae consigo un sinnúmero de complicaciones debido a el rápido descarte de estos, dos tercios de la producción de plástico son productos de vida corta, que en cuestión de minutos se desecha (UNEP, 2023), lo que genera una acumulación de basura que no es gestionada adecuadamente y se termina generando vertederos en hábitats naturales, dañando así el medio ambiente (Wagner y Lambert, 2018). En 2010 se tiene registrado una producción de 275 Mton de basura plástica, de la cual el 3.18% termino en los oceános (Jambeck et al., 2015) (Fig. 2).

Figura 2. Producción y disposición final de basura plástica en 2010.
Aunado a la producción masiva de plásticos, hay muchos países que no tienen una gestión de la basura plástica. En América Latina y el Caribe, cerca de 40 millones de personas carecen de acceso a servicios básicos de recolección de residuos, y cada día se eliminan alrededor de 17.000 toneladas de residuos plásticos en vertederos a cielo abierto (Savino et al., 2018) y a nivel mundial se señala que el 50% de estos se tira en vertederos. Además, la mayoría de las aguas residuales se vierten directamente a cuerpos de agua, sin un tratamiento adecuado (Lots et al., 2017). Naciones Unidas informa que un tercio de todos los residuos urbanos acaba en vertederos clandestinos y el 85% de las aguas residuales no son tratadas antes de llegar al mar. Además de que no hay reglamentación específica que regulel a basura marina o los microplásticos en
esta región; por lo cual el Mar Caribe está considerado actualmente como el segundo mar más contaminado con plásticos en el mundo (PNUMA, 2021).
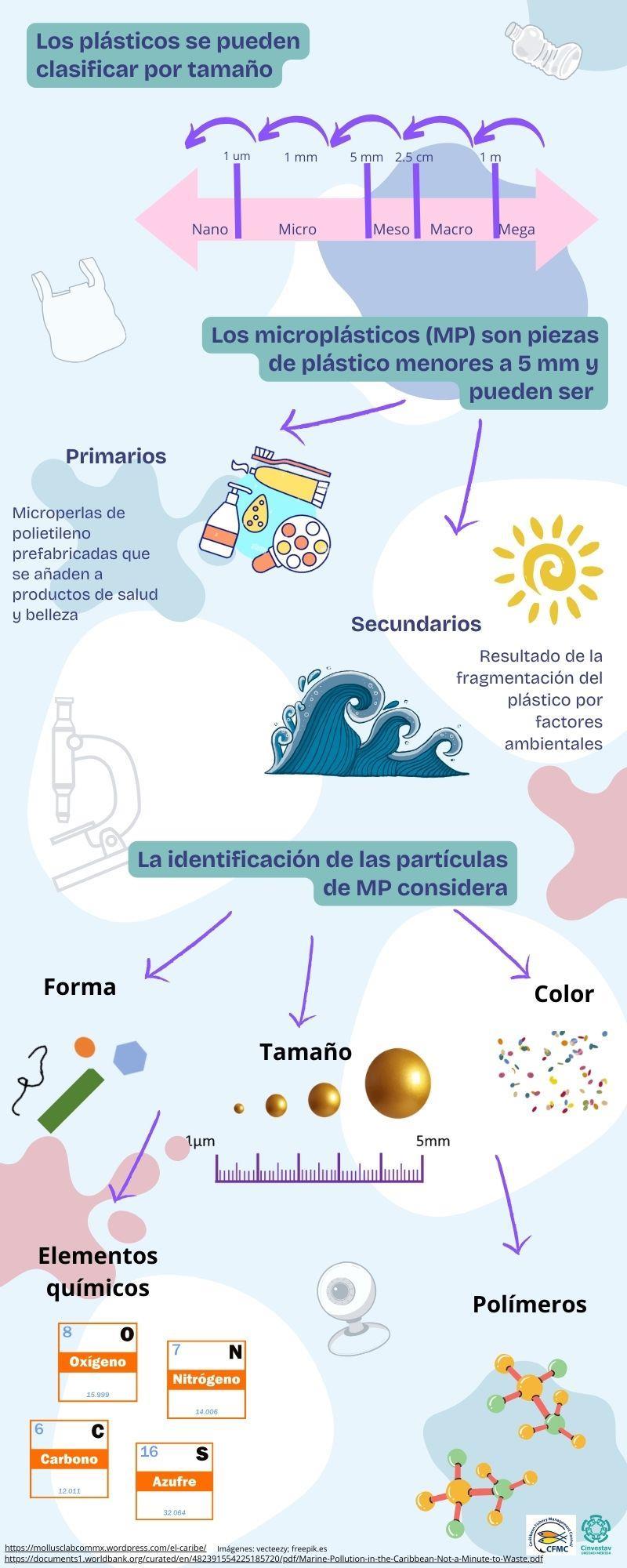
Los microplásticos se definen como una mezcla heterogénea de materiales de diferentes formas (fragmentos, fibras, esferoides, gránulos, pellets, astillas o perlas) menores a 5 mm (EFSA, 2016) Además, los microplásticos se clasifican en primarios y secundarios. Los microplásticos primarios son partículas plásticas producidas intencionalmente en un rango de tamaño de menos de 5 mm y destinadas a usos domésticos o industriales especiales (Eriksen et al., 2014). Mientras que los macro y mesoplásticos que llegan a los océanos por causa de la radiación solar y el oleaje son fragmentados, con lo cual se producen los microplásticos secundarios, los cuales contaminan el sedimento, el agua y a los organismosmarinos. La talla de estos MPs esmenor a 5 mm ydebido a este tamaño pueden ser confundidos como alimento y entrar así en la cadena alimenticia de los organismos marinos, y a través de estos llegar a ser consumidos por los seres humanos (Chen et al., 2020) (Fig. 3).

Figura 3. Diagrama del ingreso de microplásticos en la cadena alimentaria hasta llegar al consumo humano. https://www.gaceta.unam.mx/microplasticos-un-riesgo-creciente-para-la-salud/
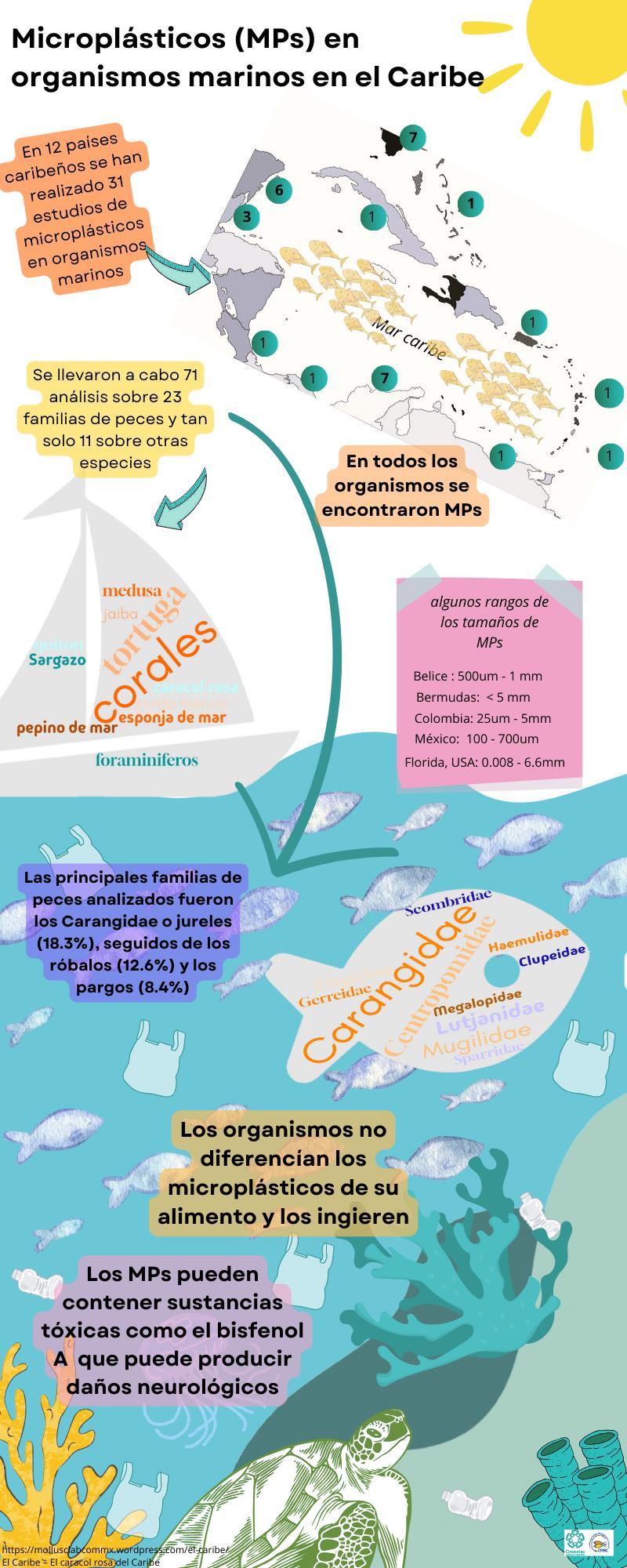
El continuar con la práctica de producción y consumos de plásticos en la región caribeña puede traer repercusiones en la economía, sobre todo en aquella relacionada en ecosistemas marinos, afectando las pesquerías (economía local), y el turismo (actividad económica principal de varios países de la región). Cada vez toma mayor relevancia atender los efectos de los microplásticos en la biota marina, de 2015 a 2024 para la región del Caribe se han encontrado alrededor de 29 estudios científicos relacionados
con este tema. En total se han realizado 71 análisis, sobre 23 familias de peces de importancia comercial en la región, los Carangidae o jureles (18.3%) son los más estudiados, seguido de los robalos (12.68%) y los pargos (8.45%). Tan solo 11 estudios se han realizado sobre otros organismos marinos (Anexo I).
Aspectos de la biología del pargo Lutjanus synagris
Las especies de pargos que pertenecen a la familia Lutjanidae tienen una distribución tropical y subtropical alrededor del mundo. Lutjanus synagris (Fig. 4), se distribuye en el Atlántico occidental, desde Carolina del Norte en Estados Unidos, hasta Bahía en Brasil (Allen, 1985).

Figura 4. Lutjanus synagris, nombre común en diferentes zonas del Caribe: rubia, lane snnaper, pargo arrayado, villajaiba. https://www.floridasportsman.com/editorial/lanesnapper/395436
Lutjanus synagris es una especie demerso-pelágica que habita alrededor de arrecifes de coral y en vegetación de zonas arenosas (Allen, 1985). Los especímenes de este pargo en estadios de desarrollo temprano han sido observados en diversos hábitats, entre ellos: raíces de mangles, fanerógamas, algas y fondos duros (Claro y Lindeman, 2004).
El crecimiento en los pargos suele considerarse lento, con tasas de mortalidad natural bajas (Brulé et al., 2004). Estos ocupan niveles tróficos altos y son considerados claves en la trofodinámica de los ecosistemas (Duarte y García, 1999; Juárez-Camargo et al.,
2020; Brulé et al., 2023). En la región del Atlántico occidental, los recursos alimenticios para los estadios tempranos de estos peces son aportados principalmente por manglares y praderas de pastos marinos (Doncel y Páramo, 2010; Vaslet et al., 2012).
L synagris ha sido categorizado como un carnívoro generalista y oportunista, que consume un amplio espectro de presas, pero con preferencia por organismos bentónicos (Duarte y García, 1999; Fernandes et al., 2020). Este pargo presenta hábitos alimenticios crepusculares y su dieta se encuentra conformada principalmente por crustáceos. El número de presas que consumen puede estar influenciado por las diferencias en la diversidad de la epifauna presente en los sitios que habita (Duarte y García, 1999; Juárez-Camargo et al., 2020).
Juárez-Camargo y colaboradores (2020) reportaron que a lo largo del litoral de Campeche observaron una variación temporal en la dieta de L. synagris entre la época de lluvia y la de seca, debido a los cambios ocurridos en la producción primaria conformada por zooplancton y organismos bentónicos. Por otro lado, en la costa norte de Yucatán se determinó que la dieta de L. synagris está conformada principalmente por los grupos Brachyura, Penaeioidea y algunos camarones no identificados (Brulé et al., 2023).
A pesar de que L. synagris comparte hábitat con otras especies de pargos como O. chrysurus, se ha demostrado que la competencia entre ambas especies es reducida, debido a que tienen un comportamiento alimenticio diferente (Brulé et al., 2023).
Contaminación por microplásticos en la línea de procesamiento de peces: captura –consumo humano
Como se mencionó anteriormente, los estudios sobre MPs en peces, dieron positivos en un 98% de los organismos muestreados. La mayoría de estos estudios se realizaron en el tracto digestivo (estómago) y raramente en otro tipo de tejido como el músculo, la piel o las branquias. En la cadena de procesamiento, los peces capturados son eviscerados en el mismo lugar de captura por lo que se sugiere que la ingesta de MPs proveniente de estos peces sería mínima (Lusher, 2017). Sin embargo, los MPs que vienen en el
organismo no son el único vector de contaminación de este, ya que, al pasar por diversos puntos de revisión y pesaje, estos adquieren trazas de los diferentes plásticos en los que son transportados y almacenados.
La inocuidad alimentaria garantiza que los alimentos no son dañinos para la salud humana. Esta se mantiene debido a la aplicación de medidas de higiene durante la producción, almacenamiento, distribución y preparación de los alimentos. Esta inocuidad alimentaria considera una serie de acciones en los sitios donde se procesan estos alimentos para evitar, reducir y minimizar riesgos físicos, químicos y biológicos. Así la trazabilidad en alimentos permite conocer y seguir el rastro de un producto desde su recolección hasta el consumidor final. Esta trazabilidad está diseñada para detectar partículas de otros alimentos por una contaminación cruzada, de igual manera se considera determinar las trazas de metales que pudieran llegar. Sin embargo, no esta totalmente reconocida la contaminación por microplásticos que acompaña a los productos pesqueros, desde que son capturados y botados en lancha, y pasar por diversas cajas o jabas plásticas, hasta llegar a la mesa de los fileteadores.
En este estudio técnico se propuso determinar si existía una contaminación cruzada por MPs en el pargo Lutjanus synagris, siguiendo la línea de transformación, desde la captura hasta el proceso de consumo, y poder establecer una trazabilidad de esta, con la idea de minimizar esta contaminación en los productos alimentarios pesqueros.
Metodología
Sitio de studio
La captura de L. synagris se realizó frente a la costa de Puerto Progreso, Yucatán y la cooperativa de productos pesqueros donde se recogieron las muestras se encuentra en en Puerto Progreso, este se encuentra ubicado en el noroeste del Estado de Yucatán, a 36 km al norte de Mérida, capital del estado. Sus coordenadas geográficas son 21°16’58” N y 89°39’49” W. Progreso es un puerto importante de la industria pesquera de altura y también cuenta con un número importante de pescadores artesanales. Las principales especies capturadas (mayor tonelaje) son: pulpo, mero,rubia, tiburón, huachinango y langosta (SEMAR. 2020). Las muetras

Figura 5. Sitio de captura de Lutjanus synagris en Progreso, Yucatán (Modificado de Winfield et al., 2015).
Captura de Lutjanus synagris
La colecta de peces se llevó a cabo en abril y noviembre de 2024, la primera colecta la realizaron pescadores de la cooperativa Auténticos pescadores del Golfo SC de RL y la segunda pescadores artesanales independientes de Progreso. Ambos grupos de pescadores pasan de 3 a 4 días en altamar, la pesca la conservan en hielo que mantienen en sus contenedores. La captura se realizó por el método de palangre, el cual fue colocado en aguas intermedias y se dejó flotar a la deriva en el mar, hay una línea madre con boyas, de la cual penden los palangres (Fig. 6). Estos fueron dejados de 2 a 3 horas a la deriva en espera de que los peces cayeran en los anzuelos. La pesca se recobró y se dejó en el bote hasta que se recuperaron todos los palangres, posteriormente se procedió a eviscerar los peces

Figura 6. Pesca con palangre (https://mytimezero.com/es/tz-professional/solucion-para-la-pescacomercial/solucion-para-palangreros)
Colecta de la muestra
En la línea de procesamiento, se determinaron 6 estaciones para colectar los pargos, en cada estación se colectaron 10 organismos, los cuales fueron depositados en hieleras térmicas flexibles. En la figura 7 se muestra el flujo que se siguió para la toma de pargos.

Figura 7. Diagrama de flujo de la colecta de peces, en cada estación se colectaron 10 organismos. 1) El pez no es eviscerado y se coloca inmediatamente en hielera, 2) el pez es eviscerado y tiene contacto con el hielo de la embarcación, 3) Los peces son transportados de la embarcación al muelle en jabas de plástico, 4) Pesados en charolas plásticas, 5) Transportados en jabas plásticas a la cooperativa, 6) Fileteados en barra de plástico tipo alimentario y empacados al alto vacío en bolsas plásticas grado alimentario. Los peces se enviaron a Cinvestav para su procesamiento.
Una vez las muestras en tierra fueron transportadas en hieleras duras forradas de aluminio a la unidad Mérida de CINVESTAV. Fueron procesadas y analizadas en el laboratorio de Biología y Cultivo de Moluscos de CINVESTAV-Mérida. Se tomaron mediciones morfométricas de longitud total (cm) con ayuda de un ictiómetro, y el peso total (g) con una balanza analítica, de 0,01 g de precisión
Digestión del tejido orgánico
a) Organismos eviscerados: Se extrajo el tejido muscular, se pesó y se colocó en envases de vidrio para iniciar la digestión oxidativa con H2O2 al 30%. De igual forma las branquias y piel fueron separadas para su posterior análisis en seco.
b) Organismos sin eviscerar: A cada organismo se le realizó una disección, se cortó desde la boca hasta el ano para extraer el sistema digestivo (esófago, estómago e intestino) de los peces. Se extrajo el tejido gastrointestinal, se pesó y se colocó en envases de vidrio para iniciar la digestión oxidativa con H2O2 al 30%. De igual forma las branquias fueron separadas para posterior análisis. El tejido gastrointestinal fue abierto para permitir una penetración más rápida del peróxido de hidrogeno, esto permitió separar el tejido del contenido estomacal (se realizó el mismo protocolo que en el informe “Contaminación por microplásticos en peces del Caribe: Puerto Rico y México” CFMC 2023) También se analizó el tejido muscular, piel y branquias (Fig. 8)

Figura 8. Diagrama en el que se señala donde se obtuvieron las muestras para el análisis y detección de microplásticos.
Identificación de microplásticos
La identificación de los MP se realizó visualmente haciendo uso del estereoscopio, asegurándose de que las partículas separadas no presentaran estructuras celulares u orgánicas y que presentaran un color claro y homogéneo (Hidalgo-Ruz et al., 2012). Los MP se contaron y se clasificaron según sus formas considerando las categorías propuesto por GESAMP (2019): fragmentos, espuma de poliestireno, películas, fibras y pellets
Como medidas complementarias para evitar la contaminación de las muestras, todo el material fue lavado con agua destilada filtrada, no se utilizó ningún tipo de plástico en el manejo de las muestras (disección, conservación, etc.), se utilizó bata de laboratorio de algodón, se redujo el empleo del aire acondicionado (Barrows et al., 2017) y se redujo el flujo del personal en el área de laboratorio asignada a este estudio. Como testigos o blancos se colocaron dos cajas de Petri con filtros de fibra de vidrio.
Espectroscopia Raman
Los espectros Raman se obtuvieron empleando un equipo InVia™ Raman microscope Renishaw. En el portamuestras se usó el láser de 633nm, con potencia entre 10 y 100% con 10 segundos de tiempo de exposición. Los datos obtenidos se graficaron con el software Origin 2021. Este análisis se desarrolló en colaboración con el Centro de Investigación Científica de Yucatán (CICY), con el Dr. J.V. Cahuich y la Dra R.F. Vargas. The Omnic software library was used initially for plastic identification when the match was above 70% and the final identification was conducted according to reported references (Reflectance FT IR spectroscopy as a viable option for textile fiber identification).
Resultados
Biometrias de L. synagris
Un total de 50 peces y 10 filetes fueron colectados para determinar la abundancia de MPs en elpargo L. synagris. Se separaron los tejidosdel estómago, músculo y branquias
En la figura 9 se presenta la talla de los organismos tomada como longitud total (cm). El
rango de talla promedio fue de 23.57 ± 1.60 a 24.15 ± 1.18 cm, no existiendo diferencia entre ellos. De igual manera, el peso promedio presentó un rango de 1.240 ± 0.11 a 1.384 ± 0.05 kg, los filetes tuvieron un peso medio de 124 ± 0.01 g (Fig. 10).

Figura 9. Talla promedio de los pargos (cm). Estaciones de muestreo: 1) Pez no eviscerado, 2) Pez eviscerado, 3) Peces transportados en jabas de plástico al muelle, 4) Pesados en charolas plásticas, 5) Transportados en jabas plásticas a la cooperativa, 6) Fileteados y empacados en bolsas plásticas grado alimentario.
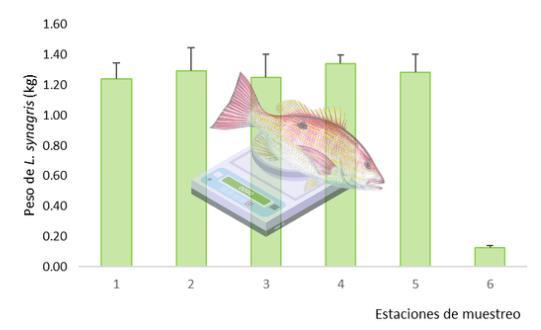
Figura 10. Peso promedio de los pargos (kg). Estaciones de muestreo: 1) Pez no eviscerado, 2) Pez eviscerado, 3) Peces transportados en jabas de plástico al muelle, 4) Pesados en charolas plásticas, 5) Transportados en jabas plásticas a la cooperativa, 6) Filetes empacados en bolsas plásticas grado alimentario.
Microplásticos en el estómago, músculo y branquias de L. synagris
Un total de 194 microplásticos (MPs) fueron encontrados en las 60 muestras analizadas. En la figura 11 se presentan la abundancia de MPs encontrados en el estómago, músculo y branquias del pargo L. synagris. En el estómago se encontró un total de 50 partículas de MPs (solo se realizó este análisis para la estación donde los peces no están eviscerados), en el músculo fueron 92 MPs y en las branquias 52 MPs (Fig. 11) Se observa una tendencia en el incremento de microplásticos conforme avanza la cadena de procesamiento.

Figura 11. Abundancia total de microplásticos en L. synagris, para cada estación de muestreo.
En la figura 12 se puede observar que el músculo de los pargos sin eviscerar presentó un menor número de MPs (0.7 partículas en promedio), mientras que en los pargos de la estación 5 se observaron 2.3 partículas en promedio. Si bien no es visible una marcada diferencia entre las estaciones, si es perceptible la tendencia de incremento de MPs conforme avanza la cadena de transformación del pez completo al filete. Aunque M4 y
M5 tengan la misma mediana (2 partículas/ pargo) se observa que en M5 el numero mayor se encuentra alojada en la parte superior de la mediana.

Figura 12. Abundancia de microplásticos obtenidos en el músculo de L. synagris para cada estación de muestreo. Para efectos del gráfico, a las estaciones se les anexo la letra M de músculo.
Solamente se encontraron microplásticos con forma de fibra, y se observaron 5 colores: transparente, negro, azul, verde y rojo. Las fibras transparentes y azules dominaron los MPs con 38 y 35 % (Fig. 13), se encontraron en todos los tejidos analizados, mientras que las fibras verdes solo se encontraron en el estómago y las branquias, y las rojas en estómago y músculo.

Figura 13. Color de las fibras de microplásticos obtenidos en L. synagris (todos los tejidos).
La espectrofotometría Raman confirmó la presencia de microplásticos en Lutjanus synagris. La mayoría de las fibras que se encontraron fueron transparentes, las cuales por su espectro fueron asociadas al polímero de polietileno (Fig 14a), el cual se puede encontrar en baldes o cajas duras, así como en barriles, mientras que las fibras azules fueron asociadas al polipropileno (Fig, 14 C) el cual se puede encontrar en bolsas plásticas y envases de alimentos. De la fibra negra se logró obtener el espectro (Fig. 14 B), pero no se identificó el polímero, posiblemente el espectro no corresponda a la muestra real, pues son unas fibras muy pequeñas.

Figura 14. Espectros Raman de fibras obtenidas en L. synagris, A) Fibra Azul = Polipropileno, B) Fibra Negra= no se ajustó a polímero de la biblioteca, y C) Fibra Transparente = Polietileno Raman: Láser de 633nm, con potencia entre 10 y 100% con 10 segundos de tiempo de exposición
Observaciones
Este estudio es uno de los que empieza a cuantificar la contaminación por MPs en el ámbito de la cadena de transformación alimentaria, que en este caso va desde la captura del pez hasta la obtención del filete. Se consideraron los diferentes puntos de contaminación debido a la manipulación de los peces y su transportación, todo el manejo se realiza a través de jabas de plástico, las cuales en su mayoría se encuentran dañadas por exceso de uso y exposición al sol entre otros factores, por lo que el aporte de MPs a los peces es inevitable.
Este estudio se realizó con organismos que no presentaron diferencia en talla y peso, lo que beneficia para disminuir la variabilidad. La estación uno, que tenía los peces sin eviscerar y que fue colocada inmediatamente en una hielera flexible cubierta de papel aluminio, fue el testigo que permitió observar el cambio en la abundancia de partículas de Mps en los peces de los otros puntos de muestreo, se pudo establecer el incremento de la contaminación por microplásticos conforme se avanzaba en la cadena de transformación. Los espectros Raman confirmaron la presencia de Polietileno y polipropileno en los tejidos de L. synagris.
Estos resultados deben considerarse para empezar a crear herramientas para mantener la inocuidad alimentaria en los recursos pesqueros, un nuevo tema relacionado a los microplásticos es el ecosistema que estas partículas plásticas están formando y que han llamado “plastisfera”, la cual se ha estado observado que sirve como vector para muchos organismos, incluyendo a los patógenos, lo cual seria otro punto a trabar para mantener la salud de los productos marinos que son de interés comercial y alimentario.

https://www.floridasportsman.com/editorial/lanesnapper/395436
Bibliografía
Alberghini Leonardo, Alessandro Truant, Serena Santonicola, Giampaolo Colavita and Valerio Giaccone. 2023. Microplastics in Fish and Fishery Products and Risks for Human Health: A Review. Int. J. Environ. Res. Public Health 2023, 20, 789. https://doi.org/10.3390/ijerph20010789
Allen G.R. 1985. FAO Species Catalogue. Vol. 6 Snappers of the world. An annotated and illustrated catalogue of lutjanid species known to date. FAO Fisheries Synopsis 125. pp. 3−158.
Barrows et al., 2017
Brulé, T., Rincón-Sandoval, L. A., González-González, M., Montero-Muñoz, J. L., Colás-Marrufo, T., Renan X., Trejo-Martínez J., 2023. Diet composition of two sympatric snappers Lutjanus synagris and Ocyurus chrysurus from the north continental shelf of Yucatan, Mexico. Cybium, 47, 1.
Brulé T., Colás-Marrufo. T., Pérez-Díaz E., Déniel C., 2004. Biología, explotación y gestión de los meros (Serranidae. Epinephelinae. Epinephelini) y pargos (Lutjanidae. Lutjaninae. Lutjanus) del Golfo de México. En: Caso M., Pisanty, I. y Ezcurra, E. (compiladores). Diagnóstico Ambiental del Golfo de México. Secretaria de Medio Ambiente y Recursos Naturales. Instituto Nacional de Ecología. Instituto de Ecología. A.C. Harte Research Institute for Gulf of Mexico Studies. México. D.F. pp. 247−300.
Chen, J.Y.-S.; Lee, Y.C.; Walther, B.A. Microplastic Contamination of Three Commonly Consumed Seafood Species from Taiwan: A Pilot Study. Sustainability 2020, 12, 9543.
Claro R., Lindeman K.C., 2004. Biología y manejo de los pargos (Lutjanidae) en el Atlántico occidental. Instituto de Oceanología, Ministerio de Ciencias, Tecnología y Medio Ambiente de la República de Cuba, La Habana, Cuba. pp. 1-65, 287−472.
Doncel, O., Páramo, J., 2010. Hábitos alimenticios del pargo rayado, Lutjanus synagris (Perciformes: Lutjanidae), en la zona norte del Caribe colombiano. Latin american journal of aquatic research, 38(3), 413−426.
Duarte, L. O., Garcia, C. B., 1999. Diet of the lane snapper, Lutjanus synagris (Lutjanidae), in the Gulf of Salamanca, Colombia. Caribbean Journal of Science, 35, 54−63.
Eriksen, M.; Lebreton, L.C.M.; Carson, H.S.; Thiel, M .; Moore, C.J.; Borerro, J.C.; Galgani, F.; Ryan, P.G.; Reisser, J. 2014. Plastic Pollutionin the World’s Oceans: More than 5 Trillion Plastic Pieces Weighing over 250,000 Tons Afloat at Sea. PLoS ONE 2014, 9, e111913
Fernandes, J. F. F., Freitas, J., Nunes, Y. B. S., Lobato, R. S., Figueiredo, M. B., 2020. Feeding habits of Lutjanus synagris (Teleostei: Lutjanidae) in the Amazon Coast of the Northeast Region of Brazil. Boletim do Instituto de Pesca, 46(4).EFSA Panel on Contaminants in the Food Chain (CONTAM). Presence of microplastics and nanoplastics in food, with particular focus on seafood. Efsa J. 2016, 14, e04501.
GESAMP. 2019.
Hidalgo-Ruz et al., 2012
Jambeck, J.R.; Geyer, R.; Wilcox, C.; Siegler, T.R.; Perryman, M.; Erady, A.; Narayan, R.; Law, K.L. Plastic waste inputs from land into the ocean. Science 2015, 347, 768–771.
Juárez-Camargo, P. G., Sosa-López, A., Torres-Rojas, Y. E., Mendoza-Franco, E. F., Aguiñiga García, S., 2020. Feeding habits variability of Lutjanus synagris and Lutjanus griseus in the littoral
of Campeche, Mexico: an approach of food web trophic interactions between two snapper species. Latin American Journal of Aquatic Research, 48(4), 552−569.
Lots FAE, Behrens P, Vijver MG, Horton AA, Bosker T. 2017. A large-scale investigation of microplastic contamination: Abundance and characteristics of microplastics in European beach sediment. Mar Pollut Bull. 2017 Oct 15;123(1-2):219-226. doi: 10.1016/j.marpolbul.2017.08.057. Epub 2017 Oct 12. PMID: 28893402.
Lusher, A.L.;Welden, N.A.; Sobral, P.; Cole, M. Sampling, isolating and identifying microplastics ingested by fish and invertebrates.
Anal. Methods 2017, 9, 1346–1360.
Plastic garbage Project, 2020. https://www.plasticgarbageproject.org/es/vida-plastico. Last accessed: Dec 2,2024
PNUMA, 2021. Acción planetaria https://wedocs.unep.org/bitstream/handle/20.500.11822/ 37946/UNEP_AR2021_SP.pdf
Savino A., Solorzano G., Quispe C., Correal M.C., 2018, Waste management outlook for Latin America and the Caribbean. UNEP, 11822, 26448
SEMAR Puerto Progreso Yucatán https://digaohm.semar.gob.mx/cuestionarios/cnarioProgreso.pdf.
UNEP 2023. Microplásticos: consecuencias históricas de la contaminación por plásticos. https://www.unep.org/es/noticias-y-reportajes/reportajes/microplasticos-consecuenciashistoricas-de-la-contaminacion-por
Vaslet, A., Phillips, D. L., France, C., Feller, I. C., Baldwin, C. C., 2012. The relative importance of mangroves and seagrass beds as feeding areas for resident and transient fishes among different mangrove habitats in Florida and Belize: evidence from dietary and stable-isotope analyses. Journal of Experimental Marine Biology and Ecology, 434, 81–93.
Wagner, M.; Lambert, S. Freshwater Microplastics: Emerging Environmental Contaminants? Springer Nature: Berlin/Heidelberg, Germany, 2018; p. 303
ANEXO I
tema autor titulo revista DOI año país
Organismos Marinos: Peces y crustáceos
Organismos marinos: Peces
Astorga Pérez María Angélica
Organismos marinos: Peces
Borges-Ramírez Merle M., Edgar F. MendozaFranco, Griselda EscalonaSegura, Jaime Rendon-von Osten
Determinación de microplásticos en especies marinas del Parque Nacional Marino Las Baulas
Plastic density as a key factor in the presence of microplastic in the gastrointestinal tract of commercial fishes from Campeche Bay, Mexico.
Calderon Ernesto A., Peter Hansen, Adriana Rodríguez, Martin C. M. Blettler, Kristian Syberg, Farhan R. Khan
Microplastics in the Digestive Tracts of Four Fish Species from the Ciénaga Grande de Santa Marta Estuary in Colombia
Tecnológico de Costa Rica https://rep ositoriotec. tec.ac.cr/h andle/2238 /12255
Environmenta l Pollution Volume 267, December 2020, 115659 https://doi .org/10.10 16/j.envpol .2020.1156 59
2020 Costa Rica
Water Air Soil Pollut (2019) 230: 257 https://ww w.research gate.net/p ublication/ 337023852 _Microplas tics_in_the _Digestive _Tracts_of _Four_Fish _Species_fr om_the_Ci enaga_Gra
2020 México
Organismos marinos: Peces
Garcés-Ordóñez Ostin, Kevin AlexanderMejíaEsquivia, TatianaSierraLabastidas, AlbertPatiño, Lina MarcelaBlandón , Luisa F.Espinosa Díaz
Pasto marino Goss Hayley , Jacob Jaskiela, Randi Rotjana
Prevalence of microplastic contamination in the digestive tract of fishes from mangrove ecosystem in Cispata, Colombian Caribbean
Marine Pollution Bulletin 154 (2020) 111085
nde_de_Sa nta_Marta _Estuary_i n_Colombi a
https://doi .org/10.10 16/j.marpo lbul.2020.1 11085
2020 Colombia
Agua y Organismos marinos: Peces Hall Kyra , Kit Shaw, Islay Van Dusen, Isabella Brown, Sam Resetarits, Gabriela Inoa
Organismos marinos: Coral Hankinsa Cheryl , Allyn Duffy, Kathryn Drisco
Thalassia testudinum as a potential vector for incorporating microplastics into benthic marine food webs
Quantifying Plastics and its Biological Impacts in the Northern Exuma Sound, The Bahamas
Scleractinian coral microplastic ingestion: Potential calcification effects, size
Marine Pollution Bulletin 135 (2018) 1085–1089 https://doi .org/10.10 16/j.marpo lbul.2018.0 8.024
2018 Belice
0
http://ww w.fishcons erve.org/ar cel/admin/ uploads/FP LP226.pdf
Marine Pollution Bulletin Volume 135, October 2018, Pages 587593 https://doi .org/10.10 16/j.marpo lbul.2018.0 7.067
0 Bahamas
2018 Estados Unidos, FL
Organismos marinos: Medusa
Iliff Samantha M. , Eliza R. Wilczek, Rachel J. Harris, Ryan Bouldin, Elizabeth W. Stoner
Agua + Organismos marinos: peces
Organismos marinos: Peces
limits and retention.
Evidence of microplastics from benthic jellyfish (Cassiopea xamachana) in Florida estuaries
Nathan Justine Microplastic and metal contamination in Bermuda fishes at different trophic levels
Pannetier P., Cachot J., Clerandeau c., Faure F., Van K., de Alencastro L., Levasseur C., Sciacca F., Bourgeois J., Morin B.
Toxicity assessment of pollutants sorbed on environmental sample microplastics collected on beaches: Part Iadverse effects on fish cell line
Organismos marinos: Peces Reyes Bonilla Héctor , Lorenzo Álvarez Filip, Horacio Pérez España, David Santillo.
Estudio sobre el impacto de la contaminación por microplásticos en peces de méxico
Marine Pollution Bulletin/Vol 159 (2020) 111521
https://doi .org/10.10 16/j.marpo lbul.2020.1 11521
Universidade do Algarve http://hdl. handle.net /10400.1/1 4614
2020 Estados Unidos, FL
Environmenta l Pollution https://doi .org/10.10 16/j.envpol .2018.12.0 91
2019 Bermudas
2018 Bermudas
Green Peace México https://ww w.greenpe ace.org/sta tic/planet4 -mexicostateless/2 019/10/01f 918b5estudiosobre-elimpactode-lacontamina
2019 México
Organismos marinos: peces
Agua + Organismos marinos: esponja
Ostin GarcésOrdóñeza,b,c,⁎, Kevin Alexander Mejía-Esquiviad, Tatiana SierraLabastidasd, Albert Patiñoa, Lina Marcela Blandóna, Luisa F. Espinosa Díaza
Prevalence of microplastic contamination in the digestive tract of fishes
Prevalence of microplastic contamination in the digestive tract of fishes from mangrove ecosystem in Cispata, Colombian Caribbean
Bailey R. Fallon , Christopher J. Freeman
Marine Pollution Bulletin 154 (2020) 111085
cion-pormicroplasti cos-enpeces-demexico.pdf
https://doi .org/10.10 16/j.marpo lbul.2020.1 11085
2020 Colombia
Sedimento + Organismos marinos: pepino de mar
Arlenie PerezRogers, Charles Coc, Eduardo Barrientos, Henry Sanchez
Plastics in Porifera: The occurrence of potential microplastics in marine sponges and seawater from Bocas del Toro, Panamá
Micro and Macroplastics
Analysis in the Digestive Tract of a Sea Cucumber (Holothuriidae, Holothuria floridana) of the Placencia Lagoon, Belize
PeerJ 9:e116 38 10.7717/p eerj.11638
Caribbean Journal of Science 5(2):166-174
DOI: 10.18
475/cjos.v 51i2.a2
Panamá
sedimentos + agua + Organismos marinos: peces
Ostin GarcésOrdóñez
a,b,c,d,⁎, Juan F. SaldarriagaVélez a, Luisa F. Espinosa-Díaz
a,c,d,⁎, Albert D. Patiño a, José Cusba a, Miquel Canals b, Kevin
Mejía-Esquivia a, Laura FragozoVelásquez a, Sol
Sáenz-Arias a, Tania CórdobaMeza a, Martin Thiel
Organismos marinos: coral
Martina M Plafcan, Christo pher D Stallings
Microplastic pollution in water, sediments and commercial fish species from Ciénaga Grande de Santa Marta lagoon complex, Colombian Caribbean
Science of the Total Environment 829 (2022) 154643
http://dx.d oi.org/10.1 016/j.scitot env.2022.1 54643 2022 Colombia
Organismos marinos: caracol rosa
Dalila Aldana Aranda , Hazel A. Oxenford, Jairo Medina, Gabriel Delgado, Martha Enríquez Díaz, Citlali Samano, Víctor Castillo
Escalante, Marion Bardet, Eve Mouret, Claude Bouchon
Microplastics do not affect bleaching of Acropora cervicornis at ambient or elevated temperatures
Widespread microplastic pollution across the Caribbean Sea confirmed using queen conch
PeerJ. 2022 Jun 17;10:e13578
doi: 10.771 7/peerj.13 578 2022 Florida USA
Marine Pollution Bulletin 178 (2022) 113582
https://doi .org/10.10 16/j.marpo lbul.2022.1 13582 2022 Mexico, Barbados, Guadelou pe y Estados Unidos, FL.
Organismos marinos: peces
V JimenezCárdenas, A Luna-Acosta, LD Gómez-Méndez
Organismos marinos: quitón Camila MercadoMolares, Alison Julieth CortesAguilar, María CabarcasMontalvo, Isabel AcostaColey, Lucellys Sierra-Marquez, Alejandro Henao-Castro, Camilo ValcarcelCastellanos
Organismos marinos: coral
Organismos marinos: peces
Colleen B. Bove, Katharine Greene, Sharla Sugierski, Nicola G. Kriefall, Alexa K. Huzar, Annabel M. Hughes, Koty Sharp, Nicole D. Fogarty and Sarah W. Davies
Differential presence of microplastics and mesoplastics in coral reef and mangrove fishes in Isla Grande, Colombia
Global pollutants assessment: Mercury bioaccumulation and microplastic bioadhesion in Acanthopleura granulata (Gmelin, 1791) in the Colombian Caribbean
Microplastics, 1(3), 477-493. 10.3390/m icroplastics 1030034
2022 Colombia
Exposure to global change and microplastics elicits an immune response in an endangered coral
Edgar J. LozadaGómez Analysis of population size and food preference of Pterygoplichthys multiradiatus:
SSRN https://ssrn.c om/abstract= 4507957
http://dx.d oi.org/10.2 139/ssrn.4 507957
2023 Colombia
Front. Mar. Sci. 9:1037130.
doi: 10.3389/f mars.2022. 1037130
2023 Estados Unidos, FL
UNIVERSITY OF PUERTO RICO AT RIO PIEDRAS CAMPUS COLLEGE OF https://rep ositorio.up r.edu/hand le/11721/3 473 2023 Puerto Rico
Organismos marinos: tortuga Clemente Balladares, Ivis Fermín, Edgar García, Juan Carlos Amilibia, Diego Rodríguez
focus on microplastics in streams with different human impacts
Preliminary analysis of microplastics from the main continental nesting beach of the hawksbill sea turtle (Eretmochelys imbricata) in Venezuela
NATURAL SCIENCES DEPARTMENT OF ENVIRONMEN TAL SCIENCES
Latin American Journal of Aquatic Research, 51(1): 79-87, 2023
DOI: 10.3856/vo l51-issue1fulltext2789 2023 Venezuela
Macroalgas Tapia-Fuentes
Jocelyn, CruzSalas Arely Areanely, MartínezSalvador Carolina, OjedaBenítez Sara, VázquezMorillas Alethia, Álvarez-Zeferino Juan Carlos
Organismos marinos: peces
Organismos marinos: foraminifer os benticos
Maria McGirl, D. Abigail Renegar, and David W. Kerstetter
Presence of microplastics deposited in Sargassum sp. on sandy beaches
Regional Studies in Marine Science 66 (2023) 103152
https://doi .org/10.10
16/j.rsma.2 023.10315
2 2023 México
Estefany Andrea Mora Galindo
Extensive Microplastic Contamination in Southeastern Florida Forage Fishes
Influence of microplastics in the community of benthic
Caribbean Journal of Science, 54(1) : 91-102
https://doi .org/10.18 475/cjos.v 54i1.a12
2024 Estados Unidos, FL
Universidad Nacional de Colombia
https://rep ositorio.un al.edu.co/h
2024 Colombia
Organismos terrestres: geckos
Rafael BorrotoPaez, Orlando Enrique Sánchez León, Boris A. Fabres
foraminifera from a historical perspective andle/unal /86429
Microplastics in invasive ): first evidence in Cuba and the Caribbean, and transfer pathways of concern
Vol. 31 No. 1 (2024): Reptiles & Amphibians
https://doi .org/10.17 161/randa. v31i1.2275
1 2024 Cuba
Organismos marinos: peces Omar Rivera-Garibay, · María Elena Méndez-López, · Edgar Torres-Irineo, · Miguel Rivas, · David Santillo, ·Lorenzo Álvarez-Filip
Organismos marinos: tortuga
Dalila Aldana Aranda, Pauline Sindou, Juan V. Cauich Rodriguez, Gisela Maldonado Saldaña, Rossana Faride Vargas Coronado, Wendy Donaji Nicolás González, Martha Enríquez Díaz, Víctor Castillo Escalante
Presence of microplastic in target species of small scale fisheries and possible social implications on the local communities
A non-invasive method of microplastics pollution quantification in green sea turtle Chelonia mydas of the Mexican Caribbean
Marine Biology (2024) 171:78
Marine Pollution Bulletin 200 (2024) 116092
https://doi .org/10.10 07/s00227024-043991 2024 México
https://doi .org/10.10 16/j.marpo lbul.2024.1 16092 2024 Mexico
Infografías sobre el Caribe
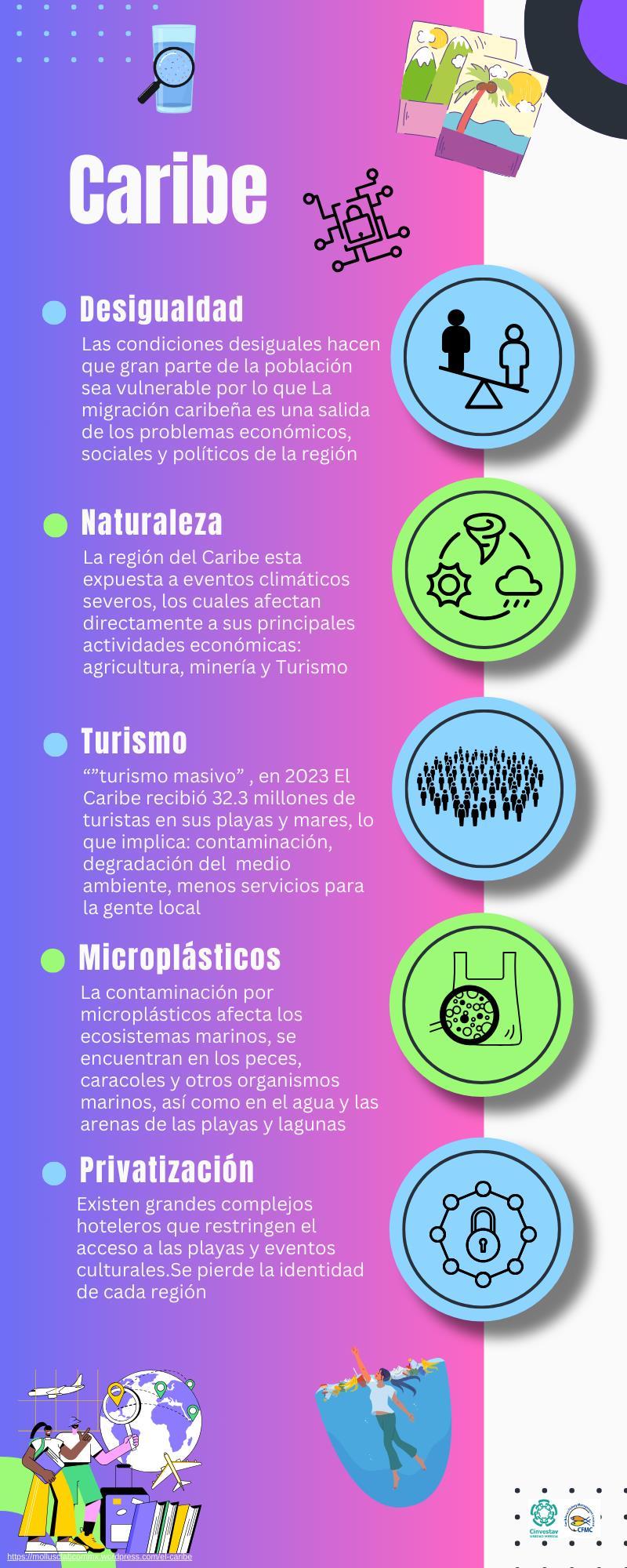
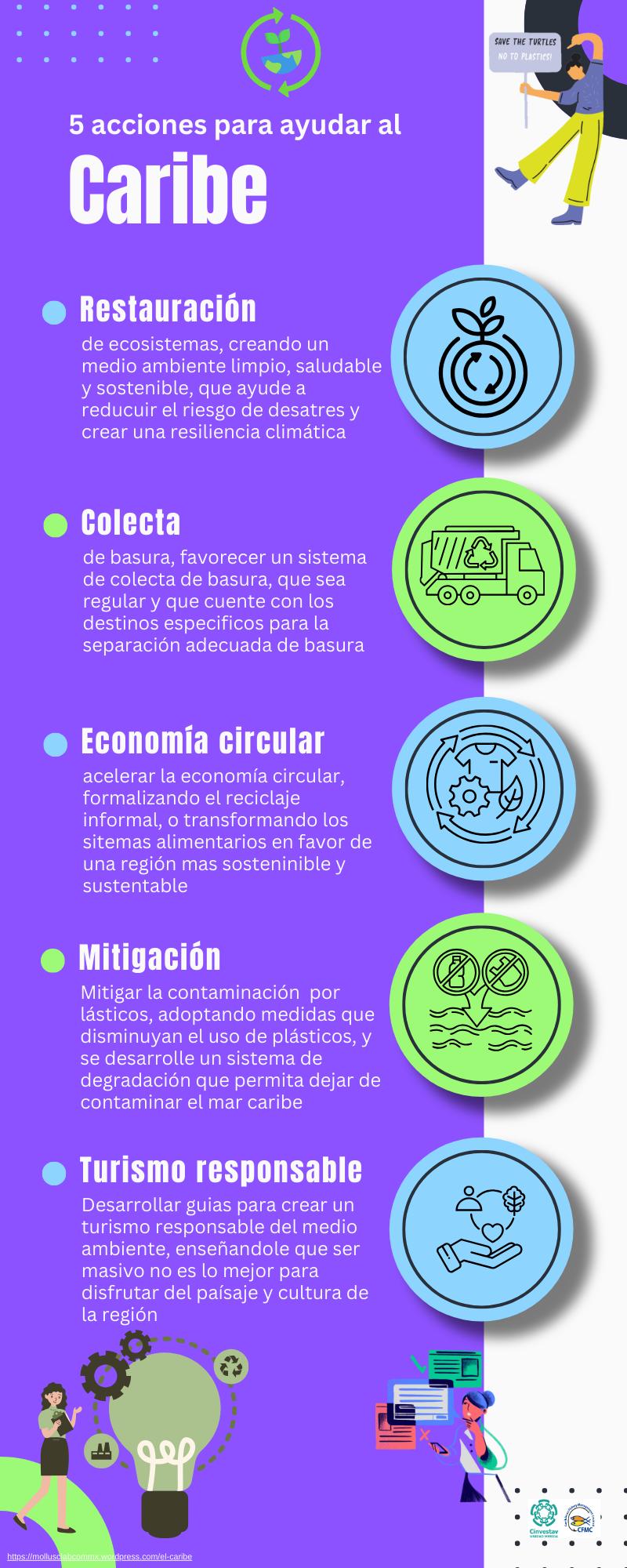
La basta complejidad de la Región del Caribe, no permite entender como se desarrolla y por lo tanto la gestión de temas como los recursos naturales y contaminación no se encuentra en el mismo plano para todas las naciones que conforman la región. Estas 14 infografías recopilan datos que permiten adentrarse tanto en la cultura como en los temas sociales, económicos yprincipalmente de contaminación plástica del mar Caribe, se hace énfasis en el control del turismo masivo para evitar/mitigar el daño ambiental que este causa, no satanizándolo pero si para poder generar herramientas de gestión que permitan mantener un ambiente sostenible y sustentable
Esta dividido en cinco temas principales y cada uno tiene subtemas:
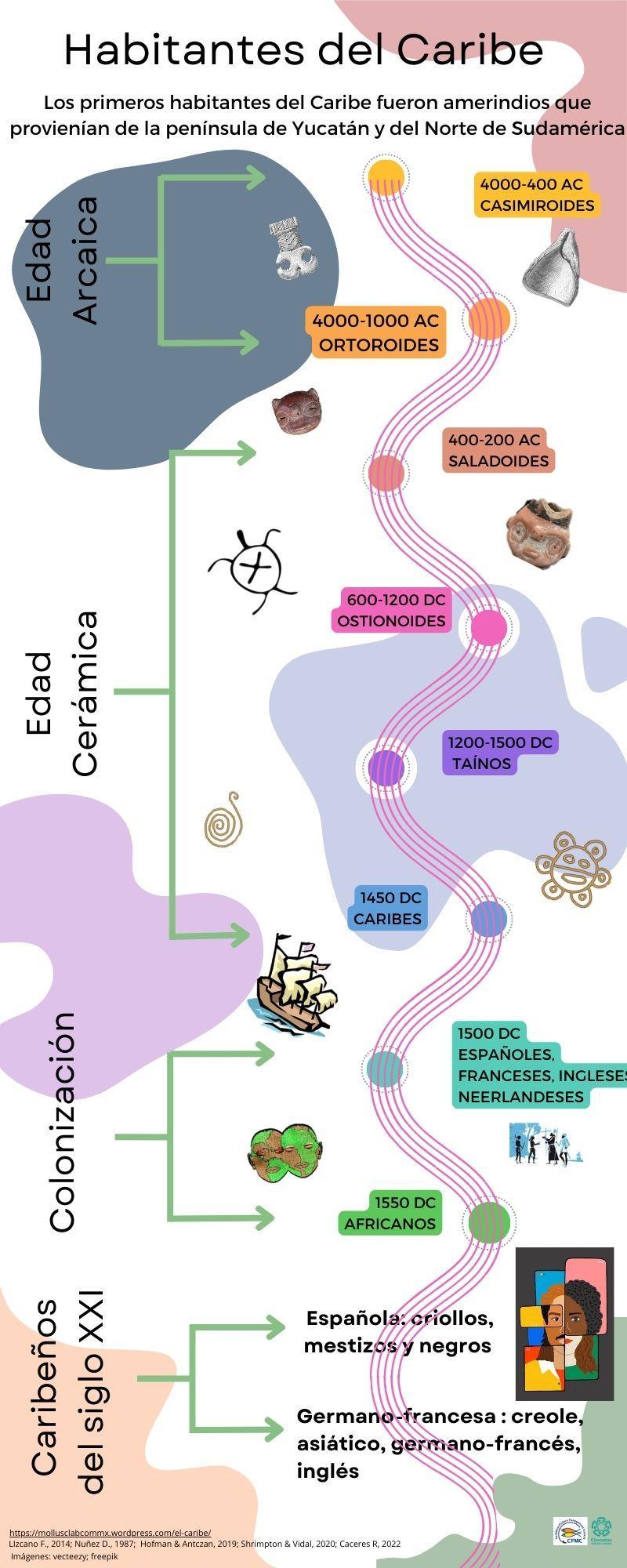
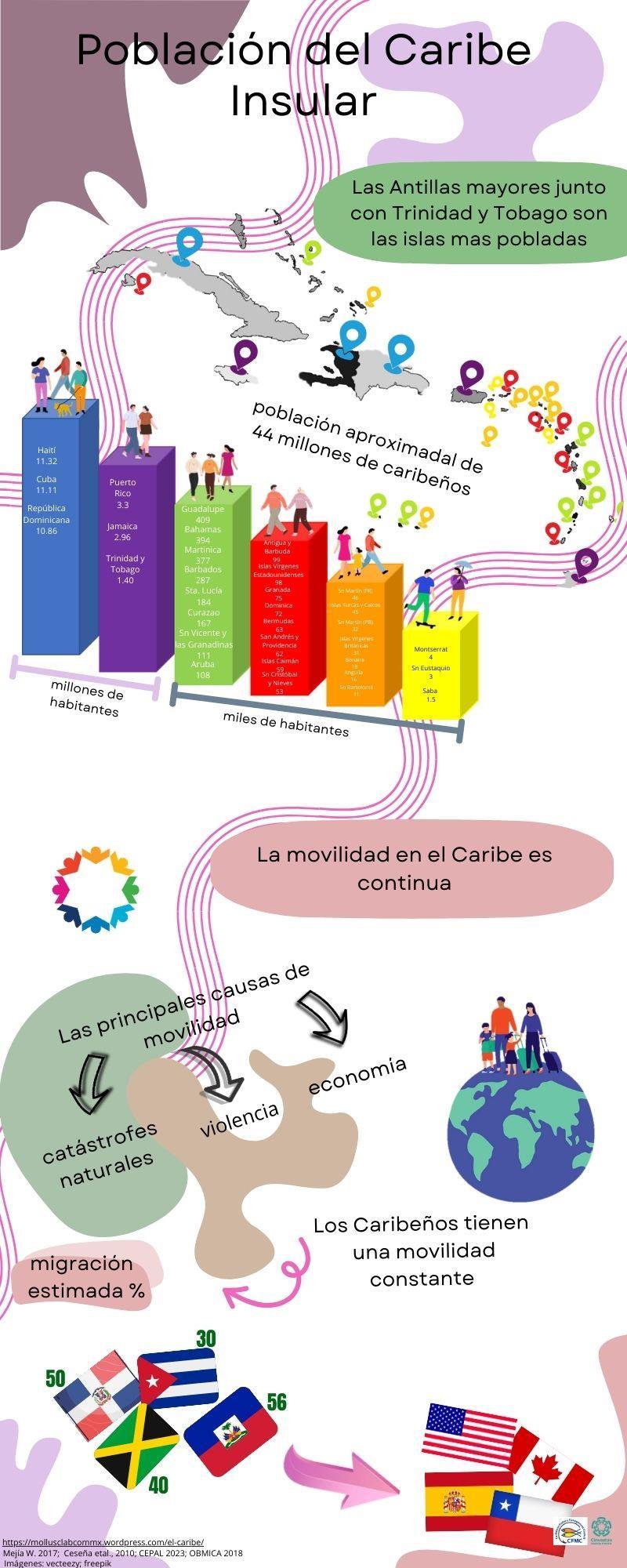
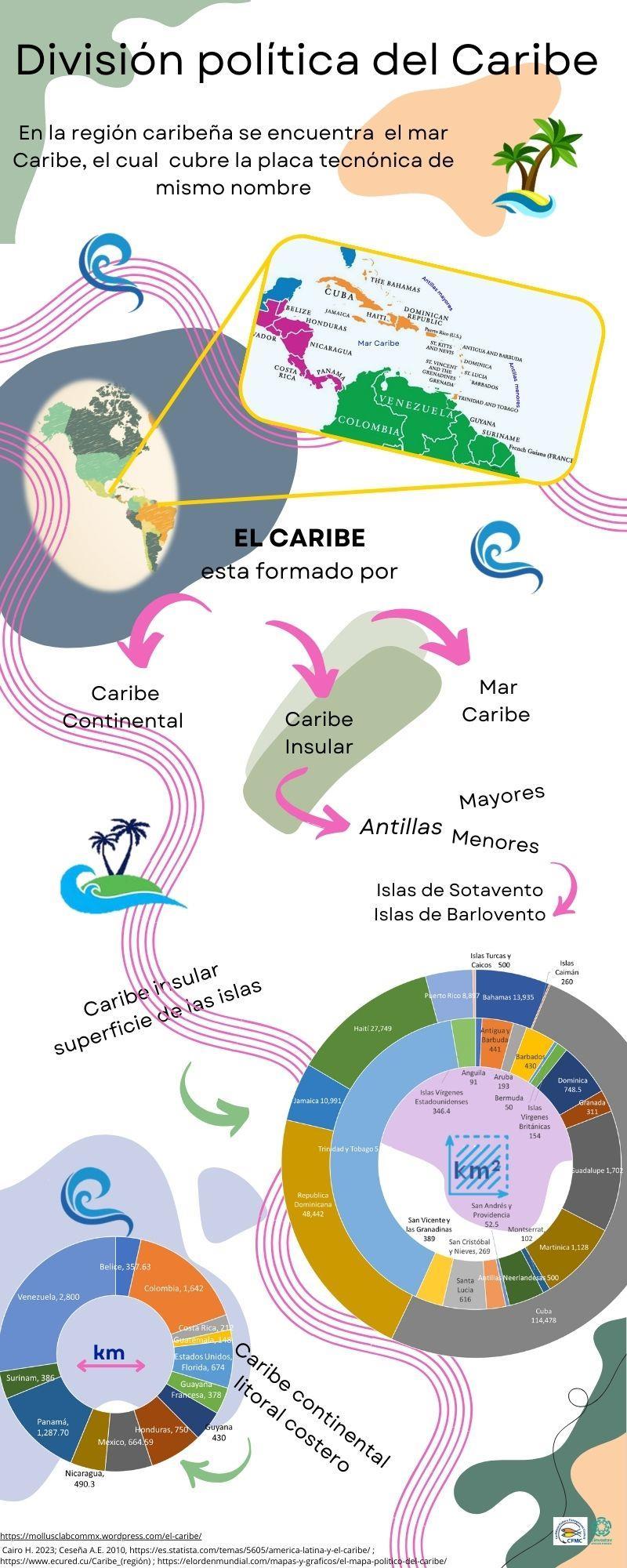
La Región Caribeña habla de los primeros habitantes que llegaron a poblar las islas y la evolución, hasta llegar a los habitantes modernos, se titula “Habitantes del Caribe”, seguida por la que nos dice cuantos habitantes viven en cada isla del Caribe “Población del Caribe Insular”, la siguiente presenta la “División política del Caribe, donde se señal al Caribe insular y Continental y se muestra el tamaño de cada isla y línea costera que lo conforman, por último se presentan los lugares naturales más emblemáticos de la región “Naturaleza del Caribe”
Economía del Caribe es el segundo tema que se aborda, donde se trata de identificar las principales actividades económicas de la región, donde sorpresivamente más del 90% de los países considera los servicios turísticos como principal actividad. En la siguiente se dan datos de la situación económica de la región, datos complicados porque se dan en conjunto con los de América Latina.
Contaminación plástica, este tema abarca los datos de producción de plástico, y como estos pueden afectar los ecosistemas marinos, se da una explicación de como se forman los microplásticos y se presentas datos de los plásticos en el mar Caribe.
Microplásticos en el Caribe, es un resumen de los trabajos científicos que se han realizado en la región caribeña, se presentan datos de microplásticos en orhganismos marinos, arena y agua de mar. El Caribe da un final a esta serie de infografías con una
reflexiones o conclusiones y acciones para desarrollar en la región, bastante complicado al ser tan megadiversa en lenguas, razas, cultura, economía…