GIÁO ÁN HÓA HỌC THEO
CÔNG VĂN 5512
vectorstock com/28062440

Ths Nguyễn Thanh Tú
eBook Collection
GIÁO ÁN CHUYÊN ĐỀ HÓA HỌC 10 CHÂN TRỜI
SÁNG TẠO (BÀI 1-10) THEO CÔNG VĂN 5512 (2
CỘT) CƠ SỞ HÓA HỌC - HÓA HỌC TRONG VIỆC
PHÒNG CHỐNG CHÁY, NỔ - THỰC HÀNH HÓA
HỌC VÀ CÔNG NGHỆ THÔNG TIN
WORD VERSION | 2023 EDITION
ORDER NOW / CHUYỂN GIAO QUA EMAIL

TAILIEUCHUANTHAMKHAO@GMAIL COM
Tài liệu chuẩn tham khảo Phát triển kênh bởi
Ths Nguyễn Thanh Tú Đơn vị tài trợ / phát hành / chia sẻ học thuật : Nguyen Thanh Tu Group
Hỗ trợ trực tuyến Fb www.facebook.com/DayKemQuyNhon
Mobi/Zalo 0905779594
I. MỤC TIÊU:
CHUYÊN ĐỀ 1: CƠ SỞ HÓA HỌC
BÀI 1: LIÊN KẾT HÓA HỌC ( 3 TIẾT)
1. Kiến thức, kĩ năng: Học xong bài này, HS đạt các yêu cầu sau:
• Viết được công thức Lewis, sử dụng được mô hình VSEPR để dự đoán dạng hình học của một số phân tử đơn giản.
• Trình bày được khái niệm về sự lai hóa AO (sp, sp2, sp3), vận dụng giải thích
liên kết trong một số phân tử
2. Năng lực
- Năng lực chung:
• Năng lực tự chủ và tự học trong tìm tòi khám phá
• Năng lực giao tiếp và hợp tác trong trình bày, thảo luận và làm việc nhóm
• Năng lực giải quyết vấn đề và sáng tạo trong thực hành, vận dụng.
- Năng lực riêng:
• Viết được công thức Lewis của một chất hay ion, từ đó viết được các cấu tạo cộng hưởng (nếu có) của một số chất hay ion; hiểu được mô hình VSEPR và xác định được hình học của các phân tử, ion.
• Tim hiểu thế giới tự nhiên dưới góc độ hoá học: Hoá học giúp con người khám phá, hiểu biết những bíản của tự nhiên (ví dụ phân tử H O có dạng góc; CH có dạng tứ diện đều; CO có dạng đường thẳng, ...).
• Vận dụng kiến thức, kĩ năng đã học: Giải thích được hình học phân tử các chất xung quanh.
3. Phẩm chất
- Có ý thức học tập, ý thức tìm tòi, khám phá và sáng tạo, có ý thức làm việc nhóm, tôn trọng ý kiến các thành viên khi hợp tác.
- Chăm chỉ tích cực xây dựng bài, có trách nhiệm, chủ động chiếm lĩnh kiến thức theo sự hướng dẫn của GV.
II. THIẾT BỊ DẠY HỌC VÀ HỌC LIỆU
1. Đối với GV: SGK, Tài liệu giảng dạy, giáo án, đồ dùng dạy học, bảng tuần hoàn nguyên tố hóa học, tranh ảnh về sự lai hóa orbital nguyên tử
2. Đối với HS: SGK, SBT, vở ghi, giấy nháp, đồ dùng học tập (bút, thước...), bảng nhóm, bút viết bảng nhóm, bảng tuần hoàn nguyên tố hóa học, tranh ảnh về sự lai hóa orbital nguyên tử.
III. TIẾN TRÌNH DẠY HỌC
A. HOẠT ĐỘNG KHỞI ĐỘNG (MỞ ĐẦU)
a) Mục tiêu:
- Gợi tâm thế vào bài học cho HS.
b) Nội dung: HS đọc tình huống mở đầu, suy nghĩ trả lời câu hỏi.
c) Sản phẩm: HS trả lời được câu hỏi mở đầu, bước đầu có hình dung về nội dung
bài học: tìm hiểu các yếu tố quyết định hình học phân tử của chất.
d) Tổ chức thực hiện:
Bước 1: Chuyển giao nhiệm vụ:
- GV yêu cầu HS quan sát một số hình ảnh:
Hình ảnh phân tử BeCl2:
Hình ảnh phân tử BF3:
Hình ảnh phân tử CH4:
Hình học phân tử (hình dạng phân tử) của một chất rất quan trọng trong việc xác
định cách thức phân tử chất đó tương tác và phản ứng với các phân tử chất khác.
Hình học phân tử cũng ảnh hưởng đến nhiệt độ sôi và nhiệt độ nóng chảy của chất.
Nhiều đặc tính của chất được giải thích từ dữ liệu hình học phân tử của nó.
Yếu tố nào quyết định hình học phân tử các chất?
Bước 2: Thực hiện nhiệm vụ: HS quan sát và chú ý lắng nghe, thảo luận nhóm đôi
hoàn thành yêu cầu.
Bước 3: Báo cáo, thảo luận: GV gọi một số HS trả lời, HS khác nhận xét, bổ sung.
Bước 4: Kết luận, nhận định: GV đánh giá kết quả của HS, trên cơ sở đó dẫn dắt HS vào bài học mới.
B. HÌNH THÀNH KIẾN THỨC MỚI
Hoạt động 1: Công thức Lewis
a) Mục tiêu:
- HS viết được công thức Lewis.
b) Nội dung:

HS đọc SGK, nghe giảng, thực hiện các nhiệm vụ được giao, suy nghĩ trả lời câu hỏi, làm Câu hỏi 1, 2, 3, Vận dụng.
c) Sản phẩm: HS hình thành được kiến thức bài học, viết được công thức Lewis của các phân tử và ion.
d) Tổ chức thực hiện:
HĐ CỦA GV VÀ HS SẢN PHẨM DỰ KIẾN
Bước 1: Chuyển giao nhiệm vụ:
- GV cho HS nhắc lại về công thức
electron. HS tìm hiểu nội dung SGK và



kiến thức đã học trình bày:
+ Thế nào là công thức Lewis?
+ Trình bày sự khác nhau giữa công thức electron và công thức Lewis?
- GV cho HS đọc Ví dụ 1, 2, HS áp dụng thực hiện:
+ Viết công thức electron và công thức
Lewis của HCl, và O2
- HS thảo luận trả lời câu hỏi Thảo luận:
1. Công thức Lewis
a) Tìm hiểu công thức electron và công thức theo Lewis
Công thức electron
Khi biểu diễn liên kết giữa các nguyên tử bằng một hay nhiều cặp electron dùng chung, ta được công thức electron.
Công thức Lewis:
Công thức Lewis được viết dựa trên công thức electron, trong đó mỗi cặp electron
1. Viết công thức Lewis của nguyên tử oxygen và nguyên tử magnesium.
2. Viết công thức electron của phân tử CH4.
- HS trả lời Vận dụng: Khi dùng chlorine để khử trùng hồ bơi, chlorine sẽ phản ứng với urea trong nước tiểu và mồ hôi người tắm tạo hợp chất nitrogen trichloride gây ra nhiều tác động xấu đến sức khoẻ như đỏ mắt, hen suyễn,... Viết công thức Lewis của nitrogen trichloride.
- GV yêu cầu HS tìm hiểu SGK, thảo luận nhóm đôi tìm hiểu:
+ Trình bày các bước để viết công thức Lewis.
- GV hỏi thêm:
+ Ở bước 1: hãy nêu lại cách xác định electron hóa trị của một nguyên tử? Nêu lại electron hóa trị của các nguyên tử theo nhóm A?
(Các electron thuộc lớp ngoài cùng hoặc sát lớp ngoài cùng tham gia vào quá trình tạo thành liên kết.
dùng chung trong công thức electron
bằng một gạch nối "-".
Ví dụ 1, 2 (SGK -tr5)
Ví dụ: HCl O2
Nhóm IA: 1 electron hóa trị, nhóm IIA: 2 electron hóa trị, tương tự với các nhóm


khác từ IIIA đến VIIIA).
- HS đọc Ví dụ 3, GV đặt câu hỏi:
+ Giải thích cách tính tổng số electron hóa trị của CO2?
(C thuộc nhóm IVA có 4 electron hóa trị,
O thuộc nhóm VIA có 6 electron hóa trị).
+ GV hướng dẫn HS thực hiện Bước 3 và
4
b) Tìm hiểu quy tắc viết công thức Lewis của một phân tử hay ion
Bước 1: Tính tổng số electron hóa trị của phân tử hay ion cần biểu diễn.
Thảo luận:
1. Cấu trúc Lewis của nguyên tử oxygen và nguyên tử magnesium:
- HS thực hiện theo nhóm đôi trả lời câu hỏi Thảo luận 3, 4, 5. GV hướng dẫn, yêu
cầu HS giải thích.
3. Hãy tính tổng số electron hoá trị của phân tử
Bước 2: Xác định nguyên tử trung tâm và vẽ sơ đổ khung biểu diễn liên kết giữa nguyên tử trung tâm với các nguyên tử xung quanh qua các liên kết đơn. Nguyên tử trung tâm thường là nguyên tử có độ âm điện nhỏ hơn (ngoại trừ một số trường hợp như Cl2O, Br2O, H2O, NH3, CH4, …)
Bước 3: Hoàn thiện octet cho các nguyên tử có độ âm điện lớn hơn (trừ hydrogen) trong sơ đồ.
2. Công thức electron của phân tử
methane CH :




4. Xác định nguyên tử trung tâm trong . Lập sơ đồ khung của phân tử .
5. Thực hiện Bước 3 cho phân tử và cho biết có cần tiếp tục bước 4 ?
- HS thực hiện Luyện tập:
Vận dụng:
Công thức Lewis của NCl3:
Viết công thức Lewis của phân tử
Bước 2: Thực hiện nhiệm vụ:
Tính số electron hoá trị chưa tham gia liên kết bằng cách lấy tổng số electron trừ số electron tham gia tạo liên kết. Nếu electron hoá trị còn dư, đặt số electron hoá trị dư trên nguyên tử trung tâm. Kiểm tra nguyên tử trung tâm đã đạt quy tắc octet chưa. Nếu nguyên tử trung tâm chưa đạt quy tắc octet, chuyển sang

Bước 4.
Bước 4: Chuyển cặp electron chưa liên kết trên nguyên tử xung quanh thành
- HS theo dõi SGK, chú ý nghe, tiếp nhận kiến thức, hoàn thành các yêu cầu, hoạt động cặp đôi, kiểm tra chéo đáp án.
- GV quan sát, hỗ trợ.
Bước 3: Báo cáo, thảo luận:
- HS giơ tay phát biểu, lên bảng trình bày
- Một số HS khác nhận xét, bổ sung cho bạn.
Bước 4: Kết luận, nhận định: GV tổng quát lưu ý lại kiến thức trọng tâm và yêu
cầu HS ghi chép đầy đủ vào vở.
electron liên kết sao cho nguyên tử trung
tâm thoả mãn quy tắc octet.
Ví dụ 3 (SGK-tr6)
Thảo luận 3:
Tổng số electron hoá trị của BF 3
7 3 24

Thảo luận 4:
Nguyên tử trung tâm trong BF là B. Sơ
đồ khung phân tử BF :
electron ngoài cùng đã trở nên bền vững.
Do đó không cần tiến hành bước 4 và
công thức Lewis của BF là
Luyện tập:
Thảo luận 5:
Hoàn thiện octet cho nguyên tử có độ âm
điện lớn hơn:
Các nguyên tử fluoride đã đạt octet. Mặt
khác số electron hoá trị chưa tham gia



liên kết là 24 24 0 nên không còn
electron hoá trị dứ trên .
Nguyên tử chưa đạt octet. Tuy nhiên, là trường hợp ngoại lệ, chỉ cần đạt 6
Hoạt động 2: Hình học một số phân tử
a) Mục tiêu:
- HS sử dụng được mô hình VSEPR để dự đoán dạng hình học của một số phân tử đơn giản.
b) Nội dung: HS đọc SGK để tìm hiểu nội dung kiến thức theo yêu cầu của GV, chú ý nghe giảng, thực hiện nhiệm vụ được giao, thảo luận trả lời câu hỏi, làm Luyện tập.
c) Sản phẩm: HS hình thành kiến thức bài học, dự đoán mô hình của một số phân tử
d) Tổ chức thực hiện:
Bước 1: Chuyển giao nhiệm vụ:
- GV giới thiệu cho HS về mô hình
VSEPR và công thức phân tử với dưới dạng
AXnEm
+ Giải thích sự phân bố về phương diện hình học của các cặp electron xung quanh nguyên tử trung tâm dựa trên sự đẩy của các cặp electron đó.
+ Phân biệt cặp electron chung và cặp electron riêng trong một phân tử.
Ví dụ: xác định cặp electrong chung và riêng của nguyên tử trung tâm của CO2, NO2)
(CO2: Không có electron riêng, NO2: có 1 electron riêng vì công thức Lewis là:


2. Hình học một số phân tử
a) Tìm hiểu mô hình VSEPR
- Liên kết cộng hóa trị là liên kết có tính định
hướng trong không gian, làm phân tử có
những hình dạng nhất định, đó là hình học
phân tử.
- Mô hình VSEPR dựa vào sự đẩy nhau giữa
các cặp electron riêng của nguyên tử trung
tâm trong công thức Lewis để dự đoán hình
dạng phân tử hoặc ion.
- Công thức các chất viết dưới dạng AXnEm
A: nguyên tử trung tâm;
X: nguyên tử xung quanh (phối tử);
n: là số nguyên tử X đã liên kết với nguyên
tử A.
E: cặp electron riêng của nguyên tử A (cũng

có thể là 1 electron hóa trị riêng của A, như
trong trường hợp NO2).
m là cặp electron riêng của nguyên tử A.
Từ đó ta có công thức của NH3 theo mô hình VSEPR là: NH3E.
- GV cho HS làm câu hỏi Thảo luận 6, 7, 8 thực hiện theo nhóm 4.
Thảo luận 6:
Theo công thức Lewis của nước, phân tử nước có bao nhiêu cặp electron chung và bao nhiêu cặp electron riêng ở nguyên tử trung tâm?
Thảo luận 7:
Xác định giá trị n, trong công thức VSEPR của phân tử . Cho biết công thức Lewis của là:
Thảo luận 6:
Công thức Lewis của HO là:
- GV phân tích Ví dụ 4 cho HS hiểu:
+ Xác định nguyên tử trung tâm A = N.
+ Xác định phối tử X = H.
+ Xác định số cặp electron riêng của
A thì m = 1.

Giá trị (n + m) quyết định hình học phân tử
AXnEm.
Ví dụ 4 (SGK -tr7)
Thảo luận 8:
Viết công thức VSEPR của và .
- GV giới thiệu nội dụng mô hình VSEPR.
- GV cho HS hoạt động nhóm 4 thực hiện Phiếu học tập.
- GV chốt lại kiến thức trọng tâm.
Như vậy trong phân tử nước, nguyên tử trung tâm có 2 cặp electron chung và 2 cặp electron riêng.

Thảo luận 7:
Phân tử SO có 2, 1. Công thức VSEPR của SO là AXE.
Thảo luận 8:
- GV có thể giới thiệu về trường hợp tổng quát:
Tổng quyết định dạng hình học của phân tử
m n 2AXE phân tử có dạng đoạn thẳng;
3AXE và AX E
phân tử có dạng tam giác phẳng; m n 4AXE,AXE và
AX E
phân tử có dạng tứ diện.
- HS thực hiện Luyện tập theo nhóm đôi.
Sử dụng mô hình VSEPR để dự đoán hình học của phân tử .
- GV có thể cho HS một số hình ảnh minh họa trực quan hơn: https://www.youtube.com/watch?v=
nxebQZUVvTg (Từ 0:42 đến 18:00).
Bước 2: Thực hiện nhiệm vụ:
- HS theo dõi SGK, chú ý nghe, tiếp nhận kiến thức, hoàn thành các yêu
Nội dung mô hình VSEPR bao gồm:
1. Hình học phân tử phụ thuộc vào tổng số các cặp electron hóa trị của nguyên tử trung tâm (n + m).
2. Các cặp electron hóa trị được phân bố xùng quanh nguyên tử trung tâm sao cho lực đẩy giữa chúng là nhỏ nhất.
3. Lực đẩy của các cặp electrong chung (X) và cặp electron riêng (E) giảm theo thứ tự:
E – E > E – X > X – X.

b) Mô tả hình học một số phân tử
Bảng 1.1 (SGK- tr8)
Hình học một số phân tử chỉ phụ thuộc vào
tổng số các cặp electron hóa trị (liên kết và
chưa liên kết) của nguyên tử trung tâm.
Luyện tập:
Công thức Lewis của phân tử CS2 là:
cầu, hoạt động cặp đôi, kiểm tra chéo
đáp án.
- GV: quan sát và trợ giúp HS.
Bước 3: Báo cáo, thảo luận:
- HS giơ tay phát biểu, lên bảng trình
bày
- Một số HS khác nhận xét, bổ sung cho bạn.
Bước 4: Kết luận, nhận định: GV
tổng quát lưu ý lại kiến thức trọng tâm và yêu cầu HS ghi chép đầy đủ vào vở.
Như vậy công thức VSEPR của phân tử CS2 là AX2 nên phân tử CS2 có dạng đường thẳng.
PHIẾU HỌC TẬP
Câu 1: Viết công thức phân tử, công thức electron và công thức Lewis của H2O, CO2, SO2, NH3 và ion ,
Câu 2: Viết công thức VSEPR cho lần lượt các phân tử và ion đã cho. Tổng giá trị (n + m) trong mỗi công thức VSEPR là bao nhiêu?
Câu 3: Dự đoán hình học các phân tử và ion.
Điền vào bảng sau:
Phân tử/ ion Công thức electron Công thức Lewis Công thức Lewis. Tổng
(n+m)
Dự đoán
hình học các phân tử và ion
Trường hợp nào góc liên kết không đúng với lí thuyết? Theo em đâu là nguyên nhân gây ra sự khác biệt?
Bảng 1.1:

Hoạt động 3: Sự lai hóa orbital nguyên tử
a) Mục tiêu:


- Trình bày được khái niệm về sự lai hóa AO (sp, sp2, sp3), vận dụng giải thích liên kết trong một số phân tử.
b) Nội dung: HS đọc SGK, nghe giảng, thực hiện các nhiệm vụ được giao, suy nghĩ trả lời câu hỏi, làm Luyện tập.
c) Sản phẩm: HS hình thành được kiến thức bài học, giải thích liên kết trong một số phân tử.
d) Tổ chức thực hiện:
HĐ CỦA GV VÀ HS
Bước 1: Chuyển giao nhiệm vụ: Nhiệm vụ 1: Tìm hiểu khái niệm lai hóa orbital
- GV đặt vấn đề: Khi sử dụng sự xen phủ các orbital nguyên tử tạo thành liên kết hóa học, không giải thích được góc liên kết ở một số trường hợp.
- GV dẫn dắt: lấy ví dụ về CH4
+ 4 orbital lai hóa xen phủ với các orbital
1s của bốn nguyên tử H, tạo ra bốn liên kết – , nên góc liên kết trong tứ diện đều (có nguyên tử C ở tâm)
bằng 109,5 .
- Để giải thích có thể sử dụng khái niệm lai hóa orbital.
- HS tìm hiểu SGK, trả lời:
+ Thế nào là lai hóa orbital?


+ Điều kiện để các AO nguyên tử có lai hóa với nhau?
- GV cho HS thảo luận trả lời câu hỏi Thảo luận 9, 10, 11:
SẢN PHẨM DỰ KIẾN
3. Sự lai hóa orbital nguyên tử
a) Tìm hiểu khái niệm lai hóa orbital
- Lai hóa orbital là sự tổ hợp các orbital của cùng một nguyên tửđể tạo thành các orbital mới có năng lượng bằng nhau, hình dạng và kích thước giống nhau, nhưng định hướng khác nhau trong không gian.
- Điều kiện để các orbital nguyên tử (AO) có thể lai hóa với nhau là chúng có năng lượng gần bằng nhau.
- Số AO lai hóa bằng tổng số AO tham gia lai hóa.
Ví dụ: mô hình mô phỏng cấu trúc phân tử methane
9. Vì sao góc liên kết trong phân tử methane không thể là 90∘ ?
10. Em có nhận xét gì về hình dạng, kích thước, năng lượng và hướng của các orbital nguyên tử lai hóa?
11. Nếu tổng số các AO tham gia lai hóa là 3 sẽ tạo ra bao nhiêu AO lai hóa?
- GV lưu ý:
+ Các obital lai hoá không tồn tại trong các nguyên tử độc lập. Chúng chỉ được hình thành trong các phân tử có liên kết cộng hoá trị
+ Các obital lai hoá có hình dạng, kích thước và hướng khác với các obital nguyên tử trong các nguyên tử độc lập.
+ Sự xen phủ của obital lai hoá tạo thành liên kết
+ Các cặp electron riêng thường hiện diện trong các obital lai hoá.
+ Theo thuyết VSERP, để giảm tối đa lực đẩy giữa bốn cặp electron chung trong phân
tử CH bốn cặp electron này phải chiếm
bốn khu vực điện tích âm sao cho lực đẩy giữa chúng là nhỏ nhất. Do đó góc liên kết không thể là 90∘ mà là 109,5°, ứng với cấu trúc tứ diện đều.
+ Kết quả này hoàn toàn phù hợp với thực nghiệm là trong phân tử methane, 4 liên kết
C-H đều có độ dài tương đương là 109pm, có độ bên liên kết là 429Kj/mol và có các góc liên kết HCH là 109,5∘ .
+ Điều này được giải thích là do trong nguyên tử C của phân tử methane, 1AO 2s
đã tổ hợp với 3AO2p, tạo thành 4AO lai hoá , trong đó các thuỳ lớn hướng về bốn đỉnh của một tứ diện, góc giữa hai obital bất kì là 109,5°.
Thảo luận 9:
Thảo luận 10:
Nhiệm vụ 2: Tìm hiểu một số dạng lai hóa cơ bản
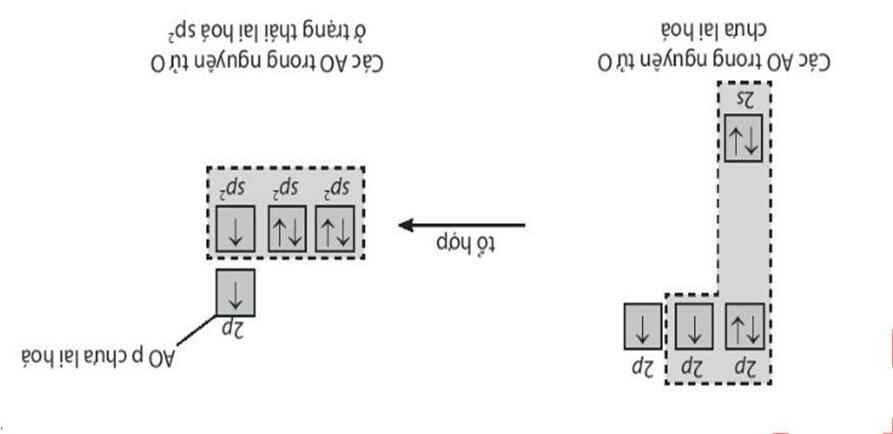
- GV giới thiệu: Một số trạng thái lai hóa cơ bản: sp, sp2, sp3

- GV đưa ra hình ảnh ví dụ về 3 phân tử: BeCl2, BF3, CH4 để HS tiếp cận đến 3
dạng lai hóa cơ bản.
+ BeCl2:
Các orbital nguyên tử lai hoá hoàn toàn
tương đồng về hình dạng, kích thước, năng
lượng và chỉ khác nhau về hướng trong
không gian
Thảo luận 11:
Do số AO lai hoá bằng tổng số AO tham gia
lai hoá nên nếu tổng số các AO tham gia lai
hoá là 3 sẽ tạo ra 3AO lai hoá.
b) Tìm hiểu một số dạng lai hóa cơ bản
a) Lai hóa sp
Trong một nguyên tử, 1 AO ns tổ hợp với 1
AO np tạo ra 2 AO lai hóa sp có góc liên
kết 180o .
Lai hóa sp còn được gọi là lai hóa đường
thẳng.
Ví dụ 5: BeCl2






b) Lai hóa sp2 :
Trong một nguyên tử, 1 AO ns tổ hợp với 2
AO np tạo ra 3 AO lai hóa sp2 hướng về 3
+ BF3:
đỉnh của một tam giác đều. 3 AO này nằm cùng một mặt phẳng. Góc tạo bởi hai trục của hai AO là 120
Lai hóa sp2 còn được gọi là lai hóa tam giác.
+ CH4:
Ví dụ 6: BF3
c) Lai hóa sp3
Trong một nguyên tử, 1 AO ns tổ hợp với 3 AO np tạo ra 4 AO lai hóa sp3 hướng về 4
đỉnh của một tứ diện đều. Góc tạo bởi hai trục của hai AO là 109,5 .
Lai hóa sp3 còn được gọi là lai hóa tứ diện.
- GV cho HS thảo luận nhóm 4, tìm hiểu một số dạng lai hóa theo các ý:
+ Khái niệm, tên thường gọi. Các góc tạo bởi bằng bao nhiêu. Dạng hình học của các lai hóa đó.
+ Hình ảnh về sự hình thành các AO lai hóa.
+ Ví dụ của lai hóa đó.
- HS thực hiện các câu hỏi Thảo luận 12,
13, 14, 15.
12. Nguyên tử carbon trong phân tử ở trạng thái lai hoá nào? Giải thích liên kết hoá học tạo thành trong phân tử theo thuyết lai hoá.
13. Theo mô hình VSEPR, phân tử formaldehyde có dạng tam giác phẳng. Xác định trạng thái lai hoá của nguyên tử trung tâm C. Cho biết formaldehyde có công thức như hình sau:

Ví dụ 7: CH4 Thảo luận 12:
- Công thức Lewis của phân tử CO2 là:
14. Tương tự như công thức VSEPR, có thể dự đoán nhanh trạng thái lai hoá của nguyên tử (nguyên tố , ) trong phân tử bất kì như sau:
• Xác định số nguyên tử liên kết trực tiếp với .
• Xác định số cặp electron hoá trị riêng của
Một 2s tổ hợp với một 2 tạo hai lai hoá sp.
- Cấu hình electron của O ( Z = 8):




1 2 2
Một AO 2s tổ hợp với hai AO2 tạo ba AO lai hoá sp².
- Như vậy trong phân tử CO tổng liên kết và số cặp electron hoá trị riêng trên nguyên tử là 2 0 2 nên nguyên tử carbon ở trạng thái lai hoá sp; tổng liên kết và số cặp electron hoá trị còn dư trên mỗi
nguyên tử O là 1 2 3 nên mỗi nguyên tử oxygen đều ở trạng thái lai hoá sp².
- Cấu hình electron của 6:1 2 2
• Nếu tổng hai giá trị là 2; 3 hoặc 4 thì trạng thái lai hoá của A lần lượt là sp; sp² hoặc sp³.
Dự đoán trạng thái lai hoá của nguyên tử , và trong các phân tử và
. Ta có
15. Phân tử chứa nguyên tử lai hóa sp3 có
cấu trúc phẳng không? Giải thích và cho ví dụ.
- GV lưu ý câu 13;
+ Do tổng liên kết và số cặp electron hoá trị riêng trên trong là 3
- Mỗi nguyên tử C có 2 AO lai hóa sp, sẽ xen phủ với 1 Ao lai hóa sp2 của mỗi nguyên tử O tạo hai liên kết , còn 2 AO p không lai hóa của nguyên tử X sẽ xen phủ
với nhau từng đôi một với AO không lai hóa của mỗi nguyên tử O tạo thêm một liên kết giữa mỗi nguyên tử O như sau:
0 3 nên nguyên tử carbon trong
HCHO ở trạng thái lai hoá sp².
+ Nếu phân tử có dạng góc, trạng thái lai hoá của nguyên tử trung tâm
ảnh hưởng đến giá trị của góc liên kết AXA. Ví dụ trong ở trạng thái lai hoá sp² có góc là 119∘ ; trong (nước) ở trạng thái lai hoá sp có góc là 104,5∘
- GV hướng dẫn tổng quát:
+ Tổng số liên kết của nguyên tử trung tâm A với các nguyên tử xung quanh X+ số cặp electron hóa trị của A chưa liên kết.
(Cặp electron liên kết được biểu diễn bằng dấu gạch, electron chưa liên kết có thể là electron độc thân và liên kết kép được coi là 1 liên kết).

+ Nếu tổng số này là 2 thì trạng thái lai hóa sp, là 3 thì trạng thái lai hóa sp2, là 4 thì trạng thái lai hóa sp3 .
- Ví dụ: Nguyên tử C trong CO2 (O=C=O) chỉ có 2 liên kết nên ở trạng thái lai hóa sp.
Thảo luận 13:
Với cấu trúc tam giác phẳng, trạng thái lai hoá của nguyên tử carbon (C) trong phân tử formaldehyde phải là sp .
Thảo luận 14:
• Xác định số nguyên tử liên kết trực tiếp với .
• Xác định số cặp electron hoá trị riêng của A
• Nếu tổng hai giá trị là 2; 3 hoặc 4 thì trạng thái lai hoá của A lần lượt là sp; sp² hoặc sp³.
Dự đoán trạng thái lai hoá của nguyên tử C, S, và N trong các phân tử CO2; SO2 và NH3:
Nguyên tử N trong NO2 (O-N=O) có 3


liên kết nên ở trạng thái lai hóa sp2 .
- GV chú ý cho HS: Các kiểu lai hóa
quyết định dạng hình học của phân tử
+ Lai hoá sp: đường thẳng
+ Lai hoá sp²: tam giác phẳng
+ Lai hoá sp : hình tứ diện (hoặc tháp tam giác)
Bước 2: Thực hiện nhiệm vụ:
- HS theo dõi SGK, chú ý nghe, tiếp nhận kiến thức, hoàn thành các yêu cầu, hoạt
động cặp đôi, kiểm tra chéo đáp án.
Bước 3: Báo cáo, thảo luận:
- HS giơ tay phát biểu, lên bảng trình bày
- Một số HS khác nhận xét, bổ sung cho
bạn.
Bước 4: Kết luận, nhận định: GV tổng
quát lưu ý lại kiến thức trọng tâm và yêu
cầu HS ghi chép đầy đủ vào vở.
Bảng tổng kết:
Thảo luận 15:
- Lai hoá sp³ là lai hoá tứ diện nên phân tử chứa nguyên tử lai hoá sp³ không thể có cấu trúc phẳng nếu công thức VSEPR của phân
tử có dạng AX (nhứCH ,… hoặc AXXE (như NH,… .
- Trong trường hợp công thức VSEPR có dạng AXE (như HO, …), phân tử có cấu trúc phẳng. Cấu trúc phẳng cũng gặp trong
trường hợp phân tử có chứa nguyên tử lai hoá sp như Cl,…






 C. HOẠT ĐỘNG LUYỆN TẬP
C. HOẠT ĐỘNG LUYỆN TẬP
a) Mục tiêu: Học sinh củng cố lại kiến thức đã học.
b) Nội dung: HS vận dụng các kiến thức của bài học làm Luyện tập (SGK -tr12),
Bài tập 1, 2, 3 (SGK- tr12).
c) Sản phẩm học tập: HS giải được bài về công thức Lewis, dự đoán cấu trúc hình học của một số phân tử, sự lai hóa orbital nguyên tử
d) Tổ chức thực hiện:

Bước 1: Chuyển giao nhiệm vụ:
- GV tổng hợp các kiến thức cần ghi nhớ cho HS.
1. Công thức Công thức Lewis dùng biễu diễn liên kết hoá học trong phân tử cộng hoá trị.
2. Mô hình VSEPR dùng biểu diễn dạng hình học của phân tử do sức đẩy khác nhau giữa các cặp electron liên kết và chưa liên kết.

3. Sự lai hoá dùng giải thích một số hiện tượng thực tế quan sát được hoặc đo lường được.
- GV tổ chức cho HS hoạt động theo nhóm làm Luyện tập (SGK -tr12), Bài tập 1, 2, 3 (SGK- tr12).
Luyện tập:
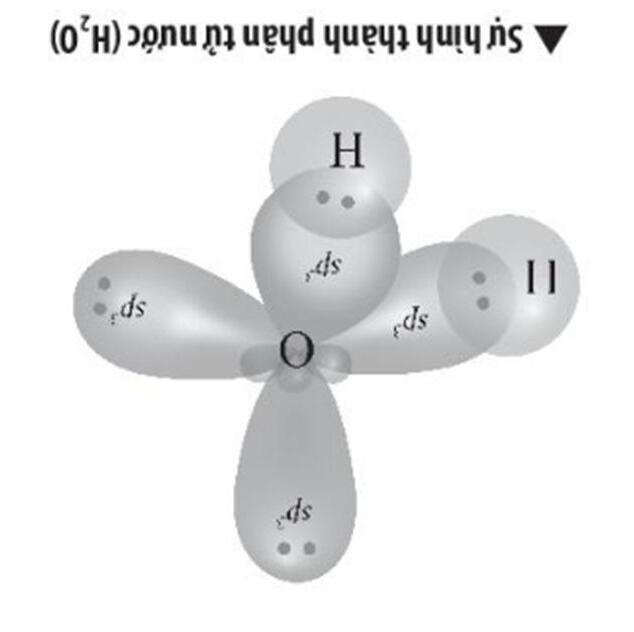
Biết nguyên tử oxygen trong phân tử H2O ở trạng thái lai hóa sp3. Trình bày sự hình thành liên kết hóa học trong phân tử H2O.
Bước 2: Thực hiện nhiệm vụ: HS quan sát và chú ý lắng nghe, thảo luận nhóm, hoàn thành các bài tập GV yêu cầu.
- GV quan sát và hỗ trợ
Bước 3: Báo cáo, thảo luận:
- Mỗi bài tập GV mời HS trình bày. Các HS khác chú ý chữa bài, theo dõi nhận xét bài trên bảng.
Bước 4: Kết luận, nhận định:
- GV nhận xét thái độ làm việc, phương án trả lời của các học sinh, ghi nhận và tuyên dương.
Kết quả: Luyện tập:
Một AO 2s tổ hợp với ba AO 2p tạo bốn AO lai hoá sp3 .
- Nguyên tử O có 4 AO lai hóa sp3, trong đó có 2 AO chứa 1 electron. Hai AO này sẽ xen phủ với AO 1s của mỗi nguyên tử H tạo hai liên kết như sau:
Do đó phân tử SO có dạng tam giác phẳng, góc hoá trị liên kết là 120∘ :
Bài tập:
Bài 1. Công thức Lewis của:
a) HCN:
c) Phân tử PH có n 3,m 1 nên công thức VSEPR có dạng AX E :
b) SO
Do đó phân tử PH có dạng hình chóp tam giác:
Bài 2. a) Phân tử có 2, 0 nên công thức VSEPR có dạng :








Do đó phân tử HCN có dạng đường thẳng, góc hoá trị liên kết là 180∘ :
Bài 3. a) CH
Nguyên tử carbon trong phân tử CH ở trạng thái lai hoá sp.
Cấu hình electron của 6:1 2 2
Một AO 2s tổ hợp với một AO2p tạo hai AO lai hoá sp.
b) Phân tử SO có n 3,m 0 nên công thức VSEPR có dạng AX :
Mỗi nguyên tử C có 2AO lai hoá sp, sẽ xen phủ với mỗi AO1s của nguyên tử H và
AO lai hoá sp của nguyên tử còn lại, còn 2AO p không lai hoá sẽ xen phủ với nhau từng đôi một tạo thành hai liên kết giữa hai nguyên tử C.
Mỗi nguyên tử C có 3AO lai hoá sp², sẽ xen phủ với 2AO s của nguyên tử H và 1AO lai hoá sp của nguyên tử C còn lại, còn 1Aop không lai hoá sẽ xen phủ bên với nhau tạo thành liên kết giữa hai nguyên tử
b) CH
Nguyên tử carbon trong phân tử CH ở trạng thái lai hoá sp².
Cấu hình electron của 6:1 2 2

Một 2s tổ hợp với hai 2 tạo ba lai hoá :

c) NH3



Cấu hình electron của 7:1 2 2 .
Một AO 2s tổ hợp với ba AO2p tạo bốn AO lai hoá sp³:
Ba lai hoá của nguyên tử xen phủ với ba s của 3 nguyên tử hydrogen


tạo thành 3 liên kết hướng về 3 đỉnh của một tứ diện. Orbital của cặp electron

không liên kết hướng về đỉnh còn lại của tứ diện. Do sự có mặt của cặp electron
không liên kết này, góc liên kết trong phân tử NH bị giảm xuống còn 107∘, thay vì
109,5∘ .
D. HOẠT ĐỘNG VẬN DỤNG
a) Mục tiêu:
- Học sinh thực hiện làm bài tập vận dụng để nắm vững kiến thức.
b) Nội dung: HS sử dụng SGK và vận dụng kiến thức đã học để làm Bài tập 4 (SGK
-tr12) và bài tập thêm.
c) Sản phẩm: HS vận dụng kiến thức đã học giải quyết bài về cấu trúc hình học của
một số phân tử, sự lai hóa orbital nguyên tử.
d) Tổ chức thực hiện:
Bước 1: Chuyển giao nhiệm vụ
- GV yêu cầu HS hoạt động hoàn thành bài tập: Bài tập 4 (SGK -tr12).
- GV cho HS làm bài tập thêm:
Bài 1:
a) Hãy cho biết kiểu lai hóa của nguyên tử trung tâm và dạng hình học của phân tử
và ion dưới đây, đồng thời so sánh các góc liên kết của chúng: NO2, , .
b) So sánh momen lưỡng cực giữa 2 phân tử và . Giải thích.
Bước 2: Thực hiện nhiệm vụ
- HS suy nghĩ, trao đổi, thảo luận thực hiện nhiệm vụ.
- GV điều hành, quan sát, hỗ trợ.
Bước 3: Báo cáo, thảo luận
- Bài tập: đại diện HS trình bày kết quả thảo luận, các HS khác theo dõi, đưa ý kiến.
Bước 4: Kết luận, nhận định
- GV nhận xét, đánh giá, đưa ra đáp án đúng, chú ý các lỗi sai của học sinh hay mắc phải.
Đáp án:
Bài 4. Công thức Lewis của phân tử các chất đã cho lần lượt là:
Như vậy:
a) PCl : Tổng số nguyên tử liên kết trực tiếp với nguyên tử P và số cặp electron hoá trị riêng của P là 3 1 4 nên P trong PCl có trạng thái lai hoá SP
Hoặc công thức VSEPR của PCl là AX E nên có tổng n m 4. Vậy trạng thái lai hoá của nguyên tử trung tâm là
b) CS : Tổng số nguyên tử liên kết trực tiếp với nguyên tử và số cặp electron hoá trị riêng của là 2 0 2 nên trong CS có trạng thái lai hoá sp.
Hoặc công thức VSEPR của PCl là AX nên có tổng n m 2. Vậy trạng thái lai hoá của nguyên tử trung tâm là sp.
c) SO : Tổng số nguyên tử liên kết trực tiếp với nguyên tử S và số cặp electron hoá



trị riêng của S là 2 1 3 nên S trong SO có trạng thái lai hoá sp².
Hoặc công thức VSEPR của SO là AX E nên có tổng n m 3. Vậy trạng thái
lai hoá của nguyên tử trung tâm là
Đáp án bài thêm:
Bài 1:
a)
Góc liên kết giảm theo thứ ự , , do lai hóa sp nên góc 180 . , đều là lai hóa sp2, nhưng ảnh hưởng đẩy của cặp electron chưa liên kết của nguyên tử N trong mạnh hơn 1 electron chưa liên kết của nguyên tử N trong làm góc của hẹp hơn góc của
b) Momen lưỡng cực của NH3 mạnh hơn củ NF3 do:
- Ở NH3: Chiều của các momen liên kết và cặp electron chưa liên kết của N cùng hướng nên momen lưỡng cực tổng cộng của phân tử lớn hơn so với NF3
* HƯỚNG DẪN VỀ NHÀ
• Ghi nhớ kiến thức trong bài.
• Hoàn thành các bài tập trong SBT
• Chuẩn bị bài mới "Bài 2: Phản ứng hạt nhân".
Ngày soạn: .../.../...
Ngày dạy: .../.../...
BÀI 2: PHẢN ỨNG HẠT NHÂN (4 TIẾT)
• Nhận thức hoá học: Nêu được sự phóng xạ tự nhiên; lấy ví dụ về sự phóng xạ tự nhiên; phóng xạ nhân tạo, phản ứng hạt nhân.
I. MỤC TIÊU:
1. Kiến thức, kĩ năng: Học xong bài này, HS đạt các yêu cầu sau:
• Nêu được sơ lược về sự phóng xạ tự nhiên, lấy được ví dụ về sự phóng xạ tự nhiên.
• Vận dụng được các định luật bảo toàn số khối và điện tích cho phản ứng hạt nhân.
• Nêu được sơ lược về sự phóng xạ nhân tạo, phản ứng hạt nhân.
• Nêu được ứng dụng của phản ứng hạt nhân phục vụ nghiên cứu khoa học, đời sống và sản xuất.
• Nêu được ứng dụng điển hình của phản ứng hạt nhân: xác định niên đại cổ vật, các ứng dụng trong lĩnh vực y tế, năng lượng.
2. Năng lực - Năng lực chung:
• Năng lực tự chủ và tự học trong tìm tòi khám phá
• Năng lực giao tiếp và hợp tác trong trình bày, thảo luận và làm việc nhóm
• Năng lực giải quyết vấn đề và sáng tạo trong thực hành, vận dụng.
- Năng lực riêng:
• Tim hiểu thế giới tự nhiên dưới góc độ hoá học: Quan sát được hiện tượng tự nhiên có liên quan đến phản ứng hạt nhân, như Mặt trời, các ngôi sao, một số loại dược phẩm phóng xạ, hay khi nhìn thấy những cổ vật có ghi niên đại hàng trăm năm, ngàn năm, ...
• Vận dụng kiến thức, kĩ năng đã học: Vận dụng được các định luật bảo toàn số khối và điện tích cho phản ứng hạt nhân; vận dụng được kiến thức về phóng xạ và hạt nhân để biết ứng dụng vào nghiên cứu khoa học, đời sống và sản xuất, hay xác định niên đại cổ vật, các ứng dụng trong lĩnh vực y tế, năng lượng.
3. Phẩm chất
- Có ý thức học tập, ý thức tìm tòi, khám phá và sáng tạo, có ý thức làm việc nhóm, tôn trọng ý kiến các thành viên khi hợp tác.
- Chăm chỉ tích cực xây dựng bài, có trách nhiệm, chủ động chiếm lĩnh kiến thức theo sự hướng dẫn của GV.
II. THIẾT BỊ DẠY HỌC VÀ HỌC LIỆU
1. Đối với GV: SGK, Tài liệu giảng dạy, giáo án, đồ dùng dạy học.
2. Đối với HS: SGK, SBT, vở ghi, giấy nháp, đồ dùng học tập (bút, thước...), bảng nhóm, bút viết bảng nhóm.
III. TIẾN TRÌNH DẠY HỌC
A. HOẠT ĐỘNG KHỞI ĐỘNG (MỞ ĐẦU)
a) Mục tiêu:
- Gợi tâm thế vào bài học mới.
b) Nội dung: HS đọc tình huống mở đầu, suy nghĩ trả lời câu hỏi.
c) Sản phẩm: HS trả lời được câu hỏi mở đầu.
d) Tổ chức thực hiện:
Bước 1: Chuyển giao nhiệm vụ:
- GV cho HS đọc tình huống mở đầu:

Nhân loại luôn đi tìm những nguồn năng lượng xanh, sạch và chi phí thấp, nhưng năng lượng hóa thạch rẻ thì gây ô nhiễm môi trường, năng lượng tái tạo sạch thường có chi phí cao, năng lượng hạt nhân gây nên các rủi ro về phóng xạ. Những hạn chế trên sẽ được khắc phục khi công nghệ Mặt Trời nhân tạo phát triển thành công. Mặt Trời nhân tạo là lò phản ứng hạt nhân, thúc đẩy phản ứng xảy ra giữa 2 hạt nhân tritium và deuterium, nhằm giải phóng năng lượng phục vụ cho nhân loại. Phản ứng hạt nhân là gì? Phản ứng hạt nhân được ứng dụng trong những lĩnh vực nào?
Bước 4: Kết luận, nhận định: GV đánh giá kết quả của HS, trên cơ sở đó dẫn dắt
HS vào bài học mới.
B. HÌNH THÀNH KIẾN THỨC MỚI
Hoạt động 1: Phóng xạ tự nhiên
a) Mục tiêu:
- Nêu được sơ lược về sự phóng xạ tự nhiên, lấy được ví dụ về sự phóng xạ tự nhiên.
- Nêu được thành phần và đặc điểm tia phóng xạ.
- Nêu được định luật bảo toàn số khối và bảo toàn điện tích, áp dụng vào làm bài tập.
b) Nội dung: HS đọc SGK để tìm hiểu nội dung kiến thức theo yêu cầu của GV, chú ý nghe giảng, làm các câu hỏi thảo luận 1, 2, 3, 4, 5, 6, Luyện tập.
c) Sản phẩm: HS hình thành kiến thức bài học, HS viết được phương trình biểu diễn sự phóng xạ của các đồng vị, nêu được các thành phần của tia phóng xạ, đặc điểm, vận dụng định luật bảo toàn vào viết phương trình phản ứng.
d) Tổ chức thực hiện:
HOẠT ĐỘNG CỦA GV VÀ HS SẢN PHẨM DỰ KIẾN
Bước 1: Chuyển giao nhiệm vụ: Nhiệm vụ 1: Tìm hiểu về phóng xạ tự nhiên, thành phần và đặc điểm tia phóng
1. Phóng xạ tự nhiên
a) Tìm hiểu về phóng xạ tự nhiên Thảo luận 1:
Hiện tượng hạt nhân nguyên tử không
Bước 2: Thực hiện nhiệm vụ: HS quan sát và chú ý lắng nghe, thảo luận nhóm đôi hoàn thành yêu cầu.
Bước 3: Báo cáo, thảo luận: GV gọi một số HS trả lời, HS khác nhận xét, bổ sung.
xạ
- GV yêu cầu HS tìm hiểu nội dung SGK, trao đổi, trả lời câu hỏi Thảo luận 1, 2:
bền, tự biến đổi thành hạt nhân nguyên
1. Trong tự nhiên, có nhiều đồng vị không
bền như (tritium), , ,… chúng
bị biến đổi thành hạt nhân nguyên tử khác, hiện tượng này gọi là gì.
2. Quan sát Hình 2.1 và đọc thông tin, cho biết đồng vị uranium nào tồn tại phổ biến trong tự nhiên?
- GV cho HS tìm hiểu SGK và rút ra kiến thức: Thế nào là phóng xạ tự nhiên?
Chúng xuất hiện ở đâu?
- HS trao đổi nhóm đôi trả lời Luyện tập: Xét 2 quá trình sau:
(1) Đốt cháy than củi (carbon) sẽ phát ra nhiệt lượng nấu chín thực phẩm;
(2) Đồng vị phân huỷ theo phản ứng:
→ . Quá trình nào là phóng xạ tự nhiên? Giải thích.
tử khác, đồng thời phát ra tia phóng xạ
gọi là hiện tượng phóng xạ tự nhiên.
Thảo luận 2:
Uranium tồn tại trong tự nhiên 2 loại đồng vị phổ biến, U chiếm 0,711%, U chiếm 99,284% (và một lượng rất nhỏ ).
Kết luận:
Phóng xạ tự nhiên là hiện tượng các nguyên tố tự phát ra tia phóng xạ, không do tác động từ bên ngoài.
- Các nguyên tố phóng xạ tự nhiên xuất
hiện ở nhiều nơi: trong lòng đất, lớp đất
đá bề mặt, không khí, nguồn nước, ...
Luyện tập:
(1) Đốt cháy than củi, xảy ra phản ứng
hoá học như sau: C O ⟶ ∘ CO đồng
thời toả ra nhiệt lượng. Quá trình biến
đổi chất từ C thành CO , không làm biến
đổi hạt nhân nguyên tử carbon, nên
không là quá trình phóng xạ.
(2) Đồng vị C phân huỷ theo phản
ứng: C→ N , có sự biến đổi
- HS tìm hiểu thông tin SGK về thành
phần và đặc điểm tia phóng xạ HS trả lời câu hỏi Thảo luận 3, 4, 5.
3. Tia phóng xạ có những loại nào? Cho biết đặc điểm của từng loại.
4. Đặc điểm của hạt nhân nguyên tử xảy ra phóng xạ và khác nhau như thế nào? So sánh khối lượng và điện tích của hạt , .
5. Trong 3 loại phóng xạ , , , loại phóng xạ nào khác biệt cơ bản với 2 loại còn lại? Nêu sự khác biệt đó.
- GV chốt lại kiến thức, cho HS rút ra kết luận về tia phóng xạ gồm các hạt và bức
xạ điện từ
- HS thực hiện Luyện tập:
Khi chiếu chùm tia phóng xạ , , đi vào giữa 2 bản điện cực, hướng đi của các tia phóng xạ thay đổi như thế nào?
hạt nhân carbon thành nitrogen và phát
bức xạ , là quá trình phóng xạ tự nhiên.
b) Tìm hiểu thành phần và đặc điểm tia phóng xạ
Thảo luận 3:
-Tia phóng xạ bao gồm hạt alpha , beta và bức xạ điện từ gamma .
+ Hạt ( He là hạt nhân helium gồm 2 proton, 2 neutron và không có electron.
+ Hạt e có điện tích 1 và số khối bằng 0.
+ Hạt e còn gọi là positron, có cùng khối lượng với electron và mang điện tích +1.
+ Bức xạ không làm thay đổi hạt nhân trước và sau khi phát bức xạ, nhưng làm giảm năng lượng của hạt nhân.
Thảo luận 4:
+ Phóng xạ xảy ra trong các hạt nhân có nhiều neutron, khi neutron chuyển thành proton và electron có năng lượng cao.
+ Phóng xạ xảy ra trong các hạt nhân
có nhiều proton, khi proton chuyển
thành neutron và positron có năng lượng cao.
+ Hạt và hạt có cùng khối lượng với electron 9,11 10 g ; có

điện tích âm 1, có điện tích dương
1 .
Thảo luận 5:
Gamma có đặc điểm khác 2 loại phóng
xạ còn lại, là hạt không có khối lượng,
không mang điện tích và có tính đâm
xuyên mạnh. Vì vậy, sau khi phát ra
phóng xạ , số khối và điện tích hạt nhân
không đổi, nhưng làm giảm năng lượng
của hạt nhân.
Kết luận:
Tia phóng xạ gồm các hạt và bức xạ điện
từ:
+ Hạt là hạt nhân nguyên tử helium (
4
2 He )
Ví dụ phóng xạ : →
+ Hạt có điện tích -1 và số khối bằng 0.
Nhiệm vụ 2: Tìm hiểu về định luật bảo
toàn số khối và bảo toàn điện tích hạt nhân
Ví dụ phóng xạ : →
Ví dụ phóng xạ : →
+ Tia là dòng photon có năng lượng cao.
Ví dụ phóng xạ : → ℎ
ℎ→ ℎ
Luyện tập: Khi chiếu chùm tia phóng xạ đi vào gữa 2 bản điện cực, hạt a mang điện tích dương, sau khi ra khỏi 2 bản điện cực sẽ bị lệch về cực âm, hạt mang điện tích âm sẽ bị lệch về cực dương, tia không mang điện tích nên truyền thẳng. Có thể mô tả như hình:
c) Tìm hiểu định luật bảo toàn số khối và bảo toàn điện tích
- GV cho HS thực hiện thảo luận và trả lời câu hỏi Thảo luận 6:
6. Quan sát và nhận xét số khối, điện tích củacácthànhphầntrướcvàsauphóng xạ hạt nhân.
- Từ đó HS hãy rút ra định luật về tổng số khối và điện tích của các thành phần trước và sau phóng xạ hạt nhân.
- GV chốt lại kiến thức. HS thực hiện Luyện tập theo nhóm đôi
Vận dụng định luật bảo toàn số khối và bảo toàn điện tích, hoàn thành các phản ứng hạt nhân:
U→ Th He
Np→ Pu e
- GV giới thiệu thêm:
+ Các đồng vị phóng xạ có >83 thường phóng xạ kiểu ℎư , , , ,…
+ Các đồng vị phóng xạ có <83 và chẵn chủ yếu phóng xạ kiểu hoặc hạt nhân có khả năng thu nhận electron.
Bước 2: Thực hiện nhiệm vụ:
Thảo luận 6:
• Phóng xạ : Sau phóng xạ :,
điện tích hạt nhân nguyên tử giảm
2 đơn vị và số khối giảm 4 đơn vị.
• Phóng xạ : Sau phóng xạ , điện tích hạt nhân nguyên tử tăng 1
đơn vị, số khối không đổi.
• Phóng xạ : Sau phóng xạ , điện tích hạt nhân nguyên tử giảm
1 đơn vị, số khối không đổi.
• Phóng xạ y không làm thay đổi điện tích hạt nhân nguyên tử và số khối của hạt nhân.
Kết luận:
Trong quá trình phóng xạ, số khối và
điện tích được bảo toàn.
Luyện tập: U→ Th He Np→ Pu e
- HS theo dõi SGK, chú ý nghe, tiếp nhận
kiến thức, hoàn thành các yêu cầu, thảo luận nhóm, suy nghĩ trả lời câu hỏi.
- GV: quan sát và trợ giúp HS.
Bước 3: Báo cáo, thảo luận:
- HS giơ tay phát biểu, lên bảng trình bày
- Một số HS khác nhận xét, bổ sung cho bạn.
Bước 4: Kết luận, nhận định: GV tổng
quát lưu ý lại kiến thức trọng tâm và yêu
cầu HS ghi chép đầy đủ vào vở
Hoạt động 2: Phản ứng hạt nhân
a) Mục tiêu:
- Nêu được khái niệm phản ứng hạt nhân và cho ví dụ.
- Nêu được thế nào là phản ứng phân hạch và nhiệt hạch, cho ví dụ.
b) Nội dung:
HS đọc SGK, nghe giảng, thực hiện các nhiệm vụ được giao, trả lời các câu hỏi.
c) Sản phẩm: HS hình thành được kiến thức bài học, phát biểu về khái niệm phản ứng hạt nhân, phân biệt được phản ứng phân hạch, nhiệt hạch.
d) Tổ chức thực hiện: HĐ CỦA GV VÀ HS SẢN PHẨM DỰ KIẾN
Bước 1: Chuyển giao nhiệm vụ: 2. Phản ứng hạt nhân
Nhiệm vụ 1: Tìm hiểu về phản
ứng hạt nhân
- HS thực hiện thảo luận nhóm đôi, tìm hiểu nội dung SGK, trả lời câu hỏi Thảo luận7, 8.
7. Phản ứng hạt nhân trong thí nghiệm của Rutherford và Chadwick có khác biệt cơ bản nào với sự phóng xạ tự nhiên?
8. Nêu sự khác nhau cơ bản của phản ứng hạt nhân với phản ứng hóa học
- GV cho HS tổng kết lại về phản ứng hạt nhân, phóng xạ tự nhiên và định luật bảo toàn số khối, điện tích của một phản ứng hạt nhân.
a) Phản ứng hạt nhân
Thảo luận 7:
- Sự phóng xạ tự nhiên là quá trình tự biến đổi hạt nhân không bền vững xảy ra trong tự nhiên, gọi là đồng vị phóng xạ tự nhiên.
- Dựa trên lí thuyết, nguyên tố phóng xạ phân rã ra đồng vị bền và hạt , thì có thể dùng hạt bắn phá vào hạt nhân bền để nghiên cứu, bắt đầu bằng các hạt nhân nhẹ. Trong thí nghiệm của Rutherfor, ông dùng hạt bắn phá hạt nhân , thí nghiệm của Chadwick dùng hạt a bắn phá hạt nhân . Đây là phản ứng hạt nhân nhân tạo.
Thảo luận 8: Phản ứng hạt nhân không phải là phản ứng hoá học, là khi hạt nhân bị biến đổi thành hạt nhân
nguyên tử của nguyên tố khác (kèm theo độ hụt khối giữa các hạt nhân nguyên tử). Phản ứng hoá học tạo ra sự biến đổi giữa các chất, không làm
thay đổi thành phần các nguyên tố tham gia, vận dụng được định luật bảo toàn khối lượng.
Kết luận:
- Phản ứng hạt nhân là phản ứng có sự biến đổi ở hạt nhân nguyên tử. Phản ứng hạt nhân không
phải là phản ứng hóa học.
Nhiệm vụ 2: Tìm hiểu phản ứng phân hạch, phản ứng nhiệt hạch và phóng xạ nhân tạo
- HS tìm hiểu về phản ứng phân hạch và trả lời câu hỏi:
+ Thế nào là phản ứng phân hạch?
+ Câu hỏi thảo luận 9:
9. Quan sát Hình 2.4 và Ví dụ 1, hãyso sánhsố khối của cácmảnh phân hạch với số khối của hạt nhân ban đầu.
- HS tìm hiểu về phản ứng nhiệt hạch, trả lời câu hỏi:
+ Thế nào là phản ứng nhiệt hạch? Cho ví dụ? Nhiên liệu thường dùng cho phản ứng?
+ Câu hỏi thảo luận 10:
- Phóng xạ tự nhiên là một loại phản ứng hạt nhân.
- Phản ứng hạt nhân tuân theo định luật bảo toàn số khối và bảo toàn điện tích.
b) Phản ứng phân hạch, phản ứng nhiệt hạch, phóng xạ nhân tạo.
- Phản ứng phân hạch
Dưới tác dụng của neutron, hạt nhân nguyên tử phân chia thành 2 hạt nhân mới, gọi là 2 mảnh phân hạch, đồng thời giải phóng năng lượng. Nhiên liệu chủ yếu của phản ứng phân hạch là 235239 , UPu .
Thảo luận 9:
Các mảnh phân hạch được tạo ra có số khối nhỏ hơn số khối của hạt nhân mẹ ban đầu. Cùng hạt nhân mẹ có thể tạo ra các mảnh phân hạch cùng nguyên tố, khác số khối; khác nguyên tố ...
n U→ U→ Ba Kr 3 n
n U→ U→ Ba Kr 2 n
n U→ U→ Y I 3 n
- Phản ứng nhiệt hạch:
10. Phản ứng nhiệt hạch được
xem là phản ứng ngược lại với phản ứng phân hạch. Giải thích.
+ GV giới thiệu về phản ứng nhiệt hạch xảy ra trong Mặt Trời
- HS tìm hiểu về phóng xạ hạt nhân, trả lời câu hỏi Thảo luận
11, 12:
11. Đồng vị phóng xạ nhân tạo được tạo ra như thế nào?
12. Trong Ví dụ 2, đồng vị nào là đồng vị phóng xạ nhân tạo?
- GV tổng kết lại các kiến thức trọng tâm.
HS thực hiện nhóm 4 làm Luyện tập:
So sánh điểm giống và khác nhau của phóng xạ tự nhiên và phóng xạ nhân tạo.
Bước 2: Thực hiện nhiệm vụ:
- HS theo dõi SGK, chú ý nghe, tiếp nhận kiến thức, hoàn thành các yêu cầu, hoạt động cặp đôi, kiểm tra chéo đáp án.
Bước 3: Báo cáo, thảo luận:
Phản ứng nhiệt hạch, còn gọi là phản ứng tổng
hợp hạt nhân, là quá trình 2 hạt nhân hợp lại để
tạo thành hạt nhân mới nặng hơn, đồng thời giải phóng năng lượng.
Nhiên liệu thường dùng cho phản ứng nhiệt hạch là đồng vị deuterium và tritium của hydrogen.
Ví dụ: → 17,6
Thảo luận 10:
Phản ứng phân hạch là khi một hạt nhân mẹ bị
vỡ thành các mảnh phân hạch là các hạt nhân con có số khối nhỏ hơn; đối với phản ứng nhiệt hạch, là quá trình 2 hạt nhân nhẹ hợp lại để tạo thành hạt nhân mới nặng hơn.
- Phóng xạ nhân tạo:
Trong nhiều phản ứng hạt nhân, có thể tạo ra các
đồng vị không bền, gọi là đồng vị phóng xạ nhân
tạo. Các đồng vị này bị phân rã tạo thành đồng vị bền hơn và phát bức xạ, gọi là sự phóng xạ nhân tạo.
Ví dụ:
Al He⟶ P n
P⟶ Si e
- HS giơ tay phát biểu, lên bảng trình bày
- Một số HS khác nhận xét, bổ sung cho bạn.
Bước 4: Kết luận, nhận định:
GV tổng quát lưu ý lại kiến thức trọng tâm và yêu cầu HS ghi chép
đầy đủ vào vở
Thảo luận 11:
Khi thực hiện bắn phá (thường dùng hạt ) vào
các hạt nhân của đồng vị bền để tạo ra các đồng vị kém bền, gọi là đồng vị phóng xạ nhân tạo.
Các đồng vị này phân rã để tạo hạt nhân khác đồng thời phát bức xạ, quá trình này giống hiện tượng phóng xạ tự nhiên.
Thảo luận 12:
Khi bắn phá Al bằng hạt , tạo ra đồng vị P không bền, phát phóng xạ và tạo thành Si:
He Al→ P n P→ Si
Vậy, đồng vị 30 P là đồng vị phóng xạ.
Luyện tập:
+ Điểm giống nhau:
Đều là phản ứng biến đổi hạt nhân, trong quá trình biến đổi phát ra tia phóng xạ.
+ Điểm khác nhau:
Phóng xạ tự nhiên Phóng xạ nhân tạo
Phóng xạ tự nhiên là hiện tượng các nguyên tố tự phát ra
tia phóng xạ, không do tác động bên ngoài.
Phóng xạ nhân tạo là quá trình biến đổi hạt nhân tự phát, gây ra bởi tác động bên ngoài lên hạt nhân.
Hoạt động 3: Ứng dụng của đồng vị phóng xạ và phản ứng hạt nhân
a) Mục tiêu:
- Nêu được ứng dụng của phản ứng hạt nhân phục vụ nghiên cứu khoa học, đời sống và sản xuất.
- Nêu được ứng dụng điển hình của phản ứng hạt nhân: xác định niên đại cổ vật, các ứng dụng trong lĩnh vực y tế, năng lượng.
b) Nội dung: HS đọc SGK để tìm hiểu nội dung kiến thức theo yêu cầu của GV, chú
ý nghe giảng, trả lời câu hỏi, thực hiện nhiệm vụ được giao.
c) Sản phẩm: HS nêu được ứng dụng của đồng vị phóng xạ và phản ứng hạt nhân.
d) Tổ chức thực hiện:
HOẠT ĐỘNG CỦA GV VÀ HS SẢN PHẨM DỰ KIẾN
Bước 1: Chuyển giao nhiệm vụ:
- GV cho HS tìm hiểu nội dung SGK, thảo luận nhóm 4 trả lời câu hỏi
+ Câu hỏi thảo luận 13: Tìm hiểu những thông tin về ứng dụng đồng vị phóng xạ và
3. Ứng dụng của đồng vị phóng xạ và phản ứng hạt nhân
Thảo luận 13:
Đồng vị phóng xạ và phản ứng hạt nhân ứng dụng trong nhiều lĩnh vực: y khoa, dược
phản ứng hạt nhân, nhận xét vai trò của đồng
vị phóng xạ và phản ứng hạt nhân trong các
lĩnh vực y học, công nghiệp, khoa học, ...
+ Hãy tìm hiểu nội dung SGK, đưa ra các ví
dụ về ứng dụng của đồng vị phóng xạ và phản
ứng hạt nhân trong lĩnh vực y học, công nghiệp, nông nghiệp, nghiên cứu khoa học, xác định niên đại cổ vật, sử dụng năng lượng hạt nhân.
- HS trả lời câu hỏi Thảo luận 14 theo nhóm đôi.
14. Phương pháp dùng đồng vị để xác định tuổi của cổ vật, các mẫu hoá thạch có niên đại khoảng 75000 năm, nhưng không dùng để xác định tuổi của đá trong lớp địa chất Trái Đất, mà sử dụng đồng vị . Giải thích.
- GV cho HS quan sát một số hình ảnh, video:
https://youtube.com/watch?v=mYcbW5PImZI
(video ứng dụng của phóng xạ hạt nhân)
https://youtube.com/watch?v=jTRU8ATnyCY
(ứng dụng của phóng xạ hạt nhân).
- HS suy nghĩ, trả lời câu hỏi Vận dụng:
phẩm, công nghiệp, nông nghiệp, khoa học kĩ thuật, công nghiệp năng lượng sạch, ...
a) Trong y học
- Ứng dụng kĩ thuật y học hạt nhân trong chẩn đoán và điều trị bệnh.
Ví dụ:
+ Kĩ thuật chụp hình phát hiện ung thư bằng máy SPECT,
+ PET – Kĩ thuật chụp cắt lớp phát xạ positron, kết hợp với CT như SPECT/CT, PET/CT, giúp chẩn đoán ung thư, kiểm tra và đánh giá mức độ hiệu quả của các phương pháp điều trị, ...
- Sử dụng dược chất phóng xạ vào cơ thể người bệnh để điều trị bệnh.
- Xạ trị là một trong những phương pháp phổ biến trong điều trị ung thư, sử dụng các hạt và sóng có năng lượng cao như: tia X, tia gamma, chùm tia điện tử, proton, ... để tiêu diệt hoặc phá huỷ tế bào ung thư. b) Trong công nghiệp, nông nghiệp, nghiên cứu khoa học
- Đồng vị phóng xạ được dùng trong chụp X-quang công nghiệp, tìm kiếm các khuyết tật trong vật liệu, đo mực chất lỏng trong bồn chứa, đo độ dày của các vật liệu, kiểm
Hãy nêu một số vận dụng khác khi ứng dụng các đồng vị phóng xạ vào thực tiễn.
- GV kết luận: Hiện nay đồng vị phóng xạ và phản ứng hạt nhân có nhiều ứng dụng trong đời sống.
Bước 2: Thực hiện nhiệm vụ:
- HS theo dõi SGK, chú ý nghe, tiếp nhận kiến thức, hoàn thành các yêu cầu.
- GV: quan sát và trợ giúp HS.
Bước 3: Báo cáo, thảo luận:
- HS giơ tay phát biểu, lên bảng trình bày
- Một số HS khác nhận xét, bổ sung cho bạn.
Bước 4: Kết luận, nhận định: GV tổng quát lưu ý lại kiến thức trọng tâm và yêu cầu HS ghi chép đầy đủ vào vở.
tra tính toàn vẹn của mối hàn hay cấu trúc turbine của máy bay phản lực, ….
- Sử dụng đồng vị phóng xạ trong theo dõi quá trình hấp thụ các nguyên tố trong phân bón hoặc làm thay đổi cấu trúc gene để tạo giống mới, năng suất và kinh tế hơn.
- Ngoài ra, còn sử dụng trong lĩnh vực xử lí nước thải, thăm dò vật chất gây ô nhiễm từ dược phẩm phóng xạ c) Xác định niên đại cổ vật
14C là đồng vị phóng xạ được dùng trong xác định niên đại cổ vật.
Bằng cách đo tỉ lệ 14C với tổng lượng carbon trong mẫu, so sánh với chu kì bán hủy 14C để xác định niên đại cổ vật.
- Để xác định những mẫu vật như đá trong lớp địa chất của Trái Đất, người ta dựa vào tỉ lệ 238206 / UPb trong mẫu vật, chuỗi phân rã cuối cùng đồng vị 238U là đồng vị bền 206 Pb . Chu kì bán hủy của 238U là 4,5 tỉ
năm.
d) Sử dụng năng lượng của phản ứng hạt nhân
Dùng các đồng vị và làm nhiên
liệu trong các lò phản ứng hạt nhân để sản
xuất ra điện (nhà máy điện nguyên tử) và chạy các tàu phá băng,..
Trong tương lai gần con người có thể tạo ra và sử dụng nguồn năng lượng từ phản ứng nhiệt hạch.
Thảo luận 14:
Đồng vị có chu kì bán huỷ 5730 năm, để xác định tuổi các cổ vật có niên đại 75000 năm. Tuổi của các mẫu đá trong lớp địa chất Trái Đất có thể lên đến hàng tỉ năm nên không thể dùng đồng vị C thay vào đó là đồng vị U có chu kì bán huỷ 4,5 tỉ năm (thời gian để mẫu U phân huỷ hoàn toàn khoảng 58 tỉ năm).
Vận dụng:
Lò phản ứng hạt nhân của Viện nghiên cứu hạt nhân Đà Lạt cung cấp các đồng vị phóng xạ trong lĩnh vực y tế như:
1, P, Cr, Co, Sm, Lu, / r,… trong chẩn đoán và điều trị bệnh.
Bảng ứng dụng sản xuất đồng vị phóng xạ nhân tạo trong công nghiệp và khoa học:
C. HOẠT ĐỘNG LUYỆN TẬP
a) Mục tiêu: Học sinh củng cố lại kiến thức đã học.
b) Nội dung: HS vận dụng các kiến thức của bài học làm Bài tập 1, 2, 3 (SGK -tr21)
c) Sản phẩm học tập: HS giải được bài về phản ứng hạt nhân, định luật bảo toàn số
khối và điệc tích.
d) Tổ chức thực hiện:


Bước 1: Chuyển giao nhiệm vụ:
- GV tổng hợp các kiến thức cần ghi nhớ cho HS.
- GV tổ chức cho HS hoạt động theo nhóm làm Bài tập 1, 2, 3 (SGK -tr21)
Bước 2: Thực hiện nhiệm vụ: HS quan sát và chú ý lắng nghe, thảo luận nhóm, hoàn thành các bài tập GV yêu cầu.
- GV quan sát và hỗ trợ.
Bước 3: Báo cáo, thảo luận:
- Mỗi bài tập GV mời HS trình bày. Các HS khác chú ý chữa bài, theo dõi nhận xét bài trên bảng.
Bước 4: Kết luận, nhận định:
- GV nhận xét thái độ làm việc, phương án trả lời của các học sinh, ghi nhận và tuyên dương
Kết quả:
Bài 1. Phản ứng (1) là quá trình phóng xạ tự nhiên, vì đồng vị tự phóng xạ và hạt nhân Th.
Phản ứng (2) là phản ứng hạt nhân nhân tạo, vì đồng vị U do hạt neutron bắn phá, tạo ra hạt nhân mới Np và phóng xạ .
Bài 2. a) Phát xạ 1 hạt của C: C⟶ B

b) Phóng xạ 1 hạt của Mo: Mo⟶ Tc
c) Phóng xạ kèm theo từ W: W⟶ Hf
Bài 3. Vận dụng bảo toàn số khối và bảo toàn điện tích trong các phản ứng hạt nhân để xác định X
a) B X⟶ Be , X là hạt nhân deuterium đồng vị H.
b) F p⟶ O X,X là hạt a.
C) n U→ Mo La 2 X 7 e,X là hạt neutron.
D. HOẠT ĐỘNG VẬN DỤNG
a) Mục tiêu:
- Học sinh thực hiện làm bài tập vận dụng để nắm vững kiến thức.
- HS chú ý lắng nghe tìm hiểu các kiến thức.
b) Nội dung: HS sử dụng SGK và vận dụng kiến thức đã học để làm bài tập, tìm hiểu kiến thức.
c) Sản phẩm: HS vận dụng kiến thức đã học giải quyết được bài toán về phương trình phản ứng hạt nhân, tìm hiểu về phóng xạ.
d) Tổ chức thực hiện:
Bước 1: Chuyển giao nhiệm vụ
- GV yêu cầu HS hoạt động hoàn thành bài tập 4 (SGK-tr21).
- GV cho HS làm bài thêm:
Bài 1: Đồng vị phóng xạ plutonium ( 239 94 Pu ) có khả năng phân hạch hạt nhân để giải phóng

ra một năng lượng cực lớn và được sử dụng trong nhà máy điện nguyên tử để sản
xuất ra điện. Đồng vị 239 94 Pu có thể phân rã theo ba cách: (1) Nhận 1 electron; (2) bức


xạ 1 positron; (3) bức xạ 1 hạt α. Hãy viết phương trình cho mỗi trường hợp đó.
- GV cho HS tìm hiểu về một vài các nhược điểm, tác hại của phóng xạ. Ví dụ:
1. Đồng vị phóng xạ trong nước thải y tế.
Nhờ khả năng điều trị bệnh và ứng dụng trong dược phẩm của đồng vị phóng xạ mà giúp con người có nhiều phương án mới cho những căn bệnh nan y.
Tuy nhiên khi điều trị bệnh, ví dụ như ung thư, cần sử dụng đến các hóa chất chứa
đồng vị phóng xạ. Các chất thải dư thừa khi vào đường ống thoát nước thải y tế cần được xử lý trước khi đưa ra môi trường. Tuy rằng dư lượng đồng vị phóng xạ so với hàng loạt các chất thải nguy hại khác có trong nước thải chỉ chiếm phần nhỏ. Nhưng không thể xem nhẹ việc xử lý loại chất thải này.
Cần xử lý và thử lại nước thải y tế trước khi xả thải vào môi trường. Với sự nguy hại và đặc thù của loại nước thải này đòi hỏi hệ thống xử lý nước thải y tế và hệ thống xử lý rác thải y tế cũng phải đáp ứng đầy đủ tiêu chuẩn quy định.
2. Thảm hỏa "hạt nhân"
Bên cạnh những ứng dụng có ích của chất phóng xạ, người ta lại luôn tìm cách
khuếch đại mức năng lượng này lên. Vì vậy, chúng cũng đã gây ra những thảm họa mà lịch sử không bao giờ quên.
Video thảm họa hạt nhân: https://www.youtube.com/watch?v=dorVP32h_rU
- Thảm họa kinh hoàng đầu tiên của chất phóng xạ là hai quả bom nguyên tử mà Mỹ ném xuống Nhật Bản ở hai thành phố là Hiroshima và Nagasaki vào năm 1945. Năng lượng hạt nhân và phóng xạ do nó tạo ra làm chết ngay 140.000 người ở Hiroshima và 74.000 người ở Nagasaki. Trong khi đó, gánh nặng ung thư do phóng xạ còn tồn tại dai dẳng đến ngày nay.


năm 1945. 31 người bị chết trực tiếp trong vụ nổ và hàng trăm nghìn người khác phải sơ tán. Khoảng 600-800 nghìn binh lính, nhân viên cứu hộ và người dân Liên Xô đã trực tiếp tham gia khắc phục sự cố Chernobyl, trong đó, đa số họ đã bị nhiễm xạ và cho tới nay vẫn còn hàng trăm nghìn người phải điều trị thường xuyên.
Video: https://www.youtube.com/watch?v=h0UvwbpRx6M + Và năm 2011, thế giới lại chứng kiến sự cố nhà máy điện hạt nhân số 1 (Fukushima) của Nhật Bản.
Chưa tính tới những hậu quả ung thư hay bệnh tật, người ta biết rằng, cùng với sóng thần và động đất, tác hại hạt nhân và phóng xạ làm ít nhất 1,4 triệu người không có nước, hơn 500.000 người sống không có nhà. Đây thực sự là những thảm kịch mang tên phóng xạ
Cho đến nay, việc ngăn chặn sự phát tán rộng của phóng xạ đang còn thách thức.
Đứng trước những gì mà chất phóng xạ đã và đang làm được, việc nói công hay tội thật khó công bằng. Ở đây, vai trò của chất phóng xạ là cứu tinh hay là thảm họa của loài người, điều đó phụ thuộc vào cách hành xử của chính con người chúng ta.
Bước 2: Thực hiện nhiệm vụ
- HS suy nghĩ, trao đổi, thảo luận thực hiện nhiệm vụ.
- GV điều hành, quan sát, hỗ trợ.
Video: Thảm họa phóng xạ về thảm kịch ở Hiroshima https://www.youtube.com/watch?v=LSFhep2xFGo
+ Thảm họa thứ hai là vụ nổ Nhà máy điện nguyên tử tại Chernobyl (Ukraine) năm 1986. Theo đánh giá của giới khoa học, thảm họa Chernobyl tương đương với vụ nổ
của 500 quả bom nguyên tử mà Mỹ ném xuống thành phố Hiroshima của Nhật Bản
Bước 3: Báo cáo, thảo luận
- Bài tập: đại diện HS trình bày kết quả thảo luận, các HS khác theo dõi, đưa ý kiến.
Bước 4: Kết luận, nhận định
- GV nhận xét, đánh giá, đưa ra đáp án đúng, chú ý các lỗi sai của học sinh hay mắc phải.
Đáp án:
Bài 4.
Bảo toàn số khối và bảo toàn điện tích trong chuỗi phóng xạ, ta có hệ phương trình 238 206 4 0 92 82 2 ⇒ 8 6
Phương trình phản ứng hạt nhân: U→ Pb 8He 6 e
Đáp án bài thêm:
Bài 1: (1) Nhận 1 electron: Pu e⟶ Np
(2) Bức xạ 1 positron: Pu⟶ Np e
(3) Bức xạ 1 hạt alpha: Pu⟶ U He
* HƯỚNG DẪN VỀ NHÀ
• Ghi nhớ kiến thức trong bài.
• Hoàn thành các bài tập trong SBT
• Chuẩn bị bài mới "Bài 3: Năng lượng hoạt hóa của phản ứng hóa học"
Ngày soạn: .../.../...
Ngày dạy: .../.../...
BÀI 3: NĂNG LƯỢNG HOẠT HÓA CỦA PHẢN ỨNG HÓA HỌC (3 TIẾT)
I. MỤC TIÊU:
1. Kiến thức, kĩ năng: Học xong bài này, HS đạt các yêu cầu sau:
• Trình bày được khái niệm năng lượng hoạt hoá (theo khía cạnh ảnh hưởng đến tốc độ phản ứng).
• Nêu được ảnh hưởng của năng lượng hoạt hoá và nhiệt độ tới tốc độ phản ứng thông qua phương trình Arrhenius: k A⋅e
• Giải thích được vai trò của chất xúc tác.
2. Năng lực
- Năng lực chung:
• Năng lực tự chủ và tự học trong tìm tòi khám phá
• Năng lực giao tiếp và hợp tác trong trình bày, thảo luận và làm việc nhóm
• Năng lực giải quyết vấn đề và sáng tạo trong thực hành, vận dụng.
- Năng lực riêng:
• Nhận thức hoá học: Nêu được khái niệm năng lượng hoạt hoá theo khía cạnh
ảnh hưởng đến tốc độ phản ứng; nêu được ảnh hưởng của năng lượng hoạt hoá và nhiệt độ tới tốc độ phản ứng thông qua phương trình Arrhenius
A e RT và vai trò của chất xúc tác.
• Tìm hiểu thế giới tự nhiên dưới góc độ hoá học: Quan sát được hiện tượng tự nhiên có liên quan đến năng lượng hoạt hoá; các chất xúc tác trong tự nhiên và ứng dụng trong đời sống.
• Vận dụng kiến thức, kĩ năng đã học: Vận dụng năng lượng hoạt hoá để giải thích các hiện tượng trong tự nhiên, giải thích được vai trò chất xúc tác trong các phản ứng hoá học.
3. Phẩm chất
- Có ý thức học tập, ý thức tìm tòi, khám phá và sáng tạo, có ý thức làm việc nhóm, tôn trọng ý kiến các thành viên khi hợp tác.
- Chăm chỉ tích cực xây dựng bài, có trách nhiệm, chủ động chiếm lĩnh kiến thức theo sự hướng dẫn của GV.
II. THIẾT BỊ DẠY HỌC VÀ HỌC LIỆU
1. Đối với GV: SGK, Tài liệu giảng dạy, giáo án, đồ dùng dạy học.
2. Đối với HS: SGK, SBT, vở ghi, giấy nháp, đồ dùng học tập (bút, thước...), bảng nhóm, bút viết bảng nhóm.
III. TIẾN TRÌNH DẠY HỌC
A. HOẠT ĐỘNG KHỞI ĐỘNG (MỞ ĐẦU)
a) Mục tiêu:
- HS được gợi mở về bài học.
b) Nội dung: HS đọc tình huống mở đầu, suy nghĩ trả lời câu hỏi.
c) Sản phẩm: HS trả lời được câu hỏi mở đầu.
d) Tổ chức thực hiện:
Bước 1: Chuyển giao nhiệm vụ:
- GV cho HS đọc tình huống mở đầu:
Trong ruột non của hầu hết chúng ta đều có enzyme lactase, có tác dụng chuyển hóa lactose (còn gọi là đường sữa, C12H22O11) có trong thành phần đường glucose (C6H12O6) và galactose (C6H12O6) giúp cơ thể dễ dàng hấp thu; quá trình này đặc biệt quan trọng đối với sự phát triển và tăng cường miễn dịch cho trẻ nhỏ. Khi cơ thể thiếu hụt loại enzyme này, lactose không được tiêu hóa sẽ bị vi khuẩn lên men, sinh ra khí và gây đau bụng. Enzyme lactase đóng vai trò xúc tác trong quá trình chuyển hóa lactose.
Xúc tác ảnh hưởng như thế nào đến tốc độ chuyển hóa giữa các chất?
Bước 2: Thực hiện nhiệm vụ: HS quan sát và chú ý lắng nghe, thảo luận nhóm đôi hoàn thành yêu cầu.
Bước 3: Báo cáo, thảo luận: GV gọi một số HS trả lời, HS khác nhận xét, bổ sung.
Bước 4: Kết luận, nhận định: GV đánh giá kết quả của HS, trên cơ sở đó dẫn dắt HS vào bài học mới.
B. HÌNH THÀNH KIẾN THỨC MỚI
Hoạt động 1: Năng lượng hoạt hóa. Ảnh hưởng của năng lượng hoạt hóa và nhiệt độ đến tốc độ phản ứng.
a) Mục tiêu:
- Trình bày được khái niệm năng lượng hoạt hoá (theo khía cạnh ảnh hưởng đến tốc độ phản ứng).
- Nêu được ảnh hưởng của năng lượng hoạt hoá và nhiệt độ tới tốc độ phản ứng thông qua phương trình Arrhenius: k A⋅e
b) Nội dung:
HS đọc SGK, nghe giảng, thực hiện các nhiệm vụ được giao, suy nghĩ trả lời câu
hỏi, làm Luyện tập, đọc hiểu Ví dụ.
c) Sản phẩm: HS hình thành được kiến thức bài học, nêu được về năng lượng hoạt hóa và các yếu tố ảnh hưởng, vận dụng phương trình Arrhenius trong các bài toán.
d) Tổ chức thực hiện:
HĐ CỦA GV VÀ HS SẢN PHẨM DỰ KIẾN
Bước 1: Chuyển giao nhiệm vụ:
Nhiệm vụ 1: Tìm hiểu khái niệm năng
lượng hoạt hóa
- GV cho HS tìm hiểu SGK, trả lời câu
hỏi:
+ Thế nào là va chạm có hiệu quả?
(Va chạm có hiệu quả là những va chạm đúng hướng và đủ năng lượng để tạo ra sản phẩm).
+ Nếu các chất không đủ năng lượng thì có xảy ra phản ứng hay không?
(Không xảy ra phản ứng).
+ Nêu khái niệm năng lượng hoạt hóa.
- HS thảo luận nhóm đôi trả lời câu hỏi
Thảo luận 1, 2:
1. Năng lượng hoạt hóa
- Năng lượng hoạt hóa là năng lượng tối thiểu
mà các chất phản ứng cần có để phản ứng hóa
học có thể xảy ra.
- Quá trình biến đổi năng lượng trong phản
ứng:
Thảo luận 1:
1. Quan sát Hình 3.1, cho biết số va
chạm hiệu quả, khả năng xảy ra phản ứng, tốc độ phản ứng của chất tham gia thay đổi như thế nào khi giá trị của năng lượng hoạt hóa càng giảm?
→ Từđó HS rút ra kết luận về mối quan hệ giữa năng lượng hoạt hóa và khả năng xảy ra phản ứng, tốc độ phản ứng.
2. Từ thông tin trong phần Khởi động, khi có chất xúc tác, năng lượng hoạt hóa của phản ứng chuyển hóa lactose tăng hay giảm? Giải thích.
- GV chốt lại kiến thức, HS thực hiện Luyện tập.
Khả năng xảy ra của một phản ứng hoá học như thế nào khi năng lượng hoạt hoá của phản ứng rất lớn? Giải thích.
- GV cho HS kết luận về mối quan hệ năng lượng hoạt hóa và khả năng xảy
ra phản ứng, mối quan hệ năng lượng hoạt hóa và tốc độ phản ứng.
Khi năng lượng hoạt hóa giảm, sẽ có nhiều phần tử đủ năng lượng vượt qua năng lượng hoạt hóa để tạo ra nhiều va chạm hiệu quả hơn, khả năng xảy ra phản ứng cao hơn, tốc độ phản ứng tăng.
Thảo luận 2:
Từ thông tin trong phần Khởi động, khi có xúc tác enzyme lactase, giúp quá trình chuyển hoá lactose thành glucose và galactose dễ dàng hơn, nếu thiếu loại enzyme này, lactose không được tiêu hoá. Vậy, khi có xúc tác, năng lượng hoạt hoá của phản ứng chuyển hoá lactose giảm, phản ứng xảy ra dễ dàng hơn. Luyện tập:

Năng lượng hoạt hoá của phản ứng càng lớn, càng có ít phần tử chất phản ứng đủ năng lượng để tạo ra các va chạm hiệu quả, phản
ứng xảy ra rất chậm.
Kết luận:
- Năng lượng hoạt hóa càng thấp phản ứng càng dễ xảy ra.
- Năng lượng hoạt hóa càng lớn thì tốc độ phản ứng càng nhỏ và năng lượng hoạt hóa càng nhỏ, thì tốc độ phản ứng càng lớn.
Nhiệm vụ 2: Tìm hiểu ảnh hưởng của năng lượng hoạt hóa và nhiệt độ tới tốc độ phản ứng
- GV giới thiệu HS các công thức về mối liên hệ giữa nhiệt độ, năng lượng hoạt hóa với hằng số tốc độ phản ứng
- HS thảo luận trả lời câu hỏi Thảo luận 3:
3. Dựa vào phương trình Arrhenius, tốc độ phản ứng thay đổi như thế nào khi
tăng nhiệt độ của phản ứng?
- HS đọc hiểu Ví dụ 1, Ví dụ 2. GV yêu
cầu HS trình bày, giải thích.
Ví dụ 1: Một phản ứng đơn giản xảy ra
ở nhiệt độ 100oC, trong điều kiện có
xúc tác và không có xúc tác, năng
lượng hoạt hóa của phản ứng lần lượt
là: Ea1=25 kJ/mol,
Ea2=50 kJ/mol. So sánh tốc độ phản
ứng trong 2 điều kiện.
- HS thảo luận, trả lời câu hỏi Thảo luận 4.
2. Ảnh hưởng của năng lượng hoạt hóa và
nhiệt độ tới tốc độ phản ứng
- Phương trình Arrhenius: k A⋅e
Trong đó:
k là hằng số tốc độ phản ứng
A là hằng số thực nghiệm Arrhenius
e là cơ số của logarit tự nhiên, e = 2,7183
Ea: năng lượng hoạt hóa (J/mol).
R là hằng số lí tưởng, R =8,324 (J/mol.K)
T là nhiệt độ theo thang Kelvin (K).
Thảo luận 3:
Theo phương trình kinh nghiệm của Arrhenius, ta có: , trong cùng
một phản ứng, E không đổi, hằng số A và R
không đổi, khi tăng nhiệt độ, dẫn đến hằng số
tốc độ của phản ứng tăng, nên tốc độ phản
ứng tăng.
Ví dụ 1:
Ở nhiệt độ không đổi, năng lượng hoạt hóa
của phản ứng trong 2 điều kiện là: Ea1=25
kJ/mol, Ea2=50 kJ/mol.
Từ Ví dụ 2, tốc độ phản ứng phân hử
thay đổi như thế nào khi giảm
nhiệt độ về 25∘ ? Nhận xét sự ảnh
hưởng của nhiệt độ đến tốc độ phản
ứng.
- GV chuẩn hóa kiến thức. HS thực
hiện Luyện tập theo nhóm đôi:
Một phản ứng có năng lượng hoạt hoá là 24 / , so sánh tốc độ phản ứng
khi phản ứng diễn ra ở 2 nhiệt độ là
27∘ lên 127∘
Bước 2: Thực hiện nhiệm vụ:
- HS theo dõi SGK, chú ý nghe, tiếp nhận kiến thức, hoàn thành các yêu cầu.
- GV gợi ý, hướng dẫn.
Bước 3: Báo cáo, thảo luận:
- HS giơ tay phát biểu, lên bảng trình
bày
- Một số HS khác nhận xét, bổ sung cho
bạn.
Bước 4: Kết luận, nhận định: GV
tổng quát lưu ý lại kiến thức trọng tâm
và yêu cầu HS ghi chép đầy đủ vào vở.
Phương trình Arrhenius viết cho phản ứng trên trong 2 điều kiện:
⇒ . , . 3170,4
Vậy khi năng lượng hoạt hóa giảm từ 50 kJ/mol về 25 kJ/mol, tốc độ phản ứng tăng 3170,4 lần.
Ví dụ 2 (SGK -tr24)
Thảo luận 4: + Phương trình Arrhenius vi
Hoạt động 2: Vai trò của chất xúc tác
a) Mục tiêu:
- Phương trình kinh nghiệm Arrhenius biểu
diễn sự ảnh hưởng của năng lượng hoạt hóa
và nhiệt độ đến hằng số tốc độ phản ứng.
- Phản ứng có năng lượng hoạt hóa nhỏ hoặc nhiệt độ của phản ứng cao, tốc độ phản ứng
càng lớn.
Luyện tập:
Phương trình Arrhenius viết cho phản ứng
trên như sau:
ln 1 1 ⇒ln 24 10 8,314
c) Sản phẩm: HS hình thành kiến thức bài học, nêu được vai trò của chất xúc tác, nêu được đặc điểm của chất xúc tác.
d) Tổ chức thực hiện:
HOẠT ĐỘNG CỦA GV VÀ HS SẢN PHẨM DỰ KIẾN
Bước 1: Chuyển giao nhiệm vụ:
- GV giới thiệu về một phương trình phản ứng của chất xúc tác.
2 3 2
- GV đặt câu hỏi:
+ Thế nào là chất xúc tác. Cho ví dụ về chất xúc tác.
- GV cho HS thảo luận tìm hiểu Ví dụ 3 và trả lời câu hỏi Thảo luận 5.
3. Chất xúc tác Chất xúc tác là chất làm tăng tốc độ phản
ứng nhưng không bị biến đổi về chất và
lượng sau phản ứng.
Ví dụ 3 (SGK -tr25)
11,09
Vậy, ở nhiệt độ127∘C, tốc độ phản ứng nhanh

ơn 11,09 lần so với ở nhiệt độ 27∘C.
- Nêu được vai trò của chất xúc tác, đặc điểm của chất xúc tác.
b) Nội dung: HS đọc SGK để tìm hiểu nội dung kiến thức theo yêu cầu của GV, chú
ý nghe giảng, thực hiện nhiệm vụ được giao, trả lời câu hỏi 5, Luyện tập, vận dụng.
+ GV hướng dẫn HS về hình 3.2, quan sát và so sánh năng lượng hoạt hóa của
phản ứng sẽ thay đổi như thế nào so với
khi không có chất xúc tác và khi có chất
xúc tác.
(Năng lượng hoạt hóa khi có xúc tác sẽ nhỏ hơn).
+ Thảo luận 5. Nhận xét ảnh hưởng của enzyme đối với năng lượng hoạt hóa
của phản ứng.
- GV đặt câu hỏi:
Thảo luận 5: Enzyme là chất xúc tác sinh học, có vai trò làm giảm năng lượng hoạt hoá của phản ứng.
Ví dụ 4 (SGK -tr25)
Ví dụ 5 (SGK -tr26)
Luyện tập:
+ Nếu năng lương hoạt hóa giảm thì tốc độ phản ứng sẽ như thế nào? (Tốc độ tăng).
+ Có phải mỗi chất xúc tác đều có thể sử dụng cho nhiều phản ứng khác nhau hay không?
(Không)
- GV nhấn mạnh về tính chọn lọc của chất xúc tác.
- HS đọc hiểu Ví dụ 4, 5.
- HS thảo luận làm Luyện tập và Vận dụng.
Luyện tập: Trong công nghiệp hoá chất, nhiều công đoạn sản xuất, người ta sử dụng chất xúc tác để tăng tốc độ của phản ứng, như: phản ứng tổng hợp từ và dùng xúc tác . Hãy kể tên một số xúc tác cho các phản ứng mà em biết.
Vận dụng: Tại sao muốn cá, thịt nhanh mềm, người ta thường chế biến kèm với những lát dứa (thơm) hoặc thêm một ít nước ép của dứa?
- GV cho HS kết luận về đặc điểm của chất xúc tác.
Bước 2: Thực hiện nhiệm vụ:
Phản ứng tổng hợp NH từ N và H cần
xúc tác Pt, trong công nghiệp sản xuất
HNO phân bón chứa nguyên tố vi lượng
N; trong nhiều phản ứng hữu cơ, cần xúc
tác giúp phản ứng dễ xảy ra: phản ứng
trùng hợp tạo ra các loại polymer, phản
ứng tổng hợp CHOH từ CH và O,…
Vận dụng:
Trong dứa (thơm) có loại enzyme
bromelain thuộc loại enzyme protease có
khả năng phân giải protein thành các chất
đơn giản hơn (các peptide). Thịt, cá là loại
thức phẩm chứa nhiều protein, khi đun nấu
với dứa (nước ép của dứa) sẽ xúc tác cho quá trình phân giải chuỗi protein, thịt cá nhanh nhừ và cơ thể cũng dễ hấp thu hơn.
Kết luận:
Đặc điểm của chất xúc tác
- Chất xúc tác làm giảm năng lượng hoạt hóa để tăng tốc độ của phản ứng.
- Chất xúc tác có tính chọn lọc.
- HS theo dõi SGK, chú ý nghe, tiếp nhận kiến thức, hoàn thành các yêu cầu, hoạt động cặp đôi, kiểm tra chéo đáp án.
- GV: quan sát và trợ giúp HS.
Bước 3: Báo cáo, thảo luận:
- HS giơ tay phát biểu, lên bảng trình
bày
- Một số HS khác nhận xét, bổ sung cho
bạn.
Bước 4: Kết luận, nhận định: GV tổng
quát lưu ý lại kiến thức trọng tâm và yêu
cầu HS ghi chép đầy đủ vào vở.
C. HOẠT ĐỘNG LUYỆN TẬP
a) Mục tiêu: Học sinh củng cố lại kiến thức đã học.
b) Nội dung: HS vận dụng các kiến thức của bài học làm Bài 1, 2, 3 (SGK -tr26).
c) Sản phẩm học tập: HS giải được bài về năng lượng hoạt hóa, chất xúc tác, tốc độ phản ứng
d) Tổ chức thực hiện:
Bước 1: Chuyển giao nhiệm vụ:
- GV tổng hợp các kiến thức cần ghi nhớ cho HS.
- GV tổ chức cho HS hoạt động theo nhóm làm Bài 1, 2, 3 (SGK -tr26).
Bước 2: Thực hiện nhiệm vụ: HS quan sát và chú ý lắng nghe, thảo luận nhóm, hoàn thành các bài tập GV yêu cầu.
- GV quan sát và hỗ trợ.
Bước 3: Báo cáo, thảo luận:
- Mỗi bài tập GV mời HS trình bày. Các HS khác chú ý chữa bài, theo dõi nhận xét
bài trên bảng.
Bước 4: Kết luận, nhận định:
- GV chữa bài, chốt đáp án, tuyên dương các hoạt động tốt, nhanh và chính xác.
Kết quả:
Bài 1:
a)

b) Giản đồ (c) dùng để biểu diễn ảnh hưởng của xúc tác đến năng lượng hoạt hoá
của phản ứng.
Bài 2.
Phương trình kinh nghiệm Arrhenius: ⇒ ln
⇒E 8,314 345 ln 11 20 1714,8 J/mol
Bài 3.
Phương trình Arrhenius cho phản ứng ở 2 nhiệt độ khác nhau
ln E R 1 T 1 T ⇒ln 111 10 8,314 1 273 1 300 4,401⇒ 82
Với 10 s ⇒ 1,22 10 s .
D. HOẠT ĐỘNG VẬN DỤNG
a) Mục tiêu:
- Học sinh thực hiện làm bài tập vận dụng để nắm vững kiến thức.
b) Nội dung: HS sử dụng SGK và vận dụng kiến thức đã học để làm bài tập Bài 4 (SGK -tr26).
c) Sản phẩm: HS vận dụng kiến thức đã học giải quyết bài tập về năng lượng hoạt hóa, tốc độ phản ứng và chất xúc tác.
d) Tổ chức thực hiện:
Bước 1: Chuyển giao nhiệm vụ
- GV yêu cầu HS hoạt động hoàn thành bài tập làm Bài 4 (SGK -tr26).
Bước 2: Thực hiện nhiệm vụ
- HS suy nghĩ, trao đổi, thảo luận thực hiện nhiệm vụ.
- GV điều hành, quan sát, hỗ trợ
Bước 3: Báo cáo, thảo luận
- Bài tập: đại diện HS trình bày kết quả thảo luận, các HS khác theo dõi, đưa ý kiến.
Bước 4: Kết luận, nhận định
- GV nhận xét, đánh giá, đưa ra đáp án đúng, chú ý các lỗi sai của học sinh hay mắc phải.
Đáp án:
Bài 4.
Phương trình Arrhenius cho phản ứng ở 2 nhiệt độ khác nhau ln
8,385⇒ 4380
Khi tăng nhiệt độ từ 350∘C lên 450∘C, tốc độ phản ứng tăng 4380 lần.
* HƯỚNG DẪN VỀ NHÀ
• Ghi nhớ kiến thức trong bài.
• Hoàn thành các bài tập trong SBT
• Chuẩn bị bài mới "Bài 4: Entropy và biến thiên năng lượng tự do Gibbs"
Ngày soạn: .../.../...
Ngày dạy: .../.../...
BÀI 4: ENTROPY VÀ BIẾN THIÊN NĂNG LƯỢNG TỰ DO GIBBS
I. MỤC TIÊU:
1. Kiến thức: Học xong bài này, HS đạt các yêu cầu sau:
• Nêu được khái niệm về entropy.
• Nêu được ý nghĩa của dấu và trị số của biến thiên năng lượng tự do Gibbs ΔG∘ .
• Tính được ΔG từ bảng cho sẵn các giá trị ΔH và S của các chất.
2. Năng lực
- Năng lực chung:
• Năng lực tự chủ và tự học trong tìm tòi khám phá
• Năng lực giao tiếp và hợp tác trong trình bày, thảo luận và làm việc nhóm
• Năng lực giải quyết vấn đề và sáng tạo trong thực hành, vận dụng.
- Năng lực riêng:
• Nhận thức hoá học: Nêu được khái niệm về Entropy S
• Tìm hiểu thế giới tự nhiên dưới góc độ hoá học: Nêu được ý nghĩa của dấu và trị số của biến thiên năng lượng tự do Gibbs của phản ứng ΔG để dự
đoán hoặc giải thích chiều hướng của một phản ứng hoá học.
• Vận dụng kiếnthức, kĩ năng đã học:Tính được ΔG∘ theo côngthức ΔG∘
ΔH∘ T ΔS∘ từ bảng cho sẵn các giá trị ΔH∘ và S∘ của các chất.
3. Phẩm chất
- Có ý thức học tập, ý thức tìm tòi, khám phá và sáng tạo, có ý thức làm việc nhóm, tôn trọng ý kiến các thành viên khi hợp tác.
- Chăm chỉ tích cực xây dựng bài, có trách nhiệm, chủ động chiếm lĩnh kiến thức theo sự hướng dẫn của GV.
II. THIẾT BỊ DẠY HỌC VÀ HỌC LIỆU
1. Đối với GV: SGK, Tài liệu giảng dạy, giáo án, đồ dùng dạy học, hình ảnh về sự biến đổi entropy của một số chất.
2. Đối với HS: SGK, SBT, vở ghi, giấy nháp, đồ dùng học tập (bút, thước...), bảng nhóm, bút viết bảng nhóm.
III. TIẾN TRÌNH DẠY HỌC
A. HOẠT ĐỘNG KHỞI ĐỘNG (MỞ ĐẦU)
a) Mục tiêu:
- HS được gợi mở về bài học.
b) Nội dung: HS đọc tình huống mở đầu, suy nghĩ trả lời câu hỏi.
c) Sản phẩm: HS trả lời được câu hỏi mở đầu.
d) Tổ chức thực hiện:
Bước 1: Chuyển giao nhiệm vụ:
- GV cho HS đọc tình huống mở đầu:
Nếu một lọ nước hoa được mở, chúng ta sẽ ngửi được mùi thơm từ xa, do các phân
tử của thành phần nước hoa khuếch tán vào không khí, đó là quá trình tự xảy ra.
Ngược lại, để thu hồi các phân tử nước hoa đó vào trong lọ như trạng thái ban đầu
thì không thể thực hiện được, đó là quá trình không tự xảy ra. Các phản ứng hóa học cũng tương tự như vậy, có phản ứng tự xảy ra và có phản ứng không tự xảy ra. Các quá trình trong tự nhiên có xu hướng xảy ra theo chiều tăng độ mất trật tự (hỗn loạn)
của các tiểu phân trong hệ, người ta gọi đó là quá trình tăng entropy. Entropy là gì?
Entropy ảnh hưởng như thế nào đến chiều hướng diễn biến của phản ứng hóa học?
Bước 2: Thực hiện nhiệm vụ: HS quan sát và chú ý lắng nghe, thảo luận nhóm đôi hoàn thành yêu cầu.
Bước 3: Báo cáo, thảo luận: GV gọi một số HS trả lời, HS khác nhận xét, bổ sung.
Bước 4: Kết luận, nhận định: GV đánh giá kết quả của HS, trên cơ sở đó dẫn dắt HS vào bài học mới.
B. HÌNH THÀNH KIẾN THỨC MỚI
Hoạt động 1: Tìm hiểu khái niệm entropy
a) Mục tiêu:
- Nêu được khái niệm về entropy, biến thiên entropy.

b) Nội dung:
HS đọc SGK, nghe giảng, thực hiện các nhiệm vụ được giao, đọc hiểu ví dụ, trả lời câu hỏi 1, 2.
c) Sản phẩm: HS hình thành được kiến thức bài học, tính được biến thiên entropy trong một số bài toán, so sánh được giá trị entropy trong một số trường hợp.

d) Tổ chức thực hiện:
HĐ CỦA GV VÀ HS SẢN PHẨM DỰ KIẾN
Bước 1: Chuyển giao nhiệm vụ: Nhiệm vụ 1: Tìm hiểu về khái niệm entropy - GV trình chiếu một số hình ảnh về (Hình ảnh từ trật tự trở nên mất trật tự, từ entropy thấp sang entropy cao).

I. Entropy
1. Entropy và mức độ mất trật tự trong hệ vĩ mô
Thảo luận:
1. Khi tăng nhiệt độ thì các phân tử chuyển động hỗn loạn hơn, mức độ mất
trật tự của hệ tăng lên làm tăng entropy

của hệ
2. Khi chất chuyển từ trạng thái rắn sang
lỏng và khí, liên kết giữa các hạt càng yếu, dao động của các hạt càng mạnh dẫn đến độ mất trật tự càng cao làm entropy của chất tăng.
Kết luận:
- Entropy là đại lượng đặc trưng cho độ mất trật tự của một hệ ở một trạng thái và điều kiện xác định. Entropy càng lớn hệ càng mất trật tự.
(Hình ảnh từ mất trật tự trở nên trật tự, từ entropy cao chuyển sang entropy thấp).
- GV cho HS tìm hiểu nội dung SGK và tả lời câu hỏi:
+ Khái quát khái niệm entropy, entropy phụ thuộc các yếu tố nào?
+ Đơn vị của entropy thường là gì?
- GV nhấn mạnh: độ tự do chuyển động càng cao thì entropy càng lớn.
- HS trả lời câu hỏi Thảo luận 1, 2:
1. Tại sao khi tăng nhiệt độ lại làm tăng
entropy của hệ?
2. Khi chuyển thể của chất từ trạng thái
rắn sang lỏng và khí thì entropy của chất
tăng hay giảm? Giải thích.
- Entropy phụ thuộc vào các yếu tố như nhiệt độ, thể của hệ,…
- Đối với cùng một chất, khi chuyển từ thể rắn, lỏng sang khí hoặc tăng nhiệt độ thì entropy của chất sẽ tăng.
- Đơn vị của entropy thường là J/mol.K.
- Giá trị entropy S của một chất xác định ở
điều kiện chuẩn (298 K, 1 bar) gọi là entropy chuẩn của chất đó, kí hiệu (J/mol.K).
Luyện tập:
Các quá trình trong hình làm tăng entropy vì quá trình bay hơi của bromine hay quá trình thăng hoa của iodine làm các phân tử chất chuyển động hỗn loạn hơn, mức độ mất trật tự của hệ tăng nên entropy tăng.
- Từ kết quả của Thảo luận 1, 2. HS hãy khái quát sự phụ thuộc của entropy với nhiệt độ Đối với một chất, các thể của hệ thay đổi thì entropy thay đổi như thế nào?
- GV hỏi thêm: So sánh entropy của nước đá, nước lỏng và hơi nước?
(Entropy: nước đá < nước lỏng < hơi nước).
- GV chuẩn hóa kiến thức.
- HS làm Luyện tập theo nhóm đôi: Quan sát bình đựng đang bay hơi (a) và bình đựng đang thăng hoa (b) trong hình bên và cho biết các quá trình trên làm tăng hay giảm entropy? Giải thích.
2. Biến thiên entropy trong phản ứng hóa học

- Khi phản ứng hóa học xảy ra:
- HS đọc Ví dụ 1, yêu cầu HS giải thích, trình bày lại.
- GV cho HS rút ra kiến thức trọng tâm
về công thức tính biến thiên entropy
trong phản ứng.
- HS làm Luyện tập theo nhóm đôi.
Dựa vào số liệu Bảng 4.1, hãy tính biến thiên entropy chuẩn của các phản ứng
sau:
a) → và so
sánh giá trị ∘ của phản ứng này
với phản ứng ở ví dụ 1. Giải thích.
b) graphite, → .
Giải thích tại sao giá trị này lại lớn hơn
0 không đáng kể.
Bước 2: Thực hiện nhiệm vụ:
- HS theo dõi SGK, chú ý nghe, tiếp nhận kiến thức, hoàn thành các yêu cầu.
- GV quan sát, hướng dẫn.
Ví dụ 1 (SGK -tr29)
Kết luận:
Xét phản ứng: →
Nhiệm vụ 2: Tính biến thiên entropy của phản ứng hóa học
- GV giới thiệu về cách tính biến thiên
entropy của phản ứng hóa học, bảng 4.1
về giá trị entropy chuẩn một số chất.
Ở điều kiện chuẩn (298 K, 1 bar):
Bước 3: Báo cáo, thảo luận:
- HS giơ tay phát biểu, lên bảng trình bày
Luyện tập: a) Δ S∘ S∘ SO, S∘ O, S∘ SO, 248,10 1 2 205,03 256,66 93,95J/K
Nhận xét: Biến thiên entropy chuẩn của phản ứng này bằng biến thiên entropy chuẩn của ví dụ 1 nhưng ngược dấu.

- Giá trị entropy chuẩn của các chất được xác định bằng thực nghiệm.
- Một số HS khác nhận xét, bổ sung cho bạn.
Giải thích: phản ứng này xảy ra làm số phân tử khí tăng lên, chuyển động các
Bước 4: Kết luận, nhận định: GV tổng
quát lưu ý lại kiến thức trọng tâm và yêu
cầu HS ghi chép đầy đủ vào vở
phân tử hỗn loạn hơn, nên entropy của hệ
tăng.
b) Δ S CO, S C graphite, S O, 213,70 5,69 205,03 2,98J/K
Nhận xét: Giá trị này lớn hơn 0 không
đáng kể vì khi 1 mol (graphite, s) phản
ứng với 1 mol O g sinh ra 1 mol
CO g thì mức độ hỗn loạn các phân tử
không tăng lên đáng kể, số mol khí trước và sau phản ứng bằng nhau.
HOẠT ĐỘNG CỦA GV VÀ HS SẢN PHẨM DỰ
Bước 1: Chuyển giao nhiệm vụ:
- GV yêu cầu HS phát biểu về biến
thiên enthalpy: Thế nào là biến thiên
enthalpy? Khi nào biến thiên enthalpy dương, khi nào âm?
(Biến thiên enthalpy của phản ứng là nhiệt lượng tỏa ra hay thu vào của phản ứng ở một điều kiện xác định).
Phản ứng toả nhiệt có ΔH<0 và phản ứng thu nhiệt có ΔH>0.
II. Năng lượng tự do Gibbs
Thảo luận 3:
Hoà tan vôi sống CaO vào nước thì phản
ứng toả nhiệt ΔH<0 .
Bằng thực nghiệm, xác định được có hai yếu tố quyết định một quá trình hóa học có tự xảy ra hay không.
+ <0: năng lượng của hệ giảm (giảm enthalpy), trở thành hệ bền vững hơn (đó là các phản ứng tỏa nhiệt).
Hoạt động 2: Năng lượng tự do Gibbs
a) Mục tiêu:
- Nêu được ý nghĩa của dấu và trị số của biến thiên năng lượng tự do Gibbs ΔG∘ .
- Tính được ΔG từ bảng cho sẵn các giá trị ΔH và S của các chất.
b) Nội dung: HS đọc SGK để tìm hiểu nội dung kiến thức theo yêu cầu của GV, chú ý nghe giảng, thực hiện các nhiệm vụ, trả lời Câu hỏi, đọc hiểu Ví dụ, làm Vận dụng.
c) Sản phẩm: HS nêu được ý nghĩa của biến thiên năng lượng tự do, tính được
ΔG , dự đoán hoặc giải thích một chiều hướng của phản ứng dựa vào biến thiên năng lượng tự do Gibbs.
d) Tổ chức thực hiện:
- HS thảo luận nhóm đôi, trả lời câu hỏi Thảo luận 3: Hoà tan vôi sống ( vào nước, phản ứng toả nhiệt hay thu nhiệt? Dự đoán dấu của phản ứng.
- GV giới thiệu cho HS các yếu tố quyết định một quá trình hóa học có tự xảy ra hay không.
- HS nêu công thức tính biến thiên năng lượng Gibbs, giải thích các yếu
tố trong công thức.
- GV chốt lại kiến thức.
+ >0: hệ chuyển từ trạng thái có độ mất trật tự thấp sang trạng thái có độ mất trật tự cao hơn (độ tự do cao hơn, làm tăng entropy).
- Khi xét chiều tự xảy ra của phản ứng, phải xem xét cả hai yếu tố H∆ và S∆ , thông qua biến thiên năng lượng Gibbs ( G∆ ) (ở nhiệt độ và áp suất không đổi).
ΔG ΔH TxΔS
Trong đó: : biến thiên enthalpy chuẩn của phản ứng ở nhiệt độ T;
- HS nêu các trường hợp xảy ra với giá trị ΔG, khi đó phản ứng tự xảy ra, không tự xảy ra hay đạt trạng thái cân bằng.
- GV dẫn dắt: sử dụng công thức tính biến thiên năng lượng tự do Gibbs
Chúng ta có thể tính được biến thiên năng lượng tự do và dự đoán chiều hướng phản ứng.
- HS thảo luận nhóm đôi, đọc Ví dụ 2.
GV hướng dẫn.
+ Tính biến thiên enthalpy của phản ứng.
+ Tính entropy chuẩn của phản ứng.
+ Tính biến thiên năng lượng tự do, sử dụng công thức đã cho.
+ Từ đó xác định chiều hướng phản
ứng.
- GV cho HS làm ví dụ thêm.
Ví dụ: Tính biến thiên năng lượng tự do Gibbs của phản ứng.
Cho phản ứng và các số liệu:
CH g HOg ⇄CHOHg
: biến thiên entropy chuẩn của phản
ứng ở nhiệt độ T;
T: nhiệt độ tại đó xảy ra phản ứng (theo thang Kelvin);
: biến thiên năng lượng tự do Gibbs
chuẩn của phản ứng ở nhiệt độ T.
Dựa vào có thể dự đoán hoặc giải
thích được chiều hướng của một phản ứng
hóa học ở nhiệt độ T:
+ <0 phản ứng sẽ tự xảy ra ở điều
kiện chuẩn, nhiệt độ T.
+ 0 phản ứng đạt trạng thái cân
bằng.
+ >0 phản ứng không tự xảy ra ở
điều kiện chuẩn, nhiệt độ T.
Ví dụ 2 (SGK -tr30)
Ví dụ:
+ Ở điều kiện tiêu chuẩn: ΔH phản ứng
235,3 52,28 241,82
45,76 kJ⋅mol
ΔH<0 nên phản ứng toả nhiệt.
ΔH kJ mol của các chất CH g,HOg,CHOHg lần lượt là: 52,28; -241,82; -235,3.
S J.K ⋅mol của các chất CH g,HOg,CHOHg lần lượt là: 219,6; 188,72; 282.
- GV cho HS đọc lại kiến thức trọng tâm.
- HS thảo luận nhóm làm Vận dụng.
Khi cho mẩu nhỏ sodium ( ) vào chậu thuỷ tinh chứa nước, mẩu sodium tan, có bọt khí xuất hiện, làm tăng nhiệt độ của nước trong chậu. Giải thích tại sao phản ứng này lại tự xảy ra một cách dễ dàng.
Bước 2: Thực hiện nhiệm vụ:
- HS theo dõi SGK, chú ý nghe, tiếp nhận kiến thức, hoàn thành các yêu cầu, thảo luận nhóm.
- GV: quan sát và trợ giúp HS.
Bước 3: Báo cáo, thảo luận:
- HS giơ tay phát biểu, lên bảng trình
bày
ΔG∘ phản ứng 45,76 0,12617
⋅298 8,16 kJ⋅mol .
+ Ở 25∘C:ΔG phản ứng <0 nên phản ứng
xảy ra theo chiều thuận.
Kết luận:
- Ở nhiệt độ T, một phản ứng có càng
âm thì phản ứng tự xảy ra ở điều kiện chuẩn
càng thuận lợi và ngược lại.
- được tính theo công thức:
Vận dụng:
- Phản ứng làm tăng nhiệt độ của nước trong chậu, do đó ΔH<0 (toả nhiệt) (1)
- Sodium tan, bọt khí xuất hiện, do đó
Δ >0 (mức độ hỗn loạn của hệ tăng) (2)
- Từ (1) và (2) nhận thấy giá trị ΔG
ΔH T ΔS<0 nên phản ứng tự xảy ra một cách dễ dàng.
- Một số HS khác nhận xét, bổ sung cho bạn.
Bước 4: Kết luận, nhận định: GV tổng quát lưu ý lại kiến thức trọng tâm và yêu cầu HS ghi chép đầy đủ vào vở
C. HOẠT ĐỘNG LUYỆN TẬP
a) Mục tiêu: Học sinh củng cố lại kiến thức đã học.
b) Nội dung: HS vận dụng các kiến thức của bài học làm Bài 1, 2, 3 (SGK -tr32).
c) Sản phẩm học tập: HS giải được bài về entropy và năng lượng tự do Gibbs.
d) Tổ chức thực hiện:
Bước 1: Chuyển giao nhiệm vụ:
- GV tổng hợp các kiến thức cần ghi nhớ cho HS.
- GV tổ chức cho HS hoạt động theo nhóm thực hiện Bài 1, 2, 3 (SGK -tr32).
Bước 2: Thực hiện nhiệm vụ: HS quan sát và chú ý lắng nghe, thảo luận nhóm, hoàn thành các bài tập GV yêu cầu.
- GV quan sát và hỗ trợ.
Bước 3: Báo cáo, thảo luận:
- Mỗi bài tập GV mời HS trình bày. Các HS khác chú ý chữa bài, theo dõi nhận xét bài trên bảng.
Bước 4: Kết luận, nhận định:
- GV nhận xét thái độ làm việc, phương án trả lời của các học sinh, ghi nhận và tuyên dương
Kết quả:
Bài 1: Quá trình trộn nước và propanol làm tăng entropy của hệ.


Bài 2: a) Δ >0;
b) Δ <0;
c) Δ ≈0;
d) Δ ≈0;
e) Δ >0
Bài 3:
a) ΔH ΔH CO, ΔH∘ O, ΔH∘ CO,
0 393,51 283,46kJ
ΔS∘ S∘ CO, 1 2 S∘ O, S∘ CO, 308,675J/K
Vậy Δ ∘ Δ ∘ Δ ∘ 283,01 298 308,675 10 ≈
375kJ>0
Phản ứng không tự xảy ra ở 298K
b) Muốn phản ứng xảy ra:
Δ ∘ Δ ∘ Δ ∘ <0⇒283,46 308,675.10 <0⇒ > 918,31 (K).
D. HOẠT ĐỘNG VẬN DỤNG
a) Mục tiêu:
- Học sinh thực hiện làm bài tập vận dụng để nắm vững kiến thức.
b) Nội dung: HS sử dụng SGK và vận dụng kiến thức đã học để làm bài tập.
c) Sản phẩm: HS vận dụng kiến thức đã học giải quyết được bài toán entropy và
năng lượng tự do Gibbs, dự đoán được chiều hướng của phản ứng.
d) Tổ chức thực hiện:
Bước 1: Chuyển giao nhiệm vụ
- Gv giới thiệu thêm các kiến thức và cho HS làm bài tập.
1. Quá trình tự diễn biến và entropy:
Trong tự nhiên có nhiều quá trình tự xảy ra và cũng có quá trình không tự xảy ra.
Sự biến thiên của entropy Δ được xác định bằng thực nghiệm dựa vào nhiệt của quá trình, nó là một hàm trạng thái: ΔS .
Quá trình chuyển trạng thái từ rắn → lỏng → khí là thu nhiệt và entropy tăng Δ >
Quá trình chuyển trạng thái từ khí → lỏng → rắn là toả nhiệt và entropy giảm ΔS<
Biến thiên Δ là độ đo tính không thuận nghịch của quá trình trong hệ cô lập và đăc trưng cho chiều diễn biến của các quá trình tự nhiên. (Hệ được gọi là cô lập nếu gồm hệ khảo sát và môi trường xung quanh).
Bài 1: Quá trình chuyển 419J nhiệt của hệ ở 300K cho môi trường xung quanh ở 200K có tự xảy ra không?
Bài 2: Một mol nước đá tại nhiệt độ 0 ∘C và áp suất 1 bar nếu hấp thụ 6003,734J nhiệt thì có tự chảy ra thành nước lỏng không?
2. Biến thiên năng lượng tự do Gibbs với cân bằng hóa học
Phản ứng: xA yB⟶zC tD đạt tới trạng thái cân bằng hoá học có hằng số cân bằng K ⋅ ⋅ .
Nhiệt động học đã chứng minh được quan hệ giữa năng lượng tự do Gibbs và hằng
số cân bằng: ΔG RTlnK. (R là hằng số lí tưởng, R = 8,314 J/(mol.K)).
Bài 3: Phản ứng: 2 → 2 có các số liệu sau:
ΔH kJ⋅mol 0 0 258,8
S ∘ J⋅K ⋅mol 130,52 205,04 70,08
Tính hằng số cân bằng của K của phản ứng.
Bước 2: Thực hiện nhiệm vụ
- HS suy nghĩ, trao đổi, thảo luận thực hiện nhiệm vụ.
- GV điều hành, quan sát, hỗ trợ
Bước 3: Báo cáo, thảo luận
- Bài tập: đại diện HS trình bày kết quả thảo luận, các HS khác theo dõi, đưa ý kiến.
Bước 4: Kết luận, nhận định
- GV nhận xét, đánh giá, đưa ra đáp án đúng, chú ý các lỗi sai của học sinh hay mắc phải. Đáp án:
Suy ra: 474⋅540 8,314⋅298⋅lnK⇒lnK 191,534⇒K 1,52⋅10
* HƯỚNG DẪN VỀ NHÀ
• Ghi nhớ kiến thức trong bài.
• Hoàn thành các bài tập trong SBT
• Chuẩn bị bài mới "Bài 5: Sơ lược về phản ứng cháy, nổ"
Bài
hệ 0,333 J⋅K .
môi truơng 0,500 J⋅K .
tồng 0,333 0,500 0,167 J K >0 nên quá trình tự xảy ra.
21,98 J⋅mol ⋅K >0 nên quá trình tự xảy ra.
Ngày soạn: .../.../...
Ngày dạy: .../.../...
CHUYÊN ĐỀ 2: HÓA HỌC TRONG VIỆC PHÒNG CHỐNG CHÁY, NỔ
BÀI 5: SƠ LƯỢC VỀ PHẢN ỨNG CHÁY, NỔ (3 TIẾT)
I. MỤC TIÊU:
1. Kiến thức, kĩ năng: Học xong bài này, HS đạt các yêu cầu sau:
• Nêu được khái niệm, đặc điểm của phản ứng cháy.
• Nêu được một số ví dụ về sự cháy một số chất vô cơ và hữu cơ.
• Nêu được điều kiện cần và đủ để phản ứng cháy xảy ra.
• Nêu được khái niệm, đặc điểm cơ bản của phản ứng nố
• Nêu được khái niệm phản ứng nổ vật lí và nổ hóa học.
• Trình bày được khái niệm về "nổ bụi".
• Trình bày được những sản phẩm độc hại thường sinh ra trong các phản ứng cháy.
2. Năng lực - Năng lực chung:
• Tự chủ và tự học: Chủ động, tích cực tìm hiểu về phản ứng cháy và nổ
• Giao tiếp và hợp tác: Sử dụng ngôn ngữ khoa học để trình bày một số khái niệm về phản ứng cháy và nổ; Hoạt động nhóm một cách hiệu quả theo đúng
yêu cầu của , đảm bảo các thành viên trong nhóm đều được tham gia và trình bày báo cáo.
• Giải quyết vấn đề và sáng tạo: Thảo luận với các thành viên trong nhóm nhằm giải quyết các vấn đề trong bài học để hoàn thành nhiệm vụ học tập.
- Năng lực riêng:
• Nhận thức hoá học: Nêu được khái niệm, đặc điểm của phản ứng cháy; điều kiện cần và đủ để phản ứng cháy xảy ra; khái niệm, đặc điểm cơ bản của phản ứng nổ; khái niệm phản ứng nổ vật lí và nổ hoá học; khái niệm về "nổ bụi".
• Tìm hiểu thế giới tự nhiên dưới góc độ hoá học: Trình bày được những sản phẩm độc hại thường sinh ra trong các phản ứng cháy và tác hại của chúng với con người.
• Vận dụng kiến thức, kĩ năng đã học: Nêu được một số ví dụ về sự cháy các chất vô cơ và hữu cơ.
3. Phẩm chất
- Có ý thức học tập, ý thức tìm tòi, khám phá và sáng tạo, có ý thức làm việc nhóm, tôn trọng ý kiến các thành viên khi hợp tác.
- Chăm chỉ tích cực xây dựng bài, có trách nhiệm, chủ động chiếm lĩnh kiến thức theo sự hướng dẫn của GV.
II. THIẾT BỊ DẠY HỌC VÀ HỌC LIỆU
1. Đối với GV: SGK, Tài liệu giảng dạy, giáo án, đồ dùng dạy học.
2. Đối với HS: SGK, SBT, vở ghi, giấy nháp, đồ dùng học tập (bút, thước...), bảng nhóm, bút viết bảng nhóm.
III. TIẾN TRÌNH DẠY HỌC
A. HOẠT ĐỘNG KHỞI ĐỘNG (MỞ ĐẦU)
a) Mục tiêu:
- HS được gợi mở về phản ứng cháy nổ trong tự nhiên, đời sống và sản xuất.

b) Nội dung: HS đọc tình huống mở đầu, suy nghĩ trả lời câu hỏi.
c) Sản phẩm: HS trả lời được câu hỏi mở đầu.
d) Tổ chức thực hiện:
Bước 1: Chuyển giao nhiệm vụ:
- GV đặt vấn đề: Cháy, nổ là các hiện tượng thường gặp trong đời sống. Các hiện tượng này đã được các nhà khoa học quan tâm, nghiên cứu để phục vụ cho cuộc sống, đồng thời hạn chế những thiệt hại do chúng gây ra. Vậy phản ứng cháy, nổ là gì? Chúng có đặc điểm như thế nào? Khi nào phản ứng cháy, nổ xảy ra?
Bước 4: Kết luận, nhận định: GV đánh giá kết quả của HS, trên cơ sở đó dẫn dắt
HS vào bài học mới.
B. HÌNH THÀNH KIẾN THỨC MỚI
Hoạt động 1: Phản ứng cháy
a) Mục tiêu:
- Nêu được khái niệm, đặc điểm của phản ứng cháy và một số ví dụ về sự cháy một
số chất vô cơ và hữu cơ.
- Nêu được điều kiện cần và đủ để phản ứng cháy xảy ra.
b) Nội dung:
HS đọc SGK, nghe giảng, thực hiện các nhiệm vụ được giao, suy nghĩ trả lời câu hỏi.
c) Sản phẩm: HS hình thành được kiến thức, trình bày được khái niệm và đặc điểm cơ bản của phản ứng cháy.
d) Tổ chức thực hiện: HĐ CỦA GV VÀ HS SẢN PHẨM DỰ KIẾN
Bước 1: Chuyển giao nhiệm vụ:
- GV chia lớp thành 4 – 5 nhóm, yêu
cầu các nhóm quan sát hình 5.1 trong
1. Phản ứng cháy
a) Khái niệm, đặc điểm của phản ứng cháy
Video nhà máy hóa chất nổ: https://www.youtube.com/watch?v=AMriEDVLe7w
Bước 2: Thực hiện nhiệm vụ: HS quan sát và chú ý lắng nghe, thảo luận nhóm đôi
hoàn thành yêu cầu.
Bước 3: Báo cáo, thảo luận: GV gọi một số HS trả lời, HS khác nhận xét, bổ sung.
SGK, tìm hiểu nội dung SGK trả lời
+ Phản ứng cháy là gì?
+ HS trả lời câu hỏi Thảo luận 1, 2 (SGK -tr33).
- Phản ứng cháy là phản ứng oxi hóa – khử giữa chất cháy và chất oxi hóa, có tỏa nhiệt và phát sáng.
Thảo luận 1:
1. Quan sát Hình 5.1, nêu hiện tượng và viết phương trình hoá học xảy ra. Xác định vai trò của các chất trong các phản ứng hoá học này và cho biết đây là loại phản ứng hoá học nào.
- Hiện tượng: các phản ứng cháy đều có ngọn lửa và
phát sáng.
- Phương trình hoá học và vai trò của các chất: 2Mg O ⟶ ∘ 2MgO
(a) (chất khử: Mg, chất oxi hoá: O )
C O ⟶ ∘ CO
(b) (chất khử: C, chất oxi hoá: O )
3. Dựa vào Hình 5.2, kể tên chất cháy, chất oxi hoá và nguồn nhiệt của các phản ứng cháy có trong Hình 5.1.
Phản ứng hoá học
2. Các phản ứng cháy nêu trên có những đặc điểm chung nào?
- HS trả lời câu hỏi Luyện tập: Nêu một số ví dụ về phản ứng cháy.
CH 5O ⟶ ∘ 3CO 4HO
(c) (chất khử: CH chất oxi hoá: O )
CH 13/2O ⟶ ∘ 4CO 5HO
(c) (chất khử: CH chất oxi hoá: O )

Các phản ứng hoá học này đều là phản ứng oxi hoá -
khử.
Thảo luận 2:
Là phản ứng của chất cháy với oxygen, là phản ứng oxi hoá - khử, có phát ra ánh sáng.
Luyện tập:
Ví dụ: cháy rừng, cháy nhà, đốt gas khi nấu nướng, quẹt diêm, đốt pháo hoa,...


4. Quan sát Hình 5.3, hãy cho biết trường hợp nào dễ bắt cháy hơn. Phản ứng cháy xảy ra phụ thuộc vào yếu tố nào?
- HS tìm hiểu điều kiện cần và đủ để xảy ra phản ứng cháy.
- GV yêu cầu HS trả lời Câu hỏi Thảo luận 3, (SGK -tr34).
b) Điều kiện cần và đủ để phản ứng cháy xảy ra
Thảo luận 3:
- GV yêu cầu HS trình bày điều kiện cần và đủ để phản ứng cháy xảy ra.
Bước 2: Thực hiện nhiệm vụ:
- HS theo dõi SGK, chú ý nghe, tiếp nhận kiến thức, hoàn thành các yêu
ọn
ửa C O ⟶ ∘ CO C O Ngọn lửa CH 5O ⟶ ∘ 3CO 4HO
CH O Ngọn lửa CH 13 /2O ⟶ ∘ 4CO 5HO
CH O Ngọn lửa Thảo luận 4:
Phản ứng cháy của cách đốt giấy bằng nguồn lửa trực tiếp xảy ra nhanh hơn. Điều này phụ thuộc vào nguồn nhiệt và thời gian tiếp xúc của 3 điều kiện cần. Nguồn nhiệt phải đạt tới giới hạn bắt cháy của chất cháy và thời gian tiếp xúc của 3 điều kiện cần phải đủ lâu để xuất hiện sự cháy.
cầu, hoạt động cặp đôi, kiểm tra chéo đáp án.
Bước 3: Báo cáo, thảo luận:
- HS giơ tay phát biểu, lên bảng trình
bày
- Một số HS khác nhận xét, bổ sung cho bạn.
Bước 4: Kết luận, nhận định: GV tổng quát lưu ý lại kiến thức trọng tâm và yêu cầu HS ghi chép đầy đủ vào vở
Hoạt động 2: Phản ứng nổ
a) Mục tiêu:
Kết luận:
- Điều kiện cần: (1) Chất cháy, (2) Chất oxi hóa; (3)
Nguồn nhiệt.
- Điều kiện đủ:
(1) Nồng độ oxygen trong không khí phải lớn hơn 14% thể tích (ngoại trừ một số chất dễ cháy, gây nổ manh: hyrogen, methane, acetylene,..)

(2) Nguồn nhiệt phải đủ đưa hỗn hợp cháy đến nhiệt độ bắt lửa của chất cháy.
(3) Thời gian tiếp xúc của 3 điều kiện cần phải đủ lâu để xuất hiện sự cháy.
- HS nêu được khái niệm, đặc điểm cơ bản của phản ứng nổ
- HS nêu được khái niệm nổ vật lí, nổ hóa học.
- Trình bày được khái niệm về "nổ bụi".
b) Nội dung: HS đọc SGK để tìm hiểu nội dung kiến thức theo yêu cầu của GV, chú
ý nghe giảng, thực hiện nhiệm vụ, trả lời câu hỏi.
c) Sản phẩm: HS hình thành kiến thức, trình bày được về phản ứng nổ
d) Tổ chức thực hiện:
HOẠT ĐỘNG CỦA GV VÀ HS SẢN PHẨM DỰ KIẾN
Bước 1: Chuyển giao nhiệm vụ:
- GV yêu cầu HS tìm hiểu nội dung
SGK và trả lời câu hỏi:
+ Phản ứng nổ là gì?
+ HS trả lời câu hỏi Thảo luận 5, 6
(SGK)
5. Từ việc quan sát Hình 5.4 và 5.5, hãy mô tả hiện tượng và so sánh mức độ của mỗi vụ nổ

2. Phản ứng nổ
a) Khái niệm, đặc điểm cơ bản của phản ứng nổ
- Phản ứng nổ là phản ứng xảy ra với tốc
độ rất lớn kèm theo sự tăng thể tích đột ngột và tỏa lượng nhiệt lớn.
Thảo luận 5:
Hiện tượng: trong vụ nổ bình gas xuất hiện đám cháy lớn, trong vụ nổ bom nguyên tử có xuất hiện cột khói rất cao trên bầu trời.
Mức độ của vụ nổ bom nguyên tử lớn hơn gấp nhiều lần so với vụ nổ bình gas thông thường.
Thảo luận 6:
Các công trình kiến trúc, nhà ở, môi trường sống bị phá hử; gây thương vong cho nhiều người do vết thương, nhiễm độc phóng xạ; ...
6. Quan sát Hình 5.5, hãy cho biết hậu
quả để lại sau vụ nổ bom nguyên tử.
- HS rút ra kiến thức: Thế nào là phản ứng nổ?
- HS thực hiện Luyện tập:
Luyện tập:
- Một số phản ứng nổ: phản ứng giữa H và O ; nổ bong bóng; nổ của ammonium nitrate NHNO
- Một số vụ nổ trên thế giới:
