Ths Nguyễn Thanh Tú eBook Collection

MINH HỌA BGD) (41-60)
WORD VERSION | 2023 EDITION
ORDER NOW / CHUYỂN GIAO QUA EMAIL TAILIEUCHUANTHAMKHAO@GMAIL
BỘ GIÁO DỤC VÀ ĐÀO TẠO
ĐỀ THAM KHẢO (Đề thi có 04 trang) (40 câu trắc nghiệm)
ĐỀ THAM KHẢO THI TỐT NGHIỆP THPT
NĂM HỌC 2022-2023
Môn: HOÁ HỌC
Thời gian: 50 phút (không tính thời gian phát đề)
Mã đề 042
Cho nguyên tử khối: H = 1; C = 12; N = 14; O = 16; Na = 23; Mg = 24; Al = 27; P = 31; S = 32; Cl = 35,5; Br = 80; K = 39; Ca = 40; Fe = 56; Cu = 64; Zn = 65; Ag = 108; I = 127; Ba = 137.
Câu 41: Natri phản ứng với clo sinh ra sản phẩm nào sau đây?
A KCl. B NaCl. C NaClO. D NaOH.
Câu 42: Dung dịch chất nào sau đây không hòa tan được Al(OH)3?
A. KOH. B. HCl. C. BaCl2. D. HNO3.
Câu 43: Ở điều kiện thường, chất nào sau đây là chất rắn?
A Đimetylamin. B Etylamin. C Glyxin. D Metylamin.
Câu 44: Cho thanh kim loại Zn vào dung dịch chất nào sau đây sẽ xảy ra hiện tượng ăn mòn điện hóa học?
A. KCl. B. HCl. C. CuSO4. D. MgCl2.
Câu 45: Nước cứng vĩnh cửu tác dụng với chất nào sau đây thu được kết tủa?
A NaNO3 B Na2CO3 C NaCl. D HCl.
Câu 46: Trong điều kiện không có oxi, sắt phản ứng với lượng dư dung dịch nào sau đây sinh ra muối sắt (III)?
A. H2SO4 đặc, nóng. B. HNO3 đặc, nguội. C. CuSO4 loãng. D. HCl loãng.
Câu 47: Trong phản ứng của kim loại Mg với khí O2, một nguyên tử Mg nhường bao nhiêu electron?
A 1. B 3. C 4. D 2.
Câu 48: Công thức của etyl axetat là
A. CH3COOCH3. B. CH3COOC2H5. C. HCOOCH3. D. HCOOC2H5.
Câu 49: Điện phân nóng chảy NaCl, ở catot thu được chất nào sau đây?
A HCl. B Cl2 C Na. D NaOH.
Câu 50: Trùng hợp vinyl clorua tạo thành polime nào sau đây?
A. Polibutadien. B. Polietilen. C. Poli(vinyl clorua). D. Policaproamit.
Câu 51: Chất nào sau đây là muối axit?
A NaHCO3 B Na2SO4 C Na2CO3 D NaCl.
Câu 52: Trong công nghiệp, nhôm được sản xuất bằng phương pháp điện phân nóng chảy chất nào sau đây?
A. AlCl3. B. Al2O3. C. Al(OH)3. D. Al(NO3)3.
Câu 53: Tác nhân chủ yếu gây “hiệu ứng nhà kính” là do sự tăng nồng độ trong khí quyển của chất nào sau
đây?
A CO2 B O2 C N2 D H2
Câu 54: Chất nào sau đây là chất béo?
A. Xenlulozơ. B. Axit stearic. C. Glixerol. D. Tristearin.
Câu 55: Kim loại nào sau đây có khối lượng riêng nhỏ nhất?
A Fe. B Li. C Pb. D W.
Câu 56: Chất nào sau đây có 2 nguyên tử cacbon trong phân tử?
Câu 57: Chất nào sau đây là amin bậc một?
A. CH3NHC2H5. B. (CH3)2NH. C. (C2H5)3N. D. C6H5NH2.
Câu 58: Crom(III) oxit là chất rắn màu lục thẫm, được dùng tạo màu lục cho đồ sứ, đồ thủy tinh. Công
thức của crom(III) oxit là
A Cr(OH)3 B CrO. C Cr2O3 D CrO3
Câu 59: Kim loại nào sau đây tác dụng với H2O (dư) tạo thành dung dịch kiềm?
A. Hg. B. Cu. C. K. D. Ag.
Câu 60: Chất nào sau đây có phản ứng tráng bạc?
A Saccarozơ B Xenlulozơ C Tinh bột. D Glucozơ
Câu 61: Hòa tan hết 2,02 gam hỗn hợp gồm MgO và ZnO cần vừa đủ 60 ml dung dịch HCl 1M, sau phản
ứng thu được dung dịch chứa m gam hỗn hợp muối. Giá trị của m là
A. 3,67. B. 4,21. C. 4,15. D. 3,85.
Câu 62: Phát biểu nào sau đây đúng?
A Trùng hợp buta-1,3-đien thu được polibuta-1,3-đien.
B. Amilopectin có cấu trúc mạch polime không phân nhánh.
C. Tơ xenlulozơ axetat và tơ visco đều là tơ tổng hợp.
D Polistiren được điều chế bằng phản ứng trùng ngưng stiren.
Câu 63: Thí nghiệm nào sau đây không xảy ra phản ứng?
A Cho dung dịch HCl vào dung dịch NaHCO3
B. Cho dung dịch KHSO4 vào dung dịch BaCl2.
C Cho thanh kim loại Ag vào dung dịch FeSO4
D Cho thanh kim loại Al vào dung dịch H2SO4 loãng.
Câu 64: Trong công nghiệp, saccarozơ là nguyên liệu để thủy phân thành glucozơ và fructozơ dùng trong kĩ thuật tráng gương, ruột phích. Để thu được 27 kg glucozơ cần thủy phân m kg saccarozơ với hiệu suất phản ứng là 60%. Giá trị của m là
A. 25,65. B. 85,50. C. 42,75. D. 51,30.
Câu 65: Để phản ứng vừa đủ với 1,24 gam amin X (no, đơn chức, mạch hở) cần 400 ml dung dịch HCl 0,1M. Công thức phân tử của X là
A CH5N. B C2H7N. C C4H11N. D C3H9N.
Câu 66: Chất X được tạo thành trong cây xanh nhờ quá trình quang hợp. Thủy phân hoàn toàn X (xúc tác axit) thu được chất Y. Chất Y có nhiều trong quả nho chín nên còn được gọi là đường nho. Hai chất X và
Y lần lượt là
A. Tinh bột và glucozơ.
C. Xenlulozơ và fructozơ.
B Xenlulozơ và saccarozơ D Tinh bột và saccarozơ
Câu 67: Đốt cháy 5,4 gam kim loại M (có hóa trị không đổi) trong 1,4 lít khí O2 đến phản ứng hoàn toàn được chất rắn X. Hòa tan hết X trong dung dịch HCl dư thu được 2,24 lít khí H2. Kim loại M là
A Al. B Ca. C Zn. D Mg.
Câu 68: Xà phòng hóa este X có công thức phân tử C4H8O2 bằng dung dịch NaOH dư thu được muối Y và ancol Z (bậc II). Công thức cấu tạo thu gọn của X là
A HCOOCH(CH3)2 C CH3COOC2H5
B CH3CH2COOCH3 D HCOOCH2CH2CH3
Câu 69: Cho 4 dung dịch riêng biệt: CuSO4, FeCl3, HCl và NaOH. Số dung dịch có khả năng phản ứng
được với kim loại Fe là
A. 3.
B. 4. C. 2. D. 1.
Câu 70: Thủy phân hoàn toàn 14,8 gam este đơn chức X bằng dung dịch NaOH dư, đun nóng, thu được 16,4 gam muối Y và m gam ancol Z. Giá trị của m là
A. Ancol propylic. B. Ancol metylic. C. Ancol etylic. D. Ancol butylic. Trang
Trang 1/4 – Mã đề 042
A. 6,4. B. 4,6. C. 3,2. D. 9,2.
Câu 71: Cho các phát biểu sau:
(a) Isoamyl axetat có mùi thơm của chuối chín.
(b) Lưu hóa cao su buna thu được cao su buna-S.
(c) Đun nóng mỡ lợn với dung dịch NaOH đặc, thu được xà phòng.
(d) Nhỏ vài giọt dung dịch I2 vào lát cắt của củ khoai lang xuất hiện màu xanh tím.
(
đ) Nhỏ dung dịch Gly-Val vào ống nghiệm chứa Cu(OH)2 xuất hiện hợp chất màu tím.
Số phát biểu đúng là
A. 5. B. 4. C. 2. D. 3.
Câu 72: Thực hiện các thí nghiệm sau:
(a) Cho kim loại Na vào dung dịch CuSO4
(b) Cho kim loại Al vào dung dịch KOH dư
(c) Cho dung dịch AgNO3 vào dung dịch HCl.
(d) Cho NH4Cl vào dung dịch Ba(OH)2 đun nóng.
(đ) Cho dung dịch H2SO4 vào dung dịch Ba(HCO3)2
Sau khi các phản ứng kết thúc, số thí nghiệm vừa thu được kết tủa vừa thu được chất khí là
A. 5. B. 3. C. 2. D. 4.
Câu 73: Một loại phân NPK có độ dinh dưỡng được ghi trên bao bì như ở hình bên.
Thí nghiệm 2: Cho 0,5 mol E vào dung dịch NaOH dư, đun nóng thì có 0,65 mol NaOH phản ứng và thu
được 32,2 gam ancol Y.
Thí nghiệm 3: Đốt cháy 0,5 mol E bằng O2 dư thu được 3,65 mol CO2 và 2,85 mol H2O.
Biết các phản ứng xảy ra hoàn toàn. Phần trăm khối lượng của Z trong E là
A 73,86%. B 71,24%. C 72,06%. D 74,68%.
Câu 78: Dung dịch X gồm CuSO4 và NaCl. Tiến hành điện phân dung dịch X với điện cực trơ, màng ngăn
xốp, cường độ dòng điện 0,5A, hiệu suất điện phân là 100%. Lượng khí sinh ra từ bình điện phân và lượng kim loại Cu sinh ra ở catot theo thời gian điện phân được cho ở bảng sau:
Thời gian điện phân (giây) t t + 17370 3t
Lượng khí sinh ra từ bình điện phân (mol) a a + 0,075 4,5a
Lượng kim loại Cu sinh ra ở catot (mol) 0,06 0,075 0,075
Số mol NaCl trong X là A 0,35 mol. B 0,40 mol. C 0,45 mol. D 0,30 mol.
Câu 79: Cho sơ đồ các phản ứng sau:
(1) NaAlO2 + CO2 + H2O → X + NaHCO3
(2) X + Y → AlCl3 + H2O
(3) NaHCO3 + Y → Z + H2O + CO2
Các chất X, Z thỏa mãn sơ đồ trên lần lượt là
A. Al(OH)3, Na2CO3. B. Al(OH)3, NaCl. C. AlCl3, NaCl. D. AlCl3, Na2CO3.
Câu 80: Cho E (C3H6O3) và F (C4H6O5) là các chất hữu cơ mạch hở. Trong phân tử chất F chứa đồng thời
các nhóm -OH, -COO- và -COOH. Cho các chuyển hóa sau:
Để cung cấp 17,2 kg nitơ, 3,5 kg photpho và 8,3 kg kali cho một thửa ruộng, người ta sử dụng đồng thời x kg phân NPK (ở trên), y kg đạm urê (độ dinh dưỡng là 46%) và z kg phân kali (độ dinh dưỡng là 60%).
Tổng giá trị (x + y + z) là
A 62,6. B 77,2. C 80,0. D 90,0.
Câu 74: Chất béo X gồm các triglixerit. Phần trăm khối lượng của cacbon và hiđro trong X lần lượt là
77,25% và 11,75%. Xà phòng hóa hoàn toàn m gam X bằng dung dịch KOH dư, đun nóng thu được a gam muối. Mặt khác, cứ 0,1m gam X phản ứng tối đa với 5,12 gam Br2 trong dung dịch. Giá trị của a là
A. 105,24. B. 104,36. C. 103,28. D. 102,36.
Câu 75: Bình “ga” loại 12 cân sử dụng trong hộ gia đình Y có chứa 12 kg khí hóa lỏng (LPG) gồm propan và butan với tỉ lệ mol tương ứng là 2 : 3. Khi được đốt cháy hoàn toàn, 1 mol propan tỏa ra lượng nhiệt là 2220 kJ và 1 mol butan tỏa ra lượng nhiệt là 2850 kJ. Trung bình, lượng nhiệt tiêu thụ từ đốt khí “ga” của hộ gia đình Y là 10.000 kJ/ngày và hiệu suất sử dụng nhiệt là 67,3%. Sau bao nhiêu ngày hộ gia đình Y sử dụng hết bình ga trên?
A 30 ngày. B 60 ngày. C 40 ngày. D 20 ngày.
Câu 76: Hỗn hợp E gồm Fe, Fe3O4, Fe2O3 và FeCO3. Nung 42,8 gam E trong bình kín chứa 0,05 mol khí O2 thu được chất rắn X (chỉ gồm Fe và các oxit) và 0,1 mol khí CO2. Hòa tan hết X trong dung dịch HCl
nồng độ 7,3% thu được 6,72 lít khí H2 và dung dịch Y chỉ chứa muối. Cho tiếp dung dịch AgNO3 dư vào Y thu được 244,1 gam kết tủa gồm Ag và AgCl. Biết các phản ứng xảy ra hoàn toàn. Nồng độ phần trăm của FeCl2 trong Y gần nhất với giá trị nào sau đây?
A 6,05%. B 6,87%. C 3,03%. D 3,44%.
Câu 77: Hỗn hợp E gồm axit cacboxylic đơn chức X, ancol no đa chức Y và chất Z là sản phẩm của phản ứng este hóa giữa X với Y. Trong E, số mol của X lớn hơn số mol của Y. Tiến hành các thí nghiệm sau:

Thí nghiệm 1: Cho 0,5 mol E phản ứng với dung dịch NaHCO3 dư thu được 3,36 lít khí CO2
(1) E + NaOH (t°) → X + Y
(2) F + NaOH (t°) → X + H2O
(3) X + HCl → Z + NaCl
Biết X, Y, Z là các hợp chất hữu cơ. Cho các phát biểu sau:
(a) Chất X có số nguyên tử oxi bằng số nguyên tử hiđro.
(b) Phân tử chất E chứa đồng thời nhóm -OH và nhóm -COOH.
(c) Trong công nghiệp, chất Y được điều chế trực tiếp từ etilen.
(d) Nhiệt độ sôi của chất Y nhỏ hơn nhiệt độ sôi của ancol etylic.
(đ) 1 mol chất Z tác dụng với Na dư thu được tối đa 1 mol khí H2
Số phát biểu đúng là
A. 4. B. 3. C. 5. D. 2.
Trang 4/4 – Mã
ĐÁP ÁN VÀ GIẢI CHI TIẾT
2Fe + 6H2SO4 đặc nóng, dư —> Fe2(SO4)3 + 3SO2 + 6H2O
Fe thụ động trong HNO3 đặc nguội. Với CuSO4, HCl thì Fe chỉ tạo muối sắt (II).
Câu 47:
Trong phản ứng của kim loại Mg với khí O2, một nguyên tử Mg nhường 2 electron:
Mg —> Mg+2 + 2e
Câu 48:
Công thức của etyl axetat là CH3COOC2H5.
Câu 41:
Natri phản ứng với clo sinh ra sản phẩm NaCl:
2Na + Cl2 —> 2NaCl
Câu 42:
A. KOH + Al(OH)3 —> KAlO2 + 2H2O
B. 3HCl + Al(OH)3 —> AlCl3 + 3H2O
C. Không phản ứng
D. 3HNO3 + Al(OH)3 —> Al(NO3)3 + 3H2O
Câu 43:
Ở điều kiện thường, glyxin (H2NCH2COOH) là chất rắn.
Glyxin tồn tại ở dạng ion lưỡng cực nên có một số tính chất vật lí giống hợp chất ion như trạng thái rắn điều kiện thường, nhiệt độ nóng chảy cao, tan tốt…
Câu 44:
Cho thanh kim loại Zn vào dung dịch CuSO4 sẽ xảy ra hiện tượng ăn mòn điện hóa học.
Zn + CuSO4 —> Cu + ZnSO4
Cu sinh ra bám vào thanh Zn tạo cặp điện cực Zn-Cu tiếp xúc với nhau và cùng tiếp xúc với môi trường
điện li nên xảy ra hiện tượng ăn mòn điện hóa học.
Câu 45:
Nước cứng vĩnh cửu (chứa Mg2+, Ca2+, Cl-, SO4 2-) tác dụng với Na2CO3 thu được kết tủa:
Mg2+ + CO3 2- —> MgCO3
Ca2+ + CO3 2- —> CaCO3
Câu 46:
Trong điều kiện không có oxi, sắt phản ứng với lượng dư dung dịch H2SO4 đặc nóng sinh ra muối sắt (III):
Câu 49:
Điện phân nóng chảy NaCl, ở catot thu được Na:
2NaCl (đpnc) —> 2Na (catot) + Cl2 (anot)
Câu 50:
Trùng hợp vinyl clorua tạo thành Poli(vinyl clorua):
nCH2=CH-Cl —> (-CH2-CHCl-)n
Câu 51:
NaHCO3 là muối axit vì gốc axit có khả năng nhường H+
Câu 52:
Trong công nghiệp, nhôm được sản xuất bằng phương pháp điện phân nóng chảy Al2O3:
2Al2O3 (đpnc) —> 4Al (catot) + 3O2 (anot)
Câu 53:
Tác nhân chủ yếu gây “hiệu ứng nhà kính” là do sự tăng nồng độ trong khí quyển của CO2.
Khí CO2 ngăn cản các tia bức xạ nhiệt từ trái đất ra ngoài không gian làm trái đất giữ lại nhiệt nhiều hơn và nóng lên.
Câu 54:
Tristearin (C17H35COO)3C3H5 là chất béo.
Câu 55:
Kim loại Li có khối lượng riêng nhỏ nhất.
Câu 56:
A. Ancol propylic (C2H5CH2OH).
Trang 6/4 – Mã
042
B. Ancol metylic (CH3OH).
C. Ancol etylic (C2H5OH).
D. Ancol butylic (C2H5CH2CH2OH).
Câu 57:
Khi thay thế 1H trong NH3 bằng 1 gốc hiđrocacbon ta được amin bậc 1 —> C6H5NH2 là amin bậc 1.
Câu 58:
Công thức của crom(III) oxit là Cr2O3.
Câu 59:
Kim loại K tác dụng với H2O (dư) tạo thành dung dịch kiềm: 2K + 2H2O —> 2KOH + H2
Câu 60:
Glucozơ (CH2OH(CHOH)4CHO) có phản ứng tráng bạc.
Câu 61:
nHCl = 0,06 —> nH2O = 0,03
Bảo toàn khối lượng: m oxit + mHCl = m muối + mH2O —> m muối = 3,67 gam
Câu 62:
A. Đúng: nCH2=CH-CH=CH2 —> (-CH2-CH=CH-CH2-)n
B. Sai, amilopectin có cấu trúc mạch polime phân nhánh.
C. Sai, tơ xenlulozơ axetat và tơ visco đều là tơ bán tổng hợp (nhân tạo).
D. Sai, polistiren được điều chế bằng phản ứng trùng hợp stiren:
nC6H5-CH=CH2 —> (-CH(C6H5)-CH2-)n
Câu 63:
A. HCl + NaHCO3 —> NaCl + CO2 + H2O
B. KHSO4 + BaCl2 —> BaSO4 + KCl + HCl
C. Không phản ứng.
D. Al + H2SO4 loãng —> Al2(SO4)3 + H2
Câu 64:
Saccarozơ + H2O —> Glucozơ + Fructozơ
Trang 7/4 – Mã đề 042
342……………………..180 m………………………27
H = 60% —> m = 27.342/(180.60%) = 85,5 kg
Câu 65:
nX = nHCl = 0,04 —> MX = 1,24/0,04 = 31
—> X là CH5N
Câu 66:
Chất X được tạo thành trong cây xanh nhờ quá trình quang hợp —> X là tinh bột:
6nCO2 + 5nH2O —> (C6H10O5)n + 6nO2
Thủy phân hoàn toàn X (xúc tác axit) thu được chất Y —> Y là glucozơ:
(C6H10O5)n + nH2O —> nC6H12O6
Câu 67:
nO2 = 0,0625; nH2 = 0,1
Kim loại M hóa trị x, bảo toàn electron:
5,4x/M = 4nO2 + 2nH2 —> M = 12x
—> Chọn x = 2, M = 24: M là Mg
Câu 68:
Z bậc 2 là CH3-CHOH-CH3
—> X là HCOOCH(CH3)2.
Câu 69:
Có 3 dung dịch có khả năng phản ứng được với kim loại Fe là: CuSO4, FeCl3, HCl
CuSO4 + Fe —> Cu + FeSO4
FeCl3 + Fe —> FeCl2
HCl + Fe —> FeCl2 + H2
Câu 70:
mRCOOR’ < mRCOONa —> R’ < Na = 23
—> R’ = 15: -CH3
nCH3OH = (16,4 – 14,8)/(23 – 15) = 0,2
—> mCH3OH = 6,4 gam
Câu 71:
Trang 8/4 – Mã đề 042
(a) Đúng
(b) Sai, lưu hóa cao su buna thu được cao su lưu hóa. Cao su Buna-S điều chế từ đồng trùng hợp
CH2=CH-CH=CH2 và CH2=CH-C6H5
(c) Đúng, mỡ lợn chứa thành phần chính là chất béo, khi bị xà phòng hóa sẽ thu được xà phòng.
(d) Đúng, khoai lang chứa nhiều tinh bột, khi gặp I2 sẽ tạo màu xanh tím.
(
đ) Sai, đipeptit không có phản ứng màu biure.
Câu 72:
(a) Na + H2O —> NaOH + H2
NaOH + CuSO4 —> Cu(OH)2 + Na2SO4
(b) Al + H2O + KOH —> KAlO2 + H2
(c) AgNO3 + HCl —> AgCl + HNO3
(d) NH4Cl + Ba(OH)2 —> BaCl2 + NH3 + H2O
(đ) H2SO4 + Ba(HCO3)2 —> BaSO4 + CO2 + H2O
Câu 73:
Theo thông tin từ bao bì thì phân NPK có %N = 16%, %P2O5 = 16% và %K2O = 8%
mN = 16%x + 46%y = 17,2
mP = 16%x.31.2/142 = 3,5
mK = 8%x.39.2/94 + 60%.z.39.2/94 = 8,3
—> x = 50; y = 20; z = 10
—> x + y + z = 80
Câu 74:
%O = 100% – 77,25% – 11,75% = 11%
nCO2 = nC = 77,25%m/12
nH2O = nH/2 = 11,75%m/2
nX = nO/6 = 11%m/(16.6)
m gam X phản ứng tối đa nBr2 = 51,2/160 = 0,32
nX = [nCO2 – (nH2O + nBr2)]/2
⇔ 11%m/(16.6) = [77,25%m/12 – (11,75%m/2 + 0,32)]/2
—> m = 96
—> nX = 0,11 —> nKOH phản ứng = 0,33 và nC3H5(OH)3 = 0,11
Bảo toàn khối lượng:
m + mKOH = a + mC3H5(OH)3 —> a = 104,36 gam
Câu 75:
nC3H8 = 2x, nC4H10 = 3x
—> m = 44.2x + 58.3x = 12000 —> x = 45,8015 mol
Tổng lượng nhiệt có ích thu được khi đốt hết bình ga trên:
Q có ích = 67,3%(2220.2x + 2850.3x) = 400409 kJ
—> Số ngày sử dụng = 400409/10000 = 40 ngày
Câu 76:
Bảo toàn khối lượng:
mE + mO2 = mX + mCO2 —> mX = 40
Quy đổi X thành Fe (a) và O (b) —> 56a + 16b = 40 (1)
nH2O = nO = b; nH2 = 0,3
Bảo toàn H —> nHCl = 2b + 0,6
B
ảo toàn electron: 3a = 2b + 2nH2 + nAg
—> nAg = 3a – 2b – 0,6
—> m↓ = 143,5(2b + 0,6) + 108(3a – 2b – 0,6) = 244,1 (2)
(1)(2) —> a = 0,6; b = 0,4
nHCl = 2b + 0,6 = 1,4
—> mddY = mX + mddHCl – mH2 = 739,4
nFe2+ = nAg = 3a – 2b – 0,6 = 0,4
—> C%FeCl2 = 0,4.127/739,4 = 6,87%
Câu 77:
TN1 —> nX = nCO2 = 0,15
Quy đổi E thành axit, ancol và H2O.
nAncol = nE – nX = 0,35 —> M ancol = 32,2/0,35 = 92: Ancol là C3H5(OH)3
Bảo toàn C —> nC của axit = 3,65 – 0,35.3 = 2,6
—> Số C của axit = 2,6/0,65 = 4
V
ậy sau quy đổi E gồm C4HyO2 (0,65), C3H5(OH)3 (0,35) và H2O
—> nH2O = 0,5 – 0,65 – 0,35 = -0,5
nH2O đốt E = 0,65y/2 + 0,35.4 – 0,5 = 2,85
—> y = 6: Axit là C3H5COOH
Z có dạng (C3H5COO)xC3H5(OH)3-x (0,5/x mol)
E ban đầu gồm:
C3H5COOH (0,15)
C3H5(OH)3 (0,35 – 0,5/x) (C3H5COO)xC3H5(OH)3-x (0,5/x mol)
nX > nY ⇔ 0,15 > 0,35 – 0,5/x —> x < 2,5
nY = 0,35 – 0,5/x > 0 —> x > 1,4
—> x = 2 là nghiệm duy nhất
—> %(C3H5COO)2C3H5(OH) = 72,06%
Câu 78:
Trong khoảng thời gian 17370s (tính từ t đến t + 17370) thì ne = 0,5.17370/96500 = 0,09:
nCu tăng = 0,075 – 0,06 = 0,015 nên Cu2+ đã hết và catot có (0,09 – 0,015.2)/2 = 0,03 mol H2
n khí tại anot tăng 0,075 – 0,03 = 0,045 = ne/2 nên vẫn chưa thoát khí O2.
—> Lúc t giây anot chỉ có Cl2 và nCl2 = a = 0,06
ne trong t giây = 0,06.2 = 0,12
—> ne trong 3t giây = 0,12.3 = 0,36
Catot: nCu = 0,075 —> nH2 = 0,105
Anot: nCl2 = x và nO2 = y
—> 2x + 4y = 0,36 và x + y + 0,105 = 4,5a
—> x = 0,15; y = 0,015
—> nNaCl = 2x = 0,3 mol
Câu 79:
Các chất X, Z thỏa mãn sơ đồ trên lần lượt là Al(OH)3, NaCl.
(1) NaAlO2 + CO2 + H2O → Al(OH)3 + NaHCO3
(2) Al(OH)3 + HCl → AlCl3 + H2O
(3) NaHCO3 + HCl → NaCl + H2O + CO2
Câu 80:
F (C4H6O5) chứa đồng thời các nhóm -OH, -COO- và -COOH, mặt khác thủy phân F chỉ tạo 1 muối hữu
cơ nên F có cấu tạo:
HO-CH2-COO-CH2-COOH
—> X là HO-CH2-COONa
—> E là HO-CH2-COOCH3 và Y là CH3OH
Z là HO-CH2-COOH
(a) Đúng, X có công thức phân tử C2H3O3Na.
(b) Sai, E chứa -OH và -COO-.
(c) Sai, CH3OH không điều chế trực tiếp từ C2H4 được.
(d) Đúng, Y và C2H5OH cùng dãy đồng đẳng, Y ít C hơn nên nhiệt độ sôi của chất Y nhỏ hơn nhiệt độ sôi
của ancol etylic.
(đ) Đúng: Z + 2Na —> NaO-CH2-COONa + H2
Trang 11/4 – Mã đề 042
SỞ GIÁO DỤC ĐÀO TẠO HÀ TĨNH
THPT HỒNG LĨNH (Đề thi có 04 trang) (40 câu trắc nghiệm)
ĐỀ THI THỬ TỐT NGHIỆP THPT LẦN 1
NĂM HỌC 2022-2023
Môn: HOÁ HỌC
Thời gian: 50 phút (không tính thời gian phát đề)
Mã đề 049
Cho nguyên tử khối: H = 1; C = 12; N = 14; O = 16; Na = 23; Mg = 24; Al = 27; P = 31; S = 32; Cl = 35,5; Br = 80; K = 39; Ca = 40; Fe = 56; Cu = 64; Zn = 65; Ag = 108; I = 127; Ba = 137.
Câu 41: Chất nào sau đây, trong nước là chất điện li yếu?
A NaOH. B H2SO4 C NH3 D NaCl.
Câu 42: Dung dịch chất nào sau đây có phản ứng màu biure?
A. Anbumin. B. Metyl amin. C. Gly-Ala. D. axit glutamic.
Câu 43: Kim loại nào sau đây có độ cứng cao nhất?
A Cu. B Cr. C Fe. D Cs.
Câu 44: Trong y tế, khí X được hóa lỏng dùng để làm chất duy trì hô hấp cho bệnh nhân. Khí X đó là
A. CO2. B. N2. C. H2. D. O2.
Câu 45: Để khử mùi tanh của cá (gây ra do một số amin) ta có thể rửa cá với
A giấm. B nước muối. C nước. D cồn.
Câu 46: Chất nào sau đây là chất béo?
A. Xenlulozơ. B. Metyl axetat. C. Glixerol. D. Triolein.
Câu 47: Polime nào sau đây thuộc loại polime thiên nhiên?
A Polietilen. B Cao su buna. C Tơ tằm. D Tơ visco.
Câu 48: Saccarozơ có nhiều trong cây mía. Công thức phân tử của saccarozơ là
A. (C6H10O5)n. B. C6H12O6. C. C12H22O11. D. C12H24O11.
Câu 49: Kim loại nào sau đây là kim loại kiềm thổ?
A Ag. B Ca. C Zn. D Na.
Câu 50: Nhiều vụ ngộ độc rượu do trong rượu có chứa metanol. Công thức của metanol là
A. CH3OH. B. HCHO. C. CH3COOC2H5. D. CH3COOH.
Câu 51: Chất X là một khí rất độc, có trong thành phần của khí than than khô (khoảng 25%). Chất X là
A CO2 B N2 C H2 D CO.
Câu 52: Công thức phân tử của benzen là
A. C6H6. B. C2H4. C. CH4. D. C2H2.
Câu 53: Axit axetic không tác dụng với chất nào sau đây?
A Na. B NaCl. C NaOH. D C2H5OH.
Câu 54: Khối lượng phân tử của glyxin là
A. 103. B. 89. C. 117. D. 75.
Câu 55: Thủy phân este nào sau đây trong môi trường kiềm tạo ra 2 sản phẩm hữu cơ có cùng số nguyên tử cacbon?
A CH3COOCH3 B CH3COOC6H5 C HCOOC2H5 D CH3COOC2H5
Câu 56: Dùng thí nghiệm nào sau đây để phân biệt C2H2 và C2H4?
A. Phản ứng với H2. B. Phản ứng với dung dịch AgNO3/NH3.
C Phản ứng với dung dịch Br2 D Phản ứng với HCl.
Câu 57: Cho kim loại R vào dung dịch CuSO4 dư, sau phản ứng hoàn toàn thu được dung dịch A và chất rắn X. Chất rắn X có khả năng tan hoàn toàn trong dung dịch H2SO4 loãng dư. R là kim loại nào sau đây?
A. Fe. B. Na. C. Mg. D. Zn.
Câu 58: Cho 0,15 mol Gly-Glu tác dụng với dung dịch KOH dư, đun nóng. Sau khi các phản ứng xảy ra hoàn toàn, số mol KOH đã phản ứng là
A 0,6. B 0,15. C 0,3. D 0,45.
Câu 59: Tripeptit Ala-Gly-Gly không tác dụng với
A. dung dịch NaOH. B. Cu(OH)2 trong môi trường NaOH.
C. dung dịch Na2SO4. D. dung dịch HCl.
Câu 60: Khi cho dung dịch Ca(OH)2 vào dung dịch Ca(HCO3)2 thấy có
A. bọt khí và kết tủa trắng. B. kết tủa trắng xuất hiện.
C. kết tủa trắng sau đó kết tủa tan dần. D. bọt khí bay ra.
Câu 61: Cho 12,6 gam hỗn hợp Mg và Al tác dụng với dung dịch H2SO4 (dư), thu được 70,2 gam hỗn hợp muối và V lít khí H2. Giá trị của V là
A 8,96. B 17,92. C 26,88. D 13,44.
Câu 62: Một loại nước cứng khi được đun sôi thì mất tính cứng. Trong loại nước cứng này có hoà tan những hợp chất nào sau đây?
A. Ca(HCO3)2, Mg(HCO3)2. B. Ca(HCO3)2, MgCl2.
C Mg(HCO3)2, CaCl2 D MgCl2, CaSO4
Câu 63: Cho các polime sau đây: (1) tơ tằm; (2) sợi bông; (3) sợi đay; (4) tơ enang; (5) tơ visco; (6) nilon6,6; (7) tơ axetat. Số polime có nguồn gốc xenlulozơ là
A. 3. B. 4. C. 5. D. 2.
Câu 64: Thuỷ phân 62,5 gam dung dịch saccarozơ 17,1% trong môi trường axit (vừa đủ) được dung dịch X. Cho dung dịch AgNO3/NH3 vào X và đun nhẹ được m gam Ag, biết các phản ứng xảy ra hoàn toàn giá trị của m là?
A 13,5. B 7,5. C 6,75. D 10,8.
Câu 65: Cho 13,6 gam CH3COOC6H5 tác dụng với 300 ml dung dịch NaOH 1M, sau phản ứng hoàn toàn thu được dung dịch X. Cô cạn dung dịch X thì khối lượng chất rắn thu được là
A. 19,8 gam. B. 12,2 gam. C. 23,8 gam. D. 16,2 gam.
Câu 66: Nhận định nào sau đây sai?
A Trong 1 phân tử triolein có 3 liên kết π
B Axit glutamic là hợp chất có tính lưỡng tính.
C. 1 mol peptit Glu-Ala-Gly tác dụng được tối đa với 4 mol NaOH.
D. Dung dịch saccarozơ hòa tan được Cu(OH)2 tạo dung dịch màu xanh lam.
Câu 67: Chất X là thành phần chính tạo nên màng tế bào thực vật, tạo nên bộ khung của cây cối. Thủy phân hoàn toàn X, thu được chất Y. Trong mật ong Y chiếm khoảng 30%. Trong máu người có một lượng nhỏ Y không đổi là 0,1%. Hai chất X, Y lần lượt là
A Xenlulozơ và glucozơ B Xenlulozơ và fructozơ
C Tinh bột và glucozơ D Saccarozơ và fructozơ
Câu 68: Phát biểu nào sau đây là sai?
A Một vật bằng gang (hợp kim Fe-C) để trong không khí ẩm bị ăn mòn điện hóa.
B Để loại bỏ lớp cặn CaCO3 trong ruột phích chứa nước nóng ta có thể dùng giấm ăn.
C Dung dịch Na2CO3 có thể dùng để làm mềm nước cứng.
D. Thạch cao nung có công thức là CaSO4.2H2O.
Câu 69: Phát biểu nào sau đây sai?
A Quần áo bằng tơ nilon, len lông cừu, tơ tằm không nên giặt với xà phòng có độ kiềm cao.
Trang 1/4 – Mã đề 049
Trang 2/4 – Mã đề 049
B. Bản chất cấu tạo hóa học của sợi bông là xenlulozơ.
C Trùng ngưng axit ađipic và etylen glicol để được tơ lapsan.
D Poli(metyl metacrylat) được dùng để chế tạo thủy tinh hữu cơ plexiglas.
Câu 70: Cho 21,4 gam hỗn hợp A gồm Al và Fe2O3 tác dụng hết với dung dịch HCl dư được dung dịch C.
Cho C tác dụng với dung dịch NaOH dư được kết tủa D. Nung D trong không khí đến khối lượng không
đổi thu được 16 gam chất rắn. Khối lượng Al và Fe2O3 trong hỗn hợp A lần lượt là:.
A. 5,4 gam và 16 gam. B. 4,4 gam và 17 gam.
C. 6,4 gam và 15 gam. D. 7,4 gam và 14 gam.
Câu 71: Thực hiện các thí nghiệm sau:
(1) Cho dung dịch Ca(OH)2 dư vào dung dịch Mg(HCO3)2
(2) Cho dung dịch FeCl2 vào dung dịch AgNO3 (dư).
(3) Cho 2x mol Ba vào dung dịch chứa x mol Al2(SO4)3.
(4) Cho từ từ đến dư dung dịch NaOH vào dung dịch chứa AlCl3 và CuCl2
(5) Cho dung dịch chưa 4a mol Ba(OH)2 vào dung dịch chưa 3a mol H3PO4 và đun nóng.
Sau khi các phản ứng xảy ra hoàn toàn, số thí nghiệm thu được kết tủa gồm hai chất là
A 5. B 3. C 2. D 4.
Câu 72: Cho sơ đồ chuyển hóa:
Biết A, B, X, Y, Z, T là các hợp chất khác nhau; X, Y, Z có chứa natri; MX + MZ = 96; mỗi mũi tên ứng
với một phương trình hóa học của phản ứng xảy ra giữa 2 chất tương ứng các điều kiện phản ứng coi như
có đủ. Phân tử khối của chất nào sau đây đúng?
A. MT = 40. B. MA = 170. C. MY = 78. D. MZ = 84.
Câu 73: Thực hiện các sơ đồ phản ứng sau:
(a) X1 + X2 dư → X3 + X4↓ + H2O.
(b) X1 + X3 → X5 + H2O.
(c) X2 + X5 → X4 + 2X3
(d) X4 + X6 → BaSO4 + CO2 + H2O.
Biết các chất phản ứng theo đúng tỉ lệ mol. Các chất X2 và X6 thỏa mãn sơ đồ trên lần lượt là
A KOH và H2SO4 B Ba(HCO3)2 và H2SO4
C. Ca(HCO3)2 và Na2SO4. D. Ba(OH)2 và HCl.
Câu 74: Cho sơ đồ phản ứng (theo đúng tỉ lệ mol):
(1) E + NaOH → X + Y
(2) F + 3NaOH → X + Y + 2Z
(3) 2X + H2SO4 → 2T + Na2SO4
Biết E, F là những este no, mạch hở công thức phân tử có dạng CnHmOn (E, F chỉ chứa nhóm chức este trong phân tử). Cho các phát biểu sau:
(a) Hai chất E và Z có cùng số nguyên tử cacbon.
(b) Chất Z là hợp chất hữu cơ tạp chức.
(c) Từ chất Y có thể điều chế trực tiếp được CH3COOH.
(d) Chất F là este của glixerol với axit caboxylic.
(e) Chất T được sử dụng để điều chế khí CO trong phòng thí nghiệm.
Số phát biểu đ
Câu 75: Hòa tan m gam hỗn hợp A gồm Mg, Al, MgO, Al2O3 bằng dung dịch HCl vừa đủ thì được dung
dịch chứa (m + 70,295) gam muối. Cho m gam hỗn hợp A tác dụng dung dịch H2SO4 đặc nóng dư thu được
13,328 lít SO2 (đktc, sản phẩm khử duy nhất). Nếu cho m gam hỗn hợp A tác dụng HNO3 loãng dư thu
được 3,808 lít hỗn hợp khí NO, N2O có tỉ khối hơi so với H2 là 318/17 và dung dịch Y. Cô cạn dung dịch Y thu được 162,15 gam muối khan. Giá trị của m là
A. 36,18. B. 40,08. C. 29,88. D. 30,99.
Câu 76: Chia 19,92 gam hỗn hợp X gồm metan, propilen, isopren thành hai phần bằng nhau. Đốt cháy hoàn toàn phần một, thu được H2O và 31,68 gam CO2. Phần hai trộn với 0,3 mol H2 rồi dẫn qua bột Ni đốt nóng, thu được hỗn hợp Y có tỉ khối so với hiđro là 13,2. Biết Y làm mất màu tối đa m gam Br2 trong dung dịch. Giá trị của m là
A 25,6. B 16,0. C 41,6. D 32,0.
Câu 77: Hỗn hợp E chứa triglixerit X và este Y đa chức mạch hở. Thủy phân m gam E trong dung dịch KOH vừa đủ thu được một ancol và 11,39 gam hỗn hợp ba muối kali của axit oleic và 2 axit cacboxylic thuộc dãy đồng đẳng của axit acrylic. Đốt cháy 11,39 gam hỗn hợp muối này thu được 9,495 gam nước. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m là
A. 11,36. B. 10,25. C. 12,48. D. 11,45.
Câu 78: Điện phân (điện cực trơ, màng ngăn xốp) dung dịch X gồm CuSO4 và NaCl với cường độ dòng điện không đổi = 2A. Sau thời gian t giây, thu được dung dịch Y và 0,04 mol hỗn hợp khí ở anot. Mặt khác, nếu điện phân X trong thời gian 2t giây thì thu được dung dịch Z; 0,04 mol khí ở catot và 0,07 mol khí ở anot. Dung dịch Z hòa tan tối đa m gam Mg. Giả thiết hiệu suất điện phân là 100%, các khí sinh ra không tan trong nước và nước không bay hơi trong quá trình điện phân. Giá trị của m là. A 1,44. B 1,92. C 1,20. D 2,40.
Câu 79: Hỗn hợp X chứa ba este đều mạch hở và không chứa nhóm chức khác; trong mỗi phân tử este đều có số liên kết π không quá 5. Đun nóng m gam X cần dùng 800 ml dung dịch NaOH 1M, thu được hỗn hợp Y gồm các ancol đơn chức thuộc cùng dãy đồng đẳng và (0,75m + 12,56) gam hỗn hợp Z gồm hai muối của hai axit cacboxylic có mạch không phân nhánh, trong đó có a gam muối T và b gam muối E (MT < ME). Nung nóng Z với vôi tôi xút (dùng dư) thu được hỗn hợp khí nặng 6,8 gam. Mặt khác, đốt cháy hoàn toàn m gam X cần dùng 2,92 mol O2. Giá trị của b là
A. 59,60. B. 62,72. C. 39,50. D. 20,10.
Câu 80: Tiến hành thí nghiệm theo các bước sau:
Bước 1: Rót khoảng 3ml dung dịch saccarozơ 1% vào ống nghiệm có sẵn 1ml dung dịch H2SO4 10%. Đun nóng dung dịch khoảng 2-3 phút rồi làm lạnh.
Bước 2: Cho từ từ tinh thể NaHCO3 vào ống nghiệm sau bước 1 và khuấy đều cho đến khi ngừng thoát khí.
Bước 3: Nhỏ từ từ dung dịch NH3 loãng vào 2ml dung dịch AgNO3 loảng đến khi kết tủa tan hoàn toàn.
Cho toàn bộ phần dung dịch thu được vào ống nghiệm sau bước 2 và ngâm trong cốc nước nóng.
Cho các phát biểu sau:
(a) Tại bước 1 xảy ra phản ứng thủy phân saccarozơ
(b) NaHCO3 có tác dụng loại bỏ H2SO4 trong ống nghiệm sau bước 1.
(c) Sau bước 3, tại thành ống nghiệm xuất hiện lớp bạc bám vào.
(d) Tại bước 1, có thể thay dung dịch H2SO4 loãng bằng dung dịch HCl 10%.
(e) Tại bước 1, việc làm lạnh dung dịch là không cần thiết.
Số phát biểu đúng là A. 3. B. 5. C. 4. D. 2.
Trang 4/4 –
ĐÁP ÁN VÀ GIẢI CHI TIẾT
Câu 62:
Một loại nước cứng khi đun sôi thì mất tính cứng —> Đây là nước cứng tạm thời, chứa Ca(HCO3)2, Mg(HCO3)2
Ca(HCO3)2 —> CaCO3 + CO2 + H2O
Mg(HCO3)2 —> MgCO3 + CO2 + H2O
Câu 63:
Các polime có nguồn gốc xenlulozơ: (2), (3), (5), (7)
Câu 64:
Câu 55:
CH3COOC2H5 + NaOH —> CH3COONa + C2H5OH
Hai sản phẩm có cùng 2C.
Câu 56:
Dùng phản ứng với dung dịch AgNO3/NH3 để phân biệt C2H2 và C2H4: Chỉ C2H2 phản ứng tạo kết tủa màu vàng:
C2H2 + AgNO3 + NH3 —> C2Ag2↓ + NH4NO3
Câu 57:
X có khả năng tan hoàn toàn trong dung dịch H2SO4 loãng dư nên X không chứa Cu
—> R là Na và X là Cu(OH)2:
Na + H2O —> NaOH + H2
NaOH + CuSO4 —> Cu(OH)2 + Na2SO4
Cu(OH)2 + H2SO4 —> CuSO4 + H2O
Câu 58:
Gly-Glu + 3KOH —> GlyK + GluK2 + 2H2O 0,15………….0,45
Câu 60:
Khi cho dung dịch Ca(OH)2 vào dung dịch Ca(HCO3)2 thấy có kết tủa trắng xuất hiện:
Ca(OH)2 + Ca(HCO3)2 —> 2CaCO3 + 2H2O
Câu 61:
nH2 = nSO4 2- = (m muối – m kim loại)/96 = 0,6
—> VH2 = 13,44 lít
C12H22O11 —> 2C6H12O6 —> 4Ag
342…………………………..4.108
62,5.17,1%………………….mAg
—> mAg = 62,5.17,1%.4.108/342 = 13,5
Câu 65:
CH3COOC6H5 + 2NaOH —> CH3COONa + C6H5ONa + H2O
nCH3COOC6H5 = 0,1; nNaOH = 0,3 —> nH2O = 0,1
Bảo toàn khối lượng —> m rắn = 23,8 gam
Câu 66:
A. Sai, triolein (C17H33COO)3C3H5 có 6 liên kết π (3C=C và 3C=O)
B. Đúng, tính axit ở nhóm -COOH, tính bazơ ở nhóm -NH2
C. Đúng: Glu-Ala-Gly + 4NaOH —> GluNa2 + AlaNa + GlyNa + 2H2O
D. Đúng, saccarozơ có nhiều OH kề nhau nên có tính chất của ancol đa chức.
Câu 67:
Chất X là thành phần chính tạo nên màng tế bào thực vật, tạo nên bộ khung của cây cối —> X là xenlulozơ.
Thủy phân hoàn toàn X, thu được chất Y —> Y là glucozơ
Câu 68:
A. Đúng, cặp điện cực Fe-C đặt trong môi trường điện li là không khí ẩm nên có ăn mòn điện hóa.
B. Đúng: CaCO3 + CH3COOH —> (CH3COO)2Ca + CO2 + H2O
C. Đúng, do CO3 2- tạo kết tủa với Ca2+, Mg2+:
Ca2+ + CO3 2- —> CaCO3;
Mg2+ + CO3 2- —> MgCO3
D. Sai, thạch cao nung là CaSO4.H2O.
Câu 69:
A. Đúng, vì các vật liệu này đều có -CONH- dễ bị thủy phân trong kiềm.
B. Đúng
C. Sai, trùng ngưng axit p-phtalic và etylen glicol để được tơ lapsan.
D. Đúng
Câu 70:
NaOH dư hòa tan hết Al(OH)3 nên mFe2O3 = 16 gam
—> mAl = mA – mFe2O3 = 5,4
Câu 71:
(1) 2Ca(OH)2 + Mg(HCO3)2 —> CaCO3 + Mg(OH)2 + 2H2O
(2) FeCl2 + 3AgNO3 —> Fe(NO3)3 + 2AgCl + Ag
(3) Ba + 2H2O —> Ba(OH)2 + H2
3Ba(OH)2 + Al2(SO4)3 —> 3BaSO4 + 2Al(OH)3
Al2(SO4)3 còn dư.
(4) AlCl3 + 4NaOH —> NaAlO2 + 3NaCl + 2H2O
CuCl2 + 2NaOH —> Cu(OH)2 + 2NaCl
(5) Tỉ lệ nH+/nOH- = 9a/8a —> Tạo Ba3(PO4)2 và BaHPO4
Câu 72:
A là H2O; X là NaOH
MX + MZ = 96 —> MZ = 56: Z là NaHS
B là (NH4)2S
Y là Na2S —> C đúng
T là HCl
Các phản ứng:
NaCl + H2O (điện phân có màng ngăn) —> NaOH + Cl2 + H2
NaOH + (NH4)2S —> Na2S + NH3 + H2O
Na2S + HCl —> NaHS + NaCl
NaHS + NaOH —> Na2S + H2O
Na2S + HCl —> NaCl + H2S
Câu 73:
(d) —> X4 là BaCO3 và X6 là H2SO4 (do X4 không tan, theo phản ứng (a)).
(a) X1 + X2 dư → X3 + X4↓ + H2O.
KOH + Ba(HCO3)2 dư → KHCO3 + BaCO3 + H2O
(b) X1 + X3 → X5 + H2O.
KOH + KHCO3 → K2CO3 + H2O
(c) X2 + X5 → X4 + 2X3
Ba(HCO3)2 + K2CO3 → BaCO3 + 2KHCO3
(d) X4 + X6 → BaSO4 + CO2 + H2O.
BaCO3 + H2SO4 → BaSO4 + CO2 + H2O
—> X2 là Ba(HCO3)2 và X6 là H2SO4
Câu 74:
Theo tỉ lệ phản ứng (1)(2) thì E đơn chức, F ba chức
—> E là C2H4O2 (HCOOCH3); X là HCOONa; Y là CH3OH
F là C6H8O6 (HCOO-CH2-COO-CH2-COO-CH3)
Z là HO-CH2-COONa
(a) Đúng
(b) Đúng
(c) Đúng: CH3OH + CO —> CH3COOH
(d) Sai
(e) Đúng: HCOOH (H2SO4 đặc) —> CO + H2O
Câu 75:
nSO2 = 0,595
Bảo toàn electron —> nH2 = 0,595
Đặt nO(A) = x —> nH2O = x
Bảo toàn H —> nHCl = 2x + 1,19
m muối = m – 16x + 35,5(2x + 1,19) = m + 70,295
—> x = 0,51
Với HNO3:
nNO = 0,08 và nN2O = 0,09
Bảo toàn electron —> 0,595.2 = 3nNO + 8nN2O + 8nNH4NO3
—> nNH4NO3 = 0,02875
m muối = (m – 16x) + 62(0,595.2 + 2x) + 80.0,02875 = 162,15
—> m = 30,99
Câu 76:
Mỗi phần nặng 9,96 gam
X gồm CH4, C3H6, C5H8 —> Có dạng CxHx+3
Trang 8/4 – Mã
nCO2 = 0,72 —> nX = 0,72/x
—> MX = 13x + 3 = 9,96x/0,72 —> x = 3,6
—> nX = 0,2
mY = mX + mH2 = 10,56 —> nY = 0,4
—> nH2 phản ứng = (nX + nH2) – nY = 0,1
Bảo toàn liên kết pi: 0,2(2x + 2 – x – 3)/2 = nH2 phản ứng + nBr2
—> nBr2 = 0,16 —> mBr2 = 25,6
Câu 77:
Quy đổi muối thành C2H3COOK (u) và CH2 (v)
m muối = 110u + 14v = 11,39
nH2O = 1,5u + v = 0,5275
—> u = 0,045; v = 0,46
nC3H5(OH)3 = u/3 = 0,015 và nKOH = u = 0,045
Bảo toàn khối lượng:
mE + mKOH = m muối + mC3H5(OH)3
—> mE = 10,25 gam
Câu 78:
Trong thời gian t đến 2t tại anot thoát ra nO2 = 0,07 – 0,04 = 0,03
—> ne trong t giây = 0,03.4 = 0,12
Trong t giây đầu tiên, anot có Cl2 (u) và O2 (v)
—> u + v = 0,04 và 2u + 4v = 0,12
—> u = v = 0,02
Sau 2t giây, bảo toàn electron cho catot:
2nCu + 2nH2 = 0,12.2 —> nCu = 0,08
Ban đầu: nCuSO4 = 0,08; nNaCl = 2u = 0,04
Z + Mg —> Dung dịch chứa Na+ (0,04), SO4 2- (0,08), bảo toàn điện tích —> nMg2+ = 0,06
—> mMg = 0,06.24 = 1,44
Câu 79:
nNaOH = 0,8
Phản ứng vôi tôi xút thay thế COONa bằng H nên:
m muối = 6,8 + 0,8(67 – 1) = 0,75m + 12,56
—> m = 62,72
Bảo toàn khối lượng —> mAncol = 35,12
—> M ancol = 43,9 —> Có CH3OH —> Ancol dạng CnH2n+1OH với n = 1,85
Quy đổi muối thành COONa (0,8), C (u), H (v)
m muối = 0,8.67 + 12u + v = 59,6
nO2 = 0,8.0,25 + u + 0,25v + 0,8.1,5n = 2,92
—> u = 0,5; v = 0
Muối không quá 5π —> (COONa)2 (0,15) và C2(COONa)2 (0,25)
—> mC2(COONa)2 = 39,50 gam
Câu 80:
(a) Đúng: Saccarozơ + H2O —> Glucozơ + Fructozơ
(b) Đúng: NaHCO3 + H2SO4 —> Na2SO4 + CO2 + H2O
(c) Đúng, các sản phẩm glucozơ, fructozơ đều có tráng gương.
(d) Đúng
(e) Sai, nên làm lạnh để bọt khí bước 2 không trào ra quá mạnh. Mặt khác hỗn hợp tham gia phản ứng tráng gương phải ở nhiệt độ thường rồi làm nóng từ từ, nóng quá mạnh ngay từ đầu có thể làm Ag tạo ra bị vón cục.
Trang 9/4 – Mã đề 049
Trang 10/4 – Mã
049
SỞ GIÁO DỤC ĐÀO TẠO NGHỆ AN CHUYÊN PHAN BỘI CHÂU (Đề thi có 04 trang) (40 câu trắc nghiệm)
ĐỀ THI THỬ TỐT NGHIỆP THPT LẦN 1
NĂM HỌC 2022-2023
Môn: HOÁ HỌC
Thời gian: 50 phút (không tính thời gian phát đề)
Mã đề 050
Cho nguyên tử khối: H = 1; C = 12; N = 14; O = 16; Na = 23; Mg = 24; Al = 27; P = 31; S = 32; Cl = 35,5; Br = 80; K = 39; Ca = 40; Fe = 56; Cu = 64; Zn = 65; Ag = 108; I = 127; Ba = 137.
Câu 41: X là loại đường có nhiều trong quả nho chín. Số nguyên tử H trong phân tử X là?
A 22. B 12. C 10. D 6.
Câu 42: Chất nào sau đây là chất điện li mạnh?
A. H3PO4. B. BaCl2. C. H2O. D. Mg(OH)2.
Câu 43: Mùa lạnh, đưa lò than vào trong phòng kín dễ gây ngạt thở. Nguyên nhân gây ngạt thở nhanh là do khí nào sau đây?
A. CO2. B. O2. C. CO. D. N2.
Câu 44: Kim loại nào sau đây thuộc nhóm IA trong bảng tuần hoàn?
A Al. B Ca. C Ba. D K.
Câu 45: Etyl axetat có công thức?
A. HCOOC2H5. B. CH3COOC2H5. C. C2H5COOCH3. D. CH3COOCH3.
Câu 46: Thạch cao nung thu được khi đun nóng thạch cao sống ở 160°C, dược dùng để nặn tượng, bó bột.
Công thức của thạch cao nung là?
A CaSO4.H2O. B CaCO3 C CaSO4.2H2O. D CaSO4
Câu 47: Công thức của sắt (III) hidroxit là?
A. Fe(OH)2. B. FeO. C. FeCl3. D. Fe(OH)3.
Câu 48: Nhóm kim loại nào sau đây tan hết trong dung dịch H2SO4 loãng dư?
A Al, Fe. B Hg, Mg. C Ag, Al. D Cu, Fe.
Câu 49: Phân tử chất nào sau đây chỉ chứa nguyên tố C và H?
A Polimetylmetacrylat. B Poli(vinyl clorua).
C Polibutadien. D Xenlulozơ
Câu 50: Kim loại Fe tác dụng với Cl2 tạo ra chất nào sau đây?
A. Fe(OH)2. B. FeCl3. C. FeCl2. D. FeO.
Câu 51: Natri cacbonat được dùng trong công nghiệp thủy tinh, bột giặt, phẩm nhuộm. Công thức của natri cacbonat là
A NaHCO3 B NaOH. C Na2SO4 D Na2CO3
Câu 52: Este tạo nên mùi thơm của quả dứa có tên là?
A geranyl axetat. B isoamyl axetat. C benzyl axetat. D etyl butirat.
Câu 53: Dữ kiện thực nghiệm nào sau đây chứng tỏ phân tử saccarozơ có nhiều nhóm -OH?
A Saccarozơ có phản ứng thủy phân.
B. Saccarozơ tác dụng với I2 tạo dung dịch màu xanh tím.
C Saccarozơ có phản ứng tráng bạc.
D. Saccarozơ tác dụng với Cu(OH)2 ở nhiệt độ thường tạo dung dịch màu xanh lam.
Câu 54: Trong sơ đồ thực nghiệm theo hình vẽ sau đây:
Trang 1/4 – Mã đề 050
Chọn phát biểu đúng:
A Chất khí sau khi đi qua bông tẩm NaOH đặc có thể làm mất màu dung dịch brom hoặc KMnO4
B Vai trò chính của bông tẩm NaOH đặc là hấp thụ lượng C2H5OH chưa phản ứng bị bay hơi.
C. Phản ứng chủ yếu trong thí nghiệm là 2C2H5OH → (C2H5)2O + H2O.
D. Vai trò chính của H2SO4 đặc là oxy hóa C2H5OH thành H2O và CO2.
Câu 55: Cho 3 ion: Fe2+, Ag+, Cu2+. Tính oxi hóa của các ion kim loại này tăng theo thứ tự nào sau đây?
A. Fe2+, Cu2+, Ag+ . B. Cu2+, Fe2+, Ag+ . C. Ag+, Cu2+, Fe2+ . D. Ag+, Fe2+, Cu2+ .
Câu 56: Phát biểu nào sau đây đúng?
A Cho Cu tác dụng hết với lượng dư dung dịch FeCl3 thu được dung dịch chứa hai muối.
B Hỗn hợp gồm Cu, Fe3O4 có thể tan hết trong dung dịch HCl.
C. Cho Fe(NO3)2 phản ứng vừa đủ với dung dịch HCl thu được khí NO duy nhất và dung dịch chỉ chứa FeCl3.
D Cu oxi hóa được ion Fe3+ trong dung dịch.
Câu 57: Cho Fe dư tác dụng với dung dịch HNO3, sau khi kết thúc phản ứng thu được dung dịch chứa chất nào sau đây?
A. Fe(NO3)3. B. Fe(NO3)3, HNO3.

C. Fe(NO3)2, Fe(NO3)3. D. Fe(NO3)2.
Câu 58: Polime nào sau đây được dùng để sản xuất chất dẻo?
A. Poli(vinyl clorua). B. Cao su buna. C. Tơ nitron. D. tinh bột.
Câu 59: Phương pháp điều chế kim loại Mg là
A Điện phân dung dịch. B Nhiệt luyện.
C Điện phân nóng chảy. D Thủy luyện.
Câu 60: Phát biểu nào sau đây là đúng?
A. Trong sản xuất gang người ta điều chế Fe bằng phương pháp điện phân dung dịch muối sắt.
B Nguyên tắc điều chế kim loại Mg là khử ion Mg2+
C Ion Na+ bị khử khi điện phân dung dịch NaCl.
D. Khi điện phân Al2O3 nóng chảy người ta dùng catot bằng than chì, anot bằng thép.
Câu 61: Cách nào sau đây không sử dụng để loại bỏ tính cứng tạm thời của nước?
A Dùng dung dịch Na2CO3 B Dùng dư dung dịch NaOH.
C. Dùng dư dung dịch Ca(OH)2. D. Đun nóng.
Câu 62: Nhận định nào sau đây không đúng về amino axit?
A Amino axit có tính lưỡng tính.
B Amino axit ở điều kiện thường là chất rắn kết tinh do sự tồn tại ion lưỡng cực.
C. Amino axit tương đối dễ tan trong nước.
D Amino axit thuộc loại hợp chất đa chức.
Câu 63: Chất nào sau đây không phải là chất lưỡng tính?
A. H2N-CH2-COOH. B. HCOOCH3. C. (NH4)2CO3. D. HCOONH3CH3.
Câu 64: Chất nào sau đây có tên là Gly-Ala?
Trang 2/4 – Mã đề 050
A. H2N-CH2-CH2-CO-NH-CH2-COOH. B. HOOC-CH(CH3)-NH-CO-CH2-NH2.
C HOOC-CH2-NH-CO-CH2-CH2-COOH. D HOOC-CH2-NH-CO-CH(CH3)-NH2
Câu 65: Vai trò nào không phải là của cacbon trong sản xuất gang?
A. Tạo xỉ. B. tạo chất khử. C. tạo ra gang. D. cung cấp nhiệt.
Câu 66: Thí nghiệm nào sau đây không có kết tủa xuất hiện?
A Cho dung dịch Ca(OH)2 vào dung dịch Ba(HCO3)2
B. Cho dung dịch BaCl2 vào dung dịch NaHSO4.
C Cho dung dịch KOH vào dung dịch Ca(HCO3)2
D Cho dung dịch Mg(HCO3)2 vào dung dịch H2SO4
Câu 67: Hỗn hợp E gồm ba este X, Y, Z đều đa chức, no, mạch hở (MX < MY < MZ). Đốt cháy hoàn toàn
8,55 gam E cần vừa đủ 8,232 lít khí O2, thu được 5,13 gam H2O. Mặt khác, đun nóng 8,55 gam E với dung dịch NaOH (vừa đủ), cô cạn dung dịch sau phản ứng, thu được muối T (có mạch cacbon không phân nhánh) và hỗn hợp hai ancol (đơn chức, kế tiếp trong dãy đồng đẳng). Đốt cháy hoàn toàn T, thu được Na2CO3, CO2 và 1,08 gam H2O. Khối lượng của 0,12 mol Y là
A. 14,16. B. 19.20. C. 17,52. D. 15,84.
Câu 68: Cho các phát biểu sau:
(a) Glucozơ là monosaccarit duy nhất có trong quả nho chín.
(b) Ancol etylic có nhiệt độ sôi cao hơn axit axetic.
(c) Dung dịch valin làm quỳ tím hóa xanh.
(d) Quần áo dệt bằng tơ tằm không nên là ủi ở nhiệt độ cao.
(e) Mặt cắt quả chuối xanh tạo màu xanh tím với iot.
Số phát biểu đúng là
A 3. B 4. C 5. D 2.
Câu 69: Hòa tan hết hỗn hợp gồm Na và Ba vào nước, thu được dung dịch X và V lít khí (ở đktc). Dung
dịch X có thể hòa tan được tối đa 8,1 gam nhôm. Giá trị của V là?
A. 3,36. B. 10,08. C. 6,72. D. 11,20.
Câu 70: Cho hỗn hợp X gồm 6,72 gam Fe và 0,24 mol Cu vào dung dịch AgNO3 đến khi phản ứng hoàn toàn, thu được m gam chất rắn Y và dung dịch Z chứa 3 cation kim loại. Giá trị của m là
A 56,72. B 90,72.
C. 77,76. D. 25,92 < m < 38,88.
Câu 71: Tiến hành điện phân dung dịch chứa m gam hỗn hợp gồm CuSO4 và KCl bằng điện cực trơ, màng ngăn xốp với cường độ dòng điện không đổi. Kết quả quá trình điện phân được ghi theo bảng sau:
Thời gian Catot (-) Anot (+)
t (giây) Khối lượng tăng 15,36 gam
3,36 lít hỗn hợp khí (đktc)
2t (giây) Khối lượng tăng 23,04 gam V lít hỗn hợp khí (đktc)
Nhận định nào sau đây đúng?
A Giá trị của V là 6,048 lít. B Giá trị của m là 66,52 gam.
C. Giá trị của m là 64,62 gam. D. Giá trị của V là 6,72 lít.
Câu 72: Hòa tan hoàn toàn m gam hỗn hợp X chứa FeO, Fe2O3, Fe3O4 và FeCO3 bằng dung dịch chứa HCl (vừa đủ) thu được 0,04 mol CO2 và dung dịch Y có chứa 24,43 gam hỗn hợp muối FeCl3 và FeCl2. Cho NaOH dư vào Y trong điều kiện không có không khí thấy xuất hiện 16,66 gam kết tủa. Giá trị của m là
A 8,33. B 14,78. C 13,86. D 14,64.
Câu 73: X là hợp chất hữu cơ mạch hở có công thức phân tử C6H8O4. Cho các phản ứng sau (theo đúng tỉ lệ mol phản ứng)
(1) X + 2NaOH → Z + T + H2O (2) T + H
Trang 3/4 – Mã đề 050
(3) Z + H2SO4 → Z1 + Na2SO4 Biết Z1 và T1 có cùng số nguyên tử cacbon; T là hợp chất hữu cơ đơn chức, no. Có các phát biểu sau:
(a) Nung Z với hỗn hợp với tôi xút thu được ankan đơn giản nhất.
(b) T1 không tác dụng với Na
(c) Tổng số nguyên tử hidro trong Z1 bằng 2.
(d) X không có đồng phân hình học
(c) Số nguyên tử trong một phân tử T bằng 10
Số phát biểu đúng là?
A 3. B 5. C 2. D 4.
Câu 74: Hòa tan hết 9,6 gam kim loại Mg trong dung dịch HNO3 loãng, thu được 1,4336 lít khi N2 (đktc) và dung dịch X. Cô cạn dung dịch X thu được m gam muối khan. Giá trị của m là
A 59,2. B 66,6. C 60,8. D 61,5.
Câu 75: Cho các nhân định
- Trong quả nho chín có nhiều đường glucozơ
- Trong mật ong có nhiều đường fructozo (khoảng 40%)
- Fructozơ có trong nhiều loại quả ngọt như dứa, xoài.
- Hàm lượng glucozơ trong máu người khoảng 0,1%
- Trong các loại đường glucozơ, fructozơ, saccarozơ thì đường saccarozơ có vị ngọt nhất.
Số nhận định đúng?
A 2. B 3. C 4. D 5.
Câu 76: A trong sơ đồ phản ứng sau là hợp chất hữu cơ đa chức, có công thức phân tử C4H6O4:
(1) A + 2NaOH → X (muối) + Y (muối) + Z (ancol)
(2) 2X + H2SO4 → 2T + Na2SO4
Biết MX > MY. Phát biểu nào sau đây sai?
A. Nhiệt độ sôi của X lớn hơn Y. B. T là hợp chất hữu cơ tạp chức.
C. 1 mol T tác dụng tối đa 2 mol Na. D. X, Y là muối của 2 axit là đồng đẳng kế tiếp.
Câu 77: Đốt cháy hoàn toàn m gam triglixerit X cần vừa đủ 3,465 mol O2, thu được H2O và 2,475 mol CO2. Cho m gam X tác dụng với dung dịch NaOH vừa đủ, thu được glixerol và 39,78 gam muối. Mặt khác, m gam X tác dụng được tối đa với a mol Br2 trong dung dịch. Giá trị của a là?
A. 0,18. B. 0,225. C. 0,135. D. 0,27.
Câu 78: Hỗn hợp X gồm 1 axit cacboxylic đơn chức Y, không no, mạch hở có một liên kết đôi C=C và 1 este đơn chức Z no, mạch hở (cùng số mol với Y). Đốt cháy hoàn toàn 0,2 mol X thì thu được 11,2 lít CO2 (dktc) và m gam H2O. Khối lượng của X là
A 12,26. B 13,40. C 13,20. D 13,00.
Câu 79: Hỗn hợp X có khối lượng 26,28 gam gồm metan, propan, etilen, propen có tổng số mol là 0,78 mol. Đốt cháy hoàn toàn 26,28 gam X cần 2,91 mol O2. Mặt khác 26,28 gam X phản ứng với tối đa a mol Br2 trong dung dịch. Giá trị của a là
A. 0,3. B. 0,62. C. 0,50. D. 0,45.
Câu 80: X là muối ngậm nước của kim loại M. Nung nóng m gam X đến khối lượng không đổi được 4,0 gam chất rắn Y và 10,8 gam hỗn hợp khí và hơi Z. Hấp thụ hoàn toàn Z vào 50 gam dung dịch NaOH 8,0% được dung dịch T chỉ chứa một chất tan có nồng độ 13,98%. Biết rằng quá trình nhiệt phân không làm thay
đổi số oxi hoá của M. Phần trăm khối lượng của nguyên tố oxi trong X gần nhất với giá trị nào sau đây ?
A 51. B 32. C 63. D 65.
ẢI CHI TIẾT
Câu 54:
Hình vẽ là sơ đồ điều chế và thử tính chất của C2H4
A. Đúng
C2H4 + H2O + KMnO4 —> C2H4(OH)2 + KOH + MnO2
B. Sai. Phản ứng có sản phẩm phụ là SO2, nó được tạo ra do H2SO4 bị khử. Bông tẩm NaOH có tác dụng ngăn SO2 thoát ra cùng sản phẩm chính C2H4
C. Sai, tại mức nhiệt độ trên 170°C thì phản ứng chính là: C2H5OH —> C2H4 + H2O
D. Sai. H2SO4 có vai trò xúc tác cho phản ứng.
Câu 56:
A. Sai, thu được dung dịch chứa 3 muối CuCl2, FeCl2, FeCl3 dư
Cu + 2FeCl3 —> 2FeCl2 + CuCl2
B. Đúng, có thể tan hết khi nCu ≤ nFe3O4:
Fe3O4 + 8HCl —> FeCl2 + 2FeCl3 + 4H2O
Cu + 2FeCl3 —> 2FeCl2 + CuCl2
C. Sai, nNO = nFe2+/3 < nNO3 - ban đầu = 2nFe2+ nên NO3 - còn dư, dung dịch thu được chứa FeCl3, Fe(NO3)3
D. Sai, Cu khử được ion Fe3+ trong dung dịch.
Câu 57:
Fe dư + HNO3 —> Fe(NO3)2 + NO + H2O
Dung dịch thu được chứa Fe(NO3)2.
Câu 60:
A. Sai, điều chế Fe bằng phương pháp nhiệt luyện.
B. Đúng: Mg2+ + 2e —> Mg
C. Sai, Na+ không bị khử trong dung dịch, lúc này H2O bị khử tạo H2
D. Sai, khi điện phân Al2O3 nóng chảy người ta dùng anot và catot đều bằng than chì.
Câu 61:
Nước cứng tạm thời chứa Mg(HCO3)2, Ca(HCO3)2 (Gọi chung là M(HCO3)2):
A. M(HCO3)2 + Na2CO3 —> MCO3 + NaHCO3
B. M(HCO3)2 + NaOH —> MCO3 + Na2CO3 + H2O
C. Không làm mềm được vì vẫn còn Ca2+ (có trong Ca(OH)2 dư).
D. M(HCO3)2 —> MCO3 + CO2 + H2O
Câu 62:
A. Đúng, amino axit có tính axit ở nhóm -COOH, tính bazơ ở nhóm -NH2
B. Đúng.
C. Đúng, do sự tồn tại ion lưỡng cực nên amino axit tương đối dễ tan trong nước.
D. Sai, amino axit là chất tạp chức.
Câu 63:
HCOOCH3 không phải chất lưỡng tính vì không có phản ứng trao đổi proton với axit, bazơ khác.
Câu 65:
Vai trò tạo xỉ không phải của C. Vai trò tạo xỉ là nhờ CaO (tạo ra do CaCO3 bị nhiệt phân):
CaO + SiO2 —> CaSiO3 (xỉ)
Câu 66:
A. Ca(OH)2 + Ba(HCO3)2 —> CaCO3 + BaCO3 + H2O
B. BaCl2 + NaHSO4 —> BaSO4 + NaCl + HCl
C. KOH + Ca(HCO3)2 —> CaCO3 + K2CO3 + H2O
D. Mg(HCO3)2 + H2SO4 —> MgSO4 + CO2 + H2O
Câu 67:
Muối T không nhánh nên tối đa 2 chức, mặt khác các ancol đều đơn chức nên T và E đều 2 chức.
nO2 = 0,3675; nH2O = 0,285
Bảo toàn khối lượng —> nCO2 = 0,345
—> nT = nE = nCO2 – nH2O = 0,06
Đốt T —> nH2O = 0,06
—> Số H của T = 2nH2O/nT = 2
—> T là CH2(COONa)2
nAncol = 2nE = 0,12 và nC(ancol) = nC(E) – nC(T) = 0,165
—> Số C = nCO2/nAncol = 1,375 —> CH3OH và C2H5OH
X là CH2(COOCH3)2
Y là CH2(COOCH3)(COOC2H5)
Z là CH2(COOC2H5)2
Khi nY = 0,12 thì mY = 17,52
Trang 6/4 – Mã đề 050
Câu 68:
(a) Sai, nho chín chứa glucozơ, fructozơ
(b) Sai, C2H5OH có nhiệt độ sôi thấp hơn CH3COOH do C2H5OH có phân tử khối nhỏ hơn, liên kết H
liên phân tử kém bền hơn CH3COOH.
(c) Sai, Val có môi trường trung tính.
(d) Đúng, tơ tằm kém bền với nhiệt, nhiệt độ cao sẽ làm tơ tằm bị nhăn, thủng.
(e) Đúng, chuối xanh chứa tinh bột nên tạo màu xanh tím với iot.
Câu 69:
2H2O + 2e —> 2OH- + H2
Al + H2O + OH- —> AlO2 - + 1,5H2
nAl = 0,3 —> nOH- = 0,3 —> nH2 = 0,15 —> V = 3,36 lít
Câu 70:
nFe = 0,12
TH1: 3 ion kim loại là Fe3+, Cu2+, Ag+
—> nAg = 3nFe + 2nCu = 0,84 —> mAg = 90,72
—> Chọn B.
TH2: 3 ion kim loại là Fe3+, Fe2+, Cu2+
—> 2nFe + 2nCu < nAg < 3nFe + 2nCu
—> 0,72 < nAg < 0,84 —> 77,76 < mAg < 90,72
—> Không có lựa chọn phù hợp.
Câu 71:
Sau t giây:
Catot: nCu = 0,24
Anot: nCl2 = a và nO2 = b —> a + b = 0,15
Bảo toàn electron: 2a + 4b = 0,24.2
—> a = 0,06 và b = 0,09
Sau 2t giây, ne trao đổi = 0,24.2.2 = 0,96
Catot: nCu = 0,36, bảo toàn electron —> nH2 = 0,12
Anot: nCl2 = 0,06, bảo toàn electron —> nO2 = 0,21
—> n khí anot lúc 2t = 0,27 —> V = 6,048 (A đúng, D sai)
nCuSO4 = 0,36 và nKCl = 2a = 0,12 —> m = 66,54 (B, C sai)
Câu 72:
Y chứa FeCl3 (a) và FeCl2 (b) —> 162,5a + 127b = 24,43
m↓ = 107a + 90b = 16,66
—> a = 0,08; b = 0,09
B
ảo toàn Cl —> nHCl = 3a + 2b = 0,42
B
ảo toàn H —> nH2O = 0,21
B
ảo toàn khối lượng:
mX + mHCl = m muối + mCO2 + mH2O
—> mX = 14,64 gam
Câu 73:
Z1 và T1 cùng C —> Z và T cùng C —> Mỗi chất 3C
T là hợp chất hữu cơ đơn chức, no và có phản ứng cộng H2 nên T là anđehit hoặc xeton.
X là:
HOOC-CH2-COO-CH=CH-CH3
HOOC-CH2-COO-C(CH3)=CH2
Z là CH2(COONa)2, Z1 là CH2(COOH)2
T là C2H5CHO hoặc CH3COCH3; T1 là C2H5CH2OH hoặc CH3CHOHCH3
(a) Đúng:
CH2(COONa)2 + NaOH —> CH4 + Na2CO3
(b) Sai, T1 là ancol nên có tác dụng với Na.
(c) Sai, Z1 có 4H
(d) Sai, tùy cấu tạo, cấu tạo đầu của X có đồng phân hình học.
(e) Đúng, T có công thức C3H6O, tổng 10 nguyên tử
Câu 74:
nMg(NO3)2 = nMg = 0,4; nN2 = 0,064
Bảo toàn electron: 2nMg = 10nN2 + 8nNH4NO3
—> nNH4NO3 = 0,02
—> m muối = mMg(NO3)2 + mNH4NO3 = 60,8 gam
Câu 75:
4 nhận định đầu đúng. Nhận định cuối sai, fructozơ có vị ngọt nhất trong số 3 đường kể trên.
Câu 76:
A là HCOO-CH2-COO-CH3
X là HO-CH2-COONa
Y là HCOONa
Z là CH3OH
T là HO-CH2-COOH
A. Đúng, X và Y đều là muối (có COONa) và MX > MY nên nhiệt độ sôi của X lớn hơn Y.
B. Đúng
C. Đúng: T + 2Na —> NaO-CH2-COONa + H2
D. Sai, X và Y không cùng dãy đồng đẳng.
Câu 77:
Đặt nX = x, nH2O = y.
Bảo toàn O: 6x + 3,465.2 = y + 2,475.2
Bảo toàn khối lượng:
(16.6x + 2y + 2,475.12) + 40.3x = 39,78 + 92x
—> x = 0,045; y = 2,25
nX = x = [2,475 – (y + a)]/2 —> a = 0,135
Câu 78:
Đặt y, z là số C của Y, Z; nY = nZ = 0,1
—> nCO2 = 0,1y + 0,1z = 0,5 —> y + z = 5 y ≥ 3 và z ≥ 2 —> y = 3, z = 2 là nghiệm duy nhất.
Y là C2H3COOH và Z là HCOOCH3 —> mX = 13,2 gam
Câu 79:
Đốt X tạo nCO2 = u và nH2O = v
mX = 12u + 2v = 26,28
Bảo toàn O —> 2u + v = 2,91.2
—> u = 1,83; v = 2,16
nX = (a + v) – u = 0,78 —> a = 0,45
Câu 80:
nNaOH = 50.8%/40 = 0,1
mT = mZ + mddNaOH = 60,8
—> m chất tan = 60,8.13,98% = 8,5
Phân tử chất tan có x nguyên tử Na —> Mol chất tan = 0,1/x
—> M chất tan = 8,5x/0,1 = 85x
Chọn x = 1; M = 85: Chất tan là NaNO3 (0,1 mol)
—> 10,8 gam Z gồm NO2 (0,1); O2 (0,1/4 = 0,025) và H2O (0,3)
%O = 16(0,1.3 + 0,3)/(4 + 10,8) = 64,86%
Trang 9/4 – Mã đề 050
SỞ GIÁO DỤC ĐÀO TẠO THANH HÓA THPT TĨNH GIA 3 (Đề thi có 04 trang) (40 câu trắc nghiệm)
ĐỀ THI THỬ THPT QUỐC GIA LẦN 3
NĂM HỌC 2022-2023
Môn: HOÁ HỌC
Thời gian: 50 phút (không tính thời gian phát đề)
Mã đề 066
Cho nguyên tử khối: H = 1; C = 12; N = 14; O = 16; Na = 23; Mg = 24; Al = 27; P = 31; S = 32; Cl = 35,5; Br = 80; K = 39; Ca = 40; Fe = 56; Cu = 64; Zn = 65; Ag = 108; I = 127; Ba = 137.
Câu 1: Canxi phản ứng với clo sinh ra sản phẩm nào sau đây?
A NaCl. B CaOCl2 C CaCl2 D Ca(OH)2
Câu 2: Dung dịch nào sau đây không hoà tan được Al2O3?
A. Ca(OH)2. B. HCl. C. NaNO3. D. NaHSO4.
Câu 3: Ở điều kiện thường, chất nào sau đây là chất khí?
A Tristearin. B Glucozơ C Metylamin. D Alanin.
Câu 4: Để bảo vệ vỏ tàu biển bằng thép bằng phương pháp điện hoá, người ta gắn vào mặt ngoài của vỏ
tàu (phần chìm dưới nước) những khối kim loại X. Kết quả kim loại X bị nước biển ăn mòn thay cho thép.
Kim loại X là
A. Na. B. Cu. C. Zn. D. Pb.
Câu 5: Cho dãy các hóa chất sau: NaOH, Ca(OH)2, Na2CO3, Na3PO4, HCl. Số hóa chất trong dãy có thể làm mềm được nước cứng tạm thời là
A 4. B 5. C 2. D 3.
Câu 6: Trong điều kiện không có oxi, sắt phản ứng với lượng dư dung dịch nào sau đây tạo muối sắt (II)?
A. FeCl3. B. H2SO4 đặc, nóng. C. HNO3 đặc, nóng. D. AgNO3.
Câu 7: Trong phản ứng của kim loại Al với khí O2, một mol nguyên tử Al nhường đi mấy mol electron?
A 1. B 2. C 3. D 4.
Câu 8: Công thức của metyl fomiat là
A. CH3COOCH3. B. HCOOCH3. C. CH3COOC2H5. D. HCOOC2H5.
Câu 9: Điện phân dung dịch CuCl2 dư, điện cực trơ, ở anot thu được chất nào sau đây?
A Cu. B Cl2 C H2 D CuCl.
Câu 10: Trùng hợp vinyl xianua, không tạo thành polime nào sau đây?
A. Policaproamit. B. Tơ olon. C. Tơ nitron. D. Poliacrilonitrin.
Câu 11: Chất nào sau đây là muối trung hoà?
A NaCl. B NaHCO3 C NaHSO4 D Na2HPO4
Câu 12: Trong công nghiệp sản xuất Al bằng phương pháp điện phân nóng chảy Al2O3, người ta hoà tan
Al2O3 trong chất X nóng chảy nhằm vừa tiết kiệm được năng lượng, vừa tạo được chất lỏng có tính dẫn điện tốt hơn, vừa tạo hỗn hợp có khối lượng riêng nhỏ hơn nhôm nổi lên trên bảo vệ nhôm nóng chảy không bị oxi hoá bởi O2 trong không khí. Chất X là?
A. criolit. B. boxit. C. pirit. D. xiđerit.
Câu 13: Tác nhân chủ yếu gây “ mưa axit “ là do sự tăng nồng độ trong khí quyển của chất nào sau đây?
A CO2; CH4 B SO2; NO2 C O2; O3 D H2; N2
Câu 14: Chất nào sau đây là thành phần chủ yếu của xà phòng?
A. Chất béo. B. Tinh bột. C. Natri stearat. D. Glixerol.
Câu 15: Cho dãy các kim loại Au, Ag, Cu, Al. Kim loại có tính dẻo nhất trong dãy là
A Au. B Al. C Cu. D Ag.
Câu 16: Chất 3-MCPD có tên đầy đủ là 3-monocloropropan-1,2-diol là một chất thuộc nhóm chlorpropanol, được sinh ra trong quá trình thuỷ phân đậu tương bằng axit lúc sản xuất nước tương và các thực phẩm khác. Nếu hàm lượng chất 3-MCPD vượt qua mức 1mg/kg và sử dụng trong thời gian dài sẽ ảnh hưởng đến sức khoẻ. Số nguyên tử oxi trong phân tử 3-MCPD là
A. 2. B. 3. C. 4. D. 1. Câu 17: Chất nào sau đây là amin thơm?
A Metylamin. B Etanamin. C Đimeyl amin. D Anilin. Câu 18: Crom (VI) oxit là chất oxi hoá rất mạnh có trong máy đo nồng độ cồn, khi gặp ancol etylic sẽ bị
khử thành crom (III) oxit màu lục thẩm, dựa vào sự thay đổi màu sắc máy đo nồng độ cồn sẽ biết được mức
độ uống rượu của lái xe. Công thức của crom (VI) oxit là
A. Cr2O3. B. CrO3. C. CrO. D. H2CrO4.
Câu 19: Kim loại nào sau đây phản ứng với nước ở điều kiện thường?
A Cu. B Be. C Na. D Ag.
Câu 20: Chất nào sau đây bị khử bởi H2 (xúc tác Ni, t°) tạo thành sobitol?
A. Saccarozơ. B. Tinh bột. C. Xenlulozơ. D. Glucozơ.
Câu 21: Khử hoàn toàn 30 gam hỗn hợp gồm CuO, FeO, Fe2O3, Fe3O4, cần dùng 5,6 lít khí CO. Khối lượng chất rắn thu được sau phản ứng là
A 28 gam. B 26 gam. C 24 gam. D 22 gam.
Câu 22: Phát biểu nào sau đây đúng?
A. Poli(metyl metacrylat) được dùng chế tạo thuỷ tinh hữu cơ plexiglas.
B Amilozơ có cấu trúc mạch phân nhánh.
C Tơ nilon-6,6 được điều chế bằng phản ứng trùng hợp.
D Keo dán ure-fomandehit được sản xuất trực tiếp từ NH3 và CO2
Câu 23: Thí nghiệm nào sau đây không có khí thoát ra?
A Cho thanh kim loại Al vào dung dịch NaHSO4
B Cho CaCO3 vào dung dịch HCl.
C. Cho Na2SO4 vào dung dịch BaCl2.
D. Cho bột đồng vào dung dịch chứa hỗn hợp NaNO3 và H2SO4 loãng.
Câu 24: Thuỷ phân 342 gam saccarozơ với hiệu suất H% trong môi trường axit thu được dung dịch X. Trung hoà dung dịch X thu được dung dịch Y, sau đó cho toàn bộ dung dịch tham gia hoàn toàn phản ứng tráng gương thu được 345,6 gam Ag. Giá trị của H là
A 90%. B 80%. C 75%. D 60%.
Câu 25: Cho 9,0 gam amin X (no, đơn chức, mạch hở) tác dụng vừa đủ với dung dịch HCl thu được 16,3 gam muối. Công thức phân tử của X là
A. CH5N. B. C2H7N. C. C3H9N. D. C4H11N.
Câu 26: Cho sơ đồ phản ứng
(a) X + H2O → Y
(b) Y + AgNO3 + NH3 + H2O → Amoni gluconat + Ag + NH4NO3.
(c) Y → E + Z
(d) Z + H2O → X + G
X, Y, Z lần lượt là
A. Tinh bột, glucozơ, etanol. B. Xenlulozơ, fructozơ, cacbon đioxit.
C. Tinh bột, glucozơ, cacbon đioxit. D. Xenlulozơ, saccarozơ, cacbon đioxit.
Câu 27: Để 8,96 gam Fe trong không khí sau một thời gian thu được 10,72 gam hỗn hợp chất rắn X gồm
FeO, Fe2O3, Fe3O4 và Fe dư. Hoà tan hết X trong dung dịch HCl thu được V lít H2 và dung dịch Y chứa 21,03 gam muối clorua. Giá trị của V là
Trang 1/4 – Mã đề 066
Trang 2/4 – Mã đề 066
A. 1,344. B. 0,896. C. 0,112. D. 0,672.
Câu 28: Cho sơ đồ chuyển hoá:
Tên của Z là
A natri stearat. B axit stearic. C axit oleic. D natri oleat.
Câu 29: Cho hỗn hợp X gồm các chất Al2O3, Fe3O4, FeO, CuO. Cho khí CO dư qua X nung nóng thu được chất rắn Y. Cho Y vào dung dịch KOH dư thu được dung dịch E và chất rắn G. Cho chất rắn G vào dung dịch CuSO4 dư thu được chất rắn F. Biết các phản ứng xảy ra hoàn toàn, chất rắn F gồm
A Cu và Al2O3 B Cu, Al2O3, FeO. C Cu, FeO, CuO. D Cu.
Câu 30: Thuỷ phân hoàn toàn 11,84 gam một este đơn chức X bằng dung dịch NaOH dư, đun nóng thu được m gam muối Y và 5,12 gam ancol Z. Giá trị của m là
A 13,12. B 7,36. C 9,6. D 12,3.
Câu 31: Cho các phát biểu sau
(a) Mọi este khi xà phòng hóa đều tạo ra muối và ancol
(b) Phản ứng tổng hợp este xảy ra chậm và thuận nghịch.
(c) Amilopectin, tơ tằm, lông cừu là polime thiên nhiên.
(d) Cao su Buna-S được điều chế bằng phản ứng trùng ngưng
(e) H2SO4 đặc chỉ đóng vai trò chất hút nước trong phản ứng tổng hợp este
(f) Tinh bột và xenlulozơ là đồng phân của nhau
(g) Protein dạng sợi dễ dàng tan vào nước tạo thành dung dịch keo
(h) Amilozơ và amilopectin đều có các liên kết α-1,4-glicozit
Số phát biểu đúng là
A. 5. B. 4. C. 6. D. 3.
Câu 32: Cho các thí nghiệm sau đây
(a) Nhúng thanh Zn vào dung dịch CuSO4
(b) Nhúng thanh Fe vào dung dịch CuSO4 và H2SO4 loãng
(c) Nhúng thanh Cu vào dung dịch AgNO3
(d) Nhúng thanh Cu vào dung dịch Fe2(SO4)3
Số thí nghiệm xảy ra ăn mòn hoá học và xảy ra ăn mòn điện hoá học là
A. 4 và 3. B. 4 và 4. C. 3 và 4. D. 1 và 1.
Câu 33: Một loại phân bón hỗn hợp trên bao bì ghi tỉ lệ 10 – 20 – 15. Các con số này chính là độ dinh dưỡng của phân đạm, lân, kaili tương ứng. Để sản xuất loại phân bón này, nhà máy Z trộn ba loại hoá chất Ca(NO3)2, KH2PO4, KNO3 với nhau. Trong phân bón đó tỉ lệ khối lượng của Ca(NO3)2 là a%; của KH2PO4 là b%. Giả sử các tạp chất không chứa N, P, K. Giá trị của (a + b) gần nhất với
A 93,8. B 59,3. C 42,1. D 55,5.
Câu 34: Đốt cháy hoàn toàn 25,74 gam triglixerit X, thu được CO2 và 1,53 mol H2O. Cho 25,74 gam X tác dụng với dung dịch NaOH vừa đủ thu được glixerol và m gam muối. Mặt khác, 25,74 gam X tác dụng được tối đa với 0,06 mol Br2 trong dung dịch. Giá trị của m là
A. 24,18. B. 27,42. C. 27,72. D. 26,58.
Câu 35: Nhiệt lượng toả ra khi đốt cháy 1,0 gam than là 23,0 kJ. Cần phải đốt m gam than để làm nóng 2070 gam H2O từ 20°C lên 90°C. Biết để làm nóng 1,0 mol H2O thêm 1,0°C cần một nhiệt lượng là 75,4 J và hiệu suất sử dụng nhiệt là 75%. Giá trị của m là
A 32,35. B 19,79. C 35,19. D 26,39.
Câu 36: Cho 5,956 gam hỗn hợp chất rắn X gồm Fe, Fe3O4, Fe(NO3)2 vào dung dịch chứa 0,24 mol HCl và 0,02 mol HNO3, khuấy đều cho các phản ứng xảy ra hoàn toàn thu được dung dịch Y (không chứa muối
Trang 3/4 – Mã đề 066
NH4 +) và 0,03 mol hỗn hợp khí Z gồm NO và N2O. Cho dung dịch AgNO3 dư vào Y thấy thoát ra 0,01 mol khí NO (là sản phẩm khử duy nhất của N+5) đồng thời thu được 35,52 gam kết tủa. Phần trăm khối lượng
Fe3O4 trong hỗn hợp có giá trị gần nhất với giá trị nào sau đây?
A. 37,1%. B. 46,6%. C. 40,8%. D. 35,8%.
Câu 37: Hỗn hợp T gồm ba este mạch hở X (đơn chức), Y (hai chức), Z (ba chức) đều được tạo thành từ axit cacboxylic và ancol. Đốt cháy hoàn toàn m gam T, thu được H2O và 1,0 mol CO2. Xà phòng hóa hoàn toàn m gam T bằng dung dịch NaOH vừa đủ, thu được hỗn hợp E gồm hai ancol (có cùng số nguyên tử cacbon trong phân tử) và 26,96 gam hỗn hợp muối F. Cho E tác dụng hết với kim loại Na dư, thu được 0,2 mol H2 Đốt cháy toàn bộ F, thu được H2O, Na2CO3 và 0,2 mol CO2. Khối lượng của Y trong m gam T là A 2,92 gam. B 5,92 gam. C 2,36 gam. D 3,65 gam.
Câu 38: Điện phân dung dịch Cu(NO3)2, CuSO4, NaCl với điện cực trơ, cường độ dòng điện không đổi 2A, hiệu suất 100%. Kết quả thí nghiệm ghi được ở bảng sau
Thời gian điện phân (giây) t t + 2895 2t
Tổng số mol khí ở cả 2 điện cực a a + 0,03 2,125a
Số mol Cu ở catot b b + 0,02 b + 0,02
Giá trị của t là A. 4825. B. 5790. C. 2895. D. 3860.
Câu 39: Hoàn tan hoàn toàn hỗn hợp chất rắn X, Y (có cùng số mol) vào H2O thu được dung dịch Z. Tiến hành các thí nghiệm sau:
Thí nghiệm 1: Cho dung dịch NaOH dư vào V lít dung dịch Z thu được n1 mol kết tủa.
Thí nghiệm 2: Cho dung dịch Na2CO3 dư vào V lít dung dịch Z thu được n2 mol kết tủa.
Thí nghiệm 3: Cho dung dịch AgNO3 dư vào V lít dung dịch Z thu được n3 mol kết tủa.
Biết các phản ứng xảy ra hoàn toàn và n1 = n2; n3 = 4n1. Hai chất X, Y lần lượt là
A Ca(HCO3)2 và CaCl2 B NaCl và FeCl2
C. NaNO3 và Fe(NO3)2. D. KCl và Ba(HCO3)2.
Câu 40: Cho các phản ứng xảy ra theo đúng tỉ lệ số mol như sau:
(1) X + 2NaOH → X1 + X2 + X3
(2) X1 + HCl → X4 + NaCl
(3) X4 + 2AgNO3 + 4NH3 + 2H2O → X6 + 2NH4NO3 + 2Ag
(4) X2 + HCl → X5 + NaCl
(5) X3 + CO → X5
Biết X có công thức phân tử C6H8O4, và chứa 2 chức este. Cho các phát biểu sau:
(a) X4 là hợp chất hữu cơ đa chức.
(b) Phân tử khối của X6 là 138.
(c) X3 là hợp chất anđehit.
(d) Dung dịch X2 làm quỳ tím hoá xanh.
(
đ) Nhiệt độ sôi của X3 cao hơn nhiệt độ sôi của X5
Số phát biểu đúng là
A 5. B 3. C 2. D 4.
Trang 4/4 – Mã đề 066
Câu 4:
ĐÁP ÁN VÀ GIẢI CHI TIẾT
Để bảo vệ vỏ tàu biển làm bằng thép (thành phần chính là Fe) người ta thường gắn vào vỏ tàu (phần ngâm dưới nước) những tấm kim loại Zn vì Zn có tính khử mạnh hơn Fe nên Zn là cực âm và bị ăn mòn, Fe là cực dương và được bảo vệ
Câu 5:
Các chất làm mềm nước cứng tạm thời: NaOH, Ca(OH)2 (vừa đủ), Na2CO3, Na3PO4.
M2+ + OH- + HCO3 - —> MCO3 + H2O
M2+ + CO3 2- —> MCO3
M2+ + PO4 3- —> M3(PO4)2
(M2+ là Mg2+, Ca2+)
Câu 6:
A. Fe + FeCl3 dư —> FeCl2
B. Fe + H2SO4 đặc, nóng, dư —> Fe2(SO4)3 + SO2 + H2O
C. Fe + HNO3 đặc, nóng, dư —> Fe(NO3)3 + NO2 + H2O
D. Fe + AgNO3 dư —> Fe(NO3)3 + Ag
Câu 7:
Một mol nguyên tử Al nhường 3 mol electron: Al → Al+3 + 3e
Câu 16: 3-MCPD (3-monoclopropan-1,2-điol) là CH2OH-CHOH-CH2Cl —> 3-MCPD có 2 oxi.
Câu 21:
nO bị lấy = nCO2 = 0,25
—> m rắn = 30 – 0,25.16 = 26 gam
Câu 22:
A. Đúng
B. Sai, amilozơ có cấu trúc mạch không phân nhánh.
C. Sai, tơ nilon-6,6 được điều chế bằng phản ứng trùng ngưng H2N-(CH2)6-NH2 và HOOC-(CH2)4COOH.
D. Sai, keo dán ure-fomandehit được sản xuất từ phản ứng trùng ngưng (NH2)2CO và HCHO.
Câu 23:
A. Al + NaHSO4 —> Na2SO4 + Al2(SO4)3 + H2
B. CaCO3 + HCl —> CaCl2 + CO2 + H2O
C. Na2SO4 + BaCl2 —> BaSO4 + NaCl
D. Cu + H+ + NO3 - —> Cu2+ + NO + H2O
Câu 24:
Saccarozơ —> Glucozơ + Fructozơ —> 4Ag
nAg = 3,2 —> nSaccarozơ phản ứng = 0,8
—> H = 0,8.342/342 = 80%
Câu 25:
nX = nHCl = (m muối – mX)/36,5 = 0,2
—> MX = 45: C2H7N
Câu 26:
(b) —> Y là glucozơ
—> X là tinh bột, E là C2H5OH, Z là CO2, G là O2.
Câu 27:
nHCl phản ứng = nCl-(muối) = (21,03 – 8,96)/35,5 = 0,34
nH2O = nO = (mX – mFe)/16 = 0,11
Bảo toàn H: nHCl phản ứng = 2nH2O + 2nH2
—> nH2 = 0,06 —> V = 1,344 lít
Câu 28:
(C17H33COO)3C3H5 + 3H2 —> (C17H35COO)3C3H5
(C17H33COO)3C3H5 + 3NaOH —> 3C17H35COONa + C3H5(OH)3
C17H35COONa + HCl —> C17H35COOH + NaCl
—> Z là axit stearic.
Trang 6/4 – Mã đề 066
Câu 29:
Y gồm Al2O3, Fe, Cu
G gồm Fe, Cu
F là Cu
Câu 30:
nRCOOR’ = nR’OH
⇔ 11,84/(R + R’ + 44) = 5,12/(R’ + 17)
⇔ 5,12(R + R’ + 44) – 11,84(R’ + 17) = 0
—> 21R’ – 16R = 75
—> R’ = R = 15 là nghiệm phù hợp. Muối là CH3COONa (0,16) —> m = 13,12 gam
Câu 31:
(a) Sai, ví dụ CH3COOCH=CH2 không tạo ancol.
(b) Đúng
(c) Đúng
(d) Sai, phản ứng trùng hợp
(e) Sai, hút nước và xúc tác.
(f) Sai, số mắt xích khác nhau
(g) Sai, dạng cầu mới tan
(h) Đúng
Câu 32:
Cả 4 thí nghiệm đều có ăn mòn hóa học vì các kim loại đều tham gia phản ứng.
Có 3 thí nghiệm (a)(b)(c) có ăn mòn điện hóa vì có cặp điện cực và môi trường điện li.
Câu 33:
Lấy 100 gam phân, trong đó có Ca(NO3)2 (x mol), KH2PO4 (y mol), KNO3 (z mol gam) và tạp chất.
mN = 10 = 14(2x + z)
mP2O5 = 20 = 142y
mK2O = 15 = 94(y + z)/2
—> x = 0,268; y = 0,141; z = 0,178
—> a + b = 164x + 136y = 63,128
Đặt nX = x, nCO2 = y và độ không no của X là k.
mX = mC + mH + mO = 12y + 1,53.2 + 16.6x = 25,74 (1)
x(k – 1) = y – 1,53 (2)
nBr2 = x(k – 3) = 0,06 (3)
(1)(2)(3) —> kx = 0,15; x = 0,03; y = 1,65
nNaOH = 3nX = 0,09 và nC3H5(OH)3 = x = 0,03
Bảo toàn khối lượng —> m muối = 26,58 gam
Câu 35:
nH2O = 115; m than = x gam
Bảo toàn năng lượng:
75%.23000x = 115.75,4.(90 – 20) —> x = 35,19 gam
Câu 36:
Thêm AgNO3 vào Y thấy xuất hiện khí NO chứng tỏ Y chứa Fe2+, H+ dư và không có NO3.
nAgCl = 0,24 —> nAg = 0,01
Bảo toàn electron: nFe2+ = 3nNO + nAg = 0,04
nH+ dư = 4nNO = 0,04
Dung dịch Y chứa Fe2+ (0,04), H+ dư (0,04), Cl- (0,24), bảo toàn điện tích —> nFe3+ = 0,04
Ban đầu đặt a, b, c là số mol Fe, Fe3O4 và Fe(NO3)2
mX = 56a + 232b + 180c = 5,956 (1)
nFe = a + 3b + c = 0,04 + 0,04 (2)
Bảo toàn H —> nH2O = 0,11
Bảo toàn O:
4b + 6c + 0,02.3 = 0,03 + 0,11 (3)
(1)(2)(3) —> a = 0,0445; b = 0,0095; c = 0,007
—> %Fe3O4 = 37,00%
Câu 37:
nH2 = 0,2 —> nNaOH = nO(E) = 0,4
—> nNa2CO3 = 0,2
nC(F) = nNa2CO3 + nCO2 = 0,4
Dễ thấy nC(F) = nNa(F) nên F gồm HCOONa (0,16) và (COONa)2 (0,12)
nC(Ancol) = 1 – nC(F) = 0,6
E chứa 2 ancol cùng C —> Số C ≥ 2
nE > 0,4/3 = 0,1333 —> Số C < 0,6/0,1333 = 4,5
Câu 34: Trang
Trang 7/4 – Mã đề 066
—> Ancol cùng 2C, 3C hoặc 4C.
Xét ancol gồm C2H5OH (0,2) và C2H4(OH)2 (0,1)
X là HCOOC2H5 (x mol)
n(COONa)2 > nC2H4(OH)2 nên Y là (COOC2H5)2 (y mol)
Z là HCOO-CH2-CH2-OOC-COO-C2H5 (z mol)
nC2H5OH = x + 2y + z = 0,2
nHCOONa = x + z = 0,16
n(COONa)2 = y + z = 0,12
—> x = 0,06; y = 0,02; z = 0,1
—> mY = 2,92
Câu 38:
Trong t giây đầu chỉ thoát Cu và Cl2 nên a = b
Trong khoảng thời gian từ t đến t + 2895 giây:
ne = 2.2895/96500 = 0,06
Catot: nCu = 0,02 —> nH2 = 0,01
Anot: nCl2 = u và nO2 = v
—> u + v + 0,01 = 0,03
ne = 2u + 4v = 0,06
—> u = v = 0,01
ne trong t giây = 2a —> ne trong 2t giây = 4a
Sau 2t giây:
Catot: nCu = a + 0,02 —> nH2 = a – 0,02
Anot: nCl2 = a + 0,01 —> nO2 = 0,5a – 0,005
n khí tổng = (a – 0,02) + (a + 0,01) + (0,5a – 0,005) = 2,125a
—> a = 0,04
ne = 2a = It/F —> t = 3860s
Câu 39:
Tự chọn nX = nY = 1
n3 = 4n1 —> Chọn B
TN1: n1 = nFe(OH)2 = 1
TN2: n2 = nAgCl + nAg = 3 + 1 = 4
Câu 40:
(5) —> X3 là CH3OH; X5 là CH3COOH
(4) —> X2 là CH3COONa
X là CH3COO-CH=CH-COO-CH3
X1 là OHC-CH2-COONa
X4 là OHC-CH2-COOH
X6 là CH2(COONH4)2
(a) Sai, X4 là chất tạp chức.
(b) Đúng
(c) Sai, X3 là ancol
(d) Đúng, CH3COO- bị thủy phân tạo môi trường kiềm nên dung dịch CH3COONa làm quỳ tím hoá xanh.
(
đ) Sai, X3 có phân tử khối nhỏ hơn và liên kết H kém bền hơn X5 nên nhiệt độ sôi của X3 thấp hơn nhiệt
độ sôi của X5
SỞ GIÁO DỤC ĐÀO TẠO VĨNH PHÚC LIÊN TRƯỜNG THPT (Đề thi có 04 trang) (40 câu trắc nghiệm)
ĐỀ THI THỬ THPT QUỐC GIA LẦN 3
NĂM HỌC 2022-2023
Môn: HOÁ HỌC
Thời gian: 50 phút (không tính thời gian phát đề)
Mã đề 065
Cho nguyên tử khối: H = 1; C = 12; N = 14; O = 16; Na = 23; Mg = 24; Al = 27; P = 31; S = 32; Cl = 35,5; Br = 80; K = 39; Ca = 40; Fe = 56; Cu = 64; Zn = 65; Ag = 108; I = 127; Ba = 137.
Câu 41: Polime nào sau đây có công thức (-CH2-CHCl-)n ?
A Poli(vinyl clorua). B Polietilen. C Poli(metyl metacrylat).D Poliacrilonitrin.
Câu 42: Tính chất nào sau đây của kim loại không phải do các electron tự do gây ra?
A. Độ cứng. B. Tính dẻo. C. Ánh kim. D. Tính dẫn điện.
Câu 43: Dung dịch chất nào sau đây làm quỳ tím hóa xanh?
A HCOOH. B KNO3 C NaOH. D HF.
Câu 44: Thủy phân hoàn toàn hỗn hợp phenyl axetat và etyl axetat trong dung dịch NaOH, thu được sản
phẩm hữu cơ gồm
A. 2 muối và 1 ancol. B. 2 muối và 2 ancol. C. 3 muối và 1 ancol. D. 1 muối và 2 ancol.
Câu 45: Xà phòng hóa hoàn toàn este X (C5H10O2) mạch hở trong dung dịch NaOH, thu được hỗn hợp gồm muối natri propionat và ancol Y. Tên gọi của Y là
A glixerol. B ancol metylic. C ancol etylic. D ancol propylic.
Câu 46: Axit stearic được dùng làm cứng xà phòng, đặc biệt là xà phòng làm từ thực vật. Công thức của axit stearic là
A. C17H35COOH. B. HCOOH. C. C17H33COOH. D. C2H5COOH.
Câu 47: Chất nào sau đây có 2 nguyên tử cacbon trong phân tử?
A Axit fomic. B Axit axetic. C Axit propionic. D Axit benzoic.
Câu 48: Cho các polime sau đây: (1) tơ tằm; (2) sợi bông; (3) sợi đay; (4) tơ enang; (5) tơ visco; (6) nilon6,6; (7) tơ axetat. Những polime có nguồn gốc từ xenlulozơ là
A. (5), (6), (7). B. (2), (3), (6). C. (2), (3), (5), (7). D. (1), (2). (6).
Câu 49: Số amin có công thức phân tử C3H9N là
A 4. B 5. C 2. D 3.
Câu 50: Polime thiên nhiên X màu trắng, dạng sợi, không tan trong nước, có nhiều trong thân cây: đay, gai, tre, nứa. Polime X là.
A. Glucozơ. B. Xenlulozơ. C. Tinh bột. D. Saccarozơ.
Câu 51: Trong các phát biểu sau, phát biểu đúng là
A Glucozơ và saccarozơ là những chất rắn kết tinh màu trắng.
B. Tinh bột và xenlulozơ là đồng phân của nhau.
C. Thủy phân hoàn toàn saccarozơ chỉ thu được một loại monosaccarit.
D Trong môi trường bazơ, fructozơ chuyển hóa một phần thành glucozơ
Câu 52: Dãy gồm các kim loại đều phản ứng với nước ở nhiệt độ thường, tạo ra dung dịch có môi trường kiềm là
A Be, Na, Ca. B Ba, Fe, K. C Na, Ba, K. D Na, Fe, K.
Câu 53: Chất nào sau đây là tetrapeptit?
A Alanin. B Ala-Gly-Ala-Val. C Gly-Gly-Gly. D Gly-Ala.
Câu 54: Chất nào sau đây tác dụng với dung dịch KOH tạo thành kali axetat?
A. CH2=CHCOOCH3. B. HCOOC2H5. C. CH3COOCH3. D. C2H5COOCH3.
Câu 55: Hợp chất nào sau đây thuộc loại aminoaxit?
A CH3OH. B C6H5NH2 C CH3COONH4 D H2NCH2COOH.
Câu 56: Để bảo quản ống thép (dẫn nước, dẫn dầu, dẫn khí đốt…) bằng phương pháp điện hóa, người ta
g
ắn vào mặt ngoài của ống thép những khối kim loại
A. Pb. B. Cu. C. Ag. D. Zn.
Câu 57: Phát biểu nào sau đây sai?
A Các kim loại kiềm đều là kim loại nhẹ
B Kim loại Na, K đều khử được H2O ở điều kiện thường.
C. Cho Na kim loại vào dung dịch FeSO4 thu được Fe.
D. Kim loại kiềm được bảo quản bằng cách ngâm trong dầu hỏa.
Câu 58: Hòa tan hoàn toàn 13,4 gam hỗn hợp X gồm NaHCO3, KHCO3 và MgCO3 bằng dung dịch HCl dư, thu được 3,36 lít khí CO2 (ở đktc) và dung dịch chứa m gam muối KCl. Giá trị của m là A 11,175. B 8,940. C 3,725. D 5,850.
Câu 59: Cho sơ đồ chuyển hóa:
Biết X, Y, Z là các chất khác nhau đều chứa kali. Phát biểu sai là
A. Có 2 chất thỏa mãn X. B. Có 2 chất thỏa mãn Z.
C Chất Y là K2HPO4 D Có 1 chất thỏa mãn Y.
Câu 60: Kim loại M tác dụng được với axit HCl và oxit của nó bị khử bởi CO ở nhiệt độ cao. M là kim loại nào sau đây?
A. Mg. B. Ag. C. Fe. D. Cu.
Câu 61: Thủy phân hoàn toàn m gam saccarozơ thu được dung dịch X, trung hòa X rồi cho phản ứng với dung dịch AgNO3 trong NH3 thu được 54 gam Ag. Biết các phản ứng xảy ra hoàn toàn, giá trị của m là A 42,75. B 21,75. C 43,5. D 85,50.
Câu 62: Kim loại nào sau đây tan được trong dung dịch HCl?
A. Ag. B. Cu. C. Au. D. Zn.
Câu 63: Trong các kim loại: Ca, Fe, K, Ag. Kim loại có tính khử mạnh nhất là
A Ca. B K. C Ag. D Fe.
Câu 64: Nung hỗn hợp gồm 0,075 mol Al và 0,025 mol Fe3O4 một thời gian, thu được hỗn hợp rắn X. Hoà tan hoàn toàn X trong dung dịch HCl dư, thu được 2,1 lít khí H2 (ở đktc) và m gam muối. Giá trị của m gần nhất với giá trị nào sau đây?
A. 13,10. B. 20,05. C. 17,18. D. 19,98.
Câu 65: Chất nào sau đây vừa phản ứng với dung dịch NaOH vừa phản ứng với dung dịch HCl ?
A Al2O3 B AlCl3 C BaCl2 D Ba(OH)2
Câu 66: Cho 9,38 gam hỗn hợp gồm kim loại kiềm X và một kim loại kiềm thổ Y tác dụng hết với lượng dư dung dịch HCl loãng, thu được 7,84 lít khí (ở đktc). Kim loại X, Y lần lượt là
A. Li và Be. B. Na và Mg. C. K và Ba. D. Na và Ca.
Câu 67: Cho một đinh sắt sạch vào 150 ml dung dịch CuSO4 1,0 M. Sau khi phản ứng hoàn toàn, khối lượng đinh sắt tăng m gam. Giá trị của m là
A 2,2. B 1,6. C 2,4. D 1,2.
Câu 68: Kim loại Al không tan được trong dung dịch nào sau đây?
A. HCl. B. NaOH. C. Ba(OH)2. D. CaCl2.
Câu 69: Một mẫu nước cứng chứa các ion: Mg2+, Ca2+, Cl-, SO4 2-. Hóa chất có thể làm mềm mẫu nước
cứng trên là
Trang 1/4 – Mã đề 065
Trang
A. Ba(NO3)2. B. CaCl2. C. H2SO4. D. Na2CO3.
Câu 70: Xà phòng hóa hoàn toàn 7,4 gam HCOOC2H5 bằng một lượng dung dịch NaOH vừa đủ. Cô cạn
dung dịch sau phản ứng, thu được m gam muối khan. Giá trị của m là
A 6,8. B 9,6. C 6,3. D 4,6.
Câu 71: Cho các phản ứng xảy ra theo sơ đồ sau:
(1) X + H2O → X2 + Y + Z (điện phân có màng ngăn)
(2) CO2 + X2 → X3
(3) CO2 + 2X2 → X4 + H2O
(4) X3 + X5 → T + X2 + H2O
(5) 2X3 + X5 → T + X4 + 2H2O
Hai chất X2 và X5 lần lượt là
A K2CO3 và BaCl2 B KOH và Ba(HCO3)2
C KOH và Ba(OH)2 D KHCO3, Ba(OH)2
Câu 72: Cho các phát biểu sau:
(1) Xà phòng hóa este đều tạo ra muối và ancol.
(2) Fructozơ có nhiều trong mật ong.
(3) Liên kết của nhóm CO với nhóm NH giữa các aminoaxit là liên kết peptit.
(4) Amilopectin, tơ tằm, lông cừu là polime thiên nhiên.
(5) Cao su Buna–S được điều chế bằng phản ứng trùng ngưng.
(6) Tinh bột và xenlulozơ là đồng phân của nhau.
(7) Protein dạng sợi dễ dàng tan vào nước tạo thành dung dịch keo.
(8) Amilozơ và amilopectin đều có các liên kết α-1,4-glicozit.
Số phát biểu đúng là
A 4. B 3. C 6. D 5.
Câu 73: Tiến hành các thí nghiệm sau:
(a) Cho Fe3O4 vào dung dịch H2SO4 loãng.
(b) Cho NaHCO3 vào dung dịch KOH vừa đủ.
(c) Cho Mg dư vào dung dịch Fe2(SO4)3
(d) Cho dung dịch Fe(NO3)2 vào dung dịch AgNO3 dư
(e) Cho dung dịch Ba(OH)2 vào dung dịch Na2SO4 dư.
Sau khi các phản ứng xảy ra hoàn toàn, số thí nghiệm thu được dung dịch chứa hai muối là
A 5. B 4. C 3. D 2.
Câu 74: Hòa tan hết m gam hỗn hợp gồm Na, Na2O, Ba và BaO vào H2O, thu được 0,15 mol khí H2 và dung dịch X. Sục 0,32 mol khí CO2 vào dung dịch X, thu được dung dịch Y chỉ chứa các muối và kết tủa
Z. Chia dung dịch Y làm 2 phần bằng nhau:
+ Cho từ từ phần 1 vào 200 ml dung dịch HCl 0,6M thấy thoát ra 0,075 mol khí CO2.
+ Nếu cho từ từ 200 ml dung dịch HCl 0,6M vào phần 2, thấy thoát ra 0,06 mol khí CO2
Các phản ứng xảy ra hoàn toàn. Giá trị của m là
A 28,28. B 20,92. C 30,68. D 25,88.
Câu 75: Hỗn hợp X gồm axit oleic, axit stearic và triglixerit Y. Đốt cháy hoàn toàn m gam hỗn hợp X cần
vừa đủ 71,792 lit khí O2 (đo ở đktc) thu được 2,25 mol CO2. Mặt khác m gam hỗn hợp X làm mất màu vừa
đủ 6,4 gam brom trong CCl4. Nếu cho m gam hỗn hợp X phản ứng với dung dịch NaOH đun nóng (vừa đủ) thu glixerol và dung dịch chứa hai muối. Phần trăm khối lượng của Y trong m gam hỗn hợp X là
A. 75,81%. B. 50,54%. C. 75,88%. D. 67,63%.
Câu 76: Để tạo ra 1 tấn hạt ngô thì lượng dinh dưỡng cây ngô lấy từ đất là: 22,3 kg N; 3,72 kg P và 10,14 kg K. Lượng phân hao hụt để tạo ra 1 tấn hạt ngô là 33,9 kg N; 6,2 kg P và 14,04 kg K. Loại phân mà người dân sử dụng là phân NPK (20-20-15) trộn với phân kali KCl (độ dinh dưỡng 60%) và phân đạm ure (NH2)2CO (độ dinh dưỡng 46%). Tổng khối lượng phân bón hóa học cần dùng là
A. 102,8 kg. B. 90,3 kg. C. 206,5 kg. D. 200 kg.
Câu 77: Tiến hành điện phân dung dịch chứa m gam hỗn hợp muối CuSO4 và NaCl bằng dòng điện một chiều có cường độ 2A (với điện cực trơ, có màng ngăn xốp). Kết quả thí nghiệm được ghi trong bảng sau:
Thời gian điện phân (giây) t t + 3377,5 2t
Lượng khí sinh ra từ bình điện phân (mol) x x + 0,035 2,0625x
Lượng kim loại Cu sinh ra ở catot (mol) y y + 0,025 y + 0,025
Giả sử hiệu suất điện phân 100%, các khí sinh ra không tan trong dung dịch. Giá trị của m gần nhất với:
A 18,60. B 21,40. C 14,60. D 16,84.
Câu 78: X là hợp chất hữu cơ mạch hở có công thức phân tử C6H8O4. Cho các phản ứng sau (theo đúng tỉ
lệ mol phản ứng):
X + 2NaOH → Z + T + H2O
T + H2 → T1
2Z + H2SO4 → 2Z1 + Na2SO4
Bi
ết Z1 và T1 có cùng số nguyên tử cacbon; Z1 là hợp chất hữu cơ đơn chức. Nhận định nào sau đây đúng?
A Tổng số nguyên tử trong T1 bằng 12.
B Nung Z với hỗn hợp vôi tôi xút thu được ankan đơn giản nhất.
C X không có đồng phân hình học.
D. T là hợp chất hữu cơ no, đơn chức.
Câu 79: Hỗn hợp M gồm ancol no, đơn chức X và axit cacboxylic đơn chức Y, đều mạch hở và có cùng số nguyên tử C, tổng số mol của hai chất là 1,5 mol (số mol của Y nhỏ hơn số mol của X). Nếu đốt cháy hoàn toàn M thì thu được 100,8 lít khí CO2 (đktc) và 75,6 gam H2O. Mặt khác, nếu đun nóng M với H2SO4 đặc để thực hiện phản ứng este hóa (hiệu suất là 90%) thì số gam este thu được là
A 18,24. B 60,48. C 34,20. D 53,78.
Câu 80: Hỗn hợp M gồm C2H5NH2, CH2=CHCH2NH2, H2NCH2CH2CH2NH2, CH3CH2CH2NH2 và CH3CH2NHCH3 Đốt cháy hoàn toàn 5,6 lít M, cần dùng vừa đủ 25,76 lít O2, chỉ thu được CO2; 18 gam H2O và 3,36 lít N2. Các thể tích khí đều đo ở điều kiện tiêu chuẩn. Phần trăm khối lượng của C2H5NH2 trong M là:
A. 48,21%. B. 24,11%. C. 40,18%. D. 32,14%.
Trang 4/4 –
Câu 45:
ĐÁP ÁN VÀ GIẢI CHI TIẾT
Muối natri propionat là C2H5COONa —> X là C2H5COOC2H5 —> Y là C2H5OH:
C2H5COOC2H5 + NaOH —> C2H5COONa + C2H5OH
Câu 48: Các polime có nguồn g
Câu 49:
C3H9N có 4 đồng phân:
CH3—CH2—CH2—NH2 (CH3)2CH—NH2
CH3—NH—CH2—CH3 (CH3)3N
Câu 51:
c xenlulozơ: (2), (3), (5), (7)
A. Sai, glucozơ và saccarozơ là những chất rắn kết tinh không màu.
B. Sai, tinh bột và xenlulozơ không phải đồng phân của nhau vì số mắt xích khác nhau nên CTPT khác nhau.
C. Sai, thủy phân hoàn toàn saccarozơ thu được 2 loại monosaccarit là glucozơ và fructozơ.
D. Đúng
Câu 57:
A. Đúng, các kim loại kiềm có khối lượng riêng nhỏ hơn 5 gam/cm³ nên đều là kim loại nhẹ
B. Đúng
C. Sai, Na khử H2O trước:
Na + H2O —> NaOH + H2
D. Đúng, dầu hỏa không tác dụng với kim loại kiềm và ngăn kim loại kiềm tiếp xúc với môi trường bên ngoài.
Câu 58:
nNaHCO3 + nMgCO3 = a và nKHCO3 = b
—> mX = 84a + 100b = 13,4
nCO2 = a + b = 0,15
—> a = 0,1; b = 0,05
nKCl = b = 0,05 —> mKCl = 3,725 gam
Câu 59:
Khi cộng KOH, số K trong muối tăng, số H giảm. Ngược lại, khi cộng H3PO4, số K trong muối giảm, số
H trong muối tăng —> Y ít K hơn X và Z
Mặt khác, X, Y, Z là các chất khác nhau nên Y phải là KH2PO4
—> C sai, D đúng.
X và Z là 2 muối còn lại, X là K3PO4 thì Z là K2HPO4 hoặc ngược lại, X là K2HPO4 thì Z là K3PO4
—> A và B đều đúng.
Câu 60:
Kim loại M tác dụng được với axit HCl —> M đứng trước H trong dãy điện hóa.
Oxit của M bị khử bởi CO ở nhiệt độ cao —> M đứng sau Al trong dãy điện hóa.
—> Chọn M là Fe:
Fe + HCl —> FeCl2 + H2
FexOy + CO —> Fe + CO2
Câu 61:
Saccarozơ —> Glucozơ + Fructozơ —> 4Ag
nAg = 0,5 —> nC12H22O11 = 0,125 —> m = 42,75 gam
Câu 64:
nH2O = nO = 0,025.4 = 0,1; nH2 = 0,09375
Bảo toàn H —> nHCl phản ứng = 2nH2O + 2nH2 = 0,3875
m muối = 0,075.27 + 0,025.3.56 + 0,3875.35,5 = 19,98125
Câu 65:
Al2O3 vừa phản ứng với dung dịch NaOH vừa phản ứng với dung dịch HCl:
Al2O3 + NaOH —> NaAlO2 + H2O
Al2O3 + HCl —> AlCl3 + H2O
NaOH + FeSO4 —> Fe(OH)2 + Na2SO4 Trang 6/4 –
Còn lại: AlCl3, Al2(SO4)3 có phản ứng với NaOH nhưng không phản ứng với HCl.
NaAlO2 có phản ứng với HCl nhưng không phản ứng với NaOH.
Câu 66:
nH2 = 0,35, kim loại chung là R, hóa trị x
Bảo toàn electron —> 9,38x/R = 0,35.2
—> R = 13,4x
1 < x < 2 —> 13,4 < R < 26,8
Ít nhất có 1 kim loại có M nằm trong khoảng 13,4 đến 26,8 hoặc 1 kim loại có M < 13,4, kim loại kia có
M > 26,8
—> Loại A, C.
Loại D do hệ m kim loại và nH2 ra nghiệm âm. Chọn B.
Câu 67:
Fe + CuSO4 —> Cu + FeSO4
—> nFe phản ứng = nCu = nCuSO4 = 0,15
Δm = 0,15.64 – 0,15.56 = 1,2 —> Đinh sắt tăng 1,2 gam.
Câu 68:
A. HCl + Al —> AlCl3 + H2
B. NaOH + Al + H2O —> NaAlO2 + H2
C. Ba(OH)2 + Al + H2O —> Ba(AlO2)2 + H2
D. CaCl2: Không phản ứng
Câu 69:
Hóa chất có thể làm mềm mẫu nước cứng trên là Na2CO3:
Ca2+ + CO3 2- —> CaCO3
Mg2+ + CO3 2- —> MgCO3
Câu 70:
HCOOC2H5 + NaOH —> HCOONa + C2H5OH
nHCOONa = nHCOOC2H5 = 0,1 mol
—> mHCOONa = 6,8 gam
Câu 71:
(1) điện phân có màng ngăn nên chọn X2 là KOH
—> X3 là KHCO3; X4 là K2CO3
KHCO3 + Ba(OH)2 —> BaCO3 + KOH + H2O
2KHCO3 + Ba(OH)2 —> BaCO3 + K2CO3 + 2H2O
Còn lại X là KC, Y và Z là H2, Cl2
Câu 72:
(1) Sai, tùy loại este, ví dụ este của phenol sẽ không tạo ancol.
(2) Đúng
(3) Sai, liên kết của nhóm CO với nhóm NH giữa các α-amino axit là liên kết peptit.
(4) Đúng
(5) Sai, cao su buna-S điều chế bằng phản ứng đồng trùng hợp CH2=CH-CH=CH2 và CH2=CH-C6H5
(6) Sai, chúng không phải đồng phân vì có CTPT khác nhau do số mắt xích khác nhau.
(7) Sai, protein dạng sợi không tan, protein dạng cầu mới tan.
(8) Đúng
Câu 73:
(a) Fe3O4 + H2SO4 —> Fe2(SO4)3 + FeSO4 + H2O
(b) NaHCO3 + KOH —> Na2CO3 + K2CO3 + H2O
(c) Mg dư + Fe2(SO4)3 —> MgSO4 + Fe
(d) Fe(NO3)2 + AgNO3 dư —> Fe(NO3)3 + Ag
(e) Ba(OH)2 + Na2SO4 dư —> BaSO4 + NaOH
Câu 74:
Do lượng CO2 thoát ra khác nhau nên HCl không dư. Trong phần 1 đặt a, b là số mol CO3 2- và HCO
phản ứng.
—> nHCl = 2a + b = 0,12
nCO2 = a + b = 0,075
—> a = 0,045 và b = 0,03 —> Tỉ lệ 3 : 2
Khi đó phần 2 chứa nCO3 2- = 3x và nHCO3 - = 2x
—> nH+ = 3x + 0,06 = 0,12
—> x = 0,02
V
ậy phần 2 chứa nCO3 2- = 0,06 và nHCO3 - = 0,04
—> Y chứa nCO3 2- = 0,12 và nHCO3 - = 0,08
Bảo toàn điện tích —> nNa+ = 0,32
Bảo toàn C —> nBaCO3 = nCO2 – nCO3 2- – nHCO3 - = 0,12
—> Quy đổi hỗn hợp đầu thành Na (0,32), Ba (0,12), O (z mol)
Bảo toàn electron: 0,32.1 + 0,12.2 = 2z + 2nH2
—> z = 0,13
X5 là Ba(OH)2: Trang 8/4
Trang 7/4 – Mã đề 065
—> m = mNa + mBa + mO = 25,88 gam
Câu 75:
Quy đổi X thành C17H35COOH (a), C3H5(OH)3 (b), H2O (-3b) và H2 (-0,04)
nO2 = 26a + 3,5b – 0,04.0,5 = 3,205
nCO2 = 18a + 3b = 2,25
—> a = 0,12; b = 0,03
—> mX = 35,14
Muối gồm C17H33COONa (0,04) và C17H35COONa (0,08)
—> Y là (C17H35COO)2(C17H33COO)C3H5 (0,03)
—> %Y = 75,81%
Câu 76:
m phân NPK = x; m phân kali = y và m phân ure = z
mN = 33,9 + 22,3 = 20%x + 46%z
mP = 6,2 + 3,72 = 20%x.2.31/142
mK = 14,04 + 10,14 = 15%x.2.39/94 + 60%y.2.39/94
—> x = 113,6; y = 20,17; z = 72,78
—> x + y + z = 206,55
Câu 77:
Trong khoảng thời gian 3377,5 tính từ t đến t + 3377,5 thì ne = 2.3377,5/F = 0,07
nCu = 0,025 —> nH2 = 0,01
nCl2 = u, nO2 = v —> u + v + 0,01 = 0,035
và 2u + 4v = 0,07
—> u = 0,015; v = 0,01
Trong t giây đầu chỉ thoát Cu và Cl2 nên x = y
ne trong t giây = 2x —> ne trong 2t giây = 4x
Sau 2t giây:
Catot: nCu = x + 0,025 —> nH2 = x – 0,025
Anot: nCl2 = x + 0,015 —> nO2 = 0,5x – 0,0075
n khí tổng = (x – 0,025) + (x + 0,015) + (0,5x – 0,0075) = 2,0625x
—> x = 0,04
nCuSO4 = x + 0,025 = 0,065
nNaCl = 2(x + 0,015) = 0,11
—> m = 16,835
Câu 78:
Z1 và T1 cùng C —> Z và T cùng C —> Mỗi chất 3C
Z1 là axit đơn chức —> Z là muối đơn.
X là CH3-CH2-COO-CH=CH-COOH
Z là CH3-CH2-COONa
T là OHC-CH2-COONa
Z1 là CH3-CH2-COOH
T1 là HO-CH2-CH2-COONa
A. Đúng
B. Sai, thu C2H6
C. Sai, X có đồng phân hình học
D. Sai, T tạp chức
Câu 79:
nCO2 = 4,5 —> Số C = nCO2/nM = 3
nH2O = 4,2 —> Số H = 2nH2O/nM = 5,6
—> X là C3H7OH
Nếu Y là CH2=CH-COOH thì nX = 0,6; nY = 0,9 (Không thỏa mãn nY < nX, loại)
Nếu Y là CH≡C-COOH thì nX = 0,9; nY = 0,6 (Thỏa mãn nY < nX)
nCH≡C-COOC3H7 = 0,6.90% = 0,54
—> mCH≡C-COOC3H7 = 60,48
Câu 80:
nO2 = 1,15; nH2O = 1; nN2 = 0,15 và nM = 0,25
Bảo toàn O: 2nO2 = 2nCO2 + nH2O
—> nCO2 = 0,65
mM = mC + mH + mN = 14
M gồm C2H5NH2 (u mol) và C3HyNz (v mol)
nM = u + v = 0,25
nCO2 = 2u + 3v = 0,65
—> u = 0,1 và v = 0,15
—> %C2H5NH2 = 32,14%
Trang 9/4 – Mã đề 065
SỞ GIÁO DỤC ĐÀO TẠO VĨNH PHÚC THPT NGUYỄN VIẾT XUÂN (Đề thi có 04 trang) (40 câu trắc nghiệm)
ĐỀ THI THỬ THPT QUỐC GIA LẦN 3
NĂM HỌC 2022-2023
Môn: HOÁ HỌC
Thời gian: 50 phút (không tính thời gian phát đề)
Mã đề 064
Cho nguyên tử khối: H = 1; C = 12; N = 14; O = 16; Na = 23; Mg = 24; Al = 27; P = 31; S = 32; Cl = 35,5; Br = 80; K = 39; Ca = 40; Fe = 56; Cu = 64; Zn = 65; Ag = 108; I = 127; Ba = 137.
Câu 41: Phát biểu nào sau đây sai?
A. Dung dịch fructozơ hoà tan được Cu(OH)2.
B. Dung dịch fructozơ tác dụng với AgNO3/NH3 khi đun nóng cho kết tủa Ag.
C. Sản phẩm thuỷ phân xenlulozơ (H+, t°) có thể tham gia phản ứng tráng gương.
D. Thuỷ phân saccarozơ (H+, t°) chỉ cho một loại monosaccarit duy nhất.
Câu 42: Trong công nghiệp, một lượng lớn chất béo dùng để sản xuất
A. glucozơ và ancol etylic. B. xà phòng và etilen glicol.
C. glucozơ và glixerol. D. xà phòng và glixerol.
Câu 43: Một mẫu nước cứng chứa các ion: Mg2+; Ca2+, Cl-, SO4 2. Đây là loại nước cứng nào?
A. tạm thời. B. tổng hợp. C. vĩnh cửu. D. toàn phần.
Câu 44: Trong các dung dịch cùng nồng độ mol/l sau, dung dịch nào dẫn điện kém nhất?
A. NaOH. B. HCl. C. CH3COONa. D. CH3COOH.
Câu 45: Fomanlin (còn gọi là fomon) được dùng để ngâm xác thực vật, thuốc da, tẩy uế, diệt trùng, …
Focmanlin là dung dịch của chất hữu cơ nào sau đây?
A. C2H5OH. B. HCHO. C. CH3CHO. D. HCOOH.
Câu 46: Trong tự nhiên, canxi sunfat tồn tại dưới dạng muối ngậm nước (CaSO4.2H2O) được gọi là
A. đá vôi. B. thạch cao nung. C. quặng đolomit. D. thạch cao sống.
Câu 47: Để bảo vệ chân cầu bằng sắt ngâm trong nước sông, người ta gắn vào chân cầu (phần ngập trong
nước) những thanh kim loại nào sau đây?
A Sn. B Zn. C Cu. D Pb.
Câu 48: Polime thiên nhiên X được sinh ra trong quá trình quang hợp của cây xanh. Nhỏ I2 vào dung dịch
X thấy xuất hiện màu xanh tím. Polime X là
A. tinh bột. B. glicogen. C. saccarozơ. D. xenlulozơ.
Câu 49: Công thức nào sau đây là một loại phân đạm?
A. Ca3(PO4)2. B. K2SO4. C. (NH2)2CO. D. Ca(H2PO4)2.
Câu 50: Tơ nào sau đây là tơ nhân tạo?
A. Tơ nitron. B. Tơ tằm. C. Tơ nilon-6. D. Tơ axetat.
Câu 51: Thủy tinh hữu cơ plexiglas là loại chất béo rất bền, trong suốt, có thể cho gần 90% ánh sáng truyền
qua nên được sử dụng làm kính ô tô, máy bay, kính xây dựng, kính bảo hiểm,… Polime dùng để chế tạo thủy tinh hữu cơ có tên gọi là
A. poli (hexametylen ađipamit). B. poli acrilonitrin.
C poli (metyl metacrylat). D poli (etylen terephtalat).
Câu 52: Etyl fomat là chất mùi thơm, không độc, được dùng làm chất tạo hương trong công nghiệp thực phẩm. Nó có phân tử khối là
A. 60. B. 88. C. 68. D. 74.
Câu 53: Amin nào sau đây là khí ở điều kiện thường?
A đietylamin. B propylamin. C metylamin. D anilin.
Câu 54: Tecmit là hỗn hợp của Fe2O3 và kim loại X dùng để hàn đường ray tàu hỏa. Kim loại X là
A Al. B Fe. C Cu. D Ag.
Câu 55: Những tính chất vật lý chung của kim loại là
A tính dẻo, tính dẫn điện, nhiệt độ nóng chảy cao.
B tính dẻo, tính dẫn điện, dẫn nhiệt, và ánh kim.
Trang 1/4 – Mã đề 064
C. tính dẫn điện, dẫn nhiệt, ánh kim và tính cứng.
D. tính dẻo, có ánh kim và tính cứng.
Câu 56: Peptit nào sau đây không có phản ứng màu biure?
A. Ala-Gly-Gly. B. Gly-Ala-Gly. C. Ala-Ala-Gly-Gly. D. Ala-Gly.
Câu 57: Chọn câu phát biểu sai?
A. Phân biệt fructozơ và saccarozơ bằng phản ứng tráng gương.
B. Phân biệt glucozơ và saccarozơ bằng phản ứng tráng gương.
C. Phân biệt hồ tinh bột và xenlulozơ bằng I2.
D. Phân biệt saccarozơ và glixerol bằng Cu(OH)2.

Câu 58: Mệnh đề nào sau đây sai khi nói về nhôm và hợp chất của nó?
A. Khi cho a mol Al tác dụng với 1,5a mol NaOH thu được dung dịch có môi trường bazơ.
B. Nhôm bị thụ động trong dung dịch HCl đặc nguội.
C. Cho dung dịch AlCl3 tác dụng với Na2CO3 thu được kết tủa trắng keo.
D. Phèn chua có công thức K2(SO4).Al2(SO4)3.24H2O.
Câu 59: Có các chất sau: protein; sợi bông, amoni axetat; nhựa novolac; tơ capron; tơ nilon-6,6. Trong các chất trên có bao nhiêu chất mà trong phân tử của chúng có chứa nhóm -NH-CO-?
A. 3. B. 5. C. 2. D. 4.
Câu 60: Cho các chất sau: triolein, tristearin, tripanmitin, vinyl axetat, metyl axetat. Số chất tham gia phản ứng cộng H2 (xúc tác Ni, t°) là
A. 2. B. 1. C. 4. D. 3.
Câu 61: Số đồng phân amin đơn chức bậc 1 chứa vòng benzen có công thức phân tử C7H9N là
A. 6. B. 3. C. 4. D. 5.
Câu 62: Thực hiện quá trình phân tích định tính C và H trong hợp chất hữu cơ theo hình bên.
Hiện tượng xảy ra trong ống nghiệm chứa dung dịch Ca(OH)2 là
A. Dung dịch chuyển sang màu vàng. B. Dung dịch chuyển sang màu xanh.
C. Có kết tủa trắng xuất hiện. D. Có kết tủa đen xuất hiện.
Câu 63: Cẩm tú cầu là loài hoa được trồng nhiều nhất ở Sa Pa và Đà Lạt. Màu của loài hoa này thay đổi tùy thuộc vào pH của đất, nên có thể điều chỉnh màu hoa thông qua việc điều chỉnh độ pH của đất như sau: pH đất trồng < 7 = 7 > 7
Hoa sẽ có màu Lam Trắng sữa Hồng
Khi trồng hoa trên, nếu ta bón thêm ít vôi (CaO) và chỉ tưới nước thì khi thu hoạch hoa sẽ
A Có màu hồng. B Có đủ cả 3 màu lam, trắng, hồng.
C Có màu lam. D Có màu trắng sữa.
Câu 64: “Nước đá khô” không nóng chảy mà dễ thăng hoa nên được dùng để tạo môi trường lạnh và khô, rất tiện cho việc bảo quản thực phẩm. “Nước đá khô” là
A H2O rắn. B CO2 rắn. C CO rắn. D SO2 rắn.
Câu 65: Phát biểu nào dưới đây sai?
A Ăn mòn hóa học phát sinh ra dòng điện một chiều.
B Bản chất của ăn mòn kim loại là quá trình oxi hóa khử
C Nguyên tắc chung để điểu chế kim loại là khử ion kim loại thành nguyên tử
D Tính chất hóa học đặc trưng của kim loại là tính khử
Câu 66: Thực hiện các thí nghiệm sau:
Trang 2/4
(a) Cho từ từ dung dịch HCl vào lượng dư dung dịch Na2CO3.
(b) Nhiệt phân AgNO3
(c) Cho dung dịch Na2CO3 vào dung dịch KHSO4.
(d) Hòa tan Fe3O4 trong dung dịch HNO3
(e) Cho dung dịch Ba(HCO3)2 vào dung dịch NaOH.
Sau khi các phản ứng xảy ra, số thí nghiệm sinh ra chất khí là
A. 2. B. 3. C. 5. D. 4.
Câu 67: Chất X (C7H8O2) có chứa vòng benzen, tác dụng với NaOH theo tỉ lệ 1 : 1. Có bao nhiêu CTCT
phù hợp của X?
A 4. B 6. C 5. D 3.
Câu 68: Dãy gồm các chất được xếp theo chiều tính bazơ giảm dần từ trái sang phải là
A C6H5NH2, NH3, CH3NH2 B CH3NH2, NH3, C6H5NH2
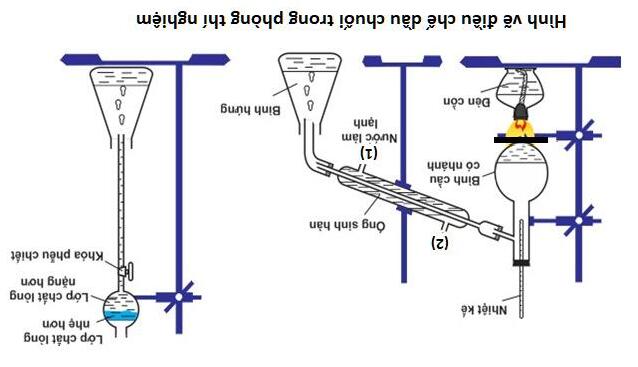
C. NH3, CH3NH2, C6H5NH2. D. CH3NH2, C6H5NH2, NH3.
Câu 69: Cho 1,68 gam bột sắt và 0,36 gam Mg tác dụng với 375 ml dung dịch CuSO4 khuấy nhẹ cho đến khi dung dịch mất màu xanh, thấy khối lượng kim loại thu được sau phản ứng là 2,82 gam. Nồng độ mol/l
của CuSO4 trong dung dịch trước phản ứng là
A 0,15M. B 0,05M. C 0,1M. D 0,2M.
Câu 70: Cho X, Y, Z, T là các chất khác nhau trong số 4 chất: axetilen, anđehit axetic, etanol, axit axetic.
Nhiệt độ sôi của chúng được ghi lại trong bảng sau:
Chất X Y Z T Nhiệt độ sôi (°C) 21 78,3 -75 118
Cho các phát biểu sau:
(a) Chất Z có khả năng tham gia phản ứng tráng bạc.
(b) Chất T hòa tan được Cu(OH)2 ở nhiệt độ thường.
(c) Đốt cháy hoàn toàn chất X thu được số mol CO2 lớn hơn số mol H2O.
(d) Phản ứng giữa chất Y và chất T (xúc tác H2SO4 đặc) được gọi là phản ứng este hóa.
Số phát biểu đúng là
A 2. B 1. C 4. D 3.
Câu 71: Hỗn hợp X gồm (0,3 mol Zn và 0,2 mol Al) phản ứng vừa đủ với 0,45 mol hỗn hợp Y gồm (Cl2,
O2) thu được x gam chất rắn. Giá trị của x gần nhất với con số nào sau đây?
A. 40. B. 60. C. 30. D. 50.
Câu 72: Cho sơ đồ các phản ứng sau:
(1) X → Y + Z + H2O (2) NaAlO2 + Z + H2O → M + X
(3) M → N + H2O (4) N (điện phân nóng chảy) → Q + T
Biết Q thu được ở cực anot; T thu được ở cực catot. Mệnh đề nào sau đây đúng?
A. X, M và N đều là các hợp chất lưỡng tính.
B. Phương trình (1) là phản ứng tạo thạch nhũ trong hang động.
C. Nếu thay NaAlO2 trong phản ứng (2) bằng AlCl3 thì sản phẩm thu được không thay đổi.
D. Q là kim loại màu trắng bạc, nhẹ và có nhiều ứng dụng.
Câu 73: Đốt cháy hoàn toàn m gam triglixerit X cần vừa đủ 2,31 mol O2, thu được H2O và 1,65 mol CO2.
Cho m gam X tác dụng với dung dịch NaOH vừa đủ, thu được glixerol và 26,52 gam muối. Mặt khác, m gam X tác dụng được tối đa với a mol Br2 trong dung dịch. Giá trị của a là
A. 0,18. B. 0,15. C. 0,12. D. 0,09.
Câu 74: Điện phân dung dịch X gồm CuSO4 và NaCl với điện cực trơ, màng ngăn xốp, cường độ dòng
điện 0,5A, hiệu suất điện phân là 100%. Lượng kim loại thoát ra ở catot và lượng khí sinh ra từ bình điện phân được cho theo bảng sau:
Thời gian điện phân (giây) t 2t t + 67550
Lượng kim loại Cu sinh ra ở catot (gam) 0,75a a a
Lượng khí thoát ra từ bình điện phân (lít) 1,68 V 8,4
Tại thời điểm (t + 67550) giây, lượng Cu sinh ra ở catot đủ để mạ lên mặt sau của một chiếc gương hình
tròn, bán kính 15cm, độ dày lớp mạ 1,01.10-3 cm. Biết khối lượng riêng của Cu là 8,96 g/cm³. Tính giá trị
củ
A 7,84 lít. B 3,36 lít. C 4,48 lít. D 5,60 lít.
Trang 3/4 – Mã đề 064
Câu 75: Cho 0,06 mol một hỗn hợp X gồm CH2=CH-COOH, CH3COOH và CH2=CH-CHO phản ứng vừa
đủ với dung dịch chứa 9,6 gam brom. Mặt khác, để trung hòa lượng X trên cần dùng vừa đủ 60 ml dung
dịch NaOH 0,75M. Khối lượng của CH2=CH-COOH trong X là
A. 1,08 gam. B. 4,32 gam. C. 2,16 gam. D. 0,84 gam.
Câu 76: Hình vẽ minh họa phương pháp điều chế isoamy axetat trong phòng thí nghiệm
Cho các phát biểu sau
(a) Hỗn hợp chất lỏng trong bình cầu gồm ancol isoamylic, axit axetic và axit sunfuric đặc.
(b) Trong phễu chiết lớp chất lỏng nặng hơn có thành phần chính là isoamyl axetat.
(c) Nhiệt kế dùng để kiểm soát nhiệt độ trong bình cầu có nhánh.
(d) Phễu chiết dùng tách các chất lỏng không tan vào nhau ra khỏi nhau.
(e) Dầu chuối tinh khiết có thể được sử dụng làm hương liệu phụ gia cho thực phẩm.
(f) Để hiệu suất phản ứng cao hơn nên dùng dung dịch axit axetic 15%.
(g) Nước trong ống sinh hàn được lắp cho chảy vào (1) và ra (2).
Số phát biểu đúng là
A. 4. B. 5. C. 3. D. 6.
Câu 77: X là este no, đa chức, mạch hở; Y là este ba chức, mạch hở (được tạo bởi glixerol và một axit cacboxylic đơn chức, không no chứa một liên kết C=C). Đốt cháy hoàn toàn 17,02 gam hỗn hợp E chứa X, Y thu được 18,144 lít CO2 (đktc). Mặt khác, đun nóng 0,12 mol E cần dùng 570 ml dung dịch NaOH 0,5M thu được dung dịch G. Cô cạn dung dịch G thu được hỗn hợp T chứa 3 muối (T1, T2, T3) và hỗn hợp 2 ancol có cùng số nguyên tử cacbon. Biết MT1 < MT2 < MT3 và T3 nhiều hơn T1 là 2 nguyên tử cacbon. Phần trăm khối lượng của T3 trong hỗn hợp T gần nhất với giá trị nào dưới đây?
A 30%. B 20%. C 25%. D 29%.
Câu 78: Hòa tan hoàn toàn hỗn hợp X gồm Mg, MgO, Fe3O4 và Fe(NO3)2 (trong đó oxi chiếm 29,68% theo khối lượng) trong dung dịch HCl dư thấy có 2,305 mol HCl phản ứng. Sau khi các phản ứng xảy ra xong thu được dung dịch Y (cô cạn Y thu được 115,7875 gam muối clorua) và 7,28 lít (đkc) khí Z gồm NO, H2. Z có tỉ khối so với H2 là 69/13. Thêm dung dịch NaOH dư vào Y, sau phản ứng thu được kết tủa Z. Nung Z trong không khí đến khối lượng không đổi được 51,1 gam chất rắn T. Phần trăm khối lượng của Fe3O4 trong X là
A 4,80%. B 14,2%. C 34,8%. D 24,0%.
Câu 79: Hỗn hợp X gồm M2CO3, MHCO3 và MCl (M là kim loại kiềm). Cho 32,65 gam X tác dụng vừa đủ với dung dịch HCl, thu được dung dịch Y và 8,96 lít CO2 (đktc). Cho AgNO3 dư vào Y, thu được 100,45 gam kết tủa. Kim loại M là
A Rb.
B Na. C Li. D K.
Câu 80: Cho 0,1 mol chất X có công thức phân tử là C2H8O3N2 tác dụng với dung dịch chứa 0,2 mol NaOH đun nóng thu được khí làm xanh giấy quỳ ẩm và dung dịch Y. Cô cạn dung dịch Y thu được m gam chất rắn khan. Giá trị của m là
A 15 gam.
B 21,8 gam. C 12,5 gam. D 5,7 gam.
Trang 4/4 – Mã đề 064
ĐÁP ÁN VÀ GIẢI CHI TIẾT
Câu 65:
A. Sai, ăn mòn hóa học không phát sinh dòng điện.
B. Đúng
C. Đúng: Mn+ + ne —> M
D. Đúng: M —> Mn+ + ne
Câu 66:
Câu 57:
A. Đúng, fructozơ có tráng gương, saccarozơ không tráng gương.
B. Đúng, glucozơ có tráng gương, saccarozơ không tráng gương.
C. Đúng, hồ tinh bột tạo màu xanh tím, xenlulozơ thì không.
D. Sai, cả saccarozơ và glixerol đều hòa tan Cu(OH)2 tạo dung dịch màu xanh thẫm.
Câu 58:
A. Đúng, với mọi tỉ lệ đều có môi trường bazơ, vì sản phẩm NaAlO2 có môi trường bazơ
B. Sai, Al thụ động trong 2 axit đặc nguội (H2SO4, HNO3), không thụ động trong HCl đặc nguội.
C. Đúng: AlCl3 + Na2CO3 + H2O —> Al(OH)3 + NaCl + CO2
D. Đúng
Câu 59:
Các chất chứa nhóm -NHCO- là: protein; tơ capron; tơ nilon-6,6.
Câu 60:
Các chất tham gia phản ứng cộng H2 (xúc tác Ni, t°) là: triolein, vinyl axetat.
Câu 61:
Các đồng phân amin đơn chức bậc 1 chứa vòng benzen có công thức phân tử C7H9N là:
C6H5-CH2-NH2
CH3-C6H4-NH2 (o, m, p)
Câu 62:
Hiện tượng xảy ra trong ống nghiệm chứa dung dịch Ca(OH)2 là có kết tủa trắng xuất hiện:
CO2 + Ca(OH)2 —> CaCO3 + H2O
Câu 63:
Bón vôi làm cho đất có môi trường kiềm (CaO + H2O —> Ca(OH)2), pH > 7 nên hoa có màu hồng.
(a) HCl + Na2CO3 —> NaHCO3 + NaCl
(b) AgNO3 —> Ag + NO2 + O2
(c) Na2CO3 + KHSO4 —> K2SO4 + Na2SO4 + CO2 + H2O
(d) Fe3O4 + HNO3 —> Fe(NO3)3 + NO + H2O
(e) Ba(HCO3)2 + NaOH —> BaCO3 + NaHCO3 + H2O
Câu 67:
C7H8O2 có k = 4 nên chỉ có chức ancol, phenol, ete.
Các cấu tạo phù hợp của X:
HO-C6H4-CH2OH (o, m, p)
CH3-O-C6H4-OH (o, m, p)
Câu 68:
Gốc no (-CH3) làm tăng tính bazơ, gốc thơm (C6H5-) làm giảm tính bazơ.
—> Tính bazơ giảm dần: CH3NH2, NH3, C6H5NH2
Câu 69:
nMg = 0,015; nFe = 0,03
Khi Mg phản ứng hết thì m kim loại = 0,015.64 + 1,68 = 2,64 < 2,82
Vậy Mg phản ứng hết, Fe đã phản ứng x mol
—> 64(0,015 + x) + 1,68 – 56x = 2,82
—> x = 0,0225
—> CM = (x + 0,015)/0,375 = 0,1M
Câu 70:
Các chất cùng C nên nhiệt độ sôi: CH3COOH > C2H5OH > CH3CHO > C2H2
Đối chiếu với bảng số liệu —> T là CH3COOH; Y là C2H5OH; X là CH3CHO và Z là C2H2
(a) Sai, Z tạo kết tủa C2Ag2, không phải phản ứng tráng bạc.
(b) Đúng: CH3COOH + Cu(OH)2 —> (CH3COO)2Cu + H2O
(c) Sai, đốt X có nCO2 = nH2O
Trang 6/4 – Mã
064
Câu 71:
nCl2 = a và nO2 = b —> a + b = 0,45
Bảo toàn electron: 2a + 4b = 0,3.2 + 0,2.3
—> a = 0,3; b = 0,15
—> x = mX + mY = 51 gam
Câu 72:
X là NaHCO3; Y là Na2CO3; Z là CO2
M là Al(OH)3; N là Al2O3
Q là O2, T là Al
A. Đúng
B. Sai, thạch nhũ hình thành do phản ứng Ca(HCO3)2 —> CaCO3 + CO2 + H2O
C. Sai, AlCl3 không phản ứng với CO2.
D. Sai, Q là O2
Câu 73:
Đặt nX = x và nH2O = y
Bảo toàn O: 6x + 2,31.2 = 1,65.2 + y (1)
mX = mC + mH + mO = 1,65.12 + 2y + 16.6x = 96x + 2y + 19,8
nNaOH = 3x và nC3H5(OH)3 = x.
Bảo toàn khối lượng:
96x + 2y + 19,8 + 40.3x = 26,52 + 92x (2)
(1)(2) —> x = 0,03 và y = 1,5
X có độ không no là k.
—> 0,03(k – 1) = 1,65 – 1,5
—> k = 6
—> nBr2 = x(k – 3) = 0,09
Câu 74:
nCu = a/64 = π.R².1,01.10-3.8,96/64 = 0,1 mol
• Lúc t giây: nCu = 0,075; n khí anot = 0,075 —> Chỉ có khí Cl2
• Trong khoảng từ t đến t + 67550 thì ne = 0,5.67550/F = 0,35
nCu = 0,025 —> nH2 = 0,15
n khí anot = 0,375 – 0,075 – 0,15 = 0,15 < ne/2 nên đã có O2
nCl2 = u; nO2 = v —> u + v = 0,15
Trang 7/4 – Mã đề 064
và 2u + 4v = 0,35
—> u = 0,125; v = 0,025
nCl2 tổng = 0,075 + 0,125 = 0,2
• Lúc 2t giây ne = 0,075.2.2 = 0,3 —> Cl2 chưa thoát ra hết.
Anot: nCl2 = 0,3/2 = 0,15
Catot: nCu = 0,1 —> nH2 = 0,05
—> n khí tổng = 0,15 + 0,05 = 0,2 —> V = 4,48 lít
Câu 75:
Đặt a, b, c lần lượt là số mol CH2=CH-COOH, CH3COOH và CH2=CH-CHO.
nX = a + b + c = 0,06
nBr2 = a + 2c = 0,06
nNaOH = a + b = 0,045
—> a = 0,03; b = 0,015; c = 0,015
—> mCH2=CHCOOH = 72a = 2,16 gam
Câu 76:
(a) Đúng
(b) Sai, lớp chất lỏng nặng hơn có H2O, CH3COOH, ancol isoamylic. Este nhẹ hơn nổi ở trên.
(c) Đúng, quan sát nhiệt kế và điều chỉnh ngọn lửa cho phù hợp.
(d) Đúng, khi mở khóa phễu, chất lỏng nặng hơn chảy xuống, sau khi bỏ đi một ít ở phần tiếp giáp 2 lớp chất lỏng, phần còn lại là chất lỏng nhẹ hơn.
(e) Đúng
(f) Sai, H2O làm cân bằng chuyển dịch theo chiều este bị thủy phân, vậy nên cần hạn chế tối đa sự có mặt của H2O.
(g) Đúng
Câu 77:
Với NaOH:
nE = nX + nY = 0,12
nNaOH = 2nX + 3nY = 0,285
—> nX = 0,075 và nY = 0,045
—> nX : nY = 5 : 3
X là CnH2n-2O4: 5a mol
Y là CmH2m-10O6: 3a mol
—> 5a(14n + 62) + 3a(14m + 86) = 17,02 (1)
nCO2 = 5na + 3ma = 0,81 (2)
(1) – (2).14 —> a = 0,01
Trang 8/4 –
064
(2) —> 5n + 3m = 81
Do n ≥ 6 và m ≥ 12 và m lấy các giá trị 12, 15, 18… nên n = 9 và m = 12 là nghiệm duy nhất.
Sản phẩm xà phòng hóa gồm 3 muối T1, T2, T3; MT1 < MT2 < MT3 và T3 nhiều hơn T1 là 2 nguyên tử cacbon nên cấu tạo các este là:
X là CH3COO-C3H6-OOC-C3H7 (0,05 mol)
Y là (CH2=CH-COO)3C3H5 (0,03 mol)
(Thủy phân 0,08 mol E hay 0,12 mol E thì %muối có giá trị không đổi)
Các muối gồm:
T1 là CH3COONa (0,05)
T2 là CH2=CH-COONa (0,09)
T3 là C3H7COONa (0,05) —> %T3 = 30,45%
Câu 78:
Z gồm NO (0,1) và H2 (0,225)
Ban đầu đặt mX = m —> nO = 29,68%m/16
Do chỉ thu được muối clorua nên bảo toàn O:
nH2O = 29,68%m/16 – 0,1
Bảo toàn khối lượng:
m + 2,305.36,5 = 115,7875 + 0,325.2.69/13 + 18(29,68%m/16 – 0,1)
—> m = 50
Vậy nO = 0,9275 và nH2O = 0,8275
Bảo toàn H —> nNH4 + = 0,05
Bảo toàn N —> nFe(NO3)2 = 0,075
Đặt a, b, c là số mol Mg, MgO, Fe3O4 trong X
—> nO = b + 4c + 0,075.6 = 0,9275
mX = 24a + 40b + 232c + 180.0,075 = 50
mT = 40(a + b) + 160(3c + 0,075)/2 = 51,1
—> a = 0,5; b = 0,1775; c = 0,075
—> %Fe3O4 = 34,8%
Câu 79:
Đặt a, b, c là số mol M2CO3, MHCO3 và MCl
Trong Y: nMCl = 2a + b + c = nAgCl = 0,7 (1)
nCO2 = a + b = 0,4 (2)
mX = a(2M + 60) + b(M + 61) + c(M + 35,5) = 32,65
⇔ M(2a + b + c) + 60(a + b) + b + 35,5c = 32,65
Thay (1)(2) vào —> 0,7M + b + 35,5c = 8,65
—> 0,7M < 8,65
—> M < 12,36
—> M = 7: M là Li
Câu 80:
X là C2H5NH3NO3 hoặc (CH3)2NH2NO3
—> Y chứa NaNO3 (0,1) và NaOH dư (0,1)
—> m rắn = 12,5 gam
Trang 9/4 – Mã đề 064
Trang 10/4 – Mã đề 064
SỞ GIÁO DỤC ĐÀO TẠO QUẢNG TRỊ THPT VĨNH LINH (Đề thi có 04 trang) (40 câu trắc nghiệm)
ĐỀ THI THỬ TỐT NGHIỆP THPT LẦN 1
NĂM HỌC 2022-2023
Môn: HOÁ HỌC
Thời gian: 50 phút (không tính thời gian phát đề)
Mã đề 051
Cho nguyên tử khối: H = 1; C = 12; N = 14; O = 16; Na = 23; Mg = 24; Al = 27; P = 31; S = 32; Cl = 35,5; Br = 80; K = 39; Ca = 40; Fe = 56; Cu = 64; Zn = 65; Ag = 108; I = 127; Ba = 137.
Câu 1: Chất nào sau đây làm mất màu dung dịch nước brom?
A C2H5OH. B CH3COOH. C C2H4 D CH4
Câu 2: Kim loại nào sau đây được bảo quản bằng cách ngâm trong dầu hỏa?
A. Au. B. Ag. C. Na. D. Hg.
Câu 3: Chất nào sau đây có tính bazơ?
A glucozơ B axit axetic. C metylamin. D ancol etylic.
Câu 4: Dầu ca cao có hàm lượng gốc axit béo no (stearat và panmitat) đến 75% còn lại là gốc axit béo
không no. Công thức của axit stearic là
A. C15H31COOH. B. C3H5(OH)3. C. C2H3COOH. D. C17H35COOH.
Câu 5: Kim loại Na tác dụng với H2O tạo ra H2 và chất nào sau đây?
A NaHCO3 B Na2O2 C Na2O. D NaOH.
Câu 6: Sắt trong hợp chất nào sau đây vừa có tính oxi hóa và tính khử?
A. Fe2(SO4)3. B. Fe(OH)3. C. Fe2O3. D. FeO.
Câu 7: X là kim loại dẫn điện tốt nhất. Người ta có thể chia X ở kích thước nhỏ (nanomet). Ion X+ có khả năng diệt khuẩn rất lớn. X là
A Cr. B Au. C Ag. D Cu.
Câu 8: Kim loại Al tan trong dung dịch nào sau đây?
A. HNO3 đặc nguội. B. H2SO4 đặc nguội. C. NaCl. D. NaOH.
Câu 9: Nước rửa tay khô (dùng để phòng chống COVID-19) có chứa glixrerol và một số chất khác. Số
nhóm hidroxyl (OH) trong phân tử Glixerol là
A 3. B 4. C 2. D 1.
Câu 10: Số oxi hóa của Fe trong muối Fe(NO3)3 là
A. +4. B. 3+. C. +2. D. +3.
Câu 11: Trong dung dịch ion nào sau đây oxi hóa được kim loại Fe?
A Na+ B K+ C Mg2+ D Fe3+
Câu 12: Chất nào sau đây là chất không điện li?
A. NaOH. B. NaCl. C. CH3COOH. D. C2H5OH.
Câu 13: Khi sản xuất nhôm bằng cách điện phân nóng chảy Al2O3, người ta trộn nó với criolit. Hỗn hợp
này có nhiệt độ nóng chảy thấp hơn nhiều so với Al2O3. Công thức hóa học của criolit là
A Al2O3.2H2O. B CaF2
C Na3AlF6 D KAl(SO4)2.12H2O.
Câu 14: Số nguyên tử H trong phân tử glyxin là
A 7. B 3. C 9. D 5.
Câu 15: Kim loại nào sau đây thuộc nhóm IIA trong bảng tuần hoàn?
A. Na. B. Al. C. Fe. D. Mg.
Trang 1/4 – Mã đề 051
Câu 16: Khí sunfurơ không màu, mùi hắc, là một trong những chất gây ô nhiễm môi trường, là nguyên nhân chính gây mưa axit. Công thức hóa học của khí sunfurơ là
A. SO3. B. SO2. C. CO2. D. H2S.
Câu 17: Kim loại nào sau đây điều chế bằng phương pháp thủy luyện?
A Mg. B Ca. C Ag. D Na.
Câu 18: Trong phân tử nào sau đây có 1 liên kết C=C và một nhóm COO?
A. Metyl fomat. B. Etyl axetat. C. Etyl fomat. D. Vinyl axetat.
Câu 19: Canxi hidrocacbonat dễ bị phân hủy thành canxi cacbonat, hơi nước và khí cacbonic (là cơ sở giải
thích sự tạo thành thạch nhũ trong hang động núi đá vôi). Công thức của canxi cacbonat là
A CaCO3 B CaSO4 C CaSO3 D Ca(HCO3)2
Câu 20: Polime nào sau đây thành phần chính có chứa nguyên tố C, H và N.
A. Poli(metyl metacylat). B. Poliacrilonitrin.
C Polietilen. D Poli(vinyl clorua).
Câu 21: Cho các polime sau: poli(vinyl clorua), poli(metyl metacrylat), poli(hexametylenađipamit), poliacrilonitrin, polibutađien. Số polime điều chế từ phản ứng trùng hợp là
A 3. B 2. C 4. D 5.
Câu 22: Để khử hoàn toàn 6,96 gam Fe3O4 thành Fe cần V lit khí CO ở nhiệt độ cao. Giá trị của V quy về
điều kiện tiêu chuẩn là
A 2,688. B 1,568. C 1,344. D 2,216.
Câu 23: Cho 200 ml dung dịch glucozơ 1M tác dụng với lượng dư dung dịch AgNO3 trong NH3, đun nóng nhẹ, thu được m gam Ag. Biết phản ứng xảy ra hoàn toàn. Giá trị m là
A. 10,8. B. 21,6. C. 32,4. D. 43,2.
Câu 24: Cho 8,4 gam hỗn hợp X gồm Fe và CaO tác dụng vừa đủ với V ml dung dịch HCl 0,5M. Giá trị
của V là
A 150. B 300. C 200. D 600.
Câu 25: Phát biểu nào sau đây đúng?
A. Trong phản ứng tráng bạc, glucozơ đóng vai trò là chất oxi hóa.
B. Saccarozơ thủy phân trong môi trường axit tạo ra một loại mono saccarit.
C Glucozơ và Fructozơ bị khử bởi H2 tạo ra sobitol.
D Tinh bột và xenlulozơ dễ tan trong nước.
Câu 26: Phản ứng nào sau đây chứng tỏ FeO là một oxit bazơ?
A. 3FeO + 10HNO3 → 3Fe(NO3)3 + NO + 5H2O.
B FeO + H2 (t°) → Fe + H2O.
C FeO + CO (t°) → Fe + CO2
D. FeO + 2HCl → FeCl2 + H2O.
Câu 27: Trung hòa m gam axit glutamic cần 300 ml dung dịch NaOH 0,1M. Giá trị m là A 4,410. B 2,205. C 2,190. D 2,312.
Câu 28: Este E có công thức phân tử C4H8O2. Thủy phân E trong dung dịch NaOH dư, thu được sản phẩm gồm ancol metylic và muối M. Công thức phân tử của M là
A. C3H7O2Na. B. C3H5O2Na. C. C2H3O2Na. D. C2H5O2Na.
Câu 29: Cho a gam hỗn hợp A gồm Fe2O3, Fe3O4 và Cu vào dung dịch HCl dư, thấy có 0,7 mol axit phản ứng và còn lại 0,35a gam chất rắn không tan. Mặt khác, khử hoàn toàn a gam hỗn hợp A bằng H2 dư, thu
được 34,4 gam chất rắn. Phần trăm khối lượng Cu trong hỗn hợp A gần nhất với giá trị nào sau đây?
A 34,5%. B 45,3%. C 25,5%. D 50,8%.
Câu 30: Tiến hành thí nghiệm theo các bước sau:
Trang 2/4 –
Bước 1: Trộn 1 gam bột CH3COONa và 2 gam vôi tôi xút (CaO + NaOH) rồi cho vào ống nghiệm khô có
lắp ống dẫn khí.
Bước 2: Đun nóng ống nghiệm bằng đèn cồn.
Bước 3: Lắp ống thủy tinh vuốt nhọn vào đầu ống dẫn khí rồi đốt.
Bước 4: Dẫn khí sinh ra vào dung dịch nước brom.
Cho các phát biểu sau:
(a) Thí nghiệm trên sinh ra chất khí là một hidrocacbon đơn giản nhất.
(b) CaO đóng vai trò là chất xúc tác cho phản ứng.
(c) Ở bước 3, ngọn lửa cháy có màu vàng nhạt.
(d) Ở bước 4, dung dịch nước brom mất màu.
Số phát biểu đúng là
A 1. B 4. C 2. D 3.
Câu 31: Cho các phát biểu sau:
(a) Các monome dùng để tổng hợp tơ nilon-6,6 đều có 6 nguyên tử C.
(b) Dung dịch các amino axit đều làm quì tím hóa hồng.
(c) Ở điều kiện thích hợp, triolein tham gia phản ứng cộng H2
(d) Metylamin có lực bazơ mạnh hơn anilin.
(e) Thủy phân hoàn toàn 1 mol Gly-Ala-Glu cần 3 mol NaOH.
Số phát biểu đúng là
A 2. B 3. C 4. D 5.
Câu 32: Cho các phát biểu sau:
(a) Trong công nghiệp đạm urê được điều chế từ NH3 và CO2.
(b) Khi điện phân dung dịch (điện cực trơ) chứa AgNO3 và Cu(NO3)2 thì Ag bám vào catot trước.
(c) Đun nóng nước cứng tạm thời sẽ có xuất hiện kết tủa.
(d) Các đồ vật bằng nhôm được bảo vệ bởi lớp màng Al2O3 mỏng, bền.
Số phát biểu đúng là A. 3. B. 2. C. 1. D. 4.
Câu 33: Cho sơ đồ chuyển hóa:
Z X NaOH Y Z
Biết: X, Y, Z, E, F là các hợp chất khác nhau, mỗi mũi tên ứng với một phương trình hóa học khác nhau
của phản ứng xảy ra giữa hai chất tương ứng. Các chất E, F thỏa mãn sơ đồ trên lần lượt là
A NaHCO3, BaCl2 B P2O5, KCl. C NaHCO3, HCl. D H3PO4, Ca(OH)2
Câu 34: Nhiệt phân hoàn toàn hỗn hợp X gồm NaNO3, Al(NO3)3, Cu(NO3)2, thu được 10 gam chất rắn Y và hỗn hợp khí Z. Hấp thụ khí Z vào 112,5 gam H2O được dung dịch axit có nồng độ 12,5% và có 0,56 lít một khí (đktc) duy nhất thoát ra. Phần trăm khối lượng của NaNO3 trong hỗn hợp X là
A. 25,15%. B. 18,09%. C. 17,49%. D. 22,25%.
Câu 35: Cho 20 gam hỗn hợp X gồm Fe, FeCO3, Fe2O3 vào ống sứ nung nóng và dẫn từ từ 0,2 mol hỗn hợp khí Y gồm CO và H2 (tỉ khối so với H2 bằng 4,25) qua ống sứ, sau một thời gian thu được hỗn hợp rắn X1 và khí Y1. Cho khí Y1 hấp thụ vào dung dịch Ca(OH)2 dư, thu được 7 gam kết tủa và 0,06 mol khí Y2 (tỉ khối so với H2 bằng 7,5). Hoà tan X1 bằng dung dịch HNO3 (đặc, nóng, dư), thu được dung dịch Z và 0,62 mol hỗn hợp 2 khí, trong đó có một khí màu nâu đỏ là sản phẩm khử duy nhất của N+5. Nếu cho X tác dụng với dung dịch H2SO4 (đặc, nóng, dư) thì thu được 0,225 mol hỗn hợp 2 khí. Phần trăm khối lượng của Fe2O3 trong X là
A 20%. B 40%. C 30%. D 25%.
Trang 3/4 – Mã đề 051
Câu 36: X là este no, đơn chức; Y là este no, hai chức; Z là este không no, ba chức chứa một liên kết C=C
(X, Y, Z đều mạch hở). Đun nóng 24,08 gam hỗn hợp E chứa X, Y, Z với dung dịch NaOH vừa đủ, thu
được hỗn hợp chứa hai muối của hai axit cacboxylic đều đơn chức và hỗn hợp T gồm ba ancol no có cùng
số nguyên tử C, phân tử khối nhỏ hơn 100 (đvC). Dẫn T qua bình đựng Na dư, thấy khối lượng bình tăng
11,68 gam. Đốt cháy hoàn toàn hỗn hợp muối, thu được CO2, 0,42 mol H2O và 0,14 mol Na2CO3. Phần trăm khối lượng của Y có trong hỗn hợp E là
A. 33,22%. B. 53,51%. C. 25,36%. D. 46,13%.
Câu 37: Nung nóng a mol hỗn hợp X gồm propen, axetilen và hidro với xúc tác Ni trong bình kín (giả sử chỉ xảy ra phản ứng cộng H2) thu được hỗn hợp khí Y có tỉ khối so với O2 là 1,0875. Đốt cháy hết Y, thu được 0,024 mol CO2 và 0,03 mol H2O. Biết các phản ứng xảy ra hoàn toàn. Thành phần phần trăm về thể tích propen trong X là
A 27,27%. B 22,00%. C 18,18%. D 30,33%.
Câu 38: Điện phân (với điện cực trơ, màng ngăn xốp) dung dịch X chứa CuSO4 và NaCl (có tỉ lệ mol tương ứng 3 : 2) bằng dòng điện một chiều có cường độ 5 A, sau thời gian t giờ thu được dung dịch Y chứa hai chất tan và thấy khối lượng dung dịch Y giảm 33,1 gam so với khối lượng của dung dịch X. Dung dịch Y hòa tan tối đa 3,6 gam Al. Giả sử khí sinh ra trong quá trình điện phân thoát hết ra khỏi dung dịch. Giá trị của t gần nhất với giá trị nào sau đây?
A. 4,27. B. 5,42. C. 5,36. D. 4,25.
Câu 39: Hỗn hợp X gồm glyxin alanin, valin và axit glutamic. Hỗn hợp Y gồm tristearin và tripanmitin.
Đốt cháy hoàn toàn 0,3 mol hỗn hợp X gồm a gam X và b gam Y cần dùng 3,885 mol O2, sản phẩm cháy gồm N2, CO2 và 51,3 gam H2O. Đun nóng b gam Y với dung dịch KOH dư, thu được m gam glixerol. Giá trị của m là A 9,2. B 12,88. C 11,04. D 7,36.
Câu 40: Cho sơ đồ phản ứng theo đúng tỉ lệ mol, các kí hiệu đều là hợp chất hữu cơ
X + 3NaOH → X1 + X2 + X3 + X4
X1 + HCl → A1 + NaCl.
X2 + 2HCl → A2 + 2NaCl.
X4 + CuO → A3 + Cu + H2O
Biết X mạch hở, có công thức phân tử C8H12O6. Mỗi kí hiệu là một chất hữu cơ khác nhau.Trong thành
phần của X1 cũng như X2 thì số mol Na bằng số mol C. Phân tử khối của X1 nhỏ hơn của X2. X4 sinh ra từ quá trình lên men rượu glucozơ. Cho các phát biểu sau:
(a) Phân tử khối của X3 là 76.
(b) Từ X4 có thể điều chế trực tiếp axit axetic.
(c) Chất A1 có nhiệt độ sôi cao hơn X4.
(d) Đốt cháy hoàn toàn 1 mol X2 thu được 2 mol CO2.
(e) X3 là hợp chất hữu cơ tạp chức. Số phát biểu đúng là A. 2. B. 4. C. 5. D. 3.
Trang 4/4 – Mã đề 051
Câu 21:
ÁP ÁN VÀ GIẢI CHI TIẾT
Các polime điều chế từ phản ứng trùng hợp là: poli(vinyl clorua), poli(metyl metacrylat), poliacrilonitrin, polibutađien.
Câu 22:
Fe3O4 + 4CO —> 3Fe + 4CO2
nFe3O4 = 0,03 —> nCO = 0,12 —> V = 2,688 lít
Câu 23:
nC6H12O6 = 0,2 —> nAg = 0,4 —> mAg = 43,2 gam
Câu 24:
Fe + 2HCl —> FeCl2 + H2
CaO + 2HCl —> CaCl2 + H2O
nX = 8,4/56 = 0,15 —> nHCl = 0,3 —> Vdd = 600 ml
Câu 25:
A. Sai, trong phản ứng tráng bạc, glucozơ đóng vai trò là chất khử: glucozơ khử Ag+ thành Ag.
B. Sai, saccarozơ thủy phân trong môi trường axit tạo ra glucozơ và saccarozơ.
C. Đúng
D. Sai, tinh bột và xenlulozơ đều không tan trong nước. Trong nước nóng tinh bột tan được một phần.
Câu 26:
Phản ứng D FeO đóng vai trò là oxit bazơ, các phản ứng còn lại FeO đóng vai trò chất khử hoặc chất oxi hóa.
Câu 27:
H2NC3H5(COOH)2 + 2NaOH —> H2NC3H5(COONa)2 + 2H2O
nNaOH = 0,03 —> nGlu = 0,015 —> mGlu = 2,205 gam
Câu 28:
C2H5COOCH3 + NaOH —> C2H5COONa + CH3OH
Muối M là C2H5COONa hay C3H5O2Na.
Câu 29:
nHCl = 0,7 —> nH2O = 0,35 —> nO = 0,35
Đặt x, y là số mol Fe và Cu trong A
—> 56x + 64y = 34,4 (1)
và mA = a = 34,4 + mO = 40
—> mCu dư = 0,35a = 14
—> nCu pư = y – 0,21875
B
ảo toàn điện tích cho dung dịch muối:
2x + 2(y – 0,21875) = 0,7 (2)
Giải hệ (1)(2) —> x = 0,25 & y = 0,31875
—> %Cu = 51%
Câu 30:
(a) Đúng: CH3COONa + NaOH —> CH4 + Na2CO3
(b) Đúng
(c) Đúng: CH4 cháy với ngọn lửa vàng nhạt
(d) Sai, CH4 không làm mất màu dung dịch brom.
Câu 31:
(a) Đúng, các monome là HOOC-(CH2)4-COOH và H2N-(CH2)6-NH2 đều có 6C
(b) Sai, tùy tương quan số lượng nhóm NH2 và COOH mà dung dịch amino axit có môi trường kiềm, trung tính hoặc axit.
(c) Đúng, triolein là chất béo không no, có 3C=C nên tham gia phản ứng cộng H2
(d) Đúng, gốc no -CH3 làm tăng tính bazơ, gốc thơm -C6H5 làm giảm tính bazơ
(e) Sai: Gly-Ala-Glu + 4NaOH —> GlyNa + AlaNa + GluNa2 + 2H2O
Câu 32:
(a) Đúng, NH3 + CO2 —> (NH2)2CO + H2O
(b) Đúng, Ag+ có tính oxi hóa mạnh hơn Cu2+ nên Ag+ bị điện phân tạo Ag trước.
(c) Đúng: M(HCO3)2 —> MCO3 + CO2 + H2O
(d) Đúng
Câu 33:
Loại A, C do NaOH + NaHCO3 chỉ có 1 phản ứng với mọi tỉ lệ
Loại B do KCl không phản ứng được với X, Y.
Chọn D: E là H3PO4, X và Y là 2 trong 3 chất Na3PO4, Na2HPO4, NaH2PO4
Z là Ca3(PO4)2.
Câu 34:
4NO2 + O2 + 2H2O —> 4HNO3
4x………..x……………………4x
mHNO3 = 63.4x = 12,5%(112,5 + 46.4x + 32x)
—> x = 0,0625
Khí thoát ra là O2 dư (0,025)
—> mX = mY + mZ = 24,3
nNaNO3 = 2nO2 dư = 0,05 —> %NaNO3 = 17,49%
Câu 35:
Đặt a, b, c là số mol Fe, FeCO3, Fe2O3 trong X
—> mX = 56a + 116b + 160c = 20 (1)
X với H2SO4:
nSO2 + nCO2 = (3a + b)/2 + b = 0,225 (2)
Khí Y chứa nCO = 0,05 & nH2 = 0,15
Khí Y2 chứa nCO = nH2 = 0,03
—> nCO pư = 0,02 & nH2 pư = 0,12
X1 với HNO3 thu được NO2 & CO2
Bảo toàn electron:
nNO2 = 3a + b + 0,02.2 + 0,12.2 = 3a + b + 0,28
Bảo toàn C:
nCO2 = b + 0,02 – 0,07 = b – 0,05
—> nNO2 + nCO2 = (3a + b + 0,28) + (b – 0,05) = 0,62 (3)
(1)(2)(3) —> a = 0,09; b = 0,06; c = 0,05
—> %Fe2O3 = 40%
Câu 36:
Các muối đều đơn chức nên các este đa chức tạo bởi ancol đa chức.
T gồm ba ancol no có cùng số nguyên tử C, phân tử khối nhỏ hơn 100 (đvC) là C3H7OH, C3H6(OH)2 và
C3H5(OH)3
nNaOH = 2nNa2CO3 = 0,28
—> mT = m tăng + mH2 = 11,68 + 2.0,28/2 = 11,96
Trang 7/4 – Mã đề 051
Bảo toàn khối lượng —> m muối = 23,32
Quy đổi muối thành HCOONa (a), C2H3COONa (b) và CH2 (c)
nNaOH = a + b = 0,28
nH2O = 0,5a + 1,5b + c = 0,42
m muối = 68a + 94b + 14c = 23,32
—> a = 0,25; b = 0,03; c = 0,25
Muối gồm CH3COONa (0,25) và C2H3COONa (0,03)
—> nC3H5(OH)3 = 0,03
Đặt x, y là số mol C3H7OH, C3H6(OH)2
—> nNaOH = x + 2y + 0,03.3 = 0,28
mAncol = 60x + 76y + 0,03.92 = 11,96
—> x = 0,09; y = 0,05
X là CH3COOC3H7: 0,09
Y là (CH3COO)2C3H6: 0,05 —> %Y = 33,22%
Z là (CH3COO)2(C2H3COO)C3H5: 0,03
Câu 37:
mX = mY = mC + mH = 0,348
—> nY = 0,348/(1,0875.32) = 0,01
Dễ thấy nH2O – nCO2 < nY nên Y không còn H2 dư
Đặt x, y, z là số mol C3H6, C2H2 và H2 trong X
nCO2 = 3x + 2y = 0,024
nH2O = 3x + y + z = 0,03
nY = x + y = 0,01
—> x = 0,004; y = 0,006; z = 0,012
—> %VC3H6 = 18,18%
Câu 38:
Đặt nCuSO4 = 3x và nNaCl = 2x
Y chứa hai chất tan gồm SO4 2- (3x), Na+ (2x) —> H+ (4x)
Bảo toàn electron —> nH+ = 3nAl —> 4x = 3.3,6/27
—> x = 0,1
Catot: nCu = 0,3 và nH2 = a
Anot: nCl2 = 0,1 và nO2 = b
Bảo toàn electron: 0,3.2 + 2a = 4b + 0,1.2
m giảm = 0,3.64 + 2a + 32b + 0,1.71 = 33,1
—> a = b = 0,2
Trang 8/4 – Mã
051
—> ne = 0,3.2 + 2a = It/F
—> t = 19300s = 5,36h
Câu 39:
Quy đổi E thành H2 (0,3), CO2, CH2 (x), NH (y)
nO2 = 0,3.0,5 + 1,5x + 0,25y = 3,885
nH2O = 0,3 + x + 0,5y = 2,85
—> x = 2,46; y = 0,18
nX = nNH = 0,18 —> nY = nE – nX = 0,12
—> nC3H5(OH)3 = 0,12 —> m = 11,04
Câu 40:
X4 sinh ra từ quá trình lên men rượu glucozơ —> X4 là C2H5OH
—> A3 là CH3CHO
Trong thành phần của X1 cũng như X2 thì số mol Na bằng số mol C và MX1 < MX2 —> X1 là HCOONa
và X2 là (COONa)2.
—> A1 là HCOOH; A2 là (COOH)2
X là:
HCOO-CH2-CH2-CH2-OOC-COO-C2H5
HCOO-CH2-CH(CH3)-OOC-COO-C2H5
HCOO-CH(CH3)-CH2-OOC-COO-C2H5
X3 là C3H6(OH)2.
(a) Đúng
(b) Đúng: C2H5OH + O2 —> CH3COOH + H2O
(c) Đúng, MA1 = MX4 nhưng A1 có liên kết H liên phân tử bền hơn X4 nên A1 có nhiệt độ sôi cao hơn X4
(d) Sai, đốt 1 mol X2 thu 1 mol CO2:
(COONa)2 + 0,5O2 —> Na2CO3 + CO2
(e) Sai, X3 là chất đa chức.
Trang 9/4 – Mã đề 051
SỞ GIÁO DỤC ĐÀO TẠO KHÁNH HÒA THPT NGÔ GIA TỰ (Đề thi có 04 trang) (40 câu trắc nghiệm)
ĐỀ THI THỬ TỐT NGHIỆP THPT LẦN 2
NĂM HỌC 2022-2023
Môn: HOÁ HỌC
Thời gian: 50 phút (không tính thời gian phát đề)
Mã đề 052
Cho nguyên tử khối: H = 1; C = 12; N = 14; O = 16; Na = 23; Mg = 24; Al = 27; P = 31; S = 32; Cl = 35,5; Br = 80; K = 39; Ca = 40; Fe = 56; Cu = 64; Zn = 65; Ag = 108; I = 127; Ba = 137.
Câu 41: Đốt cháy hoàn toàn m gam amin X (no, đơn chức, mạch hở) thu được H2O, 8,96 lít CO2 (đktc) và 1,12 lít khí N2 (đktc). Cho m gam X tác dụng hết với dung dịch HCl dư, thu được dung dịch chứa a gam muối. Giá trị của a là
A 9,55. B 8,15. C 10,95. D 7,30.
Câu 42: Chất nào sau đây làm mất màu dung dịch Br2?
A. Valin. B. Glyxin. C. Anilin. D. Metylamin.
Câu 43: Chất nào sau đây có phản ứng màu biure?
A Lipit. B Amin.
C Cacbohidrat. D Anbumin (lòng trắng trúng).
Câu 44: Kim loại nào sau đây có nhiệt độ nóng chảy cao nhất?
A Na. B K. C Cu. D W.
Câu 45: Cho từ từ đến dư kim loại X vào dung dịch FeCl3, sau khi phản ứng xảy ra hoàn toàn thu được dung dịch Y chứa hai muối. X là kim loại nào sau đây?
A Mg. B Zn. C Cu. D Na.
Câu 46: Phát biểu nào sau đây không đúng?
A Chất béo là trieste của axit béo với glixerol.
B Chất béo nhẹ hơn nước, không tan trong nước.
C Thủy phân chất béo trong môi trường axit gọi là phản ứng xà phòng hóa.
D. Tripanmitin là chất béo rắn.
Câu 47: Để bảo vệ kim loại kiềm, người ta ngâm chúng chìm trong chất nào sau đây?.
A Nước. B Phenol. C Ancol etylic. D Dầu hỏa.
Câu 48: Thủy phân hoàn toàn cacbohiđrat X thu được dung dịch chứa hai loại monosaccarit khác nhau. Chất X có thể là
A. Glucozơ. B. Saccarozơ. C. Xenlulozơ. D. Tinh bột.
Câu 49: Kim loại nào sau đây là kim loại kiềm thổ?
A Na. B Ca. C Al. D K.
Câu 50: Kim loại nào sau đây tác dụng được với dung dịch H2SO4 loãng sinh ra khí H2?
A. Au. B. Zn. C. Ag. D. Cu.
Câu 51: Chất nào sau đây không phải là axit béo?
A Axit oleic. B Axit panmitic. C Axit stearic. D Axit propionic.
Câu 52: Kim loại nào sau đây được điều chế bằng phương pháp điện phân nóng chảy
A. Ag. B. Cu. C. Fe. D. Al.
Câu 53: Phân tử polime nào sau đây có chứa nitơ?
A Polietilen. B Poli(vinyl clorua).
C. Poli(metyl metacrylat). D. Poliacrilonitrin.
Câu 54: Chất nào dưới đây không tác dụng với HCl trong dung dịch?
A. C6H5NH2. B. CH3NH2. C. (CH3NH3)2SO4. D. Anilin.
Câu 55: Dung dịch chất nào sau đây làm quỳ tím chuyển sang màu đỏ?
A Glyxin. B Metylamin. C Axit glutamic. D CH3NHCH3
Câu 56: Cho các este sau: etyl acrylat, etyl axetat, propyl axetat, metyl propionat, metyl metacrylat. Có bao nhiêu este tham gia phản ứng trùng hợp tạo thành polime?
A. 3. B. 2. C. 1. D. 4.
Câu 57: Cho một lượng dung dịch HCl vào dung dịch chứa glyxin, sau đó thêm lượng dư dung dịch NaOH. Chất hữu cơ trong dung dịch thu được là
A ClNH3-CH2-COONa. B NH2-CH2-COONa.
C. NH2-CH2-COOH. D. ClNH3-CH2-COOH.
Câu 58: Thủy phân 34,2 gam saccarozơ với hiệu suất a%, thu được hỗn hợp X. Cho toàn bộ X tác dụng với lượng dư dung dịch AgNO3 trong NH3, đun nóng, sau khi các phản ứng xảy ra hoàn toàn, thu được 34,56 gam Ag. Giá trị của a là
A 60%. B 75%. C 80%. D 81%.
Câu 59: Nguyên tắc điều chế kim loại là
A. Oxi hóa ion kim loại thành nguyên tử. B. Oxi hóa nguyên tử kim loại thành ion.
C. Khử ion kim loại thành nguyên tử. D. Khử nguyên tử kim loại thành ion.
Câu 60: Chất nào sau đây có phản ứng tráng bạc?
A C2H5COOCH3 B CH3COOH. C HCOOCH3 D CH3COOCH3
Câu 61: Cho m gam hỗn hợp X gồm 3 este đơn chức tác dụng với lượng vừa đủ dung dịch KOH đun nóng, sau phản ứng thu được dung dịch Y. Làm bay hơi Y thu được 85,3 gam hỗn hợp Z gồm 3 muối và phần hơi chứa 26,4 gam hai ancol là đồng đẳng kế tiếp nhau. Đốt cháy hết 85,3 gam hỗn hợp Z trong O2, thu được 0,425 mol K2CO3, 1,625 mol CO2 và 0,975 mol H2O. Phần trăm khối lượng của este có phân tử khối lớn nhất trong X là
A. 22,46%. B. 53,33%. C. 13,33%. D. 32,63%.
Câu 62: Polisaccarit X là chất rắn, ở dạng bột vô định hình, màu trắng và được tạo thành trong cây xanh nhờ quá trình quang hợp. Thủy phân X, thu được monosaccarit Y. Phát biểu nào sau đây không đúng?
A Y tác dụng với H2 tạo sorbitol.
B. X không tan trong nước lạnh, nhưng tan trong nước nóng.
C. X có phản ứng tráng bạc.
D Y làm mất màu dung dịch nước Br2
Câu 63: Chất nào sau đây được dùng để làm mềm nước có tính cứng toàn phần?
A. HCl. B. NaNO3. C. K3PO4. D. NaHCO3.
Câu 64: Cho các phản ứng sau theo đúng tỉ lệ mol:
(1) X (t°) → Y + CO2
(2) Y + H2O → E
(3) E + F → T + X + H2O
(4) E + 2F → G + X + 2H2O
Biết mỗi kí hiệu X, Y, Z, E, F, T, G là một chất vô cơ khác nhau và MX = MF. Công thức của các chất T, G lần lượt là
A NaHCO3 và NaCO3 B NaOH và Na2CO3
C KOH và K2CO3 D KHCO3 và K2CO3
Câu 65: Phát biểu nào sau đây sai?
A. Các aminoaxit có nhiệt độ nóng chảy cao.
B Tất cả các peptit đều phản ứng được với Cu(OH)2 tạo phức chất màu tím đặc trưng.
Trang 1/4 – Mã đề 052
C. Các amin đều có tính bazơ nên đều phản ứng được với dung dịch HCl.
D. Thủy phân hoàn toàn các peptit thì thu được hỗn hợp các α-amino axit.
Câu 66: Đốt cháy hoàn toàn 0,02 mol hỗn hợp X gồm etyl axetat, metyl acrylat, metyl metacrylat và hai hiđrocacbon mạch hở cần vừa đủ 0,06 mol O2, tạo ra CO2 và 0,9 gam H2O. Nếu cho 0,02 mol X vào dung dịch Br2 dư thì số mol Br2 phản ứng tối đa là
A 0,03 mol. B 0,05 mol. C 0,005 mol. D 0,07 mol.
Câu 67: Đốt cháy hoàn toàn 6,84 gam hỗn hợp X gồm fructozơ, saccarozơ, xenlulozơ trong O2 dư, thu được x mol CO2 và 3,96 gam H2O. Dẫn hết x mol CO2 vào dung dịch Ba(OH)2 dư thu được m gam kết tủa. Giá trị của m là
A. 98,50. B. 49,25. C. 39,40. D. 47,28.
Câu 68: Tiến hành điện phân dung dịch CuSO4 và NaCl bằng điện cực trơ, màng ngăn xốp với cường dòng điện không đổi, ta có kết quả ghi theo bảng sau:
Thời gian (s) Khối lượng catot tăng Anot Khối lượng dung dịch giảm
3088 m (gam) Khí Cl2 duy nhất 10,80 (gam)
6176 2m (gam) Khí thoát ra 18,30 (gam)
t 2,5m (gam) Khí thoát ra 22,04 (gam)
Giá trị của t là
A 7720 giây. B 8299 giây. C 8685 giây. D 8878 giây.
Câu 69: Cho các phản ứng sau theo đúng tỉ lệ mol:
(1) C9H22O4N2 (X) + 2NaOH → (Y) + (Z) + (T) + 2(H)
(2) (Y) + 2HCl → (F) + (G);
(3) (E) + HCl → (F)
(4) (E) → Tơ nilon-6 + (H);
(5) (Z) + HCl → (I) + (G)
(6) (I) + (J) → este có mùi chuối chín + (H)
Cho các phát biểu sau:
(1) X có hai công thức cấu tạo.
(2) Dung dịch T làm quỳ tím hóa đỏ.
(3) F có phân tử khối là 167,5.
(4) J có phân tử khối là 60.
(5) Y có 6 nguyên tử cacbon trong phân tử.
(6) T là chất khí ở điều kiện thường.
Số phát biểu đúng là
A 3. B 2. C 5. D 4.
Câu 70: Phát biểu nào sau đây đúng?
A. Đốt sắt trong không khí xảy ra ăn mòn điện hóa học.
B Dùng thùng bằng nhôm để đựng HNO3 đặc, nguội.
C Kim loại K khử được ion Cu2+ trong dung dịch.
D. CO tác dụng với MgO ở nhiệt độ cao tạo Mg.
Câu 71: Dẫn 0,55 mol hỗn hợp X gồm hơi nước và khí cacbonic qua than nung đỏ thu được a mol hỗn hợp
khí Y gồm CO, H2, CO2 (trong Y có b mol CO2). Hấp thụ hết b mol CO2 ở trên bằng dung dịch chứa hỗn h
ợp KOH 0,15M và Na2CO3 0,05M thu được dung dịch Z. Nhỏ từ từ toàn bộ dung dịch Z vào 200 ml dung dịch NaHSO4 0,5M đồng thời khuấy đều, sau khi kết thúc phản ứng thu được 1,568 lít (đktc) khí CO2 và dung dịch T. Thêm dung dịch Ba(OH)2 tới dư vào T thì thu được 78,46 gam kết tủa. Giá trị của a là
Trang 3/4 – Mã đề 052
A. 0,85. B. 0,68. C. 0,75. D. 0,96. Câu 72: Nung nóng hỗn hợp gồm Al và Fe2O3 (trong điều kiện không có không khí), thu được 7,23 gam hỗn hợp X. Nghiền nhỏ, trộn đều và chia X thành hai phần. Cho phần một tác dụng với dung dịch NaOH (dư), thu được 0,336 lít khí H2 (đktc) và 1,12 gam chất rắn không tan. Hòa tan hết phần hai trong 170 ml dung dịch HNO3 2M, thu được 0,672 lít khí NO duy nhất (đktc) và dung dịch Y chỉ chứa m gam hỗn hợp muối. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m là
A 20,65. B 23,45. C 21,84. D 22,64.
Câu 73: Thực hiện các thí nghiệm sau:
(a) Sục khí CO2 đến dư vào nước vôi trong.
(b) Sục khí CO2 đến dư vào dung dịch NaAlO2.
(c) Sục khí NH3 đến dư vào dung dịch AlCl3.
(d) Cho dung dịch Ba(OH)2 đến dư vào dung dịch Al2(SO4)3
(e) Đun sôi nước cứng tạm thời.
(f) Cho dung dịch BaCl2 vào dung dịch KHSO4.
Kết thúc các phản ứng, số thí nghiệm thu được kết tủa là
A 3. B 4. C 6. D 5.
Câu 74: Chất nào sau đây không có tính lưỡng tính?
A. Al(NO3)3. B. Al2O3. C. NaHCO3. D. Al(OH)3.
Câu 75: Cho các loại tơ sau: tơ tằm, sợi bông, len, tơ visco, tơ nilon-6, tơ nilon-6,6, tơ axetat, tơ nitron. Số tơ thuộc loại tơ bán tổng hợp là
A 5. B 2. C 3. D 4.
Câu 76: Cho 0,81 gam Al phản ứng hoàn toàn với khí O2 dư, thu được m gam oxit. Giá trị của m là
A. 3,06. B. 6,12. C. 1,53. D. 2,55.
Câu 77: Hỗn hợp E gồm ba axit béo X, Y, Z và triglixerit T (T được tạo ra từ X, Y, Z và glixerol). Đốt cháy hoàn toàn 52,24 gam E cần dùng vừa đủ 4,72 mol O2. Nếu cho 52,24 gam E vào dung dịch Br2 (trong CCl4) dư thì có 0,2 mol Br2 phản ứng. Mặt khác, hòa tan hết 52,24 gam E trong 600 ml dung dịch NaOH 0,3M (vừa đủ). Cô cạn dung dịch sau phản ứng, thu được m gam muối khan. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m là
A 54,68. B 55,76. C 53,20. D 53,92.
Câu 78: Cho các phát biểu sau:
(a) Dầu thực vật, mỡ động vật không tan trong nước.
(b) Sacarozơ bị hóa đen khi tiếp xúc với dung dịch H2SO4 đặc.
(c) Sự đông tụ của lòng trắng trứng là một tính chất hóa học của protein.
(d) Tất cả các dung dịch amin đều làm quỳ tím hóa xanh.
(e) Ở điều kiện thường, glucozơ và alanin đều là những chất rắn, dễ tan trong nước.
(g) Peptit Ala-Gly-Val hòa tan được Cu(OH)2 trong NaOH tạo thành dung dịch màu tím.
Số phát biểu đúng là
A. 5. B. 2. C. 3. D. 4.
Câu 79: Phát biểu nào sau đây đúng?
A Tơ nilon-6,6 được điều chế bằng phản ứng trùng hợp.
B Sợi bông, tơ tằm đều thuộc loại tơ thiên nhiên.
C. Tơ nitron được điều chế bằng phản ứng trùng ngưng.
D. Cao su lưu hóa có cấu trúc mạch không phân nhánh.
Câu 80: Hòa tan hết 6,85 gam kim loại R (hóa trị II) trong dung dịch HCl dư, thu được 1,12 lít H2 (đktc).
Kim loại R là
A Ba.
B Mg. C Ca. D Fe.
Trang 4/4 – Mã
052
ĐÁP ÁN VÀ GIẢI CHI TIẾT
Câu 56:
Các este tham gia phản ứng trùng hợp tạo thành polime: etyl acrylat (CH2=CHCOOC2H5), metyl metacrylat (CH2=C(CH3)COOCH3)
Câu 57:
H2NCH2COOH + HCl —> ClH3NCH2COOH
ClH3NCH2COOH + 2NaCl —> H2NCH2COONa + NaCl + H2O
H2NCH2COOH + NaOH —> H2NCH2COONa + H2O
Chất hữu cơ trong dung dịch thu được là H2NCH2COONa.
Câu 41:
nN2 = 0,05 —> nX = 0,1
nCO2 = 0,4 —> Số C = nCO2/nX = 4
X là C4H11N, muối là C4H12NCl (0,1) —> a = 10,95 gam
Câu 45:
A. Mg dư + FeCl3 —> MgCl2 + Fe
B. Zn dư + FeCl3 —> ZnCl2 + Fe
C. Cu dư + FeCl3 —> CuCl2 + FeCl2
D. Na + H2O —> NaOH + H2
NaOH + FeCl3 —> Fe(OH)3 + NaCl
Câu 46:
C sai, thủy phân chất béo trong môi trường kiềm mới gọi là phản ứng xà phòng hóa.
Câu 47:
Trong phòng thí nghiệm, kim loại kiềm được bảo quản bằng cách ngâm trong dầu hỏa vì dầu hỏa không tác dụng với kim loại kiềm, không hút ẩm, không hòa tan O2 nên ngăn kim loại kiềm tiếp xúc với môi trường bên ngoài.
Câu 54: (CH3NH3)2SO4 không phản ứng với HCl vì (CH3NH3)2SO4 là muối của axit mạnh (H2SO4), HCl không đẩy ra được.
Các amin còn lại đều tác dụng với HCl tạo muối amoni.
Câu 55:
Dung dịch axit glutamic (H2NC3H5(COOH)2) làm quỳ tím chuyển sang màu đỏ
Còn lại glyxin (H2NCH2COOH) không làm đổi màu quỳ tím; metylamin (CH3NH2) và CH3NHCH3 làm quỳ tím hóa xanh.
Câu 58:
Saccarozơ —> Glucozơ + Fructozơ —> 4Ag
nAg = 0,32 —> nSaccarozơ phản ứng = 0,08
—> a = 0,08.342/34,2 = 80%
Câu 59:
Nguyên tắc điều chế kim loại là khử ion kim loại thành nguyên tử:
Mn+ + ne —> M
Câu 61:
Z chứa -COOK (x) và -OK (y)
—> nKOH = x + y = 2nK2CO3 = 0,85
mZ = 16(2x + y) + 12(0,425 + 1,625) + 0,975.2 + 0,85.39 = 85,3
—> x = 0,75 và y = 0,1
nAncol = x – y = 0,65
—> M ancol = 40,61 —> CH3OH (0,25) và C2H5OH (0,4)
X gồm ACOOCH3 (0,25), BCOOC2H5 (0,4) và RCOOP (0,1) (2 trong 3 gốc A, B, R trùng nhau)
Z gồm ACOOK (0,25), BCOOK (0,4), RCOOK (0,1) và POK (0,1)
mZ = 0,25(A + 83) + 0,4(B + 83) + 0,1(R + 83) + 0,1(P + 55) = 85,3
—> 5A + 8B + 2R + 2P = 351
—> A = 27; B = 1; R = 27; P = 77 là nghiệm duy nhất.
X gồm C2H3COOCH3 (0,25), HCOOC2H5 (0,4) và C2H3COOC6H5 (0,1)
—> %C2H3COOC6H5 = 22,46%
Câu 62:
Polisaccarit X là chất rắn, ở dạng bột vô định hình, màu trắng và được tạo thành trong cây xanh nhờ quá
trình quang hợp —> X là tinh bột (C6H10O5)n
Thủy phân X —> monosaccarit Y là glucozơ (C6H12O6)
Câu 63:
K3PO4 được dùng để làm mềm nước có tính cứng toàn phần vì:
Ca2+ + PO4 3- —> Ca3(PO4)2↓
Mg2+ + PO4 3- —> Mg3(PO4)2↓
Câu 64:
MX = MF và X bị nhiệt phân tạo CO2 nên X, F là các cặp (CaCO3, KHCO3) hoặc (MgCO3, NaHCO3).
Y tan trong nước nên chọn X là CaCO3, F là KHCO3
Y là CaO, E là Ca(OH)2
T là KOH, G là K2CO3
Câu 65:
A. Đúng, các amino axit tồn tại ở dạng ion lưỡng cực nên có tính chất giống hợp chất ion là nhiệt độ nóng chảy cao.
B. Sai, đipeptit không tạo phức chất màu tím đặc trưng.
C, D. Đúng
Câu 66:
X + a mol H2 (tối đa) —> E gồm CxH2xO2 (e mol) và ankan
—> nE = nX = 0,02 —> nAnkan = 0,02 – e
Đốt E cần nO2 = 0,5a + 0,06 và tạo ra nH2O = a + 0,05
nAnkan = nH2O – nCO2
—> nCO2 = nH2O – nAnkan = a + 0,05 – (0,02 – e) = a + e + 0,03
Bảo toàn O: 2e + 2(0,5a + 0,06) = 2(a + e + 0,03) + a + 0,05
—> a = 0,005
—> nBr2 = 0,005
Câu 67:
Quy đổi X thành C và H2O
—> nC = (mX – mH2O)/12 = 0,24
—> nCO2 = 0,24
Ba(OH)2 dư —> nBaCO3 = 0,24 —> mBaCO3 = 47,28
Câu 68:
Trong thời gian 3088 giây:
nCu = nCl2 = x
—> m giảm = 64x + 71x = 10,8 —> x = 0,08
ne = 2x = 3088I/F —> I = 5A
Trong thời gian 6176 giây, tại catot vẫn thoát Cu (0,16 mol), anot thoát ra Cl2 (a mol) và O2 (b mol)
—> m giảm = 0,16.64 + 71a + 32b = 18,3
B
ảo toàn electron: 2a + 4b = 0,16.2
—> a = 0,1 và b = 0,03
Khi thời gian là t giây:
Tại catot: nCu = 2,5x = 0,2; nH2 = y
T
ại catot: nCl2 = 0,1; nO2 = 0,03; nO2 mới = z
m giảm = 64.0,2 + 2y + 0,1.71 + 0,03.32 + 32z = 22,04 (1)
B
ảo toàn electron cho 2 điện cực trong thời gian t – 6176 giây (Catot có 0,5x mol Cu + y mol H2; anot có z mol O2):
2.0,5.0,08 + 2y = 4z (2)
(1)(2) —> y = 0,03 và z = 0,035
Vậy ne tổng ở catot = 0,2.2 + 0,03.2 = It/F
—> t = 8878
Câu 69:
(4) —> E là H2N-(CH2)5-COOH và H là H2O.
(5)(6) —> I là CH3COOH
J là (CH3)2CHCH2CH2OH; G là NaCl; Z là CH3COONa
(3) —> F là ClH3N-(CH2)5-COOH
(2) —> Y là H2N-(CH2)5-COONa
(1) —> X là CH3COOH3N-(CH2)5-COONH3CH3
—> T là CH3NH2
(1) Sai, X có cấu tạo duy nhất.
(2) Sai, dung dịch T làm quỳ tím hóa xanh.
(3) Đúng
(4) Sai, MJ = 88
(5)(6) Đúng
Câu 70:
A. Sai, không có cặp điện cực nên không có ăn mòn điện hóa học.
B. Đúng, do Al bị thụ động trong HNO3 đặc, nguội nên có thể dùng bình bằng Al để đựng HNO3 đặc, nguội.
C. Sai, K khử H2O trước.
D. Sai, CO chỉ khử được oxit kim loại đứng sau Al.
Trang 8/4 – Mã
Câu 71:
nNaHSO4 = 0,1; nCO2 = 0,07
—> nCO2 < nH+ < 2nCO2 —> Z chứa CO3 2- và HCO3 -
Đặt u, v là số mol CO3 2- và HCO3 - đã phản ứng
—> nH+ = 2u + v = 0,1 và nCO2 = u + v = 0,07
—> u = 0,03; v = 0,04
T chứa CO3 2- dư (0,03k) và HCO3 - dư (0,04k)
m↓ = 197(0,03k + 0,04k) + 233.0,1 = 78,46
—> k = 4
Z chứa CO3 2- (0,03 + 0,03k = 0,15); HCO3 - (0,04 + 0,04k = 0,2), bảo toàn điện tích —> nNa+ + nK+ = 0,5
nNa2CO3 = p; nKOH = 3p
—> nNa+ + nK+ = 2p + 3p = 0,5 —> p = 0,1
Bảo toàn C —> nCO2 = b = 0,15 + 0,2 – p = 0,25
nC phản ứng = nY – nX = a – 0,55
Bảo toàn electron: 4nC phản ứng = 2nCO + 2nH2
⇔ 4(a – 0,55) = 2(a – 0,25) —> a = 0,85
Câu 72:
Phần 1: nH2 = 0,015 —> nAl dư = 0,01
Do có Al dư nên chất rắn là Fe (0,02)
2Al + Fe2O3 —> 2Fe + Al2O3 0,02…0,01……….0,02
Quy đổi phần 1 thành Al (0,03), Fe (0,02) và O (0,03)
—> m phần 1 = 2,41 —> m phần 2 = 7,23 – 2,41 = 4,82
Dễ thấy m phần 2 = 2m phần 1 nên phần 2 gồm Al (0,06), Fe (0,04) và O (0,06)
nHNO3 = 0,34; nNO = 0,03
nH+ = 4nNO + 2nO +10nNH4 + —> nNH4 + = 0,01
m muối = mAl + mFe + 62(2nO + 3nNO + 8nNH4 +) + mNH4NO3 = 22,64
Câu 73:
(a) CO2 dư + Ca(OH)2 —> Ca(HCO3)2
(b) CO2 dư + H2O + NaAlO2 —> Al(OH)3 + NaHCO3
(c) NH3 dư + H2O + AlCl3 —> Al(OH)3 + NH4Cl
(d) Ba(OH)2 dư + Al2(SO4)3 —> BaSO4 + Ba(AlO2)2 + H2O
(e) M(HCO3)2 —> MCO3 + CO2 + H2O
(f) BaCl2 + KHSO4 —> BaSO4 + KCl + HCl
Trang 9/4 – Mã đề 052
Câu 75:
Các tơ thuộc loại tơ bán tổng hợp là: tơ visco, t
xenlulozơ
Câu 76:
4Al + 3O2 —> 2Al2O3
nAl = 0,03 —> nAl2O3 = 0,015 —> mAl2O3 = 1,53 gam
Câu 77:
nCO2 = x; nH2O = y; nNaOH = 0,18
Bảo toàn khối lượng: 44x + 18y = 52,24 + 4,72.32
Bảo toàn O: 2x + y = 0,18.2 + 4,72.2
—> x = 3,36; y = 3,08
nT = [nCO2 – (nH2O + nBr2)]/2 = 0,04
nAxit = nNaOH – 3nT = 0,06
—> nC3H5(OH)3 = 0,04 và nH2O = 0,06
Bảo toàn khối lượng:
mE + mNaOH = m muối + mC3H5(OH)3 + mH2O
—> m muối = 54,68
Câu 78:
(a) Đúng, dầu thực vật, mỡ động vật có thành phần chính là chất béo, không tan trong nước.
(b) Đúng, do H2SO4 đặc háo nước mạnh làm saccarozơ mất nước hóa than (C) màu đen:
C12H22O11 —> 12C + 11H2O
(c) Sai, sự đông tụ là tính chất vật lý.
(d) Sai, nhiều amin có tính bazơ rất yếu, không làm đổi màu quỳ tím như anilin.
(e)(g) Đúng
Câu 79:
A. Sai, tơ nilon-6,6 được điều chế bằng phản ứng trùng ngưng HOOC-(CH2)4-COOH và H2N-(CH2)6NH2.
B. Đúng
C. Sai, tơ nitron được điều chế bằng phản ứng trùng hợp CH2=CH-CN.
D. Sai, cao su lưu hóa có cấu trúc mạch không gian.
Câu 80:
R + 2HCl —> RCl2 + H2
nR = nH2 = 0,05 —> MR = 137: R là Ba
SỞ GIÁO DỤC ĐÀO TẠO LẠNG SƠN (Đề thi có 04 trang) (40 câu trắc nghiệm)
ĐỀ THI THỬ TỐT NGHIỆP THPT LẦN 1
NĂM HỌC 2022-2023
Môn: HOÁ HỌC
Thời gian: 50 phút (không tính thời gian phát đề)
Mã đề 053
Cho nguyên tử khối: H = 1; C = 12; N = 14; O = 16; Na = 23; Mg = 24; Al = 27; P = 31; S = 32; Cl = 35,5; Br = 80; K = 39; Ca = 40; Fe = 56; Cu = 64; Zn = 65; Ag = 108; I = 127; Ba = 137.

Câu 41: Hidrocacbon nào sau đây tác dụng với dung dịch AgNO3 trong NH3 tạo thành kết tủa?
A But-1-in. B But-2-in. C Butan. D But-1-en.
Câu 42: Chất nào sau đây thuộc loại polisaccarit?
A. Glucozơ. B. Saccarozơ. C. Amilopectin. D. Fructozơ.
Câu 43: Trong môi trường kiềm, tripeptit tác dụng với Cu(OH)2 cho hợp chất màu
A xanh. B tím. C đỏ D vàng.
Câu 44: Ở điều kiện thường, kim loại có nhiệt độ nóng chảy cao nhất là
A. W. B. Ag. C. Cu. D. Zn.
Câu 45: Kim loại nào sau đây là kim loại kiềm?
A Al. B Na. C Fe. D Ba.
Câu 46: Nung CaCO3 ở nhiệt độ cao, thu được chất khí X. Chất X là
A. CO2. B. H2. C. CaO. D. CO.
Câu 47: Lysin là amino axit thiết yếu giúp trẻ em phát triển chiều cao, được cung cấp chủ yếu từ thực phẩm
như trứng, thịt, đậu nành, pho mát. Số nhóm amino và cacboxyl trong phân tử lysin lần lượt là
A 1 và 2. B 2 và 1. C 1 và 1. D 2 và 2.
Câu 48: Ancol nào sau đây có số nguyên tử cacbon nhiều hơn số nhóm -OH?
A. Glixerol. B. Etylen glicol. C. Ancol metylic. D. Ancol etylic.
Câu 49: Thủy phân este nào sau đây trong dung dịch NaOH thu được natri axetat?
A HCOOCH3 B C2H5COOCH3 C CH3COOCH3 D C2H5COOC2H5
Câu 50: Số nguyên tử cacbon có trong phân tử tripanmitin là
A. 51. B. 15. C. 48. D. 45.
Câu 51: Dung dịch muối X tác dụng với dung dịch NaOH, thu được kết tủa màu xanh. Muối X là
A MgSO4 B Fe2(SO4)3 C Na2SO4 D CuSO4
Câu 52: Tiến hành phản ứng khử oxit X thanh kim loại bằng khí H2 (dư) theo sơ đồ hình vẽ dưới đây:
Câu 53: Tơ nitron dai, bền với nhiệt và giữ nhiệt tốt, nên thường được dùng để dệt vải may quần áo ấm hoặc bện thành sợi "len" đan áo rét. Thành phần nguyên tố có trong tơ nitron là
A. C, H và S. B. C, H và Cl. C. C, H và N. D. C, H và O.
Câu 54: Cho dãy các kim loại: Al, Cu, Fe, Ag. Số kim loại trong dãy phản ứng được với dung dịch H2SO4 loãng là
A 1. B 3. C 4. D 2.
Câu 55: Chất nào sau đây là chất điện li yếu?
A. HNO3. B. CH3COOH. C. NaOH. D. HCl.
Câu 56: Chất nào sau đây không bị thủy phân trong môi trường axit?
A Xenlulozơ B Saccarozơ C Fructozơ D Tinh bột.
Câu 57: Baking soda (thuốc muối, bột nở) là tên gọi hay dùng trong ngành thực phẩm của hợp chất sodium bicarbonate (tiếng Việt là natri hidrocacbonat hay natri bicacbonat). Công thức hóa học của Baking soda là
A. NaHCO3. B. Na2CO3.10H2O. C. NaCl. D. Na2CO3.
Câu 58: Chất nào sau đây là đồng phân của propylamin?
A Trimetylamin. B Đietylamin. C Đimetylamin. D Phenylamin.
Câu 59: Muối nào sau đây tạo kết tủa khi tác dụng với dung dịch NaOH?
A. NaCl. B. Na2SO4. C. CaCl2. D. Ca(HCO3)2.
Câu 60: Nung 6,0 gam hỗn hợp Al và Fe trong không khí, thu được 8,4 gam hỗn hợp X chỉ chứa các oxit.
Hòa tan hoàn toàn X cần vừa đủ V ml dung dịch HCl 1M. Giá trị V là
A 200. B 150. C 300. D 400.
Câu 61: Cho 7,12 gam alanin tác dụng với dung dịch chứa 0,1 mol NaOH. Sau phản ứng xảy ra hoàn toàn, cô cạn dung dịch, khối lượng chất rắn khan thu được là
A. 9,32 gam. B. 11,12 gam. C. 8,88 gam. D. 9,68 gam.
Câu 62: Cho 2,7 gam kim loại Al tác dụng với dung dịch NaOH dư, sau phản ứng hoàn toàn thu được V lít khí H2 (đktc). Giá trị của V là
A 3,36. B 4,48. C 1,12. D 2,24.
Câu 63: Cho dung dịch Ba(OH)2 đến dư lần lượt vào các dung dịch sau: NaHCO3, AlCl3, NaHSO4, NH4Cl, FeCl3, Na2SO4 và Na3PO4. Số trường hợp thu được kết tủa sau khi kết thúc thí nghiệm là
A. 5. B. 4. C. 6. D. 7.
Câu 64: Để xà phòng hoá 2,22 gam một este no, đơn chức, mạch hở X cần dùng 30 ml dung dịch NaOH 1M. Công thức phân tử của X là
A C5H10O2 B C3H6O2 C C4H8O2 D C2H4O2
Câu 65: Tiến hành thí nghiệm theo các bước sau đây:
Bước 1: Lấy 3 ống nghiệm, mỗi ống đựng khoảng 3 ml dung dịch HCl loãng.
Bước 2: Cho 3 mẫu kim loại có kích thước tương đương là Al, Fe, Cu vào 3 ống nghiệm.
Bước 3: Quan sát, so sánh lượng bọt khí hiđro thoát ra ở các ống nghiệm trên.
Phát biểu nào sau đây sai?
A. Ống nghiệm chứa Cu không thoát khí H2 vì Cu không phản ứng với dung dịch HCl.
B Ống nghiệm chứa Al thoát khí mạnh hơn ống nghiệm chứa Fe.
C Ống nghiệm chứa Fe thoát khí mạnh hơn ống nghiệm chứa Al.
D. Khí H2 thoát ra ở 2 ống nghiệm chứa Al và Fe.
Oxit X là
A. CuO.
Trang 1/4 – Mã đề 053
Câu 66: Đốt cháy hoàn toàn m gam hỗn hợp X chứa các triglixerit tạo bởi từ cả 3 axit panmitic, oleic, stearic thu được 48,4 gam CO2 và 18,72 gam H2O. Nếu xà phòng hóa hoàn toàn m gam X bằng dung dịch KOH vừa đủ sẽ thu được a gam muối. Giá trị của a là
A. 16,48. B. 15,04. C. 19,54. D. 18,72.
Câu 67: Thí nghiệm nào sau đây không tạo ra đơn chất?
A. Cho Na vào dung dịch FeCl2. B. Cho bột nhôm vào dung dịch NaOH.
C. Cho bột Cu vào dung dịch AgNO3. D. Cho dung dịch FeCl3 vào dung dịch AgNO3.
Câu 68: Nung nóng hoàn toàn hỗn hợp CaCO3, Ba(HCO3)2, MgCO3, Mg(HCO3)2 đến khối lượng không
đổi, thu được sản phẩm chất rắn gồm
A Ca, BaO, Mg, MgO. B CaO, BaO, MgO.
C. CaO, BaCO3, MgO, MgCO3. D. CaCO3, BaCO3, MgCO3.
Câu 69: Phát biểu nào sau đây đúng
A Poli(etylen terephtalat) được điều chế bằng phản ứng trùng hợp.
B Poli(metyl metacrylat) được điều chế bằng phản ứng trùng hợp.
C Trùng hợp axit adipic với hexametylendiamin thu được nilon-6,6.
D. Trùng hợp axit ε-aminocaproic thu được policaproamit.
Câu 70: Nung nóng hỗn hợp X gồm metan, etilen, propin, vinyl axetilen và a mol H2 có Ni xúc tác (chỉ
xảy ra phản ứng cộng H2) thu được 0,1 mol hỗn hợp Y (gồm các hiđrocacbon) có tỉ khối so với H2 là 17,4.
Biết 0,1 mol Y phản ứng tối đa với 0,04 mol Br2 trong dung dịch. Giá trị của a là
A 0,10. B 0,20. C 0,15. D 0,05.
Câu 71: Đốt cháy hoàn toàn x gam hỗn hợp gồm xenlulozơ, tinh bột, glucozơ và saccarozơ cần V lít O2 (đktc), sản phẩm thu được dẫn qua bình H2SO4 đặc thấy bình tăng y gam. Biết rằng x - y = 2,4. Giá trị của
V là
A. 5,60. B. 6,72. C. 3,36. D. 4,48.
Câu 72: Cho dãy các chất: phenyl axetat, metyl axetat, etyl fomat, tripanmitin, vinyl axetat, metyacrylat. Số chất trong dãy khi thủy phân trong dung dịch NaOH loãng, đun nóng sinh ra ancol là
A 3. B 1. C 2. D 4.
Câu 73: Cho 5,956 gam hỗn hợp chất rắn X gồm Fe, Fe3O4 và Fe(NO3)2 vào dung dịch chứa 0,24 mol HCl và 0,02 mol HNO3, khuấy đều cho các phản ứng xảy ra hoàn toàn, thu được dung dịch Y (không chứa NH4 +) và 0,03 mol hỗn hợp khí Z gồm NO và N2O. Cho dung dịch AgNO3 đến dư vào dung dịch Y, sau phản ứng thấy thoát ra 0,01 mol NO (sản phẩm khử duy nhất của N+5), đồng thời thu được 35,52 gam kết tủa. Phần trăm khối lượng Fe3O4 trong hỗn hợp X có giá trị gần nhất với giá trị nào sau đây?
A. 35,8%. B. 46,6%. C. 37,1%. D. 40,8%.
Câu 74: Cho các phát biểu sau:
(a) Trong giấm ăn có chứa axit axetic.
(b) Trong một phân tử triolein có 3 liên kết π.
(c) Khi tham gia phản ứng hiđro hóa, andehit axetic bị khử thành ancol etylic.
(d) Thủy phân hoàn toàn tinh bột hoặc xenlulozơ trong môi trường kiềm, đều thu được glucozơ
(e) Có thể tiêu hủy túi nilon và đồ nhựa bằng cách đốt cháy vì không gây ô nhiễm môi trường.
Số phát biểu đúng là
A. 3. B. 4. C. 2. D. 5.
Câu 75: Cho các phát biểu sau:
(a) Cho dung dịch NH3 vào dung dịch AlCl3 có xuất hiện kết tủa.
(b) Nhiệt phân hoàn toàn Cu(NO3)2 tạo thành Cu.
(c) Hỗn hợp Na2O và Al (tỉ lệ mol 1:1) tan hết trong nước dư.
(d) Trong công nghiệp dược phẩm, NaHCO3 được dùng để điều chế thuốc đau dạ dày.
(e) Trong công nghiệp, Al được sản xuất bằng phương pháp điện phân nóng chảy AlCl3
Số phát biểu đúng là
A. 4. B. 5. C. 2. D. 3.
Câu 76: Cho m gam hỗn hợp E (gồm este đơn chức X và este hai chức Y mạch hở) tác dụng vừa đủ với dung dịch NaOH, thu được hỗn hợp Z chứa hai muối và một ancol T duy nhất. Đốt cháy hoàn toàn Z cần
Trang 3/4 – Mã đề 053
vừa đủ 1,19 mol O2, thu được 14,84 gam Na2CO3; tổng số mol CO2 và H2O bằng 1,58 mol. Cho T tác dụng
với Na dư, thoát ra 1,792 lít khí (đktc). Biết để đốt cháy hết m gam E cần vừa đủ 1,51 mol O2. Phần trăm khối lượng của Y trong E có giá trị gần nhất với giá trị nào sau đây?
A. 65%. B. 63%. C. 61%. D. 37%.
Câu 77: Dẫn 0,32 mol hỗn hợp gồm khí CO2 và hơi nước qua cacbon nung đỏ thu được 0,54 mol hỗn hợp
X gồm CO, H2 và CO2. Cho toàn bộ X vào dung dịch chứa 0,12 mol NaOH và a mol Ba(OH)2, sau phản
ứng hoàn toàn thu được m gam kết tủa và dung dịch Y. Nhỏ từ từ từng giọt đến hết Y vào 100 ml dung dịch
HCl 0,6M thu được 0,02 mol khí CO2. Giá trị của m là
A 5,91. B 3,94. C 9,85. D 11,82.
Câu 78: Cho sơ đồ sau (các chất phản ứng theo đúng tỉ lệ mol):
(1) X + NaOH (t°) → X1 + X2
(2) X1 + NaOH (CaO, t°) → X3 + Na2CO3
(3) X2 (H2SO4 đặc, 170°C) → X4 + H2O
(4) X2 + O2 (men giấm) → X5 + H2O
(5) 2X3 (1500°C, làm lạnh nhanh) → X6 + 3H2
(6) X6 + H2O (HgSO4, 80°C) → X7
(7) X7 + H2 (Ni, t°) → X2
Trong số các phát biểu sau:
(a) Trong phân tử X có 4 nguyên tử cacbon.
(b) Tổng số liên kết giữa các nguyên tử trong phân tử X2 là 8.
(c) X4 làm mất màu dung dịch Br2
(d) X6 có phản ứng với AgNO3/NH3 dư, tạo thành kết tủa màu trắng bạc.
(e) Cho đá vôi vào dung dịch X5 sẽ có khí bay ra.
Số phát biểu đúng là
A 2. B 5. C 4. D 3.
Câu 79: Cho sơ đồ các phản ứng sau:
(a) X1 + H2O → X2 + X3↑ + H2↑ (Điện phân dung dịch có màng ngăn).
(b) X2 + X4 → CaCO3 + Na2CO3 + H2O
(c) X2 + X3 → X1 + X5 + H2O.
(d) X4 + X6 → CaSO4 + Na2SO4 + CO2 + H2O.
Các chất X5, X6 thỏa mãn sơ đồ trên lần lượt là
A NaClO, H2SO4 B Ca(HCO3)2, NaHSO4
C Ca(HCO3)2, H2SO4 D NaClO, NaHSO4
Câu 80: Điện phân dung dịch chứa đồng thời NaCl và CuSO4 (điện cực trơ, màng ngăn xốp, hiệu suất điện phân 100%, bỏ qua sự hòa tan của các khí trong nước và sự bay hơi nước) với cường độ dòng điện không đổi. Kết quả của thí nghiệm được ghi ở bảng sau:
Thời gian (s) Khối lượng catot tăng Anot Khối lượng dung dịch giảm
t1 = 1544 m (gam) Một khí duy nhất 5,4 (gam)
t2 = 4632 3m (gam) Hỗn hợp khí 15,1 (gam)
t 4,5m (gam) Hỗn hợp khí 20,71 (gam)
Giá trị của t là
A 7720. B 8685. C 11580. D 8106.
Trang 4/4 – Mã đề 053
ĐÁP ÁN VÀ GIẢI CHI TIẾT
Trimetylamin là đồng phân của propylamin vì chúng có cùng công thức phân tử
Câu 59:
Ca(HCO3)2 tạo kết tủa khi tác dụng với dung dịch NaOH:
Ca(HCO3)2 + 2NaOH —> CaCO3 + Na2CO3 + 2H2O
Câu 60:
nH2O = nO = (8,4 – 6)/16 = 0,15
Câu 41:
But-1-in tác dụng với dung dịch AgNO3 trong NH3 tạo thành kết tủa:
C2H5 -C≡CH + AgNO3 + NH3 → C2H5 -C≡CAg↓ + NH4NO3
Câu 50:
Tripanmitin (C15H31COO)3C3H5 có 51C.
Câu 51:
A. MgSO4 + NaOH —> Mg(OH)2 (trắng) + Na2SO4
B. Fe2(SO4)3 + NaOH —> Fe(OH)3 (nâu đỏ) + Na2SO4
C. Không phản ứng.
D. CuSO4 + NaOH —> Cu(OH)2 (xanh) + Na2SO4
Câu 52:
Oxit X bị H2 khử thành kim loại —> X là CuO:
CuO + H2 —> Cu + H2O
Câu 54:
Có 2 kim loại trong dãy phản ứng được với dung dịch H2SO4 loãng là Al và Fe:
Al + H2SO4 —> Al2(SO4)3 + H2
Fe + H2SO4 —> FeSO4 + H2
Câu 55:
CH3COOH là chất điện li yếu vì khi tan trong nước, nó chỉ phân li một phần thành ion:
CH3COOH ⇌ CH3COO- + H+
Câu 56:
Fructozơ là monosaccarit nên không bị thủy phân khi đun nóng trong môi trường axit.
Câu 58:
Bảo toàn H —> nHCl = 2nH2O = 0,3 —> V = 300 ml
Câu 61:
H2N-CH(CH3)-COOH + NaOH —> H2N-CH(CH3)-COONa + H2O
nAla = 0,08; nNaOH = 0,1 —> nH2O = 0,08
Bảo toàn khối lượng —> m rắn = 9,68 gam
Câu 62:
2Al + 2NaOH + 2H2O —> 2NaAlO2 + 3H2
nAl = 0,1 —> nH2 = 0,15 —> V = 3,36 lít
Câu 63:
NaHCO3 + Ba(OH)2 —> BaCO3 + NaOH + H2O
AlCl3 + Ba(OH)2 —> Ba(AlO2)2 + BaCl2 + H2O
NaHSO4 + Ba(OH)2 —> BaSO4 + NaOH + H2O
NH4Cl + Ba(OH)2 —> BaCl2 + NH3 + H2O
FeCl3 + Ba(OH)2 —> BaCl2 + Fe(OH)3
Na2SO4 + Ba(OH)2 —> NaOH + BaSO4
Na3PO4 + Ba(OH)2 —> NaOH + Ba3(PO4)2
Câu 64:
nX = nNaOH = 0,03
—> MX = 74: X là C3H6O2
Câu 65:
Al + HCl —> AlCl3 + H2
Fe + HCl —> FeCl2 + H2
Cu không phản ứng. Al có tính khử mạnh hơn Fe nên khí H2 thoát ra từ Al mạnh hơn từ Fe.
—> C sai.
Trang 6/4
Câu 66:
X là các đồng phân của (C15H31COO)(C17H33COO)(C17H35COO)C3H5
nCO2 = 1,1 —> nX = nCO2/55 = 0,02
Muối gồm C15H31COOK (0,02, C17H33COOK (0,02) và C17H35COOK (0,02)
—> m muối = 18,72 gam
Câu 67:
A. Na + H2O —> NaOH + H2
NaOH + FeCl2 —> Fe(OH)2 + NaCl
B. Al + H2O + NaOH —> NaAlO2 + H2
C. Cu + AgNO3 —> Cu(NO3)2 + Ag
D. FeCl3 + AgNO3 —> AgCl + Fe(NO3)3
Câu 68:
CaCO3 —> CaO + CO2
Ba(HCO3)2 —> BaO + CO2 + H2O
MgCO3 —> MgO + CO2
Mg(HCO3)2 —> MgO + CO2 + H2O
—> Sản phẩm chất rắn gồm: CaO, BaO, MgO.
Câu 69:
A. Sai, poli(etylen terephtalat) được điều chế bằng phản ứng trùng ngưng C2H4(OH)2 và p-C6H4(COOH)2.
B. Đúng, poli(metyl metacrylat) được điều chế bằng phản ứng trùng hợp CH2=C(CH3)-COOCH3
C. Sai, trùng ngưng axit adipic với hexametylendiamin thu được nilon-6,6.
D. Sai, trùng ngưng axit ε-aminocaproic thu được policaproamit.
Câu 70:
Y có dạng CnH2n+2-2k với k = nBr2/nY = 0,4
MY = 14n + 2 – 2k = 17,4.2 —> n = 2,4
—> Y là C2,4H6
Phản ứng cộng H2 không làm thay đổi số C nên các hiđrocacbon trong X có dạng C2,4H4
C2,4H4 + H2 —> C2,4H6
—> nH2 = nY = 0,1
Câu 71:
Quy đổi hỗn hợp thành C (a mol), H2O (b mol)
Trang 7/4 – Mã đề 053
—> 12a + 18b – 18b = 2,4 —> a = 0,2
—> nO2 = 0,2 —> V = 4,48 lít
Câu 72:
phenyl axetat
CH3COOC6H5 + 2NaOH → CH3COONa + C6H5ONa + H2O
metyl axetat
CH3COOCH3 + NaOH → CH3COONa + CH3OH
etyl fomat
HCOOC2H5 + NaOH → HCOONa + C2H5OH
tripanmitin
(C15H31COO)3C3H5 + 3NaOH → 3C15H31COONa + C3H5(OH)3
vinyl axetat
CH3COOCH=CH2 + NaOH → CH3COONa + CH3CHO
metyacrylat
CH2=CH-COOCH3 + NaOH → CH2=CH-COONa + CH3OH
Câu 73:
Thêm AgNO3 vào Y thấy xuất hiện khí NO chứng tỏ Y chứa Fe2+, H+ dư và không có NO3.
nAgCl = 0,24 —> nAg = 0,01
Bảo toàn electron: nFe2+ = 3nNO + nAg = 0,04
nH+ dư = 4nNO = 0,04
Dung dịch Y chứa Fe2+ (0,04), H+ dư (0,04), Cl- (0,24), bảo toàn điện tích —> nFe3+ = 0,04
Ban đầu đặt a, b, c là số mol Fe, Fe3O4 và Fe(NO3)2
mX = 56a + 232b + 180c = 5,956 (1)
nFe = a + 3b + c = 0,04 + 0,04 (2)
B
ảo toàn H —> nH2O = 0,11
Bảo toàn O:
4b + 6c + 0,02.3 = 0,03 + 0,11 (3)
(1)(2)(3) —> a = 0,0445; b = 0,0095; c = 0,007
—> %Fe3O4 = 37,00%
Câu 74:
(a) Đúng
(b) Sai, trong một phân tử triolein có 6 liên kết π (3C=C và 3C=O)
(c) Đúng: CH3CHO + H2 —> CH3CH2OH
(d) Sai, tinh bột và xenlulozơ không bị thủy phân trong môi trường kiềm.
Trang 8/4 –
(e) Sai, quá trình đốt cháy tạo nhiều khói độc và tro độc.
Câu 75:
(a) Đúng.
3NH3 + 3H2O + AlCl3 —> Al(OH)3 + 3NH4Cl
(b) Sai: 2Cu(NO3)2 —> 2CuO + 4NO2 + O2
(c) Đúng:
Na2O + H2O —> 2NaOH
Al + NaOH + H2O —> NaAlO2 + 1,5H2
(d) Đúng
(e) Sai, điện phân nóng chảy Al2O3.
Câu 76:
nNa2CO3 = 0,14 —> nNaOH = 0,28
nH2 = 0,08 —> nOH trong ancol = 0,16
—> X là este của phenol và nX = (0,28 – 0,16)/2 = 0,06
X là RCOOP (0,06); Y là (RCOO)2A (0,08)
Muối gồm RCOONa (0,22) và PONa (0,06). Đốt muối —> nCO2 = u và nH2O = v
—> u + v = 1,58
Bảo toàn O —> 2u + v + 0,14.3 = 0,22.2 + 0,06 + 1,19.2
—> u = 0,88 và v = 0,7
Bảo toàn khối lượng:
mZ = 0,22(R + 67) + 0,06(P + 39) = mCO2 + mH2O + mNa2CO3 – mO2
—> 11R + 3P = 550
Do R ≥ 1 và P ≥ 77 —> R = 29 và P = 77 là nghiệm duy nhất.
Muối gồm C2H5COONa và C6H5ONa.
nO2 đốt T = nO2 đốt E – nO2 đốt Z = 0,32
T có dạng CxHyO2 (0,08 mol)
CxHyO2 + (x + 0,25y – 1)O2 —> xCO2 + 0,5yH2O
nO2 = 0,08(x + 0,25y – 1) = 0,32
—> 4x + y = 20
Do y ≤ 2x + 2 nên x = 3 và y = 8 là nghiệm duy nhất. T là C3H6(OH)2
X là C2H5COO-C6H5 (0,06)
Y là (C2H5COO)2C3H6 (0,08)
—> %Y = 62,56%
Câu 77:
nC phản ứng = 0,54 – 0,32 = 0,22
Bảo toàn electron: 4nC phản ứng = 2nCO + 2nH2
—> nCO + nH2 = 0,44 —> nCO2 = 0,54 – 0,44 = 0,1
nHCl = 0,06 < nNaOH nên HCl hết.
nHCl > 2nCO2 nên Y chứa Na2CO3 và NaOH dư
nNa2CO3 phản ứng = nCO2 = 0,02
nHCl = 2nNa2CO3 phản ứng + nNaOH phản ứng
—> nNaOH phản ứng = 0,02
—> Y chứa Na2CO3 (x) và NaOH dư (x)
nNaOH ban đầu = 2x + x = 0,12 —> x = 0,04
B
ảo toàn C —> nBaCO3 = 0,1 – x = 0,06
—> mBaCO3 = 11,82 gam
Câu 78:
(4) —> X2 là C2H5OH; X5 là CH3COOH
(5) —> X3 là CH4; X6 là C2H2
(6) —> X7 là CH3CHO
(3) —> X4 là C2H4
(2) —> X1 là CH3COONa
(1) —> X là CH3COOC2H5
(a) Đúng, X là C4H8O2.
(b) Đúng, CH3CH2OH có 8 liên kết (5C-H, 1C-C, 1C-O, 1O-H)
(c) Đúng: C2H4 + Br2 —> C2H4Br2
(d) Sai, X6 + AgNO3 + NH3 —> C2Ag2 (↓ vàng) + NH4NO3
(e) Đúng: CH3COOH + CaCO3 —> (CH3COO)2Ca + CO2 + H2O
Câu 79:
(a) NaCl + H2O —> NaOH + Cl2 + H2
(b) 2NaOH + Ca(HCO3)2 —> CaCO3 + Na2CO3 + 2H2O
(c) NaOH + Cl2 —> NaCl + NaClO + H2O
(d) Ca(HCO3)2 + 2NaHSO4 —> CaSO4 + Na2SO4 + 2CO2 + 2H2O.
—> X5, X6 là NaClO, NaHSO4
Câu 80:
Trong 1544 giây: nCu = nCl2 = a
—> m giảm = 64a + 71a = 5,4 —> a = 0,04
—> m = 64a = 2,56
Trang 9/4 – Mã đề 053
ne trong 1544s = 2nCu = 0,08 (1)
Trong 4632 giây: nCu = 3a = 0,12; nCl2 = u và nO2 = v
m giảm = 0,12.64 + 71u + 32v = 15,1
Bảo toàn electron —> 0,12.2 = 2u + 4v
—> u = 0,1 và v = 0,01
Trong t giây: nCu = 4,5a = 0,18; nH2 = x; nCl2 = 0,1 và nO2 = y
m giảm = 0,18.64 + 2x + 0,1.71 + 32y = 20,71
Bảo toàn electron —> 0,18.2 + 2x = 0,1.2 + 4y
—> x = 0,045; y = 0,0625
—> ne trong t giây = 0,18.2 + 2x = 0,45 (2)
(1)(2) —> 1544.0,45 = 0,08t
—> t = 8685s
Trang 11/4 – Mã đề 053SỞ GIÁO DỤC ĐÀO TẠO HẢI PHÒNG THPT LÊ QUÝ ĐÔN (Đề thi có 04 trang) (40 câu trắc nghiệm)
ĐỀ THI THỬ TỐT NGHIỆP THPT
NĂM HỌC 2022-2023
Môn: HOÁ HỌC
Thời gian: 50 phút (không tính thời gian phát đề)
Mã đề 054
Cho nguyên tử khối: H = 1; C = 12; N = 14; O = 16; Na = 23; Mg = 24; Al = 27; P = 31; S = 32; Cl = 35,5; Br = 80; K = 39; Ca = 40; Fe = 56; Cu = 64; Zn = 65; Ag = 108; I = 127; Ba = 137.
Câu 41: Thuỷ phân hoàn toàn este X trong dung dịch NaOH, đun nóng, thu được natri axetat và metanol.
Công thức của X là:
A CH3COOCH3 B CH3COOC2H3 C CH3COOC2H5 D C2H5COOCH3
Câu 42: Khi tiến hành phân tích thành phần mẫu nước X, người ta xác định được mẫu nước đó có chứa các
ion Na+, K+, Cl-, SO4 2-. Mẫu nước X được gọi là
A. nước mềm.
C. nước cứng vĩnh cửu.
B. nước cứng tạm thời.
D. nước cứng toàn phần.
Câu 43: Nhôm hiđroxit không tan trong dung dịch nào sau đây?
A Na2SO4 B H2SO4 C HCl. D NaOH.
Câu 44: Chất nào sau đây làm đổi màu quỳ tím?
A Alanin. B Anilin. C Glyxin. D Lysin.
Câu 45: Xác định kim loại M thỏa mãn sơ đồ sau: MxOy + H2 (t°) → M + H2O
A Ca. B Cu. C Na. D Al.
Câu 46: Đốt cháy hoàn toàn 16,6 gam hỗn hợp X gồm metyl amin, etylamin và trimetylamin, thu được CO2, H2O và 4,48 lít khí N2. Cho 16,6 gam X tác dụng với dung dịch HCl dư, thu được m gam muối. Giá trị của m là
A. 28,5. B. 32,4. C. 31,2. D. 29,2.
Câu 47: Este nào sau đây khi đốt cháy thu được số mol CO2 bằng số mol H2O?
A C2H3COOCH3 B CH3COOC3H5 C CH3COOCH3 D HCOOC2H3
Câu 48: Cho hỗn hợp các kim loại Na, K, Mg, Al, Ba có cùng số mol hòa tan vào nước dư ở nhiệt độ thường. Sau phản ứng, chất rắn còn lại có thành phần là
A. Ba. B. Mg. C. Mg, Al. D. Al.
Câu 49: Cho các polime sau: cao su buna, polietilen, tơ lapsan và tơ nilon-7. Số polime được điều chế bằng phản ứng trùng ngưng là:
A 1. B 3. C 2. D 4.
Câu 50: Đốt cháy 11,9 gam hỗn hợp gồm Zn, Al trong khí O2 dư, thu được m gam hỗn hợp X gồm hai oxit.
Toàn bộ X phản ứng hoàn toàn với dung dịch HCl dư, thu được 40,3 gam hỗn hợp muối. Giá trị của m là
A. 18,3. B. 26,1. C. 28,4. D. 24,7.
Câu 51: Thủy phân m gam saccarozơ với hiệu suất 60%, thu được hỗn hợp X. Cho toàn bộ X vào lượng dư dung dịch AgNO3 trong NH3, đun nóng, sau khi các phản ứng xảy ra hoàn toàn, thu được 12,96 gam Ag. Giá trị của m là
A 20,52. B 17,1. C 16,24. D 10,26.
Câu 52: Polisaccarit X là chất rắn dạng sợi, màu trắng, không mùi vị. X có nhiều trong bông nõn, gỗ, đay, gai. Thủy phân X thu được monosaccarit Y. Phát biểu nào sau đây đúng?
A. X có cấu trúc mạch phân nhánh.
B Phân tử khối của Y là 162.
Trang 1/4 – Mã đề 054
C. Y không tan trong nước lạnh.
D. Y tham gia phản ứng với AgNO3 trong NH3 tạo ra amoni gluconat.
Câu 53: Cho 5,4 gam Al phản ứng hoàn toàn với khí Cl2 dư, thu được m gam muối. Giá trị của m là
A 26,7. B 12,5. C 26,4. D 7,64.
Câu 54: Phân tử nào sau đây chỉ chứa hai nguyên tố C và H?
A. Poli(vinyl clorua). B. Polietilen. C. Poli(vinyl axetat). D. Poliacrilonitrin.
Câu 55: Ion kim loại nào sau đây oxi hóa được ion Fe2+?
A Zn2+ B K+ C Ag+ D Cu2+
Câu 56: Kim loại nào sau đây phản ứng mạnh với nước ở nhiệt độ thường tạo ra dung dịch kiềm?
A. Na. B. Fe. C. Al. D. Mg.
Câu 57: Khi thủy phân hết 3,35 gam hỗn hợp X gồm hai este đơn chức, mạch hở thì cần vừa đủ 0,05 mol NaOH thu được một muối và hỗn hợp Y gồm hai ancol cùng dãy đồng đẳng. Đốt cháy hết Y trong O2 dư, thu được CO2 và m gam H2O. Giá trị của m là
A 1,80. B 1,35. C 3,15. D 2,25.
Câu 58: Chất nào sau đây tác dụng với kim loại Na sinh ra khí H2?
A. CH3COOC2H5. B. CH3CHO. C. C2H5OH. D. C2H6.
Câu 59: Các kim loại đều dễ rèn, dễ rát mỏng, dễ kéo thành sợi. là nhờ vào tính chất nào sau đây?
A Tính dẻo. B Tính dẫn điện. C Tính dẫn nhiệt. D Ánh kim.
Câu 60: Ở điều kiện thường, chất nào sau đây làm mất màu dung dịch Br2?
A. Benzen. B. Etilen. C. Butan. D. Metan.
Câu 61: Trong các dung dịch sau đây có cùng nồng độ 0,1M, dung dịch dẫn điện tốt nhất là:
A NH3 B KCl. C K2SO4 D CH3COOH.
Câu 62: Chất nào sau đây tác dụng với dung dịch Ba(OH)2 tạo kết tủa?
A. KCl. B. Ca(HCO3)2. C. NaCl. D. KNO3.
Câu 63: Kim loại nào sau đây là kim loại kiềm thổ?
A Ca. B Fe. C Al. D Na.
Câu 64: Chất nào sau đây có thành phần chính là trieste của glixerol với axit béo?
A. Tơ tằm. B. Bột gạo. C. Sợi bông. D. Mỡ bò.
Câu 65: Cho kim loại M vào dung dịch CuSO4 dư, thấy khối lượng dung dịch sau phản ứng tăng. Kim loại M là:
A K. B Fe. C Zn. D Mg.
Câu 66: Kim loại nào sau đây có tính khử mạnh nhất?
A. K. B. Al. C. Ag. D. Mg.
Câu 67: Cho m gam P2O5 vào dung dịch chứa 0,1 mol NaOH và 0,05 mol KOH, thu được dung dịch X.
Cô cạn X, thu được 8,56 gam hỗn hợp chất rắn khan. Giá trị của m là
A 1,76. B 4,46. C 2,84. D 2,13.
Câu 68: Phát biểu nào sau đây đúng?
A. Ở điều kiện thường, CH5N và C2H7N là những chất khí, có mùi khai.
B Metylamin làm quỳ tìm chuyển sang màu đỏ
C Tất cả các peptit đều có phản ứng màu biure.
D. H2N-CH2-CH2-CO-NH-CH2-COOH là một đipeptit.
Câu 69: Số nguyên tử hidro trong phân tử glucozơ là:
A 12. B 11. C 10. D 6.
Câu 70: Cho một lượng hỗn hợp X gồm Ba và Na vào 200 ml dung dịch Y gồm HCl 0,1M và CuCl2 0,1M.
Kết thúc các phản ứng, thu được 0,448 lít khí và m gam kết tủa. Giá trị của m là
Trang 2/4 –
A. 0,64. B. 0,98. C. 1,28. D. 1,96.
Câu 71: Phát biểu nào sau đây sai?
A Etyl fomat có phản ứng tráng bạc.
B Ở điều kiện thường, tristearin là chất lỏng.
C Triolein phản ứng được với nước brom.
D. Thủy phân metyl axetat thu được ancol metylic.
Câu 72: Chất nào sau đây là amin?
A CH3NH2 B CH3COOH. C H2NCH2COONa. D HCOONH4
Câu 73: Tơ nào sau đây thuộc loại tơ tổng hợp?
A. Tơ tằm.
C Tơ visco.
B. Tơ xenlulozo axetat.
D Tơ nilon-6,6.
Câu 74: Kim loại nào sau đây không tác dụng được với dung dịch H2SO4 loãng sinh ra khí H2?
A. Al. B. Cu. C. Na. D. Zn.
Câu 75: Cho các phát biểu sau:
(1) Fructozơ chuyển thành glucozơ trong môi trường axit hoặc môi trường kiềm
(2) Ở điều kiện thường, anilin là chất rắn
(3) Các amino axit là những chất rắn ở dạng tinh thể không màu, có vị ngọt
(4) Nhỏ vài giọt chanh nước vào cốc sữa bò thấy xuất hiện kết tủa
(5) Ở điều kiên thích hợp, triolein tham gia phản ứng cộng H2
(6) 1 mol Gly-Ala-Glu phản ứng tối đa với 3 mol NaOH
(7) Oxi hóa hoàn toàn glucozơ bằng hidro (xúc tác Ni, t°) thu được sobitol
(8) Hexapeptit X no, mạch hở có 13 nguyên tử C trong phân tử thì X sẽ có 6 đồng phân cầu tạo.
(9) Trong tự nhiên, các hợp chất hữu cơ đều là các hợp chất tạp chức.
(10) Tơ nilon-6,6 thuộc loại tơ tổng hợp.
Số phát biểu đúng là
A. 4. B. 6. C. 3. D. 5.
Câu 76: Cho các chất hữu cơ mạch hở: X là axit không no có hai liên kết π trong phân tử, Y là axit no đơn chức, Z là ancol no hai chức, T là este của X, Y với Z. Đốt cháy hoàn toàn a gam hỗn hợp M gồm X và T, thu được 0,1 mol CO2 và 0,07 mol H2O. Cho 6,9 gam M phản ứng vừa đủ với dung dịch NaOH, cô cạn dung dịch sau phản ứng thu được hỗn hợp muối khan E. Đốt cháy hoàn toàn E, thu được Na2CO3; 0,195 mol CO2 và 0,135 mol H2O. Phần trăm khối lượng của T trong M có giá trị gần nhất với giá trị nào sau đây?
A 68,1%. B 51,3%. C 68,7%. D 52,3%.
Câu 77: Điện phân dung dịch X gồm CuSO4 và KCl (tỉ lệ mol tương ứng là 1 : 5) với điện cực trơ, màng ngăn xốp, cường độ dòng điện không đổi I = 2A. Sau 1930 giây, thu được dung dịch Y và hỗn hợp khí gồm H2 và Cl2 (có tỉ khối so với H2 là 24). Mặt khác, nếu điện phân X trong thời gian t giây thì khối lượng dung dịch giảm 2,715 gam. Giả thiết hiệu suất điện phân là 100%, các khí sinh ra không tan trong nước và nước không bay hơi trong quá trình điện phân. Giá trị của t là.
A. 4825. B. 3860. C. 2895. D. 5790.
Câu 78: Cho hơi nước qua than nóng đỏ thu được 0,3 mol hỗn hợp khí X gồm CO, H2 và CO2. Hỗn hợp X phản ứng vừa hết hỗn hợp Y nung nóng gồm CuO, MgO, Fe3O4 và Al2O3 có cùng số mol thì thu hỗn hợp chất rắn Z. Hòa tan Z vào dung dịch HCl thì thu được 3,36 lít khí. Nếu cho X vào nước vôi trong dư thì thu được m gam kết tủa. Các phản ứng xảy ra hoàn toàn. Giá trị của m là
A 8. B 25. C 5. D 15.
Câu 79: X, Y, Z là ba este đều no và mạch hở (không chứa nhóm chức khác và MX < MY < MZ). Đun nóng hỗn hợp E chứa X, Y, Z với dung dịch NaOH vừa đủ thu được một ancol T và hỗn hợp F chứa hai muối A
Trang 3/4 – Mã đề 054
và B có tỉ lệ mol tương ứng là 5 : 3 (MA < MB). Dẫn toàn bộ T qua bình đựng Na dư thấy khối lượng bình
tăng 12 gam đồng thời thu được 4,48 lít khí H2 (đo ở đktc). Đốt cháy toàn bộ F thu được Na2CO3, CO2 và
6,3 gam H2O. Số nguyên tử hiđro có trong Y là:
A. 12. B. 10. C. 8. D. 6.
Câu 80: Thực hiện các thí nghiệm sau:
(a) Sục CO2 đến dư vào dung dịch Ba(OH)2
(b) Sục CO2 đến dư vào dung dịch NaAlO2 (hay Na[Al(OH)4]).
(c) Cho nước vôi vào dung dịch NaHCO3.
(d) Cho dung dịch NaOH vào lượng dư dung dịch AlCl3.
(e) Đun nóng dung dịch chứa Ca(HCO3)2
(g) Cho mẩu Na vào dung dịch CuSO4.
Số thí nghiệm thu được kết tủa sau phản ứng là
A 2. B 5. C 4. D 6.
