
TÓMTẮTLÍTHUYẾTCHƯƠNGI
• Nguyên tử được cấu tạo nên từ hai phần: lớp vỏ (chứa electron) và hạt nhân (chứa proton và neutron). Nguyên tử trung hòa về điện vì có số hạt proton bằng số hạt electron.
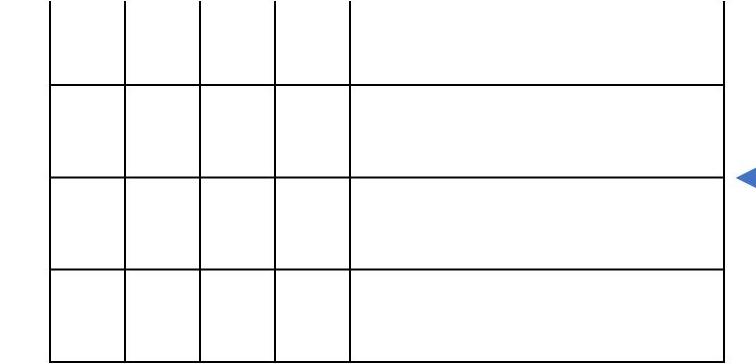
Hạt Kí hiệu Khối lượng (amu) Điện tích tương đối
Proton P ≈ 1 +1
Neutron n ≈ 1 0
Electron e ≈ 0,00055 -1
• Khối lượng nguyên tử chủ yếu tập trung ở hạt nhân do electron có khối lượng rất nhỏ so với khối lượng của proton và neutron.
• Kích thước của hạt nhân nguyên tử rất nhỏ so với kích thước của nguyên tử. Kích thước hạt nhân = 10-5 - 10-4 kích thước nguyên tử
• Nguyên tố hóa học là tập hợp các nguyên tử có cùng số đơn vị điện tích hạt nhân (cùng số hạt proton).
• Số hiệu nguyên tử (Z) = số proton

A = Z + N
• Số khối (A):
• Kí hiệu nguyên tử cho biết kí hiệu hóa học của nguyên tố (X), số hiệu nguyên tử (Z) và số khối (A).
• Nguyên tử khối là khối lượng tương đối của một nguyên tử, cho biết khối lượng của một nguyên tử nặng gấp bao nhiêu lần 1 amu.
• Orbital nguyên tử (AO) là khu vực không gian xung quanh hạt nhân nguyên tử mà xác suất tìm thấy electron trong khu vực đó là lớn nhất (khoảng 90%).
• Lớp và phân lớp electron
• Các electron thuộc cùng một lớp có năng lượng gần bằng nhau.
• Các electron thuộc cùng một phân lớp có năng lượng bằng nhau.
• Các phân lớp: s, p, d, f .
• Số orbital trong lớp n là n2 (n ≤ 4).

• Số electron tối đa trong các phân lớp:
• Đồng vị là những nguyên tử có cùng số đơn vị điện tích hạt nhân (cùng số proton) nhưng có số neutron khác nhau (có thể phát biểu: “Các nguyên tử của cùng một nguyên tố hóa học có số neutron khác nhau là đồng vị của nhau”).
A.aB.b....C.c A abc +++ = ++
Trong đó A, B, C …lần lượt là nguyên tử khối của các đồng vị A, B, C…; a, b, c…lần lượt là số nguyên tử của các đồng vị X và Y.
• Cấu hình electron cho biết thứ tự mức năng lượng các electron giữa các phân lớp. Năng lượng electron trên mỗi phân lớp tăng theo chiều từ trái sang phải.
• Cách viết cấu hình electron
• Bước 1: Điền electron theo thứ tự các mức năng lượng từ thấp đến cao: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s……

• Bước 2: Đổi lại vị trí các phân lớp sao cho số thứ tự lớp (n) tăng dần theo chiều từ trái qua phải, các phân lớp trong cùng một lớp theo thứ tự s, p, d, f.
• Biểu diễn cấu hình electron theo ô orbital
• Viết cấu hình electron của nguyên tử.
• Biểu diễn mỗi AO bằng một ô vuông, AO cùng phân lớp thì viết liền, khác lớp thì tách nhau. Thứ tự ô orbital từ trái sang phải như cấu hình electron.
• Điền electron vào từng ô orbital theo thứ tự lớp và phân lớp. Mỗi electron = 1 mũi tên.
• Quy tắc Hund: Trong mỗi phân lớp, electron được phân bố sao cho e độc thân là lớn nhất.
• Nguyên lí Pau – Li: Trên 1 orbital nguyên tử chứa tối đa 2 electron và có chiều tự quay khác chiều nhau xung quanh trục riêng của mỗi electron.
• Từ cấu hình electron nguyên tử có thể dự đoán dược tính chất hóa học cơ bản của nguyên tố hóa học.
• Có 1, 2 hoặc 3e lớp ngoài cùng thường là nguyên tử nguyên tố kim loại.
• Có 5, 6 hoặc 7e lớp ngoài cùng thường là nguyên tử nguyên tố phi kim.
• Có 8e lớp ngoài cùng là nguyên tử nguyên tố khí hiếm. (Trừ He có 2e).
• Có 4e lớp ngoài cùng nguyên tố có thể là kim loại hoặc phi kim.
• Bài tập về phổ khối:
Phổ khối (phổ khối lượng) được sử dụng để xác định phân tử khối, nguyên tử khối
của các chất và hàm lượng các đồng vị bền của một nguyên tố.
Dựa vào phổ khối lượng sẽ biết được nguyên tố có bao nhiêu đồng vị bền, phầm trăm số nguyên tử của từng đồng vị.
Ví dụ:
HẠT NHÂN
Hạt proton
Khối lượng = ………….
Điện tích = ……………
Khối lượng = ………….
Điện tích = ……………
Hạt electron
Khối lượng = …………. Điện tích = ……………
Kích thước: ……..
Khối lượng: ……….
Z = …… = ……

AO s có dạng …………
AO p gồm ……………
Phổ khối của nguyên tử Lithium
• Phổ khối lượng cho thấy Lithium có 2 đồng vị bền.

• 6 7
NGUYÊN TỐ
HÓA HỌC
Số khối (A) = ….+…





NGUYÊN X
Kí hiệu nguyên tử … …
Đồng vị và
Nguyên lý vững bền: ….
Nguyên lý Pauli:……
AO p có dạng …………
n 1

Lớp electron
Phân lớp Số AO
Số electron tối đa Thứ tự năng lượng các phân lớp từ thấp đến cao:……….
Cấu hình electron
3 4
Đặc điểm của lớp electron ngoài cùng
Quy tắc Hund: ….. Số electron 1,2,3 4 5,6,7 8


Loại nguyên tố
BÀI 2 THÀNH PHẦN NGUYÊN TỬ
Dạng1:Bàitậpcơ bản
Bài1: Nếu coi hồng cầu có hình dạng đĩa tròn với đường kính 7,8 µm thì cần bao nhiêu nguyên tử Helium (có đường kính là 0,62Å) sắp xếp thẳng hàng và khít nhau để tạo nên đoạn thẳng có chiều dài bằng đường kính của hồng cầu?
Hình1.3.Môhìnhcấutạocủanguyêntử Carbonvànguyêntử Oxygen

Tính tổng số hạt proton, neutron và electron có trong một phân tử CO2 CO2 tạo từ các nguyên tử carbon và oxygen ở trên.

Dạng2:Bàitậpcácloại hạttrongnguyêntử.
Bài6: Hợp kim chứa nguyên tố M nhẹ và bền, dùng chế tạo vỏ máy bay, tên lửa. Nguyên tử của nguyên tố M có tổng số hạt proton, neutron và electron là 40, trong hạt nhân nguyên tử M số hạt không mang điện nhiều hơn số hạt mang điện là 1 hạt. Tính số hạt proton, neutron, electron có trong nguyên tử nguyên tố M.

Bài 7: Magnesium oxide (MgO) là hợp chất được sử dụng trong y tế để làm giảm các triệu chứng ợ nóng, ợ chua của căn bệnh đau dạ dày. Cho ZMg = 12, ZO = 8.
a, Tính tổng số hạt mang điện có trong phân tử MgO.
b, Viết cấu hình electron của nguyên tử Magnesium và Oxygen.
Bài 8: Oxide của kim loại M có dạng M2O được ứng dụng trong
nhiều ngành công nghiệp như sản xuất xi măng, sản xuất phân bón,
Hình1.1.Hồngcầu
Bài 2: Một cách gần đúng coi bán kính của nguyên tử là 10-10 m, bán kính của hạt nhân nguyên tử này là 1014 m. Xác định xem bán kính hạt nhân nhỏ hơn bán kính nguyên tử bao nhiêu lần?
Bài3: Mô hình cấu tạo của nguyên tử Hydrogen và nguyên tử Helium được cho dưới đây. Vòng tròn màu đỏ đại diện cho loại hạt nào trong nguyên tử?
… Oxide này (M2O) là chất rắn, màu trắng, tan nhiều trong nước
và là thành phần dinh dưỡng không thể thiếu đối với mọi loại cây
trồng. Xác định công thức phân tử của M2O biết tổng số hạt cơ bản trong phân tử M2O là 140, trong đó tổng số hạt mang điện nhiều
hơn số hạt không mang điện là 44; nguyên tử oxygen trong M2O có 8 neutron, và 8 electron.

Hình1.4.Phânbónvới câytrồng.
Bài9: X là một trong những kim loại có nhiều ứng dụng quan trọng như làm đồ trang sức, làm chất tiếp xúc, dùng trong công nghiệp tráng gương. Trong một nguyên tử X tổng số hạt proton, neutron và electron là 155, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 33 hạt. Tính số proton, neutron của nguyên tử X.
Bài10: Hợp chất XY2 có tên hiệu là "vàng của kẻ ngốc" vì có ánh kim và sắc vàng đồng nên nhìn khá giống vàng, nhiều người hay lầm đó là
Hình1.2.Môhìnhcấutạocủanguyêntử Hydrogenvànguyêntử Helium

Bài4: Điền vào chỗ trống để hoàn thành bảng sau:
Kíhiệu Số proton Số neutron Số electron Điệntíchhạt nhân
Bài5: Cho mô hình cấu tạo của nguyên tử carbon và nguyên tử oxygen như sau:
vàng. Mỗi phân tử XY2 có tổng các hạt proton, neutron, electron bằng
178, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 54.
Mặt khác, số hạt mang điện trong nguyên tử X nhiều hơn số hạt mang
điện trong nguyên tử Y là 20. Xác định số proton của nguyên tố X và
nguyên tố Y, công thức hóa học của XY2.
Hình1.5. Tinhthể XY2
Bài 11: Tổng số hạt proton, neutron, electron trong hai nguyên tử A và B là 118 hạt, trong đó số hạt mang

điện nhiều hơn số hạt không mang điện là 34 hạt. Số hạt mang điện của nguyên tử B nhiều hơn nguyên tử A
là 28 hạt. Xác định tên của hai nguyên tố A, B.
Dạng3:Bàitậpvề bánkínhnguyêntử
Bài12: Vàng (Au) là một kim loại quý đã được sử dụng làm chất phản xạ neutron trong vũ khí hạt nhân. Trong đời sống hàng ngày vàng còn được dùng để đúc tiền, đồ trang sức và nhiều bức tranh nghệ thuật, …
BÀI 3: NGUYÊN TỐ HÓA HỌC
Dạng1:Bàitậpcơ bản Bài1: Hoàn thành bảng sau:
Hình1.6.aVàngmiếng. Hình1.6.bTinhthể vàng
Giả thiết rằng trong tinh thể vàng các nguyên tử là những hình cầu có bán kính 1,44Ǻ; khối lượng mol nguyên tử Au là 197g/mol; khối lượng riêng của Au là 19,36 g/cm3. Tính thể tích chiếm bởi các nguyên tử Au trong tinh thể?

Bài 13: Giả thiết rằng trong tinh thể sodium các nguyên tử là những hình cầu với không gian trống giữ các nguyên tử là 26%. Biết khối lượng riêng của Sodium bằng 0,97g/cm3 và khối lượng mol của Sodium là 22,99 g/mol. Tính bán kính gần đúng của nguyên tử Sodium.
Bài 14: Iron là một nguyên tố có trong cơ thể con người, nó tham gia vào quá trình tổng hợp hemoglobin và myoglobin. Iron cũng có nhiệm vụ quan trọng trong việc tổng hợp DNA, đóng vai trò trong việc vận chuyển oxygen, sản xuất ra năng lượng oxy hóa và bất
hoạt các gốc tự do gây hại. Trong tinh thể iron, các nguyên tử iron là những
hình cầu chiếm 75% thể tích toàn khối tinh thể, phần còn lại là các khe rỗng
giữa các quả cầu. Khối lượng nguyên tử của iron là 55,85 g/mol. Tính bán

kính nguyên tử gần đúng của iron ở 20oC biết khối lượng riêng của iron tại
nhiệt độ này là 7,87 g/cm3 Hình1.7.S

ng1.1. Thôngtinvề mộtsố nguyêntố

Bài 2: Iodine là một trong những nguyên tố vi lượng cần có trong chế độ dinh dưỡng của con người. Chế độ ăn uống thiếu hụt Iodine sẽ dẫn tới phì
đại tuyến giáp gây ra căn bệnh bướu cổ
Thông qua chế độ dinh dưỡng, các nguyên tử Iodine thường được đưa vào cơ thể dưới dạng anion có điện tích 1- và số khối là 127. Xác định số proton, neutron và electron có trong anion I.
Hình1.9.Ngườibệnhbị bướucổ Dạng2:Bàitậpvề đồngvị -nguyêntử khốitrungbình
Bài3: Lithium có hai đồng vị bền là 6Li và 7Li. Phổ khối của nguyên tử Li được cho trong hình dưới đây. Hãy xác định nguyên tử khối trung bình của Lithium.

Hình1.8.Phổ khốicủaLithium
Bài4: Trong tự nhiên silicon (Si) có 4 đồng vị với phần trăm số nguyên tử như bảng sau: Đồngvị %số nguyêntử Nguyêntử khối 28Si 92,21 27,98
29Si 4,70 28,98
30Si 3,09 29,97
Tính nguyên tử khối trung bình của silicon
Bài5: Krypton là một trong những khí hiếm được ứng dụng trong chiếu sáng và nhiếp ảnh. Ánh sáng của Krypton có nhiều dải phổ, do đó nó được sử dụng nhiều làm tia laser có mức năng lượng cao.
Hình 1.10b biểu thị phổ khối của Krypton, quan sát hình ảnh và trả lời câu hỏi sau:
a, Krypton có bao nhiêu đồng vị bền? Viết kí hiệu nguyên tử cho từng đồng vị
b, Xác định số hạt proton và neutron có trong từng đồng vị.
c, Tính giá trị nguyên tử khối trung bình của Krypton.
Hình1.10aKhíKrypton.
Bài 8: Boron tồn tại trong tự nhiên dưới dạng hai đồng vị bền, boron-10 và boron-11 chiếm lần lượt 20% và 80% số lượng nguyên tử. Hãy xác định nguyên tử khối trung bình của Boron.
Bài9: Neon nằm ngay dưới helium trong bảng tuần hoàn. Nó có ba đồng vị bền là neon-20, neon-21 và neon22. Cho biết các hạt nhân của neon-20, neon-21và neon-22 giống nhau và khác nhau như thế nào.

Bài10: Một thiên thạch được tìm thấy ở trung tâm Indiana chứa dấu vết của khí neon, khí này có nguồn gốc từ gió của mặt trời khi thiên thạch đi qua hệ mặt trời. Phân tích một mẫu khí cho thấy nó bao gồm 91,84% 20Ne (khối lượng 19,9924 amu), 0,47% 21Ne (khối lượng 20,9940 amu) và 7,69% 22Ne (khối lượng 21,9914 amu). Khối lượng trung bình của neon trong gió mặt trời là bao nhiêu?
Hình1.12.Hình ảnhmộtmẫuthiênthạch.
Bài11: Một mẫu Magnesium được tìm thấy chứa 78,70% số nguyên tử 24Mg (khối lượng 23,98 amu), 10,13% trong số 25Mg nguyên tử (khối lượng 24,99 amu), và 11,17% trong số nguyên tử 26Mg (khối lượng 25,98 amu). Tính nguyên tử khối trung bình của Magnesium.

Hình1.10.bPhổ khốicủaKrypton.
Bài 6: Copper là kim loại có nhiều ứng dụng trong đời sống như làm dây điện, que hàn và các đồ dùng nội thất trong nhà, đúc tượng, nam châm điện từ, các động cơ máy móc.....Trong tự nhiên, Copper có hai đồng vị là 63Cu và 65Cu. Cho biết sự khác biệt giữa hai đồng vị này?
Trong bảng tuần hoàn, nguyên tử khối của Copper được sử dụng là 64, hãy giải thích giá trị này biết rằng đồng vị 63Cu chiếm 70% số lượng nguyên tử tương ứng trong tự nhiên còn lại là 65Cu.


Hình1.11. Cáccuộndây đồng
Bài 7: Bảng dưới đây cho giá trị số khối và phần trăm số lượng nguyên tử của các đồng vị bền Copper có trong tự nhiên. Tính nguyên tử khối trung bình của Copper.
Số khối Phần trăm số
lượng nguyên tử
63 69%
65 31%
Bảng1.2.
Hình1.13.KimloạiMagnesium

Bài 12: Trong tự nhiên, Chlorine có hai đồng vị bền là 35Cl (khối lượng 34,96885 amu) và 37Cl (khối lượng 36,96590 amu). Nguyên tử khối trung bình của Chlorine được xác định là 35,453 amu. Tính thành phần phần trăm của từng đồng vị Chlorine?
Bài 13: Chlorine có hai đồng vị bền trong tự nhiên là 35 17Clvà 37 17Cl, trong đó đồng vị chứa 18 neutron chiếm 75% số lượng nguyên tử Chlorine.
a) Tính nguyên tử khối trung bình của Chlorine.
b) Tính số mol mỗi loại đồng vị có trong 5,325 gam khí Chlorine.
Bài14: Trong tự nhiên, nguyên tố Chlorine có 2 đồng vị bền là 35Cl và 37Cl. Nguyên tử khối trung bình của Chlorine là 35,5. Trong hợp chất HClOx, nguyên tửđồng vị 35Cl chiếm 26,12% về khối lượng. Xác định công thức phân tử của hợp chất HclOx.
Bài15: Một nguyên tố X có 3 đồng vị bền là AX (79%), BX (10%), DX (11%). Biết tổng số khối của 3 đồng vị là 75, nguyên tử khối trung bình của 3 đồng vị là 24,32. Mặt khác số neutron của đồng vị thứ 2 nhiều hơn

số neutron đồng vị 1 là 1 đơn vị. Tìm giá trị của A, B, D.
Bài16: Nguyên tố Boron (B) trong tự nhiên có hai đồng vị bền là 10B và 11B. Biết nguyên tử khối trung bình của B là 10,81.
a) Xác định % số nguyên tử của mỗi đồng vị trong tự nhiên.
b) Boric acid (H3BO3) được sử dụng làm thuốc sát trùng (thuốc nhỏ mắt, bôi da). Xác định % khối lượng của đồng vị 11B có trong Boric acid (biết M = 61,83 gam/mol).
Bài 17: Nguyên tố A là một khoáng chất thiết yếu đối với sự phát triển của xương và răng, trong cơ thể A
tham gia vào quá trình co cơ, đông máu, điều hòa chức năng thận, thần kinh, tái tạo mô, tế bào và đảm bảo quá trình hoạt động của tim. Tính nguyên tử khối trung bình của nguyên tố A biết rằng 95,00% nguyên tử của A có khối lượng là 31,972u, 0,76% có khối lượng là 32,971u và 4,22% có khối lượng là 33,967u. A là nguyên tố nào?
Bài 18: Công nghệ phổ khối lượng ngày nay rất nhạy để phát hiện ra những sự thay đổi cực kì nhỏ về hàm lượng các đồng vị bền của một nguyên tố hóa học, tùy thuộc vào nơi lấy mẫu. Vì vậy các nhà khoa học khai thác triệt để những khác biệt này để xác định nguồn gốc mẫu nguyên tố
Giả sử bạn được cung cấp một mẫu boron, bằng phương pháp phân tích phổ khối lượng bạn xác định
được phần trăm số nguyên tử của 10B là 18,2% và 11B là 81,8%. Tham khảo bảng dưới đây và xác định nguồn gốc mẫu boron của bạn.
Dạng1:Bàitậpvề môhìnhnguyêntử
HÌNH ELECTRON
Bài1: Dựa theo mô hình nguyên tử của RutherFord – Bohr, vẽ mô hình nguyên tử của nguyên tố có Z =2, Z = 7 , Z = 13, Z = 17.

Bài 2: Bán kính nguyên tử hydrogen (0,0529nm) lớn hơn bán kính nguyên tử của helium (0,0128nm). Hãy giải thích sự khác biệt này bằng khái niệm orbital nguyên tử.
Dạng2:Bàitậpvề cấuhình–orbitalnguyêntử
Bài 3: Nguyên tử nguyên tố X có hai lớp electron trong đó có hai electron độc thân ở phân lớp p. Vậy X có thể là những nguyên tố nào?
Bài 4: Viết cấu hình electron nguyên tử và biểu diễn cấu hình theo ô orbital của các nguyên tố: Magnesium (Z = 12), Potassium (Z=19), Carbon (Z=6). Cho biết số electron lớp ngoài cùng của mỗi nguyên tố và nguyên tố là kim loại, phi kim hay khí hiếm?
Bài5: Biểu diễn cấu hình electron lớp ngoài cùng của các nguyên tố sau theo ô orbital và cho biết số electron độc thân trong các cấu hình electron của các nguyên tố ở trạng thái cơ bản: 8O, 17Cl, 27Co, 24Cr.
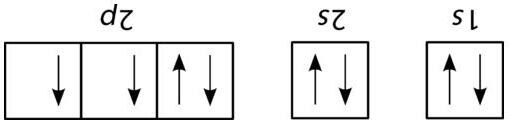
Bài6: Sử dụng mũi tên và kí hiệu phân lớp electron thích hợp để hoàn thiện cấu hình electron của nguyên tố Phosphorus trong sơ đồ dưới đây.
Bài7: Nguyên tử X có cấu hình electron là 1s22s22p63s23p63d84s2
a, Nguyên tử X có bao nhiêu electron độc thân?
b, Viết cấu hình electron của X2+
Bài 8: Biểu diễn cấu hình lớp ngoài cùng theo ô orbital của các nguyên tố có Z = 4, Z = 9, Z = 11, Z = 16.
Cho biết số electron độc thân ở mỗi nguyên tử và các nguyên tố trên có tính kim loại hay phi kim.
Bài 9: Hai nguyên tố X, Y đều thuộc nhóm A trong bảng tuần hoàn. Nguyên tử X có tổng số electron ở các phân lớp p là 11, nguyên tử Y có 4 lớp electron và có 2 electron ở lớp ngoài cùng. Viết cấu hình electron nguyên tử và xác định các nguyên tố X, Y.
Bài10: Ở trạng thái cơ bản, nguyên tử của nguyên tố X có 3 lớp electron và 2 electron độc thân.Viết cấu hình electron của nguyên tử X?
Bài11: Dưới đây là giản đồ orbital s và p, điền vào chỗ trống.
Hình1.14: Sự thay đổi nguyên tử khối trung bình của boron theo hàm lượng đồng vị (theo MW Wieser, và Coplen, Hóa học ứng dụng. 83 , 359 (2011)).
Các orbital nguyên tử của electron s có dạng ____ và mỗi mức năng lượng s có ________ orbital nguyên tử; orbital nguyên tử của electron p có dạng ________ và mỗi mức năng lượng p có ____ orbital nguyên tử
Bài12: Dưới đây là sự sắp xếp của các electron ở mức 2p và 3d của một số nguyên tử. Hãy thử đánh giá xem sự sắp xếp nào vi phạm nguyên tắc loại trừ Pauli và cái nào vi phạm quy tắc của Hund?

BÀI TẬP TỔNG HỢP
Bài1: Xác định các nguyên tố X, Y, Z và viết cấu hình các nguyên tố này dựa trên các thông tin sau:
a, X là nguyên tố vi lượng có nhiều trong cơ thể người, là thành phần cơ bản để cấu tạo nên xương và răng.
Nguyên tử của nguyên tố X có tổng số các loại hạt proton, neutron và electron là 60, trong hạt nhân số hạt mang điện bằng số hạt không mang điện.

b, Y là chất có tính oxi hoá mạnh, thường được sử dụng để khử trùng nước máy trong sinh hoạt. Nguyên tử
của nguyên tố Y có 11 electron thuộc phân lớp p.
Hình1.15.Dâytruyềntải điệntrêncaocólõilàm từ nguyêntố Z.

c, Hợp kim của nguyên tố Z được dùng làm vỏ máy bay do có đặc tính nhẹ, bền, Z cũng được sử dụng làm dây dẫn điện trên cao do có khả năng dẫn điện tốt. Nguyên tử nguyên tố Z có 3 lớp electron và 1 electron độc thân.
Bài2: Tổng số hạt proton, neutron, electron trong nguyên tử M và nguyên tử X là 86 hạt, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 26 hạt. Số khối của X lớn hơn của M là 12. Tổng số hạt trong nguyên tử X nhiều hơn trong nguyên tử M là 18 hạt.
1. Viết cấu hình electron của nguyên tố M và nguyên tố X.
2. Tính số khối của nguyên tử nguyên tố M
Bài3: Chất X tạo ra từ 3 nguyên tố A, B, C có công thức phân tử là ABC. Tổng số hạt cơ bản (proton, neutron, electron) trong phân tử X là 82, trong đó số hạt mạng điện nhiều hơn số hạt không mang điện là 22. Hiệu số khối giữa nguyên tử B và nguyên tử C gấp 10 lần số khối của nguyên tử A. Tổng số khối của nguyên tử B và nguyên tử C gấp 27 lần số khối của nguyên tử A. Xác định công thức phân tử của chất X.
Bài4: X là một trong những nguyên tố có trong thành phần của nhựa PVC, các chất dẻo hay cao su. Ngoài ra, với tính oxi hóa mạnh, hợp chất của X còn được dùng để khử trùng nước sinh hoạt, điều chế nước javen – sản phẩm được dùng để tẩy trắng quần áo, vải sợi, … a. Ở trạng thái cơ bản X có 11 electron thuộc các phân lớp p. Viết cấu hình electron của X.
lượng của mỗi đồng vị trong X tự nhiên biết nguyên tử khối (NTK) trung bình của X bằng 35,48. Coi NTK có giá
trị bằng số khối.
Bài 5: Hợp chất Z có công thức MaRb trong đó R chiếm 6,667% khối lượng. Trong hạt nhân nguyên tử M có
n = p + 4, trong hạt nhân nguyên tử R có n’ = p’(n, p, n’, p’ là số neutron và proton tương ứng của M và R).
Biết rằng tổng số hạt proton trong phân tử Z bằng 84 và a + b = 4. Tìm công thức phân tử của Z.
Bài 6: X là một nguyên tố có nhiều ứng dụng. Các hợp chất của X được sử dụng trong công nghiệp dược phẩm, sản xuất thuốc nhuộm, mực in và làm thuốc “hiện hình” trong nghề ảnh, khoan dầu. Ở trạng thái cơ
bản, nguyên tử nguyên tố X có 17 electron thuộc các phân lớp p.
a) Viết cấu hình electron của X.
b) X có hai đồng vị hơn kém nhau hai neutron. Trong đồng vị có số khối lớn hơn, số hạt không mang điện bằng 23/35 lần hạt mang điện. Xác định thành phần cấu tạo của hai đồng vị và thành phần phần trăm số nguyên tử của mỗi đồng vị, biết nguyên tử khối (NTK) trung bình của X bằng 79,91. Coi NTK có giá trị xấp xỉ bằng số khối.
Hình1.16.NướcJaven b. Trong tự nhiên X có hai đồng vị hơn kém nhau hai neutron. Trong đồng vị số khối lớn, số hạt mang điện
PhầnII:TRẮCNGHIỆMKHÁCHQUAN
BÀI 2: THÀNH PHẦN CỦA NGUYÊN TỬ
Dạng1:Bàitậplí thuyết
Câu 1: Hình ảnh mô hình nguyên tử các đồng vị của nguyên tử Hydrogen được cho dưới đây. Các đồng vị này khác nhau về
A. Số proton.
B. Số neutron.
C. Số electron.
D. Số hiệu nguyên tử
Hình1.17.Các đồngvị củanguyêntử Hydrogen
Câu 2: Mô hình cấu tạo của nguyên tử Sodium được biểu diễn tại hình 1.18. Số hạt proton trong hạt nhân nguyên tử Na là
A. Vì nguyên tử không chứa các hạt mang điện.
B. Vì nguyên tử có số proton và số electron bằng nhau.






C. Vì nguyên tử có nhiều neutron hơn proton.
D. Vì nguyên tử có chứa hạt neutron không mang điện.
Câu7: Khẳng định nào sau đây là đúng khi so sánh kích thước của hạt nhân so với kích thước của nguyên tử?
A. Kích thước hạt nhân rất nhỏ so với nguyên tử
B. Hạt nhân có kích thước bằng một nửa nguyên tử.
C. Hạt nhân chiếm gần như toàn bộ kích thước nguyên tử
D. Hạt nhân có kích thước bằng 2/3 kích thước nguyên tử.
Câu8: Hình ảnh dưới đây là mô hình cấu tạo của nguyên tử nguyên tố A. Số proton của nguyên tử A là
Hình1.18.Môhìnhcấutạocủanguyêntử Sodium
A. 10 B. 11 C. 12
Câu3: Cụm từ thích hợp điền vào ô trống ở hình bên là
A. Neutron
B. Hạt nhân.
C. Proton
D. Lớp vỏ.
D. 13.
Hình1.19.Môhìnhcấutạonguyêntử
Câu4: Nguyên tử X có mô hình cấu tạo như hình 1.20. Số hiệu nguyên tử của X là
Hình1.21.Môhìnhcấutạonguyêntử A
A. 3 B. 7 C. 17 D. 10
Câu9: Cho các phát biểu sau đây về các hạt cấu tạo nên nguyên tử
(i) Hạt nhân của tất cả các nguyên tử đều chứa neutron.
(ii) Có những nguyên tử chứa nhiều neutron hơn proton.
(iii) Các proton và neutron có cùng khối lượng.
(iv) Electron không có khối lượng.
Các phát biểu đúng là
A. (ii). B. (i) và (ii).
C. (ii) và (iii). D. (i) và (iv).
Câu10: Mô hình cấu tạo ở hình 1.22 thuộc về nguyên tử nguyên tố nào?
A. Carbon (Z = 6).
C. Oxygen (Z = 8)
Hình1.22.Môhìnhcấutạonguyêntử
B. Sodium (Z = 11).
D. Lithium (Z = 3)
Hình1.20.Môhìnhcấutạonguyêntử X
A. 1 B. 3 C. 4 D. 7
Câu5: Nhà khoa học nào đã phát hiện ra neutron?
A. Chadwick B. Rutherford C. Thomson D. Bohr
Câu6: Tại sao các nguyên tử không mang điện?
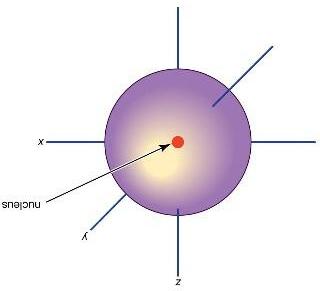
Câu11: Sơ đồ bên phải cho thấy cấu trúc của một nguyên tử. Tên gọi tương ứng với các kí hiệu A và B là
A. A = electron, B = hạt nhân.
B. A = neutron, B = proton.
C. A = proton, B = hạt nhân.

D. A = hạt nhân, B = electron.
Hình1.23.Môhìnhcấutạonguyêntử
Câu12: Nguyên tử được biểu diễn ở hình 1.24 có bao nhiêu electron?
A. 2 B. 4
C. 6. D. 10.
Hình1.24. Môhìnhcấutạonguyêntử
Câu13: Mô hình cấu tạo ở hình 1.25 thuộc về nguyên tử của nguyên tố nào?
Hình1.25.Môhìnhcấutạonguyêntử
A. Carbon (Z = 6) B. Hydrogen (Z = 1).
C. Aluminium (Z = 13) D. Lithium (Z = 3).
Câu14: Chữ cái nào chú thích cho electron?
Hình1.26.Môhìnhcấutạonguyêntử
A. X. B. Y. C. Z. D. T.
Câu15: Trong nguyên tử, hạt không mang điện có tên gọi là
A. electron. B. proton và electron.
C. neutron. D. proton.
Câu16: Hạt mang điện trong hạt nhân nguyên tử là
A. proton và electron. B. proton.




C. neutron. D. proton và neutron.
Câu17: Các hạt cấu tạo nên hạt nhân của hầu hết nguyên tử là
A. electron, proton và neutron. B. electron và neutron.
C. proton và neutron. D. electron và proton.

Câu 18: Hình vẽ sau mô tả thí nghiệm tìm ra hạt A – là một trong những thành phần cấu tạo nên nguyên tử
là
Hình1.27.Thínghi
ệm tìmrahạtA
A. Thí nghiệm tìm ra electron. B. Thí nghiệm tìm ra neutron.
C. Thí nghiệm tìm ra proton. D. Thí nghiệm tìm ra hạt nhân.
Câu19: Electron được tìm ra vào năm 1897 bởi nhà bác học Thomson. Từ khi được phát hiện đến nay electron
đã đóng vai trò to lớn trong nhiều lĩnh vực của cuộc sống như: năng lượng, truyền thông và thông tin… Hãy cho biết phát biểu nào sau đây không đúng về hạt electron?
A. Electron là hạt mang điện tích âm.
B. Electron chỉ thoát ra khỏi nguyên tử trong những điều kiện đặc biệt.
C. Electron có khối lượng 9,11.10-28 gam.
D. Electron chiếm phần lớn khối lượng nguyên tử
Câu20: Mô hình cấu tạo của nguyên tử Sodium được biểu diễ ở hình 1.28. Số hạt mang điện âm trong nguyên tử Sodium là
Hình1.28.Môhìnhcấutạocủanguyêntử Sodium.
A. 1. B. 3. C. 11. D. 13.
Câu 21: Có bao nhiêu proton trong nguyên tử trung hòa được biểu diễn ở hình 1.?
Hình1.29.Môhìnhcấutạocủanguyêntử.
A. 14 B. 9 C. 7
Câu 22: Miêu tả nào sau đây là đúng đối với proton?
A. Proton mang điện âm và được tìm thấy trong hạt nhân.
B. Proton mang điện dương và tìm thấy ở ngoài hạt nhân.
C. Proton không mang điện tích và được tìm thấy bên ngoài hạt nhân.
D. Proton mang điện dương và tìm thấy trong hạt nhân.
D.2.

Câu23: Năm 1911, E. Rutherford và các cộng sự đã dùng các hạt α bắn phá lá vàng mỏng và dùng màn huỳnh quang đặt sau lá vàng để theo dõi đường đi của các hạt α. Kết quả thí nghiệm đã rút ra các kết luận về nguyên tử như sau:
(1) Nguyên tử có cấu tạo rỗng.
(2) Hạt nhân nguyên tử có kích thước rất nhỏ so với kích thước nguyên tử.
(3) Hạt nhân nguyên tử mang điện tích âm.
(4) Xung quanh nguyên tử là các electron chuyển động tạo nên lớp vỏ nguyên tử
Số kết luận sai là
A. 1. B. 2. C. 3. D. 4.
Câu24: Hình 1.30 mô tả thí nghiệm tìm ra hạt nhân nguyên tử. Hiện tượng nào chứng tỏ điều đó
7. Cực dương Điện cực Điện trường
Dạng2:Bàitậpvề cácloạihạttrongnguyêntử.
Câu 26: Nguyên tử của nguyên tố X có tống số hạt cơ bản là 49, trong đó số hạt không mang điện bằng
53,125% số hạt mang điện. Số đơn vị điện tích hạt nhân của X là
A. 18 B. 17 C. 15 D. 16
Câu27: Tổng số hạt proton, neutron, electron trong nguyên tử C là 276. Trong nguyên tử C, số hạt mang điện nhiều hơn số hạt không mang điện là 40. Số hạt neutron trong nguyên tử C có giá trị là

A. 79 B. 118 C. 197 D. 236
Tài liệu phát hành từ website Tailieuchuan.vn
Câu28: Nguyên tử của một nguyên tố R có tổng số các loại hạt bằng 82, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 22 hạt. Điện tích hạt nhân của R là
A. -24 B.-26 C.+24 D.+26
Câu29: 1 mol nguyên tử Iron có khối lượng bằng 56 gam. Số hạt electron có trong 5,6 gam Iron là (biết trong một nguyên tử Iron có chứa 26 electron)
A. 15,66.1024 B. 15,66.1021 C. 15,66.1022 D. 15,66.1023
Câu 30: Trong hạt nhân nguyên tử M, có số hạt không mang điện nhiều hơn số hạt mang điện là 1 hạt. Mặt khác, nguyên tử M có tổng số hạt mang điện nhiều hơn số hạt không mang điện là 8. Nguyên tố M là
A. 10Ne B. 9F C. 8O D. 17Cl
Hình1.30.Thínghiệm tìm rahạtnhânnguyêntử
A. Chùm α truyền thẳng. B. Chùm α bị bật ngược trở lại.
C. Chùm α bị lệch hướng. D.B và C đều đúng.
Câu 25: Hình vẽ sau đây mô tả thí nghiệm tìm ra electron:
Hình1.31.Thínghiệmtìm rahạtelectron
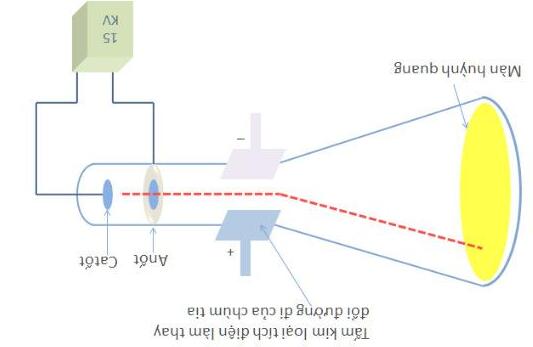
Quan sát hình vẽ và điền những thông tin thích hợp cho trước (a, b, c hay d) vào những chỗ trống trong đoạn thông tin sau:
Thomson đã cho phóng điện với hiệu điện thế 15000 vôn qua hai ….(1)…, gắn vào hai đầu của một ống thủy tinh kín đã rút gần hết ….(2)…, thì thấy màn huỳnh quang…(3)….. Màn huỳnh quang phát sáng do sự xuất hiện của các tia không nhìn thấy được đi từ …..(4)….sang …(5)…., tia này được gọi là tia ….(6)….Tia này bị hút lệch về phía …(7)… khi đặt ống thủy tinh trong một điện trường.
TT A B C D
1. Điện cực Cực Điện trường
Cực âm
2. Chân không Không khí Khí oxi Khí nitơ
3. Thay đổi màu Chuyển sang màu đen Chuyển sang màu vàng Phát sáng
4. Cực âm Cực dương Điện cực Điện trường
5. Điện cực Điện trường Cực âm Cực dương
6. Tia γ Dương cực Âm cực Tia α

Câu31: Nguyên tử của nguyên tố B có tổng số hạt cơ bản là 34, trong đó số hạt mang điện gấp 1,8333 lần số hạt không mang điện. Nguyên tố B là
A. Na (Z = 11). B. Mg (Z = 12). C. Al (Z = 13). D. Cl (Z =17).
Câu32: Tổng số hạt cơ bản trong nguyên tử của nguyên tố X là 114, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 26. Nguyên tố X là
A. 35Br. B. 17Cl. C. 30Zn. D. 47Ag.
Câu 33: Nguyên tử nguyên tố X có tổng số hạt electron trong các phân lớp p là 7. Số hạt mang điện của một nguyên tử Y nhiều hơn số hạt mang điện của nguyên tử X là 8 hạt. Các nguyên tử X và Y lần lượt là
A. 26Fe và 17Cl. B. 11Na và 17Cl. C. 13Al và 17Cl. D. 13Al và 15P.
Câu 34: Tổng số hạt trong hạt nhân của nguyên tử Y là 27, trong đó số hạt mang điện dương ít hơn số hạt không mang điện là 1 hạt. Nhận xét nào sau đây về nguyên tử Y là đúng?
A. Số hạt mang điện tích âm là 14.
B. Trong nguyên tử Y số hạt mang điện nhiều hơn số hạt không mang điện là 26.
C. Y là phi kim.
D. Số hạt neutron của Y là 14.
Câu 35: Tổng số các loại hạt cơ bản trong nguyên tử nguyên tố X là 52 hạt, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 16 hạt. Nguyên tố X là
A. 9F. B. 17Cl. C. 35Br. D. 53I.
Câu 36: M là kim loại có nhiều ứng dụng, phổ biến trong đời sống do có khả năng dẫn điện tốt. Tổng số hạt cơ bản trong M2+ là 90, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 22. M là
A. 24Cr. B. 29Cu. C. 26Fe. D. 30Zn.
Câu37: X được xem là nguyên tố của sự sống, là chất vi lượng không thể thiếu trong cơ thể người, là khoáng chất có hàm lượng cao thứ hai trong cơ thể con người. Tổng số hạt cơ bản trong ion X3- là 49, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 17. Nguyên tố X là (cho biết số hiệu nguyên tử của N = 7, P = 15, Sb = 51, As = 33).
A. N. B. P. C. Sb. D. As.
Câu38: Tổng số hạt cơ bản trong M+ là 155, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 31. Nguyên tố M là (cho biết số hiệu nguyên tử của Na = 11, K = 19, Rb = 37, Ag = 47).
A. Na. B. K. C. Rb. D. Ag.
Câu 39: Trong phân tử X2Y3 có tổng số hạt p, n, e bằng 236 hạt, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 68 hạt. Số khối của nguyên tử X lớn hơn số khối của nguyên tử Y là 40. Tổng số hạt p, n, e trong nguyên tử X lớn hơn trong nguyên tử Y là 58 hạt. Công thức của X2Y3 là (Cho số hiệu nguyên tử của Al = 13, Fe = 26, O = 8, S = 16).
A. Al2O3 B. Fe2O3 C. Al2S3 D. Fe2S3
Câu 40: Hợp chất Z được tạo bởi hai nguyên tố X và Y có công thức XY2 trong đó Y chiếm 72,73% về khối lượng. Biết rằng trong phân tử Z tổng số hạt (proton, neutron, electron) là 66, số proton là 22. Nguyên tố Y là (Cho số hiệu nguyên tử của C= 6, O = 8, S = 16, Mg = 12).
A. carbon. B. oxygen. C. Sulfur. D. magnesium.
Câu41: Hợp chất X được tạo thành từ 10 nguyên tử của 4 nguyên tố. Tổng số hạt mang điện của X bằng 84.
Trong X có ba nguyên tố thuộc cùng một chu kì và số hạt proton của nguyên tố có Z lớn nhất lớn hơn tổng số proton của các nguyên tố còn lại là 6 đơn vị. Số nguyên tử của nguyên tố có Z nhỏ nhất bằng tổng số nguyên tử của các nguyên tố còn lại. Công thức phân tử của X là (Cho số hiệu nguyên tử của N = 7, H = 1, C = 6, O = 8, S = 16).
A. NH4HSO3. B. NH4HSO4. C. NH4HCO3. D. NH4NO3.
Dạng3:Bàitậptínhkhối lượngnguyêntử
Câu42: Mỗi nguyên tử nitrogen có 7 proton, 7 neutron, 7 electron và mp=1,6726.10-27kg; mn= 1,6748.10-27kg; me = 9,1094.10-31kg. Vậy khối lượng của phân tử N2 tính theo đơn vị gam (g) là
A. 4,6876.10-26 g B. 5,6866.10-26 g C. 4,6876.10-23 g D. 5,6866.10-23 g
Câu 43: Biết nguyên tử magnesium có 12 proton, 12 neutron; 12 electron ; nguyên tử oxygen có 8 proton, 9 neutron và 8 electron. (Cho mp=1,6726.10-27 kg, mn= 1,6748.10-27 kg và me = 9,1094.10-31 kg). Vậy khối lượng (g) của phân tử MgO bằng bao nhiêu?

A. 6,8641.10-26 g. B. 6,8641.10-23g. C. 5,4672.10-23 g. D. 5,4672.10-23 g.
Câu44: Biết nguyên tử Aluminium có 13 proton, 14 neutron và 13 electron và nguyên tử oxygen có 8 proton, 8 neutron và 8 electron. (Cho mp=1,6726.10-27kg, mn= 1,6748.10-27 kg, me = 9,1094.10-31kg). Khối lượng tính theo kg của phân tử Al2O3 gầnnhất với giá trị nào sau đây?
A. 1,7077.10-25
B. 1,7077.10-26 C. 4,8672.10-25 D. 4,8672.10-26
Dạng4:Bàitậpvề bánkínhnguyêntử
Câu 45: Giả thiết trong tinh thể, các nguyên tử iron là những hình cầu chiếm 75% thể tích tinh thể, phần còn lại là các khe rỗng giữa các quả cầu, cho khối lượng nguyên tử của Fe là 55,85 ở 20oC. Khối lượng riêng của
Fe là 7,78 g/cm3. Cho Vhc = 4 3 πr3. Bán kính nguyên tử gần đúng của Fe là :
A. 1,44.10-8 cm. B. 1,29.10-8 cm. C. 1,97.10-8 cm. D. Kết quả khác.
Câu46: Chromium có cấu trúc mạng lập phương tâm khối trong đó thể tích các nguyên tử chiếm 68% thể tích tinh thể. Khối lượng riêng của Cr là 7,2 g/cm3 và khối lượng nguyên tử của Cr là 51,99. Nếu xem nguyên tử
Cr có dạng hình cầu thì bán kính gần đúng của chromium là A. 0,125 nm. B. 0,155 nm. C. 0,134 nm. D. 0,165 nm.
Câu47: Calcium là nguyên tố đóng vai trò quan trọng trong việc hình thành nên xương và răng của con người. Các nhà khoa học xác định được rằng khối lượng riêng của calcium là 1,55 g/cm3. Giả thiết rằng, trong tinh thể calcium các nguyên tử là những hình cầu chiếm 74% thể tích tinh thể, phần còn lại là khe rỗng. Bán kính nguyên tử canxi tính theo lí thuyết là
A. 0,185 nm.
B. 0,196 nm.
C. 0,155 nm.
D. 0,168 nm.
Câu 48: Giả thiết nguyên tử Aluminium có bán kính 1,43Å và có nguyên tử khối là 27. Trong tinh thể các nguyên tử chỉ chiếm 74% thể tích, còn lại là các khe trống. Khối lượng riêng của aluminium có giá trị là
A. 2,7 g/cm3 B. 3,1 g/cm3 C. 2,1 g/cm3 D. 5,6 g/cm3
Câu49: Trong nguyên tử X, giữa bán kính hạt nhân (r) và số khối của hạt nhân (A) có mối quan hệ như sau: r = 1,5.10-13.A1/3 cm. Khối lượng riêng (tấn/cm3) của hạt nhân nguyên tử X
Dạng1:Kíhiệunguyêntử -Số khối
Câu1: Nguyên tử A có 12 electron, 12 neutron, kíhiệu nguyên tử của A là A. 12 25A
25 12 A
12 24 A D. 24 12 A
Câu2: Hạt nhân của nguyên tử nào có số hạt neutron là 28?
A. 39 19 K B. 54 26 Fe C. 32 15 P D. 23 11 Na
Câu3: Kí hiệu nguyên tử Sodium được cho tại hình 1.31. Số hạt proton, neutron và electron trong nguyên tử Sodium lần lượt là
Hình1.32. Kíhiệunguyêntử Sodium
A. 23, 11, 11 B. 23, 11, 12 C. 11, 12, 11 D. 11, 23, 11
Câu4: Một nguyên tử có 29 proton, 36 neutron và 29 electron. Số hiệu nguyên tử và số khối của nguyên tử có giá trị:
A. Số hiệu nguyên tử = 16, số khối = 36.
B. Số hiệu nguyên tử = 29, số khối = 36.
C. Số hiệu nguyên tử = 29, số khối = 65.
D. Số hiệu nguyên tử = 36, số khối = 65.
Câu5: Cho bảng thông tin sau về nguyên tử nguyên tố Fluorine.
Nguyên tố Kí hiệu Số proton Số neutron Số electron
Fluorine 19 9 F 9 ……………
Bảng1.3. Thôngtinvề mộtnguyêntử củanguyêntố Fluorine.
Số neutron và số electron của nguyên tử Fluorine trên lần lượt là
A. 9 và 19. B. 10 và 9. C. 10 và 19. D. 9 và 10.
Câu6: Hạt nhân nguyên tử X có 8 proton và 9 neutron. Kí hiệu nguyên tử của X là
A. 8 9 X . B. 17 8 X . C. 8 17 X . D. 9 8 X .
Câu7: Một nguyên tử của nguyên tố X có 75 electron và 110 neutron. Kí hiệu nguyên tử của nguyên tố X là
A. 185 110 X B. 185 185 X C. 185 75 X D. 75 185 X
Câu 8: Cho các nguyên tử sau: 141620151823 78107811 A;B;C;D;E;F . Các nguyên tử nào thuộc cùng một nguyên tố hóa học?
A. A và B, C và D B. A và C, B và D
C. B và E, C và F. D. A và D, B và E.
Câu9: Một nguyên tử có 9 electron ở lớp vỏ, 10 neutron hạt nhân. Số hiệu nguyên tử của nguyên tố đó là
A. 9. B. 18. C. 19. D. 28.
Câu 10: Nguyên tử của một nguyên tố X có tổng số các loại hạt trong hạt nhân là 80. Trong đó số hạt mang điện là 35 hạt. Kí hiệu nguyên tử của X là
A. 80 35 X. B. 90 35 X. C. 45 35 X. D. 115 35 X
Câu11: Nguyên tử X có tổng các loại hạt cơ bản là 52, trong đó số hạt mang điện gấp 1,889 lần số hạt không mang điện. Nhận định sai là
A. X có 18 hạt không mang điện. B. Số hạt mang điện của X là 35.
C. X có 17 electron ở lớp vỏ. D. Số khối của X là 35.
Câu 12: Nguyên tử X có cấu hình electron ở lớp ngoài cùng là 4p5. Tỉ số giữa số hạt không mang điện và số hạt mang điện là 0,6429. Số khối của X là
A. 90. B. 85. C. 70. D. 80.
Câu 13: Nguyên tố X có 2 đồng vị bền X1 và X2. Đồng vị X1 có tổng số hạt là 18. Đồng vị X2 có tổng số hạt là 20. Biết rằng phần trăm số nguyên tử các đồng vị bằng nhau và các loại hạt trong X1 cũng bằng nhau.

Nguyên tử khối trung bình của X là
A. 15 B. 14
C. 12 D. 13
Câu14: Nguyên tử X có tổng số hạt proton, neutron, electron là 34. Biết số neutron nhiều hơn số proton là 1.
Số khối của nguyên tử X là
A. 11. B. 23. C. 35.
D. 46.
Câu15: Trong nguyên tử X tổng số các hạt cơ bản (e, p, n) là 115. Số hạt mang điện nhiều hơn số hạt không mang điện là 25. Nguyên tử X là

A. 80 35Br. B. 79 35Br .
Dạng2:Bàitậpvề đồngvị -nguyêntử khốitrungbình
C. 56 26Fe .
Câu16: Dãy nào dưới đây gồm các đồng vị của cùng một nguyên tố hóa học?
A. 1414 67X,Y . B. 1920 910X,Y . C. 2829 1414X,Y .
D. 65 30 Zn.
D. 4040 1819X,Y .
Câu17: Cho phổ khối của nguyên tố A được biểu diễn tại hình 1.33, Nguyên tử khối trung bình của A là
Hình1.33.Phổ khốicủanguyêntố A.
A. 91,32 B. 91,40 C. 90,00 D. 94,23
Câu 18: Phổ khối lượng của nguyên tố X được cho ở hình 1.34.
Nguyên tử khối trung bình của nguyên tố này là bao nhiêu?
A. 10.
B. 10,8
C. 10,2.
D. 11.
Hình1.34.Phổ khốilượngcủanguyêntố X
Câu19: Nhận định nào đúng khi nói về nguyên tử Carbon-12 và Carbon-14?
A. Chúng có số khối giống nhau. B. Chúng có số proton khác nhau.
C. Chúng có số electron khác nhau. D. Chúng có số neutron khác nhau.
Câu20: Số neutron của hai đồng vị Chlorine trong hình 1.32 theo chiều từ trái sang phải lần lượt là?
A. 17 và 17. B. 35 và 37.
C. 18 và 20 D. 17 và 35.
Hình1.35. Đồngvị củaChlorine
Câu21: Trong tự nhiên, nguyên tử Chlorine có hai đồng vị bền là 35Cl và 37Cl. Tại sao nguyên tử khối tương đối của Chlorine thường được sử dụng là 35,5?

A. Đây là giá trị trung bình cộng số khối của hai đồng vị
B. Lấy giá trị ngẫu nhiên.
C. Nó là khối lượng trung bình của các đồng vị
D. Đây là giá trị nguyên tử khối trung bình của hai đồng vị
Câu22: Cho các cặp nguyên tử sau. Đáp án nào chứa cặp đồng vị của cùng một nguyên tố hóa học?
A. Nguyên tử A: 13 proton, 12 neutron và 12 electron. Nguyên tử B: 12 proton, 12 neutron và 12 electron.
B. Nguyên tử A: 12 proton, 12 neutron và 12 electron. Nguyên tử B: 12 proton, 12 neutron và 13 electron.
C. Nguyên tử A: 12 proton, 12 neutron và 12 electron. Nguyên tử B: 12 proton, 13 neutron và 12 electron.
D. Nguyên tử A: 13 proton, 13 neutron và 12 electron. Nguyên tử B: 14 proton, 12 neutron và 13 electron.
Câu23: Thông tin về các nguyên tử Q, R, S, T được cho trong bảng sau:
Nguyêntử Số proton Số neutron Số eletcron
S 6 8 6
T 8 8 8
Bảng1.4.Thôngtinvề cácloạihạtcủamộtsố nguyêntử.


Hai nguyên tử là đồng vị của nhau là?
A. Q và S. B. Q và T.
C. R và T D. R và S
Câu24: Nguyên tố X có ba đồng vị bền, thông tin về phần trăm số lượng nguyên tử tương ứng của từng đồng vị được cho trong bảng sau:
Số khốicủa đồngvị
Phầntrămsố lượng nguyêntử
24 79,0
25 10,0
26 11,0



Bảng1.5.Phầntrăm số lượngnguyêntử các đồngvị bềncủaX
Nguyên tử khối trung bình của nguyên tố X là
A. 24,00. B. 24,15. C. 24,32. D. 24,50.
Câu26: 235 92 U là nguyên liệu quan trọng của ngành công nghiệp hạt nhân tuy nhiên hàm lượng 235 92 U trong tự nhiên rất thấp. Việc làm "giàu" 235 92 U luôn thu hút sự quan tâm của cộng đồng quốc tế. Phát biểu nào sau
đây về 235 92 U là đúng?
Hình1.36.Nhàmáyhạtnhân
A. 235 92 U và 238 92 U là đồng vị của nhau.
B. 235 92 U và 238 92 U là hai dạng thù hình của nhau.
C. Hạt nhân 235 92 U chứa 92 neutron.
D. 235 92 U có 143 electron bên ngoài hạt nhân.
Câu27: Cho hình vẽ mô phỏng các nguyên tử với 8n, 9n là số hạt neutron có trong hạt nhân mỗi nguyên tử
1
Câu 25: Nguyên tử Hydrogen có hai đồng vị bền là
1H và
2 1 H . Ý nào thể hiện đúng mô hình cấu tạo hai đồng vị của nguyên tử Hydrogen?
Hình1.37.Môhìnhcấutạonguyêntử
Nhận xét nào sau đây sai?
A. 1 và 2 là các đồng vị của cùng một nguyên tố hóa học.
B. 1 và 3 là các đồng vị của cùng một nguyên tố hóa học.
C. 1 và 2 là nguyên tử của hai nguyên tố hóa học khác nhau.
D. 1 và 3 có cùng số proton trong hạt nhân.


Câu28: Cho hình vẽ mô phỏng nguyên tử của một nguyên tố như sau:
Hình1.38.Môhìnhcấutạonguyêntử Đồng vị của nguyên tố đã cho là?
Câu29: Cho những nguyên tử của các nguyên tố sau:
Những nguyên tử nào sau đây là đồng vị của nhau ?
và
.
Câu30: Nguyên tử nào trong hình vẽ dưới đây có số e lớp ngoài cùng là 5? 1 2 3 4
A. 1 và 2
C. 3 và 4.
B. 1 và 3
D. 1 và 4.
Câu31: Theo dự đoán của các nhà khoa học, việc khai thác được hàng triệu tấn 3 2 He trong đất của mặt trăng sẽ góp phần quan trọng trong việc phát triển các lò phản ứng tổng hợp hạt nhân không tạo ra chất thải nguy hại. Thực tế, trênTrái đất, Heli tồn tại chủ yếu ở dạng 4 2 He . Khẳng định nào sau đây
Hình1.39. MặtTrăngchứanguồntàinguyênvôtận

A. Hạt nhân của 4 2 He chứa 4 proton .
B. 3 2 He và 4 2 He là đồng vị của nhau.
C. Hạt nhân 3 2 He chứa 3 neutron.
D. Số electron lớp ngoài cùng của 4 2 He là 2 nên Helium là kim loại.
Tài liệu phát hành từ website Tailieuchuan.vn
Câu32: Oxygen có ba đồng vị bền là 161718 888 O,O,O . Nitrogen có hai đồng vị bền là 1415 76N,N . Có thể có bao nhiêu loại phân tử khí Nitrogen dioxide được tạo thành từ hai nguyên tố Nitrogen và Oxygen nói trên?
A. 6. B. 9. C. 12. D. 10.
Câu33: Hydrogen có ba đồng vị bền 123 111H,H,H , Oxygen có ba đồng vị bền 161718 888 O,O,O và Chlorine có 2 đồng vị bền 3537 1717Cl,Cl . Hỏi có thể có bao nhiêu loại phân tử hypochloruos acid (HClO) được tạo thành các đồng vị trên ?
A. 16.
B. 18. C. 9. D. 12.
Câu34: Ủy ban Phê duyệt Thuật ngữ Khoa học và Công nghệ Trung Quốc đặt tên cho nguyên tố 111 (ký hiệu Rg) nhằm kỉ niệm 111 năm ngày sinh của nhà khoa học Roentgen. Một đồng vị của nguyên tố 111 có số khối là 272. Phát biểu nào sau đây về nguyên tố 111 là đúng?
A. Nguyên tố này chứa 111 neutron trong hạt nhân.
B. Nó thuộc chu kỳ 6 của bảng tuần hoàn.
C. Hiệu số giữa số netron và số electron ngoài hạt nhân là 50.
D. Nguyên tố 111 và nguyên tố 110 là đồng vị của nhau.
Câu 35: 131 53I là một trong những sản phẩm phân hạch hạt nhân thông thường, do đó có thể được sử dụng để
phát hiện sự rò rỉ chất phóng xạ trong nhà máy điện hạt nhân bằng cách đo sự thay đổi hàm lượng của 131 53I
trong khí quyển hoặc nước. Phát biểu nào sau đây về 131 53I là sai?
A. Tính chất hoá học của 131 53I giống với 129 53 I.
B. Số hiệu nguyên tử của 133 53I là 53.
C. Số electron của 133 53I là 78.
D. Số neutron trong hạt nhân của 133 53I nhiều hơn số proton là 27.
Câu 36: Trong tự nhiên, nguyên tố Copper có hai đồng vị là 63Cu và 65Cu. Nguyên tử khối trung bình của Copper là 63,54. Thành phần % số nguyên tử của đồng vị 65Cu là
A. 27%. B. 50%. C. 54%. D. 73%.
Câu 37: Trong tự nhiên Magnesium có 3 đồng vị bền 24Mg chiếm 78,99%, 25Mg chiếm 10,00% và 26Mg.
Nguyên tử khối trung bình của Magnesium là
A. 24,00. B. 24,11. C. 24,32. D. 24,89.
Câu38: Nguyên tử khối trung bình của nguyên tố X là 79,91. Biết X có hai đồng vị bền trong đó đồng vị 79X chiếm 54,5% số nguyên tử. Số khối của đồng vị còn lại là
A. 80. B. 81. C. 82. D. 83.
Câu 39: Nguyên tử khối trung bình của Neon (Ne) là 20,19. Biết Neon có ba đồng vị bền trong đó đồng vị 20Ne chiếm 90,48% và đồng vị 21Ne chiếm 0,27% số nguyên tử. Số khối của đồng vị còn lại là
A. 18. B. 19. C. 22.
D. 23.
Câu 40: Trong tự nhiên Iron gồm 4 đồng vị bền 54Fe chiếm 5,8%, 56Fe chiếm 91,72%, 57Fe chiếm 2,2% và
58Fe chiếm 0,28%. Bromine là hỗn hợp hai đồng vị bền 79Br chiếm 50,69% và 81Br chiếm 49,31%. Thành phần % khối lượng của 56Fe trong FeBr3 là
A. 17,36%. B. 18,92%. C. 27,03%. D. 27,55%.
Câu 41: Trong tự nhiên Chlorine có hai đồng vị bền: 37Cl chiếm 24,23% tổng số nguyên tử, còn lại là 35Cl.
Thành phần % theo khối lượng của 37Cl trong HClO4 là
A. 8,92% B. 8,43% C. 8,56% D. 8,79%
Câu42: Boron có 2 đồng vị bền là 10B và 11B với nguyên tử khối trung bình là 10,81. Thành phần % về khối lượng của đồng vị 11B chứa trong H3BO3 là
A. 14,00%. B. 14,16%. C. 14,42%. D. 15,00%.
Câu 43: Trong tự nhiên đồng vị 37Cl chiếm 24,23% số nguyên tử Chlorine. Nguyên tử khối trung bình của Chlorine là 35,5. Phần trăm về khối lượng của 35Cl trong KClO4 là
A. 19,42%. B. 9,82%. C. 6,47%. D. 19,15%.
Câu 44: Trong tự nhiên, nguyên tố Bromine có 2 đồng vị bền là 79Br và 81Br. Nếu nguyên tử khối trung bình là Bromine là 79,91 thì phần trăm số nguyên tử của hai đồng vị này lần lượt là
A. 35% và 65% B. 45,5% và 54,5%
C. 54,5% và 45,5%. D. 61,8% và 38,2%.
Câu45: Theo Viện Thiên văn học ETH, 20Ne và 22Ne là một trong những chất khí tạo nên mặt trời. Phát biểu nào sau đây là đúng ?
A. 20 Ne và 22 Ne là đồng vị của nhau.
B. 20 Ne và 22 Ne có cùng tổng số hạt trong hạt nhân.
C. 20 Ne và 22 Ne có cùng khối lượng.
D. 20 Ne và 22 Ne có cùng số neutron.
Câu 46: Trong tự nhiên, Iridium có hai đồng vị bền có số khối lần lượt là 191 và 193. Nguyên tử khối trung
bình của Iridium là 192,22. Tỉ lệ số nguyên tử của hai đồng vị là
A. 39 : 61 B. 61 : 39 C. 1 : 1 D. 39 : 11
Câu 47: Tai nạn hạt nhân tại Nhật Bản đã sinh ra một lượng rất nhỏ 131I, sự có mặt của 131I trong không khí có thể gây ung thư tuyến giáp khi con người tiếp xúc với nó; vậy nhưng khác với 131I, 127I lại là nguyên tố vi lượng cần thiết cho cơ thể con người với vai trò ngăn chặn sự hấp thụ phóng xạ 131I của tuyến giáp. Ngoài ra người sử dụng đủ hàm lượng 127I có tác dụng ngăn ngừa bệnh bướu cổ. Khẳng định nào sau đây là sai ?
A. 131I và 127 I là đồng vị của nhau.
B. 131I và 127 I có cùng số proton.
C. 131I và 127 I là hai nguyên tố hóa học khác nhau.
D. Dùng muối I ốt hàng ngày không có tác dụng ngăn ngừa bức xạ i-ốt.
Câu 48: Iodine là một nguyên tố vi lượng cần thiết cho cơ thể con người, iodine là thành phần của thyroxin, một loại hormone được tạo ra bởi tuyến giáp giúp kiểm soát tốc độ phát triển thể chất và tinh thần của cơ thể.
Thiếu iodine có thể gây ra bướu cổ, sưng tuyến giáp. Do đó, iondine thường được bổ sung cho cơ thể dưới dạng muối (KI, KIO3). Trong hơn 30 đồng vị của iodine đã biết, chỉ đồng vị 127I tồn tại trong tự nhiên, đồng vị phóng xạ nhân tạo 131I có thể tiêu diệt tế bào ung thư tuyến giáp, được sử dụng điều trị bệnh bệnh cường giáp, lượng 131I có trong cơ thể có thể bị đào thải nhanh do bị thay thế bởi 127I.
48.1. Cụm từ "nguyên tố vi lượng" trong đoạn văn trên được hiểu là
A. thành phần quan trọng của thyroxin.
B. nguyên tố cần thiết cho cơ thể
C. nguyên tố cơ thể cần với một lượng nhỏ.
D. nguyên tố cơ thể cần với kích thước nhỏ
48.2. Thành phần nguyên tử 131 53 I là protons Neutrons
48.3. Phát biểu nào sau đây đúng ?
A. 127I và 131I là những nguyên tố khác nhau của nguyên tử iodine.
B. 127I có tác dụng tiêu diệt tế bào ung thư.
C. 127I và 131I là có cùng số neutron trong hạt nhân.
D. 127I và 131I là các nguyên tử đồng vị.
48.4. Thực phẩm nào sau đây không phải là nguồn bổ sung iodine cho cơ thể ?
A. Tảo tía. B. Thịt gà. C. Rau chân vịt. D. Rau cần.
Câu 49: Phần lớn các phân tử nước (H2O) chứa đồng vị 16O và 1H, nhưng một tỉ lệ nhỏ chứa đồng vị 18O và
D (2H, hoặc deuterium). Khi nước bay hơi vào khí quyển, các phân tử nước chứa đồng vị nhẹ bay hơi dễ dàng
hơn, khi nước ngưng tụ thành mưa, các đồng vị nặng sẽ dễ dàng ngưng tụ hơn
đồng vị nhẹ. Như vậy, những thay đổi địa chất trong môi trường toàn cầu được nghiên cứu bằng cách phân tích các đồng vị của hydrogen chứa trong các sông

băng được tạo ra bởi sự tích tụ của tuyết. Tỷ lệ 2H/1H của các phân tử nước trong
sông băng thay đổi tùy thuộc vào nhiệt độ khi tuyết được hình thành và bằng
cách phân tích các bong bóng khí có trong sông băng, chúng ta có thể tìm hiểu
về các thành phần khí như Methane và carbon dioxide đã có mặt. trong không khí tại thời điểm đó. Từ kết quả phân tích địa chất này, chúng ta có thể biết được sự thay đổi nhiệt độ của trái đất trong quá khứ. Phát biểu nào sau đây là không đúng về điều này?
A. Tỷ lệ 2H/1H trong sông băng nhỏ hơn trong nước biển.
B. Tỷ lệ 2H/1H trong nước biển lớn hơn trong nước khí quyển.
C. Nhiệt độ càng cao thì tỉ lệ 2H/1H của nước trong khí quyển càng lớn.
D. Nồng độ carbon dioxide trong khí quyển càng cao thì nhiệt độ khí quyển càng cao.

Câu50: Cho hình vẽ mô phỏng các nguyên tử với số liệu như sau (trong đó 8n, 9n là số hạt neutron có trong hạt nhân mỗi nguyên tử).
Cho các phát biểu sau:
Bình 1 Bình 2
(1) Trong bình 1, tỉ lệ mol giữa 35Cl2/37Cl2 = 4.
(2) Số nguyên tử 37Cl trong bình 2 gấp đôi số nguyên tử 37Cl trong bình 1.
(3) Số mol neutron trong bình 1 nhiều hơn số mol neutron trong bình 2 là 2 mol.
Các phát biểu đúng là
A. (1). B. (2). C. (2) và (3). D. (1) và (3).
Câu53: Cho mô hình nguyên tử được cấu tạo bởi ba loại hạt cơ bản X - Z như hình vẽ dưới:
Phát biểu nào sau đây về các hạt cấu tạo nên nguyên tử không đúng?
A. Số hạt Y và số hạt Z bằng nhau trong mọi nguyên tử.
B. Trong mọi nguyên tử, khối lượng của Y lớn hơn khối lượng của X.
C. Tổng số điện tích của Y và Z trong tất cả các nguyên tử là dương.
D. Tổng số của Y và Z trong tất cả các nguyên tử
c gọi là số khối của nguyên t
Nhận xét nào sau đây sai?
A. 1 và 2 là các đồng vị của cùng một nguyên tố hóa học.
B. 1 và 3 là các đồng vị của cùng một nguyên tố hóa học.
C. 1 và 2 là nguyên tử của hai nguyên tố hóa học khác nhau.
D. 1 và 3 có cùng số proton trong hạt nhân.
Câu 51: Bảng sau chứa thông tin về ba nguyên tử (A), (B) và (C) thuộc về hai nguyên tố hóa học X và Y.
Trong thực tế, nguyên tố X có hai đồng vị mX, nX (m > n), nguyên tử khối trung bình là 63,6.
Nguyêntử (A) (B) (C)
Số khối 63 64 65
Số neutron a a b
BÀI 4 + 5 : CẤU TRÚC LỚP VỎ NGUYÊN TỬ - CẤU HÌNH
Dạng1:Cấutrúcvỏ nguyêntử
Cho các phát biểu sau:
(1) Nguyên tử A là đồng vị nX.
(2) Nguyên tử (B) và (C) có cùng số electron.
(3) Trong tự nhiên, đồng vị mX chiếm 30% số lượng nguyên tử
(4) Trong 2,544 gam đơn chất của X, đồng vị nX chiếm 65,33 % khối lượng.
Số phát biểu đúng là?
A. 1. B. 2. C. 3. D. 4.
Câu52: Cho 2 bình khí riêng biệt, bình 1 chứa 1 mol hỗn hợp 35Cl2 và 37Cl2, bình 2 chứa 1 mol 35Cl37Cl.
Biết số mol nguyên tử 35Cl trong bình 1 gấp 3/2 lần số mol 35Cl trong bình 2.
Câu1: Mỗi orbital nguyên tử chứa tối đa
A. 1 electron.




C. 3 electron.
Câu2: Số electron tối đa trên orbital p là bao nhiêu?
B. 2 electron.
D. 4 electron.
A. 8. B. 6. C. 3. D. 2.
Câu3: Số electron tối đa trên orbital 2s là bao nhiêu?
A. 8.
C. 3
B. 6.
D. 2
Hình1.40.Orbital2s
Câu4: Dãy nào trong các dãy sau đây gồm các phân lớp electron đã bão hòa?
A. s1, p3, d7, f12 B. s2, p6, d10, f14

C. s2, d5, d9, f13 D. s2, p4, d10, f10
Câu5: Số electron tối đa ở lớp thứ 3 là
A. 8 B. 18 C. 28
Câu6: Số electron có trên lớp L của nguyên tử Carbon (Z = 6) là
A. 2 B. 3 C. 4
Câu7: Số electron có trên lớp L của nguyên tử Nitrogen (Z = 7) là
A. 2 B. 3
Câu8: Nguyên tử nào sau đây có 5 electron trên lớp L?
4
A. 11Na B. 7N C. 13Al
Câu9: Orbital tiếp theo được lấp đầy sau 4s là
A. 5s B. 3d C. 4p
Câu10: Khẳng định nào dưới đây là đúng? Orbital py có dạng hình số tám nổi
A. được định hướng theo trục z.
B. được định hướng theo trục y.
C. được định hướng theo trục x.
D. Không định hướng theo trục nào.
32
5
5
6C
C. Orbital trong cùng một phân lớp electron có hình dạng tương tự nhau nhưng khác nhau về định hướng không gian.
D. Orbital trong cùng một lớp electron có hình dạng và định hướng không gian tương tự nhau.
Câu16: Chọn phát biểu đúng về orbital nguyên tử (AO)?
A. Quỹ đạo chuyển động của electron.
B. Vùng không gian bên trong đó các electron chuyển động.
C. Bề mặt có mật độ electron bằng nhau của đám mây electron.
D. Vùng không gian quanh nhân, trong đó có xác suất gặp electron khoảng 90%.
Câu17: Trong nguyên tử Chlorine (Z = 17), số electron ở phân mức năng lượng cao nhất là
A. 7. B. 5. C. 9. D. 2.
Câu18: Hãy cho biết lớp N có thể chứa tối đa bao nhiêu electron?
A. 2. B. 8. C. 18. D. 32.
Câu19: Chọn câu phát biểu đúng?
A. Số phân lớp electron có trong lớp N là 4.
3p
B. Số phân lớp electron có trong lớp M là 4.
C. Số orbital có trong lớp N là 9.
D. Số orbital có trong lớp M là 8.
Câu11: Khẳng định nào dưới đây là đúng? Trong nguyên tử hydrogen electron thường được tìm thấy
A. trong hạt nhân nguyên tử.
B. bên ngoài hạt nhân song ở gần hạt nhân vì electron bị hút bởi hạt proton.
C. bên ngoài hạt nhân và thường ở xa hạt nhân vì thể tích nguyên tử là mây electron của nguyên tử đó.
D. cả bên trong và bên ngoài hạt nhân vì electron luôn được tìm thấy ở bất kì chỗ nào trong nguyên tử
Câu12: Các orbital trong một phân lớp electron
A. Có cùng sự định hướng trong không gian
B. Có cùng mức năng lượng.
C. Khác nhau về mức năng lượng.
D. Có hình dạng không phụ thuộc vào đặc điểm mỗi phân lớp.
Câu13: Kí hiệu và số electron tối đa có trên lớp electron ứng với giá trị n = 2 tương ứng là
A. Lớp L và 2e.
C. Lớp K và 8e.
Câu14: Orbital nguyên tử là gì?
B. Lớp L và 8e.
D. Lớp K và 6e.
A. Khu vực không gian xung quanh hạt nhân có thể tìm thấy electron.
B. Khu vực không gian xung quanh hạt nhân.
C. Khu vực không gian xung quanh hạt nhân mà tại đó xác xuất tìm thấy electron khoảng 90%.
D. Khu vực không gian xung quanh hạt nhân mà tại đó xác xuất tìm thấy electron khoảng 95%.
Câu15: Phát biểu nào dưới đây là đúng?
A. Orbital s có dạng hình số tám nổi gồm 3 orbital định hướng theo ba hướng khác nhau.
B. Orbital s có dạng hình số tám nổi, orbital p có dạng hình cầu.
Hình1.41Cácphânlớpelectron
Câu20: Chọn phát biểu đúng khi nói về các orbital trong một phân lớp electron?
A. Có cùng sự định hướng không gian.
B. Có cùng mức năng lượng.
C. Khác nhau về mức năng lượng.
D. Có hình dạng không phụ thuộc vào đặc điểm mỗi phân lớp.
Câu21: Lớp M có bao nhiêu orbital?
A. 9. B. 6. C. 12. D. 16.
Câu22: Lớp electron thứ 4 có kí hiệu là gì?
A. K B. L C. M D. N
Câu23: Trong các AO sau, AO nào là AOs ? z z y y
x y 1 2 3 4
A. Chỉ có 1. B. Chỉ có 2.
C. Chỉ có 3 D. Chỉ có 4
Câu24: Trong các AO sau, AO nào là AOpx ? z z y y
A. Chỉ có 1
C. Chỉ có 3
Dạng2:Bàitậpcấuhình
B. Chỉ có 2
D. Chỉ có 4
Câu25: Lớp electron ngoài cùng của nguyên tử Nitrogen có cấu hình
A. 1s22s22p3 B. 2p3 C. 2s22p3 D. 1s2
Câu26: Nguyên tử của nguyên tố Aluminium có 13 electron. Kết luận nào sau đây đúng?
A. 1s2 2s2 2p6 3s1 .
C. 1s2 2s2 2p6 3s3
B. 1s2 2s2 2p6 .
D. 1s2 2s2 2p6 3s2 3p6
Câu35: Ion X2+ có cấu hình electron là 1s2 2s2 2p6. Nguyên tố X là
A. Ne (Z= 10).
C. Na (Z = 11).
B. Mg (Z = 12).
D. O (Z = 8).
Câu 36: Cấu hình electron nguyên tử ở trạng thái cơ bản nào là đúng cho nguyên tử có số hiệu nguyên tử là 16?
A. 1s2 2s
C.
Câu 37: Nguyên tử của nguyên tố X có electron ở mức năng lượng cao nhất là 3s. Nguyên tử của nguyên tố
Y cũng có electron ở mức năng lượng 3s và có 5 electron ở lớp ngoài cùng. Nguyên tử X và Y có số electron
hơn kém nhau là 3. Nguyên tố X, Y lần lượt là
A. kim loại và phi kim.
C. kim loại và khí hiếm.
Câu38: Cấu hình electron của Cu (Z = 29) là
B. phi kim và kim loại.
D. khí hiếm và kim loại.
Hình1.42.Nguyêntử Aluminium

A. Lớp electron ngoài cùng của Aluminium có 3e.
B. Lớp electron ngoài cùng của Aluminium có 1e.
C. Lớp L (lớp thứ 2) của Aluminium có 6e.
D. Lớp L (lớp thứ 2) của Aluminium có 3e hay nói cách khác là lớp electron ngoài cùng của Aluminium có 3e.
Câu27: Số electron tối đa trong lớp M là
A. 2 B. 8 C. 18 D. 32
Câu28: Nguyên tử của nguyên tố hóa học nào sau đây có cấu hình electron là 1s22s22p63s2?
A. Ca (Z=20). B. K (Z=19). C. Mg (Z=12). D. Na (Z=11).

Câu29: Các electron của nguyên tử nguyên tố X được phân bố trên 3 lớp, lớp thứ 3 có 7 electron. Số đơn vị điện tích hạt nhân của nguyên tử nguyên tố X là?
A. 7 B. 9 C. 15 D. 17.
Câu30: Các electron của nguyên tố X được phân bố trên 2 lớp, lớp thứ 2 có 7 electron. Số hiệu nguyên tử của nguyên tố X là
A. 7. B. 8. C. 9. D.10.
Câu31: Cho cấu hình electron nguyên tử của các nguyên tố sau:
X. 1s2 2s2
Z.
;
;
A. 1s2 2s2 2p6 3s2 3p6 3d10 4s1
C. 1s2 2s2 2p6 3s2 3p6 4s2 3d9 .
B. 1s2 2s2 2p6 3s2 3p6 3d9 4s2
D. 1s2 2s2 2p6 3s2 3p6 4s2 3d10 .
Câu39: Nguyên tử của nguyên tố hoá học A (Z = 20) có cấu hình electron ở lớp ngoài cùng là
A. 3s2 3p2 . B. 3s2 3p6 . C. 3s2 3p4 . D. 4s2 .
Câu40: Một ion R3+ có phân lớp cuối cùng là 3d5. Cấu hình electron củ
Dạng3:Cấuhìnhtheoorbital
Câu41: Nguyên tử M có cấu hình electron 1s22s22p4. Cấu hình electron theo ô orbital là
B.
C.
D.
Câu 42: Cấu hình electron của nguyên tử X được biểu diễn bằng ô orbital. Thông tin nào dưới đây không
đúng khi nói về cấu hình của nguyên tử X ?
;
Dãy cấu hình electron của các nguyên tử nguyên tố kim loại là
.
A. X, Y, Z. B. X, Y, T. C. Y, Z, T. D. X, Z, T.
Câu32: Nguyên tử nguyên tố Y có tổng số electron trên các phân lớp p là 11. Nguyên tố Y là
A. Sulfur (Z = 16).
C. Fluorine (Z = 9).
Câu33: Cấu hình electron nào sau đây không đúng?
A. 1s22s22p5
C. 1s22s22p63s23p5 .
B. Chlorine (Z = 17).
D. Potassium (Z = 19).
B. 1s22s22p63s2
D. 1s22s22p63s23p34s2 .
Câu34: Khi nguyên tử Chlorine (Z=17) nhận thêm 1e thì cấu hình electron của ion tương ứng là
A. Nguyên tử X có 7 electron.
B. Lớp ngoài cùng có 3 electron
C. Nguyên tử X có 3 electron độc thân.
D. Nguyên tử X có 2 lớp electron.
Câu43: Nguyên lí hay quy tắc nào bị vi phạm trong cấu hình theo ô orbital được cho dưới đây?
A. Quy tắc của Hund.
B. Không vi phạm nguyên lí, quy tắc nào.
C. Nguyên lí Pauli.
D. Quy tắc Klechkovski.
Tài liệu phát hành từ website Tailieuchuan.vn
Câu44: Nhận xét nào đúng về sự sắp xếp electron trên các orbital của nguyên tử dưới đây?
1s 2s 2p
Câu 49: Cấu hình theo ô orbital của một số nguyên tố được cho dưới đây. Cấu hình electron của nguyên tử nguyên tố là
A. 1s1 2s1 2p3 3s1 B. 1s2 2s2 2p5 3s1
C. 1s22s22p63s2 . D. 1s22s22p63s1 .
Câu50: Cấu hình electron biểu diễn theo ô lượng tử nào dưới đây không đúng?
A. B.
C. D.
Câu51: Cấu hình nào sau đây vi phạm nguyên lí Pauli?
A. 1s2 B. 1s22s22p3
A. Cả hai mũi tên trong ô 2p phải hướng lên trên.
B. Sự sắp xếp các electron trên các orbital của nguyên tử trên là hoàn toàn chính xác.
C. Trong orbital 2p chỉ nên có 1 electron trong ô 2p đầu tiên và một electron trong ô 2p thứ hai

D. Tất cả các mũi tên phải hướng lên trên.
Câu45: Nguyên tử của nguyên tố X có Z = 28, cấu hình electron của ion X2+ là
A. 1s22s22p63s23p63d8
C. 1s22s22p63s23p6 4s23d6 .
B. 1s22s22p63s23p63d6
D. 1s22s22p63s23p63d2 .
Câu46: Nguyên tử của nguyên tố X có sự sắp xếp electron trên các orbital của nguyên tử như hình dưới đây.
X là nguyên tố nào?
A. Carbon (Z = 6).




C. Oxygen (Z = 8).


Câu47: Phân lớp p có bao nhiêu AO?
A. 1 B. 3
B. Fluorine (Z = 9).
D. Nitrogen (Z = 7).
C. 5
D. 7
Câu 48: Cấu hình theo ô orbital của một số nguyên tố được cho dưới đây. Cấu hình nào vi phạm nguyên lí Pauli?
A. ↑↓ ↑↑ ↑ 1s 2s 2p

B. ↑↓ ↑↓ ↑ ↑ 1s 2s 2p
C. ↑↓ ↑ 1s 2s 2p
D. ↑↓ ↑↓ ↑↓
C. 1s22s22p63s3 . D. 1s22s22p4 .
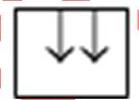
Câu 52: Cấu hình electron ở trạng thái cơ bản của nguyên tử kim loại nào sau đây có electron độc thân ở orbital s? (Cho số hiệu nguyên tử của Cr = 24, Ni = 28, Co = 27, Fe = 26)


A. Chromium B. Nickel C. Cobalt D. Iron




Câu53: Nguyên tử M có cấu hình electron 1s22s22p4. Cấu hình electron theo orbital là
B. C. D.
Câu54: Ở trạng thái cơ bản, nguyên tử của nguyên tố nào dưới đây có electron độc thân?
(Cho số hiệu nguyên tử của He = 2, Ne = 10, B = 4, Mg = 12)




A. Helium B. Neon C. Boron D. Magnesium.
Câu32: Sự phân bố electron theo ô lượng tử nào dưới đây là đúng?
C. D.
Câu55: Hình vẽ nào sau đây vi phạm nguyên lý Pauli khi điền electron vào AO?
a b c d
A. a B. b
C. a và b D. c và d
Câu56: Cho các cấu hình sau của N (Z = 7). Hình vẽ nào sau đây đúng với quy tắc Hund?
Câu60:Cấuhìnhnàosau đâycủaionNa+ (Z=11)? A.




















































































































































































↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑
↑↓ ↑↓ ↑↓ ↑↓ ↑↓
↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓
↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑
Câu 57: Cấu hình electron của nguyên tử nguyên tố X sau biểu diễn bằng ô lượng tử. Thông tin nào không đúng khi nói về cấu hình electron nguyên tử của nguyên tố đã cho? 1s2 2s2 2p3
A. Nguyên tử có 7 electron.B. Lớp ngoài cùng có 3 electron.
C. Nguyên tử có 3 electron độc thân D. Nguyên tử có 2 lớp electron.
Câu58: Cho các cấu hình lớp ngoài cùng của Sulfur (Z=16) như sau, cấu hình ở trạng thái cơ bản là
Câu61: Cấu hình nào sau đây là cấu hình của ion Cl- (Z = 17)? A. B. C.

↓↑ ↓↑ ↓↑ ↓↑ ↓↑ ↓↑ ↓↑ ↓↑ ↓
↓↑ ↓↑ ↓↑ ↓↑ ↓↑ ↓↑ ↓↑ ↓↑ ↓↑
↓↑ ↓↑ ↓↑ ↓↑ ↓↑ ↓↑ ↓↑ ↓↑ ↑
↓↑ ↓↑ ↓↑ ↓↑ ↓↑ ↓↑ ↓↑ ↑ ↑
Câu59: Cho biết đâu nào là cấu hình đúng của Aluminium (Z =13) ở trạng thái cơ bản?
↑↓ ↑ ↑ ↑ ↑
↑↓ ↑ ↑ ↑ ↑ ↑↓
↑↓ ↑ ↑ ↑↓
Câu62: Cấu hình electron lớp sát ngoài cùng và ngoài cùng của ion Fe2+ (Z=26) là: A. B. C. D.
↑ ↑ ↑ ↑ ↑ ↑
Câu63: Cấu hình theo orbital của các nguyên tử ở trạng thái cơ bản của một số nguyên tố ở chu kì II, theo đó phát biểu nào sau đây là sai ?
A. Mỗi orbital nguyên tử chỉ chứa được nhiều nhất 2 electron
B. Khi sắp xếp các electron trong cùng một mức năng lượng thì chúng luôn ưu tiên chiếm cùng một quỹ
đạo.
C. Số mức năng lượng trong mỗi lớp năng lượng bằng số lớp năng lượng
D. Nếu có 2 electron trong cùng một orbital nguyên tử thì chiều tự quay của chúng ngược nhau.
Dạng4:Bàitậptổnghợp
Câu64: Cho các phát biểu sau:
(1) Các electron ở lớp L có mức năng lượng gần bằng nhau
(2) Các electron ở lớp M (n = 3) liên kết chặt chẽ với hạt nhân hơn các electron ở lớp K (n = 1)
(3) Các electron ở lớp L có mức năng lượng cao hơn các electron ở lớp K.
(4) Các electron ở lớp K có mức năng lượng bằng nhau.
(5) Các electron ở phân lớp 3s có mức năng lượng thấp hơn các electron ở phân lớp 2p
Số phát biểu đúng là
A. 2. B. 3. C. 4. D. 5 .
Câu65: Cho các phát biểu sau
(a) Nguyên tử Iron (Z = 26) có số eletron hóa trị là 8.
(b) Cấu hình electron 1s22s22p63s23p64s1 là của nguyên tử nguyên tố Sodium (ZNa = 11).
(c) Cấu hình electron của nguyên tử 24Cr là 1s22s22p63s23p63d54s1 .
(d) Nguyên tử Sulfur (Z=16) có 5 lớp e, phân lớp ngoài cùng có 6e.
(e) Trong nguyên tử Chlorine (Z=17) số electron ở phân mức năng lượng cao nhất là 7
Số phát biểu đúng là
A. 1. B. 2. C. 3. D. 4.
Câu66: Có các nhận định sau:
(1) Số khối A là tổng số proton và số electron.
(2) Số đơn vị điện tích hạt nhân bằng số hạt proton.
(3) Nguyên tử luôn trung hòa về điện nên có số hạt electron = số neutron.
(4) Hạt nhân của hầu hết các nguyên tử do các loại proton và neutron cấu tạo nên.
(5) Tổng số proton và số electron trong một hạt nhân gọi là số khối. Số nhận định đúng là
A. 4 B. 1 C.2 D. 3
Câu67: Hình dưới mô tả orbital (a) và orbital (b) chứa electron trong nguyên tử sodium (Na) ở trạng thái cơ bản. Mức năng lượng của orbital (a) cao hơn orbital (b).
C. Các electron ở lớp K có mức năng lượng cao nhất.
D. Các electron ở lớp K có mức năng lượng bằng nhau.
Câu69: Nguyên tử của nguyên tố X có tổng số electron p là 7. Kết luận nào sau đây về X là không đúng?
A. X là kim loại. B. X là nguyên tố d.
C. Trong nguyên tử X có 3 lớp electron. D. Trong nguyên tử X có 13 electron.
(a) (b)
Cho các phát biểu sau:
(1) Electron trong các orbital (a) và (b) thuộc cùng lớp electron.
(2) Số electron trong obitan (b) gấp đôi số electron trong orbital (a).

(3) Electron trên orbital (a) nằm gần hạt nhân hơn electron trên oribital (b).
Các phát biểu đúng là
A. (1). B. (2).
C. (1) và (3).
D. (2) và (3).
Câu 68: Khi phát biểu về mức năng lượng của các electron trong nguyên tử, điều khẳng định nào sau đây là sai ?
A. Các electron ở lớp K có mức năng lượng thấp nhất.
B. Các electron ở lớp ngoài cùng có mức năng lượng trung bình cao nhất.
Câu 70: Nguyên tử của nguyên tố T có cấu hình electron nguyên tử là
. Phát biểu nào sau đây về nguyên tố T không đúng?
A. Cấu hình electron của ion T2+ là 3d5
B. Nguyên tử của T có 2 electron hóa trị
C. T là kim loại.
D. T là nguyên tố d.
Câu 71: Nguyên tử của nguyên tố X có electron ở mức năng lượng ở mức cao nhất là 3p. nguyên tử của nguyên tố Y cũng có electron ở mức năng lượng 3p và có một electron ở lớp ngoài cùng. Nguyên tử X và Y có số electron hơn kém nhau 3 hạt. Nguyên tử X, Y lần lượt là nguyên tử của các nguyên tố
A. Khí hiếm và kim loại
B. Kim loại và kim loại
C. Kim loại và khí hiếm.
D. Phi kim và kim loại
Câu 72: Nguyên tử X, ion Y2+ và ion Z- đều có cấu hình electron là 1s22s22p6. X, Y, Z là kim loại, phi kim hay khí hiếm?
A. X: Phi kim ; Y: Khí hiếm ; Z: Kim loại.
B. X: Khí hiếm ; Y: Phi kim ; Z: Kim loại.
C. X: Khí hiếm ; Y: Kim loại ; Z: Phi kim.
D. X: Khí hiếm ; Y: Phi kim ; Z: Kim loại.
Câu73: Cho các phát biểu sau:
(1). Tất cả các hạt nhân nguyên tử đều được cấu tạo từ các hạt proton và neutron.
(2). Khối lượng nguyên tử tập trung phần lớn ở lớp vỏ
(3). Trong nguyên tử số hạt electron bằng số hạt proton.
(4). Trong nguyên tử hạt mang điện là proton và electron.
(5). Trong nguyên tử, hạt electron có khối lượng không đáng kể so với khối lượng của các hạt còn lại. Số phát biểu đúng là
A. 1 B. 2 C. 3 D. 4
Câu74: Cho các phát biểu sau:
(1) Trong một nguyên tử số proton luôn bằng số electron bằng số đơn vị điện tích hạt nhân.
(2) Tổng số proton và số electron trong một hạt nhân được gọi là số khối.
(3) Số khối A là khối lượng tuyệt đối của nguyên tử
(4) Đồng vị là các nguyên tử của cùng một nguyên tố hóa học nhưng có số neutron khác
CHUYÊN ĐỀ 01: CẤUTẠO NGUYÊNTỬ
A. CÂU HỎI CỦNG CỐ KIẾN THỨC
Câu 1: Hoàn thành các nội dung sau:
- Nguyên tố hóa học là: .............................................
- Kí hiệu nguyên tử là: ....................................................................................................................................................
- Đồng vị là: ..............................................
- Orbital nguyên tử (AO) là: .........................................
- Kí hiệu các lớp electron trong nguyên tử: ...................................................................................................................
- Kí hiệu phân lớp electron trong nguyên tử: .................................................................................................................
- Nguyên lý vững bền: ................................................
- Nguyên lý Pauli:................................
- Quy tắc Hund: ..............................................................................................................................................................
- Cấu hình electron: …………………………………………………………………………………………
Câu 2: Điền thông tin còn thiếu vào ô trống thích hợp trong bảng sau:
IỆN TÍCH
SHNT KÍ HIỆU SỰ PHÂN BỐ ELECTRON TRÊN CÁC LỚP
Bảng 5
LÀ KL/PK/KH SỰ PHÂN BỐ ELECTRONG TRONG AO Ở LỚP NGOÀI CÙNG
B. HỆ THỐNG CÂU HỎI TRẮC NGHIỆM
● Cấp độ nhận biết
Câu 1: Năm 1897, nhà bác học người Anh J.J Thomson đã tìm ra loại hạt nào trong nguyên tử?
A. electron. B. neutron. C. proton. D. hạt nhân.
Câu 2: Năm 1911, nhà bác học người Anh E.Rutherford đã tìm ra loại hạt nào trong nguyên tử?
A. electron. B. neutron. C. proton. D. hạt nhân.
Câu 3: Năm 1918, nhà bác học người Anh E.Rutherford đã tìm ra loại hạt nào trong nguyên tử?
A. electron. B. neutron. C. proton. D. hạt nhân.
Câu 4: Năm 1932, nhà bác học J.Chadwick (cộng tác viên E.Rutherford) của đã tìm ra loại hạt nào trong nguyên tử?
A. electron. B. neutron. C. proton. D. hạt nhân.
Câu 5: Hầu hết các nguyên tử được cấu tạo bởi bao nhiêu loại hạt cơ bản?
A. 1. B. 2. C. 3. D. 4.
Câu 6: Những loại hạt cấu tạo nên hầu hết các hạt nhân nguyên tử là
A. Electron và neutron.
C. Neutron và proton.
Câu 7: Các hạt cấu tạo nên hầu hết các nguyên tử là
B. Electron và proton.
D. Electron, neutron và proton.
A. Neutron và proton. B. Electron, neutron và proton.
C. Electron và proton. D. Electron và neutron.
Câu 8: Nguyên tử chứa những hạt mang điện là
A. electron. B. electron và neutron.
C. proton và neutron. D. proton và electron.
ION CẤU HÌNH ELECTRON NGOÀI CÙNG CỦA ION
Bảng 6
CẤU HÌNH ELECTRON NGOÀI CÙNG CỦA NGUYÊN TỬ TƯƠNG ỨNG
KÍ HIỆU NGUYÊN TỬ
X+ 262s2p Y2+ E3+ ZT2R+ 263s3p M2+ DA24
Câu 9: Hạt mang điện trong nhân nguyên tử là
A. electron. B. proton.
C. neutron. D. proton và neutron.
Câu 10: Trong nguyên tử, loại hạt nào có khối lượng không đáng kể so với các hạt còn lại?
A. Proton. B. Neutron.
C. Electron. D. Neutron và electron.
Câu 11: Nguyên tố hóa học là tập hợp các nguyên tử có cùng
A. số khối. B. số proton. C. số electron. D. neutron.
Câu 12: Số hiệu nguyên tử cho biết thông tin nào sau đây?
A. Số proton.
C. Số khối.
Câu 13: Kí hiệu nguyên tử nào sau đây được viết đúng?
B. Số neutron.
D. Nguyên tử khối.
A. 15 7 N B. 16 7 O C. 32 15 S D. 24 12Mg
Câu 14: Kí hiệu nguyên tử nào sau đây được viết sai?
A. 23 11 Na B. 27 13 Al C. 56 26 Fe D. 20 40 Ca
Câu 15: Nguyên tử 27 13 Al có:
A. 13p, 13e, 14n. B. 13p, 14e, 14n.
C. 13p, 14e, 13n. D. 14p, 14e, 13n.
Câu 16: Các nguyên tử nào dưới đây thuộc cùng một nguyên tố hóa học?
A. G 14 7 ; M 16 8 . B. L 16 8 ; D 22 11 . C. E 15 7 ; Q 22 10 . D. M 16 8 ; L 17 8 .
Câu 17: Dãy nào sau đây gồm các đồng vị của cùng một nguyên tố hoá học?
A. 14 6 X , 14 7 Y , 14 8 Z .
C. 28 14 X , 29 14 Y , 30 14 Z
B. 19 9 X , 19 10 Y , 20 10 Z .
D. 40 18 X , 40 19 Y , 40 20 Z
Câu 18: Dãy nào sau đây gồm các nguyên tử thuộc cùng một nguyên tố hoá học?
A. 14 6 X , 14 7 Y , 16 8 Z
C. 17 8 Q , 16 9 M , 19 10 E
Câu 19: Orbital s có dạng
A. hình tròn. B. hình số 8 nổi.
Câu 20: Orbital p có dạng
A. hình tròn. B. hình số 8 nổi.
Câu 21: Mỗi orbital nguyên tử chứa tối đa
A. 1 electron. B. 2 electron.
B. 16 8 Z , 16 9 M , 16 7 G
D. 16 8 Z , 17 8 Q , 18 8 L
C. hình cầu. D. hình bầu dục.
C. hình cầu. D. hình bầu dục.
C. 3 electron. D. 4 electron.
Câu 22: Các lớp electron được đánh số từ trong ra ngoài bằng các số nguyên dương: n = 1, 2, 3,… với tên gọi là
các chữ cái in hoa tương ứng là
A. K, L, M, O,…
C. K, L, M, N, …
Câu 23: Số electron tối đa ở lớp thứ n ≤ (n4) là
A. n. B. 2n.
B. L, M, N, O,…
D. K, M, N, O, …
C. 2n2 D. n2
Câu 24: Electron thuộc lớp nào sau đây liên kết chặt chẽ nhất với hạt nhân?
A. Lớp N. B. Lớp L. C. Lớp M. D. Lớp K.
Câu 25: Electron thuộc lớp nào sau đây liên kết kém chặt chẽ với hạt nhân nhất?
A. lớp K. B. lớp L. C. lớp M. D. lớp N.
Câu 26: Nguyên tử của một nguyên tố có bốn lớp electron, theo thứ tự từ phía gần hạt nhân là: K, L, M, N. Electron thuộc lớp nào có mức năng lượng trung bình cao nhất?
A. Lớp K. B. Lớp L. C. Lớp M. D. Lớp N.
Câu 27: Các phân lớp trong mỗi lớp electron được kí hiệu bằng các chữ cái viết thường theo thứ tự là
A. s, d, p, f. B. s, p, d, f. C. s, p, f, d. D. f, d, p, s.
Câu 28: Số orbital trong các phân lớp s, p, d, f lần lượt bằng
A.
Câu 29: Phân lớp 3d có số electron tối đa là
A. 6. B. 18.
Câu 30: Phân lớp 4f có số electron tối đa là
A. 6. B. 18. C. 10.
Câu 31: Phân lớp nào sau đây bán bão hòa?
A. 4s2 . B. 4p6 . C. 4d5 .
Câu 32: Số electron tối đa chứa trong các phân lớp s, p, d, f lần lượt là:
14.
Câu 37: Lớp electron thứ 4 (lớp N) có bao nhiêu phân lớp?
A. 1. B. 2. C. 3. D. 4.
Câu 38: Lớp electron nào có số electron tối đa là 18?
A. K. B. N. C. M. D. L.
Câu 39: Số electron tối đa của lớp M, N lần lượt là:
A. 8, 32. B. 8, 18. C. 18, 32. D. 18, 18.
Câu 40: Cấu hình electron nào sau đây là của fluorine (Z = 9)
A. 1s22s22p3 B. 1s22s
Câu 41: Cấu hình electron của nguyên tử nguyên t
A. 20. B. 19. C. 39.
Câu 42: Cấu hình electron của nguyên tử Ca (Z = 20) là
Câu 43: Cấu hình electron của nguyên tử có Z=16 là
Câu 44: Cấu hình electron của nguyên tử một nguyên tố là 1s22s22p63s2. Nguyên tố đó là
A. Ca. B. Ba. C. Sr. D. Mg.
● Cấp độ thông hiểu
Câu 45: Hình ảnh dưới đây là hình dạng của những loại orbital nguyên tử nào?
4f4 .
A. 2, 6, 8, 18. B. 2, 8, 18, 32. C. 2, 4, 6, 8. D. 2, 6, 10, 14.
Câu 33: Số phân lớp bão hoà trong các phân lớp: 1s2, 2s2, 2p3, 3d10, 3p4, 4f14 là
A. 3. B. 2. C. 4. D. 5.
Câu 34: Lớp L có số phân lớp electron bằng
A. 1. B. 2. C. 3
Câu 35: Lớp M có số orbital tối đa bằng
A. 3. B. 4.
Câu 36: Lớp electron thứ 3 (lớp M) có bao nhiêu phân lớp?
4
A. s, d. B. d, f. C. s, p. D. p, f.
Câu 46: Hình vẽ sau mô tả thí nghiệm tìm ra một loại hạt cấu tạo nên nguyên tử, đó là hạt
9.
18.
A. 1. B. 2. C. 3. D. 4.
A. electron. B. neutron. C. proton. D. hạt nhân.
Câu 47: Trường hợp nào sau đây có sự tương ứng giữa hạt cơ bản với khối lượng và điện tích của chúng?
A. Proton, m0,00055 ≈ amu, q = +1.
B. Neutron, m1 ≈ amu, q = 0.
C. Electron, m1 ≈ amu, q = -1.
D. Proton, m1 ≈ amu, q = -1.

Câu 48: Thành phần nào không bị lệch hướng trong điện trường?
A. Tia α B. Proton.
C. Nguyên tử hydrogen. D. Tia âm cực.
Câu 49: Khi nói về số khối, điều khẳng định nào sau đây luôn đúng? Trong nguyên tử, số khối
A. bằng tổng khối lượng các hạt proton và neutron.
B. bằng tổng số các hạt proton và neutron.
C. bằng nguyên tử khối.
D. bằng tổng các hạt proton, neutron và electron.
Câu 50: Phát biểu nào sau đây không đúng?
A. Nguyên tử được cấu thành từ các hạt cơ bản là proton, neutron và electron.
B. Nguyên tử có cấu trúc đặc khít, gồm vỏ nguyên tử và hạt nhân nguyên tử
C. Hạt nhân nguyên tử cấu thành từ các hạt proton và neutron.
D. Vỏ nguyên tử cấu thành từ các hạt electron.
Câu 51: So sánh khối lượng của electron với khối lượng hạt nhân nguyên tử, nhận định nào sau đây là đúng?
A. Khối lượng electron bằng khoảng 1 1840 khối lượng của hạt nhân nguyên tử
B. Khối lượng electron bằng khối lượng của neutron trong hạt nhân.
C. Khối lượng electron bằng khối lượng của proton trong hạt nhân.
D. Khối lượng của electron nhỏ hơn rất nhiều so với khối lượng của hạt nhân nguyên tử, do đó, có thể bỏ qua trong các phép tính gần đúng.
Câu 52: Electron được phát minh năm 1897 bởi nhà bác học người Anh Tom–xơn (J.J. Thomson). Từ khi được phát hiện đến nay, electron đã đóng vai trò to lớn trong nhiều lĩnh vực của cuộc sống như: năng lượng, truyền thông và thông tin,... Trong các câu sau đây, câu nào sai?
A. Electron là hạt mang điện tích âm.
B. Electron có khối lượng 9,1095. 10–28 gam.
C. Electron chỉ thoát ra khỏi nguyên tử trong những điều kiện đặc biệt.
D. Electron có khối lượng đáng kể so với khối lượng nguyên tử.
Câu 53: Phát biểu nào sai khi nói về neutron?
A. Tồn tại trong hạt nhân nguyên tử
B. Có khối lượng bằng khối lượng proton.
C. Có khối lượng lớn hơn khối lượng electron.
D. Không mang điện.
Câu 54: Thông tin nào sau đây sai?
A. Proton mang điện tích dương, nằm trong hạt nhân, khối lượng gần bằng 1 amu.
B. Electron mang điện tích âm, nằm trong hạt nhân, khối lượng gần bằng 0 amu.
C. Neutron không mang điện, khối lượng gần bằng 1 amu.
D. Nguyên tử trung hòa điện, có kích thước lớn hơn nhiều so với hạt nhân, nhưng có khối lượng gần bằng khối lượng hạt nhân.
Câu 55: Nhận định nào sau đây không đúng?
A. Tất cả các hạt nhân nguyên tử đều chứa proton và neutron.
B. Nguyên tử có kích thước vô cùng nhỏ và trung hòa về điện.
C. Lớp vỏ nguyên tử chứa electron mang điện tích âm.
D. Khối lượng nguyên tử hầu hết tập trung ở hạt nhân.
Câu 56: Nguyên tử không mang điện (trung hòa về điện) vì
A. được tạo nên bởi các hạt không mang điện.
B. có tổng số hạt proton bằng tổng số hạt electron.
C. có tổng số hạt electron bằng tổng số hạt neutron.
D. tổng số hạt neutron bằng tổng số hạt proton.
Câu 57: Phát biểu nào sau đây sai?
A. Tất cả các nguyên tử đều có proton, neutron và electron.
B. Proton và electron là các hạt mang điện, neutron là hạt không mang điện.
C. Electron tạo nên lớp vỏ nguyên tử
D. Số lượng proton và electron trong nguyên tử là bằng nhau.
Câu 58: Phát biểu nào sau đây sai?
A. Điện tích của proton và electron có cùng độ lớn nhưng ngược dấu.
B. Có những nguyên tử không có neutron.
C. Có những nguyên tử không có proton.
D. Khối lượng của proton và neutron xấp xỉ bằng nhau và lớn hơn nhiều khối lượng của electron.
Câu 59: Biết rằng một loại nguyên tử Cu có 29 proton và 34 neutron. Phát biểu nào sau đây sai?
A. Nguyên tử Cu có 29 electron.
B. Hạt nhân nguyên tử Cu trên có tổng số hạt là 63.
C. Ion Cu+ có 28 electron.
D. Ion Cu+ có 30 electron.
Câu 60: Aluminium (nhôm) là kim loại phổ biến nhất trên vỏ Trái Đất, được sử dụng trong các ngành xây dựng, ngành điện hoặc sản xuất đồ gia dụng. Hạt nhân của nguyên tử aluminium có điện tích bằng +13 và số khối bằng 27. Kí hiệu nguyên tử của aluminium là
A. 27 13 Al B. 27 14 Al C. 14 13 Al D. 13 27 Al
Câu 61: Thông tin nào sau đây không đúng về 206 82 Pb ?
A. Số hiệu nguyên tử bằng 82.
C. Số neutron bằng 124.
B. Điện tích hạt nhân bằng 82.
D. Số khối bằng 206.
Câu 62: Nhận định nào sau đây về hai nguyên tử 63 29 Cu và 65 29 Cu là sai?
A. là đồng vị của nhau.
C. có cùng số neutron.
Câu 63: Phát biểu nào sau đây sai?
B. có cùng số electron.
D. có cùng số hiệu nguyên tử
A. Số hiệu nguyên tử bằng số đơn vị điện tích hạt nhân nguyên tử
B. Số khối của hạt nhân bằng tổng số proton và số neutron.
C. Trong nguyên tử, số đơn vị điện tích hạt nhân bằng số proton và bằng số neutron.
D. Nguyên tố hoá học là những nguyên tử có cùng số đơn vị điện tích hạt nhân.
Câu 64: Một nguyên tử được đặc trưng cơ bản bằng
A. Số proton và số đơn vị điện tích hạt nhân.
B. Số proton và số electron.
C. Số khối A và số neutron.
D. Số khối A và số đơn vị điện tích hạt nhân.
Câu 65: Phát biểu nào sau đây sai?
A. Chỉ có hạt nhân nguyên tử oxi mới có 8 proton.
B. Chỉ có hạt nhân nguyên tử oxi mới có 8 neutron.
C. Nguyên tử oxi có số electron bằng số proton.
D. Lớp electron ngoài cùng của nguyên tử oxi có 6 electron.
Câu 66: Phát biểu nào sau đây sai?
A. Số hiệu nguyên tử bằng số đơn vị điện tích hạt nhân nguyên tử
B. Số proton trong nguyên tử bằng số neutron.
C. Số proton trong hạt nhân bằng số electron ở lớp vỏ nguyên tử
D. Số khối của hạt nhân nguyên tử bằng tổng số hạt proton và số hạt neutron.
Câu 67: Phát biểu nào sau đây sai?
A. Các đồng vị của một nguyên tố hóa học có số proton bằng nhau.
B. Số khối của hạt nhân bằng tổng số proton và số neutron.
C. Trong nguyên tử, số đơn vị điện tích hạt nhân bằng số proton và bằng số neutron.
D. Nguyên tố hoá học là những nguyên tử có cùng số đơn vị điện tích hạt nhân.
Câu 68: Mệnh đề nào sau đây sai?
A. Chỉ có hạt nhân nguyên tử Mg mới có tỉ lệ giữa số proton và neutron là 1 : 1.
B. Chỉ có trong nguyên tử Mg mới có 12 electron.
C. Chỉ có hạt nhân nguyên tử Mg mới có 12 proton.
D. Số khối của nguyên tử Mg là 24.
Câu 69: Điều khẳng định nào sau đây là sai?
A. Hạt nhân nguyên tử được cấu tạo nên bởi các hạt proton, electron, neutron.
B. Trong nguyên tử số hạt proton bằng số hạt electron.





C. Số khối A là tổng số proton (Z) và tổng số neutron (N).
D. Trong nguyên tử, hạt proton, electron mang điện, hạt neutron không mang điện.
Câu 70: Cho các phát biểu sau, phát biểu nào đúng về đồng vị?
A. Những phân tử có cùng số hạt proton nhưng khác nhau về số hạt neutron là đồng vị của nhau.
B. Những ion có cùng số hạt proton nhưng khác nhau về số hạt electron là đồng vị của nhau.
C. Những chất có cùng số hạt proton nhưng khác nhau về số hạt neutron là đồng vị của nhau.
D. Những nguyên tử có cùng số hạt proton nhưng khác nhau về số hạt neutron là đồng vị của nhau.
Câu 71: Cho ba nguyên tử có kí hiệu là 24 12 X , 25 12Y , 26 12 Z. Phát biểu nào sau đây là sai?
A. Số hạt electron của các nguyên tử lần lượt là: 12, 13, 14.
B. X, Y, Z là 3 đồng vị.
C. X, Y, Z thuộc về nguyên tố Mg.
D. Hạt nhân của mỗi nguyên tử đều có 12 proton.
Câu 72: Các nguyên tử dưới đây là đồng vị của nguyên tố nào?
A. Be. B. Li. C. He. D. H.
Câu 73: Cho những nguyên tử của các nguyên tố sau:
Những nguyên tử nào sau đây là đồng vị của nhau?
A. 1 và 2. B. 2 và 3. C. 1, 2 và 3. D. 1, 2, 3 và 4.

Câu 74: Cho mô hình nguyên tử X như sau:
Số electron trong nguyên tử X là
A. 5. B. 6. C. 7. D. 8.
Câu 75: Đây là mô hình của nguyên tử nào?
A. Be. B. He. C. H. D. Li.
Câu 76: Cho hình vẽ nguyên tử:
Kí hiệu nguyên tử nào sau đây là đúng ?
A. 7 3 Li . B. 6 3 Li . C. 7 4 Li . D. 10 3 Li .
Câu 77: Số nguyên tố hóa học ứng với 4 nguyên tử dưới đây là
A. 1. B. 3. C. 2. D. 4.
Câu 78: Hệ Mặt Trời gồm Mặt Trời ở trung tâm và các thiên thể quay quanh theo những quỹ đạo xác định.
Hãy cho biết mô hình nguyên tử của nhà khoa học nào được gọi là mô hình hành tinh nguyên tử, tương tự như hệ Mặt Trời?
A. Mô hình nguyên tử Thomson.
B. Mô hình nguyên tử Rutherford – Bohr.
C. Mô hình nguyên tử Chadwick.
D. Mô hình nguyên tử Newton.
Câu 79: Cho các mô hình nguyên tử như sau: (a) (b) (c) (d)
Mô hình nguyên tử hiện đại của nguyên tử He là
A. (a). B. (b). C. (c). D. (d).
Câu 80: Theo mô hình nguyên tử Rutherford – Bohr, vị trí nào trong số các vị trí A, B, C, D trong hình sau mà electron không xuất hiện?
Câu 86: Dựa vào mô hình nguyên tử Rutherford – Bohr, hãy cho biết phát biểu nào sau đây đúng?
A. Số lượng electron tối đa trên các lớp là như nhau.
B. Năng lượng của các electron trên các phân lớp khác nhau có thể bằng nhau.
C. Khi quay quanh hạt nhân theo một quỹ đạo xác định, năng lượng của electron là không đổi.
D. Electron ở gần hạt nhân nhất có năng lượng cao nhất.
Câu 87: Theo mô hình Rutherford – Bohr, khi một nguyên tử H hấp thụ một năng lượng đủ lớn, electron đó sẽ
A. chuyển từ lớp electron gần hạt nhân sang lớp xa hạt nhân hơn.
B. chuyển từ lớp electron xa hạt nhân về lớp gần hạt nhân hơn.
C. không thay đổi trạng thái.
D. có thể chuyển sang lớp khác bất kì.
Câu 88: Phát biểu nào sau đây không đúng khi nói về mô hình Rutherford – Bohr?
A. Electron trên lớp K có năng lượng cao hơn trên lớp L.
B. Electron trên lớp M có năng lượng cao hơn trên lớp K.
C. Electron ở lớp K gần hạt nhân hơn so với electron ở lớp L.
D. Electron ở lớp M xa hạt nhân hơn so với electron ở lớp L.
Câu 89: Phát biểu nào sau đây là đúng?
A. Electron trong cùng một lớp có năng lượng bằng nhau.
B. Electron trong cùng một phân lớp có năng lượng bằng nhau.
C. Electron ở các phân lớp 1s, 2s, 3s có năng lượng bằng nhau.
A. Vị trí A. B. Vị trí B. C. Vị trí C. D. Vị trí D.
Câu 81: Electron được phát minh năm 1897 bởi nhà bác học ngưới Anh (J.J. Thomson). Từ khi được phát hiện đến nay, electron đã đóng vai trò lớn trong nhiều lĩnh vực của cuộc sống như: năng lượng, truyền thông và thông tin…
Trong các câu sau đây, câu nào sai?
A. Electron là hạt mang điện tích âm.
B. Electron có khối lượng là 9,1.10-28 gam.
C. Trong nguyên tử, electron được chia thành các lớp và các phân lớp.
D. Electron có khối lượng đáng kể so với khối lượng nguyên tử
Câu 82: Vỏ nguyên tử gồm các electron chuyển động như thế nào xung quanh hạt nhân?
A. Chuyển động rất nhanh không theo những quỹ đạo xác định.
B. Chuyển động rất nhanh theo những quỹ đạo xác định.
C. Chuyển động rất chậm và không theo những quỹ đạo xác định.
D. Chuyển động rất chậm và không theo những quỹ đạo xác định.
Câu 83: Theo mô hình hiện đại, xác suất tìm thấy electron lớn nhất là ở
A. bên ngoài các orbital nguyên tử B. trong các orbital nguyên tử
C. bên trong hạt nhân nguyên tử D. bất kì vị trí nào trong không gian.
Câu 84: Orbital nguyên tử là
A. đám mây chứa electron có dạng hình cầu.
B. đám mây chứa electron có dạng hình số 8 nổi.
C. khu vực không gian xung quanh hạt nhân mà tại đó xác suất có mặt electron lớn nhất.
D. quỹ đạo chuyển động của electron quay quanh hạt nhân có kích thước năng lượng xác định.
Câu 85: Chọn phát biểu đúng về electron s:
A. Là electron chuyển động chủ yếu trong khu vực không gian hình cầu.
B. Là electron chỉ chuyển động trên một mặt cầu.
C. Là electron chỉ chuyển động trên một đường tròn.
D. Là electron chuyển động chủ yếu trong khu vực không gian hình số 8 nổi.
D. Electron ở lớp bên ngoài có năng lượng thấp hơn electron ở lớp bên trong.
Câu 90: Phát biểu nào sau đây sai?
A. Electron càng ở xa hạt nhân thì có năng lượng càng thấp.

B. Số lượng electron tối đa trong một phân lớp luôn là một số chẵn.
C. Phân lớp p có nhiều orbital hơn phân lớp s.
D. Số electron tối đa trên phân lớp p gấp ba lần số eletron tối đa trên phân lớp s.
Câu 91: Phát biểu nào đúng khi nói về các orbital trong một phân lớp electron?

A. Có sự định hướng không gian.
B. Có cùng mức năng lượng.
C. Khác nhau về mức năng lượng.
D. Có hình dạng không phụ thuộc vào đặc điểm mỗi phân lớp.
Câu 92: Phát biểu nào sau đây không đúng?
A. Lớp M có 9 phân lớp.
B. Lớp L có 4 orbital.
C. Phân lớp p có 3 orbital.
D. Năng lượng electron trên lớp K là thấp nhất.
Câu 93: Phát biểu nào sau đây đúng?
A. Lớp K là lớp xa hạt nhân nhất.
B. Các electron trong cùng một lớp có mức năng lượng bằng nhau.
C. Các electron trên cùng một phân lớp có mức năng lượng bằng nhau.
D. Lớp N có 4 orbital.
Câu 94: Phát biểu nào sau đây đúng?
A. Những electron ở lớp K có mức năng lượng thấp nhất.
B. Những electron ở gần hạt nhân có mức năng lượng cao nhất.
C. Electron ở orbital 3p có mức năng lượng thấp hơn electron ở orbital 3s.


D. Các electron trong cùng một lớp có mức năng lượng bằng nhau.

Câu 95: Sự phân bố electron trong một orbital dựa vào nguyên lí hay quy tắc nào sau đây?
A. Nguyên lí vững bền.
C. Nguyên lí Pauli.
B. Quy tắc Hund.
D. Quy tắc Pauli.
Câu 96: Sự phân bố electron vào các lớp và phân lớp căn cứ vào
A. nguyên tử khối tăng dần.
C. số khối tăng dần.
B. điện tích hạt nhân tăng dần.
D. mức năng lượng electron.
Câu 97: Sự phân bố electron trên các phân lớp thuộc các lớp electron dựa vào nguyên lý hay quy tắc nào sau đây?
A. Nguyên lí vững bền và nguyên lí Pauli.
B. Nguyên lí vững bền và quy tắc Hund.
C. Nguyên lí Pauli và quy tắc Hund.
D. Nguyên lí vững bền và quy tắc Pauli.
Câu 98: Hình vẽ nào sau đây vi phạm nguyên lý Pauli khi điền electron vào AO?
Câu 104: Nguyên tử nào trong hình vẽ dưới đây có số electron lớp ngoài cùng là 8
A. 1 và 2. B. 3. C. 3 và 4. D. 2.
Câu 105: Cấu hình electron nào sau đây thuộc về nguyên tố kim loại?
A. 1s22s22p63s23p6
C.
2
B. 1s22s22p63s23p
Câu 106: Cấu hình electron nào sau đây thuộc về nguyên tố khí hiếm?
A. 1s
C. 1s22s22p63s23p6
A. (1). B. (2).
C. (1) và (2). D. (3) và (4).
Câu 99: Sự phân bố electron theo ô orbital nào dưới đây là đúng?
A. B. C. D.
Câu 100: Cấu hình của nguyên tử sau biểu diễn bằng ô lượng tử. Thông tin nào không đúng khi nói về cấu hình đã cho?
A. Nguyên tử có 7 electron.
C. Nguyên tử có 3 electron độc thân.
B. Lớp ngoài cùng có 3 electron.
D. Nguyên tử có 2 lớp electron.
Câu 101: Cấu hình electron của một nguyên tử được biểu diễn dưới dạng các ô orbital như sau:
↑↓ ↑↓ ↑ ↑ ↑
Số electron hoá trị và tính chất đặc trưng của nguyên tố hoá học này là
A. 3, tính kim loại.
C. 7, tính phi kim.
B. 5, tính phi kim.
D. 4, tính kim loại.
Câu 102: Nguyên tử M có cấu hình electron ở lớp ngoài cùng là 3s23p5. Nguyên tử M là
A. 11Na. B. 18Ar. C. 17Cl. D. 19K.
Câu 103: Cấu hình electron đầy đủ của nguyên tử có cấu hình electron lớp ngoài cùng 3s23p4 là
A. 1s22s22p63s23p4
C. 1s22s22p63s23p6
B. 1s22s23s23p4
D. 1s22s22p53s23p4
Câu 8: Nguyên tử nào trong hình vẽ dưới đây có số electron lớp ngoài cùng là 5?
A. 1 và 2. B. 1 và 3. C. 3 và 4.
D. 1s22s22p63s23p4
Câu 107: Cấu hình electron nào sau đây thuộc về nguyên tố phi kim?
A. 1s22s22p63s2
B. 1s22s22p63s23p1
C. 1s22s22p63s23p6 D. 1s22s22p63s23p4
Câu 108: Cấu hình electron nào sau đây viết sai?
A. 1s22s22p5 B. 1s22s22p63s23p64s2
C. 1s22s22p63s23p64s24p5 D. 1s22s22p63s23p63d34s
Câu 109: Cho cấu hình electron nguyên tử của các nguyên tố như sau:
Các nguyên tố kim loại là:
A. (1), (3). B. (1), (2), (4). C. (2), (4). D. (2), (3), (4).






Câu 110: Nguyên tử các nguyên tố X, Y, Z có cấu hình electron là X:


Trong các nguyên tố X, Y, Z nguyên tố kim loại là
A. X. B. Z. C. Y. D. X và Y.
Câu 111: Cho các cấu hình electron của một số nguyên tử nguyên tố như sau:
(1) 1s22s22p6
(2) 1s22s22p63s2
(3) 1s22s22p63s23p63d64s2
(5) 1s22s22p63s23p4
(6) 1s22s22p63s23p5
Số lượng các nguyên tố kim loại trong số các nguyên tố ở trên là
A. 1. B. 2. C. 3. D. 4.
Câu 112: Cho biết cấu hình electron của X, Y lần lượt là: 1s22s22p63s23p3; 1s22s22p63s23p64s1. Nhận xét nào sau đây là đúng?
A. X và Y đều là các kim loại.
B. X và Y đều là các phi kim.
C. X và Y đều là các khí hiếm.
D. X là một phi kim còn Y là một kim loại.
Câu 113: Cấu hình e nào sau đây là của nguyên tử Fe (Z=26)?
A. [Ar]3d64s2 B. [Ar]4s23d6 C. [Ar]3d8 D. [Ar]3d74s1
Câu 114: Hợp kim cobalt được sử dụng rộng rãi trong các động cơ máy bay vì độ bền nhiệt độ cao là một yếu tố quan trọng. Nguyên tử cobalt có cấu hình electron ngoài cùng là 3d74s2. Số hiệu nguyên tử của cobalt là
A. 24.
B. 25. C. 27. D. 29.
Câu 115: Trong nguyên tử 17Cl, số electron ở phân mức năng lượng cao nhất là
A. 5.
B. 5. C. 9. D. 11.
Câu 116: Photpho có Z=15 tổng số electron của lớp ngoài cùng là
A. 3. B. 4. C. 5. D. 6.
Câu 117: Nguyên tử nào sau đây có 3 electron ở lớp ngoài cùng?
A. N (Z=7). B. Na (Z=11). C. Al (Z=13). D. C (Z=6).
Câu 118: Các electron của nguyên tử X được phân bố trên 3 lớp, lớp thứ 3 có 6 electron. Số đơn vị điện tích hạt
nhân của nguyên tử của nguyên tố X là
A. 6. B. 8. C. 14. D. 16.
Câu 119: Nguyên tử Y có 3 electron ở phân lớp 3p, Y có số hiệu nguyên tử Z là
A. 17. B. 13. C. 15. D. 16.
Câu 120: Một nguyên tử X có tổng số electron ở phân lớp p là 11. X thuộc loại nguyên tố nào?
A. s. B. p. C. d. D. f.
Câu 121: Cấu hình electron của nguyên tử X có dạng 1s22s22p63s23p3. Phát biểu nào sau đây là sai?
A. X ở ô số 15 trong bảng tuần hoàn.
B. X là một phi kim.
C. Nguyên tử của nguyên tố X có 9 electron p.
D. Nguyên tử nguyên tố X có 3 phân lớp electron.
Câu 122: Ion nào dưới đây có cấu hình electron giống cấu hình electron của nguyên tử Ar?
A. O2− B. Mg2+ C. Na+ D. K+
Câu 123: Ion nào dưới đây có cấu hình electron của khí hiếm Ne?
A. Be2+ B. Mg2+ C. Cl. D. Ca2+
Câu 124: Cấu hình của ion kim loại giống cấu hình của khí hiếm là
A. Cu2+ B. Ca2+ C. Fe3+ D. Cr3+
Câu 125: Dãy gồm các ion X+, Y- và nguyên tử Z đều có cấu hình electron 1s22s22p6 là:
A. Na+, Cl-, Ar. B. Li+, F-, Ne. C. Na+, F-, Ne. D. K+, Cl-, Ar.
Câu 126: Cation X3+ và anionY2− đều có cấu hình electron ở phân lớp ngoài cùng là 2p6. Kí hiệu của các nguyên tố
X,Y là
A. Al và O. B. B và O.
C. Al và S. D. Fe và S.
Câu 127: Ion Xn+ có cấu hình electron là 1s22s22p6, X là nguyên tố thuộc nhóm A. Số nguyên tố hóa học thỏa mãn với điều kiện của X là
A. 2. B. 3.
C. 4. D. 5.
Câu 128: Tổng số electron ở các phân lớp 3p và 3d của ion 3+ 26 Fe là
A. 10. B. 12.
● Cấp độ vận dụng
C. 13. D. 11.
Câu 129: Trong các nguyên tử N (Z = 7), O (Z = 8), F (Z = 9) và Ne (Z = 10). Nguyên tử có nhiều electron độc thân nhất là
A. N. B. O. C. F. D. Ne.
Câu 130: Có những phát biểu sau đây về các đồng vị của một nguyên tố hóa học:
(a) Các đồng vị có tính chất hóa học giống nhau.
(b) Các đồng vị có tính chất vật lí khác nhau.
(c) Các đồng vị có cùng số electron ở vỏ nguyên tử
(d) Các đồng vị có cùng số proton nhưng khác nhau về số khối.
Trong các phát biểu trên, số phát biểu đúng là
A. 1. B. 2.
3.
Câu 131: Cho các phát biểu sau:
(a) Trong nguyên tử, có số proton bằng số electron.
(b) Tổng số proton và số electron trong một hạt nhân được gọi là số khối.
(c) Số khối là khối lượng tuyệt đối của nguyên tử
(d) Số proton bằng số đơn vị điện tích hạt nhân.
(e) Đồng vị là các nguyên tố có cùng số proton nhưng khác nhau về số neutron.
Số phát biểu không đúng là
A. 1. B. 2. C. 3. D. 4.
Câu 132: Cho các phát biểu về mô hình Rutherford – Bohr như sau:
(a) Electron quay xung quanh hạt nhân theo những quỹ đạo giống như các hành tinh quay xung quanh Mặt Trời.
(b) Electron không chuyển động theo quỹ đạo cố định mà trong cả khu vực không gian xung quanh hạt nhân.
(c) Electron không bị hút vào hạt nhân do còn chịu tác dụng của lực quán tính li tâm.
(d) Khối lượng nguyên tử tập trung chủ yếu ở hạt nhân.
Số phát biểu đúng là
A. 1. B. 2. C. 3. D. 4.
Câu 133: Cho các phát biểu về mô hình nguyên tử hiện đại:
(a) Trong nguyên tử, electron chuyển động không theo những quỹ đạo xác định trong cả khu vực không gian xung quanh hạt nhân.
(b) Tất cả các AO nguyên tử đều có hình dạng giống nhau.
(c) Mỗi AO nguyên tử chỉ có thể chứa được 1 electron.
(d) Các electron s chuyển động trong các AO có hình số tám nổi.
Số phát biểu đúng là
A. 1. B. 2. C. 3. D. 4.
Câu 134: Nguyên tử Fe có cấu hình 56 26 Fe . Cho các phát biểu sau về Fe:
(a) Nguyên tử của nguyên tố Fe có 8 electron ở lớp ngoài cùng.
(b) Nguyên tử của nguyên tố Fe có 30 neutron ở trong hạt nhân.
(c) Fe là một phi kim.
(d) Fe là nguyên tố
Trong các phát biểu trên, số phát biểu đúng là
A. 1. B. 3. C. 4. D. 2.
Câu 135: Sơ đồ cấu tạo của nguyên tử X được như sau:
Trong số các phát biểu sau, số phát biểu sai là:
(a) X là nguyên tử thuộc nguyên tố Liti.
(b) Số hạt mang điện trong hạt nhân là 7.
(c) Số khối của X bằng 7.
(d) Trong X, số hạt mang điện nhiều hơn hạt mang điện là 2.
A. 1. B. 3. C. 4. D. 2.
Câu 136: Cho các phát biểu sau:
(a) Các electron ở lớp L có mức năng lượng gần bằng nhau.
(b) Các electron ở lớp M (n = 3) liên kết chặt chẽ với hạt nhân hơn các electron ở lớp K (n = 1).
(c) Các electron ở lớp L có mức năng lượng cao hơn các electron ở lớp K.
(d) Các electron ở lớp K có mức năng lượng bằng nhau.
(e) Các electron ở phân lớp 3s có mức năng lượng thấp hơn các electron ở phân lớp 2p
Số phát biểu đúng là
A. 2. B. 3. C. 4. D. 5.
Câu 137: Nguyên tử của nguyên tố aluminium (nhôm) có Z = 13. Có các nhận định sau:
(a) Lớp electron ngoài cùng của aluminium có 3 electron.
(b) Lớp electron ngoài cùng của aluminium có 1 electron.
(c) Lớp L (lớp thứ 2) của aluminium có 3 electron.
(d) Lớp M (lớp thứ 2) của aluminium có 8 electron.
(e) Aluminium là nguyên tử kim loại.
Số nhận đinh sai là
A. 2. B. 3. C. 4. D. 1.
Câu 138: Cho các phát biểu sau:
(a) Phân lớp d có tối đa 10 electron.
(b) Phân lớp đã có tối electron được gọi là phân lớp bão hòa.
(c) Nguyên tử nguyên tố kim loại thường có 1 hoặc 2 hoặc 3 electron ở lớp ngoài cùng.
(d) Nguyên tử nguyên tố khí hiếm thường có 5 hoặc 6 hoặc 7 electron ở lớp ngoài cùng.
(e) Các electron trên cùng một lớp có mức năng lượng bằng nhau.
Số phát biểu đúng là
A. 2. B. 1. C. 4. D. 3.
Câu 139: Nước cất (H2O) là nước tinh khiết, nguyên chất, được điều chế bằng cách chưng cất và thường được sử dụng trong y tế như pha chế thuốc tiêm, thuốc uống, biệt dược, rửa dụng cụ y tế, rửa vết thương,... Biết nguyên tử
H có 1 proton và 1 electron, nguyên tử O có 8 proton, 8 electron và 8 neutron. Tổng số electron, proton và neutron trong một phân tử H2O là
A. 11. B. 15
C. 16. D. 28.
Câu 140: Phân lớp có năng lượng cao nhất trong cấu hình electron của hai nguyên tử X, Y lần lượt là 3p và 4s.
Tổng số electron của hai phân lớp này bằng 5 và hiệu số electron của chúng bằng 3. Số hiệu nguyên tử của 2 nguyên tố X, Y là
A. 17 và 18 B. 16 và 19 C. 15 và 20 D. 14 và 21
Câu 141: Nguyên tử của nguyên tố X có e ở mức năng lượng cao nhất là 3p. Nguyên tử của nguyên tố Y cũng có electron ở mức năng lượng 3p và có 1 electron ở lớp ngoài cùng. Nguyên tử X và Y có số electron hơn kém nhau là
2. Nguyên tố X, Y lần lượt là
A. Khí hiếm và kim loại B. Kim loại và kim loại C. Kim loại và khí hiếm D. Phi kim và kim loại
Câu 142: Nguyên tố X được sử dụng rộng rãi để chống đóng băng và khử băng như một chất bảo quản. Nguyên tố Y là nguyên tố thiết yếu cho các cơ thể sống, đồng thời nó được sử dụng nhiều trong việc sản xuất phân bón.
Nguyên tử của nguyên tố X có electron ở mức năng lượng cao nhất là 3p. Nguyên tử nguyên tố Y có một electron ở lớp ngoài cùng là 4s. Nguyên tử X và Y có số electron hơn kém nhau là 3. Nguyên tử X và Y lần lượt là
A. khí hiếm và kim loại.
C. kim loại và kim loại.
B. kim loại và khí hiếm.
D. phi kim và kim loại.
C. PHÂN DẠNG BÀI TẬP, VÍ DỤ MINH HỌA, BÀI TẬP VẬN DỤNG
1. Xác định nguyên tử dựa vào điện tích (C) hạt nhân
Ví dụ 1: Các đám mây gây hiện tượng sấm sét tạo nên bởi những hạt nước nhỏ li ti mang điện tích. Một phép đo thực nghiệm cho thấy, một giọt nước có đường kính 50 μm , mang một lượng điện tích âm là 17 3,3310C−× . Hãy cho biết điện tích âm của giọt nước trên tương đương với điện tích của bao nhiêu electron?
Bài tập vận dụng
● Cấp độ thông hiểu
Câu 1: Hạt nhân của nguyên tử X có điện tích là 30,438.10-19 culông. Vậy nguyên tử X là
A. Ar. B. K. C. Ca. D. Cl.
Câu 2: Hạt nhân của nguyên tử X có điện tích là 17,622.10-19 culông. Vậy nguyên tử X là
A. Na. B. K. C. Ca. D. Cl.
Câu 3: Lớp vỏ của nguyên tử nguyên tố X có 11 electron. Điện tích (C) hạt nhân nguyên tử X là
A. -1,76.10-18 B. +1,826.10-18 C. -1,826.10-18 D. +1,76.10-18
Câu 4: Tổng điện tích hạt nhân của nguyên tử R bằng +30,4.10-19C. Số electron trong nguyên tử R là
A. 24. B. 20. C. 19. D. 13.
Câu 5: Tổng điện tích lớp vỏ của nguyên tử R có điện tích bằng -39,84.10-19C. Số proton trong hạt nhân nguyên tử R là
A. 24. B. 20. C. 19. D. 13.
Câu 6: Nguyên tử R có điện tích lớp vỏ nguyên tử là -41,6.10-19 C. Điều khẳng định nào sau đây là không chính xác?
A. Lớp vỏ nguyên tử R có 26 electron. B. Hạt nhân nguyên tử R có 26 proton.
C. Hạt nhân nguyên tử R có 26 neutron. D. Nguyên tử R trung hòa về điện.
2. Tính khối lượng của các hạt trong nguyên tử
Ví dụ 1: Khối lượng tuyệt đối của một nguyên tử oxygen bằng 26,5595.10-27 kg. Hãy tính khối lượng nguyên tử (theo amu) và khối lượng mol nguyên tử (theo gam) của oxygen.
Ví dụ 2: Vào những ngày hanh khô, cơ thể chúng ta có thể tích tụ điện tích khi đi bộ trên một số thảm hoặc khi chải tóc. Giả sử cơ thể chúng ta tích một lượng điện tích là 10μC .
a. Hãy cho biết trong trường hợp này, cơ thể chúng ta đã nhận thêm hay mất đi electron.
b. Tổng khối lượng của các electron mà cơ thể đã nhận thêm hoặc mất đi là bao nhiêu kilogam? Cho khối lượng của 1 electron là 31 9,110 × kg. Biết rằng: 6 1 μC= 10C. Bài tập vận dụng
● Cấp độ thông hiểu
Câu 1: Nguyên tử X có 13 proton. Khối lượng của proton nguyên tử X là
A. 23,38.10-24 gam. B. 21,71.10-24 gam.
C. 25,05.10-24 gam. D. 26,72.10-24 gam.
Câu 2: Một nguyên tử X có 15 electron trong hạt nhân. Khối lượng của electron trong hạt nhân nguyên tử X là
A. 12,74.10-30 gam. B. 13,56.10-30 gam.
C. 11,83.10-30 gam.
D. 14,56.10-30 gam.
Câu 3: Khối lượng của nguyên tử magnesium là 39,8271.10-27 kg. Khối lượng của magnesium theo amu là
A. 23,978. B. 66,133.10-51
C. 24,000. D. 23,985.10-3
Câu 4: Nguyên tử của nguyên tố X có 7 proton và 7 neutron. Khối lượng tính bằng gam (phép tính gần đúng)
của nguyên tử X là giá trị nào sau đây?
A. 23,4.10-24 B. 23,4.10-34 C. 23,4.10-31 D. 23,4.10-27
Câu 5: 1 mol nguyên tử iron (sắt) có khối lượng bằng 56 gam. Số hạt electron có trong 5,6 gam iron là
A. 15,65.1024 B. 15,65.1021 C. 15,65.1022 D. 15,65.1023
Câu 6: Tổng số nguyên tử trong 0,01 mol phân tử muối amoni nitrat (NH4NO3) là
A. 5,418.1022 B. 5,418.1021 C. 6,02.1022 D. 3,01.1023
Câu 7: Mỗi nguyên tử nitrogen (nitơ) có 7 proton, 7 neutron, 7 electron và mp=1,6726.10-27kg; mn= 1,6748.10-27kg; me = 9,1094.10-31kg. Khối lượng của phân tử N2 tính theo đơn vị gam là
A. 4,6876.10-26 B. 5,6866.10-26 C. 4,6876.10-23 D. 5,6866.10-23
Câu 8: Biết nguyên tử magnesium (magie) có 12 proton, 12 neutron; 12 electron ; nguyên tử oxygen (oxi) có 8 proton, 9 neutron và 8 electron. (mp=1,6726.10-27 kg, mn= 1,6748.10-27 kg và me = 9,1094.10-31 kg). Khối lượng (gam) của phân tử MgO là
A. 6,8641.10-26 . B. 6,8641.10-23 . C. 5,4672.10-23 . D. 5,4672.10-23 .
Câu 9: Biết nguyên tử aluminium (nhôm) có 13 proton, 14 neutron và 13 electron và nguyên tử oxygen (oxi) có 8 proton, 8 neutron và 8 electron. (mp=1,6726.10-27kg, mn= 1,6748.10-27 kg, me = 9,1094.10-31kg). Khối lượng tính theo kg của phân tử Al2O3 gần nhất với giá trị nào sau đây?
A. 1,7077.10-25 B. 1,7077.10-26 C. 4,8672.10-25 D. 4,8672.10-26
Câu 10: Nếu bỏ qua khối lượng của electron (do rất nhỏ so với nguyên tử) thì khối lượng nguyên tử X là 9,352.1026 kg. Lớp vỏ của nguyên tử mang điện tích là 4,16.10-18C. Số neutron trong hạt nhân của X là (cho mn= mp = 1,67.10-27 kg)
A. 32. B. 33. C. 30. D. 31.
3. Mối quan hệ về kích thước giữa các hạt trong nguyên tử Ví dụ 1: Một bạn học sinh muốn xây dựng một mô hình nguyên tử hydrogen cỡ lớn theo đúng tỉ lệ để trưng bày trong hội chợ khoa học ở trường. Nếu nguyên tử có đường kính 1,00 m thì học sinh đó phải xây dựng hạt nhân có kích thước là bao nhiêu? Điều đó có dễ dàng thực hiện với các dụng cụ thông thường hay không? Mô hình đó có phù hợp để quan sát bằng mắt thường không? Biết rằng kích thước hạt nhân bằng 5 10 lần kích thước nguyên tử
Ví dụ 2: Khi phóng chùm tia α vào một lá vàng mỏng, người ta thấy rằng trong khoảng 108 hạt α có một hạt gặp hạt nhân.
a. Một cách gần đúng, hãy xác định đường kính của hạt nhân so với đường kính của nguyên tử.
b. Với sự thừa nhận kết quả trên, hãy tính đường kính của nguyên tử nếu ta coi hạt nhân có kích thước như một quả
bóng bàn có đường kính bằng 3 cm.
Ví dụ 3: Khi phóng chùm tia α vào một lá vàng mỏng, người ta thấy rằng trong khoảng 108 hạt α thì có một hạt gặp hạt nhân.
a. Một cách gần đúng, hãy xác định đường kính của hạt nhân so với đường kính của nguyên tử.
b. Với sự thừa nhận kết quả trên, hãy tính đường kính của nguyên tử nếu ta coi hạt nhân có kích thước như một quả bóng bàn có đường kính bằng 3 cm.
Bài tập vận dụng
● Cấp độ thông hiểu
Câu 1: Nguyên tử có đường kính lớn gấp 10000 lần đường kính hạt nhân. Nếu ta phóng đại hạt nhân lên thành một quả bóng có đường kính 6 cm thì đường kính nguyên tử sẽ là
A. 200 m. B. 600 m. C. 1200m. D. 300 m.
Câu 2: Khi phóng một chùm tia α vào một lớp nguyên tử vàng người ta nhận thấy cứ 108 hạt α thì có 1 hạt gặp hạt nhân. Một cách gần đúng xác định được liên hệ giữa đường kính của hạt nhân (d) và đường kính nguyên tử (D) là
A. D = 10d. B. D = 104d. C. D = 102d. D. D = 103d.
4. Xác định số phân tử đơn chất, hợp chất khi biết số đồng vị của mỗi nguyên tố tạo thành đơn chất, hợp chất đó
Ví dụ 1: Xác định số phân tử các chất trong bảng sau:
NGUYÊN TỐ SỐ LƯỢNG ĐỒNG VỊ PHÂN TỬ SỐ PHÂN TỬ
● Cấp độ thông hiểu
Bài tập vận dụng
Câu 1: Trong tự nhiên, chlorine (clo) có 2 đồng vị 3537 1717Cl,Cl . Số phân tử Cl2 được tạo thành từ 2 đồng vị là
A. 3. B. 6. C. 9. D. 12.
Câu 2: Oxygen (oxi) trong tự nhiên có 3 đồng vị 16O, 17O, 18O. Số phân tử O2 được tạo thành từ 3 đồng vị là
A. 3. B. 6. C. 9. D. 12.
Câu 3: Trong tự nhiên, hydrogen (hiđro) có 3 đồng vị 123 111H,H,H . Số phân tử H2 được tạo thành từ 3 đồng vị là
A. 3. B. 6. C. 9. D. 12.
Câu 4: Nitrogen (nitơ) có 2 đồng vị bền là 14 7 N và 15 7 N. Oxygen (oxi) có 3 đồng vị bền là 16 8 O , 17 8 O ,
chất NO2 tạo bởi các đồng vị trên là
A. 3. B. 6. C. 9. D. 12.
Câu 5: Nitrogen (nitơ) có 2 đồng vị bền là 14 7 N và
chất N2O tạo bởi các đồng vị trên là
Oxygen (oxi) có
A. 3. B. 6. C. 9. D. 12.
Câu 6: Biết trong tự nhiên carbon (cacbon) có 2 đồng vị 12 6 C và 13 6 C , oxygen (oxi) có 3 đồng vị 161718 888O,O,O Số loại phân tử CO được tạo thành từ các đồng vị trên là
A. 2. B. 6. C. 9. D. 12.
Câu 7: Trong tự nhiên, oxygen (oxi) có 3 đồng vị 161718 888O,O,O ; carbon (cacbon) có 2 đồng vị là 1213 66C,C . Số phân tử khí CO2 có thể tạo thành từ các đồng vị trên là
A. 12. B. 10. C. 14. D. 8.
Câu 8: Biết hydrogen (hiđro) có 3 đồng vị 123 111H,H,H và oxygen (oxi) có 3 đồng vị 161718 888O,O,O . Số phân tử H2O có thể tạo thành từ các đồng vị trên là
A. 6. B. 12. C. 18. D. 24.
Câu 9: Trong tự nhiêu, hydrogen (hiđro) có 3 đồng vị 1H, 2D, 3T và beryllium (beri) có 1 đồng vị 9Be. Số loại phân tử BeH2 có thể có trong tự nhiên được cấu tạo từ các đồng vị trên là
A. 6. B. 12. C. 14. D. 18.
Câu 10: Số phân tử H2O được tạo bởi các đồng vị 161718 888O,O,O và 12 11H,H là
A. 6. B. 9. C. 12. D. 15.
Câu 11: Trong tự nhiên copper (đồng) có 2 đồng vị là 63Cu và 65Cu, oxygen (oxi) có 3 đồng vị là 16O, 17O, 18O. Số phân tử CuO được tạo thành từ các đồng vị trên là
A. 8. B. 6. C. 12. D. 18.
5. Xác định số khối trung bình của các đồng vị - Xác định phần trăm số lượng các đồng vị của nguyên tố
Ví dụ 1: Hoàn thành thông tin còn thiếu trong bảng sau:
STT NGUYÊN TỐ ĐỒNG VỊ - % SỐ NGUYÊN TỬ NGUYÊN TỬ KHỐI TRUNG BÌNH 1 2 3 1 Cl
2 Ne
Cl 2 H2O Cu 2 CuCl2
Ví dụ 2: Nguyên tử khối trung bình của bromine là 79,91. Bromine có 2 đồng vị, trong đó đồng vị 79Br chiếm
54,5% số nguyên tử.
a. Tính nguyên tử khối của đồng vị còn lại.
b. Tính % khối lượng của đồng vị 79Br có trong phân tử HBrO4
Ví dụ 3: Krypton (kripton – Kr) là một trong những khí hiếm được ứng dụng trong chiếu sáng và nhiếp ảnh. Ánh sáng của krypton có nhiều dải phổ, do đó nó được sử dụng nhiều làm tia laser có mức năng lượng cao. Quan sát biểu thị phổ khối của krypton
Câu 10: Nguyên tử Mg (magnesium) có ba đồng vị ứng với thành phần phần trăm về số nguyên tử như sau:
Đồng vị 24 Mg 25 Mg 26 Mg % 78,6 10,1 11,3
Giả sử trong hỗn hợp nói trên có 50 nguyên tử 25Mg. Số nguyên tử tương ứng của hai đồng vị 24Mg và 26Mg là
A. 389 và 42. B. 389 và 56. C. 56 và 389. D. 42 và 389.
Câu 11: Phổ khối, hay phổ khối lượng (MS: Mass Spectrum) chủ yếu được sử dụng để xác định phân tử khối, nguyên tử khối của các chất và hàm lượng các đồng vị bền của một nguyên tố. Phổ khối của neon được biểu diễn như ở hình dưới đây.Trục tung biểu thị hàm lượng phần trăm về số nguyên tử của từng đồng vị, trục hoành biểu thị tỉ số của nguyên tử khối (m) của mỗi đồng vị với điện tích của các ion đồng vị tương ứng (điện tích z của các ion đồng vị neon đều bằng +1). Nguyên tử khối trung bình của neon là
Tính thể tích của 15 gam krypton (đktc).
Ví dụ 4: Đồng (Copper) là là kim loại dễ dát mỏng, dẫn điện và dẫn nhiệt tốt. Vì thế đồng được sử dụng rất nhiều trong sản xuất các nguyên liệu. Các đồ dùng từ đồng như: dây điện, đồ dùng nội thất trong nhà, các tượng đúc, động cơ máy móc,... Đồng có hai đồng vị bền là 65 29 Cu và 63 29 Cu . Nguyên tử khối trung bình của đồng là 63,54. Tính
số nguyên tử của 65 29 Cu trong 20,181 gam CuCl2 (Cl = 35,5).


Bài tập vận dụng
● Cấp độ thông hiểu
Câu 1: Nguyên tố carbon (cacbon) có hai đồng vị bền: C 12 6 chiếm 98,89% và C 13 6 chiếm 1,11%. Nguyên tử khối trung bình của nguyên tố carbon là
A. 12,022. B. 12,011. C. 12,055. D. 12,500.
Câu 2: Biết rằng Ar có 3 đồng vị 36 18 Ar (0,3%); 38 18 Ar (0,06%); 40 18 Ar (99,6%). Khối lượng nguyên tử trung bình của Ar là
A. 39,97. B. 37,99. C. 73,99. D. 79,39.
Câu 3: Copper (đồng) có 2 đồng vị 63 29 Cu chiếm 73% và 65 29 Cu chiếm 27%. Khối lượng nguyên tử trung bình của Cu là
A. 63,45. B. 63,63. C. 63,54. D. 64,63.
Câu 4: Trong tự nhiên Ga có 2 đồng vị là 69Ga (60,1%) và 71Ga (39,9%). Khối lượng trung bình của Ga là
A. 70. B. 71,20. C. 69,80. D. 70,20.
Câu 5: Biết rằng trong tự nhiên potassium (kali) có 3 đồng vị 39 19 K (93,08%); 40 19 K (0,012%); 41 19 K (6,9%). Khối lượng nguyên tử trung bình của nguyên tố potassium là
A. 34,91. B. 39,14. C. 39,53. D. 34,14.
Câu 6: Trong tự nhiên, bromine (brom) có hai đồng vị bền là 79 35 Br chiếm 50,69% số nguyên tử và 81 35 Br chiếm
49,31% số nguyên tử. Nguyên tử khối trung bình của bromine là
A. 80,00. B. 80,112. C. 80,986. D. 79,986.
Câu 7: Oxygen (oxi) có ba đồng vị với tỉ lệ phần trăm số nguyên tử là 16 8 O (99,757%), 17 8 O (0,038%), 18 8 O (0,205%). Nguyên tử khối trung bình của oxygen là
A. 16,0. B. 16,2. C. 17,0.
D. 18,0.
Câu 8: Copper (đồng) trong thiên nhiên gồm hai đồng vị 63Cu và 65Cu có tỉ số 63 65 Cu105 = Cu245 . Khối lượng nguyên tử trung bình của Cu là
A. 64. B. 63,9. C. 63,4.
D. 64,4.
Câu 9: Nguyên tố Mg có 3 loại đồng vị có số khối lần lượt là 24, 25, 26. Trong số 5000 nguyên tử Mg thì có 3930
đồng vị 24Mg; 505 đồng vị 25Mg còn lại là đồng vị 26Mg. Khối lượng nguyên tử trung bình của Mg là
A. 24. B. 23,9. C. 24,33. D. 24,22.
A. 20,15. B. 20,18. C. 20,28. D. 20,25.
● Cấp độ vận dụng
Câu 12: Trong tự nhiên iron (sắt) có hai đồng vị là 55Fe và 56Fe. Nguyên tử khối trung bình của Fe bằng 55,85.
Thành phần phần trăm tương ứng của hai đồng vị lần lượt là
A. 85% và 15%. B. 42,5% và 57,5%.
C. 57,5% và 42,5%. D. 15% và 85%.
Câu 13: Trong tự nhiên nguyên tố bromine (brom) có hai đồng vị là 79 35 Br và 81 35 Br . Nếu nguyên tử khối trung bình của bromine là 79,91 thì phần trăm của hai đồng vị này lần lượt là
A. 54,5% và 45,5%.
B. 35% và 65%.
C. 45,5% và 54,5%. D. 61,8% và 38,2%.
Câu 14: Nguyên tố boron (bo) có 2 đồng vị 11 Bo (x1%) và 10 Bo (x2%), nguyên tử khối trung bình của Bo là 10,8. Giá trị của x1% là
A. 80%. B. 20%. C. 10,8%. D. 89,2%.
Câu 15: Trong tự nhiên, nguyên tố copper (đồng) có hai đồng vị là 63 29 Cu và 65 29 Cu . Nguyên tử khối trung bình của đồng là 63,546. Thành phần phần trăm số nguyên tử của đồng vị 63 29 Cu là
A. 27%. B. 50%. C. 54%. D. 73%.
Câu 16: Chlorine là một nguyên tố có trong nhựa polivinyl chloride (PVC), đây là một loại nhựa nhiệt dẻo được tạo thành từ phản ứng trùng hợp vinyl chloride (CH2=CHCl). PVC là chất rắn vô định hình, cách điện tốt, khá trơ về mặt hóa học, dùng làm ống dẫn nước, vật liệu cách điện, gạch lát sàn trong xây dựng,... Nguyên tử khối trung bình của chlorine là 35,5. Điều này cho biết về sự phong phú tương đối của hai đồng vị và có trong tự nhiên của chlorine. Thành phần trăm số nguyên tử mỗi đồng vị của chlorine là
A. 27,3% và 72,7%.
C. 25% và 75%.
B. 72,7% và 27,3%
D. 75% và 25%.
Câu 17: Trong tự nhiên oxygen (oxi) có 3 đồng vị là 16O (x1%), 17O (x2%), 18O (4%), nguyên tử khối trung bình là 16,14. Phần trăm đồng vị 16O là
A. 6%.
B. 90%. C. 86%. D. 10%.
Câu 18: Đồng vị phóng xạ colbat (Co-60) phát ra tia γ có khả năng đâm xuyên mạnh, dùng điều trị các khối u ở
sâu trong cơ thể. Cobalt có ba đồng vị: 59 27 Co (chiếm 98%), 58 27 Co và 60 27 Co ; nguyên tử khối trung bình là 58,982.
Hàm lượng phần trăm của đồng vị phóng xạ Co-60.
A. 2%. B. 1,9%. C. 0,1%. D. 0,2%.
Câu 19: Nguyên tử khối trung bình của bromine (brom) là 79,91. Bromine có hai đồng vị. Biết 81Br chiếm 45,5%.
Số khối của đồng vị thứ 2 là
A. 79. B. 80. C. 78. D. 82.
Câu 20: Nguyên tố R có hai đồng vị, nguyên tử khối trung bình là 79,91. Một trong hai đồng vị là 79 R (chiếm 54,5%). Nguyên tử khối của đồng vị thứ hai là
A. 80. B. 81. C. 82. D. 80,5.
Câu 21: Một nguyên tố X gồm 2 đồng vị là X1 và X2. Đồng vị X1 có tổng số hạt là 18. Đồng vị X2 có tổng số hạt là 20. Biết rằng phần trăm các đồng vị trong X bằng nhau và các loại hạt trong X1 cũng bằng nhau. Nguyên tử khối trung bình của X là
A. 13. B. 12. C. 14. D. 15.
Câu 22: Oxygen (oxi) có 3 đồng vị 161718 888O,O,O với phần trăm số nguyên tử mỗi đồng vị tương ứng là x1, x2, x3
Trong đó x1 = 15x2 và x1 – x2 = 21x3. Số khối trung bình của các đồng vị là
A. 17,14. B. 16,14. C. 17,41. D. 16,41.
Câu 23: Nguyên tố A có 3 đồng vị bền là A1, A2, A3. Tổng số khối của 3 đồng vị bằng 75. Số khối của đồng vị thứ
hai (A2) bằng trung bình cộng số khối của hai đồng vị còn lại. Đồng vị thứ ba (A3) chiếm 11,4% và có số khối nhiều hơn đồng vị hai (A2) là 1 đơn vị
a. Số khối của mỗi đồng vị là
A. 24, 26, 27 B. 23, 24, 25. C. 24, 25, 26. D. 22, 26, 27.
b. Biết nguyên tử khối trung bình của R là 24,328 amu (đvC). Phần trăm số nguyên tử của các đồng vị A1, A2 lần lượt là
A. 67,8%; 20,8%. B. 20,8%; 67,8%. C. 78,6 %; 10%. D. 10%; 78,6%.
Câu 24: Nguyên tố X có 2 đồng vị là X1, X2 ( X M24,8 = ). Đồng vị X2 nhiều hơn đồng vị X1 là 2 neutron. Biết tỉ lệ
số nguyên tử của 2 đồng vị là 1 2
X 3 = X2
a. Tỉ lệ phần trăm của mỗi đồng vị X1, X2 lần lượt là
A. 40%; 60%. B. 72%; 48%. C. 60%; 40%. D. 48%; 72%.
b. Số khối của mỗi đồng vị X1, X2 lần lượt là
A. 26; 28. B. 28; 30. C. 24; 26. D. 22; 24.
Câu 25: Nguyên tố Cu có nguyên tử khối trung bình là 63,54 với 2 đồng vị X và Y có tổng số khối là 128. Số nguyên tử đồng vị X bằng 0,37 lần số nguyên tử đồng vị Y. Số neutron của đồng vị X nhiều hơn số neutron của đồng vị Y là
A. 1 hạt. B. 2 hạt. C. 3 hạt. D. 4 hạt.
Câu 26: Một nguyên tố X có hai đồng vị có tỉ lệ nguyên tử là 27:23. Hạt nhân của X có 35 proton. Đồng vị 1 có 44 neutron, đồng vị 2 nhiều hơn đồng vị 1 là 2 neutron. Nguyên tử khối trung bình của X là
A. 80,22. B. 79,92. C. 79,56. D. 81,32.
Câu 27: Nguyên tố Z có 2 đồng vị X, Y với khối lượng nguyên tử trung bình bằng 79,9. Hạt nhân đồng vị X có 35 hạt proton và 44 hạt neutron. Hạt nhân đồng vị Y có số hạt neutron nhiều hơn X 2 hạt. Tỉ lệ số nguyên tử Y/X là
A. 9/10. B. 10/11. C. 9/11. D. 11/9.
Câu 28: Nguyên tố X có 3 đồng vị là A1 chiếm 92,3%, A2 chiếm 4,7% và A3 chiếm 3%. Tổng số khối của 3 đồng vị bằng 87. Số neutron trong A2 nhiều hơn trong A1 là 1 hạt. Nguyên tử khối trung bình của X là 28,107 đvC. Vậy
A1, A2, A3 lần lượt bằng A. 29, 39, 31. B. 28, 29, 30. C. 30, 31, 32. D. 29, 31, 33.
Câu 29: Cho 5,9 gam muối NaX tác dụng với dung dịch AgNO3 dư, thu được 14,4 gam kết tủa. Biết nguyên tố X có 2 đồng vị X1, X2 với phần trăm các đồng vị bằng nhau và đồng vị X2 nhiều hơn đồng vị X1 là 2 neutron. Số khối
đồng vị X1, X2 là
A. 34; 36. B. 36; 38. C. 33; 35. D. 35; 37.
Câu 30: Nguyên tố chlorine (clo) có hai đồng vị bền với tỉ lệ phần trăm số nguyên tử tương ứng là: 35 17 Cl chiếm
75,77% và 37 17 Cl chiếm 24,23%. Trong phân tử CaCl2, phần trăm khối lượng của 35 17 Cl là (Ca=40) là
A. 23,9%. B. 47,8%. C. 16,2%. D. 75,8%.
Câu 31: Sb chứa hai đồng vị chính 121Sb và 123Sb, khối lượng nguyên tử trung bình của Sb là 121,75. Phần trăm khối lượng của đồng vị 121Sb trong Sb2O3 (MO = 16) là
A. 62,50%. B. 25,94%. C. 52,20%. D. 51,89%.
Câu 32: Trong tự nhiên, nguyên tố copper (đồng) có 2 đồng vị 63Cu và 65Cu, trong đó đồng vị 65Cu chiếm khoảng 27% về khối lượng. Phần trăm khối lượng của 63Cu trong Cu2O là
A. 88,82%. B. 63%. C. 64,29%. D. 32,14%.
Câu 33: Trong tự nhiên copper (đồng) có 2 đồng vị là 63Cu va 65Cu, trong đó 65Cu chiếm 27% về số nguyên tử Phần trăm về khối lượng của 63Cu trong Cu2S là (S=32)
A. 57,82. B. 75,32. C. 79,21. D. 79,88.
Câu 34: Trong tự nhiên copper (đồng) có 2 đồng vị 63 29 Cu và 65 29 Cu. Nguyên tử khối trung bình của copper là 63,54; của chlorine (clo) là 35,5. Phần trăm khối lượng của 63 29 Cu trong CuCl2 là
A. 12,64%. B. 26,77%. C. 27,00%. D. 34,18%.
Câu 35: Nguyên tử khối trung bình của bromine (Br) là 79,91. Bromine (brom) có 2 đồng vị là 79 35 Br và 81 35 Br . Phần trăm khối lượng của đồng vị 79 35 Br trong muối NaBrO3 là
A. 28,53%. B. 23,85%. C. 35,28%. D. 32,58%.
Câu 36: Trong tự nhiên chlorine (clo) có hai đồng vị bền: 37 17 Cl chiếm 24,23% tổng số nguyên tử, còn lại là 35 17 Cl .
Thành phần phần trăm theo khối lượng của 37 17 Cl trong HClO4 là
A. 8,92%. B. 8,43%. C. 8,56%. D. 8,79%.
Câu 37: Trong tự nhiên chlorine (clo) có hai đồng vị bền: 37 17 Cl chiếm 24,25% tổng số nguyên tử, còn lại là 35 17 Cl Thành phần phần trăm theo khối lượng của 37 17 Cl trong NaClO4 là
A. 7,325%. B. 8,435%. C. 8,565%. D. 8,790%.
Câu 38: Trong tự nhiên silver (bạc) có hai đồng vị bền là 107Ag và 109Ag. Nguyên tử khối trung bình của Ag là 107,87. Phần trăm khối lượng của 107Ag có trong AgNO3 là
A. 43,12%. B. 35,59%. C. 64,44%. D. 35,56%.
Câu 39: Trong tự nhiên, nguyên tố clo có hai đồng vị bền là Cl 35 17 và Cl 37 17 , trong đó đồng vị Cl 35 17 chiếm 75,77% về số nguyên tử. Phần trăm khối lượng của 37 17 Cl trong CaCl2 (Ca=40) là
A. 24,23%. B. 16,16%. C. 26,16%. D. 8,08%.
Câu 40: Tỉ lệ theo số lượng của của hai đồng vị 27 13 Al và 29 13 Al là 23 2 . Phần trăm theo khối lượng của 27 13 Al trong phân tử Al2X3 là 33,05%. Nguyên tử khối của X là
A. 32. B. 96. C. 16. D. 48.
6. Xác định nguyên tố, hợp chất dựa vào đặc điểm số hạt cơ bản
Ví dụ 1: X là nguyên tố hóa học có trong thành phần của chất có tác dụng oxi hóa và sát khuẩn cực mạnh, thường được sử dụng với mục đích khử trùng và tẩy trắng trong lĩnh vực thủy sản, dệt nhuộm, xử lí nước cấp, nước thải, nước bể bơi. Nguyên tử X có tổng số các loại hạt bằng 52, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 16 hạt. Xác định kí hiệu nguyên tử X.
Ví dụ 2: Hợp kim chứa nguyên tố X nhẹ và bền, dùng chế tạo vỏ máy bay, tên lửa. Nguyên tố X còn được sử dụng trong xây dựng, ngành điện và đồ gia dụng. Nguyên tử của nguyên tố X có tổng số hạt (proton, electron, neutron) là
40. Tổng số hạt mang điện nhiều hơn tổng số hạt không mang điện là 12.
a. Tính số mỗi loại hạt (proton, electron, neutron) trong nguyên tử X.
b. Tính số khối của nguyên tử X.
Ví dụ 3: Trong tự nhiên, hợp chất X tồn tại ở dạng quặng có công thức ABY2. X được khai thác và sử dụng nhiều trong luyện kim hoặc sản xuất acid. Trong phân tử X, nguyên tử của hai nguyên tố A và B đều có phân lớp ngoài
cùng là 4s, các ion A2+ và B2+ có số electron lớp ngoài cùng lần lượt là 17 và 14. Tổng số hạt proton trong X là 87.
a. Viết cấu hình electron nguyên tử của A và B.
b. Xác định X.
Ví dụ 4: Hợp chất Y có công thức MX2 (là hợp chất được sử dụng là cơ chế đánh lửa bằng bánh xe trong các dạng
súng cổ), trong đó M chiếm 46,67% về khối lượng. Trong hạt nhân của M số neutron nhiều hơn số proton là 4.
Trong hạt nhân của X, số neutron bằng số proton. Tổng số proton trong MX2 là 58.
a. Xác định AM và AX
b. Xác định công thức của MX2.
Ví dụ 5: Hợp chất E có công thức phân tử là M2X. Tổng số hạt cơ bản trong một phân tử là 116, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 36. Tổng hạt trong hạt nhân của nguyên tử của X lớn hơn M là 9.
Tổng số hạt trong X 2- nhiều hơn trong M+ là 17. Xác định công thức của E.
Ví dụ 6: Trên xe ô tô, phía trước thường được trang bị túi khí. Túi này được thiết kế nhằm giảm thiểu và hạn chế những chấn thương nghiêm trọng khi có sự cố va chạm, tai nạn xảy ra. Thành phần hóa chất bên trong túi khí có chứa hợp chất XY3. Mỗi phân tử XY3 có tổng các hạt proton, neutron và electron bằng 97; trong đó, số hạt mang
điện nhiều hơn số hạt không mang điện là 31, số hạt mang điện của X ít hơn số hạt mang điện của Y là 20. Hãy xác
định công thức hợp chất XY3
● Cấp độ thông hiểu
Bài tập vận dụng
Câu 1: Tổng số hạt cơ bản trong nguyên tử M là 82, trong đó tổng số hạt mang điện nhiều hơn số hạt không mang
điện là 22. M là
A. Fe. B. Cu.
C. Ni. D. Cr.
Câu 2: Tổng số hạt cơ bản trong nguyên tử X là 52, trong đó tổng số hạt mang điện nhiều hơn số hạt không mang
điện là 16. X là
A. F. B. Cl. C. Br. D. I.
Câu 3: Nguyên tử của một nguyên tố R có tổng số các loại hạt proton, electron, neutron bằng 82, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 22 hạt. Nguyên tố R là
A. Cu. B. Mg. C. Fe. D. Al.
Câu 4: Tổng số hạt cơ bản trong nguyên tử của nguyên tố X là 114. Trong đó tổng số hạt mang điện nhiều hơn số hạt không mang điện là 26. Nguyên tố X là
A. Cl. B. Br. C. Zn. D. Ag.
Câu 5: Trong một nguyên tử X tổng số hạt proton, neutron và electron là 52. Trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 16 hạt. Số electron lớp ngoài cùng của X là
A. 3. B. 7. C. 4. D. 6.
Câu 6: Hợp kim chứa nguyên tố X nhẹ và bền, dùng chế tạo vỏ máy bay, tên lửa. Nguyên tố X còn được sử dụng trong xây dựng, ngành điện và đồ gia dụng. Nguyên tử của nguyên tố X có tổng số hạt (proton, electron, neutron) là 40. Tổng số hạt mang điện nhiều hơn tổng số hạt không mang điện là 12. Số khối của nguyên tử X là
A. 22. B. 27.
C. 32. D. 34.
Câu 7: X là nguyên tố hóa học có thành phần của chất có tác dụng oxi hóa và sát khuẩn cực mạnh, thường được sử dụng với mục đích khử trùng và tẩy trắng trong lĩnh vực thủy sản, diệt nhuộm, xử lí nước cấp, nước thải, nước bể bơi. Tổng số hạt cơ bản trong nguyên tử X là 52, trong đó tổng số hạt mang điện nhiều hơn số hạt không mang điện là 16. Tổng số hạt mang điện trong nguyên tử X là A. 36. B. 18. C. 34.
Câu 8: Các hợp chất của nguyên tố X được sử dụng như là vật liệu chịu lửa trong các lò sản xuất sắt, thép, kim loại màu, thủy tinh và xi măng. Oxide của X và hợp chất khác cũng được sử dụng trong nông nghiệp, công nghiệp hóa chất và xây dựng. Nguyên tử X có tổng số hạt là 36. Số hạt không mang điện bằng một nửa hiệu số giữa tổng số hạt
với số hạt mang điện tích âm. Số neutron và electron của nguyên tử X là:
A. 11n, 12e. B. 12n, 11e. C. 12n, 12e. D. 13e, 13n.
Câu 9: Cho nguyên tử X có tổng số hạt là 34, trong đó tổng số hạt mang điện gấp 1,8333 lần số hạt không mang
điện. X là
A. Mg. B. Li. C. Al. D. Na.
Câu 10: Nguyên tử của nguyên tố hóa học X có tổng số hạt proton, neutron, electron là 180. Trong đó tổng các hạt mang điện gấp 1,4324 lần số hạt không mang điện. X là
A. Cl. B. Br. C. I. D. F.
Câu 11: Nguyên tử của nguyên tố X có tổng số hạt là 28. Trong đó số hạt không mang điện chiếm khoảng 35,71 % tổng các loại hạt. X là
A. S. B. N. C. F. D. O.
Câu 12: Nguyên tử của nguyên tố X có tổng số hạt cơ bản là 34. Số hạt mang điện gấp 1,8333 lần số hạt không mang điện. Nguyên tố X là
A. Na (Z = 11). B. Mg (Z = 12). C. Al (Z = 13). D. Cl (Z =17).
Câu 13: Nguyên tử của nguyên tố X có tổng số hạt proton, electron, neutron bằng 180. Trong đó các hạt mang điện chiếm 58,89% tổng số hạt. X là nguyên tố
A. flo. B. clo. C. brom. D. iot.
Câu 14: Nitrogen giúp bảo quản tinh trùng, phôi, máu và tế bào gốc. Biết nguyên tử nitrogen có tổng số hạt là 21.
Số hạt không mang điện chiếm 33,33%. Số hạt neutron trong phân tử nitrogen (N2) là:
A. 14. B. 5. C. 6. D. 7.
● Cấp độ vận dụng
Câu 15: Tổng số hạt cơ bản trong nguyên tử của nguyên tố X là 40. Nguyên tố X là
A. Cu. B. Mg. C. Fe. D. Al.
Câu 16: Hợp chất MX2 được cấu tạo nên từ một nguyên tử M và hai nguyên tử X, biết tổng số hạt trong MX2 là 96 hạt, tổng số hạt trong M là 48 hạt. Hợp chất MX2 là
A. CO2 B. SO2 C. CaCl2 D. MgCl2
Câu 17: Tổng số hạt cơ bản của phân tử MCl2 là 164, trong đó tổng số hạt mang điện hơn số hạt không mang điện là 52. M là
A. Ca. B. Mg. C. Cu. D. Zn.
Câu 18: Tổng số hạt cơ bản của phân tử M2O5 là 212, trong đó tổng số hạt mang điện hơn số hạt không mang điện là 68. M là
A. N. B. P. C. As. D. Bi.
Câu 19: Tổng số hạt cơ bản của phân tử CaX2 là 288, trong đó tổng số hạt mang điện hơn số hạt không mang điện là 72. Nguyên tử X là
A. clo. B. brom. C. iot. D. flo.
Câu 20: Hợp chất MX3 có tổng số hạt mang điện tích là 128. Trong hợp chất, số proton của nguyên tử X nhiều hơn số proton của nguyên tử M là 38. Công thức của hợp chất trên là
A. FeCl3 B. AlCl3 C. FeF3 D. AlBr3
Câu 21: Hợp chất E có công thức MX2. Tổng số hạt proton, electron và neutron trong phân tử E là 96. Tổng số hạt proton, neutron, electron của [M] nhiều hơn so với [X]2 trong E là 24. Khối lượng phân tử của E là
A. 111. B. 64. C. 95. D. 208.
Câu 22: Hợp chất E có công thức MX. Tổng số hạt proton, electron và neutron trong phân tử E là 86 Tổng số hạt proton, neutron, electron của M ít hơn so với X trong E là 18. Khối lượng phân tử của E là
A. 74,5. B. 56. C. 58,5. D. 153.-
Câu 23: Phân tử XY2 có tổng số hạt proton, neutron, electron là 66, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 22, số hạt mang điện của Y nhiều hơn của X là 20. Công thức phân tử XY2 là
A. SO2 B. NO2 C. CO2 D. CS2.--------
Câu 24: Tổng số hạt proton, neutron , electron trong hai nguyên tử của nguyên tố X và Y là 96 trong đó tổng số hạt mang điện nhiều hơn tổng số hạt không mang điện là 32 . Số hạt mang điện của nguyên tử Y nhiều hơn của X là
16. X và Y lần lượt là
A. Be và Mg. B. Ca và Sr. C. Na và Ca. D. Mg và Ca.
Câu 25: Nguyên tố R có hai đồng vị X và Y. Tỉ lệ số nguyên tử của X : Y là 9 : 91. Tổng số hạt trong nguyên tử
của X bằng 32. X nhiều hơn Y là 2 neutron. Trong Y số hạt mang điện gấp 2 lần số hạt không mang điện. Tính
nguyên tử khối trung bình của R.
A. 22,63. B. 20,18. C. 21,15. D. 22,35.
Câu 26: Cấu hình electron ngoài cùng của nguyên tử của nguyên tố X là 5p5. Tỉ số neutron và điện tích hạt nhân
bằng 1,3962. Số neutron của X bằng 3,7 lần số neutron của nguyên tử thuộc nguyên tố Y. Khi cho 4,29 gam Y tác dụng với lượng dư X thu được 18,26 gam sản phẩm có công thức XY. Số đơn vị điện tích hạt nhân của Y là
A. 19. B. 20. C. 21. D. 22.
● Cấp độ vận dụng cao
Câu 27: Tổng số hạt trong phân tử MX là 84 hạt, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là
28. Số neutron của M nhiều hơn số khối của X là 4 đơn vị. Số hạt trong M lớn hơn số hạt trong X là 36 hạt. Hợp chất MX là
A. CaO. B. MgO. C. CaS. D. MgS.
Câu 28: Hợp chất XY2 phổ biến trong sử dụng để làm cơ chế đánh lửa bằng bánh xe trong các dạng súng cổ. Mỗi phân tử XY2 có tổng số hạt proton, electron, neutron bằng 178. Trong phân tử số hạt mang điện nhiều hơn số hạt không mang điện là 54, số hạt mang điện của X ít hơn số hạt mang điện Y là 12. Hợp chất XY2 là
A. CuS2. B. FeCl2. C. CuCl2. D. FeS2.
Câu 29: Hợp chất Y (AB3) được sử dụng để lắng các hạt gây ô nhiễm nước từ chất thải đô thị hoặc công nghiệp. Người ta nói rằng nó cho phép loại bỏ một số ký sinh trùng và ngăn chặn mất máu do vết thương ở động vật và để chữa lành chúng. Y có tổng số hạt trong phân tử là 238; số hạt mang điện nhiều hơn số hạt không mang điện là 70.
Trong đó, số hạt mang điện của A nhiều hơn của B là 9. Công thức của Y là
A. FeCl3 B. FeBr3 C. AlBr3 D. AlCl3
Câu 30: Hợp chất Y có công thức MX2 (là hợp chất được sử dụng là cơ chế đánh lửa bằng bánh xe trong các dạng súng cổ), trong đó M chiếm 46,67% về khối lượng. Trong hạt nhân của M số neutron nhiều hơn số proton là 4.
Trong hạt nhân của X, số neutron bằng số proton. Trổng số proton trong MX2 là 58. Khối lượng phân tử của Y là
A. 111. B. 64. C. 95. D. 120.
Câu 31: Hợp chất MX3 được sử dụng là chất xúc tác trong tổng hợp chất hữu cơ. Tổng số hạt (p, n, e) trong hợp chất MX3 là 196. Trong đó số hạt mang điện nhiều hơn không mang điện là 60. Số khối của M nhỏ hơn số khối của X là 8. Tổng số hạt trong ion X- nhiều hơn trong ion M3+ là 16. Hợp chất MX3 là
A. FeCl3 B. FeBr3 C. AlBr3 D. AlCl3
Câu 32: Hợp chất A được tạo thành từ các ion X3+ và Y2- (X, Y là kí hiệu các nguyên tố chưa biết). Tổng số hạt proton, neutron, electron trong hợp chất A bằng 296, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 88 hạt. Số khối của X lớn hơn số khối của Y là 20. Số proton của Y, số electron của X, số khối của Y theo thứ tự là 3 số hạng lập thành một cấp số cộng. Công thức phân tử của A là
A. Al2O3 B. Cr2O3 C. Fe2O3 D. Cr2S3
Câu 33: Một hợp chất ion cấu tạo từ ion M2+ và X– , tổng số hạt cơ bản trong phân tử MX2 là 186 hạt trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 54 hạt.Số neutron của ion M2+ nhiều hơn X– là 12. Tổng số hạt M2+ nhiều hơn trong X– là 27 hạt. Công thức phân tử của MX2 là
A. BaBr2 B. ZnBr2 C. CaCl2 D. FeCl2
Câu 34: Hợp chất M được tạo thành từ các ion X+ và2Y (X, Y là kí hiệu các nguyên tố chưa biết). Tổng số hạt proton, neutron, electron trong một phân tử M bằng 106, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 36 hạt. Số khối của X lớn hơn số khối của Y là 23 đơn vị. Tổng số hạt proton, neutron, electron trong X+ nhiều hơn trong2Y là 8 hạt. Công thức phân tử của M là
Câu 35: Hợp chất M được tạo thành từ các ion X+ và 2 2Y (X, Y là kí hiệu các nguyên tố chưa biết). Tổng số hạt proton, neutron, electron trong một phân tử M bằng 116, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 36 hạt. Số khối của X lớn hơn số khối của Y là 7 đơn vị. Tổng số hạt proton, neutron, electron trong X+ ít hơn trong 2 2Y là 17 hạt. Công thức phân tử của M là
A. K2O2 B. BaO2 C. Na2O2 D. KO2
Câu 36: Hợp chất X có công thức phân tử là MxRy, trong đó M chiếm 52,94% về khối lượng. Biết x + y = 5. Trong nguyên tử M, số neutron nhiều hơn số proton là 1. Trong nguyên tử R số neutron bằng số proton. Tổng số hạt proton, neutron và electron trong X là 152. Công thức phân tử của X là
A. Cr2O3 B. Fe2O3 C. Cr2S3 D. Al2O3
Câu 37: Hai nguyên tố A, B tạo thành hợp chất X (ZA, ZB ≤ 105). Khi đốt nóng X đến 800oC tạo ra đơn chất A. Số electron hóa trị trong nguyên tử nguyên tố A bằng số lớp electron nguyên tử nguyên tố B. Số electron hóa trị trong nguyên tử nguyên tố B bằng số lớp electron nguyên tử nguyên tố A. Điện tích hạt nhân của nguyên tử B gấp 7 lần của nguyên tử A. Công thức phân tử của hợp chất X là
A. BaO. B. BaO2 C. Na2O. D. KO2
7. Xác định khối lượng riêng của hạt nhân nguyên tử, bán kính nguyên tử
Ví dụ 1: Nguyên tử kẽm (Zn) có nguyên tử khối bằng 65u. Thực tế hầu như toàn bộ khối lượng nguyên tử tập trung
ở hạt nhân, với bán kính r = 2×10-15 m. Khối lượng riêng của hạt nhân nguyên tử kẽm là bao nhiêu tấn trên một centimet khối (tấn/cm3)?
Ví dụ 2: Sao neutron là một dạng trong 1 số khả năng kết thúc của quá trình tiến hóa sao. Sao neutron được hình thành khi 1 ngôi sao lớn hết nhiên liệu và sụp đổ. Các ngôi sao neutron trong vũ trụ đươc cấu tạo chủ yếu từ các hạt neutron. Giả sử bản kính của neutron là khoảng 13 1,010 × cm.
a. Tính khối lượng riêng của neutron, coi neutron có dạng hình cầu.
b. Giả sử một ngôi sao neutron có cùng khối lượng riêng với neutron, hãy tính khối lượng (theo kg) của một mảnh ngôi sao neutron có kích thước bằng 1 hạt cát hình cầu với bán kính 0,1 mm.
Ví dụ 3: Calcium (canxi) là một khoáng chất có vai trò rất quan trọng trong cơ thể người. Trong cơ thể, calcium chiếm 1,5 – 2% trọng lượng, 99% lượng calcium tồn tại trong xương, răng, móng và 1% trong máu. Calcium kết hợp với phosphorus là thành phần cấu tạo cơ bản của xương và răng, làm cho xương và răng chắc khỏe. Khối lượng riêng của calcium kim loại là 1,55 gam/cm3. Giả thiết rằng, trong tinh thể calcium, các nguyên tử là những hình cầu chiếm 74% thể tích tinh thể, phần còn lại là khe rỗng. Xác định bán kính nguyên tử calcium. Cho nguyên tử khối của calcium là 40. Cho biết công thức tính thể tích hình cầu là
Bài tập vận dụng
34r V
3 π = , trong đó r là bán kính hình cầu.
● Cấp độ vận dụng
Câu 1: Bán kính nguyên tử và khối lượng mol nguyên tử Fe lần lượt là 1,28 Ao và 56 g/mol. Biết rằng trong tinh thể, các tinh thể Fe chiếm 74% thể tích, còn lại là phần rỗng. Khối lượng riêng của Fe là
A. 8,74 g/cm3 . B. 7,84 g/cm3 . C. 4,78 g/cm3 . D. 10,59 g/cm3 .
Câu 2: Bán kính nguyên tử Fe vào khoảng 0,13 nm. Vậy thể tích tính theo đơn vị cm3 của một nguyên tử Fe vào khoảng:
A. 16.33.10-24 cm3
C. 10,62.10-24 cm3
B. 9,20. 10-24 cm3
D. 5,17.10-24 cm3
Câu 3: Nguyên tử Zn có bán kính r = 1,35Ao, nguyên tử khố bằng 65 amu (đvC). Thực tế hầu như toàn bộ khối lượng nguyển tử tập trung ở hạt nhân với bán kính r = 2.10-15m. Khối lượng riêng của hạt nhân nguyên tử Zn là
A. 2,33.1015 g/cm3 B. 3,35.1015 g/cm3
C. 3,22.1015 g/cm3 D. 5,33.1015g/cm3
Câu 4: Cho biết nguyên tử Zn có bán kính nguyên tử và khối lượng mol nguyên tử lần lượt là 0,138 nm và 65 gam/mol. Biết thể tích của Zn chỉ chiếm 72,5% thể tích tinh thể. Tính khối lượng riêng của tinh thể Zn (Số Avogađro N = 6,023.1023)
A. 5,15 g/cm3 . B. 7,79 g/cm3 . C. 9,81 g/cm3 . D. 7,11 g/cm3 .
Câu 5: Trong nguyên tử, giữa bán kính hạt nhân (r) và số khối của hạt nhân (A) có mối quan hệ như sau: r = 1,5.10-13.A1/3 cm. Khối lượng riêng của hạt nhân nguyên tử (tấn/cm3) là
A. 117,5.106 B. 117,5.1012 C. 116.106 D. 116.1012
Câu 6: Một cách gần đúng coi mỗi hạt proton cũng như mỗi hạt neutron có khối lượng bằng 1amu (đvC), hãy tính khối lượng riêng của hạt nhân? Biết R= k.A1/3 trong đó k = 1,5.10-13 .
A. D = 2,1.1014 g/cm3 . B. D = 5,1.1014 g/cm3 .
C. D = 4,2.1014 g/cm3 D. D = 1,2.1014 g/cm3
Câu 7: Bán kính của hạt nhân nguyên tử carbon và bán kính của nguyên tử carbon lần lượt là khoảng 2,7 fm (femtômét) và khoảng 70 pm (picômét). Biết rằng 1512 1 fm10m;1 pm10m== . Phần trăm thể tích nguyên tử carbon bị chiếm bởi hạt nhân có giá trị là
A. 5,74.10-12 B. 8,24.10-12
● Cấp độ vận dụng cao
C. 1,44.10-11
D. 1,16.10-11
Câu 8: Khối lượng riêng của canxi kim loại là 1,55 g/cm3. Giả thiết rằng, trong tinh thể canxi các nguyên tử là những hình cầu chiếm 74% thể tích tinh thể, phần còn lại là khe rỗng. Bán kính nguyên tử canxi tính theo lí thuyết
là
A. 0,155nm. B. 0,185 nm. C. 0,196 nm. D. 0,168 nm.
Câu 9: Ở 20oC, DAu = 19,32 g/cm3. Giả thiết trong tinh thể các nguyên tử Au là những hình cầu chiếm 75% thể tích tinh thể. Biết khối lượng nguyên tử của Au là 196,97. Bán kính nguyên tử của Au là
A. 4,11.10-8cm. B. 1,14.10-8cm. C. 4,41.10-8cm. D. 1,44.10-8cm.
Câu 10: Giả thiết trong tinh thể các nguyên tử sắt là những hình cầu chiếm 74% thể tích tinh thể, phần còn lại là các khe rỗng giữa các quả cầu, cho nguyên tử khối của Fe là 55,85 và ở 200C khối lượng riêng của Fe là 7,87g/cm3
Bán kính nguyên tử gần đúng của Fe ở 20oC là
A. 1,41Ao B. 1,67Ao C. 1,29Ao D. 1,97Ao
Câu 11: Khối lượng riêng của Li là 0,53 g/cm3 và nguyên tử khối của Li và 6,94. Trong tinh thể Li, có 32% theo thể tích là khe trống. Bán kính nguyên tử gần đúng của Li là
A. 1,52.10-8cm. B. 1,12.10-8cm. C. 1,18.10-8cm. D. 1,25.10-8cm.
