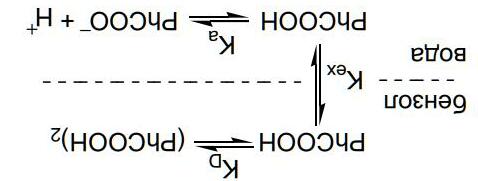
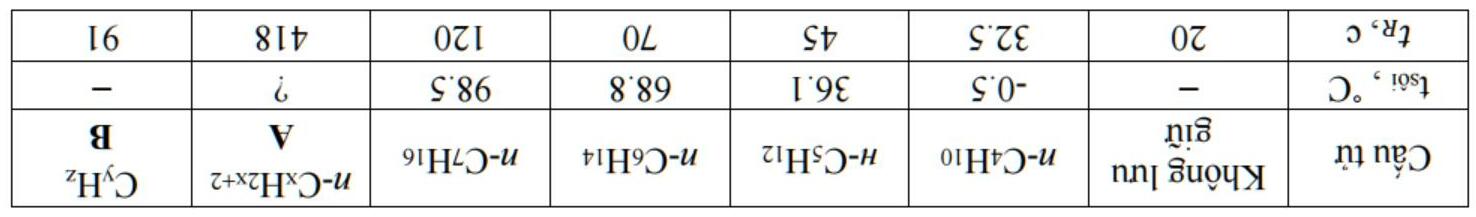
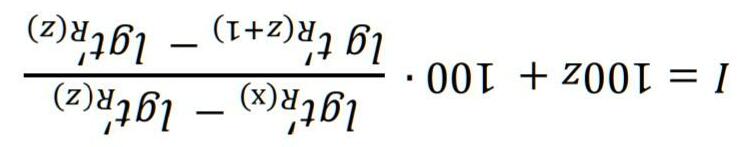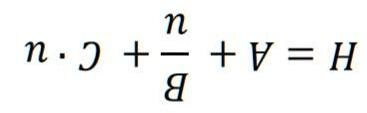Chuyên đề 28: Cân bằng ion trong dung dịch: acid và base
Bài 1
Axit xyanhydric là một axit yếu có hằng số phân ly Ka = 4.93×10–10
a) Tìm pH của dung dịch HCN 1.00 M.
b) 10 L nước tinh khiết bị lẫn NaCN do tai nạn. pH dung dịch được xác định là 7.40. Xác định nồng độ của các tiểu phân Na+, H+, OH , CN , HCN và từ đó tính khối lượng NaCN thêm vào.
Bài 2
Hàm lượng cao hơn (so với thông thường) của calcium trong nước tự
1) Dẫn ra công thức tính hằng số cân bằng K của phản ứng hoà tan đá vôi (1) và tính giá trị của nó.
2) Dẫn ra công thức tính nồng độ calcium khi biết áp suất riêng của carbon dioxide trong không khí. Tính nồng độ calcium (mol/L) khi áp suất riêng của carbon dioxide trong không khí là p(CO2) = 3.66·10-4 atm.
3) Nồng độ calcium trong nước sông Don là 80 mg/L. Tính áp suất riêng của carbon dioxide (theo atm) trong không khí ở lưu vực sông Don.
4) Tính thể tích hydrochloric acid nồng độ 0.09132 mol/L cần để chuẩn độ 100 mL nước sông Don.
5) Nên chọn chỉ thị nào sau đây: picric acid, methyl da cam, phenolphthalein, p-nitrophenol cho quá trình chuẩn độ này?
Ở 25.0°C và áp suất tiêu chuẩn p(CO2) = 1.00 bar 0.8304 L CO2 được hoà tan vào 1,00L nước.
1) Tính nồng độ mol của CO2 hòa tan.
2) Tính hằng số Henry của CO2 ở 25.0°C.
3) Tính nồng độ mol của CO2 hòa tan trong nước mưa, nếu phần thể tích của CO2 trong khí quyển là 380 ppm hôm nay và áp suất khí quyển có gía trị là 1.00 bar.
Một phần của CO2 hòa tan phản ứng với nước để tạo thành axit cacbonic.
Hằng số cân bằng của phản ứng này là K=1.67·10-3, trong biểu thức của KA thì nồng độ của nước được xem như là hằng số và được nằm trong biểu thức K.
4) Tính nồng độ của axit cacbonic hòa tan trong nước mưa ? Chú ý rằng nồng độ của CO2 không thay đổi trong qúa trình này.
Đối với hằng số phân ly nấc thứ nhất thì [H2CO3]* được sử dụng thay cho nồng độ thực của axit cacbonic. [H2CO3]* là tổng nồng độ của axit cacbonic hòa tan và nồng độ của khí cacbonic hòa tan CO2 Các gía trị KA: KA1 = 4.45·10-7 and KA2 = 4.84·10-11 .
5) Tính pH của nước mưa. Bỏ qua sự tự proton phân của nước cũng như nấc phân ly thứ hai của axit cacbonic. Lưu ý: Giá trị [H2CO3]* luôn là một hằng số
Năm 1960, phần thể tích của CO2 trong khí quyển chỉ là 320 ppm.
6) Tính pH của nước mưa vào thời điểm này (tất cả các điều kiện khác đều như câu 3.5.).Đá vôi (CaCO3) có tích số tan là KL=4.70·10-9
7) Tính độ tan của đá vôi trong nước tinh khiết. Giả sử rằng cacbonat hay hydrocacbonat đều không thể phản ứng tạo ra axit cacbonic.
Tính độ tan của đá vôi trong nước mưa trong điều kiện hiện nay. Như trên đã nói thì gía trị của [H2CO3]* luôn là một hằng số. Để giải quyết được bài này hãy làm theo các bước sau:
8) Viết các ion mà ta vẫn chưa xác định được nồng độ và được yêu cầu phải tính.
9) Viết ra tất cả các biểu thức toán học cần thiết để tính các gía trị này.
10) Xác định biểu thức cuối cùng chỉ chứa [H3O+] như là một ẩn số. Phương trình bậc cao này rất khó để có thể giải được chính xác. Ta có thể giả sử rằng pH của dung dịch này là pH = 8.26.
11) Tính độ tan của đá vôi trong nước mưa bằng cách sử dụng thông tin cuối cùng.
1) Dấm được sử dụng nhiều trong chế biến thực phẩm. Thành phần chính của dấm là acetic acid có vị cay nồng. Một mẫu dấm thường chứa khoảng 5 % acetic acid (theo tỉ lệ thể tích/thể tích, hay v/v). Khối lượng riêng của acetic acid là 1.05 g mL-1
a) Tính nồng độ mol của acetic acid trong dung dịch dấm.
b) Tính pH của mẫu dấm ở trên, cho biết Ka (acetic acid) = 1.75·10-5
2) Lấy 100 mL mẫu dấm trên pha loãng thành 250 mL, rồi lấy 25 mL đem chuẩn độ với dung dịch NaOH 0.100 M.
1) Tính pH của dung dịch khi thêm vào 10 mL dung dịch NaOH.
2) Tính pH của dung dịch ở điểm tương đương (điểm tương đương là điểm kết thúc về mặt lí thuyết của quá trình chuẩn độ).
3) Máy đo pH thường được hiệu chuẩn bằng cách sử dụng dung dịch đệm đã biết chính xác giá trị pH, ví dụ như dung dịch chứa sodium acetate và acetic acid với pH = 5. Cần bao nhiêu mol sodium acetate và acetic acid để điều chế 250 mL dung dịch đệm này? Cho biết tổng nồng độ tất cả các dạng của acetic acid trong dung dịch là 0.8 M.
Bài 5
Một loại dung dịch khử trùng dùng để xử lí vệ sinh tổ ong, có chứa formic và propionic acid. Một nhân viên vệ sinh dịch tễ đã trộn các dung dịch sẵn có của các acid này, thu được 1.5 L dung dịch chứa 0.3 mol mỗi acid. Thật tò mò khi biết cả hai dung dịch ban đầu có cùng giá trị pH. Hơn nữa, pH của dung dịch thu được cũng có giá trị như vậy.
1) Tính pH của hỗn hợp các acid. Biết hằng số acid của HCOOH và C2H5COOH là 1.77·10-4 và 1.34·10-5 .
2) Xác định nồng độ của các acid trong các dung dịch ban đầu.
3) Tính tỉ lệ thể tích của các acid đem trộn ban đầu.
4) Xác định độ phân li của các acid trong các dung dịch ban đầu và trong hỗn hợp. Giải thích kết quả này.
5) Xác định thể tích nước cần thêm vào hỗn hợp acid để tăng gấp đôi độ phân li của formic acid.
Lấy 5 ml dung dịch H3PO4 có nồng độ 39,2 % và khối lượng riêng 1,25 gam/cm3 đem pha loãng thành 500 ml, thu được dung dịch I. Cho biết các giá trị hằng số acid Ka của H3PO4 lần lượt là 7,1·10-3; 6,2·10-8; 5,0·10-12
1) Tính pH của dung dịch I.
2) Lấy 100 ml dung dịch I rồi hòa tan 0,28 gam NaOH vào, thu được dung dịch II. Tính pH dung dịch này.
3) Thêm 0,0196 gam sulfuric acid vào dung dịch II, thu được dung dịch III. Tính pH dung dịch này.
4) Thêm 20 mg NaOH vào dung dịch II, thu được dung dịch IV. Tính pH dung dịch này.
5) Thêm 30 ml nước vào dung dịch II, thu được dung dịch V. Tính pH dung dịch này.
6) Kết luận về khả năng duy trì pH ổn định của dung dịch II. Lấy một số ví dụ về các dung dịch cũng có khả năng tương tự. Các dung dịch này gọi là gì và được sử dụng cho mục đích nào?
Bài 7
Trong bài này chúng ta sẽ khảo sát sự thủy phân anion pyrophotphat (P2O7 4–) bằng enzyme. Giả thiết rằng nồng độ của pyrophotphat thấp hơn so với hằng số Michaelis, như vậy phản ứng sẽ có bậc nhất. Ở 25 °C và pH = 7 thì hằng số tốc độ của phản ứng giả bậc nhất là *1 7 0,0010sk = . Cơ chế của phản ứng thủy phân này như sau: Biết hằng số phân ly axit nấc 1 và 2 tương ứng là pK1 = 6.12 và pK2 = 8.95 và k là hằng số tốc độ thực không phụ thuộc pH (giai đoạn 3). Giả thiết rằng tốc độ phân ly axit cũng nhanh như tốc độ thủy phân.
a) Viết phương trình phân ly thể hiện các hằng số K1 và K2. Đưa ra phương trình tính tổng nồng độ anion pyrophotphat.
b) Tính giá trị hằng số tốc độ thực k.
c) Tính giá trị hằng số tốc độ * 6k (ở pH=6) và * 8k (ở pH = 8).
|
Bài 8
Bài 9 Muối vô cơ A, tan tốt trong nước, có các tính chất sau:
O H2N
Các amino acid thiên nhiên, glutamine (Gln) và glutamic acid (Glu) chỉ khác nhau bởi nhóm amide và carboxylic ở cuối mạch. Tuy nhiên, chỉ một khác biệt nhỏ như vậy cũng gây ra những khác biệt lớn đến tính chất hóa học. NH2
O OH Gln Glu
O OH NH2
O HO
1) Viết các cân bằng trong dung dịch nước của mỗi amino acid.
2) Xác định công thức tính hằng số cân bằng của các cân bằng trong ý 1.
Tính điểm đẳng điện IP (là giá trị pH mà tại đó điện tích dương bằng điện tích âm) của mỗi amino acid. Biết rằng:
Amino acid/pKa pK1 pK2 pK3
Glutamine 2.17 9.13
Glutamic acid 2.19 9.67 4.25
a) Trong dung dịch nước (pH = 9.248) thì ngoài các ion tạo thành bởi sự thủy phân, còn phát hiện ra 2 phân tử (B, C) và 3 ion (X, Y, Z). Nồng độ của các phân tử và ion trong dung dịch là [B] = 10-0.998 M; [C] = 10-3.251 M; [X] = 10-1.002 M; [Y] = 10-1.003 M; [Z] = 10-4.357 M;
b) Phản ứng phân hủy nhiệt muối A khan là quá trình thuận nghịch, đi kèm với sự tạo thành chỉ hai sản phẩm khí.
1) Xác định công thức muối A và các vi hạt được kí hiệu ở trên. Viết phương trình phản ứng trong dung dịch nước, tạo thành các ion và phân tử tương ứng.
2) Đề xuất phương pháp để thu được muối A khan.
3) Xác định nồng độ muối A.
4) Viết các phương trình phản ứng xảy ra giữa A với dung dịch: a) AlCl3; b) K2Cr2O7.
5) Tính hằng số các cân bằng được thiết lập trong dung dịch muối A. Biết: Kw = [H+][OH ] = 10-14 .
|
Bài 10
Hòa tan 1,29 g tinh thể axit selenơ H2SeO3 trong nước rồi pha loãng đến 100 mL rồi nhúng chìm các điện cực của máy đo pH vào dung dịch này. Hãy cho biết trị số pH trên máy.
Thêm vào dung dịch axit selenơ 5.00 mL dung dịch natri hydroxit (c=1.00 mol/L) rồi đo pH lần nữa. Quy trình này được lặp lại 4 lần, mỗi lần thêm 5,00 mL dung dịch NaOH rồi đo pH. Tính pH của tất cả các trường hợp đã nêu. Cho biết các hằng số axit của axit selenơ lần lượt là: pK1=2.62; pK2=8.32.
Chú ý, cho rằng thể tích dung dịch không thay đổi trong suốt quá trình chuẩn độ!
Bài 11
Maleic acid là một acid hai nấc. Tùy thuộc vào pH mà maleic acid có thể tồn tại trong dung dịch ở nhiều dạng khác nhau. Nếu dạng không phân li được kí hiệu là H2M, thì các dạng có thể tồn tại trong dung dịch là H2M, HM và M2-. Đặt CT là tổng nồng độ tất cả các dạng của acid, và tỉ lệ các dạng tồn tại của maleic
Hóa Phân tích (Fundamentals of Analytical Chemistry)
|

STT Chất chỉ thị
Phenol
Khoảng pH chuyển màu STT Indicator
Khoảng pH chuyển màu
Bromoph enol xanh dương 3.0
Bromoph enol
m-cresol tím 1.2
Bài 12
Đương lượng xà phòng hóa là khối lượng (tính theo mg) mẫu ester có thể được xà phòng hóa bởi 1 mol hydroxide ion. Đương lượng xà phòng hóa có thể được xác định bởi phương pháp sau (khoảng đương lượng 1001000 mg mol-1; khối lượng mẫu 5 - 100 mg): Cân chính xác X (mg) mẫu, đặt vào bình xà phòng hóa rồi thêm một lượng thích hợp dung dịch potassium hydroxide 0.5 mol L-1 vào. Tiếp đó, nối với một bộ ngưng hồi lưu và ống nước vôi, rồi đun hồi lưu trong 0.5 đến 3 giờ. Sau khi phản ứng xà phòng hóa diễn ra hoàn toàn, dùng 1 - 2 mL ethanol để tẩy sạch thành bên trong ống ngưng tụ, sau đó tháo ống ngưng tụ ra và nhỏ ngay 5 giọt phenolphthalein vào rồi acid hóa bằng dung dịch hydrochloric 0.5 mol L 1, dùng một lượng acid hơi dư. Dung dịch acid hóa được chuyển vào một bình nón, còn bình chứa cũ được rửa nhẹ bằng dung dịch ethanol. Sau đó, đổ dung dịch nước rửa này vào cùng bình nón trên. Thêm potassium hydroxide 0.5 mol L-1 vào bình nón cho đến khi dung dịch chuyển sang màu đỏ nhạt, sau đó điều chỉnh bằng cách thêm hydrochloric acid 0.0250 mol L-1 vào cho đến khi dung dịch thành không màu, cần V1 (mL) hydrochloric acid; sau đó thêm 3 giọt chỉ thị màu xanh bromophenol xanh dương, sau đó chuẩn độ bằng hydrochloric acid 0.0250 mol L-1 cho tới khi dung dịch chuyển sang màu xanh lá cây thì dừng lại, thấy hết V2 (mL) acid. Quy trình thực nghiệm trên được lặp lại mà không có ester và dung dịch chuẩn hydrochloric acid cần dùng lần lượt là V3 và V4 (mL).
1) Vai trò của ống nước vôi là gì?
2) Viết công thức tính đương lượng xà phòng hóa.
3) Carboxylic acid tự do gây ra những tác động gì tới kết quả phân tích? Làm sao để loại bỏ những tác động này?
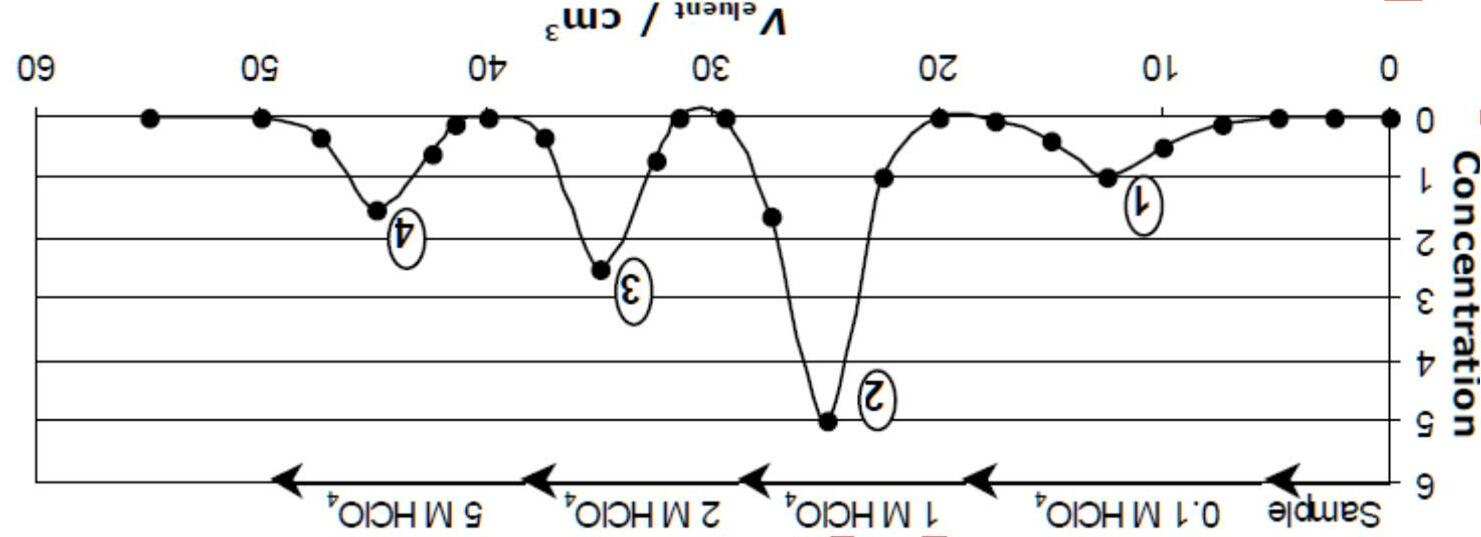
Trong phòng thí nghiệm, có hỗn hợp của 3 muối khan, là carbonate hoặc bicarbonate của các kim loại, một trong số đó là kim loại kiềm thổ. Cho 0.1 gam hỗn hợp này vào nước, rồi lọc phần không tan ra. Để chuẩn độ dung dịch sau khi lọc (dung dịch 1) - với methyl da cam - thì dùng hết 13.0 mL dung dịch HCl 0.1 M.
Nung hỗn hợp muối ở nhiệt độ 200 oC rồi lấy 0.1 gam hỗn hợp sau khi nung cho vào nước và lọc phần không tan ra. Để chuẩn độ dung dịch sau khi lọc (dung dịch 2), với chỉ thị methyl da cam, thì cần 14.7 mL dung dịch HCl 0.10 M.
Nếu nung hỗn hợp ban đầu tới 1400 oC thì khi lặp lại phép chuẩn độ tương tự với dung dịch 3 cần tới 15.4 mL dung dịch HCl 0.10 M.
1) Tính phần mol của các cấu tử trong hỗn hợp đầu.
2) Cần sử dụng bao nhiêu (mL) dung dịch chuẩn để chuẩn độ dung dịch được điều chế sau khi nung 0.1 gam mẫu ban đầu ở 200 oC (dung dịch 4)? 1400 oC (dung dịch 5)?
3) Sắp xếp các dung dịch (1 - 5) theo chiều tăng dần pH, giả sử rằng các hỗn hợp đều được hòa tan vào các thể tích bằng nhau (10 mL).
Bài 14
Chuẩn độ một mẫu (VA = 10.00 mL) dung dịch hỗn hợp hydroxide và carbonate của potassium (dung dịch A) bằng dung dịch HCl 0.1000 M, với methyl da cam (hằng số chỉ thị 10-4.4), thì cần V1 = 14.40 mL chất chuẩn (phép chuẩn độ 1). Chuẩn độ cũng mẫu dung dịch A như trên với phenolphthalein (hằng số chỉ thị 10-8.6) thì cần V2 = 12.15 mL dung dịch HCl 0.1000 M (phép chuẩn độ 2). Cho biết với carbonic acid thì: Ka1 = 10 6.3, Ka2 = 10-10.3 .
1) Viết các phương trình phản ứng xảy ra trong quá trình chuẩn độ. Tính nồng độ KOH và carbonate trong dung dịch A
2) Dẫn CO2 qua 5.00 mL dung dịch A rồi chuẩn độ dung dịch tạo thành với hydrochloric acid (0.1000 M) khi có mặt phenolphthalein, cần 2.08 mL chất chuẩn.
a) Xác định thành phần của dung dịch tạo thành khi dẫn CO2 qua.
b) Tính lượng CO2 đã bị hấp thụ.
3) Thêm 15.00 mL dung dịch HCl 0.1000 M vào 10.00 mL dung dịch A, đun sôi dung dịch tạo thành trong bình hồi lưu rồi để nguội rồi chuẩn độ với dung dịch A khi có mặt chỉ thị methyl da cam. Tính thể tích chất chuẩn cần cho phép chuẩn độ này.
4) Tiến hành chuẩn độ nhanh 10.00 mL dung dịch HCl 0.1000 M với dung dịch A khi có mặt phenolphthalein. Tính thể tích chất chuẩn cần cho phép chuẩn độ này. Biết độ tan CO2 ở nhiệt độ thường là 0.045 M.
|
Để phân tích hỗn hợp Na2CO3, Na2C2O4 và NaCl, trước tiên hoà tan 0.7371 gam hỗn hợp này vào nước. Sau đó, thêm 20.00 mL dung dịch chuẩn HCl 0.2000 M vào rồi đun sôi dung dịch thu được và chuẩn độ bằng NaOH. Cần dùng 8.24 mL dung dịch NaOH 0.1016 M cho phép chuẩn độ này, chỉ thị là phenolphthalein, có pT 9 (lần chuẩn độ đầu).
Nung 0.6418 gam hỗn hợp như trên ở 800 oC. Sau đó, hoà tan bã rắn vào nước rồi thêm 50.00 mL dung dịch chuẩn HCl 0.200 M vào. Đun sôi dung dịch và chuẩn độ bằng 14.72 mL dung dịch NaOH 0.1016 M với cùng chất chỉ thị như trên (lần chuẩn độ thứ hai).
1) Viết các phương trình phản ứng xảy ra trong quy trình phân tích này.
2) Tính % các chất trong hỗn hợp đem phân tích.
Bài 16
Một trong những đặc tính quan trọng nhất của môi trường dung dịch là độ acid. Đây là tính chất ảnh hưởng đến khả năng xảy ra của nhiều quá trình trong dung dịch. Tính chất này có tầm quan trọng đặc biệt trong các hệ sinh hóa, do các enzyme và nhiều phân tử hoạt tính sinh học chỉ hoạt động được trong một khoảng nhỏ của độ acid. Do đó, các hệ đệm - những dung dịch mà độ acid biến thiên rất ít khi pha loãng và thêm một lượng nhỏ cac acid và base mạnh - có vai trò thiết yếu. Biểu thức định lượng độ acid của môi trường là giá trị pH, một đại lượng không có thứ nguyên, bằng giá trị âm của logarithm thập phân của nồng độ hydrogen ion trong dung dịch, (pH = -lg[H+]) (nồng độ tính theo đơn vị mol/L). Do không
1) pH của nước cất bằng bao nhiêu? pH sẽ thay đổi thế nào khi để một cốc nước cất trong không khí. Một trong những chất chỉ thị nổi tiếng nhất mà bạn có thể đã thấy và sử dụng trong trường học là hợp chất A, trong quá khứ từng được dùng làm thuốc nhuận tràng. Chất A thu được bằng cách ngưng tụ hai hợp chất thơm B và C (có hàm lượng carbon tương ứng là 76.6 % và 64. 9%) khi có mặt sulfuric acid đặc.
Khi môi trường dung dịch chuyển từ trung tính sang kiềm thì A sẽ chuyển từ không màu sang màu đỏ thắm. Tuy nhiên, trong môi trường kiềm mạnh thì A lại mất màu, còn trong môi trường acid mạnh thì lại có màu da cam.
2) Xác định tên gọi thông thường của các chất A, B, C.
3) Dưới đây là các dạng khác nhau của A (A1 - A4) và các khoảng pH tồn tại nhất định của chúng.
Các khoảng pH: а) pH < 0; b) 0 < pH < 8.2; c) 8.2 < pH < 12; d) pH > 13

Xác định mỗi cấu trúc tương ứng với khoảng pH nào?
|
4) Xác định màu sắc của A trong các dung dịch sau:
a) dung dịch NaOH loãng (~ 0.001 M).
b) dung dịch HCl loãng (~ 0.01 M).
c) dung dịch NaOH đặc (~ 10 M).
d) dung dịch HCl đặc (~ 10 M).
e) dung dịch NiCl2 0.01 M.
f) dung dịch Na2CO3 0.01 M (Ka2 = 4.7·10-11).
g) dung dịch HCl 10-10 M.
h) dung dịch K2SO4 0.01 M.
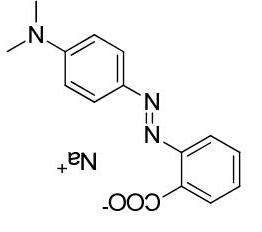
5) Một chất chỉ thị acid-base khác cũng được biết đến rộng rãi là methyl da cam. Chất này được tổng hợp bởi phản ứng diazo hóa sulfonic acid thơm G theo sơ đồ sau:

Bài 17
Phenolphthalein được Adolf von Baeyer điều chế lần đầu tiên vào năm 1871 từ C6H6O và C8H4O3 bằng cách đun nóng các hợp chất này trong sulfuric acid đặc. Hơn một thế kỉ sau, chất này được các dược sĩ sử dụng làm thuốc nhuận tràng. Còn các nhà hóa học thì tận dụng đặc tính biến đổi màu sắc theo pH của nó: Từ H3In+ H2In In2 In(OH)3 pH < 0 0 - 8.2 8.2 - 12.0 > 12.0 Màu sắc dung dịch Da cam Không màu Màu hồng Không màu
1) Đề xuất công thức cấu tạo của C6H6O và C8H4O3.
2) Vẽ công thức cấu tạo của tất cả các dạng của phenolphthalein.
a) Viết phương trình phản ứng chuyển dạng trung hòa điện của G (Г) thành D (Д).
b) Vẽ cấu tạo của các hợp chất G, D, E.
c) Xác định màu của chỉ thị methyl da cam trong môi trường acid (pH < 3) và môi trường kiềm.
d) Vẽ các cấu trúc cộng hưởng của dạng acid của methyl da cam.
3) Phenolphthalein có thể được sử dụng làm thành phần của mực tàng hình (mực biến màu), với màu hồng sẽ biến mất theo thời gian. Thành phần cần thiết thứ hai của mực tàng hình là gì? Viết phương trình phản ứng dẫn tới sự biến màu mực. Tác nhân nào có thể được sử dụng để phục hồi màu mực?
4) Một mẫu dung dịch chứa carbonate và hydrocarbonate ion được chuẩn độ bằng V1 mL dung dịch HCl chuẩn với chỉ thị phenolphthalein (khoảng biến đổi màu: pH 8.2 - 9.8). Một mẫu tương tự được chuẩn độ bằng V2 mL dung dịch HCl chuẩn, có chỉ thị methyl da cam (khoảng biến đổi màu: pH 3.1 - 4.4). Những loại hợp chất nào được tạo thành trong phép chuẩn độ của mỗi chỉ thị? Viết phương trình phản ứng. Tính tỉ lệ carbonate và hydrocarbonate ion trong dung dịch, biết rằng V2 = 3V1.
5) Phenolphthalin C20H16O3 được tạo thành bằng cách khử phenolphthalein bởi bột kẽm ở pH 10 - 12. Phenolphthalin có thể được dùng để xác định HCN trong không khí khi có mặt Cu(II), dựa vào sự xuất hiện màu hồng. Xác định công thức cấu tạo của phenolphthalin và viết các phản ứng cho phép xác định HCN.
|
18
Dưới đây là các đường cong chuẩn độ 10.00 mL dung dịch chất X (khối lượng mol 381.4) với các dung dịch sau: a) HCl 0.02274 M; b) NaOH 0.02171 M và c) mannitol 0.500 M.
Bài 19
Phương trình Henderson-Hasselbalch thường được dùng để tính pH của dung dịch đệm. Để thu được phương trình này thì luận điểm chủ yếu là axit và bazơ đệm phải yếu để có thể đơn giản hóa. Trong bài tập này chúng ta sẽ khảo sát phạm vi áp dụng của phương trình này. Biết pKA của axit dicloaxetic là 1.290.
1) Áp dụng phương trình Henderson-Hasselbalch, hãy tính pH của dung dịch hỗn hợp axit dicloaxetic và natri dicloaxetat với nồng độ mỗi chất là 0.100 mol/L,.

Tiếp theo chúng ta sẽ kiểm tra kết quả câu 1 bằng cách khảo sát dung dịch axit dicloaxetic có nồng độ 0.100 mol/L (thể tích 1L)
1) Xác định công thức hợp chất X.
2) Viết các phương trình phản ứng xảy ra trong quy trình phân tích này.
3) Xác định khối lượng chất X trong dung dịch phân tích.
4) Xác định giá trị pH của dung dịch thu được khi pha loãng 5 lần dung dịch ban đầu của X
2) Tính pH của dung dịch này (bỏ qua sự phân ly của nước và cho rằng hoạt độ các ion là 1). Bên cạnh đó hãy xác định nồng độ các ion tồn tại trong dung dịch.
Lúc này cho vào 0.1 mol natri dicloaxetat rắn để dịch chuyển cân bằng.
3) Tính pH của dung dịch mới bằng cách không áp dụng lại những giả định gần đúng đã sử dụng. Sai số thu được giữa giả định gần đúng Henderson-Hasselbalch so với nồng độ chính xác của ion H3O+-là bao nhiêu (%)?
|
Phosphoric acid (H3PO4) là một acid ba chức với K1 = 7.52·10-3, K2 = 6.31·10-8, và K3 = 1.26·10-12
1) Tính các giá trị pH ở 3 điểm tương đương (pH1, pH2, pH3) khi chuẩn độ dung dịch phosphoric acid 0.100 M bởi sodium hydroxide 0.100 M.
2) Xác định sai số chỉ thị Δ của phép chuẩn độ phosphoric acid ở giai đoạn đầu tiên (với chỉ thị methyl da cam, pT = 4.0) và giai đoạn hai (với chỉ thị phenolphthalein, pT = 9.0).
3) Tính giá trị pH của dung dịch đệm tạo thành bằng cách trộn lẫn các dung dịch Na2HPO4 1.00 M và NaH2PO4 với thể tích bằng nhau.
4) pH của một hệ đệm sẽ thay đổi như thế nào nếu bị pha loãng 10 lần?
5) Khả năng đệm (π) là số mol của một acid hoặc base cần thêm vào 1.00 L dung dịch để làm pH của nó thay đổi 1 đơn vị. Tính khả năng đệm của dung dịch ở ý 3.
6) So sánh khả năng đệm của dung dịch 1 (Na3PO4 1.00 M/Na2HPO4 1.00 M, tỉ lệ thể tích 1:1, khả năng đệm π 1) và dung dịch 2 (Na2HPO4 1.00 M/NaH2PO4 1.00 M, tỉ lệ thể tích 1:1, khả năng đệm π 2).
7) Xác định tỉ lệ mol của các thành phần trong một dung dịch đệm để khả năng đệm đạt giá trị cực đại.
Bài 21
Ammophos, một hỗn hợp của dihydrogen phosphate và ammonium hydrogen phosphate, được sử dụng rộng rãi làm phân bón chứa cả nitrogen (đạm) lẫn phosphorus (lân). Công thức của ammophos khô có thể được biểu diễn là: a(NH4)2HPO4·bNH4H2PO4 - trong đó a là phần mol của hydrophosphate (0 < a <1), và b là phần mol của dihydrogen phosphate (0 < b <1).
1) Một mảnh đất diện tích 100 m2 sử dụng 4.5 kg loại phân bón này. Xác định thành phần của ammophos để khối lượng của phosphorus và nitrogen trên mỗi m2 đất không vượt ngưỡng 11.2 gram và 8.4 gram.
2) pH của dung dịch thu được bằng cách hòa tan một mẫu ammophos trong 1.00 L nước là 6.14. Xác định thành phần của ammophos (phần mol của các cấu tử). Cho biết rằng dung dịch được chứa trong một bình gần như đóng kín, nghĩa là không giải phóng ammonia.
3) Trong khí quyển ammonia 1 atm, có 40.9 gram khí này hòa tan trong 100 gram nước (ρdung dịch = 0.76 gram/mL). Từ những dữ kiện này, hãy xác định:
a) pH của dung dịch NH3 bão hòa ở p(NH3) = 1 atm = 101325 Pa (bỏ qua sự thay đổi nồng độ ion trong dung dịch).
b) Hằng số cân bằng của phản ứng NH3 (dung dịch) ⇌ NH3 (khí)
4) Nồng độ ammonia trong không khí tối đa được phép (hay "ngưỡng giới hạn") là 0.0200 mg/L. Một kĩ thuật viên phòng thí nghiệm đã hòa tan 20.0 gram ammonium phosphate có công thức 0.50(NH4)2HPO4·0.50NH4H2PO4 vào 1.00 L nước trong một bình chứa để mở, đặt trong phòng thí nghiệm đóng kín có kích thước 8 m · 5 m · 2.5 m ở 25 oC. Sau một thời gian, pH của dung dịch giảm xuống 4.60. Nồng độ ammonia trong phòng đã đạt tới ngưỡng giới hạn chưa? Bỏ qua ảnh hưởng của CO2. Trước tiên, hãy tính các nồng độ cân bằng của phosphoric acid và các orthophosphate ion, cũng như nồng độ cân bằng của ammonia và ammonium ion trong dung dịch.
PO
|
Ascorbic acid (AA), thường biết đến với tên gọi "vitamin C", được sử dụng làm chất cung cấp vitamin.


1) Nhóm nào trong AA dễ phân li proton nhất?
2) Có bao nhiêu hằng số phân li của các giai đoạn có thể được ước lượng từ đường cong chuẩn độ dung dịch AK 0.1 M bởi dung dịch kiềm 0.1 M không? Ước tính chúng theo 3 cách khác nhau, biết rằng pH ở điểm tương đương bằng 8.4.
3) Trình bày cách xác định ascorbic và citric acid nếu bạn có dung dịch NaOH 0.1000 M và các chỉ thị: methyl da cam (pT = 3.5), bromophenol đỏ (pT = 6.0), phenol đỏ (pT = 8.0) và thymolphthalein (pT = 10.2)? Viết phương trình phản ứng là cơ sở cho phép phân tích và cho biết chỉ thị được lựa chọn. Cho biết citric acid có: рKа1 = 3.1; рKа2 = 4.7; рKа3 = 6.4. Tính pH của dung dịch citrate 2 lần thế, Na2HA, giả sử rằng trong dung dịch của nó có cân bằng: 2--32 2HAHAA +⇌ .

4) Tiến hành phân tích một hỗn hợp AA và CA khan, được làm khô bằng phương pháp chuẩn độ. Để oxid hóa AA, lấy m1 gram mẫu hòa tan vào 25.00 mL nước, rồi thêm 1.50 mL dung dịch iodine 0.0752 M vào một đơn vị mẫu (10.00 mL) dung dịch này và để hỗn hợp trong tối, sau 2 phút thì thêm chỉ thị hồ tinh bột vào và chuẩn độ với dung dịch sodium thiosulfate 0.00984 M thì cần 2.63 mL chất chuẩn. Lấy m1 gram mẫu như trên hòa tan vào 20.00 mL nước rồi thêm vào 1 mL H2SO4 đặc và 15.00 mL KMnO4 0.1053 M, đun nóng rồi chuẩn độ với dung dịch FeSO4 0.1011 M thì cần 10.88 mL chất chuẩn. Viết phương trình các phản ứng diễn ra, chú ý rằng ascorbic acid bị oxid hóa bởi iodine tạo thành dehydroascorbine C6H6O6 và permanganate oxid hóa cả hai acid thành CO2. Tính khối lượng AA và CA trong mẫu.
Đã có trường hợp những doanh nhân gian dối sử dụng citric acid (CA, công thức cho ở hình dưới) với giá thành rẻ hơn để bán dưới nhãn mác AA.
|
Biết H3PO4 có pKa1 = 2,12; pKa2 = 7,21 và pKa3 = 12,36
1. Trong phòng thí nghiệm có một lọ đựng dung dịch nước của một axit, nghi là axit citric vì tên hóa chất bị nhòe một phần, nhưng vẫn đọc được chính xác giá trị nồng độ (mol/L) của axit đó Để khẳng định điều nghi ngờ trên, người ta tiến hành đo pH của dung dịch đó thì thấy [H+] trong dung dịch bằng đúng giá trị nồng độ ghi trên nhãn. Bằng phép tính cụ thể, hãy chứng tỏ rằng dung dịch đó là axit citric và cho biết nồng độ của axit.
2. Khi chuẩn độ các đa axit hoặc đa bazơ, nếu tỉ số các hẳng số phân ly kế tiếp vượt quá 1.104 lần thì cho phép chuẩn độ riêng rẽ từng nấc với sai số không quá 1%. Mặt khác để đảm bảo sai số cho phép, người ta thường chỉ chuẩn độ các axit, bazơ có hằng số cân bằng lớn hơn 10-9 . Chuẩn độ 100,00 mL dung dịch axit trên bằng dung dịch NaOH 5,00.10 3M
a) Viết phương trình phản ứng chuẩn độ.
b) Tính pH tại điểm tương đương.
c) Hãy chọn chất chỉ thị thích hợp nhất cho phép chuẩn độ trên trong số các chất chỉ thị sau đây: Metyl đó (pH = 6,20); Bromthymol xanh (pH = 7,60); Đỏ trung tính (pH = 8,00); Phenolphtalein (pH = 9,00).
3. Trong phép chuẩn độ xác định nồng độ axit citric bằng NaOH, với mỗi trường hợp sau đây hãy cho biết nồng độ axit citric được xác định là cao hơn hay thấp hơn so với giá trị thực? Giải thích.
a) Pipet dùng để lấy 100,00 mL dung dịch H3Cit chỉ lấy được 99,90 mL dung dịch.
b) Dùng bromthymol xanh để xác định điểm dừng chuẩn độ.
c) Buret chỉ được tráng bằng nước cất mà không tráng bằng dung dịch NaOH 5,00.10-3 M. Cho biết: Đối với axit citric HOOC(OH)C(CH2COOH)2, các giá trị hằng số phân ly axit từng nấc lần lượt là pKa1 = 3,13; pKa2 = 4,76; pKa3 = 6,40.
4. Đệm vạn năng còn gọi là đệm Briston – Robinson, được dùng rất phổ biến trong thực nghiệm hóa học do có thể đệm trong một khoảng pH rất rộng từ 2 – 12. Để pha đệm này ở các pH khác nhau người ta thêm dung dịch NaOH 0,2M vào dung dịch hỗn hợp các axit H3PO4 0,04M; CH3COOH 0,04M và H3BO3 0,04M.
a) Tính pH của dung dịch thu được khi thêm 30 mL dung dịch NaOH 0,2M vào 100 mL dung dịch hỗn hợp ban đầu chứa ba axit này.
b) Cần thêm bao nhiêu mL NaOH 0,2M vào 100 mL dung dịch 3 axit này để được dung dịch có pH = 8,5.
|
3COOH có pKa = 4, 75 và H3BO3 có pKa = 9,25
Chuyên đề 29: Phản ứng tạo phức và chuẩn độ
Bài 1
Bài 2
Trong dung dịch AgNO
[Ag(NH
0.10 M và NH
[Ag(NH
Xác định giá trị của
O
M, tồn tại các cân bằng sau: Ag
[Ag(NH
[Ag(NH
đạt cực đại.
Eriocrom đen T (H3Ind) là một chất chỉ thị thông dụng trong các phản ứng chuẩn độ tạo phức với EDTA (Na2H2Y). Hợp chất này chứa một nhóm sunfonic axit tan tốt trong nước và 2 nhóm phenol chỉ tan một phần (Ka1 = 5,0.10-7 ; Ka2 = 2,8.10-12)
H2O + H2Ind = Hind2- + H3O+ Đỏ xanh da trời
H2O + Hind2- = Ind3- + H3O+
Xanh da trời cam
a) Phức kim loại của Eriocrom đen T có màu đỏ. Tính pH nhỏ nhất mà ở đó có thể sử dụng Eriocrom đen T là chất chỉ thị cho phản ứng tạo phức (cho rằng sự thay đổi màu sắc chỉ có thể quan sát được khi nồng độ của hai dạng mang màu chênh nhau 10 lần)
b) Xác định vùng chuyển màu của Eriocrom đen T khi chuẩn độ Mg2+ và Ca2+ ở pH = 10,0. Biết hằng số bền của phức MgInd là 1,0.107 và CaInd là 2,58.105
c) Chuẩn độ 50,00 mL hai dung dịch gồm Mg2+ và Ca2+ 0,00500 M (mỗi dung dịch chỉ chứa một ion) bằng 25mL dung dịch EDTA 0,0100 M ở pH = 10. Cho biết hằng số cân bằng tạo phức ở pH này là Kb(MgY2-) = 1,72.108 và Kb(CaY2-) = 1,75.1010. Xác định nồng độ cân bằng của ion kim loại.
Dưới đây là trích đoạn trong một bài báo khoa học :
Ngày nay, một trong những vấn đề trước mắt là bệnh sỏi thận… Trong đa số các trường hợp, sỏi thận đều có thành phần đa phase. Nghiên cứu về những viên sỏi lấy ra từ cơ thể sống chứng tỏ thành phần sau đây của các phần bên trong và bên ngoài: phần nhân chứa khoáng whewellite, phần giữa là khoáng whedellite, phần bên ngoài là khoáng brushite; hoặc phần nhân chứa uric acid, phần giữa là khoáng whedellite hoặc whewellite; phần bên ngoài là hydroxyapatite, …
Hiện tại đã có nhiều nhiều loại thuốc chữa sỏi thận. Blemarene - được dùng phổ biến để hoà tan (phá huỷ) sỏi - là một hệ đệm gồm gồm citric acid và các muối ba lần thế của nó, cụ thể là potassium và sodium citrate.
Hiệu quả hoà tan sỏi được giải thích bởi sự tăng giá trị pH của urine (lên đến 6.8) do tác động của blemarene… Sự phá huỷ sỏi oxalata dựa vào sự tạo phức của calcium ion với citrate (lgKstab = 4.68). (Tạp chí Hoá học Vô cơ Nga, 2002, tập 47, số 3, trang 456-464)
1) Xác định công thức hoá học của whewellite, whedellite, brushite, hydroxyapatite và uric acid dựa vào các thành phần nguyên tố sau. Gọi tên các chất này.
Khoáng Phần trăm khối lượng, %
Ca C O H P N
Whewellite 27.40 16.44 54.79 1.37
Whedellite 24.39 14.63 58.54 2.44
Brushite 23.26 55.81 2.91 18.02 Uric acid 35.71 38.57 2.38 33.33
2) Biết rằng trong dung dịch C2H4C(OH)(COOH)3 (citric acid ba chức hay H3X) thì ion dihydrocitrate H2X đạt nồng độ cực đại ở pH = 3.95; ion hydrocitrate HX2- đạt đạt nồng độ cực đại ở pH = 5.57; còn nồng độ hai ion này bằng nhau ở pH = 4.76.
Xác định hằng số acid của citric acid (Ka1, Ka2, Ka3) dựa vào các giá trị này.
3) Không cần tính toán hãy xác định giá trị pH của blemarene trong trường hợp
a) Chỉ tồn tại duy nhất dạng H3X trong dung dịch.
b) Chỉ tồn tại duy nhất dạng X3- trong dung dịch.
c) Nồng độ của hai ion hydrocitrate và citrate bằng nhau.
4) Tỉ lệ nồng độ của các dạng proton hóa khác nhau của citric acid (H3X, H2X , HX2, X3-) trong urine sau khi có tác động của blemarine là bao nhiêu? Cho biết pH của urine là 6.8.
5) Phải trộn citric acid và potassium citrate ở tỉ lệ mol nào để tạo được pH = 6.8.
6) Khả năng tạo phức của ion Ca2+ với blemarine phụ thuộc như thế nào vào pH của urine?
7) Tính độ tan của whedellite trong urine (gam/L) dưới ảnh hưởng của blemarene nếu tích số tan của whedellite là KS = 1.8·10-9. Tổng nồng độ của citric acid và muối của nó trong urine sau tác động của blemarene là 0.012M.
8) Dạng nào của citric acid tồn tại trong urine ở pH = 6.8? Cho biết hằng số acid của citric acid là Ka1 = 10-5.75 và Ka2 = 10-10.3
|
a(Cit3-) 5.6·10-12 8.9·10-11 1.4·10-9 2.01·10-8 2.7·10-7
Nhà hóa học trẻ Vasya cân 1.5 gam đinh sắt rồi đun nóng chúng trong 100 mL dung dịch citric acid (H3Cit, xem hình). Ngay khi rỉ biến mất khỏi bề mặt đinh sắt (nhưng trước khi xảy ra sự hòa tan sắt), cậu đổ chất lỏng đi và lặp lại quá trình đun nóng với dung dịch citric acid mới. Khi phản ứng kết thúc, cậu lọc dung dịch (khối lượng đinh sắt không bị hòa tan là 0.1 gam) rồi làm bay hơi đến khô. Sau đó, Vasya đặt muối khô (muối citrate monohydrate trung hòa) vào một ống nghiệm, đậy lại bằng nắp kính rồi đốt trong phòng thông gió để tránh ngộ độc bởi khí thoát ra. Sản phẩm rắn (có khối lượng tổng là 1.0 gam) được hút bởi một nam châm. Khi Vasya đổ hóa chất từ ống nghiệm ra, cậu quan sát thấy những tia lửa đẹp xuất hiện do phản ứng tự cháy trong không khí. Sau thí nghiệm, trên thành ống nghiệm còn sót lại một ít bồ hóng (muội).
рН 3.0 3.4 3.8 4.2 a(Cit3-) 3.08·10-6 2.83·10-5 2.09·10-4 1.27·10-3
1) Viết các phương trình phản ứng hòa tan đinh sắt và gỉ (Fe(OH)3), phương trình tối giản của phản ứng phân hủy citrate và phản ứng đốt cháy sản phẩm. Tính khối lượng gỉ bị hòa tan.
2)
a) Tính lượng sulfuric acid cực tiểu cần pha loãng với nước để tạo thành 100 mL dung dịch đủ hòa tan hoàn toàn 0.4 gam gỉ sắt.

b) Liệu Vasya có thể hòa tan hoàn toàn lượng gỉ sắt như vậy không nếu dùng cùng thể tích nước chanh (67 gam/L citric acid).
3) Tính tỉ lệ tốc độ hòa tan trong nước chanh và trong sulfuric acid 0.005 M với: a) gỉ sắt và b) sắt. Để trả lời câu hỏi này, bạn cần tính pH của acid, viết các sơ đồ phản ứng và phương trình tốc độ của chúng. Tích số tan của Fe(OH)3: Ks = [Fe3+][OH ]3 = 4·10-38. Các hằng số acid Kа(H3Cit) 8.4·10-4, 1.7·10-5, 4·10-7, Kа(СH3COOH) 1.74·10-5. Hằng số bền của phức chất iron citrate: β(FeCit) = [FeCit] / [Fe3+][Cit3-] = 1011.2. Phần mol của citrate ion α = [Cit3-] / cCit ở pH khác nhau: рН 1.0 1.4 1.8 2.2 2.6
|
Nhiễm độc chì luôn luôn đáng lo ngại. Trong cơ thể con người, mức độ độc hại của chì có thể được giảm bớt bằng cách sử dụng phối tử EDTA4để tạo phức [Pb(EDTA)2]2- rất bền (hằng số bền β(Pb) = 1018,0 và được thận bài tiết. Phối tử EDTA4- được cung cấp bằng cách tiêm truyền dung dịch Na2[Ca(EDTA)]. Biết phức [Ca(EDTA)]2- tương đối kém bền (hằng số bền β(Ca) = 1010,7), sự trao đổi canxi với chì chủ yếu diễn ra trong mạch máu.
a) Hàm lượng chì trong máu của một bệnh nhân là 0,828 μg/mL. Tính nồng độ chì theo μmol/L trong máu của bệnh nhân này..
b) Trong một thí nghiệm, người ta điều chế một dung dịch hỗn hợp từ Ca(NO3)2.4H2O và Na2[Ca(EDTA)]. Trong dung dịch thu được, nồng độ của Ca(NO3)2 là 2,5 mM và của Na2[Ca(EDTA)] là 1,0 mM. Thêm Pb(NO3)2 rắn vào để đạt được nồng độ chì tương ứng với nồng độ chì trong máu của bệnh nhân nêu trên.
Không xét tính chất axit bazơ của các tiểu phân có liên quan và thể tích dung dịch coi như không đổi, tính tỉ lệ nồng độ [[Pb(EDTA)]2-]/[Pb2+] trong dung dịch thu được tại thời điểm cân bằng.
c) Sự giảm nồng độ của phức [Pb(EDTA)]2- trong máu thông qua quá trình bài tiết tuân theo quy luật động học bậc nhất. Sau 2 giờ, nồng độ của phức [Pb(EDTA)]2- trong máu của hầu hết bệnh nhân giảm 60%. Tính “chu kỳ bán hủy sinh học” của phức [Pb(EDTA)]2.
Bài 6
Trộn 10 mL dung dịch Cu(NO3)2 0,02M với 10 mL dung dịch NH3 2,00M thu được 20 mL dung dịch A. Trộn 20 mL dung dịch A với 80 mL dung dịch KCN 0,25M, sau khi phản ứng xảy ra hoàn toàn thu được 100 mL dung dịch B. Tính nồng độ cân bằng của các cấu tử chính có trong dung dịch B. Cho biết: KW = 10-14 ; Ka(HCN) = 10-9,33
= 10-9,24
|
2/3 số anion trong cơ thể người là chloride ion, chủ yếu là trong dạ dày và nước tiểu. Có thể xác định hàm lượng chloride trong máu bởi phương pháp thủy ngân: sử dụng mercury(II) nitrate làm dung dịch chuẩn, diphenylcarbazone là chỉ thị. Quá trình chuẩn độ Cl bởi Hg2+ tạo ra một lượng nhỏ HgCl2 bị ion hóa. Hg2+ dư và diphenylcarbazone tạo thành phức chất càng cua màu tím.
1) Giải thích ngắn gọn lí do phải dùng nitric acid để acid hóa khi điều chế dung dịch mercury nitrate?
2) Cân 1.713 gam Hg(NO3)2·xH2O rồi pha thành 500 mL dung dịch chất chuẩn. Lấy 20.00 mL dung dịch chuẩn NaCl 0.0100 mol L-1 cho vào bình nón, acid hóa bằng 1 mL dung dịch HNO3 5 % rồi nhỏ vào 5 giọt chất chỉ thị diphenylcarbazone. Chuẩn độ bằng dung dịch mercury nitrate trên cho đến khi xuất hiện màu tím, thì dùng hết 10.20 mL chất chuẩn. Xác định công thức muối ban đầu.
3) Lấy 0.500 mL huyết thanh cho vào một bình nón nhỏ, thêm 2 mL nước khử ion vào, rồi nhỏ 4 giọt nitric acid 5 % và 3 giọt chỉ thị diphenylcarbazone. Sau đó đem chuẩn độ với dung dịch mercury nitrate trên, thì thấy hết 1.53 mL. Để làm chính xác kết quả đo, lấy lượng nước cất gấp 10 lần thể tích mẫu huyết thanh và tiến hành thí nghiệm mẫu trắng thì dùng 0.80 mL mercury nitrate. Tính nồng độ chloride ion trong huyết thanh (mg/100 mL).
Bài 8
Nhôm là kim loại phổ biến nhất trong vỏ trái đất. Một số hợp chất của nhôm, chẳng hạn phèn chua (sunfat kép KAl(SO4)2·12H2O) đã được sử dụng từ thời Hy Lạp cổ.
a) Hằng số nghiệm đông của nước là Kf = 1.86 °C kg mol-1. Tính nhiệt độ đông đặc của dung dịch thu được khi hòa tan 9.48 g KAl(SO4)2·12H2O vào 100.0 g nước.
b) Khoáng chất quan trọng nhất của nhôm là boxit với thành phần gồm Al2O3 và tạp chất. Boxit có thể được tinh chế bằng cách hòa tan vào dung dịch NaOH đặc. Viết phản ứng xảy ra khi Al2O3 phản ứng với dung dịch NaOH.
c) Sau khi loại bỏ tạp chất không tan thì axit yếu được thêm vào dung dịch thu được ở câu b để kết tủa Al(OH)3. Tích số tan KSP của Al(OH)3 là 1.3·10–33 (ở 25 °C). Tính khối lượng Al(OH)3 tinh khiết tan được trong 10.0 L of nước cất ở 25 °C.
EDTA (ethylenediaminetetraacetic acid hoặc muối của nó) là chất chỉ thị quan trọng trong chuẩn độ. Tuy nhiên nó không thực sự tốt khi xác định trực tiếp ion nhôm do EDTA phản ứng với nhôm quá chậm. Vấn đề này có thể được giải quyết bằng phương pháp chuẩn độ ngược. Ban đầu EDTA và dung dịch có chứa ion nhôm được cho phản ứng với nhau trong vài phút và lượng dư EDTA có thể được chuẩn độ nhanh và chính xác bằng Zn2+(aq). Phép phân tích được tiến hành trong dung dịch đệm. Phản ứng xảy ra theo phương pháp này được biểu diễn bằng các phương trình sau: Al3+ + EDTA4– Al·EDTA và Zn2+ + EDTA4– Zn·EDTA2–
d) 20.00 mL dung dịch chứa Al3+ được cho vào bình nón đã chứa sẵn 50.00 mL EDTA 0.0500 M EDTA. Trộn đều và đun sôi trong vài phút rồi sau đó chuẩn độ dung dịch thu được thấy tốn hết 23.25 mL dung dịch 0.0500 M Zn2+. Tính nồng độ ion Al3+ trong dung dịch đầu.
Nhôm trihalogenua (ví dụ AlCl3) là các axit Lewis mạnh nên hay được dùng là chất xúc tác. Với một số phối tử L thì nhôm clorua tạo phức phối trí 4 có công thức AlCl3L hay thậm chí phức phối trí 5 AlCl3L2.
e) Cho rằng L là phối tử đơn càng, hãy vẽ tất cả các cấu trúc có thể có của AlCl3L2.
f) Trong pha khí, nhôm triclrua tồn tại ở dạng Al2Cl6 với hai nguyên tử Cl cầu nối. Hãy vẽ cấu trúc phân tử này.
|
Phản ứng tạo phức
Dung dịch nước từ một quá trình kĩ thuật có cả chì(II) và calcium ion. Trong quy trình đảm bảo chất lượng, nồng độ ion kim loại thường được xác định bằng ICP-OES (quang phổ phát xạ nguyên tử), được kiểm soát bởi một phương pháp ướt, sử dụng chuẩn độ phức với EDTA. Pb2+ có thể được chuẩn độ bởi EDTA với chỉ thị methylthymol xanh dương ở pH = 6 trong những điều kiện được quy trịnh trong “đặc điểm kĩ thuật phân tích”, còn Ca2+ ban đầu không phản ứng. Nồng độ của Ca2+ được xác định với phép chuẩn độ tương tự ở pH = 12. Theo quy trình này, 25.00 ml chất lỏng cần phân tích được cho vào một bình định mức, rồi thêm nitric acid loãng, chỉ thị methylthymol xanh dương và urotropine rắn vào để đạt tới pH 6. Trong phép chuẩn độ chì, cần 20,30 ml dung dịch EDTA (c = 0,0100 mol/L) để đạt tới điểm tương đương và màu chuyển từ xanh dương sang vàng. Để xác định nồng độ calcium ion, cần thêm 22,3 ml NaOH để tăng pH của dung dịch chuẩn lên 12. Dung dịch lại chuyển thành màu xanh dương. Tiếp đó, 13,40 mL dung dịch EDTA được thêm vào, màu của chỉ thị lại chuyển từ xanh dương thành vàng.
1) Tính nồng độ Pb2+ và Ca2+ trong dung dịch. Để giải phần phân tích của bài tập này, chúng ta cần xét đến một số cân bằng. Cho một số giá trị như sau:
• Hằng số phân li acid của EDTA: pKA1 = 2.00; pKA2 = 2.67; pKA3 = 6.16; pKA4 = 10.26;
• Hằng số bền của phức chất: [CaEDTA] 2-: log(Kβ) = 10.70; [PbEDTA] 2-: log(Kβ) = 18.04;
• Tích số tan: KL (Ca(OH)2) = 3.9·10-6; KL (Pb(OH)2) = 4.2·10-15;
• Các hằng số bền của phức chất xét tới sự tạo thành phức với dạng phân li proton hoàn toàn EDTA4-
Tổng thể tích sau giai đoạn chuẩn độ thứ nhất là 127,8 mL.
2) Tính nồng độ chì tự do trong dung dịch ở cuối giai đoạn chuẩn độ thứ nhất. Giả sử rằng trong tính toán này, chỉ cần xét tới các ion Pb2+ , EDTA4- và [PbEDTA2-]. Nếu cần có thể đưa ra thêm một giả thiết khác và kiểm tra tính khả thi của nó
Để xác định nồng độ calcium ion, pH được tăng lên tới 12,0. Pb(OH)2 và/hoặc Ca(OH)2 cũng có thể kết tủa.
3) Chứng minh bằng tính toán rằng không có sự tạo thành kết tủa. Với [Pb2+], sử dụng kết quả ở ý 2. Nếu không thể tìm ra kết quả của ý 2, sử dụng giá trị [Pb2+] = 3,0.10-11 mol/L. Sử dụng giá trị [Ca2+] ở đầu giai đoạn chuẩn độ thứ hai.
Dung dịch EDTA với nồng độ 0,0100 mol/L được dùng trong phép chuẩn độ.
4) Tính nồng độ của tất cả các tiểu phân EDTA ở pH = 6,00 mà không cần đơn giản hóa. Không xét đến quá trình tự phân li của nước. Hệ số hoạt độ của tất cả các ion bằng 1.
|
Chuyên đề 30: Phản ứng kết tủa và chuẩn độ
Bài 1
Trong phòng thí nghiệm sẵn có các tác nhân sau: hydrochloric acid, nitric acid, acetic acid, sodium hydroxide, ammonia. Hãy chọn một tác nhân trong số đó để tách riêng các hỗn hợp chất rắn sau (không yêu cầu thu hồi, dữ kiện trong dấu ngoặc đơn là tích số tan). Hãy xác định chất rắn bị hòa tan.
a) CaCO3 ( 3.4 × 10-9) và CaC2O4 (2.3 × 10-9)
b) BaSO4 (1.1 × 10-10) và BaCrO4 (1.1 × 10-10)
c) Zn(OH)2 ( 3.0 × 10-17) và Ni(OH)2 (5.5 × 10-16)
d) AgCl ( 1.8 × 10-10) và AgI (8.5 × 10-17)
e) ZnS (2.5× 10-22) và HgS (1.6× 10-52)
Bài 2
Cho 25 mL Zn(NO3)2 0,0160 mol/L vào 75 mL dung dịch hydrazin 0,133 mol/L. Biết Ksp(Zn(OH)2) = 1,20.10-17 và Kb(N2H4) = 1,3.10-6
a) Viết phản ứng xảy ra và các biểu thức hằng số cân bằng
b) Tính nồng độ các tiểu phân có trong dung dịch khi cân bằng
c) Tính pH dung dịch sau phản ứng
|
Bài 3
Hãy xác định pH thích hợp để bắt đầu kết tủa FeS nếu biết nồng độ đầu của cation và tổng nồng độ các dạng của ion sunfua trong dung dịch đều là 0,0100 mol/L. Biết Ksp(FeS) = 5,0.10-18 và các hằng số axit của H2S lần lượt là K1 = 1,0.10-7 và 1,0.10-13. Từ đó xác định pH của dung dịch khi FeS kết tủa hoàn toàn (99,9% lượng cation ban đầu đã kết tủa hết)
Bài 4
Trước khi xác định hàm lượng tổng ion thì sắt thường được chuyển thành một trong các dạng tồn tại trong hợp chất, ví dụ như Fe(III). Sau khi toàn bộ sắt đã bị oxid hóa, Fe(OH)3 được kết tủa, sau đó kết tủa được nung thành Fe2O3 rồi cân.
1) Tính giá trị pH (với độ chính xác 0.05) trong dung dịch FeCl3 0.01 M. Xem rằng cation Fe(OH2)6 3+ là acid một nấc với hằng số acid Ka = 6.3·10-3 .
2) Tính giá trị pH (với độ chính xác 0.05) cần tạo ra trong dung dịch này để bắt đầu kết tủa Fe(OH)3. Cho biết tích số tan của Fe(OH)3 là Ksp = 6.3·10-38 .
|
Một phương pháp phân tích quan trọng đối với hợp chất chì(II) cũng như ion iodua là tạo kết tủa điển hình PbI2. Tích số tan của muối rất khó tan này được xác định vào khoảng 8.30.10-9
1) Tính nồng độ mol của các ion Pb2+ và I- trong dung dịch bão hòa PbI2. Để chuẩn bị cho phân tích lượng vết thì người ta đã chuẩn bị sẵn dung dịch kali iodua (dung dịch A) 0,100M. Bây giờ việc cần phải làm của chúng ta là cần phải chuẩn bị 100 mL dung dịch chì nitrat (dung dịch B) có nồng độ thích hợp.
2) Tính khối lường chì (II) nitrat nhỏ nhất để tạo thành dung dịch B để sao cho dung dịch B này có thể tạo được kết tủa khi phản ứng với cùng một thể tích dung dịch A.
Thêm PbI2 rắn vào dung dịch natri iodua có nồng độ 0.1 M.
3) Tính nồng độ cân bằng của ion Pb2+ trong dung dịch này bằng cách sử dụng các phép tinh gần đúng.
4) Nếu không sử dụng các phép tính gần đúng này thì nồng độ ion Pb2+ trong dung dịch này là bao nhiêu ? Để giải quyết được bài toán này thì phải áp dụng phương pháp Newton. So sánh kết qủa thu được với kết qủa cấu 5.a)3..
Bài 6
Để giải bài toán này, bạn cần biết các giá trị tích số tan và hằng số acid sau:
KS(CaCO3) = 4.8·10-9, KS(MgCO3) = 1.0·10-5, KS(Ca(OH)2) = 4.0·10-5 , KS(Mg(OH)2) = 1.8·10-11, Ka1(H2CO3) = 4.5·10-7, Ka2(H2CO3) = 4.8·10-11, Kw = 1.0·10-14 .
1) Độ cứng của nước ngầm ở thành phố N được xác định bằng phương pháp tạo phức giữa calcium ion và magnesium ion với ethylenediaminetetraacetate (EDTA). Tiến hành chuẩn độ một đơn vị mẫu (50.00 mL) nước thì cần dùng 15.00 mL dung dịch EDTA 0.0200 M. Cũng với đơn vị mẫu như trên, thêm NaOH dư vào rồi chuẩn độ hỗn hợp thì cần 10.00 mL dung dịch EDTA cùng nồng độ. Viết phương trình phản ứng xảy ra khi thêm NaOH vào nước. Tính nồng độ Ca2+ và Mg2+ trong nước ngầm.
2) Tính lượng kết tủa được tạo thành trong ấm sau khi đun sôi rồi làm loại nước ngầm như trên, nếu biết thể tích và pH cuối lần lượt là 1 L và 6.7. Những hợp chất nào được liệt kê ở đầu bài tạo thành kết tủa này (chỉ xét đến calcium, magnesium và tất cả các dạng của carbonic acid có trong nước, và cân bằng với khí quyển được bỏ qua)?
3) Tính lượng kết tủa tích tụ suốt 1 năm nếu mỗi ngày đều thực hiện 3 lần đun nước, mỗi lần 1 L.
4) Nhà hóa học trẻ Vasya quyết định giúp mẹ bằng cách đổ giấm vào trong ấm đun. Có tiếng rít lên! Khi tiếng rít dừng lại, Vasya nhìn vào bên trong và thấy có một chút cặn sót lại trong ấm. Giấy chỉ thị cho thấy pH đúng bằng mức trung tính. "Thật là ngầu!" - Vasya nghĩ và đã đi vào thư viện để tìm các hằng số (ở trên) và quan trọng nhất là nồng độ cân bằng của carbon dioxide trong nước với không khí (giá trị này là 1.3·10-5 M). "Ồ, bây giờ mình sẽ biết lượng cặn mà mình đã hòa tan thành công" - Vasya cảm thấy hạnh phúc như một người hùng, và bắt đầu ngồi xuống để tính toán - "Mình sẽ giả sử rằng nó chỉ chứa calcium carbonate". Hãy xác định giá trị mà Vasya đã tính được, nếu biết thể tích dung dịch trong ấm ở cuối quá trình là 1 L.
|
Kẽm(II)-hydroxit có tích số tan KSP =1.80·10-17
1) Tính độ tan của kẽm(II)-hydroxit trong nước.
2) Tính giá trị pH của dung dịch bão hòa kẽm(II)-hydroxit, bỏ qua khả năng tạo phức trong dung dịch.
Cho các thế khử chuẩn sau:
[Zn(OH)4]2- + 2 e ⇌ Zn(s) + 4 OH E° = -1.285 V
Zn2+ + 2e ⇌ Zn(s) E° = -0.762 V
3) Tính hằng số tạo phức tetrahydroxozincat(II) từ Zn2+ và OH .
4) Tính độ tan của kẽm(II)-hydroxit ở pH 9.58 nếu bỏ qua khả năng tạo phức tetrahydroxozincat(II).
5) Tính độ tan của kẽm(II)-hydroxit ở pH 9.58 nếu tính đến khả năng tạo phức tetrahydroxozincat(II).
6) So sánh kết quả ý 4 và 5. Nhận xét.
Bài 8
Một vấn đề quan trọng để tách các cation ra khỏi nhau chính là sự tách các cation bari và stronti. Điều này có thể thực hiện được bằng cách sử dụng giá trị độ tan khác nhau các muốu cromat của chúng. Nồng độ của cromat trong dung dịch có thể được điều chỉnh bằng cách chỉnh pH, như vậy sự tách ra có thể được hoàn toàn. Cân bằng “cromat – dicromat” dưới đây biểu diễn sự phụ thuộc nồng độ cromat vào pH: 2 H+ + 2 CrO4 2- ⇌ Cr2O7 2- + H2O K = 1.50×1015 Ở đây, K đã chứa sẵn nồng độ không đổi của (55.56 mol/L) Giá trị tích số tan của các muối là: KS(BaCrO4) = 8.5×10-11 KS(SrCrO4) = 3.6×10-5
1) Tính độ tan của BaCrO4 và SrCrO4 trong môi trường bazơ mạnh, lúc này trong dung dịch chỉ tồn tại anion CrO4 2.
2) pH của dung dịch chứa 0.10 mol/L K2Cr2O7 được điều chỉnh về 3.00 bằng cách sử dụng hệ đệm axit axetic/natri axetat. Tính nồng độ của Cr2O7 2- và CrO4 2- trong dung dịch đó. Thêm vào đó hãy tính giá trị nồng độ cực tiểu của Ba2+ và Sr2+ trong dung dịch này vào thời điểm mà sự kết tủa phân đoạn các cromat bắt đầu xảy ra.
3) Để pha chế hệ đệm thì axit axetic đem dùng có nồng 0.10 mol/L. Tính khối lượng natri axetat cần thiết để chỉnh pH = 3.00. Biết hằng số axit của axit axetic là Ka=1.78×10-5
|
Nước thải của một nhà máy xử lý nước thải có pH = 7,88 và chứa tổng lượng photpho nguyên tố là 2,0 mg trong 1 lít gồm axit photphoric, dihydrophotphat, hidrophotphat và photphat. Hằng số axit của axit photphoric: pKa1 = 2.23; pKa2 = 7.21; pKa3 = 12.32.
1) Các dạng nào của phopho có nồng độ cao nhất ở pH đã đề cập ở trên.
2) Tính nồng độ của 2 dạng ở câu 1. Để làm sạch nước thải, một số dung dịch muối kim loại được thêm vào trước khi đưa nước vào xử lý nước thải sinh học. Việc đưa các muối này vào nhằm làm kết tủa lượng lớn photphat. Chủ yếu sử dụng Fe3+. Tích số tan của FePO4 T = 9.91·10-16 .
3) Tính lượng Fe3+ phải thêm vào một lít nước thải để giảm hàm lượng photpho từ 2,0 mg/l xuống 0,5 mg/l. Giả sử tất cả photpho đều nằm ở dạng ion phophat.
Trong một số trường hợp axit photphoric ngưng tụ cho axit polyphotphoric với CTPT chung có dạng Hn+2PnO3n+1. Axit pyrophotphoric là một axit poly photphoric với n = 2, axit triphotphoric với n = 3.
4) Xác định CTCT của 2 axit đó Để xác định độ dài chuỗi axit polyphotphoric, nó có thể được chuẩn độ bằng dung dịch natri hydroxit. Axit polyphotphoric có tính chất như sau: Chỉ có một trong hai nhóm –OH tại mỗi đầu của phân tử là axit yếu, tất cả các nhóm –OH khác trong phân tử là axit mạnh. Trong phương pháp chuẩn độ axit, hai loại khác nhau của nhóm –OH có thể được chuẩn độ riêng biệt bằng cách sử dụng hai chỉ thị axit-bazơ khác nhau.
Chúng ta hãy xem xét một axit triphotphoric (n = 3). Chuẩn độ với dung dịch NaOH loãng có nồng độ xác định, 16,8 ml dung dịch đã được sử dụng để đạt đến điểm tương đương đầu tiên và cần 28 ml để đạt đến điểm tương đương thứ hai.
5) Mỗi nhóm –OH cần tốn bao nhiêu ml dung dịch NaOH để chuẩn độ? Một axit polyphotphoric được chuẩn độ. Để đạt được điểm tương đương đầu tiên cần dùng 30,4 ml, để đạt được điểm tương đương thứ hai thì cần 45,6 ml.
6) Xác định công thức của axit polyphotphoric
Bài 10
Một nhóm thực hành được yêu cầu đánh giá hằng số tích số tan của một muối của một acid yếu, hai chứa (MX). Để thực hiện các tính toán này, nhóm đã chuẩn bị hai dung dịch muối MX, một có pH = 7.0 và một có pH = 6.0. Họ thấy rằng nồng độ của ion M2+ trong dung dịch đầu tiên bằng 0.001 mol dm-3, trong khi đó với dung dịch thứ hai thì bằng 0.01 mol dm 3. Giá trị logarithm âm của các hằng số phân li của acid yếu H2X là pKa1 = 10.0 và pKa2 = 13.0. Giả sử rằng M2+ cation không thể hiện tính chất acid và không tạo thành phức chất với cả ion HX lẫn X2-
a) Dẫn ra phương trình nồng độ tổng của H+ trong dung dịch H2X ở dạng hàm của nồng độ tổng của acid này và các hằng số phân li của nó.
Trong giai đoạn tiếp theo, thực hiện các bước đơn giản hóa và tính pH của dung dịch H2X với nồng độ tổng của acid bằng 0.1 mol dm-3 .
b) Dẫn ra phương trình hằng số tích số tan của muối MX ở dạng hàm của các nồng độ ion M2+ và H+ .
c) Tính tích số tan của muối MX trong hai điều kiện pH khác nhau từ các dữ kiện cho ở đầu bài.
Một ví dụ thú vị về một muối hầu như không tan của một acid yếu, hai chức là PbCO3. Giá trị logarithm âm của hằng số tích số tan của muối này bằng 12.8, còn các giá trị tương ứng với các hằng số phân li của carbonic acid là pKa1 = 6.4 và pKa2 = 10.3. Độ tan của muối cũng phụ thuộc vào một phản ứng có thể viết ở dạng đơn giản như sau: Pb2+ + H2O ⇌ PbOH+ + H+ pKa = 7.9
d) Dẫn ra phương trình hằng số tích số tan của PbCO3, chú ý đến các cân bằng acid-base khác nhau của cả anion và cation.
e) Tính độ tan của muối này trong nước (pH = 7.0) và so sánh nó với độ tan của muối được tính khi không xét đến các cân bằng acid-base.
|
Bài 12
кJ/mol
2(g) −393,5
2CO3(aq)
2O(l)
Hồ núi lửa Nyos còn có tên là hồ tử thần do sự kiện xảy ra vào năm 1986 khi một lượng lớn khí CO2 thoát ra từ lòng hồ đã giết hết 1746 người dân sống quanh đó. Có một giả thiết cho rằng chính những cơn mưa nhiệt đới là thủ phạm của tai nạn này. Thay vì nó làm lạnh phần 50m phía trên mặt hồ thì nó lại xuống sâu đến 130 m làm phá vỡ cân bằng sinh thái trong khu vực này. Hậu quả tất yếu là khí carbonic thoát ra mạnh như một chai champagne bật nắp.
Cho rằng hồ có dạng hình trụ với diện tích 1.20 km2 và sâu 210 m. Dưới đáy hồ chứa chủ yếu FeCO3. Khí carbon dioxit được tạo thành từ vị trí có FeCO3 nóng chảy. Có thể cho rằng không có sự trộn lẫn giữa lớp nước phía trên (50 m) với lớp nước phía dưới, và nhiệt độ của vùng nước có độ sâu từ 50 m đến 180 m là 23°C.
R = 8.314 J/(mol·К), g = 9.81 m/s2, áp suất khí quyển là 1 bar. K1(H2CO3) = 3,57·10−7 M, K2(H2CO3) = 4,40·10−11 M, Ksp(FeCO3) = 5,91·10−11 M2 .
1) Tính hằng số Henry KH ở 23°C.
Các dung dịch đệm thường phải mua với giá rất cao, đặc biệt là các phòng thí nghịêm phải sử dụng lượng lớn. Công ty AustroBioGen đã tiến hành các biện pháp phân tích để có thể xây dựng chính xác thành phần dung dịch được sử dụng nhiều nhất trong kỹ thuật hóa sinh để có thể tự sản xuất ra dung dịch đệm. Thông tin duy nhất họ có được từ các nhà sản xuất hóa chất là danh sách các hóa chất đựoc dùng để điều chế dụng dịch đệm trong câu hỏi này: Axit photphoric (nồng độ 85%), natri dihydrophotphat dihydrat, dinatri hydrophotphat heptahydrat, trinatri photphat dodecahydratate.
Dung dịch đệm có giá trị pH là 6.50. Hằng số axit của axit photphoric là pKA1 = 2.23 pKA2=7.21, và pKA3=12.32. Đầu tiên tổng lượng photpho trong các chất được xác định bằng phương pháp chuân đọ pemanganat. Sau đó axit hóa hệ đệm bằng cách thêm vào axit axetic, sau đó thêm vào amoni clorua và photphat lúc này được kết tủa hoàn toàn định lượng bằng cách thêm vào dung dịch uranyl(VI) axetat để tạo muối khó tan uranyl amoni photphat (NH4UO2PO4). Ở bước kế tiếp thì muối uranyl tinh khiết được khử bằng đĩa nhôm trong axit sunfuric để tạo thành urani(IV). Ở bước cuối thì urani(IV) sẽ được chuẩn độ lại với kali pemanganat, lúc này urani(IV) sẽ bị oxy hóa để tạo lại UO2 2+
1) Viết và cân bằng phản ứng cuối.
[HCO] K p(CO)
CO2(g) + H2O(l) H2CO3(aq) , = 23(aq) H 2(g)
2) Tính pH ở độ sâu pH 50 m.
Trong trường hợp không làm được câu 2 hãy sử dụng giá trị pH ở độ sâu 50 m là pH=3.94, và 180 m là pH=3.50.
3) Tính độ tan cực đại của CO2 (mol/L) ở: i) 50 m và ii) 180 m.
4) Cho rằng trong khu vực từ 50 đến 180 m lượng CO2 biến thiên tuyến tính. Hãy cho biết số mol, khối lượng và thể tích CO2 tạo thành từ lớp này ở 30 °C
2) Để chuẩn độ 10.00 mL dung dịch đệm cần 13.34 mL dung dịch kali pemanganat (c=0.0200 mol/L). Tính tổng lượng photpho có trong các tiểu phân chứa photpho.
3) Bây giờ tính lại nồng độ của từng cấu tử chứa photpho trong dung dịch đệm. Cho rằng ở pH đã cho thì có một vài tiểu phân chứa P hiện diện với nồng độ rất bé nên có thể bỏ qua được. Dựa vào sự gần đúng này hãy xác định nồng độ của các tiểu phân có chứa P còn lại trong dung dịch. Sử dụng các giá trị này để tính toán nồng độ của các tiểu phân có chứa P mà ta đã bỏ qua trước đó. Kiểm tra độ phù hợp của kết quả với các câu trả lời trước đó (sự chênh lệch phải bé hơn 2%). Bất lợi chính của dung dịch đệm này là sự kết tủa khi có sự xuất hịên ion canxi trong dung dịch dưới dạng apatit Ca3(PO4)2. Tích số tan của apatit là 1.00‧10-26 .
4) Tính nồng độ lớn nhất mà ion canxi được phép có mặt trong dung dịch đệm này.
5) 2.00 g NaOH rắn được thêm vào 1 lít dung dịch đệm này. Tính giá trị pH của dung dịch sau phản ứng cũng như tính nồng độ của tổng lượng các ion khác có mặt trong dung dịch bằng cách sử dụng các ước lượng gần đúng.
Bài 13
Hãy trả lời các câu hỏi từ a) - c) về việc xác định thành phần khí núi lửa. Trước khi lấy mẫu khí núi lửa thì phải đuổi không khí ra khỏi ống chứa mẫu bằng 20 mL dung dịch NaOH 5 mol L-1. Một ống titan được đưa vào miệng núi lửa và ống này được gia nhiệt bằng khí núi lửa nóng để ngăn chặn sự ngưng tụ của khí núi lửa có trong ống. Bằng cách dùng ống cao su nối ống titan với ống chứa mẫu thì khí núi lửa được đưa chậm vào ống chứa mẫu. Trong quá trình lấy mẫu thì ống chứa mẫu luôn được làm lạnh bằng một tấm khăn ướt. Sau khi quá trình lấy mẫu hoàn tất thì ống chứa mẫu được để cân bằng với điều kiện ngoài (0 °C, 1013 hPa) và thể tích tương ứng của phần khí và lỏng chứa trong ống lần lượt là 50.0 mL và 38.0 mL. Lấy 10 mL dịch lọc từ 38.0 mL dung dịch có trong ống chứa mẫu rồi oxy hóa toàn bộ các hợp chất chứa lưu huỳnh thành sunfat. Sau đó thêm vào dung dịch HCl loãng để tạo môi trường có tính axit yếu thì thêm vào 20 mL dung dịch BaCl2 10% sẽ thấy xuất hiện kết tủa trắng. Sấy khô kết tủa và cân thu được 0.30 g kết tủa.
Thể tích 1 mol khí ở điều kiện chuẩn (0 °C và 1013 hPa) là 22.4 L a) Tính phần trăm thể tích hơi nước có trong mẫu khí núi lửa nếu cho rằng thể tích dung dịch NaOH không thay đổi khi hấp thụ các mẫu khí khác ngoài hơi nước. Khối lượng riêng của dung dịch NaOH luôn không đổi trong suốt quá trình thí nghiệm và có giá trị 1.0 g mL-1 .
b) Tính số mol lưu huỳnh có trong mẫu khí núi lửa. Thêm vào đó hãy tính tổng thể tích các khí H2S và SO2 (mL) ở điều kiện chuẩn (0 °C, 1013 hPa). Ghi kết quả đến hai chữ số có nghĩa.
b) Tỉ lệ mol của H2S với SO2 được xác định dựa vào khả năng phản ứng khác nhau giữa hai khí H2S và SO2. Khí núi lửa được cho sục qua một ống nghiệm chứa 30 mL dung dịch KIO3 - KI 0.03 mol L-1 và 3 mL dung dịch HCl 4M HCl. Viết các phản ứng hóa học xảy ra cho từng khí H2S và SO2.
|
Phân tích định lượng thường được sử dụng để xác định thành phần của các phân khoáng. Ví dụ, hàm lượng lưu huỳnh ở dạng sulfate ion trong phân khoáng được xác định theo quy trình sau: Chuẩn bị 4 mẫu phân bón nặng 0,2500 gam rồi hòa tan các mẫu vào 25 ml nước, nhỏ thêm 5 giọt HCl 1 M, sau đó là dung dịch BaCl2. Lọc tách kết tủa và rửa sạch. Kiểm tra nước rửa kết tủa với dung dịch AgNO3. Sấy kết tủa ở 250 oC rồi đem cân. Các kết quả thu được từ thí nghiệm của 4 mẫu là: 0,0728; 0,0730; 0,0611; 0,0725 gam.
1) Tính hàm lượng sulfate trong loại phân này.
2) Tại sao phải tiến hành phản ứng kết tủa trong môi trường acid?
3) Tại sao phải kiểm tra nước rửa kết tủa với dung dịch AgNO3? Để phân tích hàm lượng nước trong mẫu phân, kĩ thuật viên phân tích đã sử dụng một trong những phương pháp đơn giản nhất, dựa vào việc đo khối lượng bị giảm khi nung mẫu trong một thời gian dài tới 300 oC. Tuy nhiên, kĩ thuật viên đã thu được kết quả không đúng về hàm lượng nước.
4) Hãy xác định những chất nào dưới đây đã gây ra sai số thí nghiệm?
Giải thích bằng phương trình phản ứng. Để xác định hàm lượng (NH4)2SO4 trong phân bón, có thể sử dụng phương pháp Kjeldahl. Lấy 0,300 gam mẫu phân bón với hàm lượng ammonium sulfate chưa biết, cho vào bình chưng cất. Thêm nước cất và lượng dư sodium hydroxide vào. Nối bình này với một bộ ngưng tụ và đun nóng cho tới khi chỉ còn lại bã rắn. Trước khi chưng cất, thêm 100 ml dung dịch HCl 0,05 M vào bình thu. Dung dịch chưng cất thu được đem chuẩn độ với dung dịch NaOH 0,1 M cho đến khi đạt điểm tương đương.
5) Tính hàm lượng ammonium sulfate trong mẫu phân bón nếu biết đã dùng 22 ml chất chuẩn.
6) Tính pH ở điểm tương đương nếu biết thể tích dung dịch sau chưng cất trong bình thu là 130 ml. Cho biết K(NH4OH) = 1,76·10-5 .
Bài 15
Để định lượng chloride ion theo phương pháp Folgard, 20.00 mL dung dịch AgNO3 0.0500 M được thêm vào 1 đơn vị mẫu (10.00 mL) cần phân tích đã được acid hóa, sử dụng chỉ thị muối iron(III), không tách kết tủa và chuẩn độ hỗn hợp với dung dịch KSCN 0.0500 M.
1) Viết phương trình phản ứng tạo kết tủa, phương trình chuẩn độ, phản ứng của chất chỉ thị với chất chuẩn và tính số mol chloride trong mẫu. Biết rằng quá trình chuẩn độ sử dụng 5.50 mL thiocyanate. Một dung dịch cần phân tích chứa hỗn hợp chloride 0.030 M, bromide 0.040 M và cyanide 0.050 M. Quá trình phân tích được tiến hành theo nhiều cách: a) chuẩn độ Folgard thông thường; b) thêm lượng dư KIO3 trong HNO3 vào dung dịch và đun hồi lưu, thấy phần bay hơi nhuộm màu giấy chỉ thị iodine - hồ tinh bột. Sau đó thêm phosphorous acid H3PO3 vào và quá trình cất được lặp lại cho đến khi halogen tự do được loại bỏ hoàn toàn. Sau khi làm nguội dung dịch, tiến hành chuẩn độ Folgard; c) Thêm acid loãng vào dung dịch rồi đun sôi, sau đó tiến hành chuẩn độ Folgard; d) Thêm lượng dư kiềm và hydrogen peroxide 30 % vào dung dịch rồi đun sôi, ngửi thấy mùi ammonia, sau đó acid hóa dung dịch rồi tiến hành chuẩn độ Folgard.
2) Nồng độ của anion nào có thể được xác định bởi mỗi kĩ thuật? Viết các phương trình phản ứng được sử dụng để tách các anion. Tính tổng nồng độ của các anion. Cho biết các giá trị tích số tan (Ks = [Ag+][Hal ]) là: AgCl = 1.8·10-10, AgBr = 5.3·10-13, AgCN = 1.4·10-16; sự tạo thành các phức chất bạc tan được có thể bỏ qua.
3) Trong mẫu, có thể có: Ca2+, Hg2+, MnO4 , Fe2+, các mercaptan RSH. Những chất nào kể trên có thể gây nhiễu trong quá trình xác định chloride theo phương pháp Folgard?
4) Để quan sát được màu của chất chuẩn dư với chỉ thị
thiocyanate
M. Tính
tích
màu
|
Toluene và chlorine khô phản ứng trong điều kiện chiếu sáng tạo thành benzyl chloride, và phép phân tích độ tinh khiết của sản phẩm thô được tiến hành như sau: Trộn 0.255 gam mẫu với 25 mL dung dịch sodium hydroxide 4 mol L-1 trong bình 100 mL. Sau khi làm lạnh về nhiệt độ phòng, thêm 50 mL nitric acid 20 % rồi cho tiếp 25.00 mL dung dịch silver nitrate 0.1000 mol L-1. Lượng silver nitrate còn lại được chuẩn độ bởi dung dịch NH4SCN 0.1000 mol L-1 với chỉ thị ammonium ferric sulfate thì thấy cần 6.75 mL dung dịch chất chuẩn.
1) Viết các phương trình phản ứng của phép phân tích.
2) Tính hàm lượng benzyl chloride trong mẫu.
3) Thông thường, các kết quả thu được thường cao hơn so với hàm lượng benzyl chloride thực tế trong mẫu. Giải thích nguyên nhân.
4) Phương pháp phân tích trên có thể áp dụng để xác định độ tinh khiết của chlorobenzene không? Giải thích tại sao.
Bài 17
Để định lượng magie trong dung dịch, trước hết axit hóa mẫu bằng HCl, sau đó thêm dần NH3 đến môi trường kiềm nhẹ rồi thêm vào một lượng dư dung dịch (NH4)2HPO4. Lọc lấy kết tủa MgNH4PO4, rửa bằng dung dịch NH3 loãng, nung ở 1000 oC đến khối lượng không đổi rồi đem cân. Hãy trả lời các câu hỏi sau, sử dụng các số liệu cho sẵn ở phía dưới nếu cần
1) Viết phương trình ion của các phản ứng xảy ra trong quá trình phân tích.
2) Viết phương trình phản ứng xảy ra trong quá trình nung.
3) Khi xác định hàm lượng magie trong một loại thuốc giảm đau, từ 1,8005 g thuốc giảm đau người ta thu được 0,1532 g chất rắn sau khi nung. Tính phần trăm khối lượng MgO trong thuốc.
4) Trong quá trình kết tủa MgNH4PO4, một số tạp chất như MgHPO4, Mg(NH4)4(PO4)2, Mg3(PO4)2, Mg(OH)2, (NH4)2HPO4 và NH4Cl cũng có thể bị kết tủa theo. Trong đó, một số chất có thể bị nhiệt phân trong quá trình nung. Viết các phương trình phản ứng tương ứng.
5) Trong số các tạp chất cho ở bảng dưới đây, một số chất có thể gây nên sai lệch trong việc định lượng magie bằng phương pháp trên. Hãy điền 0 vào bảng nếu không có sai lệch, điền dấu cộng (+) hoặc dấu trừ (-) tương ứng với sai lệch dương hoặc sai lệch âm. Tạp chất Sai lệch
MgHPO4 Mg(NH4)4(PO4)2 Mg3(PO4)2 Mg(OH)2 (NH4)2HPO4 NH4Cl
6) Tìm giá trị pH lớn nhất tại đó có thể tách MgNH4PO4 nhưng vẫn tránh được sự kết tủa đồng thời của Mg(OH)2? Giả sử thể tích của mẫu ban đầu là 200 mL và lượng magie trong đó là 0,10 g.
|
7) Để xác định tích số tan (Ksp) của MgNH4PO4, người ta nhỏ từng giọt dung dịch NaOH vào dung dịch chứa đồng thời MgCl2, NH4Cl và Na2HPO4 (mỗi muối đều có nồng độ 0,010 M). Kết tủa bắt đầu xuất hiện tại pH = 6,48. Tính Ksp. Giả thiết thể tích dung dịch không thay đổi trong quá trình thí nghiệm. Số liệu tham khảo
H3PO4 Hằng số axit Ka1 7,1.10 3 Ka2 6,2.10 8 Ka3 5,0.10 13
NH3 Hằng số bazơ Kb 1,8.10 5
Mg(OH)2 Tích số tan Ksp 6,0.10 10 H2O Tích số ion Kw 1,0.10 14
Bài 18
Để xác định nồng độ CoCl2, một nhà hóa học trẻ đã thêm 5.0 mL dung dịch potassium nitrite 0.2 M vào 100 mL dung dịch phân tích, sau đó anh thêm vào 2 mL đệm acetate, đun nóng dung dịch đến sôi rồi để trong 4 giờ. Kết tủa vàng nhận được của potassium hexanitritocobaltate(III) K3[Co(NO2)6] được lọc qua phễu thủy tinh bằng dung dịch KNO3 0.01 M, rồi hòa tan trong sulfuric acid và chuyển vào bình định mức 100 mL. Lấy một đơn vị mẫu (10.0 mL) dung dịch này đem chuẩn độ với dung dịch potassium permanganate 0.0500 M (cho đến khi xuất hiện màu tím). Thể tích dung dịch chuẩn đã dùng là 13.75 mL.
1) Viết các phương trình phản ứng sau: a) tạo thành K3[Co(NO2)6]; b) phản ứng của potassium permanganate với nitrite ion trong môi trường acid; c) phản ứng của potassium permanganate với K3[Co(NO2)6], biết rằng cobalt bị chuyển hoàn toàn thành số oxid hóa +2.
2) Dựa vào kết quả chuẩn độ, hãy tính nồng độ muối cobalt trong dung dịch phân tích.
3) Những yếu tố nào ảnh hưởng đến độ tan của K3[Co(NO2)6] trong dịch cái sau khi kết tủa được tạo thành: a) hằng số bền của ion phức [Co(NO2)6]3-; b) tích số tan của kết tủa; c) nồng độ K+; d) nồng độ Co(II); e) nồng độ NO2 .
4) Tính độ tan của potassium hexanitritocobaltate(III) trong dịch cái (gam/L) biết rằng tích số tan Ks = [K+]3[Co(NO2)6 3-] = 4.3·10-10 và hằng số bền của ion phức là đủ cao.
5) Ước tính sai số chuẩn độ (%) do độ tan của kết tủa trong dịch cái (bỏ qua những hao hụt do sự rửa kết tủa).
6) Xác định thể tích tối ưu của dung dịch rửa (KNO3 0.01 M) tương ứng với sai số chuẩn độ nhỏ nhất nếu biết sai số được gây ra bởi (1) sự xuất hiện của nitrite ion trong bình chuẩn độ do chưa rửa kết tủa hiệu quả, và (2) bởi sự hao hụt kết tủa do sự tan của nó trong dung dịch rửa. Vẽ các đồ thị của các hai yếu tố gây ra sai số dưới dạng hàm của thể tích dung dịch rửa Vy. Giả sử rằng kết tủa chưa được rửa sẽ giữ lại nước cái với lượng bằng 1/2 khối lượng m của nó. Chú ý rằng mỗi mL của dung dịch rửa sẽ loại bỏ 1 % thể tích dịch cái bị giữ lại.
|
Để xác định nồng độ bismuth, trộn 25.0 mL dung dịch Bi3+ được acid hoá với 20 mL chloroform, rồi thêm chỉ thị methyltimol xanh dương vào; rồi chuẩn độ hỗn hợp thu được với dung dịch chuẩn ammonium oxalate (phản ứng A). Lắc bình định mức sau khi thêm các phần dung dịch chuẩn vào. Sau khi thêm vào 14.36 mL dung dịch oxalate 0.100 M thì màu xanh dương của huyền phù chuyển thành xanh lục, có thể quan sát được sau quá trình tách phase. Kĩ thuật viên phân tích cho rằng 1.000 mL dung dịch oxalate tương ứng với 13.93 mg Bi.
1) Viết phương trình phản ứng A, xác định sản phẩm ít tan tạo thành.
2) Tính toán để xác định thành phần sản phẩm.
3) Tính nồng độ Bi3+ trong dung dịch phân tích theo mol/L và gam/L.
4) Khi thêm chỉ thị methyltimol xanh dương vào dung dịch chứa muối bismuth, thì tạo thành phức chất màu xanh dương (phản ứng B): Bi3+ + Ind3- = BiInd. Giải thích nguyên lí của chỉ thị metalchromic (biến đổi màu) này bằng cách viết phương trình phản ứng của phức chất với lượng dư chỉ thị (phản ứng C). Chất nào được tạo thành trong phản ứng có màu vàng?
Các mức nồng độ bismuth thấp hơn được xác định bằng cách thêm KBr vào 100.00 mL dung dịch cần phân tích, kết tủa tạo thành ngay từ đầu (phản ứng D) sẽ tan hoàn toàn (phản ứng E) tạo thành dung dịch màu vàng nhạt. Dung dịch tạo thành được trung hoà bởi dung dịch sodium hydroxide cho tới khi dung dịch hơi vẩn đục, nhưng không biến mất hoàn toàn khi khuấy (phản ứng F). Sau đó thêm hexaammine chromium(III) nitrate vào để kết tủa hoàn toàn một hợp chất bismuth (phản ứng G). Lọc tách kết tủa, rửa với dung dịch KBr rồi rửa hoàn toàn với nước nóng. Trong quá trình này, kết tủa bị thuỷ phân tạo thành một hợp chất bismuth ít tan (phản ứng H). Thêm một lượng dư NaOH vào huyền phù tạo thành rồi đun nóng (phản ứng J) với hợp chất chromium; ammonia tạo thành được hấp thụ vào dung dịch boric acid (phản ứng K). Chuẩn độ dung dịch trong bình chứa với HCl 0.1000 M, có mặt methyl da cam (phản ứng L) thì cần 17.2 mL acid.
5) Viết các phương trình phản ứng D - L. Gạch chân chất kết tủa trong các phản ứng D và H. Khoanh tròn hơp chất có màu vàng trong phản ứng E
Bài 20
Thêm một lượng dư muối calcium vào dung dịch hợp chất hữu cơ A ở pH
8, thu được kết tủa B. Nồng độ A có thể được xác định bằng cách chuẩn độ với dung dịch KBrO3 trong môi trường acid khi có KBr dư.
1) Cho biết tên thông thường và tên hệ thống của hợp chất A. Viết
tủa B, nếu biết đường cong nhiệt trọng có 3 bước nhảy (xem bảng dưới đây). Viết phương trình phản ứng tương ứng với các quá trình này.
Hợp chất Nhiệt độ của bước nhảy, oC
B 100 - 228 398 - 420 660 - 838
C 100 230 397 478
Bảng: Dữ liệu phân tích nhiệt trọng của B và C.
3) Hợp chất C được tạo thành từ phản ứng giữa hợp chất A và magnesium ion. Đường cong nhiệt trọng của C có hai bước nhảy trong khoảng 20 - 1000 oC (xem bảng). Nung hỗn hợp B và C ở 500 oC thì thu được 14.0 gam bã rắn. Sau đó nung tiếp ở 900 oC thì thu được 9.6 gam bã rắn. Xác định hàm lượng calcium trong hỗn hợp ban đầu (ở dạng CaO).
4) Dẫn ra phương trình mô tả sự phụ thuộc của độ tan B vào pH dung dịch. Tích số tan của B là 2.0 · 10-9. Xác định hằng số proton hoá của A anion nếu độ tan của B là 0.0105 gam/100 mL ở pH = 4.0. Tính độ tan của B (gam/mL) trong nước tinh khiết, không hoà tan carbon dioxide hoặc bất kì tạp chất nào.
6) Tính nồng độ Bi3+ trong dung dịch đầu theo mol/L. 67 |
1) Tiến hành phân tích kết tủa NaH2PO4·nH2O bằng cách: Hòa tan m1 = 4.360 gram mẫu chất này vào 100 mL nước rồi lấy 1 đơn vị mẫu (V1 = 10.00 mL), thêm vào đó lượng dư MgSO4 và muối ammonium, thu được kết tủa ở dạng tinh thể hydrate của MgNH4PO4. Sấy khô kết tủa này, đem cân (m2 = 0.4486 gram), rồi thêm vào 10.00 mL dung dịch HCl 1.000 M thì kết tủa hòa tan hoàn toàn, sau đó pha loãng dung dịch thành V0 = 100 mL (dung dịch A). Lấy một đơn vị mẫu dung dịch A (VMg = 20.00 mL), thêm methyl da cam (khoảng chuyển màu: pH 3.1 - 4.4) vào, rồi chuẩn độ với dung dịch NaOH 0.0500 M cho đến khi chất chỉ thị chuyển hoàn toàn thành màu vàng thì đã dùng hết VNa1 = 16.3 mL chất chuẩn kiềm (dung dịch tạo thành là B). Viết các phương trình hòa tan kết tủa trong acid và chuẩn độ. Xác định hàm lượng phostphate trong kết tủa MgNH4PO4 và số phân tử nước kết tinh trong NaH2PO4·nH2O.
2) Chuẩn độ dung dịch B với kiềm khi có chỉ thị p-xylenolphthalein (khoảng chuyển màu: pH 9.3 - 10.5) thì cần VNa2 = 12.4 mL dung dịch NaOH 0.0500 M. Trong quá trình thêm kiềm vào, có ít nhất 3 muối magnesium đã bị kết tủa. Viết phương trình các phản ứng kết tủa này. Vì những nguyên nhân về mặt động học, không phải muối kém tan nhất sẽ tạo kết tủa (lắng đọng). Loại muối nào chiếm ưu thế trong kết tủa? Nếu chỉ dựa vào kết quả chuẩn độ này thì có thể xác định được hàm lượng phostphate trong đơn vị mẫu không?
3) Kết tủa tạo thành được lọc tách, rửa sạch và hòa tan hoàn toàn trong HCl 0.0200 M, thì pH dung dịch tạo thành là gần 4. Tính thể tích V2HCl cần để hòa tan hoàn toàn kết tủa. Cho biết các hằng số phân li của phosphoric acid là: рK1 = 2.0, рK2 = 6.7, рK3 = 12.4. Các giá trị tích số tan (Ks): MgNH4PO4 - 2·10-13, MgHPO4 - 3·10 6, Mg3(PO4)2 - 1·10-13, Mg(OH)2 - 6·10-10
Bài 22
Vasya có sở thích chăm sóc một bể cá (pH 7.2, nồng độ oxygen hoà tan là 3.12·10-4 M.) Cậu đọc được trong một cuốn sách rằng những loại thực vật thuỷ sinh của mình cần một lượng sắt hoà tan với nồng độ tối ưu là c(Fe) = 2 µM. Các giá trị tham chiếu: tích số tan của Fe(OH)3 là Ks = [Fe3+][OH ]3 = 4·10 38; ở pH 7.2 phần mol của ion tạo phức EDTA (Y4-) là 8·10-4; hằng số cân bằng của phản ứng Fe2+ + ¼O2 + ½H2O = Fe3+ + OH trong dung dịch nước là K = 105; các thông số của phức chất tạo thành từ các ion sắt được cho sau đây:
(complex = phức chất; stability constant = công thức tính hằng số bền; constant value = giá trị hằng số.)

1)
a) Tính phần mol α của cation Fe3+ tự do trong dung dịch ở pH này.
b) Quá trình này giới hạn nồng độ của sắt trong dung dịch ở pH này.
c) Có thể cung cấp cho cây nồng độ sắt cần thiết bằng cách, ví dụ, thêm iron(II) sulfate ở dạng phân bón? Tính tổng nồng độ tối thiểu của sắt hoà tan trong bể cá.
2) Vasya nghe kể rằng thực vật tiêu thụ sắt hiệu quả hơn nếu nó ở trạng thái oxid hoá +2.
a) Quá trình nào sẽ xảy ra khi thêm iron(II) sulfate vào bể cá này? Viết phương trình phản ứng tổng.
b) Tính phần trăm sắt hoà tan ở dạng 2+ khi dung dịch đạt cân bằng, nếu thêm 2 μM iron(II) sulfate vào dung dịch ở pH 7.2.
3) Có một lời khuyên phổ biến rằng độ tan và tính bền của iron(II) có thể được tăng cường bằng cách đưa sắt vào ở dạng phức càng cua (chelate) - có thể được điều chế bằng cách trộn iron(II) sulfate với EDTA.
a) Tính phần mol của Fe3+ tự do, α(Fe3+) trong dung dịch ở pH này, nếu Vasya đã thêm đồng thời cả muối iron (2 µM) và EDTA (dư gấp 1.5 lần về số mol). Dạng nào của iron(III) chiếm ưu thế trong điều kiện này? Tính phần mol của nó.
|
b) Iron(III) có kết tủa không nếu Vasya đã thêm Fe3+ 2 µM với EDTA dư gấp 1.5 lần về số mol?
c) Ước tính phần trăm Fe bị hòa tan tồn tại ở dạng iron(II), nếu iron(II) được thêm vào đồng thời với EDTA dư gấp 1.5 lần về số mol. Có thể duy trì một lượng đáng kể của iron(II) được không?
Bài 23
Ngọc trai là một trong những loại ngọc đẹp nhất, từ xa xưa đã rất có giá trị bởi màu sắc nhẹ nhàng và ánh sáng huyền bí bên trong.
Truyền thuyết kể rằng, khi cơn mưa nhiệt đới xảy ra và những giọt mưa đầu tiên chạm xuống mặt nước, thì trai ngọc từ đại dương sâu thẳm trồi lên, mở vỏ ra và chẳng bắt lấy gì ngoài một giọt nước mưa, rồi lại chìm xuống dưới. Ở đó - dưới đáy đại dương - viên ngọc trai diệu kì bắt đầu lớn dần từ những giọt nước. Sự thực thì, ngọc trai gồm lõi, phần chính và vỏ. Phần chính của ngọc trai là các tinh thể aragonite đa hình dạng (chủ yếu là dạng hình cầu), gắn với lõi ngọc trai (hoặc một tinh thể aragonite khác). Nghịch lí nằm ở thực tế là trong hai dạng tinh thể của CaCO3 (calcite và aragonite) thì calcite là dạng bền nhất trong các điều kiện thông thường. Hãy cùng nhau tìm hiểu tại sao ngọc trai lại chứa aragonite. Chú ý rằng:
Sự tạo thành một tinh thể không phụ thuộc vào lõi ngọc trai;
Dạng tinh thể là hình cầu; Độ tan phụ thuộc tuyến tính vào nhiệt độ;
Mức độ thuận tiện của quá trình tạo thành tinh thể được xác định bởi mức độ thuận tiện của việc hình thành hạt nhân cốt yếu (critical nucleus) (nghĩa là một hạt nhân mới, có thế hóa học bằng với trong dung dịch);
Công hình thành phôi cốt yếu được xác định bởi tổng hai công: công tạo thành bề mặt mới và công hóa học liên quan tới sự biến đổi trạng thái phase.
Trong đó S là diện tích bề mặt; σ là sức căng bề mặt trong hệ tinh thể-dung dịch; Vcryst là thể tích tinh thể;
tích mol;
thế hóa học của dung dịch quá bão hòa.
học của các chất trong dung dịch;
độ dung dịch bão hòa.
carbonic acid:
dịch quá bão hòa,
= 10.33.
1) Loại quá trình nào diễn ra khi hòa tan CaCO3 (phá hủy mạng tinh thể, nóng chảy, hydrate hóa ion hay thăng hoa?)
2) Tính nồng độ CO3 2- ion (mol/L) ở điều kiện mà tổng nồng độ [HCO3 ] + [CO3 2-] = 0.008 mol/L và pH = 8.2.
3) Tính độ tan của calcite và aragonite ở nhiệt độ 90, 20 và 4 oC, sử dụng dữ liệu sau: Dạng tinh thể Độ tan, mol/L 25 oC 100 oC calcite 1.43·10 4 1.78·10 4 aragonite 1.53·10 4 1.90·10 4
4) Tính nồng độ dung dịch calcium carbonate bão hòa trong nước biển, chú ý rằng tích số tan của CaCO3 là 2.8·10-8 và toàn bộ carbonate ion tạo thành từ calcium carbonate. Cho biết nồng độ của dung dịch bão hòa là hằng số.
5) Tính (với độ chính xác đến số thập phân thứ 4) tỉ lệ giữa bán kính r của các hạt nhân tinh thể cốt yếu của calcite/aragonite ở 20 và 4 oC (nghĩa là vào mùa hè và mùa đông).
6) Tính (với độ chính xác đến số thập phân thứ 4) tỉ lệ năng lượng tạo thành của các hạt nhân tinh thể cốt yếu của calcite và aragonite ở 20 và 4 oC, giả sử rằng khối lượng riêng và các hệ số sức căng bề mặt của các tinh thể này giống nhau.
7) Biểu diễn sự phụ thuộc của Δwform vào r khi Δμ = 0 Δμ và ≠ 0.

Bài 24 Cân 9.2 gram phức chất A (C10H14O8N2Na2·nH2O) để xác định độ cứng tổng của nước ở mức độ kĩ thuật. Độ chính xác của phép cân được xác thực bằng phương pháp chuẩn độ. Mẫu A được hòa tan vào nước cất rồi pha loãng tới
(ống đựng dung dịch
loãng tới 200.0
mẫu (10.00 mL) của dung dịch cuối đem chuẩn độ với dung dịch A khi có mặt hệ đệm và chất chỉ thị.
|
nghiệm chuẩn
A), mL 10.1
Vào thời điểm bắt đầu tiến hành các thí nghiệm đo đạc thì các giá trị nhiễu khỏi trị trung bình đã được loại bỏ (các trị nhiễu lớn hơn 3sn-1).
Các mẫu nước đã được thu thập từ các con suối Alpha và Beta. Lấy 100.0 mL mỗi mẫu rồi đem chuẩn độ với dung dịch A. Các kết quả chuẩn độ được ghi trong bảng sau: Con suối Alpha Beta
V(A),
Độ cứng của nước ở các con suối có khác nhau không?
Chuyên đề 31: Phản ứng oxid hóa-khử và chuẩn độ
Bài 1
Có thể định lượng nitrite ion bằng phản ứng chuẩn độ với permanganate ion (MnO4 ) trong dung dịch acid: 2MnO4 + 5NO2 – + 6H+ → 2Mn2+ + 3H2O + 5NO3
a) Viết hai bán phản ứng của phản ứng tổng giữa permanganate ion và nitrite ion trong môi trường acid.
b) Trong một thí nghiệm điển hình để xác định nồng độ nitrite ion, lấy 25.0 mL dung dịch potassium permanganate(VII) 0.0200 mol L-1 đem acid hóa, đun ở 40 oC rồi đem chuẩn độ với dung dịch sodium nitrite, thì cần 26.0 mL chất chuẩn để đạt tới điểm cuối.
i) Quan sát được sự thay đổi màu sắc nào tại điểm cuối chuẩn độ?
ii) Tính nồng độ NO2 trong dung dịch.
Mùn là loại vật chất hữu cơ phức tạp trong đất, độ màu mỡ của đất và hàm lượng mùn có mối liên hệ mật thiết với nhau. Có thể sử dụng phương pháp potassium dichromate để xác định hàm lượng mùn trong đất: Cân 0.1500 gam một mẫu đất khô rồi cho phản ứng với 5 mL dung dịch K2Cr2O7 0.10 mol L-1 trong H2SO4, đun nóng tới khi phản ứng oxid hóa carbon xảy ra hoàn toàn (C → CO2; mùn có chứa 58 % carbon và 90 % lượng carbon đó có thể bị oxid hóa). Chuẩn độ dung dịch thu được bằng (NH4)2SO4.FeSO4 0.1221 mol L-1 với chỉ thị phenanthroline thì hết 10.02 mL chất chuẩn. Tiến hành thí nghiệm mẫu trắng (blank experiment) sau: Sau khi nung mẫu đất trên ở nhiệt độ cao, cũng cân một lượng như vậy rồi rồi xử lí trong cùng điều kiện và chuẩn độ thì thấy hết 22.35 mL dung dịch (NH4)2SO4.FeSO4
1) Viết phương trình phản ứng oxid hóa carbon thành CO2 bởi K2Cr2O7 trong môi trường acid.
2) Viết phương trình của chuẩn độ bởi ferrous ammonium sulfate.
3) Tính hàm lượng (% m) của mùn trong mẫu đất.
Bài 3
Một chất oxid hóa có công thức MOxCly, trong đó M là kim loại chuyển tiếp, x và y đều là các số nguyên dương. Hòa tan 2.905 gam mẫu vào nước rồi pha loãng thành 100 mL. Lấy ra 20.00 mL dung dịch, thêm dung dịch nitric acid loãng và một lượng AgNO3 vừa đủ, thu được 1.436 gam kết tủa trắng. Lấy 20 mL dung dịch, thêm một lượng vừa đủ sulfuric acid, rồi chuẩn độ với ferrous ammonium sulfate, dùng chỉ thị 2(phenylamino)benzoic acid. Tới khi đạt điểm cuối thì hết 3.350 mmol chất chuẩn. Xác định cation MOx y+ và công thức phân tử hợp chất MOxCly. Viết phương trình phản ứng chuẩn độ MOx y+ với ferrous ammonium sulfate.
|
Một oxide hỗn hợp chứa lanthanum, calcium và manganese (tỉ lệ mol
2:2:1) được tổng hợp trong không khí ở 900 oC, trong đó mangenese có thể có số oxid hóa +2, +3, +4 hoặc hỗn hợp. Để xác định công thức oxide hỗn hợp, tiến hành phân tích theo quy trình sau:
1) Lấy chính xác 25.00 mL dung dịch sodium oxalate 0.05301 mol L-1, cho vào bình nón, thêm vào 25 mL nước cất và 5 mL dung dịch HNO3 6 mol L-1. Đun nhẹ tới 60 - 70 oC và chuẩn độ với dung dịch KMnO4 thì thấy hết 27.75 mL. Viết phương trình phản ứng chuẩn độ và tính nồng độ dung dịch KMnO4
2) Lấy chính xác 0.4460 gam mẫu oxide hỗn hợp, cho vào bình nón. Thêm 25.00 mL dung dịch sodium oxalate ở trên và 30 mL dung dịch HNO3 6 mol L-1, lắc đều ở 60 - 70 oC. Sau khoảng 30 phút, thu được dung dịch mất màu. Đem chuẩn độ với dung dịch KMnO4 ở trên thì thấy hết 10.02 mL. Dựa vào các kết quả thực nghiệm, tính số oxid hóa của manganese trong oxide hỗn hợp. Xác định công thức oxide và viết phương trình phản ứng hòa tan mẫu. Biết nguyên tử khối của La là 138.9.
Bài 5
Thành phần anode trong pin lithium, trong đó cobalt ở dạng hỗn hợp Co(III) và Co(II), có thể biểu diễn bằng công thức chung là Li1+yCoO2. Mẫu có chứa một số (x) muối trơ của lithium và nước. Hàm lượng cobalt trong vật liệu làm anod được xác định bằng phương pháp phổ hấp thụ nguyên tử, là 56.40 %. Số oxid hóa của cobalt được xác định bằng phương pháp chuẩn độ điện thế, trong đó một dung dịch - được tạo thành bằng cách hòa tan 25.00 mg vật liệu anode vào 5.00 mL dung dịch chứa FeSO4 0.1000 M, H2SO4 6 M và H3PO4 6 M - được sử dụng trong khí quyển nitrogen. Chuẩn độ iron(II) dư tiêu tốn 3.23 mL dung dịch potassium dichromate 0.01593 M (MCo = 58.933, MLi = 6.941).
1) Viết các phương trình dạng ion của phản ứng hòa tan Li1+yCoO2 trong hỗn hợp ban đầu và pahrn ứng diễn ra trong quá trình chuẩn độ.
2) Tính lượng Co(III) trong mẫu.
3) Tính số oxid hóa trung bình của cobalt trong vật liệu anode.
4) Tìm giá trị y trong công thức Li1+yCoO2
5) Xác định hàm lượng của tạp chất, ω(x)%.
|
Trong phản ứng oxid hóa 1-phenylbutane-2,3-diol bởi sodium periodate dư, acetaldehyde và phenylacetaldehyde được tạo thành. Các 1,2-diol khác và 1,2-dione bị oxid hóa bởi các periodate tương tự (phản ứng Malaprade). Trong điều kiện này, carboxylic, ester và các nhóm aldehyde không bị oxid hóa.
1) Một hỗn hợp glycerin và 1,2-propylene glycol (hỗn hợp A) được xử lí với sodium periodate. Xác định cấu tạo các hợp chất hữu cơ được tạo thành.
2) Một mẫu hỗn hợp A có khối lượng mA = 1.5 gram phản ứng với lượng dư periodate, sau đó các nhóm aldehyde được chuẩn độ với potassium permanganate trong môi trường acid, tiêu tốn nMn = 0.14 đương lượng mol của KMnO4 (1/5 KMnO4). Viết các phương trình phản ứng của potassium permanganate trong môi trường acid với các hợp chất tạo thành khi hỗn hợp được xử lí với sodium periodate. Xác định phần mol của hỗn hợp A.
3) Một mẫu hợp chất B chứa 1 nhóm amino (mB = 105 mg) được hòa tan vào nước, acid hóa rồi thêm lượng dư NaIO4. Sau khi phản ứng xảy ra hoàn toàn, thì có 1.0 · 10-3 mol nhóm carboxyl và 1.0 · 10-3 ammonium ion trong hỗn hợp, và 6.0 · 10-3 đương lượng mol của MnO4 đã được sử dụng cho chuẩn độ permanganate. Xác định các cấu trúc có thể có của B, biết nó không phải ether. Viết phản ứng oxid hóa bởi periodate của một trong các cấu trúc trên.
Bài 7 Một đột phá trong công nghệ chất siêu dẫn ở nhiệt độ cao (HTS) đã đến vào năm 1987 với sự khám phá ra hợp chất YBa2Cu3O7, trong đó đồng có các số oxide hoá khác thường (+2 và +3). Khi đun nóng, vật liệu này nhanh chóng bị mất một phần oxygen, tạo thành một hợp chất với thành phần biến đổi YBa2Cu3Ox. Số oxide hoá trung bình của đồng có thể viết ở dạng (2+p), trong đó p là phần điện tích bổ sung của mỗi nguyên tử đồng. Phương pháp chuẩn độ iodine có thể được sử dụng rất hiệu quả để xác định giá trị x trong HTS. Phương pháp này gồm hai thí nghiệm A và B. Trong thí nghiệm đầu tiên, hoà tan mẫu chất có khối lượng mA vào dung dịch perchloric acid 1 M. Ngay khi mẫu chất vừa bị hoà tan hết, thêm một lượng dư dung dịch KI vừa điều chế vào. Iodine tạo thành được chuẩn độ bởi VA mL dung dịch sodium thiosulfate có nồng độ cT (mol/L), từ đó tính được tổng lượng đồng. Trong thí nghiệm thứ hai, hoà tan mẫu chất có khối lượng mB vào dung dịch perchloric acid 1 M có chứa potassium iodide. Iodine sinh ra được chuẩn độ bởi VB mL sodium thiosulfate cT (mol/L).
1) Viết phương trình phản ứng giữa YBa2Cu3Ox và perchloric acid.
2) Viết phương trình phản ứng giữa đồng(II) và iodide.
3) Viết phương trình phản ứng giữa iodide và thiosulfate.
4) Viết phương trình phản ứng giữa YBa2Cu3Ox và perchloric acid khi có potassium iodide.
5) Đưa ra công thức tính giá trị p, sử dụng các kết quả chuẩn độ thứ nhất và thứ hai (A và B).
6) Thiết lập biểu thức tính giá trị x.
7) Xác định công thức của HTS nếu biết các giá trị: mA = 0.1134 gam, VA = 17.02 mL và mB = 0.1231 gam và VB = 22.17 mL.
|
Để xác định nồng độ của các chất oxid hóa mạnh, có thể sử dụng các chất sinh màu ở dạng không màu, ví dụ như 3,3',5,5'-tetramethylbenzidine (cation của nó được kí hiệu là A). Chất này bị oxid hóa theo phương trình: A - 2e → C + 2H+. Cation màu da cam C phản ứng nhanh với A dư, tạo thành cation màu xanh lục B, và cân bằng sau dược thiết lập: C + A → B + 2H+ (hằng số cân bằng K).
Bài 9
Trộn dung dịch CuSO4 với dung dịch K2C2O4 thu được tinh thể xanh dương. Công thức của tinh thể được xác định bởi thí nghiệm sau:
a) Cân 0.2073 gam mẫu, cho vào một bình nón rồi thêm 40 mL dung dịch H2SO4 2 mol L-1, đun nhẹ để hòa tan mẫu. Sau đó thêm vào 30 mL nước, đun tới khi gần sôi rồi chuẩn độ với dung dịch KMnO4 0.02054 mol L-1 thì hết 24.18 mL chất chuẩn.
b) Sau đó dung dịch được đun nóng cho tới khi dung dịch màu tím nhạt chuyển thành xanh dương. Sau đó, thêm 2 gam KI rắn và một lượng phù hợp Na2CO3 vào. Dung dịch chuyển thành màu nâu và xuất hiện kết tủa. Đem chuẩn độ dung dịch với Na2S2O3 0.04826 mol L-1, tới gần điểm cuối thì thêm chỉ thị hồ tinh bột vào, thì hết 12.96 mL chất chuẩn.
1) Viết phương trình phản ứng chuẩn độ (a).
2) Viết phương trình chuyển dung dịch từ màu tím sang màu xanh dương ở (b).
1) Viết phương trình tổng của phản ứng giữa A với K2S2O8, tạo thành B.
2)
a) Tính nồng độ persulfate ion trong hỗn hợp phản ứng đầu tiên có pH 6.5 (được duy trì ổn định bởi hệ đệm hiệu quả) và có chứa lượng dư A. Biết sau khi phản ứng diễn ra hoàn toàn, nồng độ B và C được xác định bằng phương pháp quang phổ là 2.0·10-4 M và 3.0·10-5 M.

b) Tính giá trị hằng số cân bằng. Nồng độ A ban đầu là cA = 5·10-4 M.
3) Dung dịch tạo thành ở phản ứng của A với persulfate ở ý 2 được điều chỉnh về pH 5.5 mà không làm thay đổi thể tích. Tính tỉ lệ nồng độ B/C. Giả sử rằng A và C chỉ phản ứng với nhau.
4) Lấy 5.0 mL dung dịch tạo thành ở ý 2 rồi đem hòa tan vào đó vài mg mẫu chất rắn D có chứa persulfate ion. Dung dịch tạo thành có màu của sản phẩm da cam C nhưng không phát hiện thấy sản phẩm màu xanh lục nào. Dự đoán về hàm lượng persulfate trong mẫu D.
3) Viết phương trình thể hiện ảnh hưởng của KI ở (b).
4) Xác định công thức tinh thể xanh dương.
|
Phản ứng của hợp chất vô cơ A với chất B trong sulfuric acid 0.5 M được ứng dụng trong phân tích chuẩn độ. Trong phép chuẩn độ mẫu B có khối lượng mB = 1.194 gam, đã dùng hết VA1 = 10.00 mL dung dịch A (cA1 = 20.0 gam/L). Biết rằng A và B là các muối potassium, B bị oxid hoá bởi H2O2 trong môi trường acid, tạo thành iodine tự do. Ngoài ra, dung dịch A cũng được sử dụng để xác định độ tinh khiết của một mẫu KBr (“tinh khiết hoá học”) theo quy trình sau. Hoà tan mẫu potassium bromide (mKBr = 9.566 gam) trong nước (tổng thể tích dung dịch là 1.000 L); lấy 10.00 mL mẫu, đem acid hoá rồi thêm một lượng dư dung dịch A vào. Bromine tạo thành được chuẩn độ với dung dịch chuẩn mercury(I) nitrate (cHg = 0.1000 mol/L, theo Hg(NO3)2) cho đến khi xuất hiện vẩn đục. Thể tích dung dịch chuẩn đã dùng là VHg = 4.80 mL. Hợp kim vanadium được sản xuất với lượng lớn tại nhà máy kim loại màu ở Chorukdaron (Tajikistan). Cần sử dụng một số phương pháp phân tích có độ nhạy cao để kiểm soát hàm lượng vanadium trong môi trường xung quanh nhà máy, ví dụ như các phương pháp xúc tác. Vanadate ion có thể xúc tác cho phản ứng giữa A và B ở pH 3.0, tức là trong điều kiện mà các chất này sẽ không thể phản ứng nếu không có xúc tác. Tính chất này được sử dụng để xác định nồng độ xúc tác, dựa vào tốc độ phản ứng giữa A và B, và sự giảm độ acid trong quá trình chuẩn độ.
1) Viết phương trình chuẩn độ bromine với muối mercury(I). Tính số mol bromine tạo thành trong quá trình chuẩn hoá dung dịch A.
2)
a) Xác định công thức của A và B. Viết các phương trình phản ứng sau: giữa KBr với A; giữa A với B; giữa H2O2 với B.
b) Tính hàm lượng KBr trong mẫu phân tích. Giả sử rằng toàn bộ bromide tồn tại ở dạng muối potassium.
3)
a) Viết các phản ứng chứng minh bản chất tác động xúc tác của vanadium(V) trong phản ứng giữa A và B.
b) Tính nồng độ B trong dung dịch (cB2) nếu chuẩn độ một mẫu VB2 = 10.00 mL khi có vanadate ở pH 3.0 cần VA2 = 15.0 mL dung dịch A 0.0100 M.
c) Trong phép phân tích một dung dịch chứa vanadium, cV1 = 0.1 mg/L, tốc độ phản ứng giữa A và B là w1 = 33 đơn vị (thí nghiệm
1). Trong phép phân tích dung dịch D chưa biết nồng độ, trong
cùng điều kiện, tốc độ đo được là w2 = 26 đơn vị (thí nghiệm 2). Tính nồng độ vanadium cv2 trong dung dịch D.
|
1) Chuẩn độ một dung dịch iodine (5.00 mL dung dịch I2 0.0200 M, chứa potassium iodide dư) với dung dịch sodium thiosulfate 0.0100 M (dung dịch A). Viết phương trình phản ứng. Tính thể tích dung dịch A cần dùng để đạt tới điểm cuối chuẩn độ.
2) Lấy 10.00 mL mẫu dung dịch A đem chuẩn độ với dung dịch potassium permanganate 0.0800 M trong môi trường kiềm. Trong phản ứng này, có 10.00 mL dung dịch chuẩn đã được sử dụng. Viết phương trình phản ứng.
3) Lấy 10.00 mL mẫu của dung dịch hỗn hợp sodium sulfite và sodium thiosulfate (dung dịch B) đem chuẩn độ với dung dịch iodine 0.0200 M, thì cần dùng 20.00 mL dung dịch chuẩn. Viết phương trình phản ứng của sulfite ion trong quá trình chuẩn độ này.
4) Lấy 10.00 mL dung dịch B đem chuẩn độ với dung dịch potassium permanganate 0.0800 M trong môi trường kiềm thì cần dùng 21.25 mL dung dịch chuẩn. Vết phương trình phản ứng của sulfite với permangate. Tính nồng độ mol của mỗi ion sulfite và thiosulfate trong dung dịch B, dựa vào dữ kiện chuẩn độ với iodine và permanganate.
Bài 12
Khi chiên hoặc bảo quản lâu, chất béo sẽ tích tụ các sản phẩm oxid hoá. Sự oxid hoá các chất béo được nghiên cứu bằng cách đun nóng chúng khi có mặt oxygen. Một chất béo nguồn gốc thực vật đã được tiến hành các xử lí khác nhau.
1) Triglyceride ban đầu (88 mg) được hoà tan vào dung môi phù hợp, acetic acid và 0.5 mL dung dịch hydrogen peroxide 5.0 M được thêm vào (trong trường hợp này, peracetic acid đã được tổng hợp, chuyển liên kết đôi thành epoxide). Lượng dư peroxide còn lại sau phản ứng phản ứng với KI giải phóng iodine. Lượng iodine này tương đương với 8.8 mL dung dịch thiosulfate 0.5 M. Giả sử quá trình epoxide hoá diễn ra hoàn toàn, hãy ước tính số liên kết đôi trong mẫu. Viết các phương trình phản ứng cần thiết và cấu trúc chất béo ban đầu, biết tất cả các gốc acid béo đều giống nhau.
2) Một lượng mẫu chất béo khác nặng 10 gram được đun nóng lâu trong không khí ở 50oC. Kết quả là các hydroperoxide chứa các mảnh C-OO-H đã được tạo thành. Thêm lượng dư KI vào chất béo và lượng iodine giải phóng được chuẩn độ với 2.2 mL dung dịch thiosulfate 0.100 M. Vẽ cấu trúc một trong các monohydroperoxide (nếu chỉ 1 trong các gốc acid béo phản ứng) và viết phương trình phản ứng tạo thành nó và phản ứng của nó với KI trong môi trường acid. Tính chỉ số peroxide của chất béo (PN, mmol O2 bị hấp thụ trên mỗi kg chất béo.)
3) a) 88 mg chất béo trên (nếu bạn không xác định được cấu trúc chất béo ở ý 1 thì hãy lấy khối lượng mol của nó bằng 700 gram/mol) được nhũ hoá trong dung dịch chất hoạt động bề mặt và oxid hoá với permanganate trong môi trường acid, đun nóng, thì cần 0.48 mmol KMnO4. Phân tử chất béo mất bao nhiêu electron trong phản ứng này? Viết công thức các sản phẩm tạo thành khi xử lí chất béo với KMnO4.
b) Quy trình tương tự được thực hiện với 88 mg chất béo chứa các hydroperoxide thì cần 0.54 mmol KMnO4. Viết phương trình phản ứng sản phẩm thoái hoá nhiệt với permanganate biết nhóm peroxy bị chuyển thành nhóm keto. Tính số nhóm hydroperoxide trên mỗi phân tử chất béo.
|
Để xác định nồng độ các anion chứa sulfur trong một mẫu lấy từ một con suối chứa bị nhiễm sulfur, thì xử lí một đơn vị mẫu (20 mL) này với 0.2 mL dung dịch NaOH 6 M, sau đó thêm vào tiếp 0.2 mL zinc acetate 1 M. Kết tủa tạo thành được lọc tách rồi chuyển vào bình Erlenmeyer. Dịch lọc A được giữ lại cho các phân tích tiếp sau.
1) Viết phương trình phản ứng tạo kết tủa.
Sau đó rửa kết tủa với nước và thêm tiếp 1 mL HCl 6 M và 10.00 mL dung dịch iodine (dung dịch I) vào, rồi chuẩn độ dung dịch tạo thành với dung dịch sodium thiosulfate (chất chuẩn II, ~ 0.025 M) cho đến khi dung dịch có màu vàng rơm. Lúc này, thêm hồ tinh bột vào hỗn hợp và tiếp tục chuẩn độ cho đến khi màu xanh dương biến mất. Thể tích chất chuẩn đã dùng là 15.77 mL.
2) Viết phương trình của hai phản ứng diễn ra trong phân tích này. Để chuẩn hóa chất chuẩn II, lấy một đơn vị mẫu (10 mL) đem xử lí với KI dư, rồi acid hóa dung dịch thu được và tiến hành chuẩn độ với chất chuẩn III tạo thành bằng cách hòa tan 2.675 gam potassium iodate khan vào 1 L nước. Thể tích chất chuẩn III đã dùng là 3.42 mL.
3) Viết phương trình thu gọn của phản ứng diễn ra trong chuẩn độ thiosulfate bởi iodate.
Tiếp theo, lấy một đơn vị mẫu (10 mL) dung dịch iodine I đem chuẩn độ với chất chuẩn II cho đến khi màu xanh dương của chỉ thị tinh bột biến mất. Thể tích chất chuẩn đã dùng là 19.75 mL.
4) Tính nồng độ iodate, thiosulfate và iodine (theo mol/L); xác định số mol ZnS đã phản ứng cũng như hàm lượng của sulfide ion trong mẫu (theo mg/L).
5) Xử lí dịch lọc A với 10 mL KI 1 M và hồ tinh bột. Sau đó dung dịch này được acid hóa và chuẩn độ với dung dịch chuẩn potassium iodate 0.1250 M cho đến khi thu được màu xanh dương bền. Thể tích chất chuẩn iodate đã dùng trong quá trình này là 2.05 mL. Viết phương trình thu gọn của phản ứng diễn ra giữa sulfite và iodate ion, và tính nồng độ sulfite ion trong mẫu theo gam/L.
6) Nồng độ của sulfite nhận được ở phần trước có sai số dương do sự có mặt của thiosulfate ion trong mẫu. Để xác định nồng độ chính xác
của sulfite ion trong mẫu, xử lí dịch lọc A mới với lượng dư formaldehyde. Viết phương trình phản ứng diễn ra trong quá trình này. Dung dịch tạo thành được chuẩn độ với I2 0.0104 M. Xác định nồng độ chính xác của sulfite ion trong mẫu (theo gam/L), biết rằng quá trình chuẩn độ đã sử dụng 2.54 mL dung dịch iodine.
|
Một số nhà hoá học trẻ đã nghiên cứu phản ứng oxide hoá potassium iodide với dung dịch permanganate tương ứng dưới các điều kiện phản ứng khác nhau. Mỗi người cân lấy 0.10 gam KI và bắt đầu tiến hành các thí nghiệm. Người đầu tiên cần 2.4 mL dung dịch KMnO4 để chuẩn độ, trong khi người thứ hai cần 24 mL, còn người thứ ba là 96 mL (!). Biết rằng người thứ ba thực hiện chuẩn độ khi có một lượng dư barium sulfate.
1) Viết các phương trình phản ứng chuẩn độ.
2) Tính nồng độ các dung dịch permanganate đã dùng.
3) Khi chuẩn độ iodide với permanganate, thu được iodine thì rất khó để quan sát thấy điểm cuối, do cả iodine và chất chuẩn đều có màu. Vì nguyên nhân này nên quá trình chuẩn độ thường được tiến hành trong bình đá, trong môi trường HCl 4 -5M sau khi thêm vào vài mL CCl4 và lắc hỗn hợp phản ứng. Đầu tiên, lớp dung môi hữu cơ bị tạo màu bởi iodine, và khi đạt tới điểm cuối thì nó hầu như không có màu. Tính tỉ lệ mol chất chuẩn/iodine trong trường hợp này và viết các phương trình phản ứng, nếu biết đã dùng 9.6 mL permanganate 0.025 M để chuẩn độ 0.10 gam KI.
4) Lấy dung dịch KMnO4 0.050 M chứa Fe(III) 0.002 M và Cu(II) 0.003 M. Những loại phản ứng nào có thể xảy ra trong quá trình chuẩn độ iodide thành iodine với dung dịch này trong môi trường acid (điểm cuối được quan sát bởi phương pháp điện hoá)? Cac phản ứng phụ này có gây nhiễu đến việc xác định chính xác nồng độ permanganate không? Nếu có thì giá trị này đã bị tính cao hơn hay thấp đi?
Bài 15
Quy trình định lượng kim loại A được thực hiện như sau. Thêm một lượng dư potassium iodide vào dung dịch cần phân tích, tạo thành một kết tủa. Hoà tan kết tủa này vào KI dư, rồi kiềm hoá dung dịch và thêm formaldehyde 40 % vào, sau đó lắc bình phản ứng trong 3 phút. Sau khi huyền phù đen được tạo thành, các formate ion đã được phát hiện trong dung dịch. Acid hoá huyền phù bởi acetic acid rồi trộn lẫn với 5.00 mL dung dịch I2 0.0998 M trong KI dư, sau đó đem chuẩn độ iodine chưa phản ứng với dung dịch thiosulfate 0.0500 M. Thể tích thiosulfate cần dùng là 8.70 mL. Quy trình phân tích này cho phép tính được khối lượng kim loại A trong mẫu là mA = 56.5 mg.
1) Xác định kim loại A. Viết các phương trình phản ứng đã xảy ra trong quy trình phân tích.
2) Trong một dung dịch có tính acid, arsenate oxide hoá iodide thành iodine theo phản ứng sau:
AsO4 3- + 2I + 2H+ → AsO3 3- + I2 + H2O Khi có một lượng dư chloride của kim loại A trong dung dịch acid thì arsenite có thể được chuẩn độ bởi iodine. Khả năng này dựa vào cơ sở nào? Viết phương trình phản ứng của iodine với chloride A và phản ứng chuẩn độ arsenite bởi iodine trong acid khi có chloride A.
3) Chọn ra một chất chỉ thị cho quá trình chuẩn độ arsenite bởi iodine khi có chloride A trong số các hợp chất sau: diphenylamine (tạo sản phẩm màu xanh-tím khi phản ứng với các chất oxide hoá mạnh); tinh bột (tạo phức màu xanh dương với iodine); sodium sulfide (tạo hợp chất có màu với ion của A); ammonium molybdate (tạo hợp chất đa dị tố với arsenite).
4) Một cách khác để định lượng A là dựa vào phản ứng khử muối A thành kim loại bằng arsenite trong môi trường kiềm, sau đó chuẩn độ lượng arsenite dư với iodine. Trong chuẩn độ này, cần dùng 7.80 mL dung dịch I2 0.0998 M. Tính lượng arsenite đã chuẩn độ (vAs, mol) và muối A (va, mol) nếu 10.00 mL dung dịch arsenite 0.2020 M được thêm vào để khử A. Viết các phương trình phản ứng.
|
Có nhiều phương pháp để chuẩn độ xác định hàm lượng iodide ion trong dung dịch. Trong trường hợp hàm lượng iodide thấp, có thể sử dụng phương pháp khuếch đại. Oxid hoá (phản ứng 1) các iodide ion trong dung dịch mẫu với bromine dư trong môi trường trung tính hoặc acid yếu, tạo thành các hợp chất iodine(V). Đun sôi để loại bromine dư, sau đó thêm lượng dư potassium iodide vào. Iodine tạo thành (phản ứng 2) được chiết hoàn toàn vào CCl4. Sau quá trình tách phase nước, iodine được chuyển từ phase hữu cơ về nước bằng phản ứng với hydrazine (phản ứng 3). Cũng như trường hợp đầu tiên, dung dịch thu được chứa iodide ion được xử lí với bromine để chuyển các iodide ion thành hợp chất iodine(V).
Lượng bromine dư được loại bỏ bằng cách đun sôi, sau đó acid hoá dung dịch, rồi thêm KI dư vào và chuẩn độ dung dịch tạo thành bằng dung dịch chuẩn sodium thiosulfate (phản ứng 4), chất chỉ thị là hồ tinh bột.
1) Viết các phương trình phản ứng 1 - 4.
2) Phản ứng của iodine(V) với iodide diễn ra trong điều kiện acid hay base?
3) Tính nồng độ mol của iodide trong 10.00 mL dung dịch chưa biết, nếu giai đoạn cuối của phép phân tích sử dụng 12.56 mL dung dịch sodium thiosulfate 0.0948 M.
4) Một phương pháp khác để xác định iodide là chuẩn độ với dung dịch AgNO3 khi có mặt chỉ thị eosin. Viết phương trình phản ứng. Tính thể tích dung dịch silver nitrare 0.0948 M cần để chuẩn độ mẫu ở ý 3.
5) Xác định sai số tương đối của phép xác định nồng độ iodide trong cả hai trường hợp, nếu burette được sử dụng với thang chia 0.01 mL.
6) Một trợ lí phòng thí nghiệm thiếu kinh nghiệm đang tiến hành phép phân tích theo phương pháp khuếch đại được mô tả sau đây. Anh ta mắc lỗi khi xác định được nồng độ iodide trong dung dịch đầu là c1 = 2.21 · 10-2 M, trong khi giá trị thực là c0 = 5.70 · 10-2 M. Anh ta quyết định thay đổi quy trình: chiết bromine bằng carbon tetrachloride thay vì đun sôi dung dịch. Phần chiết có màu tím, nhưng anh ta không chú ý vào điều này mà vẫn tiếp tục phân tích và thu được kết quả c2 = 2.04 · 10-2 M. Viết phương trình phản ứng diễn ra trong quá trình phân tích dẫn tới kết quả bị ước tính thấp hơn. Viết phương trình của các phản ứng dẫn tới c1 > c2.
Bài 17 Các hợp chất I - IV có thành phần định tính giống nhau. Hoà tan các mẫu này, với khối lượng giống nhau, vào nước. Chất I tạo thành một dung dịch không màu, trong khi II, III, IV tạo thành các dung dịch màu nâu. Thêm dung dịch sodium thiosulfate 0.05 M vào các dung dịch II, III, IV tạo thành các dung dịch không màu. Nếu thêm một lượng dư hydrogen peroxide vào các dung dịch II, III, IV thì màu chuyển trở lại (trong trường hợp dung dịch I cũng vậy), nhưng thể tích của sodium thiosulfate cần để làm mất màu các dung dịch thu được thì bị thay đổi. Các dữ kiện được cho trong bảng sau:
Chất V(Na2S2O3) (1), mL V(Na2S2O3) (2), mL I 0 7.7 II 7.8 11.7 III 9.4 12.5 IV 10.4 13.0
1. Viết phương trình của các phản ứng trên.
2. Xác định thành phần các chất I - IV.
Tính khối lượng các mẫu chất.
Vẽ công thức cấu tạo các anion II - IV.
|
Ascorbic acid (AA) là một vitamin và chất chống oxide hoá quan trọng. Hàm lượng của nó trong các loại dược phẩm được xác định bằng cách chuẩn độ với potassium iodate trong môi trường HCl 0.5 M, có mặt hồ tinh bột. Quá trình này tạo ra dehydroascorbic acid C6H6O6 (DHA) và iodide ion.
1) Viết các phương trình của quá trình chuẩn độ và phản ứng tạo ra iodine làm chỉ thị đổi màu. Tính số mol AA trong mẫu, biết 9.5 mL dung dịch KClO3 0.100 M đã được dùng để chuẩn độ.
DHA bị chuyển hoá chậm thành xylosone C5H8O5 khi cộng hợp một phân tử nước rồi decarboxylate hoá. Xylosone nhanh chóng (nhanh hơn nhiều so với giai đoạn trước) bị khử bởi phân tử AA thứ hai, tạo thành xylose C5H10O5 và một phân tử DHA khác. Sau đó, xylose vòng hoá chậm, tạo ra furfural C5H4O2.

Sau khi bắt đầu tiến hành chuẩn độ AA (tổng lượng: 1.00 mmol) với iodate như đã mô tả trong ý 1, nhà phân tích rời khỏi phòng thí nghiệm và khi quay trở lại, anh ta thấy không còn ascorbic acid trong dung dịch. Đồng thời lại thấy có xylose và furfural trong dung dịch với tổng lượng 0.55 mol.
2) Viết phương trình phản ứng (ở dạng công thức phân tử) của các chuyển hoá DHA và xylosone trong quá trình lưu giữ dung dịch.
3) Tính thể tích dung dịch iodate 0.100 M mà nhà phân tích đã dùng trước khi rời phòng thí nghiệm.
4) Sau khi nhà phân tích quay trở lại thì trong dung dịch có những thành phần hữu cơ nào, ngoài xylose và furfural, và với lượng chất bao nhiêu, nếu hệ đã đạt cân bằng?
5) Phản ứng phụ nào, ngoài quá trình đã mô tả ở trên, cũng làm giảm nồng độ AA trong dung dịch trong quá trình lưu giữ?
Nếu quá trình chuẩn độ AA bằng iodate được thực hiện trong môi trường HCl 5 M thì iodate cũng sẽ bị khử thành iodide, nhưng sẽ cần dùng 7.00 mL dung dịch iodate 0.100 M cho 0.300 mol AA.
6) Dưới những điều kiện này thì sản phẩm của phản ứng oxide hoá AA là gì? Viết phương trình phản ứng chuẩn độ và xác định cấu trúc của sản phẩm biết rằng không có sản phẩm chứa carbon nào khác được tạo thành trong phản ứng.
|
Phương pháp chuẩn độ iodide và chuẩn độ với methyl da cam (MO) được sử dụng để xác định hàm lượng chlorine hoạt động trong nước. Trong trường hợp đầu tiên, chuyển 0.5 gam KI vào 100 mL nước cần phân tích, hệ được giữ ở pH 4.5 bởi đệm acetate, rồi chuẩn độ iodine giải phóng bằng dung dịch Na2S2O3 0.005 M. Khi chuẩn độ với MO thì nhỏ 2 - 3 giọt HCl 5 M vào 100 mL nước cần phân tích, rồi chuẩn độ với dung dịch MO 0.005 % - bị mất màu trong điều kiện này. Điểm cuối của chuẩn độ tương ứng với sự xuất hiện màu hồng.
c) Thiết lập công thức tính hàm lượng (theo mg/L) chloramine chlorine theo thể tích Na2S2O3 và MO dùng để chuẩn độ hai mẫu, mỗi mẫu đều chứa 100 mL nước cần phân tích.
1) Trình bày sơ đồ điều chế methyl da cam từ N,N-dimethylaniline, sulfanylic acid và các tác nhân vô cơ.
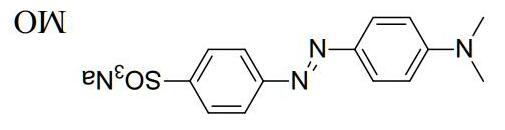
2) Tại sao chuẩn độ iodine phải tiến hành ở pH 4.5 nhưng không phải trong môi trường có tính acid cao hơn hoặc có tính kiềm? Viết phương trình của các phản ứng phụ có thể xảy ra.
3) Viết phương trình các phản ứng xảy ra trong phép chuẩn độ chlorine theo hai phương pháp mô tả. Chú ý rằng cần 0.5 mL dung dịch thiosulfate hoặc 4.61 mL dung dịch methyl da cam để chuẩn độ 100 mL mẫu nước chứa 1 mg/L chlorine hòa tan, và nitrogen phân tử là một trong các sản phẩm của phản ứng giữa MO với chlorine.
4) Một trong hai phương pháp được dùng để xác định lượng chlorine hoạt động tự do (tổng các dạng Cl2, HClO và ClO được tạo ra từ chlorine) và một đại lượng khác - chlorine hoạt động tổng (chlorine tự do + "chloramine" [dẫn xuất chlorine của ammonia]).
a) Phương pháp nào ở trên (chuẩn độ iodine hay MO) được dùng để xác định chlorine tự do và chlorine tổng? Biết rằng thế điện cực chuẩn của cặp "MO - sản phẩm oxid hóa của nó" lớn hơn cặp I2/2I .
b) Dạng chloramine chlorine nào có thể tồn tại trong hệ? Viết phương trình phản ứng tạo thành chúng từ quá trình chlorine hóa nguồn nước thô ban đầu.
1) Trong phương pháp chuẩn độ người ta thường dùng ống chuẩn là một ống thủy tinh hoặc bình kín nhỏ có chứa một lượng chính xác chất chuẩn. Để chuẩn độ đường khử bằng iodine trong môi trường kiềm theo phương trình tổng: RCHO + I2 + 3OH → RCOO + 2I + 2H2O Một ống dung dịch iodine chuẩn nhưng hết hạn đã được sử dụng. Chuẩn độ 10.00 mL dung dịch glucose 0.0216 M dùng hết 10.1 mL dung dịch iodine 0.0250 M. Trong khi đó, chuẩn độ cùng một thể tích dung dịch glucose này bằng dung dịch iodine mới chuẩn bị có nồng độ tương đương thì hết 8.60 mL. Hãy giải thích sự khác biệt này và viết phương trình phản ứng.
2) Khi có mặt cyanide và chất oxid hóa, iodine hoặc iodide tạo thành iodcyan một cách định lượng.
a) Viết phương trình phản ứng tạo thành iodcyan từ iodine và từ iodide trong sự có mặt của iodate.
b) Chất oxid hóa dùng để điều chế iodcyan có hể là ion nitrite. Viết phương trình phản ứng tạo thành iodcyan từ iodide trong môi trường acid với sự có mặt của ion nitrite.
c) Trong chuẩn độ chất khử bằng dung dịch iod nếu có dù chỉ là vết nitrite thì kết quả sẽ bị giảm. Hãy đề nghị cơ chế xúc tác của nitrite.
d) Đề nghị một phương pháp không dùng hóa chất để đuổi nitrite trong dung dịch acid loãng.
3) Sự tạo thành iodcyan có thể được dùng để xác định chọn lọc ion iodide trong sự có mặt của các chất khử khác. Dung dịch chứa iodide và iron(II) được acid hóa và thêm vào một lượng dư potassium cyanide trong khi lắc đều. Lấy mẫu dung dịch có thể tích Vo mL đem chuẩn độ bằng dung dịch KMnO4 có nồng độ cMn đến khi xuất hiện màu. Dung dịch sau chuẩn độ đem trung hòa và thêm vào một lượng dư KI, sau đó chuẩn độ lượng iodine sinh ra bằng dung dịch thiosulfate (cS) hết VS mL. Viết các phương trình phản ứng. Viết công thức tính lượng iodide nI và sắt nFe (mol) trong dung dịch ban đầu.
Bài 21
Chuẩn độ Winkler là một trong những phương pháp để phân tích định lượng oxygen trong nước. Theo phương pháp này, manganese sulfate được thêm vào một đơn vị mẫu nước cần phân tích (đã được kiềm hóa) rồi để phản ứng xảy ra trong một chu kì thời gian. Sau đó, mẫu được acid hóa bỏi dung dịch sulfuric acid, sau đó thêm potassium iodide vào. Tiếp theo, chuẩn độ iodine bằng dung dịch chuẩn sodium thiosulfate.
1) Viết tất cả các phương trình liên quan trong phương pháp này.
2) Phương pháp được mô tả ở trên đã được áp dụng với một đơn vị mẫu (0.500 L) nước, và thể tích dung dịch sodium thiosulfate 0.0423 M đã dùng là 8.42 mL. Xác định hàm lượng oxygen trong mẫu theo mg/L.
Kết quả của chuẩn độ Winkler có thể bị ảnh hưởng bởi các hợp chất có tính oxid hóa - khử mạnh. Cụ thể, các nitrite ion có trong mẫu nước có thể oxid hóa iodide ion, dẫn tới sai số dương trong phép phân tích (các kết quả vượt quá thực tế). Nhiễu loạn này có thể được giảm thiểu bằng cách thêm vào sodium azide, urea hoặc sulphamic acid NH3 +SO3 .
3) Viết phương trình phản ứng diễn ra giữa nitrite ion với các hợp chất này trong môi trường acid yếu (giả sử rằng tất cả các phản ứng đều không tạo thành bất kì nitrogen oxide nào).
4) Trong một kiểm định Winkler, một mẫu nước được xử lí trước với lượng dư sodium azide, dẫn tới kết quả cuối cùng không chính xác. Viết phương trình phản ứng gây ra lỗi này (chú ý rằng một trong các sản phẩm là nitrogen phân tử) và xác định sai số là âm hay dương.
5) Cả muối Fe(II) lẫn Fe(III) đều thuộc về nhóm các chất gây nhiễu loạn với phương pháp Winkler.
a) Lấy một mẫu chứa 30 mg/L Fe(III) để phân tích. Nồng độ oxygen được xác định bởi chuẩn độ Winkler cao hơn 1.3 mg/L so với nồng độ thực tế của oxygen. Điều này có thể được giải thích bởi một phản ứng chậm diễn ra giữa Fe(III) và iodide ion trong môi trường acid. Viết phương trình phản ứng.
b) Fe(II) cũng gây ra nhiễu loạn. Hãy viết phương trình phản ứng gây ra sự nhiễu loạn này. Sai số là âm hay dương?
|
c) Một mẫu nước chứa 15 mg/L Fe(II) và 15 mg/L Fe(III). Tính hàm lượng oxygen được xác định bởi chuẩn độ Winkler nếu biết nồng độ thực tế của oxygen là 9.0 mg/L. Quá trình phân tích được tiến hành với những điều kiện giống như trong phần 5a và 5b.
Bài 22 Phẩm crom xanh thu được bằng cách trộn chì(II) cromat với sắt(III) hexacyanoferrat(II). Một phương pháp chuẩn độ của phân tích crom xanh tuân theo các bước sau: một khối lượng phẩm được cân chính xác được xử lý với dung dịch natri cacbonat trong khi đun nóng, sau đó đem lọc.
d) Thêm một lượng NaF vào một đơn vị mẫu giống như ở ý 5c, để nồng độ NaF là 0.005 M. Xác định dấu của sai số trong phép phân tích định lượng oxygen. Chú ý rằng Fe(OH)3 phản ứng với F nhanh hơn đáng kể so với I . Viết các phương trình phản ứng giải thích sai số này. 101 |
1. Viết các phương trình phản ứng xảy ra khi xử lý phẩm xanh crom với cacbonat? Chất gì đi qua phễu lọc?
2. Để xác định cromat, phương pháp chuẩn độ iot được sử dụng. Một lượng dư KI được thêm vào dung dịch đã axit hóa, sau đó iot thoát ra sẽ được chuẩn độ bởi dung dịch Na2S2O3 chuẩn với chỉ thị hồ tinh bột. Viết các phương trình phản ứng xảy ra khi cromat được xác định bởi phương pháp này. Tại sao không chuẩn độ trực tiếp đicromat bằng dung dịch thiosulfat?
Dung dịch Na2S2O3 phải được chuẩn lại trước khi sử dụng làm chất chuẩn độ. Quá trình chuẩn lại được sử dụng bởi dung dịch K2Cr2O7 chuẩn theo cách giống với đã mô tả với việc xác định cromat. Nếu lượng axit của dung dịch dư một lượng đủ lớn 0,4M phản ứng giữa đicromat và ion iodua bị ảnh hưởng bởi quá trình oxi hóa ion iodua bằng oxi trong không khí.
3. Hãy đề xuất sơ đồ cho quá trình ảnh hưởng này? Nó sẽ ảnh hưởng đến kết quả của việc xác định thiosulfat như thế nào?
4. Lấy 10 ml dung dịch nước lọc trong mẫu dung dịch crom xanh trong tổng cộng 50ml đem xác định bởi phương pháp chuẩn độ iot mô tả ở trên thì sử dụng hết 5,01 ml dung dịch Na2S2O3 0,0485M. Tính khối lượng chì cromat trong mẫu ban đầu?
5. Một phản ứng của crom(VI) với [Fe(CN)6]4- có thể xảy ra khi thêm axit. Ước lượng nếu có sai số phân tích có nguyên nhân từ phản ứng này?
6. Lấy 5 ml dung dịch nước lọc trong mẫu dung dịch crom xanh trong tổng cộng 50 ml đem trộn với 10,00 ml dung dịch K4Fe(CN)6 0,0300M, axit hóa dung dịch bằng H2SO4 đến khi [H+] ≈ 1M và chuẩn độ bằng KMnO4 0,00500M tốn hết 2,85 ml. Phản ứng nào xảy ra khi axit hóa mẫu? Viết phương trình phản ứng chuẩn độ với pemanganat?
7. Tính lượng Prussian blue (Fe4[Fe(CN)6]3) theo mg trong mẫu ban đầu?
100 |
Sắt là một trong những nguyên tố hết sức cần thiết cho cơ thể. Thiếu sắt gây nên bệnh thiếu máu và bệnh này có thể chữa được bằng việc bổ sung thêm Fe(II). Hiệu quả chữa bệnh của các hợp chất Fe(III) ít được nhắc đến hơn.
Fe(II) là một chất khử khá mạnh, nó có thể bị oxi hóa lên Fe(III). Do đó rất cần những phương pháp xác định hàm lượng Fe(II), Fe(III) riêng rẽ cũng như hàm lượng sắt tổng nhằm kiểm soát tốt việc mua bán và sử dụng thuốc. Sau đây chúng ta sẽ xem xét cách giải quyết vấn đề này.
1. Trước khi định lượng hàm lượng sắt tổng, ta chuyển toàn bộ về dạng Fe(II) hoặc Fe(III). Dựa vào các giá trị thế oxi hóa khử chuẩn cho dưới đây, hãy cho biết trong số các chất đã cho, chất nào có thể oxi hóa Fe(II) lên Fe(III) trong điều kiện chuẩn. Viết các phương trình ion (đã cân bằng) tương ứng.
Dạng oxi hóa Dạng khử Eo, V Fe3+ Fe2+ +0,77
HNO3 NO (+H2O) +0,96 H2O2 (+H+) H2O +1,77 I2 I +0,54 Br2 Br +1,09
2. Sau khi oxi hóa tất cả các ion lên Fe(III), hàm lượng tổng được xác định bằng cách kết tủa và tách các ion dưới dạng Fe(OH)3, sau đó đem nung kết tủa được Fe2O3 rồi cân.
a) Xác định pH của dung dịch FeCl3 0,010 M trong nước. Giả sử cation 3 26Fe(OH) + là axit một nấc với hằng số điện li Ka=6,3.10-3
b) Tính giá trị pH tại đó Fe(OH)3 bắt đầu bị kết tủa từ dung dịch trên. Cho tích số tan của Fe(OH)3 là Ksp=6,3.10-38 .
c) Tính giá trị pH để Fe(OH)3 bị kết tủa hoàn toàn từ 100,0 mL dung dịch FeCl3 0,010 M. Biết rằng quá trình kết tủa dung dịch được coi là hoàn toàn nếu hàm lượng Fe còn trong dung dịch không quá 0,2 mg.
Chú ý: Các giá trị pH được tính đến độ chính xác 0,1. Bỏ qua hiệu ứng lực ion.
3. Có thể định lượng Fe(II) trong sự có mặt của Fe(III) bằng cách đem chuẩn độ với dung dịch KMnO4 trong môi trường axit. Do dung dịch KMnO4 bị phân hủy chậm theo thời gian nên cần xác định lại chính xác nồng độ của nó ngay trước khi dùng để chuẩn độ Fe(II). Dùng KMnO4 làm thuốc thử, tiến hành chuẩn độ một dung dịch chuẩn sơ cấp, một chất tinh khiết đã biết thành phần. Có thể tạo ra những dung dịch chuẩn như thế bằng cách hòa tan một lượng chính xác chất chuẩn vào nước trong một bình định mức đã biết chính xác thể tích.
Dung dịch A chứa 0,2483 g As2O3 hòa tan trong 100,0 mL nước. Để chuẩn độ 10,00 mL dung dịch này cần dùng 12,79 mL dung dịch KMnO4. Dung dịch B chứa 2,505 g Fe trong 1 lít nước. Chuẩn độ 15,00 mL dung dịch B cần dùng 11,80 mL dung dịch KMnO4 nói trên. Xác định tỉ lệ sắt tồn tại ở dạng Fe(II)trong dung dịch.
4. Thêm axit tactaric vào dung dịch có chứa Fe(II) và Fe(III). Sau khi trung hòa dung dịch này bằng dung dịch NH3, thêm vào một lượng dư KCN. Điện cực Pt nhúng trong dung dịch này có thế +0,132 V so với điện cực Calomen bão hòa.
a) Giả sử toàn bộ ion sắt trong dung dịch cuối cùng đều ở dạng n 6Fe(CN) , tính tỉ lệ Fe(II) trong mẫu ban đầu. Cho thế oxi hóa khử tiêu chuẩn của 34 66 Fe(CN)/Fe(CN) bằng + 0,364 V, thế của điện cực Calomen bão hòa bằng +0,241 V, nhiệt độ tiến hành thí nghiệm là 25 oC.
b) Việc thêm axit tactaric và dung dịch NH3 đã giúp ngăn chặn những phản ứng nào xảy ra? Viết các phương trình phản ứng dưới dạng phương trình ion thu gọn.
Bài 24
Giá trị Eo cho các bán phản ứng của các ion sắt và ion xeri (Ce) như sau:
Fe3+ + e → Fe2+ Eo = +0,77V
Ce4+ + e → Ce3+ Eo = +1,61V Hai chất chỉ thị sau được dùng để xác định điểm tương đương trong các phép chuẩn độ oxy hóa – khử:
Di-bolane (Dip): Inox + 2e → Inkh ; Eodip = +0,76V (Tím) (Không màu) p-nitro-di-bolane(pn): Inox + 2e → Inkh ; Eodip = +1,01V (Tím) (Không màu)
Cả hai chất chỉ thị trên đều đổi màu khi tỉ lệ nồng độ [Inox]/[Inkh] = 10. Bằng tính toán, cho biết chất chỉ thị nào ở trên thích hợp cho phép chuẩn độ Fe3+ bằng Ce4+ .
Bài 25
Trộn hai thể tích bằng nhau của hai dung dịch NaNO2 0,1M và I2 5.10-4M tạo thành dung dịch A.
a) Sau đó thêm hết 1 mL dung dịch NaOH 0,02M cùng một vài giọt hồ tinh bột (coi thể tích hồ tinh bột thêm vào không đáng kể) vào 1 mL dung dịch A thì hồ tinh bột có màu không? Giải thích trên cơ sở tính toán cụ thể.
b) Nếu thêm tiếp 2 mL dung dịch HCl 0,1M vào dung dịch thu được ở a) thì có biến đổi gì nữa không? Giải thích trên cơ sở tính toán cụ thể. Cho biết Eo (I2/2I ) = 0,536V ; Eo (NO3 /NO2 , OH ) = 0,01V ; Eo (NO2 /NO, H+) = 0,99V, Ka(HNO2) = 5,1.10-4
105 |
Chuyên đề 32: Pin điện - Sự điện phân
Bài 1
1) Trong ammonia lỏng thì Eo(Na+/Na) = -1.89 V, Eo(Mg2+/Mg) = -1.74 V. Tuy nhiên, phản ứng thế Na bởi Mg có thể xảy ra: Mg + 2NaI → MgI2 + 2Na. Giải thích nguyên nhân.
2) Cho Pb vào dung dịch sodium amide thu được kết tủa trắng Na4Pb, chất này sau đó chuyển thành Na4Pb9 (xanh lục) rồi tan. Nhúng 2 điện cực chì vào dung dịch này rồi dẫn dòng điện đi qua. Sau khi có 1 mol electron đi qua tế bào điện hóa thì trên điện cực nào có chì kết tủa bám vào? Tính số mol chì bám vào điện cực.
Bài 2
Giá trị tích số tan (Ksol) của PbC2O4 ở 25 oC là 8,50*10-10 và thế khử chuẩn của cặp Pb2+/Pb là Eo 1 = -0,126 V.
a) Xác định thế khử chuẩn Eo 2 của bán phản ứng: PbC2O4 (r) + 2e → Pb (r) + C2O4 2- (aq)
b) Xác định nồng độ của ion Pb2+ trong dung dịch Na2C2O4 0,0250 M chứa PbC2O4 bão hòa.
c) Tính thế khử của cặp PbC2O4/Pb ở câu trước bằng hai phương pháp.
|
Thế của điện cực bạc nhúng trong AgNO3 0,0100 mol/L đo được là E1. Sau đó cho khí NH3 vào dung dịch (10,0 mL dung dịch chứa 0,0170 g NH3). Thế điện cực bạc bây giờ nhỏ hơn E1 là 0,285 V. Nhiệt độ dung dịch là 25oC. Tính hằng số bền của phức [Ag(NH3)2]+ đã tạo thành do phản ứng: Ag+ + 2NH3 ⇌ [Ag(NH3
Bài 4
Cho hai lượng KIO3 và KI bằng nhau (đều có cùng nồng độ 0.10 M) phản ứng với nhau trong dung dịch H2SO4 ở pH ban đầu là 3.0. ½I2 + e I− E1° = +0.54 V IO3 + 6H+ + 5e ½I2 + 6H2O E2° = +1.20 V
Tính pH của dung dịch ở thời điểm cân bằng.
Cân bằng giữa dung dịch axit iothydric nhúng trong điện cực bạc có thể được biểu diễn như sau:
Ag(r) ⇌ Ag+ (aq) + e (1) và
Ag+(aq) + I (aq) ⇌ AgI (r)
Hay phương trình tổng quát
Ag(r) + I (aq) ⇌ AgI (r) + e (2)
Thế chuẩn của bán phản ứng (1) là 0.799 V và của bán phản ứng (2) là0.152 V.
a) Viết phương trình Nernst cho hai bán phản ứng (1) và (2). Từ đó tính tích số tan của AgI ở 25°C.
b) Nhúng điện cực bạc vào dung dịch HI có nồng độ 1 mol/dm3 ở 25°C. Viết phản ứng xảy ra ở điện cực (phản ứng (3)). Liệu có khả năng có hydro thoát ra trên điện cực Ag không? Giải thích.
c) Thực nghiệm chứng minh rằng phản ứng trên có sinh ra hydro nhưng tốc độ rất chậm. Giải thích
Bài 6
Nước thải là một trong những hệ hoá học phức tạp nhất trong môi trường của chúng ta. Hiểu về các phản ứng hoá học phức tạp này là yếu tố quan trọng để quản lí an toàn hệ thống nước thải. Ở đây, chúng ta sẽ xem xét một số quá trình động lực hoá học của sulphate ion trong nước thải. Dưới điều kiện khan hiếm các chất oxide hoá mạnh như O2 hay NO3 thì các ion SO4 2- có thể đóng vai trò như tác nhân oxide hoá các chất hữu cơ trong nước thải, hỗ trợ cho sự phân huỷ chúng. Phản ứng khử sulphate ion thường được tạo điều kiện thuận lợi bởi các vi khuẩn khử-sulphate (SRB1), luôn có mặt trong nước thải và phát triển mạnh trong môi trường kị khí (nồng độ oxygen thấp). Sau cùng, phản ứng khử sulphate có thể tạo thành khí H2S độc. Phản ứng oxide hoá-khử tổng có thể biểu diễn theo phương trình sau:
SO4 2-(aq) + 9H3O+ + 8e ⇌HS (aq) + 13H2O Eo = -0.22 V (1)
HS tạo ra bị chuyển hoá thành H2S. Trong nước thải, chất hữu cơ thường tồn tại ở dạng các hạt rắn huyền phù, có thể biểu diễn là {CH2}. Chất này đóng vai trò thức ăn cho SRB và là tác nhân khử sulphate. Chuyển hoá trong quá trình này có thể biểu diễn như sau: SO4 2- (aq) + 2{CH2O}(s) + H3O+ ⇌HS (aq) + 2CO2 (aq) + 3H2O (l) Eo = 0.26 V (1)
Trong toàn bộ câu hỏi này, nhiệt độ của hệ luôn là 298 K.
1) Xác định biến thiên năng lượng tự do Gibbs chuẩn, ΔGo của phản ứng (2) theo kJ.
2) Viết biểu thức tính hằng số cân bằng K của phản ứng (2) theo nồng độ mol của các chất hoá học tương ứng.
3) Tính giá trị K của phản ứng (2).
4) Nước thải được đưa vào một bể tự hoại có SO4 2- 0.5 mM và pH = 7.0. Giả
Trong điều kiện kị khí, CH4 cũng thường được tạo thành trong quá trình phân huỷ nước thải, cùng với H2S và CO2.
5) Đồ thị nào sau đây biểu diễn sự phụ thuộc vào nhiệt độ của độ tan 3 khí này trong nước, bao gồm khí ở dạng hoà tan, cũng như sản phẩm phản ứng với nước.
i. Điền công thức khí vào ô trống trong đồ thị tương ứng.
ii. Khí nào sẽ thoát ra khỏi nước thải nhanh nhất?
6) Các bể tự hoại có một lượng không khí xác định trên mức nước. Trong một bể như vậy, thành phần trung bình của không khí là N2 = 86 %; O2 = 9 %; H2O = 1.5 %; CO2 = 1.5 %; H2S = 1 % và CH4 = 1 % (theo khối lượng). Tính khối lượng riêng của không khí theo kg.m-3, giả sử áp suất là 1 atm và tất cả đều là khí lí tưởng.
7) Trừ khi có sự nhiễu loạn hoặc khuấy trộn, các khí được đưa vào một buồng ngăn sẽ không khuếch tán đều ngay lập tức. Ban đầu, chúng có xu hướng tích tụ trong những vùng nằm ngang khác nhau, tuỳ theo tỉ khối với không khí trong buồng. Các bể tự hoại được thiết kế để có tốc độ dòng nước thải chậm, do vậy không có bất kì nhiễu loạn nào trong không khí. Trong bể tự hoại đã mô tả ở ý 1.6, xác định những vùng trong không gian (A, B, C) mà các khí (CH4, H2S, CO2) thoát ra khỏi nước thải sẽ tích tụ ban đầu.
Hơi nước trong không khí bị ngưng tụ trên thành bình. Sau đó, H2S trong không khí sẽ hoà tan từ từ trong những giọt nước này. Do oxygen có sẵn trong khu vực xung quanh những giọt này (do tỉ lệ diện tích bề mặt/thể tích lớn so với nước thải dưới đây), vi khuẩn oxide hoá sulphur (SOB2) bắt đầu tích tụ trong những giọt này. Phần xi măng của thành bê tông, có thể biểu diễn dưới dạng (CaO)3(Al2O3), bị sulphuric acid tấn công.
8) Viết các phương trình phản ứng tương ứng với sự tạo thành sulphuric acid trong các giọt nước và các phản ứng có thể có với xi măng trong bê tông.
Nước thải từ các xưởng thuộc da chứa hàm lượng SO4 2- và Cr(VI) cao. Do các tiểu phân Cr(VI) rất độc nên loại nước thải này được được xử lí với các tác nhân khử như sucrose để khử Cr(VI) thành Cr(III) trước khi xả. Tuy nhiên, khi tiếp xúc với không khí, các tiểu phân Cr(III) có thể bị oxide hoá trở lại thành Cr
O
9) Một loại nước thải thuộc da chứa Cr(III) 50 mg.L-1 và SO4 2- 100 mg.L-1 có pH = 7.0 được xả qua một cống mở, tiếp xúc với khí quyển. Nếu không khí trong khí quyển chứa 21.9 % oxygen về khối lượng, phần còn lại chủ yếu là nitrogen, thì tỉ lệ Cr2O7 2-/Cr(III) sau khi hệ đạt tới cân bằng trong khí quyển là bao nhiêu?
(4)
Khi nước thải chảy trong các cống mở, thể tích của nó giảm gỉan do sự bay hơi nước. Trong cống mở như mô tả ở ý 1.9, thể tích nước giảm 30 % khi di chuyển 1 km.
10) Xác định nồng độ khi cân bằng của SO4 2-, Cr(III) và Cr2O7 2- trong nước thải sau khi di chuyển 1 km.
Sau quãng đường 1 km, nước thải ở ý 1.10 được đưa vào một hệ thống thoát nước đóng, không có oxygen. Tại đây, SRB có thể khử sulphate thành sulphide nhưng không khử Cr2O7 2- trở lại thành Cr(III).
11) Viết phương trình cho các phản ứng và tính thế điện hoá chuẩn của chúng để có thể xác định nồng độ Cr(III) và Cr2O7 2- trong hệ thống 2 sulphur oxidizing bacteria
|

thoát nước, giả sử rằng chúng chủ yếu được kiểm soát bởi chuyển hóa sulphate-sulphide
Bài 7
Phương pháp Zeisel-Vieböck-Schwappach được sử dụng để xác định các nhóm methoxyl. Các hợp chất methoxyl phản ứng với hydroiodic acid tạo thành iodomethane, chất này được chưng cất rồi thu lại trong nước bromine. Iodine monobromide tạo thành bị oxid hóa thành iodate và bromine dư bị loại bỏ (Eo(Br2/2Br ) = +1.1 V.) a) Đánh dấu vào acid phù hợp để loại bromine khỏi dung dịch: ☐ formic acid (E°(CO2/HCOOH) = -0.1 V).
☐ chlorous acid (E°(ClO3 /HClO2) = +1.2 V).

☐ hydrofluoric acid (E°(F2/2HF) = +3.0 V).
Iodate được xử lí với iodide từ một nguồn bên ngoài tạo thành iodine, sau đó khử về iodide. Chuỗi phản ứng có thể được lặp lại nhiều lần để nhân lên nhiều
11.60 cm3 dung dịch Na2S2O3 0.1000 M để chuẩn độ I2 tạo thành từ 0.100 gam mẫu (sau 1 chu kì khuếch đại Zeisel-Vieböck-Schwappach).
e) Tính phần trăm khối lượng CH3O trong mẫu gỗ.
Bài 8
a) Viết phương trình Nernst.
b) Cho các thế chuẩn và các bán phản ứng của clo.
Kiềm E°/ V Axit E°/ V
ClOHO/ClO2OH ++ 0.37 + 432 ClO2H/ClOHO ++ 1.20
ClOHO/ClO2OH ++ 0.30 + 322 ClO3H/HClOHO ++ 1.19
ClOHO/ClO2OH ++ 0.68 + 22 HClO2H/HOClHO ++ 1.67
22 2 ClOHO/Cl2OH ++ 0.42
HOClH/ClHO
1.63
22Cl/Cl 1.36 Hãy tính các đại lượng
Cl/Cl 1.36
i) Hằng số ion hóa của nước, Kw.
ii) Hằng số cân bằng của sự dị phân clo thành các trị số oxy hóa +1 và –1 trong cả hai môi trường axit và kiềm.
iii) Trị pKa của HOCl.
iv) Nồng độ của HOCl và ClO trong dung dịch mà ở đó tổng nồng độ của hypoclorit (clorat (I)) là 0.20 mmol dm–3 và thế điện cực chuẩn của phản ứng khử chúng thành clo ở pH = 7,5 này với một đơn vị hoạt tính của clo. Đây là những điều kiện của một hồ bơi điển hình.
9
Trả lời các câu hỏi sau bằng cách sử dụng các giá trị thế chuẩn, E°, cho ở bảng sau.
Bán phản ứng E°/V (298 K)
Sn2+ + 2e → Sn –0.14
Sn4+ + 2e → Sn2+ +0.15
Hg2 2+ + 2e → 2Hg +0.79
Hg2Cl2 + 2e → 2Hg + 2Cl +0.27
a) Tính giá trị hằng số cân bằng, K, của phản ứng sau ở 298 K Sn(s) + Sn4+(aq) ⇌ 2Sn2+(aq)
b) Tính độ tan, S, của Hg2Cl2 trong nước ở 298 K (mol kg–1). Biết rằng cation thủy ngân trong pha nước tồn tại ở dạng Hg2 2+ .
c) Tính thế, E°, của pin nhiên liệu hoạt động bằng phản ứng dưới đây. Biết rằng có 2 electron trao đổi trong phản ứng này H2(g) + O2(g) → H2O(l) ΔrG° = –237.1 kJ mol–1
Bài 10 Cho các giá trị thế điện cực chuẩn và các bán phản ứng của clo là: Môi trường kiềm Eo (V) Môi trường axit Eo (V)
ClO4 + H2O + 2e → ClO3 + 2OH 0,37 ClO4 + 2H+ + 2e → ClO3 + H2O 1,20 ClO3 + H2O + 2e → ClO2 + 2OH 0,30 ClO3 + 3H+ + 2e → HClO2 + H2O 1,19
ClO2 + H2O + 2e → ClO + 2OH 0,68 HClO2 + 2H+ + 2e → HClO + H2O 1,67
ClO + H2O + e → 1 2 Cl2 + 2OH
0,42 HClO + H+ + e → 1 2 Cl2 + H2O
1,63 1 2 Cl2 + e → Cl- 1,36 1 2 Cl2 + e → Cl- 1,36
Hãy tính các đại lượng sau: a) Tích số ion của nước (KW) b) Hằng số cân bằng đối với các phản ứng sau: - Trong môi trường kiềm: Cl2 + 2OH ⇌ ClO + Cl + H2O - Trong môi trường axit: Cl2 + H2O ⇌ HOCl + H+ + Cl c) Giá trị pKa của HOCl.
d) Nồng độ của HOCl và ClO trong dung dịch có pH = 7,5 với tổng nồng độ hypoclorit là 0,20 mmol/L. Tính thế điện cực 2ClOClO E tại pH = 7,5 và hoạt độ của clo bằng 1 (PCl2 = 1 atm).
|
Bài 11
a) Tính thế khử chuẩn của cặp [Fe(CN)6]3– / [Fe(CN)6]4– dựa trên các giá trị sau:
E°(Fe3+(aq) | Fe2+(aq)) = + 0.770 V

Fe3+(aq) + 6CN (aq) ⇌ [Fe(CN)6]3–(aq) log10 Kc = 43.9
Fe2+(aq) + 6CN (aq) ⇌ [Fe(CN)6]4–(aq) log10 Kc = 36.9
Biết giá trị thế khử của các bán phản ứng sau:
In+(aq) + e– ⇌ In(s) E° = – 0.13 V
In3+(aq) + 3e ⇌ In(s) E° = – 0.34 V
Tl+(aq) + e ⇌ Tl(s) E° = – 0.34 V
Tl3+(aq) + 3e ⇌ Tl(s) E° = + 0.72 V
b) Tính hằng số cân bằng của phản ứng dị ly:
3M+ (aq) → M3+ (aq) + 2M (s) với In và Tl. Rút ra kết luận.
Bài 12
Tên nguyên tố được đặt là crom do sự đa sắc trong các hợp chất của các ion crom. Sơ đồ sau đây thể hiện một giản đồ Latimer chưa hoàn chỉnh của crom và màu sắc một số các hợp chất của nó. Các giá trị thế điện cực được lấy ở pH = 0.
1) Tính giá trị của x và y.
2) Liệu Cr(IV) có thể dị ly thành Cr(III) và Cr(VI)? Khẳng định câu trả lời bằng tính toán cụ thể.
3) Viết bán phản ứng của cặp Cr2O7 2-/Cr3+ và tính sự giảm thế của cặp này khi pH tăng lên một đơn vị ở 298 K. Cho rằng nồng độ của các tiểu phân chứa crom được giữ không đổi.
|
Bài 13
Nêu các hiện tượng xảy ra, viết các phương trình phản ứng và giải thích
bằng tính toán cho các trường hợp sau.
a) Cho 1 mL dung dịch KI 2.10-2 M vào 1 mL dung dịch FeCl3 0,2M và HCl 0,2M, thêm vài giọt hồ tinh bột, thu được dung dịch hỗn hợp (1).

b) Thêm 1 mL dung dịch KF 1,5M vào dung dịch (1) thu được dung dịch (2)
c) Thêm tiếp 1 mL dung dịch AlCl3 2,0M vào dung dịch (2) thu được dung dịch (3).
Cho biết
Bài 14
Giản đồ Latimer là một cách đơn giản và thuận tiện để ghi lại các tính chất oxid hóa-khử của một nguyên tố thể hiện nhiều số oxid hóa khác nhau. Từ trái sang phải, các hợp chất của nguyên tố được sắp xếp theo chiều giảm số oxid hóa. Nếu một số oxid hóa của một nguyên tố tồn tại ở nhiều dạng tiểu phân (phân tử, ion) thì chọn tiểu phân có nồng độ chiếm ưu thế (ví dụ Cr2O4 2- ở pH > 7, Cr2O7 2- ở pH <7). Phía trên mũi tên là các giá trị Eoxid hóa/khử (không nhất thiết phải là E0oxid hóa/khử! Với tất cả các hợp chất, đa phần thì a = 1 và pH = 0 hoặc 14). Hình vẽ dưới đây biểu diễn giản đồ Latimer của các hợp chất phosphorus ở pH = 14 và pH = 0. (Lưu
Do
Dưới đây là giản đồ Latimer của một số tiểu phân chứa crom ở pH = 0 và pH = 14. Mỗi giá trị đều có đơn vị là V.
Bài 16
Dưới đây là giản đồ Latimer của một chuỗi tiểu phân chứa sulfur ở pH =
0. Các giá trị thế tính theo Volt.
1) Tính ba giá trị E còn thiếu và ghi giá trị của nó vào vị trí tương ứng trên giản đồ.
2) Cr(V) và Cr(IV) có bị dị phân không? Giải thích câu trả lời bằng cách đưa ra một bất đẳng thức.
3) Tính hằng số cân bằng cho phản ứng dị phân của Cr(II) ở 25°C.
4) Tính tích số tan của Cr(OH)3 ở 25°C.
5) Tính độ tan của Cr(OH)3 ở 25°C. Nếu không giải được ý 4. , có thể sử dụng giá trị 1.0·10-28 (đây không phải trị thực!).
1) Xác định các giá trị x, y còn thiếu.
2) Chứng minh bằng tính toán rằng S(0) bền, không bị tự oxid hóa-khử.
3) Viết phương trình tự oxid hóa-khử của S(II) với các tiểu phân được cho trong giản đồ Latimer.
4) Tính hằng số cân bằng của phản ứng tự oxid hóa-khử ở 25 oC. Hydrogen peroxide có thể đóng vai trò chất oxid hóa lẫn chất khử. Cho các giá trị thế chuẩn sau: O2 / H2O2, E° = 0,69 V H2O2 / H2O, E° = 1,77 V S2O8 2-/SO4 2-, E° = +1,96



5) Trong phản ứng với Na2S2O8 ở điều kiện chuẩn, hydrogen peroxide đóng vai trò chất khử hay oxid hóa?
6) Viết phương trình phản ứng oxid hóa-khử và tính ∆E0
|
Các kim loại X, Y, Z có bán kính nguyên tử gần như xấp xỉ 0.144 nm cũng như cùng sự sắp xếp mạng tinh thể. Khối lượng riêng của các kim loại X, Y, Z lần lượt bằng 2.7, 10.5, 19.3 gam/cm3. Trạng thái oxid hóa điển hình của X, Y, Z lần lượt là III, I, III.
a) Tính khối lượng mol các kim loại và xác định X, Y, Z.
b) Sử dụng dữ kiện từ giản đồ Latimer, hãy chứng minh bằng tính toán rằng trạng thái oxid hóa bền nhất của Y và Z trong dung dịch lần lượt bằng I và III.
nEo thực nghiệm được tóm tắt dưới đây ở dạng giản đồ Frost diagram. Có thể thấy, các nguyên tố có các trạng thái oxid hóa ưu tiên khác nhau. Một phần thì Eo được xác định bởi các giá trị ΔHion. Nói chung, do hiệu ứng chắn, năng lượng ion hóa tăng theo chu kì từ trái sang phải. Tuy nhiên, các quy luật khác xuất hiện có sự ghép cặp và trao đổi electron. Tổng thể, các giá trị năng lượng ion hóa tương đối có thể được suy luận bằng cách phân tích cấu hình electron của các nguyên tử.
Thế khử chuẩn của Men+ có thể được ước tính là:
∆+∆+∆
oatomionhydr HHH E4.52 V nF
trong đó ∆Hatom là biến thiên enthalpy nguyên tử hóa của Me, ∆Hion là tổng các năng lượng ion, và ∆Hhydr là năng lượng hydrate hóa của cation Me3+ trong nước.
c) Đánh dấu vào giả định được dẫn ra từ phương trình trên.
ΔG = -nFE°, ΔG = ΔH - TΔS, |ΔH| << |TΔS|

ΔG = -nFE°, ΔG = ΔH - TΔS, |ΔH| >> |TΔS| ☐ ΔG = -nFE°, ΔG = ΔH - TΔS, |ΔH| = |TΔS|


d) Sử dụng dữ kiện nhiệt động học được cung cấp, tính các giá trị Eo của X3+, Z3+, Fe3+ và Sc
e) Viết kí hiệu của các nguyên tố chu kì 4 có năng lượng ion hóa (IE) thứ n thấp hơn nguyên tố kế cận bên trái nó.
Các giá trị IE thứ 1, 2, 3 của Y và Cu gần như bằng nhau. Hãy xác định (các) yếu tố làm mất ưu tiên của trạng thái oxid hóa II của Y so với Cu (trong dung dịch nước).
Bán kính của Y2+ > Cu
Năng lượng ion hóa của Y < Cu.
Độ dẫn điện của Y > Cu.
Đánh dấu (các) nguyên nhân tại sao Z có giá trị IE thứ 3 thấp hơn đáng kể so với Y (cũng như tại sao Z có màu vàng còn Y là màu xám):
Hiệu ứng ghép cặp trong, nghĩa là sự co của 6s2 orbital do hiệu ứng tương đối.
☐ Sự tách orbital, nghĩa là dịch chuyển trong các mức năng lượng do tương tác spin-quỹ đạo.
☐ Sự co lanthanide, nghĩa là sự giảm bán kính ion lớn hơn so với dự đoán của các nguyên tố trong cột 6.
h) Viết phương trình phản ứng giữa các cation 3+ của X, Z, Fe, Sc với iodide anion (I ). Cho biết: Eo(I2) = +0.54 V.
Cation không tồn tại trong dung dịch ở dạng ion “trần” mà ở trạng thái hydrate hóa như các phức aqua (nước). Nếu tồn tại các phối tử khác trong dung dịch, chúng có thể thay thế các phân tử nước. Tương tự với các ion phức được tạo thành ở dạng nóng chảy. i) Vẽ cấu trúc các phức chất
(H
O)
và
Cấu trúc XF3 là dạng lập phương với X ở mỗi góc của ô mạng cơ sở và 1 nguyên tử F ở trung điểm của mỗi cạnh. Trong ZF3 rắn, số phối trí của các nguyên tử kim loại bằng 4. XCl3 chứa các lớp lập phương đặc khít, trong đó số phối trí của X là 6. Chất rắn phân tử ZCl3 chứa các dimer.
j) Xác định số phối trí của các nguyên tử F và Cl trong các hợp chất này.
k) Vẽ cấu trúc của X2Cl6, Z2Cl6, W2Cl6. Tất cả đều có dạng hình học khác nhau.
Bài 18
Nhà máy lọc nước ARA Pustertal tiếp nhận nước thải từ 26 khu vực khác nhau, sau đó được phân phối cho bốn nhà máy lọc ngầm, một trong số đó là ARA TOBL St. Lorenzen, nhà máy lớn nhất. Điểm đặc biệt của loại nhà máy này là cấu trúc dưới lòng đất của chúng. Mục tiêu chính của một nhà máy lọc là xử lý tính chất cơ học, sinh học và hóa học của nước thải, sau đó chuyển đổi nước tinh khiết thành nước tự nhiên. Bài này chủ yếu đề cập đến một phần quá trình xử lý sinh học và hóa học của nước thải. Bước quan trọng để loại bỏ nitrogen dưới dạng NH3 hay NH4 + là nitrate hóa và phản nitrate hóa. Trong quá trình nitrate hóa, NH4 + bị oxid hóa bởi oxygen không khí theo 2 giai đoạn:
1) Viết và cân bằng phương trình ion cho mỗi giai đoạn và phương trình tổng của quá trình nitrate hóa. 1.50·104 m3 nước thải với nồng độ 25 mg/L NH4 + đi qua khu vực nitrate hóa của nhà máy lọc mỗi ngày. Nước thải được đưa vào không hề có khả năng đệm. Quá trình nitrate hóa được hoàn tất khi giá trị pH không đổi. Có thể thực hiện được điều này bằng cách thêm vào Ca(OH)2.
2) Tính lượng Ca(OH)2 cần dùng trong mỗi giờ để giữ pH ổn định trong quá trình nitrate hóa.
3) Tính thế điện cực chuẩn của cặp NO3 / NH4 +
4) Tính thế điện cực của cặp oxi hóa khử trong ý 3, khi pH là 7.0, tất cả các giá trị nồng độ khác đều không đổi? T = 298 K. Trình bày cách tính. Ở bước phản nitrate hóa, nitrate bị khử thành nitrogen trong điều kiện yếm khí trong sự có mặt của vi khuẩn (nitrosomonas và nitrobacter) dưới tác dụng của các chất hữu cơ có tính oxid hóa. Nếu như không có đủ chất nền trong nước thô của quá trình nitrate hóa, hợp chất hữu cơ nói trên có thể được thêm vào (vd. methanol), sau đó CO2 được tạo ra.
5) Viết phương trình cân bằng cho phản ứng nitrat-methanol ở dạng ion. Chúng ta quay lại chuỗi oxi hóa khử (thế điện cực chuẩn tại pH = 0) của nitrogen giữa số oxi hóa +5 và 0.

6) Trình bày cách tính, chứng minh NO có thể dị phân thành N2 và NO3 .
Theo quy luật, các ion kim loại được kết tủa bằng cách thêm sulfide hoặc hydroxide.
7) Giá trị pH thấp nhất mà tại đó sắt(III) hidroxit bắt đầu kết tủa là bao nhiêu, nếu dung dịch chứa 10 g/m3 Fe3+? Trình bày cách tính của bạn, biết pKL(Fe(OH)3) = 38.7
Phosphate ion, có nguồn gốc từ các phụ gia giặt tẩy, cũng phải được loại bỏ để tránh hiện tượng phú dưỡng của nước tự nhiên. Điều này được thực hiện bằng cách thêm Fe3+ hoặc Al3+, từ đó tạo thành các hợp chất phosphate không tan. Theo hệ số tỉ lượng tỉ lệ là Fe:P = 1:1. Thực tế tỉ
Fe:P = (1,1-1,4):1 được dùng thay thế.
Với 22000 m3/d nước thải 250 kg Fe/d được dùng, hàm lượng photpho trong nước là 5.0 mg P/L.
8) Tính tỉ lệ Fe:P trong trường hợp trên.
Tại pH = 7.0 độ tan của AlPO4 là 96.4 μg/m3 .
9) Tính tích số tan của AlPO4 giả định rằng không có phản ứng trao đổi proton.
Một lượng nước thải bị ô nhiễm đặc biệt có pH là 5.0. Giá trị pH có thể gây ra nhiều khó khăn trong nhà máy lọc nước, một trong số đó là hàm lượng phosphate ban đầu cao do sự hòa tan của AlPO4.
10) Tính độ tan của AlPO4 tại pH trên. Lưu ý: Bạn có thể tính chính xác hoặc đơn giản hóa một cách hợp lý. Với trường hợp sau bạn phải đưa ra những lập luận toán học để chứng minh sự đơn giản hóa là hợp lý. Nếu bạn không có giá trị ở ý 9, bạn có thể dùng 9.0·10-19 cho KS. Cho biết H3PO4 có pKA1 = 2.15; pKA2 = 7.20; pKA3 = 12.4.
Bài 19
Một báo cáo gần đây ở Trung Quốc viết về một thí nghiệm như sau: dung dịch sodium sulfide 0.1 mol L-1 được tiêm vào vỏ trứng rỗng. Vỏ trứng sau đó được mở ra rồi nhúng một phần vào cốc chứa dung dịch copper chloride 0.1 mol L-1. Sau khi để nguyên vài tuần, lớp vỏ ngoài xuất hiện kim loại đồng, trong khi dung dịch trong cốc nhạt dần và bị đục.
1) Viết phương trình phản ứng xảy ra khi các copper ion và sulfur ion tác dụng trực tiếp với nhau. Biết rằng φo(Cu2+/Cu) và φo(S/S2-) là 0.345 V và -0.476 V, nFEo = RTlnK, Eo là suất điện động chuẩn của phản ứng, n là số electron trong phản ứng. Viết biểu thức và tính hằng số cân bằng của phản ứng ở 25 oC.
2) Giải thích sự tạo thành đồng kim loại ở lớp vỏ ngoài và việc dung dịch bị đục.
3) Báo cáo không đề cập đến độ pH của dung dịch khi các sulfur ion tác dụng với copper ion. Hãy viết phương trình phản ứng ion ở pH = 6.
|
Bài 20
Xây dựng một pin điện gồm điện cực hydro và Pb/Pb(OH)2 trong dung dịch chất điện ly KOH
a) Viết phản ứng xảy ra ở các điện cực nếu biết rằng điện cực hydro đóng vai trò cực âm
b) Đưa ra phương trình tính suất điện động của pin. Phương trình này phải không phụ thuộc nồng độ
c) Tính tích số tan của Pb(OH)2 ở 25oC nếu biết rằng Eo(Pb2+/Pb) = -0,126 V, KW = 10-14 và suất điện động của pin đo được là 0,261 V
Bài 21
Có pin điện: Zn | ZnSO4 || AgNO3 | Ag. Nếu ở 25oC nồng độ mỗi chất là 1,00 mol/dm3 thì suất điện động của pin là 1,562 V. Thể tích dung dịch điện ly là 1,00 dm3
a) Viết phản ứng xảy ra ở mỗi điện cực và phản ứng tổng quát
b) Tính thế của pin sau 20 ngày hoạt động nếu biết rằng cường độ dòng điện do pin sản xuất ra là 0,050 A
|
Một pin volta được thiết lập từ hai nửa tế bào điện hóa chứa điện cực hydro. Một trong số chúng được nhúng chìm vào 100 cm3 dung dịch 0,1 M
HCl và điện cực còn lại nhúng vào trong 100 cm3 dung dịch CH3COOH 0,1 M. Áp suất hydro trong các dung dịch là 1 atm, nhiệt độ 20 oC, F = 96485
C mol 1, R = 8.314 J mol 1 K 1 , Ka = 1.75·10-5
Hãy tính:
a) Thế của pin ở điều kiện đã cho.
b) Thế của pin khi thêm 60 cm3 dung dịch NaOH 0,1 M NaOH vào mỗi dung dịch đầu.
c) Thế của pin khi pha loãng mỗi dung dịch đầu 10 lần.
d) Thể tích dung dịch NaOH 0,1M (cm3) cần thêm vào dung dịch CH3COOH ban đầu để thế của pin là E = 0,150 V?
Bài 23
Xét một pin điện hoá gồm hai cốc thuỷ tinh nối với một cầu muối. Mỗi cốc thuỷ tinh gồm một điện cực platinum nhúng vào dung dịch chứa các cấu tử sau ở nồng độ tiêu chuẩn: Pt (tv.) | Tl3+, Tl+ || MnO4 , Mn2+, H + | Pt (tv). Các bán phản ứng điện hoá tương ứng là: Tl3+ + 2e → Tl+ E0 = 1,252 V MnO4 + 8H+ + 5e → Mn2+ + 4H2O E0 = 1,507 V
1) Viết các bán phản ứng và phản ứng hoàn chỉnh khi pin hoạt động và xác định giá trị E0, hằng số cân bằng K của phản ứng hoàn chỉnh.
2) Tính điện lượng được vận chuyển để làm biến đổi 5,0 mg thallium cation theo phản ứng trong ý 1.
3) Xác định thế của pin điện có nồng độ (theo mol/L) của các cấu tử là: Tl3+ là Tl+ đều là 0.010; MnO4 2- 0.001; Mn2+ là 0.002 ở pH = 3.
4) Viết sơ đồ pin tương ứng với các cấu tử ở ý 3.
|
24
Suất điện động của pin
Pt | H2 (k) (p =1.0 bar) | HBr (aq) (1.0×10−4 M) | CuBr | Cu là 0.559 V ở 298 K. (Cho rằng tất cả các chất trong pin đều xử sự lý tưởng).
a) Viết các bán phản ứng ở nửa pin bên phải và bên trái, phương trình Nernst cho pin và thế khử chuẩn của điện cực CuBr.
b) Thế khử chuẩn của cặp Cu/Cu+ (aq) là 0.522 V. Tính G° của sự phân ly CuBr ở 298 K và suy ra tích số tan của CuBr
c) Tính nồng độ ion Cu+ (aq) của pin này.
d) Nếu tăng áp suất khí hydro lên gấp đôi thì suất điện động của pin sẽ thay đổi như thế nào ?
Bài 25
Pin galvanic đầu tiên được A. Volta chế tạo vào năm 1800, dựa vào những thí nghiệm của L. Galvani. Sau này, các pin galvanic đã được ứng dụng rộng rãi trong khoa học, công nghệ và cuộc sống thường ngày. Nửa bên trái của pin chứa một điện cực sắt (dư) bị oxid hoá trong quá trình hoạt động và dung dịch iron(III) nitrate có nồng độ 0.01 M. Nửa bên phải của pin chứa điện cực than chì và hỗn hợp iron(II) và (III) nitrate với nồng độ lần lượt là 0.05 M và 0.30 M. Thể tích của mỗi nửa pin là 1 L.
1) Xác định điện cực nào là cathode, điện cực nào là anode. Chỉ rõ các điện cực này thuộc loại nào.
2) Viết sơ đồ pin theo dạng
(các)
chất ion phù hợp nhất làm cầu muối. Từ dữ kiện nhiệt động, biết rằng entropy chuẩn của Fe(s), Fe2+(aq), Fe3+(aq) ở 25oC là 27.3, -137.7 và -316.0 kJ/mol. Tăng nhiệt độ thêm 20oC sẽ làm giảm hằng số cân bằng K 85 lần.
5) a) Chỉ ra ion có entropy chuẩn trong dung dịch nước được giả định là bằng 0; b) Chỉ ra nguyên nhân tại sao entropy của ion có trị số điện tích bằng 3 lại thấp hơn nhiều so với ion có trị số điện tích bằng 2 (chọn một trường hợp trong Phiếu trả lời); c) Tính entropy, enthalpy và năng lượng Gibbs (ở 25oC) của phản ứng tổng. Chú ý rằng detalrHo và delarSo là các hằng số trong khoảng nhiệt độ này, R = 8.314 J/mol.K, F = 96485 C/mol (hằng số Faraday).
6) Tính (theo volt, tới độ chính xác là 3 chữ số thập phân) suất điện động (EMF) ban đầu của pin và các thế ban đầu của cathode, anode ở 25oC. Biết E0(Fe2+/Fe) = -0.447 V.
|

Pin hoạt động trong 3 giờ 20 phút cho đến khi được sử dụng hoàn toàn.
7) Tính cường độ trung bình của dòng. 139 |
Bài 26 Kỹ thuật điện hóa thường được dùng để xác định độ tan của các muối khó tan. Cho pin điện hóa: (-) Zn | Zn(NO3)2 0,2M || AgNO3 0,1 M | Ag (+) Các dung dịch Zn(NO3)2 và AgNO3 trong pin đều có thể tích 1,00L và ở 25oC.
a) Viết phương trình phản ứng ở mỗi điện cực và phương trình phản ứng xảy ra trong pin khi pin phóng điện. Tính sức điện động (sđđ) của pin.
b) Tính tổng lượng điện có thể giải phóng tới khi pin phóng điện hoàn toàn và hằng số cân bằng của phản ứng xảy ra trong pin.
Trong một thí nghiệm khác, khi cho KCl(r) vào dung dịch AgNO3 của pin ban đầu xảy ra sự kết tủa AgCl(r) và thay đổi sđđ. Sau khi thêm KCl(r), sđđ của pin bằng 1,04V và nồng độ ion K+ bằng 0,300M.
c) Tính nồng độ mol của ion Ag+ tại cân bằng.
d) Tính nồng độ mol của ion Cl và tích số tan của AgCl.
Cho biết: Eo (Zn2+/Zn) = -0,76V; Eo(Ag+/Ag) = +0,80V
Trong các tính toán, dùng nồng độ thay cho hoạt độ.
Pin lithium-ion đang trở thành giải pháp thay thế cho các pin chì-acid truyền thống. Gần đây, tính an toàn của các loại pin từ lithium đã thu hút nhiều sự chú ý của giới truyền thông. Năm 2016, một nhà sản xuất lớn đã phải thu hồi hàng triệu chiếc điện thoại di động do những vấn đề liên quan đến cháy/nổ pin.
Pin lithium-ion có các hợp chất lithium xâm nhập (chính xác hơn là “đan xen”) ở dạng vật liệu điện cực. Sự xâm nhập là quá trình chèn vào thuận nghịch của một phân tử (hoặc ion) vào các vật liệu có cấu trúc lớp.
Khi xả điện, cathode là cobalt oxide với các lithium ion xâm nhập và anode là graphite (than chì) với các lithium ion xâm nhập. Trong quá trình sạc và xả điện, các lithium ion di chuyển từ điện cực này sang điện cực khác qua chất điện giải. Chất điện giải thường dùng là muối lithium hòa tan trong dung môi hữu cơ. Nếu pin được xử lí theo đúng hướng dẫn của nhà sản xuất thì lithium đơn chất sẽ không bao giờ được tạo thành trong pin. a) Khi xả điện, bán phản ứng ở cathode có thể là CoO2 + Li+ + e → LiCoO2 i. Xác định số oxid hóa của cobalt trong CoO2 ii. Xác định số oxid hóa của cobalt trong LiCoO2.
b) Nếu pin được nạp quá tải, kim loại Li có thể được tạo thành trên một trong các điện cực và điều này có thể gây ra nguy cơ cháy nổ nghiêm trọng. Li được tạo thành ở điện cực nào? Khoanh tròn đáp án trong phiếu trả lời.
A. Ở anode, đó là điện cực cobalt oxide.
B. Ở cathode, đó là điện cực cobalt oxide.
C. Ở anode, đó là điện cực graphite.
D. Ở cathode, đó là điện cực graphite.
c) Dung môi hữu cơ phổ biến nhất được dùng làm chất điện giải là EC, có công thức phân tử C3H4O3. Một trong các sản phẩm thủy phân của EC là 1,2-ethanediol. Vẽ cấu tạo của EC.
Lithium bốc cháy dữ dội trong không khí tạo thành hỗn hợp lithium oxide và lithium peroxide (Li2O2).
d) Viết phương trình phản ứng đốt cháy lithium trong không khí, giải sử hai sản phẩm được tạo thành với tỉ lệ mol 1:1.
Lithium peroxide được dùng để lọc không khí trong các khu vực hạn chế, như là tàu ngầm hoặc tàu vũ trụ. Nó loại bỏ carbon dioxide từ không khí và tạo thành oxygen.
e) Viết phương trình phản ứng giữa lithium peroxide và carbon dioxide. Trên Tạm Vũ trụ Quốc tế, hợp chất A được dùng để lưu trữ oxygen. Kết quả phân tích nguyên tố cho thấy hợp chất A chứa 6.52 % lithium và 33.32 % chlorine về khối lượng.
f)
i. Xác định công thức kinh nghiệm của hợp chất A.
ii. Vẽ công thức Lewis của anion trong hợp chất A.
iii. Xác định dạng hình học của anion trong hợp chất A.
iv. Viết phương trình phân hủy hợp chất A. Giả sử rằng toàn bộ nguyên tử oxygen trong hợp chất A được giải phóng ở dạng oxygen phân tử trong quá trình này.
Hiệu quả của một hợp chất lưu trữ hydrogen được xác định bởi tỉ lệ thể tích oxygen:thể tích (OV): = thÓ tÝch oxygen gi¶i phãngOV thÓ tÝch hîp chÊt gi¶i phãng nã Khối lượng riêng của hợp chất A là 2.42 gam cm-3 .
g) Tính tỉ lệ oxygen:thể tích (OV) của hợp chất A ở nhiệt độ và áp suất thường.
|
Các video camera, camera, đồng hồ… cần có năng lượng để hoạt động –đó là các pin. Một pin lý tưởng phải sử dụng được lâu, có khối lượng nhẹ, bền vững và thân thiện với môi trường. Pin bao gồm anot, catot và môi trường điện phân.
Kim loại thường được dùng làm anot. Ở đây nêu một số kim loại được dùng nhiều nhất để làm anot.
1. Viết bán phản ứng của các kim loại này.
2. Tính dung lượng điện hóa của các pin này. Dung lượng điện hóa được định nghĩa là lượng điện mà
1 g kim loại có thể sản sinh ra.
Kim loại ρ (g/cm3) E0 (V)
Li 0,53 -3,04
Ca 1,54 2,87
Al 2,70 1,66
Cd 8,64 -0,40
3. Kim loại nào phù hợp nhất để làm anot của pin? Nêu hai lý do. Giá trị thế khử chuẩn của nước là -0,83 V.
4. Viết bán phản ứng khử nước.
5. Kim loại nào trong số các kim loại cho trên có thể phản ứng được với nước ở nhiệt độ phòng? Viết phản ứng và giải thích đáp án.
6. Tính hằng số cân bằng của phản ứng giữa nước và liti. Phản ứng này có tự phát không? Giải thích.
Ion sẽ bị solvat hóa trong dung dịch điện phân trong quá trình oxy hóa kim loại. Dung dịch tạo thành phải có tính dẫn điện tốt. Liti hexaflorophotphat(V) được thêm vào để làm tăng độ dẫn điện của dung môi.
7. Dung môi nào trong số các dung môi sau: (a) nước, (b) etanol, (c) dimetyl sunfoxit, (d) hexan là tốt nhất đối với pin liti? Giải thích đáp án.
8. Vẽ cấu trúc của dimetyl sunfoxit và liti hexaflorophotphat (V) dựa trên mô hình VSEPR. Cho biết điện tích riêng phần và dạng lai hóa của lưu huỳnh và photpho. Sunfua, oxit và các halogenua thường được dùng làm catot
9. Viết và cân bằng phản ứng tổng quát diễn ra trong pin liti nếu catot được dùng là (a) Bi2O3, (b) FeS2, (c) CuCl2 và nguyên tố kim loại được giải phóng. Đối với pin nào (a c) thì khả năng nonexpansion work của phản ứng là lớn nhất? Thế Gibbs tạo thành chuẩn của các chất được cho ở bảng bên.
Chất ΔfG0 (kJ/mol)
Bi2O3 493.47
FeS2 160.07
LiCl 384.02 Li2O -562.11 Li2S -439.08
CuCl2 173.81
FeS2 được dùng làm catot trong pin liti và chất điện phân được sử dụng là liti hexaflorophotphat (V) được solvat hóa trong dimetyl sunfoxit.
10. Đề nghị một lưu ý ngắn đối với pin liti này. Viết bán phản ứng xảy ra ở catot và tính thế chuẩn của nó.
11. Viết ở hình trống bên cạnh giản đồ của một pin liti: Li, FeS2, liti hexaflorophotphat(V), „+“, dimetyl sunfoxit, anot (A), cathot (K), dung dịch điện phân và nguồn điện. Chỉ ra chiều di chuyển của electron ở mạch ngoài.
12. Chất nào nên dùng với lượng dư trong pin liti? Giải thích. ΔG0 = -RT ln K ΔG0 = -nFE0 R = 8,314 J/(mol K) F = 96490 C/mol
|
Phần A: Các quá trình điện hóa trong pin sạc (ắc quy) chì - acid
Pin sạc chì - acid truyền thống được sử dụng trong ô tô và các bộ đảo điện (đổi phase) là những loại pin có thể nạp lại phổ biến nhất trên thị trường. Một bộ pin chì - acid có thể nạp lại chứa một điện cực âm Pb(s)/PbO2(s) và một điện cực âm Pb(s), cả hai đều được nhúng vào dung dịch chất điện li H2SO4.
Hình 1: Sơ đồ pin sạc chì - acid truyền thống.
Thế điện cực chuẩn của một số bán phản ứng ở 298 K được cho dưới đây.
Bán phản ứng
Eo (V)
PbO2(s) + SO4 2 (aq) + 4H+(aq) + 2e → PbSO4(s) + 2 H2O(l) +1.69
PbO2(s) + 4 H+(aq) + 2e → Pb2+(aq) + 2H2O(l) +1.46
Pb2+(aq) + 2e → Pb(s) -0.13
PbSO4(s) + 2e → Pb(s) + SO4 2 (aq) -0.36
1) Viết các bán phản ứng xảy ra ở cathode và anode của pin trên khi xả điện ở 298 K. Viết phương trình phản ứng xả điện (phóng điện) tổng và tính Eo của pin sạc này.
Enthalpy tạo thành mol của một số tiểu phân được cho ở dưới đây: Tiểu phân Hof (kJ mol 1)

PbO2(s) -277.4
H2O(l) -285.8
Pb2+(aq) 1.6
SO4 2 (aq) -909.3
PbSO4(s) -920.0
2) Tính biến thiên enthalpy (∆Ho rxn) và năng lượng tự do Gibbs (∆Go rxn) cho phản ứng xả điện tổng của pin sạc ở ý 1.
Trong một pin Galvanic, hóa năng giải phóng trong phản ứng xả điện tạo ra công của lực điện. Biến thiên năng lượng Gibbs của quá trình xả điện tương ứng với công của lực điện cực đại wmax(el) có thể thu được từ pin trong quá trình xả điện. wmax(el) = -∆Go rxn Công cực đại nhận được khi pin hoạt động thuận nghịch, nghĩa là ở cường độ rất thấp. Giả sử rằng pin được thiết kế để trao đổi nhiệt với môi trường xung quanh nhằm tránh tình trạng quá nhiệt hoặc quá lạnh.
3) Với hoạt động thuận nghịch của pin ở 298 K và tất cả các tiểu phân trong pin tồn tại ở trạng thái tiêu chuẩn, a) Hãy xác định lượng nhiệt hấp thụ bởi pin từ môi trường xung quanh trên mỗi mol phản ứng như phương trình ở ý 1.
b) Tính phần của wmax(el) nhận được từ nhiệt trao đổi thuận nghịch với môi trường xung quanh. Nồng độ c của một tiểu phân trong dung dịch có liên hệ với hoạt độ a của nó theo biểu thức a = γ ·c, trong đó γ là hệ số hoạt độ. Với các dung dịch nồng độ cao (đặc), tỉ lệ phản ứng Q cần phải được biểu diễn theo hoạt độ của các tiểu phân (nghĩa là 1γ≠ ).
Dung dịch H2SO4 (aq.) đặc được sử dụng trong pin sạc chì - acid thương mại. Để thuận tiện, các thành phần rắn và lỏng trong phản ứng hóa học thường được giả định là tồn tại ở các “trạng thái tiêu chuẩn” với hoạt độ bằng 1. Tuy nhiên, do nồng độ cao của sulfuric acid trong chất điện li, hoạt độ của nước không thể được lấy là 1.
|
5) Giả sử rằng các trạng thái xả và nạp điện tương ứng
1.00 molal và 5.00 molal, hãy tính sự giảm giá trị EMF khi xả điện
K.
Sau đây là một số dữ kiện về pin ở Hình 1.
(i) PbSO4(s) chủ yếu bám trên các điện cực và không có ở các phần khác của pin.
(ii) PbSO4(s) bám trên cả hai điện cực.
(iii) Trở kháng của kết tủa PbSO4(s) (3·109 Ω cm) cao hơn nhiều so với PbO2(s) (2·10-4 Ω cm).
(iv) Trở kháng của PbO2(s) (2·10-4 Ω cm) gần với Pb(s) (0.2·10-4 Ω cm)

6) Những dữ kiện nào ở trên là yếu tố giúp pin có khả năng sạc lại? Sự điện phân nước có thể trở thành quá trình cạnh tranh khi sạc pin ở hình 1. Các bán phản ứng liên quan được cho dưới đây: Bán phản ứng Eo (V) O2(g) + 4H+(aq) + 4 e → 2H2O(l) +1.23 2 H+(aq) + 2e → H2(g) 0.00
7) Đối với hoạt động của pin sạc ở hình 1 tại 298 K, hãy xác định các phát biểu dưới đây là đúng hay sai:
a) Trong quá trình sạc pin, đầu dương của nguồn điện một chiều được nối với điện cực bị khử, còn đầu âm nối với điện cực bị oxid hóa.
b) EMF của pin phụ thuộc vào số lượng tiểu phân Pb trong pin.
c) Nếu sạc quá tải một thời gian dài, việc phóng oxygen trên một đầu và hydrogen ở một đầu khác có thể tạo thành một hỗn hợp nổ.
d) Khi quá trình sạc kết thúc, oxygen bắt đầu được tạo thành trên điện cực âm.
e) Tổng năng lượng lưu trữ trong pin bị giới hạn bởi số mol Pb(s) trong điện cực âm hoặc số mol Pb4+ trong điện cực dương, tùy theo lượng nào ít hơn. Một kiểu pin Galvanic trên cơ sở chì khác được cho dưới đây. Pin sạc này chứa Pb2+ với độ tan lớn trong dung dịch methane-sulphonic acid CH3SO3H. Có hai điện cực trơ được nhúng vào dung dịch chất điện li. Khi nguồn cấp điện ngoài được nối với pin, Pb2+ bị khử ở một điện cực và bị oxid hóa ở một điện cực khác, với các sản phẩm tạo thành bám trên các điện cực tương ứng.
Hình 2: Sơ đồ giản lược của pin sạc acid - chì từ methane-sulphonic acid.
8) Viết bán phản ứng diễn ra ở cathode và anode của pin sạc ở hình 2 trong quá trình xả điện ở 298 K. Viết phản ứng xả điện tổng và tính Eo của pin.
9) Đối với pin ở hình 2, xác định những phát biểu sau là đúng hay sai: a) Giả sử rằng thể tích chất điện li được giữ nguyên thì pH của chất điện li sẽ giảm trong quá trình xả điện.
b) EMF của pin sẽ tăng khi nồng độ Pb2+ trong chất điện li tăng.
c) Năng lượng lưu trữ trong pin phụ thuộc vào tổng số lượng tiểu phân Pb trong pin.
Phần B: Tái chế pin sạc đã qua sử dụng trong ô tô và bộ đảo điện Gần đây, một nhóm các nhà khoa học đã chỉ ra rằng chất điện li cho pin sạc acid - chì ở hình 2 có thể thu được bằng cách tái sinh các điện cực của pin sạc ô tô. Để làm được điều này, các bản pin âm và dương của pin sạc đã qua sử dụng (hình 1) được rửa sạch, sấy khô tách riêng và nghiền thành bột. Thêm dung dịch methanesulfonic acid dư vào các bột này, thu được chất điện giải cho pin sạc acid - chì mới (hình 2).
10) Viết phương trình các phản ứng trong chuyển hóa này.
Một số máy tái chế quy mô nhỏ thu hồi kim loại Pb(s) và tách bỏ bùn PbSO4(r) từ các điện cực của pin sạc ô tô. Đã có nhiều nghiên cứu cho thấy một hợp chất X - hữu dụng cho việc chế tạo các pin mặt trời dạng màng mỏng trên cơ sở chì - có thể thu được từ bùn mà không cần nguồn năng lượng đầu vào cao. Để tổng hợp chất này, bùn PbSO4(s) đã được khuấy qua đêm với dung dịch gần bão hòa của muối A, tạo thành kết tủa trắng B, có thể thu được bằng phương pháp lọc.
11) Khi đun nóng trong ống nghiệm, A bị phân hủy thành ba chất khí không màu: một khí có tính acid, một khí có tính base và một khí trung tính. Cho que diêm đang cháy vào ống nghiệm thì ngọn lửa bị dập tắt, còn nếu cho đũa thủy tinh nhúng HCl lại gần miệng ống nghiệm thì xuất hiện khói trắng. Xác định A và B
Tiếp theo, acid một nấc yếu C được sử dụng để hòa tan B. 150 mg mẫu C được trung hòa hoàn toàn bởi 25 mL dung dịch NaOH 0.1 M.
12) Tính khối lượng mol và xác định chất C.
13) Khi thêm lượng dư một muối halide - dùng để điều trị bướu cổ - vào dung dịch trên thì thu được muối X ở dạng kết tủa vàng. Xác định X.
Bài 30
Tới đầu thế kỉ 21, acquy chì-acid có thể sạc lại vẫn là một trong những loại acquy phổ biến nhất được dùng cho ô tô. Nó có một số đặc tính vượt trội, và có thể tái chế gần như hoàn toàn. Khi xả điện, chì ở một điện cực và chì (IV) oxide ở một điện cực khác bị chuyển hoá thành chì sulphate. Sulphuric acid được dùng làm chất điện giải.
a) Viết các quá trình xảy ra ở anode, cathode và phản ứng tổng của acquy acid-chì khi xả điện.
PbSO4 có Ksp = 1.6 × 10-8. Giản đồ Latimer của chì (trong acid) là
b) Phản ứng dị phân (tự oxid hoá-khử) của ion chì(II) có tự diễn biến không? Giải thích bằng tính toán.
c) Tính thế mạch hở của một tế bào, hay cell (Eocell) trong acquy nạp đầy điện.
d) Tính thế mạch hở của một tế bào (Ecell) trong acquy nạp đầy điện (ở 25 oC) chứa sulphuric acid có khối lượng riêng bằng 1.275 gam.cm-3 .
|
C, thế mạch hở của một tế bào trong acquy chì-acid
e) Tính hệ số nhiệt độ (dEocell/dt) của một tế bào trong acquy chì-acid trong khoảng nhiệt độ này.
f) Dự đoán dấu enthalpy phản ứng của quá trình xả điện acquy.
g) Trong quá trình xả điện acquy
A. Nhiệt độ acquy tăng.
B. Nhiệt độ acquy giảm.
C. Nhiệt độ acquy không thay đổi.
D. Hơi nước thoát ra từ acquy do sự quá nhiệt.
Điện áp đầu ra của một acquy chì-acid thông thường là 12 V, và nó có chứa nhiều tế bào.
h) Cần sử dụng bao nhiêu tế bào để chế tạo acquy 12V?
i) Vẽ mạch điện trình bày cách ghép các tế bào riêng biệt trong acquy chì-acid.
j) Tính điện áp đầu ra lí thuyết của acquy chì-acid 12V, sử dụng thế mạch hở tính được ở câu d.
Acquy chì-acid thương mại có khối lượng là 4.05 kg (kích thước 9.75 × 9.8 × 15.01 cm), dung lượng 12 A.h và điện trở trong 100 mΩ.
k) Tính điện tích có thể thu được từ một acquy nạp đầy.
Sau khi xả điện acquy, khối lượng riêng của chất điện giải đo được là 1.195 gam.cm-3. Acquy nạp đầy có chứa 580 cm3 sulphuric acid.
l) Tính xem cần bao nhiêu giờ để nạp đầy acquy bằng dòng điện có cường độ trung bình 3A. Hiệu suất nạp điện là 65 %. Giả sử lượng nước không thay đổi.
m) Trong quá trình xả điện, điện trở trong của acquy
A. Tăng
B. Giảm
C. Giảm đột ngột
D. Không thay đổi
n) Thế mạch hở của acquy
A. Không thay đổi trong quá trình nạp điện.
B. Không thay đổi trong quá trình xả điện.
C. Tăng trong quá trình xả điện. D. Tăng trong quá trình nạp điện.
E. Giảm trong quá trình nạp điện.
Hiệu suất nạp điện thấp hơn 100 % khá nhiều do sử dụng điện áp quá mức ở các điện cực, do vậy thay vì chỉ nạp điện còn xảy ra các phản ứng phụ: giải phóng hydrogen và oxygen.
o) Viết phương trình các phản ứng phụ xảy ra ở anode và cathode khi xả điện.
Có thể so sánh hiệu năng của các thiết bị lưu trữ năng lượng khác nhau dựa vào mật độ năng lượng cực đại Wmax = qE/m, trong đó q là điện lượng lưu trữ trong thiết bị, E là cửa sổ điện áp (voltage window) hoạt động, và m là khối lượng thiết bị. Siêu tụ điện Maxwell BCAP3000 có các đặc trưng sau: điện dung 3000 F, cửa sổ điện áp 2.7 V và nặng 510 gam.
p) Thiết bị lưu trữ điện nào (acquy thương mại hay siêu tụ điện) có mật độ năng lượng cực đại (Wh/kg) cao hơn? Trong quá trình xả acquy, thế không đổi nhưng khi xả tụ điện thì thế giảm gần như tuyến tính, nghĩa là có thể sử dụng điện áp trung bình.
q) Mật độ năng lượng của acquy chì-acid
A. Tăng theo nhiệt độ.
B. Giảm theo nhiệt độ.
C. Không thay đổi theo nhiệt độ.
D. Tăng khi xả điện.
E. Tăng khi nạp điện.
Bài 31
Gần đây, nghiên cứu về một loại acquy thuận nghịch mới đã được công bố. Điện cực âm của loại pin này là kim loại nhôm, còn điện cực dương là Cn[AlCl4], trong đó Cn là graphite, dung dịch điện li là chất lỏng ion tạo thành từ imidazolium cation thế alkyl (R+) và AlCl4-anion. Khi pin xả điện, có sự tạo thành một phức hai nhân ở gần cực âm. Trong quá trình nạp điện và xả điện, cation trong chất lỏng ion luôn không thay đổi.
1) Viết phương trình phản ứng xảy ra ở cực dương, cực âm và trong cả acquy khi xả điện.
2) Graphite (than chì) được tạo thành theo phương pháp sau: methane bị nhiệt phân khi có mặt một lượng lớn hydrogen, tạo thành carbon bám trên bề mặt nickel bọt. Viết phương trình phản ứng nhiệt phân methane. Mục đích của việc sử dụng nickel bọt là gì? Giải thích ngắn gọn.
3) Viết phương trình phản ứng của nickel sau khi graphite được tạo thành.
4) Dung dịch điện li của acquy được điều chế bằng cách hòa tan aluminum trichloride khan vào hydrocarbon trong chất lỏng ion imidazole chloride. Viết phương trình phản ứng.
|
Thí nghiệm sau được tiến hành ở 30,00 oC. Một pin điện hóa được tạo thành từ một pin bán phần (nửa pin) hydrogen chứa điện cực platinum kim loại nhúng vào dung dịch đệm dưới khí quyển hydrogen, [Pt(s) | H2(g) | H+(aq)]. Pin bán phần hydrogen này được nối với một pin bán phần của thanh kim loại M nhúng vào dung dịch M2+(aq), chưa biết nồng độ. Hai pin bán phần được nối với nhau qua một cầu muối như trong hình 1.

Hình 1: Pin Galvani

1) Khi tỉ số phản ứng (tỉ số nồng độ các chất lúc chưa cân bằng, Q) của pin Galvanic bằng 2,18.10-4 ở 30,00 o
2)
1:
chuẩn (trong
3)
dịch M2+(aq) cho vào bình định mức rồi thêm lượng dư KI vào. Cần 25,05 ml dung dịch sodium thiosulfate 0,800 M để đạt tới điểm tương đương.
Viết tất cả các phương trình phản ứng oxid hóa-khử liên quan tới phép chuẩn độ này và tính nồng độ dung dịch M2+(aq).
[Nếu thí sinh không tìm được câu trả lời, có thể sử dụng giá trị nồng độ M2+ là 0,950 M cho các tính toán tiếp theo.]
4) Khi pin bán phần hydrogen (trong hình 1) ở dưới khí quyển hydrogen 0,360 bar và điện cực platinum bị nhúng vào 500 mL dung dịch đệm chứa 0,050 mol lactic acid (HC3H5O3) và 0,025 mol sodium lactate (C3H5O3Na) thì suất điện động đo được là +0,534 V.
Tính pH của dung dịch đệm và hằng số phân li (Ka) của lactic acid ở 30,00 oC.
[Nếu thí sinh không tìm được câu trả lời, có thể sử dụng giá trị pH đệm là 3,46 để tính Ka.]
Bài 34
Năm 1936, trong những cuộc khai quật gần Baghdad (Iraq), nhà khảo cổ học Wilhelm Koenig đã khám phá ra một chiếc bình thuộc thời kì Parthian (khoảng năm 0 sau Công nguyên). Bên trong là một ống trụ bằng đồng với một thanh sắt đã được cắm vào bên trong. Suy luận về việc sử dụng chiếc bình đã gây ra nhiều giả thuyết gây tranh cãi. Theo quan điểm được đưa ra bởi chính Koenig thì thiết bị này là một nguồn điện hóa học (HIT) hay pin điện hóa. Để củng cố cho giả thuyết của mình, Koenig đã chế tạo ra một thiết bị tương tự, dùng chất điện giải CH3COOH, và thu được một suất điện động E ≈ 0.5 V.
1)
a) Viết phương trình phản ứng diễn ra trong pin.
b) Kim loại nào ở cathode, kim loại nào ở anode trong HIT?
c) Viết phương trình diễn ra ở các điện cực.
2) Chất điện li mà người Parthian đã sử dụng có thể là nước nho đã lên men chứa các acetic, lactic, citric, butyric acid.
a) Sắp xếp các acid này theo thứ tự tăng dần Ka1.
b) Hoàn thành các phương trình chuyển hóa đường C6H12O6 thành mỗi acid này:
C6H12O6 + O2 →... (butyric acid)

C6H12O6 + O2 →... (ace c acid)
C6H12O6 → ... (lac c acid)
C6H12O6 + O2 → ... (citric acid)
c) Dung dịch acid nào sẽ tạo ra HIT có thế lớn nhất, giả sử rằng nồng độ các acid trong các dung dịch giống nhau.
3) Giả sử rằng người Parthian đã tìm được dung dịch một acid mạnh với pH = -1. Hãy đánh giá những đặc tính kĩ thuật của pin.
a) Xác định EMF cực đại dưới điều kiện [Fe2+] = 10-4 M.
|
b) Tính điện lượng Q (C) có thể được tạo thành bởi HIT nếu khối lượng trụ sắt là 25 gram.
4) Những người phản đối quan điểm của Koenig đã hỏi về mục đích sử dụng thiết bị này. Cần bao nhiêu quả pin HIT để tạo được thế U = 220 V (sử dụng Emax cho các tính toán)? Đối với bán phản ứng aA + ne → bB, phương trình Nernst là:
Bài 35
Tế bào điện hóa (ắc-quy) galvanic gồm 2 nửa pin, chứa các dung dịch copper (đồng) và zinc (kẽm) sulfate và hai điện cực đồng, kẽm được nhúng vào các dung dịch.
Các thể tích đầu của các dung dịch này là 50.0 mL. Sau khi thêm vào 5.00 mL dung dịch CuSO4 0.100 M vào dung dịch CuSO4 thì suất điện động (EMF) tăng 0.0077 V. Sau khi thêm tiếp 5.00 mL dung dịch ZnSO4 0.100 M vào dung dịch ZnSO4 thì EMF giảm 0.0012 V. Thế khử chuẩn của điện cực đồng và kẽm lần lượt
E0.337 V, E-0.763 V. Thế của điện cực có thể được tính theo phương trình
Hằng số Faraday (điện tích của 1 mol electron) F = 96500 C / mol.

Công thức cấu tạo của lactic, butyric và citric acid lần lượt là:
trong
chênh lệch thế giữa các điện cực.
electron trong bán phản ứng.
1) Viết các phương trình phản ứng diễn ra trên các điện cực. Điện cực nào là cathode, điện cực nào là anode?
2) Tính EMF của pin điện chứa dung dịch ZnSO4 0.01 M và CuSO4 0.05 M.
3) Xác định nồng độ đầu của các muối đồng và kẽm.
4) Tính EMF sau khi thêm các dung dịch vào.
5) Khi thêm dung dịch ammonia (V = 25.0 mL, c = 0.24 M) vào 50.0 mL dung dịch CuSO4 9.94 mmol/L thì EMF giảm 0.2289 V. Xác định hằng
|

Chất H2A là dạng khử của chất A (C6H4O2). Phổ H-NMR của A chỉ có một tín hiệu - một mũi đơn hẹp ở 6.73 ppm, còn của H2A có hai mũi đơn - một mũi đơn rộng ở 7.79 ppm và một hẹp ở 6.68 ppm. Tỉ lệ cường độ tích phân là 1:2. Phức chất đẳng phân tử X tạo thành từ các chất trên thường được dùng trong hóa phân tích để xác định pH bằng phương pháp điện thế.
Để xác định hàm lượng của boric acid trong mẫu dung dịch có thể tích 250 mL, người ta thêm vào mẫu 12.5 mL dung dịch NaCl 2M, vài giọt bromothymol xanh và NaOH đến khi gần kết thúc phản ứng trung hòa. Thêm vào dung dịch thu được ~0.2 gram X (lượng chất đủ để tạo dung dịch bão hòa) và nhúng vào dung dịch 2 điện cực bạc-chloride và platine, nối với nhau thành mạch kín cùng với điện kế galvano. Cẩn thận thêm dung dịch NaOH đến khi galvano kế chỉ về 0. pH thu được là 7.3. Thêm vào dung dịch 10 gram mannitol, khi đó kim chỉ của galvano kế lệch khỏi vạch 0. Dung dịch thu được được chuẩn độ bằng dung dịch NaOH 0.0231 M đến khi kim galvano kế chỉ về 0. Thể tích NaOH dùng để chuẩn độ là 3.46 mL.
1) Vẽ công thức cấu tạo các chất A, H2A và cho biết tên gọi của X
2) Để xác định pH dung dịch người ta đo điện thế của điện cực với phức chất X so với điện cực tiêu chuẩn calomel bão hòa. Giá trị thu được là 0.322 V. Xác định pH dung dịch, nếu biết điện thế của điện cực calomel bão hòa là Ecal = 0.246 V, EoA,2H+/H2A = 0.699 V. Nhiệt độ khi đo là 22oC. Hằng số Faraday = 96500 C/mol.
3) Viết phương trình dạng tổng quát của phản ứng xảy ra khi thêm mannitol vào dung dịch
4) Tính hàm lượng boric acid trong dung dịch ban đầu (theo đơn vị mg nguyên tố B).
5) Tính sai số (φ) định lượng boron trong dung dịch nếu giả sử rằng tại điểm tương đương pH = 7.0
6) Tính năng lượng tự do Gibbs tiêu chuẩn (22oC, không phụ thuộc pH) của nửa phản ứng oxid hóa-khử A,2H+/H2A. Viết phương trình phụ thuộc của năng lượng Gibbs vào pH dung dịch, sử dụng phương trình ΔG = - nFE. Vẽ giản đồ phụ thuộc của ΔG vào pH dung dịch.
|
Dung dịch A gồm FeSO4 0,020 M; Fe2(SO4)3 và H2SO4
a) Lấy chính xác 25,00 ml dung dịch A, khử Fe3+ thành Fe2+; chuẩn độ Fe2+ trong hỗn hợp (ở điều kiện thích hợp) hết 11,78 ml K2Cr2O7 0,0180 M. Hãy viết phương trình ion của phản ứng chuẩn độ. Tính nồng độ M của Fe2(SO4)3 trong dung dịch A.
b) Tính nồng độ M của H2SO4 trong dung dịch A, biết dung dịch này có pH = 1,07.
c) Ghép cực Pt nhúng trong dung dịch A (qua cầu muối) với cực Ag nhúng trong dung dịch AgNO3 0,0190 M có thêm K2CrO4 cho đến nồng độ 0,0100 M (coi thể tích được giữ nguyên). Hãy cho biết anot, catot và viết phương trình phản ứng xảy ra khi pin hoạt động. Tính sức điện động của pin.
Bài 38
Pin điện hóa sau đây dựa trên phản ứng ở pha rắn và hoạt động thuận nghịch ở 1000K dưới dòng khí O2. Các ion F khuếch tán thông qua CaF2(r) ở 1000K.
(-) MgF2(r), MgO(r) | CaF2(r) | MgF2(r), MgAl2O4(r), Al2O3(r) (+) Các nửa phản ứng: Ở điện cực âm: MgO(r) + 2F → MgF2(r) + 1/2O2(k) + 2e Ở điện cực dương: MgF2(r) + Al2O3(r) + 1/2O2(k) + 2e → MgAl2O4(r) + 2F
Cho pKa: HSO4 1,99; Fe3+( Fe3+ + H2O
FeOH2+ + H+) 2,17; Fe2+( Fe2+ + H2O
FeOH+ + H+) 5,69.
Chỉ số tích số tan pKs của Ag2CrO4 11,89. Eo : Fe3+/ Fe2+ 0,771 V; Ag+/Ag 0,799 V; (RT/F)ln = 0,0592 lg.
a) Viết phương trình Nernst cho mỗi nửa pin. Viết phương trình phản ứng tổng cộng khi pin hoạt động và phương trình Nernst của nó. Coi áp suất O2(k) là như nhau ở hai điện cực. Nồng độ của ion F là bằng nhau ở hai điện cực và được duy trì bởi dòng khuếch tán ion F thông qua CaF2(r).
b) Tính ∆Go của phản ứng (ở 1000K) biết rằng, Eo (ở 1000K) của phản ứng là 0,1529V.
c) Sức điện động chuẩn của pin trong khoảng nhiệt độ từ 900K đến 1250 K là: Eo(V) = 0,1223 + 3,06.10-5T
Giả thiết ∆Ho và ∆So là hằng số, tính các giá trị này.
Oxit có cấu trúc tinh thể kiểu CaF2 chứa lượng lớn các hốc oxy sẽ thể hiện khả năng dẫn điện kiểu oxit-ion khi đun nóng ở nhiệt độ cao, và các oxit này thường được gọi là các chất dẫn điện rắn. Một tế bào điện hóa sử dụng chất dẫn điện rắn với các điện cực Pt nhiều lỗ có thể dùng làm đầu dò oxy, chất bơm oxy và pin nhiên liệu, v.v…
Trong bơm oxy, phân tử oxy bị khử thành ion oxit ở catot, và ion oxit sẽ di chuyển đến anot rồi bị oxy hóa thành phân tử oxy bởi một hiệu điện thế ngoài. Thêm vào đó khi áp suất riêng phần của oxy khác nhau ở hai cực mà mạch điện vẫn hở thì sẽ tạo thành một sức điện động giữa hai cực, hiện tượng này được sử dụng làm đầu dò oxy.
a) Viết các phản ứng xảy ra ở anot và catot trong quá trình bơm oxy.
c) Để đưa ion oxy từ catot sang anot thì áp một dòng điện có cường độ 1.93 A trong 500 s. Tính thể tích khí oxy (mL) sinh ra ở anot ở 800 ºC và 1.01 x 105 Pa. Ghi kết quả đến hai chữ số có nghĩa.
c) Tính sức điện động (V) giữa hai cực khi tỉ lệ áp suất riêng phần của oxy P1 và P2 ở cả hai cực được điều chỉnh sao cho P1/P2 = 100 ở
800 ºC. Bỏ qua sự dẫn điện của chất dẫn điện rắn.
Bài 40
Quá trình tạo ảnh chụp đen trắng gồm 4 giai đoạn: phơi (phân hủy AgBr dưới tác động ánh sáng), rửa ảnh (xử lí với dung dịch C6H4(OH)2 trong kiềm), cố định (xử lí với dung dịch Na2S2O3), và rửa với nước.
Trong quá trình quang phân, các tâm nhạy cảm (sensitive centers - CS, là các cụm Ag4) được tạo thành ở dạng vi tinh thể (microcrystal - MC). Các CS làm tăng tốc độ rửa (khử toàn bộ MC thành Ag). Độ nhạy cảm của các lớp ảnh được đặc trưng bởi ngưỡng nhạy cảm SDo+0.1. Giá trị này là nghịch đảo của năng lượng cần để tạo ảnh sau khi rửa với mật độ quang (D) của các vùng phơi sáng sẽ cao hơn 0.10 đơn vị D, so với các vùng không phơi sáng (Do). Giả sử rằng các khối lập phương MC có độ dài cạnh 4.2·10-5 cm được sắp xếp trong 1 đơn lớp. Hàm lượng bạc trong lớp ảnh là 2.8 gam/m2. Quá trình phơi thực hiện với ánh sáng (λ = 550 nm với công suất 5.0·10-3 J s-1 cm-2) được hấp thụ hoàn toàn bởi MC. Độ bao phủ của bạc là m/s = 5.0 gam/m2 (m là khối lượng của bạc, được tạo thành trong ảnh với D = 1.0 trên diện tích s).
1) Viết các phương trình phản ứng ion xảy ra khi phơi, rửa và cố định ảnh.
2) Sử dụng các giá trị ΔGo theo kJ/mol của AgBr (-97), S2O3 2- (-514), Ag(S2O3)2- (-486), Ag(S2O3)2 3- (-1027), OH (157), Br (104), H2O (-237), C6H4(OH)2 (-222), C6H4O2 (-91), hãy thiết lập:
a) công thức phức chất, được tạo ra chủ yếu trong quá trình cố định; b) giá trị pH cực tiểu khi cố định, giả sử tất cả các giá trị hoạt độ đều chuẩn, ngoại trừ OH . Biết F = 96500.
3) Tính số MC của AgBr chứa trong 1 cm2 lớp ảnh. Biết khối lượng riêng của AgBr là 6.47 gam/cm3 .
4) Ước lượng thời gian phơi cần thiết để nhận được ảnh với D = 0.50. Biết rằng hiệu suất lượng tử bằng 1 và MC không phơi thì không xuất hiện. Cho h = 6.626·10-34 J.s.
5) Ước lượng SDo+0.1 của lớp ảnh.
|
Điện cực chọn lọc ion là công cụ rất hữu ích trong các phép phân tích hiện đại, chủ yếu nhờ vào cách thức hoạt động đơn giản và chi phí tương đối thấp của bộ đo. Chúng thường được dùng trong phân tích lâm sàng và phân tích các mẫu môi trường. Thế của điện cực chọn lọc ion được mô tả theo phương trình:
2) Thế của điện cực này được đo trong dung dịch KCl 0.01 mol/dm3 là 0.371 V, còn trong dung dịch NaCl với cùng nồng độ là 0.123 V. Trên cơ sở này, tính hệ số chọn lọc của Na+, KKa, Na. Nguyên nhân nào khiến cho tương tác giữa K+ với valinomycin tốt hơn Na+?
3) Tính thế của điện cực này trong dung dịch KCl 10-3 mol/dm3. Nếu dung dịch có thêm các ion gây nhiễu Na+ thì giá trị thế đo được sẽ khác so với khi không có Na+. Nồng độ NaCl trong dung dịch KCl phải lớn cỡ nào (gấp bao nhiêu lần K+) để thế đo được chỉ tăng thêm 1 mV?
Trong đó T là nhiệt độ (tính theo K); n là điện tích của ion phân tích có nồng độ ci; c là nồng độ của các ion “gây nhiễu” trong dung dịch; Ki,j là hệ số chọn lọc của ion j (nên giá trị hệ số này phải thấp). Phương trình trên thoả mãn khi điện tích của các ion phân tích và gây nhiễu giống nhau.
Các điện cực chọn lọc nhạy ion có cấu trúc tương tự, có thành phần quan trọng nhất là một màng nhựa (thường là polyvinyl chloride với các phụ gia) chứa thể mang ion (ionophore) - một chất hữu cơ tạo phức chọn lọc với các cation nhất định.
1) Màng của điện cực chọn lọc K+ có chứa thể mang tự ion tự nhiên: valinomycin (xem hình). Nồng độ K+ trong huyết thanh nằm trong khoảng 3
4) Một ví dụ về nguyên mẫu chưa hoàn thiện của các điện cực chọn lọc ion hiện đại là điện cực chlorine-silver (AgCl phủ bạc), nhạy với Cl ion. Dẫn ra phương trình về sự phụ thuộc của thế điện cực này với nồng độ chloride ion, sử dụng các chất rắn được cho ở cuối bài. Tính thế của điện cực chlorosilicate trong dung dịch NaCl 0.01 mol/dm3 .
5) Có thể xác định hệ số chọn lọc ion Br của điện cực chlorine bằng cách xác định thế của điện cực này trong trong dung dịch NaBr, cũng nồng độ 0.01 mol/dm3. Quá trình hoá học nào sẽ xảy ra trong trường hợp này? Viết phương trình ion cho phản ứng. Tính giá trị thế của dung dịch khi cân bằng được thiết lập. Tính hệ số chọn lọc của Br (KCl,Br). Có thể nhận xét gì về giá trị thu được với điện cực chlorine trong vai trò điện cực chọn lọc ion.
10-3 đến 6
10-3 mol/dm3. Tính giá trị thế tăng lên ở điện cực chọn lọc ion, tương ứng với sự chuyển đổi từ nồng độ potassium thấp nhất đến cao nhất?

6) Thế của điện cực chlorine không phụ thuộc vào nồng độ chloride ion trong mẫu khi giá trị này bé hơn 10-5 mol/dm3. Giải thích tại sao.
Cho biết các dữ liệu sau (đo ở 25 oC): Hằng số khí, R = 8.314 J / (mol K); hằng số Faraday, F = 96484 C / mol Thế khử tiêu chuẩn Ag+/Ag: E0 = 0.799 V

Tích số tan: Ks0(AgCl) = 1.610-10; Ks0(AgBr) = 5⋅10-13
|
Potassium permanganate (KMnO4), còn được gọi là khoáng chameleon (“tắc kè hoa”) hay “tinh thể của Condy”, là hợp chất hữu cơ tan được trong nước tạo thành dung dịch màu tím hoặc hồng đậm. Khi làm bay hơi dung dịch này sẽ thu được các tinh thể lấp lánh màu đen ánh tía, có hình lục lăng. Có thể điều chế lượng nhỏ potassium permanganate bằng phản ứng tự oxid hóa khử của potassium manganate trong môi trường acid.
1) Viết phương trình của phản ứng này.
2) Vẽ cấu trúc Lewis của các tiểu phân manganate và permanganate. Xác định tiểu phân nào có tính thuận từ. Tính moment từ của tiểu phân thuận từ.
3) Khi thêm H2SO4 đặc vào KMnO4 thì thu được dimanganese heptaoxide dạng dầu màu, có xanh lục.
a) Viết phương trình phản ứng.
b) Vẽ cấu trúc của dimanganese heptaoxide.
4) Oxide trên bị phân hủy tạo thành manganese dioxide. Viết phương trình phản ứng.

Dưới đây là giản đồ Latimer của các tiểu phân manganese trong môi trường acid (pH = 1). Các giá trị Eo là thế khử chuẩn, tính theo volt.
X(N)/X(0) với số oxid hóa (N). Đồ thị này có thể được xây dựng từ giản đồ Latimer. Dưới đây là giản đồ Frost của các tiểu phân manganese trong môi trường acid và base.
5) Trong môi trường acid, MnO2 rắn bị chuyển thành Mn2+ và MnO4
a) Viết các bán phản ứng và phản ứng tổng.
b) Sử dụng giản đồ Latimer, tính thế chuẩn của mỗi điện cực và suất điện động của pin.
c) Tính K của toàn phản ứng.
Trong môi trường acid, MnO4 là tác nhân oxid hóa mạnh và thường được dùng trong chuẩn độ oxid hóa-khử. Các cửa hàng dược phẩm bán dung dịch H2O2 6 % (w/w) làm thuốc tẩy uế. Lấy một lượng dung dịch H2O2 đem chuẩn độ với dung dịch KMnO4 0.02 M trong môi trường acid thì cần 15.0 mL dung dịch chất chuẩn.
6) Viết phương trình phản ứng chuẩn độ. Tính khối lượng H2O2 đã đem chuẩn độ.
Giản đồ Frost (còn được gọi là giản đồ trạng thái oxid hóa) của một nguyên tố X là đồ thị biểu diễn tương quan của thế cân bằng (NEo) của một cặp
7) Sử dụng giản đồ trên, hãy xác định
i) Hệ số góc của đường thẳng nối hai điểm liên tiếp thì bằng với?
ii) trạng thái oxid hóa bền nhất của manganese trong các môi trường acid và base.
iii) trong môi trường base, các tiểu phân manganese nào bị dị phân (tự oxid hóa-khử)?
iv) trong môi trường acid, hai cặp tiểu phân manganese nào sẽ kết hợp được với nhau (trái ngược với sự dị phân)?
v) trong môi trường base, các tiểu phân nào thể đóng vai trò chất khử?
vi) trong môi trường base, tác nhân oxid hóa yếu nhất là?
Giản đồ Pourbaix của manganese là đồ thị biểu diễn mối liên hệ thế (E)pH và xác định điều kiện mà tại đó các tiểu phân manganese khác nhau bền trong môi trường nước ở 25 oC và nồng độ 1 M.
Các giản đồ này thường được sử dụng trong nghiên cứu địa hóa học, môi trường và hiện tượng ăn mòn. Trong giản đồ này
• Các đường ngang chia cách những tiểu phân chỉ có liên hệ bởi sự chuyển electron.
• Các đường dọc chia cách những tiểu phân chỉ có liên hệ bởi sự chuyển proton.
• Các đường nghiêng chia cách những tiểu phân có liên hệ bởi cả sự chuyển proton và electron.
• Giữa các đường nét đứt (a) và (b) thì nước bền, trong khi đó trên đường (a) nó bị oxid hóa thành O2 và dưới đường (b) thì bị phân hủy thành H2.
8) Sử dụng giản đồ trên, hãy xác định
i) tiểu phân nào của manganese chiếm ưu thế trong: a) các hồ nước giàu oxygen, pH ≈ 7; các hồ nước sâu nhiều oxygen, bị ô nhiễm bởi các base, pH ≈ 10.0;

ii) Với các nhà vệ sinh sử dụng nước ngầm có tính acid khá yếu (pH ≈6) thì xuất hiện kết tủa bám trên thành toilet: a) xác định
các tiểu phân rắn đó; b) xác định tiểu phân manganese được tìm thấy trong nước ngầm ở dưới lòng đất.
iii) Xác định các tiểu phân tồn tại trong nước biển ở pH = 8 và E = + 0.2V đến + 0.6 V.
Đồ thị dưới đây của một hệ carbonic acid-carbonate (CO3 2- có nồng độ là 1.0·10-2 mol L-1), biểu diễn mối liên hệ giữa sự có mặt của uranium và thế của điện cực liên quan với pH (giản đồ E-pH, điện cực hydrogen chuẩn được dùng làm điện cực tham chiếu). Để so sánh, đường nét đứt biểu diễn mối liên hệ E-pH với các cặp H+/H2 và O2/H2O.
Bài 44“Copper Man” là một thợ mỏ đồng người Chile, bị mắc kẹt trong một mỏ đồng vào năm 550 sau công nguyên và sau đó bị “đồng hóa” (cơ thể bị phủ đồng). Xác ướp này đã trở thành chủ đề được quan tâm trong nhiều lĩnh vực như khảo cổ, luyện kim và gần đây hơn là nghệ thuật.
1) Trong những điều kiện phù hợp, bụi than có thể xúc tiến cho phản ứng dẫn đến sự phủ đồng Copper Man. Giả sử rằng Copper Man bị phủ bởi Cu2O và Cu0 - được tạo ra từ các muối Cu2+ trong mỏ đồng. Xác định vai trò của than trong phản ứng này.
A) chất khử.
B) chất oxid hóa.
C) xúc tác.
D) chất cách điện.
E) không phải các phương án trên.
2) Cho các phản ứng và thế khử tương ứng sau:
Cu2O + 2H+ + 2e → 2Cu + H2O E0red = 0.471 - 0.059(pH)
CuO + 2H+ + 2e → Cu + H2O E0red = 0.570 - 0.059(pH)

Hãy xây dựng một giản đồ Latimer cho các cặp oxid hóa/khử trên và tính thế khử của CuO/Cu2O trong môi trường trung tính (pH = 7.0).
1) Tính nồng độ các tiểu phân tồn tại chính trong hệ carbonic acidcarbonate ở pH 4.0 và 6.0. Cho biết với H2CO3: Ka1 = 4.5·10-7, Ka2 = 4.7·10-11 .
2) Trong đồ thị trên, a và b là các đường thẳng ở pH = 4.4 và 6.1. Viết phương trình phản ứng tạo thành các tiểu phân tương ứng với a, b.
3) Viết các phương trình phản ứng tương ứng với c, d.
4) Thêm UCl3 vào hệ đệm ở pH = 4.0. Viết phương trình phản ứng xảy ra.
5) Trong khoảng pH 8.0 - 12, thì UO2(CO3)3 4- và U4O9(s) có thể cùng tồn tại trong hệ không? Giải thích. Tương tự với trường hợp UO2(CO3)3 4và UO2(s).
3) Chalcanthite, dạng pentahydrate của copper sulfate, là khoáng chất mà Copper Man đã khai thác được từ mỏ đồng. Để chiết xuất đồng từ chalcanthite, Copper Man đã nung chalcanthite đến hơn 700 oC, có mặt Na2O và có thể đã xảy ra các phản ứng nổ sau đây: 4CuSO4 + 4Na2O → 4Na2SO4 + 2Cu2O + O2 Phản ứng I Cu2O + CO
2Cu0
CO
Phản ứng II Sử dụng các giá trị thế khử chuẩn của các bán phản ứng, hãy tính biến thiên năng lượng tự
Gibbs của từng phản ứng. Cho biết: CO2
CO
0red = 0.11 V O
0red = 1.23
Trong một cuộc triển lãm, cần phải dùng pin Galvani để phục chế Copper Man. Xét giản đồ Pourbaix của đồng.
Bài 45
Tên gọi chromium (trong tiếng Hi Lạp nghĩa là “màu sắc”) bắt nguồn từ tính đa dạng và màu sắc của các hợp chất, ion của nó. Dưới đây là giản đồ Latimer cho một số ion có màu ở pH = 0. Tất cả các giá trị thế được tính theo đơn vị volt.
4) Trong pin Galvani, Copper Man là một điện cực trong dung dịch X, ghép với điện cực kim loại Y trong dung dịch chứa ion của kim loại đó.
a) Thành phần chính của dung dịch X là A. CuCl2 B. Na2CuO2 C. Cu(OH)2 D. CuCl
b) Kim loại Y phù hợp với quá trình mạ đồng trong pin Galvani là A. Zn B. Ag C. Na D. Au c) Vẽ giản đồ pin Galvani. Chỉ rõ các thành phần bao gồm điện cực (cathode, anode), chất điện li và các phản ứng diễn ra trong các điện cực.




1) Tính các giá trị thế x, y còn thiếu.
2) Chứng minh bằng tính toán rằng Cr(VI) có thể dị phân (tự oxid hóakhử) thành Cr(III) và Cr(VI).
3) Tính hằng số cân bằng của phản ứng dị phân này ở 25 oC.
4) Cr(II) có xu hướng dị phân thành Cr(III) và Cr(0) không? Minh họa qua giản đồ Frost.
Bằng cách đồ thị hóa các giá trị thế oxid hóa-khử của tất cả các tiểu phân chromium theo pH, chúng ta có giản đồ Pourbaix dưới đây. Giản đồ này dựa vào giả định rằng hoạt độ của tất cả các tiểu phân tham gia vào một cân bằng với H+(H3O+) lên tới a = 1.
|
5) Xác định hai tiểu phân từ giản đồ mà giữa chúng xảy ra một phản ứng oxid hóa khử không phụ thuộc pH, ít nhất là trong một khoảng pH xác định.
6) Xác định hai tiểu phân từ giản đồ mà giữa chúng xảy ra một phản ứng chuyển proton không phụ thuộc vào thế. Hệ oxid hóa-khử dichromate/chromium (III) thường được sử dụng trong hóa phân tích. Thế chuẩn của cặp này là E0(Cr2O7 2-/Cr3+) = +1.33 V.

7) Trong khoảng pH nào Cr2O7 2- bị chuyển thành Cr3+?
8) Viết bán phản ứng của cặp oxid hóa-khử Cr2O7 2-/Cr3+ .
9) Dẫn ra phương trình E = f(pH) cho đường giữa các tiểu phân Cr2O7 2và Cr3+ ở 298 K. (Giả sử: Hoạt độ của tất cả các tiểu phân chromium vẫn không thay đổi.)
10) Sử dụng phương trình đã dẫn ra, tính giá trị E ở pH = 2.
Bài 46
Các phản ứng oxi hóa khử như trái tim của quá trình quang hợp. Một số phản ứng là tự diễn biến, còn gọi là phản ứng thải nhiệt (exergonic: ∆G <0); những phản ứng còn lại được thực hiện bởi ánh sáng hoặc là các phản ứng hóa học liên hợp nhau (endergonic: ∆G >0). Mọi phản ứng oxi hóa khử đều bao gồm hai quá trình liên hợp (các nửa phản ứng: quá trình oxi hóa và quá trình khử). Trong phản ứng quang hợp, các nửa phản ứng ứng không chỉ xảy ra tại một nơi mà còn cùng thời điểm. Trong các cơ thể sống, nó được biểu diễn bởi các phản ứng oxi hóa khử trong nhiều bước liên quan tới các chất hữu cơ sinh học: enzym, cofactor (nhân tố cần thiết để enzym hoạt động được)... Mọi nửa phản ứng được đặc trưng bởi thế oxi hóa khử chuẩn Eo, nó liên quan tới dung dịch nồng độ 1M cho tất cả các chất trong dung dịch và áp suất 1 bar cho tất cả các chất khí. Giá trị Eo cho một vài phản ứng liên quan tới quá trình quang hợp được cho trong bảng dưới đây. Các nhà hóa sinh thường sử dụng thế chuẩn ở pH = 7,0 và ký hiệu là Eo ′ Phản ứng quang hợp trong cây xanh và tảo có thể được mô tả bằng một phản ứng tổng cộng: H2O + CO2 → CH2O + O2
Trong quá trình này nước bị oxi hóa thành O2 và cacbonic bị khử thành cacbohiđrat. Phản ứng đầu xảy ra dưới tác dụng của ánh sáng được gọi là giai đoạn sáng; phản ứng sau là phản ứng thải nhiệt và liên quan đến giai đoạn tối.
oxi hóa khử tiêu chuẩn, E
(V)
|
Chlorophyll+ + e → Chlorophyll 0,78
1. Tính thế oxi hóa khử sinh học chuẩn cho tất cả các nửa phản ứng trên?
2. Sử dụng các kết quả thu được ở câu 2, xác định Eo và Eo ′ cho nửa phản ứng của CO2 khử thành CH2O?
3. Một số vi khuẩn chuyển CO2 thành các vật liệu hữu cơ, nhưng không tạo ra khí oxi. Trong những cơ thể này, các chất khác bị oxi hóa thay cho nước, ví dụ như H2S hoặc H2. Viết phương trình phản ứng tổng cộng của quá trình quang hợp trong vi khuẩn sulfur, chất nào oxi hóa hiđro sulfua thành lưu huỳnh nguyên tố?
Tác phương trình này thành các bước oxi hóa và khử. Tính năng lượng Gibbs tiêu chuẩn của phương trình tổng cộng tại 298 K. Giả sử rằng phương trình được thực hiện bởi ánh sáng, xác định số lượng photon nhỏ nhất (bước sóng trung bình, λ = 840 nm) cần thiết để oxi hóa một phân tử hiđro sulfua?
4. Các phản ứng sáng trong cây xanh thực hiện quá trình oxi hóa nước, quá trình khử chuyển NADP+ thành NADP⋅H; và tạo ra adenosine triphosphate (ATP) từ adenosine diphosphate (ADP) và HPO4 2- (ký hiệu là Pi). Quá trình tạo ra ATP được mô tả bằng phương trình: ADP + P + H+ → ATP + H2O
Viết phương trình tổng cộng của giai đoạn sáng của quá trình quang hợp trong cây xanh?
Trong các giai đoạn sáng, năng lượng được chuyển hóa thành năng lượng hóa học chứa trong ATP và NADH⋅H và giải phóng trong các phản ứng tối sau đó, phản ứng nào là thu năng lượng cao hơn?
5. Tính năng lượng Gibbs của phản ứng tổng cộng mô tả giai đoạn sáng của quá trình quang hợp, biết rằng năng lượng Gibbs hình thành sinhhóa học tiêu chuẩn của ATP là +30,5 kJ.mol-1 .
6. Các tính chất oxi hóa khử của các phân tử có thể đổi dấu nếu electron bị kích thích. Trạng thái kích thích có thể tạo ra chất oxi hóa mạnh hơn và chất khử mạnh hơn trạng thái cơ bản. Giả thích điều đó một cách định tính, coi như quá trình kích thích giống như một sự chuyển electron giữa HOMO và LUMO.
7. Trong tất cả các quá trình quang hợp của sinh vật được biết đến, trạng thái kích thích là những chất khử mạnh. Rút ra phương trình liên hệ thế oxi hóa khử của trạng thái kích thích, thế oxi hóa khử của trạng thái cơ bản và năng lượng kích thích, Ekt = hν. Sử dụng phương trình này, tính thế oxi hóa khử chuẩn cho quá trình: P680+ + e → P680* (λkt = 680 nm) và Chlorophyll+ + e → Chlorophyll* (λkt = 680 nm). Dấu sao (*) ký hiệu cho trạng thái kích thích.
|
47
Cho biết Eo(FeO4 2-/Fe3+) = 2.20 V, Eo(FeO4 2-/Fe(OH)3) = 0.72 V.
a) Viết phương trình phản ứng giữa chlorine và iron(III) trichloride để tạo thành ferrate ion.
b) Viết phương trình phản ứng phân hủy potassium ferrate trong dung dịch acid.
c) Ghép các điện cực potassium ferrate và magnesium với các phần khác của pin kiềm. Viết phương trình phản ứng khi pin hoạt động.
Bài 48
Hình bên mô tả “Volta kế” (dạng bình điện phân) là một thiết bị dùng để đo điện lượng. Dung dịch trong bình bên phải là K2SO4 10%, khi áp dòng điện vào sẽ thấy ngay sự thoát khí.
Cho một số các dữ kiện cần thiết để giải bài tập này:
U H 0.58V (điện cực platinum)
U O 1.77V (điện cực platinum)
E K |K 2.92 V; U 0 V

E S O |SO 2.01 V; U 0 V
1) Sản phẩm nào thoát ra ở platinum-cathode và ở platinum-anode? Giải thích câu trả lời dựa trên việc so sánh các thế phân hủy.
2) Viết và cân bằng phản ứng điện phân.
Áp một dòng điện có cường độ 805 mA đi qua volta kế trong 7.00 minutes. Dòng điện chỉ được sử dụng để điện phân sản phẩm. Nhiệt độ của khí thoát ra khỏi ống bên trái là 20.0°C, áp suất khí là 998 mbar.
3) Tính lượng sản phẩm phân hủy và từ đó xác định tổng thể tích khí thoát ra từ ống bên trái trong hình.
|
Bài 49
Điện phân dung dịch đồng sunfat trong 30,0h với cường độ dòng điện 1,00A thu được 31,75 g đồng kết tủa. Cho rằng toàn bộ lượng đồng sinh ra đã bám hết vào điện cực
a) Hợp chất nào được tạo thành vẫn còn lại trong dung dịch
b) Lượng chất đó tạo thành là bao nhiêu mol?
c) Tính thế tích khí thoát ra ở catot và anot (điều kiện tiêu chuẩn)
d) Viết tất cả các phản ứng xảy ra
Bài 50
Nguyên liệu để sản xuất nhôm là quặng boxit. Để sản xuất nhôm cần tách nhôm oxit từ quặng trên sau đó điện phân dung dịch nhôm oxit trong criolit , nhiệt độ khoảng 970oC, điện áp 5 – 7 V, dòng 130 kA.
1. Hãy trình bày quy trình tách nhôm oxit từ quặng boxit, viết các phương trình phản ứng.
2. Viết công thức criolit và giải thích vai trò của nó. Viết đầy đủ phương trình các phản ứng xảy ra ở anot, catot và phản ứng tổng quát.
3. Tính năng lượng theo kWh, khối lượng boxit (chứa 60% nhôm oxit) và khối lượng graphit dùng làm anot để sản xuất 1 tấn nhôm. Biết điện áp 5 V và hiệu suất dòng là 95%.
4.Bảng sau đây cho các số liệu tại 970oC Al(lỏng) O2(khí) Al2O3(rắn) ΔHs theo kJ/mol ở 970oC 48 38 1610
S theo J/(K.mol) ở 970oC 78 238 98 Tính điện áp lí thuyết cần dùng trong quá trình điện phân.
5.Hãy giải thích vì sao không thể điều chế nhôm bằng cách điện phân dung dịch nước của muối nhôm trong môi trường axit.
|
Bài 51
Cho dòng liên tục, cường độ 0.04193 A qua một tế bào điện hóa ở 25 oC và 101.325 kPa. Ở cathode (Pt, HNO3 0.1 mol L-1) giải phóng hydrogen, còn ở anode (Cu, NaCl 0.1 mol L-1) thu được dung dịch Cu2+. Chuẩn độ dung dịch Cu2+ tạo thành với dung dịch EDTA 0.05115 mol L-1 thì hết 53.12 mL chất chuẩn.
1) Tính thể tích hydrogen giải phóng từ cathode.
2) Tính thời gian điện phân cần thiết.
Bài 52
Xét quá trình điện phân dung dịch hỗn hợp axit etanoic và natri etanoat. Khí thoát ra ở điện cực Pt được thu lại và làm sạch bằng cách cho đi qua dung dịch KOH bão hòa. Đã ghi nhận được rằng trong quá trình điện phân thì khối lượng dung dịch KOH tăng lên 5,213 g. Điều kiện điện phân là nhiệt độ 25oC, áp suất 1,0 bar.
1) Viết các phản ứng xảy ra ở điện cực.
2) Tính lượng chất khí giải phóng ra ở anot (đơn vị mol và dm3) có thể phản ứng và không thể phản ứng với dung dịch KOH. Khí không phản ứng với dung dịch KOH có tỉ khối đối với hydro là 15,0.
3) Tính đơn vị tiêu thụ (đơn vị A h) nếu hiệu suất phản ứng hình thành sản phẩm ở anot trong điều kiện điện phân đạt 100%.
4) Tính thời gian điện phân nếu cường độ dòng điện đặt vào là 706 mA? Tính khối lượng Cu giải phóng ra trong đồng calomen mắc nối tiếp với thiết bị điện phân.
5) Tính thế cân bằng khi tỉ lệ nồng độ axit etanoic và natri etanoat là 1:3, và áp suất riêng phần của hydro đi qua dung dịch là 1,0 bar. R = 8,314 JK-1mol-1; A(Cu) = 63,55, F = 96485 Cmol-1; Kd(CH3COOH) = 1,85⋅10-5
|
Copper(I) oxide không tan trong nước, bền trong không khí khô, nhưng không khí ẩm có thể xúc tác cho một chuyển hóa (phản ứng 1)
Khi copper(I) oxide tan trong sulfuric acid loãng thì tạo thành một dung dịch màu xanh dương, chứa một kết tủa nhưng không giải phóng khí (phản ứng 2). Khi dùng sulfuric acid đặc, nóng thì không còn kết tủa nữa nhưng tạo thành một khí có mùi (phản ứng 3). Khí này cũng được tạo thành khi hòa tan kết tủa của phản ứng 2 vào sulfuric acid đặc, nóng. 1) Viết các phương trình phản ứng 1-3.
Có nhiều cách để tạo ra copper(I) oxide. Đun nóng đồng trong không khí là một trong những phương pháp phổ biến để tổng hợp bán dẫn Cu2O. Trong khí quyển oxygen tinh khiết, ba hợp chất chứa đồng [Cu(s), Cu2O(s) hoặc CuO(s)] có khả năng chuyển hóa lẫn nhau.
Giả sử rằng các dữ liệu về ΔfHo and So cho sau đây ở 105 không phụ thuộc vào nhiệt độ: ΔfHo, kJ.mol 1 So, J.mol 1.K 1
Cu(s) 0 65
O2 (g) 0 244
CuO(s) -156 103
Cu2O(s) 170 180
2) Xác định các khoảng nhiệt độ, nếu có, của độ bền nhiệt động của đồng và các oxide của nó từ 500 – 1500 K trong khí quyển oxygen 105 Pa.
Cho các giá trị sau ở 298 K. Sử dụng nhiệt độ này cho các tính toán tiếp theo:
Ksp(Cu(OH)2) = 2·10
Cu2O (s)
Cu2+ (aq)
H2O(l)
2 e
2 Cu (s) + 2 OH (aq) E0 = −0,360 V
Một phương pháp khác để tạo ra Cu2O là oxid hóa anode đồng. Điện phân một dung dịch base (như NaOH) với platinum cathode và copper anode. có thể tạo thành copper(I) oxide trên anode.
3) Viết bán phản ứng của các quá trình xảy ra trên các điện cực khi sản xuất Cu2O theo phương pháp anode trong dung dịch NaOH, với điện cực platinum cathode và copper anode.
Một phương pháp khác là khử điện phân dung dịch chứa copper(II) ion.
4)
a) Viết bán phản ứng xảy ra trên cathode để tạo thành Cu2O trong môi trường acid.
Thực hiện phản ứng điện phân dung dịch Cu2+ 0,100 mol dm-3 với các điện cực platinum.
b) Xác định giá trị pH cực đại mà tại đó nồng độ Cu2+ có thể được duy trì ở 0,100 dm3Nếu pH quá thấp, sự khử thành đồng kim loại ưu tiên hơn phản ứng tạo thành copper(I) oxide.
c) Xác định giá trị pH cực tiểu mà tại đó vẫn có thể sản xuất Cu2O bằng phương pháp cathode từ dung dịch Cu2+ 0,100 mol dm-3 .
Quá trình Haber được dùng để sản xuất ammonia, dùng trong phân bón thường được phun lên cây trồng. Khoảng 1 % nguồn năng lượng trên toàn thế giới được dùng cho quá trình Haber và do đó các nhóm nghiên cứu đang tìm kiếm các phương pháp phù hợp hơn để sản xuất ammonia: Trong câu hỏi này, bạn cần sử dụng các phương trình và hằng số sau:
∆Go = ∆Ho - T∆So
∆Go = -nFEo pin, trong đó
n là số electron di chuyển trong phương trình phản ứng của pin;
F là hằng số Faraday (điện tích được mang bởi 1 mol electron), bằng 9.65·104 C mol-1;

Eo pin là hiệu thế của pin điện hóa, tính theo volt (1 V = 1 J C-1).
Q = It, trong đó
Q là điện tích, theo coulomb;
I là cường độ dòng điện, theo ampere; t là thời gian, theo giây.
Một hướng tiếp cận được công bố gần đây để sản xuất ammonia sử dụng phương pháp 3 giai đoạn sau:
Giai đoạn 1: Điện phân lithium hydroxide nóng chảy ở 750 K tạo thành kim loại lithium: 4LiOH → 4Li + 2H2O + O2
Giai đoạn 2: Phản ứng của kim loại lithium với nitrogen tạo thành lithium nitride.
Giai đoạn 3: Phản ứng của lithium nitride với nước tái tạo lithium hydroxide và ammonia.
Lithium hydroxide được tạo thành ở Giai đoạn 3 có thể được tái sử dụng trong Giai đoạn 1 và quá trình có thể lặp lại.
a) Viết 2 bán phản ứng kết hợp lại để tạo thành phương trình tổng ở Giai đoạn 1.
Bảng dưới đây cho biết các dữ kiện nhiệt động học (với 3 chữ số có nghĩa) cho Giai đoạn 1
b) Tính các giá trị sau ở 750 K cho Giai đoạn 1:
i. ∆Ho theo kJ mol-1
ii. ∆So theo J K-1 mol-1 .
iii. ∆Go theo kJ mol-1 .
Quá trình điện phân sẽ chỉ diễn ra ở một tốc độ có thể đánh giá được khi thế áp vào vượt quá suất hiệu thế của pin điện hóa 0.60 V.
c) Tính thế tối thiểu phải áp vào ở Giai đoạn 1
d) Viết phương trình của Giai đoạn 2 và Giai đoạn 3. Tính tỉ lệ hợp thức giữa lithium tạo thành trong Giai đoạn 1 và ammonia tạo thành trong giai đoạn 3.
Trong một thí nghiệm ở quy mô, các nhà nghiên cứu đã áp vào một dòng điện 0.200 A trong 1000 giây. Hiệu suất tạo thành lithium trong quá trình này là 88.5 %. Hiệu suất của Giai đoạn 2 và Giai đoạn 3 có thể được giả định là 100 %.
e) Tính khối lượng lithium tạo thành trong Giai đoạn 1.
f) Tính thể tích ammonia tạo thành theo cm3 ở nhiệt độ và áp suất thường.
Ứng dụng tiềm năng của hướng tiếp cận này là sử dụng các nguồn năng lượng tái tạo làm nguồn điện để điện phân và sản xuất ammonia tại trang trại và sử dụng được ngay. Kích thước trang trại trung bình ở Anh quốc là 130 mẫu Anh và mỗi trang trại cần 0.0770 tấn ammonia trên mỗi mẫu hàng năm.
g) Nếu lithium hydroxide không được tái sinh ở cuối quá trình, hãy tính tổng khối lượng lithium (theo tấn) phải có để tạo ra lượng ammonia cần thiết trong 1 năm.
|
Hướng dẫn tổng hợp phức chất triphenylphosphonitetracloro cobantat(II):
Trong một tế bào điện hóa có chứa 1g triphenylphosphin được hòa tan trong 40 mL axetonitrin và 2.5 mL dung dịch HCl bão hòa. Một điện cực platin được sử dụng để làm catot. Điện cực coban đã được cân và gắn vào tế bào điện hóa để làm anot. Hai điện cực này được nối với nhau bằng dây dẫn có đi qua một ampe kế. Qúa trình điện phân xảy ra trong vòng 90 phút. Dung dịch màu xanh thu được khi kết thúc điện phân được cho bay hơi. Chất màu xanh thu được thì được hoà tan vào một lượng nhỏ axetonitrin, sau đó cô bay hơi đến khi còn khoảng 5 mL thì kết tinh trong tủ lạnh. Tinh thể thu được có màu xanh sáng đã được lọc, rửa bằng ete và tiến hành làm khô sau đó đen cân. Điện cực coban cũng được làm khô và đem cân.
Một sinh viên đã làm thí nghiệm trên và thu được các số liệu sau:
Khối lượng anot trước khi điện phân: mtrước = 10.542 g
Khối lượng anot sau khi điện phân: msau = 10.440 g
Khối lượng sản phẩm: mphức = 1.015 g
Thời gian điện phân: t = 90 ph
Cường độ dòng điện: I = 100 mA
a) Viết phản ứng xảy ra trên các điện cực (dạng ion)
b) Viết công thức của phức?
c) Tính hiệu suất của phản ứng dựa trên khối lượng sản phẩm và lượng coban sử dụng ban đầu
d) Tính hiệu suất dòng điện η !
Bài 56
Việc phủ kim loại bằng chromium có thể được thực hiện bằng cách điện phân dung dịch chromic acid (H2CrO4). Quá trình điện phân có thể được thực hiện với dòng điện 1500 A trong 7.00 giờ. Anode trơ không thay đổi. Ở cathode thì tạo thành sản phẩm phụ là 4.15 m3 hydrogen được tạo thành ở trạng thái chuẩn (25 oC, 1.00 bar), làm giảm hiệu suất dòng điện của quá trình mạ chromium. Ở anode cũng có một khí.
1) Viết các phương trình tương ứng với mỗi điện cực.
2) Tính hiệu suất dòng (%) của quá trình mạ chromium ở cathode.
3) Tính khối lượng chromium được mạ lên.
4) Tính thể tích khí được tạo thành ở anode tại trạng thái chuẩn (25 oC, 1.00 bar).
|
Vào năm 1914, Tubandt và Lorenz chứng minh rằng ở nhiệt độ trên 147oC thì bạc iodua rắn chuyển thành dạng α - AgI và làm tăng tính dẫn điện. Nhiệt độ 147oC có thể coi như nhiệt độ nóng chảy của mạng tinh thể do các nguyên tử Ag tạo thành. Phần mạng tinh thể do các nguyên tử I tạo thành bền vững đến nhiệt độ 557oC. Biết rằng iot tạo mạng tinh thể lập phương tâm khối (bcc) với thông số mạng a = 5,04.10-10m. Hình bên biểu diễn sơ đồ một tế bào điện hóa Tubandt.
Trong tế bào này mỗi điện cực bạc (khối lượng 0,1000 g) được cho tiếp xúc với AgI như hình vẽ. Sau đó cho dòng điện có cường độ 35,2 mA đi qua mạch trong 15,5 phút. Sau đó các điện cực bạc được lấy ra và cho vào hai bình có thể tích 100,0 cm3 (ký hiệu dung dịch A cho anot và dung dịch B cho catot). Thêm vào cả hai bình một lượng dư dung dịch HNO3. Sau khi hòa tan hết kim loại trong bình thì thêm nước vào cho đến khi đạt đúng thể tích 100,0 cm3. Mỗi dung dịch A và B được dùng để chuẩn độ 10,00 cm3 dung dịch NaCl có nồng độ 0,0113 mol.dm-3 có thêm K2CrO4. Điểm cuối chuẩn độ được xác định khi thấy xuất hiện kết tủa đỏ gạch.
a) Viết hai nửa phản ứng xảy ra ở cả hai điện cực khi dòng điện chạy qua
b) Viết phản ứng xảy ra khi hòa tan kim loại trong bình bằng HNO3
c) Cho biết kết tủa đỏ gạch xuất hiện khi đạt điểm cuối chuẩn độ là của chất nào
d) Tính tỉ lệ thể tích VA / VB (là thể tích cần dùng để chuẩn độ 10,00 cm3 dung dịch NaCl trên)
e) Xác định bán kính của iot trong mạng bcc

f) Tính khối lượng riêng của chất dẫn điện AgI rắn
g) Khả năng nhạy sáng của AgI làm cho nó có ứng dụng trong lĩnh vực nhiếp ảnh. Sau khi có được tấm phim đen trắng thì hình ảnh sẽ được chỉnh lại bằng cách hòa tan lượng dư AgI (hoặc một muối bạc halogenua nào đó) bằng dung dịch Na2S2O3. Hợp chất tạo thành từ phản ứng này có 26,9% bạc về khối lượng. Viết phản ứng xảy ra
Mạ điện Nguyên lý cơ bản của việc tạo thành lớp phủ điện hóa của thiết bị là chọn thiết bị đó làm catot của bình điện phân. Công ty Solutia có trụ sở ở Werndorf gần Graz ở Áo đã tổng hợp được một loại nhựa tan trong nước. Vật cần phủ đã mang sẵn loại nhựa tổng hợp và nước đã chứa 20% một polymer hữu cơ mang nhóm RNH3 +-. Quá trình làm sạch catot trước khi phủ đã phân cực hóa catot. Chỉ trong vòng vài phút đã tạo thành một lớp phủ đủ dày trên vật cần phủ.
Trong một phòng thí nghiệm thì một tấm kim loại (10x20cm) được phủ bằng cách nhúng vào một bình điện phân 2 lít. Trong một thí nghiệm điện phân thì người ta sử dụng hiệu điện thế 295 V trong vòng 2 phút để thu được một lớp phủ dày 20 µm. pH lúc bắt đầu điện phân là 7.0. Điện lượng cần cho quá trình điện phân này là Q = 20 As.
a) Viết phản ứng xảy ra ở catot (Cho rằng ion ankylamoni vẫn mang điện!)
b) Dựa vào câu a), hãy cho biết pH lúc kết thúc điện phân?
c) Ngạc nhiên thay pH không thay đổi! Giải thích.
|
trong các muối này nếu biết đã dùng 4.5 gam muối để điều chế 100.0 mL dung dịch.
d) Tính cường độ dòng điện dùng trong phép chuẩn độ điện lượng.
Chuẩn độ điện lượng là một phương pháp tiện lợi để xác định các hợp chất trong dung dịch. Trong chuẩn độ này, chất phân tích tương tác với chất chuẩn, dẫn tới phản ứng điện hoá trên các điện cực. Lượng chất chuẩn sinh ra bởi dòng điện tỉ lệ với điện lượng. Các tính toán trong phương pháp này dựa vào quy tắc Faraday. Dòng điện có cường độ cao được duy trì khi tiến hành phép chuẩn độ. Để tạo chất chuẩn sinh ra bởi dòng điện, có thể sử dụng các phản ứng điện hoá của dung môi, của chất phản ứng, hoặc của vật liệu làm điện cực. Điểm cuối của chuẩn độ điện lượng có thể được xác định bởi các phương pháp thường dùng như các chuẩn độ khác.
1) Vẽ hình dạng các đường cong chuẩn độ của 3 dung dịch chứa: thứ nhất là Cl ; thứ hai là Br ; và thứ ba là I- - với các ion Ag+ sinh ra trên điện cực bạc. Tích số tan (Ks) của các silver halide là: Ks(AgCl) = 1.8 · 10-10; Ks(AgBr) = 6 · 10-13; Ks(AgI) = 1.1 · 10-16. Vẽ các đường cong trên cùng một hệ toạ độ p[Hal ] - f, trong đó Hal là kí hiệu của halide ion, f là độ chuẩn (tỉ lệ giữa lượng ion được chuẩn độ với lượng ban đầu), p[Hal ] = -lg[Hal ]. Nồng độ mol ban đầu của các halide ion trong 3 dung dịch bằng nhau. Viết các phương trình phản ứng tương ứng với các phép chuẩn độ trên.
2) Tiến hành chuẩn độ dung dịch chứa hỗn hợp chlordie, bromide và iodide của một kim loại chưa biết trong buồng đo điện lượng điện cực bạc). Có thể dùng một điện lượng kế hydrogen-oxygen (dựa vào phản ứng điện phân nước) để xác định điện lượng tiêu thụ trong quá trình chuẩn độ. Đường cong chuẩn độ gồm 3 giai đoạn. Các điểm tương đương ứng với các thời gian chuẩn 2.0, 5.0 và 10.0 phút. Tổng thể tích khí tạo thành trong điện lượng kế là 16.8 cm3 (ở điều kiện thường). Hằng số Faraday là 9.65 · 104 C/mol.
a) Viết các phương trình phản ứng trên các điện cực của điện lượng kế hydrogen-oxygen.
b) Tính tổng thể tích khí tạo thành, nếu sử dụng điện lượng kế nitrogen-hydrogen (dựa vào phản ứng điện phân hydrazine trong dung dịch). Viết các phương trình phản ứng trên các điện cực.
c) Tính các nồng độ của Cl , Br và I (theo mol/L) trong dung dịch, nếu lấy 2.0 mL mẫu cho phép chuẩn độ này. Xác định cation chưa biết
|
Chuyên đề 33: Chuẩn độ điện lượng và đo độ dẫn điện
Hòa tan 10.2 g tinh thể không màu A vào 1000 mL nước. Lấy 10.0 mL dung dịch này cho vào bình chuẩn độ có chứa một lượng dư KBrO3 và KBr theo tỉ lệ mol 1:5. Sau khi phản ứng oxy hóa - khử kết thúc, hỗn hợp còn lại được chuẩn bằng dung dịch natri formate 0.050 M hết 7.5 mL. Tiếp tục lấy 10 mL dung dịch A cho vào tế bào chuẩn độ bằng phương pháp chuẩn độ điện lượng với ion tạo dòng điện là OH . Trên đường cong chuẩn độ chỉ xuất hiện một bước nhảy.
1) Xác định chất A, biết rằng khi đun nóng ở nhiệt độ trên 200oC thì chất này mất 6.6% khối lượng và tạo thành chất A1. Tiếp tục đun nóng ở nhiệt độ trên 600oC thì A1 mất thêm 31.5% khối lượng. Viết các phương trình phản ứng chuẩn độ chất A và các chuyển hóa khi đun nóng.
2) Xác định lượng điện tích cần thiết để chuẩn độ chất A, biết rằng hiệu suất dòng đạt 90% (hằng số Faraday F = 96500 C/mol)
3) Xác định hằng số phân li Ka của nhóm acid trong chất A, biết rằng pH của dung dịch A có nồng độ 0.10 M là 1.54.
4) Người ta dùng phương pháp phân tích khối lượng để xác định nồng độ A bằng cách kết tủa nó dưới dạng tinh thể màu trắng B (tích số tan Ks o = 1.3⋅10-10). Xác định chất B, biết rằng khối lượng phân tử của nó lớn hơn A xấp xỉ 1.7 lần.
5) Tính độ tan của B trong nước tinh khiết (mg/L)
Bài 3
Thiếu iodine là mối lo ngại đặc biệt ở Georgia bởi đây là vùng đất khan hiếm iodine trong đất và nước. Thiếu iodine có thể được ngăn chặn một cách hiệu quả và tiết kiệm chi phí nếu lượng muối con người tiêu thụ được bổ sung một lượng nhỏ iodine. Do vậy, các phương pháp phân tích hàm lượng iodine trong muối có vai trò rất quan trọng. Theo các quy định hiện hành ở Georgia thì muối iodine phải có hàm lượng iodine trong khoảng 25-55 ppm (1 ppm = 1 mg iodine/kg muối). Đa số muối được iodine hóa bằng cách bổ sung potasium iodate (KIO3). Hàm lượng iodate trong các mẫu muối có thể được xác định bằng phương pháp chuẩn độ iodine. Theo quy trình chuẩn, hòa tan 10,000 gam muối iodide vào 100 cm3 dung dịch HCl 1,0 mol/dm3 có chứa 1,0 gam KI. Chuẩn độ dung dịch thu được với dung dịch sodium thiosulfate 0,00235 mol/dm3 thì cần 7,50 cm3 chất chuẩn để đạt điểm cuối với chỉ thị hồ tinh bột.
1.
a) Viết phương trình dạng ion của phản ứng giữa iodate với iodide dư trong môi trường acid.
b) Viết phương trình dạng ion của phản ứng diễn ra trong quá trình chuẩn độ với thiosulfate.
c) Tính mức độ iodine hóa (hàm lượng iodine, theo ppm) trong mẫu muối.
Một tác nhân iodine hóa muối kém phổ biến hơn là potassium iodide, khó để định lượng bằng phương pháp chuẩn độ iodine.
Có thể phân tích hàm lượng iodide khi có mặt chloride bằng phương pháp chuẩn độ điện thế. Tuy nhiên, phương pháp này không thực sự chính xác khi có lượng lớn chloride. Theo phương pháp này, một dây bạc được nhúng vào dung dịch (chứa iodide và chloride) cần phân tích và thêm từ từ ion bạc vào dung dịch. Điện thế của sợi dây bạc được đo với điện cực tham chiếu là sợi dây bạc nhúng trong một dung dịch AgNO3 1,000 mol/dm3. Các điện thế đo được có giá trị âm và trị số của chúng đã được ghi lại.
|
cũng tạo các ion phức với bạc nhưng có thể bỏ qua do nồng độ của iodide trong thí nghiệm quá thấp)
AgI(s) ⇌ Ag+(aq) + I (aq) KspI
AgCl(s) ⇌ Ag+(aq) + Cl (aq) KspCl Ag+(aq) + 2 Cl (aq) ⇌ AgCl2 (aq) Kf
Dưới đây là kết quả của hai thí nghiệm, biểu diễn các giá trị thế đo được dưới dạng hàm số của số mol ion bạc thêm vào. Thí nghiệm A (các đường tròn đậm màu) được tiến hành với 1,000 dm3 dung dịch chứa iodide 1,00.10-5 mol/dm3 và không có chloride ion. Thí nghiệm B (các đường tròn không màu) được tiến hành với 1,000 dm3 dung dịch chứa iodide 1,00.10 5 mol/dm3 và chloride 1,00.10-1 mol/dm3
Một phương pháp khác có tính thực tế hơn, do không bị ảnh hưởng bởi sự có mặt của chloride, đó là sử dụng phản ứng Sandell-Kolthoff. Đây là phản ứng của H3AsO3 với Ce(IV) để tạo thành Ce(III) trong dung dịch acid, iodide ion là xúc tác hiệu quả của phản ứng này.
3.
a) Viết phương trình dạng ion của các phản ứng: (i) cerium(IV) với H3AsO3 trong dung dịch acid; (ii) phản ứng của cerium(IV) với một tiểu phân chứa nguyên tố iodine; và (iii) H3AsO3 với một tiểu phân chứa nguyên tố iodine, có thể giải thích hợp lí cho khả năng xúc tác của iodide trong phản ứng. Phản ứng của Ce(IV) với H3AsO3 có thể được theo dõi bằng cách đo độ hấp thụ ở 450 nm, bởi Ce(IV) có màu da cam và có hấp thụ mạnh ở 405 nm, trong khi các chất phản ứng và sản phẩm khác không có màu và hấp thụ không đáng kể. 3 thí nghiệm đã được tiến hành, đều là trong H2SO4 0,50 mol/dm3 ở 25,0 oC, với các nồng độ đầu sau đây: Thí nghiệm [H3AsO3]0, mol dm-3 [Ce(IV)]0, mol dm-3 [I ]0, mol dm-3
1 0,01250 0,00120 1.43·10 6 2 0,00625 0,00060 1.43·10 6 3 0,01250 0,00120 7.16·10 7
Phân tích viên bắt đầu phản ứng bằng cách trộn lẫn các tác nhân trong một cuvette. Sau một giai đoạn chậm trễ biến dòng (variable delay) ngắn, các phép đo độ hấp thụ đã được tiến hành, với phép đo đầu tiên ghi ở t = 0 giây. Dưới đây là dữ liệu nhận được:

2.
a) Chọn một điểm dữ kiện phù hợp từ các thí nghiệm và dùng nó để tính tích số tan của AgI (KspI).
b) Chọn một điểm dữ kiện phù hợp từ các thí nghiệm và dùng nó để tính tích số tan của AgCl (KspCl).
c) Chọn một điểm dữ kiện phù hợp từ các thí nghiệm và dùng nó để tính Kf. Bạn cần sử dụng các giá trị KspI hoặc KspCl cho tính toán này. Nếu bạn không thể xác định được chúng ở các ý 2a) và 2b) thì có thể sử dụng các giá trị tùy ý sau KspI = 1,00.10-5 và KspCl = 1,00.10-9 mà không bị trừ điểm.
|
Trong những điều kiện này (H2SO4 0,5 mol/dm3, 25 oC), biểu thức tốc độ phản ứng là tốc độ = k[H3AsO3]m[Ce(IV]n[I ]p, trong đó m, n, p là các số nguyên.

b) Xác định các giá trị m, n, p và tính giá trị của k (chỉ rõ đơn vị của nó).
Hòa tan 1,000 gam mẫu muối iodine vào nước, thu được 10,00 cm3 dung dịch. Lấy 0,0500 cm3 này rồi thêm vào hỗn hợp của 1,000 cm3 dung dịch chứa H3AsO3 0,025 mol/dm3 trong H2SO4 0,5 mol/dm3 và 0,800 cm3 dung dịch chứa H2SO4 0,5 mol/dm3. Tiếp đó thêm vào hỗn hợp này 0,200 cm3 dung dịch chứa Ce(NH4)2(NO3)6 0,0120 mol/dm3 và H2SO4 0,5 mol/dm3 và ghi lại độ hấp thụ ở 405 nm dưới dạng hàm số của thời gian ở 25,0 oC:

c) Tính mức độ iodine hoá (hàm lượng iodine, theo ppm) trong mẫu muối này.

Phương pháp phân tích điện lượng dựa trên cơ sở phép đo lượng điện tiêu thụ trong quá trình điện phân chất để được một lượng xác định hoặc tương đương của một tác nhân phản ứng. Để xác định hàm lượng H2SO4, cho vào cốc 1.00 mL dung dịch mẫu, 25 mL dung dịch K2SO4 0.1 M và một giọt phenolphthalein rồi nhúng điện cực platinum (1) và ống nghiệm thủy tinh (2) với một hỗn hống vào dung dịch. Rót dung dịch K2SO4 0.1 M vào ống nghiệm rồi đặt vào đó một điện cực platinum (3) khác. Tiến hành điện phân ở 25 oC với hiệu suất dòng 100 % (nghĩa là không có phản ứng điện hóa phụ nào khác) cho đến khi màu hồng của chỉ thị xuất hiện. Quá trình này kéo dài 8 phút 48.6 giây với dòng điện 4.50 mA. Điện lượng của 1 mol electron bằng 96485 C.
b) Phản ứng phụ nào có thể xảy ra trong quá trình mạ điện nickel?
5) Quá trình điện phân dung dịch NiSO4 10-3 M ở pH 6.0 đã bị dừng lại khi hiệu suất dòng thấp hơn 100 %. Tính nồng độ nickel còn lại trong dung dịch. Giả sử không có các phức chất Ni(II) hydroxo được tạo thành.
6) Tính pH mà tạo đó quá trình mạ điện nickel diễn ra hoàn toàn (nghĩa là nồng độ còn lại trong dung dịch không vượt quá 10-6 M) từ dung dịch 10-3 M của Ni(II) trong NH3 2 M, biết hiệu suất dòng là 100 %. Giả sử rằng trong điều kiện này chỉ có duy nhất phức chất Ni(NH3)6 2+ tồn tại (hằng số bền hóa tổng là β6 = 2·108).
1) Điện cực hoạt động là cathode hay anode? Viết phương trình phản ứng diễn ra ở cathode và anode.
2) Tính hàm lượng H2SO4 (theo gam/L) trong dung dịch mẫu.
3) Màu sắc của phenolphthalein xuất hiện ở 8.5, nghĩa là môi trường không-trung hòa. Nó gây ra một vài sai sót trong việc phát hiện điểm cuối. Tính sai số tương đối (%) của nồng độ H2SO4 được xác định theo phương pháp trên.
4)
a) Tính điện thế mà tại đó sẽ có kim loại nickel bám trên điện cực từ dung dịch NiSO4 10-3 M. Cho biết thế chuẩn của cặp Ni2+/Ni là -0.228 V.
|

Ngành công nghiệp dầu khí Trung Quốc thường sử dụng phương pháp phân tích điện lượng với dòng không đổi để xác định chỉ số bromine trong xăng. Chỉ số bromine là số mg bromine phản ứng với 100 gam mẫu, qua đó phản ánh số liên kết C=C trong hợp chất. Cho V (ml) mẫu vào tế bào phân tích điện lượng và phản ứng được thực hiện với bromine tạo thành từ điện phân và hydrocarbon không no. Khi phản ứng hoàn thành, lượng bromine dư bị khử ở điện cực chỉ thị để xác định điểm cuối. Chất điện li LiBr, hệ dung môi chỉ chứa 5 % nước, phần còn lại là methanol, benzene và acetic acid. Đặt d là khối lượng riêng mẫu xăng, Q là điện lượng tiêu thụ cho phản ứng bromine hóa được xác định tại điểm cuối (tính theo Coulomb).
1) Dẫn ra biểu thức liên hệ giữa chỉ số bromine với V, d, Q (chú ý: chỉ có 1 giá trị cụ thể được chấp nhận trong biểu thức này)
2) Cho biết ưu và nhược điểm của benzene trong hệ dung môi.

Bài 6
Khi đặt một điện áp vào các điện cực của tế bào điện hoá thì sẽ có dòng điện chạy qua. Trong các chất dẫn kim loại, dòng điện sẽ mang các electron; còn trong dung dịch là các ion. Trên mặt tiếp xúc điện cực-dung dịch, các ion (hoặc tiểu phân hoạt động mang điện) sẽ bị khử hoặc oxid hoá - nghĩa là sẽ xảy ra một phản ứng điện hoá. Dòng điện i sẽ được xác định bởi số tiểu phân phản ứng ứng bề mặt điện cực trong một đơn vị thời gian. Với điện thế nhỏ (E < E’), thì cường độ nhỏ, nhưng khi đặt tới thế phóng điện E’ của đa số tiểu phân thì cường độ sẽ tăng nhanh chóng (xem hình). Khi điện thế E > E’’ thì cường độ sẽ không tăng thêm khi điện thế tăng nữa do các tiểu phân mang điện không kịp phân tán đến các điện cực. Trong trường hợp này, cường độ giới hạn i = inp chỉ phụ thuộc vào nồng độ c của các tiểu phân hoạt động mang điện (nồng độ các tiểu phân càng cao, c3 >> c2 > c1, thì càng được xả ra nhiều ở điện cực, nghĩa là dòng điện trong mạch càng lớn): inp = kc.
Các hiện tượng mô tả trên được sử dụng trong phương pháp chuẩn độ đo ampe: một điện thế (cao hơn điện thế xả E’’ của ít nhất một tác nhân của phản ứng chuẩn độ) được đặt vào tế bài điện hoá chứa dung dịch cần phân tích. Ví dụ, muối kẽm chứa các ion Zn2+ không hoạt động điện (ở điện thế sẵn có) được chuẩn độ với hexacyanoferrate(II) - chất này có thể bị oxid hoá thành [Fe(CN)6]3- ở điện thế sẵn có. Trong giai đoạn đầu tiên của phép chuẩn độ, dòng điện gây ra bởi phản ứng oxid hoá các ion chất chuẩn [Fe(CN)6]4- có thể bỏ qua do các ion này tạo thành kết tủa Zn2[Fe(CN)6]. Các ion [Fe(CN)6]4- tự do xuất hiện khi đạt tới điểm cuối
chuẩn độ, dẫn tới một đoạn tăng dần trên đường cong chuẩn độ (xem hình):
[Fe(CN)6]4- + e → [Fe(CN)6]3-
Thể tích chất chuẩn ứng với điểm cuối được xác định bởi sự giao cắt của các phần tuyến tính của đường cong trong hình dưới đây.
1) Vẽ đường cong chuẩn độ của dung dịch K4[Fe(CN)6] bởi muối dung dịch muối kẽm trong hệ toạ độ i - V.
2) Tính nồng độ kẽm trong chất chuẩn, nếu biết c(K4[Fe(CN)6]) = 0.0036 M và thể tích chất chuẩn được xác định với điểm gấp khúc của đường cong là VZn = 2.5 mL. Phép chuẩn độ này dùng 5.0 mL dung dịch potassium hexacyanoferrate.
3) Chọn các ion trong dãy sau: Sn2+, Fe3+, I , SO3 2-, SO4 2- - có thể được chuẩn độ bởi một dung dịch muối copper(II) nếu các đường cong chuẩn độ đo ampe giống với đường đã cho ở hình trên. Cách sắp xếp tế bào điện hoá và điện thế đã được chọn để chỉ ghi được giá trị của dòng khử điện hoá copper(II).
4) Một dung dịch A chứa potassium sulfide và oxalate. Dung dịch này được đề xuất sử dụng trong chuẩn độ một muối cadmium. Tích số tan của cadmium sulfide và oxalate lần lượt là 1.6·10-28 và 1.5·10-8. Đồ thị dưới đây biểu diễn các đường cong oxid hoá của S2- và C2O4 2Cadmium không hoạt động điện hoá trong khoảng thế này.
|
a) chọn một điện thế để chuẩn độ đo ampe sulfide trong A
b) chọn một điện thế để xác định tổng số mol sulfide và oxalate. Vẽ đường cong chuẩn độ của các giá trị thế đã chọn.


Cực phổ là một kĩ thuật được dùng để xác định các ion kim loại. Điện thế giữa cathode giọt thủy ngân và anode bể thủy ngân bị biến đổi (ví dụ, trong khoảng từ 0.0 đến -1.5V) và tương ứng với những thay đổi của dòng I đo được. Khi trong dung dịch có các chất có thể bị khử thì sẽ có sự tăng mạnh cường độ dòng điện tại giá trị thế nhất định. Giản đồ được ghi lại của dòng điện với điện thế I = f(E) (cực phổ) được đặc trưng bởi độ cao sóng h (cm), hoặc dòng điện khuếch tán Imax (A) - chúng tỉ lệ thuận với nồng độ của ion chưa biết; và bởi điện thế ở điểm giữa của sóng E1/2 (thế bán-sóng [nửa sóng]) - phụ thuộc vào bản chất của chất điện li.
3) Một mẫu hợp kim chứa kẽm, chì và cadmium được hòa tan và cực phổ của dung dịch này đã được ghi lại (thế biến đổi từ 0 đến -1.2 V). Trước khi tiến hành đo, một khí trơ đã được sục qua dung dịch trong pin. Ion E1/2, V Zn(II) Cd(II) Pb(II) O2
-0.99 -0.62 -0.41 -0.1, -0.9
a) Sử dụng dữ kiện trong bảng, hãy vẽ đồ thị cường độ - điện thế (đường Số 1) và đánh dấu các giá trị Imax. Chỉ ra giá trị E1/2 phù hợp của mỗi sóng.
b) Vẽ cực phổ của dung dịch được ghi lại mà không cần phải loại bỏ oxygen ban đầu (đường Số 2). Viết phương trình các bán phản ứng với oxygen diễn ra trên cathode giọt thủy ngân trong môi trường base và acid.

Sơ đồ một thiết bị phân tích cực phổ: 1) pin điện hóa (với điện cực bể thủy ngân); 2) điện cực giọt thủy ngân; 3) điện kế; 4) điện thế kế; 5) nguồn điện.
1) Hòa tan một lượng PbCl2 vào 100 mL (V0) dung dịch KNO3 1 M (muối được sử dụng để đảm bảo tính dẫn điện). Chuyển một đơn vị mẫu (V1, 10.00 mL) dung dịch này vào pin điện hóa và tiến hành phân tích cực phổ. Sóng cực phổ nhận được thể hiện độ cao 5.0 mm (h1). Sau khi thêm 4.50 mL (V2) dung dịch PbCl2 (c2 = 3 mg/L) vào pin thì độ cao sóng trở thành 8.1 mm (h2). Dẫn ra công thức và tính khối lượng PbCl2 đã lấy để tiến hành phân tích.
2) Tính tích số tan (Ks) của PbCl2, biết sóng cực phổ ghi nhận được trong quá trình phân tích dung dịch bão hòa trong KNO3 1 M của nó có Imax = 43.2 μA. Nếu một dung dịch chuẩn PbCl2 (5.0 mM) được phân tích trong cùng điều kiện thì Imax = 13.6 μA.
4) Điện thế tương ứng với sự khử phức MetLx được mô tả bởi các phương trình: E = E1/2(Metn+) + 0.059/n·lg[Metn+] = E1/2(MetLx) + 0.059/n·lg[MetLx], trong đó E1/2(Metn+) và E1/2(MetLx) là các thế bánsóng của ion kim loại tự do và ion kim loại tạo phức; [Metn+] và [MetLx] là các nồng độ cân bằng, n là điện tích ion kim loại.
a) Viết phương trình tạo thành phức giữa lead(II) và glycine và biểu diễn hằng số bền tổng β2 của phức chất Pb(gly)2. Các phản ứng nào có glycine hoặc lead(II) có thể cạnh tranh với sự tạo thành phức trong dung dịch trung tính? Viết ít nhất một phương trình phản ứng cho ion kim loại và một cho phối tử.
b) Dẫn ra phương trình để tính thế bán-sóng của sự khử phức Pb(gly)2 (sử dụng hằng số bền β2). Tính E1/2 cho Pb(gly)2 trong dung dịch glycine 0.5 M ở pH khoảng 7 - 8, nếu β2 = 3.2·107. So sánh giá trị E1/2 nhận được với giá trị cho trong bảng của Pb2+. Tiểu phân nào dễ bị khử hơn: phức Pb(gly)2 hay ion Pb2+ trong nước?
|
Đo độ dẫn điện của dung dịch axit metanoic (axit fomic) cho gía trị độ dẫn điện riêng là κ = 7.52 mScm-1. Dung dịch chứa 9,55% axit fomic về khối lượng và có khối lượng riêng là 1.02 gcm-3. Để tính toán thì cho các giá trị sau: Λ0 (HCOO Na+) = 90.5 Scm2mol-1 Λ0 (HCl) = 380.5 Scm2mol-1 Λ0 (NaCl) = 109 Scm2mol-1
a) Tính độ dẫn điện tới hạn Λ0 của axit metanoic
b) Viết phản ứng proton phân axit metanoic
c) Tính độ điện ly α của dung dịch đang khảo sát
d) Tính pKa của axit metanoic
Bài 9
Một sinh viên đang trong quá trình thực tập ở một phòng phân tích được giao nhiệm vụ xác định hằng số phân ly acid của benzoic acid. Anh ta tiến hành như sau:
• Anh ta bắt đầu với việc chuẩn bị dung dịch nước bão hòa của benzoic acid, dung dịch có nồng độ 2.90 g/L ở 25°C.
• Anh ta đổ đầy dung dịch vào cuvette chuẩn và đo được độ dẫn điện riêng κ = 0.453 mS·cm-1 .
• Anh ta tìm thấy độ dẫn điện của chất khi pha loãng đến vô tận là: λ H 350 S·cm2·mol-1; λ C H O 32.4 S·cm2·mol-1;
1) Tính nồng độ mol của dung dịch bão hòa benzoic acid, dùng đơn vị mol·cm-3 .

2) Tính độ phân ly proton và hằng số Ka của acid này. Để chắc chắn rằng nồng độ tính được ở ý 1 là chính xác, chàng sinh viên đó tiến hành chuẩn độ 10.0 mL dung dịch acid bão hòa bằng 0.0100 M NaOH.
3) Tính thể tích NaOH cần để chuẩn độ nếu kết quả ở ý 1 là chính xác.
4) Tính pH dung dịch ở điểm cuối chuẩn độ.
|
Đo độ dẫn là một trong những phương pháp phân tích điện hóa lâu đời nhất, dựa trên phép đo độ dẫn điện σ [S/m]. Độ dẫn điện có mối liên hệ với sự tồn tại của các ion trong dung dịch. Mỗi ion được đặc trưng bởi độ dẫn điện mol λ [S·m2/mol], phụ thuộc vào điện tích z và độ lưu động μ [S·m2/C]: λ = |z|·μ·F, trong đó F là hằng số Faraday. Độ dẫn toàn phần là tổng độ dẫn của mỗi ion: σ = ∑σi = ∑λ ·c , trong đó ci là nồng độ của ion [mol/m3].
1) Độ lưu động của OH và H+ lần lượt là 2.07·10-7 và 3.63·10-7 S·m2/C. Tính độ dẫn điện mol λ(OH ), λ(H+) và độ dẫn điện (σ) của nước nguyên chất.
Trong thí nghiệm đầu tiên, chuẩn độ 50.0 mL acid mạnh HA bởi dung dịch kiềm 0.500 M. Đồ thị dưới đây biểu diễn hàm số độ dẫn - thể tích dung dịch kiềm.
4) Tính độ dẫn điện của dung dịch sau khi thêm 6.0 mL dung dịch kiềm. Trong thí nghiệm thứ hai, 20 mL hỗn hợp HCl với acid hữu cơ yếu HnB (Ka ~ 10-5) được pha loãng thành 100 mL và chuẩn độ bằng dung dịch KOH 0.600 M. Kết quả chuẩn độ được cho trong bảng dưới đây: V, mL 0 1
σ, S/m 0.6

0.4
5) Có bao nhiêu proton của acid yếu HnB đã được chuẩn độ?
6) Tính nồng độ của cả hai acid trong dung dịch không bị pha loãng (ban đầu).
2) Những ion nào gây ra tính dẫn điện trước điểm tương đương, tại điểm tương đương và sau điểm tương đương? Bỏ qua sự phân li của nước.
3) Xác định acid HA (HCl, HClO4 hay HBr) và base (LiOH, KOH, NaOH), chú ý rằng độ dẫn điện mol [mS·m2/mol] của các ion được cho như sau: λ(K+) = 7.35, λ(Na+) = 5.01, λ(Li+) = 3.86, λ(Cl ) = 7.63,λ(Br ) = 7.80, λ(ClO4 ) = 6.52.