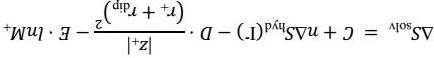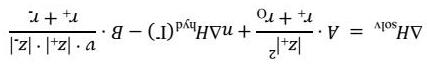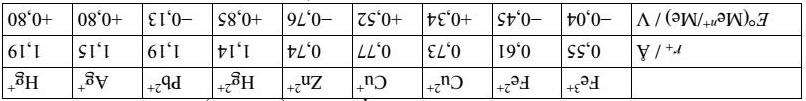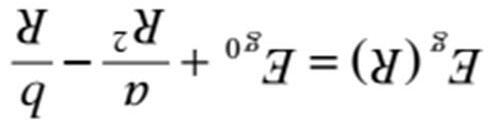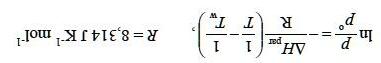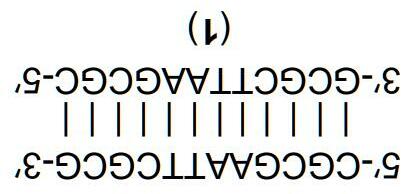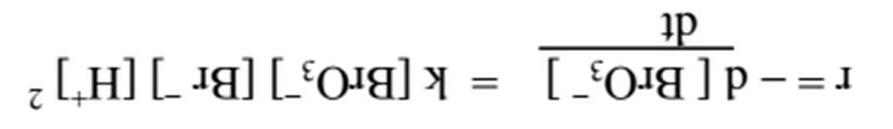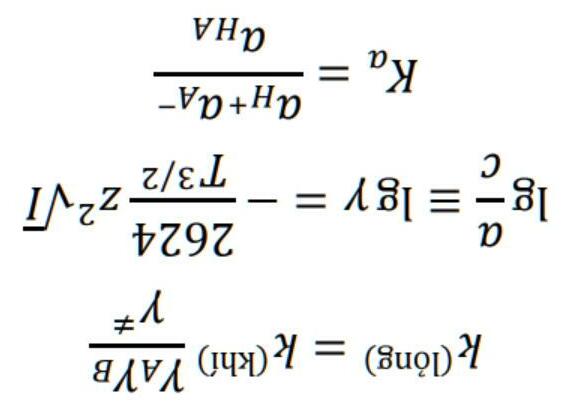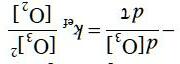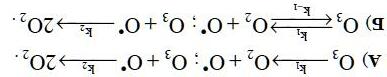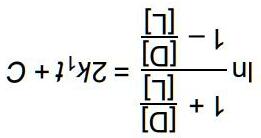phÈmSchÊt ph¶n øng
Từ thời cổ etanol cùng với dầu thực vật đã được dùng để nấu ăn và thắp sáng. Vào ngày nay thì etanol được dùng để làm nhiên liệu, phần lớn chúng được sản xuất từ phương pháp lên men bằng cách cho một loại vi khuẩn đặc chủng chuyển hóa đường thành etanol. Với nguồn năng lượng này thì có thể cho rằng chính ánh sáng mặt trời đã giúp động cơ hoạt động vì quá trình quang hợp tạo ra đường, và trong quá trình đốt cháy tạo ra cacbon dioxit và nước thì năng lượng được sinh ra. a) Viết phản ứng tổng hợp đường, tổng hợp và đốt cháy etanol
Etanol lần đầu tiên được sử dụng làm nguồn cung cấp năng lượng cho các động cơ đốt trong từ những nghiên cứu của Nikolaus Augustus Otto vào những năm 1860. Còn ngày nay etanol có thể được sử dụng làm nhiên liệu tăng sức mạnh cho các động cơ đốt cũng như động cơ sử dụng nhiên liệu etanol trực tiếp (DEFC). Loại DEFC đầu tiên đã được ShellEco –Marathon giới thiệu vào năm 2007 có sơ đồ như hình bên.
b) Xác định các chất ở các vị trí A – F trong hình vẽ
c) Hãy xác định hiệu suất chuyển hóa năng lượng cực đại của DEFC từ các giá trị nhiệt động cho ở bảng dưới ở 25oC. Biết hiệu suất chuyển hóa năng lượng được

42 | ( ) ( )ooo o 11 SSs¶n
GHTS GRTlnK R8.134 J Kmol ∆=− ∆=∆−∆ ∆=− = 43 | Bài 6
tính theo công thức η = ∆Go / ∆Ho. Lấy kết quả đến hai chữ số có nghĩa Chất O2 H2 CO2 H2O C2H5OH C6H12O6 ∆Ho, kJ.mol 1 0 0 -394 -286 -278 -1273 So, J.mol 1.K 1 205 131 214 70 161 212 d) Hãy so sánh hiệu suất chuyển hóa năng lượng của etanol và xăng trong động cơ đốt trong. Biết hiệu suất chuyển hóa năng lượng của động cơ đốt trong được tính theo phương trình η = 1 – 1/r(γ-1). Với γ = Cp/CV ≈ 1,4. Hệ số nén r của etanol và xăng lần lượt là 9 và 12,5. Cho rằng thực tế chỉ có một nửa hiệu suất chuyển hóa được dùng vào việc làm động cơ hoạt động.
Hiện với DEFC vẫn còn một số vấn đề chưa giải quyết được. Chính vì thế triển vọng tương lai của nó là chuyển etanol thành hydro để sử dụng trong các tế bào điện hóa hydro.
e) Xác định hiệu suất chuyển hóa năng lượng cực đại của tế bào điện hóa hydro từ các giá trị nhiệt động đã cho trên. Trong thực tế cần phải tính tới sự chuyển hóa năng lượng sinh ra thành cơ năng để giúp xe chạy. Cho rằng khả năng chuyển hóa của các thiết bị có trong hệ thống là 90% cho máy phát, 90% cho động cơ và 90% cho nén khí. Như vậy hiệu suất chuyển hóa năng lượng chung của toàn hệ thống cũng không hơn quá nhiều so với động cơ đốt trong vốn chuyển trực tiếp hóa năng thành cơ năng f) Xác định hiệu suất chuyển hóa năng lượng thực tế của tế bào điện hóa hydro g) Nêu rõ hai điểm lợi của: i) etanol so với xăng khi dùng làm nhiên liệu cho động cơ đốt trong; ii) tế bào điện hóa so với động cơ đốt trong
Bài 7
Câu hỏi sau đây là một điển hình về việc áp dụng chu trình nhiệt động học để xác định entalpy phân ly của một liên kết.
Bước đầu tiên của phản ứng nhiệt phân toluen (metylbenzen) là sự bẻ gãy liên kết C6H5CH2–H. Năng lượng hoạt hóa của quá trình này chính là entalpy phân ly của liên kết được xác định là 378.4 kJ mol–1 .
a) Viết và cân bằng phản ứng cháy của toluen.
Giá trị entalpy chuẩn của một số chất được cho dưới đây, sử dụng các ký hiệu chuẩn hóa của IUPAC (Nghĩa là. f = sinh ra, c = cháy, vap = hóa hơi, at = nguyên tử hóa)
ΔfH°(CO2, k, 298K) = –393.5 kJ mol–1
ΔfH°(H2O, l, 298K) = –285.8 kJ mol–1
ΔcH°(C7H8, l, 298K) = –3910.2 kJ mol–1
ΔvapH°(C7H8, l, 298K) = +38.0 kJ mol–1
ΔatH°(H2, k, 298K) = +436.0 kJ mol–1 .
i) Tính ΔfH°(C7H8, l, 298K)
ii) Xác định ΔfH° đối với gốc benzyl C6H5CH2·(k) ở 298 K.
b) Entropy hóa hơi chuẩn của toluen là 99.0 J K–1 mol–1 .
i) Tính ΔvapG° của toluene ở 298 K.
ii) Trạng thái tồn tại cơ bản của toluen ở 298 K?
iii) Tính nhiệt độ sôi của toulen.
c) Entalpy tạo thành chuẩn của dibenzyl (1,2–diphenyletan) là 143.9 kJ mol–1. Tính năng lượng phân ly của liên kết C–C trung tâm trong dibenzyl, C6H5CH2–CH2C6H5
|
44 |
45
Phản ứng vận chuyển hoá học (transport reaction) là một trong những phương pháp để tinh thế nhôm. Trong phản ứng này, hơi aluminium(III) chloride được dẫn trực tiếp qua nhôm lỏng. AlCl được tạo thành trong phase hơi ở nhiệt độ cao. AlCl bị phân hủy ở nhiệt độ thấp hơn, tạo thành Al tinh khiết: 2 Al(l) + AlCl3 (g) ⇌ 3 AlCl(g)
Δ H°inkJmol S°inJmol K
Al(l) 10.56 39.55 AlCl3(g) -584.59 314.44 AlCl(g) 51.46 227.95
1) Tính nhiệt độ tối thiểu cần để cân bằng dịch chuyển về phía tạo thành sản phẩm.
Trong giai đoạn sơ khai của nghệ thuật nhiếp ảnh, bột nhôm mịn đã được dùng cho đèn flash tương tự như magnesium. Một loại đèn flash điển hình có công suất 8000 W với ánh đèn kéo dài 1/30 giây. Phản ứng xảy ra trong quá trình này là:
4Al (s) + 3O2 (g) → 2Al2O3 (s) ΔRH = -3351,4 kJ/mol
2) Tính khối lượng nhôm đã được dùng cho đèn flash đó.
Al2O3 là chất rắn màu trắng, kết tinh dạng hệ mặt thoi. Giá trị enthalpy tạo thành lớn chủ yếu là do năng lượng mạng tinh thể (2 Al3+(g) + 3 O2-(g) → Al2O3(s)). Cho các dữ liệu sau đây:
Enthalpy thăng hoa Al 330.0 kJ/mol
Năng lượng ion hóa của Al thứ nhất 5,986 eV thứ hai 18,83 eV thứ ba 28,45 eV
O(g) + e → O (g) Δ H° = -141,0kJ/mol
O (g) + e → O2-(g) Δ H° = 1779,6 kJ/mol
Enthalpy phân li liên kết O2 493,6 kJ/mol
3) Tính năng lượng mạng lưới của Al2O3 theo kJ/mol.
Có khoảng 40 triệu tấn nhôm được sản xuất mỗi năm. Giai đoạn chính trong quá trình sản xuất nhôm là điện phân để tách nhôm khỏi Al2O3. Một lượng nhôm đã bất ngờ được tìm thấy ở phần trên đài tưởng niệm Washington ở Mỹ. Điểm mốc này là một tháp cao 169,26 m, được làm bằng đá cẩm thạch với một mặt cắt vuông, thon dần tới độ cao 152,00 m, và kết thúc ở dạng kim tự tháp. Phần trên của kim tự tháp chứa nhôm nguyên chất, nằm ở độ cao 169,04 m. Đỉnh nhôm này là một kim tự tháp đáy vuông với cạnh đáy 12 cm và thuộc hệ thống bảo vệ (chống sét) của toàn bộ đài tưởng niệm. Khối lượng riêng của nhôm là is ρ (Al) = 2,699 g / cm3 .
Ở thời điểm sản xuất (1885), đỉnh tháp này dùng những mảnh nhôm lớn nhất và có giá trị nhất từng được đúc. Giả sử rằng quá trình điện phân được tiến hành với dòng điện 2 A và hiệu suất dòng 80 %.
4) Tính thời gian (ngày) cần thiết để sản xuất đỉnh nhôm bằng phương pháp điện phân.
|
46 | Bài 8
47
Các hydrat của axit nitric rất được chú ý do nó xúc tác cho quá trình dị thể tạo thành các lỗ thủng ozone ở Nam cực. Worsnop đã tiến hành nghiên cứu sự thăng hoa của mono-, di- và trihydrat- của axit nitric. Kết quả được thể hiện bởi các thông số nhiệt động sau đây ở 220K ∆rGo, kJ.mol 1 ∆rHo, kJ.mol 1
HNO3.H2O(r) → HNO3(k) + H2O(k) 46,2 127
HNO3.2H2O(r) → HNO3(k) + 2H2O(k) 69,4 188
HNO3.3H2O(r) → HNO3(k) + 3H2O(k) 93,2 237
a) Tính ∆rGo của các phản ứng này ở 190K (là nhiệt độ của vùng cực). Giả sử ∆rHo và ∆rSo ít biến đổi theo nhiệt độ
b) Hydrat nào sẽ bền vững nhất ở 190K nếu áp suất của nước là 1,3.10-7 bar và áp suất HNO3 là 4,1.10-10 bar. Biết áp suất tiêu chuẩn là 1 bar
Hướng dẫn
a) Ta có biểu thức ∆G = ∆H - T∆S. Ở 220K thì ∆G220 = ∆H - 220∆S ⇒ ∆S = (∆H - ∆G220)/220 Ở 190K thì ∆G190 = ∆H - 190∆S
Do ∆H và ∆S không phụ thuộc nhiều vào nhiệt độ
kiện địa cực thì trihydrat sẽ bền vững nhất
Bài 10
Một chất lỏng có mùi dễ chịu có thành phần khối lượng các nguyên tố là 52.2% C và 13.0% H, phần còn lại là oxy. Phổi khối lượng của chất này không có tín hiệu ở vùng m/z > 90. Chất này đã được điều chế từ cách đây ngàn năm trước bằng phản ứng khử kị khí trong dung dịch bão hòa.
1) Chúng ta đang nói đến chất nào? Viết cấu trúc và gọi tên nó.
2) Vẽ công thức chiếu Newman cho cấu dạng bền nhất của chất đó. Áp suất hơi của chất lỏng này là p60 = 46.7 kPa ở 60°C, và p70 = 72.2 kPa ở 70°C. Giá trị trung bình của entanpy hóa hơi giữa 60°C và nhiệt độ sôi có giá trị ΔHV = 862 J.g-1 .
3) Tính giá trị nhiệt độ sôi trung bình của chất lỏng này.
4) Tính entropy hóa hơi của chất lỏng này.
5) Tính hằng số nghiệm sôi của chất lỏng. Hòa tan 5.00 g andehit vanilic (4-hydroxy-3-metoxybenzencacbandehit) vào 100 g hợp chất này.
6) Tính áp suất hơi của dung dịch ở 60°C?
|
48 | Bài 9
nên lắp biểu thức tính ∆S vào biểu thức ∆G190 sẽ thu được biểu thức như sau: ∆=∆−+∆ ooo r190rr220 190190 GH1G 220220 Thay số vào biểu thức này thu được các kết quả lần lượt cho monohydrat, dihydrat và trihydrat là 57,2; 85,6 và 112,8 kJ/mol b) Q = p(H2O)n.p(HNO3), ∆rG = ∆rGo + RTlnQ Lắp các trị tính được ở câu a vào biểu thức ∆rG ta sẽ thu được các kết quả lần lượt cho monohydrat, dihydrat và trihydrat lần lượt là: -2,0; 1,3 và 3,5 kJ/mol Như vậy ở điều
49
Trả lời các câu hỏi sau về năng lượng Gibbs của phản ứng oxy hóa.
a) Điền vào chỗ trống của đoạn văn sau các công thức hóa học hoặc thuật ngữ phù hợp.
Khi oxy hóa kim loại “M” bằng một mol khí oxy để tạo thành oxit MmOn (m, n là các số nguyên) thì có thể biểu diễn phản ứng ở dạng ( i ). Biến thiên năng lượng Gibbs chuẩn của phản ứng này là, ΔGo, có thể được biểu diễn ở dạng ( ii ) phụ thuộc vào biến thiên ( iii ) chuẩn, ΔHo, và biến thiên ( iv ) chuẩn, ΔSo , của phản ứng ở nhiệt độ tuyệt đối T. Mặt khác khi có cân bằng giữa kim loại tinh khiếu M và oxit tinh khiết MmOn ở nhiệt độ tuyệt đối T, thì áp suất riêng phần của oxy pO2 có thể được biểu diễn ở dạng ( v ) bằng cách sử dụng ΔGo và giá trị hằng số khí R. Giản đồ biểu thị các giá trị ΔGo của các phản ứng oxy hóa khác nhau được vẽ ở dạng hàm của nhiệt độ tuyệt đối được gọi là “Giản đồ Ellingham” (Hình 1). Như đã chỉ ra trên giản đồ, hầu hết các đồ thị đều có dạng đường thẳng và kim loại nằm ở phần bên dưới có xu hướng ( vi ) so với phần bên trên.
Hình
Khi cả chất phản
lẫn sản phẩm đều ở trạng thái ngưng tụ (rắn
Hình 1 thì hệ số góc của mỗi đường thẳng trên giản đồ hầu hết đều đồng nhất. Đối với khí CO2 đường thẳng sẽ nằm ngang và hệ số góc cho thấy dấu khác so với giá trị tuyệt đối trong trường hợp khí CO. Giải thích điều này.
lỏng)
c) Viết phản ứng hóa học xảy ra khi khử Cu2O bằng Al.
d) Tính nhiệt phản ứng ở câu c) cho mỗi mol Al.
e) Chỉ ra trên đồ thị đường thẳng ở đó áp suất riêng phần pO2 và tỉ lệ hai áp suất riêng phần của CO và CO2, pCO/pCO2 không đổi.
f) Khi phản ứng khử chất rắn FeO về Fe bằng cách thổi khí CO ở 1000 K đạt đến cân bằng thì có bao nhiêu % lượng khí CO đã được chuyển hóa?
50 | Bài 11
-1400 -1200 -1000 -800 -600 -400 -200 0 050010001500 2000 4Cu + O2 = 2 Cu2O 2 Fe+ O2 =2 FeO 2C+O2 = 2CO C + O2 = CO2 3/2Fe+O2 = 1/2Fe3O4 2Mn +O2 =2MnO Si+O2 =SiO2 4/3Ti +O2 = 2/3Ti2O3 4/3Al+O2 =2/3Al2O3 2Mg+O2 =2MgO 2Ca+O2 =2CaO 0 200 400 -600 -800 1000 1200 0 500 1000 1500 2000 Temperature (K) Gibbs Gibbs energy of oxidation reactions energy of oxidation reactions of oxidation reactions of oxidation reactions (kJ/mol (kJ/mol O O 2 2 2 2 ) ) 4/3Al+O =2/3AlO 51 |
1. Giản đồ biểu thị sự phụ thuộc năng lượng Gibbs của phản ứng oxy hóa vào nhiêt độ (Giản đồ Ellingham) b)
ứng
hay
ở
Bài tập này nói về heptane (“hep”) và iso-octane (2,2,4-trimethyl pentane, “oct”). Cả hai chất này đều đóng vai trò quan trọng trong các động cơ đốt trong. Dưới đây là một số dữ liệu Hóa-lí ở nhiệt độ 298 K. Trong phản ứng đốt cháy, sẽ tạo thành H2O (g). heptane, lỏng:
ρ = 0.680 g cm-3; enthalpy tạo thành ΔfH° = -224.4 kJ mol-1 iso-octane, lỏng:
ρ = 0.692 g cm-3; enthalpy đốt cháy ΔcH° = -44328 kJ kg-1
ΔfH° (CO2) = -393.5 kJ mol-1; ΔfH° (H2O(g)) = -241.8 kJ mol-1
1. Xác định khối lượng mol của hep và oct.
2. Tính enthalpy chuẩn của phản ứng cháy (ΔcH°) heptane theo các đơn vị kJ/mol, kJ/kg, kJ/L.
3. Tính enthalpy tạo thành chuẩn ΔfH° của iso-octane theo kJ/mol. Việc kiểm tra các hỗn hợp của n-heptane và iso-octane có tầm quan trọng đặc biệt. Chúng được đốt cháy trong các động cơ kiểm tra được chuẩn hóa để đo khả năng chống kích nổ của nhiều loại nhiên liệu (kích nổ động cơ = sự bắt cháy trong cylinder [xi lanh] động cơ ở sai thời điểm). Một loại nhiên liệu có khả năng chống kích nổ giống hỗn hợp kiểm tra oct-hep thì có giá trị RON (“chỉ số octane nghiên cứu”) bằng phần trăm octane về thể tích trong hỗn hợp. Iso-octane tinh khiết có RON = 100, heptane có RON = 0.
Xét một hỗn hợp kiểm tra với RON = 93, nghĩa là có phần trăm thể tích octane là 93 %.
4. Tính khối lượng riêng của hỗn hợp kiểm tra theo gam/L.
5. Tính enthalpy đốt cháy chuẩn của hỗn hợp kiểm tra theo kJ/mol.
6. Tính entropy chuẩn và năng lượng tự do Gibbs chuẩn khi trộn 100 mL hỗn hợp ở 298 K. Hầu hết việc thử nghiệm nhiên liệu mới đều được thực hiện trên động cơ nhiệt Otto. Để cho đơn giản, ở đây xét một chu trình nhiệt động học của động cơ Otto lý tưởng với nhiên liệu là không khí. Coi như khí là lý tưởng trong mọi tình huống.
Đối với không khí, nhiệt dung mol ở điều kiện đẳng tích CV,m = 20.85 JK mol , tỉ lệ công suất nhiệt γ = 1,40. Chúng ta có 4 giai đoạn thuận nghịch. Giản đồ pV biểu diễn chu trình này là
|
A (1→2) nén đẳng entropy (đoạn nhiệt)
B (2→3) gia nhiệt đẳng tích
C (3→4) giãn nở đẳng entropy (đoạn nhiệt) (thì [hành trình] nổ giãn của động cơ Otto)
(4→1) làm mát đẳng tích
Giai đoạn nào (trong bốn giai đoạn A, B, C, D) không
ra
hiện
mà
52 | Bài 12
53
D
7.
thực
công? 8. Giai đoạn nào sự đốt cháy nhiên liệu diễn
quá nhanh -
thể tích có thể xem như không đổi? 9. Giai đoạn nào entropy của khí đốt là thấp nhất? Với 4 đỉnh của giảm đồ pV, biết được các giá trị sau: T1 = 15°C, p1 = 100kPa; T3 = 1800°C Cylinder có dung tích 1,00 L. Dung tích bằng với sự chênh lệch V1-V2. Thể tích quá hạn (dead volume) V2 bằng 15 % thể tích cực đại V1. 10. Xác định V1 và V2. 11. Tính T2 và T4. 12. Tính phần mol của không khí trong cylinder.
13. Tính biến thiên nội năng (ΔU) của các giai đoạn.
Hiệu suất η là tỉ lệ nhiệt thêm vào (q) với công (w) thực hiện bởi máy.
Bài 13
Bảng dưới đây cho biết bán kính ion và thế khử chuẩn (Men+/Me) của một số kim loại:
14. Tính hiệu suất của động cơ Otto lí tưởng. 55 |
Biến thiên enthalpy của quá trình solvate hóa iodide kim loại (MeIn(s) → Men+(aq) + nI (aq)) có thể ước lượng gần đúng bằng các phương trình Latimer và Kapustinskii
Trong đó A = -610 kJ Å/mol, B = -1080 kJ Å/mol, rO = 0,50 Å, v là số ion trong công thức thực nghiệm, z+ và z là điện tích của cation và anion theo điện tích nguyên tố, r+ và r- là bán kính của cation và anion theo Å, ΔHhyd(I ) = -308 kJ/mol. Bán kính của iodide là 2,06 Å.
Biến thiên entropy của quá trình solvate hóa iodide kim loại có thể ước tính bằng các phương trình Sackur–Tedore và Powell–Latimer
Trong đó C = 88 J/(mol K), D = 644 J Å2/(mol K), rdip = 1,30 Å, E = 12,5 J/(mol K), M là khối lượng mol của cation, ΔShyd(I ) = -58,1 J/(mol K)
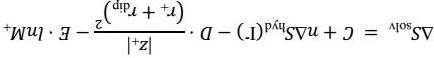
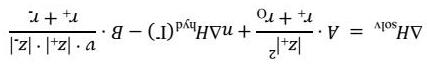
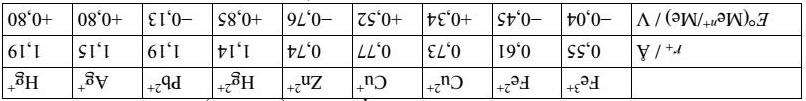
a) Chứng minh bằng tính toán rằng với CuI thì ΔGsol > 0 còn với CuI2 thì ΔGsol < 0.
b) Những iodide nào sau đây không tan trong nước:
Trong dung dịch nước, Cu2+ và Fe3+ khử I thành
54 |
I2, Eo(I2/I ) = 0,535 V. c) Tính thế khử chuẩn của Fe3+/Fe2+ và chứng minh rằng phản ứng khử I thành I2 bởi Fe3+ tự diễn biến ở điều kiện chuẩn. d) Tính thế khử chuẩn của Cu2+/Cu+ và chứng minh rằng phản ứng khử I thành I2 bởi Cu2+ tự diễn biến. Biết Ksp = 1,1.10-12 .
5 ống nghiệm A-E chứa các dung dịch nước, nồng độ 0,1 M của các chất sau: AgNO3, CuSO4, FeCl3, Hg(NO3)2, KI. Kết quả định tính từng ống nghiệm bằng cách cho chúng phản ứng lần lượt với nhau được cho trong bảng sau: A B C D E
A –
B Kết tủa đỏ cam –
C Kết tủa vàng, dung dịch nâu – –
D Dung dịch nâu – – –
E Kết tủa vàng nhạt – –
Kết tủa trắng –
e) Xác định thành phần có trong các ống nghiệm A-E. Viết các phương trình phản ứng.
Bài 14
Các chloride kim loại MeCln(s) thường được sử dụng làm nguyên liệu đầu cho các tổng hợp phase rắn. Các cân bằng giữa phase rắn và khí, và các dạng mà chloride tồn tại ở phase khí đóng vai trò then chốt. Chloride MeCln(s) bị thăng hoa không phân hủy, tạo thành MeCln(g) hoặc (MeCln)a(g) - tùy thuộc vào nhiệt độ. Đặt 5.8370 gam MeCln(s) vào một ống đậy kín (V = 100 mL) rồi đun nóng tới 277 oC để khảo sát về các cân bằng có thể xảy ra. Khi đạt cân bằng, áp suất trong ống là 0.8062 atm và còn lại 5.2561 gam MeCln. Giả sử rằng các hàm nhiệt động ΔHof và So không phụ thuộc vào nhiệt độ và có giá trị bằng: Hàm MeCln(s) MeCln(g) (MeCln)a(g) ΔHof, kJ/mol -397 -253 -654 Sof, J/(mol·K) 142 344 537
1) Xác định hệ tọa độ mà trong đó sự phụ thuộc vào nhiệt độ của áp suất phản ứng ( ) ( )AsAg ⇌ là hàm số dạng tuyến tính. Dẫn ra biểu thức sự phụ thuộc này với các chất khí trên MeCln rắn.
2) Xác định công thức các chloride.
3) Xác định chuỗi quá trình diễn ra khi đun nóng MeCln(s). Tính nhiệt độ bắt đầu các quá trình tự diễn biến.
4) Xác định áp suất riêng phần của các khí trong ống ở 727 oC nếu phase rắn đã bị loại bỏ khi các khí được tạo thành ở 277 oC.
5) Xác định cấu tạo của các phân tử trong phase khí. Xác định trạng thái lai hóa của nguyên tử kim loại trong các phân tử này.
6) Chloride kim loại nào trong phase khí ưu tiên tham gia vào phản ứng với CsCl(s) ở 727 oC (thăng hoa ở 1300 oC)?
7) Xác định chế độ phản ứng ở 727 °C, biết năng lượng hoạt hóa là khoảng 5 kJ/mol, và sự phụ thuộc của tốc độ vào áp suất có thể bỏ qua.
|
56 |
57
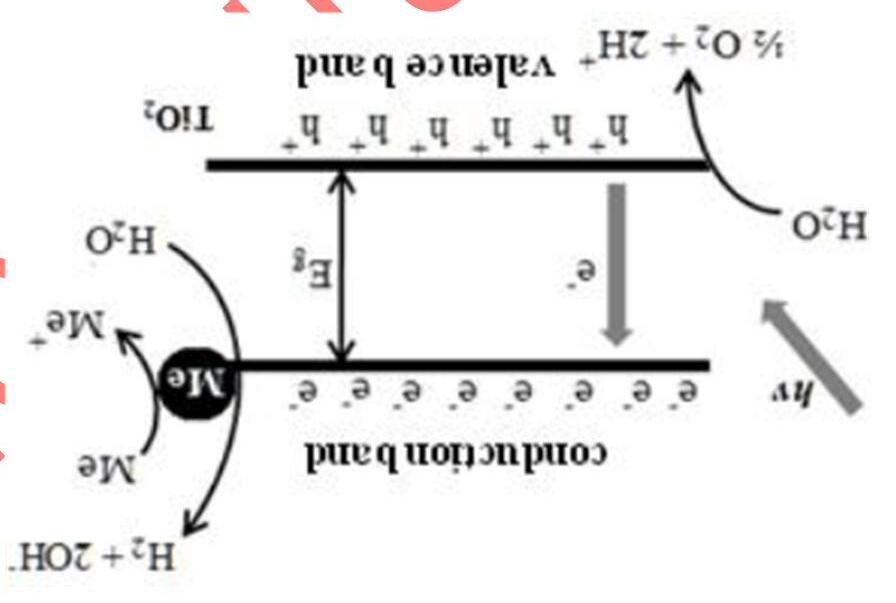
Hydrogen là một nguồn năng lượng tái tạo đầy triển vọng. Một trong những phương pháp sản xuất hydrogen là phân huỷ quang xúc tác nước. Cơ chế của quá trình này được biểu diễn trong sơ đồ dưới đây. Xúc tác được dùng có thể là titanium dioxide.
Trong điều kiện kích thích ánh sáng với năng lượng photon lớn hơn năng lượng vùng cấm của chất bán dẫn (Eg), các electron chuyển lên vùng dẫn, để lại các lỗ trống (h+) trong vùng hoá trị. Hiệu suất của quá trình giảm bởi sự tái kết hợp nhanh của các cặp e - h+. Để phân chia điện tích1, xúc tác được biến tính bởi các kim loại chuyển tiếp.
Trong đó Eg0 là năng lượng vùng cấm của phase vĩ mô (kích thước lớn, còn gọi là phase kết khối), μ = me*·mh*/(me* + mh*) - khối lượng quy đổi của các khối lượng hiệu dụng electron (me*) và lỗ trống (mh*), ε0 - hằng số điện, ε - hằng số điện môi, e - điện tích electron, R - bán kính hạt, a = h2/8μ, b = 1.8e2/4πεε0
2)

a) Tính năng lượng vùng cấm của các hạt TiO2 với R = 2 nm, nếu Eg0 = 3.0 eV, ε = 184, μ = 0.74 me
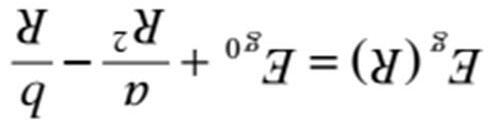

b) Đối với các hạt nano thì cần tăng hay giảm cường độ bức xạ để tăng độ dẫn điện so với phase vĩ mô?
c) Tính khối lượng hiệu dụng của electron và lỗ trống nếu me* = 12.5mh*.
Hiệu suất quá trình sản xuất hydrogen quang xúc tác có thể xác định bởi hiệu suất lượng tử φ - tỉ lệ giữa số electron “hiệu dụng” (ne) với số photon (np) tạo thành bởi nguồn sáng trên đơn vị thời gian.
1) Chọn các kim loại trong bảng mà khi thêm vào sẽ làm tăng hiệu suất phân huỷ quang xúc tác nước.
3) Tính hiệu suất lượng tử ne/np (%). Tốc độ tạo thành hydrogen tối đa với xúc tác này là Vmax = 5.6 μmol/phút, công suất nguồn sáng P = 67 mW, bước sóng anh sáng 421 nm.
Động học của phản ứng, diễn ra trên bề mặt quang xúc tác, có thể mô tả bởi mô hình Langmuir - Hinshelwood:
Trong đó Z là các tâm hấp phụ, A là chất nền hữu cơ, P là sản phẩm phản ứng, KA là hằng số hấp phụ, k là hằng số tốc
trong phản
phản
W(H
trong
Trong các hệ được tạo thành từ các hạt có kích thước nhỏ hơn 100 nm thường quan sát được các hiệu ứng kích thước - sự phụ thuộc của tính chất hóa-lý của các chất vào kích thước hạt. Với độ rộng của vùng cấm, mối quan hệ này của oxide bán dẫn được mô tả bằng công thức sau 1 https://goldbook.iupac.org/html/C/C00999.html
|
trình
58 | Bài 15
59
độ
ứng. Tốc độ của hydrogen
ứng này là
2) = knA,
đó A0A A A0A KC n 1KC = + là mức độ bao phủ bề mặt. Sau khi tuyến tính hoá đường cong W(H2) thu được phương
y = 3.27 + 1.78x.
4)
a) Xác định các biến số x, y trong đồ thị này.
b) Tính k và KA
Cho biết các hằng số vật lí: h = 6.63·10-34 J·s, NA = 6.02·1023 mol-1, c = 3·108 m·s-1, 1 eV = 1.6·10-19 J, me = 9.1·10-31 kg, ε0 = 8.85·10-12 F/m, е = 1.6·10-19 C
Bài 16
Quang hợp là cách hiệu quả để chuyển hóa năng lượng ánh sáng. Ta sẽ xem xét phát biểu đó theo các quan điểm khác nhau. Phương trình tổng quát của quá trình quang hợp bởi cây xanh có dạng: H2O + CO2 → CH2O + O2
Trong đó CH2O ký hiệu cho cacbohiđrat. Mặc dù glucose không phải là sản phẩm hữu cơ chính của quá trình quang hợp nhưng nó hay được sử dụng nhất, coi CH2O như 1/6 (glucose). Sử dụng các thông tin cho dưới đây để trả lời các câu hỏi.
1. Tính biến thiên enthalpy chuẩn và năng lượng Gibbs chuẩn của phản ứng trên tại 298K. Giả sử rằng phản ứng được thực hiện duy nhất bởi điều kiện ánh sáng. Xác định số photon nhỏ nhất cần thiết để tạo ra một phân tử khí oxi.
2. Năng lượng Gibbs tương ứng với áp suất riêng phần của tất cả (tổng) các khí (1 bar). Trong khí quyển, áp suất riêng phần trung bình của oxi là 0,21 bar và của khí cacbonic là 3.10-4 bar. Tính năng lượng Gibbs của phản ứng trên trong những điều kiện này (nhiệt độ 298K).
3. Thực tế, để giải phóng một phân tử khí oxi bằng lá xanh đòi hỏi không ít hơn 10 photon. Phần trăm của năng lượng mặt trời bị hấp thụ chứa trong dạng của năng lượng Gibbs là bao nhiêu? (giá trị này có thể được coi là hiệu suất quá trình chuyển hóa năng lượng mặt trời).
4. Bao nhiêu photon bị hấp thụ và bao nhiêu sinh khối (kg) cũng như bao nhiêu thể tích khí oxi (m3 tại 25oC và 1 atm) được tạo thành:
- Tại Moscow trong 10 ngày diễn ra kỳ thi olympic hóa học.
- Tại Khuôn viên Đại học liên bang Moscow trong 5 giờ thi lý thuyết?
5. Phần trăm năng lượng mặt trời được hấp thụ trong tổng diện tích sẽ được chuyển hóa thành năng lượng hóa học là bao nhiêu?
- Tại Moscow?
- Tại Đại học liên bang Moscow?
Các thông tin cần thiết để giải bài toán
|
60 |
61
Trung bình (trong 24 giờ), năng lượng mặt trời được hấp thụ tại vùng Moscow vào mùa hè là 150W.m-2;
Diện tích thủ đô Moscow là 1070 km2; cây xanh chiếm 18% diện tích.
Diện tích khuôn viên đại học liên bang Moscow là 1,7 km2; cây xanh chiếm 54% diện tích.
Cây xanh dùng khoảng 10% năng lượng mặt trời.
Bước sóng trung bình, λ = 680 nm.
Các thông số nhiệt động học các chất:
Chuyên đề 22: Giản đồ phase
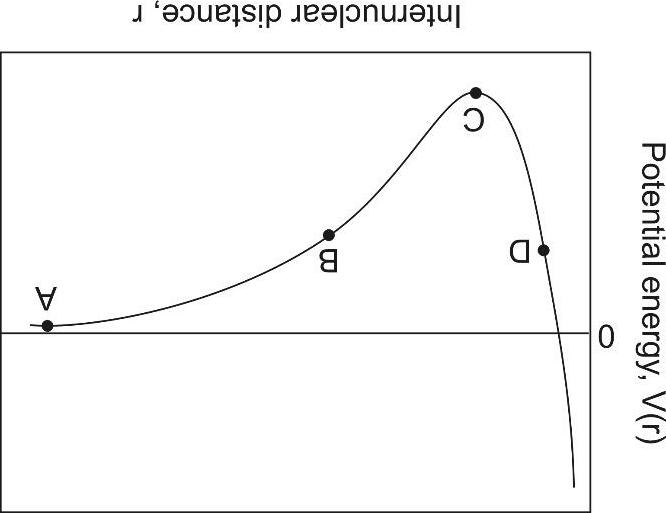
Bài 1
Giản đồ phase biểu diễn các điều kiện áp suất và nhiệt độ mà tại đó các phase bền có thể tồn tại. Hình dưới đây là giản đồ phase của CO2. Phát biểu nào sau đây là không chính xác về giản đồ này? Giải thích. (Cho biết: 1 atm = 101325 Pa và 1 atm = 1.01325 bar).
Chất H
O
CO2(k) O2(k) C6H12O6(r) Thiêu nhiệt chuẩn,
Entropy chuẩn,
A) X là điểm ba của CO2, tại đó 3 phase khác nhau cùng tồn tại.
B) C là điểm tới hạn của CO2, tạ đó các phase lỏng và khí trở nên không thể phân biệt được.
C) Dưới điều kiện áp suất khí quyển, CO2 khí có thể trở thành chất lỏng khi nhiệt độ giảm.
D) Ở nhiệt độ phòng (25 oC), CO2 khí có thể trở thành chất lỏng khi áp suất tăng.
62 |
2
(l)
с298 H∆ , kJ mol–1 – – – –2805
298S , J⋅K–1 ⋅mol–1 70,0 213,8 205,2 209,2 63 |
Giản đồ pha của CO2
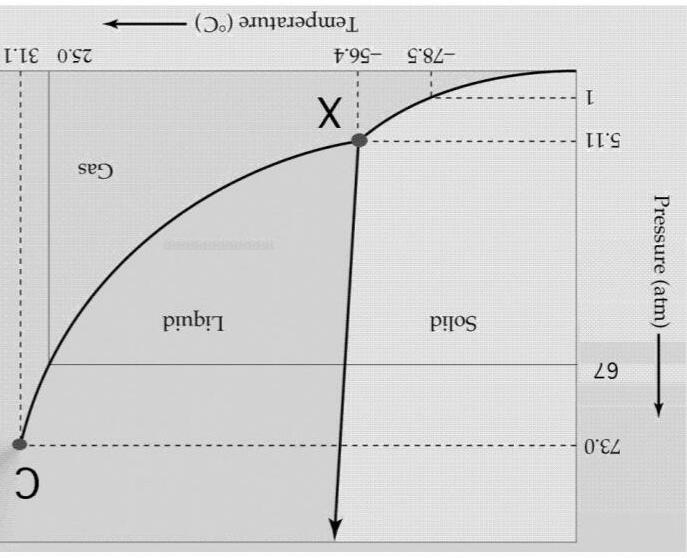
A. Giản đồ pha đơn giản:
a) Trạng thái tập hợp nào là khả dĩ đối với CO2 ở áp suất thường?
b) Để CO2 chuyển sang trạng thái lỏng thì áp suất bé nhất là bao nhiêu ?
c) Đến nhiệt độ nào thì CO2 lạnh đến mức chuyển sang trạng thái ngưng tụ?
d) Ở nhiệt độ nào xảy ra sự cân bằng giữa nước đá khô (CO2(s)) và khí CO2(g) ở áp suất thường?
e) Một bình cứu hoả chứa CO2 lỏng. Nhiệt độ cuối cùng mà bình cứu hỏa có thể đạt đến là bao nhiêu ?
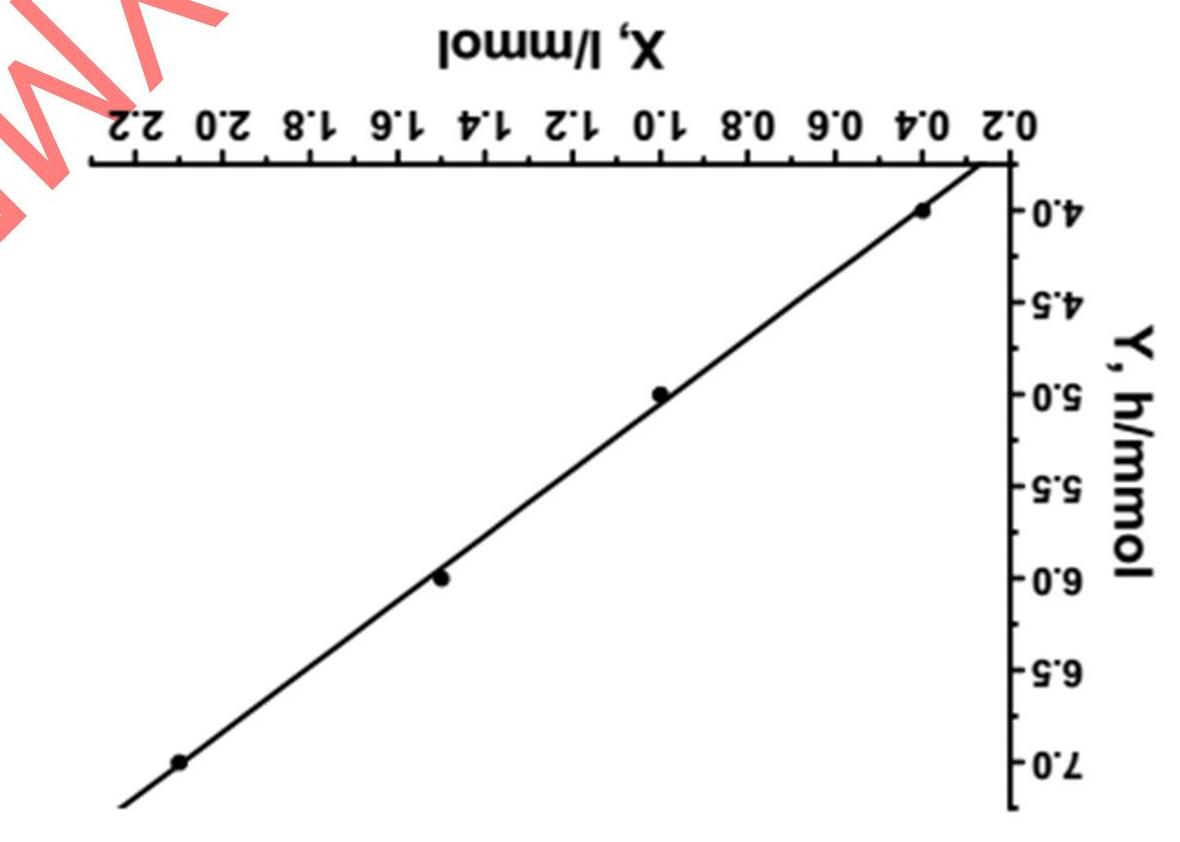
B. Điểm sôi của etanol
Áp suất hơi của etanol ở 60.0°C là 46.7 kPa. Nhiệt hóa hơi của etanol là ∆HV = 862 J/g trong khoảng 60°C và điểm sôi của nó.
a) Tính điểm sôi của etanol ở 1013 mbar.
b) Tính entropy hóa hơi ∆SV ở điểm sôi.
|
64 | Bài 2
65
Bài 3
a) Sự phân li nước thành các nguyên tử phải phá vỡ cả hai liên kết H-O. Enthalpy của quá trình này là ∆H0diss,a(H2O). Enthalpy tạo thành của nước từ các nguyên tử là ∆Ho a(H2O). ∆H0diss(H2) = 435 kJ/mol, ∆H0diss(O2) = 494 kJ/mol, ∆H0f(H2O,g) = -242 kJ/mol.
i) Viết các phương trình phản ứng cần thiết để tìm ∆H0 a(H2O) và các biến thiên enthalpy tương ứng.
ii) Tính ∆H0 a(H2O).
iii) Tính ∆H0diss,a(H2O).
b) Tìm trong giản đồ trạng thái của nước sau đây:
i) Tại nhiệt độ và áp suất nào 3 phase của nước tồn tại trong cân bằng và sự giảm áp suất ảnh hưởng như thế nòa đến
ii) nhiệt độ sôi
iii) nhiệt độ nóng chảy của nước.
Rõhk = áp suất; Temperatuur = nhiệt độ; Gaas = khí; Vedelik = lỏng; Tahke = rắn.
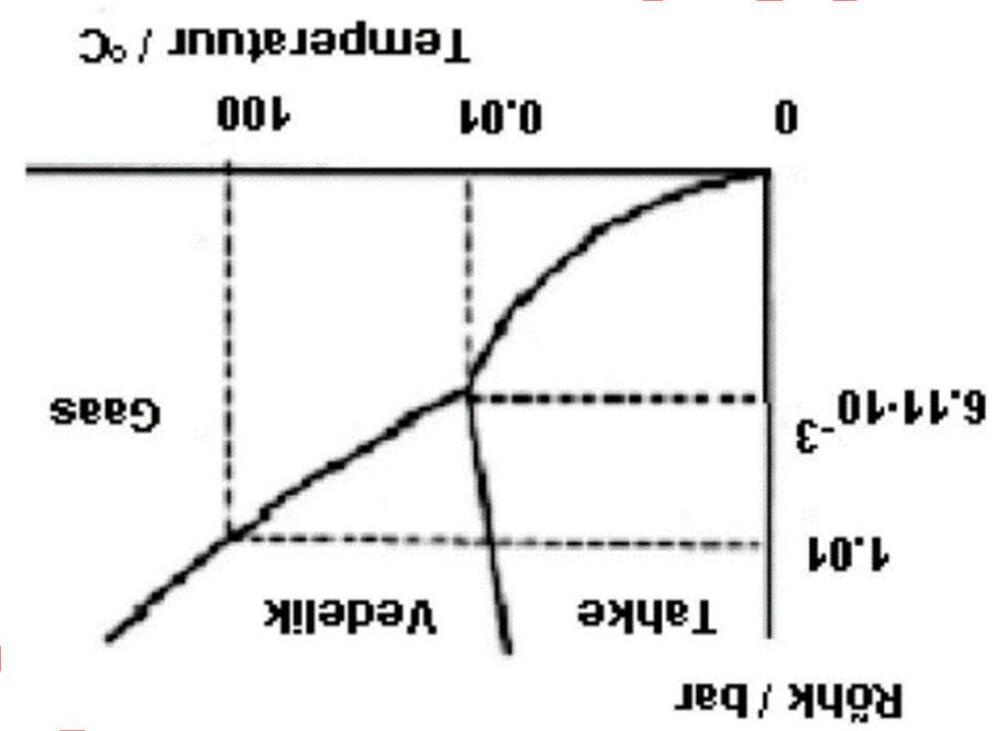
66 | 67 |
Carbon dioxide được tìm thấy trong tự nhiên dưới nhiều điều kiện. Hình vẽ dưới đây là giản đồ phase của carbon dioxide, mô tả các trạng thái cân bằng của hợp chất này ở các giá trị nhiệt độ và áp suất khác nhau. Carbon dioxide ở -100 oC và 1 atm (trạng thái 1, băng khô) đã tham gia vào các chuyển hóa sau đây:
1) được gia nhiệt ở áp suất không đổi đến 25 oC (trạng thái 2).
2) được nén ở nhiệt độ không đổi đến 60 atm (trạng thái 3).
3) được làm mát ở áp suất không đổi về -100 oC (trạng thái 4)
4) chuyển về trạng thái 1. Khối lượng riêng của CO2 rắn và lỏng là 1.56 và 1.10 gam/cm
(các giá trị này gần như không phụ thuộc vào nhiệt độ và áp suất).
1) Ở trạng thái nào, carbon dioxide có thể tích lớn nhất? Lớn hơn bao nhiêu lần so với trạng thái cơ bản?
2) Trạng thái tập hợp của carbon dioxide biến đổi bao nhiêu lần trong mỗi quá trình: 1 → 2
2
3
3
3) Vẽ đồ thị biểu diễn sự phụ thuộc của thể tích CO2 vào nhiệt độ trong các quá trình.
4) Bầu khí quyển Sao Kim gần như chỉ có carbon dioxide. Khối lượng riêng của nó gần bề mặt (450 oC, 100 atm) là 65 kg/m3. Xác định trạng thái tập hợp của CO2 ở khí quyển Sao Kim.
5) Bầu khí quyển Sao Hỏa cũng gần như chỉ có carbon dioxide, nhưng áp suất gần bề mặt nhỏ hơn 10 nghìn lần so với Sao Kim. Khối lượng riêng của khí quyển Sao Kim nhỏ hơn bao nhiêu lần so với khí quyển Trái Đất ở cùng nhiệt độ?
6) Một mảnh “băng khô” có khối lượng 50 gam được cho vào 1 lít nước. Dung dịch tạo thành được gia nhiệt tới nhiệt độ phòng ở áp suất thông thường (25 oC, 1 atm). Tính pH của dung dịch. Hằng số phân li của carbonic acid ở giai đoạn đầu tiên là 4.5·10-7. Độ tan của carbon dioxide trong nước trong những điều kiện này là 0.9 thể tích trên 1 thể tích nước.
68 | Bài 4
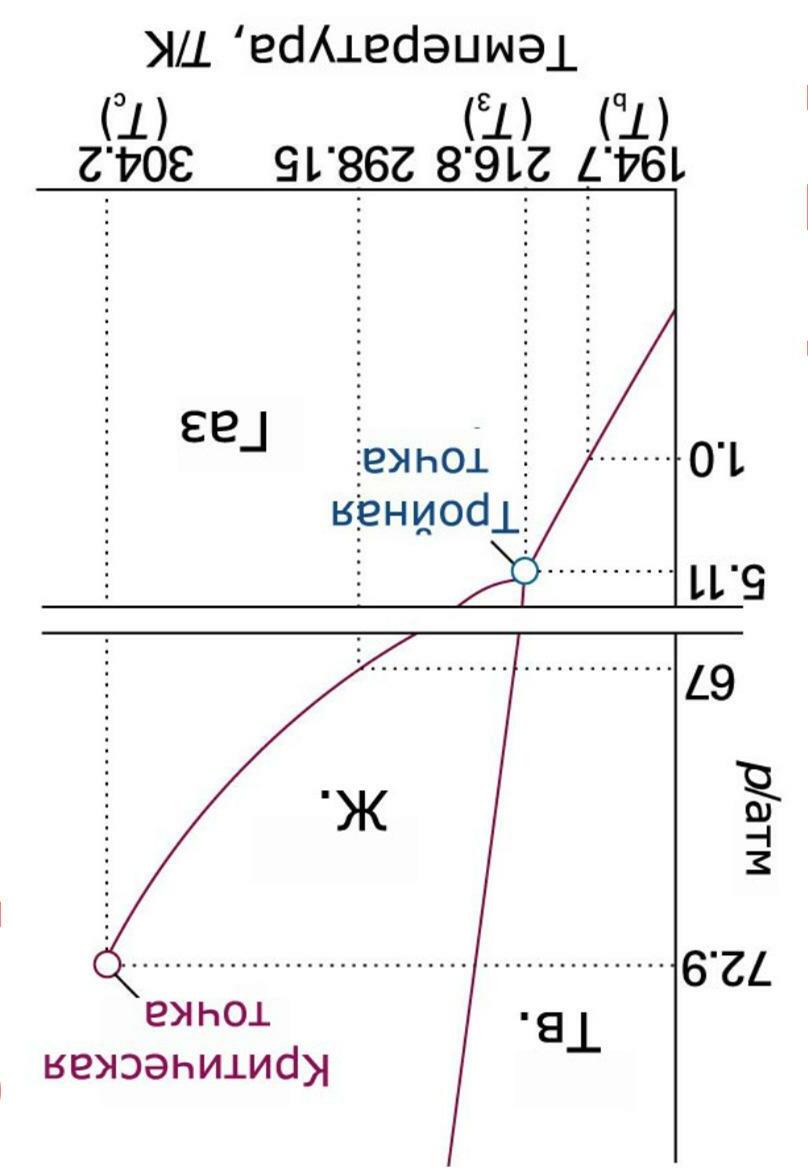
3
тройная точка = điểm ba; критическая точка = điểm tới hạn тв (viết tắt của твердый) = rắn; ж (viết tắt của жидкость) = lỏng; газ = khí 69 |
;
→
;
→ 4; 4 → 1.
Bài 5
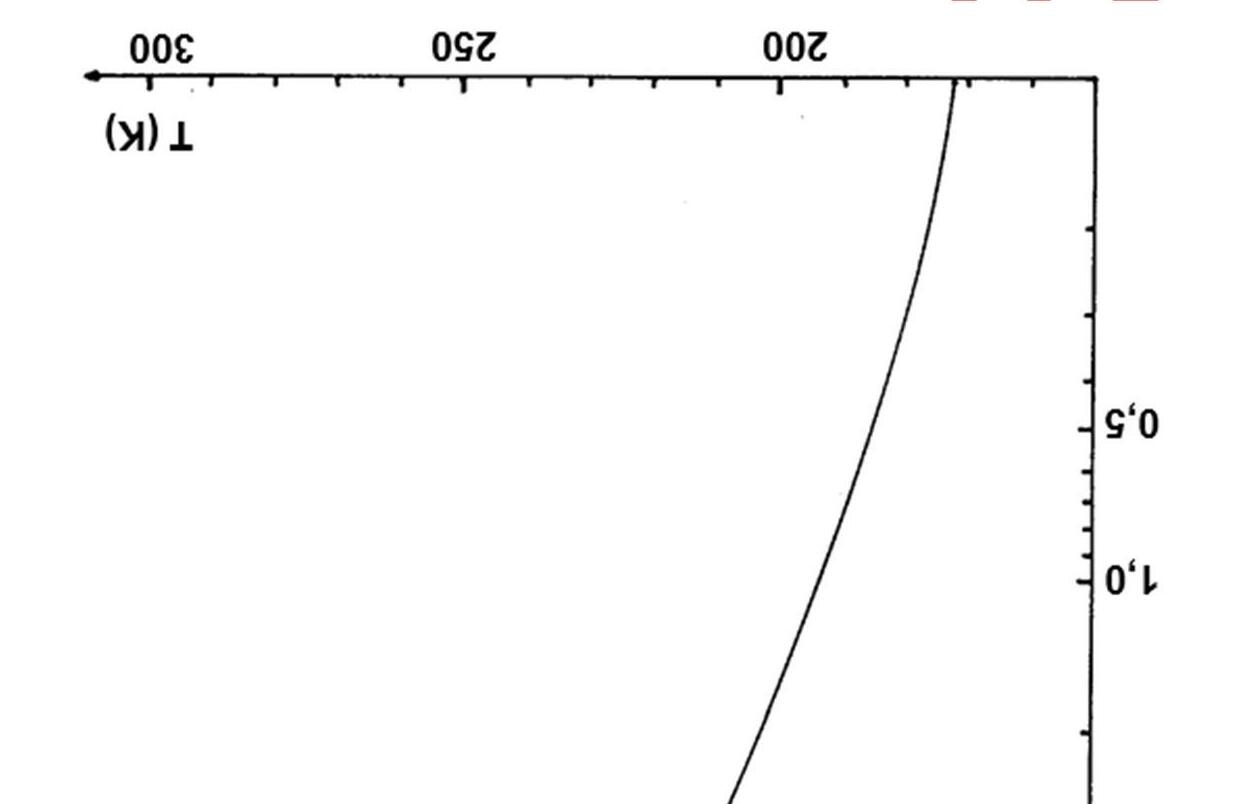
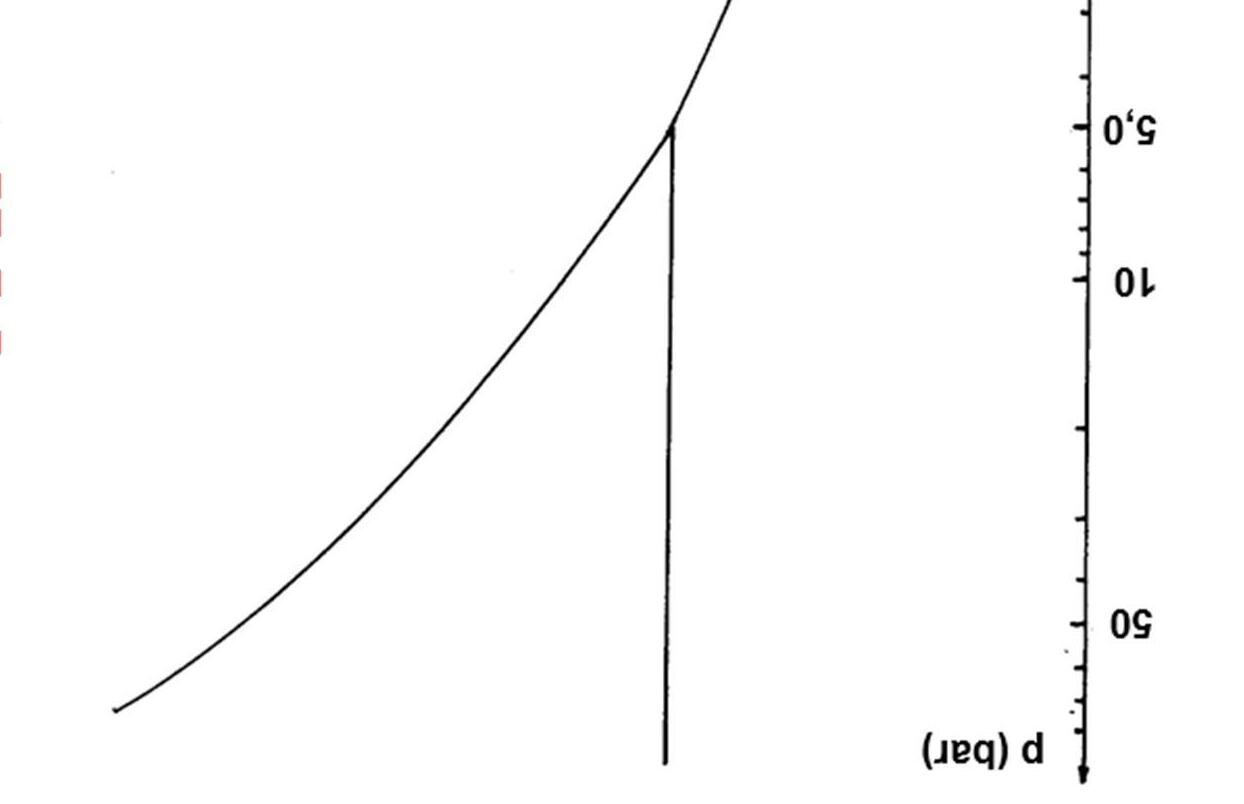
Các giản đồ pha áp suất - nhiệt độ của các chất tinh khiết mô tả các điều kiện tại đó các cân bằng pha tồn tại. Giản đồ pha của nước được chỉ ra dưới đây (áp suất được cho theo thang logarit). Giản đồ pha của nước trong tọa độ semi - log Sử dụng giản đồ pha và các phương trình nhiệt động học thích hợp mô tả các chuyển đổi pha, trả lời các câu hỏi sau:
1.
như thế nào? Giải thích một cách định tính bằng cách áp dụng nguyên
Le Chatelier?
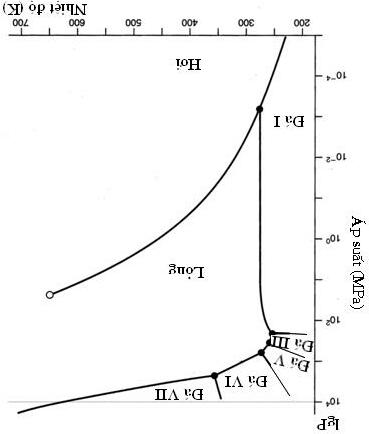
2. Điều
sẽ
với
suất
tăng từ 10 Pa đến 10 GPa tại các nhiệt độ: a) 250K;
3. Nhiệt độ thấp nhất có thể đạt được mà tại đó cân bằng nước lỏng
4. Một vài dạng
có thể tồn tại cân bằng với nước lỏng. Giả sử rằng nhiệt nóng chảy là như nhau với tất cả các dạng đá khác nhau, hãy tính nước đá có khối lượng riêng lớn nhất. Nhiệt độ nóng chảy của nước đá này tại áp suất 10 GPa là bao nhiêu?
5. Nước đá đặc khít nhất có cấu trúc tinh thể lập phương với hai phân tử nước cho một đơn vị tế bào. Cạnh của tế bào là 0,335 nm. Tính khối lượng riêng của nước đá này?
6.Xác định nhiệt nóng chảy của nước đá đặc khít nhất?
Các thông tin cần thiết:
Khối lượng riêng của nước đá thường và nước (lỏng) lần lượt: 0,917 g/ml; 1,000 g/ml.
Nhiệt nóng chảy của nước đá thường là 6010 J/mol.
Điểm ba “nước lỏng - đá VI - đá VII” là: áp suất P = 2200 MPa; nhiệt độ T = 355K.
Gợi ý: Coi như các khối lượng riêng của các pha nước ngưng tụ và các nhiệt chuyển pha không phụ thuộc vào áp suất và nhiệt độ.
70 |
71 |
Nhiệt độ sôi của nước và các nhiệt độ nóng chảy của nước đá thường (Đá I) và Đá V phụ thuộc theo áp suất
lý
gì
xảy ra
hơi nước nếu áp
từ từ
b) 400K; c) 700K.
sẽ tồn tại ở điểm ba giữa: nước lỏng, đá I và đá III. Áp suất tại điểm đó là 210 MPa, tính nhiệt độ?
nước đá
Giản đồ pha của lưu huỳnh được biểu diễn dưới đây có một chút khó khăn hơn so với trạng thái tinh khiết bình thường. Sử dụng nó để trả lời các câu hỏi tương ứng. Lưu ý rằng trên trục áp suất không chia tỷ lệ. (monocline = đơn tà)
1) Nhiệt độ cần phải nung nóng lưu huỳnh để nó trở thành chất lỏng ở 1400 bar?
2) Nếu lưu huỳnh được nung nóng từ từ lên 96oC (ở áp suất bình thường) sẽ xảy ra một quá trình chuyển pha, đó là quá trình nào ?
3) Biến thiên entropy của lưu huỳnh thay đổi như thế nào trong quá trình biến đổi đã đề cập ở trên. Đánh dấu vào câu trả lời dưới đây.

S tăng lên rất nhiều.
S giảm đi rất nhiều.
S không thay đổi nhiều.
Không thể xác định được
4) Cho biết các dữ liệu về điểm ba của lưu huỳnh?
5) Nếu lưu huỳnh rắn được đun nóng từ từ bắt đầu từ nhiệt độ phòng, nó sẽ nóng chảy ở 120oC. Còn nếu đun nóng nhanh lưu huỳnh sẽ nóng chảy ở 114 – 115oC. Giải thích vì sao?
|
72 | Bài 6
73
Chưng cất bằng hơi nước là phương pháp thuận tiện để tách và tinh chế các chất hữu cơ không bay hơi và nhạy cảm với nhiệt. Điều kiện cần thiết là các chất này phải ít tan trong nước. Để giải được các bài tập sau, bạn sẽ phải làm quen với các cơ sở nhiệt động học của quá trình này. Chủ đề thảo luận chính sẽ là cân bằng lỏng - hơi của hệ 1,3,5trimethylbenzene (mesitylene, TMB) - nước. Các giá trị nhiệt độ sôi và enthalpy hoá hơi của các chất (trong điều kiện áp suất chuẩn p0 = 1000 hPa) là
Tw [K] ΔHpar [kJ mol 1] 1,3,5 trimethylbenzene 438 45 nước 373 40
1. Sử dụng phương trình Clausius - Claperyon, hãy tính giá trị áp suất cân bằng của nước và TMB tại nhiều (5 hoặc 6) giá trị nhiệt độ T trong khoảng 363 - 373 K. Phương trình trạng thái Clausius - Claperyon sau khi áp dụng một số giả định đơn giản có dạng như sau:
Bài 8
Đối với một chất tinh khiết, điểm sôi là nhiệt độ tại đó phase lỏng trở thành phase khí. Ngược lại, trong một hỗn hợp, điểm sôi của từng chất thường khác nhau, do đó trạng thái của hỗn hợp ở một nhiệt độ bất kì tùy thuộc vào thành phần của hỗn hợp. Hỗn hợp có thể tồn tại ở trạng thái khí và lỏng, như một chất tinh khiết, hoặc một cân bằng khí-lỏng. Andi lấy 50.0 g hỗn hợp ethanol-nước ở nhiệt độ phòng, trong đó hàm lượng (% khối lượng) ethanol là 40.0% và đun nóng trong một bình kín tới 90 oC. Khi đạt tới cân bằng, áp suất trong bình là 1 atm. Sau đó, Andi dẫn phase khí vào một bình khác và làm nguội tới nhiệt độ phòng. Hình dưới đây biểu diễn một giản đồ cân bằng phase khí-lỏng giữa ethanol và nước:
Etanooli-vee gaasi-vedeliku tasakaal: cân bằng khí-lỏng của ethanol-nước; Gaasifaasi piir = biên phase khí; Vedelikufaasi piir = biên phase lỏng; Aseotroop = hỗn hợp đẳng phí; Etanooli sisaldus (mol/mol) = phần mol ethanol.
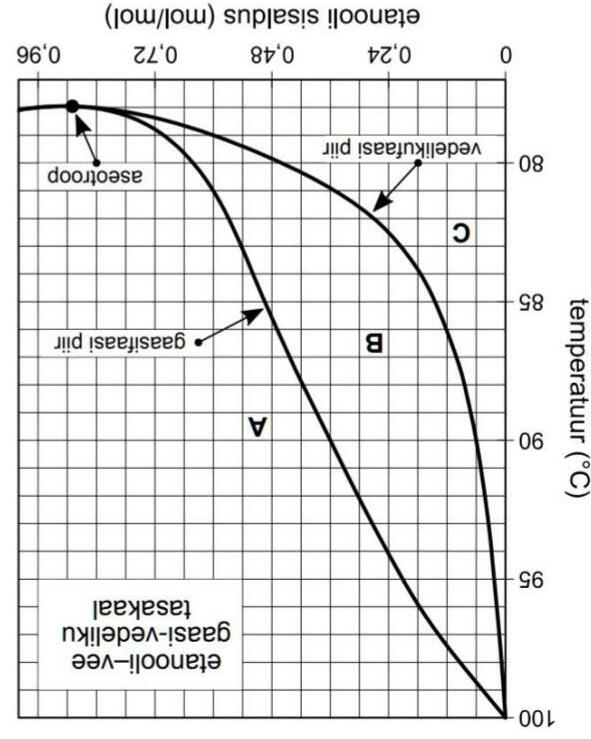
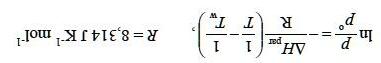
2. Ước lượng nhiệt độ tại đó hỗn hợp nước và MTB sẽ bắt đầu hoá hơi trong điều kiện áp suất p = 1000 hPa.
3. Xác định thành phần của hơi ở điểm đẳng phí (cùng sôi) và vẽ một phần tương đối trong giản đồ phase của hệ ở gần điểm này (p = 1000 hPa). Chấp nhận giả định đơn giản hoá rằng nước không trộn lẫn với TMB.
4. Tính lượng nước tối thiểu (về mặt lí thuyết) để chưng cất 100 gam TMB.
5. Cho biết những chất nào sau đây có thể được chưng cất bằng hơi nước. Đưa ra lời giải thích ngắn gọn cho mỗi trường hợp.
a) ethyl benzoate
b) aminoacetic acid (glycine)
c) 1,4-dihydroxybenzene (hydroquinone)
d) nitrobenzene
a) Tính hàm lượng ethanol trong hỗn hợp ban đầu theo phần mol.
b) Trong vùng nào (A-C) hỗn hợp tồn tại ở phase khí, lỏng và rắn?
c) Xác định phần mol ethanol và nước ở 90 oC i) trong phase khí và ii) trong phase lỏng.
d) Tính số gram chất lỏng được tạo thành khi làm nguội phase khí và có bao nhiêu gram chất lỏng còn lại trong bình chứa ban đầu?
e) Giải thích tại sao bạn có thể nhận được hỗn hợp có lượng ethanol cao hơn dựa vào nguyên lí của Andi?
f) Tại sao phương pháp của Andi không thể đạt 100% ethanol?
|
74 | Bài 7
75
Bài 9
Biết rằng điểm đông đặc của một dung dịch thấp hơn so với dung môi tinh khiết và phụ thuộc tuyến tính vào nồng độ chất tan (m): T = T0 - K · m (1). Trong đó, K là hằng số nghiệm lạnh được xác định bởi tính chất của dung môi. Nếu m được biểu diễn theo nồng độ molal (số mol chất tan trên 1 kg dung môi). K có thể được tính theo công thức Δ = 2 0 fus
RTM K H (2), trong đó T là nhiệt độ (K), M là khối lượng mol dung môi (kg⋅mol-1), ΔНfus là enthalpy nóng chảy mol của dung môi tinh khiết (J·mol-1), R = 8.314 J⋅mol 1 ⋅K 1.\ Một ví dụ về giản đồ phase của hệ hai kim loại (A và B) được cho trong hình. Sự giảm nhiệt độ nóng chảy của hỗn hợp diễn ra theo công thức (1) với các thành phần gần với các chất tinh khiết. Những phụ thuộc tuyến tính như vậy sẽ suy giảm khi nồng độ (của bất kì cấu tử) nào ở mức cao.
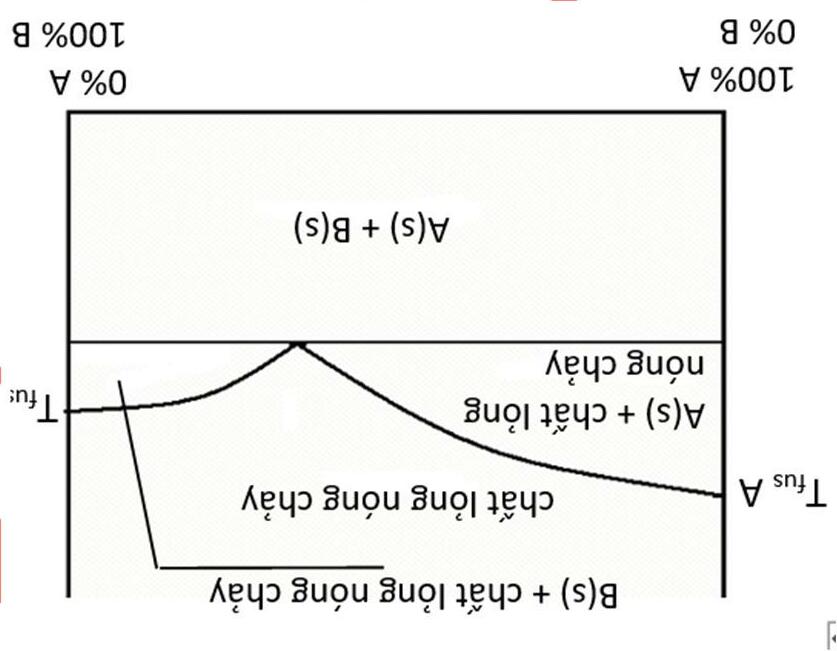
Trong bài tập này, chúng ta giả sử rằng sự phụ thuộc tuyến tính (1) vào nồng độ molal xảy ra ở mọi thành phần. Chú ý: Nếu sự phụ thuộc vào m (nồng độ molal) là tuyến tính thì sự phụ thuộc vào ω (hàm lượng) là phi tuyến tính.
1) a) Tính nồng độ molal của dung dịch NaOH 12 % trong nước.
b) Tính nồng độ molal của kim loại A trong kim loại B, nếu hàm lượng của A là ωA và khối lượng mol của nó là MA. Gallium và indium là những kim loại có nhiệt độ nóng chảy thấp, nhưng hợp kim của chúng thậm chí còn có nhiệt độ nóng chảy thấp hơn bởi hiệu ứng nghiệm lạnh: Tfus, °С ΔHfus, kJ mol 1 Ga 29.8
In 156
76 | 77 |
5.59
3.27
2) Sử dụng dữ liệu từ bảng trên, hãy tính nhiệt độ nóng chảy của hợp kim Ga-In chứa 5.00 % Ga về khối lượng.
3) Xác định khoảng hàm lượng của gallium mà trong đó nhiệt độ nóng chảy của hợp kim thấp hơn 25.0 oC. Nhiệt độ nóng chảy là nhiệt độ mà tại đó hợp kim chuyển hoàn toàn thành chất lỏng. Hợp kim có thể được xem như dung dịch của một kim loại trong một kim loại khác. Nhiệt độ nóng chảy có thể được ước tính từ giả định là indium là dung môi và gallium là chất tan, và ngược lại, indium là chất tan làm giảm nhiệt độ nóng chảy của dung môi gallium.
Hợp kim chưa biết chứa 2 kim loại A và B với hàm lượng ωA và ωB. Các thông số của kim loại tinh khiết được cho ở bảng dưới đây. Biết rằng hợp kim là chất lỏng ở 200 oC trong khoảng 0.441 < ωA < 0.630. Tfus, K ΔHfus/M, kJ kg 1 А 600.6 116.2 В 504.9 252.3
4) Xác định các kim loại A và B
5) Xác định thành phần hợp kim ứng với nhiệt độ nóng chảy cực tiểu.
6) Tính nhiệt độ nóng chảy cực tiểu của hợp kim.
Chuyên đề 23: Cân bằng hóa học Bài 1
Entanpy tự do chuẩn của phản ứng đồng phân hóa borneol (C10H17OH) thành isoborneol ở trạng thái khí ở 503 K bằng +9.4 kJ/mol. Bạn có một hỗn hợp gồm 0.15 mol borneol và 0.30 mol isoborneol sau đó đun nóng đến 503 K. Xác định chiều của phản ứng.
|
78 |
79
Bài 2
Phản ứng chuyển dịch nước (WGS, water-gas shift reaction) [CO (g) + H2O (g) → H2 (g) + CO2 (g)] là một quá trình hóa học quan trọng. Cho các dữ kiện năng lượng liên kết (BE, bond energy) sau: BE(C≡O) = 1072 kJ mol-1; BE(O-H) = 463 kJ mol-1; BE(C=O) = 799 kJ mol-1; BE(H-H) = 436 kJ mol-1. Hãy ước tính nhiệt phản ứng. Phản ứng sẽ diễn ra thuận lợi ở nhiệt độ thấp hay cao? Giải thích ngắn gọn.
Bài 3
Một cách để sản xuất hydro công nghiệp là phản ứng giữa metan với hơi nước siêu nóng ở 800°C: CH4(k) + 2 H2O(k) ⇌ CO2(k) + 4 H2(k)
Cho biết một số dữ liệu nhiệt hóa học sau đây: ΔRHo 298 = 164.9 kJ ΔRSo 298 = 172.5 J‧K-1 CP (CH4) = 35.31 J‧mol-1‧K-1 CP (H2O) = 33.58 J‧mol-1‧K-1 CP (CO2) = 37.11 J‧mol-1‧K-1 CP (H2) = 28.82 J ‧mol-1‧K-1
1) Cân bằng sẽ chuyển dịch về chiều nào ở điều kiện chuẩn? Tính toán chứng minh.
2) Cân bằng sẽ chuyển dịch về chiều nào tạo 800oC nếu i) các giá trị nhiệt động không phụ thuộc nhiệt độ và ii) các giá trị nhiệt động phụ thuộc nhiệt độ.
|
80 |
81
Phản
CO
chuyển dịch về phía tạo thành
Bài 5
Dấu năng lượng Gibbs của phản ứng hóa học, ∆G, cho biết chiều xảy ra phản ứng đó theo khuynh hướng tự nhiên (vốn có) ở nhiệt độ và áp suất hằng định. Đây là một nguyên lí. Nếu ∆G < 0 phản ứng có thể xảy ra theo chiều thuận (ưu tiên cho sự tạo ra sản phẩm). Nếu ∆G > 0 phản ứng có thể xảy ra theo chiều nghịch (ưu tiên cho sự tạo ra chất tham gia).
Khi ∆G = 0 phản ứng đạt tới cân bằng.
Có thể tính được năng lượng Gibbs tiêu chuẩn, ∆G0, từ bảng năng lượng Gibbs sinh của chất đầu, của sản phẩm (xem bảng sau). Bảng 1. Năng lượng Gibbs sinh (áp suất tiêu chuẩn là 1 atm; xem thêm các bảng JANAF)
Chất t, 0C ∆fG0, kJ/mol NiO 1627 -72,1 TiO2 727 757,8 TiC 727 -162,6 CO 727 200,2 NH3 27 16,26
1. Hãy tính hằng số cân bằng của phản ứng (1) ở 1627 0C. Nếu áp suất riêng phần ban đầu của O2 dưới 1,00 Torr phản ứng này có thể xảy
CO
Tính
C. Cần có
ứng thuận chiếm
C. Hãy tính áp suất cân
kiện nào (biết rằng có thể thỏa mãn
ra
nhiệt độ đó?
phản
(3) tại 300
3,0
không?
phản ứng
82 | Bài 4 Hỗn hợp khí gồm CO, H2, và CH3OH được cho đi qua xúc tác ở 500 K. a)
ứng
+ H2 → CH3OH có xảy ra ở điều kiện sau đây hay không: == 23 COHCHOH p9p99p , 3 CHOH 0.099barp = , and ∆°= rG21.21kJ/mol ∆=∆°+ rr GGRTlnQ b) Tính giá trị Q khi ∆rG = 0. Nó là giá trị cực đại hay cực tiểu để cân bằng
metanol? 83 |
ra theo chiều thuận đượckhông? 2Ni ( ℓ ) + O2 (k) = 2NiO (r) (1). 2. Phản ứng TiO2 (r) + 3C (r) = 2CO (k) + TiC (r) (2) có năng lượng Gibbs tiêu chuẩn dương tại 727 0
bằng của
tại727 0
điều
được) để phản
ưu thế xảy
ở
3.
năng lượng Gibbs tiêu chuẩn của
ứng
K: 3H2 + N2 = 2NH3 (3). Ở điều kiện p(NH3) = 1,0 atm; p(H2) = 0,50 atm; p(N2) =
atm
thuận trên có chiếm ưu thế được
Thực tế, tại 300 K phản ứng đó xảy ra nhưng với tốc độ không đáng kể. Tại sao?
Bài 6
Nguyên lí Lơ Satơlie khẳng định rằng: ″Một hệ ở trạng thái cân bằng bị một tác động thì chuyển dời về phía làm giảm ảnh hưởng của tác động đó″.(P.W. Atkins ″Physical Chemistry″)
Ta cùng xét việc áp dụng nguyên lí này. Có cân bằng hóa học (cbhh) sau được thiết lập ở pha khí li tưởng:
3H2 + N2 = 2NH3 (1). Ở 400 K áp suất riêng phần của mỗi khí như sau: p(H2) = 0,376 bar; p(N2) = 0,125 bar; p(NH3) = 0,499 bar. Cân bằng hóa học này chịu tác động:
a) Tăng áp suất chung của hệ tại nhiệt độ không đổi;
b) Tăng lượng NH3 khi giữ không đổi nhiệt độ và áp suất chung của hệ;
c) Tăng một lượng nhỏ N2 khi giữ không đổi nhiệt độ và áp suất chung của hệ;
d) Tăng một lượng nhỏ H2 khi giữ không đổi nhiệt độ và áp suất chung của hệ.
1. Tính năng lượng Gibbs tiêu chuẩn của phản ứng (1) tại 400 K.
2. Viết biểu thức cho năng lượng Gibbs của phản ứng (1) với áp suất bất kỳ sau khi cbhh trên bị phá vỡ. Biểu thức này được gọi là phương trình đẳng nhiệt của phản ứng hóa học.
3. Sử dụng phương trình đẳng nhiệt của phản ứng hóa học đã nêu ra ở điểm 2. trên, hãy cho biết chiều xảy ra phản ứng (1) khi có tác động được nêu ra từ a) đến d) trên.
4. Cũng có câu hỏi như ở điểm 3. nếu có trị số áp suất riêng phần cân bằng của mỗi khí là: p(H2) = 0,111 bar; p(N2) = 0,700 bar; p(NH3) = 0,189 bar. Giả thiết nhiệt độ và áp suất chung của hệ là như nhau cho cả 4 câu hỏi từ 1. đến 4
84 |
85 |
Kim cương là một trong những chất cứng nhất, được sử dụng rộng rãi trong các ứng dụng công nghiệp cần sự mài mòn cao. Trong thực tế, tổng hợp kim cương từ dạng thù hình sẵn có của cacbon như than chì rất khó khăn. Để chứng minh điều này, tính áp suất cần thiết (theo đơn vị bar, 1 bar = 105 Pa) chuyển hóa than chì thành kim cương ở 25oC. Các dữ kiện cho sau đây áp dụng ở 25oC và 105Pa.
- Biến thiên năng lượng tự do Gibbs chuẩn, ∆Gof (kJ.mol-1) hình thành của than chì và kim cương lần lượt là 0 và 2,8678.
- Thể tích mol V (cm3.mol ) của than chì và kim cương lần lượt là 5,3324 và 3,4108.
- Sự thay đổi thể tích theo áp suất của than chì và kim cương được xác định bởi công thức:
kV
(1)
Trong đó kT (Pa-1) của than chì và kim cương có giá trị lần lượt là 3,04.10 11 và 0,187.10-11
- Biến thiên năng lượng tự do Gibbs theo áp suất có thể được tính theo phương trình:
Bài 8 Ở giai đoạn cuối của quá trình lò cao, gang đúc được tạo thành theo các phản ứng:
3Fe(s) + C(s) → Fe3C(s) (1)
FeO(s) + CO(g) →Fe(s) + CO2(g) (2)
FeO(s) + C(s) → Fe(s) + CO(g) (3)
Các giá trị biến thiên enthalpy tạo thành chuẩn và entropy chuẩn của các chất trên ở 298.15 K được cho trong bảng sau: Chất FeO CO CO2 Fe C Fe3C ∆Нfo, kJ/mol 266 110 393 0 0 31 Sfo, kJ/(mol K) 57 198 214 24 6 101
1) Xác định lượng Fe3C (% khối lượng và số mol) có trong gang đúc ở dạng hỗn hợp eutetic của Fe3C và Fe, biết rằng kết quả phân tích nguyên tố cho thấy % khối lượng carbon là 4.2.
2) Viết các phương trình phản ứng diễn ra ở giai đoạn đầu của quá trình lò cao, có sự tham gia của quặng Fe2O3(s) và than cốc C(s).
3) Tính năng lượng tự do Gibbs và hằng số cân bằng của các phản ứng 13. ∆G
H
Với po là áp suất ban đầu, po = 105 Pa; p là áp suất cần xác định.
Sự phụ thuộc của năng lượng tự do Gibbs vào áp suất và nhiệt độ được cho bởi công thức:
= Vdp – SdT (3)
T
-RTlnK
4) Giả sử ∆H và ∆S không phụ thuộc vào nhiệt
mà
86 | Bài 7
T V
p ∂ =− ∂
2 2 ooo 2 G1G G(p)G(p)(pp)(pp) p2p ∂∆∂∆ ∆=∆+−+− ∂∂ (2)
-
dG
87 |
o = ∆
o –
∆So =
p
độ phản ứng, hãy ước tính nhiệt độ tự diễn biến của các phản ứng 1-3. 5) Xác định giá trị nhiệt độ T
tại đó nồng độ CO2 trong khí khí thảo là 1.05·10-2 % thể tích và áp suất tổng là 1 atm. 6) Xác định phản ứng chiếm ưu thế ở nhiệt độ T. Tính độ chuyển hoá của FeO thành Fe ( ) của phản ứng này, biết: p(CO) + p(CO2) = 1 atm. 7) Dự đoán sự thay đổi độ chuyển hoá khi tăng nhiệt độ.
Nhờ có các liên kết hydrogen mà methane acid có thể tạo thành dạng dimer trong phase khí. Ở áp suất 0.145 atm và nhiệt độ 298 K, dạng dimer chiếm 94.0 %. Ở nhiệt độ 318 K, hằng số cân bằng là 105. ΔG = ΔH - TΔS = -RTlnKp, trong đó R = 8.314 J/(mol·K).
1) Vẽ công thức cấu tạo của dimer.
2) Viết phương trình phản ứng dimer hoá. Viết biểu thức và tính Kp ở 298 K.
3) Tính biến thiên entropy và enthalpy, giả sử rằng ΔH và ΔS không phụ thuộc vào nhiệt độ.
4) Việc tăng (i) áp suất và (ii) nhiệt độ sẽ ảnh hưởng như thế nào đến cân bằng của phản ứng dimer hoá.
Bài 10
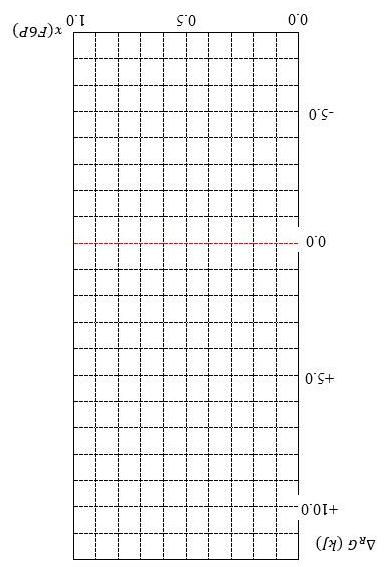
Glucose-6-phosphate đồng phân hóa tạo fructose-6phosphate ở bước đầu tiên của quá trình thủy phân đường. Enthalpy tự do tiêu chuẩn của phản ứng là ∆ G 1.7kJ tại 298 K.
1) Tính hằng số cân bằng của phản ứng và thành phần của hỗn hợp cân bằng tại 25°C.
2) Tính enthalpy tự do của phản ứng ∆ G phụ thuộc vào tỉ lệ fructose-6phosphate trong hỗn hợp phản ứng tùy chọn (ít nhất 6 giá trị), và biểu diễn sự phụ thuộc này trên sơ đồ cho sẵn dưới đây.
|
88 | Bài 9
89
Xét phản ứng cháy của graphit (C) trong oxy ở 1000°C để tạo thành cacbon oxit.
1) Viết và cân bằng phản ứng với hệ số cân bằng cực tiểu. Chỉ ra trạng thái của chất bằng cách sử dụng ký hiệu (r) cho chất rắn, (l) cho chất lỏng và (k) cho chất khí.
Trong một bình kín mà trong đó nắp bình được di chuyển tự do (p = constant) thì một cân bằng đã được thiết lập với KP = 1.5×1018 (ở 1000°C).
2) Viết biểu thức KP cho phản ứng trên.
3) Tính entanpy năng lượng tự do ΔGΘ ở 1000°C.
Bình đuợc nạp đầy bằng cách thêm vào khí oxy (p(O2) = 1.00 bar) và CO (p(CO) = 0.130 bar), rồi niêm kín và đun nóng đến 1000°C.
4) Tính tỉ số phản ứng và trạng thái mà ở đó phản ứng xảy ra tự phát.
Nhiệt phản ứng đo được khi đạt đến cân bằng là ΔH = -225 kJ.
5) Tính biến thiên entropy ΔS.
là chất tan kém trong nước. Sự phụ thuộc của
tan vào nhiệt độ khá bất thường khi so với các muối khác.
Dung dịch bão hòa CaSO4 chứa 0,67g/l ở 25oC và 0,22g/l ở 80oC. Vậy dung dịch sẽ ấm lên hay lạnh đi khi hòa tan thạch cao? Chứng minh bằng cách tính entanpy hòa tan trong khoảng nhiệt độ đã cho.
90 | Bài 11
91 | Bài 12 1) Hằng số cân bằng của phản ứng 2 C3H6(k) ⇄ C2H4(k) + C4H8(k) ở trong khoảng nhiệt độ từ 400 K đến 410 K có thể được biểu diễn bằng phương trình: =−−+ 5 2 10881.5110 lnK1.04 TT Tính các giá trị ∆RG⊝T, ∆RH⊝T và ∆RS⊝T của phản ứng ở 400 K. Có thể giả thiết rằng ∆RH⊝T và ∆RS⊝T là hằng số trong khoảng nhiệt độ đang xét. 2) Canxi sunfat (thường gọi là thạch cao)
độ
Ammonia là một trong những hóa chất cơ bản quan trọng nhất với sản lượng hàng năm trên thế giới là khoảng 180 triệu tấn. Hầu như toàn bộ ammonia được sản xuất theo phương pháp Haber-Bosch:
N2(g) + 3 H2(g) → 2 NH3(g) (R 4.1)
Dưới đây là một số dữ kiện nhiệt độ ở 298 K cho các tính toán: ΔfH° / kJ/mol S° / J/molK Cp° / J/molK N2 (g) 0 191,6 29,1 H2 (g) 0 130,7 28,8 NH3 (g) -45,9 192,8
1) Tính nhiệt lượng tổng Q1 (theo joule) giải phóng khi sản xuất ammonia dưới điều kiện đẳng áp ở 298 K.
Những đồn đoán về kế hoạch của bộ film : "Star Wars: Episode XIX - The Power of Chemistry" cho biết sẽ có một Death Star (Ngôi sao tử thần) mới.
Trong vũ khí khổng lồ này có chứa trên 180 triệu tấn ammonia được chế tạo trong một bom nhiệt lượng lớn duy nhất và sẽ được sử dụng để tiêu diệt hành tinh mục tiêu.
2) Tính nhiệt lượng tổng Q2 sẽ giải phóng khi nạp ammonia trong bom nhiệt lượng kế ở 298 K.
3) Tính khối lượng các nguyên liệu đầu mà Death Star cần hấp thụ cho một lần nạp ammonia.
Bây giờ hãy trở lại với khoa học phi-viễn tưởng. Quá trình Haber-Bosch thường được thảo luận trong các giáo trình về cân bằng hóa học.
4) Tính Kp của phản ứng tạo thành ammonia theo phương trình R4.1 ở 298 K.
5) Để tốc độ phản ứng nhanh hơn, tổng hợp ammonia được thực hiện ở nhiệt độ khoảng 400 oC. Tính Kp của phản ứng tạo thành ammonia ở 400 oC, giả sử rằng ΔRH và ΔRS giống như ở 298 K.
Thực tế thì enthalpy phản ứng dĩ nhiên phụ thuộc vào nhiệt độ. Các giá trị sau của hằng số cân bằng được xác định với phản ứng R4.1 ở các nhiệt độ khác nhau.
Sử
7) Tính Cp của NH3
Giả sử rằng các giá
C
của H2
N2
NH
không phụ thuộc vào nhiệt độ.
92 | Bài 13
T Kp 93 | 500 K 1.14 ⋅ 10 1 600 K 2.11 ⋅ 10 3 700 K 1.12 ⋅ 10 4 6)
dụng những giá trị này, hãy tính giá trị có thể có của ΔRH650.
.
trị
p
,
,
3
Bài 14
Một sinh viên cho 0.20 mol PCl3 (g) và 0.10 mol Cl2 (g) vào bình 1.00 L ở 250 oC. Khi phản ứng PCl3 (g) + Cl2 (g) ⇌ PCl5 (g) đạt cân bằng, thì thấy trong bình có 0.12 mol PCl3.
i) Tính nồng độ đầu của các chất phản ứng và sản phẩm.
ii) Nồng độ đã thay đổi như thế nào từ lúc bắt đầu cho tới khi cân bằng?
iii) Tính các nồng độ khi cân bằng.
iv) Tính giá trị KC của phản ứng.
Bài 15
Đối với phản ứng thuận nghịch pha khí 2 SO2 + O2 ⇀ ↽ 2 SO3:
a) Người ta cho vào bình kín thể tích không đổi 3,0 lít một hỗn hợp gồm 0,20 mol SO3 và 0,15 mol SO2. Cân bằng hóa học (cbhh) được thiết lập tại 250C và áp suất chung của hệ là 3,20 atm. Hãy tính tỉ lệ oxi trong hỗn hợp cân bằng.
b) Cũng ở 250C, người ta cho vào bình trên chỉ mol khí SO3. Ở trạng thái cbhh thấy có 0,105 mol O2.Tính tỉ lệ SO3 bị phân hủy, thành phần hỗn hợp khí và áp suất chung của hệ
95 |
94 |
Titanium được sản xuất từ khoáng vật tự nhiên rutile (TiO2), có nhiều ở Ukraine, theo sơ đồ nhiều giai đoạn sau:
Chuyển hóa cuối cùng được gọi là tinh luyện (bằng) iodine và được dùng để điều chế titanium gần như tinh khiết, dựa vào phản ứng thuận nghịch sau: +⇌ 42 TiI(g)Ti(r)2I(g) () 2 Ở 1300 oC, hằng số cân bằng KC = 0,86 mol/L.
1) Đề xuất các phương trình phản ứng tương ứng với sơ đồ (1) để điều chế titanium.
2) Tính khối lượng titanium trong cân bằng (2) nếu biết phản ứng được tiến hành trong bình phản ứng 10 lít, ban đầu có 20 mol TiI4 rắn, sau đó được không khí vào rồi đun nóng tới 1300 oC. Cho biết M(Ti) = 48 gam/mol
3) Tính độ chuyển hóa cua TiI4 ở 1300 oC.
4) Tính hằng số cân bằng KP của phản ứng (2) ở 1300 oC.
5) Ở 600 oC, hằng số KC = 0,52 mol/l. Tính ΔH của phản ứng, giả sử rằng đại lượng này không phụ thuộc vào nhiệt độ.
Bài 17
Ống tiêm chứa hỗn hợp NO2 và N2O4 là một trong những công cụ thí nghiệm kinh điển trong chương trình hóa học phổ thông ở Trung Quốc. Các ước lượng lí thuyết và quan sát cho thấy thể tích của hỗn hợp khí giảm từ V còn V/2 khi nhiệt độ tăng từ 298 K đến 311 K. Biết rằng các hằng số cân bằng Kp của phản ứng N2O4(g) ⇌ 2NO2(g) ở những nhiệt độ này là 0.141 và 0.363.
1) Nồng độ NO2 đã tăng lên bao nhiêu lần sau khi bị nén?
2) Các thí nghiệm động học cho thấy hỗn hợp trên có thể đạt tới cân bằng hóa học chỉ sau vài micro-giây. Khi để hỗn hợp khí ở nhiệt độ phòng thì màu sắc thay đổi như thế nào?
|
96 | Bài 16
()()→→→→ 244th«s¹ch TiOTiClTiTiITi() 1
97
Khí hydro có thể được sản xuất trong công nghiệp bằng cách nhiệt phân hydrocarbon như metan với hơi nước:
CH4 (k) + H2O (k) 3H2 (k) + CO (k) A
a) Cho biết các giá trị nhiệt động học sau đây, hãy tính DrG° cho phản ứng A ở 298 K và giá trị hằng số cân bằng Kp
DfH° (298) / kJ mol 1 S° (298) / J K 1 mol 1
CH4 (k) –74.4 186.3
H2O (k) 241.8 188.8
H2 (k) 130.7
CO (k) 110.5 197.7
b) Hằng số cân bằng phụ thuộc như thế nào vào nhiệt độ?
Quá trình công nghiệp này được tiến hành ở nhiệt độ cao và áp suất thường mà không cần xúc tác. Trong hỗn hợp cân bằng lúc này thì chỉ còn 0,2% thể tích metan.
c) Cho rằng lúc đầu phản ứng được tiến hành với một thể tích bằng nhau của metan và hơi nước. Hãy tính giá trị Kp của quá trình công nghiệp này nếu trong hỗn hợp cân bằng metan chỉ chiếm 0,2% thể tích.
d) Sử dụng đáp án của bạn ở câu (c) cùng với biểu thức tích phân của phương trình đẳng tích van’t Hoff để xác định nhiệt độ mà công nghiệp đã sử dụng để sản xuất hydro từ metan.
Bài 19
Hai nhà hóa học trẻ Kolya và Tanya tiến hành điều chế nitrogen dioxide. Để làm điều này, họ hòa tan một mẩu đồng vào nitric acid đặc và thu khí. Họ quyết định đo khối lượng riêng của khí này và nhận thấy rằng ở 25.0 oC và 1 atm thì khối lượng riêng của khí là 3.130 gam/L.
“Thật kì lạ!” - Kolya nói và nhìn chằm chằm vào máy tính, rồi sau đó là bình chứa khí.
“Có điều gì kì lạ?” - Tanya không hiểu.
“Khối lượng riêng không phù hợp” - Kolya trả lời.
“Không phù hợp với cái gì?” - Tanya cảm thấy thích thú.
“Với khối lượng riêng của NO2”.
“Và lý do là gì?”
“Đó mới là vấn đề!” - Kolya gầm lên.
“Hoặc có thể chúng ta làm khô khí không tốt? - Tanya đề xuất.
“Trước hết, chúng ta đã làm khô khí rất tốt,” - Kolya trả lời - “và thứ hai, nếu có lẫn nước thì cũng chẳng ích lợi gì.”
“Hoặc có thể nó đã phản ứng với thứ gì đó?” - Tanya không từ bỏ.
“Đây có lẽ là một ý tưởng hợp lí,” - Kolya nhìn Tanya với vẻ đồng thuận“nhưng với cái gì nhỉ?”
“Hãy thử đun nóng hơn, để phản ứng diễn ra tốt hơn?”
Kolya đồng ý. Kết quả thu được, trước sự ngạc nhiên của Kolya lẫn niềm vui của Tanya, là khối lượng riêng bằng 2.840 gam/L ở 35.0 oC và áp suất 1.00 bar.
“Ôi trời, bây giờ chẳng có gì rõ ràng cả” - Kolya cảm thấy bối rối.
“Và có thể…?” - Tanya vẫn kiên trì.
“Không, - Kolya đề nghị - đoán đủ rồi. Hãy thử tham khảo tài liệu xem.”
Cậu lấy từ giá sách xuống một cuốn giáo trình. Ngay lập tức, cả hai cùng đọc những tính chất của NO2 “Ổn rồi, bây giờ thì mọi thứ đã trở nên sáng tỏ.” - Kolya nói. - “Đã có phản ứng diễn ra trong bình nón.”
|
98 | Bài 18
99
“Vậy là chúng ta đã đo khối lượng riêng một cách vô ích.” - Tanya cảm thấy bức xúc. “Rốt cuộc, chúng ta đã biết chất nào lẫn trong khí.”
“Tại sao lại vô ích? Bây giờ chúng ta có thể tính toán được thành phần của khí, thậm chí là xác định cả hằng số cân bằng của phản ứng này nữa.”
“Cậu cũng bị kích động quá rồi à?” - Tanya chế giễu bạn.
“Tất nhiên là không vô ích đâu.” - Kolya quả quyết. - “Với các dữ liệu này, chúng ta có thể tính được các giá trị chuẩn ΔHo và ΔSo của phản ứng này.”
Và Kolya bắt đầu, với một thái độ cực kì tự tin, viết các công thức ra giấy và tính toán.
“Cậu mới thông minh làm sao, Kolya” - Tanya hoan hỉ.
“Cảm ơn cậu. Tớ biết điều đó.”
1) Tại sao Kolya lại nói rằng khối lượng riêng của khí không phù hợp với khối lượng riêng của NO2? Khối lượng riêng của NO2 trong điều kiện xác định này là bao nhiêu?
2) Tại sao Kolya nói rằng nếu có nước lẫn trong khí thì cũng chẳng ích lợi gì? Khối lượng riêng của NO2 sẽ thế nào nếu nó lẫn hơi nước?
3) Phản ứng gì đã xảy ra trong bình nón? NO2 phản ứng với cái gì?
4) Tính thành phần khí trong bình nón (theo phần mol), áp suất riêng phần của các chất và hằng số cân bằng của phản ứng ở 2 mức nhiệt độ thí nghiệm. Tính hằng số cân bằng thông qua các giá trị áp suất riêng phần (theo bar). '
5) Tính năng lượng Gibbs tiêu chuẩn của phản ứng ở 2 mức nhiệt độ thí nghiệm.
6) Không cần tính toán, hãy giải thích dấu của ΔHo và ΔSo tiêu chuẩn của phản ứng.
Bài 20
Phản ứng chuyển hóa: ⇌ 242 NO2NO là vấn đề về cân bằng hóa học được thảo luận nhiều. Cho biết hằng số cân bằng Kp ở 295 K và 315 K lần lượt là 0.100 và 0.400. Nạp một lượng xác định hỗn hợp khí trên vào một bình chứa đặc biệt có piston. Áp suất tổng của hệ luôn được duy trì là 1 bar nhờ chuyển động của piston (1 bar = 100 kPa).
1) Tính áp suất riêng phần của N2O4 và NO2 khi hệ đạt cân bằng ở 295 K.
2) Tăng nhiệt độ lên 315 K. Tính áp suất riêng phần của N2O4 và NO2 khi hệ đạt cân bằng.
3) Tính tỉ lệ thể tích và tỉ lệ số mol của hai hệ ở 295 K và 315 K.
4) Vẫn giữ nguyên điều kiện đẳng áp, tiếp tục tăng nhiệt độ thì áp suất riêng phần cực đại (về lí thuyết, bỏ qua các phản ứng khác) của NO2 có thể đạt tới là bao nhiêu?
5) Hệ được đặt trong điều kiện áp suất ngoài không đổi. Tăng nhiệt độ từ 295 lên 315K, phát biểu nào dưới đây là đúng về sự chuyển dịch cân bằng: a) Chuyển sang trái. b) Giữ nguyên c) Chuyển sang phải. d) Cả 3 khả năng đều có thể xảy ra.
6) Tăng nhiệt độ của hệ từ 295 K lên 315 K trong điều kiện đẳng tích, để duy trì áp suất đẳng áp sau đó thì phát biểu nào dưới đây là đúng: a) Cân bằng chuyển dịch nhiều hơn. b) Cân bằng chuyển dịch ít hơn. c) Mức độ chuyển dịch không thay đổi. d) Cả 3 khả năng đều có thể xảy ra.
101 |
100 |
Bài 21
Điều kiện đầu cho phản ứng H2 + N2 → NH3 là n0(H2) = n0(N2), n0(NH3) = 0. Ở 400 °C hằng số cân bằng Kp của phản ứng là 1,60·10−4
a) Viết phản ứng xảy ra.
b) Xây dựng biểu thức liên hệ giữa phần mol của amoniac x(NH3) và Kp bằng đại lượng tỉ số phản ứng y, được định nghĩa là tỉ số giữa lượng amoniac sinh ra và hai lần nồng độ đầu của chất phản ứng , y = n∞(NH3)/2n0 hay n∞(NH3) = 2yn0.
c) Tính áp suất (bar) để ở đó áp suất riêng phần của NH3 chiếm 11.11% áp suất chung.
Bài 22
Halogen tạo thành những hợp chất liên halogen có khả năng bền và kém bền. Một trong số những hợp chất đó là brom clorua (BrCl), chất này bị phân huỷ thành nguyên tố ở 500°C. Hằng số cân bằng cho phản ứng ở nhiệt độ đó là KC = 32 nếu lúc đầu ta phân huỷ 2 mol BrCl.
Bây giờ chúng ta sẽ xét hệ chứa 0,25 mol/L của tất cả các chất tham gia.
a) Viết phương trình phản ứng phân huỷ.
b) Sử dụng tính toán để chứng minh hỗn hợp mô tả ở trên không phải ở trạng thái cân bằng.
c) Trong điều kiện này, cân bằng chuyển dịch theo chiều nào ?
d) Tính năng lượng cần thiết để hỗn hợp phản ứng đạt đến cân bằng ?
e) Cho biết gía trị KP và KX của phản ứng.
f) Tính nồng độ cân bằng của các chất trong hỗn hợp nếu ta bắt đầu tiến hành thí nghiệm với hỗn hợp đã cho ở trên.
|
102 |
103
Borneol là một chất có mùi cay được phân lập từ cây camphor Borneo và Sumatra. Ở 230°C chất này sẽ đồng phân hóa để cho iso-Borneol. Biến thiên năng lượng tự do chuẩn của phản ứng này đo được là 4.9∆= θ RT G kJ.
Bài 24
Một bình chân không có thể tích 1200 cm3 chứa đầy khí nitơ monoxit ở áp suất 180,0 mm Hg ở 297 K. Sau đó khí được làm lạnh rồi thêm vào bình 720,0 mg brom sau đó nâng nhiệt độ bình lên 335 K. Sau khi cân bằng được thiết lập thì áp suất trong bình lúc này là 230,0 mm Hg.
1. Viết phản ứng xảy ra.
1) Đánh dấu hoa thị vào các trung tâm bất đối của Borneol.
2) Borneol có bao nhiêu đồng phân lập thể?
3) Tính hằng số cân bằng của quá trình đồng phân hóa này ở 230°C.
4) Tính biến thiên entanpy tự do của phản ứng ∆RGT trong hệ thống hỗn hợp gồm 0.15 mol Borneol và 0.30 mol Isoborneol ở áp suất chung 800 mbar. Chiều phản ứng lúc này sẽ như thế nào?
5) Tính toán lượng mỗi chất ở thời điểm cân bằng nếu biết ban đầu đã đưa 7.50 g Borneol và 14.0 g iso-Borneol vào một bình kín có thể tích V = 5.0 L rồi đun nóng đến 230°C.
6) Dữ kiện nào đã cho không cần thiết cho tính toán?
OH OH 105 |
2. Tính hằng số cân bằng Kp của phản ứng phân hủy nitrosyl bromua (thể tích bình chân không không thay đổi khi tăng nhiệt độ).
3. Áp suất ảnh hưởng như thế nào đến cân bằng?
4. Tính lượng nitơ oxit trong hỗn hợp ở thời điểm cân bằng.
104 | Bài 23
Quy trình tổng hợp amoniac theo Haber-Bosch đã sử dụng 1.4 % lượng năng lượng mà toàn thế giới sản xuất được.
1) Viết phản ứng tổng hợp ammoniac từ các nguyên tố. Hằng số cân bằng của phản ứng này là KP = 1.40·10-5 ở nhiệt độ 500°C.
2) Lấy các chất theo đúng hệ số tỉ lượng là 1.00 mol nitơ và 3.00 mole hydro phản ứng với nhau ở áp suất 350 bar. Tính áp suất riêng phần của các chất khác nhau sau khi cân bằng được thiết lập.
Trong môi trường nước thì các thông số chất lượng nước cần phải được đo nhiều lần. Với quá trình loại nitơ của các sản phẩm hữu cơ thì có sự tạo thành amoniac. Nếu giá trị pH quá cao thì amoniac sẽ được giải phóng, chất độc này sẽ ảnh hưởng nguy hiểm đến các loài cá
3) Một người chăm sóc sinh vật biển cố gắng giữ các thông số nước trong bể hải dương 100 L của anh ta giá trị pH là 8.00 và nồng độ amoniac là 1.00 mg/L. Tính nồng độ của ion amoni! Có thể bỏ qua tương tác với các chất khác. Biết amoniac là một base yếu có trị pKB là 4.75.
4) Bằng cách thêm vào một chất hóa học đặc biệt thì người chăm sóc sinh vật biển có thể hạ pH đến giá trị 7.00. Nồng độ amoniac trong nước lúc này (mg/L) là bao nhiêu?
Bài 26
ÖCW là một công ty của Áo (Weissenstein, Carinthia) chuyên sản xuất H2O2 theo phương pháp antraquinon. Vấn đề quan trọng nhất của phương pháp này chính là sản xuất hydro rất tinh khiết từ metan và hơi nước. Như vậy ở bước đầu tiên (quá trình cân bằng) thì tạo thành cacbon oxit, chất này sẽ phản ứng tiếp với hơi nước ở bước thứ hai.
1) Viết các phương trình phản ứng xảy ra. Giờ chúng ta sẽ xét phản ứng tạo thành cacbon oxit và hydro. Phản ứng này là phản ứng thuận nghịch nên sẽ dẫn đến cân bằng hóa học.
2) Sử dụng các giá trị nhiệt động hãy tính hằng số cân bằng KP (p: bar) ở 100°C, nước lúc này có thể xem là chất khí. Cho rằng ∆RHo và ∆RSo sẽ không phụ thuộc nhiệt độ trong khoảng nhiệt độ từ 298 đến 373 K.
Bình phản ứng (V = 3.00 m3) được nạp đầy 6.40 kg metan, 7.20 kg hơi nước, 11.2 kg cacbon oxit và 2,4 kg hydro ở 100°C.
3) Tính phần mol của từng khí trong hỗn hợp.
4) Tính áp suất chung và áp suất riêng phần của từng khí trong bình phản ứng.
5) Bằng tính toán hãy cho biết cân bằng dịch chuyển theo chiều nào. Được sử dụng thêm kết quả ở câu 2. Một bình phản ứng khác được nạp đầy bằng metan và nước theo tỉ lệ mol 1:1. Bình được đóng kín và đun nóng đến 900°C. Trong sự có mặt của chất xúc tác thì cân bằng được xác lập và áp suất chung lúc đó là 20.0 bar.
6) Sử dụng các giá trị nhiệt động hãy tính giá trị hằng số cân bằng KP (p: bar) ở 900°C. Lưu ý rằng lúc này ∆RHo và ∆RSo phụ thuộc vào nhiệt độ nhưng nhiệt dung mol thì không.
7) Sử dụng giá trị KP ở câu 6 hãy xác định % chuyển hóa của metan khi đạt đến cân bằng. Nếu không làm được câu 6 thì có thể sử dụng giá trị KP = 4000 để tính toán.
|
106 | Bài 25
107
Để điều chế một hydrocarbon thơm thì chất lỏng X, chứa 84.0 % carbon về khối lượng được đun nóng tới 500 oC và đưa vào thiết bị phản ứng chứa xúc tác. Độ chuyển hóa của X thành hydrocarbon thơm Y trong thiết bị này là 15 %. Hỗn hợp được đưa ra khỏi thiết bị rồi làm lạnh về 20 oC, tách sản phẩm khí và đun nóng chất lỏng còn lại tới 500 oC rồi lại đưa vào thiết bị.
1) Xác định công thức của X và viết phương trình chuyển hóa thành Y.
2) Cần lặp lại quy trình bao nhiêu lần để đạt tới độ chuyển hóa của X: a) lớn hơn 30 %; b) lớn hơn 50 %?
Quá trình mô tả ở trên đã được thực hiện ở áp suất gần với áp suất khí quyển và những điều kiện không cân bằng. Quá trình công nghiệp thực tế được diễn ra ở áp suất gấp 10 lần áp suất khí quyển. Trong thiết bị phản ứng 1.0 m3 chứa xúc tác chuyển hóa, cho 10 kg chất X vào. Sau một thời gian, cân bằng được thiết lập ở 500 oC và áp suất 27 bar (1 bar = 100 kPa).
3) Giả sử chỉ có chuyển hóa của X thành Y diễn ra trong thiết bị phản ứng, hãy xác định: a) áp suất riêng phần của các khí (theo bar) sau khi cân bằng được thiết lập; b) độ chuyển hóa của X; c) hằng số cân bằng X ⇌ Y (biểu diễn theo áp suất).
4) Tại sao dưới áp suất cao thì độ chuyển hóa lại cao hơn áp suất khí quyển, mặc dù điều này dường như đi ngược lại với nguyên lí Le Chatelier?
5) Đun nóng hỗn hợp thu được trong thiết bị phản ứng ở ý 3 tới 600 oC và xúc tác (hỗn hợp của silicon và aluminum oxide) được thêm vào. Chất Y chuyển thành đồng đẳng gần nhất của nó (Z), chất này có nhiều ứng dụng thực tế hơn Y. Viết phương trình phản ứng và tính độ chuyển hóa, biết hằng số cân bằng Y + ... ⇌ Z + ... là 1.7. Chất X còn lại và các sản phẩm phân hủy của nó không tham gia vào phản ứng này.
6) Xác định tỉ lệ của Y và hydrogen được trộn với nhau như trong ý 5 để 95 % Y chuyển thành Z.
|
108 | Bài 27
109
Bài 28
Cân bằng của Boudouard áp dụng cho phản ứng:
C(s) + CO2(g) ⇄ 2 CO(g)
Biểu đồ bên phải thể hiện sự phụ thuộc nhiệt độ của các thành phần trong hỗn hợp cân bằng tại pg = 1.0 bar.
1) Tỉ lệ mol của CO trong hỗn hợp cân bằng tại 727°C và 1 bar là bao nhiêu?
2) Tính KP của phản ứng tại 727°C và áp suất tổng là 0.80 bar.
3) Tính tỉ lệ CO tại 727°C và áp suất tổng 2.0 bar.
Bài 29
Nhiều phản ứng giữa các chất vô cơ rắn diễn ra với sự tham gia của phase khí. Việc khống chế áp suất của tác nhân nhẹ cho phép chúng ta kiểm soát được thành phần định tính của các sản phẩm. Một trong các phương pháp khống chế hóa học áp suất O2 trong bình phản ứng là sử dụng các getter (chất khử khí) - hỗn hợp các oxide (hoặc hỗn hợp kim loại - oxide) bị chuyển hóa thuận nghịch thành hỗn hợp khác trong các điều kiện đã xác định trước và do đó cho phép cố định áp suất O2
1) Viết phương trình phản ứng phân hủy Fe2O3 thành Fe3O4.
2) Với các chất tồn tại trong hỗn hợp phản ứng ở dạng phase riêng biệt, hằng số cân bằng (KP) có thể được viết theo các áp suất riêng phần của các khí trong cân bằng diễn ra trong phản ứng. Viết biểu thức cho hằng số cân bằng của phản ứng ở ý 1. Hãy chọn trong Phiếu trả lời những yếu tố nào ảnh hưởng đến áp suất trong bình kín chứa Fe2O3 và Fe3O4?
3) Sử dụng các dữ kiện nhiệt động học cho các oxide tương ứng để tính áp suất riêng phần của oxygen trên hỗn hợp cân bằng của các oxide này ở 700 oC (kí hiệu m ý chỉ giá trị theo mol). chất Fe2O3 Fe3O4 O2 ∆H0f, kJ/mol -824.29 -1118.44 0 S0 m, J/mol·K 87.45 146.45 205.02
CP,m, J/mol·K 103.77 143.52 29.29

110 |
111 |
Sử dụng các quan hệ nhiệt động học sau để tính toán: 00 ffP,r 00 mmP,m rrr Pr H(T)H(T)C(TT) S(T)S(T)Cln(T/T) G(T)H(T)TS(T) lnKG(T)/RT ∆=∆+∆− =+ ∆=∆−∆ =−∆ Trong đó T là nhiệt độ tuyệt đối (tính theo K), T0 = 298 K, R = 8.314 J/mol·K. 4) Đề xuất các điều chế các oxide FeO, Fe3O4, Fe2O3 từ các tác nhân sẵn có, ngoại trừ oxide sắt. 5) Dẫn 103 m3 CO2 qua ống chứa lần lượt: (1) các lớp hỗn hợp oxide Fe3O4 và Fe2O3; (2) I2O5. Sau khi dòng khí hết, một mẫu (2) chứa I2 và I2O5 được cho vào dung dịch NaHCO3 0.5 M. Số mol I2 trong mẫu (2), được
xác địnb bằng chuẩn độ với Na2S2O3, là 2·10-4 mol. KP của phản ứng oxid hóa CO thành CO2 là 9.502·10-47 Pa1/2. Viết các phương trình phản ứng đã được thực hiện. Ước tính áp suất O2 trên hỗn hợp các oxide sắt, biết áp suất CO2 trong ống là 1 atm.
30
Me H Me N O
O O
N N Me
ON H Me
AB
Me Me
Trong thí nghiệm xác đinh độ mạnh của liên kết hydro liên phân tử trong B, thì độ dịch chuyển hóa học của proton amit dobs được quan sát ở các nhiệt độ khác nhau.
T / K dobs / ppm 220 6.67 240 6.50 260 6.37 280 6.27 300 6.19 Độ chuyển dịch hóa học quan sát được, dobs, chính là trung bình đo được giữa độ chuyển dịch của proton N–H khi amit ở trạng thái hoàn toàn tạo liên kết , dh, và khi nó không tạo liên kết này , df.
a) Đề nghị một phương trình đối với độ chuyển dịch hóa học quan sát được của proton N–H , dobs b) Đề nghị một phương trình tính hằng số cân bằng K của phản ứng A B phụ thuộc vào dobs, dh, và df
c) Cho dh = 8.4 ppm và df = 5.7 ppm, tính hằng số cân bằng của sự vòng hóa này ở các nhiệt độ khác nhau.
d) Bằng phương pháp đồ thị, hãy xác định biến thiên entalpy chuẩn của phản ứng A → B và biến thiên entropy chuẩn ở 300 K.
e) Kết luận lại về những gì đã rút ra được ở câu (b).
112 |
113 | Bài
Nhiều phản ứng hóa học trong các sinh vật sống có sự hình thành những phức chất “chủ-khách” trong đó phân tử chủ ghép nối thuận nghịch với một hoặc nhiều phân tử khách. Xét một phân tử chủ H với hai tâm ghép nối, gọi là a và b, có ái lực khác nhau với phân tử khách G.
[HG]
= [H][G]
[HG]
= [H][G]
Trong đó HGa và HGb là kí hiệu phức chất mà phân tử khách bị ghép nối với tâm a và b. Ka và Kb là các hằng số ghép nối với các tâm a, b. Việc gắn một phân tử G vào H có thể làm thay đổi khả năng ghép nối của tâm thứ hai. Sự thay đổi này được mô tả bởi “hệ số tương tác” β - phản ánh tác động của một tâm ghép nối đến một tâm khác, và được xác định theo
Nếu bạn không trả lời được câu hỏi trên, hãy sử dụng giá trị tham khảo Ka = 3.14 và β = 2.72 cho các tính toán tiếp theo. 2.2) Xác định trật tự chính xác của các giá trị năng lượng Gibbs mol chuẩn của quá trình hình thành phân tử chủ H, và các phức chất khách-chủ từ H và G.
2.3) Thêm một lượng chất G vào 1 mol H, rồi hòa tan hỗn hợp vào nước, thu được 1 lít dung dịch. Số phân tử ghép nối hoàn toàn HG2 trong dung dịch bằng tổng số phân tử ghép nối đơn HG. Xác định lượng chất đầu của G (theo mol). Các hằng số Ka, Kb và hệ số β cũng giống trong ý 2.1.
2.4) Tính thành phần cân bằng của dung dịch trong các trường hợp: a) β = 0; b) β rất lớn (β → ∞). Các hằng số Ka và Kb, cũng như nồng độ đầu của H và G giống như trong ý 2.1.
trong đó HG2 là phức chất ghép nối hoàn toàn.
1.1) Xác định khoảng giá trị (hoặc một giá trị, nếu cần thiết) của β, tương ứng với 3 cách thức tương tác có thể có giữa các tâm ghép nối: a) hợp tác (sự ghép nối bởi một tâm sẽ tạo điều kiện cho sự ghép nối tiếp theo); b) cạnh tranh (sự ghép nối đầu tiên gây phức tạp cho sự ghép nối thứ hai); c) độc lập (không tương tác).
1.2) Xác định hằng số cân bằng của quá trình: HGb + G → ← HG2 theo các hằng số ghép nối và hệ số tương tác.
2.1) Chuẩn bị dung dịch với các nồng độ đầu [H]0 = 1 M và [G]0 = 2 M. Sau khi các phản ứng kết thúc, nồng độ của H giảm 10 lần còn G giảm 4 lần. Với các phân tử chủ và khách, Kb = 2Ka. Xác định nồng độ của các tiểu phân khác trong dung dịch và hằng số ghép nối Ka cùng hệ số β
114 | Bài 31
H + G → ← HGa a a
K
H + G → ← HGb b b
K
Kb ≠ Ka.
HGa + G → ← HG2 2 b a
[HG] [HG][G]=βK
22aa ba babb [HG]K[HG][HG]K= = × =βK× [HG][G][HG][G][HG]K=βK
115 |
Các chuỗi palindromic là một nhóm DNA thú vị. Trong một tiểu phân DNA xoắn kép palindromic (dsDNA), trình tự của một chuỗi được đọc theo hướng 5’→3’, khớp với trình tự 5’→3’ trên chuỗi bổ sung. Do đó, một dsDNA gồm 2 chuỗi giống hệt nhau bổ sung cho nhau. Ví dụ như DrewDickerson dodecanucleotide (1):
5) Có bao nhiêu cặp base có trong dsDNA oligonucleotide ngắn nhất có Tm trên 330 K? Ở Tm này, xét các giá trị hằng số cân bằng sau của sự kết hợp các chuỗi đơn để tạo thành một dsDNA: Knp = 1.00 × 106 với một dsDNA phi-palindromic, Kp = 1.00 × 105 với một dsDNA palindromic. Oligonucleotide là palindromic hay phi-palindromic? Cuối cùng, chúng ta hãy quên đi ý tưởng đơn giản hóa các cặp base đóng góp riêng biệt vào sự kết hợp các chuỗi DNA. Năng lượng Gibbs của quá trình này rõ ràng phụ thuộc vào nhiệt độ. Sự phụ thuộc của nghịch đảo Tm của Drew-Dickerson dodecanucleotide (1) vào logarithm của nồng độ chuỗi xoắn kép ban đầu cinit được cho dưới đây. (Chú ý: nồng độ đầu c0 = 1 mol dm-3).
1) Tồn tại bao nhiêu DNA dodecanucleotide xoắn kép palindromic khác nhau (nghĩa là các tiểu phân dsDNA với 12 cặp base)?
2) Tồn tại bao nhiêu DNA undecanucleotide xoắn kép palindromic khác nhau (nghĩa là các tiểu phân dsDNA với 11 cặp base)?
Nhiệt độ nóng chảy của dsDNA, Tm, được định nghĩa là nhiệt độ mà tại đó 50 % số lượng chuỗi xoắn kép DNA ban đầu bị phân li thành các chuỗi riêng biệt.
3) Xét một Drew-Dickerson dodecanucleotide (1). Giả sử rằng đóng góp của cặp nucleobase G-C vào tính bền của chuỗi xoắn kép lớn hơn cặp A-T. Tính xác suất mà Tm của nó tăng lên khi thay thế ngẫu nhiên một cặp base bởi cặp G-C. Hãy phân tích nhiệt động học của quá trình tạo thành DNA xoắn kép từ các chuỗi đơn, và sự phụ thuộc của nó vào độ dài của DNA và vào nhiệt độ. Hằng số cân bằng của quá trình kết hợp các chuỗi đơn để tạo thành dsDNA với các dsDNA palindromic và phi-palindromic là khác nhau. Một dung dịch dsDNA với nồng độ ban đầu cinit = 1.00×10-6 mol dm-3 được đun nóng tới Tm và cân bằng đã được thiết lập.
4) Tính hằng số cân bằng của sự kết hợp các chuỗi đơn ở Tm đối với cả DNA palindromic và phi-palindromic.
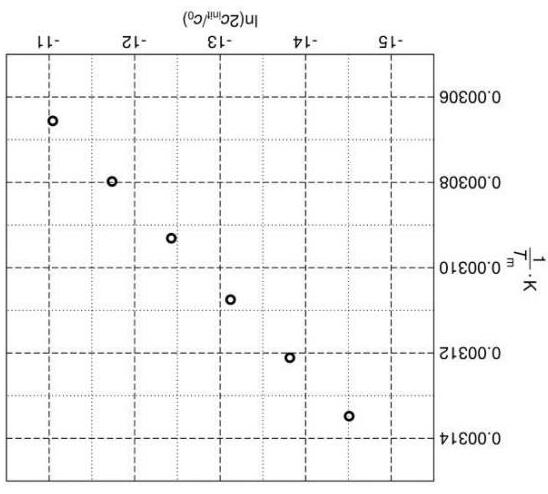
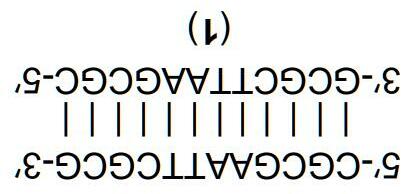
Những đóng góp trung bình vào năng lượng Gibbs của quá trình kết hợp hai chuỗi đơn để tạo thành dsDNA đã được ước tính trên một khoảng điều kiện thực nghiệm xác định, và chúng lên đến -6.07 kJ mol-1 trên mỗi cặp G-C và -1.30 kJ mol-1 trên mỗi cặp A-T có trong dsDNA.
6) Tính biến thiên enthalpy chuẩn ΔH0 và entropy chuẩn ΔS0 của sự kết hợp các chuỗi đơn DNA để tạo thành Drew-Dickerson dodecanucleotide xoắn kép palindromic (1). Giả sử rằng ΔH0 và ΔS0 không biến đổi theo nhiệt độ.
116 | Bài 32
117 |
Bài 33
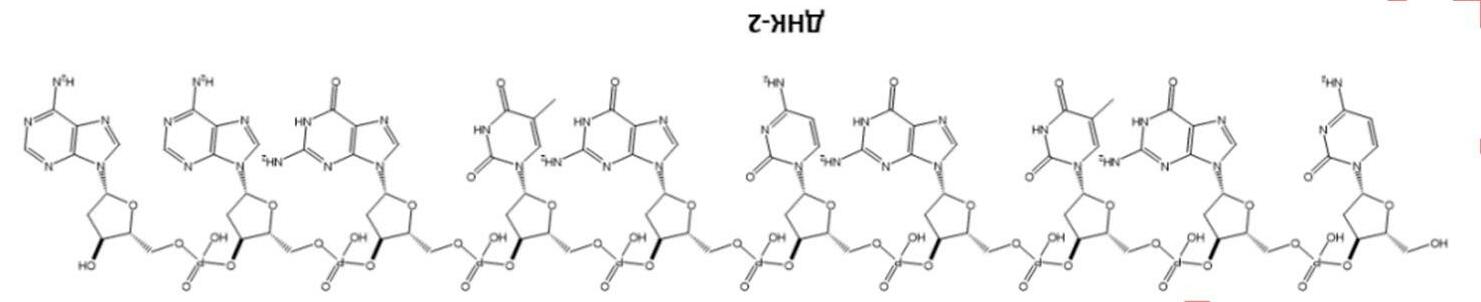
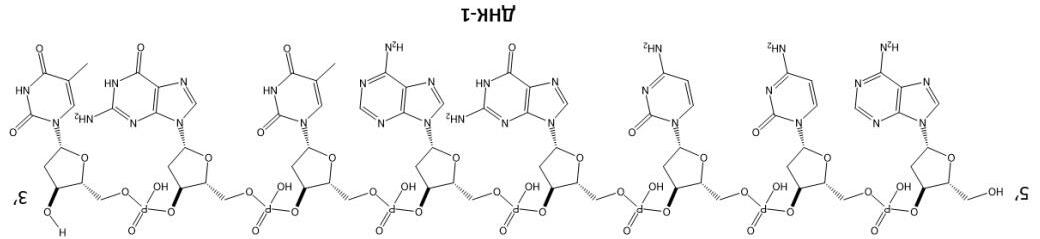
DNA (deoxyribonucleic acid) thực hiện những chức năng vô cùng quan trọng trong các cơ thể sống và có thể được xem là vật liệu polymer lưu trữ và truyền thông tin. DNA gồm 4 nucleoside: dA (deoxyadenosine), dT (deoxythymidine), dC (deoxycytitidine), dG (deoxyguanosine). Trong một phân tử DNA điển hình, các mảnh này được kết hợp bởi liên kết phosphodiester và tồn tại với số lượng và trình tự khác nhau. Hình dưới đây biểu diễn phân tử DNA-1 được mô tả bởi chuỗi 5'-ACCGATGT-3’ (mỗi chữ cái tương ứng với một deoxynucleoside và các liên kết phosphodiester không được biểu diễn, còn các kí hiệu 5’ và 3’ tương ứng với nhóm hydroxyl của nguyên tử carbon deoxyribose ở đầu nucleoside.)
1) Có bao nhiêu liên kết phosphodiester trong DNA-1?
2) Có bao nhiêu nucleoside trong chuỗi biểu diễn ở trên?
3) Vẽ cấu trúc các nucleoside dA, dG, dC, dT.
Việc sử dụng chữ cái trong mô tả các chuỗi DNA là khá thuận tiện và cho phép bạn không cần biểu diễn các cấu trúc rườm rà.
4) Hãy ghi lại cấu trúc chuỗi rút gọn của phân tử DNA-2 sau đây:
Hiệu quả tuyệt vời của phương pháp mã hóa sinh học của các phân tử DNA với chức năng và tính chất của các cơ thể sống là dựa vào sự tương tác chọn lọc của các nucleoside (là các nucleic base adenine, thymine, cytosine và guanine qua các liên kết hydrogen. Adenine tạo thành phức chất bền với thymine (dA·dT) qua 2 liên kết hydrogen, và guanine với cytosine(dG·dC) qua 3 liên kết hydrogen. Tương tác của hai phân tử DNA với các chuỗi bổ sung có thể tạo thành một chuỗi xoắn kép DNA. Ví dụ, 5'-
118 | 119 |
TTCACGCACG-3 (DNA-3) là chuỗi bổ sung của DNA-2, tương tác của chúng (liên kết hydrogen) dẫn đến sự tạo thành chuỗi xoắn kép DNA-2·DNA-3.
9) Viết biểu thức tính hằng số cân bằng Kc của quá trình tạo liên kết hydrogen của DNA-2 và DNA-3 để tạo thành chuỗi DNA xoắn kép DNA2·DNA-3.
10) Tính giá trị Kc ở Tm với mỗi nồng độ tổng của DNA được cho trong bảng.
11) Điền vào bảng nồng độ cân bằng của chuỗi xoắn kép trong dung dịch tại Tm.
12) Tính giá trị ΔH0 và ΔS0 của quá trình tạo thành DNA-2·DNA-3.
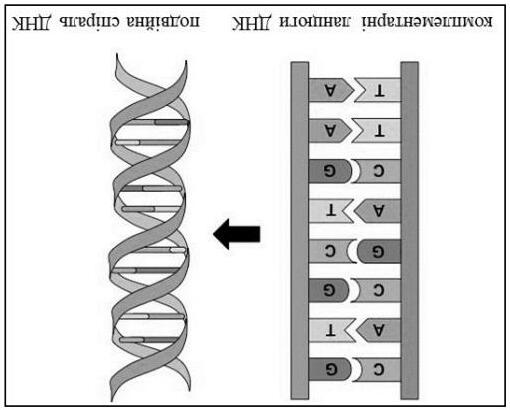
5) Vẽ cấu trúc phức chất dA·dT và dG·dC.

6) Có bao nhiêu liên kết hydrogen trong chuỗi xoắn kép DNA-2·DNA-3?
7) Xác định chuỗi bổ sung (dạng rút gọn) của 5'-TTCAGGCTTAC-3'.
Chuẩn độ trắc quang là phương pháp thuận tiện để xác định nồng độ DNA trong dung dịch. Các thành phần duy nhất của DNA hấp thụ ánh sáng bước sóng 260 nm là các nucleic base tạo nên nucleoside. Hệ số hấp thụ của chúng ở bước sóng trên được cho trong bảng:
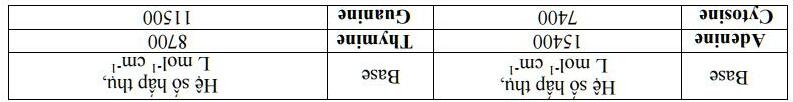
8) Xác định nồng độ của 5'-TGCTAGAAGGCTTTGC-3’ trong dung dịch, biết giá trị độ hấp thụ (A) ở 260 nm trong cuvette 1 cm là 0.96. Khi đun nóng chuỗi DNA xoắn kép, nó bị phân giải trở lại thành 2 chuỗi DNA riêng biệt. Quá trình này xảy ra bởi các liên kết hydrogen kém bền ở nhiệt độ cao. Độ bền của chuỗi DNA xoắn kép được đo bởi điểm nóng chảy (Tm). Ở nhiệt độ này, số chuỗi DNA ở trạng thái xoắn kép là 50 %. Bảng dưới đây biểu diễn giá trị Tm với chuỗi xoắn kép DNA-2·DNA-3, tùy thuộc vào nồng độ tổng (Ctot) của các chuỗi DNA trong hệ, chú ý rằng Ctot(DNA-2) = Ctot(DNA-3)
120 |
121 |
0.15 5.4·10
Viết biểu thức định luật tốc độ phản ứng.
dẫn
Bài 2
Thời
phương trình
phân hủy.
hai nhiệt độ khác nhau thì các chu kỳ bán hủy phụ thuộc vào áp suất
p0 (N2O).
(°C)
0 (kPa)
(s)
2) Từ p0 hãy tính nồng độ đầu c0 (mol/L) của N2O ở các nhiệt độ khác nhau.
3) Tính hằng số tốc độ phản ứng (L×mol-1×s-1) ở các thời điểm đó.
4) Tính năng lượng hoạt hóa của phản ứng trong vùng nhiệt độ 694°C –757°C.
5) Vẽ hai cấu trúc cộng hưởng của phân tử N2O.
6) Dựa vào mô hình VSEPR hãy cho biết dạng hình học của N2O?
7) Cho biết nhóm điểm đối xứng của phân tử này.
122 | Chuyên đề 24: Tốc độ phản ứng Bài 1 Đối với phản ứng BrO3 (aq) + 5 Br (aq) + 6 H+(aq) → 3 Br2(aq) + 3 H2O(l) Tốc độ đầu được đo bằng bằng sự thay đổi nồng độ chất ban đầu. Các gía trị của thí nghiệm được cho ở bảng dưới: Thí nghiệm Nồng độ chất ban đầu (mol/L) v0 (mol BrO3 /L.s)BrO3 Br H+ 1 0.10 0.10 0.10 1.2·10 3 2 0.20 0.10 0.10 2.4·10 3 3 0.10 0.30 0.10 3.5·10 3 4 0.20 0.10
3
Hướng
BrO3 : bậc 1 Br : bậc 1 H+: bậc 2 v = k·[ BrO3 ]·[Br ]·[H+]2 123 |
gian bán hủy của phản ứng phân hủy dinitơoxit (N2O) để tạo thành các nguyên tố thì tỉ lệ nghịch đảo với nồng độ đầu c0 của N2O. 1) Viết
phản ứng
Ở
đầu
T
694 757 P
39.2 48.0 t
1520 212
Một giai đoạn quan trọng trong tổng hợp nitric acid là sự oxid hoá nitrogen oxide thành nitrogen dioxide bởi oxygen không khí:
2 NO(g) + O2(g) → 2 NO2(g)
Phản ứng tuân theo phương trình động học:
1) Xác định hệ số tốc độ thay đổi khi nồng độ thay đổi
Thay đổi nồng độ
[O2] tăng 4 lần, [NO] giữ nguyên
[O2] giữ nguyên, [NO] tăng 4 lần
[O2] giữ nguyên, [NO] giảm một nửa
[O2] giảm một nửa, [NO] tăng 4 lần
[O2] tăng 4 lần, [NO] giảm một nửa
Tốc độ phản ứng thay đổi theo hệ số 1 2 4 8 16
Bài 4
Bây giờ chúng ta sẽ quan sát phản ứng phân hủy NO2 tạo thành NO và oxy ở 10°C dưới ảnh hưởng động học và nhiệt động học.
1) Viết và cân bằng
nhất
ứng phân huỷ này. Sử dụng các
sau cho biết tốc độ đầu của phản ứng phụ thuộc vào
số cân
Xác định bậc của phản ứng và tính toán hằng số vận tốc. Nếu chúng ta quan sát phản ứng ở cân bằng thay vì ở thời điểm đầu thì sẽ xuất hiện câu hỏi khác. Sử dụng các giá trị này để trả lời các câu hỏi sau: ∆sHo(NO2) = 33.2 kJ/mol; ∆sHo(NO) = 90.3 kJ/mol; So(NO2) = 241 J/mol; So(NO) = 211 J/mol; So(O2) = 205 J/mol;
3) Tính ∆RHo, ∆RSo và ∆RGo ở 10°C (các đại lượng có thể xem như không phụ thuộc nhiệt độ).
Tốc độ đầu của phản ứng vẫn giữ nguyên khi tăng nhiệt độ từ 460lên 600 oC và giảm nồng độ các chất đầu xuống còn một nửa.
2) Tính năng lượng hoạt hoá của phản ứng. 125 |
4) Nhiệt độ nhỏ nhất cần đạt đến để cân bằng dịch chuyển về phía phải là bao nhiêu ? (Cho biết các thông số nhiêt động học được xem như độc lập với nhiệt độ)
5) Ở 10oC thì cân bằng trong các hệ sau đây sẽ dịch chuyển theo chiều nào: a) Chỉ duy nhất NO2, b) Chỉ NO và O2, c) Tất cả các chất đều có áp suất là pi = 1.0 bar được đặt trong bình kín?
6) Tính áp suất riêng phần cực đại của oxy ở 500 K nếu p(NO2) = 1.0 bar và p(NO) = 0.010 bar và phản ứng xảy ra tự phát theo chiều thuận (Các thông số có thể được xem như là độc lập hoàn toàn với nhiệt độ)?
124 | Bài 3
∙ ∙
phản
hệ
bằng nhỏ
là số nguyên Bảng
các nồng độ đầu khác nhau của NO2: [NO2]0 (mol/L) 0.010 0.012 0.014 0.016 V0 (mol/L.s) 5,40.10-5 7,78.10-5 1,06‧10-4 1,38‧10-4 2)
Bài 5
α-halogen hóa aldehyde và ketone là các phản ứng tự xúc tác, nghĩa là sản phẩm H+ sẽ là xúc tác cho phản ứng: R'COR + X2 = RCORX + H+ + X− Phương trình tốc độ của phản ứng là: r = k[R'COR][X2][H+] Nếu ở thời điểm ban đầu [R'COR]0 = [X2]0, tính nồng độ [X2] khi tốc độ phản ứng đạt cực đại. Gợi ý: d(xn)/dx = nxn-1 .
Bài 6
Vào năm 1824 nhà hóa học Đức Friedrich Wöhler đã lật đổ lý thuyết triết học “lực sống”, là một lực bí ẩn của cuộc sống, luôn tồn tại trong các chất hữu cơ. Lý thuyết này cho rằng con người không thể tổng hợp được chất hữu cơ từ chất vô cơ mà không có sự trợ giúp của thần thánh. Thế nhưng Wöhler đã làm được điều đó bằng cách tổng hợp ure bằng cách đơn giản là đun nóng amonixianat: NH4OCN → H2NCONH2 Hơn 150 năm sau phản ứng này được nghiên cứu kỹ hơn trên khía cạnh động học. Các dữ kiện thực nghiệm cho ở bảng dưới cho biết thông tin về thời gian phản ứng. Thực nghiệm được tiến hành bằng cách hòa tan 30.0 g amonixianat trong nước rồi pha loãng đến 1.00 L. t (ph) 0 20 50 65 150 m (ure) (g) 0 9,40 15,9 17,9 23,2
1) Tính nồng độ của amonixianat ở từng thời điểm trên.
2) Tính toán chứng minh phản ứng có bậc hai và tìm giá trị hằng số tốc độ.
3) Hãy tính toán 30 phút khối lượng amonixianat còn lại là bao nhiêu?
|
126 |
127
Peroxodisulfate ion là một trong những tác nhân oxid hóa mạnh nhất và có thể oxid hóa toàn bộ halide thành halogen (trừ fluoride). Tên gọi của nó cho thấy có một liên kết O-O trong phân tử.
1. Vẽ công thức liên kết cộng hóa trị của peroxodisulfate ion, gồm cả các điện tích hình thức.
2. Xác định số oxid hóa của tất cả các nguyên tử trong cấu tạo.
Xét sự tạo thành iodine theo phương trình phản ứng: (R1) a S2O8 2- + b I → c SO4 2- + d I2
3. Xác định các giá trị hệ số tối giản (a, b, c, d).
Phản ứng diễn ra tương đối chậm. Trong các thí nghiệm, tốc độ tạo thành iodine ban đầu v0 (theo phản ứng R1) với các nồng độ đầu c0 khác nhau của chất phản ứng ở 25 oC được xác định như sau: c0(S2O8 2 ) in mol/L c0(I ) in mol/L v0 in mol/L.s 1.0·10 4 1.0·10 2 1.10·10 8 1.4·10 4 1.0·10 2 1.54·10 8 1.8·10 4 1.5·10 2 2.97·10
4. Viết phương trình động học của phản ứng R1 và xác định bậc toàn phần của phản ứng.
5. Xác định hằng số tốc độ phản ứng.
Năng lượng hoạt hóa của phản ứng trên là 42 kJ.mol-1 .
6. Tính nhiệt độ (theo oC) để tăng tốc độ phản ứng lên 10 lần, với các điều kiện khác được giữ nguyên. Thí nghiệm có thể được thay đổi bằng cách thêm một lượng rất dư sodium thiosulfate vào hỗn hợp phản ứng. Thiosulfate (S2O3 2-) khử rất nhanh iodine, tạo thành iodide.
7. Viết phương trình phản ứng khử iodine bởi thiosulfate.
8. Viết phương trình động học của biến thiên phản ứng R1.
Bài 8
Phản ứng giữa BrO3 và Br trong dung dịch acid tạo thành Br2 và H2O tuân theo phương
[BrO3 ]0 = 2.5·10-3 M, [H+]0 = 1.0 M, [Br ]0 = 0.28 M trong đó kí hiệu số 0 phía dưới là để chỉ nồng độ ban đầu.
nghiên cứu động học của phản ứng trên, một sinh viên đã thêm phenol vào hỗn hợp phản ứng, xảy ra phản ứng sau: Br2 + C6H5OH → BrC6H4OH + Br Để xác định mức độ hoàn thành của phản ứng monobromine hoá trên, sinh viên này đã thêm một giọt dung dịch methyl da cam loãng vào bình phản ứng. Methyl da cam bị tẩy trắng bởi Br2 và mất màu ngay lập tức kể cả với nồng độ Br2 rất thấp. Phản ứng monobromine hoá phenol (C6H5OH) diễn ra nhanh hơn phản ứng bromate-bromide. Sinh viên này đã chuẩn bị 3 bình phản ứng như mô tả trong bảng dưới đây. Cậu đã ghi lại thời gian, t, của các dung dịch có nồng độ phenol khác nhau tới khi mất màu. Số thứ tự bình [C6H5OH] (M)
128 | Bài 7
8
129 |
trình tốc độ sau: 1) Viết phương trình phản ứng. 2) Xác định bậc phản ứng tổng. 3) Đơn giản hoá phương trình tốc độ nếu biết
Để
[Br ] (M) [H+] (M) [BrO3 ]* (M) Thời gian đến khi mất màu, t (giây) 1 4 × 10 3 0.28 1.0 2.5 × 10 3 11 2 2 × 10 3 0.28 1.0 2.5 × 10 3 4 3 1 × 10 3 0.28 1.0 2.5 × 10 3 1.5 *BrO3 được thêm vào cuối cùng, ngay trước khi tiến hành thí nghiệm. 4) Khi tăng gấp đôi nồng độ phenol (trong bảng trên) thì t tăng lên hơn 2 lần, bởi
i. Phản ứng làm mất màu methyl da cam chậm hơn khi nồng độ phenol tăng lên.
ii. Phản ứng bromine hoá phenol bị chậm lại khi nồng độ phenol tăng lên.
iii. Khi tăng nồng độ phenol thì BrC6H4OH bị chuyển thành Br2C6H3OH.
iv. Tốc độ phản ứng bromate-bromide giảm trong suốt quá trình.
v. Khi tăng nồng độ phenol, phương trình tốc độ tối giản hoá ở ý 3.3 không còn phù hợp.
5) Tính hằng số tốc độ k của phản ứng bromate-bromide, sử dụng các dữ kiện trong bảng trên.
6) Một hướng khác để thực hiện thí nghiệm này là giữ nguyên nồng độ phenol và thay đổi nồng độ [BrO3 ]. Trong một thí nghiệm như vậy thì
i. t sẽ tăng khi nồng độ [BrO3 ]0 tăng.
ii. Có thể nhận được k từ độ dốc ban đầu của đồ thị [BrO3 ]-t phù hợp với một đường cong hàm mũ.
iii. Thí nghiệm ít chính xác hơn khi tỉ lệ [BrO3 ]0/[C6H5OH]0 giảm.
iv. t sẽ phụ thuộc vào [Br ]0.
v. Có thể nhận được k từ độ dốc của đồ thị 1/t-[BrO3 ] phù hợp với một đường thẳng.
Bài 9
Một trong các phản ứng gây ra sự phá hủy tầng ozon của khí quyển là : NO + O3 → NO2 + O2
Trong 3 thí nghiệm, tốc độ phản ứng phụ thuộc vào nồng độ của các chất phản ứng như sau: Thí nghiệm [NO], mol/l [O3], mol/l Tốc độ v, mol/l.s-1
01 0,02 0,02 7,1.10 5
02 0,04 0,02 2,8.10 4 N03 0,02 0,04 1,4.10 4 Xác định các bậc phản ứng riêng a, b và hằng số tốc độ trung bình k trong phương trình động học: v = k[NO]a
Chú ý tới đơn
[O
của các đại lượng.
130 |
131 |
N
N
.
3]b
vị
1-Bromopropan phản ứng với ion thiosulfat theo phương trình Để nghiên cứu động học của phản ứng này thì sẽ khả thi nếu chuẩn S2O3 2bằng dung dịch iot trong khoảng thời gian phản ứng. Cách làm như sau được coi là tốt nhất. Chuẩn độ 2.00 mL dung dịch thiosunfat sử dụng trong thí nghiệm cần 12.2 mL dung dịch iot có nồng độ c = 5.00·10-3 mol/L. 20.0 mL dung dịch thiosunfat được trộn lẫn với 20.0 mL dung dịch bromopropan có cùng nồng độ đầu, và cùng lúc đó khởi động đồng hồ bấm giờ. Dung dịch sau đó được đưa ngay lập tức vào một buret. Sau 20 gây thì lấy 10.0 mL dung dịch này đưa rất nhanh vào bình chuẩn độ trong chậu nước đá để ngừng phản ứng. Dung dịch này được chuẩn bằng dung dịch iot thấy tốn hết 16.0 mL. Sau 50 giây thí nghiệm được lặp lại, với việc lấy lần thứ hai 10.0 mL dung dịch thì lượng dung dịch iot cần cho lúc này là 9.35 mL.
1) Tính nồng độ của ion thiosunfat sau 20 s và 50 s.
2) Bằng tính toán hãy chứng minh phản ứng có bậc hai và tính hằng số tốc độ trung bình từ ba giá trị riêng rẽ thu được.
Bài 11
Trong phòng thí nghiệm hóa lý, một sinh viên đang giải quyết các vấn đề động học như sau.
Thêm 255 mg etyl propanoat vào 50,0 ml nước, thêm 100 mg natri hidroxit vào 50,0 ml nước khác. Sau đó, trộn cả hai dung dịch vào nhau và bấm giờ. Thể tích dung dịch lúc này là chính xác 100,0 mL.
Các phản ứng xảy ra:
Theo thời gian, pha nước lần lượt tách ra khỏi phản ứng, và nồng độ của ion hydroxit được xác định bằng chuẩn độ với HCl. Ở 20oC, đã thu được dữ liệu sau đây:
Sau 5.00 phút: [OH ] = 15.5‧10-3 mol‧L-1

Sau 10.0 phút: [OH-] = 11.3‧10-3 mol‧L-1

Sau 20.0 phút: [OH-] = 7.27‧10-3 mol‧L-1
1) Bằng tính toán, hãy chứng minh phản ứng xà phòng hóa este là một phản ứng bậc 2, tính hằng số tốc độ trung bình của phản ứng.
2) Sau bao lâu thì 75% este đã phản ứng?
|
132 | Bài 10
133
Nghiên cứu về các phản ứng diễn ra trong khí quyển là công việc cần thiết để hiểu về khí hậu toàn cầu và qua đó giảm thiểu tới mức nhỏ nhất những tác động xấu của con người tới môi trường. Hydrogen sulfide, H2S, là phân tử thể hiện những tính chất hóa học thú vị trong khí quyển. H2S là chất khí và đặc biệt phổ biến ở các khu vực gần núi lửa.
Quá trình chủ yếu để H2S được loại bỏ một cách tự nhiên khỏi không khí là bởi phản ứng với các gốc OH (là tác nhân oxid hóa chủ yếu trong khí quyển vào bản ngày). Phản ứng diễn ra qua một va chạm đơn giản giữa H2S với gốc OH.
a) Viết phương trình phản ứng giữa H2S với gốc OH, tạo thành nước và gốc mới.
Để xác định hằng số tốc độ của phản ứng ở ý a, khí H2S khô đã được điều chế trong phòng thí nghiệm bởi phản ứng giữa iron(II) sulfide với hydrochloric acid.
b) Viết phương trình điều chế H2S trong phòng thí nghiệm.
Tốc độ phát thải trung bình vào không khí của H2S ở khu vực núi lửa được ước tính là 7.65·105 phân tử cm-3 s-1. Nồng độ H2S đo được ở khu vực núi lửa là hằng số trong toàn thời gian, nghĩa là tốc độ tạo thành H2S cũng bằng tốc độ tiêu hao H2S.
Với phản ứng diễn ra qua một va chạm đơn giản giữa các tiểu phân A và B thì tốc độ (r) được xác định bởi biểu thức: r = k·[A]·[B]
Trong đó k là hằng số tốc độ, [A] và [B] là nồng độ các chất A và B.
c) Tính nồng độ H2S trong khí quyển theo đơn vị phân tử cm-3. Bạn có thể giả sử rằng chỉ có duy nhất một quá trình loại bỏ H2S khỏi khí quyển (là phản ứng với gốc OH) và nồng độ trung bình của gốc OH là 1.1·106 phân tử cm-3. Hằng số tốc độ của phản ứng ở ý a) được xác định là k = 4.7·10-12 cm3 phân tử-1 s-1 d) Nồng độ trung bình của H2S thường được biểu diễn theo đơn vị μg m 3. Biểu diễn lại nồng độ H2S xác định được ở ý c theo đơn vị này. theo đơn vị này.
được đốt cháy một phần, tạo thành SO2. Chất này sau đó phản ứng với H2S tạo thành đơn chất sulfur (lưu huỳnh).
e) i. Viết phương trình đốt cháy H2S. ii. Viết phương trình phản ứng của H2S với SO2 Rất khó để đo trực tiếp nồng độ gốc OH, nên phải sử dụng các phương pháp gián tiếp. Ngoài H2S, gốc OH cũng có thể oxid hóa các hợp chất khác trong khí quyển, như 1,1,1-trichloroethane. Do sự phát thải 1,1,1trichloroethane vào khí quyển đã ngưng từ thập niên 1990 nên sự biến đổi nồng độ của nó có thể được sử dụng để ước lượng gián tiếp nồng độ (toàn cầu) trung bình của gốc OH. Sự phụ thuộc của nồng độ của 1,1,1trichloroethane theo thời gian cho thấy nó là một phân rã động học bậc nhất. f)
i. Sử dụng đồ thị dưới đây, ước lượng chu kì bán hủy (t1/2) của 1,1,1-trichloroethane với độ chính xác 0.1 năm.
ii. Chuyển câu trả lời ở ý f(i) thành giây. Xem rằng 1 năm có 365.25 ngày.
sử
gốc OH là hằng số trong toàn thời gian, và quá trình duy nhất
loại bỏ 1,1,1-trichloroethane khỏi khí quyển là phản ứng với OH, chúng ta có thể xác định hằng số
Khí thiên nhiên thường chứa sulfur ở dạng H2S. Để giảm thiếu tới mức tối thiểu sự phát thải sulfur từ quá trình desulfur hóa khí thiên nhiên, H2S 135 |
biểu kiến của phản ứng
134 | Bài 12
Giả
nồng độ của các
để
tốc độ
theo biểu thức sau: 1/2 obs ln2 t k =
Hằng số tốc độ biểu kiến, kobs, là tích của hằng số tốc độ bậc 2 (k2nd = 1.0·10-14 cm3 phân tử-1 s-1) với nồng độ gốc OH.
g) Sử dụng giá trị chu kì bán hủy của 1,1,1-trichloroethane, tính nồng độ (toàn cầu) trung bình của gốc OH theo đơn vị phân tử cm-3. (Chú ý: Giá trị tính được không nhất thiết phải giống với nồng độ ở phần đầu của bài tập này).
Bài 13 N2O5 bị phân hủy nhiệt theo phản ứng bất thuận nghịch: 2N2O5 → 4NO2 + O2 Điều chế một mẫu N2O5 trong dung môi trơ ở 25 oC để tiến hành đo lường các thông số động học của phản ứng này. Hệ phản ứng được đun nóng tới nhiệt độ xác định T (T > 25 oC) rồi đo nồng độ N2O5. Các kết quả đo được cho trong bảng dưới đây: Thời gian, giây 0 200 400 600 1000 c(N2O5), mol/lít 0,110 0,073 0,048 0,032 0,014 Biết hằng số tốc độ phản ứng phân hủy N2O5 trong phase khí ở nhiệt độ T là 4,8·10-4 giây-1 .
1) Đề xuất một phản ứng điều chế N2O5 trong phòng thí nghiệm:
2) Dựa vào bảng dữ liệu, hãy xác định bậc phản ứng và tính hằng số tốc độ phản ứng phân hủy N2O5 trong dung môi trơ.
3) Tính chu kì bán hủy của N2O5 trong phase khí. Đặt mẫu N2O5 vào một bình kín để thực hiện phản ứng phân hủy trong phase khí. Áp suất ban đầu P0(N2O5) là 66,75 kPa ở nhiệt độ T. Xét toàn bộ oxide đều ở trạng thái khí.
4) Dẫn ra phương trình tính áp suất tổng trong toàn hệ (Pt) theo thời gian phân hủy (t, giây) và P0(N2O5).
5) Tính áp suất trong hệ ở thời điểm: i) 10 phút sau khi N2O5 bắt đầu phân hủy; và ii) sau khi sự phân hủy xảy ra hoàn toàn.
|
136 |
137
Việc đo tốc độ phản ứng hoá học và sự phụ thuộc của nó vào nhiều thông số (nồng độ các chất tham gia, nhiệt độ, áp suất, xúc tác) cho phép các nhà hoá học rút ra kết luận về cơ chế phản ứng và tiến trình cụ thể của phản ứng. Một trong các bài thực hành bắt buộc ở trường phổ thông ở Vienna là khảo sát phản ứng iodine hoá acetone với xúc tác acid.
Dữ liệu của 4 thí nghiệm đã được ghi lại trong bảng dưới đây. Các dung dịch gốc sau đã được sử dụng để trộn thành hỗn hợp cuối (20 mL) c (I2) = 0.0101 mol·L-1; c (HCl) = 1.96 mol·L-1; acetone tinh khiết (ρ = 0.790 g·mL-1);
Bắt đầu tính thời gian khi vừa thêm acetone vào và kết thúc ngay khi dung dịch mất màu.
STT V (H2O) mL V (HCl) mL V (I2) mL V (Ac) mL t, s
7.0 8.0 3.0 2.0 39.3
11 4.0 3.0 2.0 80.1
Phản ứng không diễn ra trong một mà qua nhiều giai đoạn, một trong số đó là giai doạn quyết định tốc độ phản ứng (gọi là RDS – rate determining step). Phương trình tốc độ phản ứng có dạng:
8.0 8.0 2.0 2.0 26.0
7.5 8.0 3.0 1.5 53.0
1) Tính nồng độ acetone.
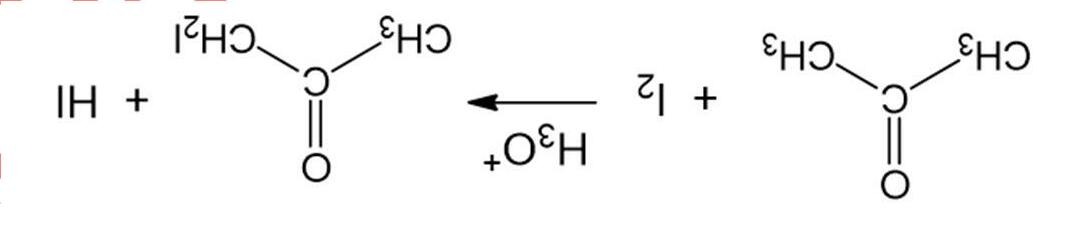
2) Bổ sung các giá trị còn thiếu
Các sinh viên cần phải trộn các thể tích khác nhau của các chất tham gia phản ứng (đã biết nồng độ đầu) và đo thời gian cho đến khi iodine mất màu. Do đó
= 0
Lọ phản ứng ở giai đoạn đầu (hoặc trong quá trình) và khi kết thúc. (“t am Ende” = t at the end = t khi kết thúc)
138 | Bài 14
∆ ∆ ∙ ∙ ∙
∆
.
139 |
1
2
3
4
vào bảng sau, tính nồng độ riêng ban đầu của từng chất và tốc độ phản ứng ở mỗi thí nghiệm STT c (H3O+), mol·L-1 c (I2), mol·L-1 c (Aceton), mol·L-1 v, mol·L 1·s 1 3) Xác định các hệ số a, b, c và viết phương trình phản ứng iodine hoá acetone. 4) Tính hằng số tốc độ phản ứng. 5) Giai đoạn nào sau đây là RDS?
Bài 14
Quá trình thủy phân p-nitrophenylaxetat (PNA) phụ thuộc thời gian để tạo thành p-nitrophenol (PNP) và axit axetic có thể được khảo sát dựa vào độ hấp thụ UV ở 398nm bởi vì các hợp chất có nhóm nitrophenyl cho một dải hấp thụ mạnh (nhưng khác biệt nhau) ở bước sóng này Một dung dịch PNA (c0 = 1.0‧10-4 mol/L) đựơc khảo sát thủy phân ở 25°C trong môi trường đệm photphat. Độ hấp thụ
1.278 1.384
140 | 141 |
quang của dung dịch được ghi lại (dãy đo 1) Sự khảo sát được lặp lại với cùng nồng độ đầu ở T = 30° C (dãy đo 2). Ở điểm cuối phản ứng thì dung dịch đạt đến trị số hấp thụ mol không thay đổi được ký hiệu với t = ∞. Tất cả các cuvet đo mẫu đều có độ dày 1.00 cm. t (s) 300 900 1500 3000 4500 6000 ∞ dãy đo 1, A 0.152 0.377 0.553 0.886 1.100 1.244 1.456 dãy đo 2, A 0.307 0.558 0.757 1.092
1.512 1) Viết và cân bằng phản ứng thuỷ phân PNA. 2) Tính hệ số hấp thụ đối với PNP ở 398 nm từ dãy đo 1. Do sự hấp thụ ứng với cả hai tiểu phân (PNA và PNP), chúng ta phải để ý rằng (A∞-At) ứng với nồng độ của PNA. 3) Chứng minh hệ thức sau: (A∞-At) =[ε(PNP) - ε(PNA)].c(PNA) ε…hệ số hập thụ 4) Xác định bậc của phản ứng và tính hằng số vận tốc dựa vào đồ thị vẽ ứng với dãy đo 1 bằng cách kiểm tra biểu thức vận tốc bậc không, một và hai (vẽ đồ thị trong giấy vẽ đồ thị được phát sẵn) 5) Bằng cách nào để đưa phản ứng này về cùng bậc với phương trình thủy phân? 6) Tính hằng số vận tốc ứng với dãy đo thứ hai (tính tối đa ba giá trị của k rồi lấy trị trung bình).
7) Tính năng lượng hoạt hóa của phản ứng này.
Bài 15
Trước đây, phản ứng oxid hóa ethanol bởi chromium(VI) là cơ sơ cho phép đo nồng độ cồn trong hơi thở và cũng được sử dụng trong hóa phân tích. Một dung dịch K2Cr2O7 trong môi trường acid mạnh (ở đây là HCl 3.6 M) cung cấp ion HCrO4 là tác nhân oxid hóa trong phản ứng.
1) Viết phương trình phản ứng giữa HCrO4 với ethanol tạo thành Cr3+ và ethanoic acid.
Dưới những điều kiện đã đề cập, biểu thức động học của phản ứng tổng có dạng vi phân là (với số nguyên x là bậc phản ứng): ∙
Sau các thời gian phản ứng t khác nhau, [HCrO4 ]t đã được đo bởi chuẩn độ iodine. Iodine phản ứng với thiosulfate (c = 0.020 mol/L) theo 2S2O3 2+ I2 ⇌ 2I + S4O6 2-, trong đó điểm cuối được xác định rõ bởi chỉ thị hồ tinh bột. Trước đó, iodine được tạo thành bởi phản ứng giữa HCrO4 dư với iodide. Từ lượng sodium thiosulfate dùng cho chuẩn độ, có thể tính được [HCrO4 ]t.
Mỗi thí nghiệm dùng 10.0 mL dung dịch. Các giá trị đã được đo lường hoặc tính toán được cho trong bảng sau: Thời gian t / phút 0 10 20 30 40 Thể tích chất chuẩn V(S₂O₃2-) / mL - 11.7 9.10 7.15 5.60
t / mol/L 0.010 0 0.007 8 0.006 1 0.004 8 0.003 7
4.61 4.85
|
142 |
143
[HCrO₄ ]
ln[HCrO₄ ]t
5.10 5,35 5.59 1 ₄ 100 128 165 210 268 2) Lấy ví dụ thể tích chất chuẩn V(S2O3 2-) = 10.3 mL, hãy tính nồng độ [HCrO4 ]t tương ứng. 3) Xác định bậc phản ứng x bằng cách vẽ đồ thị nồng độ-thời gian. 4) Tính hằng số tốc độ k và xác định đơn vị chính xác.
Sau khi uống quá nhiều thức uống có cồn, mọi người thường cảm thấy khó chịu trong những ngày sau đó. Có rất nhiều nguyên nhân gây ra cảm giác này, một trong những nguyên nhân đó chính là sự tích tụ sản phẩm chuyển hóa độc hại từ ethanol trong cơ thể người. Trong cơ thể, ethanol đầu tiên được chuyển hóa thành acetaldehyde bằng enzyme alcohol dehydrogenase, sau đó thành acid acetic bằng enzyme acetaldehyde dehydrogenase.
độ phản ứng này (tốc độ hình thành acetaldehyde) được biểu diễn như sau: = + cate M ratek[AD][EtOH]
K[EtOH]
Trong đó [AD] nồng độ enzyme alcohol dehydrogenase. Kcat = 1.33 s-1 là hằng số tốc độ của quá trình chuyển hóa phức enzyme –chất nền thành sản phẩm.
KM = 1.00 x 10-3 mol.dm-3 là đại lượng đặc trưng cho độ ức chế quá trình phân ly phức enzyme – chất nền thành chất tham gia phản ứng (đơn vị tính theo đơn vị của nồng độ).
3. Viết định luật tốc độ khi nồng độ ethanol lớn hơn rất nhiều so với giá trị KM.
Đầu tiên, ethanol phản ứng với nicotinamide adenine dinucleotide (NAD+) để hình thành acetaldehyde (NADH) và H+
4. Viết định luật tốc độ khi nồng độ ethanol nhỏ hơn rất nhiều so với giá trị KM.
5. Từ đó, dự đoán bậc của phản ứng trong hai trường hợp: hàm lượng ethanol gần và cao hơn giá trị cho phép của câu 2.
1. Chuyển hóa nào đã diễn ra trong phản ứng trên đối với NDA+? Chọn câu trả lời đúng.
A. NAD+ bị oxi hóa B. NAD+ bị khử
C. NAD+ bị thủy phân D. NAD+ đồng phân hóa E. NAD+ được bảo toàn không thay đổi trong suốt quá trình phản ứng.
Ở Anh, hàm lượng ethanol cho phép trong cơ thể người tối đa là 80 mg ethanol trong 100 mL máu. 2. Tính nồng độ ethanol theo đơn vị mol.dm-3. Biết 1 mL = 1 cm3
Sau khi uống thức uống có cồn, người tham gia giao thông không được điều khiển phương tiện giao thông cho đến khi nồng độ ethanol thấp hơn hàm lượng cho phép. Phản ứng loại bỏ ethanol được áp dụng bằng cách kết hợp ethanol với alcohol dehydrogenase để hình thành phức enzymechất nền, tiếp theo đó là quá trình chuyển đổi phức thành sản phẩm. Tốc
Biểu đồ sau biểu diễn sự thay đổi nồng độ ethanol theo thời gian của một người uống nhiều rượu bia.
6. Cho rằng khoảng thời gian khảo sát là lúc người khảo sát đã ngưng uống rượu, tính tốc độ giảm ethanol theo (mg/100 mL).h-1 và theo mol.dm-3.s-1 .
7. Tính nồng độ alcohol dehydrogenase enzyme trong cơ thể người khảo sát?

144 | Bài 16
145 |
8. Thời gian bán hủy là thời gian mà lượng ethanol giảm đi phân nửa so với giá trị ban đầu. Từ đồ thị, hãy cho biết thời gian bán hủy thay đổi thế nào theo thời gian khảo sát?
A. Thời gian bán hủy tăng. B. Thời gian bán hủy không thay đổi.
C. Thời gian bán hủy giảm. D. Không thể xác định thời gian bán hủy bằng đồ thị.
9. Giống như ethanol, các alcohol dehydrogenase cũng được đồng hóa thành các alcohol tương ứng (có độc tính cao). Xét một trong các quá trình đồng hóa, alcohol dehydrogenase có kcat = 1.10 s-1 và KM = 3.2 x 10-2 mol.dm-3. Biết rằng tốc độ đồng hóa đạt cực đại khi enzyme đã bão hòa chất nền.
Kết luận nào sau đây là đúng?
Tốc độ đồng hóa ethanol cực đại nhanh hơn so với đồng hóa alcohol dehydrogenase.
Tốc độ đồng hóa alcohol dehydrogenase cực đại nhanh hơn so với đồng hóa ethanol.
Tốc độ đồng hóa alcohol dehydrogenase cực địa bằng với đồng hóa ethanol.
Cần sử dụng ethanol nồng độ cao hơn alcohol độc để quá trình diễn ra khi tốc độ cực đại giảm phân nửa.
Cần sử dụng alcohol độc nồng độ cao hơn ethanol để quá trình diễn ra khi tốc độ cực đại giảm phân nửa.
Cần sử dụng nồng độ alcohol độc nồng độ và ethanol nhưu nhau để quá trình diễn ra khi tốc độ cực đại giảm phân nửa.
Định luât tốc độ quá trình đồng hóa thành alcohol độc khác với định luật tốc độ đồng hóa ethanol.
|
146 |
147
Nghiên cứu động học có vai trò rất quan trọng trong việc xác định hạn sử dụng của các sản phẩm dược. Nhiều phản ứng hoá học có thể ảnh hưởng tới thạn sử dụng của các sản phẩm dược và tốc độ của các phản ứng này phụ thuộc vào những điều kiện như pH, nhiệt độ, độ ẩm. Lysine acetylsalicylate (LAS) được dùng làm thuốc chống đau và chống viêm nhiễm, có tên thương mại là Aspegic. LAS bị thuỷ phân tạo thành lysine salicylate và acetic acid.
Phản ứng thuỷ phân LAS có thể được thực hiện theo 3 cách: a) xúc tác acid; b) không xúc tác; và c) xúc tác base.
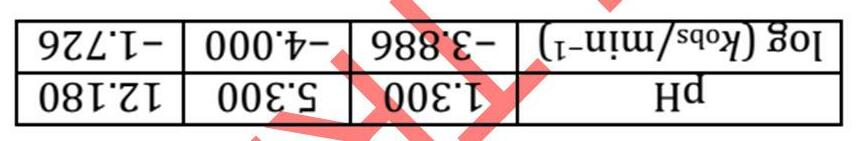
[LAS] là kí hiệu nồng độ LAS ở thời gian t, biểu thức tốc độ phản ứng thuỷ phân là: Trong đó kH, k0 và kOH là các hằng số tốc độ của phản ứng thuỷ phân xúc tac acid, không xúc tác và xúc tác base. Biểu thức tốc độ thu được là 1.
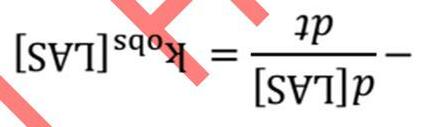
a) Viết biểu thức tính kobs theo kH, k0, kOH và [H+] Thuỷ phân LAS được tiến hành ở 298,15 K, tại nhiều giá trị pH khác nhau (từ 0,50 đến 13,0). Khi nồng độ đầu của LAS rất thấp thì chắc chắn rằng pH không thay đổi trong suốt quá trình phản ứng. Đồ thị dưới đây biểu diễn sự phụ thuộc của tốc độ phản ứng thuỷ phân của LAS vào pH.
b) (Những) phát biểu nào sau đây là đúng:
A. kobs ≌ k0 ở pH = 12
B. kobs ≌ k0 ở pH = 5.0
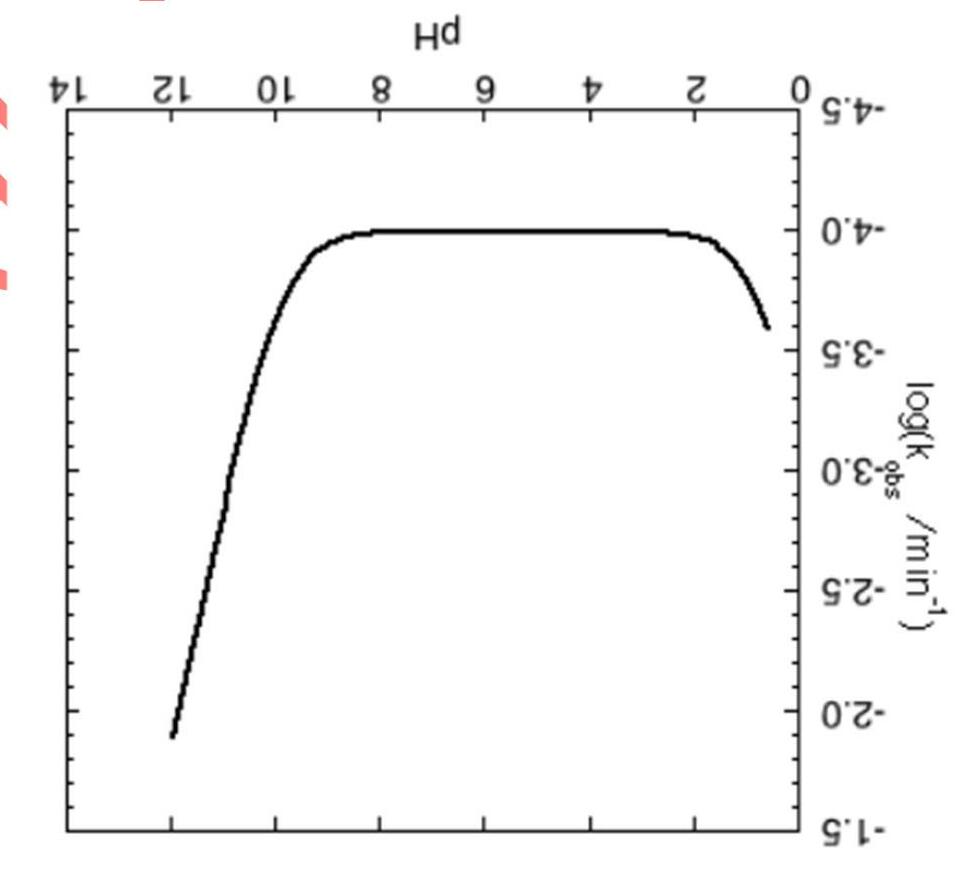
C. Tốc độ phản ứng tăng khi pH thay đổi từ 0,50 đến 1,0.
D. Tốc độ phản ứng tăng khi pH thay đổi từ 10 đến 12.
c) Sử dụng đồ thị và dữ kiện dưới đây, tính kH, k0, kOH (chỉ rõ đơn vị).
Acetylsalicylic acid, thường gọi là aspirin, là thuốc hạ sốt, giảm đau và chống viêm. Giống như LAS, phản ứng thuỷ phân aspirin cũng có thể diễn ra theo nhiều hướng, phụ thuộc vào pH. Dưới đây là đồ thị pH-tốc độ của phản ứng thuỷ phân aspirin ở 333,15 K:
|
148 | Bài 17
149
Các phản ứng sau có thể là của sự thuỷ phân aspirin. Tuỳ thuộc vào pH, một hoặc nhiều phản ứng có thể được chấp nhận.
2.
a) Sử dụng giản đồ pH-tốc độ và các phản ứng cho ở trên, hãy xác định (những) phát biểu nào sau đây là đúng? (pKa(aspirin) = 3,57 ở 333,15 K).

A. Trong vùng C-D, phản ứng IV chiếm ưu thế.
B. Trong vùng C-D, phản ứng V chiếm ưu thế.
C. Trong vùng D-E, phản ứng IV chiếm ưu thế. D. Trong vùng A-B, phản ứng II chiếm ưu thế.
Một đồ thị riêng biệt biểu diễn mối liên hệ kobs-pH của phản ứng thủy phân aspirin đã được xác nhận đạt cực tiểu ở một giá trị pH cụ thể. Ở 290.15 K các hằng số tốc độ sau với các phản ứng I, II, III đã được xác định:
Tích số tan của nước ở 290,15 K là 1,0.10-14 .
|
b) Giả sử chỉ có các phản ứng I, II, III xảy ra, hãy tính giá trị pH ở cực tiểu của kobs.
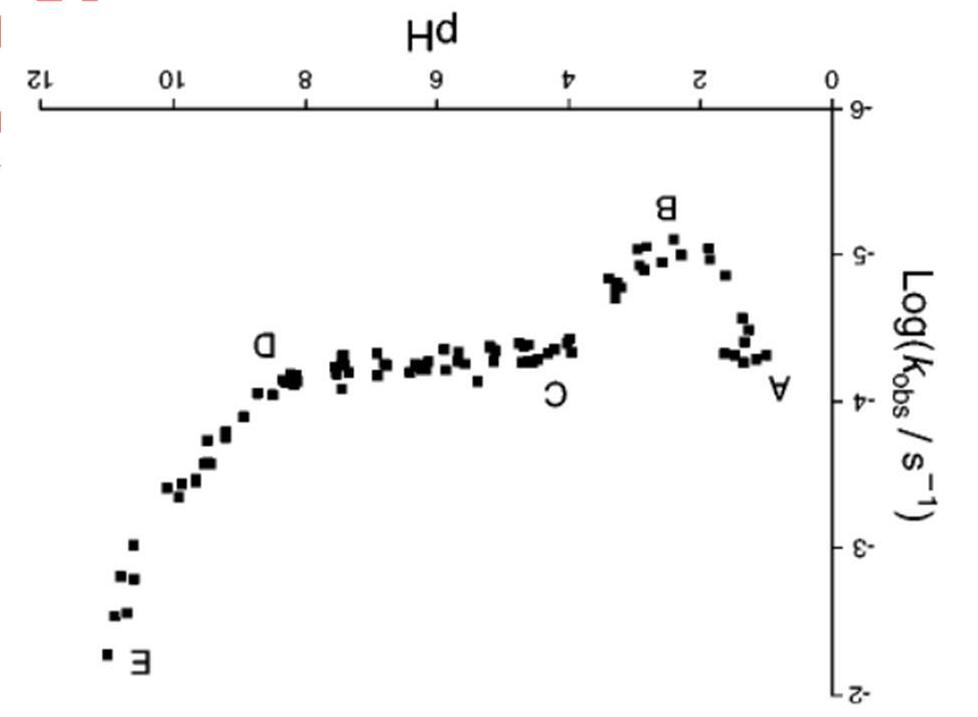
150 |
151
Sunfuryl clorua (SO2Cl2) được sử dụng rộng rãi trong công nghiệp. Sunfuryl clorua là một chất lỏng không màu, có mùi cay, sôi ở 70oC. Khi nhiệt độ trên 70oC nó sẽ phân hủy tạo thành SO2 và Cl2 theo phản ứng: SO2Cl2(k) → SO2(k) + Cl2(k) Một bình kín thể tích không đổi chứa SO2Cl2(k) được giữ ở nhiệt độ 375K. Quá trình phân hủy SO2Cl2(k) được theo dõi bằng sự thay đổi áp suất trong bình. Kết quả thu được như sau: Thời gian, t(s) 0 2500 5000 7500 10000
Áp suất, P(atm) 1,000 1,053 1,105 1,152 1,197
a) Chứng tỏ rằng phản ứng phân hủy SO2Cl2 là phản ứng bậc 1. Tính hằng số tốc độ của phản ứng ở 375K.
b) Nếu phản ứng trên được tiến hành ở 385K, áp suất của bình sau 1 giờ là 1,55 atm. Tính năng lượng hoạt hóa của phản ứng phân hủy trên.
c) Sau một khoảng thời gian dài xảy ra phản ứng, lượng SO2Cl2(k) còn lại không đáng kể. Vì vậy khí trong bình coi như chỉ có SO2 và Cl2. Tách SO2 ra khỏi hỗn hợp bằng cách chuyển hóa thành H2SO4 (lỏng). Cl2 thu được dùng để làm điện cực khí clo: Cl2/2Cl . Điện cực này được ghép với điện cực Cu2+/Cu tạo thành pin điện hóa. Viết sơ đồ của pin ở điều kiện chuẩn và tính ∆Go của phản ứng xảy ra khi pin hoạt động.
Cho biết: 2 o Cu/Cu E0,34V + =+ ; 2
o Pt,Cl/2Cl E1,36V =+
Bài 19
Xét phản ứng:
c) Vì sao có sự chuyển hóa trên.
d) Đo tốc độ phản ứng ở 123,5oC tại áp suất đầu khác nhau của 3metylxiclobuten (3-MCB) được các kết quả sau: Po(3 MCB), kPa 0,5 1,0 1,5 2,0 2,5 vo.10 7 mol.L 1.s 1 0,211
|
152 | Bài 18
153
0,422 0,633 0,844 1,055 Chứng minh rằng phản ứng (1) là phản ứng bậc một và tính hằng số tốc độ phản ứng k e) Người ta thấy rằng, hằng số tốc độ phản ứng (1) ở nhiệt độ 143,5oC là 9,52.10-4 s-1. Hãy xác định năng lượng hoạt hóa của phản ứng (1)
Khi các giếng dầu được khoan thêm ngoài khơi, ở các vùng nước sâu hơn, thì hiện tượng lắng đọng paraffin, asphaltene, và hydrate trở nên nghiêm trọng và mở rộng quy mô hơn do ảnh hưởng của nhiệt độ cực thấp ở đáy đại dương. Việc loại sáp khỏi các giếng và đường ống dầu chiếm chi phí vận hành khá lớn, ví dụ như phải có các thợ lặn biển sâu với thiết bị đặc biệt để có thể cắt và loại các khối paraffin gây tắc nghẽn khỏi đường ống dẫn.
Một trong những giải pháp khả thi hơn cho vấn đề lắng đọng paraffin là nấu chảy nó. Phản ứng giữa ammonium chloride và sodium nitrite được đề xuất để thiết kế hệ phản ứng.
1. Hoàn thành phương trình phản ứng (phản ứng 1): NaNO2 + NH4Cl → NaCl + H2O + N2 và tính biến thiên enthalpy của phản ứng, biết các giá trị enthalpy tạo thành: -359.4 kJ.mol-1 (sodium nitrite), -314.43 kJ.mol-1 (ammonium chloride), -411.12 kJ.mol-1 (sodium chloride) và -285.8 kJ.mol-1 (nước).
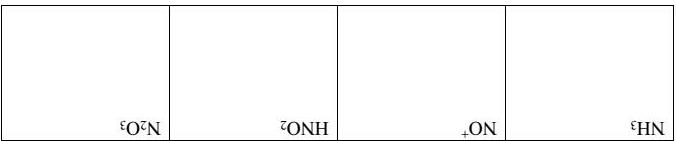
2. Biết hằng số cân bằng của phản ứng 1 xấp xỉ K = 1060. Dựa trên thông tin này và những tính toán ở trên, có thể xác định điều gì về phản ứng 1?
a) Phản ứng thu nhiệt và thuận nghịch.
b) Phản ứng tỏa nhiệt và bất thuận nghịch.
c) Phản ứng thu nhiệt và bất thuận nghịch.
d) Phản ứng tỏa nhiệt và thuận nghịch. Để đưa phản ứng 1 vào sử dụng trong công nghiệp dầu, thì tốc độ và cơ chế phản ứng cần phải được biết rõ. Các nhóm nghiên cứu đã đề xuất những cơ chế khác nhau cho phản ứng này, ví dụ, nhóm I đề xuất rằng phản ứng có bậc hai và giai đoạn quyết định tốc độ là phản ứng của nitrosyl ion (NO+) với phân tử ammonia, trong khi các nhà khoa học nhóm II đề xuất rằng phản ứng có bậc ba với giai đoạn quyết định tốc độ phản ứng là sự tấn công của N2O3, tạo ra từ HNO2, vào NH3
3. Vẽ cấu trúc Lewis của các hợp chất hoặc tiểu phân đề cập ở trên:
Một nhóm khác, gọi là nhóm III, đã tiến hành lại và biến đổi các thí nghiệm thực hiện bởi các nhóm I, II. Họ lấy 150 ml dung dịch sodium nitrite và 150 ml ammonium chloride rồi trộn lẫn hai dung dịch này ở các nhiệt độ và mức pH khác nhau (được điều chỉnh bằng cách thêm dung dịch HCl hoặc NaOH vào hỗn hợp phản ứng). Trước khi tiến hành phản ứng, các thiết bị đã được thổi
|
154 | Bài 20
155
khí nitrogen để giảm thiểu các phản ứng phụ. Dưới đây là bố trí hệ thí nghiệm để khảo sát phản ứng 1: Hình 1 4. Các phản ứng phụ nào có thể xảy ra trong thí nghiệm nếu pH nằm trong khoảng 3 đến 7. NO + ½ → NO2 2HNO2 ⇌ NO2 + NO + H2O NH4Cl + NaOH → NH3 + H2O + NaCl (pKa(NH4 +) = 9,25) NaNO2 + O2 → NaNO3 Nếu các phản ứng phụ được loại bỏ thì tốc độ phản ứng 1 có thể. Xác định được bằng cách đo khí thoát ra từ bình phản ứng. 5. Dẫn ra biểu thức tốc độ phản ứng 1 ở dạng hàm của thể tích khí, sử dụng các kí hiệu chuẩn cho biến số: == dC tèc ®é ph¶n øngdt Tốc độ phản ứng tính được ở các nồng độ khác nhau của nitrite và ammonium ion đã được vẽ thành đồ thị (hình 2, ở 25 oC, pH = 5). Sử dụng đồ thị, xác định bậc phản ứng tương ứng với hai tác nhân.
6. Xác định bậc phản ứng tương ứng với ammonium ion.
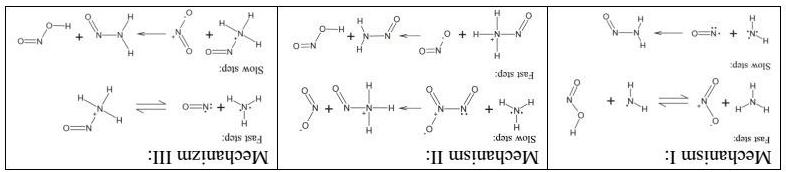
7. Xác định bậc phản ứng tương ứng với chloride ion.
2
8. Xác định giá trị và đơn vị của hằng số tốc độ phản ứng (ở 25 oC, pH = 5).
Tốc độ phản ứng giữa ammonium chloride và sodium nitrite được khảo sát dưới dạng một hàm phụ thuôc nhiệt độ từ 4 – 50oC, nồng độ đầu từng chất là 0,5 mol.dm-3 và ở pH 4, 5, 6. Tốc độ phản ứng tuân theo phương trình Arrhenius, các dữ kiện tương ứng được cho trong hình 3.
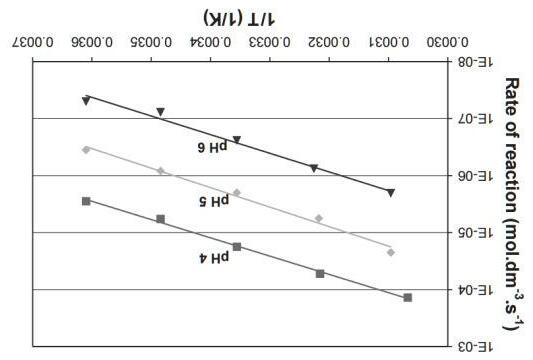
Các nhà khoa học nhóm III tiếp tục các thí nghiệm của họ với mục đích xác định cơ chế phản ứng. Trước tiên, họ tiên đoán rằng một tiểu phân trung gian có thể tạo thành hai sản phẩm cuối N2 và H2O trong giai đoạn nhanh, sau đó đề xuất các hướng phản ứng khác để tạo thành tiểu phân trung gian từ hai tác nhân thực, NH3 và HNO2 hoặc các dẫn xuất của nó. Họ tin rằng nitrosamine H2N-N=O là tiểu phân trung gian hợp lí nhất để tạo thành các sản phẩm cuối.
10. Đề xuất cơ chế phân hủy của nitrosamine.
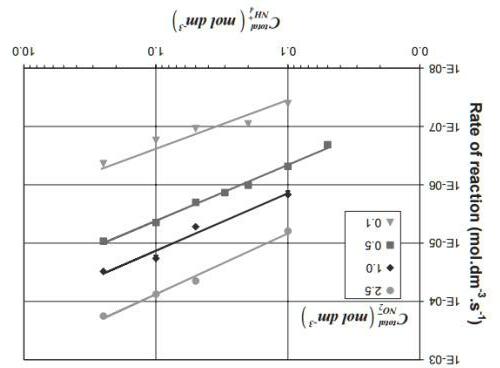
Có nhiều hướng để tạo thành nitrosamine từ các chất đầu. Một cách để kiểm tra tính khả thi của một hướng tạo thành là so sánh năng lượng hoạt hóa Arrhenius thực (E*) của nó với năng lượng hoạt hóa Arrhenius thực nghiệm (E), nhận được từ nghiên cứu động học. Năng lượng hoạt hóa Arrhenius thực có thể thu được bằng phương pháp. Mô phỏng phân tử E* = ∆H* + RT trong đó ∆H*- biến thiên enthalpy trong giai đoạn chậm nhất Nếu bạn không tính được năng lượng hoạt hóa ở ý 9, hãy giả sử rằng nó bằng 60 kJ.mol-1
11. Đã chứng minh được rằng HNO2 (aq) nằm trong cân bằng với N2O3, NO và NO2. Viết phương trình phản ứng biểu diễn cân bằng. Các nhà khoa học đã đề xuất
cơ chế
trong số chúng
3
9. Xác định năng lượng hoạt hóa từ dữ kiện đã cho.
tạo thành nitrosamine.
12.
|
156 |
Hình
Hình
157
nhiều
để
3
được cho dưới đây:
Viết biểu thức tốc độ ứng với mỗi cơ chế phản ứng theo nồng độ của HNO2 và NH3. Chứng minh bằng cách tính toán. Nhận xét về cơ chế (có phù hợp với phản ứng không?) 13. Cơ chế nào ở trên có thể là cơ chế chính xác, phù hợp với năng lượng hoạt hóa Arrhenius thực ở điều kiện chuẩn (25 oC). Các giá trị enthalpy liên kết:
Bài 21 Chất P được tổng hợp từ các chất X và Y trong thiết bị dòng chảy không đổi gồm hai nguồn nạp cho các dung dịch chất phản ứng và một đường ra cho dung dịch sản phẩm (tất cả các dung dịch đều dạng lỏng). Thiết bị được thiết đặt cho hoạt động sao cho các dòng chất tham gia và sản phẩm được chảy liên tục. Quá trình khuấy là rất mạnh nên nồng độ của tất cả các chất ở mọi nơi trong thiết bị được coi là như nhau. Các thông số kỹ thuật của thiết bị khi hoạt động được cho trong bảng sau: Thí nghiệ m
Dòng vào của dung dịch các chất đầu, m3/s
Nồng độ của các chất đầu trong dòng vào, mol/m3
Nồng độ của các chất đầu, cuối trong dòng ra, mol/m3 X Y X Y X Y P
10,0100 0,0100 1600 2100 299 48,2 501
20,0200 0,0100 1600 2100 732 30,9 335
30,0100 0,0200 1600 2100 8,87 351 524
40,0200 0,0200 1600 2100 308 66,6 492
Sử dụng các số liệu trên, cho biết các thông tin có thể thu được từ hệ này? (ví dụ: thể tích của thiết bị, hằng số tốc độ, bậc phản ứng...). Nếu tìm được bậc phản ứng, hãy đề nghị có chế phù hợp với phương trình động học vừa tìm ra?
Lưu ý: Vì phản ứng xảy ra trong pha lỏng, thể tích dòng ra bằng tổng thể tích các dòng vào.
159 |
158 | N-H 391 kJ⋅mol-1 H-H 432 kJ⋅mol-1 N-N 163 kJ⋅mol-1 N-O 201 kJ mol-1 N=N 418 kJ mol-1 N=O 607 kJ mol-1 O=O 495 kJ mol-1 O-H 467 kJ mol-1 N≡N 941 kJ mol-1
Chất khí X được đặt trong bình chân không ở 25 oC rồi đun nóng tới 500 oC. Quá trình phản ứng diễn ra ở nhiệt độ không đổi được giám sát bằng cách đo áp suất tổng. Khi độ chuyển hóa đạt 51.7 % thì khí trong bình có khối lượng riêng bằng không khí (trong cùng điều kiện). Sự phụ thuộc của tốc độ phản ứng vào thời gian có dạng:
Bài 23
Cân bằng sau đây được thiết lập cực kì nhanh:
Trong đó r được tính theo bar/h, thời gian t là giờ (h). Khi thêm hơi iodine vào, tốc độ phản ứng tăng lên 10000 lần, và năng lượng hoạt hóa giảm 55 kJ/mol.
1) Xác định chất X. Điều gì xảy ra với nó khi đun nóng - kết hợp, phân hủy hay đồng phân hóa? Viết phương trình phản ứng biết rằng (các) sản phẩm phản ứng nhẹ hơn không khí.
2) Đề xuất một cơ chế 2 giai đoạn để giải thích tác động xúc tác của iodine.
3) Xác định bậc phản ứng, tính hằng số tốc độ, áp suất đầu và cuối trong bình, cũng như thời gian để ½ lượng chất đầu tham gia vào phản ứng.
4) Các hệ số trước số mũ trong phương trình Arrhenius của phản ứng có xúc tác và không xúc tác khác nhau bao nhiêu lần?
5) Đôi khi, chất X có thể được tìm thấy trong cơ thể người. Nó đến từ đâu và chuyển hóa thành gì?
Thông tin bổ sung về sự phụ thuộc của áp suất của tác nhân P theo thời gian là
phản
bậc
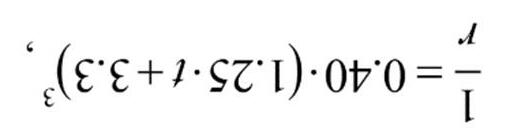
nồng độ của NH4 + (aq) và OH (aq) một lượng nhỏ. Sau thời gian phục hồi τ = 7,61 ns, độ lệch cân bằng x đã giảm xuống 1/e giá trị x0 ban đầu của chúng: . Nồng độ của nước [H2O] vẫn là hằng số và do đó không xuất hiện trong bất kì phương trình nào.
1) Viết biểu thức tốc độ theo biến thiên NH3.
2) Viết biểu thức dx/dt biết x là độ lệch tức thời từ nồng độ cân bằng.
3) Tính hằng số tốc độ k1 và k-1.
|
160 | Bài 22
= 0P ktln P với
ứng
1. =− n1n1 0 111 kt n1PP với phản ứng bậc n. Phương trình Arrhenius: = AE kAexpRT 161
NH3(aq) + H2O(l) ⇌ NH4 + (aq) + OH (aq) (25° ) 1.78∙10 Trong một thí nghiệm, nồng độ cân bằng của NH3(aq) là 0.15 mol dm-3. Một bước nhảy nhiệt độ làm tăng
Nước trải qua một quá trình tự ion hóa, có thể được mô tả bởi phương trình:
HO(l)H(aq)OH(aq)
Hoặc bởi phản ứng trao đổi hydrogen ion như dưới đây:
HO(l)HO(l)HO(aq)OH(aq)
Mức độ diễn tiến của phản ứng này nhỏ, và hằng số ion hóa, thường gọi là tích số tan ion của nước, là:
aa K
Trong đó hoạt độ thực của nước (
HOa ) bằng 1. Từ hiểu biết về Kw và sự phụ thuộc của nó vào nhiệt độ, có thể tính được các đại lượng nhiệt động học ΔrGº, ΔrHº và ΔrHº của phản ứng ion hóa chuẩn. Sự phụ thuộc của tích số tan của nước (Kw) vào nhiệt độ đã được xác minh bằng thực nghiệm [J. Chem. Educ., 45, 231 (1968)] và biểu diễn bởi phương trình:
hồi được định nghĩa là thời gian mà độ lệch của nồng độ của các tiểu phân từ trạng thái cân bằng mới (x) giảm xuống 1/e so với giá trị ban đầu của nó. Xác định thời gian phục hồi của phản ứng trung hòa.
1.1) Tính các giá trị ΔrGº, ΔrHº và ΔrHº của phản ứng này ở 60 oC.
1.2) Tính pH của nước tinh khiết ở 60 oC.
Thành phần của một hệ cân bằng phụ thuộc vào nhiệt độ. Thực tế này được sử dụng để tính các hằng số tốc độ của phản ứng cực nhanh (ultrafast). Xét phản ứng trung hòa dưới đây:
Khi một tụ điện cao thế xả đột ngột, khoảng 1 μs, qua một dung dịch thì nhiệt độ tăng từ T1 đến T2 (thường thì chênh lệch T2 - T1 nằm trong khoảng 3 đến 10 K.) Kĩ thuật này được biết đến với tên gọi “phương pháp hồi phục” (relaxation method), và ý nghĩa khoa học của phương pháp này là sự tiếp cận của hệ với một trạng thái cân bằng mới sau khi nó bị nhiễu loạn. Các hằng số tốc độ của phản ứng trung hòa được xác định bởi phương pháp hồi phục với sự tăng nhiệt độ, như mô
162 | Bài 24
+− +⇌2
+−++ ⇌ 223
+− = 2 HOH w HO
a
2
+− + ⇀ ↽ 1 2 k k2 H(aq)OH(aq)HO(l)
tả ở trên. 2.1) Biết rằng ở 25 oC, k1= 1.4·1011 dm3 mol-1 s-1 và ρ= 2 3 HO 1.00 g cm , xác định giá trị của k2 163 | Phương pháp phục hồi có thể được mô tả bởi một biến mới, x, đại diện cho độ lệch của nồng độ của một tiểu phân liên quan đến trạng thái cân bằng mới: [ ] [ ] −−++ =−=−=−22eqeq eq xHOHOOHOHHH 3.1) Xác định biểu thức cho sự biến đổi của x theo thời gian (dx/dt) ở dạng một hàm số của x và nồng độ của các tiểu phân trong cân bằng mới. Xem rằng đại lượng x2 không đáng kể (có thể bỏ qua). 3.2) Thời gian phục
Phản ứng oxide hoá iodide ion với hydrogen peroxide trong môi trường acid diễn ra chậm. Khi thêm vào một hợp chất có thể kết hợp ngay lập tức với phân tử iodine thì màu iodine biến mất trong một khoảng thời gian xác định (gọi là thời gian trễ - lag period). Khi trộn H2O2 0.125 M và KI 0.05 M (nồng độ ban đầu trong hỗn hợp phản ứng) và ascorbic acid (AA; có nồng độ ban đầu biến đổi: 1.25·10-4; 5·10-4 và 1.25·10-3 M) ở pH 4.5 thì màu iodine xuất hiện sau các khoảng thời gian tương ứng là τ = 4, 16 và 40 giây.
1) Viết
a) Phản ứng oxide hoá chậm (1) iodine ion với hydrogen peroxide trong môi trường acid;
b) Phản ứng nhanh (2) gây ra sự chậm xuất hiện màu của iodine phân tử (kí hiệu dehydroascorbic acid là C6H6O6);
c) Phương trình liên hệ giữa thời gian xuất hiện màu với nồng độ của ascorbic acid trong dung dịch (tính hệ số tỉ lệ);
d) Phương trình tốc độ tiêu thụ H2O2 theo phản ứng (1) ở pH không đổi, giả sử rằng phản ứng có bậc 1 theo iodine ion (kí hiệu hằng số tốc độ là k1.)
2) Cho biết tốc độ tiêu thụ AA và phản ứng (1) bằng nhau, tính:
a) Tốc độ tiêu thụ AA ở phản ứng (2) theo mol/(L.s)
b) Giá trị hằng số cân bằng k1 của phản ứng (1), cho rằng nồng độ hiện tại của các chất phản ứng cũng chính là nồng độ đầu
c) Thời gian trễ τ với H2O2 0.05 M; KI 0.05 M và AA 1.25·10-3 M ở pH 4.5; cho rằng nồng độ hiện tại của các chất phản ứng cũng chính là nồng độ đầu.
3) Molybdate ion xúc tác cho phản ứng oxide hoá iodine với peroxide, do supramolybdic acid H2MoO5 và anion của nó oxide hoá iodide nhanh hơn H2O2.
a) Giả sử rằng molybdate chỉ tồn tại ở dạng H2MoO5, viết phương trình động học của phản ứng này ở dạng tổng quát (kí hiệu hằng số tốc độ là kMo.)
b) Ước lượng giá trị hằng số kMo khi có MoO4 2- 1·10-4 M nếu thời gian trễ là 50 giây với các điều kiện như đã xác định ở ý 2c
c) Tính thời gian trễ với molybdate 3·10-4 M.
|
164 | Bài 25
165
Bài 27
Cộng hợp clo vào styren thường kèm theo sự hình thành 2-clostyren. Trong một vài loại dung môi, sự hình thành các sản phẩm với dung môi cũng được thấy. Ví dụ như khi clo hóa styren trong axit axetic thì thu được sản phẩm dẫn xuất của 1-acetoxy-2-clo. Quá trình tổng cộng có thể được
Viết phương trình động học, biểu
định
khối lượng của chất trung
3. Xác định áp suất tổng (theo Pa) trong hệ sau khi các nồng độ không thay đổi nữa.
4. Áp suất của A sẽ giảm bao nhiêu lần sau khi hoàn thành phản ứng?
5. Giá trị nào sau đây không phụ thuộc vào thành phần ban đầu của hỗn hợp?
6. Phản ứng đầu tiên giải phóng 34 kJ/mol, còn phản ứng thứ hai hấp thụ 22 kJ/mol. Tính hiệu ứng nhiệt của phản ứng thứ ba.
7. Đun nóng hỗn hợp đầu tới 100 oC. Tính tỉ lệ nồng độ C và B trong hỗn hợp cuối, nếu biết năng lượng hoạt hoá của phản ứng thứ hai cao hơn của phản ứng thứ ba 20 kJ/mol. Sử dụng phương trình Arrhenius để tính toán.
|
166 | Bài 26 Trong phase khí ở 60 oC, một số phản ứng diễn ra theo cơ chế sau: =⋅=⋅=⋅ →→→ 313131 123 k1110sk4.010sk2.210s ABCA Áp suất ban đầu của A, B, C lần lượt là 4.00·104, 1.33·104, và 0.64·104 Pa. 1. Tính nồng độ mol ban đầu của A 2.
diễn
luật tác dụng
gian B.
a) [ ]∞ A ; b) [ ] [] ∞ ∞ A B ; c) [ ] [ ] ∞∞ + AB ; d) [ ] [ ]∞ ∞ AB
167
mô tả bởi sơ đồ: AcOH OAc Cl Cl Cl Cl Cl +2 Sự hình thành mỗi sản phẩm tuân theo cùng định luật động học: bậc phản ứng là 1 với cả styren và clo. Sự phân bố sản phẩm trong quá trình clo hóa cis-1-phenylpropen tại 25oC được cho trong bảng Sản phẩm 1,2-dichloro 1-acetoxy-2-chloro 2-chlorostyrene % mol 61 30 9 1. Hằng số tốc độ của phản ứng tổng cộng là 1,45×104 M-1s-1 tại 25oC. Hãy tính hằng số tốc độ cho sự hình thành mỗi sản phẩm? 2. Các sản phẩm của phản ứng này có thể được tách nhờ phương pháp sắc ký. Nếu sử dụng chất hấp phụ là đối xứng (vật liệu đối xứng) thì số sản phẩm thu được khi phân tách là 6. Tại sao? Nếu sử dụng vật liệu hấp thụ là bất đối (vật liệu bất đối) thì số sản phẩm thu được là bao nhiêu?
Bài 28
Động học của 2 phản ứng phức tạp đã được nghiên cứu nhiều trong phòng thí nghiệm:
1) liên tiếp: A → B → D
2) song song: A → B, A → D Biết rằng bậc phản ứng của mỗi giai đoạn đều bằng 1, các hằng số tốc độ có thể khác nhau. Máy tính lưu trữ kết quả của các thí nghiệm đã bị nhiễm virus và bị phá hủy một số dữ liệu. Các nhà nghiên cứu thậm chí còn không biết các bảng dữ liệu tương ứng với thí nghiệm nào.
Hãy phục hổi các dữ liệu động học bằng cách điền vào các ô trống trong các bảng. Xác định cơ chế tương ứng với mỗi bảng. Xác định chu kì bán hủy của chất A trong mỗi trường hợp. Nhắc lại là trong phản ứng sơ cấp bậc một, A → P, thì mối liên hệ của nồng độ chất phản ứng theo thời gian có dạng: lncA(t) = lncA(0) - kt. Nếu A tham gia vào các phản ứng song song thì sự vẫn như vậy.
20
168 | 169 |
Cơ chế t, phút 0 10
30 ∞ с(A), M 1 0.25 с(B), M 0 0.3 0.6 с(D), M 0 0.3 Cơ chế t, мин 0 10 20 30 ∞ с(A), M 1 0.25 с(B), M 0 0.375 с(D), M 0 0.25 0.766
6) Xác định công thức cấu tạo của A C, biết A có phân tử khối nhỏ nhất có thể có.
Một quá trình quan trọng để tạo thành các liên kết C-C là chuyển vị Cope:
1) Xác định sản phẩm chuyển vị Cope của 3-phenylhexadiene-1,5.
2) Xác định nhiệt lượng giải phóng khi đốt cháy 1 gram hỗn hợp nhận được bằng cách giữ 3-phenylhexadiene-1,5 ở 100 oC cho đến khi đạt tới cân bằng, biết rằng 1 gram của 3-phenylhexadiene-1,5 giải phóng Q1 kJ và 1 gram của sản phẩm đồng phân hóa của nó là Q2 kJ. Tính ∆G0 của phản ứng đồng phân hóa, giả sử hằng số cân bằng trong khoảng nhiệt độ 95-110 oC là 80. Sử dụng công thức −∆ = 0 G/RTKe để tính toán.

3) Tính hằng số tốc độ của phản ứng chuyển vị này ở 60 oC, biết hằng số tốc độ phản ứng ở 90 oC là 4·103 s-1, và hằng số tốc độ của phản ứng nghịch ở 110 oC là 2·102 s-1 Nếu sản phẩm chuyển vị Cope giống với tác nhân ban đầu thì chuyển vị này được gọi là “suy biến”.
4) Xác định cấu trúc hai đồng phân có công thức C9H16 có thể được quan sát thấy trong một chuyển vị Cope suy biến. Các ví dụ về chuyển vị Cope hoàn toàn bất thuận nghịch cũng đã được biết đến.
5) Chuyển vị có thể xem là bất thuận nghịch nếu hỗn hợp cân bằng chứa ít hơn 0.01 % chất đầu. Xác định biến thiên năng lượng Gibbs cực tiểu của của chất đầu và sản phẩm của chuyển vị Cope cần để phản ứng diễn ra ở 100 oC được xem là bất thuận nghịch.
Hydrocarbon A (ωC = 88.89 %) khi đun nóng bị đồng phân hóa bất thuận nghịch thành B, chất này phản ứng với KMnO4 chuyển hóa thành sản phẩm C duy nhất.
|

170 | Bài 29
171
Chuyên đề 25: Trạng thái dừng và cơ chế phản ứng
Bài 1
Dinitơ pentoxit phân huỷ thông qua phản ứng sau để tạo thành nitơ dioxit và oxy: 2 N2O5 → 4 NO2 + O2

a) Vẽ hai công thức cộng hưởng của dinitơ pentoxit trong đó có thể hiện các điện tích hình thức.
b) Viết biểu thức tốc độ phản ứng tương ứng với phương trình phản ứng đã cho.
Cơ chế của phản ứng phân hủy như sau :
(1)
(2)
(3)
c) Cố gắng tìm biểu thức tốc độ phản ứng đúng khi áp dụng nguyên lý phỏng định trạng thái dừng cho NO và NO3.
Năng lượng hoạt hóa của phản ứng phân hủy ở 300 K là EA = 103 kJ.
d) Ở nhiệt độ nào thì tốc độ phản ứng tăng gấp hai lần ? Biết các chất lúc này có cùng nồng độ đầu, như vậy EA trở thành hằng số và thừa số trước mũ A không thay đổi.
Bài 2
Phản ứng cộng aldol của axeton (propanon) được xúc tác bởi base có sự tạo thành trung gian cacbanion từ axeton, phản ứng này là thuận nghịch. Cacbanion này sẽ phản ứng với phân tử axeton thứ hai để tạo thành sản phẩm. Cơ chế đơn giản hóa được biểu diễn như sau:
Tìm biểu thức vận tốc cho sự tạo thành sản phẩm P. Sau đó áp dụng nguyên lý nồng độ ổn đinh để tính nồng độ cacbanion. Sử dụng ký hiệu HA cho axeton và A cho cacbanion.
172 |
N2O5 NO2 + NO3
NO2 + NO3 NO2 + O2 + NO
NO + N2O5 3 NO2 k1 k2 k3 k 1 173 |
Nguyên tử clo đi vào tầng bình lưu từ các hợp chất của clo làm phá hủy tầng ozon. Có thể mô tả quá trình phá hủy này bằng bốn phản ứng đơn giản như sau: (đây không phải quá trình thực sự xảy ra).
Cl2 → 2 Cl k1
Cl + O3 → ClO + O2 k2
ClO + O3 → Cl + 2 O2 k3
2 Cl → Cl2 k4 Rút ra phương trình biểu diễn vận tốc tiêu thụ ozon theo thời gian (v = ), bằng cách sử dụng nguyên lý trạng thái dừng cho hai tiểu phân ClO và Cl.Phương trình này chỉ nên chứa biến là nồng độ ozon và khí clo.
Bài 4
Thí nghiệm đồng hồ iodine biểu diễn động học của một phản ứng theo cách kinh điển. Hai dung dịch không màu được trộn lẫn với nhau, sau một thời gian ngắn thì dung dịch chuyển thành màu xanh dương. Có nhiều biến thể khác nhau của thí nghiệm này, một trong số chúng là phản ứng sau đây:
cả các tiểu phân đều tan trong nước)
chế sau đây được
nghị cho phản ứng trên:
Dẫn ra phương trình tốc độ tạo thành I3 . Sử dụng phương pháp gần đúng trạng thái dừng cho tất cả các tiểu phân trung gian
|
174 | Bài 3
175
S2O8 2- + 3 I → 2 SO4 2- + I3 (Tất
Cơ
đề
+ → →2 + + → + →
Nước thải công nghiệp là nguyên nhân chính gây ô nhiễm nước và các nghiên cứu động học đã được tiến hành trong phòng thí nghiệm để thiết kế phương pháp xử lí hữu hiệu. 1,4-dioxane – thường gọi là dioxane (C4H8O2), là dung môi và sản phẩm phụ trong nhiều quá trình công nghiệp – là chất gây ô nhiễm nước đáng kể. Nó có thể bị chuyển thành các hoá chất không độc bằng những tác nhân oxid hoá như peroxodisulfate, ozone hoặc hydrogen peroxide.
Dữ liệu nghiên cứu động học phản ứng oxid hoá dioxane bởi potassium peroxodisulfate (K2S2O8) và xúc tác AgNO3 ở T = 303,15 K được cho dưới đây. Phản ứng được theo dõi bằng cách ước lượng lượng peroxodisulfate chưa phản ứng. Nồng độ AgNO3 dùng trong nghiên cứu này là 1,00.10-3 mmol.dm-3 .
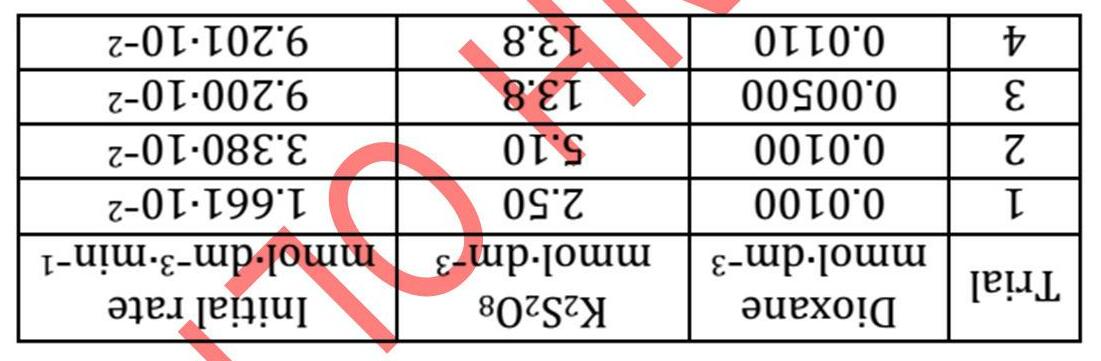
b) Giả sử rằng Ag(III) là trạng thái ổn định, xác định biểu thức tốc độ phản ứng oxid hoá dioxane.
c) (Những) phát biểu nào sau đây là đúng:
A. Tốc độ phản ứng theo cơ chế ở ý 1b), với nồng độ dioxane rất cao, là phù hợp với dữ kiện thực nghiệm ở ý 1a)
B. Tốc độ phản ứng theo cơ chế ở ý 1b), với nồng độ dioxane rất thấp, là phù hợp với dữ kiện thực nghiệm ở ý 1a)
C. Với nồng độ dioxane rất cao, đơn vị của hằng số tốc độ là dm3.mol-1.s-1 .
D. Với nồng độ dioxane rất thấp, đơn vị của hằng số tốc độ là dm3.mol-1.s-1 .
Ở nhiều quốc gia, hàm lượng cho phép của dioxane trong nước uống là khoảng 0,35 μg.dm-3. Một mẫu nước có nồng độ dioxane ban đầu là 40,00 μg.dm-3. Giả sử để oxid hoá 1 mol dioxane cần 1 mol peroxodisulfate. Nồng độ AgNO3 sử dụng trong nghiên cứu này là 1,00.10-3 mmol.dm-3 a) Tính thời gian (theo phút) mà quá trình oxid hoá cần tiếp tục để đạt tới hàm lượng cho phép của dioxane ở 303,15 K, nếu nồng độ K2S2O8 ban đầu là 5,0.10-6 mol.dm-3. Giả sử biểu thức tốc độ phản ứng nhận được từ dữ kiện trên phù hợp với các điều kiện này.
Nhiều cơ chế đã được đề xuất cho phản ứng oxid hoá dioxane bằng peroxodisulfate. Misra và Ghosh (1963) đã đề xuất cơ chế sau:
|
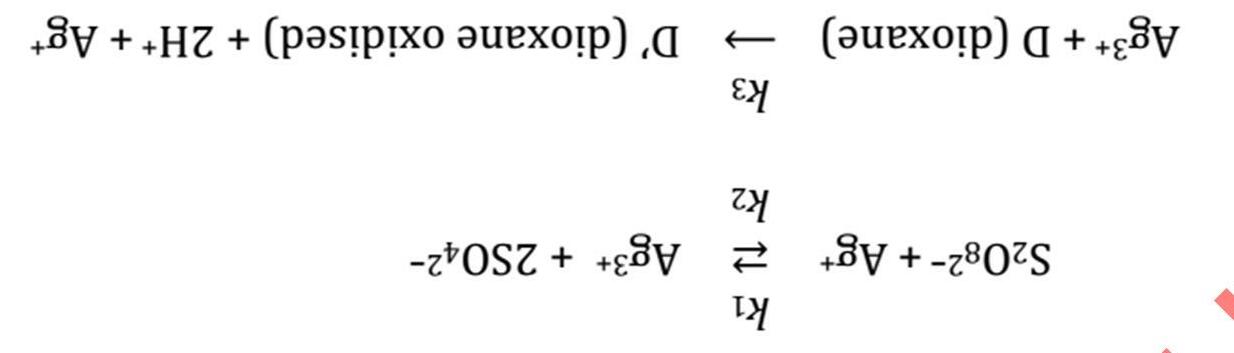
176 | Bài 5
177
Trong bối cảnh tác hại xấu của sự biến đổi khí hậu ngày càng thể hiện rõ trên phạm vi toàn cầu, hóa học khí quyển ngày càng có tầm quan trọng to lớn. Một trong những phản ứng được quan tâm nhiều của lĩnh vực này là sự phân hủy nitơ oxit NO trong pha khí.
2NO (k)
(k)
O
(k)
Phản ứng này có cơ chế được thừa nhận rộng rãi là:
a) Hãy lập biểu thức định luật tốc độ phân hủy NO theo các giả định: Nồng độ N đạt giá trị dừng, tốc độ của giai đoạn phát triển mạch vượt trội so với tốc độ của giai đoạn khơi mào (khởi đầu), và cân bằng giữa oxy và oxy nguyên tử được thiết lập.
b) Biểu diễn năng lượng hoạt hóa hiệu dụng Eeff* của phản ứng chung theo năng lượng hoạt hóa của các giai đoạn thích hợp trong cơ chế trên.
Bài 7
Một cơ chế phản ứng kiểu ion - phân tử trong quá trình tổng hợp amoniac ở vùng trong các đám mây giữa các sao được cho dưới đây:
N+ + H2 → NH+ + H k1
NH+ + H2 → NH2 + + H k2
NH2 + + H2 → NH3 + + H k3
NH3 + + H2 → NH4 + + H k4
NH4 + + e → NH3 + H k5
NH4 + + e → NH2 + 2H k6
a) Sử dụng nguyên lý nồng độ ổn định hãy đề nghị một phương trình tính nồng độ của các tiểu phân trung gian NH+, NH2 +, NH3 + và NH4 + phụ thuộc vào nồng độ các chất phản ứng là [N+], [H2] và [e ]. Xem electron xử sự như một chất phản ứng bình thường.
b) Chứng minh rằng biểu thức tốc độ phản ứng tốc quát của sự hình thành amoniac có dạng như sau:
k2nd là hằng số vận tốc của phản ứng bậc hai. Viết biểu thức k2nd phụ thuộc vào các hằng số tốc độ phản ứng của các bước sơ cấp từ
c) Nguồn gốc của năng lượng hoạt hóa trong phản ứng này là gì
178 | Bài 6
→ N2
+
2
1 2 3 4 4 k 2 k 2 k 2 k k2 2NONOO ONOON NNONO 2OMOM →+ +→+ +→+ → ++ ←
179 |
3 2nd2 d[NH] k[N][H] dt + = Với
k1 đến k6.
? Tốc độ phản ứng của các ion-phân tử hoàn toàn độc lập với nhiệt độ. d) Điều này cho ta thông tin nào về năng lượng hoạt hóa ? e) Vậy để phản ứng này xảy ra ở môi trường giữa các sao thì cần phải thỏa mãn những điều kiện nào?
Thủy phân là một quá trình công nghiệp quan trọng để chuyển than đá thành các nhiên liệu lỏng và các nguyên liệu hóa học. Có thể coi cấu trúc của than đá như mạng không gian ba chiều cúa các khối đa vòng thơm được nối với nhau bằng các cầu béo (aliphatic) ngắn. Trong số các mô hình dùng để nghiên cứu nhiệt phân, các α,ω-diphenylalkan đôi khi được dùng như là các hợp chất mô hình của than đá.
Nhiệt phân 1,3-diphenylpropan tạo ra các sản phẩm chính là toluen và styren, sản phẩm phụ là etynbenzen và một số hyđrocacbon khác. Cơ chế sự nhiệt phân trên được đề nghị như sau (chậm nhất là bước thứ nhất):
(1)
1. Áp dụng sự gần đúng nồng độ dừng cho gốc 2, hãy thiết
tốc độ cho phản ứng phụ khi tạo ra etynbenzen
2. Tỉ số nồng độ dừng giữa gốc 1 và gốc 3 bằng bao nhiêu?
phương
Ngoài ra, hai gốc tự do có thể lại liên kết với nhau theo phản ứng như vẫn được công nhận cho các gốc. Phản ứng này có hằng số tốc độ kR:
3. Liệu có thể loại bỏ được hay không các phản ứng này trong sự gần đúng nồng độ dừng đã xét ở các câu hỏi 1và 2 trên?
4. Một trong số các gốc có mặt trong hỗn hợp phản ứng có nồng độ cao hơn các gốc khác. Gốc đó là:
a) PhC•HCH2CH2Ph vì nó là gốc bền nhất;
b) PhCH2• vì phản ứng phân rã β (4) có hằng số tốc độ cao hơn phản ứng dây chuyền tăng mạch (3);
c) PhCH2CH2• vì nó tích tụ trong hệ.
Hãy cho biết tính hợp lí của mỗi giả định trên.(Bản gốc không có câu này!)
5. Hãy thiết lập phương trình tốc độ của sự hình thành toluen. Hãy xác định bậc của phản ứng. Hãy biểu thị năng lượng hoạt hóa hiệu dụng thông qua năng lượng hoạt hóa của các bước sơ cấp.
180 | Bài 8
PhCH2CH2CH2Ph → 1k PhCH2• + PhCH2CH2•
S 1 2 PhCH2CH2• + PhCH2CH2CH2Ph → 2k PhCH2CH3 + PhC•HCH2CH2Ph (2) 3 PhCH2• + PhCH2CH2CH2Ph → 3k PhCH3 + PhC•HCH2CH2Ph (3) P1 PhC•HCH2CH2Ph → 4k PhCH=CH2 + PhCH2• (4) P2
lập
trình
R1• + R2• → Rk R1R2
181 |
phản
M là phân tử khí trơ nào đó có khả năng trao đổi năng lượng với ozon khi va chạm, trong khi bản thân nó không đổi. Biết rằng tốc độ phản ứng (2) lớn hơn rất nhiều so với tốc độ phản ứng thuận và phản ứng nghịch trong cân bằng (1) (v2 >> v-1 và v2 >> v1)
a) Có thể áp dụng nguyên lý nồng độ ổn định đối với nguyên tử O được không? Tại sao?
b) Xác định biểu thức vận tốc phản ứng (*) và biểu diễn hằng số tốc độ phản ứng tổng quát (k) theo các hằng số tốc độ thành phần.
Bài 10
Một trong các phản ứng xảy ra giữa ra với các aldehyde khi có dung dịch kiềm đặc là phản ứng Cannizzaro: 2ROH + OH → RCOO + RCH2OH
1. Hoàn thành các phương trình phản ứng xảy ra trong dung dịch kiềm đặc sau:
Cơ chế được chấp nhận của phản ứng Cannizzaro gồm hai hướng cạnh tranh nhau với sự chuyển hydride tới aldehyde từ anion A hoặc dianion B. Hướng phản ứng chính phụ thuộc vào nồng độ của base. Dưới đây là cơ chế phản ứng:
2. Sử dụng cơ chế này và phương pháp trạng thái ổn định (nghĩa là giả sử rằng nồng độ của các tiểu phân trung gian hoạt động là rất thấp và không phụ thuộc vào thời gian), hãy dẫn ra phương trình động học
|
182 | Bài 9 Cho
ứng phân hủy ozon ở pha khí: 2k 32 OO2O +→ (*) Phản ứng này được xem như tuân theo cơ chế sau: 1 1 k 32 k MOOOM +++ ⇀ ↽ (1) 2 32 2k OOO +→ (2) Ở đây
183
tổng quát (k-1 >> k3, k-2 >> k4). Trên cơ sở phương trình này, hãy xác định bậc phản ứng của base và aldehyde
a) khi nồng độ base thấp.
b) khi nồng độ base cao.
Bài 11
Sucrose (Suc, C12H22O11) là một loại disaccharide phổ biến. Giống như đa số các hợp chất thiên nhiên khác, nó có tính quang hoạt. Trong môi trường nước, nó bị thủy phân từ từ thành glucose (Glc) và fructose (Fru). Trong phản ứng này, góc quay riêng của dung dịch đổi dấu - gọi là sự nghịch đảo sucrose. Quá trình này được xúc tác bởi acid: Dựa vào phương pháp gần đúng giả-trạng thái dừng (quasi-stationary approximation), tốc độ của quá trình này được biểu diễn như sau:

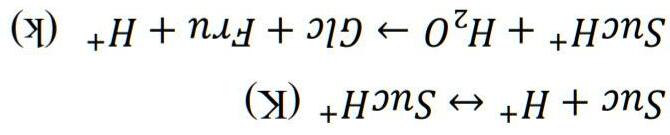
Karabas Barabas2 đã quyết định nghiên cứu về động học phản ứng nghịch đảo cấu hình sucrose. Ông ta đưa cho Malvina và Pierrot một dung dịch sucrose 1.5 M rồi hướng dẫn Malvina sử dụng HCl để acid hóa [xúc tác] còn Pierrot dùng CH3COOH. Nồng độ của cả hai acid trong nghiên cứu đều là 10-3 M. Ở các nhiệt độ 7 oC và 17 oC, hai người nhận được các hằng số tốc độ hiệu dụng sau (keff):
1) Tính giá trị
ở 17 oC (cho biết khối lượng riêng của sucrose = 1.19 g/mL) và chỉ rõ thứ nguyên của nó.
2) Tính năng lượng hoạt hóa của phản ứng nghịch đảo sucrose.
3) Tính hằng số acid của CH3COOH ở 7 oC, sử dụng dữ kiện động học. Tâm trạng của Karabas-Barabas bỗng trở nên tệ hơn và ông ta quyết định trừng phạt Malvina và Pierrot, yêu cầu họ phải đo hằng số tốc độ ở -3 oC. Hai người đã tìm ra cách và quyết định thêm KCl để hạ thấp nhiệt độ nóng
2 CácnhânvậtKarabas-Barabas(chủnhàhátmúarối,nhânvậtphảndiệnchính),Malvina (búpbê)vàPierrot(nhàthơ,yêusayđắmMalvina)đềuxuấthiệntrongcâuchuyệncổ tích Chiếc chìa khóa vàng hay Cuộc phiêu lưu của Buratino củatácgiảA.Tolstoy(Nga). Đâylàmộttácphẩmdựatrênnguyênmẫu Cuộc phiêu lưu của Pinocchio củatácgiả EnricoMazzanti(Ý).CâuchuyệnvềBuratinorấtnổitiếngởnướcNga.
184 |
185 |
kK
chảy của dung dịch. Cho biết hằng số nghiệm lạnh của nước là 1.86 K·L/mol.
4) Tính khối lượng KCl phải thêm vào 1 lít dung dịch sucrose 1.5 M để băng điểm [nhiệt độ đóng băng] của dung dịch trở thành -3 oC và lực ion được tạo thành bởi chất điện li này.
5) Chọn phát biểu đúng liên quan đến mỗi hệ của Malvina và Pierrot: Khi thêm KCl (-3 oC)
A) Không quan sát được hiệu ứng muối.
B) Quan sát được hiệu ứng muối sơ cấp.
1) keff trùng khớp với tính toán của phương trình Arrhenius.
2) keff vượt quá tính toán của phương trình Arrhenius.
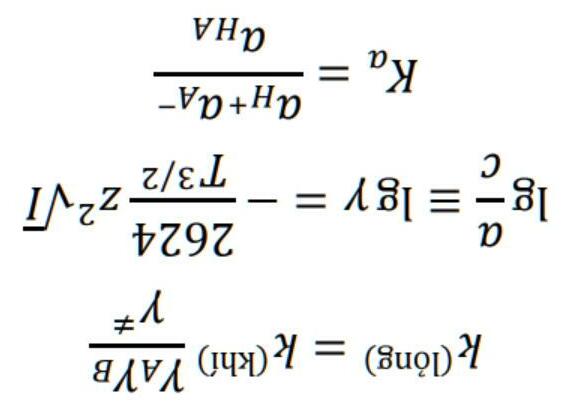
C) Có hiệu ứng muối thứ cấp. 3) keff bé hơn tính toán của phương trình Arrhenius.
6) Tính các hằng số hiệu dụng (keff) mà Malvina và Pierrot sẽ nhận được ở -3 oC khi có mặt KCl. Bỏ qua sự phụ thuộc của nhiệt độ vào hằng số phân li của acetic acid, lấy giá trị từ ý 3. Nếu Karabas-Barabas khiến bạn sợ hãi và bạn không thể tính được nó, hãy sử dụng giá trị 10-5 .
Cho biết các thông tin cơ bản:
Bài 12
Trong môi trường axit, I bị oxi hóa bởi 3BrO theo phản ứng: + 3329I+
Thực nghiệm cho biết, ở một nhiệt độ xác định, biểu thức tốc độ của phản
có dạng:
186 |
187 |
BrO + 6H 3I + Br + 3HO→ (I) 1.
ứng
3+2 3 d[BrO] [H][BrO][I] (II) d vk t =−= với k là hằng số tốc độ của phản ứng. a) Cho biết bậc của phản ứng (I). Bậc của phản ứng bằng bao nhiêu nếu phản ứng được thực hiện trong dung dịch đệm có pH = 3? b) Nếu thực hiện phản ứng trong dung dịch đệm có pH < 7 thì năng lượng hoạt hóa của phản ứng có thay đổi không? Tại sao? 2. Cơ chế của phản ứng (I) được đề nghị như sau: 1 1 ++ 323BrO +2H HBrO k k → ← (1)(nhanh, cân bằng) 2+ 2322HBrO + I IBrO + HOk → (2)(chậm) 3 222IBrO + I I + BrOk → (3) (nhanh) 4+ 222BrO + 2I + 2H I + BrO + HOk → (4) (nhanh) 5+ 22BrO + 2I + 2H I + Br + HOk → (5) (nhanh) 6 6 23I +I I k k → ← (6) (cân bằng) a) Có thể áp dụng nguyên lí nồng độ dừng cho các tiểu phân trung gian 23HBrO+ và IBrO2 được không? Tại sao? b) Chứng minh rằng cơ chế này phù hợp với biểu thức tốc độ (II) ở trên, từ đó tìm biểu thức của k.
Ở trong động cơ xe hơi và trong hệ thống thoát khí của xe xảy ra phản ứng pha khí sau.
NO2 (k) + CO (k) → NO (k) + CO2 (k)
Các dữ kiện thực nghiệm của phản ứng này được cho ở bảng: Thí nghiệm Lượng [NO2] đầu, mol/dm3 Lượng [CO] đầu, mol/dm3 Tốc độ đầu. mol/dm3s 1 0,10 0,10 0,0050 2 0,40 0,10 0,080 3 0,10 0,20 0,0050
a) Viết biểu thức định luật tốc độ phản ứng?
b) Đối với phản ứng tổng quát thì có một số cơ chế phản ứng sau được đề nghị.
I) NO2 + CO → NO + CO2
II) NO2 + NO2 → NO3 + NO NO3 + CO → NO2 + CO2
NO2 + NO2 → N2 + 2O2 O2 + 2CO → 2CO2 N2 + O2 → 2NO
Cơ chế nào phù hợp nhất với thực nghiệm? Giai đoạn nào xác định tốc độ?
c) Vẽ giản đồ năng lượng cho cơ chế trên (giản đồ năng lượng – tiến trình phản ứng).
Bài 14
Xét phản ứng: N2(k) + O2(k) ⇌ 2NO(k) (1)
1) Tính các giá trị nhiệt động học ∆Ho 298, ∆Go 298 và ∆So 298 của phản ứng này nếu biết rằng entanpy và năng lượng tự do của sự tạo thành NO lần lượt là ∆Hof,298 = 91,25 kJ/mol và là ∆Gof,298 = 87,58 kJ/mol và giải thích tại sao phản ứng (1) không thể xảy ra ở điều kiện chuẩn (p = 1 bar, T = 298 K)
2) Viết phương trình biểu diễn sự phụ thuộc năng lượng tự do vào nhiệt độ, cho rằng ∆H và ∆S không phụ thuộc nhiệt độ
3) Xác định nhiệt độ phản ứng mà ở đó lượng NO là 0,1% (về thể tích). Cho rằng
|
188 | Bài 13
III)
189
trong không khí có 78% N2 và 21% O2. Giá trị hằng số khí R = 8,31 J/mol.K 4) NO hoạt động hóa học rất mạnh, nó dễ phản ứng với nhiều chất như oxy, halogen… Cho rằng NO tác dụng với brom qua một cơ chế hai bước như sau: NO + Br2 → ← 1k k NOBr2 NOBr2 + NO → 2k 2NOBr giai đoạn chậm Sử dụng cơ chế này hãy thiết lập phương trình động học cho sự tạo thành NOBr.
Các cơ chế chuỗi gốc thường có phương trình tốc độ rất phức tạp. Tuy nhiên cũng có một vài trường hợp, thì phương trình lại khá đơn giản. Ví dụ như phản ứng nhiệt phân ethanal thành methane và carbon dioxide, có phương trình động học như sau:
Bài 16
Các phương pháp phân tích động học dựa trên cơ sở sự phụ thuộc của tốc độ đầu của các chất phản ứng với nồng độ xúc tác. Ví dụ, Cu(II) được xác định bằng phản ứng oxide hoá p-dihydroxybenzene (hydroquinone)
Năm 1934, F. O. Rice và K. F. Herzfeld đã có thể giải thích phương trình này bởi một cơ chế phản ứng phức tạp, gồm bốn giai đoạn như sau: Khơi mào:
Phát triển mạch:
Phát triển mạch:
Termination:
C
1) Viết phương trình phản ứng nhiệt phân.
2) Viết công thức các tiểu phân không bền sinh ra trong giai đoạn phát triển mạch.
3) Chứng minh phương trình động học trên bằng cách áp dụng phương pháp nồng độ ổn định cho hai tiểu phân kém bền trong giai đoạn phát triển mạch.
4) Xác định mối liên hệ giữa kEXP với hằng số tốc độ của các giai đoạn cơ bản.
H2Q bằng hydrogen peroxide trong dung dịch nước. Ở giai đoạn đầu tiên (hằng số tốc độ k1), p-benzoquinone Q không màu được tạo thành: H2O2 + H2Q → Q + 2H2O (chậm) (1) Khi có mặt ion đồng(II) thì xảy ra phản ứng sau (hằng số vận tốc k2): Cu2+ + H2O2 + H2Q → Q + 2H2O + Cu2+ (2) Ở giai đoạn thứ hai của phản ứng (hằng số vận tốc k3) p-benzoquinone phản ứng ngay lập tức với một phân tử peroxide, tạo thành sản phẩm màu hồng P chưa biết cấu trúc.
Q + H2O2 → P (3) Giả sử rằng bậc phản ứng của mỗi giai đoạn đúng bằng số phân tử.
1) Việc đo tốc độ của quá trình nào dưới đây thích hợp để xác định nồng độ đồng a) Tốc độ phân hủy hydrogen peroxide; b) Tốc độ tạo thành sản phẩm có màu P.
2) Viết biểu thức tính tốc độ tạo thành P khi có đồng(II) (phương trình động học của chất P).
3) Viết biểu thúc tính tốc độ phản ứng của H2O2 khi có đồng(II) (nồng độ của chất trung gian không xuất hiện trong biểu thức).
4) Tốc độ đầu trong dung dịch 1 (chứa 1.0 ng/mL đồng) là 22 đơn vị quy ước; còn trong dung dịch 2 (chứa 4.0 ng/mL đồng) là 56 đơn vị quy ước. Tính nồng độ ion đồng trong dung dịch phân tích thứ 3 nếu biết rằng tốc độ phản ứng lúc này là 40 đơn vị chuyển đổi.
|
190 | Bài 15
∙
CH3CHO → ⦁CH3 + ⦁CHO ka
CH3CHO + ⦁CH3 → CH4 + CH3CO⦁ kb
CH3CO⦁ → ⦁CH3 + CO kc
⦁CH3 + ⦁CH3 →
2H6 kd
191
Phản ứng oxid hóa tác nhân sinh màu HD ở dạng không màu với hydrogen peroxide trong tối thì gần như không xảy ra. Trong điều kiện quang phân UV, từ peroxide có thể tạo thành các gốc hydroxyl:
H2O2 → 2OH• (1)
Gốc này nhanh chóng phản ứng với tác nhân HD:
OH• + HD → D• + H2O (2)
Gốc D• ngay lập tức chuyển thành sản phẩm cuối có màu P (D• → P). Một lượng nhỏ mẫu được lấy ra đều đặn (theo từng khoảng thời gian) khỏi hỗn hợp phản ứng và nồng độ của P được đo ở dạng hàm số theo thời gian. Nồng độ đầu của tác nhân HD là 1·10-4 M, hydrogen peroxide là 3 M, hằng số tốc độ phản ứng (2) là k2 = 3·107 M-1s-1
1) Tính tốc độ trung bình của phản ứng tạo thành P (d[P]/dt, M/s), nếu biết giá trị này là hằng số trong phút đầu tiên của quá trình phản ứng và ở t = 45 giây thì nồng độ P là 1.25·10-5 M.
2) Chú ý rằng nồng độ của các gốc OH• trong quá trình phản ứng gần như là hằng số (và theo đó, tốc độ tạo thành gốc dưới tác động của tia UV sẽ bằng tốc độ tiêu hao win trong phản ứng 2). Tính tốc độ tạo thành các gốc OH•. Tính nồng độ ổn định (nồng độ dừng) của các gốc (bỏ qua biến thiên nồng độ của tác nhân HD).
Một hệ tương tự được sử dụng để xác định các vết sắt. Quá trình xác định dựa trên việc tạo thành các gốc hydroxyl từ peroxide theo phản ứng Fenton: Fe2+ + H2O2 → Fe3+ + ОН• + OH (3)
Do đó tốc độ tạo thành P tăng lên. Hãy thực hiện chiếu xạ hệ trong các điều kiện tương tự như trên với nồng độ ban đầu H2O2 và HD giữ nguyên, cộng thêm một lượng Fe2+
3) Xác định giá trị nồng độ Fe2+ (c1) nếu biết hằng số tốc độ phản ứng (3) là k3 = 50 M-1s-1, và nồng độ sản phẩm M trong 45 giây đầu tiên của phản ứng đạt 2.5·10-5 M.
4) Tính tốc độ tạo thành
iron(II)
(d[
trong
dịch
bằng
192 | Bài 17
sản phẩm
P]/dt)2 nếu biết nồng độ của
c2
dung
này
7.5·10-9 M. 193 | Bài 18 Năng lượng hoạt hóa của phản ứng thuận +→ ← k (g)2(g)2(g) k' 2NOO2NO có giá trị âm. [NO] (mol/dm3) [O2] (mol/dm3) = rd[NO]dt , mol·dm−3·s−1 1 0.010 0.010 2.5·10 5 2 0.020 0.010 1.0·10 4 3 0.010 0.020 5.0·10 5 a) Xác định bậc riêng phần của từng cấu tử trong phản ứng dựa trên các giá trị cho ở bảng trên. b) Tính giá trị hằng số tốc độ k. Hằng số tốc độ (k') của phản ứng nghịch ở 327 và 372 °C lần lượt là 83.9 và 407 dm3·mol−1·s−1 c) Tính năng lượng hoạt hóa của phản ứng nghịch (E'a). d) Tính entanpy của phản ứng ΔHr dựa vào các giá trị cho ở bảng sau. NO NO2 ΔHf / kJ·mol 1 90.29 33.10 e) Vẽ giản đồ năng lượng của phản ứng (trục tung biểu diễn năng lượng, trục hoành biểu diễn tiến trình phản ứng). Ký hiệu trên giản đồ Ea, E'a, ΔHr . Dựa vào kết quả thí nghiệm thì một cơ chế như sau được đề xuất: +→ ← +→ 1 1 2 k 23 k k 32 NOONO NONO2NO f) Viết phương trình động học. g) Cho biết cơ chế này có thống nhất với các kết quả động học và nhiệt động học hay không. Và giải thích tạo sao năng lượng hoạt hóa của phản ứng lại âm và hằng số tốc độ phản ứng phụ thuộc như thế nào vào nhiệt độ?
Với quá trình phân huỷ ozone trong phase khí, có hai cơ chế như sau được đề xuất:
Bài 20
Sir C.N. Hinshelwood đã được nhận giải Nobel Hóa học năm 1956 cho những thành tựu của ông trong việc nghiên cứu cơ chế các phản ứng hóa học ở nhiệt độ cao.
a) Nhiệt phân etanal xảy ra qua cơ chế sau: Phản
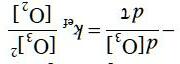
1. Xác định cơ chế nào phù hợp với bằng chứng thực nghiệm là việc đưa thêm oxygen phân tử vào bình phản ứng sẽ làm ức chế sự phân huỷ ozone.
2. Dẫn ra phương trình tốc độ của phản ứng phân huỷ ozone theo cơ chế đã chọn.
3. Phản ứng dây chuyền đề cập tới các phản ứng có bậc thay đổi. Xác định điều này với phản ứng phân huỷ ozone, chú ý đến tốc độ đầu của quá trình với điều kiện là ở thời điểm đầu không có oxygen.
Dữ kiện thực nghiệm cho thấy rằng tốc độ phản ứng phân huỷ ozone được mô tả bởi phương trình:
4. Tại sao lại bằng kf? Kết luận nào có thể được đưa ra dựa trên cơ sở phương trình này liên quan đến giai đoạn giới hạn tốc độ (tốc định)?
Thực nghiệm cho thấy, với giai đoạn nghịch đảo của quá trình K1 = 7.7 · 104 · e(-24600/RT) và k2 = 2.96 · 1010 · e (-6000 / RT) l · mol-1 · s-1
5. Xác định sự phụ thuộc của kef vào nhiệt độ và tính giá trị hằng số này ở điều kiện chuẩn.
số tốc
các phản
nêu trên vào các giai đoạn: khơi mào, phát triển mạch hay tắt mạch.
b) Sử dụng nguyên lý nồng độ ổn định áp dụng cho các gốc tự do trung gian hãy tìm biểu thức nồng độ ổn định đối với các gốc tự do HCO, H, CH3 và CH3CO.
c) Xác định biểu thức tốc độ đối với phản ứng mất etanal và tốc độ phản ứng tạo thành metan, etan, hydro và CO.
d) Có hai con đường khác nhau để phân ly etanal. Viết và cân bằng các phản ứng này và đối với mỗi phản ứng. Hãy tìm bậc riêng phần của etanal và năng lượng hoạt hóa của phản ứng.
194 | Bài 19
195 |
ứng Hằng
độ Ea / kJ mol 1 CH3CHO → CH3· + HCO· k1 358 CH3· + CH3CHO → CH4 + CH3CO· k2 8 CH3CO· → CH3· + CO k3 59 HCO· → H· + CO k4 65 H· + CH3CHO → H2 + CH3CO· k5 15 2CH3· → C2H6 k6 0 Xếp
ứng
Một trong những sản phẩm quan trọng nhất của công nghiệp tổng hợp hữu cơ là ethylene - với sản lượng toàn cầu mỗi năm khoảng 150 triệu tấn. Ở một số quốc gia, phương pháp công nghiệp chính để sản xuất hợp chất này là dehydrogen hóa ethane:
Phản ứng thường được tiến hành trên hệ xúc tác Ni/Cr2O3 ở nhiệt độ khoảng 550 - 650 oC và áp suất 0.05 MPa. Thông thường, khí nitrogen được thêm vào ethane. Hiệu suất của ethylên trong những điều kiện này là khoảng 30 %. Các đặc trưng nhiệt động học của quá trình này, đo ở 600 oC là ΔrHo = 148.3 kJ/mol, ΔrSo = 141.7 J/(mol K).
1) Dựa vào những dữ liệu ở trên, hãy giải thích (theo hướng định tính) liệu hiệu suất của ethylene sẽ bị tác động thế nào khi: a) giảm áp suất; b) giảm nhiệt độ.
Phản ứng dehydrogen hóa ethane thậm chí có thể được thực hiện mà không có xúc tác, mặc dù phương pháp này không được sử dụng trong công nghiệp. Với phản ứng dehydrogen hóa ethane không-xúc tác thì cơ chế chuỗi sau đã được đề xuất vào năm 1939:
1) M
3)
Trong đó M là bất kì vi hạt nào có trong hỗn hợp khí.
2) Trong các phản ứng gốc theo cơ chế chuỗi không phân nhánh, các phản ứng sơ cấp được chia thành các giai đoạn: khơi mào, phát triển và tắt mạch. Cho biết mỗi giai đoạn 1-5 ứng với loại nào.
3) Giai đoạn nào được đặc trưng bởi năng lượng hoạt hóa cao nhất và thấp nhất? Giải thích.
Phân tích lí thuyết cơ chế phản ứng này thu được biểu thức tốc độ phản
ứng tạo thành ethylene như sau: [ ] [][]== 24 eff26 dCH WkCHM dt
Kết quả
4) Xác định bậc phản ứng theo ethane: a) khi độ chuyển hóa ethane thấp; b) khi độ chuyển hóa ethane cao hoặc khi được làm loãng bởi nitrogen.
Một bình phản ứng (đã được hút chân không trước), dung tích 250 mL, được bơm đầy khí ethane ở nhiệt độ phòng. Sau đó, đun nóng nhanh tới 600 oC. Áp suất ban đầu của ethane ở nhiệt độ 600 oC là 0.361 bar.
5) Tính áp suất riêng phần (theo bar) của ethane, ethylene và hydrogen: a) sau 2 phút kể từ khi bắt đầu phản ứng; b) sau khi đạt trạng thái cân bằng.
6) Hãy thử so sánh phản ứng dehydrogen hóa xúc tác và không-xúc tác của ethane. Bảng dưới đây cho biết một vài đại lượng lí hóa của phản ứng. Dưới mỗi đại lượng, hãy đặt các dấu: cộng (+), nếu xúc tác ảnh hưởng đến thông số này; trừ (-), nếu không ảnh hưởng; và dấu hỏi (?), nếu không đủ dữ liệu để đưa ra câu trả lời chắc chắn. ΔrHo Kp bậc phản ứng của ethane hằng số tốc độ
hiệu suất cân bằng của ethane
lượng ethane tạo thành sau 2 phút
Cho biết
196 | Bài 21
C2H6 → C2H4 + H2
+ C2H6 → 2CH3 • + M 2) CH3 • + C2H6 → CH4 + C2H5 •
C2H5 • → H• + C2H4 4) H• + C2H6 → H2 + C2H5 • 5) C2H5 • + C2H5 • → C4H10
thực nghiệm cho thấy keff = 5.54·10-4 s-1 ở 600 oC. 197 |
1) Phương trình động học của phản ứng bậc nhất: [A] = [A]0·exp(-kt) 2) ΔrGo = ΔrHo - TΔrSo . 3) Mối liên hệ giữa năng lượng Gibbs và hằng số cân bằng: ΔrGo = -RTlnKp. 4) Hằng số khí R = 8.314 J/(mol·K)
Phản ứng polymer hoá styrene (M) theo cơ chế gốc, không dùng dung môi, có mặt chất khơi mào (I) - benzoyl peroxide (C6H5C(O)O)2 - tạo thành polystyrene với phân tử khối trung bình là 310000. Các mạch polymer ngắn (chứa khoảng 40 đơn vị) được tạo thành khi quá trình polymer hoá được thực hiện khi có chất ức chế gốc - là gốc bền 2,2,6,6-tetramethylpiperidine-1-oxy TEMPO (T•) - với nồng độ 10-5 M.
1. Viết phương trình phản ứng của các giai đoạn khơi mào, phát triển và tắt mạch của chuỗi polymer và dẫn ra các phương trình tốc độ phát triển và tắt mạch khi không có chất ức chế.
2. Tính nồng độ của các “gốc sống” M•. Có thể phát hiện các gốc này bằng phổ ESR (cộng hưởng spin electron) nếu độ nhạy của phương pháp này là nồng độ 10-6 M hay không?
3. Phản ứng nào sẽ bị thay đổi khi có mặt TEMPO? Viết các phương trình phản ứng và phương trình tốc độ tương ứng với các phản ứng này.
4. Tính hằng số tốc độ k1 của phản ứng giữa các “gốc sống” M• với chất ức chế T• .
Đề xuất
1. Sử dụng các giả thiết đơn giản hoá sau:
a) Những biến đổi nồng độ các thành phần có thể bỏ qua ở mức độ chuyển hoá thấp;
b) Tốc độ phản ứng của gốc polymer M• không phụ thuộc vào chiều dài mạch (nguyên lí Flory);
c) Các gốc khơi mào I• chỉ phản ứng với các monomer.
2. Khối lượng riêng của styrene là 0.91 gam/cm3 .
3. Chiều dài mạch bằng tỉ lệ của tốc độ phát triển mạch với tốc độ tắt mạch.
4. Hằng số tốc độ của giai đoạn phát triển mạch, kg, là 380 L/(mol·s).
5. Hằng số tốc độ của giai đoạn tắt mạch, kt, là 6.107 L/(mol·s).
198 | Bài 22
199 |
Phản ứng trùng hợp cơ chế gốc diễn ra bằng việc cộng hợp lần lượt các phân tử monomer M (ví dụ, alkene) vào các gốc hoạt động, và tắt mạch bởi sự tái kết hợp của một cặp gốc. Khi cộng hợp vào R• thì M bị chuyển thành gốc tự do, làm tăng độ trùng hợp. Ở trạng thái ổn định (dừng), tốc độ tạo thành gốc mới (khơi mào) bằng tốc độ tiêu thụ (tắt mạch). Ở giai đoạn phát triển mạch, số lượng gốc tự do không thay đổi.
1)
a) Biểu diễn sự tạo thành gốc hoạt động từ styrene và gốc phenyl.
b) Viết phương trình động học của phản ứng cơ bản trong giai đoạn phát triển mạch: R• + M → R•. Kí hiệu hằng số tốc độ là kp.
c) Viết phương trình động học của phản ứng cơ bản trong giai đoạn tắt mạch R• + R'• → R-R'. Kí hiệu hằng số tốc độ là kt.
d) Biểu diễn nồng độ của gốc [R•] ở trạng thái dừng theo tốc độ khơi mào rin và hằng số tốc độ tắt mạch kt.
e) Biểu diễn lại phương trình động học của giai đoạn phát triển mạch, không bao gồm nồng độ gốc [R•]. Phản ứng trùng hợp được khơi mào bởi ánh sáng khả kiến hoặc bức xạ tử ngoại (UV) có thể được sử dụng để chế tạo thiết bị hiển thị toàn ảnh (holographic) hoặc các bộ phận điện tử. Một trong những cách khơi mào phản ứng quang trùng hợp là dựa vào tương tác trực tiếp giữa monomer với bức xạ. Khi lượng tử ánh sáng bị hấp thụ, phân tử sẽ chuyển lên trạng thái kích thích và phân hủy thành một cặp gốc.
2) Dựa vào các giá trị năng lượng liên kết trong phân tử CH2=CHBr, hãy đề xuất hướng phân hủy vinyl bromide thành các gốc tự do dưới tác động của bức xạ tử ngoại. E(C-H) = 400 - 420 kJ/mol, E(C=C) = 630 kJ/mol, E(C-C) = 346 kJ/mol, E(C-Br) = 310 kJ/mol. Nếu tương tác giữa monomer với bức xạ không hiệu quả thì một chất nhạy quang sẽ được bổ sung vào hệ phản ứng. Các phân tử của chất này sẽ truyền năng lượng hấp thụ được cho monomer. Khi có mặt chất nhạy quang, tốc độ khơi mào của phản ứng trùng hợp được biểu diễn theo phương trình rin = 2βIa (trong đó β là hệ số khơi mào, Ia là cường độ bức xạ hấp thụ tính theo đơn vị mol lượng tử ánh sáng trong mỗi giây trong mỗi đơn vị thể tích). Thuốc nhuộm methylene blue được sử dụng để khơi mào phản ứng trùng hợp dưới tác động bức xạ bằng ánh sáng khá kiến có bước sóng 645 nm. Cường độ ánh sáng tới là 10.0 kJ/L·s, hệ số truyền của
thuốc nhuộm là ε = 16000 L/mol·cm, chiều dày của khuôn trùng hợp là l = 0.50 cm, nồng
methylene blue là 1.0·10-4 mol/L, nồng độ monomer là 2.0 mol/L.
3) Tính:
200 | Bài 23
201 |
độ
a) Cường độ bức xạ hấp thụ Ia = I0 - I (J/L·s). b) Tốc độ khơi mào với hệ số khơi mào β = 0.60. c) Tốc độ trùng hợp (phát triển mạch) ở kp 2/kt = 0.0100 J/mol·s. Cho biết: =ε 0 I -lglC I E = hc/λ h = 6.63·10-34 J·s c = 3.00·108 m/s
Một số cặp ion không bền trong dung dịch nước, có thể được làm bền trong các dung môi hữu cơ và có thể được đặc trưng bởi hằng số tạo thành K: X+ + Y ⇌ X+,Y . Bassolo, vào cuối thập kỉ 1940, và Tobe, đầu thập kỉ 1960, đã xuất bản các bài báo nghiên cứu động học phản ứng giữa dichlorobis-(ethylenediamine)-cobalt (III) (gọi tắt ACl+) với anion azide (N3 ) trong các dung môi khác nhau. Trong dung dịch nước thì:
dC vkC
với kE không phụ thuộc vào [N3 ]. Trong dung môi methanol thì phương trình động học cũng tương tự nhưng lúc này kE lại phụ thuộc vào nồng độ azide: [N3 ], mol/L 0 0,001 0,002 0,006 0,015 0,03 kE·103 2,00 2,70 3,21 4,35 5,27 5,77
Sự dịch chuyển dải hấp thụ trên phổ UV được quan sát thấy sau khi thêm mẫu N3 đầu tiên vào dung dịch một đồng phân ACl+ trong methanol. Không có dịch chuyển nào xảy ra đối với các đồng phần còn lại hay trong dung dịch nước của các đồng phân.
Đề nghị cơ chế phản ứng giữa ACl+ với N3 trong nước.
1) Dựa vào những biến đổi sau trong cơ chế phản ứng
ACl+ + N3 ⇌ ACl+ , N3 (K)
ACl+ , N3 → AN3 + Cl (k2) Hãy thiết lập sự phụ thuộc kE = f([N3 ]) trong dung môi methanol. Chứng minh rằng cơ chế đã đưa ra không phù hợp với giá trị đã cho ở bảng và chỉ thể hiện một phần của cơ chế tổng.
2) Để thiết lập cơ chế hoàn chỉnh phải gộp các biến đổi trên với hai giai đoạn nữa, một trong số đó là giai đoạn tốc định (k1). Xác định hàm tổng kE = f([N3 ]) trong dung môi methanol.
3) Tính k1, k2 và K.
4) Tại sao phản ứng trong methanol phải nên tiến hành trong dung dịch đệm?
5) Vẽ cấu trúc các đồng phân của ACl+ .
6) Xác định đồng phân nào phù hợp với bảng giá trị đã cho. Giải thích.
7) Đề nghị một phương trình động học với đồng phân còn lại
202 | Bài 24
+ + ==−⋅ ACl E ACl
dt
203 |
Năm 1957, động học của phản ứng: CH3Mn(CO)5 + 13CO → A (1)
đã được xác thực để làm hình mô hình (mẫu) cho cả nhóm phản ứng được gọi là “chèn phối tử”. Phản ứng (1) có bậc 1 với mỗi tác nhân. Mn tạo liên kết với 13CO trong phân tử A. Phổ IR của hợp chất này chứa các nhóm CO cho thấy các dao động đối xứng hóa trị (v(CO), cm-1) sau: CH3Mn(CO)5 (1895; 1863); A (1885; 1860; 1720); Mn2(CO)10 (1980; 2020); (CH3)2CO (1722). Có thể sử dụng các tác nhân nucleophile khác thay cho 13CO, ví dụ như các amine, phosphine, phosphite, … Phản ứng mô hình (2) cũng được nghiên cứu trong dung dịch tetrahydrofuran với lượng dư phosphite: CH3Mn(CO)5 + (C6H5O)3P → B (1) c(L), mol/L 0.0250 0.0500 0.100 0.125 0.500 0.750 1.00 kexp·104, s 1 4.12 5.85 7.41 7.83 9.41 9.66 9.75 Phổ IR của các tiểu phân trung gian với các phản ứng (1), (2) giống nhau, trong khi đó phổ của A và B rất tương đồng trong vùng v(CO).
1) Xác định các chất và cấu tạo của A, B, Mn2(CO)10 và các tiểu phân trung gian trong các phản ứng (1), (2) có chứa vòng 3 cạnh.
2) Đề xuất cơ chế 2 giai đoạn cho phản ứng (1) (k1; k-1; k2). Dẫn ra phương trình động học, giả định các nồng độ tiểu phân trung gian là ổn định.
3) Xác định biểu thức tốc độ dc() dt B bằng phương pháp nồng độ dừng, nếu cơ chế của phản ứng (2) là:
4) Giả sử rằng phản ứng (2) diễn ra gần như hoàn toàn, hãy đơn giản hóa biêu rthứ tốc độ và dẫn ra phương trình cho kexp. Từ biểu thức này, hãy xác định hệ tọa độ mà tại đó đồ thị thực nghiệm k = f(c) có dạng tuyến tính.
5) Tính các giá trị k3 và k3/k4, sử dụng dữ kiện từ cột đầu tiên và cuối cùng của bảng.
6) Ước tính giá trị k3 cho phối tử L khác, biết k3/k4 = 3.0·10-3 với cyclohexylamine (C6H11NH2) và 5.1·10-3 với triphenylphosphine ((C6H5)3P).
|
204 | Bài 25
()() ⇀ ⇀ ↽ ↽ 3 4 3 4 k k 3 565 k3 k CHMnCO +POCHZ ZB
205
Đề nghị cơ chế cho các phản ứng dưới đây. Chứng minh rằng cơ chế bạn đưa ra là phù hợp với định luật tốc độ theo thực nghiệm. Sử dụng phương pháp nồng độ ổn định hoặc phương pháp giai đoạn chậm nhất nếu cần thiết hoặc kết hợp cả hai phương pháp.
1. Quá trình oxi hóa của ion bromua bằng ion pemanganat trong môi trường axit:
2MnO4 + 10Br– + 16H+ = 2Mn2+ + 5Br2 + 8H2O а) khi nồng độ Br và H+ thấp r = kс(MnO4 )с2(Br )с3(H+) b) khi nồng độ Br và H+ cao r = kс(MnO4 )с(Br )с(H+) trong đó c là nồng độ các chất phản ứng. Trong cả hai trường hợp thì: с(MnO4 ) <<с(Br ), с(H+).
2. Quá trình oxi hóa benzamit bằng peroxiđisunfat trong sự có mặt của ion Ag+/dung dịch axit axetic: 2C6H5CONH2 + 2H2O + 3S2O8 2– = 2C6H5COOH + 6SO4 2– + N2 + 6H+ r = k[Ag+][S2O8 2–]
3. Quá trình oxi hóa ion fomiat bằng peroxiđisulfat trong nước: HCOO + S2O8 2– = CO2 + 2SO4 2– + H+ r = k[HCOO ]1/2[S2O8 2–]
4. Quá trình oxi hóa ion azit bằng iot trong dung dịch cacbon đisunfua: I2 + 2N3 = 3N2 + 2I r = k[N3 ]
5. Quá trình ngưng tụ của anđehit với este của axit acrylic xúc tác bazơ: 1,4-diazabicyclo[2.2.2]octane (DABCO) trong dung dịch tetrahiđrofurane (THF):
= k[ađh]
[este][DABCO]
6. Quá trình phân hủy peroxiaxit trong dung dịch nước: 2RCO3H = 2RCO2H
các dạng của axit RCO
H. Xem xét vấn đề sau: khi trộn hỗn hợp của peroxit axit thường, RCO-O-O-H và peroxit axit chứa đồng vị, RCO–18O–18O–H được dùng như chất phản ứng, thì sản phẩm khí oxi thoát ra chủ yếu gồm 16O2 và
206 | Bài 26
207 | R1CHO + COOR2 N N COOR2 OH R1 r
2
+ O2 () () + 21 3 2 + 2 H RCOH H k rc k = + , trong đó c(RCO3H) là nồng độ tổng cộng
3
18O2.
Chuyên đề 26: Năng lượng hoạt hóa và ảnh hưởng của
Bài 2
Ở 25 °C thì hằng số tốc độ phản ứng CO2 + H
còn
Bài 1 Hằng số tốc
H2CO
0
a) Tính
0.0375
phản
= 2.0·10
= 225.5 kJ/mol.
Tính nhiệt
H
Br(g)
(g)
HBr(g) có gía trị
650 K. Năng lượng hoạt hóa của phản
tăng gấp
b) Tính năng lượng
của
208 |
nhiệt độ
độ
ứng C2
5
→ C2H4
+
là k
-5 s-1 ở
ứng EA
độ mà ở đó tốc độ phản ứng
ba lần. 209 |
2O ⇌
3 là
s−1 ,
ở
°C là 0.0021 s−1. Ở 25 oC thì ∆rH0 = 4730 J·mol−1, ∆rS0 = −33,5 J·mol−1·K−1. Cho rằng ở 0 °C thì giá trị của ∆rH0 và ∆rS0 là như nhau.
hằng số cân bằng của phản ứng ở 0 °С và 25 °С .
hoạt hóa
phản ứng nghịch ở cả hai nhiệt độ.
Một trong những vấn đề chính trong nghiên cứu động hoá học là xác định được cơ chế phản ứng. Vấn đề này thường được giải quyết bằng cách dữ liệu động học thực nghiệm với các kết quả tính toán hoá lượng tử. Hãy xét hai ví dụ sau đây. Ví dụ 1: Thuỷ phân xúc tác kiềm acetyl chloride là phản ứng thuận nghịch, gồm hai giai đoạn cơ bản sau: Cl O +OH tiÓu ph©n trung gian (I) s¶n phÈm (P)
Giản đồ năng lượng của phản ứng được cho dưới đây:
1) Xác định cấu tạo của hợp chất trung gian và sản phẩm.
2) Chỉ ra vị trí của hợp chất trung gian (I), hai trạng thái chuyển tiếp (TS1 và TS2) và sản phẩm (P) trên giản đồ.
3) Xác định giai đoạn quyết định tốc độ phản ứng (tốc định).
4) Viết phương trình động học của phản ứng và xác định bậc tổng của phản ứng.
5) Xác định sự phụ thuộc của năng lượng hoá hoá vào hàng rào năng lượng chung của các giai đoạn phản ứng thứ nhất (E1) và thứ hai (E2).
Ví dụ 2: Phản ứng oxid hoá formic acid với bromine trong dung dịch được mô tả bởi phương trình sau: HCOOH + Br2 → CO2 + 2Br + 2H+
động học cho thấy rằng tốc độ tạo
210 | Bài 3
211 | Các nghiên cứu
thành sản phẩm (w) có thể được xác định bởi biểu thức: [][] + = 2 BrHCOOH wk H Giản đồ năng lượng của phản ứng này được cho dưới đây. Phản ứng oxid hoá này gồm hai giai đoạn, một trong số đó là thuận nghịch. 6) Xác định bậc tổng của phản ứng. 7) Đề xuất cơ chế phản ứng dựa vào biểu thức tốc độ và giản đồ năng lượng. 8) Viết biểu thức về sự phụ thuộc của hằng số tốc độ k với hằng số tốc độ của các giai đoạn cơ bản theo cơ chế đã đề xuất. 9) Viết biểu thức của năng lượng hoạt hoá chung E dưới dạng hàm số của năng lượng hoạt hoá các giai đoạn cơ bản (E3, E-3 và E4).
Sulfuryl chloride SO2Cl2 đóng vai trò như lachrymator - chất làm chảy nước mắt. Trong thí nghiệm Hóa, SO2Cl2 có thể được sử dụng làm nguồn chlorine để tổng hợp hữu cơ. Một số tính chất của sulfuryl chloride là: Nhiệt độ nóng chảy và sôi thông thường lần lượt là -54.1 oC và 69.4 oC. Sulfuryl chloride phản ứng với nước: SO2Cl2 + 2H2O → H2SO4 + 2HCl (phản ứng 1)
Trên nhiệt dộ sôi, sulfuryl chloride bị phân hủy: SO2Cl2(g) ⇌ SO2(g) + Cl2(g) (phản ứng 2).
Các tính chất nhiệt dộng chuẩn (1 bar và 25 oC):
Trong bài tập này, hãy giả sử: i) các khí đều lí tưởng; ii) biến thiên enthalpy và entropy của các quá trình được xét đến không phụ thuộc vào nhiệt độ.
1) 0,10 mol SO2Cl2 được hòa tan vào nước và pha loãng dung dịch đến 1.0 dm3. Tính pH dung dịch nhận được. Cho biết các hằng số ion hóa: pKa(HCl) = -6.3; pKa1(H2SO4) = -3.0; pKa2(H2SO4) = 1.92.
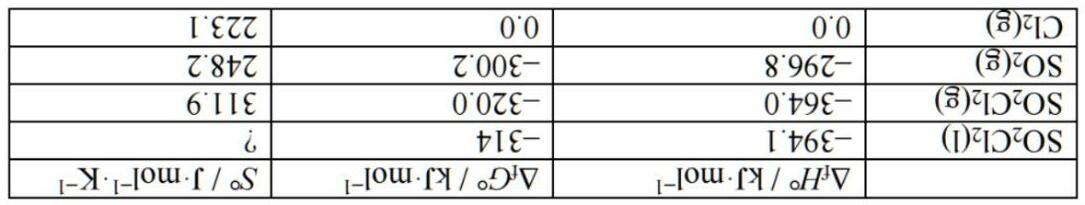
2) Trong bảng trên thiếu giá trị entropy tuyệt đối So của SO2Cl2(l). Tính giá trị này.
3) i) Tính hằng số cân bằng của phản ứng 2 ở nhiệt độ 350 K.
ii) Xác định phát biểu chính xác về hằng số cân bằng trong trường hợp tăng nhiệt độ: A. K sẽ tăng; B. K sẽ giảm. C. K vẫn không đổi.
4) Sự phân hủy sulfuryl chloride (phản ứng 2) là phản ứng bậc 1. i) Khi xét đến động học phản ứng này ở nhiệt độ cao, phản ứng ngược có thể bỏ qua bởi: A. giá trị K cao; B. giá trị K nhỏ.
Khi phản ứng phân hủy được tiến hành trong bình kín, áp suất tổng tăng. Trong bảng dưới đây, biến thiên áp suất tổng theo thời gian đã được ghi lại (ở 600 K).
(ở 0 giây, chỉ có sulfuryl chloride).
ii) Tính hằng số tốc độ và chu kì bán hủy của phản ứng ở nhiệt độ đã cho.
5) Khi nhiệt độ tăng từ 600 lên 610 K, tốc độ phản ứng phân hủy tăng 2 lần. Tính xem tốc độ của phản ứng phân hủy ở 740 K nhanh hơn bao nhiên lần so với ở 720 K?
|
212 | Bài 4
213
Tốc độ đồng phân hóa isoleuxin trong các mẫu hóa thạch có thể được sử dụng để xác định nhiệt độ trung bình của mẫu hóa thạch đang bảo quản Ở 20oC phản ứng này có chu kỳ bán hủy là 125000 năm và năng lượng hoạt hóa của phản ứng này là 139,7 kJ/mol. Sau một thời gian rất dài thì
allo/iso đạt trị số cân bằng là 1,38. Có thể giả thiết rằng hằng số cân bằng không phụ thuộc nhiệt độ. Sự phụ thuộc thời gian phản ứng vào nồng độ trong một phản ứng thuận nghịch được cho bởi phương trình:
Bài 6
Phản ứng racemic hóa là phản ứng chậm ở nhiệt độ êm dịu. Do đó, nó có thể được sử dụng để định tuổi các vật thể sinh học và thậm chí là nghiên cứu lịch sử nhiệt của chúng. Hãy lấy ví dụ là L-isoleucine (L-Ile) ((2S,3S)-2amino-3-methylpentanoic acid). Nó đồng phân hóa ở α-carbon và tạo thành (2R,3S)-2-amino-3-methylpentanoic acid, còn gọi là D-alloisoleucine. Do sự thay đổi cấu hình chỉ diễn ra trên một trong hai tâm lập thể, nên quá trình này được gọi là epimer hóa thay vì racemic hóa.
1) Chọn các phát biểu đúng:
Khi nghiên cứu hóa thạch của xương hàm dưới một con hà mã sống ở tiết xuân ấm áp ở một vùng thuộc Nam Phi thì tỉ lệ allo/iso của nó là allo/iso = 0,42. Kết quả xác định niên đại bằng đồng vị cacbon vốn không phụ thuộc vào nhiệt độ cho biết số tuổi của hóa thạch này là 38600 năm.
a) Giả sử ban đầu không hề có đồng phân allo, hãy xác định hằng số tốc độ của phản ứng thuận và phản ứng nghịch cũng như hằng số tổng (k1 + k-1)
b) Tính nhiệt độ bảo tồn hóa thạch hà mã trong đất.
☐
D-allo-isoleucine và L-isoleucine góc quay cực riêng giống nhau nhưng nhiệt độ nóng chảy khác nhau.
☐
D-allo-isoleucine có giá trị tuyệt đối của góc quay cực riêng giống nhau nhưng khác dấu. Nhiệt độ nóng chảy của hai đồng phân giống nhau.
☐
D-allo-isoleucine và L-isoleucine có góc quay cực riêng khác nhau nhưng nhiệt độ nóng chảy giống nhau.
☐ D-allo-isoleucine và L-isoleucine có góc quay cực riêng và nhiệt độ nóng chảy khác nhau.
☐ D-allo-isoleucine không quang hoạt.
2) Gắn các cấu hình tuyệt đối cho mỗi đồng phân của isoleucine.
3) Hằng số cân bằng Kep với quá trình epimer hóa L-isoleucine có giá trị 1.38 (ở 374 K). Xác định năng lượng tự do Gibbs của tất cả các cấu trúc A-D trong ý 2 ở 374 K, nếu chúng ta đặt giá trị năng lượng tự do Gibbs mol của L-isoleucine 0 mG = 0 kJ mol-1 .
|
214 | Bài 5
tỉ lệ
[ ] [ ] [][] () =−+ eq 11 oeq AA lnkkt AA
215
4) Nếu chúng ta xét đến hiện tượng đồng phân lập thể ở tất cả các tâm lập thể, thì số đồng phân lập thể cực đại có thể có của tripeptide IleIle-Ile là bao nhiêu? Ở thời điểm bắt đầu sự epimer hóa, chúng ta có thể bỏ qua phản ứng nghịch. Sự epimer hóa tuân theo quy luật động học bậc 1:
Giá trị của hằng số tốc độ ở 374 K là k1(374 K) = 9.02·10-5 h-1 và ở 421 K là k1(421 K) = 1.18·10-2 h-1. Trong các tính toán sau, viết gọn nồng độ của Lisoleucine là [L] và D-allo-isoleucine là [D].
Chúng ta có thể định nghĩa lượng de (lương dư đồng phân dia) là:
5) Đun sôi L-isoleucine trong 1943 giờ ở 374 K. Tính giá trị de (với 3 chữ số có nghĩa) của L-isoleucine a) trước khi đun sôi và b) sau khi đun sôi.
6) Cần bao lâu để chuyển 10 % L-isoleucine thành D-allo-isoleucine ở 298 K?
Thực tế thì phản ứng nghịch không thể được bỏ qua. Sơ đồ động học chính xác được biểu diễn ở dạng: Hãy xác định độ lệch nồng độ từ giá trị cân bằng [L]eq:
Có thể thấy rằng x thay đổi theo thời gian theo phương trình sau:
Trong đó x(0) là độ lệch từ cân bằng ở t = 0 giờ. 7) Đun sôi 1.00 mol dm-3 dung dịch L-isoleucine trong 1943 giờ ở 374 K. Hằng số tốc độ của phản ứng thuận là k1(374 K) = 9.02·10-5 giờ-1, Kep với phản ứng epimer hóa L-isoleucine có giá trị 1.38 (ở 374 K). Trong tính toán sau, viết gọn nồng độ của L-isoleucine là [L] và D-alloisoleucine là [D]. Hãy ước lượng (với 3 chữ số có nghĩa) a) [L]eq, b) lượng dư đồng phân dia (de) sau khi đun sôi.
Các amino acid với
tâm
(chiral)
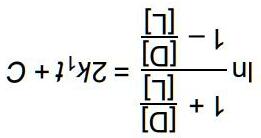
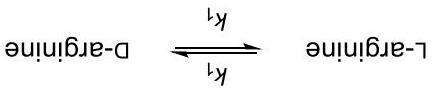
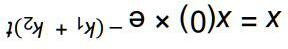
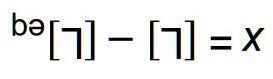

ví dụ Larginine :
Sự biến đổi của nồng độ theo thời gian được xác định bởi phương trình: Ở đây, [D] và [L] là nồng độ của D- và L-arginine ở thời gian t, k1 là hằng số tốc độ, và số hạng C được đặt theo các nồng độ ban đầu. Hoàng đế La Mã Thần thánh Lothar III đã qua đời trong cuộc hành trình đến Sicily vào năm 1137. Để thuận lợi cho việc hồi hương những tàn tích còn lại, cơ thể của ông ngay sau khi chết đã được đun sôi trong nước (373 K) trong một thời gian nhất định. Hãy thử ước tính thời gian đun sôi nhờ vào các dữ kiện động hóa học. Chúng ta biết rằng hằng số tốc độ k1 của phản ứng racemic hóa arginine trong protein ở 373 K và pH = 7 có giá trị là 5.10×10-3 giờ-1 . Để phân tích thành phần đồng phân của arginine trong xương Lothar, chúng ta cần bắt đầu với việc chuyển arginine vào dung dịch. Xương của Lother đã được thủy phân trong môi trường acid cao trong 4 giờ ở 383 K. Tỉ lệ các đồng phân quang học là [D]/[L] = 0.090. Vợ của Lothar, Richenza, đã không được đun sôi xác sau khi chết. Xương của bà cũng được thủy phân theo quy trình tương tự và trong trường hợp này, tỉ lệ [D]/[L] = 0.059. (Chú ý rằng phản ứng racemic hóa cũng diễn ra trong quá trình thủy phân, với hằng số tốc độ k1’, khác với k1).
8) Năm 1137, thi thể hoàng đế La Mã Thần thánh Lothar III đã được đun sôi trong nước bao lâu?
Chú ý: Phản ứng racemic hóa arginine là một quá trình cực kì chậm ở nhiệt độ thường gặp trong các ngôi mộ. Với cả hai cơ thể chi khoảng 880 năm tuổi, chúng ta có thể bỏ qua sự racemic hóa tự nhiên trong khoảng thời gian này.
216 |
217 |
một
thủ tính
bị racemic hóa,
1.1) Tính giá trị giới hạn của I khi [Ac]0 →
Trong một hệ, khi một phản ứng cho phép một phản ứng khác xảy ra thì các nhà khoa học gọi đó là hai phản ứng được ghép cặp. Ilya Prigogine, chủ nhân giải Nobel Hóa học 1977, đã sử dụng khái niệm “các phản ứng ghép cặp” trong những cuốn sách của mình. Sự ghép cặp của các phản ứng là một đặc điểm thiết yếu của các hệ sống, gồm cả cơ thể người. Một phản ứng khiến phản ứng khác xảy ra như thế nào? Trong bài tập này, chúng ta sẽ thảo luận về nhiều cơ chế có thể có của sự ghép cặp. (I) “Sự ghép cặp hóa học”
“Bàn về sự ghép cặp hóa học” là tiêu đề của luận án do nhà hóa học người Nga N.Shilov bảo vệ năm 1905. N. Shilov là nghiên cứu sinh của giáo sư nổi tiếng W. Ostwald. Tiến sĩ Shilov đã miêu tả các phản ứng sau đây.
Chất A không phản ứng với Ac. Tuy nhiên, khi có mặt tác nhân thứ ba (gọi là “chất gây cảm hứng” – inductor), In, thì phản ứng của A với Ac lại diễn ra:
kh«ngph¶nøng!(1)
P (2)
In không phải là xúc tác! Nồng độ của nó giảm trong suốt quá trình phản ứng. Theo sơ đồ do Shilov đề xuất, Ac không phản ứng được với A, nhưng có phản ứng với sản phẩm trung gian R của phản ứng giữa A với In. Có một phản ứng cạnh tranh khác của R tạo thành P2.
, [In]0 = hằng số?
1.2) Dẫn ra biểu thức của I, có thể sử dụng sự gần đúng trạng thái dừng nếu cần thiết. Vẽ đồ thị của I với [In]0 khi [Ac]0 là hằng số. Giả sử rằng In phản ứng hoàn toàn còn Ac vẫn dư.
Điều gì sẽ xảy ra nếu cơ
218 | Bài 7
khi kh«ng cã In khi cã In 1 AAc
AAc
+→ +→
()(3) ()(3) ()(3) ka a bkb kc c α+β→ → +→ 2 1 AInR RP R Ас P (3) α và β là các hệ số tỉ lượng. Các hệ số tỉ lượng khác và bậc phản ứng tương ứng với tất cả các tác nhân trong cả ba phản ứng đều bằng 1. Trong các thí nghiệm Shilov, tỉ lệ các lượng chất Ac và In phản ứng Ас In Δn I= Δn tăng tới giá trị không đổi cùng với sự tăng nồng độ đầu [Ac]0, còn [In]0 giữ nguyên. 219 |
∞
chế của Shilov không hợp lí và In là một chất xúc tác thông thường của phản ứng (2)? Đồng thời In phản ứng với A và bị giảm nồng độ. Sơ đồ phản ứng trong trường hợp này là () , catalysis() a b α+β→ +→ 2 1 AInP AIn Ас P (4) 1.3) Tính giá trị giới hạn của I trong sơ đồ (4) khi [Ac]0 → ∞, [In]0 = hằng số. (II) “Sự ghép cặp do động lực học” Năng lượng Gibbs chuẩn của phản ứng phase khí 5 2 5 BrH HBrH k k → ++ ← là dương, ∆G°(5) = 66 kJ⋅mol–1 ở Т = 600 K. 2.1) Tính tỉ lệ tốc độ của các phản ứng thuận và nghịch, 5 5 r r , ở nhiệt độ này, với áp suất chuẩn của H2, HBr và bằng áp suất của H, Br. Nếu bạn không trả lời được câu hỏi trên, hãy sử dụng giá trị tham khảo r5/r–5 = 3.14 10–7 cho các tính toán tiếp theo. Phản ứng (5) diễn ra theo chiều thuận do phản ứng (6) xảy ra đồng thời trong hệ: 5 2 5 6 2 BrH HBrH (5) HBr HBrBr(6) k k k → ++ ← +→+ k5, k–5, k6 là các hằng số tốc độ của phản ứng thuận và nghịch (5) và phản ứng thuận (6). Đây là sự ghép cặp do động lực học (kinetic coupling) của hai phản ứng.
Giả sử áp suất của các phân tử trung hòa đạt giá trị chuẩn p(H2) = p(Br2) = p(HBr) = 1 bar. Áp suất của các gốc p(H), p(Br) đạt giá trị trạng thái dừng. Hằng số tốc độ k6 lớn gấp 10 lần k-5.
Chuyên đề 27: Xúc tác - Enzyme
Bài 1
2.2) Tính giá trị ∆G(5) và 5
trong điều kiện này. (III) “Định luật hai của nhiệt động lực học hạn chế sự ghép cặp”
Theo định luật hai của nhiệt động lực học, hai phản ứng diễn ra đồng thời sẽ làm giảm năng lượng Gibbs của hệ, Syst 0 G
Một trong các phản ứng này có thể có năng lượng Gibbs dương và vẫn xảy ra theo chiều thuận do sự ghép cặp với phản ứng thứ hai. Phản ứng thứ hai cần phải có năng lượng Gibbs âm và các điều kiện của định luật hai cần phải được thỏa mãn. Xét ví dụ sau:
Quy trình tổng hợp urea trong các điều kiện xác định:
2NH3 + CO2 → (NH2)2CO + H2O (7)
∆G(7) = 46.0 kJ⋅mol–1 được đề xuất ghép cặp với phản ứng oxid hóa hoàn toàn glucose (trong cùng điều kiện):
1/6C6H12O6 + O2 → CO2 + H2O (8)
∆G(8) = –481.2 kJ⋅mol–1 , r(8) = 6.0 10–8 M min–1
Không có phản ứng nào khác.
3.1) Tính tốc độ cực đại phản ứng (7) được phép có theo định luật hai, khi ghép cặp với phản ứng (8).
Từ những ngày đầu ên trong lịch sử tổng hợp ammonia, Alwin Mi asch đã sử dụng sắt rất nhiều cho các nghiên cứu của mình. Phải tới thập niên 1980, Gerhard Ertl (Nobel Hóa học 2007) mới làm sáng tỏ chức năng chính xác của nó. Những giai đoạn riêng biệt của xúc tác dị thể rất phức tạp mà vai trò then chốt đầu ên là hấp phụ nitrogen trên bề mặt sắt.
Biểu đồ trên (Ertl, Angew Chem 102 (1990) 1258-1266) biểu diễn nitrogen được hấp phụ như thế nào trên bề mặt xúc tác qua nhiều bước và cuối cùng xảy ra phân cắt (α → β). Liên kết giữa nitrogen và bề mặt xúc tác càng mạnh thì liên kết N-N càng yếu.
Do đó, trong quá trình hấp thụ, các dao động kéo căng của phân tử N-N đã đo được tại hai số sóng khác nhau. Hãy gán chúng với các trạng thái chính xác:
1) Dao
lượng của quá trình tổng hợp ammonia trên xúc tác có thể được tóm lược (đơn giản hóa) như sau:
|
220 |
5 r r
t ∆ < ∆ .
221
động ở … cm-1 thuộc về trạng thái: 1500 cm 1 ☐ khí ☐ α ☐ β ☐ γ 2100 cm 1 ☐ khí ☐ α ☐ β ☐ γ Giản đồ năng
2) Tính năng lượng hoạt hóa của phản ứng.
3) Tính enthalpy tạo thành của NH3(ad).
Bài 2
Phản ứng của các alkene với hydrogen trong phase khí gần như không diễn ra thậm chí là khi đun nóng mạnh, nhưng khi có mặt các xúc tác kim loại chuyển tiếp nhất định thì diễn ra rất dễ, ngay cả ở nhiệt độ phòng, với hiệu suất có thể đạt tới 100 %. Để nghiên cứu về cơ chế của quá trình này, một số thí nghiệm đã được tiến hành ở 25 oC và áp suất thông thường, 1 atm (thể tích mol của các khí trong điều kiện này là 24.461 L/mol).
Thí nghiệm đầu tiên nghiên cứu về sự hấp phụ hydrogen bởi một lá palladium có khối lượng 0.2048 gam (khối lượng riêng 12.02 gam/cm3). Dưới đây là một số kết quả đo về mối liên hệ giữa thể tích hydrogen trong bình phản ứng theo thời gian: t, min 0 10 25 35 50
V(H2), mL 20, 0 15, 0 7,5 3,5 3,5
1) Trong điều kiện này, tỉ lệ thể tích hydrogen hấp thụ/thể tích palladium bằng bao nhiêu?
2) Trong phản ứng này, một hợp chất chứa hydrogen với palladium không theo tỉ lệ hợp thức, PdHx, được tạo thành. Tìm x.
3) Khi x ≥ 0.5, hydride PdHx mất tính dẫn kim loại và trở thành một bán dẫn. Sau bao nhiêu phút của thí nghiệm thì điều này xảy ra?
4) Trong phản ứng này, 60 J nhiệt được giải phóng. Tính năng lượng liên kết của nguyên tử hydrogen với palladium, biết năng lượng liên kết trong phân tử H2 là 436 kJ/mol.
Một thí nghiệm khác nghiên cứu về phản ứng của ethylene và lượng dư hydrogen nặng D2 trên các xúc tác palladium khác nhau. Các nhà nghiên cứu thấy rằng khi có đơn tinh thể kim loại, phản ứng gần như không xảy ra; trong khi đó với một lá kim loại hoặc các hạt nano được mang trên chất mang trơ, phản ứng diễn ra rất nhanh và hoàn toàn, tạo thành hỗn hợp 3 sản phẩm với khối lượng mol giống nhau, khối lượng riêng 1.35 gam/L.
222 |
223 |
5) Tại sao không có phản ứng xảy ra với đơn tinh thể? 6) Tính tỉ lệ thể tích C2H4/D2 đã được lấy cho thí nghiệm trên, biết rằng tất cả deuterium đã chuyển thành sản phẩm phản ứng. 7) Cơ chế phản ứng diễn ra qua 4 giai đoạn:
a) D2(г) + Pd → 2D (hấp phụ trên Pd)
b) C2H4(г) + Pd → C2H4 (hấp phụ trên Pd)
c) ?
d) ? Viết các phương trình của 2 giai đoạn cuối. Giai đoạn nào có thể đảo ngược (thuận nghịch), và giai đoạn nào tốc định? Giải thích ngắn gọn.
Bài 3
Sự phân hủy NH3 thành N2 và H2 được tiến hành trên bề mặt volfram (W) có năng lượng hoạt hóa Ea = 163 kJ.mol-1. Khi không có mặt xúc tác Ea = 335 kJ.mol-1
a) Phản ứng trên bề mặt W ở 298K nhanh hơn xấp xỉ bao nhiêu lần so với phản ứng không có xúc tác?
b) Tốc độ phản ứng phân hủy NH3 trên bề mặt W tuân theo quy luật động học có dạng [ ] [] 3 2
NH vk H = ; trong đó k là hằng số tốc độ phản ứng; [NH3], [H2] là nồng độ của NH3 và H2. Vì sao tốc độ phản ứng lại tỉ lệ nghịch với nồng độ của H2.
|
224 |
225
Khử carbon dioxide bởi hydrogen là một trong những phản ứng được nghiên cứu nhiều nhất trong phase khí. Các nhà nghiên cứu tích cực khám phá với hi vọng sẽ làm giảm hiệu ứng nhà kính của carbon dioxide và tìm được cách tạo ra nhiên liệu giá rẻ từ không khí. Nhiều xúc tác dị thể đã được sử dụng để tạo ra các sản phẩm hữu ích trong điều kiện tương đối êm dịu, ví dụ như các hạt nano kim loại platinum được mang trên chất nền trơ.
Tiến hành một số thí nghiệm với các hỗn hợp CO2 và H2 - lấy theo các tỉ lệ khác nhau - được đun nóng trong buồng phản ứng có dung tích không đổi tới 350 oC, có mặt xúc tác Rh. Xúc tác chứa các khối lập phương kim loại (37 nm) được mang trên bề mặt Al2O3. Trong những điều kiện này, chỉ có 2 phản ứng cạnh tranh diễn ra - 1 phản ứng với sự thay đổi số phân tử (sản phẩm I), và phản ứng còn lại thì không (sản phẩm II).
1) Viết phương trình của 2 phản ứng, biết tất cả các sản phẩm đều nhẹ hơn không khí.
Một số kết quả của các thí nghiệm được trình bày trong bảng:
STT Nhiệt độ, K Áp suất ban đầu, atm Áp suất sau 5 phút, atm p0(CO2) p0(H2) Chung p(H2O)
1 623 0.20 1.00 1.08 0.16 2 623 0.20 1.50 1.52
623 0.10 0.50 0.56 4 663 0.20 1.00 0.90
2) Độ chọn lọc sản phẩm của xúc tác có thể được xác định bởi tỉ lệ lượng chất phản ứng chuyển thành sản phẩm này với tổng lượng chất tiêu thụ. Tính áp suất riêng phần của sản phẩm I và II trong thí nghiệm đầu tiên và tính độ chọn lọc của xúc tác với I.
3) Xác định bậc phản ứng của các tác nhân trong phản ứng 1, nghĩa là các hệ số x và y trong biểu thức tốc độ trung bình:
rkpp
Tính năng lượng hoạt hóa của phản ứng tạo thành I
4) Khi chiếu sáng, độ chọn lọc của chất xúc tác tăng mạnh: Tốc độ tạo thành sản phẩm I tăng 10 lần ở nhiệt độ 623 K, trong khi đó tốc độ tạo
tất cả các phản ứng đều là dạng sơ cấp. Hãy điền vào các dấu “…” (trung tâm hoạt động tự do trên bề mặt xúc tác được kí hiệu (*), tất cả các tiểu phân X trên bề mặt kí hiệu là X*).
6) Các hạt nano xúc tác được điều chế từ 12 mg rhodium chloride RhCl3·H2O và được đưa lên alumina với tổng diện tích bề mặt 10 m2 . Tính mật độ bề mặt của các hạt nano rhodium (theo m2/gam, không tính bề mặt tiếp xúc với chất nền). Giả sử rằng xúc tác được phân bố đồng đều trên bề mặt, hãy ước tính khoảng cách trung bình giữa các hạt xúc tác trên chất nền lớn gấp bao nhiêu lần kích thước của chúng?
Cho biết khối lượng riêng của rhodium là 12.4 gam/cm3 . Phương trình Arrhenius: =− a E lnk(T)const RT
226 | Bài 4
3
∆ == ∆ 22 Ixy COH p
t .
.
227 | thành sản phẩm II hầu như không thay đổi. Ước lượng năng lượng hoạt hóa của phản ứng quang xúc tác tạo thành I. 5) Cơ chế tạo thành I có thể được mô tả bởi sơ đồ đơn giản sau: CO2(g) + 2… → … + … H2(g) + 2… → 2… … + … → CHO* + … CHO* + … → … + … + 3… → CH4(g) + 4… … + 2… → H2O(g) + 3… Tất cả các hệ số tỉ lượng đều được xác định. Không phải
Enzym là các protein có khả năng xúc tác đặc hiệu. Bảng sau cho thấy tốc độ đầu của phản ứng hình thành oxy xúc tác enzym khi dùng những nồng độ đầu khác nhau của cơ chất.
[S] (mol/L) 5.0·10
v (dm3/ph) 1.66·10
1.7·10
1.24·10
1) Sử dụng phương pháp Lineweaver và Burke để chứng minh quá trình trên phụ thuộc tuyến tính vào phương trình Michaelis-Menten.
2) Vẽ đồ thị 1/v phụ thuộc 1/[S].
3) Sử dụng đồ thị hãy tính hằng số Michaelis-Menten của phản ứng.
Bài 6
Năm 2013 - 240 năm kể từ khi nhà hóa học Pháp Hilaire Rouelle phát hiện ra urea. 55 năm sau, Friedrich Wöhler - học trò của Berzelius - đã lần đầu tiên tổng hợp được urea từ các chất vô cơ. Sự kiện này đã làm chấn động những học giả vốn tin tưởng vào thuyết lực sống suốt nửa đầu thế kỉ 19. Urea là một hợp chất bền, tồn tại trong tự nhiên. Tuy nhiên nó bị phân hủy chậm trong dung dịch nước ở nhiệt độ thường và pH trung tính.
1) Viết phương trình thủy phân urea trong điều kiện thường.
Trong các cơ thể sống, sự thủy phân urea được xúc tác bởi urease enzyme. Bảng dưới đây cho các dữ liệu về nồng độ sản phẩm thủy phân ở các mốc thời gian xác định (kể từ khi bắt đầu phản ứng): Thời gian, phút
Nồng độ sản phẩm, М (khi không có enzyme) 0
phẩm,
(khi có urease enzyme)
228 | Bài 5
2
2 1.0·10 2 5.0·10 3 3.0·10 3
5
5 9.52·10 6 6.25·10 6 4.26·10 6
229 |
0 1⋅10-9 1⋅10-8 20 50 150
3.38⋅1 0-14 3.37⋅1 0-13 6.75⋅1 0-4 1.7⋅10 3 5⋅10-3 Nồng độ sản
М
0 0.197 0.722 0.76 0.76 0.76 2) Dựa vào dữ liệu trong bảng về nồng độ sản phẩm, hãy xác định a) hằng số tốc độ của phản ứng thủy phân urea (nồng độ ban đầu 0.38 M) khi không có và có xúc tác urease ở nhiệt độ phòng (300 K) và pH = 7. b) thời gian bán hủy (nghĩa là thời gian để phản ứng đạt độ chuyển hóa 50 %) với các phản ứng tự thủy phân và có enzyme. c) sản phẩm phản ứng. Urea là hóa chất có sản lượng lớn, được sử dụng chủ yếu làm phân đạm. Trong công nghiệp, urea được tổng hợp từ ammonia và carbon dioxide. Vấn đề nảy sinh là việc xử lí nước thải từ dư lượng urea. Tốc độ phản ứng tự thủy phân là không đủ với quá trình này, và một trong những cách để
tăng tốc độ t hủy phân là sử dụng xúc tác, ví dụ như ZrO2 và TiO2. Phản ứng diễn ra bằng cách đun nóng, với sự đồng phân hóa urea tạo thành hợp chất trung gian, rồi cuối cùng là các sản phẩm cuối giống như trong phản ứng tự thủy phân.
3)
a) Viết phương trình phản ứng tổng hợp urea trong công nghiệp.
b) Viết các phương trình phản ứng của sự thủy phân urea khi đun nóng trong xúc tác.
c) Tính xem năng lượng hoạt hóa của phản ứng có xúc tác đã thay đổi như thế nào so với phản ứng không xúc tác, biết rằng hằng số tốc độ tăng 6 bậc (106) còn các hệ số trước hàm mũ vẫn giữ nguyên. Phương trình Arrhenius: =− a E kAexp RT , T = 300.
Urea có trong cơ thể của hầu hết các động vật có vú, bao gồm cả con người. Nó được tạo thành bởi các enzyme của chu trình ornithine (chu trình Krebs-Henseleit). Chu trình này là một chuỗi phản ứng xúc tác enzyme, dẫn đến sự đồng hóa NH3 (ở dạng NH4 +) và tổng hợp urea, được bài tiết ra khỏi cơ thể. Chu trình ornithine gồm 5 phản ứng, được xúc tác bởi các enzyme riêng biệt (E1 - E5). Dưới đây là sơ đồ chuyển hóa diễn ra trong chu trình ornithine. P là gốc phosphoric acid.
1)
a) Vẽ cấu tạo các chất X, Y, Z
b) Những phân tử nào được tạo thành bởi carbon từ urea?
2) Diacetyl monooxime đã được sử dụng trong một thời gian dài để xác định các chất lỏng sinh lí. Trong dung dịch acid của urea, chất này tạo thành hợp chất không màu. Quá trình này diễn ra theo 2 giai đoạn. Viết phương trình các phản ứng đã xảy ra.
|
230 |
231
Nghiên cứu phản ứng enzym ATPaza tác dụng lên ATP ở 20°C với nồng độ enzym [E]0 = 20 nmol/L.
Thí nghiệm động học bắt đầu từ 0.800 μmol/L ATP, sau 10s thì lượng hiện diện chỉ 0.703 μmol/L. Ở thí nghiệm thứ hai thì nồng độ ATP giảm từ 3.00 μmol/L xuống 2.83 μmol/L trong cùng khoảng thời gian.
1) Tính tốc độ đầu của phản ứng xúc tác enzym.
2) Tính hằng số Michaelis-Menten và tốc độ cực đại của phản ứn
3) Xác định số luân chuyển của enzyme?
Bài 8
Phản ứng xúc tác enzym có thể được biểu diễn ở dạng S → P trong đó S là chất nền và P là sản phẩm. Bảng dưới đây là kết quả xác định tốc độ phản ứng khi thay đổi nồng độ chất nền: Thí nghiệm [S], M v0, µM/mi n 1 1.0 x 10 2 75.0
1.0 x 10 3 74.9
1.0 x 10 4 60.0
7.5 x 10 5 25.25
6.25 x 10 6 15.0
1) Xác định vmax và KM chỉ bằng suy luận và phương trình Michaelis –Menten. Không được phép dùng đồ thị
2) Xác định giá trị vo khi nồng độ chất nền là 2,5.10-5 và 5.10-5 M
3) Xác định giá trị vo khi nồng độ chất nền là 0,02 M
4) Xác định giá trị vo khi nồng độ enzym tăng gấp 2 lần. Lúc này nồng độ chất nền là 1.10-4 M
5) Nồng độ chất nền là 0,04 M. Xác định nồng độ sản phẩm sau 3 phút
|
232 | Bài 7
233
2
3
4
5
Bằng cách oxy hóa glucozơ trong thực phẩm thì oxy sẽ bị khử thành nước nhưng một lượng nhỏ lại bị khử tạo thành gốc tự do O2 . Để huỷ diệt gốc tự do nguy hiểm này thì enzym superoxiddismutaza SOD đóng vai trò quan trọng. Enzym này được ký hiệu là E và xúc tác cho phản ứng sau:
Người ta khảo sát phản ứng này trong một dung dịch đệm có pH = 9.1. Nồng độ đầu của SOD có giá trị [E]0 = 0.400·10-6 M. Tốc độ đầu v0 của phản ứng trên được đo ở nhiệt độ phòng bằng cách sử dụng những nồng độ đầu khác nhau của anion gốc tự do O2
0(O2 ) mol/L 7.69·10 6 3.33·10 5 2.00·10
0 mol/L·s 3.85·10
1.67·10 2 0.100
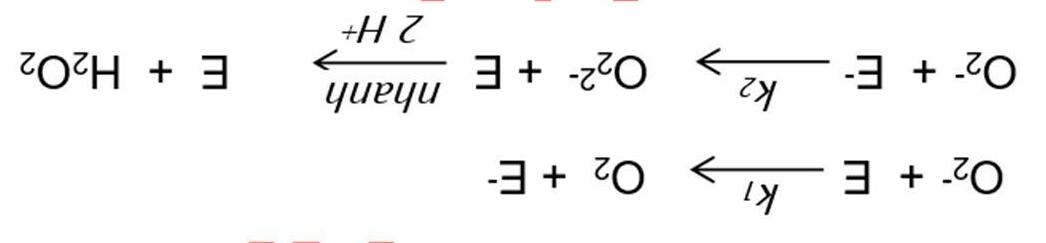
1) Xác định bậc phản ứng ứng với biểu thức tốc độ v = k·[O2 ]
2) Xác định hằng số tốc độ k.
Phản ứng trên có cơ chế được đề nghị như sau:
3) Xây dựng biểu thức tốc độ cho cơ chế này, cho rằng k2>k1. Xác định xem biểu thức tốc độ mới có khớp với biểu thức tốc độ ở câu 4.1 hay không.
Biết E rất không bền cho nên [E ] là hằng định trong một khoảng thời gian ngắn.
4) Sử dụng nguyên lý nồng độ dừng cho E , hãy tính giá trị hai hằng số tốc độ k1 và k2 nếu biết rằng k2 lớn gấp đôi k1.
Bài 10
Tính chất đặc thù của động học enzym đóng một vai trò quan trọng trong việc khám phá dược phẩm. Một hiểu biết tốt về cách xử sự của enzym trong quá trình phản ứng với các cơ chất quen thuộc là cần thiết trước khi xét đến ảnh hưởng của thuốc. Động học enzym thường được đặc trưng bởi hai thông số là Vmax và Km; chúng được xác định bằng cách phân tích sự khác nhau giữa tốc độ đầu với nồng độ cơ chất. Rất nhiều các phản ứng xúc tác enzym được xác định theo cơ chế sau: E + S → ES Hằng số vận tốc k1 ES → E + S Hằng số vận tốc k–1 ES → E + P Hằng số vận tốc k2 Với E là enzym tự do, S là cơ chất, ES là phức hoạt hóa sinh ra giữa enzym và cơ chất còn P là sản phẩm.
a) Cho rằng hệ thống đang ở trạng thái ổn định và [S] >> [E]. Hãy đề nghị biểu thức
i) Đối với sự tạo thành phức ES phụ thuộc vào [E], [S], [ES] và các hằng số tốc độ phản ứng.
ii) Đối với sự tạo thành sản phẩm P phụ thuộc vào [ES] và các hằng số tốc độ phản ứng.
Khi tiến hành thí nghiệm thì [E] không được biết rõ, tuy nhiên tổng lượng enzym hiện diện là một hằng số trong suốt phản ứng, như vậy: [E]0 = [E] + [ES]
Với [E]0
enzym ban đầu.
Michaelis,
|
234 | Bài 9
. c
4 v
3
n .
235
là nồng độ
Trong động học enzyme thì hằng số
Km, được định nghĩa như sau: Km = (k–1 + k2) / k1 b) Xác định biểu thức đối với [ES] phụ thuộc vào [S], [E]0 và Km. c) Như vậy hãy rút ra biểu thức đối với tốc độ tạo thành sản phẩm P phụ thuộc vào [E]0, [S] và các hằng số tốc độ phản ứng. Tốc độ cực đại của phản ứng, Vmax, đạt được khi tất cả lượng enzym đều được nối với cơ chất, tức là [ES] = [E]0, vậy:
d) Xác định biểu thức tốc độ tạo thành sản phẩm P phụ thuộc vào Vmax
S] và các hằng số tốc độ phản ứng.
Enzym GTP cyclohydrolase II xúc tác cho bước đầu tiên trong quá trình sinh tổng hợp riboflavin trong vi khuẩn:
GTP
GTPcyclohydrolaseII
200 mM 150 mM 100 mM 80 mM 60 mM 40 mM 20 mM 6 0.0051 4 0.0046 9 0.0044 5 0.0039 3 0.0037 7 0.0025 9 0.0019 7 7 0.0058 3 0.0054 7 0.0047 7 0.0045 4 0.0038 8 0.0025 3 0.0024 7 8 0.0070 8 0.0063 9 0.0056 8 0.0050 6 0.0045 2 0.0030 9 0.0025 3 9 0.0069 8 0.0070 3 0.0063 9 0.0059 1 0.0052 1 0.0032 5 0.0029 5 10 0.0081 8 0.0080 0 0.0070 9 0.0064 5 0.0057 4 0.0038 7 0.0030 2 11 0.0090 1 0.0088 4 0.0075 2 0.0070 2 0.0063 8 0.0044 5 0.0035 2 12 0.0103 0.0092 2 0.0084 9 0.0077 1 0.0070 7 0.0049 5 0.0038 6
e) Xác định tốc độ đầu của phản ứng ở mỗi nồng độ đầu khác nhau của GTP.
f) Mô tả phương trình nhận được ở câu (d) ở dạng y = mx + c.
Sự vắng mặt của enzym này trong các loài hữu sinh bậc cao làm cho GTP cyclohydrolase II a trở thành một dược phẩm triển vọng của các thuốc kháng khuẩn.
Mẫu protein được hòa trộn rất nhanh với các nồng độ GTP khác nhau. Sự thay đổi về độ hấp thụ quang với thời gian được xác định ở bước sóng 299nm trong một cuvet 1 ml với độ dày 1 cm. 100 mM dung dịch sản phẩm tinh chế có độ hấp thụ quang là 0.9 trong một cuvet dày 1 cm ở 299 nm.
Thời gian / s Nồng độ GTP
|
g) Như vậy hãy xác định Vmax và Km cho enzym này (bạn có thể giả định rằng các lý thuyết động học trên đều áp dụng được cho enzym này)
236 | Vmax = k2 × [E]0
, [
O HO OH O N N N NH O NH2P O P O P O OOO O O O O HO OH O HN H2N N NH O NH2 P O O O O P O P O OO O O O H O
++
237