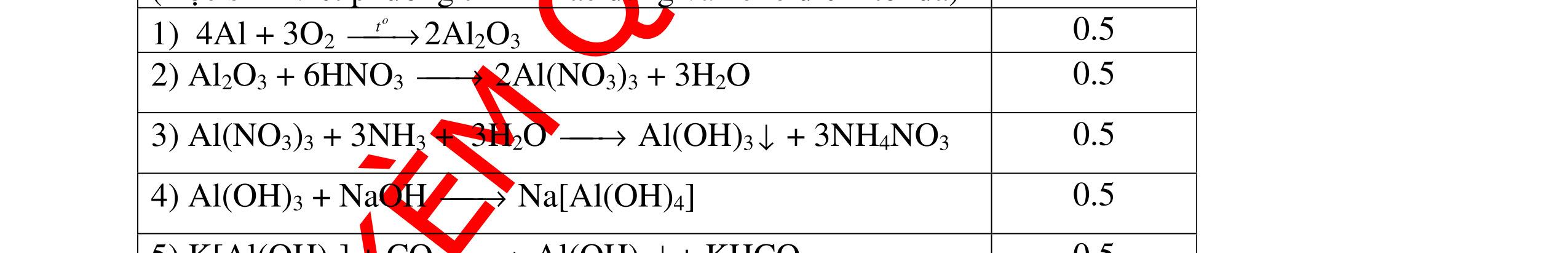
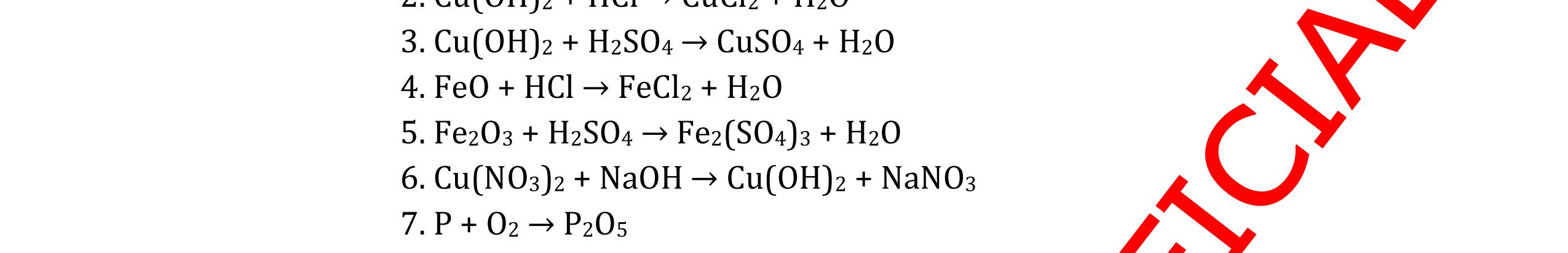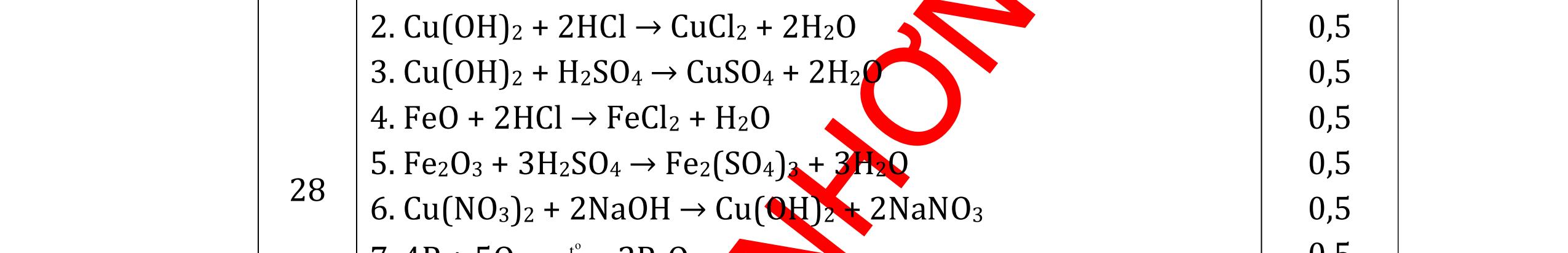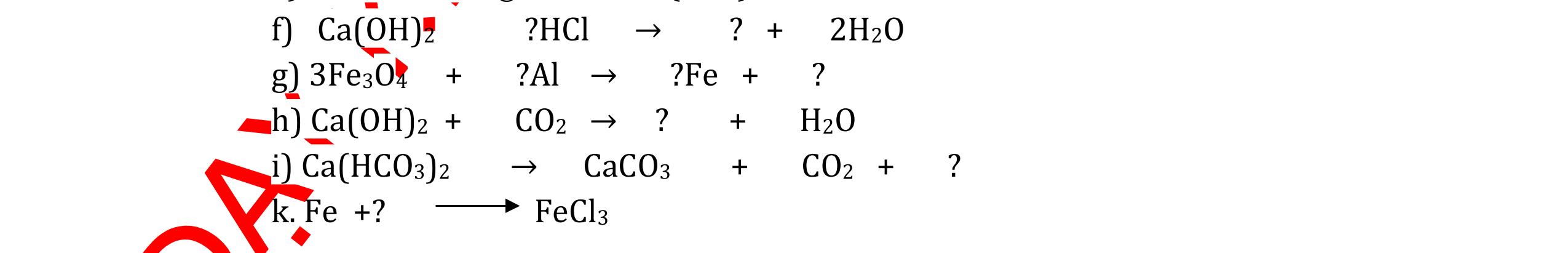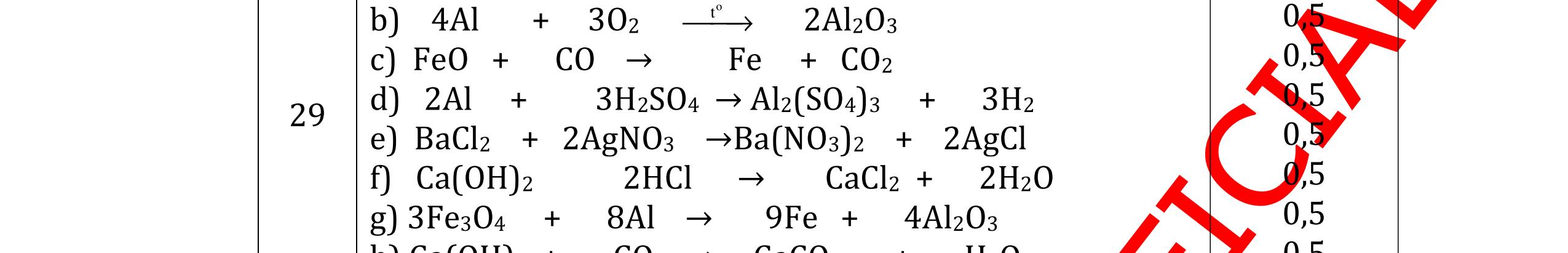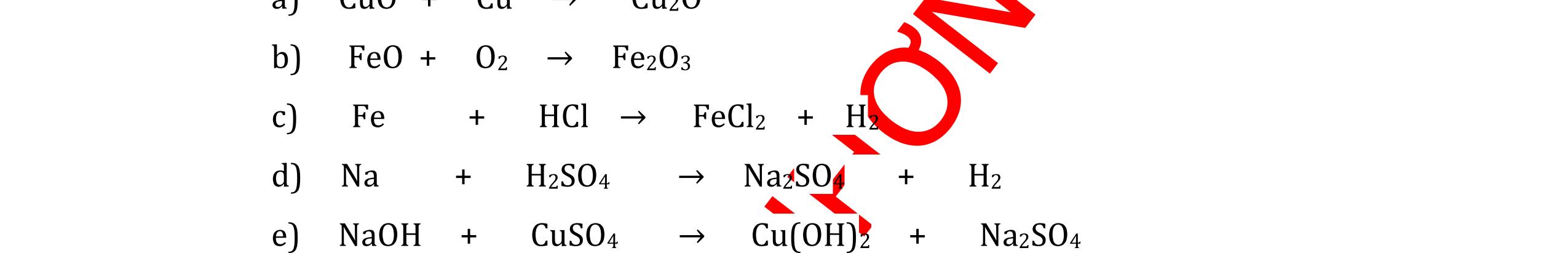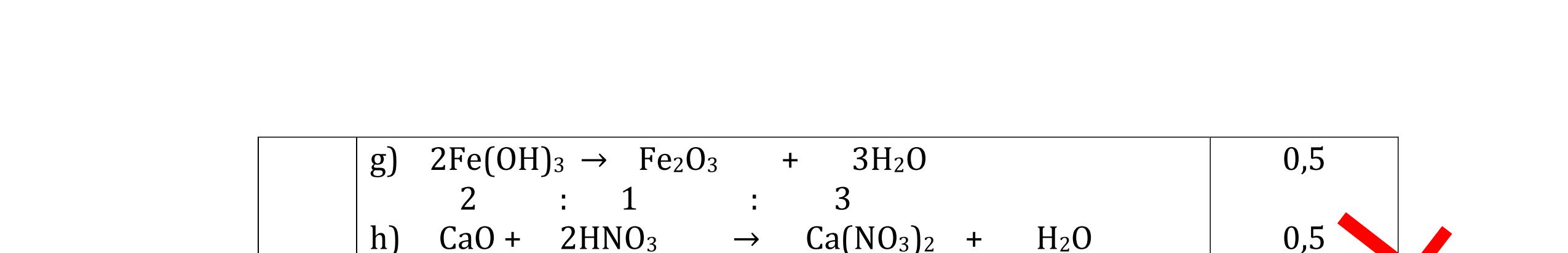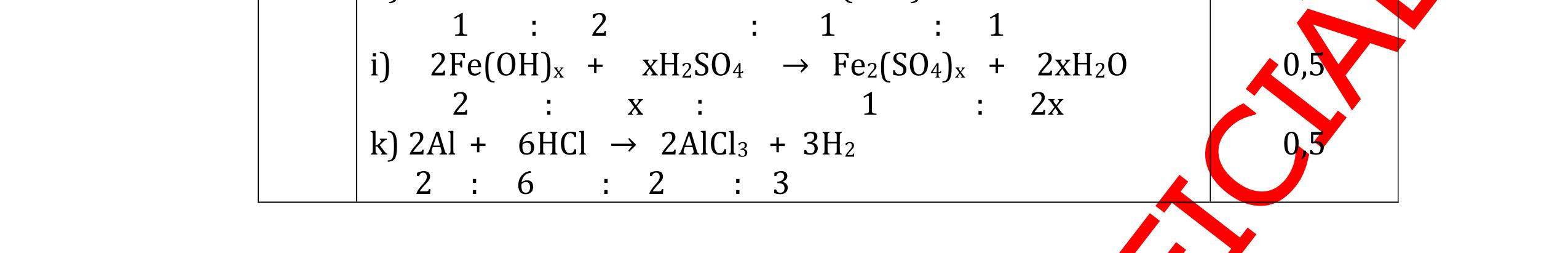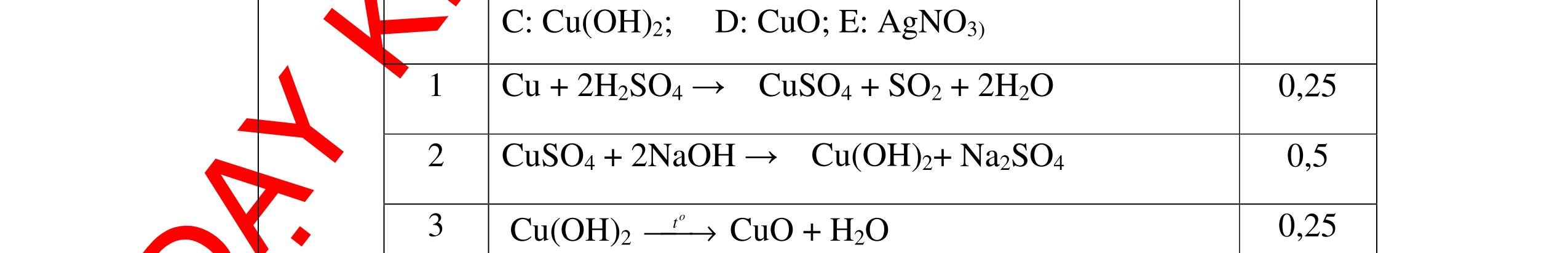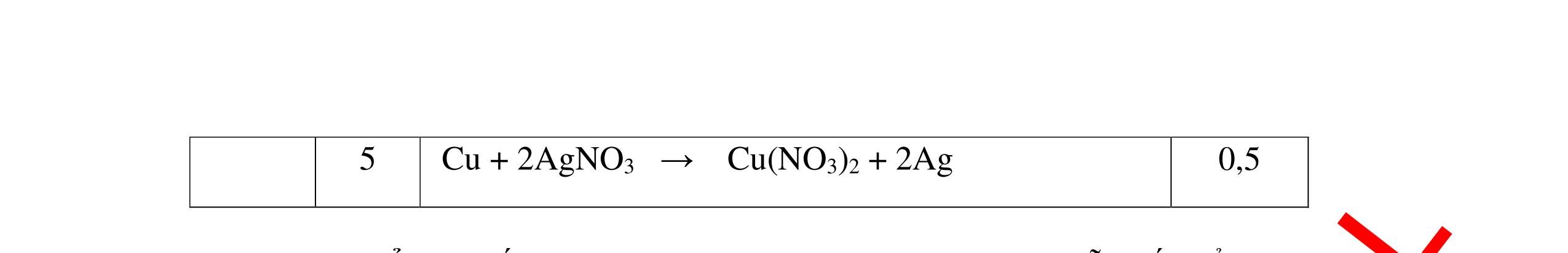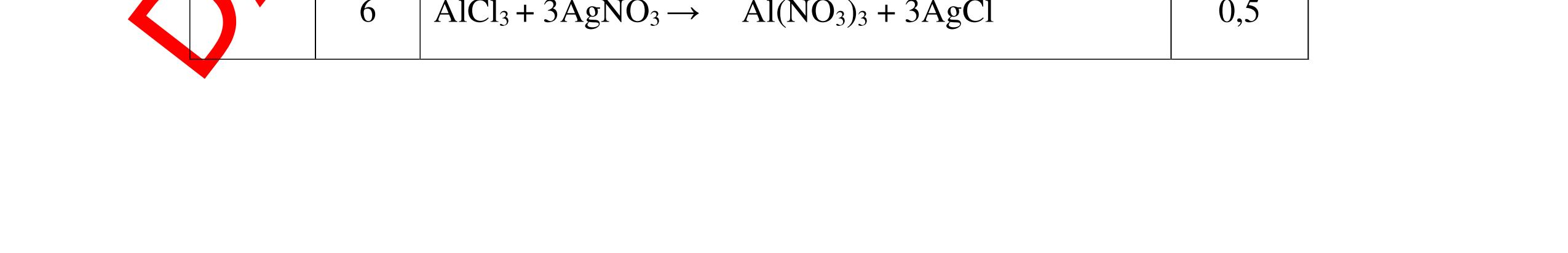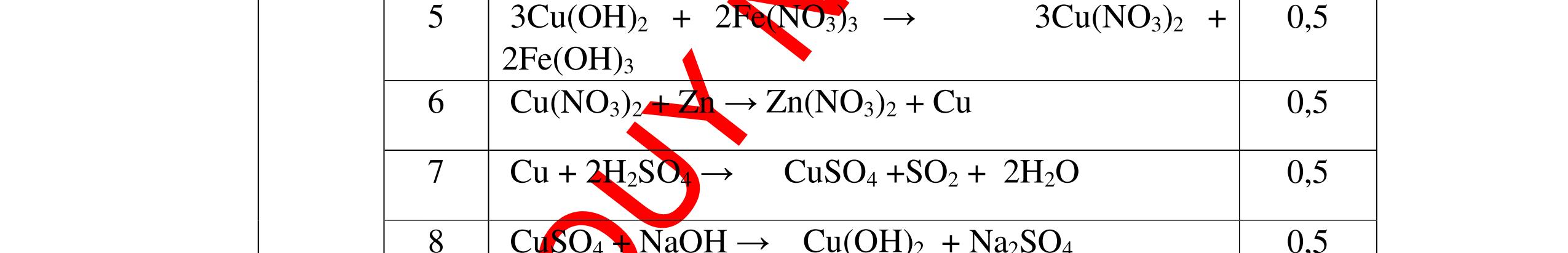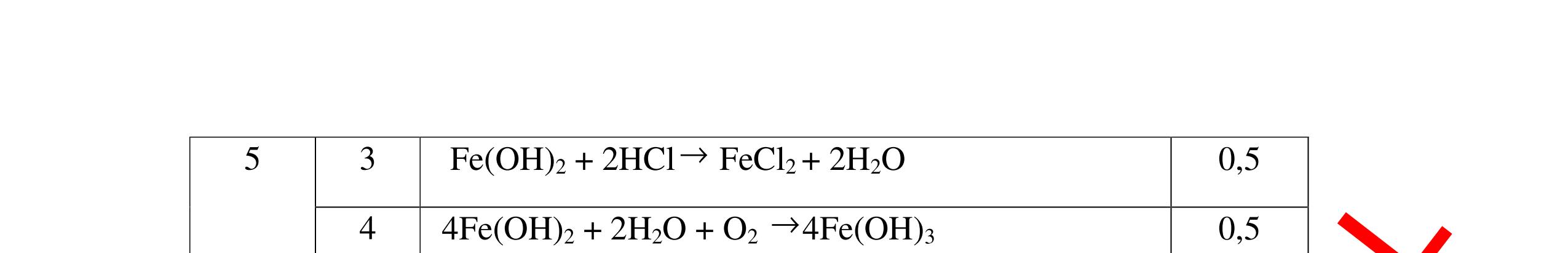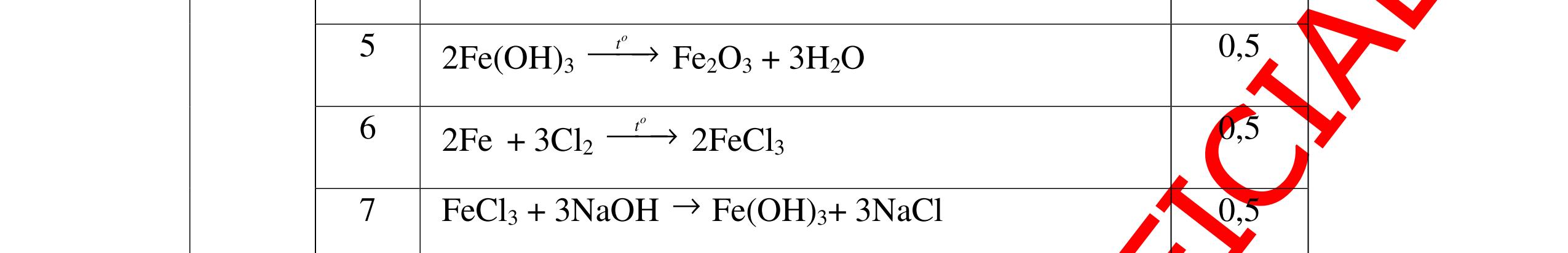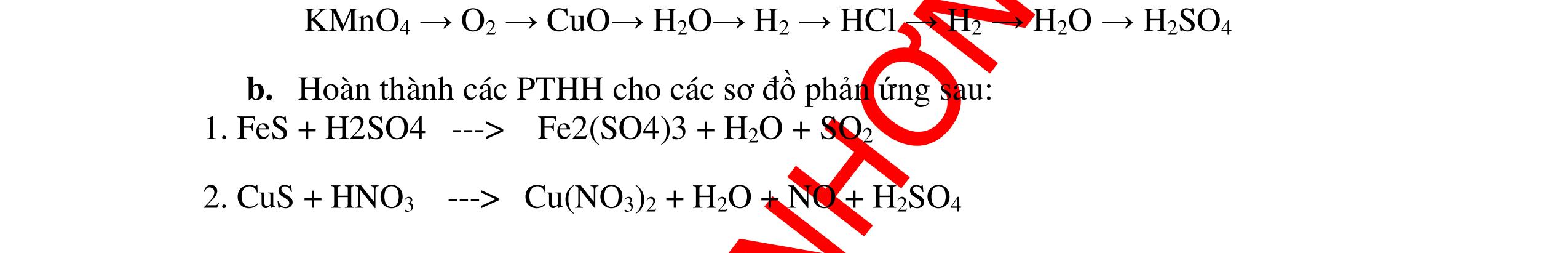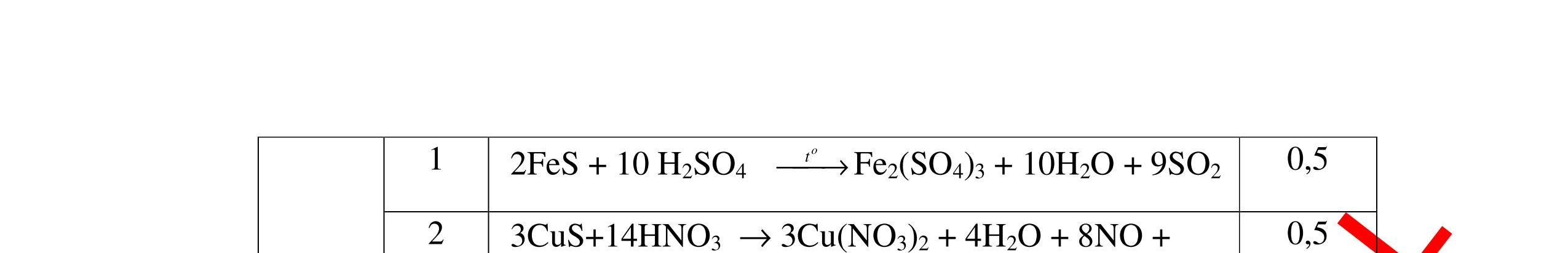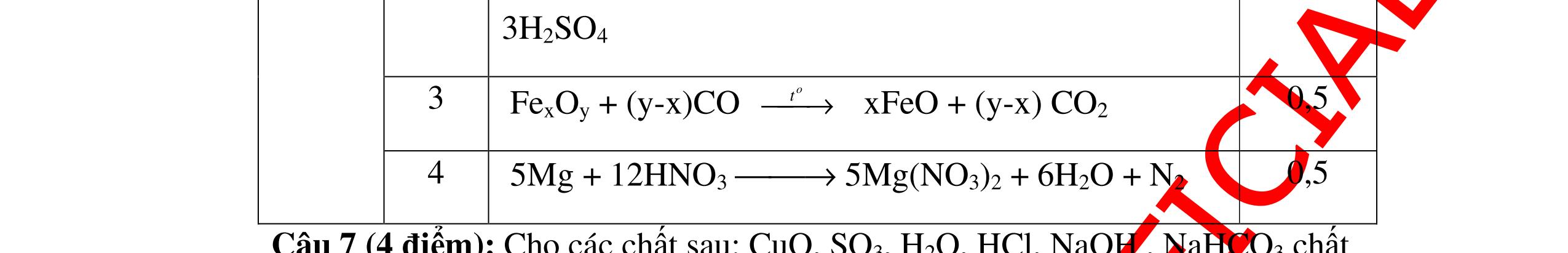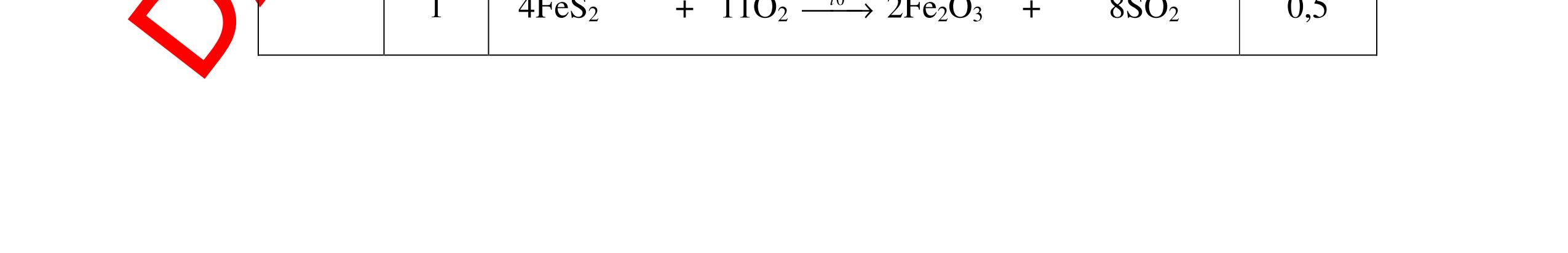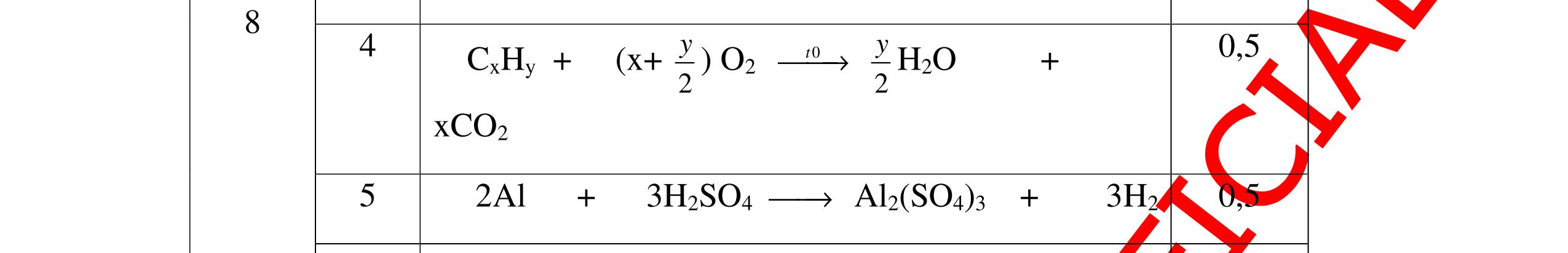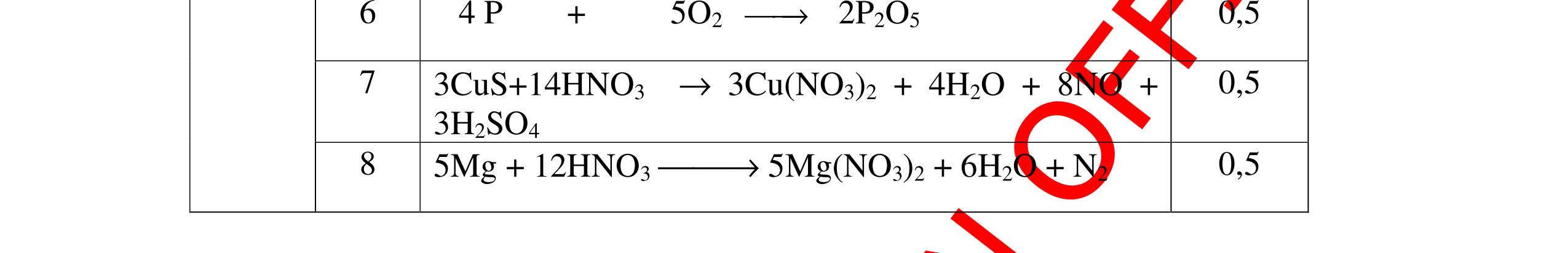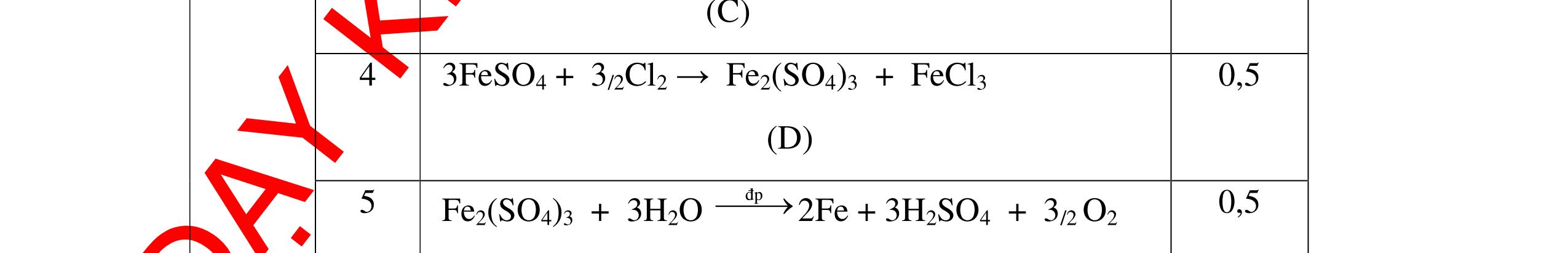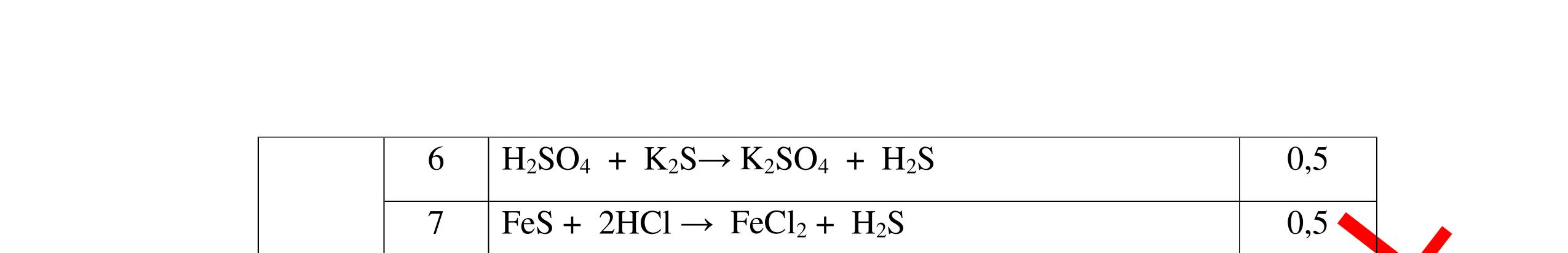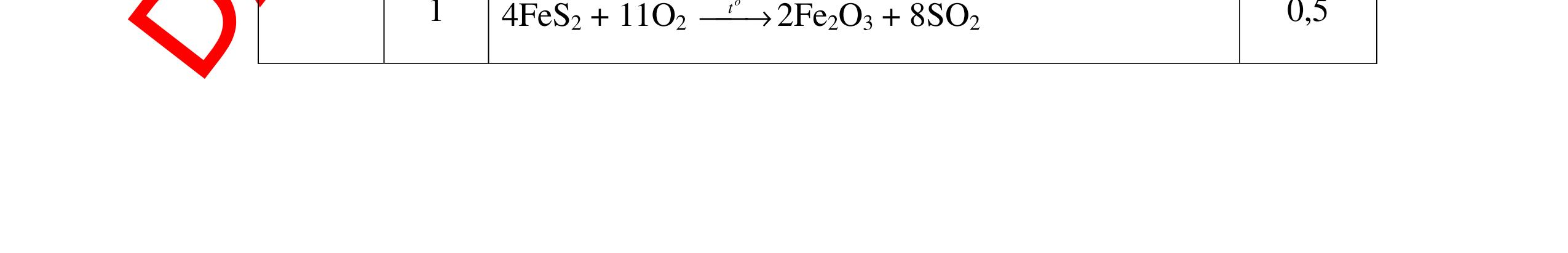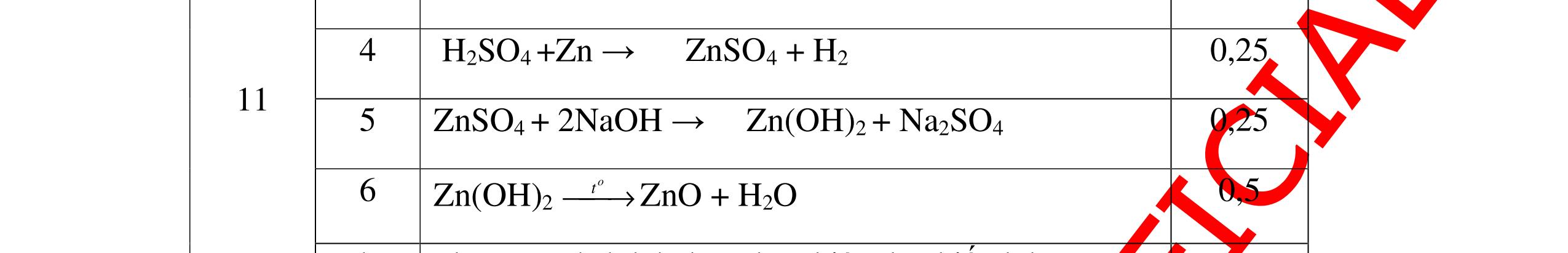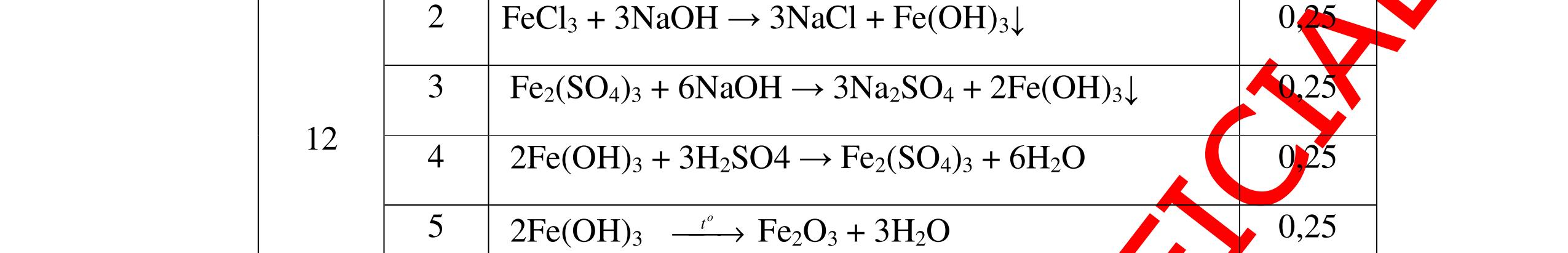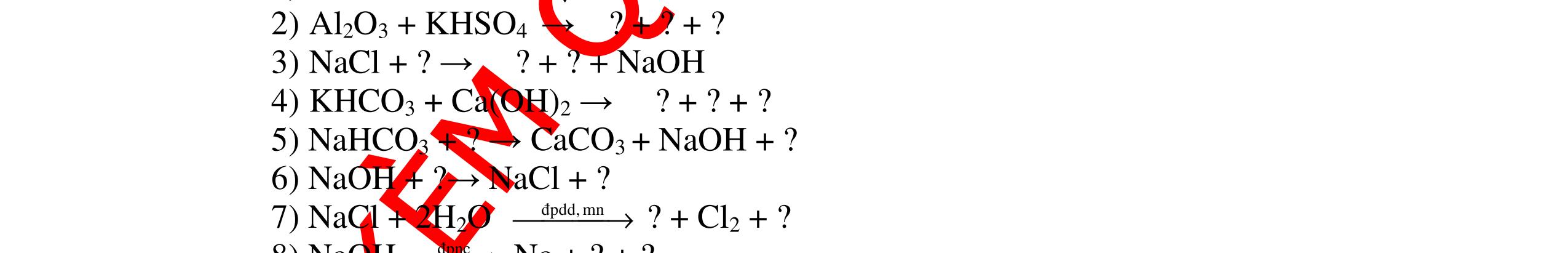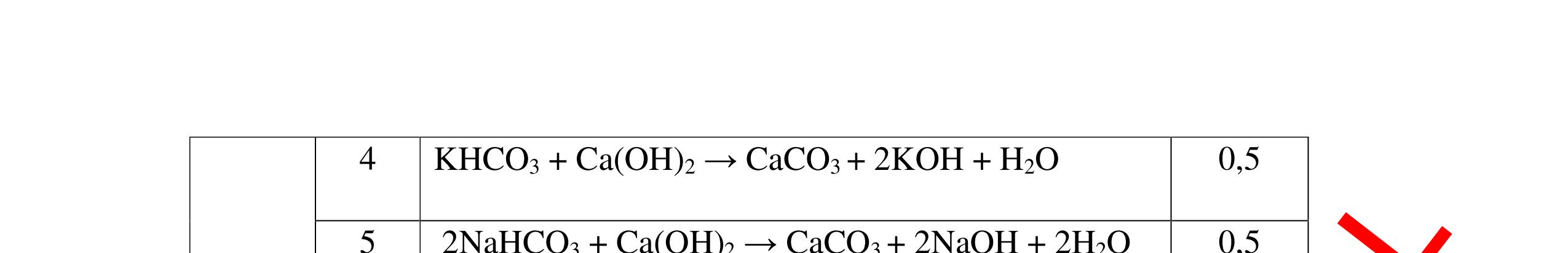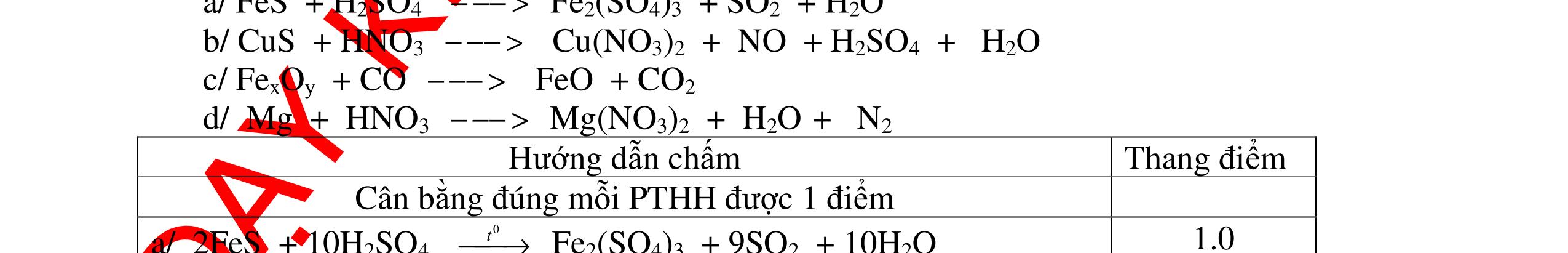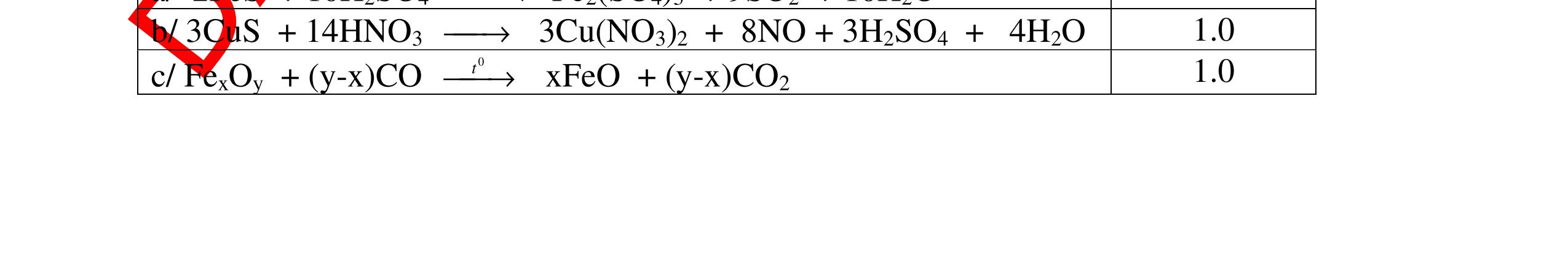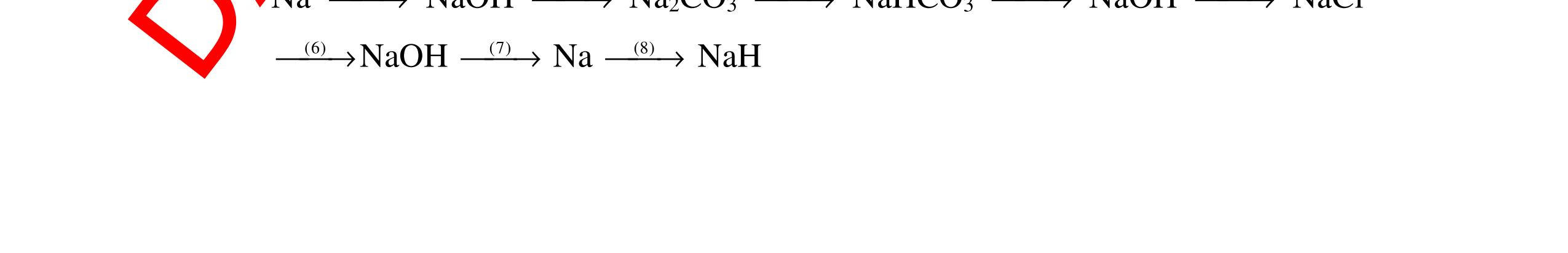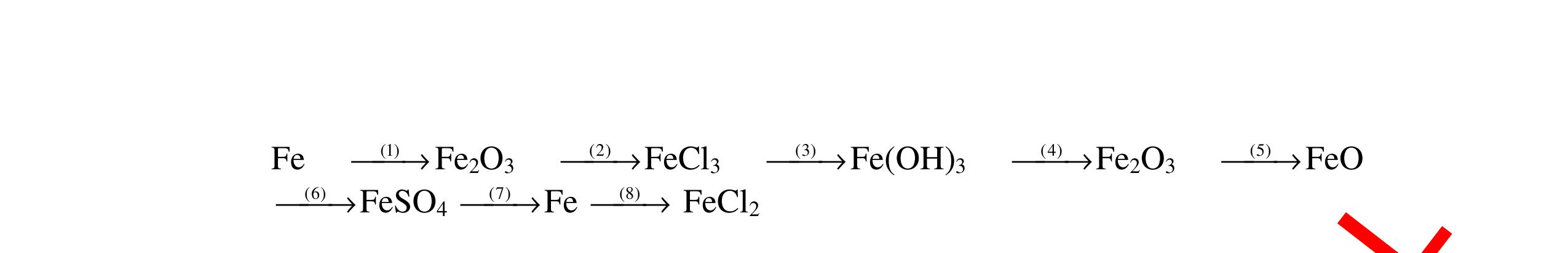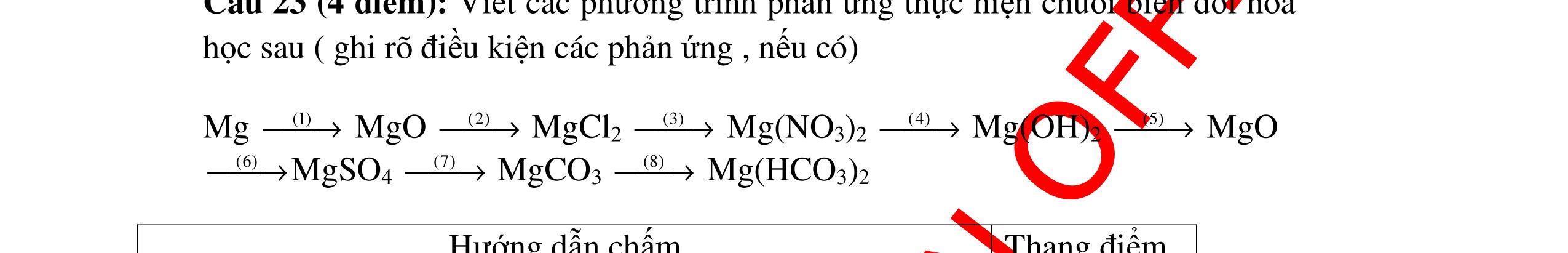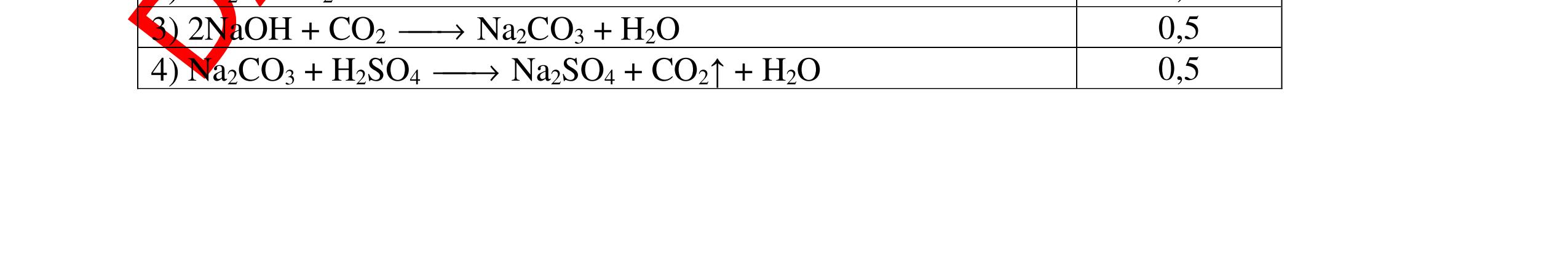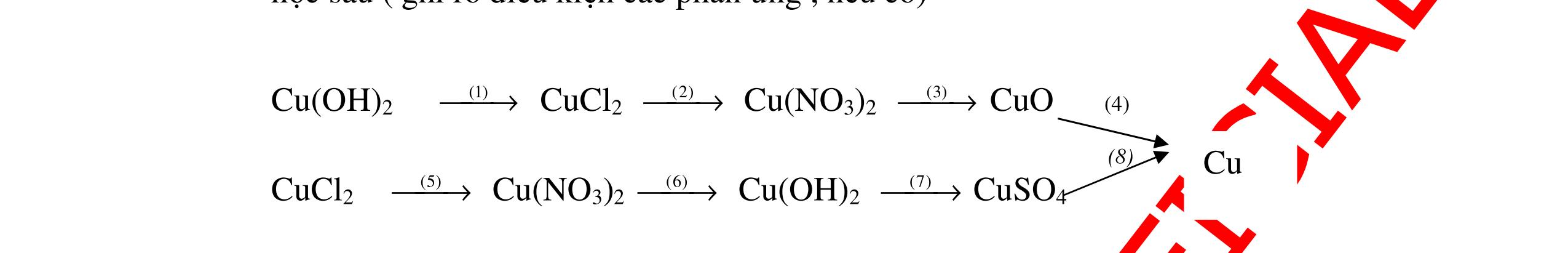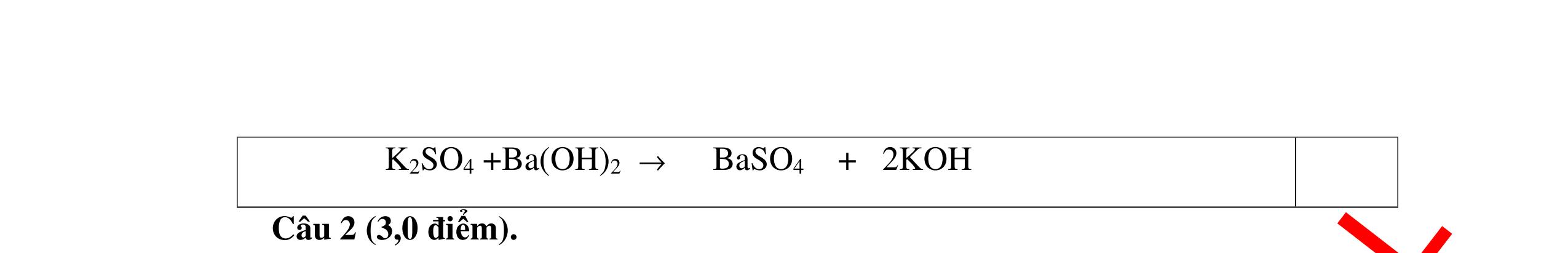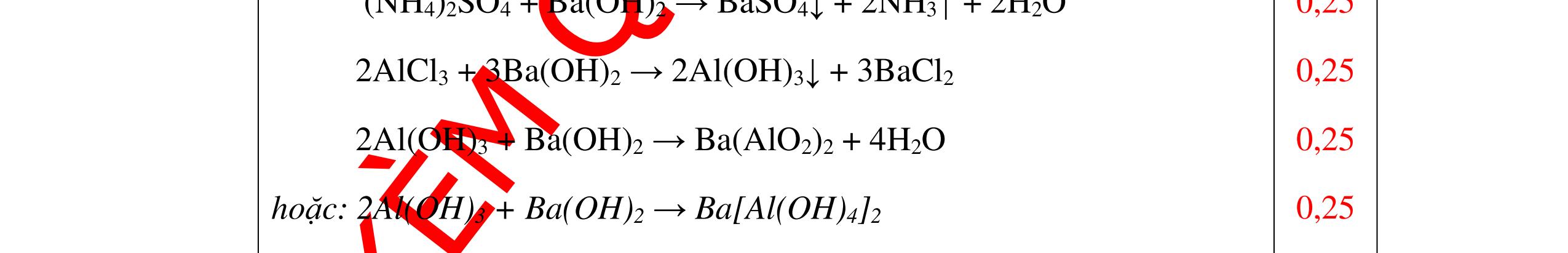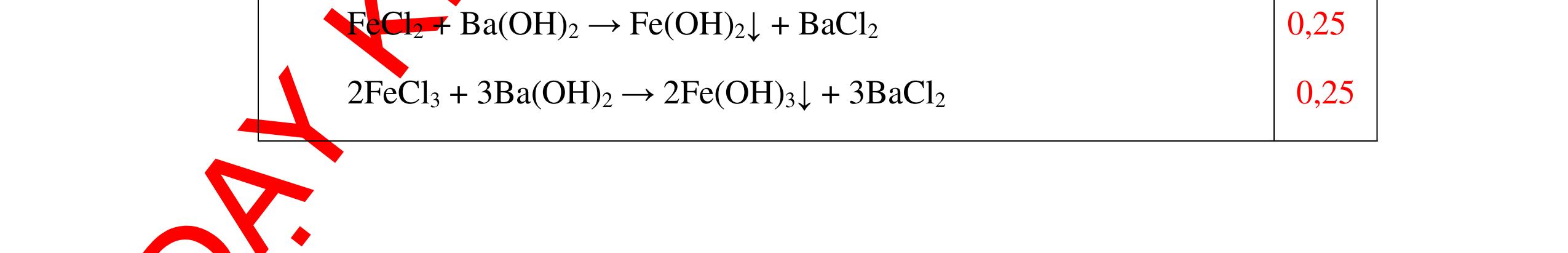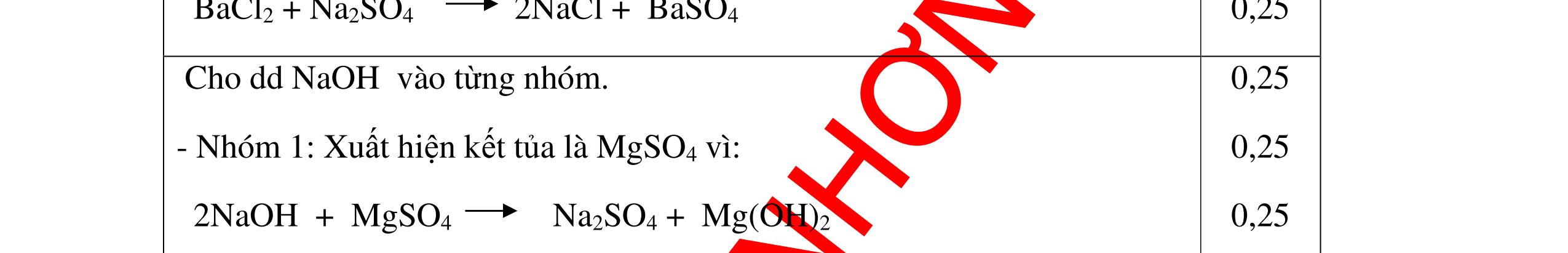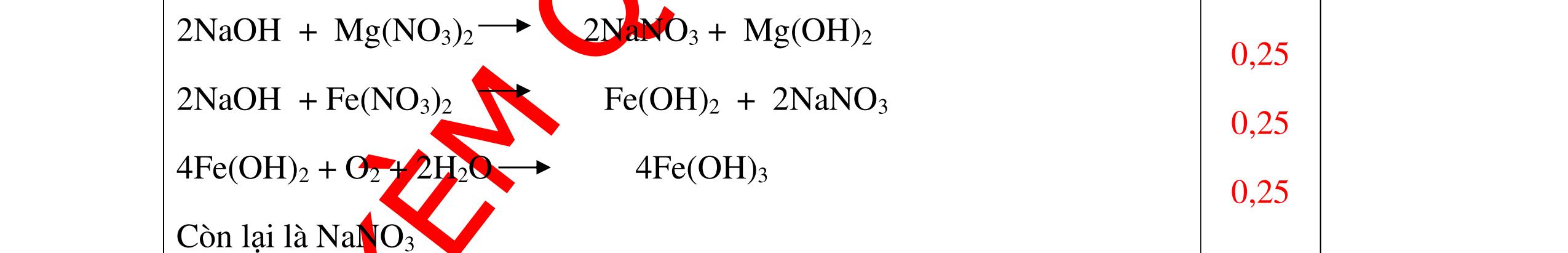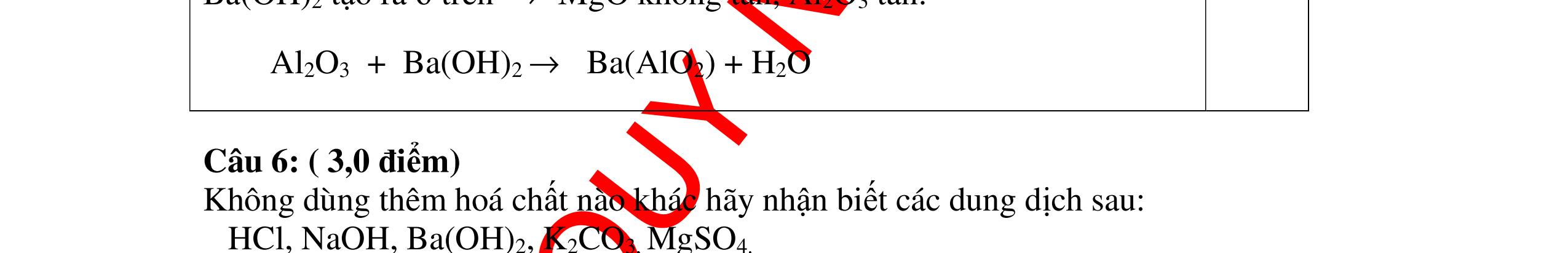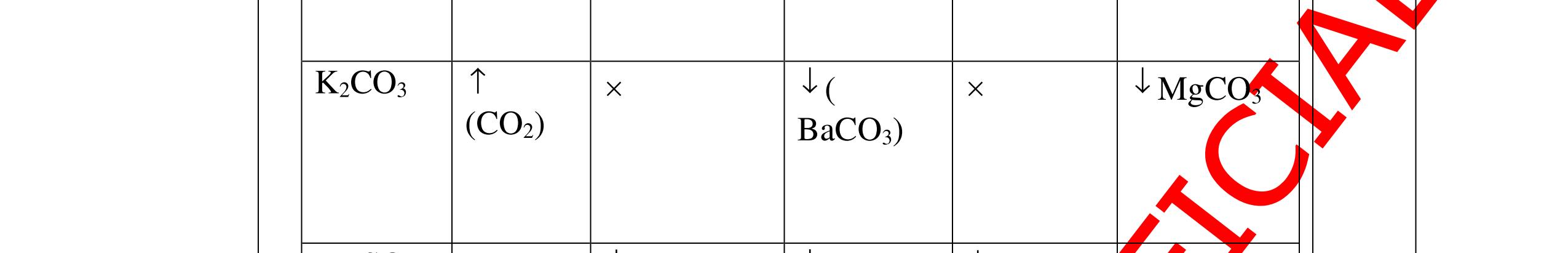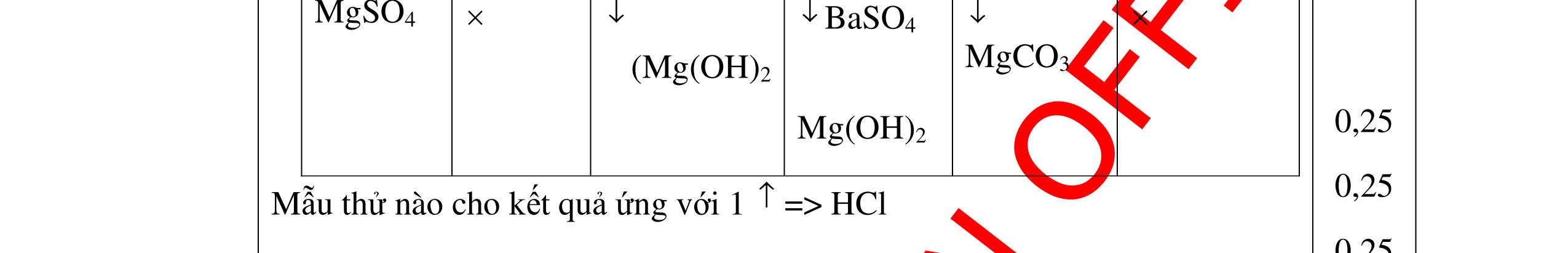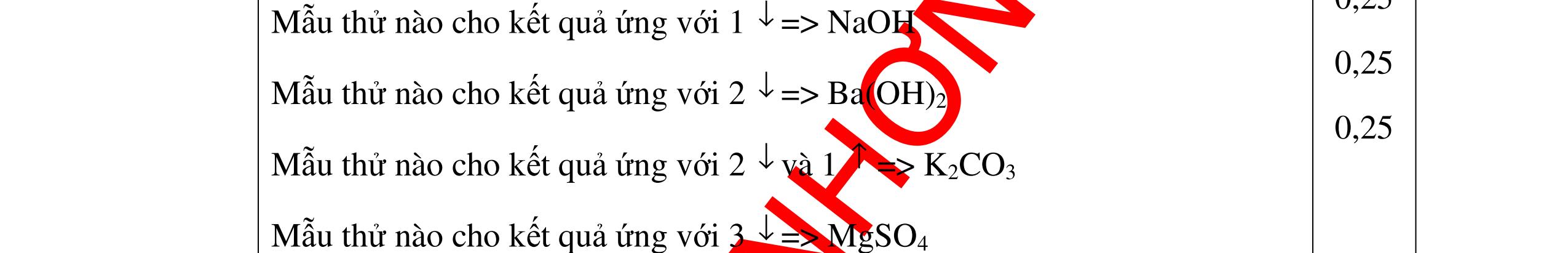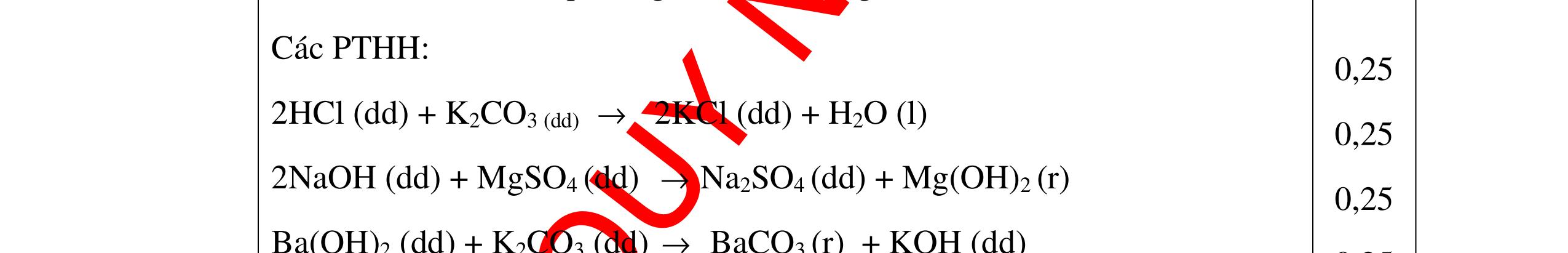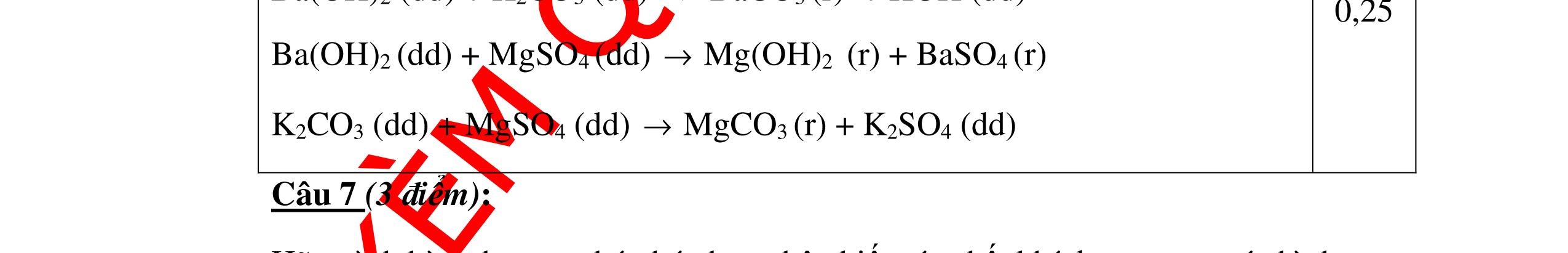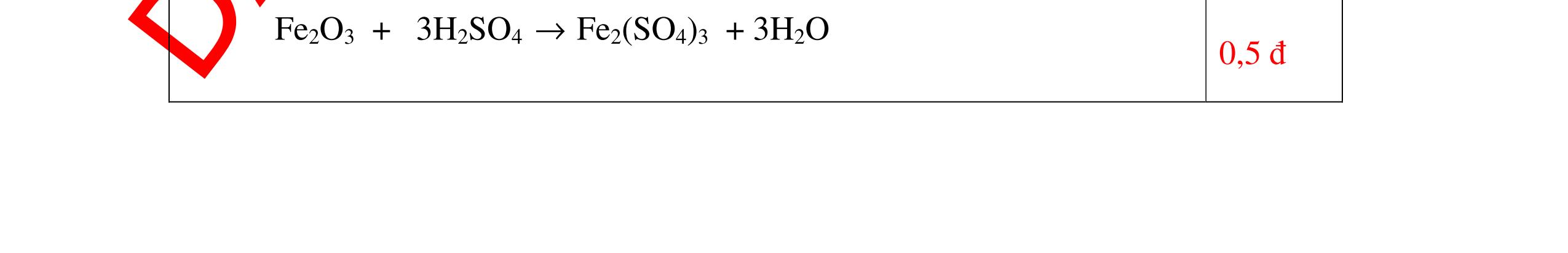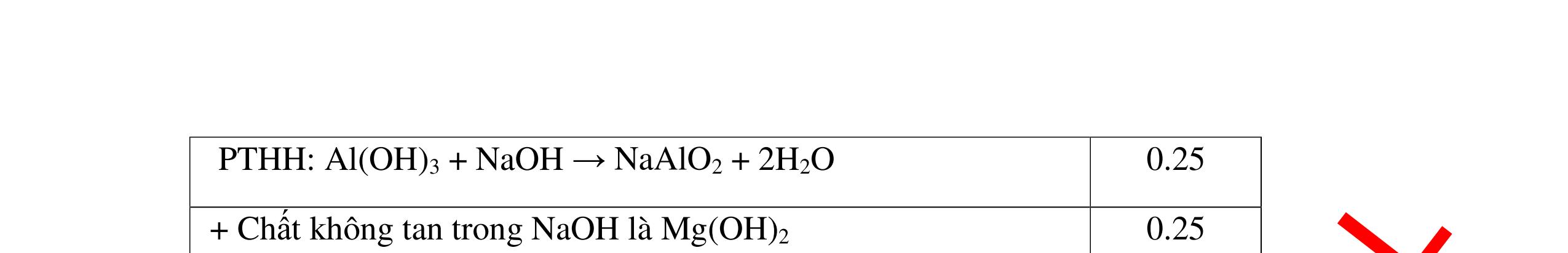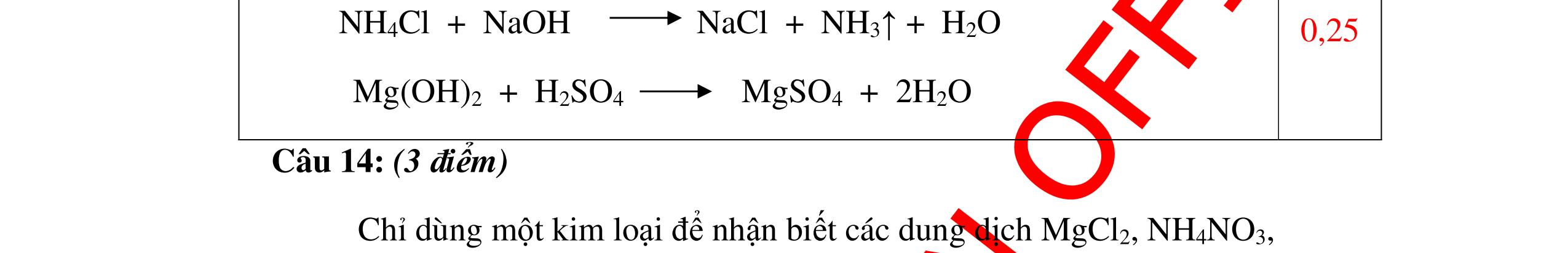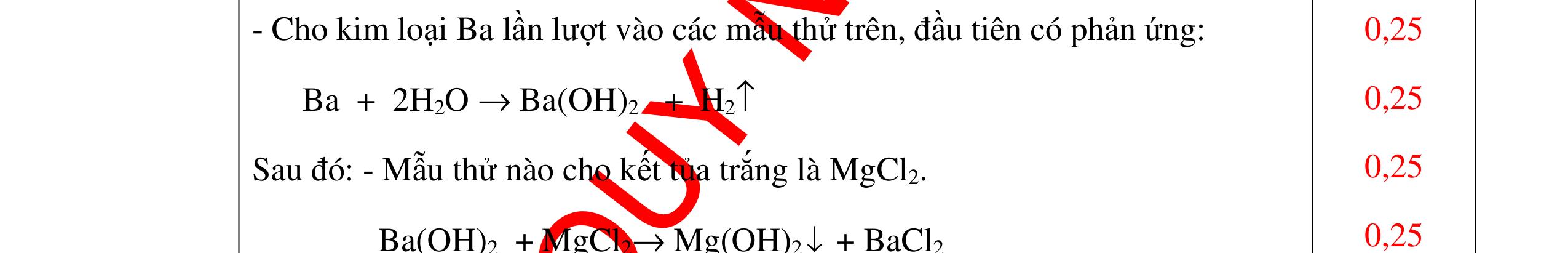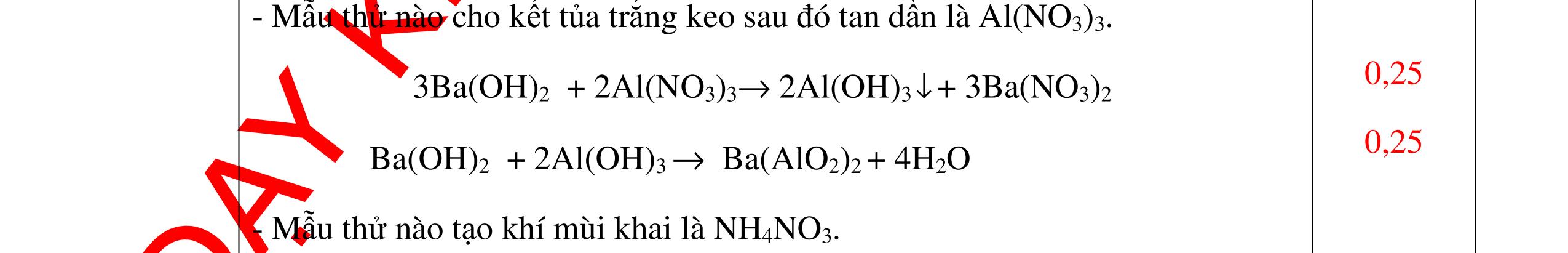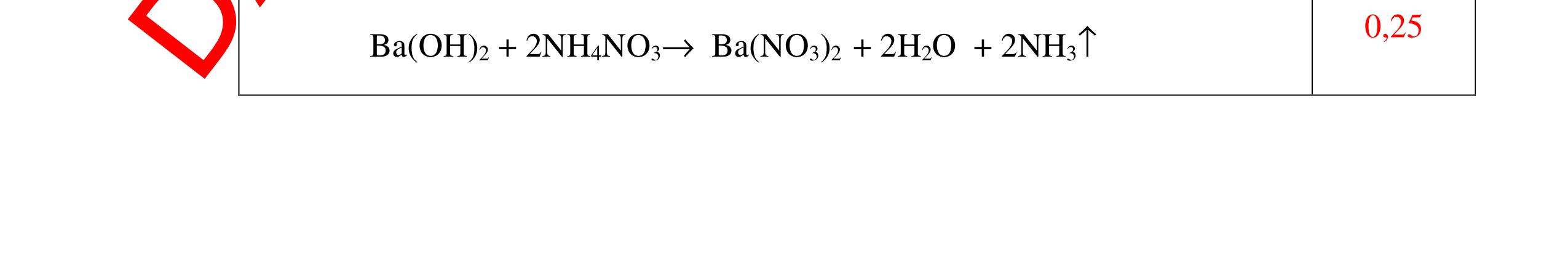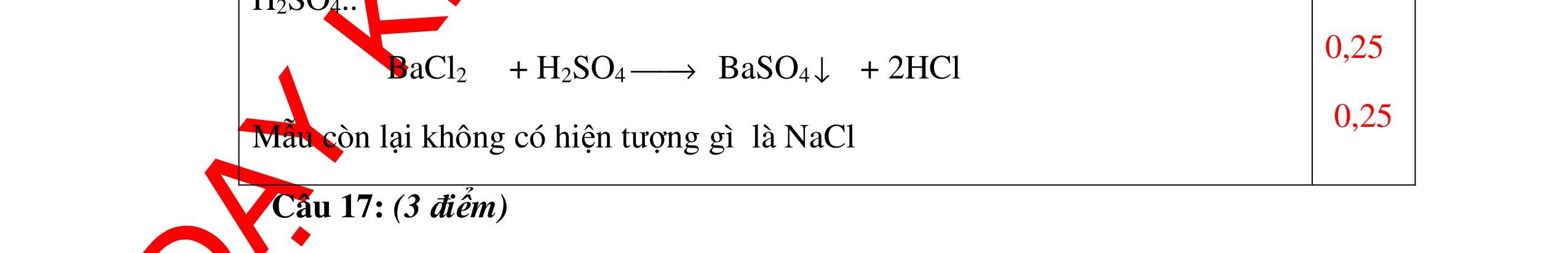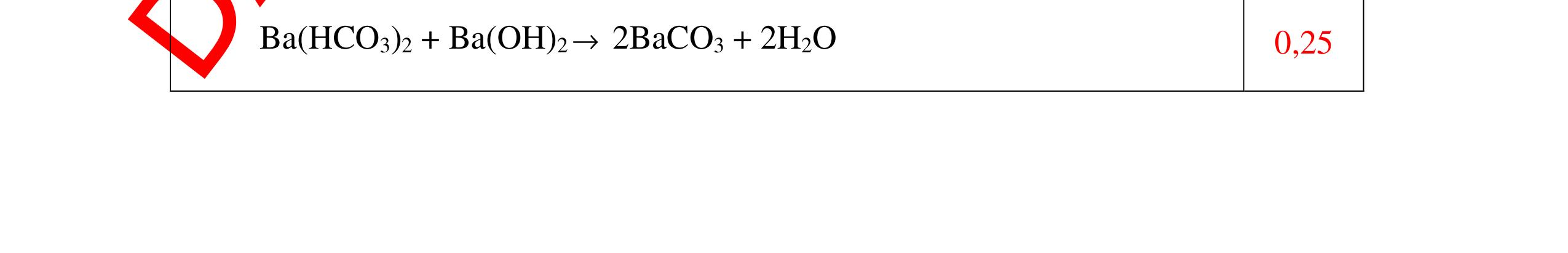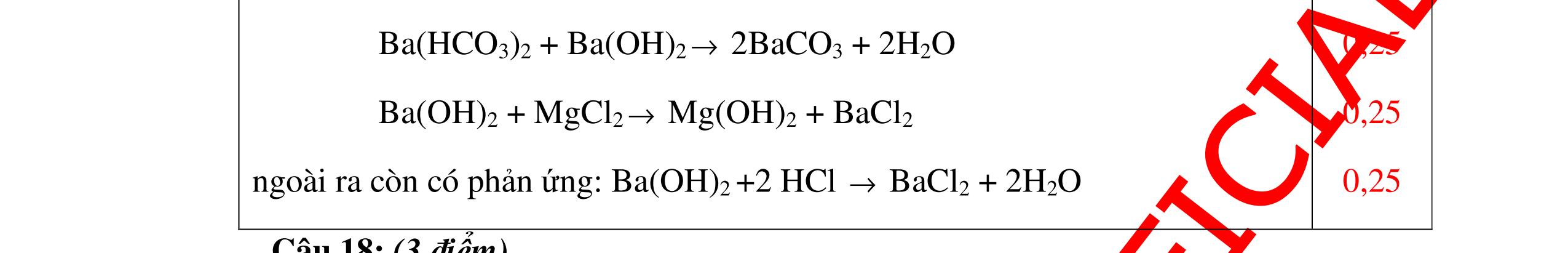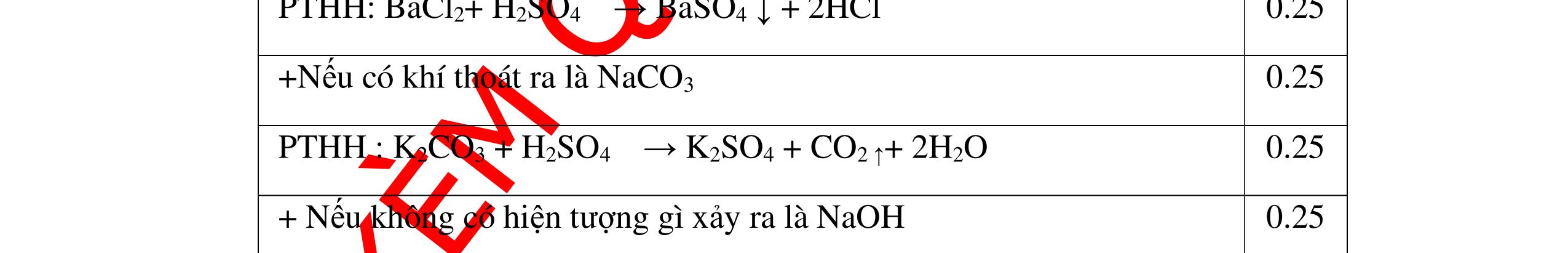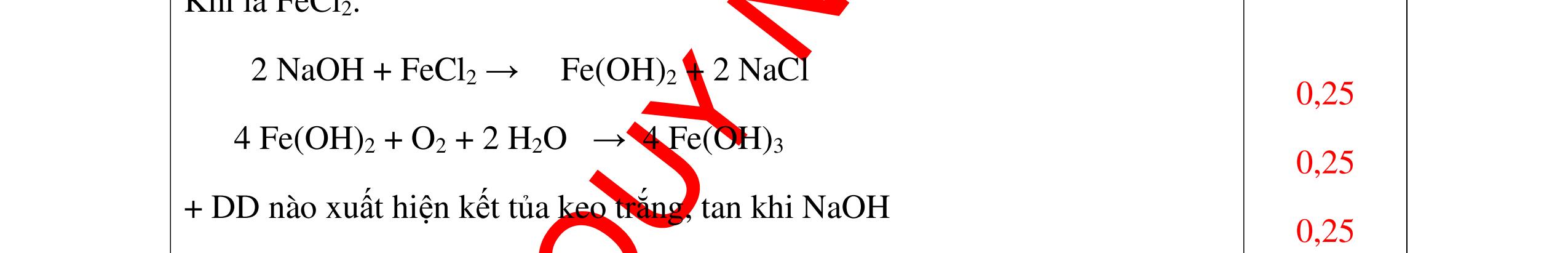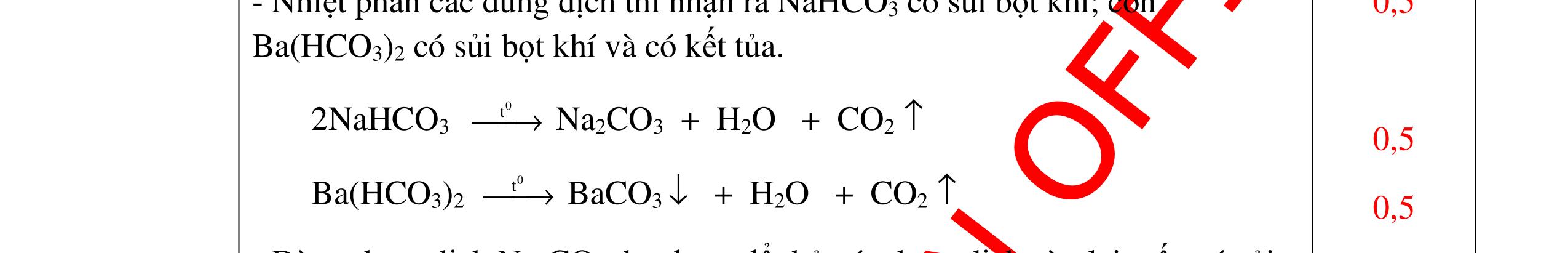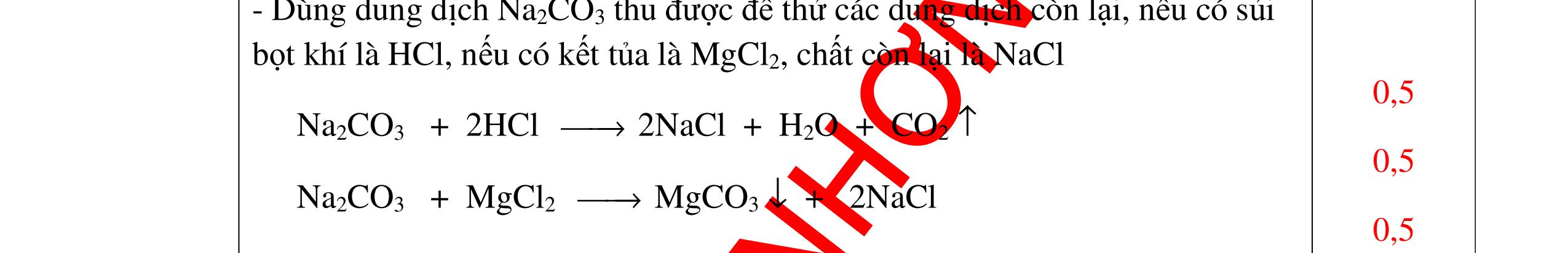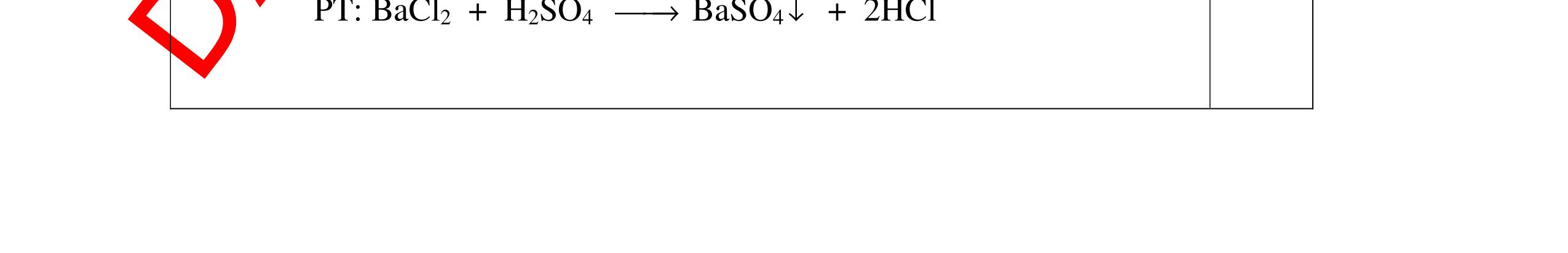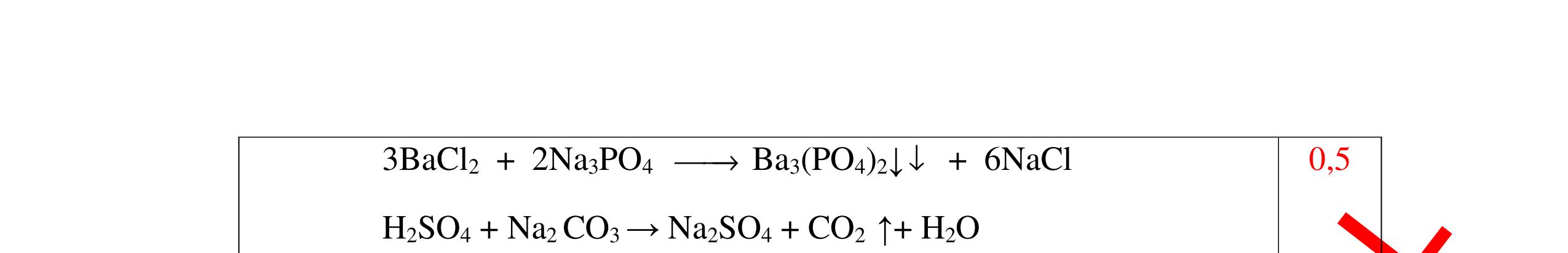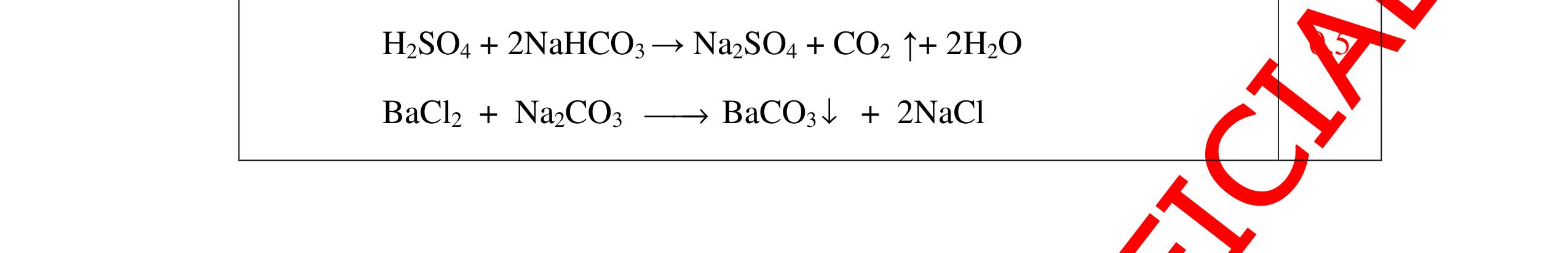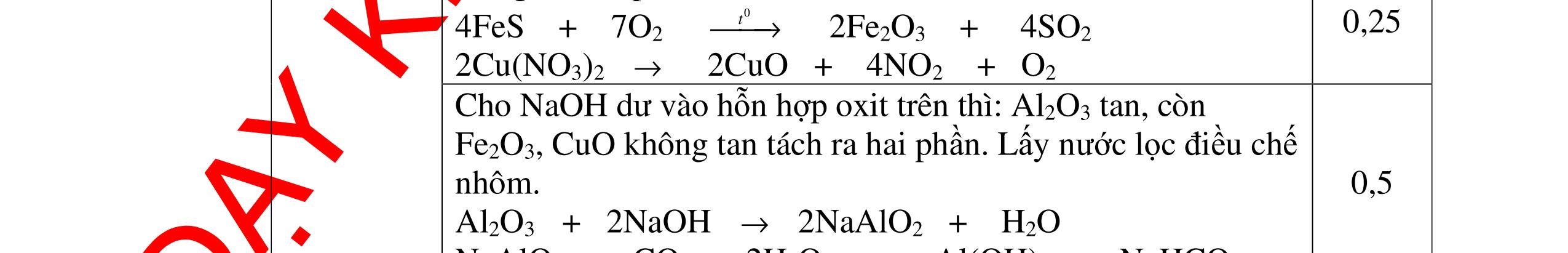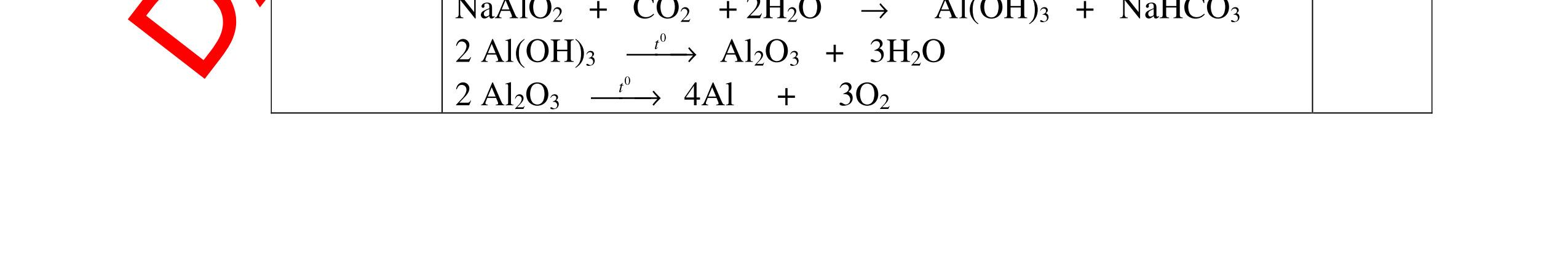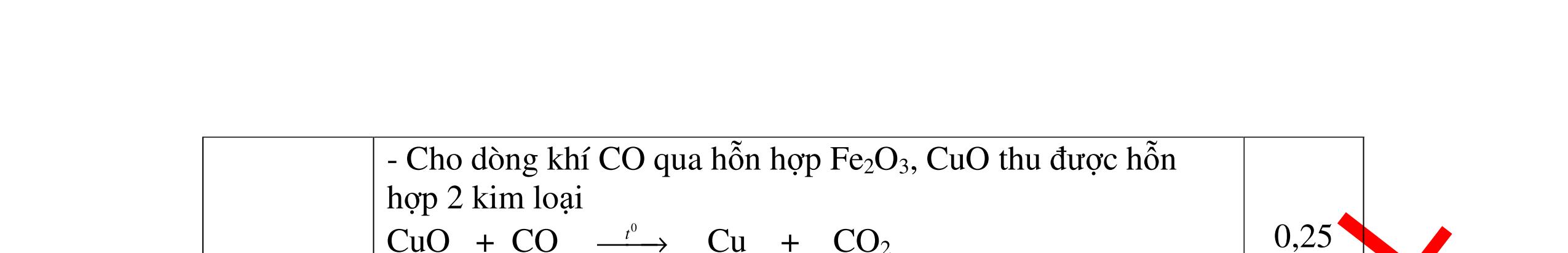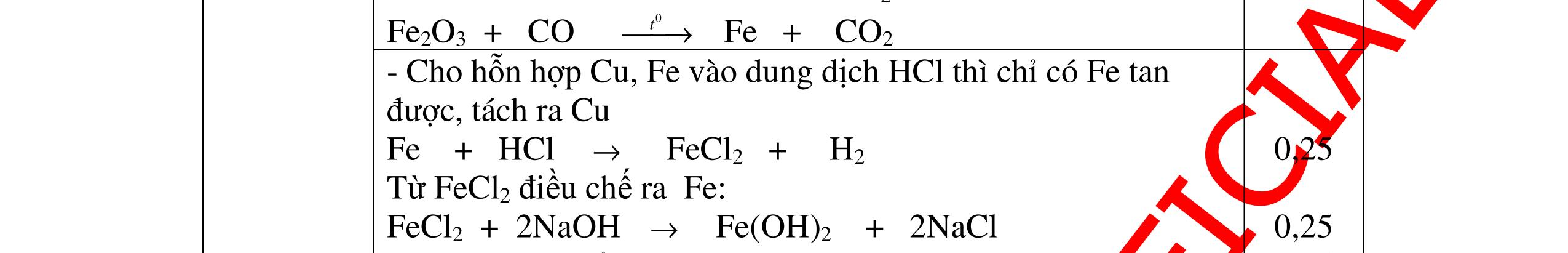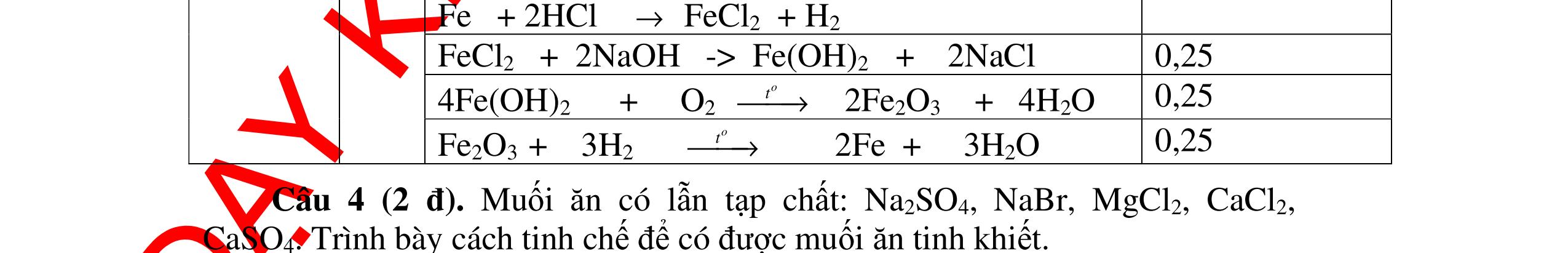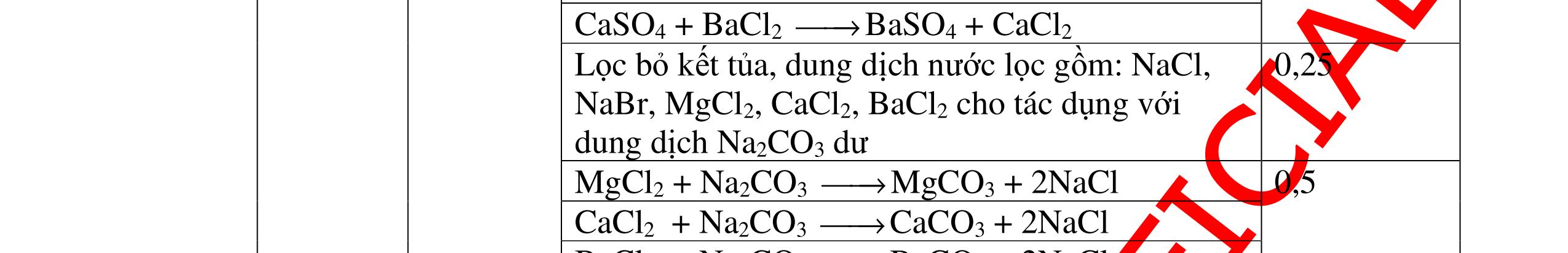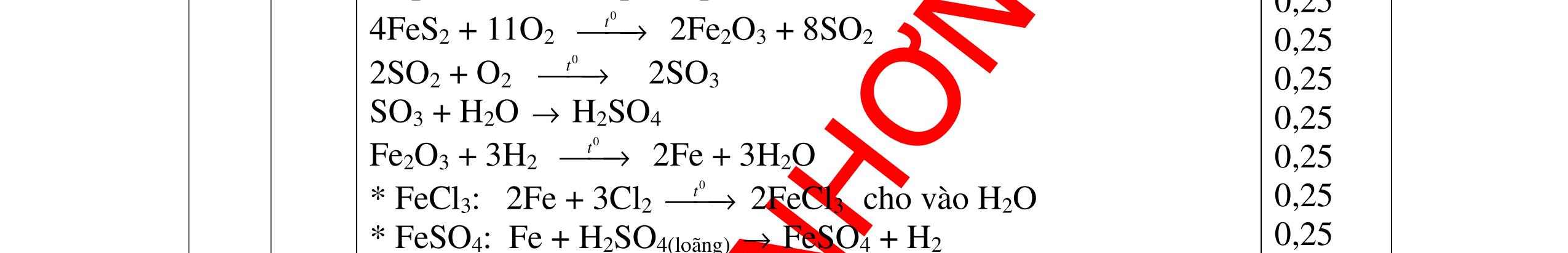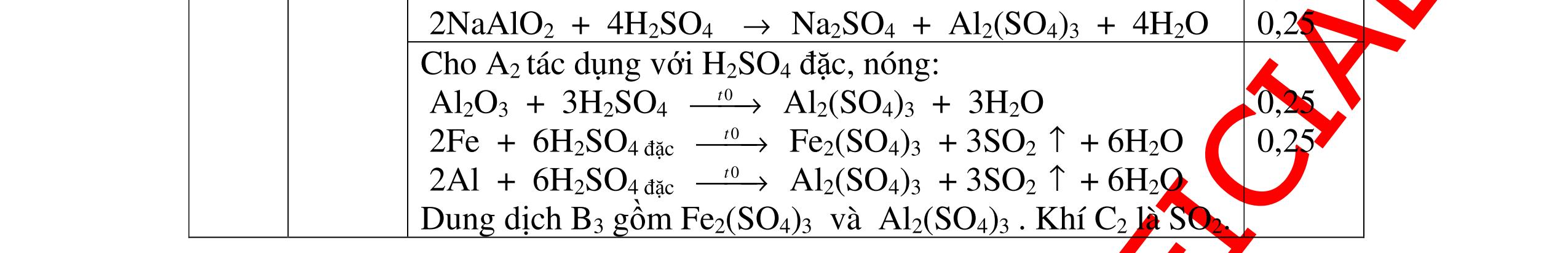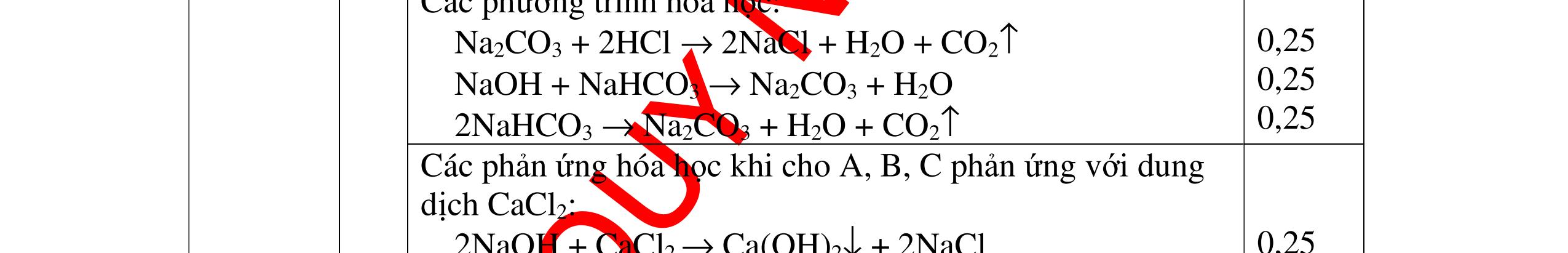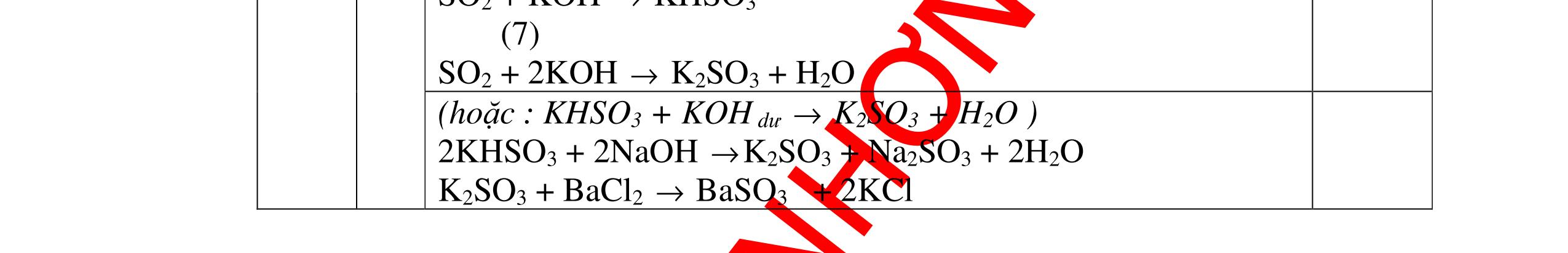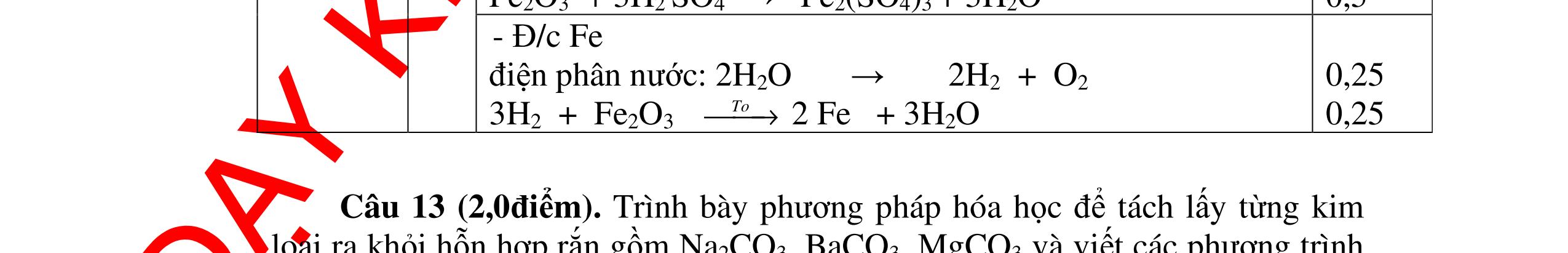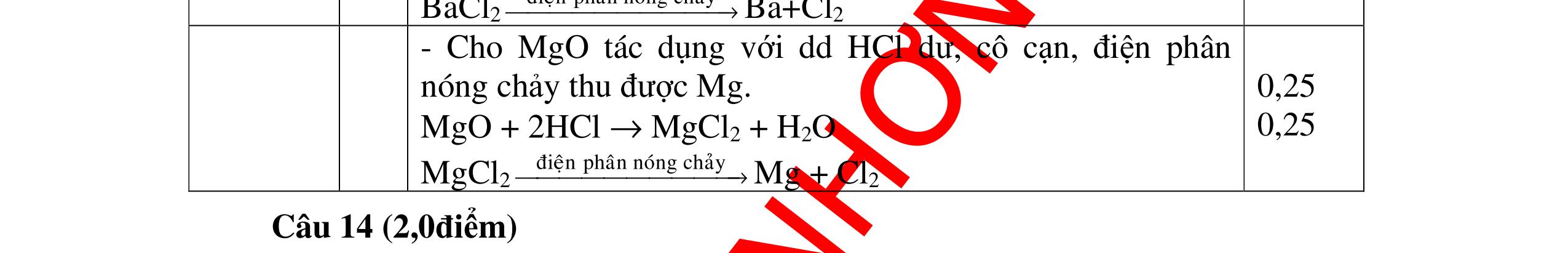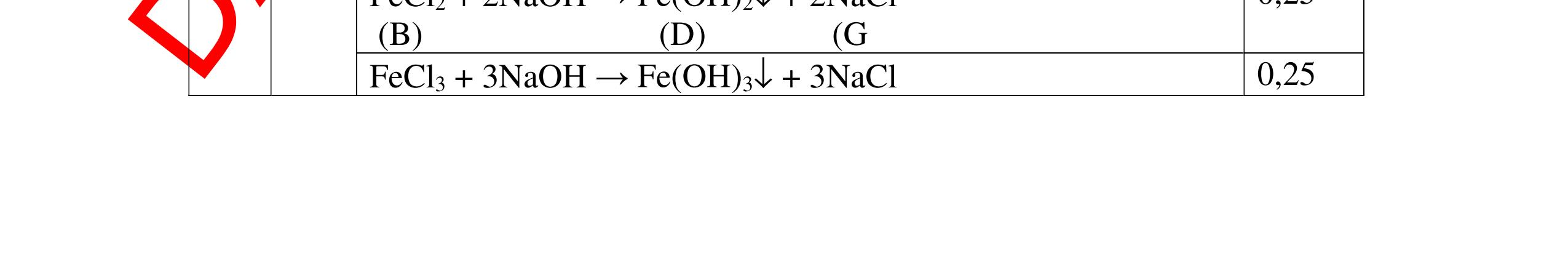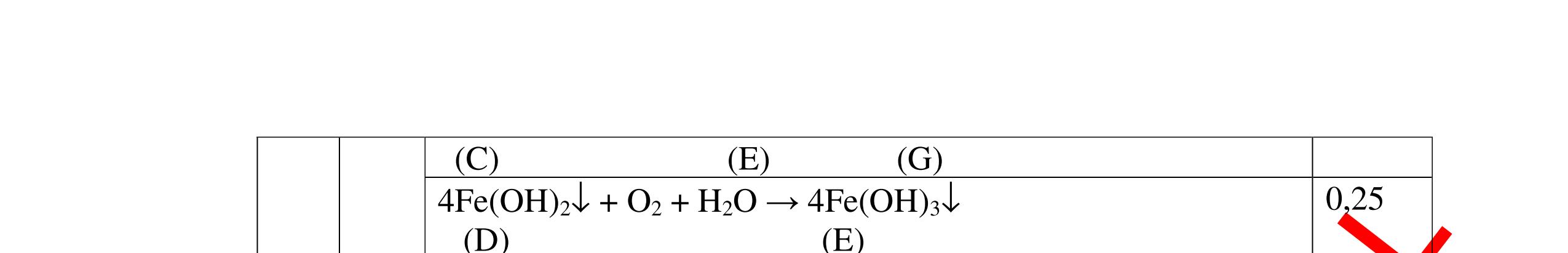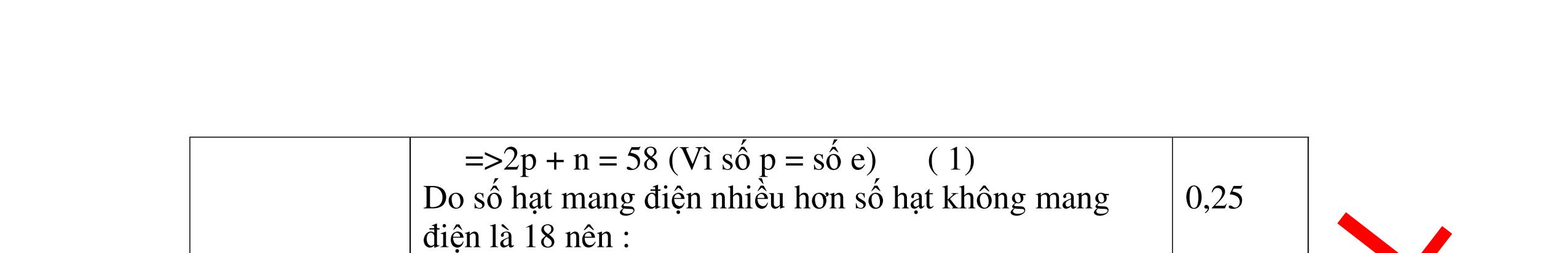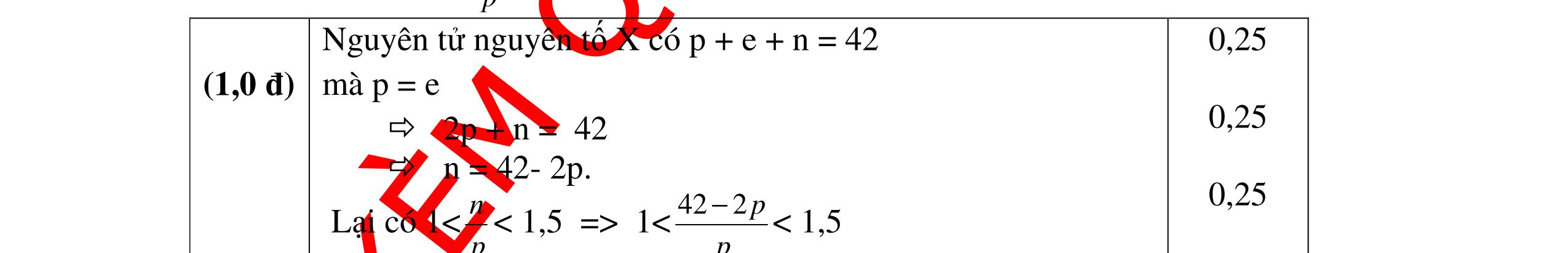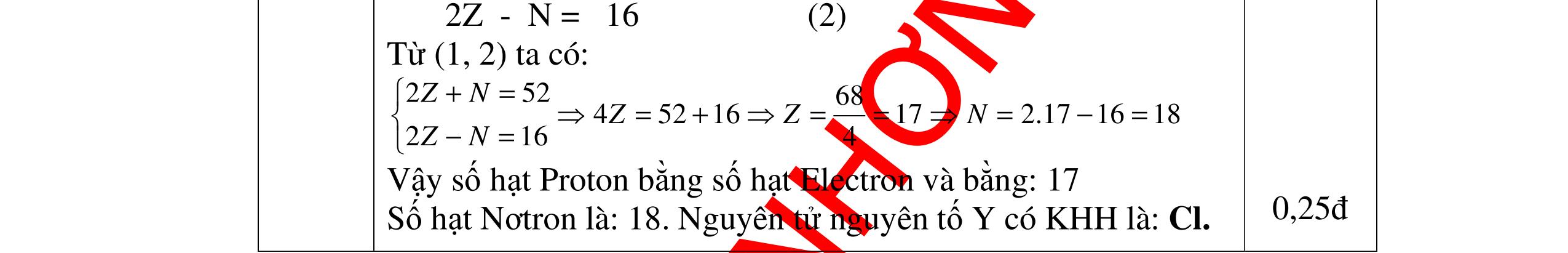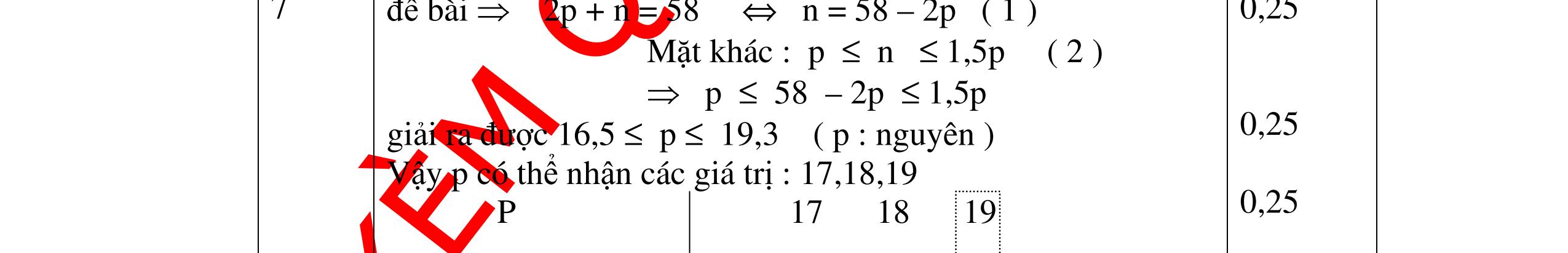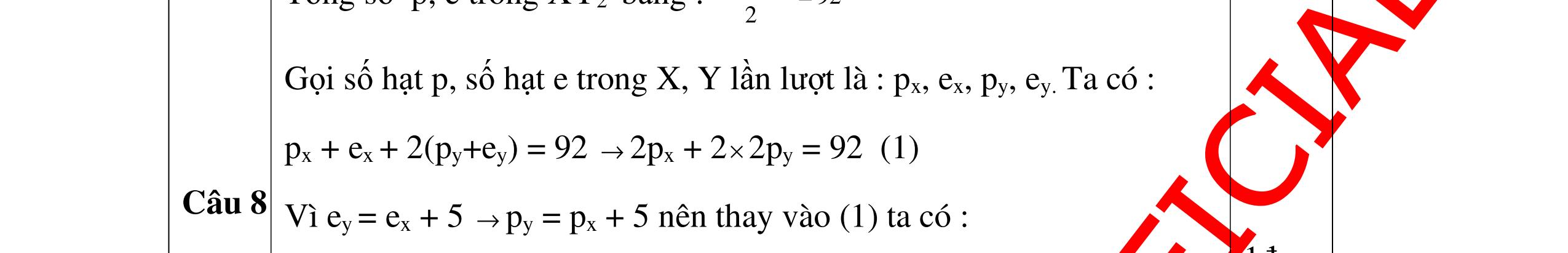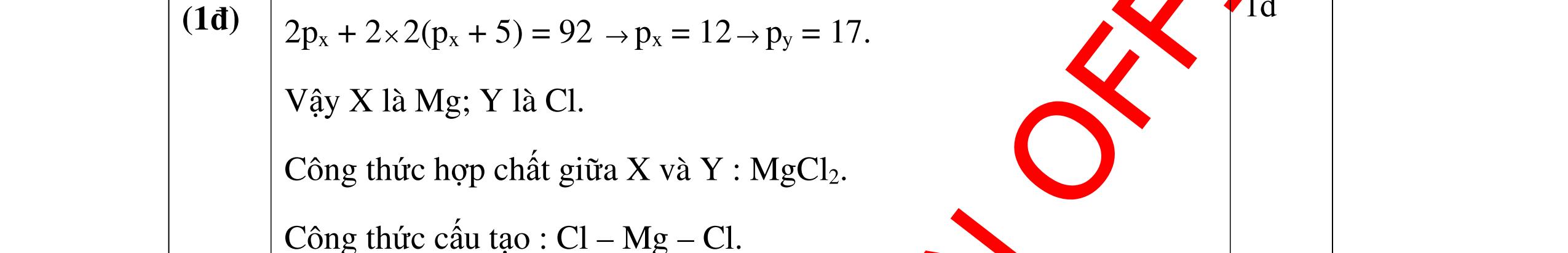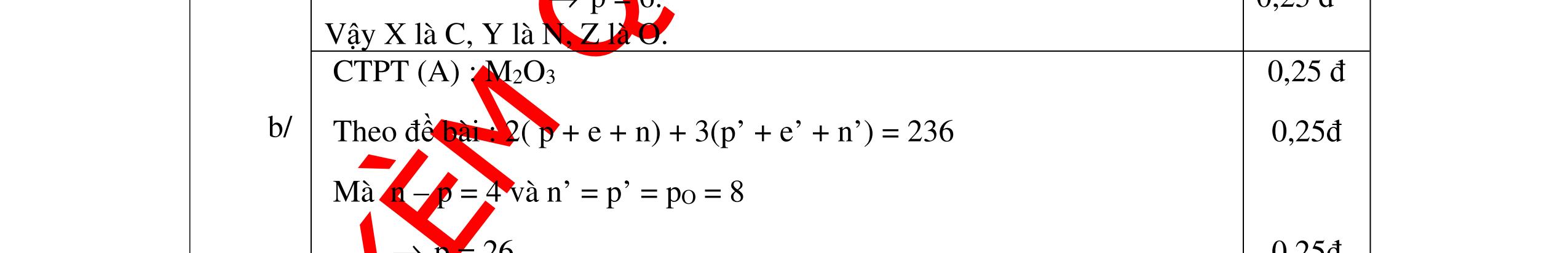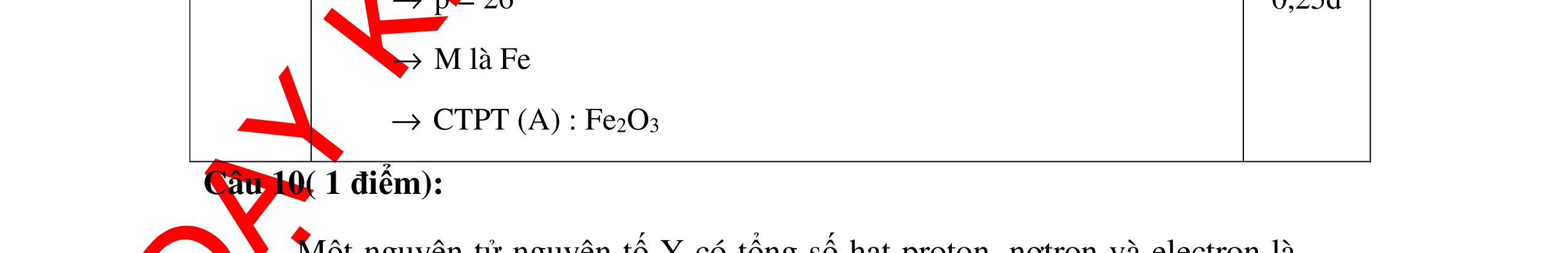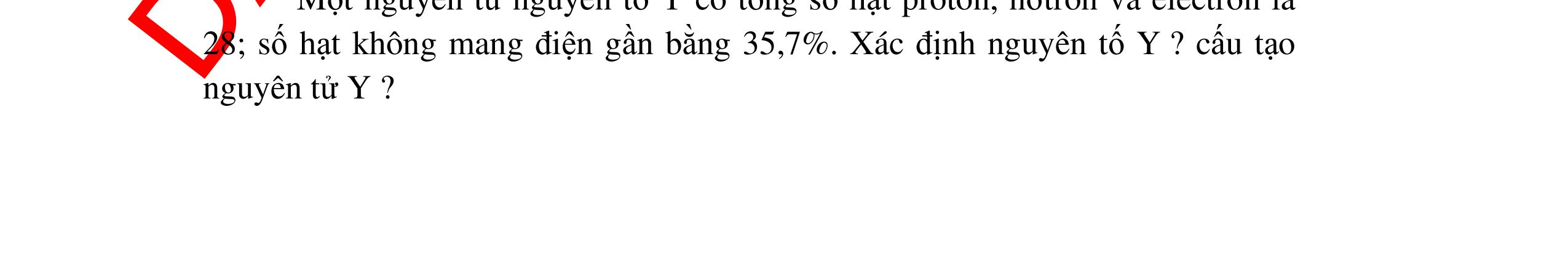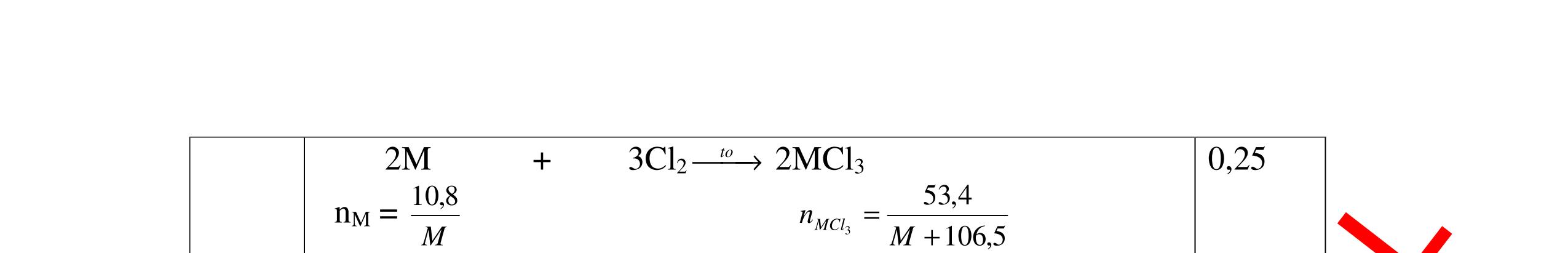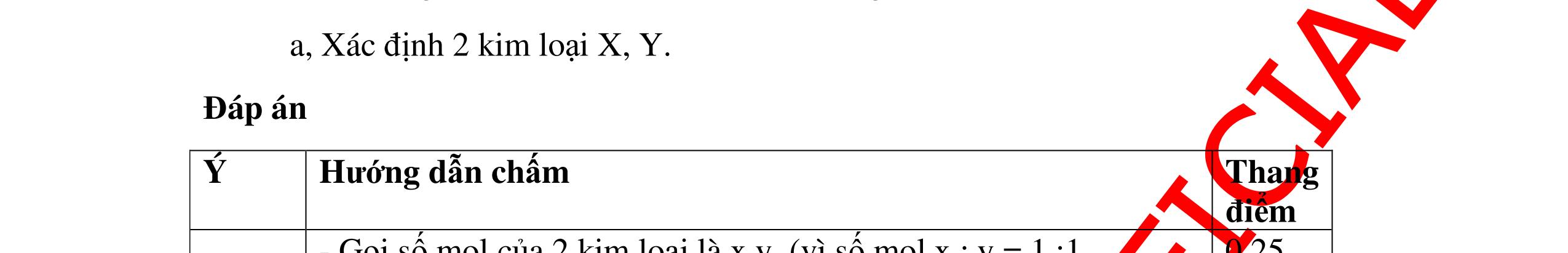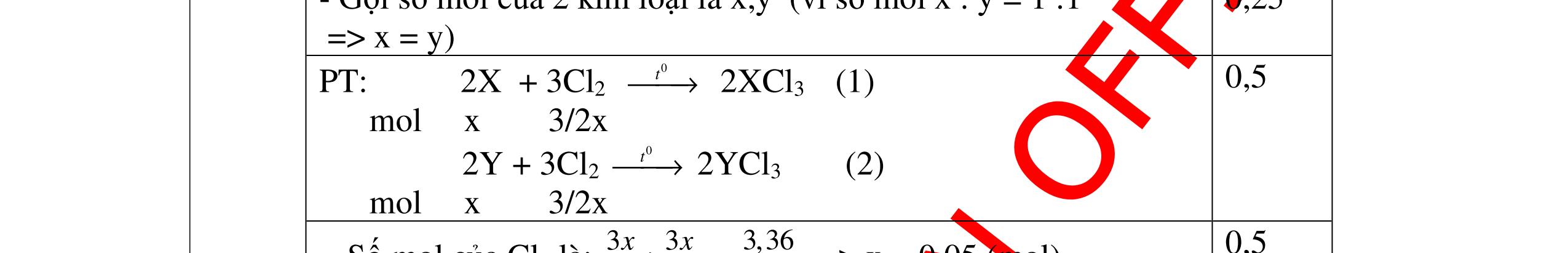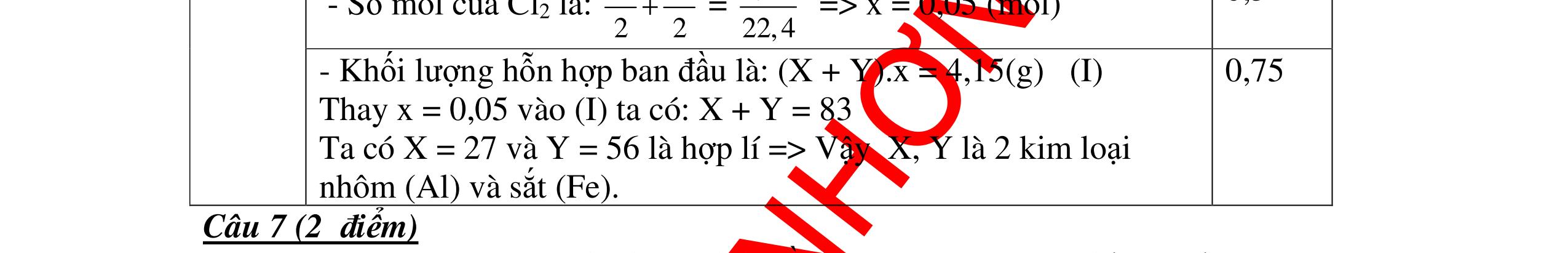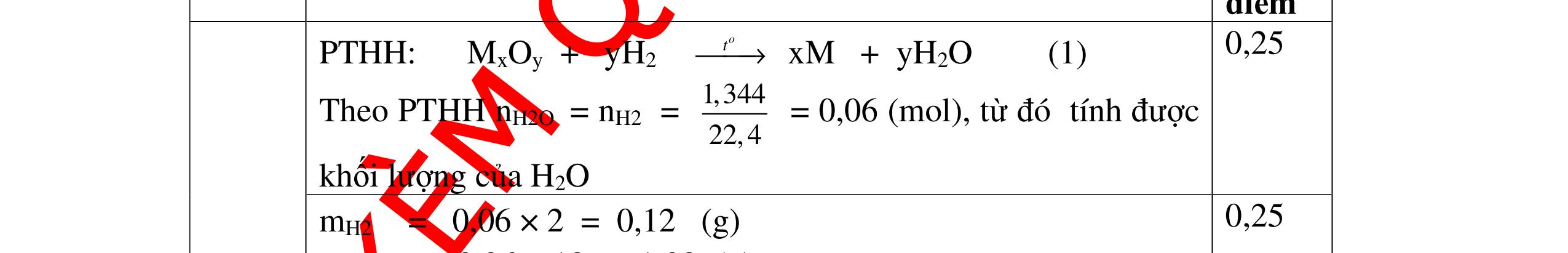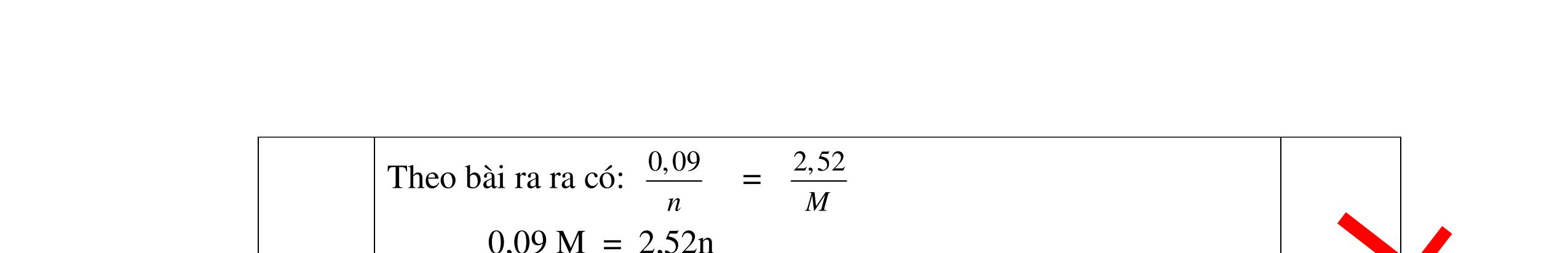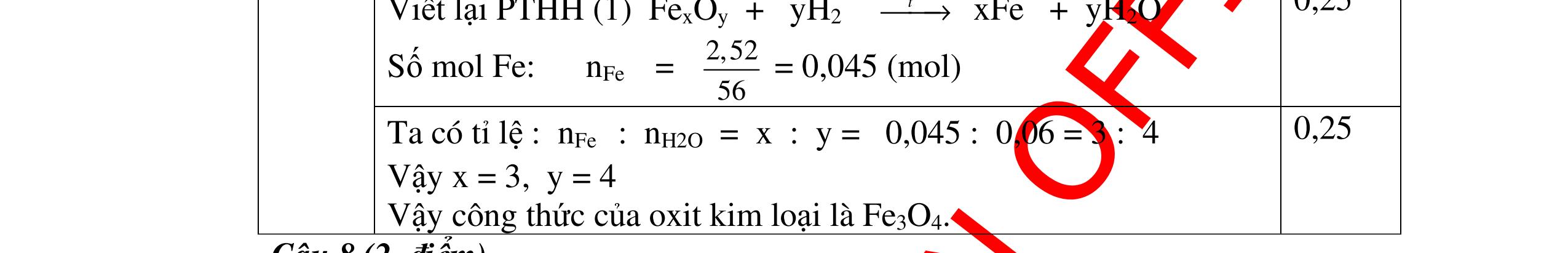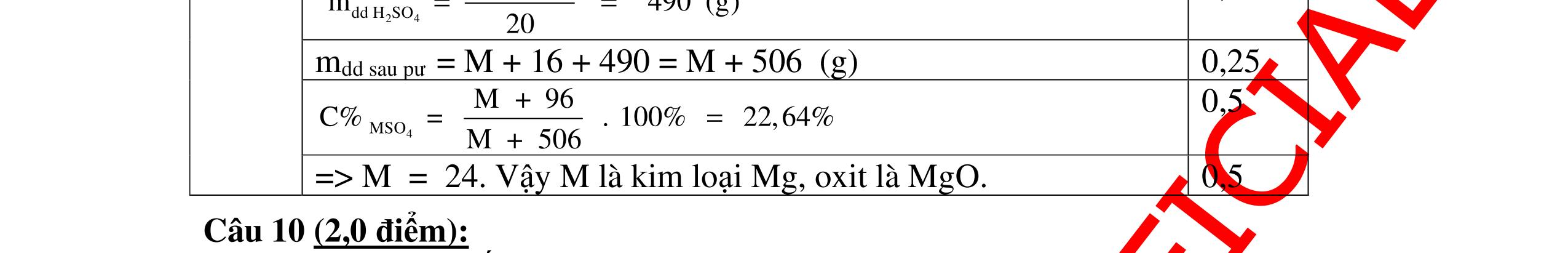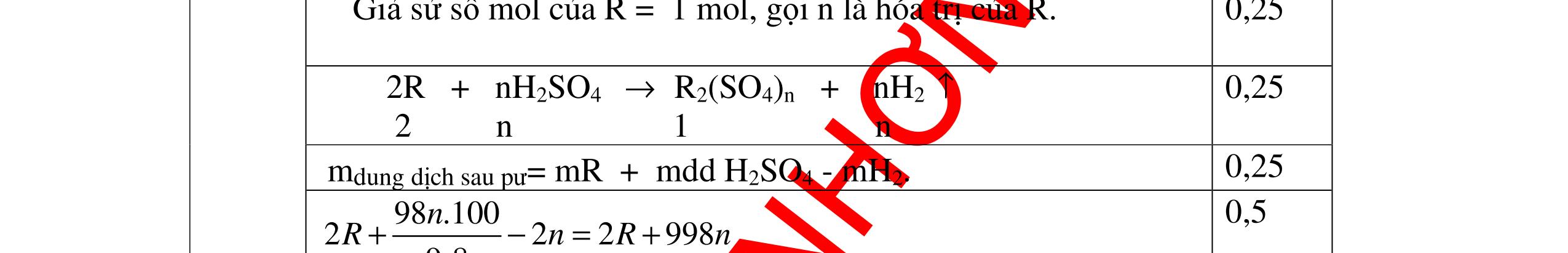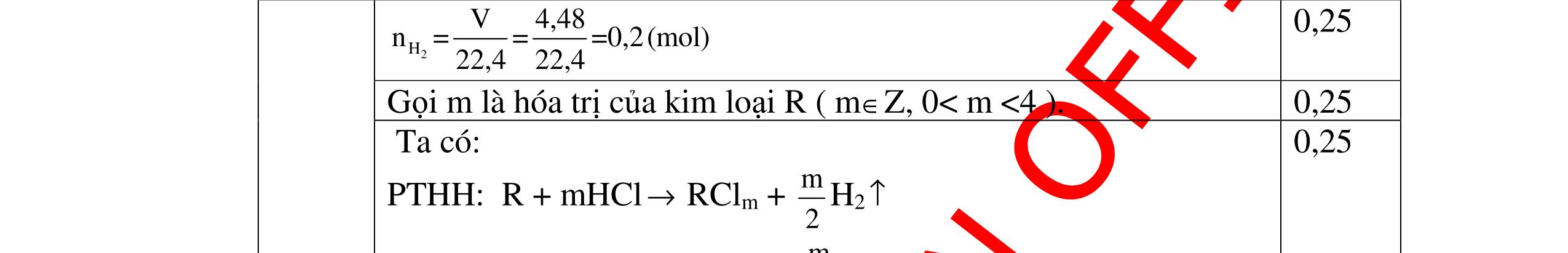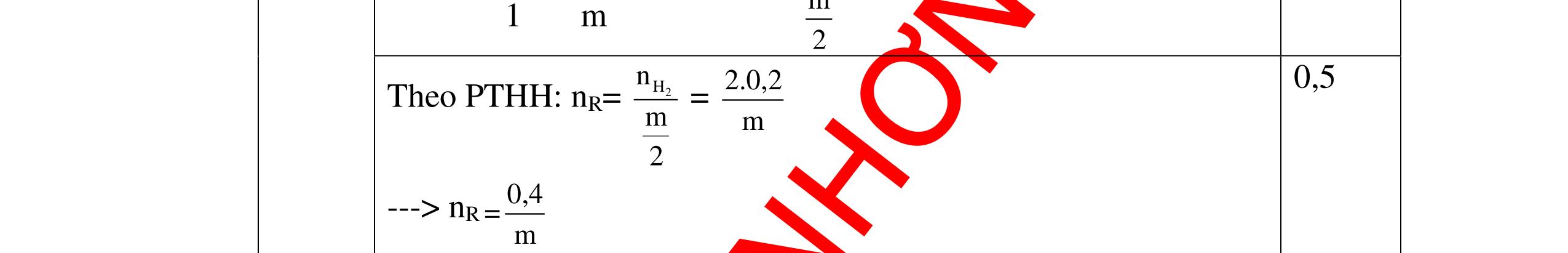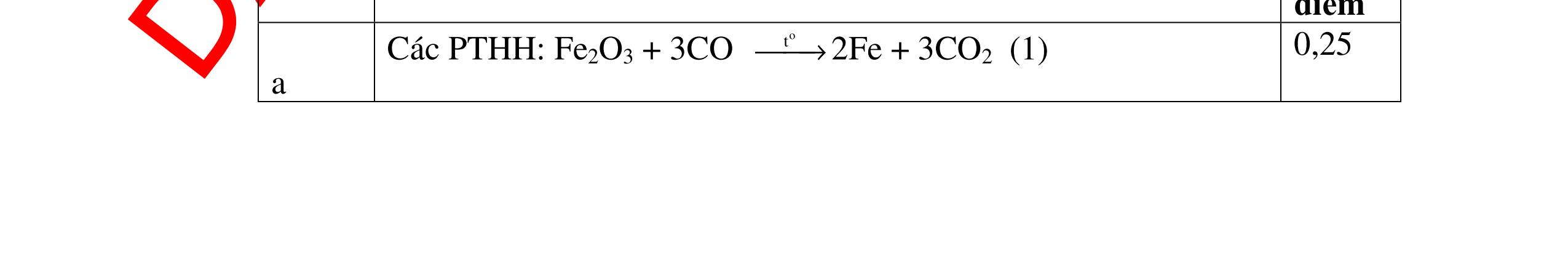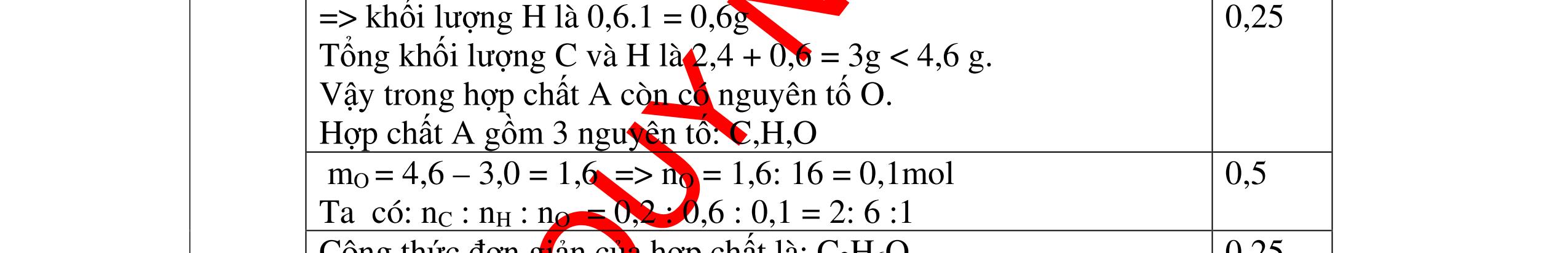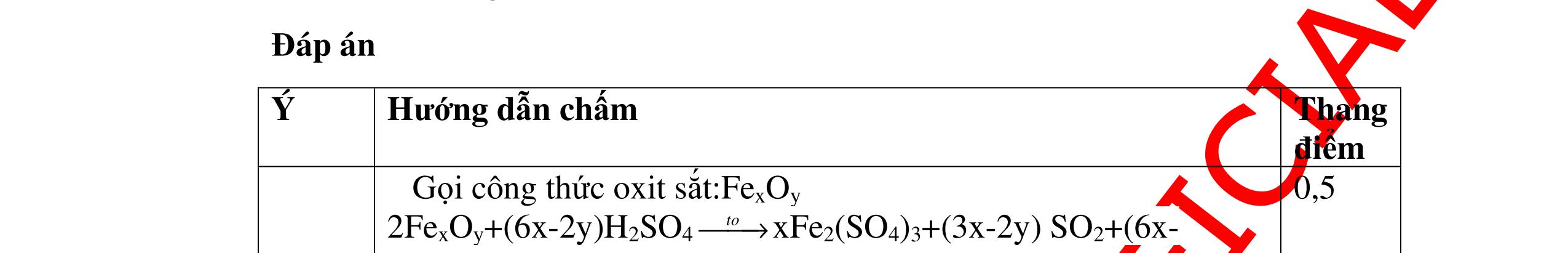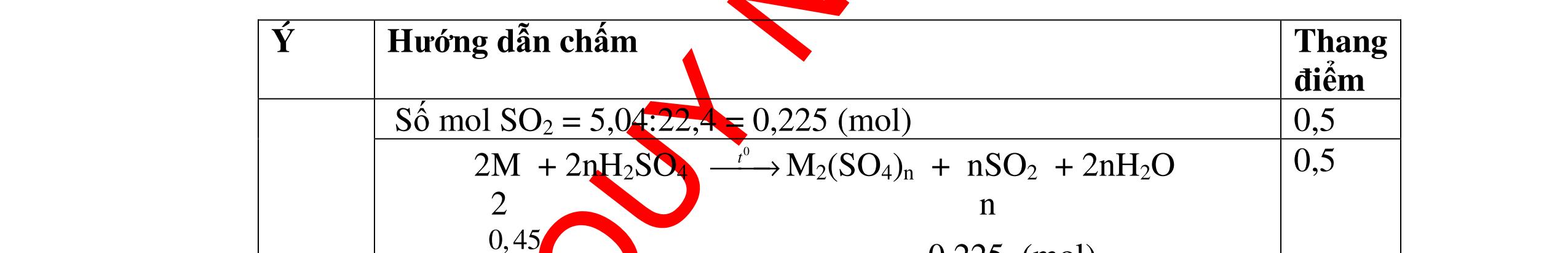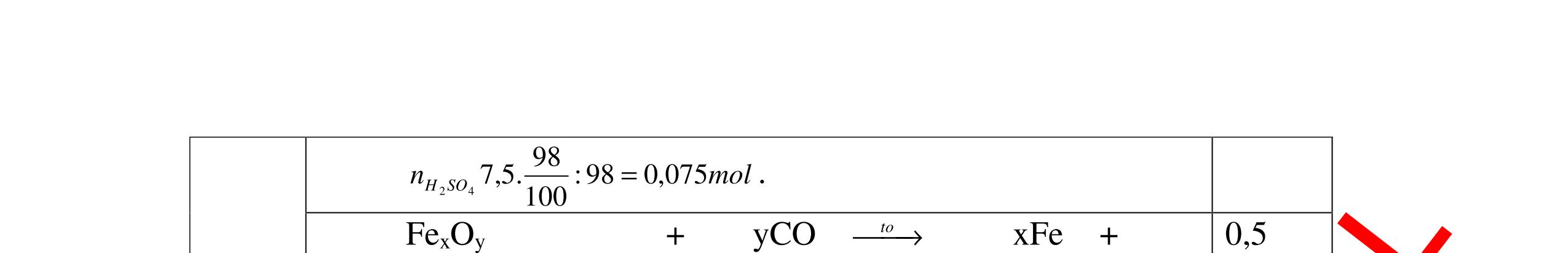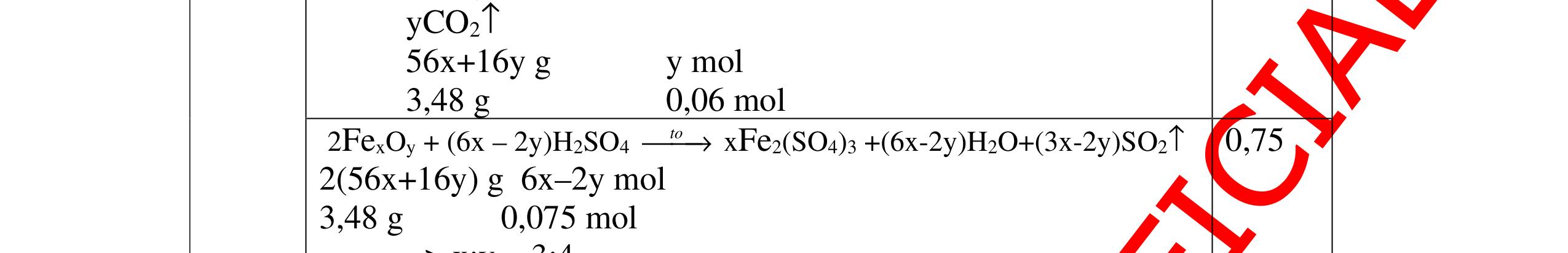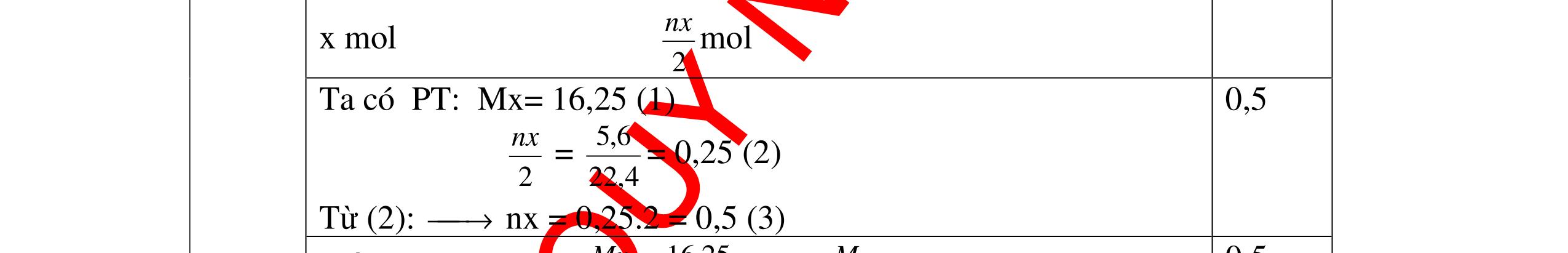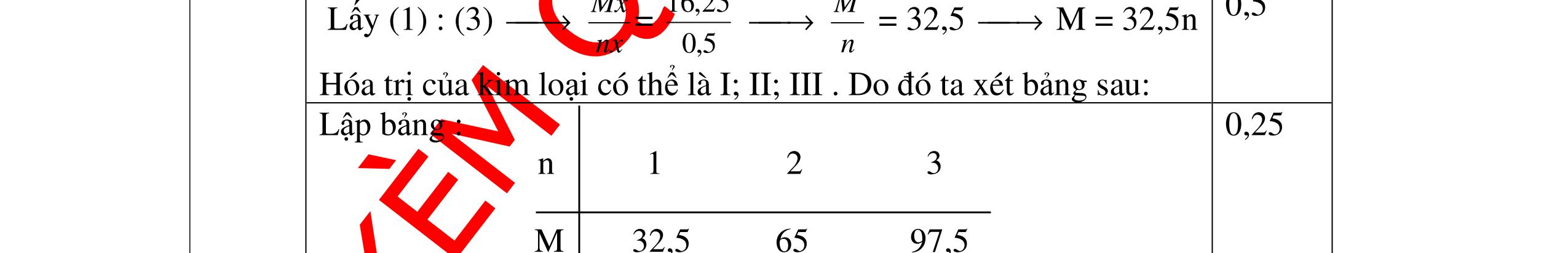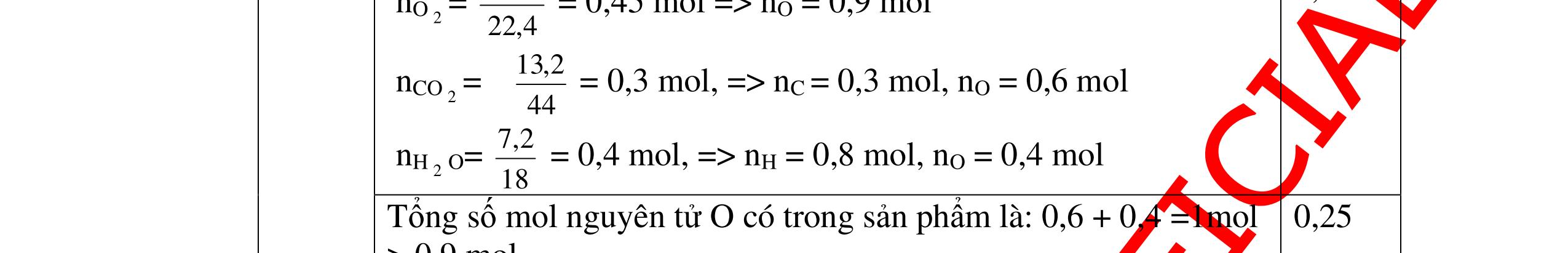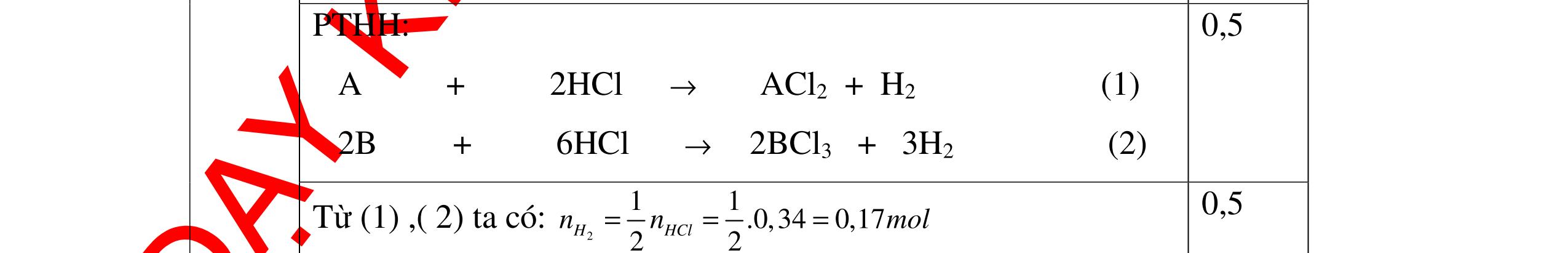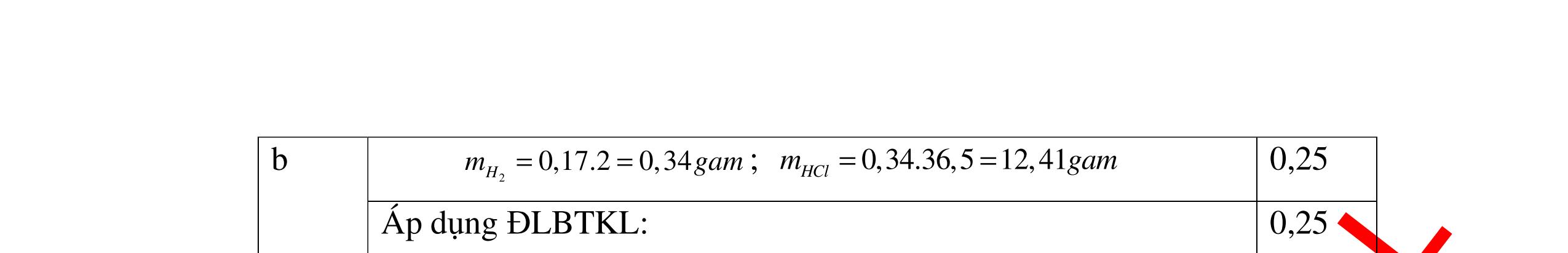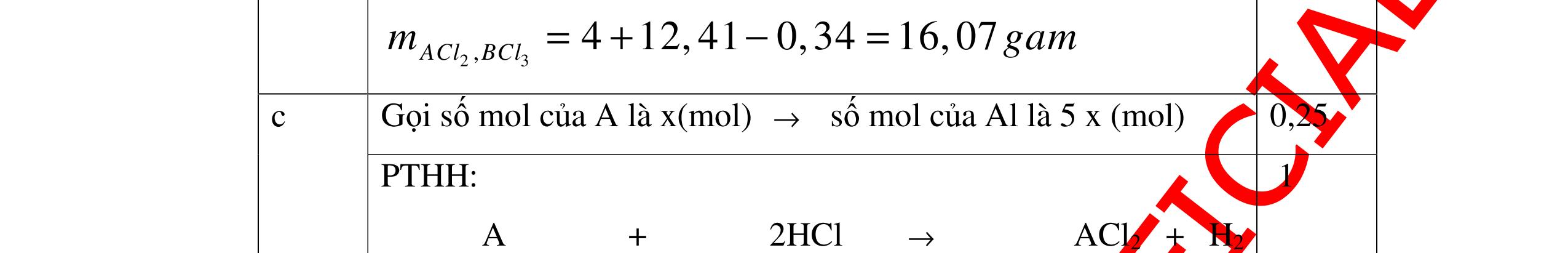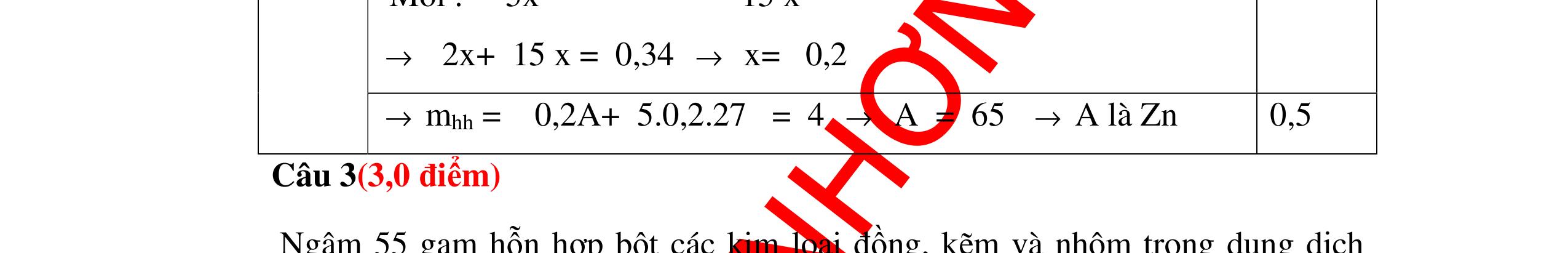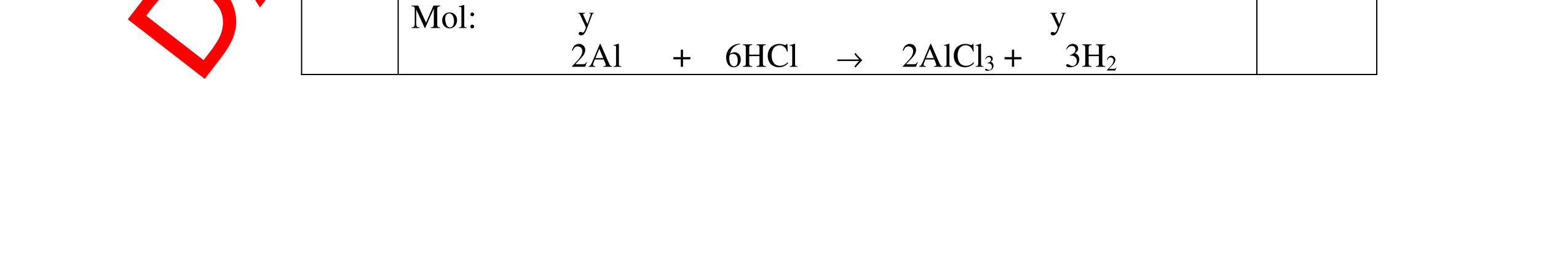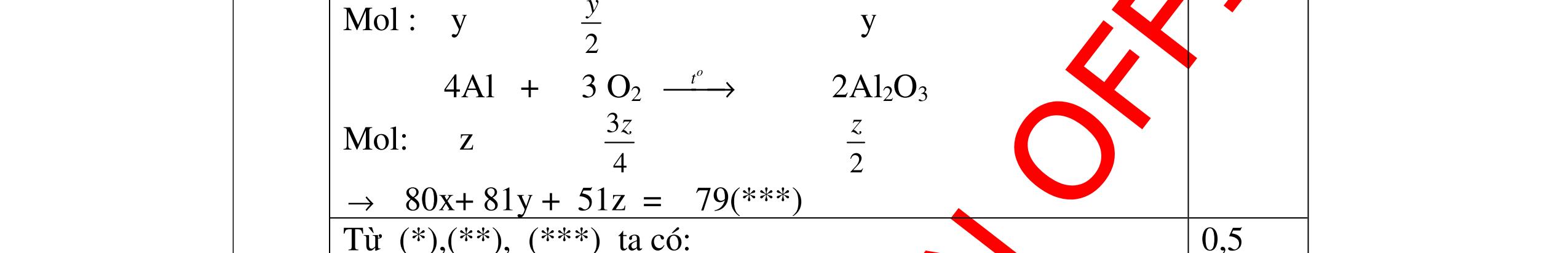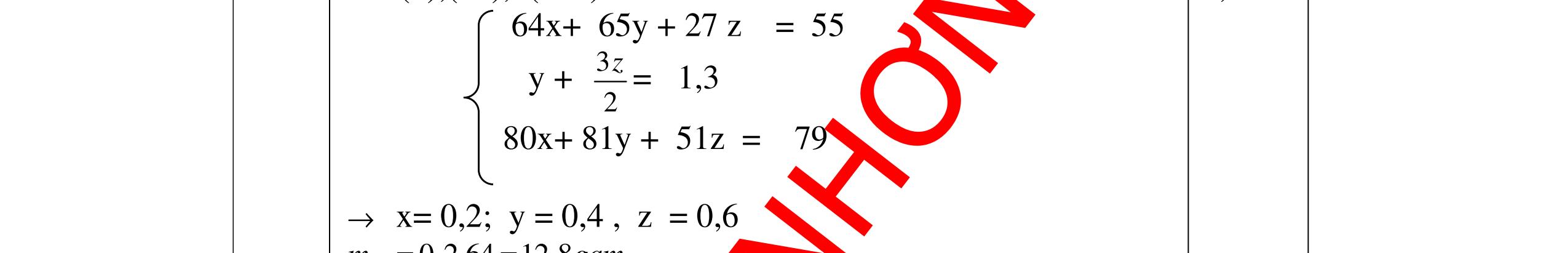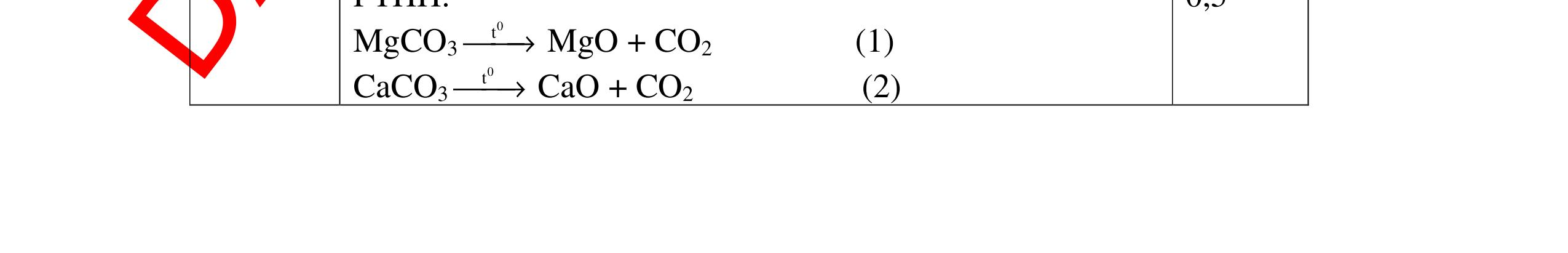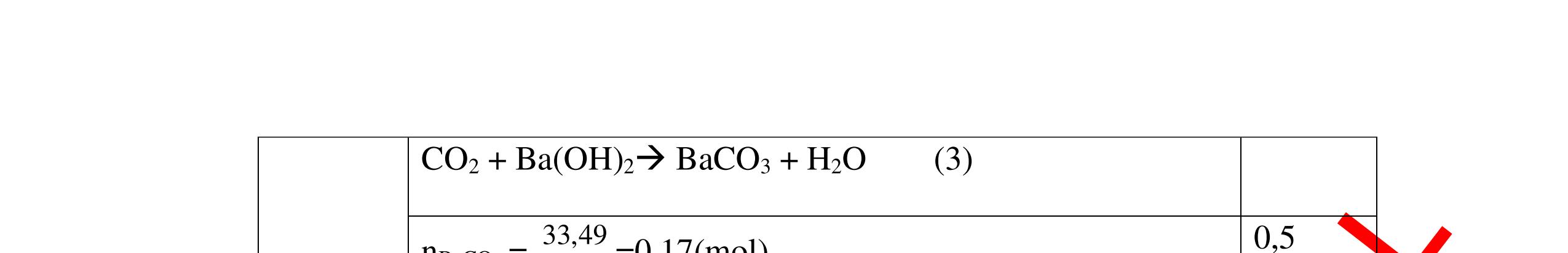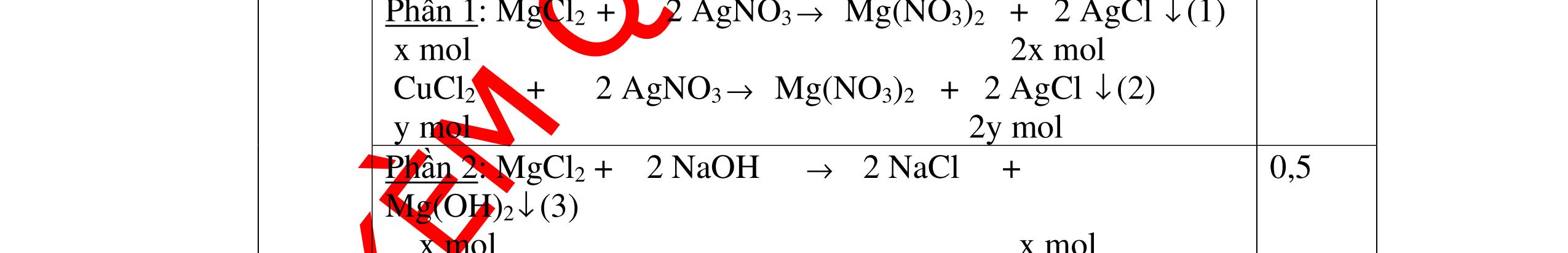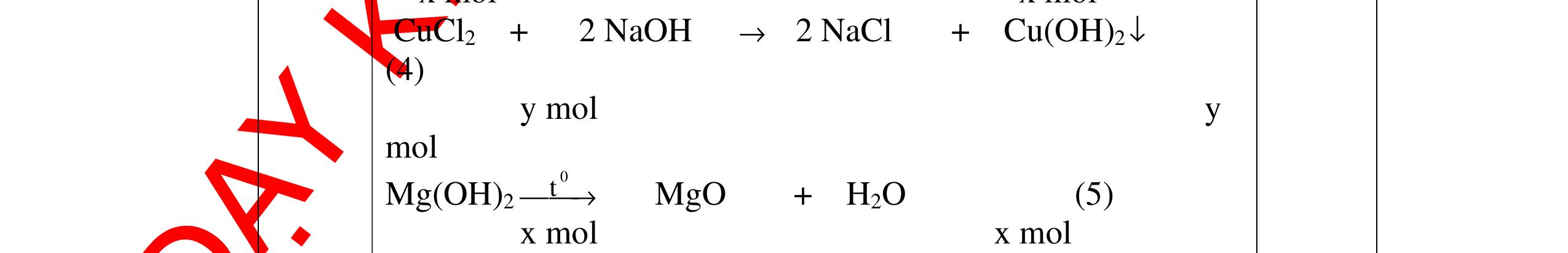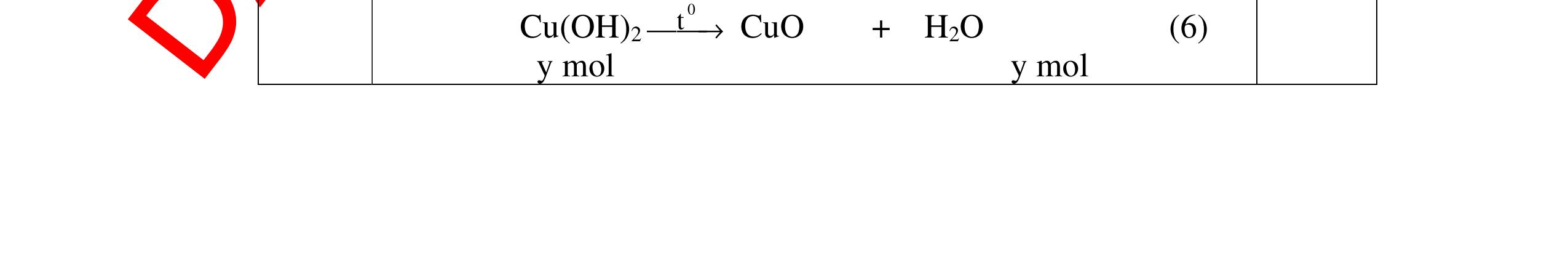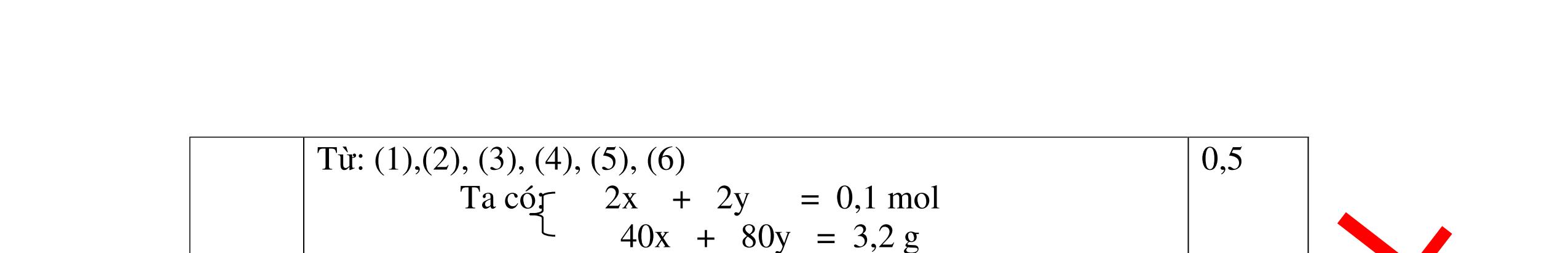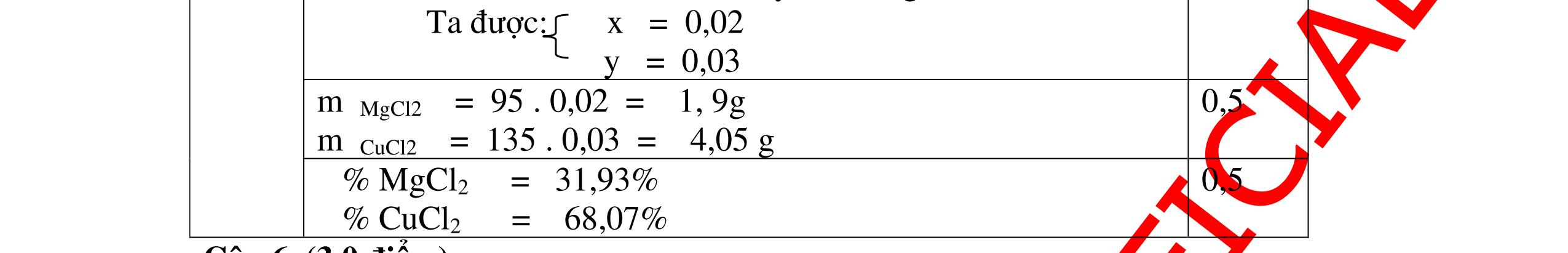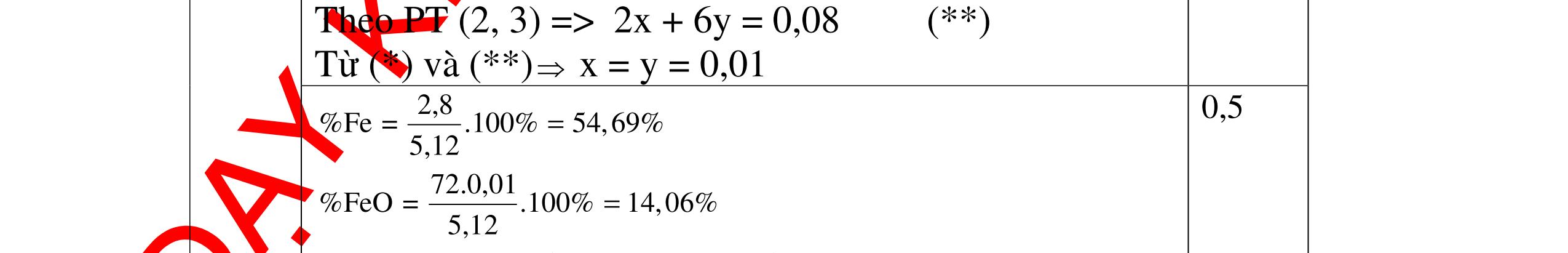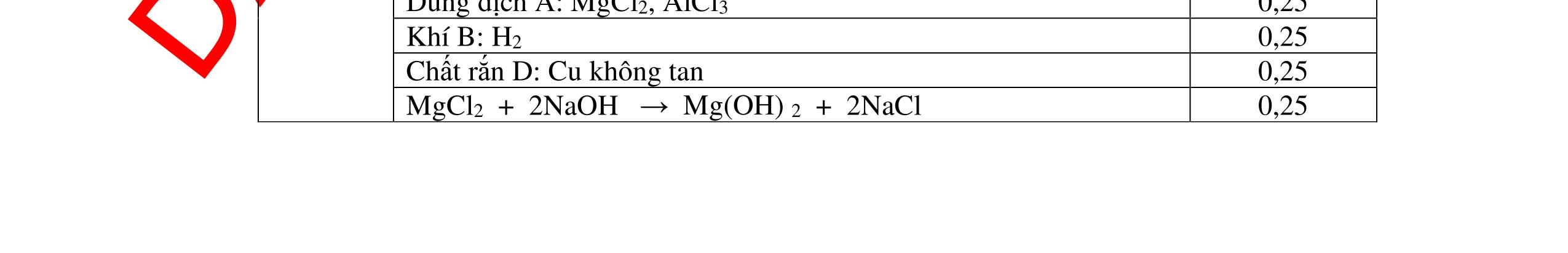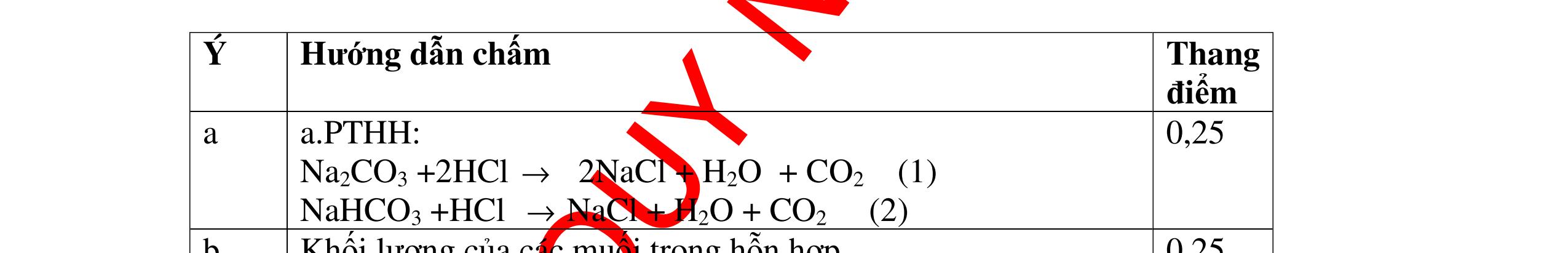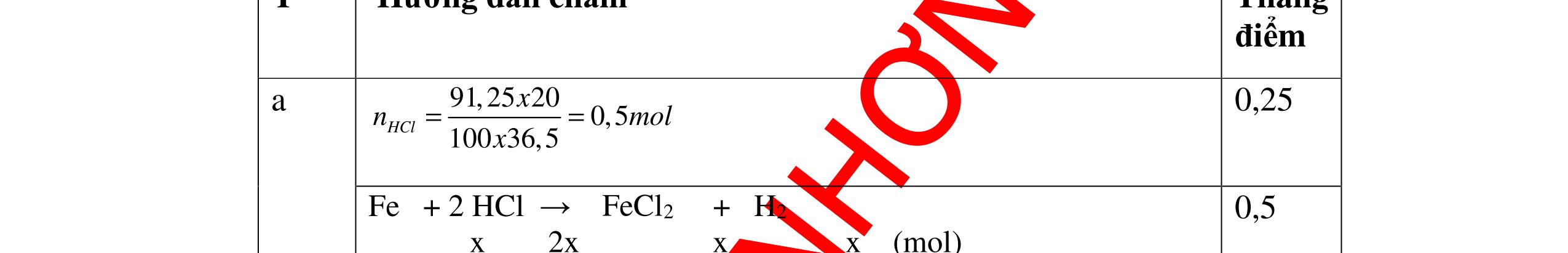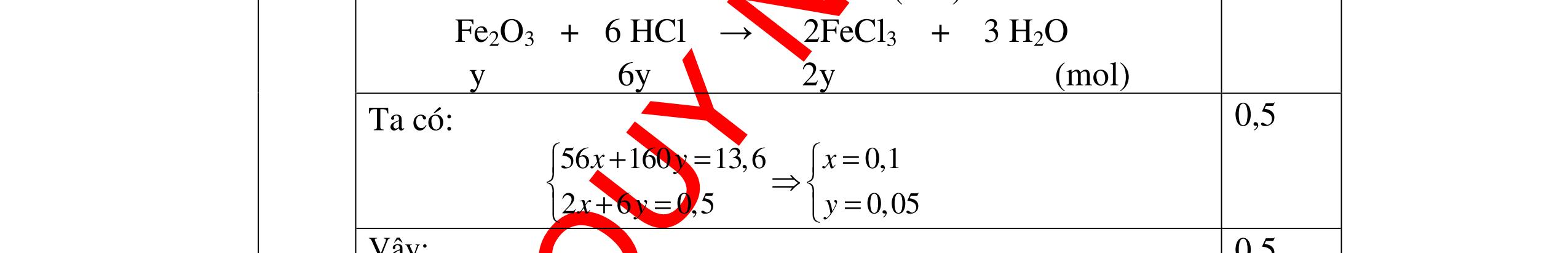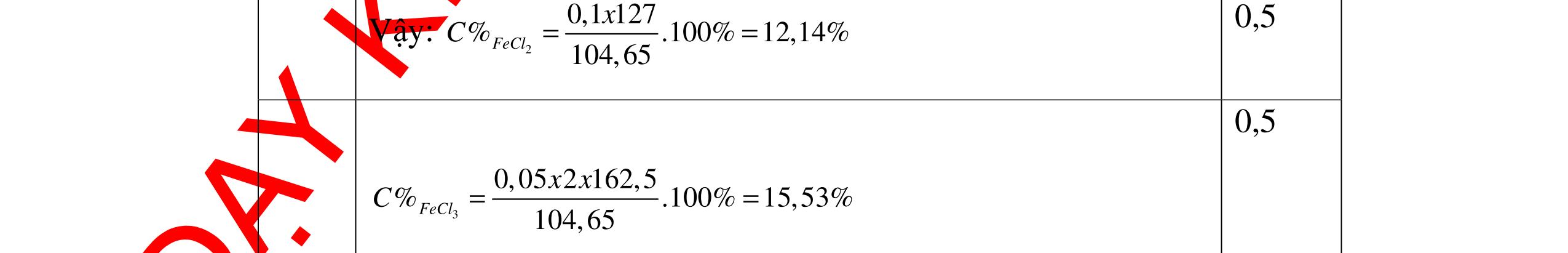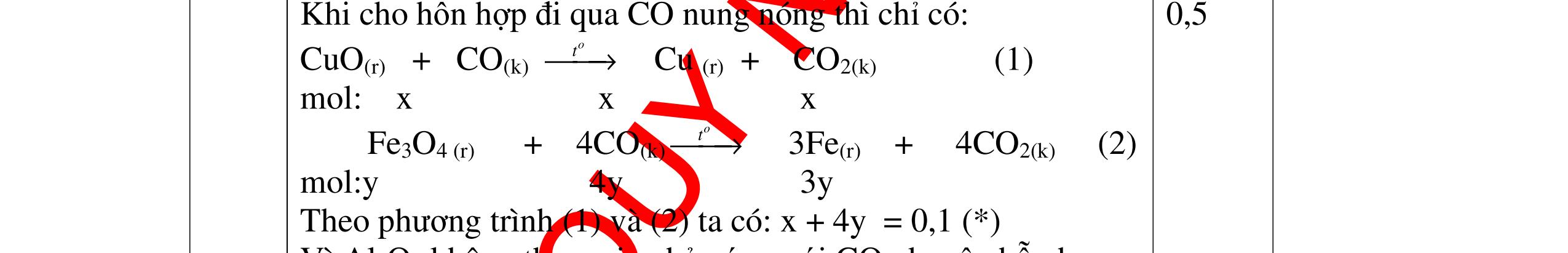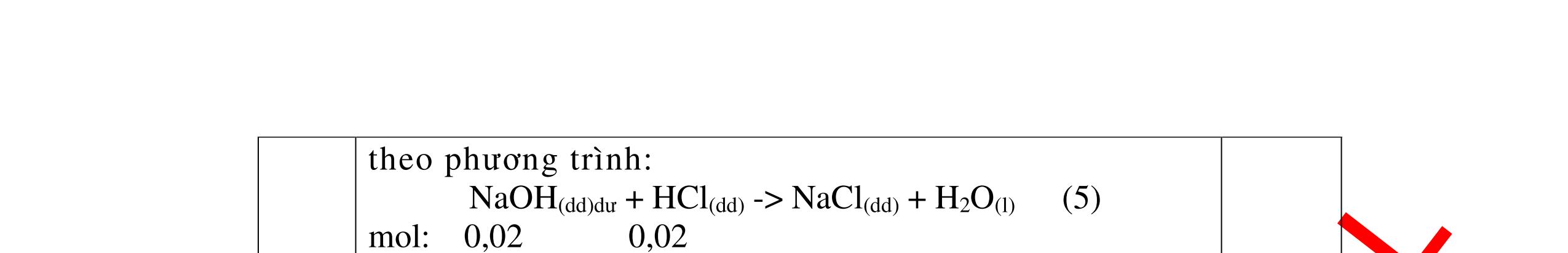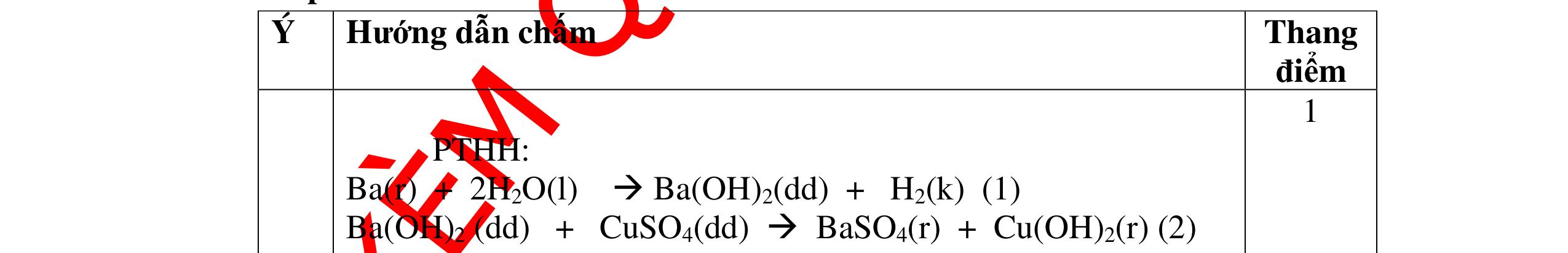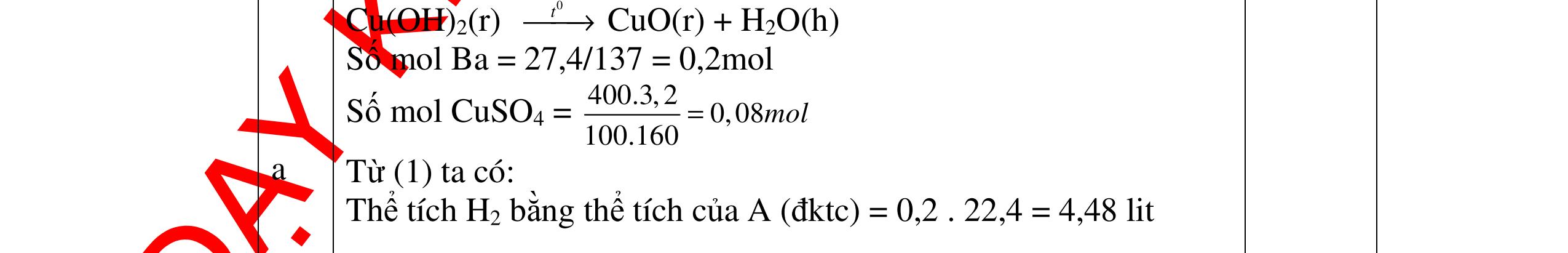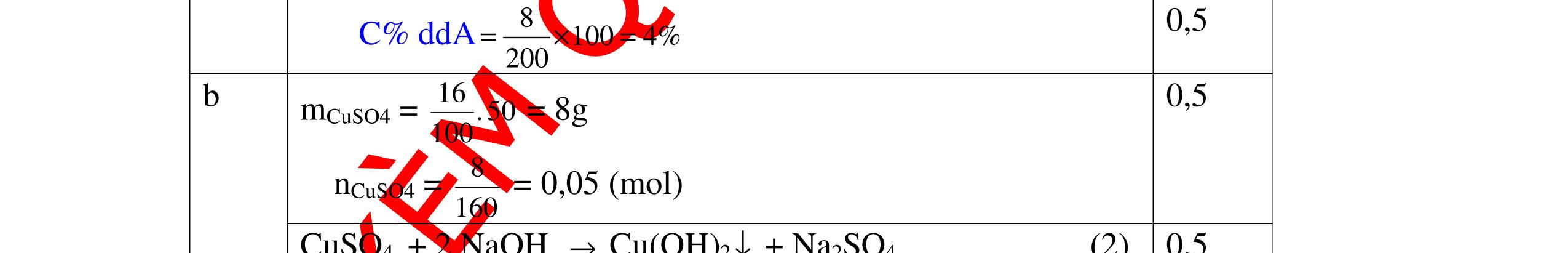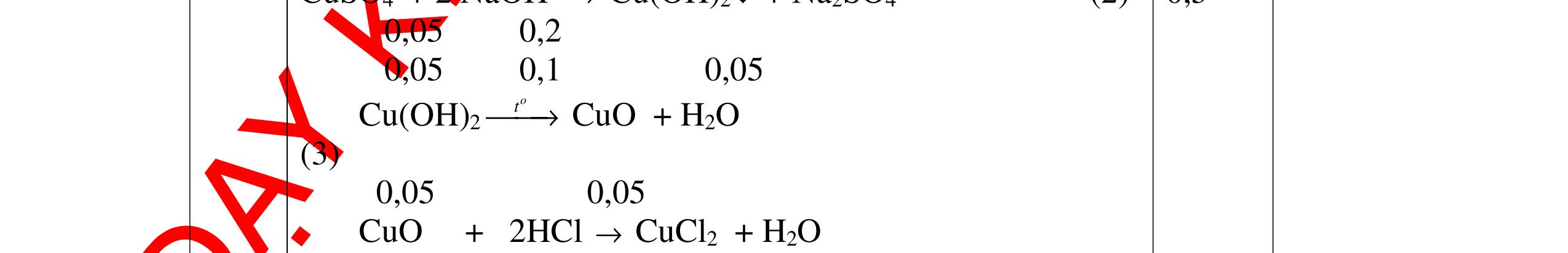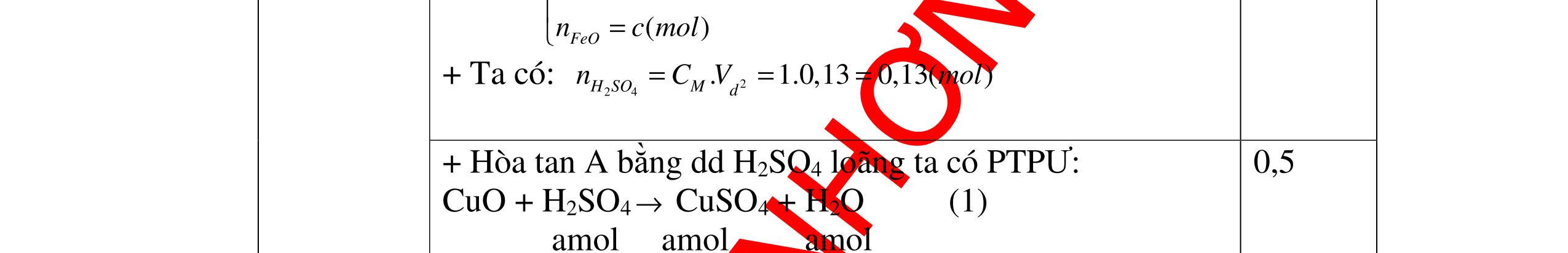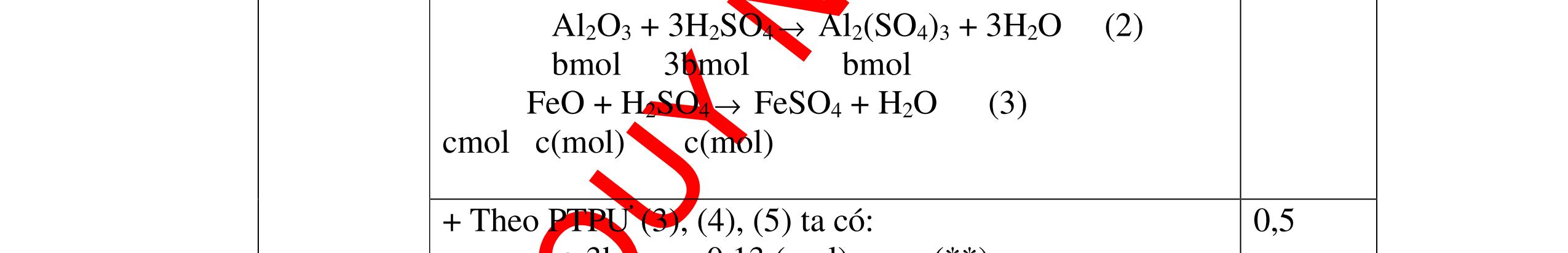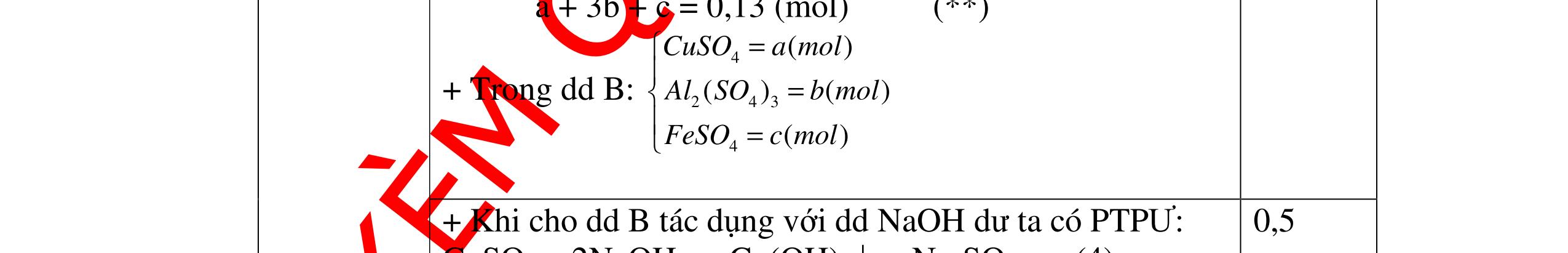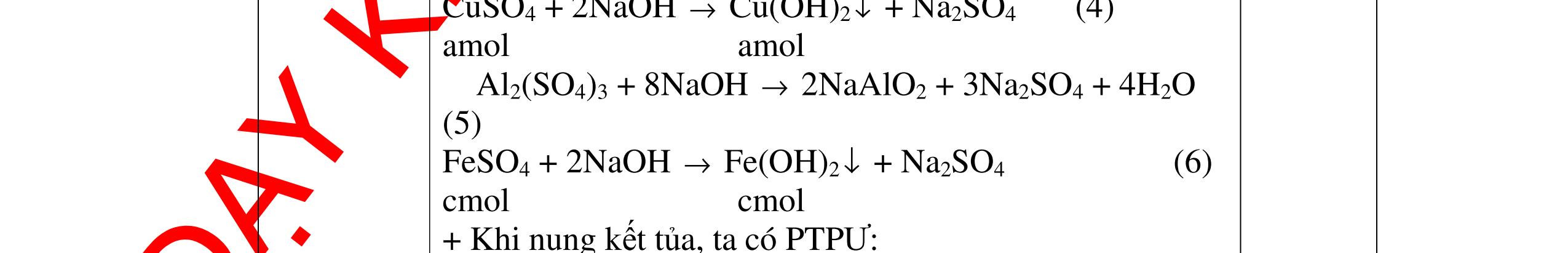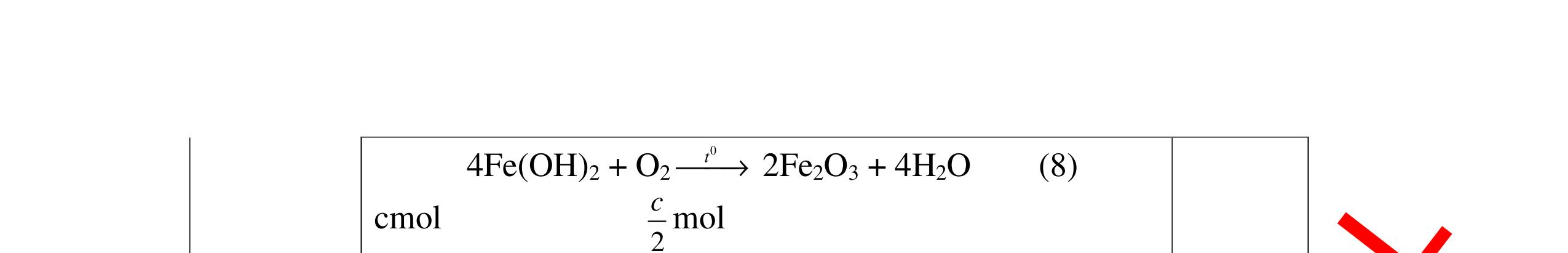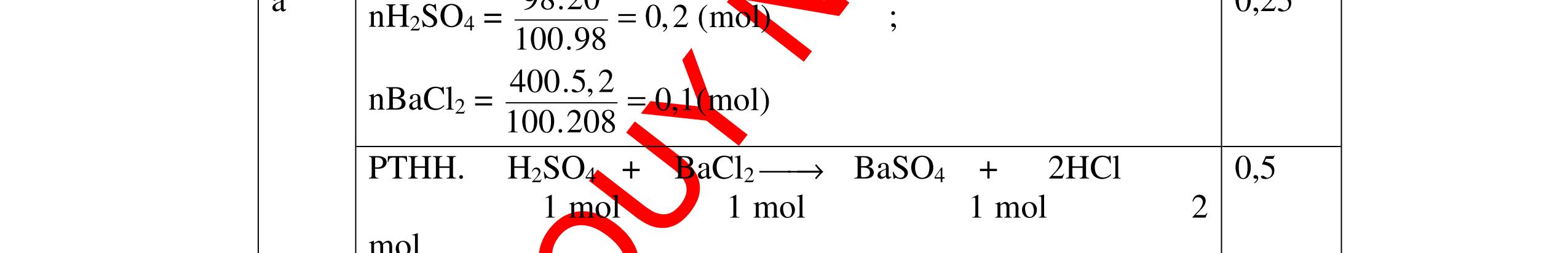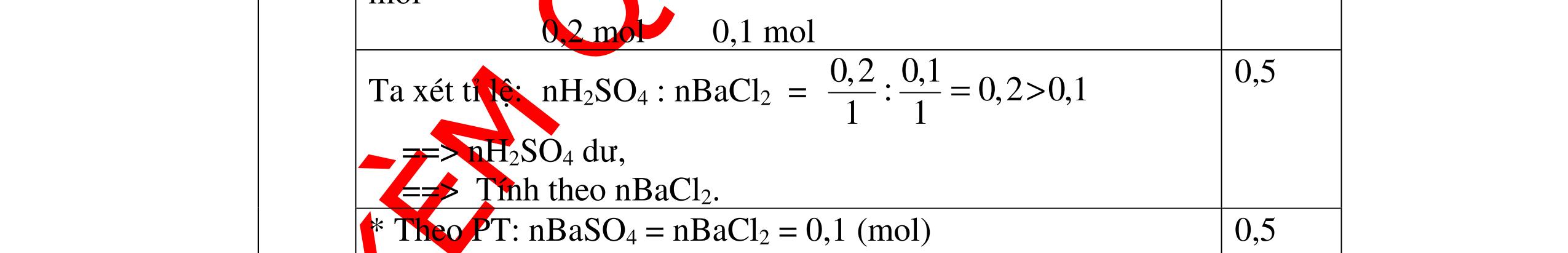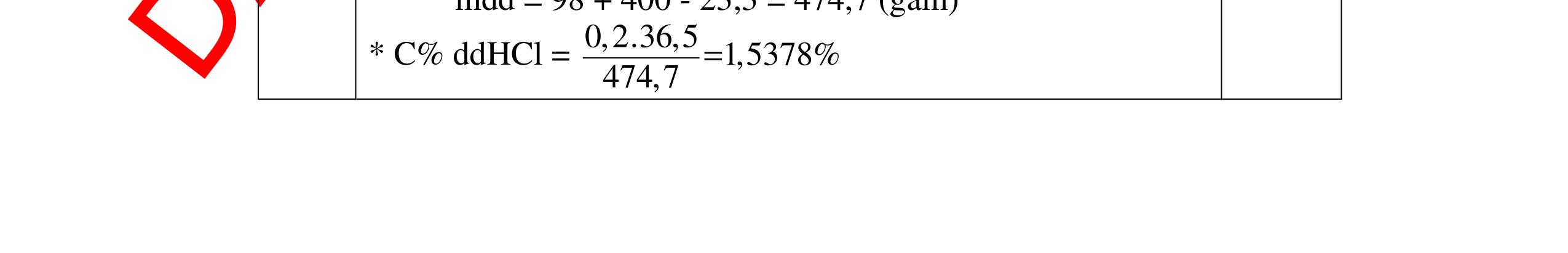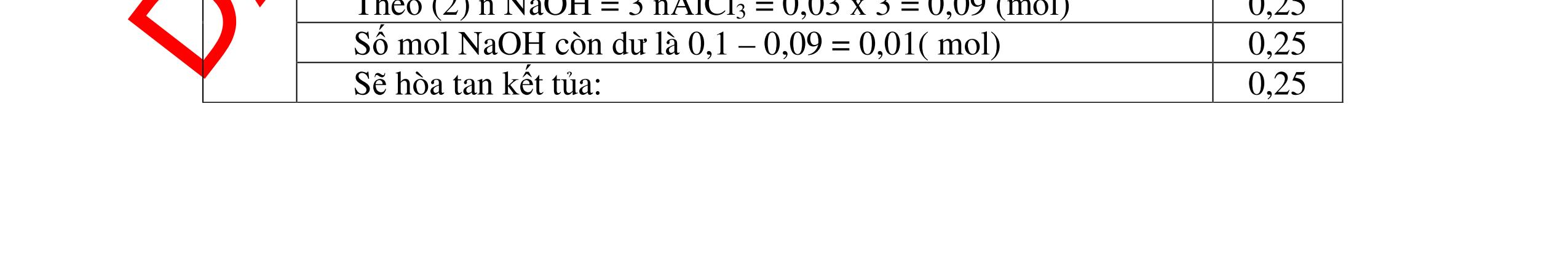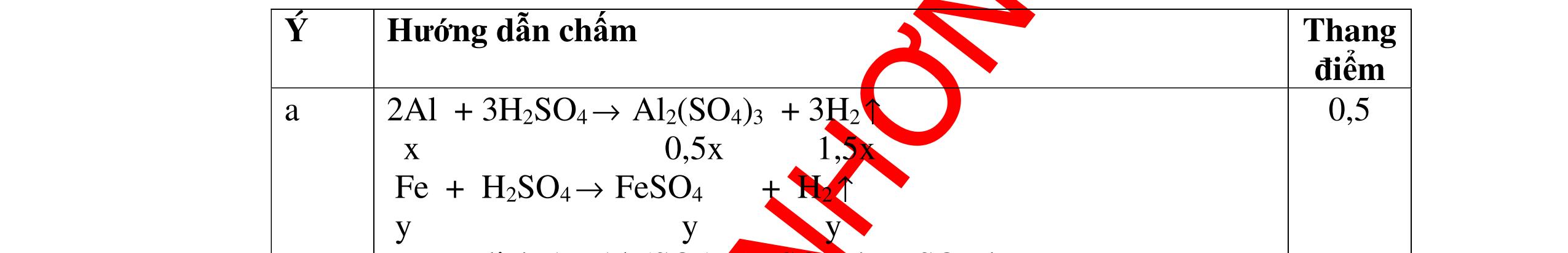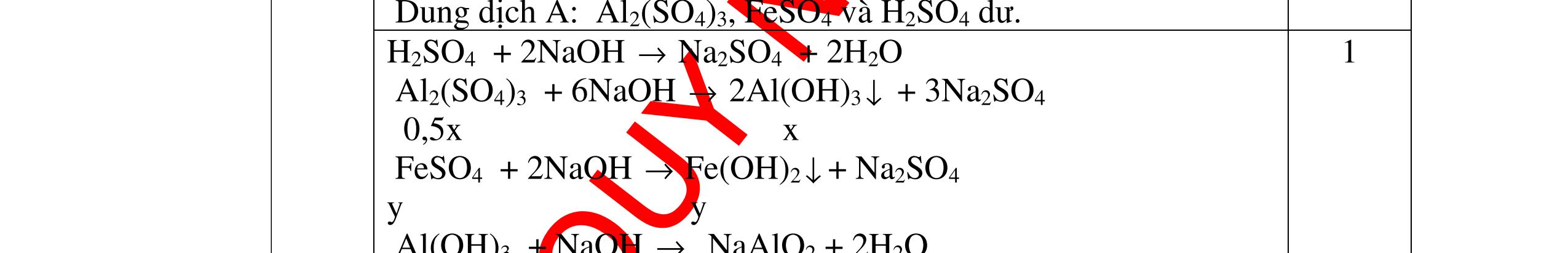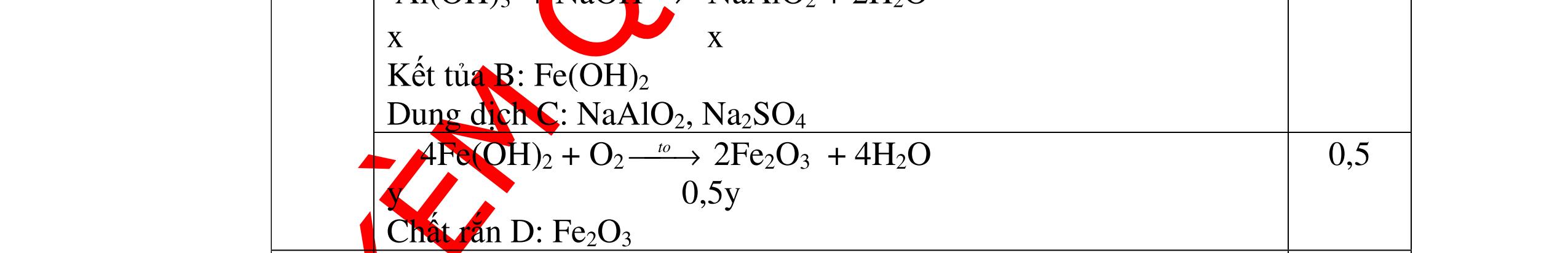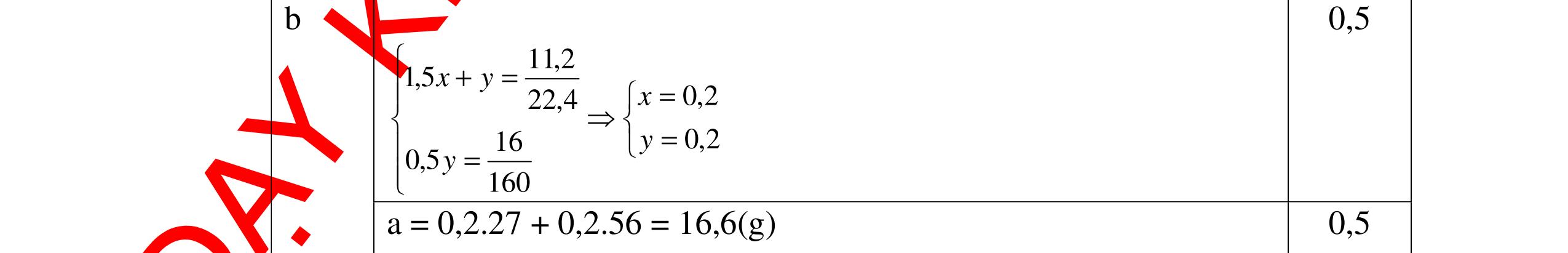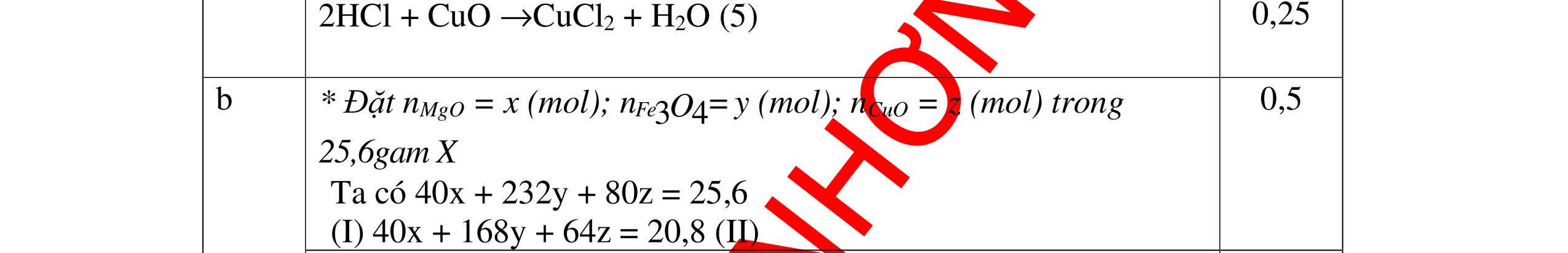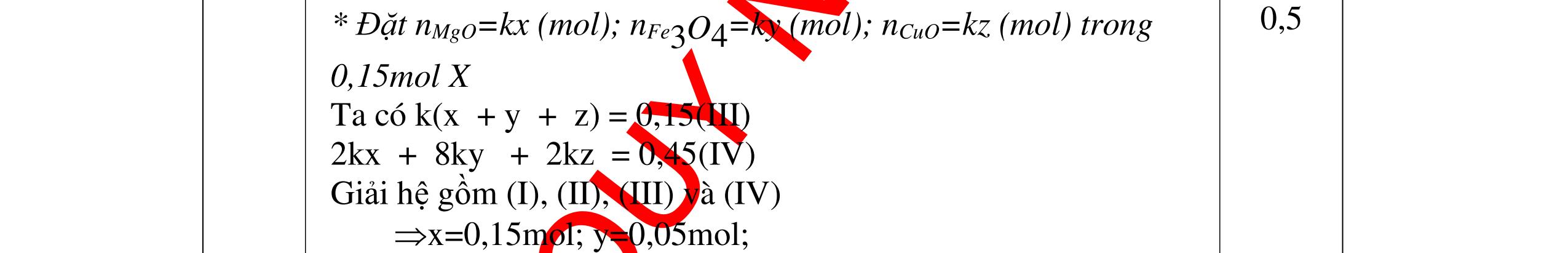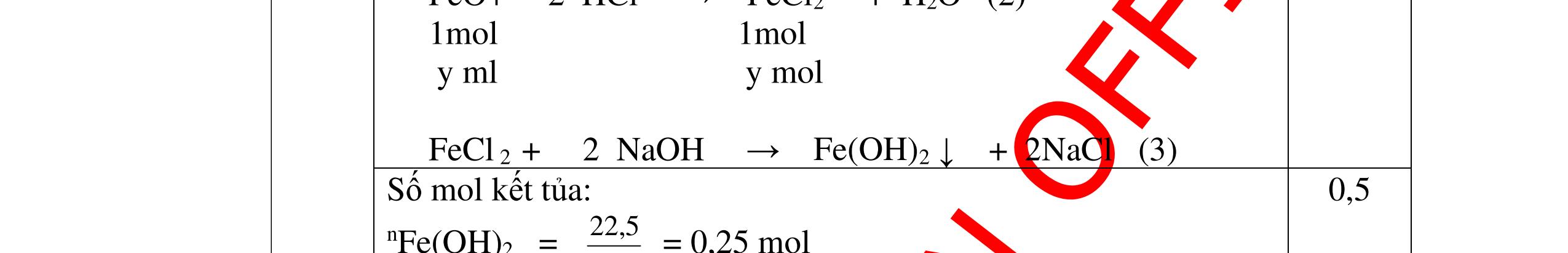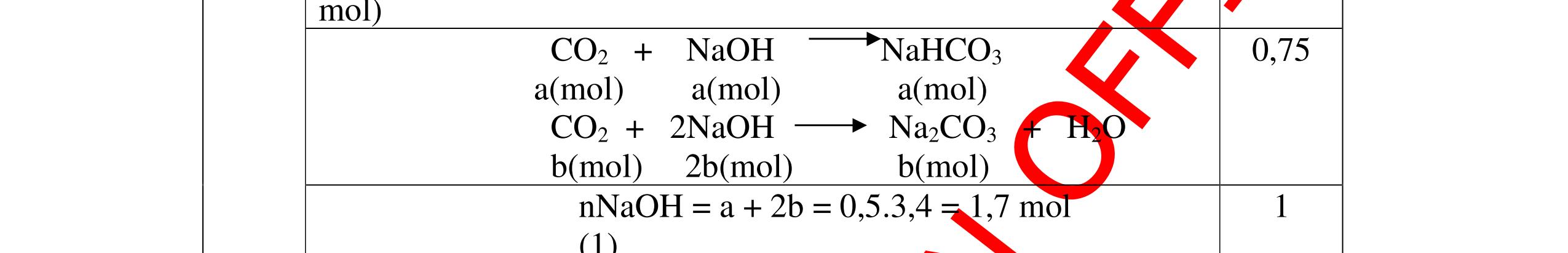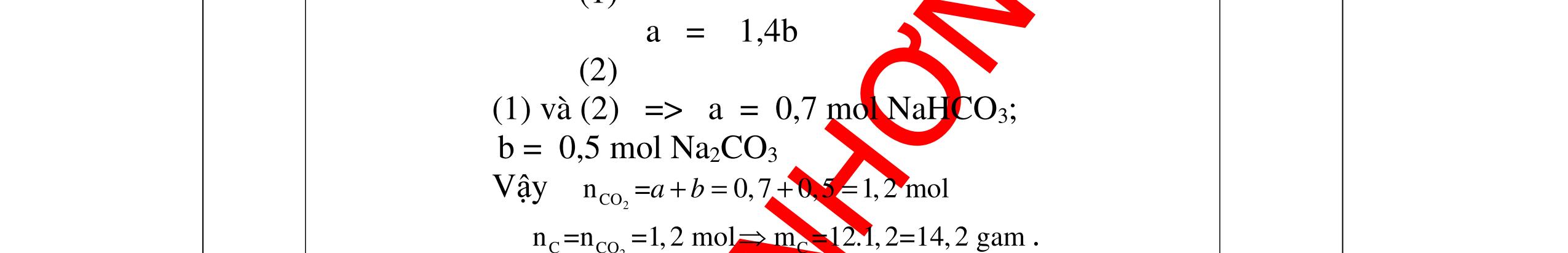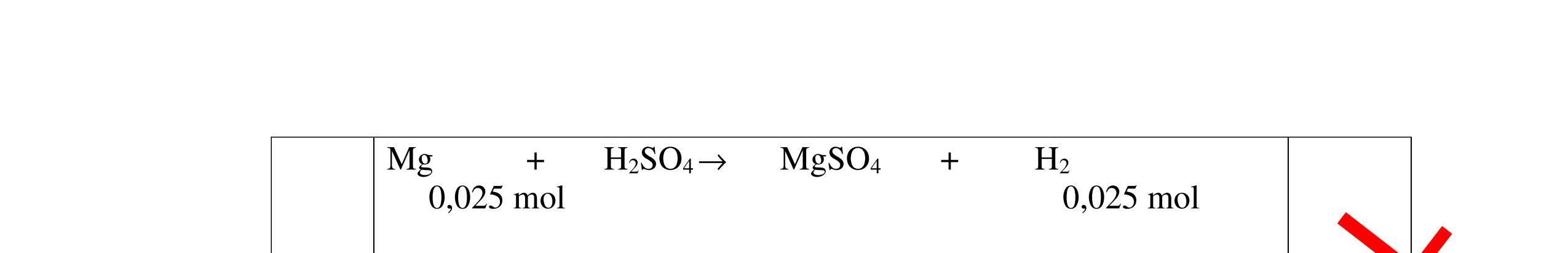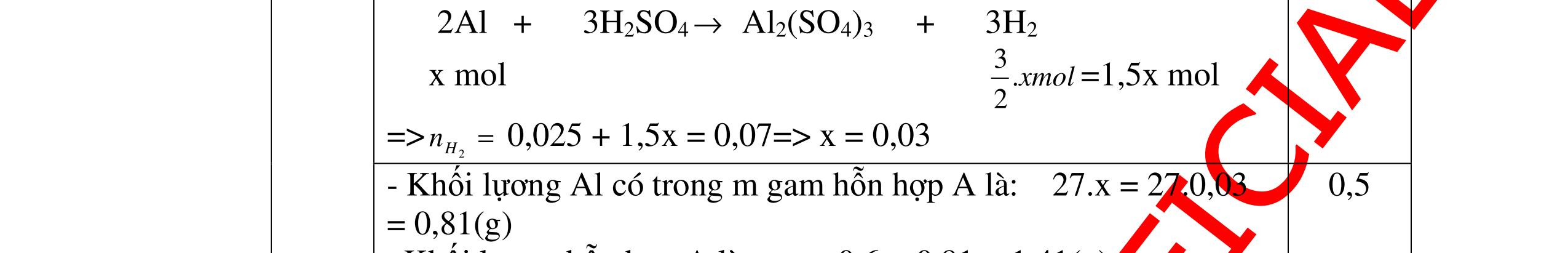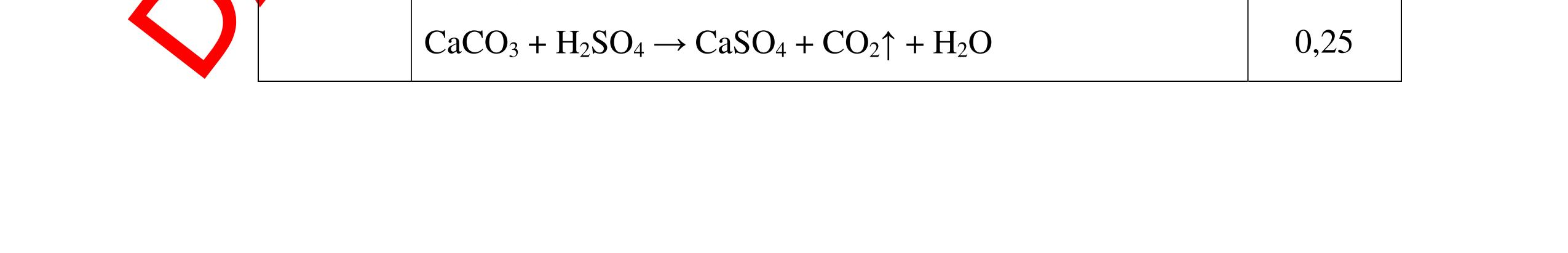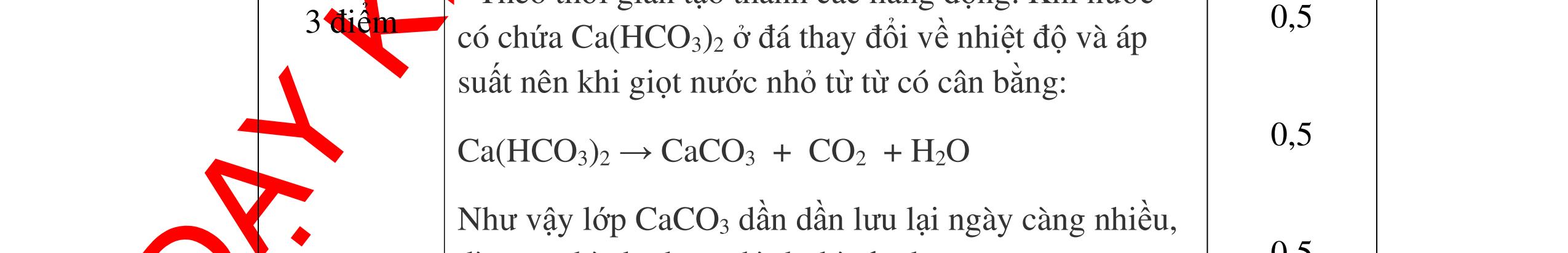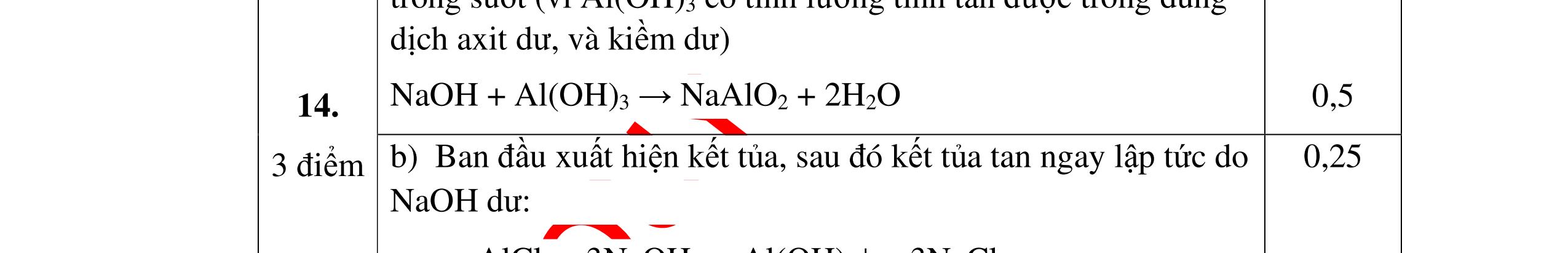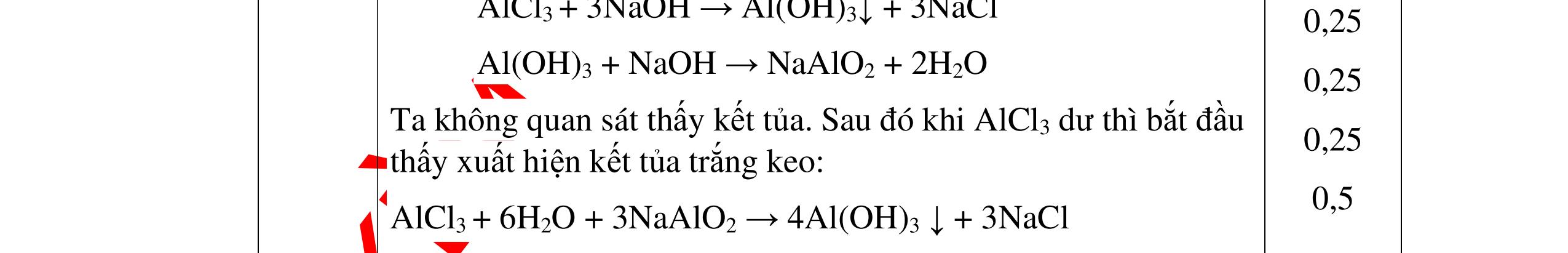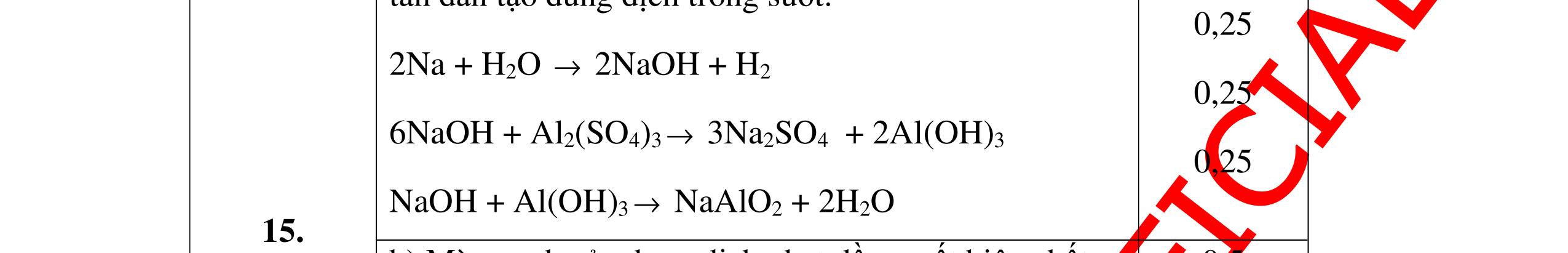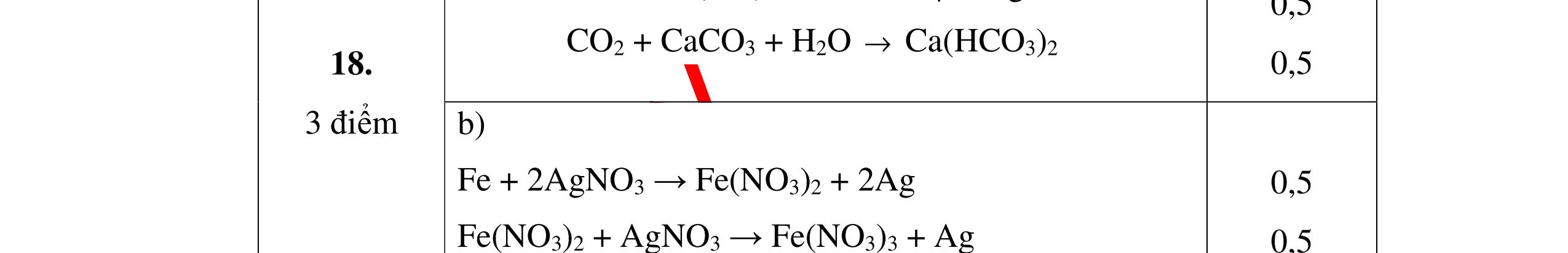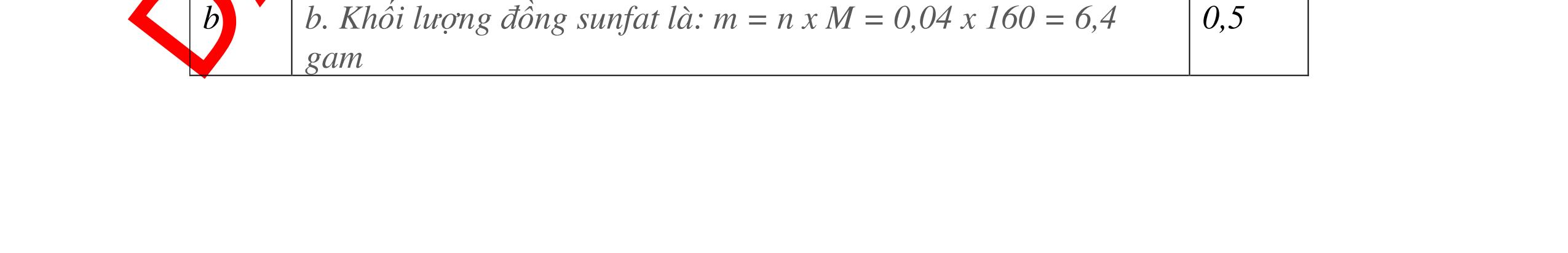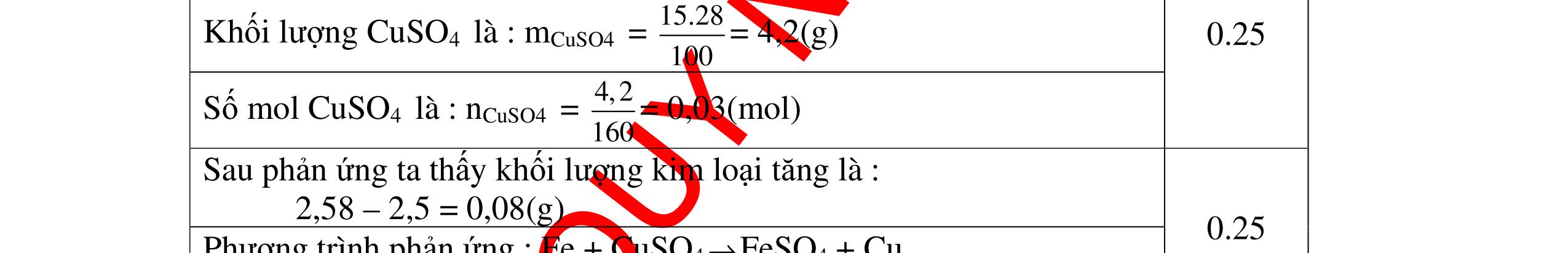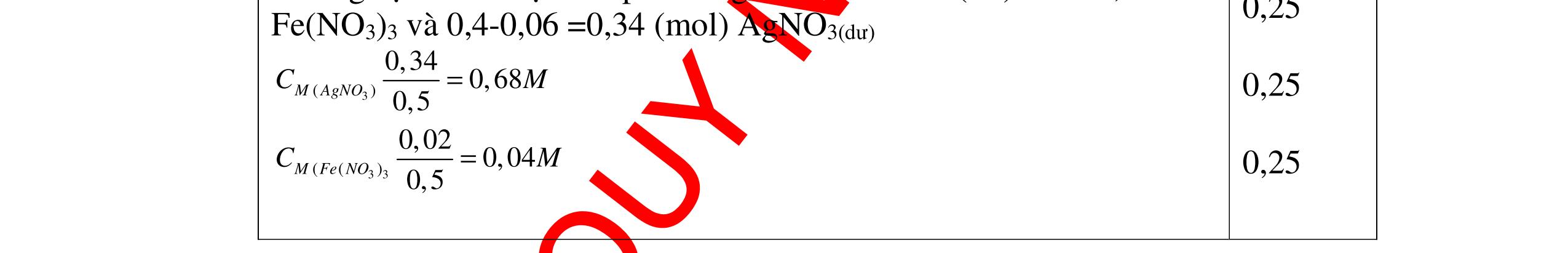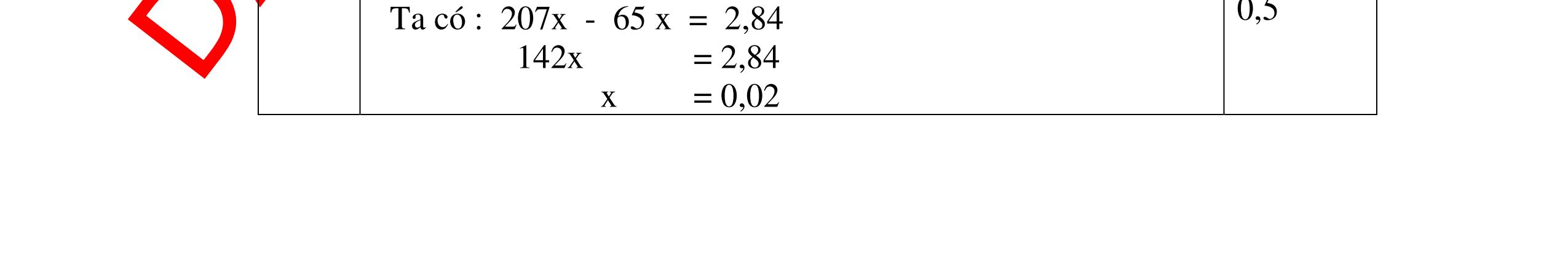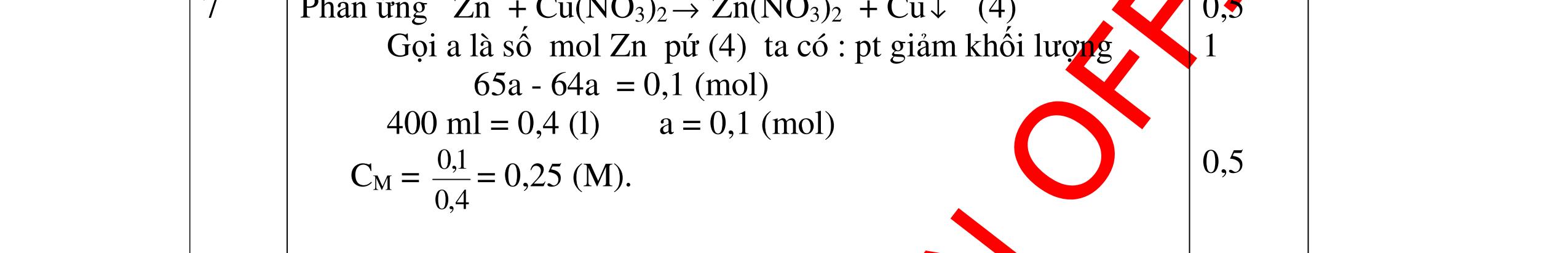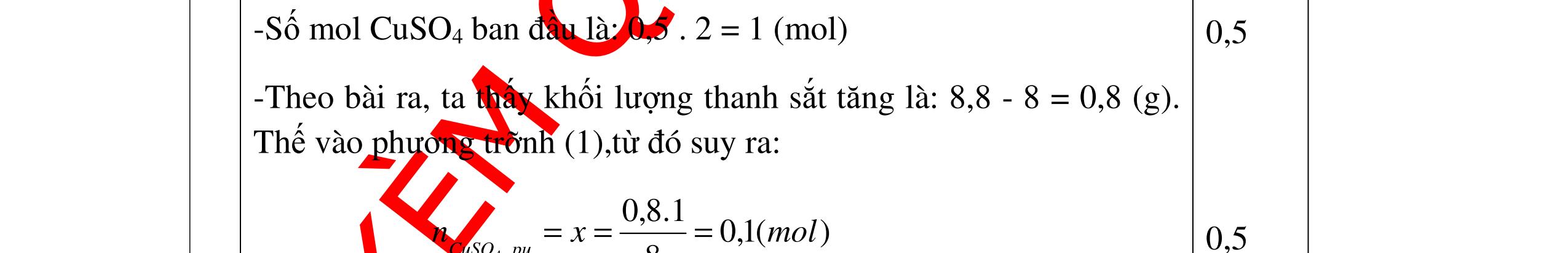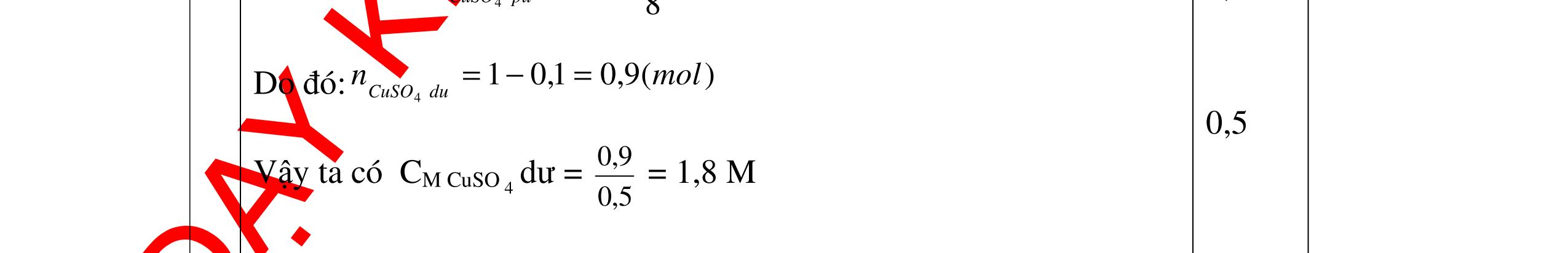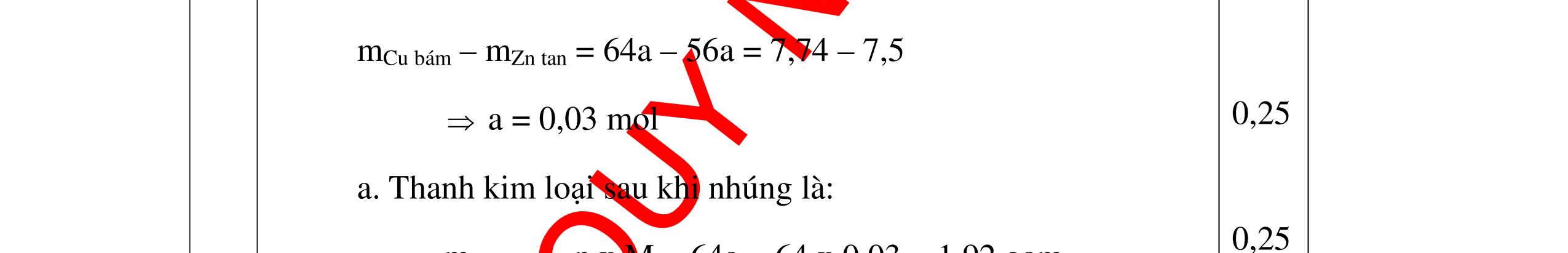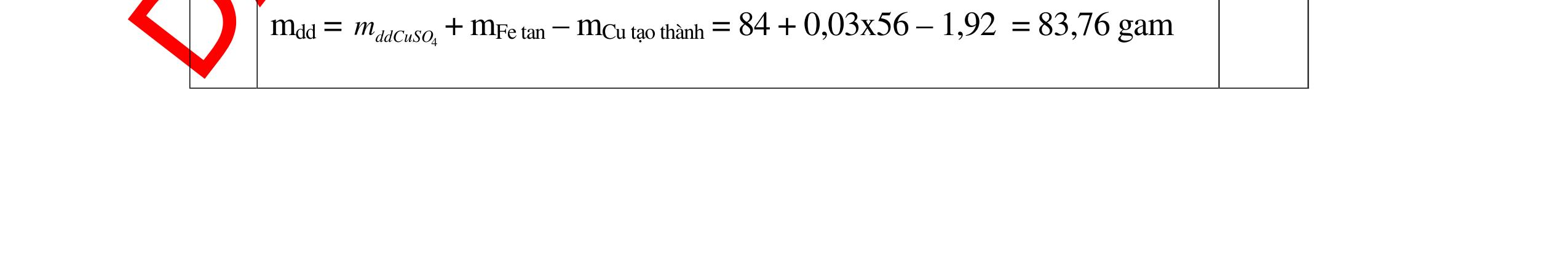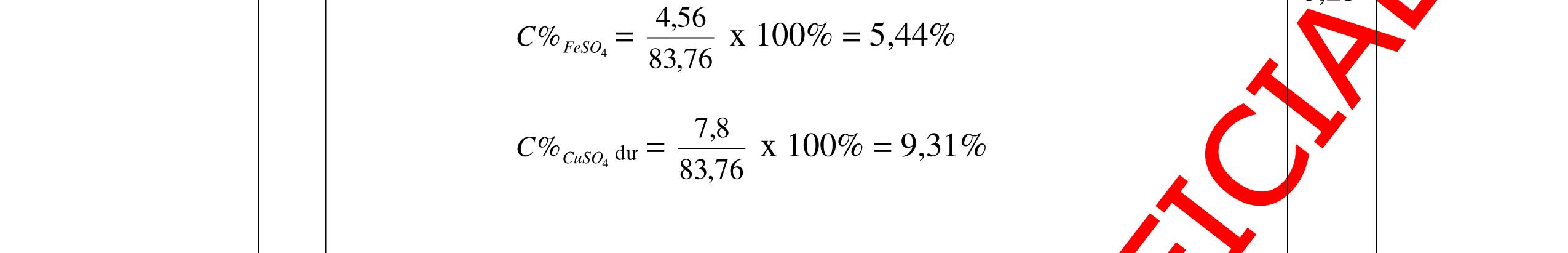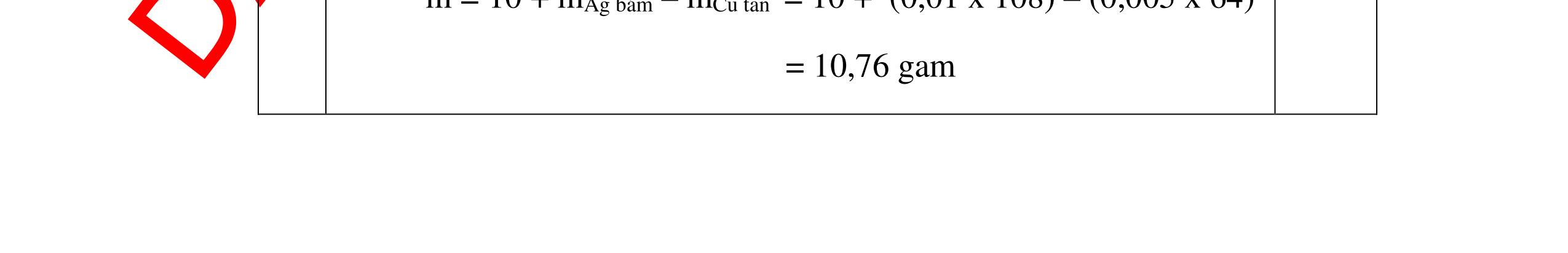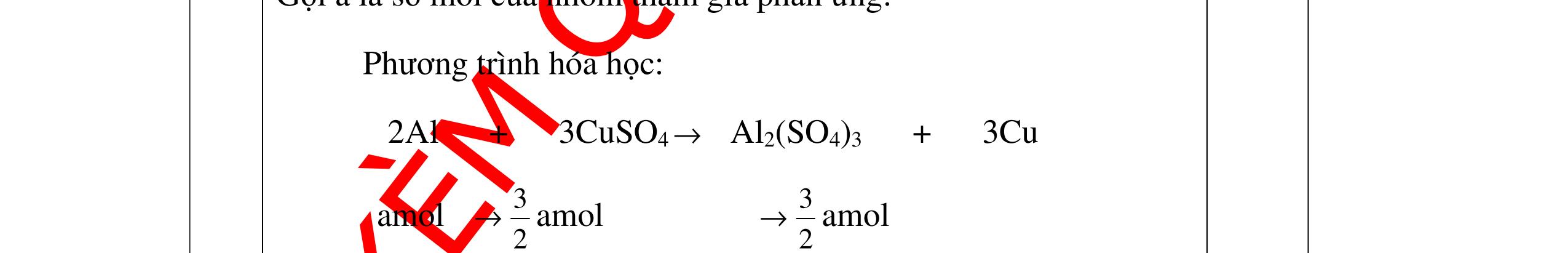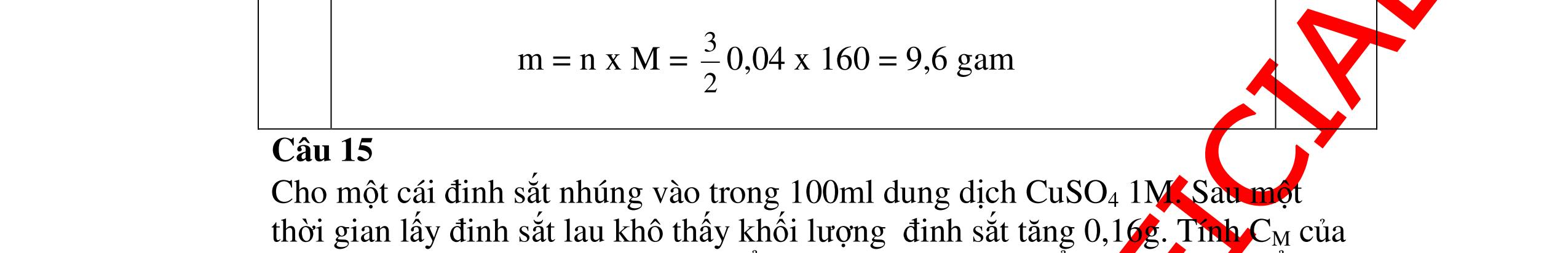CÁC CHUYÊN ĐỀ ÔN HỌC SINH GIỎI HÓA HỌC Ths Nguyễn Thanh Tú eBook Collection HỆ THỐNG CÂU HỎI MÔN HÓA HỌC 8, 9CHUYÊN ĐỀ ÔN HỌC SINH GIỎI (HƯỚNG DẪN CHI TIẾT) WORD VERSION | 2022 EDITION ORDER NOW / CHUYỂN GIAO QUA EMAIL TAILIEUCHUANTHAMKHAO@GMAIL.COM Hỗ trợ trực tuyến Fb www.facebook.com/DayKemQuyNhon Mobi/Zalo 0905779594 Tài liệu chuẩn tham khảo Phát triển kênh bởi Ths Nguyễn Thanh Tú Đơn vị tài trợ / phát hành / chia sẻ học thuật : Nguyen Thanh Tu Group vectorstock com/28062440
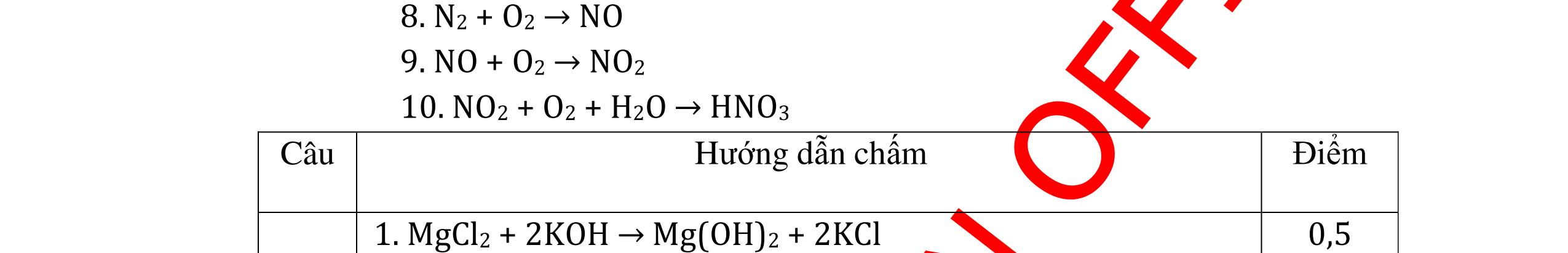
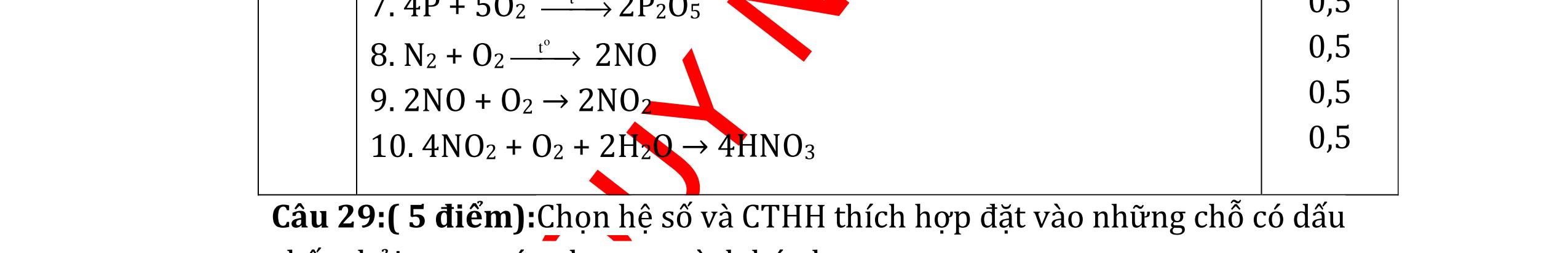
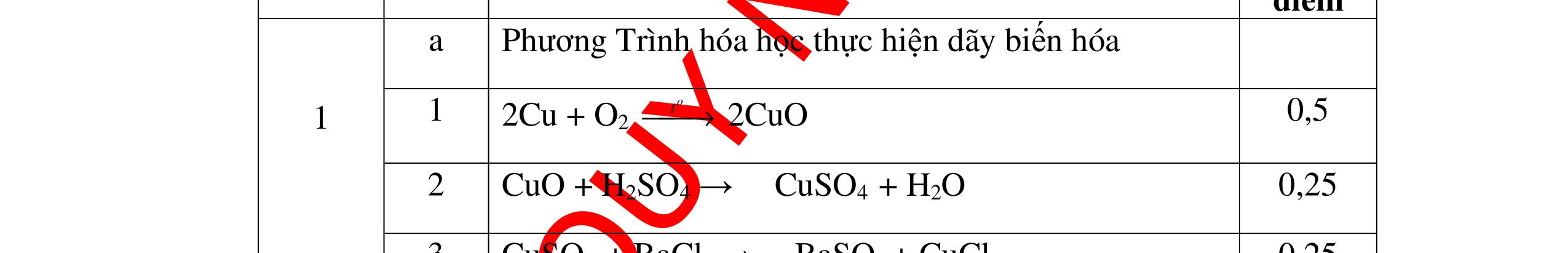
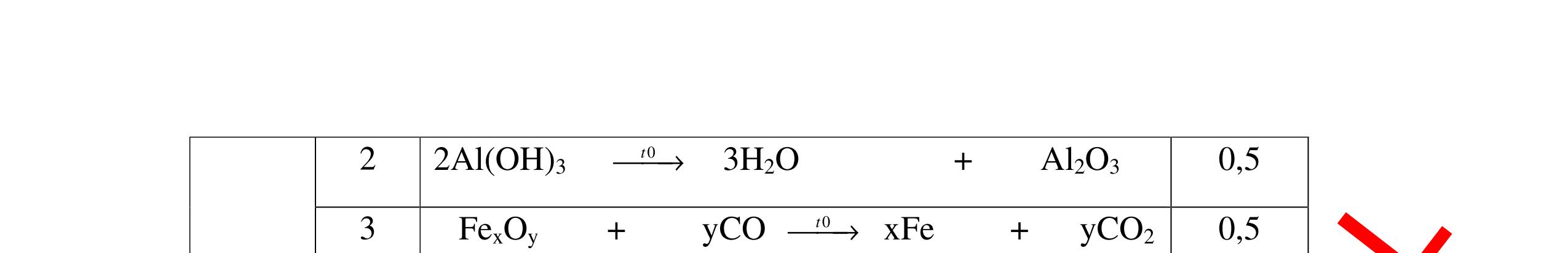
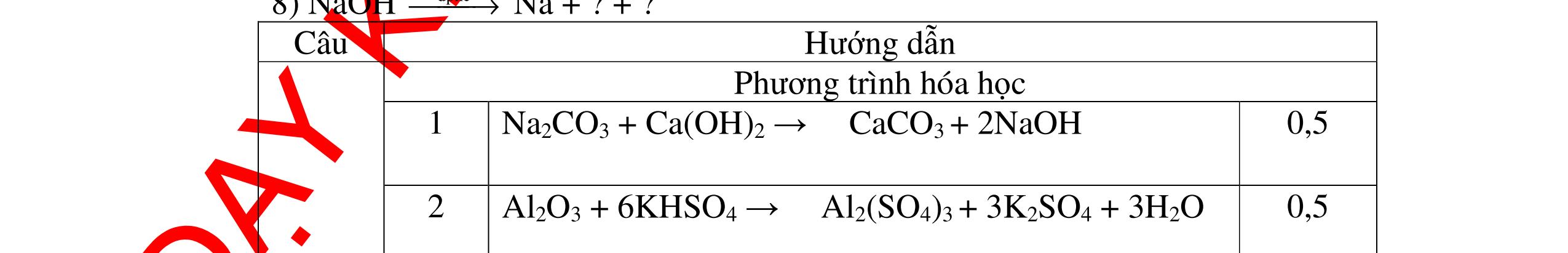
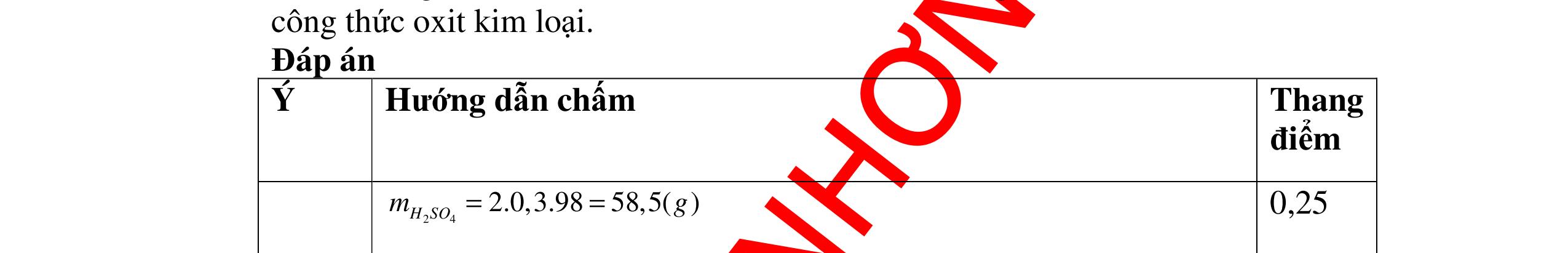
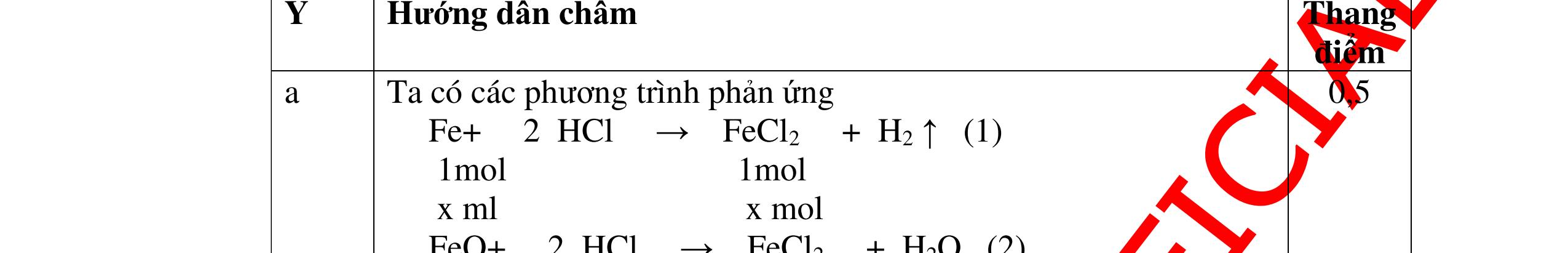
DẠYKÈMQUYNHƠNOFFICIAL CHỦ ĐỀ:ÁPDỤNG ĐỊNHLUẬTBẢOTOÀNKHỐILƯỢNG(1 điểm) Ngườithựchiện: 1)NguyễnThị ThùyDương-TrườngTHCSTTNậmNhùn(Từ câu1–3) Câu1. Hòa tan hoàn toàn 3,22g hỗn hợp X gồm Fe, Mg và Zn bằng một lượng vùa đủ dung dịch H2SO4 loãng, thu được 1,344 lít H2( ở đktc) và dung dịch chứa m gam muối. Tính giá trị của m? Câu Đápán Điểm 1 PTHH: Fe + H2SO4 → FeSO4 + H2 Mg + H2SO4 → MgSO4 + H2 Zn + H2SO4 → ZnSO4 + H2 0,5 242 HSOH nn0,06mol == Áp dụng BTKL có mmuối= 8,98 g 0,5 Câu2. Thực hiện nung a gam KClO3 và b gam KMnO4 để thu khí ôxi. Sau khi phản ứng xảy ra hoàn toàn thì thấy khối lượng các chất còn lại sau phản ứng bằng nhau. a. Tính tỷ lệ b a . b. Tính tỷ lệ thể tích khí ôxi tạo thành của hai phản ứng. Hướngdẫn: Câu 2 2KClO3 → 2KCl + 3O2 122 a → 122(74,5) a + 2 3a 0,25 2KMnO4 → K2MnO4 + MnO2 + O2 158 b → 197 2.158 b + 87 2.158 b + 2 b 0,25 87 158 197 158 74,5 122 abb =+ 0,25 122,5(19787) 1,478 2.158.74,5 a b + =≈ 0,25 3 .22,4:.22,434.434 22 aba b =≈
0,25
mN = 12,75 x 16,47 % = 2,1( gam)
mK = 12,75 - ( 4,8 + 2,1) = 5,85 (gam).
→ nO = 4,8 / 16 = 0,3 (mol); nN = 2,1 / 14 = 0,15(mol);
nK = 5,85 / 39 = 0,15 ( mol)
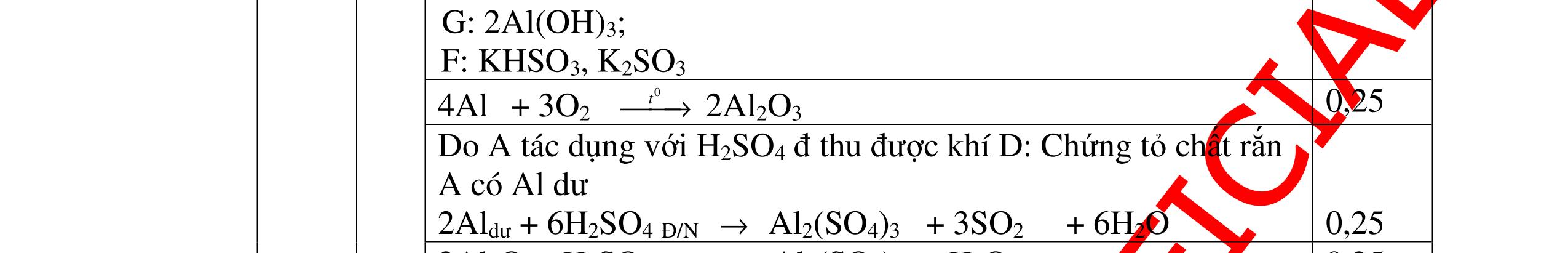
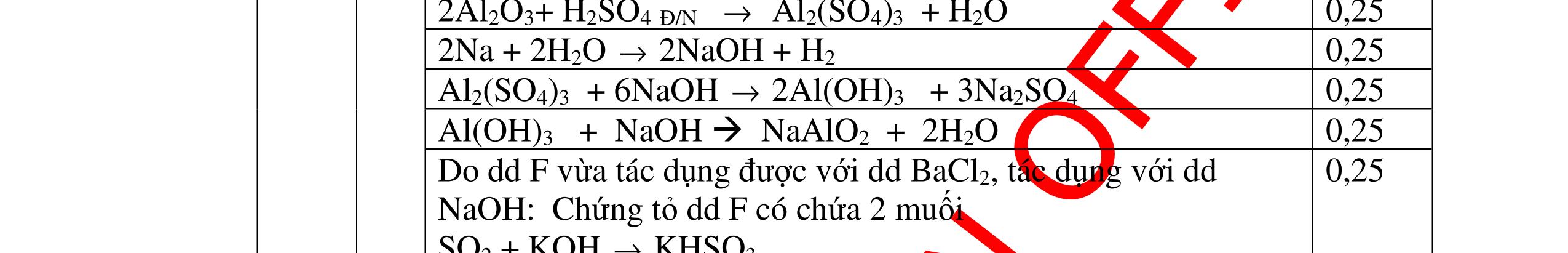
Gọi CTHH của B là KxNyOz
ta có x : y : z = nK : nN : nO = 0,15 : 0,15 : 0,3 = 1 : 1 : 2 chọn x = 1, y = 1, z = 2 → công thức đơn giản nhất là KNO2
Theo gt CTHH của B là KNO2.
Trong A: theo định luật bảo toàn nguyên tố moxi =4,8 + 2,4 = 7,2 (gam); nO = 7,2 / 16 = 0,45 (mol); nN = 0,15(mol).; nK = 0,15 ( mol)
Gọi CTHH của A là KaNbOc ta có a : b : c = 0,15 : 0,15 : 0,45 = 1 : 1 : 3 ; chọn a = 1, b = 1, c =3
theo gt CTHH của A là KNO3
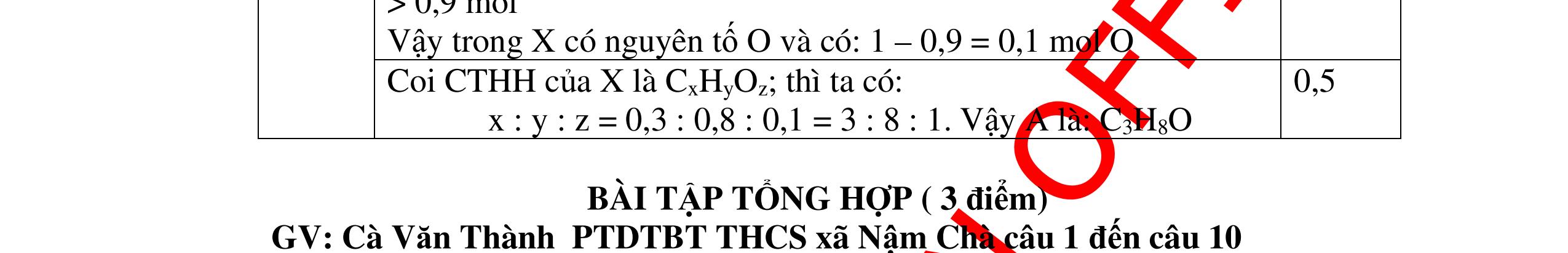
DẠYKÈMQUYNHƠNOFFICIAL Câu3. Nung hoàn toàn 15,15 gam chất rắn A thu được chất rắn B và 1,68 lít khí oxi (ở đktc). Trong hợp chất B có thành phần % khối lượng các nguyên tố: 37,65% oxi, 16,47% nitơ còn lại là kali. Xác định công thức hóa học của B và A. Biết rằng công thức đơn giản nhất chính là công thức hóa học của A, B. Câu Hướngdẫnchấm Điểm 3 Ta có sơ đồ: A → B + O2 n O2 = 1,68/ 22,4 = 0,075 (mol).; m O2 = 0,075 x 32 = 2,4 ( gam). Theo định luật bảo toàn khối lượng ta có: mA = mB + m oxi → mB = mA - moxi = 15,15 - 2,4 = 12,75(gam). 0,25 Trong B: mO = 12,75 x 37,65% = 4,8(gam)
0,5
DẠYKÈMQUYNHƠNOFFICIAL CHỦ ĐỀ:TÌMNGUYÊNTỐ DỰAVÀOSỐ HẠTP,N,E(1 điểm) Ngườithựchiện: 1)NguyễnThị ThùyDương-TrườngTHCSTTNậmNhùn(Từ câu1–8) Câu1. Tổng số hạt proton, nơtron, electron của một nguyên tố X là 40, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 12. Xác định nguyên tử khối của X, tên gọi của nguyên tố X và vẽ sơ đồ cấu tạo nguyên tử của nguyên tố X. Câu Hướngdẫnchấm Điểm 1 Gọi số proton trong hạt nhân nguyên tử của nguyên tố X là: p Số nơtron trong hạt nhân nguyên tử của nguyên tố X là: n 0.25 Lập hệ phương trình: = += 212 240 pn pn Giải ra ta được: p=13, n=14 0.25 Nguyên tử khối của nguyên tố X là: 13+14= 27 Là nguyên tố nhôm, kí hiệu hoá học là Al 0.25 +13 0.25 Câu2. Tổng số hạt trong nguyên tử nguyên tố X là 58. Số hạt mang điện nhiều hơn số hạt không mang điện là 18 hạt. Tính số n, p, e trong X ? Câu Hướngdẫnchấm Điểm 2 Ta có : p + n +e = 58 =>2p + n = 58 (Vì số p = số e) ( 1) 0.25 Do số hạt mang điện nhiều hơn số hạt không mang điện là 18 nên : 2p – n = 18 ( 2) 0.25 Từ (1) và (2) tìm được : n = 20 ; p = 19 0.5 Câu3. Tổng số hạt proton, nơtron, electron trong hai nguyên tử của nguyên tố X và Y là 96, trong đó có tổng số hạt mang điện nhiều hơn số hạt không mang điện là 32. Số hạt mang điện của nguyên tử Y nhiều hơn của X là 16. Xác định KHHH của X và Y?
DẠYKÈMQUYNHƠNOFFICIAL Câu Hướngdẫnchấm Điểm 3 - Gọi số hạt trong X: P, N, E; trong Y là : P/. N/, E/ 0.25 Theo giả thiết có hệ PT: // // / 2PN2PN96 2PN2PN32 2P2P16 +++= −+−= −= -> / / 4P4P128 2P2P16 += −+= -> P= 12; P/ = 20 0.5 X là Mg; Y là Ca 0.25 Câu4. Một nguyên tử X có tổng số hạt dưới nguyên tử là 42. Tính số proton trong nguyên tử X và cho biết X thuộc nguyên tố hóa học nào trong số các nguyên tố có số proton sau đây: C: 6; N: 7; O: 8; Na: 11; Mg: 12; Al: 13; K: 19 . Biết trong nguyên tử X có 1 < p n < 1,5 . Câu Hướngdẫnchấm Điểm 4 Nguyên tử nguyên tố X có p + e + n = 42 mà p = e 2p + n = 42 n = 42- 2p. 0.5 Lại có 1< n p < 1,5 => 1< 422 p p < 1,5 1p < 42 – 2p < 1,5p 12 < p < 14 mà p là số nguyên nên p = 13 0.25 Vậy X là nguyên tố nhôm (Al) 0.25 Câu5. Nguyên tố X có tổng các hạt cơ bản là 82. Hạt mang điện nhiều hơn hạt không mang điện là 22. Xác định nguyên tố X. Câu Hướngdẫnchấm Điểm 5 X có : p + e + n = 82 mà p + e - n = 22 0.25 Mặt khác p = e → p = e = 26 → n = 30 0.5 → X là Fe : sắt 0.25
DẠYKÈMQUYNHƠNOFFICIAL Câu6. Nguyên tử X có tổng các hạt là 52 trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 16 hạt. Hãy xác định số hạt p, n e trong nguyên tử X. Câu Hướngdẫnchấm Điểm 6 Ta có p + n + e = 52 P + e – n = 16 0.25 Vì p = e nên : 2p + n = 52 2p – n = 16 0.25 Suy ra 4p = 68 Suy ra p = e = 17 , n = 18 0.5 Câu7. Nguyên tử của một nguyên tố có tổng số các loại hạt là 34, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 10. Tính thành phần phần trăm về số lượng của các hạt trong nguyên tử nguyên tố đó. Câu Hướngdẫnchấm Điểm 7 Tổng số hạt bằng 34 ta có: n + p+ e = 34 (1) 0.25 Số hạt mang điện nhiều hơn hạt không mang điện là 10, ta có: p+e – n = 10 ( 2) Mà số p = số e ( 3) 0.25 ta có: p = e = 11, n = 12 0.5 Câu8. Một nguyên tử nguyên tố X có tổng số lượng các hạt là 34, trong đó số hạt không mang điện chiếm 35,3%. Một nguyên tử nguyên tố Y có tổng số lượng các hạt là 52, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 16 hạt. Xác định số lượng mỗi loại hạt trong nguyên tử X, Y? KHHH nguyên tử X, Y? Câu Hướngdẫnchấm Điểm + Nguyên tử nguyên tố X: Số hạt Nơtron là: 34. 100 35 = 12 (hạt) Số hạt Proton bằng số hạt Electron và bằng: 11 2 3412 = (hạt) Vậy KHHH nguyên tử nguyên tố X là: Na. 0,5 + Nguyên tử nguyên tố Y: Gọi số hạt Proton là Z, số hạt Nơtron là N số hạt Electron là Z. Tổng số lượng các hạt là: 2Z + N = 52 (1) 0,5
DẠYKÈMQUYNHƠNOFFICIAL Số hạt mang điện nhiều hơn số hạt không mang điện là: 2Z - N = 16 (2) Từ (1, 2) ta có: 1717.21618 4 68 45216 216 252 =====+ = += ZZN ZN ZN Vậy số hạt Proton bằng số hạt Electron và bằng: 17 Số hạt Nơtron là: 18. Nguyên tử nguyên tố X có KHH là: Cl.
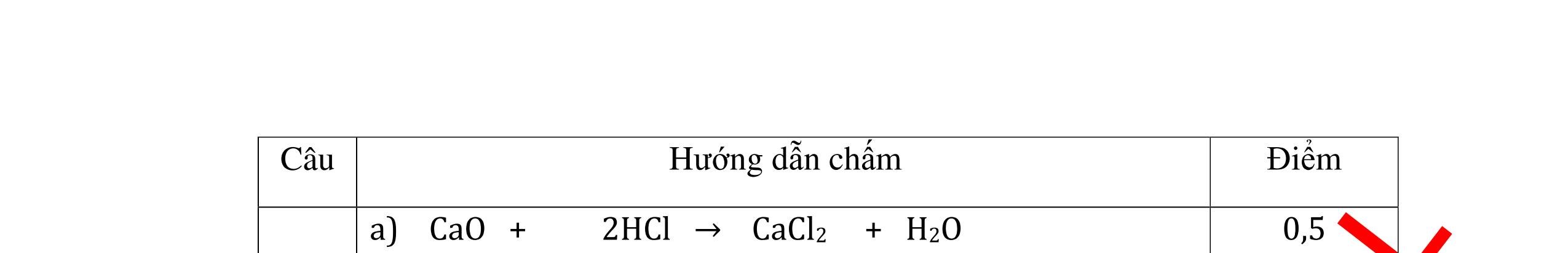
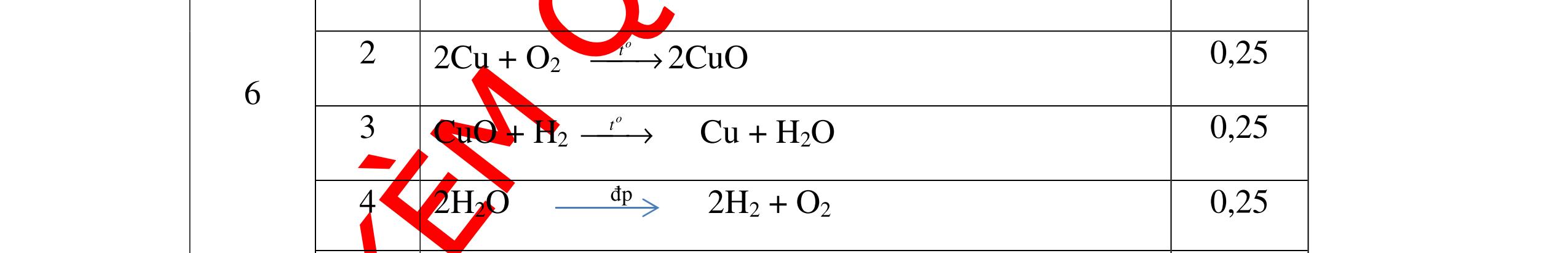
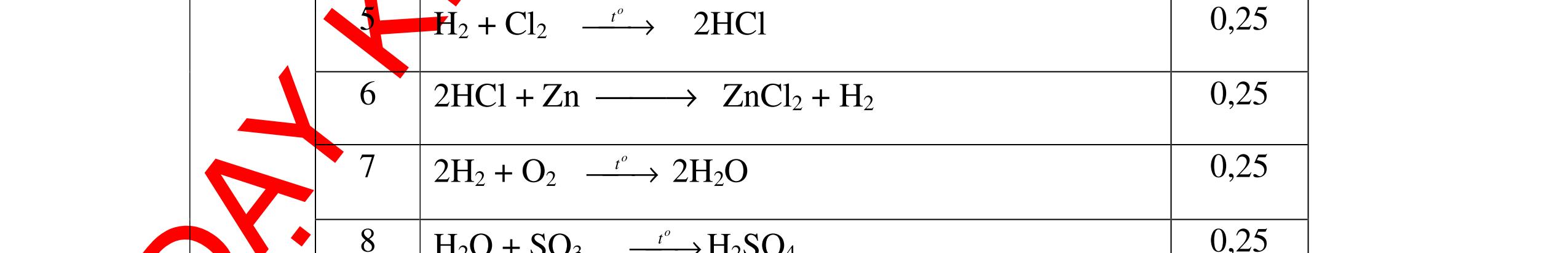
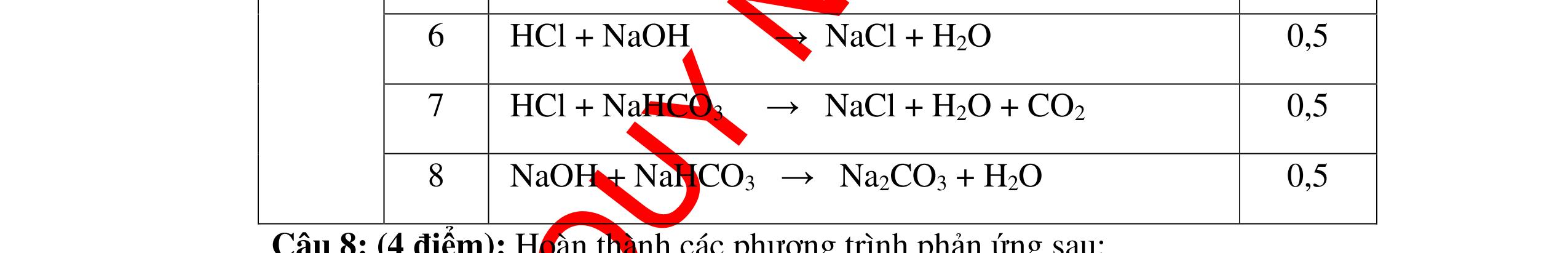
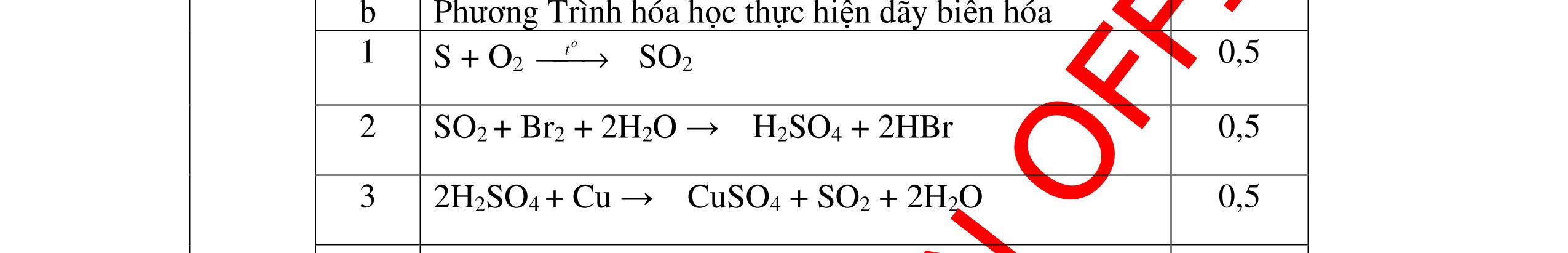
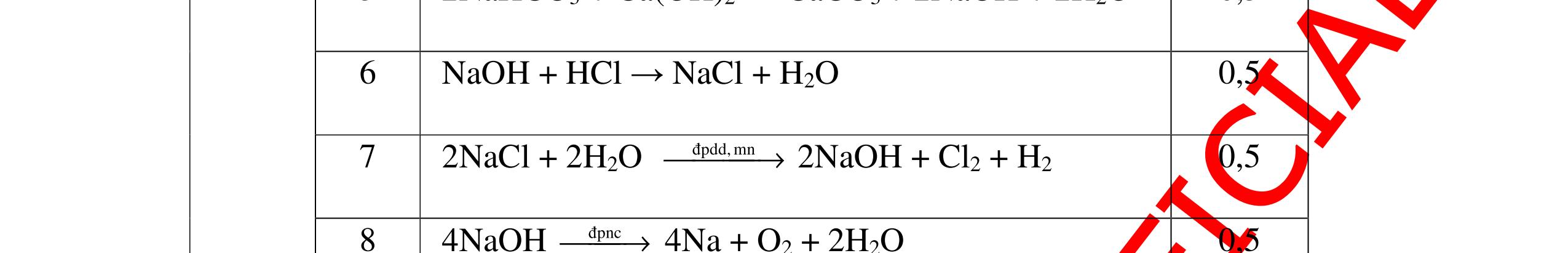
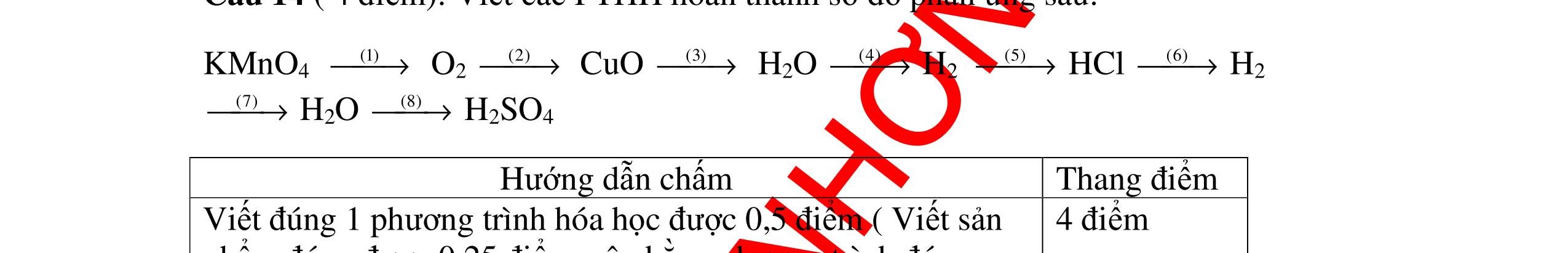
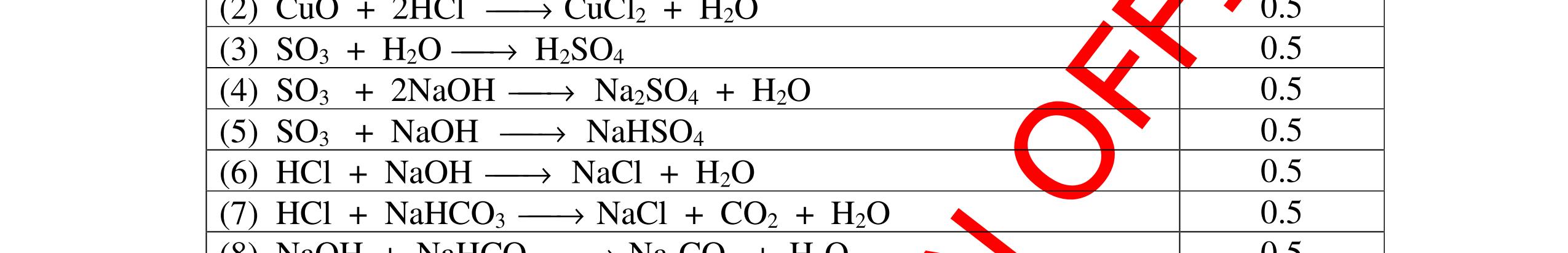
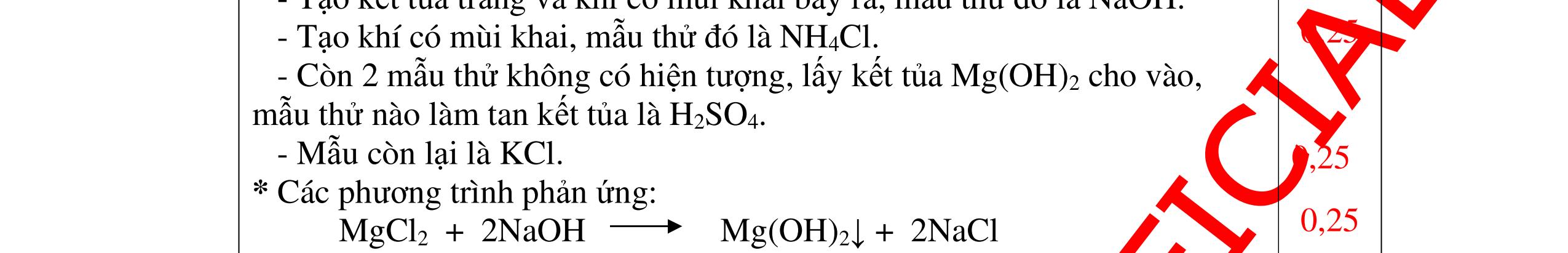
DẠYKÈMQUYNHƠNOFFICIAL CHỦ ĐỀ: ĐIỀUCHẾ CÁCCHẤT(2 điểm) Ngườithựchiện: 1)NguyễnThị ThùyDương-TrườngTHCSTTNậmNhùn(Từ câu1–8) Câu1. Cho các chất Na, H2O, CaCO3, KClO3,P và các điều kiện cần thiết. Viết PTHH để điều chế: NaOH, CO2, O2, H3PO4 Câu Hướng dẫn Điểm 1 * Điều chế NaOH 2Na + 2H2O → 2NaOH + H2 * Điều chế CO2 CaCO3 → 0t CO2 + CaO * Điều chế O2 2KClO3 → 0t 2KCl + 3O2 * Điều chế H3PO4 4 P + 5 O2 → 0t 2P2O5 P2O5 + 3H2O → 2H3PO4 0,5 0,25 0,25 0,5 0,5 Câu2. Từ các hóa chất có sẵn sau đây: Fe ; H2O với các thiết bị cần thiết đầy đủ. Hãy làmthế nào để cóthể thựchiện đượcsự biến đổisau: Fe → Fe3O4 → Fe. Câu Hướng dẫn chấm Điểm 2 - Điều chế H2, O2 bằng cách điện phân nước 0.5 2H2O 2H2 + O2 0.5 - 3Fe + 2O2 Fe3O4 0.5 - Fe3O4 + 4H2 3 Fe + 4H2O 0.5 Câu 3. Cho khí hiđro đi qua các ống mắc nối tiếp, nung nóng, chứa lần lượt các chất: MgO, CaO, CuO, Na2O, P2O5 Câu Hướng dẫn chấm Điểm 3 Dẫn khí H2 đi qua các ống sứ mắc nối tiếp, nung nóng Khí H2 Không phản ứng với MgO; CaO 0,5 Khí H2 tác dụng với CuO H2 + CuO → 0t Cu + H2O 0,5 to to to
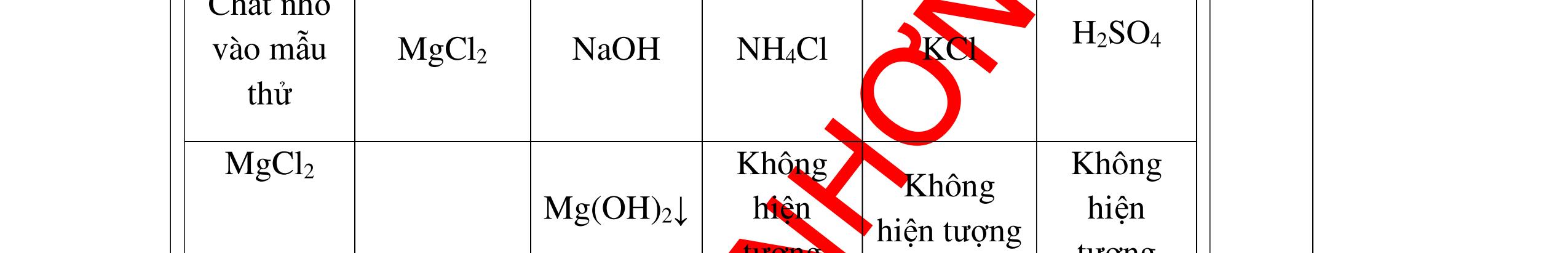
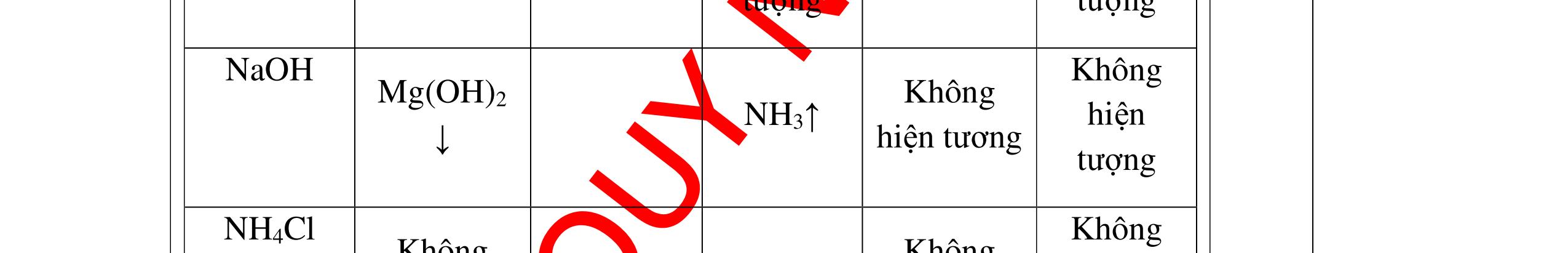
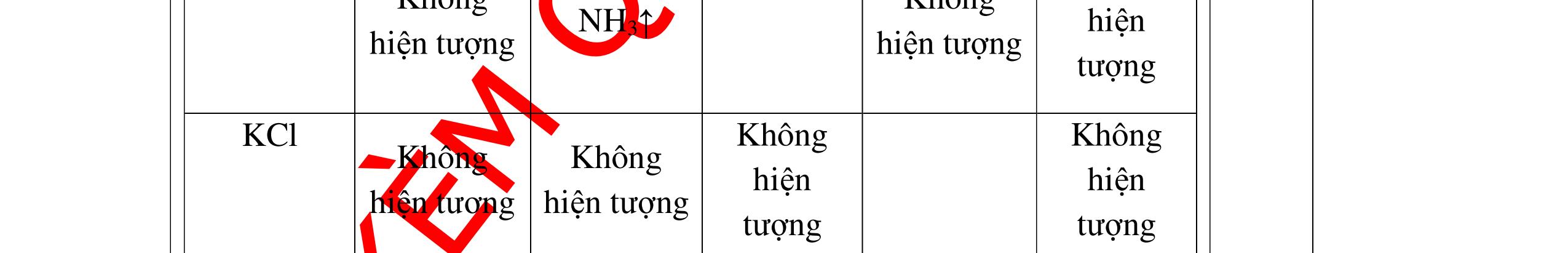
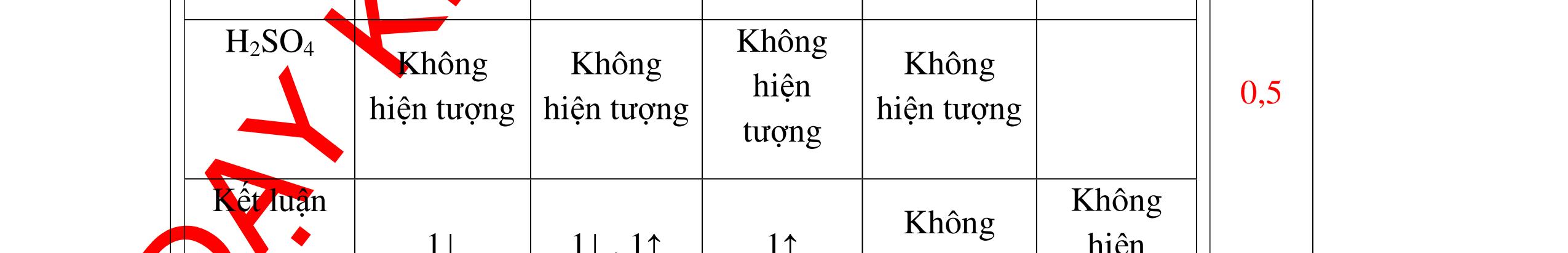
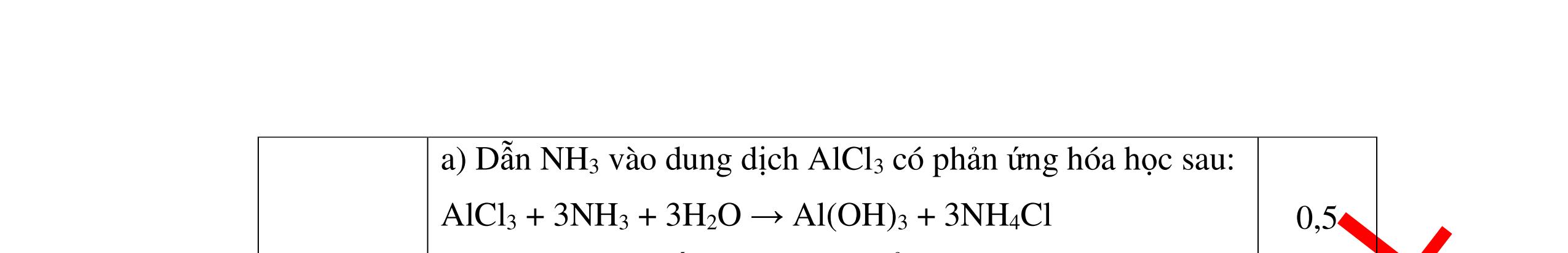
a)
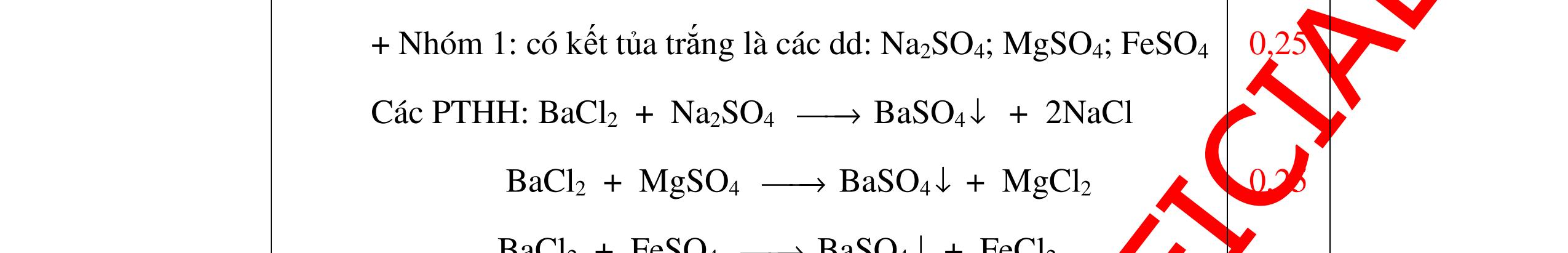
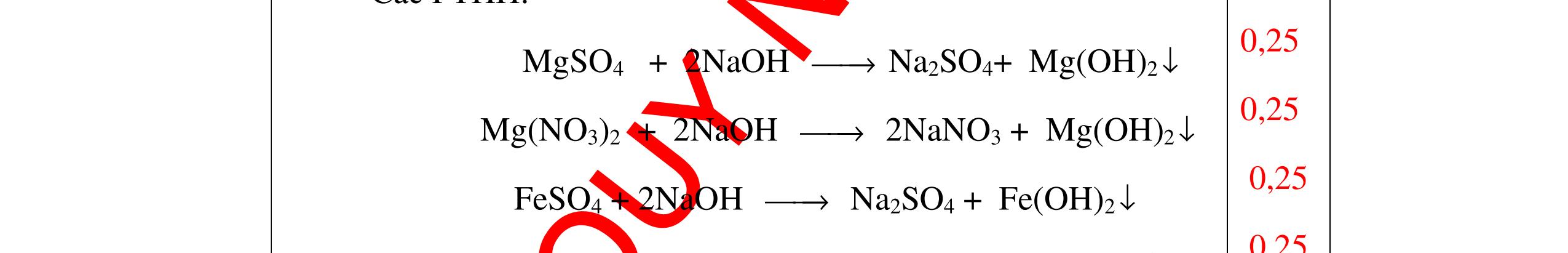
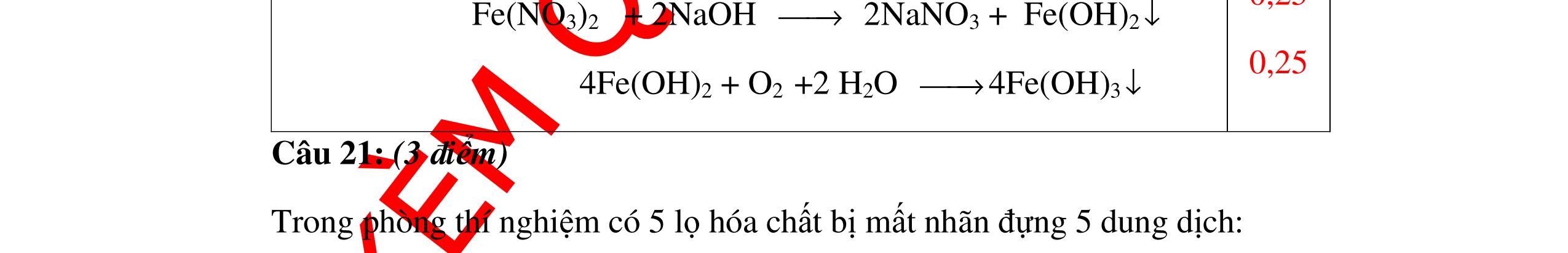
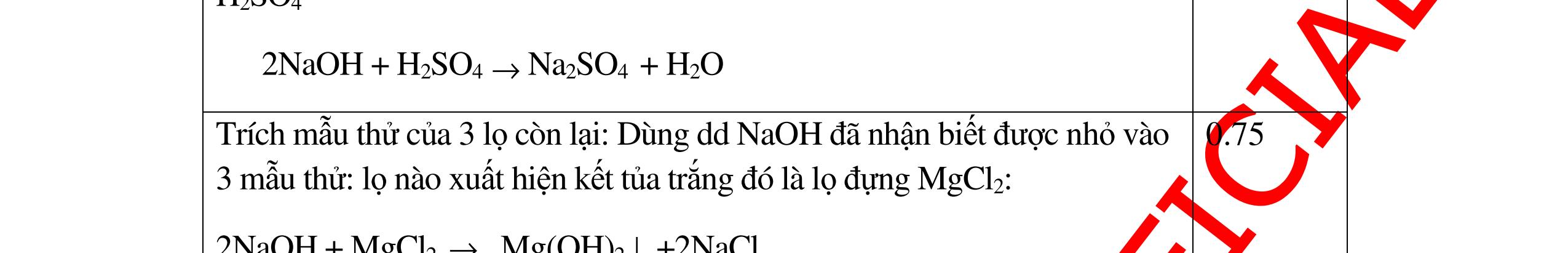
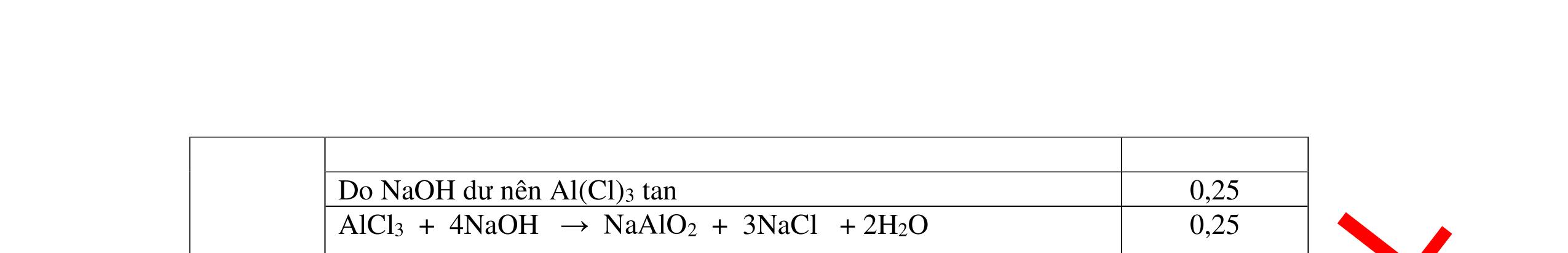
DẠYKÈMQUYNHƠNOFFICIAL Nước sinh ra ở trên tác dụng với Na2O H2O + Na2O → 2NaOH 0,5 Nước sinh ra ở trên tác dụng với P2O5 3H2O + P2O5 → 2H3PO4 Câu4. Cho 4 mẩu Na vào 4 dung dịch sau: ZnCl2, FeCl2, KCl, MgSO4. Viết phương trình phản ứng xảy ra? Câu Hướng dẫn chấm Điểm 4 Trước hết Na tác dung với nước 2Na + 2H2O 2NaOH + H2 0.5 Sau đó 2NaOH + ZnCl2 Zn(OH)2 + 2NaCl 2NaOH + Zn(OH)2 Na2ZnO2 + 2H2O 2NaOH + FeCl2 Fe(OH)2 + 2NaCl 0.25 0.25 0.25 Nếu để trong không khí : 4Fe(OH)2 + 2H2O + O2 4Fe(OH)3 KCl + NaOH Không xảy ra 2NaOH + MgCl 2 Mg(OH) 2 + 2NaCl 0.25 0.25 0.25 Câu5.
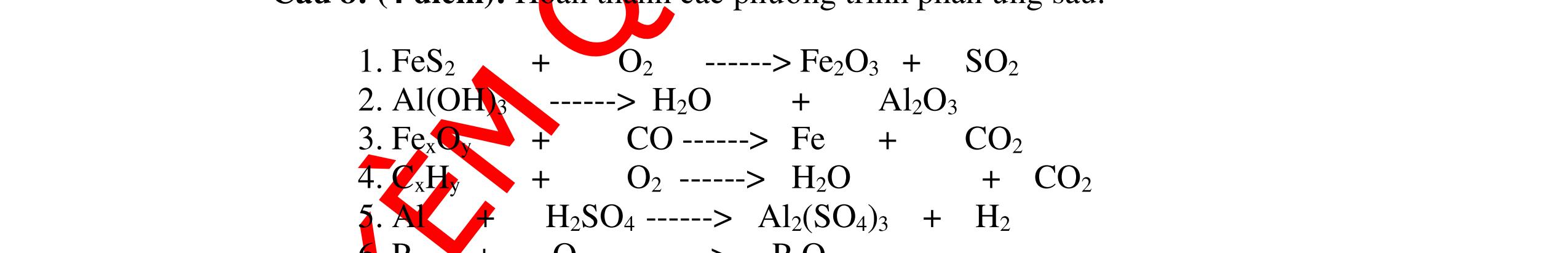
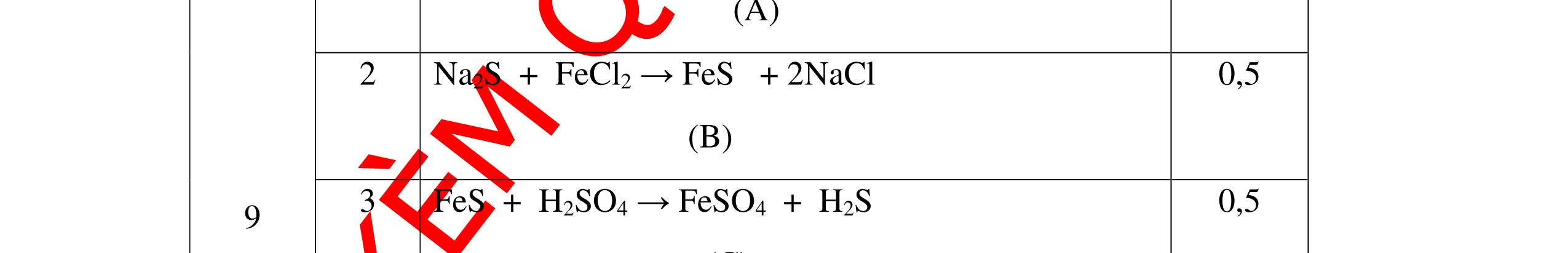
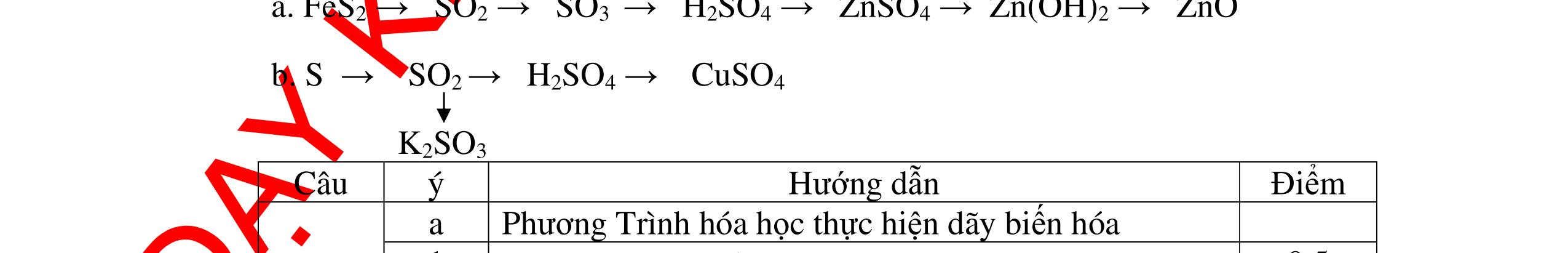
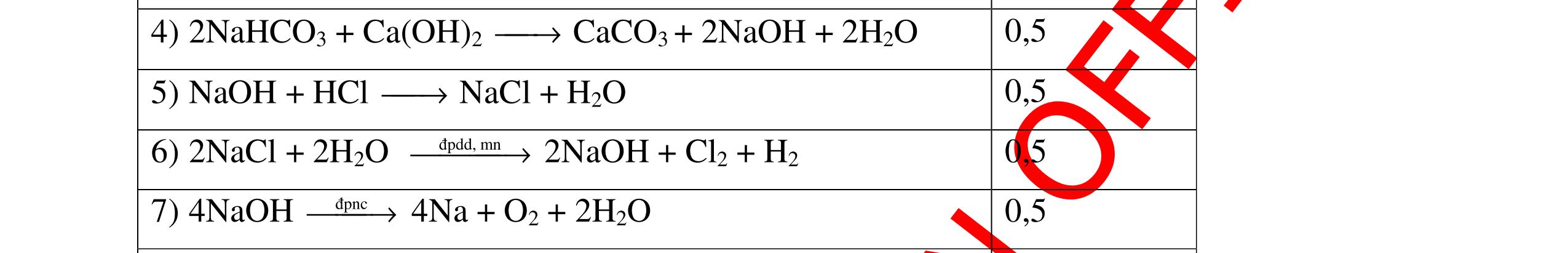
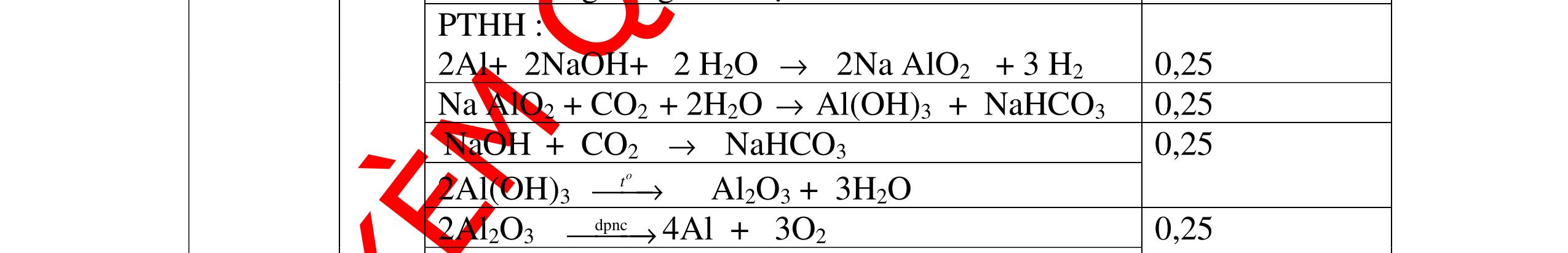
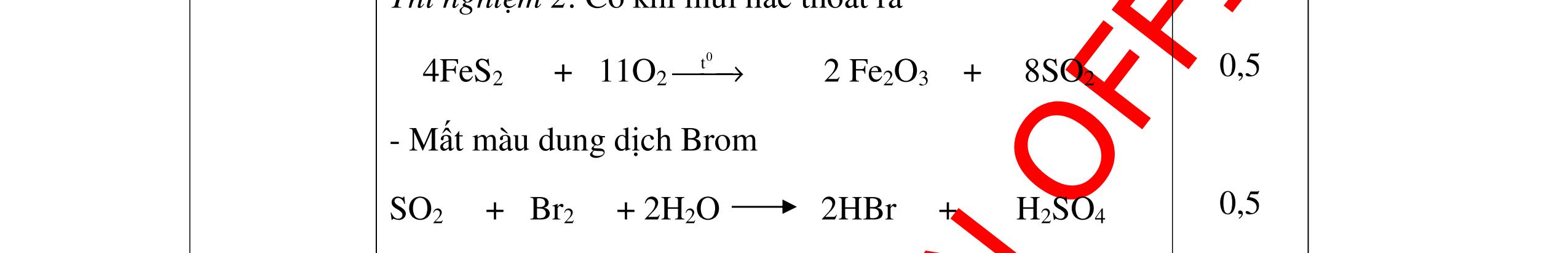
Từ MnO2, HCl đặc, Fe hãy viết các phương trình phản ứng điều chế Cl2, FeCl2 và FeCl3. b) Từ muối ăn, nước và các thiết bị cần thiết, hãy viết các phương trình phản ứng điều chế Cl2, HCl và nước Javel . Câu Hướng dẫn chấm Điểm 5 a, MnO2 + 4HCl → MnCl2 + Cl2 + 2H2 O Fe + HCl → FeCl2 + H2 ↑ FeCl2 + 2Cl2 → 2FeCl3 0.5 0.25 0.25 b, 2NaCl + 2H2O → H2 + 2NaOH + Cl2 Cl2 + H2 → 2HCl Cl2 + NaOH → NaCl + NaClO + H2 0.25 0.25 0.5 Câu6. Từ quặng pirit sắt, nước biển, không khí, hãy viết các phương trình điều chế các chất: FeCl3, Fe(OH)3, Na2SO3. Ghi rõ điều kiện (nếu có). Câu Hướng dẫn Điểm 6 Hướng dẫn: * Điềuchế FeCl3 - Điện phân dd: 2NaCl + 2H2O -> 2NaOH + H2 + Cl2 0,5
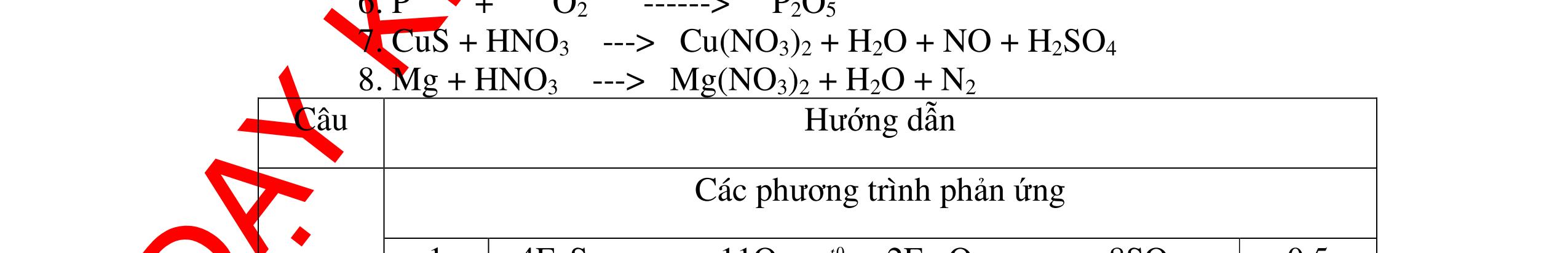
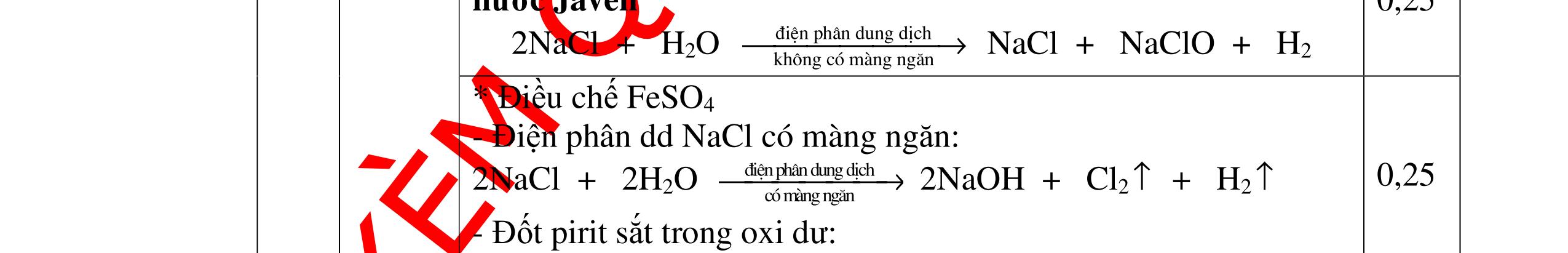
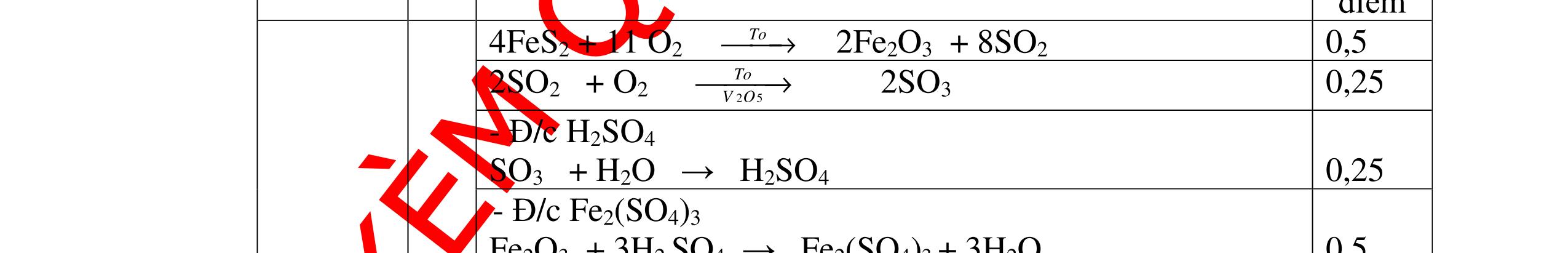
DẠYKÈMQUYNHƠNOFFICIAL H2 + Cl2 -> 2HCl 4FeS2 + 11O2 t0 8SO2↑ + 2Fe2O3 Fe2O3 + 6HCl -> 2FeCl3 + 3H2O 0,25 0,5 0,25 FeCl3 + 3NaOH -> Fe(OH)3 + 3NaCl 0,25 SO2 + 2NaOH -> Na2SO3 + H2O 0,25 Câu7. Từ hỗn hợp FeS, Cu(NO3)2, Al2O3 và các chất phụ có đủ. Viết các phương trình phản ứng điều chế từng kim loại riêng biệt. Câu Hướng dẫn chấm Điểm 7 Nung hỗn hợp thu được các oxit Fe2O3, CuO, Al2O3 4FeS + 7O2 → 2Fe2O3 + 4SO2 2Cu(NO3)2 → 2CuO + 4NO2 + O2 0.5 Cho NaOH dư vào hỗn hợp oxit trên thì: Al2O3 tan, còn Fe2O3, CuO không tan tách ra hai phần. Lấy nước lọc điều chế nhôm. Al2O3 + 2NaOH → 2NaAlO2 + H2O NaAlO2 + CO2 + 2H2O → Al(OH)3 + NaHCO3 2Al(OH)3 0t → Al2O3 + 3H2O 2Al2O3 → 4Al + 3O2 0.5 - Cho dòng khí CO qua hỗn hợp Fe2O3, CuO thu được hỗn hợp 2 kim loại CuO + CO → Cu + CO2 Fe2O3 + CO → Fe + CO2 0.25 - Cho hỗn hợp Cu, Fe vào dung dịch HCl thì chỉ có Fe tan được, tách ra Cu Fe + HCl → FeCl2 + H2 0.25 Từ FeCl2 điều chế ra Fe: FeCl2 + 2NaOH → Fe(OH)2 + 2NaCl Fe(OH)2 0t → FeO + H2O FeO 0t → Fe + CO2 0.5 Câu8. Từ pirit sắt, nước biển, không khí và các thiết bị cần thiết khác. Hãy viết các phương trình hóa học điều chế các chất: nước Javen, FeSO4, FeCl3. Câu Hướng dẫn chấm Điểm 8 Điện phân dung dịch NaCl Có màng ngăn: 2NaCl + 2H2O ®iÖn ph©n dung dÞch cã mµng ng¨n → 2NaOH + Cl2 ↑ + H2 ↑ 0,25
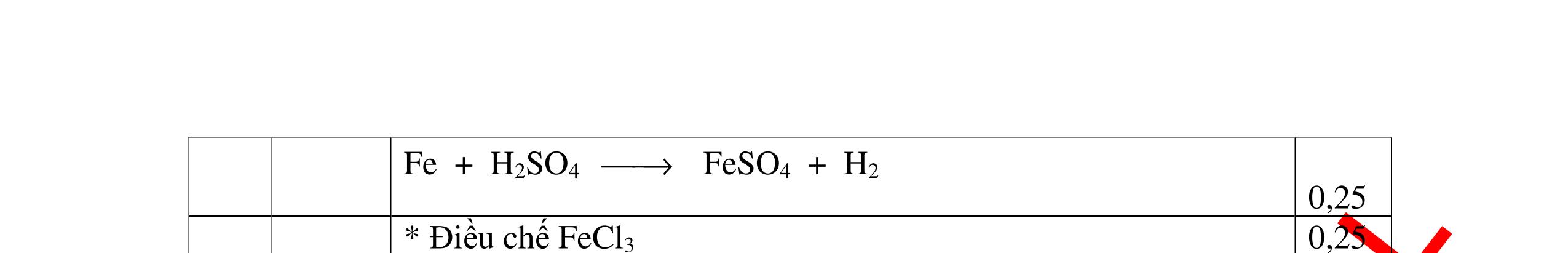
DẠYKÈMQUYNHƠNOFFICIAL - Điện phân dung dịch nước biển không có màng ngăn thu được nướcJaven: 2NaCl + H2O ®iÖn ph©n dung dÞch kh«ng cã mµng ng¨n → NaCl + NaClO + H2 0,25 - Đốt pirit sắt trong oxi dư: 4FeS2 + 11O2 ot → 2Fe2O3 + 8SO2 ↑ - Dẫn H2 dư qua Fe2O3 nung nóng: 3H2 + Fe2O3 ot → 2Fe + 3H2O - Đốt sắt trong khí clo thu được FeCl3: 2Fe + 3Cl2 ot → 2FeCl3 - Đốt khí SO2 trong không khí với chất xúc tác V2O5: 2SO2 + O2 o 25 t VO → 2SO3 - Sục khí SO3 thu được vào nước: SO3 + H2O → H2SO4 - Cho dung dịch thu được phản ứng với sắt dư thu được FeSO4: Fe + H2SO4 → FeSO4 + H2 ↑ 0,25 0,25 0,25 0,25 0,25 0,25
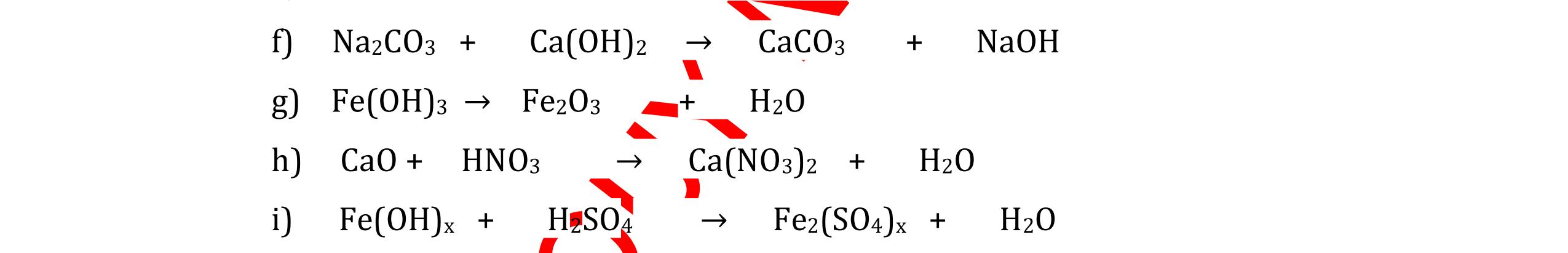
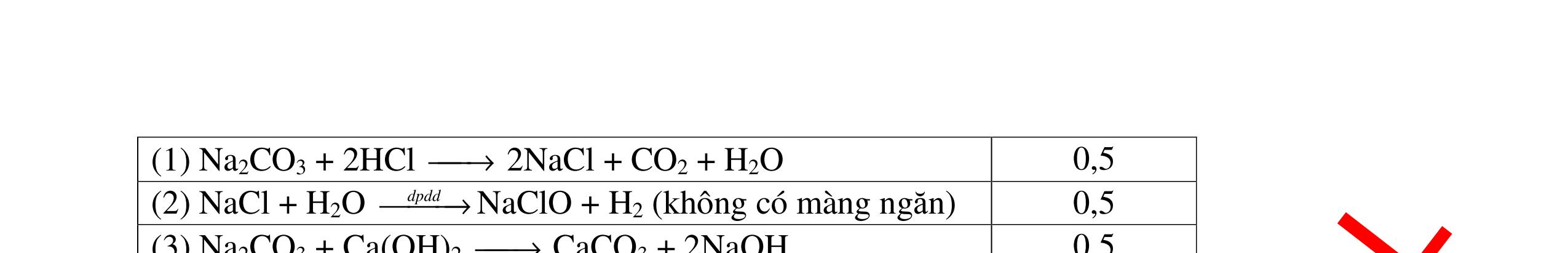
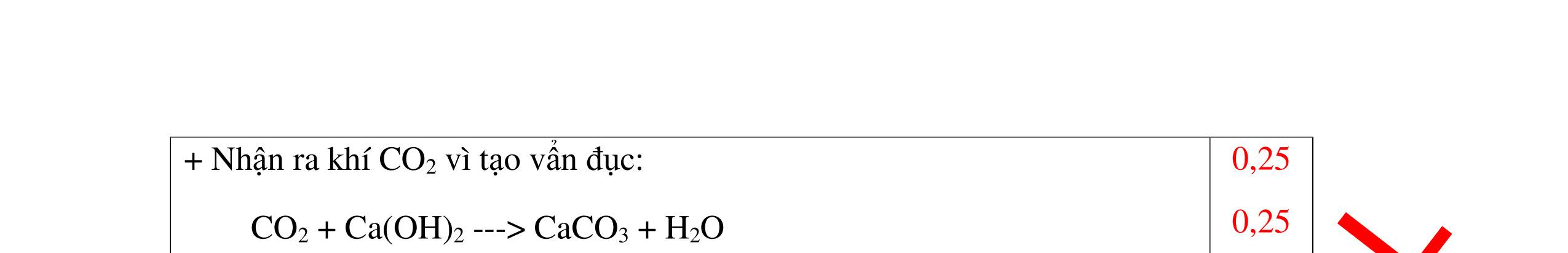
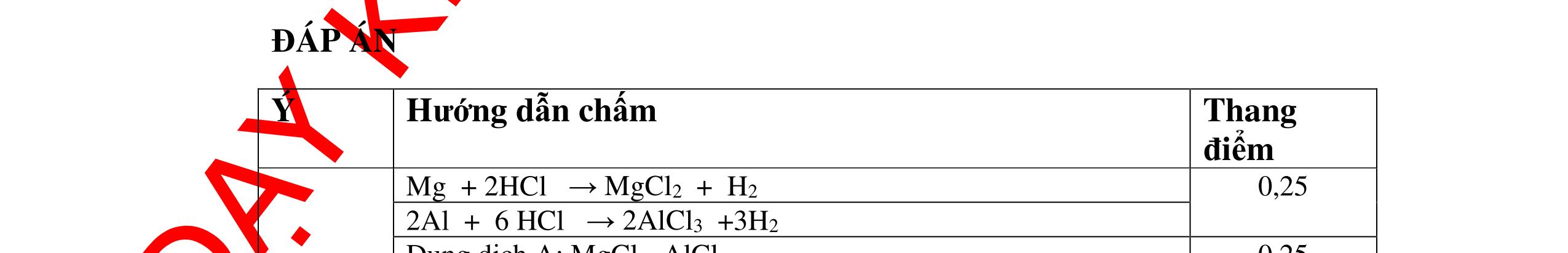
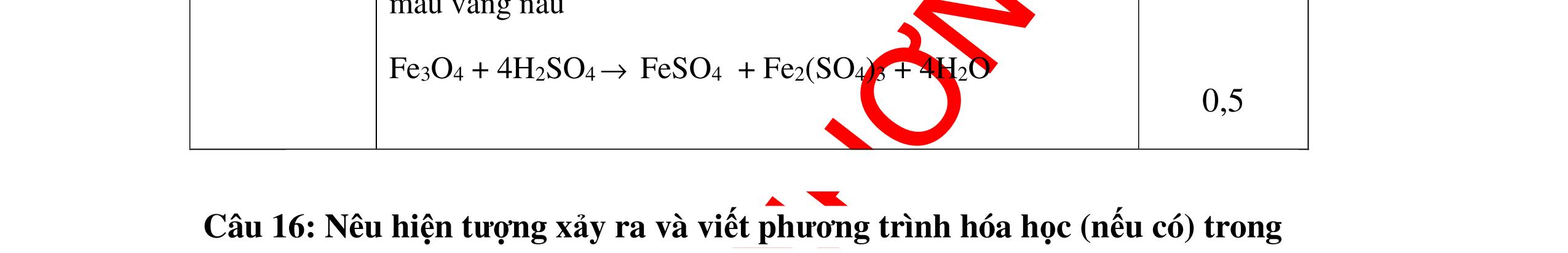
DẠYKÈMQUYNHƠNOFFICIAL CHUYÊN ĐỀ: GIẢI THÍCH HIỆN TƯỢNG, VIẾT PHƯƠNG TRÌNH PHẢN ỨNG ( 2 điểm) Hóa học: 8 Người thực hiện: 1) Quách Văn Sinh- Trường THCS Trung Chải (Từ câu 1 – 20) Câu 1: Nêu hiện tượng xảy ra và viết PTHH (nếu có) khi: Đốt photpho trong lọ đựng khí oxi có sẵn 1 ít nước cất. Sau đó đậy nút lại rồi lắc đều. Cho mẩu quỳ tím vào dung dịch trong lọ. 1. 2 điểm + Hiện tượng: P cháy mạnh trong bình khí oxi với ngọn lửa sáng chói, tạo khói trắng dày đặc bám vào thành lọ. Khói màu trắng tan hết trong nước. Giấy quỳ tím chuyển thành màu đỏ nhạt. + PTHH: 4P + 5O2 ot → 2P2O5 2P2O5 + 3H2O → 2H3PO4 0,5 0,5 0,5 0,5 Câu 2: Nêu hiện tượng xảy ra và viết PTHH (nếu có) khi: Nhỏ dung dịch H2SO4 loãng vào mẩu kẽm, đậy nút cao su có ống dẫn khí xuyên qua. Đưa que đóm đang cháy vào đầu ống dẫn khí. 2. 2 điểm + Hiện tượng: Mẩu kẽm tan dần, có bọt khí không màu thoát ra Khí cháy thoát ra cháy với ngọn lửa màu xanh nhạt + PTHH: Zn + H2SO4 → ZnSO4 + H2 2H2 + O2 ot → 2H2O 0,5 0,5 0,5 0,5 Câu 3: Nêu hiện tượng xảy ra và viết PTHH (nếu có) khi: a) Cho mẩu kim loại natri bằng hạt đậu xanh vào tờ giấy lọc tẩm nước (uốn cong mép giấy) b) Nhỏ dung dịch natri cacbonat vào ống nghiệm đựng dung dịch canxi hidroxit. 3. 2 điểm a) Hiện tượng: Mẩu natri nóng chảy thành giọt tròn chạy vòng quanh trên mặt giấy rồi bốc cháy. 0,5
và có khí không màu thoát ra 2Al + 6HCl → 2AlCl3 + 3H2
0,5 0,5 0,5 0,5 Câu 5: Nêu hiện tượng và viết phương trình hóa học xảy ra khi:
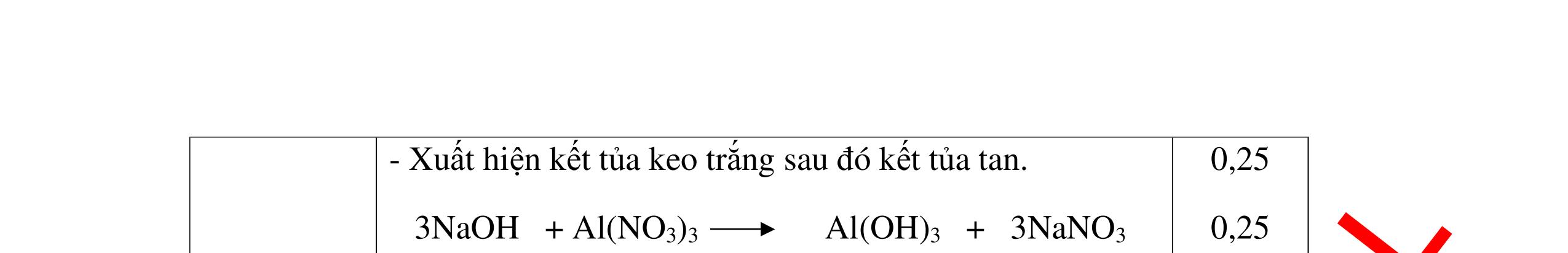
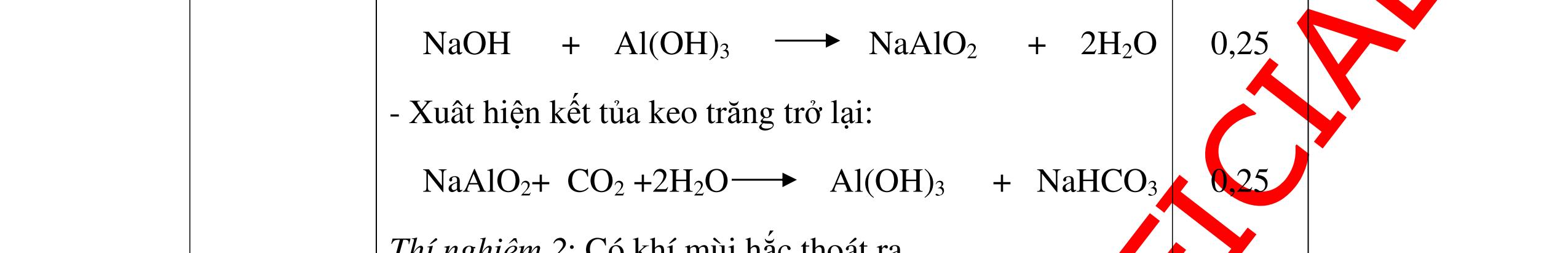
DẠYKÈMQUYNHƠNOFFICIAL + PTHH: 2Na + 2H2O → 2NaOH + H2 2H2 + O2 ot → 2H2O 0,25 0,25 b) Xuất hiện kết tủa trắng. Na2CO3 + Ca(OH)2 → CaCO3 + 2NaOH 0,5 0,5 Câu 4: Nêu hiện tượng và viết phương trình hóa học xảy ra khi: a) Cho một mẩu natri nhỏ vào cốc đựng nước có bỏ sẵn một mẩu giấy quỳ tím. b) Cho một lá nhôm vào ống nghiệm đựng dung dịch axit clohidric. 4. 2 điểm a) Natri nóng chảy thành giọt tròn chuyển động nhanh trên mặt nước, mẩu Natri tan dần, có khí không màu thoát ra, quỳ tím chuyển dần sang màu xanh. 2Na + 2H2O → 2NaOH + H2 b) Nhôm tan dần a) Nhỏ dung dịch Na2SO4 vào dung dị
ch BaCl2. b) Cho một lá nhôm vào dung dịch HCl, sau đó dẫn khí thoát ra vào ống nghiệm đựng bột CuO nung nóng. 5. 2 điểm a) Xuất hiện kết tủa màu trắng Na2SO4 + BaCl2 → BaSO4 + 2NaCl b) Có khí không màu thoát ra, Al tan dần. Bột CuO màu đen chuyển dần thành màu đỏ (Cu), xuất hiện những giọt nước trên thành ống nghiệm. 2Al + 6HCl → 2AlCl3 + 3H2 H2 + CuO(đen) ot → Cu(đỏ)+ H2O 0,5 0,5 0,5 0,25 0,25 Câu 6: Nêu hiện tượng xảy ra của các thí nghiệm : a) Hòa tan một mẩu nhỏ vôi sống CaO vào nước b) Đốt cháy dây sắt có quấn quanh mẩu than trong lọ đựng khí oxi c) Đốt cháy photpho đỏ trong lọ đựng khí oxi sau đó hòa tan vào nước 6. 2 điểm a) CaO tan dần, phản ứng tỏa nhiều nhiệt CaO + H2O → Ca(OH)2 b) Sắt cháy sáng trong oxi, có chất rắn màu nâu đen rơi xuống đáy. 3Fe + 2O2 ot → Fe3O4 c) Photpho cháy sáng trong oxi với ngọn lửa chói, có khói trắng bám trong bình. 4P + 5O2 ot → 2P2O5 0,25 0,25 0,25 0,5 0,25 0,5
a)
a)
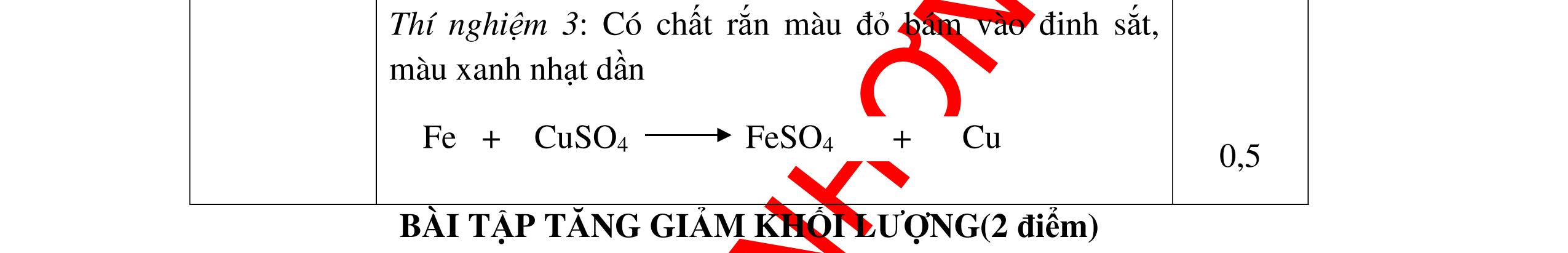
Zn
8.
DẠYKÈMQUYNHƠNOFFICIAL Câu 7:Nêu hiện tượng xảy ra và viết PTHH (nếu có) khi tiến hành các thí nghiệm sau: a) Cho một luồng khí hiđro qua bột đồng (II) oxit nung nóng. b) Cho một mẩu natri vào cốc nước pha sẵn dung dịch phenilphtalein. 7. 2 điểm a. Chất rắn màu đen chuyển dần thành đỏ (hoàn toàn). CuO + H2 ot → Cu + H2O b. Na phản ứng với nước, nóng chảy thành giọt tròn có màu trắng chuyển động nhanh trên mặt nước. Mẩu Na tan dần cho đến hết, có khí H2 bay ra.Dung dịch chuyển thành màu hồng (đỏ). 2Na + 2H2O → 2NaOH + H 0,5 0,5 0,5 0,5 Câu 8: Nêu hiện tượng quan sát được, viết phương trình hóa học giải thích.
Khi cho một viên kẽm (Zn) vào ống nghiệm chứa dung dịch axit H2SO4(loãng). b) Một mẩu nhỏ Na vào cốc nước có để sẵn 1 mẩu quỳ tím.
2 điểm
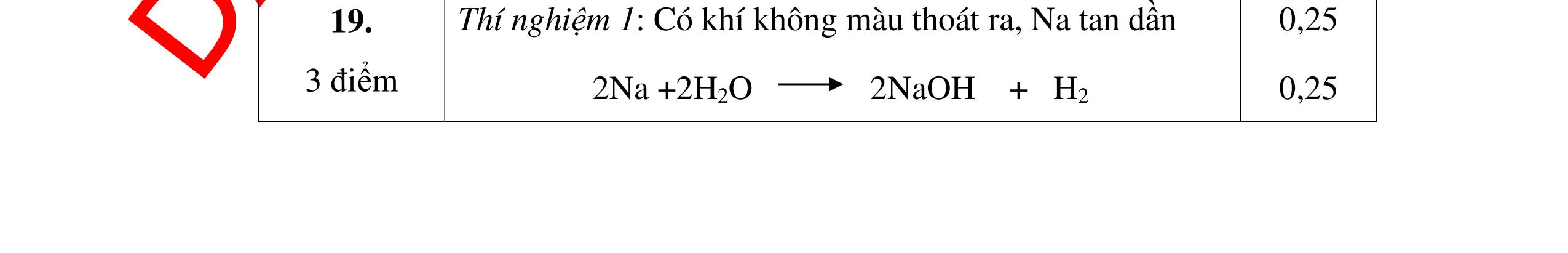
Xung quanh viên kẽm có bọt khí không màu bay lên, viên kẽm tan dần
+ H2SO4 → ZnSO4 + H2 b) Na phản ứng với nước, nóng chảy thành giọt tròn có màu trắng chuyển động nhanh trên mặt nước. Mẩu Na tan dần cho đến hết, có khí H2 bay ra. Mẩu quỳ tím chuyển sang màu xanh 2Na + 2H2O → 2NaOH + H2 0,5 0,5 0,5 0,5 Câu 9: Nêu các hiện tượng và viết các phương trình hóa học xảy ra khi cho: a) Viên kẽm vào dung dịch axit clohiđric. b) Đốt lưu huỳnh trong không khí. 9. 2 điểm a. Viên kẽm tan dần, có bọt khí không màu thoát ra. Zn + 2HCl → ZnCl2 + H2 b. Lưu huỳnh cháy trong không khí với ngọn lửa nhỏ, màu xanh nhạt. S + O2 0t → SO2 0,5 0,5 0,5 0,5 Câu 10: Nêu hiện tượng, viết PTHH và giải thích khi: Cho mẩu Na vào tấm giấy lọc có tẩm nước và dung dịch Phenolphtalein? 10. 2 điểm - Hiện tượng: + Miếng Na tan dần, có khí thoát ra + Miếng giấy lọc có tẩm phenolphtalein đổi thành màu đỏ 0,5 0,5
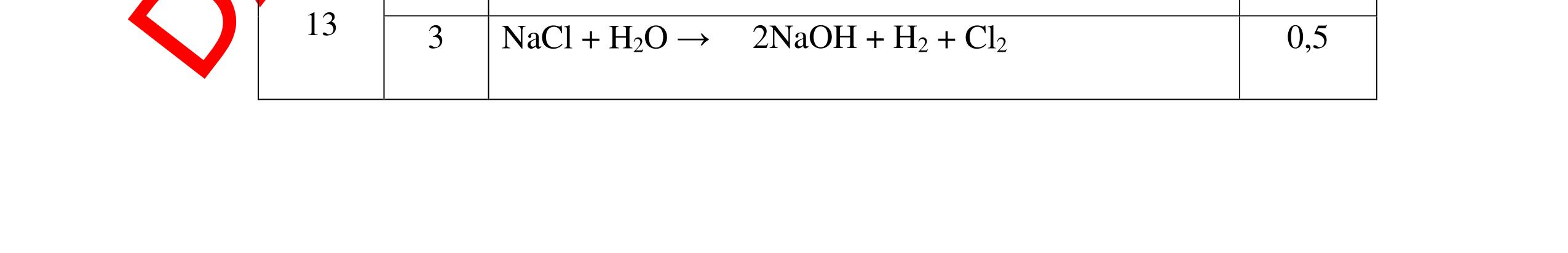
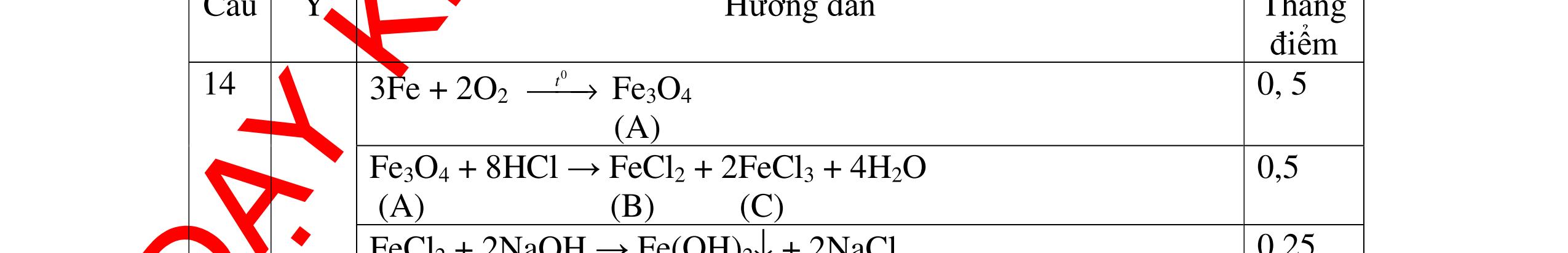
DẠYKÈMQUYNHƠNOFFICIAL - PTHH: 2Na + 2H2O → 2NaOH + H2 - Giải thích: Do Na phản ứng rất mạnh với nước tạo dung dịch bazơ làm phenolphtalein chuyển hồng, phản ứng giải phóng khí H2 0,5 0,5 Câu 11: Nêu hiện tượng, viết PTHH và giải thích khi: Rót từ từ nước cất vào mẩu nhỏ vôi sống CaO, sau đó nhỏ thêm 1-2 giọt dung dịch phenolphtalein? 11. 2 điểm - Hiện tượng: + Mẩu vôi nhão ra và tan dần, phản ứng tỏa nhiều nhiệt + Dung dịch làm đổi màu quỳ tím thành màu xanh (nếu dùng phenolphtalein thì chuyển thành màu đỏ) - PTHH: CaO + H2O → Ca(OH)2 - Giải thích: CaO tan trong nước tạo dung dịch Ca(OH)2 có tính bazơ làm quỳ tím chuyển xanh (phenolphtalein) chuyển hồng, phản ứng tỏa nhiệt. 0,5 0,5 0,5 0,5 Câu 12: Nêu hiện tượng, viết PTHH và giải thích khi: Cho vào muôi sắt một lượng photpho đỏ nung trên ngọn lửa đèn cồn rồi đưa nhanh vào lọ đựng khí oxi (đã điều chế sẵn) phản ứng xảy ra, thêm một ít nước vào lọ và lắc đều. Cho mẩu giấy quỳ tím vào dung dịch mới tạo thành. 12. 2 điểm - Hiện tượng: + Photpho cháy sáng, có khói màu trắng tạo thành, sau khi lắc khói màu trắng tan hết + Dung dịch làm quỳ tím chuyển thành màu đỏ - PTHH: 4P+5O2 0t → 2P2O5 P2O5 + 3H2O → 2H3PO4 - Giải thích: Photpho đỏ phản ứng mạnh với khí oxi tạo khói trắng là P2O5. P2O5 là oxit axit, tan trong nước tạo dung dịch axit H3PO4 làm quỳ tím chuyển đỏ 0,25 0,25 0,5 0,5 0,5 Câu 13: Nêu hiện tượng, viết PTHH và giải thích khi: Khi đưa một đoạn dây sắt vào lọ khí oxi, có hiện tượng gì xảy ra. - Quấn thêm vào dây sắt một mẩu than gỗ, đốt cho sắt và than nóng đỏ rồi đưa vào lọ đựng khi oxi. 13. 2 điểm - Khi đưa một đoạn dây sắt vào lọ khí oxi, không có hiện tượng gì xảy ra. - Quấn thêm vào dây sắt mẫu than gỗ, đốt cho sắt và than nóng đỏ rồi đưa vào lọ chứa khí oxi, hiện tượng xảy ra: Mẩu than cháy trước tạo nhiệt độ đủ cao cho sắt cháy. Sắt cháy mạnh, sáng chói, tạo ra các hạt nhỏ nóng chảy màu nâu. PTHH: 3Fe + 2O2 0t → Fe3O4 0,5 0,75 0,75
16. 2 điểm
năng hòa tan củaoxi trong không khí trong nước rất ít.
+ Do đó cần phải cung cấp thêm oxi cho cá bằng cách sục khí vào bể.
0,5 1,0 0,5 Câu 16: Giải thích vì sao sự cháy trong không khí xảy ra chậm hơn và tạo ra nhiệt độ thấp hơn so với sự cháy trong oxi.
+ Sự cháy trong không khí xảy ra chậm hơn và tạo ra nhiệ
DẠYKÈMQUYNHƠNOFFICIAL Câu 14: Giải thích tại sao: Khi nhốt một con dế mèn (hoặc một con châu chấu) vào một cái lọ nhỏ rồi đậy nút kín, sau một thời gian con vật sẽ chết dù có đủ thức ăn ? 14. 2 điểm Khi nhốt một con dế mèn (hoặc một con châu chấu) vào một cái lọ nhỏ rồi đậy nút kín, sau một thời gian con vật sẽ chết dù có đủ thức ăn. Vì trong quá trình hô hấp của chúng cần oxi cho quá trình trao đổi chất (quá trình này góp phần vào sự sinh tồn của người và động vật). Khi ta đậy nút kín tức có nghĩa là sau một thời gian trong lọ sẽ hết khí oxi để duy trì sự sống. Do đó con vật sẽ chết. 0,75 0,75 0,5 Câu 15: Vì sao người ta phải bơm sục không khí vào các bể nuôi cá cảnh hoặc chậu bể cá sống ở các cửa hàng bán cá ? 15. 2 điểm + Người ta phải bơm sục không khí vào các bể nuôi cá cảnh hoặc chậu bể chứa cá sống ở các cửa hàng bán cá. + Vì cá cũng như bao loài động vật khác cần oxi cho quá trình hô hấp, mà trong bể cá thường thiếu oxi. Khả
t độ thấp hơn so với sự cháy trong oxi. + Đó là vì trong không khí, thể tích khí nitơ gấp 4 lần khí oxi, diện tích tiếp xúc của chất cháy với các phân tử oxi ít hơn nhiều lần nên sự cháy diễn ra chậm hơn. + Một phần nhiệt tiêu hao để đốt nóng khí nitơ nên nhiệt độ đạt được thấp hơn. 0,5 1,0 0,5 Câu 17: Muốn dập tắt ngọn lửa do xăng dầu cháy, người ta thường trùm vải dày hoặc phủ cát lên ngọn lửa, mà không dùng nước. Giải thích vì sao? 17. 2 điểm - Không dùng nước là vì xăng dầu không tan trong nước, nước lại nặng hơn xăng vì thế có thể làm cho đám cháy lan rộng. - Muốn dập tắt đám cháy do xăng dầu người ta thường trùm vải dày hoặc phủ lớp cát lên ngọn lửa để cách li ngọn lửa và không khí - đó là một trong hai điều kiện dập tắt đám cháy. 1,0 1,0
khí?
c) Vì sao nhiều bệnh nhân bị khó thở và những người thợ lặn làm việc lâu dưới nước ... đều phải thở bằng khí oxi nén trong bình đặc biệt?
a) Khi càng lên cao tỉ lệ lượng khí oxi trong không khí càng giảm là vì khí oxi năng hơn không khí.
19. 2 điểm
b) Phản ứng cháy của các chất trong bình chứa oxi mãnh liệt hơn trong không khí là vì ở trong khí oxi, bề mặt tiếp xúc của chất cháy với oxi lớn hơn nhiều lần trong không khí.
c) Bệnh nhân khó thở và người thợ lặn làm việc lâu dưới nước phải thở bằng khí oxi vì khi oxi cần cho sự hô hấp để oxi hóa chất dinh dưỡng trong cơ thể ngườ
DẠYKÈMQUYNHƠNOFFICIAL Câu 18: Em hãy giải thích: a) Hãy dự đoán hiện tượng xảy ra và giải thích hiện tượng đó khi cho một cây nến đang cháy vào một lọ thủy tinh rồi đậy nút kín. b) Vì sao khi tắt đèn cồn người ta đậy nắp đèn lại? 18. 2 điểm a) Khi cho cây nến đang cháy vào một lọ thủy tinh và đậy nắp kín, ngọn lửa cây nến sẽ yếu dần rồi tắt, đó là vì khi nến cháy lượng oxi trong lọ sẽ bị giảm dần rồi hết, lúc đó nến sẽ bị tắt. b) Khi tắt đèn cồn người ta đậy nắp đèn lại vì để ngăn không khí tiếp xúc với ngọn lửa đèn cồn nghĩa là không có oxi tiếp xúc cồn không cháy được nữa. 1,0 1,0 Câu 19: Hãy giải thích vì sao: a) Khi càng lên cao thì tỉ lệ lượng oxi trong không khí càng giảm? b) Phản ứng cháy của các chất trong bình chứa oxi lại mãnh liệt hơn trong không
i sinh ra năng lượng để duy trì sự sống của cơ thể. 0,5 0,75 0,75 Câu 20: Trong các lễ hội, em thường thấy các trường thả bóng. Những quả bóng đó có thể bơm bằng khí gì? Em hãy giải thích vì sao sau khi bơm các khí đó thì quả bóng bay lên được, còn bơm không khí thì bóng không bay được? 20. 2 điểm Những quả bóng có thể được bơm bằng khí hiđro. 2 21 2915H kk d =≈ Khí hiđro nhẹ hơn xấp xỉ bằng 1 15 không khí nên bóng bay được. 0,75 0,75 0,5
DẠYKÈMQUYNHƠNOFFICIAL
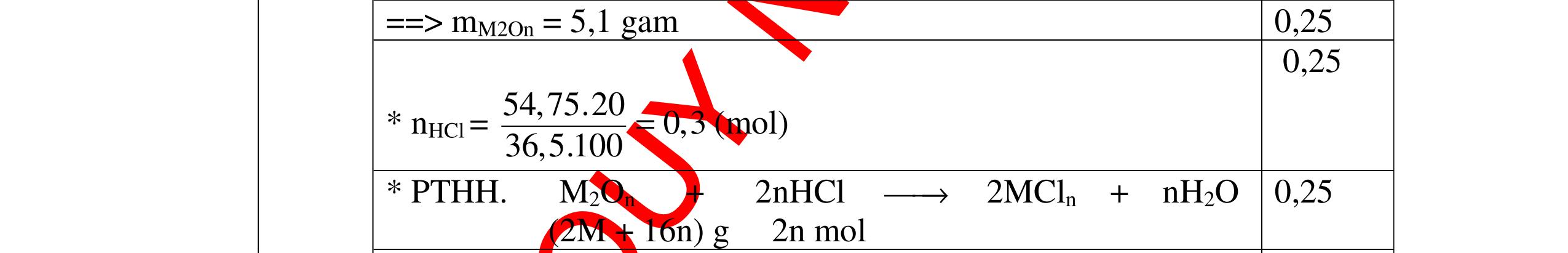
DẠYKÈMQUYNHƠNOFFICIAL CHUYÊN ĐỀ: XÁC ĐINH CÔNG THỨC HÓA HỌC CỦA CHẤT ( 2,5 điểm) Hóa học: 8 Người thực hiện: 1) Quách Văn Sinh- Trường THCS Trung Chải (Từ câu 1 – 14) 2) Tô Thanh Tuân: Trường THCS Lê Lợi (Từ câu 15 – 25) Câu 1: Hợp chất X có thành phần % theo khối lượng 28%Fe, 24%S còn lại là oxi. Tìm công thức phân tử của hợp chất X. Biết khối lượng mol của X là 400 g/mol. Bài làm: 1. 2,5 điểm Ta có mFe = 400.28 100 = 112g ⟶ nFe = 2 mol mS = 400.24 96 100 g= → nS = 3 mol %O = 48%. mO = 400.48 192 100 g= → nO = 12 mol Vậy công thức của A là Fe2S3O12 hay là Fe2(SO4)3 0,75 0,75 0,75 0,25 Câu 2: Cho 11,70 gam kim loại M tác dụng với dung dịch HCl dư thấy có 3,36 lít khí thoát ra (đktc). Hỏi M là nguyên tố nào? Bài làm: 2. 2,5 điểm 2Hn = 0,15 (mol) 2M + 2nHCl → 2MCln + nH2 ↑ 0,3 n ← 0,15 Từ PTHH có khối lượng mol của M = 11,7n 0,3 = 39n ứng với n = 1 thì M = 39 là K (Kali) 0,5 0,5 0,25 0,5 0,75
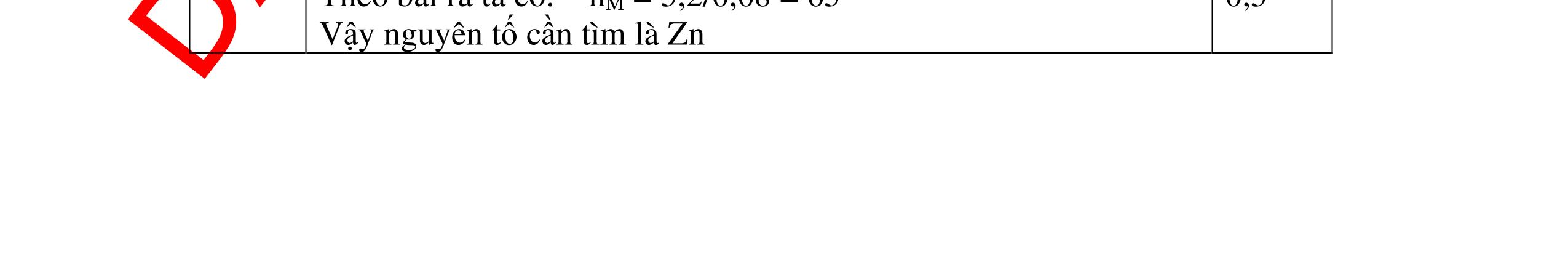
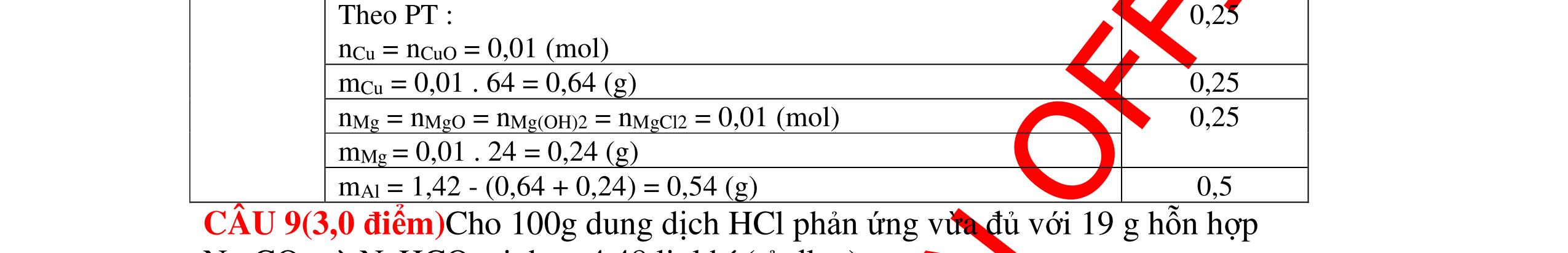
DẠYKÈMQUYNHƠNOFFICIAL Câu 3: Phân tích một hợp chất vô cơ A người ta nhận được % về khối lượng K là 45,95%; % về khối lượng N là16,45% và % về khối lượng O là 37,6%. Xác định công thức hoá học của A. Bài làm: 3. 2,5 điểm Vì %K + %N + %O = 45,95 + 16,45 + 37,6 = 100% nên A chỉ chứa K, N, O. Gọi công thức của A là KxNyOz ta có: = 1,17 : 1,17 : 2,34 = 1 : 1 : 2 vậy A có công thức hoá học là KNO2 0,5 0,25 0,5 0,5 0,25 0,5 Câu 4: Hoà tan hoàn toàn 3,78g một kim loại X vào dung dịch HCl thu được 4,704l H2 (đktc). Xác định kim loại X. Bài làm: 4. 2,5 điểm Gọi n là hoá trị của kim loại và a là số mol của kim loại X đã dùng, ta có phương trình phản ứng: X + HCl XCln + H2 1 mol mol a mol mol Suy ra ta có hệ: aX = 3,78 (1) = = 0,21 (2) (2) an = 0,42 (3) (1) : (3) = 9 X = 9n Vì hoá trị kim loại có thể là 1; 2 hoặc 3. Do đó xét bảng sau: 0,25 0,25 0,25 0,25 0,25 0,25 0,25 0,25 0,25 2 n 2 n 2 an 2 an 22 704 n x x: y: z = : 14 16 : 39 45 16 37
DẠYKÈMQUYNHƠNOFFICIAL n 1 2 3 X 9 18 27(nhận) Trong số các kim loại đã biết, chỉ có Al có hoá trị III, ứng với nguyên tử lượng 27 là phù hợp kết quả biện luận trên. Vậy X là kim loại nhôm. 0,25 Câu 5: A là hợp chất vô cơ có nhiều ứng dụng trong ngành xây dựng. Nung nóng A được chất rắn B và khí C không màu, không mùi. Cho C lội qua bình nước vôi trong, dư lại thấy xuất hiện chất rắn A. Xác định công thức hoá học của A và viết phương trình phản ứng. Bài làm: 5. 2,5 điểm - Khí C không màu, không mùi, tác dụng được với nước vôi trong và là sản phẩm của phản ứng nhiệt phân nên phải là CO2. - Khí CO2 tác dụng với nước vôi trong dư tạo muối A kết tủa cho thấy A chính là CaCO3. Vậy A có công thức hoá học CaCO3. Các phản ứng: CaCO3 CaO + CO2 CO2 + Ca(OH)2 CaCO3 +H2O 0,75 0,75 0,5 0,5 Câu 6. Một hợp chất có phân tử gồm 1 nguyên tử X liên kết với 3 nguyên tử hidro và nặng gấp 8,5 lần khí hidro. Xác định CTHH của hợp chất. Bài làm: 6. 2,5 điểm Gọi CTHH là: XH3 Theo đề, ta có: 3 2 XH H d = 3 2 XH H M M = 3 2 XHM = 8,5 (lần) 3XHM = 17 g/mol Ta có: M 3XH = NTK X + 1.3 = 17 (g/mol) NTK X = 14 (g/mol) X là nitơ (N) Vậy CTHH là NH3 0,5 0,5 0,5 0,25 0,25 0,25 0,25 t0
DẠYKÈMQUYNHƠNOFFICIAL Câu 7. Một hợp chất có thành phần phân tử gồm hai nguyên tố C và O. Tỉ lệ khối lượng của C và O là 3: 8. Công thức hóa học của hợp chất là gì? Bài làm: 7. 2,5 điểm Gọi công thức hoá học của chất X là: CxOy Theo đề bài ra ta có: MC : MO = 12x : 16y = 3 : 8 ⇔ 96x = 48y ⇔ x : y = 1 : 2 ( Chọn x = 1 , y = 2 ) Công thức hoá học của chất khí X là: CO2 0,75 0,5 0,75 0,5 Câu 8: Xác định công thức hóa học của kim loại R nặng 12.8g, hóa trị II, tác dụng với clo thu được 27g muối clorua. Tìm kim loại R? Bài làm: 8. 2,5 điểm Gọi kim loại hóa trị II là R Phương trình hóa học: R + Cl 2 → RCl 2 Ta có: n R = 12,8 RM n 2RCl = 27 (71) RM + Vì, n R = n 2RCl → 12,8 RM = 27 (71) RM + → M = 64 Vậy kim loại R cần tìm là: Đồng (Cu) 0,25 0,75 0,25 0,25 0,5 0,5 Câu 9: Xác định công thức hóa học của kim loại R hóa trị n, cho 5.4g kim loại R tác dụng với dd HCl, cho ra 6.72 lít khí (đktc). Tìm R? Bài làm: 9. 2,5 điểm Phương trình hóa học: 2R + 2nHCl → 2RCl n + nH2 0,5 0,75
DẠYKÈMQUYNHƠNOFFICIAL n 2H = 0,3 mol → n R = 0,6 n = 5,4 M → M = 9n Với n = 1,2,3,… Ta tìm ra KL mol của kim loại R: n 1 2 3 M 9 (loại) 18 (loại) 27 (Al: Nhôm) Vậy kim loại R cần tìm là Nhôm (Al) 0,75 0,5 Câu 10: Một hợp chất khí có thành phần % theo khối lượng là 82,35%N và 17,65% H. Xác định công thức hóa học của chất đó. Biết tỉ khối của hợp chất khí với hidro bằng 8,5. Bài làm: 10. 2,5 điểm Khối lượng mol của hợp chất khí bằng: M = d 2 M H .2= 8,5.2 = 17 (g/mol) 17.82,3517.17,5614;3 100100N H mgammgam ==== Số mol nguyên tử của mỗi nguyên tố trong 1 mol hợp chất: 143 1;3 141 N H NH NH mm nmolnmol MM ====== Trong 1 phân tử hợp chất khí trên có: 1mol nguyên tử N và 3 mol nguyên tử H Công thức hóa học của hợp chất trên là NH3 0,5 0,5 0,5 0,5 0,5 Câu 11: Cho một luồng khí clo dư tác dụng với 9,2g kim loại sinh ra 23,4g muối kim loại hoá trị I. Hãy xác định kim loại hoá trị I và muối kim loại đó. Bài làm: 11. Đặt M là Kí hiệu hóa học của kim loại hoá trị I. 0,25
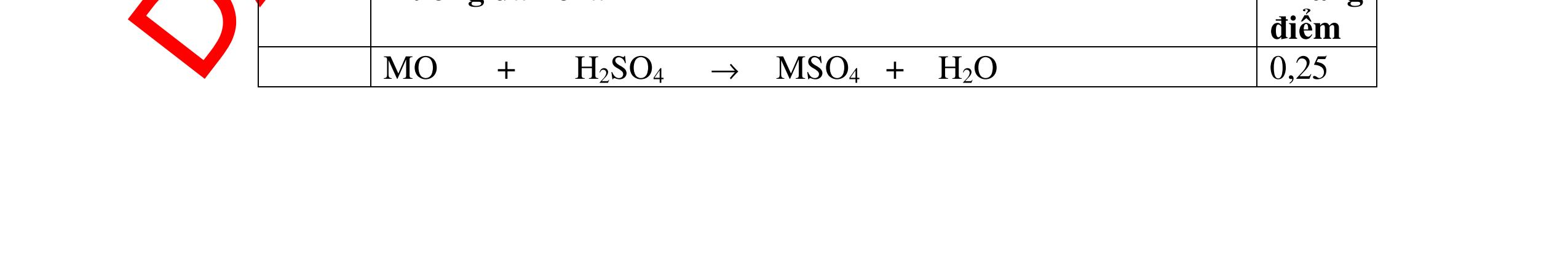
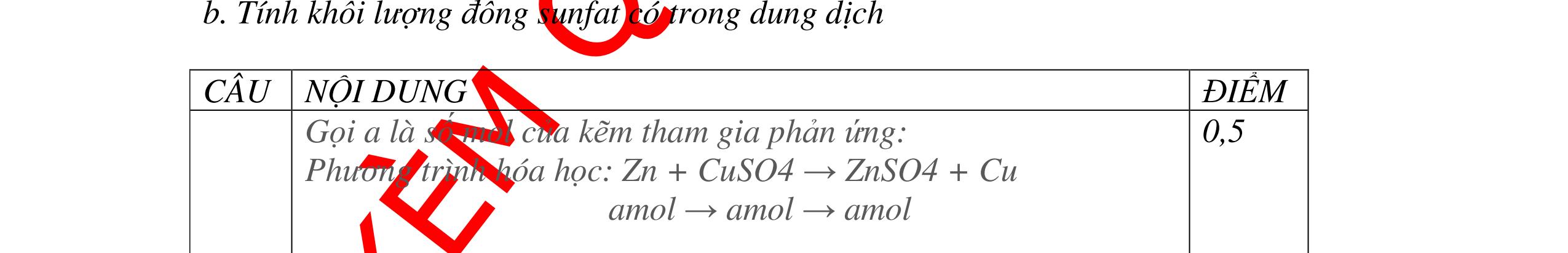
DẠYKÈMQUYNHƠNOFFICIAL 2,5 điểm PTHH: 2M + Cl2 →2MCl 2M(g) (2M + 71)g 9,2g 23,4g Ta có: 23,4 . 2M = 9,2(2M + 71) suy ra: M = 23. Kim loại có khối lượng nguyên tử bằng 23 là Na. Vậy muối thu được là: NaCl 0,75 0,75 0,25 0,5 Câu 12: Hoà tan 3,06g oxit MxOy bằng dung dich HNO3 dư sau đó cô cạn thì thu được 5,22g muối khan. Hãy xác định kim loại M biết nó chỉ có một hoá trị duy nhất. Bài làm: 12. 2,5 điểm PTHH: MxOy + 2yHNO3 → xM(NO3)2y/x + yH2O Từ PTPƯ ta có tỉ lệ: 3,065,22 16124 xx MyMy = ++ M = 68,5.2y/x Trong đó: Đặt 2y/x = n là hoá trị của kim loại. Vậy M = 68,5.n (*) Cho n các giá trị 1, 2, 3, 4. Từ (*) M = 137 và n =2 là phù hợp. Do đó M là Ba, hoá trị II. 0,5 0,5 0,5 0,25 0,25 0,5 Câu 13: Khi hoà tan một lượng của một oxit kim loại hoá trị II vào một lượng vừa đủ dung dịch axit H2SO4 4,9%, người ta thu được một dung dịch muối có nồng độ 5,78%. Xác định công thức của oxit trên. Bài làm: 13. 2,5 điểm Đặt công thức của oxit là RO PTHH: RO + H2SO4 → RSO4 + H2O (MR + 16) 98g (MR + 96)g Giả sử hoà tan 1 mol (hay MR + 16)g RO Khối lượng dd RSO4 (5,87%) = (MR + 16) + (98 : 4,9).100 = MR + 2016 C% = 96 2016 R R M M + + .100% = 5,87% 0,25 0,5 0,25 0,5 0,5
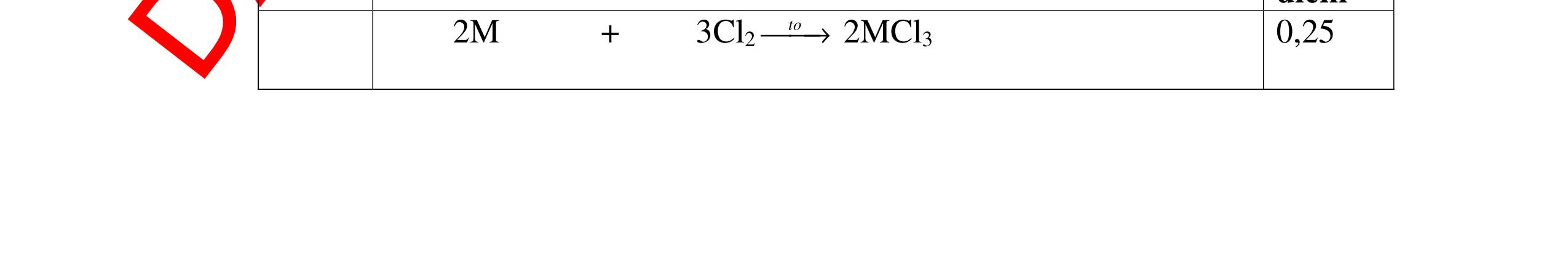
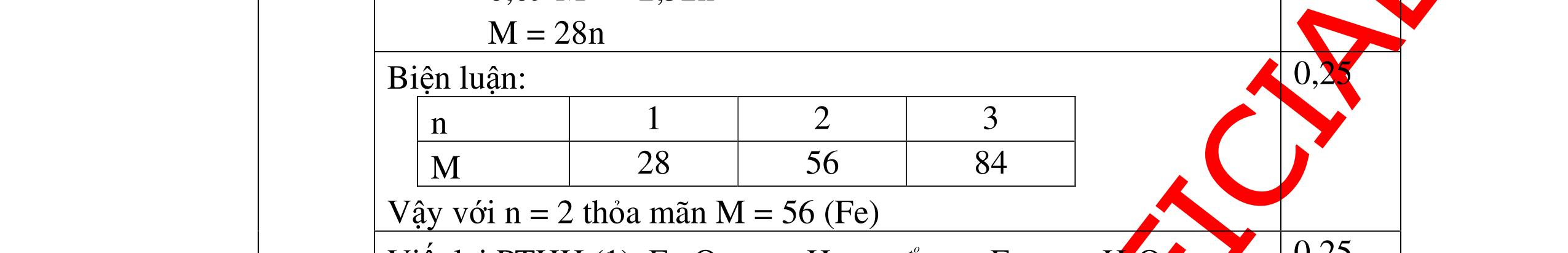
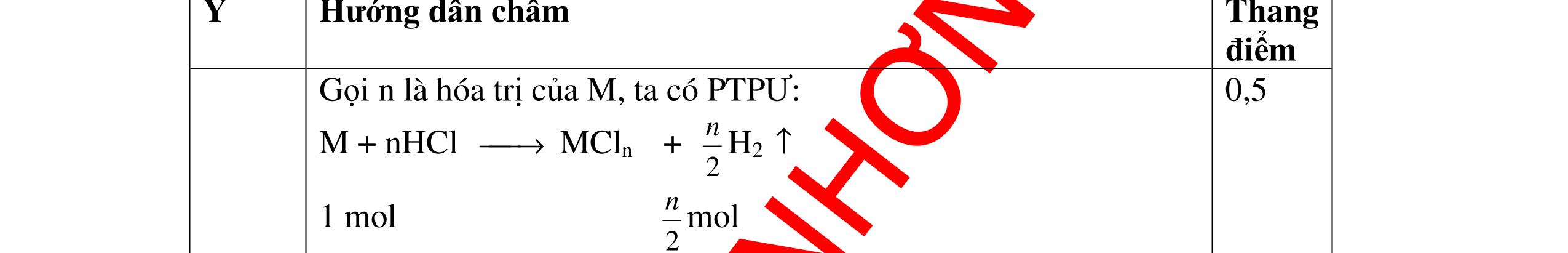
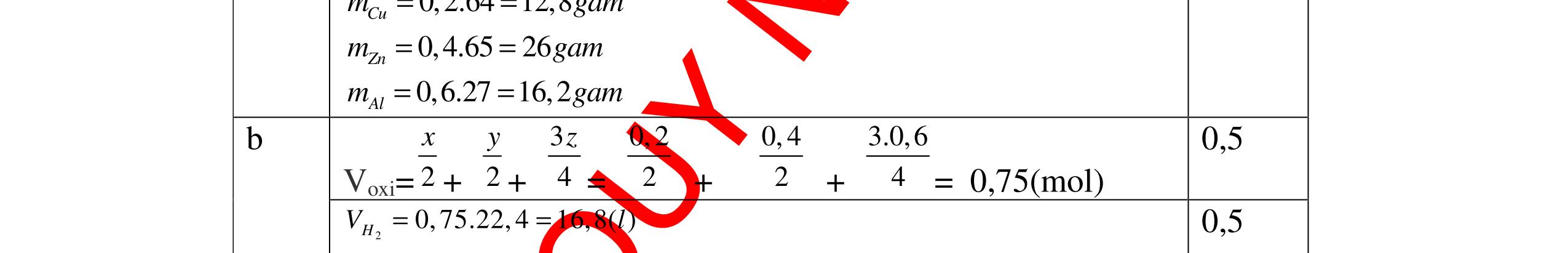
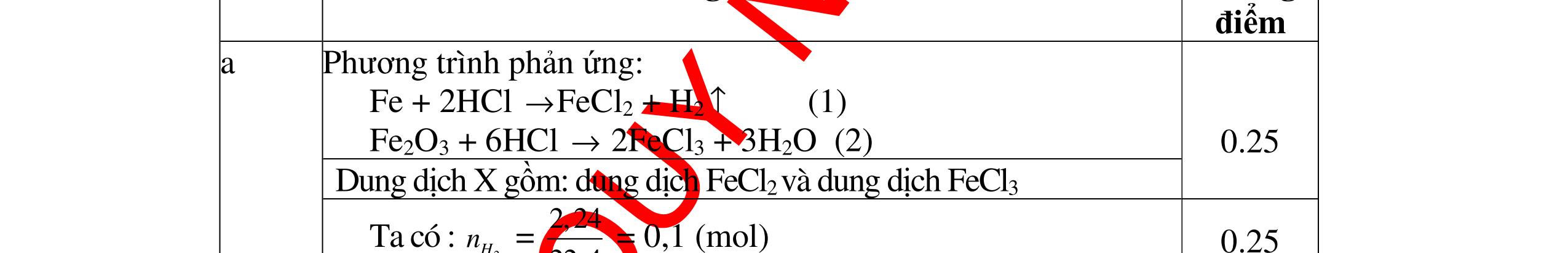
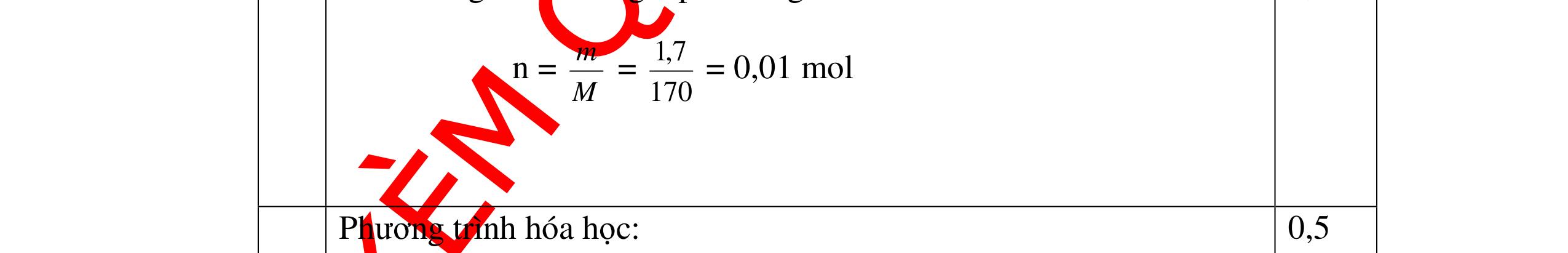
DẠYKÈMQUYNHƠNOFFICIAL Giải phương trình ta được: MR = 24 kim loại hoá trị II là Mg Công thức hóa học của oxit MgO 0,5 Câu 14: Một loại oxit sắt có thành phần là 7 phần khối lượng sắt kết hợp với 3 phần khối lượng oxi. Hãy xác định công thức hóa học của oxit sắt, biết công thức hóa học trùng công thức đơn giản nhất. Bài làm: 14. 2,5 điểm Đặt công thức tổng quát của oxit sắt là FexOy. Xét 1 mol FexOy nFe = x (mol) nO = y (mol) 567 163 Fe O m x my == 2 3 x y = Vậy công thức hóa học của oxit sắt là Fe2O3. 0,5 0,25 0,5 0,75 0,5 Câu 15:( 2,5 điểm). Hòa tan hoàn toàn 16,25 gam kim loại M ( chưa rõ hóa trị) vào dung dịch axit clohidric. Sau phản ứng kết thúc thu được 5,6 lit khí hidro (đktc). Xác định kim loại M ? 15 1 Gọi n là hóa trị của M. 0.25 PTHH: 2M + 2nHCl → 2MCln + nH2↑ 2 mol n mol x mol nx /2 mol 1 Ta có hệ phương trình: Mx = 16,25 (1) nx / 2 = 5,6 / 22,4 = 0,25 (2) Từ (2) nx = 0,25 x2 = 0,5 (3) Từ (1) và (3) Mx / nx = 16,25 / 0,5 M / n = 32,5 0,5
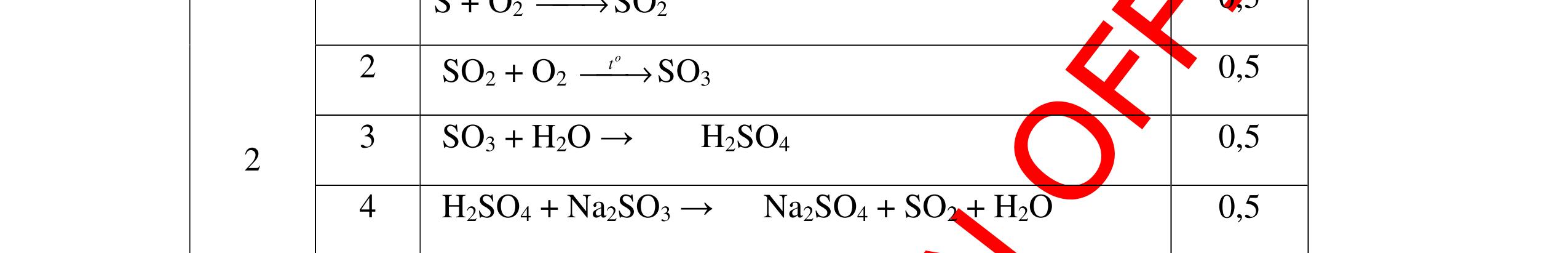
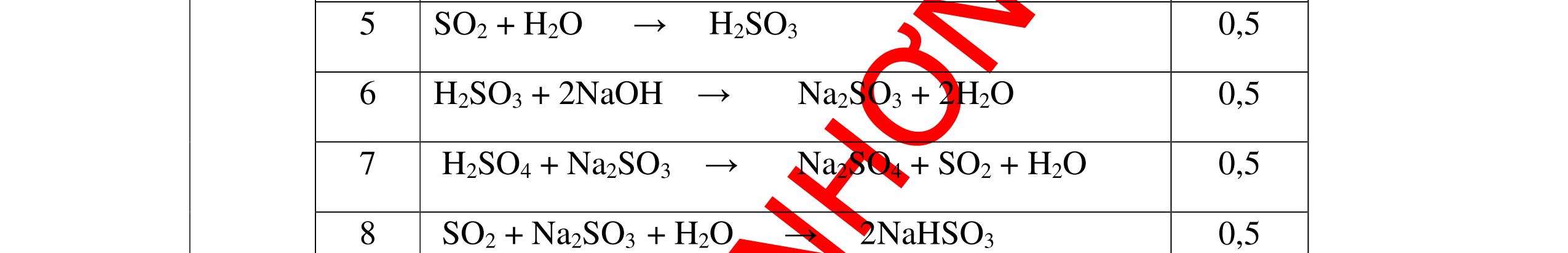
S
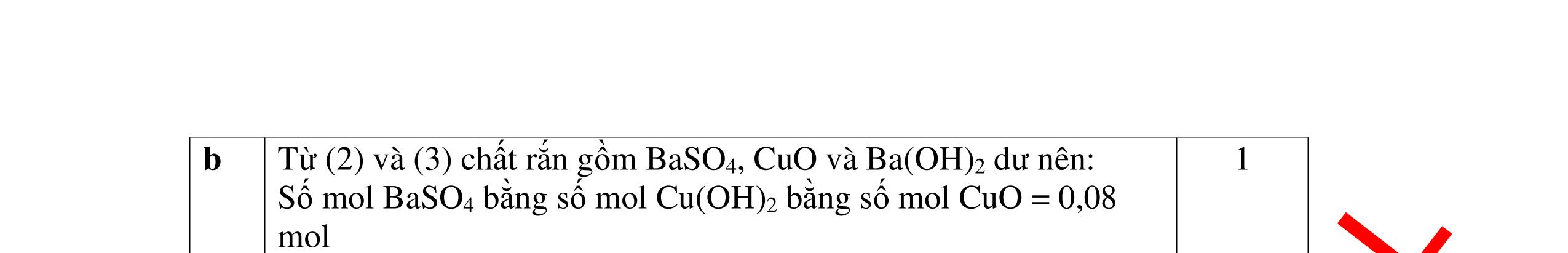
b
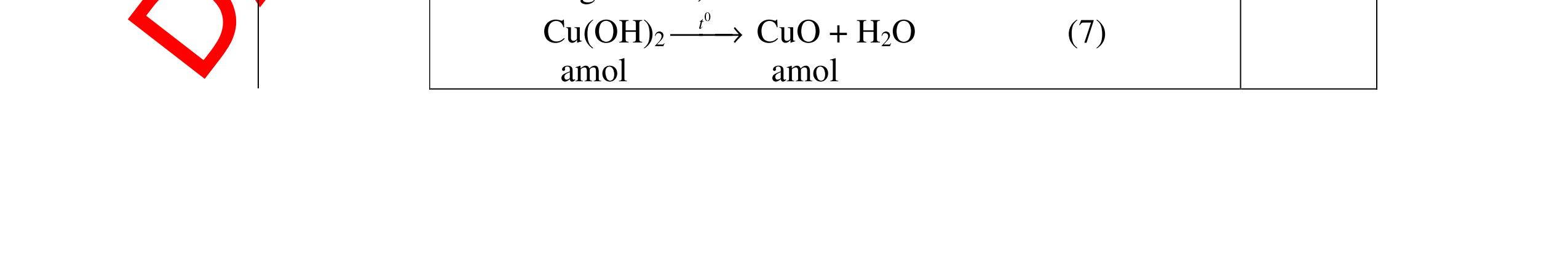
mol c
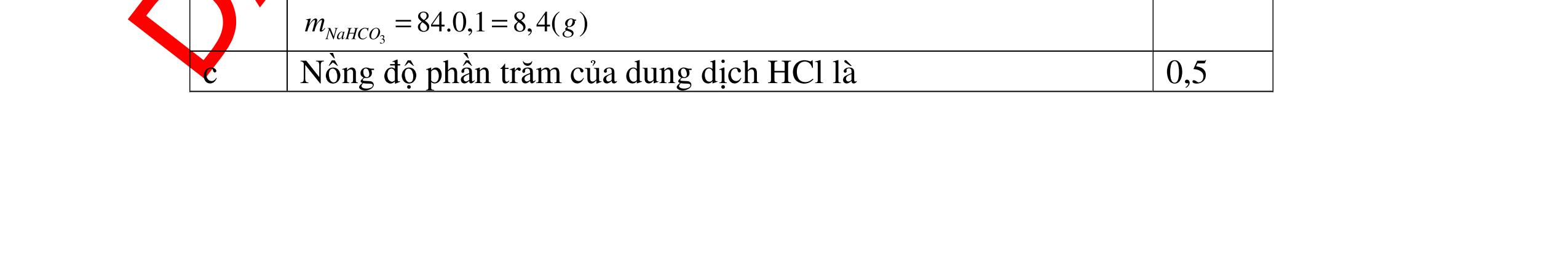
HCl là:
HCl = 0.17.2=0,34 mol
mol kim lo
mol kim lo
hóa tr
II là
mol thì s
i Al là 5 x mol
DẠYKÈMQUYNHƠNOFFICIAL Hóa trị của kim loại có thể là: I, II, III, do đó ta xét bảng sau: n 1 2 3 M 32,5 65 9,5 Nhận xét Loại M là kẽm( Zn) Loại 0.5 Trong các kim loại trên thì kẽm = 65 là phù hợp 0,25 Câu 16 ( 2,5 điểm): Để hòa tan hoàn toàn 4 gam hỗn hợp gồm một kim loại hóa trị II và một kim loại hóa trị III phải dùng 12,41gam HCl. Nếu biết kim loại hóa trị III là Al và nó có số mol gấp 5 lần số mol kim loại hóa trị II. Hãy xác định kim loại hóa trị II. 16
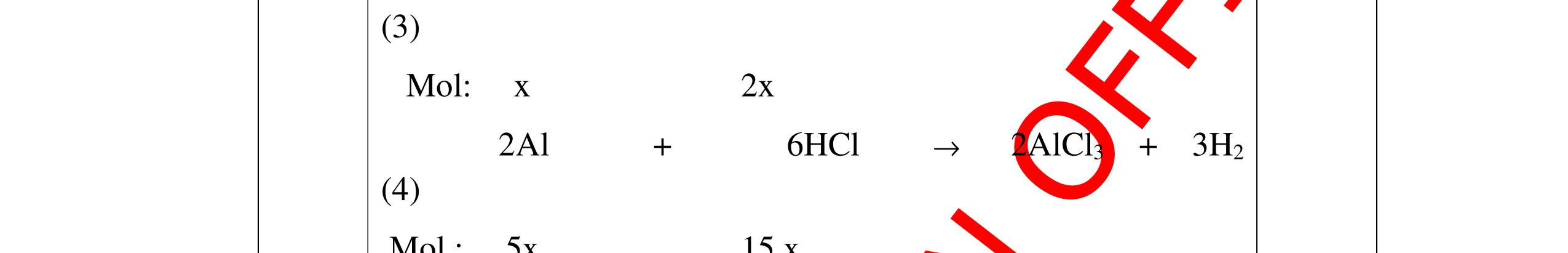
ố
ủa
n
0.25
Gọi số
ại
ị
x
ố
ạ
0.25 A + 2HCl →ACl2+ H2 xmol 2xmol 2Al + 6HCl →2AlCl3+ 3H2 5x mol 15xmol 0,5 Theo giả thiết đề bài ta có: Khối lượng kim loại: A.x+ 27.5.x = 4 gam (1) Số mol HCl= 2x+15x = 0,34 mol (2) 0,5 Giải Phương trình (2) ta được x=0,02 mol 0,25 Thay x = 0,02 vào phương trình (1) A.0,02+ 27.5.0,02=4 =>A=65 A là kim loại Zn (kẽm) 0,5 Vậy kim loại hóa trị II là Zn (kẽm) 0,25 Câu 17:(2,5) Cho một lượng kim loại R có khối lượng 11,2 gam vào dung dịch HCl dư thì thu được 4,48 l khí Hiđrô. Xác định kim loại R? 17 2H V4,48 n===0,2(mol) 22,422,4 0,25 Gọi m là hóa trị của kim loại R ( m∈Z, 0< m <4 ). 0,25
DẠYKÈMQUYNHƠNOFFICIAL PTHH: R + mHCl → RClm + m 2 H2 ↑ 1 m m 2 0,5 Theo PTHH: nR= 2Hn m 2 = 2.0,2 m => nR 0,4 = m 0,25 → R R m 11,2 R===28m n0,4 m => R = 28m 0,5 Với các giá trị của n, ta có giá trị R tương ứng như sau: m 1 2 3 R 28 56 84 0,25 Giá trị thích hợp là n=2 R=56 0,25 → Kim loại Sắt (Fe) 0,25 Câu 18 (2,5) Phân tích một hợp chất X , người ta thấy thành phần khối lượng của nó có 30,4 % là Nitơ và 69,6% là Oxi . Viết CTHH của hợp chất? 18 Gọi công thức của hợp chất là: NxOy Ta có x: y = 30,4 : 14 : 69,6 :16 = 2,171 : 4,35 Số nguyên tử N : Số ngtử O = 1 : 2 Vậy PTHC X có 1 ngtử N và 2 ngtử O CTHC là : NO2 0,5đ 1đ 0,5 0,5đ Câu 19( 2,5) Trong hợp chất oxit của lưu huỳnh có chứa 2 gam lưu huỳnh và 3 gam oxi Tìm công thức hóa học đơn giản nhất của hợp chất
DẠYKÈMQUYNHƠNOFFICIAL 19 Hợp chất A có công thức hóa học dạng chung là SxOy (x, y là số nguyên dương) Khối lượng của hợp chất: mA = 2 + 3 = 5 (gam) → thành phần phần trăm về khối lượng các nguyên tố: %S = .100%40% 5 = %O = 100%60% 5 = Ta có tỷ lệ: y x = 16 60 : 32 40 = 3 1 Chọn x = 1 và y = 3 thế vào công thức dạng chung ta có công thức hóa học là SO3 0,25 0,25 0,5 0,5 0,5 0,5 Câu 20( 2,5): Hỗn hợp gồm Mg và một kim loại hóa trị II tác dụng với HCl thu được 6,72 lit khí (đktc) và 31,7 gam muối khan. Xác định kim loại đó biết số mol kim loại đó bằng ½ số mol của kim loại Mg. Giải: 20 Gọi số mol kim loại Mg là x mol Gọi kim loại hóa trị II là A có số mol là 0,5x mol Mg + 2HCl →MgCl2 + H2 xmol x mol x mol A + 2HCl →ACl2 + H2 0,5x mol 0,5x mol 0,5x mol Số mol H2: x+0,5x = 6,72/22,4 x= 0,2 mol Khối lượng của muối: 95x+ (A+71).0,5.x =31,7 Thay x= 0,2 giải ra ta có: A= 56 Kết luận : A là kim loại sắt (Fe) 0,5 0,5 0,5 0,5 0,5 Câu 21: ( 2,5đ) Hợp chất A chứa 3 nguyên tố Ca, C, O với tỉ lệ Ca chiếm 40%, C: 12%, O: 48% về khối lượng. Tìm công thức về khối lượng.
DẠYKÈMQUYNHƠNOFFICIAL 21 Giải: Giả sử lượng chất đem phân tích là a gam. mCa : 40%.a => nCa = 40% . a = a 100 100.40 100 mC : 12%.a => nC = 12% . a = a 100 100. 12 100 mO : 48%.a => nO = 48% . a = 3a 100 100.16 100 nCa: nC: nO = a/100: a/100: 3a/100= 1:1:3 Công thức hóa học của hợp chất là: CaCO3. 0,5 0,5 0,5 0,5 0,5 Câu 22( 2,5): Lập công thức hoá học của hợp chất X, biết thành phần về khối lượng: 40% Cacbon, 53,33% Oxi và 6,67% Hiđro. Phân tử khối của X là 60 đvC. 22 a) Công thức có dạng: CxHyOZ. Theo đầu bài: 12x.100 40x2 60 y.100606,67y4 60(2.124) Z2 16 =→= =→= −+ == CTHH của X: C2H4O2 0,5đ 0,5đ 0,5đ 0,5đ 0,5đ Câu 23( 2,5): 1. Một nguyên tử nguyên tố Y có tổng số hạt proton, nơtron và electron là 28; số hạt không mang điện gần bằng 35,7%. Xác định nguyên tố Y ? cấu tạo nguyên tử Y ? 2. Biết 1/4 nguyên tử khối của nguyên tố hóa học X nặng bằng 1/3 nguyên tử khối của nguyên tố kali. Xác định tên và ký hiệu nguyên tố X?
DẠYKÈMQUYNHƠNOFFICIAL 23 1 Số hạt không mang điện là: n = 28/100 x 35,7 = 10 (hạt) 0.5 Số hạt mang điện là: 28 – 10 = 18 (hạt) p = e = 18/2 = 9 (hạt) 0,5 Vậy nguyên tố là flo ký hiệu là F công thức hóa học là F2 Flo có điện tích hạt nhân là +9, có 9e hai lớp e, lớp ngoài cùng có 7e 0,5 2 Theo bài ra ta có: 1/4 X = 1/3 x 39 => X = (39 x 4) : 3 = 52 (đvc) 0.5 Vậy nguyên tố X là Crom ký hiệu là Cr 0,5 Câu 24: Hai nguyên tử X kết hợp với một nguyên tử oxi tạo ra phân tử oxit. Trong phân tử oxit, nguyên tố oxi chiếm 25,8 % về khối lượng. Tìm nguyên tố X. 24 Công thức hóa học của oxit là X2O Vì Oxi chiếm 25,8% về khối lượng nên ta có : 16 = 0,258 2X + 16 Giải ra được X = 23. Vậy X là natri ( Na) 0,5đ 0,5đ 1đ 0,5 Câu 25:Lập công thức hoá học của các chất có thành phần như sau: a) 70% Fe, còn lại là oxi và có phân tử khối là 160đvc. b) Hợp chất gồm hai nguyên tố C và H, biết cứ 3 phần khối lượng cacbon kết hợp với 1 phần khối lượng hiđro và công thức phân tử cũng chính là công thức đơn giản. 25 a) Khối lượng Fe là : 160.70% = 112g =>nFe = 112: 56 = 2mol 0,25 0,25
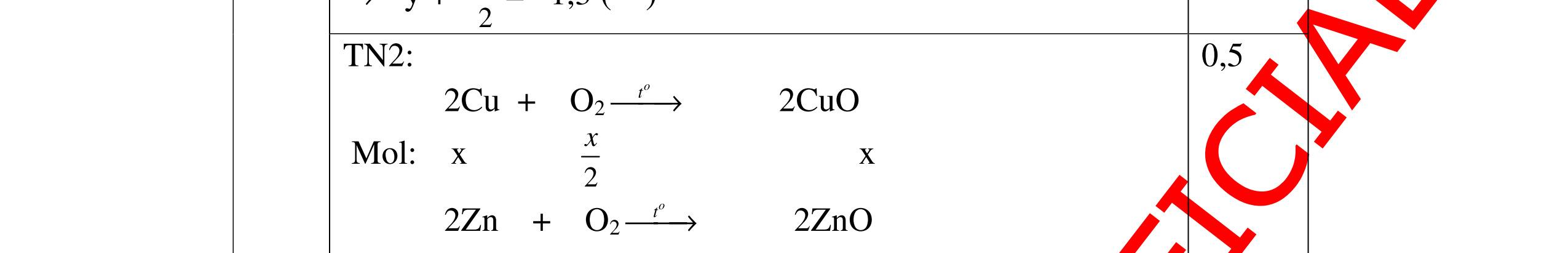
DẠYKÈMQUYNHƠNOFFICIAL => khối luợng O là : 160 – 112 = 48g => nO = 48: 16 = 3 mol Công thức hoá học của hợp chất là: Fe2O3 0,25 0,25 0,25 b) % mC = 3 .100% 31 + = 75 %; % mH = 100% 31 1 + = 25% Gọi công thức dạng chung của hợp chất là CxHy (x,y nguyên, dương) x : y = 75 12 : 25 1 = 1 4 Công thức đơn giản nhất của hợp chất là : CH4 . Vì công thức phân tử cũng chính là công thức đơn giản nên công thức hoá học của hợp chất là CH4 0,5 0,5 0,25
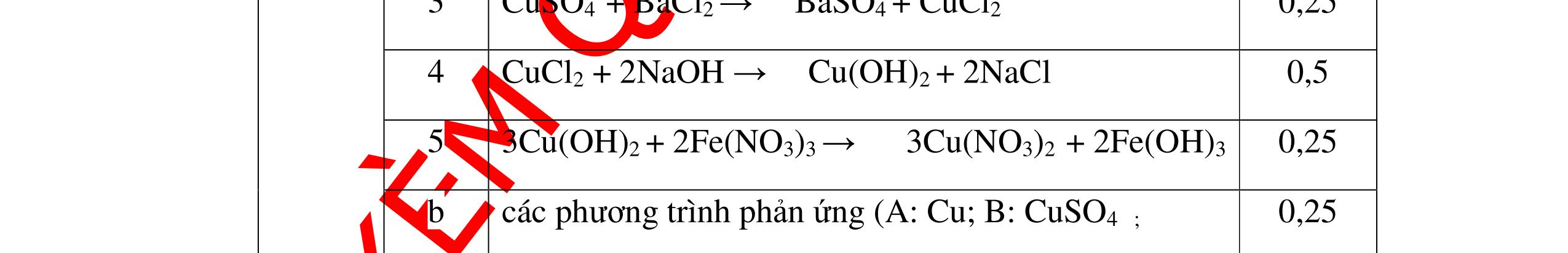
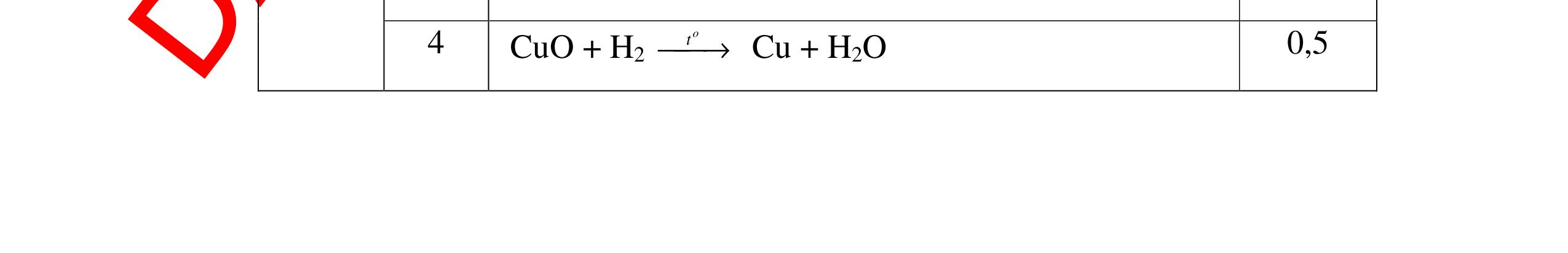
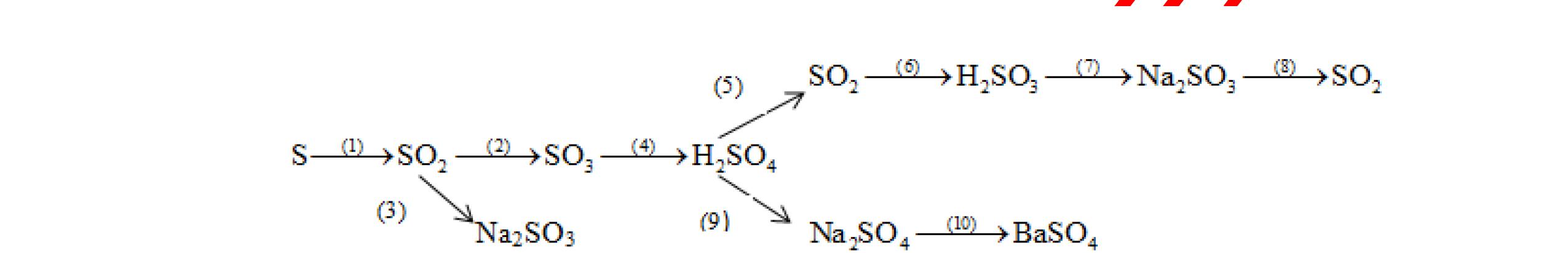
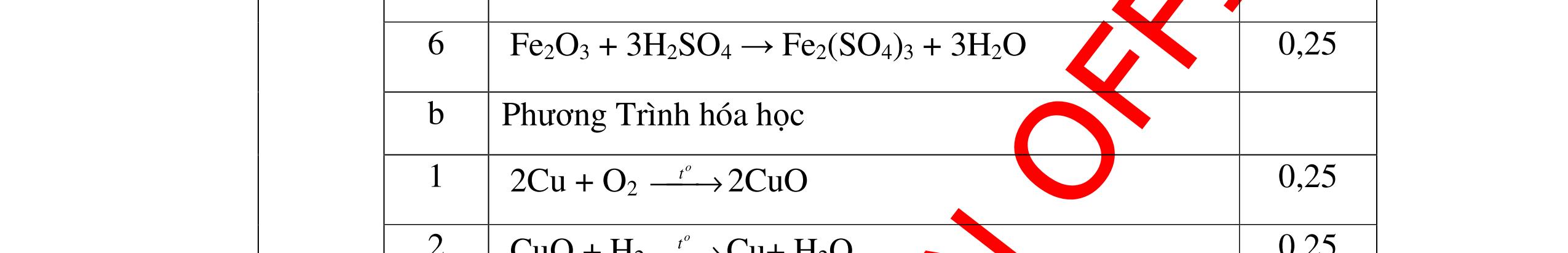
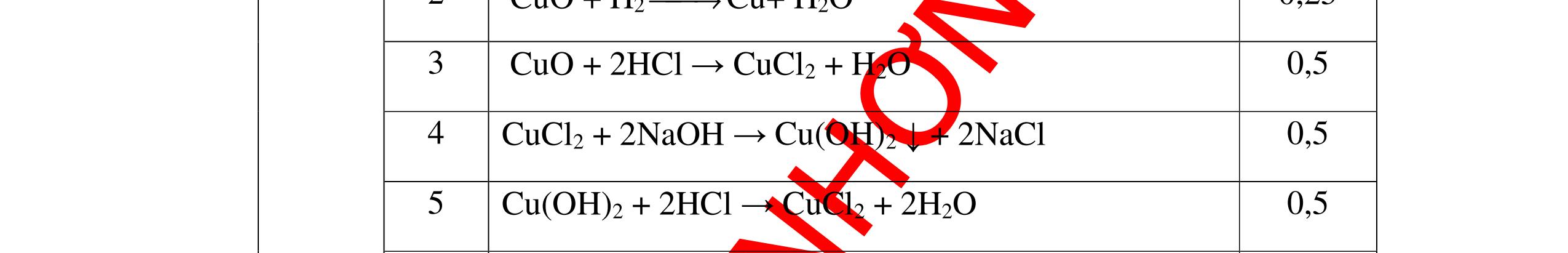
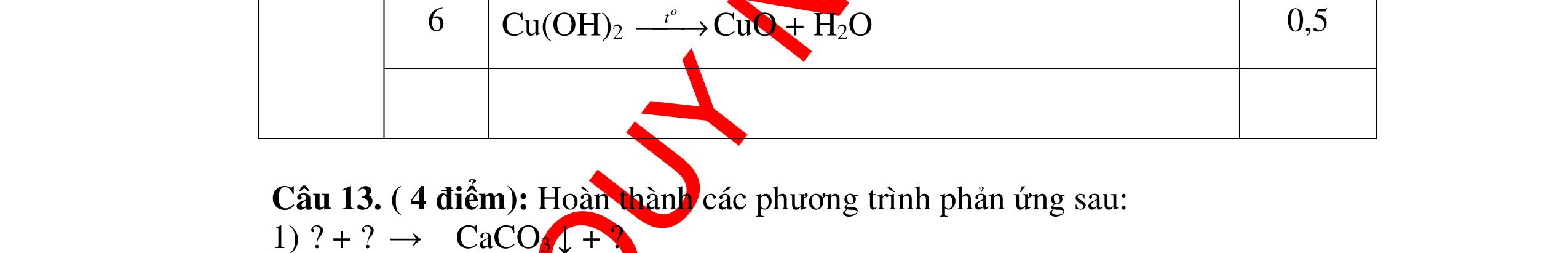
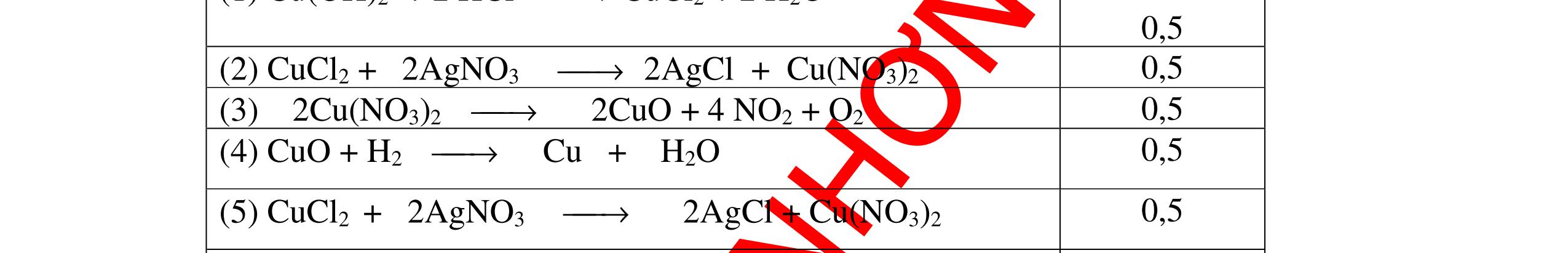
PT:
làm
-
hai khí còn
khi nào làm xu
PT: CuO+
(ho
c khí nào đố
qua
(màu
cháy trong
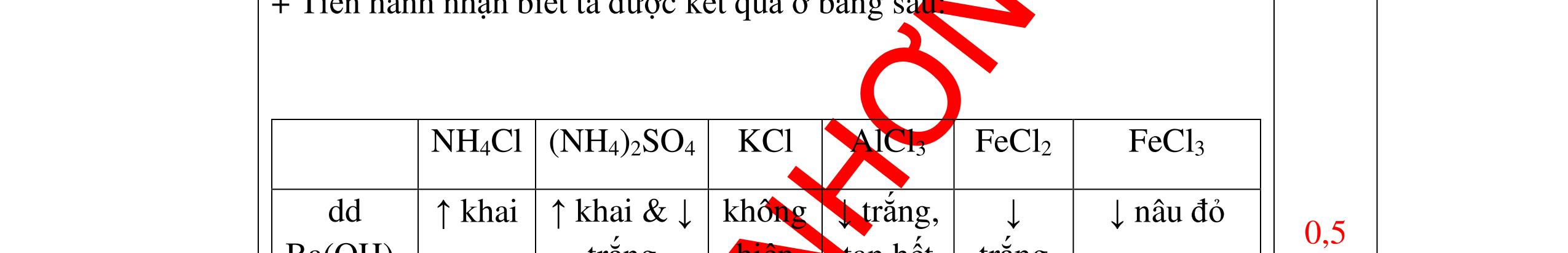
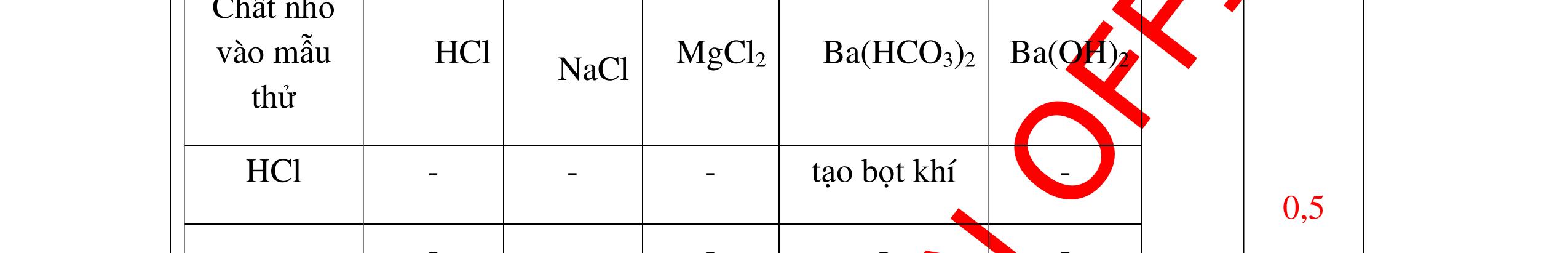
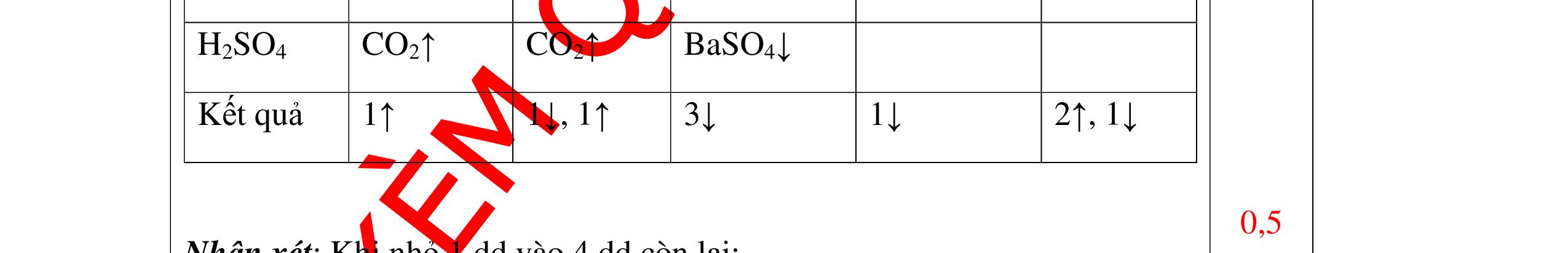
DẠYKÈMQUYNHƠNOFFICIAL CHUYÊN ĐỀ NHẬNBIẾTCÁCCHẤT(3 điểm) Ngườithựchiện: 1)LòThị Bích-TrườngPTDTBTTHCSNậmHàng(Từ câu1–20) Câu1(3.0 điểm): Bằng cách nào có thể nhận biết các khí sau đựng riêng biệt bị mất nhãn: không khí, khí hiđrô, khí oxi, khí cacbonic? Giải thích và viết phương trình hóa học (nếu có)? Câu2(3.0 điểm):Trình bày phương pháp nhận biết các dung dịch đựng trong 4 lọ mất nhãn sau: Nước, Natri hiđôxit, Axit clohiđric, Natriclorua? Viết phương trình phản ứng xảy ra (nếu có)? Câu3(3.0 điểm): Có 4 khí: O2 , H2 , CO2 và N2 đựng trong 4 lọ riêng biệt. Hãy trình bày phương pháp hóa học nhận biết mỗi lọ khí và Viết phương trình phản ứng xảy ra (nếu có)? CâuÝ Hướngdẫnchấm Thang điểm 1 - Lấy mỗi chất một ít cho mỗi lần thử - Cho các khí trên qua dung dịch nước vôi trong Ca(OH)2 dư, khí nào làm đục nước vôi trong đó là khí CO2.
CO2 + Ca(OH)2 → CaCO3↓+ H2O - Lấy que đóm có than hồng cho vào ba khí còn lại, khí nào
que đóm bùng cháy khí đó là khí oxi.
Cho
lại
đi qua CuO (màu đen), nung nóng,
ất hiện Cu
đỏ) khí đó là khí H2
H2 0t → Cu+ H2O
ặ
t
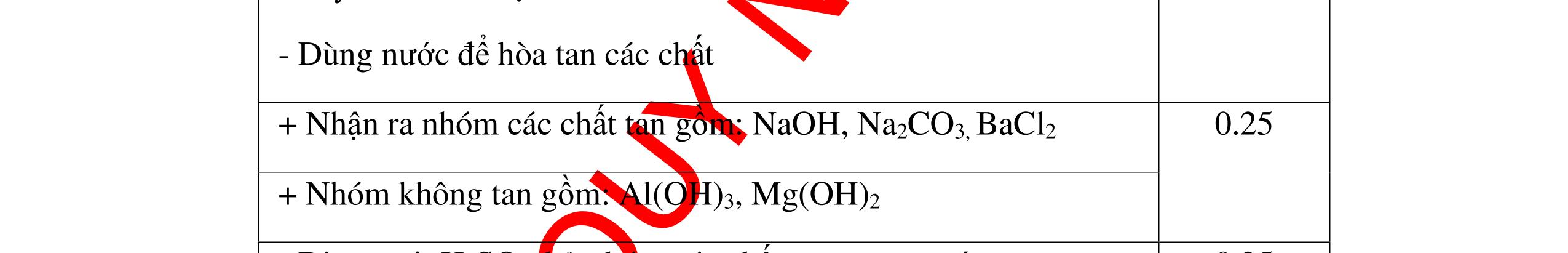
không khí là H2) - Khí còn lại không làm đổi màu CuO (hoặc không cháy) là không khí. 0.25 0.25 0.75 0.25 0.5 0.75 0.25 CâuÝ Hướngdẫnchấm Thang điểm 2 - Lấy mỗi chất một ít cho mỗi lần thử - Rót các dung dịch vào 4 ống nghiệm tương ứng - Bước 1 dùng quỳ tím để nhận biết ra: + NaOH (Bazơ) làm quỳ tím chuyển màu xanh + HCl (axit) làm quỳ tím chuyển màu đỏ - Bước 2 cho dung dịch ở 2 ống nghiệm còn lại không làm quỳ tím đổi màu : + Dùng cho bay hơi nước nóng, ống đựng nước sẽ bay hơi hết + Còn lại tinh thể là ống đựng dd muối NaCl. 0.25 0.25 0.25 0.5 0.5 0.25 0.5 0.5 CâuÝ Hướngdẫnchấm Thang điểm 3 - Lấy mỗi chất một ít cho mỗi lần thử Cho các khí trên qua dung dịch nước vôi trong Ca(OH)2 dư, 0.25 0.25
qu
tím
các
+ Mẫu chất
n tan và quỳ tím không
i màu là natriclorua NaCl.
+ Mẫu chất rắn tan và quỳ tím đổi thành màu xanh là natri oxit Na2O.
tím
thành
PT: ( ) 22CaOHOCaOH
tím
0.25 0.25 0.25 0.25 0.25 0.5 0.25 0.25
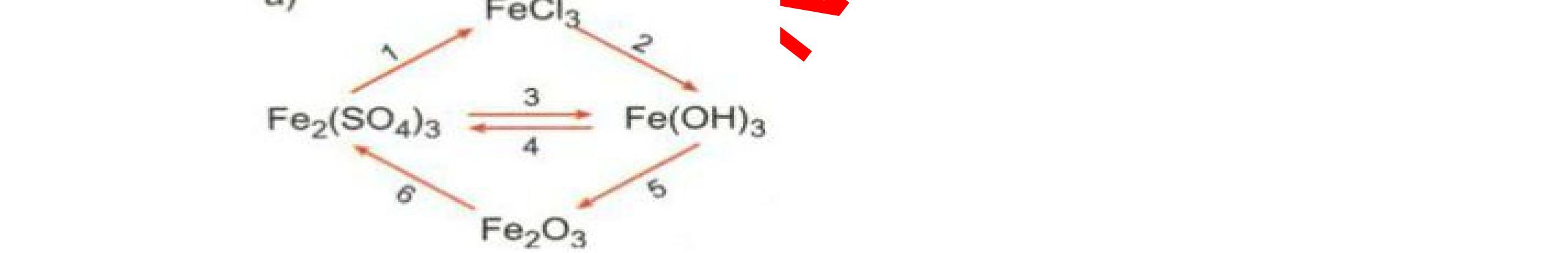
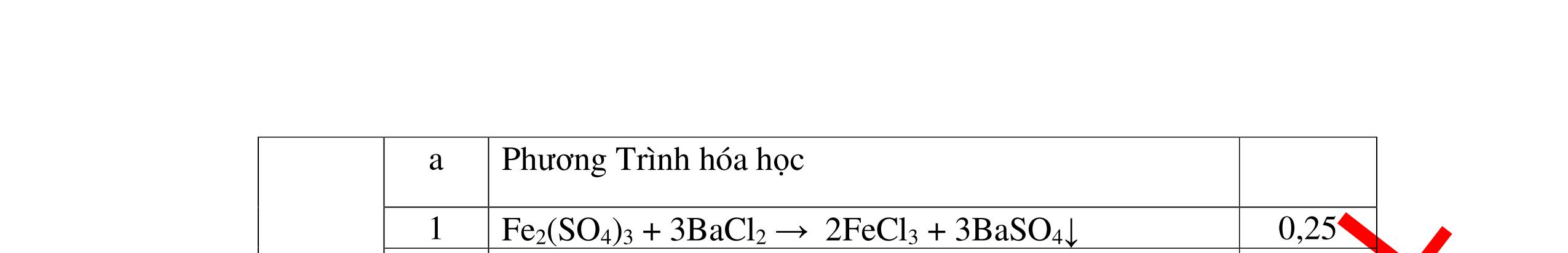
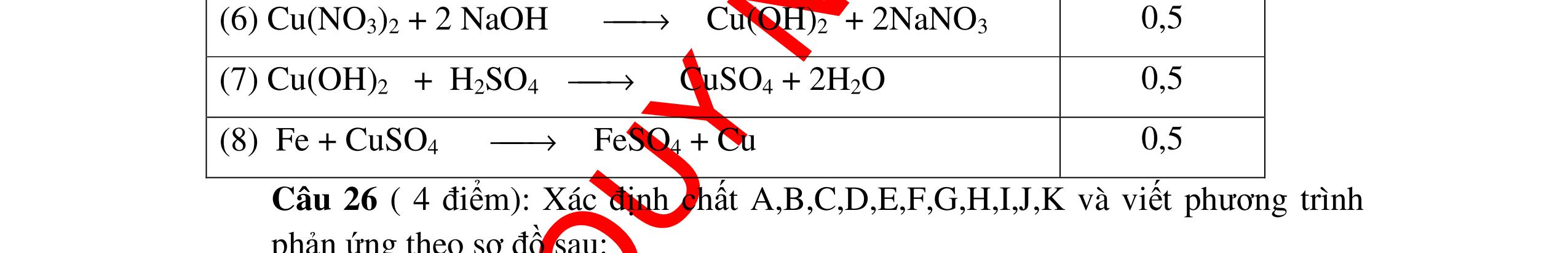
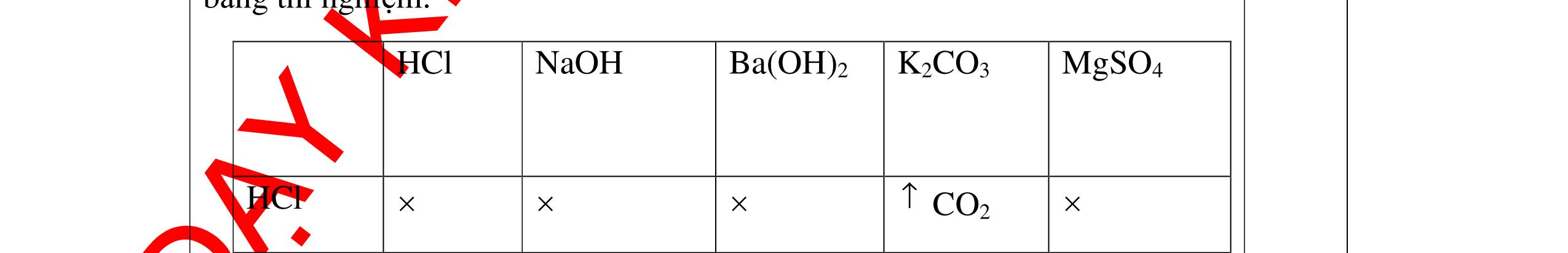
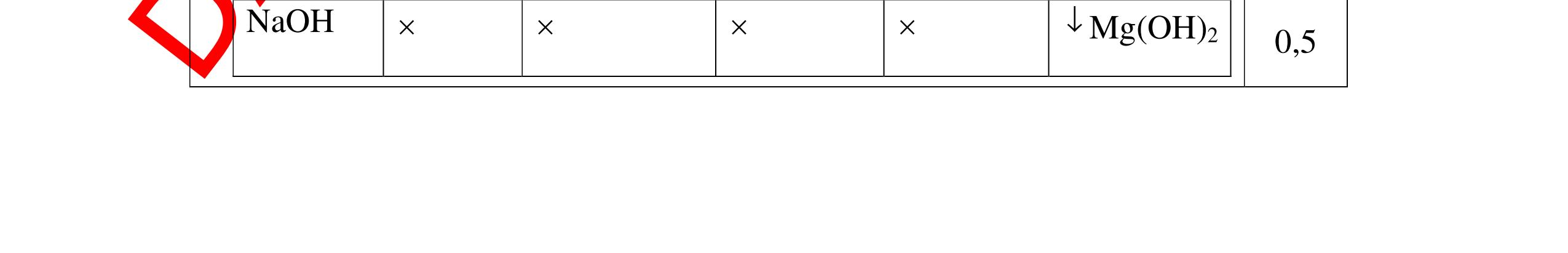
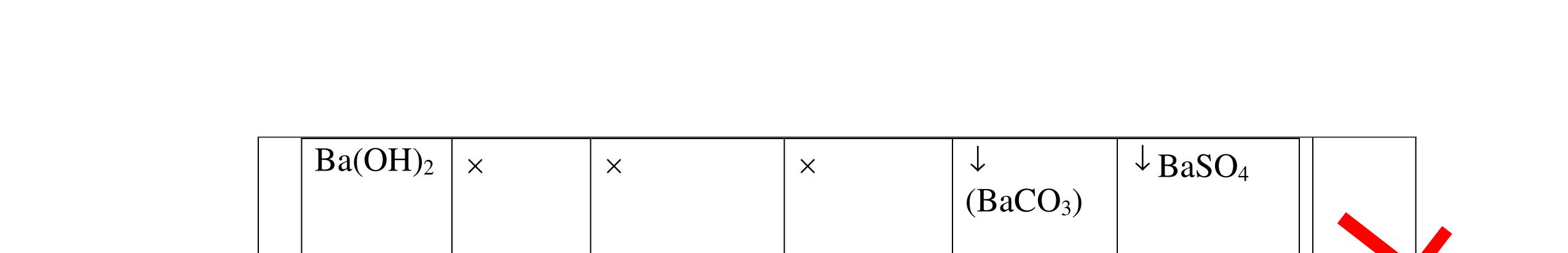
DẠYKÈMQUYNHƠNOFFICIAL Câu4(3.0 điểm): Bằng phương pháp hóa học hãy phân biệt các gói chất bột sau: vôi sống, magie oxit, điphotpho penta oxit, natriclorua, natri oxit. Viết phương trình phản ứng xảy ra (nếu có)? Câu5(3.0 điểm): Bằng phương pháp hoá học hãy nhận biết các chất rắn riêng biệt sau: BaO, MgO, CuO. Viết phương trình phản ứng xảy ra (nếu có)? khí nào làm đục nước vôi trong đó là khí CO2. PT: CO2 + Ca(OH)2 → CaCO3↓+ H2O - Cho ba khí còn lại đi qua CuO (màu đen) nhận ra khí H2 (CuO từ màu đen thành Cu màu đỏ). H2 + CuO 0t → Cu + H2O Đen Đỏ - Dùng que đóm có than hồng để nhận ra khí oxi do khí oxi làm que đóm bùng cháy + Khí còn lại là khí nitơ làm que đóm tắt. 0.75 0.5 0.75 0.25 0.25 CâuÝ Hướngdẫnchấm Thang điểm 4 - Trích các mẫu thử cho vào các ống nghiệm, đánh số thứ tự - Cho nước vào các mẫu thử khuấy đều. - Nhúng lần lượt giấy
ỳ
vào
ống nghiệm:
rắ
đổ
PT: 22 2 NaOHONaOH +→ + Mẫu chất rắn tan và quỳ tím đổi thành màu đỏ là điphotpho penta oxit PT: 25234 3 2 POHOHPO +→ + Mẫu chất rắn tan một phần tạo dung dịch đục và quỳ
đổi
màu xanh là vôi sống CaO:
+→ + Mẫu chất rắn không tan và quỳ
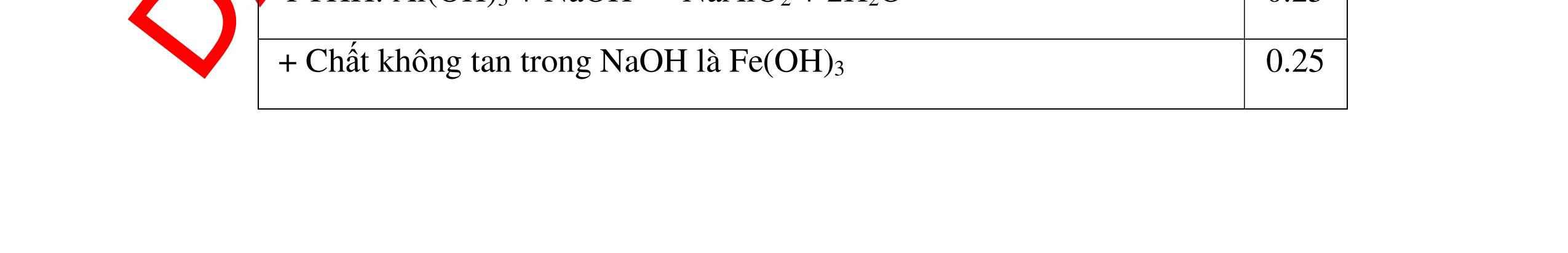
không đổi màu là magie oxit MgO 0.25 0.25
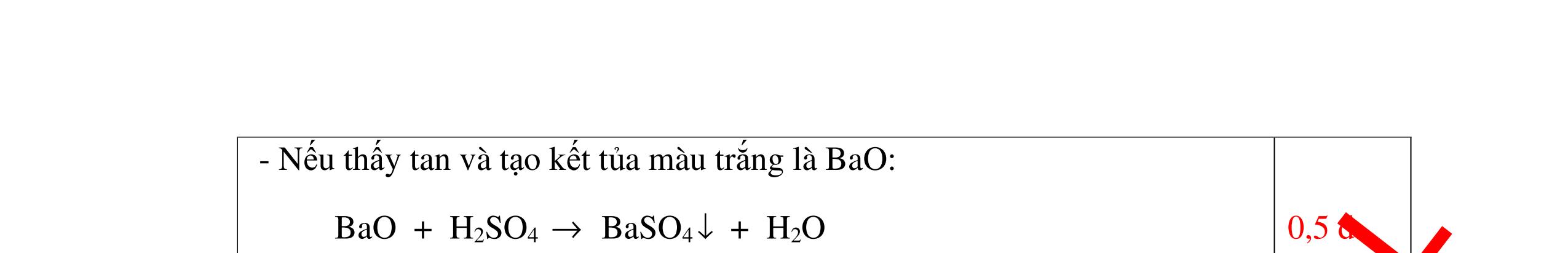
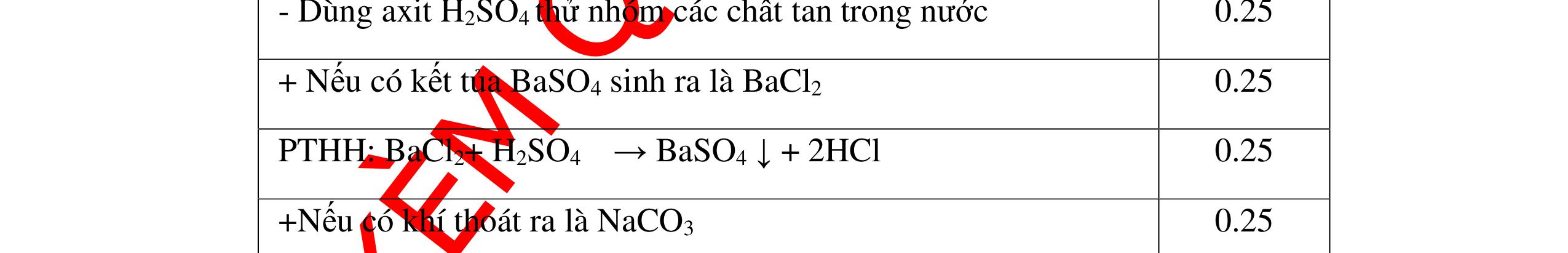
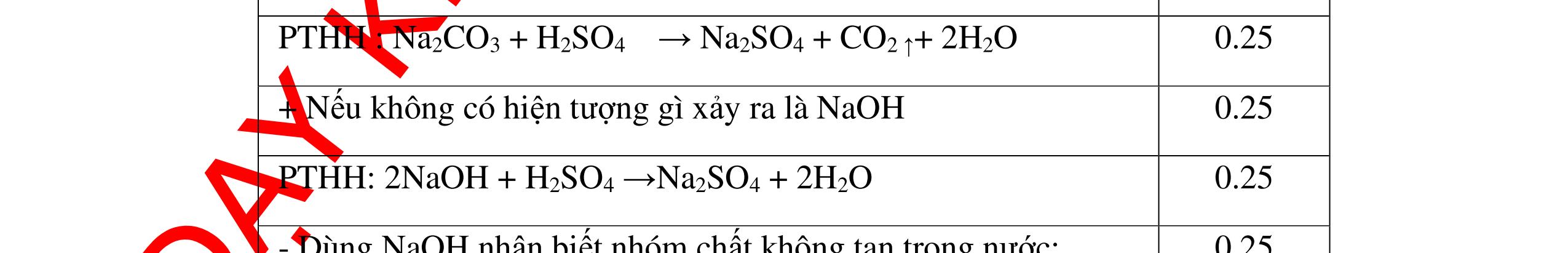
0.25 CâuÝ Hướngdẫnchấm Thang điểm 5 - Lấy mỗi chất một ít cho mỗi lần thử - Hoà tan 3 oxit kim loại bằng nước nhận biết được: + BaO tan tạo ra dung dịch trong suốt PT: BaO + H2O → Ba(OH)2 + Còn lại MgO, CuO không tan - Tiếp tục cho MgO, CuO tác dụng với dung dịch HCl, nhận ra + MgO tan tạo ra dung dịch không màu PT: MgO + 2HCl → MgCl2 + H2O 0.25 0.25 0.25 0.25 0.25 0.25 0.25
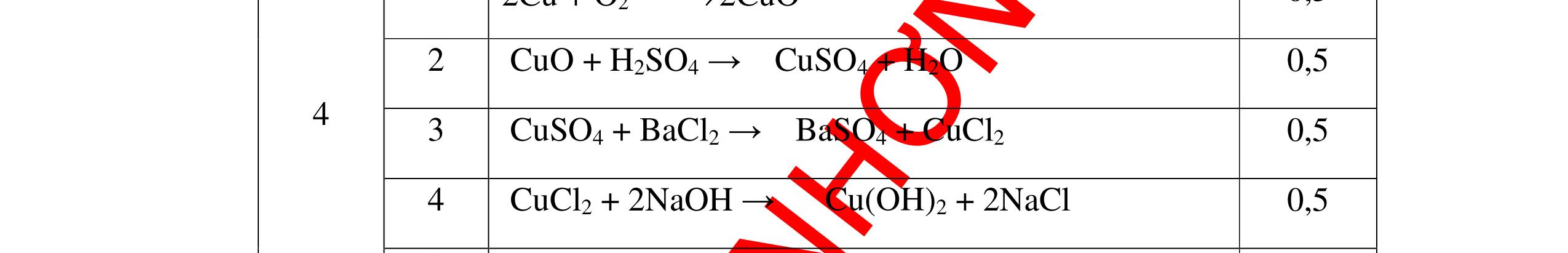
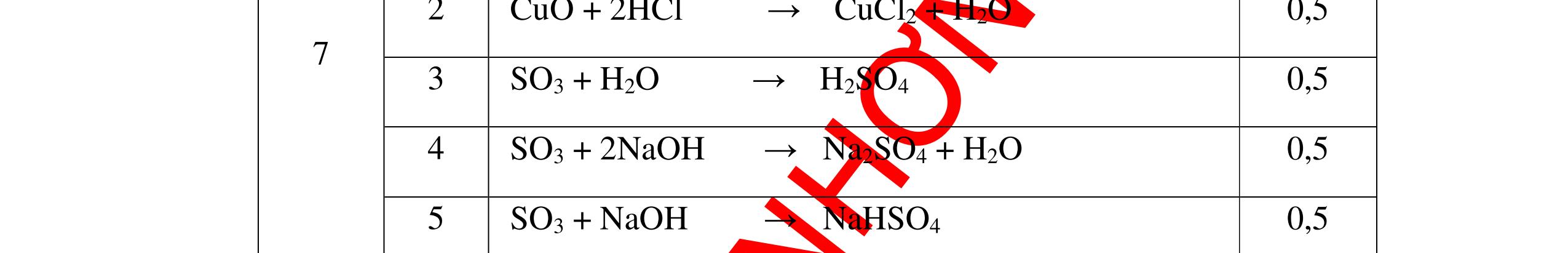
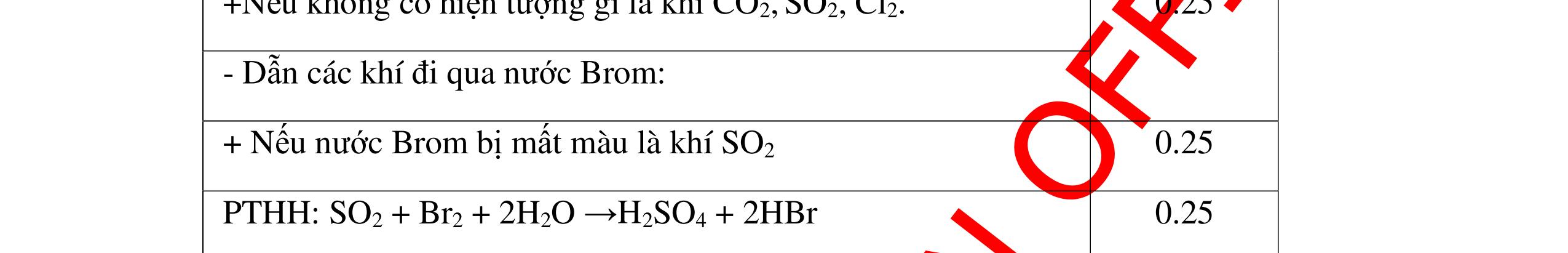
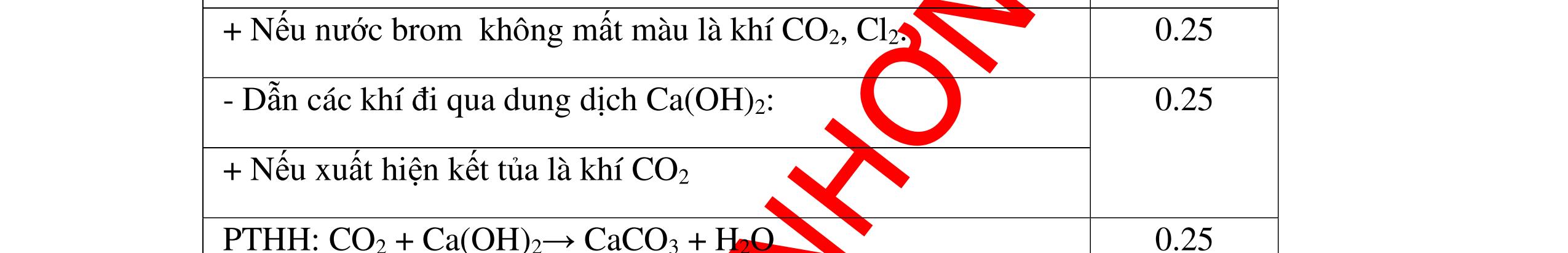
PTHH:
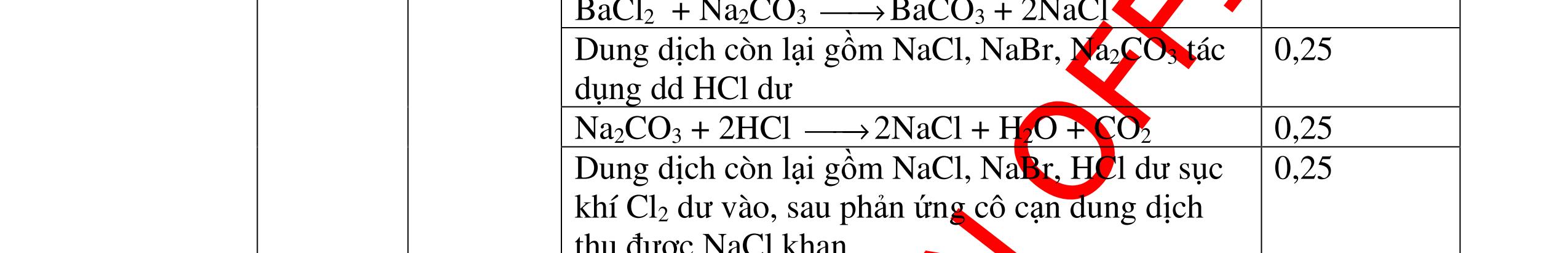
DẠYKÈMQUYNHƠNOFFICIAL Câu6(3.0 điểm): Hãy trình bày phương pháp hóa học nhận biết các chất khí đựng trong các bình bị mất nhãn sau: O2, CO2, H2, SO2, Cl2. Viết PTHH xảy ra (nếu có)? Câu7(3.0 điểm): Có 4 lọ không nhãn đựng riêng biệt từng dung dịch sau: HCl, H2SO4 NaCl, Na2CO3. Hãy nhận biết từng chất đựng trong mỗi lọ bằng phương pháp hóa học và viết phương trình phản ứng xảy ra (nếu có)? + CuO tan tạo dung dịch màu xanh. PT: CuO + 2HCl → CuCl2 + H2O 0.5 0.25 0.5 CâuÝ Hướngdẫnchấm Thang điểm 6 - Lấy mỗi chất một ít cho mỗi lần thử - Dùng que đóm có tàn đỏ đưa vào các đầu bình khí: + Nếu que đóm có tàn đỏ bùng cháy là khí oxi. + Nếu que đóm không bùng cháy là khí CO2, H2, SO2, Cl2. - Dẫn các khí đi qua CuO nung nóng: + Nếu CuO từ màu đen chuyển thành màu đỏ là khí H2
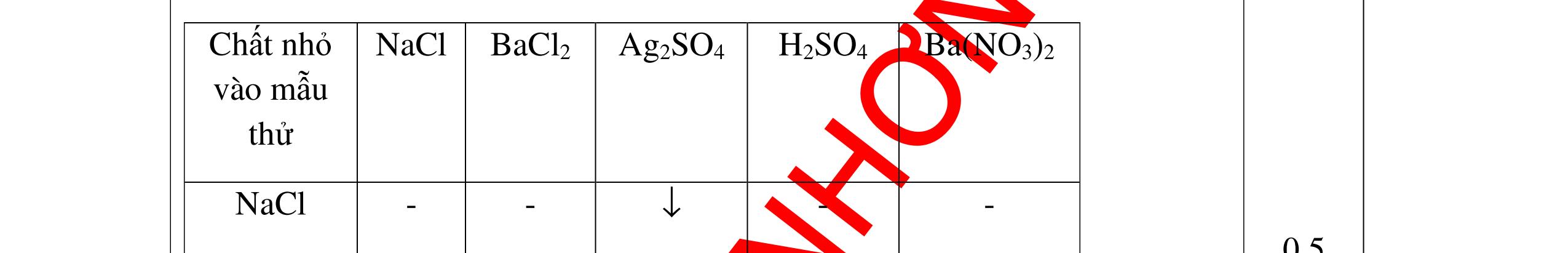
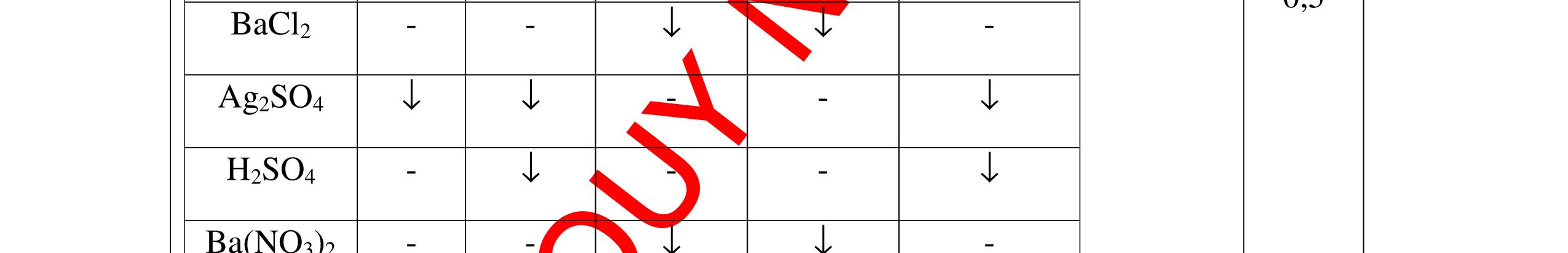
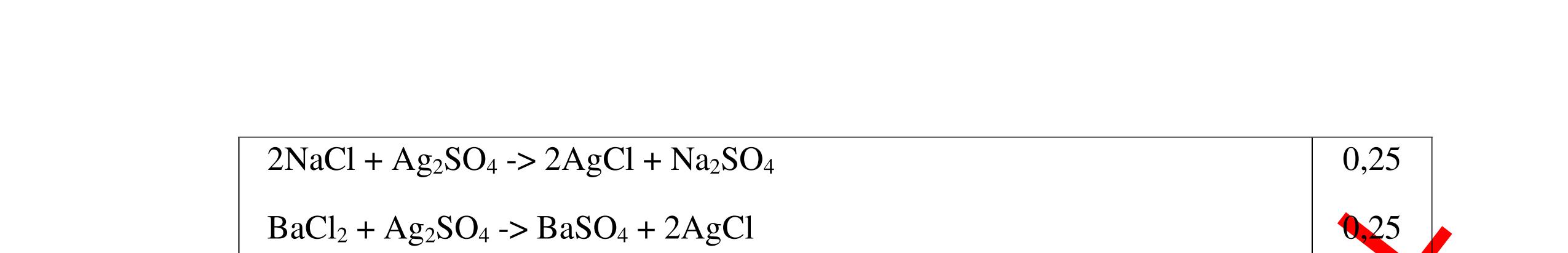
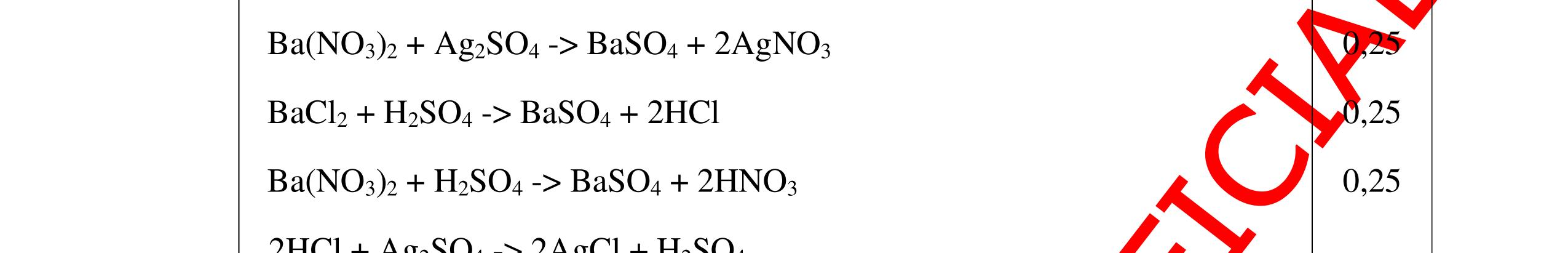
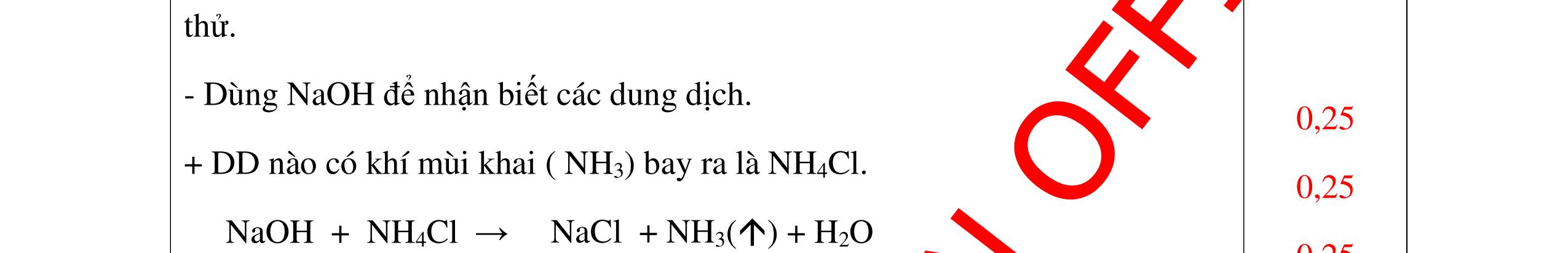
CuO + H2 to Cu + H2O +Nếu không có hiện tượng gì là khí CO2, SO2, Cl2. - Dẫn các khí đi qua nước Brom: + Nếu nước Brom bị mất màu là khí SO2 PTHH: SO2 + Br2 + 2H2O →H2SO4 + 2HBr + Nếu nước brom không mất màu là khí CO2, Cl2 - Dẫn các khí đi qua dung dịch Ca(OH)2 + Nếu xuất hiện kết tủa là khí CO2 PTHH: CO2 + Ca(OH)2→ CaCO3 + H2O + Nếu không xuất hiện kết tủa là khí Cl2 0.25 0.25 0.25 0.25 0.25 0.25 0.25 0.25 0.25 0.25 0.25 0.25 CâuÝ Hướngdẫnchấm Thang điểm 7 - Lấy mỗi chất một ít cho mỗi lần thử - Dùng quỳ tím để nhận biết được 2 nhóm: + Nhóm I làm quỳ tím hóa đỏ: HCl và H2SO4 + Nhóm II không làm đổi màu quỳ tím NaCl và Na2CO3 - Mỗi lần làm thí nghiệm thay mẫu thử mới. Cho HCl vào các mẫu thử nhóm số II. Mẫu nào sủi bọt khí là Na2CO3 PT: Na2CO3 + 2HCl → 2NaCl + CO2 ↑+ H2O + Mẫu thử còn lại không có hiện tượng gì là NaCl - Tiếp tục cho dung dịch BaCl2 vào nhóm I. Mẫu nào xuất hiện kết tủa trắng là H2SO4 PT: BaCl2+ H2SO4→ BaSO4 ↓+ 2HCl + Mẫu còn lại không có hiện tượng gì là HCl 0.25 0.25 0.25 0.25 0.25 0.5 0.25 0.25 0.5 0.25
DẠYKÈMQUYNHƠNOFFICIAL Câu8(3.0 điểm): Bằng phương pháp hoá học hãy nhận biết các chất rắn riêng biệt sau: CaO, Na2O, MgO và P2O5 . Viết phương trình hóa học (nếu có)? Câu9(3.0 điểm): Bằng phương pháp hóa học nhận biết các chất khí đựng trong các bình bị mất nhãn sau: O2, CO2, H2, SO2, N2. Viết PTHH xảy ra (nếu có)? CâuÝ Hướngdẫnchấm Thang điểm 8 - Lấy mỗi chất một ít cho mỗi lần thử - Hoà tan 4 mẫu thử vào nước nhận biết được: + MgO không tan + CaO, P2O5, Na2O tan trong nước: CaO tan tạo dung dịch đục PT: ( ) 22CaOHOCaOH +→ Hai mẫu thử còn lại P2O5 và Na2O tan tạo dung dịch trong suốt. - Thử giấy quỳ tím với hai dung dịch vừa tạo thành, nếu giấy quỳ tím chuyển sang đỏ là dung dịch axit, chất ban đầu là P2O5. PT: 25234 3 2 POHOHPO +→ + Nếu quì tím chuyển sang xanh là bazơ, chất ban đầu là Na2O. PT: 22 2 NaOHONaOH +→ 0.25 0.25 0.25 0.25 0.25 0.25 0.25 0.25 0.5 0.25 0.25 CâuÝ Hướngdẫnchấm Thang điểm 9 - Lấy mỗi chất một ít cho mỗi lần thử - Dùng que đóm có tàn đỏ đưa vào các đầu bình khí: + Nếu que đóm có tàn đỏ bùng cháy là khí oxi. + Nếu que đóm không bùng cháy là khí CO2, H2, SO2, N2. - Dẫn các khí đi qua CuO nung nóng: + Nếu CuO từ màu đen chuyển thành màu đỏ là khí H2 PTHH: CuO + H2 to Cu + H2O +Nếu không có hiện tượng gì là khí CO2, SO2, N2 - Dẫn các khí đi qua nước Brom: + Nếu nước Brom bị mất màu là khí SO2 PTHH: SO2 + Br2 + 2H2O →H2SO4 + 2HBr + Nếu nước brom không mất màu là khí CO2, N2. - Dẫn các khí đi qua dung dịch Ca(OH)2: + Nếu xuất hiện kết tủa là khí CO2 PTHH: CO2 + Ca(OH)2→ CaCO3 + H2O + Nếu không xuất hiện kết tủa là khí N2 0.25 0.25 0.25 0.25 0.25 0.25 0.25 0.25 0.25 0.25 0.25 0.25
-
Ca(OH)
+
khí nào
PT: CO2 + Ca(OH)
CaCO
H
+ Khí không làm đục nước vôi trong là khí N2, H2, Cl2
- Dẫn các khí còn lại qua đi qua CuO, nung nóng :
+ Nếu khí nào làm CuO từ màu đen chuyển thành màu đỏ là khí H2
PT:
DẠYKÈMQUYNHƠNOFFICIAL Câu10(3.0 điểm): Bằng phương pháp hóa học nhận biết các chất khí đựng trong các bình bị mất nhãn sau: O2, CO2, H2, N2, Cl2. Viết PTHH xảy ra (nếu có)? Câu11(3.0 điểm): Bằng phương pháp hoá học hãy nhận biết các dung dịch sau: HCl, NaOH, Na2SO4, NaCl. Viết phương trình phản ứng xảy ra (nếu có)? CâuÝ Hướngdẫnchấm Thang điểm 10 - Lấy mỗi chất một ít cho mỗi lần thử. - Đưa que đóm có tàn đỏ vào các khí: + Nếu khí nào làm que đóm bùng cháy khí đó là khí oxi. + Các khí không làm que đóm bùng cháy là khí CO2, H2, N2, Cl2.
Dẫn các khí còn lại đi qua dung dịch nước vôi trong
2:
Nếu
làm đục nước vôi trong đó là khí CO2.
2 →
3↓+
2O
CuO + H2 to Cu+ H2O + Khí không làm CuO từ màu đen chuyển thành màu đỏ là khí N2, Cl2 - Dẫn các khí còn lại vào dung dịch AgNO3: + Nếu khí nào phản ứng cho kết tủa trắng sau ít phút là khí Cl2: PT: Cl2 + H2O → HClO + HCl HCl + AgNO3 →AgCl↓+ HNO3 + Khí còn lại là khí N2. 0.25 0.25 0.25 0.25 0.25 0.25 0.25 0.25 0.25 0.5 0.25 CâuÝ Hướngdẫnchấm Thang điểm 11 - Lấy mỗi chất một ít cho mỗi lần thử. - Dùng quỳ tím nhận biết các dung dịch: + Dung dịch làm quỳ tím hoá đỏ là axit HCl. + Dung dịch làm quỳ tím hoá xanh là bazơ NaOH. + Na2SO4 và NaCl Dung không làm đổi màu quỳ tím là hai muối Na2SO4 và NaCl . - Tiếp tục dùng dung dịch BaCl2 để nhận biết 2 muối Na2SO4 và NaCl + Mẫu thử nào phản ứng tạo kết tủa trắng là Na2SO4 PT: BaCl2 + Na2SO4 → BaSO4 + 2NaCl + Mẫu thử còn lại không phản ứng là NaCl 0.25 0.25 0.25 0.25 0.25 0.5 0.25 0.75 0.25
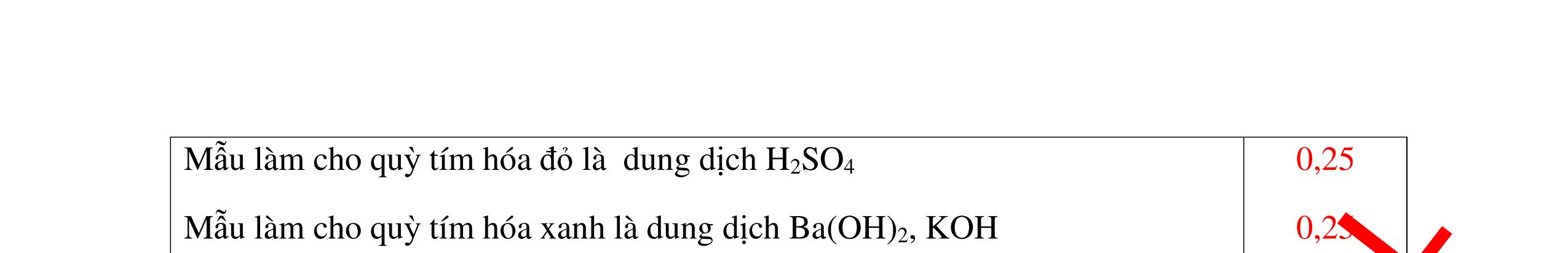
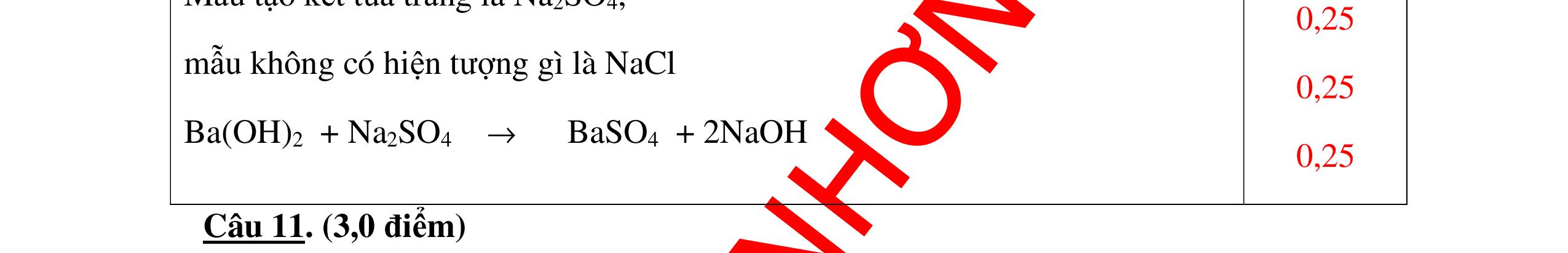
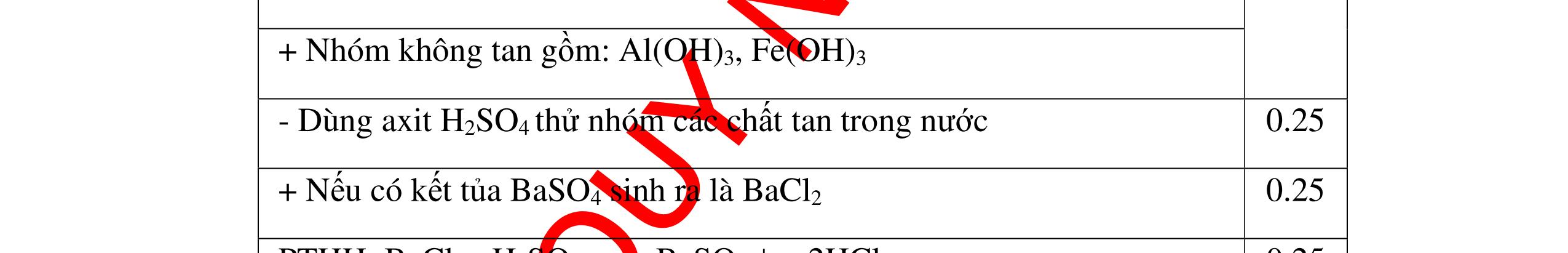
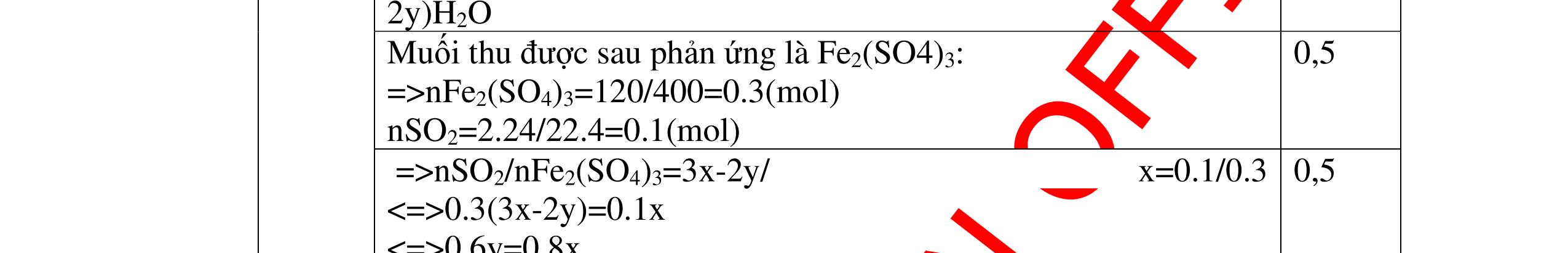
DẠYKÈMQUYNHƠNOFFICIAL Câu12(3.0 điểm): Bằng phương pháp hoá học hãy nhận biết các chất rắn riêng biệt sau: Na2O, CaO, Ag2O, CuO. Viết phương trình phản ứng xảy ra (nếu có)? Câu13(3.0 điểm): Phân biệt các chất khí đựng trong 5 bình riêng biệt sau: O2 , CO2 , Cl2, NH3 , N2. Viết các phương trình hóa học xảy ra (nếu có)? Câu14(3.0 điểm): Cho 4 lọ mất nhãn sau: H2SO4, NaOH, NaNO3, BaCl2. Bằng PPHH hãy nhận biết 4 lọ trên, Viết phương trình phản ứng xảy ra (nếu có)? CâuÝ Hướngdẫnchấm Thang điểm 12 - Lấy mỗi chất một ít cho mỗi lần thử. * Hoà tan các mẫu thử vào nước nhận biết: - Mẫu thử tan trong nước là: Na2O, CaO + Na2O tan tạo dung dịch trong suốt. PT: Na2O + H2O → 2NaOH + CaO tan tạo dung dịch đục. PT: CaO + H2O → Ca(OH)2 - Mẫu thử không tan trong nước là Ag2O, CuO - Tiếp tục dùng dung dịch HCl đặc để nhận biết các mẫu thử Ag2O, CuO + Mẫu thử tan tạo kết tủa màu trắng là Ag2O PT: Ag2O + 2HCl → 2AgCl ↓ trắng + H2O + Mẫu thử tan tạo dung dịch màu xanh là CuO PT: CuO + 2HCl → CuCl2 + 2H2O 0.25 0.25 0.25 0.25 0.25 0.25 0.25 0.25 0.25 0.25 0.25 0.25 CâuÝ Hướngdẫnchấm Thang điểm 13 - Lấy mỗi chất một ít cho mỗi lần thử. - Dẫn các khí đi qua dung dịch Ca(OH)2: + Nếu xuất hiện kết tủa là khí CO2 PTHH: CO2 + Ca(OH)2→ CaCO3 + H2O + Nếu không xuất hiện kết tủa là các khí O2 ,Cl2, NH3 , N2 - Dùng quỳ tím ẩm để nhận ra Cl2 , giấy quỳ tím hóa đỏ rồi dần mất màu 222 2 ClHOOHClO ++→ - Dẫn 3 khí còn lại O2 , NH3 , N2 vào dung dịch AgNO3 + Nếu khí nào phản ứng cho kết tủa màu đen là khí NH3 PT: NH3 + AgNO3 + H2O →AgOH↓+ NH4NO3 - Khí còn lại không có hiện tượng gì là O2 , N2 - Đưa que đóm có tàn đỏ vào 2 khí: + Nếu khí nào làm que đóm bùng cháy khí đó là khí oxi. - Khí còn lại không cháy là N2 0.25 0.25 0.25 0.25 0.25 0.25 0.25 0.25 0.25 0.25 0.25 0.25 CâuÝ Hướngdẫnchấm Thang điểm 14 - Trích mỗi lọ 1 ít làm mẫu thử. Nhúng quỳ tím vào các mẫu thử. Mẫu thử nào làm quỳ tím 0.25 0.5
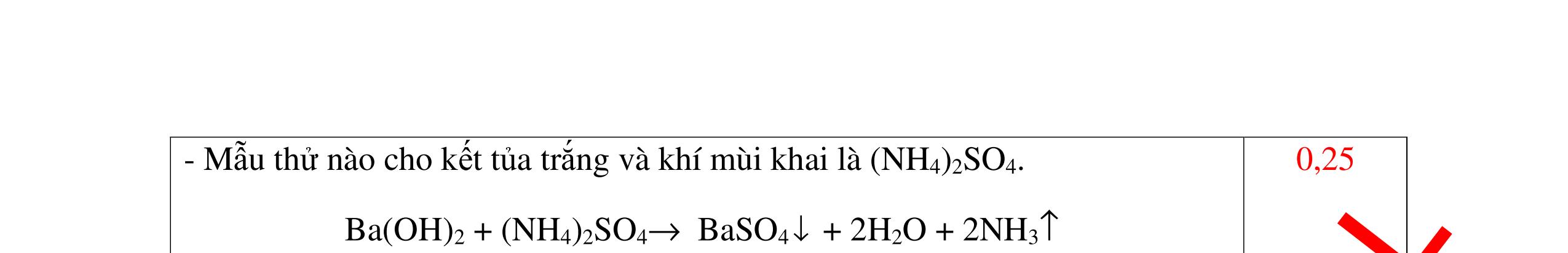
DẠYKÈMQUYNHƠNOFFICIAL Câu15(3.0 điểm): Phân biệt các chất bột màu trắng sau bằng phương pháp hóa học: MgO, P2O5, BaO, Na2SO4. Viết các phương trình phản ứng xảy ra? Câu16(3.0 điểm): Bằng phương pháp hóa học nhận biết các chất khí đựng trong các bình bị mất nhãn sau: O2, CO2, H2, Cl2. Viết PTHH xảy ra (nếu có)? hóa đỏ là axit H2SO4 + Mẫu thử làm quỳ tím hóa xanh là bazơ NaOH + Mẫu thử không làm đổi màu quỳ tím là muối NaNO3, BaCl2 - Tiếp tục cho dung dịch H2SO4 vào 2 mẫu thử còn lại. Mẫu thử nào tạo kết tủa trắng là BaCl2 + PT: H2SO4 + BaCl2 → BaSO4 + 2HCl - Mẫu thử không có hiện tượng gì là NaNO3 0.5 0.25 0.5 0.75 0.25 CâuÝ Hướngdẫnchấm Thang điểm 15 - Lấy một lượng vừa đủ mỗi mẫu hóa chất cho vào các ống nghiệm riêng biệt rồi đánh số thứ tự. - Hòa tan các mẫu thử bằng H2O . Nếu chất bột nào tan tạo dung dịch trong suốt là Na2SO4, BaO, P2O5: Na2SO4 → dd Na2SO4 BaO + H2O → Ba(OH)2 P2O5 + 3H2O → 2H3PO4 - Còn chất bột không tan là MgO - Tiếp tục dùng quỳ tím thử 3 dung dịch trong suốt Na2SO4, BaO, P2O5 : + Mẫu thử không đổi mầu quỳ tím → dd Na2SO4 + Mẫu thử làm quỳ tím chuyển màu xanh → Ba(OH)2 nhận ra mẫu ban đầu là BaO + Mẫu thử làm quỳ tím chuyển màu đỏ → H3PO4 nhận ra mẫu ban đầu là P2O5 0.25 0.25 0.25 0.5 0.5 0.25 0.25 0.25 0.25 0.25 CâuÝ Hướngdẫnchấm Thang điểm 16 - Lấy mỗi chất một ít cho mỗi lần thử - Dùng que đóm có tàn đỏ đưa vào các đầu bình khí: + Nếu que đóm có tàn đỏ bùng cháy là khí oxi. + Nếu que đóm không bùng cháy là khí CO2, H2, Cl2. - Dẫn các khí đi qua CuO nung nóng: + Nếu CuO từ màu đen chuyển thành màu đỏ là khí H2 PTHH: CuO + H2 to Cu + H2O +Nếu không có hiện tượng gì là khí CO2, Cl2 - Dẫn các khí đi qua dung dịch Ca(OH)2: + Nếu xuất hiện kết tủa là khí CO2 PTHH: CO2 + Ca(OH)2→ CaCO3 + H2O 0.25 0.25 0.25 0.25 0.25 0.25 0.25 0.25 0.25 0.25 0.25
DẠYKÈMQUYNHƠNOFFICIAL Câu17(3.0 điểm): Có 4 chất bột: MnO2, Ag2O, CuO, FeO. Hãy nêu phương pháp hóa học để nhận biết 4 chất trên. Viết phương trình hóa học (nếu có)? Câu18(3.0 điểm): Hãy trình bày phương pháp hóa học nhận biết các chất khí đựng trong các bình bị mất nhãn sau: O2, H2, SO2, Cl2. Viết PTHH xảy ra (nếu có)? Câu19(3.0 điểm): Bằng phương pháp hóa học nhận biết các chất khí đựng trong các bình bị mất nhãn sau: O2, SO2, H2, N2, Cl2. Viết PTHH xảy ra (nếu có)? + Nếu không xuất hiện kết tủa là khí Cl2 0.25 CâuÝ Hướngdẫnchấm Thang điểm 17 - Lấy ở mỗi lọ một ít mẫu thử cho vào từng ống nghiệm hòa tan vào dung dịch HCl + Mẫu thử nào xuất hiện khí màu vàng nhạt là MnO2. PT: 2222 4HCl2 MnOMnClHOCl +→++ + Mẫu thử nào xuất hiện chất rắn màu xanh lam là CuO PT: 222HCl CuOCuClHO +→+ + Mẫu thử nào xuất hiện kết tủa trắng là Ag2O PT: 2 22HCl2 AgOAgClHO +→+ + Mẫu thử nào xuất hiện chất rắn màu lục nhạt là FeO PT: 222HCl FeOFeClHO +→+ 0.25 0.25 0.5 0.25 0.25 0.25 0.5 0.25 0.5 CâuÝ Hướngdẫnchấm Thang điểm 18 - Lấy mỗi chất một ít cho mỗi lần thử - Dùng que đóm có tàn đỏ đưa vào các đầu bình khí: + Nếu que đóm có tàn đỏ bùng cháy là khí oxi. + Nếu que đóm không bùng cháy là khí H2, SO2, Cl2 - Dẫn các khí đi qua CuO nung nóng: + Nếu CuO từ màu đen chuyển thành màu đỏ là khí H2 PTHH: CuO + H2 to Cu + H2O +Nếu không có hiện tượng gì là khí SO2, Cl2. - Dẫn các khí đi qua nước Brom: + Nếu nước Brom bị mất màu là khí SO2 PTHH: SO2 + Br2 + 2H2O →H2SO4 + 2HBr + Nếu nước brom không mất màu là khí Cl2. 0.25 0.25 0.25 0.25 0.25 0.25 0.25 0.25 0.25 0.25 0.25 0.25 CâuÝ Hướngdẫnchấm Thang điểm
19
- Lấy mỗi chất một ít cho mỗi lần thử.
- Đưa que đóm có tàn đỏ vào các khí: Nếu khí nào làm que đóm bùng cháy khí đó là khí oxi. Các khí không làm que đóm bùng cháy là khí SO2, H2, N2, Cl2
- Dẫ
Câu20(3.0 điểm): Bằng phương pháp hóa học nhận biết các chất khí đựng trong các bình bị mất nhãn sau: O2, CO2, N2, Cl2. Viết phương trình phản ứng xảy ra (nếu có)?
DẠYKÈMQUYNHƠNOFFICIAL
n các khí còn lại đi qua nước Brom: + Nếu nước Brom bị mất màu là khí SO2 PTHH: SO2 + Br2 + 2H2O →H2SO4 + 2HBr + Nếu nước brom không mất màu là khí N2, H2, Cl2. - Dẫn các khí còn lại qua đi qua CuO, nung nóng : Nếu khí nào làm CuO từ màu đen chuyển thành màu đỏ là khí H2 CuO + H2 to Cu+ H2O Khí không làm CuO từ màu đen chuyển thành màu đỏ là khí N2, Cl2 - Dẫn các khí còn lại vào dung dịch AgNO3: Nếu khí nào phản ứng cho kết tủa trắng sau ít phút là khí Cl2: Cl2 + H2O → HClO + HCl HCl + AgNO3 →AgCl↓+ HNO3 Khí còn lại là khí N2. 0.25 0.25 0.25 0.25 0.25 0.25 0.25 0.25 0.25 0.25 0.25 0.25 CâuÝ Hướngdẫnchấm Thang điểm 20 - Lấy mỗi chất một ít cho mỗi lần thử. - Đưa que đóm có tàn đỏ vào các khí: Nếu khí nào làm que đóm bùng cháy khí đó là khí oxi. Các khí không làm que đóm bùng cháy là khí CO2, N2, Cl2. - Dẫn các khí còn lại đi qua dung dịch nước vôi trong Ca(OH)2: + Nếu khí nào làm đục nước vôi trong đó là khí CO2. PT: CO2 + Ca(OH)2 →CaCO3↓+ H2O + Khí không làm đục nước vôi trong là khí N2, Cl2. - Dẫn các khí còn lại vào dung dịch AgNO3: +Nếu khí nào phản ứng cho kết tủa trắng sau ít phút là khí Cl2: PT: Cl2 + H2O → HClO + HCl HCl + AgNO3 →AgCl↓+ HNO3 + Khí còn lại không có phản ứng là khí N2. 0.25 0.25 0.25 0.25 0.25 0.25 0.25 0.25 0.25 0.25 0.25 0.25
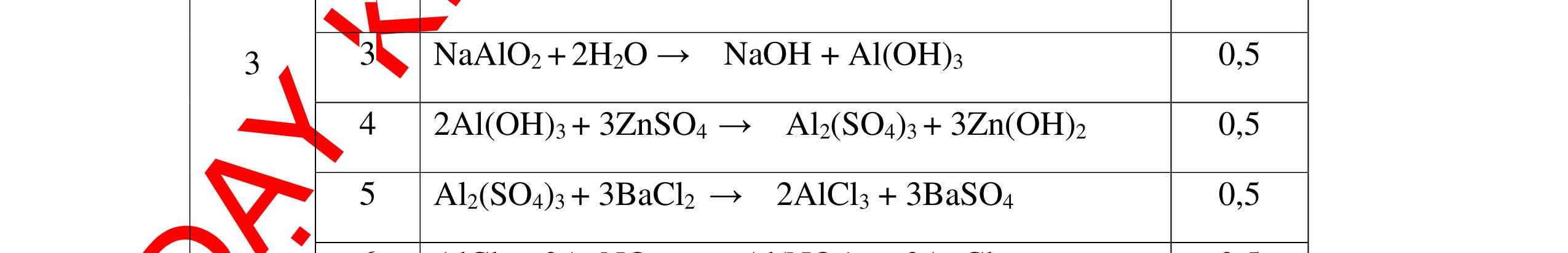
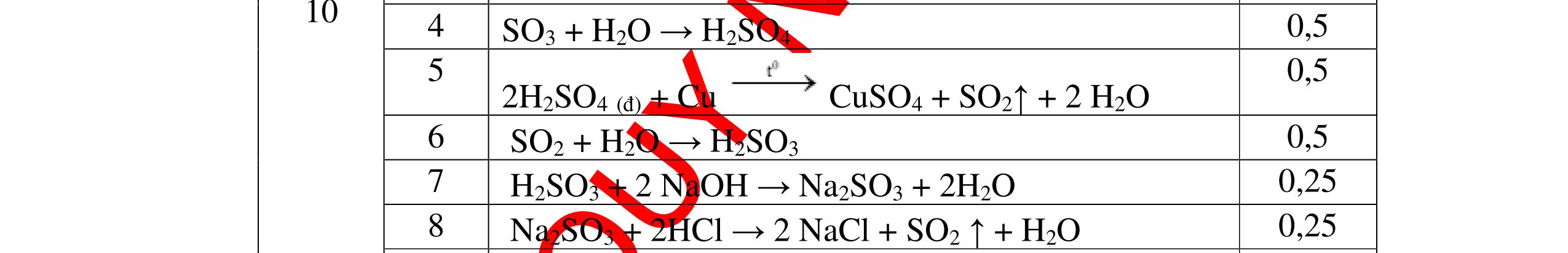
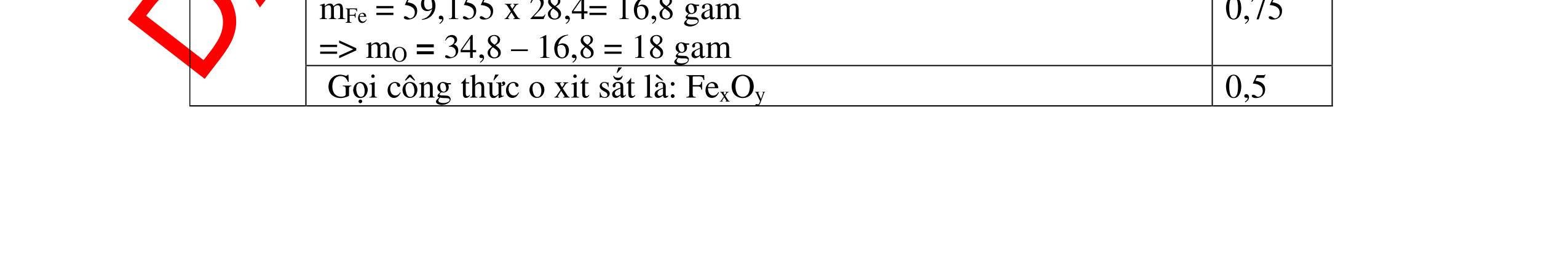
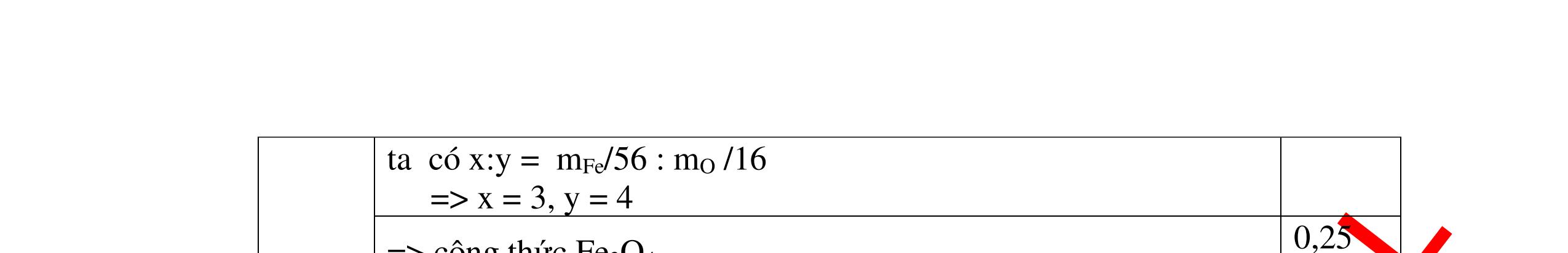
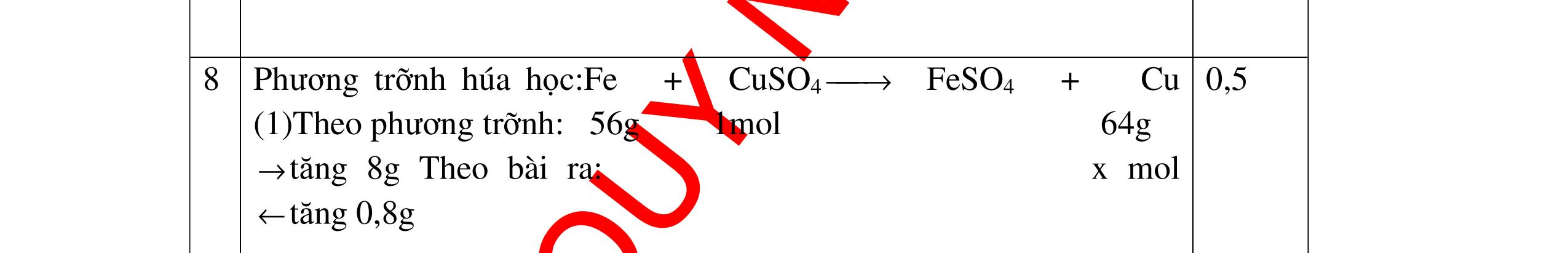
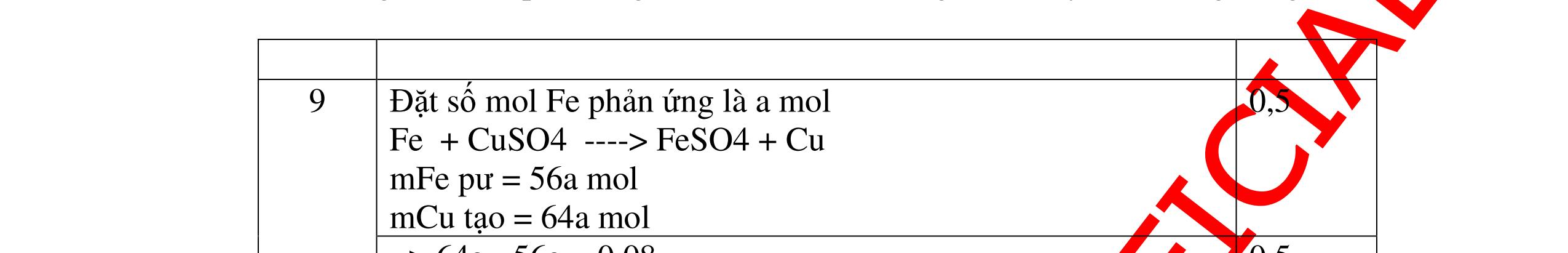
1
a
Gi
n h
p ch
có kim lo
i Mg
nMg= 3,87/24= 0,1615 mol Mg + 2HCl → MgCl2 + H2 0,1615mol →0,3225mol
0,5
Giả sử hỗn hợp chỉ có Al nAl= 3,87/27= 0,1433 mol
2Al + 6HCl → 2AlCl3 + 3H2 0,1433mol →0,4839mol
0,5 0,1433<nkim loại < 0,1615; 0,3225<nHCl < 0,4839
Mà nHCl bài cho= 0,5= 0,5 mol>0,4839mol 0,25
V
G
HCl còn
mol c
Al là y mol
Mg + 2HCl → MgCl2 + H2 xmol x mol
2Al + 6HCl → 2AlCl3 + 3H2
1,5y mol
0,25
DẠYKÈMQUYNHƠNOFFICIAL CHUYÊN ĐỀ BÀITẬPTỔNGHỢP Ngườithựchiện: 1)TôThanhTuân-TrườngTHCSLêLợi(Từ câu1–15) 2)LòThị Bích-TrườngPTDTBTTHCSNậmHàng(Từ câu16–27) Câu1 ( 3,5 điểm): Cho 3,87 g hỗn hợp gồm Mg và Al tác dụng với 18,25 gam HCl. a. Chứng minh rằng sau phản ứng HCl vẫn còn dư. b. Nếu phản ứng trên làm thoát ra 4,368 lit H2 (đktc). Hãy tính % theo khối lượng mỗi kim loại trong hỗn hợp ban đầu. 0,5
ả sử hỗ
ợ
ỉ
ạ
ậy nên sau phản ứng
dư
b
ọi số mol của Mg là x, số
ủa
ymol
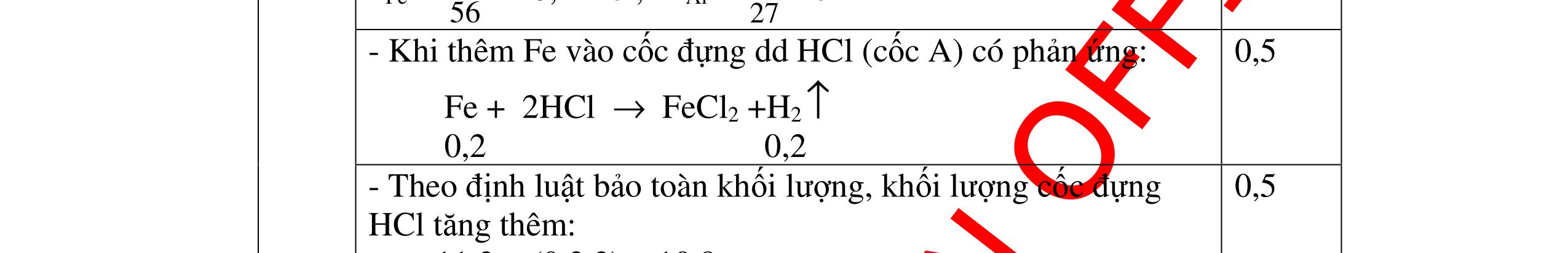
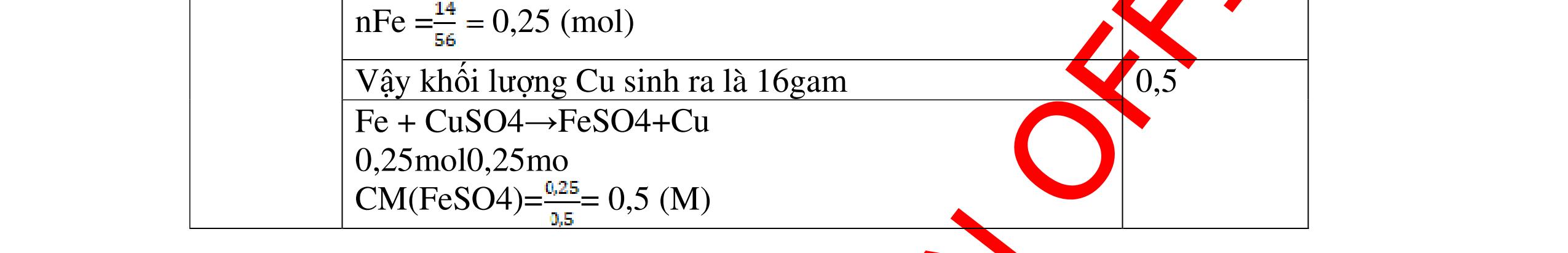
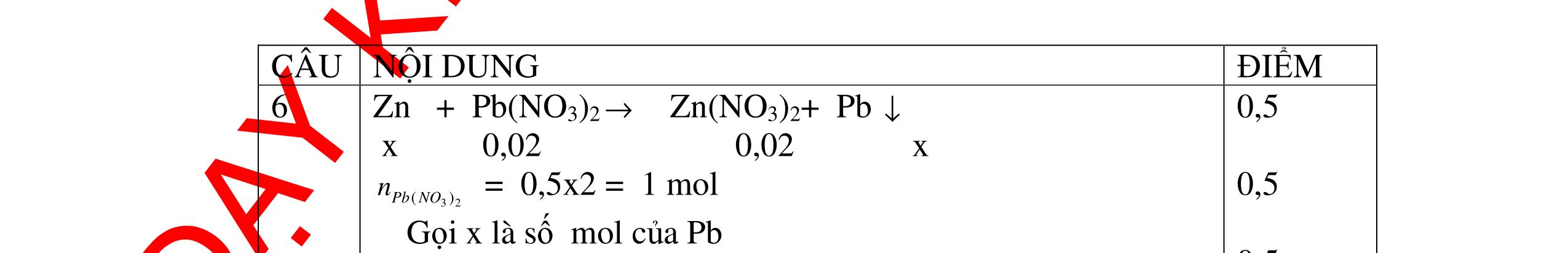
Ta có hệ phương trình: 24x+27y=3,87 x+1,5y = 4,368/22,4 Giải ra ta có : x=0,06 ; y=0,09 0,5 mMg = 0,06.24=1,44 g ; %Mg= 1,44.100/3,87=37,21% 0,5 mAl = 0,09.27=2,43g ; %Al= 2,43.100/3,87=62,79% 0,5 Câu 2 (3,5 điểm) Đặt cốc A đựng dung dịch HCl và cốc B đựng dung dịch H2SO4 loãng vào 2 đĩa cân sao cho cân ở vị trí cân bằng. Sau đó làm thí nghiệm như sau: - Cho 11,2g Fe vào cốc đựng dung dịch HCl. - Cho m gam Al vào cốc đựng dung dịch H2SO4 Khi cả Fe và Al đều tan hoàn toàn thấy cân ở vị trí thăng bằng. Tính m? - nFe= 56 11 = 0,2 mol, nAl = 27 m mol 0,5 - Khi thêm Fe vào cốc đựng dd HCl (cốc A) có phản ứng: Fe + 2HCl → FeCl2 +H2 ↑ 0,5
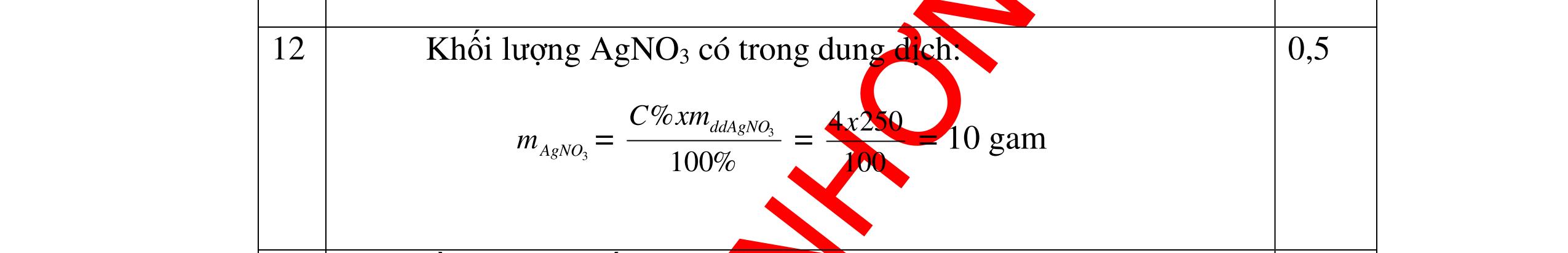
DẠYKÈMQUYNHƠNOFFICIAL 0,2 0,2 - Theo định luật bảo toàn khối lượng, khối lượng cốc đựng HCl tăng thêm: 11,2 (0,2.2) = 10,8g 0,5 - Khi thêm Al vào cốc đựng dd H2SO4 có phản ứng: 2Al + 3 H2SO4 → Al2 (SO4)3 + 3H2↑ 27 m mol → 27.2 m mol 0,5 - Khi cho m gam Al vào cốc B, cốc B tăng thêm m - 227 m 0,5 - Để cân thăng bằng, khối lượng ở cốc đựng H2SO4 cũng phải tăng thêm 10,8g. Có: m - 227 m = 10,8 0, 5 Giải được m = 12,15 (g) 0,5 Câu3:(3,5 điểm) Khử hoàn toàn 5,43 gam hỗn hợp CuO và PbO bằng khí hyđro, hơi nước thu được dẫn qua bình đựng P2O5 thấy khối lượng bình tăng lên 0,9 gam. a/ Viết phương trình hóa học. b/ Tính thành phần phần trăm theo khối lượng của mỗi oxit trong hỗn hợp ban đầu. PTHH: CuO + H2 t0 Cu + H2O (1) PbO + H2 t0 Pb + H2O (2) Sau phản ứng hơi nước dẫn qua bình đựng P2O5 thấy khối lượng bình tăng 0,9 gam => 2 HO m= 0,9gam => HO 2 0,9n= = 0,05mol 18 Gọi số mol CuO và PbO lần lượt là x mol và y mol (x,y > 0) Ta có PTĐS: 80x + 233y = 5,43 => 5,43 - 233y x = 80 (a) Theo PTHH (1) ta có: 2 HOCuO n=n=xmol Theo PTHH (2) ta có: 2 HOPbO n=n=ymol x + y = 0,005 => y = 0,05 – x (b) Thay (b) vào (a) giai ra ta có x = 0,041; y = 0,00935mol CuO CuO 3,52m= 0,041.80 = 3,252 gam => %m= 100% = 59,88%5,43 PbO PbO 2,17855m=0,00935.233=2,17855=>%m= 100%=40,12% 5,43 Vậy % theo khối lượng của CuO và PbO là 59,88%; 40,12% 0,25 0,25 0,25 0,25 0,5 0,5 0,5 0,5 0,5
DẠYKÈMQUYNHƠNOFFICIAL Câu4(3,5điểm) Cho 10 gam hỗn hợp gồm kẽm và đồng tác dụng với dung dịch axit HCl thì thu được 2,24 lit khí thoát ra ở đktc. Tính % về khối lượng của mỗi kim loại trong hỗn hợp. 4 Theo đề bài chỉ có Zn tác dụng: Zn + 2HCl → ZnCl2 + H2 Số mol khí thoát ra là: nH2 = = 0,1 mol Theo PTPƯ : nH2 = nZn = 0,1 mol Khối lượng của Zn là: mzn = 0,1 65 = 6,5 gam % Zn = 100% = 65 % % Cu = 100% - 65% = 35% 0,5đ 0,5đ 0,5đ 0,5đ 0,5 0,5 0,5 Câu5.(3,5 điểm). Cho 0,51 gam hỗn hợp A ở dạng bột gồm Fe và Mg vào dung dịch CuSO4. Sau khi các phản ứng hoàn toàn, lọc, thu được 0,69 gam chất rắn B và dung dịch C. Thêm dung dịch NaOH dư vào C, lấy kết tủa đem nung ngoài không khí đến khối lượng không đổi, được 0,45 gam chất rắn D. b) Tính thành phần phần trăm theo khối lượng của mỗi kim loại trong hỗn hợp A. c) Hòa tan hoàn toàn chất rắn B trong dung dịch H2SO4 đặc, nóng thu được V lít khí SO2 duy nhất ở đktc. Tính V? 5 3,5đ Theo đề: Lúc đầu dùng 0,51 gam hỗn hợp Mg và Fe, qua những biến đổi chỉ thu được 0,45 gam MgO và Fe2O3 CuSO4 thiếu, Fe dư Các phương trình hóa học: Mg + CuSO4 → MgSO4 + Cu (1) Fe + CuSO4 → FeSO4 + Cu (2) MgSO4 + 2NaOH → Mg(OH)2↓ + Na2SO4 (3) FeSO4 + 2NaOH → Fe(OH)2↓ + Na2SO4 (4) Nung kết tủa trong không khí: Mg(OH)2 → MgO + H2O (5) 4Fe(OH)2 + O2 → 2Fe2O3 + 4H2O (6) Gọi x, y lần lượt là số mol của Mg và Fe có trong 0,51 gam hỗn hợp, a là số mol Fe tham gia phản ứng (2). Ta có: 24x + 56y = 0,51 (I) 56(y – a) + 64(x + a) = 0,69 (II) 40x + 160.a/2 = 0,45 (III) Kết hợp (I), (II) và (III) ta có: x = 0,00375 ; y = 0,0075 ; a = 0,00375 0,25 0,25 0,25 0,25 0,25 0,25 0,25 0,25 0,25 t0 t0
DẠYKÈMQUYNHƠNOFFICIAL a) Nồng độ mol của dung dịch CuSO4: CM(CuSO 4 ) = 075 100 1000.2. 00375 = M b) Thành phần % khối lượng của hỗn hợp A. %mMg = %17.100% 51,0 00375 = %mFe = 100% - 17,65% = 82,35% c) Thể tích khí SO2 sinh ra (đktc). Chất rắn B gồm Fe dư và Cu. Khi cho B tác dụng với H2SO4 đặc, nóng: 2Fe + 6H2SO4(đặc,nóng) → Fe2(SO4)3 + 3SO2↑ + 6H2O (7) Cu + 2H2SO4(đặc,nóng) → CuSO4 + SO2↑ + 2H2O (8) (7) → nSO 2 = 2 3 nFe dư = 2 3 (y – a) = 2 3 (0,0075 – 0,00375) = 0,005625 mol (8) → nSO 2 = nCu = x + a = 0,0075 + 0,00375 = 0,01125 mol VSO 2 = 22,4.(0,005625 + 0,01125) = 0,378 lít. 0,25 0,25 0,25 0,25 0,25 Bài6: Cho 3,87 g hỗn hợp gồm Mg và Al tác dụng với 18,25 gam HCl. a. Chứng minh rằng sau phản ứng HCl vẫn còn dư. b. Nếu phản ứng trên làm thoát ra 4,368 lit H2 (đktc). Hãy tính % theo khối lượng mỗi kim loại trong hỗn hợp ban đầu. Giả sử hỗn hợp chỉ có kim loại Mg nMg= 3,87/24= 0,1615 mol Mg + 2HCl → MgCl2 + H2 0,1615mol →0,3225mol 0,5 Giả sử hỗn hợp chỉ có Al nAl= 3,87/27= 0,1433 mol 2Al + 6HCl → 2AlCl3 + 3H2 0,1433mol →0,4839mol 0,5 0,1433<nkim loại < 0,1615; 0,3225<nHCl < 0,4839 Mà nHCl bài cho= 0,5.1= 0,5 mol>0,4839mol Vậy nên sau phản ứng HCl còn dư 0,5 Gọi số mol của Mg là x, số mol của Al là y mol Mg + 2HCl → MgCl2 + H2 xmol x mol 2Al + 6HCl → 2AlCl3 + 3H2 ymol 5y mol 0,5 Ta có hệ phương trình: 24x+27y=3,87 x+1,5y = 4,368/22,4 Giải ra ta có : x=0,06 ; y=0,09 1,0 mMg = 0,06.24=1,44 g ; %Mg= 1,44.100/3,87=37,21% mAl = 0,09.27=2,43g ; %Al= 2,43.100/3,87=62,79% 0,5
DẠYKÈMQUYNHƠNOFFICIAL Câu7 : Hỗn hợp gồm Mg và một kim loại hóa trị II tác dụng với HCl thu được 6,72 lit khí (đktc) và 31,7 gam muối khan. Xác định kim loại đó biết số mol kim loại đó bằng ½ số mol của kim loại Mg. Giải: Gọi số mol kim loại Mg là x mol Gọi kim loại hóa trị II là A có số mol là 0,5x mol 0,5 Mg + 2HCl →MgCl2 + H2 xmol x mol x mol A + 2HCl →ACl2 + H2 0,5x mol 0,5x mol 0,5x mol 0,5 Số mol H2: x+0,5x = 6,72/22,4 x= 0,2 mol 1,0 Khối lượng của muối: 95x+ (A+71).0,5.x =31,7 Thay x= 0,2 giải ra ta có: A= 56 1,0 Kết luận : A là kim loại sắt (Fe) 0,5 Câu8: Hỗn hợp Na và K tác dụng hết với nước cho 2,24 lit khí H2 (đktc) và dung dịch B. Trung hòa dung dịch B bằng axit HCl rồi cô cạn dung dịch thu được 13,3 gam muối khô. Tính % khối lượng mỗi kim loại trong hỗn hợp ban đầu Giải: Gọi số mol của Na là x mol, số mol của K là y mol 0,5 PTHH : 2Na + 2H2O → 2NaOH + H2 x mol x mol x/2 mol 2K + 2H2O → 2KOH + H2 y mol y mol y/2 mol NaOH + HCl → NaCl + H2O x mol x mol x mol KOH + HCl → KCl + H2O y mol y mol y mol 1,0 Từ phương trình hóa học ta có hệ phương trình: x/2 +y/2= 2,24/22,4 58,5x+74,5y= 13,3 Giải ra ta có: x= 0,1 mol ; y=0,1 mol 0,5 mNa= 0,1.23=2,3 gam ; mK= 0,1.39= 3,9 gam 0,5 mhỗnhợp= 2,3+3,9 = 6,2 gam 0,5 % Na= 2,3.100/6,2=37,1% %K= 3,9.100/6,2 = 62,9% 0,5 Câu9:(3,5 điểm) Có V lít hỗn hợp gồm CO và H2 chia hỗn hợp thành 2 phần bằng nhau. - Đốt cháy hoàn toàn phần thứ nhất bằng oxi. Sau đó dẫn sản phẩm đi qua nước vôi trong (dư) thu được 30 gam kết tủa trắng. - Dẫn phần thứ 2 qua bột CuO nóng dư. Phản ứng xong thu được 25,6 gam kim loại Cu
DẠYKÈMQUYNHƠNOFFICIAL a. Viết phương trình phản ứng hóa học xảy ra? b. Tính thể tích của V lít hỗn hợp khí ban đầu (ở đktc)? c. Tính thành phần phần trăm của hỗn hợp khí ban đầu theo khối lượng và thể tích? 9 (3,5 điểm) a * Phương trình phản ứng: Phần1: 2CO + O2 0t → 2CO2 ↑ (1) 0.25 2H2 + O2 0t → 2H2O (2) 0.25 CO2 + Ca(OH)2 → CaCO3 ↓ + H2O (3) (Trắng) 0.25 Phần2: CuO + CO 0t → Cu + CO2 ↑ (4) 0.25 CuO + H2 0t → Cu + H2O (5) 0.25 b - Số mol CaCO3 được tạo thành sau phản ứng ở phần 1 là: 3CaCO m30 n = M100=0,3(mol)= Theo PT(1) và PT(3): 23 COCOCaCOn =n n0,3(mol)== - Số mol Cu được tạo thành sau phản ứng ở phần 2 là: Cu m25,6n = = =0,4(mol)M64 Theo PT(4) và PT(5): 2 COHCun +nn0,4(mol) == 2Hn = nCu – nCO = 0,4 – 0,3 = 0,1 (mol) - Vậy thể tích của V hỗn hợp khí ban đầu trước khi được chia 2 phần bằng nhau là: Vhh = 2. 0,4. 22,4 = 17,92 (l) 0.25 0.25 0.25 c - Thể tích khí CO và khí H2 ban đầu trước khi được chia thành 2 phần bằng nhau là: VCO = 2. 0,3. 22,4 = 13,44 (l) → 2HV = Vhh - VCO = 17,92 – 13,44 = 4,48 (l) - Thành phần phần trăm theo thể tích của hỗn hợp khí ban đầu là: CO 13,44%V .100%=75% 17,92 = 2H 4,48%V .100%=25% 17,92 = - Khối lượng khí CO và khí H2 ban đầu trước khi được chia thành 2 phần bằng nhau là: mCO = 2. 0,3. 28 = 16,8 (g) 0.25 0.25 0.25 0.25
DẠYKÈMQUYNHƠNOFFICIAL 2Hm = 2. 0,1. 2 = 0,4 (g) mhh = mCO + 2Hm = 16,8 + 0,4 = 17,2 (g) - Thành phần phần trăm theo khối lượng của hỗn hợp khí ban đầu là: CO 16,8%m .100%=97,7% 17,2 = 2H 0,4%m .100%=2,3% 17,2 = 0.25 0.25 Câu10:(3,5 điểm) Nung nóng 19,15 gam hỗn hợp CuO và PbO với một lượng cacbon vừa đủ trong môi trường không có oxi để oxit kim loại bị khử hết. Toàn bộ lượng khí sinh ra được dẫn vào dung dịch Ca(OH)2 dư, phản ứng xong thu được 7,5 gam kết tủa trắng. a. Viết phương trình phản ứng hóa học xảy ra? b. Tính thành phần phần trăm theo khối lượng của mỗi chất trong hỗn hợp ban đầu? c. Tính khối lượng cacbon cần dùng cho phản ứng khử oxit? 10 (3,5điểm) a Phương trình phản ứng: 2CuO + C 0t → 2Cu + CO2 (1) x (mol) 2 x (mol) 2PbO + C 0t → 2Pb + CO2 (2) y (mol) 2 y (mol) CO2 + Ca(OH)2 → CaCO3 ↓ + H2O (3) + 22 xy mol 0.25 0.25 0.25 b Gọi x là số mol của CuO y là số mol của PbO Theo bài ra ta có: 80x + 223y = 19,15 (4) Theo PT (3) ta có: 23 COCaCO 7,5n =n = =0,075(mol) 100 Từ (1), (2), (3) ta có: + =0,075 22 xy (5) Từ (4) và (5) ta có hệ phương trình 80 + 223y=19,15 (6) + =0,075 (7) 22 x xy ⇔ 80 +223y=19,15 (8) x+ =0,15 (9) x y Từ (9) x = 0,15 y (*) 0.25 0.25 0.25 0.25
Thay (*) vào (8) ta được: 80(0,15 – y) + 223y = 19,15
⇔ 12 – 80y + 223y = 19,15 ⇔ 143y = 7,15
y = 7,15 143 = 0,05 (mol) = nPbO
Thay y = 0,05 vào (*) ta được: x = 0,15 – 0.05 = 0,1 (mol) = nCuO
- Khối lượng của CuO tham gia phản ứng là: mCuO = n.M = 0,1. 80 = 8 (g)
- Khối lượng của PbO tham gia phản ứng là: mPbO = n.M = 0,05. 223 = 11,15 (g)
Vậy thành phần phần trăm theo khối lượng của mỗi
oxit trong hỗn hợp ban đầ
%mCuO =
.100%=41,8%
%mPbO = 100% - %m
Theo PT (1),
C = 1
Kh
Câu11:(3,5
= 100% - 41,8% =
0,05) = 0,075 (mol)
c
là: Cm =0,075.12=0,9(g)
t (Al) vào m gam dung dịch axit clohiđric (HCl), sau phản
Hòa tan 4,05 gam nhôm b
ng thu đượ
DẠYKÈMQUYNHƠNOFFICIAL
u là:
8
19,75
CuO
58,2% 0.25 0.25 0.25 0.25 c
(2) ta có: n
2 (nCuO + nPbO) = 1 2 (0,1 +
ối lượng của cacbon
ần dùng để khử CuO và PbO
0.5 0.25
điểm)
ộ
ứ
c 104,95 gam dung dịch và khí hiđro (H2) a. Tính thể tích khí hiđro (H2) thu được ở đktc? b. Tính khối lượng muối nhôm clrua (AlCl3) được tạo thành sau phản ứng? c. Tính khối lượng m của dung dịch axit clohiđric (HCl) ban đầu? 11 a - Số mol nhôm tham gia phản ứng là: 4,05= = =0,15(mol) 27Al m n M - Phương trình phản ứng 2Al + 6HCl → 2AlCl3 + 3H2 Theo PTPƯ: 2 33 = .n = 22.0,15=0,225(mol)HAln - Thể tích khí hiđro (H2) thu được ở đktc là: 22=n.22,4=5,04(l)HHV 0.25 0.25 0.25 0.25 b - Theo PTPƯ: 3 =n =0,15(mol)AlClAln 0.25
DẠYKÈMQUYNHƠNOFFICIAL - Ta có: 3 =27+3.35,5=133,5(g/mol)AlClM - Khối lượng muối nhôm clrua (AlCl3) được tạo thành sau phản ứng là: 3 =n.M=0,15.133,5=20(g)AlClm 0.25 0.5 c - Khối lượng của khí hiđro sinh ra sau phản ứng là: 2 =n.M=0,225.2=0,45(g)Hm Áp dụng định luật bảo toàn khối lượng, ta có: mAl + mddHCl = 2Hm + mdd(sauphản ứng) => mddHCl = 2Hm + mdd(sauphản ứng) - mAl = 0,45 + 104,95 4,05 = 101,35 (g) 0.5 0.5 0.5 Câu12: a. Lấy cùng một lượng KClO3 và KMnO4 để điều chế khí O2. Chất nào cho nhiều khí O2 hơn? b. Nếu điều chế cùng một thể tích khí O2 thì dùng chất nào kinh tế hơn? Biết rằng giá KMnO4 là 30.000đ/kg và KClO3 là 96.000đ/kg. Viết phương trình hóa học và giải thích. 12 a 3KClO M3935,516.3122,5g =++= 0,25 4KMnO M395516.4158g =++= 0,25 Giả sử lấy mỗi chất cùng một khối lượng là a gam 0,25 2KClO3 0t → 2KCl + 3O2 (1) 2 mol 3 mol a mol 122,5 3a mol 2.122,5 0,25 2KMnO4 0t → K2MnO4 + MnO2 + O2 (2) 2 mol 1 mol a mol 158 a mol 2.158 0,25 So sánh lượng Oxi thu được ở (1) và (2) ta có: 0,25 3a mol 2.122,5 > a mol 2.158 hay 3a mol 245 > a mol 316 0,25 Vậy khi nhiệt phân cùng một lượng như nhau, chất 0,25
DẠYKÈMQUYNHƠNOFFICIAL cho nhiều khí O2 hơn là KClO3 b Nếu điều chế cùng một thể tích khí O2 thì dùng KClO3 để điều chế sẽ kinh tế hơn. Tính toán cụ thể như sau: 0,25 2KClO3 0t → 2KCl + 3O2 2 mol 3 mol 1 mol 1,5 mol 3KClOm = 1.122,5 = 122,5 g 0,25 Số tiền mua 122,5 g KClO3 để điều chế 1,5 mol O2 là: 0,25 122,5 x96.00011.760 1000 = (đ) 2KMnO4 0t → K2MnO4 + MnO2 + O2 2 mol 1 mol 3 mol 1,5 mol 0,25 4KMnOm = 3.158 = 474 g 0,25 Số tiền mua 474 g KMnO4 để điều chế 1,5 mol O2 là: 0,25 474 x30.00014.220 1000 = (đ) Câu13:(3,5 điểm) a. Có bao nhiêu gam H2O được tạo thành sau khi cho nổ hỗn hợp gồm 1 mol hiđro và 20g oxi? b. Cho 50g hỗn hợp đồng (II) oxit và sắt (II) oxit tác dụng với khí hiđro cho hỗn hợp hai kim loại và nước. Tính thể tích khí hiđro cần dùng, biết rằng trong hỗn hợp, đồng (II) oxit chiếm 20% về khối lượng 13 a Ta có phương trình: 2H2 + O2 ot → 2H2O - Theo PT cứ 2 mol H2 tác dụng có 1 mol O2 Vậy 1 H2 tác dụng có 0,5mol O2, số mol O2 theo đầu 0,25
DẠYKÈMQUYNHƠNOFFICIAL bài cho 20 320,625(mol) = do đó số mol O2 dư - Theo PTHH 2 mol H2 tham gia phản ứng có 2 mol H2O tạo thành. Vậy 1 mol H2 tham gia phản ứng có 1 mol H2O tạo thành khối lượng 1 mol H2O =18(g) 0,25 0,25 0,25 b Theo bài ra CuO chiếm 20% về khối lượng vậy : CuO CuO FeO FeO 2010m x50 10(g) 10080n0,125(mol) 8040m x50=40(g) n 0,56(mol)10072 == == = =≈ Phương trình phản ứng : CuO + H2 ot → Cu + H2O (1) FeO + H2 ot → Fe + H2O (2) Theo PTHH (1) 2 HCuO nn0,125(mol) == Theo PTHH (1) 2 HFeO nn0,56(mol) == Vậy số mol H2 cần dùng cho 2 phản ứng là: 0,56 + 0,125 = 0,685 (mol) 2H V0,685x22,415,34(lit) == 0,25 0,25 0,5 0,5 0,5 0,5 Câu14:(3,5 điểm) Để khử hoàn toàn 40 gam hỗn hợp gồm CuO và Fe2O3 ở nhiệt độ cao cần dùng 13,44 lit khí hidro( đktc). a. Tính khối lượng mỗi chất trong hỗn hợp ban đầu. b. Tính thành phần phần trăm theo khối lượng của mỗi chất có trong hỗn hợp ban đầu. a nH2 = 13,44 / 22,4 = 0,6 (mol) 0,25 Gọi x, y lần lượt là số mol của CuO và Fe2O3 trong hỗn hợp. 0,25 Theo bài ra ta có phương trình: 80x + 160 y = 40 0,25 PTHH CuO + H2 → Cu + H2O (1) (mol) 1 1 ( mol) x x Fe2O3 + 3H2 → 2Fe + 3H2O (2) (mol) 1 3 (mol) y 3y 0,25 0,5 to to
DẠYKÈMQUYNHƠNOFFICIAL Theo phương trình phản ứng ta có: x + 3y = 0,6 0,5 Từ (1) và (2) ta có hệ phương trình: 80x + 160 y = 40 x + 3y = 0,6 x = 0,3; y = 0,1 0,5 mCuO = 0,3 x 80 = 24 (g); mFe2O3 = 0,1 x 160 = 16 (g) 0,5 b %mCuo = 24 x100 / 40 = 60% %mFe2O3 = 16 x100/40 = 40% 0,25 0,25 Câu15:(3,5 điểm): 1. Một cốc đựng dung dịch axit sunfuric loãng chứa 98 gam H2SO4. a. Bỏ vào cốc 10,8 gam nhôm. Tính khối lượng H2SO4 đã dùng. b. Bỏ tiếp vào cốc 39 gam kẽm. Tính thể tích khí hiđro (H2) thoát ra ởđktc 5 1a Ta có: - Số mol Al là: 10,8 0,4 27Al m n M === (mol) - Số mol của dung dịch H2SO4 loãng chứa 98 gam H2SO4 là: 24 98 1 98HSO m n M === (mol) 0,25 Phương trình phản ứng: 2Al + 3H2SO4 → Al2(SO4)3 + 3H2 ↑ Theo PT: 2 (mol) 3 (mol) Theo đề bài: 0,4 (mol) 1 (mol) Thực tế: 0,4 (mol) 0,6 (mol) 0,25 Ta thấy số mol Al phản ứng hết, số mol H2SO4 còn dư sau phản ứng. - Số mol H2SO4 tham gia phản ứng là: 0,6 (mol) - Số mol H2SO4 còn dư sau phản ứng là: 24HSOn dư = 1 – 0,6 = 0,4 (mol). 05 => Khối lượng H2SO4 đã dùng là: 0,5
DẠYKÈMQUYNHƠNOFFICIAL 24 .0,6.9858,8HSO mnM=== (g) 1b Ta có: - Số mol Zn là: 39 0,6 65Zn m n M === (mol) 0,5 Phương trình phản ứng: Zn + H2SO4 → ZnSO4 + H2 ↑ Theo PT: 1 (mol) 1 (mol) 1 (mol) Theo đề bài: 0,6 (mol) 0,4 (mol) Thực tế: 0,4 (mol) 0,4 (mol) 0,4 (mol) 0,5 Ta thấy số mol H2SO4 phản ứng hết (là số mol còn dư sau phản ứng giữa Al và H2SO4 kết thúc), số mol Zn còn dư sau phản ứng. Vậy ta tính số mol H2 sinh ra sau phản ứng theo số mol của H2SO4 Theo PTPƯ số mol H2 sinh ra sau phản ứng là: 224 0,4HHSOnn== (mol) => Thể tích khí hiđro sinh ra ở đktc là: 2 .22,40,4.22,48,96H Vn=== (l) 0,5 0,25 0,25 Câu16(3.5 điểm): Khử hoàn toàn 5,43 gam hỗn hợp CuO và PbO bằng khí hyđro, chất khí thu được dẫn qua bình đựng P2O5 thấy khối lượng bình tăng lên 0,9 gam. a/ Viết phương trình hóa học. b/ Tính thành phần phần trăm theo khối lượng của mỗi oxit trong hỗn hợp ban đầu. (Cho biết: O = 16, H = 1, Cu = 64, Pb = 207) Câu Ý Hướngdẫnchấm Thang điểm 16 PTHH: 22 t CuOHCuHO +→+ (1) PbO + H2 t → Pb + H2O (2) Sau phản ứng chất khí dẫn qua bình đựng P2O2 thấy khối lượng bình tăng 0,9 gam => 2 HO m=0,9gam => HO 2 0,9n= =0,05mol 18 Gọi số mol CuO và PbO lần lượt là x mol và y mol (x,y > 0) Ta có PTĐS: 80x + 223y = 5,43 => 5,43-223y x= 80 (a) Theo PTHH (1) ta có: 2 HOCuO n=n=xmol 0.5 0.5 0.25 0.25 0.25 0.25
DẠYKÈMQUYNHƠNOFFICIAL Theo PTHH (2) ta có: 2 HOPbO n=n=ymol x + y = 0,05 => y = 0,05 – x (b) Thay (b) vào (a) giai ra ta có x = 0,04; y = 0,01mol CuO CuO 3,52m=0,04.80 =3,2gam=>%m= 100%= 58,93%5,43 PbO PbO 2,23m=0,01.223 =2,23=>% m= 100% =41,07% 5,43 Vậy % theo khối lượng của CuO và PbO là 58,93%; 41,07% 0.25 0.25 0.25 0.25 0.25 0.25 Câu17(3.5 điểm): Cho 11,2 gam hỗn hợp hai kim loại gồm đồng và magie vào dung dịch chứa 7,3 gam HCl để phản ứng xảy ra hoàn toàn. Sau phản ứng thử dung dịch bằng quì tím thấy quì tím không chuyển màu. Trong dung dịch còn một lượng chất rắn. Lọc chất rắn này, đem rửa sạch, nung trong không khí đến khi khối lượng không đổi thu được 12 gam oxit. Tính khối lượng mỗi kim loại trong hỗn hợp đầu. (Cho biết: O: 16; H: 1; Fe: 56; Cu: 64; Mg: 24; Cl: 35,5) Câu ý Hướngdẫnchấm Tha ng điểm 17 PTHH : Mg + 2HCl → MgCl2 + H2 (1) 2Cu + O2 t0 2CuO (2) 2 Mg + O2 t0 2 MgO (3) Cho hỗn hợp hai kim loại Mg và Cu vào dung dịch HCl chỉ có Mg phản ứng. Sau phản ứng (1) thử dung dịch bằng quỳ tím, quỳ tím không chuyển màu.Vậy HCl phản ứng hết Số mol HCl là: 7,3 : 36,5 = 0,2 mol Theo PTHH (1): nMg = 1 2 nHCl = 0,1 mol => Khối lượng Mg tham gia phản ứng (1) là: 0,1.24 = 2,4 g Giả sử Mg không còn dư thì khối lượng Cu là 11,2 – 2,4 = 8,8 g Số mol Cu là 8,8 : 64 = 1,375 mol. Theo PTHH (2) nCuO = nCu = 0,1375 mol => Khối lượng oxit là: 0,1375. 80 = 11g trái với giả thiết là 12 gam oxit. Vậy Mg còn dư sau phản ứng (1) Gọi khối lượng Mg dư là x => Số mol Mg dư là: 24 x . => Khối lượng Cu là 8,8 – x => Số mol Cu là 8,8 64 x Theo PTHH(2) : n CuO = n Cu = 8,8 64 x Khối lượng CuO là : m CuO = (8,8).80 64 x = (8,8).5 4 x Theo PTHH(3) : n MgO = n Mg = 24 x 0.25 0.25 0.25 0.25 0.25 0.25 0.25 0.25 0.25 0.25
DẠYKÈMQUYNHƠNOFFICIAL => m MgO = 24 x . 40 = 5. 3 x Theo bài ra ta có phương trình: (8,8).5 4 x + 5. 3 x = 12 Giải phương trình tìm được x = 2,4. Vậy khối lượng Mg dư là 2,4 g Khối lượng Mg ban đầu là 2,4 + 2,4 = 4,8 g Khối lượng Cu trong hỗn hợp ban đầu là 11,2 – 4,8 = 6,4 g 0.25 0.25 0.25 0.25 Câu18(3.5 điểm): Có hỗn hợp gồm Fe và Fe2O3. Chia hỗn hợp thành 2 phần bằng nhau: - Phần 1 ngâm trong dung dịch HCl dư, phản ứng xong thu được 4,48 lit khí H2 (đktc). - Phần 2 nung nóng và cho dòng khí H2 dư đi qua thì thu được 33,6 g Fe. Tính thành phần phần trăm theo khối lượng của mỗi chất trong hỗn hợp ban đầu. (Biết N = 14; H = 1; S = 32; O = 16; Ag = 108; Na = 23; Fe = 56; Cl = 35,5) Câu ý Hướngdẫnchấm Thang điểm 18 Phần 1: Fe + 2 HCl FeCl2 + H2 Fe2O3 + 6HCl 2FeCl3 + 3H2O nH2 = 4,48 : 22,4 = 0,2 mol nFe = 0,2 mol Suy ra mFe = 0,2 . 56 = 11,2 g Phần 2: 3 H2 + Fe2O3 2Fe + 3H2O mFe sinh ra = 33,6 – 11,2 = 22,4 g nFe = 0,4 mol nFe2O3 = 0,2 mol mFe2O3 = 0,2 . 160 = 32g 11,2 % Fe = . 100% = 25,93% , %Fe2O3 = 74,07% 43,2 0.5 0.5 0.25 0.25 0.5 0.25 0.25 0.5 0.5 Câu19(3.5 điểm): Dùng khí CO để khử hoàn toàn 20 gam một hỗn hợp (hỗn hợp Y) gồm CuO và Fe2O3 ở nhiệt độ cao. Sau phản ứng, thu được chất rắn chỉ là các kim loại, lượng kim loại này được cho phản ứng với dung dịch H2SO4 loãng (lấy dư), thì thấy có 3,2 gam một kim loại màu đỏ không tan. a) Tính thành phần phần trăm khối lượng các chất có trong hỗn hợp Y.
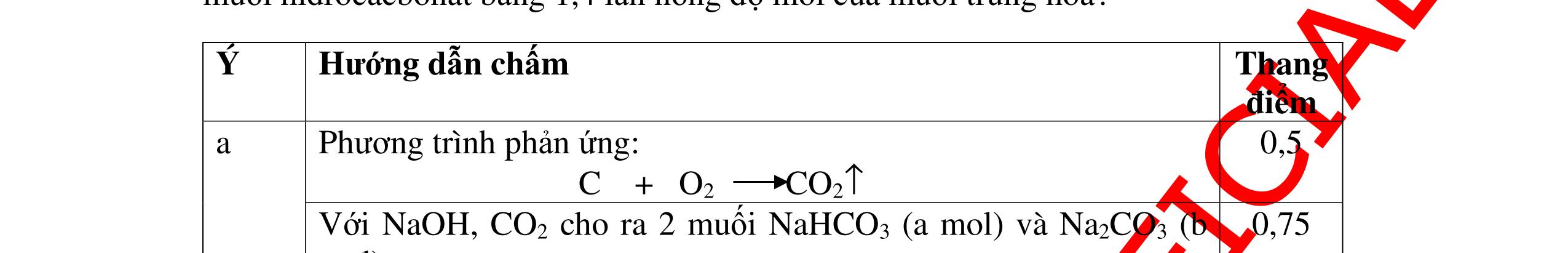
DẠYKÈMQUYNHƠNOFFICIAL b) Nếu dùng khí sản phẩm ở các phản ứng khử Y, cho đi qua dung dịch Ca(OH)2 dư thì thu được bao nhiêu gam kết tủa, biết hiệu suất của phản ứng này là 80%. Câu ý Hướngdẫnchấm Thang điểm 19 PTHH: CO + CuO → 0t Cu + CO2 (1) 3CO + Fe2O3 → 0t 2Fe + 3CO2 (2) Fe + H2SO4 → FeSO4 + H2 (3) Chất rắn màu đỏ không tan đó chính là Cu, khối lượng là 3,2 gam. nCu = 64 2,3 = 0,05 mol Theo PTHH(1) => nCuO= 0,05 mol Khối lượng là: 0,05.80 = 4 g. Vậy khối lượng Fe: 20 – 4 = 16 gam % CuO = 20 4 .100 = 20%, % Fe2O3 = 20 16 .100 = 80% b/ Khí sản phẩm phản ứng được với Ca(OH)2 là: CO2 CO2 + Ca(OH)2 → CaCO3 + H2O (4) nFe 2 O 3 = 160 16 = 0,1 mol, số mol CO2 là: 0,05 + 3.0,1 = 0,35 mol. số mol CaCO3 là: 0,35 mol. Khối lượng tính theo lý thuyết: 0,35.100 = 35 gam. Khối lượng tính theo hiệu suất: 35.0,8 = 28 gam 0.5 0.5 0.25 0.25 0.25 0.25 0.25 0.25 0.25 0.25 0.25 0.25 Câu20(3.5 điểm): a) Có hỗn hợp khí A gồm CO và CO2 . Nếu cho hỗn hợp khí A đi qua dung dịch Ca(OH)2 dư thì thu được 1 gam chất kết tủa màu trắng. Nếu cho hỗn hợp khí A này đi qua bột đồng (II) oxit nóng dư thì thu được 0,46 gam đồng. Tính thể tích của mỗi khí trong hỗn hợp. b) Hòa tan 7,8 gam hỗn hợp hai kim loại A (hóa trị II) và B (hóa trị III) bằng dung dịch H2SO4 loãng vừa đủ thu được 8,96 lít khí hidro (đktc). Tính số gam muối khan sau phản ứng và tìm A, B biết số mol kim loại B bằng hai lần số mol kim loại A và nguyên tử khối của A bằng 8/9 nguyên tử khối của B. Câu ý Hướngdẫnchấm Tha
PTPƯ : CO2 + Ca(OH)2
CaCO3 + H2O (1) CO + CuO
Cu + CO2 (2)
n CaCO3 = 100 1 = 0,01 mol n Cu = 64 46,0 = 0,01 mol
Theo (1) n CO2phản
ng = n CaCO3sinhra = 0,01 mol
→ V CO2 = 0,01 . 22,4 = 0,224 lít
Theo (2) n COphản ứng = n Cusinhra = 0,01 mol
→ V CO = 0,01 . 22,4 = 0,224 lít
b) A + H2SO4 → ASO4 + H2 2B + 3H2SO4 → B2(SO4)3 + 3H2
nH2 = 8,96 22,4 = 0,4 mol. nH2SO4 = nH2 = 0,4 mol. m H2SO4 = 0,4 x 98 = 39,2 g
Áp dụng ĐLBTKL: KL muối khan = KLA,B + KLaxit– KL H2 =7,8 +39,2 - (0,4x2)
DẠYKÈMQUYNHƠNOFFICIAL ng điểm 20 a)
→
0t →
ứ
= 46,2 g. Gọi a là số mol của A, số mol của B là 2a. nH2 = 4a = 0,4 mol => a = 0,1 mol aA + 2aB = 7,8 ⇔ a. 8 9 B + 2aB = 7,8 (thay a = 0,1) => B = 27 => B là kim loại nhôm. A = 24 => A là kim loại magiê. mAl = 5,4 g; mMg = 2,4g. 0.25 0.25 0.25 0.25 0.25 0.25 0.25 0.25 0.25 0.25 0.25 0.25 0.25 0.25 Câu21(3.5 điểm): Hỗn hợp khí X gồm H2 và CH4 có thể tích 11,2 lít (đo ở đktc). Tỉ khối của hỗn hợp X so với oxi là 0,325. Trộn 11,2 lít hỗn hợp khí X với 28,8 gam khí oxi rồi thực hiện phản ứng đốt cháy, phản ứng xong làm lạnh để ngưng tụ hết hơi nước thì thu được hỗn hợp khí Y. a) Viết phương trình các phản ứng hoá học xảy ra và xác định phần trăm thể tích các khí trong hỗn hợp X. b) Xác định phần trăm thể tích và phần trăm khối lượng các chất trong hỗn hợp Y. Câu ý Hướngdẫnchấm Thang điểm 21 a. Đặt x,y lần lượt là số mol H2 và CH4 trong X 0.25
DẠYKÈMQUYNHƠNOFFICIAL x + y = 22 11 = 0,5 mol (I) d 2O X = 0,325 8,4x – 5,6y = 0 (II) Từ (I)và(II) ta có x = 0,2 mol, y = 0,3 mol Trong cùng ĐK nhiệt độ và áp suất thì %V = %n nên ta có: %VH2 = 5,0 2,0 .100%=40%; %VCH4 = 60%. b. nO2 = 32 28 = 0,9 mol Pư đốt cháy X: 2H2 + O2 → 0t 2H2O (1) CH4 + 2O2 → 0t CO2 + 2H2O (2) Từ (1)và(2) ta có nO2pư = 2nH2 + 2nCH4 = 0,7 mol Hỗn hợp khí Y gồm: O2dư 0,9-0,7= 0,2 mol và CO2 0,3 mol (nCO2 = nCH4) %VO2dư= 40%; %VCO2 = 60% %m VO2dư= 32,65% ; %mCO2 = 67,35%. 0.25 0.25 0.25 0.25 0.25 0.5 0.5 0.25 0.25 0.25 0.25 Câu22(3.5 điểm): Để khử hoàn toàn 40 gam hỗn hợp gồm CuO và Fe2O3 ở nhiệt độ cao cần dùng 13,44 lit khí hidro( đktc). a. Tính khối lượng mỗi chất trong hỗn hợp ban đầu. b. Tính thành phần phần trăm theo khối lượng của mỗi chất có trong hỗn hợp ban đầu. Câu ý Hướngdẫnchấm Thang điểm 22 a) nH2 = 13,44 / 22,4 = 0,6 (mol) Gọi x, y lần lượt là số mol của CuO và Fe2O3 trong hỗn hợp. Theo bài ra ta có phương trình: 80x + 160 y = 40 PTHH : CuO + H2 to Cu + H2O (1) (mol) 1 1 ( mol) x x Fe2O3 + 3H2 → 2Fe + 3H2O (2) (mol) 1 3 (mol) y 3y Theo phương trình phản ứng ta có: x + 3y = 0,6 0.25 0.25 0.25 0.5 0.5 0.25 to
DẠYKÈMQUYNHƠNOFFICIAL Từ (1) và (2) ta có hệ phương trình: 80x + 160 y = 40 x + 3y = 0,6 x = 0,3; y = 0,1 mCuO = 0,3 x 80 = 24 (g); mFe2O3 = 0,1 x 160 = 16 (g) %mCuo = 24 x100 / 40 = 60% %mFe2O3 = 16 x100/40 = 40% 0.25 0.25 0.25 0.25 0.25 0.25 Câu23(3.5 điểm): a) Nung nóng 15,6g nhôm hiđroxit Al(OH)3 thu được nhôm oxit và hơi nước ở điều kiện phòng (t = 200C, p=1atm). Tính khối lượng (gam) của nhôm oxit và thể tích (lít) của hơi nước, biết hiệu suất phản ứng là 70%. b) Đặt cốc A đựng dung dịch HCl và cốc B đựng dung dịch H2SO4 loãng vào hai đĩa cân sao cho cân ở vị trí cân bằng. Cho 11,2g Fe vào cốc A và m gam Al vào cốc B. Khi cả Fe và Al đều tan hoàn toàn ta thấy cân ở vị trí thăng bằng. Tính m. Câu ý Hướngdẫnchấm Thang điểm 23 a) Ta có PTHH 2Al(OH)3 → ot Al2O3+ 3H2O Số mol của Al(OH)3 là 15,6 0,2() 78 m nmol M === Số mol của Al2O3 là 233 () 11 0,20,1 22AlOAlOHnn=== (mol) Khối lượng của Al2O3 là m =n.M=0,1.102= 10,2 (g) Số mol của nước là 23 () 33 0,20,3 22HOAlOHnn=== (mol) Thể tích của hơi nước ở nhiệt độ phòng là V=n.24=0,3.24=7,2 (lít) b) Ta có: - nFe= 56 11 = 0,2 mol. nAl = 27 m mol Khi thêm Fe vào cốc đựng dd HCl (cốc A) có phản ứng: Fe + 2HCl → FeCl2 +H2 ↑ 0,2 mol 0,2 mol Theo ĐL BTKL, khối lượng cốc đựng HCl tăng thêm: 11,2 - (0,2.2) = 10,8g Khi thêm Al vào cốc đựng dd H2SO4 cóphản ứng: 2Al + 3 H2SO4 → Al2 (SO4)3 + 3H2↑ 27 m mol → 27.2 m mol 0.25 0.25 0.25 0.25 0.25 0.25 0.25 0.25 0.25 0.5
DẠYKÈMQUYNHƠNOFFICIAL Khi cho m gam Al vào cốc B, cốc B tăng thêm m - 27.2 m Để cân thăng bằng, khối lượng ở cốc đựng H2SO4 cũng phải tăng thêm 10,8g. m27.2 m = 10,8 - Giải được m = 12,15 (g) 0.25 0.25 0.25 Câu24(3.5 điểm): Cho 60,5 gam hỗn hợp 2 kim loại kẽm và sắt tác dụng hết với dung dịch axit clohidric. Thành phần phần trăm khối lượng của sắt trong hỗn hợp kim loại là 46,289%. Tính: a) Khối lượng mỗi kim loại trong hỗn hợp. b) Thể tích khí hidro (đktc) thu được. c) Khối lượng của các muối tạo thành. Câu ý Hướngdẫnchấm Thang điểm 24 a) mFe = 60,5 . 46,289% = 28g. mZn = 60,5 – 28 = 32,5g. b) PTHH: Fe + 2HCl → FeCl2 + H2 28g xl 28.22,4x= 11,2l 56 = Zn + 2HCl → ZnCl2 + H2 32,5g yl 32,5.22,4y= 11,2l65 = Thể tích khí hidro (đktc) thu được: x + y = 11,2 + 11,2 = 22,4(l). c) PTHH: Fe + 2HCl → FeCl2 + H2 28g t1g 1 28.127 t = 63,5g56 = Zn + 2HCl → ZnCl2 + H2 32,5g t2g 2 t=32,5.136 68g65 = Khối lượng FeCl2 là 63,5g, ZnCl2 là 68g. 0.25 0.25 0.5 0.25 0.5 0.25 0.25 0.25 0.25 0.25 0.25 0.25
DẠYKÈMQUYNHƠNOFFICIAL Câu25(3.5 điểm): 1. Một hỗn hợp Y có khối lượng 7,8 gam gồm 2 kim loại Al và Mg, biết tỷ lệ số mol của Al và Mg trong hỗn hợp là 2 : 1. a) Tính số mol của mỗi kim loại trong hỗn hợp Y. b) Tính khối lượng của mỗi kim loại trong hỗn hợp Y. 2. Khi phân hủy 2,17g thủy ngân oxit (HgO), người ta thu được 0,16g khí oxi. Tính khối lượng thủy ngân thu được trong thí nghiệm này, biết rằng ngoài oxi và thủy ngân, không có chất nào khác được tạo thành? Câu ý Hướngdẫnchấm Thang điểm 25 1. a) Gọi x là số mol của Mg số mol Al là 2x Ta có: 24x + 27.2x = 7,8 ⇔ 78x = 7,8 x = 0,1 Vậy Mg n0,1 = ( mol) ; Al n0,2 = (mol) b) Mg m0,1242,4 (gam)=⋅= Al m7,8 - 2,4 =5,4gam= 2. Theo đề bài phương trình chữ: to Thủy ngân oxit thủy ngân + khí oxi Theo ĐLBTKL, ta có công thức khối lượng : mO2 + mHg = mHgO => mHg = mHgO - mO2 = 2,17 - 0,16 = 2,01 gam 0.25 0.25 0.25 0.5 0.5 0.5 0.25 0.25 0.25 0.5 Câu26(3.5 điểm): Đồng nitrat bị nhiệt phân huỷ theo sơ đồ phản ứng sau: Cu(NO3)2(r) ---> CuO(r) + NO2(k) + O2(k) Nung 15,04 gam Cu(NO3)2 sau một thời gian thấy còn lại 8,56 gam chất rắn. a, Tính % về khối lượng Cu(NO3)2 đã bị phân huỷ. b, Tính tỷ khối của hỗn hợp khí thu được đối với H2. (Fe=56, Mg=24, C=12, O=16, Na=23, H=1, Al=27; Cu = 64; N = 14; K = 39 ) Câu ý Hướngdẫnchấm Thang điểm 26 PT: 2Cu(NO3)2 ot → 2CuO + 4NO2 + O2 Áp dụng định luật bảo toàn khối lượng, ta có: Khối lượng của hỗn hợp khí sau phản ứng = 15,04 - 8,56 = 6,48 (g) Gọi số mol Cu(NO3)2 tham gia phản ứng là: a mol 0.5 0.25 0.25
DẠYKÈMQUYNHƠNOFFICIAL => m NO2 + m O2 = 2a . 46 + a/2 . 32 = 6,48 => a = 0,06 (mol) Số mol Cu(NO3)2 tham gia phản ứng là 0,06 mol Khối lượng Cu(NO3)2 tham gia phản ứng là: 0,06 . 188 = 11,28 (g) % Cu(NO3)2 bị phân huỷ = 11,28 .10075(%) 15,04 = Hỗn hợp khí sau phản ứng gồm: NO2: 0,12 (mol) và O2: 0,03 (mol) 0,12.460,03.32 43,2 0,120,03hhM + == + Tỉ khối của hỗn hợp khí so với H2 là: 2/ 43,2 21,6 2hhHd == 0.25 0.25 0.25 0.5 0.25 0.5 0.5 Câu27(3.5 điểm): 1. Có hỗn hợp khí CO và CO2 . Nếu cho hỗn hợp khí đi qua dung dịch Ca(OH)2 dư thì thu được 1 g chất kết tủa màu trắng . Nếu cho hỗn hợp khí này đi qua bột CuO nóng dư thì thu được 0,46 g Cu . a)Viết phương trình phản ứng xảy ra ? b) Tính thể tích của hỗn hợp khí ở đktc và thể tích của mỗi khí có ở trong hỗn hợp . Câu ý Hướngdẫnchấm Thang điểm 27 1. a) PTPƯ : CO2 + Ca(OH)2 CaCO3 + H2O (1) CO + CuO Cu + CO2 (2) b) n CaCO3 = 100 1 = 0,01 mol n Cu = 64 46,0 = 0,01 mol Theo (1) n CO2phản ứng = n CaCO3sinhra = 0,01 mol → V CO2 = 0,01 . 22,4 = 0,224 lít Theo (2) n COphản ứng = n Cusinhra = 0,01 mol → V CO = 0,01 . 22,4 = 0,224 lít Vậy V hh = V CO + V CO2 = 0,224 + 0,224 = 0,448 lít 0.5 0.5 0.5 0.5 0.25 0.5 0.25 0.25 0.25
DẠYKÈMQUYNHƠNOFFICIAL CHUYÊN ĐỀ CHUỖIPTHH(5 điểm) Ngườithựchiện: 1)TôThanhTuân:TrườngTHCSLêLợi(Từ câu1–10) 2) ĐinhBáTuyến-TrườngTHCSNậmPì(Từ câu11–20) 3)LýThịHặn:TrườngPTDTBTTHCSHuaBum(Từ câu21–30) Câu1:(5 điểm) a. Hoàn thành các phương trình phản ứng sau và ghi rõ điều kiện xảy ra phản ứng (nếu có): 1. Fe3O4 + ...... - - -> ..... + H2O 2. KMnO4 - - -> ..... + ..... + O2 3. HCl + CaCO3 - - -> CaCl2 + H2O + ... 4. Na2CO3 + CaCl2 - - -> CaCO3 + ..... 5. CaO + HNO3 -----> Ca(NO3)2 + ....... 6. Fe + O2 ----> ...... 7. P2O5 + H2O - - -> ........ 8. Al + HCl - - -> ....... + ....... b. 1. Viết các phương trình hóa học của các phản ứng có thể xảy ra khi: a) Cho mẫu kim loại Na vào cốc đựng dung dịch Al2(SO4)3 b) Dẫn khí SO2 đi qua cốc đựng dung dịch nước Br2 2. Chọn các chất A, B, C, D thích hợp để hoàn thành các phương trình hóa học theo sơ đồ chuyển hóa sau (mỗi mũi tên tương ứng với 1 phương trình hóa học). A B CuSO4 CuCl2 Cu(NO3)2 A B C C Câu Ý Hướngdẫnchấm Biểu điểm 1a 1 Fe3O4 + 4H2 0t → 3Fe + 4H2O 0.25 2 2KMnO4 0t → K2MnO4 + MnO2 + O2 0.25 3 2HCl + CaCO3 → CaCl2 + H2O + CO2 0.25 4 Na2CO3 + CaCl2 → CaCO3 + 2NaCl 0.25 5 CaO + 2HNO3 → Ca(NO3)2 + H2O 0.25 6 3Fe + 2O2 0t → Fe3O4 0.25 7 P2O5 + 3H2O → 2H3PO4 0.25 8 2Al + 6HCl → 2AlCl3 + 3H2 0.25 b 1 Các phương trình hóa học có thể xảy ra: a) 2Na + 2H2O → 2NaOH + H2↑ 6NaOH + Al2(SO4)3 → 2Al(OH)3↓ + 3Na2SO4 Al(OH)3 + NaOH → NaAlO2 + 2H2O 0,25 0,25 0,25 +D +D +D
Câu2 (
a. Hoàn thành nh
ng ph
ng hóa h
1/ FeS2 + O2 ----> Fe2O3 + SO2
sau
2/ KOH + Al2(SO4)3 ----> K2SO4 + Al(OH)3
3/ FeO + HCl ----> FeCl2 + H2O
4/ FexOy + CO ----> FeO + CO2
5/ Al + H2SO4(đặc nóng)
6/ Fe3O4 + Al --- -> Fe + Al2O3
7/ FexOy + H2 -----> Fe + H2O.
8/Fe + Cl2 0t → FeCl3
b. T
nh
ng ch
KMnO4, dung d
Al2(SO4)3 + SO2
+ H2O
ch CuSO
Fe, dung d
HCl các
DẠYKÈMQUYNHƠNOFFICIAL
5 điểm):
ữ
ản ứ
ọc
:
ừ
ữ
ất
ị
4,
ịch axit
điều kiện cần thiết. Viết phương trình hóa học điều chế các chất theo sơ đồ chuyển hóa sau: Cu→CuO→Cu. Biết Fe có thể phản ứng với CuSO4 theo phương trình Fe + CuSO4 →FeSO4 + Cu b) SO2 + 2H2O + Br2 → H2SO4 + 2HBr 0,25 2 A, B, C, D lần lượt là: Cu(OH)2, CuO, Cu, H2SO4. Các phương trình hóa học: H2SO4 + Cu(OH)2 → CuSO4 + 2H2O H2SO4 + CuO → CuSO4 + H2O 2H2SO4 đặc,nóng + Cu → CuSO4 + 2H2O + SO2↑ CuSO4 + BaCl2 → BaSO4 + CuCl2 CuCl2 + 2AgNO3 → 2AgCl↓ + Cu(NO3)2 Cu(NO3)2 + 2NaOH → Cu(OH)2↓ + 2NaNO3 Cu(OH)2 → CuO + H2O CuO + CO → Cu + CO2 0,25 0,25 0,25 0,25 0,25 0,25 0,25 0,25 Câu2 Ý Hướngdẫnchấm Biểu điểm 1 1 4FeS2 + 11O2 > 2Fe2O3 + 8SO2 0,5 2 6KOH + Al2(SO4)3 > 3K2SO4 + 2Al(OH)3 0,5 3 FeO + 2HCl > FeCl2 + H2O 0,5 4 FexOy + yCO > xFeO + yCO2 0,5 5 2 Al + 6 H2SO4 Al2(SO4)3 + 3 SO2 + 6 H2O 0,5 6 3Fe3O4 + 8Al 0t → 9Fe + 4Al2O3 0,5 7 FexOy + yH2 0t → xFe + yH2O 0,5 8 2Fe + 3Cl2 0t → 2 FeCl3 0,25 2 1 2KMnO4 to K2MnO4 + MnO2+ O2 (điều chế O2) 0.25 2 Fe +2HCl →FeCl2 + H2 (điều chế H2) 0.25 3 Fe + CuSO4 →FeSO4 + Cu (điều chế Cu) 0.25 4 2Cu + O2 to 2CuO (điều chế CuO) 0.25 5 CuO + H2 to Cu+ H2O (điều chế Cu) 0.25 t0 t0
DẠYKÈMQUYNHƠNOFFICIAL Câu3 ( 5 điểm): a) Viết các phương trình hóa học để thực hiện dãy biến đổi hóa học theo sơ đồ sau: Fe3O4 (1) → Fe (2) → FeCl2 (3) → FeSO4 (4) →Fe(NO3)2 (5) → Fe(OH)2 (6) → Fe(OH)3 b) Cho sơ đồ biến hóa sau: CaCO3 ( CaCO3 CaO A B C D Hãy tìm các chất ứng với A, B, C, D. Biết rằng chúng là những chất khác nhau. Viết phương trình phản ứng. ( ghi rõ điều kiện nếu có) Câu3 (5 điểm) a) (1) Fe3O4 + 4CO 0t → 3Fe + 4CO2 0,5 (2) Fe + 2HCl → FeCl2 + H2 ↑ 0,25 (3) FeCl2 + Ag2SO4 → FeSO4 + 2AgCl 0,5 (4) FeSO4 + Ba(NO3)2 → Fe(NO3)2 + BaSO4 0,25 (5) Fe(NO3)2 + 2NaOH → Fe(OH)2 + 2NaNO3 0,25 (6) 4Fe(OH)2 + 2H2O + O2 0t → 4Fe(OH)3 0,5 b) A: Ca(OH)2 ; B: CaCl2 ; C: Ca(NO3)2 ; D: Ca(HCO3)2 0,5 (1) CaCO3 0t → CaO + CO2 0,25 (2) CaO + H2O → Ca(OH)2 0,25 (3) Ca(OH)2 + 2HCl → CaCl2 + 2H2O 0,25 (4) CaCl2 + 2AgNO3 → Ca(NO3)2 + 2AgCl ↓ 0,25 (5) Ca(NO3)2 + Na2CO3 → CaCO3 ↓ + 2NaNO3 (6) CaCO3 + 2HCl → CaCl2 + CO2 ↑ + H2O (7) CaCO3 + CO2 + H2O → Ca(HCO3)2 (8)Ca(HCO3)2 + 2HNO3 → Ca(NO3)2 + 2CO2 ↑ + 2H2O 0,25 0,25 0,5 0,25 Câu4:(5 điểm): a. Hoàn thành các phương trình phản ứng sau: 1. Fe2O3 + CO → 2. AgNO3 + Al → Al(NO3)3 + … 3. HCl + CaCO3 → CaCl2 + H2O + … 4. C4H10 + O2 → CO2 + H2O (5)(4)(3)(1) (2) 6) (7) (8)
DẠYKÈMQUYNHƠNOFFICIAL 5. NaOH + Fe2(SO4)3 → Fe(OH)3 + Na2SO4. 6. FeS2 + O2 → Fe2O3 + SO2 7. KOH + Al2(SO4)3 → K2SO4 + Al(OH)3 8. CH4 + O2 + H2O → CO2 + H2 9. Al + Fe3O4 → Al2O3 + Fe 10. FexOy + CO → FeO + CO2 b. Xác định công thức hóa học của A; B; C và viết phương trình hóa học hoàn thành chuỗi biến hóa sau: (ghi rõ điều kiện phản ứng, nếu có) KMnO4 → A → Fe3O4 → B → H2SO4 → C → HCl Câu5:(5 đ) a. Hoàn thành các phương trình phản ứng sau và ghi rõ điều kiện xảy ra phản ứng (nếu có): 1.Cu + …… ------> CuSO4 + H2O + SO2 2. MnO2 + HCl ------> MnCl2 + …… + H2O 3. Fe(OH)3 + ...... ------> Fe2(SO4)3 + H2O 4. CO + Fe3O4 ------> ……. + …….. 5. FexOy + H2 ------> ….. + ……. 6. FexOy + HCl ------> FeCl2y/x + ……. b.Viết phương trình thực hiện dãy chuyển hóa sau. 1 2 3 4 5 Câu Ý Hướngdẫnchấm Biểu điểm 4 a 1. Fe2O3 + 3CO → 2Fe + 3CO2 2. 3AgNO3 + Al → Al(NO3)3 + 3Ag 3. 2HCl + CaCO3 → CaCl2 + H2O + CO2 4. 2C4H10 + 13O2 → 8CO2 + 10H2O 5. 6NaOH + Fe2(SO4)3 → 2Fe(OH)3 + 3Na2SO4. 6. 4FeS2 + 11O2 → 2Fe2O3 + 8 SO2 7. 6KOH + Al2(SO4)3 → 3K2SO4 + 2Al(OH)3 8. 2CH4 + O2 + 2H2O → 2CO2 + 6H2 9. 8Al + 3Fe3O4 → 4Al2O3 +9Fe 10. FexOy + (y-x)CO → xFeO + (y-x)CO2 0,25 0,25 0,25 0,5 0,25 0,25 0,25 0,5 0,25 0,5 b A: O2 ; B: H2O; C: H2 0,25 2KMnO4 0t → K2MnO4 + MnO2 + O2 0,25 3Fe + 2O2 0t → Fe3O4 0,25 Fe3O4 + 4H2 0t → 3Fe + 4H2O 0,25 H2O + SO3 → H2SO4 0,25 Fe + H2SO4 → FeSO4 + H2 0,25 H2 + Cl2 0t → HCl 0,25
DẠYKÈMQUYNHƠNOFFICIAL A B FeCl3 Fe(OH)3 B A 6 Al2O3 7 Al 5 1 1 Cu + 2H2SO4 đ 0t → CuSO4 + 2H2O + SO2 0,5 2 MnO2 + 4HCl 0t → MnCl2 + Cl2 + 2H2O 0,5 3 Fe(OH)3 + H2SO4 → Fe2(SO4)3 + H2O 0,25 4 4CO + Fe3O4 0t → 3 Fe + 4CO2 0,5 5 FexOy + yH2 0t → xFe + yH2O 0,5 6 FexOy + 2yHCl → xFeCl2y/x + yH2O 0,5 2 A là Fe, B là Fe2O3 0.25 1 4Fe + 3O2 0t → 2 Fe2O3 0,25 2 Fe2O3 + 6HCl → 2FeCl3 + 3H2O 0,25 3 FeCl3 + 3 NaOH → Fe(OH)3 + 3NaCl 0,25 4 2Fe(OH)3 0t → Fe2O3 + 3H2O 0,25 5 Fe2O3 + 3H2 0t → 2Fe + 3H2O 0,25 6 Fe2O3 + 2Al 0t → 2Fe + Al2O3 0,5 7 2Al2O3 đpnc 4Al + 3O2 0,25 Câu6:(5 điểm) 1. Cânbằngcácphươngtrinhphản ứnghóahọcsau: 1. FeS2 + O2 → Fe2O3 + SO2 2. P + KClO3 → P2O5 + KCl 3. C3H8 + HNO3 → CO2 + NO + H2O 4. CH3COOH + Na2CO3 → CH3COONa + H2O + CO2 5. Fe3O4 + HNO3 → Fe(NO3)3 + NO2 + H2O 6. S + NaOH → Na2S + Na2SO4 + H2O 7. CxHyOz + O2 → CO2 + H2O 8. FeClx + Cl2 → FeCl3 9.FexOy + yH2 0t → xFe + yH2O 10. FexOy + yCO ----> xFeO + yCO2 1 4FeS2 + 11O2 → 2Fe2O3 + 8SO2 0,5 2 6P + 5KClO3 → 3P2O5 + 5KCl 0,5 3 3C3H8 + 20HNO3 → 9CO2 + 20NO + 22H2O 0,5
DẠYKÈMQUYNHƠNOFFICIAL 6 1 4 2CH3COOH + Na2CO3 → 2CH3COONa + H2O + CO2 0,5 5 Fe3O4 + 10HNO3 → 3Fe(NO3)3 + NO2 + 5H2O 0,5 6 4S + 8NaOH → 3Na2S + Na2SO4 + 4H2O 0,5 7 CxHyOz + yz (x) 42 +− O2 → xCO2 + y 2 H2O 0,5 8 2FeClx + 62x () 2 Cl2 → 2FeCl3 0,5 9 FexOy + yH2 0t → xFe + yH2O 0,5 10 FexOy + yCO > xFeO + yCO2 0,5 Câu7:(5 đ): Viết phương trình hóa học cho dãy chuyển hóa sau: 1. FeS2 → SO2 → SO3 →H2SO4 →SO2 Fe2O3 →Fe→ FeCl2 → FeCl3 2. Điền các chất phù hợp vào các chữ cái B,C,D vào dãy chuyển đổi, rồi viết phương trình phản ứng hóa học hoàn thành dãy chuyển hóa trên CuSO4 →B→C→D→Cu 7.a 4FeS2 + 11O2 to 8Fe2O3 + 8SO2 2SO2 + O2 to 2SO3 SO3 + H2O → H2SO4 Cu + 2H2SO4 đ to CuSO4 + SO2 + 2H2O Fe2O3 + 3H2 to 2Fe + 3H2O Fe + 2HCl → FeCl2 + H2↑ 2FeCl2 + Cl2 →2 FeCl3 0,5 0,25 0,25 0,5 0,5 0,5 0,5 b B: CuCl2 C: Cu(OH)2 D: CuO CuSO4 + BaCl2 → BaSO4 ↓ + CuCl2 CuCl2 + 2 NaOH → Cu(OH)2 ↓ + 2NaCl Cu(OH)2 t0 CuO + H2O CuO + H2 t0 Cu + H2O 0,5 0,5 0,5 0,25 0,25 Câu8.(5 đ) Hoàn thành các phương trình phản ứng sau và ghi rõ điều kiện xảy ra phản ứng (nếu có):
DẠYKÈMQUYNHƠNOFFICIAL 1. P + KClO3 → P2O5 + KCl 2. Fe3O4 + HNO3 → Fe(NO3)3 + NO2 + H2O 3. S + NaOH → Na2S + Na2SO4 + H2O 4. FeClx + Cl2 → FeCl3 5. FexOy + H2 ------> ….. + ……. 6. FexOy + HCl ------> FeCl2y/x + ……. 7. Fe3O4 + HCl - - -> …….. + ……+ …… 8. FeS2 + O2 → …… + ……. 9. Fe2O3 + 3H2 to 2Fe + 3H2O 10. S + NaOH → Na2S + ………… + H2O 8 (5,0đ) 1 6P + 5KClO3 → 3P2O5 + 5KCl 0,5 2 Fe3O4 + 10HNO3 → 3Fe(NO3)3 + NO2↑ + 5H2O 0,5 3 4S + 8NaOH → 3Na2S + Na2SO4 + 4H2O 0,5 4 2FeClx + 62x () 2 Cl2 → 2FeCl3 0,5 5 FexOy +2yHCl → xFeCl2y/x +yH2O 0,5 6 FexOy +yH2 0t → xFe +yH2O 0,5 7 Fe3O4 + 8HCl → FeCl2 + 2FeCl3 + 4H2O 0,5 8 4FeS2 + 11O2 → 2 Fe2O3 + 8SO2↑ 0,5 9 Fe2O3 + 3H2 to 2Fe + 3H2O 0,5 10 S + NaOH → Na2S + Na2SO4 + H2O 0,5 Câu9:(5 điểm) a.Viết các phương trình phản ứng cho dãy chuyển đổi sau: b. Viết 2 phương trình phương pháp khác nhau điều chế khí H2 Câu2 (1) Fe + 2HCl → FeCl2 + H2 (2) FeCl2 + 2NaOH → Fe(OH)2↓ + 2NaCl Mỗi PTHH () () () () () () 2 2 32 56 3 323 FeClFeOH FeClFeOHFeO → ← →→ Fe (1) (4) (7) (9) (8)
DẠYKÈMQUYNHƠNOFFICIAL (5 đ) (3) Fe(OH)2 + 2HCl → FeCl2 + 2H2O (4) 2Fe + 3Cl2 ot → 2FeCl3 (5) FeCl3 + 3NaOH → Fe(OH)3↓ + 3NaCl (6) 2Fe(OH)3 ot → Fe2O3 + 3H2O (7) 2FeCl2 + Cl2 → 2FeCl3 (8) 2FeCl3 + Fe → 3FeCl2 (9) 4Fe(OH)2 + 2H2O + O2 → 4Fe(OH)3 ↓ đúng 0,5 điểm 1. Fe + 2HCl → FeCl2 + H2 0,25 2. 2H2O ot → 2H2 + O2 0,25 Câu10:5 đ a. Lập phương trình hóa học theo các sơ đồ sau: 1/ FeS2 + O2 ----> Fe2O3 + SO2 2/ KOH + Al2(SO4)3 ----> K2SO4 + Al(OH)3 3/ FexOy + CO ----> FeO + CO2 4/ Al + Fe3O4 ----> Al2O3 + Fe b.Viết phương trình hóa học thực hiện chuyển đổi hóa học sau: S 1 SO2 SO3 H2SO4 H2 Cu c.Viết phương trình hóa học xảy ra, kèm theo điều kiện (nếu có) khi: Điều chế khí oxi từ kali clorat, kali pemanganat, nước. Cho khí oxi tác dụng lần lượt với khí metan, phốt pho, sắt. Câu Đápán Điểm 10 a 1) 4FeS2 + 11O2 2Fe2O3 + 8 SO2 2) 6KOH + Al2(SO4)3 3K2SO4 + 2Al(OH)3 3) FexOy + (y-x)CO xFeO + (y-x)CO2 4) 8Al + 3Fe3O4 4Al2O3 +9Fe 0,5 0,5 0,5 0,5 b Viết phương trình hóa học: S + O2 SO2 2SO2 + O2 2SO3 SO3 + H2O H2SO4 H2SO4 + Zn ZnSO4 + H2 H2 + CuO Cu + H2O 0,25 0,5 0,25 0,25 0,25 1 2 53 4
DẠYKÈMQUYNHƠNOFFICIAL c 2KClO3 ot → 2KCl + 3O2 2KMnO4 ot → 2K2MnO4 + MnO2 + O2 H2O ot → H2 + O2 CH4 + 2O2 ot → 2H2O + CO2 4P + 5O2 ot → 2 P2O5 3Fe + 2O2 ot → Fe3O4 0,25 0,25 0,25 0,25 0,5 Câu11 ( 5đ): a.Lập phương trình hóa học của các phản ứng sau: 1.FeS2 + O2 -0t → SO2 + Fe2O3 2.FexOy + CO -- 0t → FeO + CO2 3.FexOy + HCl -- → FeCl x y2 + H2O 4.KMnO4 + HCl -- → KCl + MnCl2 + Cl2 + H2O 5. KOH + Al2(SO4)3 ----> K2SO4 + Al(OH)3 6. Al + Fe3O4 ----> Al2O3 + Fe 7. FexOy + H2 Fe + H2O 8. ..... + H2O → NaOH + H2 9. P2O5 + .......... → H3PO4 10. Fe + ....... ot → Fe3O4 Câu 11 5,0 điểm 1) 4FeS2 + 11 O2 → 0t 8SO2 + 2Fe2O3 0,5 2) FexOy + 2y HCl → xFeCl x y2 + yH2O 0,5 3) 2KMnO4 +16 HCl →2KCl + 2MnCl2 + 5Cl2 + 8H2O 0,5 4) 6KOH + Al2(SO4)3 3K2SO4 + 2Al(OH)3 0,5 5) 8Al + 3Fe3O4 4Al2O3 +9Fe 0,5 6) FexOy + (y-x)CO xFeO + (y-x)CO2 0,5 7) FexOy + y H2 x Fe + y H2O 0,5
DẠYKÈMQUYNHƠNOFFICIAL Câu12:(5điểm) Hoàn thành các phương trình phản ứng sau và ghi rõ điều kiện xảy ra phản ứng (nếu có): 1. Fe3O4 + ...... - - -> ..... + H2O 2. KMnO4 - - -> ..... + ..... + O2 3. HCl + CaCO3 - - -> CaCl2 + H2O + ... 4. Na2CO3 + CaCl2 - - -> CaCO3 + ..... 5. CaO + HNO3 -----> Ca(NO3)2 + ....... 6. Fe + O2 ----> ...... 7. P2O5 + H2O - - -> ........ 8. Al + HCl - - -> ....... + ....... 9. P2O5 + .......... → H3PO4 10. Fe + ....... ot → Fe3O4 12 (5 điểm) 1 Fe3O4 + 4H2 0t → 3Fe + 4H2O 0.5 2 2KMnO4 0t → K2MnO4 + MnO2 + O2 ↑ 0.5 3 2HCl + CaCO3 → CaCl2 + H2O + CO2 ↑ 0.5 4 Na2CO3 + CaCl2 → CaCO3 + 2NaCl 0.5 5 CaO + 2HNO3 → Ca(NO3)2 + H2O 0.5 6 3Fe + 2O2 0t → Fe3O4 0.5 7 P2O5 + 3H2O → 2H3PO4 0.5 8 2Al + 6HCl → 2AlCl3 + 3H2 ↑ 0.5 8). 2Na + 2H2O → 2NaOH + H2 0,5 9). P2O5 + 3H2O → 2H3PO4 0,5 10) 3 Fe + 2 O2 ot → Fe3O4 0,5
DẠYKÈMQUYNHƠNOFFICIAL 9 P2O5 + 3H2O → 2H3PO4 0,5 10 3 Fe + 2 O2 ot → Fe3O4 0,5 Câu13:(5 điểm) Hoànthànhcácphươngtrìnhphản ứngsauvàghirõ điềukiệnxảyraphản ứng(nếucó): 1. ..... + AgNO3 - - -> Al(NO3)3 + Ag 2. Zn + ..... ----> ZnCl2 + H2 ↑ 3. Fe(OH)3 + ...... ------> Fe2(SO4)3 + H2O 4. Na2CO3 + Ca(OH)2 - - -> CaCO3 + ..... 5. NaOH + ...... -----> Fe(OH)3 + NaCl 6. Al + O2 ----> ...... 7. BaCl2 + AgNO3 ------> AgCl + ......... 8. CaCO3 + HCl - - -> CaCl2 + ....... + ....... 9. Fe3O4 + H2 0t → ……… + ……… 10. Na2CO3 +………. → CaCO3 + NaCl 13 (5 điểm) 1 Al + 3AgNO3 → Al(NO3)3 + 3Ag 0.5 2 Zn + 2HCl → ZnCl2 + H2 ↑ 0.5 3 2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + 6H2O 0.5 4 Na2CO3 + Ca(OH)2 → CaCO3 + 2NaOH 0.5 5 3NaOH + FeCl3 → Fe(OH)3 + 3NaCl 0.5 6 4Al + 3O2 0t → 2Al2O3 0.5 7 BaCl2 + 2AgNO3 → 2AgCl ↓ + Ba(NO3)2 0.5 8 CaCO3 + 2HCl → CaCl2 + CO2 ↑ + H2O 0.5 9 Fe3O4 + 4H2 0t → 3Fe + 4H2O 0,5 10 Na2CO3 + CaCl2 → CaCO3 + 2NaCl 0,5
DẠYKÈMQUYNHƠNOFFICIAL Câu14 (5 điểm): a.Thay các chữ cái A, B, C, D bằng các công thức thích hợp và viết phương trình hóa học hoàn thành sơ đồ sau: A 1 KMnO4 2 C 5 Fe3O4 6 Fe 7 D 8 H2O B 3 9 10 KNO3 4 FeCl2 Cu b.Hoànthànhcácphản ứngsau,ghirõ điềukiệnxảyra(nếucó). 1. Al + O2 → Al2O3 2. KClO3 → KCl + O2 3. P + O2 → P2O5 4. Al + H2SO4 → Al2(SO4)3 + ? 5. KMnO4 → K2MnO4 + MnO2 + O2 6. H3PO4 + Ca(OH)2 → Ca3(PO4)2 + H2O 7. Fe3O4 + CO → Fe + CO2 8. Ca + H3PO4 → Ca3(PO4)3 + ?
8,10 H2 + CuO to Cu + H2O 0.25
14b 1 4Al + 3O2 0t → 2Al2O3 0,25
2
2KClO3 0t → 2KCl + 3O2 0,25
3 4P + 5O2 0t → 2P2O5 0,25
4 2Al + 3H2SO4 → Al2(SO4)3 + 3H2 0,25
5 2KMnO4 0t → K2MnO4 + MnO2 + O2 0,25
6 2H3PO4 + 3Ca(OH)2 → Ca3(PO4)2 + 6H2O 0,25
7 Fe3O4 + 4CO 0t → 3Fe + 4CO2 0,5
3Ca + 2H3PO4 → Ca3(PO4)2 + 3H2 0,5
DẠYKÈMQUYNHƠNOFFICIAL Câu15(5 điểm) 1.Viết đầy đủ các phương trình hóa học theo sơ đồ chuyển hóa sau: Fe → Fe2O3 → FeCl3 →Fe(OH)3 → Fe2O3 → Fe 2.Từ H2SO4 loãng, H2SO4 đặc O2 và Cu trình bầy cách điều chế CuSO4 bằng hai cách 3. Từ Na2O, CaO, H2O và các dung dịch muối CuSO4, FeCl3 viết phương trình điều chế NaOH, Ca(OH)2, Cu(OH)2, Fe(OH)3 14a Thay các chữ cái A= H2O; B= KClO3; C= O2, D= H2 0,5 1 2H2O Điệnphân 2H2 + O2 0.25 2 2KMnO4 to K2MnO4 + MnO2 + O2 0.25 3 2KClO3 to 2KCl + 3O2 0.25 4 2KNO3 to 2KNO2 + 3O2 0.25 5 2O2 + 3Fe to Fe3O4 0.25 6 Fe3O4 + 4H2 to 3Fe + 4H2O 0.25 7,9 Fe + 2HCl → FeCl2 + H2 0.25
8
DẠYKÈMQUYNHƠNOFFICIAL 1 1. 4Fe + 3 O2 → 2Fe2O3 2. Fe2O3 + 6HCl→ 2FeCl3 + 3H2O 3. FeCl3 + 3NaOH → Fe(OH)3 ↓ + 3NaCl 4. 2Fe(OH)3 Fe2O3 + 3H2O 5. Fe2O3 + 3 H2 → 2Fe + 3 H2O 0,5đ 0,5đ 0,25đ 0,25đ 0,5đ 2 1. Điều chế CuSO4: Cách 1. Cu + 2H2SO4đđ → CuSO4 + 2H2O + SO2 Cách 2. Cu + O2 CuO CuO + H2SO4 l → CuSO4 + H2O Na2O + H2O → 2NaOH CaO + H2O → Ca(OH )2 Dùng NaOH: CuSO4 + 2NaOH → Cu(OH )2 + Na2SO4 FeCl3 + 3NaOH → Fe(OH )3 + 3NaCl 0,5đ 0,25đ 0,25đ 0,5đ 0,5đ 0,5đ 0,5đ Câu16:Cânbằngcácphươngtrìnhhóahọc 1) MgCl2 + KOH → Mg(OH)2 + KCl 2) Cu(OH)2 + H2SO4 → CuSO4 + H2O 3) Fe2O3 + H2SO4 → Fe2(SO4)3 + H2O 4) Cu(NO3)2 + NaOH → Cu(OH)2 + NaNO3 5) NO + O2 → NO2 6) NO2 + O2 + H2O → HNO3 7) Ca(OH)2 + Na2CO3 → CaCO3 + NaOH 8) Fe2O3 + H2 → Fe + H2O 9) FeI3 → FeI2 + I2 10) AgNO3 + K3PO4 → Ag3PO4 + KNO3 11) SO2 + Ba(OH)2 → BaSO3 + H2O 12) FeS + HCl → FeCl2 + H2S 13) Pb(OH)2 + HNO3 → Pb(NO3)2 + H2O 16 1 MgCl2 + 2KOH → Mg(OH)2 + 2KCl 0,25
DẠYKÈMQUYNHƠNOFFICIAL 2 Cu(OH)2 + H2SO4 → CuSO4 + 2H2O 0.25 3 Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O 0.5 4 Cu(NO3)2 + 2NaOH → Cu(OH)2 + 2NaNO3 0.5 5 2NO + O2 → 2NO2 0.25 6 4NO2 + O2 + 2H2O → 4HNO3 0.25 7 Ca(OH)2 + Na2CO3 → CaCO3 + 2NaOH 0.25 8 Fe2O3 + 3H2 → 2Fe + 3H2O 0.5 9 2FeI3 → 2FeI2 + I2 0.5 10 3AgNO3 + K3PO4 → Ag3PO4 + 3KNO3 0,5 11 SO2 + Ba(OH)2 → BaSO3 + H2O 0,5 12 FeS + 2HCl → FeCl2 + H2S 0,25 13 Pb(OH)2 + 2HNO3 → Pb(NO3)2 + 2H2O 0,5 Câu17:Chọnhệ số vàcôngthứchóahọcphùhợp điềnvàodấuhỏichấm trongphươngtrìnhhóahọc 1) Al2O3 + ? → AlCl3 + H2O 2) H3PO4 + KOH → K3PO4 + ? 3) ?NaOH + CO2 → Na2CO3 + ? 4) Mg + HCl → ? + H2 5) P2O5 + ? → ?H3PO4 6) CaO + ? → CaCl2 + H2O 7) CuSO4 + BaCl2 → BaSO4 + ? 8) FexOy+ H2 → Fe + H2O 9) FexOy + HCl → FeCl2y/x + H2O 10) FexOy + H2SO4 → Fe2(SO4)2y/x + H2O 17 1 Al2O3 + 6 HCl → 2AlCl3 + 3 H2O 0,5 2 H3PO4 + 3KOH → K3PO4 + 3H2O 0.5
DẠYKÈMQUYNHƠNOFFICIAL 3 2NaOH + CO2 → Na2CO3 + H2O 0.5 4 Mg + 2HCl → MgCl2 + H2 0.5 5 P2O5 + 3H2O → 2H3PO4 0.5 6 CaO + 2 HCl → CaCl2 + H2O 0.5 7 CuSO4 + BaCl2 → BaSO4 + CuCl2 0.5 8 FexOy+ y H2 → x Fe + yH2O 0.5 9 FexOy + 2yHCl → xFeCl2y/x + yH2O 0.5 10 2FexOy + 2yH2SO4 → xFe2(SO4)2y/x + 2yH2O 0,5 Câu 18: (5,0điểm) 1. Cho sơ đồ chuyển hoá sau: Phi kim oxit axit(1) oxit axit(2) axit muối tan muối không tan. a. Tìm công thức các chất thích hợp để thay cho tên các chất trong sơ đồ trên. b. Viết phương trình hoá học biểu diễn chuyển hoá trên. 2. Hoàn thành các phương trình phản ứng sau: FeS + HCl khí A + …. KClO3 + HCl khí B + …. NaHCO3 + HCl khí C + …. 18 a. CT các chất thích hợp: S; SO2; SO3; H2SO4; Na2SO4; BaSO4 0,5 . b. PTPƯ: S + O2 TO SO2 0.5 2SO2 + O2 TO 2SO3 0.5 SO3 + H2O H2SO4. 0.5 H2SO4 + 2NaOH Na2SO4 + 2H2O. 0.5 Na2SO4 + BaCl2 BaSO4 + 2NaCl. 0.5 b.Các phương trình phản ứng
DẠYKÈMQUYNHƠNOFFICIAL Khí A: H2S; B: Cl2; C: CO2 0,5 FeS + 2HCl FeCl2 + H2S. 0.5 2KClO3 + 12HCl 2KCl + 6H2O + 6Cl2. 0.5 NaHCO3 + HCl NaCl + H2O + CO2. 0,5 Câu19 (5,0 điểm): 1. Hoàn thành các phương trình phản ứng hóa học sau (ghi rõ điều kiện phản ứng nếu có): a. FeS2 + O2 → b. Fe3O4 + HCl → c. Al2O3 + NaHSO4 → d. Fe2O3 + CO → FexOy + CO2 2: Từ quặng pirit sắt, muối ăn, nước, chất xúc tác và các điều kiện thí nghiệm cần thiết khác hãy điều chế: dd FeCl3, FeSO4, Fe2(SO4)3 và Fe(OH)3. 19 1. a. 4FeS2 + 11O2 0t → 2Fe2O3 + 8SO2 b. Fe3O4 + 8HCl → FeCl2 + 2FeCl3 + 4H2O c. Al2O3 + 6NaHSO4 → Al2(SO4)3 + 3Na2SO4 + 3H2O d. xFe2O3 + (3x-2y)CO 0t → 2FexOy + (3x-2y)CO2 0,5 0,5 0,5 0,5 2 2NaCl + 2H2O 2NaOH + Cl2 + H2 (1) 2H2O 2H2 + O2 (2) 4FeS2 + 11O2 0t → 2Fe2O3 + 8SO2 (3) 2SO2 + O2 0t → 2SO3 (4) V2O5 SO3 + H2O → H2SO4 (5) 0,5 0,25 0,25 0,25 0,25 đp đp
DẠYKÈMQUYNHƠNOFFICIAL Câu20 (5 điểm): a. Từ những chất KMnO4, dung dịch CuSO4, Fe, dung dịch axit HCl các điều kiện cần thiết. Viết phương trình hóa học điều chế các chất theo sơ đồ chuyển hóa sau: Cu→CuO→Cu. Biết Fe có thể phản ứng với CuSO4 theo phương trình Fe + CuSO4 →FeSO4 + Cu b.Thay các chữ cái A, B, C bằng các công thức thích hợp và viết phương trình hóa học hoàn thành sơ đồ sau: KClO3 1 O2 2 A 3 NaOH 4 B 5 C 6 H2SO4 7 B a 2KMnO4 to K2MnO4 + MnO2+ O2 (điều chế O2) 0.5 Fe +2HCl →FeCl2 + H2 (điều chế H2) 0.5 Fe + CuSO4 →FeSO4 + Cu (điều chế Cu) 0.5 2Cu + O2 to 2CuO (điều chế CuO) 0.5 CuO + H2 to Cu+ H2O (điều chế Cu) 0.5 b Thay các chữ cái A= Na2O ; B= SO2 ; C= SO3 0.75 1 2KClO3 to 2KCl + 3O2 0.25 2 O2 + 4Na to 2Na2O 0,25 3 Na2O + H2O → 2NaOH 0,25 4 O2 + S to SO2 0.25 Fe2O3 + 3H2 0t → 2Fe + 3H2O (6) đ/c: FeCl3: 2Fe + 3Cl2 0t → 2FeCl3 cho vào H2O (7) đ/c: FeSO4: Fe + H2SO4(loãng) → FeSO4 + H2 (8) đ/c: Fe2(SO4)3: Fe2O3 + 3H2SO4 → Fe2(SO4)3 +3H2O (9) đ/c: Fe(OH)3: FeCl3 + 3NaOH → Fe(OH)3 + 3NaCl (10) 0,5 0,25 0,25 0,25 0,25
DẠYKÈMQUYNHƠNOFFICIAL 5 2SO2 +O2 xt,to 2SO3 0.25 6 SO3 + 2H2O → H2SO4 0.25 7 2H2SO4đặc +Cu to CuSO4 +SO2+2H2O 0.25 Câu21:(5điểm): Hoànthànhphươngtrìnhphảnứngsauvàchobiếttỉlệ sốnguyêntử,sốphântửcácchất? a. FeS2 + O2 ------>Fe2O3 + SO2 b. Al(OH)3 ------>H2O + Al2O3 c. FexOy + CO------> Fe + CO2 d. CxHy + O2 ------> H2O + CO2 e. Al + H2SO4 ------> Al2(SO4)3 + H2 f. P + O2 ------> P2O5 g.Na + H2O ------> NaOH + H2 h.Al + Cl2 ------>AlCl3 i. KClO3 ------>KCl + O2 k.KMnO4 ------>K2MnO4 +MnO2 +O2 Câu Hướngdẫnchấm Biểuđiểm 21 a. 4FeS2 + 11O2 0t → 2Fe2O3 + 8SO2 4 : 11 : 2 : 8 b. 2Al(OH)3 → 3H2O + Al2O3 2 : 3 : 1 c. FexOy + yCO 0t → xFe + yCO2 1 : y : x : y d. CxHy + (x+ 2 y )O2 0t → 2 y H2O + xCO2 1 : (x+ 2 y ) : 2 y : x e. 2Al + 3H2SO4 → Al2(SO4)3 + 3H2 2 : 3 : 1 : 3 f. 4P + 5O2 → 2P2O5 4 : 5 : 2 g.2Na + 2H2O → 2NaOH + H2 2 : 2 : 2 : 1 h.2Al + 3Cl2 → 2AlCl3 2 : 3 : 2 i. 2KClO3 0t → 2KCl + 3O2 2 : 2 : 3 k.2KMnO4 →K2MnO4+MnO2+O2 2 : 1 : 1 : 1 0,5 0,5 0,5 0,5 0,5 0,5 0,5 0,5 0,5 0,5
a.
b. NH
c. Na
d. Fe
e.
f. Ca
g. Zn
h.
i.Fe(OH)
k.Al
a.
FeS
b. 4NH
NaOH
FeCl
BaSO
AlCl
8SO2
2
DẠYKÈMQUYNHƠNOFFICIAL Câu22:(5điểm): Lậpcácphươngtrìnhhóahọcsauđây:
FeS2 + O2 0t → SO2 + Fe2O3
3 + O2 → NO + H2O
+ H2O →
+ H2
3O4 + H2 0t → Fe + H2O
Fe + Cl2 0t →
3
+ H3PO4 → Ca3(PO4)2 + H2
+ O2 0t → ZnO
FexOy + CO → Fe + CO2
3 → Fe2O3 +H2O
2(SO4)3 +BaCl2 →
4+
3 22
4
2 + 11 O2 ot →
+ 2Fe
O3
3 + 5O2 ot → 4NO + 6H2O c. 2Na + 2H2O → 2NaOH + H2 ↑ d. Fe3O4 + 4H2 ot → 3Fe + 4H2O e. 2Fe + 3Cl2 ot →2FeCl3 f. 3Ca + 2H3PO4 → Ca3(PO4)2 + 3H2 ↑ g.2Zn + O2 0t → 2ZnO h. FexOy + yCO 0t → xFe + yCO2 i.2Fe(OH)3 0t → Fe2O3 +3H2O k.Al2(SO4)3 +3BaCl2 →3BaSO4+2AlCl3 0,5 0,5 0,5 0,5 0,5 0,5 0,5 0,5 0,5 0,5 Câu23:(5điểm): Hoànthànhphươngtrìnhphảnứngsauvàchobiếttỉlệ sốnguyêntử,sốphântửcácchất? 1.Ca+H3PO4 → Ca3(PO4)2 + H2 2. Fe3O4 +HCl → FeCl2 +FeCl3 +H2O 3. Zn+HCl →ZnCl2 +H2 4.CO2 +H2O+CaCO3 → Ca(HCO3)2 5.P+O2 0t →P2O5 6.KClO3 0t →KCl+O2 7.Al+ NH4ClO4 → Al2O3 +AlCl3 +NO+H2O 8.HCl+KMnO4 →KCl+MnCl2 +Cl2 +H2O 9.FexOy +CO 0t →Fe +CO2 10.Na+H2O→ NaOH +H2 Câu Hướndẫn Điểm 23 1.3Ca+2H3PO4→ Ca3(PO4)2 + 3H2 3 2 1 3 2. Fe3O4 +8HCl → FeCl2 +2FeCl3 +4H2O 1 8 1 2 4 3. Zn+2HCl →ZnCl2 +H2 0,5 0,5 0,5





DẠYKÈMQUYNHƠNOFFICIAL 1 2 1 1 4.CO2 +H2O+CaCO3 → Ca(HCO3)2 1 1 1 1 5.4P+5O2 0t →2P2O5 4 5 2 6.2KClO3 0t →2KCl+3O2 2 2 3 7.3Al+3NH4ClO4→ Al2O3 +AlCl3 +3NO+6H2O 3 3 1 1 3 6 8.16HCl+2KMnO4 →2KCl+2MnCl2 +5Cl2 +8H2O 16 2 2 2 5 8 9.FexOy +yCO 0t →xFe +yCO2 1 1y 1x 1y 10.2Na+2H2O→ 2NaOH +H2 2 2 2 1 0,5 0,5 0,5 0,5 0,5 0,5 0,5 Câu24:(5điểm): Cânbằngcácphươngtrìnhhóahọcsau: a.P+O2 0t →P2O5 b.KClO3 0t → KCl+O2 c.H3PO4+Ca(OH)2 Ca3(PO4)2 +H2O d.FeS+O2 → 0t Fe2O3 +SO2 e.KMnO4 +HCl MnCl2 +KCl+Cl2 +H2O f.MxOy +HCl MCl2y/x +H2O g.Al+NaOH+H2O NaAlO2 +H2 h.Al2O3 +H2SO4 Al2(SO4)3+H2O i.Ba(NO3)2 + Al2(SO4)3 → BaSO4 + Al(NO3)3 k. Zn+HCl → ZnCl2 +H2 Câu Hướngdẫn Điểm 24 a.4P+5O2 0t →2P2O5 b.2KClO3 0t → 2KCl+3O2 c.2H3PO4+3Ca(OH)2 Ca3(PO4)2 +6H2O d.4FeS+7O2 → 0t 2Fe2O3 +4SO2 e.2KMnO4 +16HCl 2MnCl2 +2KCl+5Cl2 +8H2O f. MxOy + 2yHCl xMCl2y/x +yH2O g.2Al+2NaOH+2H2O 2NaAlO2 +3H2 h.Al2O3 +3H2SO4 Al2(SO4)3+3H2O 0,5 0,5 0,5 0,5 0,5 0,5 0,5 0,5
3)2 + Al2(SO4)3 → 3BaSO4 + 2Al(NO3)
Zn+2HCl → ZnCl2 +H2
Ca+H3PO4 → Ca3(PO4)2 + H2
Fe3O4 +HCl → FeCl2 +FeCl3 +H2O
Zn+HCl →ZnCl2 +H2
CO2 +H2O+CaCO3 → Ca(HCO3)2
P+O2 0t →P2O5
KClO3 0t →KCl+O2
Al+NH4ClO4→ Al2O3 +AlCl3 +NO+H2O
HCl+KMnO4 →KCl+MnCl2 +Cl2 +H2O
FexOy +CO 0t →Fe +CO2
10.Na+H2O→ NaOH +H2
DẠYKÈMQUYNHƠNOFFICIAL i.3Ba(NO
k.
0,5 0,5 Câu25:(5điểm): Lậpcácphươngtrìnhhóahọcsau: 1.
2.
3.
4.
5.
6.
7.
8.
9.
Câu Hướndẫn Điểm 25 1.3Ca+2H3PO4→ Ca3(PO4)2 + 3H2 2. Fe3O4 +8HCl → FeCl2 +2FeCl3 +4H2O 3. Zn+2HCl →ZnCl2 +H2 4.CO2 +H2O+CaCO3 → Ca(HCO3)2 5.4P+5O2 0t →2P2O5 6.2KClO3 0t →2KCl+3O2 7.3Al+3NH4ClO4→ Al2O3 +AlCl3 +3NO+6H2O 8.16HCl+2KMnO4 →2KCl+2MnCl2 +5Cl2 +8H2O 9.FexOy +yCO 0t →xFe +yCO2 10.2Na+2H2O→ 2NaOH +H2 0,5 0,5 0,5 0,5 0,5 0,5 0,5 0,5 0,5 0,5 Câu26:(5điểm):Lậpcácphươngtrìnhhóahọcsauđây: a. FeS2 + O2 ------> SO2 + Fe2O3 b. AgNO3 + CuCl2------> AgCl + Cu(NO3)2 c. Na + H2O ------> NaOH + H2 d. Fe3O4 + H2------> Fe + H2O e. Fe + Cl2------> FeCl3 f. Ca + H3PO4------> Ca3(PO4)2 + H2 g.CaCO3 + HCl ------> CaCl2 +H2O+CO2↑ h.Mg + HNO3 ------>Mg(NO3)2 +NO +H2O i.KMnO4 ------> K2MnO4 +O2 +MnO2 k.NaOH + CuCl2 ------> Cu(OH)2 +NaCl
DẠYKÈMQUYNHƠNOFFICIAL Câu Hướng dẫn chấm Điểm 26 a. 4FeS2 + 11O2 0t → 8SO2 + 2Fe2O3 b. 2AgNO3 + CuCl2 → 2AgCl + Cu(NO3)2 c. 2Na + 2H2O → 2NaOH + H2 d. 2Fe3O4 + 8H2 0t → 6Fe + 8H2O e. 2Fe + 3Cl2 0t → 2FeCl3 f. 3Ca + 2H3PO4 → Ca3(PO4)2 + 3H2 g.CaCO3 + HCl → CaCl2 +H2O+CO2↑ h.Mg + HNO3 → Mg(NO3)2 +NO +H2O i.2KMnO4 0t → K2MnO4 +O2 +MnO2 k.2NaOH + CuCl2 → Cu(OH)2 +2NaCl 0,5 0,5 0,5 0,5 0,5 0,5 0,5 0,5 0,5 0,5 Câu27.(5điểm): 1. Phảnứngcủacâyxanhquanghợptạoratinhbộtvàkhíoxiđượcthểhiện bằngsơđồ: CO2 + H2O → ChÊt diÖp lôc ¸nh s¸ng (C6H10O5)n + O2 (khícacbonic) (nước) (tinhbột) (khíoxi) a)Hãylậpphươngtrìnhhoáhọcchosơđồphảnứngtrên. b)Chobiếttỉlệgiữasốphântửkhícacbonic(CO2)vàsốphântửnước. 2. Lậpphươngtrình hoáhọccủaphảnứngtheosơđồsau: a) CaCO3 + HCl → CaCl2 +H2O+CO2↑ b)Mg + HNO3 → Mg(NO3)2 +NO +H2O c)KMnO4 ot → K2MnO4 +O2 +MnO2 Câu Hướng dẫn chấm Điểm 27 1. 6nCO2 + 5nH2O ChÊtdiÖplôc/¸nhs¸ng → (C6H10O5)n +6nO2 Tinh bột -TỉlệsốphântửkhíCO2 vàphântửhơinướclà: 22 COHO n:n6:5 = . 1,0 1,0 2.LậpPTHHđúngcủamỗitrườnghợpcho a) CaCO3 + 2HCl → CaCl2 +H2O+CO2↑ b) 3Mg + 8HNO3 → 3Mg(NO3)2 +2NO +4H2O c) 2KMnO4 ot → K2MnO4 +O2 +MnO2 d) 2NaOH + CuCl2 → Cu(OH)2 +2NaCl 0,75 0,75 0,75 0,75