

GIÁO DỤC VÀ ĐÀO TẠO VĨNH PHÚC
ĐỀ THI CHÍNH THỨC (Đề thi có 03 trang)
Câu 1: (1 điểm)
KỲ THI TUYỂN SINH LỚP 10 THPT
NĂM HỌC 2022 - 2023
MÔN: HÓA HỌC (CHUYÊN)
Thời gian làm bài: 120 phút
b) Hoà tan hỗn hợp M gồm 0,4 molCu và 34 0,1 molFeO trong 400ml dung dịch HCl2M . Sau phản ứng, thu được dung dịch A và chất rắn B. Cho A tác dụng với lượng dư dung dịch 3AgNO thu được m gam kết
tủa. Biết các phản ứng xảy ra hoàn toàn. Tính m
Câu 5: (1 điểm) Cho 4 hợp chất hữu cơ mạch hở X,Y,Z,T có công thức phân tử là: 2248 CH,CH ,
26242 CHO,CHO nhưng không theo thứ tự X,Y,Z,T có các tính chất sau:
- X tác dụng được với Na và dung dịch NaOH .
1234
Hoàn thành các phương trình hóa học (ghi rõ điều kiện) trong sơ đồ chuyển hóa sau: ()()()() ( ) () 4
6 24242 8 23
253322 CHOHCHCOOHCHCOONaCHCH CHCHBr CHClPVC →→→ →
Câu 2: (1 điểm) Nêu hiện tượng và viết phương trình phản ứng xảy ra trong các thí nghiệm sau:
a) Nhỏ từ từ đến dư dung dịch HCl vào dung dịch 23NaCO
b) Nhỏ từ từ đến dư dung dịch NaOH vào dung dịch 3AlCl
c) Cho mẩu Zn dư vào dung dịch ( ) 24 3 FeSO .
d) Sục từ từ đến dư khí 2CO vào dung dịch 2Ca(OH)
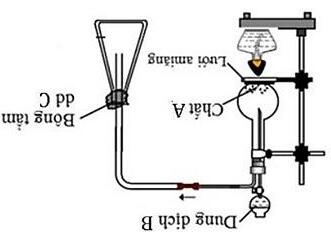
Câu 3: Hình vẽ bên mô tả cách điều chế và thu khí 2SO trong phòng thí nghiệm.
- Y,T làm mất màu nước brom.
- Z tác dụng được với Na nhưng không tác dụng được với dung dịch NaOH
- T tác dụng với dung dịch 3AgNO trong ( ) 323 NHAgO/NH thu được kết tủa màu vàng.
Biết Y có cấu tạo đối xứng. Xác định công thức cấu tạo của X,Y,Z,T và viết các phương trình phản ứng xảy ra.
Câu 6: (1 điểm) Hoàn thành các phương trình phản ứng theo sơ đồ sau (mỗi chữ cái trong ngoặc là một chất):
a) Xác định các chất A,B,C và viết phương trình phản ứng xảy ra giữa A và B
b) Giải thích cách thu khí 2SO
c) Nêu vai trò của bông tẩm dung dịch C
d) Cho 2 hóa chất là dung dịch H2SO4 đặc và CaO rắn, hóa chất nào được dùng để làm khô khi SO2? Giải thích.
Câu 4: (1 điểm)
a) Cho dung dịch 4CuSO có khối lượng riêng D1,206gam/ml = (dung dịch X ). Cô cạn 414,59 mlX thu
được tối đa 140,625 gam tinh thể 42O . CuSO5H . Tính nồng độ phần trăm và nồng độ mol của X .
( ) ( ) ( ) ( )
()()()()()
()()()()()()
()()()()()
→++ +→++ +→+++ +→++
ABCD CEGHI AEKGIH KHLIM
Biết: ( ) ( ) ( )D,I,M là các đơn chất ở trạng thái khí trong điều kiện thường; khí (I) có tỉ khối so với khí 2SO là 1,1094; để trung hòa dung dịch chứa 2,24 gam ( )L cần 200ml dung dịch 24 HSO0,1M
Câu 7: (1 điểm) Hỗn hợp khí X gồm hidro, propen, propin. Nung X với xúc tác Ni đến khi phản ứng xảy ra hoàn toàn, thu được hỗn hợp khí Y . Chia Y thành 2 phần bằng nhau:
- Đốt cháy hoàn toàn phần 1 cần vừa đủ V lít khí 2O (đktc). Hấp thụ toàn bộ sản phẩm cháy bằng dung dịch nước vôi trong dư, dung dịch thu được có khối lượng giảm 16,2 gam so với khối lượng dung dịch nước vôi trong ban đầu.
- Dẫn phần 2 vào dung dịch 2Br dư thấy có 16 gam 2Br phản ứng.
Tính V.
Câu 8: (1 điểm) Hỗn hợp X gồm Al và một oxit sắt. Nung m gam X trong điều kiện không có không khí, thu được hỗn hợp chất rắn Y . Chia Y thành hai phần:
- Cho phần 1 vào lượng dư dung dịch NaOH , thu được 1,68 lít khí và 12,6 gam chất rắn.
- Cho phần 2 vào dung dịch 24HSO đặc (nóng, dư), thu được 27,72 lít khí 2SO và dung dịch Z có chứa 263,25 gam muối sunfat.
Biết các phản ứng xảy ra hoàn toàn, các thể tích khí đo ở đktc.
a) Viết phương trình hóa học của các phản ứng xảy ra.
b) Tính m và xác định công thức của oxit sắt.
Câu 9: (1 điểm) X là dung dịch HCl,Y là dung dịch NaOH . Cho 120ml X vào cốc chứa 200 gam Y thu
được dung dịch Z chỉ chứa một chất tan. Cô cạn Z thu được 28,35 gam chất rắn T , cho toàn bộ T vào dung
d
ịch 3AgNO dư thu được 43,05 gam kết tủa.
a) Tính nồng độ mol của X và nồng độ phần trăm của Y .
b) Xác định công thức của T
c) Cho 8,2 gam hỗn hợp G gồm Al , Fe vào cốc đựng 420mlX . Sau phản ứng, thêm tiếp 800 gam Y vào
cốc. Khuấy đều cho phản ứng xảy ra hoàn toàn, lọc kết tủa đem nung trong không khí đến khối lượng không
đổi, thu được 6,55 gam chất rắn A . Tính phần trăm khối lượng mỗi kim loại trong G .
Câu 10: (1 điểm) Hỗn hợp X gồm hai este no, mạch hở. Cho X tác dụng với dung dịch NaOH vừa đủ, thu
được hỗn hợp Z gồm 2 ancol (số nguyên tử cacbon trong mỗi phân tử ancol không vượt quá 3 ) và 12,3 gam muối của một axit cacboxylic (muối Y). Đốt cháy hoàn toàn Y thu được 7,95 23gamNaCO . Mặt khác, đốt
cháy hoàn toàn Z thu được 3,36 lít khí 2CO (đktc) và 4,32 gam 2 HO . Tính phần trăm khối lượng của este có khối lượng mol phân tử lớn hơn trong X
1. Câu 1 (VDC):
Phương pháp:
HƯỚNG DẪN GIẢI CHI TIẾT
Dựa vào tính chất hoa học của các chất.
3. Cách giải:
(1) mengiam 25232 CHOHOCHCOOHHO + → +
(2) 332 CHCOOHNaOHCHCOONaHO +→+
CaO, 3 423 CHCOONaNaOH2CHNaCO t +→+
(4) 2 /ln 1500C 422 2CHCH3H →+
(5) 0 22224 CHHCH Nit +→
(6) 242242 CHBrCHBr +→
(7) 500C 2223 CHHClCHCl +→
(8) 0 2 2 nCHCHClCHCHn tpxt Cl
Câu 2 (VDC):
Phương pháp:
Dựa vào tính chất hóa học của các chất.
Cách giải:
a) Hiện tượng: lúc đầu chưa có hiện tượng sau đó có bọt khí thoát ra.
233 HClNaCONaHCONaCl +→+
322 HClNaHCONaClCOHO +→++
b) Hiện tượng: ban đầu xuất hiện kết tủa, sau đó kết tủa tan dần tạo thành dung dịch trong suốt.
33 3NaOHAlClAl(OH)3NaCl +→+
322 NaOHAl(OH)NaAlO2HO +→+
c) Hiện tượng: dung dịch màu vàng chuyển thành trong suốt không màu, đồng thời có kim loại màu xám trắng bám lên thanh kẽm.
( ) 2444 3 ZnFeSOZnSO2FeSO +→+
44 ZnFeSOFeZnSO +→+
d) Hiện tượng: ban đầu xuất hiện kết tủa, sau đó kết tủa tan dần.
Mm=+=+= (gam)
Câu 5 (VDC):
Cách giải:
2233 2 COHOCaCOCaHCO ++→
2232 COCa(OH)CaCOHO ++ → ( )
Câu 3 (VDC):
Phương pháp:
Dựa vào điều chế 2 SO trong PTN
Cách giải:
a) 23A:NaSO (tinh thể)
Câu 4 (VDC):
Phương pháp:
a) 4244 CuSO.5HOCuSOCuSOddX4 nnmmC%CuSO
b) Dựa vào dãy điện hóa kim loại.
Cách giải: ()
42 CuSO.5HO 140,625 n0,5625 mol 1605.18 == + ( ) 4CuSO n0,5625 mol = ( )
- X tác dụng được với Na và dung dịch NaOH
X
là 242CHO có CTCT của 3 X:CHCOOH
332 1 CHCOOHNaCHCOONaH 2 +→+
332 CHCOOHNaOHCHCOONaHO +→+
- Y làm mất màu dung dịch brom, có cấu tạo đối xứng
Y là 48CH có CTCT: 33 CHCHCHCH −=−
33233 CHCHCHCHBrCHCHBrCHBrCH −=−+→−−−
- T làm mất màu dung dịch brom, phản ứng được với 33AgNO/NH , có cấu tạo đối xứng
T là 22CH có CTCT:CHCH ≡
3343 CHCH2AgNO2NHAgCCAg2NHNO ≡++→−≡−+
- Z tác dụng được với Na nhưng không tác dụng được với dung dịch NaOH
Z là ancol 26 CHO có CTCT là 32 CHCHOH
32322 CHCHOHNaCHCHONa1/2H −−+→−−+
Câu 6 (VDC):
ddX m1,206.414,59500gam ==
4CuSO m0,5625.16090gam == ( )
4 90 C%CuSO100%18% 500 =⋅=
M C0,5625/0,414591,36M ==
b)
Cách giải:
MI = 1,1094.MSO2 = 1,1094.64 = 71 => I là Cl2
TH1: L là đơn bazo
24 HSOLL n0,02n0,02.20,04M2,24/0,0456 = == ==
L là KOH
TH2: L là đi bazo (loại)
( ) ( ) ( ) ( ) ( )KHLIM−+→++
dien phandung dich co mang ngan 222 2KCl2HO2KOHClH +→++
Do L là KOH,I là 2 ClM là 2 H, K và H lần lượt là 1 trong 2 chất KCl hoặc 2 HO
moln
2 FeFeAg nn0,1
( ) ( ) ( ) ( ) ( ) ( )AEKGIH −+→+++
G
là 2 MnCl, A là 4 KMnO,E là HCl
4222 2KMnO16HCl2KCl2MnCl5Cl8HO +→+++
A là 4KMnO
( ) ( ) ( ) ( )ABCD−→++ 0 42422 2KMnOKMnOMnOO t + →+
( ) ( ) ( ) ( ) ( ) CEGHIH−+→++ là 2 HO,K là KCl
2222 MnO4HClMnClCl2HO +→++
Câu 7 (VDC):
13. Phưong pháp:
Dựa vào tính chất hóa học các chất.
Cách giải:
Phần 2 :
Do hỗn hợp Y có phản ứng với dung dịch 2Br
=> Hỗn hợp gồm 38CH và 36CH
Br2C3H6 n0,1moln0,1 = =
Gọi số mol của 38CH là X
Phần 1:
Đốt cháy Y
BTNT 2CO 'C':3x3.0,1n +=
a) xy23 2yAl3FeOyAlO3xFe +→+
222 AlNaOHHONaAlO3/2H ++→+
2322 AlO2NaOH2NaAlOHO +→+
Phần 2: ( ) 242422 3 2Al6HSOAlSO3SO6HO +→++
( ) 2324242 3 AlO3HSOAlSO3HO +→+
( ) 242422 3 2Fe6HSOFeSO3SO6HO +→++
b)
Phần 1:
Chất rắn là Fe12,6 =
Fe n12,6/560,225 mol ==
( ) H2 n0,075 mol =
( )
222 AlNaOHHONaAlO3/2H ++→+
Aldu n0,05 =
Phần 2 : ( ) 2SO n1,2375 mol =
2 4SO n trong muối 2 2SOOnn=+
Mà AlduFeSO23n3n2n += 3.0,05k3.0,225k2.1,2375 +=
322 dd giamCaCO16,230,3.10030,3.4440,3.18 COHO mmmmxxx ==−−=+−+−+
BTNT 2 HO 'H':8x6.0,12n += ( ) ( ) ( )
=
x0,05
BTNT 'O': ( ) 222 OCOHO nn1/2n0,451/20,50,7 mol =+=+=
2O V0,7.22,415,68 == (lít)
Câu 8 (VDC):
Phương pháp:
Dựa vào tính chất hóa học của các chất.
Cách giải:
Y gồm Al dư, 23 AlO,Fe
k3 =
Có 263,25 ( ) 2 2 2 4 AlFeAlFeSOSOO mmmmmnn.96 =++=+++
=++++
( 2 2 263,250,05.32/3).273.0,225.56(1,2375).96 O O nn
223 Oxi trong OoxitAlO n0,9nn0,3 == =
Fe2 n/n0,675/0,93/4 O ==
Oxit là 34FeO ( ) ( ) 23 YAlAlOFe mmmm4.0,05.270,1.10212,696,6gam =++=++=
Câu 9 (VDC):
Phương pháp:
Dựa vào tính chất hóa học của các chất.
Cách giải:
a)
Vì cho 120mlX vào cốc chứa 200 gam Y thu được dung dịch Z chỉ chứa một chất tan Z là
2 NaCl.nHO
2 HClNaOHNaClHO +→+
33 NaClAgNOAgClNaNO +→+
AgClNaClHClNaOH n43,05/143,50,3nnn =====
MX C0,3/0,122,5M ==
NaOH %C0,3.40/200.100%6% ==
b)
Z là ( ) 2 NaCl.nHO0,3.58,518n28,352 n += =
Z là 2 NaCl.2HO
c) ( ) HCl n2.5.0,421,05 mol ==
( ) NaOH n6%.800/401,2 mol =
322Al6HCl2AlCl3H +→+
22Fe2HCl2FeClH +→+
22 FeCl2NaOHFe(OH)2NaCl +→+
33 AlCl3NaOHAl(OH)3NaCl +→+
322 Al(OH)NaOHNaAlO2HO +→+
Nếu G là HCl Aln0,91 =
Nếu G là HCl Fen0,29 =
Mà HCl n ban đầu 1,05HCl = dùng dư
Gọi số mol của Al và Fe ban đầu lần lượt là x,y
27568,2 xy+=
HCl phan ungAlFe n3n2n3x2y =+=+
HCl du n1,053x2y =−−
NaOH n phản ứng 23 HClduFeClAlCl n2n3n1,053x2y2y3x1,051,2 =++=−−++=<
NaOH dư ( )1,21,050,15mol −=
TH1: 3Al(OH) bị hòa tan hết
Chất rắn A là 23 23FeOFe FeOn6,55/1600,04n0,082y == ==
Mà 27568,2 xy+= ( ) Al n0,1380,15tm =<
Al %mFe56%,% m44%==
TH2: 3Al(OH) bị hòa tan 1 phần
()3 AlOHn bị hòa tan NaOH du n0,15==
Chất rắn A gồm 23FeO và 23AlO
6,55 = y.160/2 ( ) 102.x0,15/2+−
Mà 27x 56y8,2+=
x0,2,y0,05 ==
Fe % m65,85%,y34,15% ==
Câu 10 (VDC):
Phương pháp:
23 NaCONaOHCOOOH nnnn ==
muối ancol là ancol no, mạch hở n Z
CTCT của ancol X Tính %
Đốt Z:
Cách giải:
( ) 23NaCO n0,075 mol =
BTNT ( ) NaOHCOOOH Nannn0,15mol ===
muoi M12,3/0,1582 == muối là 3 CHCOONa
Đốt Z: CO2H2On0,15 mol,n0,24 mol ==
Có H2OCO2nn > ancol là ancol no, mạch hở
22 HOCO nnn0,240,150,09 Z =−=−=
Mà nOH- 0,150,09=> và số C trong mỗi C không vuợt quá 3
Số C trung bình 0,15/0,091,6==
Z gồm 1 ancol 1 chức và 1 ancol 2 chức hoặc 1 ancol 1 chức và 1 ancol 3 chức.
Z gồm 3 CHOH và 242 CH(OH) hoặc 3 CHOH và 353 CH(OH)
TH1: Z gồm 3 CHOH và 242 CH(OH)
Gọi số mol của hai ancol 2423 CH(OH),CHOH lần lượt là x,y
xy0,09 +=
20,15 xy+= 0,06,0,03xy==
Hai este lần lượt là: ( ) 33 CHCOOCH0,03 và ( ) ( ) 324 2 CHCOOCH0,06 ( ) 33 СHCOOCH
%m0,03.74/0,03.740,06.146.100%20,21% =+=
TH1: Z gồm 3 CHOH và 353 CH(OH)
Gọi số mol của hai ancol 3 CHOH và 353 CH(OH) lần lượt là a,b
ab0,09 += 30,15ab+= 0,06,0,03ab==
Hai este lần lượt là: 33 CHCOOCH và ( ) 335 3 CHCOOCH ( ) 33 СHCOOCH
%m0,06.74/0,06.740,03.218.100%40,43% =+=
SỞ GIÁO DỤC VÀ ĐÀO TẠO HÀ NỘI
ĐỀ THI CHÍNH THỨC (Đề thi gồm 02 trang)
Câu 1: (2 điểm)
KỲ THI TUYỂN SINH LỚP 10 THPT
NĂM HỌC 2022 - 2023
MÔN: HÓA HỌC (CHUYÊN)
Thời gian làm bài: 120 phút
1. Nêu hiện tượng và viết phương trình hóa học xảy ra (nếu có) trong các trường hợp sau:
a) Nhúng lá nhôm vào dung dịch 24HSO loãng.
b) Nhỏ dung dịch NaOH vào dung dịch 3FeCl .
2. Chọn 12345 ,,,, XXXXX (không theo thứ tự) trong số các chất: ( ) 32532 XCHCOONa,CHOH,CHCOOCa , 3325 CHCOOH,CHCOOCH để hoàn thiện sơ đồ bên và viết các phương trình hóa học xảy ra, ghi rõ điều kiện phản ứng (nếu có).
a) Nguyên tố cacbon có 2 đồng vị bền là X (hạt nhân chứa 6 proton, 6 nơtron) và Y (hạt nhân chứa 6 proton, 7 nơtron). Tính nguyên tử khối của các nguyên tử X,Y .

b) Trong thể thao, để gia tăng thành tích, một số vận động viên đã gian lận bằng cách sử dụngcác loại chất kích thích (doping). Một trong các loại doping thường gạp nhất là testosterone tổng hợp. Đối với testosterone tự nhiên trong cơ thể, phần trăm số nguyên tử của đồng vị Y không đổi và bằng 1,11% , trong khi testosterone tổng hợp (tức doping) có phần trăm số nguyên tử của đồng vị Y ít hơn testosterone tự nhiên. Đây chính là mấu chốt của xét nghiệm CIR (Carbon Isotope Ratio) nhằm xác định vận động viên có sử dụng doping hay không. Giả sử, kết quả phân tích CIR đối với một vận động viên thu được phần trăm số nguyên tử đồng vị X là a và Y là b . Từ tỉ lệ đó, người ta tính được nguyên tử khối trung bình của cacbon trong mẫu phân tích có giá trị là 12,0098. Tính a, b và cho biết vận động viên này có sử dụng doping không.
3. Không dùng thêm: thuốc thử, nhiệt độ và phản ứng điện phân, hãy nhận biết các dung dịch đựng trong các lọ riêng biệt mất nhãn sau: 24244 HSO,NaSO,CuSO,NaOH
Câu 3: (2 điểm)
1. Hợp chất X có công thức 2 AB( A, B là 2 nguyên tố hóa học). Tổng số hạt mang điện có trong một phân tử X là 70. Số hạt mang điện trong nguyên tử A nhiều hơn trong nguyên tử B là 22 .
a) Tìm công thức của X . (Cho số proton trong hạt nhân của các nguyên tử: H1;C6;N7;O8;Na11 ===== ; Al13;Cl17;K19;Ca20) ====

3. Các loại bim bim (snack) là món yêu thích của nhiều người, nhất là các bạn trẻ. Trong các gói bim bim,
lượng bim bim thường chỉ chiếm một nửa thể tích, phần còn lại là khí nitơ. Tại sao người ta không bơm không khí mà lại bơm khí nitơ vào các gói bim bim?
Câu 2: (2 điểm)
1. Tiến hành thí nghiệm với khí X không màu theo các bước sau:
- Bước 1: Nạp đầy X vào một bình thủy tinh trong suốt, đậy bình bằng nút cao su có ống thủy tinh vuốt nhọn xuyên qua.
- Bước 2 : Nhúng đầu ống thủy tinh vào cốc chứa nước có pha vài giọt quỳ tím.
Sau một thời gian, nước trong cốc theo ống phun vào bình thành tia (như hình vẽ).
a) X là khí nào trong số các khí: 224 O,H,CH,HC1 ?
b) Nêu mục đích của thí nghiệm và giải thích hiện tượng quan sát được.
2. Hạt nhân của hầu hết các nguyên tử đều được tạo thành từ các hạt proton và hạt nơtron. Các nguyên tử có
cùng số hạt proton nhưng khác nhau về số hạt nơtron được gọi là các đồng vị của một nguyên tố hóa học.
Tổng số hạt proton, nơtron trong hạt nhân nguyên tử được gọi là số khối. Một cách gần đúng, nguyên tử khối có giá trị bằng số khối. Vì hầu hết các nguyên tố trong tự nhiên là hỗn hợp của nhiều đồng vị nên nguyên tử khối của một nguyên tố là nguyên tử khối trung bình của hỗn hợp các đồng vị của nguyên tố đó.
b) X được sử dụng làm nguồn cung cấp oxi trong bình lặn và tàu ngầm. Viết phương trình hóa học giải thích ứng dụng trên của X .
2. Hỗn hợp X chứa Fe, FeO, FeSO4 trong đó số mol FeSO4 gấp 9 lần tổng số mol hai chất còn lại. Hòa tan hoàn toàn X trong dung dịch chứa 24 0,59 molHSO đặc, nóng thu được 2 0,27 molSO và dung dịch Y . Cho dung dịch chứa 1,48 mol NaOH vào Y thu được 51,36 gam một chất kết tủa. Tính phần trăm khối lượng của FeO trong X
Câu 4: (2 điểm)
1. Hòa tan hoàn toàn 30 gam chất X là tinh thể muối sunfat ngậm nước của kim loại M trong m gam nước được dung dịch Y . Nhỏ dung dịch NaOH đến dư vào Y , lọc kết tủa rồi nung đến khối lượng không đổi thu
được 9,6 gam chất rắn. Nếu thêm lượng dư dung dịch ( ) 3 2 BaNO vào Y thì thu được 27,96 gam kết tủa.
Biết hóa trị của M không thay đổi trong quá trình phản ứng.
a) Tìm công thức của X .
b) Trong dung dịch Y , số nguyên tử H gấp 1,68 lần số nguyên tử O . Tính m
2. Dẫn từ từ khí 2CO vào dung dịch chứa hỗn hợp 2amolBa(OH) và b molNaOH . Sự phụ thuộc của số mol kết tủa thu được vào số mol khí 2CO phản ứng được thể hiện trong bảng sau:
Số mol khí ( ) 2CO mol 0,11 0,16
Số mol kết tủa ( )mol 0,105 0,095
Lập luận tính số 2molCO để lượng kết tủa thu được là 0,08 mol
Câu 5: (2 điểm)
1. Chất hữu cơ X có trong các sản phẩm chăm sóc da để tẩy da chết, làm sáng da và mờ các vết thâm,...
Trong công nghiệp thực phẩm, X được sử dụng như một chất tạo hương để thực phẩm có vị chua cay. X
ch
ứa C,H,O với tỉ lệ khối lượng mc:mo3:5 = . Phân tử khối của X là 134 .
a) Tìm công thức phân tử của X .
b) Khi cho a mol X tác dụng hết với dung dịch 3NaHCO dư thu được 2a mol khí 2CO . X có mạch cacbon không phân nhánh, phân tử chỉ chứa các nhóm chức OH và - COOH . Viết công thức cấu tạo của X và các phương trình hóa học xảy ra khi cho X lần lượt tác dụng với dung dịch 3NaOH,NaHCO
2. Đốt cháy hoàn toàn 0,03 mol hỗn hợp X gồm hai hiđrocacbon mạch hở A và B có cùng số nguyên tử H trong phân tử, số nguyên tử C của mỗi chất không vượt quá 4 . Dẫn sản phẩm cháy sinh ra lần lượt qua
bình (1) đựng 51,3 gam dung dịch 24 HSO98% rồi bình (2) chứa 10 lít dung dịch 2 Ca(OH)0,012M . Sau khi
các phản ứng kết thúc thấy dung dịch 24HSO trong bình (1) có nồng độ 95% và dung dịch trong bình (2) có
nồng độ 0,004M
a) Tìm công thức phân tử của A,B và số mol mỗi chất trong X
b) Thêm a mol 2 H vào 0,03 molX rồi dẫn qua bột Ni đun nóng thu được hỗn hợp Y chỉ chứa các
hiđrocacbon. Y làm mất màu tối đa 10ml dung dịch 2 Br1M . Tính a .
Câu 1 (VDC):
1. (TH):
Phương pháp:
Dựa vào tính chất hóa học các chất.
Cách giải:
1)
HƯỚNG DẪN GIẢI CHI TIẾT
a) Hiện tượng: Lá nhôm tan dần và có khí thoát ra.
() ( ) 2242 4loãng3 4Al6HSO2AlSO6H +→+
b) Hiện tượng: xuất hiện kết tủa màu nâu đỏ
33 3NaOHFeClFe(OH)3NaCl +→+
2. (VDC):
7. Phương pháp:
Dựa vào tính chất hóa học các chất.
8. Cách giải:
13 X:CHCOOH
2325 X:CHCOOCH
325 X:CHOH
( ) 432 X:CHCOOCa
53 X:CHCOONa
(1) 24HSO d 325325 CHCOOHCHOHCHCOOCH + ⇆
(2) 24HSO 3252325 CHCOOCHHO%CHCOOHCHOH d ++ ⇆
(3) mengiam 25232 CHOHOCHCOOHHO + → +
(4) ( ) 3232 2 2CHCOOHCa(OH)CHCOOCaHO +→+
(5) ( ) 32333 2 CHCOOCaNaCO2CHCOONaCaCO +→+
(6) 33 CHCOONaHClCHCOOHNaCl +→+
3. (VDC):
Phương pháp:
Dựa vào lý thuyết về 2 N .
Cách giải:
- Bơm khí 2 N vào gói bim bim vì các nguyên nhân sau:
2 N trơ ở điều kiện thường nên không oxi hóa được các chất trong bim bim.
2 N không mùi nên không ảnh hưởng đến mùi vị của bim bim.
+ Tạo độ căng phồng cho gói bim bim để tránh trường hợp bị va đập làm vỡ vụn bim bim.
- Không bơm không khí vào gói bim bim vì:
2O+ trong không khí sẽ oxi hóa các chất trong bim bim làm bim bim nhanh chóng bị hỏng.
+ Nếu không khí có lẫn hơi nước sẽ làm bim bim bị ẩm dẫn đến bị ỉu.
+ Nếu không khí không sạch có vi sinh vật phân hủy nên bim bim dễ bị hỏng.
Câu 2 (VDC):
1. (VDC):
Phương pháp:
Dựa vào tính tan của các chất.
Cách giải:
a) X là khí HCl .
b) Mục đích của thí nghiệm: chứng minh tính tan của HCl
Hiện tượng: Nước trong cốc theo ống phun vào bình thành những tia có màu đỏ do khí HCl tan trong nước
làm giảm áp suất trong bình nước trong cốc phun vào bình chứa HCl . Do khí hidroclorua tan trong nước
tạo dung dịch axit clohidric nên nước nước chuyển thành màu đỏ
2. (VDC):
Phương pháp:
Dựa vào cách tính nguyên tử khối. Cách giải:
a)
Nguyên tử khối trung bình của X6612 =+=
Nguyên tử khối trung bình của Y6713 =+=
b)
Ta có: ab100% +=
Do %số nguyên tử của Y0,98%1,11% =< vận động viện đó có sử dụng doping.
3. (VDC):
Phương pháp:
Nhận biết không sử dụng thuốc thử
Cách giải:
Đánh số thứ tự từng lọ mất nhãn, trích mỗi lọ một ít ra ống nghiệm đánh số tương ứng (Trích mẫu thử).
- Mẫu thử có màu xanh lam là dung dịch 4CuSO
- Cho lần lượt dung dịch 4CuSO vừa nhận ra vào các mẫu thử còn lại:
+ Mẫu thử xuất hiện kết tủa xanh là dung dịch NaOH
4224 2NaOHCuSOCu(OH)NaSO +→↓+
+ Mẫu thử còn lại là 24HSO và 24NaSO không có hiện tượng.
- Lọc kết tủa thu được, rồi đem tác dụng với 2 mẫu thử còn lại
+ Mẫu thử hòa tan được kết tủa là dung dịch 24HSO
24242 HSOCu(OH)CuSO2HO +↓→+
+ Mẫu thử còn lại không hòa tan kết tủa là dung dịch 24NaSO
Câu 3 (VDC):
1. (VDC):
Cách giải:
a)
Gọi số hạt trong A là AAAE,P,N
Số hạt trong B là BBBE,P,N
Do tổng số hạt mang điện trong một phân tử AB X702P4P70 ==+=
Do số hạt mang điện nhiều hơn trong nguyên tử B là 22
AB 2P2P22 −=
AB P19,P8 ==
A là K,B là O
CT của X là 2KO
b)
==
121312,0098.100% ab+= a99,02%, b0,98%
2KO được sử dụng làm nguồn cung cấp oxi trong bình lặn và tàu ngầm vì 2KO hấp thụ
2CO do con người
222324KO2CO2 KCO3O+→+
2. (VDC):
Phương pháp:
Dựa vào lý thuyết về hỗn hợp tác dụng với 24HSO đặc
Cách giải: () ( ) () 2 3 3 FeOH FeSO n51,36/1070,48mol=> n0,24===
()3 OHHduHdu FeOH n3nnn0,04 −++ =+ =
242 HSOSOO2Hdu n2nnn/20,59 −+ =++=
O2FeO => n0,03n ==
Đặt ( ) 4FeFeSO nxn9x0,039x0,27 = =+=+
BTE: 30,0390,270,27.20,02 xxx +++= =
FeO % m3,01% =
Câu 4 (VDC):
1. (VDC):
Phương pháp:
Dựa vào tính chất của các chất.
Cách giải:
a)
Gọi CTPT của X là ( ) 242 MSOHO . x n ( ) 24 x24 x MSO2xNaOH2M(OH)xNaSO +→+
() 0 2x2 MOHMOHO t + → ( ) ( ) 2x
CT của X là CuO
b)
XX n0,12M30/0,12250n5 ==>== =
CTPT của X là 42 CuSO.5HO
Đặt số mol của m gam 2 HO dùng để hòa tan tinh thể X là x (mol)
Trong dung dịch Y , số nguyên tử H gấp 1,68 lần số nguyên tử O ( ) ( ) HO n1,68n2x0,12.101,68.x9.0,12x1,92 mol
= +=+ =
( )
2 HO m1,92.1834,56gam ==
2. (VDC):
Phương pháp:
Dựa vào lý thuyết bài toán 2CO tác dụng với hỗn hợp dung dịch kiềm.
Cách giải:
Tại số CO2 n0,11 = () 2 3 3 2 BaCO BaOH CO nn0,105na ====
Tại số 2CO n0,16 =
( ) 23 OHCOHCO1 +→ ( )
2 2322OHCOCO HO2+→+
23 2 3 BaCO CO(2) CO nn0,095n ===
=−=
() 2 CO1 n0,160,0950,065
( ) 20,0950,0650,045 abb −+= =
Tổng
()2 OHNaOH BaOH n2nn2.0,1050,0450,255 =+=+= (mol)
TH1: 2CO và OH phản ứng chỉ tạo muối trung hòa
2 2322OHCOCO HO++ →
4 4 BaSO M SOMx n27,96/2330,12 moln1/2.x.n9,6x/2M16x0,12 −+ =====+=
x MOMMM n9,6/2M16x=>n19,2/2M16x + =+=+ ( ) ( ) 2
Với M x1M32 = = (loại)
Với M x2M64 = = (nhận)
Với M x3M96 = = (loại)
==
( ) 23 COBaCO nn0,08 mol
TH2: 2CO và OH phản ứng hết
( ) 23 OHCOHCO1 +→
x
( ) 2 232 2OHCOCOHO2 +→+ y 20,255xy +=
Mà y0,08x0,095 = =
2 HO n0,09 = ()2 Ca n0,12 OH =
Sau phản ứng thu được bình 2 có nồng độ là () 2 2 CO CaOH pu 0,004Mnn0,1210.0,0040,08 ==−=
XCH X mmmM =+=+= ==
0,08.120,09.2.11,141,14/0,0338
( )
2CO n0,080,0950,175 mol =+=
Câu 5 (VDC):
1. (VDC):
Phương pháp:
Dựa vào tính chất của các chất
Cách giải:
a)
COCH mmnn = ==
:3:5:0.25:5/164:5
Công thức đơn giản của X là ( ) 4a5 n CHO
( ) 128.134 X Man=+=
1,6na ==
CTPT của X là 465CHO
b) Khi cho a mol X tác dụng hết với dung dịch 3NaHCO dư thu được 2 a mol khí 2CO X có mạch cacbon
không phân nhánh, phân tử chỉ chứa các nhóm chức OH và COOH
( ) Màk2.426/22 =+−=
=> có 2 nhóm chức COOH và 1 nhóm OH
CTCT của X là:
( ) ( ) 23 222 HOOCCHOHCHCOOH2NaHCONaOOCCHOHCHCOONa2CO2HO −−−+→−−−++
( ) ( ) 2 22 HOOCCHOHCHCOOH2NaOHNaOOCCHOHCHCOONa2HO −−−+→−−−+
2. (VDC):
Cách giải: a)
24HSO m98%.51,350,274 ==
Sau phản ứng kết thúc dung dịch 24HSO trong bình (1) có nồng độ 95%
+==
224 2 HOddHSO HO mm50,274/95%52,92m52,9251,31,62
Số C trung bình 2 COX n/n0,08/0,032,6 ===
Số 2 HX H2n/n2.0,09/0,036 O ===
TH1: X gồm 26CH và 36CH có số mol lần lượt là a,b
ab0,03 +=
30421,14 ab+=
a0,01,b0,02 ==
TH2: X gồm 26CH và 46CH có số mol lần lượt là x,y
xy0,03 +=
30541,14 xy+=
x0,02,y0,01 ==
b)
TH1: X gồm 26CH và 36CH
36236 CHBrCHBr +→
22 BrHpu n0,01n0,020,010,01 mola = =−==
TH2: X gồm 26CH và 46CH
Chỉ có 46CH phản ứng được với 2 H ( )
22462 BrHpuCHBr n0,01n2nn2.0,010,010,01 mola = =−=−==
ĐẠI HỌC QUỐC GIA HÀ NỘI TRƯỜNG ĐẠI HỌC KHOA HỌC TỰ NHIÊN
ĐỀ THI CHÍNH THỨC (Đề thi có 03 trang)
Câu 1: (2 điểm)
ĐỀ THI TUYỂN SINH VÀO LỚP 10
NĂM HỌC 2022 - 2023
MÔN: HÓA HỌC (CHUYÊN)
Thời gian làm bài: 150 phút
1. Cho cấu tạo lớp vỏ electron của nguyên tử thuộc các nguyên tố kí hiệu X1, X2, X3, X4, X5 như sau:


Câu 2: (2,0 điểm)
1. A1 và A2 là hợp chất của Na , trong phân tử chỉ chứa hai nguyên tố và đều có hàm lượng Na là 58,97% theo khối lượng. A1 là chất khử mạnh còn A2 là chất oxi hóa mạnh. A1 phản ứng với dung dịch 4KMnO trong 24HSO loãng tạo nên chất rắn màu vàng nhạt B1 . Phản ứng tương tự của A2 với 4KMnO tạo nên khí không màu B2. Biết B1 và B2 là đơn chất của hai nguyên tố cùng nhóm trong bảng tuần hoàn các nguyên tố hóa học.
a) Xác định A1, A2, B1, B2 và viết các phương trình phản ứng.
b) Tìm các chất từ C1 đến C5 và D1 đến 4 trong sơ đồ chuyển hóa sau. (Không cần viết phương trình phản ứng)
Trong số các nguyên tố trên, hãy cho biết:
a) Nguyên tố nào thuộc nhóm II của bảng tuần hoàn các nguyên tố hóa học?
b) Nguyên tố nào có 13 proton ở hạt nhân nguyên tử?
c) Nguyên tố nào phản ứng với kim loại kiềm theo tỉ lệ mol 1:1 ?
d) Nguyên tố nào ở chu kỳ 4 , nhóm I.
2. Viết các phương trình phản ứng xảy ra trong các thí nghiệm sau:
a) Cho dung dịch 23NaCO vào dung dịch 3AlCl , thu được kết tủa màu rắng và có khí thoát ra.
b) Hòa tan hoàn toàn MgO trong dung dịch 4 NHCl đặc thấy thoát ra khí mùi khai.
3. Trình bày phương pháp hóa học để làm sạch:
a) Khí 2CO có lẫn 2SO .
b) Khí 2 HS có lẫn tập chất HCl
3. Tinh thể muối ngậm nước 42O . FeSOxH được điều chế bằng cách cho lượng dư muối sắt (II) cacbonat
phản ứng với dung dịch axit sunfuric loãng theo qui trình sau: Thêm từng lượng nhỏ sắt (II) cacbonat đến dư
vào dung dịch axit sunfuric loãng. Sau đó, lọc hỗn hợp phản ứng để thu lấy dung dịch. Đun nóng dung dịch
đến khi thu được dung dịch bão hoà rồi để nguội. Lọc thu lấy tinh thể chất rắn và thấm khô bằng giấy lọc.
a) Tại sao phải dùng lượng dư sắt (II) cacbonat?
b) Hãy chỉ ra dấu hiệu cho thấy lượng sắt (II) cacbonat đã dư.
c) Hãy cho biết hoá chất nào có thể thay thế sắt (II) cacbonat trong quy trình trên.
d) Biết Fe chiếm 20,14% khối lượng của 42O FeSOxH. Hãy xác định x
Cho biết các hợp chất từ D1,D2,D3 và D4 đều có 1 nguyên tử S trong công thức hóa học và đều có hàm lượng S là 26,67% theo khối lượng.
2. Cho 12,8 gam bột lưu huỳnh phản ứng với 41,4 gam 23KCO ở nhiệt độ cao thu được 6,72 là khí E1 (đktc) và hỗn hợp rắn X chỉ gồm hai muối E2 và E3 . Biết muối E2 và nguyên tố kali lần lượt chiếm 53,66% và
57,07% khối lượng của X. Muối 2E tạo thành tử hai nguyên tố. Khối lượng mol của E3 nhỏ hơn 200 g/mol . Xác định E1, E2, E3 và viết phương trình phản ứng xảy ra.
3. Thêm từ từ dụng dịch Y chứa 3 AlCl0,3M và HCl0,2M vào 100ml dung dịch NaOH . Tính thể tích dung dịch Y trong các trường hợp sau:
a) Kết tủa trắng bắt đầu xuất hiện.
b) Lượng kết tủa trắng làm nhất.
c) Sau khi phản ứng kết thúc, thu được 1,638 gam kết tủa.
Câu 3: (2,0 điểm)
1. Tương tự như metan, các ankan n2n2 ) (CH + phản ứng với khí clo khi chiếu sáng tạo ra cloankan
( ) n2n2xx CHCl +− bằng cách thay thế nguyên tử H bởi nguyên tử Cl (gọi là phản ứng cho hóa).
a) Vẽ công thức cấu tạo của các sản phẩm 362CHCl từ phản ứng clo hóa 38CH .
b) Khi clo hòa ankan G1 và G2 có cùng công thức phân tử 512CH . G1 chỉ cho một sản phẩm còn G2 cho ba sản phẩm đều có công thức phân tử 511 CHCl. Vẽ công thức cấu tạo của G1,G2 và các sản phẩm này.
2. Anken mạch hở là các hợp chất có công thức phân tử n2nCH , chứa liên kết đôi CC = trong phân tử. Dãy hợp chất này thể hiện tính chất hoá học tương tự etilen như phản ứng cộng 2Br , phản ứng trùng hợp,
a) Quá trình "bẻ gãy" các ankan có khối lượng phân tử lớn hơn tạo thành anken và ankan có khối lượng phân
t
ử nhỏ hơn gọi là quá trình "cracking" thường dùng trong hoá học dầu mỏ. Cracking ankan dưới đây thu được
38CH và hai anken mạch không phản nhánh G3,G4 có cùng công thức phân tử 510CH
- Vẽ công thức cấu tạo của hai anken G3 và 4G .
- Phản ứng trùng hợp giữa hai anken G3 và 64 tạo nên polime T. Vẽ các công thức cấu tạo có thể có của đoạn mạch trong T tạo thành bởi sự kết hợp một phân tử G5 và một phân tử G4 .
b) Tách loại nguyên tử H và nguyên tử Cl liên kết với hai nguyên tử C cạnh nhau trong cloankan tạo thành anken tương ứng. Khi tiến hành tách loại H và Cl từ hợp chất G5 có công thức phân tử 715 CHCl thì chỉ thu
được duy nhất sản phẩm ( ) 714G6CH . Biết rằng, G5 là một sản phẩm được tạo ra bởi phản ứng clo hóa
Câu 1 (VDC):
1. (VDC):
Phương pháp:
Dựa vào lý thuyết cấu tạo nguyên tử.
Cách giải:
a) X2, X5 thuộc nhóm II trong BTH.
HƯỚNG DẪN GIẢI CHI TIẾT
b) X4 có 13 proton ở hạt nhân nguyên tử.
c) Nguyên tố phản ứng với kim loại kiềm theo tỉ lệ mol 1:1: X5 (vì có 7 electron lớp ngoài cùng).
d) Nguyên tố thuộc chu kì 4, nhóm I là X1
2. (VDC):
Phương pháp:
Dựa vào tính chất hóa học của các chất.
Cách giải:
( ) 716
UCH G5 và U đều chứa ba nhóm 3CH trong phân tử. Vẽ công thức cấu tạo của G5 và G6
Câu 4: (2,0 điểm) Cho 0,864 gam hỗn hợp kim loại Fe và Cu tác dụng với 250ml dung dịch A chứa đồng thời ( ) 3 3 FeNO và 3AgNO , thu được 1m gam chất rắn X và dung dịch B . Cô cạn dung dịch B rồi nung cặn
rắn trong bình kín (không có không khí) tới khối lượng không đổi, thu được 2,4 gam chất rắn Y và hỗn hợp khí Z . Hấp thụ hoàn toàn Z vào nước tạo ra dung dịch C . Dung dịch này phản ứng vừa đủ với 130ml dung dịch NaOH0,5M thu được hai muối với tỉ lệ mol 23:3 . Biết các phản ứng xảy ra hoàn toàn.
a) Xác định phần trăm khối lượng các chất trong Y
b) Xác định 1m và nồng độ mol các chất trong A
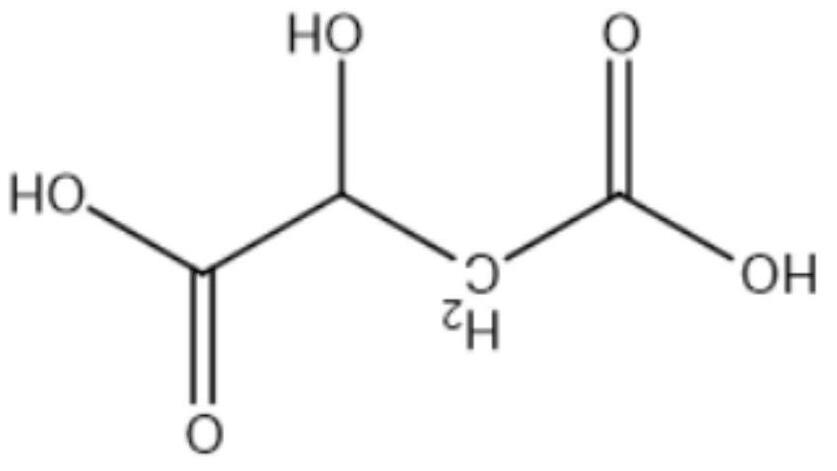
Câu 5: (2,0 điểm) Axit malic (hình bên) có trong thành phần quà xanh
như táo, nho, anh đào... và được dùng làm chất phụ gia thực phẩm để tạo
hương vị và bảo quản. Axit malic chứa hai nhóm cacboxyl và một nhóm
OH trong phân tử nên thể hiện tính chất hoá học của cả ancol và axit.
Khi đun nóng axit malic trong ancol etylic có mặt axit sunfuric thì thu
được các chất H1,H2 và H3 , trong đó chỉ H1 không làm sủi bọt dung dịch 23NaCO H2 và H3 đều chứa
44,44% khối lượng cacbon trong phân tử. Mặt khác, đun nóng axit malic trong sự có mặt axit sunfuric thì thu được ba sản phẩm H4,H5 và H6 đều làm sủi bọt dung dịch 23NaCO . Chất H4 (có vòng 6 cạnh) chứa
55,17% khối lượng oxy trong phân tử. H5 và H6 đều chứa 38,40% khối lượng cacbon trong phân tử. Vẽ công thức cấu tạo của các chất từ H1 đến H6.
a) 233232 3NaCO2AlCl3HO2Al(OH)3CO6NaCl ++→++

b) 4223 MgO2NHClMgClHO2NH +→++
3. (VDC):
Phương pháp:
Dựa vào tính chất hóa học của các chất.
Cách giải:
a) Sục hỗn hợp khí qua dung dịch nước 2Br dư thì 2SO bị giữ lại. Khí thoát ra là 2CO
22224 BrSO2HO2HBrHSO ++→+
b) Cho hỗn hợp khí qua dung dịch NaHS dư, khí HCl bị giữ lại theo phản ứng.
2 NaHSHClNaClHS +→+
4. (VDC):
Phương pháp:
Dựa vào tính chất hóa học của các chất.
Cách giải:
a) Phải dùng lượng dư sắt (II) cacbonat vì nếu sắt (II) cacbonat thiếu, 24HSO còn dư. Khi đun nóng lượng axit này không bay hơi vẫn còn tồn tại trong dung dịch, 4FeSO rất dễ tác dụng với oxi của không khí thu
được sản phẩm không tinh khiết.
( ) 4242242 3 4FeSO2HSO2O2FeSO2HO ++→+
b) Dấu hiệu cho thấy sắt (II) cacbonat đã dùng dư là khí ngừng thoát ra.
324422 FeCOHSOFeSOCOHO +→++
c) Hóa chất có thể thay thế là FeS
d) ( ) Fe %m20,1456.100%/152x.18 ==+
x7 =
Câu 2 (VDC):
1. (VDC):
Phương pháp:
Dựa vào tính chất hóa học của các chất.
Cách giải:
a)
- A1 là hợp chất của Na , trong phân tử chỉ chứa hai nguyên tố; có hàm lượng Na là 58,97% theo khối
lượng; A1 là chất khử mạnh, phản ứng với dung dịch 4KMnO trong 24HSO loãng tạo nên chất rắn màu vàng
nhạt B1
A1 là 2 NaS; chất rắn màu vàng B1 là S
- A2 là hợp chất của Na , trong phân tử cũng chứa hai nguyên tố và có hàm lượng Na cũng là 58,97% theo
khối lượng. A2 là chất oxi hóa mạnh, phản ứng của A2 với 4KMnO tạo nên khí không màu B2 . Mà B1 và
B2 là đơn chất của hai nguyên tố cùng nhóm trong bảng tuần hoàn các nguyên tố hóa học.
C3: 3SO
C4: 24HSO
C5: 2Mg(OH)
D4: 4MgSO
D3: 4NaHSO
C2: 23NaSO
A2: 22NaO
2. (VDC):
Cách giải:
S n0,4 mol =
K2CO3 n0,3 mol =
CO2 n0,3 mol =
Tổng 23KKCO n2n0,6 mol ==
mmuối = 0,6.39/57,07%41 = gam
Mà mmuối KOSOO mmm0,6.390,4.32mn0,3 mol =++=++ =
E2 m0,5366.4122gam ==
E3 m412219gam =−=
Mà E2 chỉ chứa hai nguyên tố
là 22 NaO, B2 là 2O
A2
5Na S2KMnO8HSO2MnSO5 SKSO5NaSO8HO++→++++
2424424242
5NaO2KMnO8HSO2MnSO5OKSO5NaSO8HO ++→++++
b)
224244224242
chat M32/0,2667120 ==
D1, D2, D3 và D4 là các chất sau: 4343 MgSO,CaSO,NaHSO,KHSO
2C1:SO
3D1:KHSO
3D2:CaSO
2B2:O
Muối gồm 3 thành phần nguyên tố K,S,O
E2 là 2 KS
2 KSK trong E22 n0,2 moln0,4 mol,nE20,2 mol StrongE = = = =
=
s trong E3 ns0,2mol
K trong E3 n0,2mol =
O trong E3 n0,3mol =
E3
là 223KSO
E1 là 2CO 23222232
6 S4 KCOO4CO2 K SO2 KS ++→++
3. (VDC):
Phương pháp:
Dựa vào bài toán muối nhôm phản ứng với dung dịch kiềm, axit.
Cách giải:
NaOH n0,154 mol =
a)
Kết tủa bắt đầu xuất hiện
Gọi thể tích dung dịch Y cần lấy là V (lít), ta có:
( ) NaOH n0,154 mol =
Các phản ứng hóa học có thể xảy ra:
2 HClNaOHNaClHO +→+ (1)
322 AlCl4NaOHNaAlOHO3NaCl +→++ (2)
3223 AlCl3NaAlO6HOAl(OH)3NaCl ++→↓+ (3)

223 HClNaAlOHOAl(OH)NaCl ++→↓+ (4)
332 3HClAl(OH)AlCl3HO +→+ (5)
Trong đó (1), (2) đồng thời; khi hết NaOH thì đến (3), (4) đồng thời; khi hết 2NaAlO thì đến (5).
a) Kết tủa trắng bắt đầu xuất hiện khi (1), (2) kết thúc
0,3..40,2.0,154V0,11 VV+= = (lít)
b)
Lượng kết tủa lớn nhất OHYY n3.V0,3V0,20,154 =+=
0,14 YV = lít 140ml =
c)
()3 AlOH n0,021mol =
TH1: chưa xảy ra PT (5):
()() 3 AlCl3HCl4 n0,3y,n0,2y ==

()3 AlOH n0,3y.40,2y0,021y0,015 =+= =
y V0,110,0150,125 =+= lít
TH2: đã xảy ra PT (5)
()3 AlOHmax n0,014.30,042 == mol
()3 AlOH n bị hòa tan0,0420,0210,021 =−=
HCl n0,063V0,140,063/0,20,455 mol = =+=
Câu 3 (VDC):
1. (VDC):
Phương pháp:
Dựa vào tính chất hóa học của ankan.
Cách giải:
a)
Công thức cấu tạo của các sản phẩm có công thức phân tử 362CHCl từ phản ứng clo hóa 38CH :
23 ClHCCHClCH
222 ClHCCHCHCl
223 CHClCHCH ;
323 CHCClCH
b)
G1:
Phương trình hóa học:
G2: 32223 CHCHCHCHCH
Phương trình hóa học:
askt32222
−−−−+−−−−
3222323223
CHCHCHCHCHCl CHCHCHCHCHClCHCHCHCHClCH CHCHCHClCHCH
3223
2. (VDC):
Phương pháp:
Dựa vào lý thuyết về anken
Cách giải:
a)
- Công thức cấu tạo của hai anken 3G và 4G :
3222 CHCHCHCHCH −−−= và 323 CHCHCHCHCH −−=−
- Phản ứng trùng hợp giữa hai anken G3 và G4 tạo thành polime T . Các công thức có thể có của đoạn mạch trong T tạo thành khi kết hợp một phân tử 3G và một phân tử 4G :
G5: : U
b)
G6:
Câu 4 (VDC):
Phương pháp:
Dựa vào tính chất hóa học của các chất.
Cách giải:
Gọi số mol của Fe,Cu lần lượt là a,b
0,86456640,864 FeCu mmab +==>+=
NaOH n0,13.0,50,065 mol ==





Hỗn hợp khí Z: 22NO,O
2223 4NOO2HO4HNO ++→ (1)
4x x 4x mol
2232 2NOHOHNOHNO +→+ (2)
2y y y mol
Dung dịch tác dụng với NaOH
332 HNONaOHNaNOHO +→+ (3)
222 HNONaOHNaNOHO +→+ (4)
Hai muối: 32 NaNO,NaNO
BTNT “Na” NaOHNaNONaNO nnn0,065 =+=
BNTN “N” NO2NaNO3NaNO2 nnn0,065 =+=
2
( ) 23 FeOCuO mm2,4160.ac/280b2,4abc0,03 += ++= ++= (II)
BNTN “N”: 3cd0,065 += (III)
Theo 32 NaNONaNO1,2,3,4nn >
NaNO3NaNO2 n:n23:3 =


NaNO3NaNO2 nn0,065 += 32 NaNONaNO n0,0575,n0,0075 ==
4xy0,0575 += 0,0075 y = 0,0125 x = mol, 0,0075 mol y =
Từ I, II, III, IV: a0,004, b0,01,c0,016, d0,017====

CuO % m33,33% = 23Fe %m66,67% O = b)
1 m108.0,0171,836gam ==
C0,016/0,250,064M ==
() () 3 3 MFeNO
C0,017/0,250,068M O ==
() () 3 2 MCuN
Câu 5 (VDC):
Phương pháp:
Dựa vào lý thuyết về axit cacboxylic.
Cách giải:
Axit malic:
+ 2.0,065 + 2.0,0125 (IV)
- Khi đun nóng axit malic trong ancol etylic ( ) 25 CHOH có mặt axit sunfuric thì thu được các chất H1 , H2
và H3 trong đó H1 không làm sủi bọt dung dịch 23NaCO
H1 có công thức cấu tạo là:
H2 và H3 đều chứa 44,44% khối lượng cacbon trong phân tử
Công thức phân tử của H2,H3 là 6105CHO
Công thức cấu tạo H2:
Công thức cấu tạo H3:
- Đun nóng axit malic trong sự có mặt của axit sunfuric thì thu được ba sản phẩm H4,H5 và H6 đều làm sủi
bọt dung dịch 23NaCO
Trong phân tử H4, H5 và H6 chứa nhóm chức cacboxylic hoặc anhiđrit axit.




- Chất H4 (có vòng 6 cạnh) chứa 55,17% khối lượng oxi trong phân tử
Công thức phân tử H4 là 888CHO .
Công thức cấu tạo H4 là:
- H5 và H6 đều chứa 38,40% khối lượng cacbon trong phân tử
Công thức phân tử H5,H6 là 8109CHO .
Công thức cấu tạo của H5:
Công thức cấu tạo của H6:
SỞ GIÁO DỤC VÀ ĐÀO TẠO NAM ĐỊNH
THPT CHUYÊN LÊ HỒNG PHONG
ĐỀ THI CHÍNH THỨC (Đề thi gồm: 04 trang)
Câu 1: (2,5 điểm)
ĐỀ THI TUYỂN SINH VÀO LỚP 10
NĂM HỌC 2022 - 2023
MÔN: HÓA HỌC (CHUYÊN)
Thời gian làm bài: 150 phút
1. Hoà tan hỗn hợp A gồm các chất: 2342 NaO,NaHCO,NHCl,BaCl có số mol mỗi chất bằng nhau vào nước dư. Sau phản ứng, đun nóng để khí bay ra hết thu được khí X , dung dịch Y và kết tủa M . Xác định các chất tan trong Y và viết các phương trình phản ứng xảy ra.
2. Nguyên tử của nguyên tố R có tổng số hạt proton, netron và electron là 18 , trong đó số hạt mang điện gấp đôi số hạt không mang điện.
a) Xác định tên gọi của R.
b) Nung nóng đỏ R rỗi dẫn hơi nước đi qua thì thu được hỗn hợp gồm khí Z và khí T (trong đó Z là khí độc).
Ở nhiệt độ cao, Z và T đều khử được oxit sắt từ thành kim loại. Xác định công thức của Z,T và viết phương
trình phản ứng xảy ra.
3. Nêu hiện tượng và viết phương trình phản ứng xảy ra trong các quá trình sau:
a) Nhỏ từ từ đến dư dung dịch 24HSO vào dung dịch 2Ba(OH) có nhỏ sẵn vài giọt phenolphtalein.

b) Cho dung dịch KOH vào dung dịch 4FeSO rồi để ống nghiệm ngoài không khí.
4. Độ tan của 4CuSO ở 0 10C là 17,4 gam. Hòa tan hoàn toàn 16 gam CuO vào dung dịch 24 HSO20% lấy
vừa đủ, đun nóng rồi đưa về 10C thì thấy tách ra m gam tinh thể 42O CuSO5H . Viết phương trình phản
ứng, tính m
Câu 2: (2,75 điểm)
1. Cho các chất rắn sau: ( ) 4333 2 BaSO,CHCOONa,BaHSO,NaHCO
a) Chất nào không thể điều chế bằng cách cho kiềm tác dụng với oxit axit?
b) Chất nào tác dụng với dung dịch axit HCl tạo khí gây hiệu ứng nhà kính? Viết phương trình phản ứng.
c) Chỉ dùng một thuốc thử, hãy phân biệt bốn chất trên bằng các phản ứng hóa học.
2. Một học sinh làm thí nghiệm với ba chiếc đinh sắt có kích thước như nhau, chiếc thứ nhất để ngoài không khí, chiếc thứ 2 ngâm trong dầu hỏa (thành phần chính là các hidrocacbon), chiếc thứ 3 ngâm trong dung dịch muối ăn. Em hãy dự đoán thứ tự về tốc độ ăn mòn của ba chiếc đinh sắt và đề xuất hiện pháp bảo vệ vật làm bằng sắt, thép đối với sự ăn mòn.
3. Cho m gam hỗn hợp các muối 44 MgSO,CuSO , và 4BaSO trong đó lưu huỳnh chiếm 19,07% về khối lượng vào nước được dung dịch A và một phần không tan có khối lượng 9,32gam . Nhúng thanh nhôm (dư) vào dung dịch A . Sau phản ứng khối lượng thanh kim loại tăng 4,14 gam. Tính m .
4. Đốt một lượng sắt trong oxi sau một thời gian thu được m gam chất rắn X gồm 2334 Fe,FeO,FeO,FeO .
Hòa tan X vào 200ml dung dịch 24 HSO1M đến phản ứng hoàn toàn thì thu được 1,12 lít khí 2 H còn lại
2,8gam kim loại chưa tan. Tính m.
5. Cho m gam hỗn hợp 3FeCO và Al vào dung dịch 24HSO loãng dư thu được hỗn hợp khí D . Cho khí D hấp thụ vào 200ml dung dịch 2 Ba(OH)0,3M thu được 7,88 gam kết tủa và còn lại 3,36 lít một khí thoát ra.
Viết phương trình phản ứng và tính m
Câu 3: (2,25 điểm)
1. Công thức đơn giản nhất của một chất hữu cơ cho biết tỷ lệ nguyên, tối giản số nguyên tử của các nguyên tố trong hợp chất. Ví dụ: Buten có công thức phân tử là 48CH thì công thức đơn giản nhất là 2CH .
Hiđrocacbon A mạch hở, có công thức phân tử trùng với công thức đơn giản nhất, tỉ lệ khối lượng giữa
hiđro và cacbon trong A là 1:5
a) Xác định công thức phân tử của A
b) Bậc của mỗi nguyên tử cacbon trong phân tử hợp chất hữu cơ là số nguyên tử cacbon liên kết trực tiếp với nguyên tử cacbon đó. Biết trong mỗi phân tử A có một nguyên tử cacbon bậc IV , viết công thức cấu tạo của A
c) A có tính chất hóa học tương tự metan. Viết phương trình phản ứng của A với 2Cl theo tỉ lệ mol 1:1.
2. Sơ đồ dưới đây mô tả thí nghiệm điều chế khí X từ đất đèn
a) Xác định công thức cấu tạo, tên gọi của X , viết phương trình phản ứng điều chế trong thí nghiệm.
b) Khí X có khả năng làm mất màu nước brom. Khi cháy trong oxi tỏa nhiều nhiệt nên được dùng để hàn,
cắt kim loại. Viết phương trình phản ứng của X với dung dịch brom dư và phản ứng đốt cháy X
c) Đất đền ngoài thành phần chính là 2CaC còn có thêm tạp chất, khi thực hiện phản ứng trên thường sinh ra
H2S là khí rất độc, có mùi khó chịu. Em hãy nêu giải pháp loại bỏ 2 HS trước khi thu khí X
d. Trong điều kiện thích hợp, X cũng có phản ứng cộng hidro và một số chất khác. Thực hiện phản ứng cộng hỗn hợp gồm 0,15 molX và 2 0,3 molH trong bình kín có xúc tác thích hợp thì thu được hỗn hợp Y gồm
hiđro, chất X , một hidrocacbon chứa liên kết đôi trong phân từ và một hidrocacbon chỉ chứa liên kết đơn có tính chất tương tự metan. Ti khối của Y so với 2 H là 5,625 . Dẫn Y qua dung dịch brom dư thì có m gam brom phản ứng. Tính m
Câu 4: (1,5 điểm)
1. Glucozơ là một cacbohiđrat quan trọng, có nhiều ứng dụng như làm thuốc tăng lực cho người già, trẻ em, người ốm, là nguyên liệu phản ứng tráng gương, sản xuất rượu etylic....
a) Tính % khối lượng của nguyên tố oxi trong glucozơ
b) Viết các phương trình phản ứng theo sơ đổ chuyển hóa sau:
glucozơ → rượu etylic → axit axetic → etyl axetat
c) Thực hiện lên men glucozơ với hiệu suất quá trình đạt 75% . Tinh thể tích rượu etylic (lít) thu được từ
90 kg glucozơ. Biết khối lượng riêng của rượu etylic nguyên chất là 0,8 g/ml
2. Các axit cacboxylic no đơn chức, mạch hở là các chất có chứa nhóm COOH trong phân tử và có tính chất hóa học tương tự nhau (axit axetic là một trong các chất này). Hỗn hợp A gồm hai axit cacboxylic no đơn chức mạch hở X,Y có công thức lần lượt là n2n2CHO và ( ) m2 m2 CHOn2m += . Cho a gam hôn hợp A tác dụng với lượng dư dung dịch 3NaHCO thì thu được 6,72 lít khí 2CO Đốt cháy hoàn toàn a gam A rồi dẫn
toàn bộ sản phẩm cháy chỉ gồm 2CO và hơi nước qua bình 1 đựng 25PO khan, dư, sau đó qua bình 2 đựng
400 gam dung dịch NaOH% . Sau khi phản ứng xảy ra hoàn toàn thấy khối lượng bình 1 tăng 14,4 gam, bình
2 được dung dịch B có chứa 88,8 gam chất tan và không thấy có khi thoát ra (giả thiết lượng khí chưa phản ứng không hòa tan trong dung dịch).
a) Xác định công thức phân tử, tính phần trăm khối lượng mỗi axit trong A .
b) Tính x.
Câu 5: (1 điểm)
1. Biến thiên entanpi chuẩn của một phản ứng hóa học, kí hiệu là
0 r298 Δ H , chính là nhiệt tỏa ra hay thu vào
kèm theo phản ứng đó ở điều kiện chuẩn. Nếu giá trị 0 r298 Δ H0 < thì phản ứng tỏa nhiệt, nếu giá trị
0 r298Δ H0 > thì phản ứng thu nhiệt. Khi các chất trong phản ứng đều là chất khí, có thể tính 0 r298 Δ H bằng
cách lấy tổng năng lượng liên kết ( ) bE của các chất phản ứng trừ đi tổng năng lượng liên kết ( ) bE của các chất sản phẩm. Cho giá trị trung bình của một số năng lượng liên kết ở điều kiện chuẩn
Liên kết CH CC = CC ≡ CC
( ) / b EkJmol 418 346 612 837
a) Tính giá trị 0 r298 Δ H cho phản ứng ( ) ( ) ( )
323422 CHCHCHkCHkCHCHk −−→+= và nhận định phản

ứng tỏa nhiệt hay thu nhiệt? Biết các chất phản ứng và các sản phẩm đều ở thể khí.
b) Một loại gas (khi hóa lỏng) chứa hỗn hợp propan ( ) 38CH và butan ( ) 410CH với tỉ lệ mol 1:2.
Cho biết giá trị 0 r298 Δ H (lượng chất tham gia phản ứng tỉnh theo mol) của các phản ứng:
()() ( ) () 0 322r298 8k2kk CHO3COk4HO Δ H 2220 kJ +→+=−
()() ( ) () 0 422r298 10k2kk CHO4COk5HO Δ H 2874 kJ +→+=−
Xác định lượng nhiệt tỏa ra khi đốt cháy hoàn toàn 12kg khí gas trên ở điều kiện chuẩn.
Trung bình mỗi ngày, một hộ gia đình cần đốt gas để cung cấp 10.000kJ nhiệt (hiệu suất hấp thụ nhiệt là 80% ) Sau bao nhiêu ngày hộ gia đình trên sử sử dụng hết bình gas 12kg ?
c) Từ ý nghĩa của hiệu ứng nhiệt của phản ứng, em hãy lí giải ngắn gọn tại sao người ta khuyến cáo không nên bón phân đạm cho lúa vào buổi sáng sớm hay những ngày quả rét?
2. Độ tan của một chất trong nước là số gam chất đó hòa tan trong 100 gam nước để tạo thành dung dịch bão hỏa ở một nhiệt độ xác định. Thông thường, độ tan của chất rắn tăng còn độ tan của chất khí giảm khi nhiệt độ tăng. Đồ thị dưới đây thể hiện sự thay đổi độ tan của một số chất tan theo nhiệt độ (ký hiệu các chất là 1234 X,X,X,X )
Các dung dịch 1234 X,X,X,X đang đạt trạng thái bão hòa ở 80C , nếu hạ nhiệt độ xuống 0 0C thì phần trăm khối lượng chất tách ra khỏi dung dịch so với khối lượng chất tan ban đầu của chất nào là lớn nhất ? Giải thích.
Câu 1 (VDC):
1. (VDC):
Phương pháp:
HƯỚNG DẪN GIẢI CHI TIẾT
Dựa vào tính chất hóa học của các chất.
Cách giải:
22 NaOHO2NaOH +→
323 NaOHNaHCONaCO +→
432 NaOHNHClNaClNHHO +→++
2323 NaCOBaCl2NaClBaCO +→+
Chất tan trong y là NaCl
2. (VDC):
Phương pháp:
Dựa vào lý thuyết về cấu tạo nguyên tử
Cách giải:
a)
2ZN19 +=
2Z2N =
Z6 =
R là Cacbon
b)
Z là CO, T là 2 H 0
22 CHOCOH t +→+ 0
342 4COFeO3Fe4CO t +→+ 0
2342 4HFeO3Fe4CO t +→+
3. (VDC):
Phương pháp:
Dựa vào tính chất hóa học các chất
Cách giải:
a) Hiện tượng: Xuất hiện kết tủa trắng, màu đỏ của dung dịch nhạt dần rồi mất màu
24242 HSOBa(OH)BaSOHO +→+
b) Hiện tượng: Xuất hiện kết tủa trắng xanh, sau đó chuyển dần sang màu nâu đỏ
4242 2KOHFeSOKSOFe(OH) +→+
2223 4Fe(OH)O2HO4Fe(OH) ++→
4. (VDC):
Phương pháp:
Dựa vào tính chất hóa học của các chất
Cách giải:
2442 CuOHSOCuSOHO +→+
244 CuoHSOCuSO nnn0,2 mol ===
24ddHSO m98gam =
H2O m90.80%0,2.1882gam =+=
Giả sử có 2 xmolCuSO4.5CO tách ra
( ) ( ) 17,4/100160.0,2/8218.5x x =−−
x0,123 =
m30,75gam =
Câu 2 (VDC):
1. (VDC):
Phương pháp:
Dựa vào tính chất hóa học của các chất.
Cách giải:
a) 3 CHCOONa
b) 322 HClNaHCONaClCOHO +→++
c) Thuốc thử: 24HSO
4BaSO không tan, không có hiện tượng
3 CHCOONa tan, không có khí, không có kết tủa
3NaHCO tan, có khí thoát ra
( ) 3 2 BaHSO có khí thoát ra và kết tủa
243324 HSO2CHCOONa2CHCOOHNaSO +→+
2432422 HSO2NaHCONaSOCOHO +→++
( ) 243422 2 HSOBaHSOBaSOSOHO +→++
2. (VDC):
Phương pháp:
Dựa vào lý thuyết ăn mòn hóa học.
Cách giải:
- Thứ tự ăn mòn tăng dần: 213 <<
- Biện pháp: sơn, mạ lên bề mặt kim loại.
3. (VDC):
Phương pháp:
Dựa vào dãy điện hóa kim loại.
Cách giải:
Phần không tan là 44BaSO BaSOn0,04mol =
Gọi số mol của 44 CuSO,MgSO lần lượt là x,y ( ) 424 3 2Al3CuSOAlSO3Cu +→+
Al n2x/3 =
4,146427.2/3 xx =− x0,09mol = ( ) ( ) %S32.0,040,09y:23,72120y0,1907 =+++= y0,04 = m28,52 = gam
4. (VDC):
Phương pháp:
Dựa vào tính chất hóa học của các chất.
Cách giải:
Quy đổi X thành Fe và O
Dung dịch sau phản ứng là 4FeSO
242 HSOH2O2 n0,2nn0,05n O ==+=+
O2 n0,15 = ( )
SSO2FeSO4Fe BTNTSnnnn0,2 ====
FeO mmm0,2.560,15.162,816,4 =+=++= gam
5. (VDC):
Phương pháp:
Dựa vào tính chất hóa học của các chất.
Cách giải:
324422 FeCOHSOFeSOCOHO +→++
2Al3HSOAlSO3H +→+
( ) 24242 3
2H Al n3,36/22,40,15 moln0,1mol == =
()2 BaOH n0,06 =
3BaCO n0,04 =
TH1: 2CO phản ứng với 2Ba(OH) chỉ tạo muối trung hòa
323 BaCOCOFeCO nnn0,04mol === 0,04.1160.1.277,34 m =+= gam
TH2: 2CO phản ứng với 2Ba(OH) tạo hai muối ( )
223 2 2COBa(OH)BaHCO +→
2232 COBa(OH)BaCOHO +→+
3 CO FeCO n0,040,02.20,08n
2
m0,08.1160,1.2711,98 gam
Câu 3 (VDC):
1. (VDC):
Phương pháp:
Dựa vào cách lập CT hợp chất hữu cơ
Cách giải: a) :1:5:12:5
HCHC mmnn = =
CTPT của A là 512CH
b)
CTCT của A là:
c)
2. (VDC):
Phương pháp:
Dựa vào phương pháp điều chế khí 22CH
Cách giải:
a) X là CHCH ≡ , có tên gọi là axetilen
Pt điều chế X trong PTN: 22222 CaC2HOCHCa(OH) +→+
b)
222 CHCH2BrCHBrCHBr ≡+→−
0
22222 CH5/2O2COHO ++ →
c)
Để loại bỏ 2 HS, người ta dẫn hỗn hợp khí qua bình đựng lượng dư dung dịch kiềm.
22 HSCa(OH) + dư 2 CaS2HO→+


d) 0
222 CHCHHCHCH t ≡= → + 0
233 CHCH2HCHCH → ≡+−
Hỗn hợp Y gồm: 22233 H,CHCH,CHCH,CHCH ≡=−
Các phản ứng khi Y tác dụng với dung dịch brom:
222 CHCH2BrCHBrCHBr ≡+→−
22222 CHCHBrCHBrCHBr =+→−
BTKL: 0,15.26 +0,3.2 11,25n0,4 mol . YYn = =
Đốt cháy X và 2 H tương tự như đốt Y ( ) ( ) yCO2H2O nnn/k1 =−− ( ) 22 2 YYCOHO BrYnknnn0,15.20,150,3nn −=−=−+=−
2 2BrBrn0,25 molm40 gam = =
Câu 4 (VDC):
1. (VDC):
Phương pháp:
Dựa vào lý thuyết về glucozơ
Cách giải:
a) %16.6.100%/18053,33% Om ==
b)
men 6126252 CHO2CHOH2CO + →
men 25232 CHOHOCHCOOHHO ++ → 24 HSO, 3253252 CHCOOHCHOHCHCOOCHHO d ++ ⇆
c)
Khối lượng glucozơ phản ứng 90.75%67,5 kg ==
Khối lượng 25 CHOH67,5.92/18034,5 kg ==
V34,5/0,843,125 == lít
2. (VDC):
Phương pháp:
Dựa vào tính chất hóa học của axit
Cách giải:
a)
Gọi CTTB của 2 axit là x2x2CHO hoặc RCOOH 322 RCOOHNaHCORCOONaCOHO +→++
ACO2 nn0,3 mol ==
( ) x2x2222 CHO3x2/2OxCOxHO +−→+
==
CO2H2O nn0,8 mol
0,3.0,88/3 xx = =
TH1: Hai axit là ( HCOOHa mol) và 25 CHCOOH (b mol)
- Lập hệ tính được 0,05;0,25ab==
=> %mHCOOH =11,06%;% mC2H5COOH = 88,94%
TH2: Hai axit là ( 3 CHCOOH c mol) và 37 CHCOOH(d mol)
- Lập hệ tinh được c0,2;d0,1 ==
==
3 37 CHC С HCOOH OO % m57,69%;% m42,31% H
b)
CO2 n0,8 mol =
- Giả sử CO2 0,8n khi tác dụng với NaOH tạo hết muối 23NaCO thì khối lượng muối thu được tối đa là
84,8gam . Nếu tạo hết muối 3NaHCO thì khối lượng muối thu được tối đa là 67,2gam
- Nếu có tạo thành 3NaHCO , thì khối lượng muối 84,8 g <
- Vì khối lượng chất tan trong dung dịch là 88,8gam84,8 > dung dịch có 23NaCO và NaOH dư
2232 CO2NaOHNaCOHO +→+
23NaCO n0,8 =
NaOHdu m4gam =
NaOHpuNaOH ban đau nn1,7 mol =
x1,7.40/400.100%17% ==
Câu 5 (VDC):
1. (VDC):
Phương pháp:
Dựa vào lý thuyết biến thiên enthapy.
Cách giải:
a) 0 r298 Δ H8.4182.3468.41861280 kJ0=+−−=+>
=> Phản ứng thu nhiệt
b) 38CH n75 mol =
410CH n150 mol =
- Lượng nhiệt = 75.(-2220) + 150.(-2874) = 597600kJ
- Thời gian sử dụng 97600.80%1000047,8 =⋅= ngày
c) Vì quá trình hòa tan phân đạm thu nhiệt làm nhiệt độ giảm, vào buổi sáng sớm hay ngày rét làm nhiệt độ giảm sâu gây hại cho lúa.
2. (VDC):
Cách giải:
Từ đồ thị có thể ước lượng được phần trăm lượng chất tách ra của các chất.
1 X3/8.100% =
2 X1/5.100% =
3 X2/3.100% =
X4: không tách ra
Nên 3X là chất có tỉ lệ tác ra nhiều nhất.
SỞ GIÁO DỤC VÀ ĐÀO TẠO HÀ NAM
ĐỀ THI CHÍNH THỨC (Đề thi có 02 trang)
KỲ THI TUYỂN SINH LỚP 10
NĂM HỌC 2022 - 2023
MÔN: HÓA HỌC (CHUYÊN)
Thời gian làm bài: 150 phút
Câu 1: (1,0 điểm) Nêu hiện tượng xảy ra, viết phương trình hóa học khi cho
1) Một mẫu kim loại Na vào dung dịch 4CuSO
2) Một dây kim loại Cu vào dung dịch 3AgNO .
3) Dung dịch 3 CHCOOH vào 2Cu(OH)
4) Cho mẫu Na vào cốc đựng rượu etylic khan. (Biết Drượu etylic 3 Na 0,8 g/ml,D0,97 g/cm == ).

Câu 2: (1,0 điểm) Hãy giải thích:
1) Vì sao khi cho một sợi dây đồng đã cạo sạch vào bình cắm hoa thì hoa sẽ tươi lâu hơn?
2) Vì sao các đồ vật làm bằng nhôm khó bị ăn mòn trong không khí?
3) Vì sao khi hạ đường huyết người ta cho uống nước đường thay vì ăn các loại thức ăn khác?
4) Vì sao trên thực tế người ta không dùng nước để dập tắt các đám cháy do xăng dầu?
Nêu biện pháp xử lí các đám cháy do xăng dầu?
Câu 3: (1,0 điểm)
Cho biết A là hôn hợp gồm Mg và Cu , hãy viết phương trình phản ứng theo sơ đồ sau:
chất gì?
2. Trong phòng thí nghiệm giả sử chỉ có: khí 2CO , bình tam giác có một vạch chia, dung dịch NaOH , pipet,
đèn cồn, giá đỡ. Trình bày hai phương pháp để điều chế 23NaCO tinh khiết.
Câu 5: (1,0 điểm) 1. Hỗn hợp X gồm 4 chất khí sau: 232 CO,SO,SO và 2 H . Trình bảy phương pháp hóa
h
ọc nhận biết từng khí trong hỗn hợp X . Viết các phương trình phản ứng xảy ra.
2. Một hỗn hợp X gồm các chất: 2342 KO,KHCO,NHCl,BaCl có số mol mỗi chất bằng nhau. Hoà tan hỗn hợp X vào nước, rồi đun nhẹ thu được khí Y , dung dịch Z và kết tủa M . Xác định các chất trong Y,Z,M và viết phương trình phản ứng xảy ra.
Câu 6: (1,0 điểm) Hòa tan hoàn toàn a gam kim loại R (hóa trị không đổi) vào dung dịch HC1 được dung
d
ịch X Để trung hòa lượng axit còn dư trong dung dịch X cần dùng 64 gam dung dịch NaOH 12,5%.
Phản ứng xong thu được dung dịch Y chứa 4,68%NaCl và 213,3%RCl . Cho tiếp lượng dư NaOH vào Y ,
l
ọc tách kết tủa tạo thành rồi đem nung đến khối lượng không đổi được 14 gam chất rắn.
1) Viết phương trình phản ứng.
2) Xác định R , tìm a và nồng độ phần trăm dung dịch HCl
Câu 7: (1,0 điểm) Cho hỗn hợp khí X gồm 3 hiđrocacbon A,B,C (với B,C là 2 chất kế tiếp nhau trong
cùng một dãy đồng đẳng). Đốt cháy hoàn toàn 672ml hỗn hợp X rồi cho toàn bộ sản phẩm cháy vào bình chứa 437,5ml dung dịch 2 Ba(OH)0,08M , phản ứng xong thu được 4,925 gam kết tủa. Mặt khác, dẫn 1209,6ml hôn hợp X qua bình chứa nước brom dư. Sau phản ứng thấy khối lượng bình brom tăng 0,468 gam và có 806,4 ml hỗn hợp khí thoát ra. Biết các thể tích khi đo ở điều kiện tiêu chuẩn và các phản ứng xảy ra hoàn toàn.
1) Tìm công thức phân tử của ,, ABC . Biết ,, ABC thuộc trong các dãy ankan, anken, ankin.
Câu 4: (1,0 điểm)
1. Quan sát hình vẽ điều chế khí X dưới đây và trả lời các câu hỏi
a) Khí X là gì? Nêu hiện tượng và viết phương trình hóa học khi dẫn khí X vào ống nghiệm đựng dung dịch 4KMnO
b) Nêu vai trò của đá bọt trong thí nghiệm trên? Nếu khi làm thí nghiệm không có đá bọt em có thể thay bằng
2) Tính thành phần trăm theo thể tích các chất trong hỗn hợp X
Câu 8: (1,0 điểm) Cho 9,2 gam hỗn hợp X gồm Mg và Fe vào dung dịch hỗn hợp 3AgNO và ( ) 3 2 CuNO thu được chất rắn Y và dung dịch Z . Hòa tan hết Y bằng dung dịch 24HSO đặc, nóng, dư thu được 6,384 lít khí 2SO (sản phẩm khử duy nhất, ở điều kiện tiêu chuẩn). Cho dung địch NaOH dư vào Z , thu được kết tủa T . Nung T trong không khí đến khối lượng không đổi, thu được 8,4 gam hỗn hợp rắn. Tính thành phần phần trăm theo khối lượng của mỗi kim loại trong X ? (Biết các phản ứng xảy ra hoàn toàn).
Câu 9: (1,0 điểm) Cho một hợp chất A có chứa các nguyên tố C,H,O và nguyên tố X . Kết quả phân tích cho thấy % khối lượng các nguyên tố C,H,O trong A lần lượt là 44,72%;1,24%;9,94% và còn lại là % khối lượng của X . Trong phân tử A chứa 2 nguyên tử oxi và số nguyên tử X gấp 2 lần số nguyên tử oxi. Xác định công thức phân tử của A
Câu 10: (1,0 điểm) Hỗn hợp X chứa 3 este A,B,C đều mạch hở, không phân nhánh (không chứa nhóm chức

khác) và AB MMMc << . Để phản ứng với 41,24 gam X cần dùng 280ml dung dịch NaOH2M (đun nóng), thu được hỗn hợp muối Y và hỗn hợp Z chứa 3 ancol no. Trộn hỗn hợp Y với vôi tôi xút ( )CaO,NaOH dư, đun nóng, thu được 11,2 lít một chất khí duy nhất là metan (đo ở điều kiện tiêu chuẩn).
Mặt khác, để đốt cháy 41,24 gam X cần dùng 42,784 lít 2O (đo ở điều kiện tiêu chuẩn).
1) Xác định công thức phân tử của các muối trong Y.
2) Xác định công thức phân tử của A
3) Tính thành phần phần trăm về khối lượng của các ancol có trong hỗn hợp Z
Câu 1 (VDC):
Phương pháp:
Dựa vào tính chất hóa học các chất
Cách giải:
HƯỚNG DẪN GIẢI CHI TIẾT
1) Hiện tượng: có bọt khí thoát ra, sau đó kết tủa xanh xuất hiện
22 NaHONaOH1/2H +→+
4224 2NaOHCuSOCu(OH)NaSO +→+
2) Hiện tượng: Có kết tủa trắng bạc bám vào thanh đồng, dung dịch chuyển dần thành màu xanh ( ) 33 2 Cu2AgNOCuNO2Ag +→+
3) Hiện tượng: chất rắn màu xanh tan dần tạo thành dung dịch màu xanh. ( ) 2332 2 Cu(OH)2CHCOOHCHCOOCu2HO +→+
4) Hiện tượng: Mẩu Na lơ lửng trong rượu, tan dần và có bọt khí không màu thoát ra. (Drượu etylic < DNa , nên Na chìm trong rượu, phản ứng với rượu làm Na tan dần, khí 2 H tạo ra lực đẩy làm Na lơ lửng trong rượu)
25252 NaCHOHCHONa1/2H +→+
Câu 2 (VDC):
Phương pháp: Dựa vào lý thuyết về các chất.
Cách giải:
1) Đồng kim loại tạo lên 1 lượng nhỏ 2 Cu + (rất nhỏ) tan trong nước có tác dụng diệt khuẩn. Vì ion 2 Cu + có tính oxi hóa mạnh. Do đó, các cuống hoa đỡ bị tắc nên hoa tươu lâu hơn.
2) Trong không khí, Al tiếp xúc với khí 2O với 2 HO tạo ra lớp màng oxit nhôm 23AlO , mỏng nhưng rất bền vững. Lớp màng oxit nhôm bảo vệ nhôm tiếp xúc với môi trường bên ngoài, ngăn ngừa quá trình oxi hóa khử.
3) Hạ đường huyết là cụm từ để chỉ sự giảm lượng đường trong máu dưới mức bình thường (đường ở đây muốn ám chỉ đường glucozơ và mức bình thường được quy định từ 3,9-6,4 mol/lit). Trong máu đường glucozơ được đưa đi khắp cơ thể đề nuôi dưỡng các tổ chức bảo đảm cho sự sống bình thường của con người. Glucozơ là nguồn năng lượng chính của cơ thể đồng thời cũng là nguồn nhiên liệu cực kì quan trọng và cần thiết cho hệ thần kinh và tổ chức não bộ. Khi đường huyết bị thấp hơn bình thường sẽ ảnh hưởng rất lớn đến các chức năng và hoạt động của con người. Do vậy khi đói là (hạ đường huyết) người ta phải uống nước đường, đặc biệt là uống nước mía, hoa quả thay vì ăn các loại thức ăn khác để bổ sung và cân bằng đường máu.
4) Trên thực tế người ta không dùng nước để dập tắt các đám cháy do xăng dầu. Vì nếu dùng nước để dập tắt
thi do khối lượng riêng của xăng dầu nhẹ hơn nước, xăng dầu nổi lên trên mặt nước khiến diện tích đám cháy
càng lan rộng hơn
Để xử lý các đám cháy xăng dầu, người ta thường dùng cát, một số chất có tác dụng hấp thụ nhiệt, hoặc một
số chất có thể ngăn vật liệu cháy với oxi như chăn bông... khiến quá trình cháy không thể duy trì và tắt hẳn.
Câu 3 (VDC):
Phương pháp:
Dựa vào tính chất hóa học các chất.
Cách giải:
0
2 2MgO2MgO t +→
0
2 CuOCuO t +→
B: MgO,CuO
22 MgO2HClMgClHO +→+
22 CuO2HClCuClHO +→+
22C:MgCl,CuCl
22 2Na2HO2NaOHH +→+
22 MgCl2NaOHMg(OH)2NaCl +→+
22 CuCl2NaOHCu(OH)2NaCl +→+
D: 2 H
E:NaCl
22 F:Mg(OH),Cu(OH) 0
22 Mg(OH)MgOHO + → 0
22 Cu(OH)CuOHO t + →
G: MgO,CuO
Câu 4 (VDC):
1. (VDC):
Phương pháp:
Dựa vào phương pháp điều chế 24CH
Cách giải:
a) X là etilen ( ) 24CH
Dẫn X vào dung dịch 4KMnO
Hiện tượng: dung dịch nhạt màu
2242222 3CHCH2KMnO4HO3HOCHCHOH2MnO2KOH =++→−−−++
b) Đá bọt có vai trò điều hòa quá trình sôi, làm cho hỗn hợp sôi đều, tránh hiện tượng quá sôi. Có thể thay thế
đá bọt bằng mảnh thủy tinh.
2. (VDC):
Phương pháp:
Dựa vào tính chất hóa học của các chất.
Cách giải:
Cách 1: Sục dư 2CO dư vào dung dịch NaOH
23 CONaOHNaHCO +→
Đun nóng dung dịch thu được 0
2NaHCONaCOCOHO ++ →
32322
Cách 2:
Lấy dung dịch NaOH vào 2 bình tam giác đến vạch chia (có cùng thể tích cùng số mol). Sục 2CO đến
dư vào bình 1 , thu được dung dịch 3NaHCO . Sau đó, đổ bình 2 vào dung dịch thu được ở bình 1 ta sẽ thu
được 23NaCO
323 NaOHNaHCONaCO +→
Câu 5 (VDC):
1. (VDC):
Phương pháp:
Dựa vào tính chất hóa học của các chất.
Cách giải:
Lấy 1 mẫu khí X làm thí nghiệm:
Bước 1: Dẫn hỗn hợp khí X qua dung dịch 2BaCl dư, nhận ra 3SO và loại bỏ được 3SO
3224 SOHOBaClBaSO2HCl ++→+
Bước 2: Dẫn hỗn hợp khí sau khi đi ra khỏi bình dung dịch 2BaCl vào dung dịch 2Br dư, nhận ra và loại bỏ
22224 SOBr2HO2HBrHSO ++→+
Bước 3: Dẫn hỗn hợp khí sau khi đi ra khỏi bình dung dịch 2Br vào dung dịch nước vôi trong nhận ra và loại
bỏ 2CO
2232 Ca(OH)COCaCOHO +→+
Bước 4: Dẫn khí thoát ra qua CuO đun nóng nhận ra 2 H
22 CuOHCuHO +→+
2. (VDC):
Phương pháp:
Dựa vào tính chất hóa học của các chất.
Cách giải:
Y là 3NH
Z là KCl
M là 3BaCO
22 KOHO2KOH +→
432 KOHNHClKClNHHO +→++
323 KOHKHCOKCO +→
2323 KCOBaClBaCO2KCl +→+
Câu 6 (VDC):
Phương pháp:
Dựa vào tính chất hóa học của các chất.
Cách giải:
1)
22RHClRClH +→+
2 NaOHHClNaClHO +→+
22 RCl2NaOHR(OH)2NaCl +→+
0
22 R(OH)ROHO + →
2)
NaOHNaCln0,2 moln== trong Y
ddY m0,2.58,5/4,68%250 == gam
RCl2 m13,3%.25033,25 == gam ( ) ( )
RCl2RO nn14/R1633,25/R71R24 = +=+ =
R là Mg
HCl ban đau n0,22.14/400,9 mol =+=
HCl m32,85gam =
Mg am0,35.248,4gam ===
BTKL: MgHClddNaOHddyH2 mmmmm ++=+
ddHCl m2502.0,358,464178,3 =+−−= gam
==
HCl %C32,85/178,3.100%18,42%
Câu 7 (VDC):
Phương pháp:
Dựa vào tính chất hóa học của các chất.
Cách giải:
1)
Khí A bị hấp thụ bởi dung dịch brom là anken hoặc ankin ( ) A n1,20960,8064/22,40,018 mol =−=
A M0,468/0,01826 ==
A là 22CH
Hỗn hợp khí thoát ra gồm 2 ankan B và C
Đặt CTTB của B,C là n22CH n+
nC2H2 trong 672ml hỗn hợpX = B,C trong X 0,01moln0,030,010,02 = =−=
()2 BaOH n0,035 =
3BaCO n0,025 =
TH1:Chỉ tạo muối trung hòa, 2Ba(OH) dư
23 COBaCOn0,025 n ==
0,01.20,02.n0,025n0,25 += = (loại)
TH2: Tạo hai muối: () 3 2 BaHCO n0,0350,0250,01 =−=
2CO n0,0250,01.20,045 =+=
0,01.20,02.n0,045n1,25 += = ( ) ( ) 426 B, C là CHxmol và CHymol
2)
x:y:z:t %%%%44,144,721,249,9444,144,116 ::::::6:2:1: 12116121169,94 CHO XXX
Do số nguyên tử X gấp 2 lần số nguyên tử O trong A nên có 44,116 2X35,5X 9,94 X
CTĐGN của A là 622 CHOCl
CTPT của A có dạng ( ) 622 n CHOCl , A có 2 nguyên tử O nên n2 =
CTPT của A là: 12424 CHOCl
Câu 10 (VDC):
Phương pháp:
==
Ta có hệ x2y0,025 += xy0,02 += x0,015,y0,005
CH4C2H6C2H2 % V50%,% V16,67%, V33,33% ===
Câu 8 (VDC):
Phương pháp:
Dựa vào tính chất hóa học của các chất.
Cách giải:
Gọi a, b lần lượt là số mol Mg,Fe phản ứng, c là số mol Fe dư
Bảo toàn e với 2 SO2a2 b3c0,57 ++=
( ) AgCuMgFe n2n2n2n2a2 b +=+=+
Mà 9,2 245656 abc=++
Khối lượng hỗn hợp chất rắn 8,440a80 b8,4==>+=
===
a0,15, b0,03,c0,07
Mg % m39,13% =
Fe % m60,87% =
Câu 9 (VDC):
Phương pháp:
Dựa vào cách lập CT hợp chất hữu cơ.
Cách giải:
Ta có ( ) %X100%%C%H%O44,1% =−++=
Gọi công thức X là Xyzt CHOX
Dựa vào tính chất hóa học các chất.
Cách giải:
1)
-Khí duy nhất thoát ra từ phản ứng vôi tôi xút và là hidrocacbon no đơn giản nhất X là 4CH
42 CHOn0,5 mol,n1,9 mol ==
NaOH n0,56 mol =
- X chứa 3 este mạch hở, không phân nhánh và Y là hỗn hợp muối tham gia phản ứng với vôi tôi xút tạo ra 4CH Y chứa 3 CHCOONa và 22 CH(COONa)
2)
Gọi x, y lần lượt là số mol của 3 CHCOONa và 22 CH(COONa)
Theo đề bài ta có: X nxy0,5 =+=
NaOH nx2y0,56 =+= x0,44,y0,06 ==
Gọi a,b lần lượt là số mol của 2CO và 2 HO khi đốt cháy 41,24 gam X
BTKL: 222 XOCOHO mmmm +=+
44a18 b41,241,91.32 +=+
BTNT ( ) ( ) O:2ab0,44.20,06.41,91.2 +=++
a1,68,b1,58 ==
Mol este 2 chức 1,681,580,1 mol =−=
Mol este đơn chức 0,562.0,10,36=−=
=+=
X n0,10,360,46
Số C trung bình của 1,68/0463,652 X ==
Phải có este ( ) 33 CHCOOCH0,36mol
Vì ABC MMMA << là 33 CHCOOCH
3)
25 CHOH
Trong X có chứa: 1 este 2 chức axit và 1 este 2 chức ancol
BTKL: XNaOHmuoi ancolmmmm +=+
ancol 18,68 m = gam
TH1: Hai este 2 chức là ( ) 32CHCOO A và 22 CH(COOB)
() () 2 3 2 2 CHCOONaCHCOOA n0,06moln0,10,060,04 = =−=
Các ancol gồm
( ) 2 A(OH):0,04 mol,BOH:0,12mol và 3 CHOH:0,36 mol
++++=
( ) ( ) A34.0,04B17.0,1232.0,3618,68
A3B94 +=
Vì B29A7 = = (loại)

TH2:
- Hai este đa chức là ( ) 32CHCOO A:0,04mol và 32 CHOOCCHCOOB:0,06 mol
Các ancol gồm
( ) 2 A(OH):0,04 mol,BOH:0,06mol và 3 CHOH:0,42 mol
2A3B143 +=
Cặp giá trị phù hợp là ( ) 24A28CH =− và ( ) 25BCH
Các ancol là 242 CH(OH) và 325 CHOH,CHOH
() 24 2 CHOH %m13,276% =
% m71,949% =
3 CHOH
BỘ GIÁO DỤC VÀ ĐÀO TẠO
TRƯỜNG ĐẠI HỌC SƯ PHẠM HÀ NỘI
ĐỀ THI CHÍNH THỨC (Đề thi có 04 trang)
Câu 1: (2 điểm) Các hợp chất vô cơ
1. Cho các chuyển hóa sau:
0
3 BaCOXM + →
2 2NaOHMYHO +→+
3 NHHClZ +→
33 NHHNOT +→
a) Xác định các chất X,Y,Z,T và M .
ĐỀ THI TUYỂN SINH VÀO LỚP 10
NĂM HỌC 2022 - 2023
MÔN: HÓA HỌC (CHUYÊN)
Thời gian làm bài: 120 phút
ABCDE ++→+ du ANaOHBCE +→++
BHCDG ++→+
Xác định các chất A,B,C,D,E,G và H . Viết phương trình hóa học xảy ra.
4. Trong tự nhiên, nhôm có trong quặng boxit. Quặng boxit có chứa 232 AlO.2HO, tạp chất là
23FeO , 2 SiO, Để sản xuất nhôm, người ta sẽ loại bỏ tạp chất để thu được 23AlO , sau đó tiến hành điện phân nóng chảy (đpnc) với điện cực dương (anot bằng than chì) hỗn hợp gồm 23AlO và criolit theo phản ứng dpnc 232 criolit 2AlO44Al3O + →
Biết hiệu suất quá trình điện phân là 90% và quặng boxit chứa 25% (về khối lượng) tạp chất không chứa nhôm.
a) Cho biết vai trò của criolit trong quá trình điện phân.
b) Cho đồng thời các chất X, Y, Z, T có cùng số mol vào trong một lượng nước dư, rồi đun nhẹ thu được khí
A, dung dịch B và kết tủa C . Xác định các chất có trong A,B và C . Viết các phương trình hóa học xảy ra.
2. Chia 76,8 gam hỗn hợp F gồm Mg và Fe thành hai phần bằng nhau:
- Cho phần 1 vào dung dịch HCl dư, thu được 17,92 lít 2 H (đktc).
- Cho phần 2 vào 0,6 lít dung dịch ( ) 3 2 CuNOaM , thu được dung dịch G và b gam chất rắn H . Cho dung dịch G vào dung dịch NaOH dư, lọc lấy kết tủa rồi nung đến khối lượng không đổi, thu được 40 g chất rắn.
Biết các phản ứng xảy ra hoàn toàn. Tính các giá trị a và b.
Câu 2: (2 điểm) Nhôm và hợp chất của nhôm
Nhôm là kim loại màu trắng bạc, mềm, dễ kéo sợi, dát mỏng, dẫn điện và dẫn nhiệt tốt. Nhôm có thể được
dát thành giấy nhôm dùng để gói thực phẩm. Nhôm và hợp kim của nhôm có đặc tính nhẹ, bền với không khí và nước, được dùng làm vật liệu chế tạo máy bay, ôtô, tên lửa, tàu vũ trụ, các vật dụng trong cuộc sống...
1. Mùa hè năm ngoái, bạn Tuấn được bố mẹ cho về quê ngoại thăm ông, bà. Bà ngoại Tuấn hay ăn trầu nên đã bảo Tuấn đi xin một ít vôi tôi của hàng xóm, Tuấn đã lấy một cái ca bằng nhôm để đựng với tôi. Mấy hôm sau, khi bà ngoại Tuấn mang vôi ra ăn trầu thì thấy ca bị thủng và vôi bị chảy hết ra ngoài. Em hãy giúp Tuấn giải thích tại sao ca bằng nhôm đựng vôi tôi lại bị thủng?
2. Mặc dù nhôm là một kim loại khá hoạt động (chỉ sau kim loại kiềm và kiểm thổ) nhưng nhôm vẫn được dùng để chế tạo các dụng cụ nhà bếp như xoong, nồi... Hãy giải thích ngắn gọn.
3. Dưới đây là sơ đồ chuyển hóa có sự tham gia của nhôm và hợp chất của nhôm.
2AlHClAH +→+
AGDEH +→++
b) Sau một thời gian điện phân, người ta thấy cực dương bị ăn mòn và phải thay thế. Giải thích và viết phương trình hóa học minh họa.
c) Để điều chế được 54 tấn nhôm thì cần dùng bao nhiêu tấn quặng boxit?
Câu 3: (2 điểm) Kali và vai trò của kali
Kali là một trong số các nguyên tố hóa học quan trọng đối với cơ thể con người. Thiếu kali, cơ thể đối mặt
với nguy cơ yếu cơ, liệt cơ và rối loạn nhịp tim... Kali đặc biệt cần thiết cho hệ thần kinh. Sự sụt giảm nồng độ kali trong máu có thể ảnh hưởng đến khả năng tạo ra xung thần kinh của cơ thể. Kali cũng là nguyên tố rất cần thiết cho cây trồng, đặc biệt là cho những cây ăn quả.
1. Đồng vị là những nguyên tử của cùng một nguyên tố có cùng số proton, khác số notron. Trong tự nhiên, kali có ba loại đồng vị là ( ) ( ) 3940 K93,258%, K0,012% và ( ) 41 K6,730%.
a) Tính nguyên tử khối trung bình của kali.
b) Chuối là một trong những loại hoa quả giàu kali. Khi thi đấu, nhiều vận động viên tennis thường ăn chuối để bổ sung kịp thời lượng kali cho cơ thể. Một quả chuối nặng 150 g chứa 420mg kali. Tính khối lượng mỗi
loại đồng vị của kali có trong quả chuối này.
c) Kali luôn có mặt trong máu người với một nồng độ ổn định. Một người trưởng thành nặng 70 kg có lượng máu trong cơ thể là 5 lít, có chứa lượng kali trong máu từ 0,690-0,986 g. Tính nồng độ kali (mmol/l) có trong máu người trưởng thành trên.
2. Cây thanh long có nguồn gốc nhiệt đới. Chúng dễ trồng trên nhiều loại đất khác nhau như đất bạc màu (Bình Thuận), đất phèn (đồng bằng sông Cửu Long), đất đỏ (Đồng Nai),... Chất lượng thanh long phụ thuộc nhiều vào phân bón. Chế độ bón phân giàu đạm, ít kali thưởng cho trái có độ ngọt kém, mau hư thối, khó bảo quản và vận chuyển. Ngược lại chế độ bón phân cân đối đạm và kali hoặc giàu kali sẽ cho trái có độ ngọt cao
hơn, trái cứng chắc và lâu hư thối, dễ bảo quản, vận chuyển.
Độ dinh dưỡng của một số loại phân được quy định như sau:
- Độ dinh dưỡng của phân đạm được tính bằng %m(N) có trong phân.
- Độ dinh dưỡng của phân lân được tính bằng ( ) 25%mPO tương ứng với lượng P có trong phân.
- Độ dinh dưỡng của phân kali được tính bằng ( ) 2 %m KO tương ứng với lượng K có trong phân.
a) Tính độ dinh dưỡng của phân 3KNO biết loại phân này chứa 20% (về khối lượng) tạp chất không chứa kali và nitơ.
b) Bảng dưới đây hướng dẫn liều lượng trên tả
Giai đoạn phát triền cây Loại phân bón Thành phần
Ngay trước khi thu hoạch N 216 g
25PO 216 g
Chất hứu cơ 20 kg
Hai tháng sau khi thu hoạch quả N 162 g
25PO 144 g
2 KO 45 g
Ngay sau khi cây ra hoa N 54 g
25PO 288 g
2 KO 120 g
Khi trái non đang phát triển N 108 g
25PO 72 g
2 KO 135 g
Nguồn: http://chemicalsolutionstech.wordpress.com
Một bác nông dân trộn phân để bón cho thanh long như sau: Trộn 430 gKC1 (phân kali) với 3 1312 gNaNO
(phân đạm) và 34 334 gNaPO (phân lân). Cho biết bác nông dân đó chuẩn bị phân bón cho cây thanh long ở giai đoạn nào?
Câu 4: (2 điểm) Hiđrocacbon và nhiệt của phản ứng
1. Đốt cháy hoàn toàn 4,16 gam hiđrocacbon A (mạch hở, là chất khí ở điều kiện thường và A M26 > ) rồi dẫn hỗn hợp sản phẩm cháy vào dung dịch 2Ca(OH) dư, thu được 32 gam kết tủa trắng.
a) Tìm công thức phân tử và viết công thức cấu tạo của A
b) Dẫn 1,12 lít A (đktc) vào lượng dữ dung dịch 33AgNO/NH , thu được m gam kết tủa. Tính m ?
2. Biến thiên entanpi của phản ứng (kí hiệu là ΔH ) có thể hiểu đơn giản là nhiệt toả ra hoặc thu vào khi phản
ứng hoả học xảy ra. Nếu phản ứng toả nhiệt thì ΔH có dấu âm và ngược lại, nếu phản ứng thu nhiệt thì AH có dấu dương. Khi một phản ứng hoá học xảy ra, các liên kết trong chất phản ứng bị cắt đứt và các liên kết mới được hình thành, tạo nên chất sản phẩm. Để tính AH của phản ứng, người ta dựa vào năng lượng các liên kết ( lk E ). Elk là năng lượng cần cung cấp để cắt đứt một liên kết thành các nguyên tử ở thể khí. Năng lượng tỏa ra khi hình thành liên kết đó từ các nguyên tử ở thể khí cũng có giá trị dấu ngược lại. Ek của một số liên kết được cho trong bảng sau: giá trị của E nhưng có
Liên kết CC ≡ C-C C-H H-H
Xét phản ứng: ( ) 22226 CH2HCH1 +→
Dựa vào bảng số liệu trên hãy:
a) Tính năng lượng cần cung cấp để phá vỡ liên kết của các chất tham gia trong phản ứng (1) (lưu ý hệ số của các chất trong phương trình phản ứng).
b) Tính năng lượng toả ra khi hình thành các liên kết trong chất sản phẩm của phản ứng (1).
c) Từ các kết quả trên, xác định ΔH của phản ứng (1) và cho biết phản ứng (1) toả nhiệt hay thu nhiệt?
Câu 5: (2 điểm) Axit hữu cơ, este và tác nhân phản ứng
1. Axit X (chỉ chứa C,H,O trong phân tử) là một hợp chất hữu cơ sinh học. Khi vận động mạnh trong một thời gian dài và cơ thể không được cung cấp đủ oxi, glucozơ trong cơ thể sẽ bị chuyển hóa thành axit X .
Axit X sinh ra trong quá trình vận động là nguyên nhân chính tạo ra cảm giác mỏi ở cơ bắp. Axit X cũng có mặt trong sữa chua và dưa muối.
a) Bằng phương pháp phổ khối lượng MS, người ta xác định được phân tử khối của X là 90 . Bằng các
phương pháp phổ hiện đại khác như phổ hồng ngoại IR và phổ cộng hưởng từ hạt nhân NMR, người ta xác
định được phân tử của X chứa nhóm chức OH và COOH cùng liên kết với một nguyên tử cacbon. Xác
định công thức phân tử và công thức cấu tạo của axit X .
b) Nêu một biện pháp đơn giản giúp vận động viên giảm cảm giác mỏi cơ do axit X bị tích tụ nhiều trong quá trình tập luyện thể thao.
c) Để axit X trong bình phản ứng, cho thêm vài giọt axit sunfuricđặc (làm xúc tác), rồi đun nóng. Sau một thời gian, thu được hỗn hợp các chất, trong đó có hợp chất hữu cơ Y . Trong phân tử Y, nguyên tố oxi chiếm
44,44% về khối lượng và phân tử khối của Y khoảnh từ 75 đến 150 . Xác định công thức phân tử, công thức cấu tạo của Y . Viết phương trình hóa học của phản ứng tạo ra chất Y
2. Chất Z là một tác nhân hóa học được dùng nhiều trong tổng hợp hữu cơ.
a) Bằng phương pháp phân tích nguyên tố người ta xác định được thành phần phần trăm về khối lượng của
N và H trong Z lần lượt là 87,5% và 12,5% . Do điều kiện thí nghiệm không đầy đủ nên người ta chỉ xác
định được phân tử khối của Z năm trong khoảng 30 đến 40 . Việt công thức cấu tạo của chất Z .
b) Biết chất Z có tính khử, viết phương trình hóa học xảy ra khi cho Z phản ứng với 2Cl
c) Ngoài việc thu được chất Y khi nhỏ axit sunfuric vào axit X (trong Câu 5.1, ý c ở trên), người ta còn thu
được chất hữu cơ T . Quá trình hình thành và chuyển hóa T (có sử dụng tác nhân Z ) thành chất hữu cơ Q nhu sau:
Câu 1 (VDC):
1. (VDC):
Phương pháp:
D
ựa vào mối liên hệ các hợp chất vô cơ.
Cách giải:
a)
X:BaO 2M:CO 23Y:NaCO 4 Z:NHCl 43T:NHNO

b)
Gọi số mol của ,,, XYZT là a 22 BaOHOBa(OH) +→
Dự đoán công thức cấu tạo của chất T,P và Q biết trong phân tử của Q,N chiếm 32,56% về khối lượng.
42232 2NHClBa(OH)BaCl2NH2HO +→++
a1/2a ( ) 432332 2 2NHNOBa(OH)BaNO2NH2HO + → ++
a 1/2a 2233 BaClNaCOBaCO2NaCl +→+
1/2a 1/2a
( ) 32333 2 BaNONaCOBaCO2NaNO +→+
1/2a 1/2a
A là 3NH
C : là 3BaCO
B: 3NaCl,NaNO
2. (VDC):
Phương pháp:
Dựa vào tính chất hóa học của các chất.
Cách giải:
Gọi số mol của Mg và Fe trong 1 phần lần lượt là x,y
Phần 1:
H2 n0,8 mol =
Ta có hệ:
245676,8/2 xy+=
220,8.2 xy+= 0,2 x = 0,6 y =
Phần 2 :
Nếu chỉ có Mg phản ứng thì ran m40x8 ==
Nếu cả Mg và Fe phản ứng hết thì ran m40x160y/256 =+=
Mà 84056Mg << phản ứng hết và Fe phản ứng 1 phần. ( ) 23 FeFe phan ung n408/1600,2n0,4mol O =−= =
() 3 2 MgFepu CuNO nnn0,6mol =+=
a1M = ( ) CuFedu bmm0,6.640,60,4.5649,6gam =+=+−=
Câu 2 (VDC):
1. (VDC):
Phương pháp:
Dựa vào lý thuyết về nhôm.
Cách giải:
Vì vôi tôi có thành phần là 2Ca(OH) là chất kiềm, chất này sẽ phá hủy dần các đồ vật bằng nhôm do có xảy
ra các phản ứng. Do đó, ca nhôm bị thủng.
( ) 23222 2 AlOCa(OH)CaAlOHO +→+
( ) 2222 2 2AlCa(OH)HOCaAlO3H ++→+
2. (VDC):
Phương pháp:
Dựa vào lý thuyết về nhôm.
Cách giải:
Do nhôm có đặc tính nhẹ, bền với không khí
d
ụng làm dụng cụ nhà bếp như xoong, chảo...
3. (VDC):
Phương pháp:
Dựa vào lý thuyết về nhôm.
Cách giải:
322Al6HCl2AlCl3H +→+
3332 AlCl3NaHCOAl(OH)3NaCl3CO +→++
3223 AlCl3NaAlO6HO3NaCl4Al(OH) ++→+
3du22 AlCl4NaOHNaAlO3NaCl2HO +→++
22233 CONaAlO2HOAl(OH)NaHCO ++→+
3A:AlCl
B,C là 2NaAlO và 2CO (có thể đổi cho nhau)
3D:Al(OH)
E: NaCl
2H:CO
G: 3NaHCO
4. (VDC):
Phương pháp:
Dựa vào lý thuyết về điều chế nhôm.
Cách giải:
a) Vai trò của criolit trong phản ứng điều chế nhôm bằng phương pháp điện phân nóng chảy.
- Tạo với 23AlO một hỗn hợp có nhiệt độ nóng chảy thấp làm giảm năng lượng trong quá trình điện phân.
- Criolit có tỷ khối nhỏ hơn nhôm nên ngăn không cho nhôm nóng chảy mới sinh tiếp xúc với oxi.
- Tăng tính dẫn điện của hỗn hợp điện phân.
b) Sau 1 thời gian điện phân, người ta thấy hiện tượng dương cực tan bị ăn mòn là do C phản ứng với 2O sinh ra tạo 2CO , tại đây xảy ra ăn mòn điện cực than chì
22 COCO +→
Do đó sau một thời gian điện phân, người ta thấy cực dương bị ăn mòn và phải thay thế
c)
Al n2 = tấn mol
23 n AlO lý thuyết Al 1/2n/90%10/9 . == tấn mol
bôxit 10.102.100/9.75151,1 m == tấn
Câu 3 (VDC):
1. (VDC):
Phương pháp:
Dựa vào lý thuyết về kali
Cách giải:
a)
Nguyên tử khối Tb của 39.93,25840.0,01241.6,730 K39,13 100 ++ ==
b)
Tổng số nguyên tử K trong 32321420mg420.106.10/39,136 . ,44.10 == (nguyên tử)
Khối lượng của đồng vị 392123 K0,93258.6,44.1039/6.100,39 == gam
Khối lượng đồng vị 4021235 K0,00012.6,44.10.40/6.105,152.10 == gam
Khối lượng đồng vị 412123 K0,0673.6,44.10.41/6.100,0229 == gam
c)
Mol của K trong máu trong khoảng: 0,690/39,130,986/39,130,0180,025 −=−
Nồng độ của K trong máu là: 330,018/50,025/53,6.105.10 −=−
2. (VDC):
Phương pháp:
Dựa vào lý thuyết về phân bón hóa học Cách giải:
a)
Xét 100 gam 3KNO
n80/101n40/101 = =
32KNO KO
K2O % m40.94/10037,23% ==
NaNO3Nn15,44 molm15,44.14216,16 g = ==
n2,04 molm1/2.2,04142144,84 g = =⋅=
Na3PO4 P2O5
So sánh bảng trên ta thấy, lượng phân kali và đạm bón nhiều, lân bón ít ứng với giai đoạn cây thanh long khi
có trái non đang phát triển.
Câu 4 (VDC):
1. (VDC):
Phương pháp:
D
ựa vào bài toán đốt cháy hiđocacbon.
Cách giải:
a)
CO2 n0,32 mol = ( )
H2O n4,160,32.12/20,16 =−=
CH n:n0,32:0,321:1 ==
Dó A M26 > và x là chất khí có số C4A ≤ là 44CH
CTCT của 2 A:CHCCHCH ≡−= hoặc 22 CHCCCH ===
b)
Vì A có phản ứng với 33 AgNO/NHCTCT của A là 2 CHCCHCH ≡−=
A n0,05 mol =
2AgCCCHCH m0,05.1597,95gam =−= ==
2. (VDC):
Phương pháp:
Dựa vào lý thuyết hiệu ứng nhiệt phản ứng.
Cách giải:
a) Năng lượng cần cung cấp để phá vỡ liên kết của các chất tham gia trong phản ứng (1) là ( ) lk( (dâu)
E2.418,4839,02.432,02539,8 kJ/mol =++=
b)
Năng lượng tỏa ra khi hình thành các liên kết trong chất sản phẩm của phản ứng (1)
NN n80/101%m80.14.100%/101.10011,08% = ==
b)
( ) ( )
n5,77 molm1/2.5,77.94271,19 g = ==
KCl K2O
( ) cuoi E343,36.418,42853,7 kJ/mol =+=
c)
ΔHEE539,82853,7313,9 kJ/mol0=−=−=−<

( ) lk (dau)cuoi
(1) là phản ứng tỏa nhiệt, năng lượng tỏa ra của phản ứng (1) là 313,9 ( )kJ/mol
Câu 5 (VDC):
1. (VDC):
Phương pháp:
Dựa vào lý thuyết về axit.
Cách giải:
a)
Vì X M90 = nên X chỉ có thể chứa 1 nhóm OH và 1 nhóm COOH
Đặt CT của X là ( )( ) R ROHCOOHM28 →=
→ CTPT phù hợp của X là: ( )( ) 24 CHOHCOOH hay 363CHO
CTCT phù hợp: ( ) 3 CHCHOHCOOH
b)
Một số biện pháp giúp hạn chế tích tụ axit lactic gây mỏi cơ:
- Uống đủ nước, bổ sung oserol khi tập thể thao nặng ra nhiều mồ hôi.
- Nghỉ ngơi giữa các buổi tập, thực hiện bài tập thở.
- Làm nóng và giãn cơ để hạn chế tích tụ axit lactic....
c)
Khi có mặt axit sunfuric đặc (làm xúc tác), axit lactic sẽ thực hiện phản ứng este hóa. Dễ thấy 90.2 - 15018 >
nên sản phẩm tạo thành phải là este vòng, 2 chức.
Phương trình hóa học: 0
3636842 2CHOCHO2HO + →
Kiểm tra lại: %m16.4.100%/14444,44% O ==
CTPT của Y là 684CHO
CTCT của Y là
2. (VDC):
Phương pháp:
Dựa vào tính chất hóa học của các chất.
Cách giải:
a)
NH m:m87,5%:12,5% =
NH n:n1:2 =
Vì Z 30M40 << nên Z chỉ có 1 hoặc 2 nguyên tử N , vì số H chẵn nên số N cũng phải chẵn
Z → phải có 2 nguyên tử N → CTPT của Z là 24NH
CTCT của Z là 22NHNH .
b)
2422 NHClNHCl +→+
c)
CTCT của các chất:
T là ( ) ( ) 33 CHCHOHCOOCHCHCOOH hoặc ( ) 23 CHCHCOOCHCHCOOH =−
P là ( ) ( ) 333 CHCHOHCOOCHCHCOOCH hoặc ( ) 233 CHCHCOOCHCHCOOCH =−
Vì trong Q có N chiếm 32,56% , mà Q phải có 2 nguyên tử N nên Q M86 =
Q → là 22 CHCHCONHNH =−−
GIÁO DỤC VÀ ĐÀO TẠO THANH HÓA
TRƯỜNG THPT CHUYÊN LAM SƠN
ĐỀ THI CHÍNH THỨC (Đề thi có 04 trang)
Câu 1: (1 điểm)
ĐỀ THI TUYỂN SINH VÀO LỚP 10
NĂM HỌC 2022 - 2023
MÔN: HÓA HỌC (CHUYÊN)
Thời gian làm bài: 150 phút
1. Một hợp chất có công thức 2MX , trong đó M chiếm 62,5% về khối lượng. Trong hạt nhân của M,X đều có số hạt nơtron bằng số hạt proton. Tổng số hạt proton trong 2 MX là 32 . Tìm công thức của 2 MX
2. Cho các dung dịch sau: 4232 NaHSO,NaCO,NaOH,BaCl . Trộn lẫn các dung dịch với nhau từng đôi một, viết phương trình phản ứng hóa học xảy ra.
Câu 2: (1 điểm) Hoà tan hỗn hợp rắn A gồm 23BaO,FeO,AlO vào lượng nước dư, thu được dung dịch D
và phần không tan B . Sục khí 2CO dư vào dung dịch D , thu được kết tủa. Dẫn khí CO dư qua B nung
nóng thu được chất rắn E. Cho E tác dụng với dung dịch NaOH dư, thấy tan một phần và còn lại chất rắn
G . Hoà tan hoàn toàn G bằng dung dịch HCl vừa đủ thu được dung dịch H . Chia H thành 2 phần
Ph
ần 1: Tác dụng với dung dịch NaOH dư, lọc kết tủa nung trong không khí đến khối lượng không đồi, thu
được chất rắn K
Phần 2: Tác dụng với dung dịch 4KMnO trong dung dịch 24HSO loãng dư
Biết các phản ứng xảy ra hoàn toàn. Xác định thành phần các chất trong ,,,,, BDEGHK và viết phương trình phản ứng hoá học xảy ra.
Câu 3: (1 điểm)
1. Chỉ được dùng thêm dung dịch phenolphtalein, phân biệt các dung dịch cùng nồng độ 0,1 mol/l trong các

ống nghiệm mất nhãn sau: 224 HCl,NaOH,NaCl,BaCl,HSO
2. Hỗn hợp gồm 3223 CuO,AlCl,CuCl,AlO . Nêu phương pháp tách riêng từng chất ra khỏi hỗn hợp.
Câu 4: (1 điểm) Cho các sơ đồ phản ứng sau:
(1) 2FeS + Khí ( )A → Chất rắn ( )B + Khí ( )D
(2) ( )D + Khí ( )E → Chất rắn ( ) 2 FHO +
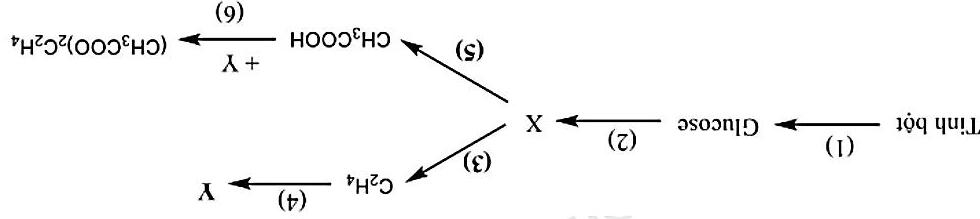
(3) ( ) ( ) ( )FAD +→
(4) ( ) ( ) 2 ENaOHGHO +→+
(5) (G) ( ) 2 NaOHHHO +→+
(6) ( ) ( ) ( )HI(K)L ↓ +→+
(7) ( ) ( ) ( )KHClIE +→+
(8) ( ) 22 EClHO++→
Biết (E ) là khí độc, sinh ra trong quá trình phân hủy xác động vật, hoàn thành sơ đồ phản ứng trên.
Câu 5: (1 điểm)
1. Cho từ từ dung dịc HCl đến dư vào dung dịch X chứa a 23 molNaCO, b mol 3NaHCO . Ta có đồ thị như
hai hình dưới đây:
Cho từ từ dung dịch X vào dung dịch chứa 1,4amolHCl, khuấy đều. Tính số 2 molCOsinh ra?
2. Hòa tan hoàn toàn 36 gam oxit của kim loại M (hóa trị II) bằng lượng vừa đủ dung dịch 24 HSO20% (loãng), thu được dung dịch X có nồng độ 28,07% (coi 2 HO không bay hơi trong quá trình phản ứng).
a) Tìm kim loại M
b) Làm nguội dung dịch X đến nhiệt độ tC thấy tách ra m gam tinh thể 42O . MSO5H . Biết rằng độ tan của
4MSO ở nhiệt độ 0 tC là 17,074 gam. Tính giá trị của m.
Câu 6: (1 điểm) Hòa tan 28 gam hỗn hợp X gồm 34 Fe,FeO,CuO vào dung dịch HCl, thu được 3,2 gam một kim loại, dung dịch Y chỉ chứa muối và 2 0,05 molH . Cho Y tác dụng với dung dịch 3AgNO dư, thu được 132,85 gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Tính khối lượng mỗi chất trong X .
Câu 7: (1 điểm)
1. Cho chuỗi phản ứng sau (mỗi mũi tên tương ứng với một phương trình hóa học):
Viết phương trình hóa học (ghi rõ điều kiện) và xác định các chất X,Y
2. Cho X là hợp chất hữu cơ no, mạch hở có công thức đơn giản là 233CHO . Biết X chỉ chứa các nhóm chức OH, - COOH . Xác định công thức cấu tạo của X Câu 8: (1 điểm)
1. Nếu quy ước: Công thức cấu tạo thu gọn nhất chỉ biểu diễn liên kết giữa các nguyên tử cacbon và nhóm chức. Mỗi đầu đoạn thẳng hoặc điểm gấp khúc ứng với một nguyên tử cacbon, không biểu thị số nguyên tử hiđro liên kết với mỗi nguyên tử cacbon...Chất X có công thức cấu tạo thu gọn nhất như hình bên.
2. Bằng kiến thức hóa học, giải thích và viết phương trình hóa học trong các trường hợp sau:
a) Nói về việc ăn cơm, các cụ xưa có câu: “nhai kĩ no lâu”
b) Khi lên men rượu (ancol etylic) thì cần ủ kín còn khi lên men giấm thì lại để thoáng khí.
Vận dụng quy ước trên, cho biết
a) Phân tử chất X có bao nhiêu liên kết ?
b) Công thức phân tử của X?
2. Dẫn 1 gam hỗn hợp X gồm axetilen, propen, etan vào lượng dư dung dịch chứa 33AgNO/NH thu được

1,2 gam kết tủa. Mặt khác, 3,36 lít hỗn hợp X làm mất màu tối đa 200ml dung dịch 2 Br0,5M . Tính thể tích
mỗi khí trong 1 gam hỗn hợp X.
Câu 9: (1 điểm) Hỗn hợp X gồm 3 este đơn chức, mạch hở, tạo thành từ cùng một ancol Y với 3 axit
cacboxylic (phân tử chỉ có nhóm - COOH , trong đó, có hai axit no là đồng đẳng kế tiếp nhau và một axit
không có chứa một liên kết đôi CC = trong gốc không nằm ở đầu mạch cacbon). Thủy phân hoàn toàn m gam X bằng dung dịch NaOH , thu được 9,78 gam hỗn hợp muối và a gam ancol Y . Cho a gam Y vào
bình đựng Na dư, sau phản ứng thu được 1,344 lít khí và khối lượng bình tăng 5,4 gam. Mặt khác, nếu đốt cháy hoàn toàn m gam X thì thu được 2 HO và 10,752 lít 2CO . Thể tích các khí đều đo ở điều kiện tiêu chuẩn.
Xác định công thức cấu tạo và phần trăm khối lượng mỗi chất trong X
Câu 10: (1 điểm)
1. Cho sơ đồ thí nghiệm điều chế khí A như hình bên. Vậy khí A có thể là khí nào trong hai khí sau:
22Cl,SO ? Giải thích, chọn chất X,Y,Z thỏa mãn và viết phương trình phản ứng xảy ra?

Câu 1 (VDC):
1. (VDC):
Phương pháp:
Dựa vào bài toán về số hạt.
Cách giải:
HƯỚNG DẪN GIẢI CHI TIẾT
( ) 23222 2 AlOBa(OH)BaAlOHO +→+
Do E tan một phần trong dung dịch NaOH , chứng tỏ E có 23AlO
Dung dịch D gồm: ( ) 2 2 BaAlO , chất rắn B là 23FeO,AlO dư.
Sục 2CO dư vào dung dịch D : ( ) ( ) 22233 2 2 2COBaAlO4HO2Al(OH)BaHCO ++→+
PN PNPN + =⋅= +++
% m100%62,5% 2 MM M MMXX
Dẫn khí CO dư qua B nung nóng:
⋅= +
10062,5 2 M MX
P PP
Mà tổng số hạt proton của hợp chất là 32
MX P2P32 +=
M P20M = là Ca
X P6X = là C
CT của 2 MX là 2CaC
2. (VDC):
Phương pháp:
Dựa vào tính chất hóa học của các chất.
Cách giải:
4232422 2NaHSONaCO2NaSOCOHO +→++
4242 NaHSONaOHNaSOHO +→+
424 NaHSOBaClBaSOHClNaCl +++ →
2323 NaCOBaClBaCO2NaCl +→+
Câu 2 (VDC):
Phương pháp:
Dựa vào tính chất hóa học của các chất.
Cách giải:
A tác dụng với 2 HO dư:
22 BaOHOBa(OH) +→
0 2COFeOFeCO t +→+
Chất rắn E là 23Fe,AlO
E tác dung với dung dịch NaOH dư:
2322 AlO2NaOH2NaAlOHO +→+
Chất rắn G là Fe
G tác dụng với dung dịch HCl vừa đủ 22Fe2HClFeClH +→+
Dung dịch H là 2FeCl
Xét phần 1 : 22 FeCl2NaOHFe(OH)2NaCl +→+
Kết tủa: 2Fe(OH)
Nung trong không khí 0 22232 4Fe(OH)OFeO4HO + → +
Chất rắn K là 23FeO
Xét phần 2 : ( ) 24242424242 3 10FeCl24KMnO6HSO5FeSO10Cl6MnSO3 KSO24HO++→++++
Câu 3 (VDC):
1. (VDC):
Phương pháp:
Dựa vào tính chất hóa học của các chất.
Cách giải:
Trích mỗi dung dịch một ít làm mẫu thử, cho các mẫu thử vào các ống nghiệm riêng biệt có đánh số
Nhỏ vài giọt phenolphtalein vào các dung dịch:
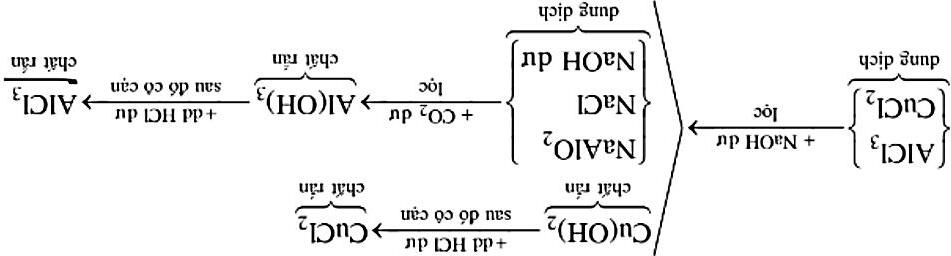
+ Dung dịch làm phenolphtalein hóa hồng: NaOH
+ Các dung dịch không chuyển màu phenolphtalein: 24HCl,NaCl,BaCl,HSO
Lấy 5 mL các dung dịch 224 HCl,NaCl,BaCl,HSO có chứa vài giọt phenolphtalein. Sau đó nhỏ vào mỗi dung dịch 10 mL dung dịch NaOH
+ Các dung dịch thu được có màu hồng là 2HCl,NaCl,BaCl
2 NaOHHClNaClHO( +→+ vì NaOH dư)
+ Dung dịch thu được không màu là 24HSO
24242 HSO2NaOHNaSOHO +→+ (vì NaOH hết)
Nhỏ dung dịch 24HSO vào các dung dịch 2HCl,NaCl,BaCl
+ Dung dịch thu được kết tủa trắng là 2BaCl
2244 BaClHSOBaSO2HCl +→+
+ Các dung dịch không hiện tượng: HCl,NaCl
Nhỏ từ từ dung dịch NaOH vào các dung dịch HCl,NaCl có sẵn phenolphtalein

+ Dung dịch thu được màu hồng ngay là NaCl
+ Dung dịch còn lại là HCl :
2 NaOHHClNaClHO +→+
2. (VDC):
Phương pháp:
Dựa vào tính chất hóa học của các chất.
Cách giải:
Cho hỗn hợp vào nước khuấy đều, sau đó lọc sẽ thu được
- Dung dịch gồm: 32 AlCl,CuCl
- Chất rắn: 23 AlO,CuO
• Sơ đồ quá trình 32AlCl,CuCl
Các phương trình hóa học
33 AlCl3NaOHAl(OH)3NaCl +→+
22 CuCl2NaOHCu(OH)2NaCl +→+
322 Al(OH)NaOHNaAlO2HO +→+
222 Cu(OH)2HClCuCl2HO +→+
23 CONaOHNaHCO +→
22233 CONaAlO2HOAl(OH)NaHCO ++→+
332 Al(OH)3HClAlCl3HO +→+
Sơ đồ tách 23 AlO,CuO ra khỏi hỗn hợp
Các phương trình hóa học
2332 AlO6HCl2AlCl3HO +→+
22 CuO2HClCuClHO +→+
2 HClNaOHNaClHO +→+
33 AlCl3NaOHAl(OH)3NaCl +→+
22 CuCl2NaOHCu(OH)2NaCl +→+
322 Al(OH)NaOHNaAlO2HO +→+
0
22 Cu(OH)CuOHO t + →
0 3232 Al(OH)AlO3HO + →
Câu 4 (VDC):
Cách giải:
A: 2O B: 23FeO D: 2SO E: 2 HS F: S
G: NaHSH: 22NaI I:FeCl K:FeS L: NaCl
(1) 0 22232 4FeS11O2FeO8SO t +→+
(2) 222SO2HS2 S2HO+→+
(3) 0 22SOSO t → +
(4) 2 2 HSNaOHNaHSHO +→+
(5) 22 NaHSNaOHNaSHO +→+
(6) 22 NaSFeClFeS2NaCl +→+
(7) 22 FeSHClFeClHS +→+
(8) 22224 HS4Cl4HOHSO8HCl ++→+
Câu 5 (VDC):
1. (VDC):
Phương pháp:
Dựa vào tính chất hóa học của các chất.
Cách giải:
Thứ tự phương trình hóa học:
233 NaCOHClNaHCONaCl +→+ (1)
( ) 322 NaHCOHClNaClCOHO2 +→++
Xét hình 1:
Xét tại 1,5a mol HCl, b/3 mol CO2: Xảy ra cả (1), (2) và 3NaHCO dư
Cho từ từ dung dịch ( ) 233XNaCO:0,16 mol;NaHCO:0,24 mol vào dung dịch chứa 1,4a mol HCl
HCl N1,4.0,160,224 mol ==
Các phương trình hóa học
322 NaHCOHClNaClCOHO +→++
x x x mol
2322 NaCO2HClNaClCOHO +→++
y 2y y mol
323HClNaHCONa nn2n0,242.0,160,56HCl CO <+=+= hết, các muối đều dư
HCl nx2y0,224 =+= (III)
Ta có () 3 3 2323
NaHCOpu NaHCO(ban đau) NaCO(pu) NaCO(bandau)
n n x0,24 (IV) nny0,16 = =
Từ (III) và (IV) x0,096 mol,y0,064 mol ==
CO2 n0,0960,0640,16 mol =+=
2. (VDC):
Phương pháp:
Dựa vào tính chất hóa học của các chất.
Cách giải:
a)
Đặt số mol của MO là a mol
( ) M16.a36Ma16a36 += += (I)
2442 MOHSOMSOHO +→+
Dung dịch X là ( ) 4 MSOamol
( ) 24ddXMOHSO mmm3698a/20%36490a =+=+=+ gam
232 HClNaCOCO nnn1,5aab/3
=+ =+ (I)
Xét hình 2:
Xét tại 23 0,75amolHCl,00,04 molNaCO = : chỉ xảy ra (1)
Theo PT (1): 23 NaCOHCl nna0,040,75aa0,16 mol = −= = (II)
Từ (I), (II) b0,24 mol =
( ) ( ) ( ) 4 C%MSOM96.a.100%:36490a28,7% =++= (II)
Từ (I), (II) Ma28,8,a0,45 mol ==
M28,8/0,45 b64 ==
Vậy M là Cu
b)
ddX m36490.45256,5 =+= gam
Làm nguội dung dịch X đến nhiệt độ tC ( ) ddbãohòa m256,5mgam =−
Dung dịch Y tác dụng với 3AgNO dư: ( ) 2333 FeCl2AgNOFeNO2AgClAg +→++ ( ) 2332 CuCl2AgNOCuNO2AgCl +→+
AgCl n2a6 b2c0,1=++−

nCuSO4 (dung dịch đã bão hòa) ( ) 0,45m/250mol=− () () 4
Câu 6 (VDC):
160.0,45 17,074 250
m m m
=⋅=⋅ = −+
C%CuSO100%100%70gam 256,517,074100
Ag na3 b =+ ( ) ( ) 143,52620,1108.3132,85 abcab ++−++= (III)
Từ I, II, III a0,15 = mol, b0,05 mol,c0,1mol==
Khối lượng mỗi chất trong X là
Phương pháp:
Dựa vào tính chất hóa học của các chất.
21. Cách giải:
Đặt số mol các chất trong X gồm 34 Fe,FeO,CuO lần lượt là a,b,c
34 FeFeCuOX mmmm56a232y80c28 O ++==++= (I)
Kim loại thu được là Cu Cun3,2/640,05 mol ==
Sơ đồ phản ứng:
BTNT “Fe” ( ) 3422 FeFeOFeClFeCl n3.nnna3bmol += =+
BTNT “Cu” ( ) 22 CuOCuCuClCuCl nnnnc0,05mol =+ =−
BTNT ''O'' ( ) 3422 FeOCuOHOHO 4nnnn4bcmol += =+
BTNT “Cl” ( ) ( ) HClFeCl2CuCl2HCl n2n2nn2.a3 b2.c0,05 =+ =++−
BTNT “H” 22 HClHHO n2n2n =+ 2.( ) a3 b ++ 2.(c ) ( ) 0,052.0,052.4 bc−=++ (II)
Fe m8,4 = gam
Fe3O4 m11,6 = gam
Cu m6,4 = gam
Câu 7 (VDC):
1. (VDC):
Phương pháp:
Dựa vào tính chất hóa học của các chất.
Cách giải: 25 X:CHOH 22 Y:HOCHCHOH
(1) () 0 H, 610526126 n CHOnHOnCHO + +→
(2) men ruou 61266126 CHO%nCHO →
(3) 24 HSO,170C 25222 CHOHHCCHHO d =+ →
(4) 2242222 3HCCH2KMnO4HO3HOCHCHOH2MnO2KOH =++→−−−++
(5) mengiam 25232 CHOHOCHCOOHHO ++ →
(6) () 0 24 HSO, 32423242 2 2CHCOOHCH(OH)CHCOOCH2HO d t ++ ⇆
2. (VDC):
Phương pháp:
Dựa vào tính chất hóa học của các chất.
Cách giải:
Công thức phân tử của X là: 2n3n3nCHO hay nnn2 (HO)CH(COOH)
X no, mạch hở XCOOHX kkkn = = ( ) 2.223/22knnnn =+−= =
X là 466CHO
CTCT của X là: 2222 (HO)CH(COOH)
2,3-dihydroxysuccinic acid
Câu 8 (VDC):
1. (VDC):
Phương pháp:
Dựa vào cấu tạo của X
Cách giải:
a)
2-hydroxy-2-(hydroxymethyl)malonic acid


Phân tử X có 2 liên kết π .
b)
Công thức phân tử của X là: 7134 CHNO
2. (VDC):
Phương pháp:
Dựa vào tính chất hóa học của các chất.
Cách giải:
Xét 1 gam hỗn hợp X:
Đặt số mol các chất trong 1 gam hỗn hợp 22X:CH (a mol); 36CH (b mol); 26CH (c mol).
223826 CHCHCHmmm26a42 b30c11 X m ++= ++=
( )
Trong X chỉ có 22CH tác dụng với 33AgNO/NH dư:
3343 HCCH2AgNO2NHAgCCAg2NHNO =++→=↓+
22CAg namol =
= = (II)
240a1,2a0,005 mol
Xét 3,36 lít hỗn hợp X:
X n0,15 mol =
2Br n0,2.0,50,1mol ==
Đặt số mol các chất trong 3,36 lít hỗn hợp ( ) ( 2236 X:CHkamol;CH kb mol) 26 ;CH(kc mol).
( )kakbkc0,15III ++=
X tác dụng tối đa với 2Br :
222224 CHBrCHBr +→
ka2ka →
362362 CHBrCHBr +→
kb kb →
( ) Br2 n2kakb0,1IV =+=
Ta có: (III) ( ) ( ) ( ) ( ) ( ) :IVkakbkc/2kakb0,15/0,1abc/2ab1,5 =+++= +++=
Từ I, II, IV a0,005 mol;b0,01mol;c0,015 mol ===
Thể tích mỗi khí trong 1 gam hỗn hợp X:
V0,005.22,40,112 == lít
22CH
36CH V0,01.22,40,224 == lít
26CH V0,015.22,40,336 == lít
Câu 9 (VDC):
Phương pháp:
Dựa vào tính chất hóa học các chất.
Cách giải:
Xét giai đoạn YNa + dư:
2H n0,06 mol =
2 R'OH2Na2RONaH ′ +→+
ROH n0,12 mol =
==
25325 HCOOCHCHCOOCH n0,06 mol,n0,03 mol
HCOOC2H5 % m42,28% =
325 СHCООCH % m25,14% =
325 CHCHCHCH % m32,58% −=− =
YHY mmmm −= =−= gam
2 bình ăng 5,42.0,065,52
Y M5,52/0,1246Y == là 25 CHOH
Xét giai đoạn X tác dung với NaOH
Đặt công thức trung bình của X là 25RCOOCH
25 25 RCOOCHNaOHRCOONaCHOH +→+
BTKL: 25 NaOHmuoiCHOHmmmm +=+
Câu 10 (VDC):
1. (VDC):
Phương pháp:
Dựa vào lý thuyết điều chế khí 2SO
Cách giải:
Khí A là 2SO
X là 24HSO đặc
9,785,5240.0,1210,5
m =+−= gam
Xét giai đoạn đốt cháy :
CO2 n0,48 mol =
Đặt công thức và số mol của các chất trong ( ) n2n2m2m2 X:ChO(xmol,n3);CHOymol,m6 >≥
( )xy0,12I +=
( ) ( ) 1432.1430.10,5 nxmy +++= (II)
BTNT “C”: nx + ny = 0,48 (III)
Từ I, II, III x0,09,y0,03 ==
Từ III ( ) 0,480,03 m/0,093m7 −> <
Mà 6 m ≥
6 m =
=> este không no: 325 HCCHCHCOOCH −=−
( ) n0,480,03.6/0,093,33 =−= este là 25HCOOCH và 325 CHCOOCH
З 2525 СH СООС HHCOOCH nn0,09 +=
25325 HCOOCHCHCOOCH 3n4n6.0,030,48 ++=
Y là 23NaSO
Z là NaOH ()
0 224(dac) 2422 3 NaSOHSONaSOSOHO t r +++ →
24HSO đặc có tính hóa nước nên 2SO thu được là 2SO khô.
Bông tẩm dung dịch NaOH có vai trò hấp thụ 2SO để hạn chế 2SO bay ra ngoài gay ô nhiễm môi trường và
ảnh hưởng đến sức khỏe con người vì 2SO là khí độc
2232 SO2NaOHNaSOHO +→+
23 SONaOHNaHSO +→
Khí A không thể là 2Cl vì khi đó 2Cl lẫn HCl và hơi nước.
0 đac 222 2 MnO4HClMnClCl2HO t r ++ → +
()
2. (VDC):
Phương pháp:
Dựa vào lý thuyết điều chế khí 2SO
Cách giải:
a)
Nhai kĩ là để chia nhỏ hạt cơm làm tăng diện tích tiếp xúc giữa hạt cơm và nước bọt, giúp enzim trong nước
bọt xúc tác cho phản ứng thủy phân tinh bột thành đextrin, rồi thành đường mantozơ nhanh hơn, sau đó
mantozơ đi xuống ruột và sẽ bị thủy phân thành glucozơ. Tại các mô glucozơ bị oxi hóa chậm thành 2CO và
2 HO đồng thời giải phóng năng lượng cho cơ thể hoạt động:
enzim
2CHOnHOnHO +→
61052122211 n mantozo
enzim
CHOnHOnCHO +→
12221126126 mantozoglucozo
CHO6O6CO6HO +→+
6126222
glucozo
b)
Khi lên men rượu (ancol etylic) thì cần ủ kín vì lên men rượu cần môi trường không có oxi: men ruou
61266126 CHO%nCHO →
Nếu lên men rượu có oxi thì rượu sẽ bị oxi hóa một phần thành 33 CHCHO,CHCOOH
Khi lên men giấm thì lại để thoảng khí vì lên men giấm cần oxi: mengiam
25232 CHOHOCHCOOHHO + → +
GIÁO DỤC VÀ ĐÀO TẠO HẢI DƯƠNG
ĐỀ THI CHÍNH THỨC (Đề thi có 03 trang)
Câu 1: (2 điểm)
ĐỀ THI TUYỂN SINH VÀO LỚP 10
NĂM HỌC 2021 - 2022
MÔN:
HÓA HỌC (CHUYÊN)
Thời gian làm bài: 150 phút
1. Nêu hiện tượng và viết phương trình hóa học cho các thí nghiệm sau:
a) Sục khí 2CO từ từ đến dư vào dung dịch 2Ba(OH)
b) Thả mảnh Al vào dung dịch NaOH dư đến khi phản ứng hoàn toàn.
c) Dẫn từ từ khí 2SO vào dung dịch hỗn hợp gồm 22 Br,BaCl (tỉ lệ mol 1:1 ) tới dư.
d) Cho từ từ dung dịch 4NaHSO vào dung dịch ( ) 3 2 BaHCO cho tới dư.
2. Tổng số hạt proton, nơtron, electron trong hai nguyên tử của hai nguyên tố X và Y là 78 , trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 26 . Tỉ lệ số hạt mang điện trong X so với số hạt mang điện trong Y là 10:3 .
a) Tìm tên 2 nguyên tố X và Y
b) M là hợp chất chứa 2 nguyên tố X và Z , khi hoà tan trong nước cho dung dịch có tính kiềm, R là hợp chất chứa hai nguyên tố Y và Z , khi hoà tan trong nước cho dung dịch chứa chất tan E có tính axit yếu.
Hợp chất G chứa đồng thời cả ba nguyên tố ,, XYZ , không tan trong nước nhưng tan trong dung dịch E
Xác định các chất M,R,E,G . Viết các phương trình phản ứng.
Câu 2: (2 điểm)
1. Có 6 dung dịch: 2442 KOH,HCl,HSO,KCl,KHSO,BaCl có cùng nồng độ mol. Chỉ dùng thêm quì tím
trình bày cách phân biệt các dung dịch trên. Viết các phương trình phản ứng hóa học xảy ra.
2. A,B,C,D,E là các hợp chất hữu cơ mạch hở khác nhau (chứa C,H,O ) và đều có phân tử khối bằng 60 .
Cho các chất lần lượt tác dụng với Na , dung dịch 3NaHCO , dung dịch NaOH kết quả thí nghiệm thu được
như sau: (dấu ( )+ là có phản ứng; dấu ( ) là không phản ứng)
A B C D E
Na + - + + -
3NaHCO + - - - -
NaOH + + - - -
Biết rằng C là hợp chất đơn chức. Xác định công thức cấu tạo của các chất A,B,C,D,E và viết phương
trình phản ứng xảy ra.
3. X là este có công thức đơn giản nhất là 232CHO được tạo thành từ axit cacboxylic và ancol. Tìm công
thức phân tử và viết công thức cấu tạo có thể có của X
Câu 3: (2 điểm)
1. Từ 222 FeS,O,HO và NaCl (chất xúc tác và các điều kiện thí nghiệm có đủ), viết phương trình phản ứng
điều chế ( ) 2443 3 FeSO,FeSO,Fe(OH)
2. Hỗn hợp X có khối lượng 28,11 gam gồm hai muối vô cơ 23RCO và 3RHCO . Chia X thành 3 phần bằng nhau:
- Phần 1 hòa tan hết trong nước rồi cho tác dụng với dung dịch 2Ba(OH) dư, thu được 21,67 gam kết tủa.
- Phần 2 nhiệt phân một thời gian, thu được chất rắn có khối lượng giảm nhiều hơn 3,41 gam so với khối lượng đem nhiệt phân.
- Phần 3 phản ứng được tối đa với V ml dung dịch KOH 1M.
Xác định công thức của 2 muối và tính giá trị của V
3. Trong thực tế người ta thường nấu rượu (ancol etylic) từ gạo. Tinh bột chuyển hóa thành ancol etylic qua 2 giai đoạn. Tinh bột → glucozo → ancol etylic. Tính thể tích (số lít) ancol etylic 46 thu được từ 10 kg gạo (chứa 81% tinh bột, còn lại là chất không tham gia chuyển hóa). Biết hiệu suất mỗi giai đoạn là 80% , khối lượng riêng của 25 CHOH là 0,8 g/ml
Câu 4: (2 điểm)
1. Cho 21,7 gam hỗn hợp R gồm Fe,Mg và Al vào 500ml dung dịch X chứa HCl1M và 24 HSO2M (loãng). Sau khi các phản ứng xảy ra hoàn toàn thu được khí B và dung dịch C .
a) Chứng tỏ trong C còn axit dư
b) Dẫn toàn bộ khí B đi qua 100 gam CuO nung nóng (chỉ xảy ra phản ứng khử CuO thành Cu ), lấy chất rắn thu được cho tác dụng với dung dịch 3AgNO dư thu được 202 gam chất rắn D . Các phản ứng xảy ra hoàn toàn. Tính % khối lượng các chất có trong D
c) Thêm dung dịch chứa 2,6 molNaOH vào dung dịch C , lọc lấy kết tủa đem nung ngoài không khi đến khối lượng không đổi thu được 30,2 gam gam chất rắn E . Tìm khối lượng mỗi kim loại trong R . Các phản ứng xảy ra hoàn toàn.
2. Cho m gam hỗn hợp kim loại Cu,Fe vào 200ml dung dịch chứa hỗn hợp muối ( ) 33 2 CuNO0,5M,AgNO1M . Sau một thời gian thu được dung dịch Z và 28 gam hỗn hợp chất rắn T Thêm 19,5 gam Zn vào Z , sau khi phản ứng hoàn toàn được 18,5 gam chất rắn G và dung dịch M . Tính m .
Câu 5: (2 điểm)
1. Hỗn hợp X gồm 2 H và hai hiđrocacbon A,B được chứa trong bình kín có sẵn chất xúc tác thích hợp.
Nung nóng bình một thời gian (chỉ xảy ra phản ứng cộng 2 H ) thu được 13,44 lít hỗn hợp khí Y (ở đktc).
Chia hỗn hợp khí Y thành 2 phần bằng nhau:
Phần 1: được dẫn qua bình dung dịch brom thấy khí thoát ra khỏi bình chỉ có A . Đốt cháy hoàn toàn A tạo
ra khí 2CO và hơi 2 HO có tỉ lệ thể tích tương ứng là 4:5 (đo ở cùng điều kiện nhiệt độ, áp suất). Đốt cháy
hoàn toàn phần 2 cần 2 1 mol và thu được 10,8 gam 2 HO
a) Xác định công thức phân tử, công thức cấu tạo của A,B
b) Tính phần trăm thể tích của mỗi chất trong X .
2. Hỗn hợp M gồm axit cacboxylic đơn chức X , rượu đơn chức Y và este đơn chức Z(X,Y,Z đều mạch
hở và có số nguyên tử cacbon khác nhau). Để phản ứng vừa đủ với m gam hỗn hợp M cần dùng 150ml dung dịch NaOH 2M (đun nóng), cô cạn hỗn hợp sau phản ứng thu được 28,8 gam một muối khan và hỗn hợp E chứa 2 rượu. Đun nóng toàn bộ E trong 24HSO đặc ở 170C một thời gian thu được 2 anken kế tiếp,
2 rượu dư. Đốt cháy hoàn toàn hỗn hợp gồm 2 anken và 2 rượu dư cần dùng 23,52 lít 2O (đktc). Mặt khác, nếu cho toàn bộ hỗn hợp E vào bình đựng Na dư, sau khi phản ứng hoàn toàn thấy khối lượng bình đựng Na tăng 14,9 gam.
a) Xác định công thức cấu tạo các chất trong M
b) Tính m và khối lượng mỗi chất trong M.
HƯỚNG DẪN GIẢI CHI TIẾT
Câu 1 (VDC):
1. (VDC):
Phương pháp:
Dựa vào tính chất hóa học của các chất.
Cách giải:
a)
Hiện tương: Ban đầu thu được kết tủa trắng, kết tủa tăng dần đến cực đại.
223 COBa(OH)BaCO +→
Sau đó kết tủa tan dần, tan hết khi 2CO dư và thu được dung dịch không màu. ( ) 2323 2 COBaCOHOBaHCO ++→
b)
Hiện tượng: Ban đầu phản ứng chậm do NaOH phá hủy lớp màng oxit bảo vệ:
2322 AlO2NaOH2NaAlOHO +→+
Sau khi lớp màng oxit bị phá hủy, khí bắt đầu xuất hiện, phản ứng tỏa nhiệt, nhiệt tỏa ra của phản ứng lại cung cấp cho phản ứng tiếp tục xảy ra và xảy ra mãnh liệt.
222 2 A12NaOH2HO2NaAlO3H ++→+
c)
Hiện tượng: Dung dịch 2Br bị mất màu, thu được kết tủa trắng.
22224 SOBr2HOHSO2HBr ++→+
2244 BaClHSOBaSO2HCl +→+
d)
Hiện tượng: Thu được kết tủa trắng và có khí không màu bay ra:
( ) 4342422 2 2NaHSOBaHCOBaSONaSO2CO2HO +→+++
2. (VDC):
Phương pháp:
Dựa vào cấu tạo của nguyên tử.
Cách giải:
a)
2PN2PN78 XXYY+++= (I)
X 2P2PNN26 YXY +−−= (II)
Từ I, II X 4P4P104 Y +=
Mà XY P/P10/3 =
XY P20,P6 ==
X là Ca, Y là C
b)
M là CaO
22 CaOHOCa(OH) +→
R là 2CO
2223 COHOHCO + ⇌
Chất tan E là 23HCO
G là 3CaCO ( ) 3223 2 CaCOCOHOCaHCO ++→
Câu 2 (VDC):
1. (VDC):
Phương pháp:
Dựa vào tính chất hóa học các chất.
Cách giải:
Trích mỗi dung dịch một ít làm mẫu thử cho vào các ống nghiệm khác nhau có đánh số.
Nhúng quì tím vào các mẫu thử:
+ Dung dịch làm quì tím hóa xanh: KOH
+ Các dung dịch làm quì tím hóa đỏ (nhóm 1): 244 HCl,HSO,KHSO .
+ Các dung dịch không làm đổi màu quì tím (nhóm 2): 2KCl,BaCl
Lấy 10mL mỗi dung dịch trong nhóm 1. Sau đó nhỏ vào mỗi dung dịch 20mL dung dịch KOH , sau đó
nhúng quì tím vào các dung dịch thu được:
+ Dung dịch không làm đổi màu quì tím thì chất ban đầu là 24HSO vì KOH và 24HSO phản ứng vừa đủ với
nhau:
24242 2KOHHSOKSO2HO +→+
+ Các dung dịch làm quì tím hóa xanh thì các chất ban đầu là 4HCI,KHSO vì KOH dư:
2 HClKOHKClHO +→+
4242 KHSOKOHKSOHO +→+
Nhỏ dung dịch 24HSO vào các dung dịch trong nhóm 2
+ Dung dịch thu được kết tủa trắng là 2BaCl .
2424 HSOBaClBaSO2HCl +→+
+ Dung dịch không có hiện tượng là KCl
Nhỏ dung dịch 2BaCl vào dung dịch 4HCl,KHSO
+ Dung dịch thu được kết tủa trắng là 4KHSO
424 KHSOBaClBaSOHClKCl +→++
+ Dung dịch không có hiện tượng là: HCl
2. (VDC):
Phương pháp:
Dựa vào tính chất hóa học của các chất.
Cách giải:
Công thức phân tử ứng với phân tử khối 60 gồm: 242CHO và 38 CHO
CTCT của 242332 CHO:HCOOCH,CHCOOH,HOCHHCHO
CTCT của ( ) 3832233323 CHO:CHCHCHOH,CHCHOHCH,CHOCHCH
A tác dụng với 3 Na,NaOH,NaHCOA là 3 CHCOOH
332 CHCOOHNaCHCOONa1/2H +→+
332 CHCOOHNaOHCHCOONaHO +→+
33322 CHCOOHNaHCOCHCOONaCOHO +→++
B là 3HCOOCH
3 3 HCOOCHNaOHHCOONaCHOH +→+
C là 322 CHCHCHOH hoặc ( ) 33 CHCHOHCH
37372 2CHOH2Na2CHONaH +→+
D là 2 HOCHCHO
2 22 2HOCHCHO2Na2NaOCHCHOH +→+
E là 323 CHOCHCH
3. (VDC):
Phương pháp:
Dựa vào lý thuyết về xác định CTCT của hợp chất hữu cơ.
Cách giải:
Công thức phân tử của X là ( ) 232CHO n
( ) xchuc k2.2n23n/21/21k1/2122 nnnnn=+−=+≥ +≥ ≤ =
Vậy X là 464CHO
CTCT của X là:
3322 CHOOCCOOCH,HCOOCHCHOOCH
Câu 3 (VDC):
1. (VDC):
Phương pháp:
Dựa vào tính chất hóa học của các chất.
Cách giải:
Điều chế ( ) 24 3 FeSO
0t 22232 3FeS11O2FeO8SO +→+
( ) 0 22325 2SOO2SOxtVO,450500C +− ⇌
3224 SOHOHSO +→
( ) 2324242 3 FeO2HSOFeSO3HO +→+
Điều chế 4FeSO :
222 2NaCl2HO2NaOHHCl +→++ (điện phân dung dịch không có màng ngăn)
0
2322 FeO2H2Fe3HO + → +
24( loãng)42 FeHSOFeSOH +→+
Điều chế 3Fe(OH) : ( ) 24324 3 FeSO6NaOH2Fe(OH)3NaSO +→+
2. (VDC):
Phương pháp:
Dựa vào tính chất hóa học của các chất.
Cách giải:
Đặt số mol của 23RCO và 3RHCO trong mỗi phần lần lượt là a,b
Phần 1:
2 3 ВаСО CO n0,11n=a b ==+
X/3TB hon hop m9,37M85,18 = =
RRR M6185,182M6012,59M24,18 +<<+ <<
R là 4 NH hoặc Na
Phần 2:
TH1: R là Na 0 32322 2NaHCORCOCOHO ++ →
giamCOHO 3,41
mmm=+= gam
22
. b. 441/2 + . b. 183,41 =
1/2
b0,11 mol =
Mà a + b = 0,11 a 0 = (loại)
TH2: R là 4 NH
()43322 2 NHCO2NHCOHO ++ → 0
43322 NHHCONHCOHO t ++ →
96a79 b9,37 +=
Mà ab0,11 +=
a0,04, b0,07 ==
Xét phần 3 :
( ) 433232 2 NHCO2KOH2NHKCO2HO +→++
433232 NHHCO2KOHNHKCO2HO +→++
() 4 4 2 KOHNHHCO NHCO n2n2n2.0,110,22mol =+==
V0,22/122 mL ==
3. (VDC):
Phương pháp:
