

SỞ GIÁO DỤC VÀ ĐÀO TẠO HÀ NỘI (Đề thi có 03 trang)
ĐỀ THI CHÍNH THỨC
Câu 1: (2 điểm)
ĐỀ THI TUYỂN SINH VÀO LỚP 10
NĂM HỌC 2021 - 2022
MÔN: HÓA HỌC (CHUYÊN)
Thời gian làm bài: 120 phút
1. Nêu hiện tượng và viết phương trình hóa học của phản ứng xảy ra trong các thí nghiệm sau:
a) Cho một đỉnh sắt vào dung dịch CuSO4
b) Nhỏ vài giọt dung dịch phenolphtalein vào cốc dựng dung dịch NaOH loãng, sau đó nhỏ từ từ đến dư dung dịch HCI vào cốc và khuấy đều.
2. Cho: X là kim loại phổ biến trong vỏ Trái Đất và có tính nhiễm từ; Y là oxit có chứa 72,41% X về khối lượng; Z và T là các muối khan của X. Phân tử khối của các chất Y, Z, T thỏa mãn điều kiện: MY + MZ = 384 và MT – MZ = 248.
a) Xác định công thức hóa học của X, Y, Z, T.
b) Với các chất X, Y, Z, T ở trên, viết các phương trình hóa học thực hiện sơ đồ chuyển hóa sau (ghi rõ điều
kiện nếu có): () () ()() 1 34 2 % YXZT → →→ ←
Câu 2: (2 điểm)
1. Để xác định xem thực vật có hô hấp hay không, một bạn học sinh
đã làm thí nghiệm như sau: Cho các hạt nảy mầm vào bình được nối
với ống dẫn khí như hình vẽ bên. Dẫn không khí vào ống nghiệm 1 dựng dung dịch KOH dư. Khí thoát ra khỏi ống nghiệm 1 được dẫn qua ống nghiệm 2 dựng nước vôi trong dư. Khí thoát ra khỏi ống nghiệm 2 được dẫn tiếp vào bình chứa hạt nảy mầm. Để khí thoát ra khỏi bình chứa hạt nảy mẩm một thời gian rồi mới cắm đầu ống dẫn khí vào ống nghiệm 3 dựng nước vôi trong dư. Kết thúc thí nghiệm, ở ống nghiệm 2 không có hiện tượng gì
còn ở ống nghiệm 3 thấy xuất hiện vẫn dục màu trắng.
a) Giải thích vì sao phải dẫn không khí qua ống nghiệm 1 và ống nghiệm 2 trước khi dẫn vào bình chứa hạt này mầm.
b) Giải thích vì sao phải để khí thoát ra khỏi bình chứa hạt nảy mầm một thời gian rồi mới cắm đầu ống dẫn khí vào ống nghiệm 3.
c) Dựa vào kết quả thí nghiệm trên, kết luận thực vật có hô hấp không. Từ đó cho biết có nên để nhiều chậu ngâm hạt giống trong phòng ngủ không, vì sao?
2. Tại một phòng thí nghiệm, để kiểm tra hàm lượng hiđro sunfua có trong mẫu khí lấy từ một khu dân cư, người ta cho mẫu khí đó đi vào dung dịch đồng(II) sunfat dư với tốc độ 2,5 lít/phút trong 400 phút (giả thiết
chỉ có phản ứng: H2S + CuSO4 → CuS + H2SO4, phản ứng xảy ra hoàn toàn). Lọc lấy kết tủa, làm khô thu
được 1,92 mg chất rắn màu đen. Biết tại thời điểm nghiên cứu, theo tiêu chuẩn Việt Nam đối với khu dân cư,
hàm lượng hidro sunfua trong không khí không được vượt quá 0,3 mg/m3. Xác định hàm lượng hidro sunfua có trong mẫu khí trên và cho biết không khí tại khu dân cư đó có bị ô nhiễm không.
Câu 3: (2 điểm)
1. Hợp chất X có công thức AB4. Tổng số hạt proton, nơtron và electron trong một phân tử X là 226, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 70. Nguyên tử A có số hạt proton bằng số hạt nơtron. Nguyên tử B cả tổng số hạt trong hạt nhân nhiều hơn số hạt ở lớp vỏ là 18. Xác định số hiệu nguyên tử của A và B.

2. Hấp thụ hết 4,928 gam khí CO2 bằng dung dịch chứa hỗn hợp x mol Ba(OH)2 và y mol NaOH thu được 5,91 gam kết tủa và dung dịch chỉ chứa 8,708 gam muối. Tìm giá trị của x và y.
3. Hòa tan hoàn toàn m gam hỗn hợp X gồm FeO, Fe2O3, Fe3O4 bằng 350 gam dung dịch HCl 14,6% thu
được dung dịch Y. Để trung hòa lượng axit dư trong Y cần dùng 140 ml dung dịch KOH 2M. Mặt khác, để
khử hoàn toàn m gam X thành kim loại cần tối thiểu V lít (đktc) khi CO. Tìm giá trị của V.
Câu 4: (2 điểm)
1. Cho 22,62 gam hỗn hợp X gồm NaOH, Na2CO3, CaCO3, Ca(OH)2 tác dụng hết với dung dịch HCl dư thu
được 3,36 lít (đktc) khí CO2 và dung dịch Y. Cô cạn Y thu được 18,72 gam NaCl và m gam CaCl2. Viết phương trình hóa học của các phản ứng xảy ra và tìm giá trị của m.
2. Hòa tan hết m gam hỗn hợp X gồm Zn, S, FeS2, FeS, Cu2S, MgS bằng dung dịch H2SO4 đặc, nóng thu được dung dịch Y chỉ chứa 169m/89 gam hỗn hợp các muối sunfat trung hòa và 8,4 lít (đktc) khí SO2 là sản phẩm khử duy nhất. Thêm từ từ dung dịch Ba(OH)2 vào Y thu được tối đa 33,165 gam kết tủa. Tìm giá trị của m.
Câu 5: (2 điểm)
1. Các chất hữu cơ X, Y, Z, T đều có công thức dạng CnH2nOn (MX = MY <MZ = MT <100). Biết:
- Chất X phản ứng được với dung dịch NaHCO3
- Chất Y phản ứng được với dung dịch NaOH (đun nóng) nhưng không phản ứng được với Na;
- Chất Z phản ứng được với dung dịch NaOH (đun nóng) và phản ứng được với Na nhưng không phản ứng
được với dung dịch NaHCO3
- Dung dịch chất T làm đổi màu quỳ tím thành đỏ; khi T phản ứng với Na dư thì số mol H2 thu được bằng số mol T tham gia phản ứng.
Xác định công thức cấu tạo của X, Y, Z, T.
2. Hỗn hợp X gồm hai hiđrocacbon mạch hở có công thức CnH2n+2 và CmH2m+2; hỗn hợp Y gồm C2H7N và
C3H9N. Trộn X với Y theo tỉ lệ mol tương ứng là 2 : 1 được hỗn hợp Z. Đốt cháy hoàn toàn 10,28 gam Z
bằng O2 vừa đủ thu được sản phẩm cháy chỉ gồm CO2, H2O và N2. Dẫn toàn bộ sản phẩm cháy vào bình
đựng nước vôi trong dư. Sau khi phản ứng xảy ra hoàn toàn thấy có khí thoát ra khỏi bình, khối lượng bình
đựng nước vôi trong tăng 41,56 gam và có 56 gam kết tủa. Mặt khác, dẫn X qua dung dịch brom dư thì có tối
đa 0,04 mol Br2 tham gia phản ứng và khối lượng bình brom tăng 1,12 gam. Xác định công thức phân tử của các hiđrocacbon trong X.
HƯỚNG DẪN GIẢI CHI TIẾT
Câu 1 (VDC):
1. (VDC):
Phương pháp:
Dựa vào tính chất hóa học của các chất.
Cách giải:
a) Hiện tượng: Đinh sắt bị tan một phần, có kim loại màu đỏ bám vào đinh sắt, dung dịch CuSO4 bị nhạt màu.
PTHH: Fe + CuSO4 ⟶ FeSO4 + Cu
b) Hiện tượng: Ban đầu dung dịch NaOH làm phenolphtalein chuyển màu hồng. Khi nhỏ từ từ đến dư dung
d
ịch HCl thì màu hồng nhạt dần đến mất màu.
PTHH: NaOH + HCl ⟶ NaCl + H2O
2. (VDC):
Phương pháp:
Dựa vào tính chất hóa học của sắt và hợp chất của sắt.
Cách giải:
X là kim loại phổ biến trong vỏ Trái Đất và có tính nhiễm từ ⟹ X là sắt (Fe).
Gọi công thức của Y là FexOy (x, y là số nguyên dương).
(trong ) 56x %100%72,41% 5616 XYm xy =⋅= +
⟹ 56x.100= 72,41.(56x +16y)
⟹ 1545,04x =1158,56y
⟹ x : y= 1158,56: 1545,04 =0,75= 3: 4
⟹ Công thức Ylà Fe3O4
Theo đề bài Z,T là các muối khan củaX:
MY +MZ= 384 ⟹ MZ = 384 -MY =384 -232 =152 ⟹ Z làFeSO4
MT -MZ= 248 ⟹ MT = 248 +MZ= 248 +152 =400 ⟹ TlàFe2(SO4)3.
Sơ đồ chuyển hóa: () (1)(3)(4) 34424 3 (2)
FeOFeFeSOFeSO →→
(1) Fe3O4 + 4H2 0 → Fe + 4H2O
(2) 3Fe + 2O2 0 t → Fe3O4
(3) Fe + H2SO4 loãng ⟶ FeSO4 + H2
(4) 424 2FeSO2HSO + đặc () 2422 3 FeSOSO2HO t ++ →
Câu 2 (VDC):
1. (VDC):
Phưong pháp:
Dựa vào tính chất hóa học của 2CO
Cách giải:
Quá trình hô hấp là quá trình hấp thụ khí oxi ( ) 2O và giải phóng ra khí cacbonđioxit ( ) 2CO
a) Ta phải dẫn không khí vào bình 1 để loại bỏ khí 2CO do xảy ra phản ứng:
2du232 CO2KOHKCOHO +→+
Sau đó không khí thoát ra khỏi ống 1 được dẫn tiếp vào ống 2 đựng nước vôi trong để kiểm chứng xem 2CO
đã bị loại bỏ hết hay chưa. Ta thấy ống 2 không có hiện tượng chứng tỏ 2CO đã được loại bỏ. Nếu còn khí
2CO thì ống 2 sẽ có hiện tượng vẩn đục do có phản ứng:
2232 COCa(OH)CaCOHO +→↓+
b) Ta phải để khí thoát ra khỏi bình chứa hạt nảy mầm một thời gian rồi mới cắm đầu ống dẫn khí vào ống 3
để đẩy hết không khí trong bình tam giác (chứa hạt) và trong ống dẫn khí nối với ống 3 ra. Vì trong không
khí trong bình tam giác và trong ống dẫn khí nối với ống 3 có chứa sãn một lượng 2CO có thể dẫn đến kết
quả bị sai.
c) Ở ống 3 thấy có vẩn đục do có xảy ra phản ứng:
2232 COCa(OH)CaCOHO +→↓+
Như vậy đã xảy ra quá trình hô hấp của thực vật.
Do đó ta không nên để chậu ngâm hạt giống trong phòng ngủ vì cây sẽ hấp thụ khí oxi ( ) 2O khiến cho
phòng ngủ trở nên ngột ngạt thiếu khí oxi ( ) 2O cho sự hô hấp của con người.
2. (VDC):
Phương pháp:
Dựa vào tính chất hóa học của muối.
Cách giải:
- Thể tích không khí đã dẫn vào dung dịch 4CuSO trong 400 phút là:
2,54001000( kkV =×= lit ( ) 3 )1 m =
- Ta có số mol của CuS là: () CuS 1,92 0,02mmol 96 n ==
PTHH: 2424 HSCuSOCuSHSO +→↓+
Theo PTHH trên, ( ) 2 CuS 0,02mmol S H nn==
Khối lượng của 2 HS trong 3 1m không khí đó là:
( )
2S 0,02.340,68mg0,3mg Hm ==>
Không khí của khu dân cư đó bị ô nhiễm.
Câu 3 (VDC):
1. (VDC):
Phương pháp:
Dựa vào lý thuyết về cấu tạo nguyên tử.
Cách giải:
G
ọi số proton, notron, electron của A lần lượt là 11p,n , 1e
Gọi số proton, notron, electron của B lần lượt là 222p,n,e
Tổng số hạt proton, notron, electron trong phân tử 4AB là 226
( ) ( )
1122 2422261 pnpn →+++=
Số hạt mang điện nhiều hơn số hạt không mang điện là 70 ( ) ( )
1212 284702 ppnn →+−+=
Nguyên tử A có số hạt proton bằng số hạt notron ( ) 11 3 pn→=
Nguyên tử B có tổng số hạt trong hạt nhân nhiều hơn số hạt ở lớp vỏ là 18 : ( ) 222 184 pnp →+−=
=
p p n n =
=
=
Vậy số hiệu nguyên tử của A là 6 ; số hiệu nguyên tử của B là 17 .
2. (VDC):
Dựa vào bài toán 2CO phản ứng với dung dịch kiểm.
Cách giải:
2CO 4,928 0,112 mol 44 n ==
Kết tủa là 33BaCO 5,91 BaCO:0,03 mol 197 n ==
Bảo toàn nguyên tố C : () 23CO Ва muoiCO 0,1120,030,082 mol C nnn=−=−=
Trường hợp 1: Toàn bộ 2 Ba + nằm trong muối 3BaCO : 23 Ba(OH)BaCO 0,03 mol nny →===
Ba(OH)NaCO COBaCOCOHO NaOHNaHCO +→+++
223 2322 3
Gọi số mol của 23 NaCOvà 3 NaHCOlần lượt là a và b mol
Số molHClphản ứnglà: HClpu 1,40,281,12 mol n =−=
Bảotoànnguyêntố () 2 OHOHCl oxit 1 O,H:0,56 mol 2 nnn===
FeO FeOCOFeCO FeO
+→+
O(oxit) 0,56 mol CO nn== 0,56.22,412,544( COV →== lit )
Câu 4 (VDC):
1. (VDC):
Phương pháp:
Tính chất hóa học của HCl .
+== → +==− (loại)
Ta có hệ phương trình: 4 0,0820,0827 106848,7087,27.10 aba abb
Trường hợp 2: 2 Ba + còn trong mu
HCl 350.14,6%51,1gam m ==
1,4mol
Cách giải:
PTHH: 2 NaOHHClNaClHO +→+
NaCO2HCl2NaClHOCO Ca(OH)2HClCaCl2HO CaCO2HClCaClHOCO
+→++ +→+ +→++
2322 222 3222
Ta có: ( ) ( ) ( ) 2 2 3 ;3,36/22,40,15;18,72/58,50,32 CO NaCl OHCO namolnnmolnmol ======
2 3HClpurCO nn2na0,15.2a0,3 OH =+=+=+ (mol).
BTNT Cl: HClNaClCaCl2 CaCl2CaCl2 nn2na0,30,322nn0,5a0,01 =+⇔+=+ =− (mol)
BTKL: XHClpurYCO2H2O mmmmm +=++
22 0,15 HOCO OH nnna=+=+
( ) ( ) ( ) 22,6236,5.0,318,72111.0,50,010,15.4418.0,15 aaa ++=+−+++
( )a0,18mol = ( ) ( ) 111.0,5.0,180,018,88 mgam =−=
2. (VDC):
Phương pháp:
Dựa vào tính chất hóa học của 24HSO
Cách giải:
Quy đổi hỗn hợp X thành KL (a gam) và S (b mol)
Đặt 24 HSOpu ncmol =
Bảo toàn nguyên tố ( ) 224 HOHSO H:nncmol ==
Bảo toàn ( ) 2 242 4 SOSHSOSO S:nnnnbc0,375 mol =+−=+−
Sơ đồ: gam gam mol 24 22 2 4
Io: : 169 ():() Muoi :0,375O: 89 :0,375 : mol mol nKLa KLa m mgXHSOcgYSOHc SObc Sb +→++ +−
+) BTKL: 2 22 4 XHSOmuoi SOHOmmmmm +=++
() ()() 169 3298320,375.64181 89 abcabc ++=+++
+) () () YX 169169 m ma96.bc0,375a32 b 8989 = ++−=+ (2)
+) Kết tủa gồm có:
có cùng CTPT là 242 CHO;Z,T có cùng CTPT là 363CHO
Bi
X,Y
ện luận tìm cấu tạo của X,Y,Z,T :
- Chất X phản ứng với 3 NaHCOX chỉ chứa 1 nhóm - COOH
3 CTCTX:CHCOOH
- Chất Y phản ứng với NaOH (đun nóng), không phản ứng với NaY chỉ chứa 1 nhóm este -COO-
CTCT Y: 3HCOOCH
- Chất Z phản ứng với NaOH (đun nóng), Na và không phản ứng với 3 NaHCOZ có 1 nhóm -COO-, 1 nhóm -OH và không có nhóm - COOH
CTCT Z: 23 HOCHCOOCH
32 CHCOOCHOH; 22
KL:
mol 4 gam mol
BaSO:0,375 (BTNT.S)
OH:220,75
bc a bc
+− +−
Giải thích chỗ tìm số mol OH trong kết tủa: ( ) 24n n RSO2R(OH) →
Ta thấy 4nmolSO tạo thành 4OHSO2nmolOHn2n =
Ta có kêttua m33,165 = gam ( ) ( ) 233.0,37517.220,7533,165 bcabc
Giải hệ (1), (2), (3) được: a5,13;b0,09;c0,39 ===
Vậy 328,01mab=+= gam.
Câu 5 (VDC):
1. (VDC):
Phương pháp:
Dựa vào tính chất hóa học của các chất.
Cách giải:
Các chất có công thức dạng n2nnCHO .
Tất cả các chất có M10030n100n3,33n1;2;3 < < < = .
XY MMX = và Y là đồng phân
ZT MMZ = và T là đồng phân
Các chất không thể có n1 = vì với n1 = chỉ có duy nhất 1 đồng phân là HCHO.
HCOOCHCHOH; ( ) 3HCOOCHOHCH ;
- Chất T làm đổi màu quỳ tím thành đỏ nên T có chứa nhóm chức - COOH ; khi T phản ứng với Na dư thì số mol 2 H thu được bằng số molT tham gia phản ứng
CTCT T: 22 HOCHCHCOOH ( )
3 CHCHOHCOOH
2. (VDC):
Phương pháp:
Dựa vào tính chất của các chất.
Cách giải:
Ta có: ( ) 23 COCaCO nn56/1000,56 mol ===
22 22 binhtăng CO HO HO HO mmm41,560,56.4418.nn0,94 =+=+= (mol)
BTNT O: 222 2O2COHOOO 2n2nn2.n2.0,560,94n1,03 =+⇔=+ = (mol)
BTKL: 10,28 + 1,03.32 =0,56.44 + 18.0,94 + 28. N2N2 nn0,06 = (mol).
===
( ) YN2 n2n2.0,060,12 mol
==
( ) XY n2n0,24 mol
ZXY nnn0,240,120,36 mol =+=+=
( )
1 < số TB C0,56/0,361,56 == Trong X có 4CH và m4CH
Gọi k là số liên kết π trong 4m4CH CHn0,04/k m = Mà: ( ) binh brom ăng m1,12 g =
Xét CmH4 241M1,12/0,0428m2CH k = == =
Xét CmH4 k2M1,12/0,0256m4,3 = == = (Loại)
Vậy công thức của các hiđrocacbon trong X là 4CH và 24CH
TRƯỜNG ĐẠI HỌC QUỐC GIA HÀ NỘI
TRƯỜNG ĐẠI HỌC KHOA HỌC TỰ NHIÊN
ĐỀ THI CHÍNH THỨC (Đề thi gồm 02 trang)
ĐỀ THI TUYỂN SINH VÀO LỚP 10
NĂM HỌC 2021 - 2022
MÔN: HÓA HỌC (CHUYÊN)
Thời gian làm bài: 150 phút
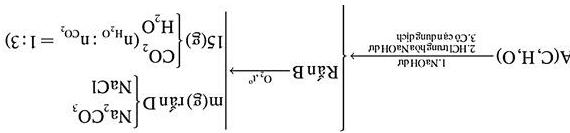
Câu 1: Cho 20 gam hỗn hợp A gồm 3 FeCO,Fe,Cu và Al tác dụng với 60ml dung dịch NaOH 2M thu
được 2,688 lít khí 2 H . Sau khi phản ứng kết thúc, cho tiếp 740ml dung dịch HCl1M và đun nóng, thu được hỗn hợp khí B và chất rắn C (chỉ có các kim loại). Cho B hấp thụ từ từ vào dung dịch 2Ca(OH) dư thu
được 10 gam kết tủa. Cho chất rắn C tác dụng với dung dịch 3HNO đặc, nóng dư thu được dung dịch D và
1,12 lít khí 2NO (sản phẩm khử duy nhất). Cho dung dịch D tác dụng với dung dịch NaOH dư thu được kết tủa E . Nung E đến khối lượng không đổi thu được m gam chất rắn. Biết các phản ứng xảy ra hoàn toàn.
Xác định khối lượng của mỗi chất trong hỗn hợp A và giá trị của m Câu 2: Hợp chất đơn chức A (chứa C, H, O) trong đó oxi chiếm 21,62% khối lượng.
(a) Xác định các CTPT có thể có của A .
(b) Biết A không làm mất màu dung dịch brom và phân tử không chứa nhóm metyl. 0 Ni, 2 AH%B t → + (duy nhất, oxi chiếm 20,78% khối lượng). 4,44 gam A phản vừa đủ với 30ml dung dịch NaOH1M , sản phẩm tạo ra chỉ có một chất C duy nhất. Đun nóng C với dung dịch 24HSO đặc, tạo ra hỗn hợp sản phẩm hữu cơ gồm A và D (là đồng phân của A ). Chất D làm mất màu dung dịch brom. Xác định CTCT của các chất
A,B,C,D và viết các phương trình phản ứng nêu trên.
Câu 3: Hợp chất A (chứa C, H, O) có A M200 < đvC. Cho 8,2 gam A vào cốc đựng 250ml dung dịch NaOH1M , lượng NaOH dư được trung hòa bởi 36,5 gam dung dịch HCl5% . Cô cạn dung dịch thu được chất rắn khan B và phần bay hơi chỉ có nước. Nung nóng B trong oxi dư để các phản ứng hoàn toàn, thu
được m gam chất rắn khan D và 15 gam hỗn hợp E gồm 2 HO và 2CO có tỉ lệ số mol tương ứng là 1:3 .
Lượng oxi đã phản ứng bằng lượng oxi tạo ra khi nhiệt phân hoàn toàn 110,6 gam 4KMnO
(a) Xác định giá trị của m , CTPT và CTCT của A .
(b) Hòa tan B vào nước rồi cho tác dụng với lượng dư dung dịch 424 KMnO/HSO thu được khí F khô (với hiệu suất 100% ) và dung dịch G chỉ chứa các chất vô cơ. Viết các phương trình phản ứng xảy ra và xác định tỉ khối của F so với heli.
Câu 4: Nung nóng hỗn A gồm 4KMnO và 3KCIO (trong đó kali chiếm 30,94% khối lượng). Sau một thời gian 4KMnO bị nhiệt phân hết, tạo ra 5,936 lít khí C và hỗn hợp chất rắn B (không chứa ) 4KCIO . Cho B vào một cốc nước, khuấy đều khi đun nóng nhẹ, đồng thời thêm 24HSO loãng, dư vào cốc. Sau khi các phản ứng xảy ra hoàn toàn, thu được 1,344 lít khí D và dung dịch E (có chứa KCl ).
(a) Xác định thành phần % khối lượng của mỗi chất trong A và hiệu suất phản ứng nhiệt phân KClO3
(b) Trộn toàn bộ lượng khí C và D ở trên với nhau, rồi dẫn vào cốc đựng 40 gam bột đồng và 200ml dung dịch 24 HSO2,65M (axit loãng, D1,2gam/ml = ), khuấy đều để các phản ứng xảy ra hoàn toàn, thu được dung dịch G . Giả thiết nước bay hơi không đáng kể, xác định nồng độ % của dung dịch G .
Câu 5: (a) Hợp chất A (chứa C,H,O ) trong đó oxi chiếm 53,33% khối lượng và A M150 < đvC. Biết A không phản ứng với dung dịch NaOH , nhưng có phản ứng với Na tạo ra H2A 2n n = và sản phẩm B Đun nóng B với lượng dư dung dịch 424 KMnO/HSO tạo ra 2CO . Biết trong phân tử A không có nguyên tử cacbon bậc ba. Xác định CTCT của A và viết các phương trình phản ứng xảy ra.
(b) Hỗn hợp A gồm 33 MgCO,FeCO và 23NaCO . Dung dịch B là dung dịch HCl . Nung nóng A ngoài không khí đến khối lượng không đổi thu được chất rắn C và 15,68 lít khí. Chia C thành hai phần. Cho phần thứ nhất vào cốc đựng 100ml dung dịch B thu được 1,12 lít khí, làm bay hơi cẩn thận thì trong cốc còn lại 25,1gam chất rắn khan D . Nếu cho B vào D thì không có khí thoát ra. Cho phần thứ hai vào cốc đựng 600ml dung dịch B , thấy C tan hết, giải phóng 3,36 lít khí và tạo ra dung dịch E . Làm bay hơi cần thận E thu được 87,675 gam chất rắn khan G. Xác định nồng độ mol của dung dịch B và thành phần % khối lượng của mỗi chất trong hỗn hợp A .
Câu 1 (VDC):
Phương pháp:
HỨỚNG DẪN GIẢI CHI TIẾT
Dựa vào tính chất hóa học của các chất.
Cách giải:
*Khi ANaOH + :
222 AlNaOHHONaAlO3/2H ++→+
NaOHpu H2 n2/3.n2/3.0,120,08mol ===
NaOH dư, Al trong A đã phản ứng hết; NaOH n dư 0,120,080,04mol=−=
AlNaOH pu nn0,08 mol ==
*Khi hỗn hợp khí 2BCa(OH) + dư:
3CaCO n10/1000,1mol ==
2232 COCa(OH)CaCOHO +→↓+ ( ) 0,1 0,1 mol ←
32 FeCOCO nn0,1mol ==
* Xét dung dịch thu được sau phản ứng giữa ANaOHHCl ++ :
Thành phần của dung dịch gồm
BTĐT trong dung dịch: 232 NaFeAlFe 0,740,123.0,08 nn2n3nn0,19mol 2 Cl−++++ =++ ==
BTNTFe: 3
2 FeFe puFeCOFe pu nnnn0,190,10,09 + =+ =−= mol
*Thành phần củachất rắn C gồm ( )Cuxmol và Fe dư (ymol)
3 CCuFeduAFeCOAlFe pu mmmmmmm =+=−−− ( )6456200,1.1160,08.270,09.561,21 xy +=−−−=
Cácquátrình nhườngnhận electronkhi 3CHNO + đặc,nóng, dư:
2 Cu2eCu+ −→ 54N1eN ++ +→
x2x → ( )0,050,05mol ←
3 Fe3eFe+ −→ ( )y3ymol →
B
ảo toàn electron 2x3y0,05 += (2)
Từ (1)(2) xy0,01 ==

*Thành phần chất rắn thu được cuối cùng sau khi nung E gồm 23
( ) CuOCu nn0,01molBTNTCu ==
23 FeFe du nn/20,01/20,005 mol O === (BTNT Fe)
m0,01.800,005.1601,6 g =+= .
Câu 2 (VDC):
Phương pháp:
Dựa vào tính chất hóa học các chất.
Cách giải:
a)
- Nếu phân tử A chứa 10 (ancol, ete):
A 16.100
M74 g/mol 21,62 ==
CTPTcủa A códạng xy CHO với y2x2 ≤+
12xy1674 ++=
12xy58 +=
x4;y10 == là cặp nghiệmduynhất thỏa mãn điềukiện
СТРТ của A là 410 CHO.
-Nếu phântử A chứa 2O (axit cacboxylic, este):
CuO FeO
A 2.16.100
M148 g/mol 21,62 ==

CTPT của A có dạng xy CHO với y2x ≤
12xy32148 ++=
12xy116 +=
x9;y8 == làcặp nghiệm duy nhất thỏamãn điều kiện
CTPT của A là 982CHO
b)
- Xét CTPT 410 CHO có độ bất bão hòa 4.2102 k0 2 −+ ==
Đây là hợp chất no, chắc chắn có chứanhóm metyl ( ) 3CH Loại
- Xét CTPT 982CHO có độ bất bão hòa 9.282 k6 2 −+ ==
Phản ứng "A 2 H+ B" chỉ cộng 2 H chứ không làm thay đổi số nguyên tử O
Trong B chứa B 2.16.100 2OM154 g/mol 20,78 ==


BAH2 MM63MA −== đã cộng tối đa 23H để tạo thành B
A có thể chứa vòng benzen.
- Khi A cộng NaOH :
ANaOH n4,44/1480,03n ===
A phản ứng với NaOH theo tỉ lệ 1:1
Mà sản phẩm chỉ tạo ra chất C duy nhất A có cấu tạo vòng.
*Có 2 bộ CTCT các chất phù hợp:
- Bộ 1:
- Các PTHH xảy ra với bộ 1 :
- Bộ 2:
- Các PTHH xảy ra với bộ 2 :
Câu 3 (VDC):
Phương pháp:
Dựa vào tính chất hóa học các chất.
Cách giải:
a)
Sơ đồ phản ứng:
NaOH n0,25 mol =
HClNaOHduHCl 36,55 n0,05 molnn0,05 mol 36,5100 × == == ×
NaOH pu n0,250,050,2mol =−=



*Chất rắn khan D gồm 23NaCO và NaCl ( ) NaClHCl nn0,05molBTNTCl == ( ) 23 NaCONaOH pu n1/2n1/2,0,20,1molBTNTNa === 0,05.58,50,1.10613,525g m =>=+=
*Khi nung nóng B trong 2O dư:
Đặt 2CO n3x = mol; 2 HO nx = mol
+= =
44.318150,1 xxx

==
CO2H2On0,3 mol;n0,1mol


Lượng 2O đã phản ứng bằng lượng tạo ra khi nhiệt phân 4 110,6gKMnO :
4KMnO n110,6/1580,7 mol ==
42422 2KMnOKMnOMnOO + → +
==
O2 n0,7/20,35 mol
BTKL: 222 BCOHODO mmmmm0,3.440,1.1813,5250,35.3217,325 g =++−=++−=
*Khi cho ANaOH + :
hay
==
BTKL: H2O (sp)ANaOHHClB mmmmm8,20,25.400,05.36,517,3252,7g =+−−=++−= () 2 HOsp n2,7/180,15mol
BTNT H: () 22NaOHHClHO (sp)HO (dot HAB) nnn2n2n ++=+
=+−−=+−−=
()() 2 2 HO (dot HAHOspB)NaOHHCl n2n2nnn2.0,152.0,10,250,050,2mol
BTNT C: () 232 CANaCOCO nnn0,10,30,4mol =+=+=
A được cấu tạo từ ()OACHO C,H,Ommmm8,20,4.120,23,2gn3,2/160,2mol A =−−=−−= ==
A chứa 0,4molC;0,2molH;0,2molO
Tỉ lệ số nguyên tử C:H:O0,4:0,2:0,22:1:1 ==
CTPT của A có dạng ( ) 2nCHO với n chẵn vì số H phải chẵn.
A M20041n200n4,81n2 < < < = hoặc n4 =
- Nếu n2A = là 422A CHO,M82 =
ANaOH pur n0,1mol;n0,2mol ==
1 mol A phản ứng tối đa với 2molNaOH không có CTCT thỏa mãn Loại.
- Nếu n4A = là 844A CHO,M164 =
ANaOH púr n0,05mol;n0,2mol ==
1molA phản ứng với tối đa 4molNaOH
CTCT của A là:
b)
Dung dịch G chỉ chứa các chất vô cơ Đây là phản ứng oxi hóa hoàn toàn HCHC thành 2CO
B gồm 642 CH(ONa) và 2(COONa)
6424242424422 5CH(ONa)26KMnO44HSO5NaSO13 KSO26MnSO30CO 54HO ++→++++ (1)
5(COONa)2KMnO8HSO5NaSOKSO2MnSO10CO8HO ++→++++ (2)
24242424422
Khí F là 2 2CO/He 44 CO11 4 d ==
*Cách cân bằng phản ứng:
Vai trò của cacbon trong công thức cấu tạo ở cả 2(COONa) và ( ) 642CHONa là như nhau
có thể dùng số oxi hóa trung bình.
- Với (1): Từ 121H,O,Na +−+ dễ tìm được số oxi hóa của C bằng +3 .
342C2e2C ++ −→ (a)
( ) 72Mn5eMn b ++ +→
Nhân (a) với 5, nhân (b) với 2 rồi cân bằng các nguyên tố còn lại ta sẽ được PTHH hoàn chỉnh.
- Với (2): Từ 121H,O,Na +−+ dễ tìm được số oxi hóa của C bằng 2/6
( ) 2/64 6C26e6Cc −+ −→
( ) 72Mn5eMn d ++ +→
Nhân (c) với 5, nhân (d) với 26 rồi cân bằng các nguyên tố còn lại ta sẽ được PTHH hoàn chỉnh.
Câu 4 (VDC):
Phương pháp:
Dựa vào tính chất hóa học các chất. Cách giải:
a)
- Đặt 4KMnO nx = mol; 3KClO ny = mol
() ( )( ) 39 KA mxyg =+ ( ) 39 30,94 %m30,94%y9x 158122,5100
K xy xy + = = ≈ +
=> HỗnhợpAgồm 43 xmolKMnO;9xmolKClO
4KMnO 158158 %m 100%12,53% 158122,5.9158122,5.9 x xx
==⋅≈ ++ 3КСІО %m100%12,53%87,47% =−=
n5,936/22,40,265 mol;n1,344/22,40,06 mol
- Các quá trình nhường - nhận electron: 72Mn5eMn ++ +→ 20 2O4eO −→
5 xx → 1,060,265 ← (mol)
50 22Cl10eCl + +→ 0,120,60,06 ←←
( ) 51 Cl6eCl1 +− +→
() 5 Cl1 n 9x0,12 + =−
Bảo toàn electron ( ) 5x0,669x0,121,06x0,02 ++−= =
3KClO n9x0,18 mol ==
- Xét các phản ứng nhiệt phân: 42422
2KMnOKMnOMnOO + → + ( ) 0,02 0,01mol →
32 2KClO2KCl3O t →+ () () 3 O22KClOpuO22 n0,2650,010,255 moln2/3n2/3.0,2550,17 mol
=−= ===
Hiệu suất phản ứng nhiệt phân 3 0,17 KClO:H%100%94,44% 0,18 =⋅≈
b)
Hỗn hợp khí gồm 2 0,265 mol và 2 0,06 molCl
24HSO n0,2.2,650,53 mol ==
- Các quá trình nhường nhận electron:
2 Cu2eCu + −→ 2 2 O4e2O +→
2 2Cl2e2Cl +→
Bảo toàn electron Cu puO2Cl2Cu pu 4.0,2652.0,06 2n4n2nn0,59 mol 2 +
=+ ==
Cu pur m0,59.6437,7640Cu ==< dư
- Có: 2224ddsaupuCupuC1Odd HSO mmmmm37,760,06.710,265.32200.1,2290,5g =+++=+++= .
2 du 2 4 + +
( ) ()
SO:0,53
Cu:0,59BTNTCu H Cl:0,12BTNTCl
BTĐT trong dung dịch H n 0,53.20,59.20,120 + =−−=
Dung dịch chứa 2 0,06 molCuCl và 4 0,53 molCuSO
2 0,06.135
C%CuCl100%2,79% 290,5 =⋅≈
C% CuSO4 0,53.160.100%29,19% 290,5 =≈
Câu 5 (VDC):
Phương pháp:
Dựa vào tính chất hóa học các chất.
Cách giải:
a)
- Trong A , oxi chiếm 53,33% về khối lượng và A M150 <
5(CHONa)16KMnO34HSO10NaSO8 KSO16MnSO20CO 44HO ++→++++
44242424422
(đây là phản ứng oxi hóa hoàn toàn)
*Cách cân bằng phản ứng:
Vai trò của 4 cacbon trong công thức cấu tạo là như nhau có thể dùng số oxi hóa trung bình.
Với 121H,O,Na +−+ dễ tìm được số oxi hóa của C bằng 0 .
16 .(số oxi) 100 150 53,33
⋅<
số oxi 4,99 A < có nhỏ hơn hoặc bằng 4 số nguyên tử oxi.
- Có: AH2n2n = Trong A có 4 nhóm chức có thể tác dụng với Na tạo 2 H (nhóm chức ancol hoặc axit)
Mà số oxi trong A4 ≤ Cả 4 nhóm chức đều là nhóm OH (ancol), A chứa 4 nguyên tử oxi
A 100 M16.4120 53,33 =⋅=
- CTPT của A có dạng xy4CHO với x4;y2x2 ≥≤+
124.16120 xy ++=
12xy56 +=
Kết hợp với điều kiện 4;8CTPTxy == của A là 484CHO
A có độ bất bão hòa 4.282 k1 2 −+ ==
- A chứa 4C và 4 nhóm OH Mỗi nhóm OH sẽ đính vào 1 nguyên tử C => 4 C đều phải no
Mà trong A không có nguyên tử C bậc 3
CTCT của A là:
( ) 04 416e4C1 C + −→
( ) 72 Mn5eMn2 ++ +→
Nhân (1) với 5, nhân (2) với 16 rồi cân bằng các nguyên tố còn lại ta sẽ được PTHH hoàn chỉnh.
b)
Sơ đồ phản ứng:
PTHH:
- Khi cho phần 1200ml + dung dịch ( )BHCl :
Nếu cho thêm ( )BHCl vào chất rắn D không thấy có khí thoát ra 23NaCO đã phản ứng hết
==
() 2 23 NaCOP1CO nn0,05 mol(BTNTC)

- Khi cho phần 2600ml + dung dịch ( )BHCl thấy tan hết 23NaCO đã phản ứng hết
232NaCO (P2)CO nn0,15mol(BTNTC)

== C)
Khối lượng phần 2 gấp 0,15/0,053 = lần so với phần 1 .
==+=

()()2323 NaCOCNaCOA nn0,050,150,2mol
- Đặt số mol các chất trong hỗn hợp A như sau:
MgCO:
() mol 3 mol 3 mol 23
FeCO:xy0,71 NaCO:0,2
x y += (BTNT C)
xBTNTMg yBTNT
MgO: FeO:0,5Fe NaCO:0,2
Số mol các chất trong hỗn hợp C là ( ) () mol mol 23 mol 23
MgO:0,25MgO:0,75
1FeO:0,125;2FeO:0,375
Dựa vào tỉ lệ số mol 23NaCO , tính được số mol các chất trong phần 1 và phần 2 lần lượt là 2323
xx PyPy
NaCO:0,05NaCO:0,15
2323
++= ( )71,25x121,875y70,1252
0,75x.950,75y.162,50,3.58,587,675
+=
Từ ( )( ) 120,3;0,4 xy == .
3MgCO
MgCl:0,75BTNTMg
2 3
NaCl:0,3Na Py BTNT
2FeCl:0,75BTNTFe
- Thành phần của 87,675 ( g ) muối E gồm: ( ) () ()
×
0,3.84 % m.100%27,16% 0,3.840,4.1160,2.106 =≈ ++
3FeCO 0,4.116 % m100%50% 0,3.840,4.1160,2.106 =⋅= ++
23NaCO % m100%27,16%50%22,84% =−−=
*Khi cho phần 1HCl + ( HCl phản ứng hết): Phần 1 gồm 2323 0,075 molMgO;0,05 molFeO;0,05 molNaCO
Đặt HCl nx = mol
BTNT 2 HO Hn0,5 mol =
BTKL: 22 P1HClran DCOHOmmmmm +=++
0,075.400,05.1600,05.10636,5x25,10,05.44 18.0,5x +++=++
MHCl 27,5x11x0,4C0,4/0,14M = = ==
NG NINH
KỲ THI TUYỂN SINH VÀO LỚP 10 THPT
NĂM HỌC 2021 - 2022
Môn thi: Hóa học (Chuyên)
Thời gian làm bài: 120 phút, không kể thời gian phát đề
MỤC TIÊU
- Đề thi giúp học sinh củng cố lại kiến thức, rèn luyện kĩ năng làm bài
- Đề thi giúp học sinh đánh giá được bản thân và có chiến lược ôn thi hiệu quả
Câu 1 (3 điểm)
1. Từ các nguyên liệu ban đầu là 33 KClO,FeS,CaCO và 2 HO , không sử dụng thêm hóa chất khác, có thể điều chế được những chất khí nào bằng phương pháp hóa học? Viết phương trình hóa học của các phản ứng xảy ra. Biết các điều kiện và thiết bị thí nghiệm cần thiết có đủ.
2. Có 5 lọ hóa chất mất nhãn, mỗi lọ đựng dung dịch riêng biệt của một trong 5 chất tan sau: HCl , 2234NaOH,Ba(OH), KCO,MgSO . Không sử dụng thêm hóa chất khác, hãy trình bày phương pháp hóa học nhận ra 5 dung dịch trên.
3. Hỗn hợp rắn A gồm 3 BaCO,Cu và FeO. Nung nóng hỗn hợp A trong điều kiện không có không khí, sau một thời gian thu được hỗn hợp rắn B và khí D . Cho hỗn hợp rắn B vào nước dư đến khi phản ứng xảy ra hoàn toàn thu được dung dịch E và hỗn hợp rắn F. Cho hỗn hợp rắn F tác dụng với dung dịch HCl dư, sau khi kết thúc phản ứng thu được khí D , dung dịch G và chất rắn M . Xác định các chất trong
B,D,E,F,G và M . Viết phương trình hóa học của các phản ứng xảy ra.
Câu 2 (2 điểm)
1. Nêu hiện tượng, viết phương trình phản ứng hóa học xảy ra trong các thí nghiệm sau:
a. Thí nghiệm 1: Dẫn khí etilen từ từ cho đến dư qua dung dịch brom.
b. Thí nghiệm 2: Cho vỏ trứng (đã được đập nhỏ) vào ống nghiệm chứa sẵn dung dịch giấm ăn.
c. Thí nghiệm 3: Cho vào ống nghiệm 2ml rượu etylic khan, 2ml axit axetic, nhỏ thêm từ từ khoảng 1ml
axit sunfuric đặc, lắc đều. Đun nhẹ trên ngọn lửa đèn cồn từ 5 đến 6 phút. Cho thêm 2ml dung dịch muối ăn
bão hòa, lắc nhẹ rồi để yên.
d. Thí nghiệm 4: Cho dung dịch saccarozơ vào ống nghiệm, thêm vào 1 giọt dung dịch 24HSO , đun nóng từ
2 đến 3 phút. Sau đó, thêm dung dịch NaOH vào để trung hòa. Cho dung dịch vừa thu được vào ống nghiệm chứa dung dịch 3AgNO trong amoniac.
2. Cho hỗn hợp khí X gồm 22CH và 2 H có tỉ khối so với khí 2 H là 5,8 .
Đun nóng 3,36 lit hỗn hợp X (có xúc tác Ni ) thu được hỗn hợp Y. Cho hỗn hợp Y đi qua bình đựng dung dịch brom dư thấy bình đựng dung dịch brom tăng m gam và thoát ra 1,344 lít khí Z có tỉ khối so với khí
2H là 4,5. Biết các thể tích khí đo ở điều kiện tiêu chuẩn.
a. Tính phần trăm khối lượng mỗi chất trong hỗn hợp X.
b. Tính giá trị của m. Câu 3 (3 điểm)
1. Hòa tan hoàn toàn 6,7 gam hỗn hợp X gồm 2 K,BaO,Ba,KO trong nước, sau phản ứng thu được 500ml dung dịch B và 336ml khí 2H (đo ở đktc). Cho dung dịch B tác dụng với dung dịch 3NaHCO dư, kết thúc phản ứng thu được 5,91 gam kết tủa. Tính nồng độ mol của các chất trong dung dịch B .
2. Cho 3,84 gam Mg vào 200ml dung dịch A chứa hỗn hợp 4 CuSOxM và 4 FeSO0,8M . Sau khi các phản ứng xảy ra hoàn toàn, thu được 9,6 gam chất rắn B và dung dịch D . Cho dung dịch D tác dụng với dung dịch 2Ba(OH) lấy dư đến khi phản ứng kết thúc thu được kết tủa E. Lọc lấy kết tủa E , sau đó nung E trong
không khí đến khối lượng không đổi thu được a gam chất rắn. Tính giá trị của x và a
3. Hỗn hợp A gồm 23 FeO,MgO và CuO. Tiến hành 2 thí nghiệm sau:
- Thí nghiệm 1: Hòa tan m gam hỗn hợp A trong dung dịch HCl dư, sau phản ứng, cô cạn dung dịch thu
được 157 m 80 gam muối khan.
- Thí nghiệm 2: Dẫn một luồng khí CO dư qua m gam hỗn hợp A nung nóng, thu được hỗn hợp khí X. Cho
toàn bộ hỗn hợp khí X vào nước vôi trong dư, thu được 5 m 4 gam kết tủa.
Tính phần trăm khối lượng mỗi chất có trong hỗn hợp A . Giả thiết các phản ứng xảy ra hoàn toàn.
Câu 4 (2 điểm)
1. Cho hỗn hợp khí A gồm hai hiđrocacbon.
Dẫn 336ml hỗn hợp khí A vào bình đựng dung dịch brom dư. Sau phản ứng thấy thoát ra 112 lít khí, đồng thời khối lượng bình đựng dung dịch brom tăng 0,4 gam.
Đốt cháy 336ml hỗn hợp khí A trong 2O dư, cho toàn bộ sản phẩm cháy hấp thụ hết vào bình đựng 200ml dung dịch NaOH0,4M ; sau phản ứng thu được dung dịch B . Biết dung dịch B chứa 4,11 gam chất tan, khối lượng dung dịch B lớn hơn khối lượng dung dịch NaOH ban đầu là m gam.
Xác định công thức phân tử của hai hiđrocacbon trong hỗn hợp A và tính giá trị của m Giả thiết các phản ứng đều xảy ra hoàn toàn, các thể tích khí đo ở điều kiện tiêu chuẩn.
2. Nung m gam hỗn hợp X gồm 3NaHCO và 3CaCO ở nhiệt độ cao đến khi khối lượng không đổi thu được chất rắn Y . Cho chất rắn Y vào nước dư, kết thúc phản ứng thu được 1m gam kết tủa Z và dung dịch E.
Khi nhỏ rất từ từ dung dịch HCl1M vào dung dịch E , thấy hiện tượng như sau:
- Nếu dùng hết V lít dung dịch HCl thì bắt đầu có khí thoát ra.
- Nếu dùng hết 1,2 V lít dung dịch HCl thì khí ngừng thoát ra.
HƯỚNG DẪN GIẢI CHI TIẾT
Câu 1 1 (VD)
m m
Tính tỉ lệ 1
Phương pháp:
Dựa vào tính chất hóa học của các chất.
Cách giải: t
32 2KClO2KCl3O+↑ → t
32 CaCOCaOCO+↑ → dien-phan
222 2HO2HO→↑+↑ dpnc 2 2KCl2 KCl →+↑
2223 4FeS7O4SO2FeO +↑+ → askt
22 HCl2HCl → +
25t,O
223 2SOO2SO V → +
=> Có thể điều chế được các khí: 2222223 O,CO,H,Cl,SO,HCl,SO.
1.2 (VD)
Phương pháp:
Dựa vào tính chất hóa học của các chất.
Cách giải:

- Đánh dấu lần lượt các ống nghiệm chứa các dung dịch cần nhận biết từ 1 đến 5 .
- Lấy 1 dung dịch bất kỳ đổ vào các dung dịch còn lại:
+) Nếu chỉ thấy sủi bọt khí thì dung dịch cho vào là HCl .
+) Nếu chỉ thấy xuất hiện 1 kết tủa trắng thì dung dịch cho vào là NaOH
+ Nếu thấy xuất hiện 2 kết tủa trắng thì dung dịch cho vào là 2Ba(OH) .
+) Nếu thấy xuất hiện 2 kết tủa trắng và có sủi bọt khí thì dung dịch cho vào là 23KCO
+) Nếu thấy xuất hiện 3 kết tủa trắng thì dung dịch cho vào là 4MgSO
PTHH:
2322 2HClKCO2KClCOHO +→+↑+
42 2NaOHMgSOMg(OH)+→↓ trắng 24NaSO+
2233trang Ba(OH)KCOBaCO2KOH +→↓+
242 Ba(OH)MgSOMg(OH)+→↓ trắng 4BaSO +↓ trắng
2342 KCOMgSOMg(OH)+→↓ trắng 24KSO+
1.3 (VD)
Phương pháp:
Dựa vào tính chất hóa học của các chất.
Cách giải:
- Hỗn hợp rắn B gồm: BaO,Cu,FeO và 3BaCO .
- Khí D gồm: 2CO
- Dung dịch 2E:Ba(OH) và 2 HO
- Hỗn hợp rắn F:Cu,FeO và 3BaCO .
- Dung dịch 22G:FeCl,BaCl và 2 HO
- Chất rắn M:Cu
3222 BaCO2HClBaClCOHO +→+↑+
Câu 2
1 (TH)
Phươnng pháp:
Dựa vào tính chất hóa học của các chất.
Cách giải:
a. Thí nghiệm 1 :
Hiện tượng: Dung dịch Brom (màu nâu đỏ) nhạt màu dần đến khi mất màu hoàn toàn.
PTHH: 22222 CHCHBrCHBrCHBr =+→−
b. Thí nghiệm 2 :
Hiện tượng: Vỏ trứng tan dần đến hết thành dung dịch trong suốt, không màu đồng thời xuất hiện bọt khí không màu thoát ra.
PTHH: ( ) 33322 2 CaCO2CHCOOHCHCOOCaCOHO +→++
c. Thí nghiệm 3:
Hiện tượng: Dung dịch trong ống nghiệm thu được tách thành hai lớp (lớp este ở trên)
PTHH: 0 24 3253252 HSOdact CHCOOHCHOHCHCOOCHHO +→+
d. Thí nghiệm 4:
Hiện tượng: Xuất hiện lớp kết tủa, sáng như gương bám lên thành ống nghiệm.
PTHH:
Phản ứng thủy phân: H,t 12221126126 CHOHOCHO + → + (glucozo) 6126CHO+ (fructozo)
Phản ứng trung hòa axit dư: 24242 2NaOHHSONaSO2HO +→+
Phản ứng tráng gương: [] () t 2 4232442 CHOHCHOHCHO2AgNHOHCHOHCHOH]COONH2AgHO [ + +↓+ →
2.2.(VD)
Phương pháp:
FeO2HClFeClHO +→+
PTHH: 0 32 BaCOBaOCO + → ↑ 22 BaOHOBa(OH) +→ 22
Dựa vào tính chất hóa học của các chất.
21. Cách giải:
a.
XXn0,15 mol;m2.5,8.0,151,74=== gam
Gọi số 22molCH và 2 H trong hỗn hợp X lần lượt là x và y mol
Ta có hệ phương trình: 0,15 xy+= và 2621,74 xy+= 0,06;0,09xy ==
01 KK1e + →+ 02O2eO +→
02 BaBa2e + →+ 2 2H2eH + +→
Áp dụng định luật bảo toàn 2 :222KBaOH ennnn +=+
( ) a2.0,032 b2.0,0152 +=+
Giải hệ (1) và (2) được: a0,05 = và b0,04 =
Vậy dung dịch B chứa: 2 0,03 molBa(OH) và 0,05 molKOH
===
22CH m0,06.261,56 == gam; 2H m0,09.20,18 == gam ( ) C2H2 H2 % m1,56/1,75.100%89,66%;% m10,34%
b.
ZZ n0,06;m0,06.2.4,50,54gam ===
Bảo toàn khối lượng: XY mm1,74 == gam.
Nhận thấy, hỗn hợp Y gồm hợp chất không no (giữ lại trong bình brom), hợp chất no (khí Z thoát ra ngoài)
Do đó, khối lượng bình brom tăng bằng khối lượng hợp chất không no trong hỗn hợp Y.
() ( ) ( ) 2 MKOH MBaOH C0,03/0,50,06M;C0,05/0,50,1M ====
3. 2 (VD)
Phương pháp:
CRm Biện luận các chất trong B vàtìm rasố mol mỗi chất
Tìm được các chất trong D, viết PTHH để tìm số mol mỗichất a .
Cách giải:
=+ =−= gam .
YZ mmmm1,740,541,2
Câu 3
3.1. (VD)
Phương pháp:
() 3 2 2 BaCOBaHKOM BaOHOHnnn;n 2nnnC ===
Cách giải:
H2 n0,015 mol =
Dung dịch B chứa 2Ba(OH) và KOH.
Khi cho B tác dụng với 3NaHCO dư thì tạo kết tủa 3BaCO theo phản ứng:
233232 Ba(OH)2NaHCOBaCONaCO2HO +→↓++
Theo PTHHtrên: () 3 2 BaOHBaCO nn5,91/1970,03 mol ===
Quy đổi hỗn hợp thành: ( ) ( ) Kamol;Ba0,03 mol và O(b mol )
)m6,7gam=>39a0,03.13716 b6,7+=++= (1)
hon hop
+) Bảo toàn e:
( )
CuSO:0,2x9,6gchatranB
Mg:0,16FeSO:0,16ddDEagchatran +→
4 BaOHdu Nung 4
() () 2
Thứ tự xảy ra các phản ứng là:
44 MgCuSOMgSOCu +→+ (1)
44 MgFeSOMgSOFe ++ → (2)
Theo đề bài ta thấy 444 MgFeSOMgCuSOFeSO nnnnn = <+
Khi phản ứng với hỗn hợp 4CuSO và 4FeSO thì Mg hết.
Trường hợp 1: Mg hết; 4CuSO dư hoặcvừa đủ, 4FeSO chưa phản ứng.
Chất rắn B chỉ có Cu Cun9,6/640,15 mol ==
44 MgCuSOMgSOCu +→+
0,15 ← 0,15
=> nMg pư = 0,15 mol < nMg ban đầu (mâu thuẫn với giả thiết Mg hết)
Trường hợp 2: Mg hết; 4CuSO hết, 4FeSO dư
44 MgCuSOMgSOCu +→+
0,2x0,2x 0,2x0,2x←→→
44 MgFeSOMgSOFe
0,160,20,160,2 0,160,20,160,2 xxxx
22 MgO2HClMgClHO +→+
22 CuO2HClCuClHO +→+
+TN2:
+−=
Chấtrắnchứa:0,2xmolCuvà ( ) 0,160,2xmolFe ( ) 64.0,2x56.0,160,2x9,6
=
0,4 x
DungdịchDchứa: ( ) 4 MgSO0,16mol và ( ) 4 FeSO0,08mol.
ChoDtácdụng 2Ba(OH) dư xảyracácphản ứng:
4242 MgSOBa(OH)BaSOMg(OH)
232 3COFeO2Fe3CO ++ →
COMgO+→ khôngphản ứng
2COCuOCuCO ++ →
2232 COCa(OH)duCaCOHO +→↓+
→→
0,16 0,16 0,16
4242 FeSOBa(OH)BaSOFe(OH)
0,08 0,08 0,08
Kếttủachứa: ( ) ( ) ( ) 422 BaSO0,24mol;Mg(OH)0,16mol;Fe(OH)0,08mol
Đemnungkếttủatrongkhôngkhí đếnkhốilượngkhông đổixảyracácphản ứng: t
22 Mg(OH)MgOHO + →
0,16 0,16 → 0
Cách giải:
Chọn 80 m = gam.
Giả sử 80gamAchứa ( ) 23 FeMgOCuO nx;ny;nzmol O ===
hh m80gam160x40y80z80+= ++= (1)
1TN+ :
2332 FeO6HCl2FeCl3HO x 2x +→+ →
22 MgO2HClMgClHO y y +→+ →
22232 4Fe(OH)O2FeO4HO
0,08 0,04 + → → +
Vậychấtrắnsaukhinunggồm: ( ) ( ) ( ) 234 MgO0,16mol;FeO0,04mol;BaSO0,24mol.
=++
chat ran m0,16.400,04.1600,24.233
68,72gam a =
3 (VD)
Phương pháp:
Xétm80 =
TínhtheoPTHH:
+TN1
2332 FeO6HCl2FeCl3HO +→+
22 CuO2HClCuClHO z z +→+
→
muoi m157m/80157 == gam 162,5.2x95y135z157 ++= gam(2)
+TN2:
232 3COFeO2Fe3CO x 3x ++ → →
COMgO+→ khôngphản ứng
2COCuOCuCO z z ++ → →
()()
2232 COCa(OH)duCaCOHO 3xz 3xz +→↓+ +→+
3 3 CaCO CaCO m5m/4100gamn1mol == = 3xz1 += (1)
Từ (1),(2),(3)tacó: x0,2;y0,4;z0,4 === ( ) 23FeO %m0,2.160/80.100%40% == ( ) MgO %m0,4.40/80.100%20% ==
CuO %m100%40%20%40% =−−= .
Câu 4
1 (VDC)
Phương pháp:
Br2HDCnn = bị giữ lạ MHĐC không no Côngthứccủahiđrocacbonkhôngno.
Đốtcháyhônhợpkhí A thu được 2CO và 2 HO
Từ NaOH n vàmchất rắn biệnluậntìmsố mol của 2CO côngthứccủahiđrocacboncònlạivàtìm m
Cách giải:
A n0,336:22,40,015mol ==
Hiđrocacbonthoátrakhỏibìnhbromlàankancócôngthứctổngquát: n2n2CH +
n2n2CH n0,112:22,40,005mol + == .
Số molhiđrocacboncònlại: n0,0150,0050,01 =−=
PTHH:
23 CONaOHNaHCO +→
2232 CO2NaOHNaCOHO +→+ ( ) 22 HONaOHCO nnn0,080,030,005n0,050,005n =−=−+=−
Bảotoànkhốilượng: CO2NaOHBH2O mmmm +=+ ( ) ( ) 44.0,030,005n0,08.404,1118.0,050,005n ++=+−
n1,58 = (loại)
Trườnghợp 22:CO phản ứnghết, NaOH dư
PTHH:
2232 CO2NaOHNaCOHO +→+
22 HOCO nn0,030,005n ==+
Bảotoànkhốilượng: 2 2 CONaOHBHO mmmm +=+ ( ) ( ) 44.0,030,0050,08404,1118.0,030,005 nn ++⋅=++
n1 =
Vậyankanlà 4CH .
Côngthứcphântử củahaihiđrocacbontrong A là: 434CH;CH
Do đó, CO2 H2O n0,030,0050,035;n0,06 =+==
Hỗn hợp sản phẩm cháy hấp thụ hoàn toàn vào dung dịch NaOH tạo thành dung dịch B nên khối lượng dungdịch B tăngsovớikhốilượngdung NaOH ban đầubằngkhốilượngsảnphẩmcháy.
CO2 H2O n0,030,0050,035;n0,06 =+==
M ==
Khốilượngbìnhbromtăngbằngkhốilượnghiđrocacbonbị giữ lại:0,4gam 340,4:0,0140CH
Đốtcháyhônhợpkhí A thu được 2CO và 2 HO
Bảotoànnguyêntố 234n2n2COCHCH C:n3nn.n0,030,05n + =+=+
NaOH n0,2.0,40,08mol ==
Ankanlàchấtkhínên CO2 n4n0,030,005.40,05 ≤ ≤+=
Xảyrahaitrườnghợp:
Trườnghợp1: 2CO và NaOH phản ứnghếtsinhrahaimuối.
CO2H2O mmm0,035.440,06.182,62 =+=+= gam
Vậy,Côngthứcphântử củahaihiđrocacbontrong A là: 434CH,CH và m2,62 = gam
4. 2 (VDC)
Phương pháp:
TínhtheoPTHH:
PTHH:
t 32322 2NaHCONaCOCOHO ++ → (1)
t 32 CaCOCaOCO →+ (2)
22 CaOHOCa(OH) +→ (3)
2233 Ca(OH)NaCOCaCO2NaOH +→+ (4)
Vìkhinhỏ HCl vàodungdịch E thấycókhíthoátranêntakếtluận 23NaCO dư, 2Ca(OH) hết.
TN1:
OHHHO −+ → + (5)
2 33CO HHCO −+− +→ (6) H n + (*)
TN2: 2 OHHHO −+ → + (5)
2 33 COHHCO −+− +→ (6) 322 HCOHCOHO −++→+ (7) H n +
()
22 l CaOHH(3 OCa b (O) ) bmo + → →
t 32 l CaCOCaOC (2) bo O bm → → + ()
2233 Ca(OH)NaCOCaCO2NaOH(4) +→+
T: b a (mol)
P: b → b → b → 2b (mol)
S: 0 a-b b 2b (mol)
Vìkhinhỏ HCl vàodungdịch E thấycókhíthoátranêntakếtluận 23NaCO dư, 2Ca(OH) hết.
TN1: ( ) () 2 OHHHO5 22bbmol
−++→ →
2 33 COHHCO −+− +→ (6)
ababab −→−→− (mol)
TN2:
2 OHHHO −++→ (5)
2 b2 b → (mol)
2 33 COHHCO −++→ (6)
ababab −→−→− (mol)
322 HCOHCOHO −++→+ (7)
abab −→− (mol)
( ) ( ) ( )
H n2 babab2a1,2 V** + =+−+−==
Từ ( )* và () ab1 ** 2a1,2 + =
2a3 ba1,5 b = =
Ta có: +) 33 NaHCOCaCO truoc pu mmm2a.84b.1002.1,5 b.84b.100352b=+=+=+=
+)m1 = mCaCO3 sau pư = 100b
SỞ GD&ĐT TRÀ VINH
Trường THPT Chuyên Nguyễn Thiện Thành
KỲ THI TUYỂN SINH VÀO LỚP 10 THPT
NĂM HỌC 2021 - 2022
Môn thi: Hóa học (Chuyên)
Thời gian làm bài: 120 phút
Câu 5 (2 điểm)
Hoà tan hoàn toàn 15,50 gam hỗn hợp A gồm: Al,Mg,Fe bằng dung dịch HCl (lấy dư), thu được 12,32
lít khí 2 H (đo ở điều kiện tiêu chuẩn). Nếu hoà tan 0,05 mol hỗn hợp A bằng dung dịch 24HSO loãng, dư
MỤC TIÊU
- Đề thi giúp học sinh củng cố lại kiến thức, rèn luyện kĩ năng làm bài
- Đề thi giúp học sinh đánh giá được bản thân và có chiến lược ôn thi hiệu quả
I. PHẦN CHUNG DÀNH CHO TẤT CẢ CÁC THÍ SINH (7 điểm)
Câu 1 (2 điểm)
1. Có 4 dung dịch mất nhãn đựng trong 4 lọ riêng biệt gồm: 3 KOH,KNO,HCl,NaCl. Bằng phương pháp hóa
học hãy nêu cách nhận biết từng dung dịch trên. Viết phương trình phản ứng hóa học minh họa (nếu có).
2. Cho 4 chất hữu cơ A,B,C,D đều là những hợp chất hữu cơ đơn chức (mỗi chất chỉ chứa một trong các
nhóm: OH,COOH,COO,O) . Biết A,B có cùng công thức phân tử 26 CHO và C,D có cùng công
thức phân tử 242CHO . Khi đun nóng chất B với chất C có mặt chất xúc tác 24HSO đặc, thu được hợp chất hữu cơ E có công thức phân tử 482CHO .
a) Hãy xác định công thức cấu tạo đúng của các chất A,B,C,D .
b) Cho các chất A,B,C,D lần lượt tác dụng với: 3Na,NaOH,CaCO . Hãy viết các phương trình phản ứng hóa học có thể xảy ra (ghi rõ điều kiện phản ứng nếu có).
Câu 2 (1 điểm)
Hãy viết các phương trình phản ứng hóa học (ghi rõ điều kiện phản ứng nếu có) thực hiện dãy chuyển hóa
sau:
Tinh bột () 1 → glucozo () 2 (3) (4) 252426 CHOHCHCH→→→
Câu 3 (1 điểm)
Hãy nêu hiện tượng và viết phương trình phản ứng hóa học để giải thích khi tiến hành các thí nghiệm sau:
1. Nhỏ từ từ đến dư dung dịch HCl vào dung dịch 2NaAlO
2. Cho từ từ đến dư kim loại Na vào dung dịch ( ) 3 2 CaHCO
Câu 4 (1 điểm)
Trước đây trong xây dựng người ta thường tạo màu sáng cho các ngôi nhà bằng cách cho vôi sống (vôi dạng bột) vào nước, khuấy đều thu được dung dịch nước vôi dùng để quét lên bề mặt của tường. Dung dịch nước vôi còn dư sau khi sử dụng để lâu ngày trong không khí thường có một lớp màng rắn trên bề mặt dung dịch. Hãy giải thích hiện tượng trên và viết các phương trình phản ứng hóa học xảy ra.
thì thu được dung dịch C . Thêm một lượng dư dung dịch NaOH vào dung dịch C thu được kết tủa D . Lọc lấy kết tủa D rồi nung trong không khí ở nhiệt độ cao đến khối lượng không đổi thu được 2,00 gam chất rắn
E.
1. Viết các phương trình phản ứng hóa học đã xảy ra.
2. Tính khối lượng các kim loại trong hỗn hợp ban đầu.
II. PHẦN TỰ CHỌN (3 điểm)
Thí sinh chọn 1 trong 2 đề sau đây:
ĐỀ 1:
Câu 6 (1 điểm)
Có hỗn hợp gồm: 232 AlO,Cu,FeO. Bằng phương pháp hóa học hãy nêu cách tích từng chất ra khỏi hỗn hợp mà không làm thay đổi khối lượng ban đầu. Viết các phương trình phản ứng hóa học chứng minh.
Câu 7 (2 điểm)
Hỗn hợp khí A gồm 3 hiđrocacbon thuộc loại ankan ( ) n2n2CH + hoặc anken ( ) m2 m CH , trong đó có 2
hiđrocacbon cùng loại. Đốt cháy hoàn toàn V lít hỗn hợp A thu được 1,50 V lít khí 2CO và 7 V 3 lít hơi
nước (các thể tích khí đo ở cùng điều kiện). Mặt khác, dẫn 6,72 lít (đo ở điều kiện tiêu chuẩn) hỗn hợp khí A đi qua bình đựng dung dịch brom (lấy dư), thấy khối lượng bình brom tăng thêm 1,40 gam và có 5,60 lít khí thoát ra khỏi bình (đo ở điều kiện tiêu chuẩn). Biết trong A có 2 hiđrocacbon có số mol bằng nhau.
1. Xác định công thức phân tử của 3 hidrocacbon trên.
2. Tính thể tích của từng hiđrocacbon trong hỗn hợp A .
ĐỀ 2:
Câu 6 (1 điểm)
Có một học sinh cho rằng cây xanh giống như nhà máy sản xuất gluxit (cabohiđrat) đồng thời điều hòa lượng oxi trong khí quyển bằng quá trình quang hợp.
1. Hãy giải thích ý kiến đó bằng phương trình phản ứng hóa học xảy ra.
2. Tính thể tích khí cacbonic ( ) 2CO mà cây xanh đã hấp thụ được bằng quá trình quang hợp nếu quá trình đó giải phóng 134,4 3 m khí oxi (đo ở điều kiện tiêu chuẩn). Biết hiệu suất quá trình tổng hợp trên đạt 80,0% . Hãy nêu lợi ích của việc trồng cây xanh.
Câu 7 (2 điểm)
Hòa tan hoàn toàn vừa đủ m gam hỗn hợp gồm Fe và một oxit sắt bằng lượng vừa đủ 600,000ml dung
dịch HCl 1,000M (biết chỉ có xảy ra phản ứng hóa học giữa Fe , oxit sắt với dung dịch HCl ). Sau phản ứng thu
được dung dịch X và 1,344 lít khí 2 H (đo ở điều kiện tiêu chuẩn). Cho dung dịch X tác dụng với dung dịch 3AgNO (lấy dư), thu được 99,060 gam kết tủa.
1. Hãy viết các phương trình phản ứng hóa học đã xảy ra.
2. Hãy xác định công thức hóa học của oxit sắt và tính giá trị m.
HƯỚNG DẪN GIẢI CHI TIẾT
Câu 1
1 (TH)
Phương pháp:
Dựa vào tính chất hóa học của các chất.
Cách giải:
Trích một lượng các mẫu thử ra các ống nghiệm
Nhúng quỳ tím vào các mẫu thử:
- Quỳ chuyển đỏ HCl →
- Quỳ chuyển xanh KOH →
- Quỳ không chuyển màu 3 KNO,NaCl →
Thêm dung dịch 3AgNO vào hai ống nghiệm chứa 3 KNO,NaCl
- Xuất hiện kết tủa trắng NaCl →
- Không hiện tượng 3KNO →
PTHH: 3 AgNONaClAgCl+→↓ trắng 3NaNO+
1. 2
1.2.1 (TH)
Phương pháp:
Dựa vào tính chất hóa học của các chất.
Cách giải:
Chất A,B có công thức phân tử là 26 CHO nên A,B chứa nhóm: OH,O
Chất C,D có công thức phân tử là 242CHO nên C,D chứa nhóm: COOH,COO -
Khi đun nóng, chất B tác dụng với chất C có mặt chất xúc 24HSO đặc thu được hợp chất E có công thức
phân tử là 482CHO nên:
- Chất B là 25 CHOH → Chất A là 33 CHOCH
- Chất C là 3 CHCOOH → Chất D là 3HCOOCH
PTHH: 0 2dac HSO, 2533252 CHOHCHCOOHCHCOOCHHO t ++
1.2.2 (TH)
Phương pháp:
Dựa vào tính chất hóa học của các chất
Cách giải:
Các phản ứng:
Chất 33 A:CHOCH : không phản ứng với chất nào
Chất B: 25 CHOH : phản ứng với Na
25252 CHOHNaCHONa0,5H +→+
Chất 3 C:CHCOOH : phản ứng được với cả ba chất
332 CHCOOHNaCHCOONa0,5H +→+
332 CHCOOHNaOHCHCOONaHO +→+ ( ) 33322 2 2CHCOOHCaCOCHCOOCaCOHO +→++
Chất D: 3HCOOCH phản ứng với NaOH 3 3 HCOOCHNaOHHCOONaCHOH +→+
Câu 2 (TH)
Phương pháp:
Dựa vào tính chất hóa học của các chất.
Cách giải:
(1) () H 610526126 n CHOnHOnCHO + → +
Tinh bột Glucozo
(2) men-ruou 6126252 CHO2CHOH2CO + →
Glucozo
(3) 24 HSOdac,170 25222 CHOHCHCHHO →=+
(4) Ni,t 24226 CHHCH → +
Câu 3
3. 1 (TH)
Phương pháp:
Dựa vào tính chất hóa học của các chất.
Cách giải:
- Hiện tượng: ban đầu xuất hiện kết tủa trắng, sau đó kết tủa tan dần.
- PTHH:
223trangHAlOHOAl(OH) +−++→↓
3 32 3HAl(OH)Al3HO ++ +→+
3. 2 (TH)
Phương pháp:
Dựa vào tính chất hóa học của các chất.
Cách giải:
- Hiện tượng: có sủi bọt khí và xuất hiện kết tủa trắng.
- PTHH: 22 2Na2HO2NaOHH; +→+↑
( ) 33 2 2NaOHCaHCOCaCO+→↓ trắng 232 NaCO2HO++
Câu 4 (TH)
Phương pháp:
Dựa vào tính chất hóa học của các chất.
Cách giải:
- Cho vôi sống vào nước tạo thành dung dịch nước vôi: 22 CaOHOCa(OH) +→
Vôi sống nước vôi
- Nước vôi để lâu ngày trong không khí thấy xuất hiện lớp màng rắn:
223trang 2 Ca(OH)COCaCOHO ↓ → ++
Kết tủa trắng chính là 3CaCO .
Câu 5
5.1 (TH)
Phương pháp: Dựa vào tính chất hóa học của các chất.
Cách giải:
- Cho hỗn hợp A tác dụng HCl dư:
22Mg2HClMgClH+→+↑
322Al6HCl2AlCl3H+→+↑
22Fe2HClFeClH+→+↑
- Cho hỗn hợp A tác dụng 24HSO dư:
2442 MgHSOMgSOH+→+↑ ( ) 24242 3 2Al3HSOAlSO3H +→+↑
2442 FeHSOFeSOH+→+↑
Dung dịch C chứa: 24HSO dư, ( ) 4244 3 MgSO,AlSO,FeSO
- Cho dung dịch C tác dụng NaOH dư:
24242 HSO2NaOHNaSO2HO +→+
4224 MgSO2NaOHMg(OH)NaSO +→↓+ ( ) 24324 3 AlSO6NaOH2Al(OH)3NaSO +→↓+
322 Al(OH)NaOHNaAlO2HO +→+
4224 FeSO2NaOHFe(OH)NaSO +→↓+
Kết tủa D chứa: 22 Mg(OH),Fe(OH)
- Nung D trong không khí tới khối lượng không đổi: t 22 Mg(OH)MgOHO + → t 22232 4Fe(OH)O2FeO4HO → ++
Chất rắn E chứa: 23MgO,FeO .
5. 2 (VD)
Phương pháp:
AAlFeMg mmmmPT =++ (1)
2 HAlMgFe n1,5nnnPT =++ (2)
CRE mPT (3)
Từ (1), (2), (3) AlMgFen;n;n
Cách giải:
Đặt AlMgFe nxmol;nymol;nz === mol.
+) hhA m15,5 = gam 27x24y56z15,5 ++= (1)
+) Khi cho 15,5 gam A tác dụng với HCl :
22Mg2HClMgClH+→+↑
y → y
322Al6HCl2AlCl3H+→+↑
x → 1,5x
22Fe2HClFeClH+→+↑
z → z
H2 ny1,5xz0,55 =++= (2)
)+ Nếu dùng 15,5 gam ( hh AnAxyz =++ mol) thì chất rắn E chứa:
BTNT Mg: MgOMg nny ==
BTNT Fe: 23 FeOFe n1/2.n0,5z ==
E m40y160.0,5z40y80z =+=+
Ta có tỷ lệ:
( )xyz ++ mol A thu được ( )40y80z + gam E
0,05mol A thu được 2 gam E ( ) ( ) 0,05.40802.yzxyz +=++
Từ (1), (2), (3) x0,1;y0,3;z0,1 ===
Vậy:
Al m0,1.272,7 == gam
Mg m0,3.247,2 == gam
Fe m0,1.565,6gam ==
ĐỀ 1
Câu 6 (TH)
Phương pháp:
Dựa vào tính chất hóa học của các chất.
Cách giải:
- Cho dung dịch HCl tới dư vào hỗn hợp 2323 AlO,Cu,FeO . Sau khi phản ứng xảy ra hoàn toàn thu được chất rắn không tan và dung dịch X . Lọc dung dịch thu được chất rắn là Cu và dung dịch X chứa 33AlCl,FeCl và HCl dư.
PTHH: 2332 AlO6HCl2AlCl3HO +→+
2332 FeO6HCl2FeCl3HO +→+
- Cho tới dư dung dịch NaOH vào dung dịch X , sau khi phản ứng xảy ra hoàn toàn thu được kết tủa màu
nâu đỏ và dung dịch Y . Lọc dung dịch ta thu được kết tủa 3Fe(OH) và dung dịch Y chứa 2 NaAlO,NaCl
và NaOH dư
PTHH: 322 AlCl4NaOHNaAlO3NaCl2HO +→++
33 FeCl3NaOHFe(OH)+→↓ nâu đỏ + 3 NaCl
- Nung kết tủa 3Fe(OH) trong không khí đến khối lượng không đổi thu được chất rắn là 23FeO
t
3232 PTHH: 2Fe(OH)FeO3HO + →
- Sục khí 2CO tới dư vào dung dịch Y , sau phản ứng hoàn toàn thu được kết tủa trắng và dung dịch Z . Lọc dung dịch ta thu được kết tủa là 3Al(OH)
PTHH: 2223 CONaAlO2HOAl(OH) ++→↓ trắng 3NaHCO+
- Nung kết tủa 3Al(OH) trong không khí đến khối lượng không đổi ta thu được chất rắn là 23AlO
0
3232 PTHH: 2Al(OH)AlO3HO + →
Câu 7
7.1. (VDC)
Phương pháp:
TN2: 2 bình brom tăngAnkenBrankenmm;nn == Công thức anken
ankanAanken nnn =−
TN1:
+) Số 2 TBCOA Cn/n = biện luận tìm được công thức 1 ankan
+) Trong X có 2 chất có số mol bằng nhau Chia các trường hợp để tìm ankan còn lại.
Cách giải:
TN2:
- A n6,72/22,40,3 mol ==
binh brom ăngAnken mm1,4 == gam
- ( ) khithoátra Ankan Ankan VV5,6ln0,25 mol == =
Anken n0,30,250,05 =−= mol.
Anken M1,4/0,0528 == Anken là 24CH
Trong A có 2 ankan.
TN1: Tỉ lệ về thể tích bằng tỉ lệ số mol
Xét 22 ACOHO n1moln1,5 mol;n7/3 mol = ==
- Số 2 TBCOA Cn/n1,5/11,51A ===> có 4CH .
Trong A có 244 CH,CH và 1 ankan X
- Ta có: 22 4 AnkanHOCOCHX nnn7/31,55/6nn =−=−==+
24CH n15/61/6 mol =−= .
- Trong A có 2 hiđrocacbon có số mol bằng nhau, ta chia thành 3 trường hợp:
TH1: 244 CHCHX nn1/6n5/61/62/3 == =−=
BTNT C: 424 CHCHX n2na.n1,5 ++= (a là số nguyên tử C trong X )
1/62.1/6a.2/31,5a1,5⇔++= = (Loại)
TH2: 24 4CHXCH nn1/6n5/61/62/3 == =−=
BTNT C: 424 CHCHX n2na.nx1,5 ++=
2/32.1/6.1/61,5a3X a ⇔++= = là 38CH (Thỏa mãn)
TH3: 4 CHX nn1/2.5/65/12 ===
BTNT C: 424 CHCHX n2na.n1,5 ++=
5/122.1/6a.5/121,5a1,8⇔++= = (Loại)
Vậy A gồm 438CH,CH và 24CH
7. 2 (VD)
Phương pháp:
Sau khi tìm được công thức của các ankan thì dựa vào tỉ lệ số mol để tìm thể tích mỗi chất.
Cách giải:
Trong V (l) hỗn hợp A có: 42438 CHCHCHV2/3 V; V1/6 V; V1/6 V ===
ĐỀ 2
Câu 6
6. 1 (TH)
Phương pháp:
Dựa vào tính chất của các chất.
Cách giải:
Trong quá trình quang hợp của cây xanh xảy ra phản ứng hóa học:
( ) askt,diep-luc 2261052 n 6nCO5nHOCHO6nO +→+
- ( ) 6105CHO n là tinh bột, thuộc loại gluxit nên cây xanh được ví như nhà máy sản xuất gluxit.
- Phản ứng sinh ra khí 2O nên điều hòa lượng khí oxi trong khí quyển.
6. 2 (VD)
Phương pháp:
Từ 22 OCOVV theo PTHH
Cách giải:
Theo 22 COOPTHH,nn =
Mà trong cùng điều kiện thì tỉ lệ thể tích bằng tỉ lệ về số mol) nên:
22Fe2HClFeClH +→+
34322 FeO8HCl2FeClFeCl4HO +→++
( ) 2333 FeCl3AgNOFeNOAg2AgCl
( ) 3333 FeCl3AgNOFeNO3AgCl
7.2 (VDC)
Phương pháp:
2 HFe pu nn 2AgClAgFeCl Cl nnnn
BTNT Fe Fe (oxit) n
3 COLTO VV134,4m ==
() ( ) 2 2
Do hiệu suất quá trình tổng hợp đạt 80% nên lượng 2CO thực tế cây xanh hấp thụ là:
BTNT H () 2 HO Ooxit nn
()() FeoxitOoxitn/n Công thức của oxit sắt.
() ( ) ( ) 2 2
3 COTTCO VVLT.100/H134,4.100/80168m ===
Câu 7
7.1 (VDC)
Phương pháp:
Dựa vào tính chất hóa học của sắt và hợp chất.
Cách giải:
- PTHH của các phản ứng đã xảy ra:
*Trường hợp 1: Nếu oxit sắt là FeO
22Fe2HClFeClH +→+
22 FeO2HClFeClHO +→+
( ) 2333 FeCl3AgNOFeNOAg2AgCl +→+↓+↓
*Trường hợp 2: Nếu oxit sắt là 23FeO
22Fe2HClFeClH +→+
2332 FeO6HCl2FeCl3HO +→+
( ) 2333 FeCl3AgNOFeNOAg2AgCl
( ) 3333 FeCl3AgNOFeNO3AgCl +→+↓
*Trường hợp 2: Nếu oxit sắt là 34FeO
Cách giải:
HClH2n0,6 mol;n0,06 mol ==
- BTNT Cl: AgClHClAgCl nn0,6 molm0,6.143,586,1 == == gam
Ag m99,0686,112,96 =−= gam
==
Ag n12,96/1080,12 mol
- BTNT H: 22 22 HClHHOHOHO n2n2n0,62.0,062nn0,24 mol =+ =+ =
BTNT O: 2 HOO(oxit) nn0,24 mol ==
- Từ các 2 2 FeHFeClAgPTHH:nn0,06 mol;nn0,12 mol ====
BTNT Cl: ( ) 323 HClFeClFeClFeCl n3n2nn0,62.0,12/30,12 mol =+ =−=
BTNT Fe: 32 Fe(oxit) FeClFeClFe nnnn0,120,120,060,18 mol =+−=+−=
=> Oxit có tỉ lệ FeO n:n0,18:0,243:4 ==
=> Công thức oxit sắt là 34FeO
Vậy hỗn hợp chứa:
Fe n0,06 mol =
34 FeOFe (oxit) n1/3.n0,06 mol ==
34FeFeO mmm0,06.560,06.23217,28 =+=+= gam.
GIÁO DỤC VÀ ĐÀO TẠO LÀO CAI
ĐỀ THI CHÍNH THỨC
Câu 1: (1,5 điểm)
ĐỀ THI TUYỂN SINH LỚP 10 THPT CHUYÊN
NĂM HỌC 2021 - 2022
MÔN: HÓA HỌC
Thời gian làm bài: 150 phút
1. Viết các phương trình phản ứng có thể xảy ra trong các thí nghiệm sau:
a) Cho CaO vào dung dịch HCl dư.
b) Cho khí 3NH dư vào dung dịch HCI và 2FeCl
c) Dẫn 25NO vào dung dịch 23NaCO dư.
d) Cho 23AlO vào dung dịch 2Ba(OH)
e) Cho Na vào dung dịch chứa hỗn hợp 3NaHCO và 2MgCl
2. Chất A là ( ) 24 2 CaHPO . Cho 2xmolNaOH vào dung dịch chứa xmol A thu được hỗn hợp muối B . Nếu
cho 2x mol HCl vào dung dịch chứa x mol A , thu được dung dịch C A có thể phản ứng với dung dịch 2Ca(OH) dư tạo kết tủa trắng.
a) Xác định thành phần của B và C và viết phương trình hóa học của các phản ứng xảy ra.
b) A là thành phần chính của phân bón Supephotphat kép. Từ quặng photphorit (có chứa ( ) ) 34 2 CaPO và
axit sunfuric đặc em hãy viết các phương trình phản ứng điều chế supephotphat kép.
Câu 2: (1,5 điểm)
1. Tiến hành thí nghiệm sau: Dẫn hơi nước qua than nóng đỏ thu được khí than uớt là hỗn hợp khí và hơi X
(gồm 22 CO,CO,H và hơi nước dư). Dẫn toàn bộ hỗn hợp X qua bình 1 nung nóng đựng CuO (dư) đến
phản ứng hòa toàn thu được hỗn hợp khí và hơi Y ; dẫn Y qua bình 2 dựng bột 4CuSO khan thu được khí Z ; tiếp tục dẫn Z vào bình 3 dựng dung dịch 2Ba(OH) dư. Em hãy viết tất cả các phương trình phản ứng có thể xảy ra trong toàn bộ thí nghiệm và cho biết hiện tượng xảy ra ở bình 1 , bình 2 và bình 3 .
1. Cho 31,6 gam 4KMnO , tác dụng hết với dung dịch HCl đặc, dư và đun nóng thu được hỗn hợp khí và hơi
A . Dẫn toàn bộ A lần lượt bình 1 đựng dung dịch NaCl bão hòa, bình 2 đựng dung dịch 24HSO đặc, dư thu được V lít khí M duy nhất (ở 25C và 1 atm).
a) Tính V biết hiệu suất của toàn bộ quá trinh là 80% và ở điều kiện (ở 25C và 1atm ) thì 1mol khí có thể tích là 24 lít.
b) Dẫn toàn bộ V lít khí M trên vào 1 lít dung dịch NaOH1M ở nhiệt độ thường để phản ứng xảy ra hoàn toàn, thu được dung dịch Q . Viết các phương trình phản ứng xảy ra và tính nồng độ mol các chất có trong dung dịch Q (giả thiết rằng thể tích dung dịch sau phản ứng thay đổi không đáng kể, phản ứng xảy ra hoàn
toàn).
Câu3: (1,5 điểm)
1. a) Tiến hành thí nghiệm nhiệt phân 2Cu(OH) (Hình 1). Em hãy nêu hiện tượng trước và sau khi xảy ra phản ứng nhiệt phân, viết phương trình hóa học minh họa.
b) Người ta tiến hành thí nghiệm để xác định thành phần hóa học của một nhúm bông có nguồn gốc thiên nhiên (Hình 2). Em hãy dự đoán hiện tượng xảy ra trong 2 ống nghiệm và giải thích bằng phương trình phản ứng (nếu có). Biết thành phần hóa học chính của bông là xenlulozơ. Thí nghiệm cho phép chúng ta kết luận như thế nào về thành phần hóa học của bông có nguồn gốc thiên nhiên?
2. Muối ăn được sản xuất từ nước biển thường có lẫn tạp chất là 2MgCl và 4CaSO . Em hãy nêu phương pháp để loại bỏ các tạp chất trên để thu được muối ăn tinh khiết và viết phương trình phản ứng đã xảy ra trong quá trình đó. Giả thiết các hóa chất, điều kiện cần thiết có đủ
Câu4: (2,0 điểm)

1. Hỗn hợp A gồm 3 CaCO,Cu,FeO và Al . Nung nóng A (trong điều kiện không có không khí) một thời gian thu được hỗn hợp chất rắn B chứa 6 chất. Cho B vào một lượng nước dư, thu được dung dịch C và chất rắn D và không thấy có bọt khí thoát ra. Chất rắn D không thay đổi khối lượng khi cho vào dung dịch NaOH . Cho D tác dụng với dung dịch 24HSO đặc nóng, dư. Xác định thành phần của ,, BCD và viết các phương trình phản ứng xảy ra.
2. Cho m gam hỗn hợp X gồm Fe và 3FeCO . Hòa tan hoàn toàn trong dung dịch HCl loãng, dư. Sau phản
ứng thu được 13,44 lít hỗn hợp khí Y có tỉ khối so với hiđro là 4,5. Thể tích các khi đo ở điều kiện tiêu chuẩn.
a) Tính m và phần trăm khối lượng 3Fe,FeCO trong hỗn hợp ban đầu.
b) Cho m gam hỗn hợp X trên vào cốc dụng 170 gam dung dịch axit 24HSO đặc và đun nóng. Dung dịch thu được sau phản ứng chỉ chứa duy nhất 1 chất tan. Khi thu được gồm 22CO,SO . Tính nồng độ % của dung dịch axit 24HSO ban đầu.
Câu5: (1,5 điểm)
1. Hoàn thành các phương trình phản ứng theo sơ đồ chuyển hóa sau
34 CHCOONaCHXYZT →→→→→→ Cao su Buna.
2. Cho m gam hỗn hợp X gồm Metan, Propan ( ) 38CH , Etilen và Propen ( ) 36CH có tổng số mol là 0,57 mol
Thí nghiệm 1: Đốt cháy hoàn toàn m gam X cần vừa đủ 54,88 lít khí 2O (đktc).
Thí nghiệm 2: Mặt khác cho m gam X qua dung dịch nước Brom dư thì thấy số mol brom phản ứng là 0,32 mol. Viết phương trình phản ứng xảy ra trong các thí nghiệm trên và tính giá trị của m.
Câu6: (2,0 điểm)
1. Cho ,,, MRQT là những hợp chất hữu cơ mạch hở, có công thức phân tử (không theo thứ tự) là
2236 CH,CHO , 26243 CHO,CHO và có tính chất thỏa mãn các thí nghiệm sau:
Thínghiệm M R Q T
1. Đốt cháy trong không khí 22 COHOnn = 22 COHOnn = 22 COHOnn < 22 COHOnn >
2. Tác dụng với dung dịch NaOH, đun nóng Có phản ứng Không phản ứng Không phản ứng Không phản ứng
3. Tác dụng với Na ở nhiệt độ thường
Có bọt khí 2 HMnn = Có bọt khí Có bọt khí Không hiện tượng
4. Tác dụng với nước Brom Không hiện tượng
Làm mất màu nước Brom
Không hiện tượng
Làm mất màu nước Brom
Em hãy xác định công thức phân tử và công thức cấu tạo phù hợp của ,,, MRQT (có lập luận) và viết phương trình phản ứng xảy ra trong các thí nghiệm trên. Biết nhóm OH của ancol không bền khi liên kết với nguyên tử CC = hoặc CC ≡
2. Cho hợp chất X có thành phần nguyên tố gồm cacbon, hidro và oxi. Biết X có khối lượng mol là 92gam/mol và 1,84 gam chất X tác dụng hết với Na (dư) giải phóng 2 672mlH (đktc). Chất X không tác dụng với 3NaHCO và X chỉ chứa 1 loại nhóm chức trong phân tử
a) Em hãy xác định công thức cấu tạo của X . Biết rằng mỗi nguyên tử C (cacbon) chỉ liên kết với tối đa 1 nhóm OH)
b) Đun X với hỗn hợp axit béo 1735 CHCOOH và 3 CHCOOH có mặt 24HSO đặc làm chất xúc tác thu được
một hỗn hợp este Y (chỉ chứa nhóm chức este). Em hãy viết công thức cấu tạo các sản phẩm este trong hỗn hợp Y.
Câu1(VDC):
1.(VDC):
Phươngpháp:
HƯỚNGDẪNGIẢICHITIẾT
Chú ý: Sản phẩm sinh ra vẫn có thể tham gia phản ứng tiếp.
Cáchgiải:
a) 22 CaO2HClCaClHO +→+
b) 34 NHHClNHCl +→
32224 2NH2HOFeClFe(OH)2NHCl ++→↓+
c) 2523 NOHO2HNO +→
32333 HNONaCOduNaHCONaNO +→+
d) ( ) 23222 2 AlOBa(OH)BaAlOHO +→+
e) 22 2Na2HO2NaOHH+→+↑
3232 NaOHNaHCONaCOHO +→+
22 2NaOHMgClMg(OH)2NaCl +→↓+
2323 NaCOMgClMgCO2NaCl +→↓+
2.(VDC):
Phươngpháp:
a)
* Khi cho 2x mol NaOH tác dụng với x mol Ca ( ) ( ) 24 2 HPO A :
Xác định tỉ lệ số mol giữa 2 ion OH và 24HPO sản phẩm sinh ra (tương tự bài toán 2 COdd + kiềm)
* Khi cho 2xmolHCl tác dụng với ( ) ( ) 24 2 xmolCaHPO A :
Xảy ra phản ứng: 2434 HPOHHPO −++→
So sánh tỉ lệ số mol của 2 ion H+ và 24HPO xem có ion nào còn dư sau phản ứng không.
b) Lý thuyết về quá trình điều chế supephotphat kép từ quặng apatit ( ) 34 2 CaPO và 24HSO đặc.
Cáchgiải:
a) *Khi cho 2x mol NaOH tác dụng với x mol Ca( ) ( ) 24 2 HPO A :
Ta thấy nон 24HPO n 2x OH n ==
Xảy ra phản ứng: 2 244OHHPO 2HPO +→
hoặc có thể viết thành: ( ) 244242 2 2NaOHCaHPOCaHPONaHPO2HO +→++
B
gồm 2 muối là 4CaHPO và 24NaHPO
*Khi cho 2x mol HCl tác dụng với ( ) ( ) 24 2 xmolCaHPO A :
X
ảy ra phản ứng: 2434HHPO HPO +−+→
Ta thấy 24HHPO nn 2x +− == Hai ion phản ứng hết với nhau
Có thể viết phản ứng xảy ra thành: ( ) 24234 2 2HClCaHPOCaClHPO +→+
gồm 2 chất là 2CaCl và 34HPO
b)
C
( ) 3424 2 CaPO3HSO + đặc 344 2HPO3CaSO t →+
( ) ( ) ( )
343424 22 CaPO4HPO3CaHPO A +→
Câu2(VDC):
1.(VDC):
OH HPO
n T n =
24
2 2442 OHHPOHPOHO +→+ (1)
23 442 OHHPO PO HO+→+ (2)
T1 ≤ chỉ xảy ra phản ứng (1)
1T2 << xảy ra cả hai phản ứng (1) và (2)
T2 ≥ chỉ xảy ra phản ứng (2)
Phươngpháp:
- Chất khí phản ứng ở bình 1 là 2CO,H
- Chất khí phản ứng ở bình 2 là 2 HO.
- Chất khí phản ứng ở bình 3 là 2CO .
Cáchgiải:
*Khi dẫn hơi nước qua than nóng đỏ có thể xảy ra các phản ứng:
22 CHOCOH +→ +
222 C2HOCO2H → ++
2 CCO2CO i → +
*Dẫn hỗn hợp khí ( 22 XCO,CO,H , hơi ) 2 HO qua bình 1 đựng CuO dư, nung nóng:
2COCuOCuCO t ++ →
đen đỏ gạch
22 HCuOCuHO t + → +
đen đỏ gạch
Hiện tuợng: Chất rắn màu đen ( )CuO dần chuyển sang màu đỏ gạch ( ) Cu , có hơi nước bám vào thành bình.
*Dẫn hỗn hợp khí ( 2YCO , hơi ) 2 HO qua bình 2 đựng 4CuSO khan:
4242 CuSO5HOCuSO5HO +→
trắng xanh lam
Hiện tượng: Chất rắn màu trắng ( ) 4CuSO dần chuyển sang màu xanh lam ( ) 42 CuSO.5HO
*Dẫn khí ( ) 2ZCO qua bình 3 đựng dd 2Ba(OH) dư:
2232 COBa(OH)BaCOHO +→↓+ trắng
Hiện tượng: Xuất hiện kết tủa trắng ( ) 3BaCO
2.(VDC):
Phươngpháp:
a) PTHH: 4 222 2KMnO16HCl2KCl2MnCl5Cl8HO +→++↑+
Bình dung dịch NaCl bão hòa đề giữ khí HCl
Bình dung dịch 24HSO đặc để giữ hơi nước.
KhíM là 2Cl
Tính 42222 KMnOClLTClTTClLTClTT nnnn.HVn24 . = =
b) 2 2 PTHH:Cl2NaOHNaClNaClOHO +→++ (nhiệt độ thường)
So sánh tỉ lệ 2Cl 1 n và NaOH 2 n xem chất nào còn dư sau phản ứng
Nồng độ mol các chất có trong dung dịch sau phản ứng: / M CnV = Cáchgiải:
a)
PTHH: 4222 2KMnO16HCl2KCl2MnCl5Cl8HO +→++↑+
Bình dung dịch NaCl bão hòa đề giữ khí HCl
Bình dung dịch 24HSO đặc để giữ hơi nước.
Khí M là 2Cl
4KMnO n31,6/1580,2 mol ==
24 ClLTKMnO n2/5.n5/2.0,20,5 mol === (lý thuyết )
22 ClTTClLT nnH0,5.0,80,4 mol === (thực tế) 2 ClTT Vn.240,4.249,6 === lít.
b)
NaOH n1mol =
PTHH: 22 Cl2NaOHNaClNaClOHO +→++ (nhiệt độ thường)
Ban đầu: 0,4 1 (mol)
Pứ: 0,4 → 0,8 → 0,4 → 0,4 (mol)
Sau pứ: 0 → 0,2 → 0,4 → 0,4 (mol)
Dung dịch sau phản ứng gồm 0,2 molNaOH dư; 0,4 molNaCl;0,4 molNaClO
MNaOHdu C0,2/10,2M ==
MNaCl C0,4/10,4M ==
MNaClO C0,4/10,4M ==
Câu3(VDC):
1.(VDC):
Phươngpháp:
a) PTHH: 22 Cu(OH)CuOHO + →
b) Bông có thành phần chính là xenlulozo ( ) 6105CHO n
Khi đốt: ()6105222 n CHO6nO6nCO5nHO t + → +
Cáchgiải:
16.a)
Trước nhiệt phân: 2Cu(OH) là chất rắn màu xanh lam
Sau nhiệt phân: thu được chất rắn có màu đen ( )CuO
PTHH: 22 Cu(OH)CuOHO t + → xanh lam đen

b)
- Hiện tượng khi đốt: xuất hiện hơi nước bám vào thành ống nghiệm.
()6105222 n CHO6nO6nCO5nHO t + → +
- Hiện tượng khi đổ nước vôi trong: xuất hiện kết tủa trắng ( ) 3CaCO .
2232 COCa(OH)CaCOHO +→↓+ trắng
Kết luận: Sản phẩm cháy có khí 2CO Thành phần hóa học của bông có nguyên tố cacbon.
(Muốn kết luận thành phần hóa học của bông có nguyên tố hiđro cần dẫnsản phẩm cháy qua 4CuSO khan -
hiện tượng tương tự câu2).
2.(VDC):
Phươngpháp:
Dựa vào lý thuyết về hợp chất vô cơ.
Cáchgiải: Sơ đồ
- Hòa tan mẫu muối ăn vào lượng nước dư, ta được dung dịch (1) chứa 24 NaCl,MgCl,CaSO .
- Cho dung dịch (1) tác dụng với dung dịch 2BaCl ,thu được dung dịch (2) chứa 222 NaCl,MgCl,CaCl,BaCl :
+→↓+
2442 BaClCaSOBaSOCaCl
- Cho dung dịch (2) tác dụng với 23NaCO dư, thu được dung dịch (3) chứa 23NaCl,NaCO dư:
+→↓+
2233 MgClNaCOMgCO2NaCl
+→↓+
2233 CaClNaCOCaCO2NaCl
+→↓+
2233 BaClNaCOBaCO2NaCl
- Cho dung dịch (3) tác dụng với HCl dư, thu được dung dịch (4) chứa NaCl,HCl dư:
2322 NaCO2HCl2NaClHOCO
- Cô cạn dung dịch (4), HCl bay hơi hết sẽ thu được được NaCl rắn (muối ăn) tinh khiết.
Câu4(VDC):
1.(VDC):
Phươngpháp:
- Khi cho B vào nước dư, không thấy có khí thoát ra Trong B không có A vì nếu có sẽ xảy ra phản
ứng: Al 222 OHHOAlO3/2H ++→+↑
Thành phần chất rắn B(6 chất ) , dung dịch C
- Chất rắn D không thay đổi thành phần khi cho vào dung dịch NaOH Trong D không có 23AlO vì nó sẽ tan trong 2322 NaOH:AlO2NaOH2NaAlOHO +→+
Thành phần chất rắn D .
Cáchgiải:
- Khi nung nóng A: 32 CaCOCaOCO t →+
2Al3FeOAlO3Fe t + → +
23
- Khi cho B vào nước dư, không thấy có khí thoát ra Trong B không có A vì nếu có sẽ xảy ra phản
ứng: Al 222 OHHOAlO3/2H ++→+↑
Trong B gồm các chất: 233 CaO,AlO,Fe,Cu,CaCO dư, duFeO 22 CaOHOCa(OH) +→ ( ) 23222 2 AlOCa(OH)CaAlOHO +→+
Dung dịch C gồm ( ) 2 2 CaAlO , có thể có 2Ca(OH) dư
- Chất rắn D không thay đổi thành phần khi cho vào dung dịch NaOH Trong D không có 23AlO vì nó
sẽ tan trong 2322 NaOH:AlO2NaOH2NaAlOHO +→+
Trong D gồm các chất 3 Fe,Cu,CaCO,FeO
- Khi cho D tác dụng với 24HSO đặc nóng: ( ) 0 24 đ 2422 3 2Fe6HSOFeSO3SO6HO + +→+
24đ 422 Cu2HSOCuSO2SO2HO → +++
324422 CaCOHSOCaSOCOHO +→++
( ) 242422 3 2FeO4HSOFeSOSO4HO +→++
2.(VDC):
Phươngpháp:
a)
-Dùng PP đường chéo để tìm số mol 22 ,CO H cótrong Y
-PTHH:
22Fe2HClFeClH+→+↑
3222 FeCO2HClFeClHOCO +→++↑
232 FeHFeCOCO nn;nn ==
m
FeFeCO3-%;%m
b)Dungdịch sau phản ứngchỉ chứa duy nhất 1chất 24tanHSO đặcphản ứngvừa đủ.
-PTHH:
() 242422 3 2Fe6HSOFeSO3SO6HO dac +++ →
( ) 324 dac24222 3 2FeCO4HSOFeSOSO2CO4HO +→+++
24HSO n đặc 3FeFeCO3n2n=+
24 m HSO đặc
24C%HSO đặ
Cáchgiải:
a)
-Xét hỗn hợp khí Y:
Y M4,5.29 g/mol ==

13,44/22,40,6 mol Yn ==
Phươngpháp đườngchéo: 22 22 22
n5n n0,5mol;n0,1mol nnn0,6 =
HCO HCO HCOY
== +==
-PTHH:
22Fe2HClFeClH+→+↑
0,5 ← 0,5 (mol)
FeCO2HClFeClH 0,0 OO ,o C 11m +→+↑ ← +
() 3222 l
Hỗn hợp X gồm 3 0,5 molFevà0,1molFeCO
m0,5.560,1.11639,6 g =+= .
Fe 0,5.56 %m.100%70,71% 39,6 =≈
%100%70,71%29,29% =−=
3FeCO
b)
Dungdịchsauphản ứngchỉ chứaduynhất1chất 24tanHSO đặcphản ứngvừa đủ.
-PTHH:
( ) 24d2422 3 2Fe6HSOFeSO3SO6HO +→++
0,5 → 1,5 (mol)
( ) 324d24222 3 2FeCO4HSOFeSOSO2CO4HO +→+++
0,1 → 0,1 (mol)
24HSO đac n1,50,21,7 mol =+=
==
24HSO đac m1,7.98166,6 g.
24 HSOdacC% 166,6/170.100%98%. ==
Câu5(VDC):
1.(VDC):
Cáchgiải: CaO, 3ran 423 CHCOONaNaOHCHNaCO t → ++ ( ) 1500C
4222 LLN 2CHCHX3H + → ( ) 3Pd/bCO 22224 CHHCHY P +→ () H 24225 CHHOCHOHZ + → + () 252222 xt 2CHOHCHCHCHCH T2HOH =−= →++
t,p,xt
2222 n nCHCHCHCHCHCHCHCH (caosubuna) → =−=−=−−
2.(VDC):
Phươngpháp:
-Xétthínghiệm2:
242242 CHBrCHBr +→
362362 CHBrCHBr +→
CHCHBr nnn
với 4 24 metanpropan etilenpropen ; CHCH nnnnnn =+=+
244 CHCHnn
-Khi đốtcháy X:
4222 CH2OCO2HO + → +
24222 CH3O2CO2HO t + → +
t 2222 CH1,5OCOHO + → +
Biết 22442 OCHCHCH n,n,nn
4242 CHCHCHmmmm =++
Cáchgiải:
-Xétthínghiệm2:
Br2 n0,32 mol =
242242 CHBrCHBr +→
362362 CHBrCHBr +→
+==
24362 CHCHBr nnn0,32 mol
CH CH:0,32 CH
-Quy đổihỗn hợp Xthành 4 mol 24 2
với 4 24 metan propan eilen propen ; CHCH nnnnnn =+=+
+= =−=
4244 CHCHCH nn0,57n0,570,320,25 mol
-Khi đốtcháy X :
2O n54,88/22,42,45 mol ==
4222 CH2OCO2HO + → +
0,250,5 →
24222 CH3O2CO2HO t + → +
0,320,96 →
2222 CH1,5OCOHO → ++
==
2CH 2,450,50,96 n0,66 mol 1,5
=++=++=
4242 CHCHCH mmmm0,25.160,32.280,66.1422,2 g
Câu6(VDC):
1.(VDC):
Phươngpháp:
*Tính độ bấtbão hòacủamỗi CTHH.
Côngthứctính độ bấtbãohòa k chohợp chất xyz CHO : 22 k 2 xy−+ =
*Nhận thấy,khi đốtcháy M và R có CO2H2Onn =
M và R có độ bãohòa k1 =
M có phản ứng với Na có H2M nnM = có 2nhóm chứcphản ứng đượcvới NaM
R cóphản ứng với Na ,cólàmmất màudung dịch brom R làancolkhôngno R
*Nhận thấy, đốt Q có 22 COHO nnQ < có độ bất bão hòa k0Q ==>
*Nhận thấy, đốt T có n 22HO nT COn > có độ bấtbãohòa k2T ≥
Cáchgiải:
*Độ bấtbãohòacủamỗi CTTH:
22 2222 CH:k2 2 x −+ ==
36 2362 CHO:k1 2 x −+ ==
26 2262 CHO:k0 2 x −+ ==
243 2242 CHO:k1 2 x −+ ==
*Nhận thấy,khi đốtcháy M và R có 22 COHOnn =
M và R có độ bãohòa k1 =
M và R là2chất 36 CHO và 243CHO
-M có phản ứngvới Na có 2 HM nnM = có 2nhóm chứcphản ứng đượcvới Na
22222 CHCHCHOHNaCHCHCHONa1/2H =−+→=−+
22222 CHCHCHOHBrCHBrCHBrCHOH =−+→−−
*Nhận thấy, đốt Q có n 22 COHnQ O n < có độ bấtbão hòa k0 =
Q
là 26 CHO, CTCTlà 25 CHOH
26222 CHO3O2CO3HO t + → +
25252 CHOHNaCHONa1/2H +→+
*Nhận thấy, đốt T có 22 COHO nnT > có độ bấtbãohòa k2 ≥
=>Tlà 22 CH,CTCT là HCCH ≡
22222 CH5/2O2COHO t → ++
222 HCCH2BrCHBrCHBr ≡+→−
2.(VDC):
Cáchgiải:
a)
X khôngtácdụng với 3NaHCO vàchỉ chứamột loạinhómchứctrongphân tử X làancol
X n1,84/920,02 mol ==
2H n0,672/22,40,03mol ==
2 HXn3/2n =

X làancol3chức
CTCTcủaXlà:
M
là 243CHO ,CTCTlàHOOC- 2 CHOH (hợpchấttạpchức)
243222 CHO1,5O2CO2HO t + → +
HOOC- 2 22 CHOHNaOHNaOOCCHOHHO +→−+
HOOC- 2 22 CHOH2NaNaOOCCHONaH +→−+
-R có phản ứng với Na , có làm mấtmàudung dịchbrom
R là 36 CHO ancolkhôngno,CTCTlà 22 CHCHCHOH =−
36222 CHO4O3CO3HO t + → +
b)
Hỗn hợpYgồm cáceste:
-
T HÀ TĨNH KỲ THI TUYỂN SINH VÀO LỚP 10 THPT
NĂM HỌC 2021 - 2022
Môn: Hóa học (Chuyên)
Thời gian làm bài: 120 phút
MỤC TIÊU
- Đề thi giúp học sinh củng cố lại kiến thức, rèn luyện kĩ năng làm bài
Đề thi giúp học sinh đánh giá được bản thân và có chiến lược ôn thi hiệu quả
Câu 1:
X là muốicủakimloạiCanxi, Y làmuốicủakimloạiNatri.Từ X và Y thựchiệncácphản ứngsau:
12XXCO t →+
122 XHOX +→
212 XYXYHO +→++
222 X2YXY2HO +→++
Xác định 122 X,Y,X,X,Y,Y vàhoànthànhphươngtrìnhhóahọccủacácphản ứng.
Câu 2: Giảithíchhiệntượngxảyratrongcáctrườnghợpsau:
a) Cho một ít mỡ lợn vào ống nghiệm chứa dung dịch NaOH , sau đó đun nóng ống nghiệm thì thấy mỡ tan
trong dung dịch NaOH
b) Cho một ít rượu etylic vào ống nghiệm chứa lòng trắng trứng thì xuất hiện kết tủa.
c) Nhỏ axeton vào quả bóng bàn thì quả bóng sẽ bị thủng.
d) Một khúc mía để lâu trong không khí thì đầu vết cắt có mùi của rượu etylic.
Câu 3:
Có 4 chất hữu cơ mạch hở có công thức phân tử 2434224226 CH,CHO,CHO,CHO được ký hiệu ngẫu
nhiên X , Y,Z,T . Biết rằng:
- Chất Y,T làm mất màu dung dịch brom.
- Chất X,Z,T tác dụng với Na giải phóng khí 2 H
- Chất Z không làm đổi màu quỳ tím.
Xác định X,Y,Z,T và viết phương trình hóa học của các phản ứng xảy ra.
Câu 4:
1. Hợp chất của nguyên tố X có nhiều trong đất sét. X là chất rắn, màu xám, khó nóng chảy và được dùng
làm vật liệu bán dẫn. X tác dụng được với oxi ở nhiệt độ cao tạo thành hợp chất Y . Chất Y tác dụng được
với NaOH rắn và với CaO ở nhiệt độ cao tạo thành các hợp chất Z và T. Xác định nguyên tố X , các hợp chất Y,Z,T và viết phương trình hóa học của các phản ứng.
2. Chia 22,65 gam hỗn hợp ba kim loại Zn,Mg,Al thành hai phần bằng nhau. Cho phần 1 tác dụng hoàn toàn với dung dịch HCl dư, thu được a gam hỗn hợp muối và 8,96 lít (đktc) khí. Cho phần 2 tác dụng hoàn toàn với oxi dư, thu được b gam hỗn hợp ba oxit. Tính , ab
Câu 5: Đốt cháy hoàn toàn 0,2 mol hỗn hợp X (có khối lượng m gam) gồm 42224 CH,CH,CH và 36CH , thu được 7,84 lit (đktc) khí 2CO và 7,65 gam 2 HO. Mặt khác, 12,625 gam X tác dụng tối đa với a mol 2Br trong dung dịch. Tính m,a
Câu 6: Cho 34,4 gam hỗn hợp X gồm 3 3Fe,FeO,FeCO,MgOvàMgCO tác dụng vừa đủ với dung dịch 24HSO loãng, thu được 7,84 lít (đktc) hỗn hợp khí Y gồm 22CO,H và dung dịch Z chỉ chứa 68 gam hỗn hợp muối sunfat trung hòa. Tỉ khối hơi của Y so với 2H là 13 . Tính khối lượng của 4MgSO có trong dung dịch Z.
Câu 7:
Đốt cháy hoàn toàn 3,52 gam hợp chất MS (muối sunfua của kim loại M ) trong oxi dư, thu được m gam chất rắn X. Hòa tan hết m gam X trong dung dịch 3 HNO37,8% vừa đủ, thu được dung dịch Y có nồng độ của muối là 41,72%. Làm lạnh dung dịch Y, thu được 6,464 gam muối rắn Z. Lọc tách Z ra khỏi dung dịch Y , thu được dung dịch T có nồng độ của muối là 34,703% . Xác định công thức của Z , biết kim loại M có hóa trị cao nhất là III trong các hợp chất.
Câu 8:
Hỗn hợp X gồm Na và Al. Cho m gam hỗn hợp X tác dụng với nước dư, thu được V lít 2H (đktc) và còn lại 0,5192 m gam chất rắn không tan. Cho 0,5 mol hỗn hợp X tác dụng với dung dịch NaOH dư, thu được 3,125 V lít 2H (đktc). Tính m.
Câu 9:
Hỗn hợp X gồm các axit 15311735 CHCOOH,CHCOOH và một chất béo Y Đốt cháy hoàn toàn m gam X thu được 2 1,56 molCO và 2 1,52 molHO. Mặt khác, m gam X tác dụng vừa đủ với 100ml dung dịch NaOH0,9M, thu được glixerol và dung dịch chỉ chứa a gam muối natri của hai axit 1531 CHCOOH và 1735 CHCOOH . Tính a .
Câu 10:
1. Hòa tan hết x mol Fe trong lượng vừa đủ dung dịch chứa 24ymolHSO (biết x:y5:12 = ), thu được
một khí X và dung dịch chứa 42,8 gam muối (không tạo ra lưu huỳnh). Biện luận xác định X và tính x,y
2. Hòa tan hết a gam hỗn hợp X gồm 34233 Fe,FeO,FeO,FeCO trong dung dịch HCl dư, thu được 3,584 lít (đktc) hỗn hợp khí có tỉ khối so với 2H bằng 8,875 và dung dịch chứa m gam muối. Mặt khác, nếu hòa tan hết a gam hỗn hợp X trên trong dung dịch chứa 24 0,69 molHSO thì thu được dung dịch chỉ chứa 69,12 gam hỗn hợp muối sunfat và 5,376 lít (đktc) hỗn hợp gồm hai khí (có một khí là 2SO ). Tính m
Câu 1 (TH):
Phương pháp:
Dựa vào tính chất hóa học của các chất.
Cách giải:
X là 3 CaCO;Y là 31NaHCO;X là 2CaO;X là 21 Ca(OH);Y là 2NaOH;Y là 23NaCO t 32 CaCOCaOCO →+
(X) ( ) 1X 22 CaOHOCa(OH) +→
( ) 1X ( ) 2X
2332 Ca(OH)NaHCOCaCONaOHHO +→++
( ) 2X (Y) (X) (Y1)
233232 Ca(OH)2NaHCOCaCONaCOHO +→++
( ) 2X (Y) (X) ( ) 2Y
Câu 2 (TH):
Phương pháp:
Dựa vào tính chất hóa học của các chất.
Cách giải:
a) Mỡ lợn có thành phần hóa học là chất béo có dạng 335(RCOO)CH , với RCOO- là gốc axit béo.
Khi đun nóng mỡ lợn với dung dịch NaOH xảy ra phản ứng: t 335353 (RCOO)CH3NaOH3RCOONaCH(OH) +→+
Sau phản ứng tạo ra muối RCOONa và 353 CH(OH) (glixerol) là hai hợp chất tan trong nước
Mỡ lợn sẽ tan trong dung dịch NaOH khi đun nóng.
b) Khi gặp rượu etylic, protein sẽ bị đông tụ lại thành kết tủa.
c) Quả bóng bàn có thành phần hóa học là celluloid - một loại nhựa nhiệt dẻo, dễ dàng bị hòa tan bởi các dung môi hữu cơ như axeton
Quả bóng bàn sẽ bị thủng khi nhỏ axeton.
d) Trong khúc mía có chứa saccarozo ( ) 122211CHO , dưới tác dụng của những vi sinh vật trong không khí, dần dần saccarozơ sẽ bị phân cắt thành glucozơ và fructozơ:
enzim
1222116126 CHOCHO → (glucozo) 6126CHO+ (fructozo )
Glucozơ sẽ tiếp tục bị vi sinh vật lên men thành rượu etylic 25 CHOH :
enzim
6126252 CHO2CHOH2CO + →
Câu 3 (VD):
Phương pháp:
Dựa vào tính chất hóa học của các chất.
Cách giải:
- Z tác dụng được với Na sinh ra 2 H,Z không làm đổi màu quỳ tím, Z không có phản ứng với brom
Z là ancol no
Z là 26 CHO,CTCT là 32 CHCHOH
32322 CHCHOHNaCHCHONa1/2H +→+↑
- T tác dụng được với Na sinh ra 2 H, T làm mất màu dung dịch brom
T là 342 CHO,CTCT là 2 CHCHCOOH =−
2 2 2CHCHCOOHNaCHCHCOONa1/2H =−+→=−+↑
222 CHCHCOOHBrCHBrCHBrCOOH =−+→−−
- Y làm mất màu dung dịch brom Y là 24CH
22222 CHCHBrCHBrCHBr =+→−
- X tác dụng được với Na sinh ra 2 HX là 242 CHO,CTCT là 3 CHCOOH
332 CHCOOHNaCHCOONa1/2H +→+↑
Câu 4
1. (VD):
Phương pháp:
Đất sét có thành phần chính là 223 SiO,AlOX có thể là Si hoặc A
X là chất rắn, màu xám khó nóng chảy và được dùng làm vật liệu bán dẫn X
Cách giải:
X là chất rắn, màu xám khó nóng chảy và được dùng làm vật liệu bán dẫn; hợp chất của X có nhiều trong
đất sét
X là Si
Y là 2 SiO,Z là 23 NaSiO, T là 3CaSiO 0 t 22 SiOSiO → + (X) (Y)
2ran 232 SiONaOHNaSiOHO + → + (Y) (Z)
23 SiOCaOCaSiO +→
(Y) (T)
4.2 (VD):
Phương pháp:
- Tính khối lượng kim loại ở mỗi phần.
*Khi cho phần 1 tác dụng với HCl dư:
Zn2HClZnClH +→+
22
22Mg2HClMgClH +→+
322Al6HCl2AlCl3H +→+
- Từ PTHH ta thấy: nCl-= 2nH2
=> mmuối = a + mKL + mCl-
- Muối tạo thành là 223ClZnMgAlZnCl,MgCl,AlCln 2n2n3n =++ (1)
*Khi cho phần 2 tác dụng với oxi dư: t 2
2ZnO2ZnO → +
2MgO2MgO → +
2
4Al3OAlO → +
223
Oxit tạo thành là 23OZnMgAl ZnO,MgO,AlOnnn3/2n =++ (2)
Từ ( )( ) OoxitKLO 12nmbmm ==+
Cách giải:
mmỗi phần 22,65/211,325 g ==
*Khi cho phần 1 tác dụng với HCl dư: ( )
2H n8,96/22,40,4mol ==
22Zn2HClZnClH +→+
22Mg2HClMgClH +→+
322Al6HCl2AlCl3H +→+
- Từ PTHH ta thấy: 2H n2n2.0,40,8 mol Cl ===
muoi KLCl=>mamm 11,3250,8.35,539,725 g ==+=+= .
- Muối tạo thành là 223ZnMgAl Cl ZnCl,MgCl,AlCln2n2n3n =++ (1)
*Khi cho phần 2 tác dụng với oxi dư: t
2 2ZnO2ZnO → +
2 2MgO2MgO → +
223 4Al3OAlO → +
Oxit tạo thành là 23OZnMgAl ZnO,MgO,AlOnnn3/2n =++ (2)
Từ (1)(2) ( ) ( ) OgCl n1/2.n1/2.0,80,4 mol oc ===
oxit KLO mbmm11,3250,4.1617,725 g ==+=+=
Câu 5 (VD):
Phương pháp:
*Khi đốt cháy hoàn toàn 0,2 mol hỗn hợp X:
Tính 22 COHO , nn
BTNT C: 2CCOnn =
BTNT H: 2 HHOn2n =
X gồm các hiđrocacbon cấu tạo từ 2 nguyên tố C và H
XCH mmmm ==+
( ) CO2H2OXnXX nnk1.nknn −=−=−
22 XCOHOX k.nnnn =−+
*Khi cho 12,625 g hỗn hợp X tác dụng với dung dịch brom n2n22k2n2n22k2k CHkBrCHBr +−+− +→
( ) 2 BrX an12,625/m.k.n ==
Cách giải:
*Khi đốt cháy hoàn toàn 0,2 mol hỗn hợp X :
CO2 n7,84/22,40,35 mol ==
H2O n7,65/180,425 mol ==
BTNT C: CCO2 nn0,35 mol ==
BTNT H: HH2O n2n2.0,4250,85 mol ===
- X gồm các hidrocacbon cấu tạo từ 2 nguyên tố C và H XCH mmxmm0,35.120,85.15,05 g ==+=+= .
- Gọi CTTQ của hỗn hợp X là n2n22kCH +− (với k là độ bất bão hòa - biểu thị số liên kết π trong phân tử hidrocacbon).
()() t n2n22k222 CH1,5n0,50,5kOnCOn1kHO +− ++−+→+−
- Từ PTHH ta có:
2 COXnn.n =
( )
2 HOX nn1k.n =+−
( ) CO2H2OXnXX nnk1.nknn −=−=−
=−+=−+=
22 XCOHOX k.nnnn0,350,4250,20,125 mol
*Khi cho 12,625 g hỗn hợp X tác dụng với dung dịch brom
Gọi CTTQ của hỗn hợp X là
n2n22kCH +− (với k là độ bất bão hòa - biểu thị số liên kết π trong phân tử hiđrocacbon).
()() t n2n22k222 CH1,5n0,50,5kOnCOn1kHO +− ++−+→+−
Từ PTHH ta có:
( ) 22 COXHOX nn.n;nn1k.n ==+−
n2n22k2n2n22k2k CHkBrCHBr +−+− +→
( ) Br2X an12,625/5,05.k.n2,5.0,1250,3125 mol ====
Câu 6 (VD):
Phương pháp:
- Sơ đồ phản ứng:
Fe,FeO,FeCO HhXHSO MgO,MgCO
→+↑+
loãng 42 2 42
- Dùng PP đường chéo để tìm số mol mỗi khí trong hỗn hợp Y .
BTNT H: 2422 HSOHHO2n2n2n =+
2242 HOHSOH nnn =−
BTKL: 24 2 XHSOmuoi YHO mmmmmx +=++
- Xét hỗn hợp muối trong dung dịchZ :
Đặt 44 FeSOMgSO namol;nbmol ==
Lập hệ PTtìm a,bdựa vào:
+ Tổng khối lượng hai muối.
+ BTNT S: 2444 HSOFeSOMgSO nnn =+
4MgSOm
Cách giải:
- Sơ đồ phản ứng:
BTKL: 24 2 XHSOmuoiYHO mmmmm +=++ ( )34,498x680,35.2618x0,15 +=++−
24HSO xn0,5 mol ==
- Xét hỗn hợp muối trong dung dịchZ :
Đặt 44 FeSOMgSO namol;nb == mol
152a120 b68 += (1)
BTNT S: 2444 HSOFeSOMgSO nnn =+
ab0,5 += (2)
Từ ( )( ) 12ab0,25 mol == 4MgSO m0,25.12030 g
==
Câu 7 (VDC):
Phương pháp:
2232 4MS11O2MO8SO ++ →
3 24
Fe,FeO,FeCO HhXHSO MgO,MgCO +
3
- Xét hỗn hợp khí Y :
Y n7,84/22,40,35 mol ==
Phương pháp đường chéo:
loãng 42 2 42
FeSOH ddZhhYHO MgSOCO
22 HCO n/n3/4 = và 22 22 HCOYHCO nnn0,35n0,15;n0,2 +== ==

- Đặt 24HSO nxmol =
BTNT H: 2422 HSOHHO2n2n2n =+
2242 HOHSOH nnnx0,15 mol =−=−
Đặt 23MO na = mol ( )
23332 3 MO6HNO2MNO3HO +→+
a6a2a →→
Tính 233 MOHNO m,mtheo 3ddHNOam
BTKL: 233 dd MOHNOmmm =+
Tính () 3 3 MNOm theoa
Lậpcôngthứctínhnồng độ ( ) 3 3 MNO ,rútgọnata đượcphươngtrình ẩn MKim loại M.
*Khilàmlạnhdungdịch Y thu đượcmuốirắn Z :
dd TddZ mmYm =−
() 3 3 FeNO =>n trong T
() 3 3 FeNO =>n trong Z ()() 3333 FeNOFeNOtrong T nn=−
CTHHcủamuốirắn Z códạng ( ) 32 3 FNO.enHO
() 3 3 ZFeNOtrong Z =>nn =
Z Mn .
Cách giải:
2232 4MS11O2MO8SO ++ →
Đặt 23MO namol = ( ) 23332 3 MO6HNO2MNO3HO +→+
24218n404n9 += =
Vậy CTHH củamuốirắn Z là ( ) 32 3 FNO.e9HO
Câu 8 (VD):
Phương pháp:
*Xét 0,5 mol hỗn hợp X :
Đặtsố mol Natrong 0,5 mol hỗn hợp X làamol
( ) Al =>n0,5amol =−
22 2Na2HO2NaOHH +→+
==
a 6a 2a →→ ( ) 3HNO m6a.63378ag == ()
3ddHNO 378a.100 m1000ag 37,8
BTKL: ( ) ( ) 233ddYMO mmma2M481000a2aM1048ag HNO =+=++=+
( ) ( ) muoi m2aM1862aM372ag =+=+
Nồng độ dung dịch sau phản ứng:
222 2Al2NaOH2HO2NaAlO3H ++→+
H2NaAl n0,5n1,5n =+ (ứng với 3,125 V lít)
*Xét m gam hỗn hợp X:
-Lượng 2H sinh ralà V lít
H2 n theo a
33 2aM372a
2aM1048a + == +
C%M(NO)0,4172
2M37241,72 M56M 2M1048100 + = ≈ + là Fe.
FeS n3,52/880,04 mol ==
FeS an/20,02 mol ==
==
() 3 3 FeNO n2a0,04mol
*Khilàmlạnh dungdịch Y thu đượcmuốirắn Z :
-PTHH: 22 2Na2HO2NaOHH +→+
222 2Al2NaOH2HO2NaAlO3H ++→+
Ở trường hợp này,sau phản ứng vẫn còn chấtrắn không tan là AlNaOH hết, Al dư
=+=+=+=
H2NaNaOHNaAl puNaNaNa n0,5n1,5n0,5n1,5n0,5n1,5n2n
Na n theoa ( )1
-Khối lượng chấtrắn đãtan: m0,5192 m0,4808 m −=
NaAlpu NaNaNa 0,4808 mmm23n27n50n=>=+=+=
ddTddYZ mmm23,26,46416,736g =−=−=
ddY m2aM1048a23,2 g =+= ( )
=≈
() 3 3 FeNO trong T 16,736.34,703 n0,024 mol 100.242
=−=
() 3 3 FeNO trong Z n0,040,0240,016 mol
CTHHcủamuốirắn Z có dạng ( ) 32 3 FNO.enHO
() 3 3 ZFeNO trong Z nn0,016 mol ==
=>Liên hệ giữaavà ( )2 m
-Tỉ lệ số mol Al và Na ở 2 hỗn hợp bằng nhau:
Tính Al n theo a(3)
-Thế (1),(2),(3)vào NaAlmmm =+ tìmra am
Cách giải:
*Xét 0,5 mol hỗn hợp X:
Z M6,464/0,016404 g/mol
==
Đặtsố mol Natrong 0,5 mol hỗn hợp X làamol
( ) Al n0,5amol =−
22 2Na2HO2NaOHH +→+
222 2Al2NaOH2HO2NaAlO3H ++→+ ( ) ( ) H2NaAl n0,5n1,5n0,5a1,50,5a0,75amol =+=+−=− (ứngvới 3,125 V lít 2H )
*Xétm gamhỗnhợpX
-Lượng 2H sinh ralà V lít ( ) ( ) H2 n0,75a/3,125 mol =−
-PTHH:
22 2Na2HO2NaOHH +→+
222 2Al2NaOH2HO2NaAlO3H ++→+
Ở trường hợp này,sau phản ứng vẫn còn chấtrắn không tan là AlNaOH hết, Al dư
Phương pháp:
*Chứng minh công thức:
Khi đốt cháy hỗn hợp chất hữu cơ XchứaC,H,OcóCTTQlà n2n22kx CHO +− ( ) ( ) n2n22kx 222 CHO1,5n0,50,5k0,5xOnCOn1kHO +− ++−−→++−
Dựa vào PTHH:
CO2Xnn.n = ( ) 2 HOX nn1k.n =+− ( ) ( ) 22 COHOX nnk1.n* −=−
Chênh lệch nCO2, nH2O doYgây ra Y n
*Khi choXtác dụng vói dung dịchNaOH:
- Sơ đồ phản ứng:
==−
H2NaNaOHNaAlpuNaNaNa =>n0,5n1,5n0,5n1,5n0,5n1,5n2n =+=+=+= ( ) 2NaH nn/20,75a/6,25
-Khối lượng chấtrắn đãtan: m0,5192 m0,4808 m −= NaAl puNaNaNa 0,4808 mmm23n27n50n=>=+=+=
=−
( ) 0,4808 m50.0,75a/6,25
a0,750,0601m =− hay ( ) m0,75a/0,0601 =−
-Tỉ lệ số mol Al và Na ở 2 hỗn hợp bằng nhau: Al
a = ( )( ) Al 0,75a0,5a n 6,25a = ( )( ) 0,75a0,5a0,75a0,75a2723 6,25a6,250,0601
0,75 a 6,25 n0,5a
=≈
⋅+⋅= a0,125 mol ≈ 0,75a m10,3990,0601g
Câu 9 (VD):
+→++
CHCOOH CHCOONa CHCOOHNaOHCH(OH)HO CHCOONa (RCOO)CH(Y)
COOCOOHNaOHOtrongX nnnn +=
X được cấu tạo từ 3 nguyên tố XCHO C,H,Ommmm =++
COOHNaOHCOONaOHY nnnn3n =−=−
KL: () 2 35 3 XNaOHmuoiHO CHOH mmmmm +=++ .
=> mmuối = () 2 35 3 XNaOHHO CHOH a=mmmm +
Cách giải:
*Chứng minh công thức:
Khi đốt cháy hỗn hợp chất hữu cơ X hứaC,H,O cóCTTQ à n2n22kx CHO +− .
( ) ( ) n2n22kx222 CHO1,5n0,50,5k0,5xOnCOn1kHO +− ++−−→++−
Dựa vàoPTHH
2 COXnn.n = . ( ) 2 HOX nn1k.n =+−
−=−
( ) ( )
22 COHOX nnk1.n*
* Khi đốt cháy hỗn hợpX ồm các axit béo và chất béoY
- Axit 1531 CHCOOH , axit 1735 CHCOOH ó k1 = (là 2 axit no, đơn chức, mạch hở).
Từ (*) => Khi đốt cháy 2 axit này có CO2H2Onn =
- Sau khi thủy phân hỗn hợp X bằngNaOH chỉ thu được 2 muối 1531 CHCOONa và 1735 CHCOONa
=> Chất béo Y cũng được cấu tạo từ 2 gốc axit 1531 CHCOO-và 1735 CHCOO-là 2 gốc axit no
Chất béoY có độ bất bão hòak3 =
Từ (*) => chênh lệch giữa số mol 2 COvà 2 HO khi đốt cháy hỗn hợpX do chất béoY gây ra:
( ) 22 COHOYY nn31.n2n −=−=
( ) Y n1,561,52/20,02mol=>=−=
- BTNT C: 2 C trong XCO nn1,56 mol ==
- BTTNT 2 Htrong XHO H:n2n2.1,523,04 mol = ==
* Khi cho X tác dụng với dung dịchNaOH - Sơ đồ phản ứng:
CHCOOH CHCOONa CHCOOHNaOHCH(OH)HO CHCOONa (RCOO)CH(Y)
- Có: NaOH n0,1.0,90,09 mol == . COOCOOHNaOH nnn0,09 mol
mol
() 2 35 3 muoiXNaOHHO CHOH mammmm ==+−− .
a24,640,09.400,02.920,03.1825,86 g. =+−−=
Câu 10 10.1. (VDC)
Phương pháp:
- Tỉ lệ 24FeHSO n:n5:12 = Đây phải là 24HSO đặc, vì nếu 24 HSOloãng tỉ lệ này sẽ là1:1 2442 FeHSOFeSOH +→+
- Đặt số oxi hóa trung bình củaFesau phản ứng là a (với 2a3 ≤≤ , số oxi hóa của S trong sản phẩm khử
là b ( b 6) <
-Viết các quá trìnhnhường nhận e.
-Dùng BT electron, dùng BTNT S ( ) 2 24 4
b HSOS nn SO n + =+ để tínha theo b
-Chặn khoảng 2a3 ≤≤ khoảnggiátrị của b chọngiátrị b phùhợp a
-Tính ()() 2424 FeSOaFeSOa nx2ny = .
Cách giải:
-Tỉ lệ 24FeHSO n:n5:12 = Đâyphải là 24HSO đặc, vì nếu 24HSO loãngtỉ lệ này sẽ là 1:1.
2442 FeHSOFeSOH +→+
- Đặt số oxi hóa trung bình của Fe sau phản ứng là a (với 2a3 ≤≤ , số oxi hóa của S trong sản phẩm khử là b (b 6) <
-Cácquá trìnhnhường, nhậne:
0Fe a.e a Fe+ →
( )xaxmol →
6b S6b.eS ++ +−→
( )
( ) ( ) ax ax/6b mol →−
=++=++=
XCHO mmmm1,56,123,04,10,18,1624,64 g.
- Có: COOHNaOHCOONaOHY nnnn3n0,093.0,020,03 mol =−=−=−= .
-Muối thu được sau phản ứng có dạng ( ) 24 a FeSO
2 SOFe n0,5a.n0,5axmol ==
4
( )
nn0,03 mol
HOCOOH
-BTNT S: 244
b2 HSOSSO nnn +−=+
== ==
nn0,02 mol
CH(OH)Y
2 353
KL: mX + mNaOH = mmuối + mC3H5(OH)3 + mH2O
0,5 6 ax axy b +=
6 a ayx b
SO2khíCO2 nnn =−
0,5/2,4
+== ( ) ( )2aa6b4,86b +−=−
( ) a8b28,84,8 b −=−
28,84,8 b a 8b =
Mà 28,84,8 b 2a323( 8b ≤≤ ≤≤ với 8b0 −> do b6) < 2,67b4,57b4
<< = ứngvới số oxi hóa 4 S+ trong 2SO
Khí thu được là 2SO
Khi đó 28,84,8.4 a2,4 84 == Muối thu đượcgồmcả 4FeSO và ( ) 24 3 FeSO
-PTHH: ( ) 242422 a 2Fe2aHSOFeSOaSO2aHO +→++
Với ()24 FeSOa a2,4M342,4 g/mol = =
==
()24 FeSOa n42,8/342,40,125 mol
()24 FeFeSOa xn2n.n2.0,1250,25 mol;y12/5x0,6 mol =====⋅=
10.2 (VDC):
() () 3442 242 23242
- Dùng PP đường chéo để tìm số 22 molH,COtrong hỗn hợp khí. 24*KhiXHSO + :
- Xét hỗn hợp khí 2 COvà 2 SOsinh ra khi 24XHSO + :
2 SO4HSOSO nnn =−
- BTNT S: 242
2 FemuoiSOmmm =−
4
- BTNT H: 224 HOHSOnn =
- BTNT O: nO trong X 24
2 HSOSO4CO2SO2H2O 4n4n2n2nn +=+++
2 O trong XSO4CO2SO2H2OH2SO4n4n2n2nn4n =+++−
*KhiXHCl + :
- BTNT O: 22 COHOn2nn OtrongX =+
2 2 HOO trong XCOnn2n =−
- BTNT H: 22 HClHHO n2n2n =+ HCl Cl nn
=
Cách giải:
()()3422 2 2332
FeOFeSOSO agHSOHO FeOFeSOCO
() () 3442 242 23242
3
- Xét hỗn hợp khí 2 Hvà 2 COsinh ra khiXHCl + :
n3,584/22,40,16 mol ==
Y M13.217,75 g/mol ==
Phương pháp đường chéo:
22 HCO n/n26,25/15,755/3 == và 22 22 HCOYHCO nnn0,16n0,1;n0,06 +== ==

==
32 FeCOCO nn0,06 mol
24*KhiXHSO + :
- Xét hỗn hợp khí 2 COvà 2 SOsinh ra khi 24XHSO + :
n5,376/22,40,24 mol ==
CO2FeCO3 nn0,06 mol ==
=−=
SO2 n0,240,060,18 mol
- BTNT S: 2 242 4 SOHSOSO nnn0,690,180,51 mol =−=−=
2 4FeSO mmm69,120,51.9620,16 g muoi
- BTNT H: 224 HOHSO nn0,69 mol ==
2 O trongXHSOSO4COSOHO n4n4n2n2nn +=+++
- BTNT O: 24 222
2 22224 4 OtrongXCOSOHOHSO SO n4n2n2nn4n =+++−
O trong X n4.0,512.0,062.0,180,694.0,690,45 mol =+++−=
*KhiXHCl + :
- BTNT O: nO trong 22 OtrongXCOHO n2nn =+
=−=−=
2 2 HOO trong XCO nn2n0,452.0,060,33 mol
- BTNT H: 22 HClHHO n2n2n2.0,12.0,330,86 mol =+=+=
Cl n0,86 mol =
muoiFeCl mmmm20,160,86.35,550,69 g ==+=+=
SỞ GD&ĐT BÀ RỊA - VŨNG TÀU
Trường THPT chuyên Lê Quý Đôn
KỲ THI TUYỂN SINH VÀO LỚP 10 THPT
NĂM HỌC 2021 - 2022
MÔN: HÓA HỌC (chuyên)
Thời gian làm bài: 120 phút
ứng xong thu được 6,62 gam kết tủa. Xác định công thức của tinh thể muối sunfat trên.
Câu 8: Từ đá vôi, than đá và được dùng thêm các hóa chất vô cơ cần thiết, hãy viết các phương trình điều chế: Rượu etylic, Poli etilen (PE), Poli (vinyl clorua) (PVC).
MỤC TIÊU
- Đề thi giúp học sinh củng cố lại kiến thức, rèn luyện kĩ năng làm bài
- Đề thi giúp học sinh đánh giá được bản thân và có chiến lược ôn thi hiệu quả
Câu 1: Viết phương trình phản ứng biểu diễn các biến hóa sau:
Câu 9: Đốt cháy hoàn hoàn x gam hỗn hợp X gồm axetilen, etilen và propilen ( ) 36CH . Toàn bộ sản phẩm cháy hấp thụ hoàn toàn vào dung dịch 2Ca(OH) , sau phản ứng thu được 4,0 gam kết tủa và dung dịch A có khối lượng tăng thêm 1,31 gam so với khối lượng dung dịch 2Ca(OH) ban đầu. Thêm tiếp dung dịch 2Ca(OH) dư vào dung dịch A thì thu được 5,0 gam kết tủa nữa. Tính thành phần % về khối lượng của axetilen trong hỗn hợp X
( ) ( )
332324333 FeClFe(OH)FeOFeSOFeNO →→→→
Câu 2: Cho hỗn hợp gồm các kim loại: Cu,Al,Mg . Bằng phương pháp hóa học, hãy tách 2 riêng các chất ra
khỏi hỗn hợp.
Câu 3: Chỉ dùng thêm bột sắt làm thuốc thử, hãy trình bày phương pháp hóa học để phân biệt 5 dung dịch loãng chứa trong các lọ riêng biệt sau: 2432322 HSO,NaNO,NaCO,MgCl,Ba(OH) . Viết phương trình hóa học xảy ra.
Câu 4: Hai nguyên tố A và B thuộc cùng một nhóm A (nhóm chính), ở hai chu kỳ kế tiếp nhau trong bảng tuần hoàn các nguyên tố hóa học và có tổng diện tích hạt nhân là 30 .
1. Xác định tên và kí hiệu hóa học của hai nguyên tố A và B
2. Nguyên tố C có điện tích hạt nhân là 12 , Hãy sắp xếp các nguyên tố A,B,C theo thứ tự tăng dần tính kim loại.
Câu 5: Cho 6,45 gam hỗn hợp A gồm Mg và Al tác dụng với khí 2Cl đun nóng. Sau một thời gian, thu
được 20,65 gam chất rắn B. Cho toàn bộ B tan hết trong dung dịch HCl , thu được dung dịch C và khí 2 H .
Dẫn toàn bộ khí 2 H này qua ống đựng 20gamCuO đun nóng. Sau một thời gian thu được chất rắn nặng
18,4gam . Biết chỉ 80% khí 2 H tham gia phản ứng. Viết phương trình phản ứng xảy ra và tính khối lượng
mỗi kim loại trong A
Câu 6: Giải thích các hiện tượng hóa học và viết phương trình phản ứng:
1. Trong tự nhiên có nhiều nguồn tạo ra khí 2 HS nhưng lại không có sự tích tụ 2 HS trong không khí.
2. Trong phòng thí nghiệm, khi nhiệt kế thủy ngân bị về người ta dùng bột lưu huỳnh rắc lên nhiệt kể bị vỡ
3. Trong phòng thí nghiệm bị ô nhiễm khí 2Cl , để khử độc người ta xịt vào không khí dung dịch 3NH
4. Sự tạo thành thạch nhũ trong các hang động.
Câu 7: Tinh thể hiđrat hóa của một muối sunfat kim loại (hóa trị là n), có gốc muối sunfat chiếm 38,4% về khối lượng. Cho 5,0 gam tinh thể muối sunfat này tác dụng vừa đủ với dung dịch 2Ba(OH) , sau khi phản
Câu 10: X là hỗn hợp gồm một ancol A có công thức n2n1 CHOH + và một axit B có công thức n2n1 CHCOOH + Đốt cháy hoàn toàn m gam X thì thu được 30,8 gam 2CO , còn nếu cho m gam X tác dụng với Na dư thì thu được 3,36 lít khí 2 H (đktc).
1. Viết phương trình phản ứng xảy ra.
2. Xác định công thức phân tử của A,B
3. Đun nóng m gam X có mặt của 24HSO đặc, sau phản ứng thu được 7,65 gam este. Tính hiệu suất của phản ứng este hóa.
Câu 11: Xà phòng hóa hoàn toàn 3,544 gam một chất béo bằng 100ml dung dịch NaOH0,12M (vừa đủ), sau phản ứng thu được glixerol và m gam hỗn hợp chỉ chứa hai muối.
1. Tính m.
2. Viết công thức cấu tạo thu gọn của chất béo trên? Biết rằng số nguyên tử cacbon của 2 gốc axit béo là bằng nhau.
HƯỚNG DẪN GIẢI CHI TIẾT
Câu 1 (TH):
Cách giải:
33 FeCl3NaOHFe(OH)3NaCl +→↓+
3232 2Fe(OH)FeO3HO + → ( ) 2324242 3 FeO3HSOFeSO3HO +→+ ( ) ( ) ( ) 24343 32 3 FeSO3BaNO3BaSO2FeNO +→↓+
Câu 2 (TH):
Cách giải:
Sơ đồ tách:
PTHH:
222 2Al2NaOH2HONaAlO3H ++→+
22233 NaAlOCO2HOAl(OH)NaHCO ++→+
t
3232 2Al(OH)AlO3HO + →
dpnc
232 2AlO4Al3O + →
22Mg2HClMgClH +→+ dpnc
22 MgClMgCl + →
Câu 3 (TH):
Cách giải:
PTHH: 2442 FeHSOFeSOH+→+↑
24232422 HSONaCONaSOCOHO +→+↑+
2424 HSOBa(OH)BaSO+→↓ trắng 2 2HO+
222 Ba(OH)MgClMg(OH)+→↓ trắng 2BaCl+
Câu 4 (VD):
1.(VD):
Phương pháp:
Hai nguyên tố A và B thuộc cùng một nhóm A , ở hai chu kì kế tiếp nhau trong bảng tuần hoàn (giả sử
ABZZ < ) Xảy ra 3 trường hợp:
BA TH1:ZZ2 +−=
BA TH2:ZZ8 +−=
BA TH3:ZZ18 +−=
Cách giải:
- Hai nguyên tố A và B thuộc cùng một nhóm A , ở hai chu kì kế tiếp nhau trong bảng tuần hoàn (giả sử
AZ < BZ ) nên xảy ra 3 trường hợp:
BA TH1:ZZ2 +−=

Có hệ PT: BAA ABB
ZZ2Z14 ZZ30Z16 −== +==
A là Silic (Si), B là Lưu huỳnh (S) Loại vì 2 nguyên tố này không thuộc cùng một nhóm A

TH2:ZZ8 +−=
BA
