
11 minute read
Qué revelan los resultados coprológicos obtenidos en ganado vacuno de Segovia?
from Albéitar 234
by Grupo Asís
En el número anterior (Albéitar nº 233, marzo 2020) se publicó el resumen de cómo se había realizado este estudio y los resultados obtenidos. A continuación, se ofrece la discusión y las conclusiones.
Nélida Fernández Pato 1 , Irene Aguilar García 2 , Óscar García 3 y Elvira Rodríguez 3
1 Doctora en Veterinaria, coordinadora de Enfermedades Parasitarias Grado en Veterinaria y responsable del servicio de diagnóstico parasitológico Hospital Clínico Veterinario Universidad Alfonso X el Sabio. Miembro de la Unidad Biomédica de Investigación UAX. nfernpat@uax.es 2 Estudiante Veterinaria. Hospital Clínico Veterinario. UAX 3 Veterinaria clínica y asesoramiento en vacuno. Segovia Imágenes cedidas por los autores
DISCUSIÓN Y CONCLUSIONES
1. ELEVADA INCIDENCIA DE ENDOPARÁSITOS DIGESTIVOS: INTERPRETACIÓN DE RESULTADOS Muchos endoparásitos digestivos tienen distribución cosmopolita 3 , hecho que se confirma con la incidencia global detectada del 71,5 %.
Los parásitos que generalmente presentan mayor incidencia en rumiantes en pastoreo son los nematodos gastrointestinales (NGI) 4 ; sin embargo, en este estudio, Calicophoron daubneyi, con una incidencia del 42,8 %, es el más frecuente. Uno de los motivos puede ser que el único antiparasitario efectivo para todas las fases de Calicophoron daubheyi es la oxiclozanida 5 , que no se suele utilizar para control de ningún otro parásito y que tampoco debe utilizarse si no se detectan signos clínicos producidos por este trematodo. El 39,9 % de las muestras fueron positivas a NGI. Dentro de estos nematodos se engloban distintos agentes etiológicos, algunos muy prolíficos como H. contortus con eliminaciones de unos 10.000 huevos/día. Además, en España se ha confirmado que, bajo condiciones medioambientales adecuadas, las larvas 3 o formas infectantes, pueden estar presentes en el campo durante todo el año 6 .
Fasciola hepatica es otro de los trematodos detectados, con una incidencia del 14 %. Comparte con C. daubneyi hospedador intermediario y otros factores medioambientales, que posibilitan coinfecciones frecuentes en el ganado vacuno 7 , también detectadas en un 27,9 % de las muestras del presente estudio.
La incidencia de Eimeria fue del 16,7 %. La excreción de ooquistes al medio disminuye al aumentar la edad y los adultos son portadores asintomáticos, que eliminan bajas cargas parasitarias o incluso obtienen resultados coprológicos negativos 8 .
2. VARIACIONES ESTACIONALES: CONTAMINACIÓN DEL MEDIO AMBIENTE, DETECCIÓN EN PATENCIA, CONTROLES ANTIHELMÍNTICOS La incidencia de endoparásitos digestivos está relacionada con distintos factores de la tríada epidemiológica, que dependen del parásito, del hospedador y del medio ambiente 9 .
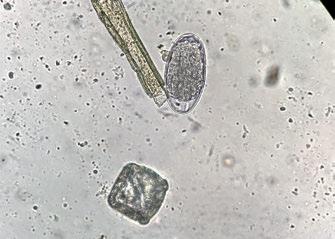
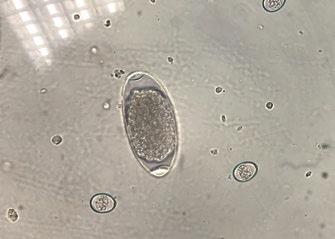
Al analizar los datos globales, C. daubneyi es el parásito más detectado, sin embargo, en la incidencia por estación se observa que, aunque en primavera y otoño es el más frecuente, en las estaciones de invierno y verano lo son los NGI, como se observa en la tabla. Se han omitido los positivos a M. benedeni y T. discolor por su baja incidencia.
La incidencia de endoparásitos digestivos está influenciada por la estación. Este hecho se debe, entre otras causas, a que el desarrollo y supervivencia de las formas preparásitas dependen de factores medioambientales como la humedad y la temperatura 9 .
La presencia o no de humedad permitirá a las L3 de NGI subir a la hierba, o incluso abandonar o no las heces, como se ha detectado en el caso de H. contortus 10 . En el caso de F. hepatica, temperaturas por debajo de los de 10 °C no permiten que se continúe la fase exógena del ciclo biológico, hecho que se extrapola para C. daubneyi.
En Eimeria el porcentaje mayor de muestras parasitadas se observó en otoño (25,4 %), seguido de la primavera (12,8 %), estaciones en las que hay mayor humedad relativa que favorece la supervivencia de los ooquistes. Además, en temperaturas moderadas entre los 18-27 °C se favorece la esporulación 3 .
3. PARASITACIÓN PURA Y PARASITACIÓN MIXTA Muchos parásitos completan su ciclo biológico bajo condiciones medioambientales similares, lo que posibilita la presencia de infecciones mixtas en los animales. De hecho, del total de muestras positivas, Porcentaje de muestras positivas a cada endoparásito digestivo por estación
Primavera Verano Otoño Invierno
NGI EIMERIA C. DAUBNEYI F. HEPATICA D. DENDRITICUM 40,8 12,8 57,1 17,7 0 35,8 7,5 30,2 2,0 1,8 38,4 25,4 40,2 10,3 0,9 44,2 7,8 20,8 23,4 1,3
solo en el 37,9 % se observaron infecciones por un único parásito, género parasitario (Eimeria) o grupo parasitario (NGI).
La infección pura más frecuente fue la producida por C. daubneyi, que se halló en un 48,8 % de muestras con un solo parásito, seguida del 39,8 % de los NGI, el 10,9 % de Eimeria y solo el 0,5 % de F. hepatica, siendo el resto de las infecciones detectadas mixtas.
La distribución cosmopolita de todos los parásitos del estudio 3 hace posible la presencia de infecciones mixtas, producidas por dos, tres o cuatro parásitos distintos/géneros o grupos parasitarios.
Las condiciones medioambientales (humedad y temperatura) necesarias para completar la fase exógena del ciclo biológico de la mayoría de los endoparasitos digestivos, se dan en climas templados 9 como Segovia, a pesar de las bajas temperaturas de los meses de invierno.
Sirva como ejemplo las temperaturas mínimas de 10 °C que necesitan los huevos de F. hepatica y C. daubneyi para formar el miracidio; las temperaturas superiores a 6-8 °C que precisan los NGI para que se acabe formando la L3; o las temperaturas medias que requieren los ooquistes de Eimeria y que posibilitan la esporulación. No obstante, se ha demostrado que los ooquistes de algunas de las especies más patógenas para el ganado vacuno como E. zuernii o E. alabamensis son capaces de sobrevivir a la congelación y llegar a ser infectantes 11 .


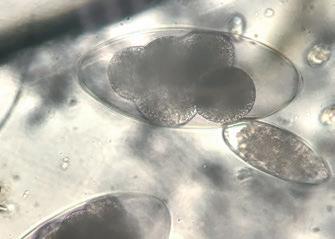
Las infecciones mixtas detectadas en el estudio, pueden explicarse también por la localización distinta que cada parásito tiene en el ganado vacuno. F. hepatica se localiza en el hígado; los adultos de C. daubneyi en rumen, los NGI parasitan abomaso, intestino delgado o intestino grueso y las distintas especies de Eimeria pueden afectar a intestino delgado o intestino grueso, pero completando su ciclo o bien en vellosidades intestinales o criptas 3,9 .
El hecho de que la vía de infección para todos estos parásitos sea oral, por ingestión de hierba con las formas infectantes presentes o ingestión del hospedador intermediario con la forma infectante (ácaro oribátido con cisticercoide en el caso de M. benedeni y una hormiga con metacercaria en el caso de D. dendriticum), posibilita que rumiantes en extensivo tengan mayor contacto con endoparásitos digestivos que animales sometidos a un régimen más intensivo.
Sin olvidar que en el caso de C. daubneyi y F. hepatica comparten también el hospedador intermediario, lo que explica el 27,9 % de las infecciones mixtas detectadas por ambos trematodos. Cabe destacar que C. daubneyi presenta mayor incidencia, un hecho descrito ya en estudios previos 7 .
4. UTILIDAD DE LAS TÉCNICAS COPROLÓGICAS PARA LA DETECCIÓN DE ENDOPARÁSITOS DIGESTIVOS Y CÁLCULO DE CARGA PARASITARIA Los endoparásitos digestivos reciben este nombre porque cuando se completa la fase endógena de su ciclo en el ganado vacuno, pueden ser detectados mediante el uso de técnicas coprológicas. La técnica coprológica rutinaria en herbívoros es el McMaster modificado; sin embargo, el elevado peso específico del huevo de las distintas especies de trematodos hace que la copa de sedimentación sea la técnica de elección. Por este motivo, durante todo el estudio se utilizaron ambas técnicas.
Existen numerosas variantes de la técnica de sedimentación en copa y distintos resultados en cuanto a su sensibilidad en la detección de F. hepatica. Pero el análisis de las heces en ganado vacuno debe seguir realizándose de forma individual a diferencia de la mezcla de heces de 10 animales descrita en ganado ovino, como se ha realizado en este estudio 12 .
Con las dos técnicas coprológicas utilizadas se ha podido calcular la carga parasitaria que, si bien en ningún caso indica el número de parásitos real que tiene en el interior un hospedador, sí ofrece una estimación y permite diferenciar entre animales con presencia de parásitos y animales responsables de la contaminación del medio ambiente y que deben ser controlados para evitar la aparición de enfermedades parasitarias 13 .
En el caso de los animales parasitados por NGI de este estudio, si bien el rango de huevos por gramos de heces es muy amplio, solo en 11 de las muestras positivas las cargas parasitarias estuvieron por encima de los 200 hpg, lo que implica una elevada contaminación del medio ambiente 13 .
Destacan las diferencias en la excreción de huevos de los trematodos C. daubneyi (rango entre 0,05 y 90 hpg) y F. hepatica (rango 0,05-5 hpg), hecho que podría explicar la elevada incidencia de este parásito en el estudio.
5. INFECCIÓN PARASITARIA NO SIEMPRE ES SINÓNIMO DE ENFERMEDAD Tras detallar los resultados obtenidos, se puede afirmar que el ganado vacuno en pastoreo está en contacto continuo con endoparásitos digestivos. Además, la presencia de infecciones mixtas es muy frecuente.



Técnica coprológica rutinaria en rumiantes McMaster modificado.

A pesar de ello, es imprescindible relacionar los resultados laboratoriales obtenidos con posibles signos clínicos producidos por las acciones patógenas de estos parásitos.
Los animales, por contacto controlado y prolongado con la mayoría de los parásitos detectados en el estudio, desarrollan mecanismos de regulación de poblaciones parásitas, por lo que los animales adultos no suelen mostrar signos clínicos y las cargas parasitarias suelen ser bajas. De hecho, en estos animales, solo deberían desparasitarse aquellos con cargas parasitarias elevadas, aunque no presenten clínica, ya que contaminan el medio 3 .
Un ejemplo de esta inmunidad adquirida parcial sería el hecho de que solo un animal de los parasitados con Eimeria (E. zuernii), tenía una carga elevada y a la vez tenía una diarrea hemorrágica que produce este protista.
Por lo que, a pesar de que la presencia de endoparásitos digestivos es frecuente, solo cuando suponen un riesgo de aumentar excesivamente los niveles de contaminación del medio ambiente o porque existen consecuencias de sus acciones patógenas deberían aplicarse tratamientos farmacológicos efectivos en los rumiantes.
6. CONCEPTO “ONE HEALTH” La detección de endoparásitos digestivos mediante técnicas coprológicas permite conocer las especies parásitas presentes en una explotación, además de poder decidir qué medidas de control son las más adecuadas en cada caso.
De esta forma, los sistemas de producción modernos y sostenibles, son aquellos en los que la presencia de animales produce un menor impacto medioambiental 14 , asegurando no solo el bienestar animal, sino la ausencia de problemas sanitarios en humanos debidos a la transmisión de agentes zoonóticos que parasitan al ganado vacuno, como el caso de F. hepatica 3 .
BIBLIOGRAFÍA
1 . Stromberg BE, Gasbarre LC, Waitec A, Bechtol DT, Brownd MS, Robinsona NA, Olsona EJ, Newcomb H. Cooperia punctata: Effect on cattle productivity? Vet Parasitol. 2012;183: 284-291. 2. Allonby EW, Urquhart GM. The epidemiology and pathogenic significance of haemonchosis in a merino flock in East Africa. Vet Parasitol. 1975;1:129–143. 3. Arias MS, Sanchís J, Francisco I, Francisco R, Piñeiro P, Cazapal-Monteiro C, Cortiñas FJ, Suárez JL, Sánchez-Andrade R, Paz Silva A. The efficacy of four anthelmintics against Calicophoron daubneyi in naturally infected dairy cattle. Vet Parasitol. 2013;197:126–129. 4. Capper JL Cady RA, Bauman DE. The environmental impact of dairy production: 1944 compared with 2007. J. Anim. Sci. 2009; 87:2160–2167. 5. Cordero del Campillo M y Rojo Vázquez FA. Parasitología Veterinaria. Madrid: McGraw-HillInteramericana de España; 1999. 6. Fitzpatrick JL. Global food security: the impact of veterinary parasites and parasitologists. Vet. Parasitol. 2013;195:233–248. 7. Graham-Brown J, Williams DJL, Skuce P, Zadoks RN, Dawes S, Swales H, Van Dijk J. Composite Fasciola hepatica faecal egg sedimentation test for cattle. Vet Rec. 2019;184:589. 8. Khadijah S, Kahn LP, Walkden-Brown, Bailey JN, Bowewea SF. Effect of simulated rainfall timing on faecal moisture and development of Haemonchus contortus and Trichostrongylus colubriformis eggs to infective larvae. Vet Parasitol. 2013;192:199-210. 9. Koutny H, Joachim A. Tichy A, Baumgartner W. Bovine Eimeria species in Austria. Parasitol Res. 2012;110(5):1893-901. 10. Lassen Brian, Seppä-Lassila Leena. Recovery and sporulation of bovine Eimeria oocysts after exposure to sub-zero temperatura. Veterinarija ir Xootechnika. 2014;66(88);35-39. 11. Murray J, Lanigan E. Gilleard J, Waldner C, Royan F. Survey of gastrointestinal nematode parsites in Saskatchewan beef herds. Can Vet J. 2016;57(2):160-163. 12. Naranjo-Lucena A, Munita Corbalán MP, Martínez-Ibeas AM, McGrath G, Murray G, Casey M, Good B, Sayers R, Mulcahy G, Zintl A. Spatial patterns of Fasciola hepatica and Calicophoron daubneyi infections in ruminants in Ireland and modelling of C. daubneyi infection. Parasit Vectors. 2018;11(1):531. 13. Nogareda C, Mezo M, Uriarte J, Lloveras J, Cordero del Campillo M. Dynamics of infestation of cattle and pasture by gastrointestinal nematods in an Atlantic temperate environment. J Vet Med. 2006; 53:439-444. 14. Rojo Vázquez FA, Meana Mañes A. 60 Q and A sobre parasitología bovina. Libro de preguntas y respuestas. Zaragoza: Servet; 2013.











