
9 minute read
La science de la sérendipité
À l'ère de la conception de médicaments assistée par ordinateur, beaucoup pensent que les découvertes fortuites en médecine et sciences font partie du passé. Heureusement, ce n'est pas le cas.
Même aujourd'hui, des observations aléatoires et des échecs imprévus ouvrent des voies nouvelles à des innovations révolutionnaires. Le monde scientifique a un terme pour qualifier ces découvertes involontaires : « sérendipité ». Le terme provient d'un conte oriental. Lors de leurs voyages aventureux, trois princes de Serendip – ancien nom du Sri Lanka – faisaient toujours des découvertes sans le vouloir. La sérendipité va toutefois au-delà de la pure coïncidence car seuls ceux qui identifient une opportunité peuvent transformer les hasards en découvertes. Les scientifiques qui ont suivi ont travaillé dans leurs domaines pendant des années et ont donc pu juger de la valeur du hasard. Leur talent particulier a été la capacité à reconnaître la sérendipité et à en tirer profit.
Rayons X - une étrange lueur Un seul événement peut être décisif et plusieurs découvertes capitales peuvent être liées à une date ou même un moment de la journée. Tel fut le cas pour le physicien Wilhelm Conrad Röntgen qui, le soir du 8 novembre 1895, faisait une expérience avec un tube de Crookes (tube à vide dans lequel des rayons cathodiques se propagent en ligne droite sans champ magnétique) à l'université de Würzburg, Allemagne. Lorsqu'il a appliqué la tension, un papier fluorescent qui se trouvait par là dans la salle sombre s'est soudainement mis à briller. Röntgen a essayé d'empêcher la lueur gênante avec un carton noir - en vain. Il a vite réalisé que certains matériaux, tels l'os et le métal, étaient moins perméables à ce « rayonnement X » et que le plomb le bloquait complètement. Plaçant une plaque photo derrière la main de sa femme, il a pu représenter ses tissus internes - l'un des premiers clichés radio-
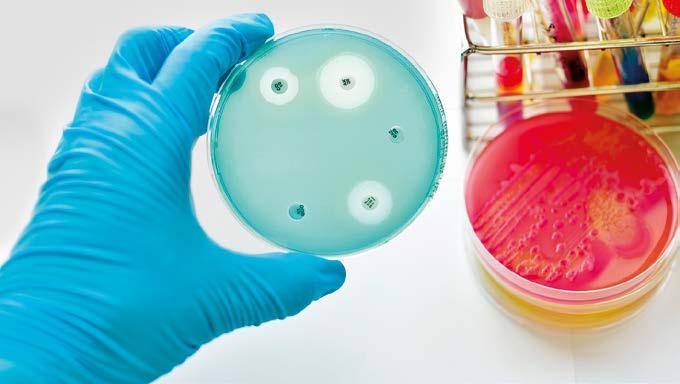
FIG. 1 : Près d'un médicament antimicrobien, la croissance bactérienne est inhibée. Le principe et le premier antimicrobien, la pénicilline, ont été découverts par Alexander Flemming en 1928.
logiques jamais réalisés. La découverte accidentelle et, plus tard, l'étude approfondie des rayons X ont valu à Röntgen le prix Nobel de Physique en 1901.
Pénicilline – un couvercle oublié Les recherches du bactériologiste écossais Alexander Flemming ont été marquées par ses expériences pendant la première guerre mondiale. Il y a plus de soldats morts dans les tranchées à cause d'infections de plaies que de blessures au combat. La recherche révolutionnaire d'un remède a été due à une coïncidence. Lorsque Fleming est parti en vacances en août 1928, il a oublié de fermer ses boîtes de Petri contenant des cultures de staphylocoques. De retour à son laboratoire à l'hôpital St Mary à Londres, le 28 septembre, il a remarqué de la moisissure dans l'une des boîtes. Mais partout où le champignon avait été en contact avec les staphylocoques, les bactéries avaient disparu. Flemming a cultivé le champignon et découvert qu'il sécrétait un poison antibactérien. Cependant, plus d'une décennie s'est écoulée avant que ce poison, appelé plus tard pénicilline, puisse être produit en quantité suffisante et utilisé comme antibiotique. Flemming, qui a reçu le prix Nobel de Médecine avec deux autres bactériologistes en 1946, est resté modeste toute sa vie. Interrogé sur sa grande découverte, il a dit : « C'est la nature qui l'a créée. Je suis juste tombé dessus. »

Empreinte génétique – on a ça dans le sang Le 10 septembre 1984, dans son laboratoire de l'université de Leicester en Grande-Bretagne, le biochimiste Alec John Jeffreys menait ses recherches sur ce que l'on appelle l'ADN minisatellite. Les minisatellites sont des portions dans le génome humain consistant en des répétitions variables d'une courte séquence d'ADN.
Jeffreys a étudié des échantillons de sang de plusieurs membres d'une même famille, côte à côte. Il a relevé que chaque image d'ADN minisatellite pouvait être attribuée à une seule personne, comme un code à barres. Les liens familiaux étaient également visibles - plus la concordance était élevée, plus la parenté était proche. Jeffreys a immédiatement compris l'importance de sa découverte. Il avait trouvé ce que nous appelons aujourd'hui l'empreinte génétique. Il est aujourd'hui impossible d'imaginer des enquêtes criminelles ou des tests de paternité sans empreinte génétique ou profil d'ADN.
Inhibiteurs de la PDE-5 – des effets secondaires inattendus En 1989, deux chercheurs britanniques, Peter Ellis et Nick Terret, cherchaient un médicament pour prévenir les crises cardiaques et autres troubles cardiovasculaires. Ils s'intéressaient au sildénafil, substance active et vasodilatatrice. Après deux années d'étude, l'efficacité du sildénafil contre la coronaropathie n'était pas encore démontrée mais le médicament avait un effet secondaire inattendu : les hommes avaient plus d'érections et elles persistaient. Le sildénafil avait inhibé l'enzyme phosphodiestérase-5 (PDE-5) et la concentration du messager secondaire cGMP dans le tissu érectile du pénis est restée élevée, ce qui a entraîné la dilatation des vaisseaux et causé des érections inattendues et durables. L'une des causes les plus fréquentes du dysfonctionnement érectile à ce jour - constriction des vaisseaux sanguins et apport sanguin au pénis insuffisant - avait à présent un traitement pharmaceutique. L'effet secondaire observé par hasard a fait des inhibiteurs de la PDE-5 l'un des médicaments les plus utilisés au monde aujoud'hui.
Hémangiome – rétrécissement soudain La tache de naissance caoutchouteuse rouge vif sur le nez du bébé s'était rapidement étendue et commençait déjà à appuyer sur sa trachée. L'hémangiome est un nodule de vaisseaux sanguins en plus sous la peau. En 2007, la pédiatre Christine Léauté-Labrèze de l'hôpital universitaire de Bordeaux a initié un traitement avec des corticostéroïdes systémiques mais le traitement a échoué. À l'âge de trois mois, le bébé ayant également développé un trouble du muscle cardiaque, un traitement avec le bêta-bloquant propranolol a été initié. Seulement quelques jours plus tard, une chose totalement inattendue s'est pro-
duite : l'excroissance voyante est passée du rouge au violet et s'est ramollie. En quelques semaines, elle a commencé à rétrécir. Lorsque le bêta-bloquant a été arrêté à 14 mois, l'hémangiome avait presque complètement disparu. Neuf autres enfants avec un hémangiome facial problématique ont rapidement été soignés de la même façon. Pour les médecins, les parents et surtout des milliers d'enfants, cette observation aléatoire dans le sud de la France a été, plus que tout, un gros coup de chance.
Virus géants – coincés dans le tamis bactérien En 2003, dans une clinique britannique, Didier Raoult de l'Université de la Méditerranée à Marseille, ne cherchait pas des virus mais un type particulier de bactérie : legionellae. Quand Raoult a examiné le contenu d'un filtre à bactéries de plus près, il a trouvé des virus géants alors inconnus qui allaient mettre sens dessus dessous certaines idées sur les virus. Longs de 0,4 µm et contenant environ 900 gènes, ils étaient non seulement bien plus gros que tous les virus connus, et que beaucoup de bactéries, mais c'était également une espèce d'organisme hybride ayant la capacité de produire des protéines. De tels micro-organismes géants avaient déjà été observés par des chercheurs dans les années 1990 qui les ont pris pour de nouvelles espèces de bactéries. Didier Raoult a non seulement trouvé les organismes mais les a aussi identifiés comme étant des mégavirus. Depuis, tout un spectre de virus géants encore plus gros a été décrit. Leur étude indique que la ligne entre les virus et les bactéries, viables et non viables, est à présent moins nette. Tout un nouveau chapitre de la virologie a commencé, par hasard.
Bibliographie 1 Meckel M, Rettig D: Serendipity. Wer nicht sucht, der findet. Kein & Aber 2018.
DANS LA MATRICE : INTÉGRATION OU DÉSINTÉGRATION
SHAHRAM GHANAATI et son équipe du FORM-Lab enquêtent sur la réaction des cellules à un biomatériau implanté – p. ex. une matrice ou membrane de collagène ou un substitut osseux.
... en réalisant une chirurgie maxillo-faciale majeure impliquant l'utilisation d'une matrice de collagène.
éponges coraux requins
bactéries poissons (vertéprocaryotes brés) (cellules sans noyau) 2 1 0,7 0,5 insectes volants
3 oiseaux 4 0,3
5 eucaryotes (cellules avec noyau) protozoaires (premiers organismes « ressemblant à des animaux ») vertébrés terrestres, amphibiens, insectes mammifères
« Explosion cambrienne »
des milliards d'années en arrière (première apparition de la plupart des groupes d'animaux actuels) reptiles, dinosaures 0,1
UNE FAMILLE DE PROTÉINES abeilles
HAUTEMENT CONSERVÉES
Le collagène est phylogénétiquement très ancien et hominidés 10 millions hautement conservé chez les mammifères, y compris les humains. Il est bien accepté par le système immunitaire humain. humains (Homo sapiens) 300 000 aujourd'hui

COMMENT L'ORGANISME RÉAGIT-IL ?
Pour tester la réponse immunitaire, différentes matrices et membranes de collagène ont été implantées sous la peau de souris. Des coupes histologiques de ce comblement ont été analysées après...
Épiderme Derme Hypoderme
Biomatériau
Geistlich Mucograft®
*Les coupes histologiques montrent Geistlich Mucograft®1 . Autres membranes et matrices testées : Geistlich Bio-Gide®2, membrane de collagène BEGO3, Ossix® Plus4, Mucoderm®5 , membrane de collagène Symbios SR et Collprotect®6 . Nous savons que le sang et les facteurs de croissance s'accumulent dans la matrice de collagène. Dans le temps, du tissu nouveau se forme et s'intègre dans la structure.
Mais comment le système immunitaire réagit-il à un biomatériau implanté ? La matrice de collagène provoquet-elle une réaction à un corps étranger ?
... 3 jours
... 10 jours
... 15 jours
... 30 jours
... 60 jours
Geistlich Mucograft® et Geistlich BioGide® n'ont induit que des cellules mononucléées. Toutes les autres matrices et membranes testées ont en revanche induit des cellules géantes multinucléées. Les études sur d'autres animaux et les études cliniques ont abouti à la même conclusion7 .
Cellule géante multinucléée
Shahram Ghanaati et sa collègue Sarah Al-Maawi évaluent les résultats. Nous devons étudier comment les biomatériaux provoquent ces différentes réactions et si les cellules géantes multinucléées perturbent la régénération tissulaire.
LES MACROPHAGES DEVIENNENT DES CELLULES GÉANTES
MULTINUCLÉÉES réparation et le maintien de l'intégrité des tissus7-10 . Les macrophages sont des cellules mononucléées. Leur activi- En cas d'échec à éliminer les particules étrangères (p. ex. un bioté phagocytaire et leur capacité à libérer facteurs de croissance et cytokines sont importantes pour la cicatrisation des plaies, la matériau implanté) par phagocytose, ils fusionnent pour former des cellules géantes multinucléées. Ensuite, ils dégénèrent.
ACCUMULATION 0-10 jours
IL-4 IL-4
FUSION
10-15 jours
DÉGRADATION/DÉSINTÉGRATION
15-60 jours
IL-4 IL-13
IL-13 IL-4 IL-13

IL-4
Selon la réaction immunitaire, on distingue deux schémas :
A) Intégration physiologique
Les biomatériaux sont bien intégrés dans le tissu hôte sans signe de réaction aux corps étrangers ni de dégradation prématurée. Je suis convaincue que l'ingénierie tissulaire guidée nécessite des biomatériaux servant de structure pendant un temps défini. L'élimination rapide par les cellules géantes multinucléées est donc contre-productive.
B) Désintégration pathologique
Les biomatériaux suscitent une réaction aux corps étrangers caractérisée par la présence de cellules géantes multinucléées . Cette réaction est associée à une perte prématurée de la fonction et de l'intégrité7 .
temps
(jours) 3 10-15 30 60 Oui, il faut s'interroger de manière critique sur la contribution ou non de ces cellules au processus de régénération. Mais avant, il nous faut plus d'études à ce sujet !






