p. 6
ESTUDIO DE LA MICROBIOTA INTESTINAL EN PRODUCCIÓN
PORCINA: TÉCNICAS Y APLICACIONES
 Nº5 | Julio 2022
Nº5 | Julio 2022
Trabajamos por la seguridad de los animales
Yo uso antibióticos
Yo soy responsable


p. 6
ESTUDIO DE LA MICROBIOTA INTESTINAL EN PRODUCCIÓN
PORCINA: TÉCNICAS Y APLICACIONES
 Nº5 | Julio 2022
Nº5 | Julio 2022
Trabajamos por la seguridad de los animales
Yo uso antibióticos
Yo soy responsable


La gama de antibióticos betalactámicos de Laboratorios Syva que ofrece soluciones a las principales enfermedades bacterianas en animales de producción a través de tratamientos individualizados.

6/14
ESTUDIO DE LA MICROBIOTA INTESTINAL EN PRODUCCIÓN PORCINA: TÉCNICAS Y APLICACIONES
Sofía Lázaro Gaspar y Óscar Mencía Ares EXOPOL S.L.
16/21
LOGROS Y NUEVAS ACCIONES DEL PRAN EN SANIDAD ANIMAL - UN MODELO DE PROYECTO ONE HEALTH EN ESPAÑA
Cristina Muñoz Madero
Coordinadora del PRAN en el área de Sanidad Animal
22/26
REDUCCIÓN DEL USO DE ANTIBIÓTICOS Y ÓXIDO DE ZINC. UNA GUÍA PRÁCTICA
Enric Marco
Marco Vetgrup, SLP
28/41
USO RACIONAL DE ANTIMICROBIANOS EN PORCINO: ANTIMICROBIANOS QUE ACTÚAN INHIBIENDO LA SÍNTESIS DE PROTEÍNAS – PARTE II

Juan A. Gilabert, Sonia Rubio, Mª Dolores San Andrés y Manuel I. San Andrés
Sección Dptal. de Farmacología y Toxicología, Facultad de Veterinaria, Universidad Complutense de Madrid
42/50
SÍNDROME DE NECROSIS AURICULAR PORCINA - ETIOLOGÍA Y PATOGÉNESIS
Panagiotis Tassis1a y Dimitrios Floros1b
1Clínica de Animales de Granja, Facultad de Medicina Veterinaria, Universidad Aristóteles de Tesalónica, Grecia
aProfesor Adjunto de Medicina y Reproducción Porcina
bDVM, candidato a Doctorado
51/60
PERFILES DE CITOQUINAS EN INFECCIONES RESPIRATORIAS VÍRICAS PORCINAS
Hanna Turlewicz-Podbielska1, Ewelina CzyżewskaDors2 y Małgorzata Pomorska-Mól1
1Departamento de Ciencias Preclínicas y Enfermedades Infecciosas, Facultad de Veterinaria, Universidad de Ciencias de la Vida de Poznan, Polonia.
2Departamento de Medicina Interna y Diagnóstico, Facultad Veterinaria, Universidad de Ciencias de la Vida, Poznan, Polonia
62/73
SEGURIDAD DEL CANDIDATO VACUNAL LV17/WB/RIE1 FRENTE A LA PPA EN JABALÍES: SOBREDOSIS Y DOSIS REPETIDAS
José A. Barasona1,2, Estefanía CadenasFernández1,2, Aleksandra Kosowska1,2, Sandra Barroso-Arévalo1,2, Belén Rivera1,2, Rocío Sánchez1,2, Néstor Porras1,2, Carmina G. Frontaura3 , José M. Sánchez-Vizcaíno1,2
1Departamento de Sanidad Animal, Universidad Complutense de Madrid
2VISAVET (Centro de Vigilancia Sanitaria Veterinaria - UCM)
3Centro de Investigación en Sanidad Animal, Instituto Nacional de Investigación y Tecnología Agrícola y Alimentaria

74/80
SOLUCIONES PRÁCTICAS PARA OPTIMIZAR EL RENDIMIENTO REPRODUCTIVO DE CERDAS ADULTAS Y NULÍPARAS
Servicio Técnico MSD Animal Health
Agradecemos a nuestros anunciantes por hacer posible la publicación de esta revista: Boehringer Ingelheim, Ceva, Elanco, MSD Animal Health, Qualivet/Biomin, S.P. Veterinaria, Tashia, Vetia, Vetoquinol y Zoetis.

Zoetis lanza Zoetis VETCloud, el repositorio de informes en la nube.

Ponemos a disposición del veterinario y el cliente todos los informes procedentes de los distintos servicios que ofrece Zoetis.
Soporte a los veterinarios en la prescripción de antibióticos, ya que el almacenaje de los informes de sensibilidad antibiótica (Sensitrack) son la justificación técnica de dichas prescripciones.
Accesibilidad a todos los informes en un mismo lugar, lo que permite un mayor control sobrela salud de tu granja.
Inmediatez en el acceso de la información, lo que ayuda a tomar decisiones de forma rápida.
Archivo y orden de los informes en un lugar seguro. Ni los pierdes ni tardas en encontrarlos.
Comparte la información con veterinarios, clientes y técnicos de Zoetis.

BOARBETTER es el ÚNICO SPRAY con tres feromonas del verraco que:

• Libera una respuesta sexual máxima en cerdas
• Compensa la variación individual y estacional en la liberación de feromonas por parte del verraco
• Compensa una posible bajada de libido del verraco
• Disminuye el riesgo de perder un celo
• Puede usarse junto con macho recela
Juntos podemos hacer que la detección de celos sea más certera.
BOARBETTER®
Provee feromonas de verraco para estimular el comportamiento sexual de cerdas en celo. COMPOSICIÓN: Feromonas de porcino BSA*: Quinolina, Androstenona, Androstenol. 0,0020%; ingredientes inertes c.s.p. .100%. *Boar Saliva Analog (BSA- Análogo de Saliva de Verraco). Este producto puede estar protegido por una o varias patentes, o solicitudes de patentes en trámite. INDICACIONES: BOARBETTER® puede usarse solo, sin verraco, o en combinación con un verraco recela para potenciar la exposición a las feromonas. Para obtener buenos resultados, aplicar BOARBETTER® desde el comienzo del celo, generalmente en los días 3-4 después del destete. Aplicar 4 ml de BOARBETTER® en el hocico de la hembra (dirigiéndolo hacia las fosas nasales) antes de comprobar si está en celo • Comprobar el reflejo de inmovilidad aplicando presión sobre el lomo. Si se utiliza inseminación artificial convencional inseminar a la cerda, si está en celo, siguiendo los protocolos específicos de la granja. • Si se utiliza IAPC (inseminación artificial poscervical), esperar 30-60 minutos y siempre de acuerdo a los protocolos IAPC específicos de la granja • Si la hembra no está en celo, repetir la administración del producto hasta que aparezcan signos de celo, siguiendo los protocolos de detección de celo de la granja. Manejo: Usar guantes protectores, ropa protectora, protección ocular y facial. Lavarse las manos después de cada uso. EN CASO DE CONTACTO CON LA PIEL (o el pelo): quítese inmediatamente toda la ropa manchada. Lávese la piel con agua o dúchese. Almacenamiento: Mantener a temperatura ambiente lejos del calor y de la luz. No congelar. Consulte https://www.vetoquinol.com/boarbetter/ip para detalles y estatutos.
¿ANESTRO
“ “
¿Quién no se ha enfrentado alguna vez a la maldición de la hoja en blanco? Una situación que solemos atribuir a los escritores pero que, en algún momento, todos hemos vivido. ¿Quién no conoce esa sensación frustrante de dar vueltas a un problema cuya solución nos elude o una idea que no termina de tomar forma?
Suele ser en esos momentos en los que dejamos vagar nuestros pensamientos cuando, repentinamente y casi por arte de magia, nos llega la INSPIRACIÓN.
La inspiración se define como un “estímulo o lucidez repentina que siente una persona y que favorece la creatividad, la búsqueda de soluciones a un problema, la concepción de ideas que permiten emprender un proyecto”. Este concepto a veces parece colisionar con la racionalidad y la objetividad que atribuimos a la ciencia.
Y es que, en un mundo gobernado por la observación sistemática, la medición, la experimentación, la formulación, el análisis y la modificación de hipótesis, nos podríamos cuestionar si nuestras emociones e instintos tienen cabida en el desarrollo del método científico.

Sin embargo, recordemos que todo avance científico nace de la curiosidad, un comportamiento instintivo natural y emocional que nos impulsa a explorar, investigar y aprender. Es por ello que es tan importante encontrar nuestra inspiración científica en algo tan sencillo como el acto de disfrutar de pensar y comprender, dejar volar nuestra imaginación evocando un futuro en el que el sector porcino sea el motor que impulse la sostenibilidad ambiental, económica y social.
La inspiración se nos puede presentar de formas inconcebibles a través de vivencias, lugares, palabras, imágenes, personas... El pensamiento difuso, creativo, innovador, out of the box, debe formar parte de nuestro método científico si queremos afrontar con éxito las grandes amenazas que llevamos viendo venir desde hace tiempo y que ya están aquí.
La crisis climática, las zoonosis, las resistencias antimicrobianas, la escasez de recursos naturales y la falta de alimentos no tienen soluciones sencillas. Únicamente a través de un modelo cooperativo basado en el aprendizaje mutuo e interdisciplinar, que tenga en cuenta a los profesionales veterinarios y al sector agroganadero, podremos dejar un mundo mejor para las futuras generaciones.
Desde porciSapiens, nuestro deseo es que se dejen inspirar por la ciencia, por la naturaleza, por sus mentores, compañeros de profesión, ilustres científicos, amigos, familiares o, incluso, por sí mismos. Nunca pierdan la curiosidad y la pasión por desentrañar los misterios de la vida. Nunca se sabe a quién podrían inspirar… Fe de erratas:
En la pasada edición nº 4 abril de porciSapiens, en el artículo "Uso racional de antimicrobianos en porcino: Antimicrobianos que actúan inhibiendo la síntesis de proteínas –Parte I.", en el fragmento referente al tiempo de espera de la combinación de espectinomicina y lincomicina (página 53), se debería haber indicado: "El tiempo de espera en carne es de 0 días en las formulaciones para administración oral y 14 – 21 días para formulaciones inyectables".
porciS apiens
EDITOR
GRUPO DE COMUNICACIÓN AGRINEWS S.L.
DISEÑO GRÁFICO & WEB
Marie Pelletier
Enrique Núñez Ayllón Sergio Rodríguez
PUBLICIDAD
Laura Muñoz +34 629 42 25 52 laura@mediatarsis.com
Luis Carrasco +34 605 09 05 13 lc@agrinews.es
REDACCIÓN
Daniela Morales Osmayra Cabrera F.X. Mora
ADMINISTRACIÓN
Mercè Soler
Barcelona
España
Tel: +34 93 115 44 15 info@agrinews.es
www.porcinews.com
www.porcinews.com/revista-porcisapiens/
Precio de suscripción anual:

España 45 €
Extranjero 120 €
ISSN (Revista impresa) 2696-8142
ISSN (Revista digital) 2696-8151
DIRIGIDA A VETERINARIOS DE PORCINO Depósito Legal PorciSapiens B 7620-2021
Revista Cuatrimestral
revistano se
hace responsable de las opiniones de los autores. Todos los derechos reservados. Imágenes: Noun Project/Freepik/ Dreamstime/BioRender


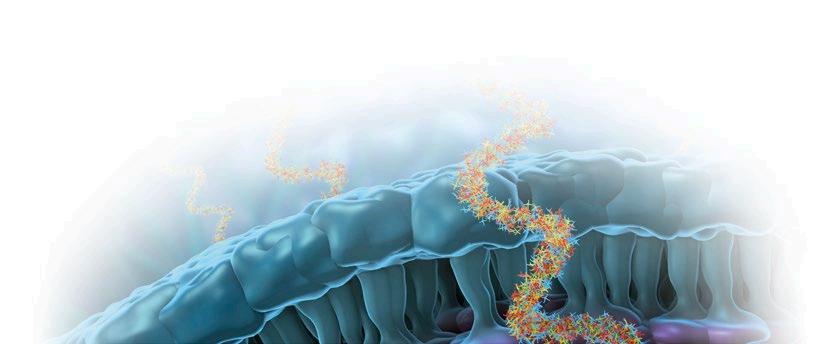
La microbiota desempeña un papel indispensable en el mantenimiento de la salud intestinal y, en definitiva, sobre la salud global de los animales.

En el intestino de los mamíferos habitan un gran número de microorganismos en simbiosis con el animal, lo que se conoce como microbiota, compuesta en su mayoría por bacterias, pero también arqueas, virus, protozoos y hongos.
Esta microbiota no es homogénea en todo el tracto gastrointestinal, sino que existen marcadas diferencias tanto entre tramos, incluyendo las heces, como entre el lumen y la mucosa intestinal.
La microbiota intestinal no es estática, sino que existen múltiples factores internos (edad, sexo o genética) y externos (dieta, tratamientos antimicrobianos, estación del año o manejo) que afectan a su estructura y composición. De hecho, a lo largo de la vida del cerdo, la microbiota evoluciona mediante un fenómeno conocido como sucesión microbiana.
Así, por ejemplo, en los primeros días de vida, las familias microbianas que predominan son aquellas capaces de metabolizar los monosacáridos y oligosacáridos presentes en la leche materna mientras que, durante el destete, se produce un gran cambio en la microbiota, principalmente debido al estrés y al cambio brusco de dieta.
Los microorganismos que componen la microbiota intestinal juegan un papel clave en:
La digestión de nutrientes, esencial para el aprovechamiento de componentes no digeribles por el propio animal.
La síntesis de vitaminas o ácidos grasos de cadena corta, como butirato o acetato.
Una microbiota sana puede contribuir a la resistencia frente a determinados patógenos intestinales, como Escherichia coli o Salmonella enterica, al proporcionar unas condiciones que dificulten su desarrollo e implantación en el tracto gastrointestinal, por ejemplo, creando un ambiente con pH más ácido o produciendo péptidos con actividad antimicrobiana.
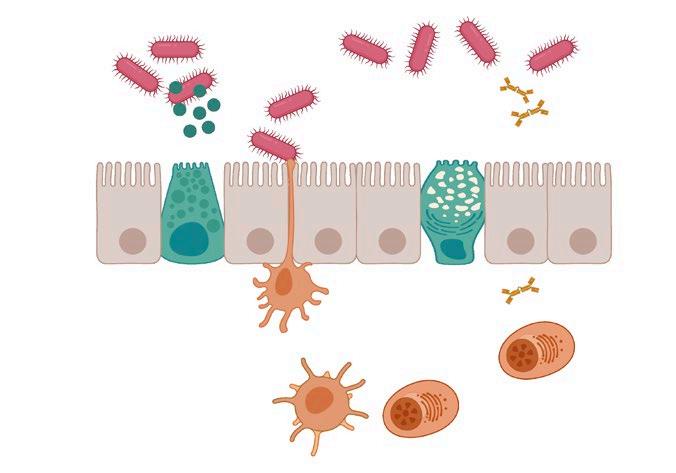
La microbiota intestinal interactúa con la mucosa de la pared intestinal contribuyendo al desarrollo de inmunidad local, muy importante para la salud global del animal.
Esta estimulación se produce vía presentación de patógenos y otros antígenos a las células inmunitarias, induciendo la producción y liberación de inmunoglobulinas A (IgA) a la luz intestinal y la maduración de linfocitos T, lo que contribuye a su vez a la modulación de la microbiota (Figura 1).
La microbiota también se relaciona con el mantenimiento de la integridad intestinal y con un correcto desarrollo y maduración del tracto gastrointestinal, ya que se ha visto que animales sin microbiota presentan alteraciones en la proliferación celular y la morfología intestinal.
Esquema de la regulación de la inmunidad intestinal y su interacción con la microbiota. La pared intestinal está compuesta en su mayoría por enterocitos, responsables de mantener su integridad. Las células de Paneth secretan sustancias antibacterianas, como defensinas, regulando las poblaciones microbianas. Las células caliciformes producen mucina, responsable de mantener la capa mucosa intestinal. Las células dendríticas actúan como células presentadoras de antígenos a los linfocitos presentes en la lámina propia, contribuyendo a la respuesta inmunitaria y a la diferenciación de linfocitos B para la producción de IgA. (Adaptado de PengJ.ycol.,2021y creado con BioRender.com).
Históricamente, el estudio de la microbiota ha tenido una gran complejidad, habiéndose centrado principalmente en la identificación y caracterización de las bacterias.
Las técnicas empleadas van desde el cultivo microbiológico hasta la secuenciación de ADN, aunque con la llegada de la secuenciación masiva algunas de ellas han caído en desuso. Con cada técnica podemos obtener diferentes tipos de información, lo que nos permite determinar:
Qué bacterias están presentes (taxones bacterianos).
En qué cantidad está cada población microbiana (cuantificación).
Cómo es la estructura global del ecosistema (diversidad).
Por otro lado, algunas técnicas requieren un conocimiento previo del microorganismo a detectar, mientras que otras permiten identificar nuevas especies no encontradas hasta la fecha.
Capa mucosa externa Activación de linfocitos T y B Maduración de linfocitos B Capa mucosa interna Lámina propia FIGURA 1
COLIDEX-C ®
LA INMUNIDAD ES EL MEJOR SUPERPODER
¿Estás preparado para la retirada del óxido de zinc?
Protege a tus lechones frente a la colibacilosis posdestete hasta el inicio del cebo con la vacuna inyectable COLIDEX-C®

COLIDEX-C ® emulsión inyectable
Composición por dosis (2 ml): E. coli (adhesina F4ac), cepa P6 ≥ 1 PR; E. coli (adhesina F5), cepa P1 ≥ 1 PR; E. coli (adhesina F6) cepa P2 y P4 ≥ 1 PR; E. coli (adhesina F5 + F41), cepa P10 ≥ 1 PR; E. coli (adhesina F18ab), cepa P5 ≥ 1 PR; E. coli (adhesina F18ac), cepa P9 ≥ 1 PR; Toxoide β de C. perfringens tipo C ≥ 10 UI. Indicaciones y especies de destino: Porcino: cerdas y lechones. Para la inmunización activa de cerdas primíparas y multíparas y pasiva de los lechones para prevenir la colibacilosis causada por las cepas de E. coli enterotoxigénicas y enteropatogénicas que expresan las adhesinas F4ac, F5, F6, F18ac y F41, frente a la enfermedad de los edemas causada por la cepa de E. coli que expresa la adhesina F18ab y frente a la enteritis necrótica causada por C. perfringens tipo C. Para la inmunización activa de los lechones frente a la diarrea post-destete. Posología y via de administración: Vía intramuscular profunda en los músculos del cuello. Dosis: Cerdas primíparas y multíparas: 2 ml. Lechones: Primera dosis: 0,5 ml. Segunda dosis: 1 ml. Pauta de vacunación: Cerdas gestantes: Administrar una primera dosis 6 a 7 semanas antes del parto, y una segunda dosis 4 semanas antes del mismo. Revacunar en las gestaciones siguientes con una dosis única, 4 semanas antes del parto. Lechones: Administrar, a los diez días de edad, una primera dosis de 0,5 ml. En el momento del destete inyectar una segunda dosis de 1 ml. Contraindicaciones: No usar en caso de hipersensibilidad a las sustancias activas, a los adyuvantes o a algún exicipiente. Tiempo de espera: Cero días Titular: CZ Veterinaria, S.A. Reg. Nº: 3450 ESP
En la Tabla 1, se recogen parte de las metodologías empleadas, el tipo de información que proporcionan y los posibles inconvenientes.
TÉCNICA EN QUÉ CONSISTE
Cultivo microbiológico
Identificación de los microorganismos presentes
TABLA 1
Relación de las principales técnicas empleadas para el estudio de la microbiota.
INFORMACIÓN QUE PROPORCIONA
Diversidad del ecosistema
Detección de nuevos géneros o especies
Cuantificación de cada microorganismo
INCONVENIENTES
Técnicas de visualización de ADN de una muestra mediante electroforesis
Crecimiento de bacterias en medios de cultivo específicos.
Tratamiento del ADN (digestión enzimática, amplificación PCR, desnaturalización, etc.) y posterior visualización de los fragmentos en un gel.
Sí No No No
Gran parte de las bacterias de la microbiota intestinal no son cultivables.
PCR a tiempo real
No Sí No No
Procedimiento lento y laborioso.
Secuenciación masiva gen
ribosómico 16S
Amplificación de regiones específicas del genoma de diferentes bacterias o microorganismos.
Secuenciación de secuencias hipervariables en el gen rRNA 16S para conocer la filogenia y las bacterias presentes.
Sí No No Sí
Se requiere el conocimiento previo de los genomas de los microorganismos a detectar.
Sí Sí Sí Sí
No se obtiene información de otros agentes: virus, hongos o arqueas, ni tampoco de genes y funciones metabólicas presentes.
Coste elevado e interpretación compleja.
Actualmente, la técnica más empleada es la secuenciación masiva gen ribosómico 16S.
Tras la extracción del ADN de las heces o tramos del intestino, se amplifican por PCR unas regiones hipervariables de este gen (denominadas V3 y V4) que permiten diferenciar entre bacterias. Con esta tecnología se obtienen millones de secuencias (algunas iguales entre sí y otras diferentes). De esta forma, podemos:
Detectar bacterias no cultivables y aquellas de las que no se conocen previamente las secuencias de sus genomas. Conocer la concentración relativa de cada una, la distribución y la diversidad de la microbiota.
La principal información que se deriva de un estudio de microbiota es la composición taxonómica de la población microbiana, variando esta información en función de la técnica empleada.
En el caso de los estudios de secuenciación masiva, además, podemos obtener información adicional, como la diversidad microbiana observada dentro del mismo individuo (alfa-diversidad) y entre individuos (beta-diversidad). Toda esta información puede representarse de forma gráfica, lo que permite obtener una visualización rápida y fácilmente interpretable de los resultados (Figura 2).
Las medidas de alfa-diversidad, además de cuantificar las especies diferentes, pueden considerar otros aspectos, como las relaciones filogenéticas entre ellas o la cantidad relativa de cada una para valorar posibles situaciones de disbiosis.
La beta-diversidad permite evaluar la similitud o diferencia de las poblaciones microbianas entre muestras o grupos experimentales.
Se usan matrices de distancias y, de nuevo, se puede tener en cuenta únicamente información cualitativa, cuantitativa o filogenética entre las distintas especies.
Las matrices de distancias pueden visualizarse en gráficas en las que cada muestra está representada con un punto, estando más próximos aquellos con mayores similitudes en cuanto a su composición microbiana.
¿QUÉ INFORMACIÓN SE OBTIENE EN UN ESTUDIO DE MICROBIOTA INTESTINAL?
Esquema de la información obtenida en un estudio de microbiota por secuenciación masiva 16S:
A. Taxones presentes en cada muestra y su abundancia relativa.
B. Representación esquemática del concepto de alfa-diversidad en dos muestras. C. Representación gráfica de las medidas de beta-diversidad.
Dada la multitud de aplicaciones prácticas que puede tener el estudio de la microbiota intestinal, a continuación se resumen algunas descritas en producción porcina.
Los estudios de microbiota permiten conocer de qué forma productos como probióticos, prebióticos, simbióticos, postbióticos u otro tipo de aditivos actúan a nivel intestinal modulando la microbiota.
En los últimos años, como consecuencia de las restricciones al uso de antibióticos y la retirada del óxido de zinc (ZnO), estos estudios se han acelerado con el objetivo de encontrar aditivos que puedan ser una alternativa.
Por ejemplo, Yu y colaboradores (2017) estudiaron el efecto del suplemento de quitosano en cerdos destetados, comparando con un grupo suplementado con ZnO y antibióticos y un grupo control.
Diferentes taxones bacterianos: familias, géneros, especies...
La microbiota de los diferentes grupos fue distinta, pero en los grupos del aditivo y de ZnO-antibióticos, a pesar de que alteraban la proporción de diferentes taxones, mostraban una tendencia similar en la modulación de la microbiota.
Estudios como este, combinados con la valoración de índices productivos e incidencias de enfermedades infecciosas, pueden contribuir a la búsqueda de alternativas.
MICROBIOTA INTESTINAL, CRECIMIENTO Y EFICIENCIA ALIMENTARIA
Dado el papel crucial que tiene la microbiota en el procesamiento de nutrientes y en la utilización de la energía, su modulación puede ser una herramienta útil para mejorar la productividad.
EXISTEN NUMEROSOS ESTUDIOS DE ASOCIACIÓN DE TAXONES BACTERIANOS CON LA PRODUCTIVIDAD Y EL CRECIMIENTO EN PORCINO

La revisión de Gardiner y colaboradores (2020) destaca la complejidad de encontrar un microbioma “sano o ideal”, ya que son muchos los factores que influyen en su composición. Sin embargo, entre los diferentes estudios, encontraron géneros bacterianos asociados con un mejor crecimiento y eficiencia, como Treponema y Methanobrevibacter en intestino delgado y grueso, y Lactobacillus en intestino grueso. Otros géneros productores de butirato, como Roseburia y Ruminococcus, también podrían tener un importante papel en una mejor eficiencia.
Con estos datos, estos taxones podrían considerarse como probióticos o como dianas en estrategias nutricionales.
BÚSQUEDA DE BIOMARCADORES DE SALUD INTESTINAL
El estudio de la composición de la microbiota previa a la aparición de la enfermedad intestinal puede ser útil para relacionar los cambios en la misma con la predisposición a una infección o con la evolución tras el periodo de enfermedad.
Muchos de los estudios se han focalizado en la búsqueda de grupos bacterianos que puedan actuar como marcadores de salud o enfermedad en el tracto gastrointestinal, destacando el papel de la familia Enterobacteriaceae o del género Lactobacillus. Por ejemplo, se ha observado una susceptibilidad diferente a la diarrea postdestete en función de la diversidad y la riqueza de la microbiota en los lechones durante el periodo de lactancia con variaciones en las proporciones de diversas familias bacterianas (Lachnospiraceae, Ruminococcaceae, Prevotellaceae y Lactobacillaceae).

Por otro lado, una mayor alfa-diversidad y proporción de las familias Methanobacteriaceae, Ruminococcaceae y Streptococcaceae se ha relacionado con una mejor tasa de crecimiento en cerdos tras la coinfección de PRRS y PCV2.
En general, en lo que respecta a las aplicaciones del estudio de la microbiota, la literatura científica es extensa y en diversas revisiones destacan la gran variabilidad de resultados y los diferentes factores que la originan, llegando incluso a encontrar resultados opuestos. Por ello, sería necesario ir un poco más allá y abordar el estudio de este ecosistema desde una perspectiva más global, haciendo uso de las nuevas técnicas denominadas “técnicas ómicas”.
La microbiota es considerada como un órgano más en los mamíferos, dada las importantes funciones en las que está implicada. Los estudios referidos en este artículo investigan únicamente una parte de este ecosistema y, en concreto, se centran en la composición taxonómica de las bacterias ahí presentes. Sin embargo, gracias al desarrollo de nuevas tecnologías y herramientas, englobadas dentro del concepto de “técnicas ómicas”, podríamos conocer con más detalle qué está ocurriendo en el tracto gastrointestinal. En la Tabla 2 vienen resumidas algunas de las principales técnicas ómicas.
Genómica/ Metagenómica ADN
Secuenciación del ADN de un microorganismo/ muestra.
Información de todo el ADN presente en la muestra evaluada, incluyendo factores de virulencia (viruloma), genes de resistencia a antibióticos (resistoma) o elementos genéticos móviles (mobiloma).
Transcriptómica ARN mensajero
Secuenciación del ARN mensajero expresado por las células diana.
Información sobre qué genes se están expresando en las células y cuánto se están expresando.
Proteómica Proteínas
Metabolómica Metabolitos
Caracterización del nivel de expresión proteica en células/ muestra.
Identificación del conjunto de metabolitos presentes en una célula/ muestra.
Información relativa a la estructura y función de las proteínas expresadas.
Epigenómica ADN/ARN
Información relativa a los procesos celulares para conocer qué se está produciendo.
TABLA 2
Principales técnicas ómicas empleadas para el estudio de la microbiota intestinal.
Todavía queda recorrido, particularmente en los métodos de análisis, interpretación y abaratamiento de costes, pero todo apunta a la necesidad de usar este análisis global de moléculas y las interacciones entre ellas para caracterizar un ecosistema.
Arnold, J. W., Roach, J., &Azcarate-Peril, M. A. (2016).Emerging technologies for gut microbiome research. Trends in microbiology, 24(11), 887-901.
Chen, L., Y. Xu, X. Chen, C. Fang, L. Zhao and F. Chen (2017).The Maturing Development of Gut Microbiota in Commercial Piglets during the Weaning Transition. Frontiers in microbiology 8: 1688.
Crespo-Piazuelo, D., Migura-García, L., Estellé, J., Criado-Mesas, L., Revilla, M., Castelló, A., Muñoz, M., García-Casco, J.M., Fernández, A.I., Ballester, M., Folch, J.M. (2019). Association between the pig genome and its gut microbiota composition.Scientific Reports, 9(1), 8791.
Dou, S., P. Gadonna-Widehem, V. Rome, D. Hamoudi, L. Rhazi, L. Lakhal, T. Larcher, N. Bahi-Jaber, A. Pinon-Quintana and A. Guyonvarch (2017). Characterisation of early-life fecal microbiota in susceptible and healthy pigs to post-weaning diarrhoea.PloS one 12(1): e0169851.
Fouhse, J. M., R. T. Zijlstra and B. P. Willing (2016).The role of gut microbiota in the health and disease of pigs. Animal Frontiers 6(3): 30-36.
Identificación de los patrones de metilación del ADN o ARN.
Evaluación de las modificaciones en el ADN y ARN que pueden interferir con la expresión génica.
La microbiota intestinal desempeña un papel indispensable en el mantenimiento de la salud intestinal y la aplicación de técnicas de secuenciación para su estudio nos permite conocer cómo se modula en función de factores externos y estrategias nutricionales. Todo ello orientado, en definitiva, a garantizar una salud y un rendimiento productivo óptimos.
Gardiner, G. E., Metzler-Zebeli, B. U., & Lawlor, P. G. (2020). Impact of intestinal microbiota on growth and feed efficiency in pigs: A review. Microorganisms, 8(12), 1886.
Kim, H. B., K. Borewicz, B. A. White, R. S. Singer, S. Sreevatsan, Z. J. Tu and R. E. Isaacson (2012). Microbial shifts in the swine distal gut in response to the treatment with antimicrobial growth promoter, tylosin. Proceedings of the National Academy of Sciences 109(38): 15485-15490.
Looft, T., H. K. Allen, B. L. Cantarel, U. Y. Levine, D. O. Bayles, D. P. Alt, B. Henrissat and T. B. Stanton (2014a). Bacteria, phages and pigs: the effects of in-feed antibiotics on the microbiome at different gut locations. The ISME journal 8(8): 1566.
Marchesi, J. R. (2010).Prokaryotic and eukaryotic diversity of the human gut.Advances in applied microbiology 72: 43-62.
Ober RA, Thissen JB, Jaing CJ, Cino-Ozuna AG, Rowland RRR, Niederwerder MC. Increased microbiome diversity at the time of infection is associated with improved growth rates of pigs after co-infection with porcine reproductive and respiratory syndrome virus (PRRSV) and porcine
circovirus type 2 (PCV2). Vet Microbiol. 2017 Sep;208:203-211.
Peng, J., Tang, Y., Huang, Y. (2021). Gut health: The results of microbial and mucosal inmune interactions in pigs. Animal Nutrition, 7, 282-294. Willing, B. and A. Van Kessel (2010). Host pathways for recognition: establishing gastrointestinal microbiota as relevant in animal health and nutrition. Livestock Science 133(1): 82-91.
Yu, T., Y. Wang, S. Chen, M. Hu, Z. Wang, G. Wu, X. Ma, Z. Chen and C. Zheng (2017). Low-molecular-weight chitosan supplementation increases the population of Prevotella in the cecal contents of weanling pigs. Frontiers in microbiology 8.
Zhang, L., W. Wu, Y. K. Lee, J. Xie and H. Zhang (2018).Spatial heterogeneity and co-occurrence of mucosal and luminal microbiome across swine intestinal tract. Frontiers in microbiology 9: 48.
Zhao, W., Y. Wang, S. Liu, J. Huang, Z. Zhai, C.He, J. Ding, J. Wang, H. Wang and W. Fan (2015). The dynamic distribution of porcine microbiota across different ages and gastrointestinal tract segments.PloSone 10(2): e0117441.



Descarga el PDF
l nuevo PRAN es una oportunidad para continuar mejorando la situación de la resistencia a los antibióticos y para poner en práctica el uso racional de los mismos. Es esencial involucrar a todas las partes implicadas, formando un foro de colaboración y coordinación efectiva para el beneficio de todos.


La resistencia antimicrobiana es uno de los grandes retos de la medicina moderna y engloba tanto la salud humana como la sanidad animal y el medioambiente. Este problema pone de manifiesto:
La importancia de observar la aparición de enfermedades zoonóticas, incluidas las causadas por patógenos resistentes.
La importancia de prevenir infecciones, proteger la biodiversidad y fomentar prácticas agrícolas y ganaderas que se basen en el uso prudente de antimicrobianos.
Según un estudio global publicado en The Lancet en 2022 y realizado con datos de 204 países y territorios, la resistencia antimicrobiana se ha convertido en una de las principales causas de muerte en todo el mundo.
En 2019 provocó cerca de 1,27 millones de fallecimientos , por encima de enfermedades como el sida y la malaria, que causaron 860.000 y 640.000 muertes, respectivamente, ese mismo año.
Con el objetivo de abordar el problema de las resistencias antimicrobianas de forma global, en 2011 la Comisión Europea solicitó a los Estados miembros un plan de acción sobre resistencia y se publicó una resolución no legislativa por la que se establecía un Plan Director de Acción sobre Resistencias Antimicrobianas (2011-2016) que estimuló la puesta en marcha de planes nacionales en 13 países, entre ellos España.
El primer Plan Nacional frente a la Resistencia a los Antibióticos (PRAN) español fue aprobado en 2014 por el Consejo Interterritorial del Sistema Nacional de Salud y la Conferencia Sectorial del Ministerio de Agricultura en un intento de reducir el riesgo de selección y diseminación de resistencias a los antibióticos.
Los esfuerzos se elevaron al ámbito global en 2015, cuando la 68ª Asamblea Mundial de la Salud aprobó el Plan de Acción Mundial para luchar contra la Resistencia a los Antimicrobianos.
En septiembre de 2016, los líderes mundiales se reunieron en la Asamblea General de las Naciones Unidas para comprometerse con la lucha contra la resistencia. Era la cuarta vez en la historia de las Naciones Unidas en la que la Asamblea General discutía un tema relacionado con la salud (los anteriores fueron el VIH, las enfermedades no transmisibles y el Ébola), lo que revelaba las dimensiones de este problema.
Durante los años posteriores a la creación del PRAN y, tras formalizarse los diferentes grupos de trabajo, se han elaborado más de 60 documentos con diferentes contenidos que atienden a las seis líneas estratégicas del PRAN y que están sirviendo como base para la implementación de un total de 80 medidas en todo el ámbito nacional.
El PRAN lanzó su primer programa (PRAN 2014-2018) con la intención de involucrar al mayor número de agentes posibles en la lucha contra la resistencia a los antibióticos.
Esta primera inmersión reveló la importancia de abordar el problema con un enfoque “One Health” o de una “Única Salud”, dando vida a un segundo PRAN (2019-2021) que, además de establecer objetivos cuantitativos y acciones más concretas y específicas en salud humana y sanidad animal, incorporaba un componente medioambiental.

Entre los logros alcanzados hasta la fecha en sanidad animal, cabe destacar que el consumo total de antibióticos en el área veterinaria en España ha registrado una reducción estimada en un 56,7% entre 2014 y 2020 (de 419 mg/PCU a 181 mg/PCU).
Destacan los programas REDUCE y el pionero Acuerdo para la Reducción del Uso de Colistina en el sector del porcino, iniciativa que ha logrado una reducción del consumo de colistina del 97,18% en dicho sector.
FIGURA 1Se han desarrollado unas guías de referencia en la terapia antimicrobiana que:
1 2
Optimizan y homogeneizan la prescripción de los antibióticos en la práctica clínica.
Establecen criterios únicos de selección de tratamiento, tanto en salud humana como en sanidad animal.
La Guía Terapéutica de Antimicrobianos en Sanidad Animal, en concreto, intenta orientar a los veterinarios clínicos en el abordaje terapéutico y ayudar a llevar a cabo los planes de uso racional de antibióticos. Para que sus contenidos sean accesibles desde cualquier terreno, se presenta en formato de herramienta web interactiva y como aplicación web.

De este modo, contenidos tan útiles como la categorización de los antibióticos, las fichas técnicas de los productos y los cambios legislativos pueden estar al alcance del veterinario desde cualquier lugar a través de esta aplicación.
Esta guía es un proyecto vivo, sujeto a actualización continua y a revisión permanente, que está organizado por especies y utiliza la información agregada del Mapa Epidemiológico de bacterias patógenas clínicas para seleccionar el tratamiento adecuado.
Antes de desarrollar el PRAN actual, el equipo de coordinación del PRAN elaboró y difundió una encuesta de calidad entre las sociedades científicas, entidades colaboradoras y grupos de trabajo con el fin de valorar el trabajo que se había realizado hasta la fecha y poder identificar las actividades que han sido fructuosas y requieren continuidad, así como las necesidades inmediatas y nuevas acciones a desarrollar.
Una de estas acciones es el Proyecto de Vigilancia de Baterías Patógenas Clínicas por especies que, con la creación de una red de laboratorios de análisis clínicos y de una aplicación informática, el mapa de patógenos , facilita la prescripción de antibióticos veterinarios según datos epidemiológicos.
También se está desarrollando un proyecto piloto en pequeños animales para el análisis del consumo real de antibióticos, tanto de registro veterinario como de registro humano, en clínicas y hospitales veterinarios.
Los Programas Reduce fueron identificados sin ninguna duda como una de las actividades más fructíferas.
Tras 6 años desde el inicio del programa Reduce Colistina, el balance se resume en más de 230 adhesiones de empresas productoras del sector porcino y una reducción desde 52 mg/PCU a 0,4 mg/PCU (casi un 100%).
Además, se continúa con los Programas Reduce de cunicultura, bovinos de carne, bovinos de leche y ovino y caprino de carne, y se amplía el grupo de avicultura a aves de puesta y pavos. Finalmente se ponen en marcha nuevos grupos de trabajo de ovino y caprino de leche, équidos, pequeños animales y acuicultura.
Esto ha supuesto un ejemplo en toda Europa, habiendo pasado de los primeros puestos en consumo de antibióticos de importancia crítica (categoría B) a uno de los países de menor consumo.
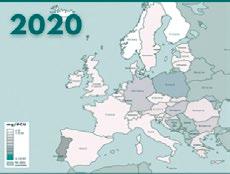
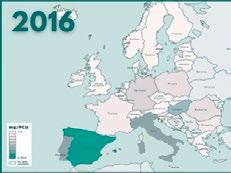
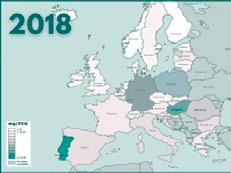
Informe ESVAC sobre distribución de las ventas de polimixinas para uso veterinario (mg/PCU).

Para desarrollar el nuevo PRAN, también se han tenido en cuenta nuevos retos:
CAMBIOS EN EL USO DE ANTIMICROBIANOS
CAMBIOS EN EL USO DE ANTIMICROBIANOS
La nueva legislación veterinaria establece una nueva forma de usar los antimicrobianos y remarca, entre otras cosas, que “los medicamentos antimicrobianos no se utilizarán de forma rutinaria ni para compensar una falta de higiene, una cría de animales inadecuada o una falta de cuidados, ni una mala gestión de las explotaciones ganaderas”.
Restringe, por tanto, muy significativamente el uso de los antimicrobianos en profilaxis y metafilaxis y, en general, indica que debemos cambiar la manera de hacer las cosas para caminar hacia una producción más sostenible.
RETIRADA DEL ÓXIDO DE ZINC
En marzo del 2017, el Comité de Medicamentos de Uso Veterinario (CVMP) completó la revisión sobre la seguridad y efectividad de los medicamentos veterinarios que contienen óxido de zinc para su administración oral en animales de producción, llegando a la conclusión de que la relación global beneficio-riesgo que existe es negativa. Es decir, los efectos beneficiosos del óxido de zinc con respecto a la prevención de la diarrea en cerdos no contrarrestan los riesgos medioambientales y sanitarios.
Por esta razón, se fijó un periodo de retirada para estos medicamentos no superior a los 5 años, con fecha de vencimiento el 26 de junio del 2022.
ESTRATEGIA “DE LA GRANJA A LA MESA”
ESTRATEGIA “DE LA GRANJA A LA MESA”
Cabe destacar también la estrategia “De la granja a la mesa” que fija un objetivo de reducción de ventas de antimicrobianos en la EU del 50% antes del año 2030. Esta reducción se hará, por supuesto, en función del consumo que tengan los diferentes sectores y países.
En este sentido, el PRAN ha propuesto al sector porcino dar un paso más y avanzar de un proyecto de reducción de colistina a uno nuevo de reducción de antibióticos, el ya mencionado Programa Reduce Antibióticos Sector Porcino, siempre teniendo en cuenta la situación actual e intentando partir de la experiencia que han aportado los esfuerzos previos.
EL NUEVO PRAN ES UNA OPORTUNIDAD PARA MEJORAR LAS COSAS DE FORMA ADECUADA
Y RACIONAL Y PARA ELLO ES NECESARIO EL COMPROMISO DE TODAS LAS PARTES INVOLUCRADAS, LO
SER UN FORO DE COLABORACIÓN Y COORDINACIÓN
EFECTIVA PARA EL BENEFICIO DE TODOS
El cálculo del consumo global del sector desde el año 2017 y la identificación de las moléculas que tienen un consumo más elevado, muestran que la amoxicilina es sin duda el antibiótico que presenta un mayor consumo
Al existir datos de resistencia de bacterias patógenas clínicas, el siguiente paso será cruzar estos datos con los de consumo para establecer Indicadores de consumo/ resistencia que permitan un mejor conocimiento de la situación clínico-epidemiológica y que avalen la puesta en marcha de medidas orientadas concretas, tales como las medidas específicas para la retirada del óxido de zinc.
Descarga el PDF
EEl uso generalizado de antimicrobianos en medicina humana y veterinaria en los últimos años ha acelerado la aparición y propagación de microorganismos resistentes. Esta situación se ha visto agravada por la falta de inversión en el desarrollo de nuevos antibióticos eficaces.

La gravedad de las consecuencias es obvia:

Se estima que, cada año, las infecciones resistentes a los antibióticos matan al menos a 25.000 pacientes y le cuestan a la UE 1.500 millones de euros en atención médica y pérdida de productividad1.
Para remediar esta situación y siguiendo las recomendaciones de la Organización Mundial de la Salud, muchos países han establecido estrategias para contener el desarrollo de resistencias a los antibióticos, con una perspectiva conjunta: salud humana, veterinaria y medio ambiental. Un concepto que se ha denominado “One Health” o Salud Única.
Ya hace algunos años que se han iniciado una serie de acciones que incluyen:
Formación.
Vigilancia del consumo y desarrollo de resistencias antimicrobianas a bacterias específicas.
Además, con la aplicación del nuevo reglamento europeo sobre los medicamentos veterinarios2 , su uso es mucho más restrictivo, limitándolos a un uso terapéutico siempre respaldado por diagnóstico y pruebas de sensibilidad.
El método más sencillo para reducir el uso de antibióticos y óxido de zinc (ZnO) sería despoblar y repoblar la granja con animales de alto estado sanitario:

Libres de PRRS, Mycoplasma hyopneumoniae, Actinobacillus pleuropneumoniae, Streptococcus suis virulentos, Brachyspira hyodysenteriae, Pasteurella multocida toxigénica, etc.

Para que este tipo de estrategias sean exitosas es imprescindible que la granja se encuentre en una localización que impida que lleguen las infecciones a partir de granjas vecinas y que, además, disponga de unas buenas medidas de bioseguridad.
No obstante, aun conociendo la solución, esta no es viable para muchas granjas pues se encuentran cerca de otras que supondrán un riesgo muy elevado para el mantenimiento de su estado sanitario.
Para una mayoría de granjas porcinas, la estrategia debe ser otra y, aunque más compleja, puede conseguir resultados espectaculares. Esta estrategia debe considerar los siguientes puntos:
Un correcto estado inmunitario se inicia con un buen plan vacunal en reproductoras y con un correcto aporte de calostro.
El calostro proporciona a los lechones inmunidad pasiva para la protección contra patógenos, la energía necesaria para la termorregulación y el crecimiento corporal, y factores de crecimiento que estimulan el crecimiento y la maduración intestinal3
Con el progreso genético la prolificidad ha aumentado en las granjas. Las camadas grandes se asocian con menores pesos al nacer4 y los lechones con bajo peso al nacer se han asociado con una menor ingesta de calostro5
Los lechones con bajo peso al nacimiento y bajo consumo de calostro tienen mayor probabilidad de morir, ya sea antes o después del destete, y mayor probabilidad de alcanzar pesos más bajos al final del engorde6.
Cualquier medida dirigida a asistir en el parto reducirá la hipoxia de los lechones durante este proceso y ayudará a que los de bajo peso al nacimiento tomen suficiente calostro, lo que tendrá un impacto positivo en la salud7
En este sentido, proporcionar una buena temperatura a los lechones, especialmente a los de menor peso al nacimiento, tendrá un impacto indirecto en la ingesta de calostro, ya que los lechones son más fuertes para llegar al pezón y succionar 8
Algunos estudios que compararon la eficacia del protocolo de limpieza y desinfección en diferentes granjas encontraron que, con demasiada frecuencia, los bebederos y comederos no se limpian adecuadamente10
La correcta aplicación de la técnica del “todo dentro-todo fuera” tiene que incluir el vaciado completo de la sala, una buena limpieza y posterior desinfección.
El secado de la sala debe considerarse un elemento clave del procedimiento de limpieza y desinfección para eliminar no solo las bacterias presentes en la sala, sino también los virus comunes en nuestras granjas como el PRRS11.

Minimizar la transmisión de patógenos entre lotes requiere aplicar algunas reglas básicas de higiene, entre ellos:
Limpieza del carro de procesamiento de lechones entre lotes, limpieza y desinfección de herramientas entre lotes, lavado de manos y cambio de botas o zapatos entre lotes12
PRODUCCIÓN DE CALOSTRO
Cualquier medida destinada a aumentar la producción de calostro por parte de la cerda también será útil, ya que la ingesta individual de calostro se reduce a medida que la camada es más grande.
Aplicar una correcta pauta vacunal a los lechones es esencial para que desarrollen la inmunidad activa necesaria para protegerse de las infecciones más comunes en las granjas, como las asociadas a Circovirus o M. hyopneumoniae, o prevenir aquellas que todavía representan una amenaza, como la infección por el virus de la Enfermedad de Aujeszky. Es común considerar correctos los protocolos de higiene de las granjas sin ningún tipo de auditoría. Sin embargo, con demasiada frecuencia, las salas se lavan parcialmente o no se dejan secar antes de que los animales vuelvan a ocuparlas.
UN BUEN PROCEDIMIENTO DE LAVADO DEBE CONSEGUIR ELIMINAR TODA
Evitar las lesiones, evitando cortar los dientes o, en caso de cortar la cola, cauterizando la herida ayudará a reducir infecciones en los lechones13
Las agujas usadas pueden potencialmente propagar patógenos de cerdo a cerdo14. Por ello, es importante cambiar las agujas, no solo entre camadas o lotes, sino entre distintos animales para prevenir infecciones.
Mover cerdos entre lotes supone romper la integridad de lote y, en consecuencia, el incumplimiento del sistema “todo dentro-todo fuera” que ha sido reconocida como una de las herramientas más efectivas para controlar la salud y mejorar el rendimiento de los cerdos durante el período de crecimiento-engorde15
Mover cerdas nodrizas procedentes de otra sala de partos es un ejemplo.
La contaminación procedente de otra sala de partos se trasladará con ellas. De hecho, se ha demostrado que el virus PRRS y el virus de la Influenza Porcina pueden infectar nuevos lotes de lechones de este modo16

En las granjas comerciales, las cerdas nodrizas superan fácilmente el 10% de las presentes en un lote de partos, lo que representa al menos el doble de lechones transferidos, ya que la adopción en dos pasos es la comúnmente utilizada.
MOVIMIENTO DE LECHONES
Cuando se mueven más del 20% de los lechones, se pierde la integridad de la camada. Para ciertos patógenos, el estado de carga de las cerdas no es el mismo, lo que influye en el estado de salud de su camada al destete17,18
El porcentaje de lechones colonizados al destete puede determinar la expresión clínica de algunas enfermedades, como es el caso de M. hyopneumoniae 19 .
Para otros patógenos, la mezcla de lechones favorecerá su transmisión20
Limitar las adopciones de lechones a las primeras 24 horas después del parto y mover la cantidad mínima necesaria para ocupar todos los pezones disponibles reduce la mortalidad durante los brotes de PRRS21.
Se han realizado pocas investigaciones sobre el efecto de las adopciones en la transmisión de enfermedades y su efecto en etapas posteriores, pero un estudio realizado en la Universidad de Wageningen demostró que la propagación de enfermedades se puede reducir evitando la mezcla de animales desde el nacimiento y hasta el sacrificio.
Las enfermedades respiratorias y el gasto de medicamentos se redujeron como consecuencia de las mejoras en la salud y el rendimiento de los cerdos22 MANEJO
En la práctica, para optimizar la utilización del espacio, es común hacer retroceder a los animales de crecimiento lento, mezclándolos con animales más jóvenes (de lotes posteriores). Estos movimientos se realizan generalmente antes del destete, al final de la fase de postdestete o al final del cebo.
Los sistemas de manejo en bandas hacen más difícil la práctica de estos movimientos de cerdos y, en consecuencia, mantienen mejor la integridad de los lotes, reconociéndose como una herramienta eficaz en el manejo de las enfermedades23.
Los sistemas de bandas que crean un intervalo más largo entre lotes podrían tener un impacto negativo en la producción, pero ayudan a mantener una buena higiene y, por tanto, resultan un instrumento muy interesante para controlar infecciones24.
Para algunos patógenos como Lawsonia intracellularis, M. hyopneumoniae y A. pleuropneumoniae, se ha comprobado que el manejo en bandas ha mejorado su control, siendo el sistema de bandas a 5 semanas el que mostró una mejora más constante a lo largo del tiempo en comparación con el sistema de bandas a 4 semanas25
Uno de los episodios que más problemas genera es el destete, que hasta ahora nos ha obligado a medicar con antibióticos o con ZnO para controlarlo.
Al destete, los lechones pasan de consumir una dieta líquida altamente digestible (la leche de la cerda) a consumir una dieta sólida de menor digestibilidad.
Este cambio provoca que los lechones pasen por un periodo de ayuno inmediatamente después de ser destetados y su duración depende de la ingesta de dieta solida que tomaban antes de ser destetados.
MÁS PROLONGADOS26
Una ingesta de pienso reducida durante la primera semana postdestete se correlaciona con un mayor riesgo de sufrir una diarrea post-destete27,28
Una ingesta deficiente de pienso reducirá el crecimiento, contribuyendo a la inflamación del intestino y afectando a la longitud de sus microvellosidades y profundidad de las criptas29. Estos cambios de la mucosa intestinal son los que promueven un ambiente ideal para la multiplicación de bacterias como E. coli.
Destetar lechones de más edad reduce el riesgo de sufrir diarreas al postdestete, ya que tendrán un tracto gastrointestinal más maduro y una mayor ingesta de pienso antes del destete, sufriendo menos estrés al ser destetados30
Nos llevaría mucho más de un artículo comentar cuáles deberían ser las pautas correctas de manejo, los requerimientos ambientales, las distintas dietas y las instalaciones necesarias para los cerdos en sus distintas fases de crecimiento. Pero la correcta aplicación de todas ellas será básica para conseguir reducir el uso de antibióticos.
El camino hacia una producción animal que use una cantidad inferior de antimicrobianos está iniciado.

Evidentemente, este camino no es fácil y complica el trabajo de productores y técnicos (tanto veterinarios como nutrólogos). Pero para ello, es imprescindible trabajar en el control de los factores de riesgo, aun sabiendo que la obtención de resultados será lenta y muchas veces menos espectacular.
Ha llegado la hora de aplicar todo lo que sabemos en higiene, sistemas de manejo, nutrición, calidad ambiental , etc., y demostrar con ello que la producción intensiva no está reñida con un uso racional de los antibióticos.



Juan A. Gilabert, Sonia Rubio, Mª Dolores San Andrés y Manuel I. San Andrés.

Sección Dptal. de Farmacología y Toxicología, Facultad de Veterinaria, Universidad Complutense de Madrid
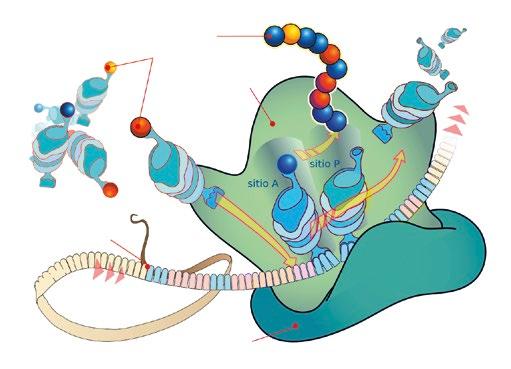
En la segunda parte de este artículo se abordan las clases de antibióticos que basan su mecanismo de acción en la inhibición de la síntesis proteica (Figura 1) dependiente de la subunidad ribosomal 50S (macrólidos, lincosamidas, estreptograminas, anfenicoles y pleuromutilinas), centrándonos en las más relevantes en el tratamiento de las enfermedades infecciosas que afectan al ganado porcino.

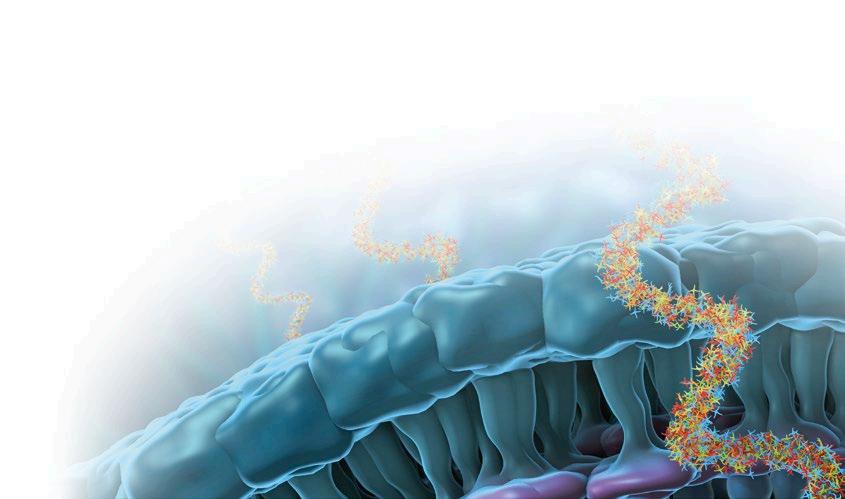
FIGURA 1
Alteración de la síntesis proteica bacteriana a nivel de la subunidad 50S mediante la inhibición de la actividad peptidil transferasa, impidiendo la formación de los enlaces peptídicos y, por ende, la elongación de la cadena de aminoácidos (Modificado de LadyofHats – Wikimedia Commons).
En el grupo de los macrólidos se incluyen numerosos compuestos:
De origen natural (1ª generación): son casi todos producidos por diversas especies de Streptomyces
Derivados semisintéticos (2ª generación): con mejores propiedades farmacocinéticas.
Cetólidos (3ª generación): con mejores propiedades frente a cepas resistentes a otros macrólidos, pero que no se han aprobado para el uso en animales.
Etimológicamente, su denominación proviene de “macro” = grande y “olido” = lactona, ya que contienen un anillo lactónico de 12, 14, 15 o 16 átomos de carbono, unidos por un enlace glucosídico a dos o tres residuos de azúcares neutros o básicos, normalmente hexosas.
Los macrólidos forman, junto con las lincosamidas y las estreptograminas, el grupo MLS (de sus siglas en inglés, Macrolides – LincosamidesStreptogramins), ya que comparten características comunes (mecanismos de acción, espectro de actividad y propiedades farmacológicas) a pesar de las diferencias químicas que hay entre ellos.
Macrólidos (Cetólidos), Lincosamidas, Estreptograminas, Anfenicoles y Pleuromutilinas
Los macrólidos se caracterizan por tener un amplio espectro frente a bacterias Gram+ y anaerobias, particularmente como bacteriostáticos. También presentan actividad frente a algunos patógenos Gram-.
En general, son antibióticos bacteriostáticos, pero pueden ser bactericidas para algunos patógenos según las dosis.

Su mecanismo de acción se basa en la estimulación de la disociación de la peptidiltransferasa del ribosoma durante el proceso de translocación, impidiendo la translocación del tRNA.
El sitio de unión de los macrólidos es similar al de cloranfenicol y lincosamidas por lo que interfieren en su acción.
EN VETERINARIA, LOS MÁS UTILIZADOS SON LOS DE 14 C (ERITROMICINA) Y LOS DE 16 C (TILOSINA, TILMICOSINA Y TILVALOSINA, DE USO EXCLUSIVO EN ANIMALES)
Los macrólidos se caracterizan por tener una buena absorción por vía GI y parenteral, aunque la vía IM causa dolor en el punto de inyección por lo que es preferible la vía IV.
Tienen buena liposolubilidad y se distribuyen bien a pesar de su alto peso molecular, excepto en LCR y cerebro. Su eliminación es, fundamentalmente, por vía biliar por lo que se recomienda vigilar la función hepática.
Las interacciones son más destacables en la eritromicina que en otros macrólidos más modernos y se deben a su inhibición del metabolismo hepático por citocromo P-450 y a la inhibición de la glicoproteína-P o complejo MDR (MultiDrug Resistance)
Las resistencias a los macrólidos son frecuentes y suele deberse a una mutación cromosómica que impide su unión al ribosoma bacteriano o a la metilación postranscripcional del ARN, por la producción de metilasas bacterianas mediada por plásmidos. También puede darse por una resistencia adquirida por enzimas que inactivan al macrólido o por sistemas de eflujo (bombas de eflujo o transportadores de membrana).
FIGURA 2
Mecanismos de resistencia de los macrólidos. A. Alteración del lugar diana ribosomal (metilación), a menudo referido como resistencia MLSB, ya que afecta a los macrólidos, lincosamidas y estreptograminas del grupo B. B. Utilización del mecanismo de flujo activo. C. Producción de enzimas inactivadoras. En general, es de esperar resistencia cruzada entre macrólidos, lincosamidas o estreptograminas.
PRINCIPALES MACROLIDOS DE USO EN PORCINO
El macrólido de 14 C de uso en porcino es la eritromicina
La eritromicina fue descubierta en 1952 a partir de una cepa de Streptomyces erythreus, habiéndose obtenido posteriormente algunos derivados semisintéticos.
Solo está disponible en forma de solución inyectable para su administración por vía IM. No se debe administrar por otras vías. Existen 2 formulaciones comercializadas.
Es bacteriostática, pero puede comportarse como bactericida a altas dosis frente a determinados patógenos.
Es activa frente a bacterias Gram+ (Streptococcus spp., Staphylococcus spp., Corynebacterium spp.) y bacterias Gram- (Haemophilus spp., Bordetella spp., Pasteurella multocida, Dichelobacter nodosus, Fusobacterium necrophorum), así como a otras como Mycoplasma spp., Leptospira spp.
En cambio, son resistentes a la eritromicina Klebsiella spp., Salmonella spp., Proteus spp., Aerobacter spp., Pseudomonas spp. y E. coli.
Por su naturaleza irritante, la eritromicina puede provocar inflamación y dolor en el punto de inyección que desaparece en unos días. Por otro lado, no ha quedado demostrada la seguridad del medicamento veterinario durante la gestación o la lactancia en las especies de destino, siendo el tiempo de espera en carne de 10 días.
Macrólidos de 15 C
Los macrólidos de 15 C o azálidos de uso en porcino son la tulatromicina y la gamitromicina.
La tulatromicina es un azálido, macrólido semisintético de larga duración de acción, ya que posee una semivida de eliminación larga, en parte, por poseer tres grupos amino en su estructura.
Se presenta en solución inyectable para su administración por vía IM, existiendo 28 formulaciones comercializadas.
Este antibiótico está indicado en el tratamiento del Complejo Respiratorio Porcino (CRP).
Si bien, no se han descrito interacciones, en el punto de inyección se observan frecuentemente reacciones patomorfológicas reversibles (congestión, edema, fibrosis y hemorragia) durante aproximadamente 30 días. Su tiempo de espera en carne es de 13 días.
Este antibiótico está indicado en el tratamiento del Complejo Respiratorio Porcino (CRP)
Presenta un amplio margen de seguridad y su tiempo de espera en carne es de 16 días.
Los macrólidos tilosina, tilmicosina y tilvalosina se usan ampliamente para el tratamiento de enfermedades que son comunes en los animales destinados a la producción de alimentos, como infecciones gastrointestinales y respiratorias. Otros representantes de este grupo son la tildipirosina y la espiramicina
La tilosina es un macrólido natural, estructuralmente similar a la eritromicina, producida por Streptomyces fradiae, que presenta una baja solubilidad en agua.
Se comercializa en varias formas farmacéuticas para su administración oral (premezcla medicamentosa o granulado para mezclar con el alimento o como polvo o granulado para administrar con el agua bebida o leche) o parenteral (IM, IV), existiendo 27 formulaciones comercializadas.
Tiene una actividad principalmente bacteriostática frente a cocos Gram+ (Staphylococcus, Streptococcus), bacilos Gram+ (como Erysipelothrix), algunos bacilos Gram- y Mycoplasma.
Los productos inyectables que contienen tilosina están indicados para el tratamiento y la prevención de la neumonía enzoótica porcina y de las infecciones respiratorias causadas por Actinobacillus pleuropneumoniae, Pasteurella multocida y Haemophilus parasuis.
Los datos de eficacia no apoyan su uso frente a la disentería porcina causada por Brachyspira hyodysenteriae por la alta tasa de resistencia observada in vitro.
Los tiempos de espera en carne son (según especialidades):
Vía oral en pienso: 0- 5 días
Vía oral en agua de bebida/leche: 0-21 días
Vía parenteral: 13-21 días
La tilmicosina es un macrólido semisintético obtenido en 1989 a partir de tilosina y de uso exclusivamente veterinario.
Se comercializa en varias formas farmacéuticas para su administración solo por vía oral (premezcla medicamentosa o granulado o como concentrado o solución oral para mezclar con el agua bebida o leche), existiendo 9 formulaciones comercializadas, ninguna de ellas en formato inyectable.
Actúa principalmente frente a bacterias Gram+, aunque también afecta a ciertas bacterias Gram- y micoplasmas, concretamente, Mycoplasma hyopneumoniae, Pasteurella multocida y Actinobacillus pleuropneumoniae.
En cerdos, está autorizada por procedimiento centralizado de la EMA para administración oral y está indicada en cerdos para el tratamiento de la enteropatía proliferativa porcina causada por Lawsonia intracellularis, el tratamiento y metafilaxis de la disentería porcina causada por Brachyspira hyodysenteriae y de la neumonía enzoótica porcina asociada a Mycoplasma hyopneumoniae.
Los tiempos de espera en carne están entre 14 días (concentrado o solución oral para mezclar con el agua bebida o leche) y 21 días (premezcla medicamentosa o granulado). Sus residuos se consideran seguros para el medio ambiente.
La tilvalosina es un macrólido semisintético que se encuentra disponible en varias formas (premezcla medicamentosa, polvo oral o en granulado para administrar en el agua bebida) para su administración por vía oral, existiendo 3 formulaciones comercializadas.
Se caracteriza por su mayor potencia frente a Mycoplasma que otros macrólidos.
Está indicada para el tratamiento y la metafilaxis de la neumonía enzoótica porcina causada por Mycoplasma hyopneumoniae, el tratamiento de la enteropatía proliferativa porcina (ileítis) causada por Lawsonia intracellularis y el tratamiento y la metafilaxis de la disentería porcina causada por Brachyspira hyodysenteriae.
El tiempo de espera en carne es de 2 días.
La tildipirosina es un macrólido semisintético que puede usarse en todas las etapas de crecimiento y es usado mayoritariamente en lechones.
Se presenta en solución inyectable para su administración por vía IM (debe tenerse especial cuidado en evitar la autoinyección, ya que los estudios toxicológicos muestran efectos cardiovasculares), existiendo solo 1 especialidad farmacéutica autorizada.
Está indicada en el tratamiento del Complejo Respiratorio Porcino.
Dada su larga semivida de eliminación, se administra una dosis única y se valora su efecto a las 48 horas tras la inyección. Si los síntomas persisten o aumentan, o si tiene lugar una recaída, el tratamiento debe cambiarse utilizando otro antibiótico.
Su tiempo de espera en carne es de 9 días.
La espiramicina es un macrólido bacteriostático, a dosis habituales, y bactericida, a dosis más altas.
Se comercializa en varias formas farmacéuticas para su administración oral (como premezcla medicamentosa para mezclar con el alimento o como polvo para administrar con el agua bebida) o de administración parenteral (IM), existiendo 5 formulaciones comercializadas.
Su espectro de acción comprende bacterias Gram-, como Haemophilus parasuis, y micoplasmas como Mycoplasma hyopneumoniae.
El desarrollo de resistencias a la espiramicina es lento y ocurre a través de plásmidos R o por sumatorio de mutaciones.
Los tiempos de espera en carne son (según especialidades):
Vía oral en pienso: 12 días
Vía oral en agua de bebida: 9-14 días
Vía parenteral: 22 días
Los antibióticos de este grupo también son producidos por distintas especies de Streptomyces.
El primero de ellos con aplicación clínica fue la lincomicina a partir del cual se obtuvo la clindamicina (aunque no se usa en cerdos).
La lincomicina es menos potente que la clindamicina (valores de CIM más altos) por lo que se formula sola o en combinación (con espectinomicina).
Se puede administrar por vía oral (premezcla, polvo para administrar en agua de bebida), o por vía parenteral (IM o IV), existiendo 18 especialidades farmacéuticas como único principio activo y 9 más combinada con espectinomicina (IM o en polvo para agua de bebida).
Los macrólidos y las lincosamidas, aunque estructuralmente diferentes, comparten muchas propiedades, entre las que se pueden destacar su amplio espectro frente a bacterias Gram+, por lo que son una alternativa a las penicilinas. Además, son activas frente a Mycoplasma y eficaces frente a anaerobios Gram+ (excepto Enterococos). En cambio, son ineficaces frente a Gram-.
Las lincosamidas son bacteriostáticas y están indicadas frente a disentería porcina y micoplasmosis, aunque se recomienda el uso de tiamulina, como primera elección.
Sus características farmacocinéticas se basan en que son liposolubles, por lo que tienen amplia distribución (llegan a la leche y pueden generar disbiosis) y buena penetración tisular. Además, sufren atrapamiento a pH ácido.
Causan alteraciones gastrointestinales, como diarreas fatales y colitis pseudomembranosa en personas y en otras especies animales (muy tóxica para herbívoros, équidos y roedores).
Las estreptograminas se diferencian de otros miembros del grupo MLS por estar formadas por dos componentes estructurales:
Estreptograminas del grupo A: son macrolactonas
Estreptograminas del grupo B: son hexadepsipéptidos
Su representante más característico en la terapéutica veterinaria es , que está formada por virginiamicina M1 del grupo A y virginiamicina S1 del grupo B.
Si bien, este antibiótico no se encuentra aprobado para uso veterinario , se utiliza en otros países fuera de la UE para tratar las infecciones originadas por patógenos Gram+ y anaerobios o como promotor del crecimiento en el ganado vacuno, cerdos y aves de corral (uso prohibido en la UE).
En porcino, se emplea para el tratamiento de la enterocolitis necrosante en neonatos o del síndrome hemorrágico intestinal en cerdos de engorde causado por Clostridium.
Las resistencias constitutivas a todos los antibióticos del grupo MLS son comunes en animales tratados con virginiamicina o tilosina como promotores del crecimiento.
Los anfenicoles son antibióticos con estructura fenilpropanoide. El primero de su clase fue cloranfenicol que fue aislado en 1947 de Streptomyces venezuelae a partir de una muestra de suelo. Fue el primer antibiótico de amplio espectro en ser administrado tanto sistémicamente como por vía oral en humanos.

Tienen amplio espectro de actividad tanto frente a patógenos Gram+, entre los que se incluyen gran número de Streptococcus y Staphylococcus, así como Gram-, tales como Pasteurella, Escherichia, Neisseria, Brucella, Salmonella, Shigella y Haemophilus
Muchas bacterias anaerobias son sensibles al cloranfenicol, como Clostridium, Bacteroides, Fusobacterium y es destacable su actividad frente a Nocardia, Chlamydia, Mycoplasma y Rickettsia.
Poseen actividad bacteriostática que puede llegar a ser bactericida a concentraciones suficientemente superiores a la CIM.
Su mecanismo de acción es el mismo que el de los antibióticos pertenecientes al grupo de las lincosamidas, bloqueando la enzima peptidiltransferasa de la subunidad 50S.
La unión de los fenicoles inhibe la reacción de peptidación, reduciendo la actividad catalítica de la peptidiltransferasa y, por tanto, inhibiendo la traducción del ARNm bacteriano. Sin embargo, pueden unirse también al ribosoma 70S de las mitocondrias de células eucariotas, produciendo alteraciones de la hematopoyesis o aplasias. Por ello, está prohibido su uso en animales por causar anemias fatales en humanos.

El cloranfenicol tiene resistencias cruzadas con el tianfenicol. Además, a veces interviene otro mecanismo de resistencia más contingente, la reducción adquirida de la permeabilidad de la membrana externa bacteriana a los fenicoles.
Dentro de esta clase, los más representativos por su uso en porcino son el tianfenicol y el florfenicol:
El tianfenicol es un derivado metil-sulfonil del cloranfenicol con un espectro de actividad similar, pero de 2,5 a 5 veces más potente y menos tóxico.
Se encuentra disponible para la administración por vía oral en agua de bebida o leche o parenteral (IM o IV), existiendo 2 formulaciones comercializadas.
Es un antibiótico de amplio espectro, activo frente a bacterias Gram+ y Gram-, anaerobias. Es activo frente a los patógenos bacterianos aislados más comúnmente responsables de infecciones respiratorias porcinas (como pasteurelosis o pleuroneumonía).
Puede causar problemas cutáneos o prolapso anal, más frecuentemente con la forma inyectable.
Se excreta como fármaco original y como glucuronato de tianfenicol, variando los tiempos de espera en carne de 5 a 13 días según la vía de administración.
Es un derivado fluorinado sintético de tianfenicol. Se encuentra disponible para la administración por vía oral como premezcla medicamentosa, en agua de bebida o en soluciones/suspensiones inyectables (IM), existiendo 24 formulaciones comercializadas.
La resistencia a florfenicol se debe principalmente a la presencia de bombas de eflujo específicas (ej. florR) o multi-sustrato (ej. AcrAB-TolC).
Los genes correspondientes a estos mecanismos están codificados en elementos genéticos como plásmidos, transposones o casetes génicos. La resistencia cruzada con cloranfenicol es posible.
Frecuentemente, las reacciones adversas observadas son diarrea y/o eritema/edema perianal o rectal transitorias que pueden afectar al 50% de los animales. Estas reacciones pueden observarse durante una semana.
Los tiempos de espera en carne varían de 14 a 23 días según vía de administración y potencia.
Las pleuromutilinas son un grupo de antibióticos descubierto en 1951 a partir de hongos (género Pleurotus, hoy reclasificados en otros géneros).
Existen varias pleuromutilinas que fueron aprobadas primero para uso veterinario (la tiamulina y la valnemulina son de uso exclusivo en animales y ambas autorizadas en cerdos), aunque a la medicina humana no llegaron hasta 2007.
Hoy en día, todas pueden obtenerse por síntesis química como derivados de la pleuromutilina, un diterpenoide tricíclico natural.
ESPECTRO Y MECANISMO DE ACCIÓN
ESPECTRO Y MECANISMO DE ACCIÓN
El espectro de acción de las pleuromutilinas es similar al de los macrólidos, como la tilosina, aunque con una mayor potencia frente a bacterias Gram- por lo que representa una alternativa.
Su mecanismo de acción también consiste en la inhibición de la enzima peptidiltransferasa.
Las pleuromutilinas se caracterizan por su amplia absorción y distribución, acumulándose en tejidos diana (pulmón o hígado). Se metabolizan en el hígado en un elevado porcentaje y tanto el fármaco como sus metabolitos se excretan, principalmente, por vía biliar.
La valnemulina tiene un pronunciado efecto de “primer paso”, por lo que las concentraciones plasmáticas dependen del método de administración, concentrándose mucho más en los tejidos, en particular los pulmones y el hígado, que en el plasma.
El mecanismo de resistencia de las pleuromutilinas se asocia a mutaciones cromosómicas, haciendo que la aparición de resistencias sea lenta y progresiva. Se han descrito resistencias cruzadas a la tilosina y a otros macrólidos. Las principales interacciones se producen con antibióticos ionóforos.
La tiamulina fue la primera pleuromutilina aprobada para uso veterinario en 1979. Está disponible en distintas formas farmacéuticas para su administración oral (premezcla medicamentosa para administrar junto al alimento o como solución, polvo y granulado para administrar junto al agua de bebida o leche) o en forma de solución oleosa inyectable para la administración parenteral (IM), existiendo 25 formulaciones.
Posee acción bacteriostática y presenta actividad in vitro frente a micoplasmas porcinos (M. hyosynoviae y M. hyopneumoniae), anaerobios Gram- (Brachyspira hyodysenteriae) y aerobios Gram- (Actinobacillus pleuropneumoniae). Se utiliza fundamentalmente en el tratamiento de la disentería porcina asociada a Brachyspira hyodysenteriae y complicada por Fusobacterium spp. y Bacteroides spp., tratamiento de la neumonía enzoótica causada por cepas de Mycoplasma hyopneumoniae sensible a tiamulina, tratamiento de la artritis micoplásmica causada por cepas de Mycoplasma hyosynoviae sensible a tiamulina y tratamiento de la pleuroneumonía causada por cepas de Actinobacillus pleuropneumoniae sensible a tiamulina.
Se ha demostrado que la tiamulina interacciona con los ionóforos como la monensina, la salinomicina y la narasina, produciendo signos idénticos a los de una toxicosis por ionóforos. Se debe al bloqueo de su metabolismo y eliminación hepática. Por tanto, los animales no deben recibir estos ionóforos durante el tratamiento con tiamulina, al menos 7 días antes o después del mismo. Puede producirse una grave disminución del crecimiento, ataxia, parálisis o muerte.
El tiempo de espera en carne es de 1 a 10 días para las formas orales y de 21 o 22 días para las inyectables, dependiendo de la especialidad utilizada.
La valnemulina fue aprobada para uso veterinario en 1999. Se presenta como premezcla medicamentosa para su administración oral en el pienso, encontrándose disponible en 2 especialidades.
Es activa frente a Mycoplasma spp., Lawsonia intracellularis y espiroquetas como Brachyspira hyodysenteriae. En porcino se utiliza para el tratamiento y/o prevención de infecciones digestivas (disentería, enteropatía proliferativa, colitis, ileítis) o pulmonares (neumonía enzoótica).
Se han demostrado resistencias cruzadas entre pleuromutilinas y oxazolidinonas, anfenicoles, estreptogramina A y lincosamidas en aislados porcinos de MRSA (Staphylococcus aureus resistentes a meticilina).
Al igual que tiamulina, no se debe administrar junto con ionóforos. Además, se debe considerar cuidadosamente el uso de valnemulina cuando las pruebas de sensibilidad a los antimicrobianos hayan demostrado resistencia a pleuromutilinas, oxazolidinonas, fenicoles, estreptogramina
A y lincosamidas porque su efectividad puede verse reducida.
El tiempo de espera en carne es de 1 día.
Patologías infecciosas más frecuentes en ganado porcino y sus posibles tratamientos antibióticos. En gris se muestran los antimicrobianos que no pertenecen al grupo de inhibidores de la síntesis proteica.
Salmonelosis
Salmonella typhimurium, Salmonella choleraesuis, Salmonella derby
Antimicrobianos de amplio espectro. Muchos problemas de resistencias y se pueden generar transmisores de plásmidos.
Apramicina | Espectinomicina Neomicina C | Apramicina
Clortetraciclina + Sulfametoxacina Sulfamidas potenciadas
Múltiples resistencias en ETEC (E. coli enterotoxigénicas)
Diarreas postdestete
Enteropatía proliferativa porcina (EPP) –Ileítis porcina
Disentería porcina y espiroquetosis intestinal Yersiniosis
Escherichia coli Campylobacter coli, Campylobacter jejuni Lawsonia intracellularis
Brachyspira hyodysenteriae, Brachyspira pilosicoli Yersinia enterocolitica
Colitis no específica
Enfermedad de los edemas (muerte por shock endotóxico)
Enteritis asociada a Clostridium
Escherichia coli
Clostridium difficile, Clostridium perfringens
Apramicina | Neomicina | Tetraciclina Sulfamidas potenciadas | Ampicilina
Danofloxacina
No suelen tratarse. Muy sensibles a: Eritromicina | Estreptomicina
Potencialmente resistentes a macrólidos. Tiamulina | Valnemulina | Tilosina Eritromicina | Clortetraciclina Lincomicina (menos efectiva) Difloxacina | Virginiamicina | Clortetraciclina
Tiamulina | Valnemulina | Tilosina Lincomicina | Neomicina C Lincomicina + Espectinomicina Lincomicina + Nitroimidazoles Sedacamicina | Imidazoles Monensina (pienso)
Tetraciclinas
Fluoroquinolonas Penicilinas sintéticas
Oxitetraciclina
Apramicina
Neomicina
No son útiles los antibióticos Resistencia a Eritromicina Resistencia a Tetraciclina
Rinitis atrófica
Bordetella bronchiseptica, Pasteurella multocida
Tratamientos en estadíos tempranos y casi todos parenterales.
Tilosina | Oxitetraciclina | Eritromicina
Tulatromicina | Gamitromicina
Florfenicol | Sulfamidas potenciadas
APP no sensible a antibióticos. Tilmicosina (en brotes) | Clortetraciclina | Ceftiofur
Pleuroneumonía asociada a Actinobacillus
Actinobacillus pleuropneumoniae (APP), Haemophilus pleuropneumoniae
Fluoroquinolonas (Danofloxacina, Enrofloxacina, Marbofloxacina )
Florfenicol | Estreptomicina C
Espectinomicina + lincomicina
En pienso metafilaxia y control: Oxitetraciclina | Doxiciclina | Tilmicosina
Florfenicol
Neumonía por Mycoplasma
Mycoplasma hyopneumoniae
No hay tratamiento efectivo. Solo reduce signos. Lincomicina + espectinomicina
Doxiciclina | Tilosina | Tulatromicina
Espectinomicina | Gamitromicina Espiramicina | Florfenicol | Clortetraciclina
Fluoroquinolonas
Complejo Respiratorio Porcino y neumonía por Mycoplasma
Pasteurella, Actinobacillus (APP), Escherichia coli, Klebsiella, Bordetella bronchiseptica, Streptococcus, Staphylococcus
Pasteurelosis
Pasteurella multocida
PRRS (Síndrome Reproductivo y Respiratorio Porcino)
Casos agudos
Leptospira interrogans (variedad Pomona)
Leptospirosis
Casos crónicos (abortos)
Leptospira interrogans (variedad Bratislava), Leptospira borgpetersenii, Leptospira kirschneri
Pielonefritis
Actinobaculum suis, Escherichia coli
Vacunación y manejo adecuado. Buen estado inmunitario.
Tulatromicina | Gamitromicina Clortetraciclina | Doxiciclina
Tetraciclinas | Estreptomicina | Espiramicina Espectinomicina | Tilmicosina | Telitromicina Clortetraciclina | Doxiciclina Ceftiofur + Sulfamidas
Gamitromicina | Tulatromicina Tilvalosina | Tilmicosina
Ampicilina | Amoxicilina, Penicilina G | Cefalotina
Estreptomicina | Clortetraciclina Dihidroestreptomicina | Oxitetraciclina Tilosina | Eritromicina
Solo en ciertos casos:
Estreptomicina
Penicilina
Enrofloxacina
Artritis-sinovitis séptica Enfermedad de Glässer
Artritis por Micoplasma y bursitis poliarticular
Trueperella pyogenes, Fusobacterium necrophorum, Staphylococcus spp., Erysipelothrix rhusiopathiae, Mycoplasma hyosynoviae, Histophilus somni
Glaesserella parasuis
Mycoplasma hyosynoviae
Tetraciclinas | Gentamicina | Amikacina
Espectinomicina | Clortetraciclina
Ceftiofur | Marbofloxacina
Tratamiento intraarticular: Gentamicina | Amikacina | Ceftiofur
Florfenicol Eritromicina Estreptomicina C
Tilosina Lincomicina
Espectinomicina+ Tilosina Oxitetraciclina
Colibacilosis neonatal (ETEC y EPEC)
Staphylococcus, Pseudomonas, Fusarium, y Escherichia coli
Serotipos de Escherichia coli septicémico, enterotoxigénico (ETEC), enteropatógeno (EPEC)
Tularemia
Pododermatitis Estreptococias
Francisella tularensis
Florfenicol
Oral Colistina | Neomicina | Clortetraciclina Amoxicilina o Amoxicilina + clavulánico Fluoroquinolonas (Enrofloxacina, Marbofloxacina)
Parenteral Amoxicilina | Ceftiofur
Tetraciclinas Estreptomicina
Penicilina | Clortetraciclina
Streptococcus spp.
Erysipelothrix rhusiopathiae
Muchas resistencias: Tetraciclinas | Eritromicina | Gentamicina Estreptomicina C | Tilmicosina
Penicilina + Sulfamidas potenciadas
Tratamiento frente a meningitis
Beta-lactámicos | Neomicina
Oxitetraciclina | Tilosina
Penicilina, Fluoroquinolonas, Cloxacilina
Muchas resistencias: Ciprofloxacina, Neomicina, | Estreptomicina, Polimixinas
MRSA
Staphylococcus hyicus, Staphylococcus chromogeno, Staphilococcus epidermidis
Dermatitis ulcerativa
Borrelia suilla
Brucelosis
Síndrome de la cerda sucia
MMA o Síndrome de disgalactia postparto
Brucella abortus, Brucella suis + Brucella abortus
Oxitetraciclina (tratamiento de apoyo)
Tetraciclina (tópica, IM)
Tetraciclinas a altas dosis tiempo prolongado. Tetraciclinas + Estreptomicina
Tetraciclinas + Estreptomicina + Gentamicina
Klebsiella spp., Escherichia coli, Streptococcus spp., Staphylococcus
Septicemia por Actinobacillus
Infecciones clamidiales
AEMPS. Base de datos CIMAVET. Disponible en línea: https://cimavet.aemps.es/cimavet/publico/home.html
Calvo, J. & Martínez-Martínez, L. Mecanismos de acción de los antimicrobianos. Enferm Infecc Microbiol Clin. Vol. 27. Núm. 1. páginas 44-52 (enero 2009). DOI: 10.1016/j. eimc.2008.11.001
Cobos-Trigueros, N., Ateka, O., Pitart, C. & Vila, J. Macrólidos y cetólidos. Enfermedades Infecciosas y Microbiología Clínica. Vol. 27 (7): 412-418. DOI: 10.1016/j. eimc.2009.06.002
Dinos, G. P. The macrolide antibiotic renaissance. Br J Pharmacol. 2017 Sep; 174(18): 2967–2983. doi: 10.1111/ bph.13936
Debono M, Willard K.E., Kirst H.A., Wind J.A., Crouse G.D., Tao EV et al. (1989). Synthesis and antimicrobial evaluation of 20‐deoxo‐20‐(3,5‐dimethylpiperidin‐1‐yl)desmycosin (tilmicosin, EL‐870) and related cyclic amino derivatives. J Antibiot (Tokyo) 42: 1253–1267.
Actinobacillus suis, Actinobacillus equuli Chlamydia spp.
Tetraciclinas Oxitetraciclina Sulfamidas potenciadas
Ceftiofur, Sulfamidas potenciadas Clortetraciclina
Muchas resistencias: Gentamicina | Tetraciclinas, Amoxicilina | Ampicilina
Tetraciclina es el fármaco de elección (21 días). Quinolonas y macrólidos, 2ª elección. No afecta a clamidias.
EMA/CVMP (Agencia Europea de MedicamentosComité de Medicamentos de Uso Veterinario), 2011. Documento de reflexión sobre el uso de macrólidos, lincosamidas y estreptograminas (MLS) en animales productores de alimentos en la Unión Europea: desarrollo de resistencia e impacto en la salud humana y animal. EMA/CVMP/SAGAM/741087/2009. 14 de noviembre de 2011. Disponible en línea: https://www. ema.europa.eu/en/documents/scientific-guideline/ reflection-paper-use-macrolides-lincosamidesstreptogramins-mls-food-producing-animalseuropean_en-0.pdf
Kothari, U. & Krilov, L.R. Aminoglycosides. Pediatr Rev. 2012 Nov;33(11):531-2; discussion 533. doi: 10.1542/ pir.33-11-531.
Krause, K.M., Serio, A.W., Kane, T.R. & Connolly, L.E.A. Harb Perspect Med. 2016 jun 1;6(6): a027029. doi:10.1101/cshperspect. a027029.
Molina, J., Cordero, E., Palomino, J. & Pachón, J. Aminoglucósidos y polimixinas. Enfermedades Infecciosas y Microbiología Clínica Vol. 27. Núm. 3. Páginas 139-196 (marzo 2009)
Perez-Trallero, D.V. Tetraciclinas, sulfamidas y metronidazol. Enferm Infecc Microbiol Clin 2010; 28:12230. 10.1016/j.eimc.2009.10.002
Mella, S., Sepúlveda, M., González, G., Bello, H., Domínguez, M-. Zemelman, R. & Ramírez C. Aminoglucósidos-aminociclitoles: Características estructurales y nuevos aspectos sobre su resistencia. Rev Chil Infect 2004; 21 (4): 330-338.
Serio, A.W., Keepers, T., Andrews, Logan, Krause & Kevin M. Aminoglycoside Revival: Review of a Historically Important Class of Antimicrobials Undergoing Rejuvenation. EcoSal Plus. 2018 nov;8(1). doi: 10.1128/ ecosalplus.ESP-0002-2018.
l síndrome de necrosis auricular porcina (PENS, por sus siglas en inglés, Porcine ear necrosis syndrome) es una condición patológica de distribución mundial, especialmente en granjas intensivas1. Su prevalencia es mayor en los lechones destetados que en los cerdos de engorde, aunque las lesiones pueden observarse en todas las fases.

En los últimos años se han utilizado diferentes nombres para este síndrome, entre ellos, espiroquetosis ulcerosa, síndrome de necrosis auricular, mordedura de oreja o dermatitis auricular estreptocócica2.
Se ha descrito una prevalencia diferente del síndrome en muchos países del mundo.
Panagiotis Tassis1a y Dimitrios
Floros1b
1Clínica de Animales de Granja, Facultad de Medicina Veterinaria, Universidad Aristóteles de Tesalónica, Grecia
aProfesor Adjunto de Medicina y Reproducción Porcina
bDVM, candidato a Doctorado

Según Petersen et al. (2008), la necrosis de las orejas fue el signo clínico más frecuente en 90 rebaños de cerdos de engorde daneses, con una prevalencia del 30%3.
Se observaron hallazgos similares en el estudio llevado a cabo por Van Staaveren et al. (2018), donde las lesiones en las puntas de las orejas fueron las más frecuentes en 31 explotaciones porcinas irlandesas4
Una alta prevalencia del síndrome fue reportada por Branislav Kureljusic et al. (2021)5, detectándose la aparición clínica de PENS entre los 45 y 50 días de edad con más del 80% de los lechones destetados afectados, lo que indica una prevalencia muy alta en la población examinada.

Los estudios han demostrado que el síndrome puede tener un impacto importante en el crecimiento de los lechones.
Según la revisión de Malik et al. (2021), las lesiones leves no parecen tener un impacto en la ganancia media diaria de los lechones6. Sin embargo, otro estudio señala que las lesiones moderadas y severas del PENS pueden tener un efecto negativo en el rendimiento de los cerdos, con una reducción de la ganancia media diaria (GMD)2
Otro posible resultado de la necrosis de la oreja es la embolia séptica que puede causar infecciones y abscesos en el pulmón y las articulaciones7 .
A pesar de que el PENS es bien conocido desde hace muchos años (el primer intento de caracterización del síndrome fue realizado por Richardson et al., en 1984), aún no se han dilucidado completamente los mecanismos implicados en su etiología y patogénesis8.
Hasta la fecha, se han propuesto tres posibles causas:
1 2 3
Infección bacteriana
Lesión isquémica
Lesión traumática o factores ambientales
La primera hipótesis establece la implicación de patógenos, como los estafilococos. Concretamente, se ha sugerido que Staphylococcus hyicus y S. aureus son agentes etiológicos del síndrome debido a que producen lesiones histopatológicas típicas de dermatitis exudativa2
S. hyicus y S. aureus producen toxinas exfoliativas y toxinas tipo serina proteasas que pueden desintegrar la piel de los mamíferos2,9
La diana de las toxinas exfoliativas es la desmogleína 1 (Dsg1) presente en la piel de cerdo, una proteína extracelular que mantiene la estructura de la epidermis mediante su función adhesiva (Figura 1)
Staphylococcus Dsg1 intacta Dsg1 alterada Células epidérmicas
Toxinas DIAGNÓSTICO 43
Otras bacterias aisladas de las lesiones auriculares son las espiroquetas, siendo la más común Treponema spp.11 .
Las bacterias como Treponema spp. se encuentran en la cavidad oral, concretamente en las encías, desde donde contaminan la piel de los lóbulos de las orejas mediante mordedura o lamido (Karlsson et al., 2017)12. Sin embargo, en el mismo estudio, la inducción de lesiones por PENS tras la inoculación con T. pedis T A4 a cerdos no tuvo éxito.
En este punto, cabe aclarar que la reducida concentración bacteriana y el tiempo de exposición a la bacteria no permitieron inducir las lesiones, a pesar de que T. pedis ha sido caracterizado como agente etiológico del PENS. Sin duda, se necesitan más estudios para aclarar el papel de Treponema spp. como causa primaria del síndrome o como invasores secundarios de la piel por mordedura12
El virus del síndrome reproductivo y respiratorio porcino (PRRSV), debido a su frecuente aparición en las explotaciones intensivas y a su efecto inmunosupresor, se ha propuesto como factor de riesgo para la aparición de PENS. Este efecto inmunosupresor podría favorecer la multiplicación de la microbiota cutánea habitual y causar daños9
Se ha sugerido también que el PENS es el resultado de la isquemia asociada a la lesión o infarto de los pequeños vasos de la punta de la oreja por los inmunocomplejos inducidos por Mycoplasma suis9
Las infecciones subclínicas de M. suis pueden conducir a la manifestación clínica del síndrome, ya que esta bacteria tiene la capacidad de desencadenar la producción de autoanticuerpos fríos (IgM) asociados con cuadros de anemia.
Estos anticuerpos IgM reactivos se encuentran principalmente durante la fase crónica de la enfermedad y su principal diana son los eritrocitos (actúan como autoanticuerpos), formando inmunocomplejos que provocan infartos a nivel de los pequeños vasos del pabellón auricular9,13 (Figura 2)
Además, M. suis podría adherirse a las células endoteliales, evitando así su fagocitosis y provocando una infección persistente, mientras que el daño endotelial provoca trombosis vascular13.
ACTINOBACILLUS & HAEMOPHILUS
ACTINOBACILLUS & HAEMOPHILUS
En un análisis metagenómico previo se observó un aumento de los géneros Actinobacillus y Haemophilus en los cerdos con afectación aguda en comparación con los controles no afectados. Sin embargo, su papel en la inducción del PENS no se ha aclarado7.
Inducción de la formación de autoanticuerpos fríos (IgM) frente a los eritrocitos del cerdo con la formación de inmunocomplejos
Isquemia asociada al infarto de los pequeños vasos sanguíneos de la punta de la oreja obstruidos por inmunocomplejos inducidos por M. suis
Pequeños vasos sanguíneos de la oreja
FIGURA 2
Isquemia de la punta de la oreja asociada a la formación de inmunocomplejos tras la infección con Mycoplasma suis. La presencia de M. suis en el organismo induce la formación de autoanticuerpos fríos (IgM) que reaccionan frente a los eritrocitos propios, conduciendo a la formación de inmunocomplejos que, cuando llegan a pequeños vasos sanguíneos, como en la punta de la oreja, producen obstrucciones del flujo sanguíneo y la consiguiente isquemia de la zona irrigada por éstos (Creado con BioRender.com).

Otros investigadores sugieren que la necrosis de la oreja es el resultado de una lesión isquémica debida a la formación de trombos en los pequeños capilares dérmicos de las puntas de la oreja como resultado de la deposición de inmunocomplejos asociados a infecciones víricas, como en la enfermedad asociada al circovirus porcino (PCVAD, del inglés, porcine circovirus associated disease)5
Se cree que el mecanismo está asociado a un fenómeno de hipersensibilidad tipo III y a la deposición de complejos antígeno-anticuerpo14 .
Otras lesiones dermatológicas asociadas al circovirus porcino (PCV) se observan en el síndrome de dermatitis y nefropatía porcina (PDNS, del inglés, porcine dermatitis and nephropathy syndrome), causado por una vasculitis necrotizante sistémica.
En este caso, las lesiones vasculares se observan también en otros órganos, como los riñones, el bazo y el mesenterio10. UN
Pueden observarse hallazgos similares de vasculopatía en el curso de los casos de micotoxicosis.
Las micotoxinas son metabolitos secundarios estructuralmente diversos producidos por hongos que crecen en los alimentos consumidos por los animales y el hombre.
Sus efectos, que dependen de la dosis y tiempo de exposición, van desde una reducción del rendimiento productivo hasta casos de mortalidad aguda15
Weissenbacher-Lang et al. (2012) estudiaron el papel de las micotoxinas en el PENS y señalaron que el deoxinivalenol (DON) está implicado en las etapas iniciales del síndrome (induciendo alteraciones microscópicas), mientras que no observaron efectos asociados a micotoxinas evaluadas en el estudio (toxina T2, toxina HT-2, diacetoxiscirpenol [DAS], acetil-deoxinivalenol [acDON] y nivalenol [NIV], así como los alcaloides del cornezuelo de centeno ergosina, ergotamina, ergocornina, ergocriptina y ergocristina) en la inducción del PENS16
En otro estudio con ocurrencia clínica de PENS, el análisis de los piensos reveló la presencia de varias micotoxinas a bajas concentraciones (DON, toxina T-2, zearalenona, aflatoxina y ocratoxina)5
Debido al posible efecto sinérgico o aditivo de estas micotoxinas o a una posible interacción sinérgica entre las micotoxinas y los agentes infecciosos, no se puede descartar la hipótesis de su implicación como agentes causantes del PENS5
Por su parte, Park et al. (2013), basándose en la descripción histológica de las lesiones del PENS y en la ausencia de otros signos clínicos asociados a la micotoxicosis, descartaron la implicación de las micotoxinas en la etiología de este síndrome, aunque no determinaron el nivel de contaminación de los piensos con micotoxinas, ya que no causan necesaria y exclusivamente necrosis en las orejas, sino que tienen potencial dermonecrótico (DON a altas concentraciones) o inmunosupresor (aflatoxinas, ocratoxinas [OTA] y los tricotecenos, como la toxina T-2)2
La toxina T-2, además de otras condiciones patológicas, como la depleción linfoide profunda, la gastroenteritis, la diarrea, la insuficiencia cardiovascular, entre otras, también puede causar irritación directa de la piel y necrosis15
La tercera hipótesis, afirma que los traumatismos externos (por ejemplo, mordedura de oreja) y los factores ambientales, con la posterior infección por estreptococos betahemolíticos, pueden ser posibles causas del PENS8
Si bien, Streptococcus suis no suele ocasionar signos clínicos en la piel sana, se ha aislado en varios casos de PENS a lo largo de los años7,16
Bacterias como S. hyicus o Streptococcus spp. forman parte de la microbiota normal de la piel porcina por lo que su presencia no necesariamente conducirá a la PENS, pero en circunstancias específicas (por ejemplo, cicatrices en la piel o mordeduras en las orejas) pueden exacerbar el daño9
Los traumatismos autoinfligidos resultantes de la irritación de la infección por Sarcoptes scabiei en las orejas podrían estar asociados a la inducción de lesiones tempranas7.
LAS LESIONES EN
LAS OREJAS PUEDEN PRODUCIRSE POR MORDEDURAS O POR CONDICIONES INADECUADAS DE LA GRANJA (POR EJEMPLO, SALIENTES AFILADOS)9
En otro estudio, se señalaron cuatro factores que podrían aumentar la probabilidad de ocurrencia de mordeduras en orejas y colas17:
Suelo de rejilla
Temperatura ambiente elevada
Número limitado de comederos
Alimento seco
En conjunto, aunque se han aislado varios microorganismos a partir de las lesiones, la patogenicidad/cascada de eventos del PENS no está totalmente aclarada, ya que estos microorganismos pueden ser los agentes causantes del síndrome, pero también pueden actuar como complicaciones secundarias de otra etiología12
Se han adoptado como indicadores de Bienestar Animal las lesiones en las puntas de las orejas, la bursitis, las cicatrices en todo el cuerpo y los signos de mordedura de la cola18
Por tanto, el cumplimiento de los requisitos de bienestar en la producción porcina moderna también puede ayudar a reducir la aparición del PENS en las explotaciones porcinas intensivas.
Las condiciones ambientales de la granja, como la alta humedad, la baja calidad del aire, la alta densidad de población y el comportamiento inadecuado de los trabajadores de la granja hacia los animales podrían aumentar los niveles de estrés del cerdo.
El estrés es un factor importante en los lechones destetados que reduce su capacidad para enfrentarse al entorno. Un mayor nivel de estrés podría afectar a la presencia de lesiones auriculares en la granja19
Finalmente, el destete a una edad demasiado temprana podría aumentar los conflictos entre los lechones dentro de un corral, lo que conlleva un aumento de las mordeduras y las lesiones2
Es frecuente observar las lesiones auriculares tras el destete, con una edad media de inicio a las 7 semanas, permaneciendo visibles hasta la semana 14-16 (más frecuentemente de 1 a 12 semanas de edad).
LESIONES MACROSCÓPICAS LESIONES MACROSCÓPICAS
Las lesiones son generalmente bilaterales, con necrosis localizada en la punta de la oreja, normalmente en las superficies anterior y posterior1,7,9
DESDE EROSIONES
DE LA EPIDERMIS SIN
HEMORRAGIA HASTA
HEMORRÁGICOS Y EDEMA
EN LOS CASOS GRAVES2,8,9
Según otro estudio, se puede observar una necrosis epidérmica focal como lesión inicial16
En la superficie, la epidermis está cubierta por una costra marrónrojiza formada por exudado, células epidérmicas muertas y neutrófilos2,8,11.

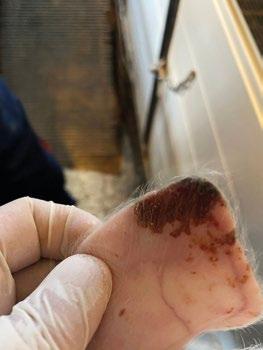


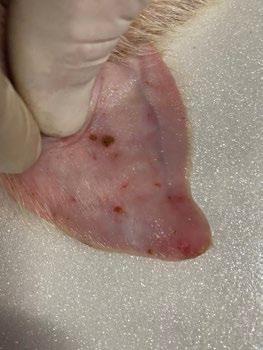
A
C E B D
FIGURA 3Las lesiones histológicas más frecuentes encontradas por primera vez por Richardson et al. (1984) fueron hiperqueratosis, acantosis y abscesos intraepidérmicos8, habiéndose encontrado hallazgos similares en estudios más recientes.
Otros estudios histológicos han revelado una dermatitis auricular erosiva o ulcerosa con presencia de cocos bacterianos en las costras y dermatitis neutrofílica de leve a grave2
La severidad de las lesiones se categoriza mediante un sistema de puntuación de cinco puntos6:
Puntuación 0: ausencia de alteraciones.
Puntuación 1: decoloración roja leve o costra en la punta de la oreja.
Puntuación 2: decoloración más oscura y punta de la oreja redondeada.
Puntuación 3: necrosis severa con ausencia de una parte inferior a un tercio de la punta de la oreja.
Puntuación 4: ausencia de más de un tercio de la punta de la oreja.
También se ha propuesto otro sistema de puntuación18 basado en el tamaño de la zona afectada20
Lesiones graves (+++): necrosis grave que afecta a más del 10% de la punta de la oreja.
Lesiones moderadas (++): la zona necrótica abarca el 5-10% de la oreja.
Lesiones leves (+): el área necrótica cubre menos del 5% de la oreja.
Una de las complicaciones más importantes y peligrosas de la necrosis de la oreja es la bacteriemia y la sepsis que pueden conducir a una neumonía grave o a la artritis1,8
Debido a la inflamación local, los cambios en la permeabilidad de los vasos y las heridas abiertas permiten la colonización de los tejidos infectados y edematosos con bacterias8. En ocasiones, las lesiones se expanden a la zona de la paleta y la papada2,8,18
A lo largo de los años, se ha intentado establecer un tratamiento para el PENS sin obtener resultados óptimos2,9,18. No obstante, en los casos de presencia de Treponema spp., el tratamiento con macrólidos podría tener éxito18
…a lo largo de todo el ciclo de producción.
Mycofix® es la solución para la gestión del riesgo por micotoxinas. *
*Autorizado por los Reglamentos de la UE No 1115/2014, 1060/2013, 1016/2013, 2017/913 y 2017/930 para la reducción de contaminación con fumonisinas, aflatoxinas y tricotecenos.
mycofix.biomin.net
MYCOFIX (IR-554780) y BIOMIN (IR-509692) son marcas comerciales registradas por Erber Aktiengesellschaft.
EcoVet Economía Veterinaria


Avda. Reyes Católicos 6-16A
28220 Majadahonda-Madrid (Spain)
Tel: (+34) 916363251
qualivet@qualivet.es
En resumen, el síndrome de necrosis auricular porcina es una condición patológica con una etiología y patogénesis poco claras.
A lo largo de los años, se han propuesto como factores implicados en la etiología del síndrome bacterias como S. hyicus, S. aureus y M. suis, virus como el PCV-2 y el PRRSV, factores de manejo y ambientales, así como las mordeduras de oreja.
Datos recientes señalan una combinación de varios factores y mecanismos como posible explicación.
Por ejemplo, un estudio reciente sugirió la combinación de la infección por el PRRSV y S. hyicus como agente causal21, mientras que un estudio de desafío demostró que un daño externo a la piel, seguido de la introducción de microrganismos, se relaciona con las etapas iniciales del PENS (hiperemia seguida de dermatitis local). Posiblemente, los daños vasculares adicionales son el factor necesario para el agravamiento del síndrome, conduciendo a la pérdida permanente del tejido auricular22
Sin duda, se necesitan más investigaciones para dilucidar varios aspectos, como el papel de las micotoxinas en la inducción del síndrome, la cascada exacta de acontecimientos y la interacción de los mecanismos implicados, así como el grado de implicación de cada factor de riesgo cuando se producen simultáneamente.
An investigation of ear necrosis in pigs. Can Vet J 2013 ;54:491–495..
3. Petersen, H.H., Nielsen, E.O., Hassing, A.-G., Ersbøll, A.K., Nielsen, J.P.,. Prevalence of clinical signs of disease in Danish finisher pigs. Veterinary Record 162, 377–382.. 2008
4. Van Staaveren, N., Calderón Diaz, J.A., Garcia Manzanilla, E., Hanlon, A., Boyle, L.A., Prevalence of welfare outcomes in the weaner and finisher stages of the production cycle on 31 Irish pig farms. Irish Veterinary Journal 71. 2018.
5. Kureljuši B, Savi B, Mili evi V, Jezdimirovi N, Radanovi O, Žuti J, Weissenbacher-Lang C. Investigation of possible aetiological/triggering factors in porcine ear necrosis syndrome at a farrow-to-feeder pig system. Acta Vet Hung. 2021 Jun 7. doi: 10.1556/004.2021.00018.
6. Malik, M., Schoos, A., Chantziaras, I., Biebaut, E., Bernaerdt, E., Beuckelaere, L., Donkers, D., Croubels, S., Maes, D.,. Occurrence and impact of ear tip necrosis on daily weight gain in weaned piglets. Proceedings for the International Pig Veterinary Society Congress, Rio De Janeiro Brazil In press, 2021.
7. Zimmerman J.J., Dee S.A., Holtkamp D.J., Murtaugh M.P., Stadejek T.,Stevenson G.W., Torremorell M., Yang H., and Zhang J., Integumentary system. In: Diseases of Swine, Zimmerman J.J., Karriker L.A., Ramirez A., Schwartz K.J., Stevenson G.W., Zhang J. (Eds)., 11th Edition. 2019, 685-702, doi:10.1002/9781119350927.
8. Richardson JA, Morter RL, Rebar AH, Olander HJ. Lesions of porcine necrotic ear syndrome. Vet Pathol, 1984, 21:152–157.
9. Malik M, Chiers K, Boyen F, Croubels S, Maes D. Porcine ear necrosis. Vet J. 2021. May;271:105655. doi: 10.1016/j.tvjl.2021.105655. Epub 2021 Mar 18.
10. Segalés, J., Allan, G.M., Domingo, M. Porcine circovirus disease. Animal Health Research Reviews, 2005, 6, 119–142.
11. Pringle, M., Backhans, A., Otman, F., Sjölund, M., Fellström, C., Isolation of spirochetes of genus Treponema from pigs with ear necrosis. Vet. Microbiol. 2009. 139, 279–283
12. Karlsson, F., Rosander, A., Fellström, C., Backhans, A.,. Experimental inoculation of Treponema pedis T A4 failed to induce ear necrosis in pigs. Porcine Health Management 3. 2017.
13. Pieters, M G., and Maes, D., Mycoplasmosis. In: Diseases of Swine, Zimmerman J.J., Karriker L.A., Ramirez A., Schwartz K.J., Stevenson G.W., Zhang J. (Eds)., 11th Edition. 2019, 876-878 doi:10.1002/9781119350927.
14. Drolet, R.,. Urinary system, In: Diseases of Swine, Zimmerman J.J., Karriker L.A., Ramirez A., Schwartz K.J., Stevenson G.W., Zhang J. (Eds)., 11th Edition. 2019, 408-422, doi:10.1002/9781119350927
15. Ensley St.M., and Radke S.L., Integumentary system. In: Diseases of Swine, Zimmerman J.J., Karriker L.A., Ramirez A., Schwartz K.J., Stevenson G.W., Zhang J. (Eds)., 11th Edition. 2019, 1055-1068 doi:10.1002/9781119350927.
16. Weissenbacher-Lang, C., Voglmayr, T., Waxenecker, F., Hofstetter, U., Weissenböck, H., Hoelzle, K., Hoelzle, L.E., Welle, M., Ogris, M., Bruns, G., et al.,. Porcine ear necrosis syndrome: a preliminary investigation of putative infectious agents in piglets and mycotoxins in feed. The Veterinary Journal, 2012. 194, 392–397.
17. Smulders, D., Hautekiet, V., Verbeke, G., Geers, R.,. Tail and ear biting lesions in pigs: an epidemiological study., Animal Welfare 2008. 17, 61–69
18. Svartström O, Karlsson F, Fellström C, Pringle M. Characterization of Treponema spp. isolates from pigs with ear necrosis and shoulder ulcers. Vet Microbiol. 2013 Oct 25;166(3-4):617-23. doi: 10.1016/j.vetmic.2013.07.005.
19. Diana, A., Boyle, L.A., Garcia Manzanilla, E., Leonard, F.C., Calderon Diaz, J.A. Ear, tail, and skin lesions vary according to different production flows in a farrow-to finish pig farm. Porcine Health Management 2019, 5.

20. Pejsak, Z., Markowska-Daniel, I., Pomorska-Mól, M., Porowski, M., Kolacz, R.,. Ear necrosis reduction in pigs after vaccination against PCV2. Research in Veterinary Science, 2011. 91, 125–128.
21. Lee, S., Jung, J.-Y., Kim, S.-H., Kim, J.-W., Park, J.-W., Kang, D.-Y., … Yoon, S.-S. Porcine ear necrosis syndrome by coinfection of porcine reproductive and respiratory syndrome virus and Staphylococcus hyicus. Korean Journal of Veterinary Research. The Korean Society of Veterinary Science (KJVR), 2017, 57, 2. https:// doi.org/10.14405/kjvr.2017.57.2.143
22. Costa, M.; Nosach, R.; Harding, JCS.; Huang, Y. Partial reproduction of ear-tip necrosis suggests an infectious, initially bacterial aetiology, Veterinary Microbiology, 2021, 262. https://doi.org/10.1016/j.vetmic.2021.109246.
1. Papatsiros V. Ear necrosis syndrome in weaning pigs associated with PCV2 infection: A case report. Vet Res Forum. 2012 Summer;3(3):217-20. PMID: 25610573; PMCID: PMC4299987. 2. Park, J.; Friendship, R.M.; Poljak, Z.; DeLay, J.; Slavic, D.; Dewey, C.E.l virus de la Influenza A (IAV) y el virus del Síndrome Reproductivo y Respiratorio Porcino (PRRSV) son considerados patógenos clave involucrados en el Complejo Respiratorio Porcino. El efecto de un virus sobre otro en lo que respecta a la respuesta inmunitaria local es aún muy limitado y la determinación de la presencia y la cantidad de citoquinas en el tejido pulmonar, así como su relación con la patología pulmonar, puede conducir a una mejor comprensión de la respuesta inflamatoria del hospedador y su influencia en la patología pulmonar durante la infección con uno o varios virus. El objetivo del presente estudio fue explorar y comparar los patrones de respuesta de citoquinas pulmonares en cerdos tras una infección única o mixta con IAV y/o PRRSV.



Hanna Turlewicz-Podbielska1, Ewelina

Czyżewska-Dors2 y Małgorzata Pomorska-Mól1
1Departamento de Ciencias Preclínicas y Enfermedades Infecciosas, Facultad de Veterinaria, Universidad de Ciencias de la Vida de Poznan, Polonia.
2Departamento de Medicina Interna y Diagnóstico, Facultad Veterinaria, Universidad de Ciencias de la Vida, Poznan, Polonia
El Complejo Respiratorio Porcino (CRP) es un grave problema sanitario para la producción porcina mundial1,2, estando implicados en este síndrome varias combinaciones de agentes virales y/o bacterianos. Entre ellos, el virus de la Influenza A (IAV) y el virus del Síndrome Reproductivo y Respiratorio Porcino (PRRSV) se consideran patógenos virales cruciales implicados en el CRP3-5
El PRRSV es el agente causal del Síndrome Reproductivo y Respiratorio Porcino6, siendo características típicas de la infección por este virus la supresión de la producción de interferón tipo I y la modulación de la respuesta inmunitaria del hospedador7.
El virus de la Influenza A es el agente etiológico de la Influenza porcina, una enfermedad caracterizada por una baja mortalidad (1-2%) y una alta morbilidad (hasta el 100%)8. El aumento de la producción de muchas citoquinas proinflamatorias, fenómeno conocido como “tormenta de citoquinas”, es típica en la gripe aguda en humanos9-11 y se considera de gran importancia en la patogénesis de la gripe porcina12-14.
Anteriormente, se han publicado algunos estudios relativos a la infección simultánea de cerdos con diversos virus respiratorios, incluidos IAV y PRRSV15-18. Hasta ahora, los estudios experimentales sobre infecciones simples o mixtas con PRRSV e IAV se han centrado en las manifestaciones clínicas y en el rendimiento productivo, obteniéndose resultados clínicos muy diversos en el caso de las coinfecciones16-18.

Independientemente de los resultados de los estudios previos de coinfección, nuestra comprensión del efecto de un virus sobre otro con respecto a la respuesta inmunitaria local sigue estando muy limitada.


Las citoquinas proinflamatorias desempeñan un papel importante en las infecciones respiratorias porcinas al coordinar y activar la respuesta inmunitaria adaptativa19,20. Sin embargo, si el nivel de citoquinas es excesivo, puede producirse daño tisular y exacerbación de la enfermedad21.
La determinación de la presencia y la cantidad de citoquinas en el tejido pulmonar y su relación con la patología pulmonar puede mejorar la comprensión de la respuesta inflamatoria del hospedador durante la infección por uno o varios virus.
En un estudio in vitro se investigó el impacto de las coinfecciones de PRRSV y virus de la influenza porcina (SIV, por sus siglas en inglés, swine influenza virus) en varios genes (receptores de reconocimiento de patógenos, interferones tipo I, citoquinas y genes inducibles por IFN) y proteínas, demostrándose efectos en la respuesta inmunitaria celular y tisular a nivel molecular22.
Otro estudio in vivo sobre la respuesta inmunitaria innata local en las células del líquido de lavado broncoalveolar (BAL) de cerdos inoculados individualmente con PRRSV o coinoculados con PRRSV e IAV, reveló que la infección con PRRSV solo o con IAV afectaba a la expresión de IFN-α y retrasaba el inicio de la expresión de IFN-γ Además, la coinfección con ambos virus demostró tener efectos aditivos sobre la expresión del ARNm de IL-6 y IL-1023.
El objetivo del presente estudio fue determinar los patrones de respuesta de las citoquinas pulmonares en los cerdos tras la infección simple o mixta con IAV y/o PRRSV.
ANIMALES E INFECCIÓN CON CEPAS DE PRRSV Y/O IAV
ANIMALES E INFECCIÓN CON CEPAS DE PRRSV Y/O IAV
El estudio se realizó con 56 lechones de 7 semanas de vida, libres de IAV y PRRSV (seronegativos y no vacunados frente a estos patógenos), además de ser seronegativos frente al virus de la enfermedad de Aujeszky y Mycoplasma hyopneumoniae. Los exámenes clínicos, serológicos y anatomopatológicos no revelaron ningún indicio de estreptococias ni de rinitis atrófica.
Los lechones se distribuyeron aleatoriamente en cuatro grupos experimentales (14 lechones/ grupo):
Grupo PRRSV
Grupo IAV + PRRSV
Grupo IAV
Grupo CONTROL
Los lechones fueron sometidos a un examen clínico diario y a la medición de la temperatura rectal (desde el día 7 preinoculación hasta el día 21 postinoculación (dpi) o hasta la eutanasia (a los 2, 4 y 10 dpi).
La severidad de las lesiones clínicas se evaluó basándose en un sistema de puntuación adaptado al PRRS y a la Influenza Porcina24. Los parámetros de bienestar, respiración, trastornos oculares, temperatura rectal y apetito se puntuaron de 0 (estado normal) a 1 (los trastornos más graves de cada categoría).
Con el fin de evaluar los patrones de lesiones asociados a las infecciones en los distintos grupos evaluados, se sacrificaron a los lechones a los 2, 4, 10 y 21 dpi, realizándose la necropsia completa de cada animal, con especial atención al tracto respiratorio.
Las lesiones pulmonares macroscópicas se puntuaron según el método descrito por Halbur et al.39 y adaptado por Pomorska-Mól et al.24
A cada lóbulo pulmonar se le asignó un número para reflejar el porcentaje aproximado del volumen de todo el pulmón representado para alcanzar el total de 100 puntos posibles.
INTRANASAL CON IAV
(SWH1N1) Y/O PRRSV
(CEPA PL15-33, SUBTIPO 1 DEL PRRSV)
El día 0, los lechones de los grupos IAV e IAV + PRRSV fueron inoculados por vía intranasal con SwH1N1 (107 TCID50) en 2 ml de PBS.
Los lechones de los grupos PRRSV e IAV + PRRSV fueron inoculados por vía intranasal con PRRSV (105 TCID50) en 2 ml de PBS.
Los lechones inoculados con PBS sirvieron de control.
Las puntuaciones de los cerdos individuales en cada categoría se sumaron para obtener una puntuación clínica acumulada (CS) por animal.
La evaluación según el procedimiento mencionado dio una puntuación pulmonar (LS) que permite estimar el porcentaje del pulmón afectado por neumonía.
El tejido pulmonar recogido de lechones durante la necropsia se preparó en PBS (pH 7,4)8,24. 1,0 g de tejido pulmonar recogido de los lóbulos craneal, medio y accesorio derecho (3,0 g en total) se suspendieron en 3 ml de PBS (1:1 p/v) y se congelaron antes de ser homogeneizados. A continuación, las muestras se centrifugaron a 12.000 rpm durante 10 minutos. Los sobrenadantes se recogieron y se almacenaron a -80°C hasta un máximo de 1 mes.
Posteriormente, se analizaron las concentraciones de las siguientes citoquinas mediante kits ELISA:
Cuantificación de citoquinas en los pulmones de los lechones control y de los lechones inoculados con IAV o PRRSV o coinoculados con ambos virus (IAV + PRRSV) (promedio ± SD) a los 2, 4, 10 y 21 DPI. a, b, c = diferentes superíndices indican diferencias significativas entre los grupos (p < 0,05).
En general, las concentraciones pulmonares de las citoquinas estudiadas se vieron afectadas en los lechones inoculados (IAV o PRRSV) y coinoculados (IAV + PRRSV).
En los lechones inoculados únicamente con PRRSV se observó un nivel significativamente mayor de IFN-α, IFN-γ, IL-1β, IL-10, TNF-α e IL-8 en varios momentos después de la inoculación.
En los lechones inoculados únicamente con IAV, las concentraciones de IFN-α, IFN-γ, TNF-α, IL-6, IL-8 e IL-10 en el pulmón fueron elevadas (p < 0,05), sobre todo en las primeras etapas tras la inoculación (2 a 4 dpi).
En los lechones coinoculados (IAV + PRRSV) se encontraron niveles elevados de todas las citoquinas estudiadas en comparación con los lechones control.

La concentración de IFN-α se elevó principalmente en la fase inicial de las infecciones experimentales (2 y 4 dpi).
Los niveles más altos de esta citoquina en los pulmones se observaron a los 2 dpi en los lechones inoculados con PRRSV o coinoculados con IAV y PRRSV.
A los 4 dpi, la concentración de IFN-α fue significativamente mayor en todos los grupos inoculados en comparación con el grupo control.
En el grupo coinoculado (IAV + PRRSV) también se observó un incremento significativo de IFN-α a los 10 dpi.
IL-1β
En los lechones inoculados con IAV no se observaron cambios en los niveles de IFN-γ salvo a los 2 dpi.
A partir de los 10 dpi se observó un ligero incremento en la concentración de IFN-γ en los lechones inoculados o coinoculados con PRRSV.
Las concentraciones medias de esta citoquina fueron particularmente altas a los 10 dpi en los grupos PRRSV y IAV + PRRSV. A los 4 dpi, la concentración media de IFN-γ fue similar a la observada en los lechones control.
Se observó una concentración significativamente mayor de IL-1β en los lechones coinoculados (a los 4, 10 y 21 dpi), mientras que en los lechones inoculados únicamente con PRRSV solo se observó este incremento a los 10 dpi.
IL-6
La concentración media de IL-6 fue elevada en los lechones inoculados y coinoculados con IAV a los 2 dpi. En cambio, a los 10 dpi se encontraron concentraciones elevadas de IL-6 en los lechones inoculados y coinoculados con PRRSV. A los 4 y 21 dpi no se encontraron diferencias significativas en comparación con el grupo de control.
IL-10
A los 2 dpi, el nivel de IL-10 fue mayor en los animales inoculados o coinoculados con IAV. También se observaron diferencias significativas a los 4 dpi entre el grupo IAV y el grupo control. A los 10 dpi, el nivel de esta citoquina fue máximo en los lechones coinoculados (IAV + PRRSV), siendo significativamente mayor en todos los grupos inoculados en comparación con los lechones control. A los 21 dpi, las concentraciones medias de IL-10 fueron significativamente mayores en el grupo IAV + PRRSV en comparación con los lechones control.
Se observaron cambios significativos en los niveles de TNF-α a los 4 dpi en el grupo IAV, a los 10 dpi en los grupos PRRSV e IAV + PRRSV y a los 21 dpi en el grupo IAV + PRRSV.
En todos los animales inoculados se observó una concentración significativamente mayor de IL-8, en comparación con los controles a los 2 y 10 dpi, mientras que a los 21 dpi este aumento solo fue significativo en los animales inoculados/coinoculados con PRRSV. Además, a los 2, 4 y 10 dpi el nivel de IL-8 en los pulmones fue significativamente mayor en los grupos inoculado y coinoculado con PRRSV en comparación con el grupo inoculado solamente con IAV.
Al analizar la correlación entre la carga de patógenos en el pulmón y la concentración de citoquinas se observó una asociación significativa entre la concentración pulmonar media de TNF-α, IFN-γ e IL-8 y el título de SwH1N1 en el pulmón.
También se encontraron correlaciones significativas para el TNF-α y la IL-8 y el título pulmonar del PRRSV, para los grupos coinoculados (IAV + PRRSV) e inoculados con un patógeno (IAV o PRRSV).
En este artículo se han descrito los efectos de la inoculación única o mixta de lechones con IAV y PRRSV en la respuesta local de citoquinas a nivel pulmonar durante el curso de la infección con estos patógenos.
Datos publicados anteriormente revelan que los signos respiratorios asociados a la infección por IAV no son solo el resultado del daño tisular directo causado por la replicación del virus, sino que también están relacionados con la respuesta proinflamatoria de citoquinas locales14,26,27.
Por su parte, los signos respiratorios observados durante la infección por PRRSV también son el resultado de la patología en el pulmón y de la interacción con el sistema inmunitario del hospedador, incluida la secreción de citoquinas proinflamatorias21. Además, el PRRSV predispone a los cerdos a la coinfección con otros virus respiratorios debido a la destrucción de los tejidos o células pulmonares6,28
Las citoquinas desempeñan un papel importante en la inmunopatogenia de las infecciones respiratorias víricas porcinas14,18,21,23,25,29,30 de forma que, cuando el hospedador está infectado por varios virus, la secreción de citoquinas se regula al alza o a la baja26. De hecho, las concentraciones de citoquinas en el líquido de lavado broncoalveolar se han correlacionado con la replicación viral y los signos clínicos, así como con las lesiones pulmonares exacerbadas y la infiltración de neutrófilos18,26
Generalmente, la magnitud de las lesiones patológicas no se correlaciona positivamente con el número de partículas víricas en los tejidos infectados, sino que puede ser el resultado de una lesión asociada a la respuesta inmunitaria, incluida la secreción de citoquinas21,31
En este estudio, las concentraciones de las citoquinas evaluadas fueron elevadas en los pulmones de los lechones inoculados con IAV, PRRSV o con ambos en comparación con los controles. Las concentraciones más altas de citoquinas se observaron en varios momentos dependiendo del virus inoculado.
En estudios anteriores sobre la inmunopatogénesis de la infección por el IAV se ha observado una correlación positiva entre un nivel elevado de IL-1β y el reclutamiento de neutrófilos en los pulmones, lo que puede conducir a una inflamación más grave30,32. La elevada concentración de IL-8 también puede contribuir a que las lesiones sean más graves14
TNF-
Según Damjanovic et al.33, el TNF-α es necesario para regular el alcance de la afectación pulmonar durante la infección aguda por influenza.
En este sentido, la correlación entre los niveles de esta citoquina y la afectación pulmonar podría confirmar su implicación en el desarrollo de las lesiones pulmonares durante las infecciones víricas.
IL-6
Se encontraron concentraciones significativamente más altas de IL-6 en los pulmones de los lechones inoculados con IAV en las primeras etapas de la infección (a los 2 dpi). En cambio, en los lechones inoculados o coinoculados con PRRSV también se observó un nivel elevado de IL-6 a los 10 dpi.
Lauder et al.34 señalaron que la IL-6 tiene un papel crucial y la capacidad de limitar la inflamación, promover la inmunidad adaptativa protectora y prevenir la mortalidad.

UNA IMPORTANTE





Tratamiento y metafilaxis de infecciones respiratorias



10%



Tratamiento y metafilaxis de infecciones respiratorias y digestivas




El papel de la IL-10 durante la infección respiratoria, especialmente la influenza aguda, parece ser contradictorio.
Sun et al.35 descubrieron que la inhibición de la secreción de IL-10 en la infección por influenza provocaba un aumento de la inflamación y una disminución de la supervivencia, mientras que McKinstry et al.36 señalaron que la inhibición de la señalización de IL-10 antes de la infección mejoraba la eliminación del virus y aumentaba la supervivencia.
La fuerte correlación positiva entre el nivel de IL-10 en los pulmones y las lesiones observadas en el presente estudio parecen confirmar las observaciones de Sun et al.35
La concentración de IL-10 en los lechones inoculados y coinoculados con PRRSV fue significativamente elevada a los 10 y 21 dpi.
En concordancia con nuestro estudio, varios estudios anteriores habían demostrado que la infección por PRRSV, especialmente en la fase activa, resultaba en la producción sistémica y local de la citoquina inmunosupresora IL-1037,38
En general, el perfil de cambios en los niveles de citoquinas pulmonares en este estudio refleja la patogénesis de ambas infecciones. La presencia de lesiones pulmonares típicas de la infección por IAV se observó antes, principalmente hasta los 10 dpi, mientras que las lesiones típicas de la infección por PRRSV se encontraron más tarde, a partir de los 10 dpi.
En el grupo inoculado únicamente con IAV, los niveles más altos de citoquinas se observaron en las primeras fases de la infección (2-4 dpi) en correspondencia con las lesiones pulmonares patológicas más graves.
En el grupo inoculado únicamente con PRRSV, los cambios de citoquinas más pronunciados también se asociaron con el periodo en el que la gravedad de las lesiones pulmonares era mayor (de 10 a 21 dpi).
Cabe resaltar que no se observaron efectos sinérgicos entre IAV y PRRSV en cuanto a la respuesta local de citoquinas. Esto puede estar asociado a la diferente patogénesis de ambas infecciones, especialmente en el contexto del momento de aparición de las lesiones en los pulmones.
En el caso de la influenza porcina, las lesiones pulmonares aparecen y desaparecen antes, mientras que en el caso del PRRS la intensidad de las lesiones pulmonares es mayor durante el periodo en el que desaparecen las lesiones asociadas a la influenza.
En conclusión, los resultados actuales indican que la infección experimental de cerdos con IAV o PRRSV, solos o en coinfección, induce una respuesta inflamatoria pulmonar local. Sin embargo, se observaron diferentes cinéticas de la respuesta local de citoquinas en lechones inoculados con IAV o PRRSV.
Dado que se ha observado una fuerte correlación positiva entre la concentración local de TNF-α e IL10 y la alteración pulmonar, nuestra hipótesis es que estas citoquinas están implicadas en la inducción de lesiones durante la infección por PRRSV e IAV. Sin embargo, no se observó un aumento aparente de la respuesta de las citoquinas pulmonares en los lechones coinoculados simultáneamente con ambos patógenos en comparación con los grupos inoculados únicamente con uno de los dos. También puede explicar que no haya un efecto significativo de la coinfección sobre la afectación pulmonar y la carga de patógenos en comparación con las infecciones simples.
La fuerte correlación entre la concentración local de TNF-α, IFNγ, IL-8 y la carga de SwH1N1 en el pulmón, así como los títulos pulmonares de TNF-α, IL-8 y PRRSV, sugiere que la replicación local de ambos virus también influye en la respuesta local de citoquinas durante la infección.
Artículo traducido y adaptado de: TurlewiczPodbielska, H., Czyżewska-Dors, E. & PomorskaMól, M. Respiratory viral infections drive different lung cytokine profiles in pigs. BMC Vet Res 17, 5 (2021). https://doi.org/10.1186/s12917-02002722-8 (CC BY 4.0)
1. Jimenez LF, Ramirez Nieto G, Alfonso VV, Correa JJ. Association of swine influenza H1N1 pandemic virus (SIV-H1N1p) with porcine respiratory disease complex in sows from commercial pig farms in Colombia. Virol Sin. 2014;29: 242–9.
2. Levesque C, Provost C, Labrie J, Hernandez Reyes Y, Burciaga Nava JA, Gagnon CA, Jacques M. Actinobacillus pleuropneumoniae possesses an antiviral activity against porcine reproductive and respiratory syndrome virus. PLoS One. 2014;9:e98434. 3. Choi YK, Goyal SM, Joo HS. Retrospective analysis of etiologic agent associated with respiratory diseases in pigs. Can Vet J. 2003;44:735–7.
4. Fablet C, Marois-Crehan C, Simon G, Grasland B, Jestin A, Kobisch M, Madec F, Rose N. Infectious agents associated with respiratory diseases in 125 farrow-tofinish pig herds: a cross-sectional study. Vet Microbiol. 2012;57:152–63.
5. Opriessnig T, Gimenez-Lirola LG, Halbur PG. Polymicrobial respiratory disease in pigs. Anim Health Res Rev. 2011;12:133–48.
6. Rossow KD. Porcine reproductive and respiratory syndrome. Vet Pathol. 1998;35:1–20.
7. Huang C, Zhang Q, Feng WH. Regulation and evasion of antiviral immune responses by porcine reproductive and respiratory syndrome virus. Virus Res. 2015;202:101–11.
8. Loving CL, Brockmeier SL, Vincent AL, Palmer MV, Sacco RE, Nicholson TL. Influenza virus coinfection with Bordetella bronchiseptica enhances bacterial colonization and host responses exacerbating pulmonary lesions. Microb Pathog. 2010;49:237–45.
9. Cheung CY, Poon LL, Lau AS, Luk W, Lau YL, Shortridge KF, Gordon S, Guan Y, Peiris JS. Induction of proinflammatory cytokines in human macrophages by influenza A (H5N1) viruses: a mechanism for the unusual severity of human disease? Lancet. 2002;360:1831–7.
10. Liu Q, Zhou Y, Yang Z. The cytokine storm of severe influenza and development of immunomodulatory therapy. Cell Mol Immunol. 2016;13:3–10.
11. Van Reeth K. Cytokines in the pathogenesis of influenza. Vet Microbiol. 2000;74:109–16.
12. Barbé F, Atanasova K, Van Reeth K. Cytokines and acute phase proteins associated with acute swine influenza infection in pigs. Vet J. 2011;187:48–53.
13. Khatri M, Dwivedi V, Krakowka S, Manickam C, Ali A, Wang L. Swine influenza H1N1 virus induces acute inflammatory immune responses in pig lungs: a potential animal model for human H1N1 influenza virus. J Virol. 2010;84:11210–8.
14. Pomorska-Mól M, Markowska-Daniel I, Kwit K, Czyzewska E, Dors A, Rachubik J, Pejsak Z. Immune and inflammatory response in pigs during acute influenza caused by H1N1 swine influenza virus. Arch Virol. 2014;159:2605–14.
15. Jung K, Renukaradhya GJ, Alekseev KP, Fang Y, Tang Y, Saif LJ. Porcine reproductive and respiratory syndrome virus modifies innate immunity and alters disease outcome in pigs subsequently infected with porcine respiratory coronavirus: implications for respiratory viral co-infections. J Gen Virol. 2009;90:2713–23.
16. Pol JM, Van Leengoed LA, Stockhofe N, Kok G, Wensvoort G. Dual infections of PRRSV/influenza or PRRSV/Actinobacillus pleuropneumoniae in the respiratory tract. Vet Microbiol. 1997;55:259–64.
17. Van Reeth K, Nauwynck H, Pensaert M. Dual infections of feeder pigs with porcine reproductive and respiratory syndrome virus followed by porcine respiratory coronavirus or swine influenza virus: a clinical and virological study. Vet Microbiol. 1996;48:325–35.
18. Van Reeth K, Nauwynck H, Pensaert M. Clinical effects of experimental dual infections with porcine reproductive and respiratory syndrome virus followed by swine influenza virus in conventional and colostrum-deprived pig. J Vet Med B Infect Dis Vet Public Health. 2001;48:283–92.
19. Huang H, Potter AA, Campos M, Leighton FA, Willson PJ, Haines DM, Yates WDG. Pathogenesis of porcine Actinobacillus pleuropneumoniae. Part II. Roles of proinflammatory cytokines. Can J Vet Res. 1999;63:69–78.
20. Van Reeth K, Labarque G, Nauwynck H, Pensaert M. Differential production of proinflammatory cytokines in the pig lung during different respiratory virus infections: correlations with pathogenicity. Res Vet Sci. 1999;67:47–52.
21. Liu Y, Shi W, Zhou E, Wang S, Hu S, Cai X, Rong F, Wu J, Xu M, Li L. Dynamic changes in inflammatory cytokines in pigs infected with highly pathogenic porcine reproductive and respiratory syndrome virus. Clin Vaccine Immunol. 2010;17:1439–45.
22. Dobrescu I, Levast B, Lai K, Delgado-Ortega M, Walker S, Banman S, Townsend H, Simon G, Zhou Y, Gerdts V, Meurens F. In vitro and ex vivo analyses of co-infections with swine influenza and porcine reproductive and respiratory syndrome viruses. Vet Microbiol. 2014;169:18–32.
23. Czyżewska-Dors E, Pomorska-Mól M, Dors A, Pluta A, Podgórska K, Kwit K, Stasiak E, Łukomska A. Proinflammatory cytokine changes in bronchoalveolar lavage fluid cells isolated from pigs infected solely with porcine reproductive and respiratory syndrome virus or co infected with swine influenza virus. J Vet Res. 2019;63:489–95.
24. Pomorska-Mól M, Podgórska K, Czyżewska‐Dors E, Turlewicz‐Podbielska H, Gogulski M, Włodarek J, Łukomska A. Kinetics of single and dual simultaneous infection of pigs with swine influenza A virus and porcine reproductive and respiratory syndrome virus. J Vet Intern Med. 2020;34:1903–913.
25. Pomorska-Mól M, Dors A, Kwit K, Kowalczyk A, Stasiak E, Pejsak Z. Kinetics of single and dual infection of pigs with swine influenza virus and Actinobacillus pleuropneumoniae. Vet Microbiol. 2017;201:113–20.
26. Van Reeth K, Van Gucht S, Pensaert M. In vivo studies on cytokine involvement during acute viral respiratory diseases of swine: troublesome but rewarding. Vet Immunol Immunopathol. 2002;87:161–8.
27. Barbé F, Saelens X, Braeckmans D, Lefèvre F, Reeth KV. Role of IFN-alpha during the acute stage of a swine influenza virus infection. Res Vet Sci. 2010;88:172–8.
28. Mateu E, Diaz I. The challenge of PRRS immunology. Vet J. 2008;177:345–51.
29. Chen ZW, Chien MS, Chang NY, Chen TH, Wu CM, Huang C, Lee WC, Hsuan SL. Mechanisms underlying Actinobacillus pleuropneumoniae exotoxin ApxI induced expression of IL-1β, IL-8 and TNF-α in porcine alveolar macrophages. Vet Res. 2011;42:25.
30. Van Reeth K, Nauwynck H, Pensaert M. Bronchoalveolar interferon-α, tumor necrosis factor-α interleukin-1, and inflammation during acute influenza in pigs: a possible model for humans? J Infect Dis. 1998;177:1076–9.
31. Lager KM, Mengeling WL. PRRS: nature of the RNA virus and how it causes disease. Proceedings of the International Pig Veterinary Society. IPVS Melbourne, Australia, 2000;538–543.
32. Gauger PC, Vincent AL, Loving CL, Henningson JN, Lager KM, Janke BH, Kehrli ME Jr, Roth JA. Kinetics of lung lesion development and proinflammatory cytokine response in pigs with vaccine-associated enhanced respiratory disease induced by challenge with pandemic (2009) A/H1N1 influenza virus. Vet Pathol. 2012;49:900–12.
33. Damjanovic D, Divangahi M, Kugathasan K, Small CL, Zganiacz A, Brown EG, Hogaboam CM, Gaulide J, Zhou X. Negative regulation of lung inflammation and immunopathology by TNF-α during acute influenza infection. Am J Pathol. 2011;179:2963–76.
34. Lauder SN, Jones E, Smart K, Bloom A, Williams AS, Hindle JP, Ondondo B, Taylor PR, Clement M, Fielding C, Godkin AJ, Jones SA, Gallimore AM. Interleukin-6 limits influenza-induced inflammation and protects against fatal lung pathology. Eur J Immunol. 2013;43:2613–25.
35. Sun J, Madan R, Karp CL, Braciale JT. Effector T cells control lung inflammation during acute influenza virus infection by producing IL-10. Nat Med. 2009;15:277–84.
36. McKinstry KK, Strutt TM, Buck A, Curtis JD, Dibble JP, Huston G, Tighe M, Hamada H, Sell S, Dutton RW, Swain SL. IL-10 deficiency unleashes an influenza-specific Th17 response and enhances survival against high-dose challenge. J Immunol. 2009;182:7353–63.
37. Suradhat S, Thanawongnuwech R. Upregulation of interleukin-10 gene expression in the leukocytes of pigs infected with porcine eproductive and respiratory syndrome virus. J Gen Virol. 2003;84:2755–60.
38. Suradhat S, Thanawongnuwech R, Poovorawan Y. Upregulation of IL-10 gene expression in porcine peripheral blood mononuclear cells by porcine reproductive and respiratory syndrome virus. J Gen Virol. 2003;84:453–9.
39. Halbur PG, Paul PS, Frey ML, Landgraf J, Eernisse K, Meng XJ, Lum MA, Andrews JJ, Rathje JA. Comparison of the pathogenicity of two US porcine reproductive and respiratory syndrome virus isolates with that of the Lelystad Virus. Vet Pathol. 1995;32:648–60.
LLa peste porcina africana (PPA) es una enfermedad infecciosa altamente letal que afecta a los cerdos domésticos y a los jabalíes, estando su control dificultado por la falta de un tratamiento o vacuna eficaz. Teniendo en cuenta el importante papel del jabalí en la propagación del virus, la vacunación oral de estos animales sería una esperanza para hacer frente a este problema.
José A. Barasona1,2, Estefanía CadenasFernández1,2, Aleksandra Kosowska1,2, Sandra Barroso-Arévalo1,2, Belén Rivera1,2, Rocío Sánchez1,2, Néstor Porras1,2, Carmina G. Frontaura3, José M. SánchezVizcaíno1,2
1 Departamento de Sanidad Animal, Universidad Complutense de Madrid
2VISAVET (Centro de Vigilancia
Sanitaria Veterinaria - UCM)
3Centro de Investigacion en Sanidad
Animal, Instituto Nacional de Investigacion y Tecnologia Agricola y Alimentaria
El presente estudio tuvo como objetivo evaluar la seguridad de un candidato vacunal (Lv17/WB/RIE1), con eficacia evaluada previamente, en términos de sobredosis (dosis alta) y dosis repetidas (revacunación) en jabalíes. Teniendo en cuenta los resultados y la situación epidemiológica actual de la PPA en los jabalíes, este prototipo de vacuna es una herramienta prometedora para el control de la enfermedad en estas poblaciones silvestres, aunque se necesitan más estudios.

La peste porcina africana (PPA) es una de las enfermedades infecciosas más relevantes que afectan a los suidos, tanto en cerdos domésticos como en jabalíes euroasiáticos (Sus scrofa).

La enfermedad está causada por un virus de ADN grande y complejo perteneciente a la familia Asfarviridae que evolucionó en el sureste de África en un ciclo selvático entre facóqueros comunes (Phacochoerus africanus) y garrapatas de la familia Argasidae1 .


El control de la PPA se ve dificultado por la falta de un tratamiento o vacuna eficaz, por lo que las medidas de control se basan en la aplicación de estrictas medidas sanitarias que implican la despoblación de las explotaciones afectadas y medidas preventivas4.
Los países afectados por la PPA luchan por controlar y minimizar las pérdidas, mientras que los países que aún están libres se enfrentan a un mayor riesgo de introducción del patógeno. Estas medidas tienen un gran impacto sanitario y económico, por lo que la PPA es una enfermedad de declaración obligatoria para la Organización Mundial de Sanidad Animal (OMSA).
En brotes recientes, tanto los cerdos domésticos como los jabalíes han desarrollado la forma aguda de la enfermedad caracterizada por fiebre alta y muerte súbita4,6.
En Asia, la enfermedad se ha notificado principalmente en cerdos domésticos, con notificaciones esporádicas en jabalíes3,7. Sin embargo, la situación en Europa es la opuesta: el jabalí es el principal hospedador afectado en la mayoría de los países europeos, excepto en Rusia, Ucrania, Rumanía y Serbia2
El VPPA mantiene un ciclo estable en el jabalí debido a su alta densidad poblacional en Europa y a su comportamiento carroñero7, ya que el virus se transmite principalmente por contacto con la sangre. El jabalí se considera, por tanto, un reservorio silvestre muy relevante para la PPA en Europa y es responsable de brotes esporádicos en cerdos domésticos8,9
Esto complica aún más el control de la enfermedad y las estrictas medidas sanitarias empleadas tradicionalmente para controlar la PPA no son suficientes cuando la enfermedad está extendida en estas poblaciones silvestres9
En 2019, se publicaron por primera vez los detalles de un ensayo de vacunación oral realizado con jabalíes frente un aislado de PPA que circula actualmente en Europa10. Los resultados obtenidos fueron muy prometedores en términos de eficacia, ya que lograron un 92% de protección. Sin embargo, este candidato vacunal se basa en un virus naturalmente atenuado, lo que plantea ciertas preocupaciones de seguridad11 Esto significa que, aunque se observó una atenuación prácticamente completa en el estudio anterior, se requieren más estudios con los que evaluar su seguridad.
En este estudio, teniendo en cuenta que debe ser posible administrar este candidato vacunal por vía oral en poblaciones silvestres en las que es más difícil controlar la dosis exacta, se evaluó la seguridad en términos de sobredosis (dosis alta) y dosis repetidas (revacunación) en jabalíes.
MATERIALES Y MÉTODOS
AISLADOS DE VPPA ANIMALES AISLADOS DE VPPA ANIMALES
CANDIDATO VACUNAL
El candidato vacunal, una cepa natural atenuada del genotipo II Lv17/WB/Rie1 del VPPA, se cultivó en monocitos de sangre porcina (PBM) durante 7 días.
Posteriormente, se recogió el medio de cultivo que contenía el virus extracelular y se centrifugó a baja velocidad para eliminar los restos celulares y luego a alta velocidad para sedimentar el virus12.
El título viral se definió como la cantidad de virus que causaba efectos citopáticos en el 50% de los cultivos infectados (TCID50/mL)19.
El estudio se realizó en las instalaciones de bioseguridad de nivel 3 del Centro de Vigilancia Sanitaria VISAVET con 15 rayones de 3-4 meses de vida procedentes de una explotación comercial de jabalíes de Andalucía.
Estos animales no habían sido vacunados frente a ninguna enfermedad infecciosa antes del estudio y fueron ELISA negativos frente a Virus de Aujeszky, Mycobacterium bovis, virus de la peste porcina clásica (VPPC), VPPA, virus de la enfermedad vesicular porcina (VEVP), Mycoplasma hyopneumoniae, virus del síndrome reproductivo y respiratorio porcino (VPRRS) y circovirus porcino tipo 2 (PCV2).
A su llegada, todos los animales fueron identificados individualmente y colocados aleatoriamente en los grupos de estudio. Durante la fase de aclimatación (2 semanas), los rayones recibieron un tratamiento metafiláctico con oxitetraciclina dihidratada e ivermectina para eliminar los parásitos y controlar cualquier infección bacteriana subyacente.
Los procedimientos de manejo y toma de muestras se llevaron a cabo de acuerdo con la normativa regional, nacional y europea, y el protocolo experimental in vivo fue aprobado previamente por los Comités de Ética de la Universidad Complutense de Madrid y de la Comunidad de Madrid (referencia PROEX 159/19).
Se utilizó como virus de desafío el aislado del genotipo II del VPPA Arm07, altamente virulento y con capacidad de hemadsorción.
El virus se propagó en PBM como se ha descrito anteriormente12.
El título viral se definió como la cantidad de virus que causaba hemadsorción en el 50% de los cultivos infectados (HAD50/mL).
El protocolo incluía una descripción detallada de los esfuerzos para prevenir y evitar el sufrimiento innecesario de los animales, incluyendo criterios de valoración humanitaria y directrices relativas a la eutanasia.
Todos los procedimientos fueron diseñados y llevados a cabo por personal y veterinarios especialmente formados (categorías B, C y D de experimentación animal) siguiendo la Directiva 86/609/CEE de la CE.

A lo largo del estudio, se evaluó la inocuidad y eficacia del candidato vacunal Lv17/WB/Rie1 a diferentes dosis y durante la revacunación mediante administración oral, 103 y 104 TCID50 (Figura 1):
Grupo dosis baja: siete rayones fueron vacunados por vía oral con 1 ml de 103 TCID50 de VPPA Lv17/WB/Rie1.
Grupo dosis alta: seis rayones fueron vacunados por vía oral con 1 ml de 104 TCID50 de VPPA Lv17/WB/Rie1 (10x).
Grupo Control: los dos rayones restantes se mantuvieron naïve hasta el desafío.
La revacunación se realizó por vía oral a los 18 dpv con la dosis de administración correspondiente, 103 TCID50 para el grupo de dosis baja y 104 TCID50 para el grupo de dosis alta.
42 días después de la primovacunación (42 dpv), todos los animales fueron desafiados mediante la administración intramuscular de 1 ml de 10 TCID50 del VPPA Arm07.
Los animales se mantuvieron durante 32 días después del desafío (dpc) o hasta que sucumbieron a la enfermedad y, en consecuencia, se establecieron los puntos finales humanitarios.

Durante el periodo de vacunación, que puede entenderse como el periodo entre la primovacunación y el desafío (42 dpv), se tomaron muestras de sangre y suero una vez a la semana, los días 0, 7, 11, 18, 25, 32 y 39 dpv para la detección del genoma del VPPA y sus anticuerpos.
Durante el periodo de desafío, entre 0 dpc/42 dpv hasta el final del experimento (32 dpc/74 dpv), se mantuvo la frecuencia de muestreo en 0, 4, 7, 11, 18, 25 y 32 dpc o el último día de vida de cada animal.
Diseño experimental del estudio, desde la vacunación inicial (0 días postvacunación, dpv) hasta el final del experimento (32 días postdesafío, dpc; y 74 dpv).
FIGURA 1Se llevó a cabo una evaluación clínica diaria de los animales con el fin de detectar cualquier signo clínico durante los períodos de vacunación y desafío y poder evaluar la atenuación y eficacia del candidato vacunal.
Los animales fueron observados cada día del experimento mediante una cámara de vídeo de 24 horas y visitas in situ de veterinarios especialistas en fauna silvestre para registrar sus signos clínicos diarios.
Los signos clínicos se expresaron en términos de una puntuación cuantitativa (CS, clinical score) siguiendo las directrices específicas para la evaluación de la enfermedad clínica de la PPA en jabalíes descritas previamente por Cadenas-Fernández et al. (2020)13. Este sistema de puntuación incluye:
Temperatura rectal Comportamiento Condición corporal Alteraciones cutáneas
Secreción ocular/nasal
Inflamación articular
Signos respiratorios
Signos digestivos
Signos neurológicos
El único parámetro clínico que no se registró diariamente fue la temperatura rectal para reducir al máximo el manejo de los animales, midiéndola solamente 2 veces a la semana y en animales con algún signo grave, definiéndose como fiebre una temperatura rectal superior a 40,0˚C.

La presencia de anticuerpos frente al VPPA se determinó mediante un test ELISA comercial y una prueba de inmunoperoxidasa indirecta (IPT), tal y como realiza el Laboratorio de Referencia de la Unión Europea14
El genoma viral de la PPA obtenido de la sangre (viremia) se amplificó empleando el protocolo de PCR a tiempo real de la Universal Probe Library (UPL), utilizando el ADN extraído sin diluir para cada muestra15
Los resultados se expresaron en valores Cq (equivalente al ciclo umbral, Ct), considerándolos positivos cuando Cq < 40,0.
Se aisló el VPPA de desafío mediante células PBM, como se describe en el Manual de Pruebas de Diagnóstico y Vacunas para Animales Terrestres16.
Las placas se examinaron para la determinación del nivel de hemadsorción durante seis días, realizando pases ciegos tres veces en las células PBM.
Signos clínicos
Tras la primovacunación, dos de los siete rayones vacunados con dosis baja (28,8%) presentaron una ligera fiebre (40,45 ± 0,35˚C) y un ligero letargo a partir de los 11 y 18 días postvacunación (dpv), respectivamente (esto se observó solo en un día de muestreo).
Tras la revacunación, estos dos rayones, y otros tres del mismo grupo, presentaron una ligera fiebre (40,50 ± 0,29˚C) a los 12 días post revacunación (25 - 39 dpv). Dos de estos animales tuvieron fiebre leve en dos días de muestreo consecutivos, durante los cuales también se observó un ligero letargo además de la fiebre.
Todos los rayones vacunados del grupo de dosis baja se recuperaron y sobrevivieron al periodo de vacunación antes del desafío.
En estos animales, la puntuación clínica (CS) más alta registrada fue de 5,5 a los 25 dpv (7 días después de la revacunación), siendo el promedio de la CS durante este periodo de 0,7 ± 1,4 (Gráfica 1)
Tras la primovacunación, solo tres de los seis animales (50%) desarrollaron una ligera fiebre (40,15 ± 0,10˚C) a partir de los 11 dpv, lo que se observó en dos días de muestreo consecutivos.
Tras la revacunación, uno de estos animales, junto a otro más, presentó una ligera fiebre (40,10 ± 0,14˚C) a los 10 días de la revacunación (25 - 32 dpv), y uno de ellos también presentó un ligero letargo.
Uno de los rayones de este grupo presentó una fiebre elevada (41,5˚C) a los 14 días de la revacunación (32 dpv). Este fue el único animal vacunado que sucumbió durante el periodo de vacunación, ya que desarrolló un curso clínico que comenzó tras una pelea muy agresiva. A pesar de recibir tratamiento, comenzó a mostrar signos de fiebre seguidos de letargo y finalmente anorexia, hasta su eutanasia a los 21 días post revacunación (39 dpv). El análisis de sus muestras reveló la presencia del ADN del VPPA en sangre junto con una septicemia debida al Streptococcus suis y la detección del ADN bacteriano en el cerebro.

Los demás animales del grupo de dosis alta se recuperaron y sobrevivieron al periodo de vacunación.
En estos animales, la puntuación CS más alta registrada, aparte del del animal que no sobrevivió, fue de 2 a los 7dpv, con un promedio durante este de 0,5 ± 1,2 (Gráfica 1)
No se observaron diferencias estadísticamente significativas entre los grupos de dosis baja y dosis alta durante el periodo de vacunación en cuanto a las variaciones de temperatura y CS.
GRÁFICA 1
Promedios de la puntuación clínica (CS), temperatura rectal y viremia expresados en valores de ciclos cuantificación (Cq) de la PCR en tiempo real realizados para jabalíes vacunados por vía oral con con 103 TCID50 (grupo de dosis baja; verde claro) y 104 TCID50 (grupo de dosis alta; verde oscuro) de VPPA Lv17/WB/Rie1 en los días de muestreo posteriores a la vacunación (dpv). Los resultados obtenidos para el animal no superviviente del grupo de dosis alta durante el periodo de vacunación se presentan por separado (gris oscuro).
En general, se observaron dos picos transitorios de detección del genoma viral del VPPA en sangre en los animales vacunados.

El primer pico se observó tras la primovacunación en 5 de los 13 animales (38,5%), mientras que el segundo se observó tras la revacunación en 11 animales, es decir, en el 84,6% de ellos (Gráfica 1).
Viremia Respuesta de anticuerpos
Tras la primovacunación, se detectó el genoma viral del VPPA de forma transitoria en la sangre de tres rayones del grupo de dosis baja a partir de los 7 dpv con un valor Cq medio de 27,1 ± 4,0. Solo uno de estos animales tuvo fiebre antes de la revacunación.
Tras la primovacunación, dos rayones del grupo de dosis alta empezaron a mostrar una viremia positiva a partir de los 7 dpv, con valores medios de Cq de 32,1 ± 4,5, presentando uno de estos animales fiebre antes de la revacunación.
Tras la revacunación, el genoma viral del VPPA se detectó de forma transitoria en la sangre de los animales mencionados (tras la primovacunación), así como en la de los demás animales del grupo de dosis baja y en la de otros dos rayones del grupo de dosis alta a partir de los 7 a los 21 días post revacunación (25 - 39 dpv; valores medios de Cq de 32,9 ± 3,7 y 34,4 ± 4,7, respectivamente).
No hubo diferencias estadísticamente significativas en cuanto a la viremia entre los grupos de dosis baja y alta durante todo el periodo de vacunación.
Antes del desafío, todos los animales del grupo de dosis baja presentaron una respuesta de anticuerpos positiva al VPPA, tanto en la prueba ELISA como en la prueba de inmunoperoxidasa indirecta (IPT), con la excepción de uno que dio positivo a los anticuerpos solo en la IPT (Gráfica 2)
Los mismos tres animales del grupo de dosis baja que presentaban viremia antes de la revacunación fueron positivos a los anticuerpos frente al VPPA antes de la revacunación, a partir de los 11 dpv, y los cuatro animales restantes empezaron a mostrar una respuesta de anticuerpos entre los 7 y los 21 días post revacunación (25 - 39 dpv).
En cuanto al grupo de dosis alta, cuatro de los seis animales (66,6%) presentaron una respuesta positiva de anticuerpos frente al VPPA en las pruebas ELISA e IPT.
Lo mismo ocurrió con los dos animales del grupo de dosis alta que tenían viremia antes de la revacunación y desarrollaron anticuerpos frente al VPPA antes de la revacunación (a partir de los 11 dpv), mientras que los dos animales restantes fueron seropositivos entre los 14 y los 21 días post revacunación (32 - 39 dpv).
Los animales seropositivos mantuvieron un alto título de anticuerpos durante todo el experimento (Gráfica 2)
Porcentaje de rayones con respuesta positiva de anticuerpos (ELISA) y títulos de anticuerpos (prueba de inmunoperoxidasa indirecta; IPT) tras la vacunación oral con 103 TCID50 (grupo de dosis baja; líneas no discontinuas) y 104 TCID50 de VPPA Lv17/WB/ Rie1 (grupo de dosis alta; líneas discontinuas) tras la vacunación (dpv) y el desafío (dpc).
Todos los animales del grupo de dosis baja resultaron estar totalmente protegidos y sobrevivieron al desafío con Arm07 10 HAD50 a las 32 dpc (100% de eficacia protectora) En cambio, los dos animales vacunados con dosis altas que no tuvieron una respuesta positiva de anticuerpos durante el periodo de vacunación no sobrevivieron tras el desafío (desprotegidos; eficacia protectora del 60% en este grupo), y presentaron los mismos signos compatibles con la PPA que los observados en el grupo de control.
No se observaron signos clínicos en el grupo de dosis bajas tras el desafío IM, salvo un aumento muy ligero de la temperatura corporal en un animal (40,2˚C) a los 11 dpc (Gráfica 3).
En cuanto a la detección del genoma viral del VPPA en sangre, cinco animales de este grupo presentaron una viremia transitoria tras el desafío, a partir de los 4 dpc (46 dpv), con un valor Cq medio de 36,4 ± 2,0 (Gráfica 3), mientras que solo un animal mantuvo una viremia constante desde los 4 dpc hasta el final del experimento, con un valor Cq medio de 25,5 ± 0,8.
Promedios de la puntuación clínica (CS), temperatura rectal y viremia expresada en valores Cq de la PCR en tiempo real en rayones vacunados por vía oral con 103 TCID50 (grupo de dosis baja; verde claro) y 104 TCID50 de VPPA Lv17/WB/Rie1 (grupo de dosis alta; verde oscuro) y dos rayones naïve (control; rojo) tras el desafío IM con 10 HAD50 de Arm07 a los 42 días postvacunación (dpv). Los resultados obtenidos para los dos animales no supervivientes del grupo de dosis altas tras la provocación se presentan por separado (gris claro).
Los animales control desafiados y no vacunados mostraron lesiones patológicas consistentes con la PPA, confirmadas por qPCR, aislamiento del virus y hemadsorción.

Los principales hallazgos de la necropsia fueron congestión y hemorragias focales en la superficie pulmonar, el bazo (esplenomegalia), los ganglios linfáticos (linfadenomegalia), los riñones, el hígado (hepatomegalia) y la mucosa intestinal.
Además, se observó con frecuencia una acumulación de líquido amarillento-rojizo en la cavidad abdominal (ascitis), el tórax (hidrotórax) y el saco pericárdico (hidropericardio). Todos los tejidos (100%) de estos animales fueron positivos al genoma viral del VPPA (20 tejidos diferentes).
Los animales vacunados supervivientes de los grupos de dosis baja y alta que sobrevivieron al desafío no mostraron lesiones compatibles con la PPA a los 32 días de vida.
En promedio, solo 7 ± 3 tejidos (35%) de los jabalíes de estos grupos fueron positivos al genoma viral de la PPA, solamente pudiéndose aislar el virus en un ganglio linfático retrofaríngeo de los 20 tejidos analizados de estos animales. Este virus aislado no era hemadsorbente.
El valor Cq medio de los tejidos de los animales supervivientes del grupo de dosis baja fue de 37,1 ± 0,5, muy similar al valor Cq medio de los tejidos de los animales supervivientes del grupo de dosis alta, 36,3 ± 2,0.
Los niveles del genoma viral de la PPA de estos grupos fueron significativamente menores (Cq = 38,8 ± 1,9) que en los controles desafiados y en los animales no protegidos del grupo de sobredosis.
La capacidad de replicación viral de las vacunas atenuadas las convierte en una gran herramienta para el control eficaz de diversas enfermedades17 Comúnmente, se han descrito como insuficientemente seguras frente a la PPA debido a las formas clínicas crónicas, los efectos secundarios y la inmunidad no estéril21, pero este ensayo clínico proporciona resultados prometedores en términos de inocuidad y seguridad en jabalíes vacunados por vía oral.
La razón para evaluar esta vacuna en condiciones de revacunación y con una dosis elevada residía en simular la administración de cebos vacunales orales y su consumo por parte de los jabalíes en el campo.
En este caso, leves diferencias en términos de seguridad según la dosis utilizada para la vacunación.
Dos de los siete rayones que recibieron una dosis baja y dos de los cinco que recibieron una dosis alta no mostraron signos clínicos tras la primo- y revacunación. Los animales restantes solo presentaron una ligera fiebre transitoria, junto con un ligero letargo, similar a las observaciones realizadas anteriormente tras una vacunación oral10. Asimismo, se están evaluando actualmente otros candidatos vacunales con deleción genética artificial con la finalidad de incrementar aún más la seguridad del protocolo vacunal.
En lo que respecta a la eficacia, todos los animales con una respuesta de anticuerpos positiva antes del desafío (el 100% del grupo de dosis baja y el 60% del grupo de dosis alta) estaban totalmente protegidos.
En general, los resultados determinaron que la vacuna candidata protegió al 83,3% de los jabalíes frente a Arm07. Este resultado no solo demuestra la supervivencia de los animales frente al desafío, sino también la ausencia de signos clínicos.

Dado que la eficacia vacunal no parece verse afectada por la dosis, sugerimos llevar a cabo estudios con dosis aún más bajas.
Igualmente, sería recomendable evaluar dosis aún más altas para comprobar la relación entre la seguridad de la vacuna y la dosis por dos razones:
Se trata de una vacuna viva atenuada.
El jabalí debe ser vacunado por vía oral a partir de cebos. En estas condiciones, el control de la dosis por individuo en el campo es complejo, por lo que hay que tener en cuenta el riesgo de que los animales tomen dosis mucho más altas.

Por otro lado, es probable que no podamos definir una dosis muy baja por el mismo hecho de que la vacunación se realiza a partir de cebos lanzados en el campo, que pueden permanecer durante horas o incluso días, lo que puede afectar a la viabilidad de la vacuna y a su eficacia.
La viremia y, por tanto, la replicación viral, parecen ser esenciales para el desarrollo de una respuesta inmunitaria protectora contra la infección por el VPPA19,20, ya que se observó una correlación directa entre la viremia y la aparición de respuestas de anticuerpos.
Aunque se desconocen y existen contradicciones en cuanto a los mecanismos inmunitarios específicos que intervienen en la respuesta protectora frente a la infección por el VPPA18, la aparición de anticuerpos ha sido, en el presente estudio, indicativa de una protección eficaz frente al desafío.
Los resultados de este estudio también ponen de manifiesto la importancia potencial de la inmunidad asociada a las mucosas, siendo necesario realizar más estudios que evalúen el desafío de contacto/natural, ya que la inmunización se realiza por vía oral.
Esto nos permitiría comprender y evaluar el efecto de las barreras mucosas, previamente activadas por la inmunización oral, frente a la infección por el VPPA.
A pesar de que aún existen dudas sobre la seguridad de este candidato vacunal, hay muchas razones de peso para seguir estudiándolo y buscar formas de hacerlo más seguro, siendo el único que ha tenido resultados altamente efectivos en jabalíes por administración oral10 hasta la fecha. Disponer de una herramienta como esta vacuna candidata para el control de la PPA en jabalíes ayudaría enormemente a controlar la propagación de la enfermedad en estas poblaciones.
Artículo traducido y adaptado de: Barasona JA, Cadenas-Fernández E, Kosowska A, Barroso-Arévalo S, Rivera B, Sánchez R, Porras N, Gallardo C, Sánchez-Vizcaíno JM. Safety of African Swine Fever Vaccine Candidate Lv17/WB/Rie1 in Wild Boar: Overdose and Repeated Doses. Front Immunol. 2021 Nov 30;12:761753. doi: 10.3389/fimmu.2021.761753. PMID: 34917082; PMCID: PMC8669561. (CC BY).
1. Gallardo MC, de la Torre A, Fernández-Pinero J, Iglesias I, Muñoz MJ, Arias ML. African Swine Fever: A Global View of the Current Challenge. Porc Heal Manag (2015) 1:21. doi: 10.1186/s40813-015-0013-y - DOI - PMC - PubMed
2. OIE WAHIS . World Animal Health Information System (2021). Available at: http://www.oie.int/wahis_2/public/ wahid.php/Diseaseinformation/reportarc....
3. Zhou X, Li N, Luo Y, Liu Y, Miao F, Chen T, et al. Emergence of African Swine Fever in China, 2018. Transbound Emerg Dis (2018) 66:1482–4. doi: 10.1111/tbed.12989DOI - PubMed
4. Arias M, Jurado C, Gallardo C, Fernández-Pinero J, Sánchez-Vizcaíno JM. Gaps in African Swine Fever: Analysis and Priorities. Transbound Emerg Dis (2018) 65:235–47. doi: 10.1111/tbed.12695 - DOI - PubMed
5. Li L, Wang Q, Ge S, Liu Y, Liu C, Liu F, et al. Infection of African Swine Fever in Wild Boar, China, 2018. Transbound Emerg Dis (2019) 66:1395–8. doi: 10.1111/ tbed.13114 - DOI - PubMed
6. Cukor J, Linda R, Václavek P, Mahlerová K, Šatrán P, Havránek F. Confirmed Cannibalism in Wild Boar and Its Possible Role in African Swine Fever Transmission. Transbound Emerg Dis (2019) 67:1068–73. doi: 10.1111/ tbed.13468 - DOI - PubMed
7. Nurmoja I, Mõtus K, Kristian M, Niine T, Schulz K, Depner K, et al. Epidemiological Analysis of the 2015–2017 African Swine Fever Outbreaks in Estonia. Prev Vet Med (2018) 181:104556. doi: 10.1016/J.PREVETMED.2018.10.001 - DOI - PubMed
8. Barasona JA, Gallardo C, Cadenas-Fernández E, Jurado C, Rivera B, Rodríguez-Bertos A, et al. First Oral Vaccination of Eurasian Wild Boar Against African Swine Fever Virus Genotype II. Front Vet Sci (2019) 6:137. doi:

10.3389/fvets.2019.00137 - DOI - PMC - PubMed
9. Arias M, de la Torre A, Dixon L, Gallardo C, Jori F, Laddomada A, et al. Approaches and Perspectives for Development of African Swine Fever Virus Vaccines. Vaccines (2017) 5:35. doi: 10.3390/vaccines5040035DOI - PMC - PubMed
10. World Organisation for Animal Health (OIE) – Chapter 1.1.8 . Principles of Veterinary Vaccine Production. In Manual of Diagnostic Tests and Vaccines for Terrestrial Animals, 8th Ed. OIE, Paris, France (2019). Available at: https://www.oie.int/en/what-we-do/standards/codes-and-manuals/terrestria....
11. Gallardo C, Soler A, Rodze I, Nieto R, Cano-Gómez C, Fernandez-Pinero J, et al. . Attenuated and Non-Haemadsorbing (Non-HAD) Genotype II African Swine Fever Virus (ASFV) Isolated in Europe, Latvia 2017. Transbound Emerg Dis (2019) 66:1399–404. doi: 10.1111/tbed.13132 - DOI - PubMed
12. Cadenas-Fernández E, Sánchez-Vizcaíno JM, Kosowska A, Rivera B, Mayoral-Alegre F, Rodríguez-Bertos A, et al. Adenovirus-Vectored African Swine Fever Virus Antigens Cocktail Is Not Protective Against Virulent Arm07 Isolate in Eurasian Wild Boar. Pathogens (2020) 9:1–14. doi: 10.3390/pathogens9030171 - DOI - PMC - PubMed
13. Fernández-Pinero J, Gallardo C, Elizalde M, Robles A, Gómez C, Bishop R, et al. . Molecular Diagnosis of African Swine Fever by a New Real‐Time PCR Using Universal Probe Library. Transbound Emerg Dis (2013) 60:48–58. doi: 10.1111/j.1865-1682.2012.01317.x - DOI - PubMed
14. OIE - World Organization For Animal Health . Manual of Diagnostic Tests and Vaccines for Terrestrial Animals. 8th Ed. OIE, Paris, France (2019). Available at: https://www.oie.int/en/what-we-do/standards/codes-and-manuals/terrestria....
15. Team Core R Development . R: A Language and Environment for Statistical Computing. In: R Founda-
tion for Statistical Computing. Vienna, Austria: (2013). Available at: http://www.r-project.org.
16. Bull JJ. Evolutionary Reversion of Live Viral Vaccines: Can Genetic Engineering Subdue It? Virus Evol (2015) 1:vev005. doi: 10.1093/ve/vev005 - DOI - PMC - PubMed
17. Rossi S, Staubach C, Blome S, Guberti V, Thulke H-H, Vos A, et al. . Controlling of CSFV in European Wild Boar Using Oral Vaccination: A Review. Front Microbiol (2015) 6:1141. doi: 10.3389/fmicb.2015.01141 - DOI - PMCPubMed
18. Tizard I. Veterinary Immunology (2017). Elsevier Saunders. Available at: https://www.elsevier.com/books/ veterinary-immunology/tizard/978-0-323-52... (Accessed July 27, 2020).
19. Sánchez-Cordón PJ, Chapman D, Jabbar T, Reis AL, Goatley L, Netherton CL, et al. . Different Routes and Doses Influence Protection in Pigs Immunised With the Naturally Attenuated African Swine Fever Virus Isolate OURT88/3. Antiviral Res (2017) 138:1–8. doi: 10.1016/j. antiviral.2016.11.021 - DOI - PMC - PubMed
20. Mulumba-Mfumu LK, Goatley LC, Saegerman C, Takamatsu HH, Dixon LK. Immunization of African Indigenous Pigs With Attenuated Genotype I African Swine Fever Virus OURT88/3 Induces Protection Against Challenge With Virulent Strains of Genotype I. Transbound Emerg Dis (2016) 63:e323–7. doi: 10.1111/tbed.12303
- DOI - PubMed
21. Rock DL. Challenges for African swine fever vaccine development—“… perhaps the end of 510 the beginning.” Vet Microbiol (2017) 206:52–58. doi:10.1016/j. vetmic.2016.10.003
l manejo reproductivo de las cerdas nulíparas y multíparas es clave para el éxito de las granjas porcinas, siendo frecuente emplear estrategias de sincronización del estro con altrenogest, así como la administración de gonadotropinas para reducir los días no productivos y la inducción del parto con cloprostenol.
La sincronización de la actividad ovárica de grupos de hembras es una práctica frecuente en todo el mundo para generar lotes de animales e incorporar a las nulíparas en el lote de cría.
Servicio Técnico MSD Animal Health

Compendium de reproducción porcina. 11ª Edición
Mientras que para la sincronización en vacas se utilizan Prostaglandinas (Pg), GnRH y progesterona, existen menos opciones en el caso del porcino. De hecho, las Pg no se pueden emplear para sincronizar en porcino, ya que el cuerpo lúteo solo es sensible a sus efectos luteolíticos cuando tiene 12 días (Diehl y Day, 1974)
Los programas que combinan GnRH y Pg no funcionan en porcino tan bien como en vacuno, ya que, a diferencia de las vacas, las cerdas no desarrollan ondas foliculares durante la fase luteal.
La única forma de manipular el funcionamiento ovárico de manera eficiente en porcino es usar progestágenos. Con los tratamientos de sincronización en porcino se han resuelto dos limitaciones.
En primer lugar, los tratamientos con progestágenos tienen que durar un tiempo similar al de la fase luteal (14-18 días) porque en porcino no se pueden combinar con Pg (las Pg funcionan durante un periodo corto).
En segundo lugar, debido a la gran diferencia entre las concentraciones de progesterona circulante en porcino (30-50 ng/ml) y las de vacuno (5-10 ng/ml), se tienen que utilizar moléculas muy potentes (altrenogest) en lugar de progesterona.
La actividad hormonal del altrenogest es similar a la de la progesterona, lo que hace que actúe mediante un proceso de retroalimentación negativa en el eje hipotálamo-hipofisario, ralentizando la secreción pulsátil de LH y evitando el pico de LH.
Así, durante la administración de altrenogest, el tamaño de los folículos más grandes no supera los 4 mm y al final del tratamiento la secreción pulsátil de LH comienza inmediatamente. Esto permite el crecimiento y maduración folicular y da lugar al comienzo sincronizado del estro 5-6 días tras la última toma de altrenogest.
Existen dos dosis de altrenogest clínicamente recomendadas y que funcionan bien, 15 mg/día en EE.UU. y 20 mg/día en Europa.
Administrar cantidades menores de altrenogest conlleva el riesgo de desarrollar folículos quísticos. Por ello, se recomienda el suministro individual de altrenogest (frente al de grupo).
Si la nulípara se encuentra en la fase luteal cuando se inicia el tratamiento de altrenogest, el cuerpo lúteo involucionará de manera natural durante el tratamiento y en la última fase del mismo el altrenogest será responsable de evitar el crecimiento folicular terminal.
Si la nulípara está en la fase folicular al comienzo del tratamiento, el altrenogest actuará mediante feedback negativo en la hipófisis, evitando el crecimiento folicular terminal durante todo el periodo de tratamiento.

EL TRATAMIENTO REGISTRADO PARA NULÍPARAS EN EUROPA
(20 MG ALTRENOGEST/ DÍA) DURANTE 18
DÍAS SINCRONIZA EL COMIENZO DEL ESTRO EN UN PERIODO DE 3 DÍAS (93% DE LAS NULÍPARAS PASADOS 5-7 DÍAS
TRAS EL FINAL DEL TRATAMIENTO), CON EL 40-60% DE LAS CERDAS
COMENZANDO EL ESTRO EN EL DÍA 6 (MARTINAT BOTTE ET AL., 1985)
El estro en las cerdas que reciben 15 mg/día se presentará, de media, 1 día antes que en aquellas que reciben 20 mg/día.
Un prerrequisito para esta sincronización tan precisa es que todas las nulíparas deberían haber presentado la pubertad antes del comienzo del tratamiento con altrenogest. De hecho, si se administra a nulíparas que no hayan llegado a la pubertad, la mitad presentará un estro retrasado (sobre el día 10 tras el final del tratamiento) y la otra mitad no mostrará estro ni ovulará.
Tras la inseminación en el estro detectado, la tasa de concepción de las nulíparas tratadas con altrenogest aumenta 12 puntos de fertilidad en comparación con la tasa de cerdas control, llegando a alcanzar el 89%
Hay un cuerpo lúteo más en las nulíparas tratadas con altrenogest, lo que da lugar a medio lechón más (Martinat Botte et al., 1995)
Estos resultados son la base para el amplio uso del altrenogest en nulíparas.
PRIMÍPARAS PRIMÍPARAS
En cerdas, varios estudios han intentado posponer el estro postdestete con altrenogest, utilizando varias duraciones y momentos de tratamiento alrededor del destete. A pesar de que no hay consenso en la estrategia de tratamiento óptima, algunos han reportado efectos positivos en la tasa de ovulación, tasa de partos o tamaño de camada (revisión de Kemp y Soede, 2012)
Esta metodología puede ser útil para cerdas primíparas que necesiten más tiempo para recuperarse de su primera lactación antes de ser cubiertas de nuevo.
Algunos estudios recientes sobre este modelo han demostrado que los beneficios del tratamiento en la tasa de partos y tamaño de camada están más claros cuando se administra altrenogest durante 14 días (Patterson et al., 2008; Van Leeuwen et al., 2011)
Hay situaciones en las que los cambios esperados de la función ovárica que dan lugar al estro y a la ovulación no ocurren y se retrasan. Los fallos incluyen:
Casos de pubertad retrasada.
Ausencia de retorno al estro tras el destete en cerdas primíparas durante el verano.
El retraso de la vuelta a la actividad ovárica se observa normalmente en cerdas primíparas que no comen mucho durante la lactación y tienen un balance energético negativo tras el destete.
Dada la dependencia secuencial de los folículos de la FSH (para crecer de 2 a 4 mm) y la LH (para crecer de 4 a 8 mm), la inyección de una gonadotropina, como la PG 600, con esta doble actividad hormonal y una vida media larga, tiene el potencial de corregir las deficiencias mencionadas anteriormente.
Varios estudios han establecido claramente el rendimiento reproductivo asociado al uso de PG 600 para:
El momento de la pubertad es muy variable, siendo tentador inducirlo y así evitar su variabilidad. La inyección de PG 600 en nulíparas prepuberales (mayores de 150-160 días) da comienzo a un estro sincronizado 4 días más tarde en una gran proporción (70-80%) de las nulíparas, seguido de la ovulación.
Sin embargo, para una eficacia óptima, todas las nulíparas deberían estar en la “fase de espera” del periodo prepuberal y ser expuestas regularmente a un verraco activo sexualmente durante los días siguientes al tratamiento (Bartlett et al., 2009)
La tasa de ovulación en el estro inducido, está dentro del rango normal. Así, se proponen dos estrategias de cría:
1 2
Cubrir a las nulíparas en el propio estro inducido.
Cubrir a las nulíparas en el estro que presentan 21 días después de la ovulación inducida por el tratamiento.
Cada una de estas estrategias tiene sus ventajas y limitaciones

EL ESTRO INDUCIDO
El tamaño de camada puede verse algo reducido debido a una supervivencia embrionaria subóptima.
La rapidez de la estrategia hace que sea eficiente con respecto al tiempo.
INSEMINACIÓN EN EL ESTRO QUE SE PRESENTA 21 DÍAS DESPUÉS DEL ESTRO INDUCIDO
Normalmente ofrece mejor rendimiento reproductivo.
Requiere una proporción muy alta de nulíparas que vuelvan al estro.
Retrasa la cubrición 21 días en comparación con la estrategia anterior.
Debido a la variabilidad en la edad a la pubertad, algunas nulíparas pueden no mostrarla a pesar de ser mayores de 180 días. Esta subpoblación incluye dos tipos de animales:
Nulíparas que presentan un celo silencioso asociado a ovulación.
Nulíparas que son realmente prepuberales
Para optimizar la eficacia del tratamiento, se debe identificar a las dos subpoblaciones, ya que la inyección con PG 600 solo funcionará en las prepuberales
Estas hembras se pueden identificar fácilmente mediante ecografía del tracto genital (Martinat Botte et al., 2011)
El rendimiento reproductivo de las nulíparas tratadas y cubiertas en su segundo celo parece similar al de las cerdas control (Martinat Botte et al., 2011).
LA ADMINISTRACIÓN DE PG 600 A ESTA SUBPOBLACIÓN INDUCE
LA PUBERTAD EN EL 96% DE LOS ANIMALES EN 3 O 4 DÍAS Y, A CONTINUACIÓN, TIENE LUGAR LA OVULACIÓN EN TODOS LOS CASOS
MEJORAR EL RENDIMIENTO REPRODUCTIVO DE LAS CERDAS PRIMÍPARAS
Debido a un estado metabólico inestable en el momento del destete, es más probable que las cerdas primíparas muestren intervalos destete-estro largos y variables.
El uso estratégico de PG 600, inyectado al destete en esta subpoblación, permite a las cerdas primíparas conseguir el mismo alto rendimiento reproductivo que las multíparas. De hecho, la inyección de PG 600 al destete desencadena un intervalo desteteestro corto y muy sincronizado, aumentando la proporción de cerdas cubiertas a los 7 días postdestete (Kirkwood et al., 1998)
La tasa de partos de las hembras tratadas con PG 600 fue similar a la de cerdas control (87% frente a un 86% en los grupos control y tratado, respectivamente), mientras que el tamaño de camada se redujo alrededor de medio lechón en las cerdas tratadas (Kirkwood et al., 1998).
Sin embargo, la productividad (medida por el número de lechones producidos por cerda destetada) fue claramente superior tras la administración de PG 600 (1,5 lechones) (Kirkwood et al., 1998)

SOLUCIONAR LOS PROBLEMAS CAUSADOS POR EL ESTRÉS TÉRMICO EN VERANO
Las temperaturas ambientales altas durante la lactación se asocian a una reducción en el consumo de pienso, lo que altera el estado metabólico de las madres.
El incremento del balance energético negativo, especialmente en las cerdas primíparas o en las criadas en extensivo, se traduce en un enlentecimiento de la vuelta a la actividad pulsátil de la LH tras el destete, que puede no ser adecuada para mantener el crecimiento folicular terminal. En estas cerdas, el estro y la ovulación se retrasan más de 7 días postdestete o incluso no suceden
En todas las cerdas con anestro el día 7 postdestete, la inyección de PG 600 ha demostrado desencadenar el estro y la ovulación en 3 y 5 días, respectivamente.
La tasa de concepción tras la inseminación, de alrededor de un 80%, demuestra que las ovulaciones inducidas son de buena calidad (Bracken et al., 2006).
LOS CUATRO USOS DE LA PG 600 QUE SE HAN DESCRITO SON ESTRATEGIAS ECONÓMICAMENTE
VIABLES QUE MAXIMIZAN LA PRODUCTIVIDAD DE CERDAS ADULTAS Y NULÍPARAS
Dado el papel esencial del aumento de la secreción uterina de PgF2α en el comienzo del parto, no es extraño que la inyección de PgF2α natural o de análogos sintéticos desencadene el parto (Einarsson, 1981) mediante la inducción de la regresión de los cuerpos lúteos que mantenían la gestación.

Por ejemplo, una sola inyección de 175 μg de cloprostenol (Planate) a cerdas entre los días 112 y 114 de gestación (que normalmente dura 114-117 días si no se induce el parto) da lugar a un intervalo inyección-parto de 21-23 horas, con unos 2/3 de las cerdas pariendo en las siguientes 25-30 horas (Willemse et al., 1979; Jainudeen y Brandenburg, 1980) y más del 90% entre las 16 y las 36 horas postinyección. En cambio, el parto de las cerdas no tratadas se extiende a lo largo de más de 50 horas.
MOMENTO
DEL PARTO
No se detectan efectos negativos de la inducción del parto sobre los lechones en cuanto a su peso corporal, supervivencia y tasa de crecimiento.
No obstante, no se debería intentar la inducción del parto con la inyección de cloprostenol antes del día 111 de gestación, ya que el nacimiento de lechones inmaduros se asocia siempre a unas altas tasas de mortalidad.
Para evitar inducir prematuramente el parto, es de vital importancia mantener buenos registros de cría, justificando el día de gestación en el que se puede inyectar cloprostenol.
Por supuesto, cuando se induce la ovulación con agonistas de la GnRH y se lleva a cabo una IA única a tiempo fijo, es muy fácil determinar el momento en el que se debería inyectar cloprostenol para lograr el óptimo rendimiento.
BENEFICIOS: PERMITE OPTIMIZAR LA MANO DE OBRA EN LA SUPERVISIÓN DE PARTOS, MINIMIZAR
LA PROPORCIÓN DE PARTOS EN FIN DE SEMANA
O POR LA NOCHE, Y APLICAR LAS CONDICIONES IDÓNEAS PARA LAS ADOPCIONES

La referencia para la sincronización de celos en porcino
Inducción y sincronización de celos en cerdas prepúberes y adultas
REGUMATE PORCINO SOLUCIÓN ORAL. COMPOSICIÓN POR ml: Sustancia activa: Altrenogest 4,0 mg. Excipientes: Butilhidroxitolueno (E321) 0,07 mg, butilhidroxianisol (E320) 0,07 mg, otros excipientes, c.s INDICACIONES Y ESPECIES DE DESTINO: Porcino (cerdas reproductoras). Sincronización del estro. CONTRAINDICACIONES: No administrar a machos. No administrar a cerdas con infecciones uterinas. No administrar a cerdas nulíparas en las que no se haya producido el primer celo. PRECAUCIONES: Precauciones especiales para su uso en animales: Administrar sobre el alimento tomando las precauciones necesarias para que solo sea ingerido por el animal objeto del tratamiento. El alimento medicado no consumido deberá ser eliminado de forma segura y en ningún caso se administrará a otro animal. No superar la dosis indicada. Este medicamento no contiene ningún conservante antimicrobiano. Precauciones específicas que debe tomar la persona que administre el medicamento veterinario a los animales: Las mujeres embarazadas, que crean que puedan estarlo, así como las mujeres en edad fértil, deben evitar todo contacto con el medicamento. Este medicamento no debe ser manipulado por personas con tumores dependientes de progesterona (confirmados o sospechados) o que padezcan trastornos tromboembólicos. Las personas con hipersensibilidad conocida a la sustancia activa deben evitar todo contacto con el medicamento veterinario. Debe evitarse el contacto directo con la piel. Usar un equipo de protección personal consistente en guantes y mono al manipular el medicamento. Los guantes porosos pueden dejar que el medicamento entre en contacto con la piel. La absorción transcutánea puede ser incluso mayor cuando la zona está recubierta con material oclusivo, como guantes de goma o de látex. Cualquier contacto accidental con la piel debe lavarse inmediatamente con agua y jabón. Lavarse las manos después del tratamiento y antes de comer. En caso de producirse una exposición accidental de los ojos, aclarar con abundante agua durante 15 minutos. Buscar atención médica. Efectos de una sobreexposición: una absorción accidental repetida puede generar una interrupción del ciclo menstrual, contracciones uterinas o abdominales, aumento o disminución de la hemorragia uterina, prolongación de la gestación o dolor de cabeza. En caso de sobreexposición consulte con un médico y muéstrele el prospecto o la etiqueta. Otras precauciones relativas al impacto medioambiental: Cuando se esparza el estiércol de los animales tratados, la distancia mínima a las aguas superficiales, tal como se define en la normativa nacional o local, tiene que ser estrictamente respetada, ya que el estiércol puede contener altrenogest que podría causar efectos adversos en el medio ambiente acuático. No administrar a hembras gestantes. Este medicamento veterinario no requiere condiciones especiales de conservación. Período de validez después de abierto el envase primario: 90 días. Período de validez después de su incorporación en el pienso o comida granulada: el alimento medicado no consumido deberá ser eliminado y en ningún caso podrá ser administrado a otro animal. REGUMATE PORCINO SOLUCIÓN ORAL no se deberá verter en cursos de agua puesto que podría resultar peligroso para los peces y otros organismos acuáticos. TIEMPO DE ESPERA: Carne: 9 días. Uso veterinario – medicamento sujeto a prescripción veterinaria. Administración bajo control o supervisión del veterinario. Instrucciones completas en el prospecto. Mantener fuera de la vista y el alcance de los niños. Reg. Nº: 734 ESP. Merck Sharp & Dohme Animal Health, S.L. Ficha técnica actualizada a 9 de enero de 2020. PG 600 MONODOSIS. PG 600
MULTIDOSIS. Liofilizado para solución inyectable. PG 600 MONODOSIS: COMPOSICIÓN: Vial con el liofilizado: Sustancias activas: Gonadotropina coriónica (HCG) 200 U.I.; gonadotropina sérica equina (PMSG) 400 U.I. PG 600 MULTIDOSIS: COMPOSICIÓN: Vial con el liofilizado: Sustancias activas: Gonadotropina coriónica (HCG) 1000 U.I.; gonadotropina sérica equina (PMSG) 2000 U.I. Una vez reconstituido, 1 ml de la solución contiene 40 U.I. de gonadotropina coriónica y 80 U.I. de gonadotropina sérica equina. INDICACIONES Y ESPECIES DE DESTINO: Porcino (cerdas adultas y cerdas nulíparas).
Inducción y sincronización del celo; anestro prepuberal; anestro post-destete. CONTRAINDICACIONES: No usar en caso de hipersensibilidad a las sustancias activas o a alguno de los excipientes. PRECAUCIONES: El tratamiento durante la fase luteínica primaria o a la mitad del ciclo puede aumentar el riesgo de desarrollar quistes ováricos. Respetar la posología. Aumentar la dosis no incrementa la eficacia del medicamento veterinario. Este medicamento no contiene ningún conservante antimicrobiano. Precauciones específicas que debe tomar la persona que administre el medicamento veterinario a los animales: Las personas con hipersensibilidad conocida a las gonadotropinas deben evitar todo contacto con el medicamento veterinario. Administrar el medicamento con precaución para evitar la autoinyección accidental. En caso de autoinyección accidental, consulte con un médico inmediatamente y muéstrele el prospecto o la etiqueta. Los estudios efectuados en animales de laboratorio demostraron efectos teratogénicos dependientes de la dosis después de la administración de la combinación HCG / PMSG. Las mujeres embarazadas, mujeres con el propósito de quedarse embarazadas o cuyo estado de gestación sea desconocido, no deberían utilizar el medicamento veterinario por el riesgo de autoinyección accidental. El medicamento puede provocar una ligera irritación cutánea. En caso de derrame accidental sobre la piel, aclare inmediatamente con agua en abundancia. Lávese las manos tras manipular el medicamento veterinario. No utilizar este medicamento durante la gestación. Conservar en nevera (entre 2 °C y 8 °C). Proteger de la luz. La solución reconstituida deberá conservarse en nevera (entre 2 °C y 8 °C). Período de validez después de abierto el envase primario: uso inmediato. Período de validez después de su reconstitución según las instrucciones: 24 horas. TIEMPO
DE ESPERA: Carne: Cero días. Uso veterinario - medicamento sujeto a prescripción veterinaria. Administración bajo control o supervisión del veterinario. Instrucciones completas en el prospecto. Mantener fuera de la vista y el alcance de los niños. Reg. Nº: PG 600 MONODOSIS: 2843 ESP; PG 600
MULTIDOSIS: 2844 ESP. Merck Sharp & Dohme Animal Health, S.L. Ficha técnica actualizada a 9 de enero de 2020. PLANATE. Solución inyectable. COMPOSICIÓN POR ml: Sustancia activa: Cloprostenol (sódico) 0,0875 mg. Excipientes: Alcohol bencílico (E 1519) 20 mg. INDICACIONES Y ESPECIES DE
DESTINO: Cerdas. Inducción del parto a partir del día 113 de gestación (el día 1 de gestación es el último día de inseminación natural o artificial). CONTRAINDICACIONES: No usar en animales con enfermedades respiratorias agudas o crónicas. No usar en animales gestantes para los que no se pretende el aborto o la inducción del parto. No aplicar antes del día 113 de gestación, ya que puede provocar un aumento de la tasa de mortalidad y disminución de la vitalidad neonatal. No usar en animales con hipersensibilidad conocida a la sustancia activa o a algún excipiente. PRECAUCIONES: Precauciones especiales para su uso en animales: No utilizar por vía intravenosa. La inyección en tejido adiposo puede determinar una absorción incompleta del medicamento. Debido a la posibilidad de infecciones bacterianas post-inyección, se deben emplear estrictas medidas de asepsia en la aplicación del medicamento. La inducción del parto demasiado prematura en la gestación puede dar lugar al nacimiento de lechones no viables. Un aumento del número de lechones no viables puede ocurrir si se utiliza más de dos días antes del fin de la gestación. Sólo debe utilizarse en aquellas granjas que lleven un registro exacto de las inseminaciones. Precauciones específicas que debe tomar la persona que administre el medicamento veterinario a los animales: Administrar el medicamento con precaución para EVITAR LA AUTOINYECCION ACCIDENTAL O EL CONTACTO CON LA PIEL. Las prostaglandinas F2α pueden absorberse por la piel y causar broncoespasmo y aborto. Las mujeres embarazadas, en edad fértil, asmáticos y personas con otros problemas respiratorios deben extremar las precauciones cuando manejen cloprostenol. Estas personas deben evitar el contacto, o usar guantes de plástico desechables durante la administración del medicamento. En caso de dificultad respiratoria, consulte inmediatamente con un médico. En caso de autoinyección accidental, contacte inmediatamente con un médico y muéstrele el prospecto o la etiqueta del medicamento. En caso de contacto accidental con la piel, lavar inmediatamente con agua y jabón. No utilizar este medicamento durante toda la gestación o parte de la misma a menos que se desee la inducción del parto o del aborto. Conservar a temperatura inferior a 30 °C. Conservar el vial en el embalaje exterior con objeto de protegerlo de la luz. Período de validez después de abierto el envase primario: 28 días. TIEMPO DE ESPERA: Carne: 2 días. Uso veterinario – medicamento sujeto a prescripción veterinaria. Administración bajo control o supervisión del veterinario. Instrucciones completas en el prospecto. Mantener fuera de la vista y el alcance de los niños. Reg. Nº: 790 ESP. Merck Sharp & Dohme Animal Health, S.L. Ficha técnica actualizada a 12 de abril de 2017.
Inductor y sincronizador de partos
1,2,3
Ingelvac CircoFLEX® suspensión inyectable para cerdos. Composición: Cada dosis de 1 ml de la vacuna inactivada contiene: Proteína ORF2 de Circovirus Porcino Tipo 2. PR* mínima 1,0; PR* máxima 3,75. *Potencia Relativa (test ELISA) por comparación con una vacuna de referencia. Adyuvante: Carbómero 1 mg. Especies de destino: Porcino. Indicaciones: Inmunización activa de cerdos a partir de 2 semanas frente al PCV2 para la reducción de la mortalidad, signos clínicos- incluyendo pérdida de peso- y lesiones en tejidos linfoides relacionadas con las enfermedades asociadas al PCV2 (PCVD). Además, la vacunación ha demostrado reducir la excreción nasal de PCV2, la carga viral en sangre y tejidos linfoides y la duración de la viremia. Inicio de la protección: 2 semanas tras la vacunación. Duración de la protección: al menos 17 semanas. Uso durante la gestación y la lactancia: Puede utilizarse durante la gestación y la lactancia. Reacciones adversas: Muy frecuentemente se produce hipertermia leve y transitoria el día de la vacunación. En muy raras ocasiones, pueden ocurrir reacciones anafilácticas que deberán tratarse sintomáticamente. Posología: Inyección única por vía intramuscular de una dosis (1 ml), independientemente del peso vivo. Esta vacuna se puede mezclar con Ingelvac Mycoflex (a razón de 1 ml de cada vacuna) y administrar en un punto de inyección en cerdos de a más de 3 semanas, pero no a cerdas gestantes o lactantes. Interacción con otros medicamentos: Esta vacuna se puede mezclar con Ingelvac MycoFLEX y administrar en un punto de inyección. Tiempo de espera: Cero días.
Conservación: Conservar y transportar refrigerado (entre 2°C y 8°C). No congelar. Proteger de la luz. Usar inmediatamente después de abierto. Nº autorización: EU/2/07/079/002-003.
Presentación: Frascos de 50 y 100 ml. Titular: Boehringer Ingelheim Vetmedica GmbH. Medicamento sujeto a prescripción veterinaria.