PROYECTO DIGITAL

LICENCIA 12 MESES

PROYECTO DIGITAL

LICENCIA 12 MESES
J.M. Vílchez González, A.M.a Morales Cas, G.Villalobos Galdeano
¿Hipótesis de un desquiciado o de un pionero?
1. Conocimiento científico
2. Cambios físicos y químicos
3. Magnitudes físicas. Unidades y medida
4. El lenguaje de la ciencia
5. Material de laboratorio. Normas y seguridad
6. Ciencia, tecnología y sociedad
Ciencia recreativa
Informe científico. El muñeco de nieve
La decantación del agua en tiempos de Roma
1. Propiedades de la materia

2. Sustancias puras y mezclas
3. Disoluciones en estado líquido
4. Técnicas de separación de mezclas
5. Suspensiones y coloides
Ciencia recreativa
¿Sólido o líquido viscoso?
Trabajo práctico
¿Disolución, coloide o suspensión?
Para terminar
Gases de efecto invernadero
1. Características de los estados de agregación
2. La teoría cinética de la materia, TCM
3. Presión y temperatura
4. Leyes de los gases
5. Los cambios de estado
6. Gráficas de cambios de estado
Ciencia recreativa
Cubitos de aceite
Trabajo práctico
Ebullición de una mezcla
Para terminar
El átomo: desde la antigua Grecia hasta hoy
1. Primeras ideas sobre el átomo
2. De la naturaleza eléctrica de la materia al primer modelo atómico
3. De la radiactividad al modelo nuclear del átomo
4. El núcleo del átomo
5. Clasificación de los elementos químicos
6. La corteza del átomo
7. Aplicaciones de los isótopos radiactivos
1. Sustancias simples y compuestas
2. Cambios en sistemas materiales
3. Reacciones químicas
4. Características de las reacciones químicas
5. Productos químicos de origen natural y artificial
6. Química sostenible y compromiso ODS
7. Reacciones químicas y medioambiente
Ciencia recreativa
Pegamento casero
Trabajo práctico
Reacciones químicas
Para
1. Fuerza gravitatoria
2. Fuerza electrostática
3. Fuerza magnética
4. Electromagnetismo Ciencia recreativa
El electroimán Trabajo práctico
¿Dónde está el norte?
¿Catástrofe natural o castigo divino?
1. Energía
2. Manifestaciones de la energía
3. Intercambios de energía
4. Ondas mecánicas
5. Sonido
¿De
El descubrimiento de las ondas de radio
1. Energía térmica y temperatura
2. Equilibrio térmico
3. Efectos del calor
4. Propagación del calor
5. Ondas electromagnéticas
6. Luz
El camino correcto
Cautivados por el universo
1. Fuerzas
2. Fuerzas cotidianas
3. Naturaleza de las fuerzas
4. Estudio del movimiento
5. Deformaciones elásticas. Ley de Hooke
6. Máquinas simples
Ciencia recreativa
El factor tiempo en las fuerzas
Trabajo práctico. Ley de Hooke Para
1. Fuentes de energía
2. Principales usos de la energía
3. Problemáticas derivadas del uso energético
4. Posibles soluciones al problema energético
5. Desarrollo sostenible
EDUCACIÓN DE CALIDAD
Este curso te encuentras por primera vez con la asignatura de ciencias de Física y Química, así que nuestro primer objetivo es conocer la utilidad del trabajo científico en diferentes aspectos cotidianos de nuestro día a día, además de servir para dar explicación a los fenómenos naturales del mundo en el que nos encontramos.
¿Sabes qué estudian la física y la química? ¿Conoces de qué están compuestas las sustancias que te rodean o qué diferencias hay entre los distintos estados de agregación? A preguntas como estas vamos a intentar dar respuesta en este proyecto, a la vez que se despierta tu interés por la química y la física y sus miles de conceptos; nos espera un viaje apasionante.

Con el desarrollo de este trabajo, además, estaremos atendiendo los Objetivos de Desarrollo Sostenible al promover oportunidades de aprendizaje a la vez que, como personas investigadoras, aprendemos a detener la degradación de las tierras.

Grupos de investigación.
Empezamos a investigar las propiedades de la materia.
Unidad 1
¿Qué expulsa un volcán?
Investigamos las sustancias que componen la lava y los gases del volcán.
Póster científico.




















Empezamos a componer nuestro póster.
Construimos el volcán.
Elaboramos un boceto y elegimos los materiales que utilizaremos.






Unidad 2
El cono. Determinamos si el tamaño del cono influye en la presión con que salen expulsados los gases.
La reciente erupción del volcán Cumbre Vieja nos mostró muchos ejemplos de las diferentes propiedades que tiene la materia según el estado de agregación en que se encuentre. Vimos imágenes de la lava fluyendo y de los gases difundiéndose por la atmósfera.

Este proyecto nos ayudará a entender todo lo que sucedió, por medio de la construcción una maqueta de un volcán acompañada de un póster científico en el que explicaremos las propiedades de la materia que nos ayudan a distinguir las diferentes sustancias expulsadas por un volcán, resumiremos las características de los tres estados de agregación y mostraremos la estructura de los átomos de diferentes sustancias que son expulsadas por un volcán.
El póster científico lo haremos en la aplicación Canva, que nos ofrece la posibilidad de escoger la plantilla que más nos guste para llevar a cabo nuestra actividad.
Tras la realización de este proyecto, seremos capaces de compartir toda la información que hemos ido recapitulando de una manera visual y esquemática.

gráfica.




Elegimos una sustancia del volcán para representar su gráfica de cambios de estado.
Línea histórica. Investigamos sobre los átomos que componen la materia.
¿Átomos en el volcán? Analizamos la composición de alguna sustancia del volcán.
Póster y maqueta final Completamos el póster con toda la información y finalizamos la maqueta.
400 años. Los pensadores de la antigua Grecia tenían inquietudes y formulaban hipótesis acerca de la descomposición de la materia. Así, propusieron la teoría atomista, que afirma que la materia está formada por partículas indivisibles a las que denominaron átomos. Alrededor de 2 200 años después, John Dalton consiguió dotar de cierta base científica las primeras hipótesis atomistas. Sin embargo, años más tarde, los suJ. Thomson (1897), E. Rutherford (1919), J. Chadwick (1932) y M. Gell-Mann y G. Zweig (1964) demostraron que el átomo sí es divisible en partículas aún más pequeñas.


En 1953, el presidente de EE.UU., D. D. Eisenhower, presentó el programa Atoms for Peace ante las Naciones Unidas. El objetivo era impulsar el desarrollo en los ámbitos agrícola, industrial, médico, transporte y energético a partir de la energía atómica. Más recientemente, y con propósitos similares, en mayo de 2018 tuvo lugar en España el simposio internacional Atoms for Peace and Europe: Nuclear Energy Networks in Europe and around the Globe. Programas como este hacen que la ciencia sea un asunto común a varios países y que los nuevos descubrimientos puedan lograrse de forma más eficiente y colaborativa. La publicación de los resultados es la manera de hacer partícipe a toda la comunidad científica y poder seguir avanzando.
COMPROMISO ODS
Contestad en grupo a estas preguntas:
1. ¿Quiénes fueron los filósofos griegos que propusieron la primera teoría atomista? ¿En qué se basaban? Explicad qué ideas de ese momento perduraron hasta los primeros modelos atómicos del siglo xix
2. Piensa y comparte en pareja. Buscad en la web más información sobre los eventos relacionados con Atoms for Peace y analizad la implicación de sus propuestas en las metas 16.4 17.1 y 17.7
3. En grupos documentaos sobre la gestión de los desechos radiactivos. Elaborad una infografía en la que expliquéis la gestión de dichos residuos y los avances logrados en su tratamiento, así como su impacto en la meta 12.4. Poned en común vuestras conclusiones y compartidlas con el resto del centro.
El átomo: desde la antigua Grecia hasta hoy
1. Primeras ideas sobre el átomo






2. De la naturaleza eléctrica de la materia al primer modelo atómico.
3. De la radiactividad al modelo nuclear del átomo
4. El núcleo del átomo
5. La corteza del átomo
6. Aplicaciones de los isótopos radiactivos
Taller de ciencias
Ciencia recreativa. Construimos átomos
Trabajo práctico. Discontinuidad de la materia
En anayaeducacion.es
Para motivarte:
• Vídeo: «Antes de empezar».
Para detección previa de ideas:
• Actividad interactiva: Autoevaluación inicial.
• Presentación: «Qué necesitas saber».
Para estudiar:
• Presentaciones: «Estructura del átomo», «Configuraciones electrónicas de distintos elementos» y «Para estudiar».
• Actividad interactiva: «La tabla periódica» y «Leyes fundamentales de la química».
• Simulaciones: «Construye un átomo», «Isótopos y masa atómica» y «Dispersión de Rutherford».
Para evaluarte:
• Actividad interactiva: Autoevaluación final.
• Soluciones de las actividades numéricas.












Y, además, toda la documentación necesaria para aplicar las claves del proyecto.
La materia que compone la lava está formada por átomos. En este momento, haréis una pequeña pausa en vuestro proyecto para conocer más sobre los átomos. Investigad los diferentes modelos que se han ido proponiendo hasta la actualidad, quién los creó, y cuáles son las características de cada uno.
Cada miembro del equipo investigará sobre un modelo para recogerlos todos en conjunto sobre una línea temporal al final de la investigación.
Los gases están formados por moléculas, y estas, a su vez, por átomos. Vuestro objetivo ahora es elegir una sustancia emitida por el volcán (puede ser la misma del paso 6 u otra diferente) y centraros en sus átomos: elaborad un esquema con la composición de la sustancia e información sobre cada uno de los átomos que la componen (nombre, símbolo, masa atómica, número atómico).
Trasladad toda la información que queremos tener en el póster relacionado con el volcán. Acompañadla con imágenes de los diferentes aspectos estudiados, desde fotografías de un volcán, pasando por imágenes térmicas de la lava, hasta imágenes de microscopía de la lava solidificada. También es el momento de finalizar la maqueta para acabar con vuestro proyecto.
+ orientaciones en anayaeducacion.es
vas a descubrir?
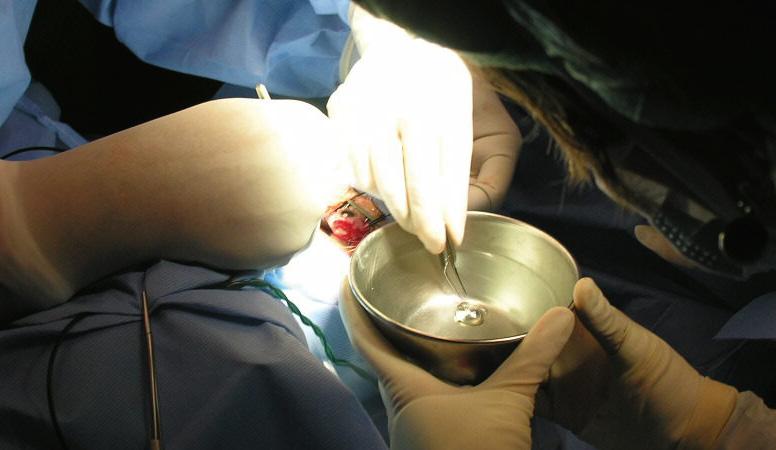
¿Qué reacción química puede estar teniendo lugar en la imagen de la izquierda? Indica el nombre de los reactivos y de los productos, así como su estado de agregación.
La primigenia idea del átomo data del año 400 a. C., cuando Leucipo y Demócrito, pensadores naturalistas de la antigua Grecia, buscaban una explicación acerca del principio de todas las cosas: el arché Postularon la teoría atomista, cuya idea principal es que todo está formado por diminutos corpúsculos que ya no se pueden dividir más, a los que llamaron átomos (del griego a-, ‘sin’, y tómos, ‘cortar, dividir’). Según la teoría atomista, en la naturaleza solo existen átomos (el «ser») y vacío (el «no ser»). Sus ideas fueron referente para pensadores y científicos posteriores: Aristóteles, Epicuro, Giordano Bruno y John Dalton, entre otros.

Las primeras investigaciones químicas, investigaciones basadas en la experimentación, versaron sobre la naturaleza de las sustancias y los cambios químicos. Destacamos las siguientes:
• En 1661, R. Boyle, en su obra El químico escéptico, clasificó las sustancias en dos categorías: las que pueden descomponerse en otras diferentes, llamadas compuestos, y las que no, denominadas elementos.
• En 1789, A. Lavoisier publicó la ley de la conservación de la masa, indicando que en una reacción química la materia se transforma, pero no se crea ni se destruye.
• Entre 1794 y 1804, J. L. Proust concluyó que la proporción en masa de dos elementos que forman un compuesto es siempre la misma. Esta afirmación se conoce como ley de las proporciones definidas.
• En 1803, J. Dalton enunció la ley de las proporciones múltiples, que extrae conclusiones sobre compuestos diferentes formados por los mismos elementos.
Estas tres últimas son conocidas como las leyes ponderales. Puedes practicarlas con la actividad interactiva «Leyes fundamentales de la química» disponible en anayaeducacion.es












A partir de los resultados expuestos en la página anterior, y de una vasta investigación realizada por él mismo, en el año 1808, el científico inglés J. Dalton publicó su obra Un nuevo sistema de filosofía química, en la que exponía las bases en las que se sustentaba su teoría atómica:
• Los bloques básicos de la materia son partículas indivisibles, llamadas átomos.
• Los átomos del mismo elemento químico son idénticos en masa y propiedades, y diferentes de los de otro elemento químico.
• Los compuestos están formados por átomos de elementos químicos diferentes en una proporción numérica sencilla.
• En una reacción química ocurre una reordenación de los átomos para dar lugar a sustancias diferentes, pero los átomos ni se crean ni se destruyen.
En esta obra, Dalton propuso una simbología para los átomos de algunos elementos y para los compuestos formados por ellos. Además, estableció las masas atómicas tomando como referencia el elemento más ligero, el hidrógeno, al que asignó el valor de 1, como se muestra en la imagen de la derecha.

Posteriormente, en 1815, W. Prout planteó la hipótesis de que toda materia estaba formada a partir de hidrógeno; por tanto, las masas atómicas de los elementos serían múltiplos de la masa del hidrógeno.
Sustancias simples
Las sustancias simples, llamadas elementos por R. Boyle, están formadas por átomos del mismo elemento químico.
1 Cabezas pensantes. En cada fila de esta tabla se recogen los resultados de la reacción entre el cloro y el sodio para formar cloruro de sodio.
Para representar los elementos químicos, Dalton utilizó un sistema de símbolos circulares combinado con otros símbolos o letras.
Aunque al principio su teoría atómica no fue aceptada por el conjunto de la comunidad científica, hacia mediados del siglo xix nadie ponía en duda la discontinuidad de la materia, es decir la existencia de los átomos.
Los compuestos son las sustancias formadas por átomos de diferentes elementos.
a) Comprueba, a partir de estos resultados, que se cumple la ley de la conservación de la masa.
b) A partir de las tres primeras filas de la tabla, establece la proporción en la que se combinan el cloro y el sodio para formar el cloruro de sodio. ¿Qué ley empírica estás comprobando? Comprueba que se cumple también en las dos últimas filas.
c) Indica qué sustancias de la tabla son compuestos, de acuerdo con la teoría atómica de Dalton, y cuáles están formadas por átomos del mismo elemento.
2 Organizador gráfico. Haz un esquema con las ideas de la teoría atómica de Dalton.
Razona como un científico
En la figura hemos representado el rayo para visualizar su trayectoria, pero ¿sería posible verlo en la realidad? ¿Por qué? ¿Qué parte del tubo permitió a Thomson observar los fenómenos que sucedían en el tubo?
Los tubos de rayos catódicos
A finales del siglo xix se conocían cuáles eran los fenómenos que producían la electricidad, pero no se sabía qué era la electricidad en sí misma. Se utilizaba la electricidad en las bombillas de filamento incandescente, los motores eléctricos, los tranvías, etc.; sin embargo, nada se podía exponer sobre la causa de este fenómeno.
El conocimiento científico acerca de los fenómenos eléctricos se inició a finales del siglo xix, cuando un grupo de científicos, entre los que destacan W. Crookes y J. J. Thomson, experimentando con tubos de rayos catódicos, demostraron la naturaleza eléctrica de la materia.
Los tubos de rayos catódicos son ampollas de vidrio, en las que se ha hecho el vacío, con dos discos metálicos en su interior y una pantalla fosforescente en el extremo cercano al ánodo. Al aplicar una diferencia de potencial entre los discos, aparece una radiación en el interior del tubo a la que se denomina rayo catódico.
Se observaron estos fenómenos:
• Al introducir un objeto en el tubo, se observa una sombra en la pantalla. Por tanto, los rayos provienen del cátodo y tienen naturaleza corpuscular; son partículas con masa.
• Los rayos catódicos se desvían hacia una placa con carga positiva; por tanto, tienen carga eléctrica negativa.
A partir de las conclusiones de estos y de otros experimentos, Thomson determinó, en 1897, que la naturaleza de los rayos catódicos no era la de una radiación, sino que se trataba de partículas con carga eléctrica negativa que formaban parte del átomo (partículas subatómicas), ya que:
• Su masa era mucho menor que la masa del hidrógeno, el átomo de menor masa.
• Se trataba de la misma partícula independientemente del gas que se introducía en el tubo. Su relación carga/masa (q/m) era 1,76 · 1011 C/kg.
La causa de los fenómenos eléctricos radica en el intercambio de estas partículas que fueron denominadas electrones.
Ánodo Placa cargada positivamente
Rayos catódicos
Cátodo
Dentro del tubo hay pocas moléculas de gas. La gran diferencia de potencial provoca que algunos electrones salgan de los átomos y se aceleren.
Gracias a la superposición del efecto del imán y de las placas cargadas, J. J. Thomson logró medir la relación carga/masa del electrón.

De la naturaleza eléctrica de la materia al primer modelo atómico
A partir del descubrimiento del electrón, en 1897, la idea que se tenía del átomo, propuesta por J. Dalton, cambió, pues se constató que una parte constituyente del átomo eran los electrones.
En 1904, en su obra Electricidad y materia, J. J. Thomson expuso un nuevo modelo para el átomo. Este modelo es conocido como el «bollo con pasas».
Según el modelo de Thomson, el átomo está constituido por una esfera de electrización uniforme positiva, en la cual están incrustados los electrones, de carga negativa. Los átomos son neutros, su carga neta es cero.
Como todos los modelos científicos, el modelo de Thomson para el átomo sirve para explicar algunos fenómenos observados, pero otros no.
• La electrización es un fenómeno que se puede explicar con el modelo atómico de Thomson. Un cuerpo adquiere carga negativa si tiene un exceso de electrones, y positiva si ha perdido electrones.
• La formación de iones se explica con el modelo de Thomson. Si un átomo pierde electrones forma un catión, y un anión, si los gana. El avance científico se basa, en gran medida, en ir dando explicación a los nuevos fenómenos observados, partiendo del conocimiento que ya se tiene. Como veremos en el siguiente epígrafe, los fenómenos radiactivos no podían ser explicados por el modelo de Thomson.
Un ion se forma a partir de un átomo que gana o pierde carga negativa, mediante el intercambio de la unidad de carga: el electrón. Los iones con carga negativa se denominan aniones, y los que tienen carga positiva, cationes.
Carga positiva uniformemente distribuida
Electrones con carga negativa incrustados en el átomo
Según el modelo atómico de Thomson, la carga negativa reside en unos corpúsculos denominados electrones; estos electrones son la unidad de carga de la materia
3 A la vista de la relación carga/masa del electrón, ¿qué conclusión podemos extraer acerca de los valores relativos de ambas magnitudes? En 1910, R. A. Millikan midió experimentalmente la carga del electrón, 1,6 · 10–19 C. Calcula la masa del electrón.
Además, esta es la parte del átomo que puede intercambiarse entre unos átomos y otros dando lugar a iones y explicando así los fenómenos de electrización.
4 Hacia 1750, B. Franklin propuso que la electricidad era un fluido. Busca información sobre las características de este fluido y los experimentos que llevó a cabo en sus investigaciones. ¿Cómo cambia esta visión del fenómeno eléctrico a partir del descubrimiento del electrón?
Infórmate sobre los detectores de partículas









Durante el resto del siglo xx y hasta nuestros días se han construido poderosas máquinas con refinados detectores para estudiar la materia. Investiga sobre ello y sobre las aplicaciones médicas de los detectores de partículas.


En 1896, H. Becquerel descubrió que ciertas sales de uranio presentaban una fosforescencia inusual. Este fenómeno consiste en la emisión de una radiación verdosa por parte de ciertos minerales después de haber sido expuestos a la radiación solar; esta emisión persiste aun cuando se deja de iluminar el mineral. Pero el fenómeno que observó Becquerel era inusual porque las sales de uranio no son fosforescentes.
Dos años después, Pierre y Marie Curie verificaron que ese nuevo fenómeno estaba presente en muestras de otros elementos químicos, y gracias a esta característica, a la que denominaron radiactividad, descubrieron dos elementos nuevos: el polonio y el radio. Concluyeron que los rayos emitidos provenían de los átomos, pero para poder explicar su naturaleza era necesario avanzar en el conocimiento del átomo.


Existen tres tipos de emisiones radiactivas: la radiación alfa (a), la radiación beta (b) y los rayos gamma (g).
La descripción de las características de la radiactividad y de la interacción de este nuevo fenómeno con la materia era el tema de investigación de E. Rutherford. En 1899, estableció que la radiación a tenía poco poder de penetración en la materia y carga eléctrica positiva, a diferencia de la radiación b que tenía mayor poder de penetración y carga negativa. Posteriormente se descubrió que los rayos g no tienen carga eléctrica pero sí un gran poder de penetración.
Entre 1902 y 1903, E. Rutherford y F. Soddy llegaron a la conclusión de que la radiactividad es la desintegración espontánea de átomos de gran masa.
En 1909, los colaboradores de Rutherford, H. Geiger y E. Marsden, publicaron los sorprendentes resultados del experimento de bombardeo de oro con radiación alfa (imagen inferior).
pocas rebotan
Algunas se desvían
Geiger y Marsden observaron que la mayoría de las partículas a atravesaban la fina lámina de oro sin desviarse apenas (1), unas pocas se desviaban ángulos inferiores a 90° (2) y un pequeño número de ellas lo hacían en un ángulo superior al ángulo recto (3).



La explicación de los resultados de estos experimentos llevó a Rutherford a proponer un nuevo modelo para el átomo.
La mayoría no se desvían
Para explicar los resultados de los experimentos de bombardeo con partículas alfa, en 1911 E. Rutherford propuso un nuevo modelo para el átomo:
• La carga positiva no se encuentra uniformemente distribuida por todo el átomo, sino que se halla concentrada en un espacio minúsculo denominado núcleo, donde está la mayoría de la masa del átomo.
• Los electrones, de carga negativa, orbitan alrededor del núcleo. La carga total de los electrones es igual a la carga del núcleo.
Consulta en anayaeducacion.es una simulación sobre este experimento.
El aporte principal del modelo de Rutherford es que la materia está fundamentalmente vacía.
Núcleo cargado positivamente
Electrones cargados negativamente
Partículas a
La mayoría de las partículas a atravesaban la lámina de oro sin alterar su trayectoria, puesto que la mayor parte del átomo está vacía. Las partículas alfa que pasaban cerca del núcleo (trayectorias representadas en color azul) se desviaban poco. Las partículas alfa que pasaban muy cerca del núcleo (trayectorias de color verde) eran repelidas por este (al tener ambos carga positiva) y se desviaban ángulos mayores de 90°.






5 Uno de los descubrimientos que surgió a partir de la experimentación con tubos de rayos catódicos se debió a las conclusiones de un científico alemán, y a la imagen de la mano de su esposa. Este descubrimiento se usa de forma habitual en medicina. Investiga sobre ello y escribe un párrafo para explicarlo.
6 El mayor problema del modelo de Rutherford era la inestabilidad del electrón, ilustrada en la imagen de la derecha. Explica con tus propias palabras este problema y realiza una infografía con las ideas principales del modelo de Rutherford y su limitación.
7 Busca alguna analogía que sirva para ilustrar la relación entre el tamaño del núcleo y el volumen total del átomo.
En la publicación científica de 1911 en la que Rutherford presentó su modelo para el átomo destacó que en ese momento no era necesario considerar si este podía o no ser estable, puesto que no tenía elementos para determinar la forma en la que los electrones orbitaban alrededor del núcleo.
Además, aludió al trabajo de H. Nagakoa, que había propuesto en 1904 un modelo planetario para el átomo.
El modelo atómico de Rutherford supuso un gran paso en el conocimiento de la estructura de la materia. Los avances posteriores nos permiten tener un modelo más completo del átomo.
En 1913, H. Moseley observó una característica de los átomos que aumentaba al pasar de un elemento químico a otro, si estos estaban colocados en orden de masa creciente. Esta característica se conoce como número atómico (Z ). El propio Moseley estableció que el número atómico correspondía a la carga del núcleo (expresada como un múltiplo de la carga eléctrica elemental, e). Posteriormente, en 1919, E. Rutherford descubrió una partícula nueva que provenía del núcleo del átomo, el protón. La masa del protón es aproximadamente igual a la masa del átomo de hidrógeno y su carga es igual a la del electrón, pero de signo positivo. Podemos concluir que:
• La carga del núcleo corresponde al número de protones.
• El número atómico, Z, es el número de protones de un núcleo.
Carga eléctrica elemental y masa atómica
La carga eléctrica elemental, de símbolo e, es la carga de un protón, equivalente al valor absoluto de la carga de un electrón. Desde mayo de 2019, esta es una constante física fundamental definida exactamente como:
e = 1,602 176 634 · 10–19 C

La unidad de masa atómica unificada, de símbolo u, es una unidad de masa definida exactamente como 1/12 de la masa de un átomo de carbono-12. Esta unidad, conocida también como dalton (Da), es aceptada por el SI y equivale, aproximadamente, a:
1 u ≈ 1,66 · 10–27 kg
Rutherford había establecido, a partir de su modelo atómico, que cada núcleo tenía una carga positiva igual a, aproximadamente, la mitad de su masa atómica; por tanto, debía existir otra partícula en el núcleo sin carga eléctrica, pero con masa. En 1932, J. Chadwick, a partir de los trabajos sobre radiactividad artificial de I. Joliot-Curie (hija de P. y M. Curie), descubrió esta partícula neutra: el neutrón. La masa de un neutrón es aproximadamente igual a la masa de un protón, es decir a la unidad de masa atómica.
Podemos concluir que:
• La masa de un átomo es la masa de su núcleo.
• El número másico, A, es, aproximadamente, la masa del átomo en unidades de masa atómica (u); coincide con la suma del número de protones y neutrones.
El núcleo del átomo está formado por dos clases de partículas de masa parecida: protones, de carga positiva, y neutrones, sin carga.
Se utiliza la notación de la figura de la izquierda para describir el número de partículas que hay en el núcleo de un átomo:
• El número másico, A, es la suma de protones y neutrones.
• El número atómico, Z, corresponde al número de protones.
• El número de neutrones presente en un núcleo corresponde, por tanto, a la diferencia entre el número másico y el número atómico.
Desde 1910 se conoce la existencia de átomos de distinta masa atómica (o distinto número másico, A), pero con idénticas propiedades químicas. Este descubrimiento es debido a F. Soddy, quien en 1913 decidió denominar a estos átomos isótopos (iso, ‘mismo’; topos, ‘lugar’).
Los isótopos son átomos del mismo elemento químico, es decir, con el mismo número atómico (Z ), pero que tienen distinta masa (distinto número másico, A) y, por tanto, diferente número de neutrones.
Debido a la existencia de los isótopos, para referirnos a la masa atómica de un elemento químico no podemos fijarnos únicamente en la masa de un átomo, sino que debemos tener en cuenta la masa atómica promedio de todos los isótopos del elemento. Para calcular su valor, necesitamos conocer la abundancia relativa de cada isótopo; es decir, la proporción de átomos del isótopo respecto del total de átomos del elemento químico, como se muestra en el ejercicio resuelto inferior.
En anayaeducacion.es encontrarás una simulación que te ayudará a comprender mejor los conceptos de isótopo y masa atómica.
En 1964, M. Gell-Mann y G. Zweig propusieron la existencia de los quarks. Estas partículas, de carga fraccionaria (2/3 o 1/3 de la carga del electrón), forman parte de protones y neutrones, por lo que estos no son partículas fundamentales.
Los protones y los neutrones no son partículas fundamentales
Existen seis tipos de quarks, dos de ellos forman protones y neutrones: el quark up (u), cuya carga es +2/3, y el quark down (d), cuya carga es –1/3.
No es posible aislar un quark, pues siempre aparecen unidos a otro, o a otros dos.
Existen otras entidades, los gluones, que mantienen unidos a los quarks.
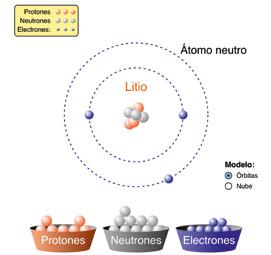
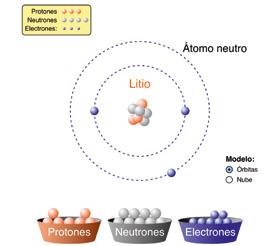
1 Calcula la masa atómica promedio del litio a partir de los datos de la tabla.
COMPRENDE, PIENSA, INVESTIGA...
8 En la página anterior indicamos el valor de la carga eléctrica elemental en el SI. ¿Cuántos protones son necesarios para obtener una carga de 1 C? ¿Qué carga se obtendría con el mismo número de electrones?
9 Calcula el número de átomos de carbono-12 necesarios para obtener una masa de 1 g.
10 Indica el número de protones y neutrones de: 23892U , 19K 40 , 21884Po, 146C, 1H 3 y 4Be 7
11 Calcula la masa atómica promedio de la plata, sabiendo que existen dos isótopos de este elemento: el primero es el 107Ag, de masa 107 u y abundancia de 51,83 %, y el segundo isótopo tiene una masa de 109 u.



Desde la publicación de la teoría atómica de Dalton, se sabía que las sustancias que llamamos sustancias simples están formadas por átomos del mismo elemento químico. Como hemos visto, llegar a conocer las características de esos átomos y qué diferenciaba un tipo de átomo de otro (un elemento químico de otro) ha sido un conocimiento al que se ha llegado, a veces, de forma indirecta; por ejemplo, estudiando el porqué de otros fenómenos, como la electricidad y la radiactividad.
La clasificación actual de los elementos químicos, la tabla periódica, tiene su origen en la publicación de D. I. Mendeleiev en 1869, refrendada por el trabajo de L. Meyer de 1870. Esta clasificación se basa en:


• Colocar los elementos en orden creciente de masas atómicas.
• Ubicar, en la misma columna de la tabla, elementos de propiedades químicas similares.
Una aportación audaz de Mendeleiev a la tabla fue dejar huecos para elementos químicos que no se conocían en la fecha y cuya existencia predijo en función de las características químicas esperadas y de su masa atómica. Con anterioridad a Mendeleiev, algunos científicos ya habían intentado clasificaciones de los elementos químicos. Destacamos entre ellos a Dobereiner quien, entre 1817 y 1829, propuso agrupaciones de tres en tres elementos que presentan una relación entre sus masas atómicas y propiedades químicas parecidas.
Conoce los inicios de la tabla periódica
Localiza los elementos de la imagen en el sistema periódico. ¿Por qué fueron nombrados de esa forma por Mendeleiev?
El criterio de colocación de la tabla de Mendeleiev fue corregido por Moseley, quien concluyó que la ordenación en función del número atómico, que él mismo había descubierto, evitaba ciertas incoherencias en las propiedades químicas.
Todos los avances en investigación que han sucedido a la tabla de Mendeleiev han tenido cabida en la misma, con alguna leve modificación, como veremos en el epígrafe siguiente.
Aportaciones posteriores a la tabla de Mendeleiev
Henry Moseley descubrió el número atómico y lo interpretó como la carga del núcleo del átomo. Su principal contribución a la tabla periódica fue colocar los elementos por número atómico creciente, no por masa creciente.
Mendeleiev, en 1869, predijo la existencia del escandio, del galio y del germanio. Los denominó eka-boro, eka-aluminio y eka-silicio, respectivamente. Fueron descubiertos en 1875, 1879 y 1886.

En el sistema periódico, los elementos químicos están ordenados por número atómico. Como hemos visto, todos los átomos del mismo elemento químico tienen el mismo número atómico; por tanto, los átomos del mismo elemento químico que tienen distinta masa, o número másico (isotopos), se ubicarán en la misma posición en el sistema periódico. La masa atómica que figura en el sistema periódico es la masa atómica promedio de los isótopos de cada elemento.
En el sistema periódico actual los elementos están distribuidos en:
• 18 columnas, denominadas grupos. Todos los elementos del mismo grupo tienen propiedades químicas similares. Como veremos más adelante, las propiedades químicas dependen de la distribución de los electrones de los átomos.
• 7 filas o períodos. Veremos que el número de electrones más externos es idéntico en todos los elementos del mismo período, aunque sus propiedades químicas son muy diferentes.
No todos los grupos ni todos los períodos tienen el mismo número de elementos químicos. Puedes comprobarlo –así como consultar otros muchos datos– en la imagen inferior y en la tabla periódica interactiva que te ofrecemos en anayaeducacion.es
12 Indica el nombre, grupo y período de los elementos Li, Be, B, C, N, O, F y Ne. Inventa una frase para recordar el orden de estos elementos.
13 A partir de la actividad anterior, inventa una regla nemotécnica para memorizar el orden, símbolo y nombre de los elementos de los grupos 1, 2, 13, 14, 15, 16, 17 y 18.
14 Busca los elementos químicos cuyo nombre se debe a un científico. Elabora una tabla con el nombre del elemento, su símbolo y el nombre del científico. ¿Cuántos de ellos están dedicados a mujeres? Consulta la información relativa a las metas fijadas para lograr el objetivo 5 de los ODS y reflexiona sobre cómo ha evolucionado la presencia de la mujer en la investigación en las últimas décadas.
Hasta ahora hemos descrito con bastante detalle el núcleo de los átomos, pero ¿qué ocurre con los electrones?, ¿cómo están ubicados en el átomo? Daremos respuesta a estas preguntas utilizando un nuevo modelo para el átomo, el modelo de Bohr. No obstante, en los siguientes cursos estudiarás que la corteza atómica, la parte del átomo que no es el núcleo, es algo más compleja que lo expuesto en esta unidad.
El modelo atómico de Rutherford presentaba el problema de que el electrón orbitando alrededor del núcleo debería ser inestable según las leyes de la física conocidas hasta el momento.
En 1913, el científico danés N. Bohr dio una explicación a esta circunstancia abriendo la puerta a una nueva rama de la física: la física cuántica. Las principales ideas de Bohr acerca de la corteza del átomo eran:

• Los electrones se encuentran orbitando en unos niveles de energía concretos en el átomo.
• En cada uno de esos niveles, el electrón no emite ni absorbe energía, pero sí lo hace cuando pasa de un nivel a otro. Esta energía absorbida o emitida, corresponde a la diferencia de energía entre los niveles.
En una primera aproximación, el llenado de estos niveles o capas de electrones sigue estas reglas:
• Se completan las capas en orden de menor energía a mayor energía.
• El número máximo de electrones en cada capa corresponde a 2 · n 2 , donde n es 1 para la primera capa, denominada capa K; 2 para la segunda, llamada capa L, y así sucesivamente.
Este modelo de capas solo es válido para las tres primeras capas de electrones, que se muestran en la tabla de la izquierda.
Niveles de energía creciente Modelo atómico de Bohr
Al absorber energía, el electrón pasa a un nivel superior.
Energía
La idea fundamental reside en que no es posible cualquier valor de energía en la corteza del átomo; solo se dan ciertos valores de energía, que corresponden a las órbitas de los electrones. En estas órbitas, el electrón no emite energía, al contrario de lo previsto en la física clásica.
El descubrimiento de la estructura en niveles de energía de la corteza atómica es posterior al establecimiento de la tabla periódica por parte de Mendeleiev, pero puso de manifiesto las relaciones que existen entre dicha estructura y la composición de grupos y períodos:
• Todos los elementos del mismo período tienen el mismo número de capas de electrones.
• Todos los elementos del mismo grupo tienen el mismo número de electrones en su última capa. Estos electrones, denominados electrones de valencia, determinan las propiedades químicas del elemento.
En la segunda regla existe una excepción: los átomos de helio tienen un número diferente de electrones que el resto de los átomos del grupo 18.
Distribución de electrones en niveles de energía
Observa en los dos átomos la distribución de los electrones en capas. ¿Qué semejanza encuentras? Comprueba tu conclusión haciendo la distribución por capas de los electrones de H, Li y Na. Una vez que finalices este apartado, te recomendamos visualizar las presentaciones sobre la estructura del átomo y las configuraciones electrónicas de algunos elementos, así como la simulación «Construye un átomo» disponibles en anayaeducacion.es
Un átomo de nitrógeno, Z = 7, tiene siete electrones: dos en la capa K y cinco en la L.
Un átomo de fósforo, Z = 15, tiene quince electrones: dos en la capa K, ocho en L y cinco en M.
EJERCICIO RESUELTO COMPRENDE, PIENSA, INVESTIGA...
2 Indica la distribución en capas de los electrones de los átomos de helio, neón y argón.
Según el modelo de capas, obtenemos la siguiente distribución.
Para el helio (Z = 2):
Capa K Capa L Capa M
2 Vacía Vacía
Para el neón (Z = 10):
Capa K Capa L Capa M
2 8 Vacía
Para el argón (Z = 18):
Capa K Capa L Capa M
15 ¿Cuántos electrones tiene un catión Na+ y en qué capas están estos electrones? Dato: Z = 11.
16 Escribe la distribución de electrones por capas de los siguientes átomos y de sus respectivos iones:
a) Cl y Cl
b) Al y Al3 +
c) O y O2−
d) Si y Si4 +
17 Elabora una tabla en la que indiques el número de electrones en la capa de valencia y el grupo al que pertenece cada uno de los elementos químicos situados entre el hidrógeno y el argón.
18 A partir de la tabla anterior, infiere cuántos electrones tienen en su última capa los elementos químicos siguientes: Ga, I, Cs y Ca.
7 El descubrimiento de la radiactividad fue un gran avance que impulsó la investigación sobre la estructura de la materia. Hoy en día encontramos aplicaciones de este fenómeno en ámbitos diversos.

Hemos visto que la radiactividad es debida a la desintegración del núcleo de los átomos de gran masa. Ocurre que no todos los isótopos de los átomos pesados presentan este comportamiento, sino que solo lo hacen los denominados isótopos radiactivos, o radioisótopos.
Los isótopos se clasifican en estables, que no emiten radiactividad, y radioisótopos, que son inestables y se transforman en otros núcleos más estables emitiendo radiactividad.
Algunos radioisótopos se encuentran de forma natural en la corteza terrestre, pero otros, que solo existen en otras partes del universo, son creados de forma artificial en la Tierra. Entre los primeros, destacan, por sus aplicaciones: 238U, 40K, 232Th, 226Ra, 222Rn, 218Po, 14C, 3H y 7Be. Los radioisótopos artificiales se producen, en la actualidad, en aceleradores de partículas, con fines concretos. El primero de ellos fue el 30P, obtenido por el matrimonio Joliot-Curie en 1934.
La radiación de los radioisótopos artificiales se usa en medicina, para:
• El diagnóstico de enfermedades (radiología y medicina nuclear), ya que la radiación hace posible la obtención de imágenes de tejidos y órganos.
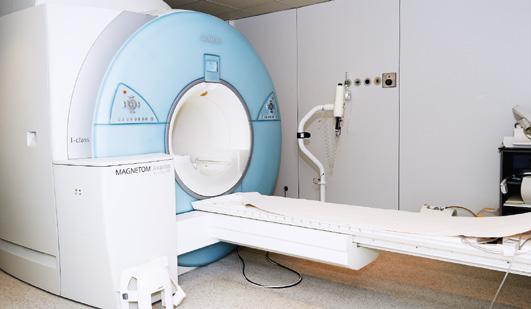
• El tratamiento de enfermedades (radioterapia), generalmente tumores, pues la radiación tiene la capacidad de destruir las células cancerígenas.
Física de partículas y aplicaciones médicas
Radioterapia Radiología y medicina nuclear
Existen distintos tipos de radioterapia: la braquiterapia consiste en la colocación de fuentes radiactivas encapsuladas dentro del propio tumor; la teleterapia, por otra parte, consiste en irradiar los tejidos cancerosos con rayos gamma, rayos X, electrones o iones de distinto tipo.
El diagnóstico por imagen tiene una importancia fundamental en la detección de diferentes enfermedades. Algunos métodos se benefician de las mejoras técnicas provenientes de los detectores de partículas que se utilizan en el LHC, acelerador de partículas del CERN.
Los procesos nucleares implicados en la liberación de la energía del núcleo son de dos tipos diferentes:
• Fisión, en la que un núcleo de gran masa, al ser bombardeado con neutrones, se convierte en radiactivo y se descompone en dos núcleos, desprendiendo gran energía y emitiendo a su vez neutrones. Estos neutrones provocan más fisiones, que dan lugar a una reacción en cadena.
Los neutrones inciden en otros núcleos y se produce la reacción en cadena.

• Fusión, en la que dos núcleos ligeros se unen formando uno más pesado y desprendiendo energía. Para que tenga lugar, hay que vencer la repulsión entre los núcleos ligeros de carga positiva, lo que a su vez requiere de energía.

Aporte de energía
Reactor de fisión nuclear de una central nuclear. El interior del reactor solo es visible cuando se procede a la sustitución de las varillas de combustible.
Los núcleos se unen formando otro más pesado.


19 Indica el número de protones y neutrones de los radioisótopos naturales 14C y 3H. Compáralo con el número de protones y neutrones de los isótopos estables de estos elementos: 12C y 1H. Extrae conclusiones acerca de la relación entre el número de protones y neutrones de un núcleo y su estabilidad.
20 ¿Por qué la reacción de fisión nuclear del 23592U es una reacción en cadena? Elabora un dibujo con esta idea a partir del detalle de la reacción nuclear de la figura.
21 Organizo y defiendo la postura. Investiga sobre la fusión fría. ¿Crees que aportaría una solución al problema energético? Las primeras evidencias experimentales de este fenómeno están rodeadas de polémica; ¿cómo afectan hechos como este al desarrollo de la ciencia?
22 La radiactividad tiene múltiples aplicaciones en numerosos ámbitos de la sociedad: medicina, industria, investigación, etc. Indaga y haz un listado de profesiones relacionadas con aplicaciones de los radioisótopos.
Introducción
Hemos visto que todos los átomos están formados por la combinación de tres partículas subatómicas: el protón, el neutrón y el electrón. En este apartado te proponemos que construyas átomos e iones diferentes combinando el número adecuado de partículas subatómicas.

Para ello, utilizaremos la simulación «Construye un átomo» que encontrarás en el banco de recursos de anayaeducacion.es, y trabajaremos en equipo, intercambiando propuestas y resultados con nuestros compañeros y compañeras de clase.
Los átomos son neutros porque tienen el mismo número de protones, con carga positiva, que de electrones, con el mismo valor de carga, pero negativa.
Los iones tienen distinto número de protones que de electrones; por ello, no son eléctricamente neutros. Hay núcleos estables y otros que no lo son. Esto depende del número de protones y neutrones de su núcleo.
Experimenta
Elabora fichas
Inventa varios conjuntos de número de protones, neutrones y electrones, y pide a tus compañeros y compañeras que indiquen si se trata, en cada caso, de un átomo o un ion, la carga del ion, el número atómico, el número másico y si es un núcleo estable o inestable.
Para ello, elabora fichas con cada combinación de datos, recogiéndolos en una tabla.

Puedes intercambiar las fichas con tus compañeros y compañeras y completar los datos que faltan antes de utilizar la simulación.
Puedes elaborar series de fichas para un mismo elemento químico, manteniendo constante el número de protones, y haciendo combinaciones con diferente número de electrones; con esto, irás obteniendo iones. Si varías el número de neutrones, obtendrás distintos isótopos.
Tres protones, dos electrones y cuatro neutrones: se trata de un catión de litio con número másico igual a siete.
Tres protones, tres electrones y cuatro neutrones: se trata de un átomo de litio con número másico igual a siete.
Tres protones, tres electrones y tres neutrones: se trata de un isótopo del litio con número másico igual a seis.
Planteamiento del problema. Objetivo
El objetivo de esta práctica es constatar que la materia se compone de partículas que están en continuo movimiento.
Preliminares
Antes de seguir leyendo, reflexiona sobre cómo se mezcla una sustancia líquida con otra; por ejemplo, la tinta de un rotulador en agua.
Nuestra propuesta
La materia es discontinua. Por ello, al mezclar dos sustancias, líquidas o gaseosas, cada una de ellas puede penetrar en la otra. Comprobemos esta hipótesis utilizando tinta y agua.
Material
• Vasos de precipitado • Rotuladores o cartuchos de pluma estilográfica • Agua • Alcohol etílico o etanol • Cronómetro • Varilla de vidrio • Cámara fotográfica (opcional).
Orientaciones para la realización de la experiencia
• Llena dos vasos de precipitados; uno con agua y otro con alcohol. Intenta que los volúmenes de líquido sean iguales en ambos casos. Colócalos en una superficie lisa y espera a que el movimiento del líquido en el interior de los vasos cese. Para asegurarte de que este movimiento ha terminado, lo más recomendable es que llenes los vasos con al menos un día de antelación a la realización de la práctica.

• El líquido debe estar en absoluto reposo, pues el objetivo es comprobar que existe movimiento en la materia debido al propio movimiento de las partículas que la forman. Por eso, el movimiento del líquido supone un factor adicional que no queremos considerar.



1 ¿Cómo crees que influiría en tu observación una agitación del líquido?
2 ¿Qué diferencias has encontrado entre el vaso con alcohol y el vaso con agua?
3 Busca información sobre las propiedades del agua y las del alcohol y explica las diferencias que has observado. Fíjate sobre todo en la propiedad «tensión superficial».
4 ¿Qué conclusiones puedes sacar después de haber realizado este trabajo práctico?
• Una vez han transcurrido las 24 horas de reposo de los líquidos, añade unas gotas de tinta del cartucho, del rotulador o de la pluma estilográfica, en cada vaso.
• En ese momento, pon en marcha el cronómetro y observa lo que sucede. Si quieres, puedes colocar una cámara fotográfica frente a los vasos e ir tomando fotografías cada cierto intervalo de tiempo. Esto puede servirte para observar cómo se produce la difusión de la tinta en cada líquido a lo largo del tiempo.
• Registra tus observaciones tomando notas. Ten en cuenta que el tiempo que ha de transcurrir para observar el final de este fenómeno de mezcla completa puede ser de varias horas.
5 Repite la experiencia con agua y tinta provocando un movimiento circular en el vaso; ¿qué observas?
6 Busca información sobre el movimiento browniano y relaciónalo con lo observado en la práctica.
Organiza tus ideas Mapa conceptual sistémico
1-2-4. Copia el esquema en tu cuaderno e incluye nuevas ramas y recuadros según estas actividades.
1 Completa los nombres de los tipos de ion aludidos en las etiquetas 1 y 2.
2 Indica el tipo de carga en la etiqueta 3.
3 Indica por qué los átomos son eléctricamente neutros a partir de la etiqueta 4.
4 Indica la masa de los protones en la etiqueta 5.
5 Indica la masa de los neutrones en la etiqueta 6.
6 Pon un ejemplo de isótopos en la etiqueta 7.
4 Los átomos
son los constituyentes de toda la son Materia ...................
Protones
formado por con carga
Número atómico, Z
Positiva y caracteriza a cada
Núcleo Corteza Electrones Neutrones su número más el número de protones se llama Isótopo Y caracteriza a cada 7
constan de si se ceden si se ganan
donde se encuentran los con carga
1
5 3 2
Número másico, A 6
Recuerda que dispones de las soluciones de todas las actividades numéricas en anayaeducacion.es
Primeras ideas sobre el átomo
1 Indica si las siguientes afirmaciones son verdaderas (V) o falsas (F):
a) La idea de átomo es original del científico inglés Dalton.
b) En la teoría atómica de Dalton no se da explicación alguna a las reacciones químicas.
c) Según Dalton, los átomos son inmutables; es decir, no cambian.
d) La palabra átomo significa «diminuto, infinitesimal».
2 Si la materia está formada por átomos, ¿qué hay entre los átomos de las distintas sustancias del aire?
De la naturaleza eléctrica de la materia al primer modelo atómico
3 Busca información y explica la analogía del «bollo con pasas» y el modelo atómico de Thomson.


4 Indica si las siguientes afirmaciones acerca del descubrimiento del electrón son verdaderas o falsas. Justifica tu respuesta:
a) Thomson propuso la existencia del electrón y calculó su masa y su carga eléctrica.
b) Considerando únicamente las conclusiones de Thomson no se puede explicar la naturaleza eléctrica de la materia.
c) Las características de los rayos catódicos dependen del gas que se introduzca en el tubo de descarga.
De la radiactividad al modelo nuclear del átomo
5 ¿Cuál es la principal diferencia entre el modelo atómico de Rutherford y el de Thomson? ¿Explican estos modelos la formación de iones? Justifícalo.
6 Responde brevemente sobre las conclusiones y las hipótesis de Rutherford:
a) ¿Por qué esperaba Rutherford que las partículas alfa no se desviaran de su trayectoria al atravesar la fina lámina de oro?
b) ¿Qué explicación dio al hecho de que algunas partículas se desviaran de su trayectoria?
c) ¿Cuál es la explicación para las que no se desvían de la trayectoria?
El núcleo del átomo
7 Completa la tabla:












8 Calcula la masa atómica promedio del cobre a partir de estos datos:
Vamos a realizar la autoevaluación de esta última parte del desafío. Descarga la rúbrica que te ofrecemos en anayaeducacion.es, complétala y pide a dos personas que te evalúen. Cuando evalúes a otras personas, ofréceles ideas de cómo mejorar.
Realiza la autoevaluación competencial incluida en anayaeducacion.es
Clasificación de los elementos químicos
9 En el sistema periódico que utilizamos en la actualidad, ¿qué criterios se utilizan para colocar los elementos químicos?
10 ¿Todos los grupos del sistema periódico tienen el mismo número de átomos? Explícalo brevemente.

La corteza del átomo
11 Indica si las siguientes afirmaciones son verdaderas o falsas, y justifica tu respuesta:
a) Según el modelo atómico de Rutherford la materia era neutra, pues, aunque existieran los electrones, con carga negativa, el núcleo del átomo tenía carga positiva y la compensaba.
b) Según el modelo de Bohr, los electrones no orbitan en cualquier valor de energía, sino en unas órbitas definidas.
c) Según Rutherford, la mayor parte del átomo es espacio vacío.
Radiactividad
12 Dibuja un mapa conceptual de araña con las aplicaciones de la radiactividad en medicina utilizando los términos que has aprendido en la unidad.
© GRUPO ANAYA, S.A., 2023 - C/ Valentín Beato, nº 21 - 28037 Madrid.
Reservados todos los derechos. El contenido de esta obra está protegido por la Ley, que establece penas de prisión y/o multas, además de las correspondientes indemnizaciones por daños y perjuicios, para quienes reprodujeren, plagiaren, distribuyeren o comunicaren públicamente, en todo o en parte, una obra literaria, artística o científica, o su transformación, interpretación o ejecución artística fijada en cualquier tipo de soporte o comunicada a través de cualquier medio, sin la preceptiva autorización.