FÓSFORO SOBRE LA ARQUITECTURA

RADICAL DE RAPS, AMARANTO Y QUÍNOA
Effect of phosphorus on radical architecture of canola, amaranth and quinoa
1Departamento de Ciencias Agropecuarias y Acuícolas, Facultad de Recursos Naturales, UniversidadCatólicadeTemuco(UCTemuco).Temuco,Chile.
2Scientific and Technological Bioresource Nucleus, Universidad de La Frontera (UFRO). Temuco, Chile.
3NúcleodeInvestigaciónenProducciónAlimentaria,UCTemuco.Temuco,Chile.
4InstitutodeInvestigacionesAgropecuarias,INIACarillanca,CasillaPostal929.Temuco,Chile.

*Autorparacorrespondencia:ccastill@uct.cl
ABSTRACT
Soils derived from volcanic ash have low levels of available phosphorus (P) and high fixation capacity.TouseunavailablesourcesofP,plantsdevelopdiverseadaptativemechanisma including changes in root architecture. The objective of this study was to evaluate the root architecture of canola, amaranth and quinoa at early stages of development in a fertilized Andisol under controlled conditions. In a growth chamber a bioassay was established in pots using two treatments: without (P0) and with fertilization (P1) using amaranthus and quinoa as ancestral crops jointly to canola which is commonly incorporated in short rotations with wheat. Plants were harvested at 61 days after establishment (DAE) for canola and 49 DAE and 56 DAE for amaranth and quinoa, respectively. Significant differences in canola root architecture parameters were observed. On the contrary, in amaranth and quinoa no differences were observed due to the application of phosphate fertilization to Andisol. It is concluded that the ancestral crops, amaranth andquinoa,wouldbebetteradaptedtosoilnutritionalstresses.
Key words:rootlength,roothairs,rootdiameter,rootdensity.
25 | INNOVAGRO | agronomia.uct.cl
Claudia Castillo1,3*, Constanza Borkowski1, Sacha Debouzy1, Pedro Campos4, Jaime Solano1 , GustavoCuraqueo1,FernandoBorie1,2
INTRODUCCIÓN
En el sur de Chile, losAndisoles derivados de cenizas volcánicas mediante meteorización del material parental desarrollan estructuras no cristalinas y complejos aluminio-humus quedefinenpropiedadescomocargavariable, alta capacidad de fijación de fósforo (P) superior al 85%, baja densidad aparente con gran volumen de porosa distintospotenciales mátricos, formación de agregados estables y alto contenido de materia orgánica (MO) (Jensen et al., 2019). La baja disponibilidad de P en estos suelos está determinada por acumulación de formas orgánicas de P (Borie et al., 2019) que representan entre 30% a 90% del P total del suelo (Campos et al., 2018). A nivel mundial, para corregir deficiencias de P para los cultivos se aplican elevadas cantidades de fertilizantes fosfatados sintetizados a partir de rocas fosfóricas, un recurso no renovable. Además, la producción mundial de alimentos requiere anualmente gran demanda de P utilizándose alrededor de 148 millones de toneladas de roca fosfórica con proyecciones que señalan que en 75 a 100 añosseagotarádichorecursocomenzandoun serio desabastecimiento (Pradel y Aissani, 2019).
Cuando se aplica un fertilizante como el superfosfato al suelo, el fosfato monocálcico altamente soluble (CaH2PO4)4 reacciona rápidamente con el carbonato de calcio (CaCO3) para formar fosfato dicálcico y nuevamente reacciona con CaCO3 para formar fosfato tricálcico, experimentando una
serie de reacciones físico-químicas hasta volverse aún más insoluble, llegando a nivelessobre1000vecesmásinsolublequelos fosfatos tricálcicos recientemente formados (Hasan etal.,2016).
El P es un nutriente que debe estar disponible en cantidades adecuadas durante la etapa temprana de crecimiento del cultivo para que el rendimiento sea óptimo. Sin embargo, las plantas absorben sólo una pequeña fracción del fertilizante fosfatado aplicado y el resto del P se acumula en el suelo quedando potencialmente disponible para ser absorbido por cultivos de años siguientes. Por falta de conocimientos adecuados, los agricultores tienden a utilizar elevadas cantidades de fertilizantes fosfatados durante la temporada de cultivo (Mahdi et al., 2011). Sinembargo, la aplicación a gran escala de fertilizantes no es económicamente sostenible y puede conducir a la contaminación ambiental, por precipitaciones o pérdidas permanentes a través de erosión por viento y agua que producen graves daños ambientales, como contaminación de acuíferos (Cocozza et al., 2020). La Organización de las Naciones Unidas (ONU) para la Alimentación y la Organización Agrícola (FAO) estiman que las plantas, como promedio sólo absorben aproximadamenteentreel20%a30%de Pdel fertilizante aplicado cada año (Syers et al., 2008).
Cuando las plantas sufren estrés por bajo contenido de P tienden a desarrollar mecanismos adaptativos especiales que
26 | INNOVAGRO | agronomia.uct.cl
mejoran la absorción y utilización de P (López-Bucio et al., 2003), entre los que destacan cambiosen la arquitectura de la raíz, esdecir, reducción en el crecimiento de la raíz primaria y formación de másraíceslateralesy pelos radicales (PR) (Bastanib y Hajibolanda, 2017). Estas estrategias permiten aumentar la adquisición de P mejorando la capacidad y eficiencia en la exploración de suelo (Borie et al., 2019) mediante modificaciones de la arquitectura de las raíces en parámetros como área superficial, longitud de raíz, longitud y diámetro de PR (Pang et al., 2018). Los PR son importantes para la absorción de nutrientes, ya que aumentan el área superficial de la raíz incrementando el volumen de suelo explorado por unidad de raíz (Cabeza y Claassen, 2017). Según Lambers et al. (2006), especies que desarrollan mayor número de PR y/o más largos, son más eficientes para acceder al P disponible del suelo y desde los intersticiosomicroporos.

En la zona Centro-Sur del país, un cultivo habitual que se utiliza como pre cultivo en rotaciones cortas con trigo es raps (Brassica napus), oleaginosa importante para la producción de aceite de canola. A nivel mundial, se cultiva ampliamente siendo la segunda fuente de cultivo de aceite vegetal para consumo humano, después de soja (Wang y Lambers, 2020). Brassica napus es particularmente sensible a la deficiencia de P requiriendo grandes cantidades para un
crecimiento y desarrollo óptimo. Además, es un cultivo no micorrícico perteneciente a las crucíferas y que no forma raíces proteoídeas (Marschner,1995).
Una alternativa de agricultura sostenible podría ser la incorporación de cultivos ancestrales llamados reutilizables, como amaranto y quínoa, que reintegran P al suelo apartirdesusresiduos. Además,alestablecer estos cultivos como pre cultivos en rotaciones cortas con trigo presentarían el potencial necesario para incrementar significativamente las cantidades de P disponible en el suelo requerido por el cereal (Serri et al., 2017).
Además de mejorar la fertilidad por los bajos requerimientos de fertilizante permite a la vez, mayor disponibilidad del nutriente para el cultivo siguiente en la rotación (Büchi et al., 2018).
El objetivo del trabajo fue comparar, en condiciones controladas el efecto de la aplicación de P-fertilizante sobre la arquitectura radical en estadios tempranos de desarrollo de cultivos de raps, amaranto y quínoaestablecidosenunAndisol.
MATERIALES Y MÉTODOS
El estudio se realizó en los laboratorios de Cultivo de Tejidos Vegetales y de Suelos y Nutrición Vegetal del Departamento de Ciencias Agropecuarias y Acuícolas, ubicado en el campus San Juan Pablo II de la UC Temuco. El sustrato utilizado correspondió a

27 | INNOVAGRO | agronomia.uct.cl
unAndisol serie Temuco (9,68mg POlsen kg1) mezclado con arena de río en proporción suelo:arena (70:30). Los cultivos utilizados fueron: a) raps (B. napus) cv. ‘Phoenix’ como pre cultivo de referencia comúnmente usado en rotaciones cortas con trigo (Triticum aestivum); b) amaranto (Amaranthus spp.) y c) quínoa (Chenopodium quinoa) cv. ‘Regalona’ . Las semillas de los tres cultivos se desinfectaron y se colocaron en placas Petri para germinación en cámara de crecimiento a 20°C por 7 d (fotoperiodo de 16 h luz y 8 h de oscuridad). Los tratamientos fueron dos: sustrato sin adición de P (P0) y sustrato fertilizado con P equivalente a 65,5 kg ha-1 (P1) en forma de KH2PO4. Para el establecimiento del bioensayo se utilizaron contenedores plásticos de 2 L de capacidad donde se colocó una semilla pre germinada por contenedor manteniéndolos en cámara de crecimiento hasta la finalización del ensayo. Cada 15 d, las macetas se regaron con solución nutritiva de Hewitt exenta de P. La cosecha se realizó a los 61 días después del establecimiento (DDE) en estado fenológico “desarrollodehojas”pararapsyenelcasode los cultivos ancestrales, a los 49 DDE y 56 DDS para amaranto y quínoa, respectivamente.
A la cosecha se midieron parámetros de arquitectura radical como longitud total de raíces (LTR) (cm) y diámetro promedio de raíz (mm) mediante imágenes obtenidas
utilizando escáner (Epson, Expression 11000 XL)quefueronposteriormenteanalizadascon el software WinRhizoTM (Regent Instrument, Quebec, Canadá). WinRhizo™ es un software comercial, de código cerrado lanzado en 1993 (Arsenault et al., 1995) que se basa en el principio de estandarizar el uso de escáneres de escritorio, con analizador de imágenes que usan algoritmos. Está destinada como herramienta que permita a los investigadores rutinariamente medir raíces de plantas con la finalidad de responder a una variedad de preguntas biológicas. El software en sí es de fácil uso, rápido, generalista, que facilita la estandarización de medidas arquitectónicas y morfológicas de la raíz (Seethepalli et al., 2021).
La longitud de raíz específica (m g-1) se calculó como LTR por unidad de peso seco (PS) de raíz y la densidad de raíces (cm mL-1) como LTR (cm) por unidad de volumen (mL) ocupadoenelcontenedor.

Para las mediciones realizadas a los PR (longitud, volumen y densidad) se utilizó el escáner EasyScan One (Motic, China) y el softwareMoticDigitalSlideServer.
Las raíces se mantuvieron en agua destilada a 4°C, luego que las plantas fueron cosechadas. Se escogieron al azar cinco raíces a las que se eliminaron los primeros 4 cm de la zona apical para raps y 2 cm, en el caso de amaranto y quínoa (zona donde no se evidencia crecimiento de PR). De la zona de

28 | INNOVAGRO | agronomia.uct.cl
maduración de la raíz, se cortaron cinco trozosde1cmquesecolocaronextendidos en unportaobjeto,selesañadióunagotadeagua destilada, para mantener la humedad y se cubrieron cuidadosamente con un cubreobjeto eliminando burbujas de aire (Figura1).


de 80x y resolución estándar. Para determinar la longitud promedio de PR, de cada trozo de raíz de 1 cm, se escogieron al azar tres PR distribuidos homogéneamente en la raíz principal y se midieron con ayuda del software (Figura 2A), obteniendo un total de 15 (3x5) observaciones de PR, por repetición. Del promedio de mediciones se obtuvo longitud promedio de PR. Para calcular la densidad de PR se seleccionó aleatoriamente en cada uno de los cinco trozos de raíces, una zona de 1 mm de largo, en la cual se contabilizó la cantidad de PR obteniéndose número de PR promedio por cm de raíz (Figura 2). La longitud de raíz específica (LRE) se calculó como LTR (m) por unidad de PSderaíz(mg-1).Paradeterminarelvolumen del cilindro de PR se utilizó metodología descrita por Pang et al. (2018) como volumen del cilindro que encierra la raíz y la zona del PR,deacuerdoconEcuación1.


Figura 1. Protocolo para mediciones de PR: selecciónderaíces(A); portaobjetoconraízen agua (B); escáner EasyScan One, Motic en el que se procesaron las muestras (C); selección de área a escanear con procesamiento de imagen(D).


Finalmente, los portaobjetos se llevaron al escáner donde se digitalizaron con aumento
VolumencilindroPR(cm3)=π[(diámetroraíz promedio(cm)/2)+longitudPR(cm)]2 *LTR (cm) (Ecuación1)
29 | INNOVAGRO | agronomia.uct.cl
A B C D
En el bioensayo se empleó un diseño experimental completamente al azar con dos tratamientos (P0 y P1) y seis repeticiones, que hizo un total de 12 unidades experimentales por cultivo. Para el tratamiento estadístico de los datos se verificó normalidad y posteriormente, se realizó un análisis de varianza usando ANDEVA de una vía, seguido por la prueba T-Student (p ≤ 0,05) de comparación de medias, utilizando el software R Studio para Windows versión 4.1.1.
RESULTADOS Y DISCUSIÓN
La aplicación de fertilizantes fosfatados es importanteparalaproducciónde cultivospor la baja biodisponibilidad de P para las plantas, tanto en suelos ácidos como calcáreos. Aunque raps, generalmente es sensible a la deficiencia de P, diferentes cultivares varían ampliamente en este aspecto. En general, la eficiencia de P en raps se debería a un sistema radical mejor




30 | INNOVAGRO | agronomia.uct.cl
Figura 2. ImágenesobtenidasconelsoftwareMoticDigitalSlideServerenresoluciónestándar,con aumento de 80x para mediciones de longitud promedio (A) y densidad de pelos radicales (B) en raícesderaps,amaranto(C)yquínoa(D).
A B C D
desarrollado, así como a una absorción más eficientedelnutriente(Hu etal., 2010). En el bioensayo de raps se observaron diferencias significativas en la mayoría de los parámetros medidos de arquitectura radical. El tratamiento P1 incrementó LTR en alrededor de 108% sobre P0 (Cuadro 1). Estos resultados concuerdan con los informados por Duan et al. (2020) quienesen plantas de B. napus observaron que la LTR se reducía significativamente en suelos deficitarios en P. Además, el diámetro de la raíz en P1 incrementóenalrededorde20%sobreP0, con este último tratamiento presentando más raíces finas. En general, en ambos tratamientos predominaron las raíces finas (0 mm a 0,25 mm) mientras que, las raíces gruesas (0,75 mm a 1 mm) se observaron en mayor porcentaje en P1. En relación a la longitud de raíz específica (LRE) los resultados mostraron que P0 presentó mayor longitud de raíz por gramo de peso seco. En relación con la densidad de raíces, el tratamiento P1 resultó significativamente mayor respecto a P0, lo que indicaría que P1 ocupó mayor volumen radical en el contenedor para facilitar la captación de P del fertilizante. Si bien, las plantas sin adición de P mostraron menor crecimiento radical se pudo observar que la longitud y número de PR (Cuadro 1) fue significativamente mayor que en P1, incrementando ambos parámetros en 84% y 115%, respectivamente. Estos
resultados concuerdan con lo informado por Cabeza y Claassen (2017) quienes observaron que deficiencias de P incrementaron el desarrollo de PR. Por otra parte, en unensayo realizado en solución por Hu et al. (2010) con dos cultivares de raps, uno eficiente y otro no eficiente en la absorción de P, al evaluar cambios producidos en la arquitectura radical, el cultivar P-eficiente bajo estrés de P desarrolló raíces más largas y PR densos, lo que resultó en la formación de una arquitectura de raíces mejorada y con una absorciónmáseficientedeP.

En relación con la arquitectura radical de los cultivos ancestrales, se observaron diferencias por aplicación de la fertilización fosfatada sólo en algunos parámetros de amaranto como diámetro radical, donde el tratamiento P0 fue significativamente más alto que P1 y con un mayor volumen de PR, similar a lo observado en quínoa (Cuadro 1). Estos cultivos al requerir menor fertilización podrían ser incorporados como pre cultivos en rotaciones cortas con trigo ya que proporcionan beneficios ambientales y financieros por reducción en la aplicación de fertilizantesdePinorgánicos.

31 | INNOVAGRO | agronomia.uct.cl
Cuadro 1. Arquitecturaradicaldeamaranto,quínoayrapsalacosecha.
Letras diferentes en cada columna indican diferencias significativas según prueba T-Student (p ≤ 0,05).
LTR: longitud de raíz total; Dr: diámetro de raíz promedio; LRE: longitud de raíz específica; dr: densidad de raíces; LPR: longitud promedio pelos radicales; N° PR: número pelos radicales; Volumen PR: volumen del cilindro de pelos radicales. P0 (exento P) y P1 (adicionado de P).
Kakabouki etal. (2019)enunensayorealizado en campo con quínoa (Ch. quinoa Willd. cv. ‘Faro’) observaron que durante los primeros 50 DDS, el desarrollo del sistema radical fue lentoconunarápidatasadecrecimientoantes del comienzo de la antesis (75 DDS), transición vegetal entre crecimiento vegetativo y reproductivo y finalmente, el crecimiento aumentó casi linealmente hasta el final de la antesis y comienzo del desarrollo del fruto. A los 50 DDS, ellos informaron una LTR de aproximadamente 700 cm en 2 L, valor que resulta menor al encontrado en este estudio (2.200 cm en 2 L), diferencias que probablemente surgen por las condiciones donde se implementaron los dos ensayos (campo y cámara de crecimiento) y por el cultivarutilizadoenelensayo.
Las raíces son fundamentales para comprender y solucionar desafíos globales
como el impacto del cambio climático en las comunidades de plantas y en la seguridad alimentaria. Desde una perspectiva agrícola, la creciente demanda de alimentos, con el aumento en los costos de producción, la intensificación agrícola y el agotamiento de los recursos finitos tendrán efectos adversos en las perspectivas de la seguridad alimentaria (Godfray et al., 2010). Los cultivos con arquitectura de raíz optimizados son considerados importantes para la seguridad alimentaria futura pudiendo mejorar la productividad y sostenibilidad agrícola. Por último, la rizosfera se considera el espacio clave para el descubrimiento futuro de nuevascaracterísticas de raíces relevantesque permitan aumentar la productividad de los cultivos. Por tanto, una mejor comprensión y caracterización de la arquitectura de raíces permitirá un mayor conocimiento de los procesos ecosistémicos subyacentes que
32 | INNOVAGRO | agronomia.uct.cl
Parámetro Amaranto Quínoa Raps P0 P1 P0 P1 P0 P1 LTR(cm) 2005a 2252a 2178a 2206a 1255b 2641a Dr(mm) 0,98a 0,37b 1,05a 0,89a 0,28b 0,34a LRE(mg-1) 37,8a 40,5a 52,0a 55,4a 80,2a 54,3b dr(cmmL-1) 1,02a 1,15a 1,11a 1,12a 0,64b 1,35a LPR(mm) 0,25a 0,26a 0,24a 0,22a 0,35a 0,18b N°PR(cmraíz-1) 148a 158a 40a 59a 262a 115b VolumenPR(cm3) 22,1a 13,9b 40,7a 31,3b 9,0a 9,5a
ocurren en los agroecosistemas (Tracy et al., 2020).
CONCLUSIONES
Las plantas de raps no adicionadas de P mostraron menor crecimiento radical con raíces finas, PR más largos y densos que las plantas fertilizadas; comportamiento que probablemente corresponda a un mecanismo de respuesta desarrollado por raps frente al estrés por déficit de P en el suelo.
En la arquitectura radical de los cultivos ancestrales, amaranto y quínoa, no se encontraron diferencias con la fertilización fosfatada del Andisol. Los resultados podrían revelar que estos cultivos estarían adaptados al estrés nutricional del suelo, contrario a lo observadoenraps.
Elestudiodelaarquitecturaradical delos tres cultivos fue posible por la implementación de los programas computacionales WinRhizoTM y Motic Digital Slide Server que analizan imágenes obtenidas del escaneo de las raícesdelasplantas.

AGRADECIMIENTOS
Se agradece al proyecto FONDECYT
Nº1191551 “How precedent non-mycorrhizal crops affect soil P bioavailability, physiological root traits, and mycorrhizal
symbiosis of wheat in a rotation system in volcanic soils of Chile”, ANID, Chile, por el financiamiento otorgado para la ejecución del estudio.
LITERATURA CITADA
Arsenault, J.L., Poulcur, S., Messier, C., and Guay, R. 1995. WinRhizo™, a root measuring system with a unique overlap correction method. HortScience 30:906D–906.
Bastanib,S., andHajibolanda, R. 2017. Uptake and utilization of applied phosphorus in oilseed rape (Brassica napus L. cv. Hayola) plants at vegetative and reproductive stages: Comparison of root with foliar phosphorus application. Soil Science and PlantNutrition 63(3):254–263.

Borie, F., Aguilera, P., Castillo, C., Valentine, A.,Seguel,A.,Barea,J.M.,andCornejo,P. 2019. Revisiting the nature of phosphorus pools in chilean volcanic soils as a basis for arbuscular mycorrhizal management in plant P acquisition. Journal of Soil ScienceandPlantNutrition 19:390-401.
Büchi, L., Wendling, M., Amossé, C., Necpalova, M., and Charles, R. 2018. Importance of cover crops in alleviating negative effects of reduced soil tillage and promoting soil fertility in a winter wheat cropping system. Agriculture, Ecosystems andEnvironment 256:92-104.
33 | INNOVAGRO | agronomia.uct.cl
Cabeza, R., y Claassen, N. 2017. Sistemas radicales de cultivos: extensión, distribución y crecimiento. Agro Sur 45(2):31-45.

Campos, P., Borie F., Cornejo, P., López-Ráez, J., López-García, A., and Seguel, A. 2018. Phosphorus acquisition efficiency related to root traits: is mycorrhizal symbiosis a key factor to wheat and barley cropping? FrontiersinPlantScience 9:752.
Cocozza, C., Brilli, F., Pignattelli, S., Pollastri, S., Brunetti, C., Gonnelli, C., et al. 2020. The excess of phosphorus in soil reduces physiological performances over time but enhances prompt recovery of salt-stressed Arundo donax plants. Plant Physiology and Biochemistry 151:556-565.

Duan, X., Jin, J., Ding, G., Wang, C., Cai, H., Wang, S., White, P.J., Xu, F., and Shi, L. 2020. The impact of different morphological and biochemical root traits on phosphorus acquisition and seed yield of Brassica napus Field Crops Research 258:107960.
Godfray, C.J., Beddingtonian, J.R., Crute, R., Haddad, L., Lawrence, D., J.F., Muir, J.F., Pretty, J., Robinson, Thomas, S.M., and Toulmin, C. 2010. Food Security: the challenge of feeding 9 billion people. Science 327(5967):812-818.
Hasan, Md. Mahmudul, Hasan, Md. Mainul, Teixeira da Silva, J., and Li, X. 2016. Regulation of phosphorus uptake and
utilization: transitioning from current knowledge to practical strategies. Cellular andMolecularBiologyLetters 21:7.
Hu, Y., Ye, X., Shi, L., Duan, H., and Xu, F. 2010. Genotypic differences in root morphology and phosphorus uptake kinetics in Brassica napus under low phosphorus supply. Journal of Plant Nutrition 33:889–901.
Jensen, L. C., Neira-Albornoz, A., and Escudey, M. 2019. Herbicides mechanisms involved in the sorption kinetic of ionisable and non ionisable herbicides: impact of physical/chemical properties of soils and experimental conditions. In: Kinetic modeling for environmental systems.IntechOpen.
Kakabouki, I.P., Roussis, I., Hela, D., Papastylianou, P., Folina, A., and Bilalis, D. 2019. Root growth dynamics and productivity of quinoa (Chenopodium quinoa Willd.) in response to fertilization and soil tillage. Folia Horticulturae 31(2):285-299.
López-Bucio, J., Cruz-Ramírez, A., and Herrera-Estrella, L. 2003. The role of nutrient availability in regulating root architecture. Current Opinion in Plant Biology 6:280-287.
Lambers, H., Shane, M., Cramer, M., Pearse, S., and Veneklaas, E. 2006. Root structure and functioning for efficient acquisition of phosphorus: matching morphological and
34 | INNOVAGRO | agronomia.uct.cl
physiological traits. Annals of Botany 98:693-713.
Mahdi, S.S., Hassan, G.I., and Hussain, A. 2011. Phosphorus availability issue- its fixationandroleofphosphatesolubilizing bacteria in phosphate solubilization. Research Journal of Agricultural Science 2:174–179.
Marschner, H. 1995. Mineral nutrition of higherplants.AcademicPress.London.
Pang, J., Bansal, R., Zhao, H., Bohuon, E., Lambers, H., Ryan, M., Ranathunge, K., and Siddique, K. 2018. The carboxylatereleasing phosphorus-mobilizing strategy can be proxied by foliar manganese concentration in a large set of chickpea germplasm under low phosphorus supply. NewPhytologist 219:518-529.
Pradel, M., and Aissani, L. 2019. Environmental impacts of phosphorus recovery from a “product” life cycle assessment perspective: Allocating burdens of wastewater treatment in the production. Science of the Total Environment 656:55-69.
Serri, D.L., Faggioli, V.S., y Lorenzon, C.A. 2017. Fósforo del suelo: calidad del rastrojo y descomposición microbiana

bajo diferentes contenidos hídricos. CienciadelSuelo 35(2):239-248.
Seethepalli, A., Dhakal, K., Griffiths, M., Guo, H., Freschet, G.T., and York, L.M. 2021. RhizoVision Explorer: open-source software for root image analysis and measurement standardization. AoB Plants 13(6).

Syers, J.K., Johnston, A.E., and Curtin, D.C. 2008. Efficiency of soil and fertilizer phosphorus use. Food and Agriculture Organization of the United Nations (ONU).Rome,Italy
Tracy, S.R., Nagel, K.A., Postma, J.A., Fassbender, H., Wasson, A., and Watt, M. 2020. Crop improvement from phenotyping roots: highlights reveal expanding opportunities. Trends in Plant Science 25(1):105-118.
Wang, Y., and Lambers, H. 2020. Rootreleasedorganicanionsinresponsetolow phosphorus availability: recent progress, challenges and future perspectives. Plant andSoil 447:135-156.
35 | INNOVAGRO | agronomia.uct.cl
COMPOSICIÓN DE ÁCIDOS GRASOS DE LECHE DE OVEJAS SUFFOLK DOWN A LOS 30 Y 60 DÍAS DE LACTANCIA
Milk fatty acid composition of Suffolk Down ewes at 30 and 60 days in milk
Karla Inostroza1*,MarioDíaz2,SilvanaBravo3
1Departamento de Ciencias Agropecuarias y Acuícolas, Facultad de Recursos Naturales, UniversidadCatólicadeTemuco(UCTemuco).RudecindoOrtega02950,Temuco,Chile.


2Escuela de Graduados, Facultad de Ciencias Agrarias y Alimentarias, Universidad Austral de Chile.Valdivia,Chile.
3Instituto de Producción Animal, Facultad de Ciencias Agrarias y Alimentarias, Universidad AustraldeChile,CampusIslaTeja.Valdivia,Chile.
*Autorparacorrespondencia:kinostroza@uct.cl
ABSTRACT
Suffolk Down is the predominant breed in sheep production systems in La Araucanía Region, which is mainly used for meat production. However, due to the diversification of the production systems and the market of “gourmet” products, milk products derived from sheep’s milk are highly valued. The aim of the present study was to analyze the milk fatty acid composition at 30 and 60 days in milk from Suffolk Down ewes. Twenty healthy single-bearing ewes were selected after lambing (body condition score of2.6±0,4, ewe weight of65.6±4,9 kg, andage of3.1±0,5 years). Milk samples were obtained 30 and 60 days in milk. Milk and pasture fatty acid composition were analyzed by gas chromatography. Suffolk Down ewe’s milk had a high content of C18:3n3 at day 30 and present a better health index during this period. The results could become the basis for developing healthier sheep's milk products and an alternative for the diversification of sheep productioninsouthernChile.
Key words: fattyacids,milk,SuffolkDown,pasture.
INTRODUCCIÓN
En la Región de La Araucanía, la producción ovina se caracteriza por ser de carácter
extensivo y orientada principalmente a la producción de carne, siendo Suffolk Down la raza predominante en la mayoría de estos
36 | INNOVAGRO | agronomia.uct.cl
sistemas de producción (Romero y Bravo, 2012; ODEPA, 2017). La rentabilidad de los sistemas tradicionales de producción de carne y lana, en pequeños y medianos productores, no es muy alta, por lo que en Chile la producción de leche de oveja nace como una diversificación de la producción agrícola y a la conquista de mercados con productos “gourmet” que ofrezcan un valor agregado para productores que quieren mejorar su rentabilidad (Avendaño, 2001). Por otra parte, la región presenta características económicas, sociales, étnico-culturales e históricas, que le confieren una imagen específica, que puede ser aprovechada para el desarrollo de productos con una denominación geográfica (Romero y Bravo, 2012), por ejemplo, para el desarrollo de productos lácteos proveniente de los sistemas ovinos. La producción de leche de oveja es importante en muchos países, los cuales enfocan sus programas de cruzamiento a la producción lechera, y que, por sus características, alta en grasa y proteína, es principalmente usada en la elaboración comercial o artesanal de quesos (Fuertes et al., 1998). En este sentido, se ha caracterizado la producción y composición química de la leche de ovejas Suffolk (Peeters et al., 1992; Avendaño et al., 2002) y de razas locales criollas (Inostroza et al., 2020); sin embargo, debido a la orientación de los consumidores por productos más saludables, conocer la composición de ácidos grasos (AG)

de la leche de la raza predominante en la región, provee la oportunidad de conocer la calidad de la materia prima con la que se pueden generar nuevos productos lácteos. En consecuencia, el objetivo de esta investigación fue analizar la composición de AG de leche a los 30 y 60 días de lactancia en ovejas Suffolk DownenlaRegióndeLaAraucanía.
MATERIALES Y MÉTODOS
Animales y sistema de producción
La investigación se llevó a cabo durante los meses de julio y agosto del año 2020, en un predio de ovinos de la raza Suffolk Down (n=90) localizado en la comuna de Gorbea, Región de La Araucanía, Chile. Se seleccionaron 20 ovejas sanas, de parto único, con un peso inicial de 65,6±4,9 kg y una condición corporal de 2,6±0,4, estimada en una escala de 5 puntos, desde 1 (flaco) a 5 (obeso) (Russel, 1984), y una edad de 3,1±0,5 años. La dieta de las ovejas correspondió a praderas naturales y suplementación con avena durante el primer mes de lactancia (100 g/animal/día). La composición de AG de la pasturayavenafuedeterminadautilizandoel método Bligh-Dyer (Burja et al., 2007) y Folch et al. (1957), respectivamente. La carga animal del sistema fue de 11 ovinos por hectárea. Los ovinos tenían agua fresca disponible adlibitum.

37 | INNOVAGRO | agronomia.uct.cl
Muestras de leche y análisis
Las muestras de leche fueron recolectadas durante los 30 y 60 días de lactancia (julio y agosto, respectivamente). A las ovejas se les removía toda la leche residual y eran separadas de sus corderos por un período de 8 horas, para proporcionar un tiempo adecuado a la secreción láctea (Fuertes et al., 1998). Las ovejas fueron ordeñas a mano. Las muestras fueron congeladas hasta análisis (20°C). Los AG de leche fueron extraídos según la metodología de Röse-Gottlieb (AOAC, 1990). Los ésteres metílicos de AG (FAME) fueron preparados usando 1,3 mL de hidróxido de potasio en metanol 2N y 0,8 mL de n-hexano, agitados por 30 min y el sobrenadante filtrado con sulfato de sodio anhidro para análisis. Los FAME de leche fueron analizados en un cromatógrafo de gases modelo Clarus 500 (Perkin Elmer, Buckinghamshire, UK), acoplado a un detector de ionización de llama (FID) y equipado con una columna SPTM Fused Silica Capillary Column 2380 (60 m x 0,25 mm x 0,2 µm film thickness, Supelco, Bellefonte, PA, USA). Para la detección de los AG se utilizó un programa de temperatura de 48 min que incluyó: 150°C por 1 min, luego un aumento de temperatura a razón de 1°C por min hasta llegar a los 168°C y mantenidos por 11 min, seguido por un segundo incremento de temperaturade6°Cporminuto,paraalcanzar finalmente los 230°C mantenidos por 8 min.
Se utilizaron las mezclas estándar de 37 componentes de AG F.A.M.E Mix (C4-C24, Supelco, Bellefonte, PA, USA) para la identificación de los AG y Octadecadienoic Acid Conjugated Methyl Ester (CLA SigmaAldrich, Milwaukee, WI, USA) para la identificación de los isómeros de ácido linoleico conjugado. La temperatura del inyector y detector fue de 250°C, se inyectó 1 μL y se utilizó nitrógeno como gas carrier. Los FAMEs fueron expresados como porcentaje.
Análisis de datos

Los datos fueron analizados estadísticamente usando análisis de varianza (ANDEVA) y comparación de medias utilizando test de Tukey con el programa estadístico SPSS v23.0 (IBM SPSS Statistics para Windows, Version 23.0. Armonk, NY: IBM Corp.). Diferencias significativas fueron consideradas a nivel P≤0,05.
RESULTADOS Y DISCUSIÓN
La grasa de la leche de ovejas tiene una alta proporción de AG saturados(AGS, 66%), yen menor proporción se encuentran los AG mono (AGM, 28%) y poliinsaturados (AGP, 6%) (Sánchez et al., 2010). Los AG mayoritariosfueronC16:0,seguidodeC18:0y C18:1n9, que juntos representan el 71% de los AG presentes en la grasa de leche de ovejas Suffolk Down en esta investigación. La

38 | INNOVAGRO | agronomia.uct.cl
composición de AG de leche de oveja se caracterizaporpresentarunagranproporción de AG de cadena larga, seguido de los AG de cadena media y corta. Esta composición puede variar a lo largo de la lactancia, debido a la regulación de las actividades metabólicas que ocurren en el rumen y la glándula mamaria. Los AG de la leche de rumiantes derivan de cuatro fuentes principalmente: de la síntesis de novo de AG en la glándula mamaria (dando lugar principalmente a los AG de cadena corta, desde C4:0 hasta 50% del AG C16:0), de la dieta (la cual contiene normalmente AG C16:0 y C18:0), formación en el rumen por biohidrogenación y de los depósitos grasos (los cuales contienen principalmente C16:0, C18:0 y C18:1n9c)
(Nudda et al., 2014). Se observaron diferencias estadísticas principalmente en los AG de cadenacortaentrelos30y60díasdelactancia (Cuadro 1). A los 30 días se observa un aumento de los AG de cadena corta (C4:0, C6:0yC8:0),loqueocurreprincipalmentepor una mayor capacidad de síntesis por el epitelio glandular; sin embargo, estos tienden a disminuir a medida que avanza la lactancia debido a la movilización de reservas corporales de las ovejas tras el peak de lactación(Palmquist etal., 1993).
La glándula mamaria de los rumiantes tiene una sustancial actividad delta 9-desaturasa, y los principales productos son C14:1, C18:1n9c
y ácido linoleico conjugado (ALC), lo cual resulta de importancia en la conversión de AGSaAGM,mejorandolacalidaddelagrasa en productos de rumiantes y por sus implicancias en la salud humana (Milanesi et al., 2008). Sin embargo, el mejor indicador de la actividad desaturasa es la relación C14:1/C14:0, debido a que todo el C14:0 en la grasa de la leche es producido vía síntesis de novo en la glándula mamaria; consecuentemente, la desaturación es la única fuente de C14:1. Todos los demás AG pueden ser absorbidos desde el sistema circulatorio (Lock y Garnsworthy, 2003). En la leche de ovejas Suffolk se observó una mayor actividad desaturasa DI:C14 a los 60 días de lactancia y una mayor actividad desaturasa DI:C18alos30díasdelactancia(P≤0,05). Además, de calcularon los índices IA, IT, n6/n-3yAGP/AGS.Estosíndicessonutilizados para evaluar aspectos nutricionales de la calidad de la grasa de origen animal para los consumidores. Los índices IA e IT descritos por Ulbricht and Southgate (1991), permiten la comparación de diferentes alimentos considerando el contenido de AG saturados aterogénicos. En esta investigación sólo se determinó diferencias en el índice IT, observándose un menor valor a los 30 días (P≤0,05). De acuerdo con este índice, la leche seconsideramássaludableenesteperíodo.


39 | INNOVAGRO | agronomia.uct.cl
Cuadro 1. Composición de ácidos grasos (expresados como % de FAME) de leche de ovejas Suffolk Down a los 30 y 60 días de lactancia.
a,b Indican diferencias significativas P≤0,05; 1AG de cadena corta: (C4:0-C11:0); 2AG de cadena media: (C12:0-C17:1); 3AG de cadena larga: (C18:0-C22:6n3); 4Índice desaturación: C14:1/(C14:0+C14:1); 5Índice desaturación: C18:1/(C18:0+C18:1); 6Relación AG poliinsaturados (n-6/n-3).


40 | INNOVAGRO | agronomia.uct.cl
Ácido graso Ácido graso Período de lactancia 30 días 60 días Ácido butírico C4:0 0,3±0,1a 0,2±0,03b Ácido caproico C6:0 0,6±0,1a 0,4±0,1b Ácido caprílico C8:0 1,2±0,2a 0,9±0,1b Ácido cáprico C10:0 4,2±0,8 3,9±0,7 Ácido undecanoico C11:0 0,1±0,02 0,1±0,03 Ácido láurico C12:0 3,0±0,8 2,9±0,6 Ácido tridecanoico C13:0 0,1±0,03 0,1±0,03 Ácido mirístico C14:0 7,9±1,2 7,6±1,5 Ácido miristoleico C14:1 0,5±0,1b 0,6±0,03a Ácido pentadecanoico C15:0 1,1±0,2b 1,2±0,2a Ácido palmítico C16:0 25,4±1,5 25,7±1,8 Ácido palmitoleico C16:1 0,7±0,1b 0,8±0,1a Ácido heptadecanoico C17:0 1,0±0,3 1,1±0,2 Ácido cis-10-heptadecenoico C17:1 0,6±0,2 0,6±0,2 Ácido esteárico C18:0 23,7±3,9 25,5±4,0 Ácido elaídico C18:1n9t 0,3±0,1 0,3±0,1 Ácido oleico C18:1n9c 22,4±3,2 21,2±3,6 Ácido linolelaidico C18:2n6t 0,5±0,2 0,5±0,1 Ácido linoleico C18:2n6c 1,6±0,3 1,6±0,4 Ácido γ-linolénico C18:3n6 0,3±0,04 0,3±0,02 Ácido α-linolénico C18:3n3 1,0±0,3a 0,8±0,2b cis-9 trans-11/trans-9 cis-11 C18:2 ALC 2,5±0,8 2,4±0,5 Ácido heneicosanoico C21:0 0,1±0,04 0,1±0,02 Ácido cis-11,14-eicosadienoico C20:2 0,2±0,02 0,2±0,01 Ácido behénico C22:0 0,1±0,03 0,1±0,03 Ácido tricosanoico Ácido eicosapentaenoico Ácido docosahexaenoico C23:0 C20:5n3 C22:6n3 0,2±0,05 0,1±0,02 0,1±0,02a 0,2±0,03 0,1±0,02 0,05±0,02b AG saturados (AGS) 69,1±2,8 70,4±4,0 AG monoinsaturados (AGM) 24,6±3,0 23,6±3,7 AG poliinsaturados (AGP) 6,4±1,3 6,0±0,7 AG de cadena corta1 6,4±1,0a 5,6±1,0b AG de cadena media2 40,1±2,9 40,8±2,9 AG de cadena larga3 53,1±3,4 53,6±3,6 DI C144 0,06±0,01b 0,08±0,01a DI C185 0,5±0,03a 0,4±0,03b n-6/n-36 2,1±0,9 2,5±0,5 AGP/AGS 0,09±0,02 0,09±0,01 Índice aterogénico (IA) 2,1±0,3 2,2±0,5 Índice trombogénico (IT) 3,2±0,4b 3,7±0,7a
Por otra parte, nutricionalmente se recomienda una relación AGP/AGS sobre 0,45 y n-6/n-3 bajo 4,0 (Simopoulos, 2002). En este sentido, la leche de ovejas Suffolk poseen una relación AGP/AGS considerablemente baja y una relación de AGP n-6/n-3 (2,1-2,5) bajo el nivelrecomendado.
Las pasturas son una excelente fuente de αlinolénico (C18:3n3) y es uno de los alimentos más efectivos en cambiar la composición de AG de la leche hacia un espectro más saludable (Nudda et al., 2014). En esta investigación, los principales AG identificados en la pradera fueron: C18:3n3 con un contenido de 38,6% y 34,8%, a los 30 y 60 días de lactancia, y C18:2n6c con un 19,1% y 18,4%, respectivamente. En el caso de la avena, los principales AG fueron C18:1n9c (25,7%) y C18:2n6c (23,5%). A los 30 días se observa una mayor concentración del AG C18:3n3 en la leche de las ovejas. Este AG adquiere importancia debido a que es parcialmente biohidrogenado en el rumen y luego secretado a la leche, así como parcialmente convertido a ALC en el tejido mamario. Además, contribuye a la salud debido a sus propiedades antiinflamatorias y en la prevención de enfermedades coronarias, elcualpuedeseraportadodesdelalecheylos productoslácteos(Cabiddu etal.,2005)
CONCLUSIÓN
En general, la composición de AG de leche de ovejas Suffolk Down mantenidas en praderas, posee importantes proporciones de AG
beneficiosos para la salud. A los 30 días de lactancia, se observó un mejor índice nutricional y un mayor contenido de AG n-3, indicando que la leche de las ovejas Suffolk podríasermássaludableduranteesteperíodo para la elaboración de productos lácteos. Finalmente, esta investigación sugiere la utilización de la leche de estas ovejas, la cual representa una alternativa para los sistemas productivosovinosenelsurdeChile.
LITERATURA CITADA
AOAC. 1990. Official methods of analysis. 17th ed. Association of Official Analytical ChemistsInc.Arlington.VA,USA.770p.
Avendaño, J. 2001. Producción de leche y queso de oveja. Boletín INIA N°14. Instituto de Investigaciones Agropecuarias, Centro Regional de Investigación INIA Quilamapu. Chillán, Chile.16p.
Avendaño, J.,Fernández, F., and Sandoval, C. 2002. Milk production comparison of different breeds of ewes in the centralsouth zone of Chile. Agricultura Técnica 62(4):530-540.
Burja, A.M., Armenta, R.E., Radianingtyas, H., and Barrow, C.J. 2007. Evaluation of fatty acid extraction methods for Thraustochytrium sp. ONC-T18. Journal of Agricultural and Food Chemistry 55:47954801.
Cabiddu, A., Decandia, M., Addis, M., Piredda, G., Pirisi, A., and Molle, G. 2005. Managing mediterranean pastures in
41 | INNOVAGRO | agronomia.uct.cl
order to enhance the level of beneficial fatty acids in sheep milk. Small Ruminant Research 59:169-180.

Folch, J., Lees, M., and Sloane Stanley, G. 1957. A simple method for the isolation and purification of total lipids from animal tissues. Journal of Biological Chemistry 226:497–509.
Fuertes, J.A., Gonzalo, C., Carriedo, J.A., and San Primitivo, F. 1998. Parameters of test day milk yield and milk components for dairy ewes. Journal of Dairy Science 81:1300-1307.
Inostroza, K., Bravo, S., Larama, G., Saenz, and C., Sepúlveda, N. 2020. Variation in milk composition and fatty acid profile during the lactation of Araucana creole ewes in a pasture-based system. Animals 10:92.
Lock, A., and Garnsworthy, P. 2003. Seasonal variation in milk conjugated linoleic acid and Δ9-desaturase activity in dairy cows. LivestockProductionScience 79:47:59.
Milanesi, E., Nicoloso, L., and Crepaldi, P. 2008.StearoylCoAdesaturase(SCD)gene polymorphisms in Italian cattle breeds. Journal of Animal Breeding and Genetics 125:63-67.
Nudda, A., Battacone, G., Boaventura Neto, O., Cannas, A., Francesconi, A., Atzori, A., and Pulina, G. 2014. Feeding strategies to design the fatty acid profile of sheep
milk and cheese. Revista Brasileira de Zootecnia 43(8):445–456.
ODEPA. 2017. Encuesta de ganado ovino. Disponible en internet: https://www.odepa.gob.cl› uploads › 2017/01.Leídoel23deoctubrede2022.

Palmquist, D., Denise-Beaulieu, A., and Barbano, D. 1993. Feed and animal factors influencing milk fat composition. Journal ofDairyScience 76:1753-1771.
Peeters, R., Buys, N., Robijns, L., Vanmontfort, D., and Van Isterdael, J. 1992. Milk yield and milk composition of Flemish milksheep, Suffolk and Texel ewesandtheircrossbreds. SmallRuminant Research 7:279-288.
Romero, O., y Bravo, S. 2012. Fundamentos delaproducciónovina enlaRegióndeLa Araucanía. Boletín INIA N° 245. Instituto de Investigaciones Agropecuarias, Centro Regional de Investigación Carillanca. Temuco,Chile.206p.
Russel, A. 1984. Body condition scoring of sheep. InPractice 6:91–93.
Sánchez, J., San Primitivo, F., Barbosa, E., Varona, L., and De la Fuente, L. 2010. Genetic determination of fatty acid composition in Spanish Churra sheep milk. JournalofDairyScience 93:330-339.
Simopoulos, A. 2002. The importance of the ratio of omega-6/omega-3 essential fatty acids. Biomedicine & Pharmacotherapy 56:365-379.
42 | INNOVAGRO | agronomia.uct.cl
Ulbricht, T.L., and Southgate, D.A. 1991. Coronary heart disease: Seven dietary factors. Lancet 338:985-992.


43 | INNOVAGRO | agronomia.uct.cl
ÁCIDO ASCÓRBICO: MOLÉCULA CLAVE PARA ALIVIAR EL ESTRÉS CAUSADO POR ALUMINIO EN PLANTAS DE ARÁNDANO ALTO (Vacciniumcorymbosum L.).


Ascorbic acid: key molecule by alleviation to aluminum stress in plants of highbush blueberry (Vacciniumcorymbosum L.).
Paz Cárcamo-Fincheira1*, Ricardo Tighe-Neira1, Adriano Nunes-Nesi2, Marjorie Reyes-Díaz3 , BraulioSoto-Cerda1,ClaudioInostroza-Blancheteau1
1Departamento de Ciencias Agropecuarias y Acuícolas, Facultad de Recursos Naturales, UniversidadCatólicadeTemuco(UCTemuco).RudecindoOrtega02950,Temuco,Chile
2DepartamentodeBiologiaVegetal,UniversidadeFederaldeViçosa.36570-900Viçosa,MG,Brazil.
3Departamento de Ciencias Químicas y Recursos Naturales, Facultad de Ingeniería y Ciencias, UniversidaddeLaFrontera.FranciscoSalazar01145,Temuco,Chile.
*Autorparacorrespondencia:mcarcamo@uct.cl
ABSTRACT
Ascorbic acid (ASC) is an important antioxidant involved in the mitigation of oxidative stress. It is related to growth, development, as well as various physiological and metabolic processes for the adaptation ofplantsto stress. On the other hand, factorssuch assoil acidity, high rainfall, facilitate the leaching of exchange bases from the soil, allowing the solubilization of phytotoxic aluminum (Al3+), which can alter physiological and metabolic processes in plants. In this sense, ASC has been related to the reduction of damage caused by Al through its functions as antioxidant, cofactor and regulator. Likewise, due to its close relationship with the generation of oxalate, the main organic acid identified in Vaccinium corymbosum. In this sense, it is necessary to generate basic and applied research that allows to know in depth the role of ASC in the mitigation of Al toxicity in tall blueberries,withtheaimofincreasingtheresistanceofthiscultivartodifferentabioticstresses.
Key words: toxicity,Al,ascorbicacid,stress,resistance
INTRODUCCIÓN
ElácidoL-ascórbico(Ascorbato[ASC],L-treohex-2-enono-1,4-lactona), más conocido como
vitamina C, es un antioxidante esencial involucrado en la mitigación de los efectos de las especies reactivas al oxígeno (EROs) a
44 | INNOVAGRO | agronomia.uct.cl
través de reacciones enzimáticas y no enzimáticas (Baron, 2009; Carpenter, 2012; Xiao et al., 2021). En plantas el ASC está asociado con el proceso fotosintético, la división y diferenciación celular, el crecimiento y desarrollo, y en la adaptación al estrés abiótico. Además, el ASC se encuentra principalmente en el citoplasma celular (95%) y una pequeña parte es transportada al aploplasto (5%). La fracción aplopástica ha sido relacionada a la activación de los sistemas de señalización al estrés oxidativo, dado a su poder redox, transformando a esta molécula como parte de la primera línea de defensa contra diversos tipos de estreses (Barnes et al., 2002; Foyer y Noctor, 2005; Gallie, 2013). Adicionalmente, el ASC en el aploplasto ha sido asociado al equilibrio hormonal, el crecimiento, la activación de cascadas de señalización de MAPK, actividad de enzimas antioxidantes y, en la percepción y respuestas fisiológicas y bioquímicas de la planta en condiciones normales y de estrés abiótico (Pignocchi et al., 2003; Akram et al., 2017).
En las plantas superiores, el ASC se sintetiza en la mitocondria, distribuyéndose a lo largo de la célula (Smirnoff, 2000; Gallie, 2013), siendo la L-galactosa o Smirnoff-Wheeler (SW), la principal vía de síntesis, que se inicia mediante la conversión de D-manosa en Lgalactosa; posteriormente, la L-galactosa se oxida a L-galactono-1,4-lactona, precursor

inmediato de la síntesis de ASC, por la enzima L-galactosa deshidrogenasa (GalDH) dependiente de NAD, oxidando el Lgalactono-1,4-lactona a ASC a través de la enzima L-galactono-1,4-lactona deshidrogenasa (GalLDH), que se encuentra en la membrana interna de la mitocondria, la que a su vez dona electrones al citocromo C (Smirnoff, 2000). Sin embargo, también se han propuesto otras tres vías de biosíntesis de ASC en plantas, pero se requiere mayor investigación, correspondientes a las vías Lglucosa, ácido D-galacturónico y a la del mioinositol(Liu etal.,2015).
En los seres humanos el ASC es considerado comounmicronutriente,elcualencantidades insuficientes provoca enfermedades graves, como el escorbuto (Baron, 2009; Carpenter, 2012; Xiao et al., 2021). Esto se debe a que en los humanos se perdió la capacidad de sintetizar ascorbato debido a la acumulación de mutaciones en la secuencia codificante de la enzima L-gulono-1,4-lactona oxidasa (última enzima en las vías de síntesis del ASC), por lo que esta molécula debe ser incorporada de forma externa en la dieta, a través del consumo de frutas y verduras, siendo el tomate, manzana, naranjas y las bayas, las principales fuentes de ASC que pueden consumir los seres humanos (Drouin etal.,2011).
Adicionalmente, esta molécula tiene beneficios en la salud de las personas, ya que

45 | INNOVAGRO | agronomia.uct.cl
ha sido propuesta como tratamiento contra varios tipos de cánceres y en la regeneración de moléculas antioxidantes como la vitamina E (Ishikawa et al., 2006; Cocetta et al., 2012; Miura etal.,2018).
Relación del ascorbato con el estrés abiótico En las plantas el ASC tiene varias funciones esenciales, principalmente por su rol como molécula antioxidante, así como también, el de cofactor y regulador, complementando así su función en el link de múltiples vías de señalización en respuesta a estrés abiótico (Akram et al., 2017; Xiao et al., 2021). Se le atribuye a esta molécula características de antioxidante, debido a su capacidad de captación de las EROs, normalmente provocadas por estreses abióticos como la intensidad de la luz, la salinidad, la sequía y los metales pesados (Ahmed et al., 2014; Gaafar et al., 2020). En relación a su rol como cofactor y cosustrato, se debe a que es una molécula clave para la biosíntesis de hormonas como el etileno, ácido abscísico y ácido giberélico (Noctor y Foyer, 1998; Davey et al., 2000, Cocetta et al., 2012). En el mismo sentido, el ASC es un cofactor para el ciclo de la violaxantina, dado a que la enzima violaxantina de-epoxidasa utiliza esta molécula en la formación de zeaxantina (un fotoprotector) (Neubauer y Yamamoto, 1994). Mientras que, su función reguladora, está relacionada con el mantenimiento de la

homeostasis redox extracelular e intracelular de la planta, debido a que, en condiciones de estrés, esta molécula activa el mecanismo regulador para la eliminación de EROs en plantas (Noctor y Foyer, 1998). Las EROs son detectadas por receptores de la célula, los cuales envían una señal que a su vez conduce a la activación de factores transcripcionales, que modifican la expresión de la enzima ascorbato peroxidasa y de la glutatión reductasa, manteniendo la homeostasis celular y la regeneración de ASC en plantas, superando así, el estrés oxidativo (Kaur y Nayyar,2014).
De esta forma el ASC ha sido asociado con diferentes estreses abióticos tales como: alta irradiación de luz, bajas temperaturas, déficit hídrico, anegamiento y metales pesados, donde actúa como cofactor en el ciclo de las xantófilas, donante de electrones en el PSII, incrementa la actividad de enzimas antioxidantes y de ABA, así como también, genera una regulación positiva de transcritos y hormonas (jasmonatos, defensina, glucosinolatos) y factores de transcripción, mejorando así la tolerancia al estrés abiótico (Smirnoff y Wheeler, 2000; Tóth et al,. 2009; Terzi etal.,2015;Nepal etal.,2019).
La toxicidad causada por el aluminio (Al) es un factor que limita el crecimiento de las

46 | INNOVAGRO | agronomia.uct.cl
Ácido ascórbico y su efecto en la resistencia al estrés por aluminio
plantas que son cultivadas en suelos ácidos (pH< 5,0). El exceso de Al en forma tóxica ya sea como ión trivalente (Al3+) y/o aluminato (Al(OH)2+), está relacionado con baja fertilidad, deficiencia de nutrientes, interacción con elementos de las membranas celulares y la inducción de la peroxidación lipídica en plantas, alterando así el normal funcionamiento de diversos procesos metabólicos y fisiológicos (Kochian et al., 2004; Chen et al , 2005; Silva et al., 2012). Sin embargo, estudios sugieren que el daño inducido por Al podría aliviarse mediante la activación de los mecanismos antioxidantes, propiciados por el ASC (Noctor y Foyer, 1998). Por ejemplo, en plantas de Oryza sativa L., se encontró que los niveles de ASC eran más altos en hojas bajo tratamiento con Al, asimismo, se menciona que ASC, dehidroascrobato (DHA) y la relación ASC/DHA son clave para mantener la regeneración de ASC y, en consecuencia, la eliminación de EROs en plantas expuestas a Al3+ (Ribeiro et al., 2012). En este mismo sentido, de Souza et al. (2016) reportaron que en genotipos de Secale cereale, los niveles de ASC en hojas de los genotipos tolerantes a Al aumentaron 23% después de 24 h de exposición al estrés por Al, mientras que en los genotipos sensibles a Al no se observaron cambios.

Para aminorar el efecto tóxico por Al las plantas han desarrollado mecanismos
basados principalmente en la biosíntesis de moléculas o ligandos orgánicos. Estos mecanismos de resistencia a Al se conocen como tolerancia y exclusión o evitación (de Sousa et al., 2016). El mecanismo de tolerancia está relacionado con la translocación de iones Al3+ hacia la vacuola, a través de la formación de complejos no fitotóxicos con moléculas orgánicas (principalmente compuestos fenólicos y ácidos orgánicos [AOs]) (Kochian, 1995; Delhaize et al., 2012). Mientras que, el mecanismo de evitación o exclusión del Al, está asociado a la exudación de moléculas orgánicas (ácidos orgánicos, fenoles, entre otros) desde las raíces, las que quelan el Al en larizosferayasí,evitanlaentradadelAlenla planta. Los principales AOs exudados por las plantas inducidos por la toxicidad del Al son el citrato, oxalato y malato (en orden de fuerza iónica AO:Al) (Kochian et al., 2004). En el caso del oxalato, éste se produce por la degradación de ASC por oxidación de DHA y ácido 4-O-oxalil-L-treónico. De esta forma en cultivares de Vaccinium corymbosum, Alresistentes, se sugiere que ASC es clave en la generación y síntesis de oxalato bajo tratamiento con Al (Cárcamo-Fincheira et al., 2021).
Es por ello que, el proyecto FONDECYT de postdoctorado 3220674 2022-2024 titulado como “Ascorbic acid and its function in growth, development and in Al-resistance in cultivars of highbush blueberry (Vaccinium

47 | INNOVAGRO | agronomia.uct.cl
corymbosum L.).” tiene como objetivo evaluar el papel de la molécula de ASC como antioxidante, cofactor y regulador; así como también, su relación con los mecanismos de resistencia a Al, sobre el crecimiento, rendimiento y calidad del fruto en cultivares Al contrastantes de arándano alto cultivados en suelos ácidos de nuestro país. El proyecto es patrocinado por el Dr. Braulio Soto-Cerda, así como también, cuenta con el apoyo del Grupo de Investigación en Fisiología y Biotecnología Vegetal de la UC Temuco, liderado por el Dr. Claudio InostrozaBlancheteau. Los resultados obtenidos preeliminarmente indican que el ASC produce un efecto benéfico en los parámetros fotosintéticos y el crecimiento en el cultivar Al-sensible. Es por ello que, se espera al finalizar esta evaluación, la obtención de resultados que permitan identificar las dosis de aplicación de ASC que permita mejorar la actividad antioxidante, el contenido de ASC, el rendimiento fotosintético y la exudación de AOs, reduciendo los efectos fitotóxicos del Al sobre el crecimiento en cultivares contrastantes a Al, así como también, proponer la vía de biosíntesis, reciclaje y la oxidacióndeASC,ydelostransportadoresde Al que permitan, vislumbrar una mejora en la calidad de la planta y de los frutos en cultivares de arándanos alto cultivados en condiciones ácidas y sometidos a toxicidad porAl.
LITERATURA CITADA

Ahmed, F., Baloch, D.M., Sadiq, S.A., Ahmed, S.S., Hanan, A., Taran, S.A., Ahmed, N., and Hassan, M.J. 2014. Plant growth regulators induced drought tolerance in sunflower (Helianthus annuus L.) hybrids. Journal of Animal and Plant Sciences 24:886–890.
Akram, N.A., Shafiq, F., and Ashraf, M. 2017. Ascorbic acid-a potential oxidant scavenger and its role in plant development and abiotic stress tolerance. FrontiersinPlantScience 8:613.

Barnes, J.D., Zheng, Y., and Lyons, M.T. 2002. Plant resistance to ozone: the role of ascorbate p. 235–254. In Omasa, K., Saji, K., Youssefian, S., and Kondo, N. (eds). Air pollution plant biotechnology SpringerVerlag.Tokyo.
Baron, J.H. 2009. Sailors’ scurvy before and after James Lind a reassessment. NutritionReviews 67:315–332.
Cárcamo-Fincheira, P., Reyes-Díaz, M., Omena-Garcia, R.P., Vargas, J.R., Alvear, M., Florez-Sarasa, I., Rosado-Souza, L., Rengel, Z., Fernie, A.R., Nunes-Nesi, A., and Inostroza-Blancheteau, C. 2021. Metabolomic analyses of highbush blueberry (Vaccinium corymbosum L.) cultivars revealed mechanisms of resistance to aluminum toxicity. EnvironmentalExpressB 183:104338.
48 | INNOVAGRO | agronomia.uct.cl
Carpenter, K.J. 2012. The discovery ofvitamin C. Annals of Nutrition and Metabolism 61:259–264.
Chen, L.S., Qi, Y.P., and Liu, K.H. 2005. Effects of aluminum on light energy utilization and photoprotective systems in citrusleaves. AnnalsofBotany 96:35-41
Cocetta, G., Karppinena, K., Suokasa, M., Hohtolaa, A., Häggmana, H., Spinardib, A., Mignanib, I., and Jaakolaa. L. 2012. Ascorbic acid metabolism during bilberry (Vaccinium myrtillus L.) fruit development.
JournalofPlantPhysiology 169:1059–1065.
Davey, M.W., Van Montagu, M., Inzé, D., San martin, M., Kanellis, A., Smirnoff, N., Benzie, I.J.J., Strain, J.J., Favell, D., and Fletcher, J. 2000. Plant l-ascorbic acid: chemistry, function, metabolism, bioavailability and effects of processing.
Journal of the Science of Food and Agriculture 80:825–60.
Delhaize, E., James, R.A., and Ryan, P.R. 2012. Aluminium tolerance of root hairs underlies genotypic differences in rhizosheath size of wheat (Triticum aestivum) grown on acid soil. New Phytologist 195:609-619.
de Sousa, A., AbdElgawad, H., Han, A., Teixeira, J., Matos, M., and Fidalgo, F. 2016. Oxidative metabolism of rye (Secale cereale L.) after short term exposure to aluminum: uncovering the glutathione–
ascorbate redox network. Frontiers in Plant Science 7:685.


Drouin,G., Godin, J.R.,and Page,B.2011. The genetics of Vitamin C loss in vertebrates. CurrentGenomics 12:371–378.
Foyer, C.H., and Noctor, G. 2005. Redox homeostasis and antioxidant signaling: a metabolic interface between stress perception and physiological responses PlantCell 17:1866–1875.
Gaafar, A.A., Ali, S.I., El-Shawadfy, M.A., Salama, Z.A., Sekara, A., Ulrichs, C., and Abdelhamid, M.T. 2020. Ascorbic acid induces the increase of secondary metabolites, antioxidant activity, growth, and productivity of the common bean under water stress conditions. Plants 9(5):627.
Gallie, D.R. 2013. Increasing vitamin C content in plant foods to improve their nutritional value successes and challenges. Nutrients 5:3424–3446.
Ishikawa, T., Dowdle, J., and Smirnoff, N. 2006. Progress in manipulating ascorbic acid biosynthesis and accumulation in plants. PhysiologiaPlantarum 126:343–355.
Kaur, R., and Nayyar, H. 2014. Ascorbic acid. Chapter 8 – Ascorbic acid: A potent defender against environmental stresses. p.235–287.InOxidative damagetoplants. Antioxidant networks and signaling AcademicPress.
49 | INNOVAGRO | agronomia.uct.cl
Kochian, L.V., Hoeckenga, O.A., and Piñeros, M.A. 2004. How do crop plants tolerate acid soils? Mechanisms of aluminum tolerance and phosphorus efficiency. AnnualReviewofPlantBiology 55:459-493.
Kochian, L.V. 1995. Cellular mechanisms of aluminum toxicity and resistance in plants. Annual Review of Plant Physiology andPlantMolecularBiology 46(1):237–260

Liu, F., Wang, L., Gu, L., Su, H., and Cheng, X.2015. Higher transcription levels in ascorbic acid biosynthetic and recycling genes were associated with higher ascorbic acid accumulation in blueberry. FoodChemistry 188:399-405.
Miura, K., Haraguchi, M., Ito, H., and Tai, A. 2018. Potential antitumor activity of 2-Oα-d-Glucopyranosyl-6-O-(2Pentylheptanoyl)-l-ascorbic acid. International Journal of Molecular Sciences 19:E535.10.3390/ijms19020535
Nepal, N., Yactayo‐Chang, J.P., Medina‐Jiménez, K., Acosta‐Gamboa, L.M., González‐Romero, M.E., Arteaga‐Vázquez, M.A., and Lorence, A 2019. Mechanisms underlying the enhanced biomass and abiotic stress tolerance phenotype of an Arabidopsis MIOXover‐expresser. PlantDirect 3:1–27.
Neubauer, C., and Yamamoto, H.Y. 1994. Membrane barriers and Mehlerperoxidase reaction limit the ascorbate available for violaxanthin de-epoxidase
activity in intact chloroplasts. PhotosynthesisResearch 39(2):137-147.
Noctor, G., and Foyer, C.H. 1998. Ascorbate and glutathione: keeping active oxygen under control. Annual Review of Plant Physiology and Plant Molecular Biology 49:249-279.
Pignocchi, C., Fletcher, J.M., Wilkinson, J.E., Barnes, J.D., and Foyer, C.H. 2003. The function of ascorbate oxidase in tobacco. PlantPhysiology 132:1631–1641.
Ribeiro, C., Cambraia, J., Peixoto, P.H.P., and Fonseca, E.M. 2012. Antioxidant system response induced by aluminum in two rice cultivars. Brazilian Journal of Plant Physiology 24(2):107–116.

Silva, S., Pinto, G., Dias, M.C., Correia, C.M., Moutinho-Pereira, J., Pinto-Carnide, O., Santos. C, 2012. Aluminum long term stress differently affects photosynthesis in rye genotype. Plant Physiology and Biochemistry 54:105-112.
Smirnoff, N. 2000. Ascorbic acid: metabolism and functions of a multi-facetted molecule. Current Opinion in Plant Biology 3:229–235.
Smirnoff, N., and Wheeler, G.L. 2000. Ascorbic acid in plants: Biosynthesis and function. Critical Reviews in Biochemistry andMolecularBiology 35:291–314.
Terzi, R., Kalaycıoglu, E., Demiralay, M., Saglam, A., and Kadioglu, A. 2015. Exogenous ascorbic acid mitigates
50 | INNOVAGRO | agronomia.uct.cl
accumulation of abscisic acid, proline and polyamine under osmotic stress in maize leaves. ActaPhysiologiaePlantarum 37:43.

Tóth, S.Z., Puthur, J.T., Nagy, V., and Garab, G. 2009. Experimental evidence for ascorbate-dependent electron transport in leaves with inactive oxygen-evolving complexes. Plant Physiology 149:1568–1578.
Xiao, M., Li, Z., Zhu, L., Wang, J., Zhang, B., Zheng, F., Zhao, B., Zhang, H., Wang, Y., and Zhang, Z. 2021. The multiple roles of ascorbate in the abiotic stress response of plants: antioxidant, cofactor, and regulator. Frontiers in Plant Science 12:598173.

51 | INNOVAGRO | agronomia.uct.cl
RESPUESTA PRODUCTIVA DE UNA VARIEDAD DE Vaccinium corymbosum L. CULTIVADA EN SUSTRATOS A LA INOCULACIÓN CON HONGOS FORMADORES DE MICORRIZAS ARBUSCULARES
Productive response of a variety of Vaccinium corymbosum L. grown on substrates to inoculation with fungi that form arbuscular mycorrhizae
1Departamento de Ciencias Agropecuarias y Acuícolas, Facultad de Recursos Naturales, UniversidadCatólicadeTemuco(UCTemuco).RudecindoOrtega,02950, Temuco,Chile.
2DepartamentodeInvestigacióneInnovación, spinoff UniversitariaMyconativa.Freire,Chile. *Autorparacorrespondencia:paguilera@uct.cl


ABSTRACT
Vaccinium corymbosum L.hasaradical associationwithmycorrhizal-formingfungi,benefitingplant growth and fruit quality. the cultivation of V. corymbosum variety ‘Kirra’ was established in the town of Chillán, Ñuble Region, Chile. The plants were inoculated with five arbuscular mycorrhizal fungi species. The effect mycorrhizal inoculum on shoot, root, and fruit biomass, was determined. It was determined that inoculated plants had higher shoot biomass and higher root biomass than control plants. Concerning the average diameter of the fruits, the inoculated plants presented a greater diameter ofthe fruit, anda greater weight ofthe fruits, in comparison with the fruitsofthe control plants. Inoculation with mycorrhizal inoculum considerably favored growth and development of V. corymbosum, both in its vegetative phase and in flowering and its subsequent fruits.
Key words:blueberry,arbuscularmycorrhizalfungi,biomassandfruitsize.
INTRODUCCIÓN
Vaccinium corymbosum L. pertenece a la familia Ericaceae, que cuenta con 125 géneros y aproximadamente 4500 especies (Kron et al.,
2002). Habita suelos ácidos, profundos, con mucha aireación, buen drenaje y alto contenido de materia orgánica (Carrillo et al., 2015). Sus raíces no poseen pelos radicales,
52 | INNOVAGRO | agronomia.uct.cl
Paula Aguilera1,2*, Javier Retamal1, Ninozhka Becerra1,2, Juan Karlo Romero1,2, Claudia Castillo1 , FernandoBorie1,GabrielVillalobos2,RobertoRamirez2,JuanFuentes2
presentándose una desventaja fisiológica en relación a la absorción de nutrientes, por lo tanto, las encargadas de llevar a cabo esta labor son las raíces más jóvenes (Carrillo, 2012). En la naturaleza tienden a poseer una asociación a nivel radical con hongos formadores de micorrizas ericoides, si bien la literaturareconocealafamilia Ericaceaecomo una excepción al no albergar hongos formadores de micorrizas arbusculares (HFMA) (Salhi et al , 2022), se ha documentado que si se puede asociar a HMFA(Arriagada etal ,2012;Liu etal.,2017) EnChile se introdujolaespecie V.corymbosum en la década de los 80 debido a la necesidad de diversificar la fruticultura (González et al., 2017). Su fruto es muy importante, ya que Chile es el principal exportador de arándanos frescosdelhemisferiosur yelsegundoanivel mundial, esto es debido a su diversidad climática y la producción en contra estación debido a la rica geografía del país. EnChile se encuentran más de 18 mil hectáreas de arándanos, donde en la temporada 2020/2021 se exportaron cerca de 150 mil toneladas (fresca y congelada). Dentro de los países a los que se le exporta, se encuentran: EE.UU., India, España, China, Polonia, Canadá, Suecia yRusia(ODEPA,2022).
Ante el uso desmesurado de agroquímicos y fertilizantes en la agricultura, en el último tiempo, la búsqueda de producir alimentos más sanos, ha requerido de la utilización de
bioproductos, los cuales se pueden aplicar a semillas o en distintas etapas del crecimiento de la planta, con el objetivo de favorecer el desarrollo vegetativo y reproductivo de los cultivos, este es el caso del uso de micorrizas arbusculares. Los HFMA no solo favorecen un mayor crecimiento y desarrollo vegetal, sino también el sistema inmune de las plantas, mejorando la respuesta de la planta a estrésbióticoyabiótico(Barea,2015). El objetivo de este estudio fue determinar el efecto de un bioinóculo a base de HFMA sobre la producción de biomasa tanto aérea, radical y de sus frutos, en V. corymbosum comparándoloconuncontrolsininóculo.


MATERIALES Y MÉTODOS
Diseño experimental
El ensayo se llevó a cabo entre los años 20192021 en el fundo Santa Laura ubicado en la localidad de Chillán, Región de Ñuble, Chile (36°35'53.3"S 72°01'58.0"W). Esta localidad posee clima mediterráneo con estaciones marcadas de lluvia y sequía. Durante los meses de enero y febrero del año 2019 se estableció el cultivo de V. corymbosum variedad ‘Kirra’ , en el cuartel 3 del fundo Santa Laura, en macetas de 40 L en sustratos de turba con perlita (1:1, v/v), con un total de 3.333 plantas por hectárea. Se realizó manejo de fertilización mediante fertirriego, realizándose cinco pulsos de riego por 10 a 15
53 | INNOVAGRO | agronomia.uct.cl
min diarios, en el cual se aplicaban dosis de nutrientes al estanque de riego, correspondiente a: 1,5 kg de urea, 2 kg de sulfato de magnesio, 5 kg de sulfato de potasioy3Ldeácidofosfórico.
Inoculación de HFMA
Se realizaron dos inoculaciones en V. corymbosum con cinco especies de hongos formadores de micorrizas arbusculares (Acaulospora laevis, Scutellospora calospora, Claroideoglomus claroideum, Claroideoglomus etunicatum y Rhizoglomus intraradices), en noviembre de 2019 y septiembre de 2020, con una dosis de 200 g ha-1 aplicado con el fertirriegoalasplantas.
Biomasa aérea y radical

Se determinó la biomasa aérea y radical mediante peso fresco y peso seco. Por lo tanto, se tomaron las plantas separando la parte aérea de la planta (tallo y hojas) de la radical y se registró su peso fresco. Luego, fueron guardadas en bolsas de papel individualmente y se realizó el secado en una estufaa60°Cdurante3díashastaquesupeso fueestablepararegistrarpesoseco.
Análisis del fruto
Los frutos se cosecharon 2 años después del establecimiento del cultivo, se determinó el diámetro de frutosutilizando unpie de metro
electrónico, como también la masa de los frutosmedianteunabalanza.
Análisis estadístico
Para peso fresco y peso seco (tanto aéreo comoradical)delaplanta,diámetroypesode frutos, se realizó un análisis de varianza (ANDEVA) de una vía, considerando la ausencia y presencia de inóculo como factor principal. La significación estadística se determinó en p ≤ 0,05. Las medias se compararon mediante la prueba de rango múltiple de Tukey. Se utilizó el Software estadísticoStatgraphicsCenturionXVI.
RESULTADOS Y DISCUSIÓN
La Figura 1 señala una comparación de biomasas aéreas (A) y biomasa radical (B) de las plantas control y plantas con aplicación del bioproducto, tanto en peso fresco como peso seco. En cuanto al peso fresco y peso seco en biomasa aérea (Figura 1A), se observó una diferencia de 1,5 y 1,2 veces, respectivamente,mayorenplantasinoculadas con respecto al control. Respecto al peso fresco y peso seco en biomasa radical (Figura 1B), se observó que las plantas inoculadas presentaron alrededor del 100% más de biomasa que el control. Qin et al. (2022) confirmaron mediante metanálisis que la inoculación de HFMA aumenta la biomasa de brotes, raíces y total de la planta. En cuanto al rendimiento de los frutos desde plantas

54 | INNOVAGRO | agronomia.uct.cl
control y plantas inoculadas, se puede observar en la Figura 1 la comparación entre eldiámetrodelosfrutos(C),comotambién,el peso de los frutos en la primera cosecha (D). En el diámetro promedio en los frutos (Figura 1C) las plantas inoculadas presentaron el mayor diámetro del fruto, con 16,25 mm mientras que el control presentó 15,5 mm. El peso de los frutos en primera cosecha (Figura 1D), desde las plantas inoculadas posee una masa promedio de 140 g, mientras la masa promedio del control fue de 80 g, es decir, un incremento de 75%. Demostrando diferencias significativas, esto es debido al considerable

aumento del tamaño de la raíz, permitiendo ampliar considerablemente el volumen de suelo que puede ser explorado y por ende, se incrementa la cantidad de nutrientes que pueden ser obtenidos por la planta (Harrison, 1999); lo que finalmente se ve reflejado en el tamaño y calidad del fruto. Wang et al. (2022) realizaron un estudio en tomate cherry en el cualsedemostróquelainoculacióndeHFMA y el contenido de nutrientes en el suelo, se relacionan estrechamente con el crecimiento y reproducción del tomate. En el presente estudio al igual que Urcelay (2002) se observaronestructurastípicasdeHFMA.

55 | INNOVAGRO | agronomia.uct.cl
Pesode frutosen primera cosecha (g). Error estándar indicado por barras. Letras diferentes indican medias significativamente diferentes según la prueba de rango múltible de Tukey (P≤0,05). Letras mayúsculas indican diferencias significativas entre tratamientos y letras minúsculas muestran diferenciassignificativasentrepesofrescoypesosecoindependienteportratamiento
CONCLUSIÓN
Se determinó que el tratamiento correspondiente a inoculación con hongos micorrícicos arbusculares presentes en el bioestimulante favorece considerablemente el crecimiento y desarrollo de las plantas, como también a los frutos de V corymbosum, demostrando el efecto beneficioso que otorga

una asociación micorrícica arbuscular en esta especie, a pesar de que es parte de la familia Ericaceae.
LITERATURA CITADA

Arriagada, C., Manquel, D., Cornejo, P., Soto, J., Sampedro, I., and Ocampo, J. 2012.
Effects of the co-inoculation with saprobe

56 | INNOVAGRO | agronomia.uct.cl
Figura 1. Rendimiento de planta y frutos de V. corymbosum. Biomasa de plantas de arándano: A. biomasaaérea(g);B.Biomasaradical(g).Calibredefrutos:C.Diámetrodefrutos(mm);D.
and mycorrhizal fungi on Vaccinium corymbosum growth and some soil enzymatic activities. Journal of Soil Science andPlantNutrition 12(2):283-294.
Barea, J.M. 2015. Future challenges and perspectives for applying microbial biotechnology in sustainable agriculture based on a better under-standing of plantmicrobiome interactions Journal of Soil ScienceandPlantNutrition 15(2):261-282.

Carrillo, R. 2012. Micorriza ericoide en arándano (Vaccinium corymbosum L.). p. 168-186. In El cultivo de arándanos en Chile. Universidad Católica de Temuco.
Temuco,Chile.
Carrillo, R., Guerrero, J., Beraud, M.R., and Gergichevic, C.M. 2015. Colonization of blueberry (Vaccinium corymbosum) plantlets by ericoid mycorrhizae under nursery conditions. Ciencia e Investigación Agraria: Revista Latinoamericana de Ciencias delaAgricultura 42(3):365-374.
González, A., Riquelme, J., and Morales, C.G. 2017. Manual de manejo agronómico del arándano. Instituto de Desarrollo Agropecuario (INDAP). Santiago, Chile. 102p.

Harrison, M. 1999. Molecular and cellular aspects of the arbuscular mycorrhizal symbiosis. Annual Review of Plant Biology 50(1):361-389.
Kron,K.,Judd,W.,Stevens,P.,Anderberg,A., Crayn, D., Gadek, P., Quinn, C., and
Luteyn, J. 2002. A phylogenetic classification of Ericaceae: molecular and morphological evidence. Botanical Review 68(3):335-423.
Liu, X. M., Xu, Q.L., Li, Q.Q., Zhang, H., and Xiao, J.X. 2017. Physiological responses of the two blueberry cultivars to inoculation with an arbuscular mycorrhizal fungus under low-temperature stress Journal of PlantNutrition 40(18):2562-2570.
ODEPA. 2022. Boletín de fruta, abril 2022 Disponible en https://www.odepa.gob.cl/publicaciones/b oletines/boletin-de-fruta-abril-2022. Leído el24denoviembrede2022.
Qin, M., Li, L., Miranda, J.P., Tang, Y., Song, B., Oosthuizen, M.K., and Wei, W. 2022. Experimental duration determines the effect of arbuscular mycorrhizal fungi on plant biomass in pot experiments: a metaanalysis Frontiers in Plant Science 13:1024874.
Salhi, L.N., Bustamante-Villalobos, P., Forget, L., Burger, G., and Lang, B.F.2022. Endosymbionts in cranberry: diversity, effect on plant growth, and pathogen biocontrol. Plants, People, Planet 4(5):511522.
Urcelay, C. 2002. Co-occurrence of three fungal root symbionts in Gaultheria poeppiggi DC in Central Argentina. Mycorrhiza 12(2):89-92.
57 | INNOVAGRO | agronomia.uct.cl
Wang, L., Chen, X., Du, Y., Zhang, D., and Tang, Z. 2022. Nutrients regulate the effects of arbuscular mycorrhizal fungi on

the growth and reproduction of cherry tomato. FrontiersinMicrobiology 13:843010.

58 | INNOVAGRO | agronomia.uct.cl
EFECTO DE LA TÉCNICA DE PURIFICACIÓN SOBRE LA COMPOSICIÓN

AMINOACÍDICA DE UN EXTRACTO PROTEICO MICROBIANO DE ORIGEN RUMINAL
Effect of purification technique on the amino-acid composition of a microbial protein extract of ruminal origin
1Departamento de Ciencias Agropecuarias y Acuícolas, Facultad de Recursos Naturales, UniversidadCatólicadeTemuco(UCTemuco).RudecindoOrtega02950.Temuco,Chile.
2NúcleodeInvestigaciónenProducciónAlimentaria,UCTemuco.

*Autorparacorrespondencia:avelasquez@uct.cl.
ABSTRACT
In order to obtain a protein extract of ruminal origin that helps mitigate the deficit of protein sources for no-ruminant animal feeding, two protein extracts based on ruminal microorganisms were generated; one corresponding to raw pellet of microorganisms (CPM) and another to purifiedproteinextract(EPP),whichweresubsequentlyperformedbromatologicalanalysis.These analyzes showed in the case of CPM a crude protein (CP) content of 29.96% and to EPP a 94.94%. In addition, high efficiency liquid chromatography (HPLC) was performed on CPM and EPP to obtainanaminoacidanalysis.HighlightingthemethioninecontentinEPPandCPMwith8.61and 8.04 g 100 g-1, respectively. There was a difference between EPP and CPM treatment, with the exception of glycine and phenylalanine amino-acid. An adequate biological value was found in both protein extracts. EPP contains high levels of CP in comparison with current protein sources, makingitanexcellentproteinsupplement.
Key words:rumen,microbialprotein,essentialaminoacids,biologicalvalue.
INTRODUCCIÓN
El contenido de aminoácidos esenciales de unaproteínaadquiere granrelevancia cuando se desea destinar este nutriente a la alimentación de animales no-rumiantes. En
efecto, el valor biológico de una proteína releva el concepto de esencialidad de algunos aminoácidos, los cuales no pueden ser sintetizados autónomamente por el propio metabolismo de un animal, haciendo
59 | INNOVAGRO | agronomia.uct.cl
Alejandro Velásquez1,2*,MirtaTapia1,PabloMercado1 yGonzaloBruna1
imprescindible su aporte exógeno en la dieta. En esta línea, se señala que una proteína de alto valor biológico, rica en aminoácidos esenciales, es altamente aprovechada por el animal, estableciendo una alta eficiencia de utilizacióndeloscompuestosnitrogenadosde la ración. En el contexto actual de la alimentación de animales productivos de granja, toma especial relevancia la búsqueda de nuevas fuentes de proteínas con un alto valor biológico, debido, por un lado, el alto valor monetario de las fuentes proteicas utilizadas tradicionalmente, y por otro, al impacto ambiental y al uso de grandes extensiones de suelo que demandan los cultivos tradicionales para este propósito. Especial mención, a este respecto, tiene el cultivo de la soya transgénica, ocupando miles de hectáreas en todo el mundo, y al mismo tiempo, presentando controversias ecológicas y un rechazo por algunos sectores más conservadores que no apoyan la explotación de especies transgénicas (van HuisyOonincx,2017).
Bajo esta mirada, la necesidad de buscar nuevas alternativas proteicas de alta calidad nutricional para alimentar animales norumiantes ha motivado el surgimiento de innovadoras investigaciones con este propósito. Como se mencionó precedentemente, los animales no-rumiantes dependen en forma exógena de los aminoácidos esenciales para cubrir sus
requerimientos, por lo cual, si éstos no son entregados en la dieta en las cantidades adecuadas, el animal sufrirá consecuencias detrimentales en su fisiología, metabolismo y ensusalud,engeneral.
Por otro lado, las proteínas microbianas de origen ruminal presentan un gran valor biológico, destacando su alto contenido en aminoácidos esenciales, constituyendo una potencial alternativa para generar un extracto proteico con fines nutricionales (Johansen et al., 2018). Según McDonald et al. (2006) los microorganismos ruminales son una muy buena fuente de aminoácidos esenciales, además de proveer vitaminas y minerales. Se han reportado, a modo de ejemplo, valores de 9,38 g de lisina, 4,84 g de cisteína y metionina, y 6,29 g de treonina (g 100 g-1 proteína) en microorganismos aislados desde el rumen (Sok etal.,2017).
En este contexto, los procesos biotecnológicos implementados para generar extractos proteicos desde diferentes orígenes, constituye también materia de investigación y perfeccionamiento. Bajo esta mirada, la técnica de purificación proteica puede afectar la composición aminoacídica del extracto, dada la posibilidad de aislar diferentes tipos de proteínas según el método de extracción.

En consecuencia, el objetivo de esta investigación fue evaluar la composición aminoacídica de un extracto proteico

60 | INNOVAGRO | agronomia.uct.cl
microbiano de origen ruminal sometido a dos técnicasdepurificaciónproteica.
MATERIALES Y MÉTODOS
El fluido ruminal (FR) fue colectado desde dos vacas frisonas fistuladas al rumen, alimentadas con heno de ballica bajo requerimientos de mantención. El FR fue filtrado en paño quesero para posteriormente ser homogeneizado en una Blender (8011S). Los extractos proteicos ruminales se obtuvieron bajo dos alternativas de purificación: 1. Centrifugación del FR a 4000 rpm a 4°C, generando un pellet rico en microorganismos; posteriormente, este pellet se liofilizó y se conservó bajo refrigeración hasta su análisis aminoacídico (Figura 1). Este extracto fue denominado Extracto de Pellet Crudo de Microorganismos (CPM). 2. Luego de obtener el pellet de microorganismos, éste fue resuspendido en buffer fosfato de potasio
pH7,0 (KH2PO4)50 mM, 4 g L-1 (Na2CO3)y 13 mM ((NH4)2SO4) para luego, ser sometido a una disrupción por sonicación (ultrasonido), seguido de una centrifugación a 12.500 rpm a 4°C. Para aislar las proteínas se procedió a precipitarlas con sulfato de amonio (550 g L-1) mediante la técnica salting out (Velásquez y Pichard,2010).Posteriormente,secentrifugóa 12.900 rpm durante 30 minutos a 4°C, obteniendo así un segundo tipo de extracto proteico, denominado Extracto Purificado de Proteínas (EPP) (Figuras 1, 2 y 3). Luego de
generar los dos tipos de extractos se procedió a determinar PC (Kjeldahl) y su perfil aminoacídico por cromatografía líquida de alta eficacia (HPLC) en el Laboratorio de Fitoquímica del Instituto de Producción y Sanidad Vegetal, perteneciente a la Facultad de Ciencias Agrarias y Alimentarias de la Universidad Austral de Chile. El diseño experimental fue completamente al azar con un factor y con dos niveles (tipo de extracto). Se realizaron tres réplicas/tratamiento. Para evaluar las diferencias de medias se utilizó la prueba no paramétrica ordinal MannWhitney. Se infirió que las diferencias fueron significativas cuando P≤0,01. El análisis estadístico se realizó a través del programa IBMSPSSStatistics19.



61 | INNOVAGRO | agronomia.uct.cl
Figura 1. Proceso de preparación del fluido ruminal (FR) y obtención del tratamiento Extracto de Pellet Crudo de Microorganismos (CPM) a través de la técnica de centrifugación (4.000rpm).
RESULTADOS Y DISCUSIÓN
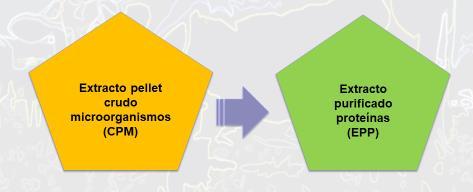

El contenido de PC fue de 29,96% y 94,94% para los tratamientos CPM y EPP, respectivamente; evidenciando claramente la diferencia en el nivel de purificación proteica que implica generar una disrupción celular y precipitar, posteriormente, las proteínas celularesliberadas(Cuadro1).


62 | INNOVAGRO | agronomia.uct.cl
Figura 2. Generación del tratamiento Extracto Purificado de Proteínas (EPP), a través de una sonicación, luego una precipitación con sulfato de amonio, seguido de centrifugación (12.900 rpm), resuspensión, dializado y liofilizaciónfinalparasuconservación.
Figura 3. Diagrama indicando la naturaleza de los dos tratamientos experimentales, donde el primero, Extracto de Pellet Crudo (CPM) da origen al segundo, Extracto PurificadodeProteínas(EPP).
Cuadro 1. Análisis bromatológico de los extractos CPM y EPP, destacando el contenido de PC (94,94%)deEPP.
CPM: Crudo Pellet de Microorganismos. EPP: Extracto Proteico Purificado.
Por otro lado, el análisis aminoacídico mostró un alto valor biológico de las proteínas estudiadas, y al mismo tiempo, se pudo observar diferencias entre los tratamientos evaluados en la mayoría de los aminoácidos comparados (Cuadro 2). En todos los casos, el contenido de aminoácidos fue mayor para el tratamiento EPP. En este mismo cuadro se puede destacar el contenido de metionina,

tanto para EPP como para CPM (8,61 y 8,04 g 100 g-1, respectivamente). También, cabe destacar los contenidos de los aminoácidos valina, prolina, histidina y arginina. Los valoresmásbajosseobservaronenlisina(2,42 y2,35,paraEPPyCPM,respectivamente). No hubo diferencias entre los tratamientos para los aminoácidos glicina, leucina y fenilalanina.
Cuadro 2. Composición aminoacídica de los extractos proteicos microbiales de origen ruminal, obtenidosbajodostécnicasdepurificación.
CPM: Crudo Pellet de Microorganismos. EPP: Extracto Proteico Purificado. NS: no significativo. *Significativo (P ≤ 0,01).
Asp (Aspartamo), Glu (Glutamato), Ser (Serina), Gly (Glicina), Hys (histidina), Arg (Arginina), Thr (Treonina), Ala (Alanina), Pro (Prolina), Tyr (Tirosina), Val (Valina), Met (Metionina), Cys (Cisteína), Ile (Isoleucina), Leu (Leucina), Phe (Fenilalanina), Lys (Lisina). Expresado: g 100 g-1 proteína.
Una posible explicación de los resultados hallados, se podría fundamentar en el hecho que la liberación de proteínas intracelulares
(desde el citoplasma y/u organelos), ocurrió en forma diferenciada, pudiendo haber generado para la purificación, proteínas de

63 | INNOVAGRO | agronomia.uct.cl
Tratamientos MS (%) Cenizas (%) PC (%) Extracto etéreo (%) Fibra cruda (%) Extracto no N (%) CPM 91,82 8,26 29,96 6,24 6,97 48,55 EPP 97,63 2,36 94,94 - 0 2,69
Tratamientos Asp Glu Ser Gly Hys Arg Thr Ala Pro Tyr Val Met Cys Ile Leu Phe Lys EPP 11,18 11,58 5,38 2,81 6,65 6,67 6,1 3,89 8,5 5,95 7,92 8,61 ND 4,72 4,73 2,89 2,42 CPM 10,76 11,22 5,15 2,81 6,3 6,42 5,86 3,77 8,15 5,69 7,55 8,04 3,8 4,56 4,7 2,87 2,35 * * * NS * * * * * * * ** NS NS *
mejor calidad al incrementar suconcentración en el extracto. Los valores hallados, tanto en contenido de PC como en calidad aminoacídica, posicionan a estos tipos de extractos como una alternativa para ser considerados como suplementos en la alimentacióndeanimalesno-rumiantes.
CONCLUSIONES
Existieron diferencias nutricionales entre los extractos EPP y CPM en su composición aminoacídica y en el contenido de PC. Se encontró un valor biológico adecuado en ambos extractos proteicos para la alimentación de animales no-rumiantes, siendo mayor el contenido de aminoácidos esenciales en EPP. La diferencia detectada entre los tipos de extractos se pudo haber debido al hecho de que se liberaron distintas proteínas y en diferentes concentraciones (origen intracelular), generando extractos aminoacídicamentediferentes.
LITERATURA CITADA

Johansen, M., Lund, P., and Weisbjerg, M.R. 2018. Amino acid profile of metabolisable protein in lactating dairy cows is affected by dry matter concentration in grassclover silage. Animal Feed Science and Technology 237:166–174.
Mcdonald, P., Edwards, R.A., Greenhalgh, J.F., y Morgan, C.A. 2006. Nutrición animal. 6°ed. Editorial Acribia. Zaragoza, España.509p.
Sok, M., Ouellet, D.R., Firkins, J.L., Pellerin, D., and Lapierre, H. 2017. Amino acid composition of rumen bacteria and protozoa in cattle. Journal of Dairy Science 100(7):5241-5249.
van Huis, A., and Oonincx, D.G. 2017. The environmental sustainability of insects as food and feed. A review. Agronomy for SustainableDevelopment 37(5):43.
Velásquez, A., and Pichard, G. 2010. Effects of rumen fluid pre-incubation on in vitro proteolytic activity of enzymatic extracts from rumen microorganisms. Animal Feed ScienceandTechnology 162:75-82.

64 | INNOVAGRO | agronomia.uct.cl
DE RESIDUO A BIOFERTILIZANTE: EN MIRAS HACIA UNA ACUICULTURA SOSTENIBLE EN CHILE
From waste to biofertilizer: Towards sustainable aquaculture in Chile

1UniversidadCatólicadeTemuco(UCTemuco).RudecindoOrtega02950,Temuco,Chile.
2ProgramadeDoctoradoenCienciasAgropecuarias,UCTemuco.
3NúcleodeInvestigaciónenProducciónAlimentaria,DepartamentodeCienciasAgropecuariasy Acuícolas,UCTemuco.
*Autorparacorrespondencia:gcuraqueo@uct.cl
ABSTRACT
The salmon farming industry has become an area of strong development for the country in recent years. This development has a negative impact on the environment, due to the generation of residual sludge. In pursuit of to mitigate these impacts, it is pointed out that these sludges can be valued for use in agricultural systems, due to their important nutritional content, especially nitrogen, phosphorus, and organic matter. This can be considered as a successful alternative in reducing chemical fertilization used in agriculture and its consequent contribution to the sustainability of agroecosystems and the promotion of the circular economy in agricultural and aquaculture systems. This brief review describes the current situation of salmon farming sludge in the country, in addition to some preliminary results of investigations that have been realized with emphasisonthemanagementevaluatedforefficienttreatmentsinthewasterevalorization.
Key words: revalorization,salmonfarming,sludge,waste.
INTRODUCCIÓN
En la actualidad, Chile se posiciona como uno de los mayores productores de salmónidos a nivel mundial, constituyéndose como uno de los sectores alimentarios de potencial crecimiento (FAO, 2022). Se estima que para
el año 2030 la producción acuícola alcance los 2,2 millones de toneladas, representando una tasa de crecimiento del 47,6% con respecto a la producción de 2020 (FAO, 2022). Este crecimiento no solo genera proyecciones desde una perspectiva social y económica,

65 | INNOVAGRO | agronomia.uct.cl
Susana Cayunao1,AndrésPérez-SanMartín2,GustavoCuraqueo3*
sino que requiere un análisis desde un punto de vista medioambiental (Bohnes et al., 2022). Esto, debido al aumento en la producción de lodos residuales provenientes del sistema productivo del cultivo de salmones, los cuales están constituidos del material fecal y alimento no digerido por los peces (Nenciu et al., 2022). Entre sus principales desventajas, se destaca la dificultad en su manejo, debido a que su contenido de agua alcanza cifras por sobre el 90% de humedad, lo cual supone que por cada tonelada de salmón producido se generan 1,4 t de este residuo (Salazar et al., 2005). A pesar de esto, sus principales beneficios se ven reflejados en sus características químicas, reportando altos valoresde materia orgánica (>50%), contenido de fósforo (8,5 a 75,5 g kg-1) y nitrógeno (2,6 a 3,7%) (Hepp et al , 2012). Por lo tanto, su contenido de materia orgánica y de nutrientes lo convierte en un potencial residuo valorizable como enmienda mejoradora de suelos de uso agroforestales, estableciendo alternativas para el desarrollo de sistemas de economía circular en el sector acuícola en Chile.
El objetivo de este trabajo fue describir la situación actual de los lodos de la salmonicultura en el país, además de algunos resultados preliminares de investigaciones que se han realizado con énfasis en el manejo evaluado para tratamientos eficientes en la revalorizaciónderesiduos.

Legislación en el manejo de lodos de piscicultura
Una de las principales características que se destaca constantemente en el uso de lodos en la agricultura es su contenido de sustancias fitotóxicas que podrían alterar la calidad del suelo y actuar como un potencial residuo de riesgo ambiental (Barattini, 2012). Sin embargo, estos niveles pueden variar de acuerdo a cada piscicultura y a los tratamientos previos utilizados en la estabilización de estos lodos. Entre ellos se destaca la presencia de metales pesados (As, Cu, Cr, Hg, Pb, Zn, entre otros), antibióticos (florfenicol y oxitetraciclina) y patógenos humanos (coliformes fecales y Salmonella sp.). Si bien estos factores pueden ser identificados como vectores de contaminación, no reportan valores significativamente elevados para ser considerados un potencial riesgo ambiental si se tratan adecuadamente. Actualmente, la presencia de antibióticos ha disminuido considerablemente en la industria acuícola en Chile debido a las legislaciones internacionales de exportación de productos marinos y a la implementación de nuevos sistemas para el control de patógenos como lo es mantener niveles óptimos de salinidad (Lozano etal.,2017).Asuvez,estassustancias y la presencia de patógenos podrían ser controladas con diversos tratamientos que disminuyansucargatóxica.

66 | INNOVAGRO | agronomia.uct.cl
Debido a estos manejos dentro del proceso productivo, los lodos podrían reportar una alta concentración de sales minerales. Investigaciones realizadas por Gwenzi et al. (2016), indicarían que estos residuos tienen la capacidad de aumentar la conductividad eléctrica(CE)delsuelo luegodesuaplicación. Una característica importante para la toma de decisiones al momento de establecer un cultivo, siendo un parámetro limitante en el desarrollo de algunasespecies sensibles a esta condición. Sin embargo, recientes investigaciones abordan el potencial de este residuo como una fuente de recuperación de nutrientes, tales como, nitrógeno en forma de amoníaco y nitrato, fósforo, MO (Jasmín et al., 2020; Yogev et al., 2020) y de sustancias estabilizadas tipo húmicas y fúlvicas existentesensistemasacuáticosyquepodrían acumularse debido al arrastre causado durante el proceso de recirculación de agua hacialosestanques(Lieke etal.,2021).

A pesar de estas cualidades, en Chile aún no existe una norma actual que establezca el rango de aplicación de estos residuos al sistema del suelo, manteniéndose como referente lo estipulado en la Norma Chilena de Compost (NCh2880). En este sentido, durante el año 2009, se publicó la “Guía de aplicación de lodos de piscicultura en suelos” (SAG, 2009), lo cual permitió establecer recomendaciones en la caracterización de estosresiduos.Posteriormente,enelaño2018,
fue publicado un informe de la Subsecretaría de Pesca y Acuicultura sobre el “Establecimiento de las condiciones necesarias para el tratamiento y disposición de desechos generados por actividades de acuicultura” (Aranda et al., 2018), lo que permitió, a comienzos del año 2021, la aprobación del Decreto 64 en el año 2021 sobre un “Reglamento que establece condicionessobreeltratamientoydisposición final de desechos provenientes de actividades de acuicultura” Finalmente, teniendo como el acontecimiento más reciente, la favorable pronunciación del “Reglamento para el manejo de lodos generados en plantas de tratamiento de efluentes de pisciculturas” detallado en el Acuerdo Nº 19/2021 del Consejo de Ministros para la Sustentabilidad (2021). Sin embargo, el principal destino de estos lodos continúa siendo su disposición final en vertederos y rellenos sanitarios, impactando directamente sobre el medio ambiente por la emisión de gases contaminantes, olores molestos y contaminación de aguas subterráneas (Machuca, 2022). Lo cual provoca la generación de focos de contaminación y aumenta los gastos en que incurren las pisciculturas debido a la externalización del procesodetraslado.

67 | INNOVAGRO | agronomia.uct.cl
Revalorización de lodos en la agricultura

Uno de los aspectos más importantes considerados en la revalorización de residuos es la implementación de nuevos mecanismos de economía circular en los sistemas industriales. Esto, considerando el aumento de este sector a nivel nacional y su producción de residuos orgánicos, lo cual genera una necesidad de acelerar esta transición para un manejo sustentable de estos materiales (Ministerio del Medio Ambiente, 2021). Una preocupación generalizada en la necesidad de disminuir la carga sobre los vertederos y los consecuentes impactos medioambientales que genera la disposición residual, ha impulsado el desarrollo de nuevas investigaciones para evaluar el efecto de los residuos industriales en las prácticas agrícolas. Esto, considerando su importancia en el contenido de nutrientes y su calidad como material orgánico de potencial revalorización (Ezziddine et al., 2020; Nenciu et al., 2022). Por el contrario, investigaciones describen la presencia de factoresque pueden influir en el contenido de nutrientes de los lodos y su impacto sobre el suelo (Hepp et al., 2012). Uno de estos, es la necesidad de un tratamiento de estabilización previo que permita la conversión del material orgánico o que mejore sus características para unaaplicacióndirecta.

Hepp et al. (2012) evaluaron estos lodos en estado fresco con previa estabilización. Estos
fueron aplicados a praderas en forma de cobertera bajo riego, obteniendo resultados positivos en términos de rendimientos de materia seca. Sin embargo, esta forma de aplicación, puede conducir a lixiviaciones y posteriormente, a la contaminación de aguas subterráneas. Otras formas de utilización han involucrado el prensado del lodo a fin de disminuir su contenido de agua, pero esta forma de utilización resulta en una difícil manipulación del mismo, ya sea para aplicaciones o para su traslado, debido a su naturaleza húmeda. Además de ello, se considera muy necesario destacar que el lodo en estado fresco resulta en la liberación de aromas desagradables, lo que puede llevar a una contaminación odorífera si estos son aplicados en grandes extensiones y como foco deacumulacióndeinsectos.
Tecnología Waister en el sector acuícola
El potencial de contenido de nutrientes y la búsqueda de manejos eficientes para el lodo ha impulsado a la búsqueda de técnicas de manejo para su aplicación y análisis. En este sentido, investigaciones realizadas por estudiantes de pre y posgrado de la UC Temuco (no publicadas) han evaluado el efecto del lodo deshidratado (7% de humedad) obtenido a partir de tecnología termomecánica de secado mediante el equipo Waister (Circular Solutions). Este lodo seco y estabilizado destaca por su contenido
68 | INNOVAGRO | agronomia.uct.cl
importante de MO (82%), pH 5,3 y CE de 5,4 dS m-1. Dicho residuo se aplicó en un huerto de avellano europeo (Corylus avellana L.), obteniendo resultados favorables a nivel del desarrollodevariables fisiológicasdel frutal y a nivel de suelo en comparación a un fertilizante convencional aplicado por registro y mantención del huerto frutal. Sin embargo, a pesar de estos resultados alentadores, se hace necesario evaluar y considerar algunas características fisicoquímicas del lodo para su uso, como por ejemplosusaltosnivelesde CE que lo hacen inapropiado para sus aplicaciones en otros cultivos agrícolas más sensibles.
Técnicas de manejo como la mencionada anteriormente, permiten la revalorización de estos residuos manteniendo un equilibrio entre eficiencia y sustentabilidad. A su vez, se facilita el transporte del residuo, disminuyendo la emisión de olores desagradables y mejorando su aplicación al suelo. Adicionalmente, evita la generación de riesgos ambientales asociados al derrame de estos o procesos de lixiviación condicionados por sus altos niveles de humedad. Por lo tanto, investigaciones en el uso de lodos de salmonicultura podrían favorecer el desarrollo de sistemas de economía circular dentro del sector acuícola en Chile, estableciéndose como una alternativa al aumento de los costos de fertilizantes
sintéticos y sus efectos negativos en la sucesivadegradacióndelossuelos.
CONCLUSIONES
El uso de los lodos de piscicultura puede ser considerado como una alternativa para disminuir la fertilización química utilizada en la agricultura, contribuyendo a la sustentabilidad de los agroecosistemas y al impulso de la economía circular en los sistemas agropecuariosyacuícolas.

A lo largo de las diversas investigaciones realizadasse hademostradoqueloslodos de pisciculturas son eficientes aportando nutrientes para los sistemas agrícolas. Sin embargo, aún quedan aspectos importantes a considerar para aumentar su eficiencia y controlar la biodisponibilidad de compuestos fitotóxicos.

Es necesario evaluar las técnicas de tratamientos más apropiados para su uso, de modo que mantengan el aporte nutricional hacia los cultivos al mismo tiempo que permita un manejo eficiente y sustentable.
LITERATURA CITADA
Barattini, P. 2012. Antibióticos en acuicultura. p. 61-67. In Hepp, Ch. (ed.). Resultados preliminares sobre el uso de lodos de pisciculturas sobre suelos agropecuarios
69 | INNOVAGRO | agronomia.uct.cl
de origen volcánico de la Patagonia Occidental (Aysén). Instituto de Investigaciones Agropecuarias (INIA). Coyhaique,Chile.
Bohnes, F., Hauschild, M., Schlundt, J., Nielsen, M., and Laurent, A. 2022. Environmental sustainability of future aquaculture production: Analysis of Singaporean and Norwegian policies. Aquaculture 549:737717.
Consejo de Ministros para la Sustentabilidad (2021). Acuerdo N°19/2021 mma (junio 30, 2021). Se pronuncia favorablemente sobre el reglamento para el manejo de lodos generados en plantas de tratamiento de efluentes de pisciculturas. Disponible en https://mma.gob.cl/wpcontent/uploads/2021/08/Acuerdo-19.pdf. Leídoel18denoviembrede2022.

Ezziddine, M., Liltved, H., and Homme, J. 2020. A method for reclaiming nutrients from aquacultural waste for use in soilless growth systems. Water Science and Technology 81:81-90.
FAO. 2022. El estado mundial de la pesca y la acuicultura (SOFIA). Hacia la transformación azul. FAO. Roma, Italia. 288p.
Gwenzi, W., Muzava, M., Mapanda, F., and Tauro, T. 2016. Comparative short-term effects of sewage sludge and its biochar on soil properties, maize growth and uptake of nutrients on a tropical clay soil
in Zimbabwe. Journal of Integrative Agriculture 15:1395-1406.

Hepp, Ch., Vidal, F., Barattini, P., y Carvajal, A. 2012. Caracterización de lodos de piscicultura con potencial para el sector agropecuario. p. 25-34. In Hepp, Ch. (ed.). Resultados preliminares sobre el uso de lodos de pisciculturas sobre suelos agropecuarios de origen volcánico de la Patagonia Occidental (Aysén). Instituto de Investigaciones Agropecuarias (INIA). Coyhaique,Chile.
Jasmin, M., Syukri, F., Kamarudin, M., and Karim, M. 2020. Potential of bioremediation in treating aquaculture sludge: Review article. Aquaculture 519:734905.
Lieke, T., Steinberg, C., Pan, B., Perminova, I., Meinelt, T.,Knopf, K.,andKloas, W. 2021. Phenol-rich fulvic acid as a water additive enhances growth, reduces stress, and stimulates the immune system of fish in aquaculture. ScientificReports 11:174.
Lozano, I., Díaz, N., Muñoz, S., y Riquelme, C. 2017. Antibióticos en la acuicultura chilena: una revisión. In Antibiotic Use in Animals (Ed.). IntechOpen. https://doi.org/10.5772/intechopen.71780. Machuca, M. 2022. Evaluación de ciclo de vida (ECV) de un biofertilizante a partir de lodos y ensilado de peces. Tesis Magister en Ingeniería Industrial.
70 | INNOVAGRO | agronomia.uct.cl
Universidad de Concepción. Facultad de Ingeniería.Concepción,Chile.
Ministerio del Medio Ambiente. 2021. Estrategia nacional de residuos orgánicos Chile 2040. Disponible en https://economiacircular.mma.gob.cl/wpcontent/uploads/2021/03/EstrategiaNacional-de-Residuos-Organicos-Chile2040.pdf.Leídoel27deagostode2022.

Nenciu, F., Voicea, I., Cocarta, D., Valentin, N., Matache, M., and Arsenoaia, V. 2022.
“Zero-waste” food production system supporting the synergic interaction between aquaculture and horticulture. Sustainability 14:13396.

SAG. 2009. Guía de aplicación de lodos de piscicultura en suelos. ECOING, Consultoría Ambiental e Ingeniería (ed.). Chile.21p.
Salazar, F., Alfaro, M., Teuber, N., y Saldaña, R. 2005. Uso de lodos de la industria salmonera en suelos agrícolas. Tierra Adentro N°60p.35-37.
Aranda, M., Cordero, E., y Stack, I. 2018. Establecimiento de las condiciones necesarias para el tratamiento y disposición de desechos generados por actividades de acuicultura. Subsecretaría de Pesca y Acuicultura. Puerto Varas, Chile.187p.
Yogev, U., Vogler, M., Nir, O., Londong, J., and Gross, A. 2020. Phosphorus recovery from a novel recirculating aquaculture system followed by its sustainable reuse as a fertilizer. Science of The Total Environment 722:137949.
71 | INNOVAGRO | agronomia.uct.cl
















 Dr. Alejandro Velásquez Briceño DirectorRevistaINNOVAGRO
Dr. Alejandro Velásquez Briceño DirectorRevistaINNOVAGRO









































