E d u c a c i ó Q u í m i c a
L’àtom
De cómo el átomo se convierte en «real» y complejo y adquiere una estructura
De com l’àtom es va fer útil i ensenyable
De com l’àtom esdevé una peça de LEGO. Una visió crítica
A holistic approach to the atom in school chemistry

S o c i e t a t C a t a l a n a d e Q u í m i c a - F i l i a l d e l ’ I n s t i t u t d ’ E s t u d i s C a t a l a n s
2 0 1 4 n ú m e r o 1 9
EduQ
Educació Química EduQ
Octubre2014,número19
Editors
FinaGuitart,CESIRE-CDEC,SCQ,Barcelona
AureliCaamaño,SCQ,Barcelona
Consell Editor
JosepCorominas,EscolaPia,Sitges
JordiCuadros,IQS-URL,Barcelona
JosepDurán,UdG,Girona
PereGrapí,INSJoanOliver,Sabadell
ClaudiMans,UB,Barcelona
ÀngelMesseguer,CSIC,Barcelona
NeusSanmartí,UAB,Barcelona
MontseTortosa,INSFerranCasablancas,Sabadell
AmparoVilches,UV,València
Consell Assessor
Consell Assessor Catalunya / Espanya
JoanAliberas,INSPuigCadafalch,Mataró
MiquelCalvet,INSCastellar,CastellardelVallès
FrancescCentellas,UB,Barcelona
ReginaCivil,EscolaSakado,Barcelona
AnicetCosialls,INSGuindàvols,Lleida
CarlosDurán,CentroPrincipia,Màlaga
XavierDuran,TV3,Barcelona JosepMFernández,UB,Barcelona
DolorsGrau,UPC,Manresa
PazGómez,INSProvençana,l’HospitaletdeLlobregat
ElviraGonzález,CentrodeCiencias,Bilbao
PilarGonzálezDuarte,UAB,Barcelona
RuthJiménez,UAL,Almeria
TeresaLupión,CentrodeRecursosUMA,Màlaga
MaríaJesúsMartín-Díaz,IESJorgeManrique,Madrid
ConxitaMayós,Departamentd’Ensenyament,Barcelona
JoséMaríaOliva,UCA,Cadis
GabrielPinto,UPM,RSEQ,Madrid
MartaPlanas,UdG,Girona
AnnaRoglans,UdG,Girona
NúriaRuiz,URV,Tarragona
OlgaSchaaff,EscolaRosadelsVents,Barcelona
MartaSegura,EscolaPiaNostraSenyora,Barcelona
RosaMariaTarín,UAB,Barcelona
RomàTauler,IDAEA-CSIC,Barcelona
GregoriUjaque,UAB,Barcelona
NoraVentosa,ICMAB-CSIC,Barcelona
JosepAntonVieta,UdG,Girona
Consell Assessor Internacional
MaríadelCarmenBarreto,UniversitatdePiura,Perú
LiberatoCardellini,UPolitecnicadelleMarche,Itàlia
AgustinaEcheverria,UniversitatFederaldeGoiás,Brasil
SibelErduran,UniversitatdeBristol,RegneUnit
OdillaFinlayson,UniversitatdeDublín,Irlanda
AndoniGarritz,UNAM,Mèxic
LidiaGalagowsky,UniversitatdeBuenosAires,Argentina
MarceloGiordanUniversitatdeSãoPaulo,Brasil
GiselaHernández,UNAM,Mèxic
ÈricJover,ObservatoridelaSostenibilitatd’Andorra
IsabelMartins,Universitatd’Aveiro,Portugal
EduardoMortimer,UniversitatdeMinasGerais,BeloHori-
zonte,Brasil CarlosJavierMosquera,UniversitatDistrital,Bogotà,Colòmbia
FátimaPaixão,CasteloBranco,Portugal
VincentParbelle,LycéeLaMartinière,Lió,França
IlkaParchmann,UniversitatdeKiel,Alemanya
MarioQuintanilla,PontifíciaUniversitatCatòlica,Xile
SantiagoSandi-Urena,UniversitatdeTampa,Florida,EUA
WilsondosSantos,UniversitatdeBrasília,Brasil
VicenteTalanquer,Universitatd’Arizona,EUA
Societat Catalana de Química (SCQ)
http://blogs iec cat/scq/
President:CarlesBo filialdel’ Institut d'Estudis Catalans (IEC)
BarcelonaCatalunyaEspanya
Impressió:GráficasRey
IS

ÍNDEX
Editorial L’àtom ..........................................3
Aureli Caamaño, Fina Guitart, Mercè Izquierdo i Claudi Mans
Monografia: L’àtom
Com es veuen els àtoms a la llum d’una espelma i com es compliquen més i més ....................4
Joan Aliberas, Mercè Izquierdo i Fina Guitart
De com els químics varen començar a parlar d’àtoms: el corpuscularisme de la química del segle XVIII com a preludi de l’atomisme químic de Dalton 10
Pere Grapí
De cómo el átomo se convierte en «real» y complejo y adquiere una estructura
Jordi Solbes
De com l’àtom es va fer útil i ensenyable 26
Iván Marchán Carvajal i Neus Sanmartí Puig
De com l’àtom esdevé una peça de LEGO.
Una visió crítica 33
Claudi Mans i Teixidó
A holistic approach
Sibel
Com ajuden els àtoms a aprendre química i quines
Mireia Garcia Viloca, Núria López, Pilar Melcón, Isabel Muñoz, David Rial, Marta Segura, Josep Maria Valls, Marta Simon, Mercè Izquierdo i Claudi Mans
Intercanvi
Using demonstrations to stimulate inquiry and students’ thinking ...........................48
Peter E Childs
Els residus en un laboratori de secundària.
Les 3 R + S de salut
Sílvia Careta, Aina Solà i Miquel Erra
Imatge de portada: Fragment de la imatge Single Pd-atoms embedded in silica-nanopores (Àtoms de Pd incrustats en sílice-nanoporus): http://www icmm csic es/spmage/spmageview09 php?id=155
Autor: Mr Jan-Frederik Jerratsch Fritz-Haber-Institut der Max-Planck-Gesellschaft (Alemanya)
Imatge del web del concurs International Scanning Probe Microscopy Image Contest: http://www icmm csic es/spmage/index php
Descripció: imatge obtinguda per microscòpia d’efecte túnel (STM) d’àtoms de Pd dipositats sobre un substrat de molibdè, en el qual ha crescut una superfície de sílice amb nanoporus on es localitzen els àtoms de Pd La microscòpia d’efecte túnel permet obtenir imatges d’àtoms i molècules
MercèIzquierdo,UAB,Barcelona
SN:2013-1755
ipòsitLegal:B-35770-2008
D
18
to the atom in school chemistry 39
Erduran
43
dificultats generen?
5
8
Editorial
Monografia: «L’àtom»
La química és una ciència antiga, derivada dels fogons alquímics i propensa a la imaginació, perquè només així pot arribar a justificar la transformació radical de les substàncies que es produeix en els canvis químics. I el millor invent de la química ha estat el concepte dels àtoms dels elements. Al llarg del segle xix, aquestes entitats imaginàries van proporcionar a la química un llenguatge qualitatiu i quantitatiu gràcies al qual es va poder establir un diàleg fecund entre els fets experimentals i els pensaments que hi volien posar ordre. Aquests àtoms inventats (però no arbitraris, alerta!) es van anar convertint en una partícula d’existència real i física, en els dos sentits del terme, al llarg del segle xx
A mesura que s’anava fent «quàntica», ens anava introduint en un món regit per noves lleis, per una nova mecànica, que se’ns hauria fet estranya i fins i tot esotèrica, si no fos que estava obligada a explicar també les lleis de la química: els elements són els que són, els metalls són sòlids… Els orbitals del carboni han de fer possible que els seus enllaços s’orientin d’una determinada manera per poder explicar els fets experimentals observats. Noves tècniques experimentals, juntament amb el tractament informàtic de les dades que obtenen, han permès als investigadors donarnos imatges dels àtoms com si els haguéssim fotografiat. La il·lustració de la portada, una imatge obtinguda amb un microscopi d’efecte túnel (STM), n’és un exemple.
L’ensenyament de la química a qualsevol nivell ha de permetre fer un flaix del que ha estat l’epopeia de la seva història, les metàfores i elucubracions que han enfrontat o convençut les persones al llarg d’anys d’interacció amb les substàncies per obtenir-ne de noves, que s’han aplicat a finalitats diverses i no sempre honorables. Ara, quan la ciència, amb la química, s’ha fet «atòmica», la certesa d’aquesta partícula feta de buit, i de partícules fonamentals, ens fa perdre el seny i arrossega la química de les aules cap a unes dimensions abans allunyades de la química, que passa a ocupar-se de les interaccions de les persones amb els materials i dels secrets íntims de la vida.
L’ensenyament competencial està compromès amb el desenvolupament de les capacitats dels alumnes i aquestes es posen en joc en les interaccions entre ells i el món que els envolta. Les entitats científiques, com l’àtom, prenen sentit en elles. Per això, quan diem que «el mol és la dotzena del químic», no ens referim al fet que, en els dos casos, comptem que tant els ous com les substàncies estan fets d’«unitats», sinó que triem un conjunt d’aquestes unitats adequat a la interacció amb les persones i a l’ús que en faran: 12 va bé per als ous; 6,02 × 1023 va bé per a la química, però és una quantitat que desconcerta. Per això, la química que interacciona amb les persones és encara la química del mol i no la de l’àtom quàntic.
Creiem que el repte «atòmic» és important a les aules: l’àtom quàntic ens va gran, si hem de parlar de combustions o d’interaccions àcid-base, però no ens podem quedar només amb l’àtom de Mendeléiev, sense estructura interna, i perdre’ns els meravellosos invents que van fer possible arribar fins a les intimitats d’aquesta partícula fins fa poc invisible, però present en el discurs i el llenguatge de la química des de molt abans. Hi ha, ara per ara, dues químiques que es refereixen a maneres diferents d’interaccionar amb els fenòmens, amb uns instruments cada vegada més sofisticats.
Aquest monogràfic pretén iniciar una reflexió sobre aquest tema, que té moltes derivacions. Una és fer evident que la ciència i les humanitats avancen juntes: la ciència és «humana», és invenció i aventura, i el que sap del món correspon al que ha pogut fer, pensar i comunicar gràcies als instruments i llenguatges que ha calgut inventar. Els títols dels articles que el componen estan pensats per confegir un relat del qual els àtoms són els protagonistes i requereixen un ensenyament holístic i didàctic, sobre el qual els professors tenen opinions diverses. Els articles i autors són els següents: «Com es veuen els àtoms a la llum d’una espelma i com es compliquen més i més», de Joan Aliberas, Fina Guitart i Mercè Izquierdo; «De com els químics varen començar a parlar d’àtoms: el corpuscularisme de la química del segle xviii com a preludi de l’atomisme químic de Dalton», de Pere Grapí; «De cómo esta partícula se convierte en “real” y compleja y adquiere una estructura», de Jordi Solbes; «De com l’àtom es va fer útil i ensenyable», d’Iván Marchán i Neus Sanmartí; «De com l’àtom esdevé una peça de LEGO. Una visió crítica», de Claudi Mans; «A holistic approach to the atom in school chemistry», de Sibel Erduran, i «Com ajuden els àtoms a aprendre química i quines dificultats generen?», amb aportacions de Núria López, Marta Segura, David Rial, Marta Simon, Mireia Garcia, Pilar Melcón, Josep Maria Valls i Isabel Muñoz.
En la secció «Intercanvi» publiquem l’article «Using demonstrations to stimulate inquiry and students’ thinking», de Peter Childs, que utilitza experiments demostratius amb la finalitat de promoure la indagació, i l’article dels professors Sílvia Careta, Aina Solà i Miquel Erra que expliquen els canvis introduïts al laboratori del seu centre de secundària per minimitzar i gestionar residus.
Esperem que el número sigui del vostre interès i tant de bo que el contingut del monogràfic i les reflexions dels autors que hi han intervingut us ajudin, lectors, a trobar el vostre propi camí per «ensenyar l’àtom»: què cal ensenyar, quan cal ensenyar-ho i com cal ensenyar-ho.



 Fina Guitart i Aureli Caamaño Editors d’Educació Química EduQ
Mercè Izquierdo i Claudi Mans Coordinadors del monogràfic
Fina Guitart i Aureli Caamaño Editors d’Educació Química EduQ
Mercè Izquierdo i Claudi Mans Coordinadors del monogràfic
Com es veuen els àtoms a la llum d’una espelma i com es compliquen més i més
How are candlelight atoms and how they become more and more complicated
Joan Aliberas i Mercè Izquierdo / Universitat Autònoma de Barcelona. Departament de Didàctica de la Matemàtica i de les Ciències Experimentals
Fina Guitart / Departament d’Ensenyament. CESIRE
resum
En aquest article proposem l’ensenyament d’un «àtom» que acompanyi els alumnes en la pràctica de la química a l’ensenyament bàsic. Sovint, els àtoms es presenten com si fossin objectes, unes boletes de colors que s’agrupen de maneres diverses. Però els àtoms no són visibles ni als microscopis òptics més potents; són entitats construïdes per la ciència que esdevenen «reals» i útils en les explicacions sobre els canvis químics. Volem que els alumnes també construeixin aquest «àtom», alhora que van coneixent canvis químics i que aprenen a intervenir-hi.
paraules clau
Àtom químic, química per a tothom, element, model de canvi químic, propietats de les substàncies.
abstract
In this paper we are speaking about an «atom» which would be adequate to the basic teaching of chemistry. Often, atoms are represented by colored balls, as objects. But atoms are not visible even to the most powerful optical microscopes; they are entities built by science that become «real» and useful for explaining chemical changes. We also want the students to build this «atom» while they are learning about chemical changes and they learn how to intervene with them.
keywords
Chemical atom, chemistry for everybody, element, chemical change model, properties of substances.
Introducció
Probablement una de les experiències humanes més meravelloses va ser el fet de poder encendre foc, que donava a les persones una capacitat nova i fascinant, la de transformar els materials: els aliments cuinats oferien moltes més possibilitats que els crus, el fang adquiria colors i textures noves, d’algunes pedres s’obtenien metalls i es podien preparar medicines (i verins). Però no era fàcil assolir expertesa en tots aquests camps, tan diversos, que van anar
desenvolupant diferents especialistes, amb més o menys fortuna i responent les demandes que rebien. Tot i les diferències, la manera de treballar, els estris i els llenguatges amb els quals identificaven els materials que utilitzaven, establien relacions entre ells: cuiners, alquimistes, apotecaris, etc., compartien el mateix interès per aquests canvis tan sorprenents, durant els quals alguns materials desapareixien mentre se’n formaven de nous.
A poc a poc, algunes regularitats es van fer evidents
i va anar emergint la química: alguns materials no desapareixien del tot perquè tornaven a aparèixer, la massa es conservava (quan es va comptar amb els gasos), les proporcions entre les quantitats d’interacció eren constants… S’establien les mateixes regles per a tots els artesans especialistes, que van esdevenir professors investigadors i, amb ells, aquesta feina dispersa de diferents artesans transformadors va esdevenir la ciència del canvi químic, la química (fig. 1).
ISSN 2013-1755, SCQ-IEC Educació Química EduQ número 19 (2014), p. 4-9 DOI: 10.2436/20.2003.02.137 http://scq.iec.cat/scq/index.html 4


Tot i que la capacitat de transformar els materials és emocionant, la de pensar-hi, fer-se preguntes i buscar respostes, imaginar estructures subjacents per relacionar-les amb les propietats dels materials, ho és encara més. I per això és tan interessant l’àtom que els químics van imaginar molt abans que es tingués una evidència física de la seva existència. Va ser una peça clau en la comprensió i la gestió dels canvis químics que va proporcionar una nova manera de parlar pròpia de la química (amb fórmules i símbols).
La idea d’àtom (vinculada a l’estructura de la matèria i al seu comportament químic) va anar emergint a mesura que la química es feia «ciència quantitativa». Per això no es pot comprendre bé l’àtom sense conèixer el canvi químic, ni el canvi químic sense l’àtom. Perquè l’àtom no es pot imaginar aïllat, l’intuïm a partir de materials que en tenen moltíssims, units els uns amb els altres.
Pensem ara en l’escola. Podem seguir aquest mateix esquema? Hauríem de començar per «veure» canvis químics i conèixer algunes substàncies, gaudir de les sorpreses que proporciona el seu comportament, aprendre a parlar-ne i a representar-los, anar adquirint expertesa en el treball pràctic… i tot això amb l’acompanyament fidel dels àtoms, que van posant ordre en les idees que ens en fem, de tot plegat, perquè ens proporcionen imatges, signes i explicacions d’allò més interessants.
Creiem que això és possible sempre que construïm un bon disseny del procés de «modelització», que consisteix a buscar «models de comportament químic» (posant en evidència les seves regles) per donar significat als «conceptes químics» que, relacionats entre si, constitueixen les teories. És a dir, hem de proposar als alumnes un fenomen o un canvi químic que prengui sentit quan imaginem un àtom adequat. Farem com si l’àtom fos una hipòtesi de treball tipus «peces de LEGO que no són ben bé peces de LEGO». Comencem afirmant que els àtoms es conserven, que amb ells es poden fer estructures molt diverses, que són les substàncies, però… que n’és, d’estranya, la manera com interaccionen aquestes suposades peces! (Chamizo, 2013).
Com que proposem començar pels «capricis» dels canvis químics reals tal com se’ns presenten quan fem experiments, plantejarem, en primer lloc, les «regles» dels canvis químics: allò que sempre hem de pensar quan fem experiments i que el nostre hipotètic àtom ha de poder explicar (així anirem veient que no és una peça de LEGO) (Driver, Guesne i Tiberghien, 1989; Sanmartí, Izquierdo i Watson, 1995).
Les regles dels canvis químics Ensenyar química és respondre la pregunta «què és el canvi químic?» a poc a poc, pas a pas, ensenyant a intervenir en canvis que estiguin a l’abast dels alumnes. La pregunta es manté oberta, malgrat les respostes que anem confegint: sempre hi ha nous canvis que cal conèixer, sempre hi ha noves característiques de canvis coneguts que no havíem tingut en compte. A mesura que s’adquireix expertesa i que es coneixen noves substàncies, es va comprenent en què consisteix la transformació dels materials i es pot explicar fent ús dels conceptes i símbols adequats, que ens ajuden a recordar què ha passat i a aplicar-ho a altres situacions similars. Així, fent, pensant i comunicant, anirem construint els coneixements de química i dominant els seus llenguatges específics.
Els canvis químics semblen màgics, però no ho són: els materials apareixen i desapareixen segons unes regles determinades; la massa, les càrregues elèctriques i l’energia del conjunt es conserven, i, és clar, les quantitats dels materials i les càrregues que intervenen en les interaccions i transferències d’energia que es produeixen són, a més a més, proporcionals. Si 1 g d’oxigen interacciona amb 3,5 g de ferro, 1 000 g d’oxigen ho faran amb 3 500 g de ferro.
Són aquestes regles les que ens diran com ha de ser el nostre àtom hipotètic, que anirem
Ensenyar química és respondre la pregunta «què és el canvi químic?» a poc a poc, pas a pas, ensenyant a intervenir en canvis que estiguin a l’abast dels alumnes
Monografia / Aprenentatge de conceptes i models Com es veuen els àtoms a la llum d’una espelma i com es compliquen més i més 5
Figura 1a. Antoine-Laurent de Lavoisier, un dels químics del final del segle xviii
Figura 1b. Michael Faraday a la Royal Institution de Londres.
construint a poc a poc, ben relacionat amb els fenòmens que interpretem per tal que el puguem «veure» en els canvis químics i que no ens sobti la seva peculiar estructura. Haurem de triar amb cura situacions representatives: quotidianes, interpretables, que ens donin pistes per comprendre altres fenòmens similars o per identificar-ne les diferències.
Presentarem, a continuació, quatre grups de fenòmens en els quals aquestes regles es concreten i s’enriqueixen, com ho farà també l’àtom que els acompanya. Com que prioritzem les situacions quotidianes, seleccionarem les següents: les combustions (l’aire), el comportament químic de les dissolucions aquoses i l’acció de l’electricitat en elles (l’aigua), l’alimentació (l’energia per viure) i ensenyar a «llegir» la taula periòdica. Amb això, anirem confegint aquest àtom hipotètic de la química, que s’ha de mantenir «químic» quan vagi esdevenint una partícula física amb parts i estructura.
Les flames, el foc…
Ens dediquem a l’oxigen L’espelma encesa serà el primer sistema químic a prendre en consideració (fig. 2).


Per què l’espelma? Hi ha molta bibliografia que avala aquesta decisió, que ve d’antic. Faraday, el 1861, hi va dedicar un llibret prou interessant (Faraday, 1965). L’espelma és un objecte familiar, però que pot ser alhora l’origen d’una indagació, a classe, a l’abast dels alumnes. Pot esdevenir un paradigma de la combustió de materials orgànics, de diferents substàncies que s’hi poden reconèixer, d’enginy (l’espelma és un objecte molt ben pensat!), de fenomen que «va sol» (un cop ja ha començat) i que es pot aprofitar per promoure altres canvis i explicacions sobre la relació entre propietats de les substàncies que també depenen de la temperatura (l’aigua que
s’obté és gas a causa de la temperatura de la flama, però pot ser líquida o sòlida a una altra temperatura; la parafina pot ser sòlida, líquida, gas, etc.).
L’objectiu de fer experiments amb l’espelma de parafina encesa és explicar les parts de la flama, fer veure que la flama és un conjunt de materials (blava on hi ha parafina gas, vermella quan hi ha carbó incandescent, diòxid de carboni i aigua invisibles més enllà de la flama), adonar-se que si no hi ha oxigen la flama s’apaga i el procés s’atura… L’espelma cada vegada és més petita perquè la parafina que la forma desapareix; l’oxigen també es gasta, però la massa de la parafina i de l’oxigen que es perd correspon a la de les noves substàncies que s’han format: diòxid de carboni i aigua.
Si, tal com diu la química, els materials estan fets d’àtoms que són com peces de LEGO que es reorganitzen en els canvis químics, quins àtoms imaginem per poder entendre i representar aquest fenomen?
Aquests àtoms han de ser adequats a aquesta «conservació de la massa» i a les substàncies que hi intervenen: les que «desapareixen» i les que apareixen. On era abans el carbó de la flama? On ha anat a parar l’oxigen? Per això hem de començar parlant dels «elements» que es conserven: la massa que es conserva és «massa d’elements que es conserven». En aquest fenomen, els protagonistes són tres elements: carboni, oxigen i hidrogen. Hem d’inferir que l’espelma està feta dels «elements-àtoms» carboni i hidrogen (perquè n’obtenim aigua i diòxid de carboni). Si donem valors a algunes masses de les substàncies que hi intervenen, podem calcular les altres i anem veient que no «pesen» el mateix totes. Aquesta és una informació cabdal
Educació Química EduQ número 19 6
Figura 2a. Espelma encesa.
Figura 2b. L’estudi de les flames va permetre identificar nous elements.
per poder anar «donant forma» al nostre àtom hipotètic!
Que quedi clar que el material (substàncies) de l’espelma que ha desaparegut no s’ha convertit en energia (encara que la flama pot enlluernar!), sinó que ha donat lloc a altres substàncies, a causa de la interacció amb l’oxigen.
En reaccions entre dues substàncies simples (per exemple, entre el coure i l’oxigen), es fa palès que les masses de reacció són diferents: «poc» oxigen reacciona amb «molt» coure. Això fa pensar que els àtoms-LEGO del coure tenen més massa que els àtoms-LEGO de l’oxigen. Els elements aporten masses diferents, pròpies de cada un, a les substàncies: això és ben estrany, els àtoms no són peces de LEGO!
Podríem dedicar a l’apartat de les combustions molt de temps, vinculades a la composició dels aliments, de les plantes i del petroli, als metalls, a l’oxigen, als gasos que són «reactius», etc. No caldria córrer, si se li dediqués prou temps començant a l’educació primària.
Tots els materials són «elèctrics»?
Ens dediquem a l’aigua Oi que ens preocupa l’efecte, bo i dolent, de les descàrregues elèctriques sobre els sistemes materials, ja que l’electricitat és molt present a les nostres vides? L’electricitat impulsa noves interaccions, amb les quals esbrinem i descobrim un nou àmbit de canvis químics i noves substàncies, i ens adonem que l’aigua té molt a veure amb aquestes interaccions. L’estudi experimental de dissolucions conductores i de les interaccions entre elles (els àcids i les bases, per exemple) requereix imaginar àtoms o grups d’àtoms amb càrrega elèctrica: els ions. La descomposició de l’aigua per electròlisi (fig. 3) ens mostra les
estranyes relacions entre les masses i els volums de l’hidrogen i l’oxigen i, amb això, comprenem millor la informació que ens dóna la fórmula de l’aigua i ens veiem amb cor d’escriure una equació química diferenciant «àtoms» i «molècules».

L’hidrogen és un gas interessant (combustible, lleuger, forma aigua quan es crema). Es pot obtenir hidrogen per electròlisi de l’aigua, però també fent reaccionar ferro i àcid clorhídric (el ferro «ha fet» el mateix que l’electricitat: ha produït hidrogen!). Si s’han intercanviat electrons entre les dues substàncies, és que els elements contenen càrregues elèctriques. I, en la mesura que podem «comptar» àtoms, també podem comptar càrregues, perquè hi ha interacció.
Els nostres àtoms hipotètics van progressant: es representen amb símbols, formen ions o molècules i tenen a veure amb l’electricitat. També coneixem noves substàncies. L’hidrogen és un bon combustible i forma aigua, quan es crema. I arribarem a veure que en totes les combustions s’intercanvien electrons. Podríem passar tot un curs investigant aquestes reaccions, aprenent a escriure, a argumentar, a reconèixer substàncies… El nostre àtom hipotètic cada vegada es fa més real.
Una ullada de conjunt als «sistemes químics»: el «sistema periòdic»
La història de la taula periòdica i l’origen del nom dels elements constitueixen un tema apassionant, ens hi podríem passar mesos i mesos. Ens fa acabar d’entendre que les substàncies simples no són el mateix que els elements (el ferroelement que forma part de l’hemoglobina no és el ferro metall-substància simple, per exemple), fa pensar en la relació entre els elements i els àtoms, fa passar llista de les substàncies químiques que ja coneixem per situar els seus elements a la taula periòdica i començar a pensar com és que algunes substàncies reaccionen entre elles i d’altres, no. La llei periòdica ens sorprèn, ens fa veure que encara no en sabíem prou i fa que ens preguntem el perquè de les diferències de massa entre els elements (fig. 4).

Figura 4. Dmitri Mendeléiev va enunciar la llei periòdica l’any 1869.
La taula periòdica ens suggereix un munt d’idees. En primer lloc, ens fa pensar de nou en la massa dels àtoms dels elements, que ara relacionem amb les propietats de les substàncies de les quals formen part. En segon lloc, ens fa veure que hi ha
7 Com es veuen els àtoms a la llum d’una espelma i com es compliquen més i més
Figura 3. L’electròlisi de l’aigua.
conceptes i models
Monografia / Aprenentatge
de
substàncies radioactives, que estan formades per àtoms de molta massa, i això ens confirma que hem de pensar en un àtom «elèctric». En tercer lloc, ens fa pensar en els lligams entre els àtoms, que podem relacionar raonablement amb la seva composició elèctrica.
No hem d’oblidar Mendeléiev i el seu disgust quan Marie Curie va començar a parlar d’àtoms que es trencaven i d’elements que es transformaven en uns altres.
Quin àtom imaginem ara? Ara ens crida l’atenció la inexistència en les substàncies d’àtoms «solts» i hem de pensar en els «enllaços». Ens adonem que les reaccions químiques ens mostren el comportament de moltíssims àtoms alhora. I que les estructures de les substàncies simples i compostes ens mostren regularitats que es reflecteixen en les seves propietats físiques.
Per això, «l’àtom que veiem al laboratori», en les reaccions químiques, és «un mol d’àtoms».
El sistema periòdic, en la forma de taula que és més habitual, ens dóna la clau per interpretar els resultats d’una quantitat enorme d’interaccions entre moltes substàncies. Quantes històries es podrien explicar, quantes recerques es podrien dur a terme amb relació a aquest tema! Totes són interessants, si es tracta de conèixer el canvi químic. Però, com que el que volem és proporcionar coneixements útils per a la vida, hem de dedicar una atenció especial a les que formen part dels éssers vius, que ens mengem els uns als altres.
La cuina, model per a la química dels organismes
Veiem que aquestes substàncies (les que formen els éssers vius, que són els aliments que mengem) tenen unes característiques pròpies: són delicades, contenen aigua, tenen una
composició semblant (només quatre elements fan gairebé tota la feina), però n’hi ha moltíssimes, molt diverses, i canvien de comportament si canvia només una miqueta la temperatura, o el pH, o la concentració… Haurem de tractar aquestes delicades estructures d’una manera diferent a com tractàvem els minerals o els metalls, o fins i tot l’espelma. I la millor manera de fer-ho és entrar a la cuina, posar-se el davantal i pensar com es pot preparar un bon dinar: els canvis que observarem ens revelaran nous aspectes de les interaccions químiques i, per tant, dels seus protagonistes imaginats, els àtoms.
El treball a la cuina ens revela l’estructura macromolecular de les biosubstàncies que formen les cèl·lules i la funció estructurant de l’aigua, que facilita les interaccions químiques que s’hi produeixen. Aquestes substàncies no són ni gasos ni líquids i, tot i que es troben en aigua, no formen dissolucions transparents, sinó llefiscoses, com la clara d’ou. Com que ja tenim clar que els àtoms de les substàncies estan enllaçats i formen estructures de les quals depenen les propietats, ara podem interpretar les imatges dels llibres de biologia, tan divulgades en publicacions de tota mena: les llargues i retorçades molècules de proteïnes, de DNA, de greixos i sucres. En podem aprendre dues idees fonamentals: que els àtoms de carboni es poden enllaçar entre si (no gaires elements es poden comportar així!) i que l’aigua es pot «enganxar» en alguns punts de les cadenes i fer-les canviar de forma.
Fer flams, gelatina, mató, coure ous, rostir, fregir, bullir… és fer canvis físics i químics! I el fet de representar algunes de les substàncies que interaccionen ens fa reflexionar sobre les peculiaritats dels enllaços i la

Figura 5. Les gelatines: un exemple d’interacció entre la proteïna i l’aigua.
seva relació amb les estructures tridimensionals de les quals depèn la vida (fig. 5).
I no podem oblidar que la vida «es consumeix com l’espelma que crema», ja que moltes d’aquestes interaccions són combustions més ben organitzades, perquè no «cremen» i, en canvi, proporcionen un treball útil.
El model «canvi químic», l’àtom químic… i també l’àtom físic! Hem mostrat un possible programa1 per introduir un àtom que es va definint a mesura que es coneix el canvi químic; a poc a poc, l’afirmació inicial sobre els àtoms (la hipòtesi atòmica, que no posem a prova, sinó que sosté el nostre pensament) s’enriqueix i es consolida. Creiem que l’àtompartícula-símbol no és el més adequat per «explicar» el canvi químic, perquè és difícil interpretar i pair tot el que representa. Per això parlem de l’àtom químic, que pren significat en la reacció química, i el diferenciem de la partícula que anomenem àtom físic. És aquesta partícula, que va anar prenent entitat a partir de la
1. Aquesta manera de treballar la química s’ha desenvolupat a la unitat «De l’espelma a la taula periòdica: gestionem els canvis químics», del projecte «Competències de pensament científic ESO 12-15», fruit de la col·laboració entre la Universitat Autònoma de Barcelona i el Departament d’Ensenyament.
8 Educació Química EduQ número 19
dècada del 1920, la que va adquirir significat gràcies a la química, no a l’inrevés: començar pel model d’àtom físic per guanyar temps i poder explicar tota la química en pocs anys.
És interessant veure com parlen els llibres de física dels àtoms per veure que poden no referir-se al comportament dels sistemes químics, tot i que fan èmfasi en fenòmens que també interessen a la química. Les reaccions nuclears, els raigs còsmics, els grans aparells que fan xocar partícules són prou interessants. Però ens deixem seduir per la suposada capacitat de manipular partícules. Per molt que els sofisticats aparells actuals
El sistema periòdic, en la forma de taula que és més habitual, ens dóna la clau per interpretar els resultats d’una quantitat enorme d’interaccions entre moltes substàncies
(nanotecnologia) ens proporcionin noves maneres d’intervenir, els àtoms que manipulem són àtoms d’elements i es col·locaran de la manera que correspongui a la seva naturalesa química, que els investigadors hauran d’esbrinar.
La proposta que presentem podria formar part d’un programa d’introducció a la química bàsica al llarg de la primària i de l’ESO, en el qual començarem imaginant un àtom-partícula que adquirirà significat químic a poc a poc; amb això, emergeix la magnitud pròpia de la química, la «quantitat de substància», que té com a unitat el mol. Com a resultat d’aquesta aventura, els alumnes coneixeran un bon nombre de canvis químics i, a 3r d’ESO (no abans), els els podran explicar amb àtoms-mol, que podran imaginar com una munió de partícules amb parts
(electrons, protons i neutrons) i estructura.
Ara veiem que l’àtom no és una peça de LEGO. En tot cas, cal reconèixer que són molt més complexos que aquestes peces: hi ha un centenar d’àtoms d’elements diferents (i molts més, si comptem els isòtops), tots de massa diferent, irreductibles entre si, tots amb els seus propis «capricis» o maneres de fer.
Referències
Chamizo, J. A. (2013). De la paradoja a la metáfora: La enseñanza de la química a partir de sus modelos Ciutat de Mèxic: Siglo XXI. Driver, R.; Guesne, E.; TiberGhien, A. (1989). Ideas científicas en la infancia y en la adolescencia Madrid: Morata.
FaraDay, M. (1965). The chemical history of a candle. Nova York: Viking Press. sanmarTí, N.; izquierDo, M.; WaTson, R. (1995). «The substantialisation of properties in pupils’ thinking and in the history of science». Science and Education, núm. 4, p. 349-369.

Joan Aliberas
És llicenciat en ciències químiques i doctor en didàctica de les ciències Actualment jubilat, ha estat professor de física i química de secundària. Membre del grup de recerca Llenguatge i Ensenyament de les Ciències. Ha col·laborat amb el Departament de Didàctica de la Matemàtica i de les Ciències Experimentals de la Universitat Autònoma de Barcelona en recerques i activitats relacionades amb la recerca didàctica, la formació del professorat i l’elaboració d’activitats i seqüències didàctiques. A/e: jabibera@xtec.cat.

Mercè Izquierdo
És doctora en ciències (química). És catedràtica de didàctica de les ciències a la Universitat Autònoma de Barcelona, on ha fet classes de química, història de la química i didàctica de les ciències. La seva recerca es dedica de manera específica al llenguatge i als aspectes històrics i epistemològics que tenen influència en l’ensenyament de la química. Ha dirigit tesis doctorals i ha participat en programes de formació de professors en actiu i en projectes de recerca en col·laboració amb universitats de l’Estat espanyol i de l’Amèrica Llatina. És codirectora de la revista Enseñanza de las Ciencias.
A/e: merce.izquierdo@uab.cat.

Fina Guitart
És doctora en química i catedràtica de física i química a l’INS Jaume Balmes de Barcelona, i actualment treballa al CESIRE del Departament d’Ensenyament. És també professora del Departament de Didàctica de les Ciències Experimentals i la Matemàtica de la Universitat de Barcelona. Ha participat en congressos, jornades i altres esdeveniments relacionats amb l’ensenyament i la divulgació de les ciències i en projectes europeus («Effective use of ICT in Science Education» i «COMBLAB»). És autora de diverses comunicacions i articles en l’àmbit de l’educació química i coeditora d’aquesta revista.
A/e: fina.guitart@gmail.com.
9
Com es veuen els àtoms a la llum d’una espelma i com es compliquen més i més
i models
Monografia / Aprenentatge de conceptes
De com els químics varen començar a parlar d’àtoms: el corpuscularisme de la química del segle xviii com a preludi de l’atomisme químic de Dalton
How chemists began to talk about atoms: the chemical corpuscularism of the 18th century as a prelude to Dalton’s chemical atomism
Pere Grapí / Universitat Autònoma de Barcelona. Centre d’Història de la Ciència
resum

La ubiqüitat de la teoria atòmica en l’ensenyament de la química, a certs nivells elementals, és un tema qüestionable per a una adequada comprensió dels fenòmens químics. Conèixer com els químics del segle xviii varen fer seva una imatgeria corpuscular pels materials amb què treballaven, com aquesta imatgeria va permetre una interpretació limitada dels canvis químics, com aquells mateixos químics varen ser capaços de superar aquestes limitacions amb un discurs alternatiu i, finalment, conèixer com Dalton va concebre a principi del segle xix la seva teoria atòmica química pot aportar elements per complementar un debat sobre el posicionament didàctic de la teoria atòmica en l’ensenyament de la química.
paraules clau
Atomisme químic, ensenyament de la química, història experimental, corpuscularisme.
abstract
The ubiquity of atomic theory in chemistry teaching in certain elementary levels is a debatable issue for an adequate understanding of chemical phenomena. Knowing how 18th century chemists endorsed a corpuscular imagery for the materials with which they worked, how such imagery enabled a limited interpretation of chemical change, how those same chemists were able to overcome these limitations with an alternative discourse and, finally, knowing how Dalton conceived, in the early 19th century, his chemical atomic theory may bring additional elements for discussion about the didactical positioning of the atomic theory in the teaching of chemistry.
keywords
Chemical atomism, teaching chemistry, experimental history, corpuscularism.
Introducció
La concepció corpuscular de la matèria ha esdevingut un recurs omnipresent en l’ensenyament de la química a nivells elementals. L’aplicació del principi de conservació de la matèria en una reacció química, és a dir, la igualació d’una equació química, es realitza
mitjançant un balanç dels àtoms de cadascun dels elements en joc en la reacció. Les lleis de les proporcions constants i múltiples de combinació se solen presentar com a corol·laris de la teoria atòmica de Dalton. El concepte mol de partícules (àtoms, molècules, ions i, fins i tot, electrons) es
troba a la base dels càlculs estequiomètrics. Els canvis químics s’interpreten com una mera reordenació de partícules (àtoms i/o ions) dels reactius que reapareixen en els productes, sense poder explicar satisfactòriament l’emergència de propietats noves en aquests últims.
ISSN 2013-1755, SCQ-IEC Educació Química EduQ número 19 (2014), p. 10-17 DOI: 10.2436/20.2003.02.138 http://scq.iec.cat/scq/index.html 10
La química del xviii no va ser exclusivament ni una història natural ni una filosofia experimental. L’estudi i la pràctica de la química d’aquella època s’entenen millor en el context d’una història experimental constituïda per la col· lecció d’experiments que exhibien, alteraven i preparaven els materials naturals
No obstant això, val a dir que el principi de conservació de la matèria ja era acceptat i utilitzat pels químics abans que Lavoisier l’explicités el 1789, i que la formació de compostos en proporcions constants era una creença fermament arrelada entre els químics abans que Proust la presentés formalment entre els anys 1795 i 1797. Tot això, evidentment, abans que Dalton fes pública la seva teoria atòmica. De la mateixa manera, fins a mitjan segle xix, coincidint amb el desenvolupament de l’esmentada teoria atòmica, els químics podien realitzar determinats càlculs estequiomètrics sobre la base del concepte pes equivalent, popularitzat per Wollaston el 1814.
Aquest article pretén proporcionar una perspectiva històrica entorn d’aquests temes amb la intenció de col·laborar a fer una valoració de les fortaleses i febleses de la teoria atòmica per a l’ensenyament de la química. Per això, primer, situarem la pràctica de la química durant el segle xviii en la tradició de la història experimental. Segon, es constatarà la persistència, implícita o explícita, d’una imatgeria corpuscular en
l’esquema mental dels químics d’aquell període. Tercer, mostrarem com la interpretació dels canvis químics va sobrepassar les limitacions d’aquest corpuscularisme latent i, finalment, es contextualitzarà la gestació de la teoria atòmica de Dalton a principi del segle xix a través del seu quadern de laboratori i s’apuntaran alguns dels reptes que va haver d’afrontar.
Aproximacions a l’estudi de la natura al segle xviii. La posició de la química
A tall de simplificació, es poden destacar al llarg del segle xviii dues grans aproximacions a l’estudi de la natura: d’una banda, l’aproximació de la història natural, basada en l’observació de plantes, animals, roques, minerals, accidents geogràfics, formacions i fenòmens atmosfèrics. Aquests naturalistes, a més de col·leccionar espècies animals, vegetals i minerals per descriure’ls i ordenar-los en els gabinets, podien utilitzar instruments (com ara lupes o microscopis) per apreciar diminuts espècimens, les fines estructures d’animals i vegetals, així com cristalls. El tret distintiu d’aquesta aproximació era observar i col·leccionar objectes creats i distribuïts per la natura.
L’altra aproximació seria la de la filosofia natural, que va créixer impulsada pel newtonianisme, tot i que amb diferents matisos. El newtonianisme no va ser una doctrina uniforme, sinó que va permetre diferents interpretacions: des de focalitzar l’atenció en les formulacions matemàtiques per estudiar la natura, representada pels Principia del 1687, fins a centrar-se en l’observació i l’experimentació, representada per l’Opticks del 1704 (Crosland i Smith, 1978).
Aquesta darrera aproximació, la filosofia experimental, es
fonamentava en l’ús d’instruments (bomba de buit, màquines elèctriques, termòmetres, baròmetres...) i en la intervenció sobre la natura per distorsionar-la o manipular-la, i així forçar la manifestació d’entitats ocultes i imperceptibles. El filòsof experimental es dedicava, doncs, a construir fenòmens desconeguts fins a aleshores tot establint relacions causals entre aquests fenòmens i uns objectes d’estudi imperceptibles (el buit, forces o afinitats, corpuscles, fluids elèctrics, èters...).
La química del xviii no va ser exclusivament ni una història natural ni una filosofia experimental. L’estudi i la pràctica de la química d’aquella època s’entenen millor en el context d’una història experimental constituïda per la col·lecció d’experiments provinents de les arts, com ara l’agricultura, la cuina, la química, el tintatge, les manufactures del vidre o l’esmaltat, i manufactures diverses, com la del sucre, la pólvora, els focs d’artifici o el paper, que exhibien, alteraven i preparaven els materials naturals (Klein, 2003, p. 538-543).
Robert Boyle (fig. 1), un seguidor incondicional de Bacon, va tenir força interès a demarcar la història experimental de la filosofia experimental, i va fer èmfasi en el punt crucial de la història experimental: no buscar ni una unitat conceptual ni articular explicacions i especulacions a partir de moviments ocults o altres causes. Encara més, l’èmfasi en la importància atorgada als artefactes tècnics i les operacions artesanals en la narració de les històries experimentals es va incrustar en un altre moviment cultural, aleshores en marxa, que valorava el paper que desenvolupaven els mètodes i els èxits dels artesans en l’adquisició de coneixement sobre la natura.
De com els químics varen començar a parlar d’àtoms... 11
la química
Monografia
/ Història i naturalesa de

Així, doncs, la química va adoptar l’estil d’una història experimental, interessada en fenòmens que proporcionava la intervenció en la natura. Els químics s’interessaven en la preparació, els usos pràctics i les propietats de les substàncies (color, olor, gust, consistència, propietats físiques mesurables i químiques en general), i aprofitaven tots els espais pràctics possibles, des dels artesanals i els de la vida quotidiana fins als laboratoris més acadèmics. En definitiva, una extensió dels objectes de la història natural al laboratori. Els seus objectius no eren ni les causes ocultes ni les entitats imperceptibles, sinó la
dimensió perceptible dels materials i les operacions químiques. No es buscava un coneixement filosòfic dels materials, sinó de les seves varietats, propietats, transformacions químiques i usos pràctics (Klein i Lefèvre, 2007, p. 22-26).
Ara bé, això no vol dir que els químics del xviii només estudiessin les substàncies com a objectes perceptibles i en el context de la història experimental i de les millores tecnològiques, sinó també com a objectes naturals que disposaven d’una certa dimensió imperceptible. Es tractava de fer una reflexió des de la perspectiva de la química sobre hipotètics components de les
substàncies, les afinitats recíproques i els seus moviments ocults en les reaccions químiques. Aquesta reflexió, tot i desenvolupar-se en el context de les pràctiques artesanals i experimentals, no va restar pas desconnectada de la reflexió més filosòfica (de caire atomístic o corpuscularista), que prenia en consideració un coneixement sensorial no sempre determinat per l’observació i l’experimentació.
La visió corpuscular de la matèria. Una imatge persuasiva per a la interpretació dels canvis químics
La tradició mecanicista va afavorir l’explicació dels fenòmens observables en termes de mecanismes materials que podien visualitzar-se de forma semblant als mecanismes dels instruments, màquines o aparells de la vida quotidiana, que funcionaven sense cap recurs immaterial o misteriós, obeint determinades lleis encara per descobrir. Si bé és cert que el declivi del sistema aristotèlic (contrari a una concepció corpuscular de la matèria) a la primera meitat del segle xvii va coincidir amb l’auge de les teories mecanicistes, hi ha altres factors que faciliten una comprensió més àmplia de la seva espectacular acceptació. Així, el redescobriment durant el segle xv de textos dels atomistes grecs (Demòcrit i Epicur), del poema de Lucreci De rerum natura (segle i aC) i l’aparició de traduccions en llatí i en llengües vernacles de la Pneumàtica d’Heró van posar a l’abast dels pensadors del segle xvii els textos de referència del mecanicisme corpuscularista. A més, el desenvolupament de la doctrina dels minima naturalia (originada pels comentaristes d’Aristòtil) va donar lloc a unes entitats, els minima, que, en representar les parts més petites d’un cos capaces de retenir totes les seves
12 Educació Química EduQ número 19
Figura 1. The Shannon Portrait of the Hon. Robert Boyle (1627-1691), pintat per Johann Kerseboom.
propietats, van proporcionar arguments suficients per consolidar una visió corpuscular de les substàncies.
Per entendre millor com s’interpretava el canvi químic des del mecanicisme, és millor acudir, precisament, als químics que van adoptar aquesta orientació en les seves obres. En concret, l’obra de Nicolas Lémery (fig. 2) és particularment representativa, atès que el seu principal text, el Cours de chymie, va tenir un èxit notable i va exercir una gran influència en altres pensadors. La primera edició va aparèixer el 1675 i fins a la darrera edició francesa, del 1757, es pot dir que no tan sols França, sinó també una gran part d’Europa, va aprendre química gràcies a aquest text.
En aquest text, els àlcalis, definits com a substàncies que reaccionen amb els àcids provocant efervescències, estaven formats per partícules poroses. D’altra banda, els àcids estaven formats per partícules que es diferenciaven per l’agudesa de les seves puntes. La diferència entre els diversos àlcalis s’atribuïa a la diferència dels seus porus, i perquè un àcid reaccionés amb un àlcali havia d’existir una proporció entre les puntes de l’àcid i els porus de l’àlcali. La reacció de neutralització entre un àcid i un àlcali es considerava com un combat entre dues substàncies diferents i oposades per les formes de les seves partícules que acabava amb l’aniquilació dels combatents.
La influència dels filòsofs mecanicistes francesos, particularment Gassendi, va ser notable en l’obra de Robert Boyle, filòsof natural anglès generalment conegut per la llei sobre el comportament dels gasos a temperatura constant. Una de les principals contribucions de Boyle a la química va ser el continuat esforç per elevar l’estatus de la

química tot emfatitzant la seva utilitat per la filosofia natural. El mecanicisme era la doctrina que estava en voga entre els filòsofs naturals anglesos del segle xvii, i Boyle va creure que el fet de presentar els fenòmens químics en termes d’accions purament mecàniques constituiria un argument prou persuasiu per aconseguir l’acceptabilitat de la química en el cercle de la filosofia natural. A pesar d’admetre que els cossos diferien fonamentalment en les afeccions mecàniques de les seves partícules constituents, no va confiar en les propietats mecàniques d’aquestes partícules per explicar les qualitats químiques dels cossos. Per això Boyle va recórrer més aviat a
partícules compostes dotades de propietats mecàniques, a més de químiques. En relació amb els canvis químics, Boyle tampoc no va dubtar a rebutjar interpretacions animistes o metafísiques. No obstant això, va arribar a admetre l’existència d’una certa base empírica per la idea que allò semblant s’uneix amb el seu semblant, sense arribar a acceptar, però, que això suposés una explicació de la seva combinació. Més aviat al contrari: Boyle era partidari d’una explicació nítidament mecanicista del canvi químic.
Caldria preguntar-se en aquest punt si el mecanicisme va ser rellevant per interpretar millor el canvi químic. Primer de tot, cal
13
De
com els químics varen començar a parlar d’àtoms...
Figura 2. Nicolas Lémery (1645-1715), segons el gravat de N. Pitau.
i
de la química
Monografia / Història
naturalesa
constatar que la concepció de la matèria en termes de partícules no va constituir un obstacle cognitiu important per als químics. De fet, aquesta concepció va estar sempre present d’una manera més o menys explícita en els seus escrits i els va ser d’una certa utilitat en alguns aspectes. La creença en la naturalesa corpuscular de la matèria els va proporcionar, sens dubte, una imatge mental prou persuasiva del decurs de les reaccions químiques com per acceptar que les partícules retenien les seves característiques, inclòs el pes, durant la reacció. En contrapartida, l’objectiu dels químics mecanicistes d’intentar explicar els canvis químics a partir únicament de la forma i el moviment de les partícules de les substàncies amb prou feines va poder realitzar-se. Les seves interpretacions del canvi químic van resultar massa simples, tosques i arbitràries, i encara que es van poder utilitzar retrospectivament per explicar qualsevol reacció coneguda, no van ser gaire útils a l’hora de predir reaccions desconegudes. Malgrat tot, la filosofia mecanicista encara havia de prestar un últim gran servei a la ciència en general i a la química en particular. Efectivament, l’obra de Boyle va tenir un més que notable efecte en el pensament d’Isaac Newton. Aquesta influència va ser tan determinant en l’evolució de les doctrines químiques que, gràcies a Newton, manifestarien un profund i fructífer canvi d’orientació durant el segle xviii (Grapí, 2012, p. 27-36).
La constitució de l’atmosfera en l’origen de l’atomisme químic de Dalton
A final del segle xviii, es pot afirmar que la majoria dels químics s’imaginaven que la matèria consistia en partícules invisibles i concebien els canvis
químics com la separació i recombinació d’aquestes partícules. Aquestes creences no sempre s’explicitaven en aquests termes i, sovint, es preferia descriure la tangibilitat de les substàncies destacant-ne l’homogeneïtat. No obstant això, les descripcions d’aquestes substàncies podien passar fàcilment al nivell de l’estructura íntima intangible sense necessitat de justificació. Així, per exemple, Lavoisier, en el «Discours préliminaire» del seu Traité élémentaire de chimie, del 1789, es va mostrar escèptic sobre l’existència d’unes últimes partícules en la composició de les substàncies. Tanmateix, en el decurs del text, en tractar aspectes teòrics, no va poder evitar referir-se a les «parts», «parts integrants» o «molècules» dels cossos, la qual cosa evidencia no tan sols que aquestes entitats formaven part del seu discurs, sinó també de la seva imatgeria de creences (Duncan, 1988, p. 450-451). Així, doncs, els filòsofs naturals del segle xviii varen assumir que cada substància elemental estigués formada per partícules idèntiques entre si però diferents de les d’una altra substància elemental. El mèrit d’articular aquest supòsit per assignar pesos relatius a aquestes partícules i per adjudicar fórmules als seus compostos es deu a John Dalton.
Dalton va ser un filòsof natural interessat al llarg de la seva vida per la meteorologia i la física dels gasos i, en particular, per qüestions com ara l’estat de vapor d’aigua en l’aire o per què l’atmosfera no se separava en capes dels seus components gasosos d’acord amb les seves densitats. A principi del 1793, Dalton va argumentar que l’aire era una barreja íntima dels seus components gasosos constituït per petites partícules que, d’acord amb les idees de Newton, es
repel·lien entre si. Va ser aleshores que Dalton va intentar reconciliar la teoria química predominant sobre l’estructura i composició de l’atmosfera amb les forces repulsives de Newton entre les partícules atmosfèriques.
Aquestes forces de repulsió s’atribuïen a un embolcall de calor que cobria el nucli central de la matèria sòlida de cada partícula de gas. Inicialment, Dalton va proposar ampliar aquest embolcall de calor de les partícules més pesants per tal de fer-les més grans i, per tant, menys denses. La grandària de l’embolcall de calor al voltant del nucli dur de cada partícula era el que en proporcionava la mida real. Va ser defensant i elaborant les seves idees sobre la constitució de l’atmosfera que Dalton va concebre la seva teoria atòmica química.
Deu anys més tard, cap al mes de març de 1803, Dalton estava ocupat en les seves recerques sobre els òxids de nitrogen en relació amb l’assaig de l’aire nitrós (òxid nítric, NO) per determinar el percentatge d’oxigen a l’atmosfera. La base d’aquest assaig era la reacció de l’òxid nítric amb l’oxigen. Abans del 4 d’agost de 1803, Dalton va descobrir que la reacció podria tenir lloc en dues proporcions diferents, i es va referir a aquest parell de proporcions com un exemple clar de les proporcions múltiples de combinació en un article publicat el 1805: «Els elements de l’oxigen poden combinar-se amb una certa porció de gas nitrós, o amb el doble d’aquesta porció, però no amb una quantitat intermèdia» La fig. 3 mostra les fórmules dels compostos elaborats per Dalton en el seu quadern de laboratori el 6 de setembre de 1803. Noteu que les diferents fórmules dels òxids de nitrogen reflecteixen la llei de
14
Educació Química EduQ número 19
combinació en proporcions múltiples:
— Òxid nitrós (N2O).
— Gas nitrós (NO).
— Àcid nítric (gas) (NO2).
— Àcid nitrós (N2O3).
Va ser, doncs, investigant sobre l’assaig analític per a la determinació de la proporció d’oxigen en l’aire que Dalton va assumir les proporcions múltiples de combinació. Un dels aspectes clau per entendre el desenvolupament de les idees de Dalton va ser el de la solubilitat del gas carbònic (diòxid de carboni), un component atmosfèric que és substancialment soluble en aigua. L’estudi de Dalton de la solubilitat d’aquest gas en aigua el va dur a pensar que la solubilitat dels gasos en aigua depenia del pes i el nombre de les seves últimes partícules. D’aquesta manera va començar a indagar sobre els pesos relatius d’aquestes últimes partícules. Efectivament, les primeres notacions atomístiques varen aparèixer en el seu quadern de laboratori el 6 de setembre de 1803, sota el títol «Observacions sobre les últimes partícules dels cossos i les seves combinacions», seguides immediatament per la primera llista dels símbols atòmics de cinc elements: hidrogen, oxigen, nitrogen (azot), carboni i sofre (fig. 4).
Quatre pàgines més endavant del quadern de Dalton apareix la primera taula de pesos atòmics relatius d’aquests cinc elements, juntament amb els pesos moleculars de nou compostos. Dalton va comunicar la taula de pesos atòmics i moleculars a la Literary and Philosophical Society de Manchester el 21 d’octubre de 1803, però l’article corresponent no es va publicar (amb modificacions importants) fins al novembre de 1805. Aquest va ser el debut públic de la teoria atòmica de Dalton, tot i que desproveït del raonament que

va conduir Dalton a aquestes particulars xifres. La fig. 5 mostra la primera taula (no publicada) de pesos atòmics de Dalton. En el quadern de laboratori, a la plana oposada a la primera taula, del 1803, hi ha la clau d’aquest raonament per determinar el pes relatiu d’aquests àtoms. Dalton va fer ús implícit de l’anomenada regla de la màxima simplicitat: «Si només es coneix un únic compost de dos elements qualssevol, se suposa que les
molècules són binàries; si es coneixen dos d’aquests compostos, aleshores, el més lleuger (menys dens) és binari i l’altre, ternari». Així, per exemple, Dalton va utilitzar les dades de Lavoisier per a la composició de l’aigua (85 % d’oxigen i 15 % d’hidrogen) i, en suposar per a l’aigua una molècula binària (HO), d’acord amb la regla de la màxima simplicitat, el pes de l’oxigen en relació amb l’hidrogen seria de 85/15 = 5,66. La fig. 6 mostra la primera taula
15
De com els químics varen començar a parlar d’àtoms...
Figura 3. Fórmules figuratives de compostos elaborades per Dalton el 1803.
i
la química
Monografia / Història
naturalesa de


publicada de pesos atòmics de Dalton, del 1805.
Després que Dalton presentés la seva teoria en un seguit de conferències a Edimburg i Glasgow, la primavera del 1807, i que Thomas Thomson publiqués una descripció de la teoria aquell
mateix any (A system of chemistry), molts químics en van començar a parlar. Més endavant, amb la publicació, el 1808, de la primera part d’A new system of chemical philosophy, de Dalton, la teoria entraria finalment a l’arena pública. Dalton no va poder estalviar gaire temps
de docència per dedicar-lo a la recerca i la comunicació. El desenvolupament de la seva teoria atòmica es va deixar en mans d’altres, sobretot, de Thomas Thomson i Jacob Berzelius (Pellón, 2003; Rocke, 2005).
El congrés de Karlsruhe. L’atomisme químic i les seves seqüeles, a debat
El gran desenvolupament que va experimentar la química durant la primera meitat del segle xix havia generat algunes polèmiques teòriques que necessitaven aclariment, com ara: la definició d’àtom i molècula; l’examen de la qüestió dels equivalents i les fórmules químiques, i la instauració d’una escala de pesos atòmics estàndard i d’una nomenclatura química. Va ser l’alemany August Kekulé qui va tenir la idea de reunir químics de tot Europa en un congrés per discutir aquests importants temes de la química del moment. El congrés es va celebrar els dies 3 i 5 de setembre de 1860, a Karlsruhe.
La primera sessió del congrés va començar amb una discussió entre Kekulé i el químic italià Stanislao Cannizzaro. La identificació de les molècules físiques de la teoria cinètica dels gasos amb les molècules químiques (com la unitat més petita d’una substància que participa en una reacció química) es va convertir en una qüestió crucial del debat entre els dos químics. Kekulé posava l’èmfasi en la necessitat de distingir entre la molècula i l’àtom i, almenys en principi, entre la molècula física i la química. Per contra, Cannizzaro sostenia l’opinió que només hi havia molècules físiques i que només calia diferenciar les molècules gasoses físiques i els àtoms químics que constituïen aquestes molècules sobre la base de la llei d’Ampère-Avogadro. El químic francès Adolph Wurtz va
16
Educació Química EduQ número 19
Figura 4. Primeres notacions atomístiques de Dalton, del 1803.
Figura 5. Primera taula de pesos atòmics de Dalton, del 1803 (no publicada).

fer veure que tothom reconeixia la utilitat de distingir entre àtom i molècula i que l’única qüestió important era, sens dubte, el significat químic d’ambdós termes. Wurtz tenia raó, és clar. Les contribucions de Cannizzaro al congrés de Karlsruhe es van veure com a més persuasives, mentre que les objeccions de Kekulé varen semblar més aviat despectives subtileses contra l’assenyada posició de Cannizzaro. Els debats celebrats en el congrés de Karlsruhe no varen
resoldre tots els desacords immediatament, però varen aplanar el camí per assolir en els anys següents el desitjat consens entre els químics (Rocke, 1984, p. 287-307).
Referències
CroslanD, M.; smiTh, C. (1978). «The transmission of physics from France to Britain: 1800-1840». Historical Studies in the Physical Sciences, núm. 9, p. 1-61. DunCan, A. (1988). «Particles and eighteenth century concepts
of chemical combination». British Journal for the History of Science, núm. 21, p. 447-453.
Grapí, P. (2012). «Las afinidades químicas en el siglo xviii y la tabla de “rapports” de Geoffroy». A: Grapí, P. (ed.). La representación de lo invisible Alacant: Universitat d’Alacant, p. 13-71.
Klein, U. (2003). «Experimental history and Herman Boerhaave’s chemistry of plants». Studies in History and Philosophy of Biological and Biomedical Sciences, núm. 34, p. 533-567.
Klein, U.; leFèvre, W. (2007). Materials in eighteenth-century science: A historical ontology Cambridge; Londres: MIT Press.
pellón, I. (2003). El hombre que pesó los átomos: Dalton. Madrid: Nivola.
roCKe, A. J. (1984). Chemical atomism in the nineteenth century: From Dalton to Cannizzaro Columbus: Ohio State University Press. (2005). «In search of El Dorado: John Dalton and the origins of the atomic theory». Social Research, vol. 72, núm. 1, p. 125-158.

Pere Grapí Vilumara És llicenciat en ciències químiques (UB) i doctor en filosofia i lletres, programa d’història de la ciència (UAB). Ha estat catedràtic de física i química d’ensenyament secundari.
Les seves principals àrees de recerca en història de les ciències són la química de final del segle xviii i principi del segle xix i les relacions entre la història de la ciència i l’ensenyament.
A/e: pgrapi@gmail.com
17
a
d’àtoms...
De com els químics varen començar
parlar
Figura 6. Primera taula publicada de pesos atòmics de Dalton, del 1805.
/
i naturalesa de la química
Monografia
Història
De cómo el átomo se convierte en «real» y complejo y adquiere una estructura
De com l’àtom es converteix en «real» i complex i adquireix una estructura
How the atom becomes «real» and complex and acquires structure
Jordi
Solbes / Universitat de València
resumen

El artículo presenta la aparición de nuevas partículas que cuestionan la indivisibilidad del átomo y la introducción de modelos clásicos, que no pueden explicar ni la estabilidad de los átomos ni los espectros atómicos, lo que lleva a Bohr y Sommerfeld a proponer sus modelos atómicos precuánticos que no explican la intensidad y la anchura de las rayas espectrales ni la existencia de direcciones privilegiadas en los enlaces atómicos. Para explicar la estructura del átomo, hay que introducir el modelo cuántico. Esta presentación histórica puede contribuir a familiarizar al alumnado con la naturaleza de la ciencia.
palabras clave
Partículas subatómicas, átomo, modelos atómicos.
resum
L’article presenta l’aparició de noves partícules que qüestionen la indivisibilitat de l’àtom i la introducció de models clàssics, que no poden explicar ni l’estabilitat dels àtoms ni els espectres atòmics, la qual cosa porta Bohr i Sommerfeld a proposar els seus models atòmics prequàntics que no expliquen la intensitat i l’amplada de les ratlles espectrals ni l’existència de direccions privilegiades en els enllaços atòmics. Per explicar l’estructura de l’àtom, cal introduir el model quàntic. Aquesta presentació històrica pot contribuir a familiaritzar l’alumnat amb la naturalesa de la ciència.
paraules clau
Partícules subatòmiques, àtom, models atòmics.
abstract
This article presents the appearance of new particles that question the indivisibility of the atom and the introduction of classical models, which can’t explain either the stability of atoms and atomic spectra, leading to Bohr and Sommerfeld to propose their pre-quantum atomic models that do not explain the intensity and width of spectral lines or the existence of privileged directions in the atomic bonds. To explain the structure of atoms, it is necessary to introduce the quantum model. This historical presentation can help familiarize students with the nature of science.
keywords
Subatomic particles, atom, atomic models.
Introducción
Pese a la reiteración en la enseñanza del tema (en nuestro
país, en cuatro cursos consecutivos, desde 3.º de ESO hasta 2.º de bachillerato), hay diversas
investigaciones (Blanco y Níaz, 1998; Justi y Gilbert, 2000; Kalkanis, Hadzidaki y Stavrou,
ISSN 2013-1755, SCQ-IEC Educació Química EduQ número 19 (2014), p. 18-25 DOI: 10.2436/20.2003.02.139 http://scq.iec.cat/scq/index.html 18
El descubrimiento de los rayos X por Röntgen en 1895, de la radioacti vidad por Becquerel en 1896 y de los electrones por J. J. Thomson en 1897 pone en cuestión la indivisibilidad del átomo de Dalton
2003; Sinarcas y Solbes, 2013) que muestran que el aprendizaje sobre los modelos de estructura atómica presenta grandes dificultades, y una proporción alta de estudiantes no consigue una comprensión adecuada de aspectos básicos de los mismos. En este artículo se intenta iluminar esta cuestión recurriendo al análisis histórico. Para ello, se analizan las teorías y modelos más utilizados a lo largo de la historia para explicar los átomos y, a continuación, se plantean algunas implicaciones didácticas. En cuanto a la bibliografía, se han utilizado libros de historia de la ciencia (Bensaude-Vincent y Stengers, 1998; Gavroglu y Simões, 2012; Kragh, 2007; Sánchez Ron, 2007) y artículos de historia y didáctica de las ciencias (Solbes y Sinarcas, 2009; Solbes, Silvestre y Furió, 2010).
Descubrimientos que cuestionan la indivisibilidad del átomo
El descubrimiento de los rayos X por Röntgen en 1895, de la radioactividad por Becquerel en 1896 y de los electrones por J. J. Thomson en 1897 pone en cuestión la indivisibilidad del átomo de Dalton.
Los rayos X
Fueron descubiertos por W. K. Röntgen en 1895. Según sus propias palabras:
Estaba trabajando con un tubo de rayos catódicos, recubierto con un cartón negro; sobre la mesa había un papel fluorescente, y estaba haciendo pasar una corriente a través del tubo, cuando noté una línea brillante a lo largo del papel [...]. El efecto solo podía ser producido por la luz, pero del tubo no podía venir luz, porque la hoja de cartón que lo cubría era completamente opaca [...]. En pocos minutos, no había duda: del tubo venían rayos que tenían un efecto luminoso sobre el papel fluorescente [...]. A primera vista, parecía una nueva clase de luz invisible. Era, evidentemente, algo nuevo no registrado hasta entonces.
Para verificar la naturaleza de los rayos X, es decir, si son ondas o partículas, hay que recurrir a experiencias como la difracción. En 1912, Laue sugirió que la distribución regular de los átomos dentro del cristal podía actuar como una red de difracción de los rayos X, puesto que dichas ondas eran del mismo
orden de magnitud que el espaciado de los átomos de un cristal. Con esta sugerencia, Friedrich y Knipping hicieron que un haz de rayos X pasase a través de un cristal detrás del cual había una placa fotográfica. Además del haz central, observaron una distribución regular de puntos (diagrama de Laue). Confirmaron así dos hipótesis importantes: que los rayos X son una forma de radiación electromagnética y que los átomos en un cristal están distribuidos en una red regular, cuyas características se pueden determinar a partir de los diagramas de difracción (fig. 1).
La primera aplicación y la más conocida de los rayos X es la realización de radiografías. Actualmente, han permitido el desarrollo de la tomografía asistida por ordenador (TAC), en la que un haz de rayos X atraviesa tejidos y las imágenes son procesadas por ordenador.
El electrón
Aunque muchos piensan que los descubrimientos comienzan con la observación, en realidad, lo que hay al inicio es un problema, un programa de investiga-

De
el átomo se convierte en «real» y complejo y adquiere una estructura 19
cómo
Figura 1. Espectro de difracción de luz, semejante al de difracción de rayos X.
/ Història i naturalesa de la química
Monografia
ción. En este caso, se trataba del estudio de la conductividad de los gases, empezado en 1858, después del éxito en el estudio de la conductividad de los metales por Ohm y de los electrolitos por Faraday. En un tubo de vidrio, donde se había hecho el vacío y que llevaba en cada extremo una placa metálica, Plücker y Geissler vieron que, cuando aplicaban una diferencia de potencial a las placas del tubo, este era atravesado por un rayo luminoso: los llamados rayos catódicos (fig. 2). Este tubo es el antecedente de las antiguas pantallas de televisor. Los trabajos de Hittorf, Crookes y Perrin pusieron de manifiesto que los rayos catódicos se desviaban en campos magnéticos y estaban cargados negativamente, pero no dejaron claro si se trataba de una radiación como la luz o de partículas. En 1897, J. J. Thomson aclaró que se trataba de partículas, de las que calculó el cociente entre la carga y la masa, por lo cual es considerado como su descubridor. Hasta que en 1910 Millikan no determinó la carga del electrón, no se pudo averiguar su masa.
La existencia de una partícula menor que el átomo implicaba que este no era indivisible, como se había pensado hasta ese momento. En otras palabras, los átomos no eran los constituyentes últimos de la materia. Así, el electrón fue el primer descubrimiento de partículas más fundamentales que el átomo, y J. J. Thomson, en 1903, describió el átomo como una esfera cargada positivamente con electrones oscilantes con respecto a su centro. Prevalece sobre el modelo de Perrin (1901), que imagina el átomo formado por una partícula positiva alrededor de la que giran como pequeños planetas electrones que compensan la carga total, ya que el modelo de Thomson era el único capaz

de conducir a rayas espectrales cuyas frecuencias estaban asociadas con las de oscilación. Ambos son modelos clásicos.
La radioactividad y el protón
Becquerel, en 1896, descubrió casualmente que las sales de uranio emiten una radiación penetrante. Pierre y Marie Curie extrajeron de un mineral de uranio dos nuevos elementos intensamente radioactivos a los que llamaron polonio y radio, por lo que recibieron, conjuntamente con Becquerel, el Premio Nobel de Física de 1903. Marie Curie fue la primera mujer que recibió un Premio Nobel, y solo otra mujer, Marie Goeppert Mayer, ha recibido otro de Física. También es la primera persona que ha sido premiada por segunda vez con el Nobel (el de Química, en 1911). El descubrimiento de la radioactividad sugirió un primer modelo de núcleo, tomando las partículas a y b como elementos fundamentales. Este modelo no puede explicar ni siquiera la constitución del núcleo del átomo más simple, el hidrógeno-1 (H-1), cuya masa es la cuarta parte de He-4.
Precisamente el hecho de que tanto la carga como la masa de cualquier isótopo fuera múltipla de la del núcleo de H-1 llevó a un segundo modelo, según el cual cualquier núcleo estaría constituido por un cierto número de núcleos de H-1, a los que se llamó protones, y de electrones. Según esto, el núcleo de He-4 está constituido por dos protones y dos pares electrón-protón. En 1920, Rutherford sugirió que dicho par era una nueva partícula, a la que denominó neutrón. Sin embargo, las relaciones de indeterminación de Heisenberg daban una energía cinética mínima del electrón dentro del núcleo de unos 15 GeV, lo cual es imposible, ya que la energía de los rayos emitidos es del orden del MeV. Cuando Chadwick descubrió, en 1932, el neutrón (una partícula neutra con masa ligeramente superior a la del protón), se abandonó definitivamente la idea de que los electrones eran constituyentes permanentes del núcleo. En lugar de esto, se admitió que el núcleo contiene Z protones y N neutrones, es decir, un total de A = Z + N nucleones.
20 Educació Química EduQ número 19
Figura 2. Haz de electrones en un tubo de rayos catódicos.
Los modelos atómicos clásicos
La radioactividad de algunos elementos, como el radio, proporcionaba la posibilidad de «bombardear» la materia con partículas cargadas muy rápidas, y comprobar así la validez del modelo clásico de átomo de Thomson. La experiencia de Rutherford y sus colaboradores, Geiger y Marsden, consistía en lanzar un haz de partículas a (iones positivos de helio) contra una fina película de oro. La trayectoria de las partículas podía observarse por las chispas que producían al chocar sobre una pantalla de sulfuro de zinc. Según el modelo atómico de Thomson, las partículas a deberían sufrir desviaciones muy pequeñas, ya que la carga del átomo estaba distribuida uniformemente. No obstante, los resultados fueron bastante diferentes: a) la mayor parte de las partículas a atravesaban la lámina de oro sin sufrir desviaciones aparentes, y b) un reducido número de partículas a sufría desviaciones notables, que llegaban, en algunos casos, al retroceso.
Rutherford expresó su sorpresa ante estos resultados: «Lo que pasaba era tan increíble como si alguien hubiese disparado un proyectil hacia un papel de seda y el proyectil volviese hacia el cañón». A partir de estas experiencias, propuso que el átomo está constituido por un núcleo cargado positivamente que contiene la mayor parte de la masa del átomo. Los electrones cargados negativamente se sitúan alrededor del núcleo. El radio del átomo es del orden de 1 Å = 10−10 m y el del núcleo, de 10 fm = 10−14 m. Es decir, el radio del átomo es diez mil veces mayor que el del núcleo, lo que implica que la mayor parte del volumen ocupado por un átomo es espacio vacío. Con este modelo clásico se explicaban los resultados de la
experiencia de Rutherford, ya que la mayoría de las partículas a pasan a través de este espacio sin desviarse; solo lo hacen las que se aproximan al núcleo y las que chocan retroceden.
Pero el modelo de Rutherford de 1911, si bien explicaba lo anterior, era inconsistente con la teoría electromagnética clásica. Según esta, un electrón que gira alrededor del núcleo emite energía continuamente en forma de ondas electromagnéticas, lo cual le llevaría a caer muy rápidamente sobre el núcleo, en contradicción con la evidente estabilidad de los átomos. Además, ambos modelos eran incapaces de explicar el carácter discontinuo y característico de los espectros atómicos (fig. 3).
nuclear de Rutherford, modificándolo de manera que diera cuenta de los espectros. De forma esquemática, podemos exponer los postulados de Bohr: 1) en el átomo, un electrón se mueve en una órbita circular alrededor del núcleo; 2) de la infinidad de órbitas que permite la física clásica, el electrón solo puede moverse en las que el momento angular orbital es un múltiplo entero de h/2π; 3) el electrón se mueve en una órbita permitida sin radiar energía electromagnética (de esta forma, su energía total E permanece constante), y 4) la emisión o absorción de energía radiante se realiza cuando el electrón pasa de una órbita a otra. Se puede constatar que Bohr «mezcla ideas clásicas y cuánti-

Los modelos atómicos precuánticos
Bohr, físico danés que en 1911 fue a Inglaterra a investigar con J. J. Thomson, en Cambridge, y meses después con Rutherford, en Manchester, explicó dichos espectros en 1913. Para poder explicar los espectros, Bohr aplicó las nuevas ideas de la teoría cuántica de Einstein al modelo
cas», introduciendo hipótesis ad hoc para evitar los problemas planteados en los modelos de Thomson y Rutherford. Los postulados 2, 3 y 4 están en abierta contradicción con la física clásica. Bohr introduce para los estados del electrón la cuantificación tanto de la energía E como del momento angular L: el electrón solo puede
21
De cómo el átomo se convierte en «real» y complejo y adquiere una estructura
Figura 3. Espectro de la luz solar visto a través de un espectroscopio de bolsillo.
la química
Monografia
/ Història i naturalesa de
estar en estados con E y L bien definidos. Como estos estados son estacionarios, es decir, de energía constante, supera así el carácter autodestructivo del modelo de Rutherford. Pero, además, el modelo de Bohr pudo explicar los espectros de absorción y emisión del hidrógeno (las distintas series espectrales), como veremos a continuación. Esto es así porque las ideas de Bohr son correctas simplemente sustituyendo el término órbita por nivel o estado energético, caracterizado por la energía E y el momento angular L.
Las hipótesis de Bohr aplicadas al átomo de hidrógeno posibilitaron el cálculo de las órbitas (estados) permitidas y de las energías correspondientes a las mismas. Se observa que la energía del electrón está cuantificada por el número cuántico principal n. El nivel fundamental se obtiene para n = 1, y su valor es E1 = −13,6 eV. Los estados superiores o excitados n = 2, n = 3, etc., tienen valores E2 = −3,4 eV, E3 = −1,5 eV, etc. Es útil representar los distintos valores posibles de la energía con rectas horizontales en un diagrama de niveles energéticos. A temperatura T ambiente, casi todos los átomos están en el estado fundamental. A T más elevada o durante una descarga, muchos átomos pueden estar en estados excitados. Así mismo, dicha hipótesis permitió deducir la expresión de la longitud de onda de la radiación emitida al pasar de un estado a otro y, en consecuencia, justificar los espectros de absorción y emisión. En efecto, al hacer incidir luz, los electrones solo podrán absorber los fotones de energías iguales a las correspondientes a la transición de un valor energético o nivel a otro superior, y solo emitirán cuando pasen de dicho nivel a otro inferior. Así, la frecuencia de la
radiación emitida es igual a la diferencia de energía entre niveles: En − Em= hn. Al calcular el valor de la energía y sustituirlo en dicha expresión, Bohr obtuvo la fórmula que Balmer introdujo empíricamente en 1885 para explicar el espectro visible del hidrógeno, formado por una secuencia de rayas, cada vez más apretadas y que se aproximan a un límite definido en la región ultravioleta UV (serie de Balmer). Esto se consideró un éxito similar al obtenido por Newton al explicar, con su ley de la gravitación, las leyes sobre las órbitas de los planetas obtenidas empíricamente por Kepler.
Las hipótesis de Bohr aplicadas al átomo de hidrógeno posibilitaron el cálculo de las órbitas (estados) permitidas y de las energías correspondi entes a las mismas. Se observa que la energía del electrón está cuanti ficada por el número cuántico principal n
Sin embargo, y a pesar e sus éxitos, pronto surgieron dificultades que obligaron a modificarlo (modelo de Sommerfeld, 1916) y, finalmente, a sustituirlo por otro, producto del establecimiento de la mecánica cuántica, que supuso un cambio radical de los conceptos físicos. Entre las deficiencias del modelo de Bohr, mencionaremos: a) no explicaba los espectros de los átomos polielectrónicos e, incluso, el espectro del hidrógeno, al utilizar espectroscopios más potentes o al aplicar campos eléctricos o magnéticos, resultaba ser más complicado de lo previsto en la teoría (aparecían desdoblamientos de las rayas espectrales); b) no explicaba la mayor intensi-
dad de unas rayas sobre otras, ni la anchura de las mismas, y c) tampoco explicaba la existencia de direcciones privilegiadas en los enlaces atómicos.
La función de ondas y su interpretación probabilista
La crítica radical de los conceptos clásicos que realizan De Broglie, en 1923, y Heisenberg, en 1925, exige una modificación radical del formalismo matemático utilizado para describir el estado de un sistema y su evolución temporal. Así, en la mecánica clásica, el estado de movimiento de una partícula, en un instante determinado, queda descrito por su posición r y su velocidad v (o cantidad de movimiento p), y en cualquier instante, por su ecuación de movimiento. Análogamente, el estado de una onda, en un instante determinado, viene dado por su amplitud, su longitud de onda y su frecuencia, y en cualquier instante, por su ecuación de onda. Pero los fotones, los electrones, etc., no son ni simplemente ondas ni simplemente partículas, sino cuantos, y, por ello, se necesita un modelo más general para describir su comportamiento (fig. 4).
Este modelo fue obra de Schrödinger, que estudió en Viena con Boltzmann. Fue profesor en Zúrich, donde, insatisfecho con la mecánica de matrices, escribió en 1926 los cuatro artículos base de la mecánica ondulatoria y del modelo cuántico del átomo. En el primer artículo, de 1926, Schrödinger introdujo una función que denominó función de ondas o función de estado Y. Así como la ecuación de un movimiento se obtiene a partir de la ecuación de Newton, para obtener la función de estado desconocida debe resolverse una ecuación, denominada ecuación de Schrödinger,
22
Educació Química EduQ número 19

independiente del tiempo. En general, hay diversas funciones posibles correspondientes a distintos valores de la energía que son soluciones de esta ecuación. En el segundo artículo, la aplicó al átomo de hidrógeno. En el tercero, obtuvo la ecuación de Schrödinger dependiente del tiempo. Y, en el cuarto, demostró que la mecánica matricial y la ondulatoria eran equivalentes.
Pero esta función planteó el problema de determinar su significado. Schrödinger consideró que el electrón era una onda difundida en el átomo. Tras una serie de discusiones en Copenhague con Bohr, abandonó esta concepción. Max Born, profesor de la Universidad de Gotinga, donde elaboró la mecánica matricial con Heisenberg y Jordan, introdujo la interpretación probabilista de Y en 1926.
Teniendo en cuenta que la intensidad de una onda luminosa es proporcional al cuadrado de la amplitud del campo eléctrico y que, según Einstein, es proporcional al número de fotones por unidad de tiempo y de superficie, Born señaló que el cuadrado de la amplitud es proporcional al número de fotones. Si tratamos
con haces luminosos poco intensos, con un solo fotón, es evidente que el cuadrado de la amplitud constituye una medida de la probabilidad de que haya un fotón. En los lugares en que el cuadrado de la amplitud sea grande, como las zonas iluminadas de un diagrama de interferencia o difracción, habrá una gran probabilidad de que se encuentre el fotón.
Por analogía con la luz, Born pensó que |Y(r,t)|2 es la probabilidad por unidad de volumen de encontrar el electrón. Es conveniente recalcar la conexión de la interpretación probabilista con la dualidad y la indeterminación que, al impedir describir el estado del electrón en un instante determinado, dando simultáneamente los valores de las coordenadas y las velocidades, como en la mecánica clásica, solo permiten predecir las probabilidades de los distintos valores que pueden obtenerse al medir las coordenadas (o la magnitud de que se trate).
La función de estado nos da información sobre el conjunto de todas las magnitudes compatibles que caracterizan el estado de un sistema, es decir, todas aquellas que se pueden determinar
simultáneamente. Así, por ejemplo, un electrón libre vendrá caracterizado por (px, py, pz, Sz), las tres componentes de la cantidad de movimiento y la tercera componente del espín. Es decir, un electrón libre tiene bien definida su cantidad de movimiento (o longitud de onda, según De Broglie), pero su posición es indeterminada.
Y, como la función de estado depende del sistema, al plantearse diversas situaciones, se comprueba que la probabilidad no se limita solo a la probabilidad de localización. También existe la probabilidad de encontrarse en un determinado estado de polarización, o de ser dispersado en un ángulo determinado, o la de emisión y absorción, etc.
Es conveniente insistir en que esta probabilidad es de carácter distinto a la de la teoría cinética y la mecánica estadística. En este caso, las leyes probabilistas se aplican a sistemas constituidos por muchísimas partículas que, a nivel fundamental, siguen leyes deterministas, y se consideran un método conveniente de cálculo para superar nuestra ignorancia sobre el comportamiento detallado de cada átomo o molécula. En la teoría cuántica, aunque se trate de sistemas sencillos (un electrón, un fotón, un átomo), las leyes básicas son intrínsecamente probabilistas. Es decir, la interpretación probabilista (para cada partícula) aparece como una nueva ley del comportamiento de la materia.
Modelo cuántico del átomo y estructura atómica
Si aplicamos la ecuación de Schrödinger a un sistema ligado, como un electrón en un átomo, aparece la discontinuidad en los valores posibles de la energía, encontrándose los mismos niveles energéticos que Bohr había calculado.
23
De cómo el átomo se convierte en «real» y complejo y adquiere una estructura
Figura 4. Diagrama de difracción de electrones.
la química
Monografia
/ Història i naturalesa de
Pero estos niveles permitidos de energía surgen a consecuencia del carácter ondulatorio del electrón y no de la supuesta existencia de órbitas electrónicas, que carecen de sentido. En efecto, en vez de órbitas, la ecuación de ondas nos proporciona funciones de estado Y u orbitales atómicos, caracterizadas no solo por el número cuántico principal n, como las órbitas de Bohr, sino por tres (n, l, ml), donde l es el número cuántico orbital y ml, el magnético. Sin embargo, con ellos no se puede explicar el número de electrones en cada nivel. Por eso Wolfgang Pauli introdujo, en 1925, un cuarto número cuántico, ms, que solo podía tomar dos valores, y el principio de exclusión de Pauli, según el cual los electrones de un átomo no pueden estar en el mismo estado, es decir, no pueden tener los mismos números cuánticos (n, l, ml, ms). Para explicarlo, en el mismo año, Uhlenbeck y Goudsmit sugirieron que el electrón, además de girar en torno al núcleo, giraba sobre sí mismo, pero esto producía velocidades de rotación superiores a la velocidad de la luz. Por eso actualmente se considera que el espín es una propiedad intrínseca del electrón y de otras partículas elementales, como la masa y la carga, en concreto, un momento angular intrínseco sin análogo clásico. El espín es una propiedad muy importante de las partículas que permite clasificarlas en dos tipos: los fermiones, con espín semientero (s = 1/2, 3/2, etc.), como el electrón, y los bosones, con espín entero (s = 0, 1, 2, etc.), como el fotón.
Los cuatro números cuánticos nos dan la información posible sobre el estado del sistema. Es decir, nos dan los valores de las cuatro magnitudes compatibles del sistema: la energía E, el momento angular L y las terceras
componentes del momento angular Lz y del espín Sz electrón en átomos hidrogenoideos (E, L, Lz, Sz) (fig. 5). Además, el cuadrado del módulo de Y nos proporciona la probabilidad de encontrar el electrón por unidad de volumen.
las mismas por las relaciones de indeterminación, ya que a un tiempo de vida del estado t le corresponde una anchura ∆E.t > h/4π, y la existencia de direcciones privilegiadas en los enlaces atómicos debido a que hay orbitales no esféricos (p, d, f).
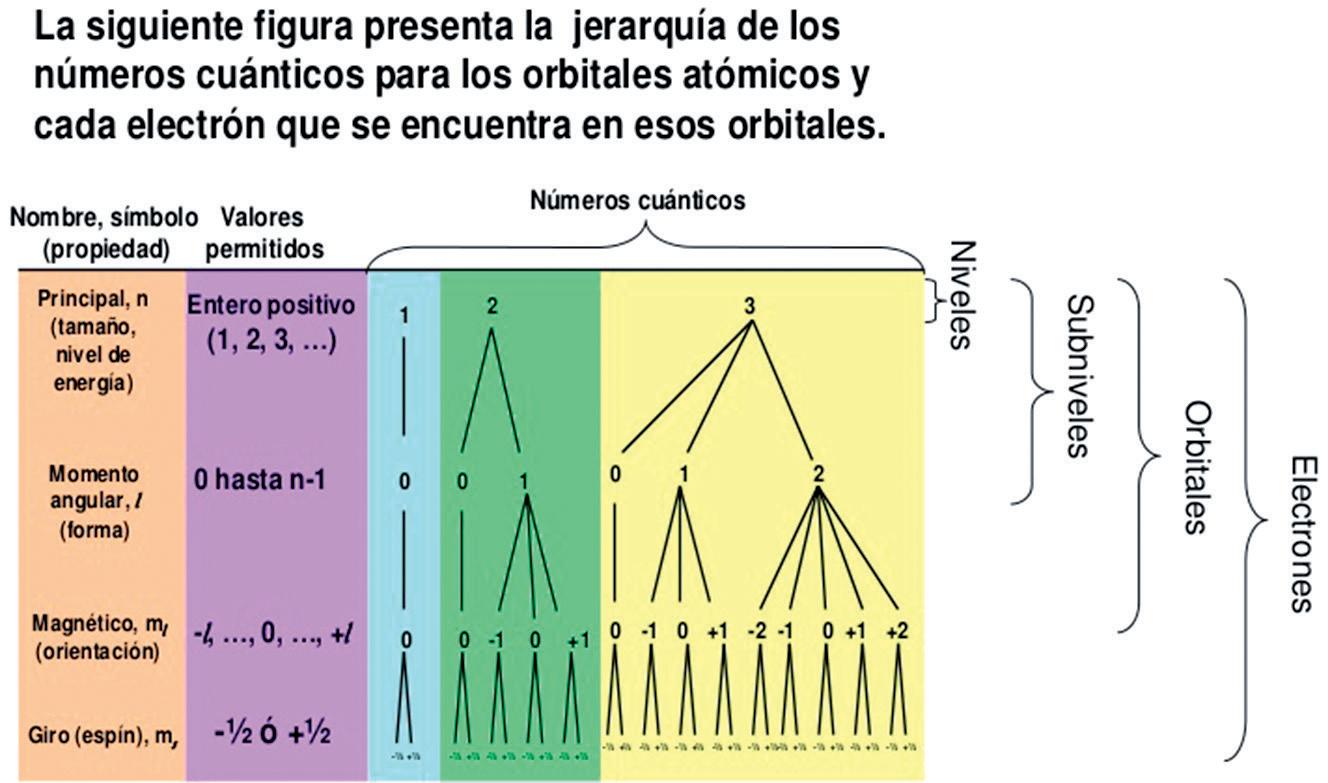
En sistemas más complejos, como los átomos polielectrónicos y las moléculas, no es posible obtener soluciones exactas de la ecuación de Schrödinger, que nos sigue proporcionando una doble información: espacial (las distribuciones de probabilidad de los electrones) y energética (sus niveles). Así, en los átomos polielectrónicos, aunque las distribuciones de probabilidad de los orbitales atómicos tengan formas similares a los orbitales del hidrógeno, la interacción entre electrones origina más niveles energéticos (subniveles), ya que la energía depende de n y l, y no solo de n, como en los átomos con un solo electrón. Estos niveles energéticos se estructuran en capas y subcapas.
Así mismo, se explica la mayor intensidad de unas rayas espectrales sobre otras por la distinta probabilidad de transición entre estados; la anchura de
El hecho de que el número de orden del elemento en el sistema periódico coincida con su número de electrones hace sospechar que esa estructura electrónica puede explicar completamente el sistema periódico, es decir, la ordenación de los elementos por su masa y sus propiedades químicas que realizó Mendeléiev en 1869. En efecto, permite interpretar las semejanzas en las propiedades químicas de los elementos de un mismo grupo (o columna), ya que todos sus elementos tienen el mismo número de electrones en su última capa. Por ejemplo, en la primera columna (grupo de los alcalinos o del litio), todos los elementos tienen un electrón en la última capa que ceden fácilmente. En la penúltima columna (grupo de los halógenos o del flúor), a todos les falta un electrón para completar la última capa y, por tanto, tienden a capturarlo. Los elementos de la
24
Educació Química EduQ número 19
Figura 5. Números cuánticos: valores permitidos y magnitudes compatibles del sistema.
última columna (gases nobles) tienen capa completa y, por tanto, son muy estables, poco reactivos. También se puede justificar la longitud de los períodos (o filas) a partir del número de electrones que completan cada capa: 2, 8, 8, 18, 18, 32, etc. La explicación de la tabla periódica se ha considerado uno de los mayores éxitos de la física cuántica.
Conclusiones
Este breve desarrollo pone de manifiesto las aportaciones didácticas que comporta el uso de la historia de la ciencia en la enseñanza del átomo y de su estructura. Como señalan diversos autores (Izquierdo, Vallverdú et al., 2006; Solbes y Traver, 2003), dicha historia facilita el aprendizaje de los conceptos, al mostrar los problemas que los originan. Además, familiariza con la naturaleza de la ciencia y, en este caso, especialmente, con el papel de los modelos científicos, viendo cómo explican determinados fenómenos pero no otros, que constituyen sus limitaciones e impulsan la aparición de nuevos modelos que las expliquen, viendo cómo dichos nuevos modelos conservan ideas de los anteriores y aportan otras nuevas. Por último, favorece una visión humanizada, no dogmática y contextualizada de la ciencia, lo que puede contribuir a la motivación del alumnado. Por eso, la historia y la filosofía de las ciencias deberían estar cada vez más integradas en la didáctica de las ciencias y en la formación del profesorado, para que este pueda usarlas en su práctica docente.
Referencias
bensauDe-vinCenT, B.; sTenGers, I. (1998). Historia de la química Madrid: Wesley Addison: Universidad Autónoma de Madrid.
blanCo, R.; níaz, M. (1998). «Baroque tower on a gothic base: a lakatosian reconstruction of students’ and teachers’ understanding of structure of the atom». Science Education, n.º 7, p. 327-360.
GavroGlu, K.; simões, A. (2012). Neither physics nor chemistry: A history of quantum chemistry Cambridge: MIT Press.
izquierDo, M.; vallverDú, J. [et al.] (2006). «Relación entre la historia y la filosofía de las ciencias II». Alambique: Didáctica de las Ciencias Experimentales, n.º 48, p. 78-91.
JusTi, R.; GilberT, J. (2000). «History and philosophy of science through models: some challenges in the case of “the atom”». International Journal of Science Education, vol. 22, n.º 9, p. 993-1009.
KalKanis, G.; haDziDaKi, P.; sTavrou, D. (2003). «An instructional model for a radical conceptual change towards quantum mechanics concepts». Science Education, vol. 87, n.º 2, p. 257-280.
KraGh, E. (2007). Generaciones cuánticas. Tres Cantos: Akal. peTri, J.; nieDDerer, H. (1998). «A learning pathway in high-school level quantum atomic physics». International Journal of Science and Education, vol. 20, n.º 9, p. 1075-1088.
sánChez ron, J. M. (2007). El poder de la ciencia. Barcelona: Crítica. sinarCas, V.; solbes, J. (2013). «Dificultades en el aprendizaje y la enseñanza de la física cuántica en el bachillerato». Enseñanza de las Ciencias: Revista de Investigación y Experiencias Didácticas [recurso electrónico], vol. 31, n.º 3, p. 9-25. <http://roderic.uv.es/ handle/10550/36186> [Consulta: 30 septiembre 2014].
solbes, J.; silvesTre, V.; Furió, C. (2010). «El desarrollo histórico de los modelos de átomo y enlace químico y sus implica-
ciones didácticas». Didáctica de las Ciencias Experimentales y Sociales [recurso electrónico], n.º 24, p. 83-105. <http:// roderic.uv.es/handle/ 10550/21173> [Consulta: 30 septiembre 2014].
solbes, J.; sinarCas, V. (2009). «Utilizando la historia de la ciencia en la enseñanza de los conceptos clave de la física cuántica». Didáctica de las Ciencias Experimentales y Sociales [recurso electrónico], n.º 23, p. 123-151. <http:// roderic.uv.es/handle/ 10550/21100> [Consulta: 30 septiembre 2014].
solbes, J.; Traver, M. (2003). «Against a negative image of science: history of science in the physics & chemistry education». Science & Education [recurso electrónico], n.º 12, p. 703-717. <http://roderic.uv.es/ handle/10550/36585> [Consulta: 30 septiembre 2014].

Es profesor titular de didáctica de las ciencias en la Universitat de València. Ha sido catedrático de secundaria de física y química. Investiga en didáctica de la física, en el uso de las relaciones CTS y la historia de la ciencia en la educación científica y en la formación del profesorado de ciencias. Sobre estos temas, ha participado en proyectos de investigación con convocatoria pública, ha dirigido catorce tesis doctorales y ha publicado numerosos artículos en revistas nacionales e internacionales de didáctica de las ciencias.
C. e.: jordi.solbes@uv.es.
25
Jordi Solbes
el
se
en
y
y
una estructura
/ Història i naturalesa de la química
De cómo
átomo
convierte
«real»
complejo
adquiere
Monografia
De com l’àtom es va fer útil i ensenyable
About how the atom became useful and teachable
Iván Marchán Carvajal / Universitat Autònoma de Barcelona. Departament de Didàctica de les Ciències Experimentals i la Matemàtica / Institut Europa, l’Hospitalet de Llobregat
Neus Sanmartí Puig / Universitat Autònoma de Barcelona. Departament de Didàctica de les Ciències Experimentals i la Matemàtica
resum

En aquest treball es presenta una proposta didàctica per aprendre un model per a l’estructura atòmica a 3r o 4t d’ESO. La construcció del model es duu a terme a partir de l’estudi de diverses situacions rellevants per a l’alumnat (contextos). Es justifica una seqüència d’activitats diverses que ajuden l’alumnat a contextualitzar, descontextualitzar i recontextualitzar les noves idees clau que s’estructuren entorn del model teòric sobre l’estructura atòmica. També es discuteix una proposta de progressió d’aprenentatge per a l’estructura nuclear i electrònica de l’àtom des de l’educació primària fins a la postobligatòria.
paraules clau
Ensenyament de la química, treball en context, models, secundària, progressió d’aprenentatge.
abstract
This paper presents a teaching sequence to learn a model for the atomic structure for 15-year-old students. The construction of the model is carried out through the study of relevant situations for students (contexts). The sequence of activities is justified by explaining how they help students to contextualize, de-contextualize and recontextualize new key ideas that are structured around the theoretical model of atomic structure. We also discuss a learning progression for the electronic and nuclear structure of the atom from primary school to post-compulsory education.
keywords
Chemistry education, context-based education, models, high school, learning progression.
Introducció
Al llarg de l’escolaritat obligatòria, es dediquen moltes hores a aprendre continguts sobre l’estructura atomicomolecular de la matèria i sobre l’estructura interna de l’àtom. Però, si aquestes lliçons s’han fet de manera descontextualitzada, seguint qualsevol dels llibres de text disponibles i sense cap relació amb fets coneguts per l’alumnat, la pregunta que probablement es farà un estudiant de secundària després d’una classe de Física i química
és: «Per a què em serveix aprendre com són els àtoms?». En aquest sentit, Millar (2005) diu:
Science teaching can too often be described as giving students answers they don’t understand to questions they have never asked.
Actualment, hi ha treballs d’investigació (Ültay i Çalik, 2012) que han recollit nombroses evidències del fet que el treball en context és una estratègia didàctica que, a més de motivar
l’alumnat i promoure actituds positives envers les ciències, també permet que l’aprenentatge de les idees científiques sigui més significatiu i es pugui assolir un nivell de competència més alt en el seu ús. Però és evident que qualsevol manera de treballar en context no necessàriament serà profitosa i que cadascuna de les propostes didàctiques que existeixen, en paper o a la xarxa, per ensenyar ciències a partir de situacions contextualitzades properes a la vida de l’alumnat té els seus punts forts i febles.
ISSN 2013-1755, SCQ-IEC Educació Química EduQ número 19 (2014), p. 26-32 DOI: 10.2436/20.2003.02.140 http://scq.iec.cat/scq/index.html 26
Un dels aspectes que la recerca en didàctica de les ciències problematitza consisteix a assegurar que els alumnes poden anar modelitzant el concepte d’àtom al llarg de les diferents etapes educatives, de manera que a cadascuna es vagin construint idees que ampliïn les anteriors i que serveixin per respondre preguntes cada vegada més complexes. En aquest sentit, Talanquer (2013) argumenta que el concepte de progressió d’aprenentatge (learning progression) té un gran potencial en el disseny de currículums, tant pel que fa a la selecció dels continguts com dels mètodes d’ensenyament i les activitats d’avaluació. Una «progressió d’aprenentatge» en relació amb algun model teòric de la ciència descriu una hipòtesi de treball sobre com l’alumnat va construint i comprenent les idees clau que el configuren al llarg del temps. Currículums com els d’Austràlia estan organitzats entorn de «mapes d’aprenentatge» en funció de grans idees de la ciència, seqüenciades des de l’etapa d’educació infantil fins als divuit anys (http://www.education. vic.gov.au/school/teachers/teaching resources/discipline/science/ continuum/Pages/conceptmaps.aspx). La majoria d’aquestes propostes es fonamenten en resultats de la recerca en didàctica de les ciències i actualment són objecte d’investigació.
En aquesta línia, aquest treball pretén integrar temes de recerca actuals en didàctica de les ciències (contextualització, modelització i progressió d’aprenentatge) a través d’una unitat didàctica que permeti construir un model teòric sobre l’àtom a l’educació secundària obligatòria, a partir de l’estudi de situacions (contextos) en les quals el coneixement sobre l’estructura atòmica és rellevant i proper a la vida quotidiana de l’alumnat
d’aquesta edat. A més a més, es justificarà la coherència entre el model atòmic construït a 3r o 4t d’ESO i els possibles aprenentatges anteriors i posteriors a partir d’una proposta de progressió d’aprenentatge basada en la de Park et al. (2009).
Ensenyar l’àtom en diferents etapes educatives
A la taula 1 es presenta una proposta de progressió d’aprenentatge per a la construcció i l’evolució de diferents nivells del model teòric sobre l’àtom al llarg de les diferents etapes educatives. La construcció d’aquest model comença a primària, on l’alumnat es pot iniciar en l’aprenentatge d’una visió discontínua de la matèria (Acher, Arcà i Sanmartí, 2007), la qual estimularà la seva imaginació i capacitat d’abstracció a partir del fet de pensar com deu ser la matèria per dins (que no poden veure) per tal d’explicar fets que observen. Per exemple, per explicar com pot passar l’aigua, que percebem contínua, a través d’un paper de filtre, ens l’hem d’imaginar formada per «parts» molt, molt petites, i per explicar que hi ha materials que costa més trencar que d’altres, ens cal imaginar que la unió entre les parts pot ser més o menys forta.
A 1r d’ESO, l’alumnat ja podrà explicar les propietats macroscòpiques de la matèria a partir del fet de pensar en un model de partícules per explicar canvis d’estat, la dilatació, dissolucions o altres canvis físics, mentre que a 3r d’ESO, per poder explicar canvis químics, fenòmens elèctrics i més propietats dels materials, s’aprofundirà en els tres tipus d’entitats elementals bàsiques de la matèria: àtoms, molècules (grups d’àtoms) i ions (àtoms amb càrrega), així com en les estructures moleculars i gegants que es formen quan
aquestes entitats s’uneixen mitjançant enllaços. També en aquest nivell es poden aprendre coses sobre l’estructura nuclear i electrònica de l’àtom per explicar fenòmens radioactius, no només per establir les bases de possibles coneixements posteriors (per exemple, el model de quarks tal com proposen Solbes i Tuzón, 2014), sinó també per la seva gran importància en els desenvolupaments tecnocientífics presents i futurs.
Els qui optin pel batxillerat científic, des de la química podran aprofundir en l’estructura electrònica dels àtoms a partir de l’estudi de l’espectroscòpia com a tècnica quantitativa i qualitativa en la determinació estructural de les substàncies. D’altra banda, des de la física podran introduir-se en el complex món de la mecànica quàntica a través del concepte d’orbital i resignar-se amb el caràcter indeterminista d’aquesta branca de la física moderna, però que ens permet explicar el funcionament del microscopi d’efecte túnel com un fenomen més propi de la ciènciaficció, ja que es basa a teletransportar matèria.
Com veiem, al llarg d’aquesta aventura del coneixement sobre l’àtom, la quantitat de fenòmens que es poden interpretar i les aplicacions tecnològiques que se’n deriven es van incrementant, per la qual cosa no es pot obviar la relació entre els fenòmens i el model que els explica. És un recorregut que recordem amb passió els físics i els químics, però que molts estudiants viuen entre la resignació i la incomprensió.
Justificació del disseny d’una unitat didàctica contextualitzada per aprendre continguts sobre l’àtom
En aquest treball ens hem centrat en l’aprenentatge dels nivells 3 i 4 de comprensió de
27 De com l’àtom es va fer útil i ensenyable
Estratègies didàctiques
Monografia /
Taula 1. Progressió d’aprenentatge de models teòrics sobre l’àtom i relació amb possibles contextos per a cada nivell educatiu
Nivell Etapa educativa
1 Educació primària
Descripció
Imaginar les substàncies formades de «parts molt petites» unides entre si amb més o menys força (Acher, Arcà i Sanmartí, 2007).
2 1r d’ESO Idea de partícula en el marc d’un model discontinu de la matèria que té en compte la seva immensurabilitat, distribució, moviment i cohesió.
3 3r d’ESO Distingir entre àtom, molècula i ió i aprofundir en l’estructura nuclear de l’àtom. Distingir una estructura molecular i una estructura gegant, així com els enllaços presents en elles.
4 4t d’ESO Caracteritzar l’estructura electrònica de l’àtom d’acord amb el model atòmic de capes de Bohr.
5 1r de batxillerat Estudi dels espectres per aprofundir en la relació entre la capacitat de combinació, les propietats atòmiques i la configuració electrònica.
6 2n de batxillerat
a) Estudi mecanoquàntic de l’àtom a partir del concepte d’orbital, la quantització dels nivells energètics dels electrons i la interacció entre els diferents tipus de radiació i la matèria.
b) Les quatre interaccions fonamentals de l’univers i els tipus de partícules elementals.
c) Equivalència massa-energia en les desintegracions nuclears.
l’àtom descrits a la taula 1, a partir de l’estudi de situacions que tinguin sentit per a l’alumnat de catorze i quinze anys. A la taula 2 resumim les característiques d’una unitat didàctica per a la Física i química de 3r d’ESO que segueix la proposta anterior. Aquesta unitat s’ha experimentat durant els cursos 2012-2013 i 2013-2014 a l’institut Europa de l’Hospitalet de Llobregat, amb alumnat de nivell sociocultural baix-mitjà. La selecció de les idees clau de la darrera columna s’ha fet tenint en compte que siguin les necessàries per construir un model atòmic prou potent perquè l’alumnat pugui interpretar fenòmens i situacions del seu entorn quotidià com els de la primera columna de la
Contextos possibles
Mescles a la cuina, manipulació (trencar, escalfar, dissoldre, etc.) de materials quotidians.
Propietats de materials que ens permeten construir objectes idonis per a alguna funció. Estats de la matèria a la natura, fenòmens que tenen a veure amb la dilatació de materials, la dispersió, la solubilitat...
Radioactivitat i medicina. Energia nuclear. Components atmosfèrics. Canvis químics en la vida diària. Fenòmens elèctrics.
Emissió de llum natural (estrelles) i artificial (fluorescents).
La composició química de l’univers a partir de la llum que ens n’arriba. Justificació de propietats físiques i químiques dels elements de la taula periòdica.
a) Espectroscòpia de masses, IR i RMN (magnetisme de l’aigua i aplicacions mèdiques) per a la determinació estructural i l’anàlisi quantitativa de mostres.
b) Acceleradors de partícules i evidències de fermions, bosó de Higgs, etc.
c) Reaccions nuclears en una central i gènesi dels elements després del Big Bang.
taula 2. Tal com es pot observar, entorn d’un context general inicial, s’han anat introduint diferents fenòmens coneguts per l’alumnat i que es poden observar, de manera que les idees que es van introduint tinguin sentit. S’han utilitzat preguntes guia per connectar el context amb les noves idees científiques que es volien introduir.
Pel que fa a la seqüenciació de les idees clau que es van aprenent, al model es poden identificar dues parts: l’estructura nuclear i l’electrònica. Creiem que són dues parts prou diferenciades, i el fet de començar per l’una o per l’altra pot dependre de quins contextos o continguts s’hagin treballat abans o es vulguin treba-
llar després. En aquesta proposta d’unitat didàctica, la seqüenciació i connexió de les idees clau de les dues parts del model amb l’anàlisi de contextos rellevants per a l’alumnat té les característiques següents:
Estructura nuclear. L’inici ve marcat pel fet de generar en l’alumnat ganes de saber com es produeixen les radiacions que poden curar alguns càncers (fig. 1). Argumentem que, per tal d’esbrinar-ho, cal endinsar-se a l’interior dels àtoms. Per fer-ho, elaborem un eix cronològic de principi del segle xx, amb els descobriments més importants pel que fa a l’estructura nuclear (el nucli, l’electró, el protó i, molt més tard, el neutró), i compartim amb l’alumnat un primer model per a
28
Educació Química EduQ número 19
2. Planificació d’una unitat didàctica contextualitzada per treballar el model d’àtom a 3r d’ESO
Context principal. Un tractament per al càncer: la radioteràpia
Subcontextos
Preguntes guia
Càncer i radioteràpia D’on surt la radioactivitat que pot curar el càncer?
Radioactivitat: bona o dolenta?
Àtoms a l’univers, a la Terra i al cos humà
Quins àtoms són radioactius? Per què?
Quants «tipus» d’àtoms diferents es coneixen i on els trobem?
Datació amb carboni 14 Com es pot saber l’antiguitat d’una mostra arqueològica?
Nuclears: sí o no? Com es genera l’energia en una central nuclear? I en una estrella?
Focs artificials Com es produeixen les llums de colors dels focs artificials?
El frau de la desintoxicació iònica En què consisteix la desintoxicació iònica?
l’estructura atòmica (relacionat amb l’històric). Amb aquest model ja podem justificar els tres tipus de radioactivitat coneguts (a, b y γ), tot i que reconeixem que els àtoms no es poden veure (mostrem imatges d’Internet de la seva superfície en microscopis de forces atòmiques) i ens els hem d’imaginar com un nucli amb molta massa i poc volum, mentre que la resta de l’àtom està buida, amb electrons movent-s’hi. Per saber per què alguns àtoms són radioactius i d’altres no, parlem de l’estabilitat nuclear en termes d’una nova força, la nuclear forta, i com aquesta depèn del nombre de protons i neutrons, a partir d’un gràfic que representa els dos nombres i mostra àtoms estables i inestables. A continuació, discutim amb l’alumnat quants «tipus d’àtoms» creuen que es
Model teòric principal. Un model per a l’estructura de l’àtom
Idees clau del model
El nucli d’un àtom concentra la majoria de la massa en una part molt petita de l’àtom. Els electrons es mouen al voltant del nucli tot ocupant la resta del volum.
Alguns nuclis són estables, però d’altres es desintegren emetent radiacions a, b i γ. L’estabilitat nuclear depèn de la intensitat de la força nuclear que uneix els protons i els neutrons.
Els àtoms d’un element es caracteritzen pel fet de tenir el mateix nombre de protons (Z) al nucli. La taula periòdica organitza tots els àtoms coneguts amb un nombre atòmic diferent.
Els isòtops són àtoms d’un mateix element químic amb un nombre diferent de neutrons al nucli.
Les reaccions nuclears de fusió (unió d’àtoms) i fissió (fragmentar un àtom) desprenen molta energia.
Els electrons es distribueixen en nivells i poden canviar de capa tot intercanviant energia amb l’entorn.
Els àtoms poden guanyar electrons (i formar anions) o perdre’n (i formar cations). Els ions es poden moure lliurement per l’aigua.
coneixen (al cos humà, a la Terra, a l’univers) per transformar aquesta idea en el concepte d’element (amb el nombre atòmic com a DNI i la taula periòdica com a organitzadora dels elements coneguts).
Després, discutim amb l’alumnat una notícia sobre arqueologia en la qual asseguren que saben l’antiguitat d’un os de dinosaure. A l’alumnat ja li sonava la prova del carboni 14, però no sabia en què consistia. Això ens permet introduir una nova idea: els àtoms d’un mateix element no són idèntics (el concepte d’isòtop; l’alumnat coneixia el terme arran del nom de l’equip de futbol de la central nuclear de la sèrie de dibuixos animats The Simpsons, fet que també permet establir una relació entre isòtops i energia nuclear).
Finalment, a partir d’un retall de diari en el qual es presentaven opinions a favor i en contra de les centrals nuclears, fem un debat a l’aula (fig. 2). La conclusió és que, per tal de posicionar-se de manera fonamentada, cal entendre a fons el fenomen, i per això aprenem les reaccions nuclears de fissió que hi tenen lloc, però també la de fusió, que s’està investigant per imitar les estrelles com a font d’energia.
— Estructura electrònica. A partir de l’estudi de dues situacions diferents, es genera la necessitat de saber més sobre com es distribueixen els electrons al voltant de l’àtom. D’una banda, l’alumnat sap (potser de l’assignatura de Tecnologia) que l’electricitat està feta d’unes partícules anomenades electrons, les quals formen part de tota la matèria, i també que, en fregar
29
De com l’àtom es va fer útil i ensenyable
Taula
Estratègies didàctiques
Monografia
/


materials, n’atreuen o en repelleixen d’altres. El repte ara serà esbrinar com estan situats aquests electrons a l’àtom i si això pot canviar.
D’altra banda, el context dels focs artificials ens permet indagar sobre l’emissió de llum de les substàncies quan es cremen a partir de l’experiment tradicional d’assaig a la flama (fig. 3). Per justificar l’experiment, va ser necessari introduir la idea de nivell energètic i transició electrònica, tot i que d’una manera senzilla.
Un tercer context s’introdueix a partir d’un vídeo d’un
anunci que vol vendre una màquina de desintoxicació iònica que sembla que elimina toxines. En aquest moment, pren sentit investigar amb el llibre de text què són els ions (els àtoms poden guanyar o perdre electrons) i, sense aprofundir en la idea d’ electròlisi ni en la de canvi químic (si fos el cas que ja s’hagués començat a construir aquest model), l’alumnat arriba a proposar experiments alternatius per demostrar el frau d’aquest producte.
Pel que fa a l’estructuració de les noves idees que van anar
apareixent, es van realitzar diferents activitats de síntesi amb l’alumnat que promovien l’organització de les noves idees. Per exemple, es va utilitzar un full de síntesi amb les preguntes guia de cada context, les idees científiques que es necessiten per respondre-les i els criteris d’avaluació, a partir del qual l’alumnat s’autoavaluava (fig. 4). També van resultar molt profitoses les activitats en què es demanava als alumnes que argumentessin de manera científica les seves idees, tant oralment com per escrit o amb dibuixos, i les activitats de regulació de l’aprenentatge en què reflexionaven sobre els seus errors en proves escrites a través de la coavaluació i l’autoavaluació. Finalment, amb l’objectiu de promoure la capacitat de transferir el coneixement científic, es van realitzar i avaluar quatre activitats de diferents graus de dificultat per aprendre a aplicar el coneixement treballat sobre l’estructura atòmica en quatre noves situacions:
— Alquimistes, els precursors dels químics. Com es podria transformar un àtom de ferro en un àtom d’or?
— Com funciona el fluorescent de l’aula?
— Gammagrafia per localitzar tumors a l’interior del cos humà fent servir tecneci-99.
— Investiguem l’espai exterior a partir de la llum que ens n’arriba. Composició química de les estrelles a partir de la llum que emeten.
Reflexions finals sobre l’ensenyament i l’aprenentatge de l’àtom
La unitat presentada incorpora moltes de les recomanacions de l’actual recerca educativa sobre l’aprenentatge en context, sense renunciar a què l’alumnat aprengui idees clau de la ciència amb un gran potencial interpretatiu, un aspecte indispensable
30 Educació Química EduQ número 19
Figura 1. Grup d’alumnes realitzant una activitat d’avaluació d’idees prèvies sobre el càncer: com es produeix, quina n’és la causa i quines maneres es coneixen de curar-lo.
Figura 2. Grup d’alumnes realitzant un debat sobre els avantatges i els inconvenients de les centrals nuclears a partir d’una notícia del diari.


per ser científicament competent. En medicina, abans d’introduir al mercat un nou fàrmac, cal molta recerca que asseguri que la nova droga té uns efectes millors que les que ja existeixen. En educació, també cal molta recerca per validar propostes d’ensenyament innovadores. A continuació, discutim alguns fonaments teòrics de la didàctica de les ciències que donen validesa a la unitat didàctica presentada després de la seva aplicació a l’aula:
— El treball en context com a element vertebrador d’una varietat d’activitats. Tractar temes d’interès per a l’alumnat és motivador, però encara ho és més quan
l’alumnat reconeix que és capaç d’entendre nous fenòmens del seu entorn. El treball en context per si sol no implicarà un millor aprenentatge, i el progrés serà mínim si s’utilitzen els contextos en una seqüència didàctica totalment expositiva, en què els alumnes només fan activitats reproductives i memorístiques. Cal promoure a l’aula un tipus d’activitat que porti l’alumnat a repensar les idees pròpies, a partir de relacionar-les amb el que coneixen o observen tot indagant, de discutir-les amb els companys en el marc d’un treball cooperatiu i de regular-les metacognitivament utilitzant
diversos instruments (rúbriques, bases d’orientació, mapes conceptuals, etc.). En general, diversificar activitats sol ser una estratègia que promou l’èxit educatiu, perquè permet arribar a tota la diversitat d’estils d’aprenentatge i tipus d’intel·ligències.
— Les progressions d’aprenentatge com a estratègia per promoure l’evolució dels models teòrics i la seva síntesi i estructuració. Les progressions d’aprenentatge són una àrea emergent en l’educació química, útils per al professorat en la tasca d’ensenyar i per a l’alumnat en la d’aprendre.
Permeten al docent planificar una evolució de les idees de l’alumnat durant un període de temps i donar coherència a tot el procés educatiu, sigui al llarg d’una unitat didàctica (un professor), d’una etapa educativa (diferents professors) o de diferents etapes educatives (diferents centres).
D’altra banda, el fet de compartir amb l’alumnat que esperem que vagi progressant en el seu aprenentatge l’ajuda a prendre consciència del que ha d’aprendre, a detectar les dificultats que van apareixent i a planificar estratègies per superar-les. La seqüència didàctica no necessàriament s’ha de fonamentar en la lògica disciplinària (que tan «lògica» és per al professorat, com a expert en la matèria), tot i que sí cal que connecti amb la lògica de la comprensió de l’alumnat.
— Imaginar per modelitzar i interpretar el món. Un aspecte controvertit i difícil del treball en context és la relació entre els models teòrics (continguts científics clau) i els contextos. Els detractors de la contextualització solen imaginar un treball en context descriptiu i que no treballa ni la modelització, ni la naturalesa de la ciència. Per tant, és important que els contextos suposin una oportunitat per saber «com la ciència sap
31 De com l’àtom es va fer útil i ensenyable
Figura 3. Alumnes observant sorpresos la llum que emet la sal d’un metall quan es crema.
Figura 4. Dues alumnes repassen el grau de domini dels criteris d’avaluació de la unitat a partir d’un resum dels contextos i les idees científiques treballades entorn del model per a l’àtom.
/ Estratègies didàctiques
Monografia
el que sap», i la millor manera d’aconseguir-ho és l’aprenentatge per modelització, interrelacionant el pensar, el fer i el comunicar en relació amb els fets que es coneixen i s’observen. A partir d’aquesta activitat interrelacionada, es promou la construcció d’un model teòric que permet a l’alumnat fer interpretacions, explicacions i prediccions de fenòmens que tenen lloc al seu entorn proper, així com identificar qüestions científiques i utilitzar proves per prendre decisions, en la línia de les propostes del programa d’avaluació PISA (OCDE, 2006).
Segons la nostra experiència, modelitzar ha resultat, en alguns moments, una tasca desagraïda i complexa, ja que suposa abstreure i situar l’alumnat en un món intangible. Tanmateix, quan els estudiants han pogut reconèixer que els models es creen per interpretar una part de la realitat amb un objectiu i que prenen sentit quan s’apliquen, és a dir, quan es contextualitzen, tant ells com nosaltres hem experimentat la satisfacció que comporta el fet de ser capaços d’explicar nous fenòmens. Per assolir-ho, ens ha estat útil centrar la mirada en aquell aspecte del context que permet la construcció d’una part del model teòric escollit i, si calia, fer breus connexions amb altres models en forma de currículum en espiral, sense perdre’ns en la complexitat de la realitat que hi ha en els contextos. Els resultats ens mostren que aquesta combinació de context i models teòrics ha ajudat l’alumnat a fer-se seu un model de l’àtom útil.
Finalment, voldríem compartir algunes opinions dels usuaris d’aquesta proposta didàctica, expressades en entrevistes realitzades a final de curs, les quals li donen validesa:
«Aquest any m’estan agradant les ciències. Les entenc. Per primer cop, les aprovaré».
«Hem après coses que ens pas-
sen, del nostre cos, del dia a dia».
«Això em quedarà a la memòria per sempre».
«Gaudeixo entenent el que passa per després poder-ho explicar a la meva mare».
«Estic més atent perquè vull saber la resposta a la pregunta del principi».
«Només m’agraden Física i química i Educació física perquè són assignatures que m’ensenyen coses útils per a mi».
«Ara entenc per què és tan important estudiar els àtoms. Et poden salvar la vida!».
Referències
aCher, A.; arCà, N.; sanmarTí, N. (2007). «Modeling as a teaching learning process for understanding materials: a case study in primary education». Science Education, vol. 91, núm. 3, p. 398-418.
millar, r (2005). «Contextualized science courses: where next?».
A: nenTWiG, P.; WaDDinGTon, D. (ed.). Making it relevant: Context based learning of science Münster: Waxmann.
oCDe (2006). Marc conceptual per a l’avaluació PISA 2006 [en línia]. Barcelona: Generalitat de Catalunya. Consell Superior d’Avaluació del Sistema Educatiu. <http://csda.gencat. cat/ca/arees_d_actuacio/ publicacions/colleccio_documents/ 09_-_marc_conceptual_ per_a_l_avaluacio_pisa_2006/> [Consulta: 30 setembre 2014].
parK, E. J.; liGhT, G.; sWaraT, S.; Denise, D. (2009). «Understanding learning progression in student conceptualization of atomic structure by variation theory for learning». Presentat a la conferència Learning Progressions in Science (LeaPS). Iowa, EUA.
solbes, P.; Tuzón, P. (2014). «Indagación y modelización del núcleo atómico y sus interacciones». Alambique:
Didáctica de las Ciencias Experimentales, núm. 78, p. 34-42. Talanquer, V. (2013). «Progresiones de aprendizaje: promesa y potencial». Educación Química, vol. 24, núm. 4, p. 362-364. ÜlTay, N.; ÇaliK, M. (2012). «A thematic review of studies into the effectiveness of contextbased chemistry curricula». Journal of Science Education and Technology, vol. 21, núm. 6, p. 686-701.

Iván Marchán Carvajal
És professor de física i química a l’institut Europa de l’Hospitalet de Llobregat i professor associat de la Universitat de Barcelona. Forma part del grup de treball de Química en Context del CESIRE i del grup de recerca Llenguatge i Ensenyament de les Ciències (LIEC) de la Universitat Autònoma de Barcelona. La seva recerca se centra en l’aprenentatge i l’ensenyament de la química a través de contextos.
A/e: imarcha2@xtec.cat

Neus Sanmartí Puig
És catedràtica emèrita de didàctica de les ciències a la Universitat Autònoma de Barcelona. Doctora en ciències químiques (didàctica), s’ha especialitzat en temes relacionats amb el desenvolupament curricular, l’avaluació formativa i el llenguatge en relació amb l’aprenentatge científic.
A/e: neus.sanmarti@uab.es
32 Educació Química EduQ número 19
De com l’àtom esdevé una peça de LEGO. Una visió crítica
How the atom becomes a LEGO brick. A critical vision
Claudi
Mans i Teixidó / Universitat de Barcelona. Facultat de Química. Departament d’Enginyeria Química
resum

Les analogies com a eines per explicar les propietats de les substàncies i els objectes s’usen des de l’antiguitat. En l’article s’analitzen diversos treballs publicats recentment que proposen l’ús de peces de LEGO com a anàlogues d’àtoms per tal de modelitzar l’estequiometria de reaccions químiques per part d’alumnes d’11 a 12 anys. S’analitzen amb un cert detall les diverses concepcions errònies que aquesta analogia pot induir als estudiants sobre estructures moleculars, cinètica i altres conceptes químics que l’analogia no permet explicar.
paraules clau
LEGO, analogia didàctica, àtom, molècula, química.
abstract
Since the antiquity, the analogies have been used as a tool to explain the properties of the substances and objects. In this article, several recently published works are analyzed proposing the use of pieces of LEGO as analogs of atoms in order to model the stoichiometry of chemical reactions for 11 to 12-year-old students. This analogy can induce several misconceptions to pupils about molecular structures, kinetics and other chemical concepts that the analogy cannot explain.
keywords
LEGO, didactic analogy, atom, molecule, chemistry.
Analogies per explicar l’estructura de la matèria
Des del bell començament de la filosofia i de la ciència s’han fet servir representacions esquemàtiques o analogies per tal de visualitzar i interpretar de forma intel·ligible les propietats de les substàncies i dels objectes. S’accepta que Demòcrit i el seu mestre Leucip foren els primers a relacionar de manera mecanística les propietats macroscòpiques de la matèria amb la seva composició i estructura microscòpica. Com es podien explicar els canvis visibles del nostre entorn quan, segons els filòsofs precedents, la matèria és una i immutable? Van postular l’existència
dels àtoms com a objectes eterns i amb tres propietats bàsiques: la mida, la forma i la massa. La resta de les propietats percebudes, com el color, el gust, la duresa o la solubilitat, les expliquen les interaccions dels àtoms de la substància entre ells, o entre els seus àtoms i els del nostre cos. Per exemple, una substància seria sòlida perquè els seus àtoms tindrien ganxos que els unirien entre ells. O una substància seria dolça perquè els seus àtoms serien rodons i passarien per la llengua i pel paladar lliscant sense agredir-lo. Demòcrit va postular també l’existència del buit, un concepte discutit a totes les èpoques.
Epicur i el seu deixeble Lucreci van acceptar aquestes idees, que desenvoluparen mitjançant analogies. Per exemple, a la seva obra bàsica De Rerum Natura, Lucreci compara la combinació d’un nombre finit de formes atòmiques amb les lletres de l’alfabet i la formació de paraules. En aquestes explicacions ja trobem presents els dos mecanismes de reflexió sobre què és i com funciona la natura: d’una banda, l’explicació de les propietats de les substàncies o dels objectes a partir de les estructures del seu interior, visualitzades o simplement postulades; de l’altra, l’ús d’analogies per comprendre l’estructura i les propie-
33 ISSN 2013-1755, SCQ-IEC Educació Química EduQ número 19 (2014), p. 33-38
DOI: 10.2436/20.2003.02.141 http://scq.iec.cat/scq/index.html
tats d’un sistema desconegut, mitjançant la comparació amb l’estructura i les propietats d’un sistema conegut.
L’explicació d’allò macroscòpic mitjançant el coneixement de les estructures microscòpiques, nanoscòpiques o atomicomoleculars ha estat un objectiu científic que ha anat progressant amb el temps, i en gran mesura en els darrers anys: tota mena de microscòpies òptiques, electròniques, de força atòmica o d’efecte túnel; tècniques d’anàlisi de superfície, difracció de raigs X i moltes d’altres, així com tècniques de tractament de dades, permeten visualitzar fins els àtoms constituents dels materials i manipular-los un a un. Amb aquest arsenal, avui hi ha un camí força ben estructurat per explicar les propietats d’un objecte o d’una substància (com ara una taula o la llet) com a format per diferents materials juxtaposats (metalls, vidre, plàstic, etc.) o format per la barreja més o menys íntima de substàncies: la llet és una emulsió de greixos en una suspensió de proteïnes disperses en una dissolució d’aigua i lactosa. I cada una d’aquestes substàncies està formada (noteu la polisèmia del terme formar) per estructures de diferents tipus: un metall és una xarxa cristal·lina d’àtoms compartint els electrons externs; un vidre és una estructura covalent no del tot regular, amb una xarxa bàsica de tetraedres de silicat i àtoms metàl·lics amb enllaços covalents entre ells, i un plàstic és una juxtaposició de macromolècules de polímers unides entre elles per forces de Van der Waals, barrejades amb altres molècules que li donen color o resistència mecànica. En els tres casos, podem explicar les propietats macroscòpiques a partir de les estructures atomicomoleculars. És la moderna ciència de materials.
Per a estructures biològiques, l’esquema de macro a micro i viceversa és una mica diferent. Un organisme macro (el lector, per exemple) es pot imaginar constituït per diferents «objectes» (teixits, òrgans), cada un format per altres objectes, les cèl·lules, formada cada una per objectes com ara nuclis o mitocondris, formats encara per objectes menors com ara cromosomes o membranes, i aquests darrers formats per molècules de DNA o de fosfolípids. Aquí arribem a l’àmbit atomicomolecular, format per una cadena d’«objectes» que arriba molt més avall que en el cas de les estructures vistes abans. En ambdós casos, però, al final s’expliquen les estructures i propietats de les matèries, substàncies, objectes i organismes a partir dels àtoms com a unitats elementals. Per descomptat, a pràcticament cap substància o objecte trobem els àtoms com a tals, sinó entitats derivades dels àtoms: ions o nuclis d’àtoms envoltats dels seus electrons més interns, però amb els electrons externs compartits amb altres àtoms. Aquestes entitats atòmiques no tenen les mateixes propietats dels àtoms dels quals deriven, naturalment. Per això l’afirmació que «la matèria és constituïda per àtoms» requereix una doble matisació: la primera, que l’expressió constituïda per (com hem dit abans de l’expressió format per) no es refereix a una simple juxtaposició, sinó a la creació de noves realitats físiques, com són les molècules o les xarxes cristal·lines. I la segona matisació és que allò que constitueix aquestes molècules o xarxes no són àtoms, sinó realitats diferents que es poden imaginar derivades dels àtoms, però que no ho són. Podríem afegir, a més, que la immensa majoria de les molècules o dels ions compostos no pot ser obtinguda a partir de la reac-
ció química entre els elements dels àtoms que la constitueixen. L’ús de les analogies com a eina didàctica ha estat analitzat de forma sistemàtica per diversos autors, i no hi ha dubte de la seva eficàcia quan són usades correctament. Desenvoluparem aquí una idea que no és pas moderna, perquè ja és present de forma embrionària a Demòcrit: l’analogia entre l’estructura de la matèria i les construccions de LEGO, amb les peces unitàries com a unitats elementals o àtoms.
LEGO: el joc
El danès Ole Kirk Christiansen, després de diversos intents, va dissenyar cap al 1930 un joc de blocs encastables de fusta, amb protuberàncies a la cara superior (mascles) que permetien fer un nombre limitat de construccions encastant-se a la cara inferior (femella) d’altres blocs. El nom LEGO ve de les paraules daneses leg godt, ‘juga bé’. El 1949 van començar a usar el plàstic, acetat de cel·lulosa. El 1958 van dissenyar la novetat crucial: les protuberàncies cilíndriques buides de la cara inferior dels blocs, que permetien encastaments més resistents que abans. Mai, però, es van fer peces doble-mascle o doblefemella, que haurien permès més versatilitat a costa de duplicar el nombre de peces a fabricar.
El 1963 van canviar al polímer ABS (terpolímer acrilonitril-butadièestirè), un material excel·lent resistent a la calor, als àcids i a les bases, poc deformable i amb uns colors molt estables. Amb el temps, LEGO va ser imitat i fins i tot superat. Per exemple, el 1972, EXIN va dissenyar el joc TENTE, una còpia de LEGO més versàtil gràcies a un orifici central a cada protuberància, però van haver de tancar en perdre les demandes judicials de plagi. Al començament, les peces eren de formes genèriques molt simples: paral-
34 Educació Química EduQ número 19
lelepípedes de diferents gruixos, amplàries, alçàries i colors, cilindres, plaques i poca cosa més. Amb els anys, han augmentat moltíssim el nombre i la varietat de peces disponibles, com ara finestres, rodes, eixos o figures humanes completes des del 1974. Moltes de les peces actuals són dissenyades ad hoc per construir una estructura determinada, en una filosofia molt llunyana de l’original. En l’analogia que es comenta aquí, interessen les peces de LEGO genèriques del sistema original del 1963.
És trivial usar peces de LEGO per a la maquetació en tota mena de camps i també en química. Amb LEGO s’han fet taules periòdiques, com la de Kuntzleman (2013); escultures matemàtiques en 3D (Lipson, 2006), i s’han representat molècules de tota mena. Des de la molècula d’aigua, H2O, feta amb un bloc vermell de 2 × 4 i dos blocs blancs de 2 × 1, fins a la molècula de DNA. Efectivament, Harshbarger (2001, 2003), professional de la construcció de tota mena de figures amb peces de LEGO, ha fet dues molècules de DNA, l’una amb eix central auxiliar i l’altra, més petita, sense. En el seu cas, les peces de LEGO no corresponen a molècules ni a àtoms: són simples unitats constructives. Però, per a la modelització de molècules, són molt millors els models moleculars de barres i esferes o d’espai ple (QuimiTube.com, 2014).
El complet treball dels científics de la WISC (2012) és de modelització, i usen cada peça de LEGO com una molècula. Les peces de LEGO els permeten construir tota mena de models d’estats sòlid, líquid, gas, nanoestructures, cristalls líquids i moltes altres estructures. Aquests models de LEGO no són necessàriament més aclaridors o explicatius que altres models fets amb dibuixos en 3D.
El concepte constructiu de LEGO també ha inspirat científics, que expliquen les estructures de les seves molècules fent-hi referència. Vázquez Tato (2005), en un treball acadèmic redactat el 1983 i no publicat fins molt més tard, il·lustra els principis i desenvolupaments de la química supramolecular amb peces de LEGO, que fa anàlogues a molè-
trems mitjançant una cadena de peces iguals de LEGO, cada una representant un monòmer. La millor de les visualitzacions, probablement, seria usant peces d’1 × 1, que es poden estendre indefinidament. També es poden representar copolímers (amb peces de colors diferents) o polímers reticulats estenent l’estructura en les tres dimensions (taula 1).
Taula 1. Taula de colors CPK (Corey, Pauling, Koltun) proposada el 1952 per representar àtoms en les estructures químiques. Coincideix parcialment amb la taula proposada per Antropoff (1926), que fou molt seguida
Hidrogen Blanc
Oxigen Vermell
Carboni Negre
Fluor, clor Verd
Nitrogen Blau fosc
Brom Vermell fosc
Iode Violeta fosc
Gasos nobles Blau clar
Fòsfor Taronja
Sofre Groc
Or, metalls de transició Rosa
Metalls alcalins Violeta
Metalls alcalinoterris Verd fosc
Titani Gris
Ferro Taronja
Altres elements Rosa
cules. Schafmeister (2007) es va basar en el concepte de LEGO per construir les seves estructures nanomètriques reals.
LEGO per a la didàctica de la química
Hi ha hagut diverses propostes per usar LEGO per a l’ensenyament de la química, mitjançant l’ús d’analogies entre les peces de LEGO i les entitats químiques, els àtoms o les molècules. Una de les més elementals és visualitzar els polímers lineals com a cadena de monòmers, units pels seus ex-
El treball més complet d’analogia entre estructures químiques i LEGO és el de Vandiver (2009). Proposa un taller de dues hores i mitja, estructurable en unitats didàctiques de quaranta-cinc minuts, i en subministra les fitxes i altres materials. Ho combina amb experiments reals de laboratori i detalla minuciosament els objectius, continguts i experiments possibles. Cada joc de LEGO per a dos estudiants conté vint-i-quatre peces blanques d’1 × 2 i peces de 2 × 4 variades: quatre marrons, vuit roses,
35
com l’àtom esdevé una
de LEGO.
crítica
De
peça
Una visió
didàctiques
Monografia /
Estratègies
vuit grogues, vuit de color verd clar, vuit de color verd fosc, dotze negres, trenta-sis vermelles i trenta-dues blaves. Els colors corresponen al codi usat en els jocs de boles i barres típics de la química. Cada tipus de peça correspon a un element, i això permet visualitzar els reagrupaments d’àtoms de les reaccions químiques del laboratori real.
Izquierdo et al. (2011) fan ús de les peces de LEGO per visualitzar les reaccions que tenen lloc en la respiració cel·lular. Anderton Gideon (2009) fa una proposta similar d’igualació de reaccions a partir de la manipulació de peces de LEGO. L’edat que totes les propostes recomanen per fer els tallers és al voltant dels 11 o els 12 anys (fig. 1).
Els punts bàsics de l’analogia en aquests treballs són comuns: — Cada peça de LEGO és anàloga d’un àtom (no es pot fer més
petita, és indivisible com els àtoms) en la perspectiva química. — Àtoms diferents són representats per peces diferents. De fet, hi ha moltes més peces diferents que tipus d’àtoms, que són cent divuit.
— La unió de dues peces equival a un enllaç entre dos àtoms. En els treballs esmentats, no s’especifica quins tipus d’enllaços són, però majoritàriament són covalents. Pel que fa a l’analogia, no es diferencien.
Les propostes usen el joc per explicar un aspecte abstracte de la reacció química, com és l’estequiometria. En essència, procedeixen de la manera següent: es defineix la reacció que es vol modelitzar i s’escriu en la seva versió molecular. Un cop s’han identificat les fórmules de les molècules que intervenen en la reacció com a reactants, es cons-

Figura 1. A i B són formes possibles de la molècula d’aigua, en l’analogia amb figures de LEGO. Les altres formes pensables són topològicament equivalents. C és la modelització amb LEGO d’una hipotètica molècula de H16O, però que no existeix en la realitat.

Figura 2. Reacció de combustió completa del metà. A l’esquerra, els reactants A (molècula de CH4 ) i B (dues molècules d’oxigen, cadascuna de fórmula O2 ). A la dreta, els productes C (molècula de CO2 ) i D (dues molècules d’aigua, H2O).
trueixen amb LEGO. En la reacció, les molècules dels reactants desapareixen i els àtoms que les constituïen es reordenen de forma que donen els productes, i es mantenen invariables el nombre i tipus d’àtoms del sistema. Aquesta és l’analogia. La participació dels alumnes en la comprensió del procés pot ser molt diferent, segons l’estratègia didàctica i els objectius del professor (fig. 2).
L’analogia que proposen els autors esmentats conté un grau d’abstracció considerable. La reacció química escrita en paper ja és una abstracció important de la reacció química vista al laboratori, perquè s’ha passat de veure substàncies a escriure fórmules, potser amb subíndexs que no queda clar d’on surten. I, després, les fórmules es fan anàlogues a construccions de LEGO, però només pel que fa al nombre i tipus de peces involucrades, no a la forma. El procés mecànic de combinar peces i imaginar noves molècules no presenta dificultats per als alumnes, especialment si no hi ha limitacions a l’hora de fer propostes de productes a partir de molècules de reactants. Però, en tot el procés, és probable que s’indueixin espontàniament malentesos o errors conceptuals que es comentaran a continuació. No són exclusius de l’ús de LEGO, per descomptat: qualsevol altra metodologia en pot introduir. Cal evitar-ho o paliar-ne la consolidació a les ments dels alumnes, de manera que cal identificar aquests errors conceptuals per tal d’explicitar-los i procurar que els alumnes en siguin conscients.
LEGO i preconceptes
Es pot portar l’analogia entre construccions de LEGO i reaccions més enllà de l’estequiometria de les reaccions? Difícilment. Hi ha el risc de generar interpretacions falses, incorrectes o massa limitades.
36 Educació Química EduQ número 19
Quan els professors intenten determinar quins són els preconceptes que els seus alumnes tenen, distingeixen entre preconceptes induïts per l’entorn no científic de l’alumne i preconceptes induïts per la forma en què els professors anteriors han explicat les coses. Un exemple del primer tipus és la confusió terminològica i conceptual entre calor i temperatura, induïda probablement per l’ús habitual d’aquests termes, no coherent amb la seva interpretació científica. Un exemple del segon tipus és pensar que a les molècules hi ha àtoms dels elements com a tals. La mateixa nomenclatura química ha induït a la confusió. Per exemple, el símbol Na s’usa tant per a l’element químic com a concepte (l’element químic sodi), com per a la substància gasosa constituïda per àtoms de l’element químic aïllat (nuclis amb onze protons i dotze neutrons, envoltats per onze electrons propis), com per a l’element químic com a substància (el sodi metàl·lic, format per nuclis i electrons alguns dels quals són compartits), com, finalment, per a la part d’àtom de l’element que forma part d’una estructura, que a la fórmula NaCl indica l’ió Na+, que és una substància radicalment diferent de les dues anteriors.
El risc que pot haver-hi en usar peces de LEGO per modelitzar aspectes de la química és que poden introduir-se moltes idees falses, preconceptes i simplificacions que caldria evitar. Se n’indiquen a continuació els més rellevants, segons el parer de l’autor. Concepte erroni 1. Imaginar que les molècules es creen unint directament els àtoms dels seus elements constituents. En realitat, els esquemes de reacció per obtenir els diferents productes gairebé mai passen per la síntesi directa a partir dels àtoms constituents: el clorur d’hidrogen, HCl,
sí que es genera a partir de H2 i Cl2, però l’àcid sulfúric, H2SO4, no s’obté a partir de S, O2 i H2. Concepte erroni 2. Imaginar que les formes de les peces determinen les possibilitats de fer molècules. Malauradament, les «molècules» modelitzades no tenen res a veure, ni en forma, ni en mida relativa (ni, per descomptat, en colors), amb les molècules reals. Només en alguns casos les «molècules» de LEGO i les reals s’assemblen una mica, com és la molècula de l’aigua feta amb una peça de 4 × 2 i dues d’1 × 2. Les formes i mides dels àtoms reals no poden ser representades en absolut amb peces de LEGO, i això és una important limitació operativa.
Concepte erroni 3. Imaginar que, així com a LEGO es poden unir totes les peces entre elles, tots els àtoms es poden unir entre ells per donar molècules. Però ni totes les molècules són possibles, ni un àtom pot reaccionar amb tots els altres.
Concepte erroni 4. Imaginar que, de la mateixa manera que les peces de LEGO es poden unir de formes diverses, els àtoms de les molècules també poden fer-ho. Així, la molècula H2O es pot fer amb LEGO unint cada H a l’O, o bé unint un H a l’O i unint-lo també a l’altre H (H–O–H o H–H–O), però només la primera estructura és correcta.
Concepte erroni 5. Imaginar que, així com en el LEGO una peça pot unir-se a d’altres mentre li quedin protuberàncies i buits, l’àtom que la peça representa també pot anar-se unint a altres àtoms. Però això no és cert, perquè depèn de la seva estructura electrònica, en absolut representada amb LEGO. En l’exemple de la molècula d’aigua, la peça vermella de 2 × 4 que representa l’oxigen podria unirse, en el límit, amb setze peces d’1 × 2 blanques que representen hidrògens, vuit per dalt i vuit per baix (que, al seu torn, podrien
anar-se unint a altres àtoms). Però l’H16O no existeix.
Concepte erroni 6. Imaginar que, de la mateixa manera que les peces a l’estructura mantenen la seva individualitat, els àtoms a les molècules també la mantenen. Però, de fet, no trobem àtoms com a tals ni a les molècules, ni als metalls, ni a les sals, ni estructures gegants covalents, ni macromolècules.
Concepte erroni 7. Imaginar que les reaccions químiques tenen lloc descomponent les molècules dels reactants en els seus àtoms, que es tornen a reagrupar com a molècules de productes. Els mecanismes de reacció són molt més complexos, i les equacions químiques globals representables amb peces de LEGO no ens diuen res dels mecanismes de reacció, sinó només dels estats inicial i final.
Concepte erroni 8. Imaginar que les reaccions tenen lloc completament, que els reactants es transformen completament en productes. Aquest error és molt comú, perquè no s’acostuma a distingir prou clarament entre la reacció química a escala de molècules, representada per l’equació química, i la reacció química a escala macroscòpica, representada per la mateixa equació química, però amb masses de reactants i de productes, on poden haver-hi equilibris amb conversions menors del cent per cent.
Concepte erroni 9. Imaginar que les reaccions modelitzables amb LEGO són les úniques existents. Però n’hi ha moltíssimes més, com ara les reaccions amb metalls o en dissolució, que no estan prou ben representades amb peces de LEGO.
Concepte erroni 10. Imaginar que les reaccions tenen lloc amb rapidesa i relacionar-la amb la rapidesa amb la qual es poden construir o destruir les estructures de LEGO. Però la cinètica i el mecanisme de les reaccions no poden
37 De com
esdevé una
de LEGO.
visió crítica
l’àtom
peça
Una
didàctiques
Monografia /
Estratègies
ser imaginats veient només l’estequiometria.
Concepte erroni 11. Imaginar que hi ha poca energia involucrada en les reaccions. De fet, el mecanisme real d’unió de dues peces de LEGO entre elles és l’elasticitat del material amb el qual estan fetes i el fregament. Considerats microscòpicament, es tracta d’enllaços febles de caràcter electrostàtic i no d’enllaços covalents, metàl·lics o iònics, com a les reaccions químiques.
Concepte erroni 12. Imaginar que, així com en el LEGO es passa directament de les peces individuals als objectes (una excavadora), en la química es passa dels àtoms als objectes pel simple creixement de l’estructura. En la realitat, hi ha altres estructures intermèdies involucrades, diferents de les molècules i unides entre elles per enllaços diferents dels covalents, tal com s’ha comentat abans. Això no és possible de visualitzar amb LEGO.
Conclusions
Com és evident, qualsevol eina didàctica pot generar disfuncions. En l’article s’ha analitzat amb un cert detall l’ús del joc de construccions LEGO com a eina de suport en determinats temes de química, i s’hi han detectat diverses limitacions. L’una és estructural: el joc indueix a visualitzar i imaginar estructures químiques que estan molt allunyades de la forma de les estructures reals de la matèria. La segona limitació té a veure amb la reacció química: en cap moment la modelització permet treure conclusions sobre aspectes termodinàmics (equilibri, conversió) o sobre aspectes cinètics (velocitat de reacció) i només permet visualitzar l’estequiometria de les reaccions.
Cal, doncs, que el professor sigui molt conscient de les limitacions de l’analogia entre LEGO i química i que n’eviti els paranys,
com caldria fer amb qualsevol altra analogia o metodologia didàctica.
Bibliografia i webgrafia
anDerTon GiDeon, A. J. (2009). LEGO my LEGO [en línia]. Austin: Texas Education Agency. <http://www.depts.ttu.edu/ gk12/modules/2008/lego_my_ lego.pdf> [Consulta: 30 setembre 2014].
anTropoFF, A. von (1926). «Eine neue Form des periodischem Systems der Elementen». Z. Angew. Chem., núm. 39, p. 722-728. ChemisTryunDersTooD Com (s. d.). Atoms, molecules and chemical reactions: Explained by LEGO analogy [en línia]. S. ll.: s. n. <http://chemistryunderstood. com/understand/Leogs/index. html> [Consulta: 30 setembre 2014].
harshbarGer, E. (2001, 2003). «The mysteries of the LEGO genome…». A: Eric Harshbarger’s LEGO website [en línia]. S. ll.: s. n. <http://www.ericharshbarger. org/lego/dna.html> [Consulta: 30 setembre 2014].
izquierDo, M. [et al.] (2011). Química a infantil i primària: Una nova mirada. Barcelona: Graó, p. 73-84.
KunTzleman, T. S. (2013). «LEGO periodic table». A: LEGO elements [en línia]. S. ll.: s. n. <http:// sites.arbor.edu/legoelements/> [Consulta: setembre 2014].
lipson, A. (2006) Mathematical LEGO sculptures [en línia]. S. ll.: s. n. <http://www.andrewlipson. com/mathlego.htm> [Consulta: setembre 2014].
quimiTube Com (2014). «Modelos moleculares: jugando como niños con la química». A: QuimiTube [en línia]. S. ll.: s. n. <http://www.quimitube.com/ modelos-moleculares> [Consulta: 30 setembre 2014].
sChaFmeisTer, C. F. (2007). «LEGO supramolecular». Inv. y Cien., núm. 367 (abril), p. 78-85.
vanDiver, K. M. (2009). Teacher’s guide for «LEGO® atoms and molecules: Chemical reactions» [en línia]. Billund: The LEGO Group; Cambridge: MIT. <https://edgerton.mit.edu/ sites/default/files/media/ LEGOChemteachersguide_ 9-7-12.pdf> [Consulta: setembre 2014]. [Revisat periòdicament]
vázquez TaTo, J. (2005). «Química supramolecular». Revista Iberoamericana de Polímeros, vol. 6, núm. 1 (febrer), p. 44-80. [Correspon a una conferència del 1983]
WISC (2012). Exploring the nanoworld with LEGO® bricks [en línia]. Madison: University of Wisconsin-Madison. Materials Research Science and Engineering Center on Nanostructured Materials and Interfaces. <http://education.mrsec.wisc. edu/LEGO/PDFfiles/nanobook. PDF> [Consulta: 30 setembre 2014].

Claudi Mans i Teixidó És catedràtic emèrit del Departament d’Enginyeria Química de la Universitat de Barcelona. Té publicats llibres de text i de divulgació, entre ells, La truita cremada (2005), Els secrets de les etiquetes (2007), La vaca esfèrica (2008) i Sferificaciones y macarrones (2010). Assessor i col·laborador de CosmoCaixa i de la unitat UB-Bullipèdia. Director científic del Comité Español de la Detergencia (CED). Vocal de les juntes de l’Associació Catalana de Comunicació Científica (ACCC), l’Associació Catalana de Ciències de l’Alimentació (ACCA) i el Col·legi de Químics de Catalunya.
A/e: cmans@ub.edu.
38 Educació Química EduQ número 19
A holistic approach to the atom in school chemistry
Un enfocament holístic a l’àtom en la química escolar
Sibel Erduran / University of Limerick (Ireland)
abstract

Many curricula and syllabi have been developed to foster meaningful understanding of the atom. Yet, the atom remains a difficult concept for many students. In this article, it is argued that a shortcoming in science teaching and learning of science concepts, including the atom, include limited coordination among (a) the various forms of scientific knowledge, and (b) the epistemic, cognitive and social aspects of scientific practices. Visual tools that can be helpful in communicating the complexity of various aspects of science are also presented.
keywords
Atom, nature of chemistry, growth of chemical knowledge.
resum
Molts plans i programes d’estudi s’han desenvolupat per fomentar la comprensió significativa de l’àtom. No obstant això, l’àtom segueix sent un concepte difícil per a molts estudiants. En aquest article, s’argumenta que una deficiència en l’ensenyament de la ciència i l’aprenentatge de conceptes científics, inclòs l’àtom, inclouen la coordinació limitada entre (a) les diverses formes de coneixement científic i (b) l’epistèmica, aspectes cognitius i socials de les pràctiques científiques. Es presenten eines visuals que poden ser útils en la comunicació de la complexitat dels diversos aspectes de la ciència.
paraules clau
Àtom, naturalesa de la química, desenvolupament del coneixement químic.
As this volume of Educació Química EduQ and many other resources worldwide illustrate, the atom is a central concept in the teaching and learning of chemistry. Substantial number of studies have been carried out on students’ conceptions and misconceptions about the atom. Many curricula and syllabi have been developed to foster meaningful understanding of the atom. Why is it, then, that there still is a significant problem in students’ understanding of the atom? Why is it that even students in higher education experience difficulties in conceptualizing the atom? What is missing in all the count-
less efforts to improve the teaching and learning of the atom?
I want to argue that a shortcoming in science teaching and learning efforts include limited coordination among (a) the various forms of scientific knowledge, and (b) the epistemic, cognitive and social aspects of scientific practices. By forms of scientific knowledge, I refer to theories, laws and models. By scientific practices, I refer to those practices that lead to the generation, evaluation and revision of scientific knowledge. In our recent book on the reconceptualization of nature of science in science education (Erduran & Dagher,
2014), we have argued that there is often very little effort placed on helping students understand science in a holistic fashion. This is true of both scientific knowledge and scientific practices. In our work, we provided a theoretical rationale drawing from work on philosophy of science to illustrate how nature of science can be represented and presented in school science in a holistic fashion, ranging from the aims and values of science to the social-institutional contexts of science. For various aspects of science, we then provided a set of visual tools referred to as generative images of science. These images, which will
39 ISSN 2013-1755, SCQ-IEC Educació Química EduQ número 19 (2014), p. 39-42
DOI: 10.2436/20.2003.02.142 http://scq.iec.cat/scq/index.html

p. 115).
be exemplified in the rest of this paper, are generative because they can lead to further articulations both conceptually and pedagogically.
Let me start with the issue of scientific knowledge and illustrate how the discussions on the teaching and learning of the atom could benefit from how we envisage the coverage of scientific knowledge in a holistic way. Theories, laws and models work together in the growth of scientific knowledge. Often, school science presents different forms of scientific knowledge without articulating them coherently let alone discussing the relationships between them. If we take atom as an example, this means that even though the atomic theory, the atomic model and periodicity as a pattern in elements are introduced to students, there is hardly ever any indication of how these forms of knowledge are about or how they interact in leading to understanding the structure and function of matter. For example, what is the relationship between the atomic «theory» and the atomic «model»? Are there lawlike regularities that contribute to our understanding of the atomic
model and how are they related to what makes a model?
Consider fig. 1, which communicates how theories, laws and models (referred thereafter as TLM) operate within a particular tradition in a coherent and interrelated fashion.
Altogether, TLM brings coherence to the various forms of scientific knowledge, illustrate how they are related and also account for how TLM grows as evidence accumulates. If you consider each quadrant of the figure, theories, laws and models are related in a particular topic like the atom in a coherent way. TLM grows in time as evidence accumulates leading to scientific understanding at every stage. However, there may be points in time when the TLM are no longer able to account for the evidence observed and hence, a new set of knowledge forms are needed, leading to a new paradigm, referred to by Thomas Kuhn as a «paradigm shift». A new paradigm could be represented as a new «plane» where the knowledge accumulation process begins and continues.
In our work, we have represented TLM and growth in TLM
visually. We can take the example of the atom. Each stage in the formulation of chemical understanding around the atom can be represented by a separate plane, for example the ancient Greek depiction of four elements (earth, water, fire, air) and Lavoisier’s conception of elements would constitute separate «planes» that have represented knowledge accumulation over time. When TLM couldn’t account for observed evidence and the entire paradigm had to change, scientists begin to formulate a new plane of knowledge. Kuhn himself used the example of atomic theory to illustrate the concept of incommensurability (Kuhn, 1970, p. 85) meaning that different par-
Let me start with the issue of scientific knowledge and illustrate how the discussions on the teaching and learn ing of the atom could benefit from how we envisage the coverage of scientific knowledge in a holistic way
Figure 1. Theories-laws-models, growth of scientific knowledge and scientific understanding (Erduran & Dagher, 2014,
40 Educació Química EduQ número 19
We can also question how these theoretical ideas can be implement ed in actual chemistry lessons. The TLM heuris tic can be used to gene rate a set of instructional sequences that places a strong emphasis on articulating the relation ships between theo ries, laws and models
adigms would not map onto each other due to their fundamentally different paradigmatic assumptions. The change from properties of matter such as colour to quantitative analysis of reactions could not possibly be mapped to the same knowledge plane. The broader theoretical framework, the regularities and patterns in the behaviour of matter and the representations of properties or reactions worked in unison to provide an overall paradigm.
A key shortcoming of school chemistry is that the curriculum does not represent the atomic theory to students in relation to the associated models and laws, or how they possess explanatory and predictive power that leads to chemical understanding. Rather, students are typically introduced to disparate pieces of knowledge (e.g. «the atom consists of a nucleus and electrons») that are essentially data points on each quadrant of fig. 1. Whenever knowledge from different paradigms are presented (e.g. Dalton’s vs. Bohr’s atom), there is rarely any lead into the historical conditions, criteria and standards that actually made the progressions in knowledge growth and revision necessary. From the students’ point of view, shifts in the TLM growth or revision remain a mystery.
How, then, could heuristics such as the one represented in fig. 1 help students in understanding the atom? First, the heuristic is a «meta-tool» that highlights the significance of understanding what constitutes chemical knowledge. Without a sense of differentiation of theories, models and laws, all information that is presented to students is of the same epistemic value. In other words, while we recognize from the work of philosophers of chemistry that various forms of knowledge have different characteristics, these are mostly undifferentiated in school chemistry. Such ambiguity presents problems for an authentic representation of chemical knowledge in school chemistry. If we are serious about promoting student understanding of chemistry, then a meta-level appreciation of what constitutes chemical knowledge is not a luxury. It’s a necessity. Second, the heuristic gives learners a sense of the progression of ideas, how ideas change over time and how ideas can at times be abandoned altogether in favour of new ones. Hence, students begin to develop an understanding of how scientific knowledge growth works.
We can also question how these theoretical ideas can be implemented in actual chemistry lessons. The TLM heuristic can be used to generate a set of instructional sequences that places a strong emphasis on articulating the relationships between theories, laws and models. Apart from some generic discussions about such relationships (e.g. what’s the difference between a theory and a model?), specific discussions can take place in reference to the atom (e.g. is the atomic theory the same thing as the atomic model?). Questioning and discussion can play a significant role in
eliciting rich coverage of not only the meta aspects of chemical knowledge but also by drawing in the particular concepts and organising them in a coherent whole, students’ conceptual understanding might also be reinforced.
Let me now turn to a brief discussion of scientific practices which underlies the processes that lead to the generation of scientific knowledge. Scientific practices such as experimentation, observation and classification all contribute to how scientists generate data. Scientists use data to build models which can be used to predict phenomena. These epistemic practices of knowledge construction happen through the mediation of cognitive and social practices such as reasoning, argumentation and social certification of ideas. We have produced a visual tool that we refer to as the benzene ring heuristic where we consolidate, in a relatively simpler fashion, the various epistemic, cognitive and social aspects of science that lead to the production of scientific knowledge. Consider fig. 2, that uses the analogy of the benzene ring to summarize scientific practices. Each carbon atom around the ring and the diffuse π bonds represent the social contexts and practices that apply to all of these aspects. The cognitive, epistemic and social aspects of science are interrelated and influence one another. The ring structure represents the «cloud» of cognitive and social practices that mediate the epistemic components such as models and explanations.
The benzene ring heuristic begins to articulate how scientists use data originating from the real world to generate models, explanations and predictions. In a sense, the heuristic highlights the mechanisms for how the TLM growth occurs. In school chemistry, the activities of experimenta-
41 A holistic approach to the atom in school chemistry
Estratègies didàctiques
Monografia
/
tion, classification and observation tend to be covered in a disconnected fashion that don’t necessarily lead to modelling practices by students themselves. What the heuristic aims to foster is a coordinated approach to how students can be helped in understanding how the various practices of science are interrelated. For example, chemists debate what data to use to generate models and how. The epistemic dimensions of such discussions are intertwined with social processes of debate and representations. In short, while fig. 1 emphasizes the components of scientific knowledge and its growth, fig. 2 illustrates some of the mechanisms and interactions that underlie and underscore how the various
The benzene ring heuris tic begins to articulate how scientists use data originating from the real world to generate mo dels, explanations and predictions. In a sense, the heuristic highlights the mechanisms for how the TLM growth occurs
forms of scientific knowledge need to be coordinated in a finer level of detail. The benzene ring heuristic can be used to get the students to think about, for instance, how a model of the atom is related to the «real world» or how the atomic model can help predict chemical behaviour. Our recent work indicates that the use of the benzene ring heuristic in teacher education can help improve pre-service science teachers’ conceptualisation of scientific practices from simple linear representations to more complex and holistic representations (Erduran, 2014). Overall, the visual tools are generative in helping guide the discussion of various aspects of scientific knowledge and practices. In summary, a holistic approach to the knowledge and practices underlying the development of the «atom» is likely to facilitate students’ understanding because it will consolidate the often fragmented aspects of chemistry in school chemistry into meaningful and interconnected set of ideas.
References
erDuran, S. (2014). «Revisiting the nature of science in science education: towards a holistic
account of science teaching and learning». European Journal of Science and Mathematics Education, vol. 3, No. 3: Papers presented at FISER’14 conference, p. 14-25.
erDuran, S.; DaGher, Z. (2014). Reconceptualizing the nature of science for science education: Scientific knowledge, practices and other family categories Dordrecht: Springer. Kuhn, T. S. (1970). The structure of scientific revolutions. 2nd ed. Chicago: University of Chicago Press.

Sibel Erduran
Is Professor of STEM Education and Director of EPI*STEM, the National Centre for STEM Education at University of Limerick, Ireland. Her research interests include the design of curricula, learning environments and teacher professional development approaches that make chemistry more authentic in chemical education. E-mail: sibel.erduran@ul.ie
42 Educació Química EduQ número 19
Figure 2. Benzene ring heuristic of scientific practices (Erduran & Dagher, 2014, p. 82).
Com ajuden els àtoms a aprendre química i quines dificultats generen?
How atoms help learning chemistry, and what problems they generate?
Mireia Garcia Viloca / Universitat Autònoma de Barcelona. Departament de Química. Unitat de Química
Física
Núria López, Pilar Melcón i Isabel Muñoz / Grup de treball Kimeia
David Rial / Escola Sant Felip Neri, Barcelona
Marta Segura i Josep Maria Valls / Escola Pia Nostra Senyora, Barcelona
Marta Simon / IES Leonardo da Vinci, Sant Cugat del Vallès
Coordinació i edició de l’article: Mercè Izquierdo i Claudi Mans
resum

Com a coordinadors del monogràfic, hem plantejat la pregunta del títol de l’article a docents dels diferents nivells educatius (universitat, secundària i infantil i primària). L’article presenta les respostes dels professors i professores editades pels coordinadors. Les seves opinions pel que fa a la manera com desenvolupen la temàtica de l’àtom a classe, així com les seves reflexions al voltant de l’àtom, mostren diferents punts de vista i ens ofereixen un ventall de possibilitats docents. Agraïm als professors la seva col·laboració.
paraules clau
Àtom, internivell, experiència d’aula, dificultats d’aprenentatge.
abstract
As coordinators of the monograph issue, we have raised the question of the title of the issue to teachers of all levels of education (university, secondary, primary school and childhood school). This article presents the responses of teachers edited by the coordinators. Their opinions regarding how to develop the theme of atoms in their lessons, as well as their thoughts on the atom and students’ difficulties, show different points of view and offer a range of educational possibilities. We thank the teachers for their collaboration.
keywords
Atom, interlevel, classroom experience, learning difficulties.
Debat: com ajuden els àtoms a aprendre química i quines dificultats generen? Què ens en podeu dir?
Hem plantejat aquesta pregunta a docents dels diferents nivells educatius. Les seves respostes ens ofereixen un ventall de possibilitats didàctiques que ens fan pensar. Presentem a continuació el contingut. Els subratllats, les negretes i
l’estructura dels paràgrafs són nostres.
Esperem que les diferents opinions facin que els àtoms ens ajudin a explicar els fenòmens químics que es produeixen al nostre entorn.
C. Mans i M. Izquierdo
1. Ens en parla Mireia Garcia Viloca, professora de química física de la Universitat Autònoma de Barcelona
— La idea d’àtom químic permet imaginar-se la matèria per dins en coherència amb l’evidència que no tota la matèria és igual.
— L’àtom químic, a diferència de les partícules físiques, respon a l’interès genuïnament químic per allò que diferencia els materials, i no pas per les qualitats que els fan semblants, com ara la solidesa. És per això que
43 ISSN 2013-1755, SCQ-IEC Educació Química EduQ número 19 (2014), p. 43-47
DOI: 10.2436/20.2003.02.143 http://scq.iec.cat/scq/index.html
cal diferenciar les partícules físiques dels àtoms de la química.
Però quan cal parlar-ne?
— El primer contacte amb la química és, de manera natural, amb els fenòmens quotidians També la història de la ciència ens mostra que el procés que ha seguit l’home en relació amb la matèria i les seves transformacions és un procés que parteix dels fenòmens i que es desenvolupa en el diàleg entre percepció sensorial i pensament.
— L’aproximació fenomenològica i històrica de la química és la més propera a l’alumne, com a persona en procés d’aprenentatge, perquè permet fer-se preguntes i trobar respostes pròpies que, amb l’ajuda del mestre, aniran apropant-se als models que actualment estan acceptats per explicar els fenòmens.
— En primer lloc, cal mostrar els fenòmens que permeten veure que un canvi físic és diferent d’un canvi químic, ja que en aquest darrer hi ha alguna cosa que desapareix i n’apareix una de nova. Però el que passa a l’interior de la matèria i per què passa és invisible al món sensorial. A 1r i 2n d’ESO, quan l’alumne té un interès natural i sincer pel món que l’envolta, és el moment d’acollir i reforçar aquesta mirada científica als fenòmens i experiments.
— Els observarem i aprendrem a descriure’n tots els elements (què tenim?, què fem?) i les qualitats (què passa?). Podem començar a parlar de per què passa, la qual cosa potenciarà la capacitat de fer preguntes i imaginar respostes (encara que aquestes siguin absurdes, perquè poden ajudar a trobar el propi camí cap a la idea correcta/acceptada).
— Ens centrarem sobretot a veure com els canvis químics (combustió, reaccions àcid-base, de precipitació, etc.) ens propor-
Les primeres dificultats amb les quals ens tro bem a les etapes d’infan til i primària per treba llar aquest tema estan relacionades amb la invisibilitat i amb la quantitat d’àtoms que formen la matèria, és a dir, la discontinuïtat (la matèria està formada per «parts») i la immensura bilitat (les parts són molt petites, no es poden veure, i n’hi ha moltes, no es poden comptar)
cionen informació sobre com és de diferent cada matèria (substància) i quin lloc tenen en l’home i en la natura (el cicle del calci, per exemple). A 3r d’ESO, a partir de la mesura exacta de les magnituds físiques mesurables en esdevenir-se un canvi químic (canvis aparents en la massa, en la temperatura, en el volum, etc.), deixarem que el pensament del nen pugui construir les relacions dels diferents elements del fenomen per apropar-se cada vegada més a les lleis que regeixen els fenòmens químics. Entre 4t d’ESO i 1r de batxillerat, els nois aprendran a modelitzar, i és en aquest moment que podran trobar-se amb el model d’àtom químic.
Quines dificultats es generen en tot aquest procés?
— Si es fa aquest procés, s’evita que es deslligui el canvi químic com a fenomen macroscòpic (que va donar origen a la taula periòdica) del canvi químic entès com a reorganització d’electrons per aconseguir la configuració electrònica més estable. Per contra, si comencem a parlar del model d’àtom químic
quan el procés de modelitzar encara no és natural en el nen, aconseguirem allunyar els fenòmens químics de l’interès de l’alumne. Les persones necessiten el contacte amb el món per fer-se preguntes.
2. Ens en parlen tres professores de primària: Núria López, Pilar Melcón i Isabel Muñoz, del grup de treball Kimeia
— Les primeres dificultats amb les quals ens trobem a les etapes d’infantil i primària per treballar aquest tema estan relacionades amb la invisibilitat i amb la quantitat d’àtoms que formen la matèria, és a dir, la discontinuïtat (la matèria està formada per «parts») i la immensurabilitat (les parts són molt petites, no es poden veure, i n’hi ha moltes, no es poden comptar). En aquest sentit, es poden proposar activitats en les quals s’hagi d’esmicolar un material determinat (una galeta, aire, aigua, etc.) tot comprovant que, per molt que el fragmentem, cada part continua mantenint les propietat originals.
— Un altre aspecte a tractar està relacionat amb la distribució a l’espai d’aquestes parts i els enllaços que les mantenen unides. És interessant fer dramatitzacions sobre l’estructura dels materials, per exemple: si fóssim parts d’un líquid, com estaríem distribuïdes en un espai? I si fóssim un sòlid? I un gas? La realització de maquetes amb plastilina i escuradents també ajuda l’infant a visualitzar la distribució interna dels materials, ja que relaciona el que veiem en l’àmbit macro amb el que ens sembla que passa en el micro.
— A infantil i als primers cicles de primària, parlem sempre de parts; més endavant apareixeran les paraules molècula i àtom, relacionades amb el fenomen que observem: molècules com l’aigua
44 Educació Química EduQ número 19
(H2O), O2 i N2 com a components de l’aire que respirem, àtoms com l’H, el Fe, el Ca, etc., relacionats amb el funcionament químic del cos humà i del nostre entorn proper, que, d’aquesta manera, s’omplen de significat.
— A poc a poc, hem de passar d’una visió estàtica de la matèria a un punt de vista dinàmic, en el qual l’objecte d’estudi siguin els canvis d’estat que es produeixen quan es canvien les condicions externes de pressió i temperatura, quan es dissolen els materials, etc. Les activitats han de passar per la descripció acurada del que teníem a l’inici, del que tenim al final i del que ha passat durant el procés. El fet de partir de preguntes com ara «on és el sucre que hem afegit a l’aigua?» ens porta, una altra vegada, a canviar d’escala, a passar del que veiem al que imaginem que ha passat, i a utilitzar el dibuix, la parla, les representacions, les maquetes, etc., per visualitzar les explicacions i compartir-les amb els altres. — Cap als últims cursos de primària, es comencen a analitzar les interaccions fortes, sempre sota la mirada de la conservació de la massa, dels elements i de l’energia. És en aquest moment que utilitzem el concepte i la paraula àtom La dificultat en aquesta etapa rau a visualitzar i representar les forces que mantenen junts els àtoms (enllaços). L’observació de fenòmens com ara l’oxidació dels metalls, el procés de producció del vi, del iogurt o del pa, etc., provoca la formulació de preguntes relacionades amb les «substàncies que apareixen» i la utilització d’instruments de mesura. Per justificar els canvis observats, es fa necessari pensar com els àtoms que formen les substàncies es redistribueixen formant-ne d’altres. La utilització de jocs de construcció ens permet
representar les substàncies inicials i redistribuir les peces per obtenir les substàncies finals.
3. Ens en parla David Rial, professor d’ESO a l’escola Sant Felip Neri de Barcelona Quan hem de començar a parlar dels àtoms a les classes de ciències?
— Els àtoms com a constituents essencials de la matèria esdevenen un concepte molt important per poder mostrar als alumnes la naturalesa i les propietats d’aquesta matèria que conforma l’Univers. D’altra banda, la seva intangibilitat els presenta com uns elements als quals resulta difícil apropar-se per part dels alumnes més joves. — Penso que el més convenient seria trobar els recursos didàctics que permetessin apropar l’àtom als alumnes, ni que sigui d’una manera molt elemental, ja en els darrers cursos de l’ensenyament primari, potser a 6è. De forma que, durant l’itinerari a l’ESO, a partir d’aquest coneixement inicial i bàsic, hi anem afegint més detall i contingut. Per exemple, un cop a 1r ESO i aprofitant l’estudi de l’Univers, es podria establir una segona aproximació al model de l’àtom a partir de la seva similitud amb l’estructura dels sistemes estel·lars com el nostre Sistema Solar, que els alumnes ja estudien en aquest curs. Fins i tot, relacionant els dos models, es faria més fàcil entendre com la matèria i l’Univers estan bàsicament buits.
Cal diferenciar les partícules físiques de les químiques?
— És important saber diferenciar quan ens trobem davant d’un canvi físic i quan ens trobem davant d’un canvi químic. I també les conseqüències que tenen aquests canvis sobre la matèria. Però, més que diferenciar les partícules que intervenen en un
cas o en l’altre, el que cal és mostrar quines són les relacions que aquests àtoms estableixen entre ells quan el procés és físic i quines quan és químic
Quines dificultats es presenten en el moment de relacionar els àtoms i els canvis químics i com es poden resoldre?
— La principal dificultat consisteix a fer entendre que en tot canvi químic ni es guanyen ni es perden àtoms, només es recombinen els que hi havia inicialment. I que hi ha una mena d’equilibri dinàmic entre reactiu i producte. I que, en tot moment, tots dos sempre sumen la mateixa massa. Seria com disposar d’un nombre fix de peses en una balança romana i anar-les passant d’un plat a l’altre. Un cop totes les peses han passat del plat dels «reactius» al dels «productes», i durant tot el procés, la massa global del sistema no ha variat.
Quina és la idea més important que aporten els àtoms a la química?
— Els àtoms serien a la química com els nombres a les matemàtiques. Es tracta dels elements a partir dels quals s’estructura qualsevol procés químic. És important que els alumnes siguin conscients que els àtoms dels diferents elements presenten unes propietats i característiques específiques que els diferencien els uns dels altres. I que, quan es combinen àtoms diferents en una reacció química, la substància resultant presentarà unes propietats que li són específiques i que poden ser molt diferents de les que presenten, de manera individual, els àtoms que la constitueixen.
— A més, és convenient anar familiaritzant els alumnes amb el fet que els àtoms, com els nombres, es poden agrupar per famílies I els integrants de cada família d’àtoms tenen en comú el fet de
45 Com ajuden els àtoms a aprendre química i quines dificultats generen?
didàctiques
Monografia /
Estratègies
presentar unes característiques o propietats determinades, ni que sigui en diferent grau. Tal com passa amb els nombres parells o els primers, també es poden agrupar àtoms segons les seves propietats comunes.
4. Ens en parlen Marta Segura i Josep Maria Valls, de l’Escola Pia Nostra Senyora de Barcelona
— El concepte àtom és fonamental en l’aprenentatge de la química. Cal parlar d’àtoms des del primer moment en què es parla de matèria. Per als més petits, la matèria, tot allò que podem veure, sentir, olorar, tastar i tocar, està feta d’unes partícules molt petites que no podem veure. De la mateixa manera que una casa està feta de pedres, totxos i altres unitats diferents les unes de les altres, la matèria està feta d’àtoms, no tots iguals.
— A mesura que apugem el nivell, cal parlar d’una altra cosa abans de parlar d’àtoms: el concepte substància pura. És la substància pura la que té les propietats físiques clares i determinades. Però la matèria que ens envolta no està feta de substàncies pures, sinó de mescles d’aquestes. I aquest discerniment és el primer que cal ensenyar i clarificar. A partir d’aquí, parlem de substància pura: de què està feta?Aquí hem de posar rigor, d’una banda, i models senzills, de l’altra, la qual cosa no és gens fàcil.
— Qualsevol substància pura està formada per unes partícules que són característiques de cada substància i que en determinen totes les propietats físiques. Però, com que coneixem i experimentem la transformació de substàncies pures, hem d’admetre que aquestes partícules estan formades per unes altres, les quals, en principi, serien immutables. I aquí entra la química.
I anomenem àtoms aquestes altres. No entrem ara en la transmutació dels àtoms perquè no és l’objectiu d’aquest escrit. — I aquí és on vénen les dificultats. Quines són aquestes partícules «físiques» que formen les substàncies pures, que intervenen en els canvis físics i que donen la «marca» de substància pura? Hem de ser rigorosos i divulgatius alhora. La clau de tot plegat és classificar bé les substàncies pures. I fer-ho en «elements» i «compostos», com s’ha fet fins ara, és un error didàctic greu, malgrat que el que es volia transmetre era el mateix que el que es vol ensenyar avui.
— No hi ha «elements» i «compostos». El que hi ha són «substàncies simples» i «substàncies compostes» (anomenades també compostos). I quina és la diferència? Ara sí que hem de parlar de quines són les «partícules físiques» que formen les substàncies pures. I ara és quan podem distingir els àtoms, les molècules, els ions i les estructures gegants. I a cada nivell sabrem com fer-ho.
— Ara és quan podrem dir que l’oxigen que respirem és una substància pura formada per partícules i que cada una està feta de dos àtoms iguals. I que l’aigua, en canvi, està formada per tres àtoms, dos d’iguals i un de diferent dels altres dos. El dioxigen (que forma part de l’aire que respirem) és una substància simple. L’aigua és un compost. I hi ha àtoms d’oxigen i d’hidrogen. I a partir d’aquí, només a partir d’aquí, arribarem al concepte, únicament mental, d’element químic
5. Ens en parla Marta Simon, de l’IES Leonardo da Vinci de Sant Cugat del Vallès Per què parlem dels àtoms a les classes de ciències? Com ajuden a interpretar fenòmens?
La teoria atòmica és potser la millor proposta per presentar una ciència en construcció. No tenim del tot clar el model i, tot i així, seguim fent hipòtesis i prediccions que acaben en avenços socials molt rellevants.
— Les teories sobre l’estructura de la matèria ofereixen la possibilitat de construir una de les narracions més rellevants i amb més possibilitats didàctiques del món de la ciència. En presentar el tema als meus alumnes, em plantejo dos objectius:
a) Facilitar-los la possibilitat de mirar el món amb uns ulls nous.
b) Ajudar-los a aprendre a representar d’alguna manera allò que s’imaginen.
Els models de la ciència han posat en joc molta imaginació, però han d’estar d’acord amb l’experimentació.
— Es poden generar preguntes a partir, per exemple, del documental de TV3 Àtom: interrogant la matèria (Què, qui, com, 2012), arran del qual ens podem interrogar sobre el pensament dels nens. Caldrà dibuixar o escriure sobre el que s’imaginen que ha passat i fer recerca sobre els científics que han pensat entorn del tema. Aquest recorregut didàctic ajuda a fer conscients els estudiants sobre el que saben de l’estructura de la matèria: conservació/canvi, micro/macro (el que no veiem/el que veiem), parts/estructura, repòs/moviment.
— Les dificultats les trobem a l’hora d’aconseguir que arribin a un model de partícules que els permeti fer prediccions. Hi ajuden les interaccions entre iguals per compartir els dibuixos i les explicacions.
— El vídeo de presentació del CERN (Lapuente, 2004) introdueix l’estat actual de la recerca i
46 Educació Química EduQ número 19


Mercè Izquierdo Aymerich
podem generar preguntes com ara «allò que no veiem no existeix?».
— Ara s’imposa el treball de les escales de mesura i de les conseqüències d’observació que se’n deriven: no es veu el mateix segons l’escala.
Quines dificultats es generen? En quins paranys no hauríem de caure?
— Si comencem el tema donant respostes i presentant les representacions dels models atòmics l’una rere l’altra, quin tipus de construcció mental afavorim? No seria més interessant traure l’accent de la memorització dels models i aprofitar la seqüència de reestructuració successiva dels models per aprendre el model de treball de la ciència? A cada nivell es pot aprofundir en un dels models.
— Si presentem les propietats dels àtoms i fem preguntes reproductives, numèriques, quins tipus de capacitats competencials desenvolupem? Potser cal minimitzar aquestes qüestions i avaluar com s’ha estructurat cada experiment per explicar tot el que l’anterior no explicava Entendre aquestes diferències comporta explicar també les
característiques i propietats dels àtoms.
— I si per tal d’aprendre a diferenciar entre isòtops i ions donem les definicions de cada tipus, què ajudem a fer als alumnes? En definitiva, què els queda per indagar? El repte d’estimular i despertar l’interès per la química és una tasca engrescadora i gratificant.
— «Sense els àtoms, la química és una artesania poc interessant, però només amb àtoms no hi ha química» (Izquierdo, 2008).
Referències izquierDo, M. (2008). «La construcció física de l’àtom: de Mendeléiev a Pauling». III Jornada d’Història de la Ciència i l’Ensenyament, vol. 1, núm. 2, p. 79-87. lapuenTe, C. (dir.) (2004). CERN: Catedrales de la ciencia [en línia]. Ginebra: CERN; Alcobendas: New Atlantis. <https://www.youtube.com/ watch?v=PXkmu-WxXE4> [Consulta: 30 setembre 2014]. què, qui, Com (2012). Àtom: interrogant la matèria [en línia]. Barcelona: Televisió de Catalunya. <http:// www.tv3.cat/videos/2542259> [Consulta: 30 setembre 2014].
És doctora en ciències (química) i catedràtica de didàctica de les ciències a la Universitat Autònoma de Barcelona, on ha fet classes de química, història de la química i didàctica de les ciències. La seva recerca es dedica de manera específica al llenguatge i als aspectes històrics i epistemològics que tenen influència en l’ensenyament de la química. Ha dirigit tesis doctorals i ha participat en programes de formació de professors en actiu i en projectes de recerca en col·laboració amb universitats de l’Estat espanyol i de l’Amèrica Llatina. És codirectora de la revista Enseñanza de las Ciencias
A/e: merce.izquierdo@uab.cat

Claudi Mans i Teixidó És catedràtic emèrit del Departament d’Enginyeria Química de la Universitat de Barcelona. Té publicats llibres de text i de divulgació, com ara La truita cremada (2005), Els secrets de les etiquetes (2007), La vaca esfèrica (2008) i Sferificaciones y macarrones (2010). És també assessor i col·laborador de CosmoCaixa i de la unitat UB-Bullipèdia, director científic del Comité Español de la Detergencia (CED) i vocal de les juntes de l’Associació Catalana de Comunicació Científica (ACCC), l’Associació Catalana de Ciències de l’Alimentació (ACCA) i el Col·legi de Químics de Catalunya.
A/e: cmans@ub.edu
47 Com ajuden els àtoms a aprendre química i quines dificultats generen?
Figura 1. Comencem a pensar químicament quan sabem veure les molècules d’aigua com a essència del mar.
Monografia
/ Estratègies didàctiques
Using demonstrations to stimulate inquiry and students’ thinking
L’ús de demostracions per estimular la investigació i el pensament dels estudiants
Peter E. Childs / University of Limerick. Department of Chemical and Environmental Sciences. Chemistry Education Research Group / National Centre for Excellence in Mathematics and Science Teaching and Learning (Limerick, Ireland)
abstract

This article describes how demonstrations can be used to stimulate inquiry and initiate the process of inquiry-based science education. This means doing demonstrations not just for fun or to illustrate some topic, but to catch students’ attention, and engage them in the inquiry process by asking questions and suggesting solutions. Some examples of such an approach are given using a selection of science demonstrations, used in a lecture in Barcelona in November 2013. The article focuses on the engagement phase of the 5E enquiry model, which is being development in the TEMI project, a new FPY IBSE project.
keywords
Demonstrations, questioning, discrepant events, 5E model, IBSE.
resum
Aquest article descriu com es poden utilitzar els experiments demostratius per estimular la investigació i iniciar el procés d’ensenyament de les ciències basat en la indagació. Això significa fer experiments demostratius no només per diversió o per il·lustrar algun tema, sinó també per captar l’atenció dels estudiants, així com per involucrar-los en el procés d’investigació per mitjà de preguntes i el suggeriment de solucions. Alguns exemples d’aquest enfocament es donen mitjançant una selecció de demostracions científiques que es van presentar en una conferència a Barcelona el novembre de 2013. L’article se centra en la fase d’implicació del model d’indagació 5E, que és el model emprat en el projecte TEMI, un nou projecte d’ensenyament de les ciències basat en la indagació (ECBI).
paraules clau
Experiments demostratius, formulació de preguntes, controvèrsies científiques, model 5E, ECBI.
Introduction
Demonstrations are widely used in lectures and in lessons to capture student’s interest or to illustrate something. Katz (2005) is well-known as a science demonstrator and said this about using demonstrations in teaching:
Magic is science without explanations. In presenting demonstrations, either explanations are often omitted or too much information is given. An
effective demonstration should promote good observation skills, stimulate thought, arouse curiosity, present aspects of complex concepts on a concrete level, and, most important, be the basis for class discussion. Explanations should contain enough information to satisfy the audience’s curiosity as to what took place and why, and should serve as a starting point for further inquiry for those individuals who need more details.
Science demonstrations may be used in magic shows without explanation or in teaching with the explanation and connections to the topic being taught. Often the student is a passive recipient of impressions or ideas, rather than an active participant in such demonstrations. As part of the Tempus SALiS project on «Student Active Learning in Science», we developed a lecture demonstration to show how demonstrations can be used to encourage students to think and become more actively involved, thus promoting
ISSN 2013-1755, SCQ-IEC Educació Química EduQ número 19 (2014), p. 48-57 DOI: 10.2436/20.2003.02.144 http://scq.iec.cat/scq/index.html 48

scientific inquiry and learning (Childs and Hayes, 2012).
This article describes the approach used in the lecture in Barcelona in November 2013 (fig. 1) as a model for using the various examples in a teaching situation. The format of the lecture was that a demonstration was introduced and performed and then the audiences were asked questions to help them think about what they had seen, to suggest explanations, propose hypotheses to explain what had happened and suggest further experiments to test their ideas.
In a teaching situation, it is envisaged that each example would be developed and would lead to further discussion and experimentation, consolidating the material and developing a deeper understanding of a scientific approach to problems. The initial demonstration would be the first stage, engagement, of the inquiry process as used in the 5E model of inquiry (fig. 2), and is used to kick-start the lesson and to engage students in the learning process (Bybee et al., 2006).

Figure 2. The 5E model of inquiry (http://www.bscs.org/bscs-5e-ins tructional-model).
This was not possible in a lecture and this article follows the format of the lecture: first, the demonstration is described, with information on how to do it; sample questions are then given to stimulate students’ thinking about the example, and finally an explanation is given for the teacher. However, it should be stressed that the teacher is not expected to jump straight to giving the answer but should lead the students through the process of questioning, hypothesising and testing ideas, only giving the explanation at the end of the process. The approach taken is very similar to the new EU FP7 project «Teaching Enquiry with
Mysteries Incorporated» (TEMI) (http://teachingmysteries.eu/en).
The purpose of this inquirybased teaching approach is to:
— Engage the students’ interest and stimulate their curiosity as a prelude to inquiry.
— Stimulate thinking and to get your students involved with their «minds-on».
— Use demonstrations and experiments to encourage thinking, not just to provide answers.
— Not to use demonstrations just as science magic, because we want to end up with answers, not just amazement.
The importance of questioning
I keep six honest serving men (They taught me all I knew); Their names are What and Why and When And How and Where and Who. ruDyarD KiplinG (1865-1936)
This famous poem by Rudyard Kipling reminds us of how important questions are in teaching. We want to get our students involved in thinking, discussing, and proposing solutions and questions are the way the teacher can start this process. Westaway (1929, p. 28) emphasised the importance of questions in doing demonstrations in school:
But in a school the lecture-room is a place for teaching, and the demonstration table is the teacher’s laboratory bench.
The teacher works experiments, often because the experiments are beyond the pupil’s skill; the lesson consists of questions and answers all the time —directed questions, and in case of emergency leading questions, and answers which are used for cross-examination and further questions.
49 Using demonstrations to stimulate inquiry and students’ thinking
Figure 1. Peter Childs giving his demonstration lecture in Barcelona.
experimental
Intercanvi
/ Treball
Some points to bear in mind when using demonstrations for inquiry-based learning:
— Make it interactive: the demonstrator should interact with the audience and get them involved.
— Ask questions throughout to raise the level of involvement.
— Get them to make observations as the demonstration proceeds.
— Stimulate thinking by showing unusual things, often known as discrepant events (Liem, 1990; O’Brien, 2010), which can be used to provoke discussion.
— Encourage discussion amongst students, so they argue with each other about what is going on and sharpen their own ideas.
— Ask students to suggest why the demonstration works and what it means.
— Get them to suggest possible reasons to explain the phenomena and how they could test them experimentally.
— Ask «what if?» to take the demonstration further by extending it, and if possible do this by proposing hypotheses and testing out their ideas experimentally.
We want to get over the idea that hypotheses are not speculations but can be tested by further experiment, and that experimental evidence is used to test them.
Good teaching is more a giving of right questions than a giving of right answers.
JoseF
albers (1888-1976)
Choosing suitable demonstrations or experiments
When deciding what demonstrations to use to engage students either in a lecture or classroom context, we need to consider a number of factors.
We need to consider:
— The background, ability and level of students.
— The topic being taught.
— Identify suitable demonstrations or experiments that are:
a) Safe.
b) Low-cost.
c) Right level.
d) Arouse curiosity.
e ) Stimulate questions.
f) Lead to fruitful inquiry.
There are a wide range of demonstrations and activities in every area of science that could be used. The difference lies in how we present them and use to stimulate inquiry, curiosity and critical thinking. The demonstration is not an end in itself, or the end of the story, but is deliberately chosen as the starting point for an adventure in inquiry for your students, which will cause them to engage with the science and develop their understanding through minds-on and hands-on activities. One source of suitable ideas is classed under the heading of discrepant events (Liem, 1990; O’Brien, 2010).
A discrepant scientific event is a surprising occurrence —such as corn growing faster in the dark than in the light— that challenges learners’ preconceptions. Because they at first appear to be non-academic in nature and frequently differ from what is expected, these tidbits can stir the interest of even the chronically disinterested student. The moment a student proclaims: «No, that just isn’t possible; it can’t work that way», a window of opportunity opens for the student to gain a better understanding of his or her world (Wright, 2014).
In the following section, some of the demonstrations covered in the lecture, and some additional ones, are described to illustrate the approach used.
There are a wide range of demonstrations and activities in every area of science that could be used. The difference lies in how we present them and use to stimulate inquiry, curiosity and critical thinking
Sample demonstrations to initiate inquiry
Colour changes
Colour changes are one way of recognising a chemical change, and when the changes are unexpected or are presented in a «magic show» format, they can be used to stimulate thinking. Some examples are given below.
1) Magic writing
How to do it:
This is then sprayed with a colourless solution and a pink message appears. When left for some time, this message disappears. It will reappear when sprayed again.
What is happening? Some questions to ask:
Why can a colourless solution produce a pink colour? (The students might recognise the colour of phenolphthalein from titrations and guess that the solution sprayed might be an alkali.)
How might you test the solution that was sprayed? (Litmus or universal indicator would show that the solution was basic. Testing with phenolphthalein would produce the same colour as that observed.)
Why does the colour slowly fade? Is this due to light or something in the air? (This is more difficult to explain and there could be several explanations. If it was due to light, then we could leave the message in the
50 Educació Química EduQ número 19
dark and see if it still disappeared. However, knowing the colour is due to an acid-base indicator that goes from colourless to pink with base might lead to the suggestion that if it changes back, an acid must be involved to neutralise the base or that the base evaporates reversing the reaction.)
Where could the acid come from? Does it come from the cloth or paper or from the air? (The same thing happens for cloth and paper so it is more likely to be the air.)
Is there anything acidic in the air? What about carbon dioxide? How could you test this hypothesis? (We could put the coloured cloth in air with no carbon dioxide. We could test whether bubbling carbon dioxide through dilute sodium hydroxide plus phenolphthalein, changes the colour from pink to colourless. We could put the paper or cloth in a jar containing carbon dioxide.)
Explanation and set-up:
An invisible message is written using phenolphthalein indicator solution on a sheet of paper or the back of a lab coat. When sprayed with dilute sodium hydroxide (e.g. 0.1M NaOH or another dilute alkali), the acidbase indicator changed from colourless to pink. However, air contains a small amount of carbon dioxide (an acidic gas), which slowly reacts with the alkali, neutralises it, and thus removes the pink colour. This is a slow reaction due to the low concentration of carbon dioxide in air and the fact that it has to diffuse into the paper or cloth and react. The pink colour will reappear if sprayed again with dilute alkali.
2) Water to wine and back again
How to do it:
Three glasses or beakers (A, B, C) are lined up each one-third full
of colourless liquid. When A is poured into the central one B, it turns pink. When C is poured into the central one, the pink colour disappears.
What is happening? Some questions to ask:
What does the colour change from colourless to pink remind you of? (The students will be familiar with acid-base indicators, and the only one showing this colour change is phenolphthalein.) Which beaker must contain the phenolphthalein? (Must be the central one, B.) What must be present in A to cause the pink colour to appear? (An alkali causes phenolphthalein to turn pink.) What sort of substance causes the pink colour of phenolphthalein due to an alkali to disappear? (An acid produces the colourless form of phenolphthalein, so C must contain an acid.) If we add an equal volume of C to B as the volume of A (the base), what can we say about the acid? (For the colour to disappear fully, the acid must be more concentrated than the alkali, so that it neutralises it and produces an acidic solution.)
Explanation and set-up:
It is important to have equal volumes in each glass/beaker to start. When added together, they should not overflow from the middle glass/beaker. The central beaker B contains water with a few drops of phenolphthalein and should be colourless to start with. Beaker A contains 0.1M sodium hydroxide solution. When A is poured into B, the pH increases and the phenolphthalein indicator changes into its pink form. Beaker C must contain an acid which is more concentrated than the alkali in A, so that it will neutralise it. 0.2M hydrochloric acid or 0.1M sulfuric acid could be used. Part of the acid will neutralise the alkali
An invisible message is written using phenolphthalein indicator solution on a sheet of paper or the back of a lab coat. When sprayed with dilute sodium hydroxide (e.g. 0.1M NaOH or another dilute alkali), the acid base indicator changed from colourless to pink
and the excess will convert phenolphthalein to its colourless form.
How could you turn it pink again? You would need to add more alkali, enough to neutralise the acid.
This simple demonstration could be used to introduce the more complex «Water into wine» series below. It is about acid-base reactions but also introduces the importance of concentrations.
3) Anyone for wine? Water into wine
How to do it:
A cup of «water» is poured into a glass and turns pink. Water into wine! This is then poured into a series of glasses and first turns colourless (lemonade); then it fizzes (7-Up lemonade); turns white and cloudy (milk), and finally the milk turns pink (indigestion mixture).
What is happening? Some questions to ask:
How can the various changes be explained? (The demonstration presupposes some knowledge of acid-base chemistry and indicators, and tests for common ions. These are often done in introductory chemistry classes, and thus this demonstration is an interesting way to revise this material.)
What could change water into wine and then back again?
51 Using demonstrations to stimulate inquiry and students’ thinking
experimental
Intercanvi / Treball
The yellow solution is an iron(III) salt, which will be acidic. On adding a base, a yellow/red precipitate of iron(III) hydroxide is formed. Iron is a transition metal and forms coloured complexes and compounds
(The characteristic colour of phenolphthalein should suggest that the initial «water» is a dilute alkali and the first cup contains phenolphthalein.)
To remove the colour we need an acid, so the second glass contains a small amount of a more concentrated acid than the original alkali.
What causes the fizzing to produce «lemonade»? What fizzes with an acid? (It could be a carbonate or hydrogencarbonate, as there is no smell.)
What causes the colour change to «milk» in the next glass? What could the white precipitate be? It must be something that reacts with the chemicals from the previous step. [White precipitates commonly covered in introductory chemistry classes include barium sulphate (test for sulphate ion) or silver nitrate (test for chloride ion). This would mean that the acid used in step 2 was either sulfuric acid or hydrochloric acid.] How could you check which it was?
In the final step, the white precipitate turns pink. What could cause this? (Since we know we have phenolphthalein present, the final glass must contain an alkali, enough to neutralise any remaining acid, thus restoring the basic colour of phenolphthalein. The white precipitate appears to turn pink.)
The idea is to try to get the students to work out the chemistry of the demonstration, and
then to try and replicate it themselves to check whether they were correct.
The explanation and set-up:
The original glass contains 1-2 cm3 0.1M NaOH(aq) diluted with water and the second class, a few drops of phenolphthalein, which turns pink in the alkali. The third glass contains a few drops of 1M sulfuric acid. This is concentrated enough to neutralise the alkali and change the phenolphthalein back to colourless. The fourth glass contains a small amount of solid sodium hydrogencarbonate or a few drops of sodium hydrogencarbonate concentrated solution. It fizzes as the solution is poured in, as the acid reacts with the hydrogencarbonate and liberates carbon dioxide. The fifth glass contains a few drops of barium nitrate or barium chloride solution. This forms a white precipitate of barium sulphate from the sulphate ions in the solution. The sixth glass turns pink, colouring the white precipitate. It contains a few drops of 1M sodium hydroxide, which neutralises any remaining acid and turns the solution alkaline and the phenolphthalein pink. The glasses appear empty to start with, as small volumes of liquid are used, which are hidden in the bottom of the glass.
There are many variations on this demonstration and it provides a good way to revise acidbase reactions and tests for common ions. You could extend it by asking students to devise their own series of colour changes using the chemistry they have covered in class.
4) Red blood or blue?
How to do it:
A spray bottle contains a yellowish solution. When sprayed on to a blank piece of paper, writing in a mixture of red and blue letters appear. Alternatively,
when poured into two «empty» glasses or beakers, one turns blood red and the other, dark blue.
What is happening? Some questions to ask:
How can one solution produce two totally different colours? (There must be something different on the paper or in the glasses to produce two different colours.) What sort of reaction could it be? (They could be acid-base reactions with two different indicators.) The yellow colour of the initial solution is a clue: what could this be due to? What tests could you do on this solution to check its identity? Acid or base? What happens if you add a base? (The intensity of the colours is another clue as they are much more intense than normal indicator colours.)
The explanation and set-up:
The yellow solution is an iron(III) salt, which will be acidic. On adding a base, a yellow/red precipitate of iron(III) hydroxide is formed. Iron is a transition metal and forms strongly coloured complexes and compounds. The first glass contains a small amount of thiocyanate ions (from potassium thiocyanate, KCNS, or ammonium thiocyanate, NH4CNS), which form an intense blood-red complex with iron(III) ions. The second glass contains a small amount of potassium ferrocyanide (K4[Fe(CN)6]), which forms a dark-blue precipitate (Prussian blue) with iron(III) ions. The invisible writing is made by painting the letters on paper or cloth using thiocyanate ions (red letters) or ferrocyanide (blue letters). This is a very colourful demonstration, which challenges students to think how one solution can produce two different colours.
Other colour changes are possible using iron(III) ions by
52 Educació Química EduQ número 19
forming different complexes or changing the pH, so that one solution can be changed into several different colours. Get your students to investigate some of the reactions of iron(III) ions, and then set up their own series of colour changes. This can be done in the same way as the «water to wine» demonstration above, using a series of «empty» glasses.
Density
Often density is taught in a very traditional way that emphasises the content —definition, equation, units, etc.—, and at the end students often do not understand the concept of density (which is a composite quantity of mass and volume). We need to start with concrete experiences and phenomena, which cause students to think and ask questions, and which eventually leads them to the concept of density
1) Two sorts of soft drink
How to do it:
Set up a large glass or plastic tank and fill nearly to the top with water. Put two cans of soft drink —a regular and diet version in the water (fig. 3). Get your students to observe what happens and suggest an explanation.
What is the difference between the two cans? (The regular drink sinks further down in the water than the diet drink, which floats higher up. There may only be a small differ ence in behaviour but one will be lower in the water than the other)
What has happened? Some questions to ask:
What is the difference between the two cans? (The regular drink sinks further down in the water than the diet drink, which floats higher up. There may only be a small difference in behaviour but one will be lower in the water than the other.) What is causing the difference? It is worth asking students the question: what is the same between the two cans and what is different? (They have the same shape and volume; they are made of the same material: aluminium. They have different labels, and if you read the labels, the students will find they have different compositions: the regular drink contains sugar and the diet drink, an artificial

sweetener.) Why would this make a difference to their behaviour in water? (A closer look at the label may reveal the mass of sugar and the suggestion that the cans don’t have the same mass. The students should then weight the two cans, after drying them.) What is observed? (The regular drink is heavier than the diet drink. So now we have a real physical difference: the volumes are the same, but the mass is different.) Why do some things sink in water and some things float? What property of an object makes it float?
The explanation: When the two cans are weighed, the regular drink is heavier than the diet drink. The volumes are the same, so the difference in mass (~ 11 g) means that they float differently. Does this work with other brands of drink? Would you expect it to work with 500 cm3 plastic bottles of the same brands? Students should make a prediction and then test them experimentally on different soft drinks and containers. The question is why do some things sink in water (stones, iron, concrete, rubber bungs) and other things float (wood, plastic, cork). Students should now investigate what floats and sinks and come up with ideas as to why materials have different properties. What is the property that makes one object sink and another float? It is something to do with size and volume: if the volumes are equal, heavier objects tend to sink. What is the relationship between the volume of an object and hence the volume and mass of water displaced, and the mass of the object? Students can find out experimentally (and not be told!) that things sink when their mass exceeds the mass of water displaced, and objects float when their mass is less than the mass of water displaced.
53 Using demonstrations to stimulate inquiry and students’ thinking
Figure 3. The experimental set-up.
Intercanvi / Treball experimental

Now get them to explain why a piece of iron (or concrete) sinks but a steel (or concrete) boat floats.
The blue bottle
How to do it:
A stoppered bottle has been prepared beforehand and is colourless (fig. 4). When shaken it slowly turns blue. The more it is shaken, the stronger the colour. When allowed to stand, the colour slowly disappears. The stronger the colour produced, the longer it takes for the colour to disappear. The bottle will continue to work many times over several hours. It can be prepared before a lesson or done on the spot.
What has happened? Some questions to ask:
Is this a chemical or a physical change? What might explain the observations? There is some sort of reversible reaction with a colour change. Is it due to putting in energy? If we used a magnetic stirrer bar to mix the liquid only, would it change colour? (There is a colour change which happens on shaking and when the air and liquid are mixed. The colour change and loss of colour are slow processes, suggesting slow reactions.) What might be causing the colour change? It
happens when the air and liquid are mixed. What is in the air that might be reactive? (Students often suggest it is due to CO2 in the air, so that it is an example of acid-base chemistry. However, there is very little CO2 in air and it would soon be used up.) How could you check this idea? (Flush out the air with CO2 and then see if it still works.) Nitrogen is unreactive, but air contains 20 % of oxygen gas, which is both reactive and an oxidising agent. Is the colour change due to oxygen in air reacting with a chemical in the solution? How could we test this idea? (We could flush out the air with a chemically inert gas, CO2 or N2, and see what happens or flush it with pure oxygen and see what effect it has.) How do we know it is something in the air? (Fill the flask to the top with water. Allow the blue colour produced to disappear. Why does it turn blue when we add water? Then shake and see if the blue colour is produced when there is no air present.) Why does the solution turn blue if we add more water carefully? Would it happen if the water was boiled first?
The explanation:
The 500 cm3 conical flask or bottle is set up beforehand by dissolving 5-10 g NaOH solid in ~ 200 cm3 water, and then adding an equal mass (5-10 g) of glucose. When both solids are dissolved, add a drop or two of methylene blue solution (in ethanol). The liquid will turn blue and eventually turn colourless. Do not add too much methylene blue or the colour will be too strong and take too long to disappear. The solution gradually turns yellowish after some time, but will still work. It can be used many times over several hours. If indigo carmine is used, a red colour is produced to give a red bottle.
All the evidence suggests that the colour change is due to mixing the air with the liquid. A chemical reaction occurs to produce a blue colour. On standing, a second reaction destroys the blue colour. Both reactions are quite slow. Adding water (which contains dissolved air) also produces a blue colour. Boiled water produces no colour change. The solution in the flask is an alkaline solution of glucose. Glucose is a reducing agent, and in alkaline solution can be oxidised by oxygen gas. Methylene blue is a redox indicator: it is blue in the presence of oxygen (oxidising) and colourless in a reducing solution. When the colourless solution is shaken, some of the air and oxygen dissolves in the water; the dissolved oxygen reacts with methylene blue turning it blue. When shaking is stopped, the glucose reacts slowly with the oxygen, and when the oxygen is used up, the solution goes colourless again. The reversible reaction can be done many times until either the oxygen is used up or the glucose is used up. It will get slower as the concentrations decrease (Campbell, 1963; Vandaveer and Mosher, 1997).
Is this a chemical or a physical change? What might explain the obser vations? There is some sort of reversible reac tion with a colour change. Is it due to putting in energy? If we used a magnetic stirrer bar to mix the liquid only, would it change colour? (There is a colour change which happens on shak ing and when the air and liquid are mixed)
54 Educació Química EduQ número 19
Figure 4. The blue bottle.

The disappearing water
How to do it:
Add water to a polystyrene cup and it appears to disappear (fig. 5). When turned upside down, the water does not run out. Where has it gone?
This can also be done as a version of the three card trick: water is poured into one of three identical polystyrene cups; they are then shuffled and the students asked to say which cup contains the water; they choose the right one, and when it is turned upside down, nothing comes out! They may try again, but still the water has disappeared.
What has happened? Some questions to ask:
Where has the water gone? What could cause it to «disappear»? Can the water really have vanished? How could you check that the water was still present? (Have a balance available to show that the mass of the cup still includes the water.)
The explanation:
When the students can look inside, they see a whitish solid instead of the water. One of the cups contained a small amount of sodium polyacrylate powder (as used in babies’ disposable nappies/diapers). When the water is added, it is slowly absorbed to form a solid gel. When the cup is turned upside down, the gel traps the water so that it doesn’t flow out. It is important to allow time for the water to be absorbed
and to use the right amounts of solid and water.
The water can’t have disappeared. If the cup was weighed before and after, it is clear the water is still there. The water must have been turned into a form where it cannot run out or perhaps the cup has a secret bottom? If you do this again with a glass beaker, then the students can see what is happening. When sodium polyacrylate is used in nappies/diapers, the liquid doesn’t disappear: it is trapped in the gel in a solid form.
Polar and non-polar liquids
How to do it:
Set up two burettes, one with water and one with a colourless non-polar liquid (e.g. hexane).
Charge a plastic pen or comb with static electricity (by rubbing on dry hair or a jumper). Adjust the taps to get a steady stream of liquid running into a beaker (fig. 6). Observe what happens to the two streams of liquid. Do they behave in the same way? In one case, the jet of liquid is deflected: is it repelled or attracted to the comb? In the other case, the stream of liquid is unaffected. If the students carefully smell the two liquids, one smells organic and the other doesn’t. (It can be revealed that one is water and the other, an alkane or oil.)

What is the difference between these two liquids that explains the behaviour? Is the difference between organic liquids and other liquids? What other organic liquids could be tested? (The students could suggest an alcohol like ethanol or acetone.) Do these behave like water or like the hexane?
there a difference? (The comb or pen will also pick up small pieces of paper.) What has happened to the pen or comb? (It has picked up a static charge.) Why is one liquid affected and the other not? Why is the water stream deflected but the other stream is not? Is it because water is not an organic substance? (If ethanol or acetone is used in one burette, then there is a similar but smaller deflection to that observed with water.) So it’s not just organic liquids. What’s the difference between water and ethanol, and hexane that would cause the difference in behaviour? Does the same effect happen if a magnet is used?
The explanation:
What is the difference between these two liquids that explains the behaviour? Is the difference between organic liquids and other liquids? What other organic liquids could be tested? (The students could suggest an alcohol like ethanol or acetone.) Do these behave like water or like the hexane?
This is an example of electrostatics and solvent polarity.
What has happened? Some questions to ask:
What effect does it have on the two streams of liquid? Why is
The electrically charged pen or comb attracts the molecules in the polar liquid (water), but not the non-polar liquid (hexane). If
55 Using demonstrations to stimulate inquiry and students’ thinking
Figure 6. The experimental set-up.
Figure 5. The experimental set-up.
Intercanvi / Treball experimental
ethanol or acetone are tried, the stream of liquid is also deflected (but not as much as water), because these are both polar liquids. The liquids are polar because they contain polar molecules (with positive and negative ends), which are attracted to the charge on the comb. A magnet does not cause a deflection, because the liquids are not magnetic.
This is a good way to introduce the topic of polarity in molecules. Why are acetone and ethanol polar but hexane is not?
The burning steel wool
How to do it:
First take two lumps of steel (iron) wool, open one up so it the wires are separated and squash the other piece into a tight ball. Show that if you use a Bunsen flame or a gas lighter, one of them will glow and catch fire and continue burning by itself, and the other will glow but then go out (fig. 7).
What is happening? Can a metal burn like wood? Is this a chemical or physical change? How could you tell?
The same demonstration is done again, but this time the terminals of a 9V battery are touched to the two samples of steel wool: one open and loose and the other tightly packed. The same behaviour is observed. The loosely packed steel wool glows and catches fire and continues to burn; the tightly packed one does not continue to glow after the battery is removed.
What has happened? Some questions to ask:
Why does the iron wire glow and spark in air? (The iron wire glows and sparks as it burns in air and the iron is oxidised with the evolution of heat. It continues to burn when the heat or battery is removed because the heat of reaction is enough to keep it
Why
does the wire change colour in the process? (The steel wire changes colour as it is oxidised and increases in mass as it goes from Fe to Fe2O3. The same reaction hap pens whether it is initiat ed with a flame or a battery)
going.) Is it a chemical or a physical process? (The steel wool changes colour, there is a heat change and the mass increases.) If it is a chemical change, would you expect the mass to increase, decrease or stay the same? (Many students think that if things burn, they lose weight. When a metal oxidise, it combines with oxygen and increases in mass. This should be confirmed experimentally: the same reaction can be done on a top-pan balance using a white tile to protect the balance. As the wire burns, its mass is seen to increase. The students should be asked to explain this.)
Why does the wire change colour in the process? (The steel wire changes colour as it is oxidised and increases in mass as it goes from Fe to Fe2O3. The same reaction happens whether it is initiated with a flame or a battery.) Why does the wire behave differently if it is loosely packed or in a tight ball? How can a battery set iron wire on fire?
The explanation:
Why does a battery set the iron on fire? Iron wire is a good conductor of electricity, and when it shorts the battery terminals, a large current flows, which heats up the wire, and the heat produced is enough to raise the temperature so that the iron starts burning and reacting with the oxygen in the air. The same reaction happens if the wire is
heated in a Bunsen flame. The loose wire continues to burn, unlike the compacted wire, because the surface area is increased and the air can penetrate to keep the reaction going. The heat generated by the reaction is enough to keep the reaction going, but it needs the heat from the flame or from the electrical heating to start the reaction.

Conclusion
I hope that this short article has shown how demonstrations can be used to stimulate questioning and initiate the inquiry process. You can probably think of other ways of using the same demonstrations described here and other questions to be asked. The important idea is for you, the teacher, to get into the habit of asking questions to get your students thinking. Catching the students’ attention with an unexpected or discrepant event is the first stage of inquiry: engagement. In a classroom or laboratory, the demonstration is not an end in itself but the starting point for inquiry and student involvement. There are many more ideas available in books and on-line for suitable science demonstrations which can be used to stimulate students’ thinking and inquiry.
56 Educació Química EduQ número 19
Figure 7. The burning steel wool.
The approach described here was used in the Tempus SALiS project (Childs and Hayes, 2012; http://www.salislab.org) and is also being used in the new EU TEMI project, and I am one of the University of Limerick’s TEMI project team (Broggy et al., 2014). TEMI is a new FP7 project in IBSE, «Teaching Enquiry with Mysteries Incorporated» (TEMI), which is due to run from 2013 to 2016 (http://cordis.europa.eu/projects/ rcn/108650_en.html). The aim of TEMI is to encourage teachers to use inquiry in science teaching by using a scientific mystery or discrepant event to engage students. This is then used to initiate enquiry in the classroom using the 5E model. Several cohorts of teachers in each partner’s country will be trained to use mysteries or discrepant events to initiate inquiry in their own schools. One of the outcomes of the project will be a bank of tested activities for the engagement phase of science inquiry lessons.
I hope that this short article has given you some ideas for introducing demonstrations into your own classroom as a prelude to inquiry. If you can catch your student’s attention and spark their curiosity, then half the battle is won. By asking questions, you can challenge them to observe carefully and think about what they see, and come up with their own explanations and suggestions for further work to test their ideas. The lesson can then proceed to investigate the topic and eventually come up with proper scientific explanations, for things that may have seemed at the beginning to be just magic. Using demonstrations in the way I suggest above starts by putting the «magic» back into science, so that the students become engaged and take on the personal
I hope that this short article has shown how demonstrations can be used to stimulate ques tioning and initiate the inquiry process. You can probably think of other ways of using the same demonstrations describ ed here and other ques tions to be asked. The important idea is for you, the teacher, to get into the habit of asking questions to get your students thinking
challenge of explaining the magic in scientific terms.
Many demonstrations are available on-line (e.g. on YouTube), and these can be used instead of live demonstrations to initiate inquiry. The lecture covered more topics and can be seen on-line.
References
broGGy, J.; ChilDs, P. E.; mCCormaCK, O.; mCmanus, B.; o’DWyer, A. (2014). TEMI: Teaching Enquiry with Mysteries Incorporated: An Insight from Ireland. Proceedings, 3rd New Perspectives in Science Education. Florence, March 2014 [on-line]. Florence: Libreria Universitaria. <http://confer ence.pixel-online.net/NPSE/ conferenceproceedings. php> [Accessed: 22 May 2014].
bybee, R.; Taylor, J. A.; GarDner, A.; sCoTTer, P. van; Carlson, J.; WesTbrooK, A.; lanDes, N. (2006). The BSCS 5E Instructional Model: Origins and Effectiveness. Colorado Springs: BSCS. Campbell, J. A. (1963). «Kinetics: Early and Often». J. Chem. Educ., vol. 40, No. 11, p. 578.
ChilDs, P. E.; hayes, S. (2012). «Using Science Demonstra-
tions to Develop Thinking and Inquiry Skills». Chemistry in Action!, No. 97, p. 28-32.
KaTz, D. (2005). The Art of Effective Demonstrations [on-line].
Tucson: D. Katz ed. <http:// www.chymist.com/Effec tive%20demonstrations.pdf> [Accessed: 22 May 2014].
liem, T. L. (1990). Invitations to Science Inquiry. Chino Hills: Science Inquiry Enterprise. o’brien, T. (2010). Brain-Powered Science: Teaching and Learning with Discrepant Events. Arling ton: NSTA Press.
vanDaveer, W. R.; mosher, M. (1997). «The blue bottle revisited». J. Chem. Educ., vol. 74, No. 4, p. 402.
WesTaWay, F. W. (1929). Science Teaching. London; Glasgow: Blackie & Son Ltd. WriGhT, E. L. (2014). Motivate the unmotivated with discrepant events [on-line]. <http://go.hrw. com/resources/go_sc/gen/ HSTPR060.PDF> [Accessed: 22 May 2014].

Peter E. Childs
Retired in 2009 from lecturing in chemistry at the University of Limerick and is Emeritus Senior Lecturer in the Department of Chemical and Life Sciences, having taught at university level since 1970. He currently directs the Chemistry Education Research Group and is Associate Director of the National Centre for Excellence in Mathematics and Science Teaching and Learning. He has produced the magazine Chemistry in Action! for Irish chemistry teachers since 1980.
E-mail: Peter.childs@ul.ie
57 Using demonstrations to stimulate inquiry and students’ thinking
Intercanvi / Treball experimental
Els residus en un laboratori de secundària. Les 3 R + S de salut
The waste in a lab of secondary school. 3 R & S of health
Sílvia Careta, Aina Solà i Miquel Erra /
INS Antoni Pous i Argila, Manlleu
resum

Curs rere curs, es pot anar acumulant en els laboratoris de secundària una varietat de reactius amb un grau de toxicitat alt o mitjà que són un risc per a la nostra salut. Aquests reactius generen alhora residus d’alt cost de tractament i, algunes vegades, no es recullen adequadament i van a l’aigüera. Substituir aquests reactius sense deixar de fer treball pràctic, treballar a microescala, utilitzar reactius de la gamma química verda, minimitzar residus i recollir-los adequadament són protocols que cal aplicar.
paraules clau
Microescala, organohalogenats, metalls pesants, química verda, minimització de residus, recollida de residus.
abstract
Day after day, there can be an accumulation of quite lot reagents in the secondary school labs. These reagents can have a mid or high toxic level and are a hazard to our health. These reagents also generate wastes that are high in cost to treat. Sometimes, they are not collected properly and end up in the drain. Replacing these reagents while still doing experiments, working at a micro scale, using green reagents, minimizing wastes and collecting them properly are protocols that should be followed.
keywords
Micro scale, organohalogenates, heavy metals, green chemistry, minimizing wastes, waste collection.
Introducció
Als laboratoris de secundària, treballem centrant-nos en el que es coneix com a bones pràctiques del laboratori, amb l’objectiu principal de garantir el sanejament de l’ambient de treball, minimitzar al màxim els residus tòxics i d’elevada perillositat i aconseguir que l’alumnat treballi en unes condicions bones i que, alhora, pugui fer el treball pràctic necessari minimitzant els riscos.
Amb això també es pretén conscienciar els alumnes sobre la importància que té treballar de manera correcta i sostenible per tal que, si en el futur treballen en un laboratori o en una empresa del sector, actuïn de manera
adient pel que fa al tractament de residus, la utilització de productes i materials i sàpiguen valorar quina quantitat de mostra és necessària per portar a terme un treball experimental, especialment en cas que l’objectiu del treball pràctic sigui qualitatiu
La generació de residus de laboratori en centres de secundària és un problema difícil de resoldre, a causa de la gran varietat d’aquests i de la potencial perillosi tat en cas de no procedir de manera adequada
i es pugui obtenir treballant a petita escala.
També és important que els alumnes valorin la importància que tenen totes aquestes accions que porten a terme al laboratori, com ara estar alerta del que no es pot llençar a l’aigüera o del que ha de ser abocat en algun tipus de contenidor. Aquestes accions són molt importants per a l’educació ambiental dels alumnes.
La generació de residus de laboratori en centres de secundària és un problema difícil de resoldre, a causa de la gran varietat d’aquests i de la potencial perillositat en cas de no procedir de manera adequada. Això esdevé especialment compli-
ISSN 2013-1755, SCQ-IEC Educació Química EduQ número 19 (2014), p. 58-62 DOI: 10.2436/20.2003.02.145 http://scq.iec.cat/scq/index.html 58
cat quan els alumnes són dels primers cursos de l’ESO, a causa de la seva inexperiència. Per aquest motiu, encara és més important la seva educació en aquests aspectes i tenir en tot moment consciència del que manipulen i dels riscos potencials.
Tanmateix, al llarg de la nostra tasca docent, passem moltes hores en laboratoris sovint no gaire ben equipats des del punt de vista de la seguretat, i per aquest motiu és necessari dedicar esforços a millorar l’organització i la seguretat dels nostres procediments.
Als laboratoris de química i de biologia del nostre centre, hem implantat un programa amb l’objectiu de minimitzar exposicions i riscos innecessaris, portat a terme en quatre etapes que es descriuen a continuació.
Primera etapa. Selecció de productes i material
Considerem que aquesta és la fase més important. Hem prescindit de les substàncies més perilloses, com els compostos organohalogenats; aromàtics (benzè i derivats), que tenen efectes cancerígens demostrats; el mercuri i les seves sals; cianurs i derivats; sulfurs, etc., i s’està duent a terme una restricció progressiva de compostos de metalls pesants.
Al centre ja no s’utilitza cap termòmetre de mercuri, d’acord amb el compromís de la Directiva europea 2007/51/CE, que modifica la Directiva europea 76/769/CEE, en què es prohibeix la comercialització de mercuri en termòmetres i altres aparells de mesura destinats a la venda al públic general, com ara manòmetres i baròmetres. Aquesta directiva, aprovada seguint indicacions de l’OMS, fa ressaltar que l’exposició al mercuri, fins i tot en petites quantitats, pot causar greus problemes de salut i és molt
perillosa per al desenvolupament intrauterí i en les primeres etapes de la vida. El mercuri pot ser tòxic per als sistemes nerviós i immunitari, l’aparell digestiu, la pell, els pulmons, els ronyons i els ulls1 (El mercuri i la salut, 2013).
Els termòmetres, com tot el material de vidre, sempre s’acaben trencant i, si són de mercuri, hi ha un risc de toxicitat afegit. Els seus vapors són tòxics i costa de recollir-ne completament les gotes, encara que s’inertitzi fent una pasta, tal com indiquen els protocols. Resolem aquest problema utilitzant termòmetres d’alcohol, vermells o blaus (fig. 1). No són tan precisos, però l’error que mesurem no afecta la metodologia usada ni l’aprenentatge adquirit pels alumnes (vegeu l’apartat de normativa al final de l’article).
Actualment, trobem al mercat termòmetres digitals prou assequibles econòmicament i que permeten fer lectures més precises.
Segona etapa. Minimització de residus
Una de les estratègies que portem a terme al centre, ja que estem convençuts que és el més
1. L’OMS considera que el mercuri és un dels deu productes o grups de productes químics que generen problemes greus de salut pública, i la principal via d’exposició humana és el consum de peix i marisc contaminat amb metilmercuri, que és la seva forma més tòxica. El metilmercuri es forma a partir del mercuri inorgànic per l’acció de microorganismes anaerobis que viuen en sistemes aquàtics, des de llacs fins a l’oceà, a través del procés de la metilació
A cada esglaó de la cadena alimentària, la concentració de metilmercuri s’incrementa en els organismes, i en els depredadors aquàtics és on es troba una concentració més elevada d’aquest compost. En realitat, el metilmercuri és el catió de monometilmercuri combinat amb anions d’altres elements.

important, és la reducció en origen. La majoria de les pràctiques de laboratori que realitzem són qualitatives, per això utilitzem solucions diluïdes i guardades en flascons comptagotes (fig. 2). Fem les reaccions en tubs o càpsules molt petites i dosificades gota a gota. D’aquesta manera, el consum de reactius és mínim, generem menys residus i la despesa econòmica és menor.

en flascons comptagotes de petita capacitat.
Tercera etapa. Classificació de residus
Si es tenen en compte les dues etapes anteriors, la recollida dels residus generats queda molt simplificada. Els recipients on es recullen els residus s’etiqueten de manera convenient tenint en compte orientacions i normatives que es poden consultar al final d’aquest article. Al centre es
Actualment, trobem al mercat termòmetres digitals prou assequibles econòmicament i que permeten fer lectures més precises
59
residus en un laboratori de secundària. Les 3 R + S de salut
Els
Figura 1. Termòmetres d’alcohol.
Figura 2. Solucions
experimental
Intercanvi
/ Treball
gestiona de manera que es diferencien les tipologies que s’esmenten a continuació:
— Solucions aquoses de substàncies que contenen elements dels grups I i II de la taula periòdica. També solucions d’àcids i bases febles o diluïdes. Si són solucions d’àcids o bases forts i/o concentrats, es neutralitzem prèviament.
— Metalls pesants. Solucions de substàncies que contenen ions que no pertanyen ni al grup I ni al II de la taula periòdica. En aquest recipient també aboquem les sals de bari.
— Dissolvents. Un cop feta la selecció detallada a la primera etapa, els dissolvents utilitzats no presenten una toxicitat greu; són majoritàriament alcohols i alcans que es poden recollir tots junts.
— Al costat de la balança hem situat un recipient petit per recollir els excessos de les pesades. També tenim altres recipients per recollir materials que no són considerats residus químics, com ara els següents:
a) Sòlids inerts: porcellana, ceràmics, metàl·lics, plàstics i polímers en general. Per a qualsevol reactiu sòlid, no utilitzem mai una paperera.
b) Paper i cartró per reciclar. En un espai al costat del laboratori, hi ha situat aquest tipus de contenidor.
c) Vidre. Es recull tot el material de vidre malmès.
Quarta etapa. Gestió de residus
Ens organitzem de manera que recollim els residus en garrafes ben etiquetades i les lliurem a un gestor de residus, que ve a recollir-les al centre dos cops l’any per portar-les a la deixalleria municipal. S’emporta els recipients de les solucions aquoses, els metalls pesants i els dissolvents. Els altres residus segueixen el mateix procés que qualsevol residu domèstic.
Planificació de treballs pràctics alternatius
Hem planificat els treballs pràctics que considerem que són més rellevants per a l’aprenentatge dels alumnes. Com que els laboratoris escolars no són centres d’investigació ni de control, és evident que no cal disposar de reactius específics d’un cert grau de toxicitat. Tot i així, la nostra planificació de treball experimental no suposa deixar de fer cap treball pràctic que considerem representatiu i necessari. Tot seguit, se citen i es comenten breument alguns exemples de treballs pràctics que exemplifiquen alguna millora pel que fa als reactius que s’utilitzen i/o a les quantitats de reactius utilitzades.
Reaccions gota a gota
Per dur a terme aquestes reaccions, utilitzem solucions diluïdes i en flascons comptagotes. Utilitzem plantilles reutilitzables (protegides dins un arxivador de plàstic), que són molt útils per a reaccions qualitatives entre cations i anions, indicadors de pH, etc. (fig. 3). Així es fan les reaccions de precipitació. A més, hem eliminat les sals de metalls
Per dur a terme aques tes reaccions, utilitzem solucions diluïdes i en flascons comptagotes. Utilitzem plantilles reuti litzables (protegides dins un arxivador de plàstic)
pesants com el plom, el cadmi, etc., que se solien utilitzar habitualment, i ara utilitzem sals de calci i de magnesi. L’objectiu és minimitzar quantitats (i, per tant, residus i riscos) i substituir els reactius amb toxicitat.
Determinació del punt de fusió Utilitzem parafina, en lloc de paradiclorobenzè, en la determinació del punt de fusió. La parafina comercial té un punt de fusió entre 47 i 64 ºC, temperatures molt adequades per treballar al bany maria. Ja tenim tubs de Buscarons preparats i sempre s’utilitzen els mateixos. Un cop fosa, es deixa solidificar lentament a temperatura ambient amb el tub en una gradeta i es mesuren les temperatures en funció del temps (fig. 4). L’objectiu és substituir un producte per un altre menys perillós.
60 Educació Química EduQ número 19
Figura 3. Reaccions gota a gota.



Coloracions a la flama
Sublimació
Es pot utilitzar iode en petites quantitats, en lloc d’àcid benzoic, per a la sublimació. Guardem el iode en un Erlenmeyer ben tapat i ens serveix per a diverses sessions (fig. 5). En aquest cas, es confinen els productes per no ser alliberats a l’ambient i es reutilitzen una vegada i una altra.
Extracció
En la pràctica de l’extracció del iode (fig. 6) en aigua iodada, utilitzem ciclohexà o bé èter de petroli.2 Ambdós són bons dissolvents del iode, malgrat que siguin menys densos, i són molt menys tòxics que el tetraclorur de carboni, usat majoritàriament en les extraccions. L’objectiu és no utilitzar organoclorats, que s’empraven anteriorment en aquest tipus d’extraccions.
2. Malgrat el nom, l’èter de petroli és una mescla d’hidrocarburs, principalment n-pentà i 2-metilpentà.
En l’estudi del color d’un metall a la flama, solem utilitzar mostres sòlides de sals de metalls. L’ús de la mostra sòlida embruta molt el cremador, sempre cauen mostres sobre la taula i s’utilitza àcid clorhídric per netejar el filament (fig. 7).
Per evitar-ho, es preparen solucions saturades de les sals a analitzar i s’usa un sol filament per a cada mostra. No hi ha pèrdues de mostra, no s’embruta el cremador i evitem netejar el filament amb clorhídric.
Matèria orgànica
Per a la determinació de la matèria orgànica en aigües, en lloc de realitzar la demanda química d’oxigen amb dicromat, fem la determinació amb permanganat de potassi molt diluït (Erra i Gallach, 2000).
Conclusió i generalització
Els canvis que hem portat a terme han estat graduals i amb la implicació de tot el professorat del departament. Utilitzem reactius poc nocius, solucions diluïdes i petites dosis de reactius. Quant a solvents, usem alcohols
de cadena curta, acetona, ciclohexà i èter de petroli i prescindim totalment de l’ús del metanol.
Amb una mica d’imaginació i unes quantes proves prèvies, es troben alternatives. Sovint es tracta d’assajar gairebé el mateix protocol, però amb substàncies amb menys risc i reduint-ne les quantitats. L’ambient del laboratori és més segur i més net, perquè es minimitzen els reactius i, per tant, també els residus.
Per netejar les taules, utilitzem els fregalls típics d’una cuina i les eixuguem amb tovalloles. No utilitzem paper.
Per ambientar el laboratori, hi tenim plantes, com el potos, i també posem una mica de música de fons, que ens ajuda a treballar en un ambient més
61
Figura 6. Extracció del iode en dissolvent orgànic.
Figura 5. Sublimació del iode en un recipient tancat.
Figura 7. Coloracions a la flama.
Les 3
Els residus en un laboratori de secundària.
R + S de salut
Figura 4. Punt de fusió de la parafina.
/ Treball experimental
Intercanvi


acollidor. Però el més important és la màxima que apliquem (fig. 8) i que fa que els alumnes no llencin cap residu a l’aigüera. És un hàbit que ràpidament aprenen i que és la clau de la nostra gestió.
Referències i altres fonts 12 principles of green chemistry [en línia] (1998). Washington: American Chemical Society.

Sílvia Careta Burdó És professora d’ensenyament secundari al Departament de Física i Química de l’INS Antoni Pous i Argila de Manlleu. És llicenciada en química per la Universitat Rovira i Virgili i té el certificat d’aptitud pedagògica per la Universitat Autònoma de Barcelona. Ha treballat anteriorment en la indústria, en departaments de qualitat del sector de l’automoció i del cosmètic.
A/e: scareta@xtec.cat.
<http://dom.cat/alk> [Consulta: 30 setembre 2014].
DomèneCh anTúnez, X. Química verda. Barcelona: Rubes, 2005. El mercuri i la salut [en línia] (2013). Ginebra: OMS. <http://dom.cat/ ali> [Consulta: 30 setembre 2014].
erra i GallaCh, M. (2000). Anàlisi d’aigües [en línia]. Vic: Promefo, 2000. <http://dom.cat/alj> [Consulta: 30 setembre 2014].

Aina Solà i Rodrigo
És llicenciada en química per la Universitat Autònoma de Barcelona (UAB) i doctora en enginyeria química per la mateixa Universitat. Va cursar el postgrau de participació i desenvolupament sostenible a la UAB per poder aplicar els aprenentatges a l’exercici de la pràctica docent com a professora de física i química a secundària. És professora a l’INS Antoni Pous i Argila de Manlleu. A/e: ainasola@gmail.com.
Medi Ambient: Tecnologia i Cultura [en línia], núm. 48: Química verda (desembre 2011). <http:// dom.cat/ais> [Consulta: 30 setembre 2014].
Químics: àcids i solucions àcides [en línia] (s. a.). Barcelona: Generalitat de Catalunya. Departament d’Educació. <http:// educacio.gencat.cat/docu ments/PC/Seguretat/GestioRe sidus/3.pdf> [Consulta: 30 setembre 2014].
Reglament CLP: Classificació i etiquetatge de substàncies i mescles [en línia] (s. a.). Barcelona: Generalitat de Catalunya. Departament de Medi Ambient i Habitatge. <http://dom.cat/air> [Consulta: 30 setembre 2014].
Normativa estatal i europea Classificació, etiquetatge i envasat de substàncies: Reglament CE/1278/2008.
Llista de residus perillosos: Directiva 2000/532/CE.
Prohibició d’ús d’aparells amb mercuri: Directiva 2007/51/CE.
Substàncies químiques perilloses: Reial Decret 363/95.

Miquel Erra i Gallach
És llicenciat en químiques per la Universitat Autònoma de Barcelona, màster en medi atmosfèric per la Universitat Politècnica de Catalunya, professor a la Universitat Oberta de Catalunya i premi Plana de Vic 2000. És també autor de diversos manuals sobre la docència de la física i la química. És catedràtic en aquestes especialitats i actualment treballa a l’INS Antoni Pous i Argila de Manlleu. A/e: merra@xtec.cat.
62 Educació Química EduQ número 19
Figura 8. Aspecte del laboratori i rètol amb la màxima que tenim present
NORMES DE PUBLICACIÓ
Preparació dels manuscrits
Elsarticleshandeferreferènciaaqualsevoldelstemesde
lesseccionsdelarevistaperaqualsevolnivelld’ educació,des
deprimàriafinsal’ educacióuniversitàriaHandeserinèditsi
hand’ estarescritsencatalà,totiquetambéespublicaranarti-
clesencastellà,francès,portuguès,italiàianglès,sil’ autoriaés
depersonesdeforadel’àmbitdelallenguacatalana
Elstreballshandetenirunaextensiómàximade25000ca-
ràcterssenseespaisihandeserescritsambunespaiatd’1,5i
handetenirelnombredecaràctersambespaisespecificaten
cadascunadelesseccionsdelarevistaEltexthad’ estaren
formatMicrosoftWordilletraTimesNewRomandecos12
Laprimerapàginahadecontenireltítoldeltreball,elnomo
nomsdelsautorsielcentreocentresdetreball,unresumde
500caràcters(incloent-hiespais)icincparaulesclauEltítol,el
resumilesparaulesclauhand’ anarseguitsdelasevaversió
enanglèsCalenviartambél’ adreçapostaldelsautorsoladel
centredetreballperpoderenviar-loselnúmerodelarevistaen
quèhanparticipat
Elsarticleshand’ anaracompanyatsdefotografiesiimatges
encolorqueillustrinelcontingutdeltextL’ articlehauràde
contenirfotografiesencolordeltreballal’ aula,delsmuntatges
delsexperimentsoaltresfotografiesrelacionadesambelcon-
tingutTambéhandecontenirgràfics,esquemes,dibuixositre-
ballsoproduccionsdelsalumnesqueillustrinifacinmés
comprensibleelcontingutdeltextLesillustracionshande
portartítol(peud’imatge)icalindicaroncalsituar-lesdins
l’ articleLesfotografiesiimatgess 'hand' enviarenarxiussepa-
ratsenformattifojpeg(resoluciómínima:300píxels/pol-
zada)i,siestractadegràfics,enExceloCorelDraw
L’ articlehad’ estarestructuratendiferentsapartatsElsau-
torshandeseguirlesnormesrecomanadesperlaIUPACa
l’horad’ anomenarelscompostsquímicsiutilitzarelsistema
internacionald’ unitatsÉsconvenientelfetd’ assenyalar3o4
frasesd el ’ a r t i c l eq u ee sd e s t a c a ra na m bu n al l e t ram é s
g ra nid ec o l o re nl ’ a r t i c l em a q u e t a t
Lesreferènciesbibliogràfiqueshand’ anaralfinaldeltext,es-
critescomelsexemplessegüents:
Per a llibres:
VILCHES,A;GIL,D(2003) Construyamos un futuro sostenible: Diálogos de supervivencia Madrid:CambridgeUniversityPress
Citacióeneltext:(VichesiGil,1994)
Per a articles:
SARDÀ,A;SANMARTÍ,N(2000)«Ensenyaraargumentarcientífi-
cament:unreptedelesclassesdeciències» Enseñanza de las Ciencias,vol18,núm3,p405-422
Citacióeneltext:(SardàiSanmartí,2000)
Per a documents digitals (webs):
OCDE(2006) PISA 2006: Marco de la evaluación Conocimientos y habilidades en Ciencias, Matemáticas y Lectura [recurselectrònic]París:
OCDE<http://wwwoecdorg/dataoecd/59/2/39732471pdf>
[Consulta:11setembre2013]
Peraaltresexemples,consulteuunnúmerorecentdelare-
vista
Alfinaldel’ articlehadeconstarunabreuressenyaprofes-
sionaliunafotografiadelespersonesautoresdel’ articleCada
ressenyahadecontenirelnomicognoms,càrrec,centrede
treball,campprincipalenelqualdesenvolupalasevatascai
correuelectrònic(màximde400caràctersambespais)Calen-
viarelsarxiusdelesfotografiesdecarnetdelsautorsenformat
tifojpeg(resoluciómínima:300píxels/polzada)
Enviament d’articles
Elsarticleshandeserenviatspercorreuelectrònical’ adreça
següent: EduQ@iec cat
Revisió dels articles
E l sa r t i c l e ss e ra nrev i s a t sp e rt re se x p e r t sE l sa r t i c l e sre -
v i s a t sie nv i a t sa l sa u t o r sh a u ra nd es e rre t o r n a t sa l se d i -
t o r se ne lt e r m i n im à x i md e1 0d i e sS e m p req u es i g u i
p o s s i b l e,l e sp rove sd em a q u e t a c i ós e ra ne nv i a d e sa l sa u t o r s
a b a n sd el as evap u b l i c a c i ó
SECCIONS
ACTUALITZACIÓ DE CONTINGUTS
Articlesquereviseniposenaldiacontingutspropisdeladisciplinaoen relacióaa
ltresàmbitsdelconeixement,iquefacilitenipromouenun
ensenyamentactualitzatdelaquímica
APRENENTATGE DE CONCEPTES I MODELS
Articlesquetractensobreconceptesimodelsquímics,desdelpuntde
vistadelesconcepcionsalternativesdelsalumnesilesdificultatsd’ a-
prenentatgeconceptuals,aixícomlesestratègiesdidàctiquesperal’ ela-
boracióil’ aplicaciódelsmodelsquímicsal’ aula
CURRÍCULUM, PROJECTES I UNITATS
Presentacióianàlisidelscurrículumsdequímicadediferentspaïsos,de
projectescurricularsiunitatsiseqüènciesdidàctiques
DIVULGACIÓ DE LA QUÍMICA
Articlesquepresententemesd’ actualitatquímicaambcaràcterdivulga-
tiuiqueposendemanifestlesrelacionsdelaquímicaamblasocietati
altresàmbitsdelconeixementobépresentenactivitatsiexperiènciesde
cairedivulgadordelaquímicaadreçadesal’ alumnatoalpúblicenge-
neral
ESTRATÈGIES DIDÀCTIQUES
Presentacióianàlisid’ enfocamentsiestratègiesdidàctiquesperal’ ensenyamentil’ aprenentatgedelaquímica:modelització,indagació,resolu-
ciódeproblemes,treballcooperatiu,avaluació,etc
FORMACIÓ DEL PROFESSORAT
Propostesiinvestigacionssobrelaformacióinicialienactiudelprofes-
soratdequímicaiciènciesengeneralquecontribueixinalseudesenvo-
lupamentprofessional
HISTÒRIA I NATURALESA DE LA QUÍMICA
Articlessobrelahistòriailanaturalesadelaquímicaisobrel’interèsdi-
dàcticd’ aquestesdisciplinesenl’ ensenyamentdelaquímicaActivitats
pertreballaraspectesdelanaturalesadelaciència
INNOVACIÓ A L’AULA
Articlesquedescriuenlaplanificacióil’ experimentacióal’ aulad’ expe-
riènciesdidàctiquesdecaràcterinnovadorLasecciópreténserunespai
percompartirexperiènciesd’ aula
LLENGUATGE, TERMINOLOGIA I COMUNICACIÓ
Articlesrelacionatsambl’ aprenentatgedeleshabilitatscomunicatives
(llegir,escriureiparlar)enrelacióambl’ aprenentatgedelaquímicaI
tambésobreelllenguatgeilaterminologiacientífics
NOVES TECNOLOGIES
Articlesrelacionatsamblautilitzaciódelesnovestecnologiesenl’ ensenyamentdelaquímica:simulacions,úsd’Internet,mitjansaudiovisuals,
laboratorisvirtuals,experiènciesambequipsdecaptaciódedades,etc
QUÍMICA EN CONTEXT
Articlesquepresentencontextosrellevants–delavidaquotidiana,tec-
nològics,industrials,socials,mediambientals,desalutoculturals–que
puguinserpresoscomapuntdepartidaperaunensenyamentdela
químicaencontextiperpromourel’ alfabetitzaciócientífica
QUÍMICA, EDUCACIÓ AMBIENTAL I SOSTENIBILITAT
Articlesquefacinpalesal’ estretaderelacióentrelaquímicaielsaspec-
tesdelmediambient,itemàtiquesmediambientalsd’ actualitatdes
d’ unavessantquímica,aixícomproposteseducativesperalasostenibi-
litat
RECERCA EN DIDÀCTICA DE LA QUÍMICA
Articlesquedifonguininvestigacionsdidàctiquesd’ utilitatperalami-
lloradel’ ensenyamentdelaquímicaDescripcióiresultatsd’ experièn-
ciesdidàctiquesquehaginestatavaluadesdeformaqualitativao
quantitativa
RECURSOS DIDÀCTICS
Articlesquepresentinqualsevoltipusderecursimaterialdidàcticpera
l’ ensenyamentdelaquímicaPodenincloure,entred’ altres,audiovisu-
als,jocs,visites,textosdelsmitjansdecomunicació,etc
TREBALL EXPERIMENTAL
Articlessobrediferentstipusdetreballspràcticsexperimentals:demos-
tracions,experiènciesinterpretatives,aprenentatgedetècniques,inves-
tigacions,etc
TREBALLS DE RECERCA DELS ALUMNES
Articlesdescriptiusdetreballsderecercadelsalumnesdinsl’àmbitde
laquímicaEnaquestasecció,elsalumnessónelsautènticsprotagonis-
tes
Properes monografies
Química en context
Enllaç i estructura
Química a la xarxa








 Fina Guitart i Aureli Caamaño Editors d’Educació Química EduQ
Mercè Izquierdo i Claudi Mans Coordinadors del monogràfic
Fina Guitart i Aureli Caamaño Editors d’Educació Química EduQ
Mercè Izquierdo i Claudi Mans Coordinadors del monogràfic


























































