Myeloma Today
Une publication de l’International Myeloma Foundation TECVAYLI
premiers
Les Lymphocyte T



bispécifiques
Cette édition de Myeloma Today a été cofinancée par Amgen

Une publication de l’International Myeloma Foundation TECVAYLI
premiers
Les Lymphocyte T



bispécifiques
Cette édition de Myeloma Today a été cofinancée par Amgen




Le 25 octobre 2022, la Food and Drug Administration (FDA, le Secrétariat des États-Unis aux produits alimentaires et pharmaceutiques) a accordé une autorisation accélérée au médicament teclistamab (Tecvayli™) pour les patients présentant un myélome récidivant ou réfractaire et ayant déjà reçu quatre lignes de traitement antérieures ou plus, parmi lesquelles un inhibiteur du protéasome, un immunomodulateur et un anticorps monoclonal anti-CD38. Le teclistamab est le premier anticorps bispécifique mobilisateur de lymphocytes T CD3 visant l’antigène de maturation des lymphocytes B (BCMA).
Le terme « bispécifique » signifie que le médicament possède deux « bras ». Un bras se fixe sur la cellule myélomateuse par le biais du BCMA sur la surface de la cellule myélomateuse. L’autre bras se fixe sur et active un lymphocyte T local afin qu’il détruise la cellule myélomateuse. Il s’agit d’une méthode remarquable se servant du propre système immunitaire d’un patient pour combattre son myélome. Le teclistamab est une forme très avancée d’immunothérapie.
La plupart des médicaments utilisés pour traiter le myélome –dans un cadre clinique et non pas dans les essais cliniques –ont présenté des taux de réponse chez les patients ayant déjà été lourdement traités d’environ 25 à 30 %. Le teclistamab, qui a été étudié chez les patients atteints d’un myélome récidivant très avancé, a obtenu un taux de réponse globale (TRG) de 61,8 %. Ce résultat impressionnant le rend très intéressant pour nos patients.
Le teclistamab a été évalué au cours de l’essai clinique multicentrique MajesTEC-1. La population d’efficacité comprenait 110 patients atteints de myélome ayant déjà reçu au moins 3 traitements antérieurs, y compris un inhibiteur du protéasome, un immunomodulateur et un anticorps monoclonal anti-CD38, mais n’ayant encore jamais reçu de traitement ciblant le BCMA. Comme indiqué plus haut, le TRG a été de 61,8 %. Avec un suivi médian de 7,4 mois pour les patients ayant répondu au traitement, le pourcentage estimé de la durée de la réponse (DR) était de 90,6 % à 6 mois et de 66,5 % à 9 mois.
Le teclistamab est un médicament « standard ». Il peut être administré directement à un patient, à la différence du processus de la thérapie par lymphocytes T-CAR qui nécessite un prélèvement des lymphocytes T du patient au préalable.

La caractéristique standard du teclistamab peut permettre une utilisation plus large de ce médicament, notamment pour les patients qui n’ont pas accès à un centre de thérapie par lymphocytes T-CAR.
Cependant, comme pour tous les médicaments contre le myélome, il existe un certain nombre de défis et de risques. Pour recevoir leurs premières doses de teclistamab, la plupart des patients devront d’abord rester à l’hôpital pendant 2 semaines environ. En effet, le médicament peut provoquer une réaction appelée syndrome de libération de cytokines (SLC) au cours de laquelle le corps répond au processus d’activation des lymphocytes T. Pour la plupart des patients, le SLC est léger, mais certains patients nécessiteront une prise en charge plus intensive dans le cadre hospitalier.
D’autres effets secondaires notables peuvent inclure des toxicités neurologiques et des numérations globulaires basses. Il est également important de noter qu’un traitement en cours avec un anticorps bispécifique accroît le risque d’infection, il est donc essentiel de surveiller et de traiter rapidement les infections. Après l’administration des premières doses de teclistamab, le traitement peut être poursuivi en ambulatoire. Tous les centres de traitement qui administrent le teclistamab doivent adhérer à un programme de stratégie d’évaluation et d’atténuation des risques (REMS) qui surveille les risques des traitements.
Les patients atteints de myélome et leurs médecins disposent maintenant d’une nouvelle option de traitement importante. Le taux de réponse très élevé obtenu avec le teclistamab peut bénéficier à de nombreux patients de manière unique et durable. Et ce n’est pas fini ! D’autres traitements contre le myélome avec des anticorps spécifiques sont en cours de développement – certains visent une cible différente sur la cellule myélomateuse – et chaque nouveau médicament
Nous vivons une période passionnante dans le domaine du myélome : de nombreux nouveaux traitements sont en cours de développement, de nouvelles combinaisons de médicaments sont utilisées pour la thérapie initiale, de nouvelles techniques d’imagerie et de diagnostic sont disponibles, et bien plus encore ! Mais, on oublie souvent l’augmentation des options pour la maladie en rechute précoce. Une rechute « précoce » est, en général, le traitement qu’une personne reçoit quand elle a déjà reçu 1 à 3 lignes de traitement antérieures. Elle s’oppose à la rechute « tardive », qui s’applique quand les patients ont été traités avec la plupart des options disponibles.
Je souhaitais mettre en avant cette portion du parcours des patients atteints de myélome, en partie parce qu’il existe maintenant plus d’options de traitement que jamais. En effet, il n’y a pas moins de CINQ essais cliniques de phase III de trithérapies récemment publiés et maintenant disponibles. L’autre raison est que je voudrais souligner un changement important dans notre approche du myélome : nous ne gardons plus « le meilleur pour la fin », mais nous utilisons l’approche la plus efficace pour chaque patient à un stade plus précoce de la maladie, y compris au cours de la thérapie initiale, car nous savons que cela aura un impact plus important sur la survie du patient sur le long terme.
Lorsque le myélome récidive, il devient plus difficile à contrôler, alors nous cherchons de plus en plus à offrir des rémissions plus longues aux patients avec des polythérapies efficaces à un stade précoce. C’est un sujet de discussion essentiel car il peut être complexe de choisir quand le menu des options s’élargit. Bien entendu, c’est une chance que nous faisions face à ce problème, car, il y a peu, il existait trop peu d’options disponibles pour contrôler cette horrible maladie. Alors quels sont ces choix formidables ? Voici les cinq essais cliniques clés qui ont façonné le traitement de la rechute précoce :
Cet essai clinique du Sarclisa® (isatuximab), un anticorps monoclonal ciblant CD38, en association avec Kyprolis® (carfilzomib) et le stéroïde dexaméthasone (Isa-Kd) est important car il offre la survie sans progression (SSP) la plus longue qui ait été observée dans le cadre de la rechute précoce : 35,7 mois, selon une annonce récente. Il est remarquable de parvenir à obtenir une moyenne de 3 ans de SSP avec un myélome récidivant. Ce traitement nécessite cependant des visites plus fréquentes à l’hôpital, car le Sarclisa est administré toutes les deux semaines après le premier mois (au cours duquel il est administré toutes les semaines). Le Sarclisa est
toujours administré en intraveineuse, même si, après les deux premières perfusions, il n’est administré que pendant 75 minutes. Au cours de l’étude IKEMA, il a été démontré que la combinaison Isa-Kd est supérieure à Kd seule.
La combinaison récemment autorisée Darzalex® (daratumumab) + Pomalyst® (pomalidomide) + dexaméthasone (DPd) a été étudiée de manière approfondie. Elle est intéressante parce que Darzalex Faspro® peut être administré sous la forme d’une courte injection sous-cutanée (sous la peau), à la différence de la manière dont Darzalex était administré auparavant, sous la forme d’une longue perfusion intraveineuse. Cet avantage, associé au Pomalyst administré par voie orale, rend la DPd bien plus pratique. Il a été démontré que DPd est supérieure à Pd seule.
Cette combinaison unique intègre le médicament oral Xpovio® (sélinexor), précédemment administré dans des lignes de traitement plus tardives, mais maintenant disponible à un stade plus précoce de la maladie. Administré toutes les semaines, au lieu de deux fois par semaine, Xpovio est beaucoup plus facile à tolérer, surtout quand il est administré en association avec deux antiémétiques, car ce médicament est connu pour provoquer des nausées importantes. Xpovio, un inhibiteur du transport nucléaire, possède un nouveau mécanisme d’action qui empêche les bons suppresseurs de tumeur de quitter le noyau cellulaire. Cette combinaison utilise également Velcade® (bortézomib) en sous-cutané selon un schéma hebdomadaire, ainsi que la dexaméthasone (XVd). Il a été démontré que la combinaison XVd est supérieure à Vd seule.
Même si la combinaison Darzalex + Kyprolis + dexaméthasone (DKd) est disponible depuis quelques années, elle reste une option importante. Même si l’étude CANDOR utilisait Kyprolis deux fois par semaine, il est maintenant couramment utilisé selon un schéma hebdomadaire (trois semaines de traitement, une semaine sans traitement) et l’autorisation du protocole DKd permet une posologie deux fois par semaine ou une fois par semaine. DKd est souvent utilisée quand Darzalex n’a pas été utilisé en thérapie initiale. Il été démontré que la trithérapie DKd est supérieure à Kd seule.
Le protocole Sarclisa + Pomalyst + dexaméthasone est disponible depuis quelques années, mais il reste une option importante en cas de rechute précoce. Le suivi sur le long terme de l’étude ICARIA a été présenté lors du congrès annuel
Dr Cohen, veuillez nous parler de la thérapie par lymphocytes T-CAR et de la manière dont elle est utilisée dans le cadre du myélome.
La thérapie par lymphocytes T-CAR (récepteur antigénique chimérique) est une nouvelle approche d’utilisation du propre système immunitaire du patient pour attaquer son myélome. La thérapie par lymphocytes T-CAR est une approche de traitement du myélome très ciblée et personnalisée. L’un de ses avantages est qu’il s’agit d’un traitement administré en une seule intervention. Une fois les lymphocytes T injectés, il suffit simplement de les laisser travailler. Les patients qui parviennent à une rémission peuvent se passer de traitement pendant un certain temps. La thérapie par lymphocytes T-CAR peut permettre d’offrir une pause aux patients atteints d’un myélome réfractaire ou récidivant, qui peuvent rarement se passer de traitement autrement. Qui peut recevoir une thérapie par lymphocytes T-CAR ? Actuellement, les deux seuls produits à base de lymphocytes T-CAR autorisés pour le myélome par la Food and Drug Administration (FDA, le Secrétariat des États-Unis aux produits alimentaires et pharmaceutiques) sont Abecma® (idecabtagene vicleucel ou ide-cel) et Carvykti® (ciltacabtagene autoleucel ou cilta-cel). Ils ciblent tous les deux une molécule sur les cellules myélomateuses appelée BCMA (antigène de maturation des lymphocytes B) et sont autorisés pour les patients qui ont déjà reçu au moins 4 lignes de traitement antérieures (4 protocoles de traitement différents), y compris un inhibiteur du protéasome, un immunomodulateur et un anticorps anti-CD38. La thérapie par lymphocytes T-CAR actuellement autorisée est une option en cas de rechute tardive pour les patients à qui il ne reste plus beaucoup d’options de traitement.
Quel est le processus du traitement pour le patient ? Lors de la première étape, nous prélevons les lymphocytes T du patient par le biais d’une procédure appelée aphérèse. Le sang du patient passe à travers une machine qui récupère les lymphocytes T tout en renvoyant immédiatement le reste du sang dans le patient. La procédure d’aphérèse dure plusieurs heures. Elle est similaire à la procédure de prélèvement de cellules souches pour une greffe, sauf que le recueil de lymphocytes T ne nécessite pas que le patient subisse des injections au préalable.
Que fait-on avec les lymphocytes T recueillis ? Ils sont envoyés dans une entreprise transformatrice où ils sont transduits (modifiés) pour exprimer un nouveau récepteur à leur surface. Ces lymphocytes T sont conçus pour reconnaître les cellules myélomateuses du patient et les tuer. Ils sont ensuite multipliés, un processus de transformation qui peut
durer 4 à 6 semaines. Souvent, pendant cette période, le patient reçoit un traitement de transition (un traitement anti-myélome supplémentaire) pour essayer de juguler son myélome.
Une fois le processus de transformation terminé, les lymphocytes sont envoyés au centre de traitement du patient. Généralement, il est nécessaire d’abaisser temporairement la numération leucocytaire normale du patient afin de permettre aux lymphocytes T-CAR transformés de se développer après leur injection, donc les patients reçoivent 3 jours de lymphodéplétion (chimiothérapie) en ambulatoire. Généralement, le protocole utilisé pour la lymphodéplétion dans le cadre du myélome est le cyclophosphamide, une chimiothérapie classique, avec un ajout de fludarabine pour améliorer les résultats.
Puis les lymphocytes T-CAR sont injectés ?
En fonction du patient, du produit injecté et du centre de traitement, le patient peut être hospitalisé. Dans mon centre, dans certains cas, nous commençons l’administration de Carvykti en ambulatoire, puis nous hospitalisons le patient le cinquième jour. Dans d’autres cas, nous hospitalisons immédiatement le patient et nous administrons Abecma. Les lymphocytes T transformés du patient sont injectés dans une veine, comme pour une transfusion. Puis nous attendons que ces lymphocytes T recherchent et tuent les cellules myélomateuses quel que soit l’endroit où elles se trouvent dans le corps.
Quels sont les taux de réponse ? Abecma a été autorisé par la FDA sur la base de l’essai clinique KarMMa, qui a abouti à un taux de réponse globale (TRG) de 73 %, avec 33 % des patients qui sont parvenus à une rémission complète (RC). Avec le niveau de dosage maximal (450 millions de cellules, la dose recommandée dans l’autorisation de la FDA), le TRG et le taux de RC étaient plus proches de 80 % et 39 %, respectivement.
Avec Carvykti, le TRG était de 98 %, plus qu’avec Abecma. Au cours de l’essai clinique CARTITUDE-1 sur lequel est basée l’autorisation de Carvykti par la FDA, à peu près 80 % des patients de l’étude ont obtenu une RC, ce qui montre une efficacité remarquable. Cependant, il est difficile de comparer les études KarMMa et CARTITUDE-1 en raison des différences concernant les populations de patients recrutés, donc nous ne pouvons pas affirmer avec certitude que l’une est meilleure que l’autre.
Veuillez nous parler des toxicités potentielles. La principale toxicité de Abecma et Carvykti est le syndrome de libération de cytokines (SLC), qui s’observe chez 85 à 95 % des patients. C’est une conséquence de l’activation des (suite à la page suivante)
lymphocytes T-CAR par les cellules myélomateuses. Lorsque les lymphocytes T-CAR commencent à se multiplier, des cytokines sont libérées dans le sang. Les cytokines sont des protéines qui sont normalement libérées en réponse à une infection. Le phénomène peut ressembler à une infection importante, comme une très mauvaise grippe avec une fièvre élevée, des douleurs musculaires, une faiblesse et/ou une perte d’appétit. Dans certains cas, les patients peuvent développer une hypotension, des difficultés respiratoires ou un faible taux d’oxygène.
Ce n’est pas une vraie infection, même si ça en a tout l’air. Ce syndrome survient, le cas échéant, généralement durant la première semaine de traitement, c’est pour cette raison que les patients sont hospitalisés, afin de gérer ces effets potentiels. Les réactions légères peuvent être traitées avec des médicaments en vente libre. Les SLC les plus graves peuvent être traités avec une thérapie biologique efficace appelée tocilizumab (toci). Il est très important que les patients choisissent des centres de traitement avec des équipes expérimentées qui savent comment gérer les toxicités potentielles.
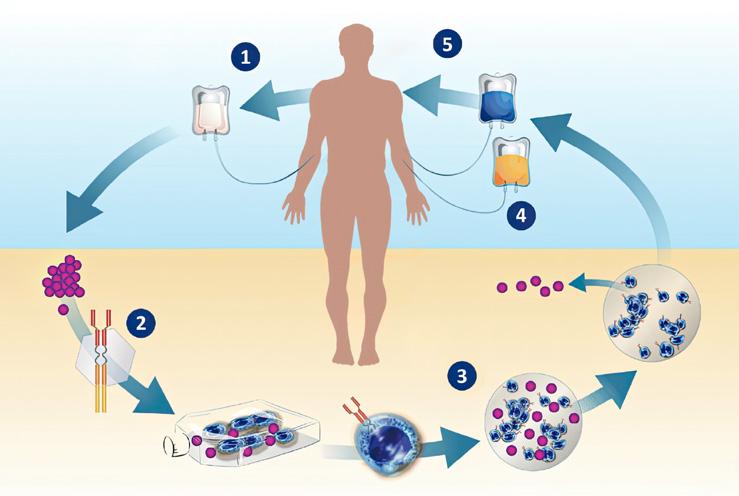
Vue d’ensemble du mécanisme d’action (MA) de la thérapie par lymphocytes T-CAR (récepteur antigénique chimérique)
1. Les lymphocytes T du patient sont prélevés dans le sang ; 2. les lymphocytes T sont modifiés pour produire des récepteurs sur leur surface qui reconnaissent les cellules myélomateuses du patient ; 3. les lymphocytes T sont multipliés ; 4. les lymphocytes T transformés sont réinjectés dans le patient afin qu’ils recherchent et tuent les cellules myélomateuses du patient ; 5. les lymphocytes T réinjectés recherchent et tuent les cellules myélomateuses du patient.
les mois avec de bons anticorps pour aider à stimuler le système immunitaire.
Est-ce que le traitement du SLC réduit le taux de réponse ?
Non, ce traitement ne semble pas nuire à la capacité des lymphocytes T-CAR à tuer les cellules myélomateuses. En fait, la majorité des patients des essais cliniques ont eu un SLC et les réponses ont quand même été très élevées.
Quelles sont les autres toxicités potentielles ?
La deuxième toxicité, moins courante que le SLC, à surveiller est la neurotoxicité. L’effet sur le système neurologique s’observe chez près de 20 % des patients. Il est généralement assez léger et transitoire, allant de maux de tête à une confusion légère. Certains patients ont connu des difficultés à trouver leurs mots. Dans de rares cas, la neurotoxicité peut entraîner des problèmes plus graves, comme des attaques. Il y a eu des morts associées. La neurotoxicité survient, le cas échéant, généralement durant la première semaine après l’injection. La neurotoxicité est traitée avec le « toci » si elle se produit en association avec le SLC et elle semble également répondre aux stéroïdes comme la dexaméthasone.
Le SLC et la neurotoxicité sont les premiers risques de la thérapie par lymphocytes T-CAR. Il existe des effets secondaires plus tardifs, comme une faible numération globulaire qui peut parfois persister pendant des semaines ou, dans de rares cas, pendant quelques mois après le traitement. Le risque d’infections est plus élevé en raison de l’affaiblissement du système immunitaire et un patient peut recevoir des antibiotiques en prévention ou une perfusion d’IVIG tous
Quelle est la durabilité des rémissions après une thérapie par lymphocytes T-CAR ?
Pour Abecma, la durée médiane de la réponse avec le niveau maximal était d’environ 12 mois. Pour Carvykti, la durée médiane de la réponse semble être plus proche de 2 ans, voire même 27 à 28 mois. Chez certains patients, la maladie n’est pas revenue et il s’est passé 3 à 4 ans depuis leur thérapie par lymphocytes T-CAR. Malheureusement, il arrive également que des patients obtiennent une réponse mais dont la maladie commence à revenir dans les 3 à 4 mois.
Quels sont les facteurs qui permettent de prédire la réponse ?
Le principal défi dans ce domaine maintenant est d’arriver à mieux prédire qui a une chance de parvenir à une rémission très durable et qui risque d’en obtenir une plus courte. Nous n’y sommes pas encore.
Des caractéristiques liées à la tumeur peuvent être associées à un risque plus élevé de rechute. Les caractéristiques cytogénétiques à haut risque continuent d’être un facteur de mauvais pronostic. La maladie extramédullaire, lorsque le myélome a appris à se développer hors de la moelle osseuse, a été associée à une durée de rémission plus courte.
La réponse vient en partie de la biologie de la tumeur, mais l’autre partie peut s’expliquer par le fait que les patients qui ont eu de nombreuses lignes de traitement antérieures peuvent avoir des lymphocytes T dysfonctionnels ou un faible nombre (suite à la page suivante)
+1 800-452-CURE appel gratuit aux États-Unis et au Canada +1 818-487-7455 numéro universel
de lymphocytes T. Ces patients risquent d’avoir un produit à base de lymphocytes T-CAR qui ne s’accroît pas aussi bien ou ne tue pas aussi efficacement les cellules myélomateuses. Cet aspect peut également être associé à une rechute.
Nous intensifions le traitement de transition pour les patients présentant une charge tumorale élevée, afin d’essayer de maîtriser le myélome avant le début du processus avec les lymphocytes T-CAR.
Veuillez partager les dernières nouvelles concernant CARTITUDE-2.
CARTITUDE-2 est un essai clinique de phase II à plusieurs cohortes qui étudie l’efficacité et la toxicité de Carvykti chez différentes populations de patients atteints de myélome.
Les patients de la Cohorte A ont été moins lourdement traités, avec 1 à 3 lignes de traitement antérieures et une progression de la maladie en étant sous Revlimid® (lénalidomide). La plupart des patients ont déjà reçu une greffe de cellules souches. Près de 60 % ont été exposés à Darzalex® (daratumumab). Les taux de réponse à Carvykti sont impressionnants : 95 % ont répondu (19 patients sur 20), 90 % ont obtenu une RC et 16 patients ont été testés négatifs à la maladie résiduelle minimale (MRM).
Le suivi est encore relativement court, avec un suivi médian de 17 mois qui a montré que près de 70 % des patients (14 sur 20) étaient toujours en rémission sans aucun signe de retour du myélome. Malheureusement, un patient est mort de la COVID-19 et un autre de septicémie. Nous attendons un suivi plus long pour voir si la durabilité de la réponse sera meilleure que celle de l’essai clinique CARTITUDE-1, qui avait étudié des patients ayant été plus lourdement traités. Cette cohorte a servi de base pour l’essai clinique CARTITUDE-4 randomisé de phase III en cours qui compare Carvykti à un traitement choisi par le médecin parmi deux traitements standard du myélome (DPd ou VPd) chez des patients ayant reçu 1 à 3 lignes de traitement antérieures.
La Cohorte B était constituée de patients dont le myélome avait récidivé dans les 18 mois après le traitement initial ou dans les 12 mois après une greffe. C’est un groupe avec un mauvais pronostic, qui correspond à un besoin encore non satisfait dans le domaine du myélome. Les données ont été présentées plus tôt cette année par l’un de mes collègues, Dr Niels Van de Donk. Le taux de réponse à Carvykti était d’environ 95 %, avec 85 % qui ont obtenu une RC, et le suivi est en cours.
La Cohorte C était un petit groupe de patients ayant déjà été lourdement traités (valeur médiane de 8 lignes de traitement antérieures) avec une maladie qui progresse après un traitement avec une thérapie ciblant le BCMA différente. Après un suivi médian de 11,3 mois, le TRG était d’environ 60 % et 7 des patients évaluables sur 10 sont parvenus à obtenir une négativité à la MRM, ce qui montre l’efficacité de Carvykti après une exposition préalable à un agent ciblant le BCMA. La durabilité médiane de la réponse était de 8 à 11 mois et
le profil de toxicité était similaire à ce que nous avons déjà vu avec Carvykti.
Après Carvykti, quelles sont les options en cas de rechute tardive ?
Le traitement de la rechute tardive du myélome est très personnalisé, en fonction des traitements que les patients ont déjà reçus et de la manière dont ils les ont tolérés, de leur numération globulaire, etc. Une nouvelle approche consiste à passer d’une thérapie ciblée à une autre. Si un patient a reçu une thérapie par lymphocytes T-CAR, puis a récidivé après une rémission, nous pouvons décider d’opter pour un médicament différent ayant déjà été autorisé par la FDA pour une ligne de traitement du myélome tardive (comme Xpovio® [sélinexor] ou Blenrep® [belantamab mafodotin]) ou nous pouvons envisager un essai clinique avec un nouvel agent ou un nouveau mécanisme d’action (MA).
Un médicament vient juste de recevoir une autorisation accélérée de la FDA : Tecvayli™ (teclistamab-cqyv), le premier anticorps bispécifique mobilisateur de lymphocytes T pour le traitement de patients atteints d’un myélome récidivant ou réfractaire, qui est administré par injection sous la peau. Il active les lymphocytes T du patient dans la moelle osseuse afin qu’ils tuent les cellules myélomateuses qui se trouvent également dans la moelle osseuse. Avec Tecvayli, il n’est pas nécessaire de prélever et de transformer les lymphocytes T comme pour Abecma et Carvykti. En tant que médicament standard, Tecvayli peut faire la même chose d’une manière moins compliquée. Il existe au moins 4 ou 5 autres bispécifiques actuellement en cours de développement, ainsi que plusieurs agents supplémentaires qui ont des cibles différentes. Il y a un riche éventail de médicaments qui sont bien avancés dans leur développement !
Pour terminer, veuillez résumer l’intérêt de la thérapie par lymphocytes T-CAR pour la rechute précoce. Nous testons l’utilisation des lymphocytes T-CAR dans le cadre de la rechute précoce, avant que les patients n’aient épuisé toutes les autres options de traitement, pour voir si nous parvenons ainsi à obtenir des réponses plus durables. Je pense que l’utilisation des lymphocytes T-CAR à un stade plus précoce de la maladie peut aider une proportion plus importante de patients ayant obtenu une réponse complète à parvenir également à une négativité à la MRM. Nous avons besoin d’études de plus grande envergure et de plus de données avant de pouvoir parvenir à une conclusion définitive concernant l’utilisation de la thérapie par lymphocytes T-CAR dans le cadre d’une rechute précoce. En attendant, nous continuerons de la réserver aux patients en rechute tardive. MT
Dr Cohen est directeur de l’immunothérapie du myélome et professeur de médecine associé à l’Université de Pennsylvanie, le premier centre à utiliser la thérapie par lymphocytes T-CAR pour traiter le myélome. Son expertise en matière de recherche se situe dans l’immunothérapie du cancer et la thérapie cellulaire. L’IMF remercie Janssen Oncology et Legend Biotech pour leur soutien apporté à Myeloma Today.
peut potentiellement nous aider dans notre combat contre le myélome et notre recherche d’un remède. C’est très enthousiasmant pour la communauté du myélome ! MT Consultez l’édition de printemps 2022 de Myeloma Today pour lire l’article du Dr Mikhael sur les anticorps bispécifiques et ne manquez pas sa prochaine chronique #WHEREISDRJOE. Veuillez contacter
de l’IMS en août 2022, avec une survie globale (SG) de près de 7 mois de plus que pour Pd seule.
Alors, comment faisons-nous pour choisir parmi toutes ces options ? Bien entendu, ce choix nécessite une discussion approfondie avec votre médecin. Vous trouverez ci-dessous quelques principes qui vous aideront à prendre cette décision importante :
Ne pas poursuivre le médicament d’entretien en cas de rechute.
Même si nous « pouvons » simplement ajouter un médicament à celui qu’une personne utilise, nous arrêtons généralement le médicament qu’une personne prend quand elle est en rechute car il est probable qu’il ne serve plus à rien.
Introduire un mécanisme d’action qui n’a pas encore été utilisé.
L’une des manières de surmonter la « résistance » que la maladie développe face aux traitements est d’introduire un médicament qui possède une méthode (ou un mécanisme d’action) d’attaque des cellules myélomateuses différente. Nous avons ainsi une meilleure chance d’obtenir une réponse plus profonde et durable.
Essayer d’utiliser une trithérapie quand c’est possible. Nous avons systématiquement observé dans les essais présentés ci-dessus que les trithérapies étaient supérieures aux bithérapies, alors nous avons tendance à préférer cette approche plus intensive.
Évaluer les facteurs liés à la maladie, au traitement et au patient.
Ces trois éléments sont fondamentaux dans le choix de la thérapie. Les facteurs de la maladie incluent l’agressivité
l’assistance de l’IMF pour toutes questions et préoccupations liées au myélome. Nous vous répondons de 9 h à 16 h (heure du Pacifique) du lundi au vendredi au +1 800.452.CURE aux États-Unis et au Canada, ou au +1 818.487.7455 dans le reste du monde. Vous pouvez également nous envoyer vos questions par e-mail à l’adresse InfoLine@myeloma.org
de la rechute, le degré de risque et la localisation de la maladie (comme la leucémie à plasmocytes ou la maladie extramédullaire). Les facteurs du traitement incluent la voie d’administration, les effets secondaires attendus et l’efficacité du protocole. Les facteurs liés au patient incluent les comorbidités, les effets secondaires antérieurs, le coût et les considérations sociales.
Prendre toujours en compte les préférences du patient. C’est primordial, surtout maintenant que nous avons plus d’options disponibles. Le patient doit être un partenaire essentiel dans le processus de prise de décision, c’est ce que nous appelons une « prise de décision partagée ».
Tant que nous n’aurons pas trouvé de remède au myélome, nous continuerons de traiter des rechutes. Nous avons appris combien il était important de traiter la rechute précoce de manière efficace pour offrir aux patients une vie plus longue et de meilleure qualité. Je suis ravi de voir la liste des options s’allonger et j’attends avec impatience d’en voir arriver davantage ! MT
Ne manquez pas la prochaine chronique #WHEREISDRJOE du Dr Mikhael. Si vous avez des questions ou inquiétudes concernant le myélome, n’hésitez pas à appeler l’assistance de l’IMF. Nous vous répondons de 9 h à 16 h (heure du Pacifique) du lundi au vendredi au +1 800.452.CURE aux États-Unis et au Canada, ou au +1 818.487.7455 dans le reste du monde. Vous pouvez également nous envoyer vos questions par e-mail à l’adresse InfoLine@myeloma.org .