Myeloma











Le premier anticorps bispécifique est maintenant disponible pour les patientsdans le cadre clinique !
A cura del Dr. Joseph Mikhael Direttore Medico IMFIl 25 ottobre 2022, la Food and Drug Administration (FDA) statunitense ha concesso l’approvazione accelerata al farmaco teclistamab (Tecvayli™) per i pazienti affetti da mieloma recidivato o refrattario che hanno ricevuto almeno 4 linee di terapia precedenti, tra cui un inibitore del proteasoma, un agente immunomodulatore e un anticorpo monoclonale anti-CD38. Il Teclistamab è il primo in linea tra gli antigeni bispecifici di maturazione delle cellule B (BCMA) diretti verso le cellule T CD3.
Il termine “bispecifico” indica che il farmaco presenta due “bracci.” Un braccio si attacca alla cellula di mieloma attraverso il BCMA sulla superficie della cellula del mieloma. L’altro braccio si attacca e attiva una cellula T locale per distruggere la cellula del mieloma. Si tratta di un metodo straordinario per combattere il mieloma utilizzando il sistema immunitario del paziente. Il teclistamab è una forma altamente avanzata di immunoterapia.
La maggior parte dei farmaci utilizzati per il trattamento del mieloma, in un contesto clinico e non in un trial clinico, ha fatto registrare nei pazienti pesantemente pretrattati tassi di risposta pari a circa il 25–30%. Il Teclistamab, studiato in pazienti affetti da mieloma recidivato molto avanzato, ha evidenziato un tasso di risposta globale (ORR) del 61,8%. Questo risultato impressionante lo renderà molto interessante per i nostri pazienti.
Il Teclistamab è stato valutato nel trial clinico multicentrico MajesTEC-1. La popolazione di efficacia era costituita da 110 pazienti affetti da mieloma sottoposti ad almeno 3 terapie precedenti, tra cui un inibitore del proteasoma, un agente immunomodulatore e un anticorpo monoclonale anti-CD38, ma che non avevano ricevuto una precedente terapia diretta con BCMA. Come detto, l’ORR è stato pari al 61,8%. Con un follow-up medio di 7,4 mesi tra i responder, la percentuale della durata stimata della risposta (DOR) è stata del 90,6% a 6 mesi e del 66,5% a 9 mesi.
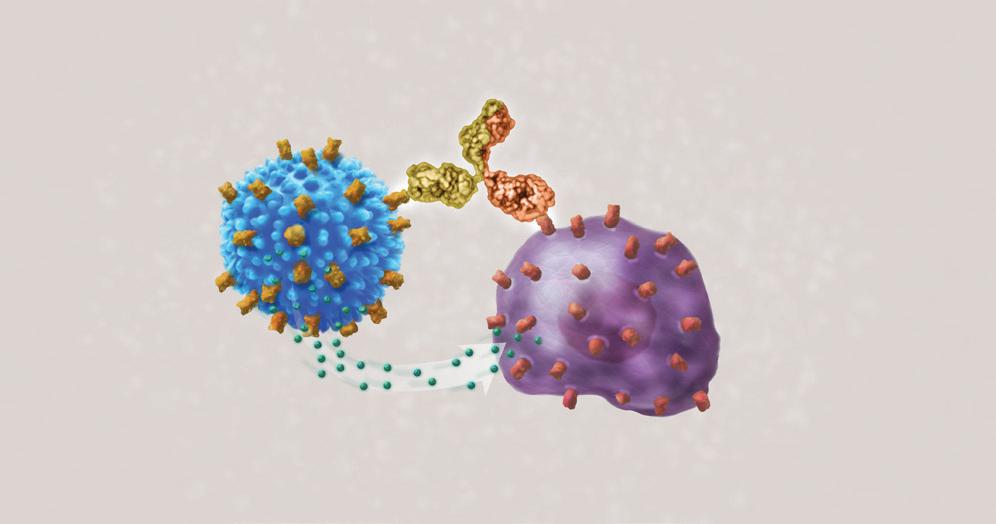
Il Teclistamab è un farmaco pronto all’uso. Esso può essere somministrato direttamente al paziente, a differenza del processo di terapia con cellule T CAR che richiede il prelievo anticipato delle cellule T dal paziente. La disponibilità in
commercio del teclistamab può facilitare l’uso di questo farmaco in modo più ampio, soprattutto per i pazienti che non hanno accesso a un centro per la terapia con cellule CAR T. Tuttavia, come per ogni farmaco contro il mieloma, esistono alcune sfide e vari rischi. Per ricevere le prime dosi di teclistamab, la maggior parte dei pazienti dovrà inizialmente essere ricoverata in ospedale per circa 2 settimane. Questo si rende necessario perché il farmaco può causare una reazione chiamata “Sindrome da rilascio di citochine” (CRS) in cui l’organismo risponde al processo di attivazione delle cellule T. Per la maggior parte dei pazienti, la CRS è lieve, tuttavia alcuni richiedono un supporto più intensivo in ambito ospedaliero. Altri effetti collaterali degni di nota possono essere tossicità neurologiche e bassi valori ematici. È inoltre importante rilevare che il trattamento continuo con un anticorpo bispecifico aumenta il rischio di infezioni, pertanto risulta fondamentale monitorare e trattare rapidamente le infezioni. Dopo la somministrazione delle prime dosi di teclistamab, il trattamento può essere continuato a livello ambulatoriale. Tutti i centri di trattamento che forniscono il teclistamab devono aderire a un programma di valutazione e mitigazione dei rischi (REMS) che monitora i rischi dei trattamenti.
I pazienti affetti da mieloma e i loro medici dispongono ora di una nuova e importante opzione terapeutica. L’altissimo tasso di risposta del teclistamab potrebbe giovare a molti pazienti, in modo unico e duraturo. E non è ancora tutto! Sono in fase di sviluppo altre terapie per il mieloma a base di anticorpi bispecifici (alcune con bersagli diversi sulla cellula del mieloma) e ogni nuovo farmaco può potenzialmente contribuire
Sono tempi davvero straordinari per il mieloma: tante nuove terapie in fase di sviluppo, nuove combinazioni di farmaci utilizzate nella terapia di prima linea, nuove tecniche di diagnostica per immagini e tanto altro! Ma ciò che spesso si dimentica sono le nuove opzioni nella malattia recidivata precoce. In genere si pensa alla ricaduta “precoce” come al trattamento che si riceve dopo 1-3 linee di terapia precedenti. Ciò si contrappone alla ricaduta “tardiva”, quando i pazienti sono stati trattati con la maggior parte delle opzioni disponibili. Si desidera evidenziare questa parte del percorso dei pazienti affetti da mieloma, anche perché le opzioni terapeutiche sono le più numerose di sempre. In effetti, abbiamo non meno di CINQUE trial clinici di fase 3 su combinazioni di triplette recentemente pubblicati e ora disponibili. Un altro motivo è quello di dimostrare un cambiamento importante nel nostro approccio al mieloma: non si lascia più “il meglio per ultimo”, bensì utilizziamo l’approccio più efficace per il singolo paziente nelle prime fasi della malattia, anche nella terapia di prima linea, perché sappiamo che questo avrà un impatto maggiore sulla sopravvivenza a lungo termine del paziente.
Con le recidive, il mieloma diventa più difficile da controllare, per cui la possibilità di offrire ai pazienti remissioni più lunghe con terapie combinate efficaci già in fase iniziale è una tendenza in crescita e importante. Si tratta di un argomento di discussione principale, perché può essere difficile scegliere quando il ventaglio di opzioni è in continua espansione. Naturalmente è un problema che va affrontato, visto che fino a non molto tempo fa avevamo poche opzioni per controllare questa terribile malattia. Quali sono le scelte migliori? Questi sono i cinque trial clinici principali che hanno dato forma al trattamento delle ricadute precoci:
1. Trial clinico IKEMA su Isa-Kd
Questo trial clinico di Sarclisa® (isatuximab), anticorpo monoclonale CD38-diretto, in combinazione con Kyprolis® (carfilzomib) e il desametasone steroideo (Isa-Kd) è importante poiché dimostra la sopravvivenza libera da progressione (PFS) più lunga che abbiamo registrato nei casi di recidiva precoce, recentemente riportati come 35,7 mesi. Riuscire a ottenere una media di 3 anni di PFS nel mieloma recidivato è un risultato davvero notevole. Tuttavia, richiede un maggior numero di visite in clinica, poiché il Sarclisa viene somministrato a settimane alterne dopo il primo mese (in cui viene somministrato settimanalmente). Il Sarclisa viene ancora somministrato per via endovenosa, sebbene dopo le prime 2 infusioni, venga somministrato solo per 75 minuti. Nello
studio IKEMA, la combinazione Isa-Kd si è dimostrata superiore rispetto alla sola Kd.
2. Trial clinico APOLLO di DPd
La combinazione Darzalex® (daratumumab) + Pomalyst® (pomalidomide) + desametasone (DPd), recentemente approvata, è stata ampiamente studiata. È interessante perché Darzalex Faspro® può essere somministrato con una breve iniezione sottocutanea (sotto pelle), a differenza del Darzalex che veniva somministrato in precedenza con una lunga infusione endovenosa. Questo, insieme al Pomalyst somministrato per via orale, rende la combinazione DPd molto più pratica. La combinazione DPd si è dimostrata superiore alla sola combinazione Pd.
3. Trial clinico BOSTON di XVd
Questa combinazione unica include il farmaco orale Xpovio® (selinexor), precedentemente somministrato in linee successive di terapia, ma ora disponibile in una fase più precoce della malattia. La somministrazione settimanale, anziché bisettimanale, ha reso Xpovio più facilmente tollerabile, soprattutto se somministrato insieme a due farmaci antinausea, dato che il farmaco è noto per provocare una forte nausea. Xpovio, inibitore del trasporto nucleare, possiede un nuovo meccanismo d’azione che impedisce ai soppressori tumorali buoni di lasciare il nucleo della cellula. Questa combinazione impiega anche Velcade® (bortezomib) per via sottocutanea e a cadenza settimanale, oltre al desametasone (XVd). La combinazione XVd ha dimostrato di essere superiore alla sola Vd.
4. Trial clinico CANDOR di DKd
Sebbene la combinazione Darzalex + Kyprolis + desametasone (DKd) sia disponibile da alcuni anni, essa rimane un’opzione importante. Nonostante il trial CANDOR abbia utilizzato Kyprolis due volte a settimana, oggi è comunemente utilizzato con un programma settimanale (tre settimane di assunzione, una di sospensione) e l’approvazione del regime DKd consente il dosaggio bisettimanale o monosettimanale. Il DKd viene comunemente utilizzato quando il Darzalex non è stato usato in prima linea. La tripletta DKd ha dimostrato di essere superiore alla sola Kd.
5. Trial clinico ICARIA di Isa-Pd
Il regime di Sarclisa + Pomalyst + desametasone è disponibile da alcuni anni, ma rimane un’opzione importante nelle ricadute precoci. Il follow-up a lungo termine dello studio ICARIA è stato presentato all’assemblea annuale IMS nell’agosto 2022, dimostrando un vantaggio nella sopravvivenza complessiva (OS) di circa 7 mesi se paragonato al solo Pd.
Dr. Cohen, ci parli della terapia con cellule CAR T e di come viene utilizzata nel mieloma.
La terapia con recettori chimerici dell’antigene (CAR) è un nuovo approccio per utilizzare il sistema immunitario del paziente per attaccare il mieloma. La terapia con cellule CAR T è un approccio molto mirato e specifico per il paziente nel trattamento del mieloma. Un vantaggio è dato dal fatto che si tratta di un trattamento “una tantum”. Dopo l’infusione delle cellule T, è necessario lasciar passare del tempo affinché “entrino in funzione”. I pazienti che raggiungono la remissione possono evitare il trattamento per un certo periodo di tempo. La terapia con cellule CAR T può offrire una pausa ai pazienti con mieloma recidivato o refrattario, che altrimenti raramente potrebbero interrompere il trattamento.
Chi è candidato alla terapia con cellule CAR T? Attualmente, gli unici due prodotti a base di cellule CAR T approvati dalla Food and Drug Administration (FDA) statunitense per il mieloma sono l’Abecma® (idecabtagene vicleucel o ide-cel) e il Carvykti® (ciltacabtagene autoleucel o cilta-cel). Entrambi i farmaci hanno come target una molecola sulle cellule del mieloma denominata BCMA (antigene di maturazione delle cellule B) e sono approvati per i pazienti sottoposti ad almeno 4 linee precedenti di trattamento [4 regimi di trattamenti diversi], incluso un inibitore del proteasoma, un agente immunomodulatore e un anticorpo anti-CD38. La terapia con cellule CAR T, così come attualmente approvata, è un’opzione in caso di recidiva tardiva per i pazienti a cui non restano molte opzioni terapeutiche.
Il primo passo consiste nel raccogliere le cellule T del paziente attraverso una procedura chiamata aferesi. Il sangue del paziente passa attraverso una macchina che seleziona le cellule T, mentre il resto del sangue viene immediatamente reinfuso al paziente. La procedura di aferesi richiede alcune ore. Si tratta di un’operazione simile al prelievo di cellule staminali per il trapianto, con la differenza che la raccolta di cellule T non richiede che il paziente si sottoponga anticipatamente a iniezioni.
Cosa succede alle cellule T raccolte?
Esse vengono inviate a un’azienda produttrice dove vengono trasdotte [modificate] per esprimere un nuovo recettore sulla loro superficie. Tali cellule T vengono ingegnerizzate per riconoscere le cellule del mieloma del paziente e diventare cellule che annientano il mieloma. Successivamente vengono coltivate in grandi numeri; tale processo di produzione può richiedere da 4 a 6 settimane. Spesso, durante tale periodo, il paziente viene sottoposto a una terapia “ponte” [terapia
aggiuntiva contro il mieloma] per tenere sotto controllo il mieloma.
Una volta completato il processo di produzione, le cellule vengono consegnate alla struttura dove è in cura il paziente. In genere, dobbiamo abbassare temporaneamente la normale conta dei globuli bianchi del paziente per consentire alle cellule CAR T ingegnerizzate di espandersi dopo l’infusione, quindi i pazienti vengono sottoposti a 3 giorni di linfodeplezione [chemioterapia] a livello ambulatoriale. In generale, il regime utilizzato per la linfodeplezione nel mieloma è la ciclofosfamide, una chemioterapia classica, con l’aggiunta di fludarabina per migliorare i risultati.
E poi il prodotto delle cellule CAR T viene infuso?
A seconda del paziente, del prodotto infuso e della struttura di cura specifica, potrebbe essere necessario il ricovero del paziente. Nel mio centro, in alcuni casi iniziamo a somministrare il Carvykti in regime ambulatoriale, per ricoverare successivamente il paziente al quinto giorno. In altri casi, ricoveriamo subito il paziente per somministrargli l’Abecma. Le cellule T ingegnerizzate del paziente vengono infuse per via endovenosa, come se fosse una trasfusione. Quindi aspettiamo che le cellule T individuino e annientino le cellule del mieloma ovunque nell’organismo. E i tassi di risposta? L’Abecma è stato approvato dalla FDA sulla base del trial clinico KarMMa, che ha dimostrato un tasso di risposta globale (ORR) pari al 73%, con il 33% dei pazienti che ha raggiunto una remissione completa (CR). Al livello di dose più alto [450 milioni di cellule, la dose raccomandata nell’approvazione della FDA], i tassi di ORR e CR si sono avvicinati rispettivamente all’80% e al 39%.
Con il Carvykti, l’ORR è stato del 98%, superiore a quello dell’Abecma. Nel trial clinico CARTITUDE-1, su cui si è basata l’approvazione del Carvykti da parte dell’FDA, circa l’80% dei pazienti dello studio ha raggiunto la CR, dimostrando una notevole efficacia. Tuttavia, è difficile confrontare gli studi KarMMa e CARTITUDE-1, a causa delle differenze nelle popolazioni di pazienti arruolati, quindi non è possibile affermare che uno sia definitivamente migliore dell’altro.
Ci parli delle potenziali tossicità. La tossicità principale dell’Abecma e del Carvykti è la sindrome da rilascio di citochine (CRS), che si manifesta nell’85-95% dei pazienti. Questo riflette l’attivazione delle cellule CAR T da parte delle cellule del mieloma. Quando le cellule T CAR iniziano a moltiplicarsi, le citochine vengono rilasciate nel sangue. Le citochine sono proteine che vengono normalmente (continua alla pagina successiva)
rilasciate in risposta alle infezioni. Questo può simulare un’infezione significativa, come un’influenza importante con febbre alta, dolori muscolari, debolezza e/o perdita di appetito. In alcuni casi, i pazienti possono sviluppare bassa pressione sanguigna, difficoltà respiratoria o bassi livelli di ossigeno.
Pur non essendoci un’infezione vera e propria, sembra che sia così. Se ciò si verifica, di solito avviene entro la prima settimana di trattamento ed è per questo che i pazienti vengono ricoverati in ospedale, per gestire questi potenziali effetti. Le reazioni lievi possono essere gestite con farmaci da banco. La CRS più grave può essere trattata con un’efficace terapia biologica, il tocilizumab (toci). È molto importante che i pazienti scelgano centri di trattamento con team esperti che sappiano come gestire le potenziali tossicità.
Il trattamento della CRS riduce gli alti tassi di risposta?
Panoramica del meccanismo di azione (MOA) della terapia con cellule T chimeriche con recettore dell’antigene (CAR)
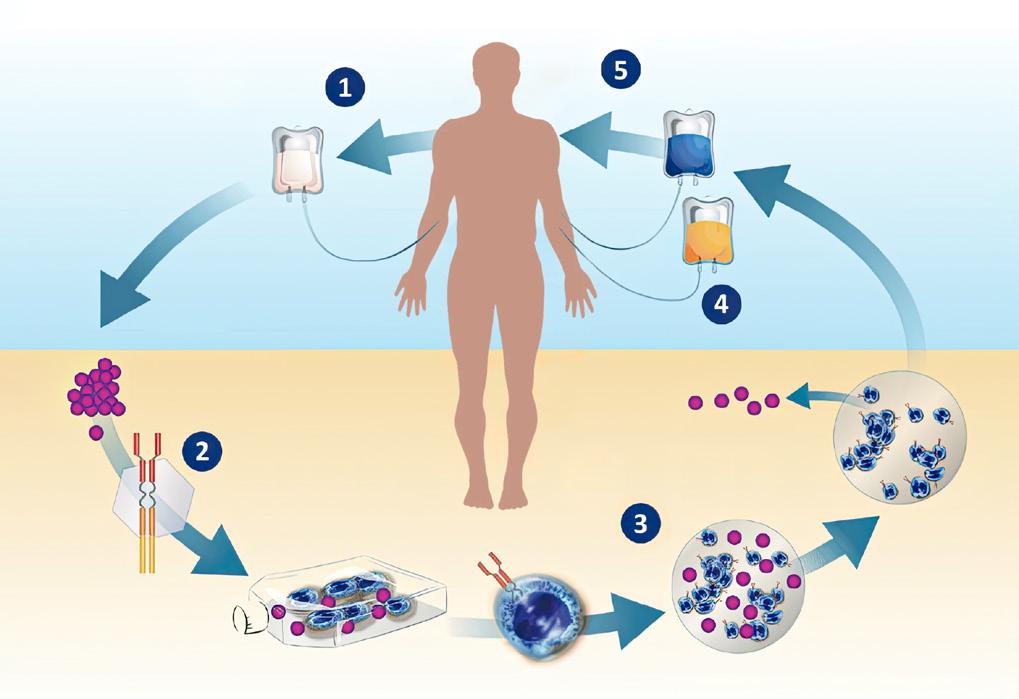
1. Le cellule T del paziente vengono prelevate dal flusso sanguigno; 2. Le cellule T vengono modificate in modo da produrre sulla loro superficie recettori che riconoscono le cellule del mieloma del paziente;
3. Le cellule T vengono prodotte in grande numero; 4. Le cellule T ingegnerizzate vengono reinfuse al paziente per individuare e annientare le cellule del mieloma del paziente.
5. Le cellule T reinfuse individuano e annientano le cellule del mieloma del paziente.
No, non sembra influire sulla capacità delle cellule CAR T di annientare le cellule del mieloma. In effetti, la maggior parte dei pazienti nei trial clinici ha manifestato la CRS, ma ha comunque ottenuto risposte molto elevate.
Quali sono le altre potenziali tossicità?
Meno comune della CRS, la seconda tossicità a cui prestare attenzione è la neurotossicità. Tale effetto sul sistema neurologico si manifesta in circa il 20% dei pazienti. Solitamente si tratta di un disturbo piuttosto lieve e transitorio, che va dal mal di testa a un leggero senso di confusione. Alcuni pazienti hanno difficoltà nel trovare le parole. In rari casi, la neurotossicità può evolvere in problemi più gravi, per esempio in convulsioni. Sono stati registrati alcuni decessi collegati a questo fenomeno. In caso di neurotossicità, solitamente avviene nella prima settimana dopo l’infusione. La neurotossicità viene gestita con il toci se si verifica in concomitanza con la CRS e sembra anche rispondere agli steroidi come il desametasone.
La CRS e la neurotossicità costituiscono i rischi iniziali della terapia con cellule T CAR. In seguito si manifestano effetti collaterali, per esempio un basso numero di cellule ematiche, che a volte può persistere per settimane o, in rari casi, fino a un paio di mesi dopo il trattamento. Il rischio di infezioni aumenta perché il sistema immunitario viene soppresso e il paziente può ricevere antibiotici preventivi o un’infusione mensile IVIg di anticorpi buoni per aiutare a rinforzare il sistema immunitario.
Qual è la durata delle remissioni dopo la terapia con cellule CAR T?
Con l’Abecma, la durata mediana della risposta al livello più alto è stata pari a circa 12 mesi. Con il Carvykti, la durata mediana della risposta sembra essere più vicina ai 2 anni, fino anche a 27–28 mesi. Esistono pazienti la cui malattia non si è ripresentata e sono trascorsi 3-4 anni dalla terapia con cellule CAR T. Purtroppo, ci sono anche pazienti che ottengono una risposta positiva, ma la malattia inizia a ripresentarsi entro 3–4 mesi.
La grande sfida del settore in questo momento è costituita dall’individuazione dei predittivi migliori per capire chi ha la probabilità di ottenere una remissione molto duratura e chi invece una remissione più breve. Non ci siamo ancora arrivati. Esistono caratteristiche legate al tumore che possono essere associate a un aumento del rischio di recidiva. La citogenetica ad alto rischio continua a essere un fattore prognostico negativo. La malattia extramidollare, quando il mieloma ha imparato a proliferare al di fuori del midollo osseo, è stata associata a una durata più breve della remissione.
Una parte è dovuta alla biologia del tumore, tuttavia l’altra parte può essere dovuta al fatto che i pazienti sottoposti a molte linee di terapia precedenti possono avere cellule T disfunzionali o un basso numero di cellule T. Tali pazienti possono ottenere un prodotto a base di cellule CAR T che (continua alla pagina successiva)
non si espande altrettanto bene o non annienta le cellule del mieloma con la stessa efficacia. Anche questo può essere associato a una ricaduta.
Stiamo intensificando la terapia ponte per i pazienti con carico tumorale più elevato, cercando di tenere sotto controllo il mieloma prima di iniziare il processo delle cellule CAR T.
Il CARTITUDE-2 è un trial clinico multi-coorte di fase 2 che studia l’efficacia e la tossicità del Carvykti in diverse popolazioni di pazienti affetti da mieloma.
I pazienti della coorte A sono stati trattati meno pesantemente, con da 1 a 3 linee di trattamento preventive e progressione della malattia pur su Revlimid® (lenalidomide). La maggior parte dei pazienti era già stata sottoposta a un trapianto di cellule staminali. Circa il 60% è stato esposto al Darzalex® (daratumumab). I tassi di risposta al Carvykti sono stati davvero impressionanti: Il 95% ha risposto (19 pazienti su 20), il 90% ha raggiunto la CR e 16 pazienti sono risultati negativi alla malattia minima residua (MRD).
Il follow-up è ancora relativamente breve: il follow-up mediano di 17 mesi ha mostrato che circa il 70% dei pazienti (14 su 20) era ancora in remissione senza alcun segno di ritorno del mieloma. Purtroppo, un paziente è morto a causa del COVID-19 e uno per sepsi. Siamo in attesa di un follow-up più lungo per comprendere se la durata della risposta sarà migliore rispetto al trial clinico CARTITUDE-1, che ha studiato pazienti sottoposti a un trattamento più pesante. Tale coorte ha fornito il razionale per una fase 3 corrente randomizzata del trial clinico CARTITUDE-4 comparando il Carvykti vs. la scelta del medico di una di due terapie per mieloma standard [DPd o VPd] in pazienti con da 1 a 3 linee di trattamento preventive.
La coorte B era composta da pazienti il cui mieloma è recidivato entro 18 mesi dal trattamento iniziale o entro 12 mesi dal trapianto. Si tratta di un gruppo a prognosi infausta, che rappresenta un bisogno insoddisfatto nel mieloma. I dati sono stati presentati all’inizio di quest’anno da uno dei miei colleghi, il Dr. Niels Van de Donk. Il tasso di risposta al Carvykti è stato di circa il 95%, con l’85% che ha raggiunto la CR, e il follow-up è in corso.
La coorte C era costituita da un piccolo gruppo di pazienti pesantemente pretrattati (mediana di 8 linee di trattamento precedenti) con malattia progressiva dopo un precedente trattamento con una diversa terapia mirata al BCMA. A un follow-up mediano di 11,3 mesi, l’ORR è stato di circa il 60% e 7 dei 10 pazienti valutabili sono stati in grado di raggiungere la negatività della MRD, dimostrando l’efficacia del Carvykti dopo una precedente esposizione a un agente BCMA-diretto.
La durata mediana della risposta è stata di 8–11 mesi e il profilo di tossicità è stato simile a quello già osservato con il Carvykti. Dopo il Carvykti, quali sono le opzioni in caso di ricaduta tardiva?
Il trattamento della recidiva tardiva nel mieloma è altamente individualizzato e si basa sulle terapie cui sono stati sottoposto i pazienti in precedenza e sulla loro tolleranza, oltre che sulla conta ematica, ecc. Un approccio emergente consiste nel passare da una terapia mirata a un’altra. Se un paziente è stato sottoposto a terapia con cellule CAR T e poi ha avuto una ricaduta dopo una remissione, possiamo decidere di utilizzare un altro farmaco già approvato dalla FDA per il trattamento di ultima linea del mieloma, come il Xpovio® (selinexor) o il Blenrep® (belantamab mafodotin), oppure possiamo prendere in considerazione un trial clinico con un nuovo agente o meccanismo di azione (MOA).
Un farmaco che ha appena ricevuto l’approvazione accelerata da parte dell’FDA è il Tecvayli™ (teclistamab-cqyv), il primo anticorpo T engager bispecifico per il trattamento di pazienti affetti da mieloma recidivato o refrattario, che viene somministrato come iniezione sotto pelle. Attiva le cellule T del paziente nel midollo osseo per annientare le cellule del mieloma anch’esse nel midollo osseo. Con il Tecvayli, le cellule T non dovranno essere raccolte e ingegnerizzate come nel caso dell’Abecma e del Carvykti. Essendo un farmaco pronto per l’uso, il Tecvayli potrebbe fare altrettanto, in modo meno complicato. Esistono almeno altri 4 o 5 bispecifici attualmente in fase di sviluppo, oltre a numerosi altri agenti che colpiscono bersagli diversi. Sono moltissimi i farmaci in fase di sviluppo!
Per concludere, riassuma il potenziale della terapia con cellule CAR T nella recidiva precoce. Stiamo testando l’uso delle cellule CAR T nelle recidive precoci, prima che i pazienti abbiano esaurito tutte le altre opzioni terapeutiche, per vedere se questo può portare a risposte più durature. Ritengo che l’uso delle cellule CAR T in fase precoce della malattia possa contribuire, in una proporzione anche superiore di pazienti, a una risposta completa per ottenere anche una negatività MRD. Abbiamo bisogno di studi più ampi e di maggiori dati prima di giungere a una conclusione definitiva sull’uso della terapia con cellule CAR T in casi di recidiva precoce. Fino a quel momento, continueremo a riservarlo ai pazienti in fase di ricaduta tardiva. MT
Dr. Cohen è Direttore dell’Immunoterapia del Mieloma e Professore Associato di Medicina presso la Pennsylvania University, il primo centro di trattamento del mieloma con terapia con cellule CAR T. L’esperienza di ricerca del Dr. Cohen riguarda l’immunoterapia del cancro e la terapia cellulare. L’IMF ringrazia Janssen Oncology e Legend Biotech per il supporto a Myeloma Today.
ulteriormente all’obiettivo di combattere e curare il mieloma. Questo risulta essere molto emozionante per la comunità del mieloma! MT
Fare riferimento all’ edizione Primavera 2022 di Myeloma Today per leggere l’articolo del Dr. Mikhael sugli anticorpi bispecifici e rimani
– CONTINUA DA PAGINA 3Quindi, come decidere tra tutte queste opzioni? Naturalmente ciò richiede un’attenta discussione con il medico. Di seguito vengono riportati alcuni principi che contribuiscono a questa importante decisione:
Non continuare il farmaco di mantenimento in caso di ricaduta.
Sebbene sia “possibile” aggiungere un farmaco a quello che si sta assumendo, solitamente si interrompe il farmaco che si sta assumendo durante la ricaduta, perché probabilmente non è più utile.
Introdurre un meccanismo di azione non ancora visto.
Uno dei modi per superare la “resistenza” che la malattia sviluppa nei confronti delle terapie è quello di introdurre un farmaco con un metodo (o meccanismo di azione) diverso per attaccare le cellule del mieloma. In questo modo è maggiore la possibilità di ottenere una risposta più profonda e duratura.
Cercare di impiegare una tripletta quando possibile.
Nei trial sopra citati abbiamo sempre riscontrato la superiorità delle triplette rispetto alle doppiette, pertanto si tende a preferire questo approccio più intensivo.
Valutare la malattia, il trattamento e i fattori del paziente.
Questi tre elementi risultano fondamentali per scegliere la terapia. I fattori patologici comprendono l’aggressività
sintonizzato per la sua prossima rubrica #WHEREISDRJOE. Contattare il numero verde IMF per eventuali domande e dubbi sul mieloma. Le linee telefoniche sono raggiungibili dal lunedì al venerdì dalle 9 alle 16 (ora del Pacifico) al numero 1.800.452.CURE negli Stati Uniti e in Canada o al numero 1.818.487.7455 dal resto del mondo. È possibile anche inviare le domande all’indirizzo e-mail InfoLine@myeloma.org .
della recidiva, lo stato di rischio e la localizzazione della malattia (per es. la leucemia plasmacellulare o la malattia extramidollare). I fattori di trattamento includono la via di somministrazione, gli effetti collaterali previsti e l’efficacia del regime. I fattori legati al paziente includono comorbidità, effetti collaterali pregressi, costi e considerazioni sociali. Far corrispondere sempre l’opzione alle preferenze del paziente.
Questo aspetto risulta di assoluta importanza, soprattutto ora che sono possibili più opzioni. Il paziente deve essere un partner fondamentale nel processo decisionale, che viene definito “processo decisionale condiviso”.
Fino a quando non otterremo una cura per il mieloma, continueremo a trattare la malattia recidivata. Abbiamo imparato quanto sia importante trattare in modo efficace le ricadute precoci per garantire ai pazienti una maggiore quantità e una migliore qualità di vita. Sono felice di vedere che l’elenco delle opzioni si sta ampliando e non vedo l’ora che ne arrivino altre! MT
Rimani sintonizzato per la prossima rubrica del Dr. Mikhael #WHEREISDRJOE e contatta il numero verde dell’IMF per eventuali domande e preoccupazioni relative al mieloma. Le linee telefoniche sono raggiungibili dal lunedì al venerdì dalle 9 alle 16 (ora del Pacifico) al numero 1.800.452.CURE negli Stati Uniti e in Canada o al numero 1.818.487.7455 dal resto del mondo. È possibile anche inviare le domande all’indirizzo e-mail InfoLine@myeloma.org .