Patientenhandbuch
für neu diagnostizierte Patienten
Ausgabe Februar 2022 | Von Brian G.M. Durie

Herausgegeben von der International Myeloma Foundation Multiples Myelom | Eine Krebserkrankung des Knochenmarks
Die International Myeloma Foundation (IMF, Internationale Myelom-Stiftung) wurde im Jahr 1990 gegründet und ist die erste und größte Organisation der Welt, die sich ausschließlich mit dem multiplen Myelom befasst. Die Reichweite der IMF erstreckt sich über mehr als 525.000 Mitglieder in 140 Ländern weltweit. Die IMF bemüht sich, die Lebensqualität von Myelompatienten zu verbessern, und arbeitet, basierend auf unseren vier Grundprinzipien, gleichzeitig an der Vorbeugung und Heilung: Forschung, Bildung, Hilfestellung und Interessenvertretung.
FORSCHUNG Die IMF widmet sich der Myelom-Behandlung und Heilung und hat für dieses Ziel eine Reihe von Initiativen im Einsatz. Unsere internationale Arbeitsgruppe, die International Myeloma Working Group, ist aus dem im Jahr 1995 gegründeten wissenschaftlichen Beirat des IWF hervorgegangen. In dieser hochkarätigen, renommierten Organisation sind mehr als 200 Myelom-Experten tätig, die sich gemeinsam der Forschung widmen, um Ergebnisse für Patienten zu verbessern und gleichzeitig kritisch bewertete Konsensrichtlinien zu erstellen, die weltweit befolgt werden. Unsere Black Swan Research Initiative® schließt die Lücke zwischen langfristiger Remission und vollständiger Heilung. Unser jährliches Brian D. Novis Forschungsstipendium unterstützt die vielversprechendsten Projekte von Junior- und Senior-Wissenschaftlern. Das Nurse Leadership Board, das sich aus Krankenschwestern und Pflegern führender Myelom-Behandlungszentren zusammensetzt, entwickelt Empfehlungen für die Pflege von Myelompatienten.
BILDUNG In den Webinaren, Seminaren und Workshops der IMF informieren führende Myelom-Experten und Kliniker Patienten und Familienangehörige direkt über die neuesten Entwicklungen. Wir verfügen über eine Bibliothek mit mehr als 100 Publikationen für Patienten, Pflegekräfte und medizinisches Fachpersonal. IMF-Publikationen stehen in englischer und in ausgewählten anderen Sprachen stets kostenlos zur Verfügung.
HILFESTELLUNG Über die IMF-InfoLine werden Ihre Fragen zum Myelom telefonisch oder per E-Mail beantwortet. Wir bemühen uns, präzise Informationen mit Empathie und Einfühlungsvermögen zu vermitteln. Wir unterhalten ein Netzwerk mit Selbsthilfegruppen und schulen Hunderte von engagierten Patienten, Betreuungspersonen und Pflegekräften, die sich freiwillig zur Leitung dieser Gruppen in ihren jeweiligen Gemeinden bereit erklären.
INTERESSENVERTRETUNG Wir unterstützen Tausende von Menschen, die sich jedes Jahr für die spezifischen Interessen der Myelom-Community einsetzen. In den USA haben wir Interessensverbände und Koalitionen im Einsatz, die die Belange der Myelom-Community sowohl auf nationaler als auch auf bundesstaatlicher Ebene vertreten. Außerhalb der USA setzt sich das Global Myeloma Action Network dafür ein, Patienten den Zugang zu Therapien zu ermöglichen.
Erfahren Sie mehr darüber, wie die IMF die Lebensqualität von Myelompatienten verbessert und gleichzeitig an der Vorbeugung und Heilung dieser Erkrankung arbeitet. Kontaktieren Sie uns unter +1.818.487.7455 oder besuchen Sie myeloma.org.
Inhaltsverzeichnis Sie sind nicht allein 4 Das Myelom ist eine sehr gut behandelbare Erkrankung 4 Vorstufen des Myeloms 5 Statistiken über das Myelom 6 Ursachen oder Auslöser eines Myeloms 7 Erhalten Sie die richtige Diagnose 7 Kriterien für die Myelom-Diagnose 9 Stadiumeinteilung des Myeloms 10 Notwendige Untersuchungen 11 Grundlegende Untersuchungen 15 Mögliche dringende Probleme bei Diagnose 17 Myelomtypen 18 Die Auswirkungen des Myeloms im Knochenmark 20 Auswirkungen des Myeloms außerhalb des Knochenmarks 20 Behandlungsmöglichkeiten bei frisch diagnostiziertem Myelom 22 Autologe Stammzellentransplantation 24 Auswahl eines Behandlungsschemas 26 Erhaltungstherapie – ja oder nein? 26 Klinische Studien 27 Unterstützende Behandlung 27 Ihr medizinisches Team 30 Myelompatienten und COVID-19 30 Abschließende Bemerkungen 31 Fachbegriffe und Definitionen 31
Sie sind nicht allein.
Die International Myeloma Foundation (IMF) ist hier, um Ihnen zu helfen. Wir engagieren uns dafür, dass Myelompatienten und Betreuer sowie deren Freunde und Familienmitglieder stets nützliche Informationen und die erforderliche Unterstützung erhalten. Dies setzen wir um, indem wir auf unserer Website myeloma.org oder myeloma.org/DE, uber unsere IMF-InfoLine sowie mit Seminaren, Webinaren, Workshops und anderen Programmen und Dienstleistungen eine breite Palette von Ressourcen zur Verfügung stellen. Alle Veröffentlichungen der IMF sind kostenlos erhältlich unter publications.myeloma.org.
Als neu diagnostizierter Patient stoßen Sie auf zahlreiche medizinische Begriffe und Konzepte, die Sie möglicherweise nicht kennen. Erläuterungen zu den fett+blau gedruckten Begriffen finden Sie im Abschnitt „Fachbegriffe und Definitionen“ am Ende dieser Broschüre. Einen umfassenderen Leitfaden zu Myelom-Begriffen, das Glossar zu Myelom-Begriffen und zugehörige Definitionen finden Sie auf glossary.myeloma.org. Wenn Sie diese Broschüre in elektronischer Form lesen, gelangen Sie über die blauen, nicht fett gedruckten Hyperlinks zu den entsprechenden Ressourcen.
Das Patientenhandbuch des IMF für Neudiagnosen soll Ihnen helfen, das Multiple Myelom (das wir hier einfach als „Myelom“ bezeichnen) besser zu verstehen. Das Myelom wird „multipel“ genannt, weil es häufig mehrere Bereiche des Körpers betrifft. Myelom gilt nur dann nicht als „multipel“, wenn der seltene Fall eines solitären Plasmazytoms aufritt.
Myelom ist eine Krebsform, die den meisten Patienten zum Zeitpunkt der Diagnose nichts sagt. Es ist wichtig, dass Sie so viel wie möglich über das Myelom und seine Behandlungsmöglichkeiten erfahren, damit Sie eine aktive Rolle in Ihrer eigenen medizinischen Versorgung spielen und mit Ihrem Arzt gute Behandlungsentscheidungen treffen können. Die Informationen in dieser Broschüre sollen Ihnen in Gesprächen mit Ihrem medizinischen Team nützen.
Myelom ist ein Krebs, der die Plasmazellen betrifft; dies sind weiße Blutkörperchen im Knochenmark. Plasmazellen sind verantwortlich für die Herstellung von Antikörpern, auch Immunglobuline (Ig) genannt. Gesunde Plasmazellen sind ein wichtiger Bestandteil des Immunsystems. Myelomzellen sind maligne Plasmazellen, die keine funktionierenden Antikörper bilden, sondern stattdessen ein abnormales monoklonales Protein (Myelomprotein, M-Protein) produzieren.
4 +1.818.487.7455 • +1.800.452.CURE
Das Myelom ist eine sehr gut behandelbare Erkrankung.
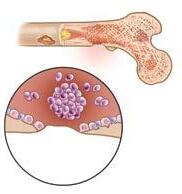
Das Myelom wächst oft im Mark der Knochen der Wirbelsäule, des Schädels, des Beckens, des Brustkorbs, der Schultern und der Hüften. Normalerweise sind die Knochen der Hände, Füße und der unteren Teile der Arme und Beine nicht betroffen. Myelom kann sich als Tumor und/oder als ein Bereich mit Knochenschwund zeigen. In beiden Fällen spricht man von einer Läsion. Das Vorhandensein von Myelomzellen im Knochenmark kann zu vielen weiteren medizinischen Problemen innerhalb und außerhalb des Mikromilieus des Knochenmarks führen.
Viele hochwirksame Therapien sind von der US-amerikanischen Food and Drug Administration (FDA), der Europäischen ArzneimittelAgentur (EMA) und anderen Aufsichtsbehörden für die Behandlung des Myeloms zugelassen. Zahlreiche klinische Studien finden derzeit auf der ganzen Welt statt und erweitern die wachsende Liste der Behandlungsmöglichkeiten um weitere vielversprechende Therapien.
Viele Patienten führen nach der Diagnosestellung jahrelang, manchmal sogar jahrzehntelang, ein normales Leben. Sowohl das Überleben als auch die Lebensqualität von Myelom-Patienten verbessern sich ständig. Zu erfahren, was das Myelom ist und wie es behandelt wird, kann dazu beitragen, dass bei Patienten und Familienangehörigen die erste Angst vnachlässt, ein Gefühl der Kontrolle entsteht und man sich mit der Diagnose arrangiert.
Vorstufen des Myeloms
Das früheste Stadium des Myeloms ist eine gutartige Erkrankung namens monoklonale Gammopathie unbestimmter Signifikanz (MGUS). Menschen mit MGUS müssen ihren Krankheitsstatus sorgfältig auf mögliche Veränderungen überwachen. Wenn der M-Proteinspiegel stabil bleibt und es keine weiteren gesundheitlichen Veränderungen gibt, können Sie die Zeiträume zwischen den Besuchen bei Ihrem Hämatologen und/oder Onkologen verlängern.
Alle Myelompatienten haben MGUS, bevor sich ein Myelom entwickelt, jedoch werden nur 20 % aller Menschen mit einer MGUS-Diagnose später an einem Myelom erkranken. Das Risiko des Übergangs von MGUS zum Myelom beträgt 1 % jährlich.
Das Stadium zwischen MGUS und aktivem Myelom nennen wir schwelendes multiples Myelom (SMM). Dabei ist der M-Proteinspiegel
5 myeloma.org
Abbildung 1. Die Auswirkungen des Myeloms im Knochenmark
zwar höher als bei MGUS, aber es liegen keine Anzeichen eines aktiven Myeloms vor. Bei SMM mit Standardrisiko beträgt das Risiko einer Progression zum aktiven Myelom in den ersten fünf Jahren 10 % pro Jahr, in den nächsten fünf Jahren 3 % pro Jahr und in den nächsten 10 Jahren 1 % bis 2 % pro Jahr. Weitere Informationen finden Sie in der IMFPublikation Understanding MGUS and Smoldering Multiple Myeloma.
Tabelle 1. Definition der MGUS und des Myeloms
NAME DEFINITION
MGUS
• Monoklonales Protein liegt vor, aber normalerweise < 3,0 g/dL
• Keine CRAB-Merkmale oder anderen Indikatoren eines aktiven Myeloms
• Monoklonale Plasmazellen im Knochenmark < 10 %
SMM
• Höheres Ausmaß der Erkrankung als MGUS: Serum-M-Komponente > 3,0 g/dL und/oder Plasmazellen im Knochenmark zwischen 10 und 60 %, aber
• Keine CRAB-Merkmale oder anderen Indikatoren eines aktiven Myeloms
Statistiken über das Myelom
In den Vereinigten Staaten gab es nach Angaben des SEER-Programms (Surveillance, Epidemiology and End Results) des National Cancer Institute im Jahr 2021 etwa 34.920 neue Fälle von Myelom; das sind 1,8 % aller neuen Krebsfälle. Nach den neuesten verfügbaren SEER-Daten lebten in den USA im Jahr 2018 schätzungsweise 149.956 Menschen mit Myelom.
Wie in der Zeitschrift Oncologist im Jahr 2020 veröffentlicht, weist die globale Inzidenz des Myeloms signifikante regionale Unterschiede auf, was darauf hindeutet, dass die Erkrankung in vielen Teilen der Welt unzureichend diagnostiziert und in weiterer Folge suboptimal behandelt wird. Der Artikel unterstreicht nicht nur die Bedeutung wirtschaftlicher Ressourcen, sondern auch, wie wichtig der Zugang zu qualitativ hochwertiger Gesundheitsversorgung und Patientenaufklärung ist, sodass sowohl die Diagnosestellung als auch die Überlebensraten für MyelomPatienten weltweit verbessert werden können.
Die Erkrankung wird am häufigsten bei Personen im Alter von 65 bis 74 Jahren diagnostiziert, jedoch mittlerweile auch bei unter 50-Jährigen. Nur 5 bis 10 % der Patienten sind jünger als 40 Jahre. Myelom bei Kindern ist extrem selten.
Männer entwickeln mit größerer Wahrscheinlichkeit ein Myelom als Frauen. Personen mit afrikanischen Wurzeln sind doppelt so häufig vom Myelom betroffen. Es scheint, dass die Inzidenz des Myeloms in einigen Teilen der Welt ansteigt, besonders in Asien.
6 +1.818.487.7455 • +1.800.452.CURE
Etwa 5 bis 7 % aller Myelomdiagnosen betreffen Personen, die eine(n) nahe(n) Verwandte(n) mit MGUS-, SMM- oder Myelom-Diagnose in der Familie haben. Wenn Sie eine(n) nahe(n) Verwandte(n) mit einer dieser Diagnosen in der Familie haben, informieren Sie Ihren Hausarzt, um diese Informationen in Ihre Krankenakte aufzunehmen. Das gilt natürlich auch umgekehrt: Teilen Sie Ihren Familienangehörigen mit, wenn Sie mit MGUS, SMM oder Myelom diagnostiziert wurden, sodass auch diese Personen ihre Ärzte entsprechend informieren können.
Ursachen oder Auslöser eines Myeloms
Die Exposition gegenüber Stoffen, die das Immunsystem unterdrücken oder stören, sowie Infektionen mit krebsverursachenden Viren wurden bislang als Ursachen oder Auslöser eines Myeloms identifiziert. Zu identifizierten giftigen Chemikalien zählen:
¡ Benzol.
¡ Dioxine (wie z. B. in Agent Orange).
¡ Landwirtschaftliche Chemikalien (z. B. Entlaubungsmittel und Pestizide).
¡ Lösungsmittel.
¡ Brennstoffe.
¡ Motorabgase.
¡ Reinigungsmittel.
Zu den auslösenden Viren, die potenziell mit dem Myelom in Verbindung stehen, gehören HIV (das AIDS-Virus), Hepatitis, einige Herpesviren und das Simian-Virus 40 (SV40, eine Verunreinigung in Sabin-PolioImpfstoffpräparaten, die zwischen 1955 und 1963 verwendet wurden).
Erhalten Sie die richtige Diagnose
Das Myelom ist eine sehr individuell verlaufende Erkrankung. Oft schreitet es nur langsam voran. In anderen Fällen kann es sehr aggressiv verlaufen. Ein erfahrener Hämatologe-Onkologe, der sich auf Myelom und andere Erkrankungen der Plasmazellen spezialisiert hat, kann die richtige Diagnose stellen und einen Behandlungsansatz wählen, der optimal auf Ihre individuelle Situation zugeschnitten ist.
Ein Onkologe vor Ort arbeitet pro Jahr möglicherweise nur mit sehr wenigen oder gar keinen Myelompatienten. Myelom-Spezialisten in großen Behandlungszentren mit hohem Patientenvolumen und akademischen Einrichtungen sehen Hunderte von Myelompatienten, führen klinische Studien mit neuen Medikamenten und neuen Kombinationstherapien durch und entwickeln das Fachwissen, das
7 myeloma.org
Tabelle 2. Mit dem Myelom verbundene medizinische Probleme
AUSWIRKUNGEN DER VERMEHRUNG DER MYELOMZELLEN IM KNOCHENMARK
CRAB -Kriterien
C – Erhöhung des Kalziumwerts im Blut
Freisetzung von Kalzium aus den geschädigten Knochen in die Blutbahn.
• Verwirrtheit
• Dehydration
• Verstopfung
• Müdigkeit und Erschöpfung
• Schwäche
• Renale Probleme
bzw. Nierenschäden
R – Renale Probleme –Nierenschäden/versagen
Die durch die Myelomzellen produzierten abnormen monoklonalen Proteine werden in den Blutstrom freigesetzt und können in den Urin gelangen und Nierenschäden verursachen. Ein hoher Kalziumwert im Blut, Infektionen und andere Faktoren können ebenfalls einen Nierenschaden verursachen oder dessen Schwere steigern.
A – Anämie Verminderung der Anzahl und Aktivität der rote Blutkörperchen produzierenden Zellen im Knochenmark.
B – Knochenschäden
• Ausdünnung (Osteoporose) oder
• Areale mit schweren Schädigungen (als lytische Läsionen bezeichnet), Brüche oder Einbrüche eines/ mehrerer Wirbelkörper
Zusätzliche Typen einer Organdysfunktion
Die Myelomzellen aktivieren Osteoklastenzellen, die den Knochen zerstören, und hemmen Osteoblastenzellen, die normalerweise den geschädigten Knochen reparieren.
• Träger Blutkreislauf
• Müdigkeit und Erschöpfung
• Verwirrtheit
Abnorme
Immunfunktion
Lokale oder systemische Auswirkungen des Myeloms, die nicht den CRAB-Merkmalen entsprechen.
Die Myelomzellen reduzieren die Anzahl und Aktivität normaler Plasmazellen, die in der Lage sind, Antikörper gegen Infektionen zu produzieren.
• Müdigkeit und Erschöpfung
• Schwäche
• Knochenschmerzen
• Fraktur oder Kollaps eines Knochens
• Knochenauftreibungen
• Schädigung von Nerven oder Rückenmark
• Neuropathie
• Häufige Infektionen
• Blutungsprobleme
• Andere individuelle Probleme
• Anfälligkeit für Infektionen
• Langwierige Erholung von Infektionen
8 +1.818.487.7455 • +1.800.452.CURE
URSACHE AUSWIRKUNG AUF DEN PATIENTEN
erforderlich ist, um geeignete Entscheidungen zu treffen. Erfahrene Myelom-Spezialisten sind in der Lage, sich bereits im Vorfeld auf behandlungsbedingte Probleme einzustellen und diesen vorzubeugen.
Auch wenn es keinen Spezialisten in Ihrer Nähe gibt, empfehlen wir Ihnen, in jedem Fall eine zweite Expertenmeinung einzuholen, entweder im Rahmen eines Arztbesuchs oder telefonisch bzw. per Videokonferenz. Ihr Hausarzt kann ebenfalls eine Beratung mit einem Myelom-Spezialisten organisieren, um Ihren konkreten Fall zu besprechen und anschließend für Ihre Behandlung mit ihm zusammenzuarbeiten.
Eine im Jahr 2016 veröffentlichte breitangelegte Studie zeigt, dass die Gesamtüberlebensrate (OS) von Patienten, die in großen Behandlungszentren bzw. großen Universitätskliniken betreut werden, höher ist als bei Patienten, die in kleineren Arztpraxen behandelt werden. Aus diesem Grund empfehlen wir Ihnen dringend, einen MyelomSpezialisten zu konsultieren.
Kriterien für die Myelom-Diagnose
Die sogenannten „CRAB“-Kriterien umfassen die häufigsten medizinischen Probleme, die durch ein Myelom verursacht werden:
¡ Erhöhter Calcium-Spiegel im Blut
¡ Nierenschäden (im medizinischen Fachjargon als Renale Schädigung bezeichnet)
¡ Niedrige Zahlen von Blutkörperchen (besonders der roten Blutzellen, auch Anämie genannt)
¡ Skelettkomplikationen (Bone damage)
Über lange Zeit waren die CRAB-Kriterien die einzige Grundlage für die Diagnose des aktiven Myeloms. Wenn diese Anzeichen, die darauf hindeuteten, dass das Myelom bereits eine sogenannte „EndorganSchädigung“ verursacht hatte, nicht vorlagen, wurden die Patienten zwar regelmäßig untersucht, aber nicht behandelt.
Innerhalb der letzten Jahre bewirkten effektivere Behandlungsmöglichkeiten des Myeloms und bessere Methoden zur Erkennung früher Krankheitsstadien jedoch eine Änderung des Behandlungsparadigmas.
Mitglieder der International Myeloma Working Group (IMWG), des Forschungsarms der IMF, untersuchten Patienten mit asymptomatischem SMM auf biologische Marker, die die Vorhersage ermöglichen, dass eine Endorgan-Schädigung innerhalb von 18 Monaten bis 2 Jahren eintreten würde. Nach Abschluss und Veröffentlichung dieser Forschungsarbeiten
9 myeloma.org
verfasste die IMWG neue Leitlinien für die MyelomDiagnose, die nun drei neue „Myelom-definierende Ereignisse“ umfassen (MDEKriterien). Die folgenden MDE-Kriterien weisen unabhängig voneinander auf die Notwendigkeit einer Behandlung hin:
1. ≥ 60%ige Infiltration von Plasmazellen im Knochenmark.
2. Quotient involvierter und nicht-involvierter freier Leichtketten beträgt ≥ 100. (nichtinvolvierte Leichtketten sind jene, die nicht von Myelomzellen gebildet werden)
3. Vorhandensein von mehr als einer fokalen Läsion, festgestellt mittels Magnetresonanztomographie (MRT).
Diese drei MDE-Kriterien können durch Tests erkannt werden, die Teil der Myelom-Bestimmung bei jedem neu diagnostizierten Patienten sein sollten:
¡ Knochenmark-Biopsie.
¡ Freelite®-Test (Leichtketten-Assay im Serum).
¡ MRT-Scan.
Stadiumeinteilung des Myeloms
Das Erkrankungsstadium ist bei jedem diagnostizierten Myelompatienten unterschiedlich.
Es wurde 1975 eine Stadieneinteilung nach Durie und Salmon eingeführt (Durie-Salmon Staging System; DSS). Das DSS zeigt die Korrelation zwischen der Menge der Myelomzellen und dem dadurch verursachten Schaden. Bei einigen Patienten, die eine große Menge an M-Protein erzeugen, kann die Anzahl der Myelomzellen ziemlich niedrig sein. Umgekehrt kann bei Patienten mit niedriger M-Proteinproduktion die Anzahl der Myelomzellen sehr hoch sein.
10 +1.818.487.7455 • +1.800.452.CURE
- +
Myelomzellen Lytische Läsionen
GESUNDER KNOCHEN
MULTIPLES MYELOM
Abbildung 2. Gesunder Knochen im Vergleich mit Myelom-Knochen
© 2017
Slaybaugh Studios
Abbildung 3. Definitionen von Myelom und frühem Myelom
CRAB-Kriterien
Myelom-de nierende Ereignisse (MDE)
Plasmazellen im Knochenmark ≥ 60%
Verhältnis monoklonaler zu normalen Leichtketten ≥100
>1 fokale Läsion in der MRT
Spanische Kriterien
Mayo-Kriterien
MM Multiples Myelom
Frühes aktives Myelom Schwelendes Myelom mit extrem hohem Risiko (Ultra-High-Risk Smoldering Myeloma)
HR SMM Schwelendes multiples Myelom mit hohem Risiko (High-Risk Smoldering Multiple Myeloma)
LR SMM Schwelendes multiples Myelom mit geringem Risiko (Low-Risk Smoldering Multiple Myeloma)
MGUS Monoklonale Gammopathie unbestimmter Signi kanz
Im Jahr 2005 entwickelte die IMWG das International Staging System (ISS), das prognostische Faktoren und erwartete Überlebensraten heranzieht. Das ISS bewertet Krankheitsmuster mit hoher prognostischer Aussagekraft für aggressives Myelom. Das ISS basiert auf vier hochprädiktiven Markern für aggressive Erkrankungen:
1. beta2-Mikroglobulin im Serum (S β2M),
2. Serum-Albumin (S ALB),
3. C-reaktives Protein (CRP) und
4. Serum-Lactatdehydrogenase (LDH).
Im Jahr 2015 veröffentlichte die IMWG das Revised International Staging System (R-ISS), das das ISS mit zwei Tests auf Chromosomenanomalien kombiniert. Wir empfehlen dringend, diese chromosomalen
Untersuchungen an einer Knochenmarkprobe vorzunehmen, die zum Zeitpunkt der Diagnose entnommen wurde.
¡ Zytogenetik (Karyotypisierung),
¡ FISH-Test (Fluoreszenz-in-situ-Hybridisierung).
Notwendige Untersuchungen
Ein Laborbluttest kann die Proteine im Blut, S β2M, S ALB, CRP und LDH, auswerten.
11 myeloma.org
MM HR SMM LR SMM Frühes aktives Myelom MGUS
STADIUM KRITERIEN GEMESSENE MYELOM-ZELLMASSE (Myelomzellen im ganzen Körper)
STADIUM I (geringe Zellmasse)
Jedes der folgenden Kriterien:
• Hämoglobinwert > 10 g/dL
• Serum-Kalzium-Spiegel normal oder < 10,5 mg/dL
• Röntgenuntersuchung der Knochen, normale Knochenstruktur (Stufe 0) oder nur solitäres Knochenplasmozytom
• Niedrige M-Komponenten-Produktion IgG-Wert < 5 g/dL; IgA-Wert < 3 g/dL
• Leichtketten-M-Komponente im Urin bei Elektrophorese < 4 g/24 Std
600 Milliarden/m2
STADIUM II (mittlere Zellmasse)
STADIUM III (große Zellmasse)
Entspricht weder den Kriterien für Stadium I noch für Stadium III
Mindestens eines der folgenden Kriterien:
• Hämoglobinwert < 8,5 g/dL
• Serum-Kalzium-Spiegel > 12 mg/dL
• Fortgeschrittene lytische Knochenläsionen (Stufe 3)
• Hohe M-Komponenten-Produktion IgG-Wert > 7 g/dL; IgA-Wert > 5 g/dL
• Leichtketten-M-Komponente im Urin < 12 g/24 Std
600 bis 1200 Milliarden/m2
> 1200 Milliarden/m2
UNTERGRUPPIERUNG (entweder A oder B)
Tabelle
• A: relativ normale Nierenfunktion (Serumkreatinin-Wert) < 2,0 mg/dL
• B: abnorme Nierenfunktion (Serumkreatininwert) > 2,0 mg/dL
PROGNOSTISCHE FAKTOREN
ISSStadium I
KRITERIEN
Serum-β2-Mikroglobulin < 3,5 mg/L, Serumalbumin ≥ 3,5 g/dl
II weder ISS Stadium I noch III
III
CA nach FISH Hohes Risiko
Serum β2-Mikroglobulin ≥ 5,5 mg/L
Vorhandensein von del(17p) und/oder Translokation t(4;14) und/oder Translokation t(14;16)
Standardrisiko Keine Risiko-CA
LDH Normal Serum LDH < oberer Grenzwert des Normalbereichs
Hoch Serum LDH > oberer Grenzwert des Normalbereichs
Ein neues Modell zur Risikostratifizierung für das multiple Myelom
R-ISSStadium I
II
III
ISS-Stadium I und Standard-Risiko-CA nach FISH und normale LDH
R-ISS-Stadium weder I noch III
ISS-Stadium III und entweder Hochrisiko-CA nach FISH oder hohe LDH
Abkürzungen: CA, Chromosomenanomalien; FISH, Interphasen-Fluoreszenz- in-situ- Hybridisierung; ISS, Internationales Staging-System; LDH, Lactatdehydrogenase; R-ISS, Revised International Staging System.
12 +1.818.487.7455 • +1.800.452.CURE
Tabelle 3. Durie-Salmon-Klassifizierung
4. Standardrisikofaktoren für Myelom und R-ISS
Tabelle 5. Prognostische Faktoren TEST SIGNIFIKANZ
Serum-ß2-Mikroglobulin (S β2M)
Je höher der Spiegel ist, desto fortgeschrittener ist das Stadium
Serum-Albumin (S-ALB) Je niedriger der Spiegel ist, desto fortgeschrittener ist das Stadium
C-reaktives Protein (CRP) Bei aktiver Erkrankung erhöht.
Laktatdehydrogenase (LDH) im Serum Bei aktiver Erkrankung erhöht.
Abnorme Chromosomen bei Zytogenetik des Knochenmarks und Fluoreszenz-insitu-Hybridisierung (FISH)
Mehrere Chromosomen-Deletionen und -Translokationen werden als hohes Risiko betrachtet; sie können mit einer kürzeren Remission assoziiert sein
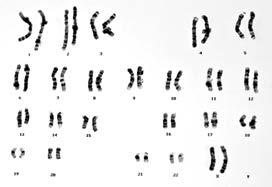
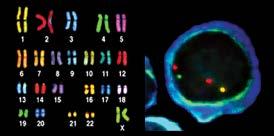
Zytogenetik ist eine labortechnische Beurteilung von Chromosomen in sich teilenden Myelomzellen. Die aktive Wachstumsrate von Myelomzellen ist in der Regel sehr niedrig. Weniger als 3 % und oft weniger als 1 % der Zellen vermehren sich. Dies ermöglicht eine nur unvollständige Beurteilung der vorhandenen Chromosomenveränderungen. Nichtsdestotrotz sind Anomalien, wenn sie bemerkt werden, wichtig, vor allem deswegen, weil sie in den wenigen Zellen auftreten, die tatsächlich wachsen.
Der FISH-Test ist die Bewertung der Chromosomen aller Myelomzellen in einer Knochenmarkprobe. Unabhängig davon, ob Myelomzellen wachsen oder nicht, ermöglicht FISH die Erkennung von Veränderungen. Spezielle fluoreszierende (leuchtende) Genproben werden der Knochenmarkprobe hinzugefügt. Diese Proben folgen dem genetischen Material nach der Zellteilung und zeigen das Vorliegen oder Fehlen von Chromosomenanomalien an, von denen man weiß, dass sie bei einem Myelom auftreten. Jedem Chromosom wird eine Probe in einer anderen Farbe zugewiesen. Wenn z. B. genetisches Material von Chromosom 4 falsch mit Chromosom 14 verbunden ist, erscheinen die verschiedenfarbigen Punkte des genetischen Materials dieser Chromosomen zusammen und zeigen die Hochrisiko-Anomalie t(4;14) an, die für „Translokation von genetischem Material zwischen den Chromosomen 4 und 14“ steht. Weitere Hochrisiko-Anomalien sind t(14;16), t(14;20), 17p-, was so viel bedeutet wie „Verlust des kurzen Arms (oberen Teils) von Chromosom 17” sowie 1q+, die Kurzform für „ein zusätzlicher langer Arm (unterer Teil) an Chromosom 1“. Das Vorliegen von Translokationen, fehlenden Stücken, zusätzlichen Stücken und einem Verlust von Chromosomen kann durch den FISH-Test erkannt werden.
Das Vorhandensein von anormalen Chromosomen ist in der Regel mit einer schlechten Prognose verbunden – wobei es sich hier um eine Tendenz, keinen garantierten Verlauf handelt. So kann es zum Beispiel
13 myeloma.org
Abbildung 4. Karyotyp-Analyse von menschlichen Chromosomen
Abbildung 5. Fluoreszenz-in-situ-Hybridisierung (FISH) einer Myelomzelle
Abbildung 6. Chromosomenanomalien beim Hochrisiko-Myelom Löschung
Translokation
14 +1.818.487.7455 • +1.800.452.CURE
rund einem Drittel der Patienten mit sogenannten Hochrisiko-Anomalien gut gehen, und es zeigen sich gute Ergebnisse mit den aktuellen Standardtherapieansätzen, etwa der Induktionstherapie gefolgt von einer autologen Stammzellentransplantation.
Grundlegende Untersuchungen
Knochenmarkbiopsie:
Anhand dieses entscheidenden Tests werden sowohl das Vorliegen als auch der Prozentsatz der Myelomzellen im Knochenmark bestimmt. In Stadium I der Erkrankung oder beim solitären Plasmozytom ist unter Umständen eine direkte Biopsie der Tumormasse notwendig. Die zytogenetische Untersuchung, für die eine frische Knochenmarkprobe erforderlich ist, kann gute oder schlechte Chromosomenmerkmale identifizieren.
Blutuntersuchungen:
Abbildung 7. Zusammensetzung des Blutes
Plasma
Blutplättchen (Thrombozyten)
Rote Blutkörperchen (Erythrozyten) Weiße Blutkörperchen (Leukozyten)
¡ Ein großes Blutbild wird verwendet, um das Vorliegen und den Schweregrad einer Anämie, einer niedrigen Anzahl weißer Blutkörperchen und einer niedrigen Thrombozytenzahl zu beurteilen.
¡ Mit einem Blutchemieprofil werden Nierenfunktion (Kreatinin und BUN) und Leberfunktion sowie Albumin, Kalziumspiegel und LDH ausgewertet.
¡ Die Serumproteinelektrophorese (SPEP) misst die Menge des abnormen Myelom-Schwerkettenproteins und zeigt das Vorhandensein einer abnormalen M-Erhöhung (Spike).
¡ Mittels Immunfixationselektrophorese können die Typen der Schwerketten (G, A, D, E und M) und Leichtketten (Kappa [κ], Lambda [λ]) des Myelomproteins nachgewiesen werden.

¡ Mittels Freelite-Assay® können die Anzahl der freien Kappa- oder Lambda-Leichtketten sowie das Kappa-zu-Lambda-Verhältnis bestimmt werden, wenn mit SPEP (Serumproteinelektrophorese) oder UPEP (Eiweiß-Elektrophorese im Urin) keine Anomalien festgestellt wurden.
¡ Ein Hevylite®-Assay kann verwendet werden, um den normalen und anormalen Wert intakter Immunglobuline zu bestimmen.
15 myeloma.org
©
2015 Slaybaugh Studios
Urintests:
Abbildung 8. SPEP-Testergebnisse
Abnormales Ergebnis mit Myelomzellen, die das M-Protein produzieren, wodurch ein M-Spike in der Beta-2-Zone entsteht
Mittels Eiweiß-Elektrophorese im Urin (UPEP) kann die M-Proteinmenge im Urin nachgewiesen werden. Mittels Immunfixation kann die Art des M-Proteins nahgewiesen werden.
Knochenuntersuchungen: Präsenz, Schweregrad und Position einer Knochenschädigung können anhand der folgenden Faktoren beurteilt werden:
¡ Röntgenaufnahmen weisen zwar bei der Mehrheit aller MyelomPatienten eine charakteristische Knochenerkrankung nach, können aber bei etwa 25 % der Patienten mit aktivem Myelom einen negativen Befund liefern. Eine weitere Bildgebung mit GanzkörperMRT, Ganzkörper-Niedrigdosis-CT oder PET/CT ist erforderlich, um eine mögliche Knochenbeteiligung auszuschließen. Benötigt wird eine komplette Aufnahme des Skeletts mittels einer Reihe von Röntgenuntersuchungen, um ein Myelom zu identifizieren und den myelombedingten Verlust oder die Ausdünnung von Knochen (Osteoporose oder Osteopenie) sowie lytische Läsionen und/oder Brüche oder Einbrüche des Knochens aufzuzeigen.
¡ Mittels Magnetresonanztomographie (MRT) kann festgestellt werden, ob und wie sich die Krankheit im Knochenmark ausgebreitet hat, falls eine Röntgenuntersuchung keine Knochenschäden zeigt, und es können bestimmte Bereiche wie Wirbelsäule und/oder Gehirn präzise getestet werden. Sie kann Erkrankungsareale außerhalb des Knochens aufzeigen, zum Beispiel Nervenkompressionen und/oder Auswirkungen auf das Rückenmark.
¡ Eine Computertomographie (CT) wird verwendet, wenn Röntgenuntersuchungen negativ ausfallen, und/oder für eine
16 +1.818.487.7455 • +1.800.452.CURE
Albumin alpha-1 alpha-2 beta-1 gamma beta-2 Albumin alpha-1 alpha-2 beta-1 beta-2 gamma Normales SPEP-Ergebnis Albumin alpha-1 alpha-2 beta-1 gamma beta-2 Albumin alpha-1 alpha-2 beta-1 beta-2 gamma
detaillierte Messung einzelner Bereiche. Dies ist besonders hilfreich für die detaillierte Bewertung kleiner Areale mit möglichen Knochenschäden oder Nervenkompressionen.
¡ Die Positronen-Emissionstomografie (PET) ist eine hochempfindliche Ganzkörper-Scantechnik. FDG/PET- oder PET/CT-Scans sind bei der Krankheitsüberwachung äußerst nützlich, insbesondere bei nichtsekretorischen Myelompatienten. Eine Computertomographie wird für eine Bewertung der Areale mit PET-positiver Erkrankung verwendet.
¡ Knochendichtemessungen bewerten bei Myelompatienten die Schwere des diffusen Knochenverlusts und die fortlaufende Verbesserung durch Bisphosphonat-Therapien.
¡ Nuklearmedizinische Scans sind bei Myelompatienten nicht sinnvoll und sollten nur durchgeführt werden, um andere Diagnosen auszuschließen.
Weitere Informationen zu Tests, die beim Myelom verwendet werden, finden Sie in der IMF-Publikation Understanding Your Test Results.
Mögliche dringende Probleme bei Diagnose
Da oft die Wirbel vom Myelom betroffen sind und das Knochenmark durch diese Wirbel verläuft, sind schmerzhafte Wirbelfrakturen, die die Nerven einklemmen, nicht selten. Ein Verlust der motorischen Nerven kann zu Lähmungen führen. Myelom-Tumore, die in den Wirbel wachsen, können auf die Nerven im Rückenmark drücken. Kalkabbau in den Knochen kann zu einem starken Anstieg der Kalziumwerte im Blut, einer Hyperkalzämie, führen. Sowohl die Hyperkalzämie als auch hohe Werte des monoklonalen Proteins im Blut können die Nieren schwer schädigen und zu einem Nierenversagen führen.
Wirbelkörperkompressionsfrakturen, Schädigung der Nerven des Rückenmarks, Infektionen und Nierenversagen sind medizinische Notfälle, die vor der systemischen Myelom-Therapie behandelt werden müssen. Wir empfehlen, dies mit einem Myelom-Spezialisten abzuklären, damit durch die Behandlung dieser dringenden Probleme die späteren, das Myelom betreffenden therapeutischen Möglichkeiten nicht eingeschränkt werden. Zum Beispiel ist die Bestrahlung zur Verkleinerung des Plasmozytoms, das auf Nervengewebe drückt, sorgfältig mit einem chirurgischen Eingriff abzuwägen: Die Bestrahlung kann das Knochenmark dauerhaft schädigen und je nach Lage des Tumors und Stärke der Bestrahlung die späteren Behandlungsoptionen einschränken.
17 myeloma.org
Myelomtypen
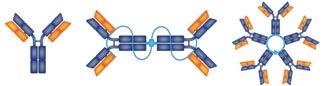
Es gibt verschiedene Arten und Subtypen des Myeloms, die von der Art des Immunglobulins, das von den Myelomzellen produziert wird, abhängen. Die fünf Arten von normalen schwerkettigen Immunglobulinen – IgG, IgA, IgD, IgE und IgM – erfüllen jeweils unterschiedliche Funktionen im Körper.
Jedes Immunglobulin besteht aus zwei schweren und zwei leichten Ketten Die zwei Arten von Leichtketten sind Kappa (κ) und Lambda (λ). Die Typisierung des Myeloms erfolgt mittels Immunfixationselektrophorese (IFE).
Myelomzellen produzieren nur eine einzige Art von monoklonalem Protein, eine Gruppe identischer Zellen aus einer gemeinsamen Vorläuferzelle. Rund 65 % der Myelompatienten haben ein IgG-Myelom mit entweder Kappa- oder Lambda-Leichtketten. Am nächsthäufigsten tritt das IgA-Myelom auf, ebenfalls entweder mit Kappa- oder LambdaLeichtketten. IgM-, IgD- und IgE-Myelome treten hingegen sehr selten auf.
Circa ein Drittel der Myelompatienten produzieren zusätzlich zur gesamten Molekülverbindung aus an Schwerketten gebundenen Leichtketten freie Leichtketten. Bei etwa 15 – 20 % der Patienten produzieren die Myelomzellen nur Leichtketten, aber keine Schwerketten. Dies wird als Leichtketten- oder Bence-Jones Myelom bezeichnet, das nach dem englischen Arzt benannt ist, der 1848 Leichtketten erstmals identifizierte und seine Erkenntnisse veröffentlichte. Monoklonale Leichtkettenproteine sind kleiner und wiegen weniger als Schwerketten, sodass sie durch die winzigen Kapillaren passen, die das Blut zu den Nieren leiten. Die Ablagerung von Leichtketten, die über das Blut zu den Nieren gelangen, kann dazu führen, dass die Nierenkanälchen blockiert werden, was zu einer verminderten Nierenfunktion führt.
In seltenen Fällen (nur 1 – 2 % der Patienten) wird von den Myelomzellen entweder nur sehr wenig oder gar kein monoklonales Protein produziert.
Abbildung 9. Strukturen von Immunglobulinen
18 +1.818.487.7455 • +1.800.452.CURE
IgM IgA IgG,
IgE, IgD
Hier spricht man vom asekretorischen Myelom. Allerdings kann der sogenannte Freelite®-Test kleinste Mengen von Leichtketten bei 70 % dieser kaum sekretierenden Patienten im Blut nachweisen. Eine von der Mayo Klinik mit 124 Patienten durchgeführte Studie, die 2015 veröffentlicht wurde, hat ergeben, dass das Überleben von Patienten mit asekretorischem Myelom höher zu sein scheint als das von Patienten mit einem sekretorischen Myelom.
Die Relevanz der richtigen Identifikation
Ihres Myelomtyps
Wenn Sie Ihre Art von Myelom kennen, können Sie Ihre Testergebnisse im Verlauf Ihrer Behandlung besser verstehen und nachverfolgen. Der Freelite-Test wird mit SPEP kombiniert, um die Konzentration der von den Myelomzellen produzierten Leichtketten- und Schwerketten-M-Proteine zu analysieren. Die Messung der Aktivität der Myelomzellen ist eine indirekte, aber effektive Möglichkeit, um die Krebsaktivität im Körper zu beurteilen. Die einzige Möglichkeit, Myelomzellen direkt zu analysieren, ist eine Knochenmarkbiopsie.
Um Ihr Ansprechen auf die Behandlung zu beurteilen und Ihren Status in einer Remissionsphase zu beobachten, werden regelmäßig Tests zur Überwachung Ihrer M-Proteinmenge und diverse andere Analysen durchgeführt. Wir empfehlen Ihnen dringend, Ihre Testergebnisse fortlaufend aufzuzeichnen und sich mit den beim Myelom verwendeten Tests vertraut zu machen. In diesem Sinne möchten wir Sie erneut dazu einladen, die IMF-Veröffentlichung Understanding Your Test Results zu lesen.
So verhalten sich die unterschiedlichen Myelom-Typen
¡ Das IgG-Myelom ist der häufigste Myelom-Typ und zeigt die üblichen CRAB-Merkmale.
¡ Das IgA-Myelom zeigt sich gelegentlich durch Tumore außerhalb des Knochenmarks.
¡ Das IgD-Myelom kann von einer Plasmazellleukämie begleitet sein und sich durch eine große Anzahl an Myelomzellen im Blut äußern. Das IgD-Myelom ist außerdem dafür bekannt, Nierenschäden zu verursachen.
¡ Das Leichtketten-Myelom führt am häufigsten zur Nierenschädigung und/oder zu Ablagerungen von Leichtketten in den Nieren und/ oder im Nervengewebe oder anderen Organen. Abhängig von den Merkmalen der Leichtkettenablagerungen spricht man entweder von einer Leichtketten-Amyloidose (AL-Amyloidose) oder einer Leichtkettenablagerungserkrankung (LCDD).
19 myeloma.org
Zwei andere Erkrankungen der Plasmazellen sind der Morbus Waldenström (WM), der mit monoklonalem IgM-Protein assoziiert ist, und das POEMS-Syndrom, eine seltene Krankheit, die mit Neuropathie, vergrößerten Organen, endokrinen Störungen, monoklonalem Protein und Hautveränderungen einhergeht.
Die Auswirkungen des Myeloms im Knochenmark
Myelomzellen setzen verschiedene Proteine und andere Substanzen in das lokale Mikro-Milieu des Knochenmarks und direkt in das Blut frei. Alle Blutzellen – weiße Blutzellen, rote Blutzelle und Thrombozyten – werden im Knochenmark hergestellt. Wenn das Myelom im Knochenmark wächst, ist eine der Auswirkungen eine Reduzierung der Blutzellenproduktion. Die Anämie, eine niedrige Anzahl von roten Blutzellen, ist ein frühzeitiges und häufiges Symptom des Myeloms.
Die Zellen des gesunden Knochenmarks sorgen in unserem Skelett für einen dynamischen, ausgewogenen Prozess des Abbaus und Aufbaus von Knochen. Das Vorhandensein von Myelomzellen im Knochenmark regt die Zellen an, die Knochen abbauen (Osteoklasten) und hemmen die Zellen, die neuen Knochen bilden (Osteoblasten). Dadurch kommt das System aus dem Gleichgewicht, es entstehen Knochenschmerzen und Brüche und es wird Kalzium in das Blut freigesetzt.
Auswirkungen des Myeloms außerhalb des Knochenmarks
Wenn sich Myelomzellen im Knochenmark vermehren und aufbauen, wird M-Protein in das zirkulierende Blut freigesetzt. M-Protein kann in unterschiedlichen Körperregionen Gewebeschäden verursachen.
Recht häufig treten zum Beispiel Nierenschäden auf. Außerdem kann M-Protein die Blutgerinnung und/oder den Blutkreislauf beeinträchtigen und so weitere Organ- und Gewebeschäden verursachen, darunter
Schäden des Nervengewebes (periphere Neuropathie, PN).
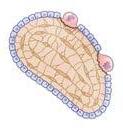
Abbildung 10. Anatomie des Knochenaufbaus
Spongiosa mit rotem Knochenmark Knochenkompakta gelbes Knochenmark
Osteoklast (knochenabbauend)
Osteozyt
Osteoblast (knochenbildend)
20 +1.818.487.7455 • +1.800.452.CURE
© 2017 Slaybaugh Studios
Tabelle 6. Myelom-Typen und verwandte Erkrankungen ERKRANKUNGSTYP BESCHREIBUNG
Myelom: IgG κ oder λ IgA κ oder λ
Seltenere Subtypen: IgD, E oder M
Leichtketten- oder Bence-Jones-Myelom: κ- oder λ-Typen
Nicht-sezernierendes
Myelom: κ- oder λ-Typen
IgM-Myelom:
κ- oder λ-Subtypen
Amyloidose:
AL- oder ImmunglobulinLeichtketten-Typ
κ- oder λ-Subtypen
• Typisches Myelom: Mehrzahl der Patienten.
• Kontrolliert durch den Nachweis des monoklonalen Proteins im Serum mittels SPEP (IgG) und/oder quantitativer Immunglobulin (QIG)-Messung (IgA/D/E). Für das IgA-Myelom ist die quantitative Immunoglobulin-Messung häufig zuverlässiger.
• Bence-Jones-Myelom: etwa 15–20 % der Patienten.
• Kontrolliert durch den Nachweis der monoklonalen Leichtketten im Urin mittels UPEP und/oder der Messung der freien Leichtketten im Serum (Freelite®).
• Weniger häufiges Myelom: 1–2 % der Patienten.
• Da sowohl SPEP als auch UPEP negativ sind (kein monoklonaler Spike im Serum oder Urin), wird die Erkrankung anhand des Freelite®-Tests kontrolliert.
• Das IgM-Myelom ist ein sehr seltener Subtyp.
• Normalerweise tritt die IgM-Produktion beim sogenannten Morbus Waldenström auf, der mehr ein Lymphom (Lymphdrüsenkrebs) als ein Myelom ist. Letzteres ist ein Knochenmarkkrebs.
• Bei der Amyloidose werden die Leichtketten im Gewebe linear angeordnet (β-Faltblatt), anstatt zu zerfallen und/oder über den Urin ausgeschieden zu werden.
• Es gibt verschiedene Variationen der Amyloidose, die das Ablagern verschiedener Proteintypen umfassen. Bei Alzheimer bilden sich z. B. Proteinablagerungen im Gehirn.
• Beim Myelom-assoziierten Amyloid können Leichtketten in vielen Geweben abgelagert werden, einschließlich Haut, Zunge, Herz, Nieren, Nerven, Lunge, Leber und Gedärmen.
• Das Gewebe verfärbt sich bei der „Kongo-Rot-Färbung“ positiv, was diagnostisch ist. Möglicherweise sind eingehendere Tests mit Massenspektroskopie und/oder Elektronenmikroskopie angemessen und notwendig.
Leichtkettenablagerungserkrankung (LCDD): κ- oder λ-Subtypen
• Bei LCDD werden die Leichtketten unorganisierter abgelagert (randomisierte Querverbindungen).
• Das Gewebe verfärbt sich bei direkter κ- oder λ-Immunfärbung positiv. Die Kongo-Rot-Färbung ist gewöhnlich negativ.
• Es gibt verschiedene Muster bei der Gewebeablagerung, die häufig die Nieren, die Auskleidung der Lungen (Brustfell) oder das Bauchfell (um die Gedärme) oder die Augen betreffen.
POEMS-Syndrom:
Normalerweise IgG oder IgA λ (selten κ-Subtyp)
• Das POEMS-Syndrom ist eine komplexe Erkrankung, die Polyneuropathie, Organomegalie, Endokrinopathie, monoklonale Gammopathie und Hautveränderungen umfasst. Es wird anders als das Myelom diagnostiziert und behandelt. Siehe Text zur Beschreibung.
21 myeloma.org
Abbildung 11. Wann mit der Behandlung von Myelom oder SMM zu beginnen ist
potenzielles neues Myelom oder SMM
Irgendwelche Myelom-de nierenden Ereignisse?
• CRAB
• ≥ 60% Plasmazellen









• FLC-Verhältnis ≥ 100
• >1 fokale Läsion in der MRT
Hochrisiko-SMM (mediane Zeit bis zur Progression ~ 2 Jahre)
SMM mit mittlerem oder niedrigem Risiko
Klinische Studien Beobachtungen
Behandlungsmöglichkeiten bei frisch diagnostiziertem Myelom
Eine umgehende und effektive Therapie ist für alle Myelompatienten, besonders aber für Patienten mit Hochrisiko-Merkmalen, wichtig. Dazu sind die Untersuchungen zum Diagnosezeitpunkt, die Stadiumeinteilung und die prognostische Klassifikation unerlässlich. Die wichtigste erste Entscheidung ist, wann Sie mit der Behandlung Ihres Myeloms beginnen sollen.
Die Behandlung des Myeloms hemmt Knochenabbau und Tumorwachstum sowie die verschiedenen Auswirkungen, die durch die Proteine des Myeloms und die von ihnen angeregten Zytokine verursacht werden.
Eine Behandlung wird für symptomatisch aktives Myelom und für asymptomatisches SMM mit MDE empfohlen. Wie dringend der Therapiebeginn ist, hängt von den speziellen Problemen/Befunden des einzelnen Patienten ab. Hier sind die Erfahrungen und das Know-how eines Myelom-Spezialisten von großer Hilfe.
Die signifikanten Fortschritte bei der Behandlung des Myeloms in den letzten Jahren haben die Möglichkeiten für neu diagnostizierte Patienten erweitert. Die veröffentlichten Serien zum besseren Verständnis der Erkrankung sind kostenlos bei der IMF erhältlich und beschäftigen sich unter anderem ausführlich mit Arzneimitteln und Wirkstoffen zur Behandlung von Myelom. Ab Februar 2022 gelten die folgenden Therapien für neu diagnostiziertes Myelom als von der FDA zugelassen:
22 +1.818.487.7455 • +1.800.452.CURE
Keine Myelomde nierenden Ereignissev
©2020 SV Rajkumar
Frühtherapie mit Revlimid oder Rd
als Myelom behandeln
¡ Darzalex® (Daratumumab) ist ein monoklonaler Antikörper, der intravenös verabreicht und in Kombination mit Velcade® (Bortezomib) + Thalidomid + Dexamethason (VTd) für Patienten zugelassen ist, die für eine ASCT geeignet sind, sowie in Kombination mit Revlimid® (Lenalidomid) + Dexamethason (Rd) oder Velcad + Melphalan + Prednison (VMP) bei Patienten, die für eine ASCT nicht geeignet sind.
¡ Darzalex Faspro® (Daratumumab und Hyaluronidase-FIHJ) wird durch subkutane Injektionen (unter die Haut) in Kombination mit VTd bei Patienten verabreicht, die für eine ASCT geeignet sind, bzw. mit Rd oder VMP bei Patienten, die für eine ASCT nicht geeignet sind.
¡ Dexamethason und andere Steroide werden typischerweise in Kombination mit einem oder mehreren anderen Wirkstoffen – oral oder intravenös – verabreicht.
Tabelle
Ziele der Myelombehandlung
BEHANDLUNGSART Stabilisierung Linderung
ZIEL Den lebensbedrohlichen Störungen auf Körperchemie und Immunsystem entgegenzuwirken
BEISPIELE • Plasmapherese, um das Blut zu verdünnen und einen Schlaganfall zu verhindern
• Hämodialyse, wenn die Nierenfunktion eingeschränkt ist
• Medikamente, um eine Hyperkalzämie zu reduzieren (dazu kann eine Chemotherapie gehören)
Beschwerden lindern und körperliche Funktionen des Patienten bessern
• Bestrahlung, um die Knochenzerstörung aufzuhalten
• Transfusion mit roten Blutkörperchen, um eine Anämie zu bessern
• Orthopädische Chirurgie, um Knochen zu reparieren und/oder zu stärken
ZEIT ZUR ENTSCHEIDUNG
Stunden bis Tage
BEHANDLUNGSART Remissionsinduzierend
ZIEL Symptome lindern, Verlauf der Erkrankung verlangsamen oder aufhalten
BEISPIELE • Therapie, um bösartige Zellen im gesamten Körper zu zerstören
• Strahlentherapie, um bösartige Zellen an einer bestimmten Stelle zu zerstören
Tage bis Monate
Kurativ
Dauerhafte Remission*
• Knochenmarktransplantation und Verabreichung einer hochdosierten Chemotherapie
ZEIT ZUR ENTSCHEIDUNG
Wochen bis Monate
Wochen bis Monate
*Heilung bedeutet das dauerhafte Überwinden einer Krankheit. „Funktionelle Heilung“ ist ein Begriff, der ein ausgezeichnetes Ansprechen auf die Behandlung beschreibt, sodass der Patient viele Jahre nach der Diagnose stabil und in Remission ist, wobei das Myelom selbst nicht vollständig eliminiert wurde.
23 myeloma.org
7.
¡ Revlimid® (Lenalidomid) ist ein oral verabreichter immunmodulatorischer Wirkstoff. Er ist Bestandteil mehrerer zugelassener Kombinationsbehandlungen in der Erstlinientherapie, einschließlich VRd (siehe unten).
¡ Thalidomid wurde im Jahr 2006 von der FDA für Myelom genehmigt und ist damit der erste zugelassene immunmodulatorische Wirkstoff seiner Art.
¡ Velcade® (Bortezomib) ist ein Proteasom-Hemmer. Er ist Bestandteil mehrerer zugelassener Kombinationsbehandlungen in der Erstlinientherapie, einschließlich VRd (siehe unten).
¡ Die VRd-Kombinationstherapie mit Velcade + Revlimid + Dexamethason gilt derzeit als Standardbehandlung für Patienten mit neu diagnostiziertem Myelom. Eine aktualisierte Analyse der klinischen Studie GRIFFIN, die im Dezember 2021 auf der Jahrestagung der American Society of Hematology (ASH) vorgestellt wurde, zeigte, dass die Zugabe von Darzalex zu VRD (D-VRD) bei Patienten mit neu diagnostiziertem Myelom, dir für eine ASCT in Frage kommen, sicher und wirksamer war als VRD allein und mit keinen zusätzlichen Sicherheitsbedenken oder negativen Auswirkungen auf die Stammzellmobilisierung verbunden war.
Andere wichtige Wirkstoffklassen, die von der FDA für die FrontlineBehandlung zugelassen sind, sind Alkylantien (z. B. Melphalan, Cyclophosphamid) und Anthrazykline (z. B. Doxorubicin, liposomales Doxorubicin), jedoch werden diese Medikamente selten verwendet, da aktivere Wirkstoffe verfügbar sind.
Wenn eine bestimmte Induktionstherapie nicht funktioniert, stehen zahlreiche Behandlungsmöglichkeiten zur Verfügung, die in diesem einleitenden Handbuch nicht behandelt werden. Es ist hingegen nicht empfehlenswert, rasch von einer zur nächsten Therapie überzugehen, ohne die verfügbaren Optionen ausgeschöpft zu haben.
Autologe Stammzellentransplantation
Die Autologe Stammzellentransplantation (autologous stem cell transplant, ASCT) wird seit über zwei Jahrzehnten in der Behandlung des Myeloms eingesetzt. Transplantationsmediziner versuchen, die Tumorlast zu reduzieren (so viele Myelomzellen wie möglich abzutöten), bevor sie Stammzellen entnehmen und eine Hochdosistherapie (HDT) durchführen. Die Patienten erhalten daher eine Induktionstherapie, bevor das HDTVerfahren mit Stammzellen-Rescue eingeleitet wird. Selbst wenn das Ansprechen auf die Erstlinientherapie gering ist, ist bei den Patienten eine
24 +1.818.487.7455 • +1.800.452.CURE
Abbildung 12. Myelom-Frontline-Behandlungsalgorithmus – Dezember 2021
Neu diagnostiziertes Myelom*
nicht für ASCT geeignet
VRd-Induktion für 6 Zyklen, gefolgt von Revlimid-Erhaltungstherapie oder Darzalex + Revlimid + Dexamethasom (DRd)
für ASCT geeignet
VRd**- oder Darzalex-basierte 4-Wirksto -Induktion
ASCT gefolgt von Erhaltungstherapie:
• Revlimid für Standard-Risiko-Myelom
• Revlimid + Velcade für Hochrisiko-Myelom
ausgewählte Patienten mit Standard-Risiko-Myelom:
• VRd-Induktion für
4 Zyklen, gefolgt von Revlimid-Erhaltungstherapie
• verzögerte ASCT
Entnahme, eine HDT und eine ASCT mit guten Ergebnissen möglich. Viel wichtiger als das Ansprechen vor der HDT ist das Ansprechen danach, solange die Krankheit nicht weiter fortschreitet.
Im März 2021 hat das National Comprehensive Cancer Network (NCCN) seine Richtlinien für die Behandlung des Myeloms aktualisiert. Laut NCCN ist die ASCT nach wie vor ein wichtiger Bestandteil der FrontlineBehandlung für geeignete Patienten mit neu diagnostiziertem Myelom. Aktualisierte Ergebnisse aus den Follow-up-Daten der klinischen IFMStudie 2009 bestätigten den Nutzen von ASCT bei neu diagnostiziertem Myelom. Bei einem medianen Follow-up von 93 Monaten betrug das mediane progressionsfreie Überleben (progression-free survival, PFS) 47,3 Monate mit ASCT nach Induktion mit einer VRd-Kombination gegenüber 35,0 Monaten mit VRd allein.
In den USA deckt die Medicare-Versicherung eine einzige ASCT für berechtigte Patienten jeden Alters ab, wenn sie an Myelom des Stadiums II oder III nach Durie und Salmon erkrankt sind und entweder neu diagnostiziert wurden oder noch auf eine Behandlung ansprechen. Die Patienten müssen auch eine ausreichende Herz-, Leber-, Lungen- und Nierenfunktion haben. Die Medicare-Versicherung deckt generell keine sogenannten „Tandem“-Transplantationen (zwei aufeinanderfolgende Transplantationen) ab, jedoch wird gegebenenfalls eine weitere Transplantation bezahlt, wenn ein Patient, der einer von Medicare abgedeckten Transplantation unterzogen wurde, nach einer zumindest zwei Jahre langen Remissionsphase einen Rückfall erleidet.
25 myeloma.org
**V Td/ VCd if VRd
©2021, SV
*Based on CALGB 100104, S0777, IFM -2009, C TN 0702, HOVON, MAIA , CASSIOPEIA
not available
Rajkumar
Weitere Informationen finden Sie in der IMF-Publikation Understanding Stem Cell Transplant in Myeloma.
Auswahl eines Behandlungsschemas
Mehrere wichtige Fragen müssen berücksichtigt werden.
¡ Der Alltag: Wird die Behandlung den Alltag beeinträchtigen?
¡ Arbeit: Sind Änderungen am Arbeitsplatz oder Auszeiten/ Krankschreibungen notwendig?
¡ Alter: Ist dies ein Faktor bei der Therapiewahl und den zu erwartenden Ergebnissen?
¡ Nebenwirkungen der Therapie: Wie schwer sind diese?
¡ Andere medizinische Probleme: Werden diese die Art der Behandlung und deren Verträglichkeit beeinflussen?
¡ Transplantation: Wird eine hochdosierte Chemotherapie mit einer Transplantation empfohlen?
¡ Schnelligkeit des Ansprechens: Wie schnell wird die Behandlung wirken? Wie wird das Ansprechen bewertet?
¡ Entscheidungen jetzt und später: Was muss alles sofort entschieden werden?
¡ Finanzielle Überlegungen: Welcher Teil meiner Behandlung wird von meiner Versicherung übernommen? Für welche Kosten bin ich selbst verantwortlich? Gibt es Stellen, die mich bei der Zahlung meiner Behandlung unterstützen können?
Erhaltungstherapie – ja oder nein?
Nach Erreichen des maximalen Ansprechens auf die Therapie wird Ihr Arzt möglicherweise eine Erhaltungstherapie empfehlen. Die Vorteile einer
Abbildung 13. Was bei der Auswahl eines Behandlungsschemas zu beachten ist
26 +1.818.487.7455 • +1.800.452.CURE
Überlegungen zur Behandlung Transplantation Schnelligkeit des Ansprechens Arbeit Alltag Finanziell Andere medizinische Probleme Entscheidungen jetzt und später Nebenwirkungen der Therapie Alter
durchgehenden Therapie bis zu einer Krankheitsprogression wurde in Bezug auf die Verbesserung des Überlebens umfassend nachgewiesen, sie ist aber nicht für jeden Patienten notwendig oder geeignet. Die finanziellen, körperlichen und emotionalen Aspekte der kontinuierlichen Therapie müssen zusammen mit den Merkmalen des Myeloms des einzelnen Patienten berücksichtigt werden.
Klinische Studien
Klinische Studien zur Induktionstherapie können eine hervorragende Möglichkeit sein, eine neue Kombinationstherapie oder eine neue Behandlung zu erhalten, die sonst nicht verfügbar ist. In einer randomisierten klinischen Studie erhält jeder teilnehmende Patient nach dem Zufallsprinzip entweder die Standardversorgung oder eine neue Therapie, und es gelten strenge Vorgaben für die Dokumentierung der Behandlung und der Überwachung. Wenn Sie sich für die Teilnahme an einer klinischen Studie entscheiden, ist es wichtig, dass Sie den vollen Umfang des Behandlungsprüfplans verstehen. Eine umfassendere Erörterung der klinischen Studien erhalten Sie in der IMF-Publikation Understanding Clinical Trials.
Unterstützende Behandlung
Ebenso wichtig wie die Einleitung einer Induktionstherapie ist der frühzeitige Einsatz unterstützender Pflegemaßnahmen zur Linderung der körperlichen und psychischen Auswirkungen einer Myelom-Erkrankung.
Die IMF-Broschüre Understanding Treatment of Myeloma Bone Disease behandelt knochenmodifizierende Wirkstoffe wie die Bisphosphonate Aredia® (Pamidronat) und Zometa® (Zoledronsäure) sowie den monoklonalen Antikörper Xgeva® (Denosumab).
Die IMF-Broschüre Understanding Fatigue behandelt das Thema Müdigkeit und Erschöpfung als Folge einer Krebserkrankung bzw. Krebsbehandlung; dieser Zustand wird vom NCCN definiert als „ein belastendes, anhaltendes, subjektives Gefühl der Müdigkeit oder Erschöpfung aufgrund einer Krebserkrankung bzw. Krebsbehandlung, das in keinem Verhältnis zur eigentlichen körperlichen Aktivität steht und ein normales Funktionieren beeinträchtigt“.
Die IMF-Broschüre Understanding Peripheral Neuropathy in Myeloma wurde zusammengestellt, um Myelompatienten zu helfen, die bereits an einer PN leiden, und andere Patienten dabei zu unterstützen, diesem Problem vorzubeugen. Es ist immer besser, Probleme zu verhindern, bevor sie auftreten, und sie frühzeitig zu behandeln, sobald sie erkannt werden. Dies gilt insbesondere für PN.
27 myeloma.org
Tabelle 8. Unterstützende Behandlung
SYMPTOM BEHANDLUNG ANMERKUNGEN
Müdigkeit und Schwäche aufgrund einer Anämie
• Bluttransfusion (konzentrierte rote Blutkörperchen: kaum Leukozyten, auf Viren untersucht) bei schwerer Anämie
• Erythropoetin bei therapiebedingter leichter bis mittelgradiger Anämie
Knochenschmerzen
• Bisphosphonat (z. B. Aredia® 90 mg i. v. über 2–4 Stunden, 1-mal monatlich; Zometa® 4 mg i. v. über 15–45 Minuten, 1-mal monatlich)
• Schmerzlindernde Medikamente nach Bedarf (z. B. Acetaminophen, orale Morphium-Derivate, Fentanyl)
Die Behandlungen sind einfach, normalerweise sehr wirksam und führen zu einem besseren Wohlbefinden.
• Die Linderung von Knochenschmerzen ist für sich genommen sehr wichtig und ermöglicht die körperliche Betätigung welche wiederum die Knochenstärkung und Heilung unterstützt und das emotionale Wohlbefinden stärkt.
• Mögliche Schäden an Nieren und Kiefer können in seltenen Fällen durch eine chronische Bisphosphonat-Therapie verursacht werden.
• Die Kenntnis ist der Schlüssel zur Prävention.
Fieber und/oder Anzeichen einer Infektion
• Geeignete Antibiotika
• Gegebenenfalls Neupogen®, um die Anzahl der weißen Blutkörperchen anzuheben
• Intravenöses Immunglobulin (IVIG) bei schweren Infektionen
• Es sollten erforderliche Tests zur exakten Diagnose des Infektionstyps durchgeführt werden (mit Ausnahme von gefährdenden Biopsien/Kulturen)
Gastrointestinale Nebenwirkungen:
• Geeignete Medikamente zur Behandlung von Übelkeit, Erbrechen, Verstopfung oder Durchfall
• Es sollte auf eine ausreichende Flüssigkeitszufuhr und Ernährung geachtet werden
Blutgerinnsel und thromboembolische Ereignisse
• Blutgerinnsel sind medizinische Notfälle; die Behandlung richtet sich nach Schwere und Risikofaktoren des jeweiligen Patienten
• Es können Aspirin oder Gerinnungshemmer verschrieben werden
Periphere Neuropathie
• Schmerzmedikamente
• Anpassung von Dosis, Zeitplan und/oder Darreichungsform
• Physiotherapie, Vitamine und andere Nahrungsergänzungsmittel
Nebenwirkungen von Steroiden
• Nehmen Sie Präparate nach Anweisung Ihres Arztes ein.
• Achten Sie auf Anzeichen und Symptome einer Infektion und Änderungen des Blutzuckerspiegels
• Medikamente zur Prävention von Gürtelrose und Pilzinfektionen
• Obwohl Antibiotika mit Sorgfalt ausgewählt und verwendet werden sollten, ist es sehr wichtig, Infektionen schnell zu behandeln.
• Es wird empfohlen, für Notfälle (besonders auf Reisen) ein Antibiotikum bei sich zu haben.
Die Symptome sollten mit dem Arzt besprochen werden; bei schweren Symptomen ist unter Umständen eine Einweisung ins Krankenhaus erforderlich.
Die Risiken können durch körperliche Betätigung, Gewichtsabnahme und Abstinenz vom Rauchen gemindert werden.
• Die Symptome sollten mit dem Arzt besprochen werden.
• Eine frühe Intervention kann dauerhafte Schäden verhindern und ermöglicht eine Fortsetzung der Therapie.
• Nehmen Sie Dosisänderungen nicht ohne Rücksprache mit dem Arzt vor.
• Nehmen Sie Nahrungsergänzungsmittel nicht ohne Rücksprache mit dem Arzt ein.
• Besprechen Sie Nebenwirkungen und Symptome mit dem Arzt.
• Brechen Sie die Therapie nicht ohne Rücksprache mit dem Arzt ab oder nehmen Dosisänderungen vor.
28 +1.818.487.7455 • +1.800.452.CURE
Neben der Behandlung der spezifischen Symptome sind eine Reihe weiterer unterstützender Maßnahmen äußerst wichtig:
¡ Körperliche Betätigung: Fragen Sie Ihren Arzt, ob körperliche Aktivität für Sie weiterhin möglich ist beziehungsweise ob Sie aufgrund der zugrundeliegenden Knochenerkrankung oder Knochenschädigung bestimmte Anpassungen vornehmen sollten. Normalerweise sind bestimmte körperliche Aktivitäten möglich, zum Beispiel Gehen oder Schwimmen, Flexibilitäts-und/oder Kräftigungsübungen oder ein persönliches Yogaprogramm.
¡ Ernährung: Für Myelompatienten wurde bislang noch keine spezifische Ernährungsempfehlung entwickelt, es wurde aber gezeigt, dass zwischen Übergewicht und Myelom eine Verbindung besteht. Wir empfehlen Patienten eine gesunde Ernährung nach dem Vorbild der Mittelmeer-Diät mit viel Obst, Gemüse, Fisch, anderen fettarmen tierischen Eiweißen, Vollkornprodukten und unverarbeiteten „echten“ Nahrungsmitteln. Wir empfehlen Patienten, Lebensmittel mit raffiniertem Zucker und künstlichen Transfetten zu vermeiden. In zwei Bereichen ist Vorsicht geboten:
Pflanzliche Nahrungsergänzungsmittel und Vitamin-Präparate: Beraten Sie sich während Ihrer Myelom-Therapie VOR der Einnahme von etwaigen Nahrungsergänzungsmitteln mit Ihrem Arzt oder Apotheker. Bestimmte Wechselwirkungen zwischen Medikamenten und/oder Nahrungsergänzungsmitteln können die Wirksamkeit Ihrer Myelom-Therapie schwächen und einige Wechselwirkungen können sogar ernsthafte medizinische Probleme verursachen. Apotheken verfügen über erforderlichen Referenzen und Ressourcen, um potenzielle Wechselwirkungen zu identifizieren.
Vitamin C: Hohe Dosen von mehr als 1000 mg/Tag können beim Myelom kontraproduktiv sein und die Gefahr einer Nierenschädigung erhöhen.
¡ Geistige Gesundheit: Ihre geistige Gesundheit ist während der geplanten Behandlung äußerst wichtig. Stellen Sie sicher, dass Sie sich mit dem Therapieplan wohlfühlen. Fragen Sie nach psychologischer Betreuung, wenn Sie glauben, depressiv zu sein oder wenn andere in Ihrem Umfeld besorgt sind, dass Sie eine Depression entwickeln könnten. Bei einer Krebsdiagnose ist dies nichts Ungewöhnliches; die meisten Patienten brauchen unter diesen besonderen Umständen mehr Unterstützung als sonst. Ein Austausch mit anderen Betroffenen kann hier ebenfalls viel Positives beitragen. Daher empfehlen wir, an einer Myelom-Selbsthilfegruppe teilzunehmen. Um eine geeignete Myelom-Selbsthilfegruppe zu
29 myeloma.org
finden, besuchen Sie support.myeloma.org oder setzen Sie sich mit der IMF-InfoLine in Verbindung.
¡ Regelmäßiger Schlaf: Dies ist für Ihr Immunsystem sehr wichtig.
¡ Anpassungen und Änderungen: Reduzieren Sie, wenn möglich, jeglichen Stress in beruflichen, familiären oder sozialen Situationen und vermeiden Sie Menschenmassen und engen körperlichen Kontakt mit Schulkindern. Waschen Sie sich oft die Hände. Ihr Immunsystem ist sowohl durch die Krankheit als auch die Behandlung geschwächt. Die Kontrolle des Myeloms hat höchste Priorität, bis eine Remission erreicht ist oder sich Ihr Zustand stabilisiert hat.
Ihr medizinisches Team
Neben den Hämatologen/Onkologen, die Ihre Behandlung planen und durchführen, kann Ihr medizinisches Team auch folgende wichtige Experten umfassen:
¡ Hausarzt bzw. praktischer Arzt;
¡ Fachpflegekraft, Krankenschwester oder Krankenpfleger;
¡ Orthopädischer Chirurg (Knochenspezialist);
¡ Apotheker;
¡ Nephrologe bzw. Nierenspezialist;
¡ Zahnarzt und/oder Kieferchirurg.
Eine optimale Betreuung ist dann möglich, wenn zwischen allen Mitgliedern des medizinischen Teams und dem Patienten oder der Pflegeperson eine gute Kommunikation besteht.
Myelompatienten und COVID-19
Besuchen Sie covid19.myeloma.org für die neuesten Informationen für Myelompatienten.
Ab Februar 2022 empfiehlt die CDC eine zusätzliche Haupt- bzw. Auffrischungsimpfung für bestimmte Personen, die mäßig oder stark immungeschwächt sind. Bei etwa der Hälfte aller Myelompatienten in aktiver Behandlung ist der Antikörperspiegel zu niedrig und eine zusätzliche primäre Impfung, gefolgt von einer Auffrischungsimpfung, kann zusätzlichen Schutz bieten. Sprechen Sie mit Ihrem Arzt über Ihren Gesundheitszustand und fragen Sie, ob eine zusätzliche Schutzimpfung für Sie richtig ist.
Im Januar 2022, als sich die Omikron-Variante verbreitete, erklärte die CDC den spezifischen Unterschied zwischen Quarantäne und Isolierung:
30 +1.818.487.7455 • +1.800.452.CURE
Quarantäne ist für diejenigen erforderlich, die potenziell dem Virus ausgesetzt waren und sich eventuell infiziert haben, und Isolierung ist erforderlich, wenn man mit dem Virus infiziert ist, egal ob man symptomatisch ist oder nicht.
Im Dezember 2021 genehmigte die FDA zwei orale antivirale Behandlungen für COVID-19: Molnupiravir (MK-4482) für Erwachsene, die anfällig für eine schwere COVID-Erkrankung sind, und Paxlovid™ (Nirmatrelvir und Ritonavir) für Hochrisikopatienten ab 12 Jahren.
Die IMF empfiehlt dringend, dass Patienten mit Myelom, SMM oder MGUS entweder mit dem Pfizer-BioNTech COVID-19-Impfstoff oder dem Moderna-Impfstoff geimpft werden, je nachdem, was verfügbar ist. Diese Impfstoffe bieten hervorragenden Schutz und ihr Nutzen überwiegt derzeit bei weitem die potenziellen Risiken bzw. Toxizitätsbedenken. Bevor Sie den COVID-19-Impfstoff erhalten, sprechen Sie mit Ihrem Arzt, um alle Fragen und Bedenken vor Ihrer Impfung zu klären.
Abschließende Bemerkungen
Die Broschüre ist nicht dazu gedacht, den Rat von Ärzten und Pflegefachkräften zu ersetzen, da diese Ihre Fragen zu Ihrem speziellen Gesundheitsmanagementplan am besten beantworten können. Die IMF möchte Ihnen lediglich Informationen liefern, die Ihnen in Gesprächen mit Ihren Ärzten und dem Krankenpflegeteam als Anhaltspunkte dienen können. Um eine effektive Behandlung mit guter Lebensqualität zu gewährleisten, müssen Sie in Ihrer medizinischen Behandlung eine aktive Rolle spielen.
Wir möchten Sie ermutigen, myeloma.org zu besuchen, um weitere Informationen zum Myelom abzurufen, und sich mit myelombezogenen Fragen und Sorgen an die InfoLine der IMF zu wenden. Die IMF InfoLine versorgt Anrufer auf fürsorgliche und einfühlsame Art und Weise mit den neuesten Informationen. Die IMF InfoLine kann unter InfoLine@myeloma.org oder +1.818.487.7455 erreicht werden.
Fachbegriffe und Definitionen
In dieser Broschüre werden die folgenden ausgewählten Fachbegriffe verwendet. Einen umfassenderen Leitfaden zu Myelom-Begriffen, das Glossar zu Myelom-Begriffen und zugehörige Definitionen finden Sie auf glossary.myeloma.org.
Albumin (ALB): Einfaches wasserlösliches Protein im Blutserum. Die Produktion von Albumin wird von Interleukin-6 gehemmt, wenn das Myelom sehr aktiv ist.
31 myeloma.org
Anämie: Ein Rückgang der roten Blutkörperchen und des darin enthaltenen Hämoglobins, welches das Gewebe und die Organe des Körpers mit Sauerstoff versorgt. Eine Anämie wird normalerweise definiert als ein Hämoglobinwert unter 10 g/dl bzw. ein Rückgang von ≥ 2 g/dl unter den normalen Wert. Ein Wert über 13–14 g/dl gilt als normal.
Ansprechen oder Remission: Komplettes oder teilweises Verschwinden der Anzeichen und Symptome der Krebserkrankung. Remission und Ansprechen sind synonyme Begriffe.
• Stringente komplette Remission (sCR) – Die sCR ist eine CR (gemäß vorstehender Definition) plus ein normales FLC-Verhältnis und Fehlen klonaler Zellen im Knochenmark gemäß Immunhistochemie oder Immunfluoreszenz.
• Komplette Remission (CR) – Beim Myelom ist eine CR eine negative Immunfixation im Serum (Blut) und Urin sowie ein Verschwinden von Weichgewebe- und ≤ 5 % Plasmazellen im Knochenmark. Eine komplette Remission ist nicht mit einer Heilung gleichzusetzten.
• Sehr gute partielle Remission (VGPR) – Eine VGPR ist weniger als eine CR. Bei einer VGPR kann das M-Protein im Serum und Urin durch Immunfixation, aber nicht durch Elektrophorese nachgewiesen werden, oder aber es liegt eine Reduktion des Serum-M-Proteins von mindestens 90 % und des Urin-M-Proteins von weniger als 100 mg in 24 Stunden vor.
• Partielle Remission (PR) – Eine PR ist ein Ansprechen mit einer mindestens 50 %-igen Reduktion des M-Proteins und einer Reduktion des M-Proteins im 24-Stunden-Urin um mindestens 90 % (auf unter 200 mg in 24 Stunden).
Antikörper: Ein von Plasmazellen gebildetes Protein, das in den Körper gelangte Antigene abwehrt. Siehe auch „Immunglobulin (Ig).“
Asymptomatisch: Frei von Anzeichen oder Symptomen.
Asymptomatisches Myelom: Ein Myelom, das ohne Anzeichen oder Symptome auftritt; Myelom im Frühstadium. Auch als „schwelendes multiples Myelom (SMM)“ bezeichnet.
Bence-Jones-Myelom: Ein durch das Vorliegen des Bence-Jones-Proteins gekennzeichnetes Myelom. Bence-Jones bezeichnet ein abnormes, aus freien Kappa- oder Lambda-Leichtketten bestehendes Protein im Urin.
Bence-Jones-Protein: Ein monoklonales Protein des Myeloms. Das Protein besteht entweder aus kranken freien Kappa- oder LambdaLeichtketten. Aufgrund ihrer geringen Größe können Bence-JonesLeichtketten durch die Nieren gefiltert werden und in den Urin gelangen.
32 +1.818.487.7455 • +1.800.452.CURE
Die Menge des Bence-Jones-Proteins im Urin wird in g pro 24 Stunden angegeben. Im Urin ist normalerweise immer eine geringe Proteinmenge (< 0,1 g/24 h) nachweisbar, bei diesem Protein handelt es sich jedoch in der Regel um Albumin und nicht um das Bence-Jones-Protein. Das Vorliegen des Bence-Jones-Proteins im Urin ist abnormal. MyelomproteinSchwerketten sind zu groß, um durch die Nieren gefiltert zu werden.
Benigne: Gutartig, nicht kanzerös; breitet sich nicht in das umgebende Gewebe oder in andere Teile des Körpers aus.
Beta-2-Mikroglobulin (β2-Mikroglobulin, β2M oder β2M): Ein kleines Protein, das im Blut vorhanden ist. Hohe Werte treten bei Patienten mit aktivem Myelom auf. Niedrige oder normale Werte treten bei Patienten mit einem Myelom im Frühstadium und/oder inaktiver Erkrankung auf. Bei etwa 10 % der Patienten tritt ein Myelom auf, das kein β2M produziert. Zum Zeitpunkt eines Rezidivs kann der β2M-Spiegel ansteigen, ehe sich eine Änderung des Myelomproteinspiegels zeigt. Faktoren wie Virusinfektionen oder Niereninsuffizienz können ebenfalls erhöhte Serumβ2M-Werte verursachen.
Biopsie: Die Entnahme von Gewebeproben zur mikroskopischen Untersuchung, z.B. zur Diagnosestellung.
Bisphosphonate: Ein Medikament, das die Aktivität von Osteoklasten (Knochenabbau) hemmt und so den weiteren Knochenabbau verhindert. Bisphosphonate binden an der Knochenoberfläche und werden dann resorbiert.
Blutplättchen: Neben den roten und weißen Blutkörperchen einer der drei Hauptbestandteile des Blutes. Blutplättchen verschließen Defekte in der Wand von Blutgefäßen und produzieren Botenstoffe, welche die Bildung von Blutgerinnseln anregen. Blutplättchen sind der wichtigste Schutz gegen Blutungen. Sie werden auch als Thrombozyten bezeichnet.
C-reaktives Protein (CRP): Ein in der Leber gebildetes Protein, das sich vermehrt, wenn im Körper eine Entzündung vorhanden ist.
Elektrophorese: Eine Laboruntersuchung, bei der die Bestandteile des Proteins im Serum (Blut) oder im Urin eines Patienten gemäß ihrer Größe und elektrischen Ladung aufgetrennt werden. Die Serum- oder Urinelektrophorese (SPEP oder UPEP) ermöglicht sowohl die Berechnung der Menge an Myelomprotein als auch die Identifizierung der Art des M-Spikes für jeden Patienten.
Erstlinientherapie: Ein allgemeiner Begriff für die Erstbehandlung, die bei einem neu diagnostizierten Myelompatienten angewendet wird, um eine Remission zu erzielen. Siehe „Induktionstherapie“ und „Ansprechen“
33 myeloma.org
Extramedulläres Plasmozytom: Ein Tumor aus monoklonalen Plasmazellen im Weichgewebe außerhalb des Knochenmarks und vom Knochen getrennt.
Fluoreszenz-in-situ-Hybridisierung (FISH): Ein Verfahren, anhand dem Forscher die Position spezifischer DNA-Sequenzen auf Chromosomen bestimmen können.
Freie Leichtkette: Eine Immunglobulin-Leichtkette ist der kleinere der beiden Komponenten eines Antikörpers. Es gibt zwei Arten von Leichtketten-Immunglobulinen: Kappa und Lambda. Eine Leichtkette kann mit einer Schwerkette verbunden sein oder nicht (frei). Freie Leichtketten zirkulieren im Blut und sind klein genug, um in die Nieren zu gelangen, wo sie entweder in den Urin gefiltert werden oder zusammenkleben und die Nierenkanälchen verstopfen.
Gesamtüberlebenszeit (OS): Die mittlere Anzahl an Personen in der Gruppe, die nach einem bestimmten Zeitraum noch am Leben sind. Es wird in klinischen Studien oft als Parameter für die Therapiewirksamkeit herangezogen. Durch die immer länger werdende Dauer des Gesamtüberlebens in Myelomstudien ist dies ein komplizierter Endpunkt, so dass die minimale Resterkrankung (MRD) als neuer Endpunkt verwendet wird.
Hämatologe: Ein Arzt, der auf Erkrankungen des Blutes und des Knochenmarks spezialisiert ist.
Hyperkalzämie: Ein erhöhter Blutkalziumspiegel. Bei Myelompatienten ist er meistens die Folge einer Knochenzerstörung mit der Freigabe von Kalzium in den Blutkreislauf. Dieser Zustand kann eine Reihe von Symptomen hervorrufen, einschließlich Appetitverlust, Übelkeit, Durst, Müdigkeit, Muskelschwäche, Unruhe und Verwirrung. Siehe „Kalzium“.
Immunfixationselektrophorese (IFE): Ein immunologischer Test, der zur Identifikation von Immunglobulinen und Proteinen verwendet wird. Der Arzt ist bei Myelompatienten in der Lage, den M-Proteintyp (IgG, IgA, Kappa oder Lambda) zu bestimmen. Die empfindlichste Methode zur routinemäßigen Immunfärbung. Dient zur Identifikation des exakten Schwer- und Leichtketten-Typs des M-Proteins.
Immunglobulin (Ig): Ein Protein, das von Plasmazellen produziert wird und ein wesentlicher Teil des Immunsystems ist. Immunglobuline binden an fremde Substanzen (Antigene) und tragen zu deren Zerstörung bei. Die Klassen (auch Isotypen genannt) der Immunglobuline sind IgG, IgA, IgD, IgE und IgM. Die Laienbezeichnung für Immunglobulin ist „Antikörper“.
Immunmodulatorischer Wirkstoff: Ein Arzneimittel/ Chemotherapeutikum, das das Immunsystem beeinflusst, stimuliert oder
34 +1.818.487.7455 • +1.800.452.CURE
hemmt. Immunmodulatorische Medikamente werden manchmal als IMiDVerbindungen® bezeichnet.
Immunsystem: Das körpereigene Abwehrsystem gegen Pathogene und Fremdstoffe zerstört infizierte und maligne Zellen und räumt Zelltrümmer aus dem Weg. Das Immunsystem setzt sich u. a. auch aus weißen Blutkörperchen und Organen und Gewebe des Lymphsystems zusammen.
Induktionstherapie: Ein spezifischer Begriff für die anfängliche Behandlung, die ein Patient im Vorfeld einer autologen Stammzellentransplantation (ASCT) erhält. Siehe „Erstlinientherapie“ und „Therapielinie“.
Kalzium: Ein Mineral, das hauptsächlich in den harten Strukturen der Knochenmatrix oder in Hydroxyapatit gefunden wird. Wird es im Überschuss gebildet oder freigesetzt, kann es sich im Blutkreislauf ansammeln. Siehe „Hyperkalzämie“.
Klinische Studie: Eine Forschungsstudie zu einer neuen Behandlung, die an Patienten durchgeführt wird. Jede Studie wird entwickelt, um bessere Wege zur Prävention, Erkennung, Diagnose oder Behandlung von Krebs zu finden und um wissenschaftliche Fragen zu beantworten.
• Kontrollgruppe – Der Arm einer randomisierten klinischen Studie, die die Standardbehandlung oder Placebo (keine Behandlung/ Scheinbehandlung) erhält.
• Experimentelle Gruppe – Der Arm einer randomisierten Studie, der die neue Behandlung erhält.
• Randomisierte klinische Studie – Eine Forschungsstudie, in der die Teilnehmer zufällig einer bestimmten Behandlung zugeordnet werden.
• Arm – Eine der Behandlungsgruppen einer randomisierten Studie. Die Mehrzahl der randomisierten Studien haben zwei, manchmal aber auch mehr Arme.
• Endpunkt – Das Ziel der Studie; was eine klinische Studie messen oder herausfinden möchte. Typische Endpunkte umfassen Messungen zu Toxizität/Nebenwirkungen, Ansprechraten und Überleben.
• Doppelblindstudie – Durchführung einer randomisierten, klinischen Studie, bei der weder der Teilnehmer noch der Prüfarzt das Ziel der Studie kennen, der der Patient zugewiesen ist. Der Zweck dahinter ist, jegliche Voreingenommenheit bezüglich der Ergebnisse vermeiden.
• Phase-I-Studie – Eine Studie, bei der die maximal tolerierbare Dosis (MTD) eines neuen Medikaments oder einer neuen Medikamentenkombination bestimmt werden soll. Normalerweise ist dies die erste Anwendung einer neuen Behandlung beim Menschen, obwohl in Phase-I-Studien mit Kombinationstherapien
35 myeloma.org
die individuellen Elemente auch bereits getestet worden sein können. Patienten, die an einer Phase-I-Studie teilnehmen, müssen eine fortgeschrittene Krebserkrankung haben, die refraktär auf jede Standardbehandlung ist. In einer typischen Studie der Phase I wird die Behandlung bei aufeinanderfolgenden Gruppen („Kohorten“) von 3–6 Patienten angewendet. Alle Patienten in einer Kohorte erhalten die gleiche Dosis. In der Regel erhält die erste Kohorte eine sehr niedrige Dosis. Die Dosis wird bei jeder nachfolgenden Kohorte angehoben, bis eine vorgegebene Anzahl der Patienten an dosislimitierender Toxizität (DLT) leidet. Die Dosis, die für die vorhergehende Kohorte verwendet wurde, wird dann als MTD genommen. Diese Dosis wird dann in einer Phase-II-Studie angewendet.
• Phase-II-Studie – Eine Studie, in der die Ansprechrate auf eine neue Therapie bestimmt werden soll, die bereits in einer Phase-I-Studie getestet wurde. Normalerweise werden 14 bis 50 Patienten mit einer bestimmten Krebsart behandelt, um herauszufinden, wie viele auf die Behandlung ansprechen. Die Patienten müssen in der Regel eine fortgeschrittene Krebserkrankung haben, die refraktär auf jede Standardbehandlung ist. Darüber hinaus muss eine messbare Erkrankung vorliegen. Wenn die Ergebnisse einer Phase-II-Studie vielversprechend genug sind, kann die Therapie in einer Phase-III-Studie getestet werden. Wenn die Ergebnisse offensichtlich viel besser ausfallen als die der Standardbehandlung, muss eine Phase III-Studie nicht notwendigerweise durchgeführt werden, sondern die Therapie kann, basierend auf den Ergebnissen der Phase II Studie, zugelassen werden.
• Phase-III-Studie – Eine Studie, bei der zwei oder mehr Behandlungen für eine bestimmte Art und ein bestimmtes Stadium einer Krebserkrankung verglichen werden. Der Endpunkt einer Phase-IIIStudie ist normalerweise das Überleben oder das krankheitsfreie Überleben. Phase-III-Studien sind normalerweise randomisiert, sodass Patienten nicht auswählen können, welche Behandlung sie erhalten. Eine typische Phase-III-Studie hat 50 bis Tausende von Patienten als Teilnehmer. Einige Phase-III-Studien vergleichen eine neue Therapie, die in Phase-II-Studien zu guten Ergebnissen geführt hat, mit einer älteren, bereits etablierten Standardbehandlung. Andere Phase-IIIStudien vergleichen Behandlungen, die bereits verwendet werden. Einige Behandlungen der Phase-III-Studien sind möglicherweise auch außerhalb klinischer Studien verfügbar.
• Phase-IV-Studien – Auch nach der Zulassung eines Arzneimittels durch die US-amerikanischen Zulassungsstelle United States Food and Drug Administration (FDA) für eine bestimmte Indikation kann ein Bedarf für weitere Studien bestehen. Phase-IV-Studien können von
36 +1.818.487.7455 • +1.800.452.CURE
den Behörden vorgeschrieben sein und werden vom finanzierenden Unternehmen aus verschiedenen Gründen durchgeführt. Eine Sicherheitsprüfung dient beispielsweise der Erkennung von seltenen oder langfristigen Nebenwirkungen und wird über einen längeren Zeitraum und mit einer größeren Patientenpopulation durchgeführt, als dies in den Studien der Phasen I-III möglich war.
Knochenmark: Das weiche, schwammige Gewebe im Inneren des Knochens. Hier werden weiße und rote Blutkörperchen sowie Blutplättchen produziert. Wenn das Myelom wächst, bauen sich abnormale Plasmazellen im Knochenmark auf.
Krebs: Eine Bezeichnung für Erkrankungen, bei denen sich bösartige Zellen unkontrolliert teilen. Krebszellen können umgebendes Gewebe infiltrieren und sich über den Blutstrom und das Lymphsystem in andere Teile des Körpers ausbreiten.
Laktatdehydrogenase (LDH): Ein energieerzeugendes Enzym, das in fast allen Geweben im Körper vorhanden ist. Der LDH-Spiegel im Blut kann nach einer Zellschädigung ansteigen. LDH kann zur Überwachung der Aktivität des Myeloms verwendet werden.
Läsion: Ein abnormaler Gewebebereich; ein Knoten oder Abszess, der durch eine Verletzung oder eine Erkrankung wie Krebs hervorgerufen wird. Beim Myelom kann sich „Läsion“ auf ein Plasmozytom oder ein Loch im Knochen beziehen.
• Diffuse Läsion – Eine sich ausbreitende Knochenmarkinfiltration durch das Myelom in einem spezifischen Knochenbereich.
• Fokale Läsion – Ein Bereich mit irregulären Zellen im Knochenmark gemäß MRT (Magnetresonanztomografie) und PET-/CT-Scans. Damit die Diagnose Myelom gestellt werden kann, muss die MRT zumindest 2 fokale Läsionen mit einer Größe von je > 5mm zeigen.
• Lytische Läsion – Geschädigter Bereich eines Knochens, der sich auf einem Röntgenbild als dunkler Fleck abzeichnet, wenn mindestens 30 % des gesunden Knochens in einem bestimmten Bereich abgebaut wurden. Lytische Läsionen sehen wie Löcher im Knochen aus und beweisen, dass der Knochen geschwächt wird.
Siehe „Lytisch (Lyse/Lysis)“
Leichtketten-Amyloidose (AL-Amyloidose): Eine Erkrankung, bei der von Plasmazellen gebildete, monoklonale Leichtketten sich in Form eines „β-Faltblatts“ miteinander verbinden und anschließend in Gewebe und Organen im gesamten Körper ablagern, so zum Beispiel in Herz, Nerven und Nieren, statt über die Nieren ausgeschieden zu werden. Diese Erkrankung wird auch als primäre Amyloidose bezeichnet.
37 myeloma.org
Leichtkettenablagerungserkrankung (LCDD): Eine monoklonale Gammopathie, die durch die Ablagerung von Leichtketten in verschiedenen Organen, am häufigsten in den Nieren, gekennzeichnet ist.
Lytisch (Lyse): Auflösung oder Zerstörung von Zellen oder Gewebe.
M-Spike: Ein monoklonaler Spike; ein markantes Muster, das bei einer Proteinelektrophorese auftritt und ein Marker für die Aktivität von Myelomzellen ist. Siehe „monoklonal“ und „monoklonales Protein“
Magnetresonanztomographie (MRT): Eine bildgebende Untersuchungsmethode, bei der statt ionisierender Strahlung magnetische Felder und hochfrequente Wellen zum Einsatz kommen, um detaillierte zwei- oder dreidimensionale Aufnahmen von Organen und Strukturen des Körpers zu erstellen. Die MRT hat eine sehr hohe Auflösung für Weichteilgewebe, insbesondere für das Knochenmark, ist allerdings weniger genau bei Knochenläsionen.
Maligne: Bösartig; kann sich im umgebenden Gewebe oder in anderen Teilen des Körpers ausbreiten.
Monoklonal: Ein Klon oder ein Duplikat einer einzigen Zelle. Myelomzellen entstehen aus einer „monoklonalen“, also aus einer einzigen malignen Plasmazelle im Knochenmark. Das erzeugte Myelomprotein ist ebenfalls monoklonal; es hat eine einzige Form statt vieler Formen (polyklonal). In der klinischen Praxis ist die Monoklonalität des Proteins deshalb wichtig, weil es in der Proteinelektrophorese als scharfe Spitze (M-Spike/M-Protein) erscheint.
Monoklonale Gammopathie unbestimmter Signifikanz (MGUS): Eine Kategorie einer Plasmazellerkrankung, die durch eine vergleichsweise niedrige Konzentration an monoklonalem Protein im Blut und/oder Urin gekennzeichnet ist. Die Plasmazellkonzentration im Knochenmark ist gering (< 10 %). Myelombedingte Symptome (z. B. Anämie, Nierenversagen, Hyperkalzämie und lytische Läsionen) sind nicht vorhanden.
Monoklonales Protein (Myelomprotein, M-Protein): Ein abnormes Protein, das von Myelomzellen gebildet wird und sich im Knochen und Knochenmark ansammelt und diese schädigt. Es kommt in ungewöhnlich großen Mengen im Blut und/oder im Urin von Myelompatienten vor. Siehe „monoklonal“ und „M-Spike“.
Multiples Myelom: Ein Krebs der Plasmazellen des Knochenmarks, den weißen Blutkörperchen also, die Antikörper herstellen. Entartete Plasmazellen werden als Myelomzellen bezeichnet.
Nicht-sezernierendes Myelom: Bei ca. 1 % der Myelompatienten ist im Blut (Serum) oder Urin kein M-Protein nachweisbar. Einige dieser Patienten können unter Anwendung des freie Leichtketten-Assays erfolgreich
38 +1.818.487.7455 • +1.800.452.CURE
überwacht werden; bei anderen wiederum erfolgt die Überwachung ggf. per Knochenmarkbiopsie und/oder PET/CT-Scans. Patienten mit nichtsezernierendem Myelom erhalten die gleiche Behandlung wie Patienten mit M-Protein-sekretierender Erkrankung.
Onkologe: Ein Arzt, der auf die Krebsbehandlung spezialisiert ist. Einige Onkologen spezialisieren sich auf eine bestimmte Krebsart.
Osteoblast: Eine Knochenzelle, die an der Produktion von Knochengewebe beteiligt ist. Osteoblasten produzieren Osteoid, das mit Kalzium mineralisiert wird, um einen neuen, harten Knochen zu bilden.
Osteoklast: Eine Zelle, die am Verbindungspunkt zwischen Knochenmark und hartem Knochen vorkommt. Sie bewirkt den Abbau oder das Remodellieren des alten Knochengewebes. Beim Myelom werden die Osteoklasten überstimuliert, während die Aktivität der Osteoblasten blockiert wird. Die Kombination aus vermehrter Knochenresorption und gehemmter Knochenneubildung führt schließlich zu lytischen Läsionen.
Periphere (Poly-)Neuropathie (PN/PNP): Das Gefühl von Taubheit, Kribbeln und/oder Schmerzen in Händen, Füßen, Waden und/oder Armen.
Plasma: Der flüssige Teil des Blutes, in dem weiße Blutkörperchen, rote Blutkörperchen und Blutplättchen schweben.
Plasmapherese: Der Prozess zur Entfernung bestimmter Proteine aus dem Blut. Die Plasmapherese kann eingesetzt werden, um große Mengen des monoklonalen Myelomproteins aus dem Blut von Myelompatienten zu entfernen.
Plasmazellen: Spezielle weiße Blutkörperchen, die Antikörper produzieren. Das Myelom ist ein Krebs der Plasmazellen. Beim Myelom produzieren bösartige Plasmazellen abnorme Antikörper, denen die Fähigkeit zur Bekämpfung von Infektionen fehlt. Bei diesem abnormen Antikörper handelt es sich um das monoklonale Protein oder M-Protein, welches als Tumormarker für das Myelom fungiert. Das Vorhandensein von bösartigen Plasmazellen im Knochenmark kann zu Organ- und Gewebeschäden (Anämie, Nierenschäden, Knochenerkrankungen und Nervenschäden) führen.
Plasmozytom: Siehe „extramedulläres Plasmozytom“ und „solitäres Plasmozytom (SPB)“.
Proteasom: Eine verbundene Gruppe (oder ein Komplex) an Enzymen, die beschädigte oder unerwünschte Proteine und unbeschädigte Proteine zerstört, die in der Zelle abgebaut werden müssen. Dieser Umsatz bzw. dieses „Recycling“ von Proteinen ist für den Erhalt des Gleichgewichts in der Zelle wichtig und reguliert verschiedene Zellfunktionen, wie z. B. das Zellwachstum.
39 myeloma.org
Proteasominhibitor: Jedes Medikament, das die normale Funktion des Proteasoms, eines für den Abbau und die Wiederverwertung unerwünschter Proteine in normalen und Krebszellen verantwortlichen Enzymkomplexes, stört. Siehe „Proteasom“.
Proteine: Substanzen, die sich aus Aminosäuren zusammensetzen. Proteine sind ein wesentlicher Teil aller lebenden Organismen und dienen dort insbesondere als Bausteine für Körpergewebe wie Muskeln, Haare, Kollagen usw. sowie als Enzyme und Antikörper.
Rote Blutkörperchen (RBK): auch Erythrozyten genannt; diese Blutzellen enthalten Hämoglobin, transportieren Sauerstoff in alle Körperbereiche und transportieren Kohlenstoffdioxid ab; die Bildung von roten Blutkörperchen wird durch ein Hormon (Erythropoetin) stimuliert, das in den Nieren produziert wird. Myelompatienten mit geschädigten Nieren produzieren nicht genug Erythropoietin und können daher anämisch werden. Myelompatienten können zudem infolge der Verdrängung der natürlichen Blutbildung im Knochenmark durch Myelomzellen zu wenig rote Blutkörperchen produzieren und anämisch werden.
Schwelendes multiples Myelom (SMM): SMM ist ein stärkerer Erkrankungsgrad als MGUS, aber immer noch kein aktives Myelom mit CRAB-Merkmalen, die auf eine Organschädigung hinweisen. Patienten mit Standardrisiko-SMM erfordern keine Behandlung, sollten jedoch in regelmäßigen Intervallen von einem Hämatologen/Onkologen untersucht werden. Patienten mit hochrisiko-SMM könnten sich für die Teilnahme an einer klinischen Studie entscheiden.
Serum: Der farblose, flüssige Teil des Blutes, in dem die Blutzellen schweben. Solitäres Plasmozytom (SPB): Eine abgrenzbare, einzelne Ansammlung an monoklonalen Plasmazellen in einem Knochen. Für die Diagnose SPB müssen eine einzige Knochenläsion, eine Biopsie, auf der die Infiltration mit Plasmazellen zu sehen ist, negative Bildgebungsergebnisse in Bezug auf andere Knochenläsionen, das Fehlen klonaler Plasmazellen in einer stichprobenartig genommenen Knochenmarksprobe (meistens am Becken) und kein Nachweis von Anämie, Hyperkalzämie oder Nierenbeteiligung (welche auf ein systemisches Myelom hinweisen würde) vorliegen.
Therapielinie: Ein Begriff für die Angabe der Anzahl an Therapien, die ein Patient bereits durchlaufen hat. Eine Induktionstherapie + eine autologe Stammzellentransplantation (ASCT) gilt als eine einzige Therapielinie. Siehe „Induktionstherapie“.
Transplantation: Es gibt verschiedene Formen der Transplantation.
• Periphere Blutstammzellen (PBSC)-Transplantation – Hier entnimmt der Arzt gesunde blutbildende Stammzellen aus dem Blutkreislauf
40 +1.818.487.7455 • +1.800.452.CURE
eines Patienten (nicht aus dem Knochenmark). Diese werden dann eingefroren und aufbewahrt. Der Patient erhält eine hochdosierte Chemotherapie, durch die die Krebszellen zerstört werden. Allerdings werden dabei auch die gesunden Blutzellen abgetötet. Die gefrorenen Stammzellen werden aufgetaut und dem Patienten wieder zugeführt, damit sie neue Blutzellen produzieren und die durch die Therapie zerstörten Zellen ersetzen.
• Autologe Transplantation – Ein Verfahren, bei dem Stammzellen dem Blut eines Patienten entnommen und ihm dann nach einer intensiven Therapie wieder zugeführt werden.
• Knochenmarktransplantation – Dieser Begriff bezieht sich auf den Vorgang, bei dem Stammzellen dem Knochenmark entnommen werden, um diese einem Patienten zu infundieren. Dieser Begriff wird heute beim Myelom weniger häufig verwendet, da Stammzellen mittlerweile aus dem peripheren (zirkulierenden) Blut gewonnen werden.
• Allogene Transplantation (Allograft) – Die Infusion von Knochenmark oder Stammzellen von einer Person (Spender) zu einer anderen (Empfänger). Ein Patient erhält Knochenmark oder Stammzellen eines passenden, jedoch genetisch nicht identischen Spenders. Es wird ein HLA-Bluttest durchgeführt, um zu bestimmen, ob für einen Patienten möglicherweise ein passender Spender vorhanden ist. Der Spender kann ein Familienmitglied sein oder über ein Spenderregister wie das Zentrale Knochenmarkspender-Register für die Bundesrepublik Deutschland (ZKRD) gesucht werden. In seltenen Fällen findet sich über eine Nabelschnurblutbank ein Spender. Die Zellen des Immunsystems des Spenders identifizieren die Myelomzellen des Empfängers als fremd und greifen sie an und zerstören sie. Leider greifen die Spenderzellen auch anderes Gewebe im Körper des Empfängers an, so dass es zur Graft-versus-Host-Erkrankung (GvHD) kommt, welche tödlich enden kann.
• Allotransplantation mit reduzierter Konditionierung (RIC) – Ein neueres und, beim Myelom, sichereres Verfahren als eine allogene Transplantation. Bei der RIC handelt es sich um eine nicht myoablative „Mini-Allo“-Transplantation mit reduzierter Intensität, die innerhalb von 180 Tagen nach einer standardmäßigen autologen Transplantation durchgeführt wird.
• Tandemtransplantation – Ein Begriff, der zwei zeitlich eng aufeinanderfolgende autologe Transplantationen beschreibt.
Tandemtransplantationen werden normalerweise in 3- bis 6-monatigen Intervallen zwischen den Transplantaten geplant. Die Tandemtransplantation ist in den USA im Zeitalter der wirksamen neuartigen Therapien seltener geworden.
41 myeloma.org
• Transplantation mit passendem Fremdspender (MUD) – Bezieht sich auf eine Stammzellentransplantation, bei der der Patient Stammzellen einer genetisch passenden Person bekommt, die allerdings kein Familienangehöriger ist. Dieses Verfahren wird aufgrund des hohen Mortalitätsrisikos wegen Graft-versus-Host-Reaktionen (GvHD) für Myelompatienten nicht empfohlen.
• Syngene Transplantation – Die Infusion von Knochenmark oder Stammzellen von einem eineiigen Zwilling zum anderen.
• Nabelschnurblut-Transplantation – Der Nabelschnur Neugeborener werden Stammzellen entnommen. Diese werden eingefroren und in Nabelschnurblutbanken gelagert. Da für eine ausreichende Menge Stammzellen für eine Transplantation bei einem Erwachsenen mehrere Nabelschnüre nötig sind, erhöht sich bei dieser Art Transplantation das Risiko für die Graft-versus-Host-Erkrankung (GvHD), wodurch sie für Myelompatienten mit einem noch höheren Risiko verbunden ist.
Tumor: Eine abnorme Gewebemasse, die durch übermäßige Zellteilung entsteht. Beim Myelom wird ein Tumor als Plasmozytom bezeichnet.
Virus: Ein kleines lebendes Partikel, der Zellen infizieren und die Zellfunktion verändern kann. Die Erkrankung und die durch diese Partikel entstehenden Symptome hängen von der Art des Virus und des befallenen Zelltyps ab.
Waldenström macroglobulinemia/Morbus Waldenström (WM): Ein seltener Typ eines indolenten Lymphoms, der die Plasmazellen betrifft. Es kommt zu einer Überproduktion von IgM. Es handelt sich hierbei nicht um eine Myelomerkrankung.
Weiße Blutkörperchen: Allgemeine Bezeichnung für verschiedene Zellen, die für die Bekämpfung von Keimen, Infektionen oder allergieverursachenden Substanzen verantwortlich sind. Diese Zellen werden im Knochenmark gebildet und gelangen dann in andere Teile des Körpers. Spezifische weiße Blutkörperchen sind Neutrophile, Basophile, Eosinophile, Lymphozyten und Monozyten.
Wirbel (Vertebra): Eines der 33 Knochensegmente der Wirbelsäule. Der Plural des Substantivs (lat.) ist „Wirbel“ (Vetrebrae).
Zytokine: Zytokine sind von Zellen hergestellte Proteine, die das Wachstum/die Aktivität anderer Zellen stimulieren oder hemmen können.
Zytokine werden lokal produziert (beim Myelom im Knochenmark) und können im Blutstrom zirkulieren. Die Zytokine werden normalerweise bei einer Infektion freigesetzt.
42 +1.818.487.7455 • +1.800.452.CURE



















