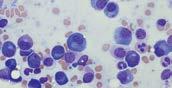
Tabella 2. Problemi correlati al mieloma
EFFETTI DELLE CELLULE MIELOMATOSE SUL MIDOLLO OSSEO CRITERI CRAB
C – Aumento dei valori del Calcio
Rilascio di calcio nel circolo ematico da parte dell’osso danneggiato.
• Confusione
• Disidratazione
• Costipazione
• Astenia
• Debolezza
• Danno renale
R – Problemi Renali –danno renale
Le proteine che costituiscono la componente monoclonale anomala prodotta dalle cellule mielomatose vengono rilasciate nel circolo ematico e possono passare nelle urine causando un danno renale. Alti livelli di calcio, infezioni e altri fattori possono inoltre causare o incrementare la gravità del danno renale.
A: Anemia Riduzione del numero e dell’attività delle cellule adibite alla produzione dei globuli rossi nel midollo osseo.
B: Danno osseo
• Assottigliamento osseo (osteoporosi) o
• Aree di danno maggiore (chiamate lesioni litiche), fratture o crolli vertebrali
Altri tipi di disfunzione d’organo
Le cellule mielomatose attivano gli osteoclasti, che distruggono l’osso e bloccano gli osteoblasti, che normalmente riparano l’osso danneggiato.
• Circolazione rallentata
• Astenia
• Confusione
Alterazione dell’attività immunitaria
Effetti del mieloma locali o sistemici, diversi da CRAB.
• Astenia
• Debolezza
• Dolore osseo
• Fratture o crolli ossei
• Tumefazione ossea
• Danni nervosi o al midollo spinale
Le cellule mielomatose riducono il numero e l’attività delle normali plasmacellule in grado di produrre anticorpi contro le infezioni.
• Neuropatia
• Infezioni ricorrenti
• Sanguinamenti
• Altri problemi individuali
• Suscettibilità alle infezioni
• Guarigione dalle infezioni più lenta
8 +1.818.487.7455 • +1.800.452.CURE
EFFETTO
CAUSA
SUL PAZIENTE
virus 40 (SV40, un contaminante presente nelle preparazioni per il vaccino Sabin anti-polio usate tra il 1955 e il 1963).
Formulare una diagnosi corretta
Il mieloma è una malattia con caratteristiche fortemente individuali. Spesso progredisce lentamente, altre volte può rivelarsi molto aggressivo. Un ematologo-oncologo specializzato nel mieloma e in altre malattie delle plasmacellule sarà in grado di effettuare la diagnosi corretta e stabilire l’approccio terapeutico migliore per ogni situazione individuale.
Può succedere che un oncologo locale veda solo pochi pazienti affetti da mieloma o addirittura nessuno. Gli specialisti nel campo del mieloma che lavorano presso importanti centri di cura visitano centinaia di pazienti, conducono sperimentazioni cliniche con nuovi farmaci e nuove terapie di combinazione, e sviluppano l’esperienza e le competenze necessarie per prendere decisioni appropriate, riuscendo ad anticipare e prevenire i problemi correlati alle cure.
Anche se nelle vostre vicinanze non è presente uno specialista nel campo del mieloma, vi consigliamo di cercare altrove un esperto con cui prendere appuntamento, di persona oppure da remoto. Anche il vostro medico di fiducia potrà programmare un consulto con uno specialista per discutere il vostro caso e potrà quindi collaborare con quest’ultimo per stabilire la vostra cura.
Un ampio studio pubblicato nel 2016 mostra che il tasso di sopravvivenza globale (OS) è più elevato per i pazienti in cura presso centri importanti, piuttosto che in piccoli ambulatori. Per questo raccomandiamo di consultare uno specialista nel campo del mieloma.
Criteri per la diagnosi del mieloma
I "criteri CRAB" (dall’inglese Calcium, Renal damage, Anemia, Bone damage) sono i più comuni problemi di carattere medico causati dal mieloma, vale a dire:
¡ Un elevato livello di calcio nel sangue.
¡ Danni renali.
¡ Bassi livelli di cellule nel sangue (specialmente bassi livelli di globuli rossi o anemia).
¡ Lesioni ossee.
Per molti anni, i criteri CRAB hanno rappresentato l’unica base per diagnosticare il mieloma attivo. In assenza di uno di questi segnali, che indicano che il mieloma ha già danneggiato fatalmente un organo, i pazienti venivano monitorati da un medico ma non erano trattati.
9 myeloma.org
Mieloma attivo in fase iniziale
SMM ad alto rischio
SMM a basso rischio
MGUS
Criteri CRAB
Eventi che de niscono il mieloma (MDE)
Plasmacellule presenti nel midollo osseo ≥ 60%
Rapporto tra catene monoclonali e normali leggere ≥100
>1 lesione focale rilevata in MRI
Criteri da gruppo spagnolo
Criteri da Mayo
MM Mieloma Multiplo
Mieloma attivo in fase iniziale Mieloma smoldering ad altissimo rischio
HR SMM Mieloma smoldering ad alto rischio
LR SMM Mieloma smoldering a basso rischio
MGUS Gammopatia monoclonale di incerto signi cato
Negli ultimi anni, cure più efficaci per il mieloma e metodi migliori di valutazione dello stadio iniziale hanno comportato significativi cambiamenti nel paradigma di cura.
I membri della divisione di ricerca dell’IMF, l’International Myeloma Working Group (IMWG), hanno studiato pazienti affetti da SMM asintomatico per individuare i marcatori biologici che potrebbero prevedere l’insorgere di un danno fatale agli organi entro 18 mesi–2 anni. In seguito al completamento e alla pubblicazione di questa ricerca, l’IMWG ha redatto le nuove linee guida per la diagnosi del mieloma che includono tre “eventi che definiscono il mieloma” (MDE myeloma-defining events). I seguenti MDE indicano, indipendentemente l’uno dall’altro, la necessità di cura:
1. Presenza di ≥60% di plasmacellule nel midollo osseo.
2. Un rapporto tra le catene leggere libere coinvolte e non coinvolte ≥100 (le catene leggere non coinvolte sono quelle che non sono costituite da cellule mielomatose).
3. Presenza di più di una lesione focale rilevata mediante risonanza magnetica (MRI).
Questi tre MDE possono essere identificati attraverso test che devono essere inseriti nell’iter diagnostico del mieloma per i pazienti di nuova diagnosi:
10 +1.818.487.7455 • +1.800.452.CURE
MM
Lorem ipsum
Figura 3. Definizioni di mieloma e mieloma in fase iniziale
¡ Biopsia osteomidollare.
¡ Test Freelite® (dosaggi delle catene leggere libere sieriche).
¡ Scansione MRI.
Stadiazione del mieloma
Quando viene fatta una diagnosi di mieloma, lo stadio della malattia varia da paziente a paziente.
Nel 1975 è stato introdotto il Durie/Salmon Staging System (DSS, Sistema di stadiazione Durie/Salmon) per classificare i pazienti affetti da mieloma. Il DSS ha dimostrato la correlazione tra l’estensione del mieloma e il danno causato dallo stesso. In alcuni pazienti che producono una grande quantità di proteina M, il numero di cellule mielomatose può risultare inaspettatamente piuttosto basso. Al contrario, in pazienti con una bassa produzione di proteina M, il numero di cellule mielomatose può essere alto.
Nel 2005, l’IMWG ha messo a punto l’International Staging System (ISS, Sistema di stadiazione internazionale) che si basa su fattori prognostici e sulla sopravvivenza attesa. L’ISS valuta il comportamento della malattia che è maggiormente predittivo di un mieloma aggressivo. L’ISS si basa su quattro marcatori altamente predittivi di una malattia aggressiva:
1. Beta-2 microglobulina sierica (S β2M),
2. Albumina sierica (S ALB),
3. Proteina C reattiva (CRP), e
4. Lattato deidrogenasi sierica (LDH).
Nel 2015 l’IMWG ha pubblicato il Revised International Staging System (R-ISS, Sistema di stadiazione internazionale rivisto) che associa l’ISS a due test per le anomalie cromosomiche. È fortemente raccomandato che questi due studi cromosomici vengano effettuati su campioni di aspirato midollare prelevati al momento della diagnosi:
¡ Citogenetica (cariotipo),
¡ Ibridazione in situ fluorescente (FISH).
Esami che è necessario eseguire
Un test di laboratorio eseguito sul sangue può valutare le proteine presenti nel sangue, vale a dire la S β2M, S ALB, la CRP, e la LDH.
L’analisi citogenetica consiste nella valutazione dei cromosomi delle cellule mielomatose durante la divisione cellulare. Il tasso di crescita attiva delle cellule mielomatose è normalmente estremamente basso. Di norma si assiste a una proliferazione delle cellule inferiore al 3% e spesso inferiore
11 myeloma.org
STADIO CRITERI
STADIO I
(massa con poche cellule)
Tutti i seguenti:
• Valore di emoglobina > 10 g/dl
• Valore di calcio sierico normale o < 10,5 mg/dl
• Radiografia dello scheletro con normale struttura ossea (scala 0) o con un singolo plasmocitoma osseo solitario
• Basso tasso di produzione di proteina monoclonale, valori di IgG <5 g/dl; valori di IgA <3 g/dl
• Catene leggere della proteina M nelle urine all’elettroforesi <4 g/24h
MASSA DI MIELOMA MISURABILE (cellule mielomatose nell’intero organismo)
600 miliardi/m2
STADIO II
(massa intermedia) Criteri che non rientrano né nello Stadio I né nello Stadio III
STADIO III
(massa con molte cellule)
Uno o più dei seguenti valori:
• Valori di emoglobina < 8,5 g/dl
• Valori di calcio sierico > 12 mg/dl
• Lesioni litiche avanzate (scala 3)
• Alto tasso di produzione di proteina monoclonale, valori di IgG >7 g/dl; valori di IgA >5 g/dl
• Catene leggere della proteina M nelle urine >12 g/24h
Da 600 a
1.200 miliardi/m2
> 1.200 miliardi/m2
SOTTOCLASSIFICAZIONE (A o B)
• A: funzionalità renale relativamente nella norma, (creatinina nel siero <2,0 mg/dl)
• B: funzionalità renale alterata (creatinina nel siero >2,0 mg/dl)
Tabella 4. Fattori di rischio standard per il mieloma e l’R-ISS
FATTORE PROGNOSTICO
Stadio ISS I
CA rilevate mediante
FISH
CRITERI
β2-microglobulina sierica <3,5 mg/L, albumina sierica ≥3,5 g/dL
II Non di stadio I o II secondo ISS
III
Alto rischio
β2-microglobulina sierica ≥5,5 mg/L
Presenza di del(17p) e/o traslocazione t(4;14) e/o traslocazione t(14;16)
Rischio standard Non CA ad alto rischio
LDH Normale LDH sierica < limite superiore di normalità
Alto LDH sierica > limite superiore di normalità
Un nuovo modello di stratificazione del rischio per il mieloma multiplo
Stadio R-ISS I Stadio ISS I e CA a rischio standard rilevato mediante FISH e LDH normale
II Non stadio R-ISS I o III
III Stadio ISS III e CA ad alto rischio rilevato mediante FISH o LDH alta
Abbreviazioni: CA (chromosomal abnormalities) = Anomalie cromosomiche; FISH (interphase fluorescence in situ hybridization) = Ibridazione in situ fluorescente in interfase; ISS (International Staging System) = Sistema di stadiazione internazionale);
LDH (lactate dehydrogenase) = Lattato deidrogenasi; R-ISS (Revised International Staging System) = Sistema di stadiazione internazionale rivisto.
12 +1.818.487.7455 • +1.800.452.CURE
Tabella 3. Sistema di stadiazione di Durie/Salmon (DSS)
Tabella 5. Fattori prognostici TEST SIGNIFICATO
β2 microglobulina sierica (S β2M)
Albumina sierica (S ALB)
Proteina C reattiva (CRP)
Lattico deidrogenasi sierica (LDH)
Alterazioni cromosomiche alla citogenetica e alla ibridazione in situ con fluorescenza (FISH) su midollo osseo
Più il valore è elevato, più lo stadio è avanzato.
Più il valore è basso, più lo stadio è avanzato.
Il valore aumenta con la malattia attiva.
Il valore aumenta con la malattia attiva.
Diverse delezioni o traslocazioni cromosomiche sono considerate ad alto rischio e possono associarsi a una durata più breve della remissione.
all’1%, il che fornisce una valutazione incompleta di eventuali alterazioni cromosomiche presenti. Ciò nonostante, le eventuali anomalie rilevate sono importanti poiché si manifestano su quelle poche cellule che in realtà stanno crescendo.
La FISH consiste nella valutazione dei cromosomi di tutte le cellule mielomatose contenute in un campione di midollo osseo. Indipendentemente dalla crescita delle cellule mielomatose, la FISH consente di rilevare eventuali alterazioni. Al campione di midollo osseo vengono aggiunte speciali sonde geniche che utilizzano la fluorescenza. Queste sonde tracciano il materiale genetico in seguito alla divisione cellulare e segnalano la presenza o l’assenza di anomalie cromosomiche che sono solite comparire nel mieloma. A ciascun cromosoma viene assegnata una sonda di colore diverso. Ad esempio, se il materiale genetico dal cromosoma 4 viene erroneamente collegato al cromosoma 14, i punti di colori diversi di materiale genetico provenienti da questi cromosomi vengono visualizzati insieme, indicando un’anomalia ad alto rischio t(4;14), abbreviazione per “traslocazione di materiale genetico tra il cromosoma 4 e 14”. Altre anomalie considerate ad alto rischio sono t(14;16), t(14;20), 17p-, che sta per “perdita del braccio corto (parte superiore) del cromosoma 17”, e 1q+ che sta per “braccio lungo aggiuntivo (parte inferiore) del cromosoma 1”. Il test con metodica FISH consente di rilevare la presenza di traslocazioni, elementi mancanti ed elementi aggiuntivi, nonché la perdita cromosomica.
La presenza di anomalie cromosomiche generalmente porta a prognosi negative, ma si tratta solo di una tendenza e non di una certezza. Circa un terzo dei pazienti che presentano una delle anomalie ad alto rischio può avere un decorso clinico favorevole e registrare risultati normali con gli approcci terapeutici standard attuali, come la terapia basata su induzione seguita dal trapianto autologo di cellule staminali (ASCT).
13 myeloma.org


14 +1.818.487.7455 • +1.800.452.CURE
Figura 5. Ibridazione in situ fluorescente (FISH) di una cellula mielomatosa
Figura 6. Anomalie cromosomiche nel mieloma ad alto rischio Cancellazione Traslocazione
Figura 4. Analisi del cariotipo dei cromosomi umani
Esami di base
Biopsia del midollo osseo:
Si tratta dell’esame più importante finalizzato alla determinazione sia della presenza sia della percentuale di cellule mielomatose nel midollo osseo e alla valutazione della prognosi. Nello stadio I del mieloma o in caso di plasmocitoma solitario, potrebbe essere necessaria la biopsia diretta della massa tumorale. L’analisi citogenetica può fornire un’indicazione sulle caratteristiche dei cromosomi, ma per questo tipo di test è necessario un campione di midollo osseo fresco.
Esami del sangue:
¡ L’esame emocromocitometrico completo (CBC) serve per valutare la presenza e la gravità dell’anemia, una bassa conta di globuli bianchi e un abbassamento del livello di piastrine.
¡ Gli esami ematochimici sono utilizzati per valutare la funzionalità renale (creatinina e azoto ureico nel sangue, BUN), la funzionalità epatica e i livelli di albumina, calcio e LDH.
¡ L’elettroforesi delle sieroproteine (SPEP) valuta la quantità anomala di proteine a catena pesante del mieloma e mostra la presenza del picco M.
¡ L’elettroforesi con immunofissazione (IFE) mostra il tipo di catena pesante (G, A, D, E e M) e catena leggera (kappa [κ], lambda [λ]) della proteina coinvolta nel mieloma.
¡ Il saggio Freelite® misura i livelli delle catene leggere kappa o lambda libere e il rapporto kappa-lambda, se la SPEP o l’UPEP non hanno riscontrato anomalie.
¡ Il test Hevylite® misura i livelli normali o anomali delle immunoglobuline intatte.

Esami delle urine:
L’elettroforesi delle proteine urinarie (UPEP) quantifica la proteina M presente nelle urine. L’immunofissazione mostra il tipo di proteina M.
15 myeloma.org
Figura 7. Composizione del sangue
Globuli rossi
Globuli bianchi
Piastrine
Plasma
© 2015
Slaybaugh Studios
albumina
alfa-2 beta-1 beta-2 gamma
alfa-2 beta-1 beta-2 gamma Risultato SPEP normale
Esami sullo scheletro:
albumina
alfa-2 beta-1 gamma
alfa-2 beta-1 gamma
Risultato anomalo con cellule mielomatose che producono la proteina M, creando un picco M nella zona beta-2
La presenza, la gravità e la localizzazione del danno osseo possono essere valutati utilizzando quanto segue:
¡ I raggi X rivelano il tipico quadro di danno osseo da mieloma presente nella maggioranza dei pazienti, ma la radiografia può essere negativa nel 25% circa dei pazienti con mieloma attivo. Sono necessari altri esami con MRI completa, TC completa a basso dosaggio o PET/TC per ricercare un eventuale coinvolgimento osseo. Una valutazione dell’intero scheletro mediante una serie di radiografie è necessaria per rilevare la perdita ossea (osteoporosi) o l’assottigliamento osseo (osteopenia) causate dalla distruzione ossea da parte del mieloma, la presenza di lesioni litiche e/o qualunque tipo di frattura o cedimento osseo.
¡ La risonanza magnetica (MRI) può rivelare la presenza e la distribuzione della malattia nel midollo osseo quando l’Rx non riscontra alcun danno osseo o per indagare più nel dettaglio alcune aree come la colonna vertebrale e/o il cervello. Può anche identificare la presenza di malattia fuori dall’osso, che potrebbe comprimere nervi e/o il midollo spinale.
¡ La tomografia computerizzata (TAC) è utilizzata quando l’Rx è negativa o per avere maggiori dettagli su alcune aree particolari. È utile soprattutto per la valutazione ottimale di piccole aree di danno osseo o di compressione dei nervi.
¡ La Tomografia a emissione di positroni (PET) è una tecnica molto più sensibile per l’analisi dell’intero organismo. La PET con FDG o la PET/TC è utile per monitorare la malattia, soprattutto nella forma non secretoria. La TC viene usata per valutare le aree risultate positive alla PET.
16 +1.818.487.7455 • +1.800.452.CURE
beta-2
Figura 8. Risultati del test SPEP
albumina alfa-1
albumina alfa-1
alfa-1
beta-2
alfa-1
¡ La densitometria ossea è utile per valutare la perdita ossea diffusa nel mieloma e per misurare il progressivo miglioramento in corso di terapia con bifosfonati.
¡ La scintigrafia non è utile nel mieloma e non deve essere eseguita se non nel sospetto di altre diagnosi.
Per ulteriori informazioni sui test utilizzati nel mieloma, vi invitiamo a leggere la pubblicazione dell’IMF Understanding Your Test Results (Conoscere e comprendere i risultati dei propri esami).
Possibili problemi urgenti al momento della diagnosi
Dal momento che le vertebre vengono spesso colpite da mieloma e poiché il midollo spinale si trova all’interno delle vertebre, è facile che si verifichino dolorose fratture vertebrali che causano la compressione del nervo. I danni ai nervi motori possono causare paralisi. I mielomi che si sviluppano all’interno delle vertebre possono anche comprimere i nervi spinali. Il rilascio di calcio dalla ossa può causare ipercalcemia, ovvero un alto livello di calcio nel sangue. Sia l’ipercalcemia sia gli elevati livelli di proteina M nel sangue possono compromettere seriamente i reni causando insufficienza renale.
Fratture vertebrali da compressione, danni ai nervi del midollo spinale, infezioni e insufficienza renale, sono tutti problemi gravi di carattere medico che devono essere trattati prima dell’inizio della terapia sistemica contro il mieloma. Consigliamo di consultare tempestivamente uno specialista del mieloma per assicurarsi che qualsiasi trattamento dei problemi urgenti lasci aperte tutte le opzioni terapeutiche per il futuro. Ad esempio, la radioterapia per la riduzione di un plasmocitoma che preme sul tessuto nervoso deve essere valutata attentamente in opposizione all’opzione chirurgica, poiché le radiazioni potrebbero danneggiare permanentemente il midollo osseo e limitare la scelta dei trattamenti successivi.
Tipi di mieloma
Ci sono diversi tipi e sottotipi di mieloma, che dipendono dal tipo di proteina o immunoglobulina prodotta dalle cellule mielomatose. I 5 tipi di immunoglobuline a catena pesante normali – IgG, IgA, IgD, IgE e IgM –hanno diverse funzioni all’interno dell’organismo.
Ogni immunoglobulina è costituita da due catene pesanti legate a due catene leggere. I due tipi di catene leggere prendono il nome di kappa (κ) e lambda (λ). La tipizzazione del mieloma viene eseguita attraverso l’elettroforesi con immunofissazione (IFE).
17 myeloma.org
Le cellule mielomatose formano un solo tipo di proteina monoclonale, un gruppo di cellule identiche generate da una cellula ancestrale comune. Circa il 65% dei pazienti affetti da mieloma presenta un mieloma da IgG con catene leggere kappa o lambda. Il secondo tipo più comune è il mieloma da IgA, anche questo a catene leggere kappa o lambda. I mielomi IgD, IgE e IgM sono abbastanza rari.
Circa un terzo dei pazienti affetti da mieloma produce catene leggere libere, oltre alle molecole complete costituite dalla combinazione di catene leggere legate a catene pesanti. In circa il 15%-20% dei pazienti, le cellule mielomatose producono solo le catene leggere e non le catene pesanti. In questo caso, si parla di mieloma di Bence-Jones, dal nome del medico inglese che per primo ha rilevato e identificato le catene leggere e pubblicato le sue scoperte nel 1848. Le proteine monoclonali costituite da catene leggere sono più piccole e pesano meno di quelle pesanti, essendo così in grado di penetrare nei sottili capillari che portano il sangue ai reni. Le catene leggere che portano il sangue ai reni possono accumularsi al punto da ostruire i tubuli renali, causando una riduzione della funzionalità renale.

Raramente, in circa l’1% o il 2% dei pazienti, le cellule mielomatose producono pochissime o nessuna proteina monoclonale di qualunque tipo. In questo caso il mieloma è definito non secernente. Il test Freelite è in grado di determinare la conta al minuto delle catene leggere nel sangue di circa il 70% di questi pazienti con bassi livelli di secrezione. Nel 2015, uno studio pubblicato dalla Mayo Clinic su 124 pazienti affetti da mieloma non secernente ha dimostrato che la sopravvivenza dei pazienti affetti da mieloma non secernente sembra essere superiore a quella dei pazienti affetti da una forma secretoria.
L’importanza di conoscere il proprio tipo di mieloma
Conoscere il proprio tipo di mieloma aiuterà a comprendere e sorvegliare i risultati dei proprio esami nel corso del trattamento. Il test Freelite e la SPEP sono utilizzati per monitorare i livelli di proteina M a catene
18 +1.818.487.7455 • +1.800.452.CURE
Figura 9. Strutture delle immunoglobuline
IgM IgA IgG, IgE, IgD
leggere e catene pesanti prodotte dalle cellule mielomatose. Quantificare la produzione delle cellule mielomatose rappresenta un modo indiretto ma efficace per valutare l’entità e l’attività del cancro. Il solo modo per osservare le cellule mielomatose direttamente è attraverso una biopsia del midollo osseo.
Test per monitorare il livello di proteina M e molti altri esami saranno eseguiti regolarmente per valutare la risposta al trattamento e seguire le vostre condizioni durante i periodi di remissione. Consigliamo vivamente di tenere traccia dei risultati dei vostri esami e di prendere dimestichezza con gli esami utilizzati nella diagnosi e trattamento del mieloma. Ancora una volta, consigliamo di leggere la pubblicazione dell’IMF Understanding Your Test Results (Conoscere e comprendere i risultati dei propri esami).
Comportamento dei diversi tipi di mieloma
¡ Il mieloma IgG è il tipo più comune di mieloma e il suo comportamento è in linea con le normali caratteristiche CRAB.
¡ Il mieloma IgA è talvolta caratterizzato dalla presenza di masse al di fuori dell’osso.
¡ Il mieloma IgD può essere accompagnato da leucemia plasmacellulare (PCL), caratterizzata da alti livelli di cellule mielomatose che circolano nel sangue. Il mieloma IgD è anche causa di danni renali.
¡ Il mieloma a catene leggere è il tipo che più di frequente causa danno ai reni e/o forma depositi di catene leggere nei reni e/o causa danni al sistema nervoso o ad altri organi. A seconda delle caratteristiche dei depositi di catene leggere, questa condizione viene definita amiloidosi da catene leggere di amiloide (amiloidosi AL) o malattia da deposito di catene leggere (LCDD).
Altre malattie delle plasmacellule sono la macroglobulinemia di Waldenström (WM), che è associata alle IgM, e la sindrome di POEMS, una malattia rara associata a neuropatia, ingrossamento degli organi, disturbi a livello endocrino, componente monoclonale e alterazioni della cute.
Effetti del mieloma sul midollo osseo
Le cellule mielomatose rilasciano diverse proteine e altri agenti chimici all’interno del microambiente locale del midollo osseo e direttamente nel flusso sanguigno. Tutte le cellule sanguigne – ovvero i globuli bianchi, i globuli rossi e le piastrine – vengono generate dal midollo osseo. Quando il mieloma si sviluppa all’interno del midollo osseo, gli effetti comprendono una riduzione della produzione di cellule sanguigne. L’anemia, ovvero un livello ridotto di globuli rossi o emoglobina, è un segnale iniziale e comune di mieloma.
19 myeloma.org
Tabella 6. Tipi di mieloma e malattie correlate
TIPO DI MALATTIA DESCRIZIONE
Mieloma: IgG κ o λ IgA κ o λ Sottotipi più rari: IgD, E o M
Solo catene leggere o mieloma di Bence-Jones: Tipo κ o λ
Mieloma non secernente: Tipo κ o λ
Mieloma IgM:
Sottotipo κ o λ
Amiloidosi:
AL o catene leggere delle immunoglobuline
Sottotipo κ o λ
• Tipico mieloma: maggior parte dei pazienti.
• Monitorato misurando la proteina monoclonale nel siero mediante SPEP (Elettroforesi delle sieroproteine) (IgG) e/o mediante la misurazione quantitativa dell’immunoglobulina (QIG) (IgA/D/E). Nel caso del mieloma IgA, la misurazione quantitativa dell’immunoglobulina è spesso più affidabile.
• Mieloma di Bence-Jones: circa il 15%–20% dei pazienti.
• Seguito misurando le catene leggere monoclonali nelle urine mediante UPEP e/o mediante misurazione delle catene leggere libere nel siero (Freelite®).
• Mieloma meno comune: 1%-2% dei pazienti.
• Siccome sia SPEP che UPEP sono negative (non c’è un picco monoclonale nel siero o nelle urine), la malattia viene seguita con il test Freelite®.
• Il mieloma IgM è un sottotipo molto raro.
• Tipicamente, la produzione di IgM si verifica in una malattia chiamata Macroglobulinemia di Waldenström, che è più simile ad un linfoma (tumore di un linfonodo) rispetto al mieloma, che è un cancro del midollo osseo.
• Nell’amiloidosi, le catene leggere si depositano nei tessuti in maniera lineare (foglietto β-ripiegato) anziché scomporsi per poi essere escrete nelle urine.
• Esistono diverse varianti di amiloidosi, che comportano depositi di diversi tipi di proteina. Per esempio, l’Alzheimer è caratterizzato da depositi di proteine nel cervello.
• Nell’amiloidosi associata a mieloma, le catene leggere possono depositarsi in diversi tessuti, come la pelle, la lingua, il cuore, i reni, il sistema nervoso, i polmoni, il fegato e l’intestino.
• I tessuti colpiti risultano positivi a un test che prevede la “colorazione rosso congo”, che è un esame diagnostico. Potrebbero rivelarsi appropriati e necessari esami più approfonditi con spettroscopia di massa e/o microscopia elettronica.
Malattia da deposito di catene leggere (LCDD): Sottotipo κ o λ
• Nella LCDD, le catene leggere si depositano in forme più disordinate (random cross link).
• I tessuti risultano positivi all’immunoistochimica diretta per le catene κ o λ. La colorazione rosso congo è di solito negativa.
• Ci sono diversi tipi di depositi a livello dei tessuti, che spesso coinvolgono i reni, il rivestimento dei polmoni (pleura) o il peritoneo, che si trova intorno all’intestino, o a livello degli occhi.
Sindrome di POEMS: Di solito IgG o IgA λ (raro il sottotipo κ)
• La sindrome di POEMS è una patologia complessa che comprende la polineuropatia, l’organomegalia, l’endocrinopatia, la gammopatia monoclonale e alterazioni della cute. La diagnosi e il trattamento sono diversi da quelli previsti per il mieloma. Per maggiori informazioni, proseguire con la lettura del testo.
20 +1.818.487.7455 • +1.800.452.CURE
Le cellule di un midollo osseo sano mantengono il nostro scheletro in un processo dinamico ed equilibrato tra fratture ossee e produzione ossea. La presenza di cellule mielomatose nel midollo osseo stimola le cellule responsabili delle fratture ossee (osteoclasti) e sopprime le cellule che producono nuove ossa (osteoblasti). Questo sconvolge il loro equilibrio, causando dolori ossei, fratture e rilascio di calcio nel sangue.
Effetti del mieloma in sede extra midollare
Poiché le cellule mielomatose si riproducono e si sviluppano nel midollo osseo, la proteina M viene rilasciata nel flusso sanguigno. La proteina M può causare danni tissutali anche distanti. Ad esempio, il danno renale è abbastanza frequente. La proteina M può anche interferire con la coagulazione e/o con la circolazione e può causare potenzialmente altri danni a livello di organi o tessuti, ad esempio danni al tessuto nervoso [neuropatia periferica (PN)].
Trattamento per i pazienti con nuova diagnosi di mieloma
Cure tempestive ed efficaci sono fondamentali per ogni paziente affetto da mieloma, specialmente per quelli che presentano caratteristiche di una malattia ad alto rischio. Gli esami di base, la stadiazione e la classificazione prognostica sono essenziali. La prima importante decisione da prendere è quando iniziare il trattamento per il mieloma.
Il trattamento per il mieloma tiene sotto controllo le fratture ossee e la crescita tumorale, così come altri effetti causati dalle proteine M e dalle citochine che vengono stimolate.
Il trattamento è raccomandato nel caso di mieloma attivo sintomatico e di SMM asintomatico con MDE.
L’urgenza del trattamento dipende dai problemi che presenta ciascun singolo paziente. Ecco perché l’esperienza e la competenza di uno specialista nell’ambito del mieloma è così importante.
Figura 10. Anatomia della formazione ossea
Osteocita
Osteoblasto (forma nuovo tessuto osseo)
Osteoclasto (disgrega la matrice ossea)


21 myeloma.org
Osso spugnoso contenente midollo rosso Osso compatto Midollo giallo © 2017 Slaybaugh Studios
I significativi progressi compiuti nel trattamento del mieloma negli ultimi anni hanno ampliato le opzioni disponibili per i pazienti di nuova diagnosi. Le pubblicazioni della serie Understanding relative ai diversi farmaci, messe gratuitamente a disposizione dall’IMF, illustrano in maggior dettaglio i farmaci utilizzati per trattare il mieloma. A febbraio 2022, i trattamenti approvati dalla FDA per il mieloma di nuova diagnosi sono i seguenti:
¡ Darzalex® (daratumumab): un anticorpo monoclonale somministrato mediante infusione endovenosa e approvato in combinazione con Velcade® (bortezomib) + talidomide + desametasone (VTd) per i pazienti candidabili a ASCT, e in combinazione con Revlimid® (lenalidomide) + desametasone (Rd) o Velcade + melfalan + prednisone (VMP) per i pazienti non candidabili a ASCT.
Tabella 7. Obiettivi del trattamento per il mieloma
TIPO DI TRATTAMENTO Stabilizzare Palliativo
OBIETTIVO Contrastare i disturbi che mettono in pericolo l’equilibrio chimico-fisico del corpo e il sistema immunitario
ESEMPI
• Plasmaferesi per fluidificare il sangue ed evitare ictus
• Emodialisi quando la funzionalità renale è compromessa
• Farmaci per ridurre l’ipercalcemia (potrebbe essere inclusa la chemioterapia)
Alleviare i sintomi e aumentare la capacità del paziente di svolgere le normali funzioni quotidiane
• Radiazioni per interrompere la distruzione ossea
• Trasfusioni di globuli rossi per migliorare l’anemia
• Intervento ortopedico per trattare e/o rinforzare l’osso
TEMPO PER DECIDERE Da ore a giorni Da giorni a mesi
TIPO DI TRATTAMENTO
Per indurre remissione Curativo
OBIETTIVO Miglioramento dei sintomi, rallentamento o arresto del corso della malattia
ESEMPI • Terapia per distruggere le cellule maligne all’interno dell’organismo
• Radioterapia per distruggere le cellule maligne in un’area tumorale
TEMPO PER DECIDERE Da settimane a mesi
Remissione permanente*
• Trapianti di cellule staminali per poter somministrare al paziente alte dosi di chemioterapia
Da settimane a mesi
*Cura significa eradicazione permanente della malattia. “Cura funzionale” è un termine utilizzato per descrivere una risposta eccellente al trattamento, quando il paziente è stabile e in remissione per molti anni dopo la diagnosi, ma il mieloma non è completamente eradicato.
22 +1.818.487.7455 • +1.800.452.CURE
¡ Darzalex Faspro® (daratumumab e ialuronidasi-fihj): somministrato mediante iniezione sottocutanea (sotto cute) in combinazione con VTd per i pazienti che sono candidabili a ASCT, r Rd o VMP per i pazienti non candidabili a ASCT.
¡ Desametasone e altri steroidi: solitamente somministrati in combinazione con uno o più agenti diversi per via orale o endovenosa.
¡ Revlimid® (lenalidomide): un agente immunomodulatore orale che è presente in diverse terapie di combinazione approvate nell’ambito della prima linea, incluso VRd (vedi sotto).








¡ Talidomide: approvato dalla FDA per il mieloma nel 2006, è il primo agente immunomodulatore ad aver ricevuto tale approvazione.
¡ Velcade® (bortezomib): un inibitore del proteasoma che è presente in diverse terapie di combinazione approvate nell’ambito della prima linea, incluso VRd (vedi sotto).

¡ La terapia di combinazione VRd (Velcade + Revlimid + desametasone) è attualmente considerata lo standard di cura per i pazienti con mieloma di nuova diagnosi. Un’analisi aggiornata tratta dalla sperimentazione clinica GRIFFIN, presentata nel dicembre 2021 al meeting annuale dell’American Society of Hematology (ASH, Associazione Americana di Ematologia), ha dimostrato la maggiore sicurezza ed efficacia dell’aggiunta di Darzalex a VRd (D-VRd) rispetto a VRd in monoterapia nei pazienti con mieloma di nuova diagnosi candidabili a ASCT, senza causare ulteriori problemi per la sicurezza o effetti negativi sulla mobilitazione delle cellule staminali.
Figura 11. Quando iniziare il trattamento per mieloma o SMM
potenziale nuovo mieloma o SMM
Ci sono eventi che de niscono il mieloma?
• CRAB
• Plasmacellule ≥ 60%
• Rapporto FLC ≥ 100
• Lesioni focali rilevate in MRI>1
Non ci sono eventi che de niscono il mieloma
trattare come mieloma
SMM ad alto rischio (tempo mediano alla progressione ~2 anni)
SMM intermedio o a basso rischio terapia precoce con Revlimid o Rd
23 myeloma.org
©2020 SV Rajkumar
sperimentazioni cliniche osservazione
Altre principali classi di farmaci che sono approvate dalla FDA per il trattamento di prima linea includono agenti alchilanti (per es. melfalan, ciclofosfamide) e antracicline (per es. doxorubicina, doxorubicina liposomiale), ma questi farmaci vengono utilizzati di rado data la disponibilità di agenti più attivi.
Se una particolare terapia di induzione non funziona, esistono numerose opzioni terapeutiche che non sono trattate in questo manuale introduttivo. Tuttavia, non è consigliabile passare rapidamente da un regime terapeutico all’altro senza esaurire tutte le opzioni disponibili.
Trapianto autologo di cellule staminali
La ASCT è utilizzata come trattamento per il mieloma da oltre vent’anni. I medici che effettuano i trapianti cercano di ridurre il carico tumorale (distruggere il maggior numero possibile di cellule mielomatose) prima di raccogliere le cellule staminali e somministrare la terapia ad alte dosi (HDT). I pazienti, quindi, ricevono una terapia di induzione prima di iniziare il processo della HDT con recupero delle cellule staminali. Anche se non vi è una risposta significativa alla terapia di prima linea, i pazienti possono procedere alla raccolta, alla HDT e alla ASCT e ottenere comunque un risultato eccellente. La risposta dopo la HDT è di gran lunga più importante della risposta prima della HDT, a condizione che la malattia non stia ancora progredendo.
Nel marzo 2021, il National Comprehensive Cancer Network (NCCN, Rete oncologica nazionale) ha aggiornato le proprie linee guida per la gestione

24 +1.818.487.7455 • +1.800.452.CURE
Figura 12. Algoritmo di trattamento di prima linea del mieloma – Dicembre 2021
del mieloma. L’NCCN afferma che l’ASCT rimane una parte fondamentale del trattamento di prima linea per i pazienti con mieloma di nuova diagnosi idonei. I risultati aggiornati ottenuti dai dati di follow-up della sperimentazione clinica IFM 2009 hanno confermato il beneficio dell’ASCT nel mieloma di nuova diagnosi. Ad un follow-up mediano di 93 mesi, la sopravvivenza libera da progressione (PFS) mediana era di 47,3 mesi con ASCT dopo induzione con terapia combinata VRd contro 35,0 mesi con VRd in monoterapia.
Negli Stati Uniti, l'assicurazione Medicare copre un solo ASCT per i pazienti idonei di qualsiasi età, a condizione che siano affetti da mieloma DurieSalmon di stadio II o III di nuova diagnosi o ancora in grado di rispondere al trattamento. I pazienti, inoltre, devono avere un'adeguata funzionalità cardiaca, epatica, polmonare e renale. Medicare non copre trapianti autologhi in tandem o consecutivi, ma qualora il paziente si sottoponga a trapianto coperto dall’assistenza medica Medicare e si verifichi successivamente una recidiva dopo una remissione di due anni o più, Medicare potrebbe coprire un altro trapianto al momento necessario.
Per ulteriori informazioni, leggere la pubblicazione dell’IMF Understanding Stem Cell Transplant in Myeloma (Conoscere e comprendere il trapianto di cellule staminali nel mieloma).
Scelta di un regime di trattamento
Occorre considerare una serie di fattori importanti.
¡ Attività quotidiane: Il trattamento porterà ad una riduzione della capacità di svolgere le attività quotidiane?
¡ Lavoro: Sarà necessario cambiare o interrompere la propria professione?
¡ Età: È questo un fattore che condiziona la scelta del trattamento e le risposte attese?
¡ Effetti collaterali del trattamento: Quanto saranno “gravi”?
¡ Altri farmaci assunti: Possono influenzare le scelte di trattamento o la tolleranza al trattamento?
¡ Trapianto: È raccomandata un’alta dose di chemioterapia con ASCT?
¡ Velocità di risposta: Quanto sarà rapido l'effetto del trattamento? Come sarà valutata la risposta alla terapia?
¡ Decisioni iniziali e successive: Cosa dev’essere deciso subito?
¡ Valutazioni finanziarie: Quale parte del trattamento sarà coperta dall’assicurazione? Quali saranno le mie responsabilità finanziarie?
Esistono delle risorse per aiutarmi a pagare il trattamento?
25 myeloma.org
Terapia di mantenimento oppure no
Dopo aver raggiunto la risposta massima alla terapia, il vostro medico potrebbe consigliarvi un regime di mantenimento. È stato ampiamente dimostrato che la terapia continua fino alla progressione della malattia aumenta la sopravvivenza, ma non è necessaria o indicata per ogni paziente. Le implicazioni finanziarie, fisiche ed emotive della terapia continua devono essere prese in considerazione insieme alle caratteristiche del mieloma di ogni paziente.
Sperimentazioni cliniche
Le sperimentazioni cliniche per terapie di induzione possono rappresentare un eccellente modo per ricevere una nuova terapia di combinazione o un nuovo trattamento che non sarebbe altrimenti disponibile. Anche in una sperimentazione clinica randomizzata, nella quale i pazienti hanno un'eguale probabilità di ricevere lo standard di cura o una nuova terapia, una sperimentazione clinica fornisce trattamento e monitoraggio rigorosamente documentati. Se si sceglie di partecipare a una sperimentazione clinica, è fondamentale comprendere l’intero ambito e scopo del protocollo di trattamento. Per una discussione completa in merito alle sperimentazioni cliniche, consultate la pubblicazione dell’IMF Understanding Clinical Trials (Conoscere e comprendere le sperimentazioni cliniche).
Terapia di supporto
Il precoce utilizzo di terapie di supporto è importante tanto quanto l’inizio di una terapia di induzione per alleviare gli effetti fisici ed emotivi che il mieloma può avere sul paziente.
Il manuale dell’IMF Understanding Treatment of Myeloma Bone Disease (Conoscere e comprendere il trattamento della malattia ossea nel
26 +1.818.487.7455 • +1.800.452.CURE
Trapianto Velocità di risposta Lavoro Attività quotidiane Aspetti nanziari Altri farmaci assunti Decisioni iniziali e successive E etti collaterali del trattamento Età
Figura 13. Cosa considerare nella scelta di un regime di trattamento
considerazioni sul trattamento
mieloma) illustra gli agenti modificatori della malattia ossea come i bifosfonati Aredia® (pamidronato) e Zometa® (acido zoledronico) e l’anticorpo monoclonale Xgeva® (denosumab).
Il manuale dell’IMF Understanding Fatigue (Conoscere e comprendere l’astenia) illustra l'astenia correlata al cancro e i relativi trattamenti, secondo la definizione data dall’NCCN come di una “sensazione soggettiva, stressante, persistente di stanchezza o spossatezza correlata al cancro o al suo trattamento, che non è proporzionale all’attività svolta e interferisce con il normale funzionamento del soggetto”.
Il manuale dell’IMF Understanding Peripheral Neuropathy in Myeloma (Conoscere e comprendere la neuropatia periferica nel mieloma) è intesa sia ad aiutare i pazienti con mieloma che sono già affetti da PN sia ad aiutare i pazienti a prevenire questo problema. È sempre meglio prevenire i problemi prima che insorgano e trattarli precocemente quando si manifestano. Questo è particolarmente vero per la PN.
Oltre alla gestione dei sintomi specifici, è estremamente importante tenere in considerazione altre misure di supporto:
¡ Attività fisica: Verificare con il proprio medico se sia o meno adeguata la pratica di un’attività fisica intensa, o se sia invece necessario apportare delle modifiche a causa di problemi a livello osseo o danni ossei. Normalmente, è consentita un po’ di attività fisica, come camminare o nuotare, esercizi per aumentare la flessibilità e per rinforzare la muscolatura e/o un programma di yoga personalizzato.
¡ Dieta: Non esiste una dieta specifica per i pazienti affetti da mieloma, sebbene la ricerca abbia chiaramente dimostrato il collegamento tra l’obesità e il mieloma. Consigliamo di prediligere una sana dieta mediterranea ricca di frutta, verdura, pesce, altre proteine animali magre, alimenti integrali, genuini e non lavorati. Evitare cibi che contengono zuccheri raffinati e grassi trans di origine artificiale. Bisogna prestare attenzione a due aspetti:
Tisane e supplementi di vitamine: Consultare il proprio medico o farmacista PRIMA di assumere integratori nel corso del trattamento per il mieloma. Alcune interazioni tra farmaci e/o integratori possono impedire il funzionamento efficace dei trattamenti per il mieloma e alcune interazioni possono creare gravi problemi di carattere medico. Le farmacie dispongono di risorse utili a identificare le potenziali interazioni.
Vitamina C: Dosi superiori a 1000 mg/giorno possono essere dannose nei pazienti affetti da mieloma e possono aumentare il rischio di danno ai reni.
27 myeloma.org
Tabella 8. Terapia di supporto
SINTOMO TRATTAMENTO COMMENTI
Astenia e debolezza dovute all’anemia
• Trasfusioni di sangue (emazie concentrate prive di leucociti, filtrate e irradiate) in caso di anemia severa
• Eritropoietina se l’anemia è lieve o moderata e indotta dalla terapia
Dolore osseo
• Bifosfonati (es. Aredia® 90 mg IV per 2-4 ore al mese; Zometa® 4 mg IV per 15-45 minuti al mese)
• Antidolorifici al bisogno (es. paracetamolo, derivati della morfina per bocca, fentanyl)
Le terapie sono semplici, offrono solitamente ottimi benefici e migliorano il benessere del paziente.
• Alleviare il dolore osseo è importante anche per migliorare l’attività fisica e, di conseguenza, aumentare la forza ossea e migliorare il benessere emotivo.
• Benché si tratti di una condizione rara, l’utilizzo cronico di bifosfonati può danneggiare i reni e la mandibola.
• La consapevolezza è la chiave della prevenzione.
Febbre e/o infezioni
• Antibiotici adeguati
• Neupogen® se è necessario incrementare la conta dei globuli bianchi
• Immunoglobuline per uso endovenoso (IVIG) per infezioni gravi
• Sarebbe utile eseguire esami specifici per conoscere il tipo esatto di infezione in atto (escluse biopsie o colture pericolose)
Effetti collaterali a livello gastrointestinale
Disturbi della coagulazione ed episodi trombo-embolici
• Farmaci adeguati per contrastare la nausea, il vomito, la costipazione o la diarrea
• Mantenere un’adeguata assunzione di liquidi e un’alimentazione corretta
• Gli eventi trombotici sono delle vere e proprie emergenze mediche; il trattamento dipende dal tipo di evento e dai fattori di rischio del paziente
• Possono essere prescritti aspirina o altri anticoagulanti
Neuropatia periferica
• Antidolorifici
• Aggiustamenti della dose, del programma terapeutico e/o della via di somministrazione
• Fisioterapia, vitamine e altri integratori
• Anche se la terapia antibiotica va selezionata e utilizzata con cura, è estremamente importante tenere sotto controllo le infezioni.
• Si raccomanda di tenere a portata di mano un antibiotico per le emergenze, soprattutto durante i viaggi.
Discutere i sintomi con i medici; sintomi gravi potrebbero richiedere l’ospedalizzazione.
Il rischio si reduce con l’esercizio fisico, la perdita di peso e non fumando.
• Discutere i sintomi con il proprio medico.
• Un intervento precoce può prevenire i danni permanenti e consente di non interrompere il trattamento.
• Non modificare le dosi per conto vostro.
• Non assumere integratori senza consultare il medico.
Effetti collaterali degli steroidi
• Assumere come prescritto dal proprio medico
• Tenere sotto controllo segni e sintomi di infezione e alterazione della glicemia
• Profilassi per l’Herpes zoster e per le infezioni fungine
• Riportare gli effetti collaterali e i sintomi al proprio medico.
• Non interrompere e non modificare il dosaggio autonomamente.
28 +1.818.487.7455 • +1.800.452.CURE
¡ Stato psicologico: La vostra condizione psicologica è messa alla prova nel corso della terapia. Dovete essere certi di sentirvi a vostro agio con il piano terapeutico. Programmate un appuntamento con uno psicologo o uno psichiatra se temete di essere depressi o se i vostri parenti o amici sono preoccupati che possiate sentirvi depressi. Si tratta di una reazione normale alla diagnosi di cancro e la maggior parte di questi pazienti potrebbe avere bisogno di aiuto prima o poi. Il supporto tra persone che stanno vivendo la stessa situazione è di fondamentale importanza in questo momento e anche il ricorso a un gruppo di supporto per i malati di mieloma può essere utile in questo contesto. Per rivolgersi a un gruppo di supporto, visitate support.myeloma.org e chiamate l’InfoLine dell’IMF.
¡ Sonno regolare: Questo è molto importante per il vostro sistema immunitario.
¡ Altre accortezze: Cercate di ridurre il più possibile lo stress nella professione, in famiglia o in altri contesti, ed evitate i luoghi affollati e contatti ravvicinati con bambini in età scolare. Lavatevi frequentemente le mani. Il vostro sistema immunitario è compromesso sia a causa della malattia sia a causa delle terapie. La gestione del mieloma è la priorità fondamentale fino a quando non si è ottenuta una remissione della malattia o fino a quando la situazione non si è stabilizzata.
Il personale sanitario di riferimento
Se da una parte gli ematologi-oncologi pianificano e somministrano le terapie, il personale sanitario di riferimento potrebbe includere anche le seguenti importanti figure:
¡ Medico di medicina generale o medico di famiglia,
¡ Infermiere o infermiere specializzato,
¡ Chirurgo ortopedico (specialista delle ossa),
¡ Farmacista,
¡ Nefrologo (specialista dei reni),
¡ Dentista e/o chirurgo orale.
Le cure sono tanto più efficaci quanto più è efficiente la comunicazione tra i membri del personale sanitario di riferimento e il paziente o l’assistente sanitario designato.
Pazienti affetti da mieloma e COVID-19
Visitate covid19.myeloma.org per informazioni aggiornate di interesse per i pazienti affetti da mieloma.
29 myeloma.org
A febbraio 2022, il CDC raccomanda di procedere alla somministrazione di una dose aggiuntiva a completamento del ciclo vaccinale primario e di una dose di richiamo per alcuni soggetti che sono moderatamente o gravemente immunocompromessi. Circa metà dei pazienti affetti da mieloma in trattamento attivo presentano livelli di anticorpi bassi e inadeguati, e una dose aggiuntiva a completamento del ciclo primario seguita da una dose di richiamo può fornire una protezione supplementare. Tuttavia, è bene rivolgersi al proprio medico che valuti la vostra condizione medica e stabilisca se è opportuno che riceviate una dose di vaccino aggiuntiva.
Nel gennaio 2022, con le preoccupazioni generate dalla variante omicron, il CDC ha chiarito la differenza tra quarantena e isolamento, identificando la quarantena come necessaria per chi potrebbe essere stato esposto al virus ed averlo o non averlo contratto, e l’isolamento come necessario quando un soggetto contrae il virus, indipendentemente dal fatto che sia sintomatico o asintomatico.
Nel dicembre 2021, la FDA ha autorizzato due trattamenti antivirali orali per il COVID-19: molnupiravir (MK-4482) per i soggetti adulti che hanno più probabilità di ammalarsi gravemente di COVID, e Paxlovid™ (nirmatrelvir e ritonavir) per i pazienti ad alto rischio di età pari o superiore a 12 anni.
L’IMF consiglia vivamente la somministrazione del vaccino Pfizer-BioNTech COVID-19 o del vaccino Moderna, a seconda di quale sia disponibile, per i pazienti affetti da mieloma, SMM o MGUS. Questi vaccini offrono eccellenti benefici e attualmente la loro efficacia supera di gran lunga qualsiasi preoccupazione sulla tossicità. Prima di sottoporsi alla vaccinazione contro il COVID-19, è opportuno rivolgersi al proprio medico per esporre eventuali domande e dubbi prima di programmare la vaccinazione.
Conclusioni
Questo manuale non intende sostituirsi alle indicazioni fornite dal personale medico e infermieristico di riferimento, che daranno al paziente risposte esaustive in merito al piano terapeutico scelto. L’IMF intende fornire unicamente ai pazienti una serie di informazioni da utilizzare come riferimento durante le discussioni sulla malattia con il proprio personale sanitario. Per contribuire ad assicurare un trattamento efficace con una buona qualità di vita, è necessario svolgere un ruolo attivo nelle proprie cure mediche.
Consigliamo, quindi, di visitare il sito web myeloma.org per avere maggiori informazioni sul mieloma e di contattare l’InfoLine dell’IMF
30 +1.818.487.7455 • +1.800.452.CURE
per domande e dubbi relativi a tale malattia. L’InfoLine dell’IMF fornisce sistematicamente le informazioni più precise e aggiornate sul mieloma, in maniera attenta e premurosa. L’InfoLine dell’IMF è disponibile all’indirizzo InfoLine@myeloma.org o al numero +1.818.487.7455.
Termini e definizioni
Di seguito sono illustrati alcuni dei termini contenuti nel presente manuale, mentre per un compendio più completo relativo alla terminologia sul mieloma si rimanda al Glossario dei termini e delle definizioni del mieloma disponibile alla pagina glossary.myeloma.org.
Agente immunomodulatore: Farmaco che colpisce, potenzia o sopprime il sistema immunitario. I farmaci immunomodulatori sono talvolta denominati anche “composti IMiD®”.
Albumina (ALB): Proteina semplice idrosolubile che si trova nel siero ematico. La produzione di albumina viene inibita dall’interleuchina-6 quando il mieloma è particolarmente attivo.
Amiloidosi da catene leggere di amiloide (Amiloidosi AL): L’amiloidosi AL è una condizione in cui le catene leggere nel mieloma si legano le une alle altre “a foglietto beta ripiegato” e si depositano successivamente nei tessuti e negli organi di tutto il corpo, come il cuore, i nervi e i reni, anziché essere espulse dai reni. Questa condizione è nota anche come amiloidosi primaria.
Anemia: Diminuzione dell’emoglobina, una proteina contenuta nei globuli rossi che porta ossigeno ai tessuti e agli organi del corpo. L’anemia, di solito, si verifica quando l’emoglobina presenta valori >10 g/dl e/o come una diminuzione ≥2 g/dl dal livello normale per un individuo. Un valore superiore a 13–14 g/dl è considerato normale.
Anticorpo: Proteina prodotta da plasmacellule in risposta all’ingresso nel corpo di un antigene. Vedere anche “Immunoglobulina (Ig).”
Asintomatico: Che non presenta segni o sintomi.
Benigno: Non cancerogeno, ovvero che non invade il tessuto vicino e non si diffonde in altre parti del corpo.
Beta-2 microglobulina (β2-microglobulina, β2M o β2M): Piccola proteina presente nel sangue. Alti livelli di β2M si manifestano in pazienti affetti da mieloma attivo. Livelli bassi o normali si manifestano in pazienti in fase iniziale e/o con malattia inattiva. Circa il 10% dei pazienti affetti da mieloma non produce β2M. In caso di recidiva, i valori di β2M possono aumentare
31 myeloma.org
prima di un eventuale aumento dei livelli di proteina del mieloma. In recidiva, la β2M può aumentare prima che si manifesti qualsiasi altro cambiamento nei livelli di proteine.
Bifosfonato: Tipo di farmaco che si lega alla superficie dell’osso, dove viene riassorbito o distrutto, proteggendolo dall’attività osteoclastica (fratture ossee).
Biopsia: Prelievo di una parte di tessuto ai fini dell’esecuzione dell’esame microscopico come supporto alla diagnosi.
Calcio: Minerale che si trova principalmente nella parte più dura della matrice dell’osso (idrossiapatite). Se prodotto o rilasciato in eccesso, può accumularsi nel flusso sanguigno. Vedere “Ipercalcemia.”
Cancro: Termine usato per malattie nelle quali le cellule maligne si dividono senza controllo. Le cellule cancerogene invadono i tessuti vicini e si diffondono attraverso il flusso sanguigno e linfatico ad altre parti del corpo.
Catena leggera libera: Una catena leggera di immunoglobuline è la più piccola di due unità che compongono un anticorpo. Ci sono due tipi di catene leggere: kappa e lambda. Una catena leggera può essere legata a una catena pesante oppure può essere slegata (libera). Le catene leggere libere circolano liberamente nel sangue e sono abbastanza piccole da riuscire a superare il filtro renale e passare nelle urine o agglomerarsi e ostruire i tubuli renali.
Citochina: proteine secrete dalle cellule che stimolano o inibiscono la crescita o l’attività di altre cellule. Le citochine sono prodotte localmente (per il mieloma, nel midollo osseo) e circolano nel flusso sanguigno. Le citochine sono normalmente rilasciate per combattere un’infezione.
Elettroforesi: Test di laboratorio, a scopo sia diagnostico sia di monitoraggio, in cui il siero del paziente (sangue) o le proteine presenti nell’urina vengono separate in base alle dimensioni e alla carica elettrica. L’elettroforesi del siero o delle urine (SPEP o UPEP) permette sia di quantificare le proteine del mieloma sia di identificare il tipico picco monoclonale specifico di ogni paziente.
Elettroforesi con immunofissazione (IFE): Test immunologico del siero o delle urine impiegato ai fini dell’identificazione delle proteine. Per i pazienti affetti da mieloma, consente al medico di identificare il tipo di proteina M (IgG, IgA, kappa o lambda). La tecnica di “immunostaining” (immunoistochimica) più sensibile e più comunemente utilizzata consente di identificare il tipo esatto di catene pesanti e leggere della proteina M.
32 +1.818.487.7455 • +1.800.452.CURE
Ematologo: Medico specializzato nei problemi del sangue e del midollo osseo.
Gammopatia monoclonale di incerto significato (MGUS, monoclonal gammopathy of undetermined significance): Tipo di disturbo delle plasmacellule caratterizzato da livelli relativamente bassi di proteina monoclonale nel sangue e/o nelle urine. I livelli di plasmacellule nel midollo osseo sono bassi (<10%). I sintomi correlati al mieloma (ad es. anemia, insufficienza renale, ipercalcemia e lesioni litiche) sono assenti.
Globuli bianchi (WBC): Termine generico utilizzato per indicare una varietà di leucociti in grado di combattere germi, infezioni e agenti che causano allergie. Queste cellule si sviluppano nel midollo osseo e si espandono in tutte le altre parti del corpo. I globuli bianchi includono neutrofili, basofili, eosinofili, linfociti e monociti.
Globuli rossi (RBC): Denominate anche eritrociti, queste cellule del sangue contengono emoglobina, trasportano l’ossigeno e prelevano l’anidride carbonica in ogni parte dell’organismo. La produzione dei globuli rossi è stimolata da un ormone (eritropoietina) prodotto dai reni. I pazienti affetti da mieloma con danno renale non producono un livello sufficiente di eritropoietina e possono presentare anemia, a causa degli effetti delle cellule di mieloma sulla capacità del midollo osseo di produrre nuovi globuli rossi.
Ibridazione in situ fluorescente (FISH): Procedura che consente ai ricercatori di individuare le posizioni di sequenze specifiche di DNA sui cromosomi.
Immunoglobulina (Ig): Proteina prodotta dalle plasmacellule; parte essenziale del sistema immunitario dell’organismo. Le immunoglobuline si legano alle sostanze estranee (antigeni) e collaborano alla loro distruzione. Le classi (chiamate anche isotipi) di immunoglobuline sono IgG, IgA, IgD, IgE e IgM. Il termine non medico per immunoglobulina è “anticorpo”.
Inibitore del proteasoma: qualsiasi farmaco che interferisce con la normale funzione del proteasoma, un complesso di enzimi responsabile della distruzione e del riciclaggio delle proteine indesiderate sia nelle cellule normali che in quelle tumorali. Vedere “Proteasoma.”
Ipercalcemia: Livello di calcio nel sangue più alto del normale. Nei pazienti affetti da mieloma, di solito risulta dalle fratture ossee con rilascio di calcio dall’osso nel flusso sanguigno. Questa condizione può causare diversi sintomi, inclusi perdita di appetito, nausea, secchezza delle fauci, astenia, affaticamento muscolare, agitazione e confusione. Vedere “Calcio”.
33 myeloma.org
Lattico deidrogenasi (LDH): Enzima che produce energia ed è presente in quasi tutti i tessuti del corpo. I livelli di LDH nel flusso sanguigno aumentano in risposta al danno cellulare. L’LDH può essere utilizzato per il monitoraggio dell’attività del mieloma.
Lesione: Cambiamento anomalo dell’area tissutale: protuberanza o ascesso che può essere causato da una malattia, come il cancro. Nel mieloma, la “lesione” può essere attribuita a un plasmocitoma o a un buco nell’osso.
• Lesione diffusa – Un coinvolgimento esteso del midollo osseo conseguente al mieloma in un’area dell’osso.
• Lesione focale – Un’area definita di cellule irregolari nel midollo osseo rilevate mediante risonanza magnetica (MRI) e studi con PET/TC. Per poter formulare una diagnosi di mieloma, devono esserci almeno 2 lesioni focali di almeno 5 mm rilevate mediante MRI.
• Lesione litica – Area danneggiata di un osso che appare come un punto scuro in una radiografia quando almeno il 30% dell’osso sano in un’area qualsiasi è stato mangiato. Le lesioni litiche assomigliano a dei veri e propri fori e sono conseguenza dell’indebolimento dell’osso. Vedere “Llitica (lisi)”.
Linea di terapia: Termine utilizzato per calcolare il numero di terapie che un paziente ha ricevuto. La terapia di induzione + trapianto autologo di cellule staminali (ASCT) è considerata una singola linea di terapia. Vedere “Terapia di induzione.”
Litico (lisi): Dissoluzione o distruzione di cellule o tessuti.
Macroglobulinemia di Waldenström (WM): Raro tipo di linfoma indolente che colpisce le plasmacellule, caratterizzato dalla produzione di un livello eccessivo di proteine IgM. Non si tratta di mieloma.
Malattia da deposito di catene leggere (LCDD): Un tipo di gammopatia monoclonale che è caratterizzata dal deposito di catene leggere in vari organi, più frequentemente nei reni.
Maligno: Cancerogeno; in grado di invadere il tessuto vicino e di espandersi ad altre parti del corpo.
Midollo osseo: Tessuto molle e spugnoso situato all’interno delle ossa che produce globuli bianchi, globuli rossi e piastrine. Quando il mieloma cresce, si verifica un accumulo di plasmacellule anomale nel midollo osseo.
34 +1.818.487.7455 • +1.800.452.CURE
Mieloma asintomatico: Mieloma che non presenta segni o sintomi di malattia; si tratta di un mieloma in fase iniziale. Vedere “Mieloma multiplo smoldering (SMM)”.
Mieloma di Bence-Jones: Mieloma caratterizzato dalla presenza della proteina di Bence-Jones, una proteina anomala nelle urine composta da catene leggere libere kappa o lambda.
Mieloma multiplo: Tumore che colpisce le plasmacellule presenti nel midollo osseo, i leucociti che producono gli anticorpi. Le plasmacellule neoplastiche prendono il nome di cellule di mieloma o mielomatose.
Mieloma multiplo smoldering (SMM): Il quadro SMM corrisponde a un livello di malattia più alto rispetto a MGUS, ma non costituisce ancora mieloma attivo con caratteristiche e criteri CRAB tali da indicare danni agli organi. I pazienti con SMM a rischio standard non necessitano di trattamento, ma dovrebbero essere monitorati a intervalli regolari da un ematologo-oncologo. I pazienti con SMM ad alto rischio potrebbero scegliere di partecipare ad una sperimentazione clinica.
Mieloma non secernente: In circa l’1% dei pazienti affetti da mieloma la proteina M non è rilevabile nel sangue (siero) e nell’urina. Alcuni di questi pazienti possono essere tenuti sotto osservazione con successo usando dosaggi delle catene leggere libere sieriche, mentre altri possono essere tenuti sotto controllo attraverso la biopsia del midollo osseo e/o PET/TC. I pazienti affetti da mieloma non secernente sono trattati allo stesso modo di quelli affetti da mieloma secernente proteina M.
Monoclonale: Clone o duplicato di una singola cellula. Le cellule mielomatose derivano da un “monoclone”, una singola plasmacellula maligna. Anche la proteina prodotta dal mieloma è di tipo monoclonale ed è caratterizzata da una forma singola piuttosto che da diverse forme (policlonale). Un importante aspetto pratico della proteina monoclonale è il tipico picco M che viene rilevato con l’elettroforesi sierica.
Neuropatia periferica (PN): Intorpidimento, formicolio, bruciore e/o dolore alle mani, ai piedi, alla parte inferiore delle gambe e/o alle braccia.
Oncologo: Medico specializzato nel trattamento del cancro. Alcuni oncologi sono specializzati in un particolare tipo di cancro.
Osteoblasti: Cellule ossee associate alla produzione di tessuto osseo. Gli osteoblasti producono osteoidi, che quindi si mineralizzano con il calcio per formare una nuova struttura ossea compatta.
35 myeloma.org
Osteoclasti: Cellule che si trovano alla giunzione tra l’osso e il midollo osseo. Sono responsabili della distruzione o del rimodellamento del vecchio tessuto osseo. Nel mieloma, gli osteoclasti sono sovrastimolati, mentre l’attività degli osteoblasti è bloccata. La combinazione tra riassorbimento accelerato dell’osso e blocco della formazione di nuovo tessuto osseo causa lesioni litiche.
Piastrine: Uno dei tre principali tipi di cellule ematiche, insieme ai globuli rossi e ai globuli bianchi. Le piastrine si dispongono nelle pareti dei vasi sanguigni danneggiati e rilasciano sostanze in grado di stimolare la formazione di coaguli nel sangue. Le piastrine sono le maggiori difese contro sanguinamenti ed emorragie. Sono chiamate anche trombociti.
Picco M, picco monoclonale: Tipico tracciato di elettroforesi proteica che si ottiene in presenza di una proteina monoclonale e che funziona da marker per l’attività delle cellule mielomatose. Vedere “Monoclonale” e “Proteina monoclonale.”
Plasma: Parte liquida del sangue in cui sono sospesi globuli rossi, globuli bianchi e piastrine.
Plasmacellule: Particolari globuli bianchi che producono anticorpi. Il mieloma è un tumore delle plasmacellule. Nel mieloma, le plasmacellule maligne producono anticorpi anomali che non sono in grado di combattere le infezioni. Tali anticorpi anomali sono rappresentati dalla proteina monoclonale (proteina M) che funziona da marker tumorale per il mieloma. La presenza di plasmacellule maligne nel midollo osseo può causare danni a livello di organi e tessuti (anemia, danni renali, problemi a livello osseo e danni al sistema nervoso).
Plasmaferesi: Processo di eliminazione di alcune proteine dal sangue. La plasmaferesi può essere utilizzata per eliminare alti livelli di proteina M nel sangue dei pazienti affetti da mieloma.
Plasmocitoma: Vedere “Plasmocitoma extramidollare” e “Plasmocitoma solitario dell’osso (SPB).”
Plasmocitoma extramidollare: Tumore formato da plasmacellule monoclonali che si trova nei tessuti molli al di fuori del midollo osseo ed è separato dall’osso.
Plasmocitoma solitario dell’osso (SPB): Massa singola di plasmacellule monoclonali in un osso. La diagnosi di SPB prevede la presenza di una lesione solitaria dell’osso, la cui biopsia mostra un’infiltrazione da parte
36 +1.818.487.7455 • +1.800.452.CURE
delle plasmacellule; assenza di evidenza radiologica di lesioni ossee; assenza di plasmacellule clonali in un campione casuale di midollo osseo; nessuna traccia di anemia, ipercalcemia o di coinvolgimento dei reni che suggerisca un mieloma sistemico.
Proteasoma: Gruppo congiunto (o complesso) di enzimi che distruggono le proteine danneggiate o indesiderate e le proteine non danneggiate che richiedono la degradazione nella cellula. Questo ricambio o “riciclaggio” di proteine è importante per mantenere l’equilibrio all’interno della cellula e aiuta a regolare numerose funzioni tra cui la crescita cellulare.
Proteina C reattiva (CRP, C-reactive protein): Proteina prodotta nel fegato che aumenta in quantità quando nell’organismo è in corso un’infiammazione.
Proteina di Bence-Jones: Proteina monoclonale nel mieloma. La proteina è composta da otto catene leggere libere kappa o lambda. Date le loro dimensioni ridotte, le catene leggere di Bence-Jones possono superare il filtro renale e passare nelle urine. Il valore della proteina di Bence-Jones nelle urine è espresso in grammi per 24 ore. Normalmente, nelle urine può essere presente un valore molto basso di proteina (<0,1 g/24 h), ma in questo caso si tratterà di albumina anziché della proteina di BenceJones. La presenza di qualsiasi proteina di Bence-Jones nelle urine è una condizione anomala. Le catene pesanti della proteina del mieloma sono troppo grandi per superare il filtro renale.
Proteina monoclonale (proteina del mieloma, proteina M): Proteina anomala prodotta dalle cellule mielomatose che si accumula e danneggia l’osso e il midollo osseo. È presente in quantità insolitamente grandi nel sangue e/o nelle urine in pazienti affetti da mieloma. Vedere “Monoclonale” e “Picco M, picco monoclonale.”
Proteine: Sostanze composte da aminoacidi. Le proteine sono una parte essenziale di tutti gli organismi viventi, soprattutto come componenti strutturali dei tessuti corporei come i muscoli, i capelli, il collagene ecc., nonché enzimi e anticorpi.
Risonanza magnetica (MRI): Test diagnostico per immagini che utilizza campi magnetici e onde radio, anziché radiazioni ionizzanti, per produrre immagini dettagliate bidimensionali o tridimensionali degli organi e delle strutture interne del corpo. Questo esame offre una buona risoluzione del tessuto molle, specialmente delle alterazioni nel midollo spinale, ma è meno accurato nelle lesioni dell’osso.
37 myeloma.org
Risposta o remissione: Scomparsa completa o parziale dei segni o sintomi del cancro. Remissione e risposta sono termini utilizzati indistintamente.
• Risposta completa stringente (sCR) – Una sCR consiste in una risposta completa (CR), come definito nel paragrafo successivo, accompagnata da un rapporto FLC normale e dall’assenza di cellule clonali nel midollo osseo attraverso esami di immunoistochimica o immunofluorescenza.
• Risposta completa (CR) – Per il mieloma, la CR è data da immunofissazione negativa nel siero (sangue) e nelle urine, scomparsa di plasmocitomi dei tessuti molli e percentuale ≤ 5% di plasmacellule nel midollo osseo. La CR non è sinonimo di cura.
• Risposta parziale molto buona (VGPR) – La VGPR è inferiore alla CR. La VGPR corrisponde alla presenza di proteina M sierica e urinaria rilevabile mediante immunofissazione ma non con elettroforesi, oppure a una riduzione minima del 90% della proteina M sierica accompagnata da livelli di proteina M urinaria inferiori a 100 mg/24 ore.
• Risposta Parziale (PR) – La PR è un livello di risposta in cui si verifica una riduzione di almeno il 50% della proteina M e una riduzione della proteina M urinaria con urine delle 24 ore di almeno il 90% (o inferiore a 200 mg/24 ore).
Siero: Parte liquida del sangue, incolore, in cui sono sospese le cellule ematiche.
Sistema immunitario: Il sistema di difesa dell’organismo contro agenti patogeni e sostanze estranee, in grado di distruggere le cellule infettate e maligne e rimuovere i detriti cellulari. Il sistema immunitario include i globuli bianchi e gli organi e tessuti del sistema linfatico.
Sopravvivenza globale (OS): Il numero mediano di individui appartenenti a un gruppo che sono in vita dopo uno specifico periodo di tempo. La OS è spesso utilizzata come misura del livello di efficacia dei trattamenti nell’ambito delle sperimentazioni cliniche. L’allungamento della OS riscontrato nelle sperimentazioni sul mieloma fa dell’OS un endpoint di difficile utilizzo e ha reso opportuno valutare la malattia residua minima (MRD) come nuovo endpoint convalidato.
Sperimentazione clinica: Studio di ricerca di un nuovo trattamento che coinvolge i pazienti. Ogni studio è concepito allo scopo di trovare soluzioni migliori finalizzate alla prevenzione, scoperta, diagnosi o trattamento del cancro e alla ricerca di risposte a questioni scientifiche.
38 +1.818.487.7455 • +1.800.452.CURE
• Gruppo di controllo – Braccio di una sperimentazione clinica randomizzata che riceve il trattamento standard o placebo (assenza di trattamento).
• Gruppo sperimentale – Braccio di una sperimentazione randomizzata che riceve il nuovo trattamento.
• Sperimentazione clinica randomizzata – Studio di ricerca nel quale i soggetti sono assegnati, tramite randomizzazione (assegnazione casuale), a ricevere o meno un particolare trattamento.
• Braccio – Uno dei gruppi di trattamento di una sperimentazione randomizzata. La maggior parte delle sperimentazioni randomizzate hanno due bracci, ma alcune ne hanno di più.
• Obiettivo finale – Ciò che una sperimentazione clinica cerca di misurare o scoprire, l’obiettivo dello studio. Sono tipici obiettivo finali le valutazioni della tossicità, dei tassi di risposta e della sopravvivenza.
• Doppio cieco – Aspetto della sperimentazione randomizzata in cui né il partecipante all’esperimento né il ricercatore conoscono il braccio della sperimentazione a cui il paziente è assegnato. Lo scopo è quello di eliminare qualsiasi pregiudizio nella presentazione dei risultati.
• Sperimentazione di fase I – Sperimentazione concepita allo scopo di determinare la MTD (dose massima tollerata) di un nuovo farmaco o una nuova combinazione di farmaci. Solitamente, questa costituisce il primo test su esseri umani di un nuovo trattamento. Tuttavia, nelle sperimentazioni di fase I relative alle terapie combinate, i singoli elementi potrebbero già essere stati efficacemente testati. I pazienti arruolati nelle sperimentazioni di fase I presentano generalmente un tumore in stadio avanzato refrattario a tutti i trattamenti standard. In una tipica sperimentazione di fase I, gruppi successivi (“coorti”) di 3–6 pazienti vengono sottoposti al trattamento. Tutti i pazienti in una coorte ricevono la stessa dose. La prima coorte solitamente riceve una dose molto bassa, che viene aumentata in ogni successiva coorte fino a che un determinato numero di pazienti sperimenta la DLT (tossicità limitante la dose). La dose utilizzata per la precedente coorte è considerata la MTD (dose massima tollerata). Questa dose viene quindi utilizzata in una sperimentazione di fase II.
• Sperimentazione di fase II – Sperimentazione concepita allo scopo di determinare il tasso di risposta di una nuova terapia che è già stata testata in una sperimentazione di fase I. Tipicamente vengono trattati dai 14 ai 50 pazienti con un determinato tipo di tumore, per analizzarne
39 myeloma.org
la risposta. Di solito, i pazienti devono presentare un tumore in stadio avanzato refrattario a ogni trattamento standard. Inoltre, i pazienti devono avere malattia misurabile. Se i risultati di una sperimentazione di fase II sono abbastanza promettenti, il trattamento può essere testato in una sperimentazione di fase III. Se i risultati sono obiettivamente migliori rispetto a quelli di un trattamento standard, può non essere necessario testarli in una sperimentazione di fase III e il trattamento può essere approvato sulla base dei risultati ottenuti nella sperimentazione di fase II.
• Sperimentazione di fase III – Sperimentazione concepita allo scopo di comparare due o più trattamenti per un determinato tipo e stadio di tumore. L’obiettivo finale in una sperimentazione di fase III è di solito la sopravvivenza o la sopravvivenza libera da malattia. Le sperimentazioni di fase III sono solitamente randomizzate: ciò significa che i pazienti non scelgono quale trattamento ricevere. Una tipica sperimentazione di fase III viene eseguita su un numero di pazienti che varia da 50 a svariate migliaia. Alcune sperimentazioni di fase III comparano un nuovo trattamento che ha dato buoni risultati nella sperimentazione di fase II con un trattamento standard precedente e ben conosciuto. Altre sperimentazioni di fase III mettono a confronto trattamenti che sono già usati comunemente. Alcuni trattamenti nelle sperimentazioni di fase III possono essere disponibili al di fuori della regolazione della sperimentazione clinica.
• Sperimentazione di fase IV – Anche dopo l’approvazione di un farmaco da parte della Food and Drug Administration (FDA) statunitense per l’uso in una particolare terapia, potrebbero essere necessari ulteriori studi. Le sperimentazioni cliniche di fase IV possono essere richieste dalle autorità di regolamentazione o intraprese dalla società patrocinante per diverse ragioni. Per esempio, il controllo della sicurezza è pensato per identificare eventuali effetti collaterali rari a lungo termine su una popolazione di pazienti più ampia e in un arco di tempo maggiore rispetto alle sperimentazioni cliniche di fase I–III.
Terapia di induzione: Termine specifico utilizzato per il trattamento iniziale somministrato a un paziente in preparazione di un trapianto autologo di cellule staminali (ASCT). Vedere “Terapia di prima linea” e “Linea di terapia.”
Terapia di prima linea: Termine generale per il trattamento iniziale utilizzato con lo scopo di migliorare la risposta in pazienti con nuova diagnosi di mieloma. Vedere “Terapia di induzione” e “Risposta.”
40 +1.818.487.7455 • +1.800.452.CURE
Trapianto: Esistono numerosi tipi di trapianto.
• Trapianto di cellule staminali da sangue periferico (PBSC) – Procedura con cui i medici prelevano le cellule staminali sane dal sistema sanguigno del paziente (non dal midollo osseo) e le conservano congelate. Al paziente viene somministrata una chemioterapia ad alte dosi che ha lo scopo di distruggere le cellule tumorali, ma che distrugge anche le cellule sane. Le cellule staminali congelate vengono quindi scongelate e reintrodotte nell’organismo del paziente, dove possono produrre nuove cellule ematiche che sostituiranno le cellule distrutte dal trattamento.
• Trapianto autologo – Procedura con cui le cellule staminali vengono prelevate dal sangue del paziente e reinfuse nel paziente stesso dopo un trattamento intensivo.
• Trapianto del midollo osseo – Questo termine si riferisce al processo di raccolta delle cellule staminali dal midollo osseo e all’infusione delle stesse nei pazienti. Questo termine oggi è utilizzato meno frequentemente nel mieloma poiché le cellule staminali vengono ora raccolte dal sangue (circolante) periferico.
• Trapianto allogenico (allotrapianto) – Infusione di midollo osseo o di cellule staminali da un individuo (donatore) a un altro (ricevente). Un paziente può ricevere midollo osseo o cellule staminali da un donatore compatibile, sebbene non geneticamente identico. Viene effettuato un esame del sangue HLA per stabilire se il paziente ha un potenziale donatore compatibile. Il donatore può essere un familiare oppure può essere scelto attraverso un registro dei donatori come il National Marrow Donor Program (NMDP). Raramente, le cellule del donatore possono essere ottenute da una banca del sangue di cordone ombelicale. Le cellule del sistema immunitario del donatore riconoscono le cellule mielomatose del ricevente come estranee e le attaccano. Purtroppo, le cellule donate attaccano anche altri tessuti dell’organismo ricevente, causando la cosiddetta malattia del trapianto contro l’ospite (GVHD, graft-versus-host disease), che può avere esito fatale.
• Allotrapianto con condizionamento a intensità ridotta (RIC) – Tecnica più innovativa e, per il mieloma, più sicura rispetto al trapianto allogenico. Il RIC è un “mini allotrapianto” a ridotta intensità, non mieloablativo, che viene eseguito entro 180 giorni da un trapianto autologo standard.
• Trapianto in tandem – Termine utilizzato per indicare due trapianti autologhi effettuati in successione. I trapianti in tandem di solito vengono pianificati a intervalli di 3–6 mesi l’uno dall’altro. Il trapianto in tandem è diventato meno frequente negli Stati Uniti in un’epoca in cui esistono nuove terapie efficaci.
41 myeloma.org
• Trapianto da donatore non consanguineo (MUD) – Procedura di trapianto di cellule staminali in cui le cellule staminali del paziente e del donatore sono geneticamente identiche, ma il donatore non è un familiare del ricevente. Questa procedura non è consigliata per pazienti affetti da mieloma, in quanto comporta un tasso di mortalità inaccettabilmente elevato a causa del rischio di malattia del trapianto contro l’ospite (GVHD).
• Trapianto singenico – Infusione di midollo osseo o di cellule staminali da gemelli geneticamente identici.
• Trapianto del sangue del cordone ombelicale – Cellule staminali ottenute dai cordoni ombelicali dei neonati. Questi vengono congelati e conservati in banche del sangue di cordone ombelicale. Poiché sono necessari molteplici cordoni ombelicali per fornire cellule staminali in quantità sufficiente per un trapianto in un soggetto adulto, il rischio di malattia del trapianto contro l’ospite aumenta con questo tipo di trapianto, con un rischio ancora maggiore a carico dei pazienti affetti da mieloma.
Tumore: massa anomala di tessuto risultante da un’eccessiva divisione delle cellule. Nel mieloma, il tumore viene denominato plasmocitoma.
Vertebra: Uno qualsiasi dei 33 segmenti ossei della spina dorsale. Il nome plurale è “vertebre.”
Virus: Piccola particella vivente che può infettare le cellule e modificarne il funzionamento. La malattia e i sintomi causati da un’infezione virale variano in base al tipo di virus e di cellule infettate.
42 +1.818.487.7455 • +1.800.452.CURE