Edukapromo Даница Павловић
Данијела Малинар
ХЕМИЈА
Лабораторијске
ГЛАВНИ УРЕДНИК
Проф. др Бошко Влаховић
ОДГОВОРНА УРЕДНИЦА
Доц. др Наташа Филиповић
РЕЦЕНЗЕНТИ
Жељко Јанковић, професор
Кецман, професор хемије, ОШ Бора Станковић, Београд
Душица Комановић, професор
ИЛУСТРАЦИЈЕ И ДИЗАЈН
Јасмина Игњатовић
Јелена Коштица
ЛЕКТУРА И КОРЕКТУРА
Тамара Каримановић
ИЗДАВАЧ
Едука д.о.о. Београд
Ул. Змаја од Ноћаја бр. 10/1
Тел./факс: 011 3287 277, 3286 443, 2629 903
Сајт: www.eduka.rs; имејл: eduka@eduka.rs
ЗА ИЗДАВАЧА
Проф. др Бошко Влаховић, директор
Edukapromo ШТАМПА
BiroGraf Comp, Београд
Издање бр.: 1, Београд, 2020. година
Тираж: 4000
, Прњавор
37.016:54(075.2)(076)
ПАВЛОВИЋ, Даница, 1954Хемија : лабораторијске вежбе са збирком задатака за седми разред основне школе / Даница Павловић, Данијела Малинар ; [илустрације Јасмина Игњатовић, Јелена Коштица]. - Изд. бр. 1. - Београд : Eduka, 2020 (Београд : Birograf comp). - 116 стр. : илустр. ; 29 cm
Тираж 4.000. - Решења задатака: стр. 106-116.
ISBN 978-86-6013-465-5
1. Малинар, Данијела, 1966- [аутор]
COBISS.SR-ID 15422985
Ауторке
Водич кроз збирку • 6
ХЕМИЈА
ХЕМИЈСКА
Атом • 42
МОЛЕКУЛИ ЕЛЕМЕНАТА
ВОДОНИК, КИСЕОНИК
помоћу индикатора • 88
Различити задаци • 93
Решења задатака • 106
Edukapromo Edukapromo 1.
Edukapromo Edukapromo 4.
5.
6.
I Edukapromo 7. Хемикалије узимај у тачно одређеним
количинама.
8. Никада не пробај укус хемикалија (већина је отровна).
9. Мирис супстанци се испитује тако што се руком махне ка носу изнад отвора посуде у којој се супстанца налази. Супстанцу никад немој да миришеш директно.
10. При загревању супстанци, отвор епрувете треба да буде окренут супротно од свих
присутних у лабораторији или учионици. Води рачуна о сопственој безбедности, али и о безбедности околине.
11. Лабораторија или учионица у којој се изводе експерименти мора бити проветрена. Огледе са запаљивим, испарљивим и отровним супстанцама ради у капели, ако је има у лабораторији.
12. При раду радно место мора увек да буде чисто. Када
13. Супстанце
14.
15.
16.
Мензура – направљена је од стакла, у облику цилиндра. Употребљава се за одмеравање запремине течности. Градуисана је у cm3 (што значи да су на скали угравиране запремине).
Пипета – цилиндричног је облика, прави се од стакла. Користи се за одмеравање запремине течности. Запремине су угравиране на стаклу.
Бирета – као и пипета, употребљава се за прецизно одмеравање запремине. Најчешће се
се назива титрација. Сахатно
2. У хемијској лабораторији
3.
4.
5. Заштитну маску неопходно
в) у свакој хемијској лабораторији, г) са супстанцама
6.
Edukapromo 1. Корозивно, 2. експлозивно, 3. еколошка
7. шкодљиво, надражујуће.
На овом часу ћеш увежбати:
1. уситњавање супстанци;
2. пуњење
3. загревање у епрувети;
4. правилно коришћење шпиритусне лампе.
Стаклено
водом, а на крају испрано
Шта запажаш?
II 1.
Попуни
3.
•
•
• две чаше од
1.
2.
5.
6.
7.
Edukapromo 9.
2 kg = ____________ g, 15 ml = ____________ cm3, 5 g = _____________ mg, 2,5 dm3 = _________________ cm3.
станци.
Потребне супстанце: креда, шећер, парафин (свећа), цинк, сирћетна киселина, бакарна жица, кухињска со, вода, млеко, лимун, магнезијумова трака, јабука. Потребан прибор: пинцета (2 комада), сахатно стакло (3 комада), чаша (2 комада), кашичице, (2 комада), аван са тучком, шпиритусна лампа, епрувете (3 комада), сталак за епрувете, папир, папирни тањир, дрвена штипаљка, нож.
Предлажемо да се
парафин.
Парафин је супстанца
Комади јабуке
мова трака запали, подметни под њу сахатно стакло.
Магнезијумова трака гори ___________________
пламеном.
На сахатно стакло пада супстанца ______________
боје.
Ствара се / не ствара се нова супстанца.
Ово је ________________ промена.
Сецкање јабуке
Узми јабуку и исецкај је. Исецкану јабуку стави на
тацну.
Јабука мења ________________.
Питања
Физичке промене: ________________, _________________ и ________________.
Хемијске промене: ________________.
2. Која промена се дешава на супстанцама у наведеним примерима:
а) сагоревање папира, б) труљење воћа, в) горење свеће, г) паљење магнезијумове траке.
Промена је __________________________________________________ .
3. Прецртај нетачно у датим реченицама.
а) Испаравањем воде јесте / није настала нова
5.
16.
а ) ватромет, б) заслађивање чаја, в) паљење дрвета, г) мржњење воде, д) труљење лишћа, ђ) млевење лешника, е) фарбање косе, ж) рђање гвожђа, з) кисељење купуса, и) светљење сијалице.
17. Ако је исказ тачан, заокружи ДА, а ако је нетачан, заокружи НЕ.
а) Појава росе
• промена агрегатног стања
• очвршћавање
• уситњавање
• рас тварање
• топљење
• испаравање
Примери:
• испаравање воде
• топљење леда
уситњавање шећера • растварање различитих супстанци у води
• промене у којима настају нове супстанце
Примери:
• горење дрвета
сагоревање бензина у
сагоревање шећера
Edukapromo 1.
2.
10.
11.
1.
Edukapromo дестилована вода n-хексан
У води се раствара:
Трећа група испитује растворљивост супстанци са јонском и ковалентном
растворљивости
Добијене резултате упиши у табелу.
Растварач
дестилована вода n-хексан
Четврта група
Четврта група испитује температуру
Потребан
Потребан прибор: сахатно стакло, стаклена чаша, сталак са епруветама.
Потребне хемикалије: медицински алкохол, калијум-перманганат, шећер, сирће, ацетон, калцијум-оксид, уље, маргарин...
Наведене супстанце разврстај према агрегатном стању:
Течне супстанце: ________________________________________________
Чврсте супстанце: _______________________________________________
Супстанце у којима је јонска веза: __________________________________
Питања и задаци
1. Разврстај супстанце према типу
Супстанце са ковалентном везом: _________________________________ Edukapromo
2.
налази.
а) HCl, б) NH3, в) KCl, г) O2, д) MgBr2, ђ) H2S, е) H2, ж) CO2, з) NaCl, и) H2O, ј) CaO, к) P4, л) HF, љ) S8, м) LiF, н) BaO.
Јонска веза: ____________________________________________ Ковалентна – поларна: __________________________________ – неполарна: ________________________________
3.
4.
5.
Закључак
Edukapromo Испитивање растворљивости супстанци.
Edukapromo Поступак
растварају у дестилованој води, а које се не растварају?
Потребне хемикалије: со, плави камен, шећер, сода бикарбона, калијум-нитрат (натријум-нитрат), дестилована вода.
Потребан прибор: пет чаша, шпиритусна лампа, троножац, метална мрежица, термометар, кашичица, мензура, вага, стаклени штапић.
Прва група припрема 30 g засићеног раствора шећера на 20 0С. Растворљивост шећера на 20 0С у 100 g воде јесте 204 g,
Потребне хемикалије: кухињска со, дестилована вода.
Потребан прибор: четири чаше од 150 cm3, четири стаклена штапића, мензура, вага.
Задатак: Поделите се у четири групе и направите наведене растворе.
Прва група: 30 g 20%-ног раствора соли.
Друга група: 40 g 10%-нограствора соли.
Трећа група: 50 g 20%-ног раствора соли.
Четврта група: 30 g 10%-ног раствора соли.
Пре почетка рада свака група треба да израчуна потребну масу соли и масу воде.
Сипати потребну запремину воде (ако је потребно 30 g воде, то је 30 cm3).
Запремину дотерати сипањем. У чашу од 100 cm3 сипати претходно одмерену масу соли
2.
3.
8. Растворљивост кухињске соли на 25 oС износи 36 g у 100 g воде. У 75 g воде (25 oС) растворено је 8 g соли и добијен је раствор.
Заокружи слово испред тачног исказа:
а) рас твор је незасићен, б) рас твор је засићен, в) рас твор је презасићен.
Уколико се у истој маси воде раствори 18,4 g соли, раствор ће бити: а) незасићен, б) засићен, в) презасићен.
исказа.
а) Сваки раствор чине један растварач и једна растворена
штапић, троножац.
14. У 100 g воде на 20 0С може се највише растворити 20,7 g CuSO4
Друга група: припрема смешу земље и воде
Потребне супстанце: кашичица земље, дестилована вода. Потребан прибор: чаша, кашичица, мензура, штапић, левак, филтер-папир, маказе, статив.
Прављење смеше и раздвајање на састојке цеђењем (филтрацијом)
Кашичицу земље сипај у чашу. Одмери мензуром 50 cm3 дестиловане воде и сипај у чашу са земљом. Промешај стакленим штапићем
лампа.
Поступак: Са мало песка помешај 0,5 g јода и стави у
Edukapromo • одливањем (декантовањем),
• цеђењем (филтрирање),
• сублимација.
Edukapromo • упаравањем,
• кристализацијом,
• дестилацијом.
Edukapromo 1.
2.
5. Прикажи хемијским знацима
а) два молекула угљеник(IV)-оксида ________________________________,
б) пет атома злата ________________________________________________,
в) три молекула амонијака ________________________________________,
г) молекул кисеоника _____________________________________________,
д) пет атома хлора _______________________________________________, ђ) две формулске јединке калцијум-флуорида ________________________, е) три формулске јединке натријум-хлорида _________________________.
Састављање једначина хемијских реакција
1.
2.
3.
чачкалица
Edukapromo 4.
5.
12.
а)N2O, б) MgCO3, в) N2O5, г) C2H2. A r (N) = 14, Ar (O) = 16, Ar (Mg) = 24, Ar (С) = 12, Ar (H) = 1.
Edukapromo Edukapromo Маса 1 mol атома натријума је 23 g, а толико је и релативна атомска маса натријума.
Маса 1 mol атома магнезијума је 24 g, колика је маса 2 mol атома магнезијума? Поступак
Моларна маса магнезијума је 24 g/mol. n = 2 mol
M = m m = M ∙ n m = 24 g/mol ∙ 2 mol m = 48 g n
1. Опиши поступак мерењa: а) масе, б) запремине, в) температуре.
2. За мерење запремине супстанце користи се (заокружи слово испред тачног одговора): а) стаклена чаша, б) мензура, в) вага, г) пипета, д) бирета, ђ) термометар.
Прва група
Друга група
Потребан прибор: мензура, техничка вага, шприц-боца, сахатно стакло, кашичица.
Потребне супстанце: дестилована вода, опиљци гвожђа.
Измери у мензури 18 ml дестиловане воде.
Твој друг нека измери 7 g гвожђа.
Опиши поступак мерења.
Масу измерених супстанци изрази као моларну масу и одреди количину супстанце. m = ? n = ? M = ?
Трећа група
Потребан прибор: два сахатна
8.
а) CO, б) N2O3, в) Fe2O3, г) Na2SO4, д) SO3 10. Израчунај
а) 3 mol NaCl, б) 3 mol N2, в) 2 mola Al2O3, г) 0,5 mol Na2O, д) 0,25 mol H2SO4.
11.
а) 32g S, б) 88g CO2, в) 20,0g CaCO3, г) 24,5g H3PO4.
Edukapromo Edukapromo Потребне супстанце: лимунов сок, млеко, раствор
3.
4.
кречна вода, HCl, NaOH, сапун, сирће, HNO3, кафа, H2SO3, амонијак.
а) Супстанца је кисела.
б) Супстанца је слабо базна. в) Супстанца
5.
7. Какву рН вредност очекујеш да ће имати следеће
7):
а) сок од поморанџе _____,
б) раствор кухињске соли _____,
в) раствор калцијум-хидроксида _____,
г) чиста вода _____, д) сирће _____.
8. У ком ће од понуђених примера
а) Растварање кухињске соли у води, б) мешање млека и воде, в) разблаживање хлороводоничне киселине, г) растварање натријум-хидроксида у води, д) растварање соде бикарбоне у води.
Edukapromo 1.
запаљива хемикалија, – експлозивна хемикалија, – радиоак тивна хемикалија?
3. Допуни реченице одговарајућим речима из заграде.
а) Сви делови _____________________ (хомогене / хетерогене) смеше немају исти састав.
б) Спреј је хетерогена смеша_____________(чврстог / течног / гасовитог) у гасу.
в) Шећер се добија ______ (кристализацијом / цеђењем / дестилацијом) из шећерног раствора.
г) Дестилат настаје_____________(хлађењем / загревањем) паре течности.
д) Густина воде у чврстом агрегатном стању ___________ (већа / једнака / мања)
4. Заокружи
14.
Одговор:
15.
16.
атома водоника (А = 1, Z = 1) и једног атома кисеоника (А = 16, Z = 8). Одговори.
а) Колико протона има у молекулу? ___________________
б) Колико електрона има у молекулу? __________________
в) Колико неутрона има у молекулу? ___________________
г) Колика је релативна молекулска маса? _______________
д) Колики је однос маса водоника и кисеоника? __________
23. Прецртај нетачно у наведеном тексту:
а) Молекули
26.
а) 8O, 16S, б) 19K, 17Cl, в) 11Na, 17Cl, г) 4Be, 10Ne.
28. Дати су јони: 8O2-, 9F-, 17Cl-, 12Mg2+, 20Ca2+, 11Na+
31.
38. O2-, S, S8, Cl-, NH3, Fe2+, CO2, Al3+, P4, N, N3-, Cu2+.
А) Распореди честице у четири групе:
Атоми _________________, молекули _____________________,
анјони _________________, катјони _______________________.
Б) Које групе честица наведених под А):
1. јесу неутралне? _______________
2. имају већи број протона него електрона? _______________________
3. имају већи број електрона него протона? _______________________
39. На загрејану плочу решоа сипај мало кухињске соли,
40.
41. Заокружи слово испред формуле.
а) NH3, б) KF, в) HF, г) SO2, д) CН4.
42. Прецртај нетачно у реченицама.
44.
50. Колику масу изражену у килограмима има 1,5 ∙ 1023 атома сумпора?
Одговор: _______________ kg.
51. Колику запремину, при нормалним условима, заузима 0,5 mol кисеоника?
Одговор: ______________________________________________________________
52. Колику запремину, при нормалним условима, има 2 mol кисеоника?
Одговор: ______________________________________________________________
53. Колику запремину, на 4 оС, има 36 g воде, ако је густина воде 1 g/cm3?
Одговор: ______________________________________________________________
54. Одговор напиши на линији. Реакцију сједињавања азота и кисеоника у азoт(V)-
Edukapromo једначину хемијске реакције: ___________________________________
59. Колико грама воде треба додати у 250 g 15%-ног раствора да
раствор?
60. Заокружи слово испред тачног одговора. Младен је у 66 g млека додао 13 g какаоа. Мешао је кашичицом
а) 6,1%, б) 16,4%, в) 19,6%, г) 21,0%, д) 47,0%.
61. У ком су се молском
Одговор:
62.
Одговор:
63.
68. Растворљивост неке супстанце јесте 25 g. Колико је
растворено у 175 g засићеног раствора?
69. Колико грама шећера и воде треба
припремање 150 g 30%-ног раствора?
70. У 150 g 30%-ног раствора додато је 25 g супстанце. Израчунај процентни садржај раствора.
71. Хемијским поступком добијене су чисте супстанце:
1. водоник, 2. кисеоник, 3. гвожђе, 4. јод, 5. жива, 6. сумпор, 7. злато, 8. цинк.
а) Разврстај супстанце на
метали __________________________________________,
неметали ________________________________________.
б) Које су од наведених супстанци
собној температури:
гасови _____________________________________________,
течности ____________________________________________,
чврсте супстанце _____________________________________.
72. Допиши
а) CH4 + O2 → H2O + CO2, б) Al + Cl2 → AlCl3, в) N2O5 + H2O → HNO3, г) H2 + F2 → HF.
Mg + O2 → MgO ______ CaO + H2O → Ca(OH)2 ______ HgO → Hg + О2 ______ Na + Cl2 → NaCl ______ NaHCO3 → Na2CO3 + CO2 + H2O ______ P2O5 + H2O → H3PO4 ______
1. Природна, грађе. Експерименталним. Лабораторији.
2.
3. ђ).
4. Прашак за пециво, детерџенти, вештачка влакна, физиолошки раствор, стакло, вештачка ђубрива.
5. а) Бакар, креч, б) маслиново уље, кухињска со, брашно, в) сребро, злато, пластика.
6. а) Експеримент или оглед, б) супстанце, в) хемија.
7. а) Дрво, морска вода, злато, песак, б) пластика, гасови, вештачка кожа.
ЛАБОРАТОРИЈСКА ВЕЖБА I (стр. 17–19)
1. Машице, аван са тучком, левак, епрувете, сталак за епрувете, пипета. а) Левак, епрувете, пипета, б) пинцета, в) аван са тучком, г) сталак за епрувете.
2. а) Мензура, б) епрувета, в) левак, г) аван са тучком.
3. а) За држање епрувете при загревању, б) за придржавање левка, в) на њој се држи посуђе при загревању.
4. г)
5. а).
Edukapromo 6. б), може се загревати.
7. 1, 2 и 5.
8. А- токсично , Б- лако запаљиво.
9. Б- лако запаљиво.
10.
ЛАБОРАТОРИЈСКА ВЕЖБА II (стр. 26–28)
1. а).
2. б), в), г).
3. а) Запремина, б) маса, в) запремина, г) маса, д) запремина, ђ) температура.
4. а).
5. 39,25 g
6. 6).
7. в) 42 cm3
8. Килограм, грам и милиграм. Живом. Запремину у cm3
9. 2 kg = 2000 g
5 g = 500 mg
15 ml = 15 cm3
2,5 dm3 = 2500 cm3
10. a) и e).
11.
ЛАБОРАТОРИЈСКА ВЕЖБА III (стр. 29, 30)
1. Натријум-хлорид (кухињска со): бела
сланог укуса. Шећер: бела кристална супстанца, слатког укуса, растворљива у
може да се намагнетише. 2.
Физичке промене супстанце Хемијске
растварање шећера у води, испаравање воде, савијање жице, сублимација јода, кондензација алкохолних пара, филтрирање, ливење метала
Edukapromo сагоревање папира, рђање гвожђа, горење свеће, труљење воћа
3.
4.
5. г).
6.
ЛАБОРАТОРИЈСКА ВЕЖБА III (стр. 35–40)
1. Физичке промене: уситњавање, растварање, кондензација (испаравање).
Хемијске промене: угљенисање шећера.
2. Хемијска промена.
3. а) Јес те, б) није, в) нису, г) јесте, д) јесте.
4. а) ДА, б) ДА, в) НЕ, г) ДА, д) ДА, ђ) ДА.
5.
6. а) 0 0С и 100 0С, б) 0 0С, в) 100 0С , г ) 4 0С на тој температури вода је најгушћа.
7. Хемијске: в) и г), физичке: а), физичке и хемијске: б).
8. а) Бензин је лако запаљива течност. Парафин је
б) Топљење
9. Ослобађа се б) и в), троши се енергија а) и г).
10.
Edukapromo чврстом
11.
14. в), а), б), д), г).
15. а) и в).
16. а), в), д), ж), з).
17. а) ДА, б) ДА, в) ДА, г) НЕ, д) ДА.
18. Хемијска промена. Настала је нова супстанца.
ЛАБОРАТОРИЈСКА ВЕЖБА IV (стр. 42–46)
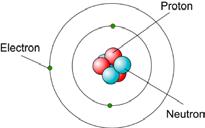
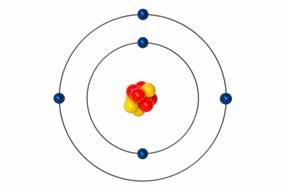
1. а) неутрона б) нису в) није г) јесте
2. а) L, б) L, в) М, г) М, д) N.
3. Језгро: а), в), г), д). Електронски омотач: б), ђ).
4. а) Флуор, б) алуминијум, в) калцијум, г) бакар.
Решење задатка на страни 44: а) 2. ниво, 3 валентна електрона; б) 4. ниво, 2 валентна електрона.
5.
6. а) 1, 13, г) 1, 13, б) 1, 13, д) 1, 27. в) нема 14,
7. По енергији.
8. 8 електрона, 18 електрона.
9. а) К, б) L, в) L, г) М, д) М, ђ) N.
10. a) L, б) K , в) L, г) L.
11. Ca - 2 електрона, К - 1 електрона.
12. F - 1 електрон , O - 2 електрона.
13. 17 електрона.
ЛАБОРАТОРИЈСКА ВЕЖБА V (стр. 52, 53)
1. Јонска веза: KCl, MgBr2, NaCl, CaO, LiF, BaO. Ковалентна – поларна: HCl, NH3, H2S, CO2, H2O, – неполарна: O2, H2, P4, S8.
2. a) Не, б) Да, в) Да, г) Не, д) Да.
3. а) У води, б) у неполарном растварачу, в) у с личном.
4. а) У води, б) у води.
5. а) NaCl, б) графит, в) MgO
6. а) Од типа хемијске везе, б) честице се крећу, в) јони се привлаче снажним магнетним силама
решетке од јона, г) честице се не крећу, само вибрирају.
7. а) Филтрација, б) загревањем, в) рас твор плаве боје.
ЛАБОРАТОРИЈСКА ВЕЖБА VI (стр. 56, 57)
1. а) Не, б) Да, в) Не, г) Да, д) Да.
2. б) и г).
3. а).
4. а) Више, б) температура, поларност, величина кристала, в) растворљивост.
ЛАБОРАТОРИЈСКА ВЕЖБА VI (стр. 60–65)
1. а) Да, б) Не, в) Да, г) Не.
2. 277 g воде.
3. 16,67 g.
Edukapromo 4. 24,5 24,925,225,926,4
5. б).
6. 30 g соли и 120 g воде.
7. 170 g воде.
8. а) и а).
9. а) Не, б) Не, в) Не, г) Да, д) Не.
10. А) в), Б) 120,7 g, В) 17,15%.
11. а) 50 g, б) 400 g, в) 60 g
12. б).
13. Вага, термометар, чаша и мензура.
14. а) Хетерогена, б) 180 g, в) 16,7%, б).
15. 2,7 g.
16. 16 g.
17.
12,0514,9517,621,225,7531,7 10 15 20 25 30 Растворљивост у g у 100 g угљен-дисулфида
18. Треба додати 200 g воде.
19. 100 g.
20.
21. 150 g
22. 10%.
23. 17,5%.
24. 10%.
25. 4,76%.
ЛАБОРАТОРИЈСКА ВЕЖБА VII (стр. 66 и 70–72)
1. Гвожђе, кисеоник, азот.
2. а), в), г).
3. а) Није, б) јесте, в) не задржавају, г) јесте, д) не гради.
1.
2. б), а), д), ђ), а).
3. а) Хомогена, е) хомогена, б) хомогена, ж) хетерогена, в) хомогена, з) хетерогена, г) хетерогена, и) хетерогена, д) хомогена, ј) хомогена, ђ) хетерогена, к) хетерогена.
4. а) Цеђење, б) декантовање, в) магнетом.
5. Хомогена. Хетерогена. Хомогена. Хетерогена.
6. а) и г). А) хетерогена, Б) филтрирањем.
7. Хомогена – вода и натријум-хлорид. Хетерогена – бакар и гвожђе.
8.
9. 1. Додавање воде, 2. филтрирање, 3. кристализација (упаравање).
ЛАБОРАТОРИЈСКА ВЕЖБА VIII (стр. 74, 75 и 77–79)
1. а) 4, б) 5.
2. а) 2 - H и 2 - Cl, б) 10 - H и 10 - Cl.
3.
4. a) Li2S, jонска, б) 3H, 1N, NH3 ковалентна поларна,
в) FeCl2 jонска, г) S8 ковалентна неполарна.
5. а) 2CO2, б) 5Au, в) 3NH3, г) O2, д) 5Cl, ђ) 2CaF2, е) 3NaCl.
6. а) Fe2O3, б) AlH3, в) MgO, г) Cl2O7
7. а) SO2, б) KHSO4, в) HClO3, г) FeCl3
1. Хемијска.
2. б).
3. Издвојила се гасовита супстанца. Маса гвожђа се повећала, гвожђе је везало кисеоник из ваздуха.
4. 18 g H2O.
24 g угљеника. 12 g водоника.
5. 4,5 g воде.
6. Хемијска промена.
7. Аван с тучком.
8. а) Синтеза, б) анализа, в) анализа, г) синтеза, д) синтеза.
9. а) Анализа, б) синтеза, в) синтеза, г) анализа.
10.
11. а) 7 : 4, б) 2 : 1 : 4, в) 7 : 20, г) 12 : 1.
12. CaCO3.
ЛАБОРАТОРИЈСКА ВЕЖБА IХ (стр. 84, 85)
1. Килограм. Мол. 6 10 23; 6 10 23; 6 10 23 .
2. г).
3. а) и д).
4. 95,30 g/mol.
Edukapromo 5. 0,2 mol.
6. 175,5 g.
7. 2 mol.
8. M = 36,5 g/mol.
9. a) = 28g/mol, б) 76g/mol, в) 160 g/mol, г) 142 g/mol, д) 80 g/mol.
10. a) 175, 5 g, б) 84 g в) 204 g г) 12,4 g д) 24,5 g
11. a) 1 mol, б) 2 mol, в) 0,2 mol, г) 0,25 mol.
ЛАБОРАТОРИЈСКА ВЕЖБА Х (стр. 90– 92)
1. Сок од љубичастог
2. а) Раствор амонијака, кречна вода, б) дестилована вода, в) сок од
4. б).
5. в) .
6. а) Сапун је базан, зато што је наведено рН = 9. б) Може се рециклирати, наведен је знак за рециклажу.
7. а) < 7, б ) =7, в ) 7<, г) = 7, д) < 7.
8. г), д).
РАЗЛИЧИТИ ЗАДАЦИ (стр. 93–105)
1.
2. А – гвожђе, Б – плута, В – песак, Г – со.
3. а) Хетерогене, б) течног, в) кристализацијом, г) хлађењем, д) мања.
4. б).
5. а) Неутрон, б) протон, в) нуклеони, г) протон, д) електрон, ђ) омотач, е) ел. омотач, ж) електрон, з) протон, и) валентни електрони, ј) омотач.
6. A r (Al) = 26,82.
7. S 2- K-2, L-8, M-8. S K-2, L-8, M-6, A = 32.
8. 311H 21H 31H.
9. 21H 21H 2 31H.
10. б).
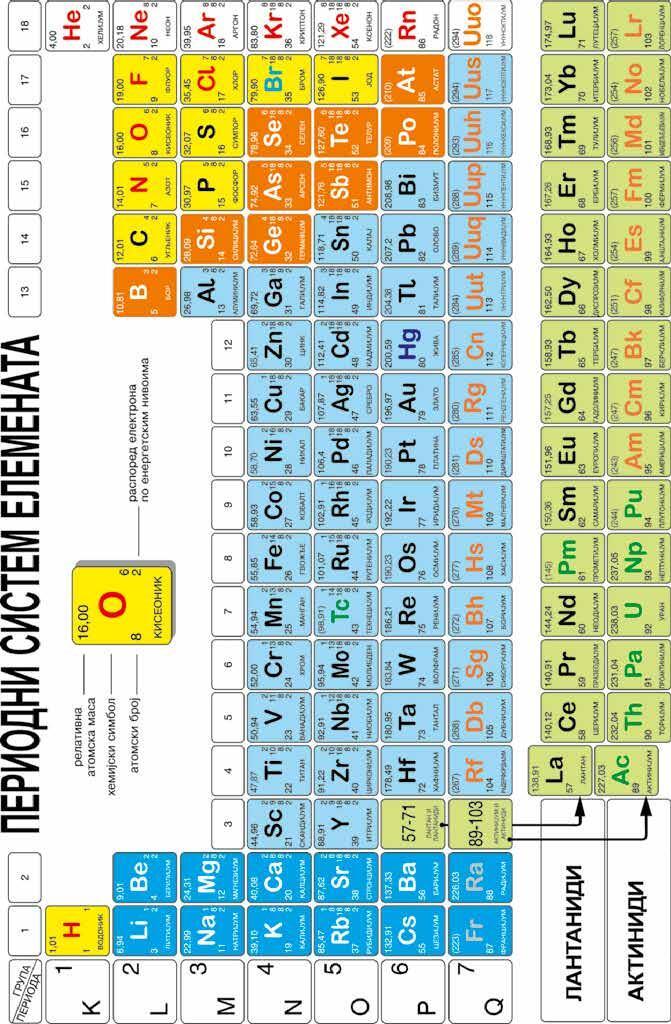
11. A r = 24,3.
12. Б група 15 периода 3, В група 13 периода 2, Г група 2 периода 3.
Edukapromo 13. 1 и в, 2 и б, 3 и г, 4 и а.
14. 3. периода.
15. 20 Ca2+ и S2-.
16. Два, један, претходи, примају, стичу, негативно, неметалима.
17. Јeдним електроном, два електрона.
18. 2He теже атоми H, Li, 10Ne теже атоми F, Na, Mg, 18Ar теже атоми Cl, K, Ca,
19. N – 3 електрона, P – 3 електрона.
20. а).
21. г).
22. а) 10, б) 10, в) 8, г) 18, д) 1:8 .
23. а) Једињења, б) јонском, в) јонских, г) три, д) два.
24. HgO, PbO, Cu2O, N2O3 , PbO2
25. a), в), г), д).
26. 1) в, г, 2) а, 3) б и в, 4) в.
27. 3,40 пута.
28. а) Cl- и Ca2+, б) MgS, CaS, Na2S.
29. a), б), a), б), б).
30. а) Атоми: S, N, анјони: Cl -, N3- , F-, молекули: CO2 , S8, N H3, P4, O2, катјони: K+ , Al3+ , Fe3+ , Cu+, б) K+ , Al3+ , Fe3+ , Cu+, в) S , S8 , NH3, P4 ,N, CО2, O2, г) Cl -, N3-, F-.
31. г).
32. Cl и а), C и в), O и а), F и в).
33. неона, аргона, Na+ и Cl-, јонско.
34. Анјон: б), в) катјон: а), г).
35. један, хелијума, један, 17, 7, аргона, један, молекул, један, настаје H + Cl, H - Cl, H Cl.
36. 16 , 6, Ne, 2. молекул, два, два, две.
37. 15 , 5 , Ne , 3. молекул, три, три, три.
38. Атоми: S ,N, молекули: S8, NH3, CO2, P4, анјони: O2- , Cl- , N3-, катјони: Fe2+, Al3+ , Cu2+
1. су неутралне: S, S8, NH3, CO2, P4, N,
2. имају већи број протона него електрона: Fe2+, Al3+, Cu2+, 3. имају већи број електрона него протона: O2-, Cl-, N3-.
39. Кристали шећера су се истопили, променили боју и на крају угљенисали. Дошло је до хемијске промене. Кристали соли нису.
40. Натријум-хлорид, водоник, хлор. 41. б).
Edukapromo 42. задржавају, не може, анализа, исто/мање.
43. ковалентна поларна, 16, гасовито.
44. а) 4Н, 2S, 8О, б) 6К, 3S, в) 4С, 8О, г) 4N, 12Н. а) 196 g, б) 330 g. б) јонска, г) ковалентна поларна.
45. M r (MgSО4 • 7 H2O) = 246, 51% , M r (CuSО4 • 5 H2O) = 249,5 ; 36% .
46. а) 12 - C; 22 - H , 11 - O, б) 342, в) 342 g, г) n = 2 mol, д) 2,5 • 6 • 1023 , ђ) C - 42%, H - 6,4%, O - 51,46%, e) 72 : 11 : 88.
47. 0, 5 mol H2O.
a) 35, б) 8 • 6 •10 23 , в) 9 • 6 •10 23, г) 30 • 6 • 1023 .
48. 16 g O.
49. a) Не могу, б) физичким, в) задржавају, г) немају.
50. 0,008 kg.
51. 11,2 dm3
52. 44,8 dm3
53. 36 сm3
54. 2N2 + 5O2 2N2 O5 а) 2 mol N2 : 5 mol O2 2 mol N2O5, б) 7:20, в) 2 : 5.
55. 2H2 + O2 2H2O,
36 g H2O.
56. a) 73 g, б) 69 g H, в) H2 + Cl2, 2HCl.
57. a).
58. 28,58 g супстанце.
59. 962,5 g.
60. 16,4 % = б).
61. 0,05 mol H и 0,05 mol Cl.
62. 2 mol Ca (OH)2 и 2 mol H2 SO4
63. 48 g.
64. 4,5 g H2O.
65. 25 g.
66. 125 g воде упарити.
67. 250 g + 1 = 251 g.
68. 35 g.
69. 45 g супстанце и 105 g растварача.
70. 40%.
71. Метали: гвожђе, жива, злато, цинк; неметали: водоник, кисеоник, јод, сумпор. Гас: H2, О2, течно: Нg, чврсте: Fe, I2, S, Au, Zn.
72. а) СH4 + 2О2 → 2Н2О + CО2 б) 2Аl + 3Cl2 → 2АlCl3 в) N2О5 + Н2О → 2HNO3 г) Н2 + F2 → 2HF
73. 2Мg + O2 → 2МgO (С); СaO + H2O → Сa(ОH)2 (С); 2НgO → 2Hg + O2 (А); 2Na + Cl2 → 2NaCl (С); 2NaHCO3 → Na2CО3 + CO2 + H2O (А); P2O5 + 3H2O → 2H3PO4 (С)
74. а) Hg + S → HgS б) 4Na + O2 → 2Na2O в) CН4 → C + 2H2 г) 2HCl → H2 + Cl2 д) 2H2O → 2H2 + O2
Edukapromo Edukapromo