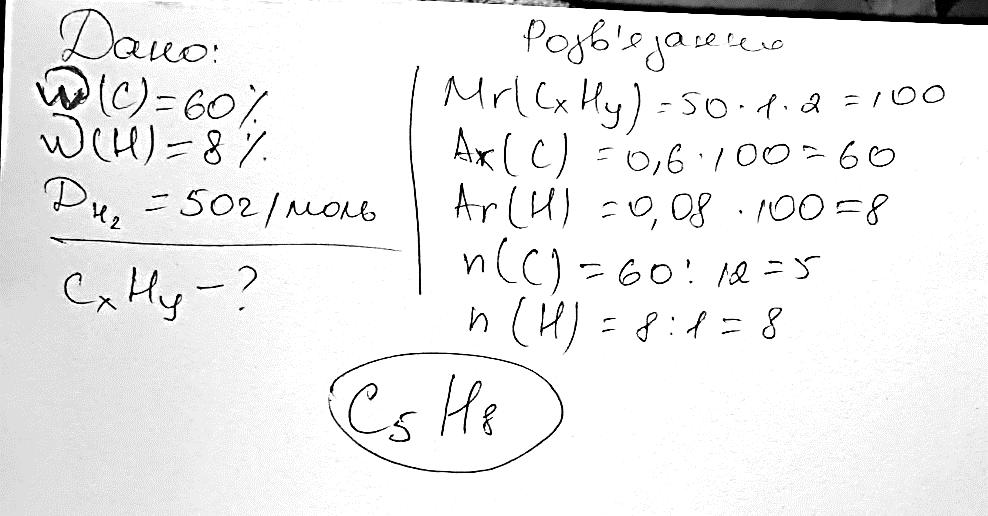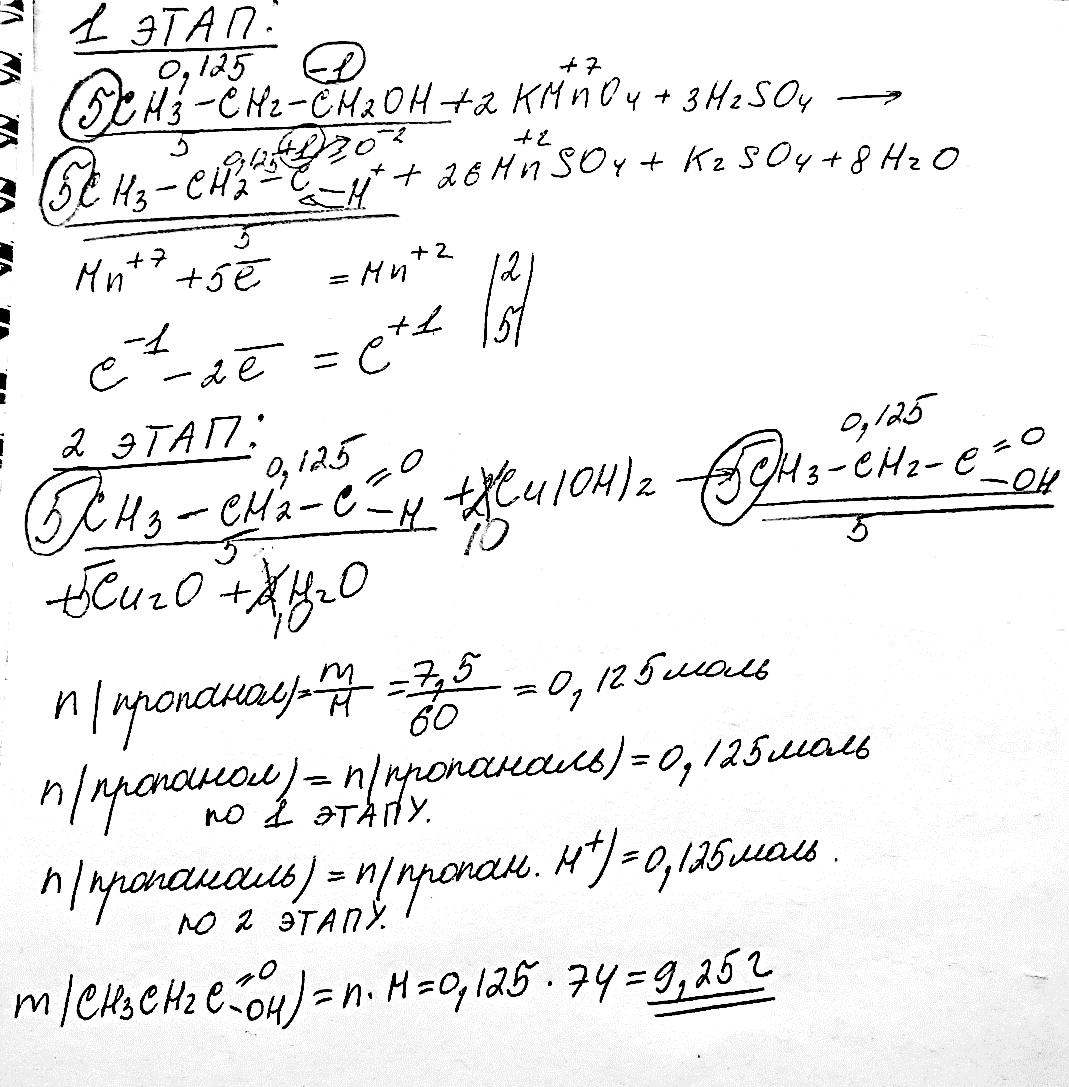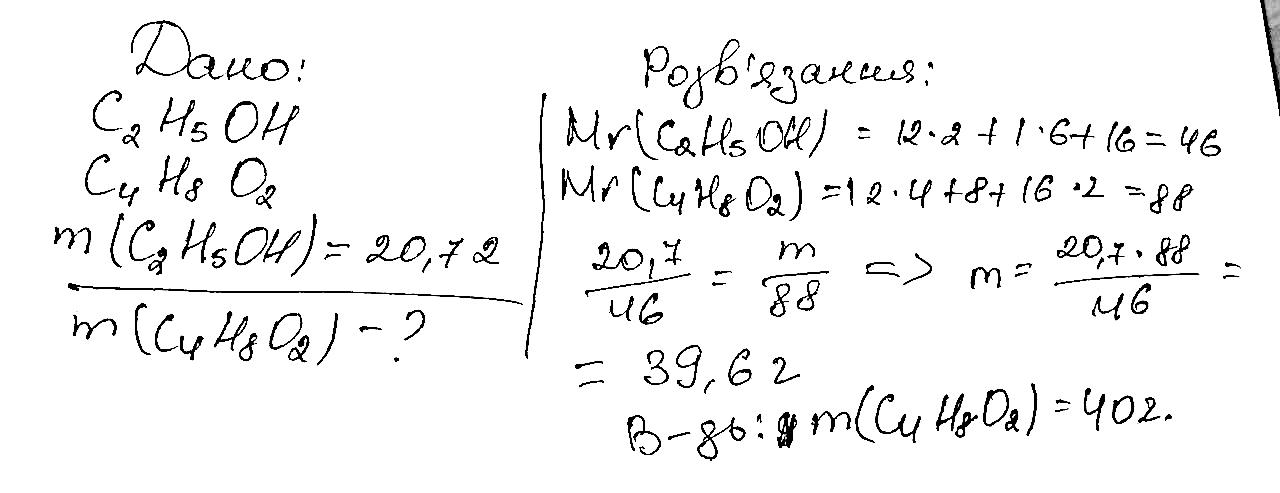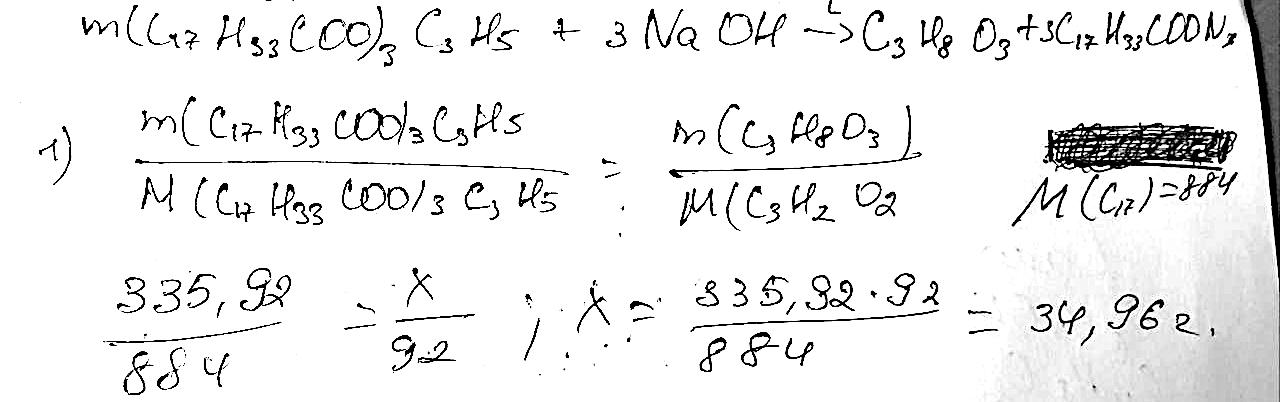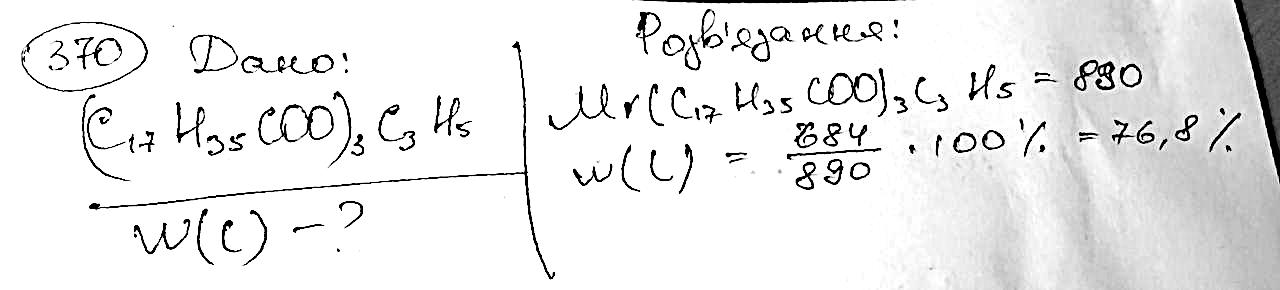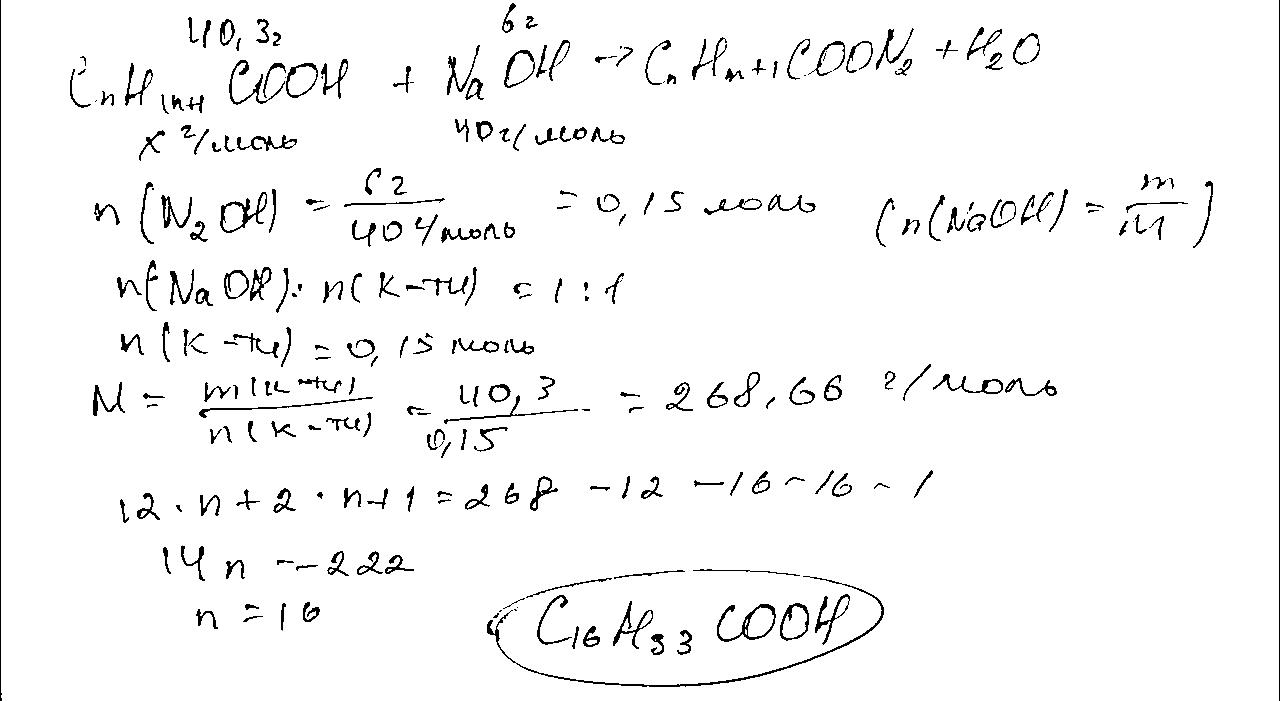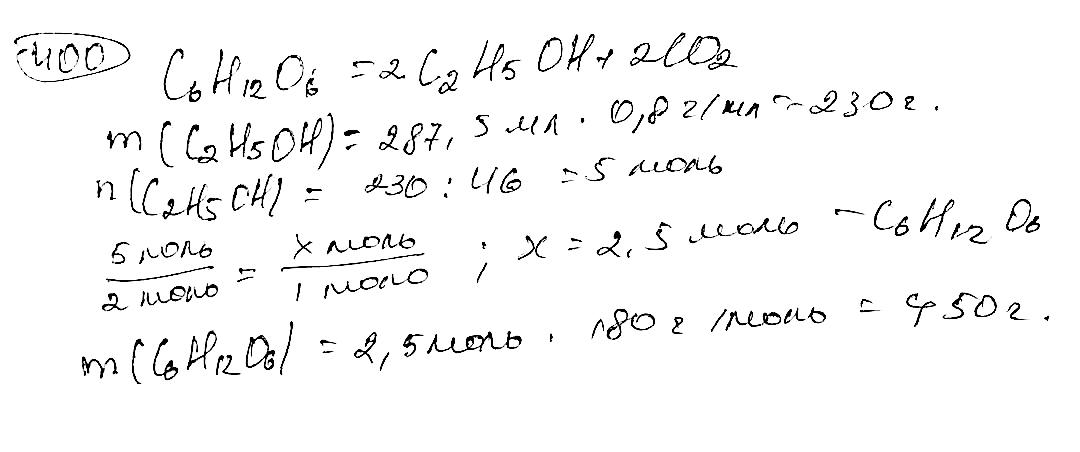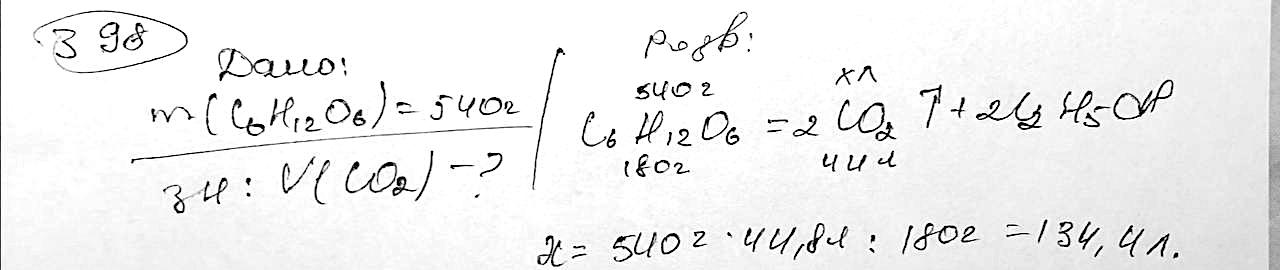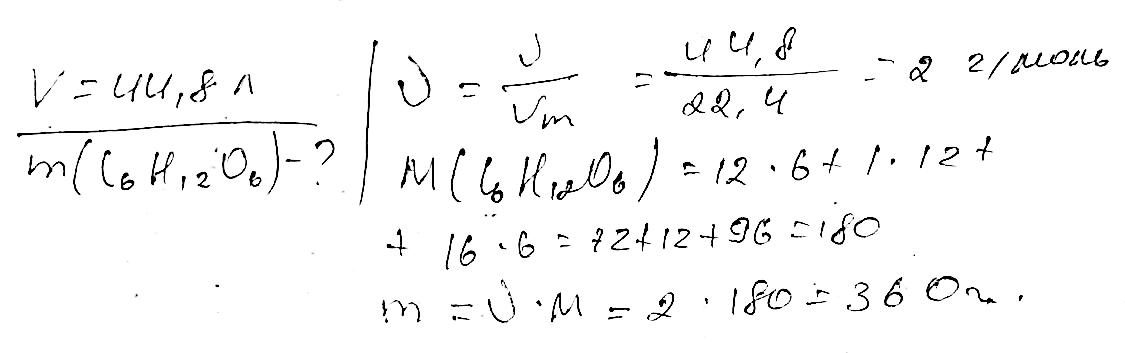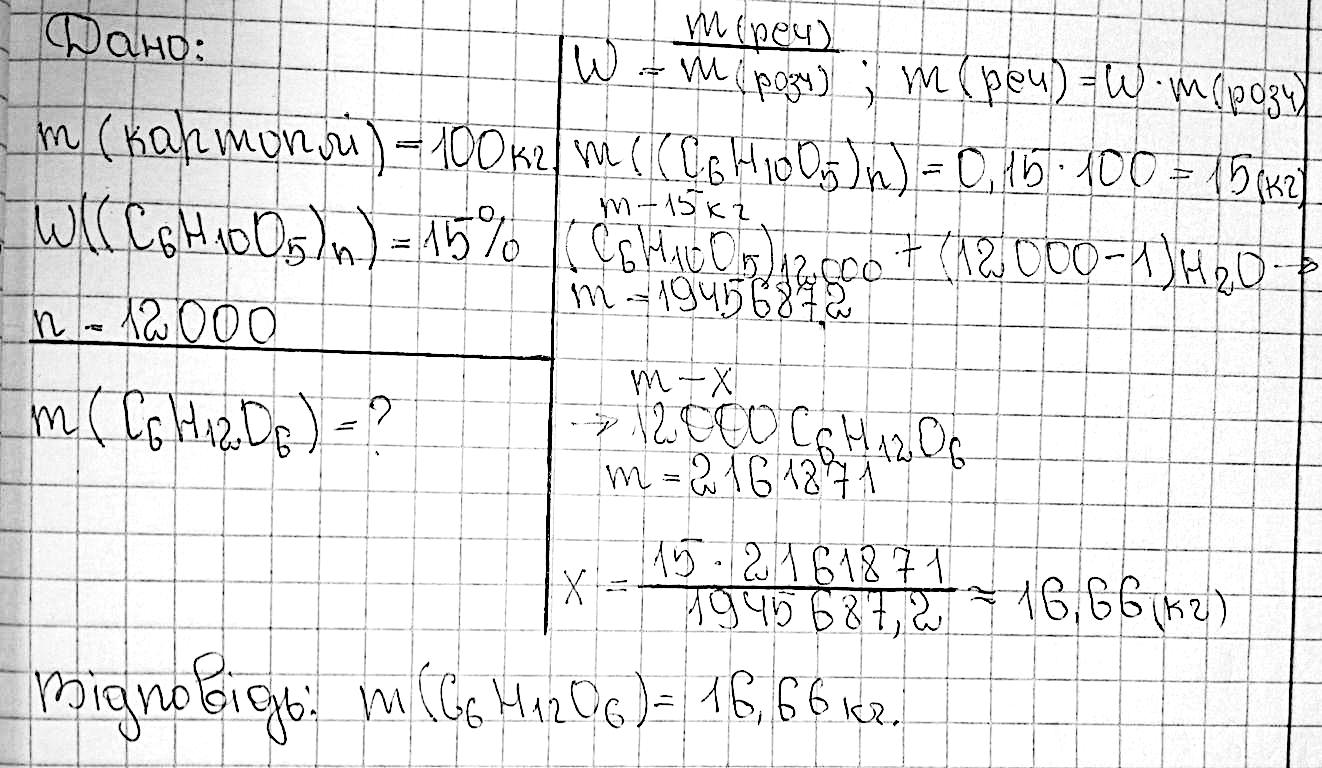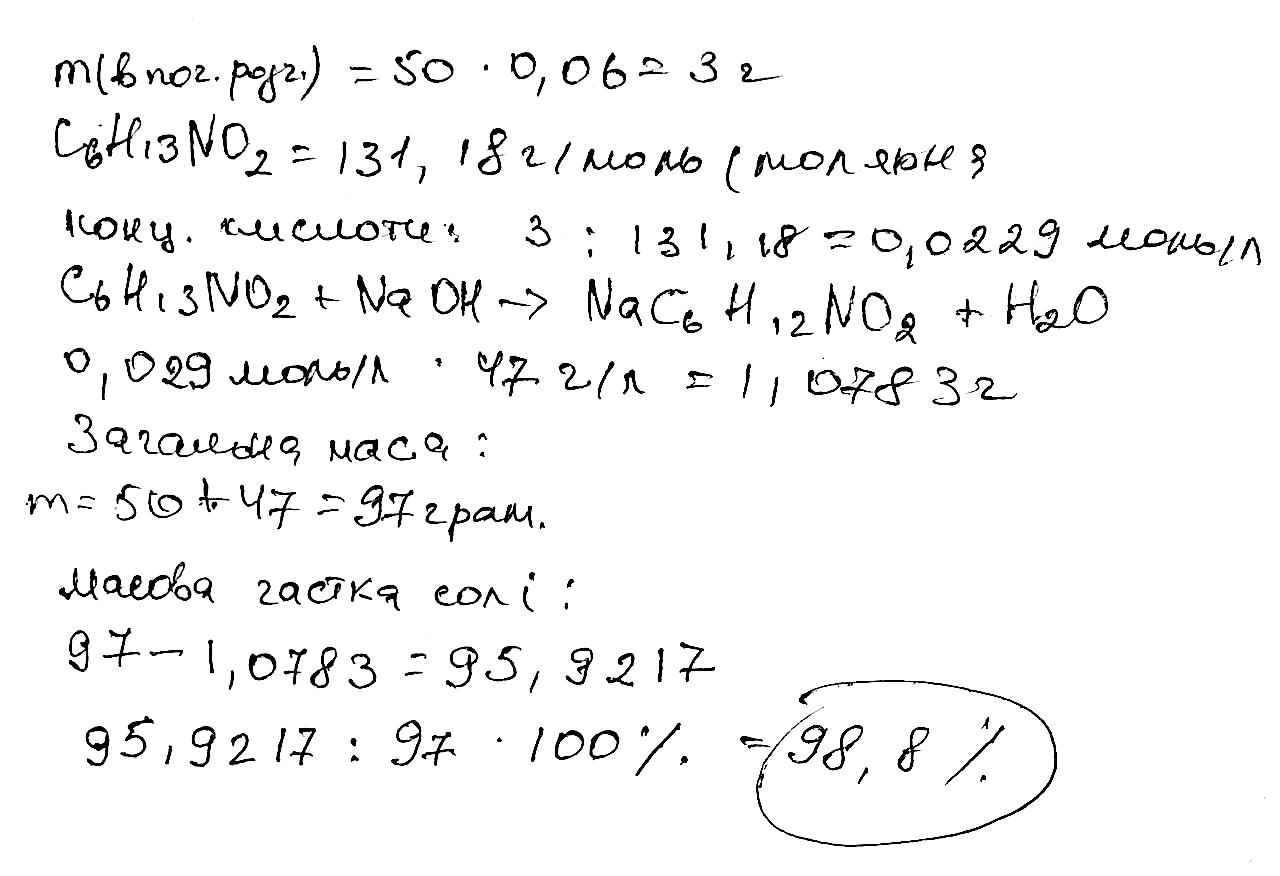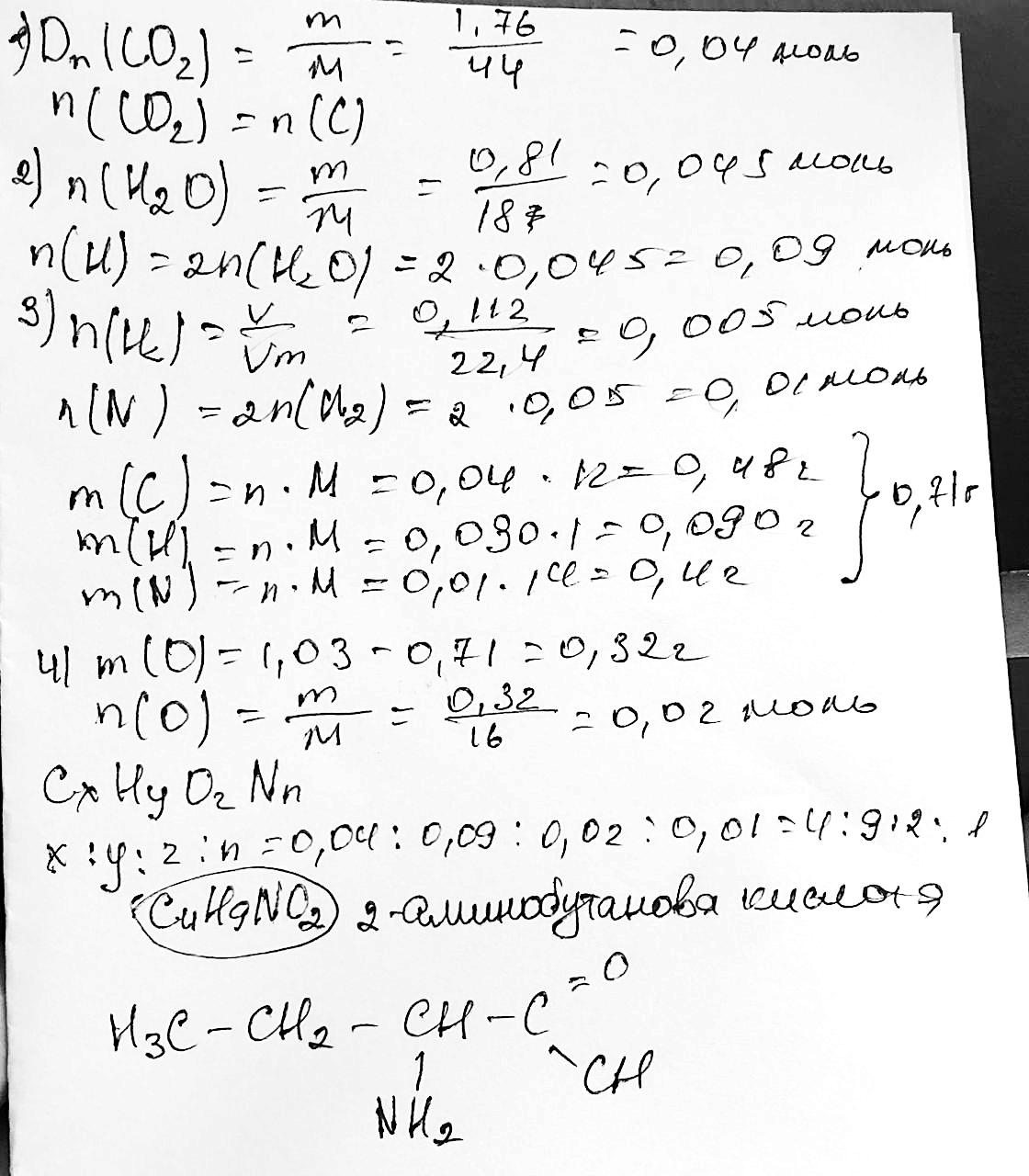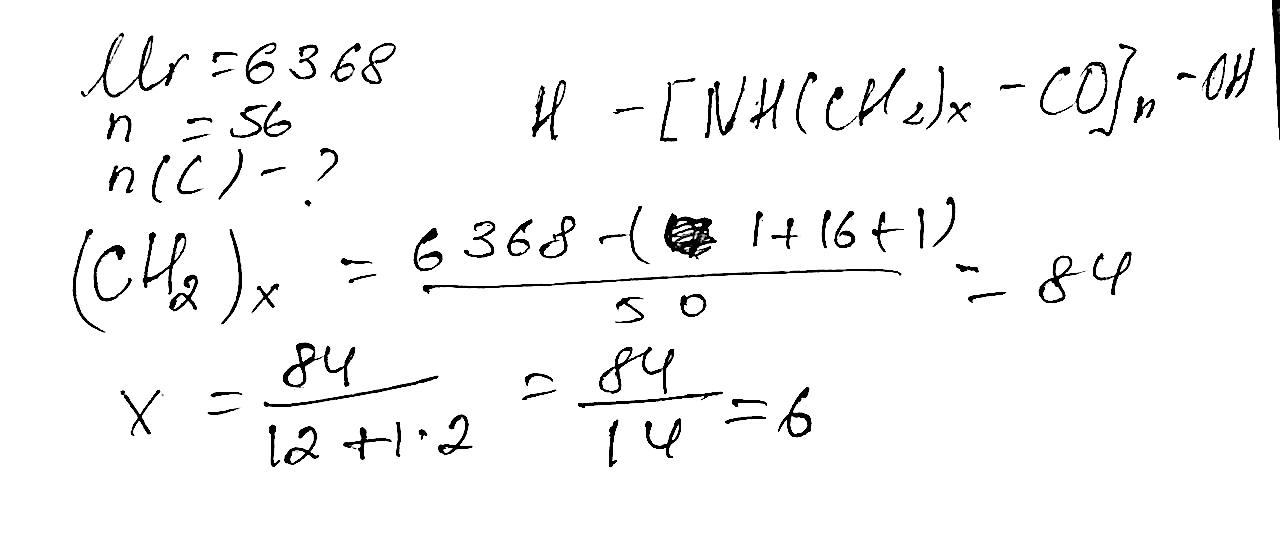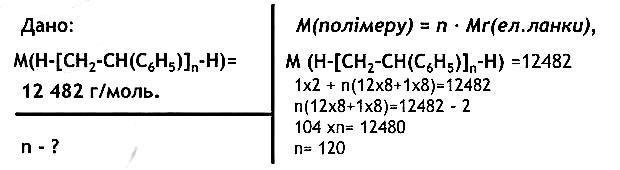ГДЗ Хімія 10 клас Григорович 2023 (2018) Параграфи §20-38 (ст. 119 - 226)
shkola.in.ua
§20. Карбонові кислоти. Ізомерія та номенклатура. Фізичні властивості
Контрольні запитання
295. Які речовини відносять до карбонових кислот? Напишіть загальну
структурну та молекулярну формули насичених одноосновних карбо- нових
кислот.
Карбонові кислоти - це клас органічних сполук, які містять карбоксильну групу (COOH). Загальна структурна формула насичених одноосновних карбонових кислот має
вигляд: R-COOH
де R - вуглеводневий залишок, який може включати вуглецевий ланцюг або кілька вуглецевих атомів.
Молекулярна формула карбонових кислот включаєся відповідно до конкретного
вуглеводневого залишку. Наприклад, для насиченої одноосновної карбонової кислоти з двома вуглецевими атомами у вуглеводневому залишку (ацетатна кислота) молекулярна формула буде CH3COOH.
298.Як утворюються назви карбонових кислот за систематичною номенклатурою? Як називають кислоту з формулою CH3–CH2–COOH? Назви карбонових кислот за систематичною номенклатурою складаються наступним чином:
1. Визначаються вуглецеві атоми, на яких знаходиться карбоксильна група. Цей вуглецевий атом нумерується так, щоб вуглекислий водень мав найнижчий можливий номер.
2. Додається суфікс "-оїкислота" до назви вуглеводневого залишку, який складається з вуглецевих атомів, до яких не належить вуглець з карбоксильною групою.
3. Вуглецеві атоми у вуглеводневому залишку нумеруються так, щоб вуглець з карбоксильною групою мав найнижчий можливий номер.
4. Перед суфіксом "-оїкислота" додається індекс, який вказує на номер вуглецькарбоксильного вуглеця.
Наприклад, для кислоти з формулою CH3–CH2–COOH (пропанова кислота):
1. Карбоксильна група знаходиться на другому вуглецевому атомі, тому цей вуглецевий атом має найнижчий можливий номер - 2.
2. Вуглеводневий залишок - CH3–CH2-.
3. Вуглець з карбоксильною групою має номер 2.
4. Назва: 2-пропаноїкислота.
Отже, кислоту з формулою CH3–CH2–COOH називають 2-пропаноїкислотою.
shkola.in.ua
299. Схарактеризуйте фізичні властивості насичених одноосновних карбонових кислот. Поясніть, як впливає на них можливість утворення водневого зв’язку. Фізичні властивості насичених одноосновних карбонових кислот визначаються їхньою молекулярною структурою та можливістю утворення водневого зв'язку. Температури плавлення та кипіння: Температури плавлення та кипіння карбонових кислот зазвичай вищі, ніж у подібних алканів або алкенів зі звідносною молекулярною масою. Це пов'язано з наявністю полярної карбоксильної групи (-COOH), яка сприяє утворенню водневих зв'язків між молекулами кислот. Розчинність у воді: Карбонові кислоти, особливо ті, що містять короткий вуглеводневий залишок, можуть утворювати водневі зв'язки з молекулами води. Це сприяє їхній розчинності у воді. Довільний атом водню з карбоксильної групи може утворити водневий зв'язок з киснем іншої молекули кислоти чи молекули води.
Кислотні властивості: Карбонові кислоти виявляють кислотні властивості через наявність карбоксильної групи, яка може віддавати протони (H⁺) у водних розчинах. Вони можуть реагувати з лужними розчинами, утворюючи солі. 300. Порівняйте загальні формули альдегідів і карбонових кислот. Що в них спільного, а що відмінного? Загальні формули альдегідів і карбонових кислот відображають спільні і відмінні структурні особливості цих класів органічних сполук. Загальна формула альдегідів: RCHO, де R представляє вуглеводневий залишок. Загальна формула карбонових кислот: RCOOH, де R також представляє вуглеводневий залишок. Спільне:
1. Обидва класи мають карбоксильну групу (COOH), яка є їхньою характерною функціональною групою.
2. Обидва класи можуть містити різні вуглеводневі залишки, що визначають конкретні сполуки.
Відмінне:
1. В альдегідах карбонільна група (-C=O) розташована на кінці молекули, тоді як в карбонових кислотах карбоксильна група (-COOH) розташована на одному з кінців молекули.
2. Альдегіди мають структурну формулу RCHO, де R - будь-який вуглеводневий залишок. Карбонові кислоти мають структурну формулу RCOOH.
3. Карбонові кислоти виявляють більш виражені кислотні властивості через наявність карбоксильної групи (-COOH), яка може віддавати протони у водних розчинах. Загалом, альдегіди і карбонові кислоти поділяють спільні хімічні особливості, пов'язані з наявністю карбоксильної групи, але мають відмінні структурні особливості, що визначають їхні унікальні характеристики та хімічні властивості. 301. Схарактеризуйте фізичні властивості та біологічну роль карбонових кислот. Де карбонові кислоти трапляються в природі? Наведіть приклади. Фізичні властивості карбонових кислот: Температура плавлення і кипіння: Температури плавлення і кипіння карбонових кислот зазвичай вищі порівняно з вуглеводнями або спиртами з такою самою кількістю атомів вуглецю. Це пов'язано з наявністю карбоксильної групи, яка сприяє утворенню водневих зв'язків між молекулами.
Розчинність: Короткі (до 4 атомів вуглецю) насичені карбонові кислоти розчиняються добре у воді завдяки водневим зв'язкам між карбоксильною групою та молекулами води.
shkola.in.ua
Біологічна роль карбонових кислот: Карбонові кислоти мають важливу роль в біологічних процесах: Метаболізм: Карбонові кислоти є важливими компонентами метаболічних шляхів в організмах. Наприклад, ацетилкоензим A (Acetyl-CoA) є ключовим міжпродуктом метаболізму вуглеводів, жирів та амінокислот. Клітинний регулятор: Деякі карбонові кислоти, такі як оцтова кислота і яблучна кислота, виступають як важливі регулятори pH в клітинах. Біосинтез: Карбонові кислоти використовуються для біосинтезу інших біологічно активних сполук, таких як амінокислоти, ліпіди і нуклеїнові кислоти. Карбонові кислоти в природі зустрічаються у багатьох органічних сполуках: Рослини: Фрукти і ягоди часто містять карбонові кислоти, такі як яблучна кислота.
Тварини: Карбонові кислоти можуть бути частинами жирових кислот, які є складовими ліпідів у тварин.
Мікроорганізми: Деякі бактерії і гриби виробляють або використовують карбонові кислоти в своєму обміні речовин.
Метаболічні шляхи: В метаболічних шляхах організмів карбонові кислоти є
проміжними продуктами, необхідними для здійснення різних біохімічних процесів.
Завдання для засвоєння матеріалу 302. Речовини з якими формулами є: а) одноосновними карбоновими кислотами; б) насиченими одноосновними карбоновими кислотами? а) Одноосновні карбонові кислоти мають загальну формулу CnH2n+1COOH. Приклади таких кислот:
• Масляна кислота (C16H32O2)
• Оцтова кислота (C2H4O2)
• Пропіонова кислота (C3H6O2)
б) Насичені одноосновні карбонові кислоти також мають загальну формулу
CnH2n+1COOH і включають кислоти, які не містять подвійних зв'язків в молекулі. Такі кислоти можуть бути насиченими вуглеводневими залишками (алкілами). Примеры:
• Ацетова кислота (CH3COOH)
• Пропіонова кислота (CH3CH2COOH)
• Масляна кислота (CH3(CH2)16COOH)
Ці речовини входять до класу карбонових кислот і мають загальну карбоксильну (COOH) групу в молекулі.
303. Складіть усі можливі структурні формули карбонових кислот зі складом: а) C5H10O2; б) C6H12O2.
а) Для формули C5H10O2 можливі наступні структурні формули карбонових кислот: Пентанова кислота: CH3CH2CH2CH2COOH
2-Метилбутанова кислота: CH3CH(CH3)CH2COOH б) Для формули C6H12O2 можливі наступні структурні формули карбонових кислот: Гексанова кислота: CH3CH2CH2CH2CH2COOH
2-Метилпентанова кислота: CH3CH(CH3)CH2CH2COOH
3-Метилбутанова кислота: CH3C(CH3)2CH2COOH
304. Серед наведених формул речовин визначте формули гомологів та ізомерів: Гомологи а, б і г, ізомери а і в; д і е
305. Класифікуйте за всіма ознаками карбонові кислоти, формули яких наведено в підрозділі «Поширеність карбонових кислот у природі». За різними ознаками карбонові кислоти можна класифікувати наступним чином: 1. За походженням:
- Органічні карбонові кислоти (молочна, щавлева, яблучна, лимонна, винна, масляна, акрилова, бензойна, ацетилсаліцилова, нікотинова).
- Ароматичні карбонові кислоти (бензойна).
- Карбонові кислоти, які є природними компонентами (молочна, щавлева, яблучна, лимонна, винна).
2. За структурою:
- Насичені одноосновні карбонові кислоти (молочна, яблучна, лимонна, винна).
- Ненасичені одноосновні карбонові кислоти (акрилова).
- Ароматичні карбонові кислоти (бензойна).
shkola.in.ua
- Карбонові кислоти з додатковими гідроксильними групами (щавлева, молочна, лимонна).
3. За кількістю карбоксильних груп:
- Одноосновні карбонові кислоти (молочна, щавлева, яблучна, лимонна, винна, масляна, акрилова, бензойна, ацетилсаліцилова, нікотинова).
- Двоосновні карбонові кислоти (бурштинова).
4. За наявністю функціональних груп:
- Карбонові кислоти з однією карбоксильною групою (молочна, щавлева, яблучна, лимонна, винна, масляна, акрилова, бензойна, ацетилсаліцилова, нікотинова).
- Карбонові кислоти з карбоксильною та гідроксильною групами (бурштинова).
5. За біологічною роллю та поширеністю у природі:
- Поширені в організмах (молочна, яблучна, лимонна, винна, масляна, нікотинова).
- Характерні для рослин (молочна, щавлева, яблучна, лимонна, винна).
- Характерні для ароматичних рослин (бензойна).
- Використовуються в медицині (бензойна, ацетилсаліцилова, нікотинова).
- Поширені у продуктах харчування (молочна, яблучна, лимонна, винна).
306. Складіть назви кислот за систематичною номенклатурою:
А: 2-хлоретанова кислота.
Б: 2,2-диброметанова кислота.
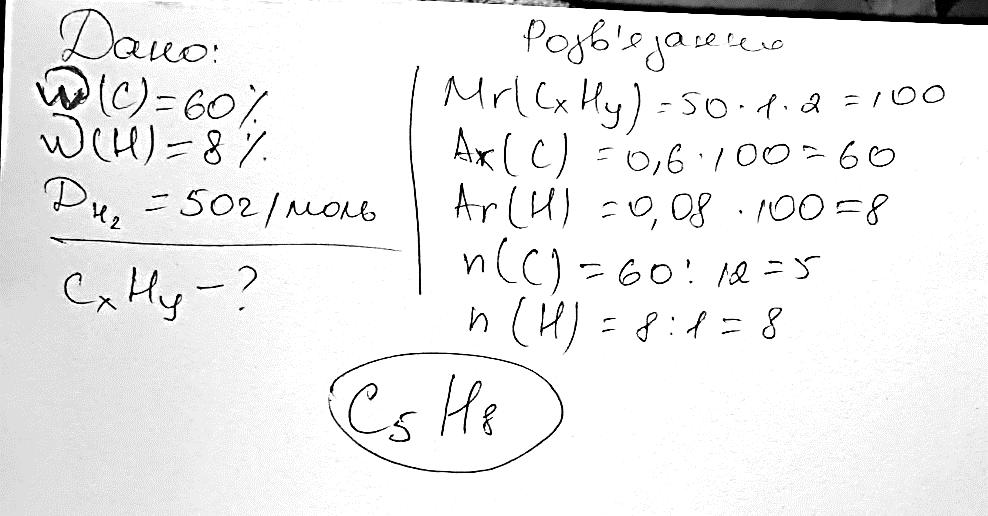
В: 2,2,2-трифторетанова кислота:
Г: 2-метил-3-хлорбутанова кислота:
306. Формули солей утворюються з формул кислот заміною атомів Гідрогену (у випадку з карбоновими кислотами атома Гідрогену карбоксильної групи).
Складіть молекулярні формули солей з Натрієм для всіх кислот із таблиці 11, дайте їм традиційні назви та за систематичною номенклатурою.
НСООNa форміат натрію
СН3СООNa ацетат натрію
С2Н5СООNa пропіорат натрію
С3Н7СООNa бутират натрію
С4Н9СООNa пентаноат натрію
С5Н11СООNa гексаноат натрію С15Н31СООNa пельмітат натрію С17Н35СООNa стеарат натрію Комплексні завдання 308.Певна органічна речовина складається з Карбону, Гідрогену та Оксигену. Масова частка Карбону в ній становить 60 %, а Гідрогену — 8 %. Відносна густина випарів цієї речовини за воднем дорівнює 50. Визначте молекулярну формулу цієї речовини.
shkola.in.ua
309. Визначте молекулярну формулу речовини з масовими частками Кар- бону 40 %, Гідрогену 6,66 %, Оксигену 53,34 %. Відносна густина її ви- парів за воднем
дорівнює 30.
M(CxHyOz)=30*2=60 г/моль
Частки елементів
З - 0,4/12 = 0,0333
H - 0.066/1 = 0.066
O - 0.5334/16 = 0,0333
Ставлення
C/H/O - 0,0333/0,066/0,0333 - 1/2/1
При молярній масі 60 г/моль та зазначеному співвідношенні елементів це може бути
тільки С2H4O2
310. Визначте молекулярну формулу насиченої одноосновної кислоти з молярною масою 130 г/моль. Для визначення молекулярної формули насиченої одноосновної кислоти з молярною масою 130 г/моль, потрібно розглянути можливі склади та співвідношення атомів водню, вуглецю та кисню в молекулі.
1. Давайте припустимо, що кислота містить x атомів вуглецю, y атомів водню і z атомів кисню. Тоді маса такої молекули буде рівною:
M = x * M(C) + y * M(H) + z * M(O),
де M(C) - маса атома вуглецю, M(H) - маса атома водню, M(O) - маса атома кисню.
2. Підставляючи числові значення мас атомів та враховуючи молярну масу кислоти 130 г/моль, отримуємо:
130 = x * 12 + y * 1 + z * 16.
3. З огляду на те, що ми шукаємо насичену одноосновну кислоту, молекулярна формула якої має вигляд CxHyOz, можна записати співвідношення між атомами:
x = 1 (атом вуглецю), y = 2 (атоми водню), z = 1 (атом кисню).
Отже, молекулярна формула насиченої одноосновної кислоти з молярною масою 130 г/моль буде CH2O.
311. Визначте молекулярну формулу одноосновної карбонової кислоти, в якій масова частка Оксигену становить 43,2 %. Для визначення молекулярної формули одноосновної карбонової кислоти, в якій масова частка кисню становить 43,2%, потрібно врахувати співвідношення атомів вуглецю, водню та кисню у молекулі.
1. Припустимо, що маса атомів вуглецю, водню та кисню в молекулі карбонової кислоти дорівнює x, y та z відповідно.
2. За умовою, масова частка кисню становить 43,2%, тобто: (z * M(O)) / (x * M(C) + y * M(H) + z * M(O)) = 0.432, де M(C) - маса атома вуглецю, M(H) - маса атома водню, M(O) - маса атома кисню.
3. Додатково маємо умову, що в одноосновній карбоновій кислоті група COOH міститься лише один раз.
shkola.in.ua
4. Оскільки масова частка кисню становить 43,2%, зрозуміло, що в карбоновій кислоті є одна група COOH (кислотна група), а інші атоми кисню будуть у формі ОН (гідроксильна група).
5. Підставляючи вищезазначені відомості, враховуючи масові відношення атомів та зв'язки, ми можемо скласти рівняння:
z * M(O) = M(C) + 2 * M(H) + z * M(O), де M(C) - маса атома вуглецю, M(H) - маса атома водню, M(O) - маса атома кисню.
6. Вирішуючи рівняння відносно z, ми отримуємо, що z = 2. 7. Отже, молекулярна формула одноосновної карбонової кислоти буде: C1H2O2, що відповідає оцтовій кислоті (CH3COOH).
Завдання з розвитку критичного мислення
312. Як ви вважаєте, чому характеристичну групу карбонових кислот називають
карбоксильною? Характеристичну групу карбонових кислот, яка містить карбонільну (C=O) та гідроксильну (OH) групи, називають карбоксильною групою. Ця назва походить від латинського слова "carbo" (вуглець) та "oxys" (кисень), що вказує на наявність атомів вуглецю та кисню у цій групі. Карбоксильна група є характерною для карбонових кислот і визначає їх хімічні та фізичні властивості.
313. Поясніть причину зміни розчинності у воді, температур плавлення й кипіння в гомологічному ряду насичених одноосновних карбонових кислот.
Гомологічний ряд насичених одноосновних карбонових кислот включає сполуки з однією і тією ж самою функціональною групою (карбоксильною) та різними вуглеводневими залишками. Прямий вплив довжини вуглеводневого залишку на фізичні властивості речовини здійснюється через зміну молекулярної маси та молекулярної структури. 1. Зміна розчинності у воді:Зі збільшенням довжини вуглеводневого залишку розчинність в воді зазвичай зменшується. Більші молекули мають більш значущу гідрофобну (нефільну до води) частину, що зменшує їх здатність взаємодіяти з водою.
2. Зміна температур плавлення та кипіння: Існує зв'язок між довжиною вуглеводневого залишку і міжмолекулярними силами. Зі збільшенням довжини цей залишок, молекули отримують більше поверхні контакту, дозволяючи виникненню більш сильних ван-дерВаальсових сил між ними. Це зазвичай призводить до збільшення температури плавлення та кипіння. Більші молекули мають більше електронних хмар, які можуть взаємодіяти, зміцнюючи міжмолекулярні взаємодії. Отже, в гомологічному ряду насичених одноосновних карбонових кислот довжина вуглеводневого залишку впливає на розчинність у воді та температури плавлення й кипіння через зміну характеру міжмолекулярних взаємодій.
§21. Насичені одноосновні карбонові кислоти: хімічні властивості та методи одержання Контрольні запитання
shkola.in.ua
314. Схарактеризуйте хімічні властивості насичених одноосновних карбонових кислот. Порівняйте їх з властивостями неорганічних кислот. Хімічні властивості насичених одноосновних карбонових кислот (карбонові кислоти) визначаються наявністю карбоксильної групи (-COOH) у їх молекулах. Основні хімічні реакції карбонових кислот включають іонізацію, естерифікацію, заміщення, окиснення та реакції конденсації. Іонізація: Карбонові кислоти можуть іонізуватися у водних розчинах, виділяючи H⁺-іон (протон) та утворюючи карбоксилатні іони. Це призводить до здатності карбонових кислот взаємодіяти з лугами. Естерифікація: Карбонові кислоти можуть утворювати естери за участі спиртів, деOH група карбоксильної групи реагує з -OH групою спирту, утворюючи воду та естер. Заміщення: Карбонові кислоти можуть піддаватися заміщенню груп, наприклад, заміщенню -OH групи налоговою групою через дію хлоридів ацилу.
Окиснення: Карбонові кислоти можуть бути окислені до відповідних карбонових кислот вищого рангу (наприклад, з молочної кислоти може утворитися оцтова кислота). Реакції конденсації: Карбонові кислоти можуть утворювати реакції конденсації з амінами або амінокислотами, утворюючи аміди або пептиди. Порівнюючи з неорганічними кислотами, карбонові кислоти мають деякі схожі реакції (наприклад, іонізацію), але також виявляють більшу різноманітність реакцій через більшу комплексність їх молекулярної структури. Неорганічні кислоти, які включають
солі кислотних і амфотерних металів, мають інші хімічні властивості, такі як дисоціація та нейтралізація, що відбувається за допомогою засобів або лугів.
315. Як змінюють забарвлення індикатори за наявності карбонових кислот? Чи пов’язана здатність кислот змінювати кольори індикатора з їхнім кислим смаком?
Забарвлення індикаторів змінюється відповідно до кислотності середовища. Карбонові кислоти, будучи слабкими органічними кислотами, можуть впливати на забарвлення індикаторів через їхню здатність діяти як кислоти. Зазвичай індикатори, такі як лакмус, фенолфталеїн і бромтимоловий синій, змінюють колір у залежності від рівня pH середовища. У кислому середовищі карбонові кислоти, які мають здатність виділяти H⁺-іони, знижують pH, і це може призвести до зміни колірного індикатора в кислому напрямку. Зокрема, індикатори можуть перейти з лужного забарвлення (синій або фіолетовий) до кислого (червоний або рожевий), якщо карбонові кислоти присутні. Важливо відзначити, що здатність карбонових кислот змінювати кольори індикаторів не пов'язана безпосередньо з їхнім кислим смаком. Зміна кольорів індикаторів відбувається через іонізацію кислот у водних розчинах, що впливає на концентрацію H⁺-іонів та pH. Смак кислоти пов'язаний з дією H⁺-іонів на рецептори смаку в ротовій порожнині, і він може бути відчутний, незалежно від того, чи існують зміни в колірному індикаторі. Отже, хоча карбонові кислоти можуть впливати на зміну забарвлення індикаторів через їхню кислотну природу, це не має прямого впливу на їхній кислий смак. 316. Схарактеризуйте методи одержання етанової кислоти. Які з них застосовують у промисловості, а які — у лабораторії? Етанова кислота, також відома як оцтова кислота, має важливе застосування як хімічна речовина та в побуті. Існують кілька методів одержання етанової кислоти, які застосовуються як у промисловості, так і в лабораторних умовах:
1. Окиснення етанолу: Цей метод є одним з найпоширеніших. Етанол окислюється киснем або кисневмісним повітрям в присутності каталізаторів, таких як паладій на вуглеці або родій. Цей метод використовується як в лабораторних умовах, так і в промисловості.
2. Карбонільна хлорування: Етанова кислота може бути отримана шляхом хлорування етаналу у присутності хлороводню та каталізаторів, наприклад, фосфору(V) хлориду. Цей метод частіше використовується у лабораторних умовах.
shkola.in.ua
3. Карбонільна гідроліз: Важливий метод, за якого відбувається гідроліз етанового ангідриду у присутності води, формуючи етанову кислоту. Цей метод використовується як в лабораторних умовах, так і у промисловості.
4. Метанолокиснення: Метанол може бути окиснений киснем або кисневмісним повітрям у присутності каталізаторів для отримання етанової кислоти. Цей метод частіше застосовується в промисловості.
У промисловості найпоширеніші
методи включають окиснення етанолу та метанолокиснення. У лабораторних умовах можуть використовуватися різні методи залежно від конкретної мети.
Завдання для засвоєння матеріалу
317. Як відрізнити розчин етанової кислоти від: а) розчину етанолу; б) хлоридної
кислоти?
а) Від розчину етанолу: Розчин етанової кислоти має характерний кислий смак і кислотну реакцію в
присутності індикаторів, таких як лакмус або фенолфталеїн. Реакція з натрій
гідроксидом (NaOH) дає натрієву сіль кислоти (цілому або частковому), і виникає характерний запах оцтової кислоти.
Етанол (спирт) має характерний запах спирту і може виділятися за допомогою непрямих ознак, таких як запалюваність. Реакція з натрій гідроксидом може бути проведена для виділення спирту або розрізнення, але реакція буде відрізнятися від реакції з етановою кислотою. б) Від хлоридної кислоти: Розчин хлоридної кислоти (HCl) також має кислий смак та кислотну реакцію з індикаторами, але його реакція з натрій гідроксидом відрізняється. Реакція між хлоридною кислотою та натрій гідроксидом дає хлорид натрію (NaCl) та воду (H2O), не утворюючи солі карбонової кислоти.
Загалом, для визначення типу розчину (етанової кислоти, етанолу або хлоридної кислоти) важливо звертати увагу на характерний смак, реакцію з індикаторами та можливість утворення солей відповідних кислот з лужними розчинами.
318. Складіть рівняння реакцій для здійснення перетворень за схемами: а) етанол → етаналь → етанова кислота → натрій етаноат:
1. Етанол → Етаналь: CH3CH2OH → CH3CHO + H2 (окиснення)
2. Етаналь → Етанова кислота: CH3CHO + [O] → CH3COOH (окиснення)
3. Етанова кислота → Натрій етаноат: CH3COOH + NaOH → CH3COONa + H2O (нейтралізація)
б) пропанол → пропаналь → пропанова кислота:
1. Пропанол → Пропаналь: CH3CH2CH2OH → CH3CH2CHO + H2 (окиснення)
2. Пропаналь → Пропанова кислота: CH3CH2CHO + [O] → CH3CH2COOH (окиснення)
в) етан → етен → етанол → етаналь → етанова кислота:
1. Етан → Етен: CH3CH3 → CH2=CH2 (дегідрогенізація)
2. Етен → Етанол: CH2=CH2 + H2O → CH3CH2OH (гідратація)
3. Етанол → Етаналь: CH3CH2OH → CH3CHO + H2 (окиснення)
4. Етаналь → Етанова кислота: CH3CHO + [O] → CH3COOH (окиснення)
г) етен → етин → етаналь → етанол:
1. Етен → Етин: CH2=CH2 → HC≡CH (дегідрогенізація)
shkola.in.ua
2. Етин → Етаналь: HC≡CH + H2O → CH3CHO (гідратація)
3. Етаналь → Етанол: CH3CHO + H2 → CH3CH2OH (зворотнє окиснення)
д) етан → етен → етанол → етанова кислота → калій етаноат:
1. Етан → Етен: CH3CH3 → CH2=CH2 (дегідрогенізація)
2. Етен → Етанол: CH2=CH2 + H2O → CH3CH2OH (гідратація)
3. Етанол → Етанова кислота: CH3CH2OH → CH3COOH + H2 (окиснення)
4. Етанова кислота → Калій етаноат: CH3COOH + KOH → CH3COOK + H2O (нейтралізація)
е) CH4 → C2H2 → CH3CHO → CH3COOH → CH3COONa:
1. Метан → Етин: CH4 → C2H2 + 2H2 (дегідрогенізація)
2. Етин → Етаналь: C2H2 + H2O → CH3CHO (гідратація)
3. Етаналь → Етанова кислота:
CH3CHO + [O] → CH3COOH (окиснення)
4. Етанова кислота → Натрій етаноат:
CH3COOH + NaOH → CH3COONa + H2O (нейтралізація)
є) C2H6 → C2H4 → C2H5OH → CH3CHO → CH3COOH:
Етан → Етен:
C2H6 → C2H4 + H2 (дегідрогенізація)
Етен → Етанол:
C2H4 + H2O → C2H5OH (гідратація)
Етанол → Етаналь: C2H5OH → CH3CHO + H2 (окиснення)
Етаналь → Етанова кислота:
CH3CHO + [O] → CH3COOH (окиснення)
ж) алкан → алкен → алкін → альдегід → карбонова кислота → сіль:
Алкан → Алкен:
CH3CH3 → CH2=CH2 + H2 (дегідрогенізація)
Алкен → Алкін:
CH2=CH2 → HC≡CH (дегідрогенізація)
Алкін → Альдегід:
HC≡CH + H2O → CH2=CHOH (гідратація)
Альдегід → Карбонова кислота:
CH2=CHOH + [O] → CH2=C(=O)OH (окиснення)
Карбонова кислота → Сіль:
shkola.in.ua
CH2=C(=O)OH + NaOH → CH2=C(=O)ONa + H2O (нейтралізація)
Комплексні завдання 319. Обчисліть масу солі, що утворюється під час взаємодії етанової кислоти масою 15 г з надлишком вапняку. Реакція карбонату кальцію з оцтовою кислотою описується наступним рівнянням
хімічної реакції: СаСО3 + 2СН3СООН = Са(СН3СОО)2 + СО2 + H2O;
Реакція двох молей кислоти призводить до утворення одного молячи солі. Знайдемо кількість кислоти. Її молярна маса дорівнює: М СН3СООН = 12 х 2 + 16 х 2 + 4 = 60 г/моль; Кількість речовини становитиме: N СН3СООН = 15/60 = 0,25 моль; Розрахуємо масу 0,25/2 = 0,125 моль Са(СН3СОО)2. Його молярна маса дорівнює: М Са(СН3СОО)2. = 40 + (12 х 2 + 16 х 2 + 3) х 2 = 158 г/моль; Маса солі складе: m Са(СН3СОО)2. = 0,125 х 158 = 19,75 г;
320. Яку масу кислоти можна добути окисненням пропан-1-олу масою 7,5 г?
321. Обчисліть об’єми бутану та кисню (н. у.), що необхідні для одержання
етанової кислоти масою 30 кг.
2C4H10 + 5O2 → 4C2H4O2 + 2H2O
n(C2H4O2)= 30 кг : 60 кг/кмоль = 0,5 кмоль;
n(C4H10)= 0,25 кмоль; V(C4H10) = 0,25 кмоль*22,4 = 5,6 куб.м
shkola.in.ua
n(O2)= 0,625 кмоль; V(O2) = 0,625 кмоль*22,4 = 14 куб.м 322. Під час спалювання зразка одноосновної насиченої карбонової кислоти масою 6,225 мг виділилися вуглекислий газ масою 12,44 мг та вода масою 5,091 мг. Визначте емпіричну та молекулярну формули кислоти. Обчисліть масу розчину калій гідроксиду з масовою часткою 1,2544 %, що необхідна для нейтралізації цієї кислоти масою 0,822 г. 323. Обчисліть масу солі, що можна добути з етанової кислоти та розчину калій гідроксиду масою 80 г з масовою часткою лугу 14 %.
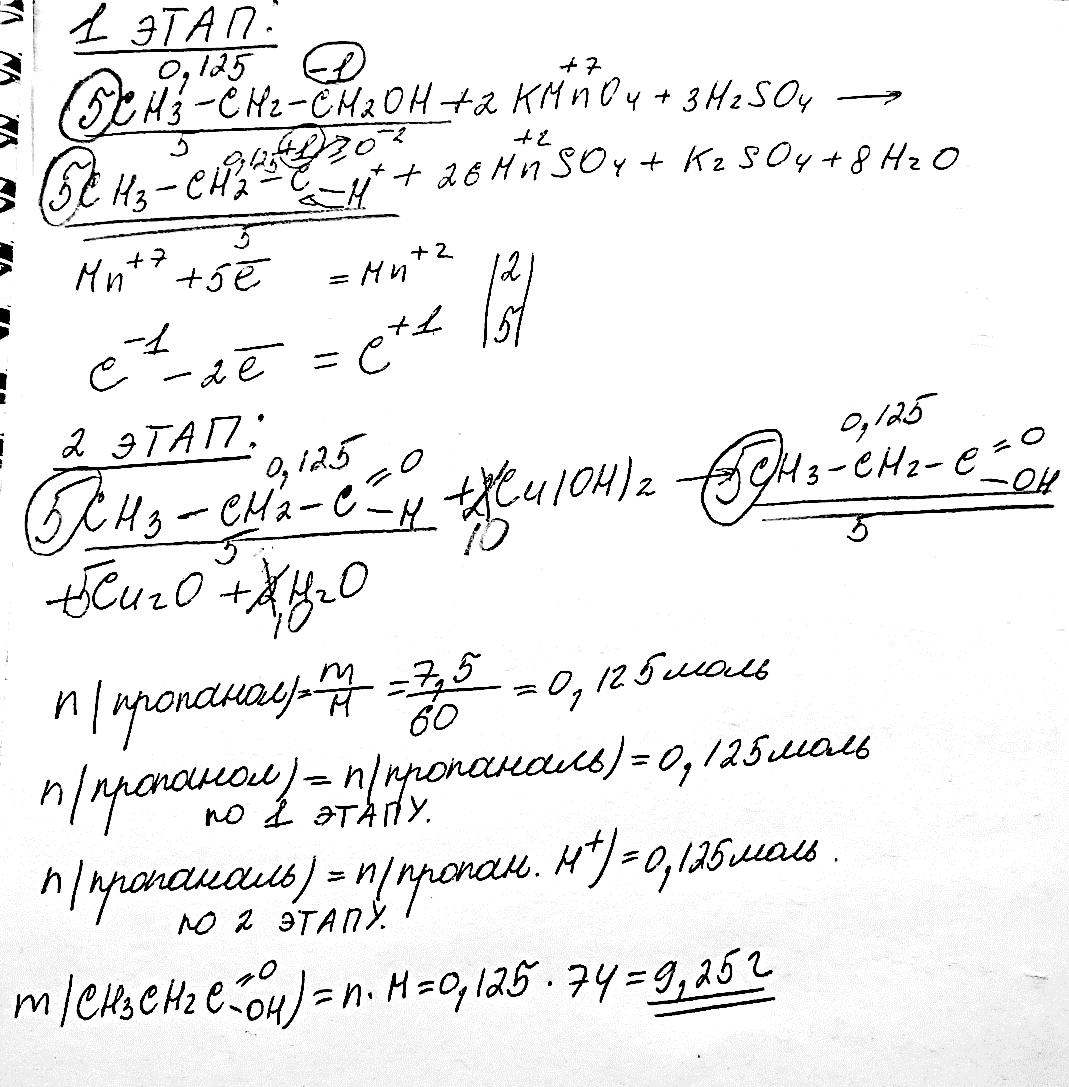
Збалансоване хімічне рівняння реакції між етановою кислотою та гідроксидом калію виглядає так: CH3COOH + KOH → KCH3COO + H2O
З рівняння ми бачимо, що один моль етанової кислоти реагує з одним молем гідроксиду
калію, утворюючи один моль етаноату калію та один моль води.
Щоб обчислити масу утвореної солі, нам потрібно знати кількість молей гідроксиду калію в розчині. Ми можемо обчислити це, використовуючи масу та масову частку лугу
наступним чином:
Маса калій гідроксиду = 80 г × 0,14 = 11,2 г
Молярна маса KOH становить 56,1 г/моль, тому кількість присутніх молей KOH
становить:
Кількість молей KOH = 11,2 г / 56,1 г/моль = 0,199 моль Оскільки стехіометричне співвідношення KOH до KCH3COO становить 1:1, кількість утворених молей KCH3COO також становить 0,199 молей. Молярна маса KCH3COO становить 98,14 г/моль, тому маса утвореного KCH3COO становить:
Маса KCH3COO = 0,199 моля × 98,14 г/моль = 19,5 г Отже, маса солі (калій етаноат), яку можна одержати при взаємодії етанової кислоти з даним розчином калій гідроксиду, дорівнює 19,5 г. 324.Обчисліть масу розчину етанової кислоти з масовою часткою 15 %, необхідного для взаємодії з магнієм масою 55,2 г.
2 CH3COOH + Mg → Mg(CH3COO)2 + H2 Знайдемо кількість речовини магнію:
n(Mg) = m(Mg)/ M(Mg) = 55,2/24 = 2,3 моль
З РХР бачимо , що
n(CH3COOH) = 2n(Mg) = 2 * 2,3 = 4,6 моль Знайдемо масу етанової кислоти
М(CH3COOH) = 12 * 2 + 1 * 4 + 16 * 2 = 60 г/моль m(CH3COOH) = n(CH3COOH) * М(CH3COOH) = 4,6 * 60 = 276 г Обчислимо масу розчину етанової кислоти:
m(р-нуCH3COOH) = m(CH3COOH)/w(CH3COOH) * 100% = 1840 г
325. Обчисліть масу солі, що утворюється під час взаємодії етанової кислоти масою 42 г з розчином натрій гідроксиду.
CH₃COOH + NaOH ⟹ CH₃COONa + H₂O
n(CH₃COONa) = n(CH₃COOH) = 42 г / 60 г/моль = 0,7 моль
m(CH₃COONa) = 0,7 моль · 82 г/моль = 57,4 г.
326. Визначте молекулярну формулу насиченої одноосновної кислоти, якщо відомо, що на нейтралізацію цієї кислоти масою 12 г витрачено натрій гідроксид масою 8 г.
shkola.in.ua
Молекулярну формулу насиченої одноосновної кислоти можна визначити, якщо відома кількість основи, необхідна для її нейтралізації. Для цього необхідно використовувати збалансоване хімічне рівняння реакції нейтралізації.
Реакцію між одноосновною кислотою та сильною основою, такою як гідроксид натрію (NaOH), можна представити так:
HX + NaOH → NaX + H2O
де HX являє собою кислоту, а NaX являє собою її сіль.
З наведеної інформації ми знаємо, що для нейтралізації кислоти, яка мала масу 12 г, було використано 8 г NaOH. Отже, 12 г - 8 г = 4 г кислоти залишилося непрореагувавшим.
Молі NaOH можна розрахувати наступним чином: 8 г NaOH / (40 г/моль) = 0,2 моль NaOH
Оскільки збалансоване хімічне рівняння стверджує, що 1 моль NaOH реагує з 1 молем HX, ми можемо зробити висновок, що в реакції було присутнє 0,2 моль HX.
Молекулярну масу кислоти можна розрахувати наступним чином:
4 г HX / (0,2 моль HX) = 20 г/моль
Молекулярна формула одноосновної кислоти з молекулярною масою 20 г/моль — H2O. Отже, молекулярна формула насиченої одноосновної кислоти — H2O.
Завдання з розвитку критичного мислення
327. Запропонуйте схему добування етанової кислоти з глюкози. Складіть
відповідні рівняння реакцій. Добування етанової кислоти (оцтової кислоти) з глюкози може відбуватися
допомогою мікроорганізмів, таких як ацетобактер ацети та родін Bifidobacterium. Оцтова кислота утворюється шляхом ферментації глюкози.
Основні етапи схеми добування етанової кислоти з глюкози:
1. Глюкоза окислюється до пірувату у процесі гліколізу.
C6H12O6 → 2 CH3COCOOH + 2 CO2 + 4 H2O
2. Піруват згодом перетворюється на оцтову кислоту та діоксид вуглецю у присутності мікроорганізмів, зокрема ацетобактер ацети.
CH3COCOOH + 2 H2O → CH3COOH + HCO3- + H3O+ Загалом, процес ферментації глюкози може бути представлений так:
C6H12O6 → 2 CH3COOH + 2 CO2 + 2 H2O Цей метод добування оцтової кислоти застосовується у харчовій та хімічній промисловості.
shkola.in.ua
328. Проаналізуйте, за яких умов можливе окиснення альдегідів за параграфом 19, та порівняйте з методами одержання етанової кислоти, наведеними у цьому параграфі. У чому полягають відмінності? Як ви вважаєте, чому не всі реакції, під час яких утворюється етанова кислота, можна застосовувати для її добування? У чому полягають відмінності між лабораторними та промисловими методами добування різних сполук? Окиснення альдегідів можливе за умов наявності окисню (наприклад, кисню з повітря або кисневого газу) та каталізаторів, таких як каталітичні метали (наприклад, родій, паладій) або оксиди металів. У результаті окиснення альдегіди перетворюються на відповідні карбонові кислоти. Наприклад, етаналь може бути окиснений до етанової кислоти за наявності кисню та каталізатора: CH3CHO + 1/2 O2 → CH3COOH Методи окиснення альдегідів відрізняються від методів одержання етанової кислоти тим, що вони базуються на використанні окисню з повітря чи кисневого газу, який взаємодіє з альдегідами за наявності каталізатора, тоді як методи одержання етанової кислоти можуть включати ферментаційні процеси або взаємодію альдегідів з іншими сполуками.
Не всі реакції, під час яких утворюється етанова кислота, можна застосовувати для її добування через ефективність процесів та економічні фактори. Деякі реакції можуть бути повільними, дорогими або вимагати умов, які не є практично здійсними на промисловій шкалі.
за
Відмінності між лабораторними та промисловими методами добування різних сполук можуть полягати у масштабі, ефективності, вартості реакцій та умовах, в яких вони проводяться. Промислові методи зазвичай оптимізовані для забезпечення високої виходу продукту за економічно вигідних умов. 329. Попередній аналіз певного зразка довів, що в розчині наявні етанол і натрій етаноат. Як за допомогою тільки сульфатної кислоти довести наявність цих речовин за запахом продуктів реакції? Складіть відпо- відні рівняння реакцій. Для доведення наявності етанолу і натрій етаноату за запахом можна використовувати реакцію естерифікації, яка відбувається за участю сульфатної кислоти. В результаті цієї реакції утворюється запаховий сполук — ефіри. Для доведення наявності етанолу та натрій етаноату можна виконати такі реакції:
1. Етанол + Сульфатна кислота → Етановий ефір + Вода
CH3CH2OH + H2SO4 → CH3CH2OCH2CH3 + H2O
У результаті реакції утворюється запаховий етановий ефір.
2. Натрій етаноат + Сульфатна кислота → Етановий ефір + Натрій сульфат
CH3CH2COONa + H2SO4 → CH3CH2OCH2CH3 + NaHSO4
Ця реакція також утворює запаховий етановий ефір. 330. У двох пробірках містяться сухі зразки натрій стеарату і натрій етаноату. Відрізнити вміст двох пробірок можна двома способами: а) додати в пробірку воду; б) додати розчин амоній карбонату. На яких принципах ґрунтуються ці способи? Складіть відповідні рівняння реакцій. а) Додавання води. Натрій стеарат і натрій етаноат мають різну поведінку в реакції з водою.
Натрій стеарат (C17H35COONa) є соллю довшого карбонового кислоти, тому взаємодія його з водою викликає гідроліз карбоксильної групи: C17H35COONa + H2O → C17H35COOH + NaOH Натрій етаноат (CH3COONa) має коротший карбоновий ланцюг і менше піддається гідролізу.
б) Додавання розчину амоній карбонату. Цей спосіб базується на відмінностях у поведінці карбонатних і стеаратних іонів в реакції з амоній карбонатом.
Розчин амоній карбонату (NH4)2CO3 реагує з карбонатними іонами (CO3^2-) натрію стеарату, утворюючи більш складний натрієвий карбонат: (NH4)2CO3 + 2C17H35COONa → (NH4)2C17H35COO + 2NaHCO3 Амоній карбонат не реагує з націєвим етаноатом. Таким чином, зважаючи на реакції, при додаванні води натрій стеарат розпадеться на карбонову кислоту та лужну сіль, а натрій етаноат залишиться незмінним. При додаванні розчину амоній карбонату натрій стеарат утворить менш розчинний натрієвий карбонат, а натрій етаноат залишиться незмінним.
§22. Естери Контрольні запитання
shkola.in.ua
332. Які речовини відносять до естерів? Естери - це органічні сполуки, які утворюються в результаті реакції між карбоновою кислотою та алкоголем (спиртом). Естери мають загальну структурну формулу RCOOR', де R представляє собою залишок карбонової кислоти, а R' - залишок алкоголю (спирту).
333. Схарактеризуйте особливості складання назв естерів за систематичною номенклатурою.
Систематична номенклатура для найменування естерів базується на назвах вуглеводневих груп, які складаються з залишків карбонових кислот та алкоголів, з яких утворюється естер. Основні кроки при складанні назви естера за систематичною номенклатурою:
1. Визначення залишку карбонової кислоти: Це робиться шляхом взяття назви відповідної карбонової кислоти і заміни суфіксу "-ова кислота" на "-оат".
2. Визначення залишку алкоголю: Тут назва алкоголю перетворюється на суфікс "-ілат", із зазначенням числа, яке вказує на скільки атомів водню в алкогольному залишку
відповідає одному атомові водню в карбоновій кислоті.
3. Порядок написання: Спершу йде назва залишку карбонової кислоти, потім вказується залишок алкоголю.
Наприклад, якщо ми маємо естер, що утворився від метанової кислоти та етанолу, то його систематична назва буде метаноат етилу.
334. Схарактеризуйте фізичні властивості естерів. Порівняйте їх з фізичними властивостями карбонових кислот та опишіть вплив водневого зв’язку. Фізичні властивості естерів можуть бути описані так: Запах і смак: Багато естерів мають приємний аромат і смак, що робить їх використовуваними в харчовій та парфумерійній промисловості. Температура кипіння та плавлення: Температури кипіння та плавлення естерів зазвичай нижчі порівняно з відповідними карбоновими кислотами та алкоголями. Це пояснюється меншими молекулярними масами та меншими взаємодіями між молекулами у порівнянні з кислотами. Розчинність: Більшість естерів незапаюється у воді через відсутність іонних груп і здатність до водневого зв'язку з водою незначна. Проте, естери з великими атомами можуть мати деяку розчинність через дипольні взаємодії. Вплив водневого зв'язку: Водневий зв'язок — це слабка хімічна взаємодія між молекулою з електронними парочками (донор) та молекулою з вільними або частково позитивними водневими атомами (акцептор). Карбонові кислоти мають вільний водневий атом в гідроксильній групі, що дозволяє їм утворювати водневі зв'язки з іншими молекулами. Це робить карбонові кислоти більш розчинними у воді порівняно з естерами, які зазвичай не мають вільного водневого атома та не можуть утворювати такі сильні водневі зв'язки. 335. Схарактеризуйте хімічні властивості естерів. Наведіть відповідні рівняння хімічних реакцій.
Хімічні властивості естерів включають такі аспекти: Гідроліз: Естери під дією лужних розчинів або кислих каталізаторів гідролізуються на відповідну карбонову кислоту і спирт:
Лужний гідроліз:
RCOOR' + NaOH → RCOONa + R'OH
Кислий гідроліз:
shkola.in.ua
RCOOR' + H2O + H+ → RCOOH + R'OH Естроліз (зворотний гідроліз): При підвищених температурах та в присутності кислот
або лужних каталізаторів може відбуватися естроліз, коли естер розкладається на кислу та алкогольну компоненту:
Естроліз з кислотою:
RCOOR' + H2O + H+ → RCOOH + R'OH
Естроліз з лужною каталізатором:
RCOOR' + H2O → RCOOH + R'OH
Взаємодія з гідроксидами: Естери можуть взаємодіяти з гідроксидами за утворення солей та алкоголю:
RCOOR' + NaOH → RCOONa + R'OH
Окиснення: Деякі естери можуть бути окислені до карбонових кислот або кетонів:
RCOOR' + [O] → RCOOH + R'OH
Де [O] позначає окисник, який може бути
киснем або іншим окиснювачем.
Естерифікація: Естери можуть бути утворені відновленням карбонової кислоти зі
спиртом за наявності кислого каталізатора:
RCOOH + R'OH + кислий каталізатор →
RCOOR' + H2O
336. Яка реакція гідролізу естерів є оборотною, а яка — необоротною? Чому?
Гідроліз естерів може бути оборотним та необоротнім, залежно від умов реакції та типу каталізатора.
Оборотний гідроліз: Під впливом лужних розчинів (наприклад, гідроксиду натрію або калію) або кислотних каталізаторів (наприклад, сульфатної кислоти) естери гідролізуються на відповідну карбонову кислоту і спирт. Ця реакція є оборотною, оскільки обидва продукти, карбонова кислота і спирт, можуть знову реагувати та утворювати естер.
Необоротній гідроліз: Під впливом концентрованих кислот (наприклад, сульфатної або хлоридної кислоти) або лужних каталізаторів (наприклад, лужних металів) естери можуть гідролізуватися до карбонової кислоти і спирту, але ця реакція зазвичай є неповоротною через те, що вода або кислота витісняє спирт з продукту, ускладнюючи повторну естерифікацію. 337. Схарактеризуйте поширеність естерів у природі та їх застосування. Естери є важливою класом органічних сполук, які мають широке поширення у природі і знаходять застосування в різних галузях.
Поширеність у природі:
• Ефіри алькоголів та карбонових кислот є ключовими сполуками у жирах та оліях рослин та тварин, які є важливим джерелом енергії та будівельних матеріалів.
• Ароматичні естери відомі своїм приємним ароматом і використовуються в парфумерії та харчовій промисловості.
• Естери жирних кислот та гліцерину входять до складу ліпідів, таких як тригліцериди, які зберігаються у живих організмах як запасна форма енергії.
• Естери сечовини є ключовими компонентами мочи тварин та людей. Застосування:
• Харчова промисловість: Деякі естери мають приємний аромат і смак, тому використовуються як ароматизатори та добавки у харчових продуктах.
• Парфумерія та косметика: Ароматичні естери широко використовуються в парфумерії та косметиці для створення різних ароматів та ароматичних олій.
• Фармацевтична промисловість: Деякі естери застосовуються як активні компоненти у фармацевтичних препаратах.
• Спирти та лаки: Деякі естери використовуються у виробництві спиртів та лаків.
shkola.in.ua
• Синтетичні матеріали: Деякі естери використовуються у виробництві синтетичних полімерів та пластмас. У загальному, естери мають велике значення як важлива клас сполук у природі та технології, які знаходять застосування в різних аспектах нашого повсякденного життя. Завдання для засвоєння матеріалу
338.Складіть формули таких естерів: а) метилетаноат; б) пропілпропано- ат; в) етилпропаноат; г) етилетаноат; д) метилпропаноат; е) метилме- таноат; є)
етилметаноат.
а) Метилетаноат: CH3COOCH3
б) Пропілпропаноат: CH3CH2COOCH2CH2CH3
в) Етилпропаноат: CH3COOCH2CH3
г) Етилетаноат: CH3COOCH2CH3
д) Метилпропаноат: CH3COOCH2CH(CH3)2
е) Метилметаноат: CH3COOCH3
є) Етилметаноат: CH3COOCH2CH3
339.Складіть структурні формули естерів
традиційними назвами: а)
метилацетат; б) етилформіат; в) пропілпропіонат; г) метилбутират; д)
етилвалерат.
а) Метилацетат: CH3COOCH3
б) Етилформіат: CH3CHOOC2H5
в) Пропілпропіонат: CH3CH2COOCH2CH2CH3
г) Метилбутират: CH3COOCH2CH2CH(CH3)2
д) Етилвалерат: CH3COOCH2CH2CH2CH2CH3
340. Складіть систематичні та традиційні
естерів: а) CH3COOC2H5; б) C2H5COOC2H5; в) C2H5COOCH3; г) CH3COOCH3; д) HCOOCH3; е) HCOOC2H5; є) C2H5COOC3H7.
Ось систематичні та традиційні назви для вказаних
а) CH3COOC2H5:
Систематична назва: Етилетаноат
Традиційна назва: Етиловий ацетат
б) C2H5COOC2H5:
Систематична назва: Етилпропаноат Традиційна назва: Етиловий пропіонат
в) C2H5COOCH3: Систематична назва: Метилпропаноат Традиційна назва: Метиловий пропіонат
г) CH3COOCH3:
Систематична назва: Метаноат Традиційна назва: Метиловий метаноат або Метиловий форміат
д) HCOOCH3:
Систематична назва: Метаноат
Традиційна назва: Метиловий метаноат або Метиловий форміат е) HCOOC2H5:
shkola.in.ua
Систематична назва: Етаноат Традиційна назва: Етиловий етаноат або Етиловий ацетат є) C2H5COOC3H7:
Систематична назва: Пропаноат Традиційна назва: Пропіловий пропаноат або Пропіловий пропіонат 341. Складіть назви естерів, структурні формули яких наведено на мал. 22.1. Ізоамілацетат, етилбутират, амілацетат, ізобутилформіат, метилбутират, фінілатиланін. 342.Складіть скорочені структурні формули та назви естерів за моделями молекул:
за їх
назви
естерів:
343.Естер, утворений етановою кислотою та бензиловим спиртом C6H5–CH2–OH, використовують для виробництва дешевих дезодорантів. Складіть рівняння реакції утворення цього естеру. Реакція утворення естеру зазвичай називається естерифікацією. У вашому випадку, етанова кислота (CH3COOH) реагує з бензиловим спиртом (C6H5CH2OH), утворюючи естер – бензиловий етаноат. Ось рівняння реакції: CH3COOH + C6H5CH2OH → CH3COOC6H5CH2 + H2O Ця реакція відбувається за участі концентрованих кислот або каталізаторів, таких як сіль мінеральних кислот або сульфати. 344.Складіть структурну формулу естеру, утвореного метиловим спиртом і метановою кислотою. Яка речовина іншого класу сполук має таку саму молекулярну формулу?
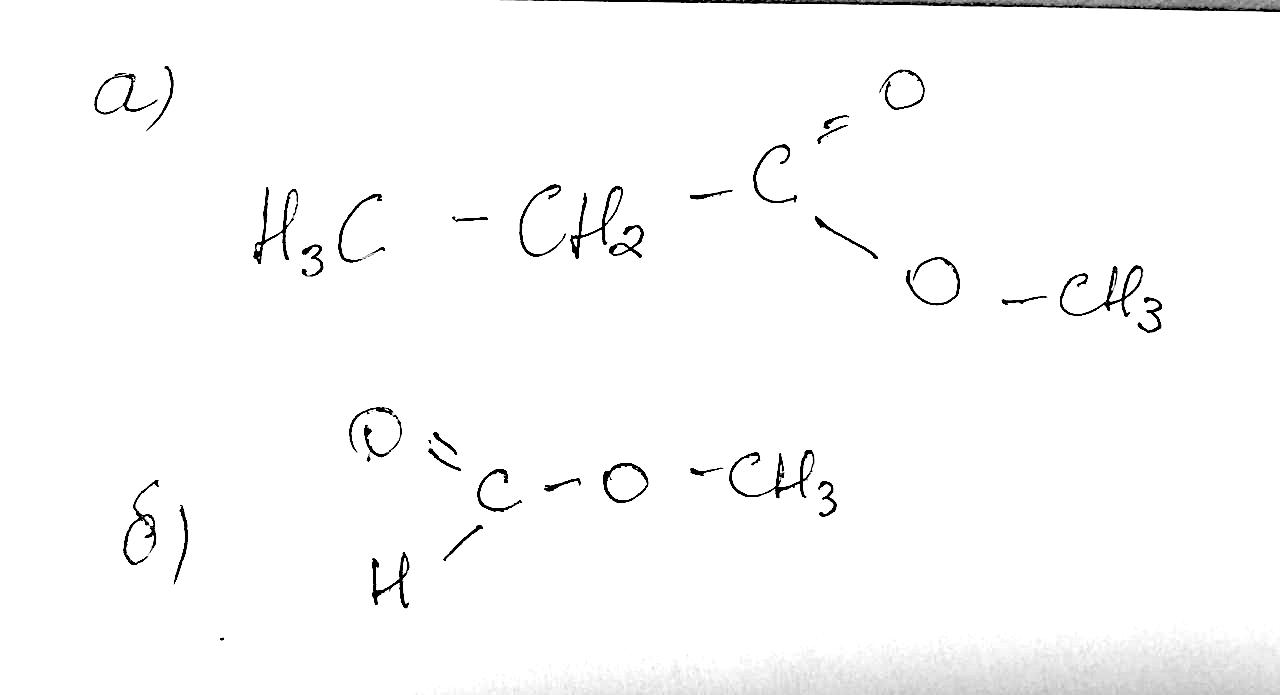
Структурна формула естеру, утвореного метиловим спиртом (CH3OH) і метановою кислотою (HCOOH), буде виглядати наступним чином: CH3OH + HCOOH → HCOOCH3 + H2O Цей естер називається метиловим метаноатом. Речовина іншого класу сполук, яка має таку саму молекулярну формулу CH3COOH, це ацетооцтова кислота. 345.Складіть формули всіх можливих естерів, що можна добути, маючи в наявності метанол, етанол, пропанол, метанову, етанову та пропанову кислоти. Метил метаноат (метанова кислота + метанол): CH3COOCH3
Метил етаноат (етанова кислота + метанол): CH3CH2COOCH3
Етил метаноат (метанова кислота + етанол): CH3COOCH2CH3
Етил етаноат (етанова кислота + етанол): CH3CH2COOCH2CH3
Етил пропаноат (пропанова кислота + етанол): CH3CH2CH2COOCH2CH3
Метил пропаноат (пропанова кислота + метанол): CH3CH2CH2COOCH3
Пропил метаноат (метанова кислота + пропанол): CH3COOCH2CH2CH3
shkola.in.ua
Пропил етаноат (етанова кислота + пропанол): CH3CH2COOCH2CH2CH3 Пропил пропаноат (пропанова кислота + пропанол): CH3CH2CH2COOCH2CH2CH3 346. Складіть рівняння реакції лужного гідролізу: а) метилетаноату; б) етилметаноату. А) Реакція лужного гідролізу метилетаноату (метилового естеру етанової кислоти): CH3COOCH3 + NaOH → CH3COONa + CH3OH Б) Реакція лужного гідролізу етилметаноату (етилового естеру метанової кислоти): C2H5COOCH3 + NaOH → C2H5COONa + C2H5OH
347. Складіть два рівняння реакцій, під час яких утворюються два різні ес- тери, але з однаковою молекулярною формулою.
Рівняння реакцій: Етиловий естер етанової кислоти (етановий етилат): CH3COOCH2CH3 + H2O → CH3COOH + CH3CH2OH
Метиловий естер пропанової кислоти (пропановий метаноат):
C2H5COOCH3 + H2O → C2H5COOH + CH3OH
348. Складіть рівняння реакцій для здійснення перетворень за схемами: а) C2H4 → C2H5OH → CH3COOH → CH3COOCH3 → CH3COONa:
1. Етен (етилен) утворює етанол: C2H4 + H2O → C2H5OH
2. Етанол окислюється до етанової кислоти: CH3CH2OH + 2[O] → CH3COOH + H2O
3. Етанова кислота утворює метиловий естер: CH3COOH + CH3OH → CH3COOCH3 + H2O
4. Метиловий естер пропанової кислоти нейтралізується натрієм: CH3COOCH3 + NaOH → CH3COONa + CH3OH
б) C3H6 → C3H7OH → C2H5COOH → C2H5COOC2H5 → C2H5COOK:
1. Пропен перетворюється в пропан-1-ол: C3H6 + H2O → C3H7OH
2. Пропан-1-ол окислюється до пропанової кислоти:
C3H7OH + 2[O] → C2H5COOH + H2O
3. Пропанова кислота утворює етиловий естер: C2H5COOH + C2H5OH → C2H5COOC2H5 + H2O
4. Етиловий естер пропанової кислоти нейтралізується калієм: C2H5COOC2H5 + KOH → C2H5COOK + C2H5OH
в) Етин → Етаналь → Етанова кислота → Пропілетаноат:
1. Етин окислюється до етаналь:
C2H2 + H2O → CH3CHO
2. Етаналь окислюється до етанової кислоти: CH3CHO + [O] → CH3COOH
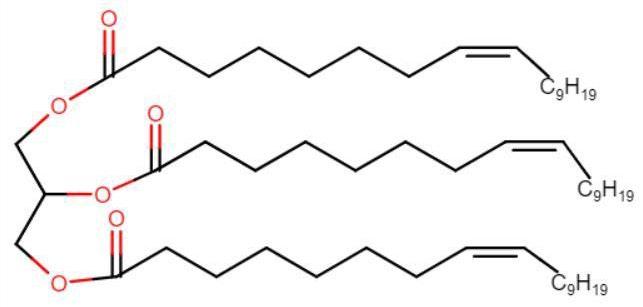
3. Етанова кислота утворює пропілетаноат:
CH3COOH + CH3CH2COOH → CH3CH2COOCH2CH3 + H2O
г) Етан → Етен → Етанол → Етилметаноат:
1. Етан дегідратує до етену (етилену):
C2H6 → C2H4 + H2O
2. Етен окислюється до етаналь:
C2H4 + O2 → CH3CHO
3. Етаналь зводиться до етанолу:
CH3CHO + 2[H] → CH3CH2OH
4. Етанол утворює етиловий естер метанової кислоти (етилметаноат):
CH3CH2OH + CH3COOH → CH3COOCH2CH3 + H2O
д) Бутан → Етанова кислота → Етилетаноат → Натрій етаноат:
shkola.in.ua
1. Бутан окислюється до етанової кислоти: C4H10 + 6[O] → 2CH3COOH + 2H2O
2. Етанова кислота утворює етиловий естер: CH3COOH + C2H5OH → CH3COOC2H5 + H2O
3. Етиловий естер нейтралізується натрієм: CH3COOC2H5 + NaOH → CH3COONa + C2H5OH Комплексні завдання
349. Обчисліть масу етилетаноату, що піддали омиленню, якщо в результаті одержали етанол масою 20,7 г.
350. Обчисліть маси кислоти та спирту, необхідних для одержання метилетаноату масою 3,33 г.
Дано:
m(CH3COOCH3)=3,33г
m(CH3OH) -?
m(CH3COOH)-?
Рівняння реакції:
CH3OH+CH3COOH →CH3COOCH3+H2O
n=m/Mr
1)n(CH3OH)=n(CH3COOH)=n(CH3COOCH3)=3,33г/(74,08 г/моль)=0,045 моль
m=n*Mr
2)m(CH3OH)=0,045*32=1,44г
3)m(CH3COOH)=0,045*60=2,7г
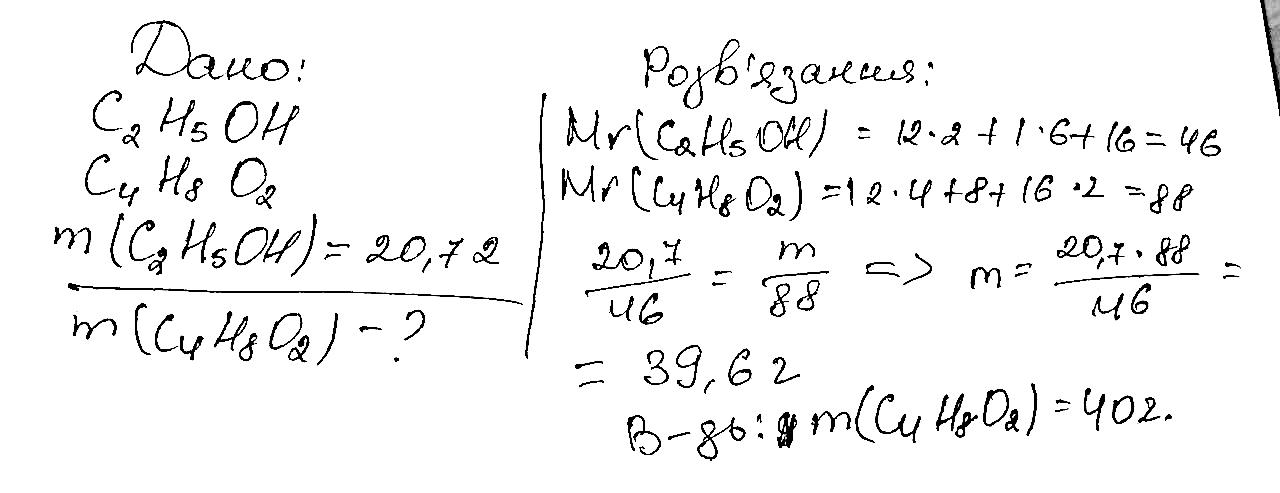
351. Обчисліть масу метилетаноату, що можна одержати в реакції естери- фікації
з етанової кислоти масою 3,6 г. Пишемо реакцію одержання метилетаноату
CH₃COOH + CH₃OH = CH₃COOCH₃ Рахуємо кількість речовини етанової кислоти
n(CH₃COOH) = m(CH₃COOH) / M(CH₃COOH) = 3.6 / 60 = 0.06 моль
Така ж кількість і естеру. Рахуємо масу естеру m(CH₃COOCH₃) = n(CH₃COOCH₃) · M(CH₃COOCH₃) = 0.06 · 74 = 4.44 г
352. Під час лужного гідролізу пропілетаноату добуто натрій етаноат масою 229,6 г. Обчисліть масу естеру, що вступив у реакцію.
shkola.in.ua
Дано: маса натрій етаноату (CH3COONa) = 229,6 г Це важливо: під час гідролізу естеру одержуємо натрій етаноат (CH3COONa), тобто його маса збігається з масою естеру. Отже, маса естеру, що вступив у реакцію, дорівнює 229,6 г. 353. Метилетаноат масою 240,5 г добули за схемою: метан → етин → ета- наль → етанова кислота → метилетаноат. Визначте об’єм витраченого метану (н. у.). Використаємо закон збереження речовини, згідно з яким сума мас продуктів рівна сумі мас реагентів. Також необхідно використати відомості про молярні співвідношення між реагентами та продуктами реакції. За формулою закону збереження маси: метилетаноат + етанова кислота + етанол = метилетаноат
Можна записати рівняння реакції: CH4 + C2H2 + 2O2 → CH3COOCH3 + H2O Молярні співвідношення:
1 моль CH4 + 1 моль C2H2 → 1 моль CH3COOCH3
Молярна маса метилетаноату CH3COOCH3 = 74 г/моль Отже, маса метилетаноату, яку можна отримати з 1 моля CH4 і 1 моля C2H2: маса CH3COOCH3 = 74 г/моль × 1 моль = 74 г Щоб отримати 240,5 г метилетаноату, необхідно витратити: кількість молей CH3COOCH3 = маса CH3COOCH3 / молярна маса CH3COOCH3 = 240,5 г / 74 г/моль ≈ 3,25 моль Закон збереження маси також означає, що кількість молей метану, витраченого на реакцію, дорівнює кількості молей метилетаноату, що було отримано: кількість молей CH4 = кількість молей CH3COOCH3 = 3,25 моль Молярний об'єм метану (н.у.) при стандартних умовах (температурі 0 градусів Цельсія та тиску 1 атмосфери) дорівнює 22,4 л/моль. Отже, об'єм метану (н.у.), який було витрачено на реакцію, дорівнює:
об'єм CH4 = кількість молей CH4 × молярний об'єм (н.у.) = 3,25 моль × 22
об'єм CH4 = 72,8 л (до першого знака після коми) Відповідь: для отримання метилетаноату масою 240,5 г було витрачено метан об'ємом 72,8 л (н.у.).
354. Обчисліть масу етилетаноату, що можна добути зі 100 г оцтової есенції, яка містить 25 % води. Дано: маса оцтової есенції = 100 г, вміст води = 25% По-перше, ми можемо знайти масу оцтової кислоти в оцтовій есенції, враховуючи, що вода має масу 18 г/моль, а оцтова кислота (CH3COOH) має масу близько 60 г/моль. Маса оцтової кислоти = маса оцтової есенції * вміст оцтової кислоти Маса оцтової кислоти = 100 г * (100% - 25%) = 75 г Тепер ми можемо використовувати масу оцтової кислоти для знаходження маси етилетаноату (CH3COOC2H5), знаючи, що молекулярна маса етилетаноату близько 88 г/моль.
shkola.in.ua
Маса етилетаноату = маса оцтової кислоти = 75 г Отже, маса етилетаноату, яку можна добути з 100 г оцтової есенції, становить 75 г. Завдання з розвитку критичного мислення 355.Порівняйте вплив водневих зв’язків на фізичні властивості естерів, карбонових кислот, альдегідів та спиртів. Водневі зв'язки є важливою фактором, що впливає на фізичні властивості органічних сполук, таких як естери, карбонові кислоти, альдегіди та спирти. Особливості їх взаємодії з водним середовищем визначають ряд характеристик, таких як температура кипіння, температура плавлення, розчинність у воді та інші. Естери: Водневі зв'язки в естерах відіграють менш значущу роль порівняно з іншими класами сполук. Це призводить до того, що естери зазвичай мають нижчі температури кипіння та плавлення порівняно з карбоновими кислотами і спиртами з аналогічними молекулярними масами. Карбонові кислоти: Водневі зв'язки між молекулами карбонових кислот зумовлюють високі температури кипіння і плавлення, а також добре виражену розчинність у воді. Водневі зв'язки важливі для утворення димерів та полімерів карбонових кислот у твердому стані.
Альдегіди: Водневі зв'язки в альдегідах також призводять до підвищеної температури кипіння та плавлення, але менш істотно, ніж у карбонових кислотах. Альдегіди також можуть утворювати димери через водневі зв'язки. Спирти: Спирти також мають водневі зв'язки, які впливають на їхні фізичні властивості. Вони мають вищі температури кипіння та плавлення порівняно з аналогічними алканами, але нижчі, ніж у відповідних карбонових кислотах. 356. Порівняйте фізичні властивості естерів, карбонових кислот, альдегідів, спиртів та вуглеводнів. Що в них є спільного, а чим вони відрізняються?
Фізичні властивості органічних сполук, таких як естери, карбонові кислоти, альдегіди, спирти і вуглеводні, визначаються їхньою молекулярною структурою, водневими зв'язками, дисперсійними силами, ароматичними взаємодіями та іншими чинниками. Спільне для цих класів сполук: Температура кипіння і плавлення: Естери, карбонові кислоти, альдегіди і спирти мають вищі температури кипіння та плавлення порівняно з вуглеводнів з аналогічною молекулярною масою, через водневі зв'язки та інші міжмолекулярні взаємодії.
Розчинність: Карбонові кислоти, альдегіди і спирти мають хорошу розчинність у воді завдяки водневим зв'язкам. Естери, зазвичай, менше розчинні у воді через відсутність водневих зв'язків. Легкозаймистість: Естери, альдегіди, спирти і вуглеводні можуть бути легко
запальними.
Відмінності: Функціональні групи: Кожен клас має свою функціональну групу. Естери містять групу -COO-, карбонові кислоти -COOH, альдегіди -CHO, спирти -OH, а вуглеводніCH.
Запах: Вони мають різний запах. Наприклад, естери можуть мати приємний аромат, альдегіди часто мають характерний запах, карбонові кислоти можуть бути запахливими, а спирти можуть мати характерний запах. Хімічні властивості: Кожен клас має власні хімічні властивості, зокрема відмінності у реакціях гідролізу, окисненні, взаємодії з основами та інші. Сполучення: Вуглеводні складаються лише з вуглецю і водню, тоді як інші класи містять кисневі атоми, що робить їх більш полярними. 357. Які речовини утворюються при кип’ятінні етилметаноату з розчином калій гідроксиду? Чому в цій реакції не утворюється калій метанолят? При кип'ятінні етилметаноату (CH3COOCH2CH3) з розчином калій гідроксиду (KOH) відбувається гідроліз естеру, який розщеплюється на калій етаноат та етанол. Реакційна рівняння:
shkola.in.ua
CH3COOCH2CH3 + KOH → CH3COOK + CH3CH2OH У результаті цієї реакції утворюються калій етаноат (CH3COOK), який є соллю етанової кислоти (CH3COOH), і етанол (CH3CH2OH). Водневий атом з гідроксидної групи калій гідроксиду (KOH) заміщується ацетиловою групою етилметаноату (CH3COOCH2CH3), утворюючи сіль калій етаноат та етанол. У цій реакції не утворюється калій метанолят (CH3OOK), оскільки реакція гідролізу відбувається з використанням алкалічної середовище, де водневий іон (H+) від гідроксидної групи гідроксиду калію реагує з ацетиловою групою естилю, утворюючи ацетиловий іон (CH3COO-), який утворює сіль калій етаноат, а не калій метанолят. 358. Проаналізуйте таблицю та дайте відповіді на запитання.
• — Як ви вважаєте, чому для порівняння наведено: а) саме такі речовини; б) речовини саме цих класів сполук?
• — На прикладі наведених сполук схарактеризуйте відмінності в густині речовин.
• — Як впливає наявність подвійного зв’язку C=O на температури плавлення та кипіння речовин?
• — Яка основна причина відмінності
бутану?
температур плавлення етилетаноату та
• — Які дві пари ізомерів наведено в таблиці?
• — Як відрізнятиметься температура кипіння речовин (°C), якщо в молекулі
бутану один атом Гідрогену кінцевого атома Карбону замінити на гідроксильну групу?
• — Для кожної пари речовин поясніть причини відмінності в температурах кипіння.
а) Для порівняння наведено речовини з різних класів сполук, що дозволяє аналізувати вплив різних груп функціональних груп на їх фізичні властивості.
б) Густина речовин залежить від маси молекули та її структури. В даному випадку, бачимо, що густина зазвичай збільшується разом зі збільшенням маси молекули.
в) Подвійний зв'язок C=O (карбонільний зв'язок) утворюється у функціональній групі кетонів та альдегідів. Наявність цього зв'язку призводить до зміни дипольного моменту молекули, що може впливати на міжмолекулярні взаємодії та, відповідно, на температури плавлення та кипіння.
г) Основна причина відмінності температур плавлення етилетаноату та бутану полягає у наявності подвійного зв'язку C=O в молекулі етилетаноату. Цей карбонільний зв'язок робить молекулу менш симетричною, що може впливати на міжмолекулярні взаємодії. д) Пари ізомерів: бутан та бутанова кислота, етилетаноат та бутанова кислота. е) Температура кипіння речовин зазвичай збільшується зі збільшенням маси молекул та залежить від міжмолекулярних взаємодій. Замінюючи один атом водню на гідроксильну групу, ми можемо змінити масу молекули та зробити молекулю більш полярною, що може призвести до збільшення температури кипіння. ж) Для кожної пари речовин відмінність в температурах кипіння може пояснюватися різницею в масі молекул, структурою, типом міжмолекулярних взаємодій (дисперсійні сили, диполь-дипольні взаємодії, водневі зв'язки тощо).
§23. Жири Контрольні запитання
359. Які речовини відносять до жирів? Які спільні властивості в естерів та жирів, а в чому полягають відмінності?
Жири є складною групою хімічних сполук, відомих як ліпіди. Ліпіди включають жири, масла, воски, фосфоліпіди, стероїди та інші речовини. Жири є одним з видів ліпідів і є основним джерелом енергії для організмів, а також виконують структурні та захисні функції.
shkola.in.ua
Спільні властивості естерів та жирів: Молекулярна структура: Як і естери, жири мають структуру, що базується на гліцеролі (гліцерині) та жирних кислотах. Три жирні кислоти можуть реагувати з молекулою гліцерину, утворюючи три естерні зв'язки (тригліцериди). Вуглеводневий залишок: Жири та більшість естерів містять вуглеводневий залишок. Вони можуть бути насиченими або ненасиченими залежно від того, чи містять вони одинарні або подвійні вуглецеві зв'язки.
Відмінності між естерами та жирами:
Функції: Естери в основному використовуються як ароматизатори, ароматичні речовини, розчинники тощо. Жири служать важливим джерелом енергії, резервними запасами енергії в організмах, важливі для будови клітинних мембран та інших функцій.
Молекулярна структура: Головною відмінністю між ними є те, що естери містять ацетилові групи (CH3COO-) та можуть бути утворені з реакцій жирних кислот та спиртів. З іншого боку, жири, такі як тригліцериди, містять гліцериновий залишок, на який приєднуються жирні кислоти через естерні зв'язки. Фізичні властивості: Фізичні властивості естерів і жирів можуть відрізнятися через довжину та насиченість жирних кислот. Наприклад, насичені жири мають вищу температуру плавлення порівняно з ненасиченими, оскільки ненасичені жири мають подвійні зв'язки, які сприяють меншій компактності молекул. 360. У чому полягає хімічна різниця між поняттями «олія» та «жир»?
Терміни "олія" та "жир" використовуються для позначення двох різних видів ліпідів, які мають різні хімічні та фізичні властивості.
Олія:
Сполука: Олії - це рідкі ліпіди, які зазвичай мають ненасичені жирні кислоти. Ці ненасичені жири мають подвійні вуглецеві зв'язки у своїх вуглеводневих ланцюгах. Стан: Олії мають рідкий стан при кімнатній температурі. Їх температура плавлення нижча, оскільки наявність подвійних зв'язків у жирних кислотах сприяє меншій компактності молекул, що робить їх менш в'язкими. Джерела: Олії зазвичай отримуються з рослинних джерел, таких як насіння, плоди чи горіхи. Олії рослинного походження містять велику кількість ненасичених жирних кислот, які сприяють поліненасиченим жирам та іншим корисним речовинам. Жир: Сполука: Жири - це тверді ліпіди, які зазвичай містять насичені жирні кислоти. Вони мають вуглеводневі ланцюги без подвійних зв'язків.
Стан: Жири мають твердий стан при кімнатній температурі. Їх температура плавлення вища, оскільки насичені жирні кислоти мають більш компактну молекулярну структуру.
Джерела: Жири часто мають тваринне походження. Вони містять більше насичених жирних кислот, що може сприяти високому вмісту холестерину. Хоча деякі рослинні джерела теж можуть містити жири, але вони відомі своєю насиченою харчовою цінністю.
361. Що таке жирні кислоти? Які жирні кислоти вам відомі? Як впливає склад молекул жирів на їхні фізичні властивості? Жирні кислоти - це органічні сполуки, що належать до класу карбонових кислот. Вони є одним з основних компонентів ліпідів, таких як жири та олії. Жирні кислоти мають довгий вуглецевий ланцюг, на якому розташовані карбоксильна група (-COOH) та водневі атоми Деякі приклади жирних кислот:
shkola.in.ua
• Пальмітинова кислота (16 вуглецевих атомів у ланцюзі)
• Стеаринова кислота (18 вуглецевих атомів у ланцюзі)
• Олеїнова кислота (18 вуглецевих атомів у ланцюзі, один подвійний зв'язок)
• Лінолева кислота (18 вуглецевих атомів у ланцюзі, декілька подвійних зв'язків)
Склад молекул жирів, який включає тип та кількість жирних кислот, має значний вплив на їхні фізичні властивості:
Температура плавлення: Насичені жири з насиченими жирними кислотами (наприклад, пальмітинова, стеаринова) мають вищу температуру плавлення, оскільки молекули компактно упаковані. У них відсутні подвійні зв'язки, які можуть розривати міжмолекулярні силові взаємодії.
Рідкість: Ненасичені жири з ненасиченими жирними кислотами (наприклад, олеїнова, лінолева) мають нижчу температуру плавлення. Подвійні зв'язки створюють
"колінарний" згин у вуглецевому ланцюзі, що знижує компактність молекул та сприяє рідкому стану при кімнатній температурі. Текстура: Насичені жири, які мають більш твердий стан, зазвичай використовуються для здійснення функції структурного компонента в живих організмах та для збереження енергії. Ненасичені жири, які мають рідкий стан, можуть бути більш придатними для транспорту жиророзчинних вітамінів та інших молекул. 362. Поясніть, з якою метою здійснюють гідрування жирів у промислових масштабах. Гідрування жирів є важливим хімічним процесом, який здійснюється у промислових масштабах з метою отримання насичених жирів та жирних кислот. Основною причиною гідрування є поліпшення фізичних властивостей та підвищення стійкості жирів для забезпечення їхнього використання у харчовій та хімічній промисловості. Ось деякі основні мети гідрування жирів: Покращення текстури: Гідрування жирів збільшує їхню твердість та стійкість, що робить їх більш придатними для використання в харчових продуктах. Насичені жири часто мають більш тверду консистенцію, що корисно для виробництва маргарину, тістечок, кондитерських виробів тощо. Збереження: Гідрування збільшує стійкість жирів до окислення та псування, що дозволяє зберігати продукти з довших періодів часу. Підвищення температури плавлення: Гідрування допомагає збільшити температуру плавлення жирів, що корисно для стабільності та збереження продуктів при високих температурах.
Виробництво жирних кислот: Гідрування жирів також може бути першим кроком у
виробництві жирних кислот, які використовуються в харчовій, фармацевтичній та хімічній промисловості.
Застосування в харчовій промисловості: Гідрування дозволяє створювати продукти з бажаною текстурою та структурою, такі як розплавлені сирки, креми, масла для печіння та інші.
363. Наведіть приклади різних галузей застосування жирів.
Жири застосовуються в різних галузях, включаючи:
Харчова промисловість: Виробництво масел, маргарину, тістечок, шоколаду, сирків та інших харчових продуктів.
Фармацевтика: Виготовлення лікарських препаратів, вітамінів та дієтичних добавок.
Косметична промисловість: Виробництво мила, кремів, лосьйонів та інших косметичних засобів.
shkola.in.ua
Хімічна промисловість: Виготовлення пластичних матеріалів, мастильних матеріалів, рідин для технічних потреб та інших хімічних сполук. Енергетика: Використання біопалива на основі рослинних та тваринних жирів. Сільське господарство: Застосування в якості джерела енергії для тварин та рослин
вирощуванні та годівлі.
Матеріали: Виготовлення мила, лаків, пластичних матеріалів, воску та інших матеріалів.
у
Виробництво промислових змащувальних речовин: Використання жирів для змащення та захисту машин та обладнання.
Медицина: Використання жирів у дослідженнях, виробництві лікарських препаратів та медичних матеріалів.
364.Які особливі властивості жирів дозволяють їм виконувати ті функції в організмах, що описані в параграфі?
Особливі властивості жирів дозволяють їм виконувати важливі функції в організмах: Запас енергії: Жири мають високу енергетичну щільність, тобто вони містять багато енергії на одиницю маси. Це дозволяє організмам зберігати енергію в жирах у вигляді запасу для подолання періодів голоду або підвищеної активності. Теплоізоляція: Жири утворюють ізольований шар навколо організму, що допомагає зберігати тепло та підтримувати стабільну температуру тіла. Захист органів: Вони виступають як амортизатори, захищаючи органи від ударів та пошкоджень.
Будівельний матеріал: Жири є важливою складовою клітинних мембран та структур організму, допомагаючи підтримувати їхню цілісність та функціонування. Вітамінний транспорт: Деякі розчинні в жирах вітаміни (наприклад, вітаміни A, D, E, K) потребують жирів для ефективного транспорту та зберігання в організмі. Гормональна функція: Деякі жири впливають на вироблення гормонів та регулювання різних функцій організму. 365. Запишіть рівняння реакції омилення гліцерол тристеарату розчином натрій гідроксиду. Назвіть продукти реакції. Рівняння реакції омилення гліцерол тристеарату (тристеарину) розчином натрій гідроксиду має вигляд: C3H5(C18H35O2)3 + 3NaOH -> 3C3H5(OH)3 + 3C18H35O2Na
Продуктами реакції є гліцерин (гліцерол) та натрій солі стеаринової кислоти (натрій стеарат).
Завдання для засвоєння матеріалу 366. Складіть структурні формули жирів, у складі яких містяться по три залишки молекул кислот: а) пальмітинової; б) масляної; в) стеаринової; г) олеїнової.
а) Пальмітинова кислота (C16H32O2):
CH3(CH2)14COOH
б) Масляна кислота (C18H34O2):
CH3(CH2)16COOH
в) Стеаринова кислота (C18H36O2):
CH3(CH2)16COOH
г) Олеїнова кислота (C18H34O2):
CH3(CH2)7CH=CH(CH2)7COOH
367. Складіть структурну формулу трилінолеату — жиру, утвореного лінолевою кислотою. Складіть рівняння його повного гідрування.
shkola.in.ua
368.Коли дієтологи говорять про жири, то часто використовують терміни «омега9», «омега-6» чи «омега-3 ненасичені жири». Які жири та які особливості будови їх молекул позначають цими термінами? Для відповіді на запитання в структурних формулах ненасичених жирних кислот пронумеруйте атоми Карбону в ланцюзі. Терміни "омега-9", "омега-6" та "омега-3" вказують на розташування останнього ненасиченого зв'язку вуглеводневого ланцюга жирної кислоти від кінця молекули. Ці числа вказують на відстань вуглецевого атома, на якому знаходиться ненасичений зв'язок, від останнього вуглецевого атома у ланцюзі. Приклади:
- Омега-9: Ненасичена жирна кислота з останнім ненасиченим зв'язком вуглеводневого ланцюга на 9 вуглецевому атомі від кінця ланцюга.
- Омега-6: Ненасичена жирна кислота з останнім ненасиченим зв'язком на 6 вуглецевому атомі від кінця ланцюга.
- Омега-3: Ненасичена жирна кислота з останнім ненасиченим зв'язком на 3
вуглецевому атомі від кінця ланцюга.
369. Складіть дві можливі формули жирів, молекули яких містять по 57 атомів Карбону та два подвійні зв’язки.
C57H106 (CH=CH)2(CH2)52CH3
C57H106 (CH=CH)(CH2)53CH3
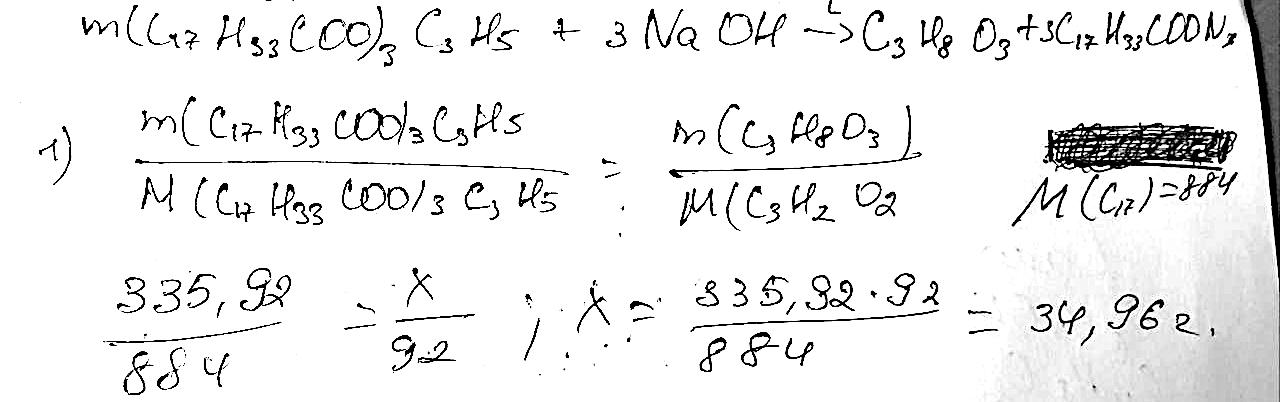
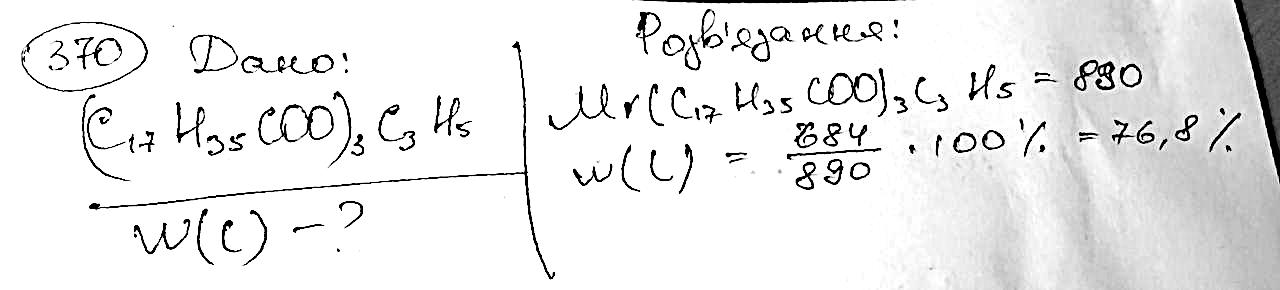
Комплексні завдання
370. Обчисліть масову частку Карбону в тристеараті.
371.
масу гліцеролу, що утворюється під час омилення триолеїнового жиру масою 335,92 г.
C3H5(C17H31COO)3
> C3H5(C17H35COO)3
+ 6H2 (t*, Ni/Pt)
Обчисліть
shkola.in.ua
372. Обчисліть масу натрій стеарату, що утворюється під час лужного гідролізу гліцерол тристеарату масою 1780 г. Реакція гідролізу гліцерол тристеарату має наступний вигляд: C3H5(C18H35O2)3 + 3NaOH → C3H5(OH)3 + 3Na(C18H35O2)
Для знаходження маси натрій стеарату, який утворюється, необхідно визначити кількість речовини, що бере участь у реакції. Для цього необхідно перевести масу гліцерол тристеарату в кількість речовини за допомогою молярної маси: n(C3H5(C18H35O2)3) = m(C3H5(C18H35O2)3) / M(C3H5(C18H35O2)3), де m(C3H5(C18H35O2)3) = 1780 г - маса гліцерол тристеарату, M(C3H5(C18H35O2)3)молярна маса гліцерол тристеарату.
Молярна маса гліцерол тристеарату складається з суми молярних мас гліцерину і тристеаринової кислоти відповідної кількості від атомів у молекулі:
M(C3H5(C18H35O2)3) = 3*M(C18H35O2) + M(C3H5(OH)3)
Молярні маси гліцерину та тристеаринової кислоти становлять відповідно 92,09 г/моль та 284,48 г/моль.
Підставляючи ці значення, отримуємо:
M(C3H5(C18H35O2)3) = 3*284.48 г/моль + 92.09 г/моль = 940.93 г/моль.
Тоді кількість речовини гліцерол тристеарату: n(C3H5(C18H35O2)3) = 1780 г / 940.93 г/моль = 1.89 моль.
З рівняння реакції видно, що коефіцієнт перетворення гліцерол тристеарату в натрій стеарат дорівнює 3, тому кількість натрій стеарату, що утворюється, дорівнює: n(NaC18H35O2) = n(C3H5(C18H35O2)3) * 3 = 1.89 моль * 3 = 5.67 моль.
Молярна маса натрій стеарату складається з суми молярних мас натрію і стеаринової кислоти відповідної кількості від атомів у молекулі: M(NaC18H35O2) = M(C18H35O2) + M(Na)
Молярна маса стеаринової кислоти становить 284.48 г/моль, а молярна маса натрію22.99 г/моль.
Тоді молярна маса натрій стеарату дорівнює: M(NaC18H35O2) = 284.48 г/моль + 22.99 г/моль = 307.47 г/моль.
shkola.in.ua
Тоді маса натрій стеарату, що утворюється, дорівнює: m(NaC18H35O2) = n(NaC18H35O2) * M(NaC18H35O2) = 5.67 моль * 307.47 г/моль ≈ 1745 г.Отже, маса натрій стеарату, що утворюється під час лужного гідролізу гліцерол тристеарату масою 1780 г, становить близько 1745 г. 373. Обчисліть масу тристеаринового жиру, що необхідно піддати омиленню для одержання калій стеарату масою 772,8 кг. Тристеарин (C57H110O6) має молекулярну масу 884,2 г/моль. Для отримання 772,8 кг калію стеарату (C18H35KO2) необхідно омилити (гідролізувати) 884,2 г тристеарину, щоб отримати 884,2 г стеарату калію. Реакція омилення тристеарину: C57H110O6 + 3KOH -> C18H35KO2 + 3C12H22O11 + 3H2O Таким чином, кількість тристеарину, необхідне для отримання 772,8 кг калію стеарату, буде: 772,8 кг / (884,2 г 18,05 г) = 3527,2 моль І маса тристеарину буде: 3 527,2 моль x 884,2 г/моль = 3 127 099,04 г = 3
127,1 кг
374. Обчисліть об’єм водню (н. у.), необхідного для гідрування жиру масою 8,7516 кг, у молекулах якого містяться по одному залишку молекул пальмітинової і по два залишки молекул олеїнової кислот.
1. Визначимо молекулярну масу пальмітинової кислоти (C16H32O2) та олеїнової кислоти (C18H34O2):
Маса пальмітинової кислоти (C16H32O2) = 16 * 12.01 + 32 * 1.01 + 2 * 16.00 ≈ 256.42
г/моль
Маса олеїнової кислоти (C18H34O2) = 18 * 12.01 + 34 * 1.01 + 2 * 16.00 ≈ 282.48
г/моль
2. Знаючи маси і кількість залишків молекул кислот у жирі, знайдемо масу одного
жиру:
Маса одного жиру = 1 * 256.42 г + 2 * 282.48 г ≈ 821.38 г/моль
3. Знайдемо кількість молекул жиру у 8.7516 кг:
Кількість молекул жиру = маса жиру / маса одного жиру = 8751.6 г / 821.38 г/моль
10.651 моль
4. Оскільки для гідрування одного жиру необхідно 3 молекули водню (H2), то кількість молекул водню буде: Кількість молекул водню = 10.651 моль * 3 = 31.953 моль
5. Обчислимо об'єм водню (н. у.) за ідеальним газовим законом V = n * Vм (де Vм ≈ 24.45 л/моль):
Об'єм водню (н. у.) = 31.953 моль * 24.45 л/моль ≈ 782.91 л Отже, об'єм водню (н. у.), необхідного для гідрування даного жиру, становить приблизно 782.91 л. 375. Ферменти нашого організму розщеплюють ланцюг стеаринової кислоти на
фрагменти по два атоми Карбону і перетворюють їх на молекули оцтової кислоти. Складіть схему цього процесу. Обчисліть масу оцтової кислоти, що виробляється нашим організмом з 0,1 г тристеаринового жиру.
1. Знаходимо масу стеаринової кислоти (C57H110O6):
Маса стеаринової кислоти = 57 * 12.01 + 110 * 1.01 + 6 * 16.00 ≈ 856.74 г/моль
2. Обчислюємо кількість молекул стеаринової кислоти у 0.1 г: Кількість молекул стеаринової кислоти = маса / маса одного молекули = 0.1 г / 856.74 г/моль ≈ 0.000116 моль
3. Оскільки ферменти розщеплюють стеаринову кислоту на фрагменти по два атоми вуглецю і перетворюють їх на оцтову кислоту, то кількість молекул оцтової кислоти буде такою ж, як кількість молекул стеаринової кислоти.
shkola.in.ua
4. Обчислюємо масу оцтової кислоти, що виробляється: Маса оцтової кислоти = Кількість молекул * маса одного молекули = 0.000116 моль * 60.05 г/моль (маса оцтової кислоти) ≈ 0.00698 г Отже, наш організм виробляє близько 0.00698 г оцтової кислоти з 0.1 г тристеаринового жиру, який розщеплюється на фрагменти по два атоми вуглецю. 376. Суміш триолеату і тристеарату, в якій кількість речовини обох жирів однакова, піддали лужному гідролізу. Отриману суміш продуктів реак- ції піддали зворотній реакції естерифікації. Зобразіть структурні формули жирів, що при цьому могли утворитися. Визначте серед отриманих жирів ті, що мають однакову молекулярну масу. Зворотна естерифікація означає, що два молекули жирів можуть знову утворити естер за умови наявності кислоти або каталізатора. Оскільки суміш містить рівні кількості речовини триолеату (триподвійний естер олеїнової кислоти та гліцеролу) і тристеарату (тріпалмітат гліцерину), у результаті гідролізу утвориться суміш олеїнової кислоти і пальмітинової кислоти з гліцерином.
Олеїнова кислота: CH3-(CH2)7-CH=CH-(CH2)7-COOH Пальмітинова кислота: CH3-(CH2)14-COOH
Гліцерин: C3H5(OH)3
≈
Після зворотної реакції естерифікації, можуть утворитися такі жири: - Олеїновий трипальмітат: 3 пальмітинові кислоти + гліцерин - Триолеат: 3 олеїнові кислоти + гліцерин - Тристеарат: 3 пальмітинові кислоти + гліцерин
Молекулярна маса триолеату і тристеарату буде різною, тому що вони мають різні склади кислот. 377. Жир масою 88,6 г, молекула якого має залишки молекул і олеїнової, і стеаринової кислот, під час бромування збільшує свою масу на 32 г. Визначте, скільки залишків стеаринової кислоти в молекулі жиру. Обчисліть, який об’єм водню (н. у.) витратиться на реакцію з тією самою кількістю жиру.
Спочатку обчислимо, скільки молекул брому додається до молекули жиру. За умовою, маса жиру збільшується на 32 г під час бромування.
Маса брому = 32 г Кількість молекул брому = маса брому / молекулярна маса брому = 32 / 160 = 0.2 моль (так як молекульна маса брому = 160 г/моль)
Так як одна молекула брому додається до одного подвійного зв'язку, то маса жиру збільшиться на 32 г на 0.2 моль брому, що відповідає 0.2 подвійним зв'язкам. Залишки стеаринової кислоти = загальна кількість залишків - кількість залишків олеїнової кислоти Залишки стеаринової кислоти = 0.2 - 0.2 = 0 моль Тепер обчислимо об'єм водню (н. у.), необхідного для реакції з молекулою жиру. Для цього ми використовуємо відомий факт, що під час гідрування одного подвійного зв'язку додається 1 молекула водню. Об'єм водню = кількість подвійних зв'язків * об'єм 1 молекули водню = 0.2 * 22.4 л = 4.48 л (при нормальних умовах). Таким чином, залишки стеаринової кислоти в молекулі жиру відсутні, і для реакції з тією самою кількістю жиру буде витрачено 4.48 л водню (н. у.). 378. Жир, у молекулах якого містяться залишки молекул тільки однієї жир- ної кислоти, масою 40,3 г піддали омиленню. Під час реакції витратився натрій гідроксид масою 6 г. Визначте, залишки якої кислоти місти- лися у складі жиру.
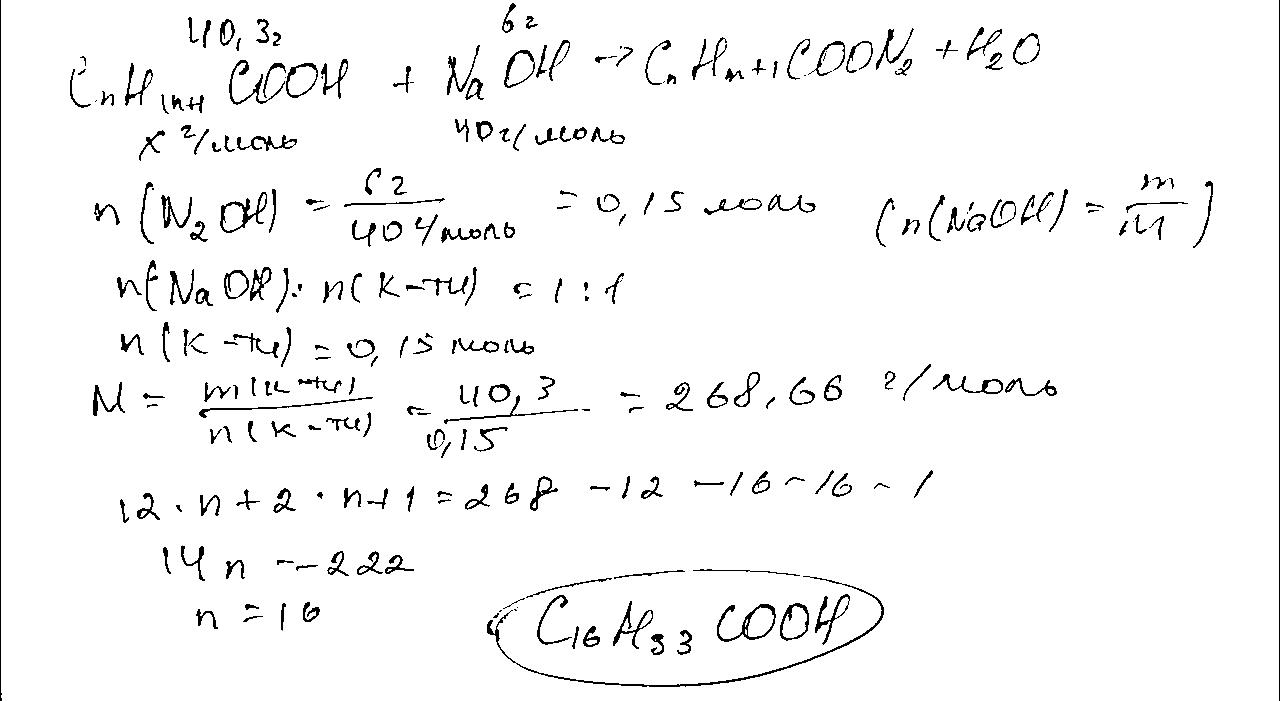
shkola.in.ua
Завдання з розвитку критичного мислення
379. У який спосіб можна стабілізувати емульсію олії у воді? Наведіть приклади таких емульсій з власного досвіду.
Емульсію олії у воді можна стабілізувати за допомогою емульгаторів. Емульгатори це речовини, які здатні зв'язувати молекули олії та води, утворюючи стійкі емульсійні системи. Емульгатори можуть бути природного походження, наприклад, лецитин, який міститься в жовтку яйця, або штучні, як наприклад, полісорбати.
Приклади емульсій з власного досвіду: 1. Відкритий салат з олією та оцтом: В салаті з овочів та олії стабілізація емульсії
здійснюється за допомогою емульгаторів, які містяться уцукровому оцті та природному соку.
2. Майонез: Майонез - це класичний приклад емульсії, де олія та яйця емульговані за допомогою лецитину в яйці.
3. Косметичні засоби: Багато кремів та лосьйонів містять емульгатори, які допомагають стабілізувати емульсію між водою та олією.
Міні-проекти
380. Які жири і в якій кількості є корисними для людини з точки зору біологічної цінності? Вживання в їжу яких жирів треба обмежити? Запропонуйте дієту з раціональним уживанням жирів, у якій зазначте добову норму вживання відповідних продуктів. Корисність жирів для організму залежить від їхнього типу та складу. Ненасичені жири, такі як Омега-3 та Омега-6, мають багато корисних властивостей для здоров'я, включаючи підтримку серцево-судинної системи та запаленні. Деякі джерела корисних жирів:
1. Риба: Жирні риби, такі як лосось, сардина, тріска, є відмінним джерелом Омега-3 жирних кислот.
2. Олії: Оливкова олія, льняна олія, реп'яшкова олія містять ненасичені жири.
3. Горіхи та насіння: Горіхи, насіння чіа, гарбузове насіння, лляне насіння містять багато Омега-3 та Омега-6 жирних кислот. В той же час, насичені та трансжири вважаються менш корисними, і їх вживання в їжу потрібно обмежити. Вони можуть збільшити ризик серцевих захворювань, цукрового діабету та інших проблем зі здоров'ям. Пропонована дієта з раціональним уживанням жирів може виглядати наступним чином: Сніданок:
- Омлет з яйцями та овочами на оливковій олії.
- Вівсянка з горіхами та свіжими ягодами.
Обід:
- Полоски запеченої риби (лосось, тріска) з лимоном та зеленью.
- Салат з свіжих овочів з оливковою олією.
Полудень:
- Половина авокадо з лимоном та сіллю.
shkola.in.ua
- Нежирний йогурт з насіннями чіа та медом. Вечеря:
- Куряча грудка на грилі зі стручковою квасолею та паровим броколі.
- Крихітка з печінковими та насіннями.
381. Дослідіть наявність жирів у різних доступних вам продуктах. Якщо на аркуш паперу покласти шматочок вершкового масла й розтерти його, залишиться характерна жирна пляма, яка не висихає. Так само можна перевірити, чи є
жири в інших харчових продуктах, зокрема волоському горісі й насінні. Для цього слід розчавити ядро горіха або насіння без шкірки на аркуші паперу.
Складіть самостійно перелік продуктів, що ви можете перевірити на вміст жирів, та проведіть дослідження.
Вершкове масло.
Волоські горіхи.
Соняшникові насіння.
Гарбузове насіння.
Мигдаль.
Кунжут.
Лляне насіння.
Арахіс (земляний горіх).
Кокосова стружка або кокосове масло.
§24. Вуглеводи: поняття, класифікація та поширеність у природі
Контрольні запитання
382. Які речовини називають вуглеводами? Вуглеводи - це клас органічних сполук, що складаються з вуглецю, водню і кисню відповідною загальною молекулярною формулою (CH2O)n, де n - ціле число. Вони включають моносахариди (одиночні цукри), дисахариди (складаються з двох моносахаридних одиниць) і полісахариди (полімери моносахаридів).
Моносахариди: глюкоза, фруктоза, галактоза тощо.
Дисахариди: сахароза (цукор), лактоза (молочний цукор), мальтоза.
Полісахариди: крохмаль, целюлоза, глікоген. 383. Схарактеризуйте класифікацію вуглеводів. На чому ґрунтується розділення вуглеводів на різні класифікаційні групи?
Вуглеводи можна класифікувати за різними ознаками, такими як структура, кількість моносахаридних одиниць у молекулі, та їхня функціональна роль. Основні класифікаційні групи вуглеводів включають:
1. За структурою:
- Прості (односахариди) - містять одну молекулу цукру. Приклади: глюкоза, фруктоза, галактоза.
- Складні (олігосахариди та полісахариди) - містять дві або більше молекул цукрів. Приклади: сахароза, лактоза, крохмаль, целюлоза.
2. За кількістю моносахаридних одиниць:
- Моносахариди - складаються з однієї молекули цукру. Приклади: глюкоза, фруктоза.
- Олігосахариди - містять від двох до десяти молекул цукру. Приклади: мальтоза (два молекули глюкози), рафіноза (глюкоза, фруктоза, галактоза).
- Полісахариди - містять багато молекул цукрів. Приклади: глікоген (у тварин), крохмаль (у рослин), целюлоза.
3. За функціональною роллю:
shkola.in.ua
- Енергетичні - служать джерелом енергії, особливо для мозку та м'язів. Приклади: глюкоза.
- Структурні - входять до складу клітинних стінок рослин і набряклостей. Приклади: целюлоза.
- Резервні - запасаються для подальшого використання. Приклади: глікоген у печінці та м'язах, крохмаль у рослин.
Розділення вуглеводів на різні класифікаційні групи ґрунтується на їхній будові, функціональних властивостях та ролях, які вони виконують в живих організмах. 384. Схарактеризуйте поширеність вуглеводів у природі, їх біологічну роль та застосування.
Вуглеводи є однією з найпоширеніших класів органічних сполук у природі. Вони зустрічаються в рослинах, тваринах та мікроорганізмах і виконують різноманітні
біологічні ролі. Основні аспекти їх поширеності, біологічної ролі та застосування: Поживна роль: Вуглеводи є важливим джерелом енергії для живих організмів.
Моносахариди, такі як глюкоза і фруктоза, використовуються клітинами для отримання енергії шляхом гліколізу та дихання. Вони є основним джерелом енергії для мозку та м'язів.
Структурна роль: Деякі вуглеводи, зокрема полісахариди, входять до складу клітинних стінок рослин (целюлоза) та екзоскелетону комах (хітин), надаючи їм міцність і структурну стійкість. Запасна роль: Деякі організми використовують вуглеводи як запасний матеріал для майбутнього використання. Наприклад, глікоген у тварин та крохмаль у рослин служать запасом глюкози.
Захисна роль: Вуглеводи можуть брати участь у захисних реакціях організмів. Полісахариди, які утворюють глікопротеїни та гліколіпіди, можуть брати участь у визнанні імунними клітинами, що сприяє імунній відповіді. Застосування: Вуглеводи використовуються у харчовій промисловості як важливий джерело енергії та смакові добавки. Також вони використовуються в медичних дослідженнях, біотехнології, косметиці та інших галузях. Завдання для засвоєння матеріалу 385. Запишіть молекулярні формули відомих вам вуглеводів, схарактеризуйте їх фізичні й хімічні властивості.
Ось молекулярні формули декількох вуглеводів та їх характеристики: Глюкоза: C6H12O6
• Фізичні властивості: Біла кристалічна речовина, солодкого смаку, розчинна у воді.
• Хімічні властивості: Глюкоза є моносахаридом, вона піддається гліколізу, деградації та іншим хімічним реакціям для вироблення енергії. Фруктоза: C6H12O6
• Фізичні властивості: Біла кристалічна речовина, дуже солодка, розчинна у воді.
• Хімічні властивості: Як і глюкоза, фруктоза є моносахаридом і використовується як джерело енергії. Сукроза (цукор): C12H22O11
• Фізичні властивості: Біла кристалічна речовина, солодкого смаку, добре розчинна у воді.
shkola.in.ua
• Хімічні властивості: Сукроза є дисахаридом, який розщеплюється на глюкозу та фруктозу під впливом ферментів. Крохмаль: (C6H10O5)n
• Фізичні властивості: Білий порошок, не має солодкого смаку, погано розчинний у воді.
• Хімічні властивості: Крохмаль є полісахаридом, основним запасним матеріалом рослин для зберігання глюкози. Целюлоза: (C6H10O5)n
• Фізичні властивості: Білий порошок, не має смаку, практично нерозчинний
воді.
• Хімічні властивості: Целюлоза є полісахаридом, складовою клітинних стінок рослин, і не може бути перетравлена без певних ферментів.
386. З наведених формул виберіть ті, що можуть належати вуглеводам: C3H8O, C5H10O5, C12H26, C12H22O11, C6H12O.
З вказаних формул до класу вуглеводів належать наступні:
• C5H10O5 (глюкоза - моносахарид)
• C12H22O11 (сукроза - дисахарид)
• C6H12O (гексоза - моносахарид) Завдання з розвитку критичного мислення
387. Порівняйте склад молекул пентоз та гексоз. Поясніть походження назв цих груп вуглеводів.
Пентози і гексози - це дві різні класи вуглеводів, які відрізняються за кількістю атомів вуглецю у своїх молекулах.
Пентози мають п'ять атомів вуглецю в своїх молекулах. Прикладом пентозу є рибоз, який є складовою частиною нуклеїнових кислот (РНК та ДНК), а також деяких інших важливих молекул у клітині. Гексози мають шість атомів вуглецю в своїх молекулах. Серед гексоз відомі глюкоза, фруктоза та галактоза. Глюкоза є одним з основних джерел енергії для клітин, а фруктоза та галактоза також мають важливу роль в метаболізмі та харчуванні. Назви "пентоз" і "гексоз" походять від кількості атомів вуглецю у молекулах цих вуглеводів. "Пент" означає п'ять, а "гекс" означає шість, вказуючи на кількість вуглецевих атомів у відповідних сполуках. 388.Як ви вважаєте, чому вуглеводи можуть виконувати і енергетичну, і структурну функції? Вуглеводи можуть виконувати як енергетичну, так і структурну функції через свою різноманітність в структурі та властивостях. Енергетична функція: Вуглеводи є важливим джерелом енергії для організмів. Після розщеплення вуглеводів до простих цукрів, таких як глюкоза, ці цукри можуть бути окислені в клітинних мітохондріях для отримання енергії у формі АТФ (аденозинтрифосфату). Це особливо важливо для організмів, які активно функціонують, таких як м'язи та нервова тканина.
Структурна функція: Деякі вуглеводи можуть виконувати структурну функцію, будуючи складні молекули, такі як клітинні стінки рослин, хітиновий екзоскелет комах, глікопротеїни та гліколіпіди в клітинних мембранах, а також нуклеїнові кислоти у формі ДНК та РНК, які містять дезоксирибозу та рибозу (пентози) в своїх структурах.
§25. Глюкоза Контрольні запитання
shkola.in.ua
389. До якої групи вуглеводів — моно-, ди- чи полісахаридів — відносять глюкозу? Чому? Глюкоза відноситься до моносахаридів. Моносахариди є найпростішими вуглеводами і не можуть бути розщеплені на менші одиниці гідролізом. Глюкоза являє собою найбільш поширений моносахарид, який має важливе значення в біологічних процесах, таких як енергетичний обмін та синтез біомолекул. 390. Схарактеризуйте фізичні властивості глюкози.
у
Глюкоза - це білі кристали, без запаху та солодкого смаку. Вона добре розчиняється у воді, утворюючи безбарвний розчин. Розчинена глюкоза проявляє оптичну активність, оскільки молекули глюкози можуть поворотити площину поляризованого світла, це зумовлено її хіральною структурою. Глюкоза також дуже розчинна в спирті та гліцерині. Точка плавлення глюкози
становить близько 146-150°C, а точка кипіння - близько 410-420°C.
391. Запишіть молекулярну та структурну формули глюкози. Характеристичні
групи яких класів сполук наявні в молекулах глюкози? Молекулярна формула глюкози: C6H12O6 Структурна формула глюкози:
H----C----OH
H----C----OH
H----C----OH
H----C----OH
H----C----OH
392. У результаті якого процесу в природі утворюється глюкоза? Глюкоза утворюється в природі завдяки процесу фотосинтезу. Фотосинтез — це процес, за якого рослини та деякі мікроорганізми використовують сонячне світло для
здійснення хімічних реакцій, під час яких вуглекисний газ та вода перетворюються на глюкозу та кисень. 393. Схарактеризуйте поширеність і застосування глюкози. На яких властивостях воно ґрунтується?
Глюкоза є однією з найважливіших та найрозповсюдженіших молекул у природі. Вона відіграє важливу роль у біохімії і метаболізмі організмів. Основні аспекти поширеності і застосування глюкози включають: Енергетичний паливний джерело: Глюкоза є основним джерелом енергії для більшості клітин організмів. Вона піддається окисненню в кліткових мітохондріях, виділяючи енергію, яка необхідна для клітинних функцій.
Роль у вуглеводному обміні: Глюкоза є важливою складовою вуглеводного обміну організмів. Вона може бути використана для синтезу інших вуглеводів, таких як глікоген (у тварин) та крохмал (у рослин).
shkola.in.ua
Основний мономер для синтезу полісахаридів: Глюкоза є мономером для синтезу різноманітних полісахаридів, таких як глікоген у тварин, крохмал у рослин та хітин у деяких організмах. Споживча продукція: Глюкоза використовується у харчовій промисловості для виробництва солодощів, солодких напоїв та інших продуктів. Медичні застосування: Глюкоза використовується у медицині як інфузійний розчин для підтримання глюкозного рівноваги у пацієнтів. Основні властивості глюкози, на яких ґрунтується її використання, включають:
|
H
|
|
|
|
|
OH
Солюбільність: Глюкоза легко розчиняється у воді, що дозволяє їй бути транспортованою у крові та розподілятися в організмі.
Енергетична цінність: Глюкоза є ефективним джерелом енергії через її окиснення
клітинах.
Біореактивність: Глюкоза є ключовим молекуларним субстратом для багатьох
біохімічних реакцій в організмі, включаючи гліколіз та синтез вуглеводів
394. Схарактеризуйте хімічні властивості глюкози. Відповідь проілюструйте відповідними рівняннями реакцій.
Глюкоза має ряд хімічних властивостей, що визначають її реакційну здатність. Деякі характеристики глюкози включають: Окиснення глюкози: Глюкоза може бути піддана окисненню за участю різних
окислювачів, таких як кисень або оксид міді (І). Окиснення глюкози може призвести до утворення глюконової кислоти.
Рівняння: C6H12O6 + O2 → C6H12O7
Ферментативна гідратація: Глюкоза може піддаватися ферментативній гідратації
участю ензиму глюкоза-ізомерази, утворюючи фруктозу.
Рівняння: C6H12O6 ⇌ C6H12O6
Естрогенез глюкози: Глюкоза може утворювати естери з різними спиртами, такими як глюкозіди. Наприклад, утворення метилглюкозиду.
Рівняння: C6H12O6 + CH3OH →
C6H12O5CH3 + H2O
Завдання для засвоєння матеріалу 395. У двох пробірках містяться розчини: а) глюкози та гліцеролу; б) глюкози та фруктози. Як можна відрізнити вміст пробірок?
a) Додайте деяку кількість концентрованої сірчаної кислоти (H2SO4) до зразку. Гліцерол при взаємодії з концентрованою сірчаною кислотою утворить чорний вуглецевий осад.
b) Додайте концентрований розчин натрій гідроксиду (NaOH) до зразку. При взаємодії глюкози з натрій гідроксидом відбудеться Молішова реакція, під час якої утвориться червоний осад Cu2O (оксид міді(I)), що вказує на наявність глюкози.
396. Складіть рівняння реакцій для здійснення перетворень за схемою: метан → вуглекислий газ → глюкоза → етанол → вуглекислий газ.
1. Метан до вуглекислого газу:
CH4 + 2O2 → CO2 + 2H2O
2. Вуглекислий газ до глюкози (фотосинтез):
6CO2 + 6H2O + світлова енергія → C6H12O6 + 6O2
3. Глюкоза до етанолу (спиртове бродіння):
C6H12O6 → 2C2H5OH + 2CO2
4. Етанол до вуглекислого газу (здійснюється окисненням):
C2H5OH + 2O2 → 2CO2 + 3H2O Комплексні завдання
397. Обчисліть масу глюкози, яку необхідно піддати бродінню, для одер- жання етанолу масою 55,2 г.

у
за
shkola.in.ua
398. Обчисліть об’єм вуглекислого газу (н. у.), що виділяється під час спиртового бродіння глюкози масою 540 г.
399. Обчисліть масу кальцій карбонату, що утвориться під час поглинан- ня вапняною водою газу, який виділиться у ході спиртового бродіння глюкози
масою 18 г.
С6Н12О6 = 2С2Н5ОН + 2СО2
н(глюкози) = 18/180 = 0,1 моль
н(СО2) = 0,2 моль
Са(ОН)2 + СО2 = СаСО3 + Н2О 0,2 0,2
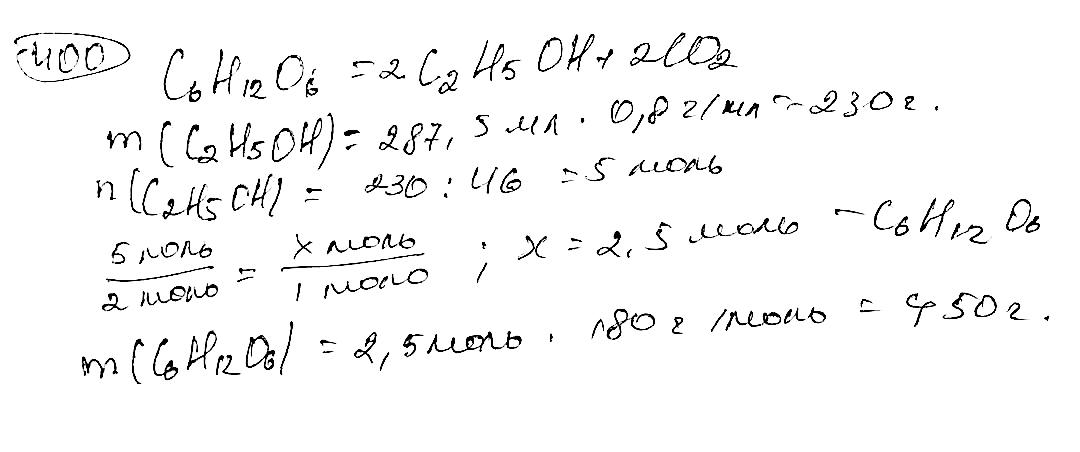
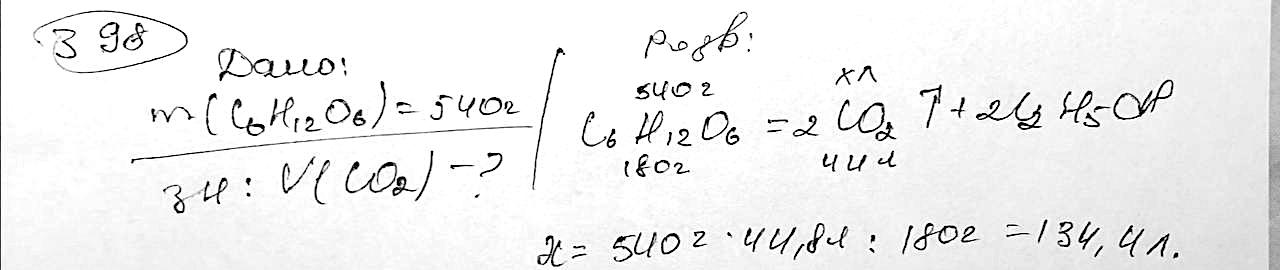
н(карбонату) = 0,2 моль
маса = 0,2 * 100 = 20 г
400. Обчисліть масу глюкози, яку піддали бродінню, якщо при цьому добу- то етанол об’ємом 287,5 мл (густина етанолу 0,8 г/мл).
shkola.in.ua
401. Суміш глюкози й фруктози масою 18 г обробили амоніачним розчином аргентум(І) оксиду. При цьому утворився осад масою 8,64 г. Обчисліть масову частку глюкози в суміші. Для вирішення задачі використаємо реакцію Tollens, яка дозволяє виявляти наявність глюкози в розчині. При цій реакції іони Ag⁺ зв'язуються з глюкозою і відновлюються до Ag⁰, що в результаті утворює срібний відклад (осад), який має вигляд дзеркала. Реакція має наступний вигляд: C₆H₁₂O₆ + 2Ag(NH₃)₂OH → Cu₂O + 2NH₃ + 4H₂O + 2Ag↓ За рівнянням реакції, 1 моль глюкози взаємодіє з 2 молями Ag(NH₃)₂OH, що вагово дорівнює 342,3 г. Звідси можна знайти кількість глюкози в зразку: 1 моль глюкози = 342,3 г / 2 моль = 171,15 г/моль Масова частка глюкози в зразку складатиме: маса глюкози / загальна маса зразка × 100% Дано, що маса зразка 18 г, а маса утвореного осаду (Ag) дорівнює 8,64 г. Тоді маса глюкози в зразку дорівнюватиме: 18 г - 8,64 г = 9,36 г
Масова частка глюкози в зразку:
9,36 г / 18 г × 100% ≈ 52%
Отже, масова частка глюкози в суміші становить близько 52%.
402.Газ, отриманий під час спиртового бродіння глюкози масою 90 г, був повністю
поглинутий розчином із надлишковою кількістю натрій гід- роксиду. Обчисліть
масу солі, що утворилася в розчині.
Дано:
m(C6H12O6) = 90 r
V(p.NaOH) = 602 мл
ω(NaOH) = 30% или 0,3
р= 1,33 г/мл
m(Na2CO3) -?
m(NaOH) = V(p.NaOH)*p*ω(NaOH)
m(NaOH) = 602 мл*1,33 г/мл*0,3 = 240,2 г
M(NaOH) = 40 г/моль
n(NaOH) = m(NaOH)/M(NaOH) = 240,2 г/40 г/моль ≈ 6 моль
M(C6H12O6) = 180 г/моль
n(C6H12O6) = m/M = 90 г/180 г/моль = 0,5 моль
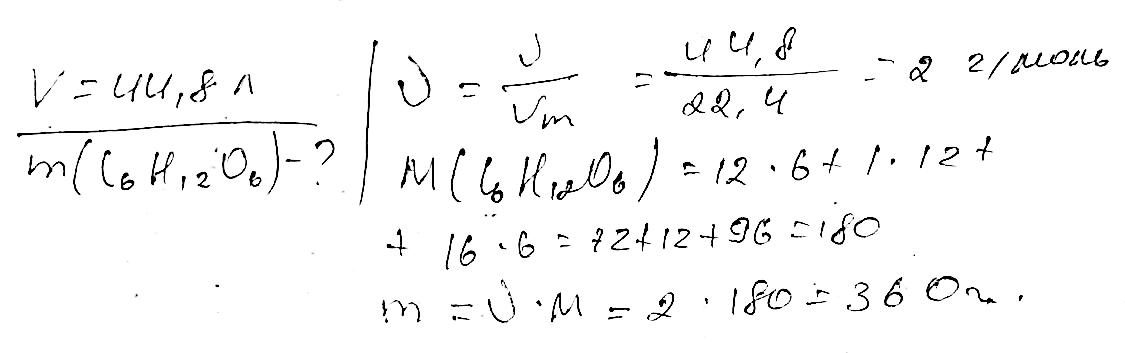
С6Н12О6 = 2С2Н5ОН + 2СО2 (1)
n(CO2) = 2n(C6H12O6)
n(CO2) = 2*0.5 моль = 1 моль
СО2 + 2NaOH = Na2CO3 + H2O (2)
n(CO2):n(NaOH) = 1:2, ⇒ NaOH
n(Na2CO3) = n(CO2) = 1 моль
M(Na2CO3) = 106 г/моль
m(Na2CO3) = n(Na2CO3)*M(Na2CO3)
m(Na2CO3) = 1 моль*106 г/моль = 106 г
403. Під час фотосинтезу було поглинуто 44,8 л вуглекислого газу. Обчисліть масу утвореної глюкози.
404. Обчисліть об’єм розчину спирту у воді з масовою часткою спирту 40 % (густина розчину 0,72 г/мл), що можна добути з глюкози масою 1 кг. Для розв'язання цієї задачі варто використати співвідношення між об'ємом розчину і його густини. Густина розчину = (маса розчину) / (об'єм розчину) Маса розчину = маса спирту + маса води З масовою часткою спирту 40 % у розчині, маса спирту дорівнює 0.4 кг (40 % від 1 кг глюкози), а маса води дорівнює різниці між масою глюкози та масою спирту: 1 кг - 0.4 кг = 0.6 кг.
Тепер можна обчислити масу розчину:
shkola.in.ua
Маса розчину = маса спирту + маса води = 0.4 кг + 0.6 кг = 1 кг
Підставляючи дані до співвідношення для густини розчину: Густина розчину = (маса розчину) / (об'єм розчину)
0.72 г/мл = 1 кг / об'єм розчину
Об'єм розчину = 1 кг / 0.72 г/мл ≈ 1.389 мл
Отже, об'єм розчину спирту у воді з масовою часткою спирту 40 %, який можна добути з 1 кг глюкози, становить приблизно 1.389 мл.
405. Суміш глюкози з інертними домішками масою 7,5 г піддали спиртовому бродінню. Утворений вуглекислий газ пропустили крізь вапняну воду, в результаті чого утворився осад масою 3,5 г. Визначте масову частку глюкози в початковій суміші.
Під час спиртового бродіння глюкоза розщеплюється на спирт (етанол) і вуглекислий газ за реакцією:
C6H12O6 -> 2 C2H5OH + 2 CO2.
За реакцією виділяється два молекули спирту та два молекули вуглекислого газу на одну молекулу глюкози.
Маса вуглекислого газу дорівнює 3,5 г. Оскільки маса двоокису вуглецю (CO2) складає 44 г/моль, то кількість молей CO2 можна знайти як: молі CO2 = маса CO2 / маса молекули CO2 = 3,5 г / 44 г/моль ≈ 0,0795 моль. Оскільки на одну молекулу глюкози утворюється 2 молекули CO2, то кількість молей глюкози визначимо як: молі глюкози = 0,0795 моль / 2 = 0,03975 моль.
Маса глюкози дорівнює масі молекули глюкози помножити на кількість молей: маса глюкози = маса молекули глюкози * молі глюкози = 180 г/моль * 0,03975 моль
7,155 г.
Тепер можна знайти масову частку глюкози в початковій суміші: масова частка глюкози = (маса глюкози / загальна маса суміші) * 100% = (7,155 г / 7,5 г) * 100% ≈ 95,4%.
Отже, масова частка глюкози в початковій суміші становить близько 95,4%.
§26. Складні вуглеводи: сахароза, крохмаль, целюлоза Контрольні запитання
406. За якою ознакою сахарозу, крохмаль та целюлозу відносять до ди- чи полісахаридів? Сахарозу, крохмаль та целюлозу відносять до полісахаридів за ознакою складу їхніх молекул. У молекулах полісахаридів міститься багато молекульних підрядних одиниць моносахаридів, які пов'язані між собою глікозидними зв'язками. 407. Назвіть та схарактеризуйте проміжні продукти гідролізу крохмалю Гідроліз крохмалю – це процес розщеплення крохмалевих полісахаридів на більш прості сполуки за участі води та ферментів. Проміжні продукти гідролізу крохмалю включають:
shkola.in.ua
1. Мальтозу: Мальтоза є проміжним продуктом гідролізу крохмалю. Це дисахарид, що складається з двох молекул глюкози, які пов'язані альфа-1,4-глікозидними зв'язками.
2. Олігосахариди: Під час дальшого гідролізу мальтози можуть утворюватися короткі ланцюги глюкозних залишків, які називають олігосахаридами.
3. Декстрини: Декстрини – це короткі полісахаридні ланцюги, які містять відносно невелику кількість глюкозних залишків. Вони утворюються під час початкового етапу гідролізу крохмалю.
≈
4. Глюкоза: В кінцевому результаті гідролізу крохмалю відбувається повне розщеплення полісахаридних ланцюгів на окремі молекули глюкози, які є простими моносахаридами. Проміжні продукти гідролізу крохмалю є важливими, оскільки вони представляють собою проміжні стани у процесі розщеплення крохмалю на більш прості сполуки, що можуть бути використані для енергетичних потреб організму. 408.Схарактеризуйте фізичні властивості, біологічне значення, поширеність у природі та застосування сахарози, крохмалю і целюлози. Сахароза, крохмаль і целюлоза - це тріє з найважливіших вуглеводів, які мають різні фізичні властивості, біологічне значення, поширеність у природі та застосування: 1. Сахароза:
- Фізичні властивості: Сахароза є кристалічною речовиною у вигляді білих кристалів або порошку. Вона добре розчиняється у воді, має солодкий смак і використовується як підсолоджувач.
- Біологічне значення: Сахароза є однією з основних форм харчування для людини та інших організмів. Вона надає енергію для метаболічних процесів.
- Поширеність у природі: Сахароза зустрічається в багатьох рослинах, особливо в цукрових тростині та цукровому буряку.
- Застосування: Використовується як підсолоджувач у харчовій промисловості, а також в приготуванні різних продуктів. 2. Крохмаль:
- Фізичні властивості: Крохмаль - це білий або слабо кремовий порошок. Він добре розчиняється в гарячій воді, утворюючи густу колоїдну дисперсію.
- Біологічне значення: Крохмаль є основним джерелом енергії для багатьох організмів, включаючи людину. Він зберігається в рослинах у вигляді запасного поживного матеріалу.
- Поширеність у природі: Крохмаль зустрічається в багатьох рослинах в якості запасного продукту для зберігання енергії.
- Застосування: Використовується як добавка до харчових продуктів для загущування та зміцнення консистенції.
3. Целюлоза:
- Фізичні властивості: Целюлоза є нерастворимою у воді речовиною, що утворює ниткоподібні волокна. Вона має важку структуру та є одним з основних компонентів рослинної клітинної стінки.
- Біологічне значення: Целюлоза є важливим компонентом рослинної клітинної стінки, надає їй жорсткість та структуру.
- Поширеність у природі: Целюлоза зустрічається в клітинних стінках рослин і є найпоширенішим органічним сполуками на Землі.
shkola.in.ua
- Застосування: Використовується для виготовлення паперу, тканин, деревних матеріалів та інших продуктів. Усі ці вуглеводи мають важливе значення для харчування, енергетики та структурної підтримки організмів. Завдання для засвоєння матеріалу 409. Яка хімічна властивість є спільною для сахарози, крохмалю і целюлози? Спільною хімічною властивістю для сахарози, крохмалю і целюлози є їхній вміст у молекулах вуглеводів. Вони всі складаються з вуглеводневих залишків, які включають атоми вуглецю, водню та кисню. Тобто, всі ці речовини належать до класу органічних сполук вуглеводів.
410. Складіть рівняння реакцій для здійснення перетворень за схемами: а) Целюлоза → CO2:
6 (C6H10O5)n + 6 O2 → 6 CO2 + 6 H2O
глюкоза → етанол:
C6H12O6 → 2 C2H5OH + 2 CO2
етанол → бромоетан:
C2H5OH + HBr → C2H5Br + H2O
б) CO2 → глюкоза: 6 CO2 + 6 H2O + світло → C6H12O6 + 6 O2
глюкоза → крохмаль: n C6H12O6 → (C6H10O5)n + n H2O
крохмаль → глюкоза: (C6H10O5)n + n H2O → n C6H12O6
г) Целюлоза → глюкоза:
(C6H10O5)n + n H2O → n C6H12O6
глюкоза → CO2:
C6H12O6 + 6 O2 → 6 CO2 + 6 H2O
глюкоза → крохмаль: n C6H12O6 → (C6H10O5)n + n H2O
411. Варену картоплю іноді використовують як клей. Поясніть, на чому
ґрунтується таке її застосування. Картопля містить значну кількість крохмалю, який є полісахаридом і має властивість утворювати коллоїдні розчини в присутності води. Колоїди - це системи, в яких дисперсна фаза розчинена в диспергованій рідині (в даному випадку, крохмаль у воді). При нагріванні крохмалю у воді в процесі готування картоплі, крохмаль гелює. Гелювання - це утворення тривимірної мережі з гранул крохмалю, які утворюють структуру, що здатна утримувати воду та інші частки разом, діючи як клей. Це забезпечує картоплі характерну густоту і в'язкість. Таким чином, здатність крохмалю гелювати допомагає зробити варену картоплю злипкою та здатною використовуватися як природний клей.
412. Запропонуйте схему добування оцтової кислоти з деревини. Складіть
відповідні рівняння реакцій.
Процес добування оцтової кислоти з деревини відомий як процес "деревне оцтіння". Основна реакція цього процесу відбувається через перетворення целюлози деревини у оцтову кислоту та деревний оцет. Схему можна описати наступним чином:
1. Підготовка сировини: Деревина піддається дробленню та сушінню, щоб отримати деревний чіпс.
2. Піроліз: Деревний чіпс піддається піролізу, або нагріванню відсутності повітря, щоб перетворити целюлозу на деревне волокно та деревний оцет (раціональніше відомий як "сирець оцетної кислоти").
3. Окиснення: Сирець оцетної кислоти піддається окисненню до оцтової кислоти за допомогою кисню з повітря.
4. Відділення: Оцтова кислота виділяється з отриманої суміші за допомогою дистиляції.
Реакційні рівняння: Піроліз:
shkola.in.ua
C6H10O5 (целюлоза) → C6H12O6 (деревний оцет) + H2O Окиснення:
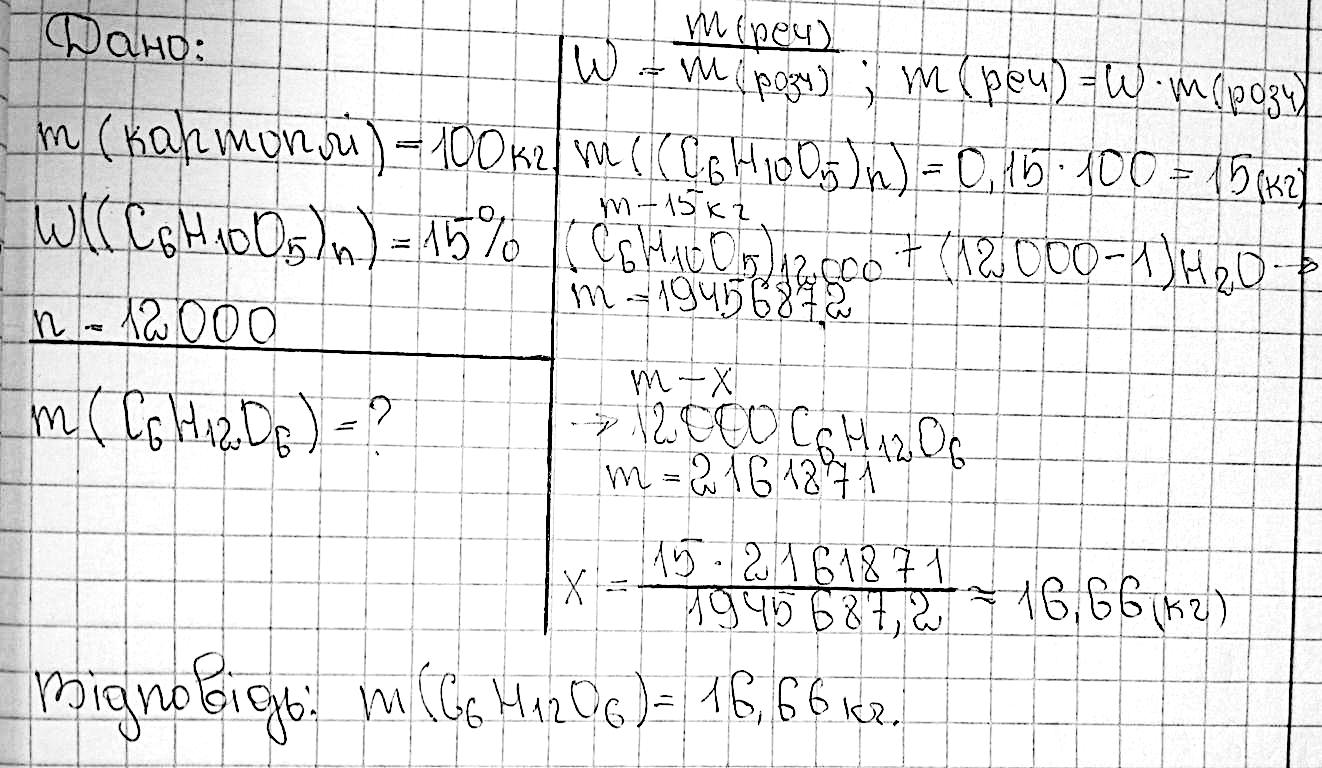
C6H12O6 (деревний оцет) + O2 → 3CH3COOH (оцтова кислота) + 3H2O 413. Речовина А білого кольору без смаку, набухає у воді й розчиняється в ній під час нагрівання, забарвлюється за наявності йоду в темно-синій колір. Під час гідролізу речовини А утворюється речовина Б, яка під дією ферментів
перетворюється на безбарвну рідину В, що змішується з водою в будь-яких співвідношеннях. Про які речовини йдеться? Речовина А, яка набухає у воді, розчиняється при нагріванні та забарвлюється в темносиній колір за наявності йоду, ймовірно, є крохмалем. Під час гідролізу крохмалю утворюється речовина Б, якою може бути целюлоза. Під дією ферментів целюлоза перетворюється на рідину В, якою може бути глюкозний розчин. Таким чином, в даному описі можуть йти мова про крохмаль, целюлозу та глюкозу. Комплексні завдання
414. Обчисліть масу глюкози, яку можна добути гідролізом картопляного
крохмалю, виділеного з картоплі масою 100 кг. У розрахунках візьміть до уваги, що в бульбах картоплі міститься 15 % крохмалю, а одна молекула крохмалю в середньому складається з 12 000 залишків молекул глюкози.
shkola.in.ua
Завдання з розвитку критичного мислення 415. Як ви вважаєте, з якої картоплі можна виділити більше крохмалю: з щойно зібраної чи з тієї, що всю зиму перебувала в овочесховищі? Крохмаль є важливим вуглеводом, який накопичується в картоплі. Однак збільшення часу зберігання картоплі може призвести до зниження вмісту крохмалю в картоплі через різні процеси, такі як розклад та конвертація крохмалю в інші речовини, зокрема цукри.
З цим уважністю, краще виділяти крохмаль зі свіжозібраної картоплі, оскільки це дасть вам більше вірогідність отримати більшу кількість цього важливого вуглеводу. 416. Чи можна сахарозу назвати гомологом глюкози? Чому? Ні, сахарозу не можна назвати гомологом глюкози. Гомологи - це сполуки, що належать до одного класу сполук і відрізняються один від одного на один атом водню із
сусіднього ряду вуглеводнів. Сахароза (C12H22O11) і глюкоза (C6H12O6) мають різний хімічний склад і будову молекул, тому вони не є гомологами. Міні-проекти 417. Складіть план дослідження, результатом якого має бути порівняння
солодкості різних вуглеводів та підсолоджувачів. Проведіть дослідження та
надайте порівняльну характеристику доступних вам вуглеводів та
підсолоджувачів.
Ось план дослідження для порівняння солодкості різних вуглеводів та підсолоджувачів: Підготовка матеріалів:
• Зберіть різні типи вуглеводів, такі як цукор (сахароза), глюкоза, фруктоза, лактоза, крохмаль.
• Здобудьте деякі підсолоджувачі, такі як сукралоза, аспартам, сахарин, стевіозид.
Створення розчинів:
• Приготуйте розчини вуглеводів та підсолоджувачів з однаковою концентрацією (наприклад, 10% масової частки) у окремих склянках.
Оцінка солодкості:
• Запросіть добровольців для оцінки солодкості різних розчинів.
• Пропонуйте добровольцям кожен розчин та питайте, як вони оцінюють його солодкість на шкалі від 1 до 10, де 1 - дуже низька солодкість, 10 - дуже висока солодкість.
Аналіз результатів:
• Зіберіть оцінки від усіх добровольців для кожного вуглеводу та підсолоджувача.
• Розрахуйте середні оцінки солодкості для кожного розчину. Порівняння результатів:
• Порівняйте середні оцінки солодкості різних вуглеводів та підсолоджувачів.
• Зробіть висновки щодо того, які речовини були сприйняті як найбільш солодкі, а які менше солодкі.
Обговорення факторів:
• Розгляньте можливі фактори, які можуть впливати на сприйняття солодкості, такі як індивідуальні смакові уподобання, концентрація розчину, довжина смакового враження.
Підсумок:
• Підсумуйте результати дослідження та зробіть висновки щодо солодкості різних вуглеводів та підсолоджувачів.
Висновки:
• Презентуйте результати дослідження у вигляді графіків або таблиць.
shkola.in.ua
• Зробіть висновки про солодкість різних речовин та їх можливе застосування в харчовій промисловості або особистому споживанні. 418. Дослідіть процес утворення крохмалю в зелених листках рослин. Для цього підійдуть рослини із широкими, не надто товстими й твердими листками. Листок зривати не треба, дослід проводьте безпосередньо на рослині. Звечора частину листка обережно закрийтез двох боків, загорнувши в алюмінієву фольгу,як показано на малюнку. Наступного дня, після того як листок був протягом декількох годин на світлі, зріжте його, зніміть фольгу й занурте на 2–3 години в гарячий спирт (або горілку), поки зелене
забарвлення листа не зникне повністю. Вийміть лист зі спирту, протріть його йодною настоянкою. Поясніть спостереження.
Процес утворення крохмалю в зелених листках рослин відбувається під час фотосинтезу. Фотосинтез - це процес, за якого рослини використовують сонячне
випромінювання, воду та вуглекислий газ для виробництва глюкози (цукру) та кисню.
1. Закриття листка фольгою вночі обмежує доступ світла до частини листка. Це призводить до зниження або призупинення фотосинтезу в цій області.
2. Наступного дня, після відкриття фольги та експозиції листка до сонячного світла, фотосинтез відновлюється. Зелений пігмент рослини, хлорофіл, починає захоплювати сонячне випромінювання для перетворення вуглекислого газу та води на глюкозу та кисень.
3. Якщо після цього листок занурити в гарячий спирт, то хлорофіл розчиниться в спирті, і листок втратить свій зелений колір. Це свідчить про видалення хлорофілу з тканини листка.
4. Протирання листка йодною настоянкою після зняття зі спирту виявить наявність крохмалю. Якщо відбудеться зміна колірної реакції на синій або фіолетовий, це свідчить про наявність крохмалю в листку. Цей дослід підтверджує наявність фотосинтезу в зелених листках рослин і демонструє, як вуглеводи (у цьому випадку - крохмаль) утворюються в процесі фотосинтезу.
419. Виготовлення крохмалю. Приготувати крохмаль можна самостійно вдома. Для цього очищену картоплину натріть на дрібній тертці, отриману масу розмішайте у воді. Потім профільтруйте її через марлю й відіжміть. Залишок маси в марлі знову перемішайте з водою і ще раз профільтруйте. Дайте рідині відстоятися. Крохмаль осяде на дно посудини. Злийте рідину, а осілий крохмаль знову розмішайте. Повторіть ці дії кілька разів, поки крохмаль не стане зовсім чистим і білим. Профільтруйте й просушіть добутий крохмаль.
§27. Аміни
Контрольні запитання
420. Які речовини називають амінами? Наведіть приклади.
Аміни - це органічні сполуки, які містять азотний атом, зв'язаний з однією або більше органічними групами. Вони можуть бути розподілені на різні класи в залежності від кількості аміногруп та їх приєднання до ароматичних або аліфатичних груп. Аміни грають важливу роль в органічній хімії, біології та медицині. Приклади амінів:
1. Примарні аміни: містять одну аміногрупу (-NH2).
- Метиламін: CH3NH2
- Етиламін: C2H5NH2
2. Секундарні аміни: містять дві аміногрупи (-NH2).
- Диметиламін: (CH3)2NH
- Діетиламін: (C2H5)2NH
3. Терціарні аміни: містять три аміногрупи (-NH2).
- Триметиламін: (CH3)3N
- Тріетиламін: (C2H5)3N
4. Ароматичні аміни: аміногрупа
нерозгалужених ароматичних кільць.
- Анілін: C6H5NH2
- Толуїдін: CH3C6H4NH2
приєднана до ароматичних розгалужених або
shkola.in.ua
5. Аліфатичні аміни: аміногрупа приєднана до аліфатичних груп.
- Пропиламін: C3H7NH2
- Бутанамін: C4H9NH2
6. Гетероциклічні аміни: аміногрупа приєднана до атома азоту у складі ациклічних кілець.
- Піролідин: C4H9NH
- Піперідин: C5H11NH
421. Яка група атомів є характеристичною для амінів? Схарактеризуйте її електронну будову. Характеристичною групою атомів для амінів є аміногрупа (-NH2). Електронна будова аміногрупи включає азотний атом та два водневих атоми. Азотний атом в аміногрупі має електронну конфігурацію 1s² 2s² 2p³, що означає, що у нього є три незайняті p-орбіталі, які можуть утворити зв'язки. Один з електронів на атомізованому азоті утворює неспарений електронний спін, що робить азотний атом здатним до сполучення з іншими атомами. Азотний атом аміногрупи може утворювати ковалентні зв'язки з водневими атомами (NH2), а також може брати участь у взаємодії з іншими атомами або групами функцій. Електронна будова аміногрупи дає можливість амінам проявляти хімічну активність, так як азотний атом може брати участь у різноманітних хімічних реакціях, включаючи зв'язування з іншими атомами або молекулами.
Це лише кілька прикладів амінів з різних класів. Аміни можуть відігравати різноманітні ролі в органічній хімії, біології та інших галузях. 422. За якими ознаками класифікують аміни? Аміни класифікуються за наявністю та кількістю аміногруп (-NH2) у молекулі та за типом атомів, з якими аміногрупи можуть утворювати зв'язки. Основні ознаки, за якими класифікують аміни, включають: Кількість аміногруп: За цією ознакою аміни можуть бути класифіковані на примарні (1 аміногрупа), секундарні (2 аміногрупи) та терціарні (3 аміногрупи). Тип атомів, з якими утворюється зв'язок:
• Аліфатичні аміни: Це аміни, де аміногрупи зв'язані з аліфатичними (вуглеводними) ланцюгами. Вони можуть бути аліфатичними примарними, секундарними та терціарними амінами.
• Ароматичні аміни: Аміногрупа зв'язана з атомами у ароматичному кільці, зазвичай бензольному кільці. Прикладом є анілін. 423. Які особливості складання назв амінів?
shkola.in.ua
Складання назв амінів відбувається відповідно до назв алканів, з додаванням відповідної префікса, який вказує на тип аміну (примарний, секундарний, терціарний), та суфікса "амін" або "ін". Основні особливості складання назв амінів: Примарні аміни: Назва складається з префікса "амін-" або "ін-", який вказує на примарний амін, та назви алканового ланцюга, до якого приєднана аміногрупа. Назва ланцюга закінчується на суфікс "-амін" або "-інамін". Наприклад, метанамін, етанамін. Секундарні та терціарні аміни: У цих випадках префікс "амін-" замінюється на "діамін-" (для секундарних) або "тріамін-" (для терціарних), залежно від кількості аміногруп у молекулі. Потім слідує назва ланцюга, яка закінчується на суфікс "-ін" для секундарних амінів і "-тріін" для терціарних амінів. Наприклад, діамінетан, тріамінпропан.
Ароматичні аміни: Для ароматичних амінів, де аміногрупа приєднана до ароматичного кільця, використовується назва ароматичного кільця (наприклад, бензольного), за якою
слідує суфікс "-амін". Наприклад, анілін. 424. Які типи ізомерії характерні для амінів? Відповідь проілюструйте
прикладами. Для амінів характерні різні типи ізомерії, зокрема структурна, просторова (геометрична) та оптична ізомерія. Структурна ізомерія: Структурна ізомерія для амінів включає ланцюжкову і функціональну ізомерію. Ланцюжкова ізомерія виникає внаслідок різного розташування аміногруп на молекулі. Функціональна ізомерія спостерігається, коли різні аміни мають різні функціональні групи, наприклад, один амін може мати аміногрупу, а іншийамідну групу. Просторова (геометрична) ізомерія: Ця ізомерія виникає, коли в аміні в молекулі є подвійний зв'язок або дзеркальний асиметричний атом водню (хіральний атом), що призводить до утворення двох чи більше різних структур, які не можна одну в іншу перетворити без зламання зв'язків.
Приклад геометричної ізомерії: етенамін (виниламін) та пропенамін (аліламін). У першому випадку аміногрупа приєднана до вуглеводневого атома вуглецю, а в другому - до атома вуглецю з подвійним зв'язком. Оптична ізомерія (хіральність): Вона пов'язана з наявністю хірального атома в молекулі, тобто атома, який має чотири різних підвісники. Оптична ізомерія розділяється на два типи: R-ізомер (або декстроротний) та S-ізомер (або леворотний). Це важливе поняття в органічній хімії, оскільки хіральність може впливати на фізичні, хімічні та біологічні властивості молекул.
Приклади оптичної ізомерії: D-аланін та Lаланін. Вони є оптичними ізомерами, які відрізняються залежно від орієнтації оптично
активного атома водню в аміногрупі. Завдання для засвоєння матеріалу
425. Серед наведених формул визначте формули сполук, що є амінами: а) CH3–CH2–CH2–NH2; б) CH3–CH2–NH–CH3; в) CH3–CH2–OH; г) (CH3)3N.
Серед наведених формул амінами є такі:
а) CH3–CH2–CH2–NH2
б) CH3–CH2–NH–CH3
г) (CH3)3N
426. Із наведених формул випишіть окремо первинні, вторинні та третинні аміни.
Складіть їхні назви.
а) C2H5NH2 - етанамін (первинний амін)
б) C3H7NHCH3 - N-метилпропанамін (вторинний амін)
в) C3H7NH2 - N-пропанамін (первинний амін)
г) CH3–CH(CH3)–CH2–NH2 - N,2-диметилпропанамін (первинний амін)
д) CH3–CH(CH3)–NH2 - N,2-диметилетанамін (первинний амін)
е) CH3–CH(CH3)–CH2–NH2 - N,2-диметилбутанамін (первинний амін)
є) CH3–CH(NH2)–CH2–CH3 - N-бутан-2-амін (вторинний амін)
shkola.in.ua
427.Складіть структурні формули сполук:
а) 2,3-диметилбутан-2-амін:
CH3 CH3
CH3-C-C-C-NH2
CH3 CH3
| |
| |
б) 2-хлоропропан-1-амін
CH3-C-NH2
CH3
в) 2-хлоропропан-2-амін: CH3
CH3-C-NH2 | Cl
г) Пропан-2-амін: CH3
CH3-C-NH2
CH3
д) 3-метилгексан-2-амін: CH3
CH3-C-NH2
CH3
е) Гептан-4-амін: CH3
CH3-C-NH2
CH2-CH2-CH2-CH2-CH3
428. Складіть назви сполук за систематичною номенклатурою:
а) 3-аминогексан
б) 2-метил-3-аминопентан
в) 1-аминопентан
г) 4-аминогептан
д) 2-метил-3-аминогексан
е) 2,4-диметил-3-аминогептан
429. Складіть структурні формули всіх
C3H9N; б) C4H11N; в) C5H13N.
а) C3H9N (первинні аміни):
1. Метиламін:
CH3
H-N
H
2. Етиламін:
CH3
можливих первинних амінів складу: а)
Cl |
|
|
|
|
|
|
|
|
|
|
shkola.in.ua
CH3
б) C4H11N (первинні аміни):
1. Метиламін: CH3 | H-N | H
2. Етиламін: CH3 | H-N | CH3
3. n-Пропиламін: CH3 |
H-N |
CH2-CH3
в) C5H13N (первинні аміни):
1. Метиламін: CH3 | H-N | H
2. Етиламін: CH3 | H-N | CH3
3. n-Пропиламін: CH3 | H-N |
shkola.in.ua
CH2-CH3
4. n-Бутиламін: CH3
CH2-CH2-CH3
|
|
H-N
| H-N |
Комплексні завдання 430.Визначте об’єм (н. у.), що займає: а) 0,4 моль метанаміну; б) суміш 1,2 моль метанаміну та 2,3 моль кисню.
431. Визначте молекулярну формулу аміну, в якому масова частка Карбону становить 38,7 %, а Нітрогену — 45,1 %. Складіть його структурну формулу.
Молекулярна формула речовини CH₃NH₂ - це метиламін. Пояснення: Визначити молекулярну формулу аміну, у якому масова частка вуглецю становить 38,7%, а азоту – 45,1%. скласти його структурну формулу.

Аміни – це похідні аміаку, в якому атоми водню заміщені вуглеводневими радикалами. До складу аміну входить 38,7% та 45,1% азоту, отже у ньому 16,2% водню.
Масова частка (%) елементів показує, що у 100 г речовини міститься 38,7 г вуглецю, 45,1 г азоту, 16,2 г водню.

Кількість речовини (моль) дорівнює відношенню маси речовини до його молярної маси: n = m/M.
Знайдемо молярне відношення елементів у речовині.
1 моль речовини містить 1 моль атомів
вуглецю, 1 моль атомів азоту, 5 моль атомів водню. Відповідно, 1 молекула речовини містить 1 атом вуглецю, 1 атом азоту, 5 атомів водню. Молекулярна
CH₃NH₂ -
shkola.in.ua
формула речовини
це метиламін.
Структурна формула малюнку.
432.Установіть число атомів Карбону в молекулі аміну, в якому масова частка Нітрогену становить 15,05 %. Аміни - це органічні сполуки, що містять функціональну групу аміно (-NH₂). Молекула аміну містить атоми водню, карбону та нітрогену. Щоб знайти число атомів карбону в молекулі аміну, нам потрібно знайти хімічну формулу молекули. Оскільки масова частка нітрогену в молекулі становить 15,05%, то масова частка водню та карбону разом становить 100% - 15,05% = 84,95%.
Далі, ми можем використати відомі значення масових часток карбону, водню та нітрогену, щоб побудувати систему рівнянь, яка допоможе знайти хімічну формулу молекули.
Нехай x буде числом атомів карбону в молекулі аміну, тоді: Масова частка карбону: 12x Масова частка водню: 2x Масова частка нітрогену: 14
Тоді, ми можем записати рівняння: 12x + 2x + 14 = 100 14x = 86 x = 6.14
Отже, число атомів карбону в молекулі аміну дорівнює 6 (округлюється до найближчого цілого числа). Хімічна формула такого аміну буде C_6H_{13}N
shkola.in.ua
§28. Властивості насичених амінів Контрольні запитання 433.Схарактеризуйте фізичні властивості амінів. Опишіть, як впливає на них можливість утворення водневого зв’язку. Фізичні властивості амінів визначаються їхньою молекулярною структурою та взаємодією молекул між собою. Основні фізичні властивості амінів включають точку плавлення, точку кипіння, розчинність у воді та інших розчинниках. Важливою характеристикою амінів є можливість утворення водневих зв'язків. Молекули амінів містять атом азоту, який може бути донором або акцептором водневих зв'язків. Це призводить до того, що аміни можуть утворювати водневі зв'язки з водою та іншими молекулами амінів. Можливість утворення водневих зв'язків між молекулами амінів значно підвищує їхню киплячу точку та точку плавлення порівняно з аналогічними алканами (вуглеводні з одинарними зв'язками). Крім того, водневі зв'язки впливають на розчинність амінів у воді: аміни зазвичай розчинні у воді завдяки можливості утворення водневих зв'язків з молекулами води.
Проте, збільшення маси та складності молекул амінів може зменшити вплив водневих зв'язків на їхні фізичні властивості. Наприклад, довгі аміни можуть мати меншу
розчинність у воді через збільшення власних молекулярних розмірів. Таким чином, можливість утворення водневих зв'язків впливає на фізичні властивості амінів, зокрема на їхню точку плавлення, точку кипіння та розчинність у різних
розчинниках.
434.Якими речовинами є аміни з точки зору теорії електролітичної дисоціації?
З точки зору теорії електролітичної дисоціації, аміни є слабкими основами.
435.Напишіть рівняння реакцій, що характеризують хімічні властивості амінів. Аміни - це органічні сполуки, які містять функціональну групу -NH2. Вони можуть мати різні хімічні властивості внаслідок наявності аміногрупи. Ось декілька
характерних реакцій, які описують хімічні властивості амінів:
1. Аміні як основи: Аміни можуть проявляти основні властивості, реагуючи з кислотами та іншими кислотними сполуками. Приклад реакції:
RNH2 + HCl → RNH3+ Cl-
2. Утворення солей амонію: Аміни можуть утворювати солі амонію, які мають здатність утримувати іони амонію (NH4+). Приклад:
RNH2 + HCl → RNH3+ Cl-
3. Ацетилювання амінів: Аміни можуть піддаватися ацетилюванню, додаванням ацетильної групи (CH3CO-) до аміногрупи. Приклад:
RNH2 + CH3COCl → R-NH-COCH3 + HCl
4. Утворення ізоціанатів: Аміни можуть реагувати з ізоціанатами, утворюючи тіоціанати. Приклад:
RNH2 + PhNCS → RNCS + C6H5NH2
5. Утворення діалкіламінів: Аміни можуть реагувати з галогеновуглеводнями, утворюючи діалкіламіни. Приклад: RNH2 + RX → RR'NH + HX
6. Гідроксиламінові реакції: Гідроксиламіни (NH2OH) можуть реагувати з альдегідами та кетонами, утворюючи оксаміни. Приклад: RCHO + NH2OH → RCH=NOH + H2O Завдання для засвоєння матеріалу
436. Використовуючи дані, наведені в параграфі, визначте, в якому агрегатному стані перебувають за кімнатної температури (18 °C): а) метанамін; б) етанамін; в) пропанамін. Відповідь поясніть. За кімнатної температури (18 °C), речовини можуть перебувати в різних агрегатних станах в залежності від їх фізичних властивостей, зокрема температури кипіння та температури плавлення. Давайте розглянемо кожну з речовин: а) Метанамін (CH3NH2):
Температура кипіння метанаміну при нормальному атмосферному тиску близька до6,3 °C. Оскільки 18 °C вище за температуру кипіння метанаміну, він перебуватиме в газоподібному агрегатному стані. б) Етанамін (C2H5NH2):
Температура кипіння етанаміну при нормальному атмосферному тиску близька до 37,7 °C. Таким чином, за кімнатної температури 18 °C, етанамін буде перебувати в рідкому агрегатному стані.
shkola.in.ua
в) Пропанамін (C3H7NH2): Температура кипіння пропанаміну при нормальному атмосферному тиску близька до 48,4 °C. Отже, при 18 °C пропанамін також буде перебувати в рідкому стані. Загалом, відповідно до температур кипіння, за кімнатної температури (18 °C), метанамін буде газом, а етанамін та пропанамін будуть рідкими речовинами. 437. Складіть рівняння реакцій взаємодії з водою та хлоридною кислотою: а) етанаміну; б) пропан-1-аміну. Назвіть продукти реакції. а) Взаємодія етанаміну (C2H5NH2) з водою та хлоридною кислотою (HCl): Рівняння реакції: C2H5NH2 + H2O + HCl → C2H5NH3+ Cl- + H2O Продукти реакції:
1. Етанамін (C2H5NH2) перетворюється на етанамоній катіон (C2H5NH3+).
2. Одна молекула хлоридної кислоти (HCl) дисоціює, утворюючи катіон хлориду (Cl-) та вільний протон (H+).
3. Утворюється також вільна молекула води (H2O). б) Взаємодія пропан-1-аміну (C3H7NH2) з водою та хлоридною кислотою (HCl): Рівняння реакції:
C3H7NH2 + H2O + HCl → C3H7NH3+ Cl- + H2O Продукти реакції:
1. Пропан-1-амін (C3H7NH2) перетворюється на пропан-1-амоній катіон (C3H7NH3+).
2. Одна молекула хлоридної кислоти (HCl) дисоціює, утворюючи катіон хлориду (Cl-) та вільний протон (H+).
3. Утворюється також вільна молекула води (H2O).
У цих реакціях аміни реагують з водою та хлоридною кислотою, утворюючи відповідні амоній катіони та іони хлориду.
438. Використовуючи загальну молекулярну формулу насичених амінів, складіть у загальному вигляді рівняння реакції насичених амінів. Загальна молекулярна формула насичених амінів має вигляд R-NH2, де R представляє вуглеводневий залишок (алкільний або арильний). Реакція насичених амінів може бути представлена загальним рівнянням у вигляді:
R-NH2 + HX → R-NH3+ XУ цьому рівнянні:
- R-NH2 представляє насичений амін.
- HX представляє кислоту (наприклад, HCl, HBr тощо), яка може взаємодіяти з аміном.
- R-NH3+ представляє амоній катіон, утворений в результаті процесу.
- X- представляє анион, що утворився в результаті дисоціації кислоти. Ця загальна реакція демонструє взаємодію насичених амінів з кислотами, що призводить до утворення амоній катіону та відповідного аниону.
439.Складіть рівняння реакції горіння: а) етанаміну; б) пропанаміну; в) триетиламіну; г) етилдиметиламіну.
а) Етанамін (C2H5NH2):
shkola.in.ua
C2H5NH2 + 6 O2 → 2 CO2 + 5 H2O + N2
б) Пропанамін (C3H7NH2):
C3H7NH2 + 9 O2 → 3 CO2 + 7 H2O + N2
в) Триетиламін (N(C2H5)3):
N(C2H5)3 + 10 O2 → 3 CO2 + 6 H2O + N2
г) Етилдиметиламін (C4H11N):
C4H11N + 13 O2 → 4 CO2 + 5 H2O + N2
439. Складіть рівняння реакцій для здійснення перетворень за схемою: CH4 → CH3Cl → CH3NH2 → CH3NH3Cl → CH3NH2.
1. Метан (CH4) до хлориду метилу (CH3Cl): CH4 + Cl2 → CH3Cl + HCl
2. Хлорид метилу (CH3Cl) до метиламіну (CH3NH2):
CH3Cl + NH3 → CH3NH2 + HCl
3. Метиламін (CH3NH2) до метиламоній хлориду (CH3NH3Cl): CH3NH2 + HCl → CH3NH3Cl
4. Метиламоній хлорид (CH3NH3Cl) до метиламіну (CH3NH2):
CH3NH3Cl + NaOH → CH3NH2 + NaCl + H2O
Зверніть увагу, що у реакції 4 було використано натрій гідроксид (NaOH) для нейтралізації хлориду метиламонію та відновлення метиламіну.
Комплексні завдання
440. Обчисліть масу диметиламіну, що може взаємодіяти з хлороводнем об’ємом 3,36 л (н. у.).
2(CH3)2NH + 2HCl = 2(CH3)2NH2+ Cl2
M (CH3)2NH = 45 г/моль
X / 45 = 3,36 / 22,4
X = 45 × 3,36 / 22,4 = 6,75 г
441. Обчисліть масу метанаміну та етанаміну, що може вступити в реакцію з хлороводнем об’ємом 33,6 л (н. у.).
Завдання вимагає обчислити масу метанаміну (метиламіну) та етанаміну, яка може вступити в реакцію з хлороводнем за умови, що об'єм хлороводню дорівнює 33,6 л (н. у.). Давайте розглянемо обидві реакції:
1. Реакція метанаміну з хлороводнем:
CH3NH2 + HCl → CH3NH3+Cl-
2. Реакція етанаміну з хлороводнем:
C2H5NH2 + HCl → C2H5NH3+ClОб'єм хлороводню дорівнює 33,6 л. Оскільки умови задачі надають об'єм хлороводню в нормальних умовах (н. у.), то ми можемо вважати, що об'єм хлороводню відповідає
молекулярному об'єму газів при н. у., який дорівнює 22,7 л/моль.
1 моль метанаміну (CH3NH2) має молекулярну масу 31 г/моль.
1 моль етанаміну (C2H5NH2) має молекулярну масу 45 г/моль.
Обчислимо кількість молей хлороводню:
Кількість молей HCl = Об'єм HCl / Молекулярний об'єм газу при н. у.
Кількість молей HCl = 33,6 л / 22,7 л/моль ≈ 1,48 моль
Тепер обчислимо масу метанаміну та етанаміну, які можуть вступити в реакцію: Для метанаміну:
shkola.in.ua
Маса метанаміну = Кількість молей * Молекулярна маса Маса метанаміну = 1,48 моль * 31 г/моль ≈ 45,88 г Для етанаміну:
Маса етанаміну = Кількість молей * Молекулярна маса Маса етанаміну = 1,48 моль * 45 г/моль ≈ 66,6 г Отже, маса метанаміну, яка може вступити в реакцію з хлороводнем, становить приблизно 45,88 г, а маса етанаміну - 66,6 г. 443.Крізь хлоридну кислоту масою 300 г із масовою часткою кислоти 1,825 % пропустили метанамін. Обчисліть масу утвореної солі в розчині.
Дано
m(HCI)=300 г
w(HCI)= 1,825 %=0,01825
m(CH₃NH₃CI)=?
CH₃NH₂ + HCI = CH₃NH₃CI
m(HCI)=300*,01825=5,475 г
M(HCI) 36,5 г = M(CH₃NH₃CI) 67,5
m(HCl)5,475 г = m (CH₃NH₃CI) х
x=5,475 *67,5 /36,5
Х=10,125 г
444.Під час згоряння невідомого насиченого первинного аміну кількістю речовини
10 моль утворилося 20 моль вуглекислого газу. Визначте молекулярну формулу аміну.
Запишемо хімічну реакцію згоряння аміну:
CnH2n+1NH2 + (3n+1/2)O2 -> nCO2 + (n+1)H2O + CO2
Згідно з умовою задачі, у реакції було використано 10 моль аміну, тому кількість утвореного вуглекислого газу дорівнює 20 моль. Звідси можна записати співвідношення між кількостями речовин:
10 моль аміну : 20 моль CO2 З цього співвідношення можна знайти число моль вуглекислого газу, яке утворюється з однієї молі аміну:
1 моль аміну : 2 моль CO2 Тепер можна визначити склад молекули аміну. Оскільки кількість атомів вуглецю у вуглекислому газі дорівнює кількості атомів вуглецю у молекулі аміну, то: 1 моль аміну містить n моль вуглецю 20 моль CO2 містять n моль вуглецю
n = 20/2 = 10
Таким чином, молекула аміну складається з 10 атомів вуглецю і 2n+1=21 атома водню. За кількістю атомів водню це може бути дециламін, який має молекулярну формулу C10H23NH2.
445. Обчисліть масу етанаміну, що згорів, якщо під час реакції утворилося 112 л (н. у.) газуватих продуктів реакції. Для вирішення цього завдання нам потрібно знати рівняння реакції горіння етанаміну і молярну масу етанаміну. Рівняння реакції горіння етанаміну:
shkola.in.ua
C2H7N + 3.5O2 → 2CO2 + 4H2O + N2 З цього рівняння видно, що коефіцієнт стехіометрії між етанаміном і CO2 дорівнює 2, тобто на кожні 2 молекули етанаміну утворюється 1 молекула CO2. Таким чином, щоб знайти масу етанаміну, необхідно спочатку визначити кількість молів CO2, що утворилася, і потім перетворити цю кількість молів на масу етанаміну. Кількість молів CO2 можна визначити за допомогою закону Дальтона про часткові тиски:
n = V * P / R * T, де n - кількість молів, V - об'єм газу, P - тиск газу, R - універсальна газова стала, Tтемпература в кельвінах. Зазвичай для таких розрахунків використовують стандартні умови (н.у.), тобто тиск 1 атмосфера і температура 273 К. Отже, кількість молів CO2, що утворилася, дорівнює:
n = (112 л) * (1 атм) / (0,0821 л * атм / (моль * К)) * 273 К = 4,22 моль.
Оскільки маса етанаміну дорівнює кількості молів, помноженій на молярну масу, то
маса етанаміну, що згорів, дорівнює:
m = n * M,
де M - молярна маса етанаміну.
Молярна маса етанаміну складає 45,08 г / моль.
Тому маса етанаміну, що згорів, дорівнює:
m = 4,22 моль * 45,08 г / моль = 190,4 г.
Отже, маса етанаміну, що згорів, дорівнює 190,4 г.
446.Визначте молекулярну формулу органічної речовини, якщо під час згоряння її зразка масою 4,5 г утворилися вуглекислий газ масою 8,8 г, вода масою 6,3 г та
азот масою 1,4 г. Відносна густина випарів речови- ни за повітрям становить 1,55.
Дано:
m(CxHy) = 4,5 г
m(CO₂) = 8,8 г
m(H₂O) = 6,3 г
m(N₂) = 1,4 г
D(повітря) = 1,55
Найти: CxHyNz - ?
Знайдемо молекулярну масу речовини:
M(CxHy) = D(повітря) * M(повітря) = 1,55 * 29 = 45 г/моль
Складемо РХР:
CxHyNz + O₂ = CO₂ + H₂O + N₂
n = 1моль n=1моль n = 1 моль
Визначимо кількість речовин
n(CxHyNz) = m(CxHyNz)/Mr(CxHyNz) = 4,5/45 = 0,1 моль
n(CO₂) = m(CO₂)/М(CO₂) = 8,8/44 = 0,2 моль
n(С) = n(CO₂) * n/n(CxHyNz) = 0,2* 1/0,1 = 2 моль
n(H₂O) = m(H₂O)/ М(H₂O) = 6,3/18 = 0,35 моль
n(H) = 2 * n(H₂O)/n(CxHyNz) = 2 * 0,35/0,1 = 7 моль
n(N₂) = m(N₂)/М(N₂) = 1,4/28 = 0,05 моль
n(N) = 2n(N₂) /n(CxHyNz) = 2 * 0,05 / 0,1 = 1 моль
n(С) : n(H) : n(N) = 2 : 7 : 1
Отже формула : С₂Н₇N - диметиламін
Завдання з розвитку критичного мислення
447. Альбутерол — дуже важлива речовина для людей з бронхіальною астмою, оскільки дозволяє робити профілактику та усуває її напади. За структурною формулою альбутеролу визначте, до яких відомих вам класів органічних сполук можна його віднести. Альбутерол належить до класу органічних сполук, відомих як бета-адренорецепторні агенти, або бета-агоністи. Це означає, що він взаємодіє з бета-адренорецепторами у бронхіальних м'язах, спричиняючи розширення бронхів та полегшення дихання. 448.Вуглеводневий залишок в етанаміну більший, ніж у метанаміну. Як ви вважаєте, чому при цьому етанамін у воді розчиняється краще за метанамін? Етанамін має більший вуглеводневий залишок ніж метанамін, оскільки у його молекулі є більше атомів вуглецю і водню. Таке збільшення числа атомів може створювати більше можливостей для образування водневих зв'язків з водою. Водневі зв'язки
shkola.in.ua
виникають між водними молекулами та атомами водню, кисню або азоту в молекулі етанаміну, які мають легкодоступні пари електронів. Водневі зв'язки можуть покращити розчинність сполук у воді, оскільки вони дозволяють стабілізувати взаємодію між речовинами, покращуючи їх взаємодію з розчинником. Таким чином, етанамін, який має більший вуглеводневий залишок, може мати більшу здатність розчинятися у воді через здатність утворювати більше водневих зв'язків з молекулами води. 449.Порівняйте фізичні властивості амінів (табл. 13, с. 171) та спиртів (табл. 8, с. 85) із властивостями алканів (табл. 2, с. 6). Визначте, як і на які саме властивості впливає наявність характеристичних груп та довжина карбонового ланцюга. Аміни, спирти і алкани - це органічні сполуки з різними хімічними групами, які впливають на їх фізичні властивості. Давайте порівняємо їх за декількома параметрами: Температура плавлення та кипіння: Температури плавлення та кипіння амінів та спиртів зазвичай вищі, ніж у відповідних алканів. Це пов'язано з наявністю водневих зв'язків у молекулах амінів та спиртів, які потребують додаткової енергії для розриву під час плавлення або кипіння. Також довжина карбонового ланцюга може впливати на температури плавлення та кипіння - більша довжина ланцюга зазвичай призводить до збільшення цих температур. Розчинність у воді: Спирти і аміни мають можливість утворювати водневі зв'язки з молекулами води, що робить їх більш розчинними у воді порівняно з алканами. Тут також важливість наявності характеристичних груп у молекулі (гідроксильна група для спиртів, аміногрупа для амінів) та довжина карбонового ланцюга. В'язкість: Спирти та аміни можуть мати вищу в'язкість порівняно з алканами, особливо при наявності більшого кількості атомів у молекулах та водневих зв'язків. Карбоновий ланцюг: Довжина карбонового ланцюга в амінах, спиртах і алканах також впливає на їх фізичні властивості. Збільшення довжини ланцюга може призвести до збільшення молекулярної маси, температур плавлення та кипіння. 450.Під час горіння вуглеводнів та оксигеновмісних органічних сполук утворюються тільки оксиди, а під час горіння амінів — ще й азот. Пригадайте, за яких умов відбувається реакція азоту з киснем, та характеристики хімічного зв’язку між атомами Нітрогену в молекулі азоту. Використовуючи це, поясніть, чому одним із продуктів горіння амінів є азот, а не оксиди Нітрогену.
shkola.in.ua
Азот утворює оксиди за високих температур і високому тиску, наприклад, під час горіння в автомобільних двигунах або в спеціальних пальниках. Однак, при нормальних умовах (таких, як у повітрі) азот не реагує з киснем. Основною причиною є висока енергетична стабільність подвійного зв'язку між атомами азоту в молекулі N2. В амінах атом азоту зв'язаний з атомами водню та органічними залишками. Під час горіння амінів відбувається розрив азот-водень зв'язку та подальший реакційний шлях, який може включати окиснення атомів водню до води та азоту до оксидів азоту (якщо є відповідна температура і тиск). Однак, зв'язок між атомами азоту у молекулі азоту (N2) дуже міцний і не розривається під час звичайного горіння амінів. Тому основним продуктом може бути азот у молекулярному вигляді (N2) в процесі горіння амінів. Узагалі, ця реакція є більш складною з хімічної точки зору, і можуть бути інші продукти залежно від умов та наявності каталізаторів. 451. У трьох пробірках містяться розчини метанаміну, етанової кислоти та глюкози. Як можна розрізнити вміст пробірок одним реактивом?
Для розрізнення розчинів метанаміну, етанової кислоти та глюкози можна використати реактив - дихромат калію (K2Cr2O7) у кислому середовищі. Ця реакція базується на
окислювальних властивостях дихромату калію.
1. Метанамін: Метанамін містить аміногрупу, яка може бути окислена до азоту у
вигляді газу (N2). Така реакція може відбутися, і в результаті вироблятиметься азотний газ.
2. Етанова кислота: Етанова кислота містить вуглець і водень, але немає аміногрупи, яка може бути окислена до азоту. Отже, у разі реакції з дихроматом калію у кислому середовищі вона не виділить азотний газ.
3. Глюкоза: Глюкоза - це вуглевод, який також не містить аміногрупу, яка може бути окислена до азоту. Таким чином, реакція з дихроматом калію у кислому середовищі не призведе до виділення азотного газу. Таким чином, за допомогою реакції з дихроматом калію у кислому середовищі можна розрізнити розчини метанаміну, етанової кислоти та глюкози, оскільки лише метанамін спричинить виділення азотного газу.
452. Амоніак у лабораторії добувають взаємодією солей амонію з лужними
речовинами, зокрема з кальцій гідроксидом. Як ви вважаєте, чи можна в подібний спосіб добувати аміни? Ні, аміни не можуть бути добути взаємодією солей амінію з лужними речовинами аналогічно до амоніаку. Основна причина полягає у тому, що аміни мають органічні радикали, які можуть містити різні функціональні групи та вуглецеві ланцюги. Взаємодія амінів з лужними речовинами не приведе до утворення амінів таким же чином, як вона відбувається у випадку амоніаку. Аміни можуть бути синтезовані через різноманітні органічні реакції, такі як амінування, реакції з гідроамінуванням, реакції з амінокислотами тощо. У більшості випадків ці реакції вимагають спеціальних умов та реагентів, які дозволяють встановити
аміногрупу в молекулі сполуки.
shkola.in.ua
453.Як ви вважаєте, чи можна кислотно-оснóвні взаємодії амінів використовувати для їх очищення? Якщо так, то в який спосіб? Так, кислотно-основні взаємодії амінів можна використовувати для їх очищення методом формування солей. Очищення амінів від небажаних домішок може бути досягнуте застосуванням кислот або лугів, які взаємодіють з амінами і утворюють солі. Оскільки солі амінів мають різну розчинність у воді порівняно зі смішаною системою реакцій, вони можуть бути відокремлені і відігнані від неочищеного матеріалу. Цей метод може бути ефективним, але його використання залежить від конкретних умов і типу амінів, які потрібно очистити. У деяких випадках інші методи очищення можуть бути більш відповідними, особливо якщо аміни мають чутливі функціональні групи, які можуть піддаватися деградації під час реакцій з кислотами або лугами. Міні-проекти 454.Із додаткових джерел інформації дізнайтеся про способи кількісного опису оснóвних властивостей сполук. На прикладі амінів поясніть зміни в їх оснóвних властивостях. Способи кількісного опису основних властивостей сполук зазвичай включають в себе вимірювання певних параметрів, таких як pH, розчинність, температура кипіння, температура плавлення, константи рівноваги тощо. Поєднуючи ці дані, можна отримати більш глибоке розуміння хімічної поведінки сполук і зміни їх властивостей під впливом різних чинників.
Прикладом можуть бути аміни. Вони є органічними сполуками, що містять аміногрупу (-NH2). Основні властивості амінів пов'язані з їхньою здатністю приймати протони (H+). Оскільки аміногрупа містить нещасний парний електрон, вона може здійснювати зв'язок з протонами, утворюючи амонійні катіони. Зміни в основних властивостях амінів можуть бути спричинені різними факторами, такими як розмір аміногрупи, наявність інших функціональних груп, електронні ефекти та інші. Наприклад, власність приймати протони може бути модифікована наявністю ароматичних кілець, які можуть впливати на розподіл електронів у молекулі. Також, аміни можуть мати різний розмір алкілових груп, що може впливати на стереоелектронні ефекти та кількість можливих конформацій. Отже, вивчення основних властивостей амінів за допомогою різних способів кількісного опису дозволяє отримати більш глибоке розуміння їхньої хімії та зміни цих властивостей при різних умовах.
§29. Анілін — представник ароматичних амінів Контрольні запитання
455. Запишіть молекулярну, розгорнуту та скорочену структурні формули аніліну.
Молекулярна формула аніліну: C6H7N. Розгорнута структурна формула аніліну:
shkola.in.ua
Скорочена структурна формула аніліну: C6H5NH2. 456.Схарактеризуйте фізичні властивості аніліну. Що відбуватиметься, якщо в склянку з водою налити стільки ж аніліну? Анілін — це рідка органічна сполука, яка при кімнатній температурі та нормальному атмосферному тиску є безбарвною рідинною речовиною з характерним запахом. Вона має відносно низьку температуру замерзання та високу температуру кипіння. Анілін не є летким і легкозаймистим. Він розчиняється у воді в обмежених кількостях і утворює гідрати, але не є повністю розчинним у воді через гідрофобну ароматичну групу. Водний розчин аніліну має слабку основну властивість і нейтралізується кислотами. Якщо в склянку з водою налити стільки ж аніліну, як води, то анілін, як вже зазначалося, буде розчинятися у воді у вигляді обмеженого кількістю гідратів. Така суміш не буде однорідною, анілін може утворити верхній шар, імітуючи фазовий розподіл.
457. Схарактеризуйте хімічні властивості аніліну. Що є спільного та в чому полягають відмінності у хімічних властивостях аніліну з бензеном та амінами? Наведіть відповідні рівняння реакцій.
H | H — C — H | N | H — C — H | H — C — H |
|
H — C — H
H
Хімічні властивості аніліну визначаються наявністю ароматичного кільця та аміногрупи. Відмінності та спільність аніліну з бензеном та амінами можна описати наступним чином:
1. Спільність з бензеном:
- Анілін має ароматичне кільце, так само як і бензен. Це робить анілін підатливим до ароматичних реакцій, таких як електрофільна підстановка та нуклеофільна ароматична підстановка.
2. Відмінність від бензену:
- Анілін має аміногрупу (NH2), що робить його більш реактивним у порівнянні
бензеном. Анілін може взаємодіяти з кислотами, утворюючи солі амонію.
- Анілін також може взаємодіяти з хлоруючими агентами, як хлор, утворюючи аміногалогеніди.
3. Спільність з амінами:
- Анілін є сам по собі аміном, тому він може взаємодіяти з кислотами, утворюючи солі амонію.
4. Відмінність від амінів:
- Анілін має ароматичне кільце, що робить його більш стійким до окиснення та взаємодії з киснем, у порівнянні з амінами.
- Анілін може піддаватися нуклеофільній ароматичній підстановці, що є характерним для ароматичних сполук, але менше типове для амінів. Приклади реакцій:
1. Електрофільна ароматична підстановка аніліну: C6H5NH2 + NO2+ -> C6H4NHC6H4NO2 + H+
2. Утворення солі амонію: C6H5NH2 + HCl -> C6H5NH3+Cl-
3. Утворення аміногалогеніду:
C6H5NH2 + Cl2 -> C6H5NHCl2 + HCl
Завдання для засвоєння матеріалу
458. За якою ознакою метиламін та анілін можна віднести до: а) однієї групи амінів (якої); б) до різних груп амінів (яких)?
Метиламін (CH3NH2) та анілін (C6H5NH2) можна віднести до різних груп амінів. а) Метиламін відноситься до первинних амінів. У нього аміногрупа прикріплена безпосередньо до вуглеводневого залишку. б) Анілін відноситься до ароматичних амінів, оскільки має аміногрупу, яка прикріплена до ароматичного кільця бензену.
459. Складіть рівняння реакції феніламоній хлориду з лугом. Феніламоній хлорид (C6H5NH3Cl) реагує з лугом (наприклад, NaOH) у водному середовищі для утворення аміду та солі натрію. Ось рівняння реакції: C6H5NH3Cl + NaOH → C6H5NH2 + NaCl + H2O У цій реакції феніламоній хлорид реагує з лугом, аміногрупа відокремлюється від хлориду, утворюється амід (феніламін) та сіль натрію, а вода є продуктом реакції.
shkola.in.ua
460. Складіть рівняння реакції для здійснення перетворень за схемами:
а) C6H6 → C6H5NO2 → C6H5NH2 → C6H5NH3Cl → C6H5NH2;
а) C6H6 + HNO3 → C6H5NO2 + H2O
C6H5NO2 + 6[H] → C6H5NH2 + 2H2O
C6H5NH2 + CH3COCl → C6H5NHCOCH3 + HCl
C6H5NHCOCH3 + 2[H] → C6H5NH2 + CH3COOH
Комплексні завдання
з
461. Обчисліть масу аніліну, що можна добути з нітробензену масою 36,9 г.
C6H5NO2 + 3H2 = C6H5NH2 + 2H2O
36.9/123 = y/93
y = 27.9 г

462. Обчисліть масу трибромоаніліну, що можна добути з аніліну масою 32,55 г.
C₆H₅NH₂ + 3Br₂=C₆H₂NH₂Br₃↓ + 3HBr
n(аніліну)=m/M=32,55 г / 93 г/моль = 0,35 моль
n(триброманіліну)=n(аніліну)= 0,35 моль m(триброманіліну)= n*M= 0,35 моль * 330 г/моль=115,5 г 463. Технічний анілін масою 5 г змішали з хлоридною кислотою. У результаті отримали розчин масою 50 г із масовою часткою солі 12,95 %. Обчисліть масову частку домішок в аніліні.
464.Обчисліть масу технічного нітробензену, що містить 18 % домішок, необхідного для добування аніліну масою 18,6 кг.
shkola.in.ua
Завдання з розвитку критичного мислення
465. Складіть рівняння реакцій, за якими можна добути анілін з метану. Добування аніліну (C6H5NH2) з метану (CH4) вимагає декількох послідовних реакцій. Основна ідея полягає в перетворенні метану в хілорамін, а потім його гідролізі до аніліну.
1. Підготовка хлораміну (C6H5NHCl) з метану (CH4):
CH4 + Cl2 → CH3Cl + HCl
CH3Cl + NH3 → CH3NH2 + HCl
CH3NH2 + Cl2 → CH3NHCl + HCl
CH3NHCl + NaOH → C6H5NHCl + NaCl
2. Гідроліз хлораміну (C6H5NHCl) до аніліну (C6H5NH2):
C6H5NHCl + NaOH → C6H5NH2 + NaCl + H2O Таким чином, рівняння реакцій для добування аніліну з метану виглядають так:
CH4 + Cl2 → CH3Cl + HCl
CH3Cl + NH3 → CH3NH2 + HCl

CH3NH2 + Cl2 → CH3NHCl + HCl
CH3NHCl + NaOH → C6H5NHCl + NaCl
C6H5NHCl + NaOH → C6H5NH2 + NaCl + H2O
466. Уважно прочитайте, як проводять демонстрацію взаємодії аніліну з хлоридною кислотою. Хлоридна кислота і так містить значну кількість води, оскільки є водним розчином гідроген хлориду. Як ви вважаєте, для чого перед хлоридною кислотою додають значну кількість води? Додавання значної кількості води перед хлоридною кислотою в цій демонстрації взаємодії аніліну має на меті забезпечити безпечність та пом'якшити потенційно
shkola.in.ua
небезпечну реакцію. Анілін (C6H5NH2) реагує з хлоридною кислотою (HCl), утворюючи аніліну гідрохлорид (C6H5NH3Cl), а під час цієї реакції може виділятися тепло. Додавання води перед хлоридною кислотою може розбавити кислоту та знизити її концентрацію, що може зменшити інтенсивність реакції та об'єм виділеного тепла. Це може робити реакцію менш екзотермічною та менш небезпечною. Оскільки хлоридна кислота вже містить воду у своєму складі (у вигляді гідроген хлориду), додаткове введення води допомагає розбавити кислоту, що може забезпечити безпеку при проведенні демонстрації.
§30. Амінокислоти Контрольні запитання
467. Які сполуки є амінокислотами?
Амінокислоти - це органічні сполуки, які містять аміногрупу (-NH2) та карбоксильну
кислотну групу (-COOH) в своїй молекулі. Вони є основними будівельними блоками білків і грають важливу роль в життєдіяльності організмів. Деякі приклади амінокислот:
1. Гліцин (Gly) - найпростіша амінокислота.
2. Аланін (Ala)
3. Валін (Val)
4. Лейцин (Leu)
5. Ізолейцин (Ile)
6. Треонін (Thr)
7. Серин (Ser)
8. Цистеїн (Cys)
9. Метіонін (Met)
10. Аспартат (Asp)
11. Глютамат (Glu)
12. Лізин (Lys)
13. Аргінін (Arg)
14. Гістидин (His)
15. Тирозин (Tyr)
16. Пролін (Pro)
17. Триптофан (Trp) Усього існує близько 20 основних амінокислот, які відіграють важливу роль у структурі та функціях білків, а також в інших біологічних процесах. 468.Чому водні розчини одноосновних амінокислот не змінюють
забарвлення
індикаторів?
Водні розчини одноосновних амінокислот, таких як гліцин, аланін, валін тощо, не змінюють забарвлення індикаторів через те, що вони є слабкими амфотерними речовинами. Це означає, що вони можуть взаємодіяти як з кислотами, так і з лугами, залежно від рН середовища. У водному розчині амінокислоти мають аміногрупу (-NH2) та карбоксильну кислотну групу (-COOH). При нейтральному рН, ці групи могут знаходитися відповідно в амфотерних формах - аміногрупа може бути протонованою (-NH3+) або не протонованою (-NH2), а карбоксильна група може бути депротонованою (-COO-) або не депротонованою (-COOH).
Ці зарядові стани амінокислот залежать від покажчика рН середовища. Якщо розчин амінокислоти має близький до нейтрального рН, то амінокислоти перебувають у внутрішній рівновазі між протонованими та непротонованими формами. Ця рівновага не забарвлює індикатори, так як вони чутливі до зміни концентрації іонів водню (H+) в розчині, а у випадку амінокислот ця концентрація не велика. Зазвичай індикатори змінюють своє забарвлення внаслідок наявності великої концентрації іонів водню або гідроксидних іонів, що відбувається в кислих або лужних середовищах, відповідно.
469. Які особливості складання назв амінокислот у порівнянні з карбоновими кислотами?
Складання назв амінокислот відрізняється від складання назв карбонових кислот. Основна особливість полягає у вказанні аміногрупи та карбоксильної кислотної групи в
shkola.in.ua
амінокислот, а також вказанні
на атомі вуглецю у складі молекули.
Основні етапи складання назв амінокислот:
1. Вказання аміногрупи: Назва амінокислоти
допомогою префіксу "аміно-".
2. Назва бокового вуглецевого ланцюга: Після назви аміногрупи додається назва
бокового вуглецевого ланцюга, який визначає характерність конкретної амінокислоти. Ця назва може містити різні суфікси та префікси в залежності від хімічної структури ланцюга.
3. Позиція аміногрупи: Вказується номер атома вуглецю, до якого приєднана аміногрупа. Це може бути вказано числом перед назвою амінокислоти (наприклад, αамінокислота).
4. Вказання карбоксильної групи: В кінці назви додається вказівка на наявність карбоксильної кислотної групи, наприклад, через префікс "-ова кислота".
У порівнянні з карбоновими кислотами, де важливо вказати кислотну групу та можливість її дисоціації, складання назв амінокислот більш специфічне через необхідність вказати аміногрупу, карбоксильну групу та боковий вуглецевий ланцюг, які визначають їх унікальні хімічні властивості. 470. Схарактеризуйте фізичні властивості та поширеність амінокислот. Амінокислоти є важливими органічними сполуками, які виконують різноманітні функції в організмах живих організмів. Ось деякі фізичні властивості та інформація про поширеність амінокислот: Точка плавлення та кипіння: Точки плавлення і кипіння амінокислот залежать від їх хімічної структури. Вони можуть бути твердими, рідкими або газоподібними при стандартних умовах. Наприклад, амінокислоти з довгими боковими ланцюгами, такі як тирозин, можуть мати вищу точку плавлення через великий обсяг молекул.
Розчинність: Багато амінокислот розчиняються у воді, оскільки мають поларні групи (аміногрупу та карбоксильну кислотну групу), які можуть утворювати водневі зв'язки з молекулами води. Вони також можуть бути розчинні у різних органічних розчинниках. Поширеність: Амінокислоти зустрічаються в природі в різних органічних сполуках. Вони є будівельними блоками білків, які входять у склад тканин та структур організмів. Також амінокислоти виконують функції гормонів, ферментів та нейромедіаторів, що контролюють біологічні процеси.
Поларність: Властивість амінокислот мати поларні групи сприяє їхній взаємодії з водою, що робить їх важливими для розчинення та транспорту водних розчинів. Кислотність та основність: Амінокислоти можуть виявляти як кислотні, так і основні властивості, оскільки мають карбоксильні та аміногрупи. Це робить їх буферними розчинами, які можуть допомагати підтримувати сталу рівновагу pH в організмах. Здатність до реакцій: Амінокислоти можуть брати участь у різних хімічних реакціях, зокрема у реакціях утворення пептидних та поліпептидних ланцюгів під час синтезу білків.
shkola.in.ua
471. Схарактеризуйте хімічні властивості амінокислот. Наведіть відповідні рівняння реакцій на прикладі аміноетанової кислоти. Хімічні властивості амінокислот є різноманітними і визначаються наявністю аміногрупи (-NH2) та карбоксильної кислотної групи (-COOH) у їхній структурі. Основні реакції амінокислот включають: Згоряння: Амінокислоти можуть піддаватися згорянню у присутності кисню, утворюючи CO2, H2O та азотну оксиду (якщо вони містять азот).
назві
позиції аміногрупи відносно карбоксильної групи
починається з вказання аміногрупи за
Збудження амфотерність: Амінокислоти можуть виявляти як кислотні, так і основні властивості через наявність аміногрупи і карбоксильної групи. Це дозволяє їм
взаємодіяти з кислотами та лугами, утворюючи солі. Утворення солей: Амінокислоти можуть утворювати солі з лугами, утворюючи аміди. Утворення пептидних та білкових ланцюгів: Амінокислоти можуть з'єднуватися
пептидними зв'язками, утворюючи пептиди, а також білкові ланцюги, що мають
ключове значення для функціонування організмів.
Утворення амідів: Амінокислоти можуть взаємодіяти з кислотами за участю
аміногрупи, утворюючи аміди.
На прикладі аміноетанової кислоти (гліцину), можна розглянути наступні реакції: Згоряння:
C2H5NO2 + 3O2 → 2CO2 + 2H2O + 2NO
Збудження амфотерність:
C2H5NO2 + NaOH → C2H5NO2-Na+ + H2O
C2H5NO2 + HCl → C2H5NH3+Cl- + H2O
Утворення пептидного зв'язку:
C2H5NO2 + C2H5NO2 → H2N-C2H4-CO-NH-C2H4-CO-NH2 + H2O
Утворення аміду: C2H5NO2 + HCl → H2N-C2H4-CO-NH2 + Cl- + H2O
472. Який зв’язок називають пептидним?
Пептидний зв'язок (амідний зв'язок) - це хімічний зв'язок, який утворюється між аміногрупою одного амінокислотного залишку та карбоксильною групою іншого амінокислотного залишку під впливом дегідрування (видалення молекули води). У результаті цього зв'язку утворюється пептидна (амідна) група: R₁-CO-NH-R₂
де R₁ і R₂ - бічні ланцюги амінокислот, які визначають їхні властивості та характер. Пептидні зв'язки утворюють основу пептидних ланцюгів і білків. Коли амінокислоти з'єднуються пептидними зв'язками, утворюються пептиди (короткі ланцюги амінокислот) або білки (довгі ланцюги амінокислот). Завдання для засвоєння матеріалу
473. Складіть назви амінокислот за систематичною номенклатурою:
а) 3-амінопентанова кислота
б) 3-амінопропанова кислота
в) 2-амінопропанова кислота
г) амінооцтова кислота
д) 2-аміно-2-метилпропанова кислота
е) 3-аміно-2-хлорпропанова кислота
є) 3-аміно-2-метил-4-хлорпентанова кислота
474. Складіть формулу: а) 2-амінопропанової кислоти; б) гідрохлорид 2-амінопропіонової кислоти; в) натрій 2-амінопропаноату; г) 2-аміно-2-хлоропропанової кислоти; д) дипептид 2-амінопропанової кислоти.
а) 2-амінопропанова кислота: CH3CH(NH2)COOH
б) Гідрохлорид 2-амінопропіонової кислоти: CH3CH(NH2)COOH • HCl
в) Натрій 2-амінопропаноат: CH3CH(NH2)COONa
г) 2-аміно-2-хлоропропанова кислота: CH3C(NH2)(CH2Cl)COOH
д) Дипептид 2-амінопропанової кислоти: CH3CH(NH2)CO-NH-CH2-COOH
475.Складіть усі можливі структурні формули амінокислот зі складом: а) C4H9NO2; б) C3H6NO2Cl. Назвіть їх.
а) Для складу C4H9NO2 є дві можливі амінокислоти:
shkola.in.ua
1. Аланін: CH3CH(NH2)COOH
2. Ізолейцин: CH3CH2CH(CH3)CH(NH2)COOH
б) Для складу C3H6NO2Cl є одна можлива амінокислота: 3-хлораланін: CH2ClCH(NH2)COOH
476. Складіть рівняння реакції аміноетанової та амінопропанової кислот з калій гідроксидом, хлоридною кислотою, метанолом. Реакція аміноетанової кислоти з калій гідроксидом:
CH3NH2COOH + KOH → CH3NH2COOK + H2O
Реакція аміноетанової кислоти з хлоридною кислотою:
CH3NH2COOH + HCl → CH3NH2COOHCl
Реакція аміноетанової кислоти з метанолом:
CH3NH2COOH + CH3OH → CH3NH2COOCH3 + H2O
Реакція амінопропанової кислоти з калій гідроксидом:
CH3CH(NH2)COOH + KOH → CH3CH(NH2)COOK + H2O
Реакція амінопропанової кислоти з хлоридною кислотою:
CH3CH(NH2)COOH + HCl → CH3CH(NH2)COOHCl
Реакція амінопропанової кислоти з метанолом:
CH3CH(NH2)COOH + CH3OH → CH3CH(NH2)COOCH3 + H2O 477. З якими з речовин — калій гідроксид, хлор, вода, хлоридна кисло- та — взаємодіятиме: а) аміноетанова кислота; б) α-амінопропанова а) аміноетанова кислота: - Калій гідроксид (KOH): CH3NH2COOH + KOH → CH3NH2COOK + H2O - Хлор (Cl2): Взаємодія аміноетанової
кислоти з хлором може призвести до різних реакцій, в залежності від умов.
- Вода (H2O): Аміноетанова кислота розчиняється в воді.
- Хлоридна кислота (HCl): CH3NH2COOH + HCl → CH3NH2COOHCl б) α-амінопропанова кислота:
- Калій гідроксид (KOH): CH3CH(NH2)COOH + KOH → CH3CH(NH2)COOK + H2O - Хлор (Cl2): Взаємодія α-амінопропанової кислоти з хлором може призвести до різних реакцій, в залежності від умов.
- Вода (H2O): α-амінопропанова кислота розчиняється в воді.
- Хлоридна кислота (HCl): CH3CH(NH2)COOH + HCl → CH3CH(NH2)COOHCl
478. Складіть рівняння реакцій для здійснення перетворень за схемами: а) C2H5–CHO → C2H5–COOH → CH3–CHCl–COOH → CH3–CHNH2–COOH → CH3–CHNH2–COOCH3:
1. Оксидація етаналь до етанової кислоти:
C2H5–CHO + O2 → C2H5–COOH
2. Заміщення гідрогену в етановій кислоті хлором:
C2H5–COOH + SOCl2 → CH3–CHCl–COOH + SO2 + HCl
3. Заміщення гідроксильної групи в кислоті аміногрупою:
CH3–CHCl–COOH + NH3 → CH3–CHNH2–COOH + HCl
shkola.in.ua
4. Етерифікація амінокислоти метанолом:
CH3–CHNH2–COOH + CH3OH → CH3–CHNH2–COOCH3 + H2O
б) CH3–COOH → CH2Cl–COOH → CH2NH2–COOH → [CH2NH3–COOH]+Cl– →
CH2NH2–COONa:
1. Заміщення гідроксильної групи в оцтовій кислоті хлором:
CH3–COOH + SOCl2 → CH2Cl–COOH + SO2 + HCl
2. Заміщення гідроксильної групи в хлорооцтовій кислоті аміногрупою:
CH2Cl–COOH + NH3 → CH2NH2–COOH + HCl

3. Протонування аміногрупи в амінокислоті з утворенням амонійного іону: CH2NH2–COOH + HCl → [CH2NH3–COOH]+Cl–
4. Нейтралізація амініокислотного катіону натрієвою сіллю: [CH2NH3–COOH]+Cl– + NaOH → CH2NH2–COONa + H2O
479. Визначте амінокислоти, що утворюються під час гідролізу наведеного
пептиду, та складіть їхні структурні формули й назви.
1. 2-амінопропанова кислота
2. 3-аміно-2-метилбутанова кислота
3. 3-аміно-2,3-дихлорпропанова кислота
4. 3-аміно-2-метилпропанова кислота
shkola.in.ua
Комплексні завдання 480.Обчисліть масу аміноетанової кислоти, що можна добути з етанової кислоти масою 24 г. 481.Аміноетанову кислоту можна добути пропусканням амоніаку крізь розчин хлороетанової кислоти. Обчисліть мінімальний об’єм амоніаку (н. у.) для реакції з 200 г розчину з масовою часткою хлороетанової кислоти 25 %. Спочатку визначимо кількість хлороетанової кислоти у розчині: Маса хлороетанової кислоти = маса розчину × масова частка хлороетанової кислоти Маса хлороетанової кислоти = 200 г × 0.25 = 50 г
Після цього можемо визначити кількість молей хлороетанової кислоти, використовуючи її молекулярну масу. Молекулярна маса хлороетанової кислоти (CH3COOH) приблизно 60 г/моль: Кількість молей хлороетанової кислоти = Маса хлороетанової кислоти / Молекулярна
маса
Кількість молей хлороетанової кислоти = 50 г / 60 г/моль ≈ 0.833 моль Реакція формується між хлороетановою кислотою (CH3COOH) та аміаком (NH3), і один молекула хлороетанової кислоти реагує з однією молекулою аміаку.
Молірне співвідношення між хлороетановою кислотою та аміаком: 1:1
Це означає, що для реакції з 0.833 моль хлороетанової кислоти потрібно 0.833 моль аміаку.
Тепер можемо визначити об'єм аміаку, використовуючи його молірний об'єм за нормальних умов (н. у.), який приблизно дорівнює 22.4 л/моль: Об'єм аміаку = Кількість молей аміаку × Молірний об'єм аміаку (н. у.)
Об'єм аміаку = 0.833 моль × 22.4 л/моль ≈ 18.65 л Отже, мінімальний об'єм аміаку, необхідний для реакції з 200 г розчину хлороетанової кислоти з масовою часткою 25%, дорівнює близько 18.65 л. 482. До розчину аміноетанової кислоти масою 50 г із масовою часткою кислоти 6 % додали розчин натрій гідроксиду масою 47 г із надлишковою кількістю лугу. Обчисліть масову частку солі в одержаному розчині.
483.Визначте молекулярну формулу сполуки, якщо в ній масова частка Карбону становить 32,00 %, Нітрогену — 18,7 %, Оксигену — 42,7 %.
Гіпотетично, тут повинен бути водень, його частка 100-(32+18.7+42.7)=6.6%
C : N : O : Н = 32/12 : 18.7/14 : 42.7/16 : 6.6/1 = 2.7 : 1.3 : 2.7 : 6.6 = 2 : 1 : 2 : 5
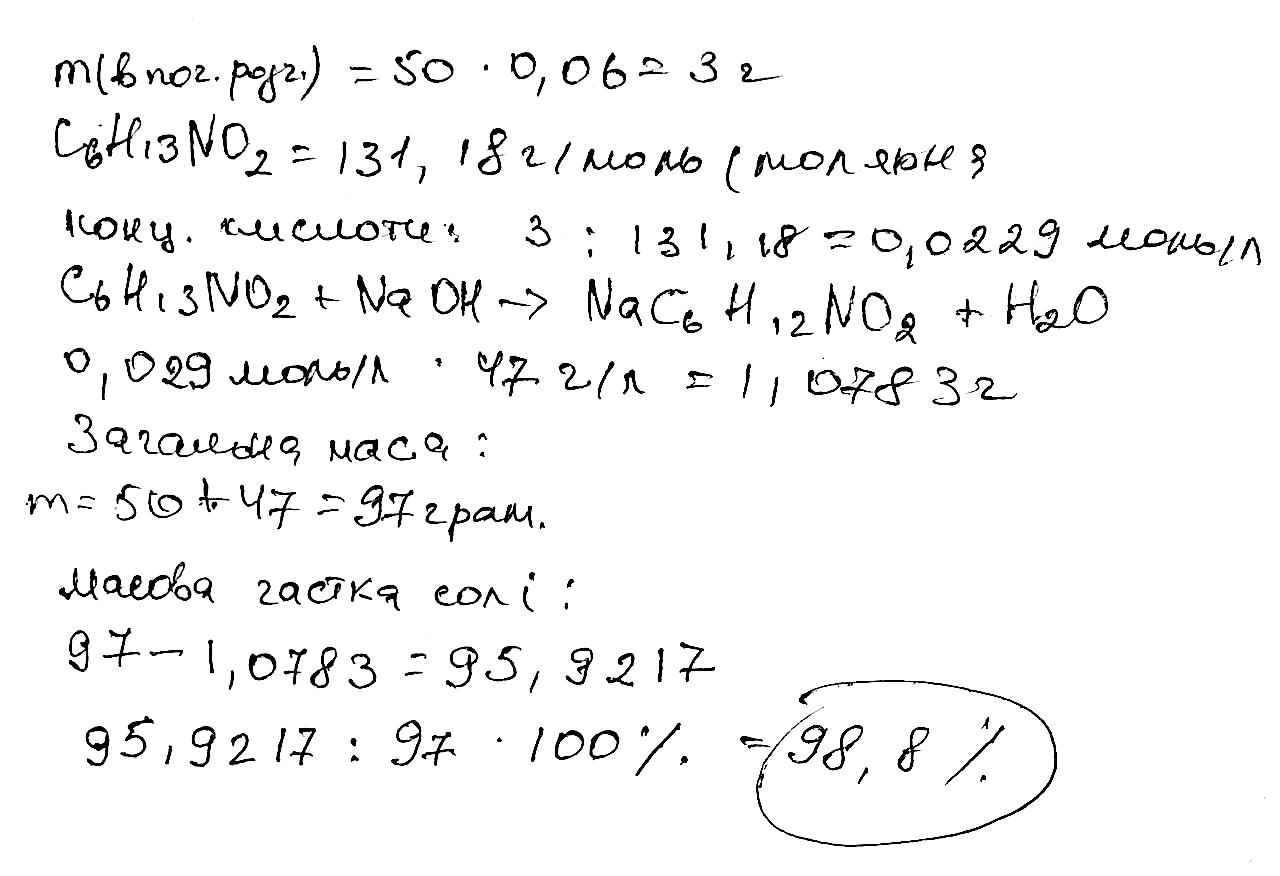
C2NO2H5
H2NCH2COOH це гліцин або амінооцтова кислота
shkola.in.ua
CH3CH2NO2 нітроетан
484. У певній амінокислоті масова частка Карбону становить 40,4 %, Гідро- гену — 7,9 %, Нітрогену — 15,7 %. Визначте молекулярну формулу цієї амінокислоти.
Запропонуйте, які структурні формули можуть відпові- дати такому складу амінокислоти.
Для визначення молекулярної формули амінокислоти, нам необхідно врахувати масові частки окремих атомів у її складі. Відомо, що в амінокислотах містяться вуглець (C), водень (H), азот (N) та кисень (O).
Загальна масова частка елементів у даній амінокислоті складає 100%:
Масова частка C + Масова частка H + Масова частка N + Масова частка O = 100%
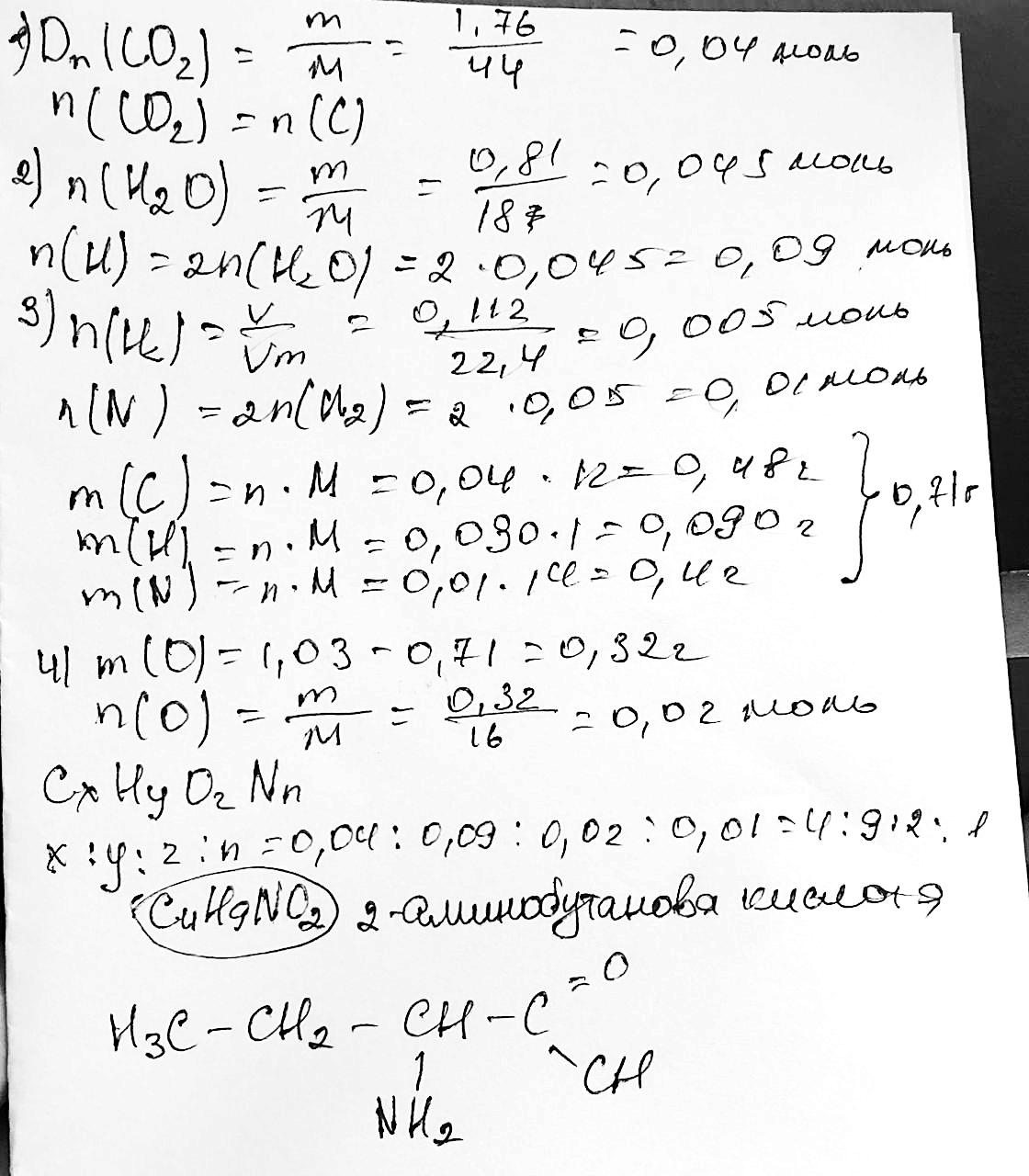
Підставляючи вказані масові частки (C - 40.4%, H - 7.9%, N - 15.7%) у рівняння, можемо знайти масову частку кисню:
40.4% + 7.9% + 15.7% + Масова частка O = 100%
64% + Масова частка O = 100%
Масова частка O = 36%
Тепер ми можемо використовувати масові частки елементів для побудови можливих структурних формул амінокислоти. Помічаємо, що водень, карбон та азот вже враховані в масових частках, тож залишилося додати кисень, який має масову частку 36%.
Серед можливих структурних формул амінокислоти зазначимо ті, де азот може бути частиною аміногрупи (NH2) та карбоксильної групи (COOH):
1. Одна можлива структурна формула: NH2CH2COOH (гліцин, Gly).
2. Друга можлива структурна формула: NH(CH2)2COOH (аланін, Ala). Обидві ці амінокислоти відповідають наданим масовим часткам елементів.
485.Під час згоряння органічної речовини масою 1,03 г утворилися вуг- лекислий газ масою 1,76 г, вода масою 0,81 г та азот об’ємом 112 мл (н. у.). Установіть
молекулярну формулу речовини. До якого класу спо- лук вона може належати? Запропонуйте її структурну формулу.
shkola.in.ua
486.Обчисліть число амінокислотних залишків у поліпептиді, утвореному аміноетановою кислотою, якщо його молярна маса 1329 г/моль.
Фрагменти гліцину, з яких складається пептид, мають М=57г/моль (-nh-сн2-co-).
одна з кінцевих амінокислот має додатковий атом водню, друга кінцева амінокислота
має групу ОН. Таким чином, М(пептида) =57х+18
57х +18 = 1329
х = 23
Пептид містить 23 амінокислотні залишки.
Завдання для розвитку критичного мислення 487. Чи є коректними такі назви сполук: α-аміноетанова кислота, амінобутанова кислота?
Так, назви сполук "α-аміноетанова кислота" і "амінобутанова кислота" є коректними. "α-аміноетанова кислота" вказує на те, що аміногрупа (NH2) знаходиться на αвуглецевому атомі етанової кислоти. Така назва вказує на структурну особливість молекули.
"Амінобутанова кислота" вказує на те, що в цій сполуці є аміногрупа і цільна кислотна група, і що ця сполука містить чотири вуглецеві атоми у своєму вуглецевому ланцюжку.
Обидві назви відображають коректну номенклатуру для органічних сполук з аміногрупами.
§31. Білки Контрольні запитання
488. Які сполуки є білками?
Білки - це біомолекули, які складаються з амінокислот і виконують різноманітні функції в організмах. Основна структурна одиниця білків - це поліпептид, який утворений з ланцюга амінокислот, з'єднаних використовуючи пептидні зв'язки. Білки можуть бути дуже різноманітні за своєю структурою і функціями. 489. За яким параметром білки відносять до полімерів? Білки відносяться до полімерів за параметром молекулярної структури. Полімери - це молекули, які складаються з повторюючихся однакових або схожих підряд одиниць, відомих як мономери. У випадку білків, мономерами є амінокислоти. Білкова молекула складається з одного або більше поліпептидних ланцюгів, які в свою чергу складаються з амінокислот, з'єднаних пептидними зв'язками. Ці амінокислоти можуть бути унікальними, але більшість білків складається з обмеженого набору 20 стандартних амінокислот.
shkola.in.ua
Таким чином, білки є полімерами через те, що вони мають повторюючуся структуру (послідовність амінокислот), яка визначає їхню форму, функцію і властивості. 490. За яких умов відбувається денатурація та гідроліз білків? Денатурація білків відбувається за певних умов, які призводять до зміни їхньої третинної або часткової структури без руйнування пептидних зв'язків. Такі умови включають:
1. Тепловий стрес: Висока температура може ламати слабкі водні зв'язки та гідрофобні взаємодії, що підтримують третинну структуру білків.
2. Екстремальні pH: Зміна pH середовища може руйнувати заряджені амінокислоти та зв'язки між ними, порушуючи структуру білка.
3. Хімічні реагенти: Деякі хімічні речовини, такі як сечовина або гуанідин гідрохлорид, можуть руйнувати нековалентні зв'язки, призводячи до денатурації.
4. Механічний стрес: Агітація, віджимання або інші механічні дії можуть призвести до зміни конформації білків. Гідроліз білків - це розщеплення білкової молекули на молекули амінокислот за допомогою гідролітичних реакцій, таких як гідроліз пептидних зв'язків. Цей процес може відбуватися за таких умов:
1. Каталіз ферментами: Ферменти, відомі як протеази або пептидази, каталізують
розщеплення пептидних зв'язків у білках.
2. Екстремальні pH: Дуже низьке або дуже високе pH може сприяти гідролізу пептидних зв'язків.
3. Висока температура: Підвищена температура може прискорити гідролітичні реакції, зокрема при наявності каталізаторів.
4. Присутність хімічних реагентів: Деякі хімічні речовини можуть сприяти гідролізу, особливо якщо вони взаємодіють з пептидними зв'язками.
Умови гідролізу та денатурації можуть залежати від конкретного білка та його структурних особливостей.
491. Схарактеризуйте біологічну роль білків.
Білки грають важливу роль в біологічних системах і виконують різноманітні функції, що є критичними для життя організмів. Ось деякі з їхніх ключових біологічних ролей: Каталіз ферментативних реакцій: Більшість ферментів - це білки, які керують швидкістю та специфічністю хімічних реакцій в організмі. Вони каталізують біохімічні перетворення, допомагаючи розкладати та синтезувати різні речовини. Структурна підтримка: Багато білків відповідають за структуру та механічну підтримку клітин, тканин і органів. Наприклад, колаген підтримує міцність і гнучкість сполучних тканин. Транспорт та передача речовин: Транспортні білки переносять різні молекули через клітинні мембрани або кров'яно-судинну систему. Наприклад, гемоглобін переносить кисень у крові. Регуляція: Деякі білки діють як гормони або рецептори, регулюючи різноманітні біологічні процеси, такі як ріст, розвиток, обмін речовин, апетит і багато інших. Захист: Антитіла - це білки, які визначаються імунною системою для боротьби з інфекціями та видаляння чужорідних агентів.
Передача сигналів: Білки взаємодіють з іншими білками або молекулами, передаючи сигнали в клітині та між клітинами. Це допомагає в регулюванні процесів комунікації та сприйняття навколишнього середовища. Енергетичні запаси: Деякі білки можуть слугувати як джерело енергії, якщо інші джерела обмежені.
Складові структур клітин: Білки входять до складу багатьох клітинних органел та структур, таких як цитоскелет, ядра, мітохондрії тощо. 492.Чим відрізняється елементний склад білків від елементного складувуглеводів та жирів?
shkola.in.ua
Елементний склад біологічних молекул, таких як білки, вуглеводи та жири, відрізняється через різний склад атомів, які входять до їхнього складу. Білки складаються з амінокислот, які містять атоми вуглецю, гідрогену, кисню, азоту та іноді сірки. Амінокислоти є основними будівельними блоками білків і містять аміногрупи та карбоксильні групи, що дозволяють їм утворювати пептидні зв'язки для створення поліпептидних ланцюгів. Вуглеводи складаються з вуглецю, гідрогену та кисню в співвідношенні, яке відповідає формулі (CH2O)n, де "n" - це кількість повторюючихся одиниць. Вони можуть також
містити інші елементи, такі як азот, фосфор і сірка, але основні складові - це вуглець, гідроген і кисень. Жири (також називають ліпідами) складаються в основному з гліцерину та жирних кислот. Гліцерин містить атоми вуглецю, гідрогену та кисню. Жирні кислоти мають подібний елементний склад, включаючи атоми вуглецю, гідрогену та кисню, але вони також містять карбоксильну групу (-COOH) на кінці молекули. Отже, основні відмінності у елементному складі білків, вуглеводів та жирів полягають
вмісті різних елементів (азоту в білках, вуглецю, гідрогену і кисню в вуглеводах та жирах) та в структурних особливостях їхніх складових. 493. Які реакції називають кольоровими та для чого їх застосовують? Кольорові реакції (або реакції з утворенням барвних сполук) - це хімічні реакції, під час яких утворюються продукти, що мають характерний колір. Ці реакції можуть бути використані в аналітичій хімії для виявлення наявності певних речовин або для визначення їхньої концентрації.
Завдання для засвоєння матеріалу
Комплексні завдання
494. Під час гідролізу трипептиду масою 46,2 г з натрій гідроксидом утво- рилася сіль тільки однієї насиченої амінокислоти масою 66,6 г. Визначте цю амінокислоту.
Позначимо масу кислоти М. Тоді маса трипептиду буде 3М - 2H2O = 3M - 36
Маса натрієвої солі кислоти буде M - H + Na = M + 22
За умовами 3(M + 22)/3M – 36 = 66,6/46,2
3M +66 = 1,4416 (3M - 36)
3M +66 = 4,325M - 51,84
1,325 M = 117,84
M = 89
495. Визначте, якою може бути відносна молекулярна маса білка, в якому масова частка Сульфуру становить 0,4 %. Під час обчислень прийміть до уваги, що в молекулі білка щонайменше два залишки молекул амі- нокислот, у яких по одному атому Сульфуру в молекулі. Масова частка сульфуру в молекулі білка становить 0,4%, що означає, що на кожні 100 одиниць маси білка припадає 0,4 одиниць маси сульфуру. Так як в молекулі білка є щонайменше два залишки молекул амінокислот, у яких по одному атому сульфуру в молекулі, то максимальна кількість сульфуру в молекулі може бути 2 * 32 = 64 г/моль (адже атомна маса сульфуру дорівнює близько 32 г/моль). Отже, молекулярна маса білка, в якому масова частка сульфуру становить 0,4%, може бути максимум 100 / 0,4 * 64 = 16000 г/моль. Завдання з розвитку критичного мислення 496.У першій пробірці міститься розчин білка, а в другій — гліцеролу. За допомогою яких реакцій можна розрізнити вміст обох пробірок?
shkola.in.ua
Для розрізнення вмісту пробірок, що містять розчин білка і гліцерол, можна використовувати дві реакції: реакцію на білок і реакцію на гліцерол. Реакція на білок (наприклад, біуретова реакція): Біуретова реакція допоможе визначити наявність білка в першій пробірці. Під впливом біуретового реагенту білки утворюють фіолетовий комплекс, що відрізняється від кольору гліцеролу. Таким чином, перша пробірка з білком покаже позитивну реакцію на біуретовий реагент.
Реакція на гліцерол (наприклад, реакція з додаванням концентрованої сірчаної кислоти та хлорного кислоти): Гліцерол може пройти через дегідратацію у кислому
у
середовищі, утворюючи акролеїн. Акролеїн має характерний запах, який може бути відчутний, коли додається концентрована сірчана кислота та хлорна кислота до пробірки з гліцеролом. Отже, за допомогою реакцій на білок і гліцерол можна розрізнити вміст обох пробірок.
497. Як ви вважаєте, чи можна на тривалий час замінити білкову їжу на їжу, що складається тільки з жирів та вуглеводів? Які зміни відбуватимуться в організмі людини за такої дієти?
Заміщення білкової їжі на їжу, що складається тільки з жирів та вуглеводів, на тривалий термін є небажаним і може призвести до негативних наслідків для організму людини. Білки виконують безліч важливих функцій в організмі, і їх відсутність може вплинути на здоров'я та фізіологічні процеси.
Деякі можливі наслідки заміщення білкової їжі на їжу, що складається тільки з жирів та вуглеводів: Втрата м'язової маси: Білки важливі для побудови та підтримання м'язової тканини. Відсутність адекватного постачання білків може призвести до втрати м'язової маси та зниження м'язового тонусу. Порушення імунної системи: Білки є важливим компонентом імунної системи. Вони допомагають виробляти антитіла та інші молекули, необхідні для боротьби з інфекціями та підтримання імунної відповіді.
Порушення гормональної рівноваги: Багато гормонів, які регулюють різні аспекти організму, такі як ріст, обмін речовин, апетит та інші, є білками або мають білкову структуру.
Порушення структурних функцій: Білки входять до складу багатьох клітинних структур, органел та тканин. Відсутність білків може призвести до порушення структурних функцій і властивостей клітин. Зниження синтезу ензимів: Багато ферментів, які керують хімічними реакціями в організмі, є білками. Відсутність адекватного постачання білків може знизити синтез ензимів та вплинути на метаболічні процеси. Отже, заміщення білкової їжі на їжу, що складається тільки з жирів та вуглеводів, може призвести до серйозних проблем зі здоров'ям, які можуть включати втрату м'язової маси, зниження імунітету, порушення гормональної рівноваги та інші. Раціональна дієта повинна включати в себе всі необхідні макро- та мікроелементи, включаючи білки, жири та вуглеводи.
498. Проаналізуйте наведену діаграму та дайте відповіді на запитання.
— На діаграмі порівнюють два білки: α-кератин у вовні та фіброїн павутинного шовку. Яким кольором позначено дані про білок, що міститься у вовні?
— Залишків якої амінокислоти найбільше міститься в павутинному фі- броїні?
— Яка мольна частка аланіну в α-кератині та фіброїні?
— Визначте мольну частку всіх інших амінокислот, не позначених на діаграмі, для обох білків.
— Павутинний фіброїн набагато міцніший матеріал за α-кератин у вов- ні. Якби ви були технологом текстильної компанії і перед вами постала задача виготовити якомога міцнішу тканину, то які амінокислоти ви б використали для створення поліпептидного волокна?
1. синім
2. З діаграми видно, що найбільше залишків амінокислоти гліцину міститься в павутинному фіброїні.
shkola.in.ua
3. З діаграми видно, що мольна частка аланіну у α-кератині становить 6%, а в фіброїні28%.
4. Щоб знайти мольну частку інших амінокислот, не позначених на діаграмі, треба відняти суму мольних часток всіх вказаних амінокислот від 100%.
5. Якщо мета - створення міцної тканини, то важливо використовувати амінокислоти з більшим вмістом бічних груп, які можуть сприяти утворенню хімічних зв'язків, таких як дисульфідні зв'язки. Амінокислоти з сульфур-місткими бічними ланцюгами, такі як цистеїн і цистин, можуть бути важливими для забезпечення міцності тканини.
Міні-проекти 499. У кабінеті хімії разом з учителем виконайте експериментальний проект. Під час роботи дотримуйтеся правил безпеки.
Дослід 1. Обережно розбийте сире яйце так, щоб не ушкодити жовток. Відокремте невелику частину білка і помістіть її у дві пробірки. Якщо пробірку з білком нагріти на вогні, то слизувата маса стане білою й твердою, як це відбувається під час готування яєчні. Відбувається денатурація білка. На металевому дроті спаліть невеликий шматочок цього білка й понюхайте його. Утворюється характерний запах, що на- гадує запах паленого рога, за яким завжди можна впізнати білок. Дослід 2. Уміст другої пробірки обережно змішайте з водою, при цьо- му білок частково розчиняється. Енергійно струсіть уміст пробірки і спостерігайте утворення тягучої в’язкої маси — у разі механічного впливу білок також піддається денатурації. До тієї ж пробірки додайте розчин солі важкого металічного елемента, наприклад мідного купо- росу, і спостерігайте денатурацію під дією йонів металічних елементів. Дослід 3. Якщо потримати над вогнем пташине перо або волосся, від- чуєте знайомий запах паленого рога. Це свідчить про те, що перо й волосся містять білок.
§32. Високомолекулярні сполуки Контрольні запитання 500. Дайте визначення поняттям «полімер», «високомолекулярна сполука», «мономер», «елементарна ланка», «ступінь полімеризації», «макромо- лекула».
Полімер: Полімер - це хімічна сполука, що складається з довгого ланцюга однотипних або схожих повторюваних одиниць, які називаються мономерами. Полімери можуть мати різні структури і властивості, і вони зустрічаються у багатьох різних матеріалах. Високомолекулярна сполука: Високомолекулярна сполука - це сполука, яка має довгий ланцюг, складений з великої кількості мономерних одиниць. Це також відомо як полімер.
shkola.in.ua
Мономер: Мономер - це молекула, яка може бути повторювана у полімерному ланцюзі для створення полімеру. Мономери з'єднуються між собою через хімічні зв'язки під час процесу полімеризації. Елементарна ланка: Елементарна ланка - це найменша повторювана одиниця в полімерному ланцюзі. Вона складається з одного або декількох мономерних одиниць. Ступінь полімеризації: Ступінь полімеризації - це кількість мономерних одиниць (повторюваних одиниць) у полімерному ланцюзі. Він вказує на довжину полімеру. Макромолекула: Макромолекула - це велика молекула, така як полімер або білок, яка складається з великої кількості атомів чи мономерних одиниць, з'єднаних між собою. 501. Що називають термопластичністю? Які полімери називають термопластичними, а які — термореактивними? Чим вони відрізняються? Наведіть приклади.
Термопластичність - це властивість полімерів, яка полягає в їхній здатності змінювати свою форму та структуру при підвищенні температури і повертатися до попередньої
форми при зниженні температури. Термопластичні полімери можуть бути плавлені та формовані в різноманітні вироби без докладного руйнування їхньої структури.
Термопластичні полімери - це полімери, які при підвищенні температури м'якшають, розплавляються та стають формованими. При охолодженні вони затвердіють та зберігають нову форму. Термореактивні полімери - це полімери, які при обробці високою температурою втрачають свою пластичність і вступають у хімічні реакції, які призводять до великого зміцнення структури. Після затвердіння ці полімери не можуть бути розплавлені та перероблені без докладного знищення структури.
Відмінність між термопластичними та термореактивними полімерами полягає в їхньому поведінці при обробці та після охолодження. Термопластичні полімери плавляться, можуть бути легко формовані та перероблені багато разів, тоді як термореактивні полімери реагують на високу температуру шляхом хімічних змін, які нереверсібельно зміцнюють їхню структуру. Приклади термопластичних полімерів: поліетилен, поліпропілен, полістирол, полівінілхлорид.
Приклади термореактивних полімерів: епоксидна смола, фенольна смола.
502.Схарактеризуйте відмінності механічних властивостей та здатності
розчинятися для високо- та низькомолекулярних речовин. Високомолекулярні та низькомолекулярні речовини мають суттєві відмінності у механічних властивостях та здатності розчинятися через їхню молекулярну структуру та взаємодії між молекулами. Ось деякі з основних різниць: Механічні властивості: Високомолекулярні речовини:
• Вони мають велику кількість атомів у молекулярному ланцюзі, що призводить до більшої довжини і великих молекулярних мас.
• Високомолекулярні речовини, як правило, мають високу міцність та стійкість через їхню велику молекулярну масу та структурну організацію. Вони можуть
витримувати великі навантаження та деформації.
• Властивості високомолекулярних речовин можуть бути змінені за допомогою різних методів обробки та модифікації.
Низькомолекулярні речовини:
• Вони мають невелику кількість атомів у молекулярній структурі, що призводить до менших молекулярних мас.
• Зазвичай низькомолекулярні речовини мають меншу міцність та стійкість порівняно з високомолекулярними речовинами.
shkola.in.ua
• Їхні механічні властивості зазвичай не можуть бути значно змінені шляхом обробки або модифікації, оскільки їхня молекулярна структура обмежує зміни. Здатність розчинятися: Високомолекулярні речовини:
• Вони зазвичай малорозчинні або нерозчинні в більшості розчинниках через їхню велику молекулярну масу та міцні внутрішні молекулярні зв'язки. Низькомолекулярні речовини:
• Вони зазвичай добре розчиняються в різних розчинниках, оскільки їхні молекули мають менші розміри та слабкі взаємодії між собою.
Узагальнюючи, високомолекулярні речовини мають більшу міцність та стійкість, але меншу здатність до розчинення порівняно з низькомолекулярними речовинами.
503.Схарактеризуйте різну будову макромолекул. Як будова макромолекул
позначається на властивостях полімерів?
Макромолекули, які включають полімери, можуть мати різні типи будови, які впливають на їхні механічні, хімічні та фізичні властивості. Ось декілька типів будови макромолекул та їх вплив на властивості полімерів: Лінійні полімери: У лінійних полімерах мономери пов'язані у ланцюг, який не має гілок або перетинів. Це робить їх властивими для розтягування і вигину. Лінійні полімери можуть мати високу міцність та еластичність, але їх здатність до пластичної деформації обмежена. Гілковані полімери: Гілковані полімери мають додаткові гілки або відгалуження від основного полімерного ланцюга. Це може покращити їх міцність, гнучкість та здатність до пластичної деформації. Перетинані полімери: Вони мають перетини між різними полімерними ланцюгами. Це може призвести до зміцнення матеріалу і підвищення його термостійкості. Сітчасті полімери: Вони мають мережу з взаємопов'язаних полімерних ланцюгів. Це робить їх міцними, стійкими до розчинення та добре влаштованими для виготовлення твердих і гумових матеріалів. Зігнуті полімери: Деякі полімери можуть мати завивисту або спіральну форму, що може впливати на їхні фізичні властивості. 504.Чим відрізняються реакції полімеризації та поліконденсації? Які полімери добувають за першою реакцією, а які — за другою? Полімеризація та поліконденсація - це два різних механізми утворення полімерів, які відрізняються процесом реакції та результатом. Полімеризація:
• Це процес, у якому відбувається з'єднання мономерних одиниць без виділення небажаних побічних продуктів (наприклад, води чи інших реакційних залишків).
• Полімеризація може відбуватися за різними механізмами, такими як радикальна, каталізаторна, катіонна полімеризація тощо.
• Результатом полімеризації є утворення лінійних, гілкованих або сітчастих полімерних ланцюгів.
• Приклади полімерів, утворених за механізмом полімеризації: поліетилен, поліпропілен, полістирол. Поліконденсація:
• Це процес, у якому мономери з'єднуються за участю хімічних реакцій конденсації, залишки яких можуть виділятися у вигляді небажаних побічних продуктів (наприклад, вода, спирт, аміак і т.д.).
• В процесі поліконденсації зазвичай відбувається звуження молекулярних ланцюгів, що може впливати на молекулярну масу та властивості полімеру.
shkola.in.ua
• Поліконденсація може призводити до утворення різних функціональних груп в полімерних ланцюгах.
• Приклади полімерів, утворених за механізмом поліконденсації: поліестери, поліаміди (наприклад, нейлон), поліуретани. Отже, реакції полімеризації та поліконденсації відрізняються механізмом з'єднання мономерів та виділенням побічних продуктів. Результатом полімеризації є полімери зі збереженою структурою мономерів, а результатом поліконденсації - полімери, де можуть бути втрачені певні функціональні групи та звуження молекулярних ланцюгів.
Завдання для засвоєння матеріалу
505. Поясніть, що спільного та відмінного у поняттях «мономер» та «елементарна
ланка».
Поняття "мономер" та "елементарна ланка" пов'язані з побудовою та структурою
полімерів, але мають деякі відмінності.
Мономер - це однакова або схожа хімічна одиниця, яка може бути повторена в
полімерному ланцюзі під час процесу полімеризації. Мономери можуть бути одноатомними або складнішими молекулами, які повторюються для створення полімеру.
Елементарна ланка - це найменша повторювана одиниця в полімерному ланцюзі. Вона може складатися з одного або кількох мономерних одиниць. Елементарна ланка
визначає структурну одиницю, яка повторюється в полімері, і може бути основою для будови довшого полімерного ланцюга.
Спільне:
Обидва поняття пов'язані зі структурою полімерів і вказують на повторюваність одних і тих самих хімічних одиниць у полімерному ланцюзі.
Відмінності:
Мономер - це окрема хімічна одиниця, яка може бути використана для створення полімеру. Вона має свою власну хімічну структуру та властивості.
Елементарна ланка - це структурна одиниця, яка складається з кількох мономерних одиниць і повторюється у полімері. Вона може мати іншу структуру та властивості, ніж окремий мономер. Отже, мономери є будівельними блоками для створення полімерів, а елементарні ланки є структурними одиницями, які складаються з мономерних одиниць і повторюються у полімерному ланцюзі. 506. Поясніть, як пов’язана будова макромолекул полімерів з їхніми властивостями. Проілюструйте прикладами. Будова макромолекул полімерів має велике вплив на їхні механічні, фізичні та хімічні властивості. Різні типи полімерної структури визначають здатність полімерів витримувати навантаження, гнучкість, твердість, теплостійкість, розчинність та багато інших характеристик. Ось кілька прикладів, як будова впливає на властивості полімерів: Лінійні полімери: Лінійні полімери, які складаються з довгих ланцюгів мономерів, мають здатність до вигинання і розтягування. Це надає їм деяку еластичність, та зазвичай забезпечує твердість, пружність та міцність. Приклади: поліетилен, поліпропілен.
Сітчасті полімери: Сітчасті полімери мають взаємопов'язані полімерні ланцюги, які утворюють мережу. Це надає їм стійкість до витягування та вигинання, та робить їх твердими та міцними. Приклади: полістирол, фенольна смола. Гілковані полімери: Гілковані полімери мають додаткові гілки, що покращує їх гнучкість, пластичність та здатність до деформації. Гілковані полімери можуть бути менш жорсткими та більш еластичними. Приклади: низькогустинний поліетилен. Перетинані полімери: У полімерах з перетинами між ланцюгами відбувається зміцнення структури. Це може покращити їх міцність та стійкість до температурних змін. Приклади: нитратцелюлоза. Зігнуті полімери: Деякі полімери мають завивисту або спіральну структуру, що може впливати на їх фізичні та оптичні властивості. Приклади: гідроксипропілметилцелюлоза.
shkola.in.ua
507. Утворення крохмалю у рослинах з глюкози є реакцією полімеризації чи поліконденсації?
Утворення крохмалю у рослинах з глюкози є реакцією полімеризації. Крохмаль є природним полімером, який утворюється з молекул глюкози шляхом послідовного
з'єднання за відсутності виділення небажаних побічних продуктів, як це відбувається
поліконденсаційних реакціях.
Комплексні завдання
508.Формулу поліпропілену можна записати так: H–[CH2–CH(CH3)]n–H. Визначте молярну масу поліпропілену, якщо кожна молекула містить по 150 структурних ланок.
Дано:
H-[CH2-CH(CH3)]n-H
n=150
Знайти:
M(H-[CH2-CH(CH3)]n-H) - ?
Розв‘язання :
M(полімеру) = n ∙ Mr(ел.ланки),
М(H-[CH2-CH(CH3)]n-H) = 150х (12х3 + 1х6) + 1х2= 6302 г/моль Відповідь: 6302 г/моль
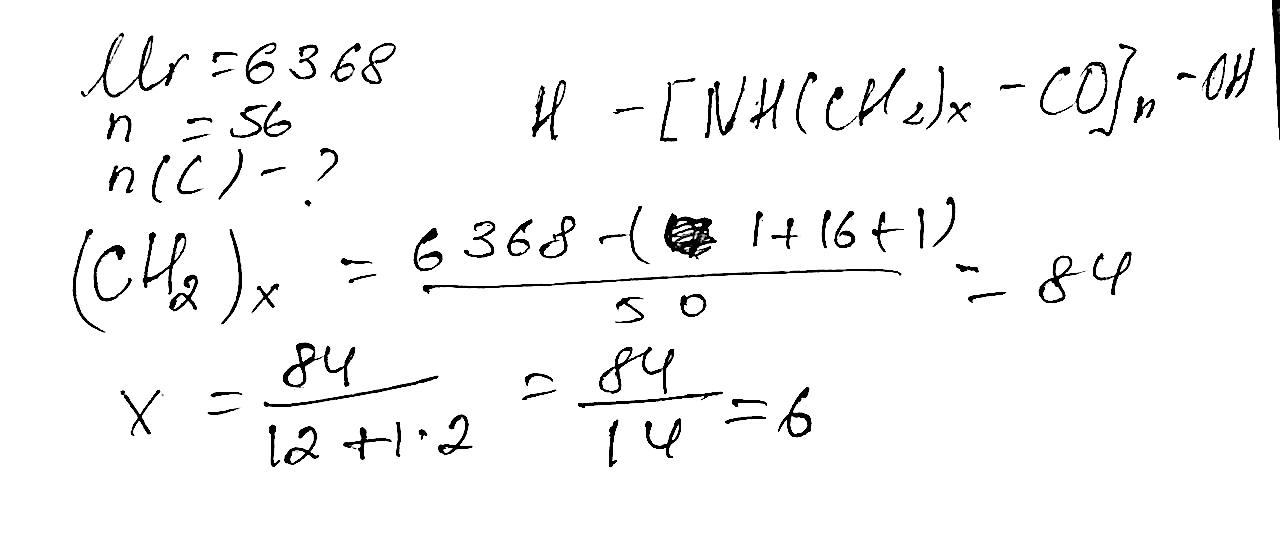
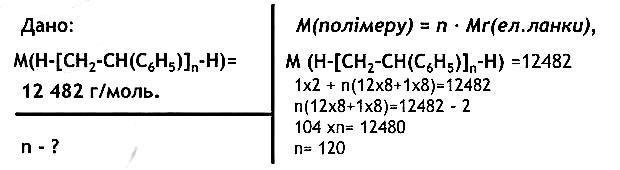
509.Формулу полістиролу можна записати так: H–[CH2–CH(C6H5)]n–H. Ви- значте число структурних ланок у його молекулах n, якщо його мо- лярна маса дорівнює 12 482 г/моль.
510. Формулу капрону, що є продуктом поліконденсації певної амінокис- лоти, можна записати так: H–[NH–(CH2)х–CO]n–OH. Визначте число атомів Карбону в одній молекулі цієї амінокислоти, якщо молярна маса капрону дорівнює 6368 г/моль, а кожна його молекула містить по 50 структурних ланок.
shkola.in.ua
в
Завдання з розвитку критичного мислення 511. Як ви вважаєте, в яких випадках ми спостерігаємо еластичність білків як полімерів лінійної форми? Відповідь проілюструйте прикладами. Еластичність білків як полімерів лінійної форми спостерігається у випадках, коли білкові ланцюги можуть піддаватися вигину, розтягуванню та деформації, але при цьому зберігають свою структуру та повертаються до початкового стану після припинення навантаження. Така еластичність може бути пов'язана з наявністю гнучких зв'язків та конформаційних змін у білковій структурі. Приклади:
Еластин: Еластин є білком, що забезпечує еластичність та пружність в тканинах, таких як шкіра, легені та судини. Він має лінійну структуру та спряжені гідроскопічні
амінокислоти, які дозволяють ланцюгам розтягуватися та повертатися в початковий стан.
М'язовий білок титін: Титін є найбільшим білком у м'язах і має властивість еластично розтягуватися. Він допомагає м'язам повертатися до початкової довжини після зміщення під час скорочення.
Дезмін: Дезмін - це білок, який утворює волокнисті структури в клітинних тканинах.
Він забезпечує структурну підтримку і еластичність. 512. Що є спільного та відмінного в будові сітчастих полімерів і речовин з атомними кристалічними ґратками?
Спільне: Регулярність в структурі: Як у сітчастих полімерах, так і в атомних кристалах, структура може бути дуже регулярною, з встановленими взаємними відстанями між атомами або групами атомів. Повторюваність: Як сітчасті полімери, так і атомні кристали складаються з повторюваних одиниць - в сітчастих полімерах це повторюючіся структурні мотиви, а в атомних кристалах це атоми, розташовані в ґратці. Зліплювання частинок: Як у сітчастих полімерах, так і в атомних кристалах, частинки (молекули або атоми) зліплюються між собою за певних умов, утворюючи тривимірну структуру.
Відмінності: Склад:
• Сітчасті полімери: Складаються з повторюючихся молекулярних одиниць, які можуть бути різного хімічного складу.
• Атомні кристали: Складаються з атомів одного або кількох видів, які утворюють атомні ґратки.
Типи зв'язків:
• Сітчасті полімери: Молекули утримуються разом зв'язками координації, водними зв'язками або іншими слабкими хімічними зв'язками.
shkola.in.ua
• Атомні кристали: Атоми утримуються разом відносно сильними хімічними зв'язками, такими як ковалентні або йонні зв'язки. Розмір:
• Сітчасті полімери: Зазвичай мають більші розміри і більше гнучкості, що дозволяє їм деформуватися та розтягуватися.
• Атомні кристали: Мають точкові розміри атомів, що визначають їхню геометрію. Властивості: • Сітчасті полімери: Зазвичай мають більш слабкі механічні властивості, здатні до деформації та гнучкості.
Атомні кристали: Мають чітко визначені атомні розташування, які визначають їхні хімічні, механічні та оптичні властивості.
513. Як ви вважаєте, чому розчинні полімери не утворюють істинних розчинів?
Розчинні полімери не утворюють істинних розчинів через особливості їхньої молекулярної структури та взаємодії з розчинником. Основні причини такої поведінки включають: Великий розмір молекул: Молекули розчинних полімерів зазвичай мають велику молекулярну масу та довжину. Це робить їх важкими для диспергування в розчиннику на молекулярному рівні. Значна взаємодія між полімерними ланцюгами: Велика кількість хімічних зв'язків або фізичних взаємодій між полімерними ланцюгами може призводити до утворення агрегатів або великих структур, які утримують ланцюги разом.
Сильна солватація: Полімери можуть зв'язувати розчинник великою кількістю місць на своїй поверхні. Це може створювати зони солватації, які утримують полімери разом у великих агрегатах. Молекулярна структура: Розчинні полімери можуть мати гідрофільні та гідрофобні частини в своїй молекулярній структурі. Це може спричиняти утворення мікрофаз, де гідрофільні частини привертаються до розчинника, а гідрофобні - відтіскають його. Інтра- та міжмолекулярні взаємодії: Розчинні полімери можуть мати міжмолекулярні зв'язки, такі як водні зв'язки, воднізв'язні мостики тощо, які зміцнюють їхню структуру. 514. Поясніть справедливість ключової ідеї параграфа. Справедливість ключової ідеї параграфа §32 полягає в поясненні основних понять та характеристик високомолекулярних сполук, які включають полімери та біополімери. Ключова ідея цього параграфа полягає в тому, що високомолекулярні сполуки мають дуже велику молекулярну масу через повторення мономерних одиниць у їхніх ланцюгах. Ця ідея є важливою для розуміння природи, властивостей та застосувань полімерів.
§33. Полімерні матеріали. Пластмаси Контрольні запитання
515. Які матеріали називають пластмасами? Пластмасами називають широкий клас полімерних матеріалів, які можуть бути синтетичними або напівсинтетичними, і використовуються у виробництві різноманітних товарів.
516. Які речовини використовують для створення пластмас?
Для створення пластмас використовують різні хімічні речовини, які називають мономерами. Деякі з них включають етилен для виготовлення поліетилену, стирол для полістиролу, вінілхлорид для ПВХ, акрилонітрил, бутадієн та стирол для ABS тощо. 517. Наведіть приклади полімерів, пластмас на їх основі та виробів, що з них
виготовляють.
Поліетилен (PE):
shkola.in.ua
• Види: Високогустинний поліетилен (HDPE), низькогустинний поліетилен (LDPE).
• Приклади виробів: Пляшки для напоїв, пластикові пакети, контейнери для їжі.
Поліпропілен (PP):
• Приклади виробів: Тара для продуктів, автомобільні деталі, пластикові посудини.
Полівінілхлорид (PVC):
• Приклади виробів: Труби для водопостачання, вікна, електричні ізоляційні матеріали.
•
Полістирол (PS):
• Приклади виробів: Одноразовий посуд, упаковка, ізоляційні матеріали.
Поліетилентерефталат (PET):
• Приклади виробів: Пляшки для напоїв, текстильні волокна, упаковка.
Акрилонітрил-бутадієн-стирол (ABS):
• Приклади виробів: Автомобільні деталі, іграшки, електроніка.
Полікарбонат (PC):
• Приклади виробів: Окуляри, пляшки, пластикові вікна. Поліуретан (PU):
• Приклади виробів: Меблі з пінною наповнювачем, ізоляційні матеріали, оббивка автомобільних сидінь.
518. У який спосіб маркують вироби з пластмас? Вироби з пластмас можуть бути марковані різними способами, включаючи:
Застосування знаків і логотипів: Багато виробників друкують на виробах свій знак або логотип, які дозволяють ідентифікувати бренд чи компанію. Вирізання або вигравірування: Виробники можуть вирізати або вигравірувати інформацію, наприклад, назву товару, серійний номер або інші дані, безпосередньо на поверхні пластмасового виробу.
Етикетки та наклейки: Велика кількість виробів має наклейки або етикетки з інформацією про виріб, виробника, інструкції з використання тощо. Лазерний маркування: Використання лазерних променів дозволяє наносити дуже точну інформацію на поверхню пластмаси.
Відбитки чи тиснення: Іноді виробники можуть створювати відбитки чи тиснення на поверхні пластмаси, що додає виробу характеристичний вигляд.
QR-коди або штрих-коди: Електронні або оптичні коди можуть бути нанесені на виріб, де міститься додаткова інформація, яку можна зчитати з використанням спеціальних пристроїв.
519. У чому полягає природоохоронний аспект застосування пластмасових виробів людством? Застосування пластмасових виробів має як позитивні, так і негативні природоохоронні
аспекти:
Позитивні аспекти: Енергозбереження: Деякі пластмаси є легкими та мають добру теплоізоляцію, що дозволяє зменшити енергоспоживання для опалення та охолодження будівель.
Зменшення використання природних ресурсів: Виробництво пластмасових виробів може вимагати менше природних ресурсів порівняно з традиційними матеріалами, такими як метал чи скло.
Зменшення ваги транспортних засобів: Використання пластмас допомагає знизити вагу автомобілів та інших транспортних засобів, що може призвести до зменшення
shkola.in.ua
споживання пального та викидів CO2. Негативні аспекти: Забруднення довкілля: Пластмаси є стійкими до розкладу та можуть залишатися
природі на десятиліття, спричиняючи забруднення середовища. Мікропластик: Розклад пластмас відбувається на менші фрагменти, які можуть потрапити у водні екосистеми, включаючи океани, та негативно впливати на морських організмів. Ресурсоємність виробництва: Виробництво пластмас вимагає нафти та інших важких вуглеводнів, що може вести до експлуатації природних ресурсів та викидів CO2.
в
Проблеми з утилізацією: Велика частина пластмасових виробів після використання
відправляється на сміттєзвалища або попадає до океанів, що має негативний вплив на довкілля.
Завдання для засвоєння матеріалу
520. Для полімерів, наведених у таблиці 15, складіть формули мономерів.
Поліетилентерефталат:
Мономери: Етиленгліколь та терефталова кислота.
Поліетилен високої густини (поліетилен низького тиску):
Мономер: Етилен.
Полівінілхлорид:
Мономер: Вінілхлорид (хлоретилен).
Поліетилен низької густини (поліетилен високого тиску):
Мономер: Етилен.
Поліпропілен:
Мономер: Пропілен.
Полістирол:
Мономер: Стирол.
Пінополістирол:
Пінополістирол є варіантом полістиролу, у якому додано пухирці, які утворюють піноподібну структуру.
521. Для чого необхідне маркування пластмасових виробів? Маркування пластмасових виробів має декілька важливих цілей: Ідентифікація: Маркування дозволяє ідентифікувати виріб та встановити його характеристики, такі як виробник, модель, серійний номер тощо. Це може бути корисним для виробників, дистриб'юторів, продавців та споживачів. Брендування: Маркування дозволяє вирізняти продукцію конкретного бренду чи компанії. Це може впливати на рекламу, лояльність споживачів та відомість бренду. Інформація для споживачів: На маркуванні може бути надрукована корисна інформація для споживачів, така як інструкції з використання, попередження та попередження про безпеку, технічні характеристики тощо.
Законодавча вимога: Деякі продукти, особливо ті, які можуть впливати на здоров'я та безпеку споживачів, повинні мати обов'язкове маркування згідно з вимогами законодавства.
Слідження та контроль якості: Маркування допомагає вести слідження за переміщенням та реалізацією виробів, а також контролювати якість та відповідність стандартам.
Екологічна ініціатива: Маркування може включати інформацію про екологічні параметри виробу, такі як можливість переробки, вторинне використання тощо. 522. Як ви вважаєте, що мають на увазі, коли про безпечність полімерів пишуть «Вважається безпечним для...»? Чому у цьому випадку не пи- шуть більш конкретно про безпечність чи небезпечність матеріалів? Фраза "Вважається безпечним для..." вказує на те, що існує певний ступінь неоднозначності або відсутність абсолютних даних щодо безпеки використання даного полімеру. Коли вказують "вважається безпечним", це може означати, що на даний момент немає доказів або зазначених ризиків для певних застосувань.
Існує декілька причин, чому можуть застосовувати менш конкретне формулювання: Невизначеність довгострокових наслідків: Деякі матеріали можуть бути безпечними для короткотривалого використання, але можуть викликати проблеми здоров'я при
shkola.in.ua
тривалому впливі. Оскільки довгострокові наслідки можуть бути складні для передбачення, вони можуть сказати, що матеріал "вважається безпечним", але не можуть гарантувати безпеку в кожному випадку. Варіація в реакціях на матеріали: Люди можуть виявляти різну чутливість до різних матеріалів. Те, що може бути безпечним для одних людей, може викликати алергічні реакції чи інші проблеми для інших. Обмежена наукова інформація: У деяких випадках може бути обмежена наукова інформація про певний матеріал, особливо якщо він є новим на ринку. Це може
зумовити використання менш конкретних висловів.
Юридичні аспекти: В умовах судових позовів і правових вимог, фраза "вважається безпечним" може допомогти компаніям уникнути відповідальності у разі спірних ситуацій.
Загалом, такий підхід може відображати відсутність однозначної відповіді щодо безпеки та наголошує на необхідності обачності та подальшого дослідження при використанні даного матеріалу.
Міні-проекти
523. Розробіть план експериментів для дослідження того, як швидко
розкладаються звичайні та біорозкладні пластмаси. Якщо вчитель схвалить ваш план, виконайте свої експерименти, використовуючи різні споживчі товари.
Етап 1: Підготовка зразків Зібрати зразки звичайних пластмас і біорозкладних пластмас різних типів (наприклад, поліетилен, поліпропілен, PLA тощо).
Визначити розмір і масу кожного зразка.
Етап 2: Експозиція до середовища Розмістити зразки в різних середовищах для розкладу, таких як:
• Земля у відкритому повітрі.
• Вода (наприклад, в морі або водоймі).
• Умови компосту чи садового грунту. Планувати регулярні інтервали часу для збору даних (наприклад, кожний тиждень чи місяць).
Етап 3: Збір та аналіз даних Регулярно вимірювати зміни в розмірі, масі та структурі зразків. Виміряти втрату маси (деґрадацію) під час кожного вимірювання.
Зіставити зміни між звичайними та біорозкладними пластмасами. Етап 4: Аналіз результатів Використовувати дані для створення графіків, які покажуть, як змінюється розмір та маса зразків з часом.
shkola.in.ua
Аналізувати темпи розкладу для різних типів пластмас та середовищ. Етап 5: Висновки та інтерпретація Зробити висновки про те, як швидко розкладаються різні типи пластмас в різних середовищах. Розглянути можливі причини різниці в швидкості розкладу, такі як хімічна структура матеріалу, властивості середовища та т.д. Дискутувати про практичні наслідки дослідження для використання біорозкладних пластмас та їхнього впливу на довкілля. 524. Виготовлення покриття з полімерної плівки. У кабінеті хімії разом з учителем виконайте експериментальний проект. Під час
роботи дотримуйтеся правил безпеки.
Полімерними плівками часто покривають таблиці чи малюнки для запобігання
забрудненню та пошкодженню паперової поверхні. Для створення полімерної плівки на папір наносять розбавлені розчини полімерів. Для приготування таких розчинів 1
подрібненого по- лімеру (оргскло, полістирол) розчиняють у 50 мл придатного органічного розчинника (можна використати рідину для зняття лаку або бензин). Розчин наносять кілька разів після повного висихання по- переднього шару. Покриття виготовляють на відкритому повітрі або у витяжній шафі, щоб уникнути отруєння леткими розчинниками.
§34. Каучуки Контрольні запитання
525. Що таке еластомери? Еластомери - це клас полімерів, які мають високу еластичність і гумовий характер. Вони також відомі як гуми або каучуки. Основною властивістю еластомерів є їх здатність повертатися до своєї початкової форми після деформації, а це відбувається за рахунок внутрішніх молекулярних сил, які дозволяють полімеру розтягнутися та повернутися до своєї первинної форми. Головною причиною такої властивості є використання специфічних молекулярних структур та взаємодій. У еластомерах зазвичай присутні довгі ланцюги полімерних молекул, які можуть рухатися одна відносно одної, але також містять перехресні зв'язки між ланцюгами, які призводять до того, що при деформації молекули здатні повертатися в початкове положення. Еластомери використовуються для виготовлення гумових виробів, таких як шини, пружини, ущільнювачі, резинові деталі, силіконові вироби та інші гнучкі вироби, де важлива властивість еластичності і здатність відновлювати форму.
526. Які матеріали називають каучуками? Каучуками називають матеріали, які мають високу еластичність та здатність до відновлення форми після деформації.
527. Поясніть, чому для каучуків характерна еластичність.
Еластичність каучуків зумовлена їхньою молекулярною структурою, яка містить перехресні зв'язки між ланцюгами та вільно рухливість молекул. Ці зв'язки дозволяють каучукам деформуватися під впливом зовнішньої сили і повертатися до початкової форми, коли сила зникає. 528. Чим відрізняється натуральний каучук від синтетичного? Які існують види синтетичних каучуків? Чим вони відрізняються? Натуральний каучук походить з соку дерева гевеї, тоді як синтетичний каучук виготовляють хімічним шляхом. Синтетичні каучуки включають стирол-бутадієн, нітрильний, силіконовий тощо. Вони відрізняються хімічною структурою та властивостями.
shkola.in.ua
529. Що таке вулканізація? Які матеріали добувають вулканізацією каучуків? Чим відрізняються ці матеріали? Вулканізація - це хімічний процес, в якому каучукові матеріали обробляють теплом та додатковими хімічними речовинами для зміцнення їхньої структури. Вулканізовані каучуки стають більш міцними, менш придатними до деформації та більш стійкими до температурних змін.
Процес вулканізації застосовують до натурального каучуку та різних типів синтетичних каучуків, таких як стирол-бутадієн, нітрильний, епіхлоргідриновий тощо. Вулканізовані
–2 г
каучуки мають вищу стійкість до зносу, розриву та агресивних середовищ, порівняно
невулканізованими.
Завдання для засвоєння матеріалу
530. Складіть рівняння реакцій для здійснення перетворень за схемами:
a) CH3-CH2-CH2-CH2-CH3 (t*, AlCl3) > CH3-CH(CH3)-CH2-CH3
CH3-CH(CH3)-CH2-CH3 (t*, Ni/Pt) > CH2=C(CH3)-CH2=CH2 + 2H2
nCH2=C(CH3)-CH2=CH2 (кат) > [-CH2-C(CH3)=CH-CH2-]n
б) C2H6 (t*, Ni/Pt) > C2H4 + H2
C2H4 (ініціатор) > 2CH2•
в) 2CH4 (1500*)--> C2H2 + 3H2
C2H2 + H2 (t*, Ni/Pt)--> C2H4
C2H4 + H2O (H+, t*<140*) > C2H5OH
2C2H5OH (450*, Al2O3 + ZnO) > CH2=CH-CH=CH2 + 2H2O + H2
CH2=CH-CH=CH2 (ініціатор) > 2CH2• + С2H2
§35. Природні та хімічні волокна Контрольні запитання
531. Схарактеризуйте класифікацію волокон. На яких ознаках вона ґрунтується? Класифікація волокон ґрунтується на наступних ознаках: По походженню:
• Натуральні волокна: отримані з рослин (бавовна, льон, конопля), тварин (шовк), мінералів (асбест).
• Синтетичні волокна: створені хімічно (нейлон, поліестер, поліпропілен).
По хімічній будові:
• Натуральні білкові волокна: наприклад, шовк.
• Натуральні целюлозні волокна: наприклад, бавовна, льон.
• Синтетичні волокна: створені з полімерів, таких як поліестер, нейлон.
По застосуванню та властивостях:
• Волокна для текстилю: використовуються в одязі та текстильних виробах.
• Технічні волокна: застосовуються у виробництві шин, ремінців, робочого
спорядження тощо.
532.Поясніть, чим відрізняються штучні та синтетичні волокна. Наведіть
приклади штучних та синтетичних волокон. Штучні волокна виготовляють з природних матеріалів, таких як деревина або целюлоза, шляхом хімічних процесів. Синтетичні волокна створюються повністю хімічним шляхом зі сировини, яка зазвичай є нафтопродуктом.
Приклади штучних волокон: віскоза, ацетат.
Приклади синтетичних волокон: поліестер, нейлон, поліпропілен.
Ці дві категорії волокон відрізняються походженням сировини та методами
виробництва, що впливає на їхні властивості та застосування. 532. Перелічіть синтетичні волокна та галузі їх застосування. Синтетичні волокна: поліестер, нейлон, акрил, поліпропілен. Галузі застосування: текстильна промисловість (одяг, білизна, текстильні вироби), виробництво штучної трави, автомобільна та аерокосмічна промисловість, ущільнювачі, ремінці, робоче спорядження тощо. Завдання для засвоєння матеріалу
533. До якої групи полімерів відносять капронове волокно за різними класифікаційними ознаками?
з
shkola.in.ua
Капронове волокно відноситься до групи синтетичних волокон. В класифікації за хімічною будовою це азотистий синтетичний полімер (поліамід), а за походженнямсинтетичне волокно, створене з нафтопродуктів. 535. У чому переваги хімічних волокон перед натуральними?
Переваги хімічних волокон перед натуральними включають вищу міцність, стійкість до зносу, стабільність у вологому середовищі, можливість контролювати властивості під час виробництва, менший ризик руйнування під впливом мікроорганізмів та
біологічних факторів.
536. Чи можливо замінити натуральні волокна хімічними в усіх галузях
застосування волокон?
Ні, заміна натуральних волокон хімічними не завжди є можливою в усіх галузях
застосування волокон. Натуральні волокна мають свої унікальні властивості, які можуть бути недосяжні для хімічних аналогів. Наприклад, шовк володіє надзвичайною міцністю та благородним виглядом, бавовна має дихаючість та комфорт при контакті зі шкірою. Отже, в деяких випадках, натуральні волокна залишаються незамінними для досягнення певних властивостей виробів. 537. Що є спільного та відмінного між найлоном та поліетиленом?
Спільне між найлоном та поліетиленом: Хімічна структура: Обидва ці матеріали належать до синтетичних полімерів, і вони мають лінійну або вигнуту хімічну структуру. Висока міцність: Найлон і поліетилен відзначаються досить високою міцністю, що робить їх важливими матеріалами в різних галузях. Відмінності між найлоном та поліетиленом: Хімічна структура: Найлон належить до класу поліамідів і має азотні атоми у своїй структурі, тоді як поліетилен - це полімер з вуглецевими і водневими атомами. Температурна стійкість: Найлон може витримувати вищі температури порівняно з поліетиленом, що робить його популярним у виробництві волокон та пластмасових виробів, які піддаються нагріванню.
Застосування: Найлон використовується у виробництві штучних волокон, шнурів, пластикових виробів, а також у текстильній та автомобільній промисловості.
Поліетилен широко використовується у виробництві пластикових пакетів, контейнерів, труб і засобів пакування.
Міні-проекти 538. Дослідження волокон різного походження.
Дослід 1. Вовну одержують із волосяного покриву овець, кіз та інших тварин. Отже, вона містить білок. Якщо шерстяну нитку підпалити, то пошириться запах паленого білка. Бавовну одержують із рослин, і якщо її підпалити, то відчуєте зовсім інший запах — запах паленого паперу. Випробуйте яку-небудь тканину. Зробити це дуже просто — потрібно висмикнути з неї кілька ниток і спалити. За запахом легко визначити, з якою тканиною ми маємо справу — вовняною чи бавов- няною.
shkola.in.ua
Дослід 2. У кабінеті хімії разом з учителем виконайте експеримен- тальний проект. Під час роботи дотримуйтеся правил безпеки. Розрізнити вовняне та бавовняне волокна можна й іншим способом. Помістіть у пробірку з розчином натрій гідроксиду шматок вовняної тканини й обережно нагрійте розчин. Через деякий час тканина роз- чиниться. В аналогічному досліді з бавовняною тканиною такого не відбудеться, оскільки білки, на відміну від полісахаридів, піддаються гідролізу під дією лугів.
§36. Взаємозв’язок між органічними речовинами Контрольні запитання
539. Наведіть причини багатоманітності органічних сполук. Багатоманітність органічних сполук обумовлена різноманітністю можливих хімічних зв'язків та структур, що можуть утворюватися між атомами вуглецю та інших елементів. Вуглець може утворювати одинарні, подвійні та потрійні зв'язки з іншими атомами вуглецю і іншими елементами, а також різноманітні циклічні структури. Це дозволяє створювати велику кількість різних молекул з різними властивостями та функціями.
540. Схарактеризуйте взаємозв’язок між органічними та неорганічними речовинами, між класами органічних сполук. Органічні та неорганічні речовини відрізняються хімічною структурою та властивостями. Органічні сполуки містять атоми вуглецю, часто відображаючи складні молекулярні структури, тоді як неорганічні сполуки можуть містити інші хімічні елементи.Класи органічних сполук включають алкани, алкени, алкіни, ароматичні сполуки, спирти, альдегіди, кетони, кислоти, ефіри та інші. Ці класи визначаються за наявністю певних функціональних груп або хімічних зв'язків у молекулі.Взаємозв'язок між класами органічних сполук виражається у спільних структурних елементах та хімічних реакціях. Наприклад, алкени та алкіни можуть претерпівати адиційні реакції, а карбонільні групи (альдегіди та кетони) можуть бути зменшені до спиртів. Завдання для засвоєння матеріалу 541. Складіть рівняння реакцій для ілюстрації схеми взаємозв’язку органічних
неорганічних сполук, наведеної у параграфі. Взаємодія органічних та неорганічних сполук може бути проілюстрована реакцією нітрогенокислого калію (неорганічна сполука) з бензоїновою кислотою (органічна сполука) для утворення нітробензоїнової кислоти: Неорганічна сполука (нітрогенокислий калій): KNO3 Органічна сполука (бензоїнова кислота): C6H5COOH Реакція:
2C6H5COOH + 4KNO3 + H2SO4 → 2C6H5NO4 + K2SO4 + 2H2O + CO2
У цій реакції відбувається окиснення бензоїнової кислоти до нітробензоїнової кислоти за участі неорганічного нітрогенокислого калію.
542.Складіть схеми генетичних зв’язків А, Б і В (с. 217) на прикладі конкретних
сполук та складіть рівняння реакцій для їх здійснення.
А. Алкан → галогеноалкан → спирт → альдегід → карбонова кислота → естер.
Б. Алкан → алкін → алкен → спирт → альдегід → карбонова кислота →
галогенопохідна карбонової кислоти → амінокислота → → естер → амінокислота → поліпептид.
В Проста речовина → карбід → алкін → альдегід → спирт → естер.
Завдання з розвитку критичного мислення
shkola.in.ua
543.Проаналізуйте, як можна зіставити причини багатоманітності органічних сполук, перелічених у цьому параграфі, з такими: а) існування гомологів; б) різний характер карбонових ланцюгів: нерозгалужені, розгалужені та циклічні; в) різноманітність елементів, що містяться у складі органічних сполук (N, O, P, S тощо).
а) Існування гомологів (органічних сполук з однаковою функціональною групою та різною довжиною вуглецевого ланцюга) сприяє багатоманітності органічних сполук,
та
оскільки кожен новий гомолог має подібну хімічну структуру, але відрізняється за кількістю повторень однієї і тієї ж функціональної групи. б) Різний характер карбонових ланцюгів (нерозгалужені, розгалужені та циклічні) додає різноманітності органічним сполукам. Нерозгалужені аліфатичні ланцюги можуть бути
довгими або короткими, розгалужені ланцюги відкривають додаткові можливості для різних груп та функціональних груп, а циклічні структури можуть утворювати
різноманітні гідроксильні, кетонні, карбонові кільця тощо. в) Різноманітність елементів, що містяться у складі органічних сполук (наприклад, N, O, P, S), додає різноманітності їхнім хімічним властивостям. Наявність цих елементів дозволяє утворювати різні функціональні групи та взаємодії, що розширює спектр можливих сполук і реакцій.
§37. Біологічно активні речовини Контрольні запитання 544.Які речовини називають біологічно активними? Наведіть приклади. Біологічно активні речовини - це хімічні сполуки, які мають властивості взаємодіяти з біологічними системами організмів, включаючи рецептори, ферменти та інші біомолекули, і викликати в них певні фізіологічні або біохімічні відповіді. Біологічно активні речовини можуть впливати на різні аспекти функціонування організму, такі як метаболізм, сигнальні шляхи, імунну відповідь та інші. Приклади біологічно активних речовин включають:
1. Лікарські засоби: Наприклад, аспірин - протизапальний та антикоагулянтний засіб; інсулін - гормон, що регулює рівень цукру в крові; антибіотики - речовини, що знищують бактерії.
2. Гормони: Наприклад, адреналін - гормон, що викликає реакцію "боротьба або втеча"; інсулін - гормон, що контролює рівень цукру в крові.
3. Ферменти: Наприклад, пепсин - фермент, що розщеплює білки в шлунку; ДНКполімераза - фермент, що копіює ДНК під час реплікації.
4. Вітаміни: Наприклад, вітамін С - антиоксидант, що підтримує імунну систему; вітамін D - регулює кальцій та фосфорний обмін в організмі.
545. Що таке ферменти, вітаміни, гормони, алкалоїди? Ферменти - це білкові каталізатори, що сприяють хімічним реакціям у живих організмах.
Вітаміни - це органічні сполуки, необхідні для нормального функціонування організму, але у нього недостатньо виробляються.
Гормони - це хімічні регулятори, що передають сигнали між клітинами та органами. Алкалоїди - це природні органічні сполуки, які часто мають активні фармацевтичні властивості.
546.Наведіть приклади представників кожної групи біологічно активних речовин, їх поширеність, біологічну роль або застосування.
shkola.in.ua
1. Ферменти: Пепсин (фермент для розщеплення білків у шлунку), рибонуклеаза (фермент для розкладання РНК), амілаза (фермент для розщеплення крохмалю). Вони необхідні для швидкого та ефективного каталізу хімічних реакцій у живих системах.
2. Вітаміни: Вітамін C (аскорбінова кислота, важливий антиоксидант), вітамін D (регулює кальцій та фосфорний обмін), вітамін B12 (необхідний для нормального функціонування нервової системи).
3. Гормони: Інсулін (регулює рівень цукру в крові), адреналін (активує "боротьба або втеча"), естрогени (жіночі статеві гормони).
4. Алкалоїди: Морфін (природний анальгетик), кофеїн (стимулюючий алкалоїд у каві та чаї), нікотин (присутній у тютюні, має вплив на нервову систему).
Завдання для засвоєння матеріалу
547. Складіть рівняння реакції, що відбувається з етанолом та метанолом за
наявності ферменту алкогольдегідрогенази. Рівняння реакції для окислення етанолу та метанолу ферментом
алкогольдегідрогеназою виглядає так: Для етанолу:
Етанол + NAD+ → Ацетальдегід + NADH + H+
Для метанолу:
Метанол + NAD+ → Формальдегід + NADH + H+
У цих реакціях фермент алкогольдегідрогеназа відіграє роль каталізатора окислення етанолу та метанолу, що призводить до утворення відповідних альдегідів та водню. 548. На сторінках підручника в рубриці «Хімія навколо нас» знайдіть ті факти, де йдеться про біологічно активні речовини.
- Біологічно активні речовини включають ферменти, гормони, вітаміни, алкалоїди та інші хімічні сполуки.
- Ферменти допомагають у каталізі хімічних реакцій у живих системах, прискорюючи їхній перебіг.
- Гормони є хімічними регуляторами, які передають сигнали між різними частинами організму.
- Вітаміни є необхідними для нормального функціонування організму, але не синтезуються в достатніх кількостях організмом.
- Алкалоїди - це природні сполуки, які мають часто активні фармацевтичні властивості.
- Біологічно активні речовини грають важливу роль у різних фізіологічних процесах та можуть впливати на здоров'я людини та інших організмів.
- Вони застосовуються як ліки, добавки до їжі, поживні речовини та інші продукти для підтримання здоров'я. Завдання з розвитку критичного мислення 549. Прочитайте епіграф до підручника. Ґрунтуючись на знаннях про властивості
органічних сполук, вивчених протягом навчального року, доведіть або
спростуйте думку автора. Думка автора в епіграфі підручника підтримується знаннями про властивості біологічно активних речовин (БАР). БАР, такі як ферменти, гормони, вітаміни, алкалоїди та інші, дійсно можуть проявляти високу фізіологічну активність при низьких концентраціях в організмі. Наприклад, навіть невелика кількість вітамінів чи гормонів може має значний вплив на здоров'я та функціонування організму. Проте, варто враховувати, що висока активність БАР може бути корисною, але також може бути й небезпечною. Деякі БАР можуть мати негативний вплив на здоров'я, спричиняючи алергічні реакції, токсичність чи інші небажані ефекти. Також фізіологічна активність БАР може варіювати в залежності від особливостей конкретного організму та його стану. Отже, думка автора підтримується загальними знаннями про біологічно активні речовини, але варто мати на увазі їхні різні аспекти та можливі наслідки.
550. Прочитайте вислів до завдання 92. Обговоріть питання, чи є існування
ферментів доведенням вислову М. Д. Зелінського.
Вислів М. Д. Зелінського "Не існує нездійсненних реакцій. А якщо реакція не відбувається, то просто ще не винайдений відповідний каталізатор" вказує на його віру
shkola.in.ua
в те, що всі хімічні реакції теоретично можливі, але можуть вимагати певних умов або каталізаторів для їх сприяння. Щодо питання, чи є існування ферментів доведенням для цього вислову, то так, ферменти можуть служити як доказ твердження Зелінського. Ферменти є прикладом каталізаторів, які здатні сприяти відбуванню реакцій, які без їх участі відбувалися б незначно або взагалі не відбувалися. Ферменти ускладнюють хімічні реакції, знижуючи активаційну енергію, і допомагають організмам ефективно виконувати багато життєво важливих функцій.
Отже, існування ферментів можна вважати одним з підтверджень того, що, як висловив Зелінський, всі реакції можуть відбутися за наявності відповідних умов чи каталізаторів.
551. За інформацією цього параграфа та § 23 обґрунтуйте необхідність вживання
харчових продуктів, що містять вітаміни А, D та Е. Вітаміни A, D і E є життєво важливими поживними речовинами, які відіграють ключову роль у підтриманні оптимального функціонування організму людини. Нижче
розглянуто необхідність вживання продуктів, що містять вітаміни A, D та E: Вітамін A:
• Зорова функція: Вітамін A важливий для підтримання зору, особливо при слабкому освітленні. Він забезпечує працездатність рецепторів в сітківці очей, що сприяє адаптації до різних рівнів освітлення.
• Здоров'я шкіри: Вітамін A підтримує здоров'я шкіри, сприяючи її вологості та відновленню. Він важливий для запобігання висиханню, виразкам та покращенню загоєння ран.
• Імунітет: Вітамін A підтримує імунну систему, забезпечуючи нормальне функціонування бар'єрів організму, таких як слизові оболонки дихальних та травних шляхів.
Вітамін D:
• Здоров'я кісток: Вітамін D є ключовим для підтримки здорових кісток і зубів, оскільки він допомагає поглибленому всмоктуванню кальцію та фосфору з їжі.
• Міцність м'язів: Вітамін D впливає на м'язову функцію та координацію рухів, сприяючи підтримці м'язового тонусу.
Вітамін E:
• Антиоксидантна дія: Вітамін E є потужним антиоксидантом, що допомагає захищати клітини від пошкоджень від вільних радикалів, які можуть спричинити окиснення та стрес клітин.
• Здоров'я шкіри: Вітамін E сприяє здоров'ю шкіри, підтримуючи її гладкість та еластичність.
Ураховуючи ці фактори, важливо включати до раціону харчові продукти, які містять достатні кількості вітамінів A, D та E. Це можуть бути продукти, такі як молочні продукти, яйця, риба, овочі червоного та помаранчевого кольору, оріхи, насіння, рослинні олії та інші джерела цих вітамінів. 552. За інформацією цього параграфа обґрунтуйте необхідність вживання в їжу йодованої кухонної солі, а також наслідки йододефіциту, особливо в дитячому віці. Вживання йодованої кухонної солі є важливим засобом запобігання йододефіциту, який може призвести до серйозних наслідків для здоров'я, особливо в дитячому віці. Ось деякі аргументи, які обґрунтовують необхідність вживання йодованої солі:
shkola.in.ua
Запобігання йододефіциту: Йод є необхідним для правильного функціонування
щитовидної залози, яка відповідає за виробництво гормонів, регулюючих обмін речовин і ріст. Недостатність йоду може призвести до розвитку захворювань щитовидної залози, таких як збільшення її розмірів (зоб) та недостатність гормонів щитовидної залози (гіпотиреоз).
Здоровий розвиток мозку та нервової системи: Йод є важливим елементом для нормального розвитку мозку та нервової системи, особливо в перші роки життя.
Йододефіцит
у
дітей
може призвести до
погіршення
когнітивних функцій, зниження
інтелектуального потенціалу та навчальної успішності. Здоров'я вагітних жінок та дітей: Йод є особливо важливим для вагітних жінок, оскільки він впливає на розвиток плода та забезпечує нормальний розвиток мозку майбутньої дитини. Йододефіцит в цей період може призвести до вад розвитку, низької ваги при народженні та інших проблем.
Зменшення ризику захворювань: Вживання достатньої кількості йоду в їжу допомагає підтримувати імунну систему, знижує ризик захворювань і сприяє загальному здоров'ю. Забезпечення гармонійного росту та розвитку: Діти та підлітки потребують особливої уваги до важливих мінералів, включаючи йод, для гармонійного росту, розвитку та збереження здоров'я.
У випадку відсутності достатньої кількості йоду в організмі можуть виникнути такі наслідки:
• Зоб (патологічне збільшення щитовидної залози).
• Гіпотиреоз (недостатність гормонів щитовидної залози), який може призвести до втоми, пригнічення, нерівності настрою
§38. Роль органічної хімії у розв’язанні проблем людства Контрольні запитання
shkola.in.ua
553.Схарактеризуйте роль органічної хімії у розв’язуванні сировинної, енергетичної, продовольчої проблем, створенні нових матеріалів. Органічна хімія відіграє важливу роль у розв’язуванні різних проблем, таких як сировинна, енергетична, продовольча проблеми, а також у створенні нових матеріалів. Основні аспекти цієї ролі включають: Сировинна проблема: Органічна хімія визначає методи отримання різноманітних органічних сполук з вуглецем в їхній основній структурі. Це дозволяє створювати різноманітні речовини для виробництва ліків, пластиків, фарб, пестицидів, добрив та інших продуктів, які є необхідними для сучасного суспільства. Енергетична проблема: Органічна хімія вивчає багато способів отримання та зберігання енергії. Наприклад, виробництво сонячних батарей, які використовують органічні пігменти для збору сонячної енергії, а також розробка органічних матеріалів для суперконденсаторів та акумуляторів. Продовольча проблема: Органічна хімія грає важливу роль у розробці нових методів зберігання та обробки продуктів харчування, зокрема шляхом розробки пластиків, які можуть зберігати продукти довше, зменшуючи втрати. Також органічні сполуки використовуються для створення ароматизаторів, барвників та консервантів. Створення нових матеріалів: Органічна хімія є основою для розробки нових функціональних матеріалів, таких як наноматеріали, полімери, мембрани та інші. Ці матеріали використовуються в електроніці, медицині, будівництві, текстильній промисловості та інших галузях.
Таким чином, органічна хімія є ключовою дисципліною, яка вносить важливий вклад у розв'язання сучасних проблем суспільства, а також у розробку нових технологій та матеріалів для покращення якості життя людей. Міні-проекти 553. Назвіть продукти хімічних виробництв, які використовують у повсякденному житті. У повсякденному житті ми стикаємося з безліччю продуктів хімічних виробництв. Ось лише деякі з них: Пластикові матеріали: Пластикові продукти, які використовуються в упаковці, побутовій техніці, одягу, іграшках та багатьох інших сферах. Миючі засоби: Мило, шампуні, гелі для душу, засоби для посуду та інші миючі та доглядові продукти.
Ліки: Фармацевтичні препарати, вітаміни, додатки до їжі та інші засоби для підтримки здоров'я.
Косметичні засоби: Креми, декоративна косметика, засоби для догляду за шкірою та волоссям.
Добрива: Різноманітні добрива, які використовуються для покращення родючості
ґрунту та забезпечення врожаю в сільському господарстві. Пестициди: Засоби для захисту рослин від шкідників та хвороб, що допомагають
збільшити виробництво сільськогосподарських культур.
Побутова хімія: Засоби для чищення, дезінфекції, дезодорації, засоби для чищення води тощо.
Полімерні матеріали: Гума, піни, плівки, покриття для поверхонь та інші матеріали на основі полімерів.
Папір та картон: Виробництво паперу та картону, які використовуються у пакуванні, друкарстві, письмовому спілкуванні тощо.
Електронні компоненти: Провідники, напівпровідники, чіпи, батареї та інші елементи, що використовуються в електроніці. Барвники та фарби: Різноманітні барвники для фарбування тканин, фарби для малювання, покриття для меблів та інше.
Автомобільні рідини: Паливо, мастила, антифриз, рідини для омивання лобового скла тощо.
shkola.in.ua
555.Наведіть приклади несприятливого впливу хімічних речовин, знань або технологій на навколишнє середовище або людину. Хімічні речовини, знання та технології можуть мати негативний вплив на навколишнє середовище та здоров'я людини. Ось деякі приклади: Забруднення повітря: Викиди газів із заводів, випуск автотранспорту та інші джерела можуть призводити до забруднення повітря шкідливими речовинами, такими як оксиди азоту, сірки та летючі органічні сполуки. Це може призвести до змін в кліматі, глобального потепління, а також сприяти розвитку респіраторних захворювань у людей. Забруднення води: Несправне поводження з хімічними речовинами, такими як викиди із промисловості та використання пестицидів у сільському господарстві, може призвести до забруднення водних ресурсів токсичними речовинами. Це може спричинити загрозу водному екосистемі та здоров'ю людей, які використовують цю воду.
Виведення видів з рівноваги: Використання пестицидів, гербіцидів та інших хімічних засобів для збільшення виробництва сільськогосподарських культур може впливати на
рівновагу природних популяцій шкідників, комах та інших видів, що може призвести до екологічної дисбалансу. Активні хімічні речовини в повсякденних товарах: Деякі хімічні речовини, які використовуються у пластиках, косметиці, текстильних матеріалах та інших товарах, можуть мати потенційно шкідливий вплив на здоров'я людини через контакт, алергічні
реакції або накопичення в організмі.
Ядерні аварії: Технології ядерної енергетики можуть призвести до серйозних наслідків у разі аварій, таких як аварія на Чорнобильській АЕС чи Фукусімська ядерна аварія. Це
може спричинити радіаційне забруднення навколишнього середовища та загрозу здоров'ю людей.
Антропогенні зміни в природних середовищах: Зміни викликані розширенням міст, доріг, промислових комплексів можуть призводити до втрати біорізноманіття, забруднення та руйнування екосистем.
Ці приклади демонструють, як недбале використання хімічних речовин, знань та технологій може негативно вплинути на навколишнє середовище та людське здоров'я.
556. Опишіть, яким було б ваше життя, якби в ньому не було продуктів хімічного виробництва.
Без продуктів хімічного виробництва, багато аспектів повсякденного життя було б суттєво іншими: Забезпечення життєвих потреб: Відсутність хімічних продуктів означало б обмежені можливості для виробництва ліків, медичних засобів, мінеральних добрив, що призвело б до зниження якості життя та погіршення здоров'я. Медицина: Без хімічних речовин було б складніше проводити лікування, діагностику та профілактику багатьох хвороб. Лікарські засоби, медичні інструменти, матеріали для хірургічних операцій і т.д. стали б недоступними або обмеженими. Технологія та промисловість: Відсутність хімічних матеріалів і сполук змусило б шукати альтернативні способи виробництва продуктів, пристосовуватися до менш ефективних технологій та можливо зменшити обсяги виробництва багатьох товарів. Засоби особистої гігієни та косметика: Без хімічних інгредієнтів, які використовуються у миючих засобах, косметиці та засобах догляду за шкірою, люди мали б обмежені можливості доглядати за собою. Харчування: Вирощування і зберігання їжі стало б складнішим, оскільки брак хімічних засобів може спричинити збільшення втрат врожаю та скорочення терміну зберігання продуктів.
Транспорт: Відсутність хімічних розробок у транспортних засобах, таких як пальне, матеріали для виготовлення автомобілів та літаків, призвело б до зміни способів пересування.
shkola.in.ua
557. Схарактеризуйте роль органічної хімії у створенні нових матеріалів, розв’язанні енергетичної та сировинної проблем. Органічна хімія відіграє важливу роль у створенні нових матеріалів та розв'язанні енергетичної та сировинної проблем. Ось як вона впливає на ці аспекти: Створення нових матеріалів: Полімери: Органічна хімія відіграє ключову роль у синтезі полімерних матеріалів, таких як пластик, гума та текстиль. Ці матеріали мають широкий спектр застосувань, включаючи упаковку, будівництво, автомобільну промисловість, електроніку та інші сфери.
Наноматеріали: Органічна хімія допомагає в розробці наноматеріалів, які мають унікальні властивості на нанометровому рівні. Ці матеріали використовуються у сучасних технологіях, таких як наноелектроніка, наномедицина та нанокаталіз. Фарби та покриття: Органічні сполуки використовуються для створення
різноманітних фарб, лаків, покриттів, які не тільки надають виробам естетичний вигляд, але й захищають їх від корозії та інших зовнішніх впливів. Розв’язання енергетичної та сировинної проблем: Сонячні елементи: Органічна хімія використовується для створення сонячних батарей на основі органічних пігментів. Це дозволяє конвертувати сонячну енергію у
відновлювальний джерело електроенергії.
Суперконденсатори: Органічні матеріали використовуються для розробки
суперконденсаторів, які зберігають і вивільнюють енергію швидше та ефективніше, ніж звичайні акумулятори.
Катализатори: Органічні катализатори грають важливу роль у хімічних процесах, таких як виробництво палив, усунення викидів та інші процеси, що можуть сприяти підвищенню енергоефективності та зменшенню забруднення.
Відновлювальні ресурси: Органічна хімія може використовуватися для розробки методів переробки та використання відновлювальних сировинних ресурсів, таких як біопалива, біопластики та інші. Усі ці аспекти демонструють, як органічна хімія впливає на розв'язання енергетичних та сировинних проблем, а також сприяє створенню нових матеріалів і технологій, що важливо для розвитку сучасного суспільства.
shkola.in.ua