59 minute read
Il nuovo regolamento dei Dispositivi medici (UE 2017/745)”
Il nuovo regolamento dei Dispositivi medici (UE 2017/745)”
I n t r o d u z i o n e
Il settore dei dispositivi medici ricopre un ruolo importante nel contesto sanitario italiano ed europeo perché favorisce il miglioramento della tutela della Salute attraverso lo sviluppo di soluzioni innovative per diagnosticare, prevenire, curare e riabilitare. La complessa normativa nazionale, emanata in attuazione delle direttive europee, mira a garantire la sicurezza del dispositivo medico e ad evitare la diffusione di dispositivi che potrebbero compromettere la salute dei pazienti e degli utilizzatori. Per ottenere la marcatura CE, il fabbricante deve dimostrare che il dispositivo medico fornisce, nelle comuni condizioni di applicazione, le prestazioni per le quali è stato progettato, e che tutti i rischi prevedibili e la frequenza degli eventi avversi sono stati ridotti al minimo accettabile rispetto i benefici. Il rapporto rischio/beneficio di un dispositivo medico viene valutato tramite indagini cliniche appositamente programmate e progettate, che possono essere svolte in ogni struttura sanitaria, pubblica o privata accreditata al SSN, che, riferita alla specifica tipologia e classe di rischio del dispositivo, deve rispettare i seguenti requisiti: • competenze ed esperienza in merito a studi clinici controllati; • uso documentato e consolidato nella pratica clinica quotidiana di dispositivi clinici della stessa tipologia di quello che deve essere sperimentato.
I n d a g i n i c l i n i c h e s u i d i s p o s i t i v i m e d i c i P re-r e g o l a m e n t o
Prima del nuovo Regolamento, i riferimenti normativi che disciplinavano l'indagine clinica nel campo dei dispositivi medici erano: (i) D.Lgs 46/97 (recepimento della Direttiva Generale 93/42/CEE sui dispositivi medici classi III, II e I ), modificato dal D. Lgs 25/01/2010 n. 37; (ii) Decreto Legislativo 507/92 (recepimento della Direttiva Generale 90/385/CEE sui dispositivi medici impiantabili) modificato dal D. Lgs 25/01/2010 n. 37; (iii) Decreto Legislativo 332/00 (recepimento della Direttiva Generale 98/79/CEE sui dispositivi medico-diagnostici in vitro). Per ottenere il marchio CE da parte di un Organismo Notificato (NB), il fabbricante deve dimostrare che i requisiti del dispositivo sono in linea con quelli di sicurezza e di efficacia richieste dalle norme tecniche. Nell'Allegato 7 del D.Lgs 507/92 e nell'Allegato X del D.Lgs46/97 viene introdotto il principio di necessità della valutazione clinica come metodologia sistematica per confermare i requisiti clinici attesi dei dispositivi nel loro comune utilizzo, al fine di valutare gli eventi avversi e l'accettabilità del rapporto rischi/benefici. La valutazione clinica deve seguire una procedura ben definita e metodologicamente valida costituita da: • una valutazione critica dei risultati delle specifiche indagini cliniche condotte sul dispositivo in fase di sperimentazione;
47
• una valutazione critica della letteratura scientifica disponibile della sicurezza, dell’efficacia, delle caratteristiche progettuali e della destinazione d’uso del dispositivo; • un'analisi critica combinata dei dati clinici disponibili dalla letteratura scientifica e dall'indagine clinica. La valutazione clinica è un processo continuo svolto durante l'intero ciclo di vita di un dispositivo medico. Viene prima di tutto condotta durante il processo che porta alla commercializzazione di un dispositivo medico (fase Pre-CE mark) e poi sistematicamente ripetuta durante l'uso del dispositivo nella pratica clinica (fase Post CE mark). Valutazione pre-commercializzazione. Per ottenere la marcatura CE, il fabbricante deve dimostrare che il dispositivo fornisce, nella pratica clinica, le prestazioni per cui è stato progettato e che i rischi prevedibili e la frequenza degli eventi avversi siano ridotti al minimo accettabile rispetto ai benefici. L'Organismo di Vigilanza (OdV) valuta l'adeguatezza e la sufficienza dei dati presentati dal produttore. In caso contrario non rilascia il marchio CE e può consigliare di effettuare altre indagini cliniche. Valutazione post-commercializzazione. La valutazione clinica effettuata dal produttore, iniziata in fase di pre-commercializzazione, prosegue dopo la marcatura CE per confermare la sicurezza e le prestazioni del dispositivo, l'accettabilità del rapporto rischio/beneficio e l'identificazione di eventuali rischi che possono emergere dall'uso del prodotto su larga scala e a lungo termine. Il processo di aggiornamento della valutazione dei dati clinici (follow-up clinico post-commercializzazione) fa capo alle attività di sorveglianza post vendita effettuate dal produttore.
I l n u o v o r e g o l a m e n t o s u i d i s p o s i t i v i m e d i c i
L'indagine clinica è definita dalla norma UNI EN ISO 14155:2012 “[...] qualsiasi studio sistematico progettato sull'uomo con lo scopo di verificare la sicurezza e/o le prestazioni di uno specifico dispositivo. [...]”. Tale definizione è utilizzata anche nell'articolo 2 comma 45 del nuovo Regolamento dispositivi medici (MDR) n. 2017/745 dal Parlamento Europeo, dove si precisa che per “indagine clinica” si intende “qualsiasi indagine sistematica nella quale siano coinvolti uno o più soggetti umani, finalizzata a valutare la sicurezza e l'efficacia di un dispositivo”. Un'indagine clinica può essere effettuata solo se sono soddisfatte tutte le seguenti condizioni: • l’autorizzazione è rilasciata dallo Stato membro o dagli Stati membri in cui si svolgerà l'indagine clinica; • il comitato etico non ha emesso un parere negativo, valido in tutti gli Stati membri; • il promotore, o il suo legale rappresentante o referente, ha sede in UE; • le popolazioni e i soggetti vulnerabili siano adeguatamente tutelati; • i benefici attesi, per le persone o per la salute pubblica, giustificano i rischi prevedibili;
48
• il soggetto o, qualora il soggetto non sia in grado di prestare il proprio consenso informato, il suo legale rappresentante designato abbia fornito il proprio consenso informato scritto; • sono stati forniti al soggetto o, qualora il soggetto non sia in grado di prestare il proprio consenso informato, al suo legale rappresentante designato, i recapiti di un organismo presso il quale è possibile ottenere, se del caso, ulteriori informazioni; • sono rispettati il diritto all'integrità fisica e psichica del soggetto, il diritto alla riservatezza e alla protezione dei dati che lo riguardano ai sensi della direttiva 95/46/CE: • i rischi prevedibili devono essere espressamente definiti nel piano di indagine clinica e sono oggetto di continua verifica; • l'assistenza medica prestata al soggetto è a carico di un medico adeguatamente qualificato; • la persona o, se del caso, il suo legale rappresentante designato, non ha subito alcuna influenza indebita, anche di natura economica, per partecipare all'indagine clinica; • il dispositivo oggetto di indagine è conforme ai requisiti generali di sicurezza e efficacia definiti nell'allegato I, ad eccezione degli aspetti oggetto dell'indagine clinica e, per quest'ultimo, sono state adottate tutte le precauzioni per tutelare la salute e la sicurezza dei i soggetti. Il nuovo Regolamento introduce due novità riguardanti la raccolta dei dati pre e post marketing. Per quanto riguarda i dati clinici di follow-up clinico post-marketing (PMCF), questi hanno lo scopo di confermare la sicurezza e le prestazioni del dispositivo nella pratica reale e per tutta la durata del suo utilizzo. L'accesso al mercato dei dispositivi medici, infatti, avviene con dati di sicurezza clinica e di efficacia, ottenuti con modelli atti a mimare le condizioni d'uso previste per i dispositivi medici. Il concetto di sorveglianza post-marketing, che è alla base del Regolamento, richiede che durante l’utilizzo del dispositivo medico siano verificate le effettive condizioni d'uso. Come precedentemente specificato, il nuovo Regolamento fa riferimento a diverse tipologie di indagine clinica: 1. Indagini pre-marketing: valutazione clinica finalizzata alla valutazione della conformità (art. 62, comma 1); 2. valutazione clinica per finalità diverse dalla valutazione della conformità (art. 82); 3. Indagini post marketing: Indagini cliniche per dispositivi già marcati CE (art. 74). Le indagini cliniche pre-marketing hanno lo scopo di: (i) stabilire e verificare che, in normali condizioni d'uso, i dispositivi siano progettati, fabbricati e confezionati forniscano le prestazioni attese specificate dal produttore; (ii) stabilire e verificare i benefici clinici di un dispositivo definiti dal fabbricante e infine (iii) stabilire e verificare la sicurezza clinica del
49
dispositivo e gli eventuali effetti collaterali indesiderati nelle normali condizioni d'uso del dispositivo e valutare se rappresentano un accettabile rischio rispetto ai benefici attesi. Per quanto riguarda gli studi post marketing (PMCF) e quindi le indagini cliniche relative ai dispositivi muniti della marcatura (art. 74), questi possono essere studi osservazionali o di monitoraggio attuabile tramite la definizione di registri che hanno lo scopo di verificare il raggiungimento di determinati benefici legati all’utilizzo del dispositivo medico. In particolare in questo tipo di indagine, i soggetti devono sottoporsi a procedure aggiuntive rispetto a quelle eseguite nelle normali condizioni di utilizzo del dispositivo e queste procedure aggiuntive sono invasive o impegnative. Il Regolamento prevede deroghe all'obbligo di condurre un'indagine clinica, a condizione che: • il dispositivo è stato progettato con modifiche di un dispositivo già commercializzato dallo stesso produttore; • il fabbricante ha dimostrato che il dispositivo è equivalente a quello commercializzato e tale dimostrazione è stata confermata da un organismo notificato; • la valutazione clinica del dispositivo in commercio è sufficiente a dimostrare la conformità del dispositivo modificato i principali requisiti di sicurezza e prestazioni.
P r o c e s s o d i v a l u t a z i o n e p e r l a n o t i f i c a d e l l a d o m a n d a d i a t t i v a z i o n e d i u n ' i n d a g i n e c l i n i c a
Il promotore di un'indagine clinica presenta una domanda, corredata di documentazione, nello Stato membro o negli Stati membri in cui verrà effettuata l'indagine clinica. I documenti da allegare alla domanda di indagine clinica come definiti nell'Allegato XV, 2 del regolamento sono: 1. Modulo di domanda; 2 Dossier per lo sperimentatore; 3. Piano di indagine clinica; 4. Altre informazioni: • Una dichiarazione attestante che il dispositivo in questione soddisfa i requisiti generali di sicurezza e prestazione, ad eccezione degli aspetti oggetto dell'indagine clinica e che, per quest'ultima, sono state adottate tutte le precauzioni per tutelare la salute e la sicurezza dei il soggetto. • Una copia del/i parere/i rilasciato/i dai comitati etici interessati. • La ricevuta di copertura assicurativa o indennizzo dei soggetti in caso di infortunio • I documenti da utilizzare per ottenere il consenso informato • La descrizione delle disposizioni volte a garantire il rispetto della normativa applicabile in materia di protezione e riservatezza dei dati personali • Tutti i dettagli della documentazione tecnica disponibile Gli Stati membri sono responsabili della valutazione:
50
• dell'adeguatezza del protocollo per la dimostrazione della rispondenza del controllo sperimentale ai requisiti di sicurezza e prestazione applicabili e l'adozione di ogni PRECAUZIONE necessaria a tutelare la salute e la sicurezza dei soggetti partecipanti allo studio clinico; • dell'adeguatezza delle misure previste per l'installazione, la messa in servizio, la messa in servizio e la manutenzione del dispositivo in prova; • dell'affidabilità e la robustezza dei dati generati con lo studio clinico; • se le soluzioni fornite dallo sponsor per minimizzare i rischi sono descritte secondo norme armonizzate (e, in caso negativo, se le soluzioni per minimizzare i rischi garantiscono un livello di protezione equivalente a quello delle norme armonizzate); • nel caso di dispositivi per uso sterile, evidenza della convalida delle procedure di sterilizzazione fornite dal produttore (o delle informazioni sul ricondizionamento e sulle procedure di sterilizzazione da attuare da parte del sito di prova); • la dimostrazione di sicurezza, qualità e fruibilità di ciascuno dei componenti di origine animale o umana o delle sostanze che potrebbero essere considerate medicinali ai sensi della Direttiva 2001/83/CE. Il Regolamento definisce inoltre le motivazioni di un eventuale rigetto della domanda di autorizzazione che sono nello specifico: 1. Il fascicolo è incompleto dopo le richieste dello Stato membro; 2. Il dispositivo stesso o i documenti inviati non corrispondono allo stato delle conoscenze scientifiche in materia; 3. Lo studio clinico non è in grado di fornire evidenze sufficienti in merito alla sicurezza, alla conformità della prestazione del paziente a al beneficio per i pazienti; 4. I requisiti per gli studi clinici previsti dall'art. 62 del MDR non sono rispettati.
51
R e g o l a m e n t o ( U E ) 2 0 1 7 / 7 4 5 e C l a s s e d i r i s c h i o d e l d i s p o s i t i v o D e v i c e
Toilé è un dispositivo non impiantabile, classificato come dispositivo di classe I (non sterile, senza funzione di misurazione, strumento chirurgico non riutilizzabile). Per la commercializzazione di tale dispositivo medico nell'Unione Europea è necessario il marchio CE in cui di certifica che il dispositivo soddisfa tutti i requisiti normativi della Direttiva sui dispositivi medici. Ai sensi del Regolamento n. 2017/745, i dispositivi di classe I devono fornire una Dichiarazione di conformità e non è richiesto alcun intervento dell'Organismo Notificato. È richiesta, però, la procedura di sorveglianza medica post-mercato (PMS). Il rapporto di sorveglianza post-marketing include i risultati e le conclusioni delle analisi dei dati raccolti nell'ambito della sorveglianza post-marketing e una descrizione di eventuali azioni preventive e correttive intraprese. La relazione viene aggiornata ove necessario e messa a disposizione dell'autorità competente su richiesta. Inoltre, è necessario prevedere un Fascicolo Tecnico che fornisca informazioni dettagliate sul dispositivo medico, e dimostri la conformità alla 93/42/CEE in cui è richiesto di produrre dati clinici che devono riferirsi al dispositivo in oggetto. Infine, come per tutti i dispositivi, il dispositivo Toilé sarà sottoposto a verifica annuale da un Organismo Notificato al fine di garantire la continua conformità. Il mancato superamento dell'audit invaliderà il certificato di marcatura CE.
L a v a l u t a z i o n e p r e c l i n i c a d e l D i s p o s i t i v o m e d i c o T o i l é
La valutazione delle procedure di analisi preclinica non può prescindere dai risultati della revisione della letteratura e di tutte le convalide, controlli e test effettuati. Per pianificare, condurre e documentare continuamente una valutazione clinica, i produttori devono: a) stabilire e aggiornare un piano di valutazione clinica che includa almeno: - l'identificazione della sicurezza generale e dei requisiti prestazionali che devono essere supportati da dati clinici rilevanti, - una specifica dell'uso previsto del dispositivo, - una chiara definizione dei gruppi target con chiare indicazioni e controindicazioni, - una descrizione dettagliata dei benefici clinici attesi per i pazienti, compresi i parametri di esito rilevanti, - una descrizione dei metodi da utilizzare per la valutazione degli aspetti qualitativi e quantitativi della sicurezza clinica, con chiaro riferimento alla determinazione dei rischi residui e degli effetti collaterali, - un elenco indicativo dei parametri da applicare per determinare l'accettabilità del rapporto rischio-beneficio per le diverse indicazioni e la destinazione d'uso del dispositivo,
52
- un'indicazione di come devono essere affrontate le questioni relative ai rischi e ai benefici di componenti b) identificare i dati clinici disponibili relativi al dispositivo e alla sua destinazione d'uso e le eventuali lacune nelle evidenze cliniche attraverso un esame sistematico della letteratura scientifica; c) esaminare tutti i dati clinici rilevanti e valutare la loro idoneità a stabilire la sicurezza e le prestazioni del dispositivo; d) produrre, attraverso indagini cliniche opportunamente progettate in accordo con il piano di sviluppo clinico, dati clinici nuovi o aggiuntivi necessari per affrontare questioni in sospeso; e) analizzare tutti i dati clinici pertinenti per trarre conclusioni sulla sicurezza e sulle prestazioni cliniche del dispositivo, compresi i suoi benefici clinici.
I l p r o t o c o l l o c l i n i c o
Al fine di procedere con la trasmissione di una notifica di indagine clinica relativamente al dispositivo medico proposto è necessaria la redazione del Piano di valutazione clinica o Piano di indagine clinica (CIP) in cui si descrivono in modo dettagliato le modalità di svolgimento dello studio clinico con il dispositivo Toilé. All’interno del CIP si definiscono “l’obiettivo, la progettazione, la metodologia, le considerazioni statistiche e l’organizzazione dello studio. Il protocollo fornisce anche le informazioni di base e il razionale dello studio clinico” (Codice per la Buona Pratica Clinica per l’esecuzione delle sperimentazioni cliniche dei medicinali - GCP).
Piano di indagine clinica (CIP)
Il piano di indagine clinica definisce il razionale, gli obiettivi, la progettazione, la metodologia, il monitoraggio, la realizzazione, la registrazione e il metodo di analisi dell'indagine clinica relativamente al dispositivo medico proposto, in accordo a quanto indicato nel Regolamento UE 2017/745 nell’Allegato XV, Capo II, punto 3. Nella Tabella 10 si riportano le informazioni indicate nell’Allegato XV del Regolamento UE 2017/745.
53
Tabella 11 Piano di indagine clinica (Regolamento UE 2017/745 nell’Allegato XV, Capo II, punto 3)
1 Aspetti generali 1.1 Numero di identificazione unico dell'indagine clinica, di cui all'articolo 70, paragrafo 1 1.2 Identificazione dello sponsor — nome, indirizzo e coordinate dello sponsor e, se del caso, nome, indirizzo e coordinate del referente o rappresentante legale dello sponsor ai sensi dell'articolo 62, paragrafo 2, stabilito nell'Unione. 1.3 Informazioni sullo sperimentatore principale presso ogni sito di indagine, sullo sperimentatore coordinatore di un'indagine, le coordinate di ciascun sito di indagine e le coordinate di emergenza dello sperimentatore principale presso ogni sito. I ruoli, le responsabilità e le qualifiche dei vari tipi di sperimentatori sono specificati nel piano di indagine clinica. 1.4 Una breve descrizione del metodo di finanziamento dell'indagine clinica e una breve descrizione del contratto tra lo sponsor e il sito.
[DA INSERIRE]
[DA INSERIRE]
[DA INSERIRE DOPO AVER IDENTIFICATO I SITI DI INDAGINE]
[DA INSERIRE]
1.5 Sintesi generale dell'indagine clinica, in una lingua ufficiale dell'Unione stabilita dallo Stato membro interessato. A causa dell’emergenza pandemica da Covid-19, l’attenzione dei ricercatori si è focalizzata, nell’ultimo anno, sulla trasmissione di virus, batteri e agenti patogeni attraverso l’aerosol includendo come luogo di trasmissione anche i bagni pubblici. La fase critica di una possibile diffusione è rappresentata dalla fase di risciacquo del WC. Infatti, all’interno del sanitario si genera una forte turbolenza e questo flusso indotto potrebbe provocare la diffusione nell’aria di particelle di aerosol contenenti virus e agenti patogeni, contaminando, di conseguenza, le superfici dell'ambiente circostante. È evidente che le ipotetiche misure precauzionali, come il totale ricambio
54
di aria e la pulizia completa dell'intero ambiente bagno dopo ogni utilizzo, non costituiscano una soluzione praticabile e risulterebbero comunque ancora insufficienti. Il dispositivo medico Toilé si inserisce in un contesto di sicurezza sul lavoro, relativamente al rischio di contagio per gli operatori sanitari, particolarmente esposti in quanto possono trovarsi a contatto con i pazienti durante l’espletamento delle loro funzioni fisiologiche e comunque operare nei servizi igienici, o utilizzarli, in un ambiente ad elevato rischio quali le strutture sanitarie. La tecnologia Toilé è un WC capace di aspirare l’aerosol direttamente dal bacino del WC durante l’uso, convogliandolo all’esterno dell’edificio attraverso il condotto fognario. Aspirando l’aerosol all’origine, il WC così realizzato contrasta sia la diffusione dei cattivi odori sia quella dei virus e altri patogeni. La ceramica di Toilé è realizzata in modo da avere un condotto dedicato all’aspirazione dell’aerosol contaminato direttamente dal bacino del WC. Un aspiratore integrato nel sanitario è collegato a questo condotto e indirizza l’aerosol contaminato direttamente nel discendente fognario. Inoltre: • le camere separate evitano sovrapposizioni di flusso di risciacquo e di aerosol aspirato; • continua la sua attività di estrazione per tutto il tempo di utilizzo del WC soprattutto, quindi, durante la fase di risciacquo; • il sistema aeraulico (estrazione e scarico aria contenete aerosol contaminato) è già all'interno del sanitario e non prevede quindi la necessità di opere murarie addizionali per la creazione di tubature dedicate; • dispone di connessioni idrauliche di qualsiasi WC standard, secondo normativa EN33, consentendo quindi la rapida sostituzione con qualsiasi WC. Le possibili alternative tecnologiche che potrebbero essere adottate nei bagni pubblici, sono ad esempio (i) i tradizionali aspiratori d’aria a parete; o (ii) Estrattori d'aria collegati alla cassetta di scarico. Nel primo caso il ricambio d’aria richiede molto tempo e quindi non è possibile prevenire la diffusione dell’aerosol che sarà inalata dall’utente successivo e si depositerà sulle superfici, contaminandole. L’uso del bagno, in questo caso, dovrebbe essere obbligatoriamente interdetto, fino a processo di totale ricambio completato. Nel secondo caso l’aspirazione avviene attraverso il tubo che collega la cassetta di scarico al WC. Tuttavia, con questo
55
sistema non è possibile aspirare l’aerosol poiché durante la fase di risciacquo la capacità di aspirazione dell'aria svanisce completamente perché il tubo è pieno d'acqua e non potrà aspirare l’aerosol.
Indagine clinica con il dispositivo medico: A seguito dell’installazione del dispositivo Toilé nei reparti delle aziende ospedaliere indicate per lo svolgimento dello studio clinico, verrà effettuata una valutazione di eleggibilità dei pazienti secondo i criteri di inclusione: pazienti maggiorenni (età > 18 anni) ricoverati nel reparto indicato durante il periodo di svolgimento dello studio. Prerequisito fondamentale è che essi non siano già affetti da infezione (infezione non presente né in forma clinica manifesta né in fase di incubazione al momento dell’ingresso in ospedale). Successivamente si procede alla valutazione dello sviluppo di infezioni nosocomiali nei pazienti durante il periodo di degenza: i pazienti ricoverati potranno utilizzare esclusivamente il nuovo sanitario durante tale periodo. Infine si procede alla valutazione dello sviluppo di infezioni nosocomiali nei pazienti 30 giorni dopo la dimissione attraverso visite ambulatoriali di controllo. È infatti possibile considerare come Infezione Correlata all’Assistenza (ICA) tutte le infezioni che all’atto della dimissione non siano clinicamente manifeste ma che si presentino al domicilio del paziente, entro un periodo variabile che va dai 30 giorni ai 90 giorni dopo il ricovero.
Obiettivo dell’indagine clinica: Attraverso lo studio si vuole verificare se, tramite l’utilizzo del dispositivo medico Toilé in ambito ospedaliero, sia possibile attestare una riduzione del numero di infezioni nosocomiali che si verificano in seguito all’utilizzo dei sanitari da parte di pazienti. Il dispositivo medico proposto si inserisce in un contesto di prevenzione ospedaliera in quanto le infezioni nosocomiali che si verificano nei pazienti, potrebbero successivamente riflettersi sugli operatori sanitari in contatto con essi durante l’espletamento delle loro funzioni fisiologiche e/o operano nel contesto dei servizi igienici. Inoltre si vuole valutare quanto l’introduzione della nuova tecnologia inciderà sui costi del sistema sanitario. Secondo quanto atteso, a seguito di un iniziale incremento dei costi, dovuto ai costi di acquisizione e di installazione del dispositivo nei reparti ospedalieri indicati, seguirà una riduzione dei costi sanitari sostenuti causati dallo sviluppo di infezioni nosocomiali che si verificano sia nei pazienti ricoverati ad esempio in termini di prolungamento della durata di degenza, disabilità a lungo termine, carico economico aggiuntivo per i sistemi
56
2 Identificazione e descrizione del dispositivo, compresa la destinazione d'uso, il fabbricante, la tracciabilità, la popolazione destinataria, i materiali che entrano in contatto con il corpo umano, le procedure mediche o chirurgiche inerenti al suo uso e la formazione e l'esperienza necessarie per il suo utilizzo, il riesame della letteratura di riferimento, l'attuale stato dell'arte dell'assistenza clinica nel pertinente ambito di applicazione e i vantaggi proposti dal nuovo dispositivo.
sanitari, per i pazienti e le loro famiglie, decessi per i quali l’infezione rappresenta una concausa, sia in operatori sanitari ad essi correlati in termini di assenza lavorativa e/o visite ospedaliere/ambulatoriali. Identificazione e descrizione del dispositivo: La tecnologia Toliè è un WC capace di aspirare l’aerosol direttamente dal bacino del WC durante l’uso, convogliandolo all’esterno dell’edificio attraverso il condotto fognario. Aspirando l’aerosol all’origine, il WC così realizzato contrasta sia la diffusione dei cattivi odori sia quella dei virus e altri patogeni. La ceramica di Toilé è realizzata in modo da avere un condotto dedicato all’aspirazione dell’aerosol contaminato direttamente dal bacino del WC. Un aspiratore integrato nel sanitario è collegato a questo condotto e indirizza l’aerosol contaminato direttamente nel discendente fognario.
Fabbricante: Planus SPA (Via S.Giovanni Valdarno, 8 00138 ROMA – Italy Tel. (+39) 0761 542052 www.planus.eu info@planus.eu).
Tracciabilità: [DA INSERIRE]
Popolazione destinataria: Pazienti maggiorenni (età > 18 anni) ricoverati in ambito ospedaliero indicato durante il periodo di svolgimento dello studio proposto. Prerequisito fondamentale è che essi non siano già affetti da infezione (infezione non presente né in forma clinica manifesta né in fase di incubazione al momento dell’ingresso in ospedale).
Materiali che entrano in contatto con il corpo umano: L’unico materiale con cui saranno in contatto i destinatari dello studio è la ceramica di cui è costituito il dispositivo Toilé.
Procedure mediche o chirurgiche inerenti al suo uso e la formazione e l'esperienza necessarie per il suo
utilizzo: Non sono previste procedure mediche o chirurgiche inerenti al suo uso.
Riesame della letteratura di riferimento: Nell’ambito dello studio di fattibilità, è stata effettuata una revisione sistematica della letteratura. Il primo passo affrontato è stato quello di definire l’argomento (topic) oggetto dell’indagine in modo chiaro e preciso, avvalendosi dello studio preliminare dei lavori forniti dall’azienda Planus 57
Spa, nonché di ulteriori evidenze reperite sul database PubMed, attraverso una ricerca preliminare di articoli e testi riguardanti il topic oggetto di approfondimento. Questa strategia preliminare ha consentito di definire il “problema di salute” ed individuare le parole chiave (key-words) necessarie per la costruzione delle stringhe di ricerca, indispensabili per la revisione sistematica, successivamente esplicitate. La domanda di ricerca (policy question) è stata strutturata utilizzando il metodo PICO (Population, Intervention, Comparator, Outcome); questo modello include la popolazione di riferimento oggetto della valutazione (P), l’intervento o gli interventi sui quali si sta indagando (I), il comparatore o i comparatori (C), e gli outcome di riferimento (O). Nella tabella seguente si riporta il modello PICO utilizzato per l’impostazione dell’analisi:
Popolazione Popolazione potenzialmente affetta da infezioni trasmissibili per via oro-fecale
Intervento Toilé Comparatore Sanitari consueti, non provvisti di sistema di aspirazione integrato (setting: strutture sanitarie)
Outcome
Prevenzione della trasmissione, via aerosol, di microrganismi patogeni
Al termine del processo di revisione di letteratura, effettuata attraverso i database Medline e Web of Science, sono stati selezionati 10 articoli. Gli articoli selezionati sono stati sistematizzati in una tabella riassuntiva (Tabella 5). In aggiunta ad essi sono state selezionate le principali linee guida utili per un ulteriore inquadramento dell’argomento oggetto di analisi (Tabella 6). Tale revisione ha sottolineato l’importanza della prevenzione soprattutto negli ambienti ospedalieri in quanto luoghi maggiormente coinvolti nella trasmissione delle infezioni.
Attuale stato dell'arte dell'assistenza clinica nel pertinente ambito di applicazione e i vantaggi proposti dal nuovo dispositivo: Numerosi studi effettuati a livello internazionale hanno dimostrato che batteri e virus,
58
3 Rischi e benefici clinici del dispositivo da esaminare, assieme alla giustificazione dei corrispondenti risultati clinici previsti nel piano di indagine clinica.
4 Descrizione della rilevanza dell'indagine clinica nell'ambito dello stato dell'arte della pratica clinica.
incluso i Coronavirus, sono largamente presenti nelle feci e conseguentemente nell’aerosol che si genera durante l’uso dei WC. Tali studi hanno dimostrato che l’aerosol diffuso dal WC rimane in sospensione nell’aria dell’ambiente bagno anche per alcune ore divenendo fonte di diffusione di SARS-CoV-2 se inalato da un operatore sanitario e comunque da un utilizzatore successivo. L’uso del WC inoltre genera batteri e virus sotto forma di aerosol che si deposita su tutte le superfici circostanti incrementando il rischio di infezione. Planus SpA ha realizzato un WC capace di aspirare l’aerosol direttamente dal bacino del WC durante l’uso, convogliandolo all’esterno dell’edificio attraverso il condotto fognario. Aspirando l’aerosol all’origine, il WC così realizzato contrasta sia la diffusione dei cattivi odori sia quella dei virus e altri patogeni. Questo nuovo dispositivo medico si inserisce in un contesto di sicurezza sul lavoro, relativamente al rischio di contagio per gli operatori sanitari, particolarmente esposti in quanto possono trovarsi a contatto con i pazienti durante l’espletamento delle loro funzioni fisiologiche e comunque operare nei servizi igienici, o utilizzarli, in un ambiente ad elevato rischio quali le strutture sanitarie. Non sono presenti rischi clinici nell’utilizzo del dispositivo medico Toilé. Attraverso lo studio si vuole verificare se, tramite l’utilizzo del dispositivo medico Toilé in ambito sanitario, sia possibile attestare una riduzione del numero di infezioni nosocomiali che si verificano in seguito all’utilizzo dei sanitari da parte di pazienti. Il dispositivo medico proposto si inserisce in un contesto di prevenzione ospedaliera in quanto le infezioni nosocomiali che si verificano nei pazienti, potrebbero successivamente riflettersi sugli operatori sanitari in contatto con essi durante l’espletamento delle loro funzioni fisiologiche e/o operano nel contesto dei servizi igienici. Inoltre si vuole valutare quanto l’introduzione della nuova tecnologia inciderà sui costi del sistema sanitario. Secondo quanto atteso, a seguito di un iniziale incremento dei costi, dovuto ai costi di acquisizione e di installazione del dispositivo nei reparti ospedalieri indicati, seguirà una riduzione dei costi sanitari sostenuti causati dallo sviluppo di infezioni nosocomiali che si verificano sia nei pazienti ricoverati sia negli operatori sanitari ad essi correlati in termini di assenza lavorativa e/o visite ospedaliere/ambulatoriali. Gli studi precedentemente condotti sulla tematica in oggetto dimostrano la presenza di una correlazione tra il bioaerosol generato dallo sciacquone dei servizi igienici e la contaminazione delle superfici ospedaliere, con conseguente esposizione a rischio aumentato di inalazione di materiale contaminato sia tra pazienti che tra
59
5 Obiettivi e ipotesi dell'indagine clinica.
operatori sanitari. Il dispositivo medico Toilé si inserisce in un contesto di prevenzione ospedaliera e la sua adozione potrebbe ridurre l'elevato impatto delle infezioni nosocomiali sulla salute dei pazienti, sulla sicurezza degli operatori sanitari e, di conseguenza, incidere sui costi del sistema sanitario. A causa dell’emergenza pandemica da Covid-19, l’attenzione dei ricercatori si è focalizzata, nell’ultimo anno, sulla trasmissione di virus, batteri e agenti patogeni attraverso l’aerosol includendo come luogo di trasmissione anche i bagni pubblici. La fase critica di una possibile diffusione è rappresentata dalla fase di risciacquo del WC. Infatti, all’interno del sanitario si genera una forte turbolenza e questo flusso indotto potrebbe provocare l’espulsione nell’aria di particelle di aerosol contenenti virus e agenti patogeni, contaminando, di conseguenza, le superfici dell'ambiente circostante. È evidente che le ipotetiche misure precauzionali, come il totale ricambio di aria e la pulizia completa dell'intero ambiente bagno dopo ogni utilizzo, non costituiscano una soluzione praticabile e risulterebbero comunque ancora insufficienti. Il dispositivo medico Toilé si inserisce in un contesto di sicurezza sul lavoro, relativamente al rischio di contagio per gli operatori sanitari, particolarmente esposti in quanto possono trovarsi a contatto con i pazienti durante l’espletamento delle loro funzioni fisiologiche e comunque operare nei servizi igienici, o utilizzarli, in un ambiente ad elevato rischio quali le strutture sanitarie.
Obiettivo dell’indagine clinica: Obiettivo di tale studio è attestare l’efficacia del dispositivo medico Toilé valutando gli effetti collaterali, in termini di eventi avversi che si verificano sui pazienti ricoverati e che sono correlati al verificarsi di infezioni nosocomiali causate dall’utilizzo dei sanitari. Attraverso lo studio si vuole valutare se l’utilizzo del dispositivo proposto comporta una riduzione nell’incidenza di contrazione delle infezioni nosocomiali da parte dei pazienti e, al tempo stesso, si vuole stimare la riduzione dei costi del sistema sanitario che comporta l’utilizzo del dispositivo Toilé.
6 Progettazione dell'indagine clinica e test della sua solidità e validità scientifica.
6.1 Informazioni generali quali il tipo di indagine e i criteri della scelta, degli endpoint e delle variabili indicati nel piano di valutazione clinica.
Tipologia di indagine: [DA INSERIRE] Criteri di scelta: [DA INSERIRE]
60
6.2 Informazioni sul dispositivo oggetto di indagine, su eventuali prodotti di raffronto e su qualsiasi altro dispositivo o medicazione, da utilizzare nell'indagine clinica.
6.3 Informazioni sui soggetti, i criteri di selezione, l'entità demografica della popolazione oggetto dell'indagine, la rappresentatività della popolazione oggetto dell'indagine rispetto alla popolazione destinataria e, se del caso, informazioni sui soggetti vulnerabili partecipanti, quali bambini, donne incinte, immunodeficienti o soggetti anziani. 6.4 Dettagli delle misure da adottare per ridurre al minimo l'errore sistematico e gestione dei potenziali fattori di confusione. 6.5 Descrizione delle procedure cliniche e dei metodi diagnostici attinenti all'indagine clinica, indicante in Endpoint: Attraverso lo studio clinico si vuole valutare l’incidenza di contrazione delle infezioni nosocomiali da parte dei pazienti sia durante il periodo di degenza sia nel periodo successivo alla loro dimissione (entro i 30 giorni successivi alla dimissione) al fine di determinare se essa si riduce con l’utilizzo del dispositivo proposto. Variabili: Due indicatori per valutare il tasso di contrazione delle infezioni nosocomiali che si verificano sia durante il periodo di degenza sia nel periodo successivo alla loro dimissione (entro i 30 giorni successivi). Toilé è un dispositivo non impiantabile, classificabile come dispositivo di classe I (non sterile e senza funzione di misurazione). Il dispositivo è un WC capace di aspirare l’aerosol direttamente dal bacino del WC durante l’uso, convogliandolo all’esterno dell’edificio attraverso il condotto fognario. Aspirando l’aerosol all’origine, il WC così realizzato contrasta sia la diffusione dei cattivi odori sia quella dei virus e altri patogeni. La ceramica di Toilé è realizzata in modo da avere un condotto dedicato all’aspirazione dell’aerosol contaminato direttamente dal bacino del WC. Un aspiratore integrato nel sanitario è collegato a questo condotto e indirizza l’aerosol contaminato direttamente nel discendente fognario. Non verranno utilizzati dispositivi di confronto durante lo svolgimento dell’indagine clinica. Tuttavia, i risultati ottenuti verranno confrontati con i dati già presenti in letteratura circa l’incidenza di infezioni ospedaliere. I soggetti che parteciperanno allo studio clinico sono pazienti maggiorenni (età > 18 anni) ricoverati nel reparto indicato durante il periodo di svolgimento dello studio proposto. Prerequisito fondamentale è che essi non siano già affetti da infezione (infezione non presente né in forma clinica manifesta né in fase di incubazione al momento dell’ingresso in ospedale).
[DA INSERIRE]
A seguito dell’installazione del dispositivo Toilé nei reparti delle aziende ospedaliere indicate per lo svolgimento dello studio clinico, verrà effettuata una valutazione di eleggibilità dei pazienti secondo i criteri di
61
particolare qualsiasi scostamento dalla normale pratica clinica.
6.6 Piano di monitoraggio.
7 Considerazioni statistiche, e relativa giustificazione, compreso un calcolo della potenza per la dimensione del campione, se del caso. 8 Gestione dei dati. 9 Informazioni su eventuali modifiche al piano di indagine clinica. 10 Politica in materia di follow-up e gestione di eventuali scostamenti dal piano di indagine clinica presso il sito di indagine e chiaro divieto di applicare deroghe al piano di indagine clinica.
inclusione: pazienti maggiorenni (età > 18 anni) ricoverati nel reparto indicato durante il periodo di svolgimento dello studio. Prerequisito fondamentale è che essi non siano già affetti da infezione (infezione non presente né in forma clinica manifesta né in fase di incubazione al momento dell’ingresso in ospedale). Successivamente si procede alla valutazione dello sviluppo di infezioni nosocomiali nei pazienti durante il periodo di degenza: i pazienti ricoverati potranno utilizzare esclusivamente il nuovo sanitario durante tale periodo. Infine si procede alla valutazione dello sviluppo di infezioni nosocomiali nei pazienti 30 giorni dopo la dimissione attraverso visite ambulatoriali di controllo. È infatti possibile considerare come Infezione Correlata all’Assistenza (ICA) tutte le infezioni che all’atto della dimissione non siano clinicamente manifeste ma che si presentino al domicilio del paziente, entro un periodo variabile che va dai 30 giorni ai 90 giorni dopo il ricovero. In seguito alla valutazione di eleggibilità dei pazienti ricoverati, verrà monitorato il loro stato di salute sia durante il periodo di ricovero sia nei 30 giorni successivi alla dimissione, in modo da verificare se i pazienti abbiano contratto infezioni nosocomiali correlate con l’utilizzo dei sanitari. Attraverso il dispositivo proposto si vuole attestare la presenza di un minor rischio di contrarre l’infezione e, conseguentemente, una maggiore sicurezza per gli operatori sanitari che, durante lo svolgimento delle attività lavorative, vengono in contatto con i pazienti durante l’espletamento delle loro funzioni fisiologiche.
[DA INSERIRE]
[DA INSERIRE] Non applicabile
Non applicabile
62
11 Responsabilità relativa al dispositivo, in particolare controllo dell'accesso al dispositivo, commenti concernenti il dispositivo utilizzato nell'indagine clinica e restituzione delle risorse inutilizzate, dispositivi scaduti o guasti. 12 Dichiarazione di conformità ai principi etici riconosciuti per la ricerca medica che coinvolge soggetti umani e ai principi di buona pratica clinica in materia di indagini cliniche di dispositivi, nonché a tutte le prescrizioni normative applicabili. 13 Descrizione del consenso informato. 14 Relazioni sulla sicurezza, comprese le definizioni di eventi avversi ed eventi avversi gravi, difetti del dispositivo, le procedure e i termini per la presentazione di dette relazioni.
15 Criteri e procedure per il follow-up dei soggetti a seguito della fine, dell'interruzione temporanea o della conclusione anticipata di un'indagine e per il follow-up dei soggetti che hanno ritirato il proprio consenso e procedure per i casi di abbandono da parte dei soggetti. Per i dispositivi impiantabili tali procedure riguardano come minimo la tracciabilità. 16 Una descrizione delle modalità per fornire cure ai soggetti alla conclusione della loro partecipazione
Il protocollo clinico può avere avvio esclusivamente a seguito dell’installazione del dispositivo nel reparto indicato dell’azienda ospedaliera in cui si svolgerà lo studio proposto. I pazienti ricoverati potranno utilizzare esclusivamente il nuovo sanitario. Essendo il dispositivo non impiantabile e non sterile non è prevista la sua restituzione in termini di risorse inutilizzate e/o dispositivi scaduti o guasti.
[DA INSERIRE]
[DA INSERIRE]
Gli studi precedentemente condotti sulla tematica in oggetto dimostrano la presenza di una correlazione tra il bioaerosol generato dallo sciacquone dei servizi igienici e la contaminazione delle superfici ospedaliere, con conseguente esposizione a rischio aumentato di inalazione di materiale contaminato sia tra pazienti che tra operatori sanitari. L’utilizzo del dispositivo proposto è sicuro per gli utilizzatori, inoltre esso consente di ridurre l’elevato impatto delle infezioni nosocomiali sulla salute dei pazienti e sulla sicurezza degli operatori sanitari. Per lo svolgimento dello studio è necessario valutare lo stato clinico dei pazienti ricoverati nei reparti delle aziende ospedaliere indicate circa la manifestazione di infezioni nosocomiali (sia durante il periodo di degenza sia nei 30 giorni successivi la dimissione del paziente). Non è prevista una conclusione anticipata dell’indagine clinica, in caso di abbandono da parte dei soggetti partecipanti all’indagine clinica si terrà in considerazione soltanto l’indicatore relativo al tasso di contrazione delle infezioni nosocomiali durante il periodo di degenza.
Non sono necessarie cure aggiuntive al termine della partecipazione all’indagine clinica.
63
all'indagine clinica, qualora a seguito della partecipazione a tale indagine siano necessarie cure aggiuntive e tali cure differiscano da quelle normalmente previste per la condizione clinica in questione. 17 Politica relativa alla definizione della relazione sull'indagine clinica e pubblicazione dei risultati in forza delle prescrizioni giuridiche e dei principi etici di cui al Capo I, punto 1. 18 Elenco delle caratteristiche tecniche e funzionali del dispositivo, con l'indicazione specifica di quelle che formano oggetto dell'indagine.
La definizione di indagine clinica e la pubblicazione dei risultati sono svolti in accordo a quanto indicato nel Regolamento UE 2017/745, Allegato XV, Capo 1, punto 1: “Principi etici” - Ogni fase delle indagini cliniche, dalla riflessione iniziale sulla necessità e la giustificazione dello studio alla pubblicazione dei risultati, è eseguita nel rispetto dei principi etici riconosciuti”. La tecnologia Toilé è un WC capace di aspirare l’aerosol direttamente dal bacino del WC durante l’uso, convogliandolo all’esterno dell’edificio attraverso il condotto fognario. Aspirando l’aerosol all’origine, il WC così realizzato contrasta sia la diffusione dei cattivi odori sia quella dei virus e altri patogeni. La ceramica di Toilé è realizzata in modo da avere un condotto dedicato all’aspirazione dell’aerosol contaminato direttamente dal bacino del WC. Un aspiratore integrato nel sanitario è collegato a questo condotto e indirizza l’aerosol contaminato direttamente nel discendente fognario. (Planus, 2021) Inoltre: • le camere separate evitano sovrapposizioni di flusso di risciacquo e di aerosol aspirato; • continua la sua attività di estrazione per tutto il tempo di utilizzo del WC soprattutto, quindi, durante la fase di risciacquo; • il sistema aeraulico (estrazione e scarico aria contenete aerosol contaminato) è già all'interno del sanitario e non prevede quindi la necessità di opere murarie addizionali per la creazione di tubature dedicate; • dispone di connessioni idrauliche di qualsiasi WC standard, secondo normativa EN33, consentendo quindi la rapida sostituzione con qualsiasi WC.
64
Autore Best E.L.
Abreu A.C.T.
Matoušková I.H.
Verani M.
Cooper J.B.
Sassi H.P.
Knowlton S.D.B.
Wilson G.M.
Chia P.Y.S.
Alsved M.F. Anno
Riferimento documentale
2012 Best, E. L., Freeman, J., & Wilcox, M. H. (2012). Models for the study of Clostridium difficile infection. Gut microbes, 3(2), 145-167. 2013 Abreu, A. C., Tavares, R. R., Borges, A., Mergulhão, F., & Simões, M. (2013). Current and emergent strategies for disinfection of hospital environments. Journal of Antimicrobial Chemotherapy, 68(12), 2718-2732. 2014 Matoušková, I., & Holy, O. (2014). Monitoring of the environment at the transplant unit—hemato-oncology clinic. International journal of environmental research and public health, 11(9), 9480-9490. 2014 Verani, M., Bigazzi, R., & Carducci, A. (2014). Viral contamination of aerosol and surfaces through toilet use in health care and other settings. American journal of infection control, 42(7), 758-762. 2016 Cooper, J., Bryce, E., Astrakianakis, G., Stefanovic, A., & Bartlett, K. (2016). Efficacy of an automated ultraviolet C device in a shared hospital bathroom. American journal of infection control, 44(12), 1692-1694. 2017 Sassi, H. P., Reynolds, K. A., Pepper, I. L., & Gerba, C. P. (2018). Evaluation of hospital-grade disinfectants on viral deposition on surfaces after toilet flushing. American journal of infection control, 46(5), 507-511. 2018 Knowlton, S. D., Boles, C. L., Perencevich, E. N., Diekema, D. J., & Nonnenmann, M. W. (2018). Bioaerosol concentrations generated from toilet flushing in a hospital-based patient care setting. Antimicrobial Resistance & Infection Control, 7(1), 1-8. 2020 Wilson, G. M., Jackson, V. B., Boyken, L. D., Schweizer, M. L., Diekema, D. J., Petersen, C. A., ... & CDC Prevention Epicenter Program. (2020). Bioaerosols generated from toilet flushing in rooms of patients with Clostridioides difficile infection. Infection Control & Hospital Epidemiology, 41(5), 517-521. 2020 Chia, P. Y., Sengupta, S., Kukreja, A., Ponnampalavanar, S. S., Ng, O. T., & Marimuthu, K. (2020). The role of hospital environment in transmissions of multidrug-resistant gram-negative organisms. Antimicrobial Resistance & Infection Control, 9(1), 1-11. 2020 Alsved, M., Fraenkel, C. J., Bohgard, M., Widell, A., Söderlund-Strand, A., Lanbeck, P., ... & Löndahl, J. (2020). Sources of airborne norovirus in hospital outbreaks. Clinical Infectious Diseases, 70(10), 2023-2028.
65
Linee guida Impianti di climatizzazione: salute e sicurezza nelle attività di ispezione e bonifica Linea guida sulla valutazione del processo di sanificazione ambientale nelle strutture ospedaliere e territoriali per il controllo delle infezioni correlate all’assistenza (ICA) Linee guida per la prevenzione e il controllo di enterobatteri, Acinetobacter baumannii e Pseudomonas aeruginosa resistenti ai carbapenemi nelle strutture sanitarie Indicazioni sugli impianti di ventilazione/climatizzazione in strutture comunitarie non sanitarie e in ambienti domestici in relazione alla diffusione del virus SARS-CoV-2 Fonte
INAIL 2017 https://www.inail.it/cs/internet/docs/alg-pubbl-impianticlimatizzazione.pdf
Associazione Nazionale dei Medici delle Direzioni Ospedaliere 2018 https://www.anmdo.org/wp-content/uploads/2019/01/libro-uno-finzi1.pdf
Anno Riferimento documentale
Ministero della Salute 2020 https://www.salute.gov.it/imgs/C_17_pubblicazioni_2989_allegato.pdf
Rapporto ISS COVID-19 - n. 33/2020 2020 https://www.iss.it/rapporti-covid-19/ /asset_publisher/btw1J82wtYzH/content/rapporto-iss-covid-19-n.-332020-indicazioni-sugli-impianti-di-ventilazione-climatizzazione-instrutture-comunitarie-non-sanitarie-e-in-ambienti-domestici-inrelazione-alla-diffusione-del-virus-sars-cov-2.-versione-del-25-maggio2020
66
Informazioni generali sul protocollo clinico (Modulo di domanda)
Per la notifica di indagine clinica è necessario trasmettere all’Autorità Competente il “Modulo di domanda”, un documento in cui sono contenute le informazioni relative al dispositivo medico oggetto di valutazione clinica. Al suo interno è presente una sezione relativa al protocollo clinico e all’obiettivo dello studio che si vuole svolgere con il dispositivo proposto. In accordo a quanto indicato all’interno del “Modulo di domanda”, i dettagli relativi al protocollo clinico ipotizzato relativo al dispositivo Toilé sono di seguito riportati.
Studio internazionale SI [] NO [] [DA INSERIRE]
Studio multicentrico SI [] NO [] [DA INSERIRE]
ELENCO CENTRI PARTECIPANTI (indicare anche i corrispondenti sperimentatori principali):
SEDE STRUTTURA COINVOLTA Principal Investigator E-MAIL COMITATO ETICO E AREA DI APPARTENENZA
[Inserire nome dell’Azienda Sanitaria 1] [Inserire nome del Principal Investigator] [Inserire mail del Principal Investigator] [Inserire il Comitato Etico e Area di Appartenenza]
[Inserire nome dell’Azienda Sanitaria 2]
[Inserire nome dell’Azienda Sanitaria 3]
[Inserire nome dell’Azienda Sanitaria n] [Inserire nome del Principal Investigator] [Inserire mail del Principal Investigator] [Inserire il Comitato Etico e Area di Appartenenza]
[Inserire nome del Principal Investigator] [Inserire mail del Principal Investigator] [Inserire il Comitato Etico e Area di Appartenenza]
[Inserire nome del Principal Investigator] [Inserire mail del Principal Investigator] [Inserire il Comitato Etico e Area di Appartenenza]
SPERIMENTATORE COORDINATORE DELLA RICERCA: [Indicare Nome]
NUMERO PAZIENTI totali: [N]
NUMERO PAZIENTI in Italia: [N]
NUMERO PAZIENTI per centro: [N]
SEDE STRUTTURA COINVOLTA
[Inserire nome dell’Azienda Sanitaria 1]
Numero di pazienti
[N1]
[Inserire nome dell’Azienda Sanitaria 2] [Inserire nome dell’Azienda Sanitaria 3] [N2]
[N3]
[Inserire nome dell’Azienda Sanitaria n] [Nn]
NUMERO dei D.M. che si prevede verranno utilizzati nella sperimentazione nel territorio
italiano: [N]
RAZIONALE DELLO STUDIO (con riferimento alle pagine della documentazione scientifica in cui sono descritti i relativi dettagli ed alla letteratura disponibile):
Background
L'emergenza sanitaria legata all'infezione da SARS-CoV-2 e la sua potenziale trasmissione attraverso le superfici contaminate in ambienti sanitari, ha portato ad attenzionare con maggior scrupolosità la problematica delle infezioni correlate all’assistenza (ICA), sia di origine virale che batterica. In particolare, la pandemia ha consentito l’implementazione di studi di efficacia relativi ai metodi di disinfezione convenzionali e alla ricerca di nuovi strumenti alternativi per prevenirne la diffusione. Una delle principali modalità di trasmissione delle infezioni è rappresentata dalla via aerea. In ambito ospedaliero e sanitario, la ventilazione rappresenta la strategia di controllo principale delle malattie infettive; essa favorisce la diluizione dell'aria con conseguente rimozione dei virus respiratori (Francisco et al, 2014). In un ambiente ottimamente ventilato, il numero di goccioline potrebbe essere dimezzato dopo 30 secondi, mentre in stanze con scarsa ventilazione o assenza di ventilazione questo potrebbe richiedere 1-4 m e 5 m, rispettivamente (Knowlton et al, 2018).
I servizi igienici, a causa della diffusione di microrganismi potenzialmente patogeni nel materiale fecale e successivamente nell'aerosol durante la fase di risciacquo del WC, impone una pulizia accurata e regolare (ad es. ventilazione + sterilizzazione). la chiusura del sedile del water riduca i livelli di aerosol rilasciati nell’ambiente circostante, non ne elimina completamente la fuoriuscita, poiché le particelle aerosolizzate fuoriescono attraverso gli spazi tra il coperchio, la seduta e la ceramica. Tale problematica risulta rilevante soprattutto negli ospedali ma anche nei bagni multiutenza in generale. In ogni caso, fognature e sistemi di drenaggio (scarichi fognari) inadeguati potrebbero aumentare il rischio di formazione di aerosol contaminato e quindi diffusione di particelle infette, che potrebbero, a loro volta, depositarsi sulle superfici circostanti oppure infettare direttamente l’utilizzatore del WC. Quindi, i processi di disinfezione dovrebbero essere svolti frequentemente, ma, in alcuni casi, potrebbero non essere sufficienti a prevenire la trasmissione delle infezioni.
L e I n f e z i o n i C o r r e l a t e a l l’ A s s i s t e n z a ( I C A )
Il rischio infettivo, ossia il rischio per i pazienti, visitatori ed operatori di contrarre un’infezione durante la permanenza in ospedale o in strutture di residenza assistita, è uno dei principali problemi di gestione negli ambienti sanitari. Le evidenze intenzionali suggeriscono di considerare come associata all’assistenza sanitaria ogni infezione che insorga dopo almeno 48 ore di ricovero (WHO, 2021). Prerequisito fondamentale è che l’infezione non sia presente, né in forma clinica manifesta né in fase di incubazione, al momento dell’ingresso in ospedale. Analogamente, si considerano come Infezione Correlata all’Assistenza (ICA) tutte le infezioni che all’atto della dimissione non siano clinicamente manifeste ma che si presentino al domicilio del paziente, entro un periodo variabile che va dai 30 giorni (es. per le infezioni del sito chirurgico) ai 90 giorni dopo il ricovero (es. impianto di protesi articolare). (Ricciardi et al, 2021) Le ICA sono infezioni causate da batteri, virus o funghi, patogeni convenzionali o opportunisti, spesso multi-resistenti. Le principali cause di ICA in Europa sono: Staphylococcus aureus meticillino-resistente (MRSA) e Clostridium difficile e batteri Gram negativi sempre più resistenti (ECDC, 2017). Come per ogni altra infezione, lo stato di malattia dipende dall’incontro di tre diversi ordini di fattori: fattori legati all’individuo, al microorganismo e fattori legati all’ambiente. Quest’ultimi sono costituiti dalle superfici (pareti, letti ed oggetti) presenti nell’ospedale e dalle persone che vengono a contatto con il paziente, ovvero gli operatori sanitari, i familiari ed i visitatori (Ministero della Salute. Malattie infettive). Le persone a rischio di contrarre una ICA sono innanzitutto i pazienti e, con minore frequenza, il personale ospedaliero, gli assistenti volontari, studenti e tirocinanti. Tra le condizioni che aumentano la suscettibilità alle infezioni ci sono: età (neonati, anziani), altre infezioni o gravi patologie concomitanti (tumori, immunodeficienza, diabete, anemia, cardiopatie, insufficienza
renale), malnutrizione, traumi, ustioni, alterazioni dello stato di coscienza e trapianti d’organo (Istituto Superiore di Sanità-Epicentro. Infezioni correlate all’assistenza-Informazioni generali). In molti Paesi dell’Unione Europea (UE), le ICA vengono periodicamente indagate con uno studio di prevalenza puntuale che utilizza una metodologia standardizzata proposta dall’European Centre for Disease Prevention and Control (ECDC). Da questi studi è emerso che la prevalenza dei pazienti infetti varia dal 6,8% al 9,3% e quella di infezioni dal 7,6% al 10,3%. In media, quindi, il 5% dei pazienti ospedalizzati contrae un’infezione durante il ricovero, mentre risulta infetto in un dato momento dal 7% al 9% dei pazienti ricoverati. Si tratta comunque di stime medie, che non si applicano quindi a contesti specifici: l’incidenza di infezioni ospedaliere, infatti, varia molto a seconda delle dimensioni dell’ospedale, del tipo di reparto, della durata della degenza e delle misure di controllo adottate (Istituto Superiore di Sanità-Epicentro, “Infezioni correlate all’assistenza-Aspetti epidemiologici”). In Italia, non esiste un sistema di sorveglianza nazionale tuttavia sono stati condotti numerosi studi multicentrici di prevalenza. Sulla base di questi e delle indicazioni della letteratura, si può stimare che in Italia il 5-8% dei pazienti ricoverati contrae un’infezione ospedaliera (Istituto Superiore di Sanità-Epicentro, “Infezioni correlate all’assistenza-Aspetti epidemiologici”). Ogni anno, quindi, si verificano in Italia 450-700 mila infezioni in pazienti ricoverati in ospedale. Di queste, si stima che circa il 30% siano potenzialmente prevenibili (135-210 mila) e che siano direttamente causa del decesso nell’1% dei casi (1350-2100 decessi prevenibili in un anno) (Istituto Superiore di Sanità-Epicentro, “Infezioni correlate all’assistenza-Aspetti epidemiologici”). Nel 2016, su un campione di oltre 14.000 pazienti ricoverati in 19 regioni italiane, sono stati riscontrati 1.186 casi di ICA, corrispondente all’8% del totale dei pazienti ricoverati, dimostrando una prevalenza di ICA, nei giorni dello studio, superiore alla media europea (6.5%) (Report italiano HALT3 2016/2017). Secondo quanto riportato dal Ministero della Salute (Ministero della Salute, “Infezioni correlate all'assistenza: cosa sono e cosa fare”) la maggior parte delle ICA interessa il tratto urinario, l’apparato respiratorio, le ferite chirurgiche, le infezioni sistemiche (sepsi, batteriemie). Le più frequenti sono le infezioni urinarie, che da sole rappresentano il 35-40% di tutte le infezioni ospedaliere. Le cause riconducibili all’ICA sono molteplici e riassumibili nei seguenti punti [www.salute.gov.it]: - progressiva introduzione di nuove tecnologie sanitarie, con l’uso prolungato di dispositivi medici invasivi e gli interventi chirurgici complessi, che, pur migliorando le possibilità terapeutiche e l’esito della malattia, possono favorire l’ingresso di microrganismi in sedi corporee normalmente sterili; - indebolimento del sistema di difesa dell'organismo (immunosoppressione) o gravi patologie concomitanti;
- la scarsa applicazione di misure di igiene ambientale e di prevenzione e controllo delle infezioni in ambito assistenziale; - emergenza di ceppi batterici resistenti agli antibiotici, dovuta soprattutto all’uso scorretto o eccessivo di questi farmaci, che complica ulteriormente il decorso di molte ICA. Le persone a maggior rischio di contrarre una ICA sono gli assistiti; tuttavia, sono esposti e possono essere colpiti anche il personale sanitario e i visitatori. La sorgente di infezione può essere rappresentata da un paziente (colonizzato o con ICA in atto) o dall’ambiente, intendendo per ambiente l’insieme delle matrici ambientali contaminate o impropriamente sanificate e dagli impianti idrici, di gas e di ventilazioni non correttamente gestiti. Le modalità di trasmissione delle ICA possono essere riassumibili come segue: - Contatto sano vs malato; - Contatto/trasmissione indiretto attraverso un veicolo contaminato; - Trasmissione per contatto diretto o indiretto con superfici contaminate; - Trasmissione aerea (Ministero della Salute, “Malattie infettive”). In tutti i casi, al fine di prevenire la trasmissione delle infezioni, è indispensabile: - identificare le sorgenti e gli agenti microbiologici responsabili dell’insorgenza della malattia infettiva, - quantificare il potenziale impatto sulla salute del personale sanitario e degli utenti, per l’esposizione a singoli agenti o a loro miscele, - individuare rimedi tecnici e soluzioni di bonifica ambientale adeguate. Per quel che concerne la trasmissione aerea, è opportuno specificare che le particelle organiche sospese in aria (bioaerosol) e costituite da microrganismi (virus, batteri come la Legionella pneumophila, Staphylococcus aureus, Streptococcus pyogenes o Pseudomonas aeruginosa, lieviti, miceti quali Aspergillus fumigatus, Cladosporium spp.; ecc..) possono diffondere e distribuirsi anche a grande distanza in tutti gli ambienti ospedalieri, in special modo se veicolate da impianti di climatizzazione non opportunamente filtrati. In conclusione, in ambito assistenziale la presenza di una sorgente primaria di infezione dipende da (ASR Regione Emilia Romagna, Dossier 123-2006): - grado di affollamento degli ambienti; - tempo di contatto o tempo assistenziale (durata delle procedure sanitarie a diretta interazione paziente/personale); - comportamento (movimenti, attitudine a parlare o tossire-starnutire) - grado di pulizia del vestiario; - livello di igiene personale; - formazione del personale.
Circa l’80% di tutte le infezioni ospedaliere riguarda quattro sedi principali: il tratto urinario, le ferite chirurgiche, l’apparato respiratorio, le infezioni sistemiche (sepsi, batteriemie). Le più frequenti sono le infezioni urinarie, che da sole rappresentano il 35-40% di tutte le infezioni ospedaliere. Tuttavia, negli ultimi quindici anni si sta assistendo a un calo di questo tipo di infezioni (insieme a quelle della ferita chirurgica) e a un aumento delle batteriemie e delle polmoniti. L’aumento delle infezioni sistemiche è la conseguenza di un graduale aumento dei fattori di rischio specifici, in particolare l’uso abbondante di antibiotici e di cateterismi vascolari (Istituto Superiore di Sanità-Epicentro, “Infezioni correlate all’assistenza-Aspetti epidemiologici”). Per quanto riguarda i microrganismi coinvolti, variano nel tempo. Fino all’inizio degli anni Ottanta, le infezioni ospedaliere erano dovute principalmente a batteri gram-negativi (per esempio, Escherichia coli e Klebsiella pneumoniae). Poi, per effetto della pressione antibiotica e del maggiore utilizzo di presidi sanitari di materiale plastico, sono aumentate le infezioni sostenute da gram-positivi (soprattutto Enterococchi e Stafilococcus epidermidis) e quelle da miceti (soprattutto Candida), mentre sono diminuite quelle sostenute da gram-negativi (Istituto Superiore di Sanità-Epicentro, “Infezioni correlate all’assistenza-Aspetti epidemiologici”). Le ICA hanno un impatto clinico ed economico rilevante. Secondo il primo rapporto globale dell’Organizzazione Mondiale della Sanità, le ICA provocano un prolungamento della durata di degenza, disabilità a lungo termine, aumento della resistenza dei microrganismi agli antibiotici, un carico economico aggiuntivo per i sistemi sanitari e per i pazienti e le loro famiglie e una significativa mortalità in eccesso (WHO, 2011). In Europa, le ICA provocano ogni anno: - 16 milioni di giornate aggiuntive di degenza; - 37.000 decessi attribuibili; - 110.000 decessi per i quali l’infezione rappresenta una concausa. (WHO, 2011). Sulla base dei dati della rete di sorveglianza delle ICA, in Europa oltre 3,2 milioni pazienti vengono infettati almeno una volta all'anno in seguito all'esposizione nelle strutture sanitarie. Anche a livello Europeo, così come precedentemente riportato per l’Italia, i tipi più comuni di infezione sono quelle del tratto urinario, la polmonite, le infezioni del sito chirurgico, le infezioni del sangue e le infezioni gastro-intestinali. L’European Centre for Disease Prevention and Control (ECDC) stima che ogni anno negli ospedali per acuti si verifichino 3.8 milioni di nuovi casi di ICA e 90.000 decessi nei Paesi dell’Unione Europea. La frequenza e la tipologia di ICA variano di Paese in Paese ma anche di struttura in struttura (ECDC, 2017). Non tutte le ICA sono prevenibili, ma si stima attualmente che possa esserlo una quota superiore al 50%. Pertanto è fondamentale sorvegliare selettivamente quelle che sono attribuibili a problemi nella qualità dell’assistenza. In genere, si possono prevenire le infezioni associate a determinate procedure, attraverso una riduzione delle procedure non necessarie, la scelta di
presidi più sicuri, l’adozione di misure di assistenza al paziente che garantiscano condizioni asettiche (Istituto Superiore di Sanità-Epicentro, “Infezioni correlate all’assistenza-Informazioni generali”). Le ICA hanno un costo sia in termini di salute che economici, sia per il paziente che per la struttura. Da qui la necessità di adottare pratiche assistenziali sicure, in grado di prevenire o controllare la trasmissione di infezioni sia in ospedale che in tutte le strutture sanitarie non ospedaliere.
Obiettivi
A causa dell’emergenza pandemica da Covid-19, l’attenzione dei ricercatori si è focalizzata, nell’ultimo anno, sulla trasmissione di virus, batteri e agenti patogeni attraverso l’aerosol includendo come luogo di trasmissione anche i bagni pubblici. La fase critica di una possibile diffusione è rappresentata dalla fase di risciacquo del WC. Infatti, all’interno del sanitario si genera una forte turbolenza e questo flusso indotto potrebbe provocare l’espulsione nell’aria di particelle di aerosol contenenti virus e agenti patogeni, contaminando, di conseguenza, le superfici dell'ambiente circostante. È evidente che le ipotetiche misure precauzionali, come il totale ricambio di aria e la pulizia completa dell'intero ambiente bagno dopo ogni utilizzo, non costituiscano una soluzione praticabile e risulterebbero comunque ancora insufficienti. Il dispositivo medico Toilé si inserisce in un contesto di sicurezza sul lavoro, relativamente al rischio di contagio per gli operatori sanitari, particolarmente esposti in quanto possono trovarsi a contatto con i pazienti durante l’espletamento delle loro funzioni fisiologiche e comunque operare nei servizi igienici, o utilizzarli, in un ambiente ad elevato rischio quali le strutture sanitarie. La tecnologia Toilé è un WC capace di aspirare l’aerosol direttamente dal bacino del WC durante l’uso, convogliandolo all’esterno dell’edificio attraverso il condotto fognario. Aspirando l’aerosol all’origine, il WC così realizzato contrasta sia la diffusione dei cattivi odori sia quella dei virus e altri patogeni. La ceramica di Toilé è realizzata in modo da avere un condotto dedicato all’aspirazione dell’aerosol contaminato direttamente dal bacino del WC. Un aspiratore integrato nel sanitario è collegato a questo condotto e indirizza l’aerosol contaminato direttamente nel discendente fognario. Inoltre: • le camere separate evitano sovrapposizioni di flusso di risciacquo e di aerosol aspirato; • continua la sua attività di estrazione per tutto il tempo di utilizzo del WC soprattutto, quindi, durante la fase di risciacquo; • il sistema aeraulico (estrazione e scarico aria contenete aerosol contaminato) è già all'interno del sanitario e non prevede quindi la necessità di opere murarie addizionali per la creazione di tubature dedicate;
• dispone di connessioni idrauliche di qualsiasi WC standard, secondo normativa EN33, consentendo quindi la rapida sostituzione con qualsiasi WC. Obiettivo di tale studio è attestare l’efficacia del dispositivo medico Toilé valutando gli effetti collaterali, in termini di eventi avversi che si verificano sui pazienti ricoverati e che sono correlati al verificarsi di infezioni nosocomiali causate dall’utilizzo dei sanitari. Attraverso lo studio si vuole valutare se l’utilizzo del dispositivo proposto comporta una riduzione nell’incidenza di contrazione delle infezioni nosocomiali da parte dei pazienti e, al tempo stesso, si vuole stimare la riduzione dei costi del sistema sanitario che comporta l’utilizzo del dispositivo Toilé.
Metodi
Nell’ambito dello studio di fattibilità è stata effettuata una revisione sistematica della letteratura. Il primo passo affrontato è stato quello di definire l’argomento (topic) oggetto dell’indagine in modo chiaro e preciso, avvalendosi dello studio preliminare dei lavori forniti dall’azienda Planus Spa, nonché di ulteriori evidenze reperite sul database PubMed, attraverso una ricerca preliminare di articoli e testi riguardanti il topic oggetto di approfondimento. Questa strategia preliminare ha consentito di definire il “problema di salute” ed individuare le parole chiave (keywords) necessarie per la costruzione delle stringhe di ricerca, indispensabili per la revisione sistematica, successivamente esplicitate. La domanda di ricerca (policy question) è stata strutturata utilizzando il metodo PICO (Population, Intervention, Comparator, Outcome); questo modello include la popolazione di riferimento oggetto della valutazione (P), l’intervento o gli interventi sui quali si sta indagando (I), il comparatore o i comparatori (C), e gli outcome di riferimento (O). Nella tabella seguente si riporta il modello PICO utilizzato per l’impostazione dell’analisi:
Popolazione Popolazione potenzialmente affetta da infezioni trasmissibili per via oro-fecale
Intervento Toilé Comparatore Sanitari consueti, non provvisti di sistema di aspirazione integrato (setting: strutture sanitarie)
Outcome
Prevenzione della trasmissione, via aerosol, di microrganismi patogeni
Al termine del processo di revisione sistematica di letteratura, effettuata attraverso i database Medline e Web of Science, sono stati selezionati 10 articoli. Gli articoli selezionati sono stati sistematizzati in una tabella riassuntiva. In aggiunta ad essi sono state selezionate le principali linee guida utili per un ulteriore inquadramento dell’argomento oggetto di analisi. Tale revisione ha sottolineato l’importanza della prevenzione soprattutto negli ambienti ospedalieri in quanto luoghi maggiormente coinvolti nella trasmissione delle infezioni.
Autore Best E.L.
Abreu A.C.T.
Matoušková I.H.
Verani M.
Cooper J.B.
Sassi H.P.
Knowlton S.D.B.
Wilson G.M.
Chia P.Y.S.
Alsved M.F. Anno
Riferimento documentale
2012 Best, E. L., Freeman, J., & Wilcox, M. H. (2012). Models for the study of Clostridium difficile infection. Gut microbes, 3(2), 145-167. 2013 Abreu, A. C., Tavares, R. R., Borges, A., Mergulhão, F., & Simões, M. (2013). Current and emergent strategies for disinfection of hospital environments. Journal of Antimicrobial Chemotherapy, 68(12), 2718-2732. 2014 Matoušková, I., & Holy, O. (2014). Monitoring of the environment at the transplant unit—hemato-oncology clinic. International journal of environmental research and public health, 11(9), 9480-9490. 2014 Verani, M., Bigazzi, R., & Carducci, A. (2014). Viral contamination of aerosol and surfaces through toilet use in health care and other settings. American journal of infection control, 42(7), 758-762. 2016 Cooper, J., Bryce, E., Astrakianakis, G., Stefanovic, A., & Bartlett, K. (2016). Efficacy of an automated ultraviolet C device in a shared hospital bathroom. American journal of infection control, 44(12), 1692-1694. 2017 Sassi, H. P., Reynolds, K. A., Pepper, I. L., & Gerba, C. P. (2018). Evaluation of hospital-grade disinfectants on viral deposition on surfaces after toilet flushing. American journal of infection control, 46(5), 507-511. 2018 Knowlton, S. D., Boles, C. L., Perencevich, E. N., Diekema, D. J., & Nonnenmann, M. W. (2018). Bioaerosol concentrations generated from toilet flushing in a hospital-based patient care setting. Antimicrobial Resistance & Infection Control, 7(1), 1-8. 2020 Wilson, G. M., Jackson, V. B., Boyken, L. D., Schweizer, M. L., Diekema, D. J., Petersen, C. A., ... & CDC Prevention Epicenter Program. (2020). Bioaerosols generated from toilet flushing in rooms of patients with Clostridioides difficile infection. Infection Control & Hospital Epidemiology, 41(5), 517-521. 2020 Chia, P. Y., Sengupta, S., Kukreja, A., Ponnampalavanar, S. S., Ng, O. T., & Marimuthu, K. (2020). The role of hospital environment in transmissions of multidrug-resistant gram-negative organisms. Antimicrobial Resistance & Infection Control, 9(1), 1-11. 2020 Alsved, M., Fraenkel, C. J., Bohgard, M., Widell, A., Söderlund-Strand, A., Lanbeck, P., ... & Löndahl, J. (2020). Sources of airborne norovirus in hospital outbreaks. Clinical Infectious Diseases, 70(10), 2023-2028.
75
Linee guida Impianti di climatizzazione: salute e sicurezza nelle attività di ispezione e bonifica Linea guida sulla valutazione del processo di sanificazione ambientale nelle strutture ospedaliere e territoriali per il controllo delle infezioni correlate all’assistenza (ICA) Linee guida per la prevenzione e il controllo di enterobatteri, Acinetobacter baumannii e Pseudomonas aeruginosa resistenti ai carbapenemi nelle strutture sanitarie Indicazioni sugli impianti di ventilazione/climatizzazione in strutture comunitarie non sanitarie e in ambienti domestici in relazione alla diffusione del virus SARS-CoV-2 Fonte
INAIL 2017 https://www.inail.it/cs/internet/docs/alg-pubbl-impianticlimatizzazione.pdf
Associazione Nazionale dei Medici delle Direzioni Ospedaliere 2018 https://www.anmdo.org/wp-content/uploads/2019/01/libro-uno-finzi1.pdf
Anno Riferimento documentale
Ministero della Salute 2020 https://www.salute.gov.it/imgs/C_17_pubblicazioni_2989_allegato.pdf
Rapporto ISS COVID-19 - n. 33/2020 2020 https://www.iss.it/rapporti-covid-19/ /asset_publisher/btw1J82wtYzH/content/rapporto-iss-covid-19-n.-332020-indicazioni-sugli-impianti-di-ventilazione-climatizzazione-instrutture-comunitarie-non-sanitarie-e-in-ambienti-domestici-inrelazione-alla-diffusione-del-virus-sars-cov-2.-versione-del-25-maggio2020
76
Risultati attesi
Attraverso lo studio si vuole verificare se, tramite l’utilizzo del dispositivo medico Toilé in ambito sanitario, sia possibile attestare una riduzione del numero di infezioni nosocomiali che si verificano in seguito all’utilizzo dei sanitari da parte di pazienti. Il dispositivo medico proposto si inserisce in un contesto di prevenzione ospedaliera in quanto le infezioni nosocomiali che si verificano nei pazienti potrebbero successivamente riflettersi sugli operatori sanitari in contatto con essi durante l’espletamento delle loro funzioni fisiologiche e/o operano nel contesto dei servizi igienici. Inoltre si vuole valutare quanto l’introduzione della nuova tecnologia inciderà sui costi del sistema sanitario. Secondo quanto atteso, a seguito di un iniziale incremento dei costi, dovuto ai costi di acquisizione e di installazione del dispositivo nei reparti ospedalieri indicati, seguirà una riduzione dei costi sanitari sostenuti causati dallo sviluppo di infezioni nosocomiali che si verificano sia nei pazienti ricoverati ad esempio in termini di prolungamento della durata di degenza, disabilità a lungo termine, carico economico aggiuntivo per i sistemi sanitari, per i pazienti e le loro famiglie, decessi per i quali l’infezione rappresenta una concausa, sia in operatori sanitari ad essi correlati in termini di assenza lavorativa e/o visite ospedaliere/ambulatoriali.
BREVE SINTESI DEL PROTOCOLLO CLINICO (allegare flow chart):
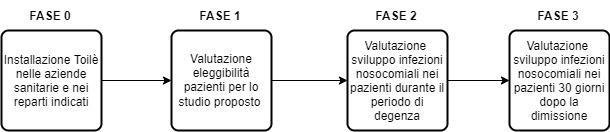
Il protocollo clinico può essere suddiviso in 3 fasi, precedute da una fase iniziale (fase 0) che rappresenta il prerequisito per lo svolgimento dello studio clinico. Il protocollo clinico è di riportato in figura 1:
Figura 9: Protocollo clinico per lo studio del dispositivo Toilé
• Fase 0: Installazione del dispositivo Toilé nei reparti delle aziende ospedaliere indicate; • Fase 1: Valutazione eleggibilità pazienti per lo studio proposto secondo i criteri di inclusione: pazienti maggiorenni (età > 18 anni) ricoverati nel reparto indicato durante il periodo di svolgimento dello studio. Prerequisito fondamentale è che l’infezione non sia presente, né in forma clinica manifesta né in fase di incubazione, al momento dell’ingresso in ospedale;
• Fase 2: Valutazione sviluppo di infezioni nosocomiali nei pazienti durante il periodo di degenza. I pazienti ricoverati potranno utilizzare esclusivamente il nuovo sanitario durante il periodo di degenza; • Fase 3: Valutazione sviluppo di infezioni nosocomiali nei pazienti 30 giorni dopo la dimissione attraverso visite ambulatoriali di controllo attraverso visite ambulatoriali di controllo. È infatti possibile considerare come Infezione Correlata all’Assistenza (ICA) tutte le infezioni che all’atto della dimissione non siano clinicamente manifeste ma che si presentino al domicilio del paziente, entro un periodo variabile che va dai 30 giorni ai 90 giorni dopo il ricovero.
Titolo: Efficacia del dispositivo medico Toilé nel ridurre lo sviluppo di infezioni nosocomiali correlate all’utilizzo dei sanitari da parte di pazienti ricoverati in ambito ospedaliero
OBIETTIVO DELLO STUDIO:
• PRIMARIO: Verificare l’efficacia del dispositivo Toilé valutate in termini di effetti collaterali (eventi avversi) determinati dallo sviluppo di infezioni nosocomiali correlate all’utilizzo dei sanitari da parte dei pazienti ricoverati e selezionati per lo studio proposto. • SECONDARIO: Costo-efficacia misurata in termini di: o Costi sanitari sostenuti a causa di infezioni nosocomiali che si sviluppano sia nei pazienti ricoverati ad esempio in termini di prolungamento della durata di degenza, disabilità a lungo termine, carico economico aggiuntivo per i sistemi sanitari, per i pazienti e le loro famiglie, decessi per i quali l’infezione rappresenta una concausa, sia in operatori sanitari ad essi correlati in termini di assenza lavorativa e/o visite ospedaliere/ambulatoriali; o Costi di acquisizione del dispositivo tenendo in considerazione la potenziale riduzione di infezioni nosocomiali che il dispositivo è in grado di apportare.
I costi sono a carico del servizio sanitario.
SINTESI DEI CRITERI DI INCLUSIONE:
Pazienti maggiorenni (età > 18 anni) ricoverati nel reparto indicato durante il periodo di svolgimento dello studio proposto. Prerequisito fondamentale è che essi non siano già affetti da infezione (infezione non presente né in forma clinica manifesta né in fase di incubazione al momento dell’ingresso in ospedale).
SINTESI DEI CRITERI DI ESCLUSIONE:
Tutti i pazienti che non rientrano nei criteri di inclusione.
SINTESI DEI CRITERI DI VALUTAZIONE DI EFFICACIA PRIMARI E SECONDARI:
• Efficacia: Verifica della riduzione degli effetti collaterali (eventi avversi) determinati dallo sviluppo di infezioni nosocomiali correlate all’utilizzo dei sanitari da parte dei pazienti ricoverati e selezionati per lo studio proposto. La presenza di infezioni viene valutata nei pazienti sia durante il periodo di degenza sia 30 giorni dopo la loro dimissione; • Valutazione economica: Valutare sia i costi sanitari sostenuti a causa di infezioni nosocomiali che si sviluppano nei pazienti ricoverati sia il costo finalizzato all’acquisizione e all’installazione del dispositivo tenendo in considerazione la potenziale riduzione di infezioni nosocomiali che il dispositivo è in grado di apportare.
I costi sono a carico del servizio sanitario.
SINTESI DEI CRITERI DI VALUTAZIONE DELLA SICUREZZA:
Gli studi precedentemente condotti sulla tematica in oggetto dimostrano la presenza di una correlazione tra il bioaerosol generato dallo sciacquone dei servizi igienici e la contaminazione delle superfici ospedaliere, con conseguente esposizione a rischio aumentato di inalazione di materiale contaminato sia tra pazienti che tra operatori sanitari. L’utilizzo del dispositivo proposto è sicuro per gli utilizzatori, inoltre esso consente di ridurre l’elevato impatto delle infezioni nosocomiali sulla salute dei pazienti e conseguentemente sulla sicurezza degli operatori sanitari che vengono in contatto con i pazienti durante l’espletamento delle loro funzioni fisiologiche incidendo, al tempo stesso, su una riduzione dei costi del sistema sanitario.
SINTESI DEI CRITERI DI VERIFICA DELLE PRESTAZIONI DEL DM:
È possibile valutare il tasso di infezioni nosocomiali che si verificano sia durante il ricovero in ospedale sia in seguito alla dimissione del paziente e correlarle con l’utilizzo del nuovo dispositivo Toilé. I risultati ottenuti verranno poi confrontati con i dati già presenti in letteratura.
POPOLAZIONE DELLO STUDIO:
VOLONTARI SANI SI [] NO [] PAZIENTI SI [X] NO [] PAZ. RICOVERATI SI [X] NO [] PAZ. AMBULATORIALI SI [] NO []
RICOV. + AMBUL SI [] NO []
DISEGNO DELLO STUDIO: [DA INSERIRE]
[] CONTROLLATO [] A GRUPPI PARALLELI [] NON CONTROLLATO [] APERTO [] SINGOLO CIECO [] DOPPIO CIECO [] RANDOMIZZATO [] NON RANDOMIZZATO [] CROSS OVER [] ALTRO
CONFRONTO VERSO:
[] STESSO D.M. NON ATTIVATO [] ALTRO D.M. ATTIVATO [] ALTRO D.M. NON ATTIVATO [] TERAPIA FARMACOLOGICA [] PLACEBO [] GRUPPO DI CONTROLLO NON TRATTATO [X] CONFRONTO NON PREVISTO
DESCRIZIONE DEL D.M. procedura USATO COME CONFRONTO:
1) FABBRICANTE: NA 2) NOME DEL D. M.: NA 3) DESTINAZIONE D’USO: NA 4) MARCHIO CE: NA 5) CLASSIFICAZIONE DEL D.M.: NA
BREVE DESCRIZIONE DELLA PROCEDURA DI APPLICAZIONE DEL D.M. SPERIMENTALE
A seguito dell’installazione del dispositivo Toilé nei reparti delle aziende ospedaliere indicate per lo svolgimento dello studio clinico, verrà effettuata una valutazione di eleggibilità dei pazienti per lo studio proposto secondo i criteri di inclusione: pazienti maggiorenni (età > 18 anni) ricoverati nel reparto indicato durante il periodo di svolgimento dello studio. Prerequisito fondamentale è che essi non siano già affetti da infezione (infezione non presente né in forma clinica manifesta né in fase di incubazione al momento dell’ingresso in ospedale).
Successivamente si procede alla valutazione dello sviluppo di infezioni nosocomiali nei pazienti durante il periodo di degenza: i pazienti ricoverati potranno utilizzare esclusivamente il nuovo sanitario durante tale periodo. Infine si procede alla valutazione dello sviluppo di infezioni nosocomiali nei pazienti 30 giorni dopo la dimissione attraverso visite ambulatoriali di controllo. È infatti possibile considerare come Infezione Correlata all’Assistenza (ICA) tutte le infezioni che all’atto della dimissione non siano clinicamente manifeste ma che si presentino al domicilio del paziente, entro un periodo variabile che va dai 30 giorni ai 90 giorni dopo il ricovero.
ANALISI DEI RISCHI CLINICI e/o CHIRURGICI ASSOCIATI AL D.M. e/o ALLE PROCEDURE DI APPLICAZIONE RISPETTO AI TRATTAMENTI (anche farmacologici) GIA’ IN USO PER LA MEDESIMA INDICAZIONE CLINICA:
Non sono presenti rischi clinici relativi all’utilizzo del dispositivo medico Toilé. Gli effetti collaterali, in termini di eventi avversi, possono essere valutati come numero di infezioni nosocomiali correlate all’utilizzo dei sanitari da parte dei pazienti. Tale risultato potrebbe riflettersi sui casi di infezioni nosocomiali che si verificano su operatori sanitari che vengono in contatto con i degenti durante l’espletamento delle loro funzioni fisiologiche e/o operano nel contesto dei servizi igienici. Attualmente le alternative tecnologiche adottate nei bagni pubblici sono ad esempio (i) i tradizionali aspiratori d’aria a parete; o (ii) Estrattori d'aria collegati alla cassetta di scarico. Nel primo caso il ricambio d’aria richiede molto tempo e quindi non è possibile prevenire la diffusione dell’aerosol che sarà inalata dall’utente successivo e si depositerà sulle superfici, contaminandole. L’uso del bagno, in questo caso, dovrebbe essere obbligatoriamente interdetto, fino a processo di totale ricambio completato. Nel secondo caso l’aspirazione avviene attraverso il tubo che collega la cassetta di scarico al WC. Tuttavia, con questo sistema non è possibile aspirare l’aerosol poiché durante la fase di risciacquo la capacità di aspirazione dell'aria svanisce completamente perché il tubo è pieno d'acqua e non potrà aspirare l’aerosol. Il dispositivo medico Toilé si inserisce in un contesto di sicurezza sul lavoro, relativamente al rischio di contagio per gli operatori sanitari. L’adozione del dispositivo medico proposto infatti potrebbe ridurre l'elevato impatto delle infezioni nosocomiali sulla salute dei pazienti agendo al tempo stesso sulla sicurezza degli operatori sanitari, incidendo di conseguenza sui costi del sistema sanitario.
EVENTUALI TRATTAMENTI CONCOMITANTI: Non presenti
PIANIFICAZIONE DELLO STUDIO: DATA PREVISTA INIZIO [DA INSERIRE] DATA PREVISTA TERMINE [DA INSERIRE]
DURATA DELLO STUDIO (riferita al singolo paziente e comprensiva di tutte le fasi: reclutamento, trattamento, follow-up): [DA INSERIRE]
STATISTICA
a) Esplicitare le modalità di calcolo del campione: [DA INSERIRE] b) Sintetizzare il piano di analisi dei dati [DA INSERIRE]




