– leki przeciwgruźlicze – izoniazyd, kwas paraaminosalicylowy
leki przeciwdrgawkowe – zwłaszcza karbamazepina i fenytoina
– niesteroidowe leki przeciwzapalne (NSLPZ) –mesalazyna
– diuretyki – acetazolamid, chlortalidon, hydrochlorotiazyd, spironolakton
– pochodne sulfonylomocznika
– leki przeciwnowotworowe (przeciwciała monoklonalne – inhibitory punktów kontrolnych układu odpornościowego), antracykliny, 5 fluorouracyl
– inne leki – metylodopa, amitryptylina, klozapina
b) inne substancje i czynniki – alkohol, amfetamina, kokaina, metale ciężkie, nadmiar katecholamin (guz chromochłonny), promieniowanie jonizujące, azydek sodu, jady owadów i węży.
U osób z kardiomiopatią arytmogenną ZMS może wystąpić na podłożu desmoplakinopatii (warianty genu DSP ).
ZMS charakteryzuje się różnego stopnia nacieczeniem mięśnia sercowego przez komórki immunokompetentne.
Najczęściej występuje limfocytowe ZMS, z naciekiem zapalnym składającym się głównie z limfocytów T, uszkadzającym przyległe kardiomiocyty, z ogniskową martwicą i obrzękiem śródmiąższowym. W fazie gojenia naciek zapalny ustępuje i pojawia się włóknienie. Znacznie rzadziej występują eozynofilowe i olbrzymiokomórkowe ZMS.
Eozynofilowe ZMS jest następstwem naciekania mięśnia sercowego przez eozynofile, które uwalniają substancje uszkadzające kardiomiocy ty, przede wszystkim główne białko zasadowe (MBP) i białko kationowe eozynofilów (ECP) o działaniu cytotoksycznym.
W olbrzymiokomórkowym ZMS stwierdza się: intensywny naciek zapalny złożony głównie z limfocytów T, eozynofilów, makrofagów i wywodzących się z makrofagów komórek olbrzymich oraz masywną destrukcję mięśnia sercowego.
Uszkodzenie mięśnia sercowego w przebiegu wirusowego ZMS rozpoczyna się od zakażenia kardiomiocytów (zdolność taką mają jedynie nieliczne wirusy − enterowirusy, adenowirusy). Najlepiej poznane są drogi zakażenia enterowirusowego i parwowirusem B19.
Zakażenie enterowirusowe można podzielić na 3 fazy. Pierwsza obejmuje wniknięcie wirusa poprzez receptor do kardiomiocy tu i aktywację mechanizmów odporności wrodzonej (np. komórek NK). W 2. fazie zachodzi replikacja wirusa i uruchomienie odporności antygenowo swoistej (przeciwcia ła przeciwwirusowe, limfocyty T). Charakterystyczne dla tej fazy są duże stężenia cytokin prozapalnych (TNF, IL 1a). Przetrwała replikacja prowadzi do martwicy kardiomiocytów. Rozpad komórek powoduje uwolnienie antygenów wewnątrzkomórkowych, nieprezentowanych w okresie rozwoju zarodkowego w grasicy, co podtrzymuje odpowiedź przeciwwirusową i autoimmunologiczną. Uszkodzenie komórek, które prowadzi do upośledzenia czynności mięśnia sercowego, może wystąpić także w następstwie działania enzymów enterowirusa, np. proteazy 2A, która rozszczepia białko strukturalne kardiomiocytu – dystrofinę, naśladując w ten sposób mutacje genu dystrofiny, które mogą prowadzić do NS.
W fazie 3. dochodzi do gojenia lub progresji do kardiomiopatii rozstrzeniowej. U większości chorych bez zaburzeń
immunologicznych zakażenie wirusowe mięśnia sercowego jest szybko ograniczane przez mechanizmy odpornościowe, czynność kurczliwa mięśnia sercowego poprawia się, gdy dochodzi do eliminacji wirusa i wygaszenia odpowiedzi immunologicznej. Jeśli odpowiedź przeciwwirusowa nie jest adekwatna, u chorych z predyspozycją immunogenetyczną wirus może przetrwać w mięśniu sercowym i podtrzymywać odpowiedź przeciwwirusową, co dalej upośledza czynność mięśnia sercowego (niszczenie zakażonych kardiomiocytów). Progresja do kardiomiopatii rozstrzeniowej zachodzi również wtedy, gdy wirus zostaje wyeliminowany, ale nie dojdzie do wygaszenia odpowiedzi immunologicznej. Parwowirus B19 nie wnika bezpośrednio do kardiomiocytu, zakaża komórki śródbłonka naczyń wieńcowych (małe żyłki i tętniczki). U dorosłych najczęściej dochodzi do reaktywacji zakażenia parwowirusem B19, gdy po pierwotnym zakażeniu w dzieciństwie wirus przetrwał w szpiku kostnym. Parwowirus B19 poprzez aktywację cytokin prozapalnych (IL 6 i TNF), wywołuje apoptozę komórek śródbłonka i prowadzi do jego dysfunkcji. Ponadto dochodzi do nagromadzenia limfocytów T w mikrokrążeniu wieńcowym, co powoduje zwiększenie oporu wieńcowego i sprzyja martwicy kardiomiocytów. Jeśli proces jest rozległy, może doprowadzić do upośledzenia perfuzji tkankowej, niedokrwienia mięśnia sercowego i dysfunkcji skurczowej.
➔ OBRAZ KLINICZNY
Objawy ZMS są różnorodne i nieswoiste. U większości chorych z ostrym lub piorunującym ZMS stwierdza się w wywiadzie niedawne przebycie zakażenia wirusowego. Objawy zwiastunowe (występują nawet u 90% chorych) zależą od wrót zakażenia (górne drogi oddechowe lub przewód pokarmowy) i wyprzedzają objawy sercowe o kilka dni lub tygodni. Wyróżnia się 4 manifestacje kliniczne ZMS:
1) naśladujące przebieg ostrego zespołu wieńcowego – ból w klatce piersiowej, zmiany STT w EKG, niekiedy zaburzenia kurczliwości i zwiększone stężenia troponin sercowych (TnT i TnI)
2) ostry początek – objawy NS bez choroby wieńcowej i innych przyczyn NS
3) przewlekła NS bez choroby wieńcowej i innych przyczyn NS
4) stan bezpośredniego zagrożenia życia – groźne zaburzenia rytmu serca lub przewodzenia, nagłe zatrzymanie krążenia, wstrząs kardiogenny, skrajnie mała frakcja wyrzutowa lewej komory (LVEF).
Typowe objawy podmiotowe:
1) duszność (wysiłkowa, w ciężkiej NS – spoczynkowa), związana z NS
2) ból w klatce piersiowej, związany ze skurczem tętnic wieńcowych, martwicą kardiomiocytów lub towarzyszącym zapaleniem osierdzia
3) kołatanie serca, związane z tachykardią lub arytmią. Objawy przedmiotowe:
1) objawy NS
2) objawy zapalenia osierdzia, jeśli towarzyszy ZMS (np. tarcie osierdziowe)
3) objawy zatoru obwodowego (może być pierwszym objawem ZMS).
395 I Choroby układu krążenia
–
mięśnia sercowego
W eozynofilowym ZMS mogą wystąpić objawy aler giczne – osutka i eozynofilia krwi obwodowej, ale nie obecność eozynofilii nie wyklucza eozynofilowego ZMS. Najcięższą postacią eozynofilowego ZMS jest ostre mar twicze eozynofilowe ZMS z NS o piorunującym przebiegu. W olbrzymiokomórkowym ZMS najczęściej (u ¾ chorych) stwierdza się objawy NS , mogą występować bloki prze wodzenia i oporne na leczenie częstoskurcze komorowe.
➔ PRZEBIEG NATURALNY
ZMS o piorunującym przebieg u cechuje się nagłym, wyraźnym początkiem i szybkim narastaniem objawów NS, do wstrząsu kardiogennego włącznie. Dysfunk cja mięśnia sercowego ustępuje samoistnie albo – rza dziej – prowadzi do zgonu. Ostre ZMS ma mniej wyraźny początek, a u części chorych dysfunkcja mięśnia lewej komory postępuje do kardiomiopatii rozstrzeniowej. Pod ostre lub przewlekłe ZMS jest nie do odróżnienia od kardiomiopatii rozstrzeniowej; najczęściej powoduje postępującą NS.
Przebieg ZMS może być także bezobjawowy. U cho rych na ZMS naśladujące świeży zawał serca (uniesienie odcinka ST, zwiększone wskaźniki martwicy mięśnia sercowego, odcinkowe zaburzenia kurczliwości), ale z pra widłowym obrazem tętnic w koronarografii – zaburzenia kurczliwości najczęściej ustępują. U chorych z opornymi na leczenie częstoskurczami komorowymi przebieg choroby nie został poznany; u części chorych arytmie ustępują jednak samoistnie. ZMS może spowodować pojedyncze lub mnogie mikrotętniaki lewej komory. U chorych z mikro tętniakami globalna czynność lewej komory jest prawi dłowa, natomiast mogą wystąpić epizody nietrwałego częstoskurczu komorowego.
➔ ROZPOZNANIE
Badania pomocnicze
1. Badania laboratoryjne Stwierdzane nieprawidłowości nie są swoiste dla ZMS:
1) zwiększone stężenie CRP w surowicy (u 80–90% chorych)
2) leukocytoza z przewagą neutrofilów (u 50% chorych); duża eozynofilia w ZMS w przebiegu większości roba czyc i układowych zapaleń naczyń
3) zwiększone stężenie sercowej troponiny T lub I w osoczu (u 30% chorych) z dynamiką w seryjnych oznaczeniach
4) 4‑krotny wzrost miana wirusowoswoistej immunoglo buliny G w fazie zdrowienia (u 20% chorych); u chorych z podejrzeniem ZMS badanie serologiczne w kierunku wirusów nie ma znaczenia dla rozpoznania (spośród chorych, u których zakażenie wirusem zidentyfiko wano w biopsji endomiokardialnej, tylko u 4% udało się stwierdzić to zakażenie za pomocą badania sero logicznego).
2. EKG
Zapis EKG prawie zawsze nieprawidłowy, może wykazywać cechy ostrego uszkodzenia mięśnia sercowego, najczęściej zmiany odcinka ST i załamka T w wielu odprowadzeniach, arytmie nadkomorowe i komorowe, zaburzenia przewodze nia przedsionkowo komorowego (AV) i śródkomorowego.
3 . Echokardiografia
Stwierdza się zwykle nowe zmiany strukturalne i/lub czynnościowe: prawidłowe lub nieznacznie zwiększone objętości rozkurczowe, uogólnione lub regionalne zabu rzenia kurczliwości lewej komory, pogrubiałą ścianę lewej komory (prawdopodobnie w następstwie obrzęku śródmiąż szowego), płyn w worku osierdziowym, czasem skrzepliny wewnątrzsercowe. W miarę rozwijania się NS – obraz taki jak w kardiomiopatii rozstrzeniowej.
4 . MR serca
Powinno się wykonywać u chorych z klinicznie uzasad nionym podejrzeniem ZMS obejmującym objawy kliniczne oraz zmiany w ≥1 z badań pomocniczych (EKG, badania laboratoryjne, echokardiografia) po wykluczeniu lub przy małym prawdopodobieństwie choroby wieńcowej Ocenę należy opierać na zaktualizowanych kryteriach z Lake Louise (2018), które wymagają spełnienia w fazie ostrej 1 kryterium (charakterystycznych nieprawidłowości) w obrazowaniu T2 ‑zależnym i 1 kryterium w obrazowaniu T1‑zależnym. Obrazowanie T 2 ‑zależne pozwala wykryć obrzęk mięśnia sercowego (ryc. I.J.1 1A). Mapowanie czasu T1 z oceną przestrzeni pozakomórkowej umożliwia dodat kowo wykr ycie przekrwienia i przecieku włośniczkowego oraz włóknienia (następstwo uszkodzenia kardiomiocy tów). Klasyczne obrazowanie T1‑zależne z oceną późnego wzmocnienia wykrywa głównie włóknienie (ryc. I.J.1 1B) Ogniska późnego wzmocnienia są w ZMS położone śród mięśniowo lub podnasierdziowo. Dodatkowe kryteria roz poznania ZMS w MR to: obecność płynu w jamie osierdzia i pogorszenie czynności skurczowej lewej komory. MR może ułatwić wykonanie biopsji endomiokardialnej, ale nie może jej zastąpić, zwłaszcza u chorych z piorunującym przebiegiem choroby, nie wnosi bowiem informacji o rodza ju nacieku zapalnego (limfocytowy, olbrzymiokomórkowy, eozynofilowy) ani o obecności patogenu.
5. Koronarografia lub angio‑TK tętnic wieńco wych
Są to dodatkowe badania pomocnicze, które wykorzystuje się w celu wykluczenia choroby wieńcowej.
6. Biopsja endomiokardialna
W ostrym infekcyjnym ZMS rzadko wykonywana Biopsję wykonuje się w celu wykrycia przyczyny poddającej się lecze niu (np. olbrzymiokomórkowego czy eozynofilowego ZMS). Wskazaniem do biopsji jest postępująca lub utrzymująca się NS i/ lub zagrażająca życiu arytmia komorowa, i/lub blok przewodzenia AV II° typu Mobitz II lub zaawansowa ny przy braku odpowiedzi na typowe leczenie w krótkim czasie (<1–2 tyg.). Należy pobrać ≥5 wycinków z lewej i/lub prawej komory, a najlepiej 7, w tym 3 do oceny histologicznej, 2 do oceny zakażenia (DNA, PCR) i 2 w kierunku wirusów RNA/replikacji. W celu wyboru miejsca biopsji można wyko rzystać MR serca. Stwierdza się martwicę kardiomiocytów i naciek zapalny o różnym nasileniu (rozdz. I.B.11). Przyjęto (tzw. kryteria Dallas), że do rozpoznania aktywnego ZMS konieczne jest stwierdzenie rozsianego lub wieloogniskowego nacieku zapalnego (nietypowego dla świeżego zawału serca) z towarzyszącym zwyrodnieniem lub martwicą przylega jących kardiomiocytów. Czułość biopsji endomiokardialnej w wykrywaniu nacieku limfocytowego (najczęstszego) z towa rzyszącym uszkodzeniem przyległych kardiomiocytów wynosi
396 J Choroby
Ryc. I.J.1-1. MR serca u osoby z podejrzeniem ostrego zapalenia mięśnia sercowego ( ZMS), projekcja w osi krótkiej na wysokości segmentów podstawnych. Spełnione są oba kryteria rozpoznania ostrego ZMS. A – cechy obrzęku mięśnia sercowego (s trzał ka), kryterium T 2‑zależne, obra zy T 2‑zależne B – cechy obrzęku mięśnia sercowego (strzałka), kryterium T 2‑zależne, mapowanie czasu T 2 C – obecność typowego podnasier dziowego obszaru późnego wzmocnienia kontrastowego w tej samej lokalizacji, co obrzęk (strzał ka) – kryterium T1‑zależne
30–40%, zatem ujemny wynik biopsji nie wyklucza ZMS. Częstość ZMS rozpoznanego na podstawie biopsji endomio kardialnej wykonanej u osób z niewyjaśnioną NS trwającą <2 lata, z LVEF <45% – wynosi ~10%. Do wiarygodnego roz poznania ZMS konieczne jest stwierdzenie nacieku z limfocy tów T. U 40% chorych na ZMS w bioptacie mięśnia sercowego wykrywa się metodami biologii molekularnej genomy wiru sów, najczęściej Coxsackie B, adenowirusów i parwowirusa B19. Wykrycie obecności genomu wirusa nie dowodzi jednak, że wirus ten jest czynnikiem etiologicznym ZMS.

Kryteria rozpoznania
Pewne rozpoznanie ZMS można postawić jedynie na pod stawie wyniku biopsji endomiokardialnej (kryteria histo logiczne i immunohistochemiczne).


Możliwe subkliniczne ZMS można rozpoznać w przy padku nieprawidłowego wyniku jednego z badań pomoc niczych, sugerującego ZMS (p. niżej), a prawdopodobne ostre ZMS, jeśli występują objawy i nieprawidłowe wyniki badań pomocniczych.
Kryteria rozpoznania klinicznego ZMS:
1) objawy
a) ostry ból w klatce piersiowej o charakterze osier dziowym lub pseudoniedokrwiennym
b) świeża (do 3 mies.) lub narastająca duszność spo czynkowa lub wysiłkowa i/lub zmęczenie z objawami podmiotowymi NS lub bez tych objawów
c) podostra lub przewlekła (utrzymująca się >3 mies.) duszność spoczynkowa lub wysiłkowa i/lub zmę czenie z objawami podmiotowymi NS lub bez tych objawów
d) kołatanie serca i/lub objawy arytmii/zaburzeń prze wodzenia o nieznanej przyczynie, i/lub omdlenie, i/lub nagłe zatrzymanie krążenia
e) wstrząs kardiogenny o nieznanej przyczynie
2) wyniki badań pomocniczych
a) nowe nieprawidłowości EKG (spoczynkowego, 24‑godzinnego metodą Holtera lub wysiłkowego) –
blok AV lub blok odnogi, zmiany odcinka ST‑T (unie sienie odcinka ST, odwrócenie załamka T), zahamo wanie zatokowe, częstoskurcz komorowy, migotanie komór, asystolia, migotanie przedsionków, zmniej szenie amplitudy załamka R, zwolnienie przewo dzenia śródkomorowego (poszerzenie zespołu QRS), patologiczny załamek Q, niski woltaż załamków, częste pobudzenia dodatkowe, częstoskurcz nad komorowy
b) zwiększenie stężenia markerów uszkodzenia mięśnia sercowego – TnT i TnI
c) nieprawidłowości czynnościowe lub strukturalne w badaniach obrazowych (echokardiografii, MR) –nowe, niewyjaśnione w inny sposób, zaburzenia czynności i budowy lewej i/lub prawej komory (w tym przypadkowo stwierdzone u osób bez objawów podmio towych): zaburzenia czynności skurczowej globalnej i regionalnej oraz czynności rozkurczowej z poszerze niem komory lub bez takiego poszerzenia, z pogrubie niem ściany lub bez jej pogrubienia, z płynem w worku osierdziowym lub bez płynu, ze skrzepliną wewnątrz jamy komory lub bez skrzepliny
d) obraz tkanek w MR – obrzęk lub charakterystyczny dla ZMS obraz późnego wzmocnienia po gadolinie. Należy podejrzewać ZMS, jeśli występuje ≥1 manifesta cja kliniczna (spośród 1a–d) i ≥1 nieprawidłowość w bada niach pomocniczych, pod warunkiem wykluczenia choroby wieńcowej i innych chorób, które mogą wywoływać podobne objawy (m.in. wad serca, nadczynności tarczycy). Podejrze nie jest tym silniejsze, im więcej kryteriów jest spełnionych. U chorych bezobjawowych (niespełnione żadne z kryte riów 1a–d) muszą być obecne ≥2 nieprawidłowości w bada niach pomocniczych (z różnych grup 2a–d).
Ostre ZMS trzeba podejrzewać zwłaszcza u młodych osób z nagle pojawiającymi się: NS, uporczywymi aryt miami lub zaburzeniami przewodzenia bądź cechami zawału serca przy prawidłowym obrazie koronarograficz nym. Większość chorych na ostre ZMS podaje w wywia dach przebyte zakażenie wirusowe. Rozpoznanie ostrego
397 I Choroby układu krążenia
A C B
aorty i tętnic obwodowych
➔ ETIOLOGIA I PATOGENEZA
Podział tętniaków aorty:
1) ze względu na etiologię
a) miażdżycowe
b) zwyrodnieniowe
c) zapalne
d) pourazowe
e) inne
2) ze względu na kształt
a) wrzecionowate (znacznie częstsze)
b) workowate (zwykle w okolicy tętnicy podobojczykowej lewej lub dolnej k rzywizny łuku aorty)
3) ze względu na budowę ściany
a) prawdziwe
b) rzekome (ścianę tworzy przydanka z otaczającymi tkankami po przerwaniu błony wewnętrznej i środ kowej; najczęściej pourazowe)
4) ze względu na obraz kliniczny
a) bezobjawowe
b) objawowe
c) pęknięte.
Powstawanie tętniaków jest związane z wzajemnym oddziaływaniem sił ścinających zależnych od objętości wyrzutowej lewej komory, sił rozciągających zależnych od średnicy aorty i ciśnienia wewnątrzaortalnego oraz procesów patologicznych zachodzących w ścianie aorty. Oddziaływania fizyczne strumienia krwi na ścianę aorty zwiększają się u chorych z niedomykalnością zastawki aorty lub z nadciśnieniem tętniczym. W ścianie aorty zmie nionej tętniakowato wykazano zwiększoną aktywność enzymów proteolitycznych, zwłaszcza elastazy i metalo proteinaz, oraz upośledzenie ich hamowania przez swoiste inhibitory (α‑antytrypsynę i tkankowe inhibitory meta loproteinaz), co może tłumaczyć częstsze występowanie tętniaków aorty u chorych na przewlekłą obturacyjną chorobę płuc (POChP) i u osób palących tytoń (5‑krotnie większe ryzyko tętniaka aorty brzusznej).
Istnieje predyspozycja genetyczna do rozwoju tęt niaka aorty. Tętniak aorty brzusznej występuje 11 razy częściej u potomków osoby chorej, a ryzyko jego wystąpie nia zwiększa się istotnie wraz ze zwiększeniem się liczby chorujących krewnych. Tętniaki aorty piersiowej wystę pują szczególnie często u chorych z zespołem Marfana (rozdz. I.T.1 ☚a7b), zespołem Ehlersa i Danlosa naczynio wym (rozdz. I.T.2 ☚aoq ), zespołem Loeysa i Dietza (triada objawów: krętość tętnic, tętniaki w całym układzie naczy niowym, hiperteloryzm) i ze zwyrodnieniem torbielowatym aorty, w których ściana aorty jest istotnie osłabiona.
Za czynniki wykazujące silny związek z występowaniem tętniaka aorty brzusznej uznaje się: starszy wiek, płeć męską, nadciśnienie tętnicze i miażdżycę. Ta ostatnia odgrywa prawdopodobnie większą rolę w powstawaniu tętniaków aorty brzusznej niż aorty piersiowej, co tłumaczy się ubogim unaczynieniem podnerkowego odcinka aorty przez naczynia odżywcze. Znaczenie dyslipidemii jako czynnika ryzyka jest słabiej udokumentowane.
Zapalenia aorty – choroba Takayasu, olbrzymio komórkowe zapalenie tętnic, zapalenie w przebiegu cho rób układowych (zwłaszcza zesztywniającego zapalenia
stawów kręgosłupa i reumatoidalnego zapalenia stawów), kiła sercowo‑naczyniowa i zakażenia krwiopochodne, takie jak infekcyjne zapalenie wsierdzia i sepsa – prowadzą do powstawania tętniaków aorty.
Czynniki ryzyka progresji i pęknięcia tętniaka aorty brzusznej: średnica tętniaka, wiek chorego, aktualne palenie tytoniu (czynnik środowiskowy najsilniej związany z ryzykiem szybkiego powiększania się tętniaka), POChP, nadciśnienie tętnicze i uwarunkowania genetyczne. Przy danej wielkości tętniaka ryzyko jego pęknięcia jest więk sze u kobiet – występuje zwykle przy średnicy tętniaka o ~10 mm mniejszej niż u mężczyzn
Worek tętniaka najczęściej jest w ypełniony przyścien ną skrzepliną różnej grubości, która może być źródłem zatorów obwodowych
1.1.1. Tętniak aorty piersiowej
➔ O BRAZ KLINICZNY
1. Objawy podmiotowe
1) ból w klatce piersiowej i ból pleców (u 25% chorych bez rozwarstwienia) – wskutek ucisku narządów wewnątrz klatki piersiowej lub ściany klatki piersiowej, bądź wskutek nadżerek w kościach; zwykle stały, przeszy wający, często silny; pęknięcie tętniaka wywołuje silny stały ból w klatce piersiowej z szybko rozwijającym się wstrząsem hipowolemicznym
2) dysfagia – rzadko, wywołana uciskiem przełyku
3) chrypka – wywołana uciskiem nerwu krtaniowego wstecznego
4) kaszel, duszność (niekiedy zależne od pozycji ciała), krwioplucie i nawracające zapalenia płuc – wskutek ucisku tchawicy lub oskrzeli głównych przez tętniaka łuku aorty lub aorty zstępującej
5) objaw Hornera
2. Objawy przedmiotowe
W tętniaku aorty wstępującej lub łuku aorty mogą wystąpić:
1) objawy niedomykalności zastawki aortalnej (rozdz. I.H.2), często z objawami niewydolności serca
2) objawy zespołu żyły głównej górnej wywołane uciśnię ciem tej żyły (rozdz. X.F.1)
3) czasem pierwszym objawem tętniaka jest incydent zato rowy pod postacią udaru mózgu, niedokrwienia kończyn dolnych lub jelit bądź zawału nerki. Niekiedy występuje tzw. zespół sinych palców (blue toe syndrome) – ostre niedokrwienie palców stóp wywołane drobnymi zato rami wywodzącymi się z worka tętniaka (ryc. I.O.1 3), mogące doprowadzić do martwicy palców przy obecnym tętnie na tętnicach piszczelowej tylnej i grzbietowej stopy.
➔ PRZEBIEG NATURALNY
Tętniaki aorty wstępującej powiększają się średnio o 1 mm/rok, a tętniaki aorty zstępującej o 3 mm/rok. Rodzin ne tętniaki aorty piersiowej powiększają się do 2,1 mm/rok (średnio dla aorty wstępującej i zstępującej), w zespole Marfana o 0,5–1 mm/rok, a w zespole Loeysa i Dietza nawet
504 O
Choroby
szybciej niż 10 mm/rok, co skutkuje wczesnym zgonem (średnio w wieku 26 lat). Prawdopodobieństwo rozwarstwienia lub pęknięcia aorty gwałtownie się zwiększa przy średnicy aorty wstępującej >60 mm, a aorty zstępującej >70 mm (dla tętniaka aorty piersiowej o średnicy >60 mm wynosi 7%/rok, a o średnicy <50 mm 2%/rok).
➔ ROZPOZNANIE
Badania pomocnicze
1. RTG klatki piersiowej
Uwidacznia poszerzenie aorty (ryc. I.O.1-4 A i ryc. I.O.1-4B); badanie o małej czułości i swoistości. Prawidłowa sylwetka aorty nie pozwala na wykluczenie obecności tętniaka aorty wstępującej.
2. Echokardiografia
Badanie przezklatkowe wykorzystuje się w diagnostyce i monitorowaniu niektórych segmentów aorty, zwłaszcza




505 I Choroby układu krążenia
A B C
Ryc. I.O.1-3 Zatorowość tętniczo ‑tętnicza – zespół sinych palców
Ryc. I.O.1- 4 Tętniak aorty zstępującej. RTG klatki piersiowej w projekcji P‑A ( A ) i lewobocznej (B) oraz USG przezprzełykowa z kolorowym dop lerem (C ) (fot. dr Marek Krzanowski)
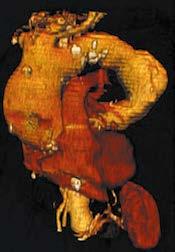
AB Ryc. I.O.1-5 A – TK, tętniak aorty piersiowej. B – rekonstrukcja 3D
proksymalnych: korzenia aorty (ocena w projekcji przymostkowej w osi długiej i zmodyfikowanej koniuszkowej projekcji pięciojamowej), łuku i odchodzących od niego dużych naczyń (w projekcji nadmostkowej). Umożliwia również wizualizację aorty zstępującej w wymiarze poprzecznym (za lewym przedsionkiem w projekcji przymostkowej w osi długiej oraz w projekcji czterojamowej) i podłużnym – po zrotowaniu sondy. Jest to użyteczna przesiewowa metoda badania aorty wstępującej. Umożliwia seryjne (w czasie) pomiary maksymalnej średnicy korzenia aorty oraz ocenę niedomykalności zastawki aortalnej. Informacje uzyskane podczas kolejnych badań są pomocne w określeniu odpowiedniego momentu przeprowadzenia planowej operacji tętniaka.
Echokardiografia przezprzełykowa (ryc. I.O.1- 4C) pozwala na dokładną ocenę zastawki aortalnej i aorty od korzenia do pnia trzewnego. Z uwagi na przebieg anatomiczny prawego oskrzela i tchawicy krótki segment dystalnego odcinka aorty wstępującej nie jest widoczny przy użyciu tej techniki. Badanie to jest przydatne do kontroli i optymalizacji przebiegu interwencji wewnątrznaczyniowej na tętniakach aorty piersiowej.
3. Angio‑TK
Pozwala dokładnie ocenić wielkość i morfologię tętniaka oraz zależności anatomiczne między tętniakiem a sąsiednimi narządami i tętnicami odchodzącymi od aorty (ryc. I.O.1-5). Zwykle wystarcza do oceny przedoperacyjnej chorego. Zalety w porównaniu z innymi metodami obrazowania: szeroka dostępność badania, krótki czas akwizycji i przetwarzania obrazów, możliwość obrazowania 3D całej aorty, możliwość wykrycia współistniejącego rozwarstwienia, krwiaka śródściennego (TK bez środka kontrastowego) lub wrzodu drążącego aorty (TK ze środkiem kontrastowym).
4. Angio‑MR
Wskazana do oceny średnicy, kształtu i rozległości tętniaka u chorych, u których nie można wykonać angio-TK (rozdz. I.B.4.2.2.3). Angio-MR jest szczególnie uzasadniona w ramach seryjnych badań kontrolnych wykonywanych u młodszych chorych, gdyż nie wiąże się z ekspozycją na promieniowanie jonizujące ani nie wymaga użycia jodowego środka kontrastowego. Badanie to jest mniej przydatne w stanach ostrych z powodu ograniczonej dostęp-
ności, trudności w monitorowaniu stanu chorego w trakcie badania i dłuższej rejestracji obrazów. Nie pozwala na ocenę zwapnień w zastawce aortalnej ani w tzw. strefach kotwiczenia stentgraftów.
5. PET
Badanie przydatne w diagnostyce chorób zapalnych aorty (choroba Takayasu, olbrzymiokomórkowe zapalenie tętnic), w których mogą wystąpić tętniaki aorty piersiowej, oraz w diagnostyce zakażenia stentgraftu. Może stanowić składową obrazowania hybrydowego (PET-TK).

6. Aortografia
U niektórych chorych kwalifikowanych do interwencji wewnątrznaczyniowej (wszczepienia stentgraftu) wskazane jest wykonanie angiografii z zastosowaniem cewnika kalibrowanego Badanie nie pozwala na ocenę ściany naczynia ani niewielkich tętniaków wypełnionych skrzepliną.
7. Ultrasonografia wewnątrznaczyniowa (IVUS) Pozwala na optymalizację obrazu ściany aorty podczas leczenia wewnątrznaczyniowego.
Kryteria rozpoznania
Rozpoznanie wstępne ustala się zazwyczaj na podstawie wyniku badań obrazowych (RTG klatki piersiowej, USG jamy brzusznej, echokardiografii) wykonywanych z innych wskazań. Przypadkowo w okresie bezobjawowym rozpoznaje się obecnie ~50% tętniaków aorty piersiowej. W razie wykrycia u chorego tętniaka aorty na jakimkolwiek poziomie należy przeprowadzić badanie całej aorty, aby wykluczyć współistnienie tętniaków w innych odcin kach. Jednocześnie zaleca się ocenę zastawki aortalnej, zwykle echokardiograficzną. Dodatkowo należy rozważyć badanie ultrasonograficzne (doplerowskie) tętnic obwodowych w ramach przesiewowej oceny w kierunku tętniaków tych naczyń.
➔ LECZENIE
Leczenie zachowawcze
Podstawowe znaczenie ma eliminacja czynników ryzyka chorób sercowo-naczyniowych, ze szczególnym uwzględnieniem zaprzestania palenia tytoniu i normalizacji ciśnienia
506 O Choroby
aorty i tętnic obwodowych
tętniczego, które, jeśli nie ma cech rozwarstwienia aorty, powinno wynosić <140/90 mm Hg.
Udokumentowano skuteczność β‑blokerów w spowalnia niu tempa powiększania się tętniaka aorty i w ograniczaniu powikłań w zespole Marfana oraz zespole Loyesa i Dietza. Powszechną praktyką jest stosowanie β‑blokerów u chorych z dwupłatkową zastawką aortalną i poszerzeniem korzenia aorty >40 mm, chociaż nie ma jednoznacznych dowodów na skuteczność tego postępowania. β‑blokery stosowane przewlekle p.o. zmniejszają częstość zdarzeń wieńcowych u chorych operowanych z powodu tętniaka. Leki te zaleca się również chorym z zespołem Marfana (rozdz. I.T.1 ☚a7b) Badania potwierdzają także wpływ losartanu na posze rzanie się korzenia aorty u chorych z zespołem Marfana (rozdz. I.T.1 ☚a7b).
Leczenie inwazyjne
Według wytycznych ACC i AHA (2 022) do leczenia inwa zyjnego kwalifikuje się:
1) bezobjawowe tętniaki aorty wstępującej o średnicy:
a) ≥55 mm u wszystkich chorych bez elastopatii i obcią żonych małym ryzykiem operacyjnym
b) ≥55 mm u chorych z dwupłatkową zastawką aortalną, ≥50 mm w razie współistniejących czynników ryzyka (rozdz. I.H.2)
c) ≥50 mm u chorych z zespołem Marfana (≥45 mm w razie obecności czynników ryzyka – rozdz. I.H.2)
2) bezobjawowe tętniaki aorty zstępującej o średnicy
≥55 mm lub < 55 mm przy dodatkowych czynnikach ryzyka rozwarstwienia aorty
3) wszystkie tętniaki objawowe lub pęknięte.
Niższe wartości progowe dla leczenia inwazyjnego
można przyjąć u chorych z małymi rozmiarami ciała (np. w zespole Turnera leczenie inwazyjne rozważa się przy wymiarze aorty ≥25 mm/m2 pc.), a także w razie szybkiej progresji tętniaka, niedomykalności zastawki aortalnej, planowanej ciąży i preferencji chorego.
Tętniaki aorty wstępującej i łuku aorty stanowią wskazanie do leczenia chirurgicznego. Celem leczenia operacyjnego jest zapobieganie rozwarstwieniu lub pęk nięciu aorty przez przywrócenie prawidłowego wymiaru aorty wstępującej. Jeśli tętniak obejmuje ≥1 z zatok aorty (zatok Valsalvy), postępowanie zależy od stopnia zajęcia pierścienia aortalnego i zastawki aortalnej. W przypadku prawidłowej zastawki trójpłatkowej bez niedomykalności (lub gdy niedomykalność jest tylko centralna, wtórnie do poszerzenia pierścienia zastawki) preferuje się operację oszczędzającą z zachowaniem natywnej zastawki. Takie operacje zaleca się zwłaszcza u młodych chorych; w niektó rych ośrodkach wykonuje się je także przy dwupłatkowej zastawce aortalnej i niedomykalności aortalnej spowodo wanej innymi czynnikami niż izolowane poszerzenie pier ścienia zastawki. W pozostałych przypadkach (np. miaż dżyca aorty, zwężenie zastawki aortalnej) wszczepia się protezę złożoną (aorty wstępującej i zastawki) wykonaną z tworzywa sztucznego lub ksenograft, zależnie od wieku chorego i przeciwwskazań do długoterminowego leczenia przeciwkrzepliwego.
Według wytycznych ESVS i EACTS (2019) w przypadku izolowanego tętniaka łuku aorty operację należy rozwa
żyć, jeśli średnica aorty wynosi ≥55 mm lub występują objawy miejscowego ucisku przez worek tętniaka. W razie objęcia przez tętniak ujścia pnia ramienno‑głowowego wykonuje się wszczepienie protezy do łuku aorty w krą żeniu pozaustrojowym. Wiele zabiegów wymiany łuku aorty to reoperacje z powodu tętniaka powstałego po roz warstwieniu aorty typu A w następstwie ograniczonego zakresu wymiany aorty wstępującej lub naprawy prok symalnego odcinka łuku aorty, wykonywanych w trybie pilnym. Decyzja o operacji łuku aorty powinna uwzględniać większe ryzyko zgonu okołooperacyjnego lub udaru mózgu niż przy zabiegach na pozostałych częściach aorty. Wraz z rozwojem technik wewnątrznaczyniowych tętniaki łuku aorty zaczęły być zaopatrywane za pomocą stentgraftów z odgałęzieniami. Wszczepienie stentgraftu zaleca się u chorych dyskwalifikowanych od operacji otwartej przy sprzyjającej anatomii tętniaka.
Tętniaki aorty zstępującej można leczyć operacyjnie lub wewnątrznaczyniowo (wszczepienie stentgraftu – pro tezy naczyniowej ze stentem; tzw. TEVAR [thoracic endovascular aortic repair]). Jeśli jest to możliwe pod względem warunków anatomicznych, należy w pierwszej kolejności rozważyć leczenie wewnątrznaczyniowe, z wyłączeniem chorych z zespołem Marfana. W przypadku zabiegów planowych częstość okołozabiegowych zgonów i powikłań neurologicznych (udar mózgu, paraplegia) wśród chorych leczonych wewnątrznaczyniowo jest mniejsza niż wśród chorych operowanych, natomiast przeżycie średniotermi nowe jest podobne w obu grupach.
Powikłania zabiegów wewnątrznaczyniowych: przecieki, powikłania neurologiczne i rzadsze – wsteczne rozwarstwienie aorty wstępującej (u 1,3% chorych), jatro genne uszkodzenie ściany naczynia i zakażenie graftu. W leczeniu przewlekłych tętniaków, a obecnie rów nież ostrego rozwarstwienia aorty obejmującego aortę wstępującą, łuk i aortę zstępującą, stosuje się niekiedy podejście hybrydowe (w ramach jednoetapowej procedu ry) polegające na wymianie aorty wstępującej i łuku oraz wszczepieniu stentgraftu do aorty zstępującej (technika frozen elephant trunk). Jest to zabieg trudny technicznie, trwa dłużej i wiąże się z większym ryzykiem powikłań neurologicznych, ale z mniejszym prawdopodobieństwem ponownej interwencji w obserwacji odległej.
➔ MONITOROWANIE
W przypadku bezobjawowych chorych należy monitorować naturalny rozwój tętniaka najlepiej za pomocą angio‑TK lub angio‑MR. Pierwsze badanie kontrolne należy prze prowadzić 6 –12 mies. po wykryciu tętniaka, a następne 1 ×/6–12 mies., zależnie od anatomii tętniaka i dostępnych badań obrazowych. Kolejne badania powinno się przepro wadzać tą samą metodą i w tym samym ośrodku. Po we wnątrznaczyniowej naprawie tętniaka aorty piersiowej obrazowanie aorty (najlepiej angio‑TK) należy wykonać po 1 i 12 mies., a następnie raz w roku. Przy stabilnych wynikach badań obrazowych i niewystępowaniu przecieku w okresie 24 mies. po zabiegu kolejne badania obrazowe można wykonywać co 2 lata, a co roku przeprowadzać ocenę kliniczną. Należy rozważyć zastąpienie angio‑TK przez
507 I Choroby układu krążenia
zmiany elastyczności ścian żołądka (podatność na rozdymanie wdmuchiwanym powietrzem) lub cechy ucisku z zewnątrz. Przesuwając endoskop do dwunastnicy, ocenia się szerokość odźwiernika. Przykłady obrazów nieprawidłowych i zabiegów terapeutycznych wykonywanych w obrębie żołądka – ryc. III.B.4-11 ☚d7s, ryc. III.B.4-12 ☚fhf, ryc. III.B.4-13 ☚fek, ryc. III.B.4-14 ☚fhg, ryc. III.B.4-15 ☚fhh, ryc. III.B.4-16 ☚fhi, ryc. III.B.4-17 ☚fhj, ryc. III.B.4-18 ☚fhk, ryc. III.B.4-19 ☚fhl, ryc. III.B.4-20 ☚fhm, ryc. III.B.4-21 ☚fi2, ryc. III.B.4-22 ☚fhn
3. Dwunastnica
W dwunastnicy ocenia się jej światło, wygląd błony śluzowej (w tym obecność prawidłowych fałdów Kerckringa) i brodawkę dwunastniczą większą (Vatera). Obrazy prawidłowe – ryc. III.B.4-23 i ryc. III.B.4-24 . Poszukuje się nadżerek i owrzodzeń, zmian błony śluzowej w postaci
zmniejszenia wysokości i liczby fałdów (np. w celiakii), polipów i guzów nowotworowych oraz uchyłków. Przykłady obrazów nieprawidłowych i zabiegów terapeutycznych wykonywanych w obrębie dwunastnicy – ryc. III.B.4-25 ☚fhp, ryc. III.B.4-26 ☚fhx, ryc. III.B.4-27 ☚fhy, ryc. III.B.4-28 ☚fhz, ryc. III.B.4-29 ☚fh2, ryc. III.B.4-3 0 ☚fh3.
4.3. Endoskopia jelita grubego (rektoskopia, rektosigmoidoskopia, kolonoskopia)
Złotym standardem w diagnostyce chorób jelita grubego jest kolonoskopia, czyli badanie jelita endoskopem giętkim. Badania endoskopem sztywnym (rektoskopia, rektosigmoidoskopia) wykonuje się rzadko.


➔ OPIS BADANIA
Kolonoskopię z reguły rozpoczyna się u pacjenta w pozycji na lewym boku z podkurczonymi nogami. W trakcie badania pozycja może być zmieniona na ułożenie na plecach lub na prawym boku, co ułatwia badanie w przypadku trudności z wprowadzeniem kolonoskopu do dalszych części okrężnicy. Przed wprowadzeniem endoskopu należy dokładnie obejrzeć okolicę odbytu, czy nie występują zmiany okołoodbytowe (ropnie, przetoki, pęknięcia, guzki krwawnicze) oraz wykonać badanie palcem per rectum
Instrument należy wprowadzać powoli, tylko wtedy, gdy widoczne jest światło jelita Należy minimalizować insuflację gazu (preferuje się użycie CO2).
Endoskop należy wprowadzić do kątnicy, identyfikując ją poprzez uwidocznienie zbiegających się fałdów z ujściem wyrostka robaczkowego w miejscu ich połączenia oraz zastawki Bauhina. Zaleca się wprowadzenie endoskopu przez zastawkę do końcowego odcinka jelita krętego (ileokolonoskopia). Dokładnej oceny jelita dokonuje się w trakcie wycofywania endoskopu, co powinno trwać ≥6 min. Podczas badania należy ocenić przygotowanie jelita do badania za pomocą zwalidowanej skali, np. Boston (Boston Bowel Preparation Scale – BBPS). BBPS określa w punktach jakość przygotowania 3 segmentów jelita, ( kątnica-wstępnica, poprzecznica i zstępnica-esica), w skali 0–3 (ryc. III.B.4-31: 3 pkt – dobrze widoczna błona śluzowa, bez resztek kału i mętnego płynu; 2 pkt – błona śluzowa dobrze widoczna, w niewielkim stopniu pokryta grudkami kału i/ lub mętnym płynem; 1 pkt – błona śluzowa tylko częściowo widoczna z powodu dużej ilości stałego kału lub mętnego płynu; 0 pkt – jelito nieprzygotowane i błona śluzowa pokryta stałym, niedającym się spłukać kałem. Wynik stanowi suma punktów ze wszystkich segmentów jelita (np. BBPS 3+3+3/9). Za dobre przygotowanie uznaje się wynik ≥6 pkt dla całego jelita i ≥2 pkt dla każdego z segmentów. Podczas kolonoskopii należy wykonać dokumentację fotograficzną, obejmującą m.in. obszary pozwalające na ocenę głębokości wprowadzenia endoskopu (jelito kręte, zastawka krętniczo -kątnicza, dno kątnicy) i czasu jego wycofywania (odbytnica podczas wycofywania), oraz udo -
998 B Badania diagnostyczne
Ryc. III.B.4-23. Ezofagogastroduodenoskopia. Prawidłowa błona śluzowa dwunastnicy z widocznymi kosmkami
Ryc. III.B.4-24. Ezofagogastroduodenoskopia. Prawidłowa brodawka dwunastnicza większa (Vatera; s trzałka), widoczne również okrężne fałdy błony śluzowej
Ryc. III.B.4-31. Oczyszczenie jelita w skali
Boston: A – 0 pk t B – 1 pk t C – 2 pk t D – 3 pkt (fot. lek. Mateusz Szmit, dr Marek Bugajski, prof. Michał. F. Kamiński)
opcjonalnie:
wprowadzenie diety ubogoresztkowej u pacjentów z czynnikami ryzyka złego przygotowania
dodatkowa dawka preparatu przeczyszczającego u pacjentów z czynnikami ryzyka złego przygotowania lub po złym przygotowaniu
3 dni przed badaniem 2 dni przed badaniem
dieta ubogoresztkowa u wszystkich pacjentów
ostatni posiłek (płynny, np. zupa) 2. porcja preparatu przeczyszczającego
godz. 13.00 od rana
rozpoczęcie przyjmowania preparatu przeczyszczającego –1. porcja
zakończenie przyjmowania preparatu przeczyszczającego
godz. 16.00 rozpoczęcie 3–5 h przed badaniem ≥2 h przed badaniem
1 dzień przed badaniem w dniu badania
badanie endoskopowe (2–5 h od zakończenia przygotowania)
Ryc. III.B.4-32. Schemat przygotowania jelita do badania z uwzględnieniem diety i stosowania preparatu przeczyszczającego w dawce podzielonej (przedruk z: Med. Prakt., 2020; 3: 70)
kumentować wszystkie zmiany patologiczne i wykonane zabiegi terapeutyczne.
Najczęstszym zabiegiem terapeutycznym w kolonoskopii jest polipektomia. Ze względu na częstoś ć występowania polipów każdą kolonoskopię diagnostyczną powinno się traktować jak badanie z ewentualnym wykonaniem polipektomii, co powinno zostać uwzględnione podczas uzyskiwania świadomej zgody pacjenta na badanie.
➔ PRZYGOTOWANIE PACJENTA
Przed sigmoidoskopią, kolonoskopią i przed wszystkimi zabiegami terapeutycznymi konieczne jest zastosowanie diety i leków przeczyszczających. Schemat przygotowania – ryc. III.B.4-32 .
W przygotowaniu do sigmoidoskopii i kolonoskopii zaleca się dietę ubogoresztkową (dieta płynna jest gorzej tolerowana, a nie poprawia jakości przygotowania) Przez 3 dni przed badaniem nie należy spożywać owoców pestkowych, zwłaszcza z drobnymi pestkami ( kiwi, truskawki, winogrona), pieczywa z ziarnami, musli, siemienia lnianego, maku czy sezamu. W dniu poprzedzającym badanie należy zastosować dietę ubogoresztkową, ostatni posiłek należy spożyć ~13 .00.

Do przygotowania jelita dostępne są preparaty przeczyszczające o dużej objętości (3–4 l), czyli izoosomotyczne i zrównoważone elektrolitowo roztwory glikolu polietylenowego ( polyethylene glycol – PEG) oraz preparaty o małej objętości (1–2 l), czyli roztwory PEG z askorbinianem, cytrynianem lub bisakodylem, roztwory pikosiarczanu
999 III Choroby
pokarmowego
układu
C
D
A
B
sodu z cytrynianem magnezu oraz roztwory siarcza nów sodu, magnezu i potasu. W przypadku zastosowania preparatów o małej objętości konieczne jest dodatkowe wypicie wody, aby osiągnąć łączną objętość 3–4 l płynu. Skuteczność przygotowania preparatami o małej obję tości i preparatami o dużej objętości jest podobna, przy czym te pierwsze są lepiej tolerowane, a preparaty PEG o dużej objętości uznaje się za bezpieczniejsze i zalecane u pacjentów obciążonych ryzykiem wystąpienia zaburzeń wodno‑elektrolitowych (np. z przewlekłą chorobą nerek lub niewydolnością serca), u chorych w wieku podesz łym, u kobiet ciężarnych, u chorych na nieswoistą chorobę zapalną jelit, a także przed badaniami wykonywanymi w trybie pilnym z powodu krwawienia z dolnego odcinka przewodu pokarmowego.
Dodanie simetykonu do preparatu przeczyszczającego poprawia przygotowanie jelita. Nie zaleca się natomiast rutynowego stosowania dodatkowych środków, takich jak bisakodyl czy leki prokinetyczne, ale można je rozważyć u pacjentów z czynnikami ryzyka niewystarczającego przy gotowania do kolonoskopii, takimi jak cukrzyca, zaparcie, przyjmowanie opioidów i uszkodzenie rdzenia kręgowego. Z e względu na duże ryzyko powikłań nie należy stosować doustnych preparatów fosforanów (mogą powodować zabu rzenia elektrolitowe i uszkodzenie nerek oraz nadżerki błony śluzowej jelita utrudniające ocenę endoskopową i histologiczną).
Środek przeczyszczający należy przyjąć w dawkach podzielonych, tj. ½ dawki leku wieczorem w dniu poprze dzającym badanie (~16.00) i ½ dawki wcześnie rano w dniu badania (rozpoczęcie ~5 h i zakończenie ~2 h przed wykona niem kolonoskopii). Przygotowanie takie jest lepiej tolerowa ne i zapewnia lepsze oczyszczenie jelita. Jedynym wyjątkiem od tej zasady jest przygotowanie do badania zaplanowanego na godziny popołudniowe, kiedy można całą dawkę środka przeczyszczającego podać rano w dniu badania.
Jakość przygotowania do badania poprawia przekazanie pacjentowi oprócz wyczerpującej informacji ustnej także informacji pisemnej lub filmu instruktażowego (np. z wy korzystaniem aplikacji mobilnej).
Przygotowanie doustne nie jest wymagane do rektosko pii diagnostycznej; pacjenta można przygotować 2‑krotnym (wieczorem w dniu poprzedzającym badanie i rano w dniu badania) wykonaniem wlewki doodbytniczej ze 150 ml roztworu fosforanów sodu lub czystej wody.
➔ WSKAZANIA
1. Wskazania do kolonoskopii przesiewowej (ba danie w celu poszukiwania stanów przedrakowych i raka jelita grubego w zdrowej populacji)
1) osoby bez czynników ryzyka – w wieku 50–65 lat
2) osoby z dodatnim wywiadem rodzinnym w kierunku raka jelita grubego u krewnego 1. stopnia – w wieku 40–49 lat
3) nowotwory jelita grubego uwarunkowane genetycznie (wiek rozpoczęcia badań określają osobne wytyczne).
2. Wskazania do kolonoskopii diagnostycznej
1) krwawienie z przewodu pokarmowego (obecność krwi w stolcu lub smolisty stolec [po wykluczeniu przyczy ny w górnym odcinku przewodu pokarmowego], dodatni
wynik badania kału na krew utajoną, niedokrwistość z niedoboru żelaza o nieznanej przyczynie – p. rozdz. VI.D.3, Postępowanie diagnostyczne)
2) zmiana rytmu wypróżnień
3) przewlekła choroba zapalna jelita grubego (weryfikacja rozpoznania, określenie zasięgu zmian)
4) istotna klinicznie biegunka o niejasnej przyczynie
5) wynik badania radiologicznego jelita nasuwający podej rzenie zmiany organicznej
3 . Wskazania terapeutyczne
1) usuwanie polipów i powierzchownych zmian nowo tworowych (polipektomia, mukozektomia, dyssekcja podśluzówkowa, resekcja pełnościenna)
2) tamowanie krwawień z malformacji naczyniowych, owrzodzeń i guzów oraz krwawienia po polipektomii (techniki jak w górnym odcinku przewodu pokarmowego)
3) usuwanie ciał obcych
4) poszerzanie i/lub protezowanie zwężeń nienowotworo wych i nowotworowych
5) odbarczenie ostrej niedrożności rzekomej (atonia i roz dęcie okrężnicy mogące wystąpić w ciężkich chorobach ogólnoustrojow ych lub po operacjach) i skrętu jelita (w wyjątkowych przypadkach)
6) znakowanie zmian kwalifikowanych do usunięcia chi rurgicznego
4 . Wskazania do kolonoskopii nadzorczej (powta rzanej okresowo)
1) stan po leczeniu z powodu raka jelita grubego
2) stan po polipektomii jelita grubego – ryc. III.F.10 5
3) nieswoiste choroby zapalne jelit (nadzór)
4) zwiększone ryzyko nowotworów jelita grubego uwarun kowane genetycznie.
Kryteria kwalifikacji, czas rozpoczęcia i zaprzestania nadzoru oraz częstotliwość wykonywania badań określają osobne wytyczne – p. odnośne rozdziały.
➔ PRZECIWWSKAZANIA
Swoiste przeciwwskazania do wykonania kolonoskopii stanowią:
1) zapalenie otrzewnej
2) perforacja jelita
3) ostre zapalenie uchyłków jelita grubego
4) piorunujące zapalenie jelita grubego.
Przeciwwskazanie względne stanowią ciąża i duży tętniak aorty brzusznej ze skrzepliną.
➔ POWIKŁANI A
Istotne powikłania sercowo‑naczyniowe związane z przygo towaniem i sedacją do kolonoskopii występują u 0,1–0,2% badanych.
Częstość swoistych powikłań diagnostycznej kolono skopii jest mała. Do perforacji (najczęściej esicy) dochodzi w <0,1% bada ń; do czynników ryzyka zalicza się starszy wiek, chorobę uchyłkową, choroby zapalne jelit
W kolonoskopii zabiegowej ryzyko powikłań zależy od lokalizacji zmian i rodzaju zabiegu (większe w przy padku zabiegów w prawej połowie jelita i usuwania zmian o większej średnicy):
1000 B
Badania diagnostyczne
1) krwawienie – ~1% po standardowej polipektomii, 6–7% po EM R , ≤10% po ESD zmian o dużej średnicy
2) perforacja – 0,1% po polipektomii, 1% po EMR i ~5% po ESD
3) zespół oparzenia ściany jelita po polipektomii (tzw. zespół po polipektomii) – ~1%.
Rzadkim, ale istotnym powikłaniem kolonoskopii jest uszkodzenie śledziony.
➔ OCENA OBRAZU ENDOSKOPOWEGO
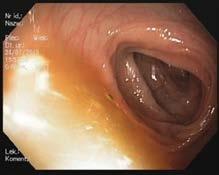
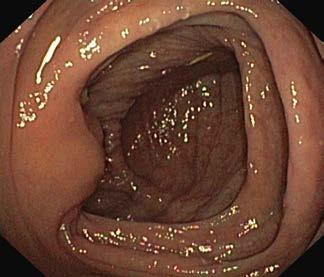
Prawidłowa błona śluzowa jelita grubego jest gładka, lśniąca, z widocznym rysunkiem naczyniowym (ryc. III.B.4-33)
W kątnicy widoczny jest charakterystyczny układ fałdów
i zastawka krętniczo-kątnicza (ryc. III.B.4-34), natomiast w końcowym odcinku jelita krętego widoczne są kosmki. W chorobach zapalnych jelit można stwierdzić zatarcie rysunku naczyniowego, przekrwienie błony śluzowej, jej kruchość (tendencję do krwawienia po dotknięciu endoskopem) lub samoistne krwawienie, nadżerki i owrzodzenia, zwężenia i przetoki. Mogą występować uchyłki, zmiany naczyniowe (angiodysplazje, teleangiektazje, żylaki), polipy różnego rodzaju (rozdz. III.F.10.1); rak jelita grubego może mieć postać polipowatą albo płaskiego nacieku. Przykłady zmian patologicznych w obrębie jelita grubego – ryc. III.B.4-35 ☚fh5, ryc. III.B.4-36 ☚fi4, ryc. III.B.4-37 ☚fh6, ryc. III.B.4-38 ☚fh7, ryc. III.B.4-39 ☚fia, ryc. III.B.4-40 ☚fib, ryc. III.B.4-41 ☚fi5, ryc. III.B.4-42 ☚fic, ryc. III.B.4-43 ☚fiw, ryc. III.B.4-44 ☚fid
4.4. Endoskopia jelita cienkiego
Jelito cienkie jest odcinkiem przewodu pokarmowego trudnym do badania endoskopowego. Do bezpośredniej oceny błony śluzowej jelita czczego i krętego może być wykorzystana enteroskopia wspomagana balonem
(jedno- lub dwubalonowa), enteroskopia spiralna oraz endoskopia kapsułkowa (video capsule endoscopy – VCE).

VCE i enteroskopia są metodami uzupełniającymi się, ale niestety nadal nie są one szeroko rozpowszechnione. Enteroskopię powinno się wykonywać, gdy VCE jest niedostępna, występują przeciwwskazania do jej wykonania ( p niżej) lub jej wynik nie pozwala na ustalenie rozpoznania, lub konieczne jest uzyskanie materiału do badania histologicznego, a także w przypadku dużego prawdopodobieństwa konieczności wykonania zabiegu terapeutycznego (zatrzymania krwawienia lub wykonania polipektomii).
➔ OPIS BADANIA
1. Endoskopia kapsułkowa
VCE przeprowadza się za pomocą połykanej przez pacjenta jednorazowej, bezprzewodowej kapsułki (z kamerą cyfrową i lampą LED) o długości 24–28 mm i średnicy 11–13 mm, która dzięki ruchom perystaltycznym biernie przemieszcza się przez przewód pokarmow y, wykonując 2–6 zdjęć jelita na sekundę. Obrazy są transmitowane do noszonego przez pacjenta rejestratora. Kapsułka pracuje 10–12 h. W tym czasie pacjent może pić przejrzyste płyny (>2 h po połknięciu kapsułki), a spożyć posiłek i przyjąć leki –4 h po połknięciu kapsułki. Pacjent może w czasie badania normalnie funkcjonować (np. prowadzić samochód, używać komputera czy telefonu komórkowego). Po przesłaniu obrazów z rejestratora do stacji roboczej dokonywana jest analiza obrazów. Kapsułka ulega w ydaleniu ze stolcem zwykle do 48 h od połknięcia.
2. Enteroskopia
Enteroskopię wykonuje się endoskopami o długości 150–200 cm, wyposażonymi w urządzenia służące do fałdowania jelita (tubę zewnętrzną z balonem i ew. dodatkowy balon na końcówce endoskopu, tubę ze spiralą bądź sterowaną silnikiem elektrycznym spiralę na części roboczej endoskopu). Konieczność wielokrotnego powtarzania sekwencji wprowadzania endoskopu i tuby zewnętrznej
1001 III
Choroby układu pokarmowego
Ryc. III.B.4-33 Kolonoskopia. Prawidłowa błona śluzowa jelita gru bego – gładka, lśniąca, z widocznym rysunkiem naczyniowy m
Ryc. III.B.4-34 Kolonoskopia. Prawidłowa kątnica; widoczna zastaw ka krętniczo ‑kątnicza (strzałka) i typowy układ fałdów


















