Das Camadas à Reconstrução
Christopher B. Harmon
Stanislav N. Tolkachjov


Christopher B. Harmon
Stanislav N. Tolkachjov

Christopher B. Harmon, MD, FA AD, FACMS
Dermatologic Surgeon
Surgical Dermatology Group; Direc tor
ACGME Fellowship in Micrographic Surgery and Dermatologic Oncology Birmingham, Alabama, USA
Stanislav N. Tolkachjov, MD, FA AD, FACMS
Dermatologic Surgeon and Dallas-Fort Worth Area Direc tor Mohs Micrographic & Reconstruc tive Surgery
Epiphany Dermatology; Clinical Assistant Professor Univer sit y of Texas Southwestern Medical Center; Clinical Associate Professor
Texas A&M College of Medicine; Core Facult y Division of Dermatology
Baylor Univer sit y Medical Center Dallas, Texas, USA
813 Ilustrações
T hieme
Rio de Janeiro• St ut tgar t• New York •Delhi
Dados Internacionais de Catalogação na Publicação (CIP) (eDOC BRASIL, Belo Horizonte/MG)
Harmon, Christopher B.
H288c
Cirurgia micrográfica de Mohs: das camadas à reconstrução / Christopher B. Harmon, Stanislav N. Tolkachjov. – Rio de Janeiro, RJ: Thieme Revinter, 2024.
21 x 28 cm
Inclui bibliografia
Título original: Mohs Micrographic Surgery
ISBN 978-65-5572-253-6
eISBN 978-65-5572-254-3
1. Pele – Câncer. 2. Dermatologia. 3. Cirurgia micrográfica de Mohs. I. Tolkachjov, Stanislav N. II. Título.
CDD 616.994
Elaborado por Maurício Amormino Júnior – CRB6/2422
Tradução
Sandra Malmann (Caps. 1-6)
Tradutora Especializada na Área da Saúde, SP
Vilma Varga (Cap. 7)
Médica e Tradutora Especializada na Área da Saúde, SP
Silvia Spada (Cap 8-12)
Tradutora Especializada na Área da Saúde, SP
Revisão Técnica
Antonio Macedo D’Acri
Professor Associado da Disciplina de Dermatologia – EMC Chefe do Departamento de Medicina Especializada – EMC
Docente Permanente do PPGHIV-HV/UNIRIO Escola de Medicina e Cirurgia – Universidade Federal do Estado do Rio de Janeiro (UNIRIO)
Coordenador da Câmara Técnica de Dermatologia – CREMERJ
Presidente da Sociedade Brasileira de Dermatologia – Regional Rio de Janeiro – SBDRJ 2023-2024
Copyright © 2023 of the original English language edition by Georg Thieme Verlag KG, Stuttgart, Germany.
Original title: Mohs Micrographic Surgery: From Layers to Reconstruction by Christopher B. Harmon and Stanislav N. Tolkachjov
Copyright © 2023 do original em Inglês editado por Georg Thieme Verlag KG, Stuttgart, Germany.
Título original: Mohs Micrographic Surgery: From Layers to Reconstruction por Christopher B. Harmon e Stanislav N. Tolkachjov
© 2024 Thieme. All rights reserved.
Thieme Revinter Publicações Ltda. Rua do Matoso, 170 Rio de Janeiro, RJ
CEP 20270-135, Brasil http://www.ThiemeRevinter.com.br
Thieme USA http://www.thieme.com
Design de Capa: © Thieme
Impresso no Brasil por Forma Certa Gráfica Digital Ltda. 5 4 3 2 1
ISBN 978-65-5572-253-6
Também disponível como eBook: eISBN 978-65-5572-254-3
Nota: O conhecimento médico está em constante evolução. À medida que a pesquisa e a experiência clínica ampliam o nosso saber, pode ser necessário alterar os métodos de tratamento e medicação. Os autores e editores deste material consultaram fontes tidas como confiáveis, a fim de fornecer informações completas e de acordo com os padrões aceitos no momento da publicação. No entanto, em vista da possibilidade de erro humano por parte dos autores, dos editores ou da casa editorial que traz à luz este trabalho, ou ainda de alterações no conhecimento médico, nem os autores, nem os editores, nem a casa editorial, nem qualquer outra parte que se tenha envolvido na elaboração deste material garantem que as informações aqui contidas sejam totalmente precisas ou completas; tampouco se responsabilizam por quaisquer erros ou omissões ou pelos resultados obtidos em consequência do uso de tais informações. É aconselhável que os leitores confirmem em outras fontes as informações aqui contidas. Sugere-se, por exemplo, que verifiquem a bula de cada medicamento que pretendam administrar, a fim de certificar-se de que as informações contidas nesta publicação são precisas e de que não houve mudanças na dose recomendada ou nas contraindicações. Esta recomendação é especialmente importante no caso de medicamentos novos ou pouco utilizados. Alguns dos nomes de produtos, patentes e design a que nos referimos neste livro são, na verdade, marcas registradas ou nomes protegidos pela legislação referente à propriedade intelectual, ainda que nem sempre o texto faça menção específica a esse fato. Portanto, a ocorrência de um nome sem a designação de sua propriedade não deve ser interpretada como uma indicação, por parte da editora, de que ele se encontra em domínio público.
Todos os direitos reservados. Nenhuma parte desta publicação poderá ser reproduzida ou transmitida por nenhum meio, impresso, eletrônico ou mecânico, incluindo fotocópia, gravação ou qualquer outro tipo de sistema de armazenamento e transmissão de informação, sem prévia autorização por escrito.
Para começar, estou grato ao meu tio, Dr. John Yarbrough, pela influência que me deu para seguir a dermatologia cirúrgica como carreira, em vez da cirurgia cardiovascular e de outras subespecialidades cirúrgicas. O “Tio” (como lhe chamavam carinhosamente) deu-me um apreço pela arte e pelo aspeto relacional da medicina, que se sobrepõe à ciência da medicina. Mais do que qualquer outra pessoa que conheci, John tinha a capacidade de se relacionar com os doentes e de prestar cuidados com compaixão. Nas suas palavras, “Com a fragilidade de um ser humano a ajudar outro ser humano... praticamos medicina”. Ele estava de facto inclinado a tratar em vez de não tratar. Outra citação favorita que ele pegou emprestado do Dr. John Voorhees era: “Eu não sou muito no diagnóstico, mas sou um inferno no tratamento”.
Como aprendiz ao longo da vida, tive a oportunidade de continuar a aprender com os mais de 25 colegas de cirurgia de Mohs que formamos num período de 20 anos. Como eles agora exercem a sua atividade em locais desde a Carolina do Sul até à Califórnia, a nossa colaboração contínua promove a partilha de ideias, a evolução de novos conceitos cirúrgicos, as melhores práticas comerciais e, mais importante e, o mais importante, a amizade e o companheirismo contínuos. Obrigado a todos pela “mentoria de ressalto”... continuem o bom trabalho.
Este texto é o resultado da experiência adquirida em mais de 80.000 casos cirúrgicos nos últimos 22 anos encaminhados para a nossa clínica (Grupo de Dermatologia Cirúrgica) dos dermatologistas e outros médicos que exercem a sua atividade no Alabama e nos estados vizinhos. e estados vizinhos. A sua amizade crescente ao longo dos anos é muito apreciada. O voto de confiança que depositam ao confiarem os vossos Valorizamos os excelentes cuidados que prestam aos vossos pacientes e agradecemos a oportunidade de participar nos seus cuidados. Agradecemos a oportunidade de participar nos seus cuidados.
Não poderia ter sido bem-sucedido com empreendimento como este livro, ou com a abertura de novos consultórios, e com elevado volume de casos cirúrgicos que realizamos sem os membros da equipa do “Surgical Dermatology Group”. Desde os médicos aos médicos, passando pelos membros da equipa executiva, pelos enfermeiros do centro de cirurgia ambulatória, pelos técnicos de enfermagem, pelos assistentes médicos, bem como programadores de cirurgias, recepcionistas e pessoal de apoio administrativo... obrigado a todos por fazerem o que fazem com humildade e um compromisso com a excelência. Aos meus pais... obrigado por proporcionarem uma vida familiar que incentiva o progresso e uma busca incessante da excelência. Esta base de amor, aprovação e apoio culminou nesta escrita e em todos os sucessos que experimentei. Em última análise, dedico este trabalho à minha mulher Sandy e às nossas duas filhas, Mary Elizabeth e Haley, por apoiarem os meus por apoiarem os meus vários esforços profissionais, como o empreendimento de um livro de texto que invade as noites e os fins de semana. Elas são a alegria são a alegria da minha vida e a razão pela qual faço o que faço... seja no campo de ténis, no campo missionário ou durante o tempo de oração à mesa de jantar.
Christopher B. Harmon, médico, FAAD, FACMS
Ao Deus Todo-Poderoso, através do qual todas as coisas são possíveis e cuja vontade é feita. Tu nos dás força quando não temos nenhuma. Levanta-nos quando ficamos muito mal. Usais as nossas mãos e os talentos que nos destes para fazer a Vossa cura. O Teu Filho fez o derradeiro sacrifício, para que possamos estar para sempre Contigo. Minha abnegada e amorosa esposa, Holly. Estiveste ao meu lado na viagem desde que a medicina era apenas um sonho. Realizaste muita coisa, mas recuaste para permitir que eu perseguisse os meus sonhos. e um belo exemplo de amor duradouro. És um indivíduo incrivelmente forte, mas um melhor amigo altruísta. Eu amo-te por ti.
Os meus filhos, Alexander e Ekaterina. Muitas das longas horas passadas neste projeto foram tiradas de vocês. Cada momento convosco alimenta e recarrega a minha alma. Não há nada mais precioso do que ver-vos crescer e amarem-se a vossa família e o mundo à vossa volta. O vosso espírito de empatia, honestidade, idealismo, amor, entusiasmo, humor, diversão e carinho são exemplos que trago diariamente para tratar os meus doentes. Que os nossos laços continuem a crescer e que tu cresças para ser uma luz brilhante e uma mão amiga para o mundo à tua volta. Tu és e serás sempre a nossa maior conquista. Minha mãe e Brian. Trouxeram-me da Rússia em tenra idade, mas ensinaram-me o valor do trabalho árduo, da educação e do sacrifício. Desistiram dos vossos sonhos por uma vida melhor para mim. Eu amo-te.
Stanislav N. Tolkachjov, MD, FAAD, FACMS
2.4.2
2.5
2.5.1
3.1
3.2
3.3
3.3.1
3.3.3
3.3.4
3.3.5
3.3.6
3.4
3.4.2
3.4.3
F. Sobanko
4.1 Anatomia Fontal e Temporal
4.1.1 Delimitação das Subunidades Frontal e Temporal 66
4.1.2 Músculos da Fronte e da Têmpora 66
4.1.3 Suprimento Sanguíneo da Fronte e da Têmpora
4.2 Preservação da Função Sensorial e Motora
4.2.1 Função Sensorial
4.2.2
4.3
4.4
4.5.5
5.1.4
5.2.2
9.3
9.3.1
9.3.2
9.3.3
10
10.1
10.2.1
10.2.3 Septo Orbital (SO) e Compartimentos de Gordura Pós-Septal 168
10.2.4 Alça Tarsoligamentar 170
10.2.5 Retratores da Pálpebra............................................. 171
10.2.6 Conjuntiva 171
10.2.7 Sistema Lacrimal 171
10.2.8 Sistemas Neurovascular e Linfático das Pálpebras .... 172
10.2.9 Órbita 175
10.2.10 Anatomia da Sobrancelha 175
10.3 Princípios e Objetivos da Reconstrução Periocular 176
10.4 Dicas Cirúrgicas Perioperatórias, Instrumentações e Suturas na Reconstrução Periocular 177
10.5 Avaliação Cirúrgica do Defeito Periocular e Diretrizes para Reconstrução................................... 178
10.6 Cicatrização por Segunda Intenção 179
10.7 Enxertos em Reconstrução Periocular ................... 180
10.8 Reparo de Defeitos Palpebrais Superficiais Não Marginais............................................................ 182
10.9 Reconstrução dos Defeitos de Pálpebra em Espessura Total ................................................... 185
10.9.1 Fechamento Primário de Defeitos das Pálpebras em Espessura Total ................................................ 185
10.9.2 Retalho Semicircular (Tenzel) ................................. 189
10.9.3 Retalho Tarsoconjuntival para Reconstrução da Pálpebra Inferior (Retalho de Hughes)..................... 189
10.9.4 Retalho Transposicional Tarsal para Reconstrução da Pálpebra Superior Lateral .............. 192
10.9.5 Retalho de Cutler-Beard para Reconstrução Completa da Pálpebra Superior ................................ 194
10.10 Procedimentos de Estiramento da Pálpebra Inferior 195
10.11 Curativos de Ferida e Cuidados Pós-Operatórios em Pacientes de Cirurgia Periocular 196
10.12 Avaliação e Reconstrução do Sistema Canalicular Lacrimal 196
10.13 Complicações das Reconstruções da Pálpebra ..... 198
10.14 Objetivos e Princípios da Reconstrução da Sobrancelha ............................................................... 198
Retalhos Pediculado em Ilha ...................................
Retalhos Transposicionais
Retalhos Pediculados ..............................................
Enxertos Livres Contendo Cabelo (Enxertos Compostos - Pele e Cabelos) ...................................
11.4.1 Grandes Defeitos Nasais
11.4.2 Lábio ........................................................................
11.2 Reconstrução Combinada Primária e Enxerto 207
11.2.1 Braço/Mão ................................................................ 208
11.2.2 Têmpora................................................................... 208
11.2.3 Bochecha 209
11.3 Reconstrução Combinada de Retalho e Enxerto ..... 209
11.3.1 Bochecha Infraocular Lateral 209
11.3.2 Bochecha Periauricular/Orelha 209
11.3.3 Porção Cutânea do Lábio Superior/Filtro/Soleira Alar ......209
11.3.4 Bochecha Medial/Parede Nasal Lateral ..................... 209
11.3.5 Fronte/Têmpora ....................................................... 210
11.3.6 Grandes Defeitos Nasais 211
11.4 Combinação de Retalhos para Reconstrução de Defeitos Únicos e Múltiplos 215
12
Jason R. Castillo ▪ Jennifer L. Hanson ▪ Randall K. Roenigk
12.1 Considerações Pré-Operatórias ............................... 227
12.1.1 Profilaxia com Antibiótico ......................................... 227
12.1.2 Anticoagulantes ....................................................... 230
11.5 Reconstrução de Múltiplos Defeitos ....................... 215
11.5.1 Múltiplos Defeitos Reparados como um Só .............. 215
11.5.2 “Oeste por Leste-Oeste” 215
11.5.3 Retalho de Avanço O-T, Retalho de Rotação de Couro Cabeludo/Fronte e Retalho de Fronte Paramediano ........221
11.5.4 Retalho 2 “Combo-Z” 221
11.5.5 Múltiplos Defeitos Reparados com Enxertos de Burow 222
11.5.6 A “Pia da Cozinha”: Quando a Combinação de Reconstrução e Granulação Resolvem Problemas 225
11.6 Resumo 226
12.1.3 Sedação Consciente/Sedação Consciente com Analgesia 232
12.1.4 Dispositivos Implantáveis Marca-Passos/Desfibriladores ................................... 233
12.2 Cuidados Pós-Operatórios ...................................... 235
12.2.1 Granulação/Segunda Intenção Cicatrização ............. 236
12.2.2 Xenoenxertos Porcinos e Curativos Biológicos 236
12.2.3 Suturas de Reforço 237
12.2.4 Cuidados Pós-Dermabrasão ..................................... 238
12.2.5 Pós-fechamento Primário na Extremidade Inferior 238
12.2.6 Cuidados Pós-Retalho ............................................... 238
12.3 Tratamento do Hematoma 239
12.4 Tratamento das Infecções ........................................
12.4.1 Infecções ..................................................................
12.4.2 Seleção de Antimicrobianos
12.5
Vídeo 1.1
Curetagem após debulking acentuado.
Vídeo 1.2
Vídeo 1.3
Vídeo 1.4
Debulking acentuado – pálpebra.
Vídeo 1.5
Excisão no primeiro estágio durante cirurgia de Mohs.
Vídeo 1.6
Estágio inicial de Mohs atraumático sem fórceps.
Vídeo 1.7
Processamento básico do tecido no primeiro estágio.
Vídeo 1.8
Estágios de Mohs subsequentes.
Vídeo 1.9
Amostra do ponto de articulação nos estágios de Mohs subsequentes.
Técnica de identificação epidérmica da camada profunda.
Técnica de selo postal da camada profunda.
Vídeo 1.10
Grade para camadas profundas apenas.
Vídeo 1.11 Estágio inicial e subsequente.
Vídeo 3.1 Técnica de raspagem e lixamento.
Vídeo 3.2 Retalho bilobado.
Vídeo 3.3 Retalho frontal.
Vídeo 3.4 Enxerto de pele de espessura profunda no sulco conchal.
Vídeo 3.5 Retalho nasogeniano.
Vídeo 7.1 Avanço da borda helicoidal.
Vídeo 7.2 Retalho invertido.
Vídeo 8.1 Reparo de um defeito grande no lábio superior lateral cutâneo com um retalho de avanço crescente. (Cortesia de Stanislav N. Tolkachjov, MD.)
Vídeo 10.1 Teste Snap
Vídeo 10.2 Enxerto de pele de espessura total com defeito na pálpebra inferior com incisão de blefaroplastia.
Vídeo 10.3 Retalho de Tenzel semicircular.
Vídeo 10.4 Inserção e remoção de escudos protetores da córnea.
Vídeo 11.1 Combo-Z (pescoço).
Vídeo 11.2 Combo-Z (têmpora).
Vídeo 12.1 Sutura de reforço.
Acredito que este livro é um acréscimo indispensável aos recursos educacionais vitais para o desenvolvimento e a manutenção do conjunto de habilidades essenciais para a prática da cirurgia de Mohs, desde a remoção tecidual até a reconstrução. Minha experiência de 30 anos como cirurgião de Mohs e em cirurgia reconstrutiva me ajudou a reconhecer fortemente a importância de nos apoiarmos em tudo o que adquirimos por meio do nosso treinamento. Durante estes anos, ensinar e participar da formação de outros médicos tem constituído uma grande parte das minhas atividades profissionais. Seja ensinando residentes como Program Director na Mayo Clinic, e posteriormente como membro clínico da University of Pittsburgh, ou dirigindo nosso programa de bolsas em Cirurgia Micrográfica e Oncologia Dermatológica, os recursos educacionais sempre foram componentes fundamentais na oferta dos fundamentos adequados aos jovens médicos. Mas a educação permanente para o praticante mais experiente não é menos vital para a qualidade dos cuidados prestados a pacientes com câncer cutâneo. Nossos pacientes obtêm maiores benefícios de um cirurgião que possui formação acadêmica sólida e que assimila as nuances criativas na reconstrução de feridas. Depois de atuar como Program Director no encontro anual da Mohs College, em 1999, ficou ainda mais evidente para mim que a educação permanente é valiosa para todos os cirurgiões de pele. Desde 1999, tenho o privilégio de trabalhar como editor da seção Reconstruction Conundrums em Dermatologic Surgery, que oferece novas e criativas abordagens para defeitos cutâneos comuns e não tão comuns. Através destas experiências, constatei que o ponto principal na otimização dos cuidados de pacientes com câncer cutâneo por meio da educação é entender que os jovens cirurgiões anseiam por uma estrutura judiciosa e bem fundamentada para seu arsenal reconstrutivo, e os cirurgiões mais experientes continuam a procurar técnicas novas e criativas para lidar com desafios reconstrutivos comuns e raros.
Este manual atende às necessidades de todos.
O Dr. Chris Harmon e o Dr. Stan Tolkachjov formaram a equipe perfeita para desempenhar a árdua tarefa de elaborar um livro abrangente sobre reconstruções. Tenho certeza de que para os dois, este foi um trabalho de amor. Chris, com seu quarto de século de experiência em uma prática intensa com câncer cutâneo, e cujo domínio da cirurgia de Mohs e da estética da reconstrução, embasado por uma experiência excepcionalmente sólida em cirurgia cosmética, é idealmente o profissional indicado para esta tarefa. Ele esteve envolvido por muitos anos na formação de jovens cirurgiões através do seu programa de bolsas de treina-
mento, e pelo envolvimento contínuo nos programas educacionais nas mais proeminentes reuniões nacionais dermatológicas. Ele exibe uma abordagem ponderada e calma da vida em geral, mas particularmente no domínio da reconstrução, que estará manifesta neste manual.
Stan, por sua vez, é o complemento perfeito para Chris, com seu entusiasmo juvenil. Mas não se iluda com a sua juventude. Stan está anos além da sua idade no conhecimento da cirurgia reconstrutiva e da importância de um recurso estrutural, porém criativo, para a prática do cirurgião de câncer cutâneo. Ele possui um conhecimento profundo do que é essencial para o desenvolvimento de um jovem cirurgião. Juntos, Chris e Stan foram a dupla perfeita para desenvolver este importante conjunto de informações.
Este manual é importante para cirurgiões de pele, porque organiza o conhecimento específico necessário para a execução competente da remoção do câncer, seguida pela reconstrução dos defeitos... e dá conta disto de modo conciso, tendo em mente o profissional atarefado. Seu formato de fácil compreensão apresenta uma organização algorítmica complementada por fotos, vídeos e ilustrações instrutivos. Em suma, os leitores se beneficiarão da experiente engenhosidade do primeiro grupo de especialistas que Chris e Stan reuniram como autores dos capítulos, e que escreveram sobre um tema pelo qual são apaixonados. Sua paixão fica evidente nestes capítulos, e irá inspirar e guiar tanto os cirurgiões mais jovens quanto os profissionais mais experientes que lerem este livro. Os capítulos aqui incluídos representam centenas de horas de preparação e dezenas de milhares de horas de experiência. Este esforço coletivo está magistralmente organizado e condensado para aqueles que optarem por passar algumas horas absorvendo seu conteúdo. Em nome dos pacientes com câncer cutâneo no mundo todo, e por sua causa, espero que este livro se torne um recurso importante para os muitos cirurgiões de câncer cutâneo.
David G. Brodland, MD
Zitelli & Brodland Skin Cancer Center; Assistant Professor Departments of Dermatology, Otolaryngology and Plastic Surgery, University of Pittsburgh Pittsburgh, Pennsylvania, USA
Quando apresentamos este manuscrito ao nosso editor, estávamos em meio à pandemia da COVID-19. Entretanto, há um período mais longo temos experimentado uma epidemia de câncer de pele globalmente e nos Estados Unidos. Isto se deve predominantemente aos mais velhos da geração baby boomer que agora têm mais de 65 anos. Nos próximos 20 anos, enquanto esta fatia da população continuar a comemorar seu aniversário até seus 80 e 90 anos, veremos a incidência de câncer cutâneo ultrapassar a taxa atual de um em cada cinco americanos. Este contexto fornece o pano de fundo para o motivo que nos impele a publicar este livro... compartilhar conhecimento com nossos pares de hoje e das futuras gerações de dermatologistas, cirurgiões de Mohs e reconstrucionistas. Somos gratos por estarmos trabalhando no campo da dermatologia, sendo especializados na remoção de cânceres de pele com as mais altas taxas de cura disponíveis. A técnica da cirurgia de Mohs, desenvolvida pelo Dr. Fred Mohs na década de 1950, vem se aprimorando ao longo dos anos, especialmente com o advento da técnica de congelamento a fresco, aperfeiçoada por Stegman e Tromovitc, na década de 1980, como mencionado em seu artigo seminal Microscopically Controlled Excision of Cutaneous Tumors: Chemosurgery, Fresh Tissue Technique. Atualmente, a cirurgia micrográfica nos permite gerar uma taxa muito alta de cura nos pacientes que atendemos. Nossa abordagem com a cirurgia de Mohs é erradicar cada tumor com o menor número
possível de estágios, ao mesmo tempo proporcionando o melhor conforto para nossos pacientes e preservando a maior parte do tecido saudável subjacente. Nosso objetivo para reconstrução é uma abordagem sistemática de cada defeito para obtenção dos resultamos mais funcionais e esteticamente satisfatórios para nossos pacientes e seus médicos de referência.
Neste manual, reunimos o grupo de cirurgiões de Mohs e reconstrutivos mais conceituados e experientes no campo, com a visão abrangente de criar a abordagem sistemática para a reconstrução das subunidades, e a descrição passo a passo das técnicas reconstrutivas. Cada autor escolheu sua área de expertise no campo, bem como a seção ou localização anatômica específica. Para compreensão plena da cirurgia de Mohs, incluímos capítulos sobre a técnica de Mohs, como o processo é adaptado em sítios anatômicos difíceis, considerações pré-operatórias/pós-operatórias, retalhos e a mecânica reconstrutiva, e “reconstruções combinadas” abrangendo múltiplas subunidades. O material é bem ilustrado e facilmente implementado na prática diária.
Este livro é um guia completo, embora sucinto, para cirurgia micrográfica de Mohs e reconstrução, tendo a prática de Mohs e o cirurgião reconstrutivo facial em mente.
Christopher B. Harmon, MD, FAAD, FACMS Stanislav N. Tolkachjov, MD, FAAD, FACMS
Para mim, pessoalmente, este projeto é uma colaboração privilegiada entre mentores e colegas que representam alguns dos melhores cirurgiões dentro da nossa especialidade. Quando eu era residente em dermatologia na Mayo Clinic em Rochester, Minnesota, o Dr. Randy Roenigk e o Dr. Dave Brodland ofereceram a mentoria e o treinamento que definiram a trajetória da minha carreira. É certamente um privilégio contar com sua contribuição neste manual. Depois da residência, dediquei-me por 3 anos à Força Aérea, o que me levou para a Keesler Air Force Base em Biloxi, Mississipi, onde continuei a fazer cirurgia de Mohs com outro mentor, o Dr. Rick Mora. Durante aqueles 3 anos também tive a oportunidade de realizar vários treinamentos de 1 semana em Pittsburg, trabalhando com o Dr. John Zitell e, mais uma vez, com o Dr. Dave Brodland... aprendendo mais técnicas cirúrgicas antes de ingressar na bolsa de treinamento na cirurgia de Mohs. Depois do serviço na Força Aérea, mudei-me para Birmingham, Alabama, para uma bolsa patrocinada no Mohs College com o Dr. Gary Monheit. Então trabalhei com o Dr. Monheit como parceiro durante os 12 anos seguintes. Hoje em dia, muito do que fazemos em nossa prática corrente reflete a cirurgia, o planejamento, o processo de trabalho e a visão empresarial que aprendi durante meus anos com ele...por tudo isto sou muito agradecido. Por fim, o Dr. Stan Tolkachjov, um antigo colega e parceiro de prática, inequivocamente recebe os créditos por ser o incentivador deste manual. Seu encorajamento para a realização deste projeto e o desejo de contribuir de forma prática foram os estímulos que eu precisava para colocar em curso este trabalho significativo. A natureza colaborativa do texto me ofereceu a oportunidade de parceria tanto com mentores seniores, como os descritos acima, quanto contemporâneos mais jovens. Stan e eu nos sentimos privilegiados por reunir um grupo tão sério de cirurgiões e autores.
A Stan e os outros autores – sou grato por suas contribuições e me sinto orgulhoso pelo trabalho colaborativo aqui representado.
Christopher B. Harmon, MD, FAAD, FACMS
Agradeço o trabalho árduo de antigos e atuais médicos assistentes, enfermeiros, técnicos em histologia, antigos companheiros e outros colegas por dedicarem tempo e esforço, fotografando e fazendo vídeos, ajudando em cirurgias, obtendo consentimentos dos pacientes e, principalmente, cuidando com excelência dos pacientes. Agradeço a Elizabeth Bryant por sua ajuda na coordenação destes esforços na concepção inicial do livro.
Agradeço a orientação do Dr. Christopher Harmn no aprendizado da cirurgia de Mohs e de técnicas reconstrutivas e pela confiança para realizar qualquer reconstrução. Acreditamos no entusiasmo com os tumores maiores e mais difíceis para ajudar os pacientes e melhorar a cada cirurgia com mente e coração abertos. Gostaria, também, de agradecer por sua parceria comigo neste livro.
Agradeço imensamente o trabalho de Preston McDonald e Chelsea Decker pela ajuda na edição dos vídeos e o financiamento de Gherghe Pusta e Epiphany Dermatology para edição dos vídeos. Por fim, quero agradecer aos meus pais por gentilmente nos permitirem usar suas fotos e imagens para ensinar gerações de cirurgiões, e melhorar os cuidados com os pacientes. Agradeço também aos profissionais que fizeram os encaminhamentos por nos confiarem seus pacientes. Sem seus pacientes, este sonho não seria possível.
Stanislav N. Tolkachjov, MD, FAAD, FACMS
ASHWIN AGARWAL, MD
Department of Dermatology Perelman School of Medicine University of Pennsylvania Philadelphia, Pennsylvania, USA
DAVID G. BRODLAND, MD
Zitelli & Brodland Skin Cancer Center; Assistant Professor
Departments of Dermatology, Otolaryngology and Plastic Surgery, University of Pittsburgh Pittsburgh, Pennsylvania, USA
JONATHAN CAPPEL, MD
Surgical Dermatology Group Birmingham, Alabama, USA
JASON R. CASTILLO, MD
Micrographic Surgery and Dermatologic Oncology Fellow Mayo Clinic Rochester, Minnesota, USA
GABRIELA M. ESPINOZA, MD
Associate Professor Program Director
Ophthalmology, Plastic and Reconstructive Surgery
Saint Louis University St. Louis, Missouri, USA
JEREMY R. ETZKORN, MD
Assistant Professor of Dermatology Hospital of the University of Pennsylvania Philadelphia, Pennsylvania, USA
VICTORIA GODINEZ-PUIG, MD, FAAD, FACMS
VitalSkin Chicago, Illinois, USA
NICHOLAS GOLDA, MD
Associate Professor of Dermatology
Dermatology Medical Director
Micrographic Surgery and Dermatologic Oncology Program Director University of Missouri School of Medicine Columbia, Missouri, USA
JENNIFER L. HANSON, MD, FAAD Vitalogy Skincare Georgetown, Texas, USA
CHRISTOPHER B. HARMON, MD, FAAD, FACMS
Dermatologic Surgeon
Surgical Dermatology Group; Director
ACGME Fellowship in Micrographic Surgery and Dermatologic Oncology Birmingham, Alabama, USA
H. WILLIAM HIGGINS II, MD, MBE
Assistant Professor of Dermatology Penn Dermatology Oncology Center University of Pennsylvania Philadelphia, Pennsylvania, USA
THOMAS HOCKER, MD
Advanced Dermatologic Surgery, P.A.
ADS Ambulatory Surgery Center Overland Park, Kansas, USA
NICOLE HOWE, MD
Novem Dermatology
Lutz, Florida, USA
GEORGE HRUZA, MD, MBA, FAAD
Adjunct Professor of Dermatology
St. Louis University
St. Louis, Missouri, USA; Laser & Dermatologic Surgery Center Chesterfield, Missouri, USA
IRÈN KOSSINTSEVA, MD, FRCPC, FAAD, FACMS
Associate Professor
Dermatologic Surgery Centre
Department of Dermatology and Skin Sciences
University of British Columbia Vancouver, British Columbia, Canada
ALEKSANDAR L. KRUNIC, MD, PHD, FAAD, FACMS, FEADV, FESMS
Adjunct Associate Professor of Dermatology
Rush University Medical Center; Director of Dermatologic Surgery
Cook County Hospital Health System; Health Clinician
Northwestern University Feinberg School of Medicine; Chicago, Illinois, USA
CHRISTOPHER J. MILLER, MD
Director of Dermatologic Surgery
Hospital of the University of Pennsylvania Philadelphia, Pennsylvania, USA
MOLLY POWERS, MD
Henry Ford Medical Center Novi, Michigan, USA
RANDALL PROCTOR, JR, MD, MBA, FACMS Eastern Dermatology & Pathology, PA Greenville, North Carolina, USA
NICOLA A. QUATRANO, MD
SkinCare Physicians
Chestnut Hill, Massachusetts, USA
RANDALL K. ROENIGK, MD
Professor of Dermatology
Director of the Micrographic Surgery and Dermatologic Oncology Fellowship
Mayo Clinic
Rochester, Minnesota, USA
THOMAS E. ROHRER, MD
Dermatologic Surgeon
SkinCare Physicians
Chestnut Hill, Massachusetts, USA
THUZAR SHIN, MD, FAAD, FACMS
Hospital of the University of Pennsylvania Philadelphia, Pennsylvania, USA
JOSEPH F. SOBANKO, MD
Mohs Surgery & Reconstruction
Laser Surgery & Cosmetic Dermatology
Director of Dermatologic Surgery Education
Associate Professor, Dermatology
Hospital of the University of Pennsylvania
Perelman Center for Advanced Medicine
Division of Dermatologic Surgery and Cutaneous Oncology
Philadelphia, Pennsylvania, USA
EVAN STIEGEL, MD, FAAD, FACMS
Wilson Dermatology
An Affiliate of The Skin Surgery Center Wilson, North Carolina, USA
STANISLAV N. TOLKACHJOV, MD, FAAD, FACMS
Dermatologic Surgeon and Dallas-Fort Worth Area Director
Mohs Micrographic & Reconstructive Surgery
Epiphany Dermatology; Clinical Assistant Professor
University of Texas Southwestern Medical Center; Clinical Associate Professor
Texas A&M College of Medicine; Core Faculty
Division of Dermatology
Baylor University Medical Center Dallas, Texas, USA
JOHN ZITELLI, MD
Adjunct Associate Professor
Departments of Dermatology, Otolaryngology, and Plastic Surgery
University of Pittsburgh Medical Center Pittsburgh, Pennsylvania, USA
DAVID ZLOTY, MD, FRCP
Clinical Professor Faculty of Medicine
Department of Dermatology and Skin Science
University of British Columbia Vancouver, British Columbia, Canada
Resumo
Os dois principais objetivos da cirurgia micrográfica de Mohs (CMM) são oferecer a mais alta taxa possível de cura para o tratamento de neoplasias cutâneas, ao mesmo tempo, também, assegurando que a malignidade seja removida de maneira a conservar e preservar o tecido o máximo possível. Ainda que esses dois princípios básicos do procedimento pareçam simples, é necessária atenção aos detalhes
Sumário e Pérolas
e à qualidade do processo para fornecer qualidade que os pacientes esperam da CMM.
Palavras-chave: Cirurgia de Mohs, cirurgia micrográfica, tratamento para câncer de pele, preservação do tecido, avaliação completa circunferencial periférica e da margem profunda, estágios/camadas iniciais de Mohs, estágios/camadas subsequentes de Mohs, melhora do processo.
▪ A cirurgia micrográfica de Mohs (CMM) fornece as taxas mais altas de cura com o máximo de conservação do tecido para a maioria dos cânceres de pele.
▪ O sucesso do procedimento depende da seleção adequada do tumor e da execução cuidadosa da técnica.
▪ No momento da excisão do espécime cirúrgico de Mohs, vários refinamentos na técnica podem facilitar o processamento do tecido, o mapeamento acurado do tumor e, por fim, a reconstrução do defeito resultante.
▪ O conhecimento de aspectos cirúrgicos e relacionados com o processamento do tecido que podem levar a artefatos no espécime do tecido pode auxiliar o cirurgião a evitar leituras falso-positivas.
Nicholas Golda ▪ George Hruza
A cirurgia micrográfica de Mohs (CMM) é mais adequada ao tratamento de malignidades que se desenvolvem de maneira contígua, significando que elas se desenvolvem de maneira em que a totalidade do tumor faz parte de uma massa singular com nenhuma parte fisicamente separada do sítio primário de crescimento. Os profissionais adequadamente treinados mais comumente usam CMM para o tratamento de todos os subtipos de carcinoma basocelular (CBC) e carcinoma espinocelular cutâneos (CEC), mas o procedimento também é comumente usado para quase todas as malignidades anexiais cutâneas – dermatofibrossarcoma protuberante (DFSP), leiomiossarcoma cutâneo, doença de Paget extramamária (DPEM), fibroxantoma atípico (FXA), melanoma in situ (MMIS) e, em alguns casos, para melanoma invasivo, carcinoma de células de Merkel (CCM) e outras malignidades cutâneas muito menos comuns.¹ A característica unificadora de todas as malignidades tratadas com sucesso com CMM é que estes tumores são contíguos, permitindo, deste modo, que o cirurgião detecte a totalidade da extensão microscópica do tumor, com frequência subclínica, enquanto o procedimento é realizado de modo apropriado.¹
A seleção do tratamento mais apropriado é muito importante para produzir os melhores resultados para o paciente. Embora a CMM possa ser utilizada para quase todas as formas de malignidade cutânea, é importante discernir sobre quais malignidades são tratadas com o procedimento, já que há várias alternativas para o tratamento de câncer de pele além da CMM, cada um com seus méritos e desvantagens. A CMM, embora não seja um procedimento mais
agressivo ou árduo para o paciente quando comparada com uma excisão padrão, é um procedimento trabalhoso para o médico e a equipe de CMM, geralmente consistindo em vários profissionais além do médico, incluindo enfermeiros e técnicos em histologia. Reconhecendo isto, a CMM frequentemente é reservada a malignidades com alguma das seguintes características:
Malignidades em que haja risco de desfiguramento ou perda funcional, como na cabeça e pescoço, nas mãos, nos pés e na genitália.
Malignidades que apresentaram recorrência ou foram tratadas de modo incompleto com outras modalidades de tratamento.
Malignidades em pacientes imunossuprimidos, particularmente para CEC em leucemia linfocítica crônica (LLC) e pacientes de transplantes de órgãos sólidos.
Malignidades grandes em qualquer sítio do corpo.
Malignidades em pacientes em quem a borda do tumor é mal definida, frequentemente em decorrência do dano actínico severo ou do crescimento subclínico do tumor, por exemplo, em tumores infiltrados.
Malignidades exibindo características de crescimento agressivo clínica e histologicamente.
Malignidades em sítios onde a cicatrização é desafiadora, e uma técnica maximamente conservadora reduzirá a carga da cura da ferida para o paciente, como em campos previamente irradiados e nas pernas, em pacientes com doença vascular periférica ou diabetes.
Em um esforço para criar um auxílio na decisão para a determinação de quais malignidades são apropriadas para tratamento com CMM, a Academia Americana de Dermatologia organizou uma força-tarefa para desenvolver critérios para uso apropriado (CUA) da CMM. O CUA é uma diretriz publicamente disponível que visa auxiliar os médicos as-
sistentes na tomada de decisão médica. Como um auxiliar na decisão, ele não pretende substituir o julgamento de um médico assistente na consulta com seus pacientes. Além disso, não pretende estabelecer um padrão de cuidado para o tratamento do câncer cutâneo, já que nem todos os tumores julgados apropriados por este sistema devem ser tratados com CMM, e, por outro lado, há situações em que o sistema pode considerar a CMM inapropriada para um tumor particular, enquanto o médico assistente, levando em conta informações clínicas adicionais não consideradas no AUC, pode tomar a decisão de tratar com CMM. Também deve ser observado que os critérios do AUC estão em constante evolução e são influenciados não só pelas considerações do que é melhor para o paciente, mas também pelas forças econômicas no sistema de saúde em geral.
Ao escolher o tratamento mais adequado para câncer de pele, também é importante reconhecer que uma biópsia de pele, particularmente devido à sua natureza superficial, pode não representar a verdadeira natureza de um câncer de pele. Já foi demonstrado que na ocasião do tratamento definitivo para o câncer de pele, a biópsia cutânea sub-representava a natureza agressiva de um câncer de pele em até 33% dos casos, enquanto os tumores eram revelados como menos agressivos do que a biópsia em 17% dos casos.² Além do mais, tumores que não são passíveis de conclusão do tratamento sob anestesia local serão desafiadores de concluir no contexto de internação com CMM, mas CMM pode ser usada, em muitos casos, como um componente do atendimento multidisciplinar para cânceres de pele particularmente avançados, como aqueles que invadem os ossos, forames do crânio ou órbita. Assim sendo, o julgamento do clínico, associado a todos os fatores do paciente, incluindo o exame clínico e um possível exame radiológico, a correlação patológica com esse exame e uma discussão com o paciente sobre seus objetivos para o tratamento, ainda é a melhor ferramenta para a escolha de um plano para manejo do câncer cutâneo.
As taxas de cura são mais altas quando o procedimento é feito na localização correta. Isto parece óbvio, mas em pacientes com lesões pequenas ou histórico significativo de dano actínico, ou quando é usada apenas informação oral para descrever o local original da biópsia, algumas vezes é possível que seja difícil identificar o local correto para cirurgia. Além do mais, com frequência os pacientes não são capazes de lembrar o local da biópsia com precisão, com um estudo mostrando a taxa de erro de 16,6% na identificação do local da biópsia pelos pacientes.³ Portanto, é importante a existência de um processo claramente definido para identificação do local correto para cirurgia. A utilização da fotografia no momento da biópsia é a melhor prática para evitar uma cirurgia na localização equivocada.³ As fotografias no momento de uma biópsia de pele devem ter o local planejado para a biópsia claramente demarcado, e elas devem ser tiradas a uma distância suficiente para incluir os pontos de referência anatômicos que podem facilitar a identificação do local quando a cirurgia finalmente for re-
alizada. Uma forma de HIPAA (Health Insurance Portability and Accountability Act of 1996) compatível e relativamente simples de obter uma fotografia do local da biópsia é tirar a foto do local demarcado para a biópsia com o telefone celular do paciente, e pedir que ele traga seu telefone na consulta cirúrgica, caso a biópsia revele uma malignidade que requeira tratamento adicional.4,5
Além de utilizar fotografia, ou quando não estiver disponível uma fotografia do local da biópsia, os médicos podem usar seu julgamento clínico para identificar o local da biópsia, com a confirmação do paciente usando um espelho ou uma foto em um tablet. Familiares que acompanham o paciente, particularmente aqueles que o auxiliaram nos cuidados com a ferida do local da biópsia, também podem ser uma fonte para confirmação da localização correta para cirurgia.
Se o local correto não puder ser confirmado, restam poucas opções ao cirurgião. Primeiramente, o procedimento pode ser cancelado, com o paciente retornando ao médico que o encaminhou para confirmação ou monitoramento do local. Como alternativa, pode ser obtida uma biópsia de congelação de um fragmento do local candidato mais provável, com o tratamento definitivo sendo feito no mesmo dia se a biópsia confirmar uma malignidade na pele. Uma biópsia de congelação de um fragmento pode ser realizada com uma biópsia por qualquer técnica que o cirurgião considere que não afetará de modo adverso o procedimento definitivo posterior; caso a biópsia seja positiva e possa produzir uma ferida esteticamente apropriada se o local estiver livre de câncer. O espécime da biópsia é então processado por secção vertical (em vez do seccionamento tangencial típico da CMM) no centro do espécime da biópsia, corado e interpretado para confirmar a presença ou a ausência de malignidade.6
Ocasionalmente, há um local óbvio da biópsia ou tumor residual óbvio com pele adjacente que é clinicamente suspeito por estar envolvido por câncer de pele, mas não definidamente envolvido. Nestes casos, desenvolvemos a prática de contornar o tumor definido ou o local da biópsia com uma linha contínua e delimitamos a área que é suspeita, mas não seguramente envolvida, com uma linha pontilhada. Isto ajuda a administrar as expectativas dos pacientes, informando-os de que estamos fazendo tudo o que podemos para sermos conservadores, mas que seu câncer pode ser maior do que eles pensavam previamente (uFig. 1.1).
Depois que o sítio cirúrgico correto foi marcado e confirmado, fotografia e exame clínico podem ser usados para documentar o local que será operado, bem como o estado pré-cirúrgico original da anatomia do paciente. A documentação fotográfica e a discussão do estado pré-cirúrgico do paciente podem auxiliar no eventual planejamento da reconstrução, além de prevenir que o médico assistente seja implicado como causador de alguma assimetria, deformidade ou paralisia que o paciente tenha antes do procedimento cirúrgico planejado. Além disso, durante esse tempo também pode ser útil marcar as fronteiras anatômicas relevantes antes da instilação de anestesia, se essas fronteiras forem úteis durante o planejamento da reconstrução. Um exemplo comum em que isto é útil é a marcação das bordas brancas dos lábios, pois o edema da cirurgia e a


anestesia injetada podem tornar este ponto de referência mais difícil de visualizar de modo confiável, especialmente em pacientes idosos, com uma borda vermelha menos definida (uFig. 1.2a, b).
Uma prática fundamental para a execução segura e acurada de um procedimento cirúrgico é a checagem cirúrgica. Ele pode ser realizado de inúmeras maneiras, mas, essencialmente, o médico que vai realizar o procedimento precisa confirmar que a intervenção correta está sendo feita no local correto para o paciente correto. Muitos cirurgiões de Mohs fazem checagens formais no início da CMM, e checagens menos formais com os estágios subsequentes. A checagem para um estágio subsequente pode ser particularmente importante se os pacientes estiverem sendo levados para diferentes salas ao longo do dia, desse modo assegurando que o mapa correto de Mohs está sendo referenciado e os instrumentos corretos estão sendo usados.
Nicholas Golda ▪ George Hruza
Curetagem é um procedimento comum em dermatologia frequentemente usado como um tratamento definitivo para cânceres de pele superficiais em áreas não sensíveis cosmeticamente. No início da CMM, a curetagem é feita para definir grosseiramente a largura e a profundidade do câncer de pele, mas o procedimento é realizado de modo diferente da
Fig. 1.1 Marcação inicial de um tumor mostrando a área que seguramente está envolvida, com uma linha contínua, e a área que tem suspeita de envolvimento, com uma linha pontilhada. A ilustração de até onde você considera que o tumor pode se estender, antes de começar a cirurgia, pode ajudar os pacientes a se prepararem mentalmente para um defeito que seja maior do que eles preveem.
Fig. 1.2 (a, b) A marcação dos limites anatômicos na fase pré-operatória pode ser útil na identificação destes limites após a CMM durante o planejamento da reconstrução. Estes limites com frequência são distorcidos pelo edema que se segue à remoção do tumor.
curetagem feita no curso de destruição maligna. Antes da CMM, a curetagem é realizada cuidadosamente, de modo a evitar uma ruptura desnecessária na pele que não está envolvida clinicamente pelo câncer de pele. Isto geralmente é obtido com curetas dermatológicas reutilizáveis, que geralmente são menos afiadas e, portanto, mais adequadas para o tumor do que curetas descartáveis de uso único, que tendem a ser extremamente afiadas para este propósito. Geralmente, trabalhando a partir do centro de uma lesão até a periferia, o tumor se revela com relativa facilidade, proporcionando um feedback tátil mais firme para o cirurgião quando é encontrada derme normal perifericamente e na margem profunda. Depois que o feedback de tecido rígido é encontrado em todas as margens, e não resta câncer de pele a ser removido nas partes moles, a curetagem é interrompida e o sítio operatório é limpo com gaze para remover qualquer fragmento de câncer de pele que possa ter sido liberado pela curetagem, mas permanece no sítio cirúrgico ou próximo a ele. Esta gaze é então descartada para evitar a reintrodução desses fragmentos de câncer de pele no campo operatório e aumentar o risco de uma margem histológica falso-positiva em decorrência de fragmento de tumor deslocado (uVídeo 1.1).
São vários os benefícios da curetagem antes da primeira camada de CMM:
A confirmação do local como tumor em um sítio cirúrgico identificado corretamente geralmente facilita a curetagem.
A remoção do volume da malignidade dá ao cirurgião melhor conceito da largura e profundidade grosseiras do tumor.7 A curetagem pode confirmar a impressão clínica do cirurgião quanto ao tamanho de uma malignidade, mas também pode informar ao cirurgião se a malignidade é
maior ou menor do que pensado inicialmente, desta forma poupando o paciente de camadas posteriores desnecessárias ou permitindo um procedimento mais conservador, respectivamente.
Floaters (fragmento sobrenadante tumoral e outros artefatos tumorais nas margens de Mohs podem ser reduzidos por curetagem. Com a remoção do tumor bruto, é menos provável que fragmentos do tumor sejam deslocados para a margem periférica ou profunda durante o processamento do tecido, desse modo reduzindo a chance de tumor falso-positivo na margem, tornando a interpretação histológica menos desafiadora.
• O deslocamento do tumor falso-positivo para as margens profundas durante cortes de relaxamento ou clivagem do espécime é referido como erro push-through (uFig. 1.3a).
• O tumor residual no centro do espécime, que se dobra para dentro da margem profunda depois do processamento do espécime, deste modo causando um falso-positivo na margem profunda, é referido como um erro fall over (por queda) (uFig. 1.3b).
O relaxamento do tecido para fins de processamento do tecido é facilitado pela remoção do volume central do tumor pela curetagem.
Também há dificuldades para o processo de curetagem:
Malignidades fibrosas, infiltrativas, incompletamente excisadas e recorrentes não serão bem curetadas, portanto, curetagem não é confiável nestes contextos para definição da extensão bruta do tumor.
Curetagem em áreas onde a pele é particularmente frágil ou fina e propensa a rasgar, como uma pálpebra envelhecida afetada, significativamente, por elastose solar, pode, de modo inadvertido, remover tecido normal não envolvido e introduzir lesões na pele que podem tornar mais desafiadora a orientação do tecido e sua posterior reconstrução.
Se não for tomado cuidado com o procedimento ou se forem usadas curetas descartáveis extremamente afiadas, o processo de curetagem pode danificar a epiderme adjacente não envolvida e tornar a excisão de Mohs maior do que o necessário para alcançar uma cura.

Fig. 1.3 (a, b) A curetagem pode auxiliar na redução do risco de erros histológicos posteriormente no procedimento, em particular o artefato push-through, em que o tumor bruto é empurrado até a margem profunda durante o processamento e o artefato fall over, em que o tumor bruto cai para margem profunda a partir do centro do tumor em espécimes divididos.
A intenção a enucleação cirúrgica de um tumor antes da excisão pode ser variada. O uso mais típico do da enucleação cirúrgica é remover o volume bruto de um tumor exofítico, facilitando a posterior curetagem e/ou processamento do tecido. O cirurgião também pode querer obter a secção do centro de um tumor para análise histológica para que possa ser comparado com as margens durante a tentativa de extirpar o tumor. Esta técnica pode ser particularmente útil para malignidades menos comuns ou malignidades onde a histologia é atípica ou esteja, de alguma forma, em questão (uma biópsia para “conhecer seu inimigo”). A análise do centro de um tumor também pode ser útil para identificação de características de alto risco da malignidade que podem não ter ficado evidentes na biópsia diagnóstica inicial e podem não estar manifestas nas margens dos espécimes de Mohs. Esta informação adicional pode auxiliar na obtenção de um estadiamento mais completo do tumor, como em casos de CEC, e pode fornecer informações importantes para o futuro manejo do paciente. O processamento do espécime da enucleação pode ser feito com processamento da secção congelada horizontal e interpretação pelo cirurgião de Mohs, ou submetendo o espécime à análise da secção congelada ou permanente por um dermatopatologista. Em cada caso deve ser produzido um relatório patológico para documentar os achados dessas biópsias. Os benefícios da enucleação cirúrgica antes da primeira camada de CMM são similares aos vistos com curetagem. A saber, a remoção da maior parte do volume do tumor reduzirá a chance de o tecido maligno ser desalojado da massa tumoral durante a excisão e o processamento do tecido, e acabar nas margens histológicas examinadas do espécime da CMM. Quando as células tumorais são desalojadas dessa maneira, isso pode aumentar as interpretações falso-positivas ou tornar a interpretação histológica mais desafiadora quando o cirurgião trabalha para determinar se o tumor está na margem. Em geral a margem profunda, nestes casos, onde a divisão ou os cortes de relaxamento do espécime empurram o tecido maligno para a margem, é um verdadeiro ou falso-positivo.
A principal dificuldade de retirar um espécime com enucleação cirúrgica é que o cirurgião tem o risco de, inadvertidamente, fazer uma citorredução muito larga ou muito profunda, desse modo tornando a excisão final de Mohs maior que o necessário. Esse risco pode ser minimizado por uma técnica cuidadosa (uVídeo 1.2).
Nicholas Golda ▪ George Hruza
Lembre-se de que os dois objetivos principais da CMM são a cura oncológica e a conservação máxima do tecido, nessa ordem. Dito isso, o objetivo em cada estágio da CMM deve ser remover, de modo conservador, a malignidade em sua totalidade. O exame clínico pelo cirurgião de Mohs para identificar a extensão do tumor clinicamente óbvio é a melhor ferramenta para determinação do tamanho do primeiro
estágio. Esse exame pode ser complementado, como discutido anteriormente, pelo uso de curetagem antes do primeiro estágio. É importante reiterar que ainda que o cirurgião possa suspeitar que o tumor seja maior do que aparenta, apenas a extensão do tumor clinicamente óbvio deve ser removida no primeiro estágio, com o cirurgião usando a histologia das margens da CMM para confirmar ou refutar a suspeita clínica inicial. O uso desta técnica pode resultar na necessidade de um estágio adicional, mas também permite a conservação máxima do tecido.
O primeiro estágio consiste na remoção completa do tumor bruto inteiro, bem como uma margem de 1 a 2 mm de pele clinicamente normal imediatamente em torno e na profundidade do tumor (uVídeo 1.3). Para tumores muito grandes ou agressivos, uma margem inicial maior pode ser útil para reduzir o número de estágios necessários para remoção do tumor. Esta borda de tecido clinicamente normal é necessária para comprovar as margens negativas, além de permitir o monitoramento da qualidade do processamento do tecido pelo cirurgião, como será discutido mais tarde. Se houver cuidado durante os estágios de excisão de Mohs para tornar o espécime do tecido mais fácil de ser processado pelo cirurgião ou o técnico em histologia, a secção histológica será processada mais rapidamente, será de maior qualidade e mais fácil de ser interpretada. A seguir apresentamos uma descrição do primeiro estágio, com sugestões para facilitação do processamento do tecido e a qualidade da otimização.
O primeiro estágio inicia com uma incisão muito superficial ou marca em torno do tumor em um ângulo de 90 graus em relação à superfície da pele. Esta incisão define a margem do espécime que será processado. Para auxiliar no processamento subsequente do tecido, a borda da camada de Mohs deve consistir em contorno suave, arredondado e convexo. Os cantos acentuados, formas côncavas e movimento serrilhado (camadas estriadas) são mais desafiadores de relaxar e achatam no plano apropriado para processamento do tecido. Estas imperfeições na excisão de Mohs podem criar áreas onde a epiderme está ausente, deste modo tornando essa secção do espécime impossível de ser interpretada, exigindo estágios adicionais de cirurgia que poderiam ter sido evitados. Além disso, movimento serrilhado também pode causar a introdução de marcas falsas no tecido que podem tornar desafiadora a localização do tumor (uFig. 1.4).
A incisão inicial para a excisão de Mohs é feita superficialmente, pois o objetivo é deixar o espécime em perfeita orientação em relação ao sítio, no paciente, de onde ele está sendo removido, assim as marcas de orientação do tecido podem ser colocadas com precisão no espécime e no paciente. Essas marcas de orientação podem ser feitas por meio de diferentes técnicas e em diferentes padrões com base na preferência do cirurgião e no tamanho e forma do tumor (uFig. 1.5). O essencial quando são colocadas as marcas é assegurar que, se o tumor estiver presente, o cirurgião será capaz de localizar com precisão o tumor residual no paciente com base nessas marcas. Portanto, as marcas são colocadas antes da incisão na espessura total da derme para assegurar que a marca no lado do espécime corresponda exatamente à
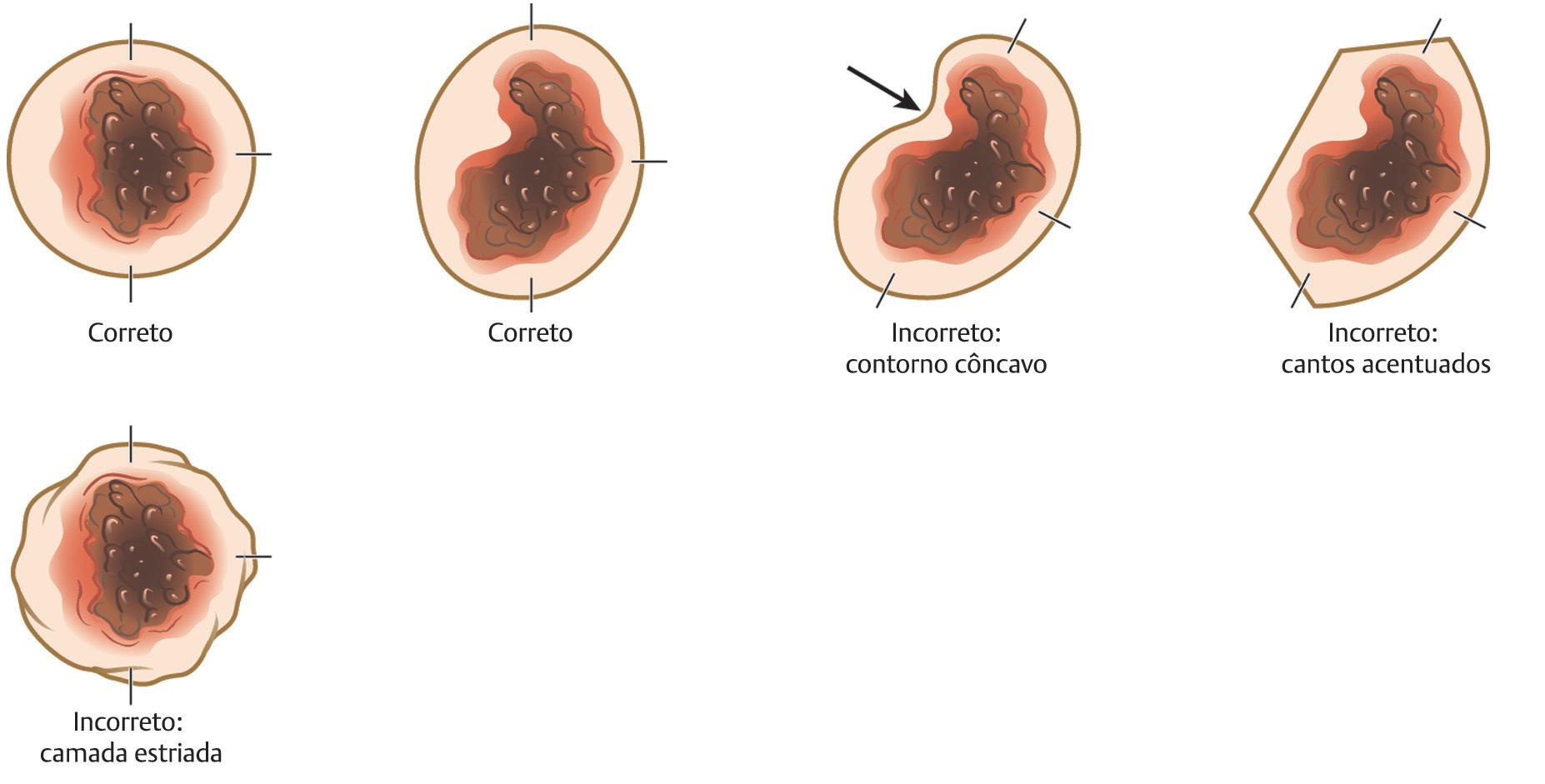
Fig. 1.4 Um estágio apropriado da CMM consiste em uma incisão suave imediatamente em torno do tumor bruto com bordas convexas e paredes chanfradas para dentro para facilitar o processamento do tecido. Cantos acentuados, formas côncavas e movimentos serrilhados devem ser evitados.

Fig. 1.5 Padrões comuns para posicionar marcas de orientação no tecido.
marca no lado do paciente. As marcas de orientação mais comumente são feitas com um corte superficial no tecido feito com bisturi. Este corte deve ser suficientemente profundo e grande para ser facilmente encontrado caso seja necessário um estágio posterior, mas não tão grande e profundo que interfira na reconstrução. O padrão dos cortes no tecido é altamente variável entre os cirurgiões. O cirurgião deve escolher a técnica que acha que vai permitir maior habilidade para localizar e fazer seletivamente a excisão do tumor residual usando os mapas histológicos. Um aspecto fundamental é que, independentemente da técnica usada, as marcas de orientação devem ser assimétricas. Ao fazer as marcas assimétricas, o cirurgião pode reorientar o espécime para o paciente caso ocorra algum erro no manuseio do tecido durante o processamento do tecido, tal como um espécime derrubado ou um mapa rotulado erroneamente, porque o espécime só vai “encaixar” no defeito do paciente de uma maneira, muito semelhante a uma cavilha que só vai encaixar no seu orifício correspondente se estiver na orientação correta.
Os cirurgiões utilizam diversas técnicas para fazer as marcas orientadoras. Alguns usam violeta de genciana para evitar marcas no tecido, mas violeta de genciana exibe tendência a perder sua nitidez sobre a pele (borramento) e pode ser removida pelas preparações cirúrgicas e pelo sangue entre os estágios, desta forma afetando negativamente a precisão da localização do tumor. Mais comumente, os cirurgiões utilizam cortes de orientação no tecido, como discutido anteriormente. Os padrões assimétricos comuns incluem uma marca única em uma localização e três marcas em uma posição de 12, 3 e 6 horas ou orientação assimétrica similar. Alternativamente, muitos profissionais vão colocar quatro marcas em uma orientação cruzada simétrica, embora isso não exija mais cuidado para manter a orientação, pois a simetria das marcas não permite reorientação se houver um erro no manuseio do tecido durante a transferência, inspeção ou processamento do tecido. Quando são feitos cortes no tecido, é útil colocá-los em linha com o vetor de fechamento mais provável, de modo que os cortes sejam excisados com cones verticais e não confundam a aproximação epidérmica durante o fechamento da ferida. Tumores maiores são mais bem marcados com uma técnica de “grade” que permita a mais alta resolução possível para o tumor residual na margem profunda dentro do maior campo destes tumores. Nessa técnica, as marcas são colocadas de tal forma que o tecido possa ser dividido em quadrados semelhante a um papel quadriculado durante o processamento do tecido. Outro método de marcação de tumores grandes é o uso de grampos cutâneos em torno das margens do defeito combinando com os grampos no espécime excisado. Os grampos também podem ser úteis para orientação da ressecção da margem profunda do tumor sem uma borda de pele com os grampos usados para delinear as margens do espécime excisado (uFig. 1.6).
Ao colocar as marcas, o cirurgião precisa equilibrar a resolução da localização do tumor durante a análise do tecido com a falibilidade introduzida pela colocação de várias marcas de orientação no espécime. A habilidade do cirurgião em identificar no paciente, com precisão, onde permanece o tumor residual para reexcisão seletiva em um estágio subsequente é melhorada se o tumor estiver próximo a

1.6 Tumores grandes, com a dermatofibrossarcoma protuberans, são mais bem orientados com as marcas colocadas em um padrão em forma de grade para que o tumor residual nas margens profundas possa ser facilmente resolvido e removido acuradamente. Tumores grandes como estes são mais bem marcados redundantemente com violeta genciana e marcas no tecido.
uma marca de orientação. Assim sendo, quanto mais marcas o cirurgião colocar no espécime, maior sua capacidade de localizar com precisão o tumor residual no paciente. As marcas, no entanto, introduzem um erro potencial à CMM, porque cada marca produz uma área onde a epiderme pode ser disposta no plano seccionado. Se a marca resultar em falha na visualização do tumor residual focal em uma margem em decorrência da acomodação epidérmica incompleta, as taxas de cura poderão ser afetadas negativamente. A decisão de quantas marcas são necessárias para atingir os objetivos da CMM é, portanto, deixada para o cirurgião determinar com base na confiança nas técnicas laboratoriais da prática individual e na sua habilidade para localizar o tumor dentro de um espécime com mais ou menos marcas. Em seguida é usada uma incisão biselada para fazer uma incisão na pele, e em tecidos mais profundos, se necessário, até a profundidade desejada da excisão abaixo da profundidade da malignidade grosseiramente evidente. Esta incisão biselada é realizada fazendo-se várias passagens em torno do espécime dentro da incisão inicial superficial, em um ângulo de aproximadamente 45 graus, na maioria dos casos, até que seja atingida a profundidade correta. A excisão do tecido com um bisel facilita o processo de colocação da borda epidérmica plana no mesmo plano que a margem profunda durante o processamento do tecido, já que a borda epidérmica viaja uma distância menor e encontra menos resistência torcional quando o tecido é biselado em relação a uma excisão de 90 graus (uFig. 1.7). A quantidade de bisel necessária varia com base no sítio anatômico do tumor (já que a derme é mais ou menos rígida em diferentes sítios) e a profundidade do mesmo (camadas superficiais, somente na derme, precisam de maior grau de biselamento que os tumores que são mais profundos que largos).8 É comum, por exemplo, em lesões nasais distais e na asa nasal retirar uma camada transdérmica em um esforço para facilitar melhor resultado com um

Fig. 1.7 Demonstração de biséis apropriados. Ter muito poucos biséis pode causar dificuldade com o processamento do tecido, ao passo que muitos biséis podem, inadvertidamente, transeccionar o tumor dentro da parede do espécime.

enxerto de pele ou cicatrização por segunda intenção, porém, essas camadas transdérmicas geralmente exigem biselamento mais extremo para facilitar um processamento de alta qualidade no tecido devido à rigidez da pele (uVídeo 1.4). Isto foi referido como a técnica em camada de espessura parcial.8,9 Finalmente, depois que a incisão biselada na periferia do espécime está completa, o espécime é removido do paciente por meio de uma incisão plana na margem profunda do espécime, a uma profundidade logo abaixo da extensão mais profunda do tumor. Em alguns casos, esta profundidade pode ser intradérmica. Em outros, pode ser mais profunda em um nível que vai até o periósteo, inclusive. Os erros que podem ser cometidos durante a incisão da margem profunda incluem (uFig. 1.8a-e):
Fazer uma incisão que não é plana: Uma incisão marginal denteada profunda aumentará a probabilidade de áreas removidas, levando à possibilidade de falso-negativos.
Fazer uma incisão que se desvia mais superficialmente ou mais profundamente na margem profunda:
• Desvio superficial: Risco de mais estágios pela incisão inadvertida na margem profunda do tumor.
Fig. 1.8 Dificuldades com a margem profunda em um estágio de Mohs inicial. (a) Margem profunda recortada. (b) Desvio superficial ou profundo dentro do plano profundo. (c) Margem profunda antibiselada. (d) Margem profunda em casa de botão. (e) Preensão da margem profunda muito firmemente com fórceps dentado produzindo uma perfuração na margem profunda.
• Desvio profundo: Perda desnecessária de tecido, perda de volume e possível dano a estruturas mais profundas com nervos ou vasos.
Criação de um antibisel que interfere no relaxamento do tecido, fazendo a incisão na totalidade de uma margem profunda em todo o espécime a partir de uma direção.
Margem profunda incompleta ou em casa de botão (buttonhole):
• Cria uma área removida com margem profunda impossível de interpretar, pela incisão na margem profunda curetada do espécime ou criando entalhes extras que simulam os planejados para orientação.
Segurar o tecido muito firmemente com fórceps serrilhado durante a remoção do espécime pode criar impressões triangulares na margem profunda que prejudicam a avaliação da margem profunda completa:
• O fórceps serrilhado também pode transferir tecido maligno do tumor para a margem profunda se não for tomado o cuidado de usar somente um lado do fórceps no lado do tumor e o outro no lado profundo ao segurar o tecido.
O processo de remoção no primeiro estágio de Mohs de um sítio que foi previamente excisado ou é recorrente depois de um procedimento excisional prévio apresenta desafios únicos. Um tumor excisado de modo incompleto é aquele em que foi tentada uma excisão, e a patologia revelou malignidade persistente em uma margem lateral ou profunda. Pode ser útil ter informação se o tumor residual está presente nas margens lateral ou profunda, ou ter as lâminas do espécime excisional original disponíveis para exame, para o planejamento da CMM posterior. O problema criado por um tumor incompletamente excisado ou recorrente é que a malignidade pode não estar mais contígua e/ou pode estar obscurecida pela cicatriz clínica e histologicamente. É por isso que as taxas de cura para CMM são mais altas quando a CMM é o primeiro tratamento escolhido para um tumor.10,11 Em nossa prática, geralmente executaremos uma “camada de mapeamento” nos casos de excisão incompleta como primeiro estágio da CMM (uFig. 1.9). Uma camada de mapeamento consiste essencialmente em uma reexcisão estreita da totalidade da cicatriz do procedimento anterior para incluir o tecido abaixo da margem profunda do procedimento anterior. Esta reexcisão completa da margem profunda abaixo da cicatriz anterior é essencial para comprovar as margens profundas negativas com CMM. A margem profunda de uma excisão anterior pode ser identificada tanto clínica quanto histologicamente pela visualização da cicatriz, em vez da gordura subcutânea normal na margem profunda. Em casos de recorrência e excisão incompleta, só é possível comprovar as margens liberadas pela avaliação histológica completa das margens cirúrgicas prévias. Isto requer a reexcisão cuidadosa do procedimento anterior e, compreensivelmente, causa perda adicional de tecido e, ocasionalmente, grandes defeitos que poderiam ter sido evitados se a CMM tivesse sido usada para tratamento primário da malignidade.
Nicholas Golda ▪ George Hruza
1.4.1 Transferência do
Depois que o espécime da CMM foi excisado, ele é colocado em um meio de transferência para transporte até a mesa de
macroscopia. O meio usado é variável entre as práticas de Mohs e pode consistir em cartolina ou papel com ou sem desenhos anatômicos ou pré-impressos, filtro de papel,compressas não aderentes ou gaze embebida em solução salina. Além disso, algumas práticas usam placas de Petri para alojar o tecido e o já mencionado meio de transferência para transportar o tecido até o laboratório para processamento. Independentemente do meio de transferência escolhido por determinado cirurgião, algumas coisas são consistentes entre as práticas:
A maioria dos meios tem um mecanismo para identificar a localização das marcas de orientação, ou pelo menos a posição de 12 horas, no tecido excisado. Isso pode ser obtido com mapas detalhados desenhados ou pré-impressos ou uma simples marca de tinta sobre uma compressa não aderente ou uma gaze (uFig. 1.10).
Deve haver um mecanismo para identificação do paciente e do sítio, ou um número de registro para evitar confundir um espécime com outro no laboratório (uFig. 1.10).
Depois que o processamento estiver concluído, deve ser usado um mecanismo para rastrear qual espécime de tecido congelado corresponde a qual paciente, caso secções adicionais sejam necessárias. Alguns cirurgiões utilizam rótulos nas lâminas codificados com cores e o meio de temperatura ideal de corte (TOC), enquanto outros rotulam por ordem dentro do criostato.
O objetivo das incisões relaxantes é alinhar a margem epidérmica no mesmo plano que a margem profunda do espécime. A compreensão de que a borda epidérmica deve se mover para o mesmo plano que a margem profunda, rodando sobre um pivô ou ponto de “articulação”, antes do congelamento do tecido é um dos elementos fundamentais do seccionamento tangencial da CMM.12,13 ( uFig. 1.11). Se a totalidade da borda epidérmica de um espécime não for movida para este plano, ele não poderá ser examinado microscopicamente, sendo aumenta-se a possibilidade de perda de uma margem positiva e recorrência da malignidade. 14

Fig. 1.9 Mapeamento de Mohs para um tumor previamente excisado (Mohs para uma excisão incompleta prévia).

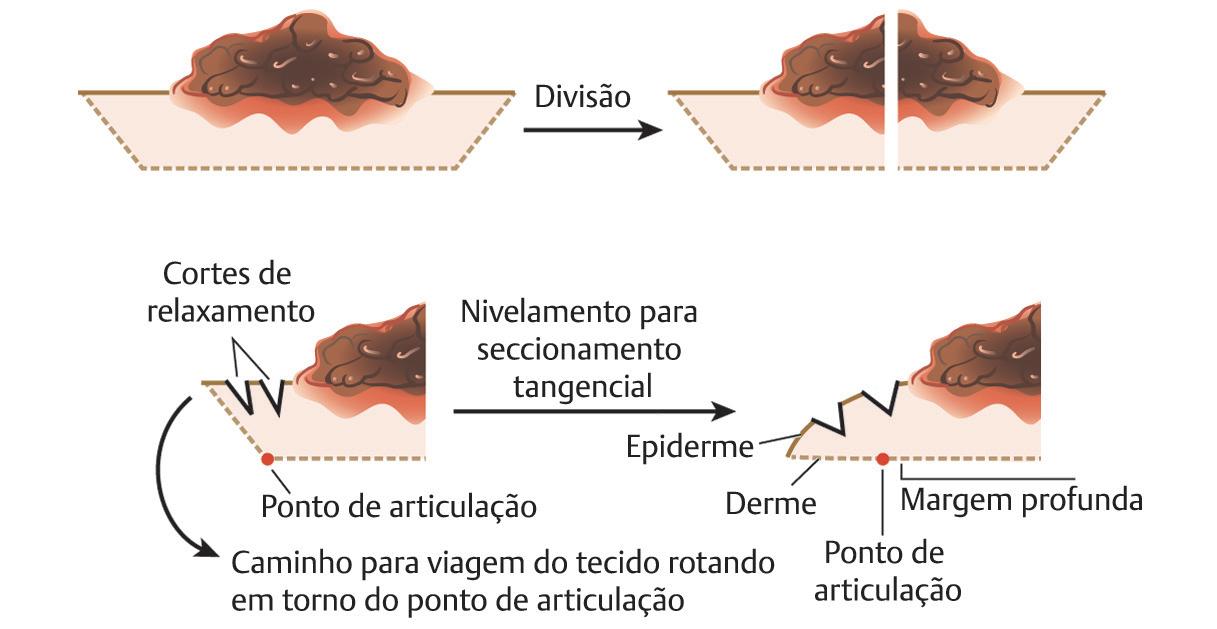
As práticas podem usar uma das seguintes opções para relaxamento do tecido ou uma combinação delas, como fazemos em nossa prática. O primeiro passo para permitir que a borda epidérmica se mova para o plano apropriado é a enucleação (remoção inicial do tumor) e a curetagem, como discutido anteriormente. A remoção da massa central do tecido maligno permite que a borda epidérmica recaia no plano apropriado mais facilmente e também reduz a oportunidade de transferência do tecido maligno para as margens durante o processamento com resultantes falso-positivos. A seguir, incisões de relaxamento radiais e circunferenciais podem ser feitas no tecido. Para os dois tipos de incisões relaxamentos é importante evitar a incisão completa através do espécime até a face dérmica ou margem profunda do espécime, pois isso pode resultar em artefato push-through, em que as células tumorais são empurradas pela lâmina até a margem do espécime, desse modo tornando a interpretação histológica mais difícil e, possivelmente, causando falso-positivos. Incisões radiais são incisões no tecido orientadas perpendicularmente à borda da ferida, apontando para o
Fig. 1.10 Amostra de mapa e placa de Petri rotulada para transporte do tecido até o laboratório.
Fig. 1.11. Ilustração de tecido sendo rotado em torno de um “ponto de articulação” para produzir seccionamento tangencial.
centro do espécime. Incisões radiais não devem ser feitas em todo o caminho até a margem epidérmica do espécime a fim de evitar a introdução de marcas falsas no tecido na margem. As incisões circunferenciais seguem um curso paralelo à borda da ferida dentro do espécime. Isso permite que a borda epidérmica se mova para dentro da margem profunda por meio de um movimento “em acordeão”. Com base na preferência do cirurgião, os espécimes da CMM podem ser segmentados antes do congelamento e seccionamento, ou podem ser processados como uma peça única.15,16 Há vantagens e desvantagens em ambas as abordagens. Há uma evidência óbvia de tempo obtido no laboratório quando um espécime é processado como uma peça única, desde que o técnico em histologia tenha facilidade para deixar a margem epidérmica inteira apropriadamente relaxada no plano profundo. Se a obtenção da totalidade da epiderme for um desafio para o técnico em histologia de Mohs, resultando em perda de tempo ou novos cortes, então a eficiência de uma peça única pode ser perdida. Um espécime divido será sempre necessário se o tumor for mui-
to grande para caber em uma lâmina de microscópio. Os cirurgiões de Mohs também podem optar por dividir os espécimes para aumentar ainda mais a facilidade para obter a epiderme apropriadamente achatada, uma vez que a divisão serve como um procedimento de relaxamento adicional para o espécime. Há algumas dificuldades potenciais que podem ocorrer neste estágio do processamento do tecido:
Um espécime dividido pode resultar em um artefato push-through, em que o tumor é empurrado até a margem profunda pela lâmina quando está sendo clivado, resultando em margens profundas falso-positivas.
O tecido tumoral da parte superficial do espécime pode enrolar ou cair no plano da margem profunda, causando, potencialmente, um falso-positivo na margem profunda.
A margem profunda em espécimes divididos pode ser disposta incompletamente no plano da secção, desse modo não permitindo a avaliação histológica da totalidade da margem profunda.
Pressão descendente excessiva sobre o espécime durante o congelamento do tecido na orientação planar para seccionamento tangencial pode pressionar, inadequadamente, o tecido tumoral mais próximo à margem profunda e predispor a falso-positivos.
A exposição excessiva ao bloco de tecido congelado devido a relaxamento epidérmico ideal pode, inadvertidamente,cortar o tumor macroscópico quando ele pode não estar presente na margem verdadeira se o espécime foi seccionado mais de modo mais conservador.
• O cirurgião, em geral, consegue visualizar que um bloco foi cortado muito profundamente observando que estruturas superficiais da pele estão presentes na porção central, ou profunda, do tumor. Além disso, as bordas epidérmicas periféricas começarão a apresentar seccionamento tangencial com uma rede alveolar de cristas epidérmicas, sendo visíveis nas seções cortadas muito profundamente no bloco do tecido.
Corantes permanentes são usados no tecido para codificar com cores o espécime de forma que sua orientação anatômica seja conhecida (uVídeo 1.5). Esta coloração é compatível com um mapa do tecido simultaneamente criado que mostra um desenho do espécime com todas as mar-
cas de orientação, frequentemente definidas no contexto de estruturas anatômicas próximas. Quando a coloração do tecido estiver concluída, o espécime deve corresponder ao mapa de Mohs em apenas uma orientação; assim o cirurgião será capaz de mapear acuradamente algum tumor residual baseado na tinta visível nas lâminas histológicas.8 Várias técnicas podem ser empregadas para garantir que a coloração auxilie ao máximo na orientação do tecido e na identificação do tumor (uFig. 1.12):
A tinta deve ser aplicada com moderação para evitar que o excesso de tinta escorra e marque erradamente mais do que uma margem ou corte do tecido.
A coloração deve, sempre que possível, seguir uma convenção predeterminada para todos os casos; por exemplo, azul indica a parte superior do tumor, vermelho a parte inferior, e verde a marca assimétrica lateral. Por outro lado, uma mnemônica usada é: verde para a grama, azul para o céu, vermelho para a direita. Os editores usam uma tinta azul para indicar a posição de 6 horas e tinta vermelha para indicar a posição de 3 horas, o que permite a orientação adequada, mesmo sem coloração nas posições de 9 ou 12 horas.
A coloração deve ser feita de maneira que reforce a assimetria da amostra do tecido para evitar erros no mapeamento.
Procure evitar o uso da mesma cor em duas seções diferentes do mesmo espécime para evitar confusão durante o mapeamento do tumor.
Em espécimes divididos, particularmente espécimes grandes com várias peças, faça coloração na margem profunda onde ocorreu a divisão, de modo a identificar o espécime no mapa e para não permitir que espécimes diferentes no mesmo mapa sejam confundidos entre si.
Em espécimes apenas com margem profunda, as laterais do espécime, ou cortes nas laterais do espécime podem ser tingidos de modo a ilustrar anatomicamente sua orientação em relação ao paciente.
Alguns defendem a coloração em papel cartolina e a manutenção desta cartolina até o final do dia cirúrgico para o caso de haver dúvidas sobre a coloração que podem ser respondidas recorrendo-se à cartolina de transferência colorida e orientada que foi guardada.8
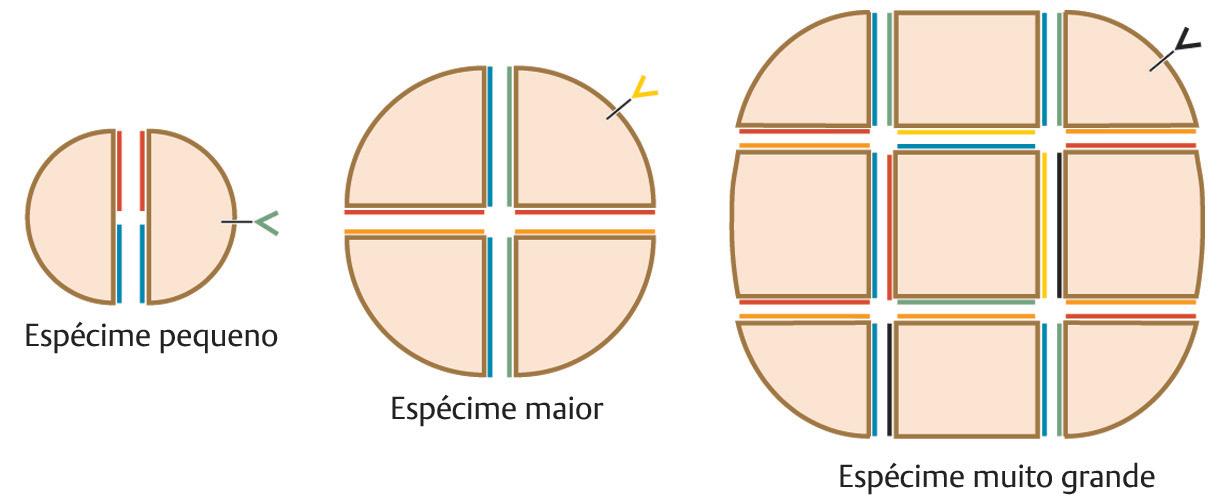
Fig. 1.12 Padrões potenciais de coloração do tecido para tumores simples e complexos.
Nicholas Golda ▪ George Hruza
Uma parte significativa do treinamento em CMM inclui a interpretação adequada da histologia da seção congelada tangencialmente processada para uma variedade de malignidades cutâneas comuns e incomuns. A interpretação histológica não só requer a habilidade de reconhecer alterações sutis compatíveis com a borda de fuga do câncer de pela nas margens de uma excisão de Mohs, como também requer habilidades para avaliar cada espécime do tecido quanto à qualidade do processamento histológico e coloração, pois deficiências nestas áreas podem resultar em uma habilidade reduzida do cirurgião de Mohs para reconhecer a presença de malignidade em uma margem. O treino para isso é cumulativo, por meio do treinamento em residência dermatológica, onde os aprendizes são expostos à dermatopatologia e CMM e, em muitos casos, com bolsas de estudos para treinamento em cirurgia micrográfica e oncologia dermatológica, onde o aprendiz tem a oportunidade de ter treinamento rigoroso no procedimento, incluindo técnicas laboratoriais, tratamento de tumores raros ou avançados, bem como técnicas reconstrutivas avançadas. É digno de nota que nem todos os profissionais que realizam CMM passaram por uma formação formal em CMM ou até mesmo por uma residência em dermatologia.
Um primeiro passo importante na interpretação é o conhecimento do tumor que está sendo excisado. Embora as malignidades comuns sejam mais facilmente reconhecidas depois de anos de treinamento e trabalho na prática, as variantes menos comuns de câncer de pele podem ser mais desafiadoras. Nestes casos geralmente é útil examinar as lâminas da biópsia diagnóstica original ou realizar uma biópsia congelada da secção para seccionamento vertical do centro da malignidade no dia da cirurgia.
Antes de apresentar uma interpretação histológica do espécime, o cirurgião, primeiramente, realiza uma revisão inicial da qualidade da lâmina. Foi constatado que erros na preparação da lâmina e na interpretação representam uma grande proporção das recorrências depois de CMM.14,17,18
A rotulagem da lâmina, frequentemente com um número de registro ou outra informação de identificação, deve ser confirmada com a marcação do mapa de Mohs em que o cirurgião documentará os achados.
A seguir o cirurgião pode inspecionar visualmente o espécime para confirmar se não há características que indicariam que esse não é o espécime correto para o paciente ao qual, ou o sítio a que ele é atribuído. Exemplos de formas de detectar erros potenciais incluem: o tamanho do espécime não combina com o que foi excisado do paciente identificado (muito grande ou muito pequeno), a área anatômica não combina com a que foi excisada do paciente identificado (isto é, um espécime com mucosa ou conjuntiva de um espécime identificado como proveniente do couro cabeludo), e assim por diante.
Depois disso, o cirurgião examinará a lâmina microscopicamente para se assegurar que ela foi adequadamente preparada. Os problemas laboratoriais a seguir podem interferir na interpretação histológica e devem ser resolvidos pelo cirurgião com a equipe do laboratório:
Erros na colocação da lamínula podem produzir bolhas de ar. Isso pode ser abordado com a colocação do meio da lamínula diretamente sobre lâmina em quantidade suficiente, mas não excessiva, e colocando a lamínula lentamente a partir de uma extremidade.
Clareamento insuficiente com xileno ou substituto de xileno pode resultar em coloração castanha requerendo a remoção da lamínula e reclareamento.
Pouca coloração pode tornar o tumor mais difícil de distinguir de estruturas normais no espécime. Isso pode ser resultado de um erro no protocolo de coloração, velhos reagentes de coloração ou um erro mecânico em um corante automatizado.
Espécimes cortados muito espessos são mais fáceis de serem transferidos do criostato para a lâmina, mas tornam a coloração muito escura e a interpretação desafiadora. Em nossa prática observamos o limite superior de 8 µm para espessura interpretável.
A seguir o cirurgião deve avaliar a lâmina para se assegurar que o espécime está completo. Se algum tecido marginal, seja da borda epidérmica ou da margem profunda, estiver ausente, então o espécime não poderá ser interpretado com segurança, e o cirurgião deve considerar agir para garantir que um espécime completo seja obtido e interpretado. Isto pode requerer a reincorporação e/ou recorte de secções mais profundas no espécime, “balançando” o espécime em uma direção para assentar a borda necessária para um corte extra, ou retirar tecido adicional do paciente para assegurar a análise marginal completa. Os fatores que podem contribuir para o tecido ausente na margem podem incluir:
Epiderme ausente:
• Curetagem da epiderme antes do estágio de Mohs.
• Epiderme frouxa em áreas de cicatriz que desliza ou se descola do espécime durante o processamento.
• Relaxamento epidérmico incompleto no plano da secção durante o a macroscopia do tecido.
• Lay-down epidérmico incompleto imediatamente adjacente às marcas de orientação.
• As bordas do espécime são côncavas, dentadas ou não niveladas de outra forma.
• Dobra da borda epidérmica, especialmente se é usada uma lâmina pouco afiada ou higienizada de modo incompleto em um criostato no ponto onde a lâmina, primeiramente, encontra o tecido incorporado.
• Artefato por vibração em decorrência de uma lâmina do criostato com defeito ou pouco afiada.
• Artefato devido a pelo espesso no espécime desviando o caminho da lâmina do criostato. Isso pode ser atenuado arrancando-se manualmente o pelo presente no espécime em sítios anatômicos onde o tecido é, em outros aspectos, delicado, como a pálpebra e a mucosa nasal.
Tecido ausente na margem profunda:
• Congelamento incompleto da gordura, que requer tempos mais longos no freezer para ser preservada no espécime.
• Trauma por fórceps dentado no tecido profundo causando defeitos triangulares na margem profunda.
• Relaxamento insuficiente do tecido pode fazer com que a porção central da margem profunda se erga quando a epiderme está sendo achatada, desta forma elevando-o do plano da secção.
• Falha do cirurgião em remover a margem profunda como um plano uniforme quando executa o estágio.
• Artefato por vibração de uma lâmina do criostato com defeito ou pouco afiada.
• A continuidade da margem profunda é mais facilmente avaliada em espécimes que não estão divididos ou são processados como uma peça única, embora isso nem sempre seja possível.
Depois que o cirurgião concluiu uma revisão de qualidade das lâminas e determinou que elas são apropriadas para fazer uma determinação histológica sobre as margens do espécime excisado, ele pode, então, prosseguir com a interpretação da lâmina. O fato de que o cirurgião também faz a avaliação histológica é uma característica única da CMM e é, de fato, uma parte necessária da CMM. Os altos padrões para orientação do espécime e a habilidade de identificar com precisão a localização do tumor residual na margem de um espécime, que são típicos da CMM, requerem que o cirurgião e o patologista sejam o mesmo indivíduo. Além disso, os cirurgiões de Mohs são bem treinados na avaliação e mapeamento histológico de tecido de secção congelada processado pelo seccionamento tangencial para malignidades comuns e raras da pele. O reconhecimento tanto de malignidade óbvia quanto sutil na margem de um espécime é bem abordado em manuais e atlas inteiros dedicados a este tema, e está além do escopo deste capítulo. O que é importante salientar neste capítulo são as oportunidades potenciais de erro neste estágio do procedimento além de uma falta de treinamento ou da habilidade para reconhecer malignidade persistente em uma margem, e como um cirurgião pode evitar esses erros.
Primeiramente, o cirurgião deve estar alerta para fatores que podem obscurecer o tumor presente na margem. Durante o processamento do tecido, a epiderme pode-se dobrar um pouco sobre o espécime, desse modo obscurecendo a margem com uma espessura dupla do tecido. Embora a secção possa ser suficientemente fina para fazer uma interpretação através deste tecido dobrado, isto é mais desafiador e aumenta o risco de que malignidades sutis, como CBC superficial ou CEC in situ, possam passar despercebidas.14 Inflamação é outro fator que pode mascarar o tumor em uma margem. Inflamação, geralmente se manifestando como agregados linfocíticos densos no espécime, pode ocorrer por uma variedade de motivos: em resposta a uma biópsia recente, como uma reação à malignidade próxima (inflamação peritumoral), rosácea em tecido facial sebáceo ou devido a outros processos inflamatórios primários ou leu-
cemia cutânea não relacionada com câncer de pele.13 Além disso, certas localizações, como a concha auricular profunda na cartilagem pode mostrar um certo grau de inflamação, e na pesquisa tumores profundos, podem ser encontrados linfonodos mimetizando inflamação peritumoral. Ainda que a inflamação densa possa tornar a interpretação mais desafiadora ao obscurecer focos pequenos de malignidade invasiva, também pode ser útil em muitos casos por chamar a atenção do cirurgião para uma inspeção mais detalhada, deste modo tornando, em alguns casos, a detecção de pequenos focos de malignidade mais fácil. Inflamação densa e evidência histológica de fibrose provaram anunciar CEC residual, com um estudo mostrando CEC residual em uma camada subsequente em 1,9% dos casos em que outro estágio da CMM foi realizado em decorrência desses achados histológicos.19 Por isso os cirurgiões podem considerar a realização de um estágio adicional quando estes achados forem visualizados histologicamente. Uma correlação similar entre inflamação densa e CBC residual não foi demonstrada,20 embora tecido estromal possa levar alguns cirurgiões a executarem uma camada adicional.
Tecido estromal também pode estar presente nas lâminas histológicas de CMM devido a circunstâncias que ocorrem durante a excisão e o processamento do tecido. Se um cirurgião não se sentir confortável para reconhecer um artefato tumoral, podem ocorrer interpretações histológicas falso-positivas, resultando em cirurgia adicional desnecessária para o paciente. Além de ter a habilidade de reconhecer o artefato, caso ele ocorra em espécimes de patologia, é importante melhorar os processos no início do procedimento visando minimizar a ocorrência de um artefato tumoral. Alguns artefatos são simples de identificar. Eles são comumente referidos como flutuadores. O uso da palavra flutuador é uma denominação imprópria em CMM, já que o termo se origina de tecido estranho de um espécime prévio que flutuava em uma água de banho e acabou em outro espécime durante o processamento da secção permanente em parafina.21 Na CMM é mais apropriada a referência como tecido tumoral deslocado, embora, ainda que impreciso, o termo flutuador faça parte do linguajar comum. Estes fragmentos de tumor frequentemente se manifestam como tecido tumoral completamente separado e fisicamente removido do espécime primário na lâmina. Ocasionalmente, fragmentos do tumor podem vir a repousar sobre o próprio espécime. Isto pode ocorrer em dois cenários: o fragmento do tumor repousa sobre o espécime do tecido ou o fragmento repousa em uma abertura ou defeito no espécime. Quando se deposita no alto da secção, ele pode ser facilmente identificado como um flutuador, porque o tecido tumoral estará em um plano diferente da secção do tecido e não estará no foco do microscópio quando o verdadeiro espécime estiver no foco. Quando o fragmento tumoral se deposita em um defeito na secção do tecido, a identificação como um falso-positivo pode ser mais desafiadora e poderá depender do julgamento do cirurgião de que o fragmento de tumor não corresponde ao tecido circundante arquitetonicamente. Além do mais, um fragmento de tumor pode se alojar na margem profunda de um espécime dividido (uFig. 1.13). Isto pode causar uma interpretação falso-positiva de uma

margem profunda se não for reconhecido como um flutuador. Com frequência, esses fragmentos de tumor podem ser diferenciados de um verdadeiro-positivo pelo fato de o tumor deslocado frequentemente estar completamente rodeado por tinta, demarcando o tecido, e também pode não ser arquitetonicamente consistente com a margem profunda verdadeira próxima do espécime. Quando existe dúvida, o cirurgião deve recorrer a tecido adicional para confirmar se as margens estão livres de tumor, já que a cura oncológica é o fator motivador mais importante para realizar CMM.
Ainda que garantir a remoção completa da malignidade seja um objetivo primário da CMM, a conservação do tecido também é um elemento crítico do procedimento. Uma forma de ser idealmente conservador é ter conhecimento da aparência histológica de todas as estruturas normais da pele que podem ocorrer em diferentes áreas anatômicas, bem como dos tumores benignos desta pele que podem estar incidentalmente presentes durante a histologia de Mohs. Não se deve tomar o caminho inapropriado de remover cirurgicamente qualquer anormalidade observada na pele em razão de uma inabilidade de distinguir entre neoplasias benignas e malignas.22
As estruturas na pele que podem mimetizar malignidade incluem:
Glândulas salivares: Durante a realização de cirurgia no lábio ou na face, especialmente na área imediatamente anterior e inferior da orelha, glândulas salivares podem estar presentes nos espécimes de Mohs. Essas estruturas podem ser diferenciadas de CBC por seu epitélio bem organizado de células epiteliais cuboides e colunares serosas (escuras) e mucosas (esponjosas e cor de rosa) com ductos.
Folículos pilosos e glândulas sebáceas: Em algumas secções, particularmente secções que tangencialmente vislumbram uma borda de um folículo piloso ou glândula sebácea, os folículos pilosos e as glândulas sebáceas podem estar relacionados com a malignidade. Isto pode, em geral, ser resolvido pelo exame das secções mais profundas de
um bloco de tecido para ver a área de preocupação evoluir para um folículo ou glândula normal.
Epitélio conjuntivo: O epitélio conjuntivo é um epitélio escamoso estratificado não queratinizado com células caliciformes. Ele pode ser um desafio para processar e é vulnerável ao lay-down (achatamento) marginal incompleto durante o a macroscopia. Além disso, é preciso ter cuidado para evitar confundir células caliciformes com células pagetoides, particularmente quando está sendo realizada Mohs para carcinoma sebáceo da pálpebra. Epitélio de transição na uretra pode apresentar dificuldade similar.
Proliferação folicular basaloide (proliferação folicular benigna ou hamartoma folicular benigno): Ninhos de células basaloides interconectadas semelhantes a CBC infundibulocístico, mas essa neoplasia benigna exibe um estroma perifolicular normal versus estroma mixoide do CBC, bem como uma citologia de aparência mais normal.23
Neoplasias anexiais benignas: As neoplasias anexiais benignas comumente encontradas que podem ser confundidas com malignidade incluem tricoepitelioma, tricoblastoma, tumor do infundíbulo folicular, siringoma etc.23
Calcificação cutânea (Cutis calcinosis): A calcificação geralmente via aparecer como um flutuador claramente identificado; no entanto, pequenos depósitos de cálcio podem se assemelhar a CBC ou lâminas de CEC.
Ao fazer a interpretação histológica de espécimes de tecido na CMM, o cirurgião deve ter cuidado para não negligenciar outras malignidades que podem ser encontradas nos espécimes. Não é incomum encontrar uma nova malignidade incidental durante o tratamento de um paciente. Por exemplo, pode-se encontrar um CBC incidental durante o uso de CMM para tratar um sSCC e vice-versa. É apropriado reconhecer e tratar este tumor adicional durante o mesmo encontro com o paciente para CMM. Além disso, tumores próximos e clinicamente evidentes que podem ser incluídos em uma reconstrução potencial, como um retalho, também devem ser tratados.
Por fim, é ideal que o cirurgião de Mohs examine os espécimes de tecido não só quanto à presença ou ausência de malignidade, mas também quanto à presença de fatores que podem contribuir para os cuidados ao paciente, como encontrar e documentar características que podem alterar o estágio do CEC de um paciente de T2a para um estágio T2b, segundo a classificação do Brigham and Women’s Hospital (BWH), e documentar a presença de infiltração linfocítica consistente com doença linfoproliferativa, como LLC, e iniciar exames diagnósticos se estas características forem identificadas.25
CMM é efetiva porque o cirurgião e o patologista são a mesma pessoa. Conforme discutido anteriormente, como o cirurgião está completamente ciente da orientação de um espécime do tecido quando ele é removido do paciente, tem controle de todos os processos laboratoriais entre a excisão e a interpretação histológica, e faz a interpretação histológica, o cirurgião é capaz de identificar com precisão
a localização exata de alguma malignidade residual no paciente e fazer a reexcisão de forma seletiva. O mapeamento histológico é a ferramenta que permite a documentação da malignidade residual em relação à anatomia do paciente e as marcas de orientação que o cirurgião colocou no paciente e no espécime.
A maioria dos cirurgiões emprega uma variedade de meios para mapeamento dos tumores que variam desde desenhos simples do espécime e marcas de orientação em mapas pré-desenhados, mostrando o espécime excisado e as marcas de orientação em relação a um desenho anatômico padronizado, até fotografias intraoperatórias do paciente com as marcas de orientação e o mapeamento sobrepostos fisicamente com desenhos à mão, ou digitalmente, com um software de edição de fotos.26 Alguns utilizam, adicionalmente, um sistema de numeração anatômica padronizado para localizar tumores em sítios muito específicos.27 Esta técnica pode ser útil na condução de pesquisa retrospectiva, onde a localização anatômica precisa do tumor é essencial. Independentemente do verdadeiro mapa usado, o processo de transferência das informações que o cirurgião observa nos espécimes histológicos para o mapa é semelhante. Primeiro, para garantia de qualidade, o cirurgião deve confirmar que o mapa e o espécime histológico correspondem ao mesmo local no mesmo paciente. Isto é comumente obtido pela utilização de números de registro ou outra informação de identificação única que está presente tanto no mapa quanto nas lâminas do microscópio. Isto ainda pode ser confirmado pelo cirurgião pelo exame do tamanho bruto do espécime histológico e a aparência histológica do espécime para confirmar que este e o mapa possuem correspondência. Por exemplo, quando o mapa de um tumor grande acompanhado por lâminas com um espécime pequeno não combina, isso deve servir como um sinal para o cirurgião explorar a possibilidade de um erro no laboratório. Como outro exemplo, a aparência histológica do couro cabeludo, da pele do nariz, da pálpebra, do dorso etc., é um tanto peculiar, assim o cirurgião também deve se preocupar com a transferência de um tecido ou erro no laboratório se o mapa de uma área anatômica for acompanhado por lâminas que são evidentemente de outra área anatômica no exame histológico. Finalmente, o cirurgião examinará a coloração do espécime e a colocação de marcas assimétricas para se assegurar que a coloração e a orientação do tecido e a ilustração da coloração e da orientação do espécime no mapa combinam, e que o espécime do tecido não foi, por exemplo, rodado 180 graus em relação à sua orientação anatômica original. Este passo é importante para evitar mapear o tumor inadvertidamente no lado errado do espécime, desta forma levando à excisão desnecessária de pele normal e, pior ainda, à não excisão do tecido maligno residual.
Depois de feitas essas verificações de qualidade, o cirurgião prossegue com a interpretação histológica do espécime. Durante este estágio, uma das questões mais óbvias que pode levar a uma recorrência depois da CMM é a falha em reconhecer tumor na margem do espécime. O risco para isso é maior em casos de tumores incomuns ou particularmente insidiosos, em que o reconhecimento do tumor na
sua periferia, onde as evidências histológicas de tumor residual podem ser sutis, pode ser desafiador. Além disso, há erros que podem ser cometidos no mapeamento de tumor residual que podem explicar as recorrências de tumores. O mapeamento impreciso pode levar a uma reexcisão seletiva do sítio incorreto, ou à reexcisão de uma largura ou profundidade inadequada do sítio correto. A reexcisão seletiva do sítio incorreto é particularmente desafiadora, porque o resultado será uma margem histologicamente livre de tumor na camada subsequente e a falsa garantia de que o tumor foi tratado de modo adequado.
Ao mapear um tumor, é importante que o cirurgião tenha em mente que o tumor que está sendo mapeado é uma figura tridimensional (3D) com uma borda, uma parede, um “ponto de articulação”, onde a parede faz transição para a base e uma margem profunda. Com frequência há evidências histológicas que auxiliam o cirurgião a identificar tumor na parede de um espécime e tumor no ponto de articulação ou na base. A forma mais óbvia desta evidência ocorre na forma de folículos pilosos, que são verticalmente seccionados na parede e, horizontalmente, na base. A atenção cuidadosa com a localização tridimensional precisa do tumor residual ao mapear é muito importante. Isso vale, particularmente, para tumores residuais que residem no ponto de articulação, onde uma nova amostra sem se entender através da articulação até a margem profunda produzirá uma margem falso-negativa em um estágio subsequente. O mapeamento tumoral adequado deve incluir o tipo e o subtipo do tumor, e sua profundidade anatômica. O registro do tecido cicatricial, quando observada, é uma exigência de impostos federais (EUA) pode auxiliar o cirurgião na solução, se a verdadeira margem profunda ou lateral foi atingida e histologicamente avaliada em um tumor recorrente ou incompletamente excisado. O cirurgião também pode indicar anormalidades histológicas que não são malignidades para documentar que elas foram observadas e não consideradas como margem positiva. Tais estruturas podem incluir neoplasias anexiais benignas, folículos pilosos ou glândulas sebáceas que não parecem absolutamente nevo melanocítico intradérmico típico, e ceratoses seborreicas. A indicação de ceratoses actínicas pode ser útil uma vez que o cirurgião tenha anotado no registro médico a presença de dano actínico em segundo plano que não requeria excisão pela técnica de Mohs, mas que podria exigir tratamento superficial posterior, e também para evitar confusão com um tumor recorrente posteriormente. A indicação de estruturas normais que estavam envolvidas pelo tumor também é útil, como quando os canalículos lacrimais, as glândulas parótidas ou outras glândulas salivares, ou outras estruturas normais estão envolvidos na excisão de Mohs. Saber que os canalículos lacrimais foram danificados, por exemplo, é importante se desejamos tentar recuperar cirurgicamente a função desta estrutura. Em nossa prática indicamos essas estruturas não malignas em uma cor diferente do vermelho que usamos para indicar a presença de malignidade a fim de evitar confusão sobre se uma área requer reexcisão seletiva ou não. As cartilagens, que podem ser vistas em camadas da orelha ou no nariz, também podem ser ilustradas no mapa
para mostrar os lados da cartilagem onde um tumor pode estar presente.
O mapa histológico é uma ferramenta para auxiliar o cirurgião na localização precisa do sítio no paciente envolvido por tumor residual. Quanto mais precisamente esse tumor e estruturas não malignas forem identificados, maior a probabilidade do cirurgião obter uma cura para o paciente. Além do mais, o mapa é uma parte importante do registro médico, ilustrando as observações que o cirurgião faz de forma histológica, e a tomada de decisão referente às estruturas que vão exigir reexcisão, porque foram determinadas como malignas, e aquelas que foram deixadas para trás porque foram determinadas como benignas ou mais apropriadamente tratadas por outros meios, como no caso de ceratose actínica. Um cirurgião pode querer fazer comentários por escrito sobre o mapa, bem como acrescentar clareza às decisões que são tomadas com base na histologia, e para guiar a reexcisão seletiva de tumor residual, como o tumor presente nos cortes de tecido profundo examinados que podem esclarecer quanto aos verdadeiros cortes na margem cirúrgica.
Nicholas
Golda ▪ George Hruza
A taxa de recorrência aumenta na CMM, requerendo múltiplos estágios para a remoção completa de uma malignidade.18 A justificativa por trás disso é variada. Tumores que requerem múltiplos estágios são mais prováveis de serem mais agressivos, biologicamente; a habilidade do cirurgião em se reorientar pode diminuir com camadas adicionais e há mais oportunidades para um erro, como o mapeamento impreciso ou reamostragem marginal imprecisa.
No que diz respeito a camadas subsequentes, à medida que aumenta o número de camadas subsequentes para tratar um tumor particular, a habilidade do cirurgião de Mohs em manter a resolução precisa de onde o próximo estágio precisa ser executado se torna mais desafiadora. Ser intencional no planejamento e execução de camadas subsequentes é importante. Embora o cirurgião deva tentar remover completamente todo o tumor residual a cada camada subsequente, o objetivo também continua a ser conservador. Portanto, o cirurgião também deve fazer a excisão da camada subsequente de modo que permita a fácil reorientação para o sítio, caso ainda seja necessário outro estágio.
Quando da preparação para realização de uma camada subsequente, deve ser reservado um momento para se reorientar para o mapa histológico e para o paciente. O cirurgião deve confirmar se estão presentes os mapas corretos para o paciente correto. Deve ser prestada atenção à localização dos pontos de referência anatômicos e as marcas de orientação, com a confirmação de que eles correspondem ao que está presente no mapa.
Depois que isso estiver confirmado, o cirurgião prossegue com a excisão da camada subsequente e pode querer empregar uma técnica conhecida como “flanqueamento”, onde uma pequena quantidade de tecido em cada dimensão em torno do tumor (ambos os lados e profundamente) é incluída com a
reexcisão seletiva. Esta pequena quantidade de tecido adicional é, em geral, inconsequente para o cirurgião se a localização do tumor residual não for exata ou se as bordas do tecido nas pontas estiverem incompletamente estendidas durante o processamento do tecido. Essa técnica também auxilia em situações em que o tumor residual está perto do ponto de articulação, pois uma pequena borda da margem profunda pode ser incluída na camada para fornecer evidências histológicas de que a profundidade adequada foi reexcisada para comprovar as margens negativas (uVídeo 1.6, uVídeo 1.7).
A extensão da camada subsequente pode ser indicada no paciente de várias maneiras. A mais comum delas é a colocação de marca de tecido na pele em cada lado de uma reexcisão seletiva, onde a curvatura das bordas desaparece no contorno arredondado do estágio arredondado original da CMM. Deve-se tomar cuidado para terminar estas camadas nas marcas preexistentes ou, de algum modo, deixar essas marcas discerníveis daquelas já posicionadas conforme as camadas anteriores ou, então, alguns cirurgiões podem optar pelo uso do quadrado em camadas subsequentes em seus pontos terminais, enquanto outros ainda usarão formas geométricas únicas para camadas subsequentes para reduzir confusão potencial sobre a localização de uma camada subsequente. Pode haver discussão sobre qual destas técnicas é superior, no entanto, o fator mais importante deve ser qual técnica permite ao cirurgião, de modo consistente, a maior confiança na reorientação acurada, caso ainda outra camada seja necessária.
Assim como nas primeiras camadas, os cirurgiões também podem querer colocar marcas de orientação no tecido ou marcas nas camadas subsequentes. Os benefícios e as desvantagens das marcas no tecido para os primeiros estágios persistem em estágios subsequentes, portanto, o cirurgião deve determinar o que é melhor para a situação clínica em questão. Muitos cirurgiões optam por colocar marcas em pontos intermediários nas camadas subsequentes para aumentar a resolução da localização do tumor residual. Além disso, se um cirurgião determina que mais um espécime distinto de tecido deve ser excisado durante uma única camada subsequente, estes espécimes podem ser diferenciados um do outro pela colocação de uma marca no ponto intermediário em um espécime e nenhuma marca no outro. Deve ser dada atenção especial à coloração de múltiplos espécimes de tecido em uma camada que podem ser colocados em uma lâmina histológica (um bloco) ou em lâminas separadas (blocos separados do mesmo estágio).
Quando Malignidade Está Presente apenas no Plano Profundo
Algumas vezes o cirurgião pode precisar reexcisar o tumor residual que está presente apenas na margem profunda do espécime. Há várias abordagens para manter a orientação do tecido quando o tecido profundo mais frágil, consistindo frequentemente de gordura e, possivelmente, músculo, requer reexcisão. O desafio que emerge de espécimes apenas da margem profunda é manter a orientação do tecido de tal modo que algum tumor residual que persiste na cama-
da subsequente apenas no tecido profundo possa ser acuradamente mapeado e adequadamente reexcisado. Como as camadas apenas no tecido profundo não possuem um componente dérmico na maioria dos casos, a orientação tradicional utilizando marcas ou marcações dérmicas não é possível. A seguir apresentamos algumas técnicas que foram descritas para abordar esta questão:
Técnica de marcação dérmica: Nesta técnica, o tecido profundo necessário é removido, bem como uma fina margem da derme próxima. A localização desta marcação é feita por uma marca do tecido. Quando o processamento do tecido está feito, a derme é estendida conforme o processamento do tecido de Mohs normal e algum tumor residual na margem profunda pode ser mapeado com o uso desta marca dérmica como ponto de referência (uVídeo 1.8).
Técnica do losango ou “selo postal”: Esta técnica é mais adequada para tumores grandes em que há um grande campo de tecido profundo, e o cirurgião precisa usar a técnica de grade descrita anteriormente para localizar, de forma acurada, o tumor residual em uma margem profunda. Depois de identificada(s) a(s) zona(s) na grade apropriada(s) que requer(em) reexcisão, o cirurgião realiza a excisão da totalidade desse polígono de tecido envolvido e colore o lado plano com diferentes cores para correspondência com o mapa. Isto permite a localização precisa de algum tumor profundo residual relativo às margens unicamente coloridas (uVídeo 1.9, uVídeo 1.10).
Reamostragem profunda total: Se uma lesão menor tiver envolvimento de alguma parte da margem profunda, o cirurgião pode determinar se é mais apropriado fazer reamostragem da totalidade da margem profunda para garantir que a margem esteja completamente amostrada e reverificada quanto à malignidade residual. A orientação, nestes casos, pode ser obtida com a colocação de marcas na reexcsião apenas do tecido profundo, que corresponde às marcas do tecido originais colocados para a camada precedente. Estas marcas podem, então, ser coloridas e localizadas durante a análise histológica, permitindo o mapeamento preciso da malignidade residual, se presente. A retirada da profundidade total do estágio anterior também pode ser útil na reconstrução (como a remoção do excesso de tecido no nariz ou nas costas para reparo primário) ou mesmo mudar o plano de reconstrução (como retirar uma camada mais profunda na asa nasal que necessita de um retalho, ou mesmo uma reconstrução em múltiplos estágios em oposição a um enxerto cutâneo de espessura total).
Grampos para orientação do tecido: A colocação de grampos dentro do defeito nas bordas do espécime excisado ajuda a localizar a área que está sendo excisada, e a colocação de grampos correspondentes no espécime ajuda a orientar o espécime em relação ao defeito. O número de grampos no defeito deve ser contado para assegurar que nenhum grampo seja deixado para trás na conclusão do caso.
Independentemente da técnica usada, o elemento fundamental das camadas apenas profundas é o mesmo que para todas as camadas subsequentes: a remoção completa da malignidade. Frequentemente a reexcisão de tecido profundo adicional não é impactante do ponto de vista reconstrutivo ou funcional, portanto, a reamostragem da zona que foi determinada como tendo malignidade residual, bem como um flanco de tecido adicional em torno desta zona, é apropriada para garantir o reexame completo da margem e reduzir o risco de uma camada de CMM falso-negativa. O uVídeo 1.11 ilustra o processo de execução de um estágio inicial e também o mapeamento e a remoção de um estágio subsequente.
Nicholas Golda ▪ George Hruza
Há situações anatômicas em que as técnicas anteriormente descritas para excisão, processamento e mapeamento do tecido não se aplicam ou não é necessária atenção especial ao tecido difícil de processar ou aos aspectos tridimensionais do tecido excisado. Estes se apresentam, mais frequentemente, na forma de defeitos de ponta a ponta das áreas anatomicamente mais complexas da face, como as orelhas, o nariz, os lábios e as pálpebras.
Primeiramente, em um defeito de ponta a ponta, a orientação tradicional de “profundo” e “superficial” é perdida, pois há epiderme, mucosa ou conjuntiva que requerem análise na circunferência inteira do tecido que está sendo processado. Além disso, a parte “profunda” destas excisões reside no centro entre estas duas camadas epiteliais, e pode conter tecido como cartilagem ou placa tarsal. Se o cirurgião determinar que é plausível fazer isso, as camadas subsequentes nestes contextos devem ser excisadas de um modo que facilite o processamento do tecido. É óbvio, naturalmente, que quanto mais fácil for processar uma peça de tecido, com a representação completa de todas as margens epiteliais e profundas intactas, mais fácil será interpretar, identificar acuradamente e mapear o tumor residual. Os espécimes que são mais difíceis de processar resultarão em interpretações mais desafiadoras e na maior possiblidade de tratamento incompleto ou estágios adicionais de CMM desnecessários. A melhor abordagem para facilitar o processamento histológico é executar os estágios de CMM que requerem ressecções de ponta a ponta no mesmo nível ou na mesma profundidade internamente versus externamente, de forma que o espécime possa, essencialmente, ser colocado plano numa lâmina de microscópio, com as camadas epiteliais e a margem profunda em completo contato com a lâmina imediatamente após a excisão do paciente e alguma divisão do espécime que possa ser necessária.
Um desafio adicional nestas situações são a orientação e o mapeamento acurados do tecido. Isto é especialmente verdadeiro para estágios de Mohs no estilo em cunha na orelha, onde a pele de ambos os lados da cartilagem auricular é semelhante na aparência histológica (diferente da pálpebra, nariz e lábio, onde o tecido difere histológica, interna e externamente). Casos como estes requerem comu-
nicação excelente entre o cirurgião e a equipe do laboratório, o mapeamento cuidadoso e a colocação ponderada das marcas de orientação.
Thomas Hocker
O objetivo principal da CMM em qualquer localização é a extirpação completa do tumor; assim sendo, algumas vezes é necessário sacrificar, cosmética ou funcionalmente, estruturas anatômicas importantes. No entanto, é importante conhecer os aspectos anatômicos peculiares que existem nestes “sítios especiais” para que possa ser evitada morbidade desnecessária. Uma discussão minuciosa da anatomia complexa desses sítios já foi descrita de forma eloquente em outro lugar, e não será foco da nossa discussão. Em vez disso, tentaremos destacar algumas pérolas e dificuldades cirúrgicas práticas.
A anatomia da pálpebra é, talvez, a mais complexa de todos os sítios que os cirurgiões de Mohs operam (uFig. 1.14, uFig. 1.15). Para uma discussão completa da anatomia relevante, recomendamos o excelente artigo de revisão de Patel e Itani.28
A pele da pálpebra é a mais fina de todo o corpo (< 1 mm), essencialmente sem gordura subcutânea entre ela e o músculo orbicular do olho subjacente.
A pálpebra é dividida, basicamente, em lamela anterior e posterior; embora usualmente não seja discutida como tal, também existe uma “lamela intermediária” em partes da pálpebra (uFig. 1.14):
• Lamela anterior: pele e músculo orbicular do olho. ♦ O orbicular do olho é um músculo da expressão facial ® por isso é inervado por ramos do nervo facial (nervo craniano [NC] 7). O músculo orbicular do olho é um músculo semelhante a um esfíncter dividido em duas subunidades concêntricas principais. (1) Orbital – o anel muscular mais externo, sob controle voluntário, e responsável pelo fechamento forçado da pálpebra; a pele sobrejacente é facilmente descolada acima do músculo, permitindo grande mobilidade. (2) Palpebral – anel muscular interno, sob controle voluntário e involuntário, responsável por piscar e pestanejar, e contíguo ao tendão do canto lateral (prende-se lateralmente ao tubérculo de Whitnall) e ao tendão do canto medial (TCM; uma estrutura bifurcada que envolve os canalículos lacrimais na porção medial da órbita). O orbicular das pálpebras é subdividido em uma porção pré-septal periférica e
uma pré-tarsal central. Orbicular pré-septal: a pele é frouxamente presa e móvel; no fundo desta camada encontra-se a “lamela intermediária”, que consiste no septo orbital, almofadas de gordura orbital e músculos retratores/aponeuroses das pálpebras (elevador da pálpebra superior e músculo de Muller superiormente, e fáscia capsulopalpebral inferiormente). Orbicular pré-tarsal: a pele sobrejacente é firmemente aderente à lamela posterior.
• “Lamela intermediária”: no fundo da porção pré-septal do músculo orbicular do olho encontram-se (na ordem de superficial a profundo) o septo orbital, as almofadas de gordura orbital e os retratores da pálpebra (elevador da pálpebra superior, músculo de Muller, músculo tarsal inferior e fáscia capsulopalpebral):
♦ Elevador da pálpebra superior: o principal elevador da pálpebra, inervado pelo nervo oculomotor (NC3), conectado à placa tarsal via sua aponeurose, e está comprometido na síndrome de Horner (miose, pstose e anidrose).
♦ Inervação simpática: músculo de Muller e músculo tarsal inferior.
♦ Pérola: se uma laceração na porção pré-septal da pálpebra resultar em uma grande quantidade de gordura herniada, então você saberá que o septo orbital foi comprometido.
• Lamela posterior: conjuntiva e placa tarsal:
♦ Placa tarsal: tecido fibroso compreende o suporte estrutural da pálpebra e abriga as glândulas meibomianas ® fornece secreções oleosas que impedem a evaporação da lágrima.
Os canalículos lacrimais estão localizados no fundo da asa superficial do TCM:
• O sistema de drenagem lacrimal é protegido anteriormente pelo TCM.
A glândula lacrimal está localizada no aspecto superolateral da pálpebra superior.
O suprimento vascular da pálpebra é extremamente rico!
• Existem inúmeras anastomoses entre os ramos dos sistemas da carótida interna e externa:
♦ Particularmente no TCM, os ramos da artéria facial (carótida externa) fazem anastomose com a artéria oftálmica (carótida interna).
• Pérola: o rico suprimento vascular da pálpebra representa excelente leito da ferida para enxertos de pele; os retalhos também são bem vascularizados e robustos nesta localização.
Drenagem linfática (importante para a compreensão de doença metastática regional):
• Dois terços laterais da pálpebra superior e um terço lateral da pálpebra inferior ® nódulos pré-auriculares.
• Um terço medial da pálpebra superior e dois terços mediais da inferior ® nódulos submandibulares.
Preparado de clorexidina é contraindicado próximo aos olhos devido ao risco de queratite; povidona iodada é recomendada. 18
“ROOF” (gordura ocular retro-orbicular)
Músculo orbicular orbital do olho
Músculo orbicular pré-septal do olho
Ligamento de Whitnall
Septo orbital
Aponeurose do elevador
Músculo de Müller
Músculo orbicular pré-tarsal do olho
Tarsal superior
Tarsal inferior
Pálpebra inferior equivalente ao músculo de Müller
Septo orbital
Gordura orbital
Retratores da pálpebra inferior (fáscia capsulopalpebral)
Ligamento de Lock wood
Arco marginal
Músculo orbicular
“SOOF” (gordura ocular suborbicular)
Margem orbital superior
Arco marginal
Gordura préaponeurótica
Ligamento suspensor do fórnice superior
Músculo elevador
Músculo reto superior
Músculo reto lateral
Músculo reto inferior
Músculo oblíquo inferior

Septo orbital
Glândula lacrimal, parte orbital
Glândula lacrimal, parte palpebral
Pálpebra superior
Pálpebra inferior

infraorbital
Elevador da pálpebra superior
Carúncula lacrimal
Carúncula lacrimal superior e inferior
Ligamento palpebral medial
Saco lacrimal
Puncta superior e inferior
Ducto nasolacrimal
Fig. 1.15 Anatomia básica da pálpebra: visualização frontal. Reproduzida de Schuenke M, Schulte E, Schumacher U. THIEME Atlas of Anatomy: Head, Neck, and Neuroanatomy. Ilustrações de Voll M and Wesker K. © Thieme 2020.
Grampos de calázio auxiliam na hemostase e facilitam as excisões de Mohs (especialmente da margem da pálpebra).
Protetores oculares: o uso durante CMM é controverso:
• Benefício questionável para cirurgia periocular.
♦ Usados por até 75% dos cirurgiões de Mohs, mas usado de forma consistente somente 10% do tempo por aqueles que usam.29
♦ Aproximadamente um terço dos cirurgiões de Mohs tiveram, em algum momento, um paciente que experimentou abrasões na córnea em razão do uso de protetor ocular; usualmente se autorresolve em 2 a 3 dias com medidas conservadoras para alívio da dor ± antibióticos tópicos (pomada de eritromicina ou quinolonas em gotas).
• Protetores oculares plásticos (polimentil-metacrilato) são recomendados em vez de protetores de aço inox para todos os procedimentos sem laser;30 não podem ser usados em procedimentos com laser devido ao risco de dano à córnea por indução térmica:
♦ Risco menor de bordas e brocas afiadas que o aço inox ® risco reduzido de abrasão na córnea.
♦ Menor probabilidade de conduzir energia das unidades eletrocirúrgicas.
♦ Mais baratos.
• É preciso assegurar que os protetores estão colocados adequadamente e que têm uma superfície lisa, intacta ® caso contrário, risco de abrasão na córnea.
• Técnica:
♦ Aplique proparacaína topicamente para anestesiar o olho.
♦ Inspecione o protetor ocular quanto a arranhões, bordas afiadas ou resíduos.
♦ Aplique lubrificante (lubrificantes à base de metilcelulose são preferíveis em vez de Lacri-Lube ou pomadas antibióticas).
♦ Insira o escudo ocular: (1) Diga ao paciente para olhar para cima e então retraia a pálpebra inferior. (2) Insira a borda inferior do escudo ocular na pálpebra inferior, descendo até o fórnix. (3) Diga ao paciente para
olhar para baixo e retraia a pálpebra superior (a borda superior do escudo ocular vai encaixar no lugar).
A distorção do tecido pode se tornar problemática com altos volumes de anestesia local ® utilize a mínima quantidade necessária de anestésico.
Rompimento do septo orbital ® risco de hematoma retrobulbar.
É fundamental ter um assistente para puxar e esticar a pele durante a excisão de Mohs, já que a pele periocular é fina e frouxa. Uma maneira de fazer isso na margem da pálpebra é pedir que o assistente mantenha a tração com um fórceps, gentil, mas firmemente, enquanto o cirurgião usa outro fórceps para prender o outro lado enquanto executa uma camada. Os editores preferem prender a margem da pálpebra com o fórceps primeiro, em vez do assistente, pois é um passo crítico com risco de causar lesão, e, posteriormente, permitem que o assistente assuma o comando do fórceps e mantenha a tensão.
A utilização de uma lâmina nº 11 ou lâmina 15 c é útil para incisões nas porções frouxas da pálpebra (pele que recobre a porção orbital do orbicular do olho):
• Estas lâminas mais afiadas também são úteis ao longo da margem livre da pálpebra, que é uma área onde é difícil obter grande tensão de lado a lado pelo seu assistente.
As camadas de Mohs na pálpebra frequentemente não precisam ser anguladas a 45 graus, já que a pele é muito relaxada. Mesmo excisões verticais de Mohs geralmente podem ser assentadas com facilidade. A margem da pálpebra frequentemente é relaxada com pequenas incisões verticais na porção superficial devido à espessura do tecido sebáceo.
Dada a natureza fina e frouxa da pele da pálpebra, geralmente é mais difícil executar estágios de Mohs estreitos subsequentes comparados com outros sítios com pele mais espessa. Incisões verticais com utilização de uma lâmina nº 11 ou lâmina 15 c são úteis neste sentido.
Para assegurar lâminas de Mohs de alta qualidade, é necessária atenção extra ao colorir e estender camadas de Mohs na pele da pálpebra.
• Pele frouxa e redundante pode levar a artefato dobrado.
• A margem da pálpebra e as camadas conjuntivas podem ser confusas de difíceis de posicionar (lay-down) para seu técnico em histologia, já que a conjuntiva pode ser confundida com a epiderme ausente ® é útil trazê-lo para a sala durante a camada de Mohs para lhe mostrar, in vivo, a orientação da margem verdadeira.
• Nota do editor: neste aspecto, quando uma camada precisa ser executada na conjuntiva bulbar, também é importante se assegurar de que as bordas não estejam dobradas, já que este tecido é extremamente fino. Geralmente cirurgiões de Mohs experientes, confortáveis com as camadas da pálpebra, podem continuar a executar camadas da margem da pálpebra até a conjuntiva palpebral e bulbar, se necessário. No entanto, é preciso conhecer e revisar as nuances peculiares da histologia da secção congelada da conjuntiva. De forma prática, executar uma camada da conjuntiva, uma vez sobre a esclera, permite uma chance de avaliação da margem, se o técnico em histologia e o cirurgião forem capazes de orientar adequadamente e incorporar o tecido para avaliação. Se for observada positividade depois que o limbo for abordado, outras opções terapêuticas serão consideradas por um cirurgião de córnea, como excisão com crioterapia, radioterapia na placa ou exenteração orbital.
É importante mencionar que depois que as camadas da conjuntiva palpebral estiverem esgotadas e o tumor se estender sobre a conjuntiva bulbar, uma cirurgia adicional pode levar a dano severo ao olho e até mesmo a perda de um olho. Portanto, se houver suspeita de um tumor grave, todos os possíveis riscos, tratamentos e resultados alternativos e resultados, incluindo exenteração, devem ser discutidos em detalhes com o paciente antes da cirurgia para a obtenção de consentimento informado, e essa cirurgia deve ser realizada por ou em associação a um cirurgião de córnea ou oculoplástico.
Na experiência do Dr. Tolkachjov, a execução dessas camadas em um contexto multidisciplinar e juntamente com um cirurgião de córnea e anestesia seria o ideal, se um cirurgião de Mohs tiver acesso a um hospital “de olhos” ou puder supervisionar e orientar um cirurgião de córnea (com a ajuda de um microscópio intraoperatório), fazendo as incisões e usando dissecção com tesouras rombas e afiadas, enquanto mantém a conjuntiva esticada para remover o tecido da conjuntiva do limbo sobre o canto se houver suspeita de envolvimento tumoral. Clinicamente, CEC (neoplasia intraepitelial da conjuntiva ou neoplasia escamosa da superfície ocular) se espalhando sobre a conjuntiva pode simular um pterígio ou uma pinguécula, um espessamento elevado e amarelado da conjuntiva bulbar na esclera, próximo à borda da córnea. Embora pinguéculas não sejam cancerosas, alterações rápidas ou crescimento excessivo severo podem sinalizar possível formação de CEC.
Histopatologia de secção congelada:
• O excesso de tinta pode obscurecer as verdadeiras margens da borda cutânea e prejudicar o assentamento preciso do tecido ® o depósito cuidadoso do espécime
sobre o pedaço de um papelão e a aplicação de apenas quantidades localizadas de tinta no tecido ajuda a minimizar este problema. Como discutido anteriormente, artefato dobrado é comum se o tecido não for apropriadamente estendido antes do seccionamento.
• O tecido da conjuntiva tem aspecto histologicamente diferente da pele. A mucosa conjuntival tem uma camada de epitélio muito fina e, usualmente, um infiltrado em faixa linfoplasmocitário subjacente na derme superficial.
• É necessária uma familiaridade com a histopatologia da conjuntiva, especialmente na transição de conjuntiva palpebral para conjuntiva bulbar, pois a vasculatura e as glândulas da conjuntiva bulbar podem, frequentemente, se assemelhar a CEC glandular.
O lábio é uma estrutura anatômica altamente móvel e muito simples que compreende um músculo esfincteriano (orbicular da boca), pele labial cutânea contendo pelos e mucosa.
Similar ao orbicular do olho, o músculo orbicular da boca é um músculo esfincteriano da expressão facial que é inervado por NC7.
• Entretanto, o orbicular da boca não possui fixações ósseas ® o lábio tem maior laxismo/mobilidade ® mais fácil de reorganizar o tecido durante a reconstrução.
• Como a pálpebra, as fibras do músculo orbicular da boca se fixam diretamente à pele e à mucosa sobrejacente, essencialmente sem gordura subcutânea interveniente.
O suprimento vascular é extenso:
• Anastomose das arcadas fornecida pelas artérias labiais, que penetram profundamente no músculo orbicular da boca.
Inervação motora do lábio:
• O orbicular da boca é inervado pelo ramo bucal de NC7.
• Os depressores do lábio são inervados pelo ramo mandibular marginal de NC7:
♦ A principal área de perigo é onde o nervo se estende sobre a mandíbula 31 Geralmente ocorre 3 cm anterior à tuberosidade massetérica (aproximadamente um quarto da distância entre a tuberosidade massetérica e a linha média mental; uFig. 1.16).
Inervação sensorial do lábio:
O lábio superior é inervado pelo nervo infraorbital (ramo de V2).
O lábio inferior e o mento são inervados pelo nervo mentual (ramo de V3).
Pérolas de Mohs
Bloqueios nervosos do nervo infraorbital (lábio superior) e nervo mentual (lábio inferior) são altamente eficazes e podem minimizar a distorção no tecido relacionada com o anestésico.
A borda do vermelhão se torna esbranquiçada e distorcida depois da injeção de anestesia local:
Ar téria facial Linha média mentual Nervo mandibular marginal
Glândula parótida Tuberosidade massetérica
• Antes da injeção de anestesia, marque a borda do vermelhão com um marcador cutâneo, embora ela seja facilmente vista antes da distorção com anestésico local.
• Durante sua camada de Mohs inicial, faça marcas de orientação superficiais com o bisturi ao longo da borda vermelha, pois o marcador cutâneo frequentemente se apaga durante o curso do dia.
Além da borda avermelhada, a localização dos sulcos nasogenianos e o triângulo apical são pontos de referência importantes nas abordagens reconstrutivas. Use uma caneta marcador para delinear estes pontos de referência antes de distorcer o tecido com anestesia local.
O lábio é uma margem livre e, assim, pode ser difícil de estabilizar durante a excisão de Mohs. Recomendamos os seguintes métodos para alcançar a tensão e a estabilização adequadas durante a excisão:
• Diga ao paciente: “Por favor, não fale durante esta parte; você não vai querer que eu tenha um alvo em movimento!”
• Tensão padrão na superfície lateral em quatro pontos frequentemente funciona bem para o lábio cutâneo.
• Se for necessária tensão maior ou se você estiver operando mais perto da borda do vermelhão, os métodos a seguir são úteis:
♦ Coloque gaze enrolada dentro da boca, entre os dentes e a superfície interna dos lábios, e então aplique tensão na superfície. O rolo de gaze seca serve como uma “barreira” mais estável do que os dentes úmidos escorregadios; o volume da gaze também serve para revirar o lábio.
♦ “Método pinch-pull” (beslicar-puxar): o assistente usa os dedos indicadores e os polegares das duas mãos para “beliscar” a parte interna e externa dos lábios em ambos os lados do sítio cirúrgico; então ele estica e revira o lábio. Beliscar ou prender com gaze possibilita melhor tração e preensão. Este método tem o benéfico adicional da hemostase via oclusão das artérias labiais.
Considere debulking do tumor com bisturi em vez de curetagem, pois oferece muitos benefícios e poucas desvantagens:
Fig. 1.16 Pontos de referência anatômica que podem ser usados para predizer a localização do nervo mandibular marginal. Reproduzida com permissão de Hazani R, Chowdhry S, Mowlavi A, Wlhelmi BJ. Bony Anatomic Landmarks to Avoid Injury to the Marginal Mandibular Nerve. Aesthet Surg J 2011;31(3):286-289.
Nervo auricular posterior
Nervo occipital menor
Nervo auricular magno
Veia jugular externa
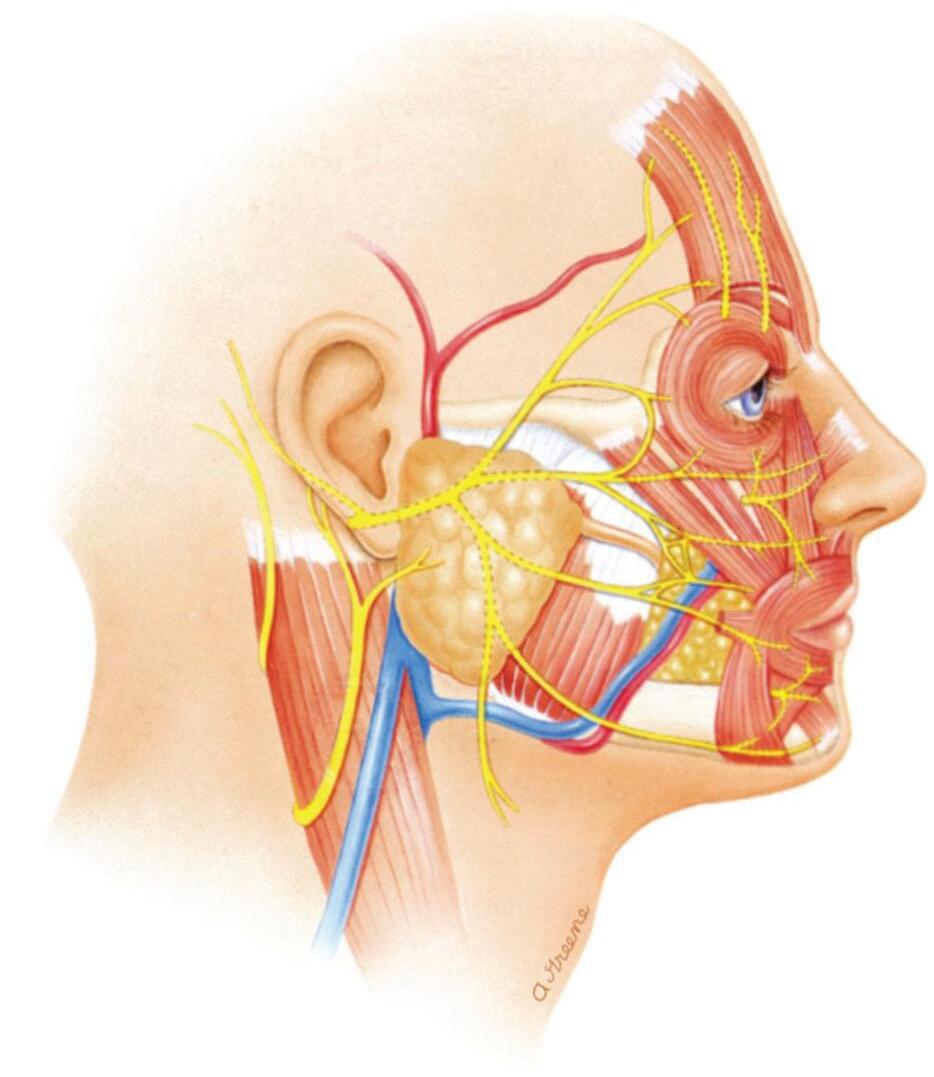
Músculo esternocleidomastóideo
Fig. 1.17 Anatomia periauricular principal. Reproduzida de Janis J. Essentials of Plastic Surgery. 3rd Edition. New York: Thieme; 2022.
• Debulking cortante ajuda a assentar/processar o tecido mais facilmente e minimiza a chance de positividade de tumor profundo.
• Muito pouco é sacrificado com o emprego de debulking com bisturi, porque a profundidade do defeito não é importante no lábio (a não ser que seja em toda a extensão):
♦ A maioria dos defeitos de Mohs no lábio é fechada primariamente ou com retalhos.
♦ Enxertos em geral não são uma boa opção de reconstrução para o lábio móvel.
Tumores superficiais nos lábios superior e inferior podem, às vezes, ser curetados levemente e retirados com uma fina camada de Mohs conservadora (CMEC) e que permite cicatrizar por segunda intenção com boa cosmese.8
As fibras musculares do orbicular se inserem diretamente na pele sobrejacente com gordura interveniente mínima ou nenhuma ® difícil estabelecer o plano prejudicado subdérmico durante a reconstrução:
• Devido à inserção das fibras musculares na pele, os fechamentos primários têm uma tendência a cicatrizar com inversão devido à faixa de tecido cicatricial no músculo, que retrai/inverte a superfície da pele ® é essencial atingir hiper-reversão por meio de suturas verticais de colchoeiro escondidas.
A orelha é uma estrutura tridimensional altamente convoluta, cujo formato é ditado pela estrutura cartilaginosa subjacente. A anatomia periauricular básica é apresentada na uFig. 1.17. A orelha está em grande proximidade com o tronco principal de NC7, com a glândula parótida e inúmeros nervos sensoriais nomeados. As considerações principais durante CMM são (1) minimizar os danos aos nervos motores e sensoriais vizinhos críticos e (2) preservar a audição, protegendo a patência do canal auditivo externo (CAE).
A pele na orelha difere de acordo com a localização:
• Superfície anterior: muito fina (1 mm ou menos), sem gordura subcutânea, difícil de descolar de tecidos profundos e relativamente imóvel.
• Superfície posterior: pele mais espessa com mobilidade aumentada e gordura subcutânea, e fácil de descolar e mobilizar para reconstruções.
O suprimento vascular é fornecido por ramos que saem de dois vasos verticalmente orientados:
• Artéria temporal superficial (ATS): abastece a porção anterior da orelha por meio de ramos não nomeados orientados horizontalmente; é um ramo terminal do sistema da carótida externa que se origina na parótida próxima à mandíbula, e se estende 1,5 cm anterior ao trago.
• Artéria auricular posterior (AAP): abastece a porção posterior da orelha e segue no sentido ascendente dentro do sulco pós-auricular.
Comprimento do CAE = 2,5 cm do sulco conchal até a membrana timpânica:
• Um terço lateral do CAE = cartilagem (sulco conchal).
• Dois terços medial do CAE = osso (osso temporal).
Estruturas importantes a serem consideradas:
• O tronco principal de NC7 e STA está localizado 1 a 1,5 cm anterior e ao fundo do trago.
• CAE: apenas 7 a 8 mm de diâmetro ® estenose no CAE, ainda que leve, pode provocar perda auditiva!
Pérolas
Para todas as áreas da orelha, enxertos de pele são uma opção reconstrutiva valiosa ® tente preservar o pericôndrio sempre que viável.
Apalpe todas as lesões na orelha!
• Se a lesão for móvel sobre a cartilagem ® menos provável que o tumor invada a cartilagem ® faça uma forte tentativa de preservar o pericôndrio no estágio de Mohs inicial.
• Se a lesão for imóvel sobre a cartilagem ® cartilagem provavelmente envolvida.
O sulco conchal é uma área difícil de executar camadas de Mohs biseladas padrão, devido à sua natureza côncava:
• Lâminas de bisturi anguladas podem ser úteis.
• Se uma lâmina nº 15 padrão for usada, comece usando a própria ponta da lâmina para fazer finamente a incisão de um círculo em torno da lesão. Depois inicie sua camada de Mohs a partir do aspecto lateral da orelha e use um movimento de pá para passar abaixo da lesão até o lado oposto (aspecto medial).
• Peça que seu assistente coloque os dedos na orelha posterior e empurre para cima a parte inferior da cavidade conchal para virá-la para fora/deixá-la menos côncava.
Tesouras são úteis para dissecar no espaço potencial entre a pele e o pericôndrio.
1.8.4 Nariz
O nariz é uma das localizações mais comuns para câncer de pele devido à sua projeção anterior e, assim, a exposição direta à luz solar. Isto é lamentável, já que o nariz é, talvez, a estrutura facial mais importante do ponto de vista estético,
Processo ascendente da maxila
Osso nasal
Rhinion
Cartilagem lateral superior
Cartilagem sesamoide
Tecido fibroareolar
Cartilagem acessória
Cartilagem lateral inferior
Crura lateral
Crura mediana
Crura medial
Raiz
Ponto de quebra supraponta
Lóbulo supraponta
Pró-nasal
Lóbulo infraponta
Columela

Espinha nasal inferior
Fig. 1.18 Estrutura cartilaginosa nasal. Reproduzida de Janis J. Essentials of Plastic Surgery. 2nd Edition. New York: Thieme; 2014.
devido à sua localização centrofacial e a simetria tridimensional de múltiplas subunidades cosméticas convolutadas. Devido a estes fatores, existem muitos livros dedicados à estética e à reconstrução nasal. Consulte a uFig. 1.18 que mostra a estrutura nasal cartilaginosa.
O nariz é dividido em subunidades cosméticas distintas: raiz, dorso, parede lateral, ponta, triângulo mole e asa.
A pele nas diferentes subunidades varia quanto à textura, mobilidade e risco de distorção relacionada à tensão.
Textura da pele:
• Pele espessa e sebácea: asa, ponta e raiz:
♦ Os enxertos de pele frequentemente são evidentes nestes locais.
• Pele fina e brilhante: dorso, parede lateral, triângulos moles e columela:
♦ Enxertos de pele são uma boa opção em termos de correspondência estética para estes locais.
Mobilidade:
• Alta mobilidade: dorso, parede lateral e raiz:
Esta maior mobilidade está em parte relacionada com a presença de uma camada de gordura subcutânea separando a pele dos músculos da expressão facial subjacentes.
• Baixa mobilidade: asa, columela, ponta e triângulo mole:
♦ O descolamento destas áreas é muito desafiador e pouco recompensador em termos da mobilidade obtida.
Três zonas de cartilagem proporcionam ao nariz a sua forma:
• Cartilagem septal:
♦ Responsável pelo grau da projeção nasal anterior.
♦ Ancorada no osso ® rígida.
♦ Fronteira medial das válvulas interna e externa.
• Cartilagens laterais superiores (pareadas):
♦ Fornece sustentação estrutural para a parede lateral da cavidade nasal.
♦ Ancorada no osso ® semirrígida (mas ainda está sujeita à distorção por forças compressivas).
♦ Fronteira lateral da válvula nasal interna (suscetível a forças compressivas).
• Cartilagens laterais inferiores (pareadas):
♦ Contribui para a projeção da ponta nasal, proeminência da crista alar e fornece sustentação para a válvula nasal externa.
♦ NÃO ancorada no osso ® muito móvel e facilmente distorcida por forças compressivas.
O risco de distorção posicional é determinado pela presença ou ausência de osso rígido subjacente, que resiste à compressão; as cartilagens alares inferiores são insuficientemente rígidas para resistir a grandes forças compressivas:
• Baixo risco de distorção: dorso, paredes laterais e raiz nasal.
• Alto risco de distorção: asa, ponta nasal e triângulo mole.
As válvulas nasais permitem o fluxo aéreo apropriado e podem ser comprometidas pela tensão relacionada com o fechamento nas porções do nariz NÃO escoradas por osso subjacente:
• Válvula externa: permite a passagem de ar pela fossa nasal distal:
♦ Pérola: Teste a integridade estrutural ocluindo a fossa nasal oposta e fazendo o paciente inspirar forçadamente ® se a fossa nasal colapsar, então é necessária sustentação estrutural.
• Válvula interna: a principal contribuinte para a resistência do fluxo de ar; está localizada superior à válvula nasal externa.
♦ Bordas: porção inferior da cartilagem lateral superior, cartilagem do septo nasal e turbinado.
♦ Risco aumentado de disfunção valvular: septo desviado e compressão da porção inferior da cartilagem lateral superior.
Vasculatura: a pele nasal tem amplo suprimento sanguíneo via ramos dos sistemas da carótida interna (artéria nasal dorsal, um ramo que sai da artéria oftálmica) e externa (artérias facial/angular):
• O canto medial é a localização da anastomose entre a artéria angular (carótida externa) e a artéria nasal dorsal (carótida interna).
• Os vasos estão localizados superficiais à musculatura nasal ® o descolamento no plano submuscular é um plano relativamente desprovido de sangue e preserva vasos importantes.
Mais do que em outros sítios, é importante minimizar não só a extensão da remoção do tecido durante Mohs, mas também a profundidade:
• Minimizar a profundidade dos defeitos permite mais opções para reconstrução e também reduz o risco de incompetência da válvula nasal iatrogênica.
• O terço distal do nariz se presta para remoção de tumor com camadas de espessura conservadora e estes defeitos cicatrizam muito bem por segunda intenção. Em alguns casos, o defeito e a pele sebácea em volta, ou mesmo rinofima, podem ser tratados com dermoabrasão com escova metálica na mesma sessão operatória de remoção do tumor com uma FCMEC.8,9
• Como as cartilagens nasais são responsáveis pelo contorno nasal, a excisão da cartilagem durante CMM frequentemente necessita de substituição da cartilagem para recuperar o contorno normal.
Maior grau de biselagem é frequentemente necessário para a acomodação apropriada da pele nasal espessa sebácea.
A pele nasal é o sítio mais comum para “proliferações foliculares basaloides” (PFBs) ou “estruturas foliculares basaloides de aparência engraçada” → o conhecimento de PFBs nasais/“folículos engraçados” ajuda a minimizar o risco de ressecções excessivamente agressivas.
O formato e a rigidez do bulbo alar são devidos ao tecido fribrogorduroso, não à cartilagem:
• Mesmo que nenhuma cartilagem tenha sido ressecada durante a excisão de Mohs, a válvula nasal externa pode ficar comprometida ® se isto ocorrer é preciso recriar a sustentação estrutural via struts de cartilagem ou tecido igualmente rígido.
♦ Pérola: Os retalhos dobrados da fronte paramediana e retalhos de Spear (retalho de interpolação do mento) frequentemente possuem rigidez intrínseca suficiente para evitar a necessidade de struts de cartilagem, mas deve-se avaliar caso a caso.
A execução de camadas de Mohs perto do osso é tecnicamente desafiadora tanto para o cirurgião quanto para o técnico em histologia. Os desafios incluem a manutenção da contiguidade da camada, o mapeamento, a extensão e o seccionamento do tecido. O periósteo é um tecido frouxo, extremamente fino, que é propenso a dobrar.
Pérolas de Mohs
Quando os tumores penetram próximos ao periósteo na sua camada de Mohs inicial, geralmente é difícil correlacionar acuradamente a localização precisa do tumor visto nas lâminas de Mohs com a localização in vivo onde é necessária ressecção adicional. Como tal, é comum ressecar o periósteo amplamente em torno da área com suspeita de positividade, ou mesmo remover a profundidade total do defeito de Mohs prévio (remoção completa do periósteo no sítio operatório). Tumores que se aproximam do periósteo são altamente infiltrativos, por definição, e assim têm risco aumentado de recorrência. Portanto, é essencial garantir que, seja qual for a abordagem a ser utilizada, ela resulte em alto grau de confiança de que você extirpou o tumor completamente. Dada a dificuldade com a localização precisa quando apenas a margem profunda é positiva, o autor geralmente inclina para a frente removendo o periósteo da profundidade total do sítio cirúrgico.
Ao remover o periósteo, é importante lembrar que o periósteo frequentemente se retrai abaixo das bordas da pele.
• Para evitar uma camada incompleta em decorrência da retração do periósteo, é útil excisar uma pequena margem da pele (2-3 mm) periférica ao defeito de Mohs prévio em todo o caminho até o osso, e então dissecar o periósteo do osso.
• Além disso, a inclusão de uma borda fina da pele periférica permite que o cirurgião coloque marcas de hashtag para mapeamento, e proporciona melhor área para preensão do tecido durante a remoção do periósteo.
O periósteo é um tecido delicado e facilmente perfurado com pontas afiadas. Para evitar perfuração, deve-se usar um elevador de periósteo com a margem curvada voltada para baixo. O periósteo pode, então, ser gradualmente liberado do osso com múltiplas pequenas ações de empurrão.
• Se em vez disso for usada tesoura ou bisturi (não recomendado), é essencial que a ponta afiada seja apontada para baixo, na direção do osso, para evitar perfuração.
Transfira o tecido cuidadosamente para uma pequena peça de papelão umedecida, que vai aderir ao seu espécime e tornará mais fácil manter a orientação e a tinta:
• Cuidado: não aplique muita tinta, o que pode obscurecer as bordas do tecido e dificultar que seu técnico em histologia processe acuradamente:
♦ Geralmente é preferível que seu técnico em histologia faça a coloração enquanto está presente na sala, durante a camada.
É difícil para seu técnico em histologia cortar uniformemente um espécime que contenha pele e periósteo, devido a suas espessuras e propriedades estruturais extremamente diferentes ® normalmente é necessário separar o periósteo para fornecer lâminas de qualidade da secção congelada.
Instrua seu técnico em histologia a cortar secções finas e evitar congelar profundamente (isto pode resultar em tecido quebradiço e fratura).
Se o tumor profundo permanecer positivo na sua camada de Mohs no periósteo ® considere encaminhamento para ENT ou neurocirurgia para possível ressecção do osso (calota externa da calvária) – a calota externa da calvária pode ser chanfrada com um dermátomo ou no ambiente do consultório, como uma broca de diamante grossa ou um dermabrading. Embora esta técnica não permita o exame microscópico das margens, ela oferece uma medida extra da remoção do tumor abaixo das áreas omitidas ou rasgadas do periósteo – esta técnica também aumenta a vascularidade do crânio exposto para cicatrização por segunda intenção ou enxerto de espessura dividida.
CMM é extremamente valiosa no tratamento de malignidades na unidade ungueal, pois pode oferecer altas taxas de cura e preservação digital.
Unidade ungueal: a placa ungueal cobre a matriz, o leito ungueal, as pregas ungueais proximais e laterais, hiponíquio e estruturas neurovasculares.
As principais estruturas neurovasculares se estendem ao longo dos aspectos lateral e medial dos dígitos e são facilmente anestesiadas com bloqueio nervoso.
• Um grande estudo de 1.111 pacientes que se submeteram a bloqueio nervoso digital para cirurgia da mão comparou o uso de lidocaína simples (sem epinefrina) com lidocaína com epinefrina ® não foram observadas complicações quando foi usada lidocaína com epinefrina ® os dados apoiam o uso de lidocaína com epinefrina para bloqueios digitais (tenha cautela se o paciente tiver um transtorno vaso-oclusivo).32
• A combinação de bupivacaína com a lidocaína e epinefrina pode fornecer anestesia prolongada e reduzir a dor pós-operatória.33
Os dois bloqueios nervosos mais comumente usados são:
• Bloqueio digital proximal:
♦ Local da injeção: porções lateral e medial do dígito proximal, perto da AMCF/AMTF.
♦ Início lento (15-20 minutos).
♦ Risco de danos aos feixes neurovasculares maiores.
♦ Não fornece homeostase.
• Bloqueios digitais distais (“bloqueios das asas”):
♦ Mais rápidos no início, mais seguros e fornecem hemostasia, comparados com bloqueios digitais proximais; mais dolorosos se não tiver sido feito um digital proximal prévio.
♦ Local da injeção: 5 mm proximal e lateral às bordas laterais da prega ungueal proximal.
Assegure um campo sem sangue:
• O assistente pode apertar os aspectos radial e ulnar do dígito para ocluir o fluxo sanguíneo.
• Pode ser feito torniquete com gaze ou dreno de penrose ou luva.
O conhecimento da deformidade da unha permite que você apresente uma opinião abalizada sobre onde o tumor se localiza:
• Lesões na matriz ® pigmento ou espessamento dentro da placa ungueal.
• Leito ungueal ® a placa ungueal de aparência normal estará elevada do leito ungueal.
A forma tridimensional do osso distal e as convoluções das pregas ungueais tornam desafiador manter uma camada de Mohs uniforme não interrompida. Tentar assegurar a totalidade da margem profunda pode ser particularmente problemático, pois há pouco tecido subcutâneo separando a unidade ungueal do osso subjacente.
• Com frequência, sua melhor chance de obtenção de um espécime de Mohs de alta qualidade é durante seu estágio de Mohs inicial.
• Se a margem profunda for positiva no seu primeiro estágio de Mohs, provavelmente você precisará usar técnicas e ferramentas similares às descritas anteriormente para camadas de Mohs no periósteo.
Devido à estrutura tridimensional complexa da unidade ungueal, certifique-se de trazer seu técnico em histologia para a sala para mostrar a aparência do espécime in vivo, para que ele possa se sentir mais confiante quanto ao que representa a “margem verdadeira” durante o relaxamento e o processamento do tecido.
A conservação do tecido na região anogenital é fundamental para preservação da função e cosmese desta área altamente sensível. A pele anogenital apresenta desafios únicos em razão de sua natureza fina, laxismo e suas zonas de transição da epiderme escamosa até o epitélio da mucosa dos tratos gastrintestinal e geniturinário. DPEM e CEC da área anogenital não são indicações infrequentes para CMM, devido ao desejo de preservação máxima do tecido.
Pérolas de Mohs
Escroto/vulva/pênis: a natureza fina e altamente redundante da pele genital apresenta desafios únicos:
• Seu assistente precisará esticar completamente a pele redundante para que suas incisões produzam margens acentuadas.
• Devido à finura da pele e à importância das estruturas facial e de tecido mole subjacentes, é fundamental evitar incisões profundas desnecessárias.
• O cirurgião deve procurar incisar somente a epiderme e a derme com seu bisturi durante a excisão de Mohs inicial. Para assegurar uma margem de tecido profundo contígua e prevenir perfuração das estruturas subjacentes, tesouras íris são as preferidas para elevação e remoção da camada de Mohs depois que a lesão foi incisada em circunferência com um bisturi.
• Marcas de hashtag podem ser extremamente difíceis de identificar tanto no espécime de Mohs quanto na pele do paciente que circunda o sítio de Mohs. Com frequência é útil suturar um ponto interrompido em cada uma dessas marcas no paciente. Também é essencial prestar muita atenção à localização das marcas no espécime de Mohs antes de colori-lo e/ou entregá-lo ao seu laboratório.
Região perianal: muitos dos mesmos desafios e abordagens que foram discutidos para a pele genital se aplicam à região perianal. Felizmente, há menos estruturas profundas de interesse e, portanto, é colocada menos ênfase na realização de excisões de Mohs superfinas.
[1] Tolkachjov SN, Brodland DG, Coldiron BM, et al. Understanding Mohs micrographic surgery: a review and practical guide for the nonder- matologist. Mayo Clin Proc. 2017; 92(8):1261–1271
[2] Stiegel E, Lam C, Schowalter M, Somani AK, Lucas J, PobleteLopez C. Correlation between original biopsy pathology and Mohs intraopera- tive pathology. Dermatol Surg. 2018; 44(2):193–197
[3] McGinness JL, Goldstein G. The value of preoperative biopsy-site pho- tography for identifying cutaneous lesions. Dermatol Surg. 2010; 36 (2):194–197
[4] Lichtman MK, Countryman NB. Cell phone-assisted identification of surgery site. Dermatol Surg.2013; 39(3, Pt 1):491–492
[5] Highsmith JT, Weinstein DA, Highsmith MJ, Etzkorn JR , Jr. BIOPSY 1– 2-3 in dermatologic surgery: improving smartphone use to avoid wrong-site surgery. Technol Innov. 2016; 18(2–3):203–206
[6] Starling J , III, Coldiron BM. Outcome of 6 years of protocol use for preventing wrong site office surgery. J Am Acad Dermatol. 2011; 65 (4):807–810
[7] Dika E, Fanti PA, Ismaili A, et al. Basal cell carcinoma margin delinea- tion: is curettage useful? A surgical and histological study. J Derma-tolog Treat. 2013; 24(3):238–242
[8] Tolkachjov SN, Cappel JA, Bryant EA, Harmon CB. How We do it: util- ity of conservative thickness layers in Mohs micrographic surgery in selected patients. Dermatol Surg. 2018; 44(9): 1227–1229
[9] Tolkachjov SN, Cappel JA, Bryant EA, Harmon CB. Conservative thick- ness layers in Mohs micrographic surgery. Int J Dermatol. 2018; 57 (9):1128–1134
[10] Rowe DE, Carroll RJ, Day CL , Jr. Long-term recurrence rates in previ- ously untreated (primary) basal cell carcinoma: implications for pa- tient follow-up. J Dermatol Surg Oncol. 1989; 15(3):315–328
[11] Rowe DE, Carroll RJ, Day CL , Jr. Mohs surgery is the treatment of choice for recurrent (previously treated) basal cell carcinoma. J Der- matol Surg Oncol. 1989; 15(4):424–431
[12] Li JY, Silapunt S, Migden MR, McGinness JL, Nguyen TH. Mohs map- ping fidelity: optimizing orientation, accuracy, and tissue identifica- tion in Mohs surgery. Dermatol Surg. 2018; 44(1):1–9
[13] Lee E, Wolverton JE, Somani AKA. A simple, effective analogy to eluci- date the Mohs micrographic surgery procedure: the peanut butter cup. JAMA Dermatol. 2017; 153(8):743–744
[14] Hruza GJ. Mohs micrographic surgery local recurrences. J Dermatol Surg Oncol. 1994; 20(9):573–577
[15] Godsey T, Jacobson R, Gloster H , Jr. Large elliptical specimens and the single section method. Dermatol Surg. 2017; 43(9):1189–1191
[16] Randle HW, Zitelli J, Brodland DG, Roenigk RK. Histologic preparation for Mohs micrographic surgery. The single section method. J Derma- tol Surg Oncol. 1993; 19(6):522–524
[17] Zabielinski M, Leithauser L, Godsey T, Gloster HM , Jr. Laboratory errors leading to nonmelanoma skin cancer recurrence after Mohs micrographic surgery. Dermatol Surg. 2015; 41(8):913–916
[18] Campbell T, Armstrong AW, Schupp CW, Barr K, Eisen DB. Surgeon error and slide quality during Mohs micrographic surgery: is there a relationship with tumor recurrence? J Am Acad Dermatol. 2013; 69 (1):105–111
[19] Macdonald J, Sneath JR, Cowan B, Zloty D. Tumor detection after inflammation or fibrosis on Mohs levels. Dermatol Surg. 2013; 39 (1, Pt 1):64–66
[20] Katz KH, Helm KF, Billingsley EM, Maloney ME. Dense inflammation does not mask residual primary basal cell carcinoma during Mohs micrographic surgery. J Am Acad Dermatol. 2001; 45(2):231–238
[21] Gephardt GN, Zarbo RJ. Extraneous tissue in surgical pathology: a College of American Pathologists Q-Probes
study of 275 laboratories.Arch Pathol Lab Med. 1996; 120(11):1009–1014
[22] Launhardt A, Golda N, North J. Atypical adnexal tumors adjacent to basal cell carcinoma: a difficult problem in patients with Brooke-Spiegler syndrome undergoing Mohs surgery. Dermatol Surg. 2014;40(3):354–357
[23] Stanoszek LM, Wang GY, Harms PW. Histologic mimics of basal cell carcinoma. Arch Pathol Lab Med. 2017; 141(11):1490–1502
[24] Karia PS, Jambusaria-Pahlajani A, Harrington DP, Murphy GF, Qureshi AA, Schmults CD. Evaluation of American Joint Committee on Cancer, International Union Against Cancer, and Brigham and Women’s Hospital tumor staging for cutaneous squamous cell carcinoma. J Clin Oncol. 2014; 32(4):327–334
[25] Padgett JK, Parlette HL , III, English JC , III. A diagnosis of chronic lymphocytic leukemia prompted by cutaneous lymphocytic infiltrates present in Mohs micrographic surgery frozen sections. Dermatol Surg. 2003; 29(7):769–771
[26] Alcalay J. Mohs mapping in the cloud: an innovative method for mapping tissue in Mohs surgery. J Drugs Dermatol. 2015; 14(10): 1127–1130
[27] Tolkachjov SN. Utilization of topographical Mohs micrographic surgery maps for rapid review of clinicopathologic characteristics of nonmelanoma skin cancers of the ear. Dermatol Surg. 2018; 44 (1):25–30
[28] Patel SY, Itani K. Review of eyelid reconstruction techniques after Mohs surgery. Semin Plast Surg. 2018; 32(2):95–102
[29] Ogle CA, Shim EK, Godwin JA. Use of eye shields and eye lubricants among oculoplastic and Mohs surgeons: a survey. J Drugs Dermatol. 2009; 8(9):855–860
[30] Shih S, Khachemoune A. Use of eye shields for mohs micrographic surgery of the eyelids and periorbital area. Dermatol Surg. 2019; 45(2): 210–215
[31] Condie D, Tolkachjov SN. Facial nerve injury and repair: a practical review for cutaneous surgery. Dermatol Surg. 2019; 45(3):340–357
[32] Chowdhry S, Seidenstricker L, Cooney DS, Hazani R, Wilhelmi BJ. Do not use epinephrine in digital blocks: myth or truth? Part II. A retrospective review of 1111 cases. Plast Reconstr Surg. 2010; 126(6):2031–2034
[33] Vinycomb TI, Sahhar LJ. Comparison of local anesthetics for digital nerve blocks: a systematic review. J Hand Surg Am. 2014; 39(4):744–751.e5
Uma abordagem sistemática à cirurgia de Mohs e reconstrução por renomados cirurgiões de câncer de pele.
Mais de 5,4 milhões de casos de câncer de pele não melanoma, sobretudo de carcinoma basocelular e espinocelular e melanoma, ocorrem anualmente só nos Estados Unidos. A técnica de Mohs, desenvolvida na década de 1950 e aperfeiçoada ao longo dos anos, tem a taxa de cura mais elevada diante de todos os tratamentos para o câncer de pele não melanoma. É cada vez mais utilizada para o melanoma e tem a taxa de recorrência mais baixa. Cirurgia Micrográfica de Mohs - Das Camadas à Reconstrução, escrita pelos conceituados cirurgiões dermatológicos e de Mohs, Christopher Harmon e Stanislav Tolkachjov, fornece um roteiro objetivo e detalhado para aprender e dominar a técnica de Mohs e reconstrução.
A organização algorítmica, juntamente com fotografias e ilustrações instrutivas, proporcionam um formato de fácil leitura, propício à aprendizagem. Os dois capítulos iniciais descrevem os princípios da cirurgia de Mohs, incluindo excisão progressiva da camada para determinar se as margens da ferida estão livres de câncer, armadilhas associadas, recorrências, locais especiais, princípios reconstrutivos e considerações gerais. Os oito capítulos seguintes estão organizados por local da face, desde o nariz até a pálpebra/sobrancelha. Os dois últimos capítulos abordam reconstruções combinadas, que se estendem por várias subunidades, e ainda gestão perioperatória e cuidados com feridas.
Principais Destaques
• Especialistas mundiais em Mohs e reconstrução fornecem pérolas que orientam o tratamento ideal
• Aspectos anatômicos relevantes que têm impacto na excisão e reconstrução são detalhados, incluindo estruturas, linhas de tensão da pele, planos de tecido e zonas de perigo
• Mais de 20 vídeos de procedimentos fornecem orientação prática sobre como efetuar passos específicos em Mohs e reconstrução
Este recurso único auxiliará residentes, fellows e cirurgiões em dermatologia, cirurgia plástica e cirurgia plástica facial a dominar as nuances das técnicas reconstrutivas de Mohs para alcançar os resultados mais funcionais e esteticamente agradáveis para os pacientes.
Online em MedOne
Acesse o conteúdo complementar online através dos QR codes específicos no texto.
ISBN 978-65-5572-253-6
www.ThiemeRevinter.com.br