




















Via www.ididdit.be heb je toegang tot het onlineleerplatform bij GENIE Chemie leerboek 6 Activeer je account aan de hand van de onderstaande code en accepteer de gebruiksvoorwaarden. Kies je ervoor om je aan te melden met je Smartschool-account, controleer dan zeker dat je e-mailadres aan dat account gekoppeld is. Zo kunnen we je optimaal ondersteunen.
LET OP: DEZE LICENTIE IS UNIEK, EENMALIG TE ACTIVEREN EN GELDIG VOOR EEN PERIODE VAN 12 MAANDEN NA ACTIVATIE.
!Help, de activatiecode hierboven is al gebruikt! Krijg je bij het activeren van de bovenstaande code de melding dat de activatiecode reeds in gebruik is? Dan ben je wellicht niet de eerste leerling die met dit leerboek aan de slag gaat. Op vanin.be/leerboeklicentie kun je terugvinden welke stappen je kunt ondernemen of hoe je een nieuwe licentie kunt aankopen.
Tip: Normaal gezien mag je niet schrijven in een leerboek. Per uitzondering mag jij na activatie de bovenstaande activatiecode doorstrepen.
Fotokopieerapparaten zijn algemeen verspreid en vele mensen maken er haast onnadenkend gebruik van voor allerlei doeleinden. Jammer genoeg ontstaan boeken niet met hetzelfde gemak als kopieën. Boeken samenstellen kost veel inzet, tijd en geld. De vergoeding van de auteurs en van iedereen die bij het maken en verhandelen van boeken betrokken is, komt voort uit de verkoop van die boeken. In België beschermt de auteurswet de rechten van deze mensen. Wanneer u van boeken of van gedeelten eruit zonder toestemming kopieën maakt, buiten de uitdrukkelijk bij wet bepaalde uitzonderingen, ontneemt u hen dus een stuk van die vergoeding. Daarom vragen auteurs en uitgevers u beschermde teksten niet zonder schriftelijke toestemming te kopiëren buiten de uitdrukkelijk bij wet bepaalde uitzonderingen. Verdere informatie over kopieerrechten en de wetgeving met betrekking tot reproductie vindt u op www.reprobel.be. Ook voor het digitale lesmateriaal gelden deze voorwaarden. De licentie die toegang verleent tot dat materiaal is persoonlijk. Bij vermoeden van misbruik kan die gedeactiveerd worden. Meer informatie over de gebruiksvoorwaarden leest u op www.ididdit.be.
© Uitgeverij VAN IN, Wommelgem, 2024
De uitgever heeft ernaar gestreefd de relevante auteursrechten te regelen volgens de wettelijke bepalingen. Wie desondanks meent zekere rechten te kunnen doen gelden, wordt verzocht zich tot de uitgever te wenden.
Credits p. 39 foto grotten van Han: Frozen_Patate © Shutterstock, p. 45 foto Biniam Girmay: Luca Bettini © AFP, p. 104 foto Zuur: Andrew Lambert Photography © Science Photo Library, p. 106 foto Svante Arrhenius: akg-images © ImageSelect, p. 123 foto pH van vlees meten: Charles D. Winters © Science Photo Library, p. 123 foto Soorten vlees: Assessment of the cavitation effect on colour attributes of chilled pork with different autolysis during brining, door Krasulya, O. & Smirnova, A. & Kazakova, E. & Bogush, V., p. 156 foto toestel van Hofmann: Menno van der Haven © Shutterstock, p. 156 foto Recyclage batterijen: iama_sing © Shutterstock, p. 190 foto Elektrische auto opladen: phaustov © Shutterstock, p. 250 foto Cradle to Cradle: T. Schneider © Shutterstock, p. 250 en 251 foto Jeans: Jeppe Gustafsson © Shutterstock, p. 250 foto Rana Plaza: Sk Hasan Ali © Shutterstock p. 28 artikel CO-vergiftiging © standaard.be – 19/01/2023
Eerste druk 2024
ISBN 978-94-647-0465-5
Vormgeving en ontwerp cover: Shtick
Tekeningen: Geert Verlinde, Tim Boers (Studio B), Julie Lefevre D/2024/0078/141
Zetwerk: Barbara Vermeersch Art. 605767/01 NUR 126
` HOOFDSTUK 1: Verklaring van de reactiesnelheid aan de hand van het botsingsmodel
1
2 Het geactiveerd complex
voor GO!, uitbreiding voor KathOndVla)
1 Inwendige energie van een chemisch systeem 42 2 Energieomzettingen
4 Soorten reactie-enthalpie en de wet van Hess
Specifieke soorten reactie-enthalpie
De wet van Hess 50
5 Drijfveren van een chemische reactie 52
1
2
3
` HOOFDSTUK 3:
1
3
4
5
6
1 Aflopende reactie versus evenwichtsreactie
Chemisch evenwicht
2.2 Grafische voorstelling 60
2.3 De evenwichtsconstante K c 64
` HOOFDSTUK 3: Factoren die de ligging van het chemisch evenwicht beïnvloeden 71
1 Principe van Le Chatelier-Van ’t Hoff 71
2 Concentratieverandering van een stof 72
3 Druk- of volumeverandering (concentratieverandering van alle stoffen) 76
4 Temperatuurverandering 79
5 Katalysator 84
` HOOFDSTUK 4: Heterogene evenwichten 91 (enkel voor GO!, uitbreiding voor KathOndVla)
1 Het oplosbaarheidsproduct (Ks) 91
2 De oplosbaarheid (S) 93
3 Neerslagvorming voorspellen 94
4 Verschuiving van het evenwicht bij neerslagreacties: het gemeenschappelijk-ioneffect 95
5 Toepassingen van neerslagreacties 97
5.1 Ionen verwijderen uit een oplossing 97
5.2 Ionsoorten aantonen 97
5.3 Zouten vormen 98
EVENWICHTEN IN WATER:
ZUREN EN BASEN
` HOOFDSTUK 1:
Zuren en basen
106
1 Zuren en basen volgens Arrhenius 106
2 Brønstedzuren en Brønstedbasen 107
3 Zuur-basekoppels 107
` HOOFDSTUK 2:
Het zuur-base-evenwicht 110
1 De waterconstante en het ionisatie-evenwicht in water 110
2 Verschuivingen van het ionisatie-evenwicht van water 111
2.1 Verandering in de concentratie van hydroxonium- en hydroxide-ionen 111
2.2 Verandering in temperatuur 112
3 De zuurconstante en de baseconstante 113
4 Het verband tussen de K z - en Kb-waarde van een zuur-basekoppel 114
5 De richting van een zuur-base-evenwicht 116
` HOOFDSTUK 3:
De zuurtegraad
4 De pH van oplossingen van meerwaardige zuren 132
5 De invloed van zouten op de pH van een oplossing 134
5.1 Zouten die dissociëren in ionen die een zwakker zuur of een zwakkere base zijn dan water 135
5.2 Zouten waarvan enkel het zure deeltje een interactie met water vertoont 135
5.3 Zouten waarvan enkel het basedeeltje een interactie met water vertoont 136
` HOOFDSTUK 5:
(uitbreiding)
1 Omschrijving van het begrip ‘buffer’
2 Samenstelling van een buffer 138
3 Verklaring van de bufferwerking 140
3.1 Toevoeging van een sterk zuur 140
3.2 Toevoeging van een sterke base 141
` HOOFDSTUK 6:
120
1 Herhaling: zure en basische oplossingen 120
2 Het begrip pH 121
3 Het begrip pOH 121
4 Het verband tussen de pH en de pOH van een oplossing 122
` HOOFDSTUK 4:
De pH van een oplossing berekenen
1 Factoren die de pH van een oplossing bepalen 125
2 De pH van sterke zuren en sterke basen berekenen 126
2.1 De pH van een oplossing van een sterk (eenwaardig) zuur 126
2.2 De pH van sterke basen 127
3 De pH van oplossingen van zwakke zuren en zwakke basen 128
3.1 De pH van oplossingen van zwakke en zeer zwakke zuren 128
3.2 De pH van oplossingen van zwakke en zeer zwakke basen 130
3.1 Titratie van een sterk zuur met een sterke base en omgekeerd 146
3.2 Titratie met een zwak zuur en/of een zwakke base 149
` HOOFDSTUK 1:
Herhaling 157
1 Soorten anorganische reacties 157
2 Oxidatiegetal 159
3 Redoxreacties: enkele belangrijke begrippen 161
` HOOFDSTUK 2:
Een redoxreactie opstellen 165
1 Halfreacties 165
2 Stappenplan 166
` HOOFDSTUK 3:
Sterkte van reductoren en oxidatoren 170
1 Kwalitatieve, experimentele bepaling 170
1.1 Verdringingsreeks van de metalen 170
1.2 Verdringingsreeks van de niet-metalen 172
2 Kwantitatieve bepaling: de reductiepotentiaal 172
2.1 Experimentele bepaling van de reductiepotentiaal 173
2.2 Een redoxreactie voorspellen 175
` HOOFDSTUK 4:
Galvanische cel 177
1 Galvani en Volta: grondleggers van de galvanische cel 177
2 Werking van een galvanische cel: de Daniell-cel 178
2.1 Redoxkoppels 178
2.2 Functie van de elektronen- en zoutbrug 180
3 Duurzame chemie: waterstofzuurstofbrandstofcel 182
` HOOFDSTUK 5:
Elektrolyse 185
1 De elektrolyse van water 185
` HOOFDSTUK 6: Redoxtitraties (enkel voor GO!)
1 Algemeen principe
2 Vaststelling van het equivalentiepunt 195
THEMA 05: BIOMOLECULEN
1 Sachariden
1.1 Monosachariden
2 Vergelijking galvanische cel – elektrolysecel 186
3 Elektrolyse van een waterige oplossing 187
4 Duurzame chemie: de lithium-ionaccu 190
4.1 Een lithium-ionaccu opladen (elektrolysecel) 191
4.2 Een lithium-ionaccu ontladen ( galvanische cel) 192
THEMA 06:
1 Vorming van kunststoffen
Polymerisatie
2 Indeling volgens eigenschappen van kunststoffen
2.1 Gedrag bij verhitting
2.2 Elasticiteit
3 Vormgeving van kunststoffen (verdieping) 4 Recyclage en verwerking van kunststoffen
5 Nieuwe ontwikkelingen
5.1 Bioplastics
5.2 Circulaire economie en Cradle to Cradle 249
1 Wat zijn nanomaterialen? 261
2 De productie van nanomaterialen 263
3 Toepassingen 264
3.1 Medische testen 264
3.2 Antibacteriële eigenschappen 264
3.3 Uv-blockers 265
3.4 Koolstofhoudende nanomaterialen 266
3.5 Eetbare coatings 267
3.6 Nanotechnologie in de landbouw 268
3.7 Geheugenmateriaal 268
Bij een chemische reactie ontstaan er altijd nieuwe stoffen. Daarvoor worden bestaande bindingen tussen atomen verbroken en worden er nieuwe chemische bindingen gevormd. Dat gaat soms makkelijk, soms iets moeizamer. Daarom kunnen reacties met uiteenlopende snelheden verlopen.
Je herinnert je misschien dat we het roesten van ijzer als een heel trage verbranding beschouwen, terwijl een explosie een heel snelle verbranding is. Beide reacties zijn redoxreacties. Enkel de snelheid van de reacties verschilt aanzienlijk.
In een chemisch bedrijf dat producten maakt via meerdere deelprocessen, is het belangrijk om die deelreacties qua snelheid goed op elkaar af te stemmen. Zo hoeft de ene reactor niet te wachten op de toevoer van reagentia die het reactieproduct zijn van een vorige reactie.

` Hoe kun je de snelheid van de deelprocessen regelen?
` Welke invloed kun je uitoefenen?
We zoeken het uit!
JE KUNT AL ...

• stoichiometrische berekeningen uitvoeren.
JE LEERT NU ...

• omschrijven wat exo- en endo-energetische reacties zijn.
• de snelheid van een reactie uitleggen aan de hand van het botsingsmodel.
• de activeringsenergie en reactiesnelheidsvergelijkingen begrijpen en toepassen.
• uitleggen wat een katalysator is.
gemiddeld ogenblikkelijk
• gemiddelde snelheden berekenen;
• het onderscheid maken tussen gemiddelde en ogenblikkelijke snelheid.
• de rol van een katalysator in een chemisch proces toelichten;
• de invloed van andere factoren op de reactiesnelheid interpreteren.
• de snelheid van een reactie op elk ogenblik berekenen;
• de reactiesnelheidsvergelijking van een gegeven reactie opstellen.
HOOFDSTUK 1
Een chemische reactie tussen verschillende moleculen vindt plaats als de bestaande bindingen verbroken worden en er nieuwe bindingen gevormd worden. Dat gaat niet altijd even gemakkelijk. De bindingskrachten tussen de atomen moeten worden overwonnen.
LEERDOELEN
L Het botsingsmodel van een chemische reactie uitleggen
L De termen ‘activeringsenergie’, ‘elastische botsing’, ‘effectieve botsing’, ‘reactie-energie’ en ‘geactiveerd complex’ toelichten
Om een reactie tussen reagentia te laten plaatsvinden, moeten de reagentia natuurlijk met elkaar in contact komen. Bovendien moet er aan 2 belangrijke voorwaarden voldaan worden:
1 De reagentia moeten met voldoende kinetische energie botsen.
2 De reagentia moeten de juiste oriëntatie hebben tijdens die botsing.

We bekijken als voorbeeld de reactie tussen de moleculen waterstofgas en chloorgas tot 2 moleculen zoutzuur: H2 (g) + Cl2 (g) → 2 HCl(g)
De moleculen moeten met voldoende hevigheid en in de juiste oriëntatie met elkaar botsen om de H-H en Cl-Cl bindingen te breken en nieuwe atoombindingen H-Cl te vormen.
• Als aan beide voorwaarden voldaan is, spreek je van een effectieve botsing
• Als aan 1 van beide voorwaarden niet voldaan is, spreek je van een elastische botsing
Een elastische botsing is een botsing waarbij de moleculen ongewijzigd blijven. Daar zijn 2 mogelijke redenen voor:
1 Er is onvoldoende kinetische energie bij de botsende deeltjes:
Afb. 2 Voorbeeld van een elastische botsing door onvoldoende energie bij de botsende deeltjes
2 De oriëntatie van de moleculen is verkeerd:
Afb. 3 Voorbeeld van een elastische botsing door een verkeerde oriëntatie van de moleculen
Een effectieve botsing is een botsing waarbij nieuwe atoomcombinaties ontstaan. Er wordt gebotst met voldoende energie en de deeltjes hebben de juiste oriëntatie. Een deel van de kinetische energie wordt daarbij omgezet in inwendige energie van de reactieproducten.
Afb 4 Voorbeeld van een effectieve botsing. Tijdens de chemische reactie vormen de atomen een tussenfase (hier H2Cl2) die niet stabiel is en verder reageert naar de eindproducten. Daarom wordt die tussen haakjes vermeld.
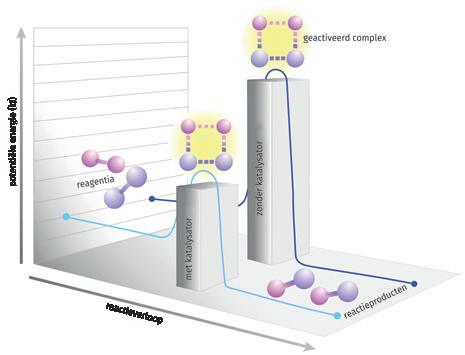
Een chemische reactie is het gevolg van effectieve botsingen tussen deeltjes. Door de opslorping van kinetische energie ontstaat een geactiveerd complex, een tussenfase met een hogere energieinhoud dan die van alle losse betrokken reagentia. Het geactiveerd complex kan enkel bereikt worden als de reagentia dus voldoende kinetische energie bezitten. Die onstabiele tussenvorm in de reactie is vaak een complexe verbinding die uiteindelijk zal uiteenvallen in verschillende reactieproducten.
In ons voorbeeld, de reactie tussen waterstofgas (H2) en chloorgas (Cl2), ontstaat dus tijdelijk een complexe molecule (H2Cl2). Dat geactiveerd complex zal daarna spontaan aanleiding geven tot de vorming van de nieuwe, stabiele deeltjes (reactieproducten). Daarbij komt er opnieuw een hoeveelheid van de opgeslorpte energie vrij.
reagentia
(H2Cl2 ) geactiveerd complex
Afb. 5 Voorbeeld van een effectieve botsing. Daarbij wordt (tijdelijk) een tussenfase of geactiveerd complex gevormd. E (kJ) t (s) reactieproducten geactiveerd complex
Legende:
E R = energie van de reagentia
E P = energie van de reactieproducten
E A = activeringsenergie
E GC = energie van het geactiveerd complex
Afb. 6 Het energiediagram van de reactie tussen H2 en Cl2. Let op de hogere energie-inhoud van het geactiveerd complex.
Bestaande bindingen breken kost altijd veel energie. Het kost minder energie om een tijdelijk geactiveerd complex te vormen, maar ook dat geactiveerd complex heeft een hogere energieinhoud dan de reagentia (EGC > ER). Er is bij een reactie dus altijd een bepaalde activeringsenergie EA nodig om de reagentia om te zetten in het geactiveerd complex. De activeringsenergie EA is dus de energie die je moet toevoegen om de reactie te starten
Op afbeelding 7 is het energiediagram van een exo-energetische reactie weergegeven. Het uiteindelijke energieniveau van de reactieproducten (EP) ligt lager dan het energieniveau van de reagentia (ER) waar de reactie mee begon. Er is dus reactie-energie vrijgesteld: ∆E = EP – ER < 0
De vorming van een geactiveerd complex is energetisch gunstiger dan de reactieweg waarbij eerst de bindingen in de reagentia volledig worden gebroken en daarna de nieuwe bindingen worden gevormd.
Tijdens de vorming van het geactiveerd complex worden immers tegelijkertijd de bindingen in de reagentia gebroken en de bindingen in de reactieproducten gevormd. De energie die vrijkomt bij het maken van de nieuwe bindingen, wordt gebruikt om de bindingen in de reagentia te breken. Daardoor is er minder activeringsenergie nodig en verloopt het proces energetisch gunstiger.
E (kJ)
E P
vorming geactiveerd complex is energetisch gunstiger
reactieverloop geactiveerd complex losse of vrije atomen
reactieproducten reagentia
Afb 7 Energieniveau van het geactiveerd complex versus het breken van bindingen. Je ziet duidelijk dat het meer energie kost om alle bindingen tegelijkertijd te breken (rode pijl), dan om tussentijds een geactiveerd complex te vormen (bruine pijl).
Het botsingsmodel is gebaseerd op 2 voorwaarden waaraan de reagentia moeten voldoen opdat een chemische reactie zou optreden (= effectieve botsing):
1 Ze moeten voldoende kinetische energie bezitten om bestaande bindingen te breken en nieuwe bindingen te vormen.
2 Ze moeten in de gepaste oriëntatie ten opzichte van elkaar contact maken.
Het geactiveerd complex is een onstabiele tussentoestand van atomen waarin zowel de bindingen die aanwezig zijn in de reagentia, als de bindingen die aanwezig zijn in de reactieproducten, voorkomen. Die reactieweg is energetisch gunstiger dan de reactieweg waarbij de reagentia eerst volledig worden afgebroken in aparte atomen en dan de nieuwe bindingen van de reactieproducten worden gevormd.
Het verschil in energie-inhoud tussen de reagentia en het geactiveerd complex is de activeringsenergie, die altijd een positieve waarde heeft.
Waarom heeft de activeringsenergie altijd een positieve waarde?
Teken het energiediagram van een endo-energetische reactie.
Vermeld de volgende gegevens: ER, EP, EA, EGC, ΔE.
De activeringsenergie van de volgende reactie is 62 kJ.
2 NO(g) + Cl2 (g) 2 NOCl(g) ∆E = –38 kJ
Wat is de activeringsenergie van de omgekeerde reactie?
a 24 kJ
b 38 kJ
c 62 kJ
d 100 kJ
Bij een bepaalde concentratie van stoffen A en B zijn er per cm³ en per s 1020 botsingen, waarvan 2 % effectief. Bij een verhoging met 10 °C is er een verdubbeling van de reactiesnelheid.
Hoeveel moleculen van stof C worden er per liter en per seconde gevormd als A + B 2 C? Hoe groot is het aantal botsingen en effectieve botsingen na de temperatuurverhoging?
oefenen?
In de wielerwedstrijd de ‘Ronde van Vlaanderen’ halen de renners vaak een gemiddelde snelheid van meer dan 40 km h . Maar dat betekent niet dat ze ook aan die hoge snelheid over de steile hellingen zoals de Koppenberg rijden. Anderzijds halen ze in afdalingen snelheden van meer dan 70 km h . Ook in chemische reacties verandert de snelheid constant. HOOFDSTUK 2
LEERDOELEN
L De reactiesnelheid uitdrukken in functie van de deelnemende reagentia en producten
L Het onderscheid maken tussen gemiddelde en ogenblikkelijke reactiesnelheid
Als we het over (reactie)snelheid hebben, bedoelen we ofwel de gemiddelde reactiesnelheid binnen een bepaalde tijdsspanne, ofwel de snelheid op een bepaald ogenblik tijdens het reactieverloop: de ogenblikkelijke snelheid. Want de snelheid waarmee een reactie verloopt, is niet constant. In elk geval is het aantal effectieve botsingen per tijdseenheid en per volume-eenheid een maat voor de snelheid van de betrokken reactie.
De reactiesnelheid van een chemische reactie kun je uitdrukken als:
• de verlaging van de concentratie (mol L ) van reagentia per tijdseenheid;
• de verhoging van de concentratie (mol L ) van reactieproducten per tijdseenheid.
In de chemie bepaal je de reactiesnelheid op 2 manieren:
1 de gemiddelde reactiesnelheid in een bepaald tijdsinterval tijdens de reactie;
2 de ogenblikkelijke reactiesnelheid op een bepaald tijdstip tijdens de reactie.
Je geeft de reactiesnelheid dan ook als volgt weer:
REACTIESNELHEID
UITGEDRUKT IN … gemiddelde reactiesnelheid
ogenblikkelijke reactiesnelheid (op tijdstip t)
Je kunt de gemiddelde reactiesnelheid uitdrukken als de verandering van de concentratie van 1 van de bij de reactie betrokken stoffen in functie van de tijd.
We bekijken eerst een reactie waarbij de voorgetallen allemaal gelijk zijn aan 1.
Bekijk de omzetting van het gevaarlijke koolstofmonoxide tot koolstofdioxide met behulp van stikstofdioxide: CO + NO2 → CO2 + NO
Je kunt de reactiesnelheid schrijven als de verandering van de koolstofdioxideconcentratie in functie van de tijd.
Aangezien er CO2 gevormd wordt in die reactie, zal <v> = ∆[CO2] ∆t
De bovenstaande vergelijking geeft je de gemiddelde reactiesnelheid over een tijdsspanne ∆t.
Wiskundig zou dat de richtingscoëfficiënt zijn van de rechte die de concentratieverandering in functie van de tijd weergeeft:
( ) mol L
Afb. 8 De concentratieverandering in een tijdsspanne
Merk op dat de snelheid initieel hoog is (er wordt veel CO2 gevormd), maar dat ze afneemt na verloop van tijd. De snelheid op eender welk ogenblik (vt) zal zelden gelijk zijn aan de gemiddelde snelheid (<v>).
Let op als er een verschil in de coëfficiënten is bij de stoffen in de reactievergelijking.
Bekijk daarvoor deze reactie: N2O4 → 2 NO2
De concentratie van NO2 zal 2 keer sneller stijgen dan dat de concentratie van N2O4 daalt.
Aangezien de snelheid altijd een positief getal is, plaats je een minteken bij de concentratieverandering van de reagentia, want die concentratie zal afnemen.
Of je neemt de absolute waarde:
Algemeen kun je stellen voor een reactie a A + b B → c C + d D:
Bekijk opnieuw de 1e reactie: de omzetting van koolstofmonoxide tot koolstofdioxide met behulp van stikstofdioxide: CO + NO2 → CO2 + NO
Als je de ogenblikkelijke reactiesnelheid op een bepaald ogenblik wilt weten, laat je het tijdsinterval naderen tot 0 (in de wiskunde noem je dat de limietwaarde).
Uit de lessen wiskunde weet je al: vt = de absolute waarde van de richtingscoëfficiënt van de raaklijn aan de kromme in een bepaald punt
[CO2] ( ) mol L
t Δ[CO2]
Afb. 9 Grafische voorstelling van de concentratie aan NO in functie van de tijd
De reactiesnelheid op een bepaald ogenblik kun je als volgt afleiden:
(s)
Aangezien er evenveel CO2 als NO gevormd wordt, geldt die reactiesnelheidsbepaling voor beide reactieproducten:
vt = d[NO] dt
Aangezien er evenveel CO en NO2 verdwijnt als er CO2 en NO gevormd wordt, geldt eveneens het volgende: vt = –d[CO] dt = –d[NO2] dt
[CO] ( ) mol L
Omdat ∆[CO] en ∆[NO2] negatief zijn, maar de snelheid vt altijd een positief getal is, plaats je een minteken voor die concentratieverandering of gebruik je de absolute waarde van de getalwaarde.
Afb. 10 De ogenblikkelijke concentratieverandering van een reagens
(s)
Je hebt de ogenblikkelijke reactiesnelheid nu geschreven in 4 verschillende vormen: de ogenblikkelijke concentratievermindering van de reagentia en de ogenblikkelijke concentratietoename van de reactieproducten: vt = d[CO2] dt = d[NO] dt = –d[CO] dt = –d[NO2] dt
Houd bij de ogenblikkelijke reactiesnelheid (vt) ook rekening met eventuele verschillen in de coëfficiënten bij de stoffen in de reactievergelijking.
Voor de 2e voorbeeldreactie, N2O4 → 2 NO2, zal de concentratie van NO2 2 keer sneller stijgen dan dat de concentratie van N2O4 daalt. vt = 1 2 d[NO2] dt = –d[N2O4] dt
Algemeen geldt voor de reactie a A + b B → c C + d D: vt = –1 a d[A] dt = –1 b d[B]
De ogenblikkelijk reactiesnelheid wordt net als de gemiddelde reactiesnelheid uitgedrukt als een concentratieverandering per tijdseenheid en heeft dus als eenheid mol L · s
VOORBEELD GEMIDDELDE VERSUS OGENBLIKKELIJKE REACTIESNELHEID
Bij een experiment voor een reactie 2 A + B → C + 2 D tekende men de volgende meetresultaten op:
VOORBEELD GEMIDDELDE VERSUS OGENBLIKKELIJKE REACTIESNELHEID (VERVOLG)
Met die gegevens kun je een grafiek maken over het snelheidsverloop, door <v> in functie van t uit te zetten. Door de punten te verbinden met een vloeiende lijn, bekom je deze snelheidscurve:
<v> L . s mol ( )
12345
Afb. 11 Grafische afleiding van de ogenblikkelijke reactiesnelheid op basis van gemiddelde reactiesnelheden
Je kunt op de grafiek aflezen dat na 3,25 s de reactiesnelheid op dat ogenblik 0,15 mol L · s is. Dat zou ook de absolute waarde van de richtingscoëfficiënt zijn van de raaklijn aan de curve op dat punt.
De reactiesnelheid kun je uitdrukken als het aantal effectieve botsingen per tijdseenheid en per volume-eenheid.
Met reactiesnelheid wordt ofwel de gemiddelde reactiesnelheid <v>, ofwel de ogenblikkelijke reactiesnelheid vt bedoeld.
Zowel de gemiddelde als de ogenblikkelijke reactiesnelheid kun je berekenen vanuit de concentratieverandering van elk reagens of reactieproduct, waarbij je bij elke specifieke stof de reactiecoëfficiënt altijd in de noemer plaatst.
Voor de reactie a A + b B → c C + d D
De reactiesnelheid v wordt uitgedrukt als een concentratieverandering in functie van de tijd en heeft de eenheid mol L · s t (s) 1
In een volume van 1 L is er 1 mol van stof A en 2,5 mol van stof B. Die reageren met elkaar volgens
deze reactie: A + 3 B → C. Na 120 s blijft er 0,95 mol A over. Bepaal de gemiddelde reactiesnelheid.
Bereken de gemiddelde reactiesnelheid voor de reactie Mg + 2 HCl → MgCl2 + H2. Na 30 s is er in een gesloten ruimte van 10 L 0,2 mol H2 gevormd.
Bekijk de volgende reactie:
2 A + 3 B → C + D + 2 E
Op tijdstip 0 s is zowel de molhoeveelheid A als de molhoeveelheid B gelijk aan 0,60 mol.
Het volume van de oplossing waarin de reactie plaatsvindt, is 1 L. De onderstaande grafiek toont de verandering van de molhoeveelheid B in functie van de tijd.
Hoeveel is de molhoeveelheid A na 6 s? Leg uit.
a 0,20 mol
b 0,40 mol
c 0,00 mol
d 0,01 mol
Wat is de juiste notatie voor de berekening van de gemiddelde reactiesnelheid van deze reactie (in een gesloten systeem)? Er zijn meerdere antwoorden mogelijk.
N2 (g) + 3 H2 (g) 2 NH3 (g)
` Meer oefenen? Ga naar
HOOFDSTUK 3
De reactiesnelheid hangt af van het aantal effectieve botsingen. Een effectieve botsing is op haar beurt een gevolg van de juiste oriëntatie en voldoende kinetische energie van de botsende deeltjes. Door die laatste 2 factoren te beïnvloeden, kun je ook de reactiesnelheid wijzigen. Dat is belangrijk om in een reeks reacties de deelstappen van een globaal chemisch proces op elkaar af te stemmen. We overlopen in dit hoofdstuk de factoren die je kunt beïnvloeden.
LEERDOELEN
L Uitleggen welke factoren de reactiesnelheid beïnvloeden
In dit hoofdstuk ga je op zoek naar factoren die de reactiesnelheid beïnvloeden, en zoek je naar een verklaring gebaseerd op het botsingsmodel. Daarbij maak je gebruik van een curve die het aantal deeltjes in functie van de kinetische energie uitdrukt, de Boltzmann-verdeling
Bij een bepaalde temperatuur hebben niet alle moleculen dezelfde kinetische energie. Volgens de wetten van de statistiek heeft een klein percentage van de moleculen een hoge Ek en een klein percentage een lage Ek. De meeste moleculen hebben een energie die rond het gemiddelde ligt van de energie van alle moleculen. De moleculaire Ek is dan ook verdeeld volgens een Boltzmann-verdeling. Om effectief te kunnen botsen, is er een bepaalde minimale kinetische energie nodig (Emin). Alleen het gedeelte van de moleculen dat die minimale kinetische energie bezit, kan effectief botsen.
aantal deeltjes N
Emin
fractie aan moleculen die een e ectieve botsing kunnen ondergaan
Afb. 12 Grafische voorstelling van het aantal deeltjes in functie van hun hoeveelheid kinetische energie (Emin = minimale kinetische energie die nodig is om effectieve botsingen te veroorzaken)
Ek (kJ)
Bekijk de applets over het effect van temperatuur op de verdeling van kinetische energie van de molecule.
Wanneer je de temperatuur verhoogt, voeg je energie toe aan de reagentia. De deeltjes krijgen een hogere kinetische energie en de kans op effectieve botsingen zal stijgen.
Afbeelding 13 toont de Boltzmann-verdeling van de deeltjes. Het gearceerde gebied toont het aantal deeltjes dat een kinetische energie bezit met een waarde boven de vereiste drempelwaarde Emin. Wanneer de temperatuur verhoogd wordt (T2 > T1), bezitten meer moleculen de minimale kinetische energie die nodig is om te kunnen reageren (Emin).
aantal deeltjes N
bijkomende fractie aan botsingen kunnen veroorzaken
min Ek (kJ)
Afb. 13 Het effect van een temperatuurstijging op een chemische reactie: effect op een Boltzmann-verdeling
Dat de temperatuur een invloed heeft op de snelheid van een reactie, merk je ook bij processen uit het dagelijks leven. Enkele voorbeelden:



• Je gebruikt de koelkast en diepvries om voedselbederf te vertragen. Bij een lagere omgevingstemperatuur gebeuren de stofwisselingsprocessen en afbraakprocessen in voedsel minder snel. Het rottingsproces in het voedsel wordt dus vertraagd.
• Koorts bevordert de nagel- en haargroei. Bij een hogere lichaamstemperatuur gebeuren de stofwisselingsprocessen sneller. De cellen zullen zich bovendien sneller delen. Het weefsel groeit sneller. Je moet de nagels van baby’s regelmatiger knippen dan die van volwassenen, omdat baby’s gemiddeld gezien een hogere lichaamstemperatuur hebben.
• De groei van planten is afhankelijk van de seizoenstemperatuur.
Invloed van de
Bij een grotere concentratie aan reagensdeeltjes zijn er natuurlijk meer botsingen. Vergelijk het met het aantal botsingen op een drukke autosnelweg ten opzichte van een verlaten landweggetje.
aantal deeltjes N
bijkomende fractie aan moleculen die e ectieve botsingen kunnen veroorzaken
Afb. 14 Het effect van een concentratiestijging op een chemische reactie: effect op een Boltzmann-verdeling
In noodsituaties, zoals bij een ademhalingsprobleem of in de medische wereld, kan zuivere zuurstof levensreddend zijn. Dat komt doordat zuivere zuurstof de reactiesnelheid van vitale processen in ons lichaam verhoogt. Normale lucht bestaat uit ongeveer 21 % zuurstof en 79 % stikstof, wat voldoende is voor onze dagelijkse behoeften. In situaties waarbij de zuurstoftoevoer naar de weefsels drastisch moet worden verhoogd, kan zuivere zuurstof echter een groot verschil maken.
Je kunt al deze invloeden onder 1 noemer brengen. Er wordt energie toegevoegd aan het systeem (licht = stralingsenergie, schok = kinetische energie), waardoor alweer meer moleculen de vereiste kinetische-energiedrempel halen om effectief te botsen.
WEETJE
Sommige stoffen zijn erg schokgevoelig. Nitroglycerine is bijvoorbeeld heel explosief. De stof ontleedt bij de minste schok in gassen volgens deze reactie:
4 C3H5N3O9 → 12 CO2 + 10 H2O + 6 N2 + O2
Dat maakte transport van nitroglycerine vroeger quasi onmogelijk. De Zweedse chemicus Alfred Nobel (1833-1896) ontdekte dat de stof iets minder schokgevoelig kon worden gemaakt door ze te absorberen in een poreuze stof zoals diatomeeënaarde. Dat mengsel wordt ‘dynamiet’ genoemd. Ook met dynamiet moet je erg voorzichtig omspringen. Bij temperaturen vanaf 35 °C zal de nitroglycerine immers uit het absorptiemiddel lekken. Hoewel Alfred Nobel waarschijnlijk ‘nobelere’ gedachten had over dynamiet, werd het mengsel vaak gebruikt voor oorlogsdoeleinden. De chemicus werd steenrijk door zijn uitvinding. Met dat geld werd de Nobelstichting opgericht. Tot op heden worden nog altijd jaarlijks Nobelprijzen uitgereikt aan mensen van wie de uitvindingen of handelingen van groot nut zijn voor de mensheid. Op het periodiek systeem van Nobels tijdsgenoot Mendelejev is het element met atoomnummer 102, nobelium, naar hem vernoemd.

WEETJE

Om te reageren, moeten de reagensdeeltjes met elkaar in contact komen. Hoe groter de verdelingsgraad (dus hoe fijner verdeeld), hoe groter de verhouding contactoppervlak/volume. Een groot blok hout ontbrandt bijvoorbeeld minder snel dan fijn verdeeld aanmaakhout. Als je een barbecue aansteekt, gebruik je ook beter geen groot blok houtskool, maar wel meerdere kleine stukjes. video: stofexplosie
Bedrijven die poederachtige stoffen verwerken of produceren, moeten zeer voorzichtig zijn dat er geen statische ontlading plaatsvindt bij een opslagcontainer of reactor. Een kleine vonk kan al leiden tot explosies met rampzalige gevolgen: stofexplosies zijn nog krachtiger dan gasexplosies!
Dat heeft de geschiedenis al vaak bewezen in onder andere suikerraffinaderijen (bloemsuiker), mengvoederbedrijven (meel) en steenkoolmijnen (kolenstof).

Om de rol van een katalysator te begrijpen, herhalen we eerst de definitie van activeringsenergie: de energie die in de vorm van licht, warmte, straling, schok … moet worden toegediend aan een reactie om de reactie te laten starten.
In een reactie kun je de activeringsenergie verlagen door een katalysator toe te voegen. Een katalysator is een stof die gebruikt wordt om de snelheid van een reactie te beïnvloeden, zonder zelf verbruikt te worden. Er wordt dan een ander geactiveerd complex gevormd met inclusie van de katalysator.
energie-inhoud
E min voor effectieve botsing
E min voor effectieve botsing met katalysator
E R
H 2 + Cl 2 + K
(H2Cl2)
(H2Cl2K)
activeringsenergie activeringsenergie met katalysator E P reactieverloop
2 HCl + K exotherm
Afb. 15 De reactie tussen H2 en Cl2 waarbij HCl gevormd wordt
Bekijk opnieuw de reactie tussen H2 en Cl2 waarbij HCl gevormd wordt. Alvorens de moleculen HCl gevormd worden, zitten de atomen in een complex H2Cl2, dat daarna in 2 stukken breekt. Door de juiste katalysator toe te voegen, kun je die reactie versnellen.
De katalysator vormt dan samen met de atomen van de reagentia een ander geactiveerd complex, H2Cl2K. De activeringsenergie is voor dat complex kleiner.
Omdat de activeringsenergie nu lager is, zal er minder E nodig zijn om effectief te botsen, waardoor de kans op botsen verhoogt.
aantal deeltjes N
bijkomende fractie aan moleculen die e ectieve botsingen kunnen veroorzaken
Emin E’min
Afb. 16 Het effect van een katalysator op een chemische reactie: effect op een Boltzmann-verdeling
Ek (kJ)
Een spectaculaire proef om de werking van een katalysator aan te tonen, is de invloed van KMnO4 op een brandend mengsel van ethanol en waterstofperoxide. Bekijk de video.
Opmerking:
Soms is het ook wenselijk om een reactie te vertragen. Dan voegt men een stof toe die een geactiveerd complex vormt met de reagentia met een hogere energiewaarde. Ook dat kan nuttig zijn bij bijvoorbeeld ongewenste nevenreacties. Een dergelijk hulpmiddel noem je een inhibitor. Die stof wordt gebruikt in het reactiemechanisme, maar niet verbruikt, net als een katalysator.
Maar hoe komt het dat een katalysator de activeringsenergie kan verlagen?
• Vaak heeft een katalysator een richtend effect op de moleculen, wat het aantal effectieve botsingen kan bevorderen.
• Een katalysator kan er ook voor zorgen dat de bindingen in de reagerende stof verzwakken, zodat er reactievere deeltjes ontstaan.
Opgelet: een katalysator heeft enkel invloed op de snelheid, niet op het rendement van een reactie!
Je zult dus niet meer reactieproduct bekomen. De reactie verloopt alleen sneller. Daar komen we later op terug, in het thema ‘Chemisch evenwicht’.
Het belang van katalysatoren kan moeilijk onderschat worden. Verschillende industriële processen, zoals reacties met organische stoffen en de synthese van kunststoffen, gebeuren katalytisch.
Het gebruik van katalysatoren speelt ook in de natuur een zeer belangrijke rol. In de lessen biologie noem je katalysatoren vaak enzymen. Een enzym is dus een biokatalysator. In de natuur verlopen heel wat reacties snel, ondanks de relatief lage lichaamstemperatuur. Dat komt doordat organismen gebruikmaken van enzymen. Omdat katalysatoren specifiek zijn, verlopen de duizenden reacties in de cel met behulp van duizenden verschillende enzymen.
amylase sucrase-isomaltase
koolwatersto en eiwitten olie vetten suikers
De reactiesnelheid kun je beïnvloeden door meerdere factoren:
• de temperatuur;
• de concentratie van de reagentia;
• licht, schok en straling;
• de verdelingsgraad;
• het gebruik van een katalysator.
Een katalysator verlaagt de activeringsenergie door zelf deel uit te maken van het geactiveerd complex. Een inhibitor verhoogt de activeringsenergie. De werking van een katalysator rust enerzijds op een richtend effect van de moleculen en anderzijds op een verzwakkend effect van de bestaande bindingen. Een katalysator heeft geen invloed op het rendement van een reactie, enkel op de snelheid.
We weten al langer dat we duurzaam moeten omspringen met energie. Niet alleen raken de fossielebrandstofvoorraden stilaan uitgeput, maar als we ook van kernenergie willen afstappen, moeten er alternatieven zoals hernieuwbare energie voorhanden zijn. Tegelijkertijd moeten we ons energieverbruik proberen te beperken. Wasmiddelenfabrikanten hebben dat allang begrepen. Ze voegen nu meer enzymen toe aan hun producten. De enzymen zorgen voor een verlaagde activeringsenergie, zodat wassen op 30 °C al voor een heel goed resultaat zorgt. Let wel op: als je wast op een lagere temperatuur, kunnen er zich bacteriën ontwikkelen in de wasmachine. Je moet dus zeker regelmatig je wasmachine reinigen!

Leg uit waarom je een haardvuur makkelijker kunt aansteken door:
a erin te blazen;
b fijn gekliefd aanmaakhout te gebruiken.
Waarom rijst brood veel gemakkelijker als het op een warme plaats staat?
Welke factor die de reactiesnelheid beïnvloedt, speelt een rol bij deze situaties?
a b Je legt een klontje suiker op tafel.
Niet pelletkachel, maar centrale verwarming oorzaak van CO-vergiftiging waarbij vader en zoon omkwamen
Zaterdag werd het gezin zwaar getroffen door een CO-intoxicatie. ‘Uit onderzoek is donderdag gebleken dat niet de pelletkachel, maar wel de centraleverwarmingsinstallatie op gas aan de basis ligt’, meldt het parket.
Naar: standaard.be, 19/01/2023
Vrouw sterft na eten van sardines in Frans restaurant
In de Franse stad Bordeaux zijn verschillende restaurantklanten opgenomen in het ziekenhuis na een ‘botulismevoedselvergiftiging’. Eén ding hadden ze gemeen: ze bezochten de afgelopen dagen allemaal hetzelfde restaurant, waar ze huisbereide geconserveerde sardines aten.
Naar: vrt.be/vrtnws, 15/09/2023
Daarna blijft het er wekenlang gewoon liggen. Wanneer de hond het na 3 weken opeet, wordt het in zijn lichaam meteen verbrand. Wat is daarvoor de verklaring?
Welke reacties zijn snel en welke traag?
a rijpend fruit
b roestend ijzer
c vuurwerk
d de vorming van kalksteen in het koffiezetapparaat
Een geopend tetrapak melk bewaar je in de koelkast, omdat …
a je de activeringsenergie van de bacteriën dan hoog houdt;
b bij een lage temperatuur de omzetting naar verzurende producten trager verloopt;
c de melk dan beter smaakt;
d de melk sneller verzuurt in een tetrapak dan in een glazen fles.
Je verdeelt 10 g KMnO4 in 2 delen. Het ene deel stamp je in een mortier tot een fijn poeder.
Het andere deel laat je ongemoeid. Dan breng je beide delen op een brandbestendige plaat (een tiental cm van elkaar) en druppel je er gelijktijdig 1 mL glycerine over. Na enkele seconden ontstaan er witte rook en gensters.
a Welk deel ontbrandt het eerst?
b Wat is de reden daarvoor?
1 de hogere concentratie in het ene hoopje KMnO4
2 de hogere temperatuur in het ene hoopje KMnO4
3 de fijnere verdeling in het ene hoopje KMnO4
4 de werking van glycerine als katalysator
Waterstofperoxide (H2O2) ontbindt onder invloed van licht volgens deze reactie:
2 H2O2 → 2 H2O + O2
De ontbinding verloopt sneller als je bruinsteen (MnO2) toevoegt.
Welke functie heeft bruinsteen hier?
Bekijk aandachtig deze foto’s. Links zie je brandhout, rechts aanmaakhout.


a Welke invloedsfactor wordt mooi geïllustreerd door de bovenstaande foto’s?
b Waarom worden de blokken links verkocht als brandhout en de blokken rechts als aanmaakhout? Verklaar aan de hand van de botsingstheorie.
Als je bij een jeugdbeweging zit, heb je op kamp je eten misschien al eens opgewarmd in een gamel (een aluminium ‘pannetje’). Die kun je immers veilig verwarmen. Aluminiumpoeder dat verhit wordt, verbrandt echter wel hevig en is moeilijk te blussen. Wat is de verklaring daarvoor?

Amila en Leon voeren elk de reactie uit van magnesium met een overmaat aan zoutzuur. Amila doet dat op een iets andere manier dan Leon. In beide gevallen wordt de reactiesnelheid bepaald als functie van de tijd. Het resultaat van beide proeven is weergegeven in het onderstaande diagram.
Uit het diagram volgt dat Amila de proef uitgevoerd kan hebben …
a bij een hogere temperatuur;
b met een hogere concentratie zoutzuur;
c met meer magnesium; d met meer zoutzuur.
` Meer oefenen? Ga naar .
De reactie van magnesiummetaal met een overmaat aan zwavelzuuroplossing wordt op 4 verschillende manieren uitgevoerd, zoals weergegeven in de onderstaande tabel.
50 mL
0,20 ( mol L )
ZWAVELZUUROPLOSSING
50 mL
0,40 ( mol L )
ZWAVELZUUROPLOSSING
0,10 g Mg-poederproef 1proef 2
0,10 g Mg-lintproef 3proef 4
Bij welke proef zal de reactiesnelheid het grootst zijn?
a bij proef 1
b bij proef 2
c bij proef 3
d bij proef 4
Uit de voorgaande grafieken wordt duidelijk dat de reactiesnelheid op elk ogenblik in verhouding staat tot de concentratie van de reagentia op datzelfde ogenblik. Het zou van pas komen in berekeningen als je dat verband in een gelijkheid kunt weergeven.
LEERDOELEN
L De reactiesnelheid uitdrukken als een wiskundige functie met behulp van de snelheidswet, en het begrip ʻreactiesnelheidsconstanteʼ (en de bijbehorende eenheid) daarin kaderen
L Het onderscheid maken tussen een eenstapsreactie en een meerstapsreactie
1 Reactiesnelheidsconstante k
Voor de meeste
reacties verdubbelt de snelheid al bij een temperatuurverhoging van 10 °C.
Er bestaat een wiskundig verband tussen de reactiesnelheid en de concentratie van de reagentia. Proefondervindelijk kun je bewijzen dat de reactiesnelheid stijgt als de concentratie van de reagentia stijgt.
Als voorbeeld bekijken we deze reactievergelijking: CO + NO2 → CO2 + NO
Je weet al dat de snelheid altijd een evenredig verband heeft met de concentratie van de reagentia. Omdat de reactiesnelheid altijd wordt uitgedrukt als een concentratieverandering per tijdseenheid, zullen er geen vaste stoffen voorkomen in de reactiesnelheidsvergelijking.
Je kunt de snelheid v dus ook altijd uitdrukken in functie van de concentratie van die reagentia die opgelost of gasvormig zijn: vt = k [CO]t [NO2]t
k is hier de reactiesnelheidsconstante. De waarde van k is afhankelijk van 2 factoren:
1 of je al dan niet een katalysator gebruikt. Een katalysator is een stof die in de reactie gebruikt wordt bij de vorming van het geactiveerd complex, maar niet verbruikt wordt. Die stof wordt achteraf immers opnieuw vrijgesteld uit het geactiveerd complex. Niet elke reactie heeft een katalysator;
2 de temperatuur.
Bovendien is k specifiek voor elke reactie
Opmerking:
Omdat de eenheid voor de reactiesnelheid altijd mol L · s is, maar het aantal reagentia in een reactie kan verschillen, zal de eenheid van k veranderlijk zijn en afhankelijk van de reactie. Uit experimenten kon men afleiden dat de reactiesnelheid voor de reactie
2 NO + 2 H2 → N2 + 2 H2O gelijk is aan: vt= k · [NO]t2 · [H2]t
Aangezien de concentratie telkens in de eenheid mol L staat, zal er in het rechterlid van de vergelijking uiteindelijk het product staan van ‘de eenheid van k’, vermenigvuldigd met mol2 L2 en met mol L . In het linkerlid van de vergelijking staat de snelheid, die altijd mol L · s als eenheid heeft.
Daaruit leid je af:
mol L · s = k · mol3 L3
Door de vergelijking te hervormen, kun je de eenheid van k voor die reactie afleiden:
mol L · s mol3 L3 = mol L · s · L3 mol3 = L2 mol2 · s
Een reactie verloopt niet altijd volgens hetzelfde reactiepatroon. Sommige reacties verlopen in 1 stap, andere in meerdere stappen, waarbij telkens een nieuw geactiveerd complex gevormd wordt.
Bekijk een aantal voorbeeldreacties waarbij alle stoffen gassen zijn:
Voorbeeld van een eenstapsreactie: 2 NO + Cl2 → 2 NOCl
De reactie tussen de moleculen stikstofmonoxide en de molecule chloorgas gebeurt in 1 stap. Experimenteel werd vastgesteld dat de reactiesnelheidsvergelijking gegeven wordt door
vt = k [NO]t2 [Cl2]t
Voorbeeld van een meerstapsreactie: 2 NO + 2 H2 → N2 + 2 H2O
Aan de vorming van stikstofgas en water gaan een aantal deelreacties vooraf:
1 Eerst wordt stikstofmonoxide omgezet in distikstofdioxide: 2 NO → N2O2
2 Vervolgens reageert distikstofdioxide met waterstofgas: N2O2 + H2 → H2O + N2O
3 Tot slot reageert het gevormde tussenproduct distikstofmonoxide opnieuw met waterstofgas: N2O + H2 → N2 + H2O
Experimenteel werd vastgesteld dat de reactiesnelheidsvergelijking gegeven wordt door vt = k · [NO]t2 · [H2]t
Enkel bij eenstapsreacties zullen de coëfficiënten in de reactievergelijking gelijk zijn aan de exponenten in de reactiesnelheidsvergelijking.
Maar bij meerstapsreacties is er vaak geen vast verband tussen de coëfficiënten in de reactievergelijking en de exponenten van de concentraties in de uitdrukking van de snelheid. Zo staat er in de reactiesnelheidsvergelijking voor de meerstapsreactie geen kwadraat bij [H2].
Vaste stoffen kunnen niet worden opgenomen in de snelheidswet.
Een concentratieverandering van het ene reagens leidt soms tot een grotere wijziging in de reactiesnelheid dan een concentratieverandering van een ander reagens.
Algemeen geldt deze snelheidswet voor reacties in een homogeen verdund stelsel:
a A + b B + c C → vt = k · [A]tx · [B]ty · [C]tz
Maar de exponenten x, y en z worden dus experimenteel bepaald en zijn enkel bij eenstapsreacties gelijk aan de voorgetallen in de reactie.
Dat zie je in de onderstaande voorbeelden (in een homogeen midden):
REACTIEVERGELIJKING
2 N2O5 → 2 N2O4 + O2
C2H4 + H2 → C2H6
CHCl3 + Cl2 → CCl4 + HCl
2 NO + 2 H2 → N2 + 2 H2O
REACTIESNELHEIDSVERGELIJKING
vt = k [N2O5]t
vt = k · [C2H4]t · [H2]t
vt = k [CHCl3]t [Cl2]t
vt = k [NO]t2 [H2]t
In die voorbeelden gaat het alleen bij de 2e reactie om een eenstapsmechanisme. De exponenten zijn enkel daar gelijk aan de voorgetallen.
Algemeen geldt deze snelheidswet voor reacties in een homogeen verdund stelsel: a A + b B + c C
[A]tx · [B]ty · [C]tz
Daarbij moeten x, y en z experimenteel bepaald worden, want enkel bij een eenstapsreactie zijn de exponenten gelijk aan de voorgetallen in de reactie. Bij meerstapsreacties moeten de exponenten in de snelheidsvergelijking altijd experimenteel bepaald worden. De eenheid van k is afhankelijk van het aantal reagentia en de exponenten bij de concentraties in de formule.
De experimentele bepaling van de exponenten in de reactiesnelheidsvergelijking gebeurt door telkens alle concentraties van de reagentia, met uitzondering van 1, constant te houden. Men onderzoekt zo de invloed van de concentratieverandering van die laatste stof op de reactiesnelheid.
Op geregelde tijdstippen kan men een staal uit het reactievat halen voor analyse. De reactie kan zelf helemaal even on hold gezet worden door de temperatuur plots sterk te verlagen of een katalysator weg te nemen.
VOORBEELD BEPALING EXPONENTEN IN REACTIESNELHEIDSVERGELIJKING
STIKSTOFMONOXIDE (NO) EN WATERSTOFGAS (H2)
Bekijk de reactie tussen stikstofmonoxide en waterstofgas: 2 NO + 2 H2 → N2 + 2 H2O
Voor die reactie zal de reactiesnelheidsvergelijking er als volgt uitzien: vt = k [NO]tx [H2]ty
Men doet 3 experimenten, waarbij men telkens 1 van beide beginconcentraties van de reagentia constant houdt en men vervolgens de startsnelheid van de reactie meet: [NO] ( mol L ) [H2] ( mol L ) v0 ( mol L · s )
Als je experiment 1 en 2 vergelijkt, zie je dat men de beginconcentratie van het reagens NO verdubbelde, terwijl men de concentratie H2 constant hield. De reactiesnelheid vt werd daardoor 4 keer groter.
Als je experiment 1 en 3 vergelijkt, zie je dat men de beginconcentratie van het reagens H2 verdubbelde, terwijl men de concentratie NO constant hield. De reactiesnelheid vt verdubbelde daardoor.
[NO] ( mol L ) [H2] ( mol L ) vt ( mol L · s )
Experiment 1 0,100 0,100 1,23 · 10-3
Experiment 20,200
4,92 · 10-3
Experiment 30,100 0,200 2,46 · 10-3
Merk op dat de verandering in concentratie voor H2 een evenredig verband heeft met de verandering in reactiesnelheid. De exponent y in de reactiesnelheidsvergelijking zal bijgevolg 1 zijn.
Merk ook op dat de verandering in concentratie voor NO een kwadratisch effect heeft op de verandering in reactiesnelheid. De exponent x in de reactiesnelheidsvergelijking zal bijgevolg 2 zijn.
De reactiesnelheidsvergelijking voor die reactie is dan: vt = k [NO]2 [H2]1
Hoe meet je de reactiesnelheid in een labo?
Elke reactie is anders (kleurverandering, neutralisatie …), en de snelheid zal dus vaak op een andere, geschikte manier opgevolgd moeten worden. Wij nemen als voorbeeld een reactie waar je de reactiesnelheid op meerdere manieren kunt opvolgen: de reactie tussen dijood en aceton.
dijood aceton 1- joodpropanon waterstofjodide
Je kunt de reactiensnelheid als volgt schrijven: vt = –d[I2] dt
Afb. 17 De veranderende hellingsgraad van de raaklijnen aan de concentratiecurve
De concentratie aan I2 neemt voortdurend af, maar de concentratievermindering zakt in de tijd. De reactiesnelheid daalt dus ook voortdurend. Ze is hoog in het begin en zakt met de tijd: v1 > v2
Meer weten?
Check de uitgebreide verklaring op
Je kunt het verloop van de snelheid van een reactie op verschillende manieren volgen. We kozen specifiek voor dit voorbeeld omdat je de reactie experimenteel kunt opvolgen met 3 methodes:
1 Colorimetrisch: je kunt de snelheid opvolgen door de kleurverandering van het reactiemidden te bekijken.
In ons voorbeeld is de dijoodoplossing geelbruin, maar waterstofjodide is kleurloos. De snelheid waarmee de geelbruine kleur verdwijnt, is een maat voor de reactiesnelheid.
2 Conductometrisch: soms ontstaan er bij een reactie elektrolyten, waardoor er geleiding optreedt. Je kunt de snelheid dan opvolgen door de geleidbaarheid te monitoren.
In ons voorbeeld geleidt de oplossing initieel geen stroom, want er zijn geen ionen aanwezig. Dat is wel het geval na de vorming van waterstofjodide als zuur. HI ioniseert en daardoor start de geleiding door de hydroxonium- en jodide-ionen.
3 Acidimetrisch: je kunt de snelheid opvolgen door een pH-meting. De pH zal geleidelijk dalen door de vorming van een zuur of stijgen door de vorming van een base.
In ons voorbeeld zal de oplossing geleidelijk verzuren door de vorming van HI. De pH zal dalen.
De orde van een reactie is per definitie de som van de exponenten in de reactiesnelheidsvergelijking. De orde van een reactie is een goede maatstaf voor de reactiesnelheid van een chemische reactie. Hoe hoger de orde van een reactie is, hoe meer deeltjes tegelijk moeten botsen en hoe onwaarschijnlijker een effectieve botsing wordt. De reactiesnelheid zal daarom lager zijn als de orde van de reactie hoger is.
Opgelet: je kunt de globale reactieorde niet zomaar gelijkstellen aan de som van de exponenten in de reactiesnelheidsvergelijking. Een reactie verloopt soms in deelstappen. Dan zal het de traagste deelstap zijn die uiteindelijk de orde van de reactie bepaalt. Net zoals de exponenten moet de globale orde van een reactie daarom experimenteel worden bepaald.
Voor een reactie 2 A + B → C geldt:
vt = k · [A]t² · [B]t en k = 0,2
In een ruimte van 1 L breng je 8 g van stof A en 2,24 g van stof B. De molaire massa van stof A en B bedraagt respectievelijk 160 g mol en 78 g mol . Na 10 min is de helft van stof A omgezet. Bepaal de reactiesnelheid op dat ogenblik.
Voor de reactie 3 A + 2 B → C + 2 D geldt dat bij verdrievoudiging van de concentratie van A de reactiesnelheid 9 keer vergroot en bij een halvering van de concentratie van B de reactiesnelheid ook halveert. Wat is de eenheid van de snelheidsconstante? Leg uit.
a mol L · s
b L2 mol2 · s
c L3 mol3 · s
d L mol · s
Gegeven: de reactie A + 2 B → C + D
Experimenteel kun je bepalen dat vt = k [A]t [B]t Bepaal de snelheid wanneer de volgende wijzigingen gebeuren:
a Je verdubbelt zowel concentratie A als concentratie B.
b Je verdubbelt concentratie A. Concentratie B blijft ongewijzigd.
c Je verdubbelt het volume van het reactievat.
d Je voegt inert gas toe, maar je houdt het volume constant.
Voor de reactie A + 3 B → C wordt de reactiesnelheid experimenteel bepaald. Bij de start bevat het reactiemengsel stoichiometrische concentratiehoeveelheden (in mol L ) A en B. Elke seconde halveert de reactiesnelheid. Welke uitspraak in verband met die reactie is met zekerheid juist?
a Elke seconde halveert de concentratie van A.
b De snelheid waarmee A wegreageert, is gelijk aan de snelheid waarmee B wegreageert.
c De verhouding van de molaire concentraties A en B blijft gedurende het volledige reactieverloop gelijk aan 1 3
d De concentratie van B zal als eerste gelijk worden aan 0 mol L .
Voor de reactie A + B → C noteerde je de volgende beginreactiesnelheden voor de verschillende concentraties:
EXPERIMENT [A]0 ( mol L )[B]0 ( mol L ) v o ( mol L · s )
1 1,01,0 0,20
2 2,01,0 0,40
3 3,01,00,60
4 1,02,0 0,20
5 1,03,0 0,20
a Leid de reactiesnelheidsvergelijking af.
b Bereken de waarde en de eenheid van de reactiesnelheidsconstante.
Stel de reactiesnelheidsvergelijking op voor deze eenstapsreacties. Alle stoffen zijn gassen.
a 2 A + B → C + D
b CH4 + O2 → CO2 + 2 H2O
Stel de reactiesnelheidsvergelijking op voor deze eenstapsreacties en geef de totale orde van de reactie. Alle stoffen zijn gassen.
a N2 + 3 H2 → 2 NH3
b 2 A + B → C
Stel de reactiesnelheidsvergelijking op voor deze eenstapsreacties en geef de eenheid van de reactiesnelheidsconstante. Alle stoffen zijn gassen.
a 4 HCl + O2 → 2 H2O + 2 Cl2
b 3 A + B → C + 2 D
KERNBEGRIPPEN
NOTITIES
Hoofdstuk 1: Verklaring van de reactiesnelheid aan de hand van het botsingsmodel botsingsmodel effectieve botsing
elastische botsing
geactiveerd complex
2 voorwaarden:
1 De reagentia moeten met voldoende kinetische energie botsen.
2 De reagentia moeten de juiste oriëntatie hebben tijdens de botsing.
• Voldoet aan beide voorwaarden.
• Er ontstaan nieuwe atoomcombinaties.
• Voldoet niet aan 1 van beide voorwaarden.
• Er ontstaan geen nieuwe atoomcombinaties.
• een onstabiele tussentoestand van atomen waarin zowel de bindingen die aanwezig zijn in de reagentia, als de bindingen die aanwezig zijn in de reactieproducten, voorkomen
• energetisch gunstiger
activeringsenergie
• het verschil in energie-inhoud tussen de reagentia en het geactiveerd complex
• Heeft altijd een positieve waarde.
Hoofdstuk 2: De gemiddelde en de ogenblikkelijke reactiesnelheid
gemiddelde reactiesnelheid
ogenblikkelijke reactiesnelheid
reactiesnelheid
• symbool: <v>
• uitgedrukt in mol L · s
• vt
• op een bepaald tijdstip t
• uitgedrukt in mol L · s
• de hoeveelheid effectieve botsingen per tijdseenheid en per volume-eenheid
• eenheid: mol L · s
• voor de reactie a
KERNBEGRIPPEN
Hoofdstuk 3: Factoren die de reactiesnelheid beïnvloeden
temperatuur hogere temperatuur → meer beweging → meer kans op botsingen concentratie grotere concentratie → meer kans op botsingen
licht, schok en straling kinetische energie stijgt → meer kans op botsingen
verdelingsgraad grotere verdelingsgraad = groter contactoppervlak → meer kans op juiste oriëntatie → meer kans op effectieve botsingen
katalysator Een katalysator heeft een richtend effect op de botsende moleculen en kan de bestaande bindingen van de reagentia verzwakken, waardoor het geactiveerd complex met de katalysator een lagere energie-inhoud heeft.
Hoofdstuk 4: Reactiesnelheidsconstante en snelheidswet reactiesnelheidsconstante k
• De waarde is afhankelijk van 2 factoren: 1 het gebruik van een katalysator; 2 de temperatuur.
• De eenheid is afhankelijk van het aantal reagentia en de exponenten bij de concentraties in de formule. → specifiek voor elke reactie
snelheidswet (in een homogeen verdund stelsel)
a A + b B + c C → ..................
vt = k · [A]tx · [B]ty · [C]tz
eenstapsreactie exponenten = de voorgetallen in de reactie meerstapsreactie
• exponenten = experimenteel bepalen
• De globale orde van een eenstapsreactie is de som van de exponenten in de reactiesnelheidsvergelijking.
orde van een reactie maatstaf voor de reactiesnelheid van een chemische reactie
Ben je al eens naar de grotten van Han geweest? Of iets verder weg, naar de grotten van Lascaux (in Frankrijk)? Niet alleen zie je bijzondere afbeeldingen uit het paleolithicum, maar je kunt ook niet anders dan bewondering hebben voor de omvang van de grotten. De vorming van die grotten is pure chemie: de reactie tussen kalksteen en CO2-rijk water is daarvoor verantwoordelijk. Maar tegelijkertijd worden er in de grotten (holtes) nog altijd stalactieten en stalagmieten gevormd. Vult de grot zichzelf weer op?

` Wat zijn de drijfveren achter een chemische reactie?
` Kan een chemische reactie worden omgekeerd?
` Wat zijn de eigenschappen van een chemisch evenwicht?
` Welke factoren hebben een invloed op een chemisch evenwicht?
We zoeken het uit!
• het onderscheid maken tussen een endoenergetische en een exo-energetische reactie;
• de begrippen ‘reactie-energie’ en ‘activeringsenergie’ uitleggen en benoemen op een grafiek.
weinig entropie veel entropie
• de inwendige energie definiëren als de som van de uitgewisselde reactiewarmte en -arbeid;
• de soorten reactie-enthalpie van elkaar onderscheiden (enkel GO!);
• de wet van Hess definiëren en toepassen (enkel GO!);
• de drijfveren van een reactie definiëren (enkel GO! + extra voor KathOndVla).
• het begrip ‘reactiesnelheid’ definiëren en de formule toepassen in oefeningen.
• het onderscheid maken tussen een aflopende reactie en een evenwichtsreactie;
• een formule opstellen voor de evenwichtsconstante;
• voorspellen of een reactie een evenwichtsreactie is.
• de invloed van de temperatuur, de concentratie, de verdelingsgraad en een katalysator op de reactiesnelheid toelichten.

• definiëren wat een neerslagreactie of gasontwikkelingsreactie is;
• het onderscheid maken tussen gasontwikkelingsreacties en neerslagreacties;
• de begrippen ‘oplossing’, ‘opgeloste stof’ en ‘oplosmiddel’ van elkaar onderscheiden.
• de invloed van de concentratie, de temperatuur, de druk, het volume en een katalysator op de ligging van het evenwicht toelichten.

• de begrippen ‘oplosbaarheidsproduct’ en ‘oplosbaarheid’ definiëren;
• voorspellen of er een neerslag zal worden gevormd;
• hoe het evenwicht verschuift bij neerslagreacties (het gemeenschappelijkioneffect).
HOOFDSTUK 1
(enkel
voor GO!, uitbreiding voor KathOndVla)
Bij een chemische reactie wordt er meestal warmte geproduceerd (exotherme reactie) of opgenomen (endotherme reactie). Sommige reacties verlopen spontaan, andere dan weer niet. Waar gaat al die energie naartoe of waar komt ze vandaan? Geldt ook in de chemie de wet van behoud van energie?
Een chemische reactie zal altijd streven naar een stabiele energietoestand. Je leerde al dat er bij de vorming van bindingen een streven is naar een zo laag mogelijke energie-inhoud. Maar is dat dan de enige reden waarom een chemische reactie al dan niet spontaan zal plaatsvinden? Absoluut niet, want dan zouden enkel exo-energetische processen spontaan gebeuren. Water zou bijvoorbeeld nooit spontaan verdampen.
Er is dus nog een 2e drijfveer die ervoor zorgt dat een reactie al dan niet spontaan zal plaatsvinden.
LEERDOELEN
L Toelichten dat zowel enthalpie als entropie een rol speelt als drijfveer van een reactie
L De entropie als een maat voor wanorde omschrijven
L De wet van Hess formuleren en toepassen
Elk chemisch proces speelt zich af op een bepaalde plaats. Dat kan in een erlenmeyer zijn, in een reactor, maar ook gewoon in onze atmosfeer. Dat noem je het systeem. Alles wat je niet tot het systeem rekent, vormt de omgeving. Men onderscheidt de volgende 3 systemen:
• een open systeem: een systeem dat materie en energie kan uitwisselen met de omgeving;
• een gesloten systeem: een systeem dat enkel energie kan uitwisselen met de omgeving;
• een geïsoleerd systeem: een systeem dat noch energie, noch materie kan uitwisselen met de omgeving.
Een systeem bevat een welbepaalde hoeveelheid van stoffen, bij een welbepaalde temperatuur, druk en aggregatietoestand(en). Die toestand kan veranderen onder invloed van chemische (het aantal mol) en fysische processen (temperatuur, druk).
Opgelet: voor energie gebruik je normaal altijd het symbool E. Als het, zoals hier, specifiek om de inwendige energie gaat, gebruik je het symbool U
In de lessen fysica leerde je de eerste hoofdwet van de thermodynamica: energie kan noch geschapen, noch vernietigd worden. Kortweg: de wet van behoud van energie. Energie kan wel worden omgezet van de ene vorm in de andere.
Bij elke chemische reactie wordt er energie overgedragen tussen het systeem en de omgeving. Een perfect geïsoleerd systeem bestaat niet. Die energie moet dus al op voorhand in de materie aanwezig zijn. Dat is de inwendige energie (U). De eenheid is joule (J)
Met een thermos kun je dranken koel of warm houden. De energie-uitwisseling met de omgeving wordt zo veel mogelijk beperkt. Een thermos bestaat altijd uit een container met daarrond een tweede container. Daartussen zit vaak lucht gevangen. Lucht is een goede thermische isolator. Maar zodra lucht kan gaan stromen, zal het ook beter de warmte afdrijven.
afsluitdop
buitenwand
vacuümisolatie
binnenwand
Isolatiemateriaal is vaak op dat principe gebaseerd. In een schuim wordt lucht geïmmobiliseerd. Piepschuim is een schuim van het polymeer polystyreen, waarin lucht gevangen zit.
Als je fietst op warme dagen, heb je misschien al gemerkt dat je pas echt begint te zweten als je stopt met fietsen, wanneer de lucht niet langer langs je stroomt.

DEMO
Inwendige energie
Onderzoeksvraag
Wat gebeurt er als je een koperen muntje van 2 of 5 eurocent in een proefbuis met salpeterzuur doet?
Werkwijze
Je leerkracht brengt onder de zuurkast een stuk van 2 of 5 eurocent in een grote proefbuis, met daarin 20 mL geconcentreerd salpeterzuur.
Waarnemingen
Het geheel begint spontaan te koken en er komt een bruine rook vrij.
Besluit
De vrijgekomen energie is enorm.
Waar kwam al die energie in de proef vandaan?
De inwendige energie is de totale energie die aanwezig is in een stof.
Ze is aanwezig op verschillende niveaus:
• atomair niveau:
–Elektronen bevatten kinetische en potentiële energie. (Dat ken je uit het 5e jaar.)
–Er is een sterke binding tussen protonen en neutronen (kernkrachten).
• (intra)moleculair niveau:
–De bindingsenergie (de energie die nodig is om 1 mol van een chemische binding te verbreken) hangt af van de aard van de binding. Een enkelvoudige binding is bijvoorbeeld minder sterk dan een meervoudige. Elke binding bevat dus een hoeveelheid potentiële energie.
–Bewegingsenergie van moleculen: net zoals de atomaire deeltjes, zitten moleculen niet stil. De beweging van moleculen verschilt naargelang de aggregatietoestand van de stof. Je kunt translatie- (vrije beweging), rotatie- en vibratie-energie onderscheiden als vormen van kinetische energie.
• intermoleculair niveau:
In het 4e jaar leerde je al dat moleculen onderling krachten op elkaar uitoefenen: london- of london-dispersiekrachten, dipoolkrachten, coulombkrachten, waterstofbruggen …
Al die energieën samen vormen de energie-inhoud of inwendige energie U van een chemische stof.
Zowel reagentia als reactieproducten hebben een inwendige energie U. De totale hoeveelheid aan inwendige energie is onmogelijk te berekenen. Bij chemische reacties worden nieuwe verbindingen gevormd, wat gepaard gaat met energieveranderingen. Het verschil in inwendige energie tussen de reactieproducten en de reagentia (of uitgangsstoffen) is wel meetbaar. Dat is de reactieenergie ∆U, uitgedrukt in joule (J). De verandering van de hoeveelheid inwendige energie is voornamelijk het gevolg van het verbreken van bestaande bindingen (wat altijd energie kost) en de vorming van nieuwe bindingen (waarbij er energie vrijkomt). Aan de energie van de atomen zelf verandert er bij chemische reacties niets.
U (J) reagentia reactieproducten
R
P
(J) reagentia reactieproducten Afb. 20 Een energiediagram voor endo- en exo-energetische reacties
endo-energetisch exo-energetisch
R
U < 0
P
(s)
Enkel het verschil in energie voor en na het proces is meetbaar. Daarom noem je de inwendige energie een toestandsgrootheid of toestandsfunctie.
(s)
Afbeelding 20 maakt duidelijk dat als ∆U < 0, er energie vrijkomt (er komt meer energie vrij bij de vorming van nieuwe bindingen dan dat er energie nodig is om bestaande verbindingen te verbreken). De reactie is exo-energetisch. Als ∆U > 0, wordt er energie toegevoegd aan het systeem. De reactie is endo-energetisch. In het zeldzame geval dat ∆U = 0, spreek je van een adiabatisch proces.
Die energie kan op verschillende manieren worden uitgewisseld met de omgeving:
• in de vorm van elektriciteit;
• in de vorm van stralingsenergie;
• in de vorm van warmte of thermische energie;
• in de vorm van ontvangen of geleverde arbeid aan de omgeving.
Wanneer je bijvoorbeeld een fles champagne of prosecco ontkurkt, kan de kurk met hoge snelheid wegvliegen. Als je niet oppast, kan er een gewonde vallen of een raam sneuvelen. De ontbinding van koolzuur in water en koolstofdioxide levert als chemische reactie arbeid aan de omgeving. In mei 2022 vierde Biniam Girmay zijn etappewinst in de Ronde van Italië door een flesje prosecco te ontkurken, maar dat verliep niet zoals hij had verwacht. De kurk kwam recht in zijn oog terecht en hij moest voor verzorging naar het ziekenhuis. Bekijk de video.

Energieomzettingen
Onderzoeksvraag
Welk soort energie wordt er geleverd door de reactie van magnesium en zoutzuur?
Werkwijze
Je leerkracht brengt een stukje magnesium in een zoutzuuroplossing en sluit de proefbuis af met een ballon.
Reactie: Mg + 2 HCl → MgCl2 + H2
Waarnemingen
De ballon wordt langzaam opgeblazen.
Besluit
De chemische reactie levert voornamelijk arbeid (in dit geval door een drukverandering).
• De energie-inhoud of inwendige energie (U) is een toestandsgrootheid en bestaat uit: –atomaire energie; –intramoleculaire energie; –intermoleculaire energie.
• De energie kan met de omgeving worden uitgewisseld in de vorm van: –warmte; –straling; –elektriciteit; –arbeid.
• ∆U < 0 → Er wordt energie geleverd door het systeem. De reactie is exo-energetisch.
• ∆U > 0 → Er wordt energie aan het systeem toegevoegd. De reactie is endo-energetisch.
• In het zeldzame geval dat ∆U = 0, spreek je van een adiabatisch proces.
We beperken ons in dit hoofdstuk tot reacties waarbij er arbeid en/of warmte geleverd en/of ontvangen wordt. De verandering van inwendige energie (U) kun je dan gelijkstellen aan de som van de uitgewisselde reactiewarmte (Q) en de arbeid (W):
U = ∆Q + ∆W
Bij consensus wordt energie die vrijkomt, bijvoorbeeld in de vorm van warmte of arbeid, binnen de thermodynamica weergegeven als een negatieve waarde: ∆Q < 0 en ∆W < 0. Wanneer er energie wordt opgenomen door het systeem, dan geldt dat de som van ΔQ en ΔW positief is: ΔQ > 0 en/of ΔW > 0. In het onderstaande diagram is zowel ΔU als ΔW negatief.
U (J)
reactieproducten reagentia ΔQ ΔW
(s) U R ΔU < 0 U P
Afb. 22 De arbeidsfactor en warmtefactor Als de arbeidsfactor in de vergelijking 0 is, wordt de verandering in inwendige energie gelijk aan de reactiewarmte:
∆U = ∆Q.
Bij een constante druk zal de inwendige energie die wordt omgezet in arbeid, vaak een gevolg zijn van gasontwikkeling en de daarbij horende volume- en drukverandering. In formulevorm wordt dat:
U = ∆QP + ∆WP
Als je de termen herschikt, wordt dat:
U
WP
Die reactiewarmte (bij een constante druk), de reactie-energie gecorrigeerd met de geleverde of ontvangen arbeid, noem je de enthalpie (H). De eenheid van H is, net als de eenheid van U, joule.
Ook de enthalpie is een toestandsgrootheid. De hoeveelheid enthalpie in een stof is onmogelijk te berekenen. Je kunt wel de vrijgekomen of opgenomen warmte tijdens de reactie meten: de reactie-enthalpie (∆H). De reactie-enthalpie vind je voor veel reacties terug in tabellen. Ze is meestal gemeten bij 25 °C en 1 013 hPa.
Opmerking:
Omdat de meeste reacties bij een constante druk worden uitgevoerd en de geleverde arbeid ∆W vaak verwaarloosbaar klein is, worden ‘reactie-enthalpie’ en ‘reactiewarmte’ vaak als synoniemen gebruikt. Of anders gesteld: ∆H is de enthalpieverandering tijdens een chemische reactie. Het is de reactiewarmte die optreedt bij een constante druk en temperatuur.
Als de reactieproducten een lagere enthalpie hebben dan de reagentia, is ∆H < 0 en is er warmte vrijgekomen: de reactie is exotherm. Als de reactieproducten een hogere enthalpie hebben dan de reagentia, slorpt het systeem warmte op (∆H > 0): de reactie is endotherm. Als ∆H = 0, spreek je van een thermoneutraal proces. Merk ook op dat als een reactie warmte levert en dus exotherm is, de omgekeerde reactie warmte zal opnemen en daarom endotherm is:
Als A → B: ∆H < 0, dan B → A: ∆H > 0.
Het deel aan inwendige energie dat als warmte wordt uitgewisseld, noem je de enthalpieverandering ∆H
Enthalpie is dus de reactiewarmte, maar gecorrigeerd met de geleverde of ontvangen arbeid:
Bij reacties waarbij de druk constant wordt gehouden, is de arbeidsfactor verwaarloosbaar en kun je de verandering van inwendige energie gelijkstellen aan de vrijgekomen (of opgenomen) reactiewarmte: de reactie-enthalpie ∆H.
∆H is de enthalpieverandering tijdens een chemische reactie. Het is de reactiewarmte die optreedt bij een constante druk. De eenheid van H is, net als de eenheid van U, joule. Als voor een reactie ∆H > 0, dan geldt voor de omgekeerde reactie logischerwijze: ∆H > 0.
De reactie-enthalpie (∆H) wordt gemeten bij 1 013 hPa en 25 °C. De waarde voor de reactieenthalpie bij die omstandigheden voor diverse reacties vind je terug in chemische tabellen.
Die gemeten waarden mag je niet verwarren met de standaardvoorwaarden: 0 °C en 1 000 hPa.
Bij een verbrandingsmotor in een auto is het belangrijk dat de inwendige energie van de brandstof zo veel mogelijk wordt omgezet in arbeid en dat de warmteverliezen worden beperkt. Als je voedsel bereidt in de keuken, wil je daarentegen vooral de warmtefactor benutten om het voedsel te garen.
Opgelet: bij een constante druk en temperatuur kan een volumeverandering enkel het gevolg zijn van een verandering in het aantal mol van een gas. Dat volgt uit de gaswet:
p · V = n · R · T
Er kan dus enkel een volumeverandering optreden en arbeid worden geleverd bij een chemische reactie als het totale aantal mol van de stof verandert:


De enthalpie is, net als de inwendige energie, een toestandsgrootheid. De absolute enthalpieinhoud van een stof kun je onmogelijk bepalen. 4 factoren bepalen die toestand:
1 de hoeveelheid stof;
2 de temperatuur;
3 de druk;
4 de aggregatietoestand.
Als je de enthalpie-inhoud of enthalpieveranderingen wilt bestuderen, moet je die 4 factoren in rekening brengen. We maken daarom een aantal afspraken:
• De variabele factor ‘hoeveelheid stof’ kun je uitschakelen door de enthalpieverandering of -inhoud altijd voor 1 mol van een stof weer te geven.
• De enthalpie is ook afhankelijk van de druk en de temperatuur. Om waarden met elkaar te kunnen vergelijken, gebruiken we altijd de reactie-enthalpie bij 25 °C en 1 013 hPa.
• Je geeft de aggregatietoestand altijd weer door ze als index tussen haakjes te plaatsen: ‘g’ voor gas, ‘vl’ voor vloeistoffen en ‘v’ voor vaste stoffen. Vaak gebruikt men echter de Engelse notatie: ‘g’ voor gas, ‘l’ voor liquid (vloeistof) en ‘s’ voor solid (vaste stof).
Vooral de enthalpieveranderingen bij een reactie tussen verschillende stoffen zijn van belang. We stellen daarom de vormingsenthalpie van enkelvoudige stoffen bij een standaarddruk, -temperatuur en -concentratie gelijk aan 0.
Als er samengestelde stoffen worden gevormd, zal er een enthalpieverandering optreden. We gebruiken in oefeningen altijd de vormingsenthalpie (∆Hf ): de reactie-enthalpie (of enthalpieverandering) die optreedt bij de vorming van 1 mol van een verbinding uit de enkelvoudige stoffen bij 25 °C en 1 013 hPa. Ze wordt uitgedrukt in kJ mol
VOORBEELD DE VORMINGSENTHALPIE VOOR DE VORMING VAN AMMONIAK
Als je de definitie van vormingsenthalpie toepast (vorming van 1 mol van de stof), zul je rechts van de reactiepijl het voorgetal 1 moeten behouden. Daardoor zullen de voorgetallen bij de reagentia (allemaal enkelvoudige stoffen) vaak breuken zijn: 1 2 N2 (g) + 3 2 H2 (g) → NH3 (g)
4.2 Specifieke soorten reactie-enthalpie
De reactie-enthalpie ∆H krijgt vaak een specifieke naam naargelang het type reactie. Naast de vormingsenthalpie zijn dit een paar van de meest voorkomende enthalpiesoorten:
• verbrandingsenthalpie: de enthalpieverandering die optreedt bij de verbranding van 1 mol van een stof;
• sublimatie-enthalpie: de enthalpieverandering die optreedt bij de sublimatie van 1 mol van een stof;
• dissociatie-enthalpie: de enthalpieverandering die optreedt bij de dissociatie van 1 mol van een zout;
• bindingsenthalpie: de enthalpie die nodig is om 1 mol van een binding te breken;
• neutralisatie-enthalpie: de warmte die vrijkomt bij de reactie van 1 mol hydroxide-ionen en 1 mol hydroxoniumionen.
We zouden ook ‘verdampingsenthalpie’ kunnen definiëren: de warmte die nodig is om 1 mol vloeistof om te zetten in 1 mol gasvormige toestand. Zo heeft water bijvoorbeeld 44 kJ mol nodig om te verdampen. Als je uit de douche stapt en het water op je huid begint te verdampen, zal het die warmte onttrekken aan je lichaam. Vandaar dat je het koud hebt als je uit de douche stapt, ook al sta je in een lekker verwarmde badkamer. Je hersenen krijgen immers een signaal van je lichaam dat er warmte verloren gaat.

Denk eraan: de vormingsenthalpie van enkelvoudige stoffen is altijd gelijk aan 0!
4.3 De wet van Hess
Wanneer een systeem overgaat van toestand A naar toestand B als gevolg van 1 of meerdere fysische of chemische processen, dan kan de toestandsverandering meestal langs 1 of meerdere wegen verlopen. In thema 01 zag je al dat een chemische reactie vaak bestaat uit meerdere deelreacties.
De enthalpieverandering zal altijd hetzelfde zijn, welke weg er ook gekozen wordt. Dat is een gevolg van de wet van behoud van energie. Het verschil in enthalpie is altijd gelijk aan het verschil in de enthalpie-inhoud van de reactieproducten en de reagentia, onafhankelijk van de gevolgde weg:
∆H = HP – HR
Bij chemische reacties wordt de wet van behoud van energie geformuleerd als de wet van Hess:
Als een reactie kan worden geschreven als de som van 2 of meerdere deelreacties, dan is de reactie-enthalpie gelijk aan de som van de reactie-enthalpie van de deelreacties.
Het maakt niet uit of je in 1 of meerdere stappen van de begintoestand naar de eindtoestand gaat of welk traject je kiest. De enthalpieverandering blijft hetzelfde.
De wet van Hess laat toe om een reactie-enthalpie te berekenen die niet bekend is. Je schrijft een reactie dan als de som van een aantal deelreacties waarvan je de reactie-enthalpie wel kent.
1 Bereken uit de gegeven reactie- en vormingsenthalpie de vormingsenthalpie voor de vorming van koolstofmonoxide.
Gegeven:
• ∆Hf CO2 = –394 kJ mol
• CO(g) + 1 2 O2 (g) → CO2 (g)
Gevraagd: ∆Hf CO(g) = ?
∆H = –283 kJ mol
Oplossing: De gevraagde vormingsenthalpie wordt in reactievorm: C(s) + 1 2 O2 (g) → CO(g) Uit de 2 gegevens kun je de gevraagde ∆Hf berekenen. Je schrijft eerst alle gegevens in de vorm van reacties door de definities toe te passen:
CO2 (g): C(s) + O2 (g) → CO2 (g)
CO(g) + 1 2 O2 (g) → CO2 (g)
∆Hf = –394 kJ mol
∆Hf = –283 kJ mol
Soms moet je vermenigvuldigen met een bepaalde factor en/of reacties omkeren. Dan moet je conform ook het teken of de waarde van ∆H aanpassen. Door hier de 2e gegeven reactie om te keren (opgelet: verander dan ook het teken van ∆H), zie je dat de gevraagde reactie de som wordt van de 2 deelreacties waarvan je wel de reactie-enthalpie kent:
C(s) + O2 (g) → CO2 (g)
CO2 (g) → CO(g) + 1 2 O2 (g)
∆Hf = –394 kJ mol
∆H = +283 kJ mol +
C(s) + 1 2 O2 (g) → CO(g)
Antwoord: ∆Hf CO(g) = –111 kJ mol
∆Hf = –111 kJ mol
2 Bereken uit de gegeven reactie- en vormingsenthalpieën de vormingsenthalpie voor de vorming van methaan.
Gegeven: • CH4 (g) + 2 O2 (g) → CO2 (g) + 2 H2O(g)
• ∆Hf CO2 (g) = –394 kJ mol
• ∆Hf H2O(g) = –286 kJ mol
Gevraagd: ∆Hf CH4 (g) = ?
of: C(s) + 2 H2 (g) → CH4 (g)
∆H = –890 kJ mol
∆Hf = ?
Oplossing: Je schrijft de gegevens opnieuw in de vorm van reacties en probeert de globale reactie te bekomen door de som te maken van de ‘deelreacties’. Ook nu zul je soms moeten vermenigvuldigen met een bepaalde factor en/of reacties moeten omkeren en conform het teken of de waarde van ∆H moeten aanpassen.
C(s) + O2 (g) → CO2 (g) ∆Hf CO2 (g) = –394 kJ mol
2 (H2 (g) + 1 2 O2 (g) → H2O(g))
H = 2 · ∆Hf H2O(g) = 2 · (–286 kJ)= –572 kJ
CO2 (g) + 2 H2O(g) → CH4 (g) + 2 O2 (g) ∆H = +890 kJ mol + C(s) + 2 H2 (g) → CH4 (g)
Als je de wet van Hess toepast, bekom je:
∆Hf CH4 (g) = –394 kJ – 572 kJ + 890 kJ = –76 kJ mol
Antwoord: ∆Hf CH4 (g) = –76 kJ mol
• Een enthalpieverandering gemeten bij 25 °C en 1 013 hPa staat vermeld in tabellen.
• De vormingsenthalpie ∆Hf is de reactie-enthalpie (of enthalpieverandering) die optreedt bij de vorming van 1 mol van een verbinding uit de enkelvoudige stoffen bij 25 °C en 1 013 hPa.
• Soorten reactie-enthalpie: –verbrandingsenthalpie: de enthalpieverandering die optreedt bij de verbranding van 1 mol van een stof –sublimatie-enthalpie: de enthalpieverandering die optreedt bij de sublimatie van 1 mol van een stof –dissociatie-enthalpie: de enthalpieverandering die optreedt bij de dissociatie van 1 mol van een zout –bindingsenthalpie: de enthalpie die nodig is om 1 mol van een binding te breken –neutralisatie-enthalpie: de warmte die vrijkomt bij de reactie van 1 mol hydroxideionen en 1 mol hydroxoniumionen
• Bij chemische reacties wordt de wet van behoud van energie geformuleerd als de wet van Hess: als een reactie kan worden geschreven als de som van 2 of meerdere deelreacties, dan is de reactie-enthalpie gelijk aan de som van de reactie-enthalpie van de deelreacties.
Uit vorige hoofdstukken weet je al dat een systeem altijd streeft naar een zo laag mogelijke energie-inhoud. Dat is ook de reden waarom atomen bindingen aangaan. De totale energie blijft echter behouden. Er gebeuren alleen energieomzettingen. Dat kan echter niet de enige drijfveer zijn waarom reacties al dan niet spontaan verlopen. Het is immers niet zo dat enkel exotherme reacties spontaan plaatsvinden. Er bestaan heel wat endotherme processen die spontaan gebeuren. Denk bijvoorbeeld maar aan de verdamping van water (44 kJ mol ) of het oplossen van NH4Cl (29 kJ mol ) in water.
Het streven naar een minimale energie-inhoud is dus niet de enige drijfveer van een chemische reactie. Alle gassen zouden anders spontaan condenseren, vloeistoffen zouden stollen …
We bestuderen opnieuw de beweging van moleculen in de verschillende aggregatietoestanden. In het 3e jaar leerde je al hoe het deeltjesmodel eruitziet:
• Vaste stoffen: de moleculen bewegen niet meer vrij. Ze zitten vast in een rooster.
• Vloeistoffen: de moleculen bewegen in beperkte mate, rollend over elkaar.
• Gassen: de moleculen kunnen vrij bewegen.
Als endotherme reacties spontaan verlopen, zie je dat de bewegingsvrijheid van de moleculen, de wanorde van het systeem, telkens toeneemt. Die maat van wanorde van een systeem noem je de entropie S (met als eenheid J K ). De verandering in entropie die optreedt bij een reactie, duid je aan met ∆S
Als de wanorde toeneemt, is ∆S > 0. Als de wanorde afneemt, is ∆S < 0.
Heb je jezelf ooit afgevraagd waarom een scheutje melk dat je aan koffie toevoegt, zich spontaan in die koffie verspreidt? De moleculen van beide vloeistoffen gaan door elkaar heen zitten. Er wordt meer wanorde gecreëerd. Het omgekeerde proces zul je nooit spontaan zien gebeuren: de melk zal niet spontaan uit de koffie gaan samentrekken. De wanorde zou dan immers afnemen. Vergelijk het met je slaapkamer: de wanorde verhoogt spontaan na verloop van tijd, maar het opruimen gebeurt niet vanzelf. Daar is jouw energie voor nodig.
De entropiewaarde voor 1 mol stof wordt uitgedrukt in J mol · K bij 25 °C en 1 013 hPa.
Er zijn dus 2 drijfveren voor een chemische reactie:
1 het streven naar een minimale enthalpie (∆H < 0);
2 het streven naar een maximale entropie (∆S > 0).

Beide termen (∆H en ∆S) kunnen zowel positief als negatief zijn. Of een reactie al dan niet spontaan zal plaatsvinden, kun je afleiden uit de definitie van de Gibbs vrije energie (∆G).
De Gibbs vrije energie (∆G) is de enthalpieverandering, gecorrigeerd met die hoeveelheid aan energie die door het systeem zelf wordt gebruikt om interne wanorde te scheppen (∆S):
Een proces verloopt spontaan als ∆G < 0.
De enige variabele in de gelijkheid waar je een invloed op hebt, is de temperatuur T.
De drijfveren voor een chemische reactie kun je dus samenvatten in 1 voorwaarde:
Er is een streven naar een minimum aan vrije energie: ∆G < 0.
We bekijken een aantal mogelijkheden om een negatieve ∆G te verkrijgen, waarbij de factoren enthalpie en entropie kunnen samenwerken of elkaar tegenwerken:
• Beide factoren zijn gunstig om ∆G negatief maken, namelijk ∆H < 0 en ∆S > 0.
→ De reactie verloopt exo-energetisch en met een toename van wanorde: spontane aflopende reactie, ∆G < 0.
• Beide factoren zijn ongunstig om ∆G negatief maken, namelijk ∆H > 0 en ∆S < 0.
→ De reactie verloopt endo-energetisch en met een afname van wanorde: nooit spontaan, ∆G > 0.
• De factoren enthalpie en entropie werken elkaar tegen:
∆H en ∆S zijn positief.
→ De reactie verloopt endo-energetisch en met een toename van wanorde.
∆H en ∆S zijn negatief.
→ De reactie verloopt exo-energetisch, maar met een afname van wanorde.
In die laatste 2 gevallen zal de reactie maar af en toe spontaan opgaan, afhankelijk van de temperatuur. De spontaniteit van de reactie zal afhangen van de onderlinge verhouding in grootteorde van ∆H en ∆S, en kan beïnvloed worden door de enige variabele in de definitie van Gibbs vrije energie: de temperatuur.
We vatten alles samen:
∆S ∆H < 0 exo-energetisch > 0 endo-energetisch
> 0 meer wanorde spontaan spontaniteit afhankelijk van de temperatuur
< 0 minder wanorde spontaniteit afhankelijk van de temperatuur nooit spontaan
VOORBEELDEN GIBBS VRIJE ENERGIE (∆G)
1 C2H6 (g) + 7 2 O2 (g) → 2 CO2 (g) + 3 H2O(g)
ΔH = –1 560 kJ mol , dus exotherm en ΔH < 0
Meer deeltjes rechts van de reactiepijl en dus meer wanorde: ΔS > 0.
De reactie zal spontaan verlopen.
2 C(s) + 2 S(s) → CS2 (s)
Endotherm, ∆H > 0
Er zijn veel minder deeltjes aanwezig na de reactie: ΔS < 0.
De reactie zal niet spontaan verlopen.
3 N2 (g) + 3 H2 (g) → 2 NH3 (g)
Exotherm, ∆H < 0 (–46 kJ), maar er zijn minder deeltjes en minder soorten deeltjes na de reactie: ∆S < 0 (–99 kJ K ). Dit is een reactie waarbij ∆H de negativiteit van ∆G in de hand werkt, maar ∆S die tegenwerkt. Om meer ammoniak te bekomen, kun je echter de tegenwerkende factor in dit geval verkleinen: de reactie zal beter plaatsvinden bij een lage temperatuur. Een lagere temperatuur zal de synthese van ammoniak bevorderen, maar tegelijk vertragen (zie thema 01). Een weloverwogen keuze van temperatuur is dus noodzakelijk.
De maat van wanorde van een systeem noem je de entropie S.
De verandering in entropie die optreedt bij een reactie, duid je aan met ∆S.
Er zijn 2 drijfveren voor een chemische reactie:
1 het streven naar een minimale enthalpie (∆H < 0);
2 het streven naar een maximale entropie (∆S > 0).
Gibbs vrije energie (∆G) is de enthalpieverandering, gecorrigeerd met dat deel van de vrijgekomen of opgeslorpte enthalpie dat door het systeem zelf wordt gebruikt om wanorde te scheppen:
∆G = ∆H – T · ∆S
Een chemische reactie zal altijd spontaan gebeuren als ∆G < 0.
Bereken de reactie-enthalpie van deze reactie door gebruik te maken van de wet van Hess:
PCl5 (g) + H2O(g) → POCl3 (g) + 2 HCl(g)
Vormingsenthalpie:
• ∆Hf POCl3 (g) = –592 kJ mol
• ∆Hf HCl(g) = –92,5 kJ mol
• ∆Hf PCl5 (g) = –399 kJ mol
• ∆Hf H2O(g) = –242 kJ mol
Bereken de reactie-enthalpie van deze reactie:
4 NH3 (g) + 5 O2 (g) → 4 NO(g) + 6 H2O(g)
Vormingsenthalpie:
• ∆Hf NH3 (g) = –46,0 kJ mol
• ∆Hf NO(g) = +90,4 kJ mol
• ∆Hf H2O(g) = –242 kJ mol
Bereken de vormingsenthalpie van methaan, als je weet dat de verbrandingsenthalpie van methaan = –803 kJ mol , de vormingsenthalpie van
CO2 (g) = –394 kJ mol en de vormingsenthalpie van H2O(g) = –242 kJ mol .
Bij de reactie van 100 mL van een zwavelzuuroplossing met 100 mL van een natriumhydroxideoplossing komt er 5,00 kJ vrij. Bereken de molariteit van beide oplossingen. De neutralisatie-enthalpie bedraagt –56,7 kJ mol
Hoeveel kJ komt er vrij als er bij 25 °C en 1 025 hPa 10,0 L zuurstofgas ontstaat uit kaliumchloraat?
Vormingsenthalpie:
• ∆H KClO3 (s) = –391 kJ mol
• ∆H KCl(s) = –435 kJ mol
Bereken de vormingsenthalpie van koolstofdisulfide, als er bij volledige verbranding van 4,00 g koolstofdisulfide 46,2 kJ vrijkomt en de vormingsenthalpie van zwaveldioxide en koolstofdioxide respectievelijk –297 kJ mol en –394 kJ mol bedraagt.
Met de warmte die vrijkomt bij de verbranding van 1,25 kg cokes, kan men de temperatuur van 1 L water laten stijgen van 20,0 °C tot 28,0 °C. Bereken het percentage koolstof in de cokes, in de veronderstelling dat de onzuiverheden niet brandbaar zijn.
• vormingsenthalpie van CO2 (g): –394 kJ mol
• soortelijke warmtecapaciteit van water: 4,19 kJ g · K
Bereken de verbrandingsenthalpie van pyriet (FeS2):
4 FeS2 (s) + 11 O2 (g) → 2 Fe2O3 (s) + 8 SO2 (g)
De vormingsenthalpie van FeS2, Fe2O3 en SO2 is respectievelijk –149 kJ mol , –831 kJ mol en –293 kJ mol .
De reactie-enthalpie ∆H voor de reactie
2 NiS(s) + 3 O2 (g) → 2 NiO(s) + 2 SO2 (g) is gelijk aan –936 kJ.
De vormingsenthalpie (bij 25 °C en 1 013 hPa) van SO2 (g) is –293 kJ mol en die van NiS(s) –73 kJ mol .
Wat is de vormingsenthalpie van NiO(s)?
De vormingsenthalpie (bij 25 °C en 1 013 hPa) van Al2O3 (s) en Fe2O3 (s) is respectievelijk –1 670 kJ mol en –830 kJ mol . Bereken op basis daarvan de reactieenthalpie voor de bereiding van 1 mol ijzer uit aluminiumpoeder en ijzer(III)oxide. Hoeveel joule is er op die manier betrokken bij de productie van 1 kg ijzer?
Hoeveel energie komt er vrij bij de verbranding van 12,70 g Cu? De vormingsenthalpie (bij 25 °C en 1 013 hPa) van CuO is –155 kJ mol .
Gegeven: N2 (g) + O2 (g) → 2 NO(g)
∆H = 181 kJ
Bereken de hoeveelheid warmte die nodig is om N2 om te zetten in 25 L NO (molair gasvolume 22,7 L mol ).
De warmte die vrijkomt bij de verbranding van acetyleen (ethyn), is 1 300 kJ mol Bepaal op basis daarvan de vormingsenthalpie van ethyn.
• ∆Hf CO2 = –394 kJ mol
• ∆Hf H2O = –286 kJ mol
Bereken de vormingsenthalpie van methaan op basis van de volgende thermochemische reactievergelijkingen:
• H2 (g) + 1 2 O2 (g) → H2O(aq) –286 kJ mol
• C(s) + O2 (g) → CO2 (g) –394 kJ mol
• CH4 (g) + 2 O2 (g) → CO2 (g) + 2 H2O(aq) –890 kJ mol
Bereken hoeveel energie er nodig is om bij de thermische ontleding van calciumcarbonaat in calciumoxide en koolstofdioxide 500 mL CO2-gas (bij 25 °C en 1 013 hPa) te ontwikkelen.
Extra gegevens:
• ∆Hf CaO(s) = –636 kJ mol
• ∆Hf CO2 (g) = –394 kJ mol
• ∆Hf CaCO3 (s) = –1 210 kJ mol
Geef de 2 drijfveren (wetten der thermodynamica) bij een chemische reactie. Gebruik de juiste begrippen en leg ze kort uit. Illustreer telkens met een voorbeeld van een chemisch proces.
Bereken de temperatuur waarbij H2O thermisch kan ontbinden.
H2O(g) → H2 (g) + 1 2 O2 (g)
ΔH = 243 kJ mol
ΔS = 50 J mol · K
Bereken de entropieverandering (ΔS) van dit proces:
1 2 H2 (g) + 1 2 I2 (g) → HI(g) ΔH = –8 kJ mol θ = 127 °C (evenwicht)
Bereken of deze reactie spontaan verloopt bij kamertemperatuur (25 °C).
2 SO3 (g) → 2 SO2 (g) + O2 (g) ΔH = +198 kJ
ΔS = +178 J k
Alle stoffen ontbinden (immers ΔS > 0), als de temperatuur maar voldoende hoog is. Beredeneer waarom de ontleding van kalksteen (CaCO3) volgens de onderstaande reactievergelijking niet spontaan verloopt bij 25 °C, maar wel zelfonderhoudend wordt bij θ > 850 °C.
CaCO3 (s) → CaO(s) + CO2 (g)
ΔH = +177,6 kJ mol
ΔS = SCaO + SCO2 – SCaCO3 = +161 J mol · K
In het vorige thema heb je geleerd om de reactiesnelheid te berekenen. Je ging er daar echter van uit dat de reactie in 1 richting verliep (van reagentia naar reactieproducten) en pas eindigde op het ogenblik dat de reagentia (of minstens het limiterende reagens) uitgeput waren.
In dit hoofdstuk bekijk je of dat wel klopt: zal een reactie onder alle omstandigheden volledig aflopend zijn?
L Het onderscheid maken tussen een aflopende reactie en een evenwichtsreactie
L Uitleggen dat een chemische reactie een dynamisch proces is
L Het begrip ‘evenwichtsconstante’ definiëren en opstellen voor een chemische reactie
L De evenwichtsconstante berekenen vanuit de evenwichtsconcentraties voor een gegeven reactievergelijking
L De evenwichtsconcentraties berekenen vanuit de evenwichtsconstante voor een gegeven reactievergelijking
In een chemische reactie heb je tot nu toe altijd een enkele reactiepijl weergegeven, van de reagentia naar de reactieproducten, bijvoorbeeld A + B → C. Volgens de kinetica zijn echter alle reacties in principe omkeerbaar: door onderlinge effectieve botsingen van de reactieproducten kunnen die – via hetzelfde geactiveerd complex – opnieuw worden omgezet in de oorspronkelijke reagentia. Om dat aan te duiden, geef je in een reactie 2 pijlen weer, de evenwichtspijl
Voorbeeld:
H2 (g) + I2 (g) ⇆ (geactiveerd complex) ⇆ 2 HI(g)
Bij sommige reacties treedt de terugreactie bijna niet op. Dat zijn reacties waar de drijfveren (∆H < 0, ∆S > 0, ∆G < 0) zo sterk zijn dat ze alleen maar kunnen verlopen van de reagentia naar de reactieproducten. De terugreactie verloopt zo moeizaam dat ze bijna niet plaatsvindt. Dat noem je aflopende reacties. Er grijpen concentratie- en snelheidsveranderingen plaats tot minstens 1 van de reagentia opgebruikt is, de reactiesnelheid 0 wordt en de reactie stopt.
Denk eraan: als 1 reagens in overmaat aanwezig is, kun je de aanwezigheid ervan na de beëindiging van de reactie aantonen, samen met de aanwezigheid van de gevormde reactieproducten.
VOORBEELD AFLOPENDE REACTIE (IN EEN OPEN SYSTEEM)
Mg(v) + 2 HCl(aq) → MgCl2 (aq) + H2 (g) ∆H < 0, ∆S > 0, ∆G < 0
Het waterstofgas kan ontsnappen en het reagens Mg reageert volledig weg. Je gebruikt dan ook een enkele reactiepijl (naar rechts) in plaats van de evenwichtspijl. Het is een aflopende reactie
In tegenstelling tot bij de aflopende reactie die we hierboven bespraken, is het ook mogelijk dat de terugreactie spontaan optreedt. In dat geval kun je op het ogenblik dat de reactie (schijnbaar) is stilgevallen, nog altijd de aanwezigheid van alle reagentia en alle reactieproducten aantonen. Zo’n reactie noem je een evenwichtsreactie.
DEMO
Evenwichtsreactie
Onderzoeksvraag
Is de reactie tussen FeCl3 en KSCN in gelijke stofhoeveelheden en in een open systeem een aflopende reactie of een evenwichtsreactie?
Werkwijze
1 Als je gelijke stofhoeveelheden lichtgeel gekleurde FeCl3-oplossing en kleurloze KSCN-oplossing samenvoegt, ontstaat er een rode oplossing. De essentiële reactievergelijking stel je als volgt voor:
Fe3+(aq) + SCN-(aq)
FeSCN2+(aq) lichtgeel kleurloos rood
2 Je laat het reactiemengsel geruime tijd staan en mag er dus van uitgaan dat de reactie een eindpunt heeft bereikt.
3 Toch kun je, naast de aanwezigheid van het typisch rood gekleurde complexion FeSCN2+, ook nog altijd de aanwezigheid van Fe3+- en SCN--ionen aantonen met behulp van respectievelijk een NaOH-oplossing en een AgNO3-oplossing. Die indicatoren werken als volgt:
AANTONEN VAN …
INDICATOR
POSITIEVE REACTIE
Fe3+ OH- bruine neerslag van Fe(OH)3
SCN- Ag+ witte neerslag van AgSCN
Tabel 1 Indicatoren om de aanwezigheid van Fe3+- en SCN--ionen aan te tonen
Besluit
Omdat geen van de reagentia in overmaat aanwezig was en je in het reactiemengsel toch alle reagentia en reactieproducten kunt aantonen, moet je besluiten dat de reactie onvolledig (niet aflopend) verloopt.
Maar kan een reactie ook omkeerbaar verlopen?
Daarvoor kun je een andere reactie onderzoeken (die jammer genoeg in een schoollabo niet mogelijk is):
H2 (g) + I2 (g) 2 HI(g)
Als je gelijke hoeveelheden waterstofgas en dijood in een gesloten reactievat brengt (bij een bepaalde temperatuur), zie je dat er na verloop van tijd HI wordt gevormd, maar dat er ook nog H2 en I2 aanwezig blijken te zijn. De reactie verloopt dus onvolledig of niet aflopend
Met behulp van de indicatoren in de onderstaande tabel kun je immers (op elk ogenblik) de aanwezigheid van zowel H2, I2 als HI aantonen.
AANTONEN VAN …
INDICATOR
POSITIEVE REACTIE
H2 lucifer knalgas I2 zetmeel donkerblauw HI lakmoes rood
Je kunt ook de omgekeerde reactie bekijken: als je waterstofjodide in een gesloten reactievat brengt (bij dezelfde temperatuur als hierboven), merk je na verloop van tijd dat er HI overblijft en dat er ook H2 en I2 werden gevormd. De reactie is dus ook omkeerbaar
Je noemt de bovenstaande reacties dan ook omkeerbare reacties of evenwichtsreacties Dergelijke reacties duid je aan met een dubbele pijl: .
Aflopende reactie: een reactie waarbij de terugreactie bijna niet plaatsvindt. Dat kan wanneer de reactieproducten het reactiemidden verlaten, bv. als gas of als neerslag.
Notatie: →
Evenwichtsreactie: een reactie die niet aflopend (onvolledig) en omkeerbaar is.
Notatie: ⇆
WEETJE
In principe is elke reactie ‘omkeerbaar’: de producten kunnen opnieuw worden omgezet in de reagentia, al dan niet spontaan. Je spreekt enkel van een omkeerbare reactie als de heenen terugreactie bij dezelfde temperatuur en druk verlopen.
Voorbeeld 1:
2 H2 (g) + O2 (g) → 2 H2O(g) Voor de synthesereactie heb je een vlam of een vonk nodig.
2 H2O(g) → 2 H2 (g) + O2 (g) Voor de analysereactie moet je elektrische energie blijven toevoegen.
De synthese en analyse verlopen onder verschillende reactieomstandigheden. De reactie is niet omkeerbaar.
Voorbeeld 2:
N2 (g) + 3 H2 (g) → 2 NH3 (g)
2 NH3 (g) → N2 (g) + 3 H2 (g)
Beide reacties verlopen bij dezelfde temperatuur en druk. Het zijn omkeerbare reacties. Je kunt ze dus noteren als een evenwichtsreactie: N2 (g) + 3 H2 (g) ⇆ 2 NH3 (g)
2.1
De chemische evenwichtstoestand wordt bereikt als beide reacties (heen- en terugreactie) in gelijke mate verlopen: de snelheid van de heenreactie is gelijk aan de snelheid van de terugreactie (v1 = v2). Er wordt een status quo bereikt. Het is een dynamisch evenwicht. ‘Dynamisch’ wil zeggen dat de reactie nooit stilvalt: de snelheid van de heen- en terugreactie is gelijk, maar niet gelijk aan 0. Er worden (op het moment van chemisch evenwicht) evenveel reagentia omgezet in reactieproducten als omgekeerd.
Het evenwicht wordt bereikt als v1 = v2
Afb 27 De algemene voorstelling van een evenwichtsreactie
Een evenwichtsreactie is een reactie die in een gesloten systeem omkeerbaar en onvolledig verloopt. Je spreekt dan ook van een dynamisch evenwicht, waarbij al de betrokken stoffen (reagentia en reactieproducten) een bepaalde evenwichtsconcentratie hebben bereikt.
Je kunt grafieken gebruiken om data voor te stellen bij evenwichtsreacties. Houd echter rekening met het volgende aandachtspunt.
Bekijk goed welk type grafiek je voor je hebt door te kijken naar de grootheid op de y-as. Er zijn immers meerdere mogelijkheden:
• een grafiek die de reactiesnelheid in functie van het reactieverloop (tijd) weergeeft: v(t)-grafiek;
• een grafiek die de concentraties (of stofhoeveelheden) van de reagentia/reactieproducten weergeeft in functie van het reactieverloop (tijd): c(t)- of n(t)-grafiek.
De grafiek op afbeelding 28 toont het verloop van de snelheid (v) van de heen- en terugreactie. Je ziet de snelheid van de heenreactie (v1) afnemen, aangezien de concentratie van de reagentia ook afneemt naarmate de reactie vordert.
v ( ) mol L · s Afb. 28 De v(t)-grafiek
v 1 = v 2 heenreactie terugreactie v 1 v 2
t (s) chemisch evenwicht
Bekijk je echter de snelheid van de terugreactie (v2), dan zie je dat die in het begin van de reactie 0 is (aangezien er nog geen reactieproduct gevormd werd). Naarmate de reactie vordert, stijgt echter die snelheid v2, aangezien er meer reactieproduct wordt gevormd.
Op een bepaald tijdstip zal de reactiesnelheid van de heenreactie (v1) gelijk zijn aan de reactiesnelheid van de terugreactie (v2): het chemisch evenwicht is bereikt. Op dat tijdstip zal er evenveel aan reagentia worden omgezet naar reactieproducten, als dat er reactieproducten worden omgezet naar reagentia. Je spreekt dan ook van een dynamisch evenwicht.
Bekijk je de c(t)- en n(t)-grafieken (zie afbeelding 29), dan zie je een gelijkaardige beweging: de hoeveelheid reagentia neemt af, terwijl de hoeveelheid reactieproducten toeneemt. Dat gebeurt tot op het moment van chemisch evenwicht: de stofhoeveelheden en concentraties blijven constant. Er wordt immers evenveel aan reagentia omgezet in reactieproducten, als (tegelijkertijd) reactieproducten in reagentia.
evenwicht
(s) chemisch evenwicht
Opgelet: die concentraties/stofhoeveelheden hoeven daarom niet noodzakelijk aan elkaar gelijk te zijn. Dat wordt duidelijk aan de hand van de volgende grafieken. De 4 reacties op de 4 grafieken hieronder geven een evenwicht weer: het moment waarop de concentraties van de reagentia en reactieproducten niet meer veranderen (= concentratie-‘einde’).
Grafiek 1: de reactie A + B ⇆ C + D is een evenwichtsreactie.
Op de 1e grafiek zie je een evenwichtsreactie met een rendement van 50 %: slechts de helft van de reagentia reageert tot reactieproduct (en omgekeerd).
Grafiek 2: de reactie A + B C + D gaat nagenoeg niet op.
Op de 2e grafiek wordt er bijna geen reactieproduct gevormd. Het evenwicht ligt duidelijk naar links (nagenoeg geen reactie). Rendement < 50 %.
Grafiek 3: de reactie A + B C + D is eerder aflopend.
Op de 3e grafiek ligt het evenwicht meer naar rechts: er blijft (bij evenwicht) bijna niets meer over van de reagentia, maar er komen vooral reactieproducten voor. Rendement > 50 %.
Grafiek 4: de reactie 2 A + B ⇆ 3 C + D is een evenwichtsreactie.
Afb. 30 c(t)-grafieken
De 4e grafiek toont een reactie met coëfficiënten verschillend van 1. De grafiek maakt duidelijk dat de concentratie van A 2 keer zoveel daalt als die van B. De concentratie van product C stijgt 3 keer zoveel als de concentratie van B daalt. De concentratiestijging van D is hetzelfde als de concentratiedaling van B. Die tendensen kun je ook afleiden uit de voorgetallen.
VOORBEELD c (t)- EN v(t)-GRAFIEK
31 c(t)- en v(t)-grafieken
Je ziet in de grafieken duidelijk dat:
• de concentratie van de reactieproducten (C en D) bij 0 start en vervolgens toeneemt, waardoor de reactiesnelheid v2 (= reactiesnelheid naar links) start bij 0 mol · L-1 · s-1 en dan langzaam stijgt;
• de concentratie van de reagentia (A en B) daalt naarmate de reactie vordert, waardoor de reactiesnelheid v1 (= reactiesnelheid naar rechts) in het begin hoog is en afneemt naarmate de tijd vordert;
• beide reactiesnelheden (v1 en v2) gelijk worden aan elkaar: de reactie bereikt een evenwicht. Merk op dat daarbij de concentraties wel constant blijven, maar daarom niet gelijk zijn aan elkaar.
2.3 De evenwichtsconstante K c
Je weet al dat een chemisch evenwicht gekenmerkt wordt door 2 reactiesnelheden, v1 en v2. Beide worden gekenmerkt door een eigen reactiesnelheidsconstante, k1 en k2. We maken gebruik van de bijbehorende snelheidswetten om een nieuwe term te definiëren: de evenwichtsconstante K c .
Bekijk deze evenwichtsreactie: v2 A + B ⇆ 2 C + D v1
De reactiesnelheid voor de heen- en terugreactie is: v1 = k1 · [A]t · [B]t v2 = k2 · [C]t2 · [D]t
Op het ogenblik dat het evenwicht wordt bereikt (= de evenwichtstijd te), worden de 2 snelheden gelijk aan elkaar. De reagentia en de reactieproducten bereiken hun evenwichtsconcentraties ([X]e). v1 = v2 of k1 · [A]e · [B]e
Dat is de dynamische evenwichtstoestand, waarbij de heen- en terugreactie onderling in evenwicht zijn en er – per tijdseenheid – evenveel A en B wordt omgezet in C en D als omgekeerd C en D in A en B. Die vergelijking kun je omvormen tot:
[C]e2 · [D]e
[A]e · [B]e = k1 k2 = K c
Het tweede lid van die vergelijking is een verhouding van 2 constante grootheden (de snelheidsconstanten k1 en k2). Bijgevolg is de verhouding van de evenwichtsconcentraties (de concentratiebreuk) ook een constante, specifiek voor een bepaalde evenwichtsreactie bij een bepaalde temperatuur. Die constante noem je de evenwichtsconstante (Kc)
De Noorse wetenschappers Cato Maximilian Guldberg (1836-1902) en Peter Waage (1833-1900) formuleerden in 1867 het bestaan van deze evenwichtswet:
Voor een homogene evenwichtsreactie
a A + b B ⇆ c C + d D
bestaat bij een bepaalde temperatuur een typische evenwichtsconstante (Kc):
K c = [C]ec · [D]ed [A]ea · [B]eb


De evenwichtswet van Guldberg en Waage stelt dat de evenwichtsconstante van een homogene evenwichtsreactie de verhouding is van het product van de evenwichtsconcentraties van de reactieproducten tot het product van de evenwichtsconcentraties van de reagentia.
Elke concentratiefactor is verheven tot een macht waarvan de exponent overeenkomt met de reactiecoëfficiënt van die stof in de evenwichtsreactie.
Omzettingsgraad (α) en rendement (η)
De mate waarin een reactie gerealiseerd is, wordt aangeduid met de omzettingsgraad (α) of het rendement (η)
De omzettingsgraad (α) is:
• de verhouding van de weggereageerde stofhoeveelheid van een reagens tot de maximaal mogelijke weggereageerde stofhoeveelheid (als de reactie aflopend was);
• de verhouding van de gevormde stofhoeveelheid van een reactieproduct tot de maximaal mogelijke gevormde stofhoeveelheid (als de reactie aflopend was). α = ∆n (X) ∆n (X)max
Het rendement (η) van een reactie is de procentuele uitdrukking van α:
= α · 100 %
Een aflopende reactie wordt bijgevolg gekenmerkt door een omzettingsgraad α = 1 en een rendement η = 100 %.
Als er geen omzetting plaatsvindt, geldt α = 0 en een rendement η = 0 %
Bij een chemisch evenwicht variëren beide grootheden tussen de 2 extreme waarden:
0 < α < 1 en 0 % < η < 100 %.
De waarden van α en η zeggen dus iets over de ligging van het evenwicht:
• Bij een grote α en η ligt het evenwicht naar rechts: er wordt veel reactieproduct gevormd.
• Bij een kleine α en η ligt het evenwicht naar links: er wordt relatief weinig reactieproduct gevormd.
Eigenschappen van de evenwichtsconstante K c
Vermits alle factoren in de Kc-uitdrukking concentraties voorstellen, wordt de eenheid van K c bepaald door het aantal concentratiefactoren in de teller en de noemer.
K c (= k1 k2 ) karakteriseert de evenwichtsreactie bij een bepaalde temperatuur. Dat is het logische gevolg van het feit dat de reactiesnelheidsconstanten k1 en k2 afhankelijk zijn van de temperatuur.
K c is een thermodynamische grootheid
K c karakteriseert de ‘ligging’ van het evenwicht bij een bepaalde temperatuur:
• Een grote K c -waarde (K c > 103) betekent dat: –het evenwicht sterk naar rechts ligt (de waarde van de teller is immers groot): de reactie is nagenoeg aflopend; –de omzettingsgraad α en het rendement η groot zijn.
Je noteert de reactie dan als een (nagenoeg) aflopende reactie:
• Een kleine K c -waarde (K c < 10-3) betekent dat: –het evenwicht sterk naar links ligt (de waarde van de teller is immers klein): er is zo goed als geen reactie naar rechts; –de omzettingsgraad α en het rendement η klein zijn.
Je noteert de reactie als een ‘moeilijk opgaande reactie’:
• Een K c -waarde tussen 103 en 10-3 betekent dat de reactie naar links ongeveer even vlot verloopt als de reactie naar rechts. Je noteert die reactie als een ‘echte’ evenwichtsreactie: ⇆
Opgelet: de grootte van K c zegt niets over de reactiesnelheid.
1 De volgende reactie vindt plaats:
2 NH3 (g) ⇆ N2 (g) + 3 H2 (g)
In een reactievat van 1,00 L brengt je 3,00 mol NH3.
Nadat het evenwicht is ingesteld, blijkt er 1,50 mol waterstofgas gevormd te zijn. De temperatuur blijft constant.
a Wat is de formule voor de evenwichtsconstante van die reactie?
b Bereken de evenwichtsconstante.
c Bereken de omzettingsgraad en het rendement van die reactie.
Gegeven:
• n0 (NH3) = 3,00 mol
• n e (H2) = 1,50 mol
• V = 1,00 L
Gevraagd: • K c = ?
• α = ?
• η = ?
Oplossing:
n0 (mol) 3,00
∆n (mol) – 1,00
K c = [N2]e · [H2]e3 [NH3]e2 = 0,50 · (1,50)3 (2,00)2 = 0,42 mol2 L2
α = Δn (X) Δn (X)max = Δn (NH3) Δn (NH3)max = –1,00 mol –3,00 mol = 0,333
η = α · 100 % = 33,3 %
Merk op: je berekende nu de omzettingsgraad voor ammoniak, maar dat kan met elk reagens of reactieproduct:
α = Δn (N2) Δn (N2)max = 0,50 mol 1,5 mol = 0,33
α = Δn (H2) Δn (H2)max = 1,50 mol 4,50 mol = 0,333
2 Je mengt de gassen A en B in een vat van 2,00 L.
De reactie verloopt als volgt:
A + 2 B ⇆ C + D
Bij een bepaalde temperatuur is de waarde van de evenwichtsconstante gelijk aan 8,00 L mol .
De evenwichtsconcentraties van A en B zijn allebei 2,00 mol L .
a Hoe groot is de concentratie van D bij die temperatuur?
b Hoeveel mol A was er oorspronkelijk aanwezig?
c Wat zijn het rendement en de omzettingsgraad van die reactie?
Gegeven:
• V = 2,00 L
Gevraagd:
• [A]e = 2,00 mol L
• [B]e = 2,00 mol L
• K c = 8,00 L mol
• [C]0 = [D]0 = 0,00 mol L
• [D]e = ?
• n0 (A) = ?
• α = ?
• η = ?
Oplossing: a K c = [C]e · [D]e [A]e · [B]e2 = 8,00 L mol
Per mol C die gevormd wordt, wordt er ook 1 mol D gevormd. Dat wil zeggen dat [C]e = [D]e:
K c = [D]e · [D]e [A]e · [B]e2 = 8,00 L mol
[D]e2 = 8,00 · [A]e · [B]e2 = 8,00 · 2,00 · 2,002 [D]e = 64,0 = 8,00 mol · L-1
b Uit de opgave:
n0 (mol)
∆n (mol)
n e (mol) 4,00 4,00
[ ]e (mol · L-1) 2,00 2,00
Uit het antwoord op vraag a haal je dat de concentratie van zowel C als D (bij evenwicht) gelijk is aan 8,00 mol · L-1. De stofhoeveelheden zijn dus 16,0 mol (want er is een totaalvolume van 2,00 L).
[ ]e (mol · L-1) 2,00 2,00
Dat wil zeggen dat er 16,0 mol gevormd is bij C en D, en dus 16,0 mol A is weggereageerd. Aangezien er per mol A 2 mol B wegreageert, is er bij evenwicht 32,0 mol B weggereageerd:
Zo kun je de oorspronkelijke stofhoeveelheden van A en B berekenen:
Op die manier is vraag b beantwoord: de oorspronkelijke stofhoeveelheid van reagens A bedroeg 20,0 mol.
c α = Δn (A)
Δn (A)max = –16,0 mol –18,0 mol = 0,889
Er kan maximaal 18,0 mol van stof A wegreageren, aangezien B het limiterende reagens is en A in overmaat aanwezig is.
Er is 36,0 mol B aanwezig en per mol A reageert er 2 mol B weg.
Er kan dus maximaal 18,0 mol A wegreageren.
η = α · 100 % = 88,9 % of α = Δn (B)
Δn (B)max = –32,0 mol –36,0 mol = 0,889
Tijdens een chemisch evenwicht verlopen beide tegengestelde reacties in gelijke mate: de snelheid van de heenreactie (v1) is gelijk aan de snelheid van de terugreactie (v2). Alle betrokken stoffen hebben een bepaalde (constante) evenwichtsconcentratie bereikt.
Je spreekt van een dynamisch evenwicht: de reactie ‘pauzeert’ niet op een bepaald ogenblik (en bij bepaalde concentraties), maar er worden tegelijkertijd evenveel reagentia omgezet in reactieproducten, als reactieproducten in reagentia.
Voor een reactie in een homogeen midden bestaat er bij een bepaalde temperatuur een typische evenwichtsconstante K c: de verhouding van het product van de evenwichtsconcentraties van de reactieproducten tot het product van de evenwichtsconcentraties van de reagentia.
Algemene voorstelling: a A + b B ⇆ c C + d D K c = [C]eC · [D]ed [A]e a · [B]eb
De grootte van die evenwichtsconstante bepaalt de ligging van het evenwicht:
• grote Kc-waarde (K c > 103) → evenwicht naar rechts (nagenoeg aflopende reactie);
• kleine Kc-waarde (K c < 10-3) → evenwicht naar links (nagenoeg geen reactie);
• K c -waarde tussen 10-3 en 103 → evenwichtsreactie.
Ook de omzettingsgraad (α) en het rendement (η) geven een indicatie van de ligging van het chemisch evenwicht:
α en η groot evenwicht naar rechts
α en η klein evenwicht naar links
Je brengt 1,00 mol SO3 in een reactievolume van 1 L. Als er evenwicht is, bevat het vat 0,60 mol SO2
Bereken de evenwichtsconstante voor het homogene evenwicht 2 SO3 (g) ⇆ 2 SO2 (g) + O2 (g).
Gegeven: de reactie in homogeen midden
CO(g) + H2O(g) ⇆ CO2 (g) + H2 (g).
Daarbij is K c = 0,63.
Een mengsel van 1,00 mol water en 3,00 mol koolstofmonoxide reageert tot evenwicht in een volume van 1,00 L. Hoeveel mol van elk gas vind je bij dat evenwicht?
In een vat van 2,00 L bevindt zich 1,00 mol NH4Cl in dampvorm. Men voert de temperatuur zo hoog op dat 3 4 van het NH4Cl reageert volgens de vergelijking
NH4Cl(g) ⇆ NH3 (g) + HCl(g).
Bereken de evenwichtsconstante bij die temperatuur.
Bekijk de volgende reactie:
H2 (g) + I2 (g) ⇆ 2 HI(g)
De evenwichtsconstante voor de bovenstaande reactie bedraagt 54 bij 700 K. Bij die temperatuur wordt een mengsel van waterstofgas, chloorgas en waterstofjodide, elk met een concentratie van 0,020 mol L , in een container gebracht. Welke uitspraak is juist?
a De reactie gaat op naar rechts om meer HI te produceren.
b Bij evenwicht is de concentratie aan HI gelijk aan 0,010 mol L .
c Bij evenwicht geldt dat de concentraties van alle drie de stoffen gelijk zijn.
d Er verandert niets, vermits het systeem in evenwicht is.
Een ruimte van 2,00 L waarin de reactie
CO(g) + Cl2 (g) ⇆ COCl2 (g) een evenwichtstoestand heeft bereikt, bevat 0,60 mol CO, 0,40 mol Cl2 en 1,60 mol COCl2. Bereken de evenwichstconstante.
Bij het evenwicht 2 HI(g) ⇆ H2 (g) + I2 (g) bedraagt
K c = 60 bij 396 °C. Bereken de concentratie aan waterstofgas, als je weet dat de concentratie aan I2 gelijk is aan 0,10 mol L en de concentratie aan HI gelijk is aan 1,00 mol L .
Je brengt 5,00 mol PCl5 in een vat van 5,00 L
bij 200 °C. Bereken de concentratie aan Cl2 en PCl3 nadat het evenwicht PCl5 (g) ⇆ PCl3 (g) + Cl2 (g) zich
heeft ingesteld, als K c = 0,030 mol L bij 200 °C.
Je mengt 2,00 mol CO en 1,00 mol H2O. Als je het mengsel verwarmt tot 1 260 K, vind je 0,60 mol waterstofgas. Bereken K c van de betrokken reactie bij 1 260 K.
Wanneer je bij kamertemperatuur 2,0 mol ethanol mengt met 2,0 mol ethaanzuur, bekom je 1,3 mol ethylethanoaat.
a Bereken de evenwichtsconstante van de reactie:
C2H5OH(vl) + CH3COOH(vl) ⇆ CH3COOC2H5 (vl) + H2O(vl)
b Hoeveel mol ethylethanoaat bekom je als je uitgaat van 2,0 mol ethanol en 3,0 mol ethaanzuur?
Bij 240 °C breng je 10,0 mol PCl5 in een vat van 20,0 L. Het volgende evenwicht stelt zich in:
PCl5 (g) ⇆ PCl3 (g) + Cl2 (g)
Het rendement bedraagt 23 %.
Bereken K c .
Meer oefenen? Ga naar .
Uit het vorige hoofdstuk weet je dat in een gesloten systeem en een homogeen midden reacties omkeerbaar en dus onvolledig verlopen. Je hebt daarbij ook de evenwichtsconstante leren berekenen, om zo in te schatten of de reactie een hoog of laag rendement (of grote of kleine omzettingsgraad) heeft (en dus waar het evenwicht ligt).
In dit hoofdstuk bekijk je welke factoren een invloed hebben op de ligging van het chemisch evenwicht van chemische reacties. Je leert dat zowel kwalitatief als kwantitatief uit te werken.
L De wet van Le Chatelier-Van ’t Hoff toepassen op chemische reacties
L Het belang van de invloed van factoren zoals concentratie, volumeverandering en temperatuur op de ligging van het chemisch evenwicht illustreren
1 Principe van Le Chatelier-Van ’t Hoff
Je kunt een chemisch evenwicht verstoren door de reactiesnelheid van de heen- of terugreactie selectief te veranderen. Uit de snelheidswet weet je dat dat kan gebeuren door:
• concentratieveranderingen (volume- en/of drukveranderingen bij gasreacties komen neer op concentratieveranderingen van alle gasvormige bestanddelen);
• temperatuurveranderingen.
In de praktijk beïnvloedt men vaak de ligging van het chemisch evenwicht met de bedoeling om de omzetttingsgraad en dus het rendement van de reactie te verhogen of te verlagen (bij een ongewenste nevenreactie).
Een chemisch evenwicht zal na een verandering namelijk altijd die verandering opvangen en opschuiven naar een nieuwe evenwichtstoestand. Bij een verstoring van de concentratie van 1 of meerdere stoffen verschuift het evenwicht, opdat de geldende Kc-waarde behouden blijft. Na een temperatuurverandering zal het evenwicht ook opnieuw worden ingesteld, maar dan bij een andere specifieke K c voor die temperatuur. Die verschuiving van het chemisch evenwicht wordt beschreven in het principe van Le Chatelier-Van ’t Hoff. Synoniemen zijn het chemisch traagheidsbeginsel of het principe van de kleinste dwang
Opmerking:
Denk eraan dat de hier beschreven regels over wijzigingen in de ligging van het chemisch evenwicht enkel geldig zijn in een gesloten systeem. Zo worden alle evenwichtsreacties in een open systeem aflopend als 1 van de gevormde reactieproducten aan het reactiemengsel wordt onttrokken door gasvorming of neerslagvorming. De concentratie van de onttrokken stof wordt immers gelijk aan 0. Het evenwicht wordt dus voortdurend verplaatst naar rechts, tot minstens 1 van de reagentia is opgebruikt.
Concreet kan de ligging van het chemisch evenwicht gewijzigd worden door deze factoren:
• de concentratieverandering van 1 stof;
• de concentratieverandering van alle stoffen (door een wijziging van druk of volume);
• de temperatuur.
We bekijken die factoren van dichterbij.
EVENWICHTSTOESTAND
VERSTORING: NIEUWE STOF TOEGEVOEGD NIEUWE EVENWICHTSTOESTAND
Afb. 33 Een chemische evenwichtsreactie Afb 34 Een verstoring van het chemisch evenwicht Afb 35 De nieuwe evenwichtstoestand
Omdat de evenwichtsconstante K c onafhankelijk is van de beginconcentraties, kun je de veranderingen als gevolg van een concentratieverandering verklaren met behulp van K c .
Om dat correct toe te lichten, gebruiken we de concentratiebreuk Q. Om het effect van een verandering in te schatten, vergelijkt men K c van het evenwicht vaak met de concentratiebreuk. Die bevat ook de concentraties van elke stof, maar dat zijn niet de evenwichtsconcentraties zoals bij Kc, maar de concentraties op het moment van de veranderingen.
Voor een homogene evenwichtsreactie a A + b B ⇆ c C + d D
bestaat bij een bepaalde temperatuur een typische evenwichtsconstante (Kc):
K c = [C]ec · [D]ed [A]ea · [B]eb
Bij een beïnvloedende factor zullen 1 of meerdere concentraties veranderen en zul je een concentratiebreuk Q kunnen bepalen op dat tijdstip t:
Q = [C]tc · [D]td [A]ta · [B]tb (dus t in plaats van e!)
Door Q te vergelijken met Kc, die opnieuw bereikt moet worden, kun je achterhalen hoe het evenwicht zich moet verplaatsen: naar links of naar rechts.
Optie 1:
Q > K c (bijvoorbeeld door C toe te voegen): als Q groter is dan Kc, dan wordt de waarde van K c bereikt als de concentraties in de noemer vergroten en die in de teller verkleinen, doordat C en D worden omgezet naar A en B. Het evenwicht verschuift naar links
Optie 2:
Q < K c (bijvoorbeeld door A toe te voegen): het evenwicht moet zich verplaatsen naar rechts
Je kunt Q ook gebruiken bij het ontstaan van het evenwicht. Q geeft dan de status van de reactie aan.
Algemeen:
Bij een concentratieverandering evolueert het reactiemengsel spontaan naar een nieuwe evenwichtstoestand door een tijdelijke overheersing van de reactie die de concentratieverandering tegenwerkt.
Dus:
• Een toename van de concentratie van de stofdeeltjes in een bepaald lid van de reactievergelijking veroorzaakt een verplaatsing van het evenwicht naar het andere lid, zodat uiteindelijk de concentratietoename wordt tegengewerkt.
• Een afname van de concentratie van de stofdeeltjes in een bepaald lid van de reactievergelijking veroorzaakt een verplaatsing van het evenwicht naar dat lid, zodat uiteindelijk de concentratieafname wordt tegengewerkt.
K c blijft daarbij constant, terwijl het rendement en de omzettingsgraad veranderen.
VOORBEELD
Berekeningen
Gegeven is deze evenwichtsreactie:
v2
Fe3+(aq) + SCN-(aq) ⇆ FeSCN2+(aq) ΔH < 0 v1
1 Stel dat je, nadat het evenwicht is ingesteld, bij een bepaalde temperatuur de volgende evenwichtsconcentraties vindt:
[Fe3+]e = 2,0 mol · L-1 [SCN-]e = 5,0 mol · L-1 [FeSCN2+]e = 10 mol · L-1
Dan is K c = [FeSCN2+]e [Fe3+]e · [SCN-]e = 10 mol L 2,0 mol L · 5,0 mol L = 1,0 L mol
2 Stel dat je Fe3+ aan het mengsel in evenwicht toevoegt, zodat [Fe3+] = 6,0 mol · L-1. Het evenwicht is verstoord, want de concentratiebreuk Q is 10 6,0 · 5,0 = 0,33 L mol . Die waarde is kleiner dan de evenwichtsconstante K c . Het evenwicht zal naar rechts verschuiven.
Als er nu 2,0 mol Fe3+ met 2,0 mol SCN- reageert tot 2,0 mol FeSCN2+, dan wordt het evenwicht hersteld:
[Fe3+]e2 = (6,0 – 2,0) mol · L-1 = 4,0 mol · L-1
[SCN-]e2 = (5,0 – 2,0) mol · L-1 = 3,0 mol · L-1
[FeSCN2+]e2 = (10,0 + 2,0) mol · L-1 = 12 mol · L-1
K c = 12 mol L 4,0 mol L · 3,0 mol L = 1,0 L mol
v1 = k1 · [Fe3+] · [SCN-] en v2 = k2 · [FeSCN2+]
Aangezien de concentratie aan FeSCN2+ groter wordt, zal die reactie tijdelijk dus ook sneller verlopen. Grafisch zie je dat v2 tijdelijk toeneemt. Het evenwicht verplaatst zich naar rechts.
Grafische voorstellingen
[Fe3+] [SCN-] [FeSCN2+] c ( ) mol L 5,0 10,0 15,0 t e ’ [Fe3+]↑ t e t (s)
0 0
1 v 1 = v 2 v 2
0 v ( ) mol L · s t e ’ [Fe3+]↑ t e t (s)
Afb 36 Grafische voorstellingen van het effect van een concentratieverandering van 1 stof op de concentraties van alle stoffen (links) en de heen- en terugreactiesnelheid (rechts)
t e = tijdstip waarop het eerste evenwicht wordt bereikt [Fe3+]↑ = tijdstip waarop extra Fe3+ wordt toegevoegd
t’ e = tijdstip waarop het nieuwe evenwicht wordt bereikt
Transport van O2 in het menselijk lichaam
Zuurstoftransport
Hemoglobine bindt met zuurstofgas tot oxyhemoglobine. De opname en afgifte van dizuurstof kun je weergeven in een evenwichtsreactie:
weefsels
Hb(aq) + 4 O2 (g) Hb(O2)4 (aq)
longen
In de longen is de concentratie aan zuurstofgas groot. Het evenwicht verschuift er dus naar rechts. De hemoglobine verbindt zich met het zuurstofgas. Daarbij wordt er oxyhemoglobine gevormd. Dat zuurstofrijke bloed wordt vanuit de longen vervolgens naar andere lichaamsdelen getransporteerd.
In weefsels, waar de concentratie aan zuurstofgas laag is, ontbindt oxyhemoglobine tot hemoglobine en O2: het evenwicht verschuift naar links.
CO-vergiftiging
We hebben het de voorbije jaren al regelmatig over CO-vergiftiging gehad. Als je lucht inademt die veel CO bevat (door een onvolledige verbranding in kachels, fornuizen en boilers, door de uitlaatgassen van auto’s, als je sigarettenrook inhaleert ...), kan dat een ernstige CO-intoxicatie veroorzaken.
Maar wat is dat nu precies?
Zowel zuurstofgas als koolstofmonoxide kan binden op hemoglobinemoleculen:
Hb(aq) + 4 CO(g) ⇆ Hb(CO)4 (aq)
Hb(aq) + 4 O2 (g) ⇆ Hb(O2)4 (aq)
Percentage CO in bloed
Veelvoorkomende symptomen
Levensbedreigend als de patiënt niet wordt verwijderd van de CO-bron
Bewusteloosheid, beroerte
Bonzende hoofdpijn, verwardheid, kortademigheid, toenemend wazig zicht, ongecontroleerd, gevoel van evenwichtsverlies
Ademhalingsmoeilijkheden, verminderd beoordelingsvermogen, toenemende slaperigheid, hoofdpijn, wazig zicht
Hoofdpijn, ademhalingsfrequentie neemt toe, lichte slaperigheid
Lichte hoofdpijn
Geen symptomen
Afb 38 CO-vergiftiging
Alleen doet CO dat beter dan O2: hemoglobine heeft een hogere affiniteit voor CO dan voor O2. De evenwichtsconstante voor de binding tussen Hb en CO is namelijk 250 keer groter dan die voor de binding tussen Hb en O2.
Dat betekent dat zelfs een heel kleine partiële druk van CO ter hoogte van de longblaasjes volstaat om zo goed als alle aanwezige hemoglobine met CO te verzadigen in plaats van met O2. Het bloed dat naar de cellen van de weefsels en de organen vertrekt, draagt dan bijna geen gebonden zuurstofgas meer mee: de brandstof die cellen nodig hebben voor hun celprocessen, ontbreekt dus. Het bloed blijft ook blauwpaars en laat de cellen (ook de hersencellen) achter met een dodelijk tekort aan zuurstofgas.
Een door CO vergiftigde persoon moet onmiddellijk worden behandeld met lucht die een extra hoeveelheid O2 bevat (waardoor het evenwicht in de 2e evenwichtsreactie naar rechts verschuift). Dat gebeurt in een speciale compressie- of drukkamer. In ergere gevallen kan men rechtstreeks methyleenblauw in de bloedbaan brengen. Daardoor zal de CO loskomen van de hemoglobinemoleculen en reageren met het methyleenblauw.
De partiële druk of partieeldruk van een gas in een mengsel is dat deel van de druk van het mengsel dat afkomstig is van dat gas.
a, b, c en d zijn de exponenten die bij de concentraties horen.
3 Druk- of volumeverandering (concentratieverandering van alle stoffen)
Bekijk deze evenwichtsreactie: 2 a A + b B ⇆ c C + d D ΔH < 0 1
Bij evenwicht geldt:
1: exotherm
2: endotherm
K c = [C]ec · [D]ed [A]ea · [B]eb
Als je het reactievolume vermeerdert (door bij oplossingen bijvoorbeeld water toe te voegen of bij reacties in gasfase de druk te verminderen), beïnvloed je de concentratie van alle aanwezige stoffen. De concentratiegradiënt wordt dan:
Q = [C]tc · [D]td [A]ta · [B]tb
We bekijken de exponenten in de concentratiebreuk:
Als c + d = a + b → geen verschuiving van het evenwicht (er zijn immers evenveel deeltjes aan beide kanten).
Als c + d > a + b → verschuiving naar de rechterkant (de kant met het grootste aantal deeltjes).
Als c + d < a + b → verschuiving naar de linkerkant (de kant met het grootste aantal deeltjes).
Als het reactievolume verkleinde, zou de verschuiving omgekeerd staan: naar de kant met het kleinste aantal deeltjes. Zo worden bij een verdubbeling van het volume alle concentraties aanvankelijk gehalveerd
Door die verstoring daalt het totale aantal deeltjes in het evenwicht. De wet van Le Chatelier-Van ’t Hoff stelt dat die verandering zal worden tegengewerkt doordat de reactie die zorgt voor meer deeltjes, bevorderd wordt.
Algemeen:
Een volumeverandering zal zorgen voor een verstoring van de concentratiebreuk. De waarde van dat quotiënt herstelt zich, zodat het weer voldoet aan de waarde van K c .
Een volumevermeerdering door de verdunning van een oplossing of een drukverlaging van gassen (minder opgeloste deeltjes of gasdeeltjes per volume-eenheid) verschuift het evenwicht naar het lid van de evenwichtsreactie met het grootste aantal opgeloste deeltjes of gasdeeltjes.
Een volumevermindering door de indamping van een oplossing of een drukverhoging van gassen (meer opgeloste deeltjes of gasdeeltjes per volume-eenheid) verschuift het evenwicht naar het lid van de evenwichtsreactie met het kleinste aantal opgeloste deeltjes of gasdeeltjes.
K c blijft daarbij constant, terwijl het rendement en de omzettingsgraad veranderen.
Opmerking:
• In de reactie 2 HCl(g) ⇆ H2 (g) + Cl2 (g) zijn er evenveel deeltjes in het linker- en het rechterlid. Bij zo’n reactie is er natuurlijk geen effect op het chemisch evenwicht door een druk- of volumeverandering.
• Het gaat altijd om deeltjes die opgelost zijn in water of die als gas voorkomen (en dus een concentratie vertegenwoordigen). Vaste stoffen worden niet meegerekend: ze komen immers niet voor in K c .
Voorbeeld: C(v) + S2 (g) ⇆ CS2 (g) Een volumeverandering heeft hier geen effect, omdat er links en rechts evenveel deeltjes in de gasfase voorkomen.
WEETJE
De toevoeging van een inert gas (edelgassen of N2) aan een reactievat (waarbij het volume constant blijft) kan nuttig zijn in industriële toepassingen. Het inerte gas zal immers zelf niet mee reageren, maar wordt gebruikt om ongewenste chemische reacties tegen te gaan die bepaalde materialen kunnen aantasten. Vaak komen die ongewenste reacties voor in vormen als oxidatie of hydrolyse met zuurstof en vocht in de lucht.
De toevoeging van een inert gas heeft echter ook een invloed op het reactievolume en/of de druk in de reactor. Zo kan men de reactiesnelheid en ook de ligging van het evenwicht beïnvloeden.
VOORBEELD INVLOED VOLUMEVERANDERING OP LIGGING CHEMISCH EVENWICHT
Berekeningen
1 Stel dat voor de reactie 2 NO2 (g) ⇆ N2O4 (g) het evenwicht zich heeft ingesteld en dat dit de evenwichtsconcentraties zijn: [NO2]e = 0,60 mol · L-1 en [N2O4]e = 0,20 mol · L-1
Op dat ogenblik is de evenwichtsconstante:
K c = [N2O4]e [NO2]e2 = 0,20 mol L (0,60 mol L )2 = 0,56 L mol
2 Stel dat het volume dan gehalveerd wordt.
De concentraties worden dus verdubbeld: [NO2] = 1,20 mol · L-1 en [N2O4] = 0,40 mol · L-1
De concentratiebreuk wordt dan:
Q = [N2O4]t [NO2]t2 = 0,40 1,202 = 0,28 L mol
Aangezien Q < Kc, zal het evenwicht zich verplaatsen naar rechts:
[]0 (halveren volume) 1,20 0,40
Δ[] (evenwicht naar rechts) – 2 · x + x
[]e2 1,20 – 2 · x0,40 + x
Aangezien de temperatuur niet verandert, blijft de evenwichtsconstante constant. Je kunt dan ook x berekenen:
K c = [N2O4]e [NO2]e2 = 0,40 + x (1,20 – 2x)2 = 0,56 L mol
Als je die tweedegraadsvergelijking oplost naar x, krijg je de volgende (wiskundige) uitkomsten:
x1 = 1,5277 → onmogelijk x2 = 0,1188
Daardoor bekom je dat de nieuwe evenwichtsconcentraties als volgt zijn:
[NO2]e2 = 1,20 – 2x = 1,20 – 2 · 0,12 = 0,96 mol L
[NO2]e2 = 0,40 + x = 0,52 mol L
Grafische voorstellingen
Afb 39 Grafische voorstellingen van het effect van een volumehalvering op de concentraties van alle stoffen (links) en de heen- en terugreactiesnelheid (rechts)
VOORBEELD INVLOED DRUKVERANDERING OP LIGGING CHEMISCH EVENWICHT
Afbeelding 40 toont op een andere manier hoe een drukverandering kan zorgen voor een verschuiving van het chemisch evenwicht.
In het oorspronkelijk chemisch evenwicht zijn er 12 moleculen in totaal: 3 H2 (g) + N2 (g) ⇆ 2 NH3 (g) 6 moleculen 2 moleculen 4 moleculen
dalende druk
lage druk: terugreactie overheerst toenemende druk
40 Het effect van een drukverandering op een chemisch evenwicht
hoge druk: heenreactie overheerst
1 Als de druk daalt (weergegeven door een toename in volume), dan zal het evenwicht verschuiven, zodat het totale aantal gasmoleculen toeneemt. De verschuiving is in die reactie naar links, waarbij het aantal H2- en N2-moleculen toeneemt, terwijl het aantal moleculen NH3 vermindert.
3 H2 (g) + N2 (g) ⇆ 2 NH3 (g) 9 moleculen 3 moleculen 2 moleculen totale aantal moleculen = 14
2 Als de druk stijgt (weergegeven door een daling in volume), dan zal het evenwicht verschuiven, zodat het totale aantal moleculen daalt. De verschuiving is in dat geval naar rechts, waarbij het aantal NH3-moleculen toeneemt, terwijl het aantal moleculen H2 en N2 daalt.
3 H2 (g) + N2 (g) ⇆ 2 NH3 (g) 3 moleculen 1 molecule 6 moleculen totale aantal moleculen = 10
De vorming van grotten en druipstenen is gekoppeld aan deze evenwichtsreactie:
CaCO3 (v) + CO2 (g) + H2O ⇆ Ca2+(aq) + 2 HCO3- (aq)
Grotten worden gevormd doordat het kalkgesteente (CaCO3) aangetast wordt door CO2-rijk (rivier)water Het bovenstaande evenwicht verschuift daardoor naar rechts en CaCO3 wordt omgezet in de wateroplosbare Ca2+- en HCO3--ionen. Op die manier zijn onder andere de onderaardse grotten van Han-sur-Lesse gevormd.

Maar wat gebeurt er in de grotten? In grotten waar er water binnen druipt, is de partiële CO2-druk kleiner. Daardoor verschuift het evenwicht naar links en worden de calcium- en waterstofcarbonaationen omgezet tot CaCO3 (v). Dat gebeurt in de vorm van stalactieten, die aangroeien van boven naar beneden (t: tomber), en in de vorm van stalagmieten, die aangroeien van beneden naar boven (m: monter).
De evenwichtsconstante K c is temperatuurafhankelijk, omdat K c = k1 k2 en die reactiesnelheidsconstanten van de heen- en terugreactie zelf temperatuurafhankelijk zijn (zie thema 01). Je kunt dan ook niet gebruikmaken van de concentratiebreuk Q!
Bekijk deze evenwichtsreactie:
A + B ⇆ AB ΔH < 0
1: exotherm
2: endotherm
Als bij evenwicht de temperatuur verhoogd wordt, dan zal de ligging van het evenwicht zo verschuiven dat de verhoging wordt tegengewerkt. In dit geval zal de terugreactie meer plaatsvinden (het evenwicht is naar links verplaatst), omdat er daardoor energie wordt opgenomen en het reactievat (de omgeving) zal afkoelen. De terugreactie is immers een endotherme reactie en zal warmte opnemen. Daardoor wordt er meer A en B gevormd.
Algemeen:
Bij een temperatuurverandering evolueert het reactiemengsel spontaan naar een nieuwe evenwichtstoestand door een tijdelijke overheersing van de reactie die de temperatuurverandering tegenwerkt.
Dus:
• Een stijging van de temperatuur in de omgeving (warmtetoevoer) zal de endotherme reactie bevorderen.
• Een daling van de temperatuur in de omgeving (warmteafvoer) zal de exotherme reactie bevorderen.
Niet alleen de omzettingsgraad en het rendement veranderen, maar ook K c verandert daarbij.
Opmerking:
Een temperatuurverhoging zorgt voor een verhoogde heen- én terugreactie, maar het effect is meer uitgesproken op de endotherme reactie, waardoor die de bovenhand neemt. Een temperatuurverlaging zorgt voor een verlaagde heen- én terugreactie, maar het effect is minder uitgesproken op de exotherme reactie, waardoor die de bovenhand neemt.
Je zou bij een exotherme reactie warmte als een extra reactieproduct kunnen beschouwen. Als je zelf warmte toevoegt, zal dat daarom tegengewerkt worden. Het evenwicht verschuift naar links.
Bij een endotherme reactie zou je warmte als een reagens kunnen beschouwen. Als je zelf warmte toevoegt, zal het evenwicht naar rechts verschuiven.
VOORBEELDEN INVLOED TEMPERATUURVERANDERING OP LIGGING CHEMISCH EVENWICHT
Voorbeeld 1
2 NO2 (g) ⇆ N2O4 (g) ΔH < 0 1
Bij evenwicht geldt eerst: v1 = v2
1: exotherm 2: endotherm
• Door T↑ zal zowel v1 als v2 toenemen. Een temperatuurstijging heeft echter meer invloed op de endotherme reactie, zodat v2 tijdelijk groter wordt dan v1: het evenwicht verschuift naar links.
• Door T↓ zal v2 meer dalen dan v1. Door een tijdelijke overheersing van reactie 1 zal het evenwicht zich verplaatsen naar rechts.
Voorbeeld 2
• Een toename in temperatuur:
–bevordert de endotherme reactie, omdat die energie opneemt (en de container koelt); –zal de endotherme reactie bevorderen, hier naar links; –zorgt voor een verschuiving van het evenwicht naar links; –zorgt voor een verhoging van de concentratie aan stikstofgas en watergas, en voor een verlaging van de concentratie aan ammoniak.
• Een daling in temperatuur:
–bevordert de exotherme reactie, omdat die energie vrijgeeft (en de container opwarmt); –zal de exotherme reactie bevorderen, hier naar rechts; –zorgt voor een verschuiving van het evenwicht naar rechts; –zorgt voor een verlaging van de concentratie aan stikstofgas en watergas, en voor een verhoging van de concentratie aan ammoniak.
Voorbeeld 3
We gebruiken telkens deze reactie:
We beginnen met de c(t)-grafieken
Bij de start van de reactie is er (in dit voorbeeld) een overmaat aan A. Wanneer het evenwicht gevormd is, veranderen we de temperatuur
• Een verhoging van de temperatuur: 0
c ( ) mol L t e ’ T↑ t e t (s)
[A] [B] [AB]
Afb 42 Een grafische voorstelling van het effect van een temperatuurstijging op de concentraties van alle stoffen
De reactie naar links is de endotherme reactie. Als je bij evenwicht de temperatuur verhoogt, zal die reactie (naar links) meer bevorderd worden, om zo de toename in temperatuur weg te werken. Daardoor stijgen de concentraties van de reagentia A en B en daalt de concentratie van het product AB. Omdat alle stoffen in de reactie coëfficiënt 1 dragen, gebeurt de stijging/daling in gelijke mate. Merk op dat er bij het nieuwe evenwicht andere evenwichtsconcentraties ontstaan.
• Een verlaging van de temperatuur:
c ( ) mol L
Afb. 43 Een grafische voorstelling van het effect van een temperatuurdaling op de concentraties van alle stoffen
De reactie naar rechts is de exotherme reactie. Als je bij evenwicht de temperatuur verlaagt, zal die reactie (naar rechts) de bovenhand nemen, om zo de afname in temperatuur weg te werken. Daardoor dalen de concentraties van de reagentia A en B en stijgt de concentratie van het product AB.
We bekijken nu de v(t)-grafieken van die temperatuurveranderingen.
• Een verhoging van de temperatuur:
Afb 44 Een grafische voorstelling van het effect van een temperatuurstijging op de heen- en terugreactiesnelheid
Door de temperatuurverhoging zullen beide reactiesnelheden verhogen (een hogere temperatuur zorgt immers voor een grotere Ek, waardoor er meer kans is op effectieve botsingen en de reactiesnelheid dus verhoogt). De snelheid van de endotherme reactie, hier v2, wordt echter meer verhoogd, zodat de stijging van de temperatuur in de omgeving wordt opgevangen. Bij het nieuwe evenwicht worden er twee nieuwe, hogere reactiesnelheden bereikt, die aan elkaar gelijk zijn.
• Een verlaging van de temperatuur:
Afb. 45 Een grafische voorstelling van het effect van een temperatuurdaling op de heen- en terugreactiesnelheid
Door de temperatuurverlaging zullen beide reactiesnelheden verlagen (lagere temperatuur = lagere Ek = minder kans op effectieve botsingen = lagere reactiesnelheid). De snelheid van de exotherme reactie, hier v1, wordt echter minder verlaagd, zodat de daling van de temperatuur in de omgeving wordt opgevangen. Bij het nieuwe evenwicht worden er twee nieuwe, lagere reactiesnelheden bereikt, die aan elkaar gelijk zijn.
Bereiding van geconcentreerd zwavelzuur
In België wordt er jaarlijks ongeveer 3 · 106 ton zwavelzuur gebruikt. Ongeveer 45 % daarvan wordt aangewend bij de bereiding van kunstmeststoffen en in de organische chemie voor onder meer de bereiding van kleurstoffen en plastics.
Dat zwavelzuur wordt industrieel aangemaakt. Daarbij maakt men gebruik van meerdere reactiestappen:
• Eerst wordt SO2 (g) bereid door de verbranding van zwavel (S8) of metaalsulfiden (bv. FeS) volgens deze reacties:
S8 (v) + 8 O2 (g) → 8 SO2 (g)
2 FeS(v) + 3 O2 (g) → 2 FeO(v) + 2 SO2 (g)
• Vervolgens wordt SO2 (g) omgezet tot SO3 (g) volgens deze evenwichtsreactie:
2 SO2 (g) + O2 (g) ⇆ 2 SO3 (g) ∆H = -97 kJ mol
Het rendement van die reactie is het grootst bij een lage temperatuur. Toch laat men de reactie verlopen bij een temperatuur van ongeveer 430 °C, omdat de reactie dan veel sneller verloopt en de omzettingsgraad toch nog voldoende groot is. Om het evenwicht nog sneller te bereiken, gebruikt men als katalysator vanadium(V)oxide (V2O5).
Er wordt gewerkt onder atmosferische druk, alhoewel een drukverhoging het evenwicht naar rechts verplaatst. De rendementsverhoging is echter te gering om hogedrukinstallaties te verantwoorden.
• Ten slotte wordt SO3 (g) omgezet tot H2SO4 (vl).
Dat gebeurt rechtstreeks volgens deze reactie:
SO3 (g) + H2O(vl) → H2SO4 (vl)
Die reactie is traag en zo exotherm dat er altijd een nevel van druppeltjes zwavelzuur wordt gevormd.
Een katalysator beïnvloedt de reactiesnelheidsconstanten k1 en k2 van de heen- en terugreactie in gelijke mate. Als je een katalysator toevoegt aan een bestaand evenwicht, dan zal dat evenwicht niet verstoord worden.
Een katalysator kan er wel voor zorgen dat een nog te vormen evenwicht sneller of trager bereikt wordt. Als het evenwicht sneller bereikt wordt, spreek je van een katalysator. Een katalysator kan zo de periode tot evenwicht verkorten, van uren, dagen of jaren tot misschien maar minuten of seconden. Sommige evenwichten worden in de praktijk zelfs nooit bereikt zonder een katalysator.
Opgelet: een inhibitor zorgt ervoor dat de evenwichtstoestand op een later moment wordt bereikt.
zonder katalysator met katalysator reagentia reactieproducten
(s)
Afb. 46 Een c(t)-grafiek van het effect van een katalysator (toegevoegd om het chemisch evenwicht te vormen) op de concentraties van alle stoffen
Merk op dat de evenwichtsconcentraties onveranderd blijven. Het evenwicht wordt enkel sneller bereikt.
v ( ) mol L
zonder katalysator met katalysator heenreactie v 1 v 2 terugreactie
(s)
Afb 47 Een v(t)-grafiek van het effect van een katalysator (toegevoegd om het chemisch evenwicht te vormen) op de heenen terugreactiesnelheid
Merk op dat het evenwicht niet alleen sneller wordt bereikt, maar dat v1 en v2 groter zijn bij het gebruik van een katalysator.
1 In een oplossing heerst dit evenwicht:
A(aq) + 2 B(aq) ⇆ 2 C(aq) + 2 D(aq)
Gegeven: Bij 293 K is de evenwichtsconstante K c gelijk aan 2 · 10-4 mol L en bij 393 K is ze gelijk aan 5 · 10-2 mol L .
Gevraagd: a Is de vorming van stof C exotherm of endotherm?
b Hoe verandert de ligging van het evenwicht bij afkoelen?
c De oplossing wordt verdund met water, dat niet aan de reactie deelneemt. Verschuift daardoor het evenwicht? Zo ja, in welke richting?
Oplossing: a Uit de gegevens haal je dat bij een hogere temperatuur de evenwichtsconstante stijgt. Dat wil dus zeggen dat de reactie naar rechts wordt bevorderd als de temperatuur stijgt. Een stijgende temperatuur zorgt ervoor dat het evenwicht verschuift naar de endotherme kant (om de extra hoeveelheid energie weg te werken). De reactie naar rechts (en dus de vorming van component C) is een endotherm proces.
b Bij afkoelen zal het evenwicht verschuiven naar de exotherme kant (zodat er energie vrijkomt). Het evenwicht zal dus naar links verschuiven.
c Als je de oplossing verdunt, daalt de concentratie van alle reagentia en reactieproducten. Het evenwicht zal dan verschuiven naar de kant met de meeste deeltjes, om die vermindering aan deeltjes tegen te werken. Aangezien de reactie naar rechts 4 moleculen per reactie levert en de reactie naar links maar 3 moleculen per reactie, zal het evenwicht naar rechts verschuiven (en zal er dus meer C en D worden gevormd).
2 Bekijk de volgende hypothetische reactie, die plaatsvindt in een afgesloten fles van 2,0 dm3 bij 298 K:
A2 (g) + 2 B2 (g) ⇆ 2 AB2 (g)
Gegeven: De grafiek hieronder geeft de verandering in stofhoeveelheid van elk gas in de fles weer voor de eerste 20 minuten.
Afb. 48 De
Gevraagd: a Hoelang duurt het tot het evenwicht voor de 1e keer bereikt wordt? Verklaar.
b Geef de uitdrukking voor de evenwichtsconstante K c voor die reactie.
c Bereken de evenwichtsconstante K c voor die reactie bij 298 K.
d Na 10 minuten wordt de temperatuur van de fles verhoogd.
Is de productie van AB2 een exotherm of een endotherm proces?
Oplossing: a Je ziet dat de concentraties constant blijven na 5 minuten. Het evenwicht wordt dus bereikt na 5 minuten.
b K c = [AB2]e 2 [A2]e · [B2]e2
c Om de grootte van de evenwichtsconstante te bepalen, heb je de concentraties van de stoffen bij evenwicht nodig (= na 5 minuten).
Je kunt de stofhoeveelheden aflezen uit de grafiek. Het volume bedraagt 2,0 dm3 = 2,0 L.
[AB2]e = 0,8 mol 2,0 L = 0,40 mol L
[B2]e = 1,2 mol 2,0 L = 0,60 mol L
[A2]e = 2,0 mol 2,0 L = 1,0 mol L
K c = [AB2]e2 [A2]e · [B2]e2 = 0,402 1,0 · 0,602 = 0,44 L mol
d Als de temperatuur wordt verhoogd, daalt de concentratie aan A2 en B2, maar stijgt de concentratie aan AB2. Door een temperatuurverhoging wordt de endotherme reactie bevorderd (om de extra hoeveelheid warmte weg te werken). De reactie naar rechts (= de productie van AB2) is een endotherm proces.
Bereiding van ammoniak (het Haber-Boschprocedé)
Ammoniak wordt gesynthetiseerd op basis van stikstofgas en waterstofgas:
N2 (g) + 3 H2 (g) ⇆ 2 NH3 (g)
ΔH = –92 kJ mol
Waterstofgas wordt gewonnen uit een gefractioneerde destillatie van aardolie. Stikstofgas bekomt men door een destillatie van vloeibare lucht.
Die reactie is een evenwichtsreactie, zodat niet alle uitgangsstoffen worden omgezet tot ammoniak. De invloed van de temperatuur en de druk wordt weergegeven op afbeelding 49.
Aangezien de vorming van ammoniak een exotherme reactie is, verschuift het evenwicht naar links bij een toenemende temperatuur. Bij 200 bar en 672 °C is het rendement gelijk aan 5 %. Bij 536 °C is dat 13 %. Hoewel men met het oog op een zo hoog mogelijk rendement de reactie het best zou laten plaatsvinden bij een zo laag mogelijke temperatuur, moet men rekening houden met het feit dat de reactiesnelheid daalt bij een afnemende temperatuur. Bij een lagere temperatuur is de vorming van NH3 niet meer rendabel. Daarom zoekt men naar een compromis: de vorming van NH3 gebeurt meestal bij 530 °C.
Op basis van de grafiek (afbeelding 49) is het duidelijk dat het rendement ook toeneemt met een toenemende druk. Bij een temperatuur van 536 °C stijgt het rendement van 13 % naar 22 % als de druk verhoogt van 200 bar naar 400 bar. Ook daar zijn er echter grenzen: het gasmengsel samenpersen is een bijzonder energieverslindende procedure. De enorme drukverhoging vereist ook zeer kostbare apparatuur. In de praktijk voert men daarom de productie van ammoniak uit bij 300 bar.
Om de reactie voldoende snel te laten verlopen, maakt men meestal gebruik van fijn verdeeld ijzer of nikkel als katalysator, in combinatie met kaliumoxide of aluminiumoxide. Die oxiden verhogen de stabiliteit en activiteit van het fijn verdeelde metaal. Voor de productie van 1 000 ton NH3 gebruikt men ongeveer 100 ton katalysator.
Het rendement van die reactie blijft ongeveer 17 tot 18 volumeprocent.
De productie van ammoniak is belangrijk voor de aanmaak van heel wat meststoffen (zoals ammoniumnitraat en -sulfaat), salpeterzuur en KNO3 (een component van buskruit).
Het principe van Le Chatelier-Van ’t Hoff
= het chemisch traagheidsbeginsel
= het principe van de kleinste dwang
= De ligging van een chemisch evenwicht kan worden beïnvloed door concentratie-, druk- en temperatuurveranderingen. De verschuiving van het evenwicht is zodanig dat de opgelegde verandering wordt tegengewerkt. Het systeem evolueert naar een nieuwe evenwichtstoestand. De omzettingsgraad of het rendement van een evenwichtsreactie kan dus worden vermeerderd of verminderd.
• Factoren die de ligging van het chemisch evenwicht beïnvloeden:
Verandering in de concentratie van 1 stof
• Als de concentratie van een reagens of reactieproduct wordt veranderd, verschuift het evenwicht, zodat die verandering wordt tegengewerkt.
–Concentratieverlaging: het evenwicht verschuift naar de kant waar die stof zich bevindt.
–Concentratieverhoging: het evenwicht verschuift naar de andere kant.
• Die verandering herstelt de concentratieverhouding tussen de reagentia en de reactieproducten: K c verandert niet. K c is specifiek voor elke reactie
Verandering in de concentratie van alle stoffen (druk/ volume)
Verandering in de temperatuur
• Het evenwicht verschuift, zodat de verandering wordt tegenwerkt.
–Volume verkleint (druk stijgt bij gasmengsel) → meer deeltjes per volume-eenheid → evenwicht verschuift naar de kant met de minste deeltjes.
–Volume vergroot (druk daalt bij gasmengsel) → minder deeltjes per volume-eenheid → evenwicht verschuift naar de kant met de meeste deeltjes.
• Die verandering herstelt de concentratieverhouding tussen de reagentia en de reactieproducten: K c verandert niet. K c is specifiek voor elke reactie.
• Zowel de heen- als de terugreactie wordt bevorderd (of vertraagd).
• Het evenwicht verschuift, zodat de verandering wordt tegenwerkt.
–Temperatuur stijgt → evenwicht verschuift naar de kant die de endotherme reactie vertegenwoordigt.
–Temperatuur daalt → evenwicht verschuift naar de kant die de exotherme reactie vertegenwoordigt.
• De concentratieverhouding tussen reagentia en reactieproducten zal veranderen: K c verandert. Er wordt een nieuw evenwicht bereikt met een specifieke K c voor die omstandigheid.
• Toevoeging van een katalysator:
–Zowel de heen- als de terugreactie wordt bevorderd (of vertraagd).
–Een bestaand evenwicht wordt niet aangetast.
–Een nog te vormen evenwicht wordt sneller (katalysator) of trager (inhibitor) bereikt.
–De concentratieverhouding tussen reagentia en reactieproducten blijft constant: K c verandert niet. K c is specifiek voor elke reactie.
Je voegt HCl toe aan een geconcentreerde CuCl2-oplossing waarin het volgende evenwicht heerst:
CuCl2 (vl) ⇆ Cu2+(aq) + 2 Cl-(aq) groen blauw
Wordt de oplossing groener of blauwer als je HCl toevoegt? Verklaar.
Gegeven is dit homogene evenwicht:
H2 (g) + I2 (g) + x kJ ⇆ 2 HI(g)
In welke richting verschuift de ligging van het evenwicht als je …
a dijood toevoegt?
b waterstofgas verwijdert?
c waterstofjodide verwijdert?
d het gasmengsel samenperst tot de helft van het volume?
e de temperatuur verhoogt?
In een vat van 2,0 L pers je 8,0 mmol CO en 12,0 mmol N2O. Het volgende evenwicht stelt zich in:
CO(g) + N2O(g) ⇆ CO2 (g) + N2 (g)
Nadat het evenwicht zich heeft ingesteld, blijkt er 6,0 mmol N2 gevormd te zijn.
a Bereken de evenwichtsconstante.
b Je voegt nu zoveel CO toe dat er, nadat er een nieuw evenwicht is bereikt, 8,0 mmol N2 aanwezig is. Hoeveel mmol CO heb je extra moeten toevoegen?
In een vat van 1,0 L breng je 10,0 mmol CO en 7,0 mmol H2. Het volgende evenwicht stelt zich in:
CO(g) + 2 H2 (g) ⇆ CH3OH(g)
Nadat het evenwicht zich heeft ingesteld, blijkt er 2,0 mmol CH3OH aanwezig te zijn.
Je voegt 2,50 mol koolstofmonoxide, 3,00 mol zuurstofgas en 4,00 mol koolstofdioxide bij elkaar in een vat van 10,0 L, waardoor zich dit evenwicht instelt:
2 CO(g) + O2 (g) ⇆ 2 CO2 (g)
Bij evenwicht blijkt er nog 2,00 mol zuurstofgas in het vat aanwezig te zijn.
a Bereken de waarde van de evenwichtsconstante K c .
b Bereken de omzettingsgraad van CO.
c Vervolgens voeg je een extra hoeveelheid H2 toe.
Nadat er zich bij dezelfde temperatuur een nieuwe evenwichtssituatie heeft ingesteld, is er in het mengsel 5,0 mmol CH3OH aanwezig. Bereken het aantal mmol H2 dat je extra hebt toegevoegd.
a Bereken de evenwichtsconstante.
b Hoe groot zou je het volume van het vat moeten maken om 2,70 mol zuurstofgas in het evenwichtsmengsel te verkrijgen?
In een reactievat van 50,0 L meng je 0,500 mol waterstofchloride, zuurstofgas, waterdamp en chloorgas. Je laat bij een bepaalde temperatuur het evenwicht intreden voor deze reactie:
4 HCl(g) + O2 (g) ⇆ 2 H2O(g) + 2 Cl2 (g) ΔH = –105 kJ
Het mengsel bevat dan nog 3 5 van de aanvankelijke hoeveelheid dichloor.
a Bereken de evenwichtsconstante K c in de gegeven omstandigheden.
b Hoe zou je de omstandigheden aanpassen om meer dichloor om te zetten?
Duid de juiste antwoorden aan.
Je onderzoekt het gasevenwicht A + B ⇆ C + D.
In een ruimte van 120 L bevinden er zich bij een bepaalde temperatuur 6,00 mol A, 3,00 mol B, 9,00 mol C en 2,00 mol D in evenwicht.
Je brengt 4,00 mol A bij in het vat.
Nadat er opnieuw een evenwicht is ingesteld, bevindt er zich in het vat:
a 9,50 mol A
b 2,00 mol B
c 9,50 mol C
d 2,50 mol D
Juist of fout? Leg elke bewering uit.
Gegeven het volgende chemisch evenwicht tussen gassen in een volume van 10,0 L:
2 A + 3 B ⇆ C
Uitgaande van 1,00 mol A, 1,00 mol B en 1,00 mol C blijft er in de evenwichtstoestand 0,50 mol C over bij een bepaalde temperatuur. Uit die gegevens leid je af dat:
a er 2,00 mol A aanwezig is bij evenwicht;
b de evenwichtsconcentratie van B 2,50 mol L bedraagt;
c de evenwichtsconstante K c = 80 L4 mol4 ;
d bij samenpersen van het gasmengsel het aantal mol C groter wordt dan 0,50.
Bij welk van deze reacties verschuift het evenwicht naar rechts, zowel bij een daling van de temperatuur als bij een stijging van de druk?
a CO(g) + H2O(g) ⇆ CO2 (g) + H2 (g) exotherm
b 2 SO2 (g) + O2 (g) ⇆ 2 SO3 (g) exotherm
c N2O4 (g) ⇆ 2 NO2 (g) endotherm
d C(s) + H2O(g) ⇆ CO(g) + H2 (g) endotherm
Juist of fout? Leg elke bewering uit.
Bekijk deze reactie:
N2 (g) + 3 H2 (g) ⇆ 2 NH3 (g) exotherm
Die evenwichtsreactie verschuift naar rechts als je:
a het gasmengsel samenperst;
b de temperatuur verhoogt;
c een katalysator toevoegt;
d een inert gas (edelgas) bijpompt.
Meer oefenen? Ga naar .
HOOFDSTUK 4
(enkel voor GO!, uitbreiding voor KathOndVla)
De oplosbaarheid (mol L ) van een stof in een oplosmiddel is gelijk aan de maximale hoeveelheid die volledig oplost in een gegeven hoeveelheid oplosmiddel bij een bepaalde temperatuur (en druk).
Een verzadigde oplossing is een oplossing waarin de maximale hoeveelheid opgeloste stof per volumeeenheid aanwezig is. Als je nog extra stof toevoegde, zou niet alles oplossen. De oplossing zou niet helder blijven en er zou een neerslag ontstaan.
Zouten worden dikwijls geclassificeerd als ofwel oplosbaar, ofwel onoplosbaar in water. Maar is het wel zo eenvoudig?
LEERDOELEN
L Een chemisch evenwicht als dynamisch evenwicht beschrijven en de wet van Le Chatelier-Van ’t Hoff toepassen bij neerslagreacties
L De evenwichtsconstante K s berekenen vanuit de evenwichtsconcentraties
L De evenwichtsconcentratie berekenen uit een gegeven evenwichtsconstante en beginconcentratie
De term ‘onoplosbare zouten’ doet vermoeden dat zulke zouten helemaal niet oplossen in water. Dat is echter niet correct. Alle zouten zullen voor een bepaalde hoeveelheid in oplossing gaan. Ook bij wat je vroeger een ‘onoplosbaar zout’ noemde, zal er een evenwicht ontstaan tussen de neerslag en de oplossing.

Als je waterige oplossingen van de goed oplosbare zouten zilvernitraat en natriumchloride mengt, ontstaat er onmiddellijk een witte neerslag van het ‘onoplosbare’ zilverchloride (AgCl): Ag+(aq) + Cl-(aq) → AgCl(s)
Als je echter de oplossing boven de neerslag nauwkeurig onderzoekt, dan stel je vast dat die zeer kleine hoeveelheden zilverionen (+I) en chloride-ionen (-I) bevat (ongeveer 0,19 mg per 100 mL oplossing bij 25 °C).
Er is eigenlijk een verzadigde oplossing ontstaan waarin opgelost AgCl (dus gedissocieerd in Ag+ en Cl-) in evenwicht is met vast AgCl in de neerslag.
Je noemt AgCl daarom voortaan weinig oplosbaar.
Opmerking:
Dat er wel degelijk een evenwicht bestaat tussen de neerslag en de oplossing, kun je ook bewijzen door de zilverchlorideneerslag te vervangen door een zilverchlorideneerslag met een radioactieve zilverisotoop. Na een tijdje zul je dan ook radioactieve zilverionen aantreffen in de oplossing.
Afb. 52 Radioactieve zilverionen in een AgCl-oplossing
In een verzadigde oplossing in zuiver water staan weinig oplosbare zouten in evenwicht met hun gedissocieerde ionen. Dat evenwicht is een dynamisch evenwicht: de snelheid waarmee het zout oplost, is even groot als de snelheid waarmee de ionen neerslaan. AgCl(s) ⇆ Ag+(aq) + Cl-(aq)
Voor dat evenwicht geldt, net zoals voor elk chemisch evenwicht, een evenwichtsconstante K c .
Bij neerslagreacties spreek je meer bepaald van het oplosbaarheidsproduct K s
Vermits er bij een evenwicht in de concentratiebreuk enkel concentraties staan en geen vaste stoffen, wordt dat voor deze reactievergelijking:
K s = [Ag+]e · [Cl-]e
In tabellen geeft men de oplosbaarheidsproducten meestal bij 25 °C en een druk van 1 013 hPa.
Voor zouten of hydroxiden met hetzelfde aantal ionen geldt: hoe kleiner Ks, hoe minder oplosbaar het zout.
Zouten met een K s in de grootteorde van 10-5 of kleiner worden beschouwd als weinig oplosbaar.
· 10-9
· 10-10
· 10-9
· 10-6
Tabel 3 Oplosbaarheidsproducten bij 25 °C (Ks)
Hoewel het oplosbaarheidsproduct K s een veranderlijke eenheid heeft, afhankelijk van de exponenten in de evenwichtsvergelijking, worden in tabellen enkel de numerieke waarden vermeld. Ook in de oefeningen zul je enkel de numerieke waarden berekenen.
De oplosbaarheid van een stof wordt aangeduid met het symbool S en heeft als eenheid mol L .
We bekijken opnieuw het voorbeeld van zilverchloride. De oplosbaarheid S van AgCl is het aantal mol AgCl in oplossing per liter. Dat kun je berekenen uit de waarde van het oplosbaarheidsproduct K s
Als er S mol AgCl opgelost kan worden, zullen er in de oplossing ook S mol Ag+- en S mol Cl--ionen aanwezig zijn. Dat leer je door de molverhouding in de dissociatievergelijking toe te passen: S (van AgCl) = [Cl-]e = [Ag+]e
Maar vermits het oplosbaarheidsproduct van zilverchloride gelijk is aan K s = [Ag+]e · [Cl-]e, kun je een verband schrijven tussen K s en de oplosbaarheid S, specifiek voor die reactie: K s = [Ag+]e · [Cl-]e = S · S = S2, dus S = K s
Voor AgCl zie je in tabel 3 dat K s = 1,8 · 10-10 bij 25 °C. Daaruit volgt de oplosbaarheid bij die temperatuur:
S = 1,8 · 10-10 = 1,3 · 10-5 mol L
De oplosbaarheid van zilverchloride is inderdaad erg klein, maar, zoals eerder gesteld, niet 0!
Opgelet: de relatie tussen het oplosbaarheidsproduct K s en de oplosbaarheid S is afhankelijk van de indexen in de formule van de stof en is niet altijd een kwadratische functie.
VOORBEELD OPLOSBAARHEID ALUMINIUMHYDROXIDE BEREKENEN
Al(OH)3 is ook een slecht oplosbare stof. Toch zal de ionendissociatie voor een deel plaatsvinden: Al(OH)3 (s) ⇆ Al3+(aq) + 3 OH-(aq)
Als je de oplosbaarheid van aluminiumhydroxide S noemt, zullen er ook S Al3+-ionen ontstaan, maar 3 S aan hydroxide- of OH--ionen.
Het oplosbaarheidsproduct voor aluminiumhydroxide K s = [Al3+]e · [OH-]3e kun je dan gelijkstellen aan:
K s = S · (3 S)3 = 27 S4
De oplosbaarheid van aluminiumhydroxide bereken je door de vergelijking te herwerken: S = K s 27
Opgelet: als de getalwaarden van de lading van het positieve en negatieve ion aan elkaar gelijk zijn, schrijf je geen indexen. Denk ze er dan even bij.
K s voor Al(OH)3 vind je in de tabel: 3,0 · 10-34
S wordt dan:
S = 3,0 · 1034
27 = 1,82 · 10-9 mol L
Je kunt veralgemenen: voor een slecht oplosbare verbinding met als algemene formule MaXb en oplosbaarheid S geldt voor de dissociatiereactie:
M aXb (s) ⇆ a My+ + b Xxwaarbij a · y = b · z
K s = [My+]ea · [Xx-]eb
Maar als we de oplosbaarheid van MaXb (s) S noemen, zullen er a · S ionen My+(aq) en b · S ionen Xx-(aq) aanwezig zijn in de oplossing.
M aXb (s) ⇆ a My+(aq) + b Xx-(aq)
S a · S b · S
Ook bij neerslagreacties ontstaat er een dynamisch heterogeen evenwicht tussen de neerslag en de opgeloste stof. Voor dat evenwicht geldt, net als voor elk chemisch evenwicht, een evenwichtsconstante Kc. Bij neerslagreacties spreek je meer bepaald van het oplosbaarheidsproduct K s .
K s = [My+]ea · [Xx-]eb
Je kunt de oplosbaarheid S afleiden uit het oplosbaarheidsproduct K s door gebruik te maken van de dissociatievergelijking. Omgekeerd kun je ook altijd het oplosbaarheidsproduct berekenen bij een gegeven oplosbaarheid.
Op basis van het oplosbaarheidsproduct kun je berekenen of er al dan niet een neerslag zal ontstaan nadat je 2 oplossingen (waarvan je de volumes en concentraties kent) hebt gemengd of nadat je een vaste stof hebt toegevoegd aan een oplossing.
Wanneer je bijvoorbeeld Ag+ en Cl- samenbrengt in een oplossing, moet je het product van de concentraties van beide ionen, ook het ionenproduct Q genoemd, vergelijken met het oplosbaarheidsproduct K s .
Het ionenproduct Q is het product van de concentratie van elk ion, verheven tot een macht die gelijk is aan de index van dat ion in de formule van het zout.
VOORBEELD IONENPRODUCT
Aluminiumsulfide (Al2S3)
Het ionenproduct voor het slecht oplosbare zout Al2S3 wordt gegeven door:
Q = [Al3+]e2 · [S2-]e3
• In een onverzadigde oplossing is het ionenproduct Q < Ks: er zal geen neerslag ontstaan.
• In een oververzadigde oplossing (ook wel ‘metastabiel’ genoemd) is het ionenproduct Q > K s en zal er product neerslaan tot het ionenproduct gelijk is aan K s
VOORBEELD NEERSLAGVORMING VOORSPELLEN
Je brengt 1 mL 0,2 mol L AgNO3-oplossing samen met 1 mL 0,2 mol L NaCl-oplossing.
Opgelet: omdat na het samenvoegen het volume verdubbelt (1 mL + 1 mL), zullen de oorspronkelijke concentraties halveren:
Q = [Ag+]e · [Cl-]e = 1
3)
Het ionenproduct Q is groter dan het oplosbaarheidsproduct K s. Dat betekent dat er AgCl zal neerslaan tot het ionenproduct gelijk is aan K s
Door het ionenproduct Q te vergelijken met het oplosbaarheidsproduct, kun je nagaan of het samenvoegen van oplossingen tot een neerslag zal leiden. Enkel als het ionenproduct het oplosbaarheidsproduct overschrijdt (Q > Ks), zal er een neerslag vormen nadat je de oplossingen hebt samengevoegd.
4 Verschuiving van het evenwicht bij neerslagreacties: het gemeenschappelijk-ioneffect
Soms wordt een zout opgelost in een oplossing die al 1 van de ionen bevat waaruit het zout is opgebouwd. De oplosbaarheid van het zout blijkt dan nog te dalen.
Als je aan een verzadigde oplossing van PbCl2 (s) (K s = 1,7 · 10-5) een kleine hoeveelheid van een Pb(NO3)2-oplossing toevoegt, zal er meteen lood(II)chloride neerslaan.
De extra toegevoegde stof zal zorgen voor een extra hoeveelheid Pb2+-ionen, waardoor het ionenproduct het oplosbaarheidsproduct overschrijdt en er een neerslag zal ontstaan.
De Pb2+-ionen zijn dan afkomstig van een dubbele bron: enerzijds van de dissociatie van PbCl2 en anderzijds van de dissociatie van het toegevoegde Pb(NO3)2. Je spreekt daarom van een gemeenschappelijk-ioneffect: elk zout is minder goed oplosbaar in een oplossing die een gemeenschappelijk ion bevat, een ion dat dus 1 van de componenten van het zout uitmaakt. Het gemeenschappelijk-ioneffect is alweer een gevolg van het principe van Le Chatelier-Van ’t Hoff. De oplosbaarheid zal dalen omdat het dissociatie-evenwicht naar links verschuift.
Bereken de oplosbaarheid (in mol L ) van calciumcarbonaat in zuiver water en in een 0,20 mol L calciumchlorideoplossing. Het oplosbaarheidsproduct K s = 8,7 · 10-9.
Gegeven:
• [CaCl2] = 0,20 mol L
• CaCO3
• K s = 8,7 · 10-9
Gevraagd
• S voor CaCO3 in zuiver water = ?
• S voor CaCO3 in de CaCl2-oplossing = ?
Oplossing: CaCO3 (s) ⇆ Ca2+(aq) + CO32-(aq)
• Als je de oplosbaarheid van CaCO3 S noemt, zullen er S CO32-- en S Ca2+-ionen in de oplossing aanwezig zijn, als je zuiver water als oplosmiddel gebruikt.
K s = S2, dus is de oplosbaarheid van calciumcarbonaat in zuiver water:
S = K s = 8,7 · 10-9 = 9,3 · 10-5 mol L
• Maar als je de stof oplost in een oplossing van 0,20 mol L calciumchloride (CaCl2), is er al een concentratie van 0,20 mol L Ca2+-ionen aanwezig in de oplossing. Dan wordt de totale concentratie aan Ca2+-ionen 0,20 + S Als je dat invult in de evenwichtsvergelijking voor het oplosbaarheidsproduct van calciumcarbonaat, bekom je:
K s = 8,7 · 10-9 = S · (0,20 + S) = S2 + 0,20 · S
Als je de vierkantsvergelijking oplost naar S, leer je dat je de oplosbaarheid van calciumcarbonaat, S, kunt gelijkstellen aan 4,4 · 10-8 mol L
Merk op dat de oplosbaarheid veel kleiner is dan in zuiver water. Het evenwicht voor het oplossen is teruggedrongen naar links door het al aanwezige Ca2+-ion in de oplossing.
De oplosbaarheid van een zout zal dalen als er in het oplosmiddel al een gemeenschappelijk ion aanwezig is. Dat gemeenschappelijk-ioneffect doet het dissociatie-evenwicht verschuiven naar links, conform de wet van Le Chatelier-Van ’t Hoff.
Neerslagreacties worden in het dagelijks leven gebruikt voor verschillende toepassingen.
Neerslagreacties kunnen worden gebruikt om ionen te verwijderen uit een oplossing. Soms bevat een oplossing ongewenste ionen. Die kan men verwijderen door een zoutoplossing toe te voegen die ionen bevat waarmee het ongewenste ion een weinig oplosbaar zout vormt. Door de ontstane suspensie te filtreren, verwijdert men de neerslag uit de suspensie. Die techniek past men vaak toe bij waterzuivering.
Duurzaam omspringen met water
Hoewel onze planeet voor 70 % bedekt is met water, is maar 1 % daarvan echt drinkbaar. Het overgrote deel van het water is zout zeewater of zit vastgevroren in poolijs. Slechts 0,31 % van de totale waterhoeveelheid op aarde betreft zoet oppervlaktewater. Maar ook daarvan is hoe langer, hoe minder geschikt als drinkwater. Door vervuiling met zware metalen, zoals lood, zink en kwik, wordt water giftig voor consumptie. Maar niet alleen zware metalen zijn de boosdoener. Ook microplastics en andere geloosde afvalstoffen zijn nefast voor het water. Denk maar aan de PFAS-vervuiling rond Zwijndrecht of aan de nitraten en pesticiden die in het grondwater terechtkomen door het gebruik van respectievelijk mesten sproeistoffen. Een waterzuiveringsinstallatie zal altijd proberen om de schadelijke ionen uit het water te verwijderen. Niet alle schadelijke stoffen zijn even makkelijk uit het water te halen door neerslagreacties of sedimentatie. Nitraten zijn bijvoorbeeld allemaal goed oplosbaar. In het waterproductiecentrum in Woumen zet men het oppervlaktewater van de rivier de IJzer om in drinkbaar water voor de regio. Even tijd? Open de video en bekijk het hele waterzuiveringsproces.

Het is mogelijk om de aanwezigheid van bepaalde ionen aan te tonen door een zoutoplossing toe te voegen die ionen bevat waarmee de aan te tonen ionen een slecht oplosbaar zout vormen. Aan de hand van voorspellingen gebaseerd op een oplosbaarheidstabel kan men bepalen of een bepaald ion aanwezig is.
Chloride-ionen kunnen het roesten van staal versnellen. Daarom worden ze zorgvuldig opgespoord tijdens het productieproces. Dat kan men doen door bijvoorbeeld zilvernitraat toe te voegen. Als er zich chloride-ionen in het staal bevinden, ontstaat er een wit spoor, dat wijst op de vorming van zilverchloride. Die techniek, waarbij men de aanwezigheid van ionen controleert aan de hand van de vorming van een neerslag, wordt ook gebruikt om heel wat andere ionen op te sporen.

Als een zout niet of moeilijk verkrijgbaar is, is het mogelijk om met behulp van een neerslagreactie dat zout te produceren. Met de neerslagreactie van koper(II)nitraat en natriumfosfaat kun je bijvoorbeeld het slecht oplosbare koper(II)fosfaat maken:
3 Cu(NO3)2 + 2 Na3PO4 → Cu3(PO4)2 + 6 NaNO3
Neerslagreacties kennen belangrijke toepassingen:
• ongewenste ionen verwijderen, bijvoorbeeld bij waterzuivering;
• de aanwezigheid van bepaalde ionen aantonen;
• zouten vormen.
Schrijf de vergelijking die het verband weergeeft tussen de oplosbaarheid en het oplosbaarheidsproduct voor deze stoffen:
a AgCl
b Pbl2
c Ca3(PO4)2
d Cr(OH)3
De oplosbaarheid van Pb(lO3)2 bedraagt bij 25 °C
4,0 · 10-5 mol
L
Wat is de waarde van het oplosbaarheidsproduct van die verbinding?
De oplosbaarheid van Ag2CrO4 bedraagt bij 25 °C
6,5 · 10-5 mol L .
Bepaal de waarde van K s
De oplosbaarheid van AgBr bedraagt bij 25 °C
8,8 · 10-7 mol L
Bepaal de waarde van K s .
Het oplosbaarheidsproduct van Cr(IO3)3 bedraagt bij 25 °C 5,0 · 10-6.
Bepaal de oplosbaarheid van die verbinding.
Het oplosbaarheidsproduct van Ag2SO4 bedraagt bij 25 °C 1,4 · 10-5
Bepaal de oplosbaarheid van die verbinding.
Het oplosbaarheidsproduct van PbF2 bedraagt bij 25 °C 3,7 · 10-8.
Bepaal de oplosbaarheid van die verbinding.
Het oplosbaarheidsproduct K s van PbF2 is 3,7 · 10-8.
Een student heeft 1,300 g lood(ll)fluoride in een maatkolf van 1 L water gebracht.
Hoeveel gram neerslag zal hij in de kolf vinden?
Bereken de oplosbaarheid van CaCO3 bij 25 °C in een 0,20 M CaCl2 oplossing.
K s (CaCO3) = 8,7 · 10-9
Bereken de oplosbaarheid van AgBr bij 25 °C in een 0,10 M CaBr2-oplossing.
K s (AgBr) = 7,7 · 10-13
Je mengt 2 gelijke volumes van een 0,2 M Pb(NO3)2oplossing en van een 0,2 M Kl-oplossing.
Ga na of er zich een neerslag van Pbl2 vormt.
K s (Pbl2) = 1,4 · 10-8
Je mengt 200 mL van een 1,0 · 10-4 M AgNO3oplossing en 900 mL van een 1,0 · 10-6 M KCloplossing.
Ga na of er zich een neerslag van AgCl vormt.
K s (AgCl) = 1,8 · 10-10
Je mengt 100 mL van een 1,0 · 10-3 M Ba(NO3)2oplossing en 200 mL van een 1,0 · 10-3 M KF-oplossing.
Ga na of er zich een neerslag van BaF2 vormt.
K s (BaF2) = 1,7 · 10-6
Het oplosbaarheidsproduct van AgCl bij kamertemperatuur is 1,6 · 10-10
Bereken de oplosbaarheid van AgCl in zuiver water.
Het oplosbaarheidsproduct van zilvercarbonaat bij 25 °C is 6,0 · 10-12.
Hoeveel zilvercarbonaat lost op in 1 L zuiver water?
De oplosbaarheid van magnesiumcarbonaat is 219 mg in 1 L water van 25 °C.
Bereken het oplosbaarheidsproduct.
KERNBEGRIPPEN
Hoofdstuk 1: Thermochemie (enkel voor GO!, uitbreiding voor KathOndVla)
energie-inhoud of inwendige energie (U)
• = toestandsgrootheid
Bestaat uit: –atomaire energie; –intramoleculaire energie; –intermoleculaire energie.
• Wordt met de omgeving uitgewisseld in de vorm van: –warmte; –straling; –elektriciteit; –arbeid.
• eenheid: joule (J)
• ∆U < 0 → Er wordt energie geleverd door het systeem. De reactie is exo-energetisch.
• ∆U > 0 → Er wordt energie toegevoegd aan het systeem. De reactie is endo-energetisch.
• ∆U = 0 → adiabatisch proces
enthalpie reactie-enthalpie (∆H)
vormingsenthalpie (∆Hf )
andere soorten reactie-enthalpie
= de reactiewarmte, gecorrigeerd met de geleverde of ontvangen arbeid
• = de enthalpieverandering tijdens een chemische reactie
• eenheid: joule (J)
de reactie-enthalpie (of enthalpieverandering) die optreedt bij de vorming van 1 mol van een verbinding uit de enkelvoudige stoffen bij 25 °C en 1 013 hPa
• verbrandingsenthalpie
• sublimatie-enthalpie
• dissociatie-enthalpie
• bindingsenthalpie
• neutralisatie-enthalpie
wet van Hess
Als je een reactie kunt schrijven als de som van 2 of meerdere deelreacties, dan is de reactie-enthalpie gelijk aan de som van de reactie-enthalpie van de deelreacties. entropie S
• maat voor de wanorde in een systeem
• verandering in entropie: ∆S
2 drijfveren voor een chemische reactie
Gibbs vrije energie (∆G)
1 het streven naar een minimale enthalpie (∆H < 0)
2 het streven naar een maximale entropie (∆S > 0)
• De enthalpieverandering, gecorrigeerd met dat deel van de vrijgekomen of opgeslorpte enthalpie dat door het systeem zelf gebruikt wordt om wanorde te scheppen, noem je de Gibbs vrije energie.
• ∆G = ∆H – T · ∆S
• ∆G < 0 → spontane reactie
KERNBEGRIPPEN
Hoofdstuk 2: Chemisch evenwicht aflopende reactie
evenwichtsreactie
dynamisch chemisch evenwicht evenwichtsconstante K
omzettingsgraad (α)
rendement (η)
• = reactie waarbij de terugreactie bijna niet plaatsvindt
• notatie: →
• = reactie die niet aflopend (volledig) en omkeerbaar is
• notatie: ⇆
een reactiemengsel waarbij de heen- en terugreactie met een gelijke snelheid verlopen en waarbij je geen concentratieveranderingen meer kunt opmerken
→ evenwichtstoestand bereikt
De heen- en terugreactie verlopen met een gelijke snelheid, die verschillend van 0 is.
• Voor een reactie in een homogeen midden bij een bepaalde temperatuur:
a A + b B ⇆ c C + d D
K c = [C]ec · [D]ed [A]ea · [B]eb
• De grootte van K c bepaalt de ligging van het evenwicht.
• de verhouding van de weggereageerde stofhoeveelheid van een reagens tot de maximaal mogelijke weggereageerde stofhoeveelheid (als de reactie aflopend was)
• de verhouding van de gevormde stofhoeveelheid van een reactieproduct tot de maximaal mogelijke gevormde stofhoeveelheid (als de reactie aflopend was)
α = ∆n (X)
∆n (X)max
Het rendement (η) van een reactie is de procentuele uitdrukking van α:
η = α · 100 %
α en η geven een indicatie van de ligging van het chemisch evenwicht.
Hoofdstuk 3: Factoren die de ligging van het chemisch evenwicht beïnvloeden
principe van Le
= het principe van de kleinste dwang
Chatelier-Van ’t Hoff beïnvloedende factoren op de ligging van het chemisch evenwicht
Een reactie in evenwicht zal een opgedrongen wijziging aan dat evenwicht tegenwerken.
• de concentratieverandering van 1 of meerdere stoffen door stoffen toe te voegen of te verwijderen
• de concentratieverandering van alle stoffen door een wijziging van druk of volume
• de temperatuur
KERNBEGRIPPEN
Hoofdstuk 4: Heterogene evenwichten (enkel voor GO!, uitbreiding voor KathOndVla)
oplosbaarheidsproduct K s
oplosbaarheid S
ionenproduct Q verzadigde oplossing
Er heerst ook een evenwicht tussen de neerslag en de opgeloste vorm van stoffen. Voor dat evenwicht geldt, net als voor elk chemisch evenwicht, een evenwichtsconstante K c .
Bij neerslagreacties spreek je meer bepaald van het oplosbaarheidsproduct K s
De oplosbaarheid van een stof wordt aangeduid met het symbool S en heeft als eenheid mol L
M aXb (s) ⇆ Q = [My+]ea · [Xx-]eb
nagaan of er een neerslag ontstaat
gemeenschappelijkioneffect toepassingen van neerslagreacties
Als het ionenproduct gelijk is aan het oplosbaarheidsproduct, is de oplossing verzadigd. De maximale oplosbaarheid is bereikt.
K s = [My+]ea · [Xx-]eb
• Q > Ks: neerslag
• Q < Ks: geen neerslag
De oplosbaarheid van een zout zal dalen als er in het oplosmiddel al een gemeenschappelijk ion aanwezig is. Dat gemeenschappelijk-ioneffect doet het dissociatie-evenwicht verschuiven naar links, conform de wet van Le Chatelier-Van ’t Hoff.
• ongewenste ionen uit oplossingen verwijderen
• de aanwezigheid van ionen aantonen
• zouten vormen
Zuren en basen spelen een belangrijke rol in alledaagse contexten, maar ook in onze industrie. Zo worden er jaarlijks enorme hoeveelheden zwavelzuur geproduceerd, om meststoffen, kunststoffen, staal en andere materialen aan te maken. De verbranding van fossiele brandstoffen zorgt nog altijd voor een enorme uitstoot van CO2 in de atmosfeer. Dat leidt wereldwijd tot het fenomeen ‘zure neerslag’. Door de opname van CO2 in de oceanen is het water langzaam aan het verzuren, wat nefast is voor het koraal, de schaaldieren en de andere organismen die er leven.
In dit thema leer je de eigenschappen van zuren en basen kennen en pas je de eigenschappen van chemische evenwichten toe op reacties waarbij er protonen worden overgedragen.

` Wat gebeurt er als zuren en basen oplossen in water?
` Hoe kun je de sterkte van een zuur of een base nagaan?
` Kun je de pH van een oplossing van een zuur, base of zout berekenen?
` Hoe werkt een buffer?
We zoeken het uit!

• toelichten dat anorganische zuren als formule H n Z hebben en in water het aantal H3O+-ionen verhogen.
sterk zuur zwak zuur geïoniseerd niet geïoniseerd
• dat er sterke en zwakke zuren bestaan.
M(OH)n → Mn+ + n OH-
• aantonen dat hydroxiden in water dissociëren in positieve ionen en negatieve OH--ionen.
sterke base gedissocieerd niet gedissocieerd zwakke base
• dat er sterke en zwakke basen bestaan.
... de snelheid van de terugreactie.

• uitleggen dat sommige reacties omkeerbaar zijn en een chemisch evenwicht vormen.
• aantonen dat er een verband bestaat tussen de pH en het aantal H3O+-ionen in het water.
Z + H2O ⇆ B + H3O+ geconjugeerd zuur geconjugeerde base base zuur

• de kennis van chemische evenwichten toepassen op reacties waarbij H+-ionen worden overgedragen.
• de pH van oplossingen van zuren, basen en zouten berekenen.
• toelichten dat door de toevoeging van een zuur of een base aan een waterige oplossing de zuurtegraad verandert.

• verklaren hoe een buffer ervoor zorgt dat de pH van een oplossing weinig verandert als je een zuur of een base toevoegt.
‘Zuren’ en ‘basen’ zijn fundamentele begrippen in de chemie. Vooraleer we dieper kunnen ingaan op hun eigenschappen, gedragingen en wisselwerking, geven we eerst een duidelijke definitie van zuren en basen. HOOFDSTUK
L Beschrijven wat zuren en basen zijn
L Aangeven dat tijdens een zuur-basereactie een protonoverdracht plaatsvindt
L Een zuur-basekoppel voorstellen
De Zweedse natuur- en scheikundige Arrhenius (1859-1927) maakte een onderscheid tussen zuren en basen op basis van hun gedrag in een waterige oplossing. Volgens Arrhenius was een zuur een verbinding die H+-ionen of protonen afstaat. Daarbij blijft er een zuurrest achter:
H n Z → n H+ + Zn-
Voorbeelden:
HCl → H+ + ClH2SO4 → 2 H+ + SO42-

Volgens Arrhenius was een base een stof die in een waterig milieu de concentratie aan hydroxide-ionen doet toenemen. Hydroxiden zijn daarom Arrheniusbasen. Als hydroxiden oplossen in water, dissociëren ze:
M(OH)n → Mn+ + n OH-
Voorbeelden:
NaOH → Na+ + OH-
Ca(OH)2 → Ca2+ + 2 OH-
Die theorie verklaart onder andere hoe zuren en basen elkaar neutraliseren. Protonen kunnen immers reageren met hydroxide-ionen tot water:
H+ + OH- → H2O
WEETJEEnkel hydroxiden van alkalimetalen, sommige aardalkalimetalen en ammoniumhydroxide dissociëren in water en zijn daarom Arrheniusbasen. Hydroxiden van aardmetalen, zoals Al(OH)3, zijn slecht oplosbaar en zijn daarom geen Arrheniusbasen.
De definitie volgens Arrhenius is gebaseerd op de vorming van ionen in water. Maar zuren en basen kunnen ook in andere oplosmiddelen of in een andere aggregatietoestand voorkomen. Zo reageren gasvormige ammoniak en gasvormig zoutzuur tot vast ammoniumchloride. HCl(g) + NH3 (g) → NH4Cl(v)
Ook zorgen sommige stoffen, zoals ammoniak en bepaalde zouten, in water voor een zure of basische oplossing.
Om daaraan tegemoet te komen, definieerden Nicolaus Brønsted en Thomas Martin Lowry zuren en basen als deeltjes die protonen overdragen.
Een Brønstedzuur is een deeltje dat een proton afstaat. Het is een protondonor. Een Brønstedbase daarentegen is een deeltje dat een proton kan opnemen, omdat het over een vrij elektronenpaar beschikt. Het is een protonacceptor. In de bovenstaande vergelijking is HCl het Brønstedzuur en NH3 de Brønstedbase.
Die definitie is niet in tegenspraak met de theorie van Arrhenius, maar een uitbreiding: als zuren reageren met water, draagt het zuur een proton over aan het water, zodat er een hydroxoniumion (H3O+) ontstaat. Het zuur is de protondonor (Brønstedzuur), het water de protonacceptor (Brønstedbase).
Voorbeeld: HCl + H2O → H3O+ + ClH+
Omdat een proton dat afgestaan werd, altijd wordt opgevangen door een ander deeltje, is een zuur-basereactie een protonoverdracht tussen een Brønstedzuur en een Brønstedbase. De overdracht van een proton noem je ook een protolyse. Als we vanaf nu over ‘zuren’ of ‘basen’ spreken, bedoelen we telkens respectievelijk Brønstedzuren of Brønstedbasen.
Als een Brønstedzuur een proton afstaat, ontstaat er een base die opnieuw een proton kan opnemen. Je noemt die base de geconjugeerde base van het zuur. Omgekeerd zal een base die een proton opneemt, aanleiding geven tot een geconjugeerd zuur dat opnieuw een proton kan afstaan. Omdat heel wat zuur-basereacties evenwichtsreacties zijn, schrijf je voortaan ook een evenwichtspijl.
Algemene voorstelling van een zuur-basereactie: zuur + base ⇆ geconjugeerde base + geconjugeerd zuur of
Voorbeelden:
In dit thema behandelen we vooral anorganische zuren en basen. Ook organische stoffen kunnen reageren als Brønstedzuur of -base. Zo leerde je vorig jaar de carbonzuren en de aminen kennen. Carbonzuren zijn organische zuren en aminen zijn organische basen.
Als een zuur meerdere protonen kan overdragen, gebeurt dat in verschillende stappen. Dat heet ‘stapsgewijze ionisatie’.
Je ziet dus dat bij elk zuur een base hoort en omgekeerd. Je spreekt van het geconjugeerde zuur en de geconjugeerde base. Beide vormen een zuur-basekoppel, dat je als volgt voorstelt:
Z ⇆ B + H+
De zuur-basekoppels die bij de bovenstaande reacties horen, zijn:
HClO2 ⇆ ClO2- + H+
NH4+ ⇆ NH3 + H+
H3O+ ⇆ H2O + H+
H2O ⇆ OH- + H+
Sommige stoffen kunnen zowel protonen opnemen als protonen afstaan. Voorbeelden daarvan zijn water en het waterstofcarbonaation. Dergelijke stoffen noem je amfolyten. Of een deeltje als zuur of als base reageert, hangt dus af van welke andere deeltjes aanwezig zijn. De begrippen ‘zuur’ en ‘base’ zijn dus relatief
Voorbeeld:
HCOOH + HCO3- ⇆ HCOO- + H2CO3 (Het waterstofcarbonaation reageert als een base.)
HCO3- + PO43- ⇆ CO32- + HPO42- (Het waterstofcarbonaation reageert als een zuur.)
In een bijzonder geval kunnen protonen worden uitgewisseld tussen dezelfde deeltjes. Je spreekt dan van autoprotolyse
Voorbeelden:
H2PO4- + H2PO4- ⇆ H3PO4 + HPO42-
H2O + H2O ⇆ H3O+ + OH-
Een Brønstedzuur is een protondonor. Een Brønstedbase is een protonacceptor.
• Als een zuur een proton afstaat, ontstaat er een geconjugeerde base.
• Als een base een proton opneemt, onstaat er een geconjugeerd zuur.
Een zuur vormt met zijn geconjugeerde base een zuur-basekoppel
Deeltjes die zowel een protondonor als een protonacceptor kunnen zijn, noem je amfolyten.
Tijdens een zuur-basereactie wordt een proton overgedragen van de protondonor naar de protonacceptor: het is een protolysereactie
Heel wat zuur-basereacties zijn evenwichtsreacties
Als een protonoverdracht gebeurt tussen gelijke deeltjes, spreek je van autoprotolyse.
Bepaal de geconjugeerde base van de gegeven stoffen. a HNO3 b NH4+ c H2O d H2S e HPO42f HCO3-
Bepaal het geconjugeerde zuur van de gegeven stoffen. a HPO42b CO32c HSO4d H2O e NO3f HNO3
Duid in de volgende reactievergelijkingen aan welke deeltjes een Brønstedzuur en welke een Brønstedbase zijn.
a HClO3 + H2O ⇆ ClO3- + H3O+ b HCl + NH3 ⇆ Cl- + NH4+
c H2SO3 + OH- ⇆ HSO3- + H2O d H3PO4 + H2O ⇆ H2PO4- + H3O+
Meer oefenen? Ga naar .
HOOFDSTUK 2
In het vorige thema zag je dat sommige reacties niet aflopen en dat er evenwichten ontstaan. De ligging van het evenwicht kun je beschrijven met de evenwichtsconstante. Je leert nu hoe zuren en basen zich gedragen in water en hoe je de eigenschappen van een zuur of een base kunt afleiden uit een evenwichtsconstante.
LEERDOELEN
L De waterconstante definiëren
L Het ionisatie-evenwicht in water beschrijven
L Het onderscheid maken tussen een zure en een basische oplossing
L De zuurconstante en baseconstante opstellen en omschrijven als een evenwichtsconstante
L Op basis van de zuurconstante en baseconstante afleiden of het zuur / de base sterk of zwak is
L Het verband tussen Kz, Kb, pKz en pKb aangeven
1
en het ionisatie-evenwicht in water
Als je twee elektroden van een open stroomkring waarin een lamp is geschakeld, onderdompelt in zuiver water, brandt de lamp niet. Daaruit zou je kunnen afleiden dat zuiver water de elektrische stroom niet geleidt en dat er dus geen ionen in aanwezig zijn. Nauwkeurige apparatuur laat toe om vast te stellen dat er in zuiver water wél een zeer beperkt aantal ionen aanwezig is. Die ionen zijn afkomstig van de autoprotolyse van water. Aangezien die reactie omkeerbaar is, komt er een chemisch evenwicht tot stand:
H2O + H2O ⇆ H3O+ + OH-
De evenwichtsconstante van die reactie is:
K c = [H3O+]e · [OH-]e [H2O]e · [H2O]e
De concentratie van H2O in H2O bedraagt 55,56 mol L en kan als constant worden beschouwd. Zo ontstaat er een nieuwe constante, die je de waterconstante K w of het ionenproduct van water noemt. Nauwkeurige metingen laten zien dat bij 25 °C de waarde van die constante gelijk is aan 10-14.
K w = [H3O+]e · [OH-]e = 10-14 mol2 L2
Die kleine evenwichtsconstante betekent dat het evenwicht volledig links ligt. Vermits in zuiver water [H3O+]e = [OH-]e, volgt dat [H3O+]e = [OH-]e = 10-7 mol L . Een oplossing waarvan de concentratie aan hydroxoniumionen en hydroxide-ionen aan elkaar gelijk is, noem je een neutrale oplossing.
2.1 Verandering in de concentratie van hydroxonium- en hydroxide-ionen
Als de concentratie van de deeltjes in een chemisch evenwicht wijzigt, zal er volgens het principe van Le Chatelier-van ’t Hoff een nieuw evenwicht ontstaan, waarbij de concentratiebreuk opnieuw gelijk zal zijn aan de waarde van de evenwichtsconstante.
Belangrijk: voor de berekening van de pH gebruik je formules. In de formules maakt je altijd gebruik van de molaire concentratie: de concentratie van de stof wordt er uitgedrukt in mol L .
• Als een zuur oplost in water, verhoogt de concentratie aan hydroxoniumionen.
Voorbeeld:
HNO3 + H2O ⇆ NO3- + H3O+
Het zuur verhoogt de concentratie aan hydroxoniumionen: [H3O+] > 10-7 mol L
Aangezien K w = [H3O+]e · [OH-]e = 10-14 (bij 25 °C), leidt dat tot een verlaging van de concentratie aan hydroxide-ionen: [OH-]e < 10-7 mol L . In het verleden leerde je al dat een zure oplossing een oplossing is waarbij [H3O+]e > 10-7 mol L > [OH-]e.
Voorbeeld:
Je voegt een zuur toe aan water, zodat [H3O+]e stijgt tot 10-3 mol L .
De concentratie aan hydroxide-ionen in die oplossing wordt dan: [OH-]e = K w [H3O+ ]e = 10-11 mol L
• Als je een base toevoegt aan een oplossing, neemt de concentratie aan hydroxide-ionen toe en wordt ze groter dan 10-7 mol L
Voorbeeld:
NH3 + H2O ⇆ NH4+ + OH-
Een verhoging van de concentratie aan hydroxide-ionen zal leiden tot een verlaging van de concentratie aan hydroxoniumionen, aangezien K w = [H3O+]e · [OH-]e = 10-14 (bij 25 °C).
In een basische oplossing is dus [H3O+]e < 10-7 mol L < [OH-]e.
Voorbeeld:
In een oplossing waarvan de concentratie aan hydroxide-ionen 5,6 · 10-9 mol L bedraagt, is de concentratie aan hydroxoniumionen [H3O+]e = 10-14 5,6 · 10-9 = 1,8 · 10-6 mol L
De ionisatie of autoprotolyse van water is een endotherm verschijnsel: H2O + H2O ⇆ H3O+ + OH- ΔH > 0
Je weet al dat de waarde van de evenwichtsconstante beïnvloed wordt door de temperatuur. Bij een temperatuurverhoging verschuift het evenwicht in endotherme zin en zullen er meer watermoleculen met elkaar reageren en ioniseren, waardoor de waarde van de evenwichtsconstante groter wordt dan 10-14. Omgekeerd zal bij een lagere temperatuur de waterconstante een lagere waarde hebben dan 10-14
TEMPERATUUR
De waterconstante K w of het ionenproduct van water beschrijft het evenwicht van de autoprotolyse van water: K w = [H3O+]e · [OH-]e = 10-14 mol2 L2 (bij 25 °C).
De temperatuur beïnvloedt de ligging van dat evenwicht.
Bij 25 °C is in een neutrale oplossing [H3O+]e = [OH-]e = 10-7 mol L .
De toevoeging van een zuur of een base zorgt voor een verandering in de concentraties van de hydroxonium- of hydroxide-ionen. Zo ontstaan er zure of basische oplossingen:
• Omdat zuren [H3O+]e verhogen, is in een zure oplossing [H3O+]e > 10-7 mol L > [OH-]e
• Omdat basen [OH-]e verhogen, is in een basische oplossing [H3O+]e < 10-7 mol L < [OH-]e
3 De zuurconstante en de baseconstante
Zuur-basereacties zijn vaak evenwichtsreacties. De evenwichtsconstanten die horen bij de reactie van een zuur met water en een base met water, zijn respectievelijk de zuurconstante K z en de baseconstante Kb
REACTIE ZUUR + WATER
REACTIE BASE + WATER
Z + H2O ⇆ B + H3O+ B + H2O ⇆ Z + OH-
K c = [H3O+]e · [B]e [H2O]e · [Z]e
K z = K c · [H2O]e = [B]e · [H3O+]e [Z]e
K c = [Z]e · [OH-]e [H2O]e · [B]e
Kb = K c · [H2O]e = [Z]e · [OH-]e [B]e
In beide gevallen geeft de grootte van de evenwichtsconstante informatie over de ligging van het evenwicht:
• Als de zuurconstante groot is, zal het zuur bijna volledig ioniseren en zullen er veel hydroxoniumionen ontstaan. Soms wordt de reactie (bijna) aflopend. Dergelijke zuren noem je sterke zuren. Je beschouwt een zuur als sterk als K z > 1 mol L . Wanneer de zuurconstante klein is, ioniseren er heel wat zuurmoleculen niet. Omdat er weinig zuurmoleculen ioniseren, noem je die zuren zwakke zuren. Als K z < 10-6 mol L , beschouw je het zuur als zeer zwak Als K z < 10-14 mol L , dan is het zuur zwakker dan water en beschouw je het als verwaarloosbaar zwak.
verwaarloosbaar zeer zwak zwak sterk
z
• Als de baseconstante groot is, dissocieert of ioniseert de base heel goed en ontstaan er veel hydroxide-ionen. Net zoals bij sterke zuren is de reactie (bijna) aflopend. Dergelijke basen zijn sterke basen. Je beschouwt een base als sterk als de baseconstante Kb > 1 mol L Zwakke basen ioniseren/dissociëren moeilijker, waardoor het evenwicht van de reactie met water links ligt.
Daardoor is de baseconstante klein. Analoog aan de zuren beschouw je basen waarvan Kb < 10-6 mol L , als zeer zwak. Als Kb < 10-14 mol L , dan is de base zwakker dan water en beschouw je ze als verwaarloosbaar zwak.
verwaarloosbaar zeer zwak zwak sterk
Meerwaardige zuren kunnen meerdere protonen afsplitsen. Elk van de reacties in de stapsgewijze ionisatie wordt gekenmerkt door een eigen zuurconstante.
VOORBEELD H3PO4 H3PO4 + H2O ⇆ H2PO4- + H3O+
De zuurconstante van de opeenvolgende protolysereacties wordt steeds kleiner, omdat negatieve deeltjes moeilijker protonen afstaan dan neutrale deeltjes.
De p-waarde in heel wat begrippen, zoals pH, pOH, pKz en pKb, heeft telkens dezelfde betekenis, namelijk ‘de negatieve logaritme van de parameter die erop volgt’.
K z en Kb zijn constanten bij een welbepaalde temperatuur. De waarde van die constanten kun je terugvinden in tabellen (zie p. 271-272). In de literatuur geeft men vaak een pKz/pKb-waarde van zuren en basen in plaats van een Kz/Kb-waarde. Het verband tussen de Kz/Kb-waarde en de pKz/pKb-waarde is:
pKz = –log K z
pKb = –log Kb
De pKz - en pKb-waarden zijn, net zoals K z en Kb, constanten. Je zult ze terugvinden in de formules voor de berekening van de pH.
pKz K z (mol L )
sterk zuur –3 103
ZUURBASE Kb (mol L ) pKb
H2SO4 HSO4- 10-17 17verwaarloosbaar zwak zuur 2,127,59 · 10-3 H3PO4 H2PO4- 1,32 · 10-12 11,88zeer zwakke base zwak zuur 4,751,78 · 10-5
CH3COOHCH3COO- 5,62 · 10-10 9,25zeer zwakke base zeer zwak zuur9,255,62 · 10-10
NH4+ NH3 1,78 · 10-5 4,75zwakke base zeer zwak zuur11,961,1 · 10-12
HS- S2- 9,12 · 10-3 2,04zwakke base verwaarloosbaar 29,00 1,0 · 10-29
O2- 1015 –15 sterke base
Als je in de tabel kijkt naar de K z - en Kb-waarde van respectievelijk azijnzuur (CH3COOH) en ammoniak (NH3), dan merk je dat ze dezelfde waarde hebben. De zuursterkte van azijnzuur is dus even groot als de basesterkte van ammoniak. Gelijke molhoeveelheden zullen elkaar dus perfect neutraliseren.
4 Het verband tussen de K z - en Kb-waarde van een zuur-basekoppel
Een zuur-basekoppel bestaat uit een Brønstedzuur en de daarmee overeenstemmende (geconjugeerde) Brønstedbase: Z + H2O ⇆ B + H3O+
Als voorbeeld nemen we salpeterzuur: HNO3 + H2O ⇆ NO3- + H3O+
De zuurconstante is de concentratiebreuk van die reactie bij evenwicht en bedraagt 1,0 · 102 mol L
K z = [H3O+]e · [B]e [Z]e = [H3O+]e · [NO3-]e [HNO3]e = 1,0 · 102 mol L
De baseconstante is de concentratiebreuk van de reactie tussen de geconjugeerde base en water bij evenwicht:
NO3- + H2O ⇆ HNO3 + OH-
Kb = [Z]e · [OH-]e [B]e = [HNO3]e · [OH-]e [NO3-]e
Je ziet dat een aantal concentraties in beide breuken voorkomen, maar wat in de noemer voorkomt bij Kz, komt in de teller voor bij Kb. Het product van de zuur- en de baseconstante wordt dan:
KZ · Kb = [H3O+]e · [B]e [Z]e · [Z]e · [OH-]e [B]e
= [H3O+]e · [NO3-]e [HNO3]e · [HNO3]e · [OH-]e [NO3-]e = [H3O+]e · [OH-]e = K w = 10-14 mol2 L2
Met andere woorden: het product van de zuurconstante en de baseconstante binnen één zuur-basekoppel is gelijk aan de waterconstante:
K z · Kb = K w = 10-14 mol2 L2
Daaruit kun je de baseconstante van NO3- berekenen, namelijk:
Kb = K w K z = 10-14 mol2 L2 102 mol L = 10-16 mol L
Daaruit volgt meteen dat de geconjugeerde base van een sterk zuur verwaarloosbaar is, en omgekeerd.
Er bestaat ook een verband tussen de pKz - en pKb-waarde van een zuur-basekoppel.
Uit K z · Kb = 10-14 mol2 L2 volgt: –log(K z · Kb) = –log K w = –log 10-14 –log K z – log Kb = 14 pKz + pKb = 14
VOORBEELDVRAAGSTUK
Ammoniak is een zwakke base met als baseconstante 1,78 · 10-5 mol L . Bereken K z en pKz van het geconjugeerde zuur NH4+.
Gegeven: NH3: Kb = 1,78 · 10-5 mol L
Gevraagd: K z en pKz van NH4+ = ?
Oplossing: De ionisatie van ammoniak wordt voorgesteld door: H2O + NH3 ⇆ OH- + NH4+.
De baseconstante beschrijft het evenwicht van de protolyse tussen NH3 en H2O:
Kb = [NH4+]e · [OH-]e [NH3]e = 1,78 · 10-5 mol L en pKb = –log Kb = 4,75
Kb is relatief klein. Ammoniak is dus een zwakke base.
Het zuur-basekoppel is: NH4+ ⇆ NH3 + H+
De zuurconstante van het zuur NH4+ kun je als volgt berekenen:
K z = K w Kb = 10-14 mol2 L2 1,78 · 10-5 mol L = 5,62 · 10-10 mol L
pK
z = –log K z = 9,25
Uit de berekende waarden van K z kun je afleiden dat het geconjugeerde zuur NH4+ zwakker is dan de base NH3.
Je kunt de sterkte van zuren en basen weergeven met respectievelijk de zuurconstante en de baseconstante. De waarde van die constanten kun je opzoeken in een tabel.
K z = [B]e · [H3O+]e [Z]e
pKz = –log K z
• sterk zuur: K z > 1 mol L
• zwak zuur: 10-6 < K z < 1 mol L
• zeer zwak zuur: 10-14 < K z < 10-6 mol L
• verwaarloosbaar: K z < 10-14 mol L
Kb = [Z]e · [OH-]e [B]e
pKb = –log Kb
• sterke base: Kb > 1 mol L
• zwakke base: 10-6 < Kb < 1 mol L
• zeer zwakke base: 10-14 < Kb < 10-6 mol L
• verwaarloosbaar: Kb< 10-14 mol L
Tussen de K z - en Kb-waarden en de pKz - en pKb-waarden van een zuur-basekoppel bestaat dit verband: K z · Kb = 10-14 en pKz + pKb = 14 (bij 25 °C).
Bij een protolysereactie wordt een proton overgedragen van een zuur naar een base.
De K z -waarden laten je toe om het verloop van een zuur-basereactie te voorspellen: Z1 + B2 ⇆ B1 + Z2
De 2 zuur-basekoppels van die reactie zijn:
• Z1 ⇆ B1 + H+ Kz1 = [B1]e · [H3O+]e [Z1]e
• Z2 ⇆ B2 + H+ Kz2 = [B2]e · [H3O+]e [Z2]e
De evenwichtsconstante voor die reactie is:
K c = [Z2]e · [B1]e [Z1]e · [B2]e = Kz1 Kz2
Als Kz1 veel groter is dan Kz2, dan ligt het evenwicht aan de rechterzijde. Omgekeerd zal het evenwicht naar de linkerzijde verschoven zijn als Kz1 veel kleiner is dan Kz2
Daaruit volgt ook dat er in een zuur-basereactie een protonoverdracht gebeurt tussen het sterkste zuur en de sterkste base. Hoe sterker het zuur en de base, hoe meer het evenwicht verschoven zal zijn naar 1 van de zijden. De waarde van K c laat dan toe om het verloop van de reactie kwantitatief te voorspellen:
K c > 103
evenwicht zodanig verschoven naar rechts dat de reactie als aflopend wordt beschouwd
10-3 < K c < 103 K c < 10-3
evenwichtsreactie evenwicht zodanig verschoven naar links dat je kunt beschouwen dat de reactie niet plaatsvindt
Op basis van de tabel met de zuurconstanten (Kz-waarden, zie p. 271-272) kan de voorspelling ook kwalitatief gebeuren door een pijl te trekken van het zuur naar de base. Hoe meer de pijl naar beneden helt, hoe gemakkelijker de reactie verloopt. Als de pijl naar boven wijst, vindt de zuur-basereactie nauwelijks of niet plaats.
sterk zuur zeer zwakke base zwak zuur zwakke base
zeer zwak zuur sterke base
VOORBEELD DE REACTIE TUSSEN HCO3- EN HSO4- IN WATER VOORSPELLEN
In principe zijn er 2 mogelijkheden om de reactie van HCO3- en HSO4- in water te voorspellen:
1 HCO3- + HSO4- ⇆ H2CO3 + SO42-
2 HCO3- + HSO4- ⇆ CO32- + H2SO4
De getalwaarden van K z en Kb van de betrokken deeltjes zijn:
z (mol L )
b (mol L )
· 10-8
HSO4- is het sterkste zuur en zal een proton overdragen aan HCO3-, de sterkste base.
Daarbij ontstaan er sulfaationen en waterstofcarbonaat: HCO3- + HSO4- ⇆ H2CO3 + SO42-
De evenwichtsconstante voor die reactie bedraagt: K c = Kz1 Kz2 = 1,2 · 10-2 5,62 · 10-11 = 2,14 ·
Aangezien de evenwichtsconstante groter is dan 103, is het een aflopende reactie.
De Kz-waarden laten toe om de richting van een zuur-basereactie te voorspellen.
Z1 + B2 ⇆ B1 + Z2 K c = Kz1 Kz2
K c > 103 10-3 < K c < 103 K c < 10-3 evenwicht naar rechts evenwichtsreactie evenwicht naar links
Kwalitatief kun je de richting voorspellen door een pijl te trekken van het zuur naar de base. Hoe meer de pijl naar beneden helt, hoe beter de reactie verloopt. Als de pijl naar boven wijst, vindt de zuur-basereactie nauwelijks of niet plaats.
Opgelet: bij een reactie in water kan water ook optreden als zuur of base.
VERDIEPING
De ionisatiegraad
Zuren ioniseren in water. Sterke zuren hebben een grote neiging om te ioniseren, zodat het evenwicht verschoven is naar de zijde met de hydroxoniumionen. Zwakke zuren ioniseren moeilijker. Het evenwicht is verschoven naar de zijde van de niet-geïoniseerde zuurmolecule. Zoals je al zag, kun je de ligging van het evenwicht weergeven door de zuurconstante. De sterkte van een zuur kan ook worden weergeven door de verhouding van het aantal geïoniseerde zuurmoleculen tot het totale aantal zuurmoleculen. Die verhouding wordt ook wel de ionisatiegraad genoemd.
α = x N waarbij x = het aantal geïoniseerde moleculen
N = het totale aantal opgeloste moleculen
De ionisatiegraad schommelt dus altijd tussen 0 en 1:
0 ≤ α ≤ 1
Bij sterke zuren benadert de ionisatiegraad 1, terwijl bij zwakke zuren de ionisatiegraad 0 benadert.
De ionisatiegraad is afhankelijk van de temperatuur en de concentratie, maar niet van de oplosbaarheid
Een stof kan slecht oplosbaar zijn en zeer goed ioniseren, maar omgekeerd kan een stof die goed oplosbaar is (zoals glucose), bijna niet ioniseren.
De verdunningswet van Ostwald
Stel: je neemt een zwak zuur met als beginconcentratie c0 mol L
Het zuur ioniseert als volgt:
Z + H2O ⇆ H3O+ + B
Bij een ionisatiegraad α bedragen de evenwichtsconcentraties van de ionen H3O+ en B allebei α c
De concentratie van de niet-geïoniseerde zuurmoleculen is (1 – α) c.
[ ]0 (mol L ) c 0
[ ] (mol L ) – α c
De evenwichtsconstante K z kun je dus als volgt schrijven:
Aangezien de ionisatiegraad α bij (zeer) zwakke zuren heel klein is, kun je stellen dat 1 – α ≈ 1.
Daaruit volgt dan:
α = K z (voor zwakke zuren) c
Die formule toont aan dat naarmate de beginconcentratie van het zwakke zuur afneemt, een groter aandeel van de moleculen ioniseert. Dat noem je ook de verdunningswet van Ostwald: bij het verdunnen van een zwak elektrolyt verhoogt de ionisatiegraad. Dat verschijnsel treedt ook op bij zwakke basen, zoals NH3. Je kunt het verschijnsel ook verklaren met behulp van het principe van Le Chatelier-Van ’t Hoff: bij het verdunnen wordt er water toegevoegd. Daardoor verschuift het evenwicht naar de rechterzijde.
Bereken de concentratie aan hydroxoniumionen in een oplossing waarvan [OH-] = 8,2 · 10-6 mol L (bij 25 °C).
Bereken de concentratie aan hydroxide-ionen in een oplossing waarvan [H3O+] = 1,9 · 10-9 mol L (bij 25 °C).
Bij 40 °C is Kw = 2,88 · 1014 mol2 L2 .
Bereken de concentratie aan H3O+ in zuiver water.
Bereken de Kb-waarde van PO43-, HPO42- en H2PO4bij 25 °C op basis van deze gegevens:
• H3PO4: Kz1 = 7,59 · 10-3 mol L
• H2PO4-: Kz2 = 6,17 · 10-8 mol L
• HPO42-: Kz3 = 2,14 · 10-13 mol L
Voor het 1e zuur-base-evenwicht van zwaveligzuur is pKz = 1,81. Bereken de zuurconstante.
De baseconstante van de organische base aniline bedraagt 7,4 · 10-10 mol L . Bereken pKb
pKb van lithiumhydroxide bedraagt 0,20.
Bereken de baseconstante.
Voorspel welke deeltjes vooral zullen ontstaan als H2PO4- en HSO3- met elkaar reageren.
H2PO4- + HSO3- ⇆ ...
Benoem in de onderstaande reactievergelijkingen de base, het zuur, de geconjugeerde base en het geconjugeerde zuur.
a HNO3 + H2O ⇆ NO3- + H3O+
b ClO3- + H2PO4- ⇆ HClO3 + HPO42-
Vul de onderstaande zuur-basereacties aan.
Benoem de base, het zuur, de geconjugeerde base en het geconjugeerde zuur.
a H2PO4- + CO32- ⇆
b NH3 + HClO3 ⇆
c Mg(OH)2 + CH3COOH ⇆
d ClO- + H2O ⇆
e salpeterzuur + natriumfloride ⇆
Rangschik deze stoffen …
a volgens toenemende zuursterkte ten opzichte van water (bij 25 °C):
HCN, H2PO4-, H2PO3-, HNO3, H2SO4, NH3, CH3OH
b volgens toenemende basesterkte ten opzichte van water (bij 25 °C):
H2PO4-, CN-, NO3-, CO32-, NH3
Voorspel kwantitatief of de onderstaande reacties in een waterig midden aflopend zijn. Noteer ook de correcte reactievergelijking.
a HClO3 + K2CO3 ⇆
b NH4+ + H2PO4- ⇆
c H2PO3- + HSO4- ⇆
Meer oefenen? Ga naar .
Om inzicht te krijgen in de werking van je eigen lichaam, je omgeving en heel wat industriële processen, is kennis van de zuurtegraad belangrijk. In de 2e graad leerde je al dat de zuurtegraad wordt weergegeven met een pH-waarde. In dit hoofdstuk zie je hoe de pH en de pOH verband houden met de concentraties aan hydroxonium- en hydroxide-ionen.
LEERDOELEN
L Het verband tussen de pH en de concentratie aan H3O+ geven
L Het verband tussen de pOH en de concentratie aan OH- geven
L Het verband tussen de pH en de pOH beschrijven
1 Herhaling: zure en basische oplossingen
In de 2e graad leerde je al dat men met de zuurtegraad of de pH weergeeft of een oplossing zuur of basisch is.
Meestal gebruikt men een pH-schaal die van 0 tot 14 loopt, omdat de pH van de meeste oplossingen binnen dat bereik valt. Lagere en hogere waarden kunnen echter wel voorkomen.
Hoe lager de pH, hoe zuurder de oplossing. Hoe hoger de pH, hoe basischer de oplossing.
• pH < 7: zure oplossing
• pH = 7: neutrale oplossing
• pH > 7: basische of alkalische oplossing
De pH-waarde hangt af van de concentratie aan hydroxonium- en hydroxide-ionen in een oplossing.
pH
sterk zure oplossing0
sterk basische oplossing14

maagsap citroensap cola zure regen water bloed zeepoplossing ammoniak ovenreinigers
Afb. 57 De pH-schaal en de pH-waarde van enkele oplossingen
De concentraties aan hydroxonium- en hydroxide-ionen in oplossingen zijn doorgaans klein en tussen oplossingen zijn er grote verschillen in concentratie mogelijk. Daarom maakte Søren Peter Lauritz Sørensen (1868-1939) gebruik van een logaritmische schaal als maat voor de zuurtegraad van een oplossing. Hij introduceerde het begrip zuurtegraad of pH. De pH van een oplossing is de negatieve logaritme van de concentratie aan hydroxoniumionen:
pH = –log[H3O+]e of [H3O+]e = 10-pH
In een neutrale oplossing, zoals zuiver water, is [H3O+]e = 10-7 mol L . De pH van die oplossing is dus exact 7.
Een zure oplossing is een oplossing waarvan [H3O+]e > 10-7 mol L . Bijgevolg is bij die oplossing de pH kleiner dan 7.
Voorbeeld:
[H3O+]e = 3,6 · 10-5 mol L pH = –log(3,6 · 10-5) = 4,44
Door de logaritmische schaal zal de pH 1 eenheid veranderen als de concentratie aan hydroxonium- of hydroxide-ionen verandert met een factor 10.
Voorbeeld:
[H3O+]e = 3,6 · 10-4 mol L pH = –log(3,6 · 10-4) = 3,44
Een basische of alkalische oplossing is een oplossing waarvan [H3O+]e < 10-7 mol L . Bijgevolg is bij die oplossing de pH groter dan 7.
Voorbeeld:
[H3O+]e = 8,3 · 10-9 mol L pH = –log(8,3 · 10-9) = 8,08
Opmerking:
De pH-waarde is net zoals de pKz-waarde een logaritme. De pKz-waarde wordt vaak gegeven met 2 cijfers na de komma. Om eenduidig te zijn, zullen we alle pH-waarden weergeven met 2 decimalen.
Analoog aan de pH, is de pOH de negatieve logaritme van de concentratie aan hydroxide-ionen van de oplossing:
pH komt van het Latijnse potentia hydrogenii, oftewel ‘de macht van waterstof’.
pOH = –log[OH-]e of [OH-]e = 10-pOH
De pOH wordt minder vaak gebruikt dan de pH, want de zuurtegraad van basische oplossingen wordt meestal ook weergegeven met de pH.
In sommige brouwerijen, waar de brouwketels na elk brouwproces gereinigd worden met natronloog, gebruikt men vaak de pOH.
Bekijk het verband tussen de concentratie aan hydroxoniumionen en hydroxide-ionen, en de pH- en pOH-waarden.
4 Het verband tussen de pH en de pOH van een oplossing
In een oplossing in evenwicht geldt bij 25 °C altijd:
K w = [H3O+]e · [OH-]e = 10-14 mol2 L2
Daaruit volgt:
–log([H3O+]e · [OH-]e) = –log(10-14)
–log[H3O+]e – log[OH-]e = 14
pH + pOH = 14
Er bestaat dus een eenvoudig verband tussen de pH en de pOH. Hoe hoger de pH-waarde van een oplossing, hoe lager de pOH, en omgekeerd.
Het verband tussen de pH en de pOH laat toe om heel snel de concentraties van ionen te berekenen.
Voorbeeld:
De concentratie aan hydroxide-ionen van een oplossing met pH = 3,60 bereken je als volgt:
pOH = 14 – pH
pOH = 14 – 3,60 = 10,40
[OH-]e = 10-10,4 mol L = 3,98 · 10-11 mol L
Hoe zuur of basisch een oplossing is, hangt af van de concentratie aan H3O+ en OH-
In de chemie geeft men de concentratie van die ionen vaak weer aan de hand van een pH- of pOH-waarde. Daarbij geldt:
pH = –log[H3O+]e of [H3O+]e = 10-pH
pOH = –log[OH-]e of [OH-]e = 10-pOH
Het verband tussen de pH en de pOH van een oplossing is: pH + pOH = 14.
WEETJE
Invloed van de temperatuur op de pH Het ionisatie-evenwicht van water wordt beïnvloed door de temperatuur, aangezien de ionisatie een endotherme reactie is. Bij een temperatuur hoger dan 25 °C stijgt de Kw-waarde. Dat betekent dat in een neutrale oplossing [H3O+]e > 10-7 mol L , waardoor de pH kleiner dan 7 wordt.
Voorbeeld:
Bij 30 °C is K w = [H3O+]e · [OH-]e = 1,48 · 10-14 mol2 L2 .
Daaruit volgt dat [H3O+]e = 1,22 · 10-7 mol L .
pH = –log(1,22 · 10-7 mol L ) = 6,91
De pH en het waterbindend vermogen Vlees bestaat voor een groot deel uit eiwitten. Eiwitten zijn polymeren van aminozuren. De pH van vlees speelt een belangrijke rol in de bereiding van bepaalde vleeswaren, omdat hij onder meer bepaalt hoeveel water vlees kan binden. Hoe meer water het vlees kan binden, hoe beter de groeiomstandigheden van bacteriën die het vlees kunnen bederven. Het komt er dus op aan om het waterbindend vermogen van vleesproducten die je lang moet kunnen bewaren, zo laag mogelijk te houden.
Het waterbindend vermogen van eiwitten hangt af van de lading van de restgroepen van de aminozuren. Die restgroepen van aminozuren kunnen positief of negatief geladen zijn. Bij een lage pH (zuur milieu) verdwijnen negatieve ladingen door binding met protonen en zijn eiwitten hoofdzakelijk positief geladen. Bij een hoge pH (basisch milieu) zijn eiwitten vooral negatief geladen door deprotonering van de restgroepen. Bij een pH van 5,3-5,5 bevatten eiwitten ongeveer evenveel positieve als negatieve ladingen, waardoor de moleculen elkaar goed aantrekken en er weinig ruimte is om water vast te houden. Bij lagere of hogere pH-waarden zijn de eiwitten respectievelijk positief of negatief geladen, waardoor ze elkaar afstoten en meer water kunnen vasthouden.
Voor de bereiding van vleesproducten die vooral uit eiwitten en vetten bestaan (zoals worsten), bepaalt de pH de mate van interactie tussen eiwitten en vetten. Een te hoge of te lage pH verstoort de interactie tussen beide groepen moleculen, waardoor er weinig binding is. De textuur en andere wenselijke eigenschappen, zoals kleur, smaak en houdbaarheid, verminderen.
Verder zegt de pH van een vleesproduct veel over de kwaliteit van het vlees. Na het slachten daalt de pH van vlees onder meer door de afbraak van glycogeen tot melkzuur. Als enkele uren na het slachten de zuurtegraad ongeveer 6 bedraagt, is de pH te weinig gedaald. De oorzaak kan een zeer laag glycogeengehalte zijn als gevolg van langdurige stress. Dergelijk vlees is donkerder gekleurd en taaier. Een te snelle daling van de pH kan een gevolg zijn van een plotse vrijstelling van grote hoeveelheden glycogeen door stress vlak voor het slachten. Die snelle daling van de pH zorgt ervoor dat er eiwitafbraak gebeurt terwijl het vlees nog relatief warm is. Daardoor ontstaat er zeer bleek en zacht vlees dat veel vocht verliest. Voor een vleesverwerker levert de pH van vlees dus waardevolle informatie op.
(pH = 6,70)NOR (pH = 5,70)PSE (pH = 4,13)

Van een oplossing krijg je telkens 1 van deze waarden bij 25 °C: de pH, de pOH, [H3O+] of [OH-]. Bereken de andere waarden.
a pH = 2,40
b pOH = 3,80
c [H3O+] = 3,0 · 10-11 mol L
d [OH-] = 9,5 · 10-4 mol L
Bij 25 °C is pH = 7,00 bij zuiver water.
Een leerling laat 300 mL water afkoelen tot 0 °C.
Bij die temperatuur is Kw = 1,12 · 10-15 mol2 L2 .
Zal de pH gestegen of gedaald zijn?
Toon dat aan met een berekening.
Bereken de pH van een oplossing die 0,030 mol H3O+ per 2,00 L oplossing bevat.
Bereken de pH van een oplossing die 0,0080 mol OHper 0,50 L oplossing bevat.
Hoe groot is de concentratie in mol L van de hydroxide-ionen in een oplossing met pH = 9,82?
Het is belangrijk om de pH van een oplossing te kunnen berekenen. In de chemie heb je namelijk vaak oplossingen met een welbepaalde pH nodig. Dan moet je weten welke hoeveelheid van een bepaald zuur of een bepaalde base je moet oplossen in een bepaald volume water om de gewenste pH te bekomen. In dit hoofdstuk leer je hoe je de pH van een oplossing kunt berekenen.
Belangrijk: voor de berekening van de pH gebruik je formules. In die formules maak je telkens gebruik van de molariteit: de concentratie van de stof wordt er uitgedrukt in mol L
L De pH van oplossingen van sterke en zwakke zuren berekenen
L De pH van oplossingen van sterke en zwakke basen berekenen
L Aangeven wat de invloed op de pH is als je zouten oplost
De pH van een oplossing wordt altijd bepaald door de concentratie aan hydroxoniumionen ([H3O+]) en hydroxide-ionen ([OH-]).
• De hydroxoniumionen zijn afkomstig van de ionisatie van het zuur ([H3O+]Z) en de ionisatie van water ([H3O+]w):
[H3O+]e = [H3O+]Z + [H3O+]w
• De hydroxide-ionen zijn afkomstig van de dissociatie of de ionisatie van de base ([OH-]B) en de ionisatie van water ([OH-]w):
[OH-]e = [OH-]B + [OH-]w
Het aantal van die ionen in een oplossing is vooral afhankelijk van:
• de sterke van het zuur of de base;
• de concentratie van het zuur of de base.
In veel gevallen zal het aantal ionen afkomstig van de autoprotolyse van water te verwaarlozen zijn. Zoals je eerder leerde, heeft ook de temperatuur een invloed op de zuurtegraad, maar in dit hoofdstuk gaan we daar niet verder op in.
Een oplossing met een welbepaalde concentratie van een zuur of base heeft een welbepaalde pH. Soms gebruikt men de pH in plaats van de concentratie van de oplossing. Met de formule voor de pH-berekening kun je schakelen tussen de molaire concentratie en de pH.
2.1 De pH van een oplossing van een sterk (eenwaardig) zuur
De Kz-waarde van sterke zuren is hoog. Omdat sterke zuren bijna volledig ioniseren, is de concentratie aan hydroxoniumionen als gevolg van de ionisatie van het zuur ([H3O+]Z) nagenoeg gelijk aan de beginconcentratie van het zuur (cZ0).
Als de concentratie van het zuur voldoende groot is, kun je het aantal hydroxoniumionen als gevolg van de ionisatie van water verwaarlozen ([H3O+]w ≈ 0 mol L ). Je kunt de pH van een dergelijke oplossing bepalen met de negatieve logaritme van de beginconcentratie van het zuur:
Z + H2O B + H3O+
[H3O+]e = [H3O+]Z = cZ0
pH = –log[H3O+]e = –log cZ0
VOORBEELDVRAAGSTUK
Bereken de pH van een oplossing zoutzuur met een concentratie van 0,050 mol L . Bereken ook de pH na 10 keer verdunnen.
Gegeven: HCl: cZ0 = 0,050 mol L
Gevraagd: pH = ?
Oplossing: pH = –log cZ0 = –log(0,050 mol L ) = 1,30
De pH na 10 keer verdunnen:
cZ0 = 0,0050 mol L
pH = –log cZ0 = –log(0,0050 mol L ) = 2,30
Merk op dat als je de concentratie van een oplossing sterk zuur 10 keer verdunt, de pH met 1 eenheid stijgt.
WEETJE
Bij het verdunnen van een zure oplossing kun je nooit een alkalische oplossing (pH > 7) bekomen. Bij zeer kleine concentraties van een zuur draagt de ionisatie van water in belangrijke mate bij aan de concentratie aan hydroxoniumionen en bepaalt ze mee de pH van de oplossing.
We bekijken een uitgewerkt voorbeeld waarbij de concentratie van het zuur zo klein is dat je rekening moet houden met de autoprotolyse van water.
Bereken de pH van een oplossing zoutzuur met een concentratie van 1,0 · 10-8 mol L .
Gegeven: [H3O+]Z ≈ cZ0 = 1,0 · 10-8 mol L
Gevraagd: pH van sterk verdunde oplossing zoutzuur = ?
Oplossing: De autoprotolyse van water wordt beïnvloed door de hydroxoniumionen die afkomstig zijn van de ionisatie van het zuur.
H2O + H2O ⇆ H3O+ + OH(1,0 · 10-8 + x) mol L x mol L
[H3O+]w = x mol L
K w = 10-14 mol2 L2 = x · (x + 1,0 · 10-8) mol2 L2
10-14 = x2 + x · 1,0 · 10-8
[H3O+]w = x mol L = 9,5 · 10-8 mol L
[H3O+]e = [H3O+]Z + [H3O+]w = 0,000 000 11 mol L
pH = –log [H3O+]e = 6,98
Als je geen rekening hield met de ionisatie van water, zou de berekende waarde van de pH van die oplossing 8,00 opleveren. Dat is echter niet correct, omdat bij zeer lage concentraties van zuren de hydroxoniumionen die afkomstig zijn van de ionisatie van water, mee de zuurtegraad van de oplossing bepalen.
Als de concentratie van het zuur de waarde van 1,0 · 10-7 benadert, moet je dus altijd rekening houden met de autoprotolyse van water.
De berekening van de pH van oplossingen van sterke basen verloopt analoog aan de pH-berekening van oplossingen van sterke zuren. De pH (of pOH) wordt bepaald door het aantal hydroxide-ionen in de oplossing. Als je een base oplost, verhoogt de concentratie aan hydroxideionen in de oplossing. Bij een sterke base dissocieert de base nagenoeg volledig, waardoor de concentratie aan hydroxide-ionen nagenoeg gelijk is aan de beginconcentratie van de base (cB0) vermenigvuldigd met de index van het hydroxide-ion.
Als de concentratie van de sterke base voldoende groot is, kunnen de hydroxide-ionen die afkomstig zijn van de ionisatie van water, worden verwaarloosd ([OH-]w ≈ 0).
M(OH)n → Mn+ + n OH[OH-]e = [OH-]B = n · cB0 pOH = –log[OH-]e = –log(n · cB0)
Vermits pH = 14 – pOH, is pH = 14 + log(n · cB0)
VOORBEELDVRAAGSTUK
Bereken de pH van de NaOH-oplossingen met concentraties van:
a 0,1 mol L ;
b 0,01 mol L .
Gegeven: a cB0 = 0,10 mol L
b cB0 = 0,010 mol L
Gevraagd: pH = ?
Oplossing: a [OH-]e = 0,10 mol L → pH = 14 + log 0,10 = 13,00
b [OH-]e = 0,010 mol L → pH = 14 + log 0,010 = 12,00
Bemerk ook hier dat als je de concentratie van de sterke base 10 keer verdunt, de pH met 1 eenheid daalt.
Analoog aan de zuren kun je nooit een zure oplossing (pH < 7) bekomen door een alkalische oplossing te verdunnen. Bij kleine concentraties van een base draagt de ionisatie van water in belangrijke mate bij aan de concentratie aan hydroxide-ionen en bepaalt ze mee de pH van de oplossing.
De sterkte van een zuur of een base en de concentratie bepalen de pH van een oplossing. Formule voor de berekening van een oplossing van een sterk zuur: pH = –log cZ0.
Formule voor de berekening van een oplossing van een sterke base M(OH)n: pH = 14 + log (n · cB0).
3 De pH van oplossingen van zwakke zuren en zwakke basen
3.1 De pH van oplossingen van zwakke en zeer zwakke zuren
Als een zwak zuur reageert met water, dragen niet alle zuurmoleculen hun proton over aan water. Daardoor is [H3O+]e < cZ0
Z + H2O B + H3O+
Bij oplossingen van zwakke zuren die niet te sterk verdund zijn, is net als bij sterke zuren de [H3O+] die afkomstig is van water, verwaarloosbaar ten opzichte van de [H3O+] die afkomstig is van het zuur. Je kunt dus stellen dat [H3O+]e = [B]e.
De zuurconstante K z = [H3O+]e · [B]e [Z]e kun je dan ook schrijven als K z = [H3O+]e 2 [Z]e
De verschillende concentraties bereken je aan de hand van de evenwichtsreactie.
Z B H3O+
[ ]0 ( mol L ) Z0 – –
∆[ ] ( mol L ) – x + x + x
[ ]e ( mol L ) Z0 – xx x
[Z]e = [Z]0 – [H3O+]e
K z = [H3O+]e · [B]e [Z]e = [H3O+]e 2 [Z]e = [H3O+]e 2 [Z]o – [H3O+]e
Door [H3O+]e uit die breuk af te zonderen, kun je de pH berekenen volgens pH = –log[H3O+]e.
VOORBEELDVRAAGSTUK
Bereken de pH van een oplossing azijnzuur (CH3COOH of HAc) met concentratie van 0,25 mol L
Gegeven: cZ0 = 0,25 mol L
Gevraagd: pH = ?
Oplossing: De Kz-waarde bedraagt 1,78 · 10-5 mol L
Azijnzuur is een zwak zuur.
CH3COOH + H2O ⇆ H3O+ + CH3COO-
De evenwichtsconcentraties bereken je aan de hand van het chemisch evenwicht:
CH3COOHH2OH3O+ CH3COO-
[ ]0 ( mol L ) 0,25 / 0 0
∆[ ] ( mol L ) – x / + x + x
[ ]e ( mol L ) 0,25 – x/ x x
K z = [H3O+]e · [CH3COO-]e [CH3COOH]e = 1,78 · 10-5 mol L = x2 0,25 – x mol L
Die tweedegraadsvergelijking levert 2 mogelijke waarden op:
x1 = 0,0021
x2 = –0,0021
Een negatieve waarde is niet mogelijk.
Bijgevolg is [H3O+]e = 0,0021 mol L .
pH = –log[H3O+]e = –log 0,0021 = 2,68
Bij zeer zwakke zuren (10-6 < K z < 10-14) is [H3O+]e verwaarloosbaar klein ten opzichte van de beginconcentratie van het zuur.
Dan kun je stellen:
Daaruit volgt:
Daaruit volgt:
[Z0] – [H3O+]e ≈ [Z0]
K z = [H3O+]e 2 [Z]0
[H3O+]e = (K z · cZ0 ) (waarbij [Z0] = cZ0) en pH = –log[H3O+]e = –log (K z · cZ0)
pH = 1 2 · pKz –1 2 · log cZ0
Met die formule kun je dus sneller de pH berekenen, omdat je geen tweedegraadsvergelijking hoeft op te lossen.
VOORBEELDVRAAGSTUK
Bereken de pH van een oplossing HBrO met een beginconcentratie van 0,50 mol L
Gegeven: cZ0 = 0,50 mol L
Gevraagd: pH = ?
Oplossing: De Kz-waarde bedraagt 2,04 · 10-9 mol L HBrO is een zeer zwak zuur.
De pH kun je als volgt berekenen: pH = 1 2 pKz –1 2
De berekening van de pH van zwakke basen verloopt analoog aan die van zwakke zuren. Als zwakke basen oplossen in water, ontstaat er een evenwichtsreactie: B + H2O Z + OH-
Omdat er bij een zwakke base maar weinig moleculen een proton opvangen, is [OH-] < cB0.
Bij niet al te sterk verdunde oplossingen van zwakke basen is de [OH-] die afkomstig is van water, te verwaarlozen ten opzichte van de [OH-] die afkomstig is van de base, waardoor je kunt stellen: [OH-]e = [Z]e
De baseconstante Kb = [OH-]e · [Z]e [B]e kun je dan schrijven als Kb = [OH-]e 2 [B]e .
De verschillende concentraties bereken je aan de hand van de evenwichtsreactie:
B Z OH-
[ ]0 ( mol L ) B0 / /
∆[ ] ( mol L ) – x + x + x
[ ]e ( mol L ) B0 – xx x
[B]e = [B]0 – [OH-]e, waardoor Kb = [OH-]e 2 [B]e = [OH-]e 2 [B]o – [OH-]e
Nadat je [OH-]e hebt afgezonderd uit die vergelijking, kun je de pOH berekenen en vervolgens de pH = 14 – pOH.
VOORBEELDVRAAGSTUK
Bereken de concentratie van een oplossing ammoniak waarvan de pH = 12,00.
Gegeven: pH = 12,00
Gevraagd: de beginconcentratie van ammoniak cB0 = ?
Oplossing: H2O + NH3 ⇆ NH4+ + OHDe Kb-waarde van ammoniak bedraagt 1,78 · 10-5 mol L . Ammoniak is dus een zwakke base.
pOH = 14 – pH = 2,00
Uit de pOH-waarde bereken je [OH-]e: [OH-]e = 10-2 mol L = 0,01 mol L
Net zoals in de vorige vraagstukken, bereken je de evenwichtsconcentraties als volgt: NH3 NH4+ OH-
[ ]0 ( mol L ) B0 0 0
∆[ ] ( mol L ) – 0,01+ 0,01+ 0,01
[ ]e ( mol L ) B0 – 0,010,010,01
Kb = [OH-]e · [NH4+]e [NH3]e = (0,01 mol L ) · (0,01 mol L ) (c0 – 0,01 mol L ) = 1,78 · 10-5 mol L
Daaruit kun je berekenen dat [NH3]0 = 5,62 mol L
Net zoals bij zeer zwakke zuren, is bij zeer zwakke basen (10-6 < Kb < 10-14) de [OH-]e verwaarloosbaar klein ten opzichte van [B]0. In die gevallen is [B]0 – [OH-]e ≈ [B]0
Daaruit volgt: Kb = [OH-]e 2 [B]0
[OH-]e = Kb · cB0 (waarbij cB0 = [B0])
pOH = –log[OH-]e = –log
Bij een oplossing van een zwak zuur of een zwakke base maak je gebruik van de evenwichtsreactie om de concentratie aan [H3O+]e of [OH-]e te berekenen. Vervolgens bereken je de pH of pOH als volgt: pH = –log[H3O+]e of pOH = –log[OH-]e
Als de zuurconstante of baseconstante tussen 10-6 en 10-14 ligt, kun je gebruikmaken van een vereenvoudigde formule om de pH en pOH te berekenen:
pH = 1 2 · pKz –1 2 · log cZ0
pH = 14 –1 2 · pKb + 1 2 · log cB0
Meerwaardige zuren zijn zuren die meer dan 1 proton kunnen overdragen naar water. De ionisatie gebeurt in sprongen (trapsgewijze ionisatie), die elk een eigen evenwichtsconstante (Kz) hebben.
Voorbeeld:
Trapsgewijze ionisatie van fosforzuur
H3PO4 + H2O ⇆ H2PO4- + H3O+ Kz1 = 7,59 · 10-3 mol L
H2PO4- + H2O ⇆ HPO42- + H3O+ Kz2 = 6,17 · 10-8 mol L
HPO42- + H2O ⇆ PO43- + H3O+ Kz3 = 2,14 · 10-13 mol L
Omdat de Kz-waarde van de 2e en 3e ionisatie veel kleiner is dan die van de 1e ionisatie, dragen die 2e en 3e ionisatie nauwelijks bij tot [H3O+]e. Daarom kun je meerwaardige zuren meestal beschouwen als eenwaardige (zwakke) zuren.
Bereken de pH van een oplossing H3PO4 met een concentratie van 5,0 mol L .
Gegeven: H3PO4: cZ0 = 5,0 mol L
Gevraagd: pH = ?
Oplossing: Fosforzuur is een zwak zuur, aangezien K z = 7,59 · 10-3
K z = [H3O+]e2 [Z]e = [H3O+]e 2 [Z]0 – [H3O+]e
Via de hoger geziene werkwijze kun je berekenen dat [H3O+]e = 0,19 mol L pH = –log[H3O+]e = 0,72
Zwavelzuur is een vrij uniek zuur door het feit dat de 1e ionisatie bijna volledig is (Kz1 = 103 mol L ), maar de 2e ionisatie niet (Kz2 = 1,2 · 10-2 mol L ).
Bij een geconcentreerde oplossing van zwavelzuur ontstaan er zoveel hydroxoniumionen door de 1e ionisatie dat de 2e ionisatie beperkt wordt. In minder geconcentreerde oplossingen ontstaan er kleinere aantallen hydroxoniumionen tijdens de 1e ionisatie, waardoor de hydroxoniumionen van de 2e ionisatie mee de zuurtegraad bepalen.
1 Bereken de pH van een H2SO4-oplossing met een concentratie van 1,0 mol L .
Gegeven: H2SO4: cZ0 = 1,0 mol L
Gevraagd: pH = ?
Oplossing: De 1e ionisatie loopt volledig af, waardoor [H3O+] van de 1e ionisatie gelijk is aan 1,0 mol L
Als je ervan uitgaat dat enkel de 1e ionisatie belangrijk is, geldt:
pH = –log cZ0 = –log 1,0 = 0,00
Om na te gaan of de 2e ionisatie een noemenswaardige bijdrage heeft aan de pH, bereken je de concentratie aan hydroxoniumionen als gevolg van de 2e ionisatie.
Daarbij is Kz2 = 1,20 · 10-2 mol L = [H3O+]e · [SO42-]e [HSO4-]e = (1,0 + x) · x (1,0 – x) mol L .
Daaruit volgt dat x = 0,012 mol L .
De concentratie aan hydroxoniumionen is dus: [H3O+]e = 1,0 mol L + 0,012 mol L = 1,012 mol L
De pH van de oplossing bedraagt: pH = –log[H3O+]e = –0,01
Je stelt vast dat de 2e ionisatie van zwavelzuur nauwelijks de pH beïnvloedt.
2 Bereken de pH van een oplossing H2SO4 met een concentratie van 0,0010 mol L .
Gegeven: H2SO4: cZ0 = 0,0010 mol L
Gevraagd: pH = ?
Oplossing: De hoeveelheid H3O+ als gevolg van de 1e ionisatie is 0,0010 mol L .
Als de hoeveelheid H3O+-ionen afkomstig van de 2e ionisatie verwaarloosbaar is, heeft die oplossing een pH = 3,00.
Het aantal hydroxoniumionen als gevolg van de 2e ionisatie bereken je volgens het chemisch evenwicht:
Kz2 = 1,2 · 10-2 mol L = [H3O+]e · [SO42-]e [HSO4-]e = (0,0010 + x) · x (0,0010 – x) mol L
Het aantal hydroxoniumionen dat ontstaat als gevolg van de 2e ionisatie van zwavelzuur, kun je berekenen door de tweedegraadsvergelijking op te lossen. Zo bekom je: x = 9,0 · 10-4 mol L
De totale concentratie aan hydroxoniumionen van de 1e en 2e ionisatie van zwavelzuur bedraagt dus: [H3O+]e = 0,0010 mol L + 0,000 90 mol L = 0,0019 mol L
Daaruit bereken je de pH van de oplossing: pH = 2,72.
In een verdunde oplossing bepalen de hydroxoniumionen die afkomstig zijn van de 2e ionisatie, mee de pH van de oplossing.
Vanaf een concentratie kleiner dan 10-3 mol L kun je de 2e ionisatie van zwavelzuur niet meer verwaarlozen.
Bij de meeste meerwaardige zuren beïnvloeden de 2e en de 3e ionisatie de zuurtegraad niet of nauwelijks. Voor de berekening van de pH kun je ze als eenwaardig zuur beschouwen.
Zwavelzuur is een bijzonder geval. In geconcentreerde oplossingen zal de zuurtegraad vooral worden bepaald door de 1e ionisatie. In minder geconcentreerde oplossingen (vanaf een concentratie < 10-3 mol L ) moet je rekening houden met de 2e ionisatie.
Zouten zijn opgebouwd uit ionen die samen in een ionrooster zitten. Als ze worden opgelost in water, kunnen de positieve en negatieve ionen vrijkomen (dissociatie).
Bepaalde soorten ionen kunnen zich gedragen zich als Brønstedzuur of Brønstedbase
Een positief ion kan zich gedragen als een zwak zuur ten opzichte van water. Ionen van alkalimetalen en aardalkalimetalen zijn verwaarloosbaar zwak en reageren nauwelijks met water. Het ammoniumion daarentegen is een zwak zuur, maar sterker dan water.
NH4+ + H2O ⇆ NH3 + H3O+
De meeste negatieve ionen gedragen zich als basen in reacties met water:
B + H2O ⇆ Z + OH-
Voorbeeld:
S2- + H2O ⇆ HS- + OH-
Ionen van metalen bevatten geen H. Ze kunnen dus strikt genomen geen proton overdragen. Opgeloste ionen zijn echter gehydrateerd. De watermoleculen van de watermantel kunnen protonen afstaan, waardoor een opgelost metaalion toch de rol van protondonor kan vervullen.
Voorbeeld: Na+(H2O)6 → Na(H2O)5OH + H+
Negatieve ionen die waterstof bevatten (zoals het waterstofcarbonaation en het diwaterstoffosfaation), kunnen reageren als een protondonor of als een protonacceptor.
HCO3- + H2O ⇆ CO32- + H3O+
HCO3- + H2O ⇆ H2CO3 + OH-
K z = 5,62 · 10-11 mol L
Kb = 2,34 · 10-8 mol L en
H2PO4- + H2O ⇆ HPO42- + H3O+
H2PO42- + H2O ⇆ H3PO4 + OH-
K z = 6,17 · 10-8 mol L
Kb = 1,32 · 10-12 mol L
Het waterstofcarbonaation reageert overwegend als base, omdat de Kb-waarde van het waterstofcarbonaation groter is dan de KZ-waarde. Daardoor neemt de concentratie aan hydroxide-ionen toe. Het diwaterstoffosfaation reageert eerder als zuur, omdat de K z -waarde groter is dan de Kb-waarde. Daardoor neemt de concentratie aan hydroxoniumionen in de oplossing toe.
Afhankelijk van de relatieve sterkte van de ionen als zuren en/of basen ten opzichte van water, beïnvloeden zouten de pH van de zoutoplossing.
5.1 Zouten die dissociëren in ionen die een zwakker zuur of een zwakkere base zijn dan water
Als een positief ion van een zout een zwakker zuur is dan water én het negatieve ion een zwakkere base is dan water, dan heeft het oplossen van het zout geen invloed op de pH. Die zouten reageren neutraal
Voorbeeld:
natriumchloride NaCl NaCl → Na+ + Cl-
• Na+: de K z -waarde van het Na+-ion is kleiner dan die van water. Na+ draagt niet bij tot een verhoging van [H3O+]e
• Cl-: de Kb-waarde van het chloride-ion (10-21) is kleiner dan de Kb-waarde van water (10-14). Cl- draagt dus niet bij tot een verhoging van [OH-]e.
Beide ionen beïnvloeden [H3O+]e en [OH-]e van de oplossing niet, waardoor de pH niet verandert als NaCl in water wordt opgelost.
5.2 Zouten waarvan enkel het zure deeltje een interactie met water vertoont
Bij de dissociatie van sommige zouten ontstaan er ionen die reageren als een zwak zuur en de concentratie aan hydroxoniumionen verhogen. Als de andere ionen een zwakker zuur of een zwakkere base zijn dan water, oefenen ze geen invloed uit op de concentratie aan hydroxonium- of hydroxide-ionen. Door ionisatie van het zwakke zuur daalt de pH. Die zouten zijn zuurvormend.
Volledig analoog aan de berekening van de pH van een oplossing van een zwak zuur (zie paragraaf 3.1), kun je de concentratie van het positieve ion (zwak zuur) gebruiken om de pH van een oplossing van het zout te berekenen.
Voorbeelden:
• ammoniumchloride NH4Cl
NH4Cl → NH4+ + Cl-
–NH4+: het ammoniumion is een sterker zuur dan water (K z = 5,62 · 10-10 mol L > Kz(H2O)) en veroorzaakt een verhoging van [H3O+]e.
– Cl-: het chloride-ion is een zwakkere base dan water en draagt niet bij tot een verhoging van [OH-]e (zie hoger).
Als je NH4Cl oplost, zorgt dat dus voor een verhoging van [H3O+]e, waardoor de pH daalt.
• natriumwaterstofsulfaat NaHSO4
NaHSO4 → Na+ + HSO4-
–Na+: het natriumion is een zwakker zuur dan water en draagt niet bij tot een verhoging van [H3O+]e (zie hoger).
–HSO4-: het waterstofsulfaation is amfolyt, maar reageert vooral als zuur, omdat de K z -waarde groter is dan de Kb-waarde. Aangezien het een sterker zuur is dan water (Kz(HSO4-) = 1,2 · 10-2 mol L > Kz(H2O)), verhoogt [H3O+]e als je het zout oplost.
Als je NaHSO4 oplost, zorgt dat dus voor een verhoging van [H3O+]e, waardoor de pH daalt.
5.3 Zouten waarvan enkel het basedeeltje een interactie met water vertoont
De dissociatie van sommige zouten levert een positief ion op dat een zwakker zuur is dan water en daarom nauwelijks een invloed heeft op de concentratie aan hydroxoniumionen. Als het negatieve ion een zwakke base is, verhoogt de concentratie aan hydroxide-ionen. Door het aanbrengen van een zwakke base stijgt de pH. Die zouten zijn basevormend.
Omdat het negatieve ion een zwakke base is, kun je de pH van een oplossing van zout die afgeleid is van een zwak zuur en een sterke base, berekenen op basis van de concentratie van het negatieve ion, analoog aan de berekening van de pH van een oplossing van een zwakke base (zie paragraaf 3.2).
Voorbeeld:
natriumacetaat NaCH3COO
NaCH3COO → Na+ + CH3COO-
• Na+: het natriumion is een zwakker zuur dan water (zie hoger).
• Ac-: het acetaation is een sterkere base dan water (Kb(Ac) = 5,62 · 10-10 mol L > Kb(H2O)), waardoor de concentratie aan hydroxide-ionen in de oplossing toeneemt.
Door die toename van [OH-]e stijgt de pH.
De positieve en/of negatieve ionen van zouten kunnen optreden als protondonor of protonacceptor en op die manier de zuurtegraad beïnvloeden. De sterkte van het positieve ion en negatieve ion als respectievelijk zuur of base bepaalt of het zout neutraal, zuurvormend of basevormend is.
POSITIEF ION
ZWAK ZUUR
VERWAARLOOSBARE INTERACTIE MET WATER
ZWAK ZUUR pH daalt pH daalt
• als Kb(anion) > Kz(kation): pH stijgt
NEGATIEF ION
ZWAKKE BASE
• als Kz(kation) > Kb(anion): pH daalt
• als Kz(kation) = Kb(anion): geen invloed op pH pH stijgt
VERWAARLOOSBARE INTERACTIE MET WATER pH daalt geen invloed op de pH
Ga naar en bereken de pH van een zoutoplossing waar zowel het positieve als het negatieve ion de pH beïnvloedt.
Bereken de pH van een oplossing HBr met een concentratie van 0,015 mol L
Bereken de pH van een oplossing die 12,6 g HNO3 per liter bevat.
Bereken de pH van een oplossing HNO2 met een concentratie van 0,025 mol L
De pH van 1,0 L HCl-oplossing bedraagt 1,50. Bereken de nieuwe pH nadat de oplossing verdund werd met 500 mL water.
Bereken de pH van 0,0020 mol L HCl.
Welke pH heeft de oplossing die je bekomt door 20,0 mL HCl van 1,0 mol L toe te voegen aan 1,00 L water?
De pH van een KOH-oplossing is 12,00. Hoe groot wordt de pH als je bij 500 mL van die oplossing 200 mL water voegt?
Bereken de concentratie van de hydroxide-ionen in een ammoniakoplossing van 0,050 mol L .
Hoeveel mL van een bariumhydroxideoplossing die 8,55 g L van dat zout bevat, moet je bij 1,0 L water gieten om een oplossing te verkrijgen met pH = 12,00?
Hoe kun 2,0 L oplossing met pH = 10,00 bereiden uit een oplossing bariumhydroxide met pH = 12,00?
Bereken de pH van een 0,10 mol L zwavelzuuroplossing, rekening houdend met de waarde van de 2e zuurconstante (de 1e ionisatie mag je als volledig beschouwen). Vergelijk het resultaat met de berekende pH als je: a alleen de 1e ionisatie als volledig beschouwt en de 2e verwaarloost; b beide ionisaties als volledig beschouwt.
Bereken de zuurtegraad van een HBrO-oplossing met een concentratie van 0,060 mol L
Gewone huishoudazijn heeft een pH van ongeveer 2,80. Hoeveel gram azijnzuur is er aanwezig in 1,0 L azijnzuuroplossing?
Bereken de de pH van deze zoutoplossingen:
a 0,651 g KCN opgelost in 500 mL water
b 0,025 mol L NH4Cl
c 1,50 g K2CO3 opgelost in 100 mL water
d 0,10 mol L NH4F
Bereken de pH van een oplossing met een concentratie van 1,0 mol L , 0,10 mol L en 0,010 mol L van deze stoffen:
a NaCH3COO
b NaCl
c NH4Br
d NH4CH3COO
e NH4ClO
f NH4NO2
g NH4CN
Hoeveel liter water moet je toevoegen aan 125 mL NaOH-oplossing (26,8 m%; ρ = 1,28) om een oplossing te verkrijgen met pH = 13,00?
Hoeveel gram natriumhydroxide bevat een oplossing van die stof per liter, als de pH ervan 14,00 is? Hoe groot wordt de pH als je aan 10 mL van die oplossing 5 druppels geconcentreerd zwavelzuur (98,1 m%; ρ = 1,84) toevoegt? (1 druppel = 0,050 mL)
Van de oplossing van een sterk zuur is de pH = 1,00. Van de oplossing van een hydroxide is de pH = 13,00. Je mengt 10 mL van de zure oplossing met 50 mL van de basische oplossing en verdunt met water tot 0,50 L. Hoe groot is de concentratie aan hydroxoniumionen (in mol L ) in het mengsel dat je verkrijgt?
Heel wat laboratoriumexperimenten, industriële processen en biologische systemen verlopen het best bij een stabiele pH. Schommelingen in de zuurtegraad zorgen voor ongewenste effecten. Buffers zijn in het domein van de chemie ware helden: het zijn de onmisbare bewakers van een stabiele pH. In dit hoofdstuk bestudeer je de principes en de werking van buffers.
LEERDOELEN
L Beschrijven wat een buffer is
L De werking van een buffer verklaren
Een buffer (ook ‘bufferoplossing’ of ‘buffermengsel’ genoemd) is een oplossing waarvan de pH constant blijft als je een (kleine) hoeveelheid zuur of base aan de oplossing toevoegt of als je de bufferoplossing verdunt.
De pH van een buffermengsel blijft nagenoeg constant nadat je een zuur of base hebt toegevoegd, omdat het mengsel in staat is om de toename in het aantal H3O+- of OH--ionen grotendeels weg te werken. Dat is mogelijk doordat een buffermengsel zowel een zwak zuur als de geconjugeerde base bevat. Het zwakke zuur en de zwakke base vormen een evenwicht. Bij een verhoging van [H3O+] of [OH-] verschuift de ligging van het evenwicht zodanig dat de verhoging in [H3O+] of [OH-] wordt weggewerkt.
Gewoonlijk vorm je een buffer door in water de volgende stoffen op te lossen:
• een zwak zuur en het zout dat het geconjugeerde base-ion bevat, zoals CH3COOH en NaCH3COO, HCN en KCN, NaH2PO4 en K2HPO4, en HNO2 en KNO2;
• een zwakke base en het zout dat het geconjugeerde zuurion bevat, zoals NH3 en NH4Cl.
We bekijken een buffermengsel dat gemaakt wordt met een zwak zuur en een zout dat het geconjugeerde base-ion bevat, zoals een oplossing van azijnzuur (CH3COOH) en natriumacetaat (NaCH3COO). Als het zwakke zuur oplost in water, daalt de pH door de ionisatie van het zuur:
CH3COOH + H2O ⇆ CH3COO- + H3O+ K z = [H3O+]e · [CH3COO-]e [CH3COOH]e
Aangezien het opgeloste zuur zwak is, zijn [H3O+]e en [CH3COO-]e klein.
De dissociatie van het zout natriumacetaat zorgt voor een toename in het aantal en de concentratie acetaationen ([CH3COO-]):
NaCH3COO → Na+ + CH3COO-
De toename in de concentratie van CH3COO- door de dissociatie van het zout zorgt voor een verschuiving in het ionisatie-evenwicht van het zuur (principe van Le Chatelier-van ’t Hoff). De reactie van de acetaationen met de hydroxoniumionen zorgt voor een daling van [H3O+]e en een stijging in de pH.
CH3COOH + H2O CH3COO- + H3O+
In het bekomen mengsel is:
• [CH3COOH]e ≈ cZ0, aangezien het een zwak zuur betreft en aangezien door de toename aan acetaationen door de dissociatie van het zout het evenwicht verschuift naar de zijde van het niet-geïoniseerde zwakke zuur;
• [CH3COO-]e ≈ c0zout, aangezien de concentratie van het zout relatief hoog is en het zout volledig dissocieert;
• [Na+] ≈ c0zout. Die metaalionen spelen verder nauwelijks een rol.
HA (zwak zuur)
(zwakke base)
H 3 O+
Afb. 60 Een buffer gevormd met behulp van een oplossing van een zwak zuur en een zout van zijn geconjugeerde base
Een buffermengsel is een mengsel van een zwak zuur en de geconjugeerde zwakke base of omgekeerd, waarvan de zuurtegraad weinig verandert nadat je kleine hoeveelheden van een zuur of een base hebt toegevoegd. In het mengsel vormen het zuur en de base een evenwicht.
VERDIEPING
Berekening van de pH van een buffer Een buffermengsel bestaat dus uit een evenwicht dat gevormd wordt tussen een zwak zuur en zijn geconjugeerde base, of omgekeerd. Voor een buffer die is opgemaakt uit azijnzuur en natriumacetaat, geldt:
CH3COOH + H2O CH3COO- + H3O+ Daarbij is:
[CH3COOH]e ≈ cZ0 en [CH3COO-]e ≈ cMZ
K z = [H3O+]e · [CH3COO-]e [CH3COOH]e = [H3O+]e · cMZ cZ0
[H3O+]e = K z · cZ0 cMZ
pH= –log[H3O+]e = pKz –log cZ0 cMZ
Vermits er in de breuk een verhouding van concentraties staat, heeft de toevoeging van water geen effect (beide concentraties worden evenzeer verdund):
pH = pKz – log cZ0 cMZ = pKz – log nZ0 nMZ
Als je werkt met een buffermengsel bereid op basis van een zwakke base en een zout van het geconjugeerde zuur, wordt de formule:
pOH = pKb – log cB0 cMZ = pKb – log nB0 nMZ
pH = 14 – pOH = 14 – pKb + log cB0 cMZ = 14 – pKb + log nB0 nMZ
Een buffermengsel is in staat om een bepaalde toename in het aantal hydroxonium- en hydroxideionen weg te werken door een verschuiving van het evenwicht dat ontstaat tussen het zuur en de base. Een buffermengsel werkt niet onbeperkt en kan enkel binnen bepaalde grenzen een verhoging van de concentratie aan hydroxonium- of hydroxide-ionen opvangen.
Als je een hoeveelheid van een (sterk) zuur aan een oplossing toevoegt, zorgt de ionisatie van dat zuur initieel voor een toename aan hydroxoniumionen. Volgens het principe van Le Chatelier-Van ’t Hoff verschuift het evenwicht naar de zijde van het zwakke zuur. De toename aan hydroxoniumionen wordt grotendeels ongedaan gemaakt doordat die ionen reageren met de zwakke base. In een bufferoplossing van azijnzuur en natriumacetaat verschuift het evenwicht naar de zijde met het azijnzuur. Daardoor verandert de pH nauwelijks:
HCl + H2O → H3O+ + ClCH3COOH + H2O CH3COO- + H3O+
De bufferwerking van een oplossing houdt op als de base volledig verdwenen is door de reactie met hydroxoniumionen. Als je extra zuur toevoegt, zal dat de concentratie aan H3O+ doen stijgen en bijgevolg de pH doen dalen.
Als je een base toevoegt aan een oplossing, verhoogt het aantal hydroxide-ionen in die oplossing Daardoor verschuift het evenwicht in de richting van de zwakke base. Zo wordt een verhoging van [OH-] tegengegaan en verandert de pH vrijwel niet. In een bufferoplossing van azijnzuur en natriumacetaat reageren de hydroxide-ionen met het azijnzuur:
CH3COOH + OH- CH3COO- + H2O
Analoog als bij de toevoeging van zuren, houdt de bufferwerking van een oplossing op als alle zuurmoleculen verdwenen zijn na de reactie met hydroxide-ionen. Als je meer base toevoegt, verhoogt de concentratie aan OH-, waardoor de pH stijgt.
Je kunt de werking van een buffer verklaren aan de hand van het principe van Le ChatelierVan ’t Hoff. De toename aan H3O+ die ontstaat nadat je een sterk zuur hebt opgelost, wordt weggewerkt doordat de hydroxoniumionen reageren met de zwakke base. Analoog wordt de toename aan OH- die veroorzaakt wordt door een sterke base op te lossen, weggewerkt doordat de OH--ionen reageren met het zwakke zuur.
Als door de toevoeging van een sterk zuur de toename aan H3O+ groter is dan de hoeveelheid van de zwakke base in het buffermengsel, of als door de toevoeging van een sterke base de toename aan OH- groter is dan de hoeveelheid van het zwakke zuur in het buffermengsel, dan zal de zuurtegraad van de oplossing snel veranderen.
Welke van de volgende 4 waterige oplossingen is geen buffermengsel?
a een oplossing met 0,15 mol L KHSO3 en 0,20 mol L K2SO3
b een oplossing van 250 mL die 0,020 mol NaCN en 0,010 mol HCl bevat
c een oplossing met gelijke concentraties aan CH3COOH en NaOH
d een oplossing met gelijke molhoeveelheden van NH3 en NH4Cl
Welke combinaties van stoffen vormen in oplossing geen buffer?
a HCN en KCN
b NH3 en (NH4)SO4
c HNO3 en NaNO3
d HNO2 en NaNO2
Je mengt 5,0 · 10-2 mol mierenzuur (HCOOH) met 6,0 · 10-2 mol natriumformiaat (NaHCOO) in voldoende water om 1,0 L buffermengsel te bekomen.
a Bereken de pH.
b Wat wordt de pH als je de oplossing 10 keer verdunt?
Bereken de pH van deze buffers:
a 24,560 g HCN en 32,816 g KCN in 500 mL oplossing
b 0,125 mol NaH2PO4 en 0,210 mol K2HPO4 in 1,00 L oplossing
c een mengsel van 25 mL NH3 van 2,12 mol L en 500 mL NH4Cl van 1,78 mol L
d 100 mL NH4Cl-oplossing met een concentratie van 0,10 mol L en 100 mL NH3-oplossing met een concentratie van 0,10 mol L
e 50 mL NaHCO3-oplossing (0,50 mol L ) en 2,65 g Na2CO3-oplossing
Je wilt een buffermengsel maken met pH = 2,00, uitgaande van een NaHSO4-oplossing met een concentratie van 0,60 mol L . Hoeveel gram natriumsulfaat moet je bij 2,0 L van die oplossing voegen?
HOOFDSTUK
In de geneesmiddelenindustrie en andere industriële processen gebruikt men zuren als katalysatoren of als reagentia. Als tijdens een bepaalde stap in de productie van een geneesmiddel een hoeveelheid van een oplossing van dat zuur met een welbepaalde concentratie nodig is, dan kan al een kleine variatie in de concentratie van het zuur leiden tot ongewenste resultaten, zoals onzuiverheden, onvolledige reacties of veranderende eigenschappen van het geneesmiddel. Dat kan gevolgen hebben voor de werkzaamheid, veiligheid of stabiliteit van het eindproduct. Om de juiste reactiesnelheid, opbrengst, zuiverheid of kwaliteit van het product te bekomen, moet men de concentratie van het zuur exact kennen. Om de exacte concentratie van een oplossing van een zuur of een base te achterhalen, maak je gebruik van de reactie tussen zuren en basen.
LEERDOELEN
L Omschrijven wat een zuur-basetitratie is
L De pH bij het equivalentiepunt berekenen
L Een geschikte indicator voor een titratie kiezen
L Het verloop van een titratiecurve bespreken
Een titratie is een techniek in de chemie om de concentratie van een oplossing te bepalen. Ze maakt gebruik van een titrant of titreervloeistof, die een stof bevat die reageert met de oplossing waarvan je de concentratie wilt bepalen. De concentratie van de titrant is zeer nauwkeurig gekend. Stapsgewijs voeg je met een buret titrant toe aan het monster. Dat is een specifieke hoeveelheid van de te onderzoeken oplossing met een onbekende concentratie. Zo bepaal je welk volume titrant nodig is om te reageren met de stof in het monster. Op basis van de concentratie van de titrant en de volumes van het monster en de titrant, kun je de concentratie van de stof in het monster berekenen.
statief
buretkraantje
Afb. 62 Een titratieopstelling
buret met titrant
erlenmeyer met monster klem
Omdat die methode gebaseerd is op volumes van oplossingen, is een dergelijke titratie een volumetrische methode om de concentratie te bepalen. Als je een titratie gebruikt om de concentratie van een zuur of een base te bepalen, spreek je van een zuur-basetitratie
Het eindpunt van de titratie is het equivalentiepunt (EP). Bij het equivalentiepunt is de stoichiometrische verhouding tussen de toegevoegde titrant en het monster exact bereikt. Het toegevoegde volume titrant bevat net zoveel stofhoeveelheid als nodig is om te reageren met de stofhoeveelheid in het monster.
Veronderstel dat de concentratie van stof B onbekend is.
Voor een reactie ‘a A + b B → reactieproducten’ zal bij het equivalentiepunt nA nB = a b .
Vermits n = c · V, kun je stellen dat
A · VA
B · VB = a b .
Daaruit volgt dat cB = b a
Vóór de proef is cA gekend en kun je a en b afleiden uit de reactievergelijking. Het volume VA is het volume toegevoegde titrant en het volume VB is het volume van het monster.
Je kunt het equivalentiepunt bij een titratie op meerdere manieren vaststellen, zoals door een plotse pH-wijziging in de titratiecurve (zie verder) of door een kleuromslag van een zuur-base-indicator.
Je voert een titratie uit met een H3PO4-oplossing met een concentratie van 0,010 mol L .
Het monster bestaat uit 50 mL van een NaOH-oplossing met een onbekende concentratie. Het equivalentiepunt wordt bereikt nadat je 25 mL titrant hebt toegevoegd.
Bereken de concentratie van de NaOH-oplossing.
Gegeven:
• cA = 0,010 mol L
• VA = 25 mL = 0,025 L
• VB = 50 mL = 0,050 L
Gevraagd: cB = ?
Oplossing: H3PO4 + 3 NaOH → 3 H2O + Na3PO4
Op basis van de formule cB = b a · cA · VA VB kun je de concentratie van de NaOH-oplossing berekenen:
cB = 3 1 · 0,010 mol L · 0,025 L 0,050 L = 0,015 mol L
Je kunt een titratie gebruiken om de ongekende concentratie van een oplossing te bepalen. Het eindpunt van de titratie is het equivalentiepunt. Dat is het punt waar de stoichiometrische verhouding tussen de titrant en het monster is bereikt. Uit het volume van het monster, de concentratie van de titrant en het volume van de titrant dat nodig is om het equivalentiepunt te bereiken, kun je de concentratie van het monster bepalen. Voor een reactie ‘a A + b B → reactieproducten’ geldt:
cB = b a · cA · VA VB
Bij een zuur-basetitratie wordt een zure oplossing getitreerd met een oplossing van een base, of omgekeerd.
Zuur-base-indicatoren worden niet alleen gebruikt om de pH van een oplossing te bepalen, maar ook om zichtbaar te maken wanneer het equivalentiepunt in een titratie wordt bereikt.
Zuur-base-indicatoren zijn (vaak organische) stoffen die een zuur-basekoppel vormen en zich gedragen als zwakke zuren en basen. Daarbij heeft het zuur een andere kleur dan de geconjugeerde base.
HInd + H2O ⇆ Ind- + H3O+ kleur zuur kleur base
De kleur die je waarneemt, hangt af van de ligging van het evenwicht:
• ‘kleur zuur’ als het evenwicht verschoven is naar links;
• ‘kleur base’ als het evenwicht verschoven is naar rechts.
K z = [H3O+]e · [Ind-]e [HInd]e
Het pH-gebied waarin de indicator van kleur verandert, noem je het omslaggebied. De centrale waarde in dat gebied is het omslagpunt
VOORBEELD INDICATOREN EN HUN OMSLAGGEBIED
eetbarepH-indicatoren
23456789101112
kersen
currypoeder
druivensap ajuin
perzik(vel)
tomaat
raap(vel)
Afb. 63 Eetbare pH-indicatoren
thymolblauw
1,2-2,8en8,0-9,2
methyloranje
3,0-4,4 broomfenolblauw
3,0-4,6 congorood
3,0-5,0
broomcresolgroen
3,8-5,4
methylrood
4,4-6,2
broomthymolblauw
6,0-7,6
fenolrood
6,8-8,4
fenolftaleïne
8,2-10,0
rodekoolkleurschaal
pH-indicatoren
Afb. 64 De kleur van pH-indicatoren bij verschillende
Universeelindicator is een mengsel van meerdere indicatoren, zodat het mengsel voor elke pH-eenheid een andere kleur heeft. Universeelindicator kan daardoor ook al een beter idee geven van de pH-waarde.
De keuze van de indicator moet doordacht gebeuren. Zo kun je de indicatoren thymolblauw, broomfenolblauw en methyloranje niet gebruiken om zure oplossingen te onderscheiden van neutrale en basische oplossingen. Die indicatoren hebben immers in een deel van het zure pH-gebied dezelfde kleur als bij neutrale en basische pH-waarden.
Bij reacties of processen waarbij de pH verandert, kan een juiste keuze van de indicator het moment zichtbaar maken waarop het mengsel een bepaalde pH bereikt. Dat is bijvoorbeeld belangrijk voor titraties.
Een zuur-base-indicator is een zuur-basekoppel waarbij het zuur een andere kleur heeft dan de geconjugeerde base. Elke zuur-base-indicator heeft een omslaggebied. Dat zijn de pH-grenzen waarbinnen de indicator van kleur verandert.
De keuze van de indicator moet altijd doordacht gebeuren. Je kunt een indicator gebruiken om een wijziging in de pH zichtbaar te maken, of om de pH van een oplossing te vergelijken met een bepaalde waarde.
Aan de hand van een pH-meter kun je het verloop van de pH tijdens een titratie opstellen. Zo bekom je een titratiecurve. De titratiecurve toont dus de verandering in het verloop van de pH van een zure oplossing in functie van de hoeveelheid toegevoegde base, of omgekeerd.
Als je 20 mL van een oplossing HCl met een concentratie van 0,10 mol L titreert met NaOH van 0,10 mol L , dan bekom je deze titratiecurve:
omslaggebied fenolftaleïne omslaggebied broomthymolblauw omslaggebied methyloranje
De pH van de oorspronkelijke zoutzuuroplossing bedraagt 1,00. De NaOH die wordt toegevoegd, reageert met het zoutzuur volgens deze reactie: NaOH + HCl → NaCl + H2O
Zolang er een overmaat is aan HCl, blijft de pH zeer laag. De pH wordt bepaald door pH = –log cZ0
Bij het equivalentiepunt zijn het aantal mol NaOH en het aantal mol HCl aan elkaar gelijk. NaOH neutraliseert het zoutzuur, waardoor de pH een sprong maakt tot 7,00
De NaOH die nu wordt toegevoegd, blijft in overmaat aanwezig en zorgt voor een stijging in de pH.
De pH wordt bepaald door pH = 14 – pOH en pOH = –log cB0.
VOORBEELDEN pH-BEREKENING OP BASIS VAN DE TITRATIECURVE
• Vóór het EP: Een deel van de HCl is niet geneutraliseerd en de pH wordt bepaald door het sterke zuur.
–19 mL NaOH toegevoegd → 0,019 L · 0,10 mol L = 0,0019 mol
–Er blijft 0,000 10 mol HCl mol over in een volume van 0,020 L + 0,019 L = 0,039 L.
–De concentratie aan H3O+ bedraagt dus 10-4 mol 0,039 L = 2,6 · 10-3 mol L .
–pH = –log[H3O+]e = 2,59
• Bij het EP:
– Als je 0,020 L NaOH toevoegt, is het equivalentiepunt bereikt.
–[H3O+]e = [OH-]e = 1,0 · 10-7 mol L
–De pH = 7,00 en maakt een sprong van meer dan 4 eenheden.
• Na het EP:
– Als je 0,021 L NaOH toevoegt, is er een overmaat aan NaOH.
–Er is een overschot van 1,0 · 10-3 L · 0,10 mol L = 10-4 mol L NaOH, en dat op een volume van 0,041 L.
– De concentratie aan OH- bedraagt dus 10-4 mol 0,041 L = 2,4 · 10-3 mol L
– Daaruit volgt dat pOH = –log[OH-]e = 2,61 en pH = 14 – pOH = 11,39.
Je ziet op de titratiecurve ook dat het omslaggebied van de indicatoren broomthymolblauw, fenolftaleïne en methyloranje volledig binnen het gebied van de pH-sprong valt. Elk van die indicatoren kan dus worden gebruikt om het equivalentiepunt te vinden. Omdat het equivalentiepunt volledig binnen het omslaggebied van broomthymolblauw valt, is dat de meest geschikte indicator voor die titratie.
Als je vertrekt van meer verdunde concentraties, wordt de pH-sprong rond het EP veel kleiner.
omslaggebied broomthymolblauw
[HCl] = [NaOH] = 0,0010 mol L
[HCl] = [NaOH] = 0,010 mol L
[HCl] = [NaOH] = 0,10 mol L aantal mL NaOH
Afb. 66 De titratiecurve van 20 mL HCl met een oplossing NaOH met verschillende concentraties
De titratiecurve van de titratie van een sterke base (zoals NaOH) met een sterk zuur (zoals HCl) verloopt op een gelijkaardige manier, maar van een hoge pH naar een lage pH.
Afb. 67 De titratiecurve van 10 mL (oranje) en 20 mL (blauw) NaOH van 0,10 mol L met 0,10 mol L HCl
omslaggebied broomthymolblauw
3.2 Titratie met een zwak zuur en/of een zwakke base
De zuren en basen die gebruikt worden bij titraties, kunnen zowel sterk als zwak zijn. Naargelang de titratie zal het monster of de titrant het zuur bevatten. Als het monster een zuur is, dan is de titrant een base, en omgekeerd.
Uit een titratiecurve kun je afleiden of het monster een zuur of een base bevat, en of die sterk of zwak is. Ook de aard van de titrant (sterk/zwak, zuur/base) kun je achterhalen.
Als de pH bij de start van de titratie kleiner is dan 7, dan bevat het monster het zuur en de titrant de base.
titratie van sterk zuur met sterke basetitratie van zwak zuur met zwakke base
Eerder zag je al dat bij de titratie van een sterk zuur met een sterke base de pH bij het EP gelijk is aan 7.
Bij de titratie van een zwak zuur met een zwakke base is er geen grote, steile pH-sprong, waardoor het EP moeilijk te bepalen is. Afhankelijk van de relatieve sterkte van het zuur en de base zal de pH bij het EP kleiner dan, gelijk aan of groter dan 7 zijn.
Bij titratie van een sterk zuur met een zwakke base of een zwak zuur met een sterke base bevinden zich op een gegeven ogenblik in de oplossing zowel het zwakke zuur als zijn geconjugeerde base. Die oplossing is dus een bufferoplossing.
titratie van sterk zuur met zwakke basetitratie van zwak zuur met sterke base
bufferzone: zwak zuur + zwakke base equivalentiepunt
toegevoegde base (mL)
Als de titrant een zwakke base is, ontstaat er door de reactie met het sterke zuur van het monster een zwak zuur. Daarom is de pH < 7 bij het EP.
Voorbeeld:
NH3 + HCl → NH4+ + Cl-
Bij het EP zijn er enkel ammoniumionen en chloride-ionen aanwezig. De ionisatie van het zwakke zuur NH4+ verhoogt de concentratie aan H3O+
NH4+ + H2O ⇆ NH3 + H3O+
bufferzone: zwak zuur + sterke base
volume toegevoegde base (mL) equivalentiepunt
Als de titrant een sterke base is, ontstaat er door de reactie met het zwakke zuur van het monster een zwakke base. Daarom is de pH > 7 bij het EP.
Voorbeeld:
CH3COOH + NaOH → CH3COO- + Na+
Bij het EP zijn er alleen natriumionen en acetaationen aanwezig in de oplossing.
CH3COO- is een zwakke base en verhoogt de concentratie aan OH-
CH3COO- + H2O ⇆ CH3COOH + OH-
Als het monster de base bevat, is de pH bij het begin van de titratie > 7. Op een analoge manier kun je op basis van de pH bij het EP en het verloop van de curve afleiden of de base en het zuur sterk of zwak zijn.
Als je tijdens de titratie van zuur met een base (of omgekeerd) de pH meet en uitzet ten opzichte van het volume van de toegevoegde titrant, bekom je een titratiecurve.
Je kunt een titratiecurve gebruiken om het equivalentiepunt te bepalen, omdat de pH bij het equivalentiepunt een sprong maakt. De ligging van het equivalentiepunt en het verloop van de titratiecurve leveren informatie over de aard (zuur/base) van het monster en de titrant, en hun sterkte.
Een monster van 20 mL KOH-oplossing wordt getitreerd met HNO3.
Er is 28,2 mL salpeterzuuroplossing nodig met een concentratie van 0,015 mol L .
Wat is de molariteit van de KOH-oplossing?
Je hebt 14,8 mL van een H2SO4-oplossing met een concentratie van 0,10 mol L nodig om 25 mL ammoniakoplossing te neutraliseren.
Bereken de molariteit van de ammoniakoplossing.
20 mL KOH-oplossing met een concentratie van 0,020 mol L wordt getitreerd met 28 mL HNO3-oplossing. Bereken de molariteit van de salpeterzuuroplossing.
Er is 14,8 mL H2SO4-oplossing met een concentratie van 0,10 mol L nodig om 25 mL ammoniakoplossing te neutraliseren.
Bereken de molariteit van de ammoniakoplossing.
Je hebt 18 mL HCl-oplossing met een concentratie van 0,020 mol L nodig om 10 mL van een Ca(OH)2-oplossing te neutraliseren.
Bereken de molariteit van de basische oplossing.
10,0 mL geconcentreerde H2SO4 wordt met water aangelengd tot 1,00 L. 20,0 mL van die verdunde oplossing wordt getitreerd tot het neutralisatiepunt met 36,0 mL NaOH-oplossing met een concentratie van 0,20 mol L Bereken de molariteit van de geconcentreerde H2SO4-oplossing.
Je titreert 4,0 mL azijnzuuroplossing met 16,3 mL NaOH met een concentratie van 0,50 mol L .
a Bereken de concentratie van het azijnzuur in mol L
b Bereken het massaprocent azijnzuur dat de oplossing bevat (dichtheid azijnzuur: 1,049 g cm3).
Hoofdstuk 1: Zuren en basen
Een zuur-basereactie is een protolysereactie tussen een Brønstedzuur of protondonor en een Brønstedbase of protonacceptor.
Z + H2O ⇆ B + H3O+ Z1 + B2 B1 + Z2
Een zuur-basekoppel bestaat uit een zuur en zijn geconjugeerde base.
Z1 ⇆ B1 + H2O
Een protolysereactie tussen 2 dezelfde deeltjes noem je een autoprotolyse. Amfolyten kunnen reageren als zuur of als base.
Hoofdstuk 2: Het zuur-base-evenwicht
• De waterconstante is de evenwichtsconstante van de autoprotolyse van water:
K w = [H3O+ ]e · [OH-]e = 10-14
–In een neutrale oplossing is [H3O+]e = [OH-]e = 10-7 mol L
–In een zure oplossing is [H3O+]e > 10-7 mol L > [OH-]e.
–In een basische oplossing is [H3O+]e < 10-7 mol L < [OH-]e.
• De zuurconstante en baseconstante geven de sterkte van respectievelijk zuren en basen weer.
ZUREN
Z + H2O ⇆ H3O+ + B
KZ = [B]e · [H3O+]e [Z]e
pKz = –log K z
• sterk zuur: K z > 1
• zwak zuur: 10-6 < K z < 1
• zeer zwak zuur: 10-14 < K z < 10-6
• verwaarloosbaar: K z < 10-14
Daarbij geldt telkens:
K z · Kb = 10-14 en pKz + pKb = 14
Hoofdstuk 3: De zuurtegraad
BASEN
B + H2O ⇆ Z + OH-
Kb = [Z]e · [OH-]e [B]e
pKb = –log Kb
• sterke base: Kb > 1
• zwakke base: 10-6 < Kb < 1
• zeer zwakke base: 10-14 < Kb < 10-6
• verwaarloosbaar: Kb < 10-14
De pH en pOH vormen een maat voor de concentratie van respectievelijk de hydroxoniumionen en de hydroxide-ionen in een oplossing:
pH = –log[H3O+]e en pOH = –log[OH-]e
Daarbij geldt voor een oplossing bij 25 °C altijd:
pH + pOH = 14
Hoofdstuk 4: De pH van een oplossing berekenen
• Berekening pH van een oplossing van …
ZUUR
STERK pH = –log cZ0
ZWAK pH = –log[H3O+]e
[H3O+]e berekenen volgens de evenwichtsreactie
ZEER ZWAK pH = 1 2 · pKz –1 2 · log cZ0
BASE
pH = 14 + log cB0
pH = 14 – pOH
[OH-]e en/of [H3O+]e berekenen volgens de evenwichtsreactie
pH = 14 –1 2 · pKb + 1 2 · log cB0
• Voor de berekening van de pH kun je de meeste meerwaardige zuren beschouwen als een eenwaardig zuur, omdat enkel de 1e ionisatie een invloed heeft op de pH. Zwavelzuur is een bijzonder geval. Daar moet je soms rekening houden met de 2e ionisatie.
• Sommige zouten beïnvloeden de pH bij oplossen.
ZWAK ZUUR
ION
NEGATIEF
ZWAK ZUUR pH daalt
• als Kb(anion) > Kz(kation): pH stijgt
• als Kz(kation) > Kb(anion): pH daalt
ZWAKKE BASE
VERWAARLOOSBARE INTERACTIE MET WATER
Hoofdstuk 5: Buffers (uitbreiding)
VERWAARLOOSBARE INTERACTIE MET WATER
pH daalt
pH stijgt
• als Kz(kation) = Kb(anion): geen invloed op pH
pH daalt
geen invloed op de pH
• Een buffermengsel is opgebouwd uit een zwak zuur en een zwakke (geconjugeerde) base, of omgekeerd.
• De pH van een buffermengsel verandert niet na de toevoeging van: –een zuur, omdat de H3O+-ionen die ontstaan, reageren met de zwakke base tot het geconjugeerde zuur; –een base, omdat de OH--ionen die ontstaan, reageren met het zwakke zuur tot de geconjugeerde base.
• De werking van de buffer is niet onbegrensd.
• Samenstelling buffer: –zwak zuur + zout geconjugeerde base –zwakke base + zout geconjugeerd zuur
Hoofdstuk 6: Titraties
• Door een titratie uit te voeren, spoor je het equivalentiepunt op.
omslaggebied fenolftaleïne
omslaggebied broomthymolblauw
omslaggebied methyloranje
a A + b B → reactieproducten
cB = b a · cA · VA VB
• Een correcte keuze van de indicator laat toe om een oplossing met een pH in een welbepaald gebied te herkennen of om een pH-verandering zichtbaar te maken.
• Het verloop van de titratiecurve laat toe om de zuur- of basesterkte van de titrant en het monster te bepalen. 05 pH 10 15 20 25 30 35
• Uit de concentratie van de titrant en het volume van het monster en de titrant bereken je de concentratie van het monster.
Dicht bij je thuis of bij een grootwarenhuis heb je misschien al eens een laadpaal gezien voor een elektrische auto. Of misschien hebben je ouders wel een elektrische auto? De transitie van benzine en diesel naar elektriciteit is een belangrijk onderdeel van de Green Deal van de Europese regering. De federale regering heeft daarom beslist dat bedrijfsauto’s vanaf 2026 allemaal elektrisch aangedreven moeten zijn. Omdat de fiscale gunstmaatregelen voor diesel- en benzinewagens al afnemen sinds 2023, schakelen bedrijven nu al massaal over op een elektrisch aangedreven wagenpark. Op die manier hoopt de regering om de uitstoot van CO2 drastisch te verlagen. Misschien roept dat bij jou enkele vragen op. In dit thema kom je er meer over te weten.

` Wat is de link tussen elektrisch rijden en redoxreacties?
` Wat is de link tussen chemie en de werking van een batterij?
` Hoe kan chemie een rol spelen in de uitdagingen rond de klimaatopwarming?
We zoeken het uit!
• de volgende reacties herkennen en onderscheiden: –neerslagreacties; –gasontwikkelingsreacties; –neutralisatiereacties; –redoxreacties.
• het begrip ‘redoxreactie’ linken aan processen uit het dagelijks leven, zoals het roesten van ijzer.

• de ontbinding van water beschrijven als een endo-energetische reactie.
3 Cu + 8 HNO3 ⇆ 3 Cu(NO3)2 + 2 NO + 4 H2O stappenplan
• hoe je een redoxreactie moet uitschrijven vanuit een gegeven basisreactie, ook voor ternaire verbindingen.

• nog meer toepassingen van redoxreacties kennen, zoals de batterij.

• dat elektrolyse ook een redoxreactie is en verschillende toepassingen heeft in het dagelijks leven, zoals galvaniseren.
In thema 03 ging je dieper in op de zuur-basereacties. In de 2e graad leerde je die reacties kennen als neutralisatiereacties. Een ander reactietype dat toen werd besproken, was de redoxreactie. In dit hoofdstuk herhaal je kort enkele belangrijke begrippen die de basis vormen voor de verdere opbouw van dit thema.
L Het oxidatiegetal van een element bepalen
L In een redoxreactie de begrippen ‘reductor’, ‘oxidator’, ‘reductie’ en ‘oxidatie’ toepassen
In de 2e graad heb je kennisgemaakt met verschillende soorten anorganische reacties:
• de neerslagreactie:
Afb. 72 Een neerslagreactie
Voorbeeld:
• de gasontwikkelingsreactie: Voorbeeld:
73 Een gasontwikkelingsreactie
• de neutralisatiereactie: Voorbeeld:
Afb. 74 Een neutralisatiereactie
Tijdens die 3 soorten reacties worden er ionen uitgewisseld: je spreekt van ionuitwisselingsreacties. Het oxidatiegetal (OG) van de betrokken elementen verandert niet tijdens de reactie.
In de 2e graad heb je ook over een ander type chemische reactie geleerd: de elektronenoverdrachtreactie. Daarbij vindt er reductie of oxidatie van enkele betrokken deeltjes plaats. Je spreekt daarom ook van redoxreacties. Door de overdracht van elektronen verandert het oxidatiegetal van enkele elementen.
WEETJE
Redoxreacties zijn goed te vergelijken met zuur-basereacties. Bij zuur-basereacties wordt één proton overgedragen van een zuur (protondonor (PD)) naar een base (protonacceptor (PA)). Bij redoxreacties gaat het om de overdracht van 1 of meerdere elektronen tussen een reductor (elektrondonor (ED)) en een oxidator (elektronacceptor (EA)). zuur 1 + base 2 ⇆ base 1 + zuur 2
De deeltjes na de reactie noem je, net zoals bij de zuur-basereacties, ook wel de ‘geconjugeerde deeltjes’. 1 H+ 1 H+ n e- n e-
1 + oxidator 2 ⇆ oxidator 1 + reductor 2
Een element bezit altijd een oxidatiegetal of OG, zowel in een enkelvoudige stof (bv. Fe of H2: OG = 0) als in een samengestelde stof (bv. H2O: OG (H) = +I; OG (O) = -II).
Het oxidatiegetal van een element in een samengestelde stof geeft weer:
• hoeveel elektronen het element minder heeft dan in ongebonden toestand (positief oxidatiegetal); of
• hoeveel elektronen het element meer bezit dan in ongebonden toestand (negatief oxidatiegetal).
Bij de vorming van een ionbinding worden er elektronen overgedragen, waardoor er ionen ontstaan. Daardoor is het oxidatiegetal voor metalen hetzelfde als de ionlading. Bij binaire verbindingen is dat ook geldig voor het niet-metaal. De ionlading wordt alleen anders genoteerd. Een ionlading noteer je met Arabische cijfers, terwijl je een oxidatiegetal voorstelt met Romeinse cijfers. In dit thema zullen we altijd spreken over het oxidatiegetal van een element.
VOORBEELD OXIDATIEGETALLEN
NaCl
KNO3
Na: 1+ Cl: 1-
K: 1+ NO3: 1-
Na: +I Cl: -I
K: +I N: +V O: -II
In de 2e graad leerde je dat je het oxidatiegetal van een element in een samengestelde anorganische stof meestal kunt aflezen in het PSE. Zo hebben de elementen uit de groepen Ia en IIa altijd respectievelijk +I en +II als oxidatiegetal. Er zijn echter ook metalen die meerdere oxidatiegetallen dragen, bijvoorbeeld Cu: +I en +II. Het oxidatiegetal van die metalen kun je gemakkelijk lezen in de verhoudingsformule van de ionverbinding, waarbij het 2e deel een vast oxidatiegetal heeft of een vaste lading draagt.
FeCl3
Cl draagt in een binair zout een vast OG = -I (groepsnummer – 8).
Fe draagt als oxidatiegetal (ionlading) +III.
Pb(NO3)4
NO3 draagt als zuurrest een vaste lading = 1-.
Pb draagt als oxidatiegetal (ionlading) +IV.
Voor de bepaling van het oxidatiegetal in organische verbindingen maak je gebruik van deze berekening:
OG = aantal valentie-elektronen (VE) – aantal toegekende elektronen (TE)
OG = VE – TE
Daarbij bepaal je het aantal toegekende elektronen (TE) als volgt:
• Eigen doublet: je kent 2 elektronen toe aan het element.
• Bindend doublet:
–Tussen 2 verschillende elementen: je kent de 2 elektronen toe aan het element met de grootste EN-waarde. Het andere element krijgt geen elektronen.
–Tussen 2 gelijke elementen: je kent elk element 1 elektron toe.
VOORBEELD OXIDATIEGETAL VAN DE ELEMENTEN IN ETHAANZUUR (CH3COOH)
EN (H) = 2,1; EN (C) = 2,5; EN (O) = 3,5
TE 07188
→: Het 1e element (kleinste EN) krijgt geen elektron toegekend. Het 2e element (grootste EN) krijgt 2 elektronen.
↔: Beide elementen krijgen 1 elektron toegekend.
Om de redoxreactie op te stellen, is het meestal voldoende om het gemiddelde oxidatiegetal van elke atoomsoort in een verbinding te kennen. In een organische stof kun je het gemiddelde oxidatiegetal van koolstof meestal gemakkelijk bepalen met behulp van het vaste oxidatiegetal van H en O. In dit leerboek kun je die methode altijd gebruiken.
CH3COOH (C2H4O2)
OG (H) = +I
OG (O) = -II
OG (C) = 0 (gemiddelde van +III en -III)
De verbranding van koolstof is een eenvoudig voorbeeld van een redoxreactie:
C + O2 ⇆ CO2
0 0 +IV -II
Tijdens die reactie wordt het oxidatiegetal van koolstof verhoogd van 0 naar +IV. Koolstof wordt geoxideerd. Je spreekt van de oxidatie van koolstof.
Koolstof stelt per zuurstofatoom 2 elektronen gemeenschappelijk in de molecule CO2. De zuurstofatomen afkomstig van zuurstofgas verwerven dus elk 2 elektronen, waardoor het oxidatiegetal van elk O-atoom daalt van 0 naar -II: zuurstof wordt gereduceerd. Je spreekt van de reductie van zuurstof. Je kunt de reactie schematisch als volgt weergeven:
Per koolstofatoom worden er 4 elektronen afgestaan.
oxidatie van koolstof– 4 e-
C + O2 ⇆ CO2 0 0 +IV -II
2 · (+ 2 e-)
2 keer, omdat er 2 zuurstofatomen worden gereduceerd.
Schema 1 De redoxreactie tussen koolstof en zuurstofgas
reductie van zuurstof
Per zuurstofatoom worden er 2 elektronen opgenomen.
Opmerking:
In het schema spreken we van ‘elektronen afstaan’ en ‘elektronen opnemen’. Bij een covalente binding, hier CO2, worden die elektronen gedeeld.
In een reactie met zoutvorming uit enkelvoudige stoffen worden de elektronen effectief afgegeven door het metaal en opgenomen door het niet-metaal: er wordt een ionbinding gevormd.
Voorbeeld:
2 · (–1 e-)
2 K + Br2 ⇆ 2 KBr 0 0 +I -I
2 · (+1 e-)
In dit leerboek maken we geen onderscheid tussen een verschuiving van elektronen (covalente binding) en een verplaatsing van elektronen (ionbinding).
In dit leerboek vermelden we de oxidatie boven de reactie. De reductie wordt telkens onder de reactie weergegeven.
Hoewel we spreken van ‘oxidatie’, is het niet noodzakelijk dat er zuurstof in de reactie voorkomt. De definitie van oxidatie is ruimer, namelijk: ‘het afstaan van elektronen’, en dat kan net zo goed met andere elementen.
Een redoxreactie kun je dus opdelen in 2 halfreacties:
• Een oxidatie is een halfreactie waarbij, in een stof of deeltje, een element elektronen afgeeft en stijgt in oxidatiegetal.
• Een reductie is een halfreactie waarbij, in een stof of deeltje, een element elektronen opneemt en daalt in oxidatiegetal.
Als voorbeeld bespreken we de reactie tussen magnesiumpoeder en een ijzerdichlorideoplossing. De chloride-ionen veranderen niet van oxidatiegetal en worden daarom niet in de reactie vermeld.
VOORBEELD REACTIE MAGNESIUMPOEDER EN IJZERDICHLORIDEOPLOSSING
In dit thema noteren we in elke redoxreactie evenwichtspijlen. Afhankelijk van de sterkte van de reagentia zal de reactie meer of minder naar rechts verlopen.
Halfreactie oxidatie: Mg ⇆ Mg2+ + 2 e-
Halfreactie reductie: Fe2+ + 2 e- ⇆ Fe
In dit leerboek gebruiken we de afkortingen RED en OX voor respectievelijk de reductor en de oxidator. De processen reductie en oxidatie korten we niet af.
elektronenoverdracht
De elektronen die afkomstig zijn van Mg, worden gebruikt bij de reductie van de Fe2+-ionen.
Dat leidt ons tot 2 nieuwe begrippen: reductor en oxidator
• De reductor (RED) is de stof of het deeltje … –die/dat elektronen overdraagt aan de oxidator en de andere stof doet reduceren; –die/dat geoxideerd wordt; –waarin een element stijgt in oxidatiegetal.
• De oxidator (OX) is de stof of het deeltje … –die/dat elektronen onttrekt van de reductor en de andere stof doet oxideren; –die/dat gereduceerd wordt; –waarin een element daalt in oxidatiegetal.
In het voorbeeld is Mg dus de reductor en Fe2+ de oxidator.
Omdat een redoxreactie een evenwichtsreactie is, moet je de halfreacties ook behandelen als omkeerbare reacties. Daaruit volgt dat:
• het deeltje dat wordt gevormd tijdens de oxidatiehalfreactie, op zijn beurt als oxidator functioneert. In het voorbeeld is Mg2+ een oxidator voor de terugreactie;
• het deeltje dat wordt gevormd tijdens de reductiehalfreactie, op zijn beurt als reductor functioneert. In het voorbeeld is Fe een reductor voor de terugreactie.
Je spreekt tijdens een halfreactie daarom van een redoxkoppel:
• een reductor en zijn afgeleide of geconjugeerde oxidator: RED1 ⇆ OX1 + n e-
• een oxidator en zijn afgeleide of geconjugeerde reductor: OX2 + n e- ⇆ RED2
Met behulp van de index geef je aan dat beide deeltjes bij elkaar horen.
Een redoxkoppel wordt genoteerd als OX/RED. Elke redoxreactie bevat dus 2 redoxkoppels: OX1/RED1 en OX2/RED2
In het voorbeeld zijn de 2 redoxkoppels Mg2+/Mg en Fe2+/Fe.
Opmerkingen:
• Als we spreken over de reductor of de oxidator in een redoxreactie, hebben we het altijd over de heenreactie.
• In een redoxreactie kunnen er ook elementen aanwezig zijn waarvan het oxidatiegetal niet verandert.
Voorbeeld:
Zn + CuBr2 ⇆ ZnBr2 + Cu
RED = Zn
OX = Cu2+
Redoxkoppels: Zn2+/Zn Cu2+/Cu
Br (-I) verandert niet van oxidatiegetal en neemt niet deel aan de redoxreactie.
In een redoxreactie worden elektronen (gedeeltelijk) overgedragen van de reductor naar de oxidator.
De reductor ondergaat de oxidatie: door 1 of meer elektronen af te staan, stijgt het oxidatiegetal van 1 element in de reductor.
De oxidator ondergaat de reductie: door 1 of meer elektronen op te nemen, daalt het oxidatiegetal van 1 element in de oxidator.
Bepaal het OG van het element Cl in deze verbindingen:
a Cl2
b ClO4-
c Cl2O3
d ClO-
Bepaal het OG van het element S in deze verbindingen.
a SO32-
b S8
c SO2
d SO42-
Bepaal het OG van:
a Mn in KMnO4
b Cr in K2Cr2O7
Bepaal het OG van alle elementen in deze organische stoffen:
a ethanal
b chloorethaan
c ethaanamide
Bepaal het OG van elk element in deze redoxreacties:
a Ca + 2 HBr ⇆ CaBr2 + H2
b Zn + CuSO4 ⇆ ZnSO4 + Cu
c 4 KClO3 ⇆ 3 KClO4 + KCl
Bepaal voor de reacties van oefening 5 de reductor, de oxidator en de redoxkoppels.
Kunnen de volgende deeltjes reductor en/of oxidator zijn tijdens een redoxreactie?
Verklaar je antwoord door bijvoorbeeld een deeltje te vermelden dat wordt gevormd tijdens het chemische proces.
Ca2+ – Cl2 – Cu+ – Fe2+ – Br -
Het roesten van ijzer in vochtige lucht gebeurt volgens deze reactie:
4 Fe + 3 O2 + 2 H2O ⇆ 2 Fe2O3 . H2O
Bepaal de reductor, de oxidator en de redoxkoppels.
Reddingsvesten zijn vaak uitgerust met een lampje. Bij bepaalde uitvoeringen is dat lampje via stroomdraadjes verbonden met een magnesiumstrip en een koperstrip. Op de koperstrip is wat vast koperchloride aangebracht. Koperchloride is eerder slecht oplosbaar. Zodra zo’n reddingsvest in het water belandt, gaat het lampje branden. De stroom voor het lampje wordt geleverd door deze redoxreactie: Mg + 2 CuCl ⇆ MgCl2 + 2 Cu
Bepaal de reductor, de oxidator en de redoxkoppels.
De begrippen ‘reductor’, ‘oxidator’, ‘reductie’ en ‘oxidatie’ vormen de basis om redoxreacties op te stellen. In dit hoofdstuk breid je je kennis over redoxreacties uit met reacties waarin er ook ternaire verbindingen voorkomen.
LEERDOELEN
L Een redoxreactie met ternaire verbindingen opstellen en interpreteren
1 Halfreacties
Tot nu toe heb je je beperkt tot redoxreacties met enkel enkelvoudige stoffen of binaire verbindingen. In dit hoofdstuk breid je dat verder uit tot ternaire verbindingen. Om de stoffenreactievergelijking te bekomen, kun je gebruikmaken van de halfreactie van de reductor en de oxidator in de reactie.
Achteraan in dit leerboek vind je een tabel met de halfreacties van verschillende reductoren en oxidatoren. In die halfreacties zijn al de vereiste H3O+/OH--ionen en H2O-moleculen vermeld. Nadat je het elektronenbehoud hebt toegepast, bekom je de stoffenreactievergelijking door de halfreacties op te tellen. Dat kun je vaststellen aan de hand van de volgende redoxreactie.
DE REACTIE TUSSEN EEN KMnO4-OPLOSSING EN EEN KI-OPLOSSING
HALFREACTIES
2 I- ⇆ I2 + 2 e-
MnO4- + 3 e- + 2 H2O ⇆ MnO2 + 4 OH-
(K+ neemt niet deel aan de redoxreactie.)
TOEPASSEN ELEKTRONENBEHOUD STOFFENREACTIEVERGELIJKING
3 · (2 I- ⇆ I2 + 2 e-)
2 · (MnO4- + 3 e- + 2 H2O ⇆ MnO2 + 4 OH-)
6 I- + 2 MnO4- + 4 H2O ⇆ 3 I2 + 2 MnO2 + 8 OH+ 8 K+ + 8 K+
6 KI + 2 KMnO4 + 4 H2O ⇆ 3 I2 + 2 MnO2 + 8 KOH
Uit de halfreacties blijkt dat je in een waterige oplossing altijd rekening moet houden met de aanwezigheid van H2O, H3O+ of OH-. Als de hoeveelheden daarvan niet gekend zijn, maak je gebruik van een stappenplan om de stoffenreactievergelijking van een redoxreactie op te stellen.
Om een redoxreactie met ternaire verbindingen in een waterig milieu op te stellen, start je altijd vanuit een gegeven ionenvergelijking. Vervolgens maak je gebruik van het volgende stappenplan:
STAP 1
De redoxbruggen opstellen
→ Vermeld bij elk element het oxidatiegetal.
→ Duid met een pijl aan waar de oxidatie en de reductie optreden.
→ Vermeld op de bruggen het aantal afgegeven en opgenomen elektronen.
STAP 2
Elektronenbalans
→ Controleer of het behoud van atomen in orde is voor de reductor/oxidator. Schrijf indien nodig een coëfficiënt voor de reductor/oxidator en/of hun geconjugeerde deeltjes.
→ Vermenigvuldig het aantal opgenomen/afgegeven elektronen met het aantal atomen van de reductor/oxidator. Gebruik daarvoor ronde haakjes.
→ Stel het aantal opgenomen elektronen en het aantal afgegeven elektronen aan elkaar gelijk (vierkante haakjes). Plaats het getal dat je toepast als coëfficiënt, vóór de bijbehorende reductor/oxidator en/of hun geconjugeerde deeltjes.
STAP 3
Ladingsbalans
Stel de totale lading van alle reagentia gelijk aan de totale lading van alle reactieproducten.
→ Als de reactie plaatsvindt in een zuur of basisch milieu, voeg je in de reactie respectievelijk H3O+ of OH- toe bij de reagentia.
→ Als de reactie plaatsvindt in een neutraal milieu, voeg je H3O+ of OH- toe bij de reactieproducten.
STAP 4
Atoombalans
Voeg H2O-moleculen toe aan de reagentia of reactieproducten om het aantal O- en H-atomen voor en na de reactie aan elkaar gelijk te stellen.
STAP 5
De stoffenreactievergelijking opstellen
Zet de verkregen essentiële redoxreactie om in de stoffenreactievergelijking. Daarvoor combineer je de geladen deeltjes bij de reagentia met de tegengesteld geladen deeltjes die vermeld staan in de opgave. Voeg dezelfde deeltjes, in een gelijke hoeveelheid, toe aan de reactieproducten. Combineer de ionen in de reactie tot de finale stoffenreactievergelijking.
VOORBEELD EEN REDOXREACTIE OPSTELLEN
Aan een kleurloze KI-oplossing voeg je druppelsgewijs een paarsgekleurde KMnO4-oplossing toe. Met een pH-meter ga je de verandering van de zuurtegraad na.
De reactie start in een neutraal milieu.
Experimentele gegevens:
• De paarse kleur, te wijten aan de MnO4--ionen, verdwijnt, terwijl het mengsel troebel wordt door zwartbruine MnO2-deeltjes.
• Het mengsel krijgt een lichtgele kleur door de vorming van I2.
• De pH stijgt van 7 naar 8 à 10.
GEGEVEN STARTREACTIE:
STAP 1
De redoxbruggen opstellen
I- = RED
MnO4- = OX
STAP 2
Elektronenbalans
• behoud van atomen bij RED en OX toepassen (in het groen)
• toepassen op bruggen (in het blauw)
• behoud van elektronen (rode cijfers)
STAP 3
Ladingsbalans
• reactie in een neutraal milieu
• ladingreagentia: 8-
• ladingreactieproducten: 0
→ + 8 OH- bij reactieproducten
STAP 4
Atoombalans
• reagentia: 8 O’s, 0 H’s
• reactieproducten: 12 O’s, 8 H’s → + 4 H2O bij reagentia
STAP 5
De stoffenreactievergelijking opstellen
• KI en KMnO4 zijn de reagentia.
• K+ (6 + 2) toevoegen aan reagentia en reactieproducten
• combineren tot stoffen
• Bij sommige oefeningen zul je merken dat: –er bij de reagentia en de reactieproducten H2O-moleculen verschijnen.
Verwijder dan het teveel aan H2O-moleculen; –de coëfficiënten een veelvoud zijn van elkaar. Deel dan de coëfficiënten door dat veelvoud.
• Het is niet altijd nodig om het volledige stappenplan uit te voeren.
Voorbeeld: als in stap 3 ook het aantal O- en H-atomen gelijk is, hoef je de volgende stappen niet meer toe te passen. De redoxreactie is al juist opgesteld. Dat type reactie vindt niet plaats in een waterig milieu, maar in vaste, gesmolten of gasfase. Een voorbeeld is de verbranding van magnesium:
Om een redoxreactie op te stellen, maak je gebruik van een stappenplan:
Stap 1: redoxbruggen opstellen
Stap 2: elektronenbalans
Stap 3: ladingsbalans (H3O+- of OH--ionen toevoegen)
Stap 4: atoombalans (H2O-moleculen toevoegen)
Stap 5: de stoffenreactievergelijking opstellen
Werk deze redoxreacties uit tot het niveau van de stoffenreactievergelijking:
a MnO2 + Cl- ⇆ Mn2+ + Cl2 (in zuur milieu HCl)
b Al + H2O2 ⇆ Al3+ + H2O (in zuur milieu HCl)
c Mn2+ + NO3- ⇆ MnO42- + NO2- (Mn(OH)2 en KNO3)
d 2 I- + NO2 ⇆ I2 + NO (KI, in zuur milieu HCl)
e Cr2O72- + SO32- ⇆ Cr3+ + SO42(K2Cr2O7 + K2SO3 in zuur milieu (H2SO4))
De volgende redoxreacties worden uitgevoerd in een neutraal milieu.
a Werk elke reactie uit tot het niveau van de stoffenreactievergelijking.
b Geef aan of de pH stijgt of daalt na de reactie.
1 MnO4- + I- ⇆ MnO2 + IO3(KMnO4 + NaI in neutraal milieu)
2 As2O3 + I2 ⇆ AsO43- + I- (in neutraal milieu)
Stel de stoffenreactievergelijking op van de volgende redoxreactie.
In een kleurloze salpeterzuuroplossing (HNO3) breng je een stukje koper.
Experimentele gegevens:
• De oplossing wordt blauw, wat wijst op het ontstaan van Cu2+-ionen: koper wordt geoxideerd.
• Tijdens de reactie wordt het gas NO gevormd.
• Redoxkoppels: Cu2+/Cu en NO3-/NO
Stel de redoxreactie op tussen C2H5OH en K2Cr2O7
Experimentele gegevens:
• Aan ethanol die is aangezuurd met geconcentreerde H2SO4, voeg je een K2Cr2O7-oplossing toe.
• Redoxkoppels: C2H4O/C2H6O en Cr2O72-/Cr3+
Stel de redoxreactie op tussen Cu en zwavelzuur.
Experimentele gegevens:
• Bij de reactie van Cu met een warme, geconcentreerde H2SO4-oplossing kleurt de oplossing blauw (door het ontstaan van Cu2+-ionen) en ontsnapt er SO2 (g) (verstikkende geur).
• Redoxkoppels: Cu2+/Cu en HSO4-/SO2
Stel de redoxreactie op tussen kaliumpermanganaat en zwaveldioxide.
Experimentele gegevens:
• Bij het borrelen van SO2 (g) door een KMnO4oplossing verdwijnt de paarse kleur van MnO4Er ontstaat een kleurloze oplossing met Mn2+- en SO42--ionen.
• Na de reactie kleurt methyloranje rood.
• Redoxkoppels: MnO4-/Mn2+ en SO42-/SO2
Stel de autoredoxreactie van KClO3 op.
Experimentele gegevens:
• Je verwarmt een beetje KClO3 in een proefbuis. Nadat de KClO3 is gesmolten, verwijder je de vlam. Daarna breng je een smeulende houtspaander in de proefbuis. Er vindt een hevige reactie plaats met een hel lichtverschijnsel en veel rookontwikkeling.
Dat is een autoredoxreactie. Dat wil zeggen dat KClO3 tegelijkertijd optreedt als OX en als RED.
• Redoxkoppels: ClO3-/Cl- en ClO4-/ClO3-
HOOFDSTUK 3
Bij zuur-basereacties stelde je vast dat met een sterk zuur een zeer zwakke geconjugeerde base overeenstemt (en omgekeerd). Hetzelfde geldt voor redoxreacties: een sterke reductor is gelinkt aan een zwakke oxidator.
In dit hoofdstuk bepaal je de sterkte van een reductor (of oxidator). Dat leidt tot een belangrijk nieuw begrip: de reductiepotentiaal E0 .
LEERDOELEN
L Metalen en niet-metalen rangschikken op basis van hun reductor-/oxidatorsterkte
L Het begrip ‘reductiepotentiaal’ duiden en toepassingen in oefeningen
In dit leerboek geven we een redoxreactie altijd weer als een evenwichtsreactie. Veel redoxreacties zullen echter aflopend zijn, omdat er een sterke RED of sterke OX wordt gebruikt.
1 Kwalitatieve, experimentele bepaling
Een zuur-basereactie verloopt (vooral) in de richting van het zwakste zuur en de zwakste base. Een analoge regel is van toepassing op een redoxreactie: RED1 + OX2 ⇆ OX1 + RED2
Situatie a: RED1 is sterker dan RED2 (en OX2 is ook sterker dan OX1): de reactie naar rechts vindt plaats
Situatie b: RED1 is zwakker dan RED2 (en OX2 is ook zwakker dan OX1): de reactie naar rechts vindt niet plaats
Je maakt van dat principe gebruik om metalen/niet-metalen experimenteel te rangschikken op basis van hun sterkte als reductor/oxidator.
1.1 Verdringingsreeks van de metalen
Als je Zn in een CuSO4-oplossing brengt, merk je een afzetting van Cu op het Zn. Als je Cu in een ZnSO4-oplossing brengt, zie je geen reactie. Je kunt dus stellen:
Zn + Cu2+ ⇆ Zn2+ + Cu
Cu + Zn2+: geen reactie
Daaruit leid je af dat Zn een sterkere reductor is dan Cu (en dat Cu2+ een sterkere oxidator is dan Zn2+).
Als je die proef uitvoert bij verschillende metalen, kun je de verdringingsreeks van de metalen opstellen. Je spreekt van de ‘verdringingsreeks’ omdat een sterkere reductor altijd een zwakkere reductor uit een verbinding kan verdringen.
Voorbeeld:
3 Na + AlCl3 ⇆ 3 NaCl + Al Aluminium wordt uit de verbinding met chloor verdrongen door de sterkere reductor natrium.
Achteraan in het leerboek vind je een tabel waarin die verdringingsreeks is opgenomen. We beperken het hier even tot een verkorte versie:
OXIDATORSTERKTE
zeer sterk
zwak
zeer zwak
OX + n e- ⇆ RED
Au3+ + 3 e- ⇆ Au
Ag+ + e- ⇆ Ag
Cu2+ + 2 e- ⇆ Cu
2 H3O+ + 2 e- ⇆ H2 + 2 H2O
Zn2+ + 2 e- ⇆ Zn
Mg2+ + 2 e- ⇆ Mg
Na+ + e- ⇆ Na
Li+ + e- ⇆ Li
REDUCTORSTERKTE
zeer zwak zwak
zeer sterk
Het valt je zeker op dat er 1 niet-metaal in de tabel staat: waterstof. Verderop zul je zien dat het redoxkoppel H3O+/H2 als referentie wordt gebruikt. Daarbij wordt de reductorsterkte van H2 altijd vergeleken met de reductorsterkte van een metaalatoom.
Als je bijvoorbeeld de metalen zink, magnesium, koper en zilver in verdund zoutzuur brengt, zie je enkel bij de eerste 2 metalen de vorming van waterstofgas. Uit de bijbehorende reacties volgt dat Zn en Mg sterkere reductoren zijn dan H2
Zn + 2 H3O+ → Zn2+ + H2 + 2 H2O
Mg + 2 H3O+ → Mg2+ + H2 + 2 H2O
Cu + H3O+ → geen reactie
Ag + H3O+ → geen reactie
In de tabel worden Zn en Mg daarom onder H2 geplaatst. Ze zijn sterkere reductoren. Je kunt ook stellen dat H3O+ een sterkere oxidator is dan Zn2+ en Mg2+.
Zwakkere reductoren, zoals Au en Ag, oxideren zeer moeilijk tot hun ion. Je noemt ze daarom ‘edelmetalen’.
Opmerkingen:
• In dit leerboek kiezen we voor de reductietabel, waarbij de sterkste oxidator links bovenaan wordt vermeld en de sterkste reductor rechts onderaan (zie p. 273-274).
• In de reductietabel kan een metaalatoom een hogervermeld metaalion uit zijn zout verdringen.
• De metaalatomen onderaan in de tabel kunnen waterstofgas ook vrijstellen uit water.
Voorbeeld:
2 Na + 2 H2O → 2 NaOH + H2
Er wordt knalgas (H2) gevormd. Daarnaast is die reactie van natrium in water ook exotherm, waardoor natrium in water leidt tot een explosie.
In een oxidatietabel wordt de sterkste reductor rechts bovenaan vermeld.
Als je een natriumbromideoplossing en dichloor samenvoegt, wordt er dibroom gevormd.
De volgende reactie vindt plaats: 2 NaBr + Cl2 ⇆ Br2 + 2 NaCl
De bromide-ionen worden door dichloor geoxideerd. De omgekeerde reactie, de oxidatie van chloride-ionen door dibroom, treedt niet op: dichloor is een sterkere oxidator dan dibroom (en Br - een sterkere reductor dan Cl-).
Met behulp van analoge experimenten komt men tot een verdringingsreeks van de niet-metalen. Ook die zijn opgenomen in de tabel achteraan in het leerboek.
OXIDATORSTERKTE OX + n e- ⇆ RED REDUCTORSTERKTE zeer sterk zwak zeer zwak
F2 + 2 e- ⇆ 2 F- zeer zwak zwak zeer sterk Cl2 + 2 e- ⇆ 2 ClO2 + 4 H3O+ + 4 e- ⇆ 6 H2O Br2 + 2 e- ⇆ 2 BrI2 + 2 e- ⇆ 2 I2 H3O+ + 2 e- ⇆ H2 + 2 H2O S + 2 e- ⇆ S2-
Tabel 5 De verdringingsreeks van de niet-metalen
In die reeks is elk niet-metaal in staat om de negatieve ionen van een lagervermeld niet-metaal te oxideren en zo uit een zoutoplossing te verdringen.
Om het oxiderend/reducerend vermogen van een redoxkoppel weer te geven, maak je gebruik van de reductiepotentiaal (E0). Die wordt voor elk redoxkoppel bepaald door dat te koppelen aan een referentiekoppel
Als referentiekoppel kiest men H3O+/H2, met als halfreactie: 2 H3O+ + 2 e- ⇆ H2 + 2 H2O
Je spreekt van de referentiewaterstofelektrode (1,0 mol L , 298 K, 1 013 hPa).
Pt-draad
glazen buis met H2 (g) H 2
De reductiepotentiaal van de referentiewaterstofelektrode is per definitie gelijk aan 0 volt:
E0 (H3O+/H2) = 0,00 V
Platina is chemisch inert: het zal de functie van reductor niet invullen.
In een referentiewaterstofelektrode plaatst men een platina-elektrode in een HCl-oplossing (1,0 mol L ). Men brengt de platina-elektrode aan in een glazen buis waarlangs waterstofgas wordt toegevoegd.
Pt-elektrode
1,0 HCl mol L
Afb. 75 Een referentiewaterstofelektrode
belletjes van H2 (g)
Ter hoogte van de platina-elektrode kan, afhankelijk van het redoxkoppel dat eraan gekoppeld wordt, H3O+ (afkomstig van HCl) als een oxidator of H2 als een reductor optreden.
Er ontstaat een OX/RED-evenwichtstoestand waarbij er tussen het redoxkoppel en de standaardwaterstofelektrode een contactspanning of potentiaal ontstaat, de elektrodepotentiaal.
De elektrodepotentiaal die ontstaat bij 298 K, 1 013 hPa en een concentratie van 1,0 mol L van de waterige oplossingen, noem je de reductiepotentiaal. Die grootheid gebruikt men in de chemie om de sterkte van een reductor/oxidator kwantitatief weer te geven.
GROOTHEID MET SYMBOOL
reductiepotentiaal E0 volt (V)
UITGEDRUKT IN …
De reductiepotentiaal wordt ook weergegeven in de tabel achteraan in het leerboek (p. 273-274). In vergelijking met de verdringingsreeksen wordt de tabel uitgebreid met verschillende ionen, zoals het nitraation (NO3-) of het waterstofsulfaation (HSO4-). In een elektrochemische cel worden die ionen, zoals de metaalionen, aangebracht door gebruik te maken van zouten. In het kort is de tabel als volgt opgebouwd:
zeer sterk
zwak
zeer zwak
Algemeen geldt:
+ 4 H3O+ + 3 e-
NO + 6 H2O 2 H3O+ + 2 e-
HSO4- + H3O+ + 2 e-
Li+ + 1 e-
H2 + 2 H2O
SO32- + 2 H2O
Li zeer zwak zwak zeer sterk
• Een sterke oxidator wordt gekenmerkt door een hoge, positieve E0-waarde.
• Een sterke reductor wordt gekenmerkt door een lage, negatieve E0-waarde
→ Het redoxkoppel Li+/Li (E0 = –3,02 V) bevat de zwakste oxidator (Li+) en de sterkste reductor (Li).
→ Het redoxkoppel F2/F- (E0 = 2,87 V) bevat de sterkste oxidator (F2) en de zwakste reductor (F-).
De reductiepotentiaal van een redoxkoppel wordt experimenteel bepaald door het betrokken redoxkoppel in contact te brengen met de referentiewaterstofelektrode. Daarbij ontstaat er een spanning (U0) tussen de 2 halfcellen. Dat komt door het verschil in elektronendichtheid tussen de 2 koppels (zie hoofdstuk 4, ‘Galvanische cel’).
De specifieke waarde van U0 wordt bepaald door het specifieke redoxkoppel.
De gemeten spanning (U0) gebruik je om de E0 van het betrokken redoxkoppel te bepalen. Daarbij maak je gebruik van de volgende formule: U0 = E0 OX – E0 RED
Daarbij geldt:
E0 OX = E0-waarde van het redoxkoppel met de sterkste oxidator (OX)
E0 RED = E0-waarde van het redoxkoppel met de sterkste reductor (RED)
Afhankelijk van het redoxkoppel waarvan je de E0 bepaalt, is ter hoogte van de referentiewaterstofelektrode H3O+ de oxidator of H2 de reductor. Dat bepaalt het teken van de E0-waarde van het betreffende redoxkoppel.
VOORBEELD DE REDUCTIEPOTENTIAAL BEPALEN
• (Zn2+/Zn) – (H3O+/H2)
Als je de spanning meet tussen de referentiewaterstofelektrode en het redoxkoppel Zn2+/Zn, bekom je 0,76 V. In de verdringingsreeks van de metalen kun je aflezen dat de zinkelektrode (Zn) optreedt als reductor. H3O+ is de oxidator.
Daarbij geldt: U0 = E0 OX – E0
0,76 V = E0 (H3O+/H2) – E0 (Zn2+/Zn)
⇓ E0 (H3O+/H2) = 0,00 V
0,76 V = 0,00 V – E0 (Zn2+/Zn)
E0 (Zn2+/Zn) = –0,76 V
• (Cu2+/Cu) – (H3O+/H2)
Als je de spanning meet tussen de standaardwaterstofelektrode en het redoxsysteem Cu2+/Cu, vind je 0,34 V. In de verdringingsreeks van de metalen kun je aflezen dat H2 optreedt als reductor. Cu2+ is de oxidator.
Bijgevolg geldt:
U0 = E0 OX – E0 RED
0,34 V = E0 (Cu2+/Cu) – E0 (H3O+/H2)
⇓ E0 (H3O+/H2) = 0,00 V
0,34 V = E0 (Cu2+/Cu) – 0,00 V E0 (Cu2+/Cu) = 0,34 V
Algemeen geldt:
Afb. 76 De spanning meten tussen de referentiewaterstofelektrode en het redoxsysteem Zn2+/Zn
Afb 77 De spanning meten tussen de referentiewaterstofelektrode en
• Redoxkoppels met een negatieve reductiepotentiaal bestaan uit een sterkere reductor dan H2 en een zwakkere oxidator dan H3O+
• Redoxkoppels met een positieve reductiepotentiaal bestaan uit een zwakkere reductor dan H2 en een sterkere oxidator dan H3O+.
2.2 Een redoxreactie voorspellen
De formule van de spanning bij 25 °C en 1,0 mol L kun je gebruiken om het verloop van een redoxreactie te voorspellen. Je gebruikt dan de notatie ΔE0
ΔE0 = E0 OX – E0 RED
Daarbij geldt:
ΔE0 > 0: spontane reactie
ΔE0 < 0: geen spontane reactie
Hoe sterker de OX (grote E0OX-waarde) en/of hoe sterker de RED (kleine E0RED-waarde), hoe groter
ΔE0 en dus hoe groter de spanning U0
Het verloop van de redoxreactie kun je ook eenvoudig voorspellen aan de hand van de plaats van de reactiepartners in de tabel met de E0-waarden (zie zuur-basereacties).
RED1 + OX2 ⇆ OX1 + RED2
1 Schuin dalende lijn:
ΔE0 > 0: spontane reactie
OX-sterkte
RED-sterkte
ΔE0 < 0: geen spontane reactie 1 2
2 Schuin oplopende lijn:
Je kunt nu bijvoorbeeld verklaren waarom niet elk metaal waterstofgas vormt in een zoutzuuroplossing.
Cu in HCl: geen gasvorming
Cu = RED
H3O+ = OX
ΔE0 = 0,00 V – 0,34 V = –0,34 V geen reactie
Mg in HCl: wel gasvorming
Mg = RED
H3O+ = OX
ΔE0 = 0,00 V – (–2,38 V) = 2,38 V wel reactie
• Metalen en niet-metalen kun je experimenteel in een verdringingsreeks plaatsen.
Je gebruikt daarbij waterstof(gas) als referentie.
• De reductiepotentiaal (E0) is een waarde voor de sterkte van een reductor of een oxidator.
Een sterke oxidator wordt gekenmerkt door een hoge, positieve E0
–Een sterke reductor wordt gekenmerkt door een lage, negatieve E0
• ΔE0 (E0 OX – E0RED) kun je gebruiken om een redoxreactie te voorspellen:
– ΔE0 > 0: spontane reactie;
– ΔE0 < 0: geen reactie.
Tijdens een practicum krijgt Ezra 5 metalen plaatjes, waarop telkens vermeld staat welk metaal het is: Ag, Mg, Pb, Zn of Cu. Anderzijds krijgt hij 5 potjes, waarvan hij enkel weet dat ze Pb(NO3)2, MgSO4, CuSO4, ZnSO4 of AgNO3 bevatten. Hij moet achterhalen welke oplossing in welk potje voorkomt. Daarvoor moet hij elk metaal in elk potje brengen. Telkens noteert hij of er al dan niet een neerslag ontstaat op het metaal. Hij stelt het volgende vast:
POTJE 1 2 neerslagen
POTJE 2 0 neerslagen
POTJE 3 4 neerslagen
POTJE 4 1 neerslag
POTJE 5 3 neerslagen
Bepaal de inhoud van de 5 potjes.
Lees aandachtig dit krantenartikel.
NATRIUM IN WC GEGOOID: POT ONTPLOFT
DRACHTEN (ANP) – De diefstal van een fles natrium heeft voor een zestienjarige jongen uit het Friese Drachten onvoorziene gevolgen gehad. Samen met een vriend had hij ingebroken in een middelbare school. Hij had daarbij onder andere een fles natrium buitgemaakt.
Een oudere broer die de diefstal ontdekte, overtuigde de jongen om de buit terug te brengen. Hij vergat echter om de fles natrium mee te nemen.
De moeder van de jeugdige dief besloot daarom om de fles via de wc in de riolering te lozen. De chemische stof zorgde echter in de wc-pot voor een ontploffing, doordat er een chemische reactie met het water ontstond. De vrouw liep ernstige snijwonden op en moest naar het ziekenhuis worden overgebracht.
Naar: Provinciale Zeeuwse Courant, 19/01/1983
Verklaar wat er is gebeurd. Gebruik een redoxreactie.
Verklaar waarom het geen probleem is dat je edele metalen, zoals goud en zilver, als sieraad draagt in de regen.
Magnesiummetaal wordt in platen aangebracht op de ijzeren romp van een schip. Dat voorkomt roestvorming. Verklaar dat fenomeen met behulp van de verdringingsreeks van de metalen of de E0-waarden.
In de goudindustrie maakt men gebruik van de E0-tabel om zilveronzuiverheden uit goudstalen te zuiveren. Men gebruikt daarbij een reactie met Cl2-gas. Toon met behulp van de E0-tabel aan dat daardoor …
a er efficiënt Ag-onzuiverheden kunnen worden verwijderd;
b het goud zelf niet wordt aangetast door het Cl2-gas.
Rangschik met behulp van de E0-waarden deze deeltjes volgens toenemende oxidatorsterkte:
a I2
b Cl2
c MnO4- (neutraal milieu)
d MnO4- (zuur milieu)
e Cu2+
f O2 (zuur milieu)
g O2 (neutraal milieu)
Rangschik met behulp van de E0-waarden deze deeltjes volgens toenemende reductorsterkte:
a Cu
b Sn
c Ag
d Fe
e S2O32-
f NO2
g I-
Voorspel het verloop van deze redoxreacties:
a Sn + H3O+
b Br2 + Cu
c Mn2+ + I2
d NO3- + Br-
De termen ‘reductor’, ‘oxidator’, ‘redoxreacties’ … ken je nu goed. Je kunt ook met behulp van de E0-tabel achterhalen of een redoxreactie al dan niet spontaan verloopt. In dit hoofdstuk gebruik je die kennis om de galvanische cel te bestuderen. Je leert de werking van de galvanische cel kennen en bekijkt de waterstofzuurstofbrandstofcel als duurzame toepassing.
LEERDOELEN
L De werking van een galvanische cel uitleggen en duiden als een spontane redoxreactie
L Het duurzame karakter van chemie aantonen in de context van een redoxreactie
De Italiaanse arts en natuurwetenschapper Luigi Galvani (1737-1798) ontdekte dat een kikkerpoot die aan een metalen haak hangt, beweegt als je hem aanraakt met een ander metaal. Hij meende – ten onrechte – de dierlijke elektriciteit te hebben ontdekt, die de levenskracht zou zijn die alles liet bewegen.
De Italiaanse natuurkundige en graaf Alessandro Volta (1745-1827) dacht echter dat elektriciteit anorganisch was en dat 2 verschillende metalen voor stroom zorgden. Om dat te bewijzen, bouwde Volta in 1800 een toestel dat samengesteld was uit een aantal kommen, gevuld met een zoutoplossing, die waren doorverbonden met koperen en zinken draden. Volta liet zien dat er door een gesloten kring een stroom liep. Hij had een apparaat gebouwd dat een ononderbroken elektrische stroom kon leveren. Later maakte hij een eenvoudiger ontwerp, dat uit plaatjes koper en zink bestond, gescheiden door een schijfje karton, gedrenkt in verdunde zwavelzuuroplossing. Die kolom van metalen en karton wordt de zuil van Volta genoemd.
Het was de voorloper van de moderne galvanische cel of de batterij. De eenheid volt is naar Volta genoemd.
In 1836 vond de Britse scheikundige John Frederic Daniell (1790-1845) de Zn/Cu-galvanische cel uit. Je noemt die daarom een Daniell-cel of Daniell-element. Ze is gekend als de eerste, vochtige, batterij. We gebruiken die cel om de werking van een galvanische cel uit te leggen.
Het principe van de galvanische cel wordt toegepast in de batterij. In dit leerboek gaan we op p. 182 enkel dieper in op de waterstof-zuurstofbrandstofcel. Op leer je meer over de werking van verschillende batterijen, onder andere de alkalinebatterij.

80 Alkalinebatterijen
De Daniell-cel bevat 2 redoxkoppels die in een aparte recipiënt, bijvoorbeeld een beker, worden geplaatst: de 2 halfcellen. Telkens wordt een metaal in een oplossing van zijn zout gebracht:
• een zinken plaat (Zn) in een zinksulfaatoplossing (ZnSO4) (1,0 mol L );
• een koperen plaat (Cu) in een kopersulfaatoplossing (CuSO4) (1,0 mol L ).
Je weet al dat er tijdens redoxreacties elektronen worden overgedragen van de reductor naar de oxidator. Uit de E0-tabel kun je afleiden dat in de Daniell-cel Zn elektronen overdraagt aan Cu2+
E0 (Zn2+/Zn) = –0,76 V
E0 (Cu2+/Cu) = 0,34 V

• Het redoxkoppel met de laagste E0-waarde levert de reductor (dus Zn).
• Het redoxkoppel met de hoogste E0-waarde levert de oxidator (dus Cu2+).
Zn en Cu2+ bevinden zich echter in een aparte recipiënt. Daarom verbind je de metaalplaatjes door middel van elektriciteitsdraden (de elektronenbrug) en een ampèremeter. In die opstelling meet je echter geen stroom.
Afb 82 De opbouw van een Daniell-cel. Als je de 2 halfcellen enkel met elkaar verbindt met elektriciteitsdraden, merk je geen stroomdoorgang.
Als je tussen beide oplossingen een zoutbrug of ionenbrug aanbrengt, wijkt de naald wel uit. In aanwezigheid van de zoutbrug meet je stroom. Maar de richting van de elektronenverplaatsing is tegengesteld aan de stroomrichting: in de uitwendige geleider lopen de elektronen van de zink-halfcel naar de koper-halfcel.
ampèremeter
zoutbrug
zinkmetaal
ZnSO4 mol L
kopermetaal
CuSO4 mol L
Afb 83 De opbouw van een Daniell-cel met een zoutbrug. Die zorgt voor een gesloten kring, waardoor er stroomdoorgang mogelijk is.
Als je een voltmeter plaatst, meet je bij 25 °C en 1,0 mol L een potentiaalverschil of spanning (U0) van: U0 = E0 OX – E0 RED = E0 (Cu2+/Cu) – E0 (Zn2+/Zn) = 0,34 V – (–0,76 V) = 1,10 V
Per halfcel kun je de volgende gegevens verzamelen:
Zn2+/Zn Cu2+/Cu
• Zn treedt op als de reductor
• Zn wordt geoxideerd tot Zn2+ Zn ⇆ Zn2+ + 2 e-
• Tijdens dat proces komen er elektronen vrij. De Zn-elektrode wordt negatief geladen. De Zn2+-ionen komen vrij in de oplossing. De zinkelektrode vormt de negatieve pool.
• De elektrode waar de oxidatie plaatsvindt, noem je de anode. Zn is de anode
• Cu2+ treedt op als de oxidator
• Cu2+ wordt gereduceerd tot Cu. Cu2+ + 2 e- ⇆ Cu
• De elektronen die door de Zn-elektrode werden afgezet, bereiken via de elektronenbrug de Cu2+/Cu-halfcel. Cu2+-ionen uit de oplossing nemen de elektronen op. De koperelektrode vormt de positieve pool
• De elektrode waar de reductie plaatsvindt, noem je de kathode. Cu is de kathode
• De zinkelektrode wordt aangevreten.
• De koperelektrode wordt aangeladen.
De finale reactie die plaatsvindt, is dezelfde reactie die doorgaat als je zink rechtstreeks in contact brengt met een koperzoutoplossing.
Zn + Cu2+ ⇆ Zn2+ + Cu
Omdat DE0 > 0 (= U0), spreek je bij een galvanische cel van een spontane reactie.
Zonder uitwendige geleider kunnen de reacties niet plaatsvinden: de vrijgekomen elektronen moeten continu worden weggevoerd vanuit de reductor-halfcel naar de oxidator-halfcel (de elektronenbrug). De zoutbrug of ionenbrug sluit de elektrische keten.
Zn-anode
beweging van positieve ionen beweging van negatieve ionen
Cu-kathode
Een zoutbrug is bijvoorbeeld een U-vormige buis die gevuld is met een geconcentreerde zoutoplossing, bv. NaCl, aangemaakt in een agaroplossing. De aanwezige ionen in de zoutbrug compenseren in de halfcellen de ladingsveranderingen die door de reductie en oxidatie optreden (behoud van ladingsbalans).
• Door de vorming van de Zn2+-ionen in de Zn2+/Zn-halfcel wordt die anode-halfcel positiever: de concentratieverhoging van de Zn2+-ionen wordt gecompenseerd door de komst van negatieve ionen (anionen) uit de zoutbrug, bv. Cl-
• Doordat de Cu2+-ionen in de Cu2+/Cu-halfcel verdwijnen, wordt die kathode-halfcel negatiever: de concentratieverlaging van de Cu2+-ionen wordt gecompenseerd door de komst van positieve ionen (kationen) uit de zoutbrug, bv. Na+
De zoutbrug maakt de verbinding tussen de halfcellen, zodat de elektrische keten gesloten is.
De corrosiecel is een toepassing van de galvanische cel. Het roesten van ijzer is een voorbeeld van een corrosiecel die bestaat uit één soort metaal. Je kunt voorkomen dat ijzer roest door een sterker reducerend metaal aan te brengen op het ijzer. Een bekend voorbeeld is het aanbrengen van zinken platen op de ijzeren romp van een boot. Het zink zal de ijzeren romp beschermen tegen corrosie. Uit de E0-tabel kun je immers afleiden dat Zn een sterkere reductor is dan Fe.
• In een corrosiecel zal O2 altijd de functie van oxidator innemen.
• In de Zn/Fe-corrosiecel wordt Zn de anode en Fe de kathode
• De 2 metalen vormen de elektronenbrug, terwijl de druppel met O2 en H2O de ionenburg uitmaakt.
E0-WAARDEN RED/OX
O 2 + 2 H 2 O + 4 e- 4 OH-
Zn-anode (–)
e - e -
E0 (Fe2+/Fe) =
Fe-kathode (+)
ANODE (–) OXIDATIE VAN RED Zn ⇆ Zn2+ + 2 eKATHODE (+) REDUCTIE VAN OX O2 + 2 H2O + 4 e- ⇆ 4 OH-
ΔE0 0,40 – (–0,76) = +1,16 V > 0, dus spontane reactie
TOTALE REACTIE
2 · (Zn ⇆ Zn2+ + 2 e-) O2 + 2 H2O + 4 e- ⇆ 4 OH-
2 Zn + O2 + 2 H2O ⇆ 2 Zn(OH)2 ↓
De aanwezige zinkionen, afkomstig van de reductor, zullen binden met de OH--ionen en er een hydroxide mee vormen. Dat is waterondoorlaatbaar en biedt daardoor een extra beschermlaag tegen corrosie. Omdat het zink nu geoxideerd wordt, en dus eigenlijk opgeofferd wordt om het ijzer te beschermen, spreek je van de ‘offeranode’.
Als je bijvoorbeeld tin (E0 (Sn2+/Sn) = –0,14 V) rond ijzer wikkelt, zal ijzer niet worden beschermd. Daarom raadt men af om etenswaren te bewaren in een geopend blik of om voedsel uit een beschadigd blik te eten. Blik is immers ijzer beschermd met een tinlaagje. Zolang het tinlaagje bij blik onbeschadigd is, kan er geen roestvorming optreden (er is immers geen corrosiecel). Zodra er echter een krasje ontstaat in het tinlaagje, zal het ijzer door contact met vochtige lucht roesten.
3 Duurzame chemie: waterstof-zuurstofbrandstofcel
De laatste decennia heeft men zich, onder meer door de invloed van de ruimtevaart, toegelegd op de ontwikkeling van zogenoemde brandstofcellen. Ook in de autosector experimenteert men druk met brandstofcellen. Ze moeten de huidige verbrandingsmotoren vervangen, omdat ze milieuvriendelijker en zelfs zuiniger zijn.
Door het elektronenbehoud wordt de reactie ter hoogte van de anode:
2 H2 ⇆ 4 H+ + 4 e-

Brandstofcellen zijn elektrochemische toestellen die chemische energie van een voortdurende reactie meteen omzetten in elektrische energie. De chemische energie hoeft dus niet eerst te worden omgezet in thermische energie en mechanische energie (zoals bij het verbruik van fossiele brandstoffen), waardoor er nauwelijks verliezen optreden en de brandstofcel op een heel efficiënte manier energie kan leveren.
Er is een belangrijk verschil tussen een batterij en een brandstofcel. In een brandstofcel moeten er namelijk telkens opnieuw reagentia (in ons voorbeeld waterstofgas en zuurstofgas) van buitenaf worden aangevoerd (open systeem), terwijl de reagentia in een batterij opgeslagen zitten (gesloten systeem).
In principe is een brandstofcel een toestel waarin waterstofgas en zuurstofgas reageren en waarbij water wordt gevormd, waarbij de vrijkomende energie rechtstreeks (zonder warmte-effect of explosie) wordt geleverd als elektrische energie. Een katalysator is essentieel opdat de halfreacties kunnen plaatsvinden. Een bijkomend voordeel van een brandstofcel is dat ze enkel water vormt en dus de natuur niet vervuilt. In een brandstofcel gebruikt men meestal 2 chemisch inerte platinaelektroden die tegelijk als katalysator functioneren.
De halfreacties zijn:
anode (–): H2 + 2 H2O ⇆ 2 H3O+ + 2 e-
(E0 (H3O+/H2) = 0,00 V)
Daarbij is de aanwezigheid van water niet vereist, dus kun je de reactie als volgt verkort weergeven:
H2 ⇆ 2 H+ + 2 e-
kathode (+): O2 + 4 H3O+ + 4 e- ⇆ 6 H2O
(E0 (O2/H2O) = 1,23 V)
Als je de verkorte reactie ter hoogte van de anode gebruikt, wordt dat:
O2 + 4 H+ + 4 e- ⇆ 2 H2O
De totale reactie is 2 H2 + O2 ⇆ 2 H2O.
De spanning bedraagt 1,23 V.
De volgende afbeelding geeft de werking van een waterstof-zuurstofbrandstofcel weer.
waterstofgas
zuurstofgas
anode (Pt)
kathode (Pt) elektrolyt
1 Als waterstofgas in contact komt met de negatieve anode (Pt), worden er H+-ionen gevormd en komen er elektronen vrij.
2 Het H+-ion beweegt door een membraan dat gevuld is met een elektrolytoplossing.
3 Het elektron verdwijnt uit de cel via een uitwendig circuit: op die manier wordt er stroom geleverd.
4 Via het circuit bereiken de elektronen de positieve kathode (Pt), waar ze binden met zuurstofgas en water vormen.
5 Het reactieproduct in een brandstofcel is water.
• De galvanische cel steunt op een redoxreactie die spontaan verloopt.
–De sterkste RED (laagste E0) ondergaat de oxidatie ter hoogte van de anode, de negatieve pool
–De sterkste OX (hoogste E0) ondergaat de reductie ter hoogte van de kathode, de positieve pool.
–Elektronen stromen in de elektronenbrug en bieden de elektriciteit aan die de galvanische cel opwekt.
–De zoutbrug of ionenbrug sluit de stroomkring.
• De galvanische cel kent als batterij en brandstofcel belangrijke toepassingen in het dagelijks leven, bijvoorbeeld in de waterstof-zuurstofbrandstofcel
Als elektrolytoplossing gebruikt men vaak een 20 % KOH-oplossing.
Bij deze oefeningen geldt overal een concentratie van 1,0 mol L , een temperatuur van 298 K en een druk van 1 013 hPa.
Maak een tekening van deze galvanische cel: Fe(NO3)2/Fe//Ag/AgNO3
Geef per halfcel weer:
OX/RED/oxidatie/reductie/anode/kathode/ halfreacties/totale reactie. Bereken U0 .
Maak een tekening van deze galvanische cel: Cu(NO3)2/Cu//Pb/Pb(NO3)2
Geef per halfcel weer:
OX/RED/oxidatie/reductie/anode/kathode/ halfreacties/totale reactie. Bereken U0
Gegeven zijn 2 samenstellingen van een galvanische cel:
• Zn2+/Zn//Pb/Pb2+
• Ni2+/Ni//Cu/Cu2+
Geef per cel weer:
a welk metaal aan de pluspool is geschakeld; b welk metaal aan de minpool is geschakeld; c de halfreactie aan de anode; d de halfreactie aan de kathode.
Welke galvanische cel geeft een bronspanning van 2,51 V?
a Pb2+/Pb//Ag/Ag+
b H+/H2//Hg/Hg2+
c Mg2+/Mg//Al/Al3+
d Al3+/Al//Hg/Hg2+
Een galvanische cel is opgebouwd uit een Mg-lint in een 1,0 mol L Mg2+-oplossing en een Ag-plaatje in een Ag+-oplossing. Hoeveel bedraagt de bronspanning van die cel?
De functie van een zoutbrug (elektrolytenbrug)
in een galvanische cel is:
a toelaten dat ionen van de ene halfcel naar de andere cel kunnen bewegen;
a 1,57 V
b 3,18 V
c 0,77 V
d 3,97 V
b elektrische stroom veroorzaken tussen de 2 elektroden van de galvanische cel;
c optreden tegen de opbouw van positieve ladingen aan de anode;
d ontstane ladingen in de halfcellen neutraliseren.
Je wilt een galvanische cel bouwen met Fe2+/Fe enerzijds en Au3+/Au anderzijds. Welk antwoord geeft het juiste kathodemetaal en de juiste bronspanning weer?
a Au – 1,83 V
b Fe – 0,99 V
c Au – 0,99 V
d Fe – 1,83 V
De referentiewaterstofelektrode bevat:
a het H2O/H2-koppel;
b het O2/H2O-koppel;
c het H3O+/H2-koppel;
d het H3O+/H2O-koppel.
De Leclanché-cel was de eerste (vochtige) batterij. Zoek op welke chemische stoffen er werden gebruikt in die batterij. Leg ook de werking van die batterij uit (anode, kathode, reactie van RED/OX).
Zoek op welke chemische stoffen er worden gebruikt in een alkalinebatterij. Leg de werking van die batterij uit (anode, kathode, reactie van RED/OX).
In een pacemaker wordt een lithium-(di)joodbatterij gebruikt.
a Schrijf de halfreactie die plaatsvindt aan de anode.
b Schrijf de halfreactie die plaatsvindt aan de kathode.
c Noteer de totale reactie.
d Bereken de bronspanning van die batterij.
Meer oefenen? Ga naar .
De galvanische cel wordt gekenmerkt door een spontane redoxreactie. In de 2e graad leerde je ook al een redoxreactie kennen die niet spontaan verloopt: de elektrolyse van water. De ontbinding van water vereist een externe energiebron: elektriciteit.
In dit hoofdstuk leer je hoe een elektrolyse in detail verloopt en wat er verschillend is ten opzichte van een galvanische cel. Je bekijkt ook toepassingen van elektrolyse en komt daarbij tot de rol die chemie kan spelen in de verduurzaming van de maatschappij.
L De werking van een elektrolysecel uitleggen en duiden als een niet-spontane redoxreactie
L Het duurzame karakter van chemie aantonen in de context van een redoxreactie
In de 2e graad bekeek je de elektrolyse van water
In een toestel van Hofmann werd water gebracht, dat via een elektrische stroom werd omgezet in waterstofgas en zuurstofgas.
Dat was een voorbeeld van een analyse: een samengestelde stof (H2O) werd ontbonden in 2 enkelvoudige stoffen (H2 en O2):
2 H2O ⇆ 2 H2 + O2
Als je de reactie in detail bekijkt, zie je dat het een redoxreactie is:
• Reductie: het oxidatiegetal van H wordt verlaagd van +I (in H2O) naar 0 (in H2).
• Oxidatie: het oxidatiegetal van O wordt verhoogd van -II (in H2O) naar 0 (in O2).
Die redoxreactie vindt enkel plaats in aanwezigheid van elektrische stroom. Het is een gedwongen redoxreactie negatieve pool positieve pool
In de galvanische cel Zn2+/Zn//Cu/Cu2+ vindt een spontane reactie plaats en wordt er elektriciteit geleverd.
Aan de 2 polen van de galvanische cel stel je het volgende vast:
ANODE (NEGATIEVE POOL) (Zn)
E0 (Zn2+/Zn) = –0,76 V
Zn = RED
oxidatie
Zn ⇆ Zn2+ + 2 e-
Waarneming:
Zn-elektrode lost op
KATHODE (POSITIEVE POOL) (Cu)
E0 (Cu2+/Cu) = 0,34 V
Cu2+ = OX reductie
Cu2+ + 2 e- ⇆ Cu
Ub = 0,34 V – (–0,76 V) = 1,10 V
De reactie is spontaan.
Totale reactie: Zn + Cu2+ ⇆ Zn2+ + Cu
Waarneming: Cu-neerslag op Cu-elektrode
Als je in dezelfde opstelling de voltmeter vervangt door een externe stroombron, pas je een elektrolyse toe. Daarbij wordt de Zn-elektrode gekoppeld aan de negatieve pool van de stroombron: de Zn-elektrode vormt de negatieve pool. Omdat in een elektrolysecel aan die pool elektronen worden opgenomen, vindt er aan die pool de reductie plaats: de negatieve pool (hier Zn) is dus de kathode bij de elektrolyse. De anode vormt in een elektrolysecel de positieve pool De oxidatie vindt in dit voorbeeld dus plaats aan de Cu-elektrode. Elektrolyse is geen spontane reactie en verbruikt stroom
Aan de 2 polen van de elektrolysecel stel je het volgende vast:
ELEKTROLYSECEL
KATHODE (NEGATIEVE POOL) (Zn)
E0 (Zn2+/Zn) = –0,76 V
Zn2+ = OX reductie
Zn2+ + 2 e- ⇆ Zn
Waarneming: Zn-neerslag op Zn-elektrode
ANODE (POSITIEVE POOL) (Cu)
E0 (Cu2+/Cu) = 0,34 V
Cu = RED oxidatie
Cu ⇆ Cu2+ + 2 e-
Ub = –0,76 V – 0,34 V = –1,10 V De reactie is niet spontaan.
Totale reactie: Zn2+ + Cu ⇆ Zn + Cu2+
Bekijk enkele belangrijke verschillen tussen een galvanische cel en een elektrolysecel:
• productie van elektriciteit
• spontane redoxreactie
• anode (Zn) = negatieve pool
• kathode (Cu) = positieve pool
Waarneming: Cu-elektrode lost op
• verbruik van elektriciteit
• gedwongen redoxreactie
• kathode (Zn) = negatieve pool
• anode (Cu) = positieve pool
‘Waterige oplossingen’ impliceert dat je rekening moet houden met de mogelijke reductie of oxidatie van H2O tot respectievelijk H2 en O2. Tijdens elke chemische reactie kan er dus H2O optreden als reductor (RED) of als oxidator (OX). Als er sterkere RED en/of OX voorkomen, zal H2O die functie niet uitvoeren. Je moet met andere woorden bij elke elektrolyse de volgende koppels meenemen in de bepaling van de RED en OX in de elektrolyse:
OX: 2 H2O + 2 e- ⇆ 2 OH- + H2 (E0 = –0,83 V) RED: 6 H2O ⇆ 4 H3O+ + O2 + 4 e- (E0 = 1,23 V)
Als je de werking van een elektrolysecel wilt verklaren, schrijf je in eerste instantie de aanwezige deeltjes op. Meestal zijn dat:
• H2O;
• de ionen die aanwezig zijn in de oplossing (Na2SO4 bevat bijvoorbeeld Na+- en SO42--ionen);
• de elektroden (bijvoorbeeld Cu of C).
Edele metalen, zoals platina (Pt), of grafiet (C) worden vaak gebruikt als elektrode.
Ze kunnen door een hoge E0-waarde geen reductor zijn en zijn chemisch inert. Op die manier interfereren ze niet in een elektrolysereactie.
Je bepaalt per elektrode welk deeltje als RED/OX betrokken is bij de reactie.
Daarbij steun je op de volgende basisregels:
• Het redoxkoppel met de laagste E0-waarde levert de reductor
• Het redoxkoppel met de hoogste E0-waarde levert de oxidator.
• De kathode is aangesloten aan de negatieve pool van de stroombron en geeft elektronen af die worden opgenomen door de oxidator, die daarbij gereduceerd wordt. OX1 + n e- ⇆ RED1
Er zijn meerdere potentiële oxidatoren, bijvoorbeeld: – metaalionen: Mn+ + n e- ⇆ M –H2O: 2 H2O + 2 e- ⇆ 2 OH- + H2 (E0 = –0,83 V)
Enkel oxidatoren met een E0-waarde die hoger is dan (of in de buurt ligt van) de E0-waarde van het redoxkoppel H2O/H2, worden gereduceerd.
• De anode vormt de positieve pool en neemt elektronen op die worden afgegeven door de reductor, die daarbij geoxideerd wordt. RED2 ⇆ OX2 + n e-
Er zijn meerdere potentiële reductoren, bijvoorbeeld:
– X- (monoatomische halogenide-ionen): 2 X- ⇆ X2 + 2 e-
– H2O: 6 H2O ⇆ 4 H3O+ + O2 + 4 e- (E0 = 1,23 V)
– M (elektrode): M ⇆ Mn+ + n e
Enkel de RED-deeltjes met een E0-waarde die lager is dan (of in de buurt ligt van) de E0-waarde van water, worden geoxideerd.
Zn2+ is de OX vanwege de hoogste E0-waarde.
Stappenplan elektrolysecel analyseren
Om een elektrolyse uit te werken, kun je de volgende stappen volgen:
1 Maak een tekening.
Op de tekening (vogelperspectief) geef je de betrokken veranderingen weer.
2 Stel een tabel op.
a Vermeld alle mogelijke betrokken deeltjes.
b Geef bij de anode alle mogelijk reductoren aan met hun E0-waarde.
c Geef bij de kathode alle mogelijke oxidatoren aan met hun E0-waarde.
d Bepaal de werkelijke RED/OX op basis van de E0-waarde (RED: laagste E0, OX: hoogste E0).
e Noteer de betrokken halfreacties.
f Bepaal de totale reactie door gebruik te maken van de regel van elektronenbehoud.
VOORBEELDEN ELEKTROLYSE UITWERKEN
Voorbeeld 1: elektrolyse van een ZnSO4-oplossing (Cu-elektroden)
Waarnemingen:
• De Cu-anode wordt verteerd.
• Ter hoogte van de Cu-kathode wordt Zn afgezet.
Tekening:
Cu is de RED vanwege de laagste E0-waarde.
Tabel:
Totale reactie: Cu(v) + Zn2+ ⇆ Cu2+ + Zn(v)
SO42- kan geen oxidator zijn, omdat het als negatief deeltje wordt aangetrokken door de anode (positieve pool).
Deze elektrolysereactie wordt vaak gebruikt om materialen te verzinken.
Als kathode kan daarbij bijvoorbeeld een lepel worden gebruikt die wordt verzinkt. Zn-afzetting
Voorbeeld 2: elektrolyse van een CuCl2-oplossing (Pt-elektroden)
Waarnemingen:
• Aan de anode (positieve pool) is er gasontwikkeling (O2) en kleurt de lakmoesindicator rood (zuur milieu).
• Aan de kathode (negatieve pool) wordt er koper afgezet.
Tekening:
Tabel:
kathode (–)
is de OX vanwege de hoogste E0-waarde.
anode (+)
Totale reactie: 6 H2O + 2 Cu2+ ⇆ 4 H3O+ + O2 + 2 Cu
Opmerking:
Tijdens een elektrolyse moet je ook rekening houden met het concentratie-effect De E0-waarden die worden gebruikt in dit leerboek, zijn geldig voor oplossingen van 1,0 mol L . Als je een geconcentreerde CuCl2-oplossing (bv. 1,5 mol L ) gebruikt, zal Cl-, ondanks een hogere E0-waarde, de reductor zijn. Een mogelijke verklaring is het kleine verschil in E0-waarde tussen de potentiële reductoren. Je kunt de vorming van chloorgas (Cl2) experimenteel bewijzen door bij de start van het experiment inkt toe te voegen aan de oplossing. Door het contact tussen chloorgas en de blauwe inkt ontstaat er een groene kleur. Dat voorbeeld bewijst dat de E0-waarde niet altijd een duidelijk antwoord biedt bij de bepaling van de reductor en de oxidator. Een experimentele vaststelling is essentieel. Bij een elektrolyse moet je dus goed opletten om geen onverwachte reacties te krijgen. Je moet rekening houden met de juiste keuze van de elektroden, de keuze van de elektrolyt en de concentratie van de elektrolyt.
is de RED vanwege de laagste E0-waarde.
Ga naar en ontdek nog meer toepassingen van elektrolyse.
Smeltelektrolyse
Je kunt een elektrolyse niet alleen uitvoeren bij een waterige oplossing. Een zout kan niet alleen in oplossing, maar ook onder gesmolten toestand worden aangeboden. Het voordeel van een zogenoemde smeltelektrolyse is dat de H2O-molecule niet langer een oxidator en/of reductor kan zijn. Daardoor kunnen deeltjes die een zwakkere reductor of oxidator zijn dan H2O, toch die functie invullen.
Een voorbeeld van een smeltelektrolyse is de smeltelektrolyse van gesmolten NaCl. Na+ is een zeer zwakke oxidator en zal in een waterige oplossing nooit die functie kunnen invullen, omdat de watermolecule in verhouding een sterkere oxidator is. Daarom past men smeltelektroforese toe: men brengt NaCl in gesmolten toestand aan in de elektrolysecel. Het smeltpunt van NaCl is 800 °C, maar door de toevoeging van CaCl2 kan men een vloeibaar mengsel verkrijgen bij 600 °C. In die smeltelektrolysecel zal Cl- de reductorfunctie invullen, waardoor er ook Cl2 wordt gevormd.
De smeltelektrolyse van NaCl wordt veelvuldig gebruikt in de industrie, omdat het een belangrijk product voor de synthese van kunststoffen genereert: chloorgas (Cl2).
Het principe van een galvanische cel is goed herkenbaar in een batterij, bijvoorbeeld de waterstofzuurstofbatterij. Je kunt batterijen echter niet opnieuw opladen.
In deze paragraaf ga je dieper in op de werking van accu’s, die een toepassing zijn van zowel de galvanische cel als de elektrolyse. In tegenstelling tot een batterij is een accu in staat om elektrische energie in de vorm van chemische energie op te slaan, te accumuleren. Je laadt accu’s op door er een elektrische spanningsbron op aan te sluiten (elektrolyse). Daarbij voltrekken de chemische processen in de accu zich in de omgekeerde richting in vergelijking met het ontladen.
Als je de geladen accu inschakelt, wordt die chemische energie opnieuw omgezet in elektrische energie: de accu ontlaadt (galvanische cel). Omdat je de accu vervolgens opnieuw kunt opladen, spreek je van een heroplaadbare batterij
Een accu of accumulator is dus een reversibele chemische spanningsbron. De chemische stoffen worden niet verbruikt, maar gegenereerd
Accu’s zijn elektrochemische cellen die stroom leveren voor draagbare en mobiele apparatuur De accutechnologie heeft de laatste decennia een enorme ontwikkeling doorgemaakt. Mede daardoor zijn laptops en mobiele telefoons mogelijk geworden. Voor die toepassingen gebruikt men accu’s met droge cellen die geheel zijn afgesloten. Tegenwoordig is een oplaadbare batterij het belangrijkste onderdeel van een elektrische auto.

Lithium heeft een lage E0-waarde en is bijgevolg als Li een sterke reductor (Li+ is een zwakke oxidator). Het zal, net zoals natrium, sterk reageren als het in contact komt met water of lucht.
Het geeft graag elektronen af. In de lithium-ionaccu wordt Li gebruikt als reductor: het wordt vanuit Li+-ionen gevormd terwijl de accu wordt opgeladen. In een ontladen lithium-ionaccu is lithium immers enkel als Li+-ion aanwezig. Daar zit het verstopt in een dubbel metaaloxide dat aangebracht is op de anode (bv. LiCoO2). In dat metaaloxide heeft Li als oxidatiegetal +I en Co +III.
Al-elektrode
elektrolyt
Cu-elektrode
O2-
Co3+ Li+
grafiet
92 Een ontladen lithium-ionaccu
Het opladen van een lithium-ionaccu verloopt zoals bij een elektrolyse: een externe stroombron wordt ingeschakeld. Ter hoogte van de anode (positieve pool) worden de kobaltionen Co3+ geoxideerd tot Co4+ (oxidatiegetal +IV). Daardoor worden de Li+-ionen, verstopt in het dubbel metaaloxide LiCoO2, vrijgezet ter hoogte van de anode (er wordt CoO2 gevormd) (reactie: LiCoO2 ⇆ Li+ + CoO2 + e-).
Het ene Co4+-ion volstaat om de lading van -4 van de 2 zuurstofionen te compenseren.
• Het vrijgekomen elektron kan niet door de elektrolyt en wordt aangetrokken door de anode (positieve pool). Vervolgens loopt het langs de externe stroombron naar de kathode (negatieve pool).
• De vrijgekomen Li+-ionen stromen door de elektrolyt naar de kathode.
• Op de kathode is grafiet aangebracht, waarin de lithiumionen en elektronen gevangen worden (als Li).
anode (Al)
O2Co4+ Li+
elektron grafiet bewegen van elektronen bewegen van Li+ kathode (Cu)
Afb 93 Een lithium-ionaccu opladen
Nu is de lithium-ionaccu volledig geladen: de Li+-ionen zijn losgemaakt uit het metaaloxide en als lithiumatoom (sterke RED) beschikbaar gesteld aan de andere pool. Dat is een onstabiele toestand voor lithium. Zodra de externe stroombron wordt uitgeschakeld, zal lithium opnieuw naar zijn stabiele toestand willen, verstopt in het metaaloxide (bv. LiCoO2). Het lithiumatoom (RED) wordt dus opnieuw geoxideerd: het ontladen van de lithium-ionbatterij start.
Het metaaloxide wordt aangebracht op een aluminiumelektrode. Het grafiet wordt aangebracht op een koperelektrode.
De elektrolyt, een organisch zout van lithium, wordt aangebracht op een separator die de 2 halfcellen scheidt.
De lithiumatomen zitten vast tussen de verschillende grafietlagen, 1 lithiumatoom per 6 koolstofatomen.
Het ontladen van de accu verloopt zoals een galvanische cel. Lithiumatomen geven ter hoogte van de negatieve pool (de anode) een elektron af. De lithiumionen migreren vervolgens door de elektrolyt (een lithiumzout) naar de kathode. Gelijktijdig stromen via de externe geleiding ook de elektronen van de anode naar de kathode. Bij de kathode worden de kobaltionen gereduceerd van Co4+ naar Co3+, waarbij de lithiumionen opnieuw in het metaaloxide worden opgenomen.
kathode (Al)
anode (Cu)
O2Co4+ Li+ elektron grafiet bewegen van elektronen bewegen van Li+
Afb 94 Een lithium-ionaccu ontladen
De halfreacties zijn:
anode (–): Li ⇆ Li+ + e- E0 (Li+/Li) = –3,02 V
kathode (+): CoO2 + Li+ + e- ⇆ LiCoO2 of Co4+ + e- ⇆ Co3+ E0 (Co4+/Co3+) = 0,60 V
De totale reactie is CoO2 + Li ⇆ LiCoO2.
De spanning bedraagt 3,62 V.
De batterij ontlaadt omdat er in de anode steeds minder lithium beschikbaar is en er bij de kathode een overmaat aan lithiumionen ontstaat die de migratie tegenhouden. De celspanning neemt daardoor gaandeweg af.
ELEKTROLYSECEL
stekker stroom OPLADEN
GALVANISCHE CEL
elektromotor stroom ONTLADEN
elektrolietkathode (–) anode (+)
elektrolietanode (–) kathode (+)
Afb. 95 Samenvattende tekening: de werking van een lithium-ionaccu
Als de interne temperatuur te hoog wordt in een lithium-ionaccu, kan de elektrolytoplossing opdrogen, waardoor er een kortsluiting ontstaat tussen de anode en de kathode. Als de kathode en anode elkaar maar lichtjes raken, zal de accu enkel sneller ontladen. Bij een grote kortsluiting zal er echter zoveel stroom tussen de elektroden stromen dat de temperatuur zal stijgen en de batterij in brand kan vliegen en zelfs ontploffen. Om dat te voorkomen, plaatst men een isolerende laag, de separator, in de elektrolyt. Die laat de lithiumionen door, maar niet de elektronen.

Er zijn verschillende manieren waarop een kortsluiting kan ontstaan. In de eerste plaats kan een fabricagefout van de afscheider (separator) aan de basis van het probleem liggen. Een gaatje in het materiaal kan er immers voor zorgen dat de elektroden met elkaar in contact komen. Een fysieke kracht, zoals een val, kan er ook voor zorgen dat de afscheider niet langer naar behoren werkt.
Nog een manier waarop er een kortsluiting kan ontstaan, is door contaminatie met kleine metalen deeltjes tijdens het productieproces van de accu. Die deeltjes kunnen op 1 plaats samenhechten, waardoor er een stroom tussen de elektroden kan ontstaan.
• Elektrolyse is een gedwongen redoxreactie: met behulp van een externe stroombron wordt er een niet-spontane reactie uitgevoerd.
–De sterkste RED (laagste E0) ondergaat de oxidatie ter hoogte van de anode, de positieve pool
–De sterkste OX (hoogste E0) ondergaat de reductie ter hoogte van de kathode, de negatieve pool
• De factoren waarop je tijdens een elektrolyse moet letten, zijn:
–het soort elektrolyten; –het soort elektroden; –de concentratie aan elektrolyten.
• Elektrolyse kent verschillende toepassingen, zoals de lithium-ionaccu.
Werk de elektrolyse uit van een Na2SO4-oplossing (2 Pt-elektroden).
a Voorspel je waarnemingen als je lakmoes gebruikt, en verklaar met behulp van de E0-tabel.
b Maak een tekening van de elektrolysecel.
Gegeven: enkele oplossingen die tijdens een elektrolyseproces worden gebruikt. Men maakt telkens gebruik van een C-kathode en een Pt-anode.
Geef de halfreacties die plaatsvinden aan de 2 polen.
a CuBr2-oplossing
b CuSO4-oplossing
c KI-oplossing
d NaOH-oplossing
e H2SO4-oplossing
Wat is het verschil tussen een batterij en een accu?
Waarom gebruikt men Li vaak in batterijen/accu’s?
Bij de elektrolyse van een geconcentreerde NaCl-oplossing met inerte C-elektroden …
a wordt Cl- geoxideerd aan de anode;
b wordt Cl- gereduceerd aan de kathode;
c wordt Na+ geoxideerd aan de anode;
d wordt Na+ gereduceerd aan de kathode.
Bij de elektrolyse van een Pb(NO3)2-oplossing met Cu-elektroden …
a wordt Pb afgezet aan de elektrode die verbonden is met de positieve pool;
b wordt de Cu-elektrode aangetast aan de positieve pool;
c wordt H2O gereduceerd aan de kathode; d wordt H2O geoxideerd aan de anode.
Sommige metalen kun je alleen uit hun zout winnen door een smeltelektrolyse uit te voeren.
Voor welke metalen geldt dat?
a metalen met een E0 < –0,83 V
b metalen met een E0 > –0,83 V
c metalen met een E0 < 1,23 V
d metalen met een E0 > 1,23 V
Welk verband is juist bij een elektrolyse?
a anode, pluspool, RED, oxidatie
b anode, minpool, RED, oxidatie
c kathode, pluspool, RED, oxidatie
d kathode, minpool, RED, oxidatie
Welke stelling is juist als het gaat over een lithium-ionaccu?
a Tijdens het ontladen worden er ter hoogte van de anode lithiumionen gereduceerd.
b Tijdens het opladen worden er ter hoogte van de anode lithiumionen gereduceerd.
c Tijdens het ontladen worden er ter hoogte van de kathode lithiumionen gereduceerd.
d Tijdens het opladen worden er ter hoogte van de kathode lithiumionen geoxideerd.
Zoek op welke chemische stoffen worden gebruikt in de loodaccu in een auto. Leg de werking van die accu uit (laden en ontladen, anode, kathode, reactie van RED/OX). ` Meer oefenen? Ga naar .
(enkel voor GO!)
In thema 03 maakte je kennis met de toepassing titratie. Op die manier kun je de concentratie van een zuur bepalen via de reactie met een base met een gekende concentratie. Hetzelfde principe kun je toepassen bij een redoxreactie.
LEERDOELEN
L Een redoxtitratie interpreteren en uitvoeren
1 Algemeen principe
Net zoals een zuur-basetitratie is een redoxtitratie een volumetrische methode om de concentratie van een opgeloste stof (hier RED of OX) te bepalen. De titratie is ook daar gebaseerd op een snelle aflopende reactie
Bekijk bijvoorbeeld de volgende algemene notatie: RED1 + OX2 OX1 + RED2
Als je de concentratie van RED1 wilt bepalen, voeg je met behulp van een buret een oplossing met een gekende concentratie toe met een gepaste OX2, zodat er een aflopende reactie plaatsvindt.
Door gebruik te maken van een OX- of RED-deeltje dat een bepaalde kleur geeft aan de oplossing of dat door de toevoeging van een andere stof aanleiding geeft tot een gekleurde oplossing, kun je het equivalentiepunt vaststellen doordat die kleur plots verdwijnt of verschijnt. Daarbij functioneert het OX- of RED-deeltje dus zelf als indicator.
• permanganometrie: titratie met MnO4KMnO4 K+ + MnO4paars
E0 (MnO4-/Mn2+) = +1,49 V, dus MnO4- is een sterke OX die aflopend kan reageren met vele RED.
Voorbeeld: Fe2+ + MnO4- Fe3+ + Mn2+ paars kleurloos
• chromatometrie: titratie met Cr2O72K2Cr2O7 2 K+ + Cr2O72oranje
E0 (Cr2O72-/Cr3+) = +1,33 V, dus Cr2O72- is een sterke OX die aflopend kan reageren met vele RED.
Voorbeeld: C2H6O + Cr2O72- C2H4O + Cr3+ oranje kleurloos
We noteren in dit hoofdstuk altijd een aflopende reactie, omdat we werken met een sterke OX/RED.
De paarse permanganaationen worden gereduceerd, eerst tot bruine Mn4+ en vervolgens tot kleurloze Mn2+
• jodi-jodometrie met als indicator zetmeel (toegevoegd aan de oplossing in de erlenmeyer)
zetmeel + I2 = donkerblauw
E0 (I2/I-) = +0,53 V, dus vrij zwakke RED en OX.
Sterkere RED kunnen I2 reduceren. Sterkere OX kunnen I- oxideren.
– jodimetrie: reductie met I- in een reactie met een sterkere OX dan I2 De titratie wordt uitgevoerd totdat de donkerblauwe kleur verschijnt.
Voorbeeld: I- + MnO4- Mn2+ + I2 + zetmeel: donkerblauw
jodometrie: oxidatie met I2 in een reactie met een sterkere RED dan IDe titratie wordt uitgevoerd totdat de donkerblauwe kleur verdwijnt.
Voorbeeld: S2O32- + I2 S4O62- + I+ zetmeel: donkerblauw
De oplossingsstrategie is analoog aan die bij zuur-basetitraties.
Je moet de redoxreactievergelijking opstellen volgens het stappenplan op p. 166. Om een redoxtitratieoefening op te lossen, volstaat het om de reactie uit te schrijven tot het niveau van het elektronenbehoud.
Opgave:
50,0 mL van een aangezuurde FeCl2-oplossing wordt getitreerd met een 0,0100 mol L KMnO4-oplossing. De paarse kleur van de MnO4--ionen blijft bestaan nadat er 0,0200 L KMnO4-oplossing is toegevoegd.
Gegeven is deze reactie:
Fe2+ + MnO4- Fe3+ + Mn2+
Bereken de concentratie van de FeCl2-oplossing.
1 Bereken het aantal mol MnO4-. n (KMnO4) = n (MnO4-), want KMnO4 K+ + MnO4n = c · V = 0,0100 mol L · 0,0200 L = 2,00 · 10-4 mol MnO4-
2 Stel de redoxreactie op tot aan het behoud van elektronen.
5 Fe2+ + MnO4- 5 Fe3+ + Mn2+ +II +VII +III +II
5 mol Fe2+ + 1 mol MnO4-
3 10,0 · 10-4 mol Fe2+ + 2,00 · 10-4 mol MnO4-
4 c (FeCl2) = c (Fe2+), want FeCl2 Fe2+ + 2 Clc (FeCl2) = n V = 10,0 · 10-4 mol 0,0500 L = 0,0200 mol L
• Redoxtitraties worden uitgevoerd om de concentratie van een oxidator of een reductor in een redoxreactie te bepalen.
• De oplossingsstrategie van een zuur-basetitratie pas je ook toe bij een redoxtitratie.
Bereken de concentratie van een FeCl2-oplossing, als je 10,00 mL ervan kunt titreren met 12,71 mL van een 0,0513 mol L I2-oplossing.
In een maatkolf bevindt zich 0,103 g KIO3-oplossing (V = 100 mL). Aan 10,0 mL van die kaliumjodaatoplossing voeg je 10,0 mL KI (c = 0,10 mol L ) en 10,0 mL H2SO4 (c = 1,0 mol L ) toe.
De volgende reactie vindt plaats: IO3-(opl) + 5 I-(opl) + 6 H3O+(opl) ⇆ 3 I2 (opl) + 9 H2O(opl)
Je titreert de verkregen I2-oplossing met 0,0250 mol L
Na2S2O3-oplossing, met als indicator een 1 % zetmeeloplossing. De kleuromslag gebeurt als je 10,8 mL van de natriumthiosulfaatoplossing hebt toegevoegd. Bereken het massaprocent in de oorspronkelijke KIO3-oplossing.
Een laborant beschikt over 150 mL kaliumpermanganaat 0,300 mol L en 20 mL waterstofperoxideoplossing met 30 % (massaprocent) zuiver waterstofperoxide. De dichtheid van de peroxideoplossing bedraagt 0,970 kg L . Beide oplossingen worden in aanwezigheid van een overmaat zwavelzuur gemengd. Bij de daaropvolgende reactie ontstaan er onder andere mangaan(II)sulfaat en zuurstofgas. Hoeveel mL O2-gas kan maximaal worden gevormd (n.o.)?
Maak gebruik van deze redoxreactie: MnO4- + H2O2 ⇆ Mn2+ + O2
Om het gehalte aan bruinsteen (MnO2) in een monster te bepalen, verhit je 100,0 mg ervan met een overmaat zoutzuur. Het vrijgekomen chloorgas breng je in een overmaat KI-oplossing. Daarna titreer je het ontstane dijood met 20,50 mL 0,1050 mol L thiosulfaat (S2O32-). Bereken het gehalte aan bruinsteen in m%
` Meer oefenen? Ga naar .
KERNBEGRIPPEN
Hoofdstuk 1: Herhaling redoxreactie
NOTITIES
• De reductor ondergaat de oxidatie.
• De oxidator ondergaat de reductie.
Hoofdstuk 2: Een redoxreactie opstellen een redoxreactie opstellen
Om een redoxreactie op te stellen, maak je gebruik van een stappenplan:
Stap 1: redoxbruggen opstellen
Stap 2: elektronenbalans
Stap 3: ladingsbalans (H3O+- of OH--ionen toevoegen)
Stap 4: atoombalans (H2O-moleculen toevoegen)
Stap 5: de stoffenreactievergelijking opstellen
Hoofdstuk 3: Sterkte van reductoren en oxidatoren verdringingsreeks
Metalen en niet-metalen kunnen experimenteel in een verdringingsreeks worden geplaatst. De waterstofgaselektrode wordt daarbij gebruikt als referentie-elektrode.
reductiepotentiaal (E0)
U0
Hoofdstuk 4: Galvanische cel galvanische cel elektronenbrug zoutbrug
Is een waarde voor de sterkte van een reductor of oxidator:
• sterke reductor: lage, negatieve E0
• sterke oxidator: hoge, positieve E0
Wordt gebruikt om een redoxreactie te voorspellen:
• DE0 > 0: spontane reactie
• DE0 < 0: geen reactie
Steunt op een redoxreactie die spontaan verloopt.
Elektronen stromen in de elektronenbrug en bieden de elektriciteit aan die de galvanische cel opwekt.
De zoutbrug of ionenbrug sluit de stroomkring en zorgt voor de ladingsbalans.
reacties ter hoogte van de polen toepassingen
De sterkste RED (laagste E0) ondergaat de oxidatie ter hoogte van de anode, de negatieve pool.
De sterkste OX (hoogste E0) ondergaat de reductie ter hoogte van de kathode, de positieve pool.
De galvanische cel kent als batterij en brandstofcel belangrijke toepassingen in het dagelijks leven, bv. de waterstof-zuurstofbrandstofcel.
KERNBEGRIPPEN
Hoofdstuk 5: Elektrolyse elektrolyse
reacties ter hoogte van de polen gedwongen (niet-spontane) redoxreactie
De sterkste RED (laagste E0) ondergaat de oxidatie ter hoogte van de anode, de positieve pool.
De sterkste OX (hoogste E0) ondergaat de reductie ter hoogte van de kathode, de negatieve pool. GALVANISCHE
• productie van elektriciteit
• spontane redoxreactie
• anode (Zn) = negatieve pool
• kathode (Cu) = positieve pool
• verbruik van elektriciteit
• gedwongen redoxreactie
• kathode (Zn) = negatieve pool
• anode (Cu) = positieve pool
toepassingen Elektrolyse kent verschillende toepassingen, zoals de lithium-ionaccu.
Hoofdstuk 6: Redoxtritaties (enkel voor GO!) redoxtitraties doel: de concentratie van een oxidator of een reductor bepalen
oplossingsstrategie = zuur-basetitratie
Heel vaak komen chemische stoffen negatief in de actualiteit. Maar eigenlijk zijn alle stoffen rondom ons chemische stoffen. Zelfs de moleculen waaruit ons lichaam en onze voedingsstoffen zijn opgebouwd, zijn chemische stoffen. Je kunt ons lichaam zowaar vergelijken met een chemisch fabriekje.

koolhydraten + vetten
koolhydraten
koolhydraten + ethanol
` Welke chemische stoffen zijn er aanwezig in ons lichaam?
` Is er een verband met de stoffen die aanwezig zijn in onze voeding?
We zoeken het uit!
• stoffen indelen in de juiste organische monofunctionele stofklasse.
monosacharide monosacharidedisacharide polysacharide
• eigenschappen zoals het kook- en smeltpunt en de oplosbaarheid van eenvoudige organische stoffen verklaren.
• de structuur van biomoleculen, zoals sachariden en eiwitten, herkennen.
• welke functie verschillende groepen biomoleculen vervullen.
Als je naar de samenstelling van het menselijk lichaam kijkt en die vergelijkt met de voedingswaarde op de etiketten van voeding, merk je dat er veel overeenkomsten zijn. Zo bevat zowel voeding als het menselijk lichaam bijvoorbeeld eiwitten en vetten. Maar hoe zien die stoffen eruit? En wat is hun functie?
LEERDOELEN
L De structuur van 4 belangrijke groepen biomoleculen herkennen: sachariden, eiwitten, lipiden en nucleïnezuren
L De functie of het belang van die biomoleculen toelichten
In het dagelijks leven spreekt men eerder van koolhydraten in plaats van sachariden. Maar eigenlijk is dat een oude benaming en is die vanuit chemisch standpunt niet helemaal correct. Zo kun je bijvoorbeeld C6H12O6 ook als C6(H2O)6 schrijven, waardoor het lijkt alsof er 6 watermoleculen op 6 koolstofatomen gebonden zijn. Maar de eigenlijke structuur ziet er helemaal anders uit.

Monosachariden zijn de eenvoudigste koolhydraten. Het zijn monomeren die als bouwsteen worden gebruikt om de complexere koolhydraten te maken. Vanuit chemisch standpunt kun je de monosachariden nog verder indelen in aldosen en ketosen, maar je kunt ook verwijzen naar het aantal C-atomen waaruit ze zijn opgebouwd.
Glucose (C6H12O6) is een aldohexose: het behoort tot de aldehyden, want het bevat een eindstandige carbonylgroep en de stamnaam ‘hex’ verwijst naar de aanwezigheid van 6 C-atomen. Glucose is een belangrijke energiebron voor de meeste organismen. Het kan onder andere uit honing worden gehaald.
De eigen doubletten bij een atoom, bv. bij O, worden in dit thema niet weergegeven.
Deze voorstelling is de Fischer-projectie.
Daarbij worden de groepen die naar voren gericht zijn, horizontaal genoteerd.
Afhankelijk van waar de hydroxylfuncties ten opzichte van elkaar staan, zowel in de open als in de gesloten vorm, bekom je andere optische isomeren.
Doordat er 4 asymmetrische C-atomen aanwezig zijn, namelijk C2 tot en met C5, bestaan er 24 = 16 optische isomeren.
Afb. 99 8 verschillende D-isomeren van aldohexose
Als bij het C5-atoom de hydroxylgroep rechts staat, spreek je van de D-vorm. Van elk van de bovenstaande moleculen bestaat er ook nog de L-vorm, die je bekomt door vanuit de D-variant het spiegelbeeld te nemen van alle optisch actieve C-atomen.
Meestal komen hexosen voor als een gesloten ring. Door het sluiten van de ring ontstaat er een extra chiraal C-atoom op plaats 1. Afhankelijk van de positie van de hydroxylgroep op het C1-atoom in de ring bekom je de α- of de β-vorm. Staat de OH-groep aan de bovenkant van de ring, dan bekom je de β-vorm. Als de OH-groep aan de onderkant van de ring staat, spreek je van de α-vorm.
Afb 100 Van glucose bestaan er verschillende isomeren: er bestaat niet alleen D- en L-glucose, maar ook bij de ringvorm zijn er nog 2 opties: α en β.
Fructose (C6H12O6) is een ketohexose. Net zoals glucose is het opgebouwd uit 6 C-atomen. In tegenstelling tot glucose behoort fructose niet tot de aldehyden, maar wel tot de ketonen, door de aanwezigheid van de niet-eindstandige carbonylgroep. Door de positie van de carbonylgroep ontstaat er bij ringsluiting geen zeshoek, maar een vijfhoek. Fructose komt voor in fruit en wordt vooral als zoetstof gebruikt. Het is 2 keer zo zoet als glucose. Je lever kan een deel fructose omzetten in glucose. Bij een te grote inname van fructose wordt het deel dat niet onmiddellijk kan worden omgezet in glucose, opgeslagen als lichaamsvet.
101 De structuur van D-fructose. Fructose heeft 6 koolstofatomen en vormt een vijfring.
Galactose (C6H12O6) is ook een aldohexose, zoals glucose, maar de plaats van de hydroxylgroep op het C4-atoom verschilt. Doordat galactose een aldohexose is, zal het ook een zesring vormen. Galactose ontstaat uit een suiker die in melk zit.
Ribose (C5H10O5) is een aldopentose. Het is een van de bouwstenen van RNA (ribonucleïnezuur).
103 Ribose bevat 5 koolstofatomen en vormt een vijfring.
Wanneer 2 monosachariden met elkaar reageren, ontstaat er een disacharide. Bij die reactie wordt er water afgesplitst. Het is dus een condensatiereactie
Maltose ontstaat uit de condensatiereactie van 2 moleculen glucose.
hydrolyse
glycosidische binding
Afb. 104 De vorming en ontbinding van maltose
Maltose wordt heel vaak in sportdranken gebruikt, omdat het de bloedsuikerspiegel heel snel en hoog laat stijgen. Het enzym maltase breekt maltose via het sleutel-slotprincipe af tot 2 glucosemoleculen. Maltase fungeert als katalysator bij die reactie. Bij de reactie is er natuurlijk ook water nodig.
actief centrum substraat enzym reactieproducten enzym-substraatcomplex
onveranderd enzym
Afb. 105 De afbraak van maltose (= substraat) tot 2 glucosemoleculen (= reactieproducten) door maltase (= enzym)
Sacharose of sucrose ontstaat uit de reactie tussen glucose en fructose. Sacharose is beter bekend als kristalsuiker. Het wordt gewonnen uit suikerbieten en suikerriet. In een raffinaderij wordt de suiker eerst in water opgelost. Vervolgens wordt een groot deel van het water verdampt. Daarna volgen nog centrifugatie en filtratie. Die twee stappen samen vormen de raffinage van suiker.
Afb. 106 De vorming en ontbinding van sacharose
Tijdens de vertering zorgt sacharase of sucrase voor de afbraak van sacharose tot glucose en fructose.
Lactose of melksuiker is de belangrijkste suiker in melk. Het is opgebouwd uit een molecule galactose en glucose. Lactose wordt afgebroken met behulp van lactase.
glycosidische binding
Zetmeel
Zetmeel is de energiereserve in planten. Het bevat zowel amylose als amylopectine. Beide polymeren zijn opgebouwd uit α-D-glucose. Bij amylose komen er alleen lineaire ketens voor, terwijl amylopectine vertakt is. In speeksel zit amylase, dat zetmeel in kleinere stukken knipt, zoals maltose. Maar ook in de zaadhuid van planten is amylase aanwezig. Bij het brouwen van bier of het kiemen van graan zorgt die amylase ervoor dat het zetmeel wordt afgebroken.
Ondanks de aanwezigheid van veel OH-groepen lost zetmeel niet op in water. Dat komt doordat er zeer sterke waterstofbruggen worden gevormd tussen de glucoseketens. Wanneer je een zetmeelwatermengsel verwarmt, zal er meer water worden opgenomen door het zetmeel, waardoor de waterstofbruggen breken en het zetmeel uiteindelijk oplost. Afhankelijk van de snelheid van afkoelen ontstaat er een zeer slecht oplosbare stof of eerder een flexibele gel, die goed oplosbaar is in water.
amylose
amylopectine
amylase
zetmeelmolecule (polysacharide)
maltosemoleculen (disacharide)
Glycogeen is een reservestof bij dieren. Het is een sterk vertakt polymeer van glucosemoleculen.
Glycogeen is goed oplosbaar in water. Door de vele vertakkingen kunnen er geen sterke waterstofbruggen tussen de ketens ontstaan, maar ontstaat er net plaats voor watermoleculen om zich in te nestelen. In de lessen biologie zag je al dat een teveel aan glucose wordt omgezet in glycogeen onder invloed van het hormoon insuline. Dat glycogeen wordt opgeslagen in de lever en de spieren. Als het bloedsuikergehalte daalt, wordt glycogeen weer omgezet naar glucose, onder invloed van het hormoon glucagon.
insuline glucagon
WEETJE
De energievoorraad die als glycogeen in de lever en de spieren is opgeslagen, wordt gebruikt wanneer je sport. Je krijgt een hongerklop wanneer die energievoorraad op is: de spreekwoordelijke ‘man met de hamer’. Je valt dan bijna letterlijk stil.
Cellulose is ook een polymeer van glucose. Maar in tegenstelling tot zetmeel en glycogeen zijn het geen α-glucosemoleculen die aan elkaar gebonden worden, maar β-glucosemoleculen. Tussen de onvertakte glucoseketens treden er waterstofbruggen op, die zorgen voor extra stevigheid. De celwand van planten is opgebouwd uit cellulose. Het is het meest voorkomende biopolymeer op aarde. Geen enkel zoogdier is in staat om cellulose af te breken.
glycogeen
Naast polysachariden die opgebouwd zijn uit glucosemoleculen, bestaan er nog andere polysachariden, zoals chitine. Heel wat ongewervelde dieren, zoals geleedpotigen (insecten, spinnen ...), hebben een uitwendig skelet dat is opgebouwd uit chitine. Het monomeer waaruit chitine is opgebouwd, lijkt sterk op glucose, maar er is 1 hydroxylgroep vervangen door een aceetamidegroep (CH3-CO-NH-).
113 Een exoskelet is opgebouwd uit chitine.
Zowel monosachariden als disachariden zijn snelle suikers: ze worden snel in de bloedbaan opgenomen, waardoor het bloedsuikergehalte snel stijgt. De glycemische index (GI) van snelle suikers is veel hoger dan die van trage suikers. Dat wil zeggen dat snelle suikers de bloedsuikerconcentratie heel snel laten toenemen.
Het lichaam reageert natuurlijk op een stijging van de bloedsuikerspiegel door extra insuline aan te maken, waardoor het bloedsuikergehalte heel sterk daalt. Dat zorgt voor de typische suikerdip een tijdje nadat je een suikerrijke maaltijd hebt gegeten.
uren na de maaltijd hoge GI lage GI
Afb 114 Het effect van een hoge en lage glycemische index op de bloedsuikerspiegel
Als het glucosepeil te hoogt wordt, produceert de alvleesklier meer insuline, met spreekwoordelijke ‘emmers tegelijk’.
insuline ↑ Hier zal je lichaam spieren ‘opeten’.
Afb 115 Voor je lichaam is het beter om je bloedsuikerspiegel binnen bepaalde grenzen te houden. Voeding met een te grote glycemische index zorgt voor een suikerdip.
waarden uit balans
de video en leer meer over de suikerdip.
Om het uiteindelijke effect op de bloedsuikerspiegel te kennen, moet je niet alleen rekening houden met de glycemische index, maar ook met de totale hoeveelheid koolhydraten in het voedingsmiddel. Dat noem je de glycemische lading of de glycemische last.
Naar: www.iamafoodie.nl
Eiwitten of proteïnen zijn belangrijke voedingsstoffen voor ons lichaam. Het lichaam breekt ze eerst af tot aminozuren, om er vervolgens specifieke lichaamseigen eiwitten mee te maken die een welbepaalde functie uitvoeren.
De naam ‘aminozuren’ geeft al aan dat de moleculen zowel een aminefunctie als een carboxylfunctie bevatten. Aminozuren die gebruikt worden in eiwitten, bevatten ook altijd een H-atoom gebonden op het centrale C-atoom. De restgroep verschilt van aminozuur tot aminozuur en bepaalt voor een groot deel de eigenschappen, zoals de oplosbaarheid, van het aminozuur. Bij het kleinste aminozuur is de restgroep een H-atoom. Dat is het enige aminozuur dat optisch niet actief is. Het centrale C-atoom bevat geen 4 verschillende atomen of atoomgroepen en is dus niet chiraal.

Menselijke eiwitten worden opgebouwd uit ongeveer 20 verschillende aminozuren, waarvan er 9 essentieel zijn. Die aminozuren kan het lichaam niet zelf aanmaken. Ze moeten via de voeding worden opgenomen.
C-atoom
Wanneer je een beperkt aantal aminozuren via een condensatiereactie met elkaar laat reageren, bekom je een peptide. De carboxylgroep van het ene aminozuur reageert met de aminegroep van het tweede aminozuur. Daarbij wordt een dipeptide gevormd en water afgesplitst.
Afb 118 De vorming van een peptidebinding tussen 2 aminozuren. Dat is een condensatiereactie waarbij een watermolecule wordt afgesplitst. De splitsing van de peptidebinding is een hydrolysereactie.
Polypeptiden die op een heel specifieke manier zijn opgevouwen, zijn eiwitten of proteïnen
De primaire structuur van een eiwit is de specifieke volgorde van de aminozuren, maar geeft nog niets van de ruimtelijke structuur weer.
In de aminozuurketens komen specifieke plooiingen voor, namelijk de α-helix en de β-plaat. Die structuur is de secundaire structuur.
Als de aminozuurketen nog verder 3D-opgevouwen wordt, ontstaat de tertiaire structuur
De quaternaire structuur van een eiwit ontstaat door interacties tussen verschillende polypeptiedeketens.
De 3D-structuur wordt in stand gehouden door waterstofbruggen, elektrostatische aantrekkingskrachten, disulfidebindingen ...
Een peptidebinding bestaat dus eigenlijk uit een amidefunctie.
PRIMAIRE STRUCTUUR
SECUNDAIRE STRUCTUUR
TERTIAIRE STRUCTUUR
QUATERNAIRE STRUCTUUR
Enzymen spelen een belangrijke rol in de stofwisseling van een organisme. Enzymen zijn eiwitten die biochemische reacties katalyseren, zoals de afbraak van zetmeel.
Daarnaast zorgen eiwitten ook voor de structuur, de vorm en de stevigheid van een cel. Het cytoskelet is immers opgebouwd uit verschillende soorten eiwitten.
Ook belangrijke transportmoleculen (bv. hemoglobine) en moleculen die instaan voor communicatie, zijn eiwitten (hormonen).
Ook al zijn veel mensen geneigd om lipiden uit hun voeding te schrappen wanneer ze op dieet zijn, toch zijn die stoffen onontbeerlijk in een gezonde voeding.

De eetbare vetten en oliën zijn triglyceriden. In tegenstelling tot de polysachariden en de polypeptiden bekom je hier geen lange ‘kralenketting’ van repeterende monomeereenheden. Door de grootte van de molecule behoren triglyceriden wel degelijk tot de macromoleculen.
Een triglyceride wordt via 3 condensatiereacties gevormd uit glycerol en vetzuren (= lange carbonzuren). De wetenschappelijke naam van glycerol is propaan-1,2,3-triol. Die molecule bevat 3 hydroxylgroepen. De hydroxylgroepen kunnen reageren met de carboxylgroep van de vetzuren, waarbij er water wordt afgesplitst. Het triglyceride bevat 3 esterfuncties.
Afhankelijk van de samenstelling van de vetzuurketen, spreek je van verzadigde en onverzadigde vetten. Door de regelmatige structuur van de vetzuurketens bij de verzadigde vetten zullen die eerder vast zijn op kamertemperatuur. De interacties, namelijk de london-dispersiekrachten, zijn er groter, wat resulteert in een hoger kook- en smeltpunt. Dierlijke vetten zijn verzadigde vetten.
Door de aanwezigheid van 1 of meerdere dubbele bindingen bij de onverzadigde vetten bekom je een structuur waarbij de stapeling van de vetzuurketens minder goed is, wat resulteert in een minder sterke london-dispersiekracht en dus een lager kook- en smeltpunt. Oliën bevatten dus eerder onverzadigde vetten.
VERZADIGDE VETTEN

glycerolvetzuurstaarten
ONVERZADIGDE VETTEN

glycerolvetzuurstaarten
onverzadigde binding
Afb 122 Lipiden die opgebouwd zijn uit verzadigde vetzuren, zijn vast bij kamertemperatuur. Lipiden met onverzadigde bindingen zijn vloeibaar bij kamertemperatuur.

123 Kokosolie is rijk aan verzadigde vetten.
Kokosolie heeft de laatste jaren een serieuze opmars gekend. Het is een plantaardige olie met een smelttraject dat veel hoger ligt in vergelijking met de andere plantaardige oliën. Het smelttraject van kokosolie ligt rond de 25 °C. Het is op kamertemperatuur dan ook vaak vast. Dat komt doordat het, in tegenstelling tot de andere plantaardige oliën, opgebouwd is uit verzadigde vetzuren, zoals laurinezuur, myristinezuur en palmitinezuur.
Ook palmolie bevat vrij veel verzadigde vetten, net zoals kokosolie, maar het bevat ook een groot aandeel aan oliezuur. Oliezuur is een mono-onverzadigd vet en behoort tot de omega 9-vetzuren. Het cijfer 9 verwijst naar de plaats van de dubbele binding: die staat op het 9e C-atoom, geteld vanaf de kant van de methylgroep. Door de grotere hoeveelheid onverzadigde vetten in vergelijking met kokosolie is palmolie gezonder. Het grote nadeel van palmolie is dat de ontginning ervan niet duurzaam verloopt. Er worden vaak grote stukken oerwoud vernietigd om plantages aan te leggen.

Afb. 125 Palmolie bevat zowel verzadigde als onverzadigde vetten.

Olijfolie bevat heel veel mono-onverzadigde vetten, waardoor het dus gezonder is dan kokosolie en palmolie. De grotere hoeveelheid onverzadigde vetten zorgt ervoor dat olijfolie minder goed tegen hogere temperaturen kan en dus niet echt geschikt is om mee te bakken.
Transvetten ontstaan onder andere bij het harden (hydrogeneren) van oliën. Ze verhogen het cholesterolgehalte in het bloed en vergroten de kans op hart- en vaatziekten.
De cis-vorm komt van nature meer voor. Die vetten hebben gunstige eigenschappen: ze worden in het lichaam vaak omgezet in hormoonachtige stoffen die bijvoorbeeld helpen om ontstekingen te bestrijden.
vetzuur met cis-verbinding: oliezuur
vetzuur met trans-verbinding: elaïdinezuur
Afb. 128 De structuurformules van de cis- en trans-vorm van 9-octadeceenzuur
Net zoals triglyceriden zijn fosfolipiden opgebouwd uit een glycerolmolecule, maar nu zijn er geen 3 vetzuren aan gebonden, maar slechts 2. Bij de laatste OH-groep van glycerol is er een fosfaatgroep gebonden. Dat zorgt ervoor dat de molecule een hydrofiele (polaire) kop en een hydrofobe (apolaire) staart heeft. Die specifieke structuur zorgt voor de typische eigenschappen van fosfolipiden: ze komen onder andere voor in het celmembraan van cellen.
Afb 129 Een fosfolipide met een molecule gebonden aan de fosfaatgroep. Fosfolipiden worden schematisch vaak voorgesteld als een polaire bol met twee apolaire vetzuurstaarten.
Gelijkaardige moleculen worden ook gebruikt in liposomen. Door hun heel specifieke structuur worden liposomen gebruikt voor het transport van hydrofiele en hydrofobe stoffen in het lichaam. Doordat hun structuur heel sterk lijkt op de samenstelling van het celmembraan, worden ze ook gebruikt in crèmes om de huid te hydrateren of te voorzien van extra vitamines. WEETJE
hydrofiel medicijn hydrofoob medicijn
Bij steroïden denken veel mensen aan anabole steroïden. Maar eigenlijk zijn steroïden een hele groep van moleculen die allemaal 4 gecondenseerde ringen gemeenschappelijk hebben, waardoor ze grotendeels apolair zijn.
Alle steroïden zijn afgeleid van cholesterol. Die molecule komt voor in het celmembraan en zorgt onder andere voor de stabiliteit van het membraan.
131 De structuurformule van cholesterol
Afb 132 Weergave van de structuur van een celmembraan volgens het vloeibare mozaïekmodel. Dierlijke cellen zitten verankerd in weefsels, doordat bepaalde transmembraanmoleculen verbonden zijn met langgerekte, vezelachtige stoffen, zoals collageen.
Je hebt misschien al gehoord van goede en slechte cholesterol, terwijl er maar 1 mogelijke formule voor cholesterol is. Door zijn apolaire karakter komt cholesterol bijna niet in vrije vorm voor in het bloed: het bindt met bepaalde transporteiwitten, die ervoor zorgen dat het wel oplosbaar is in het bloed. Daarbij ontstaat er een lipoproteïne.
HDL of High Density Lipoprotein staat bekend als ‘goede cholesterol’. Het zorgt voor de afvoer van cholesterol naar de lever, waar het vervolgens het lichaam verlaat via de ontlasting.
LDL of Low Density Lipoprotein daarentegen verplaatst zich net in de andere richting, namelijk van de lever naar de organen. Daardoor komt die vorm eerder in de bloedvaten terecht.
Het is dus vooral de verhouding van de 2 vormen die belangrijk is. Wanneer er voldoende HDL aanwezig is, zal dat ervoor zorgen dat cholesterol uit het lichaam verwijderd wordt. Is er echter te weinig HDL, dan zal LDL ertoe bijdragen dat er een afzetting (‘plaque’) ontstaat die zorgt voor een vernauwing van de bloedvaten. Die plaque kan eventueel ook openscheuren en een beroerte veroorzaken.
gezond bloedvat
slagaderverkalking
Andere steroïden die in het lichaam voorkomen en afgeleid zijn van cholesterol, zijn:
Cortisol wordt aangemaakt in de bijnierschors. Het komt vrij bij stress.
Oestradiol is 1 van de 2 belangrijke geslachtshormonen bij vrouwen. Het wordt aangemaakt in de eierstokken.
Testosteron is het belangrijkste mannelijke geslachtshormoon. Het wordt vooral aangemaakt in de teelballen. Het komt ook bij vrouwen voor in lage concentraties. Vooral de bijnieren zorgen bij vrouwen voor de productie van testosteron.
Afb 136 De structuurformule van testosteron
Anabole steroïden zijn kunstmatige steroïden, die vooral vanwege hun prestatiebevorderende eigenschappen worden gebruikt. Transgender mannen kunnen ze gebruiken als hormoontherapie.
Nucleïnezuren zijn polymeren waarin een groot aantal moleculen, nucleotiden, lineair aan elkaar gebonden zijn. Nucleïnezuren (of polynucleotiden) kunnen opgebouwd zijn uit enkele (5-10) tot verschillende miljoenen nucleotiden.
De 2 belangrijkste nucleïnezuren zijn:
• desoxyribonucleïnezuur of DNA (desoxyribonucleic acid);
• ribonucleïnezuur of RNA (ribonucleic acid).
Nucleotiden bestaan uit 3 moleculen die aan elkaar gebonden zijn:
• een monosacharide;
• een stikstofhoudende basische molecule (N-base);
• een fosfaatgroep (PO43-).
Afb. 137 De structuurformule van testosteron cypionaat: 1 van de anabole steroïden O CH2 O P
O–N N-base fosfaatgroep
monosacharide
W Afb 138 De algemene structuur van een nucleotide, met een fosfaatgroep, een monosacharide en een N-base
De nucleotiden bij DNA en RNA verschillen op 2 manieren:
1 in hun monosacharide
De monosacharide kan ofwel ribose, ofwel desoxyribose zijn. Het verschil tussen beide bestaat in een hydroxylgroep (-OH) op 1 van de koolstofatomen:
• DNA is opgebouwd uit desoxyribonucleotiden.
• RNA is opgebouwd uit ribonucleotiden.
2 in hun N-base
Er zijn 5 verschillende N-basen: adenine (A), cytosine (C), guanine (G), thymine (T) en uracil (U).
• De N-basen A, C en G komen zowel in DNA als in RNA voor.
• De N-base T komt enkel in DNA voor.
• De N-base U komt enkel in RNA voor.
adenine (A) DNA
desoxyribose
cytosine (C)guanine (G) thymine (T)
adenine (A)cytosine (C)guanine (G) uracil (U)
Afb 139 De structuur van de 4 nucleotiden die voorkomen in DNA en RNA
In de lessen biologie ga je nog dieper in op de structuur en functie van DNA en RNA.
Zetmeel komt voor in de cellen van aardappels en heeft de onderstaande structuur.
a Welke groep biomoleculen herken je: polysachariden, proteïnen of lipiden?
b Leg uit waaraan je die groep herkent.
Fructose is een vorm van suiker die 1,7 keer zoeter is dan sacharose (tafelsuiker). Fructose wordt dan ook in de voedingsmiddelenindustrie veel als zoetstof gebruikt. Een natuurlijke bron van fructose is honing: dat bevat ongeveer 40 % fructose.
Bekijk de afbeeldingen.
a Welke groep biomoleculen herken je: polysachariden, proteïnen of lipiden?
b Verklaar.
a Is fructose een monosacharide, disacharide of polysacharide?
b Verklaar.
c Hoe weet je dat dit de structuur van fructose is, en niet die van glucose?
Hieronder staan enkele suikers opgesomd.
a Zijn het monosachariden, disachariden of polysachariden?
b Hoe zie je dat?
maltose
galactose
5 stachyose
Komt voor in verschillende groenten, zoals groene bonen en sojabonen.
Link de begrippen aan de juiste afbeelding.
a aminozuur
b dipeptide
c tripeptide
d polypeptide
Bekijk de structuren van eiwitten.
a Orden de structuren van minst complex (1) naar meest complex (4).
b Welke afbeelding hoort bij welke eiwitstructuur?
Bekijk de moleculen.
a Is de molecule een verzadigd of onverzadigd vetzuur, of bevat ze een verzadigd of onverzadigd vetzuur?
b Hoe zie je dat?
Hoeveel aminozuren bevat dit stukje peptide?
De letters A, B en C stellen aminozuren voor.
a Vul deze reactie aan.
AABCABB + →
b Benoem dat reactietype.
c Hoeveel peptidebindingen zijn er aanwezig?
` Meer oefenen? Ga naar
GROEP 1: SACHARIDEN (OF SUIKERS) = koolstofverbindingen met meerdere hydroxylgroepen
• Monosachariden = snelle suikers
• Disachariden
MONOSACHARIDEN
sacharose of sucrose glucose + fructose
lactose galactose + glucose
• Polysachariden
zetmeel
STRUCTUUR
amylose
STRUCTUUR
FUNCTIE
amylopectine energiereserve planten
glycogeen energiereserve dieren
cellulose celwand planten: structuur chitine
exoskelet geleedpotigen: structuur
GROEP 2: EIWITTEN (OF PROTEÏNEN) = polymeren van aminozuren
aminozuren + aminozuur 1
eiwitten
OPGEBOUWD UIT FUNCTIE
moleculen met een centraal koolstofatoom met 4 bindingen:
• een aminogroep (-NH2)
• een H-atoom
• een carboxylgroep (-COOH)
• een restgroep (R): varieert bij de verschillende aminozuren
4 structuurniveaus:
• primaire structuur
• secundaire structuur
• tertiaire structuur
• quaternaire structuur
opbouw eiwitten
• katalyse van reacties (enzymen)
• structuur, vorm en stevigheid van een cel (cytoskelet)
• transport van stoffen (hemoglobine)
• communicatie binnen organisme (insuline)

GROEP 3: LIPIDEN (OF VETTEN) = koolstofverbindingen met apolaire ketens
triglyceriden
glycerolvetzuurstaarten
fosfolipiden
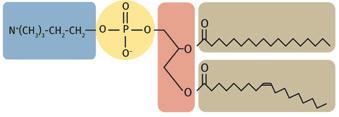
steroïden
bv. cholesterol HO cholesterol

glycerol en 3 vetzuren
glycerolvetzuurstaarten
• verzadigde vetzuren (-C-C-)
• onverzadigde vetzuren (-C=C-)
FUNCTIE
• energiereserve
• isolatie
• waterafstoting
• vetoplosbare vitaminen
glycerol, 2 vetzuren, een fosfaatgroep en choline
onverzadigde binding
4 ringvormige moleculen met daarop functionele groepen
opbouw membranen
opbouw membranen
GROEP 4: NUCLEÏNEZUREN
nucleotiden
O CH2 O P O O–O–N N-base fosfaatgroep monosacharide
OPGEBOUWD UIT FUNCTIE
• een monosacharide (ribose voor RNA en desoxyribose voor DNA)
• een stikstofhoudende base (adenine, cytosine, guanine, thymine en uracil)
• een fosfaatgroep
• energiehuishouding
• opbouw van DNA en RNA
Als je naar etiketten van kleding kijkt, kom je verschillende soorten materialen tegen. Sommige kleding bestaat uit slechts één soort materiaal, maar veel kleding is gemaakt van verschillende materiaalsoorten. Vroeger werd kleding gemaakt van natuurlijke materialen. Denk maar aan wol, katoen, zijde of linnen. Tegenwoordig worden veel textielvezels kunstmatig gemaakt. Voor fleece gebruikt men zelfs grondstoffen uit gerecycleerde petflessen.

` Op welke manier worden kunststoffen gemaakt?
` Waarom worden kunststoffen gerecycleerd?
` Wat zijn de voor- en nadelen van kunststoffen?
` Op welke manier draagt de chemische kunststofindustrie bij aan duurzaamheid?
We zoeken het uit!

• toepassingen van organische stoffen geven.
• verschillende soorten organische reacties herkennen, zoals additie en substitutie.
• eigenschappen van organische stoffen verklaren op basis van hun structuur.

• toepassingen van kunststoffen geven.
• verschillende soorten polymeervormingsreacties herkennen, zoals polyadditie en polycondensatie.
• eigenschappen van kunststoffen verklaren op basis van hun structuur.
Kunststoffen zijn ingebed in ons dagelijks leven. Zo worden kleding, meubelen, speelgoed, de verpakking van levensmiddelen, medisch materiaal en isolatiemateriaal gemaakt van kunststoffen, maar ook auto’s bestaan grotendeels uit kunststoffen. Ondanks hun voordelen hebben sommige kunststoffen een grote impact op het milieu en op onze gezondheid. Voor de productie start men vaak van syntheseproducten van fossiele brandstoffen (olie en gas). De winning van die grondstoffen en de verwerking ervan tot plastic voorwerpen dragen bij tot de klimaatverandering.
L Eigenschappen van kunststoffen verklaren op basis van hun structuur
L Verschillende reactietypes toelichten waarmee kunststoffen worden gemaakt
L De reactie voor de vorming van een aantal kunststoffen schrijven (uitbreiding)
L De oorsprong en de eigenschappen van bioplastics toelichten
L Het belang van duurzaamheid inzien bij de ontwikkeling, het gebruik en de recyclage van kunststoffen
Als je over kunststoffen leest, duiken heel dikwijls de termen macromoleculen en polymeren op.
• Een macromolecule is een molecule die bestaat uit meerdere duizenden atomen.
Ze is meestal opgebouwd uit vele aaneengesloten kleine eenheden (monomeren). De meeste macromoleculen zijn ook polymeren.
Afb. 140 Een schematische voorstelling van een monomeer, een dimeer (= 2 monomeren) en een polymeer monomeer dimeer
• Een polymeer is een organische verbinding waarvan de moleculen bestaan uit een opeenvolging van identieke, of soortgelijke, monomeren die chemisch aan elkaar zijn gekoppeld. Zo is zetmeel een polymeer van glucose-eenheden, zijn eiwitten polymeren van aminozuren …
In dit thema spreken we vooral over de synthetische polymeren. Dat wil zeggen: polymeren die in een labo of op industriële schaal door een chemisch proces uit kleine moleculen worden geproduceerd.
‘Polymeer’ is afgeleid van het Griekse πολυς (polys), dat ‘veel’ betekent, en μερος (meros), ‘deel’.
‘Bifunctioneel’ betekent letterlijk: ‘bevat 2 functionele groepen’. (Dat kunnen dezelfde groepen zijn, maar dat hoeft niet.)
Kunststoffen worden gemaakt via:
• Polymerisatie: het monomeer bevat een dubbele binding, die wordt omgezet in een enkelvoudige binding in het polymeer. Bij die reactie wordt er geen nevenproduct gevormd.
Afb 141 Een schematische voorstelling van polymerisatie
• Polycondensatie: bifunctionele monomeren worden aan elkaar geschakeld, waarbij er een kleine molecule wordt afgesplitst.
Afb. 142 Een schematische voorstelling van polycondensatie
• Polyadditie: bifunctionele monomeren worden aan elkaar geschakeld, maar zonder afsplitsing van een kleine molecule.
Afb. 143 Een schematische voorstelling van polyadditie
Polymerisatie is een reactie waarbij er een groot aantal kleine moleculen met een onverzadigde binding aan elkaar worden geschakeld tot polymeren. Bij een polymerisatiereactie wordt de π-binding van de dubbele binding tussen koolstofatomen verbroken. Vervolgens worden de monomeren met een σ-binding aan elkaar gebonden. Het monomeer is onverzadigd en het gevormde polymeer zal meer verzadigd zijn: het polymeer bevat meer enkelvoudige bindingen dan het monomeer.
VOORBEELD POLYETHEEN (PE)
Een voorbeeld van een kunststof die via polymerisatie wordt gevormd, is polyetheen De grondstof voor dat polymeer is etheen. Je weet al dat etheen een plantenhormoon is dat als gas in de natuur voorkomt. Het zorgt er bijvoorbeeld voor dat fruit sneller rijpt. Maar etheen wordt ook op grote schaal in de petrochemische sector geproduceerd om polyetheen te maken. Men gebruikt polyetheen om er bijvoorbeeld boterhamzakjes, folie of shampooflessen van te maken.


Afb 144 Een voorstelling van de vorming van polyetheen uit etheenmonomeren
VOORBEELD POLYETHEEN (PE) (VERVOLG)
Afhankelijk van het productieproces ontstaat er polyetheen met een lage dichtheid (LDPE) of een hoge dichtheid (HDPE). Ongeveer driekwart van het gefabriceerde polyetheen is van het LDPE-type. Het overige kwart wordt gebruikt voor HDPE, de hardere variant.

S Afb 145 HDPE is een hogedichtheidpolyetheen dat in aanmerking komt voor tal van industriële toepassingen. HDPE is ook geschikt voor rechtstreeks contact met levensmiddelen.

S Afb 146 LDPE is een lagedichtheidpolyetheen. Het wordt veelvuldig toegepast in de verpakkings- en voedingsindustrie.
S Afb 147 De structuur van polyetheen
VOORBEELD POLYPROPEEN (PP)
Als je propeen als monomeer neemt in plaats van etheen, bekom je polypropeen (PP). In vergelijking met polyetheen is polypropeen over het algemeen veel sterker en stugger. PP reageert niet met chemische oplosmiddelen, zuren of basen, noch met bacteriën en schimmels. De kunststof kan ook met stoom steriel worden gemaakt. Vandaar dat PP wordt gebruikt in onder andere medische apparatuur en wegwerpspuiten. Verder gebruikt men het ook om er bijvoorbeeld broodtrommels, drinkbekers, speelgoed en auto-onderdelen van te maken.
…+C C+C C+C C+C C
HCH3 HCH3 HCH3 HCH3
HHHHHHHH
…—C—C—C—C—C—C—C—C—…
HCH3 HCH3 HCH3 HCH3
HH n C C HCH3

S Afb 148 De structuur en de toepassingsmogelijkheden van polypropeen: het wordt onder andere gebruikt als verpakkingsmateriaal van poetsproducten.
Naast polyetheen en polypropeen zijn er nog verschillende andere polymeren die op een gelijkaardige manier worden gevormd. Door telkens een kleine wijziging aan te brengen in het monomeer, ontstaat er een nieuw soort polymeer met andere eigenschappen. Als je in etheen 1 waterstofatoom vervangt door een chlooratoom, bekom je het monomeer chlooretheen. Een andere benaming voor chlooretheen is vinylchloride. Daarmee kun je polyvinylchloride vormen. Dat ken je waarschijnlijk beter onder de afkorting pvc.
Die stof wordt vanwege haar goede isolatiewaarde gebruikt in raamkozijnen. Maar ook dakgoten en vinylplaten zijn uit pvc gemaakt.


Als je polystyreen onder hoge druk door een opening perst, bekom je XPS. Voeg je echter een blaasmiddel toe, dan bekom je piepschuim. Er wordt dan tijdens de productie een gas toegevoegd, dat ingesloten wordt. Daardoor wordt het polystyreen opgeblazen en bekom je de typische bolvorm.
polystyreen
152 De vorming van styreen tot polystyreen

153 Door al dan niet een blaasmiddel te gebruiken bij de productie van
Bij polycondensatie reageren monomeren met elkaar, waarbij er een klein nevenproduct, meestal water, wordt afgesplitst. Het monomeer moet telkens 2 functionele groepen bevatten. Enkel op die manier kan er een lange keten worden gevormd.
Als je vertrekt van 1 monomeer dat 2 functionele groepen bevat, spreek je van AB-monomeren. Daarmee maak je polymeren van het (AB)n-type.
Een andere mogelijkheid is dat er vertrokken wordt van 2 verschillende monomeren, waarbij het ene monomeer (het AA-monomeer) 2 keer de ene functionele groep bevat en het andere monomeer (het BB-monomeer) 2 keer de andere functionele groep. Het polymeer dat daarbij wordt gevormd, behoort tot het (AABB)n-type. Je spreekt dan van een copolymerisatie.
AB-monomeer (AB)n-polymeer
AA-monomeer
BB-monomeer (AABB)n-polymeer
Afb 154 Polymerisatie van het AB- en AABB-type
Polyetheentereftalaat (pet) zegt je hoogstwaarschijnlijk niet veel, maar van een petfles heb je waarschijnlijk wel al gehoord.
Pet is helder en transparant, maar ook licht en stevig. Een groot voordeel van pet ten opzichte van PE is dat pet ondoorlaatbaar is voor gassen. Dranken met prik zullen daarom altijd in een petfles worden verpakt (of in een glazen fles natuurlijk).

Afb. 155 De vorming van polyetheentereftalaat of pet
VOORBEELD VORMING VAN NYLON
Nylon wordt gevormd via een polycondensatiereactie. Bij die reactie wordt er water afgesplitst. Nylon behoort tot de groep van de polyamiden (PA), omdat er in het polymeer een amidegroep aanwezig is. Er zijn veel verschillende nylonsoorten, afhankelijk van de monomeren waaruit ze zijn opgebouwd. Zeer sterke vezels, zoals visdraad en trekkabels, maar ook kogelwerende vesten worden zo gemaakt. Het aantal koolstofatomen van beide monomeren bepaalt de eigenschappen van het gevormde polymeer.

156 De vorming van nylon-6,6
Kogelwerende vesten worden vaak gemaakt van Kevlar. Bij die reactie wordt er HCl afgesplitst in plaats van water. De extreem sterke eigenschappen van Kevlar kun je verklaren door de waterstofbruggen die optreden tussen waterstofatomen en zuurstofatomen.
Afb 158 De vorming van Kevlar
Afb 159 Kevlar wordt gevormd via polycondensatie, waarbij er HCl wordt afgesplitst. Tussen de polymeerketens zijn er veel zeer sterke waterstofbruggen aanwezig.

Bij een polyadditiereactie worden er bifunctionele monomeren aan elkaar gekoppeld, zonder afsplitsing van een kleine molecule. Vaak gebeurt er een H-overdracht tussen de monomeren.
+ +
VOORBEELD POLYURETHAAN (PUR)
Polyurethaan (pur) wordt vooral in de bouw toegepast om spleten te dichten, maar ook als isolatiemateriaal of matrasvulling.
Eenvoudig kan de reactie als volgt worden weergegeven: het H-atoom van de hydroxylgroep verplaatst zich naar het N-atoom van de isocyanaatgroep.
isocyanaat (-NCO)
hydroxyl


Voor de vorming van polyurethaan treedt die reactie tussen verschillende monomeren op. Afhankelijk van de keuze van de monomeren (2 of meer functionele groepen per monomeer, lengte van de C-keten, gebruik van blaasmiddel …) zal het gevormde polymeer andere eigenschappen bezitten. Denk maar aan het verschil in stevigheid tussen een matras en het isolatiemateriaal rond deuren. Maar ook autolakken zijn gemaakt van pur: daarbij is er geen blaasmiddel gebruikt. Kunststoffen worden gemaakt via:
• Polymerisatie: het monomeer bevat een dubbele binding, die wordt omgezet in een enkelvoudige binding in het polymeer, waarbij er geen nevenproduct wordt gevormd.
• Polycondensatie: de functionele groepen van de monomeren worden aan elkaar geschakeld, waarbij er een kleine molecule wordt afgesplitst.
• Polyadditie: de functionele groepen van de monomeren worden aan elkaar geschakeld, zonder afsplitsing van een molecule.
Bij de productie van kunststoffen kan men ervoor kiezen om wel of geen blaasmiddel te gebruiken. Een blaasmiddel is een gasvormige stof die ervoor zorgt dat de kunststof lichter is. Net als bij polystyreen zal het toevoegen van een blaasmiddel bij de productie van pur ervoor zorgen dat er een schuim wordt gevormd, dat als isolatie kan worden gebruikt.
2 Indeling volgens eigenschappen van kunststoffen
Je kunt kunststoffen niet alleen indelen volgens de manier waarop ze worden gevormd, maar ook op basis van hun gedrag bij verhitting en hun elasticiteit.
Als je kunststoffen indeelt volgens hun gedrag bij verhitting, spreek je enerzijds van thermoharders en anderzijds van thermoplasten. Het verschil in eigenschappen tussen die groepen van kunststoffen kun je verklaren aan de hand van hun structuur.
Thermoharders (duromeren)

Structuur: Zoals de naam al doet vermoeden, zijn thermoharders harde kunststoffen. Je kunt ze niet bekrassen en je kunt er moeilijk een stukje af breken. Thermoharders houden dezelfde vorm als je ze verhit. Dat is een gevolg van hun structuur: de polymeerketens zijn onderling verbonden tot een nauwmazig netwerk met heel sterke crosslinks (dwarsverbindingen) tussen de verschillende polymeerketens. Thermoharders zijn bestand tegen hoge temperaturen, maar eens de crosslinks verbroken zijn, kunnen ze niet meer worden hersteld: de stof smelt dus niet, maar ontleedt.
Toepassingen: Het spreekt voor zich dat thermoharders worden gebruikt in voorwerpen die hoge temperaturen moeten weerstaan, zoals handvaten van pannen.
S Afb. 164 Bij de keuze van materialen voor het handvat van een braadpan houdt men meestal rekening met factoren zoals hittebestendigheid, isolatie-eigenschappen, comfort en gebruiksgemak.
De allereerste kunststof (bakeliet) werd gemaakt door Leo Baekeland, een Amerikaan van Belgische afkomst. Bakeliet is een thermoharder die vroeger vooral werd gebruikt voor stopcontacten en telefoonbehuizingen.

S Afb. 165 Het is belangrijk dat een stopcontact door het gebruik van een elektrisch toestel niet vervormt bij verwarming. Vandaar het gebruik van bakeliet.

S Afb. 166 Een voorbeeld van een toepassing van thermoharders in het verleden is de productie van bakelieten telefoons. Bakeliet was een van de eerste thermohardende kunststoffen die op grote schaal werden gebruikt voor de fabricage van telefoonbehuizingen.
De reactie voor de vorming van bakeliet is een polycondensatiereactie, want bij die reactie wordt water afgesplitst. Je ziet duidelijk de vele crosslinks in het gevormde polymeer: typisch voor een thermoharder.
Thermoplasten (plastomeren)

Structuur: In tegenstelling tot thermoharders zijn thermoplasten wel vervormbaar bij verhitting. De polymeerketens worden door zwakkere aantrekkingskrachten bij elkaar gehouden. Er zijn weinig of geen crosslinks aanwezig. Bij verwarming wordt de kunststof week en vervormbaar. Daardoor zijn de kunststoffen goed recycleerbaar: je kunt ze na smelten hermodelleren tot allerlei voorwerpen en materialen (folie, bekertjes …). Bij afkoeling worden ze opnieuw stabiel en bruikbaar. Thermoplasten lossen ook gemakkelijk op in organische oplosmiddelen. Die kunststoffen zijn vaak minder krasvast.
Toepassingen: PE (polyetheen) ken je van het plastic van grijze huisvuilzakken. Met de kunststof PP (polypropeen) ben je waarschijnlijk opgegroeid. PP wordt bijvoorbeeld gebruikt om speelgoed mee te vervaardigen.
Een andere manier om kunststoffen in te delen, is op basis van hun gedrag wanneer er een kracht op uitgeoefend wordt. Zo zijn er enerzijds de elastomeren en anderzijds de fibers.
Elastomeren (rubbers)
Structuur: Elastomeren zitten wat betreft structuur, en dus ook qua eigenschappen, tussen thermoplasten en thermoharders in. De polymeren zijn veerkrachtig, elastisch en vervormbaar. Er zijn crosslinks (S-bruggen) aanwezig, maar niet zoveel als bij thermoharders.
Dat zorgt ervoor dat als je een kracht uitoefent op elastomeren, je ze kunt vervormen. Maar eens je die kracht wegneemt, nemen ze weer hun oorspronkelijke vorm aan.

Toepassingen: Een mooi voorbeeld van een elastomeer is rubber. Dat wordt gebruikt voor voorwerpen waarbij elasticiteit belangrijk is. Denk maar aan elastiekjes, schoenzolen, autobanden …

Natuurlijk rubber wordt gewonnen uit latex van de rubberboom. Die latex bevat 2-methylbuta1,3-dieen, ook wel ‘isopreen’ genoemd.
zwavel
warmte
natuurlijk rubber
S Afb 172 Vulkaniseren van rubber
gevulkaniseerd rubber
Helaas is natuurrubber te elastisch en te weinig hittebestendig voor veel toepassingen. Daarom behandelt men de latex die afgetapt wordt, vervolgens met zwavel (vulkanisatieprocedé volgens Goodyear). Daardoor worden er voldoende crosslinks (zwavelbruggen) gevormd tussen de polymeerketens. Die zorgen ervoor dat het rubber wel degelijk voldoende stevig en elastisch is. Afhankelijk van de hoeveelheid crosslinks die op die manier worden gemaakt, bekom je heel soepel rubber voor een ballon of heel stevig rubber voor een autoband.

S Afb 173 In een autoband zit er in de rubbercompound vaak een combinatie van synthetisch rubber en natuurlijk rubber. De verhouding tussen die twee rubbersoorten bepaalt de eigenschappen van de band en kan variëren per bandenmerk en per type autoband. Zo bevatten vrachtwagenbanden veel meer natuurlijk rubber dan autobanden.
Rubberachtige materialen die zijn gemaakt van dat natuurrubber, maar die chemisch zijn gemodificeerd of verwerkt om bepaalde eigenschappen te verbeteren, noem je kunstrubber.
Door de enorme toename in de vraag naar rubber, voornamelijk voor de bandenindustrie, werd de beschikbare hoeveelheid ontoereikend. Door dat tekort wordt rubber voor autobanden nu vervangen door synthetisch rubber of SBR (styreenbutadieenrubber).
S Afb 174 De vorming van synthetisch rubber uit buta-1,3-dieen en styreen
Het gebruik van kunststoffen staat de laatste jaren enorm onder druk, en dat is bij rubber zeker niet anders. Zowel aan kunstmatig rubber als aan synthetisch rubber zijn er voor- en nadelen verbonden. Synthetisch rubber wordt gemaakt van aardoliederivaten, en de hoeveelheid aardolie die nog aanwezig is op aarde, is beperkt. Verder komen er ook heel veel microplastics in het milieu terecht door bijvoorbeeld slijtage van rubberbanden. In tegenstelling tot natuurlijk rubber is synthetisch rubber biologisch niet afbreekbaar. Het grote nadeel van natuurlijk rubber is dan weer dat er vaak oerwouden worden gekapt om rubberplantages aan te leggen.
In tegenstelling tot elastomeren vertonen fibers absoluut geen elasticiteit. Er wordt jaarlijks wereldwijd meer dan 20 miljard kilogram fibers geproduceerd, zowel natuurlijke fibers van cellulose als halfsynthetische (gemodificeerde cellulose) of synthetische fibers. Met ‘fibers’ bedoelt men haarfijne sterke vezels.
Toepassingen: De bekendste synthetische fibers zijn polyester en polyacryl.
Bij een verestering reageren een alcoholgroep en een carboxylgroep, met afsplitsing van water. Je kunt een polyester vormen uit onder andere een polycondensatie van een diol en een dizuur. De ontstane fiber is niet elastisch en wordt vaak gebruikt in de kledingindustrie.
Het meest gekende polyester is polyethyleentereftalaat, een polyester van een diol en een aromatisch dizuur. Het gevormde pet wordt gebruikt voor de productie van petflessen, maar kan ook tot vezels worden getrokken om daarna kleding mee te maken. De commerciële naam van het polyester is dacron.

tereftaalzuurglycolpolyethyleentereftalaat
Polyacryl is een polymeer dat wordt vervaardigd uit het stikstofhoudende monomeer acrylonitril.

Polyacril is een veelgebruikte fiber in kleding, omdat het alle eigenschappen van wol heeft, nog niet eens half zo duur is en niet krimpt.
Je kunt kunststoffen indelen op basis van hun gedrag bij verhitting en hun elasticiteit
• Gedrag bij verhitting:
–Thermoharders: nauwmazig netwerk, kunnen goed tegen hitte, ontleden bij extreme hitte.
–Thermoplasten: kluwens van polymeren, kunnen door de toevoeging van warmte worden ‘gemodelleerd’.
• Elasticiteit:
–Elastomeren: beperkt aantal crosslinks, nemen hun oorspronkelijke vorm weer aan nadat de kracht is weggenomen.
–Fibers: helemaal niet elastisch.
Nylon: elastomeer of fiber?
Nylon is een heel bekend polymeer. In de zoektocht naar een volledig synthetisch materiaal, ter vervanging van zijde, ontdekte men die polyamide. Je leerde al dat je ze kunt vormen door polycondensatie. Nylon is eigenlijk een verzamelnaam. De meest gekende soort is nylon-6,6 (de cijfertjes slaan op het aantal koolstoffen in de ketens van de monomeren).
amidefunctie
(CH2)6 n
HOOC(CH2)4COOH
hexaandizuurhexaandiamine
Hoe korter de koolstofketens tussen de amidefuncties zijn, hoe sterker de intermoleculaire krachten, zoals waterstofbruggen, tussen de polymeerketens.
Door het aantal koolstoffen te variëren in beide monomeren, krijgt het gevormde nylon telkens andere eigenschappen en wordt het polymeer elastisch of een sterke fiber. De verschillende soorten nylon kennen daardoor ook enorm veel toepassingen: van klimtouw tot kunstprothese, tandenborstels, tandwieltjes, visnetten of gewoon in panty’s.
Dat panty’s vaak erg elastisch zijn, ligt niet aan de elasticiteit van het nylon (die vaak beperkt is), maar door de manier van zigzag weven. Daardoor zie je telkens dat als er 1 nylondraadje stuk is, er meteen een hele ‘ladder’ ontstaat.
Ga naar en ontdek meer over de vormgeving van kunststoffen.
KUNSTSTOFAFVAL
recyclage – energierecuperatie
Wanneer voorwerpen uit kunststoffen niet meer kunnen worden gebruikt, zijn er verschillende manieren om met dat ‘afval’ om te gaan. Het is enerzijds belangrijk om ervoor te zorgen dat er geen kunststoffen in het milieu terechtkomen, maar anderzijds is het ook belangrijk om zo veel mogelijk energie en eventuele grondstoffen uit dat afval te recupereren.
mechanische recyclage de herwerking van kunststofafval tot kunstofproducten langs fysieke weg
chemische recyclage de herwerking van kunststofafval tot basischemicaliën of kunststofmonomeren langs chemische weg
alternatieve brandstof Kunststoffen zijn dankzij hun grote energie-inhoud een alternatief voor fossiele brandstoffen in energie-intensieve processen (bv. cementproductie).
vast huisvuil
De verbranding van kunststofafval samen met andere materialen kan warmte en/of stroom opleveren.
In België worden heel veel kunststoffen via de pmd-zak verzameld, om vervolgens verder te worden verwerkt. De P in pmd staat immers voor ‘plastic’. Ook al levert de verbranding van kunststoffen energie op, economisch én ecologisch gezien is het beter om kunststoffen te recycleren. Niet alleen heb je dan minder grondstoffen nodig, maar er is ook minder energie nodig om plastics te recycleren, dan voor de productie van nieuw plastic. Sinds 1988 worden bijna alle plastics voorzien van een cijfercode, zodat ze gemakkelijker kunnen worden gerecycleerd.
SYMBOOL OMSCHRIJVING
Bekend als de petfles. Dun, doorzichtig plastic waarmee water- en frisdrankflessen worden gemaakt. Vooral gerecycleerd tot kleding.
Of PE-HD. Dikkere, hardere, ondoorzichtigere plasticsoort. Wordt gebruikt in bijvoorbeeld plastic melkpakken, sapflessen, zakken, emmers, plastic buizen, kunsthout, shampooflessen, wasmiddel en speelgoed.
Vinyl of pvc. Pvc ruikt vies. Je vindt pvc in rioleringspijpen, kunststof kozijnen, buizen, douchegordijnen, vershoudfolie, wegwerptafelkleden, zwembadjes, matrasbeschermers, slabbetjes, flessen van schoonmaakmiddelen en lijm. Vegan leer is pvc-leer. Beter vermijden. Apart recycleerbaar.
Of PE-LD. Gebruikt voor zachte plastic producten, zoals plastic boodschappentasjes, plastic hoezen en knijpflessen.
Ofwel polypropeen. Harder, flexibel plastic, zoals in boterkuipjes, rietjes, bakjes voor ijs, opbergbakjes, magnetronbakjes, scharnierende lunchboxen, bumpers en het interieur van auto’s.
PS of polystyreen is harder dan PP. Wordt gebruikt in bijvoorbeeld wegwerpscheermesjes, -bekertjes en -bestek, frietbakjes, vleesbakjes, plantentrays, speelgoed, bloempotten, video/cd-cassettes, asbakken, koffers en servies. Of foamachtig plastic: hamburgerverpakkingen, piepschuim. Beter vermijden.


Of O. Dit is de restgroep. Wel een onduidelijke! Zowel PLA (bioplastics) als nylon, teflon, acryl en plexiglas vallen hieronder. Code 7 wordt verbrand. Dan komen er schadelijke stoffen vrij. Het gebruik van code 7 kun je beter vermijden, behalve als je zeker weet dat het plastic biologisch afbreekbaar is.





Tabel 6 Elke kunststof krijgt een cijfercode. Of een kunststof kan worden hergebruikt of gerecycleerd, hangt af van de kunststofsoort. Naar: www.deduurzamekaart.nl
De inhoud van een pmd-zak moet natuurlijk worden gesorteerd. Vaak gooien we ál het plastic in de pmd-zak, omdat we het verschil tussen de soorten plastics niet kennen. Maar op basis van hun vervormbaarheid moeten:
• de thermoharders worden verbrand. De sterke crosslinks zorgen er namelijk voor dat ze niet kunnen worden gerecycleerd;
• de thermoplasten worden gemalen, vervolgens gesmolten en ten slotte omgevormd tot nieuw granulaat, als grondstof voor nieuwe producten;
• de elastomeren en fibers vaak niet afzonderlijk worden verzameld om te worden gerecycleerd. Je doet ze dus gewoon bij het restafval. Autobanden zijn een uitzondering. Die kun je naar het containerpark brengen.
het gesorteerde plastic wordt tot grote balen geperst vermalen
Tip 1: haal alle resten uit de verpakking.Tip 2: prop verpakkingen niet in elkaar.

Veel mensen gooien met de verpakking een restje van de inhoud (eten, shampoo, verf ...) weg. Daardoor moet recycleerbaar plastic toch worden verbrand. Zorg er dus voor dat je de flessen of andere verpakkingen goed leegschraapt.

Ook worden verschillende plastic verpakkingen in elkaar gepropt. Dat scheelt ruimte, zou je denken, maar zo kan een sorteermachine de plastics niet goed scheiden.
Meer info over hoe je pmd wordt gesorteerd of over wat er met je pmd gebeurt in het sorteercentrum? Bekijk de video’s.
Van pet tot fleece
De petflessen worden verzameld en gewassen.
Petflessen worden heel vaak gerecycleerd tot fleece.
Dat is niet zo milieuvriendelijk als het op het eerste gezicht lijkt.


De vezels worden als ‘draad’ gebruikt om textiel mee te weven.
Die vezels worden op spoelen gewonden.
Vervolgens worden ze versnipperd en gesmolten.




In een volgende stap worden de plastic korrels (chips) opgewarmd en gaan ze door een extrusiemachine: een matrijs waar de korrels worden doorgeperst, waardoor het lange, smalle draden (vezels) worden.
De gesmolten resten worden vervolgens als plastic korrels (granulaat) bewaard.
Fleece maken van petflessen lijkt dus de perfecte manier om te recycleren. Maar als je fleece draagt en wast, komen er miljoenen plasticvezels vrij die in het milieu en in de lucht terechtkomen. Zo is meer dan 1/3 van de microplastics in de oceaan afkomstig van synthetische kleding. Het is dus eigenlijk veel beter om petflessen te hergebruiken dan om ze te recycleren tot nieuwe producten. De laatste jaren gaan er meer en meer stemmen op om de productie van fleece aan banden te leggen.
Als kunststoffen al afbreken, dan duurt dat enorm lang en laten ze meestal schadelijke bijproducten achter. Het gevolg is heel wat vervuiling. Vandaar dat er de laatste jaren meer en meer kunststoffen zijn ontwikkeld die wél biologisch afbreekbaar zijn. Het gebruik van die bioplastics evolueert voortdurend, en er worden continu nieuwe ontwikkelingen en toepassingen ontdekt. Die ontwikkelingen dragen bij aan duurzamere alternatieven voor traditionele plastics.
VOORBEELD MENSTRUATIEPRODUCTEN
Stel je voor: een vrouw gebruikt 17 000 maandverbanden in haar leven. Kun je je dat in een grote stapel afval voorstellen? Als je het restafval weegt, zorgt maandverband in een vrouwenleven voor 90 kg restafval en zorgen tampons voor 60 kg. Gangbare maandverbanden en inlegkruisjes bevatten voor 90 % plastic uit aardolie en zijn daarom niet biologisch afbreekbaar. Als je menstruatieproducten gebruikt die plasticvrij zijn en die gemaakt zijn van natuurlijke, biologisch afbreekbare materialen, zoals biologisch katoen en plantaardige cellulose, dan kun je je maandverbanden en tampons composteren.
Biologisch katoen is beter voor het milieu, gelet op bestrijdingsmiddelen- en watergebruik, maar het is slechter qua landgebruik. Een en ander is ook nog afhankelijk van de regio waar het katoen werd geteeld.
Er bestaan ook herbruikbare producten, zoals menstruatiecups en wasbaar maandverband. Of wegwerpen slechter is voor het milieu dan hergebruiken, is nog niet voldoende onderzocht.
VOORBEELD BIOLOGISCH AFBREEKBARE VERPAKKINGEN

Biologisch afbreekbare verpakkingen kunnen worden gebruikt om voedselproducten te verpakken, zoals verse producten, snacks, granen of koffie. Die verpakkingen kunnen helpen om de versheid en kwaliteit van het voedsel te behouden, terwijl ze tegelijkertijd een duurzaam alternatief bieden voor traditionele plastic verpakkingen.

Biologisch afbreekbare verpakkingen gebruiken in de voedingsmiddelenindustrie kan de milieu-impact van verpakkingsafval verminderen en een meer circulaire economie bevorderen (zie paragraaf 5.2). Consumenten kunnen zo ook duurzamere keuzes maken als ze voedsel kopen en consumeren.
De ecologische voetafdruk van biobased polyetheen is niet kleiner dan die van gewoon plastic. Om 1 kg polyetheen te maken uit aardolie, is er een uitstoot van 2 kg CO2-equivalenten. Om dezelfde hoeveelheid bioplastics te maken, is er een uitstoot van 3 kg CO2-equivalenten. Dat komt omdat het land dat je bewerkt om bijvoorbeeld de maïs te kweken waaruit je de polyetheen maakt, en het water dat je gebruikt, je voetafdruk vergroten.

VERDIEPING
Kunststoffen in de medische wereld
De oneindige mogelijkheden van kunststoffen maken medische ontwikkelingen mogelijk die 50 jaar geleden ondenkbaar zouden zijn geweest. Kunststoffen spelen dan ook een belangrijke rol bij de verlenging van het leven, de verbetering van de gezondheid en de vermindering van menselijk lijden. De afgelopen 50 jaar zijn er honderden verschillende kunststofsoorten bedacht met eigenschappen die precies passen bij een bepaalde medische toepassing. Men verwacht zelfs dat er uiteindelijk complete kunststoforganen zullen komen die in het lichaam kunnen worden geïmplanteerd.
1
Verbandmateriaal dat exact zoveel lucht kan doorlaten als nodig is voor een snel herstel van een wond. Die doorlaatbaarheid is precies in te stellen door een bepaald mengsel te maken van verschillende kunststofvezels

3
Zacht kunststofschuim (polyurethaan of pur) is niet alleen licht en zacht, maar ook bestand tegen ontsmettingsmiddelen en medicamenten. Het materiaal wordt daarom veel gebruikt in de matrassen van ziekenhuisbedden. Er zijn ook speciale kunststof beddenhoezen die geen uitwerpselen van de huismijt doorlaten.

2
Protheses, variërend van kunstgebitten tot delen van organen. Sommige zijn van levensbelang, zoals hartkleppen. Andere maken het leven veel comfortabeler. Handprotheses bijvoorbeeld werden vroeger gemaakt van metaal, bekleed met een fluwelen handschoen. Tegenwoordig zijn ze van polyurethaan (pur), met een natuurgetrouwe huid van pvc.

4
Plastic buizen en slangen voor infusen, zakken voor infuusvloeistof, katheters, injectiespuiten, dialyseapparatuur, hechtgaren, contactlenzen en onderdelen voor een dotterbehandeling zijn gemaakt van pvc. Pvc heeft eigenschappen die daar ideaal voor zijn. Het is doorzichtig en flexibel, gaat lang mee, kan tegen temperatuurveranderingen en is makkelijk te maken.
De term bioplastics wordt gebruikt voor 2 totaal verschillende soorten plastics:
• plastics die gemaakt zijn van biologisch materiaal;
• plastics die biologisch afbreekbaar zijn.
gemaakt van biologisch materiaal niet biologisch afbreekbaar en biobased
bioplastics
bv. biobased PE, pet
niet
biologisch afbreekbaar
traditionele plastics
bv. PE, PP, pet
Abiologisch afbreekbaar en biobased
bioplastics
bv. zetmeelkorrels bioplastics
bv. PLA (polylactic acid of polymelkzuur)
biologisch afbreekbaar
biologisch afbreekbaar en niet biobased
niet biologisch afbreekbaar en niet biobased
gemaakt van fossiele brandstoffen
Biobased plastics zijn gemaakt uit een biologische grondstof, bijvoorbeeld planten of bacteriën. Maar de chemische structuur van dat plastic uit biologisch materiaal is dezelfde als die van plastic uit derivaten. Zo bestaan er bijvoorbeeld biopetflessen gemaakt uit maïs of aardappelen. Omdat biobased petflessen dezelfde chemische structuur hebben als petflessen uit aardolie, zijn ze biologisch niet afbreekbaar.
Een mooi voorbeeld van een biobased plastic is polymelkzuur of PLA (uit het Engels: polylactic acid). Het wordt niet alleen geproduceerd uit een plantaardige grondstof, maar het is ook perfect biologisch afbreekbaar. Het is daarom een perfecte vervanger voor kunststoffen zoals PE, PS of PP.
De meeste plastics zijn niet biologisch afbreekbaar. ‘Biologisch afbreekbaar’ verwijst naar de eigenschap van een materiaal om door natuurlijke processen te worden afgebroken. Dat kan onder andere door uv-licht, warmte en micro-organismen. Bij dat proces ontstaan er koolstofdioxide (CO2) en water, die vervolgens door fotosynthese in planten kunnen worden omgezet. De term ‘biologisch afbreekbaar’ betekent algemeen dat het materiaal na verloop van tijd kan worden afgebroken tot kleinere componenten die in de
video: kunststofverontreiniging
biodegradeerbaar
natuurlijke omgeving kunnen worden opgenomen zonder schadelijke gevolgen voor het milieu. Dat is bij kunststoffen dus niet het geval.
Het is belangrijk om kunststoffen niet in de natuur weg te gooien. De tijd die nodig is om ze af te breken, is vaak enorm lang.




Waswormen
Een imker heeft per toeval ontdekt dat waswormen (larven van wasmotten) PE kunnen afbreken.
Aangezien plastic vaak heel moeilijk afbreekbaar is, zou dat een oplossing kunnen zijn voor de verwerking van plastic afval. Verder onderzoek is nog nodig vooraleer het commercieel inzetbaar is.
Naar: www.vrt.be/vrtnws, 05/10/2022

Biodegradeerbaar is niet hetzelfde als composteerbaar Composteerbare materialen zijn materialen die in een industriële composteerinstallatie worden afgebroken. Om door het bos de bomen te kunnen zien, worden veel stoffen voorzien van een specifiek label om aan te geven of ze biogebaseerd, biodegradeerbaar of composteerbaar zijn.



Zakjes voor gft-afval zijn biobased, biodegradeerbaar én composteerbaar. Ze worden heel gemakkelijk afgebroken. In de zomer soms zelfs iets te snel: de zakjes beginnen dan te lekken of op te lossen nog voordat ze worden opgehaald.

Een circulaire economie is een economisch systeem waarin grondstoffen, producten en materialen zo efficiënt mogelijk worden gebruikt en hergebruikt, met als doel om afval te minimaliseren, waarde te behouden en de impact op het milieu te verminderen. In een circulaire economie worden producten ontworpen met het oog op hergebruik, reparatie, recycling en regeneratie. Het gaat om materiaalkringlopen sluiten en de levensduur van producten maximaliseren.

Die visie staat haaks op de ‘oude’ principes van take-make-waste. In tegenstelling tot de circulaire economie is take-make-waste een lineaire economie: producten worden niet ten volle gebruikt en worden na gebruik weggegooid. Veel industriële bedrijven brengen nu al het hele traject van hun producten in kaart: het concept, de ontwikkeling, het gebruik, maar ook de recyclage. Ze doen aan Product Lifecycle Management.
VOORBEELD TWEEDEHANDSKLEDING
Door deel te nemen aan kledingruil- of deelinitiatieven, kun je kledingstukken delen met anderen en zelf nieuwe kledingstukken krijgen, zonder dat er nieuwe productie nodig is. Zo kun je je kledingkast updaten en nieuwe stijlen uitproberen zonder extra consumptie of afval.


Daarnaast kun je ook gebruikmaken van onlineplatformen of sociale media om kleding en accessoires te kopen en te verkopen, zodat die items een tweede leven krijgen. Door te kiezen voor tweedehandskleding, zorg je er mee voor dat de vraag naar nieuwe kleding vermindert en de levensduur van bestaande kledingstukken wordt verlengd.
Kleding delen en ruilen stimuleert duurzaam gedrag, bevordert het bewustzijn van de waarde van kleding en helpt om de milieu-impact van de mode-industrie te verminderen. Het is een praktische en leuke manier om deel te nemen aan de circulaire economie en bewustere consumptiekeuzes te maken.
Cradle to Cradle (C2C) is een specifiek ontwerpconcept dat valt binnen het bredere kader van de circulaire economie. Binnen het C2C-concept worden producten zo ontworpen dat ze volledig veilig en gezond zijn voor mens en milieu. C2C streeft ernaar om materialen en producten te creëren die kunnen worden gescheiden in biologische voedingsstoffen (biologisch afbreekbaar) die veilig kunnen worden teruggegeven aan de natuur, en technische voedingsstoffen die kunnen worden gerecycleerd en opnieuw worden gebruikt in nieuwe producten zonder kwaliteitsverlies.
Steeds meer merken en ontwerpers creëren kledingstukken die voldoen aan de principes van C2C, waarbij ze de impact op het milieu minimaliseren en materialen hergebruiken.
Een voorbeeld daarvan is het gebruik van biologisch afbreekbare of composteerbare stoffen in kleding, zoals kleding gemaakt van biologisch katoen, hennep of bamboe. Die materialen kunnen na gebruik worden afgebroken en hebben minder negatieve gevolgen voor het milieu dan traditionele synthetische stoffen.
Daarnaast zijn er merken die werken aan het sluiten van de materiaalkringloop door gebruikte kleding te recycleren. Ze verzamelen oude kledingstukken en recycleren ze tot nieuwe vezels, die worden gebruikt om nieuwe kleding te maken. Zo verminderen ze afval en verlengen ze de levensduur van materialen.



S Afb 182 In 2013 stortte in Bangladesh een fabrieksgebouw in, Rana Plaza genoemd. Bij de instorting kwamen 1 134 mensen om het leven en raakten ongeveer 2 500 mensen gewond. Het gebouw was niet gebouwd om een fabriek te huisvesten, en was dus niet bestand tegen de trillingen van zware machines. Na de ramp trokken arbeiders massaal de straat op om te protesteren tegen de onveilige werkomstandigheden in de textielfabrieken.
Een ander aspect van duurzame mode is eerlijke arbeidsomstandigheden en sociale verantwoordelijkheid bevorderen. Merken die zich bezighouden met C2C, zorgen ervoor dat hun kleding op ethische wijze wordt geproduceerd, waarbij arbeiders een eerlijk loon krijgen en in veilige omstandigheden werken.
Door bewust te kiezen voor kledingstukken die zijn gemaakt volgens de principes van C2C, kunnen tieners bijdragen aan een duurzamere mode-industrie en hun steentje bijdragen aan het verminderen van de negatieve impact op het milieu en de samenleving.
We kunnen niet zonder kunststoffen, maar ze zijn vervuilend. Bovendien dreigt er een tekort aan grondstoffen om ze te produceren, en vergt de productie veel energie. Mogelijke oplossingen:
• recycleren, dus ook heel goed sorteren;
• traditionele kunststoffen vervangen door biobased plastics en/of biodegradeerbare kunststoffen;
• vooral inzetten op circulaire economie en Cradle to Cradle
Wanneer een bedrijf zich groener voordoet dan het daadwerkelijk is, spreek je van greenwashing. Bedrijven zetten hun groene initiatieven extra in de verf, om zo klanten te misleiden. Ze kunnen daarvoor een boete krijgen, maar dat houdt veel bedrijven niet tegen. Voor de consument is het moeilijk om door de bomen het bos nog te zien, aangezien er de laatste jaren heel veel duurzaamheidslabels zijn bijgekomen. Een aantal tips om niet in de val van greenwashing te trappen:

Wees kritisch voor bedrijven die aangeven dat ze 100 % natuurlijk of milieuvriendelijk zijn, zonder uit te leggen op welke manier ze dat doen of bereiken.

Bepaalde labels zijn verouderd en brengen dus helemaal niets bij aan een beter leefmilieu. Zo zijn cfk’s (chloorfluorkoolwaterstoffen, Engels: CFC) drijfgassen die al meer dan 20 jaar verboden zijn.


Zoek naar een label van een erkende, onafhankelijke partij die gespecialiseerd is in groene certificaten.
Bestudeer ook heel goed de verpakking. Het product zelf kan misschien wel duurzaam zijn, maar de verpakking totaal niet.
Laat je zeker ook niet misleiden door de groene kleur van een verpakking. Het is niet omdat er groen in het logo wordt gebruikt, dat het om een milieuvriendelijk product gaat.

Pas ook extra op wanneer er wordt gegoocheld met getallen. Wanneer er sprake is van meer dan 50 % minder waterverbruik, moet je je afvragen waarmee ze dat vergelijken.
Zijn de gegeven reacties polymerisatiereacties, polycondensatiereacties of polyadditiereacties?
R ( O—CH2—CH2 )n OH + H2C CH2 R ( O—CH2—CH2 ) OH n + 1
Teflon is een kunststof die wordt gebruikt voor tape, verbindingsstukken en Tefal-pannen (= teflon + aluminium).
‘Teflon’ is de gebruiksnaam van polytetrafluoretheen.
a Noteer het monomeer waaruit teflon wordt gemaakt.
b Via welk reactiemechanisme wordt teflon gemaakt?
c Noteer een stukje polymeerketen dat is opgebouwd uit 3 monomeren.
De onderstaande afbeelding toont de chemische structuur van polymethylmetacrylaat (PMMA). PMMA is beter gekend onder de benaming ‘plexiglas’ of ‘kunstglas’.
a De synthese van polymethylmetacrylaat gebeurt door radicalaire polymerisatie.
Noteer de structuurformule van het monomeer dat als grondstof dient voor de synthese van PMMA.
Polymethylmetacrylaat laat ongeveer 90 % van het licht door en wordt daarom vaak gebruikt ter vervanging van glas. Het nadeel is dat PMMA minder hard is dan glas en daardoor gevoeliger is voor beschadiging (krassen). Beantwoord de volgende vragen op basis van die informatie.
b PMMA is:
1 een thermoplast;
2 een thermoharder;
3 een elastomeer.
c PMMA bestaat uit:
1 vertakte polymeren die wanordelijk door elkaar liggen en verstrengeld zijn tot kluwens (gekookte spaghetti);
2 een ruimtelijk netwerk met nauwe mazen;
3 een ruimtelijk netwerk met ruime mazen.
Horen de afbeeldingen bij een thermoharder, een thermoplast of een elastomeer?
Deze afbeelding toont het productieproces van een plastic fles.
PRODUCTIELOCATIE 1PRODUCTIELOCATIE 2
sluiten matrijs strekkenblazen loslaten opwarming preform productie transport
a Is die fles een thermoharder of een thermoplast?
b Verklaar je antwoord.
PGA of polyglycolzuur wordt vaak gebruikt als oplosbare hechtdraad bij operaties. Glycolzuur, dat gebruikt wordt om PGA te maken, is afkomstig van suikerriet.
a Via welk reactietype wordt PGA gemaakt?
Verklaar je antwoord aan de hand van de structuur van glycolzuur en PGA.
b Verwacht je dat PGA een thermoharder of een thermoplast is?
Verklaar je antwoord aan de hand van de structuur van PGA.
c Is PGA biobased en/of biodegradeerbaar?
Verklaar je antwoord.
Melamineformaldehyde (MF) wordt vaak gebruikt om borden en bestek van te maken, omdat het krasbestendig is.
a Volgens welk reactietype wordt MF gemaakt?
b Verklaar de beschreven eigenschap van MF op basis van de structuur van MF.
Behoort nylon-6,10 tot het (AB)n- of het (AABB)n-type?
Verklaar je antwoord.
Om te beslissen of een product duurzaam is, verwijst men vaak naar de 3 P’s: People, Planet en Profit. Het product moet goed zijn voor mensen (zowel consumenten als werknemers en producenten), er moet worden nagedacht over de impact op het milieu en er moet ook winst worden gemaakt.
a Leg aan de hand van minstens 1 van de 3 P’s uit waarom het huidige plasticgebruik niet duurzaam is.
b Leg aan de hand van minstens 1 van de 3 P’s uit waarom bioplastics een verbetering zouden kunnen zijn.
Beantwoordt de tekst uit dit artikel aan ‘Cradle to Cradle’ of niet? Leg uit.
Hernieuwbaar textiel op de plank
Hoe maak je een industrie die van oudsher al werkt met biopolymeren, nog groener? Dat blijkt geen simpele klus. Vooral de celluloseproductie biedt perspectief. ‘Voor de industrie liggen op dit moment twee biopolymeren het meest voor de hand als hernieuwbare vervangers van bijvoorbeeld polyester in textiel. Dat zijn het biodegradeerbare polymelkzuur, PLA, en het stabiele polyetheenfuranoaat, PEF. De textielbranche is niet overtuigd van de eigenschappen van PLA voor een veelzijdige toepassing en vindt PEF voorlopig veel te duur’, vat Gunnar Seide het huidige gebruik van biopolymeren in de textielindustrie samen.
In Enschede ontwikkelen onderzoekers van de groep smart functional materials van Hogeschool Saxion vezels en garen voor de textielindustrie op basis van cellulose uit katoenrestafval. Het Enschedese proces gaat verder dan katoenafval mechanisch recycleren, wat al veel langer gebeurt. ‘Wij hergebruiken het katoen niet, wij halen de cellulose eruit en maken daar nieuwe vezels van.’
Naar: Mens & molecule, april 2017
Ga voor een kledingketen naar keuze na of ze aan greenwashing doen. Controleer voor die keten de 6 tips op p. 251.
Jeansfabrikanten die een circulaire economie nastreven, zullen eerder opteren voor knopen als broeksluiting dan voor een rits. Leg uit waarom.
` Meer oefenen? Ga naar .
1 Vorming van kunststoffen
• polymerisatiereactie += =+ =+ ... =
• polycondensatiereactie +
• polyadditiereactie
2 Indeling volgens eigenschappen van kunststoffen
• gedrag bij verwarmen
THERMOHARDER
• Verbrandt bij verwarmen.
• Is heel hard.
THERMOPLAST
• Wordt week bij verwarmen, kan worden vervormd en neemt na afkoelen nieuwe vorm aan.
• Lost op in organische oplosmiddelen.
• elasticiteit
ELASTOMEER
• Kan worden vervormd, maar neemt oorspronkelijke vorm weer aan als je de belasting verwijdert.
3 Recyclage en verwerking van kunststoffen
• vervuilend
PROBLEMEN
OPLOSSINGEN
FIBERS
• Rekken amper uit. Ze zijn dus niet elastisch.
• beperkte hoeveelheid grondstoffen
• veel energie nodig in productieproces
• verbranding kunststoffen levert weinig energie op
• recyclage
• bioplastics
• biologisch afbreekbare plastics
• circulaire economie
• Cradle to Cradle
Al meer dan 4 000 jaar gebruiken mensen (natuurlijke) nanomaterialen (heel kleine deeltjes met een grootte van 1 tot 100 nm) in onder andere de kunst en de geneeskunde. Bepaalde kleimineralen bevatten natuurlijke nanomaterialen, maar onderzoekers hebben vastgesteld dat synthetisch gemaakt loodsulfide, dat als haarverf gebruikt werd in het oude Egypte, ook nanokristallen bevat. De mensen waren op de hoogte van de specifieke eigenschappen, maar konden die nog niet verklaren.
` Wat zijn nanomaterialen?
` Waarvoor worden nanomaterialen gebruikt?
` Welke risico’s zijn er verbonden aan het gebruik van nanomaterialen?
We zoeken het uit!
JE KUNT AL ...
• uitleggen dat materie is opgebouwd uit heel kleine deeltjes: moleculen, die zelf zijn opgebouwd uit atomen.
• eigenschappen van thermoharders, thermoplasten en elastomeren verklaren.

• toepassingen in verband brengen met concrete kunststoffen.
JE LEERT NU ...
Als een nanodeeltje zo groot was als een voetbal … … dan zou een virus zo groot zijn als een mens.
elektronengolf
groter nanodeeltje, meer ruimte voor de elektronengolf
kleiner nanodeeltje, minder ruimte voor de elektronengolf

• op welke schaal je nanomaterialen moet situeren.
• eigenschappen van nanomaterialen verklaren.
• toepassingen in verband brengen met nanomaterialen.
Nanomaterialen worden ook weleens de ‘bouwstenen van de toekomst’ genoemd. Ze bieden ons de mogelijkheid om de wereld om ons heen op een revolutionaire manier te veranderen. In dit thema duik je in de nanowereld en ontdek je hoe kleine deeltjes een grote impact kunnen hebben.
L De grootteorde van nanodeeltjes inschatten
L De indeling van nanomaterialen in 0D, 1D, 2D en 3D toepassen en toelichten in voorbeelden
L Voorbeelden van toepassingen van nanodeeltjes geven
L De vorming van nanomaterialen via bottom-up of top-down uitleggen
Het prefix ‘nano-’ verwijst naar 10-9. Een nanometer is dus 10-9 meter. Nanomaterialen hebben minstens 1 dimensie in de grootteorde tussen 1 en 100 nm.
diameter nanodeeltje = 1 nm = 10-9 m
~ · 100 000 000 ~ · 100 000 000

diameter honkbal = 12 cm = 12 · 10-2 m = 1,2 · 10-1 m

diameter aarde = 12 756 km = 13 · 106 m = 1,3 · 107 m
Aangezien nanodeeltjes zo klein zijn, is de verhouding tussen het contactoppervlak en het volume heel groot. Voor bijvoorbeeld katalysatoren is dat een enorm voordeel: je hebt immers een veel kleinere hoeveelheid nanokatalysatoren nodig in vergelijking met gewone katalysatoren om hetzelfde reactieve oppervlak te hebben.
contactoppervlak = 6 m2
contactoppervlak = 12 m2
contactoppervlak = 24 m2
Er is geen strikte scheiding vanaf wanneer je werkelijk van een nanomateriaal spreekt. Typisch voor een nanomateriaal is dat het andere eigenschappen heeft dan een ‘gewone’ stof, maar vanaf welke afmetingen dat gebeurt, hangt af van stof tot stof. Zo kunnen er verschillen optreden in katalytische eigenschappen, maar ook verschillen in magnetische eigenschappen of elektrische geleidbaarheid zijn mogelijk.
0,1 nm watermolecule

nm goudnanodeeltje



koolstofnanobuis 5 nm diameter buckyball 1 nm benzeen 0,5 nm nanomaterialen

Afb. 185 Een aantal stoffen met hun afmetingen
punt
muntstuk

tennisbal
Je kunt nanomaterialen nog verder indelen in 0D-, 1D-, 2D- en 3D-materialen. De nanomaterialen van de nuldimensie zijn de nanopartikels. 0D-materialen hebben geen enkele dimensie die ‘afwijkt’ van het nanoniveau. Met andere woorden: ze hebben nanoafmetingen in de x-, y- en z-richting. Eendimensionale nanomaterialen hebben 1 dimensie die ‘afwijkt’ van de nanoschaal. Bij 2D-nanomaterialen zijn er 2 dimensies die groter zijn dan de nanoschaal, en bij 3D-nanomaterialen zijn alle 3 de dimensies afwijkend. 3D-nanomaterialen kunnen bijvoorbeeld opgebouwd zijn uit nanokristallen of nanobuizen en vertonen vaak inwendig kenmerken van nanomaterialen.
goudnanodeeltje kwantumstip of kwantumdot
fullereenmetalen nanostaaf koolstof nanobuizen, metalen nanobuizen polymeer nanovezels, gouden nanodraad
grafeenbladen koolstof gecoate nanoplaten polykristalvormen dendrimeer liposomen
Afb. 186 Afhankelijk van hun afmetingen worden nanomaterialen ingedeeld in 4 categorieën: 0D-, 1D-, 2D- en 3D-materialen.
De afmetingen van nanomaterialen zorgen ervoor dat ze veel licht verstrooien, wat resulteert in een schitterende kleurenpracht. Bij glas-in-loodramen mengt men metaalpoeder in gesmolten glas. Daardoor wordt het metaalpoeder heel fijn verdeeld, wat de prachtige kleuren van glas-in-loodramen veroorzaakt. Tegenwoordig gebruikt men die eigenschap in allerhande medische testen. Zo bevat de COVID-test goudnanodeeltjes (zie paragraaf 3.1). Maar ook de Nobelprijs van 2023 werd uitgereikt voor onderzoek naar de optische eigenschappen van nanomaterialen.

De productie van nanomaterialen kun je indelen in 2 grote groepen: de bottom-up- of top-downmanier. De bottom-upmanier is een chemische manier, waarbij atomen gecombineerd worden tot moleculen en vervolgens tot de gewenste nanostructuur. Bij de top-downmethode vertrek je van grotere structuren, die tot de gewenste afmetingen worden afgebroken. Dat is een fysisch proces.
nanoschaalstructuren clusters atomen fysisch proces chemische reactie
geheel onderdelen
TOP-DOWN BOTTOM-UP
Bij de afbraak van plastic, maar ook bij het gebruik ervan, komen er heel kleine deeltjes plastic in het milieu terecht. Een groot deel van die deeltjes bevinden zich op microschaal en zijn dus nog veel groter dan nanoplastics. Maar sommige plastics worden afgebroken tot op nanoniveau. De deeltjes die op die manier gevormd worden, zijn heel heterogeen van samenstelling, structuur, vorm en grootte. Daardoor hebben ze ook heel uiteenlopende eigenschappen, waardoor ze verschillen van kunstmatig gemaakte nanomaterialen. Met ‘nanomaterialen’ worden de kunstmatig geproduceerde nanodeeltjes bedoeld.
Losse atomen zijn geen nanomaterialen.
Zowel de microplastics als de plastics die tot op nanoniveau zijn afgebroken, vormen een heel groot probleem: ze komen in het milieu terecht en zijn heel moeilijk te verwijderen uit bijvoorbeeld water. Momenteel doet men onderzoek naar manieren om die verontreiniging uit het water te halen. Zo gebruikt men ijzernanodeeltjes (SPION’s of Super Paramagnetic Iron Nanoparticles) die speciaal behandeld zijn, zodat ze kunnen binden met het oppervlak van plasticdeeltjes. Wanneer die ijzerdeeltjes binden met plastic, vormen ze agglomeraten die men met behulp van magneten uit het water kan halen.
Goudnanopartikels (0D-nanomateriaal) die vastgehecht zijn aan antilichamen, kunnen worden gebruikt in bijvoorbeeld de COVID-test. De antilichamen binden aan de spike-eiwitmoleculen van het virus. Wanneer dat gebeurt, zal de oplossing van kleur veranderen: doordat de antilichamen aan het virus binden, ontstaat er immers een veel groter deeltje, dat anders interageert met licht dan de veel kleinere goudantilichaamdeeltjes.
spike-eiwitmoleculen
virus goudnanopartikels antilichamen
Zilvernanopartikels worden onder andere gebruikt vanwege hun antibacteriële eigenschappen De zilvernanopartikels geven zilverionen vrij, die de celwand en het celmembraan van de bacterie verstoren. Eens ze in de cel zijn, kunnen die ionen onder andere de ribosomen denatureren en de eiwitsynthese afremmen. Maar ook de zilvernanopartikels zelf kunnen de celwand en het celmembraan denatureren. Vanwege die eigenschappen gebruikt men zilvernanopartikels in onder andere sportkleding (om zweetgeur te voorkomen), wasmachines en ziekenhuisuitrusting.
% verstrooid licht
Grafiek A
% geabsorbeerd licht 380
Grafiek B
Titaandioxide en zinkoxide zijn als nanopartikels aanwezig in zonnecrème. Anorganische deeltjes kunnen op 2 manieren interageren met licht: ze kunnen het licht absorberen of verstrooien Onderzoek heeft uitgewezen dat nanopartikels het uv-licht even goed absorberen als hun grotere versie (zie grafiek A). Maar door hun kleinere afmetingen verstrooien ze het zichtbare licht veel minder goed, waardoor de zonnecrème transparant is (zie grafiek B). Daarnaast speelt het relatief grotere contactoppervlak ook een rol: zonnecrème met nanopartikels is veel efficiënter. ULTRAVIOLET
50 nm ZnO-deeltjes
200 nm ZnO-deeltjes
λ (nm)
golflengte licht
golflengte licht
Afb 192 De deeltjes van 50 nm en die van 200 nm absorberen uv-licht even goed (grafiek A). De deeltjes van 50 nm verstrooien vooral licht met een heel kleine golflengte (uv-licht), terwijl de deeltjes van 200 nm vooral zichtbaar licht verstrooien (grafiek B). De golflengte van ultraviolet licht is kleiner dan die van zichtbaar licht. Nanodeeltjes zullen anders interageren met zichtbaar licht dan met uv-licht.
zonnecrème nano-ZnOmicroformaat ZnO
huid
Afb 193 Hoe kleiner de deeltjes, hoe efficiënter ze als zonnecrème werken: er bereiken minder zonnestralen de huid.
3D-beelden: buckyball, nanobuis en grafiet
In wasmiddelen voor witte was worden vaak siliciumnanodeeltjes gebruikt als optische witmaker. Die deeltjes zijn fluorescerende stoffen: ze interageren met uv-licht en zenden blauw licht uit dat voor een wittere schijn zorgt. Maar ook de nieuwe generatie witmakers voor tanden zal uit nanodeeltjes bestaan.
VOOR nanodeeltjes als witmakers
De onderstaande 3 nanomaterialen met koolstof zijn 0D-, 1D- en 2D-nanomaterialen.
In 2010 ging de Nobelprijs voor Natuurkunde naar onderzoek over de eigenschappen van grafeen. Dat is een heel sterk en licht materiaal dat zowel elektrische stroom als warmte heel goed geleidt. Het is het basismateriaal waaruit buckyballs (0D), nanobuizen (1D) en grafiet (2D) zijn opgebouwd.
Buckyballs hebben een typische voetbalvorm: ze zijn opgebouwd uit vijfen zesringen van koolstof. Aangezien ze de elektrische stroom goed geleiden, kunnen ze worden gebruikt in zonnecellen
Op dit moment wordt daar silicium voor gebruikt, maar dat is heel duur en stijf.
Afb 195 Voorbeelden van fullerenen: buckyball (links), nanobuis (midden) en grafeen (rechts). Zowel een buckyball, een nanobuis als grafiet wordt opgebouwd uit grafeen.
Gemodificeerde buckyballs worden ook in de medische wereld gebruikt: ze remmen het hiv-virus, maar met behulp van buckyballs kunnen er bijvoorbeeld ook moleculen naar de juiste plaats in het lichaam worden gebracht.
Koolstofnanobuizen zijn opgerolde grafeenlagen. Er bestaan zowel enkelwandige als dubbelwandige versies van. Dubbelwandige koolstofnanobuizen geleiden zeer goed de elektrische stroom (zelfs beter dan koper), terwijl enkelwandige enkel bij heel lage stromen de elektriciteit geleiden. Koolstofnanobuizen zijn veel sterker dan staal en bovendien zeer licht. In tegenstelling tot bij andere koolstofvezels blijft de structuur intact als je ze buigt. Koolstofnanobuizen worden onder andere gebruikt in lithiumbatterijen, maar ook in bijvoorbeeld vliegtuigvleugels
Grafeenmembranen zijn zeer goed geschikt voor waterzuivering en ontzilting. Ze zijn heel goed doorlaatbaar en hebben een grote thermische stabiliteit, maar ze zijn ook bestand tegen hoge druk. Door het grote contactoppervlak en de porositeit kunnen grafeenmembranen worden gebruikt om allerhande verontreinigingen, zoals bacteriën, te verwijderen.
Het grote nadeel van koolstofnanomaterialen is dat ze momenteel nog altijd heel duur zijn.
Sommige onderzoekers beweren dat er bij de productie van grafeen en koolstofnanobuizen deeltjes in het lichaam kunnen terechtkomen. Aangezien ze niet door het lichaam kunnen worden afgebroken, zouden ze ontstekingsreacties kunnen veroorzaken die te vergelijken zijn met asbestose. Onderzoek daarnaar is nog volop bezig. Bij contact met de huid treden er geen irritaties op. Onderzoekers geven ook aan dat de hoeveelheden waarmee je in contact kunt komen, zeer klein zijn. Er is echter verder onderzoek nodig naar de veiligheid van die materialen.
In de voedingsindustrie zet men ook volop in op nanomaterialen. Zo doet men onderzoek naar eetbare coatings, die ervoor zorgen dat er geen kwaliteitsverlies is en voedsel langer bewaard kan worden. Die coatings zorgen er namelijk voor dat er onder andere geen vochtverlies is, maar ook dat er minder zuurstofgas bij het voedsel kan, zodat het voedsel minder snel oxideert en dus bederft. De coatings worden vaak van organische stoffen gemaakt, bijvoorbeeld van pectine of van etherische olie uit citroengras.
Men zet coatings niet alleen in om voedsel langer te bewaren. Sommige zaden worden voorzien van een nanocoating om ze minder vatbaar voor ziekten te maken. Zo garandeert men een betere opbrengst.
conventionele emulsie
bescherming tegen micro-organismen
bescherming tegen schadelijke stoffen
productie van nano-emulsies
bescherming tegen zonlicht
bescherming tegen schokken
minder verlies van CO 2
minder vochtverlies bescherming tegen O2
verhoogde bewaring verspreiden nano-emulsie
196 Eetbare nanocoatings zorgen voor een betere bewaring van onder andere fruit.
Aangezien de coatings ervoor zorgen dat we voedsel langer kunnen bewaren én dat we geen schadelijke sulfieten hoeven te gebruiken, dragen ze hun steentje bij aan een meer duurzame wereld. Toch maken veel mensen zich zorgen over het effect van nanomaterialen op het menselijk lichaam. Zijn de coatings zelf niet schadelijk? Of kunnen er misschien nanodeeltjes uit de coatings in het voedsel diffunderen? Veel onderzoekers zijn ermee bezig om antwoorden te vinden op die vragen.
Met behulp van zogenoemde nanodragers kunnen onder andere pesticiden en meststoffen langzaam en doelgericht worden afgegeven. Er is een kleinere hoeveelheid van bijvoorbeeld pesticiden nodig, wat voor minder verontreiniging van de bodem en het water zorgt en economisch gezien ook voordeliger is.
Nanopartikels worden zelf ook gebruikt als pesticide. Zo bestaan er onder andere metaalgebaseerde nanopesticiden, die door hun kleine afmetingen gemakkelijker door de celwand van ziekteverwekkers kunnen dringen. In vergelijking met de klassieke materialen zijn ze vaak efficiënter. Maar ze kunnen ook als nanosensor optreden: ze veranderen van kleur in de aanwezigheid van bepaalde chemicaliën of kunnen zelfs de omgevingsfactoren monitoren.
nanomeststoffen
nanotechnologie voor waterbehandeling
nanopesticiden
NANOMATERIALEN
nanosensoren
nanocapsules voor een efficiënt afgiftesysteem
Afb. 197 In de landbouw zet men nanomaterialen en nanotechnologie op verschillende domeinen in, om op die manier een grotere opbrengst te bekomen, maar ook om minder en efficiënter meststoffen en pesticiden toe te dienen.
The sky is the limit gaat echt wel op voor nanomaterialen en nanotechnologie. Zo experimenteert men volop met nanogeheugenmateriaal. Zou het niet geweldig zijn als je na een botsing gewoon met je auto door een warme douche kon rijden en de deuken als sneeuw voor de zon verdwenen? Momenteel zijn er al brillen op de markt die gebruikmaken van nanogeheugenmateriaal.

Afb. 198 Brillen uit nanogeheugenmateriaal zijn heel buigzaam.
Maar we moeten ook stilstaan bij de ethische kant. We weten nog altijd heel weinig over de mogelijke risico’s die nanomaterialen met zich meebrengen voor mens en milieu. Ook moeten we rekening houden met mogelijk misbruik van nanomaterialen in bijvoorbeeld wapens. Nanodeeltjes zouden explosies efficiënter kunnen laten verlopen. Nanosensoren zouden kunnen worden ingezet om heel nauwkeurig informatie te verzamelen, maar ze zouden ook wapens preciezer kunnen maken.
In welke grootteorde situeren nanomaterialen zich?
a 1-10 nm
b 1-100 nm
c 100-1 000 nm
d > 1 000 nm
Welke eigenschap is voor nanomaterialen anders dan voor klassieke materialen?
a elektrische eigenschappen
b magnetische eigenschappen
c optische eigenschappen
d al de bovenstaande eigenschappen
Koolstofnanobuizen behoren tot de …
a 0D-materialen
b 1D-materialen
c 2D-materialen
d 3D-materialen
Wat is de kleur van goudnanodeeltjes?
a geel
b oranje
c rood
d Dat hangt af van de grootte.
Zet deze afmetingen om in nm:
a de lengte van je leerboek GENIE Chemie
b de totale afstand die de 4 x 100 m-aflossingsploeg aflegt
c de diameter van een gewone donut (ongeveer 10 cm)
Wat is het grote voordeel van werken met een schaal met machten van 10 in plaats van met een klassieke ijking?
Zoek op wat dendrimeren zijn op nanoniveau en waarvoor ze gebruikt worden.
Reflecteer over de voor- en nadelen van nanomaterialen.
Voer een debat en stel kritische vragen. Neem een standpunt in over nanomaterialen en hun …
a duurzaamheid; b risico’s.
Meer oefenen? Ga naar
KERNBEGRIPPEN
nanomaterialen
productie van nanomaterialen
toepassingen van nanomaterialen
• minstens 1 dimensie in de grootteorde van 1 nm tot 100 nm
• heel specifieke eigenschappen
• 0D-, 1D-, 2D-materialen: afhankelijk van het aantal dimensies waarin het materiaal van de nanoschaal afwijkt
• bottom-up
• top-down
• medische testen
• antibacteriële eigenschappen
• uv-blockers
• koolstofhoudende nanomaterialen
• eetbare coatings
• nanotechnologie in de landbouw
• geheugenmateriaal
SYMBOOL
+III +V
-I +I +III +V +VII
+II
-I +I +III +V +VII
+II +III +VI
-III +III +V
+I +III
+II +III
-I +I +III +V +VII
+II +III
+II +IV
+I +II
+I +II
Tabel zuur-basekoppels
+IV
+III +IV +VI +VII
+III
+IV
+V +VI
+I +II +III +IV +V
+IV +IV +VI
+IV +VI
2,5 · 10-8
10-9
· 10-10
pKw = 14 K w = 10-14 H2O HEEL ZWAK ZUUROH- STERKE BASE
14,72,0 · 10-15
pKz bij 25 °C
Opgelet: K z is berekend uit pKz, waardoor er een fout is op de laatste decimaal ten opzichte van de exacte waarde.
Tabel standaardreductiepotentialen (E0-waarden) van redoxkoppels