
65 minute read
Sensibilizarea la acarienii din praful de casă – o interpretare moleculară
Sensitization to house dust mites – a molecular interpretation
Camelia Felicia Bănărescu1, Raluca Maria Giurgiu1, Laura Haidar2,3,4, Carmen Panaitescu2,3,4
Advertisement
1. Spitalul Clinic Județean de Urgență „Pius Brînzeu”, Timișoara 2. Disciplina Fiziologie, Departamentul III Științe Funcționale, Universitatea de Medicină și Farmacie „Victor Babeș”, Timișoara 3. Centrul de Imunofiziologie și Biotehnologii, Disciplinele Fiziologie și Imunologie, Departamentul III Științe Funcționale, Universitatea de Medicină și Farmacie „Victor Babeș”, Timișoara 4. Centrul de terapii genice și celulare în tratamentul cancerului OncoGen – Spitalul Clinic Județean de Urgență „Pius Brînzeu”, Timișoara Autor corespondent: Carmen Panaitescu, e-mail: cbunu@umft.ro
ABSTRACT
House dust mites are the leading cause of respiratory allergy, and atopic reactivity to their products is one of the most common causes of allergy worldwide. To date, more than 30 groups of allergens have been identified in house dust mites, of which the major allergens are considered to be in groups 1, 2 and 23. Another clinically relevant group appears to be group 10, due to its ability to induce cross-reactivity with other invertebrates. Accurate molecular diagnosis of allergy to house dust mites can highlight individual sensitization profiles, which can be used to determine the primary source of sensitization, to assess the risk of severe reactions and cross-reactions, and to optimize the results of allergen immunotherapy. Keywords: Dermatophagoides, house dust mite allergy, indoor allergens, molecular diagnosis, cross-reactivity
Introducere
Acarienii din praful de casă reprezintă principala cauză de alergie respiratorie, iar reactivitatea atopică la produsele lor este una dintre cele mai frecvente cauze de alergie la nivel mondial, afectând căile respiratorii superioare și inferioare, ochii și pielea (Sanchez-Borges et al., 2017; Fernández-Caldas & Calvo, 2005). Caracteristicile unice ale acarienilor le-au permis să colonizeze mediul interior în majoritatea locuințelor din regiunile temperate și tropicale și să aducă alergenele lor în contact strâns cu epiteliul. Acarienii din praful de casă produc alergene care nu numai că sunt imunogene, dar au adesea activitate proteolitică și sunt combinate cu ADN bacterian, endotoxine, chitină și alte materiale care induc răspunsuri imune, acest complex de alergene și adjuvanți fiind capabil de a induce atât reacții imune înnăscute, cât și adaptative (Miller, 2019).
Sensibilizarea la acarieni a fost identificată prima dată în jurul anului 1920. În 1967, Voorhorst și colab. au identificat Dermatophagoides pteronyssinus drept cauza sensibilizării la praful de casă (Voorhorst et al., 1967). Primul alergen identificat în acarieni sau în produsele lor (fecale) a fost Dermatophagoides pteronyssinus 1, sau Der p 1, din familia cistein-proteazelor în 1980, urmat de Der p 2 și Dermatophagoides farinae 1 și 2 (Der f 1 și Der f 2). Până în prezent au fost identificate și secvențiate peste 30 de alergene din Dermatophagoides pteronyssinus, tot mai multe alergene fiind în curs de identificare prin tehnici de transcriptomică și analiză proteomică (Bordas-Le Floch et al., 2017; Waldron et al., 2019). Alergenele majore sunt clasic considerate a fi Der p 1 și Der p 2, dar recent Der p 23 a fost identificat ca fiind un alt alergen major (Faneul et al., 2017).
REZUMAT
Acarienii din praful de casă reprezintă principala cauză de alergie respiratorie, iar reactivitatea atopică la produsele lor este una dintre cele mai frecvente cauze de alergie la nivel mondial. Până în prezent s-au identificat peste 30 de grupuri de alergene din acarienii din praful de casă, dintre care alergenele majore sunt considerate a fi cele din grupurile 1, 2 și 23. Un alt grup relevant din punct de vedere clinic pare a fi grupul 10, prin prisma reactivității încrucișate cu alte nevertebrate pe care o poate determina. Diagnosticul molecular de precizie al alergiei la acarienii din praful de casă poate evidenția profilurile de sensibilizare individuale, din care se poate determina sursa primară de sensibilizare, pentru a evalua riscul de reacții severe și de reacții încrucișate și pentru a optimiza rezultatele imunoterapiei alergenice. Cuvinte-cheie: Dermatophagoides, alergie la acarienii din praful de casă, aeroalergene de interior, diagnostic molecular, reactivitate încrucișată
Biologia acarienilor din praful de casă
Acarienii reprezintă un taxon de artropode din clasa arahnidelor, din care mai fac parte păianjenii și scorpionii. Praful de casă conține numeroase specii de acarieni; cu toate acestea, doar trei dintre ele suntmai frecvente la nivel mondial: Dermatophagoides pteronyssinus (Der p), Dermatophagoides farinae (Der f) și Euroglyphus maynei (Eur m). Aceste specii sunt răspândite pe tot globul, dar predominant în zonele cu climat temperat; în zonele cu climat tropical și subtropical este mai răspândit acarianul Blomia tropicalis (Blo t). Există alte patru specii de acarieni de depozit (Acarus siro, Glycyphagus domesticus, Lepidoglyphus destructor, Tyrophagus putrescentior), în praful din ferme sau din depozitele de alimente (Arlian, 2002), care sunt mai puțin implicate în reacțiile alergice, putând totuși exista reacții încrucișate între acarienii din praful de casă și cei de depozit.
Acarienii din praful de casă au un ciclu de viață de aproximativ trei luni, care include mai multe etape de dezvoltare, de la ou, larvă, protonimfă, tritonimfă la adult, care măsoară 250–350 μm în lungime (Sarwar, 2020) (figura 1).
Figura 1. Dermatophagoides pteronyssinus (obiectiv microscop Nikon achromatic 10x 160/0.25). Adaptat după Gilles San Martin (San Martin, 2011)
Pentru a-și menține metabolismul, rata de reproducere și producția de alergene, acarienii au nevoie de condiții speciale de temperatură și umiditate, precum și de lumină scăzută. Deoarece aproximativ 75% din greutatea lor este apă, necesită menținerea echilibrului hidric prin absorbția vaporilor de apă din mediu. Nivelul optim de umiditate pentru proliferare și supraviețuire este de aproximativ 75%; peste această valoare trebuie să competiționeze cu mucegaiurile; la valori ale umidității între 50% și 75% s-a observat o reducere progresivă a comportamentelor de hrănire, proliferare și eliminare de alergene, iar deshidratarea și decesul adulților apar la umiditate de sub 50% (Zuiani & Custovic, 2020); din acest motiv, reducerea umidității interioare reprezintă o strategie comună de reducere a numărului acestora (D’Amato, 2020).
Acarienii din praful de casă se hrănesc cu materiale organice, inclusiv scuame cutanate, ciuperci, drojdii și bacterii. Nu doar acarienii provoacă reacții alergice, ci și fecalele și alte particule provenite de la aceștia. Particulele fecale măsoară aproximativ 20-25 μm în diametru și sunt înconjurate de o membrană peritrofică ce conține enzime digestive proteolitice, fiind extrem de relevante clinic, deoarece pot pătrunde adânc în arborele bronșic (Waldron et al., 2019).
Expunerea la acarieni
Distribuția acarienilor din praful de casă variază între diferite zone și în funcție de sezon. Aceștia se găsesc în cea mai mare concentrație în locuințele particulare, observându-se o asociere între expunerea crescută la acarieni și nivelurile socioeconomice superioare, studiile superioare și numărul mai scăzut de persoane care împart o cameră (Leaderer et al., 2002). Concentrațiile de alergene provenite din acarieni sunt mai mari în locuințele fără aer condiționat (van Strien et al., 2004) și mai scăzute în locuințele urbane de tip apartament (unde predomină cele specifice gândacilor) (Chew, 2009). În locurile publice, precum școli, cafenele, trenuri, autobuze, cu excepția sălilor de cinema, acarienii se găsesc în concentrație mai scăzută comparativ cu locuințele particulare. Căminele universitare au mai puțini acarieni decât locuințele particulare, dar aceștia se găsesc și aici în număr semnificativ, mai ales dacă încăperile sunt mochetate. Majoritatea spațiilor de muncă au mult mai puțini acarieni decât locuințele, cu excepția locațiilor în care se efectuează reciclarea textilelor și curățarea covoarelor și a tapițeriei (Stemeseder et al., 2017).
În funcție de umiditatea sezonieră, acarienii se găsesc în număr mai mare în Europa și nordul SUA în lunile cu umiditate crescută și în cel mai mic număr în lunile secetoase de iarnă. Această variație sezonieră poate să fie minimizată prin utilizarea aparatelor de aer condiționat și a dezumidificatoarelor, pentru a menține umiditatea relativă sub 50% (Acevedo et al., 2019).
În ceea ce privește acumularea la nivelul anumitor suprafețe, acarienii și alergenele acestora se găsesc în obiecte care îndeplinesc cerința acarienilor pentru umiditate ridicată și lumină slabă. În interiorul caselor, aceștia se găsesc în număr mai mare în obiectele tapițate cel mai des utilizate (canapele, fotolii), precum și în zonele mochetate ale sufrageriei și dormitorului. De asemenea, ei se acumulează în saltele, în special cele cu arcuri; saltelele noi acumulează cantități semnificative de acarieni și alergene în aproximativ patru luni, numărul acestora crescând odată cu vechimea saltelei, acesta fiind probabil rezultatul multor generații de acarieni care au furnizat
deșeuri alergenice acumulate (de Oliveira et al., 2003). Pernele au fost considerate mult timp un loc important de proliferare a acarienilor și de expunere la alergene, mai ales având în vedere contactul apropiat cu căile respiratorii în timpul somnului, dar sfatul tradițional de evitare a pernelor cu pene pare să nu fie corect, deoarece s-au recuperat cantități mult mai ridicate de alergene din pernele sintetice decât din cele cu pene (Hallam et al., 1999); acest paradox poate fi explicat prin țesătura mult mai deasă care se utilizează la fabricarea pernelor cu pene și care pare să acționeze ca o barieră la intrarea acarienilor și la ieșirea alergenelor (Siebers et al., 2004).
Din punctul de vedere al individului atopic, ceea ce contează nu este acarianul dintr-un anumit substrat, ci mai degrabă acarianul care intră în contact direct cu epiteliul oftalmic, al căilor respiratorii superioare și inferioare, cu epiteliul tegumentar și intestinal. Mai mult de 80% dintre acarieni se află în particule cu diametrul de peste 10 μm și sunt nedetectabili în aerul încăperilor necirculate, ajungând în aer doar după perturbarea substraturilor moi în care a fost produs alergenul. Deși concentrațiile ridicate de acarieni din pat au condus la presupunerea că cea mai mare expunere are loc în timpul somnului, datele recente sugerează că doar 10% din expunerea aeriană are loc în pat, cea mai frecventă expunere fiind în timpul activităților zilnice (Tovey et al., 2013).
Au fost descrise numeroase alergene din acarienii din praful de casă, care au fost clasificate în grupuri specifice pe baza compoziției biochimice, a secvențelor omoloage și a greutății moleculare. Denumirea alergenului se face folosind primele trei litere ale genului, urmate de prima literă a speciei și numărul grupului. Astfel, alergenele pentru cele trei specii principale sunt Der p 1 până la Der p 38, Der f 1 până la Der f 39 și Blo t 1 până la Blo t 21 (Posa et al., 2017), cele mai importante fiind enumerate în tabelul 1. Cele mai multe studii au fost realizate pe Dermatophagoides pteronyssinus, astfel că cele mai multe informații disponibile se referă la această specie; alergenele care fac parte din același grup, dar provin din alte specii de acarieni, prezintă caracteristici similare în ceea ce privește structura chimică și alergenicitatea.
Alergenele din grupul 1 (Der p 1 și Der f 1) și grupul 2 (Der p 2 și Der f 2) sunt alergene majore, pe baza frecvenței de sensibilizare a pacientului și a cantității de imunoglobuline E (IgE) specifice, iar recent s-a observat că și Der p 23 reprezintă un alergen major. Grupurile 4, 5, 7 și 21 de alergene sunt considerate alergene de nivel intermediar, iar grupurile 3, 6, 8, 9, 10, 11, 13, 15, 16, 17, 18 și 20 sunt considerate alergene minore, datorită capacității reduse de legare a IgE. Din grupul 10, Der p 10 are o semnificație
Tabelul 1 Alergenele majore și minore din D. pteronyssinus și D. farinae. Prezentare educațională cu modificare după Thomas, 2015; Miller, 2019; Matricardi et al., 2016
Grup Moleculă alergenică Funcție biologică
1
2 Der p 1 Der f 1 Der p 2 Der f 2 Cistein-protează
Ligand lipidic
3 Der p 3 Serin-protează (tripsină)
Der f 3 4 Der p 4 Amilază 5 Der p 5 Ligand lipidic 6 Der p 6 Serin-protează (chimotripsină)
7 Der p 7 Der f 7 Ligand lipidic
8 Der p 8 Glutation transferază
Der f 8 9 Der p 9 Serin-protează (colagenază)
10 Der p 10 Tropomiozină musculară
Der f 10 11 Der p 11 Paramiozină musculară cu greutate moleculară mare 23 Der p 23 Peritrofină, ligand chitină
Prevalența sensibilizării în rândul pacienților alergici la acarienii din praful de casă (%)
70-100
80-100
16-100
30-40 30-40 40-50
40-50
40-50
5-18
6-60 74
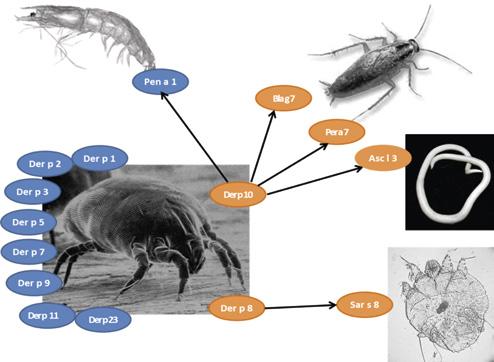
Figura 2. Prezentarea alergenelor majore (albastru) și cu reactivitate încrucișată (portocaliu) ale acarianului din praful de casă (Der p) (Pen a – crevete, Bla g, Per a – gândac de bucătărie, Sar s – sarcoptul scabiei, Asc l – limbric). Prezentare educațională cu modificare după Matricardi et al., 2016
deosebită, fiind responsabil de reactivitatea încrucișată cu gândacii și crustaceele (Thomas, 2015) (figura 2).
Der p 1/Der f 1 și Der p 2/Der f 2, alergenele de grup 1 și 2, sunt recunoscute de mult timp drept alergene majore (Trombone et al., 2002; Canonica et al., 2013; Calderon et al., 2015). Diferite studii arată că între 70% și 100% dintre pacienții alergici la acarieni sunt sensibilizați la Der p 1 și Der p 2 (Thomas, 2015; Nolte et al., 2016), astfel încât o proporție destul de mare de pacienți ar putea rămâne nedepistați dacă produsele cu care se testează conțin doar componente de grup 1 și 2. Prin natura sa chimică, Der p 1 (protează) prezintă capacitatea de a cliva receptorii CD23 ai limfocitelor B, aceștia devenind liberi, fără a mai putea fi implicați în autoreglarea răspunsului IgE mediat (Hewitt et al., 1995); de asemenea, această protează împreună cu alte proteaze din componența acarienilor (Der p 3, 6 și 9) pot induce leziuni ale epiteliului bronșic prin distrugerea joncțiunilor intercelulare, afectându-i astfel funcția de barieră și putând crește riscul de a dezvolta sensibilizări la alte alergene. Această protează poate induce și activarea unor mecanisme inflamatorii non-IgE mediate, prin clivarea receptorilor de suprafață, activarea unor receptori specifici imunității înnăscute (PAR) și reducerea clearance-ului pulmonar (Reithofer & Jahn-Schmid, 2017).
Der p 23 a fost identificat recent ca un alergen major (Weghofer et al., 2013). Este o proteină de tip peritrofină din stratul peritrofic care căptușește epiteliul digestiv și învelește particulele fecale. Importanța clinică a acestui alergen este legată de faptul că sensibilizarea la Der p 23 se asociază cu dezvoltarea astmului (Mueller et al., 2016; Semedo et al., 2019). Cu toate acestea, încă se cunosc puține lucruri despre rolul său în sensibilizare și relevanța sa clinică. Acest alergen se găsește în concentrație scăzută în extractele de acarieni utilizate pentru testarea cutanată; pentru a putea evidenția sensibilizarea față de acest alergen este necesară testarea moleculară in vitro cu componente moleculare (Casset et al., 2012).
Der p 3 face parte din familia proteinelor de tip tripsină, cu o reactivitate IgE-specifică de aproximativ 50% în rândul pacienților sensibilizați la D. pteronyssinus, însă de obicei cu un titru scăzut (Bouaziz et al., 2013).
Der p 4 este o alfa-amilază cu o reactivitate IgEspecifică destul de mare, însă cu un titru scăzut de anticorpi IgE. Sensibilizarea apare mai rar la copii comparativ cu adulții (Posa et al., 2017). Pacienții infectați cu Sarcoptes scabiei prezintă un titru crescut de IgE specifice față de Der p 4 (Walton et al., 2015).
Der p 5 are o reactivitate IgE-specifică de 30-40%, însă de obicei cu un titru scăzut de anticorpi IgE (Posa et al., 2017). Prevalența sensibilizării la acest alergen variază în funcție de grupul de pacienți testați, unele populații având titru IgE similar cu cel indus de alergenele majore Der p 1 și Der p 2 (Chen et al., 2019). Sensibilizarea la Der p 5 este relevantă clinic, deoarece se asociază cu dezvoltarea astmului (Thomas et al., 2010).
Der p 6 este un alergen din familia chemotripsinelor, cu o reactivitate IgE-specifică de 40-50%, însă de obicei cu un titru scăzut. Der p 9 este un alergen omolog din punct de vedere structural atât cu Der p 3, cât și cu Der p 6 (Randall et al., 2017).
Der p 7, o proteină de legare a lipidelor, induce o rată de sensibilizare de până la 50%, dar cu un titru IgE-specific scăzut (Mueller et al., 2010). Prevalența sensibilizării la acest alergen este mai mică în rândul copiilor (Posa et al., 2017).
Der p 8 este o proteină din familia glutation S-transferazelor, cu o reactivitate IgE-specifică de 40-50%. Importanța clinică a acestei componente este legată de faptul că sensibilizarea la Der p 8 se asociază cu dezvoltarea astmului (Huang et al., 2006). Der p 8 prezintă omologie structurală ridicată cu glutation S-transferaza din Sarcoptes scabiei, asociată cu mecanismele formării crustelor din scabie (Dougall et al., 2005). Din punct de vedere structural, ar putea induce reactivitate încrucișată cu Asc l 13, însă reactivitatea nu a putut fi confirmată prin studii (Acevedo et al., 2011; Acevedo et al., 2013).
Der p 10 este o proteină din familia tropomiozinelor care induce o rată de sensibilizare redusă. Der p 10 este principalul alergen responsabil de reactivitatea încrucișată între acarieni și alte nevertebrate – de exemplu, crustacee precum crevetele (tropomiozina fiind Pen a 1) sau homarul (Hom a 1), moluște precum melcii (Hel as 1, Tur c 1) sau stridiile (Cra g 1), gândaci de bucătărie (Bla g 7) și helminți (Asc l 3, Ani s 3) (Farioli et al., 2017; Popescu, 2015; Panzner et al., 2018) (figura 2). Tropomiozina este considerată un alergen minor din acarienii din praful de casă, dar alergen major la crevete. Tropomiozinele sunt proteine stabile atât la căldură, cât și la digestie, care produc reacții și după consumul alimentelor preparate termic. Din acest motiv ele pot induce și reacții sistemice severe, nu doar sindrom de alergie orală.
Der p 11 este o paramiozină (proteină structurală musculară) cu greutate moleculară mare (~100 kDa). Sensibilizarea la Der p 11 este mai frecvent detectată la pacienții cu dermatită atopică (Tsai et al., 2005).
Der p 21 este o proteină care prezintă omologie structurală cu Der p 5 și care provine din epiteliul digestiv al acarienilor (Weghofer et al., 2008). Der p 21 induce răspuns IgE-specific mai frecvent la copiii astmatici alergici la acarieni față de cei nonastmatici (Resch et al., 2015).
Diagnosticul alergiilor începe cu un istoric medical detaliat și cu examenul clinic, iar pentru confirmarea acestuia este disponibilă o varietate mare de opțiuni de testare, cum ar fi investigațiile in vivo (teste cutanate sau teste de provocare) sau in vitro (determinarea IgE serice specifice pentru extracte sau testul de activare a bazofilelor). Aceste teste utilizează în mod tradițional extracte alergenice, care reprezintă amestecuri de alergene și substanțe nealergenice, fiind dificil de caracterizat și standardizat și prezentând variații mari între producători și chiar între loturi diferite de la același producător (Lee et al., 2018; González-Pérez et al., 2019). De asemenea, concentrațiile alergenelor din extracte nu reflectă întotdeauna concentrațiile din mediu. Un alt aspect care trebuie luat în considerare este posibilitatea de a induce sensibilizare iatrogenică la alte proteine alergenice din extract.
Diagnosticul bazat pe componente – diagnosticul molecular – implică fie separarea componentelor alergenice din sursa alergenică, fie producerea de alergene recombinate prin tehnologii de inginerie genetică; din aceste motive, diagnosticul molecular prezintă o serie de avantaje față de diagnosticul bazat pe extracte alergenice (Li et al., 2018; Eguiluz-Gracia et al., 2020): indică prezența unui răspuns imun specific față de alergene individuale; oferă o rezoluție diagnostică mai fină, cu sensibilitate și specificitate ridicate, deoarece utilizează proteine înalt definite și purificate; permite evaluarea riscului indus de sensibilizare, cu importanță majoră în special în alergiile alimentare, deoarece alergenicitatea proteinelor din alimente este modificată prin prelucrarea termică a acestora sau prin digestie; permite evidențierea reactivității încrucișate între surse alergenice diferite; permite identificarea corectă a indicațiilor de imunoterapie alergenică, în funcție de sensibilizările primare.
Din toate aceste motive, extractele alergenice sunt înlocuite treptat cu alergenele moleculare. Aceste inovații vor permite clinicienilor să dobândească date amănunțite despre tiparele de sensibilizare și o interpretare mai precisă a simptomelor alergice. În acest sens, alergologia moleculară este un exemplu excelent al asocierii dintre medicina de precizie și alergie.
Diagnosticul molecular este reprezentat în practica de laborator de două tipuri principale de teste, teste singleplex și multiplex. Testul singleplex presupune determinarea IgE-specifice unui singur alergen (o probă de sânge, un alergen). Testul multiplex este un tip de imunoanaliză cu detecție fluorimetrică, ce determină simultan concentrațiile de IgE specifice pentru un panel mai mare de componente alergenice (Kleine-Tebbe & Jappe, 2015). În comparație cu testele singleplex, sensibilitatea sistemelor de testare multiplex poate fi scăzută la pacienții cu niveluri mici de IgE, date fiind limitele mai mari
de detectare, coeficienții mai mari de variație și potențialele inhibiții de către anticorpul specific IgG (Cui et al., 2016; Jakob et al., 2017).
Prin utilizarea alergenelor recombinate, s-au descoperit corelații între sensibilizarea la anumite molecule alergenice sau la o anumită combinație de alergene și anumite manifestări ale bolii alergice. Astfel, Der p 11 și Der p 18 (alergene asociate cu extractele complete de acarieni) sunt mai frecvent recunoscute de IgE la pacienții cu dermatită atopică, în timp ce alergenele asociate cu particule fecale (Der p 1, Der p 2, Der p 5, Der p 23) sunt mai frecvent recunoscute la pacienții cu alergii respiratorii (Huang et al., 2020). Două explicații ale acestor constatări pot fi luate în considerare: prima este că ar putea exista căi diferite de sensibilizare în dermatita atopică față de alergia respiratorie și a doua este că pacienții cu dermatită atopică pot avea un răspuns policlonal, care include alergene mai puțin recunoscute, cum ar fi alergenele derivate din corpul acarienilor, care pot induce sensibilizare pe cale tegumentară (Banerjee et al., 2014).
O abordare diagnostică individualizată care determină modele de sensibilizare moleculară a pacienților sensibilizați la acarienii din praful de casă poate ajuta la identificarea pacienților eligibili pentru imunoterapia alergenică, deoarece preparatele moderne de imunoterapie pentru acarienii din praful de casă sunt de obicei standardizate doar pentru alergenele majore Der p 1, Der f 1 (și uneori Der p 2 și Der f 2) (Demoly et al., 2016). Probabil, din acest motiv imunoterapia alergenică împotriva acarienilor prezintă rate de succes considerabil mai mici în comparație cu cea împotriva polenului de graminee sau mesteacăn (Becker et al., 2016).
Prin urmare, diagnosticul molecular poate oferi o bază pentru cercetări ulterioare, ducând la o gestionare îmbunătățită a bolii, pe principiul abordării medicale personalizate. Sensibilitatea sistemelor multiplex actualizate este în prezent comparabilă cu cea a testării bazate pe extracte. Cu toate acestea, la pacienții cu niveluri scăzute de IgE pot fi necesare teste suplimentare singleplex sau testare cutanată pe bază de extracte. Caracterizarea sensibilizării la alergene ar putea fi îmbunătățită prin tehnici mai noi pentru determinarea reactivității IgE, utilizând cipuri pentru diagnostic care eventual să conțină mai multe alergene din acarienii din praful de casă (Matricardi et al., 2019).
În prezent, în România există atât variante de testare de tip singleplex pentru alergenele din acarieni, cât și variante de tip multiplex. Sistemul ImmunoCAP™ ISAC conține alergenele Der p 1, Der f 1, Der p 2, Der f 2, Der p 10, Blo t 5 (ThermoFisher Scientific, 2021), iar sistemul ALEX conține Der p 1, Der f 1, Der p 2, Der f 2, Der p 5, Der p 7, Der p 10, Der p 11 și Der p 23 (Macro Array Diagnostics, 2021).
Diagnosticul molecular de precizie va putea astfel să determine profiluri de sensibilizare individuale, din care se poate calcula riscul pentru fiecare pacient și se pot emite recomandări pentru imunoterapie alergenică. Cu toate acestea, unele provocări persistă: 1) s-au observat discrepanțe între diferitele metode de diagnostic, care trebuie elucidate; 2) costul investigațiilor poate fi prohibitiv, acestea nefiind compensate de sistemele naționale de sănătate; 3) diagnosticul molecular prezintă încă disponibilitate limitată, fiind oferit încă de puține laboratoare. Din aceste motive, în prezent se recomandă ca aceste investigații să fie utilizate ca unelte terțiare de diagnostic, la pacienții polisensibilizați. Un posibil algoritm de diagnostic al alergiei la acarienii din praful de casă se regăsește în figura 3.
Relevanța clinică a identificării IgE-specifice pentru alergenele din acarienii din praful de casă (figura 4): confirmarea sensibilizării primare la acarienii din praful de casă: Der p 1, Der p 2, Der p 23; evaluarea riscului de evoluție spre astm a pacienților alergici la acarienii din praful de casă, prin profiluri de sensibilizare moleculară complexe – Der p 1,
Der p 2, Der p 23, Der p 5, Der p 7, Der p 8, Der p 21 (Arasi et al., 2019); cu cât o persoană este sensibilă la mai multe componente alergenice (pattern de sensibilizare mai complex), cu atât severitatea bolii alergice și riscul de evoluție spre astm sunt mai crescute (Resch et al., 2015); recomandarea imunoterapiei alergenice (AIT) adecvate – pacienții sensibilizați la Der p 1 și Der f 1 sunt cei mai potriviți candidați pentru AIT, deoarece preparatele pentru imunoterapie sunt standardizate pentru componentele din acest grup (Matricardi et al., 2016; Nolte et al., 2016; Becker et al., 2016; Thomas, 2016); având în vedere faptul că Der p 2, Der p 23 și
Der p 10 sunt prezente în cantitate redusă în preparatele imunoterapeutice bazate pe extracte alergenice, pacienții sensibilizați doar la acestea nu ar fi candidați potriviți pentru AIT, fiind de așteptat să nu producă efecte benefice (Chen et al., 2019; Huang et al., 2019; Matricardi et al., 2019); explicarea manifestărilor alergice în cazul pacienților sensibilizați la acarienii din praful de casă după ingerarea unor nevertebrate comestibile (creveți, stridii, midii, homari, melci etc.) – Der p 10 (Asero et al., 2020;
Panzner et al., 2018).
Reactivitatea încrucișată a pacienților sensibilizați la acarienii din praful de casă la alte surse de alergene care conțin tropomiozină
Reactivitatea încrucișată apare când un anticorp apărut inițial împotriva unui fragment alergenic se leagă de un fragment alergenic similar dintr-o altă sursă. Sensibilizarea la acarienii din praful de casă poate duce la simptome după ingestia orală în două situații: ingestia de nevertebrate care prezintă reactivitate încrucișată cu acarienii și ingestia de alimente contaminate cu acarieni. Înțelegerea reactivității încrucișate între componentele alergenice ale acarienilor din praful de casă și cele provenite din alte surse alergenice este încă limitată, dar, în special din punct de vedere clinic, este important de știut dacă sensibilizarea la acarienii din praful de casă modifică reacția pacienților la alte surse de alergene. Reactivitatea încrucișată a fost

Figura 3. Posibil algoritm de diagnostic în alergia la acarienii din praful de casă în zonele temperate. Prezentare educațională cu modificare după Matricardi et al., 2016
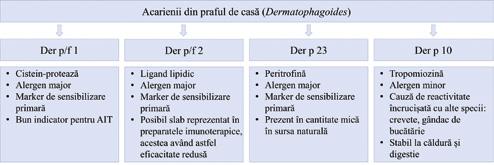
Figura 4. Relevanța clinică a identificării IgE-specifice pentru principalele alergene din acarienii din praful de casă
demonstrată între acarieni și crustacee (creveți, crabi și homar), insecte (gândac de bucătărie, lăcustă) și moluște (melci, scoici, stridii și calamar), iar simptomele clinice variază de la sindromul de alergie orală la astm sever și anafilaxie (Miller, 2019).
Tropomiozinele sunt molecule cu o capacitate crescută de reactivitate încrucișată din diverse surse alergenice (panalergene) care pot induce diverse simptome, inclusiv anafilaxie. Sensibilizarea la tropomiozine poate apărea prin ingestie (fructe de mare), inhalare (acarieni, gândaci) sau infecții parazitare (ascariază, anizakiază).
Tropomiozinele aparțin unei familii de proteine (Pfam PF00261) care include un număr mare de alergene cu reactivitate încrucișată, majoritatea din surse de nevertebrate, precum: acarienii din praful de casă, creveți, homari, crabi, melci, abalon, scoici, midii, caracatiță, gândaci și helminți (tabelul 2).
Secvența de aminoacizi a tropomiozinei este foarte bine conservată în rândul crustaceelor și al altor nevertebrate, împărțind peste 70% din omologie, în comparație cu tropomiozina vertebratelor, care relevă o omologie de 51-57% cu acestea. Tabelul 3 prezintă o comparație bazată pe similitudinea secvențelor de aminoacizi care aparțin tropomiozinelor reprezentative. Toate perechile cu o similitudine ridicată au potențial de a declanșa reacții încrucișate.
Impactul clinic al tropomiozinelor alergenice nealimentare pare să fie mai mare decât se credea anterior. Există rapoarte care sugerează că reacția încrucișată
Tabelul 2 Lista tropomiozinelor relevante clinic și a surselor de alergene. Prezentare educațională cu modificare după Matricardi et al., 2016
Similitudinea secvențelor de aminoacizi (%) între unele tropomiozine. Prezentare educațională cu modificare după Matricardi et al., 2016
Familia
Penaeoidea
Palinuridae Cancridae Hellixidae Mytilidae Octopodidae Ommastephidae Osteidae Haliotidea
Pyroglyphidae
Echymiopodidae Blattidae Blattellidae Anisakidae Ascaridae
Sursa de alergene
Crevete brun (Penaeus aztecus) Crevete roșu nordic (Pandalus borealis) Crevete tigru gigant (Penaeus monodon) Crevete european (Litopenaeus vannamei) Crevete comun (Crangon Crangon) Homar (Panulirus stimpsoni) Crab (Charybdis feriatus) Melc de grădină (Helix aspersa) Midie verde (Perna viridis) Caracatiță (Octopus vulgaris) Calmar japonez (Todarodes pacificus) Stridie (Crassostrea gigas) Scoică (Haliotis diversicolor) Acarianul din praful de casă (Dermatophagoides farinae) Acarianul din praful de casă (D. pteronyssinus) Acarianul de depozit (Blomia tropicalis) Gândac american (Periplaneta americana) Gândac german (Blattella germanica) Anisakis (Anisakis simplex) Ascaris (Ascaris lumbricoides)
Alergen
Pen a 1 Pan b 1 Pen m 1 Lit v 1 Cra c 1 Pan s 1 Cha f 1 Hel as 1 Per v 1 Oct v 1 Tod p 1 Cra g 1 Hal d 1 Der f 10 Der p 10 Blo t 10 Per a 7 Bla g 7 Ani s 3 Asc l 3
Tabelul 3
Pen a 1
Pen s 1 100% Cha f 1 100% 91% Hel as 1 71% 63% 63% Oct v 1 75% 63% 63% 83% Per v 1 55% 55% 55% 70% 70% Der p 10 71% 80% 82% 64% 63% 55% Bla g 7 76% 82% 84% 63% 63% 56% 80% Asc l 3 62% 72% 74% 64% 64% 57% 73% 70%
Pen a 1 Pen s 1 Cha f 1 Hel as 1 Oct v 1 Per v 1 Der p 10 Bla g 7 Asc l 3
Procentajele scrise cu alb indică perechi de tropomiozine cu o similitudine a secvențelor de aminoacizi <70%
dintre acarienii din praful de casă și moluște/crustacee este semnificativă clinic. Imunoterapia subcutanată la acarieni sau expunerea respiratorie la acarieni poate să inducă sensibilizare la tropomiozină, provocând sindrom de alergie orală sau simptome sistemice la crustacee. Sensibilizarea la tropomiozina din acarieni, gândaci și ascaris poate influența prevalența și severitatea astmului în zonele în care există o coexpunere la mai multe surse de tropomiozină. Relevanța clinică a sensibilizării la tropomiozine variază de la un impact clinic scăzut la anafilaxie (Matricardi et al., 2016). Aproximativ 10% dintre pacienții cu alergie la acarienii din praful de casă au IgE specifice pentru tropomiozină (Der p 10), principalul alergen implicat în reacțiile încrucișate dintre acarieni, crustacee, insecte și helminți. Acest grup de pacienți prezintă o probabilitate mai mare să dezvolte reacții alergice la crustacee, moluște, insecte și paraziți.
Mai multe studii realizate la pacienți alergici la creveți au arătat că majoritatea acestora sunt sensibilizați, de asemenea, la acarienii din praful de casă (Chiang et al., 2007; Thalayasingam et al., 2015). Pe de altă parte, când se evaluează sensibilizarea la creveți la pacienții sensibilizați la alergenele care indică sensibilizare primară la acarieni, doar o minoritate dintre aceștia prezintă IgE specific față de creveți (Thalayasingam et al., 2015). Acest lucru poate fi explicat prin rolul tropomiozinei în alergiile la creveți, respectiv la acarieni. Tropomiozina este alergenul major din creveți (Shanti et al., 1993) și, prin urmare, sensibilizarea la acest alergen se găsește la majoritatea persoanelor alergice la creveți, iar acești pacienți ar avea un potențial mai mare de reacție încrucișată cu Der p 10 din acarieni. Când se analizează pacienții cu alergie la acarieni pentru sensibilizarea la creveți, Der p 10 nu este alergenul major în alergia la acarieni; prin urmare, este de așteptat ca numărul pacienților alergici la acarieni cu sensibilizare la creveți să fie mai mic, deoarece doar o minoritate dintre aceștia sunt sensibilizați la tropomiozina specifică.
Concluzii
Acarienii din praful de casă reprezintă cauza principală a alergiilor la nivel mondial și principala sursă de alergene de interior. Sensibilizarea la aceștia se asociază cu rinita persistentă, astmul alergic și dermatita atopică. Diagnosticul molecular a devenit un instrument important în rutina alergologică zilnică în clinicile specializate. Cunoștințele despre componentele alergenice majore și minore din acarienii din praful de casă și prevalența sensibilizării la acestea au deschis noi posibilități în diagnosticul și terapia alergiei. Acest instrument puternic poate explica rezultatele uneori frustrante ale imunoterapiei alergenice și ajută la alegerea opțiunii de tratament potrivite pentru fiecare pacient. În comparație cu imunoterapia împotriva polenului de graminee sau mesteacăn, imunoterapia împotriva acarienilor prezintă rate de succes considerabil mai mici. Un motiv pentru acest succes terapeutic redus ar putea fi faptul că cei mai mulți agenți terapeutici disponibili în comerț pentru imunoterapia alergiei la acarieni sunt standardizați doar pentru unele dintre alergenele majore, prin urmare nu se adresează pacienților sensibilizați la alte componente. Până în prezent au fost descrise mai mult de 30 de componente alergenice ale acarienilor din praful de casă, cu prevalențe și relevanțe clinice și terapeutice variate. Ca o consecință a acestor constatări, diagnosticul molecular pentru componentele alergenice majore ar trebui să fie obligatoriu înainte de imunoterapie la pacienții alergici la acarieni. Astfel, pentru a determina sursa primară de sensibilizare, pentru a evalua riscul de reacții severe și de reacții încrucișate și pentru a optimiza rezultatele imunoterapiei, este necesar un diagnostic de precizie prin alergologia moleculară.
Bibliografie
1. Acevedo N, Caraballo L. IgE cross‐reactivity between Ascaris lumbricoides and mite allergens: possible influences on allergic sensitization and asthma. Parasite
Immunol. 2011 Jun;33(6):309‑21. doi: 10.1111/j.1365‑3024.2011.01288.x. PubMed
PMID: 21388422 2. Acevedo N, Mohr J, Zakzuk J, Samonig M, Briza P, Erler A, Pomés A, Huber CG,
Ferreira F, Caraballo L. Proteomic and immunochemical characterization of glutathione transferase as a new allergen of the nematode Ascaris lumbricoides.
PLoS One. 2013 Nov 4;8(11):e78353. doi: 10.1371/journal.pone.0078353. PubMed
PMID: 24223794 3. Acevedo N, Zakzuk J, Caraballo L. House dust mite allergy under changing environments. Allergy Asthma Immunol Res. 2019 Jul;11(4):450‑469. doi: 10.4168/ aair.2019.11.4.450. PubMed PMID: 31172715 4. Arasi S, Porcaro F, Cutrera R, Fiocchi AG. Severe asthma and allergy: a pediatric perspective. Front Pediatr. 2019 Feb 11;7:28. doi: 10.3389/fped.2019.00028. PubMed
PMID: 30805326 5. Arlian LG, Morgan MS, Neal JS. Dust mite allergens: ecology and distribution. Curr
Allergy Asthma Rep. 2002 Sep;2(5):401‑11. doi: 10.1007/s11882‑002‑0074‑2. PubMed
PMID: 12165207 6. Asero R, Pravettoni V, Scala E, Villalta D. House dust mite‑shrimp allergen interrelationships. Curr Allergy Asthma Rep. 2020 Apr;20(4):1‑5. doi: 10.1007/s11882‑ 020‑0902‑2. PubMed PMID: 32144500 7. Banerjee S, Weber M, Blatt K, Swoboda I, Focke‑Tejkl M, Valent P, Valenta R, Vrtala S.
Conversion of Der p 23, a new major house dust mite allergen, into a hypoallergenic vaccine. J Immunol. 2014 May 15;192(10):4867‑75. doi: 10.4049/jimmunol.1400064.
PubMed PMID: 24733847 8. Becker S, Schlederer T, Kramer MF, Haack M, Vrtala S, Resch Y, Lupinek C, Valenta R,
Gröger M. Real‑life study for the diagnosis of house dust mite allergy‑the value of recombinant allergen‑based IgE serology. Int Arch Allergy Immunol. 2016;170(2):132‑ 7. doi: 10.1159/000447694. PubMed PMID: 27505432 9. Bordas‑Le Floch V, Le Mignon M, Bussières L, Jain K, Martelet A, Baron‑Bodo V,
Nony E, Mascarell L, Moingeon P. A combined transcriptome and proteome analysis extends the allergome of house dust mite Dermatophagoides species. PLoS One. 2017 Oct 5;12(10):e0185830. doi: 10.1371/journal.pone.0185830. PubMed PMID: 28982170 10. Bouaziz A, Walgraffe D, Bouillot C, Herman J, Foguenne J, Gothot A, Louis R,
Hentges F, Jacquet A, Mailleux AC, Chevigne A. Development of recombinant stable house dust mite allergen Der p 3 molecules for component‐resolved diagnosis and specific immunotherapy. Clin Exp Allergy. 2015 Apr;45(4):823‑34. doi: 10.1111/ cea.12452. PubMed PMID: 25406386 11. Calderón MA, Kleine‑Tebbe J, Linneberg A, et al. House Dust Mite Respiratory
Allergy: An Overview of Current Therapeutic Strategies. J Allergy Clin Immunol Pract. 2015;3(6):843‑855. doi: 10.1016/j.jaip.2015.06.019. PubMed PMID: 26342746 12. Canonica GW, Ansotegui IJ, Pawankar R, et al. A WAO ‑ ARIA ‑ GA2LEN consensus document on molecular‑based allergy diagnostics. World Allergy Organ J. 2013;6(1):1‑ 17. doi: 10.1186/1939‑4551‑6‑17. PubMed PMID: 24090398 13. Casset A, Mari A, Purohit A, Resch Y, Weghofer M, Ferrara R, Thomas WR, Alessandri
C, Chen KW, De Blay F, Valenta R. Varying allergen composition and content affects the in vivo allergenic activity of commercial Dermatophagoides pteronyssinus extracts. Int Arch Allergy Immunol. 2012;159(3):253‑62. doi: 10.1159/000337654.
PubMed PMID: 22722650 14. Chen KW, Zieglmayer P, Zieglmayer R, Lemell P, Horak F, Bunu CP, Valenta R, Vrtala S.
Selection of house dust mite–allergic patients by molecular diagnosis may enhance success of specific immunotherapy. J Allergy Clin Immunol. 2019 Mar 1;143(3):1248‑ 52. doi: 10.1016/j.jaci.2018.10.048. PubMed PMID: 30445063 15. Chew GL. Mite sensitization among Latina women in New York, where dust mite allergen levels are typically low. Indoor Air. 2009 Jun;19(3):193. doi: 10.1111/j.1600‑ 0668.2008.00578.x. PubMed PMID: 19220508 16. Chiang WC, Kidon MI, Liew WK, Goh A, Tang JP, Chay OM. The changing face of food hypersensitivity in an Asian community. Clin Exp Allergy. 2007 Jul;37(7):1055‑61. doi: 10.1111/j.1365‑2222.2007.02752.x. PubMed PMID: 17581199 17. Cui YB, Yu LL, Teng FX, Wang N, Zhou Y, Yang L, Zhang CB. Dust mite allergen Der f 4: expression, characterization, and IgE binding in pediatric asthma. Pediatr Allergy
Immunol. 2016 Jun;27(4):391‑7. doi: 10.1111/pai.12544. PubMed PMID: 26842967 18. D’Amato G, Ortega OP, Annesi‑Maesano I, D’Amato M. Prevention of allergic asthma with allergen avoidance measures and the role of exposome. Curr Allergy Asthma
Rep. 2020 Mar;20(3):1‑8. doi: 10.1007/s11882‑020‑0901‑3. PubMed PMID: 32103354 19. de Oliveira CH, Binotti RS, Muniz JR, dos Santos JC, do Prado AP, de Pinho Jr AJ.
Comparison of house dust mites found on different mattress surfaces. Ann Allergy
Asthma Immunol. 2003 Dec 1;91(6):559‑62. doi: 10.1016/S1081‑1206(10)61534‑7.
PubMed PMID: 14700440 20. Demoly P, Emminger W, Rehm D, Backer V, Tommerup L, Kleine‑Tebbe J. Effective treatment of house dust mite–induced allergic rhinitis with 2 doses of the SQ HDM
SLIT‑tablet: Results from a randomized, double‑blind, placebo‑controlled phase III trial J Allergy Clin Immunol. 2016 Feb 1;137(2):444‑51. doi: 10.1016/j.jaci.2015.06.036.
PubMed PMID: 26292778 21. Dougall A, Holt DC, Fischer K, Currie BJ, Kemp DJ, Walton SF. Identification and characterization of Sarcoptes scabiei and Dermatophagoides pteronyssinus glutathione S‑transferases: implication as a potential major allergen in crusted scabies. Am J Trop Med Hyg. 2005 Nov 1;73(5):977‑84. PubMed PMID: 16282315 22. Eguiluz‑Gracia I, Palomares F, Salas M, Testera‑Montes A, Ariza A, Davila I, Bartra
J, Mayorga C, Torres MJ, Rondon C. Precision Medicine in House Dust Mite‑Driven
Allergic Asthma. J Clin Med. 2020 Dec;9(12):3827. doi: 10.3390/jcm9123827. PubMed
PMID: 33255966 23. Fanuel S, Tabesh S, Sadroddiny E, Kardar GA. Analysis of predicted B and
T‑cell epitopes in Der p 23, allergen from Dermatophagoides pteronyssinus.
Bioinformation. 2017;13(9):307. doi: 10.6026/97320630013307. PubMed PMID: 29081610 24. Farioli L, Losappio LM, Giuffrida MG, Pravettoni V, Micarelli G, Nichelatti M, Scibilia J,
Mirone C, Cavallarin L, Lamberti C, Balossi LG. Mite‑induced asthma and IgE levels to shrimp, mite, tropomyosin, arginine kinase, and Der p 10 are the most relevant risk factors for challenge‑proven shrimp allergy. Int Arch Allergy Immunol. 2017;174(3‑ 4):133‑43. doi: 10.1159/000481985. PubMed PMID: 29169170 25. Fernández‑Caldas E, Calvo VI. Mite allergens. Curr Allergy Asthma Rep. 2005
Sep;5(5):402‑10. doi: 10.1007/s11882‑005‑0014‑z. PubMed PMID: 16091214
Bibliografie (continuare)
26. González‑Pérez R, Poza‑Guedes P, Del Pino YB, Matheu V, Sánchez‑Machín I.
Evaluation of major mite allergens from European standardized commercial extracts for in vivo diagnosis: addressing the need for precision medicine. Clin Transl
Allergy. 2019 Dec;9(1):1‑8. doi: 10.1186/s13601‑019‑0254‑y. PubMed PMID: 30891182 27. Hallam C, Custovic A, Simpson B, Houghton N, Simpson A, Woodcock A. Mite allergens in feather and synthetic pillows. Allergy. 1999 Apr 1;54(4):407‑408. doi: 10.1034/j.1398‑9995.1999.00066.x. PubMed PMID: 10371108 28. Hewitt CRA, Brown AP, Hart BJ, Pritchard DI. A major house dust mite allergen disrupts the immunoglobulin E network by selectively cleaving CD23: Innate protection by antiproteases. J Exp Med. 1995. doi:10.1084/jem.182.5.1537. doi: 10.1084/jem.182.5.1537. PubMed PMID: 7595223 29. House dust mites. Accesat în 2 martie 2021. Disponibil la: https://commons. wikimedia.org/wiki/File:House_dust_mites_(5247996458).jpg. 30. Huang CH, Liew LM, Mah KW, Kuo IC, Lee BW, Chua KY. Characterization of glutathione S‐transferase from dust mite, Der p 8 and its immunoglobulin E cross‐reactivity with cockroach glutathione S‐transferase. Clin Exp Allergy. 2006
Mar;36(3):369‑76. doi: 10.1111/j.1365‑2222.2006.02447.x. PubMed PMID: 16499649 31. Huang Y, Wang C, Lin X, Lou H, Cao F, Li W, Zhang Y, Zhang L. Association between component‑resolved diagnosis of house dust mite and efficacy of allergen immunotherapy in allergic rhinitis patients. Clin Transl Allergy. 2019 Dec;9(1):1‑4. doi: 10.1186/s13601‑019‑0305‑4. PubMed PMID: 31890153 32. Huang Z, Zou X, Chen H, Liao C, Hu H, Luo W, Sun B. Identifying potential co‑ sensitization and cross‑reactivity patterns based on component‑resolved diagnosis.
Int Arch Allergy Immunol. 2020;181(2):81‑93. doi: 10.1159/000504320. PubMed PMID: 31770759 33. Jakob T, Forstenlechner P, Matricardi PM, Kleine‑Tebbe J. Molecular allergy diagnostics using multiplex assays: methodological and practical considerations for use in research and clinical routine: Part 21 of the Series Molecular Allergology.
Allergo J Int. 2015;24:320‑332. doi: 10.1007/s40629‑015‑0087‑8. PubMed PMID: 27069843 34. Kleine‑Tebbe J, Jappe U. Molecular allergy diagnostic tests: development and relevance in clinical practice. Allergologie Select. 2017;1(2):169. PubMed Central
PMCID: PMC6040004. doi: 10.5414/ALX01617E. PubMed PMID: 30402615 35. Leaderer BP, Belanger K, Triche E, Holford T, Gold DR, Kim Y, Jankun T, Ren P,
McSharry Je JE, Platts‑Mills TA, Chapman MD. Dust mite, cockroach, cat, and dog allergen concentrations in homes of asthmatic children in the northeastern
United States: impact of socioeconomic factors and population density. Environ
Health Perspect. 2002 Apr;110(4):419‑25. doi: 10.1289/ehp.02110419. PubMed PMID: 11940461 36. Lee SC, Da Woon Sim JL, Jeong KY, Park KH, Lee JH, Kim JD, Park JW. Comparison between newly developed and commercial inhalant skin prick test reagents using in vivo and in vitro methods. J Korean Med Sci. 2018 Mar 26;33(13). doi: 10.3346/ jkms.2018.33.e101. PubMed PMID: 29573248 37. Li L, Qian J, Zhou Y, Cui Y. Domestic mite–induced allergy: Causes, diagnosis, and future prospects. Int J Immunopathol Pharmacol. 2018 Jan. doi: 10.1177/2058738418804095. PubMed PMID: 30350752 38. Macro Array Diagnostics. Accesat în 2 martie 2021. Disponibil la: https://www. macroarraydx.com/ 39. Matricardi PM, Dramburg S, Potapova E, Skevaki C, Renz H. Molecular diagnosis for allergen immunotherapy. J Allergy Clin Immunol. 2019 Mar 1;143(3):831‑43. doi: 10.1016/j.jaci.2018.12.1021. PubMed PMID: 30850070 40. Matricardi PM, Kleine‑Tebbe J, Hoffmann HJ, Valenta R, Hilger C, Hofmaier S,
Aalberse RC, Agache I, Asero R, Ballmer‑Weber B, Barber D. EAACI Molecular
Allergology User’s Guide. Pediatr Allergy Immunol. 2016 May;27:1‑250. doi: 10.1111/ pai.12563. PubMed PMID: 27288833 41. Miller JD. The role of dust mites in allergy. Clin Rev Allergy Immunol. 2019
Dec;57(3):312‑29. doi: 10.1007/s12016‑018‑8693‑0. PubMed PMID: 29936683 42. Mueller GA, Edwards LL, Aloor JJ, Fessler MB, Glesner J, Pomés A, Chapman MD,
London RE, Pedersen LC. The structure of the dust mite allergen Der p 7 reveals similarities to innate immune proteins. J Allergy Clin Immunol. 2010 Apr 1;125(4):909‑ 17. doi: 10.1016/j.jaci.2009.12.016. PubMed PMID: 20226507 43. Mueller GA, Randall TA, Glesner J, Pedersen LC, Perera L, Edwards LL, DeRose EF,
Chapman MD, London RE, Pomés A. Serological, genomic and structural analyses of the major mite allergen Der p 23. Clin Exp Allergy. 2016 Feb;46(2):365‑76. doi: 10.1111/ cea.12680. PubMed PMID: 26602749 44. Nolte H, Plunkett G, Grosch K, Larsen JN, Lund K, Bollen M. Major allergen content consistency of SQ house dust mite sublingual immunotherapy tablets and relevance across geographic regions. Ann Allergy Asthma Immunol. 2016;117(3):298‑ 303. doi: 10.1016/j.anai.2016.07.004. PubMed PMID: 27613464 45. Panzner P, Vachová M, Vlas T, Vítovcová P, Brodská P, Malý M. Cross‑sectional study on sensitization to mite and cockroach allergen components in allergy patients in the Central European region. Clin Transl Allergy. 2018 Dec;8(1):1‑9. doi: 10.1186/ s13601‑018‑0207‑x. PubMed PMID: 29881542 46. Popescu FD. Cross‑reactivity between aeroallergens and food allergens. World J
Methodol. 2015 Jun 26;5(2):31. doi: 10.5662/wjm.v5.i2.31. PubMed PMID: 26140270 47. Posa D, Perna S, Resch Y, Lupinek C, Panetta V, Hofmaier S, Rohrbach A, Hatzler L,
Grabenhenrich L, Tsilochristou O, Chen KW. Evolution and predictive value of IgE responses toward a comprehensive panel of house dust mite allergens during the first 2 decades of life. J Allergy Clin Immunol. 2017 Feb 1;139(2):541‑9. doi: 10.1016/j. jaci.2016.08.014. PubMed PMID: 27793411 48. Randall TA, London RE, Fitzgerald MC, Mueller GA. Proteases of Dermatophagoides pteronyssinus. Int J Mol Sci. 2017 Jun;18(6):1204. doi: 10.3390/ijms18061204. PubMed
PMID: 28587273 49. Reithofer M, Jahn‑Schmid B. Allergens with protease activity from house dust mites.
Int J Mol Sci. 2017 Jul;18(7):1368. doi: 10.3390/ijms18071368. PubMed PMID: 28653989 50. Resch Y, Michel S, Kabesch M, Lupinek C, Valenta R, Vrtala S. Different IgE recognition of mite allergen components in asthmatic and nonasthmatic children. J Allergy Clin Immunol. 2015 Oct 1;136(4):1083‑91. doi: 10.1016/j.jaci.2015.03.024.
PubMed PMID: 25956509 51. Sánchez‑Borges M, Fernandez‑Caldas E, Thomas WR, Chapman MD, Lee BW,
Caraballo L, Acevedo N, Chew FT, Ansotegui IJ, Behrooz L, Phipatanakul W.
International consensus (ICON) on: clinical consequences of mite hypersensitivity, a global problem. World Allergy Organ J. 2017 Dec;10(1):1‑26. doi: 0.1186/s40413‑017‑ 0145‑4. PubMed PMID: 28451053 52. Sarwar M. House Dust Mites: Ecology, Biology, Prevalence, Epidemiology and
Elimination. In Parasitology and Microbiology Research 2020 Apr 29. IntechOpen. doi: 10.5772/intechopen.91891 53. Semedo FM, Dorofeeva Y, Pires AP, Tomaz E, Taborda Barata L, Inácio F, Valenta F. Der p 23: clinical relevance of molecular monosensitisation in house dust mite allergy. J
Investig Allergol Clin Immunol. 2019;29(4):314‑316. doi: 10.18176/jiaci.0392. PubMed
PMID: 30957762 54. Shanti KN, Martin BM, Nagpal S, Metcalfe DD, Rao PV. Identification of tropomyosin as the major shrimp allergen and characterization of its IgE‑binding epitopes. J
Immunol. 1993 Nov 15;151(10):5354‑63. PubMed PMID: 7693809 55. Shen CY, Tsai JJ, Liao EC. Cross‑reactivity of sIgE to mite and shrimp induced allergies in different age groups and clinical profiles of shrimp sIgE in vegetarians.
Sci Rep. 2019 Aug 29;9(1):1‑1. doi: 10.1038/s41598‑019‑49068‑2. PubMed PMID: 31467382 56. Siebers R, Nam HS, Crane J. Permeability of synthetic and feather pillows to live house dust mites and house dust. Clin Exp Allergy. 2004 Jun;34(6):888‑90. doi: 10.1111/j.1365‑2222.2004.01972.x. PubMed PMID: 15196275 57. Stemeseder T, Schweidler B, Doppler P, Klinglmayr E, Moser S, Lueftenegger
L, Himly M, Lang R, Zumbach J, Oostingh GJ, Hawranek T. Exposure to indoor allergens in different residential settings and its influence on IgE sensitization in a geographically confined Austrian cohort. PLoS One. 2017 Jan 3;12(1):e0168686. doi: 10.1371/journal.pone.0168686. PubMed PMID: 28045938 58. Thalayasingam M, Gerez IF, Yap GC, Llanora GV, Chia IP, Chua L, Lee CJ, Ta LD, Cheng
YK, Thong BY, Tang CY. Clinical and immunochemical profiles of food challenge proven or anaphylactic shrimp allergy in tropical Singapore. Clin Exp Allergy. 2015
Mar;45(3):687‑97. doi: 10.1111/cea.12416. PubMed PMID: 25257922 59. ThermoFisher Scientific. Accesat în 2 martie 2021. Disponibil la: https://www. thermofisher.com/phadia/wo/en/our‑solutions/immunocap‑allergy‑solutions/ specific‑ige‑multiplex.html 60. Thomas WR, Hales BJ, Smith WA. House dust mite allergens in asthma and allergy.
Trends Mol Med. 2010 Jul 1;16(7):321‑8. doi: 10.1016/j.molmed.2010.04.008. PubMed
PMID: 20605742 61. Thomas WR. Hierarchy and molecular properties of house dust mite allergens.
Allergol Int. 2015;64(4):304‑11. doi: 10.1016/j.alit.2015.05.004. PubMed PMID: 26433526 62. Thomas WR. House dust mite allergens: new discoveries and relevance to the allergic patient. Curr Allergy Asthma Rep. 2016 Sep;16(9):1‑0. doi: 10.1007/s11882‑016‑ 0649‑y. PubMed PMID: 27600386 63. Tovey ER, Willenborg CM, Crisafulli DA, Rimmer J, Marks GB. Most personal exposure to house dust mite aeroallergen occurs during the day. PLoS One. 2013 Jul 24;8(7):e69900. doi: 10.1371/journal.pone.0069900. PubMed PMID: 23894558 64. Trombone AF, Tobias KC, Ferriani VL, Schuurman J, Aalberse RC, Smith AM,
Chapman MD, Arruda LK. Use of a chimeric ELISA to investigate immunoglobulin
E antibody responses to Der p 1 and Der p 2 in mite‐allergic patients with asthma, wheezing and/or rhinitis. Clin Exp Allergy. 2002 Sep;32(9):1323‑8. doi: 10.1046/j.1365‑ 2745.2002.01455.x. PubMed PMID: 12220471 65. Tsai LC, Peng HJ, Lee CS, Chao PL, Tang RB, Tsai JJ, Shen HD, Hung MW, Han SH.
Molecular cloning and characterization of full‐length cDNAs encoding a novel high‐molecular‐weight Dermatophagoides pteronyssinus mite allergen, Der p 11.
Allergy. 2005 Jul;60(7):927‑37. doi: 10.1111/j.1398‑9995.2005.00637.x. PubMed PMID: 15932384 66. van Strien RT, Gehring U, Belanger K, Triche E, Gent J, Bracken MB, Leaderer BP.
The influence of air conditioning, humidity, temperature and other household characteristics on mite allergen concentrations in the northeastern United States.
Allergy. 2004 Jun;59(6):645‑52. doi: 10.1111/j.1398‑9995.2004.00470.x. PubMed PMID: 15147450 67. Voorhorst R, Spieksma FT, Varekamp H, Leupen MJ, Lyklema AW. The house‑dust mite (Dermatophagoides pteronyssinus) and the allergens it produces. Identity with the house‑dust allergen. Allergy. 1967 Jun 1;39(6):325‑39 68. Waldron R, McGowan J, Gordon N, McCarthy C, Mitchell EB, Fitzpatrick DA.
Proteome and allergenome of the European house dust mite Dermatophagoides pteronyssinus. PLoS One. 2019 May 1;14(5):e0216171. 10.1371/journal.pone.0216171. doi: 10.1371/journal.pone.0216171. PubMed PMID: 31042761 69. Walton SF, Slender A, Pizutto S, Mounsey KE, Opresecu F, Thomas WR, Hales
BJ, Currie BJ. Analysis of IgE binding patterns to house dust mite allergens in scabies‐endemic communities: insights for both diseases. Clin Exp Allergy. 2015
Dec;45(12):1868‑72. doi: 10.1111/cea.12553. PubMed PMID: 26581853 70. Weghofer M, Dall’Antonia Y, Grote M, Stöcklinger A, Kneidinger M, Balic N, Krauth
MT, Fernández‐Caldas E, Thomas WR, Hage MV, Vieths S. Characterization of Der p 21, a new important allergen derived from the gut of house dust mites. Allergy. 2008
Jun;63(6):758‑67. doi: 10.1111/j.1398‑9995.2008.01647.x. PubMed PMID: 18445190 71. Weghofer M, Grote M, Resch Y, Casset A, Kneidinger M, Kopec J, Thomas WR,
Fernández‑Caldas E, Kabesch M, Ferrara R, Mari A. Identification of Der p 23, a peritrophin‑like protein, as a new major Dermatophagoides pteronyssinus allergen associated with the peritrophic matrix of mite fecal pellets. J Immunol. 2013 Apr 1;190(7):3059‑67. doi: 10.4049/jimmunol.1202288. PubMed PMID: 23460742 72. Zuiani C, Custovic A. Update on house dust mite allergen avoidance measures for asthma. Curr Allergy Asthma Rep. 2020 Sep;20(9):1‑8. doi: 10.1007/s11882‑020‑ 00948‑y. PubMed PMID: 32561997
Anca‑Daniela Cotuna‑Coste1, Maria Bodnari1, Rebeca‑Miruna Gherman1, Corina‑Mihaela Maniu1, Carmen Panaitescu2,3,4
1. Spitalul Clinic Județean de Urgență „Pius Brînzeu”, Timișoara 2. Disciplina Fiziologie, Departamentul III Științe Funcționale, Universitatea de Medicină și Farmacie „Victor Babeș”, Timișoara 3. Centrul de Imunofiziologie și Biotehnologii, Disciplinele Fiziologie și Imunologie, Departamentul III Științe Funcționale, Universitatea de Medicină și Farmacie „Victor Babeș”, Timișoara 4. Centrul de terapii genice și celulare în tratamentul cancerului OncoGen – Spitalul Clinic Județean de Urgență „Pius Brînzeu”, Timișoara Autor corespondent: Carmen Panaitescu, e-mail: cbunu@umft.ro
ABSTRACT
Nowadays, there is a growing demand for new types of food which are less resource consuming and cheaper to produce. One solution could be to introduce edible insects on the food market in developing countries, but also in Europe and North America, where entomophagy is a less common practice. The house cricket (Acheta domesticus) is of particular interest because it is an important source of protein, although it is often found as a hidden source in food. Thus, several issues related to consumer’s safety arise. Firstly, there are risks related to contamination with microorganisms and toxins. On the other hand, there is the problem of primary allergen sensitization and the increased potential for cross-reactivity to cricket proteins, with the possibility of developing allergic reactions, up to anaphylactic shock. The cricket, as a member of the arthropod phylum, has many proteins that are similar to those of other insects, house dust mites, crustaceans and also mollusks. The most common panallergens that are responsible for cross-reactions are tropomyosin and arginine kinase. A question which is raised is whether cricket is a new source of food or a new source of allergens. Keywords: house cricket, anaphylactic shock, entomophagy, cross-reactivity, tropomyosin, arginine kinase
Introducere
În contextul global actual dominat de creșterea populației și de reducerea surselor de hrană, apar tot mai pregnant două provocări majore: malnutriția în cazul unui număr tot mai mare de oameni și poluarea mediului înconjurător(1). O sursă alternativă de hrană la consumul tradițional alimentar poate fi consumul de insecte. Insectele sunt deja, pentru multe comunități, o parte semnificativă din dietă, fiind consumate în mai multe țări din Africa, America de Sud, Asia și Oceania. Dimensiunea consumului alimentar de insecte este impresionantă, în prezent fiind aproximativ 2000 de specii de insecte consumate în 80% dintre țările lumii, de către aproximativ 2 miliarde de oameni(2). Cel mai des, insectele sunt o sursă alimentară în regiunile tropicale, deoarece cresc până la dimensiuni mari și sunt ușor de recoltat. Cu toate acestea, pe piețele occidentale, insectele sunt mai greu acceptate ca sursă de hrană, din punct de vedere cultural și social. Greierul de casă (Acheta domesticus) prezintă un interes aparte, din moment ce este pe cale să fie aprobat pentru creștere și consum în Europa(2). Scopul acestei lucrări este de a prezenta beneficiile, dar și riscurile legate de consumul greierului de casă, mai ales luând în considerare faptul că acesta poate fi o sursă de sensibilizare alergenică, precum și de șoc anafilactic(3) .
REZUMAT
În contextul mondial actual, se urmărește introducerea unor noi tipuri de hrană, care să fie mai puțin consumatoare de resurse și mai ieftin de produs. Una dintre soluții este introducerea entomofagiei pe scară largă în țările în curs de dezvoltare, dar și în Europa și America de Nord, unde aceasta este mai rar întâlnită. Un interes aparte îl reprezintă greierul de casă (Acheta domesticus) ca sursă importantă de proteine, de multe ori fiind o sursă ascunsă în alimente. De aici se ridică mai multe probleme legate de siguranța consumatorului. Pe lângă riscurile induse de contaminarea cu microorganisme și toxine, se pune problema sensibilizării alergenice primare și a potențialului crescut de reacții încrucișate față de proteinele din greier, cu riscul generării de reacții alergice, până la șoc anafilactic. Greierul, fiind un artropod, are numeroase proteine similare cu ale altor insecte, acarienilor din praful de casă și crustaceelor, dar și cu ale moluștelor. Cele mai frecvente panalergene care sunt responsabile de reacțiile încrucișate sunt tropomiozina și arginin kinaza. Astfel, se pune întrebarea dacă greierul este o nouă sursă de hrană sau o nouă sursă de alergene. Cuvinte-cheie: greierul de casă, entomofagie, șoc anafilactic, reactivitate încrucișată, tropomiozina, arginin kinază
Entomofagia în trecut și în prezent
Hrănirea cu insecte se numește entomofagie. Se poate considera că toți oamenii sunt deja entomofagi și se estimează că o persoană ingeră în medie 500 g de insecte pe an, accidental sau sub formă ascunsă în salate, fructe, orez, unt de arahide și în multe alte alimente. Ouăle, larvele, pupele și forma adultă a anumitor insecte au fost consumate de oameni din timpurile preistorice și până în prezent. Literatura din China antică, de exemplu, citează o impresionantă înregistrare a tuturor alimentelor, inclusiv a unui număr mare de insecte(4). Pe de altă
parte, în majoritatea țărilor occidentale, entomofagia este privită cu un sentiment de dezgust, alimentația cu insecte fiind o alternativă de neacceptat, asociată cu un comportament primitiv. Dezgustul formează o bază a judecății morale și joacă un rol major în respingerea insectelor comestibile de către oameni(4) .
Studiile care au urmărit modalitatea de schimbare a percepției față de entomofagie au concluzionat că, minimizând gradul de percepție a insectelor în alimente, crește acceptabilitatea acesteia. Câteva cercetări printre consumatorii occidentali arată că ingerarea de insecte sub formă întreagă le amintește că animalul era viu înainte să fie pregătit pentru consum, iar această idee provoacă atitudini negative față de insecte(3). Prin urmare, o variantă mai bună de a consuma insecte este sub formă ascunsă, așa cum este făina de insecte sau extractul de proteine(4) .
Interesul global pentru entomofagie – conceptul One Health
Organizația pentru Alimentație și Agricultură (FAO), Organizația Mondială a Sănătății (OMS) și Organizația Mondială pentru Sănătatea Animală (OIE) folosesc următoarea definiție a conceptului One Health: „Eforturile de colaborare a mai multor discipline care lucrează la nivel local, național și global pentru a obține o sănătate optimă pentru oameni, animale și pentru mediul înconjurător”. One Health este un mijloc de gestionare la amenințările reprezentate de interfața dintre sănătatea umană, animală și a mediului și recunoaște legăturile puternice și interconectarea dintre acestea(4) .
Entomofagia, precum și utilizarea insectelor pentru hrana animalelor reprezintă un domeniu în care ar putea fi aplicat acest concept, deși necesită mai multe cercetări. Este larg acceptat faptul că, până în 2050, la nivel global vor fi 9 miliarde de oameni. Pentru a hrăni acest număr în creștere, producția actuală de alimente va trebui aproape dublată. Terenul este insuficient și extinderea de terenuri dedicate agriculturii este rareori o opțiune viabilă sau de durată. În oceane se practică un pescuit excesiv, iar schimbările climatice și lipsa de apă aferentă ar putea avea implicații profunde pentru producția de alimente. Pentru a face față provocărilor alimentare și nutriționale actuale, având în vedere că există aproape 1 miliard de oameni înfometați cronic în toată lumea, trebuie reevaluate consumul și producția de mâncare și trebuie găsite noi modalități de cultivare a alimentelor(4) .
Beneficiile consumului de insecte
În țările în curs de dezvoltare, insectele sunt privite în mod tradițional ca o delicatesă. Acestea sunt consumate sub formă de insecte întregi sau sunt încorporate în diferite produse alimentare, ca ingrediente. Recent a existat un mare interes de cercetare în cultivarea, procesarea și consumul insectelor comestibile, în principal într-un efort de eradicare a nesiguranței alimentare predominante în multe țări în curs de dezvoltare. Includerea insectelor comestibile în dietele umane s-a dovedit că îmbunătățește calitatea nutrițională a alimentelor datorită nivelurilor ridicate de micronutrienți și macronutrienți, care sunt comparabile și uneori chiar mai mari decât cele ale alimentelor de origine animală(5). Din punct de vedere nutrițional, insectele oferă surse importante de vitamine, minerale, fibre și proteine de origine animală. De asemenea, necesită mai puțină hrană pentru fiecare kilogram de aliment produs și au o creștere relativă mai mare și emisii de gaze cu efect de seră mai scăzute comparativ cu creșterea porcilor și bovinelor(6) .
Acheta domesticus necesită 1,7 kg de furaje uscate pentru a produce 1 kg de alimente, comparativ cu 2, 4 și 7 kg pentru păsări, porci și bovine(7). Conform previziunilor Organizației pentru Alimentație și Agricultură, va fi necesară o creștere de 70% a producției agricole globale pentru a satisface cererea așteptată. Având în vedere eficiența lor, insectele comestibile ar putea juca un rol important pentru a satisface această cerere în creștere, în special ca o sursă importantă de proteine animale(8) .
La ora actuală se încearcă introducerea greierilor în alimente cât mai diverse – de la batoane proteice, pâine, paste și burgeri până la ciocolată, cafea, fursecuri, înghețată – și chiar băuturi, cum este berea de greier(4) .
Într-un studiu care a evaluat efectele consumului de 25 de grame/zi de pulbere de greier întreg timp de 6 săptămâni, s-au observat schimbări asupra compoziției microbiotei intestinale. Pulberea de greier a întreținut creșterea bacteriilor probiotice de la nivelul intestinului – de exemplu, Bifidobacterium animalis a crescut de 5,7 ori. Consumul de greier a fost, de asemenea, asociat cu reducerea plasmatică a TNF-α. Aceste date arată cum poate contribui consumul de greier la îmbunătățirea statusului fiziologic al intestinului și cum poate reduce inflamația sistemică; cu toate acestea, sunt necesare mai multe cercetări pentru a înțelege aceste efecte și mecanismele lor de bază(9) .
Riscurile consumului de insecte
Riscurile la care se pot expune consumatorii de insecte sunt variate și se împart în trei mari categorii: riscuri biologice (bacterii și paraziți), riscuri chimice (micotoxine, metale grele și pesticide) și riscuri de reacții alergice.
1. Riscuri biologice induse de consumul de insecte
a) Bacteriile
Riscul de contaminare cu agenți patogeni există într-o anumită măsură, mai ales când insectele sunt consumate crude. Acest aspect este valabil pentru majoritatea alimentelor și insectelor, care trebuie tratate cu aceeași grijă ca și alte produse alimentare. Este întotdeauna cel mai bine să fie gătite anterior consumului.
În literatura științifică, studiile despre contaminarea microbiană a insectelor comestibile sunt limitate, dar este un domeniu de interes crescut și de cercetare. Datele disponibile cu privire la acest aspect par să sugereze că atât microorganismele care produc alterare, cât și cele patogene pot fi inerente și că gradul de contaminare depinde de mai mulți factori, inclusiv tipul de insecte, mediul de creștere, fie sălbatic sau domesticit, procedeele de prelucrare și manipulare utilizate în pregătirea lor,
precum și respectarea măsurilor de igienă. Este bine recunoscut faptul că mai multe genuri de bacterii patogene, inclusiv Escherichia, Staphylococcus și Bacillus, pot infecta atât oamenii, cât și nevertebratele (inclusiv insectele), prezentând riscuri pentru sănătatea consumatorilor de insecte comestibile, chiar și în cazurile în care nu există contaminarea alimentelor din alte surse(4) .
Microorganismele patogene asociate adesea în izbucnirea bolilor de origine alimentară au fost izolate în multe tipuri de insecte comestibile. Au fost prezentate un număr de rapoarte privind infecțiile microbiene și intoxicațiile alimentare provenite din entomofagie. Cele mai frecvente specii bacteriene patogene care au fost izolate din insecte comestibile aparțin genurilor Staphylococcus, Micrococuss, Bacillus, Salmonella, Shigella și Clostridium.
Este necesar să se asigure proceduri igienice de producere a insectelor comestibile, prelucrare, conservare și manipulare pentru a reduce riscurile de răspândire a bolilor microbiene transmisibile prin alimente(4) .
b) Paraziții
Rolul insectelor comestibile în transmiterea bolilor parazitare este încă investigat, existând studii care atestă transmiterea paraziților de către unele insecte comestibile. Probabilitatea ca insectele recoltate din sălbăticie să transmită boli parazitare la om este mai mare decât în cazul insectelor crescute la ferme, deoarece insectele colectate din mediul sălbatic nu sunt limitate în spațiu și hrana lor nu este controlată, spre deosebire de insectele crescute la fermă(10). Greierii sunt consumați întregi în Thailanda și sunt frecvent infestați de paraziții Nosema spp., Gregarine spp. și Steinernema spp(11). În studiile făcute recent, s-a formulat o ipoteză cu privire la posibilitatea ca Abbreviata antarctica, un parazit al șopârlei, să poată avea greierii ca gazdă intermediară(2) .
2. Riscuri chimice induse de consumul de insecte
a) Micotoxinele
Micotoxinele sunt considerate cele mai importante substanțe care contaminează alimentele în raport cu impactul lor negativ asupra sănătății publice și a securității alimentare. Acestea sunt metaboliți secundari produși de numeroase mucegaiuri fitopatogene și de cele care alterează alimentele din genurile Fusarium, Aspergillus și Penicillium. Micotoxinele pot fi prezente și în substratul de alimente pe care sunt crescute insectele comestibile.
Potrivit FAO, micotoxinele detectate și cuantificate în insectele comestibile pot proveni din contaminarea substratului furajer de către cele trei genuri de mucegaiuri menționate anterior, precum și din producția lor în intestinul insectelor. Această observație demonstrează că insectele comestibile pot constitui o preocupare potențială pentru siguranța alimentelor, în special din cauza efectelor acute și cronice pe care aceste toxine le pot avea atât asupra sănătății umane, cât și a celei animale(12) .
Dintre toate micotoxinele detectate și cuantificate la insectele comestibile, aflatoxinele sunt cele care ar constitui cea mai mare problemă pentru sănătate, care apare în special în țările tropicale în curs de dezvoltare. Aflatoxinele sunt substanțe cancerigene dovedite. Un alt efect al acestora este încetinirea creșterii la copii(13) .
b) Metalele grele
A fost documentată o posibilă acumulare de metale grele la insectele comestibile, care depinde de numeroși factori, inclusiv de speciile de insecte, faza de creștere și substratul de hrană. Metalele grele – de obicei considerate toxice sistemice – includ plumbul, mercurul, arsenicul și cadmiul și sunt elemente metalice capabile să inducă toxicitate la niveluri scăzute de expunere. Se știe că o contaminare a alimentelor cu metale grele provoacă efecte negative asupra sănătății, atât acute, cât și cronice, la om și animale. În prezent există cunoștințe limitate cu privire la siguranța alimentară legată de concentrația de metale grele din insecte(4) .
c) Pesticidele
Pesticidele sunt o problemă în cazul insectelor adunate din sălbăticie și care nu au fost cultivate într-o fermă pentru consum uman. Uneori hrana lor poate fi tratată cu pesticide, ducând la acumularea acestora în organism. Astfel, consumatorii de insecte hrănite natural prezintă risc de intoxicație. În prezent, pentru prevenirea intoxicațiilor cu pesticide la consumatorii de insecte comestibile, este recomandată creșterea lor în ferme în care hrana poate fi controlată(2) .
3. Riscuri alergenice induse de consumul de insecte
Alergia alimentară este o problemă emergentă de sănătate publică, a cărei gestionare continuă să reprezinte o mare provocare pentru industrie și pentru practicienii din domeniul sănătății din întreaga lume. Deoarece cea mai mare componentă a insectelor comestibile sunt proteinele, este posibil ca unele insecte și alimente derivate din insecte să fie potențiale surse de alergene(14) .
Toate alergenele identificate până în prezent din insecte sunt proteine care aparțin familiilor de proteine conservate, și anume proteine musculare, precum tropomiozina, miozina și proteina sarcoplasmatică de legare a Ca, și enzime precum α-amilaza, chitinaza, glutationul S-transferaza (GST), arginin kinaza, proteaza serică și tripsina(15) .
a) Proteinele musculare
Proteinele musculare – tropomiozina, miozina și proteina sarcoplasmatică de legare a Ca – au fost identificate ca alergenele majore din insectele comestibile. Toate aceste alergene din proteinele musculare prezintă o rezistență destul de mare atât la proteoliză, cât și la denaturarea termică.
Conform relației filogenetice, literatura de specialitate demonstrează că insectele și crustaceele împărtășesc mai multe alergene comune. Insectele și crustaceele aparțin celei mai diversificate încrengături a regnului animal – artropodele. Ele sunt definite de exoscheletul lor și de corpurile lor segmentate. Pe lângă insecte și crustacee, ceilalți membri ai acestei mari familii sunt arahnidele (păianjeni, acarieni și scorpioni) și miriapodele (milipede și centipede)(16) .
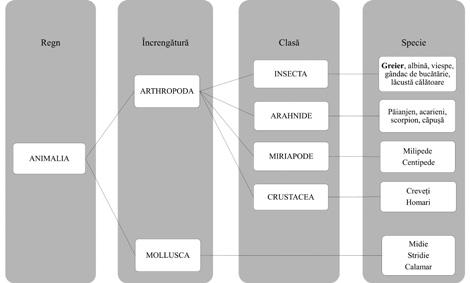
Figura 1. Principalele specii de insecte care pot da reacții alergice încrucișate și relația lor filogenetică față de alte artropode și față de moluște
Tropomiozina insectelor este similară cu cea din crustacee. Trebuie luat în considerare faptul că acele persoanele care sunt alergice la crustacee pot dezvolta o reacție alergică după ingestia de insecte(17). Alergenele majore ale acarienilor – de exemplu, Der f 10 și Der p 10 din Dermatophagoides farinae și Dermatophagoides pteronyssinus – sunt, de asemenea, tropomiozine. Multe specii de crustacee și moluște conțin tropomiozina ca alergen muscular major. Anisakis simplex, care este un nematod, prezintă ca alergen major Ani s 3, tot o tropomiozină(15) .
În aceste condiții, tropomiozina apare ca un panalergen major, găsindu-se în mare parte în acarieni, insecte, crustacee, moluște și nematode(18) .
b) Enzimele
Din insectele comestibile au fost identificate enzime cu potențial sensibilizant, inclusiv hidrolaze, precum α-amilaza, chitinaza, proteaza serică și tripsina, dar și enzime metabolice, cum sunt arginin kinaza, glutation S-transferaza și triozofosfat izomeraza(15) .
Arginin kinaza
Arginin kinaza a fost identificată ca un panalergen răspândit pe scară largă din diferite insecte, cum sunt viermele de făină (Tenebrio molitor), greierul de câmp (Gryllus bimaculatus) și greierul de casă (Acheta domesticus), dar și în cazul creveților și al crabilor. Arginin kinazele sunt alergenele majore și ale gândacului de bucătărie german (Blattella germanica) și ale gândacului de bucătărie american (Periplaneta americana). Multe alte alergene ale acarienilor, cum sunt Der f 20 din D. farinae, Der p 20 din D. pteronyssinus și Gly d 20 din G. destructor, fac parte din familia arginin kinazelor(15) .
Triozofosfat izomeraza
Triozofosfat izomeraza (TPI) este o enzimă cu un rol important în glicoliză și care este esențială pentru producția de energie. TPI a fost găsită în aproape fiecare organism, pornind de la mamifere și insecte, până la ciuperci, plante și bacterii. Aceasta a fost identificată în studiile recente ca alergen primar pentru caracatiță (Octopus fangsiao)(19) și pentru litchi (Litchi chinensis)(20) . În plus, Scy p 8 este un alergen identificat pentru crab și cauzează frecvent reacții încrucișate cu celelalte crustacee. De asemenea, această TPI este considerată un alergen important și în cazul greierului de casă(15) .
c) Alte surse alergenice
Alte proteine care sunt implicate în căile metabolice (tioredoxina) sau cele care prezintă funcții structurale (tubulinele) ori fiziologice (hemocianina și hexamerina) apar ca alergene minore din insectele comestibile(15) .
Hexamerina
Folosind o abordare bazată pe proteomică și bioinformatică, au fost cercetate insectele comestibile, cum sunt greierul de casă (Acheta domesticus), lăcusta călătoare (Locusta migratoria) și viermele galben (Tenebrio molitor). Cele mai multe alergene constau în proteine filogenetice, răspândite pe scară largă în diferitele grupuri de artropode (acarieni, insecte, crustacee) și moluște. Hexamerinele sunt „proteine de stocaj” și au fost găsite la toate insectele studiate. Utilizarea lor principală este de a stoca și elibera energie în perioadele în care insectele se hrănesc mai puțin, cum ar fi în timpul pupației sau în stadiul adult. Se crede, de asemenea, că ar putea juca un rol în semnalul pupației. Datorită formei și mărimii lor, s-a emis ipoteza că această proteină derivă din hemocianina prezentă în crustacee. Cu toate acestea, hexamerina este o proteină foarte specifică pentru insectele comestibile(15). Deși hexamerina B1 a fost găsită ca alergen specific greierului, aceasta poate fi întâlnită ca alergen și în cazul altor insecte(2) .
Tabelul 1 Posibilele reactivități încrucișate ale greierului de casă (Acheta domesticus) cu alte nevertebrate
Posibile reactivități încrucișate
+Acheta domesticus –familia de alergene
Crustacee Moluște Creveți Gândacul de bucătărie ( Blattella americanus ) Gândacul german( Blattella germanica ) Acarienii din praful de casă ( Dermatophagoides pteronyssimus ) Acarienii din făină ( Dermatophagoides farinae ) Greierul de câmp mediteraneean ( Gryllus bimaculatus ) Greierul de casă tropical ( Gryllodes Sigillatus )
Proteine musculare
Enzime
1. Hidrolaze
2. Metabolice Miozina + + + Tropomiozina + + + + + + + + + Troponina C
Chitinaza α-amilaza Arginin kinaza + + + + + + + + + Triozofosfat izomeraza + + +
Alte proteine structurale și funcționale
Polizaharide Tubulina – lanț α Hexamerina B1 + Chitina Apolipoforina III Viespea de hârtie europeană ( Polistes dominula ) Fluturele de mătase ) ( Bombyx mori Lăcusta călătoare ( Locusta migratoria ) Apis melifera ) Albina ( Viermele de făină ) ( Tenebrio molitor
Apolipoforina III și proteina cuticulară larvară
Într-o măsură mai mică, alte proteine, cum ar fi apolipoforina III și proteina cuticulară larvară, au prezentat, de asemenea, o specificitate destul de bună pentru insectele comestibile. Aceste proteine, care aparent lipsesc sau sunt mult mai puțin reprezentate în alte grupuri de artropode, moluște și nematode, împărtășesc secvențe de aminoacizi bine conservate și structuri tridimensionale foarte similare între ele. Datorită capacității lor de a declanșa un răspuns alergic la persoanele sensibilizate, acestea ar trebui utilizate pentru detectarea specifică a proteinelor din insectele folosite ca ingrediente în diferite produse alimentare și pentru a evalua siguranța alimentară a acestora, din punct de vedere alergologic(21) .
Chitina
Alergiile pot fi declanșate și de chitină, care este al doilea cel mai frecvent polizaharid din natură. Chitina poate fi găsită frecvent la organismele inferioare, cum sunt ciupercile, crustaceele sau insectele, dar nu și la mamifere.
Studiile relevă că răspunsul imunologic la chitină și rolul său în inducerea alergiilor sunt dependente de mărimea particulelor substanței chitinice. Acest lucru înseamnă că, deși particulele de chitină de dimensiuni medii pot provoca un răspuns alergic, particulele de chitină de dimensiuni mai mici pot avea un efect opus și să reducă răspunsul alergic(22) .
Chitina exoscheletelor insectelor se comportă în organismul uman asemenea celulozei, pentru că nu poate fi digerată, și din această cauză a luat denumirea de „fibră animală”. Astăzi, din cauza lipsei de alimente care conțin chitină, există o deficiență a enzimei chitinază care scindează chitina. Unii indivizi au o cantitate atât de mică din această enzimă, încât consumul de insecte poate provoca o reacție alergică la aceștia. Persoanele cele mai expuse riscului sunt cele care sunt alergice la fructele de mare, cum sunt creveții(23) .
Șocul anafilactic în urma ingestiei de insecte
În Asia a fost raportată anafilaxia la insectele ingerate. Un studiu retrospectiv efectuat în urma înregistrărilor pe parcursul a doi ani ale pacienților veniți în urgențe întrun spital din Thailanda a raportat șapte cazuri de anafilaxie cauzate în urma consumului de lăcuste și greieri. Dată fiind practica pe scară largă a entomofagiei în Asia, deși nu este menționat, s-a presupus că acești pacienți au fost sensibilizați anterior prin ingestia de insecte(3) .
Un studiu de cercetare din China a colectat din 1980 până în 2007 un număr de 358 de episoade de șoc anafilactic cauzate de ingestia de alimente. Printre cele mai frecvente alergene implicate au fost insectele comestibile, într-un procent de 14%(24) .
Prezența la toate insectele comestibile a alergenelor tropomiozină și arginin kinază, care reacționează încrucișat cu alergenele majore din componența creveților, acarienilor, moluștelor și chiar a nematodelor, sugerează că pacienții alergici la acestea sunt expuși riscului de reacții alergice când consumă insecte sau produse alimentare care conțin insecte.
Astfel, este important ca toți consumatorii să fie informați despre riscul de șoc anafilactic, prin etichetele adecvate pentru alimentele și produsele alimentare care conțin insecte(25) .
Într-un studiu din 2019 se arată că pacienții alergici la crustacee, acarienii din praful de casă și la musca domestică pot avea probleme din cauza unor reacții încrucișate cu proteinele din lăcusta de deșert și din greierul de casă. Astfel, pacienții care se cunosc alergici la acestea ar trebui avertizați înainte de a consuma insecte, deoarece sunt predispuși în mod special să reacționeze încrucișat.
Relevanța in vivo a acestei observații a fost dovedită prin testarea prick cutanată a pacienților alergici la crustacee, unde s-au observat reacții doar la extractele nemodificate, dar nu și la cele care au fost modificate enzimatic sau prin încălzire. Prin urmare, o metodă adecvată de procesare a alimentelor poate reduce reactivitatea încrucișată și alergenicitatea la insectele comestibile(26) .
Concluzii
Malnutriția în cazul unui număr tot mai mare de oameni și poluarea mediului înconjurător sunt în prezent două provocări majore la nivel global. Factorii sociali, demografici și economici contribuie la schimbarea stilului de viață și a obiceiurilor alimentare și pun presiune asupra resurselor pentru producerea hranei. În acest context, insectele comestibile reprezintă o alternativă și o sursă de nutrienți de calitate și pot juca un rol important în rezolvarea problemelor legate de nesiguranța alimentară și nutrițională(1) .
În ciuda avantajelor pe care entomofagia le poate avea asupra planetei și asupra combaterii malnutriției, rămân riscuri serioase de luat în considerare. Printre riscurile majore se numără potențialul de reacții alergice, care se dovedește a fi important, ca urmare a posibilității crescute de reacții încrucișate. Reacțiile alergice la proteinele din insecte pot avea severități diferite, ajungând până la șoc anafilactic, având în vedere că sunt termostabile și rezistente la denaturarea enzimatică. Adevărata prevalență a alergiilor alimentare la insectele comestibile nu este complet cunoscută deocamdată. În schimb, se anticipează o înmulțire a cazurilor de alergie la insecte, acest lucru fiind datorat creșterii consumului și în țările occidentale(26) .
O altă problemă o constituie bacteriile, paraziții, pesticidele, metalele grele și toxinele care pot fi prezente în insectele comestibile(2). Un risc posibil este și consumul într-o etapă de dezvoltare inadecvată a insectei. La unele insecte este necesară îndepărtarea picioarelor înainte de consum, altfel putând duce la blocaje intestinale care pot avea consecințe fatale(27) .
Nu în ultimul rând, trebuie să fie puse în discuție modul de percepție și sentimentul pe care îl are fiecare individ față de consumul de insecte. Admițând că există viziuni diferite privind conceptul de dietă sustenabilă și sănătoasă, Organizația pentru Alimente și Agricultură a ONU și Organizația Mondială a Sănătății au definit conceptul de dietă sănătoasă și sustenabilă ca fiind dieta care promovează sănătatea individului și starea de bine în toate dimensiunile sale, are un impact minor asupra mediului, este accesibilă, convenabilă, sigură și echitabilă și este acceptabilă din punct de vedere cultural(25) .
Bibliografie
1. FAO and WHO. 2019. Sustainable healthy diets – Guiding principles. Rome. 2. Fernandez‑Cassi X, Supeanu A, Jansson A, Boqvist S, Vagsholm I. Novel foods: a risk profile for the house cricket (Acheta domesticus). EFSA Journal. 2018; doi:10.2903/j. efsa.2018.e16082. 3. Khan NU, Shakeel N, Makda A, Mallick AS, Ali Memon M, Hashmi SH, Khan UR, Razzak
JA. Anaphylaxis: incidence, presentation, causes and outcome in patients in a tertiary‑care hospital in Karachi, Pakistan. QJM: An International Journal of Medicine. 2013 Dec;106(12):1095–1101. 4. van Huis A, Van Itterbeeck J, Klunder H. Edible insects: future prospects for food and feed security. Food and Agriculture Organization of the United Nations. Rome, 2013. 5. Imathiu S. Benefits and food safety concerns associated with consumption of edible insects. NFS Journal.2020; 18:1‑11, https://doi.org/10.1016/j.nfs.2019.11.002. 6. Oonincx DGAB, de Boer IJM. Environmental Impact of the Production of
Mealworms as a Protein Source for Humans – A Life Cycle Assessment. PLoS One. 2012;7(12):e51145, https://doi.org/10.1371/journal.pone.0051145. 7. Collavo A, Glew R, Huang Y‑S, Chuang LT, Bosse R, Paoletti M. Housecricket
Smallscale Farming. Science Publisher, 2005. 8. High Level Expert Forum on Addressing Food Insecurity in Protracted Crises,
Report, 13‑14 September 2012, Food and Agriculture Organization, HQ, Rome, Italy. 9. Stull VJ, Finer E, Bergmans RS, et al. Impact of Edible Cricket Consumption on Gut
Microbiota in Healthy Adults, a Double‑blind, Randomized Crossover Trial. Sci Rep. 2018 Jul 17;8(1):10762. 10. Chai JY, Shin EH, Lee SH, Rim HJ. Foodborne intestinal flukes in Southeast Asia.
Korean J Parasitol. 2009;47:S69‑S102. 11. Hanboonsong Y, Jamjanya T Durst PB. Six‑legged livestock: edible insect farming, collection and marketing in Thailand. Food and Agriculture Organization of the
United Nations Regional Office for Asia and the Pacific Bangkok; 2013. 12. van der Fels‑Klerx HJ, Camenzuli L, Belluco S, Meijer N, Ricci A. Food safety issues related to uses of insects for feeds and foods. Compr Rev Food Sci Food Saf. 2018;17:1172‑1183. 13. Gong Y, Hounsa A, Egal S, Turner PC, Sutcliffe AE, Hall AJ, Cardwell K, Wild CP.
Postweaning exposure to aflatoxin results in impaired child growth: a longitudinal study in Benin, West Africa Environ. Health Perspect. 2004;112:1334. 14. Francis F, Doyen V, Debaugnies F, Mazzucchelli G, Caparros R, Alabi T, Blecker C,
Haubruge E, Corazza F. Limited cross reactivity among arginine kinase allergens from mealworm and cricket edible insects. Food Chemistry. 2019; 276:714‑718. 15. Rouge P, Barre A. Allergy to Edible Insects: A Computational Identification of the IgE‑Binding Cross‑Reacting Allergen Repertoire of Edible Insects. 2017; doi:10.5772/68124. 16. Valentine JW. On the Origin of Phyla, University of Chicago Press, 2004; page 33,
ISBN 978‑0‑226‑84548‑7. 17. Barre A, Velazquer E, Delplanque A, Caze‑Subra S, Bienvenu F, Bienvenu J, Benoist
H, Rouge P. Cross‑reacting allergens of edible insects (article in French). Revue
Francaise d’Allergologie. 2016;56:522–532. 18. Daul CB, Slattery M, Reese G, Lehrer SB. Identification of the major brown shrimp (Penaeus aztecus) allergen as the muscle protein tropomyosin. International Archives of Allergy and Immunology. 1994;105: 49–55. 19. Yang Y, Chen ZW, Hurlburt BK, Li GL, Zhang YX, Fei DX, Shen HW, Cao MJ, Liu GM.
Identification of triosephosphate isomerase as a novel allergen in Octopus fangsiao.
Mol Immunol. 2017 May;85:35‑46. doi: 10.1016/j.molimm.2017.02.004. 20. Hoppe S, Steinhart H, Paschke A. Identification of a 28 kDa lychee allergen as a triose‑phosphate isomerase. Food and Agricultural Immunology. 2006;17:1,9‑19. 21. Barre A, Pichereaux C, Simplicien M, Burlet‑Schiltz O, Benoist H, Rouge P. A
Proteomicand Bioinformatic‑Based Identification of Specific Allergens from
Edible Insects: Probes for Future Detection as Food Ingredients. Foods. 2021 Jan 30;10(2):280. 22. Burton OT, Zaccone P. The potential role of chitin in allergic reactions. Trends in
Immunology. 2007;28(10):419‑422. 23. Kouřimska L, Adamkova A. Nutritional and sensory quality of edible insects. NFS
Journal. 2016;4:22‑26. 24. Ji K, Chen J, Li M, Liu Z, Wang C, Zhan Z, Wu X, Xia Q. Anaphylactic shock and lethal anaphylaxis caused by food consumption in China. Trends in Food Science &
Technology. 2009;20(5):227‑231. 25. Sokol WN, Wunschmann S, Agah S. Anaphylaxis After First Ingestion of Chapulines (Grasshopper) in Patients Allergic to House Dust Mite, Cockroach, and Crustaceans.
Is Tropomyosin The Cause? Clin Immunol Infect Dis. 2017;1(1):1. 26. Pali‑Scholl I, Meinlschmidt P, Larenas‑Linnemann D, Purschke B, Hofstetter G,
Rodriguez‑ Monroy FA, Einhorn L, Mothes‑Luksch N, Jensen‑Jarolim E, Jager H.
Edible insects: Crossrecognition of IgE from crustacean‑ and house dust mite allergic patients, and reduction of allergenicity by food processing. World Allergy
Organization Journal. 2019 Jan 26;12(1):100006. 27. Pali‑Scholl I, Meinlschmidt P, Larenas‑Linnemann D, Purschke B, Hofstetter G,
Rodriguez‑ Monroy FA, Einhorn L, Mothes‑Luksch N, Jensen‑Jarolim E, Jager H.
Edible insects: Crossrecognition of IgE from crustacean‑ and house dust mite allergic patients, and reduction of allergenicity by food processing. World Allergy
Organization Journal. 2019 Jan 26;12(1):100006. 28. Kouřimska L, Adamkova A. Nutritional and sensory quality of edible insects. NFS
Journal. 2016;4:22‑26.




