

Manuale di Oftalmologia per Medici e Ortottisti
© Copyright FGE srl
ISBN 978-88-97929-01-7
Settembre 2022
FGE srl
Sede Legale e Operativa: Reg. Rivelle, 7/F – 14050 Moasca (AT)
Redazione: Strada 4 Milano Fiori, Palazzo Q7 – 20089 Rozzano (MI)
Tel. 0141 1706694 – Fax 0141 856013 – info@fgeditore.it – www.fgeditore.it
Gli Autori e l’Editore declinano ogni responsabilità per eventuali errori contenuti nel testo.
Tutti i diritti sono riservati.
È vietata ogni riproduzione totale o parziale.
Enzo M. Vingolo
Università “La Sapienza” di Roma – Polo Pontino Direttore U.O.C. Oculistica
Ospedale “A. Fiorini” Terracina (LT) e Ospedale “Santa M. Goretti” - Latina
Presentazione

1 LA VISITA OFTALMICA
1.1 Strumentazione di base
La strumentazione di base per un medico oftalmologo generale è la seguente:
– oftalmoscopio diretto per l’esame del fondo oculare;
– Cassetta lenti di prova con oculare portalenti: per la correzione dei difetti visivi.
– luce a focalizzazione diretta per l’esame della reazione pupillare e della ca- mera anteriore;
– lente asferica ad alto potere (+20D,+90D) per l’esame della camera anteriore e posteriore dell’occhio e della retina;
– tavola “ottotipica” di base per l’esame dell’acuità visiva attualmente a proiezione o computerizzata per la presentazione casuale dei simboli;
– retrattore palpebrale di Desmarres o un bastoncino di cotone sterile per l’eversione palpebrale;
– aghi da insulina o una “fresetta motorizzata” per asportazione di corpi estranei corneali.
– Tonometro si Goldmann: per la misurazione della pressione endooculare.
Medicazioni:

– collirio anestetico topico (per esempio ossibuprocaina 0,4% in gocce) per anestesia locale durante la rimozione di corpi estranei congiuntivali o corneali o per anestetizzare l’occhio prima di lavaggi congiuntivali che vanno effettuati dopo contatto oculare accidentale con sostanze acide o basiche (es.: calce, am- moniaca, candeggina…);
– soluzione fisiologica sterile per lavaggi di primo soccorso dopo contatto accidentale con sostanze estranee;
– colliri antibiotici per trattamenti urgenti, bende oculari sterili e nastro adesivo in cellulosa per un miglior bendaggio protettivo.
1.2 Anamnesi del paziente
Prima di visitare il paziente è bene rilevare la storia clinica completa, che solitamente include quattro aspetti:
STORIA FAMILIARE: molte patologie oculari sono ereditarie o ad alta incidenza nella stessa famiglia (es.: errori di refrazione, glaucoma, strabismo, distacco retinico, distrofie retiniche…). Uno degli esempi più eclatanti è il glaucoma cronico semplice che spesso è asintomatico anche in presenza di un danno visivo molto marcato. Il rischio relativo è di circa 1/10 nei parenti di primo grado e una diagnosi precoce consente di arrestare totalmente la malattia ad uno stato molto iniziale. Anche una storia familiare di strabismo può essere un fattore di rischio per la presenza o lo sviluppo di strabismo, senza sottovalutare le malattie eredodegenerative della retina (in questi casi è importante anche saper estrapolare un buon albero genealogico risalendo il più possibile ai parenti più prossimi e remoti).
STORIA MEDICO FARMACOLOGICA: molte patologie oculari possono corre- larsi a patologie sistemiche e molti aspetti andrebbero investigati: diabete, disordini tiroidei o reumatici, infezioni, ipertensione. L’uso prolungato di alcuni farmaci può indurre glaucoma o cataratta (es.: da corticosteroidi) o l’uso di clorochina può provocare maculopatia così come l’uso prolungato di cordarone può dar luogo alla cheratopatia a “baffo di gatto”.
STORIA OFTALMOLOGICA: (troppo spesso è effettuata in modo superficiale e frettoloso), invece è essenziale ricercare informazioni riguardanti lo stato attuale e pregresso. Es.: se il paziente lamenta lacrimazione (mono o binoculare, semplice o accompagnata da bruciore, neutra o con occhi rossi, sempre o in particolari momenti della giornata o dell’anno, se portatore di LAC); se il paziente lamenta visione offuscata (mono o binoculare, da quanto tempo, insorgenza lenta o improvvisa, nella visione per lontano o per vicino, totale o settoriale). Inoltre, bisogna sempre investigare l’eventuale assunzione di farmaci o medicamenti locali e sistemici non- ché eventuali interventi chirurgici ricordando che spesso il paziente, soprattutto se anziano, dimentica di riferire nozioni importanti.
STORIA CLINICA CORRENTE: investigare sempre sul motivo della visita, se trattasi di un semplice controllo o se lamenta qualcosa nello specifico e soffermarsi sui sintomi riferiti. A volte è necessario richiedere le stesse cose più volte perché il paziente sia più preciso possibile.
1.3 Funzioni della vista

Acuità visiva
La capacità dell’occhio di discriminare il più piccolo dettaglio di un carattere ad una distanza determinata è definita come acuità visiva. Siccome in ogni soggetto può differire leggermente si è definita convenzionalmente dopo rilievi statistici eseguiti su un campione di popolazione molto vasto.
L’acuità visiva normale (naturale) si misura facendo leggere il soggetto prima con un occhio alla volta poi binocularmente determinati caratteri standardizzati su una monitor guidato da un computer che presenta simboli e lettere in modo casuale, questo sistema va posto a distanze non inferiori a tre metri per evitare l’accomodazione (detta prossimale) del paziente questo sistema viene denominato ottotipo.

La misura è data dalla frazione di Snellen: l’acuità visiva di un soggetto è data dal rapporto tra la distanza alla quale il soggetto legge un determinato carattere (d) e la distanza alla quale un occhio normale leggerebbe lo stesso (D)
Acuità visiva = d/D
Il visus normale è quello di un soggetto in grado di leggere un carattere o un simbolo la cui altezza sottenda ad un angolo di 5’ ed il cui dettaglio caratterizzante (cioè tratto più piccolo di esso visibile) sottenda ad un angolo di 1’ cioè l’angolo minimo in cui due punti sono ancora visibili come separati tra loro. È bene precisare che oggi si usano anche ottotipi a proiezione che hanno perlopiù soppiantato i vecchi a retroilluminazione. Anche questi sistemi non sottostanno alla
regola precisa della distanza di 3 o 5 metri poiché, si autoregolano su un quadro di proiezione e con un semplice telecomando si possono ottenere moltissimi test e non tutti presenti nei vecchi ottotipi (tavole per astigmatismo, rosso/verde, simboli per visus dei bambini, E di Albini unite e separate, C di Landolt, test numerici ed ortottici…). Qualora il livello della funzione visiva sia minore di 1/10 (ad esempio nei pazienti ipovedenti) si utilizzano tabelle differenti facendo avvicinare i pazienti ad 1/5 della distanza standard.
Conta dita a 1 m Conta dita a 1 m
Conta dita a 50 cm Conta dita a 50 cm
Conta dita a 30 cm Conta dita a 30 cm
Moto manu Moto manu
Percezione luminosa (settori) Percezione luminosa (settori)
Accomodazione
Si definisce accomodazione la capacità dell’occhio di modificare il suo potere diottrico in modo da permettere una buona conservazione della qualità dell’immagine sia nella visione da lontano che per vicino. La massima distanza in cui un occhio in fase di riposo distingue nitidamente un oggetto è detta punto remoto, mentre la minima di- stanza alla quale un oggetto è ancora percepibile nitidamente è detta punto prossimo e la funzione visiva frapposta tra i due punti è definita come estensione accomodattiva. La massima escursione visiva che può compiere il cristallino è detta ampiezza accomodativa, questa comincia a ridursi dopo i 30 anni di età fino a che dopo i 30 anni supera la distanza di 50 cm e richiede la prescrizione di un occhiale da vicino, questa difficoltà prende il nome di presbiopia. L’ampiezza accomodativa piena nell’infanzia raggiunge le 3,5–4 diottrie e si riduce progressivamente fino a raggiungere lo zero dopo i 60 anni. Per correggere la presbiopia si usano lenti correttive
sferiche positive da +1.00 D (diottrie) a +3.00 D (corrispondenti alle varie fasce di età, vedi Tabella seguente) aggiunte alla correzione per lontano. Nel caso di soggetti ipovedenti si possono utilizzare valori maggiori di +3.00 D considerando che ogni +4D si ha un ingrandimento (+4D = 1x, +8D= 2x, +12D=3x ecc.) ma in questo caso vengono usate lenti particolari con una curvatura asferica per ridurre le deformazioni dell’immagine (aberrazioni); l’ipovisione è un altro grande argomento che merita una trattazione a parte.)

Correzione della presbiopia fisiologica (distanza circa 30 - 35 cm.)
Nella presbiopia il punto di focalizzazione cade dietro la retina per diminuita accomodazione, ecco perché l’apposizione di una lente sferica positiva, di adeguato valore diottrico per l’età del soggetto permette la convergenza di tale punto sulla retina permettendone una nitida messa a fuoco.
Tabella di Donder (ampiezza accomodativa per le diverse età)
Questa tabella mostra chiaramente come l’accomodazione sia inversamente proporzionale all’aumentare dell’età: prima dei 40 anni essa decresce di 1 D ogni 4 anni; tra i 40 e i 48 anni l’accomodazione decresce di 1,5 D ogni 4 anni mentre dopo i 48 anni la diminuzione è pari a 0,5 diottrie sempre ogni 4 anni.
Cicloplegia
Per minimizzare, ed in alcuni casi impedire l’effetto confondente dell’accomodazione sulla misurazione della vista si effettua la cicloplegia ovvero il blocco recettoriale del sistema colinergico parasimpatico con paralisi momentanea del muscolo ciliare indotta da farmaci il principale è l’atropina, ma si può usare anche il ciclopentolato
che ha effetti meno prolungati (solo alcune ore); Altra applicazione è quella a scopo preventivo (es.: evitare la formazione di sinechie iridolenticolari) in particolari patologie infiammatorie dette uveiti. La cicloplegia si realizza con l’uso di colliri a base di molecole che provocano il blocco del muscolo ciliare e dello sfintere della pupilla realizzando la cosiddetta midriasi; l’effetto di questa midriasi differisce da quello precedente perché causato da farmaci simpaticomimetici che invece provocano una stimolazione dei recettori adrenergici con un effetto sul muscolo dilatatore della pupilla farmaci di questo tipo sono l’epinefrina e l’isonefrina.
1.4 Senso cromatico
La retina è sensibile alle onde elettromagnetiche comprese tra 380 e 760 nm (nanometri) che formano lo spettro della luce “visibile”. La luce con lunghezze d’onda superiori rientra nella gamma degli infrarossi mentre i raggi ultravioletti presentano lunghezze d’onda inferiori ed entrambi non sono visibili all’occhio umano. La capacità di discernere i colori deriva dalla teoria “tricromatica” (dagli studi di T. Young, Koenig ed Helmholtz) secondo cui esistono 3 colori fondamentali o primari (proprio perché mescolandone due non si può ottenere il terzo): rosso, verde e blu; tutti i colori dello spettro cromatico sarebbero la combinazione di questi. La percezione dei colori sarebbe possibile solo attraverso i coni sensibili ai tre colori primari e proprio dal sommarsi della stimolazione di due o tre tipi di coni sarebbe possibile visualizzare le sfumature intermedie degli altri colori che conosciamo.
La visione dei colori è peculiare della macula proprio perché effettuata attraverso i coni ed in caso di danni maculari il senso cromatico è principalmente colpito.
Valutazione del senso cromatico
I metodi per valutare la capacità di discernimento dei colori sono vari, dai più semplici ai più sofisticati.
Test di denominazione (esame con le matassine)
Si presentano all’esaminato alcune matassine di vari colori e si chiede di appaiare quelle di egual colore; questo metodo è veloce e facilmente praticabile ma non è utile nella discriminazione fine dell’eventuale difetto poiché il soggetto si può aiutare in base ad altre caratteristiche dei colori (es. saturazione, luminanza ecc…)
Test di confusione (Tavole di Ishihara)
Vengono presentate al soggetto delle tavole dette di “Ishihara” composte da piccoli pallini colorati di diverso diametro e variabili sia in colore che in intensità dello stesso. Ogni tavola presenta al centro una figura (solitamente un numero, come mostrato nell’esempio accanto) composta sempre da piccoli pallini colorati ma di colore differente. Il soggetto con un deficit parziale leggerà un numero errato mentre quello con un deficit assoluto non avrà percezione di alcuna figura.

Test di comparazione (pastiglie colorate)

È uno dei metodi più sofisticati per il discernimento anche delle sfumature dei vari colori; infatti, si usano delle scatole in cui vanno disposte ordinatamente delle pastiglie colorate con sfumature variabili anche di uno stesso colore e la difficoltà varia notevolmente dal Panel 15 Hue test al sofisticato e complesso Fanswort 100 Hue test
1.5 Senso stereoscopico
La stereopsi è la visione che noi percepiamo come tridimensionale ed ha origine dalla simultanea stimolazione retinica di elementi orizzontali (gli elementi verticali non inducono effetto stereoscopico).
L’area di Panum è definita come l’area di visione binoculare simultanea cioè zona in cui è possibile la visione binoculare con la percezione della profondità, al di fuori di questa area si presenta la diplopia.
Per valutare il senso stereoscopico si usano dei test che separano la percezione
dell’Occhio Destro dal sinistro, questa può essere ottenuta mediante filtri rosso/verde o polarizzati oppure mediante prismi di Fressnel per l’utilizzo senza occhiali. Tipico della prima modalità è il test TNO nel quale viene posto su un occhio un filtro rosso e sull’altro un filtro verde, il test viene effettuato con un cartoncino che ha livelli di distanziamento di anelli differente e si individua il più estremo che viene percepito separato dal paziente.
Più o meno sullo stesso principio sono il test della mosca ed il test di Wirth. Senza necessità di filtri sono i test di Lang I e II che presentano delle random dot da cui si stagliano forme di differenti profondità che il paziente viene invitato ad indicare (gatto, stella, macchina) ciascuno dei quali presenta un livello differente di disparità retinica.

1.6 Motilità oculare
L’esame della motilità oculare viene realizzato allo scopo di individuare delle anomalie nei movimenti dei singoli muscoli oculari perché talvolta una riduzione di funzionalità di uno di questi può comportare l’insorgenza di uno strabismo. Per effettuare l’esame dopo aver immobilizzato la testa del soggetto, l’esaminatore chiede al paziente di guardare verso ognuna delle nove posizioni di sguardo: 1. in alto a destra, 2. in alto, 3. in alto a sinistra, 4. a destra, 5. dritto, 6. a sinistra, 7. in basso a destra, 8. in basso, 9. in basso a sinistra.
L’esame delle sei posizioni di sguardo cardinali (destra, sinistra, in alto a destra, in basso a destra, in alto a sinistra ed in basso a sinistra) è sufficiente a verificare l’eventuale paralisi di uno dei sei muscoli extraoculari
Un errore nei movimenti oculari è il risultato di un blocco muscolare che è facilmente visibile con questo semplice esame. Solo uno dei muscoli retti è coinvolto in ogni posizione di sguardo destra o sinistra (muscolo retto mediale o laterale): tutte le altre posizioni di sguardo sono dovute al lavoro di tutti gli altri muscoli. Per evidenziare meglio la eventuale diplopia si effettua il test della diplopia o test del filtro rosso mettendo su un solo occhio un filtro rosso e presentando al paziente una sorgente luminosa. In presenza di una motilità normale il paziente percepirà la luce di fissazione rosata mentre in caso di diplopia ne vedrà una bianca ed una rossa, si avrà così la possibilità di evidenziare una diplopia omonima in cui la luce rossa (muscolo paretico è più vicino o al di qua della luce bianca), o diplopia crociata se la luce rossa è più lontana il muscolo paretico è più lontano oltre la luce bianca).
1.7 Cooperazione binoculare
Il test più importante per un’indagine della qualità della visione binoculare è il test delle luci di Worth o micro-worth in questo caso vengono presentate quattro luci due rosse una verde ed una bianca a distanza di 3-5 m, sugli occhi del paziente viene posto un occhiale costituito da un filtro rosso ed un filtro verde; se il paziente vede quattro luci (due rosse ed una giallognola la cooperazione è completa, viceversa se ne vede tre rosse è dominante l’occhio sul quale c’è il filtro rosso, mentre se ne vede due rosse e due verdi è dominante l’occhio sul quale c’è il filtro verde. In alcuni casi il paziente può vedere cinque luci qualora ci sia una deviazione importante o un’alternanza di fissazione. Il test delle micro-Worth si effettua allo stesso modo solo che essendo più piccole hanno una maggiore discriminazione spaziale e sensibilità. Test di valutazione dell’angolo di strabismo: Questi test oltre ad analizzare l’aspetto qualitativo della visione binoculare, in mani esperte forniscono informazioni quantitative importanti dello stato visivo binoculare del soggetto studiato. Il test dei Riflessi Corneali non necessita di strumentazioni particolari, si esegue velocemente e lo si può effettuare a persone di tutte le età. Misura l’angolo di strabismo, si effettua ponendo una sorgente luminosa davanti al paziente ed osservando i riflessi corneali. Se questi sono presenti sul centro di entrambi gli occhi la deviazione è pari a zero (ortoforia), se invece uno dei riflessi è spostato all’esterno si ha uno strabismo convergente (esotropia), viceversa se è spostato verso l’interno si ha una divergenza oculare (exotropia). Occludendo e riaprendo l’occhio si ha il Cover/Uncover test con questo test si evidenziano gli strabismi concomitanti intermittenti o latenti (ovvero nelle condizioni in cui la visione binoculare consente al paziente di controllare la deviazione oculare, scoprendo l’occhio si ha un movimento verso l’esterno nelle eso-

forie (nel caso di strabismo latente convergente), mentre si ha un movimento verso l’interno nelle exoforie (nel caso di strabismo latente divergente). Il Cover Test invece si effettua coprendo e scoprendo alternativamente i due occhi, anche in questo caso scoprendo l’occhio si ha un movimento verso l’esterno nelle esoforie (nel caso di strabismo latente convergente), mentre si ha un movimento verso l’interno nelle exoforie (nel caso di strabismo latente divergente) questo test è molto utile anche per evidenziare uno strabismo verticale, nel quale l’occhio si muove verso l’alto nelle ipoforie e verso il basso nelle iperforie. In mani esperte, anteponendo un prisma di valore variabile davanti l’occhio si può misurare l’angolo di strabismo che corrisponderà al valore del prisma al quale non si verifica il movimento oculare. Entrambi i test vanno effettuati sia fissando a distanza che per vicino in quanto l’angolo dei due occhi è parallelo per lontano ma tende a diventare convergente nella visione per vicino soprattutto nei giovani.
Gli strumenti che si utilizzano sono:
– PALETTA OCCLUSORIA di colore nero che funge da dissociatore totale della funzione binoculare (nel caso di bambini piccoli è preferibile l’uso della mano);
– MIRA DI FISSAZIONE di genere vario, anche in base all’età del paziente. Da lontano (5 metri) si usa solitamente una mira di proiezione su schermo, in genere una delle mire delle luci di Worth, della dimensione di circa 2 o 3 cm, mentre è sicuramente utile qualcosa in grado di attirare l’attenzione per i bambini. Da vicino (40 cm) si usa preferibilmente una luce puntiforme non abbagliante, che consente di ottenere i riflessi corneali che favoriscono delle valutazioni più fini; nei bambini è sempre meglio l’uso di oggetti simpatici come pupazzetti, animaletti e simili.
I test si eseguono sempre sia da lontano che da vicino sia per una normale differenza delle condizioni eteroforiche alle due distanze, sia talvolta, per assenza di visione binoculare ad una distanza e non all’altra. Il test si effettua in naturale e con gli occhiali abitualmente indossati dalla persona se ne è in possesso per valutarne le eventuali diversità di comportamento.
Si distinguono tre tipi diversi di cover test che si utilizzano di routine con pazienti normali, più un tipo di cover test con i prismi che si utilizza solamente in pazienti strabici per quantificare l’angolo di deviazione oltre al Parks Three Step Test per determinare il muscolo paretico in caso di strabismo verticale.
Cover test di scopertura
Questo test si esegue sempre dopo il cover test monoculare eseguito in entrambi gli occhi e dopo aver escluso un eventuale strabismo. Consiste nell’osservazione dell’oc-
chio precedentemente coperto per almeno 5 secondi, investigando così l’eventuale presenza di forie, la compensazione delle stesse e se il movimento di recupero della fusione è fluido. Il test andrebbe eseguito prima in un occhio e poi nell’altro e ripetuto più volte in modo da non tralasciare neanche la minima possibile anomalia.
Cover test alternato
Si copre alternativamente un occhio dopo l’altro senza mai lasciarli scoperti entrambi nello stesso momento e, interrompendo la fusione si può rilevare un’eventuale deviazione latente, oppure in caso di deviazione manifesta l’angolo può apparire maggiore rispetto a quello rilevato nella fase monolaterale. Il Cover Test alternante si utilizza per rilevare l’esistenza di un’eventuale foria e per effettuarne una quantificazione approssimata. Se nella fase monolaterale non si evidenzia strabismo e nella fase alternante sono apprezzabili dei movimenti, significa che il paziente è eteroforico; nel caso si noti un movimento nella fase monolaterale, sarà presente anche nella fase alternante e, come già rilevato nel cover test di scopertura si evidenzia di quale foria si tratta dal tipo di movimento.
Funzione primaria dei muscoli extraoculari in funzione della direzione di sguardo
SGUARDO A DX
Obliquo inferiore sinistro
Retto superiore destro
Obliquo superiore sinistro
Retto inferiore destro
SGUARDO A SN
Retto superiore sinistro
Obliquo superiore destro
Retto inferiore sinistro
Obliquo inferiore destro
INCLINAZIONE
TESTA A DX
INCLINAZIONE
TESTA A SN
Retto superiore destro
Obliquo superiore destro
Retto superiore sinistro
Obliquo superiore sinistro
Retto superiore sinistro
Obliquo superiore sinistro

Retto inferiore destro
Obliquo inferiore destro
1.8 Esame di ciglia e dotti lacrimali
La palpebra superiore ad occhi normalmente aperti ricopre circa la metà corneale mentre la palpebra inferiore di minore estensione si pone quasi a filo del margine inferiore dell’iride.
Il canalino lacrimale si esplora alla lampada a fessura con una lieve pressione sotto il puntino lacrimale inferiore ed è considerato normale se non rigurgita alla digitopressione, in caso di stenosi o chiusura del canale nasolacrimale si assiste ad intensa lacrimazione (detta epifora) che a volte viene accompagnata da secrezione muco purulenta soprattutto al risveglio.
La pervietà del dotto naso-lacrimale si sonda instillando soluzione di fluorescina al 10% nel sacco congiuntivale e si può ritenere aperto solo quando il colorante è espulso attraverso il secreto nasale dopo circa 2 minuti. Occorre comunque fare un lavaggio delle vie lacrimali con un apposito ago smusso ed una soluzione salina che può anche essere usata come solvente per iniettare nel dotto antibiotici. In caso di ostruzione o infezioni ed infiammazioni del dotto lacrimale bisogna sempre ricorrere ad un’accurata visita oftalmologica per evitare complicanze anche gravi.
1.9 Esame della congiuntiva
La congiuntiva deve essere esaminata con un’ispezione diretta: la congiuntiva bulbare è visibile ad occhio aperto fino alle ciglia, mentre per una migliore ispezione sempre alla lampada a fessura si invita il paziente a muovere l’occhio in tutte le posizioni esterne. Infine, tirando in basso la palpebra inferiore si osserva la congiuntiva inferiore ed effettuando l’eversione della palpebra superiore si osserva la più estesa congiuntiva sotto palpebrale superiore; la congiuntiva normale è trasparente, lucida, bianco perlacea e normo-irrorata dai vasi capillari
1.10 Esame della cornea
La cornea si esamina con una luce puntiforme ed una lente d’ingrandimento, ancora meglio alla lampada a fessura anche a forte ingrandimento. La cornea è trasparente, speculare e avascolare. È importante sondare l’eventuale presenza di abrasioni, cicatrici o zone di discontinuità con l’apposizione di fluorescina ed illuminata con luce azzurra va sempre portata via la fluorescina in eccesso mediante un lavaggio..
È importante anche sondare la sensibilità corneale in entrambi gli occhi: invitando il soggetto a guardare dritto avanti e tenendo aperta la palpebra superiore si tenta di toccare la cornea con un cotton fioc oppure con un apposito strumento chiamato
cheratoestesiometro sondando il riflesso di chiusura. Un deficit depone per una neuropatia facciale o del trigemino o per un’infezione corneale di tipo virale o per una cheratite neuroparalitica.
1.11 Esame della camera anteriore
La camera anteriore (CA) è piena di umore acqueo e deve essere perfettamente trasparente, bisogna sempre controllare l’eventuale presenza di cellule infiammatorie, di pus (ipopion) o di sangue (ipoema).
È fondamentale controllare la profondità della camera anteriore che è normale solo quando tutta l’iride, sotto il fascio luminoso della lampada a fessura che si porta da un lato all’altro, è perfettamente visibile ed illuminabile senza zone d’ombra. Soggetti con CA bassa durante la dilatazione possono manifestare un pericoloso attacco di glaucoma acuto.
1.12 Esame del cristallino
Il cristallino è visibile solo con la lampada a fessura, se trasparente e normale l’illuminazione diretta qualora si utilizzi la tecnica della retroilluminazione all’interno della pupilla si avrà un riflesso rosso dovuto alla riflessione della luce sul fondo oculare, su cui risalteranno e si noteranno opacità di differenti intensità ed opacità dal grigio chiaro al giallognolo fino al marrone. L’esplorazione accurata del cristallino prevede l’esame in midriasi per valutare la localizzazione delle eventuali opacità (nucleare, corticale, posteriore…).
1.13 Oftalmoscopia
Una buona oftalmoscopia è essenziale in molte patologie oculari ed è di fondamentale supporto per quelle sistemiche (è importante un esame del fondo oculare semestrale per i soggetti cardiopatici, diabetici, oncologici etc.). Inoltre ogni visita oculistica dovrebbe terminare con l’oftalmoscopia meglio se in midriasi senza però trascurare i possibili rischi della dilatazione come un possibile attacco di glaucoma acuto; bisognerebbe infatti avvisare i pazienti di fare attenzione a richiedere un controllo immediato oftalmologico in caso di dolore oculare o percezione visiva di aloni iridescenti attorno alle sorgenti luminose dopo dilatazione pupillare. Il farmaco per dilatazione più utile è la tropicamide in collirio all’1% che fornisce una rapida azione a breve durata nel tempo con modesti effetti sull’accomodazione. L’effetto può comunque durare anche alcune ore, pertanto è conveniente avvisare il paziente che è

preferibile evitare la guida sino alla completa risoluzione dell’appannamento visivo. L’oftalmoscopia viene effettuata con l’oftalmoscopia indiretta ed una lente (+20, +25, +28) a pupilla in midriasi farmacologica invitando il paziente a guardare lontano fissando un oggetto in modo da mantenere l’occhio fermo e riducendo la costrizione pupillare dovuta al riflesso accomodativo. La luce dell’oftalmoscopio deve essere indirizzata fino ad ottenere un riflesso rosso in campo pupillare, dovuto alla riflessione della luce dal fondo, se questo riflesso non dovesse essere presente o risultasse diminuito con buona probabilità vi è una opacità tra la cornea e la retina e l’opacità più comune tra tutte è la presenza di una cataratta. Deve essere quindi ricercato e messo a fuoco il disco ottico la cui osservazione può essere una delle poche opportunità per di gnosticare precocemente alterazioni potenzialmente anche molto gravi per il paziente. I margini sfumati del disco ottico potrebbero essere un segno iniziale di neoformazione cerebrale così come un’escavazione del nervo ottico può essere segno precoce di un glaucoma cronico ad angolo aperto. Neovascolarizzazioni dello stesso possono annunciare una retinopatia proliferativa in pazienti asintomatici e che potrebbe condurre il paziente a cecità in breve tempo e un’atrofia ottica può essere l’unico segno di un pregresso episodio di neurite ottica o di una neoformazione espansiva cerebrale.
La retina dovrebbe essere analizzata accuratamente per ricercare eventuali emorragie, neovasi ed essudati, un’oftalmoscopia con un filtro verde a luce rosso-priva può essere utile ad accentuare i vasi retinici ed i microaneurismi. È importante esaminare con molta attenzione la macula per valutare alterazioni pigmentarie o una maculopatia essudativa senile oppure gli essudati di una retinopatia diabetica.
1.14 Misurazione pressione intraoculare
La valutazione della pressione endoculare digitalmente è possibile solo in caso di una pressione intraoculare notevolmente elevata come nel caso di glaucoma acuto, per effettuarla è necessario invitare il paziente a guardare in basso e appoggiare lievemente i polpastrelli premendo attentamente il bulbo fra due dita in comparazione con l’altro occhio o con l’occhio di un altra persona (l’esaminatore) sicuramente nei limiti del normale.
L’occhio con glaucoma acuto ha una consistenza molto dura (come legno o pietra).
La possibilità di un glaucoma ad angolo stretto va accuratamente valutata in ogni persona con più di 50 anni di età che presenta un occhio rosso.
1.15 Campo visivo
Analizzare il campo visivo (CV) suggerisce informazioni sulla localizzazione di eventuali lesioni ed è utile per una corretta diagnosi. Una perdita del campo visivo inferiore suggerisce lesioni dell’emiretina superiore mentre uno scotoma centrale in- dica usualmente problemi maculari. Un’emianopsia (perdita di metà del campo visivo) omonima (dello stesso lato) può indicare problemi cerebrali soprattutto se il paziente presenta un disturbo visivo.

DIAGNOSI: un’emianopsia bitemporale potrebbe deporre per un tumore ipofisario, mentre uno scotoma arcuato a partenza dalla macchia cieca è solitamente patognomonico di glaucoma.

Per testare il campo visivo, anche in assenza di apparecchiature adeguate ed avere sufficienti informazioni, il paziente dovrebbe sedere direttamente difronte l’esaminatore e chiudendo l’occhio non testato con la propria mano, guardare il viso dell’esaminatore stesso fornendo indicazioni circa il centro del viso, il naso, la bocca così da riferire informazioni sul CV centrale.
Se non sono rilevabili deficit importanti, il CV andrebbe testato con metodiche più sofisticate.
Testando il campo visivo perifericamente con i movimenti delle dita o con l’uso di una penna, si possono evidenziare difetti campimetrici severi ma un test più sensibile
utilizza la percezione del colore rosso che è la funzione che per prima viene danneggiata; un punto rosso viene spostato dalla periferia verso il centro chiedendo al paziente quando ha la percezione cromatica.
Un altro test può essere effettuato testando la percezione del rosso nei diversi quadranti, un buon esempio d’uso è nel caso di tumori ipofisari (acromegalia) in cui si può evidenziare un deficit precoce per il rosso nei quadranti temporali comparando la qualità della percezione nei quadranti superiori temporali e nasali.
2 LE PALPEBRE
2.1 Conoscenze di base
La palpebra è la porzione più esterna e frontale dell’occhio che funge da protezione; è una formazione cutaneo membranosa (tarso) che con il suo movimento (20 – 30 movimenti/minuto) oltre a proteggere meccanicamente l’occhio aiuta a distribuire uniformemente il film lacrimale. Stimoli meccanici, ottici e acustici (ad es. corpi estranei, luce eccessiva o forte rumore improvviso) stimolano “automaticamente” il riflesso di chiusura oculare o ammiccamento. La cornea è ulteriormente protetta da un movimento meccanico bulbare che si porta verso l’alto e l’esterno (es. durante il sonno o durante l’apertura forzata delle palpebre) detto fenomeno di Bell.
Struttura palpebrale
Sono costituite da cinque strati che dall’esterno verso l’interno si distinguono in:
strato cutaneo;
connettivo sottocutaneo;

– strato muscolare;
– strato fibroso (tarso);
– congiuntiva palpebrale
Ogni occhio si compone di una palpebra superiore (più ampia) ed una inferiore tra le quali è compreso uno spazio detto rima palpebrale più o meno ampia a seconda della chiusura/apertura dei margini liberi delle rispettive palpebre.
Ogni palpebra si compone di due facce: una esterna (cutanea) ed una interna che lateralmente si fondono nelle rispettive commessure palpebrali mediale e laterale detti anche rispettivamente canto interno ed esterno
La palpebra superiore è variamente ampia secondo le caratteristiche facciali fino a raggiungere l’arcata sopraciliare corrispondente internamente all’orbita superiore.
La palpebra inferiore più piccola e più definita termina nel solco infra-palpebrale che
la distingue dal resto della faccia. L’interno delle palpebre è di natura congiuntivale liscia ed umettata per il continuo secreto lacrimale e, ripiegandosi posteriormente sul bulbo oculare, forma il cosiddetto fornice congiuntivale rispettivamente superiore ed inferiore. Il bordo di entrambe le palpebre è dotato di ciglia (speciali peli resistenti di forma arcuata) che nascono a livello delle fossette ciliari e contribuiscono alla protezione bulbare. La porzione strutturale interna di entrambe le palpebre è detta tarso, di natura fibrosa che si diparte dal setto orbitale e in modo concavo sia superiore che inferiore determina la struttura interna connettivale delle parti cutanee. I tarsi sono formati da fibre connettivali elastiche che accolgono nel loro interno le ghiandole di Meibomio o ghiandole tarsali, queste si aprono a livello del margine palpebrale e producono il sebo palpebrale. Il muscolo tarsale è un prolungamento del muscolo elevatore palpebrale che inserendosi tra le fibre del tarso contribuisce a regolare l’ampiezza della fessura palpebrale essendo sotto il controllo del sistema nervoso simpatico.
Ghiandole di Meibomio
Sono piccole ghiandole tubulari che si portano fino all’orifizio in modo quasi perpendicolare al margine palpebrale; la loro funzione principale è quella di evitare l’evaporazione del film lacrimale componendo la porzione grassa sebacea di tensione superficiale che si ripristina ad ogni chiusura/apertura palpebrale.
2.2 Esame palpebrale
La congiuntiva palpebrale esaminata tramite lampada a fessura può essere effettuata tramite una semplice eversione inferiore e superiore, quest’ultima se necessita tramite il retrattore palpebrale di Desmarres che permette di osservare tutto il fornice superiore. La congiuntiva palpebrale deve presentarsi rosea, lucida e priva di strutture cicatriziali o papilliformi.
La motilità palpebrale è regolata dall’attività di tre muscoli:
1. ELEVATORE DELLA PALPEBRA: innervato dal terzo nervo cranico (oculo- motore), il nucleo dell’elevatore è singolo e mediano e agisce su entrambe le palpebre, se questo viene danneggiato la ptosi è bilaterale;
2. MUSCOLO DI MÜLLER: ha azione sinergica con il m. elevatore ed è innerva- to dal simpatico;
3. MUSCOLO ORBICOLARE: agisce sulla chiusura delle palpebre ed è innerva- to dal settimo nervo cranico (facciale).
Lo studio della motilità palpebrale prevede:
1. VALUTAZIONE DELLA SIMMETRIA DELLA RIMA PALPEBRALE NEI DUE OCCHI: si esegue studiando la distanza margine palpebrale – riflesso corneale (in posizione di sguardo primaria si valuta la distanza in mm tra il centro del margine palpebrale ed il riflesso corneale prodotto dal fascio di luce di un lampadina). Se la distanza è anomala bisogna valutarne l’entità: se > di 5 mm si tratterà di retrazione palpebrale, se < 4 mm allora di ptosi palpebrale.
2. VALUTAZIONE DELL’AMPIEZZA DELLA FESSURA PALPEBRALE: si effettua con lo sguardo in alto, in posizione primaria e nello sguardo in basso. Normalmente in posizione di sguardo primaria la palpebra superiore dovrebbe coprire la cornea di circa 2 mm e i valori normali della fessura palpebrale dovrebbero essere tra 6 e 12 mm; mentre la distanza media tra le commessure palpebrali laterale e mediale è 28 – 30 mm.
3. VALUTAZIONE DELLA FUNZIONALITÀ DELL’ELEVATORE DELLA PALPEBRA: si effettua sottraendo all’ampiezza della rima palpebrale nello sguardo in alto quella dell’ampiezza della rima nello sguardo in basso. Altro metodo forse più semplice è il calcolo della distanza margino – limbare: si invita il paziente a guardare verso l’alto e si misura la distanza tra il margine palpebrale superiore ed il limbus ad ore 6 (valori medi tra 8 – 10mm).
4. VALUTAZIONE FUNZIONALE DEL MUSCOLO DI MÜLLER: in presenza di una ptosi, bisogna capire se la compromissione è a livello sia dell’elevatore della palpebra che del m. di Müller o se è ipofunzionante solo quest’ultimo. Si instillano quindi 2 gocce di fenilefrina al 2,5% nell’occhio con ptosi e se dopo 10 minuti la palpebra si alza il deficit è a carico del m. di Müller, se invece la ptosi rimane identica il muscolo deficitario è l’elevatore della palpebra.
5. VALUTAZIONE FUNZIONALE DEL MUSCOLO ORBICOLARE: si chiede al paziente di chiudere gli occhi e se è presente un deficit di chiusura della rima palpebrale se ne valuta l’entità. Se le palpebre non si chiudono si valuterà il fenomeno di Bell (rotazione in alto e all’esterno dei bulbi oculari) se questo è sufficiente (la cornea rimane tutta coperta dalla palpebra superiore) se insufficiente (la cornea resta in parte o del tutto scoperta).
2.3 Anomalie congenite

Coloboma
DEFINIZIONE: è un difetto unilaterale, solitamente a livello della palpebra superiore, di mancanza di parte del margine palpebrale a tutto spessore (più spesso di forma simil triangolare).
EZIOLOGIA: il coloboma è un’anomalia malformativa molto rara determinata dalla mancata chiusura della fossetta ottica. Molto spesso questo difetto si accompagna ad altre anomalie come cisti dermoidi o microftalmo; difetti congeniti che ritroviamo associati al coloboma sono anche delle vere e proprie malattie del primo arco brachiale come la Sindrome di Franceschetti (disostosi mandibolofacciale) o la Sindrome di Goldenhar (displasia oculoauricolovertebrale).
SINTOMATOLOGIA E TRATTAMENTO: in base all’estensione del difetto, la secchezza congiuntivale e corneale può essere anche molto estesa fino a produrre ulcere corneali, pertanto si deve procedere alla chiusura per accollamento diretto se possibile o a chirurgia plastica tramite innesto.
Epicanto
DEFINIZIONE: è una piega di pelle eccedente che si estende di solito bilateralmente tra la palpebra superiore e quella inferiore coprendo l’angolo mediale dell’occhio.
EZIOLOGIA E SINTOMI: è un’anomalia congenita rara ma tipica nella razza asiatica, si accompagna spesso alla sindrome. di Down (trisomia 21) mentre è presente in circa il 30% dei neonati risolvendosi verso il sesto mese di vita. Quando l’epicanto è pro nunciato simula una esotropia (è fondamentale nei bambini associare la visita ortottica a quella oculistica); solitamente questa plica nasale eccedente tende a rientrare verso i 4 anni di età.
Anchiloblefaron
DEFINIZIONE: consiste in un’incompleta separazione tra le due palpebre con fusione di solito degli angoli mediale e laterale degli occhi.
EZIOLOGIA E SINTOMI: in caso di anchiloblefaron l’occhio del paziente è parzialmente o totalmente chiuso. Tale alterazione può associarsi a malformazioni del bulbo o più raramente ad assenza dello stesso mentre è frequentemente associata a deformazioni craniche. Per separare le palpebre si può intervenire chirurgicamente.
2.4 Anomalie acquisite
Ptosi
DEFINIZIONE: si tratta di un’affezione in cui una o entrambe le palpebre sono più abbassate rispetto alla loro normale posizione, per cui la rima palpebrale risulta di
ampiezza ridotta o più spesso del tutto assente (dal greco ptosis: caduta). La ptosi completa è conseguenza di una paralisi del muscolo elevatore.
EZIOLOGIA: a seconda della causa possiamo distinguere le seguenti forme.
– PTOSI CONGENITA: di solito questa anomalia è ereditaria a trasmissione autosomica dominante, la causa più frequente è l’aplasia del nucleo del nervo oculomotore che innerva il muscolo elevatore della palpebra (causa neuro- genica); meno frequentemente si può attribuire a semplice ipofunzione dello stesso muscolo (causa miogenica).
– PTOSI ACQUISITA:
Ptosi paralitica (paralisi del m. oculomotore);
Ptosi neurologica (lesione del n. simpatico) nella paralisi di Horner (ptosi, miosi ed enoftalmo);
Ptosi miotonica (miastenia grave o distrofia miotonica);
Ptosi traumatica.
SINTOMI: la chiusura della palpebra superiore è più spesso unilaterale (segno di causa neurologica) o bilaterale (frequente segno di causa miotonica). Una tipica caratteristica della forma unilaterale è l’atteggiamento del soggetto che per compensare l’abbassamento della palpebra tende ad inarcare le sopracciglia contraendo i muscoli della fronte.
I bambini affetti da ptosi possono sviluppare ambliopia o un ritardo nello sviluppo per la limitazione della vista.
TRATTAMENTO:
– PTOSI CONGENITA: s’impone una retrazione chirurgica della palpebra superiore che dovrebbe essere attuata il prima possibile proprio per non inficiare sull’acquisizione visiva così importante nell’età infantile.
PTOSI ACQUISITA: il trattamento in questi casi dipende dalla causa primaria, in alcuni casi avviene una restituzione spontanea. Esistono diverse tecniche chirurgiche che permettono di correggere la ptosi palpebrale a seconda del muscolo palpebrale affetto; la delicata chirurgia della ptosi palpebrale consiste nel riportare la palpebra alla sua posizione originale e bilanciare la simmetria con la palpebra dell’altro lato.
Entropion
DEFINIZIONE: è caratterizzato dalla rotazione del margine palpebrale inferiore verso l’interno. Il margine palpebrale, le ciglia e nei casi più gravi la pelle palpebrale entrano in contatto diretto con il globo oculare al posto della congiuntiva.

Ci sono varie forme in base alla causa d’origine:
– Entropion congenito: solitamente è una situazione transitoria dovuta ad ipertono del muscolo orbicolare e tende a risolversi entro pochi mesi dalla nascita; nel caso perduri o ci siano problemi importanti a carico della cornea si può intervenire chirurgicamente.
– Entropion spastico: questa forma è una combinazione di diversi fattori patogenetici aggravati da stati infiammatori che ne causano la differente gravità; le strutture che supportano la palpebra inferiore (legamenti palpebrali, tarso e muscolo orbicolare) con l’età tendono ad una lassità fisiologica e all’involuzione verso l’interno dell’occhio; quando per diverse ragioni (chirurgiche, infettive, traumatiche) l’occhio presenta infiammazioni ricorrenti, l’entropion può essere un residuo anche importante e a volte divenire permanente.
– Entropion cicatriziale: questa forma è il risultato frequente di contratture tarsali dovute ad infiammazioni massive ricorrenti o traumi (es.: tracoma, ustioni, contatto con sostanze chimiche). Le cause possono essere anche di tipo allergico o di reazione tossica (es.: pemfigo, Sdr. di Stevens-Johnson, Sdr. di Lyell).
TRATTAMENTO: nelle fasi avanzate è sempre di tipo chirurgico, nei soggetti anziani in attesa d’intervento si possono placare i sintomi con l’aiuto di gel e lacrime artificiali e con l’apposizione di un cerotto adesivo che ricrei una parziale tensione del margine palpebrale verso l’esterno.
Ectropion
DEFINIZIONE: è la condizione in cui è sempre colpito il margine palpebrale inferiore che si porta verso il basso lasciando scoperto parte del bulbo oculare. Si distinguono in base alle origini le seguenti forme:
– Ectropion congenito: questa forma è veramente rara e di solito associata ad altre anomalie di sviluppo facciali (es.: Sdr. di Franceschetti).
– Ectropion senile: i legamenti palpebrali ed il tarso con l’avanzare dell’età perdono elasticità e tendono a portarsi verso il basso scoprendo gran parte della congiuntiva.
– Ectropion paralitico: consegue a paralisi facciale che comporta ridotta funzionalità del muscolo orbicolare deputato alla chiusura palpebrale.
– Ectropion cicatriziale: è un reperto conseguenziale ad infezioni ricorrenti o ad incidenti (es.: causticazioni, ustioni, tagli).
SINTOMI E TRATTAMENTO: la chiusura incompleta delle palpebre causa essiccazione corneale a volte anche grave fino alla formazione di ulcere corneali da lagoftalmo,
nello stesso tempo l’eversione del puntino lacrimale comporta lacrimazione intensa per concomitante secchezza nasale da mancato passaggio delle lacrime; si crea un circolo vizioso sostenuto anche da congiuntiviti croniche e blefariti ricorrenti. La migliore procedura è quella chirurgica che nelle fasi precoci dà ottimi risultati, nel caso di ectropion paralitico si ricorre a gel e lacrime sostitutive e in attesa d’intervento a “bendaggio ad orologio” (lente plastica protettiva e adesiva che previene l’evaporazione lacrimale); nell’ectropion cicatriziale spesso si ricorre ad una vera e propria ricostruzione plastica dei bordi palpebrali.

Ciglia in trichiasi
DEFINIZIONE: le ciglia in trichiasi sono un raro residuo post - infettivo o post- traumatico in cui l’evento destruente comporta la torsione verso l’interno del bordo palpebrale inferiore con continuo sfregamento delle ciglia e della pelle su cornea e congiuntiva. Questo crea sensazione permanente di corpo estraneo, intensa e continua lacrimazione con congiuntivite cronica.
TRATTAMENTO: i follicoli cigliari possono essere trattati con elettrolisi seppure i risultati non siano sempre risolutivi; si può anche ricorrere a crio-epilazione o a rimozione chirurgica dei follicoli.
Blefarospasmo
DEFINIZIONE: è una contrazione spasmodica involontaria del muscolo orbicolare dell’occhio innervato dal n. facciale; si accompagna spesso a fotofobia, produzione lacrimale intensa ed infiammazione della camera anteriore. La classica triade sintomatologica è caratterizzata da: fotofobia, epifora e blefarospasmo
Le cause possono includere disturbi del sistema extrapiramidale come encefaliti o sclerosi multipla; mentre più spesso alla base vi è una nevralgia trigeminale o un disturbo psicogeno.
TRATTAMENTO: ovviamente dipende dalle cause scatenanti, in genere risponde bene a miorilassanti ma nei casi più severi si può addirittura giungere alla resezione del m. orbicolare; spesso si può risolvere con iniezioni locali ripetute di tossina botulinica.
2.5 Disordini della pelle e dei margini palpebrali
Eczema da contatto
DEFINIZIONE: è causato da una tipica reazione antigene – anticorpo in soggetti con
intolleranza ad alcune sostanze particolari (più spesso a cosmetici, colliri, pomate, adesivo del bendaggio oculare... ); sono più esposte le persone di carnagione chiara o comunque soggette ad allergie.
SINTOMI: edema e gonfiore variabilmente intenso, rossore, lichenificazione ed intenso prurito seguito da indurimento e screpolatura della pelle con sensazione di tensione.
TRATTAMENTO: bisogna innanzitutto allontanare la sostanza allergenica (eventualmente consigliare delle prove allergiche) e limitare l’uso di cortisonici che molto spesso acuiscono i sintomi.
Edema palpebrale
DEFINIZIONE: è un rigonfiamento delle palpebre dovuto a ritenzione anomala di fluidi nel tessuto sottocutaneo; in questo caso le cause possono essere infettive o allergeniche gravi (es.: anche punture da insetto) che comportano una reazione non solo della pelle ma di tutte le strutture del sottocute.
TRATTAMENTO: dipende dalla causa scatenante e dal momento dell’osservazione, solitamente al mattino l’edema si presenta più grave che alla sera ed è importante fare una diagnosi differenziale tra le forme infiammatorie e non, senza dimenticare di escludere un’eventuale cellulite orbitaria.
Diagnosi differenziale dell’edema
SINTOMI
POSSIBILI CAUSE
gonfiore arrossamento sensazione di calore
dolore
solitamente unilaterale
orzaiolo
eczema
ascesso
erisipela
Associato a:
- disturbo paranasale
- cellulite orbitaria
- dacrioadenite
- dacriocistite
gonfiore pelle pallida pelle fredda
indolore
solitamente bilaterale
Disordine sistemico:
- cuore
- reni
- tiroide
Allergia (edema di Quincke)
Blefarite seborroica
DEFINIZIONE: è un disturbo relativamente frequente caratterizzato da un’infiammazione di tipo squamoso dei margini palpebrali ad entrambi gli occhi. Spesso contribuiscono diverse cause: costituzione della pelle, seborrea, ipersecrezione delle ghiandole palpebrali, anomalie di refrazione accompagnate a stimoli esterni come polveri, fumo, aria eccessivamente secca in ambienti condizionati che spesso contribuiscono al persistere dei disturbi.
SINTOMI E TRATTAMENTO: a causa della continua infiammazione i margini palpebrali si presentano ispessiti con ciglia adese per l’intensa secrezione nonché per l’esfoliazione furfuracea della pelle che appare squamosa; molto spesso si associano congiuntiviti ricorrenti. I sintomi migliorano con applicazioni locali di pomate antibiotiche e con l’accurata pulizia dei bordi palpebrali tramite adeguate soluzioni lenitive in commercio.
Herpes simplex palpebrale

DEFINIZIONE: disturbo acuto solitamente unilaterale caratterizzato da vescicole lucide di pelle e mucose; questa infezione si manifesta più spesso per riattivazione del virus Herpes Simplex, già presente nei tessuti del soggetto in forma latente, tramite radiazioni ultraviolette. Il virus si diffonde attraverso le fibre nervose sensoriali dai gangli del trigemino sino alla superficie della pelle.

Tipica eruzione da virus
Herpes Simplex con vescicole raggruppate vicine, piene di siero e nella più tipica locazione: vicino l’angolo dell’occhio tra cute e mucosa.
SINTOMI E TRATTAMENTO: l’eruzione tipica è caratterizzata da piccole vescicole molto vicine piene di siero fluido lucente che si diramano lungo il ramo nervoso di provenienza e si raccolgono tra la pelle e la mucosa viciniore. Dopo alcuni giorni le vescicole si asciugano divenendo croste squamose. È fondamentale trattare l’eruzione con agenti virostatici locali e vietare l’esposizioni ai raggi ultravioletti. La prognosi è buona anche se in alcuni soggetti gli episodi possono essere ricorrenti.
Herpes zoster oftalmico
DEFINIZIONE: rash cutaneo facciale causato dal virus Zoster (della varicella); di solito questo disturbo si manifesta in soggetti immunocompromessi anche in modo lieve di età compresa tra i 40 e i 60 anni e che molto spesso soffrono di svariati disturbi sistemici. Lo Zoster virus nella sua prima infezione esordisce con la varicella, nelle successive si riattiva nel distretto corporeo innervato dal ganglio in cui si annida in forma silente per anni.

Quando questo avviene a livello della prima branca del n. trigemino (il n. oftalmico con le sue branche d’innervazione facciale, lacrimale e nasociliare) assistiamo all’herpes Zoster oftalmico.
Rash cutaneo da riattivazione di Herpes Zoster Oftalmico con coinvolgimento della branca nasociliare; questa forma è più rara e con maggiori complicanze a livello oftalmico.
L’incubazione di norma varia tra 7–18 giorni e dopo un attacco di dolore acuto nell’area innervata dal trigemino (oftalmico, frontale, lacrimale e nasociliare) si presenta il sintomo prodromico: eritema accompagnato da fotosensibilità, gonfiore e lacrimazione. Tutti questi fenomeni appaiono poco prima delle classiche vescicole acquose lacunari più grandi rispetto all’herpes simplex; con il passare dei giorni scoppiano, diventano brunastre e crostose tipo scabbia. Si accompagna una fastidiosa blefarite nel 50-70% dei casi e a volte il situ iniziale dell’ipersensibilità cutanea seguita da fastidio e dolore intenso è proprio la punta del naso: è la branca nasociliare dell’oftalmico che può comportare un’infiammazione intraoculare veramente severa.

SINTOMI E TRATTAMENTO: gli agenti virostatici topici sono di solito scarsamente utili in quanto la patologia colpisce raramente la cornea, ma più frequentemente l’uvea, per cui bisogna ricorrere a somministrazione di acyclovir per via sistemica; ricordarsi che la forma che coinvolge la branca nasociliare è quella più severa con possibili complicanze. Le lesioni perdurano per circa 3 – 4 settimane e possono residuare cicatrici anche permanenti; il dolore è spesso urente di tipo nevralgico e può persistere una parestesia locale.
Ascesso palpebrale
DEFINIZIONE: raccolta di pus circoscritta con grave infiammazione, gonfiore, e fluttuazione palpebrale. Un ascesso palpebrale inferiore ma più spesso superiore può essere la conseguenza di un piccolo trauma (ferita palpebrale con o senza ritenuta di corpo estraneo), puntura d’insetto o più raramente la diffusione di un calazio, di un orzaiolo o di un’infezione dei seni paranasali. La raccolta purulenta appare fluttuante all’interno della palpebra e potrebbe capitare un’apertura di drenaggio spontaneo.
TRATTAMENTO: copertura antibiotica orale o per via e.v.; la raccolta purulenta va drenata chirurgicamente e la prognosi generalmente è buona. In alcuni casi quando l’ascesso si localizza più medialmente, si può incorrere in cellulite orbitaria o trombosi del seno cavernoso.
2.6 Disordini delle ghiandole palpebrali
Orzaiolo
DEFINIZIONE: è il risultato di un’infezione batterica (il più comune è lo Staphylococcus aureus) a livello di una o più ghiandole palpebrali di Zeiss o di Moll; l’orzaiolo
interno coinvolge invece le ghiandole di Meibomio. Questa infezione è più frequente in soggetti diabetici, con disturbi acneici e/o gastrointestinali. Si presenta come un nodulo dolente con una raccolta centrale di pus. L’orzaiolo si presenta all’esterno quando sono coinvolte le ghiandole sudoripare, verso l’interno nel caso delle ghiandole sebacee; in questo caso si nota meglio con l’eversione palpebrale: la reazione è più severa con frequente chemosi congiuntivale e gonfiore fino a pseudoptosi con coinvolgimento dei linfonodi preauricolari.
DIAGNOSI DIFFERENZIALE E TRATTAMENTO: il calazio generalmente è più tenero al tatto e le infiammazioni delle ghiandole lacrimali sono più rare. Buon risultato con applicazioni di pomate antibiotiche e di “calore secco” (evitare sempre gli impacchi di ogni genere) con lampada rossa riscaldante.
Calazio DEFINIZIONE: cisti da ostruzione del dotto di una ghiandola di Meibomio (meglio detto lipogranuloma) per infiammazione cronica a volte recidivante. Generalmente è indolore ma se di grandi dimensioni può comportare astigmatismo da pressione corneale e fastidio.
DIAGNOSI DIFFERENZIALE E TRATTAMENTO: orzaiolo e adenocarcinoma. Anche in questo caso si tenta con l’applicazione di pomate antibiotiche ma spesso residua comunque una cisti granulomatosa che va rimossa chirurgicamente; l’asportazione
è più spesso effettuata dall’interno palpebrale con incisione parallela al margine palpebrale per evitare ectropion cicatriziali stando ben attenti ad esportare l’intera cisti compresa la parete.
2.7 Tumori benigni
Xantelasma
È un deposito lipoproteico dovuto ad un disturbo locale del metabolismo dei grassi; si localizza più frequentemente nel canto medio spesso bilateralmente.

Rappresenta la forma più frequente di xantoma: è una macchia o placca giallastra, morbida e allungata.
È una formazione che generalmente interessa la cute a tutto spessore e si diffonde anche alle fibre sottostanti il muscolo orbicolare pertanto è necessario procedere anche alla bonifica chirurgica del muscolo.

Cisti dei dotti
Sono delle cisti rotonde a livello delle ghiandole di Moll generalmente localizzate all’angolo dell’occhio; il contenuto è chiaro e acquoso e può essere transilluminato. La terapia consiste nella marsupializzazione e la prognosi generalmente buona.
Mollusco contagioso
È un’infezione contagiosa non infiammatoria causata un virus “Molluscum contagiosum virus” (MCV) che normalmente reca una o più piccole lesioni che si manifestano a forma di nodulo di qualche millimetro di diametro, di colorito roseo con una caratterista ombelicatura centrale. Il mollusco contagioso può essere trasmesso per contatto cutaneo (non necessariamente mucose) o attraverso piccole lesioni; la trasmissione a contatto sessuale è la più comune tra gli adulti ma può essere trasmesso anche attraverso oggetti quali asciugamani o vestiti che vengono a contatto con le lesioni. A livello oculare il virus si addentra nella congiuntiva e si sviluppa a livello cutaneo tutt’intorno alla zona perioculare con le caratteristiche papule rosee con depressione centrale. Il periodo d’incubazione varia da 2 a 3 mesi con un minimo di una settimana fino ad un massimo di 6 mesi. La risoluzione può essere spontanea ma più spesso si ricorre alla rimozione con somministrazioni locali di sostanze d’attacco (acidi o immunomodulatori), crioterapia o curette chirurgica per evitare l’autoinoculazione e la diffusione ad altri soggetti.
Corno Cutaneo
È un’escrescenza di cheratina, più spesso a livello della palpebra inferiore di colore giallo–brunastro che protrude a mo’ di corno in modo più o meno pronunciato. Sono affetti generalmente pazienti anziani; la crescita è molto lenta, si può rompere e ripresentarsi.
Andrebbe sempre escisso bene alla base con cauterio poiché pur partendo come forma benigna può essere una forma precancerosa e generare un carcinoma squamocellulare.
Cheratoacantoma
DEFINIZIONE: neoplasia cutanea costituita da cheratinociti atipici ben differenziati derivanti dall’infundibulo follicolare a rapida evoluzione con auto risoluzione; si presenta con una forma simil papulare con una massa centrale di cheratina che si apre a livello cutaneo tipo cratere.


FATTORI PREDISPONENTI: sole, contatto con oli minerali o catrame e traumi locali; in caso di lesioni multiple probabilmente concorrono fattori genetici e/o fattori immunologici cellulo-mediati. Importante fare diagnosi differenziale con il carcinoma a cellule basali o a cewllule squamose; il margine del cheratoacantoma è caratteristicamente avascolare ma è dirimente l’esame istologico dalla biopsia.

DEFINIZIONE: a livello del bordo libero delle palpebre è frequente l’insorgenza di una neoformazione rilevata con aspetto a cavolfiore a larga base d’impianto (sessile) o filiforme (peduncolato); si reperta più facilmente in persone anziane in forma unica o multipla.
EZIOPATOGENESI: può essere di natura infiammatoria aspecifica o più frequentemente virale.
Emangioma
DEFINIZIONE: è un’anomalia congenita vascolare simile ad una neoplasia presente a livello cutaneo e nel sottocute dovuta a proliferazione anomala dell’endotelio vascolare. Più spesso è superficiale senza mai però sottovalutare le forme cavernose, nel 30% dei casi si manifestano nell’infanzia con risoluzione spontanea durante la crescita. Importante la diagnosi differenziale con il nevo flammeo (tumore melanocitico benigno congenito o acquisito che è formato da un’espansione sottoepidermica priva di crescita). Nel 70% dei casi si assiste ad una remissione spontanea; si agisce chirurgicamente o con crioterapia, iniezioni locali di steroidi, radiazioni se comporta problemi come ambliopia.
Neurofibromatosi di Tipo 1 (Recklinghausen)
DEFINIZIONE: difetto neuroectodermico che varia da chiazze cutanee caffè e latte alla nascita in numero maggiore/uguale a 6 ai neurofibromi plessiformi in numero maggiore/uguale a 2 dalla seconda decade di vita; questi pazienti possono presentare gliomi del nervo ottico (stazionari e talvolta regrediscono spontaneamente) ed amar- tomi dell’iride detti noduli di Lisch in numero maggiore/uguale a 2. La neurofibromatosi di tipo 1 (NF1) o malattia di von Recklinghausen è una malattia genetica a trasmissione autosomica dominante. Si tratta di una malattia ad incidenza abbastanza frequente (1 affetto ogni 3000 individui); almeno il 50% degli affetti ha una storia familiare di neurofibromatosi 1 documentata; nella restante parte dei casi si tratta di nuove mutazioni. La malattia appartiene al gruppo delle facomatosi ed è caratterizzata da diverse manifestazioni: cutaneo, nervoso e parte ectodermica dell’occhio. Le forme tumorali palpebrali si presentano morbide al tatto, a base piatta o peduncolate e si possono presentare sia a livello della pelle che del sottocute solitamente nella zona dell’angolo oculare. In alcuni casi rari le dimensioni possono essere importanti (elefantiasi palpebrale). Nei casi di piccole lesioni si può ricorrere all’esportazione chirurgica mentre nei casi più estesi l’approccio chirurgico può essere anche assai complicato.

2.8 Tumori maligni
Carcinoma a cellule basali

DEFINIZIONE: il carcinoma a cellule basali è un tumore fibroepiteliale frequente e moderatamente maligno che causa una severa destrutturazione del tessuto locale ma metastatizza molto raramente
Rappresenta circa il 90% dei tumori palpebrali maligni e l’incidenza sale con l’età. Nel 60% dei casi si localizza nella palpebra inferiore; non c’è una predisposizione particolare ma i soggetti scuri come spesso capita sono più protetti.
Anche in questo caso la causa principale è rappresentata dalla predisposizione genetica su cui agiscono sinergicamente diversi fattori come l’esposizione solare (raggi UV), il contatto con sostanze cancerogene (es.: arsenico) ed il danno cronico della pelle.
Il carcinoma basocellulare deriva dallo strato delle cellule basali dell’epidermide e dalle ghiandole sebacee dei follicoli cigliari.

SINTOMI, DIAGNOSI E TRATTAMENTO: la caratteristica di questo tumore è un iniziale rialzamento del margine palpebrale a forma di “filo di perle” con un cratere centrale e vascolarizzazione superficiale con tendenza al sanguinamento.
L’ulcerazione si espande come rosicchiata da un vero e proprio roditore invadendo la cartilagine sino all’osso. La diagnosi si basa sull’osservazione clinica della lesione e l’esame istologico.

Carcinoma Squamocellulare

DEFINIZIONE: questo tumore maligno è il secondo più frequente delle palpebre. Questo carcinoma prende origine dall’epidermide, cresce rapidamente e distrugge il tessuto circostante potendo metastatizzare nei linfonodi vicini, anche se metastasi a distanza sono rarissime.
TRATTAMENTO: il trattamento d’elezione è la completa rimozione chirurgica.
Adenocarcinoma
DEFINIZIONE: è il carcinoma palpebrale più raro, ha origine dalle ghiandole di Meibomio o di Zeiss e si presenta come un rigonfiamento indolore localizzato di norma alla palpebra superiore mobile rispetto alla cute ma non rispetto ai tessuti sottostanti.
Negli stadi iniziali può simulare un calazio e anche in questo caso può esserci metastasi locale.
Un calazio cronico e sospetto non dovrebbe mai essere rimosso chirurgicamente con la classica tecnica della rimozione dei piccoli interventi ambulatoriali e soprattutto andrebbe effettuato un rigoroso esame anatomopatologico.
3 APPARATO LACRIMALE

3.1 Conoscenze di base
I puntini lacrimali sono due piccoli orifizi, superiore ed inferiore a 6 mm dal canto mediale con diametro di circa 0,2 mm, da questi traggono origine i canalini lacrimali che presentano un tratto discendente di circa 2 mm ed uno orizzontale di circa 8 mm. In genere si uniscono e confluiscono in un canalino comune che si apre in corrispondenza della parete laterale del sacco lacrimale mentre a volte vi sboccano in maniera autonoma e separata. Il sacco lacrimale localizzato nella loggia lacrimale è di forma cilindrica ad asse verticale, membranoso e lungo circa 10 mm; da questo si diparte inferiormente il dotto naso–lacrimale, un canalino membranoso di circa 12 mm che si porta nel meato nasale inferiore. All’apertura del dotto naso – lacrimale vi è una plichetta mucosa detta Valvola di Hasner che impedisce il reflusso del secreto lacrimale.
DRENAGGIO LACRIMALE: le lacrime si raccolgono lungo il bordo palpebrale e ad ogni ammiccamento vengono trasportate per capillarità e suzione attraverso i canalini lacrimali (attraverso la pompa lacrimale: processo meccanico che in ammiccamento comprime i tratti verticali e accorcia quelli orizzontali aspirandone il secreto); nello stesso tempo sempre durante l’ammiccamento il muscolo orbicolare delle palpebre (innervato dal n. facciale) si contrae ed espande il sacco lacrimale che aumenta così il processo di suzione.
3.2 Film lacrimale
Le lacrime riparano cornea e congiuntiva da agenti esterni e le mantengono umettate permettendo la specularità e la trasparenza corneale indispensabili ad una corretta visione. Il film lacrimale è composto da tre strati che dalla cornea verso l’interfaccia film-aria sono:
3 - Apparato lacrimale
– STRATO MUCOSO (SPESSORE 0,1 - 0,8 µm). È prodotto da cellule caliciformi mucipare presenti nello strato cellulare più esterno dell’epitelio congiuntivale, ghiandole di Henle e ghiandole di Manz, a questo si aggiunge produzione di muco da parte di cellule epiteliali della cornea e della congiuntiva.
– STRATO ACQUOSO (SPESSORE 7 - 8 µm). È secreto in gran parte dalla ghiandola lacrimale principale ed in minor quantità dalle ghiandole lacrimali accessori (di Krause e di Wolfring); tali ghiandole producono elettroliti, protei- ne ed acqua.
– STRATO LIPIDICO (SPESSORE 0,2 µm). Le ghiandole di Meibomio secernono una composizione di idrocarburi, esteri di steroli, trigliceridi, colesterolo libero, ac. grassi liberi che insieme abbassano la tensione superficiale delle lacrime, ne favoriscono la distribuzione sulla cornea e prevengono l’evaporazione della parte acquea. Queste ghiandole sono tubuloacinose e a livello del tarso il loro dotto escretore sbuca proprio dietro le ciglia; ve ne sono circa 40 a livello della palpebra superiore e 20 in quella inferiore.
Ci sono inoltre delle specifiche proteine delle lacrime (lisozima, lattoferrina e gamma globulina IgA) che hanno funzioni antimicrobiche.
3.3 Test lacrimali
– BREAK-UP TIME: si rileva il tempo di rottura del film lacrimale all’osservazione microscopica con lampada a fessura. Previa instillazione di anestetico ossibuprocaina cloridrato 0,4% (Novesina) e colorazione con fluorescina si invita il paziente ad ammiccare 2-3 volte e poi ad occhio spalancato fisso si contano i secondi fino alla prima comparsa dei dry spots (isole di essiccamento) o di rottura del film lacrimale. Valori normali compresi tra 15–45 secondi.
– SCHIRMER TEST I: valuta la secrezione lacrimale totale, non si usa anestetico. Si colloca una striscia, predisposta per il test, di carta bibula (5 x 35 mm) all’interno del fornice inferiore a livello del terzo esterno e si attende per cinque minuti con il paziente ad occhi chiusi. Il risultato si legge in mm di carta imbevuta.
– SCHIRMER TEST II: questo test valuta la così detta secrezione riflessa; si utilizza la consueta striscia di carta bibula inserita nel fornice inferiore dopo instillazione di anestetico locale. La secrezione riflessa viene stimolata mediante un cotton fioc inserito nella mucosa nasale e il valore di tale secrezione verrà letto dopo 2 minuti. Valori < 15 mm / 2’ sono significativi per un’iposecrezione riflessa. I test di Schirmer sono in parte criticabili per le tante variabili presenti durante le misure, tuttavia il loro uso nella pratica clinica quotidiana è assai utile nella diagnosi di disconfort
lacrimale ed iposecrezione tanto da rendersi indispensabili fintanto non verrà proposta una valida alternativa che coniughi semplicità e qualità.
– TEST DI JONES (I E II): esame utile per valutare la funzionalità delle vie di deflusso lacrimale mediante la misurazione del tempo impiegato dalla fluoresceina a comparire nella cavità nasale dopo essere stata instillata a livello corneale. Il test di Jones I determina la presenza o meno di un’ostruzione, mentre il test di Jones II differenzia un’ostruzione parziale da una totale e localizza la sede dell’ostruzione.
– ELETTROFORESI LACRIMALE: previa raccolta di liquido lacrimale per capillarità con finissimi tubi di vetro graduati (capacità massima circa 30 µl) si possono ricercare con elettroforesi diverse proteine: albumina, lisozima, latto- ferrina, lattico deidrogenasi ecc.. ma soprattutto le immunoglobuline (di cui le più presenti sono le IgA).


– STRISCIO CONGIUNTIVALE.
– BIOPSIA CONGIUNTIVALE.
– TEST DI FELCIZZAZIONE DEL MUCO LACRIMALE.
– SCINTIGRAFIA DELLA GHIANDOLA LACRIMALE CON 99MTC.
– TEST DI COLTURA PER RICERCA GERMI COMUNI E/O CLAMYDIA.
– CITOLOGIA AD IMPRESSIONE: consiste nel prelievo degli strati superficiali dell’epitelio congiuntivale limbare superiore ed inferiore di entrambi gli occhi (quindi 4 campioni a controllo) tramite apposizione di un filtro speciale a base di nitrocellulosa. I campioni così ottenuti vengono trasferiti su un vetrino da istologia e preparati per un esame valutativo applicando metodiche di analisi varie a seconda del quesito diagnostico. Per la valutazione dei preparati citologici vengono esaminate: morfologia, distribuzione e densità delle cellule epiteliali e assetto nucleare
A questi dati si applica una metodica di stadiazione cellulare secondo Tseng che prevede l’attribuzione di un numero da 0 a 3: (valori patologici >1)

3.4 Test diagnostici
– LAVAGGIO DELLE VIE LACRIMALI: previa instillazione di anestetico nel fornice congiuntivale, si dilatano meccanicamente i puntini lacrimali e subito dopo si incannulano con un ago smusso; inizialmente si mantiene un decorso orizzontale poi si verticalizza verso la parete temporale del sacco e si cerca di iniettare liquido (collirio antibiotico–cortisonico) fin quando il paziente riferisce l’arrivo della soluzione in gola. Alla pressione esercitata, in caso di ostruzione il liquido iniettato fuoriuscirà dallo stesso puntino lacrimale o da quello superiore, a volte frammisto a muco e pus.
– DACRIOCISTOGRAFIA: consiste in una serie di radiografie in proiezione antero –posteriore e laterale delle vie lacrimali di deflusso previa iniezione di mezzo di contrasto (Lipiodol) in uno dei canalini lacrimali. Questo esame è ut le per far diagnosi di stenosi, fistole, diverticoli, tumori, infezioni micotiche etc. è comunque superato dalle attuali tecniche di multiimaging della testa (TAC multistrato, RMN ecc.)
– SCINTIGRAFIA: si marcano le lacrime con 99Tc sostanza emettente raggi γ così da seguirne il deflusso durante il drenaggio lacrimale.
– TAC DELLE VIE LACRIMALI: consiste nella stessa procedura della dacriocistografia ma come mezzo di contrasto è usato lo Iopamiro.
3.5 Flogosi delle ghiandole lacrimali
Dacrioadenite acuta e cronica
La dacrioadenite acuta è caratteristica dei bambini dopo infezioni da varicella, morbillo, rosolia e soprattutto da parotite per le affinità che questa ghiandola ha con


quella lacrimale. Questa flogosi si presenta con edema e tumefazione della porzione esterna della palpebra superiore, dolorosa al tatto, iperemica e accompagnata spesso da febbre. La forma cronica è più tipica degli anziani ed anche più rara, tipica di stati autoimmuni o d’infezioni tubercolari; si presenta come una tumefazione non dolente al tatto che può deformare la palpebra ed essere anche causa di cheratocongiuntivite secca per l’alterata lacrimazione.

3.6 Patologia delle vie lacrimali
Dacriocistite acuta
È l’infiammazione acuta del sacco lacrimale più frequentemente su base infettiva (di solito pneumococco e stafilococco); il soggetto si presenta con la zona nasale dolente, edematosa, rossa e calda con classico segno di epifora (la porzione del sacco
è rilevata dal piano ed è fortemente iperemica). Il quadro è accompagnato quasi sempre da segni generali di dolenzia, febbre, malessere e sepsi. Alla digitopressione si potrebbe assistere alla fuoriuscita di abbondante materiale purulento.
TERAPIA E TRATTAMENTO: pomate antibiotiche ed antinfiammatorie locali e sempre anche antibiotici sistemici a largo spettro con controllo della flogosi a breve termine per scongiurare la complicanza più critica e comune che è il flemmone (l’infiammazione si diffonde ai tessuti viciniori estendendosi in profondità nell’orbita fino a possibile cellulite orbitaria con prognosi infausta).

3 - Apparato lacrimale
Dacriocistite cronica
Nella dacriocistite acuta non grave anche dopo adeguato trattamento a volte può residuare un’infiammazione del sacco lacrimale che si cronicizza; il soggetto continua a presentare epifora, dolore e gonfiore meno accentuati che nella forma acuta ma sempre fastidiosi.
Di base permane una stenosi o un’ostruzione delle vie lacrimali che porta a cronicità dell’infiammazione che spesso è associata a congiuntivite lacrimale persistente.
TERAPIA: il processo non migliora se non si riporta la normale pervietà dei dotti tramite intervento chirurgico.
Dacriocistite neonatale (Dacriostenosi)
La dacriocistite del neonato è un’infiammazione dovuta all’ostruzione del dotto naso – lacrimale frequente nei bambini.
Già percepibile alla nascita raggiunge l’acuzie intorno ai due mesi di vita, si manifesta con intensa lacrimazione e secrezione muco purulenta che aumenta alla pressione del sacco lacrimale (sotto l’occhio e al lato del naso).
L’ostruzione può essere dovuta ad un difetto di sviluppo del dotto naso – lacrimale, per ritardata o anomala perforazione della mucosa o per persistenza della valvola di

Hasner del dotto lacrimale. Se il sacco lacrimale è ingrandito l’ostruzione coinvolge sia lo sbocco che l’estremità superiore ed i tal caso l’infiammazione ostruttiva di definisce mucocele o dracriocistocele
TERAPIA E TRATTAMENTO: l’ostruzione solitamente tende all’autorisoluzione entro il primo anno di età ma l’uso di antibiotico locale è d’uopo nonché dei massaggini sul sacco lacrimale che possono effettuare i familiari opportunamente istruiti più volte al giorno. Nel caso l’ostruzione persista si rende necessario il sondaggio del dotto naso – lacrimale che va ovunque effettuato entro i primi due anni di vita.
Canalicolite
La canalicolite è un’infiammazione abbastanza rara causata dall’Actinomyces israelii, un batterio anaerobio Gram (-). Si pensa che proprio la stasi e l’ostruzione canalicolare possano favorire lo sviluppo di un batterio anaerobio.
SINTOMI: epifora e congiuntivite mucopurulenta monolaterale non rispondente a terapia convenzionale; rispetto alla dacriocistite in questo caso non abbiamo ostruzione del dotto nasolacrimale e distensione del sacco dello stesso.
3.7 Disfunzioni del sistema lacrimale
Cheratocongiuntivite sicca
La cheratocongiuntivite sicca è anche definita come “dry eye” proprio per la forte secchezza oculare.

È una patologia multifattoriale che causa: sofferenza, disconfort, instabilità, ed iperosmolarità del secreto lacrimale; instabilità visiva, infiammazione cronica degli epiteli congiuntivale e corneale fino all’eventuale cheratinizzazione.
Le cause possono essere molteplici: iposecrezione lacrimale della componente acquosa (forma più tipica → Sindrome di Sjögren); così come disfunzioni della componente lipidica e mucosa che accelerano l’evaporazione; disfunzioni acquisite e congenite delle palpebre, i traumi come le causticazioni e le patologie autoimmuni.
Sindrome di Sjögren
Questa malattia infiammatoria cronica è di origine autoimmune e caratterizzata dalla distruzione delle ghiandole esocrine. Colpisce maggiormente le donne in un rapporto di 9:1.
La sindrome di Sjögren presenta come sintomo principale la secchezza del cavo orale (xerostomia) e delle congiuntive (xeroftalmia). La diagnosi oculistica si effettua con il
3
test di Schirmer e del Rosa Bengala oltre alla positività nel siero per FR ed ENA (anticorpi anti antigeni nucleari estraibili) come gli SSa/Ro e SSb/La. Questa sindrome sembra associarsi ai geni HLA-DRw52 (che aumenta di 20 volte il rischio di sviluppare la malattia) e HLA-DR3 oltre all’infezione virale da EBV e da HTLV-1.
3.8 Tumori delle ghiandole lacrimali
I tumori epiteliali primitivi costituiscono circa un terzo della patologia della ghiandola lacrimale. I tumori benigni rappresentano circa il 55% dei casi e sono rappresentati prevalentemente da adenomi pleomorfi mentre le forme maligne sono spesso adenocarcinomi, molto più raramente sarcomi; il carcinoma adenoide cistico è la lesione maligna più comune.
I pazienti affetti da tumori benigni si presentano spesso con una proptosi indolente di lunga durata e dislocazione infero mediale del bulbo mentre raramente sono riferiti disturbi visivi e diplopia. Rispetto ai tumori benigni la presentazione delle forme maligne è molto più rapida, anche entro sei mesi.
Il dolore, segno di maggiore aggressività della lesione e secondario a invasione perineurale, insieme all’evidenza radiologica dell’erosione delle pareti orbitarie indirizzerà verso le forme maligne. La terapia è chirurgica; per le forme benigne, è raccomandata una completa escissione della lesione con capsula integra. La biopsia incisionale dovrebbe essere evitata poiché discontinuando la capsula esporrebbe a elevato rischio di recidiva o trasformazione maligna della lesione.
Il trattamento delle forme maligne è ancora controverso ma si dovrebbe ricorrere ad interventi demolitori fin dall’esordio vista l’alta possibilità di disseminazione nel circolo sanguigno e nel SNC attraverso le fessure orbitarie.
Le possibilità terapeutiche sono: dacrioadenectomia, dacrioadenectomia associata a radioterapia, radioterapia isolata, exenteratio, chemioterapia citoriduttiva intraarteriosa. Purtroppo spesso la prognosi rimane comunque infausta.
4 CONGIUNTIVA
4.1 Conoscenze di base
Struttura della congiuntiva
La congiuntiva è una sottile membrana mucosa vascolarizzata che normalmente si presenta traslucida. La congiuntiva bulbare è compresa tra l’attaccatura sclerale posteriormente ed il limbus corneale anteriormente dove l’epitelio congiuntivale si fonde con quello corneale. La congiuntiva palpebrale inizia all’attaccatura ciliare fino a ricoprire tutto il tarso e si porta a cul di sacco sotto la palpebra formando il fornice congiuntivale dove si ricongiunge alla congiuntiva bulbare.
Funzioni del sacco congiuntivale

– MOTILITÀ DELL’OCCHIO: la libera connessione tra la congiuntiva bulbare e la sclera permette massima libertà del bulbo in tutte le posizioni di sguardo.
– SUPERFICIE D’ARTICOLAZIONE: la superficie congiuntivale è liscia e umida tale da consentire i movimenti delle mucose che circondano il bulbo oculare; il film lacrimale serve per la lubrificazione.
– FUNZIONE PROTETTIVA: la congiuntiva è particolarmente adatta nel respingere agenti patogeni, dove aggregazioni follicolari di linfociti e plasmacellule (linfonodi oculari) sono localizzati tra la congiuntiva palpebrale ed il fornice dove agenti antibatterici, immunoglobuline, interferone e prostaglandine aiutano a proteggere l’occhio.
4.2 Ispezione ed esame
ISPEZIONE: la congiuntiva bulbare deve essere esaminata alla lampada a fessura con luce bianca diretta; normalmente è trasparente e mobile sul piano della sottostante sclera, altre parti non devono essere presenti o visibili. Le altre porzioni vengono esaminate con l’eversione palpebrale.
4 - Congiuntiva
COLORAZIONI: difetti e condizioni di secrezione lacrimale di congiuntiva e conea possono essere visualizzate, previa applicazione di fluorescina da cartina predosata, con lampada a fessura con filtro luce blu cobalto. L’uso di colorante rosa bengala marca le cellule epiteliali morte di cornea e congiuntiva, specialmente nella “sindrome da occhio secco”.
EVERSIONE PALPEBRALE: questa metodica è conosciuta anche da medici non oftalmologi di solito per emergenze da pronto soccorso come pulizia o lavaggio congiuntivale dopo contatto accidentale con sostanze chimiche di varia natura ed asportazione di corpi estranei.
4.3 Degenerazioni congiuntivali
Pinguecola
DEFINIZIONE: è una neoformazione congiuntivale a base d’impianto sclerale a confine con la cornea e poco sporgente da essa (sempre compresa nella fessura palpebrale), inizialmente di colore bianco opalescente che diviene giallastro nelle fasi avanzate.
EPIDEMIOLOGIA: è la degenerazione congiuntivale più comunemente osservata. Il cambiamento congiuntivale è dovuto alla degenerazione ialina del tessuto collagene subepiteliale. Solitamente si reperta in soggetti di mezza età o anziani e comunque per esposizione prolungata e abituale al sole senza protezione (occhiali da sole) e ad agenti esterni (vento, polveri, aria eccessivamente deumidificata).
SINTOMATOLOGIA: non sono di norma riferiti sintomi particolari, raramente sensazione di corpo estraneo o irritazione. All’ispezione si osserva una formazione di colore variabile tra il bianco–grigio opalescente ed il giallastro a livello del limbus a ore 3 o 9. La base d’impianto triangolare (più spesso presente medialmente) è parallela al limbus corneale mentre l’apice si dirige verso l’angolo dell’occhio.
TRATTAMENTO: tutti i soggetti traggono giovamento dall’uso di occhiali da sole e di lacrime artificiali.
Pterigio
DEFINIZIONE: formazione triangolare congiuntivale che solitamente origina dalla porzione mediale della fessura palpebrale e si porta verso la cornea.
EPIDEMIOLOGIA: lo pterigio è prevalentemente riscontrato nelle regioni calde per la più facile esposizione ai raggi solari intensi.
EZIOLOGIA: istologicamente lo pterigio è identico alla pinguecola, quello che cambia è il rapporto che contrae con la cornea. Lo pterigio nel tempo si estende sempre più verso il centro della stessa e tale progressione sembra sia dovuta ad un disordine dello strato corneale di Bowman che provvede a dare substrato di crescita.
SINTOMI E CONSIDERAZIONI DIAGNOSTICHE: rispetto alla pinguecola, lo pterigio comporta quasi sempre delle problematiche sia di fastidio come da sensazione di corpo estraneo sia visive (formazione o peggioramento di astigmatismo corneale anche grave) oltre a vera e propria opacità corneale, fino a peggioramento importante del visus; in alcuni casi il soggetto rileva diplopia in abduzione.
TRATTAMENTO: è necessario sia quando dà notevole fastidio al paziente sia quando deturpa la visione, in entrambi i casi è indicata la rimozione chirurgica. L’estrazione deve essere accurata, sia del corpo sia della base d’impianto dello stesso con notevole apertura della congiuntiva sclerale in modo da eradicarne quanto più possibile. In alcuni casi, in un secondo tempo, si possono trattare le asperità corneali residue con il laser ad eccimeri.
DECORSO CLINICO E PROGNOSI: lo pterigio tende a recidivare anche se lentamente. In alcuni casi può essere indicata una cheratoplastica lamellare per rimpiazzare lo strato corneale di Bowman con tessuto sano anche se la porzione residua potrebbe sempre essere d’aiuto alla recidiva.
Pseudopterigio
Lo pseudopterigio o pterigoide è causato da processi di natura cicatriziale congiuntivale, diverso dallo pterigio poiché in questo caso si tratta di adesione post traumatica tra congiuntiva, sclera e cornea. Le cause possono essere meccaniche come abrasioni corneali, causticazioni ed ustioni. Lo pseudopterigio può causare dolore e diplopia.
Il trattamento consiste nella lisi dell’adesione, escissione del tessuto cicatriziale congiuntivale e copertura del difetto con innesto congiuntivale.

Cheratomalacia
Sindrome da carenza di vitamina A che interessa la cornea e la congiuntiva e colpisce generalmente bambini denutriti o persone con malattie da malassorbimento intestinale.
SINTOMI: all’inizio la congiuntiva perde la sua brillantezza, diventa opaca, secca e perde la sensibilità fino all’apparizione sulla cornea, a livello dell’apertura palpebrale,
una macchia opaca cui si associano macchie biancastre dell’epitelio corneale. Se non si impiega una terapia adatta, la cornea diviene opaca, facile preda di infezioni da parte di germi, a cui può seguire un processo di ulcerazione e perforazione.

TERAPIA: è possibile far regredire le forme iniziali con la somministrazione di vitamina A per via locale e sistemica mentre nessuna terapia invece è possibile nelle forme più avanzate.
Emorragia sottocongiuntivale
In presenza di estese emorragie sotto- congiuntivali è bene pensare ad una possibile lesione della congiuntiva (importante quindi anche eseguire una corretta anamnesi del paziente).
Le classiche emorragie sottocongiuntivali si presentano più spesso spontaneamente in soggetti anziani e più di frequente al risveglio (in un quadro di compromissione vascolare arterosclerotico con ipertensione latente o franca).
Alcune volte la causa può essere un semplice colpo di tosse, un violento starnuto o la manovra di Valsalva in soggetti sofferenti di stipsi. Solitamente l’emorragia è innocua e si risolve in circa due settimane, se causa di uno scompenso circolatorio o coagulativo è bene indirizzare il paziente per accertamenti mirati. Ad esempio controllo dell’assetto lipidico e coagulativo ematico, holter pressorio delle 24 ore con eventuale consulenza cardiologica.
4.4 Congiuntiviti
La congiuntivite è un processo infiammatorio che coinvolge la superficie del bulbo oculare più esposta ed è caratterizzata da iperemia vascolare con dilatazione dei vasi, infiltrazione cellulare ed essudazione.
Le congiuntiviti si distinguono in acute (quando l’insorgenza inizia prima in un occhio, poi è coinvolto il secondo occhio dopo circa una settimana e la durata in totale è minore di 4 settimane) e croniche (quando il fenomeno si protrae per più di un mese).

Le congiuntiviti acute e croniche possono essere secernenti o non – secernenti.
La congiuntivite è uno dei disturbi oculari più frequenti; le cause si possono distinguere in due categorie:
– INFETTIVE: batteriche – virali – micotiche – da parassiti.
– NON INFETTIVE: da secchezza del film lacrimale o da vizi refrattivi non corretti – allergiche – tossiche (fumo, sostanze irritanti) – secondarie ad altre malattia (es.: Sdr. Di Stevens-Johnson).

Congiuntiviti secernenti
Congiuntivite catarrale acuta
È la classica congiuntivite che secerne abbondante muco chiaro, di natura infettiva e più spesso batterica, frequentemente dovuta a germi scarsamente patogeni.
Tuttavia non bisogna sottovalutare l’uso indiscriminato di molteplici antibiotici che negli ultimi anni ha comportato l’aumento d’incidenza delle forme virali; in particolare si ricordano gli Adenovirus.
SINTOMI. I pazienti lamentano più frequentemente: importante iperemia congiuntivale e ciglia appiccicate soprattutto la mattina per l’intensa secrezione; in alcuni casi il secreto può essere così copioso da “incollare” i bordi cigliari e simulare una pseudoptosi. Importanti sono la sensazione di corpo estraneo o di pressione oculare, la fotofobia e la lacrimazione; se si associa blefarospasmo è segno di coinvolgimento corneale e di tratta in questo caso di cheratocongiuntivite
In caso d’infezione da adenovirus dopo pochi giorni si osservano infiltrati corneali sottoepiteliali che permangono anche per settimane con segno tipico di coinvolgi- mento linfonodale auricolare; questa congiuntivite oltre ad essere fastidiosa e di lenta guarigione è anche altamente infettiva (congiuntivite epidemica)
4 - Congiuntiva
TERAPIA: il decorso clinico è solitamente favorevole con diminuita secrezione già a soli tre giorni di terapia, nelle forme batteriche si prescrivono colliri (non pomate) antibiotici evitando l’occlusione oculare; nelle infezioni da adenovirus colliri antibiotici – cortisonici (facendo attenzione al coinvolgimento corneale).
Congiuntivite catarrale cronica
Questo tipo di congiuntivite presenta sintomi simili alla forma acuta ma più sfumati e maggiormente accusati al mattino e alla sera. Meno accentuato l’edema palpebrale ma si reperta spesso secreto scuro rappreso alla base cigliare con fiocchi di muco sparsi nel secreto lacrimale; molto spesso all’aumento dei sintomi si associa iperemia congiuntivale acuta.
EZIOLOGIA: è più spesso dovuta a congiuntivite acuta non trattata o antibiotico resistente associata a blefarite; spesso si rilevano cattive abitudini che favoriscono il circolo infettivo come disordini alimentari o scarsa igiene personale e a volte malattie (es.: diabete, iperuricemia, glaucoma in trattamento massimale).
TERAPIA: le forme croniche generalmente sterili si possono sovrainfettare e non sono rari i casi di Chlamydia o Klebsiella, pertanto in tutte forme croniche bisogna evitare l’uso casuale di antibiotici e su congiuntiva non trattata con farmaci richiedere sempre un tampone congiuntivale per “ricerca germi comuni con antibiogramma” ed in base a quest’ultimo mirare la terapia d’attacco.
Congiuntivite purulenta acuta
Questo tipo di congiuntivite è prodotta da microrganismi altamente patogeni detti “piogeni” esempio più tipico è il gonococco che produce un’infezione fortemente purulenta per contagio diretto dalle secrezioni sia in adulti che neonati per passaggio nel canale del parto in donne con infezione genitale. L’incubazione può variare da 1 a massimo 5 giorni e nei neonati è sempre bilaterale. Clinicamente si presenta con accentuato edema palpebrale quasi tumefattivo e ipertrofia massiva della congiuntiva che in alcuni casi fuoriesce dalla palpebra e ricopre tutta la cornea con marcata ipertrofia follicolare e secrezione copiosa e continua; è facile assistere inoltre ad un coinvolgimento corneale che a volte se non trattato può dare conseguenze anche nefaste. La virulenza di questi microrganismi è alta, in poche ore un’ulcera corneale solitamente a partenza limbare può condurre a perforazione bulbare ed endoftalmite con perdita bulbare.
TERAPIA: molto spesso il quadro infettivo si accompagna a segni generalizzati di febbre e spossatezza, pertanto è fondamentale una diagnosi precoce seguita da te-
rapia mirata locale e sistemica che comunque non cambiano la prognosi che in questi casi è sempre riservata. Negli ultimi anni quadri di questo tipo sono molto meno frequenti per la profilassi su gestanti e neonati.
Congiuntivite purulenta cronica

Proprio per il largo uso di terapie antibiotiche spesso usate in modo aspe cifico e non controllato, in questi ultimi anni si assiste sempre più frequentemente a congiuntiviti purulente a carattere meno aggressivo e a lunga decorrenza. Questo accade spesso in soggetti con infezioni sistemiche croniche che si autoinoculano e si crede che nel tempo abbiano sviluppato una certa resistenza all’infezione divenendo dei portatori cronici. Clinicamente si assiste ad edema palpebrale, iperemia congiuntivale, papille ipertrofiche e secrezione purulenta continua ma non abbondante; il bordo palpebrale appare lesionato e crostoso per l’azione delle tossine batteriche. In queste forme la prognosi è migliore e le terapie identiche alle forme acute.
Congiuntivite membranosa
È una delle forme peggiori e il decorso è sempre acuto, doloroso e molto fastidioso. Le membrane possono essere “vere” o pseudo – membrane. L’eziologia è più spesso dovuta al bacillo della difterite, in casi meno frequenti a strepto, pneumo e stafilococchi.
SINTOMI: edema palpebrale diffuso e marcato con cute a volte cianotica, dolore acuto alla difficoltosa apertura delle palpebre, importante iperemia congiuntivale e presenza di membrane biancastre più o meno aderenti alla superficie congiuntivale. Le membrane vere si localizzano anche a livello bulbare mentre le pseudo – membrane non aderiscono in questa zona e sono infatti più facilmente asportabili, l’asportazione comporta comunque sanguinamento
Nelle forme a membrane vere si forma un coagulo di fibrina tra la congiuntiva e la stessa membrana con un’adesione tenace al sottostante tessuto già attaccato in precedenza dalle tossine batteriche, la rimozione sarà molto dolorosa e complicata con notevole fuoriuscita ematica e lesioni della congiuntiva estese. Anche in questo caso è frequente il coinvolgimento corneale fino alla possibile perforazione; una congiuntivite membranosa non è mai da sottovalutare poiché se non curata ha sempre prognosi sfavorevole.
Nella migliore delle ipotesi, quando non residua un leucoma corneale, residuano comunque delle gravi lesioni congiuntivali di tipo cicatriziale con esito a lungo o breve termine di cherato - congiuntivite sicca.
4 - Congiuntiva
TERAPIA: oltre alla rimozione delle membrane anche ripetuta, bisogna sempre instaurare una terapia antibiotica locale e sistemica ed effettuare una coltura batteriologica per mirare come nel caso della difterite alla giusta terapia.
Tracoma
Il tracoma (dal greco occhio ruvido) è un’infezione del segmento anteriore dovuta alla Chlamydia Trachomatis (batterio gram - negativo intracellulare obbligato). L’infezione è a tutt’oggi endemica in paesi con scarsa acqua potabile e in condizioni igieniche precarie, Africa e Sud Est asiatico; l’agente viene usualmente trasmesso da punture di mosche che ne sono il veicolo principale.
La malattia è distinta in quattro stadi:
1. STADIO INIZIALE: congiuntivite follicolare con sensazione di corpo estraneo, forte lacrimazione, fotofobia e blefarospasmo, segno importante la pseudo – ptosi palpebrale
2. TRACOMA FLORIDO: intensa fotofobia e riduzione dell’acuità visiva, la ptosi in questo caso è franca e la congiuntiva mostra numerose papille ipertrofiche e i cosiddetti “noduli tracomatosi” rotondeggianti e giallastri che tendono a rompersi nell’eversione palpebrale. La cornea in questa fase è sempre compromessa “cheratite tracomatosa”: iperplasia paralimbare, edema, sofferenza epiteliale con neovascolarizzazione anche stromale.
3. FORMA MISTA (FLORIDA E CICATRIZIALE): mostra zone d’infezione acuta e parti in fase di cicatrizzazione, l’eversione palpebrale è molto difficoltosa per la formazione di tralci connettivali tra i noduli tracomatosi e i follicoli; questo stadio nelle zone endemiche dura anche anni, nel mondo oltre 150 milioni di bambini sono stati infettati e rischiano di diventare completamente ciechi.
4. TRACOMA CICATRIZIALE: in questa fase l’agente infettante non è più presente ma sono terribili gli esiti anche a livello bulbare. Le retrazioni cicatriziali comportano spesso trichiasi con coinvolgimento corneale anche di tipo ulcerativo, entropion ed ectropion a seconda del grado di necrosi palpebrale; il simblefaron quando molto esteso porta alla perdita del fornice congiuntivale e a limitazione dei movimenti bulbari con lagoftalmo cicatriziale. Le altera- zioni corneali possono essere così estese da comportare il cosiddetto “panno tracomatoso” e nelle forme gravi può residuare una cherato – congiuntivite sicca con perdita totale di ghiandole lacrimali e mucipare e congiuntiva completamente cheratinizzata.
TERAPIA: sulfamidici e tetracicline, azitromicina locali e sistemiche in dosi massive
con somministrazioni ripetute semestralmente anche se il processo sembra essere spento, l’infezione è insidiosa e latente e spesso comporta esacerbazioni.
Congiuntiviti non secernenti
Congiuntivite allergica

È un’infiammazione subacuta con iperemia ed ipertrofia congiuntivale da reazione locale ad allergeni di varia natura. L’allergia è più spesso locale per instillazione di colliri (es.: midriatici, pilocarpina) o uso di cosmetici, esposizione a gas, polveri, pollini, forfora di animali. In alcuni casi è una manifestazione associata a sintomi sistemici come orticaria, eczema, asma, rinite allergica.
Nei soggetti glaucomatosi, in particolare per l’instillazione cronica di colliri contenenti conservanti irritanti, si assiste spesso ad allergie anche importanti così come nelle forme congiuntivali stagionali.

SINTOMI: bruciore e prurito intenso con lacrimazione e fotofobia; all’ispezione clinica si repertano segni tipici come edema palpebrale, intensa iperemia congiuntivale accompagnata da ipertrofia papillare anche importante sia superiore che inferiore e quando l’allergia perdura da tempo si può assistere ad importante eczema palpebra le fino all’ala nasale. Queste allergie possono sussistere per lungo tempo finché non venga instaurata una corretta terapia, tenendo presente che la soluzione migliore è l’allontanamento dell’allergene.
Congiuntivite primaverile
Congiuntivite acuta con ipertrofia papillare bilaterale, recidivante e ad incidenza nella stagione primaverile con cause non precise ma sicuramente ambientali. I soggetti più colpiti sono bambini in età prepubere prevalentemente maschi.
SEGNI TIPICI: fotofobia molto intensa con ipertrofia delle papille ed edema palpe-
4 - Congiuntiva
brale talmente marcati da non riuscire ad aprire gli occhi; all’esame ispettivo la congiuntiva è mostruosamente ipertrofica con papille grandi ed appiattite (congiuntivite ad acciottolato romano). Anche la cornea può essere colpita con edema e cheratite puntata superficiale. Il decorso è subacuto e spesso limita gravemente la frequenza scolastica. Questa congiuntivite non va confusa con quella allergica che riconosce degli allergeni specifici e i segni caratteristici per la diagnosi differenziale sono: fotofobia e papille gravemente ipertrofiche. La terapia è solo palliativa i soggetti ottengono sollievo solo con l’instillazione continua di corticosteroidi.


4.5 Tumori benigni
Cisti congiuntivali
Si formano per occlusione di una ghiandola lacrimale accessoria o mucipara (cisti da ritenzione con aspetto di piccole vescicole) contenenti liquido lacrimale limpido o mucoso.
SINTOMI: il soggetto ha fastidio alla chiusura palpebrale, spesso si risolvono o si può praticare una puntura evacuativa.
Papillomi
Sono dei tumori epiteliali del tutto benigni in alcuni casi dovuti a flogosi croniche ma più spesso ad infezioni virali da Papilloma virus
Sono asintomatici o lievemente irritativi, generalmente tendono a crescere a volte raggiungono anche dimensioni fastidiose percepite dal soggetto come vero e proprio corpo estraneo.
All’esame obiettivo sono delle neoformazioni di forma mammellonata con vascolarizzazione centrale variabilmente evidente con localizzazione più spesso limbare e al bordo palpebrale mentre più difficilmente sulla congiuntiva bulbare.

Si localizzano più frequentemente su zone colpite da calazi, blefariti croniche ed infiammazioni croniche attecchendo quindi più facilmente a livello tarsale.
TRATTAMENTO: la terapia chirurgica di escissione è correlata più alla sensazione di fastidio del paziente o ad oggettive motivazioni estetiche e difficoltà visive.
Malattia di Bowman
Sono epiteliomi intraepiteliali solita- mente monolaterali, potenzialmente maligni tipici dell’età senile; non recano disturbo tranne in fase avanzata o nell’evoluzione verso la malignità.
Si localizzano preferenzialmente in zona limbare come masse non ben definite e vascolarizzate; si consiglia una resezione ad ampia base.
Angiomi
Sono tumori asintomatici molto spesso piccoli e di natura vascolare, si presentano di colore rosso scuro violaceo a livello della congiuntiva tarsale o bulbare. Non tendono alla proliferazione e col tempo si possono ridurre in maniera considerevole, pertanto non richiedono un trattamento particolare tranne se vadano ad inficiare l’aspetto estetico.
DIAGNOSI IMPORTANTE: non sottovalutare l’eventuale associazione ad altri angiomi come la classica “voglia di vino” sul volto che potrebbe nascondere la Sindrome di Sturge–Weber (angiomatosi facciale, congiuntivale, uveale, meningea con ipertono oculare). Pertanto in casi sospetti bisogna controllare la pressione ed il fondo

oculare e poiché potrebbe essere difficoltoso rilevare un angioma della coroide si consiglia un esame fluorangiografico al verde indocianina.
Nevi
Sono i tumori più diffusi e comuni della congiuntiva che già presenti alla nascita spesso si rendono visibili solo in età adulta; si presentano come chiazze scure, per accumulo di cellule ricche di melanina ed variamente estese e mobili poiché inglobate nella congiuntiva e non vascolarizzate. Raramente il nevo è apigmentato e si presenta come una piccola massa gelatinosa con propria vascolarizzazione (diagnosi differenziale con gli epiteliomi). I nevi vanno sempre considerati come potenzialmente evolutivi verso la malignità pertanto vanno controllati almeno una volta l’anno ed il cambiamento di forma, colorazione, vascolarizzazione sono segni di allarme. L’exeresi deve essere effettuata con vasto margine e controllare i limiti dell’asportazione.
ISTOLOGIA: come i nevi cutanei anche quelli della congiuntiva possono essere giunzionali, compositi e subepiteliali (equivalenti ai nevi intradermici della cute) ed anche sulla congiuntiva sono state descritte delle varianti come il nevo blu, quello di Spiltz o a cellulle baloon. Sulla congiuntiva le modificazioni legate alla pubertà pos- sono creare problemi diagnostici.
Il NEVO DI OTA è un’alterazione cutanea e/o congiuntivale benigna che compare e si estende nel corso dell’infanzia e dell’adolescenza per traumi, ustioni solari o più facilmente per cambiamenti ormonali. Si presenta come una chiazza a limiti mal definiti di colore dal marrone, grigio, blu o porpora dovuta ad errata de- posizione di melanociti.

4.6 Tumori maligni Epiteliomi
DEFINIZIONE: è una neoformazione che più spesso si evolve da una malattia di Bowen o su una leucoplachia, la massa appare giallo grigiastra con netta vascolarizzazione che nel tempo comporta dolore e fastidio al movimento palpebrale.
ISTOLOGIA: più frequentemente sono epiteliomi spinocellulari, raramente basocellulari.
TRATTAMENTO: inizialmente la malignità rimane localizzata pertanto l’asportazione chirurgica precoce con associazione a terapia radiante dà buoni risultati. Mai sottovalutare neoformazioni sospette poiché attraverso le vie linfatiche danno luogo a metastasi.

Melanoma della congiuntiva
DESCRIZIONE ED EPIDEMIOLOGIA: il melanoma della congiuntiva è una rara malattia con un’incidenza di 2 - 8 casi anno pari ad 1 caso per 10.000.000 di abitanti anno. È una malattia grave che può dare metastasi che seguono principalmente la via linfatica attraverso i linfonodi sentinella: preauricolari, sottomandibolari e latero- cervicali. Il rischio di metastasi è del 14% dopo 5 anni dalla inizio della malattia
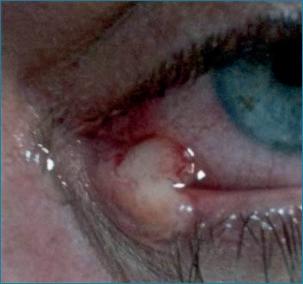
e del 20% dopo 10 anni. I melanomi della congiuntiva si presentano in modo vario, possono essere lesioni piatte localizzate o diffuse diversamente pigmentate, rilevate, mammellonate anche multiple o diffuse associate o no alla cosiddetta PAM “Primary Acquired Melanosis”.
La PAM è una situazione precancerosa particolarmente importante è va distinta dal punto di vista istologico in due forme: PAM con atipia cellulare (in cui c’è un alto rischio di evoluzione in melanoma maligno) e PAM senza atipica cellulare. Due sono i fattori principali per la prognosi vitale: lo spessore del tumore e la com- parsa delle recidive del tumore; i fattori principali responsabili delle recidive da parte dei melanoma della congiuntiva sono: presenza di un melanoma diffuso, presenza di melanoma associato a PAM, presenza di melanoma voluminoso.
TRATTAMENTO: varia a seconda del tipo, delle dimensioni e delle condizioni oftalmologiche dell’occhio affetto da melanoma della congiuntiva. In prima istanza se possibile occorre asportare in toto la lesione con un margine di sicurezza associando un trattamento crioterapico sul bordo dell’escissione chirurgica; se la lesione è troppo grossa o troppo diffusa possono essere associati trattamenti adiuvanti come chemioterapia topica (mitomicina, 5 fluorouracile) ovvero radioterpia con placche o con proto ni accelerati (trattamenti combinati). Si può quindi procedere ad una chemio-riduzione con terapia topica e successivamente passare alla asportazione chirurgica. Ogni trattamento dei melanomi della congiuntiva deve comunque rappresentare solo l’inizio di un processo oncologico di diagnosi, cura, follow-up che garantisca il paziente sul rischio di recidiva e metastasi.
Linfoma congiuntivale
Si presenta come una porzione congiuntivale di solito del fornice inferiore prominente e di color salmone, spesso è proprio il primo segno di una malattia linfatica sistemica. Si impone la biopsia della parte e l’esame istologico per appurare il grado di malignità poiché l’iniziale iperplasia linfoide benigna evolve sempre verso un linfoma maligno di grado moderato fino al grado più severo.
TRATTAMENTO: il linfoma risponde bene nelle fasi precoci a radio e chemioterapia associate decise sulla base del reperto istologico.
Sarcoma di Kaposi congiuntivale
Così come per il classico sarcoma di Kaposi cutaneo anche nel caso oculare si presenta prominente, di colore inizialmente rosso chiaro sino a bordeaux scuro a partenza dal fornice congiuntivale o dalla congiuntiva palpebrale.
ISTOLOGICAMENTE: presenta cellule maligne fusiformi ed endoteliali atipiche raggruppate a mo’ di nido. Questo tumore si associa a malattie sistemiche di immunodeficienze acquisite come l’AIDS o anche recentemente in concomitanza di infezioni da herpes virus (HHV – 8).
4.7 Depositi congiuntivali
Tesaurismosi
È una patologia congiuntivale da accumulo di sostanze di diversa natura come le tesaurismosi glicidiche, protidiche, lipidiche, pigmentarie e di minerali: alcune forme di tesaurismosi interessano zone del corpo circoscritte che possono indicare anche disturbi locali. Per esempio le tesaurismosi pigmentarie sono dovute all’accumulo di pigmenti presenti in condizioni fisiologiche e patologiche nelle cellule e nei tessuti. Si distinguono tesaurismosi dovute a pigmenti emoglobinogeni che si possono localizzare nelle sedi di emorragia o dovute a pigmenti autogeni come in eccessi di melanine e di lipofuscine. Una forma particolare è la paratesaurismosi provocata da accumulo di pigmenti introdotti nell’organismo come in seguito a tatuaggi o a esposizione a sostanze inquinanti.
Concrezioni calcaree
Si presentano come depositi giallastri di consistenza variabilmente dura localizzati più di frequente nel fornice congiuntivale inferiore in soggetti anziani o con patologie infiammatorie croniche.

SINTOMI: in fase iniziale sono del tutto asintomatiche, quando raggiungono dimensioni maggiori possono anche ledere la cornea e si impone la rimozione.
Ocronosi
L’alcaptonuria è una patologia correlata al difetto di catabolismo della fenilalanina (un amminoacido essenziale). Questa deficienza autosomica recessiva consiste in un difetto dell’enzima omogentisato 1,2-diossigenasi che non catalizza la reazione omogentisato → maleilacetoacetato e l’eccesso di omogentisato nelle urine di tali pazienti si ossida facilmente dando il tipico colore scuro (ocronosi). Il 70% di questi soggetti presentano depositi pigmentari a livello di palpebre, congiuntiva, sclera e limbus della cornea, quesri depositi aumentano col tempo ma non necessitano di trattamento.
Argirismo
Si tratta d’intossicazione cronica da sali d’argento che si manifesta in soggetti che hanno fatto uso per lungo tempo di queste sostanze a scopo terapeutico. Una pigmentazione grigiastra da argento si può osservare limitatamente alla congiuntiva. Oggi tuttavia l’uso è limitato ad alcuni colliri, per cui l’argirismo si osserva quasi esclusivamente come malattia professionale. Questa patologia da accumulo è caratterizzata da una pigmentazione grigiastra della cute e delle mucose (argirosi) dovuta al depositarsi del metallo negli interstizi tra i tessuti. Possono associarsi anche astenia, nausea ed edemi.
5 CORNEA
5.1 Struttura
La cornea rappresenta la finestra ottica dell’occhio che permette all’uomo di vedere ed è il più importante mezzo refrattivo oculare poiché da sola opera sino a 43 diottrie.
Forma e localizzazione
La curvatura corneale è maggiore di quella sclerale e s’inserisce all’interno della sclera come un vetro di orologio con un solco superficiale detto “limbus corneale” che rimarca la giunzione tra le due strutture.
Embriologia
Il tessuto corneale è formato da 5 strati: la cornea e la sclera si formano durante il secondo mese di sviluppo embrionale; l’epitelio si sviluppa dall’ectoderma, e gli strati più profondi originano dal mesenchima.
La superficie corneale è formata da un epitelio squamoso stratificato non cheratinizzato che si rigenera rapidamente se danneggiato; infatti entro un’ora i difetti epiteliali vengono chiusi dalla migrazione e da una rapida divisione cellulare.
Tuttavia, questo concetto presuppone che le cellule della radice del lembo, situate sul lembo corneale, non siano danneggiate. Non è possibile infatti una regolare rigenerazione delle cellule corneali se queste stesse ne risultano compromesse. Un epitelio intatto protegge dalle infezioni mentre un’alterazione dello stesso facilita la migrazione di batteri all’interno dell’occhio.

– Una sottile membrana basale ancora le cellule basali dell’epitelio squamoso stratificato alla membrana di Bowman, questo strato è molto resistente ma non è in grado di rigenerarsi, quindi lesioni della Bowman producono di solito cicatrici corneali.
Sotto lo strato della membrana di Bowman vi è lo stroma corneale formato da mol-
te lamelle di fibrille collagene. Lo stroma è un tessuto avascolare che può quindi rigenerarsi solo molto lentamente, tuttavia la sua avascolarità lo rende un tessuto immunologicamente privilegiato per il trapianto corneale che può essere eseguito di routine senza la tipizzazione del tessuto. Un au- mento del rischio di rigetto può essere paventato solo nel momento in cui la cornea del destinatario è altamente vascolarizzata, come potrebbe accadere nei postumi di danni chimici o infiammatori ed in questi casi è richiesta una tipizzazione tessutale del donatore o una terapia immunosoppressiva con ciclosporina.
– La membrana di Descemet e l’endotelio corneale giacciono sulla superficie posteriore dello stroma corneale, adiacenti alla camera anteriore. La membrana di Descemet è relativamente resistente e continua a definire la forma della camera anteriore anche laddove lo stroma corneale sia stato completamente liquefatto (vedi descemetocele). Dato che si tratta di una membrana puramente basale, il tessuto perso viene rigenerato dalle cellule endoteliali. L’endotelio corneale è responsabile della trasparenza della cornea e per ottenerla è necessaria un’alta densità di cellule epiteliali. L’endotelio corneale non si rigenera, i difetti dell’endotelio sono chiusi dall’allargamento e dalla migrazione cellulare.
Diametro
Il normale diametro medio corneale dell’adulto è di 11.5 mm (10 – 13 mm). Una cornea congenitamente piccola (micro cornea, diametro inferiore ai 10 mm) o una cornea congenitamente grande (megalocornea, diametro dai 13 ai 15 mm) è sempre un reperto anomalo.
Nutrimento
I cinque strati della cornea hanno poche cellule, non sono strutturati e sono ava- scolari. Come il cristallino, la sclera ed il corpo vitreo, la cornea è una struttura bra- ditrofica. Il suo metabolismo è lento e quindi anche la sua guarigione. La cornea è nutrita con metaboliti (aminoacidi e glucosio) da tre sorgenti:
– DIFFUSIONE DAI CAPILLARI AI SUOI BORDI;
– DIFFUSIONE DALL’UMORE ACQUEO;
– DIFFUSIONE DAL FILM LACRIMALE
Significato del film lacrimale per la cornea
Il film lacrimale a tre strati assicura che la superficie della cornea rimanga liscia e aiuta a nutrire la cornea.
Senza film lacrimale la superficie dell’epitelio diventa ruvida ed il paziente potrebbe vedere un’immagine sfuocata; l’enzima lisozima contenuto nel film lacrimale inoltre protegge l’occhio contro possibili infezioni.
Trasparenza
È dovuta a due fattori:
La DISPOSIZIONE UNIFORME DELLE LAMELLE DI FIBRILLE COLLAGENE nello stroma corneale e le superfici endoteliale ed epiteliale lisce prodotte dalla pressione intraoculare.

– Il CONTENUTO IN ACQUA DELLO STROMA CORNEALE RIMANE COSTANTE
AL 70%, l’azione combinata dell’epitelio e dell’endotelio mantiene un contenuto di acqua costante; l’epitelio mantiene separato lo stroma dall’esterno, mentre l’endotelio agisce come una pompa ionica che rimuove l’acqua dallo stroma. Ciò richiede una densità sufficientemente alta di cellule endoteliali. La densità delle cellule endoteliali è età – dipendente; normalmente è approssimativamente di 2500 cellule/ mm2. Ad una densità cellulare inferiore a 300/mm2 l’endotelio non è più in grado di pompare l’acqua al di fuori della cornea, causando un edema dello stroma e dell’epitelio corneale.
Protezione e supporto nervoso
La cornea è una struttura vitale dell’occhio ed è estremamente sensibile ricevendo un ampio supporto sensoriale dalla branca oftalmica del nervo trigemino.
La minima sensazione tattile causa un riflesso di chiusura dell’occhio; qualsiasi danno della cornea (erosione, penetrazione da corpo estraneo, o cheratocongiuntivi te da raggi ultravioletti) espone le terminazioni nervose sensitive e causa un intenso dolore con lacrimazione riflessa ed involontaria chiusura dell’occhio.
La triade d’involontaria chiusura oculare (blefarospasmo), lacrimazione riflessa (epifora) e dolore suggerisce un possibile danno corneale.
5.2 Metodi d’esame
I medici non oculisti possono valutare la trasparenza della cornea (opacità dello stroma e dell’epitelio possono suggerire una cicatrice o infiltrazione epiteliale), la sua specularità (la perdita di questa caratteristica suggerisce un difetto epiteliale), un possibile danno superficiale, mentre la sensibilità può essere testata con un tampone di cotone. L’oculista usa invece strumenti specifici per valutare la morfologia corneale e la sua funzione con maggior dettaglio.
5 - Cornea
Esame alla lampada a fessura
La lampada a fessura è il primo strumento usato per valutare la cornea. L’oculista sceglie tra più di 40 poteri di ingrandimento per esaminare tutti gli strati corneale con un sottile fascio di luce collimato.
Illuminazione diretta
Il fascio sottile viene mosso sull’intera superficie corneale, in questo modo possono essere valutati lo spessore e la profondità della cornea.
Illuminazione indiretta
La luce della lampada a fessura viene diretta dal lato verso il limbus corneale ed in questo modo si ottiene una totale riflessione dalla cornea completamente trasparente. Sottili opacità o un discreto edema corneale viene mostrato con questa tecnica tramite una non perfetta riflessione della luce proveniente dalla lampada a fessura.
Illuminazione retrograda
La cornea è illuminata dalla luce riflessa proveniente dall’iride tramite un sottile fascio luminoso diretto nell’occhio, in questo modo diventano visibili sottili anomalie epiteliali o endoteliali o piccoli capillari sanguigni.
Esame della cornea con colorante
Alterazioni della superficie corneale possono essere visualizzati con soluzioni di fluoresceina o rosa bengala e dato che tali coloranti non vengono di solito assorbiti dall’epitelio, possono essere usati per visualizzare una perdita di epitelio su una vasta area (come una erosione corneale) ed alterazioni estremamente sottili (come nella cheratite puntata superficiale); l’illuminazione con filtro blu cobalto esalta l’effetto della fluorescenza. Questi metodi coloranti possono rivelare difetti dell’epitelio corneale (es. lesione corneale) anche senza l’utilizzo di una lampada a fessura, il ché è di estrema utilità nell’esame dei bambini che fanno difficoltà a farsi visitare fermi alla lampada.
Topografia corneale
Il cheratoscopio (disco di Placido) permette una valutazione grossolana dell’uniformità della superficie corneale. Questo strumento è formato da un disco rotondo segnato da anelli concentrici bianchi e neri che circondano un’apertura centrale. L’immagine riflessa degli anelli sul la cornea del paziente indica l’eventuale presenza di astigmatismo, nel caso in cui questi appaiano distorti.
Questa metodica manca della precisione richiesta nelle moderne applicazioni come per la chirurgia refrattiva ed è stata quindi soppiantata dalla moderna topografia corneale computerizzata (videocheratoscopia) in cui la superficie corneale è oggi analizzata dettagliatamente.
In questo esame i contorni della cornea vengono misurati da un computer nella stessa maniera del cheratoscopio ed i valori refrattivi di specifiche regioni corneali sono rappresentati in una mappa diottrica codificata da colori (vedi foto).
Il rosso vivo, per esempio rappresenta una curvatura accentuata con un elevato potere refrattivo.
Questa tecnica è fondamentale per effettuare diagnosi certa di cheratocono o per effettuare un accurato trattamento laser di correzione refrattiva.
Determinare la sensibilità corneale
I medici non oculisti potrebbero eseguire un semplice esame preliminare della sensibilità corneale con un bastoncino di cotone, questo esame aiuta anche l’oculista per confermare la diagnosi in presenza di una infezione virale della cornea o di una neuropatia del nervo faciale o trigemino dal momento che queste patologie sono associate ad una ridotta sensibilità corneale. L’oculista può utilizzare un estesiometro


automatico di Drager per una misurazione precisa della sensibilità corneale e per esami di follow–up. Questo strumento può aumentare incrementalmente lo stimolo della sensibilità, ciò rende possibile determinare se e quanto rapidamente la sensibilità corneale aumenti in seguito ad un trapianto di cornea.
Misurazione della densità dell’epitelio corneale
Una densità sufficientemente alta delle cellule endoteliali è molto importante per la trasparenza della cornea; una stima grossolana della densità cellulare è possibile per un’area circoscritta usando una lampada a fessura ed un’illuminazione indiretta dove l’asse visivo e d’illuminazione sono entrambi posti al di fuori dall’asse visuale. Una quantificazione precisa ed una valutazione morfologica delle cellule endoteliali di una grande area è possibile solo utilizzando la microscopia speculare una tecnica realizzata proprio per questo scopo. Un’esatta analisi è necessaria quando il numero delle cellule appare notevolmente basso all’esame preliminare con lampada a fessura e il paziente è per esempio un candidato per la chirurgia della cataratta.
Misurazione del diametro corneale
Una cornea abnormemente larga o piccola (megalocornea o microcornea) si evdenzierà ad una semplice ispezione, una misura anomala sospetta può essere facilmente verificata misurando la cornea con un righello anche se il diametro corneale può essere misurato più accuratamente con un compasso (di solito in anestesia generale) o con il cheratometro di Wessely (un tipo di tubo con lenti a graduazione millimetrata) che l’esaminatore posiziona sull’occhio del paziente e guarda attraverso l’altra estremità.
Pachimetria corneale
Lo spessore corneale (circa 520 µm centralmente) è importante per una precisa misurazione della pressione intraoculare, infatti all’aumento dello spessore corneale corrisponde un innalzamento della IOP (pressione intra oculare) misurata e viceversa. Una misurazione precisa dello spessore corneale è fondamentale anche nella chirurgia refrattiva che agisce proprio sullo spessore corneale. Ci sono due tecniche di pachimetria per misurare lo spessore corneale con alto grado di precisione richiesta da questa chirurgia:
– La pachimetria ottica con lampada a fessura e misurazione compresa che può essere eseguita con il paziente in posizione seduta.
– Pachimetria ultrasonica che ha il vantaggio di una maggiore precisione e può essere eseguita anche a paziente supino.
Strumenti moderni oggi permettono di eseguire la pachimetria mediante la microscopia speculare e l’OCT.
Microscopia corneale confocale
La microscopia corneale confocale è una tecnica d’esame recentemente sviluppata che rende possibile analizzare la cornea in una grande area che va dallo strato più esterno a quello più interno. Essa differisce in tale aspetto dall’esame alla lampada a fessura che tende ad essere un esame focale condotto lungo un raggio di luce perpendicolare all’occhio. La microscopia confocale corneale visualizza le strutture cellulari al massimo ingrandimento che non può essere ottenuto con la lampada a fessura. Si possono osservare i nervi corneali, le amebe e le ife. Sebbene non ancora utilizzata di routine nella pratica clinica, la microscopia confocale della cornea sembra essere un metodo di esame promettente per il futuro.
5.3 Anomalie di sviluppo
Anomalie di protrusione

Cheratocono
DEFINIZIONE: deformazione conica della cornea di solito bilaterale e centrale con opacizzazione parenchimale ed assottigliamento della cornea.
EPIDEMIOLOGIA: il cheratocono è la malformazione corneale di più frequente riscontro, la sua presentazione è familiare sebbene le donne sembrino esserne maggiormente colpite.
EZIOLOGIA: il cheratocono è una patologia genetica e si manifesta in famiglie con vari tipi di trasmissione ereditaria. Occasionalmente è associato alla trisomia del cromosoma 21 (sindrome di Down) così come a dermatiti atopiche o ad altre patologie del tessuto connettivo come la sindrome di Marfan.
SINTOMI: il decorso clinico è episodico, l’aumento della protrusione corneale di solito produce un astigmatismo bilaterale miopico irregolare. Se non diagnosticato e non trattato, in rari casi il cheratocono può causare rotture della membrana di Descemet per il continuo stiramento. Si può giungere ad una fase di cheratocono acuto dove i sintomi includono improvvisa perdita dell’acuità visiva accompagnata da intenso dolore, fotofobia e aumento della lacrimazione.
CONSIDERAZIONI DIAGNOSTICHE: la diagnosi viene usualmente fatta con un che-
5 - Cornea ratoscopio o un oftalmometro (le immagini riflesse saranno irregolari). L’esaminatore può anche scoprire un cheratocono avanzato senza alcun mezzo diagnostico mettendosi di lato al paziente e premendo le sue palpebre superiori verso il basso. La protrusione conica della superficie corneale sarà prontamente evidente dalla deforma-zione del margine palpebrale (segno di Munson).
TRATTAMENTO: il peggioramento dell’acuità visiva può di solito essere corretto all’inizio tramite occhiali mentre saranno utili nel corso del peggioramento lenti a contatto rigide. Tuttavia ad un certo punto il paziente perderà ripetutamente le lenti a contatto e l’unico possibile trattamento sarà la cheratoplastica (trapianto di cornea da donatore). Negli ultimi anni ci sono stati enormi progressi anche con altre tecniche chirurgiche e di trattamento corneale con UV (raggi ultravioletti) previa apposizione di riboflavina (cross-linking) da effettuare in genere in giovane età (non oltre i 25 anni quando il cheratocono ha una maggiore evolutività).
PROGNOSI: la prognosi per la cheratoplastica nel trattamento del cheratocono è buona perché la cornea nel cheratocono è avascolare e quindi le reazioni avverse ed il rigetto sono meno frequenti.
Anomalie di grandezza corneale (microcornea e megalocornea)
Le anomalie della grandezza corneale sono di solito congenite e nel complesso rare.
Una cornea abnormemente piccola (microcornea) ha un diametro minore di 10 mm, ciò causa solitamente una severa ipermetropia che può predisporre in età avanzata ad un glaucoma acuto con chiusura d’angolo.
Una cornea abnormemente grande (megalocornea) può essere larga dai 13 ai 15 mm. Un allargamento corneale nel neonato e nei bambini potrebbe generarsi in seguito ad una elevata pressione intraoculare (buftalmo). Possono anche verificarsi contemporaneamente delle combinazioni di microcornea e megalocornea con altre deformità oculari.
5.4 Cheratiti infettive
Come discusso in seguito la cornea possiede meccanismi difensivi che sono fondamentali per la sua costante esposizione a microbi e a varie influenze ambientali.
I meccanismi includono:
– chiusura riflessa degli occhi;
– effetto lavaggio del fluido lacrimale (lisozima);
– l’epitelio idrofobico forma una barriera di diffusione;
– l’epitelio è in grado di rigenerarsi rapidamente e completamente.
Infezioni corneali: fattori predisponenti, patogeni e patogenesi Quando alcuni patogeni riescono a oltrepassare le difese corneali attraverso danni superficiali o difetti epiteliali minori, il tessuto bradi trofico corneale risponderà al patogeno specifico con una cheratite caratteristica.
I fattori predisponenti che promuovono l’infiammazione sono:
blefarite;
infezione degli annessi oculari (per esempio, dacriostenosi accompagnata da infezione batterica del sacco lacrimale);
– cambiamenti nella barriera epiteliale corneale (cheratopatia bollosa o occhio secco);
– lenti a contatto;
– lagoftalmo;
– disturbi neuro paralitici;

– traumi;
– agenti immunosoppressori topici e sistemici.
I patogeni che causano infezioni corneali possono includere:
– virus;
– batteri;
– acanthamoeba;
– funghi.
Patogenesi - Una volta che questi patogeni hanno invaso il tessuto braditrofico attraverso una lesione corneale superficiale, si verificherà una tipica catena di eventi:
– lesione corneale,
– i patogeni invadono e colonizzano lo stroma corneale (occhio rosso),
– gli anticorpi infiltrano il sito di infezione,
– quindi la cornea si opacizzerà ed il punto di ingresso si aprirà ulteriormente, rivelando l’infiltrato corneale,
vi sarà irritazione della camera anteriore con ipopion (il pus si accumulerà tipicamente sulla parte inferiore della camera anteriore),
– il patogeno infetterà l’intera cornea
– e lo stroma si fonderà alla membrana di Descemet, che è relativamente resistente. Questo è noto come descemetocele, solo la Descemet è ancora intatta e protruderà anteriormente come è possibile vedere dall’esame alla lampada a fessura.
– Con il progredire della patologia si verifica una perforazione della Descemet e si vedrà colare l’umore acqueo, questo è noto come ulcera corneale perforata ed è un’indicazione all’immediato intervento chirurgico (cheratoplastica d’emergenza,
5 - Cornea impianto di membrana amniotica o ricoprimento congiuntivale). Il paziente noterà una perdita progressiva della vista e gli occhi saranno ipotonici e soffici.
– Prolasso dell’iride (l’iride prolassa nel difetto corneale che si è creato) chiudendo la perforazione corneale posteriormente (l’adesione dell’iride causerà una cicatrice bianca corneale).
– Questa sequenza di eventi può variare in velocità e severità soprattutto a seconda della voracità del patogeno e dello stato del sistema immunitario del paziente; un infiltrato può formarsi in poche ore o giorni e velocemente può progredire in un’ulcera corneale, liquefazione dello stroma, e anche in descemetocele. Questa forma rapidamente progressiva di ulcera corneale infettiva (di solito batterica) è detta ulcera corneale serpiginosa. Essa penetra all’interno della cornea in modo particolarmente rapido e presto causa un coinvolgimento intra-oculare (il patogeno sarà attivo attraverso la rima visibile dell’ulcera), l’ulcera corneale serpiginosa è una delle sindromi cliniche più pericolose perché può portare rapidamente alla perdita dell’occhio.
Note generali sulla diagnosi delle forme di cheratite infettiva
Una pronta diagnosi e trattamento delle infezioni corneali sono fondamentali per scongiurare un danneggiamento permanente della vista. La diagnosi di ogni tipo di cheratite infettiva essenzialmente include i seguenti passaggi:
– Identificare il patogeno e testare la sua resistenza; ciò viene effettuato prendendo uno striscio dalla base dell’ulcera per ottenere un campione ed inoculando un terreno di coltura per batteri e funghi. Nei portatori di lenti a contatto dovrebbero essere ottenuti campioni anche provenienti dalle lenti e dal contenitore in particolare per assicurarsi che esse non siano la sorgente dei batteri o dei funghi.
– Gli strisci senza contaminazioni e trattati con colorante Gram o Giemsa vengono esaminati per individuare i batteri;
– quando si sospetta un’infezione virale, è indicato saggiare la sensibilità corneale che risulterà diminuita nelle cheratiti virali
Cheratiti batteriche
EPIDEMIOLOGIA: oltre il 90% delle infiammazioni corneali è causato da batteri.
EZIOLOGIA: la maggior parte dei batteri non sono in grado di penetrare la cornea fino a che essa resta intatta, solo i gonococchi e la difteria possono penetrare un epitelio corneale intatto.
SINTOMI: i pazienti mostrano un dolore da moderato a severo (eccetto che nelle
infezioni da Moraxella), fotofobia, compromissione del visus, lacrimazione, e secrezione purulenta. La secrezione purulenta è tipica delle cheratiti batteriche infatti le cheratiti virali producono una secrezione acquosa.
CONSIDERAZIONI DIAGNOSTICHE: fondamentale è l’identificazione del patogeno, le ulcere corneali serpiginose sono frequentemente associate ad una severa reazione in camera anteriore, incluso l’accumulo di cellule e pus nella parte inferiore della camera anteriore (ipopion) ed adesioni posteriori dell’iride e del cristallino dette (sinechie posteriori).
DIAGNOSI DIFFERENZIALE: funghi (è richiesta un’identificazione positiva del patogeno per escludere un’infezione fungina).
TRATTAMENTO: a causa del rischio di perforazione qualsiasi tipo di ulcera corneale è considerato un’emergenza che richiede il trattamento di un oculista ed in brevissimo tempo.
TERAPIA CONSERVATIVA: il trattamento è inizialmente di antibiotici topici (tipo ofloxacina, norfloxacina e polimixina) con uno spettro di azione molto ampio contro la maggior parte degli organismi Gram(+) e Gram(-) fino a che non siano noti i risultati del patogeno e della sua resistenza. Un’immobilizzazione del corpo ciliare e dell’iride con una midriasi terapeutica farmacologica è indicata in presenza di un’irritazione intraoculare (manifestata dall’ipopion).
TRATTAMENTO CHIRURGICO: le indicazioni si basano sulle seguenti situazioni cliniche:
– Ampie aree di necrosi superficiale o insufficiente guarigione dovrebbero richiedere una membrana amniotica (lembo di tessuto placentare) per accelerare la guarigione sotto il lembo protettivo, dopo la chiusura del difetto possono comparire delle cicatrici.
– La cheratoplastica di emergenza è indicata per trattare un descemetocele o un’ulcera corneale perforata.
NOTA: la stenosi o il blocco del sistema lacrimale inferiore dovrebbe essere corretto chirurgicamente dopo la guarigione dell’ulcera per evitare altre sorgenti di infezione. Non appena i risultati dell’esame batteriologico e dei test di resistenza si rendono disponibili, il medico deve verificare che i batteri siano suscettibili alla terapia impostata ed eventualmente modularla in modo efficace.
Un fallimento nella risposta al trattamento delle cheratiti potrebbe essere dovuto ad una delle seguenti cause, in particolare se il patogeno non è stato positivamente identificato.

5 - Cornea
1. Il paziente non sta mettendo l’antibiotico (scarsa compliance).
2. Il patogeno è resistente all’antibiotico.
3. La cheratite non è causata da batteri ma da uno dei seguenti patogeni:
- Herpes Simplex Virus
- Funghi
- Acanthamoeba
- Patogeni rari e specifici come la Nocardia o micobatteri (questi sono mol- to rari pertanto non verranno discussi ulteriormente in questo capitolo).
Cheratiti virali
La cheratite virale è frequentemente causata da:
– Herpes Simplex Virus
– Varicella-Zoster Virus
– Adenovirus
altre rare cause includono il citomegalovirus e quello della della rosolia.
Cheratite da herpes simplex
EPIDEMIOLOGIA E PATOGENESI: la cheratite da Herpes Simplex è fra le cause più comuni di ulcera corneale, circa il 90% della popolazione è portatrice dell’HSV. Una caratteristica tipica dell’herpes simplex ubiquitario è un’infezione primaria non notata che spesso guarisce spontaneamente. Molte persone quindi diventano portatrici del virus neurotrofico che può portare ad infezioni ricorrenti in qualsiasi momento provenendo per esempio dal ganglio trigeminale.
Un’infezione corneale è sempre una ricaduta perché un’infezione primaria dell’occhio da herpes simplex si presenterà come una blefarite o una congiuntivite. Una ricaduta può essere provocata da fattori esterni (come l’esposizione a raggi ultravioletti), stress, mestruazioni, deficit generale immunologico o infezioni febbrili.
SINTOMI: la cheratite da Herpes Simplex è di solito molto dolorosa e associata a fotofobia, lacrimazione e gonfiore palpebrale. La vista può peggiorare in base alla localizzazione.
Forme e diagnosi della cheratite da herpes simplex
Le seguenti forme di cheratite da herpes simplex sono differenziate in base allo specifico strato corneale nel quale si localizza la lesione, le ricadute sono più frequenti nello stroma e nell’endotelio.
– CHERATITE DENDRITICA: caratterizzata da lesioni epiteliali arborizzate (cellule
epiteliali necrotiche e vescicolari rigonfie); questi segni saranno visibili ad occhio nudo dopo l’applicazione del colorante fluoresceina e sono caratteristiche della cheratite dendritica. La sensibilità corneale è solitamente ridotta e questa forma può progredire in cheratite stromale.
CHERATITE STROMALE: un coinvolgimento puramente stromale senza una precedente cheratite dendritica è caratterizzato da un epitelio intatto che non mostrerà alcun difetto dopo l’applicazione del colorante fluoresceina. L’esame alla lampada a fessura rivelerà infiltrati corneali disciformi centrali (cheratite disciforme) con o senza infiltrato stromale biancastro. A seconda della frequenza di ricadute, può essere presente una neovascolarizzazione superficiale o profonda. La reazione della camera anteriore sarà solitamente accompagnata da placche endoteliali (depositi di proteine sulla superficie posteriore della cornea che includono cellule giganti fagocitate).
ENDOTELITE: l’endotelite o la cheratite endoteliale è causata dalla presenza di herpes virus nell’umore aqueo. Che causa un rigonfiamento delle cellule endoteliali ed un’opacizzazione dello stroma corneale adiacente. Il coinvolgimento delle cellule endoteliali nell’angolo della camera anteriore causa un aumento secondario della pressione intraoculare (glaucoma secondario). Altri segni includono cellule infiammate e cellule pigmentate nella camera anteriore e placche endoteliali; il coinvolgimento dell’iride con perdita segmentale di epitelio pigmentato è documentabile con l’esame alla lampada a fessura.

– SINDROME RETINICA NECROTICA ACUTA: il coinvolgimento della parte posteriore del globo oculare per tutti gli scopi pratici è visibile solo nei pazienti immunocompromessi (es. pazienti riceventi trapianti di midollo osseo e pazienti con AIDS).
TRATTAMENTO: le infezioni coinvolgenti l’epitelio sono trattate con trifluoridina come agente superficiale virostatico; le infezioni stromali e intraoculari da herpes simplex possono essere trattate con acyclovir che è disponibile per uso topico in pomate e per uso sistemico.
I corticosteroidi sono controindicati nelle infezioni epiteliali da herpes simplex ma può essere usato per trattare la cheratite stromale quando l’epitelio è intatto.
Cheratite da herpes zoster
DEFINIZIONE: cheratite rara causata dalla ricorrenza endogena del chicken pox (causato dal virus della varicella-zoster).
EZIOLOGIA: procedendo dal ganglio trigeminale, il virus reinfetta la regione innervata dal nervo trigemino; l’occhio si infetta solo quando viene coinvolta la branca
oftalmica del nervo trigemino ed in questo caso sarà interessato anche il nervo naso ciliare che innerva l’interno dell’occhio. Sarà presente anche il segno di Hutchinson (lesioni vescicolari sulla punta del naso).
CONDIDERAZIONI DIAGNOSTICHE: l’herpes zoster oftalmico si presenta anche nelle forme superficiali e profonde che in parte sono simili all’infezione corneale da herpes simplex (occhio rosso con cheratite dendritica, e cherato – uveite) , anche in questo caso la sensibilità corneale è di solito diminuita o assente.
TRATTAMENTO: l’occhio viene trattato con pomate a base di acyclovir ed è bene associare per le alterazioni cutanee dell’acyclovir sistemico. Se l’epitelio corneale è intatto, l’irritazione della camera anteriore può essere trattata accuratamente con steroidi e l’immobilizzazione della pupilla e del corpo ciliare tramite midriasi terapeutica.
Cheratite micotica
EPIDEMIOLOGIA: la cheratite micotica fino a qualche tempo fa era molto rara, tuttavia questa sindrome clinica è divenuta oggi prevalente oggi per un aumentato e spesso ingiustificato uso di antibiotici e steroidi.
EZIOLOGIA: i patogeni più frequentemente riscontrati sono L’Aspergillus e la Candida Albicans ed il meccanismo causale più frequente è un danno con materiali organici come un ramo di albero.
CONDIDERAZIONI DIAGNOSTICHE: i sintomi iniziali sono lievi e all’ispezione l’occhio presenta (normalmente la patologia è unilaterale) un’ulcera corneale a margine indefinito che nel in breve tempo si espande sotto i margini visibili (ulcera corneale serpiginosa) con possibile associazione di ipopion. L’esame alla lampada a fessura rivelerà i tipici infiltrati stromali biancastri, specialmente nella cheratite micotica da Candida albicans; gli infiltrati e l’ulcera si diffondono molto lentamente. Sono caratteristiche ma non sono necessariamente presenti le lesioni satelliti (alcuni infiltrati adiacenti e più piccoli, raggruppati attorno ad un centro più largo).
IDENTIFICAZIONE DEL PATOGENO: l’identificazione microbiologica del fungo è difficile e può portar via tempo, è importante ottenere campioni provenienti da oltre il margine dell’ulcera. Le colture fungine dovrebbero essere sempre effettuate laddove le colture batteriche siano negative.
TRATTAMENTO – TERAPIA CONSERVATIVA: il trattamento richiede una terapia protratta, pertanto si raccomandata l’ospedalizzazione; la terapia sistemica è indicata solo nel caso di un coinvolgimento intraoculare. Gli altri casi risponderanno bene al trattamento topico con agenti antimicotici.
TRATTAMENTO CHIRURGICO: la cheratoplastica d’emergenza è indicata quando la patologia non risponde o risponde troppo lentamente alla terapia conservativa e i segni peggiorano durante la terapia.
Cheratite da acanthamoeba
EZIOLOGIA: l’Acanthamoeba è un protozoo saprofita; le infezioni usualmente si verificano nei portatori di lenti a contatto, in particolare dopo traumi e in ambienti umidi come saune o piscine.
CONDIDERAZIONI DIAGNOSTICHE: il paziente lamenta dolore intenso, fotofobia e lacrimazione e mostrerà spesso di avere una storia di settimane o mesi di trattamento antibiotico senza successo. L’ispezione quindi rivelerà un arrossamento unilaterale dell’occhio senza secrezione. L’infezione si può presentare come un infiltrato sub–epiteliale, come un’opacizzazione intrastromale disciforme della cornea o come un ascesso corneale a forma di anello. La patologia è difficile da diagnosticare, anche gli studi d’immunofluorescenza in laboratori specializzati spesso sbagliano sulla diagnosi. La presenza di cisti dell’ameba può essere dimostrata solo tramite studi istologici eseguiti sul tessuto corneale prelevato; recentemente è diventato possibile dimostrare la presenza di cisti dell’ameba tramite la microscopia confocale corneale.
TRATTAMENTO – TERAPIA CONSERVATIVA: gli agenti topici attualmente includono pentamidina e propamidina. Di solito vengono anche somministrate gocce di antibiotico ad ampio spettro e si ricorre a midriasi farmacologica terapeutica. Si possono anche usare disinfettanti come lo iodopovidone al 5% e la clorexidina per istillazioni frequenti e ripetute.
TRATTAMENTO CHIRURGICO: la cheratoplastica d’emergenza è indicata quando fallisce la terapia conservativa.
5.5 Cheratiti non infettive
Questa categoria comprende un’ampia varietà di patologie corneali, alcune delle quali, come la cheratocongiuntivite sicca, si presentano molto frequentemente.

Le cause includono:
– infiammazioni (blefariti e congiuntiviti);
– lesioni (arrossamento degli occhi, corpi estranei sotto la palpebra superiore, incompatibilità alle lenti a contatto, esposizione ad intensa radiazione ultravioletta);
alterazioni correlate all’età (ectropion senile con trichiasi; entropion spastico; cheratocongiuntivite sicca);
5 - Cornea
– chirurgia (cataratta o glaucoma);
– fattori endogeni (neuropatia faciale);
– fattori esogeni (medicazioni o conservanti).
Cheratite puntata superficiale
DEFINIZIONE: si presenta con lesioni superficiali corneali puntate causate da una disfunzione del sistema lacrimale di diversa natura.
EPIDEMIOLOGIA ED EZIOLOGIA: una cheratocongiuntivite superficiale puntata è un reperto molto frequente dato che può essere causato da un’ampia varietà di fattori esogeni come corpi estranei ritenuti sotto la palpebra superiore, lenti a contatto, disconfort lacrimale, ecc. Può anche apparire come sintomo secondario di molte altre forme di cheratite (vedi le forme di cheratiti discusse precedentemente); può anche verificarsi in associazione con una patologia endogena come la malattia di Thygeson.
SINTOMI: in base alla causa ed alla severità delle lesioni corneali superficiali, i sintomi variano da un decorso clinico quasi asintomatico (come nella cheratite neuro paralitica, nella quale la cornea perde la sua sensibilità) ad un’intensa sensazione dolorosa in cui il soggetto ha sensazione di sabbia nell’occhio con il segno tipico dell’epifora, dolore acuto, bruciore, e blefarospasmo mentre l’acuità visiva di solito è compromessa al minimo.
CONSIDERAZIONI DIAGNOSTICHE: si applicata fluoresceina e l’occhio viene esaminato alla lampada a fessura con filtro a luce blu cobalto che evidenzia fini difetti epiteliali.
TRATTAMENTO E PROGNOSI: in base alla causa, le alterazioni corneali superficiali risponderanno più o meno rapidamente alla terapia con lacrime artificiali (collirio o gel ad alta viscosità) ed è quindi fondamentale eliminare ogni possibile agente eziologico di base. Nella cheratite da esposizione si utilizza un gel ad alta viscosità poiché permane per più tempo; la cheratite puntata superficiale viene invece trattata con collirio più o meno concentrato di acido ialuronico.
Cheratocongiuntivite sicca
È una delle cause più frequenti di cheratite superficiale ed è la stessa sindrome attribuibile agli occhi secchi a causa della carenza di lacrime o per qualsivoglia disconfort lacrimale.
Cheratite da esposizione
DEFINIZIONE: è una cheratite causata dalla secchezza corneale in caso di lagoftalmo
EPIDEMIOLOGIA ED EZIOLOGIA: la cheratite da esposizione è una sindrome clinica relativamente frequente, si può verificare per esempio in associazione ad una paralisi facciale conseguente ad ictus. In questo caso si verifica un’insufficiente chiusura delle palpebre (lagoftalmo) e la cornea resta esposta e non protetta da un terzo fino alla metà inferiore della cornea (cheratite da esposizione). Inizialmente in questa zona si sviluppa una cheratite superficiale puntata che può evolvere in un’erosione corneale o ulcera. Altre cause di cheratite da esposizione senza paralisi del nervo faciale sono:
– esoftalmo scompensato nel morbo di Graves;
insufficiente chiusura delle palpebre in seguito a chirurgia palpebrale per correggere una ptosi;
– insufficiente cura oculare in pazienti con respirazione artificiale in terapia intensiva.
SINTOMI: si presenta simile alla cheratite punctata superficiale (sebbene usualmente più severa) ma unilaterale.
DIAGNOSI: l’applicazione di fluoresceina rivelerà il tipico pattern di lesioni epiteliali.
TRATTAMENTO: l’instillazione di lacrime artificiali non è solitamente sufficiente quando la funzione delle palpebre è danneggiata; in questi casi sono richiesti gel ad alta viscosità, pomate (per la protezione antibiotica) e bendaggi. Il bendaggio deve esse- re applicato per creare un ambiente ermetico umido che previene un’ulteriore essiccazione dell’occhio. In presenza di una paralisi persistente del faciale che non mostra segni di regressione il trattamento di scelta è la tarsorrafia laterale. Lo stesso vale per il trattamento della cheratite da esposizione dovuta ad insufficiente chiusura palpebrale dovuta ad altre cause.Una scarsa cura nella cheratite da esposizione può portare all’insorgenza di una cheratite puntata superficiale, erosione, sovrainfezione batterica con ulcera corneale e infine a perforazione corneale.
Cheratite neuro paralitica

DEFINIZIONE: cheratite associata a paralisi della branca oftalmica del nervo tri- gemino.
EPIDEMIOLOGIA ED EZIOLOGIA: la paralisi della branca oftalmica del trigem no è meno frequente della paralisi del nervo faciale. Il nervo trigemino è responsabile della sensibilità corneale a stimoli esterni ed un disturbo della conduzione nel nervo tri- gemino è di solito una sequela di un danno al ganglio trigeminale causato da un trauma, terapia radiante di un neurinoma acustico o chirurgia e ciò può causare perdita della sensibilità corneale. Purtroppo in questi casi il paziente non avvertirà alcuna sensazione di occhio secco e la frequenza di ammiccamento palpebrale scende sotto
il livello che assicuri una corretta umidificazione della cornea. Come nella cheratite da esposizione, inizialmente si formeranno lesioni superficiali puntate seguite poi da difetti epiteliali più larghi che possono progredire in ulcera corneale se si sovrappone un’infezione batterica.
SINTOMI: premesso che i pazienti con perdita della funzione trigeminale non provano dolore, essi accuseranno solo leggeri sintomi come una sensazione di corpo estraneo o un gonfiore palpebrale.
DIAGNOSI: un danno corneale di solito centrale o leggermente decentrato, può variare da una cheratite puntata superficiale (visibile dopo applicazione di fluoresceina) fino ad un’ulcera corneale profonda con perforazione. L’occhio si presenterà rosso e in casi estremi possono verificarsi perdite di umor acqueo. Importante è la diagnosi differenziale con l’ulcera corneale erpetica.
TRATTAMENTO: è essenzialmente identico alla terapia della cheratite da esposizione, include l’umidificazione della cornea, la protezione antibiotica come profilassi contro l’infezione e, se i metodi conservativi non hanno successo, la tarsorrafia. Da alcuni anni è stato immesso in terapia l’NGF collirio da istillazione quotidiana che ha consentito un certo recupero di questi pazienti.
Problemi con le lenti a contatto
EZIOLOGIA: questi problemi si verificano a causa di lenti a contatto rigide mal indossate o con scarsa igiene, che sfregano la superficie corneale o per un abuso di lenti a contatto morbide. Se le lenti a contatto vengono portate per un periodo di tempo prolungato nonostante i sintomi, possono verificarsi: severa infiammazione, ulcerazione corneale e vascolarizzazione della periferia corneale.
SINTOMI: i pazienti trovano le lenti a contatto sempre più scomode e notano un peggioramento della loro vista, questi sintomi sono particolarmente pronunciati dopo la rimozione delle lenti a contatto dato che esse mascherano il difetto epiteliale corneale.
DIAGNOSI: l’oculista noterà tipiche alterazioni corneali dopo l’applicazione della fluoresceina: una cheratocongiuntivite sul limbus superiore con formazione di papille giganti, protrusioni del tessuto connettivo simili a verruche sul tarso superiore che sono segni di incompatibilità alle lenti a contatto o al conservante.
TRATTAMENTO: il paziente deve temporaneamente sospendere l’uso di lenti a contatto e le alterazioni infiammatorie dovrebbero essere tenute sotto controllo con steroidi fino a quando viene meno l’irritazione oculare. Una terapia protratta con steroidi
dovrebbe essere monitorata regolarmente da un oculista visto che i difetti epiteliali superficiali guariscono poco sotto terapia steroidea; inoltre una terapia protratta con steroidi ad alti dosaggi causa un aumento secondario della pressione intraoculare e l’insorgenza di una cataratta in un terzo dei pazienti.
Cheratopatia bollosa
DEFINIZIONE: opacizzazione della cornea con bolle epiteliali a causa della perdita di funzione delle cellule endoteliali.
EPIDEMIOLOGIA ED EZIOLOGIA: la cheratopatia bollosa è pressappoco la causa con più frequente indicazione al trapianto di cornea. La trasparenza della cornea dipende in gran parte dalla funzionalità dell’endotelio con un’alta densità di cellule; laddove l’endotelio venga ad essere severamente danneggiato da infiammazione, traumi o chirurgia del segmento anteriore, le poche cellule endoteliali rimanenti saranno incapaci di prevenire l’entrata dell’umore acqueo nella cornea. Questo consegue in un’idratazione della cornea con edema stromale e bolle epiteliali. La perdita di cellule endoteliali riconosce anche cause genetiche.
SINTOMI: la graduale perdita di cellule endoteliali causa un lento deterioramento della vista. Tipicamente il paziente avrà un’acuità visiva peggiore la mattina rispetto alla sera dato che il gonfiore palpebrale è maggiore durante la notte con le palpebre chiuse.
DIAGNOSI: l’esame alla lampada a fessura mostrerà ispessimento della cornea, edema epiteliale e bolle epiteliali. La cheratopatia bollosa può presentarsi anche in presenza di glaucoma tuttavia, in questi casi la pressione intraoculare risulta tipicamente aumentata.
TRATTAMENTO: nel caso in cui il danno alle cellule endoteliali non sia molto avanzato e si verifichino solo periodi occasionali di opacizzazione (come al mattino), una soluzione iperosmolare può migliorare la vista del paziente tramite la rimozione dell’acqua. Tuttavia, si tratta generalmente solo di una soluzione temporanea. Oltre un certo stadio è indicato il trapianto di cornea in parte relativa al solo endotelio (DMEK o Descemet Membrane Endothelial Keratoplasty) o in toto (cheratoplastica penetrante).

5.6 Depositi corneali e degenerazioni
Come tessuto avascolare braditrofico la cornea è particolarmente suscettibile a depositi di materiale esterno e degenerazioni.
Depositi corneali
Arcus senilis (gerontoxon)
È un deposito di grasso grigio–biancastro a forma di anello vicino al limbus che si può presentare a qualsiasi età ma di solito appare in età avanzata. L’arcus senilis è solitamente bilaterale ed è di frequente riscontro, si verifica come il risultato di depositi di grassi provenienti dai capillari del limbus intorno all’intera periferia della cornea che normalmente aumentano con l’avanzare dell’età. I pazienti sotto i 50 anni che sviluppano un gerontoxon dovrebbero essere esaminati per escludere la presenza di un’ipercolesterolemia come causa scatenante. Non è richiesta alcuna terapia dal momento che non provoca alcun difetto visivo. I depositi e le pigmentazioni discusse in seguito, generalmente non inficiano la vista.
Cornea verticillata
Depositi epiteliali bilaterali grigi o marroni che si estendono a vortice da un punto inferiore sino al livello pupillare. Questa alterazione corneale si verifica di solito con l’uso di alcuni farmaci, molto frequentemente con la clorochina e l’amiodarone. La malattia di Fabry (lipidosi glicolipidica) può anche presentare questo tipo di alterazioni corneali che possono essere di aiuto nella conferma della diagnosi.
Argirosi e crisiasi
Farmaci topici contenenti argento e l’esposizione abituale all’argento in alcuni lavori portano alla formazione di depositi d’argento nella congiuntiva e negli strati profondi della cornea (argirosi). La terapia d’oro sistemica (più di 1-2 g) porterà alla colorazione dorata dello stroma periferico corneale (crisiasi).
Linee di ferro
Qualsiasi irregolarità della superficie corneale causa la distribuzione irregolare da parte delle palpebre del film lacrimale sulla superficie corneale; sarà presente una piccola pozza di fluido lacrimale sul sito dell’irregolarità. I depositi di ferro si formano in maniera caratteristica in questa posizione nell’epitelio corneale. Le linee di ferro osservate più di frequente sono i depositi di ferro fisiologici situati nel punto di chiusura palpebrale (linea di Hudson-Stahli), la linea di Stocker con lo pterigio, la linea di Ferry con una bozza filtrante dopo la chirurgia del glaucoma, e l’anello di Fleischer del cheratocono. Linee di ferro sono state descritte anche conseguentemen te a chirurgia (cheratotomia radiale; cheratectomia foto refrattiva; cheratoplastica) e in presenza di cicatrici corneali.
Anello di Kayser – Fleischer
Questo anello corneale che va dall’oro–marrone al verde–giallastro, è causato da depositi di rame a livello della membrana di Descemet nella malattia di Wilson (degenerazione epatica con diminuzione del livello sierico di ceruloplasmina). Questo anello è così caratteristico che spesso l’oculista è il primo a diagnosticare questa rara sindrome clinica.
Negli stadi precoci, l’anello di Kayser - Fleischer è meglio rilevato tramite gonioscopia.
Degenerazioni corneali
Cheratopatia a bandelletta
Dopo molti anni d’infiammazione cronica della camera anteriore (uveite e cheratite cronica) con restringimento del globo oculare ed in pazienti con poliartrite giovanile, si verificano depositi calcifici nella membrana di Bowman causando una zona trasversa di opacizzazione nella regione della fessura palpebrale. La regione limbare rimarrà intatta e questa alterazione danneggia significativamente la vista. L’opacizza- zione può essere completamente rimossa e la visione si può ripristinare tramite la chelazione delle calcificazioni con una soluzione di sodio EDTA.
Cheratite a solco periferico
Include un gruppo eterogeneo di patologie in termini di morfologia ed eziologia. Sono tutte non infettive e causano un ispessimento ed una fusione della cornea periferica che può progredire in una perforazione.
I fattori eziologici includono:
– fattori autoimmuni (collagenosi, cheratite marginale, e sclerocheratite);

– disfunzioni trofiche (corrosione causata da mancanza di fluido lacrimale).
– processi degenerativi sconosciuti (degenerazione marginale di Terrien o ulcera di Mooren).
Queste alterazioni corneali sono frequentemente osservate in pazienti con artrite reumatoide ed in questi casi è essenziale trattare la patologia sistemica.
La Cheratomalacia è una particolare patologia nella quale un deficit di vitamina A causa xerosi della congiuntiva associata a cecità notturna. Questa patologia rimane una delle più frequenti cause di cecità nei paesi in via di sviluppo nei quali è prevalente la malnutrizione.
Distrofie corneali
DEFINIZIONE: questo termine si riferisce a un gruppo di disfunzioni corneali ereditarie metaboliche che conducono sempre ad un’opacizzazione bilaterale dei vari strati della cornea.
EPIDEMIOLOGIA ED EZIOLOGIA: la distrofia corneale è tendenzialmente rara, la forma più frequente è la distrofia endoteliale di Fuchs seguita dalla distrofia epiteliale corneale.
Le varie distrofie corneali sono disordini genetici, usualmente si manifestano nella prima o nella seconda decade di vita eccetto la distrofia endoteliale di Fuchs che diventa sintomatica solo tra i 40 e i 50 anni.
CLASSIFICAZIONE: le seguenti forme di distrofia sono differenziate secondo gli strati individuali della cornea nei quali si verificano:
– Distrofia corneale epiteliale.
– Distrofia corneale stromale. Le forme più frequenti includono:
1. Distrofia granulare (depositi ialini)
2. Distrofia a lattice (depositi amiloidi)
3. Distrofia maculare (depositi di mucopolisaccaridi acidi)
4. Distrofia endoteliale, come la Fuchs (la forma più frequente).
La classificazione morfologica è basata sul fenotipo accertato con l’esame alla lampada a fessura. Nell’ultima decade i risultati genetici molecolari hanno portato alla realizzazione di una classificazione delle distrofie corneali in base al genotipo che classifica le distrofie a lattice e granulari come distrofie epiteliali.
SINTOMI E CONSIDERAZIONI DIAGNOSTICHE: tutti i pazienti soffrono di un costante peggioramento dell’acuità visiva causata dall’opacizzazione graduale dell’intera cornea che può progredire sino alla necessità di un trapianto di cornea.
Le distrofie corneali stromali ed epiteliali sono anche spesso accompagnate da erosioni corneali ricorrenti e molto dolorose. La distrofia endoteliale di Fuchs evolve in una graduale perdita di cellule endoteliali che nel tempo conducono ad una cheratopatia bollosa (idratazione della cornea con edema stromale e bolle epiteliali). Il paziente tipicamente avrà una visione più scarsa al mattino rispetto alla sera, dato che il rigonfiamento della cornea è maggiore durante la notte con le palpebre chiuse.
TRATTAMENTO: in base alla severità della perdita di visus può essere indicato un trapianto di cornea (cheratoplastica perforante) e siccome la cornea in queste patologie rimane avascolare, la prognosi è buona.
Nella distrofia endoteliale di Fuchs il trapianto di cornea è il trattamento di elezione.
Quando i sintomi non sono troppo avanzati una frequente applicazione di soluzioni iperosmolari favorisce la riduzione dell’edema anche se di solito è una soluzione temporanea. Il trapianto di cornea è eseguito in combinazione con l’estrazione di cataratta, infatti i pazienti con una distrofia endoteliale di Fuchs che altera la loro vista sono generalmente anziani e quindi hanno nella maggioranza dei casi anche una cataratta. Le due procedure sono combinate poiché spesso la distrofia di Fuchs causa uno scompenso corneale conseguente al trauma chirurgico dell’estrazione della cataratta.

6 SCLERA
6.1 Struttura
La cornea e la sclera sono le strutture che proteggono completamente l’occhio dall’esterno e sulla sclera hanno inserzione tutti i sei muscoli oculari. La sclera è fibrosa, di color biancastro opaco ed è composta da tessuto connettivale con un alto contenuto di acqua; il suo spessore varia da circa 1 mm del limbus corneale e del polo posteriore fino a 0,3 mm all’equatore e sotto l’inserzione dei muscoli retti. Il punto dove le fibre del nervo ottico si addentrano nella sclera è detto lamina cribrosa e all’angolo con la camera anteriore forma il trabecolato ed il canale di Schlemm da dove l’umore acqueo drena dentro il plesso venoso intra ed episclerale formato da circa 20 canalicoli. Nella sclera inoltre vi penetrano le vene vorticose e le arterie ciliari anteriori e posteriori.
6.2 Metodi di esame
La porzione anteriore fino a quasi l’equatore è esplorabile direttamente con la lampada a fessura mentre tutta la parte posteriore si può esaminare solo con ecografia ad ultrasuoni, infatti l’esame in transilluminazione non può dare informazioni esatte su possibili anomalie.

6.3 Cambiamenti di colore
La sclera normale ha un colore bianco opaco simile alla porcellana e cambiamenti nel colore possono suggerire:
– infiammazioni ed iniezione congiuntivale e/o ciliare rendono la sclera rossa per congestione ed alterazione dei vasi;
– quando la sclera è notevolmente sottile appare in trasparenza il blu/bordeaux coroideale (es. nei nascituri, nell’osteogenesi inperfetta o in caso di infiammzioni sottostanti);
6 - Sclera – appare gialla in caso di ittero;
– nell’ocronosi (alcaptonuria, vedi anche Cap. 4) la sclera può assumere un colore brunastro da distinguere da quello prettamente congiuntivale.
6.4 Stafiloma ed ectasia
Lo stafiloma può essere definito come una sporgenza in cui il sottostante tessuto uveale può presentarsi sottilissimo o del tutto degenerato; la forma più comune è lo stafiloma posteriore nella miopia severa (stafiloma postìco o di Scarpa) dove può essere coinvolto anche l’intero polo posteriore dell’occhio. Lo stafiloma può anche presentarsi in seguito a severe scleriti anche nella porzione sclerale anteriore.
L’ ectasia è un vero e proprio sfiancamento della sclera che può apparire assottigliata e sporgente (es. in glaucomi gravi)
Sia lo stafiloma che l’ectasia non sono trattabili poiché dei reperti di natura incidentale.
6.5 Traumi
La sclera è spesso coinvolta in traumi penetranti che se molto profondi arrivano a coinvolgere coroide e retina. La chirurgia per i traumi bulbari arriva a trattare vaste perforazioni con riparazioni retiniche di tipo tamponante o criopessico.
6.6 Infiammazioni
Le patologie clinicamente più significative della sclera sono le infiammazioni; queste coinvolgono più spesso la sclera anteriore con episcleriti e scleriti anteriori e meno frequentemente la porzione posteriore con scleriti posteriori. L’episclerite si manifesta più in forma isolata, mentre la sclerite si manifesta più spesso associata ad una patologia sistemica (circa il 50% delle scleriti). Infatti nel 40% dei casi le scleriti risultano associate ad una malattia autoimmune (la più frequente è l’Artrite Reumatoide 20-35%) e solo nel 7% dei casi l’etiologia è di tipo puramente infettivo.
CLASSIFICAZIONE IN BASE:
– ALLA SEDE (classificazione di Watson e Hayreh)
- anteriore o posteriore in base alla sede rispetto all’equatore
– ALLA PROFONDITÀ
- superficiale (EPISCLERITE)
- profonda (SCLERITE)
– ALLA NATURA
- circoscritta o segmentale (EPISCLERITE)
- diffusa (solitamente SCLERITE)
- nodulare (EPISCLERITE e SCLERITE)
- necrotizzante e non–necrotizzante (solo SCLERITE)
Episcleriti

DEFINIZIONE: si tratta di un’infiammazione di quella porzione connettivale compresa tra la sclera e la congiuntiva sovrastante, si presenta circoscritta in modo segmentale o più frequentemente nodulare. L’episclerite di solito si manifesta come unica manifestazione senza una precisa causa, solo in rari casi si accompagna a disordini sistemici o di origine infettiva; questa infiammazione può essere uni o bilaterale con notevole arrossamento segmentale e lieve tensione alla palpazione. I vasi episclerali si nascondono nella capsula di Tenone e si dispongono radialmente, insieme ai vasi congiuntivali diventano iperemici anche per infiltrazione di cellule infiammatorie. Inoltre nell’episclerite nodulare si formano piccoli rigonfiamenti molli rossastri e rotondeggianti. Un’altra forma particolare di episclerite è la foruncolare metastatica (benigna) che può presentarsi ad ogni età in concomitanza di una foruncolosi importante; i germi coinvolti (solitamente stafilococchi) passano dalla sacca infiammata del foruncolo nei vasi circostanti e attraverso il circolo sanguigno raggiungono l’episclera dove, attorno al limbus, in pochi giorni danno luogo ad un’escrescenza ripiena di pus che andrebbe incisa nel culmine del rigonfiamento, drenata e trattata con pomata antibiotica e cortisonica.

DIAGNOSI: la diagnosi differenziale deve essere posta con le congiuntiviti e le scleri-

ti; visto che i vasi congiuntivali sono superficiali e quelli sclerali sono invece all’interno della capsula di Tenone, l’uso di un collirio vasocostrittore può dirimere la diagnosi verso un’episclerite quando i vasi infiammati non sortiscono cambiamenti.
TRATTAMENTO E PROGNOSI: le episcleriti si risolvono spontaneamente di solito in circa due settimane, solo la forma nodulare persiste per più tempo. In caso di infiammazioni severe si prescrivono colliri steroidei o antiinfiammatori non–steroidei.
Malattie sistemiche associate alle episcleriti
CAUSE FREQUENTI
CAUSE RARE
Artrite Reumatoide Leucemia
Lupus Eritematoso Sistemico Paraproteinemia
Poliarterite Nodosa Sindromi paraneoplastiche
Spondiloartropatie sieronegative Sindrome di Wiskott - Aldrich
Gotta Insufficienza adrenocorticale
TBC – sifilide - borrelliosi
Funghi
Corpi estranei e sostanze chimiche
Scleriti
Virus
Parassiti
DEFINIZIONE: trattasi d’infiammazioni localizzate o diffuse della sclera che vengono classificate per facilità di diagnosi in base alla localizzazione.
EPIDEMIOLOGIA ED EZIOLOGIA: le scleriti sono molto meno frequenti rispetto all’episcleriti, sono più colpiti i soggetti anziani e le donne. Circa il 50% dei casi di scleriti anteriori che tendono a manifestare un decorso clinico severo è associato ad un disturbo sistemico autoimmune o ad una malattia reumatica, mentre le posteriori non si associano di solito ad alcuna malattia sistemica. Come per le episcleriti le cause batteriche o virali sono rarissime.
SINTOMI: tutte le forme, ad eccezione della scleromalacia perforante, presentano dolore ed intenso arrossamento. I noduli delle scleriti sono edematosi, di colore rosso–violaceo a circa 3 – 4 mm dal limbus e non mobili rispetto a quelli episcleritici. La sclerite nodulare è molto più severa della forma diffusa poiché in ben 1/3 dei casi si associa a patologie sistemiche e può progredire verso una sclerite necrotizzante. La
scleromalacia perforante si presenta bilateralmente in pazienti donne intorno alla settima decade di vita con lunga storia di sieropositività per artrite reumatoide, non è dolorante o iperemica perché non infiammatoria e la sclera interessata appare di colore grigio–giallastra, assottigliata tanto da lasciare intravedere la coroide sottostante; la perforazione è molto rara e si verifica in seguito a traumi.
Malattie sistemiche associate alle scleriti
CAUSE FREQUENTI
CAUSE RARE
Artrite Reumatoide Tubercolosi
Polimiosite Lue
Dermatomiosite
Borreliosi
Spondilite Anchilosante Sindrome di Reiter

Spondiloartrite
Vasculiti
Herpes Zoster oftalmico
Granulomatosi di Wegener

Gotta
Sifilide
6.7 Tumori
Sono dei tumori assai rari e presentarsi come fibromi, fibrosarcomi, emangiomi e neurofibromi. In alcuni rari casi possono presentarsi delle neoformazioni post traumatiche o amartomatose come i dermoidi con sede limbare. La terapia è sempre di tipo chirurgico con resezione totale del tumore e se necessario ricostruzione della parete.
7 CRISTALLINO
7.1 Concetti di base
Il cristallino è uno dei principali mezzi refrattivi dell’occhio e concentra i raggi di luce incidenti sulla retina; esso aggiunge un elemento variabile al potere totale refrattivo dell’occhio (10-20 diottrie, dipende dall’accomodazione individuale) al potere refrattivo fisso della cornea (approssimativamente 43 diottrie).
Il cristallino sviluppato completamente ha una forma biconvessa ed è trasparente; la curvatura della superficie posteriore, con un raggio di circa 6 mm è maggiore di quella anteriore che ha invece un raggio di circa 10 mm.
Il cristallino ha uno spessore di circa 4 mm ed il suo peso aumenta di circa 5 volte rispetto a quello alla nascita fino ad arrivare, in un soggetto adulto, a circa 220 mg.
Posizione e sospensione

Il cristallino giace nella camera posteriore dell’occhio tra la superficie posteriore dell’iride e il corpo vitreo in una depressione piatta del corpo vitreo conosciuta come fossa ialoidea e insieme all’iride forma un diaframma ottico che separa la camera anteriore dell’occhio da quella posteriore. Radialmente sono disposte le fibre zonulari che prendono inserzione sulla lente intorno al suo equatore, connettendo il cristallino al corpo ciliare, queste fibre mantengono la lente in posizione trasmettendo la forza tensiva del muscolo ciliare.
Embriologia e crescita
Il cristallino è una struttura prettamente epiteliale sprovvista di nervi o capillari sanguigni. Si sposta nella sua posizione intraoculare nel primo mese di sviluppo fe- tale come ectoderma superficiale invaginato nella vescicola ottica primitiva, costituita da neuroectoderma. Il cristallino, struttura puramente ectodermica, si differenzia durante la gestazione in fibre lenticolari, una membrana anteriore di cellule epiteliali
ed in una capsula ialina acellulare. Solitamente la direzione di crescita delle strutture epiteliali è centrifuga: le cellule epiteliali completamente sviluppate migrano in super- ficie e vengono eliminate simil ad esfoliazione; tuttavia, il cristallino cresce nella dire- zione opposta. Le cellule più giovani restano sempre in superficie mentre le più vecchie rimangono al centro della lente, così che la crescita delle fibre primitive forma il nucleo embrionario. All’equatore, le cellule epiteliali si differenziano ulteriormente in cellule delle fibre della lente e queste nuove fibre secondarie spostano le fibre primarie verso il centro della lente. La formazione di un nucleo fetale che racchiude il nucleo embrionario è completa alla nascita, la formazione delle fibre equatoriali, che continua durante tutta la vita, produce il nucleo infantile durante la prima e seconda decade di vita, e il nucleo adulto durante la terza decade. Completamente avvolto dalla capsula, il cristallino non perde mai cellule in modo che il tessuto venga continuamente compresso durante tutta la vita. Le varie zone di densità formatesi durante lo sviluppo del cristallino sono facilmente distinguibili come zone di discontinuità.
Metabolismo e invecchiamento del cristallino
Il cristallino è nutrito mediante diffusione dall’umore acqueo, in questo aspetto somiglia ad una coltura tissutale, dove l’umore acqueo rappresenta il substrato e il bulbo oculare il contenitore che fornisce una temperatura costante. Il metabolismo e i processi biochimici dettagliati che si verificano durante la vita sono complessi e non completamente compresi; proprio per questo motivo non è stato possibile influenzare lo sviluppo della cataratta tramite farmaci.
Il metabolismo e la crescita delle cellule del cristallino sono auto-regolati, l’attività metabolica è essenziale per la conservazione dell’integrità, della trasparenza e delle funzioni ottiche del cristallino. L’epitelio della lente aiuta il mantenimento dell’equilibrio ionico e consente il trasporto di nutrienti, minerali e acqua nella lente, questo tipo di trasporto, denominato “sistema di pompa”, permette il trasporto atti- vo di sodio, potassio, calcio e amminoacidi dall’umore acqueo nella lente, nonché la diffusione passiva attraverso la capsula posteriore del cristallino. Il mantenimento di questo equilibrio (omeostasi) è essenziale per la trasparenza della lente ed è strettamente collegato al bilancio idrico. Il contenuto in acqua della lente è normalmente stabile e in equilibrio con il circostante umore acqueo e diminuisce con l’età, mentre il contenuto delle proteine insolubili (albuminoidi) aumenta. La lente diventa più dura, meno elastica con conseguente perdita dell’accomodazione e meno trasparente. Una diminuzione della trasparenza con l’età è inevitabile come lo sono le rughe sulla pelle o i capelli bianchi. Una manifesta riduzione della trasparenza è presente
nel 95% delle persone oltre i 65 anni anche se non sono rare eccezioni individuali. La parte centrale del nucleo della lente diventa sclerotica e lievemente giallastra con l’età.
7.2 Anomalie di sviluppo della lente
Le anomalie di forma della lente sono molto rare. Il lenticono è una protrusione conica circoscritta del polo anteriore (lenticono anteriore) o del polo posteriore (lenticono posteriore). Una protrusione emisferica è chiamata lentiglobo i cui sintomi includono miopia e riduzione dell’acuità visiva. Alcuni pazienti con sindrome di Alport (malattia dei reni accompagnata da ipoacusia neurosensoriale e anomalie di forma del cristallino) hanno un lenticono anteriore. Il lenticono posteriore può associarsi ad opacità della lente ed trattamento è lo stesso che per la cataratta congenita o giovanile. Microfachia/Microsferofachia si riferisce ad un diametro del cristallino abnormemente piccolo, in genere qualsiasi interruzione della crescita del cristallino causa microfachia/microsferofachia, questo può accadere per esempio nella sindrome di Weill-Marchesani.
7.3 Cataratta
DEFINIZIONE: una cataratta è presente quando è ridotta la trasparenza della lente al punto che l’acuità visiva del paziente viene ridotta. Il termine cataratta viene dalla parola greca katarraktes (cascata) perché anticamente si riteneva che la cataratta fosse un fluido congelato proveniente dal cervello che scorreva davanti alla lente.
SINTOMI GENERALI: lo sviluppo della cataratta e i suoi sintomi sono general- mente un processo occulto, i pazienti riferiscono sintomi vari quali: calo e sfocatura della vista, visione sfumata di grigio/giallognolo, distorsione visiva accompagnata da abbagliamento o scintille, diplopia monoculare, alterata percezione dei colori ecc… questi sintomi variano a seconda dei diversi tipi di cataratta.
La diagnosi di cataratta è generalmente inquietante per i pazienti, i quali immediatamente la associano alla chirurgia; si parla quindi di cataratta solo quando è indicata l’asportazione chirurgica, se la cataratta non è progredita fino ad uno stadio avanzato o il paziente è in grado di sopportare bene il difetto visivo, si parla invece di “opacità della lente” o di “cataratta in evoluzione”.
CLASSIFICAZIONE: nessuna classificazione in realtà è completamente soddisfacente; la cataratta può essere classificata in base a differenti criteri come ad es.:

7 - Cristallino
– tempo di comparsa (acquisita o congenita)
– maturità
– morfologia
7.4 Metodi d’esame
La retroilluminazione del cristallino (test di Bruckner) è il più veloce metodo preliminare di esame per le opacità della lente. Tramite una sorgente di luce o un oftalmoscopio (settato su 10 diottrie), le opacità appariranno nere sulla pupilla rossa. Il cri- stallino può essere esaminato dettagliatamente e in tre dimensioni sotto illuminazione focale tramite una lampada a fessura con la pupilla dilatata al massimo: si possono così valutare l’estensione, il tipo, la localizzazione e la densità delle opacità e le loro relazioni con l’asse visivo. Le opacità mature del cristallino possono essere diagnosticate a occhio nudo in presenza di una pupilla bianca (leucocoria).
Nel caso in cui il fondo non sia visibile in presenza di una opacità matura della lente, sono indicati studi con ultrasuoni (studio A-scan unidimensionale e B-scan bi- dimensionale) per escludere un coinvolgimento delle strutture oculari più profonde. Iridodonesi e facodonesi: un tremolio dell’iride e del cristallino osservato durante l’esame alla lampada a fessura suggerisce una sublussazione della lente.
7.5 Cataratta acquisita
Cataratta senile
EPIDEMIOLOGIA: la cataratta senile è sicuramente la forma più frequente di cataratta, contando il 90% delle cataratte; circa il 5% dei settantenni e il 90% degli ottantenni sono affetti da cataratta che richiede intervento chirurgico o sono già stati operati.
CLASSIFICAZIONE E FORME DI CATARATTA SENILE: la classificazione in base alla maturità segue il grado di menomazione visiva e la maturità che sono elementi che fino a qualche anno fa determinavano il momento in cui ricorrere al trattamento chirurgico. Oggi seguiamo maggiormente una classificazione morfologica che si basa sulla durezza e sullo spessore del nucleo del cristallino anche per il tipo di intervento più delicato e molto meno invasivo che si effettua attualmente.
Cataratta nucleare
Nella quarta decade di vita, la pressione causata dalla produzione di fibre periferiche della lente, causa un indurimento dell’intero cristallino e specialmente del nucleo. Il
nucleo assume un aspetto giallastro-marrone (caratta nucleare brunescente) e dato che questo processo aumenta il potere refrattivo della lente, le cataratte nucleari causano una miopia lenticolare (infatti la visione per vicino anche senza occhiali rimane buona per lungo tempo) e occasionalmente producono un secondo punto focale sulla lente che provoca diplopia monoculare.
Cataratta corticale
Le cataratte nucleari sono spesso associate a cambiamenti della corteccia lenticolare ed è interessante notare che i pazienti con cataratta corticale tendono ad avere un’ipermetropia acquisita al contrario di quelli con cataratta nucleare, i quali tendono ad essere miopi.
Mentre i cambiamenti presenti nelle cataratte nucleari sono dovuti alla durezza, quelli presenti nelle cataratte corticali sono caratterizzati da un aumento del contenuto di acqua. All’esame obiettivo con lampada a fessura in massima midriasi sono evidenti diversi cambiamenti morfologici:
– vacuoli: accumuli di fluido presenti sotto forma di vescicole corticali piccole e strette che rimangono piccoli ed aumentano di numero;
– fessure d’acqua: sono delle piccole fessure radiali ripiene di liquido presenti tra le fibre;
– speroni: le opacità si estendono dalla periferia della lente come i raggi di una ruota, reperto frequente che caratterizza la cosiddetta cataratta cuneiforme
Le cataratte corticali progrediscono più velocemente di quelle nucleari, l’acuità visiva può temporaneamente migliorare durante il corso della patologia e ciò è causato da un effetto stenopeico dato dalla luce che passa attraverso un’area trasparente compresa tra due opacità radiali.
Cataratta sottocapsulare posteriore
Si tratta di una forma particolare di cataratta corticale che si concentra a livello dell’asse visivo: inizia come un piccolo ammasso di opacità granulari che poi si estende perifericamente assumendo la forma di un disco. Con l’aumentare dell’opacità il resto della corteccia e il nucleo vengono coinvolti (spettro usuale della cataratta senile).
La cataratta sottocapsulare posteriore conduce rapidamente ad una severa perdita dell’acuità visiva, la visione per vicino è di solito peggiore di quella per lontano.
Cataratta matura
La lente è diffusamente bianca a causa di una completa opacizzazione della corteccia, spesso è debolmente distinguibile un imbrunimento del nucleo lenticolare. Dove

il contenuto di acqua è aumentato, una lente con cataratta matura può gonfiarsi e assumere una morbida lucentezza (cataratta intumescente nella quale la capsula è sotto pressione). L’aumento di spessore della lente aumenta la resistenza della pupilla e con esso il rischio di un glaucoma da chiusura d’angolo. In questi casi la visione è ridotta fino alla percezione di luce ed ombra e l’interno dell’occhio non è più esplorabile, si rende quindi necessario un approccio chirurgico in breve tempo per ripristinare l’acuità visiva.
Cataratta ipermatura
Se una cataratta matura progredisce fino al punto di una completa liquefazione della corteccia, il denso nucleo bruno si abbasserà all’interno della capsula. Il suo margine superiore sarà quindi visibile nella pupilla come un contorno marrone scuro in contrasto con la corteccia bianco-grigiastra. La pressione all’interno della capsula della lente diminuisce ed il contenuto del sacco capsulare flaccido e rugoso gravita nella capsula. Questa condizione, denominata cataratta morgagnana, rappresenta lo stadio finale di una cataratta che solitamente si sviluppa nel corso di due decenni. Una pronta estrazione della cataratta in questi casi, non solo ristabilisce l’acuità visiva ma previene anche il possibile sviluppo di un glaucoma facolitico. Quando la capsula della lente diventa permeabile per la presenza di sostanze liquefatte, diminuirà anche di volume e la capsula diventerà rugosa. La fuga di proteine dalla lente causerà un’irritazione intraoculare e attrarrà macrofagi che in seguito causeranno una congestione del trabecolato (glaucoma facolitico).
Cataratta nelle patologie sistemiche
Cataratta diabetica
La tipica cataratta diabetica è rara nei giovani pazienti diabetici, uno scompenso metabolico transitorio può causare la comparsa di tipiche opacità radiali a fiocco di neve (cataratta a fiocco di neve) e si possono accompagnare ipermetropia transitoria o miopia.
La cataratta diabetica progredisce rapidamente, le cataratte senili sono osservate circa 5 volte più frequentemente negli anziani diabetici rispetto ai pazienti non diabetici e solitamente si presentano 2 – 3 anni più precocemente.
Cataratta nella galattosemia
Questa opacità profonda posteriore della corteccia inizia dopo la nascita, la galattosemia è una rara causa di cataratta precoce nei bambini che hanno carenza di un en-
zima richiesto per il metabolismo del galattosio. I neonati ricevono ampie quantità di galattosio dal latte materno e a causa della mancanza dell’uridil-transferasi, o meno frequentemente galattochinasi, il galattosio non può essere metabolizzato in glucosio, e l’organismo viene inondato di galattosio o di galattosio e galattosio-1-fosfato. Se l’anomalia viene diagnosticata prontamente ed il bambino viene mantenuto con una dieta priva di galattosio, le opacità delle prime settimane di vita si rendono reversibili. La cataratta galattosemica è l’unica forma di cataratta che risponde alla terapia conservativa.
Cataratta nei dializzati
L’emodialisi per eliminare l’acidosi metabolica nell’insufficienza renale può disturbare l’equilibrio osmotico del metabolismo della lente e causare il rigonfiamento della corteccia lenticolare. Altri rari disturbi del metabolismo possono causare cataratta inclusa la mannosidosi, malattia di Fabry, sindrome di Lowe (sindrome oculocerebrorenale), e morbo di Wilson (degenerazione epatolenticolare).
Cataratta con distrofia miotonica
Le opacità si presentano per la prima volta tra i 30 e i 50 anni, inizialmente in un sottile strato della corteccia anteriore e in seguito anche nella corteccia sottocapsulare posteriore in forma di rosette. Sintomi che confermano la diagnosi, includono oltre alla cataratta, segni attivi di miotonia (ritardata apertura dei pugni), e segni passivi (ritardato rilassamento dei muscoli in seguito alla percussione diretta e assenza di riflessi).
Cataratta tetanica
L’opacità si trova all’interno di una zona posta inferiormente alla capsula lenticolare anteriore ed è costituita da una serie di lesioni puntiformi grigie. I sintomi che confermano la diagnosi includono bassi livelli di calcio nel sangue, positività al test dell’iperventilazione, e segni di tetania: segno di Chvostek positivo, di Trusseau positivo e segno di Erb.
Cataratte complicate
In seguito a qualsiasi infiammazione o patologia intraoculare protratta o cronica come ad es.: eterocromia, iridociclite cronica, vasculite retinica e retinite pigmentosa, si può assistere ad evoluzione di cataratta complicata.
Il risultato è una cataratta sottocapsulare posteriore simile alla pomice che progredisce assialmente verso il nucleo e questa forma di cataratta produce un estremo abbagliamento.

Cataratta traumatica
L’incidenza di queste opacità lenticolari è più alta negli uomini rispetto alle donne a causa dei traumi occupazionali e sportivi e si distinguono i seguenti tipi.
CATARATTA TRAUMATICA FREQUENTE:
cataratta contusiva: la contusione del bulbo oculare produrrà un’opacità sottocapsulare a forma di rosetta nella superficie anteriore della lente, normalmente rimane invariata ma col tempo può migrare nella corteccia più profonda a causa dell’apposizione di nuove fibre.
CATARATTE TRAUMATICHE PIÙ RARE:
– cataratta da raggi infrarossi (cataratta dei vetrai): questo tipo di cataratta si presenta in seguito a decenni di prolungata esposizione ai raggi infrarossi del fuoco senza protezione oculare. Segni caratteristici includono la separazione della capsula anteriore della lente, i cui bordi si ripiegano e galleggiano nella camera anteriore; fortunatamente le norme di sicurezza sul lavoro hanno drasticamente ridotto l’incidenza di questo tipo di cataratta.
– infortuni elettrici: questa densa cataratta sottocapsulare può essere causata da un fulmine o da una scossa elettrica ad alto voltaggio.
– cataratta da radiazioni ionizzanti
Cataratta tossica
CATARATTA DA STEROIDI
Una prolungata terapia topica o sistemica con corticosteroidi può causare un’opacità sottocapsulare posteriore ma non è noto se ci possa essere una relazione esat ta tra dose e insorgenza della cataratta. Altre cataratte tossiche possono derivare da clorpromazina, agenti miotici (specialmente inibitori della colinesterasi), e busulfano (Myleran) adoperati nei trattamenti della leucemia mieloide cronica.
7.6 Cataratta alla nascita
Cataratte ereditarie
La trasmissione può essere autosomica-dominante, autosomica-recessiva, sporadica o X-linked. Queste forme sono più facilmente diagnosticate sulla base della loro caratteristica morfologia simmetrica:
– Cataratta lamellare o zonulare: le opacità sono localizzate nello strato di fibre della
lente nella regione equatoriale;

– Cataratta nucleare: è una variante della cataratta lamellare in cui inizialmente solo lo strato più esterno del nucleo embrionario è interessato.
– Cataratta coronarica: è caratterizzata da opacità fini radiali nella regione equatoriale.
– Cataratta cerulea: è caratterizzata da un fine involucro o da opacità scure periferiche del cristallino.
Molte opacità della lente non danneggiano la vista e non sono progressive e ciò vale anche per le rare opacità del cristallino che coinvolgono la capsula come le cataratte polari anteriori e posteriori, cataratta anteriore piramidale, e le macchie di Mittendorf (residuo dell’arteria ialoidea nella capsula posteriore della lente).
Cataratta da infezione transplacentare
Uno studio statistico di Pau (1986) cita le seguenti incidenze di cataratta congenita dopo che la madre ha contratto una malattia sistemica durante il primo trimestre di gravidanza:
– rosolia 40-60 %
– parotite 10-22 %
– epatite 16%
– toxoplasmosi 5%.
Nella maggior parte di questi casi si sviluppa una cataratta totale a causa dell’infezione virale contratta dalla madre durante uno stadio precoce della gravidanza. Questa infezione si verifica dal quinto all’ottavo mese di gravidanza, la fase nella quale la lente si sviluppa e dato che la capsula protettiva della lente in questa fase non si è ancora formata, i virus possono invadere e opacizzare il tessuto lenticolare.
La più frequente causa di cataratta è l’infezione da rosolia contratta dalla madre, la quale produce anche altre anomalie di sviluppo (la sindrome di Gregg che causa opacità del cristallino, un dotto arterioso aperto, e una perdita neurosensoriale dell’udito). La cataratta è bilaterale e totale e può essere diagnosticata per la presenza di leucocoria (pupilla bianca) e cicatrice corioretinica secondaria a coroidite.
7.7 Terapia delle cataratte Terapia medica
A dispetto di approcci teorici nella ricerca sugli animali, l’efficacia di un trattamento conservativo della cataratta negli esseri umani non è stata dimostrata.
Ad oggi, non sono disponibili metodi conservativi per prevenire, ritardare o invertire lo sviluppo di una cataratta. Le cataratte galattosemiche sono l’unica eccezione a questa regola.
Terapia chirurgica
La chirurgia della cataratta è la prestazione più frequentemente eseguita in oftalmologia.
Prima le tecniche chirurgiche dipendevano dalla maturità della cataratta, mentre questo non accade più nella moderna chirurgia della cataratta. L’intervento di Facoemulsificazione anche accompagnato dall’uso di un femtolaser ha radicalmente cambiato la prognosi ed il recupero dei pazienti con cataratta.
Indicazioni ottiche
Il ripristino dell’acuità visiva è di gran lunga la più frequente indicazione per la chirurgia della cataratta.
– in presenza di cataratta bilaterale, l’occhio con acuità visiva peggiore deve essere sottoposto ad intervento chirurgico quando il paziente si sente visualmente disabile. Tuttavia, questa soglia può variare a seconda dell’attività lavorativa del paziente.
– In presenza di cataratta unilaterale, il paziente è spesso incline a posticipare l’intervento chirurgico fino a quando la visione nell’occhio sano è sufficiente.
La prospettiva di un risultato positivo è importante per il paziente, alcuni pazienti considerano come un buon esito un significativo miglioramento della vista. Quindi, è importante che il paziente venga sottoposto ad un accurato esame pre-operatorio per escludere qualsiasi disturbo oculare, oltre alla cataratta, che potrebbe peggiorare l’acuità visiva e compromettere l’intervento chirurgico. Alcuni disturbi comprendono il glaucoma non controllato, uveiti, degenerazione maculare, distacco di retina, atrofia del nervo ottico ed ambliopia.
Un’anamnesi dettagliata sui disturbi oculari e sulla vista del paziente prima della comparsa della cataratta dovrebbe sempre essere condotta prima dell’approccio chirurgico.
Affidabilità della chirurgia della cataratta
La chirurgia della cataratta è oggi eseguita come tecnica di microchirurgia attraverso un microscopio operatorio. Le moderne tecniche standardizzate tramite microincisione e facoemulsificazione nonché idrosutura (quindi non più punti di sutura) e chirurghi appositamente addestrati ad eseguire molte operazioni di cataratta, hanno reso
possibile eseguire interventi di cataratta senza serie complicanze nel 99% dei pazienti. L’intervento dura circa 15-20 minuti e, come la fase post-operatoria, è indolore. Il rischio di perdita della vista dell’ intero occhio durante l’intervento, con comparsa di un’emorragia durante la chirurgia o di un’endoftalmite dopo qualche giorno, è di circa lo 0,05%. È obbligatorio discutere con il paziente i rischi della chirurgia della cataratta prima dell’operazione.
Ecobiometria
Il potere refrattivo richiesto della lente è determinato pre-operatoriamente tramite l’ecobiometria, al fine di raggiungere il target refrattivo richiesto. In maniera semplificata il potere refrattivo della IOL viene determinato attraverso il potere refrattivo della cornea, la costante di rifrazione della IOL e la lunghezza assiale, determinata dalla misurazione con ultrasuoni. Molti macchinari recenti (es. IOL-Master Zeiss) eseguono una biometria non a contatto con numerosi parametri addizionali.
Refrazione postoperatoria
Di solito si raccomanda di raggiungere l’emmetropia o una lieve miopia (da –0.25 a -0.5 diottrie), quindi il paziente dovrà portare occhiali solo per lettura. L’ipermetropia postoperatoria (che necessita di occhiali per lontano e per vicino) non è soddisfacente per il paziente. Se l’altro occhio del paziente non necessita di un intervento di cataratta in tempi brevi, la differenza refrattiva tra i due occhi non deve essere oltre le 2 o 2.5 diottrie per scongiurare problemi di anisometropia nella visione binoculare.
Lente intraoculare (IOL)

In quasi tutte le estrazioni di cataratta viene impiantata una lente intraoculare (IOL), preferibilmente al posto di quella naturale e cioè nel sacco. Se per ragioni intra- operatorie non è possibile impiantare in camera posteriore, viene impiantata una IOL in camera anteriore (AC - IOL). Un occhio con una lente artificiale viene chiamato pseudofachico. Ogni IOL è costituita da una parte ottica centrale (elemento refrattivo) e due elementi di appoggio, per stabilizzare la IOL nel sacco capsulare, solco ciliare, o nell’angolo camerulare.
Viene fatta distinzione tra:
– IOL monofocali: con un solo fuoco specifico (per lontano o per vicino)
– IOL multifocali: con un fuoco per lontano e uno per gli oggetti vicini. Non tutte le lenti multifocali (ce ne sono di vari tipi) raggiungono la qualità di quelle monofocali e possono creare problemi dovuti alla riduzione del contrasto nella visione,
bagliori, e comparsa di aloni durante la visione notturna. È essenziale la selezione del paziente soprattutto in base alla sua refrazione di partenza (l’impianto di questa IOL è scongiurata per esempio in pazienti miopi).
– IOL toriche: correggono non solo l’ametropia sferica ma anche fino a 3D di astigmatismo ed il corretto orientamento della IOL è in questo caso fondamentale.
– IOL EDOF: Monofocali a focalità estesa.
Materiali della IOL
Le IOL possono essere distinte in IOL non flessibili e flessibili, ed in IOL mono- pezzo (nelle quali i supporti e la parte ottica sono fatti in unico materiale senza punti di connessione) e IOL in tre pezzi (nelle quali la parte ottica e i supporti sono fatti di materiali differenti come PMMA, polipropilene, e poliammide e sono connessi l’uno all’altro).
– IOL non flessibili: sono per la maggior parte costituite da polimetilmetacrilato (PMMA). Per impiantare una IOL non flessibile, l’incisione deve essere più larga del diametro della lente (5,5 – 6,5 mm), le moderne lenti non flessibili sono IOL monopezzo oggi non sono più utilizzate.
– IOL flessibili: sono ripiegate con una pinza o un sistema iniettore e sono quindi impiantabili attraverso incisioni da 2.2 - 3.0 mm con la stessa misura ottica delle IOL non flessibili. Le IOL flessibili sono costituite da silicone, acrilico, idrogel. Lo sviluppo e le modificazioni delle IOL moderne sono in costante progresso.
– IOL flessibili precaricate: Le precedenti già pronte per l’inserimento nell’occhio del paziente.
7.8 Tecniche chirurgiche
L’operazione è eseguita solo su un occhio alla volta. La procedura sull’altro occhio viene eseguita soltanto dopo minimo una settimana che il primo occhio si sia stabilizzato.
Estrazione intracapsulare della cataratta
Fino alla metà degli anni ’80 rappresentava il metodo di scelta, oggi l’estrazione intracapsulare di cataratta viene eseguita solo in caso di sublussazione o dislocazione della lente. L’intera lente viene congelata nella sua capsula attraverso un criostato o erisifaco e rimossa dall’occhio attraverso una larga incisione corneale superiore.
Estrazione extracapsulare della cataratta
L’estrazione extracapsulare consiste nell’apertura di un solco limbare di circa 160° e della capsula anteriore del cristallino (capsulotomia) con la rimozione della parte interna della cataratta attraverso un taglio chirurgico sufficiente a permettere la fuoriuscita del nucleo intero o suddiviso in grossi blocchi.
Facoemulsificazione
Viene aperta la capsula anteriore (capsuloressi) poi vengono rimossi solo la corteccia e il nucleo della lente, la capsula posteriore e la zonula di sospensione rimangono intatte. Questo fornisce una base per l’impianto di una IOL da camera posteriore. Oggi la facoemulsificazione (emulsificazione e aspirazione del nucleo della lente con uno strumento ad ultrasuoni ad alta frequenza) è la tecnica preferita per rimuovere il nucleo. Quando il nucleo è molto duro, viene rotto e aspirato; poi le parti più morbide della corteccia vengono rimosse tramite suzione con un aspiratore/irrigatore ed una manovra di aspirazione/irrigazione. La capsula posteriore viene quindi pulita e viene impiantata una lente intraoculare nel sacco capsulare vuoto. La facoemulsificazione e l’impianto della IOL richiede un’incisione di soli 2,2 – 5 mm di ampiezza. Quando viene usata una tecnica a tunnel non sono necessarie suture dato che la ferita si chiude autonomamente tramite idrosutura.
7.9 Cataratta secondaria
EPIDEMIOLOGIA: circa il 30% dei pazienti sviluppa una cataratta secondaria dopo l’estrazione di cataratta.
EZIOLOGIA: l’estrazione della cataratta rimuove solo la parte anteriore centrale della capsula, permangono quindi delle celliule epiteliali che hanno la capacità di riprodursi e possono quindi produrre una cataratta secondaria di tessuto fibroso o rigenerativo sulla capsula posteriore con conseguente diminuzione dell’acuità visiva.
TERAPIA: il laser YAG (yttrium-alluminium-garnet) è in grado di incidere la capsula posteriore lungo l’asse visivo senza richiedere una chirurgia oculare invasiva, questa tecnica migliora immediatamente lo stato del visus del soggetto.
7.10 Dislocazione della lente
DEFINIZIONE:
– Sublussazione (dislocazione parziale). La sospensione della lente (fibre della zonula) è allentata, e la lente è solo parzialmente all’interno della fossa ialoidea.

– Lussazione (dislocazione completa). La lente è completamente lacerata e libera ed è migrata nel corpo vitreo o, meno frequentemente, nella camera anteriore.
EZIOLOGIA: ci sono diverse cause di dislocazione della lente. Più frequentemente, è causata da un trauma. In età più avanzata, la pseudoesfoliazione può anche condurre alla sublussazione o alla lussazione della lente. Le cause ereditarie e le malattie metaboliche producono una dislocazione della lente più precocemente, ma nel complesso sono rare. Altre rare cause includono l’iperlisinemia (caratterizzata da ritardato sviluppo mentale) e carenza di solfato ossidasi (che conduce a ritardo mentale ed escrezione di cisteina nelle urine). Le più frequenti cause di dislocazione atraumatica della lente sono la sindrome di Marfan, l’omocistinuria e la sindrome di Weill-Marchesani.
SINTOMI: un lieve dislocamento potrebbe non avere significato funzionale per il paziente. Dislocamenti più pronunciati producono distorsioni ottiche severe con perdita dell’acuità visiva.
CONSIDERAZIONI DIAGNOSTICHE: i sintomi cardinali includono tremolìo della lente e dell’iride quando l’occhio si muove (iridodonesi e facodonesi). Questi sintomi sono rilevabili con l’uso di una lampada a fessura.
TERAPIA: le considerazioni ottiche (vedi sintomi) e il rischio di insorgenza di un glaucoma secondario da chiusura dell’angolo causato dalla protrusione dell’iride e la dislocazione della lente nella camera anteriore sono indicazioni per rimuovere la lente.
7.11 Chirurgia della cataratta nei bambini
Il bambino con cataratta congenita, traumatica o metabolica non riuscirà a comunicare a parole il suo difetto visivo che può essere diagnosticato in base a questi sintomi:
Leucocoria;
fenomeno oculodigitale: il bambino preme le sue dita contro l’occhio o gli occhi, poiché questa pressione può produrre dei bagliori che il bambino trova interessanti;
– strabismo: il primo segno di danno visivo;
– il bambino piange quando l’occhio sano viene coperto;
– il bambino ha difficoltà a camminare o ad afferrare gli oggetti;
– è presente un irregolare movimento dell’occhio;
– nistagmo.
Operare il prima possibile
La fissazione retinica e le risposte corticali visive si sviluppano entro i 6 mesi di vita, ciò
vuol dire che il bambino che viene sottoposto a chirurgia dopo il primo anno di età ha significativamente poche possibilità di sviluppare una visione normale. I bambini con cataratta congenita devono essere operati il prima possibile per scongiurare il rischio di ambliopia. La prognosi in seguito ad un intervento ben riuscito è meno favorevole per le cataratte unilaterali che per quelle bilaterali. Questo perché l’ambliopia dell’occhio con cataratta lo pone in una condizione di svantaggio irreversibile rispetto all’altro occhio.
PIANIFICARE IL FUTURO QUANDO SI EFFETTUA LA CHIRURGIA: dopo l’apertura della capsula anteriore della lente estremamente elastica, si può aspirare la soffice corteccia infantile ed il nucleo. Le cataratte secondarie sono complicanze frequenti nei bambini, la procedura potrebbe quindi includere una capsulotomia posteriore con vitrectomia anteriore per assicurare un asse visivo non ostruito. L’opera- zione preserva la porzione equatoriale della capsula per permettere il successivo impianto di una lente da camera posteriore negli anni seguenti.
LA REFRAZIONE CAMBIA COSTANTEMENTE: il potere refrattivo dell’occhio cambia drammaticamente entro un breve periodo di tempo appena l’occhio cresce. La refrazione nell’occhio di un neonato è 30 - 35 diottrie e diminuisce fino a 15 - 20 diottrie entro il primo anno di vita (shift miopico).
Compenso refrattivo
Due punti devono essere notati per la correzione ottica di un’afachia nel bambino: l’età e se la cataratta è unilaterale o bilaterale.
Possibili metodi di correzione includono:
– Gli occhiali possono essere messi nei bambini più grandi con afachia bilaterale, non in quella unilaterale. Si dovrebbe notare che gli occhiali spessi per la cataratta potrebbero essere inappropriati per il loro peso, per ragioni estetiche, per la presenza di distorsioni prismatiche e scotomi ad anello.
– Le lenti a contatto sono una buona scelta per le afachie monolaterali e bilaterali. L’uso di lenti a contatto morbide nei bambini è difficile e richiede un’intensa collaborazione con i genitori; di solito sono ben tollerate dopo i 2 anni di età.

– L’impianto di IOL è oggigiorno una procedura di routine nei bambini oltre i 2–3 anni di età, il problema nei neonati è lo shift miopico nell’occhio che cresce; il potere della IOL viene calcolato dalla biometria e consiste in una certa somma di ipermetropia, che viene poi corretta con le lenti; durante la successiva crescita del bambino l’ipermetropia si riduce fino all’emmetropia.
– È richiesta una terapia ortottica postoperatoria Le cataratte unilaterali in partico-
lare richiedono una terapia ortottica postoperatoria per colmare la differenza con l’altro occhio normale. È indicata una valutazione della fissazione retinica, e anche il trattamento dell’ambliopia.
La refrazione dovrebbe essere valutata tramite un retinoscopio ogni due mesi durante il primo anno di vita e ogni 3–4 mesi durante il secondo anno, e le lenti a contatto e gli occhiali dovrebbero essere cambiati di comune accordo.
8 UVEA
8.1 Struttura
Il tratto uveale (anche conosciuto come strato pigmentato vascolare, tunica vascolare e uvea) prende il suo nome latino uva (uva) proprio per la sua pigmentazione scura e la forma delle sue strutture che ricorda un grappolo. Il tratto uveale, compreso tra retina e sclera è costituito dalle seguenti strutture che si susseguono:

Iride
– Corpo ciliare
– Coroide
L’irrorazione sanguigna è servita dall’arteria oftalmica: le arterie ciliari posteriori brevi entrano nel bulbo con il nervo ottico e provvedono alla coroide; le arterie ciliari posteriori lunghe passano lungo la superficie interna sclerale e irrorano il corpo ciliare e l’iride. Il sangue venoso drena attraverso quattro delle otto vene vorticose che penetrano la sclera posteriore a livello equatoriale e servono le vene oftalmiche superiori ed inferiori. Al sensoriale sono deputati i nervi ciliari lunghi e brevi.
Iride
L’iride si compone di due strati:
Lo strato stromale mesodermico anteriore
– Lo strato ectodermico epiteliale pigmentato posteriore
Lo strato posteriore è opaco e protegge l’occhio dalla luce eccessiva, questo strato è talmente vicino alla superficie anteriore del cristallino che molto spesso durante le infiammazioni si formano tra loro delle adesioni (sinechie).
Il colletto dell’iride copre l’arteria circolare iridea e divide lo stroma nelle porzioni pupillare e ciliare. La porzione pupillare contiene il muscolo sfintere che è innervato dalle fibre del parasimpatico ed il muscolo dilatatore della pupilla innervato invece dal simpatico; questi muscoli regolano la contrazione e la dilatazione della pupilla così che l’iride può essere regolata come l’apertura del sistema ottico dell’occhio.
Un’iride normale è composta da una ricchissima struttura finemente colorata con numerose cripte (lacune del tessuto) ed interlinee del trabecolato; una perdita dei colori di questi tessuti può essere segno d’infiammazione tessutale (vedi iriti). Il colore dell’iride è diverso in ogni individuo secondo il contenuto di melanina nei melanociti (cellule pigmentate) nello stroma e nello strato epiteliale. Nei soggetti albini (soggetti con deficit di sintesi della melanina) l’iride è di un colore azzurro grigiastro e alla retroilluminazione appare rossastra per il riflesso del fondo.
Corpo ciliare
Il corpo ciliare si estende dall’inserzione dell’iride fino all’ora serrata dove si unisce alla coroide. Ha la forma di un anello che sporge verso l’interno del bulbo oculare e risulta composto da due porzioni: una parte esterna formata dal muscolo ciliare, che contraendosi modifica la curvatura del cristallino permettendo l’accomodazione (cioè la messa a fuoco delle immagini sulla retina) una parte interna costituita da una serie di rilevatezze dirette posteriormente verso l’asse del bulbo oculare, dette processi ciliari. Su questi si inserisce un sistema di fibre detto zonula, che costituisce il legamento sospensore del cristallino. Oltre che nell’accomodazione il corpo ciliare interviene nei processo di produzione, secrezione e di riassorbimento dell’umor acqueo.
Coroide
È la tunica media del bulbo oculare e si estende dalla papilla del nervo ottico fino al corpo ciliare ricoperta internamente dalla membrana di Bruch; è una membrana di spessore che varia tra 0,2 e 0,4 mm, ricca di vasi sanguigni da cui dipende l’irrorazione di tutta la porzione esterna della retina.
8.2 Anomalie alla nascita
Aniridia
È la completa assenza dell’iride in genere bilaterale a trasmissione autosomica dominante o in alcuni casi sporadica. Solitamente residuano i villi del corpo ciliare che si possono osservare alla lampada a fessura con retroilluminazione. La visione è seriamente compromessa per ipoplasia foveale e questa anomalia in genere è accompagnata da nistagmo, ambliopia, buftalmo e cataratta.
Coloboma
Questa anomalia si verifica per incompleta fusione della vescicola ottica che avviene di norma verso la sesta settimana di gestazione. Il coloboma può colpire i vari distretti uveali dall’iride, al corpo ciliare sino al disco ottico.
Il coloboma a ponte mostra una continuità dell’anomalia dall’iride verso le strutture posteriori, quando vengono intaccati coroide e nervo ottico si assiste a importante riduzione visiva.
Eterocromia
Anomalie di sviluppo della pigmentazione dell’iride possono comportare differenti colorazioni iridee tra i due occhi; un’iride bicolore presenta diverse pigmentazioni. Casi isolati di eterocromia non hanno necessariamente significato clinico (ete-ocromia semplice) anche se esistono delle forme tipiche (es. eterocromia ciclitica di Fuchs con iridocicliti ricorrenti associate spesso a cataratta e glaucoma).
Albinismo
Dal latino (albus: bianco) è una malattia congenita metabolica che comporta ipopigmentazione di tutta l’iride; si può assistere al semplice albinismo oculare con coinvolgimento solo oculare fino all’albinismo oculocutaneo (occhi, pelle e capelli). I soggetti colpiti presentano un’iride azzurro grigio chiara che appare rossastra alla retroilluminazione per il riflesso del fondo, spesso presentano bassa acuità visiva per ipoplasia foveale e nistagmo; caratteristica è la accentuata fotofobia per assenza dello strato pigmentato irideo posteriore.
8.3 Infiammazioni
Le infiammazioni del tratto uveale sono classificate in base ai vari distretti colpiti:
– Uveiti anteriori (iriti);
– Uveiti intermedie (cicliti);
– Iridocicliti (iride e corpo ciliare);
– Le pars – planiti (uveiti intermedie);

– Uveiti posteriori (coroiditi);
– Panuveiti (uveite che coinvolge tutti i segmenti)
Iriti e iridocicliti acute
Le iriti sono le forme di uveiti più frequenti, spesso associate alle cicliti; i tre quarti delle iridocicliti hanno un andamento clinico acuto. Le iridocicliti sono associate a cause immunologiche tipo allergie o reazioni a tossine batteriche. In alcune malattie reumatiche si riconoscono espressioni di specifici antigeni leucocitari HLA come ad es. HLA – B27; le iridocicliti sono più spesso specchio di malattie sistemiche come spondiliti, sarcoidosi, sindrome di Reiter. Meno frequentemente sono secondarie a traumi o sepsi.
8 - Uvea
SEGNI TIPICI (il paziente lamenta sempre dolore spesso patognomonico):
– Iniezione ciliare (vasi perilimbari, attorno alla cornea per cui si parla anche di iniezione pericheratica, e sclerali sono rossi e congestionati)
– Coinvolgimento congiuntivale scarso o assente
L’iride è iperemica ed infiammata con miosi reattiva; la visione è offuscata per la presenza di cellule, proteine e fibrina in camera anteriore (definita come effetto Tyn dall).
I precipitati proteiciche si accumulano sulla superficie posteriore corneale a a causa delle correnti convettive dell’acqueo in camera anteriore si dispongono a formare un triangolo creando il cosiddetto triangolo di Arlt. L’accumulo di essudati (raccolta biancastra tipo pus in basso in camera anteriore che spesso raggiunge un livello di qualche mm) è detta ipopion. Nelle infezioni virali si può assistere a presenza di sangue in camera anteriore: ipoema
La pars planite si riferisce a una uveite idiopatica intermedia ed è la forma più comune tra le uveiti intermedie. I sintomi e i segni comprendono oltre a quelli descritti: corpi mobili per presenza di cellule nel corpo vitreo o per lo stravaso di liquidi dai vasi retinici in regione maculare perifoveale, detto edema maculare cistoide. Gli essudati e il vitreo condensato nella regione della pars plana possono assumere il caratteristico aspetto degli snowbank o snowflakes.
Tabella di diagnosi differenziale in base alla localizzazione infiammatoria
TIPI DI UVEITI POSSIBILI CAUSE
Idiopatiche
Spondilite anchilosante
IRIDOCICLITI ASSOCIATE AL SISTEMA HLA - B27
IRIDOCICLITI NON ASSOCIATE AL SISTEMA
HLA - B27
IRIDOCICLITI E COROIDITI
COROIDITI
Sdr. di Reiter
Coliti ulcerative Psoriasi
Idiopatiche Virali
Tubercolosi / Sarcoidosi / Sifilide
Artrite Reumatoide (sdr. di Chauffard)
Ciclite eterocromica
Uveite facogenica
Traumi
Toxoplasma / Sarcoidosi / Tubercolosi / Sifilide
M. di Behçet
Oftalmia simpatica
Brucellosi / Yersiniosi / Borreliosi /Listeriosi
Tumori maligni
Toxoplamosi / Sarcoidosi / Sifilide
M. di Behçet Istoplasmosi
Toxocara
Iriti e iridocicliti croniche
Un quarto delle iridocicliti ha un andamento cronico, la sintomatologia e le considerazioni diagnostiche sono le stesse delle forme acute. I soggetti con episodi ricorrenti rischiano più facilmente le complicanze come le sinechie tra iride e superficie anteriore del cristallino che se non trattate subito con collirio midriatico possono dar luogo a blocco pupillare; se l’umore acqueo non riesce a circolare liberamente si può avere un’iride a bombé con conseguente glaucoma da chiusura d’angolo. L’occlusione pupillare può comportare la formazione di un vero e proprio anello fibroso adeso alla capsula anteriore con cataratta secondaria; iridocicliti ricorrenti possono anche residuare in una cheratopatia a banda calcifica.
Coroiditi

Sono le formi uveitiche meno frequenti, i pazienti non lamentano dolore ma riportano visione offuscata (segno tipico: visione galleggiante).
All’esame oftalmoscopico si rileva un focolare singolo (a focolaio), foci multipli (a focolai) o infiammazione sparsa (coroidite diffusa). In un processo coroideale primario il vitreo appare privo di cellule ma l’infiammazione non trattata tende sempre a procedere (retinocoroidite) con infiltrazioni cellulari del corpo vitreo (visione offuscata). Bisogna sempre fare attenzione alla diagnosi differenziale rispetto ad un’infiammazione che riguarda prettamente la retina come nel caso ad es. del Toxoplasma Gondii.
Oftalmia simpatica
DEFINIZIONE: infiammazione bilaterale specifica granulomatosa del trat to uveale dovuta ad irritazione cronica di un occhio in seguito a un trauma accidentale o chirurgico. È stimato che l’oftalmia simpatica si verifichi in non più dello 0,5% delle ferite oculari perforanti non chirurgiche e in meno dello 0,1% di quelle chirurgiche. La terapia richiede corticosteroidi a lungo termine e farmaci immunosoppressori. L’enucleazione a scopo profilattico dell’occhio traumatizzato cieco deve essere effettuata entro le due settimane dalla perdita della visione per prevenire il danno all’altro occhio.
Vasculite retinica
DEFINIZIONE: la vasculite retinica è un’infiammazione della vascolarizzazione retinica oltre ad essere una delle sindromi cliniche più frequenti; segni caratteristico è la presenza di cellule nel corpo vitreo.
EZIOLOGIA: la causa della vasculite retinica rimane spesso oscura, potrebbe es-sere causata da un patogeno o verificarsi in associazione con processi immunologici.
SINTOMI: i pazienti riferiscono perdita dell’acuità visiva o puntini neri (miodesopsie) nel campo visivo dovuti alla presenza di cellule nel corpo vitreo.
CONSIDERAZIONI DIAGNOSTICHE: la procedura diagnostica comprende esame clinico, oftalmoscopia, ed esame alla lampada a fessura. L’esame alla lampada a fessura mostrerà cellule nel corpo vitreo; segni oftalmoscopici comprenderanno infiltrati biancastri pre-retinici, costrizione vascolare (di solito coinvolgente le vene), occlusione vascolare, sanguinamento intraretinico ed edema retinico. L’angiografia con fluoresceina può essere usata per valutare la presenza di attività di neovascolarizzazione.
DIAGNOSI DIFFERENZIALE: devono essere escluse altre patologie vascolari della retina come l’occlusione retinica.
TERAPIA: le cause delle malattie note sottostanti dovrebbero essere trattate; i sintomi sono trattati con steroidi topici e sistemici in assenza di controindicazioni. La neovascolarizzazione è trattata con iniezioni intravitreali di sostanze (per lo più anticorpi monoclonali o frammenti degli stessi che inibiscono il VEGF che è alla base della produzuone di neovasi coroideali) per l’edema maculare cistoide cronico che spesso complica le uveiti si utilizza una terapia iniettiva di impianti biodegradabili a base di cortisone sia nella versione di desametasone o di fluorocinolone. È possibile utilizzare come terapia topica farmaci biologici o ciclosporina topica.
PROFILASSI: non è possibile alcuna profilassi eccetto il trattamento della patologia sottostante.
DECORSO CLINICO E PROGNOSI: l’occlusione vascolare può essere il risultato di una neovascolarizzazione che potrebbe condurre ad un’emorragia vitreale ed un’altra possibile complicanza è il distacco retinico trattivo.
Uveite posteriore da toxoplasmosi
Il patogeno Toxoplasma gondii è trasmesso tramite ingestione di cisti tessutali presenti nella carne cruda o poco cotta oppure oocisti dalle feci del gatto. Nella toxoplasmosi congenita il bambino acquisisce il patogeno attraverso una trasmissione transplacentare.
SINTOMI E CONSIDERAZIONI DIAGNOSTICHE: come regola generale un test di fissazione del complemento negativo non esclude l’infezione da Toxoplasma nel momento in cui sono presenti i classici sintomi clinici. Entrambe le forme della malattia si presentano con caratteristiche lesioni focali corioretiniche bianco-giallastre circondate da infiltrazione vitreale e vasculite associata.
Nella toxoplasmosi congenita i bambini affetti mostrano una cicatrice maculare che
danneggia significativamente l’acuità visiva e che spesso conduce a strabismo secondario. Mentre il coinvolgimento intracerebrale può generarsi da idrocefalo o calcificazioni intracraniche. Nella forma acquisita l’acuità visiva è danneggiata solo quando è coinvolta la macula che si verifica raramente. La toxoplasmosi congenita si presenta con una cicatrice maculare che danneggia significativamente l’acuità visiva.
Le uveiti posteriori causate dalla toxoplasmosi di solito quando la macula non è coinvolta guariscono senza severa perdita di acuità visiva; tuttavia può recidivare in qualsiasi momento.
Sindrome di Vogt – Koyanagi – Harada
Questa sindrome anche detta uveoencefalite è una rara patologia sistemica caratterizzata da uveite diffusa associata ad alterazioni cutanee e neurologi- che. Questa sindrome spesso colpisce soggetti molto pigmentati infatti più frequente nella popolazione asiatica, negli indiani asiatici e americani. Le donne sono colpite in misura doppia rispetto agli uomini solitamente verso i 30-40 anni.
L’eziologia della sindrome di Vogt - Koyanagi - Harada non è chiara anche se l’associazione con gli antigeni HLA di II classe, specialmente HLA-DR4 supporta l’ipotesi di un meccanismo autoimmune diretto contro i melanociti coroideali.
I sintomi neurologici tendono a manifestarsi precocemente e includono tinniti, disacusia, vertigini, cefalea e sintomi meningei. Le alterazioni cutanee compaiono più tardivamente e comprendono vitiligine a macchie, poliosi ed alopecia che interessa il capo e il collo. Le alterazioni oculari comprendono uveite anteriore, vitreite, edema del nervo ottico e coroidite di solito associate a distacco retinico essudativo.
Sarcoidosi oculare
Può presentarsi in varie forme: l’uveite si presenta in più del 10% di pazienti con patologia sistemica nota, anche se l’infiammazione oculare possa comparire in modo isolato rendendo difficile la diagnosi. Compaiono i segni di uveite anteriore, intermedia e posteriore; in assenza di biopsia diagnostica di un granuloma identificato clinicamente la diagnosi rimane presuntiva. La conferma si può avere: dalla Radiografia del torace o dalla Scintigrafia con gallio che dimostrano l’adenopatia ilare o l’infiammazione della ghiandola lacrimale; dagli elevati livelli di ACE sierica o livelli di lisozima (che dimostrano la presenza di un granuloma in fase attiva) o dalla reazione al test cutaneo. Le cosiddette biopsie lacrimali o congiuntivali alla cieca di tessuto sano sono da evitare poiché il campione è troppo scarso.

8 - Uvea
Sifilide oculare
La sifilide può provocare uveite in qualsiasi stadio della malattia incluse la primaria, la secondaria, la terziaria e le fasi latenti. I sintomi e i segni sono vari essendo state descritte uveiti anteriori, intermedie, posteriori e diffuse. Gli esami di laboratorio devono comprendere il test VDRL non specifico e i test più specifici per gli anticorpi del Treponema pallidum. La terapia efficace consiste nella somministrazione e.v. di penicillina per 10-14 giorni. I corticosteroidi locali e sistemici e i cicloplegici possono essere aggiunti in casi d’infiammazioni particolarmente gravi, ma soltanto una volta che sia già stata iniziata la terapia con penicillina per via sistemica.
Tubercolosi oculare
La tubercolosi è una causa poco frequente di uveite nei paesi occidentali, sebbene la sua prevalenza nei paesi in via di sviluppo può essere considerevole. La diagnosi è spesso presuntiva e si basa sulla positività cutanea alla tubercolina (PPD) e/o sulla radiografia del torace che evidenzia lesioni caratteristiche. La terapia richiede almeno 4-6 mesi di somministrazione di vari agenti antitubercolari, spesso associata con corticosteroidi locali e sistemici e cicloplegici quando l’infiammazione intraoculare è grave.
8.4 Patologie retiniche AIDS-correlate
Le patologie retiniche nell’AIDS coinvolgono microangiopatie AIDS-associate o infezioni.
EPIDEMIOLOGIA: oltre l’80% dei pazienti con AIDS hanno patologie retiniche come conseguenza della malattia mentre altri coinvolgimenti oculari sono rari.
La patogenesi della microangiopatia è ancora sconosciuta; le infezioni opportunistiche sono frequentemente causate da virus.
La microangiopatia è di solito asintomatica; pazienti con patologie infettive retiniche riportano una perdita dell’acuità visiva e difetti del campo visivo.
CONSIDERAZIONI DIAGNOSTICHE: segni oftalmoscopici nella microangiopatia associata all’AIDS comprendono emorragie, microaneurismi, teleangectasie ed essudati cotonosi. Si pensa possa avere un ruolo un coinvolgimento diretto delle cel lule vascolari endoteliali nell’infezione da HIV, o un danno alle cellule endoteliali e alle strutture vascolari mediato da immunocomplessi.
La retinite da citomegalovirus si verifica nel 20-40% dei pazienti anziani. Sono frequentemente osservate una necrosi retinica periferica e un sanguinamento intraretinico. L’occlusione vascolare è rara. Si potrebbe sviluppare un distacco regmatogeno
secondario alla necrosi della retina. Queste lesioni guariscono per produrre una cicatrice epiteliale finemente pigmentata.
Meno frequentemente, l’AIDS potrebbe generare un’infezione retinica causata dai virus dell’herpes simplex o della varicella-zoster, Toxoplasma gondii o Pneumocystis carinii. La diagnosi di un’infezione virale retinica nell’AIDS è confermata tramite l’ottenimento di colture sieriche positive e da test di resistenza.
DIAGNOSI DIFFERENZIALE: i cambiamenti retinici infiammatori da altre cause dovrebbero essere esclusi tramite studi sierologici.
TERAPIA: la microangiopatia non richiede trattamento. La retinite virale è trattata con ganciclovir o foscarnet. I virus della varicella e dell’herpes-zoster sono trattati con aciclovir.
PROFILASSI: esami di controllo oftalmologici sono indicati in presenza di un’in- fezione virale nota.
DECORSO CLINICO E PROGNOSI: la prognosi per la microangiopatia è molto buona. La retinite infettiva condurrà alla cecità se lasciata non trattata. L’acuità visiva può spesso essere preservata se viene fatta una pronta diagnosi.
8.5 Tumori uveali
Sebbene i tumori dell’uvea siano rari, clinicamente sono molto importanti poiché il riconoscimento in fase precoce permette dei trattamenti precoci con interventi poco demolitivi; diagnosi tardive comportano sovente exenteratio orbitae senza contare eventuali metastasi.
Tumori primitivi
VASCOLARI:
a) emangioma circoscritto
b) emangioma diffuso
PIGMENTATI:
a) nevo
b) melanoma
Tumori vascolari
Emangioma della coroide
Tumori secondari
METASTASI
Questo tumore può essere diffuso o circoscritto, sempre a carattere benigno e può far parte di un’angiomatosi facciale (sindrome di Sturge – Weber) o associarsi a glau-

coma per malformazione dell’angolo. Dal punto di vista istologico si presenta come un groviglio di vasi anastomizzati e ricchi in setti connettivali.
La forma circoscritta molto spesso passa inosservata, meno frequente la forma retinica che comporta disturbi visivi e reca il soggetto a visita specialistica.
La forma diffusa viene diagnosticata di norma nella prima decade di vita dato che le lesioni extraoculari sono subito visibili.
Vista la benignità di queste forme si prende in considerazione un trattamento conservativo (fotocoagulazione laser ed applicazioni di placche di cobalto episclerali); inoltre si agisce solo in caso di compromissione visiva (per interessamento maculare, distacco neuroepiteliale o emorragie).
Tumori pigmentati
Nevo della coroide
È un tumore benigno molto diffuso (circa il 25% della popolazione) costituito da melanociti atipici; solitamente si localizza centralmente ma non dà segni di sofferenza. Si presenta già alla nascita ma la crescita si ravvisa nel prepubere e proprio per questo cambiamenti di crescita durante l’età adulta sono segno di possibile trasformazione maligna.
CONSIDERAZIONI DIAGNOSTICHE: si presenta come una formazione ovale o rotonda di massimo 3 diametri papillari cioè < di 5 mm e di spessore < di 1 mm e nei nevi più ampi si possono repertare delle drusen centrali. Il nevo tipico può avere un follow–up anche di un anno, un nevo sospetto (con caratteristiche diverse da quelle descritte) deve essere controllato frequentemente ed investigato tramite: fotografie del fondo oculare, FAG (fluoranfiografia) con fluorescina ed indocianina ed ecografia A–scan. Caratteristiche importanti da non sottovalutare: lo spessore che se > di 1 mm è sempre segno di malignità, la vicinanza al nervo ottico e distacchi sierosi viciniori al nevo.
Melanoma uveale
Questo tumore ha un’incidenza di uno su 10.000 ed è il primo tumore intraoculare maligno più comune. Solitamente unilaterale, può presentarsi a livello irideo, del corpo ciliare e della coroide.
– Melanoma dell’iride: spesso inizialmente asintomatico, nel momento in cui le cellule metastatiche colpiscono l’angolo della camera anteriore si assiste ad un glaucoma secondario. Se si presenta circoscritto si può rimuovere con un’iridectomia segmentale.
– Melanoma dei corpi ciliari: comporta spesso dei problemi accomodativi per dislocazione del cristallino e in questi casi il melanoma deve essere rimosso totalmente.
– Melanoma della coroide: ha sempre un inizio asintomatico, se giunge a coinvolgere la macula si assiste ad un’importante calo visivo o a visione fortemente offuscata, si accompagna spesso a distacco retinico e la diagnosi si conferma con l’aiuto della transilluminazione, dell’ecografia e con la fluorangiografia. I tumori coroideali si trattano con placche radioattive. L’enucleazione è indicata quando il tumore supera gli 8 mm.

9 VITREO E RETINA

9.1 Vitreo
Il vitreo (essendo per il 99% d’acqua e con poche fibre collagene) è un gel viscoso perfettamente trasparente composto da mucopolisaccaridi ed acido ialuronico che ripiegato a mo’ di catena a spirale trattiene tutta l’acqua come una spugna in un volume di circa 4 cm3. Con il passare degli anni si può assistere all’effetto di sineresi (dal greco “riduzione, restringimento” cioè espulsione, per semplice riposo, di liquido dalle particelle di gel dando luogo a liquefazione con possibili formazioni addensate dette “corpi mobili vitreali” che il paziente riferisce come “mosche volanti” meglio definite come “miodesopsie”.
9.2 Metodi d’esame
Il corpo vitreo può essere osservato per il terzo anteriore alla lampada a fessura mentre per i due terzi posteriori, sempre alla stessa lampada, bisogna anteporre una lente di almeno + 78 o + 90 diottrie. L’oftalmoscopia indiretta o la retroilluminazione (test di Bruckner) vengono effettuati osservando il vitreo nell’insieme.
Test Di Bruckner (Prova del riflesso rosso)
Questo test è importante in particolare nella visita pediatrica: si esegue a stanza semioscura ponendo l’oftalmoscopio difronte il paziente a circa 45 cm di distanza illuminando entrambi gli occhi in midriasi. Un riflesso diminuito o asimmetrico, la presenza di patine chiare o macchie scure deve allertare il pediatra o medico di base per accertamenti oculistici immediati; in tutti i bambini con storia familiare per retinoblastoma, cataratta congenita, glaucoma e malattie retiniche ereditarie è necessaria una visita oculistica entro tempi brevi (almeno entro i primi 3 anni) anche se il riflesso rosso risulti nella norma.
9.3 Patologie vitreali
Sinchisi vitreale
Come già sopra accennato, dopo i 40 anni si assiste ad un rimaneggiamento delle fibre collagene che gradualmente perdono consistenza ed elasticità con effetto sineresi di liquefazione vitreale. Durante questo processo si possono creare delle lacune centrali di liquefazione che il paziente riferisce come sensazione di “visione in acqua” e solitamente l’evento prosegue portando ad un collasso dell’intero corpo vitreale che nella maggior parte dei casi si autolimita ad un distacco posteriore del vitreo sine residui, in alcuni casi si assiste a trazioni e/o rotture più o meno gravi fino a distacchi retinici.
Distacco Posteriore Vitreale (DPV)
Consiste nel distacco della faccia posteriore della ialoide dalla retina che può essere totale o parziale sempre per meccanismo di sineresi legata all’età. Durante il processo il paziente può riferire “visione di flash o lampi” causati da trazioni vitreali sulla retina (importante quindi eseguire un accurato esame retinico in particolare periferico) per trattare tempestivamente eventuali rotture che nel 70% dei casi conducono a distacco retinico.
Emorragia vitreale (Emovitreo)
Si può verificare più frequentemente nei soggetti diabetici (in particolare negli stadi di Retinopatia Diabetica proliferante), come esito di un’occlusione venosa retinica, conseguenza di trauma bulbare, in corso di DPV, nella Sdr. di Terson (emorragia subaracnoidea o subdurale per aneurismi cerebrali multipli, accompagnata da aumento della pressione intracranica ed emorragie retiniche ed intravitreali da compressione del nervo ottico), in angiomi retinici, pars planiti e i casi di Retinoschisi X-linked. Nei bambini bisogna non sottovalutare danni da traumi e/o percosse.
Persistenza di vitreo primitivo iperplastico
Malattia congenita dovuta alla mancata regressione del vitreo primario e della relativa vascolarizzazione che è presente solo nel feto; può essere anteriore con tessuto fibrovascolare adeso a cristallino e processi ciliari, posteriore con un cordone fibrovascolare a partenza dal nervo ottico verso la porzione anteriore e completa se le forme sono associate. Questo quadro si associa frequentemente a cataratta, glaucoma e distacco retinico.
Commozione retinica (Edema di Berlin)
Consiste in uno sbiancamento retinico centrale transitorio dovuto a repentino e parziale distacco dei fotorecettori con assottigliamento dello strato nucleare esterno e plessiforme; in alcuni casi possono residuare cambiamenti pigmentari (detta iperplasia EPR – epitelio pigmentato retinico) o nel tempo può svilupparsi un foro maculare traumatico ma nella maggior parte dei casi si risolve senza sequele.

Ialosi asteroide
A causa del deterioramento nel tempo del collagene vitreale si assiste alla presenza di numerose e piccole opacità sferoidali bianco–giallastre (corpi asteroidi) composte in prevalenza da grassi e sali di calcio.
Sinchisi scintillante
La stessa parola descrive la presenza di piccolissimi agglomerati di colore bianco–brillante, molto mobili durante i movimenti oculari e composti prevalente- mente da colesterina e lipidi. La forma idiopatica è più frequente e dovuta a proces-si d’invecchiamento, mentre secondaria se postuma ad infiammazioni e/o emovitreo.
Amiloidosi vitreale
È una rarissima malattia ereditaria autosomica dominante che si manifesta più spesso verso i 20 anni e consiste nel progressivo accumulo di una proteina ‘amiloide’ che nel vitreo aumenta sempre più intorno alle fibre collagene risparmiando il canale ialoide. L’unica terapia è la rimozione attraverso la vitrectomia.
9.4 Fondo oculare normale
La retina è normalmente del tutto trasparente senza alcun colore intrinseco; essa riceve il suo colorito uniforme rosso brillante dai vasi della coroide. I vasi della coroide sono loro stessi oscurati dall’epitelio pigmentato retinico e la perdita di trasparenza retinica è segno di un processo anormale (es.: negli edemi retinici appare bianco –giallastra). Il disco ottico è normalmente a margini ben definiti di colore giallastro-arancio (nei giovani è francamente roseo, e nei bambini piccoli è significativamente più pallido) e può mostrare una depressione centrale conosciuta come escavazione fisiologica. All’esame del fondo oculare il riflesso della luce sulla membrana limitante interna produce normalmente riflessi di luce multipli; inoltre i giovani possono mostrare un normale riflesso foveale e un riflesso a muraglia intorno alla macula, causato dal passaggio tra la depressione della macula verso livello più alto della retina.
9 - Vitreo e retina
CAMBIAMENTI LEGATI ALL’ETÀ: il fondo, con il progredire dell’età, diventa opaco e non riflettivo, il disco ottico diventa giallo e pallido con gli anni e spesso l’escavazione ottica diventa superficiale e circondata da una regione di atrofia coroideale. Possono essere presenti delle drusen ed in media periferia proliferazioni reticolari sempre a carico dello stesso epitelio pigmentato retinico (EPR). Le arterie si presentano sottili e stirate per perdita di elasticità con infiltrati irregolari causati da inspessimento delle cellule di parete. Le venule si presentano con segni d’incrocio e sofferenza dove l’arteria sclerotica comprimere la vena a livello dell’incrocio aterovenoso riducendo il diametro della colonna di sangue venoso; in casi estremi il sangue venoso fuoriesce del tutto dal vaso provocando delle microemorragie.
9.5 Metodi d’esame
Visione dei colori
Le alterazioni nella visione dei colori si possono presentare come una riduzione della sensibilità ad alcuni colori (i più deboli) o, molto più raramente, come una completa assenza percettiva di alcuni colori (cecità ai colori). I deficit di visione ai colori di tipo ereditario si presentano più spesso nei maschi per trasmissione X-linked (l’8% degli uomini e solo lo 0,4% delle donne).
DEFICIT QUALITATIVI NELLA VISIONE ROSSO–VERDE: sono valutati tramite tavole pseudoisocromatiche come le tavole di Ishihara (vedi cap.1) che si compongono di lettere o numeri composti da piccoli puntini colorati in diverse cromie e solo i soggetti normali riescono a percepire e leggere correttamente i simboli “nascosti”. I test di Farnsworth – Munsell possono invece evidenziare difetti nella visione del blu–giallo: il soggetto con deficit nella visione dei colori non riesce a disporre i colori con le diverse sfumature (secondo i colori dell’arcobaleno) nel giusto ordine. Con l’anomaloscopio di Nagel si effettua una valutazione quantitativa del defi- cit nella visione dei colori quando è stata già fatta diagnosi. La tavola utilizzata per questo test consiste in una metà inferiore di giallo la cui luminosità può essere sistemata e in un’altra metà superiore che il paziente prova a sistemare uguale al giallo mischiando il rosso e il verde. Il livello di anomalia si calcola in base alla sistemazione finale; i soggetti ciechi per il colore verde useranno troppo verde mentre quelli ciechi per il rosso useranno troppo rosso nel sistemare i colori. Per i deficit nella visione dei colori non vi è trattamento.
Esami elettrofisiologici
Elettroretinogramma (ERG)
Questo metodo di esame usa degli elettrodi per registrare la risposta elettrica della retina agli stimoli luminosi. Vengono realizzati ERG fotopici (adattati alla luce) e scotopici (adattati al buio). L’ERG consiste in una onda A negativa che indica la risposta dei fotorecettori e in un’onda B positiva che indica primariamente la risposta delle cellule bipolari e delle cellule di supporto di Muller. Il flicker ERG (con flash ripetuti) isola la risposta pura dei coni; un pattern ERG (come le scacchiere bianco- nero) e dei potenziali oscillanti possono essere usati per valutare lo strato interno della retina.
L’ERG rappresenta una risposta sommatoria di tutta la retina mentre l’ERG multifocale può registrare risposte di aree singole della retina: questo rende possibile registrare l’attività retinica nell’area maculare punto per punto. Infatti questo tipo di ERG è adatto per la diagnosi delle patologie maculari (es.: distrofie maculari, degenerazione maculare legata all’età) e per differenziare patologie maculari da processi a carico della testa del nervo ottico. L’indicazione classica per l’esecuzione di un ERG
è la retinite pigmentosa che comporta la perdita pre- coce dei potenziali scotopici e fotopici.
Elettrooculogramma (EOG)
L’elettrooculografia evidenzia cambiamenti anomali nell’epitelio pigmentato retinico come la distrofia maculare vitelliforme (malattia di Best). Questo metodo di esame utilizza l’occhio come un dipolo, dove la cornea rappresenta il polo positivo e l’epitelio pigmentato retinico il polo negativo. Il potenziale di riposo presente intorno alla cornea e alla retina in confronto alla cornea viene misurato indi- rettamente tramite due elettrodi temporali; durante la misurazione il paziente compie normali movimenti oculari focalizzandosi alternativamente su due fonti luminose. Il potenziale di riposo è normalmente più elevato nell’occhio adattato alla luce di quello adattato al buio; la differenza tra il valore del potenziale alla luce e il valore del potenziale al buio (Arden ratio) viene ottenuta per valutare l’occhio e questo valore è normalmente superiore a 1,8 ed è ridotto in presenza di cambiamenti anomali.

L’indicazione tipica per l’EOG è la distrofia maculare vitelliforme di Best che si presenta con una significativa riduzione dell’Arden Ratio.
Potenziali Evocati Visivi (PEV)
Questo esame viene utilizzato per diagnosticare danni lungo le vie visive (a livello del nervo ottico e della corteccia visiva), si registra come l’elettroencefalogramma
9 - Vitreo e retina

(EEG) con elettrodi di posizione localizzati sul capo mentre il paziente fissa, prima con un occhio e poi con l’altro, un punto posto al centro di un video raffigurante una scacchiera (pattern reversal) i cui quadrati cambiano alternativamente colore da bianco a nero, oppure si possono utilizzare degli occhiali per stimolare direttamente l’occhio interessato.
Tomografia a Coerenza Ottica (OCT)
L’OCT è una dettagliata scansione retinica che analizza finemente tutti gli strati, è un esame adatto all’analisi di patologie maculari (foro ed edema maculare, trazioni vitreo–maculari) della testa del nervo ottico (studio del nervo ottico nel glaucoma) e delle fibre nervose della papilla (generando una mappa delle fibre suddivise in varie zone: nasale, temporale superiori ed inferiori).

9.6 Patologie vascolari
Retinopatia Diabetica (RD)
DEFINIZIONE: la retinopatia diabetica (RD) è una microangiopatia oculare.

EPIDEMIOLOGIA: la RD è una delle principali cause di cecità acquisita (tra i 30 e i 60 anni) nei paesi industrializzati; circa il 90% dei pazienti diabetici sviluppa una retinopatia dopo 20 anni di malattia e la prevalenza è del 7%.
PATOGENESI: la RD è una microangiopatia che presenta un ispessimento del- la membrana basale (MB) dei vasi con perdita dei periciti e delle cellule endoteliali vascolari. L’iperglicemia gioca un ruolo importante in questo stadio precoce senza sottovalutare il ruolo anche peggiore degli attacchi ipoglicemici. Questi sbilanciamenti sistemici, a livello microvascolare, comportano l’occlusione dei capillari con conseguente ischemia retinica; la fase successiva è innescata dall’ipossia. Nella retina ischemica si producono fattori angiogenici come il fattore di crescita va- scolare endoteliale (VEGF) e il fattore di crescita insulino – simile (IGF-1); questi contribuiscono alla formazione di nuovi vasi nello spazio preretinico e a livello dell’iride. In ogni momento può quindi verificarsi la rottura della barriera emato – re- tinica con aumento della permeabilità vascolare causando edema maculare, primo segno tipico di RD in fase iniziale.
STADIAZIONE DELLA RETINOPATIA DIABETICA: il Diabete Mellito (DM) è in grado di causare cambiamenti in quasi tutti i tessuti oculari; ad es.: cheratocongiuntivite secca, xantelasma, infezioni micotiche dell’orbita, cambiamenti transitori della refrazione, cataratta, glaucoma, neuropatia del nervo ottico e paralisi oculomo- toria. Tuttavia, il 90% delle menomazioni visive nei pazienti diabetici è causato proprio dalla retinopatia diabetica. La retinopatia diabetica riconosce due entità patognomoniche differenti, la prima caratterizzata dai fenomeni di deficit di barriera a livello capillare (retinopatia Background con e senza edema maculare diabetico) caratterizzata da microaneurismi, microemorragie, essudati duri ed edema intraretinico. La seconda caratterizzata da fenomeni vasoproliferativi (retinopatia proliferante) che presenta ischemia retinica periferica, neovascolarizzazioni, emovitreo fibrosi e distacco retinico trazionale. Le due forme non sono successive evolutive, la forma ischemico/proliferativa soprattutto nei giovani può insorgere senza altre alterazioni. Esiste poi una forma intermedia detta preproliferante caratterizzata sia da fenomeni ischemico/necrotici (essudati molli) che da alterazioni microvascolari (loop, IRMA ecc.). Tutte le alterazioni del fondo oculare in corso di diabete sono conseguenza dei vari aspetti della microangiopatia retinica, caratterizzata nei suoi stadi iniziali da occlusione vascola-
9 - Vitreo e retina
re o da aumentata permeabilità vascolare e negli stadi più avanzati da proliferazione fibrovascolare e formazioni cicatriziali. Le alterazioni del fondo oculare seguono un decorso talvolta progressivo dalla forma non proliferante a a quella proliferante. L’edema maculare generalmente insorge prima della retinopatia proliferante ma può svilupparsi in qualsiasi momento della storia naturale della retinopatia ed essere presente già al momento della diagnosi specie nel diabete di tipo NIDDM o di tipo 2. La retinopatia proliferante si sviluppa tipicamente con la crescita di neovasi reti- nici lungo la superficie retinica e/o sulla superficie del disco ottico; i neovasi inizialmente si dispongono lungo la corticale del vitreo poi penetrano direttamente nel corpo vitreo, in conseguenza di movimenti accidentali o fenomeni episodici possono rompersi e causare emovitreo. Per giungere allo stadio di retinopatia proliferante generalmente trascorrono circa 15 anni o più dalla diagnosi di malattia nei pazienti affetti dal diabete di tipo 1, ma nel 2% dei pazienti può verificarsi anche dopo soli 5 anni. Stabilire che la RD progredisce attraverso una serie di stadi clinici ben classificabili è estremamente importante e questo fondamento scientifico è stato prodotto dal gruppo di studio statunitense dell’Early Treatment Diabetic Retinopathy Study (ETDRS) che ha statisticamente estratto un numero limitato di lesioni cliniche indicative di progressione della retinopatia da una più ampia classificazione oftalmoscopica comprendente svariate lesioni retiniche (emorragie, microaneurismi, essudati duri, anomalie vascolari intraretiniche (IRMA) ecc…) e alcune tra queste sono state selezionate per formulare un livello gerarchico di gravità della retinopatia, generando così la stadiazione nota come Final Retinopathy Severity Scale (tabella sottostante ). La diffusione e l’applicazione di questa classificazione su vasta scala ha fornito le basi per stabilire la progressione della retinopatia in ambito clinico, negli studi epidemiologici e nei più importanti trial d’intervento.
Lesioni critiche individuate nell’Early Treatment Diabetic Retinopathy Study (ETDRS)
RETINOPATIA DIABETICA NON PROLIFERANTE:
- emorragie e/o microaneurismi
- anomalie microvascolari intraretiniche
- anomalie del calibro venoso
- noduli cotonosi
RETINOPATIA DIABETICA PROLIFERANTE:
- neovascolarizzazione periferica
- neovascolarizzazione a partenza dal disco ottico
- proliferazione fibrovascolare periferica
- proliferazione fibrovascolare a partenza dal disco ottico
- emorragie preretiniche
- emorragie vitreali
- distacco di retina
Nell’ETDRS la retinopatia non proliferante è stata classificata in 4 stadi:
1. lieve;
2. moderata;
3. grave;
4. molto grave–severo.
Retinopatia non–proliferante di grado lieve. Nella fluorangiografia sono ben evidenti i microa-neurismi e alcune piccole emorragiole.



Figura
Figura
Retinografia a colori – grado moderato. Le alterazioni del calibro venoso sono spesso associate alla presenza di iniziali neovasi retinici.
Gli essudati duri in corso di edema maculare sono segno clinico di aumentata permeabilità capillare.
SINTOMI: la RD rimane asintomatica per lungo tempo, solamente negli stadi tardivi vi è coinvolgimento con edema maculare oppure per un’emorragia vitreale e il paziente noterà un calo visivo più o meno improvviso ed intenso fino alla possibilità di perdita visiva totale.
CONSIDERAZIONI DIAGNOSTICHE: la RD e i suoi vari stadi sono diagnosticati tramite esami stereoscopici del fondo con pupilla dilatata; l’oftalmoscopia con la valutazione del fondo attraverso documentazione fotografica rappresentano il gold standard; l’angiografia con fluoresceina meglio detta fluorangiografia (FAG) è un’utile metodica per stabilire se sia necessario il trattamento argon laser retinico. La presenza di rubeosi dell’iride è confermata o esclusa con l’esame alla lampada a fessura in presenza di una pupilla mobile (senza uso di midriatico) e con una gonioscopia dell’angolo camerulare anteriore. Con la tomografia a coerenza ottica (OCT) possono essere diagnosticati l’edema maculare, gli essudati duri e la maculopatia cistoide.
TRATTAMENTO: il trattamento della retinopatia diabetica sia per ciò che riguardano l’edema maculare clinicamente significativo (cioè in presenza di compromissione visiva) che la forma proliferante si basa sull’impiego intravitreale di elementi inibenti il VEGF (bevacizumab, ranimizumab e aflibercept) o con impianti contenenti cortisonici come il desametasone o il fluorometolone). L’Edema Maculare Diabetico viene trat-

tato anche con laser sottosoglia o micropulsato a griglia del polo posteriore (laser verde o giallo), anche in combinazione con terapie intravitreali, mentre la RD proliferativa viene trattata con pan–fotocoagulazione per 360° eseguita in tre o cinque sedute (1200-1600 bruciature con dimensioni degli spots retinici di 500 µm), anche in combinazione con terapie intravitreali,. Qualora siano presenti delle emorragie vitreali o distacchi retinici è necessario un trattatmento chirurgico più invasivo con la vitrectomia posteriore.

PROFILASSI: il fallimento nell’esecuzione di un regolare esame di screening nei pazienti con il diabete mellito è un’omissione negligente che espone il paziente a rischio di cecità. Tutti i pazienti con diabete di tipo 2 dovrebbero quindi fare una visita oculistica per la diagnosi della patologia, e i pazienti con diabete tipo 1 dovrebbero fare una visita oculistica entro 5 anni dal momento della diagnosi. Successivamente i pazienti diabetici dovrebbero essere sottoposti a visita oculistica (in particolare del fondo) almeno una volta l’anno o meglio ancora semestralmente, tanto più se in atto RD. Le pazienti diabetiche in gravidanza dovrebbero essere visitate una volta ogni trimestre.
DECORSO CLINICO E PROGNOSI: un controllo ottimale dei livelli di glucosio ematico (HbA1c < 7%) può prevenire o ritardare la retinopatia; anche l’ipertensione arteriosa concomitante deve essere trattata (la pressione sanguigna deve essere stabilizzata sotto i 140/85 mmHg). Senza terapia, il distacco di retina trazionale o l’edema maculare possono condurre ad un severo deficit visivo o alla cecità. Tuttavia la retinopatia diabetica può verificarsi nonostante sia stata messa in atto una terapia ottimale. La rubeosi iridea (neovascolarizzazione dell’iride) nella RD proliferativa equivale alla perdita dell’occhio, poiché rappresenta un processo implacabile ed irreversibile. Il rischio di cecità dovuto alla RD può essere ridotto con un controllo ottimale della glicemia, regolari controlli oculistici e terapie ottimali e tempestive ma purtroppo non può essere del tutto eliminato.
Occlusione venosa retinica
DEFINIZIONE: l’occlusione venosa è il risultato di una disfunzione circola- toria nella vena centrale o in una delle sue branche.
EPIDEMIOLOGIA: l’occlusione venosa retinica è la seconda più frequente patologia vascolare retinica dopo la retinopatia diabetica. Le più frequenti patologie che fa- voriscono l’evento sono l’ipertensione arteriosa ed il diabete mellito, mentre frequenti patologie oculari sottostanti includono il glaucoma e le vasculiti retiniche.
EZIOLOGIA: l’occlusione della vena centrale retinica o delle sue branche è frequentemente dovuta ad una trombosi locale nei punti in cui l’arteria sclerotica compri- me la vena; nelle occlusioni della vena centrale retinica il trombo giace a livello della lamina cribrosa; nelle occlusioni venose di branca si trova frequentemente a livello di un incrocio aterovenoso.
SINTOMI: i pazienti avvertono una diminuzione dell’acuità visiva nel caso in cui siano coinvolti la macula o il nervo ottico.
CONSIDERAZIONI DIAGNOSTICHE E SEGNI: l’occlusione della vena centrale retinica può essere diagnosticata quando si osservano emorragie lineari o puntiformi in tutti e 4 i quadranti retinici e spesso le vene sono distese portandosi maggiormente in profondità. Nell’occlusione venosa di branca le emorragie intraretiniche si verificano nelle zone alimentate e tale sanguinamento può verificarsi solamente in uno o due quadranti (occlusione venosa emisferica). Si possono riscontrare essudati cotonosi ed edema retinico e del nervo ottico (sia singolarmente che associati). Le occlusioni croniche inoltre possono essere accompagnate da depositi lipidici. L’occlusione ischemica è diagnosticata con l’ausilio della fluorangiografia (nell’occlusione della vena centrale retinica l’area di non perfusione è ³10 a diametri papillari, nell’occlusione di branca è ≥ 5).
DIAGNOSI DIFFERENZIALE: una differenziazione tra le forme ischemiche e non ischemiche è legata all’estensione dell’occlusione capillare. È necessario escludere altre forme di patologie vascolari retiniche in particolare la retinopatia diabetica ed è fondamentale il consulto di un medico internista per verificare o escludere la possibile presenza di malattie sistemiche sottostanti.
TERAPIA: nello stadio acuto dell’occlusione venosa l’ematocrito dovrebbe essere ridotto al 35-38% tramite emodiluizione. che la forma proliferante si basa sull’impiego intravitreale di elementi inibenti il VEGF (bevacizumab, ranimizumab e aflibercept) o con impianti contenenti cortisonici come il desametasone o il fluorometolone).
Tutti questi possono essere effettuati anche in combinazione con terapie laser con lo scopo di ridurre considerevolmente le aree ischemiche e l’edema ovviamente tutte queste terapie sono tanto più efficaci quanto più precocemente sono intraprese.
Edema Maculare conseguente a trombosi venosa viene trattato anche con laser sottosoglia o micropulsato a griglia del polo posteriore (laser verde o giallo), anche in combinazione con terapie intravitreali,
Le malattie presenti devono essere trattate ed i pazienti dovrebbero essere sottoposti ad un esame di follow–up ogni 4 settimane per 6 mesi ed in seguito ogni 3 mesi.
Nelle occlusioni della vena centrale retinica si sviluppa spesso una vascolarizzazione iridea entro 3 mesi, il trattamento laser viene effettuato nelle occlusioni ischemiche che progrediscono fino alla rubeosi iridea. Il trattamento laser focale viene eseguito nelle occlusioni venose di branca con edema maculare quando l’acuità visiva è ridotta a 1/20 o meno entro 3 mesi dall’occlusione.
PROFILASSI: è importante una diagnosi precoce ed una pronta terapia delle patologie oculari e sistemiche sottostanti.
DECORSO CLINICO E PROGNOSI: l’acuità visiva migliora approssimativa- mente in un terzo dei pazienti, rimane invariata in un terzo, e peggiora nell’altro terzo nonostante la terapia. Le complicazioni includono: neovascolarizzazione preretinica, distacco di retina e rubeosi iridea con glaucoma ad angolo chiuso.
Occlusione dell’arteria retinica
DEFINIZIONE: infarto retinico dovuto all’occlusione di un’arteria della lamina cribrosa o all’occlusione di un’arteria di branca.

EPIDEMIOLOGIA: l’occlusione dell’arteria retinica si verifica molto più raramente delle occlusioni venose.
EZIOLOGIA: gli emboli sono frequentemente la causa dell’occlusione dell’arteria centrale retinica e delle occlusioni di branca mentre meno frequentemente le cause includono processi infiammatori come le arteriti temporali (es.: arterite di Horton). Questa arterite dovrebbe essere esclusa quando l’occlusione dell’arteria centrale della retina è accompagnata da cefalea.
SINTOMI: nell’occlusione dell’arteria retinica centrale il paziente general- mente riferisce cecità improvvisa unilaterale senza dolore; nell’occlusione dell’arteria retinica di branca il paziente noterà una perdita dell’acuità visiva o difetti del campo visivo.
CONSIDERAZIONI DIAGNOSTICHE: la diagnosi viene fatta in base all’esame oftalmoscopico: nello stadio acuto dell’occlusione arteriosa retinica la retina appare biancastra con sfumature di grigio a causa dell’edema dello strato delle fibre nervose e non più trasparente. Solo la fovea centrale (foveola) che non contiene fibre nervose rimane visibile come un punto “rosso–ciliegia” proprio per il rosso della co- roide che si intravede attraverso tale punto. La colonna di sangue sarà visibilmente interrotta ma raramente si potrà osservare un embolo; i pazienti con arteria cilioretinica (arteria che origina dalle arterie ciliari al posto dell’arteria centrale della retina) mostreranno una normale perfusione dell’area irrorata e la loro perdita di acuità visiva sarà minore. Inoltre si osserva un difetto pupillare afferente e la perimetria mostra un severo deficit
del campo visivo. L’atrofia del nervo ottico condurrà allo stadio cronico dell’occlusione dell’arteria centrale retinica
Nelle occlusioni arteriose retiniche di branca verrà evidenziato un edema retinico nell’area vascolare irrorata durante lo stadio acuto. Per quanto riguarda la perimetria, mentre come già detto nell’occlusione dell’arteria retinica centrale si rileverà un deficit totale del campo visivo, nelle occlusioni di branca solo un deficit parziale corrispondente all’area di occlusione. Nello stadio cronico il vaso è spesso di calibro ridotto e a volte occluso.
DIAGNOSI DIFFERENZIALE: le malattie da accumulo di lipidi che possono cre are uno spot rosso–ciliegia come la malattia di Tay–Sachs, la malattia di Niemann–Pick o la malattia di Gaucher dovrebbero essere escluse, queste patologie possono essere chiaramente identificate in base ai loro numerosi sintomi e in base al fatto che colpiscono pazienti più giovani.
TERAPIA: la terapia di emergenza spesso non ha successo anche se iniziata immediatamente; il massaggio oculare, procedimento che riduce la pressione intraoculare, o la paracentesi si eseguono nel tentativo di spostare l’embolo in un vaso retinico periferico. I calcio–antagonisti e l’emodiluzione sono usati nel tentativo di migliorare la perfusione vascolare. La terapia litica sistemica non è più usata per la scarsa prognosi (non è in grado di prevenire la cecità) e mette a rischio tessuti vitali; attualmente viene studiata la lisi locale. Un’indagine per identificare la provenienza del trombo è importante per trattare la patologia di base e prevenire un’altra embolizzazione (come lo stroke). Non sono indicate terapie con inibitori del VEGF che potrebbero peggiorare la situazione.
PROFILASSI: è fondamentale iniziare al più presto una terapia e successivamente escludere patologie sistemiche. Utile un trattamento con boli di cortisone soprattutto nelle forme arteritiche (M di Horton).
DECORSO CLINICO E PROGNOSI: la prognosi è infausta a causa del danno irreparabile a carico degli strati retinici che si verifica entro 1 ora. La cecità di solito non può essere prevenuta nelle occlusioni dell’arteria centrale della retina e la prognosi è migliore quando è occlusa una sola branca dell’arteria, a meno che non sia interessata una branca maculare.
Retinopatia ipertensiva e cambiamenti sclerotici
DEFINIZIONE: i mutamenti sclerotici nell’ipertensione sono primariamente causati dal vasospasmo, nell’arteriosclerosi sono il risultato di un ispessimento della parete delle arteriole.
EPIDEMIOLOGIA: l’ipertensione arteriosa è la patologia di base che comporta le alterazioni vascolari che a loro volta causano più frequentemente l’occlusione venosa retinica.
PATOGENESI: la pressione sanguigna alta può causare la rottura della barriera emato – retinica o l’obliterazione dei capillari, questo causa sanguinamento intraretinico, essudati cotonosi, edema retinico o rigonfiamento della papilla ottica.
SINTOMI: i pazienti con pressione sanguigna alta soffrono frequentemente di cefalea o dolore oculare; disturbi del visus o perdita di acuità visiva si possono verificare solo nel III o IV stadio della retinopatia ipertensiva mentre l’arteriosclerosi non causa sintomi oculari.
CONSIDERAZIONI DIAGNOSTICHE: le alterazioni di natura ipertensiva e aterosclerotica sono diagnosticate tramite l’esame del fondo oculare preferibilmente in midriasi. Si osservano frequentemente alterazioni della vascolarizzazione retinica; gli infarti coroideali sono rari nell’ipertensione acuta (spot di Elsching: atrofia circoscritta e proliferazione dell’epitelio pigmentato retinico nell’area infartuata).
DIAGNOSI DIFFERENZIALE: l’oftalmoscopia dovrebbe essere eseguita per escludere altre patologie vascolari della retina come per es. la retinopatia diabetica.
TERAPIA: quando sono presenti alterazioni del fondo la sintomatologia sistemica si è instaurata già da tempo pertanto è fondamentale trattarla subito: la pressione del sangue dovrebbe essere ridotta sotto i 140/90 mmHg mentre i cambiamenti del fondo dovuti all’arteriosclerosi non hanno cura, è fondamentale però il follow-up di controllo del fundus almeno ogni 6 – 8 mesi per scongiurare e prevenire possibili complicanze.
DECORSO CLINICO E COMPLICANZE: le conseguenze dei cambiamenti vascolari arteriosclerotici ed ipertensivi includono l’occlusione dell’arteria e della vena retinica e la formazione di macroaneurismi che possono condurre all’emorragia vitreale. In presenza di edema della papilla, la successiva atrofia del nervo ottico può produrre una severa e prolungata perdita occasionale dell’acuità visiva.
PROGNOSI: in alcuni casi le complicanze descritte in seguito sono inevitabili nonostante un buon controllo della pressione sanguigna.

Malattia di Coats
DEFINIZIONE: teleangectasia retinica congenita con anomalie vascolari che quasi sempre si presentano in forma unilaterale e possono condurre all’essudazione ed eventualmente ad un distacco di retina essudativo.
9 - Vitreo e retina
EPIDEMIOLOGIA: questa rara patologia si manifesta nei bambini piccoli e nei giovani (circa il 90% dei casi) ed è quasi sempre unilaterale.
PATOGENESI: la teleangectasia e gli aneurismi causano essudazione ed eventualmente distacco retinico.
SINTOMI: gli stadi precoci sono caratterizzati da perdita di acuità visiva e gli stadi tardivi da leucocoria (pupilla bianca) o da strabismo unilaterale, sebbene sia possibile riscontrare entrambi.
CONSIDERAZIONI DIAGNOSTICHE E SEGNI: l’oftalmoscopia mostrerà la presenza di teleangectasie, un essudato biancastro sottoretinico con distacco retinico essudativo ed emorragie.
DIAGNOSI DIFFERENZIALE: negli stadi avanzati della malattia, deve essere esclusa la presenza di un retinoblastoma tramite l’oftalmoscopia o di una retino- patia dei prematuri sulla base dell’anamnesi del paziente; entrambe le patologie potrebbero inoltre causare leucocoria.
TERAPIA: la terapia di elezione è la fotocoagulazione laser o il criotrattamento per distruggere la vascolarizzazione anomala.
PROGNOSI: non trattata, la patologia potrà eventualmente causare cecità a causa di un distacco di retina totale. Il trattamento è efficace nel prevenire la cecità in circa il 50% dei pazienti.
9.7 Anomalie retiniche eredodegenerative
Retinite pigmentosa (RP)
DEFINIZIONE: questo termine è usato per un gruppo eterogeneo di patologie retiniche che conducono ad una progressiva perdita dell’acuità visiva, a difetti del campo visivo, e a cecità notturna. Il nome di Retinite Pigmentosa proviene dai depositi di pigmento che caratterizzano questa malattia; nella forma classica (vedi segni e considerazioni diagnostiche) questi depositi progrediscono dalla periferia fino al centro della retina.
EPIDEMIOLOGIA: l’incidenza mondiale della retinite pigmentosa è stimata esse- re tra circa 1/(35.000 - 70.000 persone); l’incidenza stimata degli alleli mutati è di uno ogni 80 persone.
FORME DI RETINITE PIGMENTOSA:
1. Distrofia dei bastoncelli – coni (retinite pigmentosa classica, di gran lunga la forma più frequente).
2. Distrofia dei coni – bastoncelli, inversa.

3. Retinite pigmentosa settoriale.
4. Retinite pigmentosa sine pigmento (forma senza pigmento).
5. Retinite pigmentosa unilaterale.
6. Amaurosi di Leber (forma che si verifica nei bambini piccoli).
7. Retinopatia puntiforme albescente (retinite puntiforme).
8. In combinazione con le altre patologie nelle sindromi e nelle malattie metaboliche come la mucopolisaccaroidosi, la sindrome di Fanconi, mucolipidosi IV, disordini perossisomali, sindome di Cockayne, miopatie mitocondriali, sindrome di Usher, lipofuscinosi neuronali, sindromi con deficit tubulari renali, ecc. La retinite pigmentosa si verifica quasi esclusivamente come distrofia dei coni, quindi le altre forme estremamente rare non sono discusse in questo trattato, tranne la forma inversa della retinite pigmentosa classica che viene presentata a scopo comparativo.
EREDITARIETÀ: forme genetiche individuali possono essere identificate tra gruppi eterogenei di patologie comprendenti la retinite pigmentosa. Questo gruppo di patologie può coinvolgere vari genotipi così come vari fenotipi essere espressione di stadi differenti di una patologia con un unico specifico genotipo. Esistono oltre 15 forme puramente oculari di retinite pigmentosa. La più comune forma di ereditarietà è autosomica–recessiva (60%), seguita dalla forma autosomica–dominante (oltre il 25%), e una X – linked (15%). Sono state anche descritte mutazioni nel gene della rodopsina (cromosoma 3) e “degenerazioni retiniche lente” (RTS) (cromosoma 6).
SINTOMI: sintomi iniziali di retinite pigmentosa includono bagliori, cecità notturna, difetti progressivi del campo visivo e deficit nella visione dei colori; l’età in cui si manifesta dipende dal tipo di ereditarietà.
SEGNI E CONSIDERAZIONI DIAGNOSTICHE: la diagnosi è fatta con l’esame oftalmoscopico in base a un quadro classico e viene confermata con gli esami strumentali specifici (campo visivo ed esami elettrofuzionali).
DISTROFIA DEI BASTONCELLI – CONI (i bastoncelli sono colpiti prima). All’esame oftalmoscopico nella media periferia retinica si osservano proliferazioni dell’epitelio pigmentato retinico sotto forma di spicole ossee che si diffondono gradualmente verso il centro e più perifericamente. Deficit precoci comprendono difetti nella visione dei colori e disturbi nella percezione del contrasto. Negli stadi avanzati si verificherà atrofia del nervo ottico, distinguibile come una papilla gialla cerea. Le arterie appariranno ridotte di calibro, e il riflesso del fondo sarà estremamente mutato. Il
9 - Vitreo e retina
paziente mostrerà una buona acuità visiva anche per lungo tempo ma tipicamente con perdita progressiva del campo visivo periferico.
DISTROFIA DEI CONI – BASTONCELLI (in questo caso sono colpiti prima i coni). In questo caso c’è una precoce perdita dell’acuità visiva con graduale e progressiva perdita di campo visivo. In entrambe le forme di RP la diagnosi è confermata tramite l’elettroretinografia. La risposta alla luce nell’elettroretinogramma (ERG) sarà nettamente ridotta o assente già all’esordio della patologia.
DIAGNOSI DIFFERENZIALE: nella diagnosi differenziale devono essere tenuti presenti tutti quei cambiamenti collettivi riferiti come pseudoretinite pigmentosa, dato che essi simulano il quadro clinico della RP. Le cause più comuni che dovrebbero essere escluse in questo caso sono: – Cambiamenti post-traumatici.
– Cambiamenti post-infiammatori o post-infettivi. Questi potrebbero includere malattie epiteliali degenerative del pigmento retinico secondarie alla rosolia con fondo “sale e pepe” di aree puntiformi di atrofia e proliferazione dell’epitelio pigmentato retinico. Altre cause comprendono la sifilide, che si può presentare con lesioni placoidi di atrofia del pigmento epiteliale e proliferazioni.
– Tumori.
– Medicamenti come la clorochina, myambutolo (etambutolo), e tioridazina.
TERAPIA: non esistono cure per le cause della malattia, ma lenti con bordi filtrati (occhiali con lenti colorate che escludono alcune lunghezze d’onda) e ausili d’ingrandimento per la visione da vicino possono aiutare il paziente ad un miglior utilizzo della visione residua.
DECORSO CLINICO E PROGNOSI: la retinite pigmentosa è clinicamente progressiva, il decorso clinico dipende dalla specifica forma della malattia e dai follow– up di controllo che si effettuano da un bravo oculista che si occupa di retina; le forme severe conducono a cecità.
Malattia di Stargardt
DEFINIZIONE: è una distrofia maculare che si sviluppa dall’epitelio pigmentato retinico.
EREDITARIETÀ: patologia autosomica recessiva.
EPIDEMIOLOGIA E SINTOMI: la malattia di Stargardt è rara; si verifica una progressiva perdita dell’acuità visiva tra i 10 e i 20 anni.
SEGNI E CONSIDERAZIONI DIAGNOSTICHE: i segni iniziali sono lievi con presenza
di “macchioline” bianche nella regione maculare, che potrebbe verificarsi in combinazione con lesioni dell’intero fondo oculare (fondo flavimaculato). L’elettroretinogramma e l’elettro-oculogramma saranno normali o ridotti; nello stadio tardivo, le lesioni bianche aumentano significativamente in dimensione e nel numero ma ciò non si ripercuoterà necessariamente sull’ERG o sull’EOG.

DIAGNOSI DIFFERENZIALE: altre patologie che comportano lesioni bianche a “macchioline” come le drusen ereditarie autosomiche dominanti devono essere escluse con l’oftalmoscopia. La diagnosi è confermata tramite l’angiografia con fluoresceina e con l’OCT. Il blocco della fluoresceina coroideale è un segno caratteristico della malattia di Stargardt.
TERAPIA: come sopra; è inoltre indicato un esame dei fratelli e una consulenza genetica.
DECORSO CLINICO E PROGNOSI: la patologia è cronicamente progressiva, la vista negli stadi finali è di solito di 0.1 (1/100) o meno.
Distrofia Vitelliforme di Best
EPIDEMIOLOGIA: la patologia è rara con un’incidenza simile alla malattia di Stargardt.
EREDITARIETÀ: la patologia è ereditata in modo autosomico dominante con penetranza ed espressività variabile; il locus genetico è sul cromosoma 11 (11q13).
SINTOMI: le manifestazioni cliniche si verificano tra i 5 e i 15 anni. Inizialmente c’è una lieve diminuzione soggettiva dell’acuità visiva. Negli stadi tardivi della patologia, la vista è ridotta fino a circa 1/100.
SEGNI E CONSIDERAZIONI DIAGNOSTICHE: una caratteristica tipica di questa forma di distrofia maculare è che l’acuità visiva è trascurabilmente diminuita all’esordio, tuttavia i segni morfologici sono rimarchevoli. L’oftalmoscopia rivelerà un anello giallastro di lesioni vitelliformi nella regione maculare che hanno l’aspetto di un tuorlo d’uovo fritto (il termine latino vitellus significa tuorlo d’uovo). Di solito queste lesioni sono bilaterali e simmetriche, tuttavia possono verificarsi anche lesioni eccentriche.
DIAGNOSI DIFFERENZIALE: la diagnosi si basa di solito sul quadro oftalmoscopico e la conferma è data dalla risposta molto ridotta o assente alla luce nell’EOG ed un ERG normale.
PROFILASSI: è indicato un esame dei fratelli e un consulto genetico.
DECORSO CLINICO E PROGNOSI: è più favorevole rispetto alla malattia di Star-
9 - Vitreo e retina
gardt. La patologia è cronicamente progressiva; l’acuità visiva nell’occhio migliore di solito resta di circa 1/20 e di solito una successiva perdita dell’acuità visiva si può verificare come risultato di una neovascolarizzazione sottoretinica.
9.8 Patologie retiniche degenerative
Distacco di retina
DEFINIZIONE: nel distacco la retina neurosensoriale si separa dal sottostante epitelio pigmentato retinico, al quale di solito è debolmente attaccata. Può essere classificato in quattro tipi:
– Il distacco di retina primario o regmatogeno può verificarsi in seguito alla presenza di una soluzione di continuo come accade in una rottura retinica.
– Il distacco di retina secondario trazionale è il risultato di una trazione, per esempio vitreale, che esercita una forza trattiva sulla retina.
– Il distacco di retina secondario essudativo è causato da un fluido. Sangue, lipidi o siero si accumula tra la retina neurosensoriale e l’epitelio pigmentato; la malattia di Coats ne è un tipico esempio.
– Distacco di retina secondario solido o tumorale
Il distacco di retina primario di solito si verifica da una lacerazione; in casi rari il distacco di retina secondario può anche scaturire da una lacerazione causata da altri insulti o patologie ed una vitreoretinopatia proliferativa si sviluppa frequentemente da un distacco di retina cronico.
EPIDEMIOLOGIA: sebbene i distacchi di retina s’incontrino abbastanza raramente nella pratica oftalmologica, sono clinicamente molto significativi dato che possono causare cecità se non trattati immediatamente.
Distacco di retina regmatogeno (la forma più frequente)
Circa il 7% degli adulti ha una rottura retinica. L’incidenza di questo segno aumenta in età adulta tanto che il picco di incidenza è tra la quinta e la settima decade d’età. Ciò indica l’importanza del distacco posteriore di vitreo (separazione del corpo vitreo dallo strato superficiale della retina; anche questo legato all’età) come causa di distacco retinico. La prevalenza del distacco di retina nell’emmetropia (visione normale) è dello 0,2% in confronto al 7% in presenza di miopia severa superiore a meno di 10 diottrie.
Distacchi di retina essudativi, trattivi e legati a tumori che si manifestano meno frequentemente.
EZIOLOGIA: il distacco di retina regmatogeno si sviluppa da una rottura retinica preesistente. Solitamente questa rottura è localizzata in periferia, raramente sulla macula e i distinguono due tipi di rottura:
– Rotture circolari: una parte della retina è stata completamente strappata via a causa di un distacco posteriore di vitreo.
– Rotture a ferro di cavallo: la retina è solo debolmente strappata. Non tutte le rotture retiniche portano ad un distacco di retina, questo infatti si verifica solo nel momento in cui il corpo vitreo liquefatto si separa e l’umore vitreo penetra nella retina attraverso lo strappo. Il distacco di retina si verifica quando le forze di adesione non riescono più a contrastare questo processo. Le forze di trazione (forze tensive) del corpo vitreo (solitamente delle briglie vitreali) possono anche causare un distacco di retina con o senza sinchisi, in questo e in ogni altro tipo di distacco di retina, c’è un’interazione dinamica tra forze trattive e adesive. Se la retina si stacca dipende da quale di queste due forze è maggiore.
Distacco di retina trazionale

Origina da forze trattive esercitate sulla retina da briglie fibrovascolari (vedi vitreoretinopatia proliferativa) specialmente nelle patologie retiniche proliferative come la retinopatia diabetica.
Distacco di retina essudativo
La causa primaria di questo tipo di rottura della barriera ematoretinica esterna o interna è di solito la risultante di patologie vascolari come la malattia di Coats. Il fluido sottoretinico con o senza essudati si accumula tra la retina neurosensoriale e l’epitelio pigmentato retinico.
SINTOMI: il distacco di retina può restare asintomatico per lungo tempo; nello stadio del distacco acuto posteriore di vitreo, il paziente noterà dei lampi (fotopsie) e dei corpi mobili, punti neri che si muovono con lo sguardo. Il distacco posteriore di vitreo che causa degli strappi retinici può anche causare l’avulsione dei vasi retinici ed il sangue che ne provenie penetra nel corpo vitreo. Il paziente percepisce ciò come una “pioggia nera”- numerosi puntini neri che scendono.
Un altro sintomo è la comparsa di un’ombra scura nel campo visivo che accade quando la retina si distacca: il paziente percepisce una tenda che scende o un muro che si innalza, a seconda che il distacco sia superiore o inferiore. Una rottura nel
centro della retina si manifesterà con un’improvvisa e significativa perdita dell’acuità visiva con metamorfopsie (distorsione delle immagini) se è coinvolta la macula. Se il paziente vede lampi luminosi o ombre è necessario un esame oculistico immediato per escludere un distacco di retina.
CONSIDERAZIONI DIAGNOSTICHE: la lesione è diagnosticata tramite un esame oftalmoscopico del fondo con pupilla dilatata. La retina staccata si presenterà bianca ed edematosa e perderà la sua trasparenza, l’oftalmoscopio mostrerà un distacco di retina bolloso; nel distacco di retina regmatogeno sarà inoltre visibile una rottura retinica rosso brillante. Le lacerazioni nel distacco di retina regmatogeno di solito si verificano nella metà superiore della retina in una regione di degenerazione equatoriale. Nel distacco di retina trazionale il distacco bolloso sarà accompagnato da briglie vitreali grigie preretiniche. Nel distacco di retina essudativo si osserverà il quadro tipico del distacco sieroso e sarà generalmente accompagnato da abbondanti depositi grassi e spesso da sanguinamento intraretinico. Il distacco di retina connesso a tumore (come può accadere nel melanoma ma- ligno) può causare un distacco di retina secondario intorno al tumore o a distanza da esso nella retina periferica inferiore. Un distacco di retina inferiore che si verifica a distanza dal tumore è indice di malignità del tumore stesso.
TERAPIA: le rotture retiniche con minimi distacchi retinici circolari possono esse- re trattate mediante coagulazione argon laser. La retina circostante la rottura viene fusa al tessuto sottostante mentre la rottura stessa viene lasciata aperta. Le cicatrici prodotte dalla terapia argon laser sono sufficienti per prevenire altri ulteriori distacchi di retina. I distacchi di retina possono essere divisi in macula on se non coinvolgono la macula oppure in macula off se la macula è distaccata. Per risolvere il distacco di retina è necessario chiudere la rottura alcuni vengono trattati tramite tamponamento retinico con gas o gel di silicone (ab interno) altro approccio definito “ab externo” prevede l’apposizione di un cerchiaggio all’esterno della sclera, che viene ancorato e suturato alla superficie più esterna della sclera. Ciò indenta la parete del globo oculare fino alla rottura retinica e porta la porzione della retina dove è situata la rottura in contatto con l’epitelio pigmentato retinico, la zona della rottura viene sottoposta a trattamento criogenico con sonde espansive a CO2 venendo così creata una cicatrice artificiale per stabilizzare i contatti ristabiliti tra la retina neurosensoriale e l’epitelio pigmentato retinico. Dopo un intervento riuscito, questa cicatrice previene la recidiva del distacco retinico e quando ci sono diverse rotture retiniche o la rottura non può essere localizzata, viene applicato al globo oculare un Piombaggio in silicone con una particolare procedura associato a introduzione di gas (pneumoretinopessia). Le
procedure finora descritte, sono applicate a distacchi retinici non complicati come per es. senza vitreoretinopatia proliferativa.
PROFILASSI: pazienti a rischio oltre i 40 anni con anamnesi familiare positiva e miopia severa dovrebbero essere regolarmente esaminati dall’oftalmologo, possibil- mente una volta l’anno.
DECORSO CLINICO E PROGNOSI: circa il 95% dei distacchi retinici regmatogeni può essere trattato con successo tramite la chirurgia, nel caso in cui sia presente un coinvolgimento maculare (es. il distacco iniziale coinvolge la macula) rimarrà una perdita dell’acuità visiva. La prognosi per le altre forme di distacco retinico è di solito infausta ed essi sono spesso associati con una significativa perdita dell’acuità visiva. In più del 20% dei pazienti un distacco di retina si verifica anche nell’altro occhio e deve essere comunque esclusa la presenza di una rottura retinica nell’altro occhio.
Retinoschisi degenerativa
DEFINIZIONE: rottura frequentemente bilaterale nello strato più interno o più esterno della retina, la rottura è frequentemente a livello dello strato plessiforme esterno.

EPIDEMIOLOGIA: circa il 25% della popolazione generale ha la retinoschisi e la tendenza aumenta con l’età.
SINTOMI: la retinoschisi è inizialmente asintomatica, il paziente di solito nota una riduzione dell’acuità visiva e vede ombre solo nel punto in cui la rottura è severa e si estende al polo posteriore.
CONSIDERAZIONI DIAGNOSTICHE: l’esame oftalmoscopico rivelerà la separazione bollosa della rottura dello strato interno della retina; la superficie più interna appare come un metallo battuto e raramente la rottura si verifica nello strato interno ed esterno.
DIAGNOSI DIFFERENZIALE: dovrebbe essere escluso il distacco retinico regmatogeno. L’oftalmoscopia rivelerà una rottura continua nella retina all’interno di un distacco retinico e la retina non apparirà trasparente come nelle retinoschisi. Tuttavia, le rotture retiniche possono anche verificarsi nella retinoschisi; nello strato interno della retina, queste rotture saranno molto piccole e difficilmente distinguibili mentre nello strato esterno saranno molto larghe. Un completo distacco retinico regmatogeno può verificarsi nella retinoschisi solamente quando c’è una rottura di entrambi gli strati.
TERAPIA: di solito non è richiesta terapia, i rari casi in cui si verifica il distacco della retina sono trattati chirurgicamente utilizzando le procedure standard per il distacco di retina.
Le retinoschisi degenerative si differenziano dal distacco retinico per il fatto che di solito non richiedono trattamento.
DECORSO CLINICO E PROGNOSI: la prognosi per la retinoschisi degenerativa è molto buona, le rotture progressive della retina o il distacco di retina con successiva riduzione dell’acuità visiva sono evenienze rare.
Degenerazioni retiniche periferiche
DEFINIZIONE: il termine degenerazioni retiniche periferiche si riferisce a cambiamenti degenerativi che si trovano paralleli all’ora serrata nelle aree periferiche della retina. Questi sono essenzialmente di due tipi:
– modificazioni retiniche innocue come cisti della pars plana del corpo ciliare posteriore o atrofia periferica corioretinica (degenerazione ad acciottolato);
– precursori del distacco retinico come il locale assottigliamento della retina che si verifica nelle degenerazioni a bava di lumaca e a lattice.
EPIDEMIOLOGIA: la prevalenza delle lesioni è del 6-10% e la patogenesi è sconosciuta.
SINTOMI: le degenerazioni retiniche periferiche sono asintomatiche.
CONSIDERAZIONI DIAGNOSTICHE: la diagnosi viene effettuata in base ad esame oftalmoscopico della periferia retinica con pupilla dilatata, la retina può essere esaminata tramite oftalmoscopia binoculare indiretta o usando una lente a tre specchi. Le degenerazioni ad acciottolato appaiono come aree nettamente biancastre e definite di atrofia retinica estesa dell’epitelio pigmentato e della coriocapillare che giacciono tra l’ora serrata e l’equatore. Le degenerazioni a bava di lumaca si presentano con puntini giallo–biancastri che consistono di microglia e astrociti. Le degenerazio ni a lattice si presentano come aree assottigliate con vasi biancastri sclerotici, queste si traducono in una atrofia focale reattiva e in un’ipertrofia dell’epitelio pigmentato retinico nella regione di degenerazione equatoriale e in una liquefazione del corpo vitreo sovrastante.
DIAGNOSI DIFFERENZIALE: i segni sono altamente caratteristici e facilmente diagnosticabili clinicamente; raramente i processi vascolari o i cambiamenti infiammatori e le cicatrici causate da altro devono essere considerati nella diagnosi differenziale.
TERAPIA: la terapia non è richiesta o non è raccomandata dal momento che la terapia laser non riduce il rischio di distacco retinico; esami oftalmoscopici di controllo dovrebbero essere eseguiti ad intervalli regolari.
DECORSO CLINICO E PROGNOSI: è solitamente benigno, le rotture retiniche atro-
fiche a cerchio possono formare delle aree di degenerazione a bava di lumaca o a lattice; tuttavia, il rischio a lungo termine di un distacco retinico è dell’1%.

Corioretinopatia sierosa centrale
DEFINIZIONE: distacco sieroso della retina e/o dell’epitelio pigmentato retinico.

EZIOLOGIA: il distacco retinico si verifica attraverso un difetto della barriera ematoretinica esterna a livello delle “giunzioni strette” dell’epitelio pigmentato retini- co; potrebbero essere coinvolti fattori locali collegati a stress fisici o psicologici.
EPIDEMIOLOGIA: la patologia interessa principalmente gli uomini nella terza e quinta decade di vita.
SINTOMI: i pazienti si presentano con una perdita dell’acuità visiva, uno scotoma centrale relativo (punto nero), distorsione dell’immagine (metamorfopsia), o percezione degli oggetti più larghi o più piccoli di come sono realmente (macropsia o micropsia).
CONSIDERAZIONI DIAGNOSTICHE: l’oftalmoscopia rivelerà un distacco retinico sieroso, di solito maculare. Nei casi cronici si svilupperà una cicatrice di pigmento epiteliale finemente marrone e bianca nel punto di fuoriuscita del fluido. Il rigonfiamento della retina centrale accorcia l’asse visivo e produce ipermetropia.
Il punto della fuoriuscita può essere evidenziato durante la fase attiva con l’aiuto dell’angiografia con fluoresceina.
TERAPIA: di solito non è richiesto alcun trattamento per la prima apparizione della patologia. Il rigonfiamento retinico si risolve spontaneamente entro poche settimane; le recidive possono essere trattate con la terapia laser a patto che la fuoriuscita
9 - Vitreo e retina
di liquido si trovi al di fuori della fovea centrale. La terapia corticosteroidea è controindicata poiché essa stessa può causare lo sviluppo di una corioretinopatia sierosa centrale in casi rari.
DECORSO CLINICO E PROGNOSI: la prognosi è solitamente buona, tuttavia le recidive delle forme croniche possono causare una perdita dell’acuità visiva permanente. Fattori locali legati allo stress e gli steroidi possono provocare un edema maculare in pazienti predisposti.
Degenerazione maculare legata all’età
DEFINIZIONE: degenerazione progressiva della macula nei pazienti anziani.
EPIDEMIOLOGIA: la degenerazione maculare legata all’età (AMD) è la più frequente causa di cecità nei pazienti oltre i 65 anni, il rischio per i pazienti oltre gli 85 anni ed oltre è dell’11-18.5% e la condizione colpisce indistintamente uomini e donne. L’AMD è più rara negli individui neri.
PATOGENESI: è stata confermata una predisposizione genetica con una mutazione nel gene ABCR (braccio corto del cromosoma 1). I fattori di rischio includono il fumo e l’esposizione prolungata alla luce del sole. I meccanismi più importanti sono i processi d’invecchiamento a carico dell’epitelio pigmentato retinico, il quale è post mitotico e ha una limitata capacità rigenerativa (la retina e l’epitelio pigmentato retinico sono tanto vecchi quanto il paziente). La degradazione del segmento esterno dei dischi fotorecettoriali genera materiali ricchi di lipidi che si accumulano nell’EPR insieme al materiale del segmento esterno e ai detriti metabolici, questo porta ad un aumento della disfunzione e causa un disturbo alla perfusione della coroide. Presumibilmente come conseguenza dell’ipossia tissutale viene prodotto il fattore di crescita vascolare endoteliale (VEGF) che sostanzialmente contribuisce alla sviluppo della forma tardiva neovascolare dell’AMD.
SINTOMI: i pazienti notano una perdita dell’acuità visiva; nella forma neovasco- lare nella quale è presente edema maculare, i pazienti si lamentano per la distorsione delle immagini (metamorfopsia), macropsia, o micropsia ed improvvisa perdita della vista. Sono inoltre disturbate la sensibilità al contrasto e la visione dei colori.
SEGNI E CONSIDERAZIONI DIAGNOSTICHE: all’oftalmoscopio si possono distinguere uno stadio precoce ed uno tardivo. Nello stadio tardivo dell’AMD in circa il 20% dei pazienti si può sviluppare neovascolarizzazione: fluido sieroso, lipidi e sangue si insinuano attraverso la parete insufficiente dei nuovi vasi. Infine, nello stadio finale si sviluppa una cicatrice fibrovascolare che porta ad una severa perdita visiva e a volte alla cecità nel 90% dei pazienti.
La diagnosi di AMD viene fatta tramite l’oftalmoscopia binoculare con pupilla dilatata e la stadiazione dell’AMD viene seguita tramite l’esame OCT ed angio OCT, in alcuni casi resta necessario effettuare ll’angiografia con fluoresceina. L’angiografia con il verde d’indocianina può fornire ulteriori informazioni specialmente riguardo i cambiamenti coroideali. La decisione di eseguire o meno trattamento laser o iniezione intraoculare di anti-VEGF è presa in base ai risultati dell’angiografia con fluoresceina
DIAGNOSI DIFFERENZIALE: altre patologie vascolari retiniche, come l’occlusione di branca della vena retinica dovrebbero essere escluse con l’oftalmoscopia. Il melanoma maligno dovrebbe essere escluso tramite studi con gli ultrasuoni.
TERAPIA:
Terapia farmacologica. Non è ancora disponibile un trattamento farmacologico sistemico tuttavia, lo studio “Age-Related Eye Disease” (ARED) ed il “Lutein Antioxidant Supplementation Trial” (LAST) hanno scoperto l’evidenza che un supplemento di antiossidanti ha un effetto benefico sulla progressione dell’AMD e sull’acuità visiva. Un’altra ricerca sta continuando su questa materia.
– Terapia con agenti inibenti il VEGF: rappresenta oggi il gold standard del trattamento dell’AMD avendo ridotto del 75% l’incidenza di cecità della malattia, si utilizzano anticorpi monoclonali o frammenti di esso (bevacizumab e ranimizumab) o inibitori del recettore (aflibercept e brolucizumab). Da poco è stato introdotto in terapia con ottimi risultati un anticorpo che inibisce più fattori di crescita (faricimab).
– Terapia laser. Nella fine dell’ultimo secolo è stata proposta all’ultimo stadio essudativo, le membrane coroideali neovascolari dovrebbero essere trattate con laser termico se sono localizzate in zona iuxtafoveale o extrafoveale e se la neovascolarizzazione può essere visualizzata tramite angiografia con fluoresceina (nota come neovascolarizzazione neocoroideale classica). Nella neovascolarizzazione coroideale occulta, i vasi non possono essere visti sull’angiografia e quindi non possono essere trattati con il laser. Lo svantaggio del trattamento laser è un tasso di recidiva del 39-76% entro 2 anni dopo la terapia laser, nel momento in cui la membrana neovascolare non è del tutto disattivata.

DECORSO CLINICO E PROGNOSI: il decorso della patologia è cronico e porta ad una progressiva perdita dell’acuità visiva. Fattori di rischio sono drusen morbide, larghe e confluenti, iperpigmentazione foveale e ipertensione arteriosa. Il 40% dei pazienti con neovascolarizzazione coroideale sviluppano AMD neovascolare nel secondo occhio.
La terapia laser può essere eseguita nello stadio essudativo della AMD nel 10% dei pazienti, purchè la patologia sia diagnosticata precocemente.
9 - Vitreo e retina
Miopia degenerativa
DEFINIZIONE ED EPIDEMIOLOGIA: il fondo oculare nella miopia degenerativa è caratterizzato da anormale atrofia corioretinica ed è un evento abbastanza raro.
PATOGENESI: l’atrofia di solito si verifica in presenza di miopia severa oltre le 6 diottrie. Le cause includono stiramento retinico, della coroide, e della membrana di Bruch dovuti all’allungamento del bulbo oculare nella miopia assiale e la perdita dell’acuità visiva si verifica quando c’è coinvolgimento maculare.
SEGNI E CONSIDERAZIONI DIAGNOSTICHE: i tipici segni includono atrofia corioretinica intorno al disco ottico e al polo posteriore e difetti della membrana di Bruch conosciuti come crepe di latta. Queste rotture possono causare aperture per le infiltrazioni vascolari con il risultato di una neovascolarizzazione subretinica che può condurre all’edema retinico e al sanguinamento (punti neri di Fuch); lo stadio finale della patologia è caratterizzato da una cicatrice disciforme. La diagnosi si effettua con l’oftalmoscopia e l’angiografia con fluoresceina è indicata nei casi in cui sia sospetta una neovascolarizzazione subretinica.
DIAGNOSI DIFFERENZIALE: le cicatrici coroideali e le strie angioidi (rotture della membrana di Bruch) nello pseudoxantoma elastico devono essere escluse dall’oftalmoscopia e la diagnosi è inequivocabile quando è presente miopia.
TERAPIA: le cause della malattia non possono essere trattate, è importante correggere la miopia in modo ottimale con occhiali o lenti a contatto per scongiurare la promozione di una progressione della patologia. La neovascolarizzazione sottoretinica al di fuori della fovea o vicina ai suoi confini può essere trattata tramite fotocoagula- zione laser. Terapia con agenti inibenti il VEGF: rappresenta oggi il gold standard del trattamento della maculopatia miopica avendo ridotto del 90% l’incidenza di cecità della malattia, si utilizzano anticorpi monoclonali o frammenti di esso (bevacizumab e ranimizumab) o inibitori del recettore (aflibercept e brolucizumab). Da poco è stato introdotto in terapia con ottimi risultati un anticorpo che inibisce più fattori di crescita (faricimab).
DECORSO CLINICO E PROGNOSI: la miopia progressiva cronica si tradurrà in un aumento di perdita dell’acuità visiva; la prognosi per la neovascolarizzazione sottoretinica è scarsa. L’incidenza di distacco retinico negli occhi miopi è più elevata.
9.9 Retinopatia della prematurità (ROP)
DEFINIZIONE: patologia retinica attribuibile ad un anomalo sviluppo della va- scolarizzazione retinica nei neonati pretermine con un peso alla nascita minore di 2500 g.
EPIDEMIOLOGIA: la patologia è rara, i neonati con un peso alla nascita al di sotto
dei 1000 g hanno un rischio maggiore di sviluppare la malattia. La retinopatia dei prematuri non è sempre prevenibile nonostante un monitoraggio stretto e ottimale della pressione parziale di ossigeno.
EZIOLOGIA: la nascita pretermine e l’esposizione all’ossigeno altera il normale sviluppo della vascolarizzazione retinica, si verifica pertanto un’obliterazione dei vasi seguita da neovascolarizzazione proliferativa. Questo può causare un’emorragia vitreale, distacco di retina e, nell’ultimo stadio cicatriziale, fibroplasia lenticolare non appena i vasi ed il tessuto connettivo si fondono con la retina staccata.

SEGNI E SINTOMI: dopo un iniziale decorso clinico asintomatico, le emorragie vitreali e il distacco di retina saranno accompagnati da strabismo secondario e può verificarsi leucocoria nello stadio della fibroplasia retrolenticolare. Come solitamente accade in oftalmologia, l’estensione delle rispettive alterazioni è specificata in analogia con il quadrante di un orologio: per esempio, si può dire che una linea di demarcazione ha un’estensione dalla posizione ore 1 ad ore 6. Un’ulteriore fase mostra una vascolarizzazione del polo posteriore dilatata e tortuosa in aggiunta alle altre modificazioni.
CONSIDERAZIONI DIAGNOSTICHE: la retina dovrebbe essere esaminata in midriasi al più tardi 4 settimane dopo la nascita. Ciò dovrebbe essere eseguito come parte degli esami di routine previsti per i neonati e controlli di follow–up dipenderanno dal grado di vascolarizzazione retinica.
DIAGNOSI DIFFERENZIALE: bisogna considerate le altre cause di leucocoria come il retinoblatoma o la cataratta.
TERAPIA: la chirurgia si dimostra raramente efficace negli stadi 4 e 5, nel terzo stadio si esegue la fotocoagulazione o la crioterapia nelle aree retiniche non vascolarizzate. Anche in questo caso è stata proposta la Terapia con agenti inibenti il VEGF: oggi non rappresenta ancora il gold standard ma l’incidenza di cecità della malattia si è ridotta, si utilizzano anticorpi monoclonali o frammenti di esso (bevacizumab e ranimizumab) o inibitori del recettore (aflibercept). Da poco è stato introdotto in terapia con ottimi risultati un anticorpo che inibisce più fattori di crescita (faricimab) con risultati promettenti.
PROFILASSI: la pressione parziale dell’ossigeno dovrebbe essere mantenuta il più bassa possibile e dovrebbe essere eseguito un controllo oculistico: la scoperta precoce della retinopatia dei prematuri è particolarmente importante.
DECORSO CLINICO E PROGNOSI: lo stadio 1 e lo stadio 2 della retinopatia si risolve spontaneamente nell’85% dei bambini affetti.
9 - Vitreo e retina
9.10 Retinopatia tossica
DEFINIZIONE: alterazioni retiniche causate dall’uso di medicamenti
PATOGENESI: la retinopatia tossica può rimanere asintomatica per lungo tempo, la perdita di acuità visiva si verifica se è coinvolta la macula. L’uso di clorochina in dosi eccedenti i 250 g causa danno retinico; inizialmente può verificarsi edema maculare mentre più tardi si sviluppano alterazioni puntate del pigmento epiteliale, le quali possono progredire in bolle di maculopatia con anelli concentrici di ipopigmentazione e iperpigmentazione nella regione maculare. Questi segni sono di solito bilaterali e simmetrici.
CONSIDERAZIONI DIAGNOSTICHE: la diagnosi è fatta in base all’oftalmoscopia binoculare in midriasi e confermata da studi elettrofisiologici che includono l’elettroretinogramma, elettro-oculogramma e i potenziali evocati visivi e la microperimetria
DIAGNOSI DIFFERENZIALE: il pigmento retinico epiteliale o il sanguinamento della retina possono derivare da molte altre patologie retiniche e può anche essere associato con patologie sottostanti per le quali sono stati prescritti i farmaci.
TERAPIA: la terapia farmacologica dovrebbe essere interrotta se possibile.
PROFILASSI: esami oftalmologici di controllo regolari sono indicati prima e durante il trattamento che implica l’uso di farmaci con effetti collaterali noti oculari.
DECORSO CLINICO E PROGNOSI: il decorso clinico dipende dalla specifica medicazione e dalla sua dose; i segni possono migliorare dopo che il farmaco viene interrotto. Tuttavia, con la clorochina in particolare i segni possono continuare a peggiorare anche dopo anni.
9.11 Retinite virale
DEFINIZIONE: patologia retinica causata da un’infezione virale molto rara.
PATOGENESI: l’infezione della retina e della struttura vascolare retinica è causata da citomegalovirus, herpes simplex, varicella-zoster o virus della rosolia e si verifica frequentemente in pazienti immunocompromessi.
SINTOMI: i pazienti riferiscono una perdita dell’acuità visiva e difetti del campo visivo.
CONSIDERAZIONI DIAGNOSTICHE: l’esame alla lampada a fessura rivelerà presenza di cellule nel corpo vitreo. Segni oftalmoscopici comprenderanno necrosi retinica con sanguinamento intraretinico. La necrosi si può verificare come una lesione acuta e coinvolgere tutta la retina entro pochi giorni, dopo la guarigione permane una vasta cicatrice.
Durante la gravidanza il virus della rosolia può causare un’embriopatia nel bambino.
L’esame oftalmologico rivelerà una tipica cicatrice pigmentata epiteliale granula- re nel fondo che è spesso associata ad una cataratta congenita; la diagnosi si conferma mediante misurazione del titolo virale sierico.
DIAGNOSI DIFFERENZIALE: l’uveite posteriore e la vasculite dovrebbero essere escluse, queste patologie possono essere distinte dalla retinite virale per l’assenza di necrosi.
TERAPIA: la patologia è trattata con alte dosi di un agente antivirale (aciclovir, ganciclovir o foscarnet) a seconda dello specifico patogeno in causa.
PROFILASSI: controlli oftalmologici sono indicati nei soggetti immunocompromessi con sospetta infezione virale.
DECORSO CLINICO E PROGNOSI: la retinite virale può essere fermata se diagnosticata precocemente, tuttavia le recidive sono frequenti nei pazienti immunocompromessi e la cecità di solito non può essere prevista nella sindrome necrotica retinica.
9.12 Retinite nella malattia di Lyme
DEFINIZIONE: infiammazione della retina causata di solito da Borrelia burgdoferi.
EPIDEMIOLOGIA: l’incidenza di questa patologia retinica è aumentata negli ultimi anni.
EZIOLOGIA: l’infiammazione è causata da spirochete che di solito si trasmettono tramite il morso di zecche.
SEGNI E SINTOMI: la malattia di Lyme può causare molte alterazioni infiammatorie oculari con i loro rispettivi sintomi che includono congiuntivite, cheratite ed iridociclite e sono state descritte anche vasculite retinica, occlusione dell’arteria retinica, neuroretinite, neurite ottica e coroidite. La malattia di Lyme dovrebbe essere esclusa come possibile causa di uveite posteriore di origine incerta.

CONSIDERAZIONI DIAGNOSTICHE: la diagnosi è fatta tramite oftalmoscopia e studi sierologici per identificare il patogeno.
TRATTAMENTO: è indicata una terapia antibiotica a base di tetraciclina, penicillina G, o cefalosporine di terza generazione.
DECORSO CLINICO E PROGNOSI: le alterazioni retiniche causate dalla malattia di Lyme tendono a recidivare.
9 - Vitreo e retina
9.13 Disordini parassitari retinici
DEFINIZIONE: l’infiammazione della retina è causata da infezioni con parassiti come Oncocerca Volvulus (il patogeno che causa l’oncocerhiasi), Toxocara canis o Toxocara cati (larve di nematodi che sono normalmente parassiti intestinali dei cani e dei gatti), Taenia solium (tenia del maiale) ed altri parassiti.
EPIDEMIOLOGIA: l’oncocerchiasi (come il tracoma e la lebbra) è una delle più frequenti cause di cecità in tutto il mondo, tuttavia come le altre parassitosi qui discusse, è rara in Europa e nel Nord America.
EZIOLOGIA:
– Oncocerca volvulus è trasmesso tramite il morso di mosche nere che per- mette alle larve (microfilarie) di penetrare la pelle e formare dei noduli fibrosi sottocutanei dove raggiungono la maturità e producono altre microfilarie che migrano nei circostanti tessuti. Il pericolo d’infiltrazioni oculari è particolarmente grande quando ci sono noduli fibrosi vicino all’occhio.
– Toxocara canis o Toxocara cati (le uova dei nematodi infestano cani e gatti) sono trasmessi agli esseri umani tramite ingestione di sostanze contaminate con le feci di questi animali. Le uova si schiudono nel tratto gastrointestinale dove ottengono l’accesso al sistema circolatorio e possono diffondersi attraverso tutto il corpo. La coroide può essere infestata in questo modo.
– Taenia solium: l’infestazione da tenia del maiale può verificarsi dall’ingestione di carni contaminate con larve o uova di tenia. Le tenie mature possono inoltre produrre uova nell’intestino e viaggiano attraverso il circolo ematico verso i vari organi potendo infettare anche l’occhio.
SINTOMI E CONSIDERAZIONI DIAGNOSTICHE: l’oftalmoscopia mostrerà la presenza di infiammazione intraoculare. L’oncocerchiasi si associa ad uveite posteriore così come la cheratite e l’irite. L’esame istologico dimostrerà microfilarie nella retina; le larve viscerali migranti Toxocara canis o catis possono causare complicanze come l’endoftalmite e il distacco retinico. Si possono verificare anche granulomi sottoretinici ed infiammazioni da larve della retina. Le larve di differenti specie di vermi possono causare neuroretinite unilaterale diffusa subacuta con il tipico quadro clinico di lesioni focali intraretiniche e sottoretiniche bianco–grigiastre; le larve delle mosche possono anche invadere lo spazio sottoretinico nell’oftalmomiasi.
TERAPIA: è indicata la fotocoagulazione laser o la rimozione chirurgica delle larve dei vermi.
DECORSO CLINICO E PROGNOSI: non è infrequente che queste patologie conducano alla cecità.
9.14 Tumori retinici ed amartomi
Retinoblastoma
DEFINIZIONE ED EPIDEMIOLOGIA: il retinoblastoma è un tumore maligno dell’infanzia che si sviluppa da cellule retiniche immature; è il più comune tumore maligno oculare dei bambini che si verifica in circa uno su 20.000 nati e nel 30% dei casi, è bilaterale.
PATOGENESI: nel 95% dei pazienti è presente una mutazione somatica (es. alterazioni del cromosoma 13) nei restanti vi è una trasmissione autosomico – dominante (in questo caso i fratelli del bambino affetto dovrebbero essere esaminati regolarmente da un oftalmologo).
SINTOMI: il retinoblastoma si manifesta prima dei 3 anni nel 90% dei bambini - affetti; solitamente i genitori osservano leucocoria (pupilla bianco–giallastra) nel 60% dei casi, strabismo nel 20% e occhio arrossato nel 10% dei casi; il pediatra dovrebbe effettuare un controllo del riflesso rosso retinico di routine in tutti i bimbi molto piccoli. E ogni bambino che si presenta con strabismo dovrebbe essere sottoposto ad esame del fondo con pupilla dilatata per escludere questo tumore.

SEGNI E CONSIDERAZIONI DIAGNOSTICHE: all’esame oftalmoscopico appare come una formazione retinica bianca–grigiastra e vascolarizzata. Nelle forme più avanzate si possono osservare infiltrazioni del corpo vitreo, della camera anteriore (pseudoipopion) e dell’orbita. Un retinoblastoma può anche coinvolgere l’occhio controlaterale e la ghiandola pineale ed in questo caso viene detto retinoblastoma trilaterale. In questi tumori si verificano frequentemente calcificazioni ed immagini radiografiche o di tomografia computerizzata possono aiutare a confermare la diagnosi.
DIAGNOSI DIFFERENZIALE. Sono da escludere altre patologie come:
– cataratta (in presenza di leucocoria),
– strabismo primario (in presenza di strabismo),
– infezioni (in presenza di occhio rosso),
– il distacco della retina,
– la persistenza di vitreo primitivo iperplastico,
– la malattia di Coats.
TERAPIA: i tumori con dimensioni minori di quattro diametri pupillari possono essere gestiti con terapia radiante trasmessa da placche di rutenio o iodino radioattivo (brachiterapia) e mediante crioterapia; i tumori più estesi richiedono l’enucleazione dell’occhio.
9 - Vitreo e retina
PROFILASSI: l’occhio controlaterale dovrebbe essere esaminato in midriasi ogni 3 mesi per 5 anni, quindi l’esame di follow–up può essere eseguito ad intervalli più lunghi.
DECORSO CLINICO E PROGNOSI: se non trattato il retinoblastoma può metastatizzare al cervello e causare la morte, i piccoli pazienti frequentemente sviluppano un tumore maligno secondario come l’osteosarcoma.
Astrocitoma
DEFINIZIONE: l’astrocitoma o amartoma degli astrociti è un tumore benigno che si sviluppa dagli astrociti del tessuto neurogliale ed è molto raro.
EZIOLOGIA: l’astrocitoma appartiene alle facomatosi ed è presumibilmente una patologia congenita che si sviluppa dallo strato delle fibre ottiche nervose; si manifesta solitamente solo a livello oculare o in associazione con la sclerosi tuberosa (malattia di Bourneville).
SINTOMI: i pazienti solitamente non riferiscono sintomi oculari. L’amartoma astrocitario calcificato nella regione dei gangli basali o nei ventricoli può causare epilessia e ritardo mentale. Un astrocitoma nella malattia di Bourneville sarà tipicamente associato ad adenoma sebaceo della cute del volto.
SEGNI E CONSIDERAZIONI DIAGNOSTICHE: gli astrocitomi possono essere dei reperti occasionali in esami oftalmologici eseguiti per altre ragioni, oppure vengono diagnosticati in pazienti che lamentano riduzione dell’acuità visiva; l’olftalmoscopia rivelerà la presenza di tumori singoli o multipli “mulberry” delle dimensioni di uno o due diametri papillari che appaiono bianchi e spesso calcificati. I tumori sono intrinsecamente fluorescenti quando osservati con luce blu durante fluorangiografia con filtro blu.
DIAGNOSI DIFFERENZIALE: il retinoblastoma dovrebbe essere escluso nei bambini anche perché all’esame olftalmoscopico è solitamente più esteso di un astrocitoma, mentre un possibile granuloma da Toxocara canis deve essere investigato tramite studi sierologici.
TERAPIA: non è richiesto alcun trattamento oculistico ma il paziente deve essere inviato dal neurologo per escludere un coinvolgimento cerebrale.
DECORSO CLINICO E PROGNOSI: raramente questi tumori aumentano di dimensioni.
Emangioma
DEFINIZIONE: l’emangioma capillare o emangioblastoma si reperta nel caso di una retina angiomatosa (malattia di von Hippel–Lindau).
EZIOLOGIA: sono alterazioni benigne congenite; potrebbe sussistere una eredità autosomico–dominante.
SINTOMI: il soggetto ravvisa disturbo o perdita dell’acuità visiva nel caso di distacco di retina.
SEGNI E CONSIDERAZIONI DIAGNOSTICHE: gli emangiomi retinici sono caratterizzati da arterie e vene tortuose e ispessite; nel 50 % dei pazienti le alterazioni sono bilaterali.
DIAGNOSI DIFFERENZIALE: deve essere effettuata con Malattia di Coats, emangiomi retinici di branca nella sindrome di Wyburn–Mason ed emangiomi cavernosi, così come emangioma cerebrale, cisti renale, ipernefroma, e feocromocitoma.
TERAPIA: l’emangioma retinico può essere trattato con terapia laser o criocauterizzazione; tuttavia un distacco retinico essudativo si svilupperà dal momento in cui il trattamento aumenta tale rischio.
DECORSO CLINICO E PROGNOSI: la malattia è gradualmente progressiva; la prognosi per l’acuità visiva è scarsa nel momento in cui si sviluppa un distacco retinico.

10 GLAUCOMA
10.1 Definizione e classificazione
Il termine “glaucoma” comprende diverse patologie con differenti eziologie che hanno in comune lo stesso segno patognomonico: caratteristiche alterazioni del nervo ottico associate ad uno specifico pattern di alterazioni del campo visivo Questa malattia è spesso, ma non sempre, associata ad un aumento della pressione intraoculare (IOP) e lo stadio finale di questa malattia può giungere sino alla cecità.

Epidemiologia
Nel mondo ci sono circa 70 milioni di soggetti affetti da glaucoma e 7 milioni ne sono stati resi ciechi. Il glaucoma è la seconda causa più frequente di cecità nei paesi in via di sviluppo dopo il diabete mellito e circa il 20 - 25% delle persone cieche ha perso la propria vista a causa del glaucoma. Pertanto la diagnosi precoce di glaucoma è una delle più alte priorità per la salute pubblica.
Fisiologia e fisiopatologia della circolazione dell’umore acqueo La pressione media intraoculare di 15 mmHg negli adulti è significativamente più alta della pressione media tissutale in quasi tutti gli altri organi del corpo, questa pressione elevata è importante per assicurare:
– curvatura uniformemente liscia della superficie corneale;
– distanza costante tra cornea, cristallino e retina;
– uniforme allineamento dei fotorecettori retinici e dell’epitelio pigmentato retinico alla membrana di Bruch che normalmente è liscia e stirata.
L’umore acqueo è formato dai processi ciliari ed è secreto nella camera posteriore dell’occhio in una quantità di circa 2-6 µl/min ed un volume totale di camera anteriore e posteriore di circa 0.2-0.4 µl; circa l’1-2% dell’umore acqueo viene sostituito ogni minuto.
L’umore acqueo passa attraverso la pupilla in camera anteriore e poiché l’iride è piatta, lungo la superficie anteriore del cristallino l’umore acqueo non riesce a superare la resistenza pupillare (prima resistenza fisiologica) fino a che non si produce una sufficiente pressione in grado di sollevare l’iride dalla superficie del cristallino. Il flusso dell’umore acqueo dalla camera posteriore a quella anteriore non è quindi continuo ma ad andamento pulsatile.
Qualsiasi incremento della resistenza al deflusso pupillare (blocco pupillare) causa un aumento della pressione nella camera posteriore, l’iride si gonfia anteriormente alla radice come una vela e fa pressione sul trabecolato; questa è la pato genesi del glaucoma ad angolo chiuso.
Vari fattori possono aumentare la resistenza al deflusso pupillare; l’umore acqueo fuoriesce attraverso l’angolo della camera anteriore da due canali:
– il reticolo trabecolare che riceve circa l’85% del deflusso che drena nel canale di Schlemm e da qui è condotto tramite 20-30 canali collettori nel plesso venoso episclerale;
il sistema vascolare uveosclerale che riceve circa il 15% del deflusso che si riversa nel sangue venoso.
Il reticolo trabecolare è la seconda fonte di resistenza fisiologica, si tratta di un corpo costituito da tessuto avascolare simil–spugnoso posto tra lo sperone sclerale e la linea di Schwalbe; un aumento della resistenza a questo livello è presente nel glaucoma ad angolo aperto
Classificazione
Il glaucoma può essere classificato in accordo con la specifica fisiopatologia, i molti differenti tipi di glaucoma sono quasi tutti attribuibili ad un aumento della resistenza al deflusso piuttosto che ad un’aumentata secrezione dell’umore acqueo.
Esistono numerose classificazioni del glaucoma, ma la descrizione principale distingue quattro categorie:
– glaucoma primario ad angolo aperto;
– glaucoma primario da chiusura dell’angolo;
– glaucoma malformativo (g. congenito, idroftalmo);
– glaucomi secondari variabilmente ad ang. aperto o chiuso.
10.2 Metodi d’esame
Illuminazione obliqua della camera anteriore
La camera anteriore (CA) deve essere illuminata con un fascio di luce tangenziale rispetto al piano dell’iride, negli occhi con una CA con profondità normale l’iride appare uniformemente illuminata, questo è un segno di camera anteriore profonda con angolo aperto.
Negli occhi con camera anteriore bassa ed un angolo che è parzialmente o completamente chiuso, l’iride protrude anteriormente e non è uniformemente illuminata.
Esame alla lampada a fessura
La profondità centrale e periferica della camera anteriore dovrebbe essere valutata sulla base dello spessore corneale. Una camera anteriore che è meno di tre volte tanto profonda quanto lo spessore corneale centrale, con una profondità periferica di valore inferiore allo spessore corneale suggerisce un angolo stretto, ma per una precisa valutazione è essenziale lo studio dell’angolo irido–sclerale con la gonioscopia (vedi di seguito).
Per valutare la profondità della camera anteriore con una lampada a fessura deve essere usato un fascio di luce stretto che deve colpire l’occhio in posizione leggermente inclinata rispetto alla linea visiva dell’esaminatore. Dispositivi d’imaging del segmento anteriore che sono recentemente disponibili (es.: Visante OCT, Zeiss oppure OPKO Spectral Domain OCT & SLO) forniscono una visione tomografica dell’intera camera anteriore e delle sue dimensioni.
Gonioscopia
L’angolo della camera anteriore è valutato con una lente gonioscopica (lente a tre specchi) che si posiziona direttamente sulla cornea previa apposizione di collirio anestetico locale e gel per esaminazione (simile all’ecografia).

La gonioscopia è l’esame di elezione per identificare le varie forme di glaucoma, questo esame può distinguere infatti le seguenti condizioni:
– angolo aperto;
– angolo chiuso (glaucoma da chiusura d’angolo);
– accesso all’angolo stretto (angolo con rischio imminente di sviluppare glauco- ma ad angolo chiuso);
– angolo chiuso con neovasi (glaucoma secondario da chiusura d’angolo) per esempio dovuto a neovascolarizzazione nella rubeosi dell’iride;
angolo aperto ma con depositi cellulari infiammatori, eritrociti o pigmento nel reticolo trabecolare (glaucoma secondario ad angolo aperto).
Pachimetria
La pachimetria è la misurazione dello spessore della cornea (la porzione trasparente più anteriore dell’occhio) ed è effettuata in µ (micron): millesimo di millimetro; lo spessore medio al centro della cornea è poco più di mezzo millimetro (520 – 540 µ). Questa misurazione può essere effettuata a contatto, previa apposizione di anestetico locale, per mezzo di una piccola sonda A – scan o non a contatto con sofisticati strumenti di acquisizione basati sulla misurazione di proiezioni luminose sulle superfici anteriore e posteriore della stessa cornea.

Importanza della pachimetria nella tonometria
Lo spessore corneale deve essere considerato nella tonometria ad applanazione poiché le misurazioni tonometriche sono troppo basse nei pazienti con cornee sottili e troppo alte in quelli con cornee spesse. Il fattore di correzione è circa 2 - 3 mmHg/50 µm di spessore corneale (dato un regolare spessore corneale di 539 µm). Ciò vuol dire che in un occhio con spessore corneale di 590 µm la IOP reale è più bassa di 2 - 3 mmHg rispetto al valore misurato. In un serio ed affidabile ambulatorio di glaucoma deve essere sempre effettuata una pachimetria ad ogni paziente seguito.
Tonometria: misura della pressione intraoculare
Palpazione
La palpazione comparativa dei due bulbi oculari è un esame preliminare che può individuare una pressione intraoculare aumentata:
– se l’esaminatore può indentare il bulbo, che fluttua durante la palpazione, la pressione è meno di 20 mmHg;
– un bulbo oculare non elastico e duro può essere segno di pressione alta, anche 6070 mmHg (glaucoma acuto da chiusura d’angolo).
Tonometro ad indentazione di Schiøtz
Questo esame ormai desueto, misura il grado con cui la cornea può essere indentata nel paziente supino e spesso fornisce risultati inesatti.
Per es.: la rigidità sclerale è ridotta in occhi miopi, pertanto l’indicatore del tonometro si abbasserà ad una maggiore profondità. Questo tipo di tonometro è stato sostituito dal tonometro ad applanazione.
Tonometro ad applanazione
Questo è il metodo più comune di misurazione della IOP, nonché riconosciuto essere il più valido in letteratura. Permette all’esaminatore di ottenere una misurazione dei pazienti da seduti in pochi secondi (metodo di Goldmann) o in pazienti supini (metodo di Draeger).
L’estremità piatta del tonometro ha un diametro di 3.06 mm per l’applanazione della cornea su una corrispondente area (7.35 mm2) eliminando la rigidità della sclera come sorgente di errore. L’estremità del tonometro che entra in contatto con la cornea può anche essere monouso sterile evitando pertanto possibili infezioni da contatto tra i soggetti esaminati.
Tonometro pneumatico non a contatto (a soffio)
Il tonometro elettronico emette un soffio d’aria di 3 ms sulla cornea e, registrando la deflessione della cornea, ne calcola la IOP in base alla sua deformazione.

Vantaggi:
– non richiede l’uso di anestesia topica,
– le misurazioni non a contatto eliminano il rischio di infezione.
Svantaggi:
– la calibrazione è difficile;
– precise misurazioni sono possibili solo per valori bassi di pressione, pertanto non utile in soggetti affetti di glaucoma;
– non può essere usato in presenza di cicatrici corneali;
– l’esame è sgradevole per il paziente;
– il flusso d’aria è rumoroso e fastidioso;
– lo strumento è più caro da acquistare rispetto al tonometro ad applanazione.
Curva di misurazione della pressione delle 24 ore
Questo esame viene eseguito per analizzare le fluttuazioni del livello pressorio per un periodo di 24 - 48 ore in pazienti con sospetto glaucoma. Una singola misurazione potrebbe non essere rappresentativa, solo una curva delle 24 ore fornisce informazioni affidabili sui livelli pressori. La IOP fluttua con pattern ritmico, i valori più alti si regi- strano frequentemente di notte o nelle prime ore della mattina. Nei pazienti normali queste fluttuazioni della IOP raramente superano i 4 - 6 mmHg.
La pressione viene misurata in reparto alle ore: 6.00, 12.00, 18.00, 21.00 e mezzanotte; le curve pressorie ambulatoriali senza misurazioni notturne o della mattina presto sono meno affidabili.
In pazienti trattati con colliri antiglaucomatosi deve essere posta particolare attenzione al tempo di somministrazione: la pressione deve essere misurata immediatamente prima di instillare le gocce.
Auto esaminazione tonometrica
Recenti progressi hanno reso possibile per i pazienti misurare da soli la IOP a casa in modo simile all’auto monitoraggio della glicemia e della PA. Il tonometro del paziente rende possibile ottenere una curva pressoria delle 24 ore nelle normali condizioni di tutti i giorni. Questo strumento sarebbe molto utile per es. nei pazienti a rischio di sviluppare glaucoma acuto; tuttavia, l’uso del dispositivo richiede una certa abilità, i pazienti che hanno problemi ad instillare le gocce e quelli più anziani con numero- se patologie e meno collaboranti non sono raccomandati per un tonometro portatile, mentre soggetti più giovani e motivati sono i migliori candidati per l’auto misurazione tonometrica.
Oftalmoscopia del disco ottico
Il disco ottico ha una depressione fisiologica nota come escavazione ottica o papillare; in presenza di una IOP persistentemente elevata questa parte si allarga e si approfonda ed è importante la valutazione oftalmoscopica. L’esame stereoscopico del disco del NO attraverso la biomicroscopia con lampada a fessura munita di lente
a contatto o con lente (78D, 90D, 100D) fornisce un’immagine tridimensionale e si esegue nel migliore dei modi in midriasi.
Il nervo ottico è la “memoria del glaucoma” nell’occhio, la valutazione di questa struttura rivelerà all’esaminatore i casi in cui è presente un danno glaucomatoso e quanto è avanzato.
Normale escavazione ottica

L’anatomia normale può variare ampiamente, escavazioni normali larghe del disco ottico sono spesso rotonde e sono differenti dall’allungamento verticale dell’escavazione papillare visibile negli occhi glaucomatosi.
Descrivere il disco ottico
Registrare i segni in appunti è utile per la documentazione di routine e gli esami di controllo del NO, fotografare il disco ottico con una fundus camera permette un follow–up a più lungo termine e la fotografia stereoscopica inoltre fornisce un’immagine tridimensionale ed oggettiva. Le misurazioni del disco ottico e la tomografia computerizzata possono fornire precise misurazioni del nervo ottico.
Misura del disco ottico
L’area del disco ottico, escavazione ottica e rima neuroretinica (tessuto vitale del disco ottico) possono essere misurate attraverso planimetria in fotografie a due dimensioni del nervo ottico.

10 - Glaucoma

OCT: Tomografia del disco ottico e delle fibre nervose
Gli oftalmoscopi moderni dotati di scansione laser OCT (tomografia a coerenza ottica) permettono una documentazione tridimensionale perfetta a tutto strato del nervo ottico con misurazione oggettiva in micron, nonché generano una mappa della media degli spessori delle fibre nervose. Le fibre nervose retiniche hanno una caratteristica disposizione che spiega i tipici difetti del campo visivo tipici del glaucoma primario ad angolo aperto, per esempio difetti arciformi. Sia la mappa della media delle fibre nervose che il campo visivo sono esami utili per il follow–up dei pazienti glaucomatosi.

Campo visivo
È possibile effettuare diagnosi precoce di glaucoma quanto prima si riesce a recuperare documentazione certa di alterazioni specifiche del campo visivo allo stadio più precoce possibile. Difetti glaucomatosi del campo visivo diventano manifesti prima nel campo supero nasale paracentrale e meno frequentemente nel campo inferiore, come scotomi relativi che più tardi progrediscono in scotomi assoluti.
La perimetria statica computerizzata (misurazione della sensibilità alle differenze della luce) è superiore a qualsiasi metodo cinetico nell’identificare questi difetti glaucomatosi precoci del campo visivo. Per esaminare i 30° di campo della visione centrale si utilizzano dispositivi semi–automatici con griglia perimetrica controllati da computer come l’Octopus e l’Humphrey.
È fondamentale la riproducibilità dei campi visivi per il follow-up dei possibili danni evolutivi della patologia insidiosa.
10.3 Glaucoma primario
Glaucoma Primario ad Angolo Aperto (GPAA)

Il glaucoma primario ad angolo aperto esordisce intorno ai 40-50 anni con sintomi minimi che progressivamente peggiorano mentre l’angolo della camera anteriore rimane caratteristicamente aperto durante il decorso clinico della patologia.
EPIDEMIOLOGIA: il glaucoma primario ad angolo aperto è senza dubbio la for- ma più comune di glaucoma e rappresenta oltre il 90% dei glaucomi in età adulta; l’incidenza della patologia aumenta significativamente oltre i 40 anni raggiungendo un picco tra i 60 e i 70. La sua prevalenza nei quarantenni è dello 0.9% paragonata al 4.7% nei pazienti ultracinquantenni. Sembra che ci sia una predisposizione genetica per il GPAA, infatti oltre un terzo dei pazienti con glaucoma ha parenti con la stessa patologia.
EZIOLOGIA: la causa del GPAA non è ben conosciuta ma è noto l’impedimento al deflusso dell’umore acqueo; la lesione primaria avviene nel tessuto neuroretinico del nervo ottico come una neuropatia compressiva dello stesso.
SINTOMI: la maggioranza dei pazienti con GPAA non presenta alcun sintomo per anni, solo alcuni pazienti accusano sintomi occasionali non specifici come cefalea, bruciore oculare, vista diminuita o sfocata che il paziente attribuirebbe alla necessità di occhiali o ad una insufficiente correzione ottica. Il paziente inoltre potrebbe percepire cerchi colorati intorno a sorgenti luminose di notte. Il GPAA spesso non mostra sintomi tipici per anni pertanto si raccomanda sempre una visita oculistica ad intervalli regolari (possibilmente annuale) per una diagnosi precoce e non solo di tale patologia. Il GPAA può essere molto avanzato già prima che il paziente noti qualsiasi esteso difetto del campo visivo in uno o in entrambi gli occhi ed è fondamentale diagnosticare la patologia il prima possibile poiché la prognosi per il glaucoma diagnosticato nel suo stadio iniziale è di gran lunga migliore del glaucoma avanzato.
10 - Glaucoma
Nei casi in cui un’aumentata IOP rimane non diagnosticata o non trattata per anni il danno glaucomatoso del nervo ottico e gli associati difetti del campo visivo aumentano fino alla cecità.
CONSIDERAZIONI DIAGNOSTICHE: fondamentale è la misurazione della IOP che dovrebbe essere sempre effettuata in una visita di routine, una IOP elevata è sempre segno di allarme e va sempre ricercata e studiata la causa.
GONIOSCOPIA: l’angolo della camera anteriore è aperto e appare normale come in pazienti non glaucomatosi.
OFTALMOSCOPIA: l’esame del nervo ottico rileva i casi in cui si sia già verificata un’escavazione glaucomatosa e quanto sia avanzato il glaucoma; nel caso in cui il disco ottico ed il campo visivo risultino normali l’esame oftalmoscopico del polo posteriore con luce verde dovrebbe rivelare la presenza di difetti dei fasci delle fibre nervose come segni precoci anormali
PERIMETRIA: è utile come test di screening e permette l’identificazione e la descrizione di eventuali scotomi. Il paziente viene sottoposto all’osservazione di un monitor tremolante che riporta il rumore in una immagine su un televisore: il soggetto non vedrà i punti tremolanti nella regione dello scotoma. Se questo test mostra difetti allora devono essere quantificati tramite metodi più specifici: la perimetria automatica a griglia è utile per gli stadi precoci mentre speciali programmi (come il programma G1 del perimetro Octopus ed il programma 30 - 2 dell’Humphrey) rivelano le alterazioni glaucomatose più precoci, in fase avanzata è utile l’esame dei 10 gradi centrali con la perimetria computerizzata o con la perimetria cinetica manuale di Goldmann.
DIAGNOSI DIFFERENZIALE: due patologie sono importanti in questo contesto.
– Ipertensione oculare: i pazienti con ipertensione oculare mostrano una IOP significativamente aumentata da anni senza segni di danno glaucomatoso al nervo ottico o difetti del campo visivo. Alcuni di questi soggetti avranno una IOP elevata senza mai sviluppare lesioni glaucomatose, altri invece svilupperanno GPAA. La probabilità che si sviluppi un glaucoma definitivo aumenta con l’aumentare della IOP nei pazienti giovani e con la concomitante anamnesi familiare positiva per glaucoma.
– Glaucoma ipotensivo: pazienti con glaucoma a bassa pressione mostrano ti- piche alterazioni glaucomatose del disco ottico e del campo visivo pur senza IOP elevata, tali soggetti sono difficili da trattare poiché la gestione non può focalizzarsi solo sul controllo della IOP. Spesso questi pazienti hanno storie di crisi emodinamiche come sanguinamenti gastrointestinali e uterini con perdita significativa di sangue, bassa pressione sanguigna, e spasmi periferici vascolari (mani e piedi freddi). Un
profilo pressorio delle 24 ore spesso mostra fasi di bassa pressione durante la notte che potrebbero restare silenti e questi intervalli di tempo di bassa perfusione causano la neuropatia ottica. A tal proposi- to pazienti glaucomatosi potrebbero mostrare un peggioramento ulteriore del campo visivo proprio a causa di un calo della pressione sanguigna, pertanto è fondamentale la comunicazione con i colleghi cardiologi ed internisti sul corretto uso di farmaci cardiovascolari antipertensivi in pazienti con glaucoma.

TERAPIA: Quando iniziare.
– Alterazioni glaucomatose dell’escavazione papillare: le terapie mediche dovrebbero essere iniziate quando ci sono segni di alterazioni glaucomatose nell’escavazione ottica o quando c’è una differenza maggiore del 20% tra le escavazioni ottiche dei due occhi.
Qualsiasi pressione intraoculare oltre i 25 mmHg dovrebbe essere trattata;
Aumento delle alterazioni glaucomatose dell’escavazione papillare o aumento dei deficit del campo visivo anche sotto terapia antiglaucomatosa; indipendentemente dalla pressione repertata, tali alterazioni mostrano che la pressione repertata è troppo alta per il NO e che è indicata una terapia medica addizionale. Dovrebbe essere definita una pressione target inferiore a circa il 30% del livello iniziale, oltre a ridurre la pressione si devono minimizzazione le fluttuazioni pressorie giornaliere e ciò vale anche in pazienti con danno glaucomatoso avanzato in cui sono indicate terapie massimali per abbassare il più possibile la pressione (10 - 12 mmHg).
– Stadi precoci: è difficile decidere per una terapia negli stadi precoci, special- mente quando la IOP è leggermente al disopra dei valori soglia. I pazienti con glaucoma a bassa pressione mostrano un aumento dell’escavazione del disco ottico anche a normale pressione (meno di 22 mmHg), mentre pazienti con una IOP elevata (2533 mmHg) possono mostrare un nervo ottico non alterato per anni.
– I pazienti con glaucoma sospetto e fattori di rischio come storia familiare per glaucoma, media miopia, glaucoma nell’occhio controlaterale o differenze tra le escavazioni delle due papille nei due occhi dovrebbero essere strettamente monitorate. Le visite di controllo dovrebbero essere eseguite tre o quattro volte l’anno specialmente per pazienti non in terapia.
OBIETTIVI TERAPEUTICI: lo scopo è di ridurre la IOP a livelli target tale da poter determinare uno specifico livello pressorio sufficiente per ogni paziente atto a prevenirne sia la perdita progressiva di campo visivo sia i danni glaucomatosi al NO; la definizione del target pressorio è un processo attento e continuo e può richiedere numerose visite.
10 - Glaucoma
TERAPIA MEDICA. Le opzioni disponibili nel trattamento del glaucoma sono:
– inibire la produzione di umore acqueo;
– aumentare il deflusso trabecolare;
– aumentare il deflusso uveosclerale.
PRINCIPI DI TERAPIA MEDICA DEL GPAA: la terapia medica è il trattamento di elezione per il GPAA mentre l’approccio chirurgico è indicato solo quando si assiste ad un fallimento continuo irreversibile.
Non esiste un piano terapeutico applicabile in generale, la scelta del farmaco dipende dall’efficacia, dagli effetti collaterali e dalle controindicazioni; innanzitutto il trattamento con singolo farmaco dovrebbe essere mirato a ridurre la IOP almeno del 20% dal livello iniziale;
– Per un trattamento locale farmacologico sono disponibili le seguenti opzioni:
- inibitori dell’anidrasi carbonica;
- alfa-2 agonisti;
- beta-bloccanti;
- analoghi delle prostaglandine;
- in casi selezionati, agenti parasimpaticomimetici e adrenergici non selettivi;
- agenti osmotici o inibitori dell’anidrasi carbonica (somministrati oralmente o e.v.) inibiscono la produzione di umore acqueo e possono essere somministrati in aggiunta ai farmaci topici solo temporaneamente per i noti effetti collaterali. È buona regola usare la più forte medicazione possibile atta a raggiungere la pressione normale in un periodo di 24 ore ed il prima possibile.
– L’efficacia di qualsiasi terapia nel ridurre la IOP dovrebbe essere verificata e controllata con un’analisi della stessa in reparto o ambulatorialmente in tempi stretti e regolari;
– l’effetto delle gocce non dovrebbe interferire con l’abilità lavorativa del paziente; la tolleranza, l’efficacia e gli effetti collaterali dei colliri dovrebbero essere continuamente verificati su base individuale durante il corso del trattamento;
non tutte le combinazioni tra farmaci anti–glaucoma sono funzionali.
TRATTAMENTO CHIRURGICO DEL GPAA. Indicazioni:
– Inadeguatezza della terapia medica;
– intolleranza del paziente alle varie terapie mediche (allergia, riduzione del visus per restringimento pupillare, dolore, spasmo ciliare e ptosi);
– quando sussiste scarsa compliance alla terapia locale o non collaborazione nell’instillazione dei colliri.
TRABECULOPLASTICA ARGON LASER (ALT)

– Il laser, bruciando il tessuto trabecolare causa una contrazione del reticolo che allarga gli spazi e migliora il deflusso attraverso il trabecolato stesso.
– Tecnica: da 50 a 100 laser spot verso il trabecolato anteriore.
– La chirurgia laser nell’angolo della camera anteriore è possibile solo se questo è aperto; la chirurgia è indolore e può essere eseguita in regime ambulatoria- le implicando poche complicanze (sanguinamento proveniente dalle strutture vascolari vicine all’angolo e formazione di sinechie tra l’iride e i singoli spot laser). La trabeculoplastica argon laser può apportare un miglioramento della IOP di più di 30 mmHg; diminuisce inoltre la IOP di circa 6 - 8 mmHg anche fino 2 anni ma è efficace solo in un paziente su due.
– La Trabeculotomia Laser Selettiva (SLT) viene effettuata con laser a luce fredda determinando quindi una riattivazione delle cellule del trabecolato provocando una netta diminuzione della pressione endooculare.
– La Trabeculotomia con Laser Giallo Micropulsato (MLT) viene effettuata con laser a luce gialla in modalità micropulsata avendo così effetti termici quasi nulli e determinando quindi una riattivazione delle cellule del trabecolato provocando una netta diminuzione della pressione endooculare
CHIRURGIA FILTRANTE: l’umore acqueo è drenato dalla CA attraverso un’apertura sclerale sottocongiuntivale che elude il trabecolato con formazione di una bozza che filtra in modo accessorio. Può essere ottenuta con tecniche miniinvasive (MIGS) mediante dispositivi impiantabili a livello dell’angolo o con vere e proprie valvole (Ahmed).
CICLODIALISI: l’umore acqueo è drenato attraverso un’apertura sullo spazio so- vracoroideale. Questa procedura oggi è meno comune rispetto agli anni 80 (è difficile valutare accuratamente l’atrofia del corpo ciliare ed occasionalmente si verifica una severa ipotonia del globo che richiede un intervento chirurgico per chiudere la dialisi d’apertura).
CICLOABLAZIONE: viene indotta atrofia in porzioni del corpo ciliare attraverso la sclera intatta per ridurre la IOP tramite una diminuzione dei tessuti che producono umore acqueo. Tecniche:
– CRIOTERAPIA: si congela il corpo ciliare in alcuni punti attraverso la sclera; questa procedura può essere ripetuta se necessaria con effetto addizionale.
– CICLODIATERMIA: simile alla ciclocrioterapia (si porta un ago diatermico attraverso la sclera nel corpo ciliare per cauterizzare con il calore); la procedura può essere eseguita con o senza dissezione preventiva di un lembo sclerale a spessore parziale.
10 - Glaucoma
– CICLOABLAZIONE: causa atrofia del corpo ciliare tramite l’uso di YAG laser o laser a diodi ad alta energia.
– ROTTURA AD ULTRASUONI: causa atrofia nel corpo ciliare con onde di ultrasuoni ad alta frequenza. Queste due ultime forme di terapia inducono l’atrofia in maniera più efficace, accurata ed in dosi più controllate con minor traumatismo per l’occhio. Tutte queste forme di cicloablazione sono irreversibili e causano ipotonia permanente, rappresentano quindi il trattamento di “ultima linea”.
PROFILASSI: non sono possibili interventi profilattici per prevenire il GPAA pertanto la diagnosi precoce è essenziale e può esser fatta solo da un oculista.
PROGNOSI: dipende soprattutto dallo stadio in cui è diagnosticato il glaucoma, la terapia ha effetto maggiore se iniziata più precocemente.
Glaucoma primario da chiusura d’angolo
Si manifesta con aumento episodico acuto della IOP che supera il valore normale (12 - 20 mmHg) per improvviso blocco del drenaggio mentre la produzione dell’umore acqueo e la resistenza trabecolare sono normali.
EPIDEMIOLOGIA: l’incidenza presso le persone oltre i 60 anni è dell’1% e le donne sono tre volte più colpite rispetto agli uomini.
EZIOLOGIA: occhi anatomicamente predisposti con camera anteriore poco profonda presentano un relativo impedimento al deflusso dell’umore acqueo attraverso la pupilla. Questo blocco pupillare aumenta la pressione in camera posteriore che sposta l’iride anteriormente verso il trabecolato bloccando improvvisamente la fuoriuscita di umore acqueo (chiusura dell’angolo). Il tipico attacco di glaucoma si verifica solitamente in un occhio in seguito ad un allargamento della pupilla o in condizioni di buio o per stress emotivo; anche midriasi farmacologiche iatrogene o farmaci psicotropi sistemici possono scatenare un attacco di glaucoma acuto.
IMPORTANTE: farmaci midriatici possono causare un attacco di glaucoma tramite l’allargamento della pupilla, è quindi importante valutare la profondità della camera anteriore in ogni paziente durante la visita oculistica prima dell’instillazione del midriatico per l’esame del fondo oculare.
SINTOMI. Insorgenza acuta di dolore intenso: l’elevata pressione intraoculare agisce sui nervi corneali (il nervo oftalmico, prima branca del N. trigemino) causando dolore sordo, più spesso localizzato alle tempie, dietro la testa, alle fauci e lungo le tre branche del nervo trigemino e questo può mascherare la sua origine oculare).
Nausea e vomito conseguono all’irritazione del nervo vago e possono simulare
patologie addominali; i sintomi generalizzati come mal di testa, vomito e nausea possono dominare il quadro clinico in modo che il paziente non nota sintomi locali.
– Diminuzione dell’acuità visiva: i pazienti notano visione offuscata e aloni colorati intorno alle luci nell’occhio affetto; questi sintomi sono causati dalla presenza di un edema corneale con precipitati causati dal forte aumento della pressione.
– Sintomi prodromici: pazienti riportano transitori episodi di visione offuscata o aloni colorati intorno alle luci prima dell’attacco, è quini importante una precoce identificazione dei pazienti ad alto rischio con camera anteriore bassa e segni gonioscopici evidenti visto che il danno alle strutture angolari potrebbe essere ben presente prima che appaiano i sintomi clinici.
– La sindrome clinica completa del glaucoma acuto non è sempre presente, la diminuzione dell’acuità visiva potrebbe non essere avvertita se l’altro occhio ha un visus normale e la percezione del dolore è decisamente soggettiva.
CONSIDERAZIONI DIAGNOSTICHE: la diagnosi è posta in base ad una triade sintomatologica:
– Occhio rosso unilateralmente con iniezione ciliare o congiuntivale;
– Pupilla fissa e dilatata;
– Globo oculare duro alla palpazione.
ALTRI SEGNI:
– Cornea opaca ed appannata con edema epiteliale;
– CA bassa o completamente collassata;
– Il fondo oculare generalmente non è esplorabile per l’opacizzazione dell’epitelio corneale;

– L’acuità visiva risulta ridotta fino al moto manu.
DIAGNOSI DIFFERENZIALE: la grande varietà di sintomi può simulare altre patologie.
– Sintomi generali come mal di testa, vomito, e nausea spesso predominano il quadro clinico e possono essere facilmente confusi con un’appendicite o un tumore cerebrale;
– Anche nelle iriti ed iridocicliti l’occhio è rosso e l’iride appare sbiadita, tuttavia la pressione intraoculare tende ad essere diminuita piuttosto che aumentata.
TERAPIA: un attacco acuto di glaucoma è un’emergenza medica ed il paziente richiede un trattamento immediato di un oculista.
PRINCIPI DI TERAPIA MEDICA NEL GPAC:
– La riduzione osmotica del volume del corpo vitreo si raggiunge tramite soluzioni
10 - Glaucoma
iperosmotiche (glicerina orale 1.0-1.5 g/kg di peso corporeo, o mannitolo e.v., 1.02.0 g/kg di peso corporeo).
– La produzione dell’umore acqueo è diminuita inibendo l’anidrasi carbonica (acetazolamide e.v., 250-500 mg). Entrambi i passaggi sono effettuati inizialmente per ridurre la IOP al di sotto dei 50-60 mmHg.
– L’uso di agenti miotici topici retraggono l’iride dall’angolo, le gocce di pilocarpina all’1% dovrebbero essere instillate ogni 15 minuti. Gli agenti miotici non sono le medicazioni di prima scelta poichè il muscolo sfintere della pupilla è ischemico a pressioni superiori ai 40-50 mmHg e non risponde, inoltre rilassano le fibre zonulari causando un dislocamento anteriore del cristallino che in seguito comprime la CA. Ciò rende importante iniziare prima la terapia con agenti iperosmotici per ridurre il volume del corpo vitreo.
GESTIONE CHIRURGICA (SHUNT TRA LA CAMERA ANTERIORE E POSTERIORE): una volta che la cornea torna trasparente le cause della patologia vengono trattate chirurgicamente tramite la creazione di uno shunt tra la camera anteriore e posteriore.
– Iridotomia Yag laser (procedura non incisionale): lo YAG laser può essere utilizzato per creare un’apertura nell’iride periferica (iridotomia) tramite una lisi tissutale dell’iride senza dover aprire l’occhio e può essere eseguita in anestesia topica locale.
– Iridectomia periferica (procedura incisionale): laddove la cornea sia ancora edematosa o l’iride è molto sottile potrebbe essere richiesta una procedura di apertura per creare uno shunt. Si esegue un’incisione limbare ad ore 12 con paziente sotto anestesia topica attraverso la quale si esegue un’iridectomia basale. Oggi l’iridectomia periferica è eseguita raramente (solo nell’1-2% dei casi).
PROFILASSI: nei casi in cui il paziente manifesta chiari sintomi prodromici e l’angolo della CA appare stretto la profilassi più sicura è l’iridotomia YAG laser o l’iridectomia periferica. Se un occhio ha già sofferto di un attacco acuto di glauco- ma, l’altro occhio dovrebbe essere trattato inizialmente ogni 4 - 6 ore con pilocarpina 1% per minimizzare il rischio di un attacco glaucomatoso. Il secondo occhio dovrebbe quindi essere trattato con YAG laser per prevenire un attacco di glaucoma acuto una volta che è stata raggiunta una stabilizzazione chirurgica del primo occhio.
PROGNOSI: i casi persistenti di glaucoma da chiusura d’angolo non possono essere trattati con iridotomia o iridectomia YAG lase e la chiusura d’angolo persisterà nonostante la chirurgia in questi casi è indicata la chirurgia filtrante. Quando la IOP è controllata e la cornea è trasparente è d’uopo un controllo gonioscopico per ve-
rificare che l’angolo sia nuovamente aperto e per escludere una chiusura d’angolo persistente.
10.4 Glaucomi secondari
Questi glaucomi sono causati da altre patologie oculari o fattori predisponenti come:

– Infiammazioni
– Traumi
– Emorragie
– Tumori
– Farmaci e fattori chimici o fisici
Glaucoma pseudoesfoliativo
Depositi di materiale cellulare amorfo si accumulano attraverso la camera anteriore e congestionano il trabecolato.
Glaucoma pigmentario
Tipico dei giovani individui miopi; la patologia è caratterizzata da un rilascio di pigmenti granulari dall’epitelio pigmentato irideo che congestionano il trabecolato.
Glaucoma da cortisone
Circa il 35 - 40% della popolazione reagisce ad una terapia steroidea di tre settimane con una IOP elevata: un aumentato deposito di mucopolisaccaridi nel trabecolato aumenta presumibilmente la resistenza al deflusso ma questa condizione regredisce nel momento in cui vengono sospesi i cortisonici.
Glaucoma infiammatorio
Due meccanismi contribuiscono all’aumento della IOP:
1. La viscosità dell’umore acqueo aumenta per afflusso di proteine dai capillari iridei infiammati;
2. Il trabecolato diventa congesto con cellule infiammatorie e detriti cellulari.
Glaucoma facolitico
Questo tipo di glaucoma acuto si verifica in occhi con cataratte mature o ipermature dove le proteine del cristallino denaturate passano attraverso la capsula della lente intatta in CA e vengono fagocitate ed il trabecolato si congestiona per la presenza di macrofagi e proteine.
10 - Glaucoma
Glaucoma secondario da chiusura d’angolo
Nel glaucoma secondario da chiusura d’angolo così come in quello primario l’aumento della IOP è causato da un blocco del trabecolato tuttavia la configurazione primaria della CA non è il fattore decisivo.
Le cause più importanti:
– La Rubeosi iridea in cui la neovascolarizzazione ritira l’angolo dalla CA a mo’ di chiusura lampo (glaucoma neovascolare). Questo può verificarsi in caso di patologie retiniche ischemiche come la retinopatia diabetica e l’occlusione venosa retinica così come in altre forme di retinopatia o tumori intraoculari; la prognosi per occhi con glaucoma neovascolare è scarsa.
– Trauma: la presenza di sangue o essudati post-traumatici nell’angolo della CA ed il contatto prolungato tra iride e trabecolato in una CA collassata (a seguito di infortuni, chirurgia o insufficiente trattamento della chiusura primaria d’angolo) può causare la formazione di sinechie anteriori e la chiusura dell’angolo senza rubeosi iridea.
Terapia dei glaucomi secondari
La terapia medica è di solito identica al trattamento del glaucoma cronico primario ad angolo aperto. I glaucomi secondari possono essere provocati da numerosi fattori differenti e l’angolo può essere aperto o chiuso pertanto il trattamento dipenderà dall’eziologia del glaucoma.
I glaucomi con uveiti (come iriti o iridocicliti) sono inizialmente trattati in modo conservativo con farmaci antinfiammatori e antiglaucomatosi e la chirurgia è indicata laddove la terapia conservativa non è sufficiente. La prognosi per i glaucomi secondari è generalmente peggiore rispetto a quelli primari.
Glaucomi dell’infanzia
Qualsiasi anormale aumento della pressione intraoculare durante il primo anno di vita causerà una dilatazione del bulbo oculare e specialmente della cornea, il risultato è un caratteristico anormale occhio allargato (buftalmo) con un aumento progressivo del diametro corneale. Questo viene anche detto idroftalmo o idroftalmia.
EPIDEMIOLOGIA: i glaucomi nei bambini si rilevano in un caso ogni 12000 - 18000 nati e rappresenta circa l’1 % dei glaucomi. Il glaucoma congenito primario è una patologia ereditaria a trasmissione autosomica recessiva, è bilaterale in circa il 70% dei casi e si manifesta prima dell’età di 6 mesi in circa il 70% dei casi. Oggi è diffusa la consapevolezza dell’esistenza del glaucoma negli adulti sfortunatamente non è lo stesso per il glaucoma nei bambini.
EZIOLOGIA: l’iride s’inserisce anteriormente lontano dal trabecolato, il tessuto embrionale mesodermico in forma di una sottile membrana trasparente (membrana di Barkan) ricopre il trabecolato e impedisce il flusso dell’umore acqueo nel canale di Schlemm; non sembrano essere presenti altri segni oculari o sistemici anormali.
SINTOMI: i classici segni includono fotofobia, epifora, opacizzazione corneale e allargamento unilaterale o bilaterale della cornea. Queste alterazioni potrebbero essere presenti dalla nascita (nel glaucoma congenito) o possono svilupparsi poco dopo o durante i primi anni di vita. I bambini con questa patologia sono irritabili, mangiano poco e spesso strofinano gli occhi; il comportamento di alcuni bambini può portare al sospetto di un ritardo mentale. I parenti che si vantano di “occhi grandi e belli” dei propri bambini andrebbero allertati ed inviati dall’oculista per misurare la IOP, è essenziale diagnosticare la patologia il prima possibile per minimizzare il rischio di perdita o di danno irreparabile alla vista del bambino.
CONSIDERAZIONI DIAGNOSTICHE: questi esami possono essere eseguiti senza anestesia generale in molti bambini, tuttavia l’anestesia generale è necessaria occasionalmente per confermare la diagnosi in bambini più grandi.
MISURAZIONE DELLA PRESSIONE INTRAOCULARE: si dovrebbe cercare di misurare la pressione intraoculare tramite un tonometro ad applanazione (tonometro manuale) e se eseguita durante la suzione al biberon la misurazione diviene più agevole. Anche una sola misurazione accurata è migliore rispetto ad una ottenuta sotto anestesia generale o narcotici specialmente barbiturici e alotano che riducono la pressione intraoculare.
OFTALMOSCOPIA DELLA PAPILLA: l’escavazione ottica è un indicatore molto sensibile di IOP alterata in modo particolare nella fase in cui si presentano permanenti deficit del campo visivo, un’asimmetria dell’escavazione ottica può essere molto utile nella diagnosi e nel follow-up della malattia.
SPECIALI CONSIDERAZIONI: un’escavazione ottica glaucomatosa nei bambini può essere facilmente reversibile, infatti può significativamente ridursi entro poche ore dopo una trabeculotomia eseguita con successo.
ISPEZIONE DELLA CORNEA: si presenta di solito biancastra e opaca per l’edema epiteliale, rotture nella membrana di Descemet possono esacerbare un edema epiteliale o stromale, queste lesioni conosciute come strie di Haab mostreranno una tipica configurazione orizzontale o curvilinea. Il diametro corneale allargato è un segno caratteristico, la cornea misura in media 9.5mm in neonati normali, un allargamento di oltre 10.5 mm suggerisce un glaucoma dell’infanzia ed una IOP cronicamente elevata in bambini sotto i 3 anni causa un allargamento dell’intero bulbo oculare.

GONIOSCOPIA DELL’ANGOLO DELLA CAMERA ANTERIORE: l’esame dell’angolo fornisce informazioni eziologiche fondamentali, l’angolo non sarà pienamente differenziato e sarà visibile tessuto embrionale che occlude il trabecolato.
DIAGNOSI DIFFERENZIALE:
Occhi larghi: un diametro corneale largo si può verificare come un’anomalia innocua detta megalocornea;
Opacizzazione corneale: con edema epiteliale si verifica nella distrofia corneale endoteliale ereditaria, mentre senza edema epiteliale nella mucopolisaccaroidosi (sindrome di Hurler, sindrome di Morquio, sindrome di Maroteaux- Lamy);
– Strie della membrana di Descemet: (in contrasto con le strie di Haab orizzontali presenti nel glaucoma congenito) rotture endoteliali possono verificarsi anche come un risultato dell’insulto durante un parto eseguito tramite forcipe (strie verticali), nel cheratocono e nelle cheratiti profonde.
IMPORTANTE: nessuna di queste diagnosi differenziali è accompagnata da una IOP elevata.
TERAPIA: i glaucomi dell’infanzia sono trattati chirurgicamente (goniotomia–tra- beculotomia).
PROGNOSI: le goniotomie e le trabeculotomie non hanno sempre pieno successo, questi bambini richiedono esami di controllo per tutta la vita (inizialmente alcune volte l’anno in seguito una volta l’anno) poiché può ripresentarsi un rialzo della IOP ed in questi casi è indicato ripetere l’intervento.
11 OTTICA E REFRAZIONE

11.1 Acuità visiva
VISUS: termine con cui è indicata comunemente l’acuità visiva che se alterata può essere corretta con lenti a frontale (occhiali) o a contatto.
– Acuità visiva non corretta: si riferisce al potere di risoluzione degli occhi senza lenti correttive.
– Acuità visiva corretta: si riferisce al potere di risoluzione degli occhi con correzione ottimale ottenuta tramite lenti stabilite in base ad un test di acuità visiva.
Entrambe forniscono informazioni su come due oggetti devono essere distanti per essere percepiti dall’occhio in modo distinto (soglia minima di risoluzione).
Affinché l’occhio percepisca due oggetti come distinti è necessario che almeno un cono, tra due stimolati, resti non stimolato sulla retina; la densità di coni è maggiore nel centro della retina e l’acuità visiva centrale è più alta. In questa regione i coni sono tra loro distanti solamente di 2,5 µm e questo intervallo aumenta verso la periferia retinica dove infatti diminuiscono sia l’acuità visiva corretta che quella non corretta.
Il distanziamento dai coni ed effetti fisici come la diffrazione e l’aberrazione ottica limitano la soglia media di risoluzione minima cioè l’angolo minimo visivo di un minuto di arco (il valore massimo individuale è approssimativamente 30 secondi di arco). Un minuto di arco è 1/60 con un grado di approssimazione di 0,004 mm che è un po’ più della grandezza di un cono. Questo corrisponde al massimo potere di risoluzione della retina.
11.2 Refrazione: emmetropia ed ametropia
La refrazione è definita come il rapporto tra il potere refrattivo del cristallino e della cornea (media refrattiva) e la lunghezza assiale del bulbo; l’emmetropia è distinta dall’ametropia.
Il visus viene misurato come consuetudine in frazioni decimali anche se andrebbe misurato come angolo minimo di risoluzione (MAR), essendo questo un valore angolare con progressione logaritmica il valore lineare è il Logaritmo del MAR (LogMAR).
Un grafico logMAR è un grafico costituito da righe di lettere che viene utilizzato da oftalmologi, ortottisti, optometristi e scienziati della vista per stimare l’acuità visiva.
EMMETROPIA (VISTA NORMALE): il rapporto tra la lunghezza assiale dell’occhio e il potere refrattivo del cristallino e della cornea è bilanciato; i raggi della luce che entrano nell’occhio sono paralleli quindi s’incontrano in un punto focale sulla retina, non anteriormente o posteriormente ad essa come invece accade nell’ametropia.
AMETROPIA (VIZIO DI REFRAZIONE): c’è una differenza tra la lunghezza assiale dell’occhio ed il potere refrattivo del cristallino e della cornea; l’ametropia può essere sia assiale caso comune, sia refrattiva meno frequente. Le patologie più comuni sono la miopia, l’ipermetropia e l’astigmatismo. Pochissime persone hanno una refrazione esatta di 0 diottrie; circa il 55% dei soggetti tra i 20 e i 30 anni hanno una refrazione che va da +1 D a -1 D.
L’emmetropia non è essenzialmente sinonimo di buona acuità visiva, gli occhi possono infatti presentare altre patologie che riducono l’acuità visiva come l’atrofia del nervo ottico o l’ambliopia.
Il potere refrattivo di un sistema ottico di lenti è espresso in diottrie che sono l’unità di misura internazionale ed il potere refrattivo è calcolato secondo leggi di ottica geometrica. In accordo con la legge di Snell la refrazione di un raggio di luce incidente è determinata dall’angolo d’incidenza e la differenza nell’indice refrattivo n dei due mezzi.
Il potere refrattivo totale massimo di un occhio emmetrope è di 63 diottrie con una lunghezza assiale del bulbo di 23,5 mm. La cornea è responsabile di 43 diottrie ed il cristallino di 10 - 20 diottrie a seconda del tono accomodativo, tuttavia il potere refrattivo dell’occhio non è semplicemente la somma di questi due valori; i mezzi ottici che circondano i sistemi di lenti dell’occhio e la distanza tra il cristallino e la cornea rendono il sistema totale più complesso.
Il potere refrattivo D (specificato in diottrie) di un sistema ottico è il reciproco della lunghezza focale di una lente f (specificato in metri) da ciò deriva l’equazione: D = 1/f.
ESEMPIO: nel caso in cui una lente focalizzi i raggi paralleli incidenti a 0.5 m dietro di essa, il potere refrattivo è 1/0,5m = +2 D e si tratta di una lente convergente. Quando il fuoco virtuale è posto davanti la lente, il potere refrattivo è 1/-0,5 m= -2 D e questa è una lente divergente.
11.3 Accomodazione
Il potere refrattivo dell’occhio descritto in precedenza non rappresenta un valore costante perché questo deve permettere la visualizzazione di oggetti vicini e lontani con contorni definiti; tale accomodazione è resa possibile dall’elasticità del cristallino
Meccanismi di accomodazione
L’accomodazione coinvolge il cristallino, le fibre della zonula e il muscolo ciliare.
– CRISTALLINO: le proteine solubili della lente sono circondate da una capsula sottile ed elastica; la curvatura della capsula posteriore del cristallino è maggio- re della curvatura anteriore con un raggio posteriore di 6,0 mm in confronto a quello anteriore di 10,0 mm. L’elasticità intrinseca della capsula fa assumere una forma sferica al cristallino, tuttavia in uno stato di non accomodazione ciò è impedito dalla trazione delle fibre della zonula. L’elasticità del tessuto interno del cristallino diminuisce progressivamente con l’età a causa del deposito di proteine insolubili.
– FIBRE DELLA ZONULA: le fibre zonulari radiate s’inseriscono all’equatore della lente e lo connettono con il corpo ciliare; esse mantengono la lente in sede e a quest’ultima trasmettono la trazione del muscolo ciliare.
– MUSCOLO CILIARE: la contrazione dell’anello del muscolo ciliare diminuisce la tensione nelle fibre zonulari. Il cristallino può così raggiungere la forma sferica (con un raggio di curvatura di 5,3 mm) dettata dalla sua naturale conformazione fisico –chimica. Questo cambio nella curvatura della lente è particolarmente pronunciato sulla sua superficie anteriore. La deformazione incrementa il potere refrattivo; il fuoco dell’occhio si sposta per un campo vicino e vengono così visualizzati gli oggetti vicini. Nel momento in cui il muscolo ciliare si rilassa, aumenta la tensione sulla lente e questa si appiattisce. Il risultato è una diminuzione del potere refrattivo e lo spostamento del fuoco dell’occhio sulla distanza, vengono pertanto visualizzati più nitidamente gli oggetti lontani. Il muscolo ciliare è innervato dai nervi ciliari brevi, fibre parasimpatiche postgangliari del nervo oculomotore. Parasimpaticolitici come l’atropina, scopolamina e il ciclopentolato inibiscono la funzione del muscolo ciliare e di conseguenza l’accomodazione. Definiti cicloplegici, questi farmaci causano anche midriasi tramite l’inibizione del muscolo sfintere pupillare. I parasimpaticomimetici come la pilocarpina provocano la contrazione del muscolo ciliare e dello sfintere pupillare, producendo miosi. Quando il muscolo ciliare è al riposo, le fibre della zonula sono sotto tensione e l’occhio focalizza gli oggetti distanti. L’accomodazione è regolata da un sistema di con- trollo, basato sulla nitidezza dell’immagine retinica; il sistema presumibilmente

11 - Ottica e refrazione
usa la dispersione del colore dell’immagine retinica per determinare la direzione in cui l’accomodazione dovrebbe essere corretta.
Intervallo di accomodazione
Si riferisce al massimo aumento del potere refrattivo che è possibile tramite l’accomodazione, espresso in diottrie. In termini matematici, l’intervallo accomoda- tivo è ottenuto sottraendo il potere refrattivo del punto prossimo al valore del punto remoto.
Il punto prossimo è la distanza più piccola alla quale si percepisce definitamente un oggetto; il punto remoto è il punto più lontano al quale un oggetto è ancora definitamente distinguibile. Il punto prossimo e remoto definiscono l’intervallo accomodativo; la sua specifica posizione nello spazio è in funzione del potere refrattivo dell’occhio.
Esempio: in un paziente nel quale il punto prossimo è a 0,1 m e il punto prossimo a 1 metro, l’intervallo accomodativo di questo paziente è di 10 diottrie – 1 diottria = 9 diottrie.
In un occhio emmetrope, il punto remoto è posto all’infinito ma l’accomodazione è in grado di mettere a fuoco gli oggetti vicini. L’elasticità della lente diminuisce con l’aumento dell’età e l’intervallo accomodativo diminuisce in accordo con essa.
La presbiopia (perdita fisiologica dell’accomodazione in età avanzata) inizia quando l’intervallo accomodativo diminuisce sotto le 3 diottrie. La graduale perdita di accomodazione causa l’allontamento del punto prossimo (le braccia del paziente diventano “troppo corte per leggere”). A seconda dell’età e della limitazione dell’accomodazione, la presbiopia può essere compensata tramite lenti convergenti da +0,50 a +3,00 diottrie.
11.4 Adattamento alla luce
Come una fotocamera, anche l’apertura dell’occhio e il sistema di lenti si adattano automaticamente alle differenze nell’intensità della luce per evitare una “sovraesposizione”.
Questo adattamento è effettuato tramite due meccanismi:
L’iride agisce come un’apertura che controlla la quantità di luce che en- tra nell’occhio, questa regolazione impiega circa un secondo e può cambiare l’intensità della luce sulla retina in un intervallo di circa una potenza di dieci.
– La sensibilità della retina cambia per adattarsi alle differenti intensità luminose, essa è regolata in funzione della concentrazione di fotopigmento nei fotorecettori
e dell’attività delle cellule neuronali retiniche. Il cambiamento nell’attività neuronale impiega pochi millisecondi ed è in grado di alterare la sensibilità alla luce della retina in un intervallo di circa tre potenze di dieci. Il cambiamento nella concentrazione del fotopigmento impiega alcuni minuti ma può coprire una vasta gamma di sensibilità della retina alla luce, tanto quanto otto potenze di dieci.
11.5 Test della refrazione
Il test della refrazione consiste in una misura del potere refrattivo addizionale richiesto per produrre un’immagine nitida sulla retina e sono usati metodi soggettivi e oggettivi. Lo scopo dell’esame di refrazione NON E’ come inteso comunemente il raggiungimento di un visus migliore di 10/10, ma la perfetta focalizzazione di tutti i meridiani sulla fovea (conseguentemente a ciò si ha il migliore angolo di risoluzione). Possiamo utilizzare metodi psicofisici soggettivi (dipendenti dalla volontà del paziente) o oggettivi (realizzati indipendentemente dalla volontà del paziente).
METODI SOGGETTIVI: consistono nel posizionare in successione varie combinazioni di lenti davanti all’occhio del paziente fino a che non viene raggiunta la massima acutezza visiva.
METODI OGGETTIVI: essi sono inevitabili quando il paziente non è in grado di fornire informazioni soggettive (per esempio con i bambini) o quando queste informazioni non sono affidabili; questi metodi inoltre accelerano enormemente i test soggettivi di refrazione.
Retinoscopia (test delle ombre)

La parola stessa significa “esame visivo della retina” e lo scopo è quello di determinare e misurare l’errore di rifrazione del soggetto in esame.
In condizioni di scarsa luminosità si illumina la retina attraverso la pupilla con il retinoscopio (vedi a lato lo strumento e stecche per l’esame del grado di refrazione dell’occhio), l’esaminatore osserva quindi il fenomeno ottico nella pupilla del paziente mentre muove la sorgente luminosa.
Proiettando un fascio luminoso nell’occhio si osserva il movimento dell’ombra proiettata sulla superficie retinica e la rifrazione dei raggi emergenti da parte dell’occhio.

11
Refrattometria
Il principio di misurazione è basato sull’osservazione oftalmoscopica di un’immagine test proiettata sulla retina del paziente. Con l’uso di opportune lenti a frontale l’esaminatore varia la distanza tra le figure test (lettere, E di Albini etc.) e l’occhio fino a che l’immagine non si focalizza sulla retina. La refrazione del soggetto in esame è data dal colore delle lenti usate per ottenere il migliore visus corretto per lontano e vicino corrispondente alla curvatura (convergente o divergente) delle lenti stesse..
Autorefrattometria
Il metodo misura automaticamente la refrazione con l’ausilio di sensori di luce e di un computer fino ad ottenere un’immagine focalizzata sulla retina; questi sistemi operano tramite raggi infrarossi. Ogni misurazione oggettiva della refrazione deve essere sempre controllata e verificata da misurazioni soggettive. Speciali metodi di esame sono indicati in presenza di opacizzazione dei mezzi diottrici (come la cataratta), per determinare la potenziale acuità visiva della retina. Questi permettono all’oculista di capire laddove l’ottimizzazione dei mezzi diottrici tramite tecniche come la chirurgia della cataratta possa effettivamente determinare un miglioramento visivo.
11.6 Anomalie di refrazione
Miopia
È un difetto assosimmetrico determinato dalla differenza tra il potere refrattivo dell’intero occhio e la lunghezza assiale del bulbo tale che i raggi paralleli di luce incidenti convergono in un punto focale posto anteriormente alla retina.
EPIDEMIOLOGIA: approssimativamente il 25% delle persone tra i 20 e i 30 anni hanno una refrazione minore di -1 diottria.
EZIOLOGIA: non è chiara, modelli familiari con aumentata incidenza suggeriscono l’influenza di fattori genetici. Molto evidente è la mancata focalizzazione delle immagini sulla retina (deprivazione visiva)
FISIOPATOLOGIA: mentre negli occhi emmetropi i raggi paralleli incidenti confluiscono in un punto posto sulla retina, negli occhi miopi essi convergono in un pun-to focale posto anteriormente, ciò vuol dire che non appaiono immagini chiaramente definite sulla retina quando il paziente guarda a distanza. L’occhio miope è in grado
di produrre immagini nitide sulla retina soltanto di oggetti vicini, dai quali i raggi di luce divergono fino all’entrata nell’occhio.
Nella miopia, il punto remoto (distanza dall’occhio = A) può essere calcolato usando la formula: A(m)=1/D, dove D rappresenta la miopia espressa in diottrie.
Possibili cause comprendono un bulbo eccessivamente lungo con un normale potere refrattivo (miopia assiale) e, meno frequentemente, un eccessivo potere refrattivo con un bulbo di lunghezza assiale normale (miopia refrattiva).
Una differenza di lunghezza del bulbo di 1 mm rispetto al normale corrisponde ad una differenza di 3 diottrie nel potere refrattivo.

SPECIALI FORME DI MIOPIA REFRATTIVA
– Sclerosi miopica del nucleo del cristallino (cataratta) nell’età avanzata; questa causa lo sviluppo di un punto focale secondario, che può condurre alla diplopia monoculare (visione doppia).
Cheratocono (aumento del potere refrattivo corneale).
– Sferofachia (lente a forma di sfera).
Queste forme includono:
– Miopia semplice (dell’età scolare): l’esordio è all’età di 10 - 12 anni, di solito questa miopia non progredisce oltre i 20 anni. La refrazione raramente supera le 6 diottrie, tuttavia esiste anche una miopia progressiva benigna, che si stabilizza solo dopo i 30 anni.
– Miopia patologica. Ereditaria, progredisce continuamente, indipendentemente da influenze esterne.
SINTOMI E CONSIDERAZIONI DIAGNOSTICHE: la diagnosi è fatta sulla base di un tipico quadro clinico ed un esame della refrazione; i pazienti miopi hanno una visione da vicino molto buona. Quando spostano lo sguardo a distanza, essi muovono gli occhi nel tentativo di migliorare la loro acuità visiva non corretta tramite un ulteriore restringimento dell’apertura ottica pupillare. Il termine “miopia” proviene da questo stringere: la parola greca “mueiν” significa stringere o chiudere gli occhi.
I pazienti miopi più anziani possono leggere senza lenti correttive tenendo il materiale da leggere circa alla distanza del punto remoto.
Le tipiche alterazioni morfologiche che si verificano nella miopia sono denominate sindrome miopica; la miopia progressiva in particolare è caratterizzata da un assottigliamento della sclera. L’allungamento del bulbo causa uno spostamento dell’asse dell’occhio che spesso simula l’esotropia. La camera anteriore è profonda, è presente un’atrofia del muscolo ciliare poiché esso è usato duramente ed il volume del corpo vitreo è troppo piccolo per l’occhio, e può collassare prematuramente. Questo si
traduce in opacizzazioni vitreali che il paziente percepisce come corpi mobili; inoltre nella miopia è aumentato il rischio di distacco di retina. A causa dell’aumentato rischio di distacco retinico, i pazienti con miopia dovrebbero essere esaminati in modo particolare per individuare eventuali segni prodromici di distacco, come degenerazioni equatoriali o retiniche. Inoltre, l’esame del fondo in midriasi è indicato sia al momento della prescrizione del primo paio di occhiali sia nei regolari controlli successivi.
TERAPIA: l’eccessivo potere refrattivo dei mezzi diottrici deve essere ridotto e questo si ottiene tramite l’impiego di lenti divergenti (lenti negative o concave). Queste lenti provocano la divergenza al di dietro di esse dei raggi paralleli di luce incidenti. I raggi divergenti convergono su un punto focale virtuale localizzato davanti alla lente. Il potere refrattivo (D) è negativo (da qui il termine “lente negativa”) ed è uguale a 1/f, dove f è la lunghezza focale in metri. In precedenza, venivano usate lenti biconcave o pianoconcave per costruire lenti correttive. Tuttavia, esse comportavano diversi svantaggi ottici. Oggi le lenti sono costruite a forma di un menisco positivo per ridurre le aberrazioni.
CORREZIONE CON LENTI A CONTATTO: offre vantaggi ottici, la riduzione della dimensione delle immagini è minore rispetto alla correzione con gli occhiali. An- che l’aberrazione è ridotta. Questi vantaggi sono clinicamente rilevanti in presenza di una miopia oltre le 3 diottrie.
Le lenti negative usate per la correzione della miopia non dovrebbero essere più forti del necessario né ipocorrettive; sebbene l’accomodazione possa compensare un’ipercorrezione, i pazienti di solito non la tollerano bene. L’astenopia accomodativa (stanchezza oculare rapida) è il risultato di un eccessivo stress causato da una con- trazione cronica del muscolo ciliare atrofico.
La correzione chirurgica della miopia si può ottenere costruendo una lente biuconcava nella cornea mediante Laser ad eccimeri con tre differenti tecniche:
– Cheratectomia Fotorefrattiva (PRK) il trattamento viene effettuato sulla superficie corneale rimuovendo l’epitelio trattando la porzione superficiale dello stroma, tecnica molto semplice, ma più dolorosa e con un tempo di convalescenza e di recupero visivo più lungo.
FemtoLaser in situ cheratomilìeusi (FemtoLASIK ), il trattamento viene effettuato preparando un lembo con un femtolaser all’interno della cornea ed un letto sul quale fare il trattamento, il lembo viene poi riposizionato con un immediato recupero visivo e possibile dolore della durata di poche ore
– Small Incision Lenticule Extraction (SMILE), il trattamento viene effettuato tutto
all’interno della cornea mediante la costruzione di un lenticolo intrastromale in una tasca da cui poi è estratto attraverso una piccolissima incisione. Recupero visivo immediato e dolore possibile per poche ore.
– Intraocular Contact Lens (ICL) o lenti intraoculari fachiche: Sono lenti di collamero (materiale biologico poste all’interno nell’occhio tra cristallino e faccia posteriore dell’ iride, è una correzione chirurgica con immediato recupero visivo e dolore della durata di poche ore.
Ipermetropia
DEFINIZIONE: nell’ipermetropia c’è una discrepanza tra il potere refrattivo e la lunghezza assiale dell’occhio tale che i raggi paralleli di luce incidenti convergono in un punto focale posteriore alla retina. è un difetto assosimmetrico, si distingue una Ipermetropia totale (misurata in cicloplegia) suddivisa in una ipermetropia manifesta (ovvero quella che si riesce a misurare senza cicloplegia) e latente (ovvero la differenza fra l’ipermetropia totale e quella manifesta).

EPIDEMIOLOGIA: circa il 20% dei soggetti tra i 20 e i 30 anni ha una refrazione di oltre +1 diottria. La maggior parte dei neonati mostra una leggera ipermetropia (ipermetropia dell’infanzia) che diminuisce durante i primi anni di vita. Nell’età avanzata, la refrazione tende a spostarsi dal lato miopico a causa della sclerosi del nucleo della lente.
EZIOLOGIA: il meccanismo che coordina lo sviluppo del globo oculare in modo da creare mezzi diottrici di un dato potere refrattivo non è ancora del tutto noto.
FISIOPATOLOGIA: nei pazienti ipermetropi, il punto remoto virtuale dell’occhio è posto dietro la retina e solo raggi di luce convergenti possono essere focalizzati sulla retina. Ciò è dovuto o ad un occhio eccessivamente corto con un potere refrattivo normale (ipermetropia assiale) o, meno frequentemente, ad un potere refrattivo insufficiente in un occhio con lunghezza assiale normale (ipermetropia refrattiva). L’ipermetropia assiale è di solito congenita ed è caratterizzata da una camera anteriore stretta con una sclera spessa e un muscolo ciliare ben sviluppato.
Gli occhi ipermetropi sono predisposti ad un glaucoma acuto da chiusura d’angolo a causa della scarsa profondità della camera anteriore; questo può essere provocato da midriasi diagnostiche o terapeutiche.
FORME SPECIALI DI IPERMETROPIA REFRATTIVA
– Assenza del cristallino (afachia) dovuta ad una dislocazione.
– Afachia post–chirurgica conseguente ad intervento di cataratta senza impianto di una IOL.
Per portare il punto focale sulla retina, un soggetto ipermetrope deve accomodare anche quando guarda a distanza. Gli oggetti vicini restano sfocati poiché l’occhio non è in grado di accomodare ulteriormente nella visione da vicino e dato che l’accomodazione è legata alla convergenza, questo processo può causare un’esotropia (esotropia accomodativa o strabismo convergente accomodativo).
SINTOMI: nei pazienti giovani, l’accomodazione può compensare un’ipermetropia leggera o moderata che causa un abuso cronico del muscolo ciliare. La lettura in particolare può provocare sintomi di astenopia come dolore agli occhi o mal di testa, sensazione di bruciore negli occhi, blefarocongiuntiviti, visione offuscata, e rapido affaticamento visivo. Può verificarsi anche esotropia, come detto sopra. Poiché l’accomodazione diminuisce con l’aumentare dell’età, la visione da vicino diventa sempre più difficile e per questo motivo, i soggetti ipermetropi diventano presbiti più precocemente.
CONSIDERAZIONI DIAGNOSTICHE: l’esame oftalmoscopico del fondo potrebbe rivelare una papilla ottica leggermente sfocata che potrebbe apparire sollevata (pseudoneurite ipermetropica). Ciò non risulta associato ad alcun difetto del campo visivo o a perdite del visus o alterazioni nella distinzione dei colori. La retina risulta troppo larga per l’occhio piccolo, perciò appare una tortuosità delle strutture vascolari
Il muscolo ciliare è cronicamente sotto tensione nell’ipermetropia leggera o moderata per un meccanismo di compenso e questo abuso del muscolo ciliare porta ad una condizione di residuo accomodativo nella quale il muscolo è incapace di rilassarsi anche dopo che l’ipermetropia sia stata corretta con lenti positive. Questo residuo di ipermetropia latente può essere scoperto se il test di refrazione viene effettuato senza prima paralizzare completamente il corpo ciliare con farmaci cicloplegici come il ciclopentolato o l’atropina.
TERAPIA: l’insufficiente potere refrattivo dovrebbe essere aumentato tramite l’uso di lenti convergenti (lenti positive o convesse). Un approccio del tipo “osserva e aspetta” è indicato nei pazienti giovani asintomatici con una leggera ipermetropia. Le lenti sferiche positive convergono i raggi incidenti paralleli di luce in un punto focale dietro la lente, il potere refrattivo (D) è quindi positivo.
Il medico dovrebbe determinare il grado totale di ipermetropia presente prima di prescrivere lenti correttive; il secondo passaggio è prescrivere le lenti positive più forti che il paziente è in grado di tollerare senza compromettere l’acuità visiva. Bisognerebbe prestare attenzione a non sotto-correggere il paziente.
Prima di qualsiasi correzione dell’ipermetropia, dovrebbe essere eseguito un test
della refrazione in cicloplegia. La correzione viene quindi effettuata con la lente positiva più forte che il paziente può soggettivamente tollerale senza compromettere l’acuità visiva.
La correzione chirurgica della ipermetropia si può ottenere costruendo una lente biconvessa nella cornea mediante Laser ad eccimeri con tre differenti tecniche:
– Cheratectomia Fotorefrattiva (PRK) il trattamento viene effettuato sulla superficie corneale rimuovendo l’epitelio trattando la porzione superficiale dello stroma, tecnica molto semplice, ma più dolorosa e con un tempo di convalescenza e di recupero visivo più lungo.
–
FemtoLaser in situ cheratomilìeusi (FemtoLASIK ), il trattamento viene effettuato preparando un lembo con un femtolaser all’interno della cornea ed un letto sul quale fare il trattamento, il lembo viene poi riposizionato con un immediato recupero visivo e possibile dolore della durata di poche ore
Small Incision Lenticule Extraction (SMILE), il trattamento viene effettuato tutto all’interno della cornea mediante la costruzione di un lenticolo intrastromale in una tasca da cui poi è estratto attraverso una piccolissima incisione. Recupero visivo immediato e dolore possibile per poche ore.

Intraocular Contact Lens (ICL) o lenti intraoculari fachiche: Sono lenti di collamero (materiale biologico poste all’interno nell’occhio tra cristallino e faccia posteriore dell’ iride, è una correzione chirurgica con immediato recupero visivo e dolore della durata di poche ore. Prima di effettuare l’impianto è necessario effettuare una iridectomia basale profilattica per prevenire gli attacchi di glaucoma acuto da blocco pupillare.
Astigmatismo
DEFINIZIONE: il termine deriva dalla parola greca “stigma” (punto) e letteralmente significa mancanza di un punto focale. La patologia è caratterizzata da una curvatura anomala dei mezzi refrattivi su tutti i meridiani tale che i raggi paralleli di luce incidente non convergono in un punto ma formano una linea, è un difetto anassosimmetrico.
EPIDEMIOLOGIA: il 42% delle persone ha un astigmatismo maggiore o uguale a 0.50 diottrie; in circa il 20% dei casi questo è maggiore di una diottria e richiede una correzione ottica.
FISIOPATOLOGIA: i mezzi diottrici dell’occhio astigmatico non sono sferici, ma rifrangono differentemente lungo due meridiani perpendicolari tra loro. Qualsiasi quantità di astigmatismo assiale introduce un conoide di Sturm nel sistema dell’immagine che produce due punti focali. Un oggetto puntiforme è quindi rappresentato
come un segmento di linea ben definito al punto focale del primo meridiano, ma appare anche come un segmento di linea ben definito ruotato di 90° al punto focale del secondo meridiano. In mezzo a questi due punti focali c’è il “cerchio di minor confusione” che è riferito al punto in cui l’immagine risulta egualmente distorta in ogni direzione, o meglio, il punto di minima perdita nella definizione dell’immagine La somma dei componenti astigmatici di tutti i mezzi diottrici comprendono l’astigmatismo totale dell’occhio. Questi includono:
– superficie anteriore della cornea;
– superficie posteriore della cornea;
– superficie anteriore del cristallino;
– superficie posteriore del cristallino. Raramente, curvature non sferiche della retina possono contribuire all’insorgenza di un astigmatismo.
CLASSIFICAZIONE E CAUSE: l’astigmatismo può essere classificato come segue:
– Esterno: astigmatismo della superficie anteriore della cornea.
– Interno: la somma dei componenti astigmatici degli altri mezzi diottrici; la somma dell’astigmatismo ed il suo asse possono cambiare durante la vita.
– L’astigmatismo può anche essere classificato in accordo con la localizzazione del meridiano di maggior potere:
– Astigmatismo secondo regola: (la forma più frequente) il meridiano con il potere maggiore è verticale e compreso tra 70° e 110°.
– Astigmatismo contro regola: meridiano con potere maggiore orizzontale compreso tra 160° e 200°.
– Astigmatismo obliquo: meridiano con potere maggiore obliquo, compreso tra 20°70° e 110°-160°.
Le condizioni sopra citate devono essere distinte dall’astigmatismo irregolare.
In questo caso, la curvatura e il potere refrattivo dei mezzi diottrici oculari sono completamente irregolari. Sono presenti molteplici punti focali, che producono un’immagine completamente sfocata sulla retina. Questa condizione può essere causata dalle seguenti patologie:
– ulcere corneali con cicatrici;
– traumi corneali penetranti;
cheratocono avanzato;
cataratta;
– lenticono.
SINTOMI: i pazienti con astigmatismo vedono tutto distorto; il tentativo di compensare gli errori refrattivi con l’accomodazione si risolve in sintomi astenopici come bruciori oculari e mal di testa.
CONSIDERAZIONI DIAGNOSTICHE: il cheratoscopio (disco di Placido) per- mette una grossolana valutazione dell’astigmatismo dove l’esaminatore valuta le immagini riflesse di anelli sulla cornea del paziente (vedi ‘topografia’). Nell’astigmatismo regolare questi anelli sono ovali; in quello irregolare sono distorti in modo irregolare. La topografia corneale computerizzata (videocheratoscopia) può essere utilizzata per ottenere un’immagine della distribuzione dei valori refrattivi lungo tutta la cornea. L’oftalmometro di Javal o di Helmotz può essere usato per misurare la curvatura corneale centrale, la quale determina il potere refrattivo della cornea.
TERAPIA: è fondamentale una correzione precoce; un astigmatismo non trattato nei bambini può condurre ad un’ambliopia refrattiva incorreggibile, dato che non viene proiettata un’immagine nitida sulla retina.
TRATTAMENTO DELL’ASTIGMATISMO REGOLARE: lo scopo della correzione è di portare le “linee focali” dei due meridiani principali insieme sul punto focale. Ciò richiede una lente che rifrange solo su un piano e per questa applicazione sono richieste lenti cilindriche. Una volta che le linee focali sono state fatte convergere sul punto focale, possono essere impiegate lenti sferiche addizionali per spostare questo punto focale sulla retina se necessario.
La correzione chirurgica dell’astigmatismo regolare si può ottenere costruendo una lente biconvessa nella cornea mediante Laser ad eccimeri con tre differenti tecniche:
Cheratectomia Fotorefrattiva (PRK) il trattamento viene effettuato sulla superficie corneale rimuovendo l’epitelio trattando la porzione superficiale dello stroma, tecnica molto semplice, ma più dolorosa e con un tempo di convalescenza e di recupero visivo più lungo trattandosi di un trattamento di superficie consente di eliminare valori di astigmatismo più bassi (2D).
– FemtoLaser in situ cheratomilìeusi (FemtoLASIK ), il trattamento viene effettuato preparando un lembo con un femtolaser all’interno della cornea ed un letto sul quale fare il trattamento, il lembo viene poi riposizionato con un immediato recupero visivo e possibile dolore della durata di poche ore, si riesce a correggere valori di astigmatismo più elevati (3,5-4D).
– Small Incision Lenticule Extraction (SMILE), il trattamento viene effettuato tutto all’interno della cornea mediante la costruzione di un lenticolo intrastromale in una tasca da cui poi è estratto attraverso una piccolissima incisione. Recupero visivo

11 - Ottica e refrazione immediato e dolore possibile per poche ore, si riesce a correggere valori di astigmatismo più elevati (3,5-4D)..
Toric Intraocular Contact Lens (ICL) o lenti intraoculari fachiche con curvatura torica (astigmatica): Sono lenti di collamero (materiale biologico) poste all’interno nell’occhio tra cristallino e faccia posteriore dell’ iride, è una correzione chirurgica con immediato recupero visivo e dolore della durata di poche ore. Prima di effettuare l’impianto è necessario effettuare una iridectomia basale profilattica per prevenire gli attacchi di glaucoma acuto da blocco pupillare si riesce a correggere totalmente valori di astigmatismo anche i più elevati (7-8D)..
TRATTAMENTO DELL’ASTIGMATISMO IRREGOLARE: questa forma non può essere corretta tramite occhiali. L’astigmatismo esterno può essere gestito con lenti a contatto rigide, cheratoplastica, o correzione chirurgica dell’errore refrattivo. L’astigmatismo interno irregolare è usualmente collegato al cristallino. In questo caso, è indicata la sua rimozione con successivo impianto di una lente intraoculare. Pertanto, solo l’astigmatismo regolare può essere corretto tramite occhiali. Un trattamento chirurgico dell’astigmatismo irregolare può essere fatto con Cheratectomia Fotorefrattiva terapeutica (PTK) il trattamento viene effettuato sulla superficie corneale rimuovendo l’epitelio trattando la porzione superficiale dello stroma regolarizzandone la curvatura usando una tecnica molto semplice passando uno strumento smusso sulla cornea bagnata con BSS, le aree asciutte vengono trattate quelle bagnate no, oppure si può utilizzare un Laser ad eccimeri guidato da un topografo (TOSCA) o un aberrometro (WASCA), è tecnica molto semplice, ma molto dolorosa e con un tempo di convalescenza e di recupero visivo più lungo trattandosi di un trattamento di superficie consente di eliminare valori di astigmatismo irregolare o cicatrici corneali superficiali.
Letture consigliate
1) Ottica, refrazione e occhiali - Nell’adulto e nel bambino, dalla lente monofocale alla lente multifocale. Luigi Mele, Andrea Piantanida, Mario Bifani
2) Correzioni ottiche dai difetti visivi - Nell’adulto e nel bambino, dalla teoria alla pratica. Luigi Mele, Andrea Piantanida, Mario Bifani
Bibliografia
– Organi di senso - Manuale per l’approccio integrato alle patologie testa – collo di Polimeni - De Vincentiis - Lambiase – Valentini 2019 Ed. Edra – Masson
Kanski - Oftalmologia Clinica Kanski - Bowling – Azzolini 2019 Ed. Edra – Masson
– Manuale di oftalmologia Luciano Liuzzi Franco Bartoli 2002 ED. Minerva Medica
– I vizi di refrazione: diagnosi e correzione. Gian Paolo Paliaga 1971 Ed. Minerva Medica
Manuale di perimetria Guido Corallo 2017 Ed. Società Editrice Universo
– Anatomia dell’occhio e dell’orbita. Fondamenti clinici Thomas F. Freddo, Edward Chaum, Raffaele Nuzzi 2019 Ed. Edizioni Medico Scientifiche
– Manuale di oftalmologia Luciano Liuzzi Franco Bartoli 2002 ED. Minerva Medica
– Patologia dei tumori oculari Feliciano Baldi 1988 Ed. Idelson Gnocchi
– Atlante di anatomia chirurgica della faccia e del collo. Vol. 1: Palpebre, orbita, vie lacrimali, naso, seni paranasali. Yves Saban, Roberto Polselli, Francesca Montemagno 2018 Ed. Acta Medica Edizioni,
Cornea - Sclera, Congiuntiva e Annessi: Krachmer - Mannis – Holland 2013, Ed. Verduci.
– Uveiti ed altre flogosi oculari: Savino D’Amelio 2017, Ed. Fabiano Editore
– IOL in Chirurgia della Cataratta Lucio Buratto, Domenico Boccuzzi 2017, Ed. Fabiano Editore
Elettrofisiologia di Base: E.M. Vingolo, S. Lupo, S. Salvatore 2008, Ed. Fabiano Editore
– The Retinal Atlas Freund MD, K. Bailey, Sarraf MD, David, Mieler MD, William F, Yannuzzi MD, Lawrence A. 2016 Ed Elsevier.
Atlas of Retinal OCT: Optical Coherence Tomography, Darin Goldman & Nadia K Waheed & Jay S. Duker
– Clinical Ocular Pharmacology, Jimmy D. Bartlett & Siret D. Jaanus 2007 Ed. Elsevie
– Glaucoma Tarek Shaarawy & Mark B. Sherwood & Roger A. Hitchings & Jonathan G. Crowston 2014 Ed. Elsevier
– Il glaucoma Roberto Carassa, Stefano Gandolfi, Stefano Miglior2002, Ed. Fabiano Editore
– Manuale pratico di vision care. L’ipermetropia e la sua correzione ottica. Dalla teoria alla pratica Luigi Mele, Andrea Piantanida Mario Bifani 2019 Ed. Fabiano Editore
I Vizi Di Refrazione: G.P. Paliaga 2008 Ed. Minerva Medica.

