
13 minute read
Leggi - Modifica tenori massimi citrinina negli integratori - Rettifica sul Re golamento 2019/1870 - Sono state pubblicate le conclusioni sulle migliori tecniche diponibili per l’industria - Modifica del livello di acido oleico nell’o lio di semi di coriandolo - Modifiche relative alla produzione e all’etichetta tura dei prodotti biologici - Autorizzazione di un nuovo alimento
Sulla Gazzetta ufficiale dell’Unione europea L 293 del 14 novembre 2019 è stato pubblicato il Regolamento (UE) 2019/1901 della Commissione del 7 novembre 2019 che modifica il regolamento (CE) n. 1881/2006 per quanto riguarda i tenori massimi di citrinina negli integratori alimentari a base di riso fermentato con lievito rosso Monascus purpureus. (…) A seguito della richiesta di un parere scientifico sui rischi sanitari della citrinina negli alimenti e nei mangimi presentata dalla Commissione, il gruppo di esperti scientifici sui contaminanti nella catena alimentare dell’Autorità europea per la sicurezza alimentare («l’Autorità») ha adottato, il 2 marzo 2012, un parere sui rischi per la salute pubblica e animale connessi alla presenza di citrinina negli alimenti e nei mangimi. Il gruppo di esperti sui contaminanti ha concluso che, sulla base dei dati disponibili, non si poteva escludere che la citrinina, a livelli non preoccupanti per la nefrotossicità, comporti comunque un rischio sul piano della genotossicità e della cancerogenicità. (…) Dai nuovi dati riguardanti la presenza della citrinina risulta che non è necessario stabilire tenori massimi di citrinina negli alimenti diversi dagli integratori a base di lievito di riso rosso. Per quanto riguarda la presenza della citrinina negli integratori alimentari contenenti lievito rosso Monascus pur
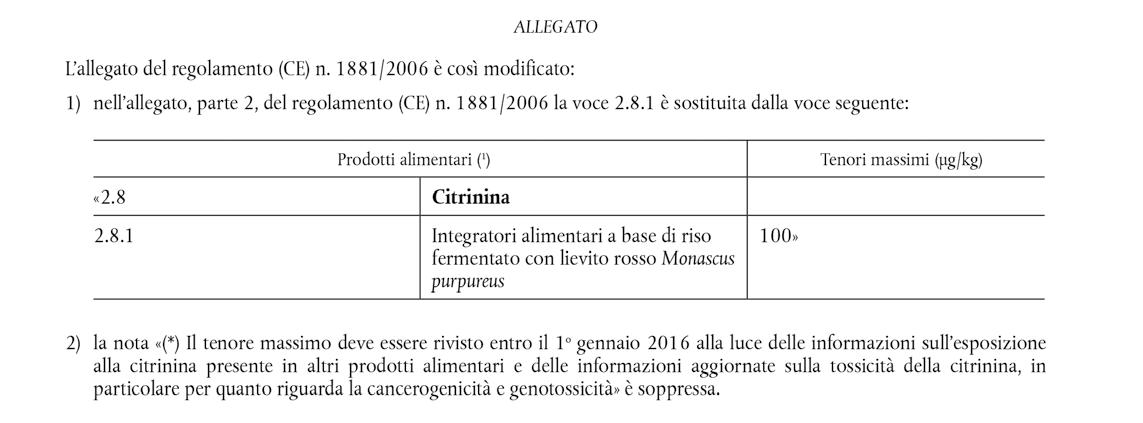
pureus, i dati rappresentativi ottenuti dimostrano tuttavia che il tenore massimo dovrebbe essere abbassato. (…) La Commissione europea ha adottato il presente regolamento: Articolo 1 L’allegato del regolamento (CE) n. 1881/2006 è modificato conformemente all’allegato del presente regolamento. Articolo 2 Gli integratori alimentari a base di riso fermentato con lievito rosso Monascus purpureus immessi legalmente sul mercato prima dell’entrata in vigore del presente regolamento possono rimanere sul mercato fino al termine minimo di conservazione o alla data di scadenza.
Rettifica sul Regolamento 2019/1870
Sulla Gazzetta ufficiale dell’Unione europea L298 del 19 novembre 2019 è stata pubblicata la Rettifica del regolamento (UE) 2019/1870 della Commissione, del 7 novembre
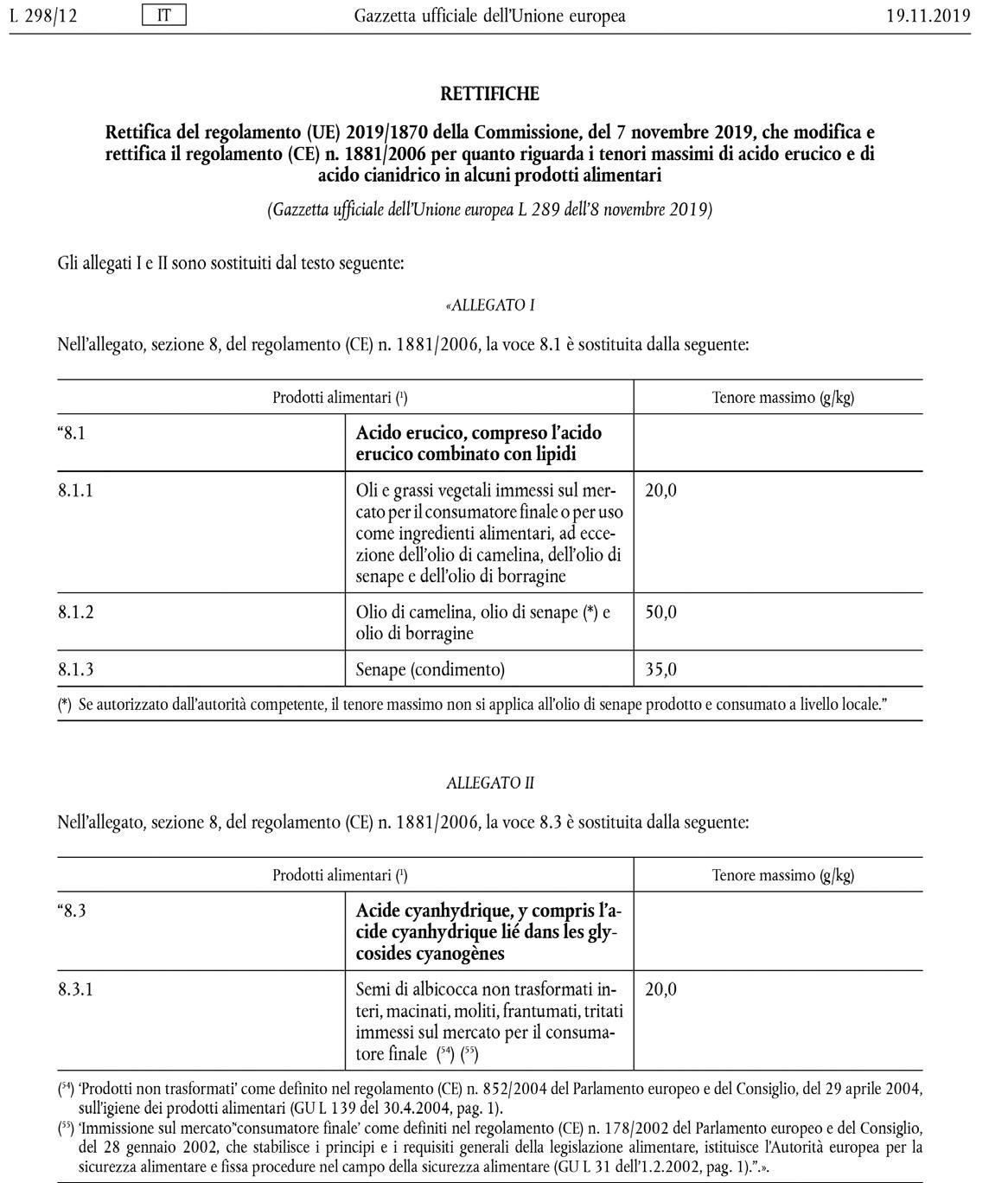
2019, che modifica e rettifica il regolamento (CE) n. 1881/2006 per quanto riguarda i tenori massimi di acido erucico e di acido cianidrico in alcuni prodotti alimentari.
(Gazzetta ufficiale dell’Unione europea L 289 dell’8 novembre 2019)
Gli allegati I e II sono sostituiti dal testo riportato.
Sono state pubblicate le conclusioni sulle migliori tecniche disponibili per l’industria
Sulla Gazzetta ufficiale dell’Unione europea L 313 del 4 dicembre 2019 è stata pubblicata la Decisione di esecuzione (UE) 2019/2031 della Commissione del 12 novembre 2019 che stabilisce le conclusioni sulle migliori tecniche disponibili (BAT) per le industrie degli alimenti, delle bevande e del latte, ai sensi della direttiva 2010/75/UE del Parlamento europeo e del Consiglio.
La Commissione europea, visto il trattato sul funzionamento dell’Unione europea, vista la direttiva 2010/75/UE del Parlamento europeo e del Consiglio, del 24 novembre 2010, relativa alle emissioni industriali (prevenzione e riduzione integrate dell’inquinamento), in particolare l’articolo 13, paragrafo 5, considerando quanto segue: 1. Le conclusioni sulle migliori tecniche disponibili (Best Available Techniques, BAT) fungono da riferimento per stabilire le condizioni di autorizzazione per le installazioni di cui al capo II della direttiva 2010/75/UE e le autorità competenti dovrebbero fissare valori limite di emissione tali da garantire che, in condizioni di esercizio normali, non si superino i livelli di emissione associati alle migliori tecniche disponibili indicati nelle conclusioni sulle BAT. 2. Il forum composto da rappresentanti degli Stati membri, delle industrie interessate e delle organizzazioni non governative che promuovono la protezione dell’ambiente, istituito con decisione della Commissione del 16 maggio 2011, ha trasmesso alla Commissione il 27 novembre 2018 il proprio parere in merito al contenuto proposto del documento di riferimento sulle BAT per le industrie degli alimenti, delle bevande e del latte. Il parere è accessibile al pubblico. 3. Le conclusioni sulle BAT di cui all’allegato della presente decisione costituiscono il nucleo del suddetto documento di riferimento sulle BAT. 4. Le misure di cui alla presente decisione sono conformi al parere del comitato istituito a norma dell’articolo 75, paragrafo 1, della direttiva 2010/75/ UE, ha adottato la presente decisione: Articolo 1 Sono adottate le conclusioni sulle migliori tecniche disponibili (BAT) per le industrie degli alimenti, delle bevande e del latte riportate in allegato (consultabile al seguente link: https:// eur-lex.europa.eu/legal-content/ T/TXT/PDF/?uri=CELEX: - 32019D2031&from=IT)
Modifica del livello di acido oleico nell’olio di semi di coriandolo
Sulla Gazzetta ufficiale dell’Unione europea L 328 del 18 dicembre 2019 è stato pubblicato il Regolamento di esecuzione (UE) 2019/2165 della Commissione del 17 dicembre 2019 che autorizza la modifica delle specifiche del nuovo alimento olio di semi di coriandolo da Coriandrum sativum a norma del regolamento (UE) 2015/2283 del Parlamento europeo e del Consiglio e che modifica il regolamento di esecuzione (UE) 2017/2470 della Commissione. (…) Il 2 luglio 2019 la società Ovalie Innovation («il richiedente») ha presentato alla Commissione una domanda di modifica delle specifiche dell’olio di semi di coriandolo da Coriandrum sativum in conformità all’articolo 10, paragrafo 1, del regolamento (UE) 2015/2283. Il richiedente ha chiesto di ridurre il livello minimo dell’acido oleico dall’attuale 8,0% al 7,0%.
Il richiedente ha motivato la richiesta affermando che la modifica è necessaria al fine di riflettere la variazione naturale dei livelli di acido oleico osservati nella pianta Coriandrum sativum. La Commissione non ritiene necessario che la domanda attuale sia sottoposta a una valutazione della sicurezza da parte dell’Autorità europea per la sicurezza alimentare («l’Autorità») in conformità all’articolo 10, paragrafo 3, del regolamento (UE) 2015/2283. L’acido oleico è la principale componente naturale dell’olio d’oliva. Esso è naturalmente presente, a livelli identici a quelli proposti per il nuovo ali
mento, in una serie di altri alimenti di base che da molto tempo vantano un consumo sicuro.
La modifica proposta dei livelli dell’acido oleico dell’olio di semi di coriandolo da Coriandrum sativum non modifica le conclusioni della valutazione della sicurezza effettuata dall’Autorità, che ne ha sostenuto l’autorizzazione con la decisione di esecuzione 2014/155/UE. È pertanto opportuno modificare le specifiche del nuovo alimento «olio di semi di coriandolo da Coriandrum sativum» con il livello proposto per l’acido oleico. (…) La Commissione ha adottato il presente regolamento: Articolo 1 L’elenco dell’Unione dei nuovi alimenti autorizzati, quale previsto all’articolo 6 del regolamento (UE) 2015/2283 e incluso nel regolamento di esecuzione (UE) 2017/2470, contenente il riferimento al nuovo alimento olio di semi di coriandolo da Coriandrum sativum, è modificato come specificato nell’allegato del presente regolamento.

Sulla Gazzetta ufficiale dell’Unione europea L328 del 18 dicembre 2019 è stato pubblicato il Regolamento di esecuzione (UE) 2019/2164 della Commissione del 17 dicembre 2019 che modifica il regolamento (CE) n. 889/2008 recante modalità di applicazione del regolamento (CE) n. 834/2007 del Consiglio relativo alla produzione biologica e all’etichettatura dei prodotti biologici, per quanto riguarda la produzione biologica, l’etichettatura e i controlli. (…) considerando quanto segue: Conformemente all’articolo 16, paragrafo 3, lettera b), del regolamento (CE) n. 834/2007, vari Stati membri hanno trasmesso alla Commissione e agli altri Stati membri fascicoli relativi a talune sostanze affinché vengano autorizzate e inserite negli allegati I, II, VI e VIII del regolamento (CE) n. 889/2008 della Commissione. I fascicoli sono stati esaminati dal gruppo di esperti chiamati a fornire una consulenza tecnica sulla produzione biologica (EGTOP) e dalla Commissione. Nelle raccomandazioni relative ai concimi il gruppo EGTOP ha concluso, tra l’altro, che le sostanze «biochar», «gusci di molluschi» e «gusci d’uovo» e «acidi umici e fulvici» sono conformi agli obiettivi e ai principi della produzione biologica. È pertanto opportuno inserire tali sostanze nell’allegato I del regolamento (CE) n. 889/2008. Il gruppo EGTOP ha inoltre raccomandato di chiarire la definizione di «carbonato di calcio» figurante in tale allegato.
Nelle raccomandazioni relative ai prodotti fitosani- tari il gruppo EGTOP ha concluso, tra l’altro, che le so- stanze «maltodestrina», «perossido di idrogeno», «ter- peni (eugenolo, geraniolo e timolo)», «cloruro di so- dio», «cerevisane» e piretrine ottenute da piante diver- se dal Chrysanthemum cinerariaefolium sono conformi agli obiettivi e ai principi della produzione biologica. È pertanto opportuno inserire tali sostanze nell’allegato II del regolamento (CE) n. 889/2008. Il gruppo EGTOP ha inoltre formulato raccomandazioni in meri- to alla struttura di tale allegato.
Nelle raccomandazioni relative ai mangimi il gruppo EGTOP ha concluso, tra l’altro, che le so- stanze «gomma di guar» come additivo per mangi- mi, «estratto di castagno» come additivo organolet- tico e «betaina anidra» per animali monogastrici e soltanto di origine naturale o biologica sono confor- mi agli obiettivi e ai principi della produzione bio- logica. È pertanto opportuno inserire tali sostanze nell’allegato VI del regolamento (CE) n. 889/2008. In tale allegato il riferimento ad alcuni additivi per insilati è ambiguo ed è necessario chiarirlo per evi- tare confusione.
Nelle raccomandazioni relative agli alimenti (6) il gruppo EGTOP ha concluso che le sostanze «glicero- lo» come agente umidificante nelle capsule di gela- tina e nella pellicola di rivestimento delle compres- se, «bentonite» come ausiliare di fabbricazione, «(L+) acido lattico» e «idrossido di sodio» come ausilia- re di fabbricazione per l’estrazione di proteine vege- tali, «gomma di tara in polvere» come addensante e «estratto di luppolo» ed «estratto di colofonia» nella produzione di zucchero sono conformi agli obiettivi e ai principi della produzione biologica. È pertanto opportuno inserire tali sostanze nell’al- legato VIII del regolamento (CE) n. 889/2008. Per la gomma di tara in polvere, le lecitine, il glicerolo, la fa- rina di semi di carrube, la gomma di gellano, la gom- ma arabica, la gomma di guar e la cera di carnauba, il gruppo EGTOP ha inoltre raccomandato che tali so- stanze siano ottenute con il metodo di produzione biologico. Affinché gli operatori dispongano di suffi- ciente tempo per adeguarsi a tale nuovo requisito, è opportuno prevedere un periodo transitorio di tre anni. (…) La Commissione ha adottato il regolamento con- sultabile al link: https://eur-lex.europa.eu/legal-content/IT/TX- T/?uri=uriserv:OJ.L_.2019.328.01.0061.01. ITA&toc=OJ:L:2019:328:TOC
Autorizzazione di un nuovo alimento
Sulla Gazzetta ufficiale dell’Unione europea L 7 del 13 gennaio 2020 è stato pubblicato il Regolamento di esecuzione (UE) 2020/16 della Commissione del 10 gennaio 2020 che autorizza l’immissione sul mercato del nicotinamide riboside cloruro quale nuovo alimento a norma del regolamento (UE) 2015/2283 del Parlamento europeo e del Consiglio e che modifica il regolamento di esecuzione (UE) 2017/2470 della Commissione. (…) Il 10 maggio 2018 la società ChromaDex Inc. («il richiedente») ha presentato alla Commissione una domanda di immissione sul mercato dell’Unione del nicotinamide riboside cloruro quale nuovo alimento ai sensi dell’articolo 10, paragrafo 1, del regolamento (UE) 2015/2283. La domanda riguardava l’uso di nicotinamide riboside cloruro come fonte di niacina negli integratori alimentari destinati alla popolazione adulta in generale a livelli di utilizzo massimi di 300 mg/ giorno. Con tale domanda è stata chiesta inoltre l’aggiunta della nicotinamide riboside, come fonte di niacina, all’elenco delle forme di niacina specificate nell’allegato II della direttiva 2002/46/CE del Parlamento europeo e del Consiglio.
Il richiedente ha presentato alla Commissione anche una richiesta di tutela dei dati oggetto di proprietà industriale per una serie di studi forniti a sostegno della domanda, cioè uno studio in vitro che valuta il metabolismo della nicoti

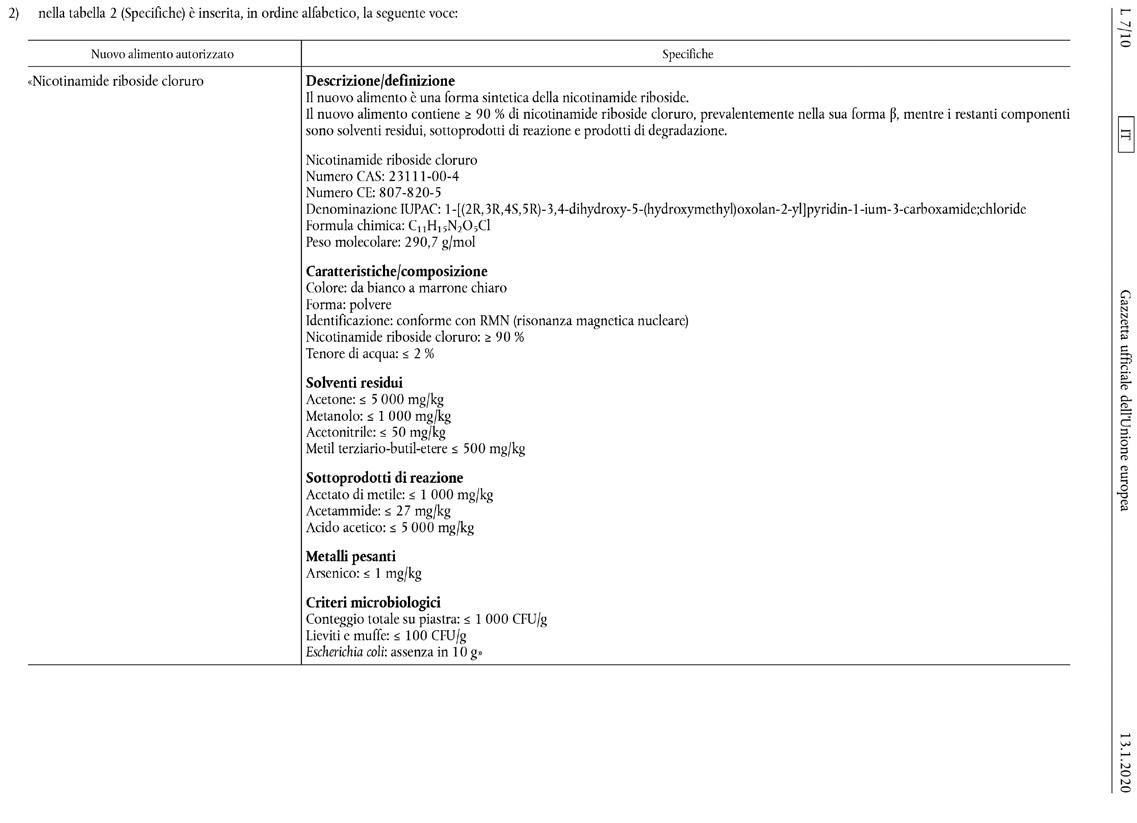
namide riboside nel sangue (studio n. 160312); uno studio della tossicità orale per determinare i dosaggi per 7 giorni in cani giovani (studio n. 17-921); un test di screening hERG (studio n. 20151223); uno studio della tossicità orale con somministrazione ripetuta di dosi per 28 giorni in cani giovani (studio n. 17-940); uno studio della tossicità orale con somministrazione ripetuta di dosi per 90 giorni nei ratti Sprague Dawley (studio n. S14022); uno studio della tossicità per la riproduzione (studio n. G10959) e uno studio della tossicità per lo sviluppo nei ratti (studio n. G10957). (…) Nel suo parere l’Autorità ha concluso che il nicotinamide riboside
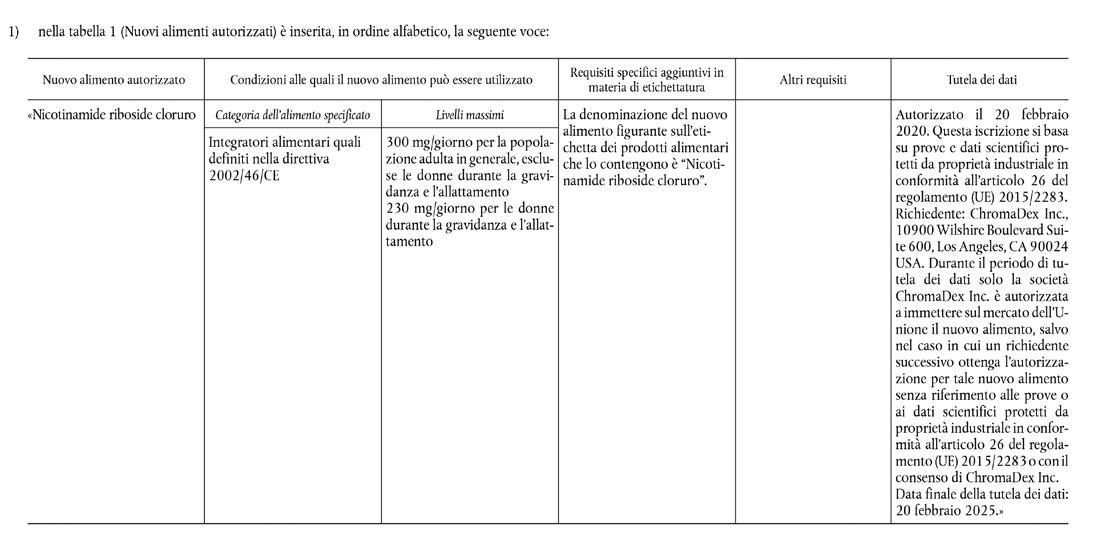
cloruro è sicuro quando è utilizzato negli integratori alimentari al livello massimo di 300 mg/giorno per la popolazione adulta in generale, escluse le donne durante la gravidanza e l’allattamento, e al livello massimo di 230 mg/giorno per le donne durante la gravidanza e l’allattamento. (…) La Commissione europea ha adottato il presente regolamento: Articolo 1 1. Il nicotinamide riboside cloruro, quale specificato nell’allegato del presente regolamento, è inserito nell’elenco dell’Unione dei nuovi alimenti autorizzati istituito dal regolamento di esecuzione (UE) 2017/2470. 2. Per un periodo di cinque anni a decorrere dalla data di entrata in vigore del presente rego
lamento, solo il richiedente iniziale: - la società: ChromaDexInc., - indirizzo: 10900 Wilshire Boulevard Suite 600, Los Angeles, CA 90024 USA, è autorizzato a immettere sul mercato dell’Unione il nuovo alimento di cui al paragrafo 1, salvo nel caso in cui un richiedente successivo ottenga l’autorizzazione per il nuovo alimento senza riferimento ai dati protetti a norma dell’articolo 2 del presente regolamento o con il consenso di ChromaDex Inc. 3. La voce figurante nell’elenco dell’Unione di cui al paragrafo 1 comprende le condizioni d’uso e i requisiti in materia di etichettatura indicati nell’allegato del presente regolamento. 4. L’autorizzazione di cui al presente articolo lascia impregiudica
te le disposizioni della direttiva 2002/46/CE. Articolo 2 Gli studi contenuti nel fascicolo di domanda, in base ai quali l’Autorità ha valutato il nuovo alimento di cui all’articolo 1, che secondo il richiedente sono protetti da proprietà industriale e senza i quali il nuovo alimento non avrebbe potuto essere autorizzato, non possono essere utilizzati senza il consenso di ChromaDex Inc. a vantaggio di un richiedente successivo per un periodo di cinque anni a decorrere dalla data di entrata in vigore del presente regolamento. Articolo 3 L’allegato del regolamento di esecuzione (UE) 2017/2470 è modificato conformemente all’allegato del presente regolamento.











notizie sempre aggiornate dal mondo del food&beverage
Agenda AITA Alcolici Alimenti Analcolici Analisi Controllo Aziende Bevande Birra Cereali Agenda AITA Alcolici Alimenti Analcolici Analisi Controllo Aziende Agenda













Convegni Elett ronica Automazione Energia Sostenibilità Igiene Ambienti Imballaggi Ingredienti Leggi Norme Libri Macchine Strumenti Macinazione Mangimi Mercati Consumi Noti zie Nutrizione Pasta Ricerca Applicata Salute e Benessere Sicurezza Alimentare Vino Convegni Elett ronica Automazione Energia Sostenibilità Igiene Ambienti Imballaggi Ingredienti Leggi Norme Mangimi Mercati Consumi Noti zie Nutrizione Pasta Ricerca Applicata Salute e Benessere Convegni Mangimi



