CHUYÊN ĐỀ DẠY THÊM
HÓA HỌC 11
1. Trạng thái tự nhiên.
CHƯƠNG 2: NITROGEN VÀ SULFUR
BÀI 3: ĐƠN CHẤT NITROGEN (Thời gian thực hiện: tiết)
Ths Nguyễn Thanh Tú
eBook Collection
vectorstock com/28062440

CHUYÊN ĐỀ DẠY THÊM HÓA HỌC 11 - SÁCH
MỚI NĂM 2023 (CHƯƠNG 2 NITROGEN VÀ SULFUR) BÀI TẬP VẬN DỤNG TỰ LUẬN - TRẮC
NGHIỆM - BÀI TẬP THEO CẤP ĐỘ
WORD VERSION | 2024 EDITION
ORDER NOW / CHUYỂN GIAO QUA EMAIL
TAILIEUCHUANTHAMKHAO@GMAIL COM
Ở trạng thái tự nhiên, nitrogen tồn tại ở dạng đơn chất và hợp chất.
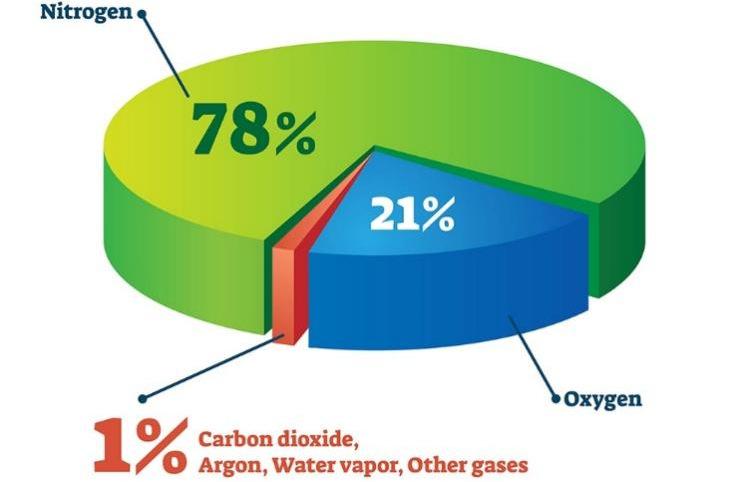
- Ở dạng đơn chất, nitrogen chiếm khoảng 78% thể tích không khí. Nitrogen trong tự nhiên là hỗn hợp của hai đồng vị 14 7 N (99,63%) và 15 7 N (0,37%).
- Ở dạng hợp chất, nitrogen có nhiều trong khoáng vật sodium nitrate (NaNO3) với tên gọi là diêm tiêu Chile. Nitrogen có trong cơ thểđộng vật và thực vật là thành phần cấu tạo của protein, nucleic acid… và trong cơ thể người chiếm khoảng 3% khối lượng.
2. Cấu tạo nguyên tử và phân tử.
- Nguyên tố nitrogen ở ô số 7, nhóm VA, chu kì 2 trong bảng tuần hoàn, độ âm điện là 3,04 và là phi kim điển hình.
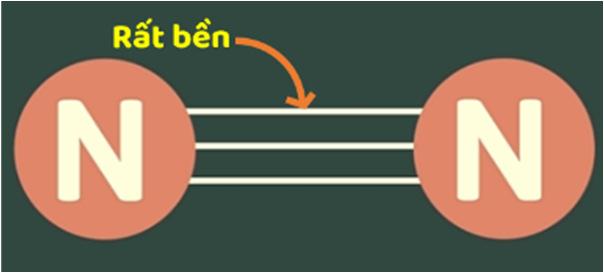
- Phân từ nitrogen N2 có chứa liên kết ba giữa hai nguyên tử nitrogen ( 1 liên kết σ và 2 liên kết π).
3. Tính chất vật lí.
- Ở điều kiện thường, nitrogen là chất khí không màu, không mùi, không vị, hơi nhẹ hơn không khí, hóa lỏng ở -1960C và hóa rắn ở -2100C và khí nitrogen rất ít tan trong nước. Nitrogen không duy trì sự cháy và sự hô hấp.
4. Tính chất hóa học.
Tài liệu chuẩn tham khảo
Phát triển kênh bởi
Ths Nguyễn Thanh Tú
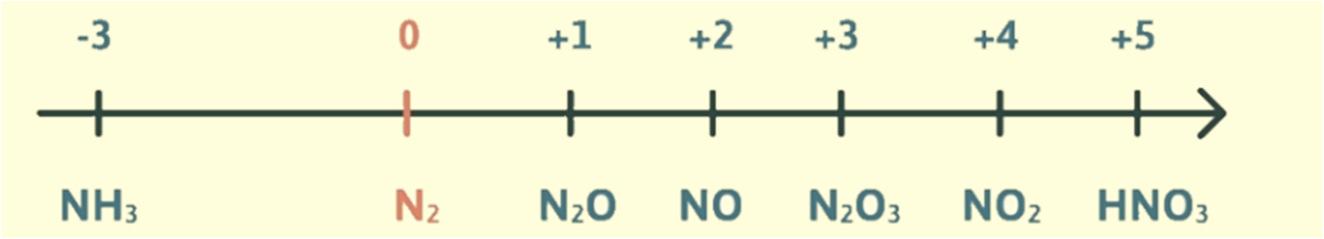
Đơn vị tài trợ / phát hành / chia sẻ học thuật :
Nguyen Thanh Tu Group
Hỗ trợ trực tuyến
Fb www.facebook.com/DayKemQuyNhon
Mobi/Zalo 0905779594
1
Ở nhiệt độ thường, phân tử nitrogen rất bền (do có chứa liên kết ba) nên khá trơ về mặt hóa
học, chỉ tác dụng với Lithium.
6Li(s) + N2(g) → 2Li3N(s)
Trong các điều kiện thích hợp, nitrogen chủ yếu thể hiện tính oxi hóa, nitrogen thể hiện tính
khử khi tác dụng với oxygen.
a/ Tính oxi hoá:
+ Nitrogen tác dụng với kim loại mạnh
3Mg(s) + N2(g) Mg3N2(s)
2Al(s) + N2(g) 2AlN (s)
+ Nitrogen tác dụng với khí hydrogen (ở nhiệt độ cao 380-4500C, áp suất cao 25 – 200 bar và xúc tác Fe)
N2(g) + 3H2(g) 0 ,, txtP⇀ ↽ 2NH3(g)
b/ Tính khử: Nitrogen tác dụng với oxygen ở 30000C (tia lửa điện) tạo thành nitrogen monoxide.
N2(g) + O2(g) 0 ⇀ ↽ 2NO(g)
5. Quá trình tạo và cung cấp nitrate cho đất từ nước mưa.
YKÈMQUYNHƠNOFFICIAL
Trong tự nhiên nitrogen kết hợp với oxygen trong những cơn mưa kèm sấm sét. Quá trình chuyển hóa nitrogen thành nitric acid sau đó tan trong nước và phân li ra ion nitrate (NO3 -) là dạng phân đạm.
N2 2O+ → NO 2O+ → NO2 22 OHO++ → HNO3 → H+ + NO36. Ứng dụng.
- Nitrogen là một trong những nguyên tố dinh dưỡng chính của thực vật.
- Phần lớn nitrogen sản xuất ra dùng để tổng hợp ammonia, từđó sản phẩm phân đạm, nitric acid... Nitrogen làm môi trường trơ trong các ngành công nghiệp như luyện kim, thực phẩm, điện tử...
- Nitrogen lỏng dùng làm môi trường đông lạnh để bảo quản máu và các mẫu vật sinh học.
CHƯƠNG 2: NITROGEN VÀ SULFUR
BÀI 4: AMMONIA VÀ MỘT SỐ HỢP CHẤT AMMONIUM. (Thời gian thực hiện: tiết)
1. Cấu tạo phân tử của ammonia.
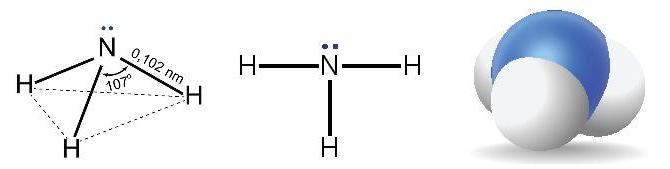
- Phân tử NH3 có cấu trúc chóp tam giác, với nguyên tử nitrogen ởđỉnh, đáy là một tam giác mà đỉnh là 3 nguyên tử hydrogen.
- Liên kết trong N – H trong phân tử ammonia là liên kết cộng hóa trị phân cực (năng lượng liên kết là 386 kJ/mol).
2. Tính chất vật lí của ammonia.
- Ammonia là chất khí không màu, mùi khai và xốc, nhẹ hơn không khí. Ammonia tan nhiều trong nước, tạo thành dung dịch ammonia (có tính kiềm). Dung dịch ammonia đậm đặc có nồng độ 25%.
- Ammonia dễ hóa lỏng (-33,30C) và dễ hóa rắn (-77,70C).
- Các phân tử ammonia có khả năng tạo liên kết hydrogen mạnh với nhau.
3. Tính chất hóa học của ammonia.
a. Tính bazơ yếu
+ Tác dụng với nước: Khi hoà tan khí NH3 vào nước, 1 phần các phân tử NH3 phản ứng tạo thành dung dịch kiềm dung dịch NH3 là một bazơ yếu.
NH3(aq) + H2O(l) ⇀ ↽ NH4 + (aq) + OH- (aq)
Làm quỳ tím chuyển sang màu xanh và phenolphthalein hóa hồng.
+ Tác dụng với acid: Ammonia dễ dàng kết hợp với acid tạo thành muối ammonium.
2NH3(aq) + H2SO4(aq) → (NH4)2SO4(aq) Ammonium sulfate
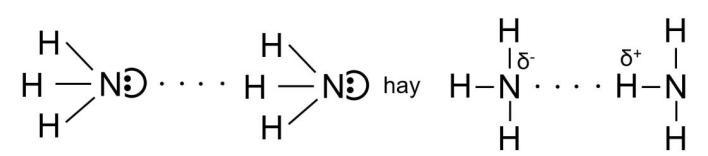
NH3(g) + HCl(g) → NH4Cl(s) Ammonium chloride
Khói trắng
+ Tác dụng với dung dịch muối: Dung dịch NH3 tác dụng với dung dịch muối của một số kim loại tạo hydroxide kim loại.
AlCl3(aq) + 3NH3(aq) + 3H2O(l) → Al(OH)3(s) + 3NH4Cl(aq)
2
0t → 0 → Ạ
3
b. Tính khử (tác dụng với oxygen)
4NH3(g) + 3O2(g) 2N2(g) + 6H2O(g)
BÀI 5: MỘT SỐ HỢP CHẤT VỚI OXYGEN CỦA NITROGEN. (Thời gian thực hiện: tiết)
4NH3(g) + 5O2(g) 850900, o CPt → 4NO(g) + 6H2O(g)
4. Tổng hợp ammonia.
N2(g) + 3H2(g) 0 ,, txtP⇀ ↽ 2NH3(g) ∆rH 0 298 = - 92 kJ
Phản ứng tổng hợp ammonia từ nitrogen và oxygen được thực hiện ở nhiệt độ 3800C –

4500C, áp suất khoảng 25 bar – 200 bar và chất xúc tác là Fe.
5. Muối ammonium.
a. Tính chất vật lí.
Muối ammonium lànhững chất tinh thể ion. Hầuhết cácmuối ammonium dễ tan trong nước.
b. Tính chất hóa học.
+ Dung dịch muối ammonium đậm đặc tác dụng với dung dịch base đun nóng tạo thành
ammonia
→ → Ạ
(NH4)2SO4(aq) + 2NaOH(l) →Na2SO4(aq) + 2NH3 (g) + 2H2O(l)

+ Các muối ammonium dễ bị nhiệt phân hủy
→ ot
NH4Cl NH3 + HCl
NH4HCO3 NH3 + CO2 + H2O

NH4NO3 N2O + 2H2O
6. Ứng dụng.
- Ammonia được sử dụng để sản xuất nitric acid, các loại phân đạm. Ammonia còn được sử dụng làm chất làm lạnh, dung môi và nhiều ứng dụng quan trọng khác trong đời sống sản xuất.
- Muối ammonium đượcsử dụng rộng rãi trong đời sống và sản xuất, đặc biệt dùng làm phân trong nông nghiệp. Muối NH4HCO3 dùng làm bột nở
I. Các oxide của nitrogen – hiện tượng mưa acid.
- Các oxide của nitrogen kí hiệu chung là NOx bao gồm:
N2O NO NO2 N2O4
Dinitrogen oxide Nitrogen dioxide Nitrogen dioxide Dinitrogen tetroxide
- Nitrogen oxide được hình thành từ những hiện tượng trong tự nhiên hoặc các thiết bị hoạt động ở nhiệt độ cao. Các khí độc này, có thể gây ảnh hưởng ngiêm trọng đến sức khỏe con người. Chúng cũng là một trong những nguyên nhân chính gây hiệu ứng nhà kính và hiện tượng mưa acid.
+ Khí nitrogen monoxide (NO) được tạo thành trong không khí ở nhiệt độ cao.
N2(g) + O2(g) 0 ⇀ ↽ 2NO(g)
+ Ởđiều kiệnthường, khí NO không màu kết hợp với oxygen tạo thànhkhí nitrogen dioxide (NO2) màu nâu đỏ
2NO(g) + O2(g) → 2NO2(g)
+ Mưa acid tạo thành do lượng khí thải SO2 và NOx từ các quá trình tiêu thụ than đá, dầu mỏ và các nhiên liệu tự nhiên khác trong sản xuất, sinh hoạt của con người.
2SO2 + O2 + 2H2O → 2H2SO4
4NO2 + O2 + 2H2O → 4HNO3
II. Nitric acid.
1. Cấu tạo phân tử.
Nitric acid có số oxi hóa là +5 và hóa trị cao nhất của N trong HNO3 là IV.
2. Tính chất vật lí.
4
CHƯƠNG 2: NITROGEN VÀ SULFUR →
ot
5
YKÈMQUYNHƠNOFFICIAL
- Nitric acid tinh khiết là chất lỏng không màu, bốc khói mạnh trong không khí ẩm, có khối lượng riêng D là 1,53 g/cm3, sôi ở 860C.
- Nitricacid tan trong nướctheo bất kì ở tỉ lệ nào. Nồng độ nitricacid đặclà 68%, khối lượng riêng là 1,40 g/cm3 .
3. Tính chất hóa học.
a. Tính acid mạnh
Theo Bronsted – Lowry nitric acid có khả năng cho proton nên HNO3 là một acid mạnh.
HNO3 + H2O → H3O+ + NO3 -
Làm quỳ tím hoá đỏ, tác dụng với basic oxide, base, muối của các acid yếu → muối nitrate.

2 HNO3 + CuO → Cu(NO3)2 + H2O
2HNO3 + Ca(OH)2 → Ca(NO3)2 + 2H2O
HNO3 + CaCO3 → Ca(NO3)2 + CO2 + H2O
b. Tính oxi hoá mạnh
Nitric acid (HNO3)có số oxi hóa + 5 có thể bị khử thành N2, N2O, NO, NO2, NH4NO3 tuỳ
theo nồng độ HNO3 và khả năng khử của chất tham gia
- Tác dụng với kim loại: Oxi hoá hầu hết kim loại (trừ Au, Pt).
Cu + 4HNO3 (đặc) → Cu(NO3)2 + 2NO2 + 2H2O
3Cu + 8HNO3 (loãng) → 3Cu(NO3)2 + 2NO + 4H2O
Chú ý: Các kim loại Fe, Al, Cr thụ động hoá với HNO3 đặc, nguội do tạo ra màng oxide
bền, bảo vệ kim loại khỏi tác dụng của acid.
YKÈMQUYNHƠNOFFICIAL
- Tác dụng với phi kim: HNO3 đặc, nóng oxi hóa được một số phi kim C, S, P,...
C + 4HNO3 CO2 + 4NO2 + 2H2O
S + 6HNO3 H2SO4 + 6NO2 + 2H2O
- Tác dụng với hợp chất: HNO3 đặc oxi hoá nhiều hợp chất vô cơ và hữu cơ.
FeO + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O
Kết luận: Nitric acid là một acid mạnh và có tính oxi hóa mạnh.
4. Ứng dụng.
- Dung dịch nitric acid 68% dùng chế tạo thuốc nổ trinitrotoluene TNT, sản xuất nitrobenzene, thuốc súng không khói cellulose trinitrate.
- Do có tính oxi hóa mạnh, nitric acid dùng để phá mẫu quặng trong việc nghiên cứu, xác định hàm lượng kim loại trong quặng.
- Hỗn hợp nitric acid đặc và hydrochloric acid đặc có tỉ lệ thể tích 1 : 3 gọi là nước cường toang có khả năng hòa tan platium và vàng.
Au + HNO3 + 3HCl AuCl3 + NO + 2H2O
III. Hiện tượng phú dưỡng.
Hiệntượngphúdưỡngxảyrakhidư thừachấtdinh dưỡngtrongmôi trườngnướcnhư nitrate vàphosphate,làmsuygiảmchấtlượngnước,gây ảnhhưởngtiêucực đến đờisốngconngười cũng như các loài động vật sống dưới nước.
- Dấu hiệu: nước ao hồ có màu xanh của tảo phát triển.
- Các chất gây ra hiện tượng phú dưỡng là: nước thải chăn nuôi, phân hữu cơ NH4NO3, (NH2)2CO, (NH4)2HPO4, Ca(H2PO4)2… chứa lượng lớn nitrogen và phosphorus.
- Hiện tượng phú dưỡng gây cản trở sự hấp thụ ánh sáng mặt trời vào nước làm giảm khả năng quang hợp của thực vật thủy sinh. Rong, tảo phát triển mạnh làm thiếu nguồn oxygen trầm trọng, gây mất cân bằng sinh thái. Xác rong, tảo phân hủy gây ô nhiễm môi trường nước, không khí và tạo bùn lắng.
+ Sự hoạt động lượng lớn vi khuẩn đã hấp thụđáng kể oxygen hòa tan trong nước.
+ Sự phát triển của tảo xanh đã ngăn cản ánh sáng và không khí chứa oxygen khuye61ch tán vào nước.
+ Quá trình phân hủy tảo chết bởi vi khuẩn đã tiêu tốn lượng lớn oxygen trong nước. - Để hạn chế hiện tượng phú dưỡng, cần:
+ Tạo điều kiện để nước trong kênh rạch, ao, hồđược lưu thông.
+ Xử lí nước thải trước khi cho chảy vào kênh rạch, ao, hồ
+ Sử dụng phân bón đúng liều lượng, đúng cách, đúng thời điểm trong năm để hạn chế
sự rửa trôi ion NO3 , PO4 3− từ nguồn phân bón dư thừa vào kênh rạch, ao, hồ
6
o
o →
→
Ạ
7
BÀI TẬP VẬN DỤNG. DẠNG 1: GIẢI THÍCH TÍNH CHẤT VẬT LÍ VÀ ỨNG DỤNG CỦA NITROGEN. ot →
YKÈMQUYNHƠNOFFICIAL
Câu 1. Trình bày cấu tạo của phân tử N2. Giải thích vì sao điều kiện thường N2 khá trơ về mặt hóa học.
Câu 5. Vì sao người ta phải bơm khí nitrogen vào các khoang chứa của tàu chở dầu sau khi chuyển dầu ra khỏi khoang?
Câu 2. Cho biết năng lượng liên kết của phân tử fluorine, nitrogen lần lượt là 159 kJ mol−1 và 946 kJ mol−1.
a) Giải thích nguyên nhân chính dẫn đến sự khác biệt giá trị năng lượng liên kết giữa hai phân tử trên.
b) Cho biết chất nào hoạt động hoá học hơn.
DẠNG 2: TÍNH CHẤT HÓA HỌC CỦA NITROGEN.
Câu 6. Viết phương trình hóa học chứng minh tính oxi hóa và tính khử của nitrogen. Cho biết số oxi hóa của nitrogen thay đổi như thế nào trong các phản ứng hóa học đó.
………………………………………………………………………………………………… …………………………………………………………………………………………………
Câu 3. Dựa vào giá trị năng lượng liên kết (Eb), hãy dựđoán ởđiều kiện thường đơn chất nào (nitrogen, hydrogen, oxygen, chlorine) khó và dễ tham gia phản ứng hóa học nhất. Vì sao?
a) N2(g) → 2N(g) Eb= 945 kJ/mol b) H2(g) → 2H(g) Eb=432 kJ/mol
c) O2 (g) → 2O(g) Eb=498 kJ/mol d) Cl2 (g) → 2Cl(g) Eb= 243 kJ/mol
Câu 7. Viết phương trình hóa học khi cho nitrogen tác dụng với khí hydrogen, oxygen, aluminium (nhôm) và magnesium (magie) ởđiều kiện thích hợp.
Câu 4.
a) Tại sao nitrogen lỏng được dùng để bảo quản mẫu vật phẩm trong y học?
b) Tại sao dùng khí nitrogen để làm căng vỏ bao bì thực phẩm mà không dùng không khí?
Câu 8. Viết các phương trình hoá học minh hoạ quá trình hình thành đạm nitrate trong tự nhiên xuất phát từ nitrogen.
8
………………………………………………………………………………………………… …………………………………………………………………………………………………
…………………………………………………………………………………………………
………………………………………………………………………………………………… …………………………………………………………………………………………………
Ạ
9 ………………………………………………………………………………………………… …………………………………………………………………………………………………
………………………………………………………………………………………………… …………………………………………………………………………………………………
………………………………………………………………………………………………… ………………………………………………………………………………………………… …………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
Câu 9. Trong công nghiệp, ammonia được sản xuất dựa vào phản ứng thuận nghịch giữa nitrogen và hydrogen trong thiết bị kín.
a) Khi phản ứng đạt trạng thái cân bằng thì trong thiết bị sẽ có các khí nào?
b) Hãy tìm hiểu về nhiệt độ hoá lỏng của mỗi khí có trong thiết bị. Từ đó cho biết, nếu giữ nguyên áp suất và làm lạnh thiết bị thì khí nào sẽ hoá lỏng đầu tiên.
Khí Nhiệt độ hóa lỏng (°C)
H2 -252,87
N2 -196
NH3 -33,3
YKÈMQUYNHƠNOFFICIAL
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
Câu 12. Trong hai phản ứng oxi hóa ammonia bằng oxygen:
…………………………………………………………………………………………………
…………………………………………………………………………………………………
Câu 10. Biến thiên enthalpy chuẩn của phản ứng tổng hợp ammonia từ nitrogen và hydrogen có giá trị âm nhưng vì sao quá trình Haber lại chọn nhiệt độ phản ứng khá cao, vào khoảng 400 °C - 600 °C?
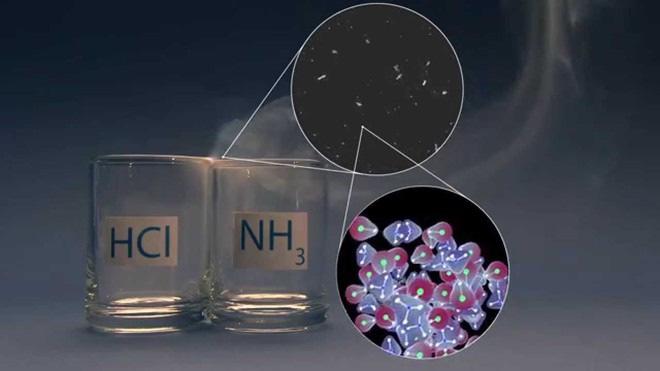
N2(g) + 3H2(g) 0 ,, txtP⇀ ↽ 2NH3(g) ∆rH 0 298 = - 92 kJ
…………………………………………………………………………………………………
DẠNG 3: TÍNH CHẤT CỦA AMMONIA
Câu 11. Chuẩn bị hai đầu đũa thủy tinh quần bông. Đũa nhúng vào dung dịch HCl đặc vào dung dịch và NH3 đặc, sau đó đưa lại gần nhau. Quan sát và nêu hiện tượng xảy ra từđó đề xuất phương pháp nhận biết Amonia bằng dung dịch HCl đặc.
4NH3(g) + 3O2(g) 2N2(g) + 6H2O(g)
0 →
4NH3(g) + 5O2(g) 850900, o CPt → 4NO(g) + 6H2O(g)
a) Xác định các nguyên tử có sự thay đổi số oxi hóa.
b) Viết quá trình oxi hóa, quá trình khử ………………………………………………………………………………………………… ………………………………………………………………………………………………… ………………………………………………………………………………………………… ………………………………………………………………………………………………… …………………………………………………………………………………………………
Câu 13. Ammonia thể hiện tính base, tính khửở quá trình nào dưới đây? Giải thích.
a) Cho ammonia phản ứng với nitric acid (HNO3) để tạo phân bón ammonium nitrate (NH4NO3).
10
…………………………………………………………………………………………………
Ạ
11 ………………………………………………………………………………………………… …………………………………………………………………………………………………
b) Dùng ammonia tẩy rửa lớp copper(II) oxide phủ trên bề mặt kim loại đồng, tạo kim loại, nước và khí nitrogen.
c) Cho ammonia phản ứng với khí chlorine tạo thành khí nitrogen và khí hydrogen chloride.
…………………………………………………………………………………………………
………………………………………………………………………………………………… …………………………………………………………………………………………………
Câu14. Chocânbằnghoáhọc:N2(g)+3H2(g) 0 ,, txtP⇀ ↽ 2NH3(g) ∆rH 0 298 =-92kJ.Cânbằng
chuyển dịch theo chiều nào (có giải thích) khi:
a) tăng nhiệt độ
b) tách ammonia ra khỏi hỗn hợp phản ứng.
c) giảm thể tích của hệ phản ứng.
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
Câu 15. Ở 472 °C, hằng số cân bằng của phản ứng tổng hợp ammonia từ nitrogen và hydrogen
theo quá trình Haber là KC = 0,105. Giả sử, kết quả phân tích cho thấy tại thời điểm cân bằng, nồng độ của nitrogen và hydrogen trong buồng phản ứng lần lượt là 0,0201 M và 0,0602 M.
a) Hãy tính nồng độ mol của ammonia có trong buồng phản ứng tại thời điểm cân bằng.
b) Làm thế nào để tách được ammonia ra khỏi hỗn hợp?
DẠNG 4: TÍNH CHẤT MUỐI AMMONIUM
Câu 16. Viết phương trình hóa học khi cho NH4Cl, NH4NO3, (NH4)2SO4 tác dụng với dung dịch NaOH.
Câu 17. Viết phương trình hóa học khi cho dung dung dịch (NH4)2CO3 tác dụng với các dung dịch KOH, HCl, Ba(OH)2, CaCl2
Câu 18. Viết phương trình hoá học của các phản ứng xảy ra khi cho dung dịch (NH4)2SO4 tác dụng với dung dịch NaOH, dung dịch Ba(OH)2, dung dịch BaCl2, dung dịch Ba(NO3)2
Câu 19. Khi thải rác thải sinh hoạt chứa một lượng lớn ion ammonium vào ao, hồ sẽ sinh ra quá trình oxi hóa ammonium thành ion nitrate dưới tác dụng của vi khuẩn. Quá trình này làm giảm oxygen hòa tan trong nước, gây ngạt cho sinh vật sống dưới nước. Người ta phải xử lý nguồn nước gây ô nhiễm đó bằng cách chuyển ion ammonium thành ammonia, rồi chuyển tiếp thành nitrogen không độc. Hãy đề xuất một số hóa chất thực hiện quá trình trên. Viết phương trình hóa học của phản ứng xảy ra.
Câu 20. Vận dụng kiến thức về cân bằng hóa học, tốc độ phản ứng, biến thiên enthalpy để giải thích các điều kiện của phản ứng sản xuất ammonia, cụ thể:
1. Nếu tăng hoặc giảm nhiệt độ sẽảnh hưởng đến sự chuyển dịch cân bằng và tốc độ phản ứng như thế nào?
12
………………………………………………………………………………………………… …………………………………………………………………………………………………
Ạ
13
YKÈMQUYNHƠNOFFICIAL
………………………………………………………………………………………………… …………………………………………………………………………………………………
………………………………………………………………………………………………… …………………………………………………………………………………………………
………………………………………………………………………………………………… …………………………………………………………………………………………………
2. Nếu giảm áp suất, cân bằng chuyển dịch theo chiều nào? Tại sao không thực hiện ở áp suất cao hơn?
3. Vai trò của chất xúc tác trong phản ứng là gì?
N2(g) + 3H2(g) 0 ,, txtP⇀ ↽ 2NH3(g)
………………………………………………………………………………………………… ………………………………………………………………………………………………… ………………………………………………………………………………………………… …………………………………………………………………………………………………
NH4Cl(s) NH3(g) + HCl(g) ∆rH 0 298 = 176kJ
Hãy cho biết muối nào có nguy cơ cháy nổ cao hơn trong quá trình lưu trữ.
DẠNG 5: GIẢI THÍCH HIỆN TƯỢNG THỰC TẾ
YKÈMQUYNHƠNOFFICIAL
Câu 21. NH4HCO3 là một trong những chất dùng làm bột nở trong sản xuất bánh bao. Giải thích.
………………………………………………………………………………………………… …………………………………………………………………………………………………
Câu 22. Hãy giải thích vì sao các loại phân bón như: NH4Cl, NH4NO3, (NH4)2SO4 không thích hợp bón cho đất chua.
………………………………………………………………………………………………… …………………………………………………………………………………………………
Câu 23. Lượng lớn ammonium nitrate và ammonium chloride được sử dụng làm phân bón. Dựa vào đặc điểm phản ứng nhiệt phân của hai muối này:
NH4NO3(s) N2O(g) + 2H2O(g) ∆rH 0 298 = - 36kJ 0 →
Câu 24. Ammonium nitrate vừa là phân bón nhưng đồng thời cũng là chất nổ do phản ứng
2NH4NO3 2N2 + O2 + 4H2O

Phản ứng trên là nguyên nhân vụ nổ kinh hoàng tại nhà kho chứa khoảng 2 700 tấn ammonium nitrate ở cảng Beriut (Lebanon) vào tháng 8 năm 2020. Em hãy đề xuất biện pháp phòng chống cháy nổ do ammonium nitrate?
Câu 25. Để giảm sốt hoặc giảm đau, người ta có thể dùng túi chườm lạnh chứa hóa chất: ammonium hydrogen sulfate, ammonium nitrate, nước. Giải thích nguyên nhân giúp túi chườm lạnh có nhiệt độ thấp.
DẠNG 6: NITRIC ACID.
Câu 26. Cho biết số oxi hoá của nitrogen trong mỗi phân tử và ion sau: NH3, NH4 +, N2, N2O, NO, NO2, HNO2, HNO3.
14
Ạ
15
………………………………………………………………………………………………… …………………………………………………………………………………………………
…………………………………………………………………………………………………
0t → 0 →
YKÈMQUYNHƠNOFFICIAL
…………………………………………………………………………………………………
Câu 27. Viết các phương trình hóa học của chuỗi phản ứng tạo thành acid từ nitrogen trong không khí: N2 → NO → NO2 → HNO3 ………………………………………………………………………………………………… …………………………………………………………………………………………………
Câu 28. Viết các phương trình hóa học minh họa tác động của mưa acid đối với calcium carbonate trong núi đá vôi và với kim loại sắt có trong thép. ………………………………………………………………………………………………… ………………………………………………………………………………………………… …………………………………………………………………………………………………
Câu29. Viết phương trình hóa học của các phân tử khi cho dungdịch HNO3 tác dụng với CuO, Ca(OH)2, CaCO3 các phản ứng này có phải phản ứng oxi hóa - khử không? Giải thích. ………………………………………………………………………………………………… …………………………………………………………………………………………………
Câu30. Trongcôngnghiệp,ngườitasảnxuấtnitricacid(HNO3)từ ammoniatheosơđồ chuyển hoá sau:
a) Viết các phương trình hoá học xảy ra.
b) Đểđiều chế 200 000 tấn nitric acid có nồng độ 60% cần dùng bao nhiêu tấn ammonia? Biết rằng hiệu suất của quá trình sản xuất nitric acid theo sơđồ trên là 96,2%.
Câu31. Nitric acid (HNO3) làhợp chất vô cơ, trong tự nhiên, được hình thành trong những cơn mưa giông kèm sấm chớp. Nitric acid là một acid độc, ăn mòn và dễ gây cháy, là một trong những tác nhân gây ra mưa acid.
Trongcôngnghiệp,nitricacid đượctổnghợptừ amoniacquabagiai đoạnvới hiệusuấtcủatoànbộ quá trình đạt 96%. Theo quá trình trên, từ 4 tấn ammonia người ta thu được m tấn dung dịch HNO3 60%. Tính giátrị củam.
DẠNG 7: HIỆN TƯỢNG PHÚ DƯỠNG.
Câu 31. Dựa vào những dấu hiệu nào để dựđoán đã có hiện tượng phú dưỡng xảy ra trong một ao nước hay hồ nước?
16
NH3 0 2 ,, Otxt+ →NO 2O+ →NO2 22 OHO++ →HNO3 Ạ
17
…………………………………………………………………………………………………
…………………………………………………………………………………………………
………………………………………………………………………………………………… …………………………………………………………………………………………………
………………………………………………………………………………………………… ………………………………………………………………………………………………… …………………………………………………………………………………………………
YKÈMQUYNHƠNOFFICIAL
Câu 32. Trong thực tế, nhiều nơi nước thải, phân bón hóa học, thuốc trừ sâu chưa qua xử lý được thả trực tiếp vào ao hồ. Trường hợp nào có thể gây ra hiện tượng phú dưỡng. Giải thích.
………………………………………………………………………………………………… …………………………………………………………………………………………………
Câu 33. Nước thải chăn nuôi làm một trong các yếu tố gây nên hiện tượng phù dưỡng cho ao hồ. Hãy giải thích điều này.
a. Cho phản ứng: NH3(g) + HCl(g) ⟶ NH4Cl(s). Biết ∆fH 0 298 (NH4Cl(s)))= − 314,4 kJ/mol; ∆fH 0 298 (HCl(g))= − 92,31 kJ/mol; ∆fH 0 298 (NH3(g))= − 45,9 kJ/mol. Tính biến thiên enthalpy chuẩn của phản ứng và cho biết phản ứng trên là phản ứng tỏa nhiệt hay thu nhiệt. Vẽ biến thiên enthalpy của phản ứng.
Câu34. Khikhơithôngnguồnnướcthìnguycơ xảyrahiện tượngphúdưỡngsẽ tănghaygiảm?
Giải thích.
…………………………………………………………………………………………………
…………………………………………………………………………………………………
Câu 35. Nhiều loài thuỷ hải sản được nuôi trong hồ, ao, "vuông" (cách gọi của người miền Tây
Nam bộ về khu vực ruộng được khoanh vùng, cải tạo để nuôi thủy hải sản),... Để hạn chế nguy cơ xảy ra hiện tượng phú dưỡng trong hồ, ao, vuông,... người nuôi thuỷ hải sản nên làm gì?
Giải thích.
…………………………………………………………………………………………………
DẠNG 8: BÀI TẬP VỀ NITROGEN VÀ HỢP CHẤT CỦA NITROGEN
…………………………………………………………………………………………………
…………………………………………………………………………………………………
Câu
b. Dựa vào giá trị enthalpy tạo thành ở của NH3 và H2O như sau: -45,9 kJ/mol và -241,82 kJ/mol, Hãy tính giá trị ∆rH 0 298 của các phản ứng
0 →
4NH3(g) + 3O2(g) 2N2(g) + 6H2O(g)
Cho biết phản ứng xảy ra thuận lợi hay không thuận lợi? Giải thích.
………………………………………………………………………………………………… ………………………………………………………………………………………………… ………………………………………………………………………………………………… ………………………………………………………………………………………………… …………………………………………………………………………………………………
18
Ạ
36.
19
Câu 37. Quá trình đốt cháy nhiên liệu trong ô tô sinh ra nhiều khi như SO2, CO, NO. Từ năm 1975, người ta thiết kế “bộ chuyển đổi xúc tác” trong hệ thống xả khí của ô tô (và cả trong máy phát điện) nhằm tạo điều kiện thuận lợi cho phản ứng: 2CO(g) + 2NO(g) → 2CO2(g) + N2(g)
a) Cho biết ý nghĩa của phản ứng trên đối với môi trường.
b) Trong phản ứng trên, chất nào là chất oxi hoá, chất nào là chất khử? Giải thích.
YKÈMQUYNHƠNOFFICIAL
c) Giá trị enthalpy tạo thành chuẩn của CO(g), NO(g), CO2(g) lần lượt là 110,5; 91,3; –393,5 (kJ mol−1). Hãy tính biến thiên enthalpy chuẩn của phản ứng trên. Phản ứng trên có thuận lợi về mặt năng lượng không? Giải thích.
Câu 39. Tính biến thiên enthanpy của phản ứng tạo thành ammonia dựa vào năng lượng liên kết của phản ứng sau:
3H2(g) + N2(g) 0 txtP⇀ ↽ 2NH3(g)
Cho biết phản ứng thu nhiệt hay toả nhiệt và vẽ sơđồ biểu diễn biến thiên enthalpy của phản ứng. Biết năng lượng liên kết của H – H là 432 kJ/mol, N ≡ N là 945 kJ/mol và H – N là 391 kJ/mol.
Câu 38. Cho năng lượng liên kết trong các phân tử O2, N2 và NO lần lượt là 494 kJ/mol, 945 kJ/mol và607 kJ/mol, tính biến thiênenthalpycủaphản ứng vàgiải thích vìsao nitrogen (N≡N) chỉ phản ứng với oxygen (O=O) ở nhiệt độ cao hoặc có tia lửa điện để tạo thành nitrogen monoxide (N=O).
N2(g) + O2(g) 0 tialuadien t → 2NO(g)
………………………………………………………………………………………………… ………………………………………………………………………………………………… ………………………………………………………………………………………………… …………………………………………………………………………………………………
Câu 40. Xét phản ứng trong giai đoạn đầu của quá trình Ostwald:
4NH3(g) +5O2(g) 850900, o CPt → 4NO(g) + 6H2O(g)
a) Tính ∆rH 0 298 của phản ứng trên và cho biết phản ứng là toả nhiệt hay thu nhiệt? Có thể tận
dụng nhiệt lượng này để làm gì? Biết nhiệt tạo thành chuẩn của NH3(g), NO(g) và H2O(g) lần lượt là -45,9 kJ/mol; 90,3 kJ/mol và -241,8 kJ/mol.
b) Tính năng lượng liên kết trong phân tử NO. Biết năng lượng liên kết N H, O═O, O H lần lượt là 386 kJ/mol, 494 kJ/mol và 459 kJ/mol.
BÀI TẬP TRẮC NGHIỆM.
20
………………………………………………………………………………………………… ………………………………………………………………………………………………… ………………………………………………………………………………………………… …………………………………………………………………………………………………
Ạ
21
………………………………………………………………………………………………… ………………………………………………………………………………………………… …………………………………………………………………………………………………
………………………………………………………………………………………………… …………………………………………………………………………………………………
…………………………………………………………………………………………………
PHẦN 1. ĐƠN CHẤT NITROGEN
Câu 1. Trong không khí, nitrogen chiếm bao nhiêu phần trăm thể tích không khí?
A. 20%. B. 21%. C. 78%. D. 80%.
Câu 2. Nitrogen còn có trong các hợp chất, điển hình có nhiều trong khoáng vật sodium nitrate (còn có tên gọi là diêm tiêu Chile). Công thức hóa học của diêm tiêu là
A. KNO2 B. NaNO2 C. NaNO3 D. KNO3
Câu 3. Hình ảnh sau mô tả thí nghiệm mô tả gì về tính chất vật lí đơn chất nitrogen?
Trong hai phản ứng trên thì nitrogen
A. chỉ thể hiện tính oxi hóa. B. chỉ thể hiện tính khử.
C. thể hiện cả tính khử và tính oxi hóa. D. không có tính khử và tính oxi hóa.
Câu 9. N2 phản ứng với O2 tạo thành NO ởđiều kiện nào sau đây?
A. Nhiệt độ 1000C. B. Nhiệt độ khoảng 30000C.
C. Nhiệt độ khoảng 10000C. D. Điều kiện thường.
Câu 10. Khi có sấm chớp sinh ra khí gì?
A. NO. B. NO2 C. O2 D. N2
Câu 11. Khí N2 thể hiện tính khử trong phản ứng với
A. H2 B. O2 C. Li D. Mg
Câu 12. Cho phản ứng hóa học sau:
A. Nitrogen là chất khí nhẹ hơn không khí. B. Nitrogen không duy trì sự cháy.
C. Nitrogen rất ít tan trong nước. D. Nitrogen không duy trì sự sống.
Câu 4. Phát biểu nào sau đây không đúng?
A. Nguyên tố nitrogen là một trong những thành phần dinh dưỡng chính của thực vật.
B. Nitrogen nằm ở ô thứ 7, chu kì 2, nhóm VA trong bảng tuần hoàn.
C. Trong các phản ứng oxi hoá – khử thì nitrogen thể hiện tính oxi hoá hoặc tính khử
D. Trong tự nhiên, nitrogen chỉ tồn tại ở dạng tự do.
Câu 5. Phân tử nitrogen có cấu tạo là
A. N═N. B. N☰N. C. N N. D. N→N
Câu 6. Ở nhiệt độ thường, nitrogen khá trơ về mặt hoạt động hóa học là do ?
YKÈMQUYNHƠNOFFICIAL
A. Nitrogen có bán kính nguyên tử nhỏ
C. Phân tử nitrogen có liên kết ba khá bền.
Câu 7. Cho các phát biểu sau:
a) Hóa lỏng ở nhiệt độ rất thấp (−1960C).
b) Có khả năng đông nhanh.
c) Tan nhiều trong nước.
d) Nặng hơn oxygen.
B. Nitrogen có độ âm điện lớn nhất
D. Phân tử nitrogen không phân cực.
e) Kém bền, dễ bị phân hủy thành nitrogen nguyên tử
Các tính chất không thuộc về tính chất của khí nitrogen?
A. a, c, d. B. a, b. C. c, d, e. D. b, c, e.
Câu 8. Cho các phản ứng sau:
(1) N2(g) + O2(g) 0t ⇀ ↽ 2NO(g) ∆rH 0 298 = +180 kJ.
(2) N2(g) + 3H2(g) 0 txtP⇀ ↽ 2NH3(g) ∆rH 0 298 = -92 kJ.
Phát biểu đúng là
A. (1) và (2) đều là phản ứng thu nhiệt.
B. (1) và (2) đều là phản ứng tỏa nhiệt.
C. (1) là phản ứng thu nhiệt, (2) là phản ứng tỏa nhiệt.
D. (1) là phản ứng tỏa nhiệt, (2) là phản ứng thu nhiệt.
Câu 13. Trong công nghiệp, phần lớn lượng nitrogen sản xuất ra được dùng để
A. Làm môi trường trơ trong luyện kim, điện tử... B. Tổng hợp phân đạm.
C. Sản xuất nitric acid. D. Tổng hợp ammonia.
Câu 14. Trong lĩnh vực y tế, nitrogen lỏng dùng để làm gì trong công nghiệp ?
A. Sản xuất ammonia (NH3).

B. Dùng làm môi trường trơ
C. Dùng để bảo quản máu và mẫu vật sinh học.
D. Dùng để bảo quản thức ăn.
Câu 15. Cho phương trình nhiệt hóa học sau: N2(g) + O2(g) → 2NO(g) ∆rH 0 298 = +180 kJ
Kết luận nào sau đây đúng?
A. Nitrogen và oxygen phản ứng mạnh hơn khi ở nhiệt độ thấp.
B. Phản ứng tỏa nhiệt.
C. Phản ứng xảy ra thuận lợi ởđiều kiện thường.
D. Phản ứng hóa học xảy ra có sự hấp thụ nhiệt năng từ môi trường.
PHẦN 2. AMMONIA VÀ MỘT SỐ HỢP CHẤT AMMONIUM.
22
Ạ
23 N2(g) + O2(g) 0 ⇀ ↽ 2NO(g) và N2(g) + 3H2(g) txtP⇀ ↽ 2NH3(g).
Câu 16. Liên kết hóa học trong phân tử NH3 là liên kết
A. cộng hóa trị phân cực. B. ion.
C. cộng hóa trị không phân cực. D. kim loại.
Câu 17. Phân tử ammonia có dạng hình học nào sau đây?
A. Chóp tam giác. B. Chữ T. C. Chóp tứ giác. D. Tam giác đều.
Câu 18. Trong thí nghiệm về sự hòa tan của amoniac trong nước, pha thêm phenolphthalein vào có tác dụng

B. Do phân tử có 3 liên kết cộng hóa trị phân cực.
C. Do ammonia (NH3) tan được nhiều trong nước.
D. NH3 tác dụng với nước tạo NH4OH.
Câu 22. Khi hòa tan ammonia vào nước xảy ra cân bằng hóa học sau: NH3 + H2O ⇀ ↽ NH4 + + OH-
Thành phần của dung dịch ammonia bao gồm?
A. NH4 +, NH3, H2O. B. NH4 +, NH3, H+, H2O.
C. NH4 +, OH-, H2O. D. NH4 +, NH3, OH-, H2O.
Câu 23. Phản ứng hóa học nào sau đây không đúng?
A. NH3 + H2O ⇀ ↽ NH4 + + OH-
B. AlCl3 + 3NH3 + 3H2O → Al(OH)3 + 3NH4Cl.
C. NH3 + HCl → NH4Cl.
D. (NH4)2SO4 → NH3 + H2SO4
Câu 24. Phản ứng nào thể hiện tính khử của NH3?
A. 4NH3 + 3O2 → 2N2 + 6H2O.
B. FeCl3 + 3NH3 + 3H2O → Fe(OH)3 + 3NH4Cl.
C. NH3 + HNO3 → NH4NO3.
D. NH3 + HCl → NH4Cl.
Câu 25. Cho phản ứng sau: 2NH3 + 3Cl2 → 6HCl + N2. Kết luận nào sau đây đúng?
A. NH3 là chất khử B. NH3 là chất oxi hoá.
A. Làm tăng độ hòa tan của ammonia vào nước.
YKÈMQUYNHƠNOFFICIAL
B. Tạo ra áp lực lớn hơn, đẩy nước phun tia trong bình đựng ammonia.
C. Nhận ra nước tạo thành trong lọđựng khí ammonia.
D. Chứng tỏ dung dịch tạo thành do ammonia tan vào nước có tính base.
Câu 19. Phát biểu nào sau đây sai?
A. Ởđiều kiện thường, ammonia là chất khí không màu, mùi khai.
B. Khí ammonia nặng hơn không khí, tan nhiều trong nước tạo dung dịch ammonia.
C. Liên kết trong phân tử ammonia là liên kết công hóa trị có cực.
D. Khí amononia dễ hóa lỏng, hóa rắn và tan nhiều trong nước.
Câu 20. Tính chất hóa học của ammonia là
A. tính acid và tính khử. B. tính acid và tính oxi hóa.
C. tính base và tính oxi hóa. D. tính base và tính khử
Câu 21. Tính base của ammonia do nguyên nhân gì gây ra?
A. Do N trong ammonia còn cặp electron tự do có khả năng kết hợp ion H+ tạo ra OH.
C. Cl2 vừa oxi hoá vừa khử D. Cl2 là chất khử
Câu 26. Ammonia đóng vai trò chất khử khi tác dụng với chất nào sau đây?
A. H2O. B. HCl. C. H3PO4 D. O2 (Pt, t°).
Câu 27. Lấy 1 thanh thủy tinh nhúng vào dung dịch HCl đặc và 1 thanh thủy tinh khác nhúng vào dung dịch NH3 đặc. Sau đó đưa 2 thanh thủy tinh lại gần nhau thấy có hiện tượng gì?
A. Tạo khói trắng bay lên. B. Tạo khói màu vàng.
C. Trên thanh thủy tinh cóhơi nướcbám vào. D. Không có hiện tượng gì.
Câu 28. Phản ứng tổng hợp amoniac trong công nghiệp N2(g) + 3H2(g) ⇀ ↽ 2NH3(g). Để tăng hiệu suất phản ứng người ta thường?
A. Giảm nhiệt độ, tăng áp suất. B. Tăng nhiệt độ, giảm áp suất.
C. Giảm nhiệt độ, giảmáp suất. D. Tăng nhiệt độ, tăng áp suất.
Câu 29. Cho cân bằng hóa học (trong bình kín) sau:
N2(khí) + 3H2(khí) ⇀ ↽ 2NH3 ∆rH 0 298 = -92kJ/mol

24
Ạ
25
Trong các yếu tố:
(1) Thêm một lượng N2 hoặc H2 (2) Thêm một lượng NH3.
(3) Tăng nhiệt độ của phản ứng. (4) Tăng áp suất của phản ứng.
(5) Dùng thêm chất xúc tác.
Có bao nhiêu yếu tố làm cho cân bằng dịch chuyển theo chiều thuận ?
A. 3 B. 4 C. 5 D. 2
Câu 30. Các chất khí điều chế trong phòng thí nghiệm thường được thu theo phương pháp đẩy
không khí (cách 1, cách 2) hoặc đẩy nước (cách 3) như các hình vẽ sau đây:
Câu 36. Cho các dung dịch không màu: NH4Cl, (NH4)2SO4, Na2SO4 người ta sử dụng thuốc thử nào?
A. Dung dịch HCl B. Dung dịch NaOH
C. Dung dịch Ba(OH)2 D. Dung dịch BaCl2
Câu 37. Dãycác muối ammonium nào khi bị nhiệt phân tạo thành khí NH3 ?
A. NH4Cl, NH4HCO3, (NH4)2CO3 B. NH4Cl, NH4NO3, NH4HCO3
C. NH4Cl, NH4NO3, NH4NO2. D. NH4NO3, NH4HCO3, (NH4)2CO3.
Câu 38. Cho sơđồ phản ứng sau: Khí X 2 HO → dung dịch X 24HSO →Y ()NaOHdac → X 3HNO → Z 0 → T
Công thức của X, Y, Z, T tương ứng là
A. NH3, (NH4)2SO4, N2, NH4NO3 B. NH3, (NH4)2SO4, N2, NH4NO2
C. NH3, (NH4)2SO4, NH4NO3, N2O. D. NH3, N2, NH4NO3, N2O.
Có thể dùng cách nào trong 3 cách trên để thu khí NH3?
A. Cách 1 B. Cách 2 C. Cách 3 D. Cách 2 hoặc 3
Câu 31. Khi nói về muối ammonium, phát biểu không đúng là
A. Muối ammoniumtạocationammoniumNH4 + vàaniongốcacid.
B. Liên kết trong muối ammonium là liên kết ion.
C. Muối ammoniumkém bền với nhiệt dễ bị nhiệt phân.
D. Dung dịch muối ammoniumluôn có tính base nên làm quì tím chuyển màu xanh.
Câu 32. Nhận xét nào sau đây đúng về muối ammonium ?
A. Muối ammonium tan nhiều trong nước nhưng lại bền với nhiệt.
YKÈMQUYNHƠNOFFICIAL
B. Tất cả các muối ammonium tan trong nước là chất điện li mạnh phân li ra NH4 + và anion gốc acid.
C. Khi nhiệt phân muối ammonium luôn thu được khí NH3
D. Muối ammonium tác dụng với kiềm đặc sinh ra chất khí làm cho quì tím ẩm chuyển sang màu đỏ
Câu 33. Khi đun nóng muối ammonium với dung dịch kiềm sẽ thấy hiện tượng gì?
A. Muối nóng chảy ở nhiệt độ xác định. B. Thấy thoát ra chất khí không màu.
C. Thoát ra chất khí màu nâu đỏ D. Thoát ra chất khí không màu, mùi xốc.
Câu 34. Nhận biết muối ammonium người ta thường dùng hóa chất nào sau đây ?
A. Dung dịch acid. B. Dung dịch kiềm. C. Dung dịch muối D. Nước
Câu 35. Để tạo độ xốp cho một số loại bánh (bánh bao) có thể dùng muối nào sau đây làm bột nở?
A. (NH4)2SO4 B. NH4HCO3 C. CaCO3 D. NH4NO2

Câu 39. Có thể nhận biết muối ammonium bằng cách cho muối tác dụng với dung dịch kiềm thấy thoát ra một khí khí đó là
A. NH3 B. H2 C. NO2 D. NO.
Câu 40. Khi so sánh phân tử ammonia với ion ammonium, nhận định nào sau đây là đúng?
A. Đều chứa liên kết ion. B. Đều có tính acid yếu trong nước.
C. Đều chứa nguyên tử N có số oxi hoá là -3. D. Đều có tính base yếu trong nước. PHẦN 3. MỘT SỐ HỢP CHẤT VỚI OXYGEN CỦA NITROGEN.
Câu 41. Trong phân tử HNO3, N có hóa trị và số oxi hóa là
A. IV, +3 B. V, +5 C. V, +4 D. IV, +5
Câu 42. Nitric acid (HNO3) tinh khiết là chất lỏng không màu, nhưng dung dịch HNO3 để lâu thường ngả sang màu vàng là do?
A. HNO3 tan nhiều trong nước.
B. Khi để lâu thì HNO3 bị khử bởi các chất của môi trường
C. Dung dịch HNO3 có tính oxi hóa mạnh.
D. Dung dịch HNO3 có hoà tan một lượng nhỏ NO2
Câu 43. Tính chất hóa học cơ bản của nitric acid là
A. Tính acid yếu và tính khử mạnh. B. Tính acid mạnh và tính khử mạnh.
C. Tính acid yếu và tính oxi hóa mạnh. D. Tính acid mạnh và tính oxi hóa mạnh.
Câu 44. Chỉ ra nội dung sai ?
A. Nitric acid là acid có tính oxi hóa mạnh.
B. Trong nitric acid, ion H+ có tính oxi hóa mạnh hơn ion NO3 -
C. Nitric acid oxi hóa được hầu hết các kim loại trừ vàng và platinum.
26
Ạ
27
D. Vàng và platinum bị hòa tan trong hỗn hợp nitruc acid đặc và hydrochloric acid đặc theo tỉ lệ thể tích 1 : 3.
Câu 45. Kim loại nào thụđộng hóa trong dung dịch HNO3 đặc nguội ?
A. Mg, Al, Fe. B. Al, Cu, Zn. C. Al, Fe, Cr. D. Fe, Al, Ag.
Câu 46. Các kim loại đều tác dụng được với dung dịch HCl nhưng không tác dụng với dung dịch HNO3 đặc, nguội
A. Fe, Al, Au. B. Cu, Fe, Al. C. Fe, Mg, Al. D. Cu, Pb, Ag.
Câu47. Phản ứng giữa FeCO3 và dungdịch HNO3 loãng tạo hỗn hợpkhí không màu, một phần hóa nâu ngoài không khí. Hỗn hợp khí thoát ra là
A. CO2 và NO2 B. CO2 và NO C. CO và NO2 D. CO và NO
Câu 48. Cho phương trình phản ứng: a Al + b HNO3 → c Al(NO3)3 + d NO + e H2O. Tỉ lệ a : b là
A. 2 : 3 B. 2 : 5 C. 1: 3 D. 1: 4
Câu 49. Tổng hệ số tỉ lượng của tất cả các chất trong phương trình phản ứng giữa Cu với dung dịch HNO3 đặc, nóng là
A. 10. B. 11. C. 8. D. 9
Câu 50. Cho các phát biểu sau:
1. Trong phân tử HNO3 nguyên tử N có hoá trị V, số oxi hoá +5.
2. Vàng và platinum tan được trong nước cường toan.
YKÈMQUYNHƠNOFFICIAL
3. Nitric acid (HNO3)tinh khiết là chất lỏng, không màu và bốc khói mạnh trong không khí ẩm.
4. Nitric acid tính khiết kém bền, bị phân hủy một phần giải phóng nitrogen dioxide (NO2) ngay ởđiều kiện thường khi có ánh sáng.
Số phát biểu đúng
A. 1 B. 3
C. 4 D. 2 -------------HẾT-------------
CHƯƠNG 2: NITROGEN VÀ SULFUR
BÀI 6: SULFUR VÀ SULFUR DIOXIDE (Thời gian thực hiện: tiết)

1. Trạng thái tự nhiên
- Trong tự nhiên, sulfur lắng đọng thành những mỏ lớn, nằm giữa lớp đá sau hàng trăm mét trong lòng đất. Sulfur ở dạng hợp chất cũng được tìm thấy trong nhiều khoáng vật trong tự nhiên.
- Sulfur tồn tại ở cả dạng đơn chất và hợp chất:
+ Đơn chất sulfur tìm thấy ở các vùng núi lửa và suối nước nóng.
+Hợpchấtsulfurgồmkhoángvậtnhư quặngpyrite(FeS2),quặnggypsum(CaSO4.2H2O), quặng galena (PbS) và quặng barite (BaSO4).

+ Trong cơ thể người, sulfur chiếm khoảng 0,2% có thành phần nhiều protein và enzyme.
2. Cấu tạo nguyên tử và phân tử
- Nguyên tố sulfur ở ô số 16, nhóm VIA và chu kì 3 trong bảng tuần hoàn. Nguyên tố sulfur có độ âm điện là 2,58 và sulfur có tính phi kim.
- Trong các hợp chất sulfur có các số oxi hóa: -2, +4, +6.
- Ở dạng phân tử, sulfur gồm 8 nguyên tử liên kết cộng hóa trị với nhau tạo thành mạch vòng S8.
3. Tính chất vật lí Ởđiều kiện thường, sulfur là chất rắn màu vàng không tan trong nước, tan nhiều trong các dung môi hữu cơ như benzene, carbon disulfide (CS2)...
3. Tính chất hóa học Sulfur đơn chất vừa có tính oxi hóa, vừa có tính khử a/. Sulfur thể hiện tính oxi hóa Fe(s) + S(s) FeS(s) o →
I. Đơn chất sulfur.
28
Ạ
29
Sulfur tác dụng với thủy ngân (mercury) ở nhiệt độ thường tạo muối HgS. Hg(l) + S(s) → HgS(s)
b/. Sulfur thể hiện tính khử
S(s) + O2(g) SO2(s)
4. Ứng dụng sulfur đơn chất Khoảng 90% sulfur dùng đểđiều chế H2SO4, lưu hóa cao su, chế tạo diêm, sản xuất chất tẩy trắng bột giấy, dược phẩm, phẩm nhuộm, chất trừ sâu và chất diệt nấm...
II. Sulfur dioxide.
1. Tính chất vật lí
Sulfur dioxidelà chất khí không màu, mùi xốc, độcgây viêm đường hô hấp, nặng hơn không khí, hóa lỏng – 100C, tan nhiều trong nước.
2. Tính chất hóa học
Sulfur dioxide vừa thể hiện tính oxi hóa, vừa thể hiện tính khử
a/. Sulfur dioxide thể hiện tính khử
SO2 + NO2 → SO3 + NO
b/. Sulfur dioxide thể hiện tính oxi hóa
SO2 + 2H2S → 3S + 2H2O
3. Ứng dụng
Sulfur dioxide dùng để sản xuất sulfuric acid, tẩy trắng giấy, bột giấy, chống nấm mốc cho
lương thực, thực phẩm…
4. Sự hình thành sulfurdioxide do tác động của con người, tự nhiên
YKÈMQUYNHƠNOFFICIAL
- Sulfur dioxide sinh ra từ hoạt động của núi lửa, quá trình đốt cháy nhiên liệu hóa thạch
chứa tạp chất sulfur như than đá, dầu mỏ...
- Sulfur dioxide là nguyên chất chính gây ra hiện tượng mưa acid.
- Biện pháp giảm thiểu tác hại của sulfur dioxide (SO2).
+ sử dụng các nhiên liệu sinh học thân thiện như hydrogen, ethanol....
+ Sử dụng các nguồn năng lượng tái tạo như năng lượng mặt trời, năng lương gió, mưa, sóng
biển, thủy triều, địa nhiệt.
+ Xử lí khí thải công nghiệp trước khi thải ra môi trường.
1. Cấu tạo phân tử
CHƯƠNG 2: NITROGEN VÀ SULFUR
BÀI 7: SULFURIC ACID VÀ MUỐI SULFATE (Thời gian thực hiện: tiết)
2. Tính chất vật lí của sulfuric acid
- Sulfuric acid (H2SO4) là chất lỏng sánh như dầu, không màu, không bay hơi, nặng gần gấp hai lần nước, khối lượng riêng của H2SO4 98% là 1,84 g/cm3 .
- Sulfur acid tan vô hạn trong nước và tỏa nhiều nhiệt. Khi pha loãng dung dịch sulfuric acid phải cho từ từ acid đặc vào nước, vừa rót vừa khuấy mà không làm ngược lại vì có thể gây bỏng.
- Sulfuric acid là chất hút ẩm mạnh để làm khô nhiều chất (để tách hơi nước có lẫn trong các chất khí như chlorine, carbon dioxide, sulfur dioxide…)
3. Tính chất hóa học của sulfuric acid.

a. Dung dịch H2SO4 loãng (tính acid mạnh)

- Dung dịch H2SO4 loãng có tính chất chung của acid: làm quỳ tím chuyển thành màu đỏ, tác dụng với kim loại, base, basic oxide, muối.
Fe + H2SO4 → FeSO4 + H2
H2SO4 + 2NaOH → Na2SO4 + 2H2O
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
MgCO3 + H2SO4 → MgSO4 + CO2 + H2O
b. Dung dịch H2SO4 đặc (tính acid và tính oxi hóa mạnh)
* Tính acid mạnh H2SO4 đặc + NaCl tinh thể → NaHSO4 + HCl
* Tính oxi hoá mạnh
- Tác dụng với nhiều kim loại (trừ Au và Pt).
- Tác dụng với phi kim
I. Sulfuric acid.
2Fe + 6H2SO4 đặc Fe2(SO4)3 + 3SO2 + 6H2O
0t →
30
ot → Ạ
31
C + 2H2SO4 đặc CO2 + 2SO2 + 2H2O
- Tác dụng với hợp chất có tính khử (ở trạng thái oxi hoá thấp)
2FeO + 4H2SO4 đặc Fe2(SO4)3 + SO2 + 4H2O
2KBr + 2H2SO4 đặc K2SO4 + SO2 + Br2 + 2H2O
*Tính háo nước:
C12H22O11 24HSO → 12C + 11H2O
C + H2SO4 đặc → CO2 + 2SO2 + 2H2O
Chú ý: Các kim loại Al, Fe, Cr không tan trong H2SO4 đặc nguội (bị thụ động hóa).
4. Ứng dụng
Lượng lớn sulfuric acid dùng để sản xuất phân bón, thuốc trừ sâu, chất tẩy rửa tổng hợp, tơ
sợi hóa học, chất dẻo, sơn màu...
5. Quy trình sản xuất sulfuric acid theo phương pháp tiếp xúc
Giai đoạn 1: Sản xuất sulfur dioxide (SO2)
2FeS2 + 11O2 2Fe2O3 + 8SO2
Giai đoạn 2: Sản xuất sulfur trioxide (SO3)
2SO2 + O2 25 0
VO ⇀ ↽ 2SO3
Giai đoạn 3: Sản xuất sulfuric acid (H2SO4)
nSO3 + H2SO4 đặc → H2SO4.nSO3
H2SO4.nSO3 + nH2O → (n + 1) H2SO4
II. Muối sulfate.
YKÈMQUYNHƠNOFFICIAL
- Calcium sulfate (CaSO4) dùng trong sản xuất vật liệu xây dựng, làm chất phụ gia làm đông
sản phẩm.
- Barium sulfate (BaSO4) làm phụ gia pha màu cho công nghiệp sơn, thủy tinh, gốm sứ...
- Magnesium sulfate (MgSO4) sản xuất muối tắm, làm giảm dịu cơ bắp khi sưngtấy, bổ sung magnesium cho tôm, cá...
- Ammonium sulfate (NH4)2SO4 là thành phần thuốc trừ sâu, diệt nấm, phân bón...
* Thuốc thửđể nhận biết ion sulfate SO42- bằng ion Ba2+
Ba2+ + SO4 2- → BaSO4
BÀI TẬP VẬN DỤNG
DẠNG 1: SULFUR VÀ SULFUR DIOXIDE
Câu 1. Viết cấu hình electron của nguyên tử S (Z = 16) và biểu diễn sự phân bố electron vào các ô orbital.
Câu 2. Xác định số oxi hóa của sulfur trong các hợp chất sau: SO2, H2S, H2SO4, Na2SO3. Cho biết:
a) Số oxi hoá thấp nhất, cao nhất của nguyên tử S trong hợp chất.
b) Sulfur đơn chất thể hiện tính oxi hoá hay tính khử
Câu 3. Phản ứng của sulfur với hydrogen, oxygen, thủy ngân (mercury) và fluorine, hãy xác định sự thay đổi số oxi hóa của nguyên tử các nguyên tố. Sulfur là chất oxi hóa hay chất khử?
Câu4. Viếtphươngtrìnhhóahọccủaphản ứngxảyrakhichonhôm(aluminium)vàkẽm(zinc) tác dụng với sulfur. Xác định vai trò của các chất trong phản ứng.
Câu 5. Thủy ngân rất độc khi hít phải hơi thủy ngân có thể gây hại cho hệ thần kinh, hệ tiêu hóa và hệ miễn dịch, gây nhiễm độc phổi và thận, gây nguy cơ dẫn đến tử vong. Hãy nêu cách xử lý thủy ngân khi nhiệt kế thủy ngân không may bị vỡ
32
0 → 0t → 0 → 0t → Ạ
33 …………………………………………………………………………………………………
………………………………………………………………………………………………… …………………………………………………………………………………………………
………………………………………………………………………………………………… …………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
YKÈMQUYNHƠNOFFICIAL
Câu 6. Hãy xác định sự thay đổi số oxi hóa của nguyên tử các nguyên tố và vai trò của sulfur dioxide trong phản ứng của sulfur dioxide với hydrogen sulfide và nitrogen dioxide.
SO2 + NO2 →SO3 + NO
SO2 + 2H2S →3S + 2H2O ………………………………………………………………………………………………… …………………………………………………………………………………………………
…………………………………………………………………………………………………
Câu 7. Sulfur dioxide thuộc loại acidic oxide. Hãy cho biết sulfur dioxide có phản ứng được với calcium hydroxide, calcium oxide không. Viết phương trình hoá học của phản ứng xảy ra (nếu có). …………………………………………………………………………………………………
Câu 10. Tại một số nhà máy, người ta dùng calcium oxide (vôi sống) hoặc calcium hydroxide (vôi tôi) để hấp thụ sulfur dioxide trong khí thải.
a) Viết phương trình hoá học của các phản ứng trên.
b) Ở mỗi phản ứng, sulfur dioxide thể hiện tính chất gì?
DẠNG 2: SULFURIC ACID VÀ MUỐI SULFATE
Câu 8. Nguyên tử sulfur thể hiện nhiều số oxi hoá khác nhau trong các hợp chất, như -2, +4, +6. Hãy giải thích vì sao SO2 có cả tính khử và tính oxi hóa.
…………………………………………………………………………………………………
Câu 11.
a. Viết phương trình hóa học minh họa tính acid của dung dịch H2SO4 loãng với kim loại Fe,
bột MgO, dung dịch Na2CO3 và dung dịch BaCl2
Câu 9. Cả sulfur và sulfur dioxide đều là những chất vừa có tính oxi hoá, vừa có tính khử. Hãy viết phương trình hoá học minh hoạ ………………………………………………………………………………………………… …………………………………………………………………………………………………
b. Hãy viết phương trình hoá học của phản ứng giữa dung dịch sulfuric acid loãng, dư với lần lượt từng chất sau: kẽm (zinc), zinc oxide, barium hydroxide, sodium carbonate.
34
………………………………………………………………………………………………… …………………………………………………………………………………………………
Ạ
35 ………………………………………………………………………………………………… …………………………………………………………………………………………………
………………………………………………………………………………………………… …………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
Câu 12. Viết phương trình hoá học của các phản ứng theo dãy chuyển hoá dưới đây.
YKÈMQUYNHƠNOFFICIAL
FeS2 → SO2 → SO3 → H2SO4 → (NH4)2SO4 ………………………………………………………………………………………………… ………………………………………………………………………………………………… …………………………………………………………………………………………………
Câu15. Dựđoán hiện tượng xảy rakhi chovài giọt dung dịchsulfuricacid đặcvào ống nghiệm chứa vài hạt cơm (thành phần chính là tinh bột ((C6H10O5)n). Viết phương trình hoá học minh họa.
Câu 13. Dung dịch sulfuric acid đặc thể hiện tính oxi hóa mạnh, khi đun nóng oxi hóa được nhiều kim loại, phi kim và hợp chất. Hãy viết phương trình hóa học cho các phản ứng sau:
a). Cho mẩukim loại copper (Cu) quadungdịch sulfuricacid đặc nóngthu muối copper sulfate, khí sulfur dioxide và nước.
b). Cho mẫu than (carbon) vào dung dịch sulfuric acid đặc nóng thu được hỗn hợp khí carbon dioxide, sulfur dioxide và nước.
………………………………………………………………………………………………… …………………………………………………………………………………………………
…………………………………………………………………………………………………
Câu 16. Dung dịch sulfuric acid đặc được sử dụng để sản xuất phosphoric acid và phân bón superphosphate từ quặng phosphorita và apatite. Hãy viết phương trình hoá học của phản ứng giữa dung dịch sulfuric acid đặc với Ca3(PO4)2 trong hai quặng trên. ………………………………………………………………………………………………… …………………………………………………………………………………………………
Câu 14.
a)Viếtphươngtrìnhhoáhọccủaphản ứngkhicholầnlượtcácchấtrắnsodiumchloride(NaCl), sodium bromide (NaBr) tác dụng với dung dịch sulfuric acid đặc.
b) Chỉ ra vai trò của sulfuric acid trong mỗi phản ứng đó.
…………………………………………………………………………………………………
Câu 17. Dựa vào tính chất nào để phân biệt nhanh muối magnesium sulfate (MgSO4) và muối barium sulfate (BaSO4)? ………………………………………………………………………………………………… …………………………………………………………………………………………………
Câu 18. Trình bày phương pháp hoá học để phân biệt các cặp dung dịch sau:
a) BaCl2 và NaCl.
b) H2SO4 loãng và HCI.
36
Ạ
37 …………………………………………………………………………………………………
………………………………………………………………………………………………… …………………………………………………………………………………………………
…………………………………………………………………………………………………
YKÈMQUYNHƠNOFFICIAL
………………………………………………………………………………………………… …………………………………………………………………………………………………
Câu 19. Hai chất phụ gia thực phẩm đều màu trắng là bột thạch cao nung (CaSO4) và bột "baking soda" NaHCO3. Làm thế nào để phân biệt hai chất phụ gia này?
………………………………………………………………………………………………… …………………………………………………………………………………………………
Câu 20. Trình bày cách sử dụng dung dịch barium hydroxide để phân biệt ba phân đạm có thành phần chính lần lượt là NaNO3, NH4Cl, (NH4)2SO4 ………………………………………………………………………………………………… ………………………………………………………………………………………………… …………………………………………………………………………………………………
DẠNG 3. BÀI TẬP VỀ SULFUR DIOXIDE VÀ SULFURIC ACID
Câu 21. Xác định biến thiên enthalpy của phản ứng sau ởđiều kiện chuẩn SO2(g) + ½ O2(g) → SO3(l) biết nhiệt tạo tạo thành ∆fH 0 298 của SO2(g) là –296,8 kJ/mol, của SO3(l) là – 441,0 kJ/mol.
…………………………………………………………………………………………………
Câu 22. Xác định biến thiên enthalpy của phản ứng sau ởđiều kiện chuẩn
4FeS(s) + 7O2(g) → 2Fe2O3(s) + 4SO2(g)
biết nhiệt tạo thành ∆fH 0 298 của các chất FeS(s), Fe2O3(s) và SO2(g) lần lượt là –100,0 kJ/mol, –825,5 kJ/mol và –296,8 kJ/mol. …………………………………………………………………………………………………
Câu 23. Cho phương trình nhiệt hóa học sau: SO2 + ½ O2 25 0
VO ⇀ ↽ SO3 ∆rH 0 298 = -98,5 kJ
a) Tính lượng nhiệt giải phóng ra khi chuyển 76,8 g SO2 thành SO3.
b) Giá trị ∆rH 0 298 của phản ứng: SO3(g) → SO2(g) + ½ O2(g) là bao nhiêu?
Câu 24.
a) Hòa tan 4,9 gam H2SO4 vào nước đểđược 1000 mL dung dịch. Tính giá trị pH của dung dịch acid?
b) Hoà tan 20 mL dung dịch HCl 0,05M vào 20 mL dung dịch H2SO4 0,075 M. Nếu sự hoà tan không làm thay đổi thể tích thì pH của dung dịch thu được có giá trị là bao nhiêu?
c) Năm 1909, nhà hoá học Đan Mạch P.L.Srensen (Pete Lanritz Srensen, 1868−1939) đưa ra khái niệm pH đểđặc trưng cho độ axit của dung dịch và định nghĩa pH = − lg[H+]. Nếu
38
Ạ
39
…………………………………………………………………………………………………
………………………………………………………………………………………………… ………………………………………………………………………………………………… …………………………………………………………………………………………………
YKÈMQUYNHƠNOFFICIAL
trộn 150ml dung dịch H2SO4 1M với 50ml dung dịch NaOH 2M thì dung dịch thu được có giá trị pH là bao nhiêu?
d) Trộn 50 mL dung dịch H2SO4 0,2M với 50 mL dung dịch NaOH 0,6M. Tính giá trị của pH tạo thành sau phản ứng? ………………………………………………………………………………………………… ………………………………………………………………………………………………… ………………………………………………………………………………………………… ………………………………………………………………………………………………… ………………………………………………………………………………………………… ………………………………………………………………………………………………… ………………………………………………………………………………………………… ………………………………………………………………………………………………… …………………………………………………………………………………………………
………………………………………………………………………………………………… ………………………………………………………………………………………………… ………………………………………………………………………………………………… ………………………………………………………………………………………………… ………………………………………………………………………………………………… ………………………………………………………………………………………………… ………………………………………………………………………………………………… ………………………………………………………………………………………………… …………………………………………………………………………………………………
BÀI TẬP TRẮC NGHIỆM
Câu 25.
a) Tính thể tích dung dịch H2SO4 98% (D = 1,84 g mL−1) cần dùng để pha chế thành 500 mL dung dịch H2SO4 0,05 M.
b) Tính thể tích dung dịch H2SO4 0,05 M cần dùng để trung hoà 10 mL dung dịch NaOH có pH = 13.
c) Cho 855 gam dung dịch Ba(OH)2 10% vào 200g dung dịch H2SO4. Lọc bỏ kết tủa, để trung hòa nước lọc phải dùng 125 ml dung dịch NaOH 25% (D= 1,28g/ml). Tính nồng độ % H2SO4 trong dung dịch ban đầu.
PHẦN 1. SULFUR VÀ SULFUR DIOXIDE
Câu 1. Nguyên tố sulfur có số hiệu nguyên tử là 16. Vị trí của sulfur trong bảng tuần hoàn các nguyên tố hóa học là
A. chu kì 3, nhóm VIA. B. chu kì 5, nhóm VIA.
C. chu kì 3, nhóm IVA. D. chu kì 5, nhóm IVA.
Câu 2. Tính chất vật lí nào sau đây không phải của sulfur?
A. là chất rắn màu vàng, không tan trong nước.
B. tinh thể sulfur gồm 8 nguyên tử liên kết với nhau tạo thành mạch vòng S8
40
Ạ
41
C. có nhiệt độ nóng chảy thấp hơn nhiệt độ sôi của nước.
D. tan nhiều trong benzene, carbon disulfile.
Câu 3. Tính chất nào sau đây không phải tính chất vật lí của sulfur
A. màu vàng ởđiều kiện thường. B. thể rắn ởđiều kiện thường.
C. không tan trong benzene. D. không tan trong nước.
Câu 4. Các số oxi hoá có thể có của sulfur là
A. -2, 0, +2, +6. B. 0, +2, +4, +6. C. -2, 0, +4, +6. D. -2, 0, +3, +6.
Câu 5. Số oxi hóa của sulfur trong phân tử SO2 là
A. + 4. B. - 2. C. + 6. D. 0.
Câu 6. Số oxi hoá của sulfur trong các hợp chất: SO2, H2S, H2SO4, CuSO4 lần lượt là
A. 0, +4, +6, +6. B. +4, -2, +6, +6. C. 0, +4, +6, -6. D. +4, +2, +6, +6.
Câu 7. Cho các chất: S, SO2, H2S, H2SO4 . Trong số chất đã cho, số chất vừa có tính oxi hóa, vừa có tính khử là
A. 1 B. 2 C. 3 D. 4
Câu 8. Câu nào sau đây diễn tảđúng tính chất hóa học của sulfur?
A. Sulfur có cả tính oxi hóa và tính khử C. Sulfur chỉ có tính khử
B. Sulfur không có tính oxi hóa và tính khử. D. Sulfur chỉ có tính oxi hóa.
Câu 9. Phát biểu nào sau đây không đúng?
A. Sulfur là một phi kim mạnh, có tính oxi hóa mạnh điển hình.
B. Khi tham gia phản ứng, sulfur thể hiện tính oxi hóa hoặc tính khử
C. Điều kiện thường, sulfur là chất rắn, màu vàng, không tan trong nước.
D. Điều kiện thường, sulfur tồn tại dạng phân tử tám nguyên tử S8
YKÈMQUYNHƠNOFFICIAL
Câu 10. Phản ứng sulfur (S) thể hiện tính oxi hóa là
A. S + O2 0 → SO2
C. S + H2SO4 → SO2 + H2O.
B. S + 3F2 0t → SF6
D. S + Hg → HgS
Câu 11. Cho các phản ứng hóa học: (a) S + O2 0t → SO2 b) Hg + S → HgS
Phát biểu đúng về vai trò của sulfur trong các phản ứng trên là
A. (a) và (b) đều thể hiện tính oxi hóa.
B. (a) và (b) đều thể hiện tính khử
C. (a) thể hiện tính khử, (b) thể hiện tính oxi hóa.
D. (a) thể hiện tính oxi hóa, (b) thể hiện tính khử
Câu 12. Trong phản ứng: 3S + 6KOH 0 → 2K2S + K2SO3 + 3H2O. Sulfur (S) đóng vai trò
A. không là chất oxi hóa cũng không là chất khử B. chất khử
C. vừa là chất oxi hóa vừa là chất khử D. chất oxi hóa.
Câu 13. Cho các phản ứng sau
a) S + O2 0t → SO2 b) Hg + S → HgS
c) S + HNO3 → H2SO4 + NO2 + H2O d) Fe + S 0 → FeS
Có bao nhiêu phản ứng trong đó sulfur đóng vai trò là chất khử
A. 1. B. 2. C. 3 D. 4
Câu 14. Cho phản ứng hóa học sau: S + 6HNO3 (đặc) 0t → H2SO4 + 6NO2 + 2H2O. Tổng hệ số các chất tham gia phản ứng là
A. 6 B. 7 C. 9 D. 8
Câu 15. Cho phản ứng hóa học: aS + bH2SO4 → cSO2 + dH2O. Hệ số cân bằng (a, b, c, d) của phản ứng trên lần lượt là
A. 2, 1, 2, 3. B. 1, 2, 3, 2. C. 1, 1, 2, 3. D. 3, 2, 1, 1.
Câu 16. Hơi thủy ngân (mercury) rất độc, bởi vậy khi làm vỡ nhiệt kế thủy ngân thì chất bột được dùng để rắc lên thủy ngân rồi gom lại là
A. vôi sống. B. cát. C. muối ăn. D. sulfur.
Câu 17. Sulfur có khả năng phản ứng với kim loại nào ở nhiệt độ thường?
A. Na B. Hg C. Fe D. Mg
Câu 18. Phát biểu nào sau đây sai?
A. Điều kiện thường, sulfur ở thể rắn.
B. Sulfur tác dụng với thủy ngân (mercury) ngay ở nhiệt độ thường.
C. Sulfur vừa có tính oxi hóa, vừa có tính khử
D. Sulfur dễ tan trong nước.
Câu 19. Ứng dụng nào sau đây không phải của sulfur?
A. Làm nguyên liệu sản xuất sulfuric acid. B. Làm chất lưu hóa cao su.
C. Khử chua đất. D. Chế tạo diêm, thuốc nổđen.
Câu 21. Chất được dùng để tẩy trắng giấy và bột giấy trong công nghiệp là
A. CO2 B. SO2 C. N2O D. NO2
Câu 22. Ô nhiễm không khí có thể tạo ra mưa acid, gây ra tác hại rất lớn với môi trường. Hai khí nào sau đây đều là nguyên nhân gây ra mưa acid?
A. H2S và N2 B. CO2 và O2 C. SO2 và NO2 D. NH3 và HCl.
Câu 23. Phản ứng hóa học nào sau đây chứng tỏ SO2 là oxide acid
A. SO2 + Br2 + H2O → HBr + H2SO4 B. SO2 + H2S→ S+H2O
C. SO2 + NaOH → Na2SO3 + H2O D. SO2 + O2 → SO3
42
Ạ
43
Câu 24. Cho phương trình hóa học: NO2 + SO2 → NO + SO3. Câu nào sau đây diễn tả
đúng tính chất của các chất trong phản ứng?
A. NO2 là chất khử, SO2 là chất oxi hóa. B. NO2 là chất oxi hóa, SO2 là chất khử
C. NO2 là chất oxi hóa, SO2 là chất bị khử D. NO2 là chất khử, SO2 là chất bị oxi hóa
Câu 25. Cho phương trình hóa học: SO2 + KMnO4 + H2O → K2SO4 + MnSO4 + H2SO4.
Ch
ọn kết luận đúng
A. SO2 là chất khử, H2O là chất oxi hóa.
B. KMnO4 là chất chất oxi hóa, H2O là chất khử
C. SO2 là chất khử, KMnO4 là chất chất oxi hóa.
D. H2O là chất chất oxi hóa, KMnO4 là chất khử
Câu 26. Trong phản ứng: SO2 + H2S → S + H2O, câu nào diễn tảđúng tính chất của chất?
A. Sulfur trong SO2 bị oxi hóa và hydrogen trong H2S bị khử.
B. Sulfur trong SO2 bị khử, sulfur trong H2S bị oxi hóa.
C. Sulfur trong SO2 bị oxi hóa và sulfur trong H2S bị khử
D. Sulfur bị khử và không có chất nào bị oxi hóa.
Câu 27. Trong phản ứng sau đây, phản ứng nào SO2 thể hiện tính khử?
A. 2SO2 + O2 25 0
VO t ⇀ ↽ 2SO3 B. SO2 + H2O ⇀ ↽ H2SO3
C. SO2 + CaO → CaSO3 D. SO2 + 2NaOH → Na2SO3 + H2O
Câu 28. Trong các phản ứng sau, phản ứng nào SO2 đóng vai trò là chất oxi hóa?
A. 2NaOH + SO2 → Na2SO3 + H2O B. 2HNO3 + SO2 → H2SO4 + NO2
C. SO2 + Br2 + 2H2O → H2SO4 + 2HBr D. H2S + SO2 →3S + H2O
YKÈMQUYNHƠNOFFICIAL
Câu 29. Cho các phản ứng sau :
2SO2 + O2 25 0
VO ⇀ ↽ 2 SO3 (I) SO2 + 2H2S → 3S + 2H2O (II)
SO2 + Br2 + 2H2O → H2SO4 + 2HBr (III) SO2 + NaOH → NaHSO3 (IV)
Các phản ứng mà SO2 có tính khử là
A. (I) và (III) B. (I) và (II) C. (I) , (II) và (III) D. (III) và (IV)
Câu 30. Cho phản ứng hóa học: SO2 + Br2 + H2O → HBr + H2SO4. Hệ số cân bằng của phản ứng trên lần lượt là
A. 1, 1, 2, 2, 1. B. 2, 2, 1, 1, 2. C. 2, 1, 2, 1, 2. D. 1, 2, 1 ,2 1.
Câu 31. Cho phản ứng hóa học (theo tỉ lệ số mol tương ứng):
SO2 + Br2 + 2H2O → X + 2HBr .
X là chất nào sau đây? A.
Câu 32. Chỉ dùng một thuốc thử nào sau đây để phân biệt các lọđựng riêng biệt SO2 và CO2?
A. dung dịch Ba(OH)2 B. dung dịch NaOH.
C. dung dịch Br2 D. dung dịch Ca(OH)2
Câu 33. Khi cho khí SO2 vào dung dịch H2S thì xảy ra phản ứng:
SO2 + 2H2S → 3S + 2H2O
Hiện tượng quan sát được sau khi kết thúc phản ứng là
A. dung dịch bị vẩn đục màu vàng. B. không có hiện tượng gì.
C. dung dịch chuyển thành màu nâu đen. D. tạo thành chất rắn màu đỏ
Câu 34. Trong công nghiệp, từ khí SO2 và O2, phản ứng hoá học tạo thành SO3 xảy ra ởđiều kiện nào sau đây?
A. Nhiệt độ phòng B. Đun nóng đến 500oC
C. Đun nóng đến 500oC và có xúc tác V2O5. D. Nhiệt độ phòngvàcó mặtxúctácV2O5.
Câu 35. Cho cân bằng sau: 2SO2(k) + O2(k) ⇀ ↽ 2SO3(k) H = -198,24 kJ.
Để tăng hiệu suất của quá trình tạo SO3 phải:
A. Giảm nồng độ của SO2 , thêm xúc tác. B. Giữ phản ứng ở nhiệt độ thường.
C. Tăng nhiệt độ của phản ứng . D. Giảm nhiệt độ của phản ứng
PHẦN 2. SULFURIC
ACID VÀ MUỐI SULFATE
Câu 36. Khi pha loãng dung dịch sulfuric cần tuân thủ thao tác nào sau đây để đảm bảo an toàn?
A. Rót từ từ acid vào nước. B. Rót từ từ nước vào acid.
C. Rót nhanh acid vào nước. D. Rót nhanh nước vào acid.
Câu 37. Rót vào cốc chứa đường saccarose khoảng 10 đến 15 ml dung dịch H2SO4 đặc. Hiện tượng quan sát được là
A. đường tan trong acid tạo thành dung dịch trong suốt.
B. đường bị hóa than màu nâu đỏ, trên bề mặt than có sủi bọt khí.
C. đường tan trong acid tạo dung dịch có màu xanh.
D. đường bị hóa than màu đen, trên bề mặt than có sủi bọt khí.
Câu 38. Tính chất hóa học chung của sulfuric acid là
A. tính acid mạnh và tính khử mạnh. B. tính acid mạnh và tính oxi hóa mạnh.
C. tính acid yếu và tính khử mạnh. D. tính acid yếu và tính oxi hóa mạnh.
Câu 39. Dãy kim loại phản ứng được với dung dịch H2SO4 loãng là
A. Ag, Ba, Fe. B. Mg, Al, Fe. C. Cu, Zn, Na. D. Au, Pt, Al.
Câu 40. Kim loại không phản ứng được với axit H2SO4 đặc, nguội là
A. Ag. B. Al. C. Mg. D. Cu.
Câu 41. Những kim loại nào dưới đây thụđộng trong H2SO4 đặc, nguội?
44
C.
D. H2
4 Ạ
H2S B. SO3
S
SO
45
A. Cu, Fe,Cr. B. Al, Fe, Cr C. Zn, Al, Mg. D. Zn, Fe, Al.
Câu 42. Cho dãy các kim loại: Na, Mg, Fe, Zn, Cu, Ag. Số kim loại tác dụng với dung dịch
H2SO4 loãng là
A. 4 B. 5. C. 2. D. 3.
Câu 43. Sulfuric acid loãng tác dụng với Fe tạo thành sản phẩm
A. Fe2(SO4)3 và H2 B. FeSO4 và H2
C. FeSO4 và SO2 D. Fe2(SO4)3 , SO2, H2O
Câu 44. Sản phẩm tạo thành giữa phản ứng FeO với H2SO4 đặc, đun nóng là
A. Fe2(SO4)3, SO2, H2O. B. Fe2(SO4)3, H2O. C. FeSO4, SO2, H2O. D. FeSO4, H2O
Câu 45. Cho FeCO3 tác dụng với H2SO4 đặc nóng, sản phẩm khí thu được gồm có
A. CO2 và SO2 B. H2S và CO2 C. CO2 D. SO2
Câu 46. Phương trình hóa học đúng là
A. Mg + H2SO4 loãng→ MgSO4 +H2
B. 2Al + 3H2SO4 đặc, nóng → Al2(SO4)3 +3H2
C. 2Fe + 3H2SO4 loãng→ Fe2(SO4)3 +3H2
D. Fe + 2H2SO4 đặc → ot FeSO4 +SO2 + 2H2O
Câu 47. Cho chất rắn nào sau đây vào dung dịch H2SO4 đặc thì xảy ra phản ứng oxi hoá - khử?
A. KBr. B. NaCl. C. CaF2 D. CaCO3
Câu 48. Chophươngtrình phản ứng: aAl + bH2SO4 → cAl2(SO4)3 +dSO2 +eH2O. Tỉ lệ a: b là
A. 2 : 3 B. 1 : 1 C. 1: 3 D. 1: 2
Câu 49. Cho phương trình hóa học sau: P + H2SO4 → H3PO4 + SO2 + H2O. Hệ số của chất oxi
hóa và chất khử trong phương trình hóa học là
A. 5 và 2. B 2 và 5. C. 7 và 9. D. 7 và 7.
YKÈMQUYNHƠNOFFICIAL
Câu 50. Cho phương trình hóa học sau: Al + H2SO4 → Al2(SO4)3 + S + H2O. Tổng hệ số tỉ
lượng của các chất tham gia phản ứng và sản phẩm của phản ứng là
A. 12. B. 10 C. 9. D. 8
Câu 51. Sulfuric acid đặc thường được dùng để làm khô các chất khí ẩm. Khí nào sau đây có thểđược làm khô nhờ sulfuric acid đặc?
A. Khí CO2 B. Khí H2S C. Khí NH3 D. Khí SO3
Câu 52. Phát biểu không đúng?
A. Sulfuric acid (H2SO4) trong đó sulfur có số oxi hóa là +6.
B. Sulfuric acid (H2SO4) là một trong những hóa chất cơ bản, ứng dụng rộng rãi trong sản xuất phân bón hóa học, chất tẩy rửa, sơn, chất dẻo, luyện kim, phẩm nhuộm, dược phẩm, hóa dầu...
C. Sulfuric acid đặc là một chất rất háo nước, có thể làm khô được nhiều chất khí ẩm.
D. Sulfuric acid loãng thể hiện tính acid mạnh và tính oxi hóa mạnh.
Câu53. Dung dịchH2SO4 đặc, nóng tácdụng đượcvới cácchất trongdãynàosau đâymàdung dịch H2SO4 loãng không tác dụng?
A. BaCl2, NaOH, Zn. B. NH3, MgO, Ba(OH)2
C. Fe, Al, Ni. D. Cu, S, FeSO4.
Câu 54. Dung dịch H2SO4 đặc, nóng tác dụng được với dãy các chất nào sau đây, thu được sản phẩm không có khí thoát ra?
A. Fe, BaCO3, Cu. B. FeO, KOH, BaCl2
C. Fe2O3, Cu(OH)2, Ba(OH)2 D. S, Fe(OH)3, BaCl2
Câu 55. Kết luận nào không đúng khi nói về H2SO4?
A. H2SO4 loãngcó đầy đủ tính chất chung của acid.
B. Khi tiếp xúc với H2SO4 đặc dễ gây bỏng nặng.
C. Khi pha loãng sulfuric acid, cho từ từ nước vào acid.
D. H2SO4 đặc là chất hút nước mạnh.
Câu 56. Cho dãy các chất: NaOH, NaCl, NaNO3, Na2SO4. Chất trong dãy phản ứng được với dung dịch BaCl2 là
A. NaOH. B. NaCl. C. Na2SO4. D. NaNO3.
Câu 57. Cho vài giọt dung dịch BaCl2 vào dung dịch nào sau đây sẽ tạo kết tủa trắng?
A. KCl. B. K2SO4. C. KNO3. D. KOH.
Câu 58. Nhận biết dung dịch muối sulfate (SO4 2-) dùng thuốc thử nào sau đây?
A. Ba(OH)2. B. quì tím. C. Na. D. HCl.
Câu 59. Để phân biệt dung dịch Na2SO4 với dung dịch NaCl, người ta dùng dung dịch
A. KNO3 B. NaOH. C. HCl. D. BaCl2
Câu60. Có 4 dung dịch đựng trong 4 lọ mất nhãn: HCl, Na2SO4, NaCl, Ba(OH)2, chỉ dùng một thuốc thử có thể nhận biết được được tất cả các chất trên là
A. Quỳ tím. B. H2SO4. C. BaCl2. D. AgNO3.
46
Ạ
47
NHÓM 4 MÔN BÀI TẬP HÓA HỌC Ở THPT
HỌCSƯPHẠM
KHOAHÓAHỌC
ĐỊNHHƯỚNG
NHÓM 4 – 18SHH
LÊ THẢO NI
LÂM PHẠM THÚY MI
NGUYỄN THỊ MỸ
PHÙNG THỊ HOÀNG MI
NGUYỄN HOÀNG BẢO AN
ĐỀKIỂMTRA
CHỦĐỀNITROGENVÀSULFUR
1.Mụcđích,yêucầucủađềkiểmtra
Đánhgiákếtquảhọctậpcủahọcsinh(HS)saukhihọcxongchủđề“NITROGENVÀ
SULFUR” .
2.Mụctiêu
2.1. Kiến thức
Củngcố,kiểmtrakiếnthứcvề:Chủđề“NITROGENVÀSULFUR” .
-Đơnchấtnitrogen
+Trạngtháitựnhiêncủanguyêntốnitrogen.
+Tínhtrơcủađơnchấtnitrogenởnhiệtđộthườngthôngqualiênkết.
+Sựhoạtđộngcủađơnchấtnitơởnhiệtđộcaođốivớihydrogen,oxygen.Quátrình
tạovàcungcấpnitratechođấttừnướcmưa.
+Ứngdụngcủađơnchấtnitrogenlỏngtrongđờisống.
-Ammoniavàmộtsốhợpchấtammonium
+ Tính chất vật lí, tính chất hoá học phân tử ammonia. Viết được phương trình hoá học
+Cânbằnghoáhọc,tốcđộphảnứngchophảnứngtổnghợpammoniatừnitrogenvà hydrogentrongquátrìnhHaber.
+Tínhchấtcơbảncủamuốiammoniumvànhậnbiếtionammoniumtrongdungdịch.
+Ứngdụngcủaammonia,củaammoniumnitratevàmộtsốmuốiammoniumtan.
-Mộtsốhợpchấtvớioxygencủanitrogen
+ Nguồn gốc của các oxide của nitrogen trong không khí và nguyên nhân gây hiện tượngmưaacid.
+CấutạocủaHNO3, tínhacid,tínhoxihóamạnhcủanitricacid.

+Nguyênnhân,hệquảcủahiệntượngphúdưỡnghóa(eutrophication).
-Lưuhuỳnhvàsulfurdioxide
+Tínhchấthóahọccơbảncủalưuhuỳnhđơnchất.
+Tínhoxihoá(tácdụngđượcvớihydrogensulfide)vàtínhkhử(tácdụngvớinitrogen dioxide,xúctácnitrogenoxidetrongkhôngkhí)vàứngdụngcủasulfurdioxide(khả năngtẩymàu).
+Sựhìnhthànhsulfurdioxidedotácđộngcủaconngười,tựnhiên,táchạicủasulfur oxidevàmộtsốbiệnpháplàmgiảmthiểulượngsulfurdioxidethảivàokhôngkhí.
-Sulfuricacidvàmuốisulfate.
+Tínhchấtvậtlí,cáchbảoquản,sửdụngvànguyêntắcxửlísơbộkhibỏngacid.
+CấutạoH2SO4;tínhchấthoáhọccơbản,ứngdụngcủasulfuricacidloãng,sulfuric acidđặcvànhữnglưuýkhisửdụngsulfuricacid.
NHÓM 4 MÔN BÀI TẬP HÓA HỌC Ở THPT 1
BÀITẬP
PHÁT TRIỂNNĂNGLỰCCHỦĐỀ NITROGENVÀSULFUR ĐẠIHỌCĐÀNẴNG TRƯỜNGĐẠI
DẠ
YKÈMQUYNHƠNOFFICIAL
2
+Thínghiệmchứngminhtínhháonướccủasulfuricacidđặc.
+Chuyểndịchcânbằng đểgiảithíchcácgiaiđoạntrongquátrìnhsảnxuấtsulfuric acidtheophươngpháptiếpxúc.
+NhậnbiếtđượcionSO4 2- trongdungdịchbằngionBa2+ .
2.2. Kĩ năng
-Kỹnăngtưduylogic,giảiquyếtvấnđềmới,cótínhsángtạo
-Tínhtoán,vậndụngkiếnthứctoánhọcvàogiảiquyếtbàitậphóahọc.
3.Hìnhthứcđềkiểmtra
-Tựluận+trắcnghiệmkháchquan.
4.Matrậnđềkiểmtra
Các câu hỏi của đề kiểm tra tương ứng với 4 mức độ nhận thức là: Nhận biết, thông hiểu,vậndụngvàvậndụngcao.
YKÈMQUYNHƠNOFFICIAL
NHÓM4 MÔNBÀITẬPHÓAHỌCỞTHPT
MATRẬNĐỀKIỂMTRA Chủđề Mứcđộnhậnthức Cộng
1.1. Đơn chất nitrogen Sốcâu:02 Sốcâu: 01 Sốcâu:01 Sốcâu:01 Sốcâu: 17 Tỉlệ: 56,7%
1.2. Ammonia và một số hợp chấtammonium Sốcâu: 01 Sốcâu: 01 Sốcâu:01 Sốcâu:02 Sốcâu:03 Sốcâu:01
1.3.Mộtsốhợp chất với oxygen củanitrogen
Sốcâu: 01 Sốcâu: 01 Sốcâu:01
2.1. Lưu huỳnh và sulfur dioxide Sốcâu:01 Sốcâu: 01 Sốcâu: 01 Sốcâu:01 Sốcâu:01 Sốcâu:01 Sốcâu: 13 Tỉlệ: 43,3%
2.2.Sulfuricacid vàmuốisulfate Sốcâu:01 Sốcâu: 01 Sốcâu:02 Sốcâu:01 Sốcâu:01 Sốcâu:01
NHÓM 4 MÔN BÀI TẬP
Ở THPT 3
HÓA HỌC
DẠ
4
1 2 3 4 TN TL TN TL TN TL TN TL
NHÓM 4 MÔN BÀI TẬP HÓA HỌC Ở THPT
A.TRẮCNGHIỆMKHÁCHQUAN
Câu1:(ND1.1,mức1)Đâulàcôngthứccấutạocủaphântửnitrogen?
A.N. B.N=N. C.N≡N. D.N–N. Câu 2: (ND 1.1, mức 1) Nitrogen chiếm khoảng bao nhiêu phần trăm thể tích trong khôngkhí?
A.78%. B.80%. C.85%. D.87%.
Câu3:(ND2.1,mức1)SốoxihoácủasulfurtrongcácchấtFeS,S,H2SO4,SO2 lần lượtlà
A.2-,0,6+,4+. B.3-,0,6+,4+. C.-3,0,+6,+4. D.-2,0,+6,+4. Câu4: (ND2.2,mức 1)Kim loại nào sau đây khôngtácdụngvới dungdịchH2SO4 đặcnguội?
A.Al. B.Mg. C.Ag. D.Zn.
Câu 5: (ND 1.1, mức 2) Sau cơn mưa có sấm sét, cây cối trở nên xanh tươi hơn do được cung cấp một lượng đạm từ quá trình chuyển đổi thành muối nitrate. Phản ứng đầutiêntrongquátrìnhtạoramuốinitratelà
D.Nướcvôitrong.
Câu10:(ND1.2,mức3)QuátrìnhHaberlàquátrìnhtổnghợpammoniatừnitrogen (N2)vàhydrogen(H2)đểchếtạophânbóntổnghợp.Đónggópphầnquantrọngtrong việcđápứngnhucầulươngthựccủangườidân.Phảnứngxảyraởnhiệtđộ550℃và ápsuấtkhoảng175atm.Đượcthểhiệntheophươngtrìnhsau:
N2 +3H2 2NH3 ∆H<0
Chocáccáchsau:
(1)TăngnồngđộH2
(2)Giảmápsuấtchungcủahệ.
(3)Tăngnhiệtđộ.
(4)GiảmnồngđộNH3
(5)Tănghàmlượngchấtxúctác.
Sốcáchlàmcânbằngchuyểndịchtheochiềuthuậnlà
A.2. B.3. C.4. D.5.
Câu 11: (ND 1.2, mức 3) Cho dung dịch Ba(OH)2 đến dư vào 80 ml dung dịch (NH4)2SO4. Biết rằng phản ứng tạo ra 13,98 gam một chất kết tủa. Tính nồng độ mol củaionNH4 +trongdungdịch(NH4)2SO4 banđầu?
A.4NH3 +5O2
B.2NH3 +3Cl2
C.2NH3 +3FeO
⎯⎯→ 4NO+6H2O
⎯⎯→ N2 +6HCl
A.0,75M. B.0,15M. C.1,5M. D.0,075M.
3
YKÈMQUYNHƠNOFFICIAL
t ⎯⎯→ 3Fe+N2 +3H2O
D.2NH3 +H2O2 +MnSO4
⎯⎯→ MnO2+(NH4)2SO4
Câu6:(ND1.2,mức2)Trongcácphảnứngsau,phảnứngnàoNH3 khôngđóngvai tròlàchấtkhử?
Câu12:(ND2.2,mức3)ChohỗnhợpXgồmMgvàFevàodungdịchsulfuricacid đặc,nóng Đếnkhicácphảnứngxảyrahoàntoàn,thuđượcdungdịchYvàmộtphần Fekhôngtan.ChấttancótrongdungdịchYlà
A.MgSO4,Fe2(SO4)3 vàFeSO4
B.MgSO4 vàFe2(SO4)3.
C.MgSO4 vàFeSO4.
D.MgSO4
Câu7:(ND1.3,mức2)HNO3 thểhiệntínhoxihóakhitácdụngvớichấtnàosauđây?
A.FeO. B.CuO. C.Al2O3. D.Na2O.
Câu8:(ND2.1,mức2)KhíXtantrongnướctạothànhdungdịchlàmquỳtímchuyển
sangmàuđỏ.Ngoàira,nócònđượcdùnglàmchấttẩymàu.KhíXlà
A.NH3 B.SO3 C.SO2 D.H2S.
Câu9:(ND2.2,mức2)Khibịbỏngbởisulfuricacidđặckhôngđượcrửavếtthương bằngdungdịchnào?
A.Nướcsinhhoạt.
B.Thuốcmuốinabica.
C.Giấmăn.
Câu13:(ND2.1,mức3)KhíSO2 docácnhàmáythảiralàmộttrongnhữngnguyên nhânquantrọnggâyônhiễmkhôngkhí.Tiêuchuẩnquốctếquyđịnh:Nếutrongkhông khínồngđộSO2 vượtquá30.10-6 mol/m3 thìkhôngkhíbịônhiễmSO2.Khitiếnhành phântích40lítkhôngkhíởmộtthànhphốAthấycóchứa0,084mgSO2,thànhphốB cóchứa0,0035mgSO2.HãychobiếtthànhphốnàobịônhiễmSO2?
A.ThànhphốAônhiễm,CM(A) =3,2.10-5 (mol/m3).
B.ThànhphốAkhôngônhiễm,CM(A) =1,3.10-6 (mol/m3)
C.ThànhphốBônhiễm,CM(B) =1,367.10-5 (mol/m3)
D.ThànhphốBkhôngônhiễm,CM(B) =5,46875.10-8 (mol/m3).
Câu14:(ND1.3,mức4)Chúngtathườngthấymộtsốao,hồ,kênh,rạchcótảo,rêu nổi lên phủ xanh mặt nước. Đó là hiện tượng phú dưỡng hoá hay còn gọi là “tảo nở
4 MÔN BÀI TẬP HÓA HỌC Ở THPT 5
NHÓM
N2 +O2 ��������ử��đ��ệ�� ⇔ 2NO
2 +2O2 ��������ử��đ��ệ�� ⇔ 2NO2 C.N2 +3H2 ,, txtp ⎯⎯⎯→ ⎯⎯⎯ 2NH3 D.4NO2
2H2O
O2 ⎯⎯→ 4HNO
A.
B.N
+
+
D
Ạ
6
hoa”. Tảo là động vật phù du, đơn bào có thể được miêu tả bằng công thức (CH2O)106(NH3)16H3PO4
Chocácphátbiểusau:
(a)Phúdưỡnghoálàhiệntượngthiếunitratevàphosphate,tạocơhộichosinhvậtphù du(tảo,rêu,...)sinhtrưởng.
(b)Cácyếutốgâynên hiệntượng phúdưỡng hóalàchấtdinh dưỡng,độsâu củahồ, khảnănglưuchuyểnnướcvàđiềukiệnkhíhậu.
(c)TỉsốN:P=16:1đượcgọilà“giátrịbiênđộđỏ”.Giátrịnàybiểuthịlượngcần thiếtNvàPtạonêntảo.
(d)Nướcthảisinhhoạtchưaquaxửlíkhônggâyrahiệntượngphúdưỡnghóa.
(e) Người nông dân sử dụng phân đạm, phân lân để tăng năng suất cây trồng cũng là nguyênnhângâyphúdưỡng(câytrồngchỉhấpthụ30–40%phânđạmcònlạibịtích tụtrongđất).
(f)Tảo,bèopháttriểnmạnhtrênmặtnướccungcấpnhiềuoxygentrongnướcgiúpcá, tômhôhấptốthơn.
(g) Hiện tượng phú dưỡng ảnh hưởng đến nguồn cung cấp nước, sức khỏe con người vàlàmảnhhưởngđếncảnhquandulịch,giảitrí(câucá,bơithuyền,…).
Sốphátbiểuđúngvềhiệntượngphúdưỡnglà
A.4. B.5. C.6. D.7.
Câu 15: (ND 2.2, mức 4) Sulfuric acid là hóa chất hàng đầu trong nhiều ngành sản xuất,đượcmệnhdanhlà“máu”củangànhcôngnghiệp.Hàngnăm,cácnướctrênthế giớisảnxuấtkhoảng160triệutấnsulfuricacid,phươngphápsảnxuấtsulfuricacidcó
3côngđoạnchính:SảnxuấtSO2 →sảnxuấtSO3 →sảnxuấtH2SO4.Chocácphátbiểu
sau:
YKÈMQUYNHƠNOFFICIAL
(a)Nguyênliệubanđầuđểsảnxuấtsulfurdioxidelàsulfurvàquặngpiritsắt.
(b)TrongcôngđoạnsảnxuấtSO3 từSO2 thìphảnứng2SO2(k) +O2(k)
2SO3(k) (∆��<0)làphảnứngtoảnhiệtnênkhităngnhiệtđộcânbằngchuyểndịchtheochiều thuận.
(c) Sulfuricacidđặchấpthụnướctừcáchợpchấtglucide(Cn(H2O)m)tạoCO2,SO2 và H2O.
(d)Sulfuricacidđượcdùngđểsảnxuấtphânbón,chấtgiặttẩyrửatổnghợp,chấtdẻo, phẩmnhuộm.
(e)NgườitadùngH2SO4 98%hấpthụSO3 đượcoleum.Mộtloạioleumcó62%SO3 vềkhốilượng,côngthứccủaoleumđólàH2SO4.3SO3
(f)Phươngphápngượcdòngđểsảnxuấtsulfuricacid(chodungdịchH2SO4 từtrênđi xuốngvàkhíSO3 từdướiđilêntrongtháphấpthụ)làmtăngtốcđộcủaphảnứnghoá họctrongtháp.
(g)Cáctoathùngthépdùngđểvậnchuyểnsulfuricacidđặc(nồngđộ>70%),saukhi lấyacidrakhỏithùngnênđểmộtthờigianngắnrồikhoávòithoátacid.
Sốphátbiểuđúnglà
A.3. B.4. C.5. D.6.
NHÓM 4 MÔN BÀI TẬP HÓA HỌC Ở THPT 8
NHÓM 4 MÔN BÀI TẬP HÓA HỌC Ở THPT 7
25, VOt ⎯⎯⎯→ ⎯⎯⎯
Ạ
D
NHÓM 4 MÔN BÀI TẬP HÓA HỌC Ở THPT
B.TỰLUẬN
Câu1:(ND2.1,mức1)BiếtnguyêntốsulfurthuộcnhómVIAtrongbảngtuầnhoàn hoáhọc.Emhãyviếtcôngthứcoxidecaonhấtcủasulfur.
Câu2:(ND1.2,mức1)Vàonhữngngàynắngnóng,nhàvệsinhthườngxuấthiệnmùi khaikhóchịu.Emhãychobiếtmùikhaiđódokhínàobốclên?
Câu3:(ND1.3+2.1,mức1)EmhãyviếtcôngthứccấutạocủaHNO3 vàH2SO4.
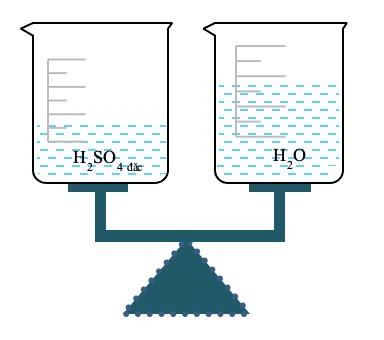
Câu4:(ND2.2,mức2)Trongphòngthínghiệm,cóhai cốc đựng dung dịch sulfuric acid đặc và nước được đặt trênbàncân.Biếtcânđangởvịtríthăngbằng(nhưhình vẽbên).Hỏisaumộtthờigiancâncònởvịtríthăngbằng haykhông.Vìsao?
Câu5:(ND2.2,mức2)Chocácphátbiểusau:
(1)Đổtừtừsulfuricacidđặcởcốcthứhaidọctheođũathủytinhvàocốcthứnhất.
(2)Xácđịnhnồngđộdungdịchsulfuricacidcầnpha.
(3) Cho lượng nước cất và sulfuric acid đặc vừa xác định được lần lượt vào cốc thủy tinhthứnhấtvàcốcthủytinhthứhai.
(4)Tiếptụcđổvàigiọtsulfuricacidđặcvàkhuấynhẹđếnkhihết.
(5)Xácđịnhthểtíchnướcvàsulfuricacidđặccầnlấy.
(6)Saukhi đổvàigiọt sulfuric acid đặc,dùngđũathủytinhkhuấy nhẹđềutrongcốc thứnhất.
YKÈMQUYNHƠNOFFICIAL
Hãysắpxếpcácphátbiểutheothứtựcácbướcphaloãngsulfuricacidđặc.
DCâu6:(ND1.1,mức2)Xácđịnhsốoxihóacủanguyêntốnitrogentrongcáchợpchất
sau:NO,NO2,Mg3N2,N2O,NH4Cl,N2O5,NH4NO3,AlN.
Câu7:(ND1.2,mức2)Trongphòngthínghiệm,đểđiềuchếkhíX,ngườitađunnóng dungdịchmuốiammoniumnitrite.Xlàkhígì?Viếtphươngtrìnhphảnứngminhhọa.

Câu8:(ND1.2,mức3)Dướiđâylàhìnhảnhhàmlượngcácchấttrênbaophânđạm
PhúMỹđượcthểhiệnnhưsau:Nitrogen46,3%,khốilượngtịnh50kg.Biếtthànhphần chính của đạm urea là (NH2)2CO. Hãy xác định khối lượng urea ít nhất có trong một baophânđạmureaPhúMỹ.

Câu9:(ND2.1,mức3)Hoànthànhchuỗiphảnứngsau:
Câu 10: (ND 2.2, mức 3) Cho m gam sulfur (S) vào dung dịch H2SO4 đặc, nóng thu đượcVlítkhí(ởđktc).SụcVlítkhínàyvàonướcchlorine(dư)thuđượcdungdịchY. ChoYvàodungdịchBaCl2 (dư)thuđược93,2gamkếttủa.TìmVvàm.
Câu 11: (ND 1.2, mức 3) Trong phòng thí nghiệm có bốn lọ hoá chất không màu bị mấtnhãnđựngtrongcáclọriêngbiệt:NH4NO3,HCl,(NH4)2SO4,Mg(NO3)2.Chỉdùng mộthóachấtemhãytrìnhbàycáchnhậnbiếtbốnlọhóachấttrên.
Câu12: (ND 1.2, mức3)Khitrao đổi trênlớphọc, bạn Tín nêura ýkiến: “Saumột thờigianbónphânđạmammonium(NH4Cl,NH4NO3,…)thìđộchuacủađấttănglên vìionNH4 +thủyphântạomôitrườngacidlàmchođấtchua”.BạnMinhlạichorằng: “BónphânđạmammoniumthìđộchuacủađấtgiảmvìNH4 + thủyphântạomôitrường base”.Theoem,ýkiếncủabạnnàođúng?Tạisao?

Câu 13: (ND 2.1, mức 4) Sulfur dioxide là một chất gây ô nhiễm môi trường không khí,pháhuỷtầngozone,cókhảnăngtácdụngvớinướctạothànhsulfuricacidgâymưa acid,ănmònkimloại,...Hìnhvẽdướiđâymôtảmộttrongcácphươngphápxửlíkhí SO2 hiệnnaylàhấpthụbằngđávôi(CaCO3).TrongđódungdịchhấpthụlàCa(OH)2
Hiệusuấtxửlícủaquátrìnhcóthểlênđến85–90%trongviệcloạibỏSO2.
NHÓM 4 MÔN BÀI TẬP HÓA HỌC Ở THPT 9
Ạ
10
NHÓM 4 MÔN BÀI TẬP HÓA HỌC Ở THPT
5.Đápán
a. Em hãy đề xuất quá trình xử lí khí SO2 ở hệ thốngbên.
b. Em hãy kể tên 2 phương pháp xử lí khí SO2 khácmàembiết.
A.TRẮCNGHIỆMKHÁCHQUAN(15câu)
Câu1:Đápán:C. Cácđápángâynhiễu:
CâuA:HSnhầmlẫngiữanguyêntửvàphântử.
CâuB,D:HSkhôngphânbiệtđượcliênkếttrongphântửnitrogen.
Câu2:Đápán:A. Vìthànhphầncủakhôngkhícó21%khíoxygen,78%khínitrogenvà1%cáckhíkhác.
Cácđápángâynhiễu:Ởmứcđộnhậnbiết,HScóthểnhớnhầmcácsốchẵnnhư80%, 85%hoặclẫnlộngiữa78%và87%.
Câu 14: (ND 1.2, mức 4) Khi đánh bắt hải sản xa bờ, các ngư dân thường thu được lượnghảisảnlớn.Đểchohảisảnluôntươingonkhivàobờ,họthườngướpchúngbằng đá.Tuynhiên,việcsử dụngđálàmchothuyềnnặng,chiếmdiệntíchnênmộtsốngư dânđãsửdụngureathaythế.
a Emhãygiảithíchtạisaoureađượcdùngđểướphảisản?
b.Cácthựcphẩmđượcngâmtrongphânureacótốtchosứckhỏekhông?Vìsao?
Câu15:(ND1.1,mức4)Kemkhóilàmộttrongnhữngloạikemđượcgiớitrẻrấtưa chuộng. Không chỉ có mùi vị thơm ngon mà còn bắt mắt bởi “làn khói” bay ra từ ly kem.Nóđượclàmtrựctiếptạicửahàngtừ100%kemtươinênvẫngiữnguyênđược hươngvịvàkhôngbị đôngđánhưkemtruyềnthống.Ngườitađãvậndụngtínhchất nàođểlàmrađượckemkhói?Đánhgiáliệukemkhóicóantoànhaykhông?
YKÈMQUYNHƠNOFFICIAL
Câu3:Đápán:D. Cácđápángâynhiễu:
A.HSnhầmvớiđiệnhoátrịcủanguyêntố.
B.HSxácđịnhnhầmsốoxihoácủaFetrongFeSdẫnđếnxácđịnhsaisốoxihoácủa Svànhầmvớiđiệnhoátrịcủanguyêntố.
C.HSxácđịnhnhầmsốoxihoácủaFetrongFeSdẫnđếnxácđịnhsaisốoxihoácủa S.
Câu4:Đápán:A.
Cácđápángâynhiễu:
B,D.HSđọcnhầmdữkiệnđềbài.
C.HSnghĩAgđứngsauHtrongdãyhoạtđộnghoáhọcnênkhôngtácdụngvớidung dịchH2SO4.
Câu5:Đápán:A. Cácđápángâynhiễu:
B.HSdễnhầmsảnphẩmNOvàNO2
C.HSdễnhầmgiữaN2 phảnứngO2 vàN2 phảnứngH2.
D.HSdễnhầmgiữathứtựcácphảnứngtạoanionnitrate.
Câu6:Đápán:D.
Cácđápángâynhiễu: HSkhôngnắmvữngbảnchấtcủaquátrìnhoxihoá
khửnên chọnnhầm.
Câu7:Đápán:A.
Cácđápángâynhiễu:Tấtcảcácđápánđềulàbasicoxide,đềucó thểtácdụngđược vớiHNO3.YêucầuHScầnnắmvữnghóatrịcủacácnguyêntốkimloạiđểtìmrađược oxidenàomàkimloạichưathểhiệnhóatrịcaonhất.
Câu8:Đápán:C.
NHÓM 4
11
MÔN BÀI TẬP HÓA HỌC Ở THPT
DẠ
12
–
NHÓM 4 MÔN BÀI TẬP HÓA HỌC Ở
SO2 làmộtacidicoxidetannhiềutrongnướctạothànhdungdịchsulfurousacidH2SO3, đâylàacidyếunênlàmquỳtímhoáđỏ,PTHH:SO2 +H2O→ H2SO3;SO2 đượcdùng
làmchấttẩytrắnggiấyvàbộtgiấy.
Cácđápángâynhiễu:
A.HSnhầmmàuquỳtímkhinhúngtrongdungdịchacidvàbase.
B.HSnhầmlẫntrạngtháiởđiềukiệnthườngcủaSO3,HSnhầmlẫnứngdụngcủaSO3.
D.HSnhầmlẫnứngdụngcủaH2S.
Câu9:Đápán:C.
Cácđápángâynhiễu:
A. Dùng nước để hạn chế tối đa quá trình sulfuric acid đặc hút nước của cơ thể (vì sulfuricacidđặccótínhháonước)vàlàmloãngacidđặc.
B.Dùngdungdịchnabica(NaHCO3)khôngcótínhoxihóa,cótínhkiềmnhẹđểtrung hòasulfuricacidđặc.
PTHH:2NaHCO3 +H2SO4 →Na2SO4 +2CO2 +2H2O
D.DùngnướcvôitrongCa(OH)2 trunghòasulfuricacidđặc.
PTHH:Ca(OH)2 +H2SO4 →CaSO4 +2H2O
Câu10:Đápán:A.
Cácđápángâynhiễu:HScầnhiểuđượcnguyênlýLaChatelierthìmớiphânbiệtđược cácđápán.
(2)Giảmápsuấtchungcủahệ,cânbằngsẽchuyểndịchtheochiềulàmtăngsốmolkhí →chiềunghịch.
(3)Khităngnhiệtđộ,cânbằngchuyểndịchtheochiềuthunhiệt→chiềunghịch.
(5)Hàmlượngchấtxúctáckhôngảnhhưởngđếnchuyểndịchcânbằng.
Câu11:Đápán:B.
Tacó:2NH4 ++SO4 2 +Ba2++2OH →BaSO4↓+2NH3↑+2H2O
nBaSO4 = 1398 233 =0,06(mol)
DẠYKÈMQUYNHƠNOFFICIAL
VìlấydưdungdịchBa(OH)2 nên(NH4)2SO4 sẽphảnứnghết,theophươngtrìnhtacó:
nNH4 + =2 nBaSO4 = 0,06.2=0,12(mol)
NồngđộmolcủaionNH4 + trongdungdịchmuốibanđầulà:
CMNH4+ = 012 008 =1,5(M)
Cácđápángâynhiễu:
A.HSnhầmsốmolNH4 +bằngsốmolBaSO4
B.HSđổiđơnvịtừmlsanglsai.
D.HSnhầmsốmolNH4 +bằngsốmolBaSO4vàđổiđơnvịtừmlsanglsai.
Câu12:Đápán:C.
TínhkhửcủaMg>Fe,kimloạicótínhkhửmạnhhơnphảnứngtrước,khihếtkimloại đónếu còn dưacid, kimloại khác mớiphản ứng. Nên Mg phản ứngtrước ⇒Cómặt muốiMgSO4,mộtphầnFekhôngtantứclàFeđãcóphảnứng,màkhiFedưsauphản ứngthìthuđượcmuốisắt(II).
PTHH: Mg+2H2SO4đặc ���� → MgSO4 +SO2 +2H2O
2Fe+6H2SO4đặc ���� →Fe2(SO4)3 +3SO2 +6H2O
Fe2(SO4)3 +Fe →3FeSO4
Cácđápángâynhiễu:DoHSkhôngnắmđượcthứtựphảnứngcủacácchấttronghỗn hợpXnêndẫnđếnxácđịnhchấttantrongdungdịchYsai.
Câu13:Đápán:B
Đápángâynhiễu: B,D.HSkhôngđọckĩđềchỉtínhđếnsốmolSO2 rồikhoanhđápán.
C.HSđổiđơnvịsaidẫnđếnkếtquảsai.
Đổi:40lít=40dm3 =40.10-3 m3
NồngđộkhíSO2 ởcácthànhphốlà:
+ThànhphốA:0,084mgSO2 =0,084.10-3 gSO2
������2(��) = 0,08410 3 64 =1,3.10-6(mol)
CM(A) = 1,310 6 4010 3 =3,2.10-5 (mol/m3)>30.10-6 +ThànhphốB:0,0035mgSO2 =0,0035.10-3 gSO2
������2(��)= 0003510 3 64 =5,46875.10-8(mol)
CM(B) = 5,46875.10 8 4010 3 =1,367.10-6 (mol/m3)<30.10-6
VậythànhphốAcómẫukhôngkhíbịônhiễmSO2
Câu14:Đápán:A.
Cácđápánđúnglà:(b),(c),(e),(g).
Phúdưỡnglàhiệntượngnitratevàphosphatedưthừa,bịsinhvậtphùdu(tảo,rêu…) hấpthụ.
Cácđápángâynhiễu:
(a)HSnhầmlẫngiữahiệntượngthừahoặcthiếunitratevàphosphate.
(d)HSkhôngxácđịnhđượcnhữngnguyênnhângâyhiệntượngphúdưỡng.
(f)HSnhầmlẫntảo,bèochelấpmặtnướclàcungcấpnhiềuoxygen.Thựctế,tảophát triểnmạnhsẽhạnchếoxygenđivàotrongnước,gâycảntrởquátrìnhhôhấpcủađộng vậtthuỷsinh.
Câu15:Đápán:B.
Cácđápánđúnglà(a),(c),(d),(f).
NHÓM 4 MÔN BÀI TẬP HÓA HỌC Ở THPT 13
THPT 14
NHÓM 4 MÔN BÀI TẬP HÓA HỌC Ở THPT
Cácđápángâynhiễu:
(b)TrongcôngđoạnsảnxuấtSO3 từSO2 thìphảnứng2SO2(k) +O2(k) 2SO3(k)
(∆��<0)làphảnứngtoảnhiệtnênkhităngnhiệtđộcânbằngchuyểndịchtheochiều nghịch
(e)NgườitadùngH2SO4 98%hấpthụSO3 đượcoleum.Mộtloạioleumcó62%SO3
vềkhốilượng,côngthứccủaoleumđólàH2SO4.2SO3.
CôngthứcchungcủaoleumlàH2SO4.nSO3
PhầntrămkhốilượngSO3 là:
80.��
80��+98 .100%=62%→n=2
VậycôngthứccủaoleumlàH2SO4.2SO3
(g)Cáctoathùngvậnchuyểnsulfuricacidđặc(nồngđộ> 70%)đượclàmbằngthép, do sắt bị thụ động trong sulfuric acid đặc, nguội nên không có phản ứng. Nếu không khoá vòi ngay lập tức, lượng sulfuric acid còn lại trong toa thùng hấp thụ mạnh hơi nướctrongkhôngkhílàmloãngdungdịchacid.Khiđósulfuricacidsẽphảnứngvới toathùngsắtvàlàmhỏngtoathùng.
YKÈMQUYNHƠNOFFICIAL
B.TỰLUẬN(15câu)
STT Đápán Điểm
Câu1 (mức1)
Câu2 (mức1)
NguyêntốsulfurthuộcnhómVIAtrongbảngtuầnhoànhoáhọc nênhoátrịcaonhấtcủanólàVI.
⇒CôngthứcoxidecaonhấtcủasulfurlàSO3 (sulfurtrioxide).
Vàonhữngngàynắngnóng,mùikhaitrong nhàvệsinhbốclên
làkhíammonia(NH3).
CôngthứccấutạocủaHNO3 là
Câu3 (mức1)
CôngthứccấutạocủaH2SO4 là
Câu4 (mức2)
Sulfuricacidđặccótínhháonướcnêncókhảnănghúthơinước
từkhôngkhí,làmchocốcacidnặnghơn.
⇒Cânlệchkhỏivịtrícânbằngvànghiêngvềphíacốcđựngacid.
Thứtựcácbướcphaloãngsulfuricacidđặc:
(2)Xácđịnhnồngđộdungdịchsulfuricacidcầnpha.
(5)Xácđịnhthểtíchnướcvàsulfuricacidđặccầnlấy.
(3) Cho lượng nước cất và sulfuric acid đặc vừa xác định được lầnlượtvàocốcthủytinhthứnhấtvàcốcthủytinhthứhai.
Câu5 (mức2)
(1)Đổtừtừsulfuricacidđặcởcốcthứhaidọctheođũathủytinh vàocốcthứnhất.
(6)Saukhiđổvàigiọtsulfuricacidđặc,dùngđũathủytinhkhuấy nhẹđềutrongcốcthứnhất.
(4) Tiếp tục đổ vài giọt sulfuric acid đặc và khuấy nhẹ đến khi hết.
Sốoxihoácủanitrogentrongcáchợpchất:
Câu6 (mức2)
Câu7 (mức2) Xlàkhínitrogen(N2).
PTHH:NH4NO2 ���� →N2↑+2H2O
NHÓM 4 MÔN BÀI TẬP HÓA HỌC Ở THPT 15
Ạ
D
16
NHÓM 4 MÔN BÀI TẬP HÓA HỌC Ở
Khối lượng nguyên tố nitrogen trong 1 bao phân đạm urea (50 kg)ítnhấtlà: 46,3 50 100 =23,15(kg)
mS = 0,4 3 .32=4,26(g)
-Tríchmẫuthử.
Câu8 (mức3)
Khốilượngureatươngứngvớilượngnitrogentrênlà: 23,15 60 28 =49,6(kg)
Vậykhốilượng(NH2)2COítnhấtcótrong1baophânđạmurea
PhúMỹlà49,6kg.
Acómùitrứngthối⇒AlàH2S.
(1)S+H2 ���� →H2S
⇒Xlàlưuhuỳnh(S).
(2)2H2S+SO2 →3S+2H2O
⇒DlàH2O.
(3)S+O2 ���� →SO2
⇒BlàSO2.
Câu9 (mức3)
(4)SO2 +Br2 +2H2O→2HBr+H2SO4
⇒ZlàH2SO4
(5)S+Fe ���� →FeS
⇒ElàFeS.
(6)FeS+H2SO4 →H2S↑+FeSO4
⇒GlàFeSO4.
YKÈMQUYNHƠNOFFICIAL
Vậy X là lưu huỳnh (S); A là H2S; D là H2O; B là SO2; Z là
H2SO4;ElàFeS;GlàFeSO4
nBaSO4 = mBaSO4 MBaSO4
= 93,2 233=0,4(mol)
S + 2H2SO4đặc ���� → 3SO2↑ + 2H2O
⎯⎯→
-Tacóbảngnhậnbiết. Mẫu
thử
Thuốcthử
Câu10 (mức3)
Dungdịch
Ba(OH)2
-PTHH:
NH4NO3 HCl (NH4)2SO4 Mg(NO3)2
Xuất hiện khí không màu, có mùikhai.
Không hiện tượng.
Xuất hiện kết tủa trắng và khí không màu có mùi khai.
Ba(OH)2 +2NH4NO3 →Ba(NO3)2 +2NH3↑
Ba(OH)2 +2HCl→BaCl2 +2H2O
Xuất hiện kết tủa trắng.
Ba(OH)2 +(NH4)2SO4 →BaSO4 ↓trắng +2NH3↑+2H2O
Ba(OH)2 +Mg(NO3)2 →Ba(NO3)2 +Mg(OH)2↓trắng
ÝkiếncủabạnTínđúng.
Câu12 (mức3)
Vì trong phân đạm ammonium có ion NH4 + thủy phân sinh ra
H3O+ tạomôitrườngacidnênlàmchođấtchua.
PTHH:NH4 ++H2O
a.
NH3+H3O+
-Tháphấpthụkhíthảitừdướilên,chấtônhiễmnhưSO2 vàbụi
bẩnsẽbịgiữlại,khôngkhísạchđilêntrênvàthoátrangoài:
+DungdịchhấpthụCa(OH)2 đượchệthốngdẫnbơmtuầnhoàn lênphầnthântrụvàđượcphunrabởihệthốngdànphunsương, tướiđềudungdịchhấpthụtrongtháp.
Câu10 (mức3)
0,4 3 mol 0,4mol
SO2 + 2H2O +Cl2 → 2HCl + H2SO4
0,4mol 0,4mol
BaCl2 + H2SO4 → 2HCl + BaSO4↓ 0,4mol 0,4mol
������2 =0,4.22,4=8,96(lít)
Câu13 (mức4)
+Dòngkhíđitừdướilên,dòngdungdịchlỏngCa(OH)2 từtrên xuốngvàchúngtiếpxúcvớinhau,khiđóquátrìnhhấpthụđược diễn ra, SO2 bị giữ lại trong dung dịch hấp thụ, không khí sạch thoátrangoài.
-Quátrìnhhấpthụdiễnratheophươngtrìnhnhưsau:
2SO2 +Ca(OH)2 →Ca(HSO3)2
Ca(HSO3)2 +Ca(OH)2 →2CaSO3 +2H2O
- CaSO3 là chất rắn ít tan nên dễ dàng lắng xuống đáy tháp và
đượcđemđixửlýbằngcáchchônlấp.
4
17
NHÓM
MÔN BÀI TẬP HÓA HỌC Ở THPT
D
Ạ
THPT 18
⎯⎯
Câu14 (mức4)
-Khísạchraởđỉnhthápđượctáchẩm,sauđóđượcđưarangoài môitrường.
b.CácphươngphápkhácxửlíkhíSO2
-HấpthụkhíSO2 bằngnước.
-Phươngphápmagnesiumoxide.
-Phươngphápkẽm.
-XửlíSO2 bằngamonia.
-XửlíSO2 bằngcácchấthấpthụhữucơ.
-XửlíSO2 bằngcácchấthấpphụthểrắn.
a. Urea có công thức hoá học là (NH2)2CO. Khi hòa tan trong
nước, urea thu một nhiệt lượng khá lớn vì vậy nó làm lạnh môi
trườngxungquanhvà ngăncảnkhảnănghoạtđộngcủavisinh vật.Nhờđặctínhnàyngườitadùngureabảoquảnhảisản.
b.Cácthựcphẩmđượcngâmtrongureakhôngtốtchosứckhỏe.
Vì:
Ureahòatanvàonước:(NH2)2CO+H2O→2NH3+CO2
Sauđó: NH3→NH4 + →NO2 →NO3
Quátrìnhphângiảiureatạoramuốinitrate(NO3 -).Nếuănphải
thựcphẩmđượcngâmureathìlượngnitritetíchtụdầnmỗingày
gây giảm hoạt động của tuyến giáp, rối loạn thần kinh. Một số
trường hợp ngộ độc cấp tính với các dấu hiệu đau bụng, buồn nôn,tiêuchảy,nếukhôngcấpcứukịpthờithìdẫnđếntửvong.
Vìvậykhôngđượcdùngureađểướpcá,bảoquảnthựcphẩm.
YKÈMQUYNHƠNOFFICIAL
Câu15 (mức4)
-Ởđiềukiệnthường,nitrogenlàchấtkhíkhôngmàu,khôngmùi, khôngvị,nhẹhơnkhôngkhívàhóalỏngở-196℃.Vớinhiệtđộ hóalỏngthấp,nitrogenlỏnglàmđóngbănghầunhưmọithứkhi chúng tiếp xúc trong một thời gian nhất định. Tạo sự đậm đặc, tránh bị đông đá như kem truyền thống. Nitrogen lỏng nhanh chóngbayhơitạokhóitrắng.Lợidụngtínhchấtnày,ngườitađã sảnxuấtrakemkhói.
-Khinitrogenlỏngnguộiđilàmngưngtụhơinướctrongkhông khí,phầnkhóitỏara.Vớilykemđầykhóitrướcmặt,ngườitiêu dùnghítmộtcáchtrựctiếpvàquánhiềukhóivượtmứcchophép
sẽdễbịbỏnglạnh.Sauđónãobộpháttínhiệuchohemoglobin
dừngvậnchuyểnoxygendẫnđếntimngừngđập.Đểđảmbảoan
toànkhisửdụngnênđểkhóibayđihếtrồimớithưởngthức.
NHÓM 4 MÔN BÀI TẬP HÓA HỌC Ở THPT 19
DẠ
20
NHÓM 4 MÔN BÀI TẬP HÓA HỌC Ở THPT




























