


5.1.1Verband
5.1.3Verband
5.2.1Faseovergangen
5.2.2Verband




5.1.1Verband
5.1.3Verband
5.2.1Faseovergangen
5.2.2Verband
Een kopje koffie in de ochtend is voor velen onder ons geen onbekende. Deze kop koffie wordt vaak als lekker warm (= hoge thermische energie) beschouwd. Een ijsberg daarentegen zouden we toch eerder als koud (= lage thermische energie) bestempelen. Maar schijn kan bedriegen of hoe fysische terminologie in de volksmond nog wel eens verkeerd gebruikt wordt.
Scan de QR-code, leerhet verschil tussen thermische energie (warmte-energie) en temperatuur en kom te weten welke van de twee de meeste thermische energie bezit: de ijsberg of de kop koffie.





In module 1 Energieomzettingen hebben we gezien dat energie in verschillende vormen voorkomt: chemische energie, elektrische energie, thermische energie, stralingsenergie, enz.
In deze module bekijken we de thermische energie naderbij en verdiepen we ons in de thermodynamica of warmteleer. Dit deel van de natuurkunde bestudeert de interacties tussen deeltjes op macroscopisch niveau.
De grootheden thermische energie, warmte en temperatuur spelen hierin een cruciale rol. We bekijken die even naderbij.
We bestuderen eerst de grootheden thermische energie en temperatuur.
Thermische energie is een vorm van energie, ook wel warmte-energie genoemd.
De thermische energie is de totale bewegingsenergie van de structurele elementen (atomen, moleculen …) van een systeem.
Bij 0 K liggen de structurele elementen van een stof stil. Ze bezitten dan geen thermische energie.
Hoe heftiger moleculen bewegen, hoe verder ze zich van elkaar bevinden, hoe hoger hun totale inwendige energie. Maar er geldt natuurlijk ook: hoe meer structurele elementen een systeem bezit, hoe groter zijn thermische energie.

Dit is ook het geval bij heel koude objecten zoals een ijsberg.
Aangezien de temperatuur van een ijsberg een stuk hoger is dan het absolute nulpunt (0 K) en een ijsberg een heel grote massa heeft, bezit deze dus heel wat thermische energie.
Temperatuur is een maat voor de gemiddelde snelheid van de deeltjes in een stof.
Als twee systemen dezelfde temperatuur hebben, dan zijn deze in thermisch evenwicht.
Bij het absolute nulpunt (0 K) liggen de deeltjes in een stof helemaal stil, hun snelheid is dan nul.
Warmte en temperatuur hebben veel met elkaar te maken, maar warmte is niet hetzelfde als temperatuur. Als warmte aan een systeem wordt toegevoegd, dan neemt de temperatuur toe. We zeggen dan dat een warmte Q, ook wel warmtehoeveelheid genoemd, is toegevoegd aan het systeem.
We definiëren warmte dus als volgt.
Warmte is de hoeveelheid thermische energie die uitgewisseld wordt tussen twee voorwerpen ten gevolge van een temperatuurverschil.
Die warmte uitwisseling gebeurt niet zomaar.
Warmte wordt uitgewisseld tussen systemen die niet in thermisch evenwicht zijn. Die uitwisseling van thermische energie tussen systemen met een verschillende temperatuur gebeurt steeds van het systeem met de hogere temperatuur naar het systeem met de lagere temperatuur.
temperatuur θ graden Celsius °C absolute temperatuur T kelvin K
warmte Q joule J
De eenheid joule is de SI-eenheid van energie, genoemd naar de Engelse natuurkundige James Prescott Joule (1818 – 1889).


Voor temperatuur zijn er verschillende eenheden. In de wetenschap gebruiken we kelvin en graden Celsius.
De eenheid kelvin werd genoemd naar de Engelse natuurkundige William Thomson (1824 – 1907), die later in de adelstand werd verheven als Lord Kelvin.
De eenheid graden Celsius is genoemd naar de Zweedse astronoom Anders Celsius (1701 – 1744).

WIST-JE-DAT
Voor een temperatuur in kelvin gebruiken we niet het woordje ‘graden’. We zeggen niet 300 graden kelvin, maar 300 kelvin. We noteren dat als 300 K. Als we deze temperatuur in graden Celsius geven, dan wordt dat 27 graden Celsius (27 °C)
De laagst mogelijke temperatuur is 273,15°C . Dat is het absolute nulpunt. De absolute temperatuur T heeft als nulpunt 0K = 273,15°C
Eén schaaldeel op de kelvinschaal is even groot als één schaaldeel op de celsiusschaal.
–273 °C 0 K 0 °C 273 K
We ronden het absolute nulpunt 273,15°C meestal af tot 273°C .
We kunnen de temperatuur in °C gemakkelijk omrekenen naar de temperatuur in K. Dit doen we als volgt:
T = θ + 273 (in K)
θ = T 273 (in °C)
Aangezien één schaaldeel op de kelvinschaal even groot is als één schaaldeel op de celsiusschaal, is een temperatuurverandering in °C altijd even groot als de overeenkomstige temperatuurverandering in K:
Δθ = ΔT
Voorbeeld
Een stof warmt op van 20 °C tot 50 °C. Zijn temperatuurverandering bedraagt dan:
Δθ = θ2 θ1 = 50°C 20°C = 30°C
Noteren we de temperatuur van deze stof in kelvin, dan krijgen we:
ΔT = T2 T1 = 323K 293K = 30K
Dit is een heel belangrijk gegeven voor wat volgt.
Zoals we net zagen, houdt warmte-energie dus verband met de inwendige energie van een stof. Deze inwendige energie hangt dan weer samen met de fase van de stof. We bekijken dit alles even naderbij.
Een stof kan zich in vaste, vloeibare en gasvormige toestand bevinden. Deze fasen kunnen we ons het beste voorstellen aan de hand van het deeltjesmodel. Het deeltjesmodel is een geïdealiseerde voorstelling van een stof die ons in staat stelt om bepaalde eigenschappen van die stof te verklaren.
In een vaste stof zijn de aantrekkingskrachten tussen de verschillende deeltjes van de stof groot. Deze aantrekkingskrachten tussen deeltjes van dezelfde soort noemen we cohesiekrachten.
De atomen zitten op een vaste plaats en kunnen amper bewegen. Als de temperatuur toeneemt, gaan ze wel heftiger trillen en gaan ze wat verder uit elkaar zitten.
Vaste stof bij lage temperatuur
• atomen trillen een beetje
• atomen op vaste posities
Vaste stof bij hogere temperatuur
• atomen trillen heftiger
• de ruimte tussen de atomen is toegenomen
• de atomen trillen nog steeds rond een vaste positie
In een model worden de atomen soms voorgesteld als bollen die door middel van veren met elkaar verbonden zijn.
De atomen in een vaste stof zitten dus op een vaste plaats en trillen een beetje heen en weer. Alleen bij het absolute nulpunt, 0 K, staan ze helemaal stil. De absolute temperatuur is een maat voor hun beweging.
Neon in vaste toestand
Zuurstof in vaste toestand
Wil je zelf eens de vaste toestand van neon, argon, zuurstof of water bekijken?
Scan dan de QR-code hiernaast.
Wat gebeurt er met deze stoffen bij 0K? Noteer.
In een vloeibare toestand zitten de deeltjes nog dicht bij elkaar, maar ze hebben geen vaste plaats meer. Ze kunnen vrij langs elkaar heen bewegen. Vloeistoffen zijn daardoor beweeglijker dan vaste stoffen. Als de temperatuur van een vloeistof toeneemt, dan gaan de atomen (of moleculen) sneller door elkaar bewegen en verder uit elkaar zitten.
De vloeistof in een thermometer zet uit als de temperatuur toeneemt
Vloeistof bij lage temperatuur
Vloeistof bij hogere temperatuur
Een model voor vloeistoffen is om deze te vergelijken met een potje knikkers die over elkaar kunnen rollen.
Neon in vloeibare toestand
Zuurstof in vloeibare toestand
Scan de QR-code hiernaast en bekijk zelf de vloeibare toestand van neon, argon, zuurstof of water.
Wat gebeurt er als de temperatuur toeneemt? Noteer.
In een gas is de krachtwerking tussen de verschillende deeltjes klein. De atomen (of moleculen) zijn heel beweeglijk en bewegen los van elkaar, met verschillende snelheden, kriskras door elkaar. Aangezien de deeltjes elk een andere snelheid hebben, wordt de gemiddelde inwendige kinetische energie van de deeltjes als referentie genomen voor de bewegingsenergie. Gas

Gassen gedragen zich hierdoor anders dan vaste stoffen of vloeistoffen.


In module 3 Gaswetten bekijken we de formules die gelden voor ideale gassen. De meeste reële gassen kunnen we met deze gaswetten zeer nauwkeurig als ideale gassen benaderen. Enkel bij lage temperaturen of bij hoge dichtheden volgen ze de ideale gaswetten niet meer.
We bekijken opnieuw even neon en zuurstof.
Neon in gasvormige toestand
Zuurstof in gasvormige toestand
Scan de QR-code hiernaast en bekijk zelf de gasvormige toestand van neon, argon, zuurstof of water.
Vergelijk de snelheid van de verschillende deeltjes en kijk wat er gebeurt bij een botsing. Noteer.
Wat gebeurt er als de temperatuur toeneemt? Noteer.
WIST-JE-DAT
Als een gas geïoniseerd wordt, dan wordt het gas een plasma. Plasma wordt vaak de vierde fasetoestad waarin materie zich kan bevinden, genoemd. In deze fasetoestand zijn de deeltjes van een gas dus enigszins geïoniseerd.
In de gasfase heeft elk atoom evenveel positief en negatief geladen deeltjes. De positieve lading bevindt zich in de kern; de elektronen, die rond de kern bewegen, dragen de negatieve lading. Zo is elk atoom in zijn totaliteit neutraal.
In een plasma zijn sommige atomen (of moleculen) één of meerdere elektronen kwijtgeraakt, dit kan door een temperatuursverhoging of door andere toegevoegde energievormen. Deze toestand van het atoom (of molecule) noemt men geïoniseerd. Die vrije elektronen bewegen zich vrij door de ruimte. Er moeten voldoende atomen (of moleculen) geïoniseerd zijn om van een plasma te kunnen spreken. Bij een plasma is het elektrisch karakter van het gas veranderd. Dit zien we duidelijk in deze plasmabol, misschien heb je er zo wel eentje op je kamer. Maar we kennen plasma ook van neonverlichting en de bliksem.




Bovendien bestaat 99 % van de massa in het heelal uit plasma. Zo komt ook in de Melkweg heel wat plasma voor.
Misschien nog een leuk weetje: de naam plasma is afgeleid van de naam ‘bloedplasma’. Dit is de vloeistof die overblijft nadat de vaste deeltjes uit het bloed verwijderd zijn.
In plaats van fase wordt ook wel het begrip aggregatietoestand gebruikt om de fase aan te duiden.
Wij beperken ons verder tot de drie fases: vast, vloeibaar en gas.


vast vloeibaar gas
De fase van de stof hangt samen met de inwendige energie van de stof.
De inwendige energie E inw is de som van alle vormen van energie die inwendig in het systeem aanwezig zijn. Het is dus de som van de bewegingsenergie van de deeltjes (atomen of moleculen) en de bindingsenergie tussen de deeltjes.
De inwendige kinetische energie
In een stof bewegen de deeltjes met een bepaalde snelheid. De snelheid van de deeltjes onderling is verschillend. Om een beeld te krijgen van hun bewegingsenergie moeten we dus de gemiddelde inwendige kinetische energie bekijken. Als de temperatuur van een systeem toeneemt, neemt de inwendige kinetische energie van de deeltjes toe, dus ook hun gemiddelde inwendige kinetische energie. De absolute temperatuur is een maat voor de gemiddelde inwendige kinetische energie. Bij 0 K is er geen beweging meer van de atomen (of moleculen) en is de inwendige kinetische energie van de deeltjes nul.
De inwendige potentiële energie
Tussen de deeltjes van een stof heersen er cohesiekrachten. Deze geven de stof inwendige potentiële energie en bepalen zo de toestand waarin de stof zich bevindt. De inwendige potentiële energie van de deeltjes stijgt als de afstand tussen de deeltjes stijgt. Hoe verder de deeltjes uit elkaar zitten, hoe groter hun inwendige potentiële energie. Tijdens een faseovergang moet dus de inwendige potentiële energie wijzigen.
Atomen hebben een haat-liefde verhouding met elkaar. Atomen trekken elkaar aan als ze op een kleine afstand van elkaar zitten, maar als ze te dicht bij elkaar komen, stoten ze elkaar af. Probeer dit zelf maar eens uit in de applet. Scan hiervoor de QR-code.
Nu we de inwendige structuur van de materie en de daaraan gekoppelde energieën beter begrijpen, komen we terug op de begrippen warmte en temperatuur en bekijken we warmteoverdracht naderbij.
We weten al dat twee systemen met dezelfde temperatuur in thermisch evenwicht zijn en dat tussen systemen die niet in thermisch evenwicht zijn warmte wordt uitgewisseld.
Twee systemen met dezelfde temperatuur zijn in thermisch evenwicht Tussen systemen die niet in thermisch evenwicht zijn, wordt warmte uitgewisseld. Die uitwisseling van thermische energie tussen systemen met een verschillende temperatuur gebeurt van het systeem met de hogere temperatuur naar het systeem met de lagere temperatuur. De hoeveelheid thermische energie die wordt uitgewisseld, noemen we warmtehoeveelheid of kortweg warmte
Warmte is, net zoals arbeid, een overdrachtsvorm van energie.
Warmte is een vorm van energietransport ten gevolge van een temperatuurverschil.
Twee kubussen naast elkaar
De atomen in de warme kubus hebben een hoge inwendige kinetische energie
De atomen in de koude kubus hebben een lage inwendige kinetische energie
Twee kubussen die tegen elkaar liggen
Warmteoverdracht van de warme kubus naar de koude kubus
De inwendige kinetische energie van de atomen in de warme kubus neemt af
De inwendige kinetische energie van de atomen in de koude kubus neemt toe
De twee kubussen hebben dezelfde temperatuur
De warmteoverdracht is gestopt
De inwendige kinetische energie heeft zich verspreid over het geheel van de twee kubussen
Deze uitwisseling van warmte kan in principe op drie manieren gebeuren:
1 Door geleiding
2 Door straling
3 Door stroming















geleiding







stroming



Geleiding (conductie)


















Straling (radiatie)





straling


Deze warmteoverdracht gebeurt binnen de stof. Hierbij stroomt warmte-energie van deeltjes met een hogere inwendige kinetische energie naar deeltjes met minder inwendige kinetische energie. De warmte-energie stroomt dus van de deeltjes met een hoge temperatuur naar de deeltjes met een lage temperatuur. Eigenlijk is het de trillingsenergie van de deeltjes die wordt doorgegeven, de deeltjes zelf blijven op dezelfde plaats. De thermische geleidbaarheid van de stof en het temperatuurverschil over een afstand bepalen de warmtestroom. Metaal geleidt de warmte goed, hout daarentegen niet.





Ook straling is een vorm van energietransport. Bij straling gebeurt de warmteoverdracht tussen twee systemen die niet met elkaar in aanraking zijn en zonder gebruik te maken van een middenstof. Het warme systeem geeft elektromagnetische straling af en verliest zo dus warmte-energie. Het andere systeem absorbeert deze elektromagnetische straling deels of volledig en warmt zo op. Hier is dus geen contact met de warmtebron nodig, de warmteoverdracht kan zelfs in vacuüm gebeuren. Het duidelijkste voorbeeld is de zon: je kan de warmte van de zon voelen op aarde, alhoewel de zon heel ver weg is en van ons gescheiden is door een hele zone vacuüm. De opgenomen warmtestraling doet de deeltjes in materie harder trillen, waardoor hun bewegingsenergie toeneemt en de materie dus opwarmt.

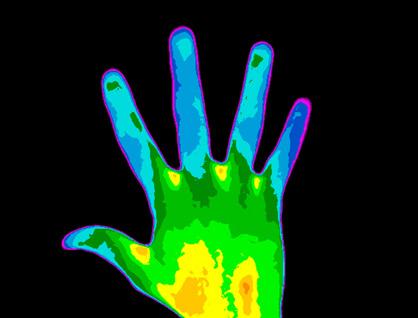
Eigenlijk geven alle systemen warmtestraling af. Hoe hoger hun temperatuur, hoe meer warmtestraling. Onderstaande beelden werden genomen met een infraroodcamera. Hierbij duiden de blauwe tinten koudere zones aan, terwijl de gele tot rode tinten de warmere zones weergeven.

Stroming (convectie)
Bij stroming gebeurt de warmteoverdracht door verplaatsing van een warm gas of warme vloeistof, of van een koud gas of koude vloeistof. De warmte verplaatst zich door stroming. Een voor de hand liggend voorbeeld is een radiator, die warmt de lucht rondom zich op. Doordat warme lucht stijgt en koude lucht daalt, krijg je stroming.

Kruis bij onderstaande voorbeelden aan hoe de warmteoverdracht gebeurt.
Het zand op het strand is warm van de zon.
Je wil een pan van het vuur nemen en verbrandt daarbij jouw vingers.
In een waterkoker zit een metalen weerstand, het verwarmingselement. Op welke manier gebeurt de warmteoverdracht daarin?
Je kijkt naar de BBQ. Het ziet er allemaal lekker uit, maar je voelt ook de warmte.
In de kamer is het behoorlijk warm. Als je echter naast de kat op de mat gaat zitten, lijkt het kouder.
Je wil een lekker korstje op de ovenschotel en zet hem even in de oven onder de grill.
Bij warm weer ben je blij dat je jouw drankje kan afkoelen met ijsblokjes.
STRALINGGELEIDINGSTROMING
Het is zalig om samen rond een kampvuur te zitten, en lekker warm.
Met de nieuwe airco is het lekker fris in de kamer.

Tijdens het smeden wordt dit stuk metaal snel warm.

Als thermische energie wordt toegevoegd of onttrokken aan een stof, dan zijn er – naargelang de toestand waarin de stof zich bevindt – twee mogelijkheden.
De warmte kan ervoor zorgen dat de temperatuur van de stof verandert of de warmte kan ervoor zorgen dat de aggregatietoestand (fase) van de stof verandert. Naargelang het effect van de toegevoegde of onttrokken thermische energie krijgt de warmte ook een andere benaming.
Merkbare warmte heeft een temperatuurverandering tot gevolg. Latente warmte heeft een faseovergang tot gevolg, zonder dat daarbij een temperatuurverandering plaatsvindt.
Indien er geen thermisch evenwicht is in een systeem, gebeurt er een uitwisseling van thermische energie in het systeem om tot thermisch evenwicht te komen. Die warmte kan merkbare en/of latente warmte zijn.
We bekijken even een paar voorbeelden.
Voorbeeld 1
Heet water wordt in een koude theepot gegoten en de pot wordt op tafel gezet.
De watermoleculen hebben een hoge temperatuur en trillen dus heel heftig. Ze hebben een hoge gemiddelde inwendige kinetische energie. Die energie wordt doorgegeven aan de theepot-deeltjes en vervolgens ook aan de luchtmoleculen in de kamer. Dit proces duurt tot de gemiddelde inwendige kinetische energie van alle deeltjes gelijk is, met andere woorden: tot de temperatuur van alle deeltjes dezelfde is en er thermisch evenwicht heerst.

De warmte die toegevoegd werd, noemen we merkbare warmte
Merkbare warmte heeft een temperatuurverandering tot gevolg.
Merkbare warmte is warmte die zorgt voor een verandering van de temperatuur van een stof.
Voorbeeld 2
Het is warm buiten en je hebt zin in een fris drankje. Je giet wat limonade in een beker en doet er een aantal ijsblokjes bij die je uit de diepvriezer (–18 °C) haalt.
Na een tijdje zijn de ijsblokjes verdwenen uit je drankje. Ze zijn gesmolten en vloeibaar water geworden. Ze hebben er gelukkig ook wel voor gezorgd dat jouw drankje een aantal graden koeler is geworden.
De warme limonade heeft ervoor gezorgd dat de ijsblokjes gesmolten zijn en dat ze ook dezelfde temperatuur hebben gekregen als jouw drankje.

De warmte van de limonade heeft dus niet alleen de temperatuur van de ijsblokjes veranderd, maar heeft ook de aggregatietoestand van de ijsblokjes veranderd. Ze waren eerst in vaste toestand en zijn vloeibaar geworden. De warmte die voor de faseovergang heeft gezorgd, noemen we latente warmte. Daarnaast heeft ook een deel van de warmte een temperatuurverandering tot gevolg gehad. Die warmte noemen we ook hier merkbare warmte.
Latente warmte heeft geen temperatuurverandering tot gevolg, maar wel een verandering van aggregatietoestand.
Latente warmte is de warmte die zorgt voor een faseovergang van een stof, zonder dat er een temperatuurverandering optreedt.
We bekijken de merkbare warmte even naderbij.
Ondertussen weten we dat:
Merkbare warmte zorgt voor een verandering van de temperatuur van een stof.
We onderzoeken dit nu grondiger.
5.1.1 Verband tussen de merkbare warmte Q en de temperatuurverandering Δθ of ΔT
Bekijk het filmpje waarin twee gelijke hoeveelheden water opgewarmd worden door twee verschillende vlammen via de QR-code.
Wat denk je dat het verband is tussen de toegevoegde warmte en de temperatuurverandering na het zien van dit filmpje? Noteer.
We kunnen dit vermoeden controleren door een experiment uit te voeren. Scan de QR-code om het onderzoek naderbij te bekijken of zelf het experiment uit te voeren.
We zien dat de temperatuurstijging Δθ toeneemt als de hoeveelheid toegevoegde warmte Q toeneemt.
De toegevoegde warmte Q is recht evenredig met de temperatuurverandering Δθ.
Q is recht evenredig met Δθ
Q = constante ⋅ Δθ
Q = C ⋅ Δθ
warmtecapaciteit C
joule kelvin of joule gradenCelsius J K of J °C
Thermodynamisch geeft de warmtecapaciteit het vermogen van een voorwerp weer om energie in de vorm van warmte op te slaan.
De warmtecapaciteit van een systeem is de capaciteit om per kelvin een hoeveelheid warmte op te slaan:
C = Q Δθ = Q ΔT Q = C ⋅ΔT = C ⋅Δθ
WIST-JE-DAT
De warmtecapaciteit van een baksteen van 1 kg is: C = 750 J °C .
De warmtecapaciteit van 1 liter (1 kg) water is: C = 4186 J °C
Begrijp je nu waarom mensen vroeger een warmwaterkruik in hun bed legden om het bed op te warmen?
De warmtecapaciteit wordt vaak gebruikt voor voorwerpen die uit verschillende stoffen bestaan, zoals een ei of een thermos, maar kan voor elk voorwerp gebruikt worden.


Voorbeeld 1
Wat is de warmtecapaciteit van een bronzen kunstwerk als je weet dat er 30450 J warmte nodig is om de temperatuur van het kunstwerk te verhogen van 15 °C tot 28 °C?
Gegeven: Q = C ⋅Δθ
θ1 = 15°C
θ2 = 28°C
Q = 30450J
Gevraagd: C
Oplossing: Q = C ⋅Δθ
C = Q Δθ = 30450J 28°C 15°C = 30450J 13°C = 2342 J °C = 2,3 kJ °C = 2,3 kJ K
Voorbeeld 2
Een kop warme thee met warmtecapaciteit 1010 J K koelt af van 65 °C naar 20 °C. Hoeveel warmte wordt hierbij afgestaan aan de omgeving?
Gegeven: C = 1010 J K
θ1 = 65°C
θ2 = 20°C
Gevraagd: Q
Oplossing: Q = C ⋅Δθ
Δθ = θ2 θ1 = 20°C 65°C = 45°C
Q = C ⋅Δθ = 1010 J K ⋅ ( 45°C) = 45450J = 45kJ
In het eerste voorbeeld neemt het kunstwerk warmte op, de Q is daar positief.
In het tweede voorbeeld wordt warmte afgestaan aan de omgeving. Als we deze warmte berekenen, dan zien we dat deze negatief is.
We zien dus dat:
De warmte Q is positief als de warmte opgenomen wordt.
De warmte Q is negatief als de warmte afgestaan wordt.
WIST-JE-DAT
Deze regel geldt voor alle grootheden in de fysica.
Als een systeem iets afgeeft, dan weerspiegelt zich dat in een negatief toestandsteken.
Voorbeeld: een negatieve energieverandering of een negatieve snelheidsverandering
Als een systeem iets opneemt, dan weerspiegelt zich dat in een positief toestandsteken.
Voorbeeld: een positieve energieverandering of een positieve snelheidsverandering
5.1.2 Verband tussen de temperatuurverandering Δθ of ΔT en de massa m
Bekijk het filmpje waarin twee verschillende massa’s water opgewarmd worden via de QR-code.
Wat denk je dat het verband is tussen de massa en de temperatuurverandering na het zien van dit filmpje? Noteer.
We kunnen dit vermoeden controleren door een experiment uit te voeren. Scan de QR-code om het onderzoek naderbij te bekijken of zelf het experiment uit te voeren.
We zien dat de temperatuurstijging Δθ afneemt als de massa vloeistof toeneemt.
De massa m is omgekeerd evenredig met de temperatuurverandering Δθ.
Δθ is omgekeerd evenredig met m
m ⋅ Δθ = constante
5.1.3Verband tussen de temperatuurverandering Δθ of ΔT, de merkbare warmte Q en de massa m
We weten ondertussen dat:
Δθ ∼ Q en Δθ ∼ 1 m
daaruit volgt:
Δθ ∼ Q m of:
Q m ∼Δθ of:
Q m = constante ⋅Δθ
Q = constante m ⋅Δθ
Deze constante noemen we de specifieke warmtecapaciteit c van de stof en is afhankelijk van de stof.
GROOTHEID
specifieke warmtecapaciteit c joule kilogram ⋅ kelvin of joule kilogram gradenCelsius J kg K of J kg °C
We vinden dus dat:
Q = c m ⋅Δθ of:
Q = c ⋅ m ⋅ΔT
Ook als een systeem warmte afstaat, geldt deze formule. In dat geval zijn Q en Δθ negatief.
De specifieke warmtecapaciteit van een stof is de hoeveelheid warmte die nodig is om de temperatuur van één kilogram van die stof met 1 °C of 1 K te verhogen.
Thermodynamisch geeft de specifieke warmtecapaciteit het vermogen van een stof weer om energie in de vorm van warmte op te slaan.
Uit de formule:
c = Q m ⋅Δθ = Q m ⋅ΔT
volgt dat c uitgedrukt wordt in J kg K of J kg °C of J kg K of J kg °C .
Bij de specifieke warmtecapaciteit c wordt meestal de naam van de stof als index genoteerd, bijvoorbeeld cwater.
In de tabel vind je de specifieke warmtecapaciteit van een aantal stoffen.
Bij gassen geeft cV de specifieke warmtecapaciteit in een constant volume weer en cp geeft de specifieke warmtecapaciteit bij constante druk.
WIST-JE-DAT
De mens behoudt vrij gemakkelijk zijn temperatuur dankzij de hoge waarde van de specifieke warmtecapaciteit van water. Hierdoor kunnen we heel wat warmte afstaan of opnemen zonder dat onze temperatuur veel zal wijzigen.
cwater = 4186 J kg ⋅ °C
Heel wat factoren beïnvloeden het klimaat. Zo heeft de nabijheid van een zee of een oceaan een grote impact op het klimaat. Ook dit is te wijten aan de hoge waarde van de specifieke warmtecapaciteit van water. De zee neemt namelijk veel warmte op, of staat veel warmte af, zonder dat de temperatuur van het water veel wijzigt. Daardoor hebben gebieden die dicht bij een zee liggen een gematigder klimaat met minder drastische temperatuurschommelingen.
Zand heeft niet zoveel warmte nodig om in temperatuur te stijgen, minder dan één vijfde van de warmte die water nodig heeft.
czand = 1600 J kg °C
cwater = 4186 J kg °C
Als de zon fel schijnt, voelt het zand op het strand dan ook vaak heel warm aan, je bent dan ook meestal blij dat je in het frisse water kan springen.

Met:
C = warmtecapaciteit in J °C J K of J °C J K
m = massa in kg
c = specifieke warmtecapaciteit in J kg ⋅ K of J kg ⋅ °C of J kg ⋅ K of J kg ⋅ °C
Δθ = temperatuurverandering in °C
ΔT = temperatuurverandering in K
Q = warmte in J
Nu is het tijd om ook de latente warmte eens onder de loep te nemen.
Latente warmte is de warmte die zorgt voor een faseovergang van een stof zonder dat er een temperatuurverandering optreedt.
We bekijken eerst even de verschillende faseovergangen.
Welke faseovergang er optreedt, is afhankelijk van de druk en de temperatuur van een stof.
5.2.1 Faseovergangen

Als een stof van fase verandert, spreken we van een faseovergang. Tussen de drie fasen zijn er zes faseovergangen mogelijk:
1 Overgang van vaste fase naar vloeibare fase: smelten
2 Overgang van vloeibare fase naar vaste fase: stollen
3 Overgang van vloeibare fase naar gasvormige fase: verdampen
4 Overgang van gasvormige fase naar vloeibare fase: condenseren
5 Overgang van vaste fase naar gasvormige fase: sublimeren
6 Overgang van gasvormige fase naar vaste fase: desublimeren

vloeibaar vast gas smelten
stollen
Wil je deze faseovergangen al eens van dichtbij in werking zien? Scan dan de QR-code.
Herken je de faseovergang die gebeurd is op volgende afbeelding? Noteer.














De warmte die zorgt voor de faseovergang is dus latente warmte. We bekijken in wat volgt de verschillende faseovergangen naderbij. We beperken ons hierbij tot een zuivere stof.
Smelten en stollen
Smelten
De overgang van vaste fase naar vloeibare fase noemen we smelten. Ondertussen weten we dat de deeltjes in een vaste stof op een vaste plaats in het rooster zitten en daar trillen. Als er thermische energie wordt toegevoegd, neemt de trillingsenergie toe en komen de deeltjes verder van elkaar te zitten. De temperatuur stijgt dus en de stof zet uit. Zowel de inwendige kinetische energie als de inwendige potentiële energie nemen dus toe.
Op een bepaald moment bewegen de deeltjes zo snel en zijn ze zo ver van elkaar verwijderd dat de cohesiekrachten ze niet meer bij elkaar kunnen houden in het rooster. De stof heeft haar smeltpunt bereikt en smelt. Tijdens het smelten wordt alle toegevoegde warmteenergie gebruikt om de inwendige potentiële energie van de stof te verhogen. De inwendige kinetische energie van de deeltjes neemt niet meer toe en de temperatuur blijft dus constant. Alle thermische energie die het systeem opneemt tijdens het smelten dient om de aggregatietoestand te veranderen, dus om de deeltjes van het rooster los te maken.
De warmte die toegevoegd wordt tijdens het smelten is latente warmte.



vloeistof
Tsmeltpunt
vaste stof en vloeistof komen samen voor

vaste stof
smelten begintsmelten compleet t
Op de y-as van deze grafiek staat de temperatuur, op de x-as staat de tijd. Naarmate de tijd verstrijkt, wordt er meer warmte toegevoegd. We zouden op de x-as dus ook de warmte Q kunnen noteren.
Smelten gebeurt bij het smeltpunt.
Bij die temperatuur gaat de stof over van vaste naar vloeibare fase.
Tijdens het smelten blijft de temperatuurconstant en komt de stof tegelijkertijd in vloeibare en vaste fase voor.
Het smeltpunt verschilt van stof tot stof en is afhankelijk van de druk. Bovenstaande grafiek toont wat er gebeurt bij atmosferische druk.
Stollen
De overgang van vloeibare naar vaste fase noemen we stollen. Tijdens het stollen gebeurt het omgekeerde proces als tijdens het smelten. Als er thermische energie onttrokken wordt, neemt de trillingsenergie af en komen de deeltjes dichter bij elkaar te zitten. De temperatuur neemt af en de stof krimpt. Zowel de inwendige kinetische energie als de inwendige potentiële energie nemen dus af.
Op een bepaald moment bewegen de deeltjes zo traag en zijn ze zo dicht bij elkaar dat ze zich gaan ordenen in een rooster. De stof heeft haar stolpunt bereikt en stolt. Tijdens het stollen wordt alle onttrokken thermische energie gebruikt om de inwendige potentiële energie van de stof te verlagen. De inwendige kinetische energie daalt niet meer en de temperatuur blijft constant. Alle warmte-energie die aan het systeem onttrokken wordt, zorgt voor een verandering van de aggregatietoestand.
De warmte onttrokken tijdens het stollen is latente warmte.
Er moet evenveel warmte onttrokken worden om een stof te laten stollen als dat er warmte nodig is om dezelfde stof te laten smelten.



vloeistof
Tstolpunt

vaste stof en vloeistof komen samen voor
vaste stof

stollen begintstollen is compleet t
Op de y-as van deze grafiek staat de temperatuur, op de x-as staat de tijd. Naarmate de tijd verstrijkt, wordt er meer warmte onttrokken. We zouden op de x-as dus ook de warmte Q kunnen noteren.
Stollen gebeurt bij het stolpunt.
Bij die temperatuur gaat de stof over van vloeibare fase naar vaste fase.
Tijdens het stollen blijft de temperatuurconstant en komt de stof tegelijkertijd in vloeibare en vaste fase voor.
Het stolpunt verschilt van stof tot stof en is afhankelijk van de druk. Bovenstaande grafiek toont wat er gebeurt bij atmosferische druk.
Voor een zuivere stof zijn smeltpunt en stolpunt gelijk. Een stof kan enkel op het smeltpunt/stolpunt tegelijk in vaste en vloeibare toestand voorkomen.
De warmte die nodig is om een stof te laten smelten is even groot als de warmte die onttrokken wordt tijdens het stollen.
WIST-JE-DAT
Bij nachtelijk vriesweer in het voorjaar worden de pas gevormde, fragiele bloesems van onder andere fruitbomen besproeid met water. Het water stolt en er een ontstaat een beschermende ijslaag rond de bloesems. Tijdens het stollen komt er warmte vrij en blijft de temperatuur van de bloesems rond de 0 °C. Een temperatuur die niet gevaarlijk is voor de bloesems.

Verdampen en condenseren Verdampen
De overgang van vloeibare fase naar gasvormige fase noemen we verdampen. In de vloeibare fase rollen de deeltjes over elkaar. Als er warmte wordt toegevoegd, neemt de inwendige energie van de deeltjes toe en komen de deeltjes verder van elkaar te zitten. De temperatuur stijgt dus en de stof zet uit. Zowel de inwendige kinetische energie als de inwendige potentiële energie nemen dus toe.
Af en toe krijgt een deeltje genoeg inwendige kinetische energie om zich los te maken van de vloeistof en verdampt. Evengoed kan zo’n verdampt deeltje, na botsing met een luchtdeeltje, terug in de vloeistof terechtkomen en condenseren. Pas als de temperatuur hoog genoeg is, gaan er voldoende deeltjes genoeg inwendige kinetische energie hebben om de vloeistof te verlaten. De stof heeft dan haar kookpunt bereikt en kookt.
Een vloeistof kookt als er in de vloeistof dampbellen ontstaan die opstijgen en dan aan het vloeistofoppervlak openbarsten. Koken is inwendige verdamping.


Verdampen












Koken
Tijdens het koken wordt alle toegevoegde thermische energie gebruikt om de inwendige potentiële energie van de stof te verhogen. De inwendige kinetische energie van de deeltjes neemt niet meer toe en de temperatuur blijft constant. Alle warmte-energie die het systeem opneemt tijdens het koken dient om de aggregatietoestand te veranderen, dus om de deeltjes uit de vloeistof los te maken.
De warmte die toegevoegd wordt tijdens het koken is latente warmte. T Tkookpunt



vloeistof en gas komen samen voor
vloeistof gas

koken begintkoken is compleet t
Op de y-as van deze grafiek staat de temperatuur, op de x-as staat de tijd. Naarmate de tijd verstrijkt, wordt er meer warmte toegevoegd. We zouden op de x-as dus ook de warmte Q kunnen noteren.
Koken gebeurt bij het kookpunt
Bij die temperatuur gaat de stof over van vloeibare fase naar gasvormige fase.
Tijdens het koken blijft de temperatuurconstant en komt de stof tegelijkertijd in vloeibare en gasvormige fase voor.
Het kookpunt verschilt van stof tot stof en is afhankelijk van de druk. Bovenstaande grafiek toont wat er gebeurt bij atmosferische druk.
Wij houden onze lichaamstemperatuur op peil door te zweten. Door de verdamping van lichaamsvocht koelen we af. Als honden te warm hebben, dan gebruiken ze hun tong om af te koelen. De belangrijkste manier waarop een hond zijn warmte kwijtraakt, is door te hijgen met de tong uit de bek.
Het leidenfrost-effect
Zou jij jouw hand onderdompelen in vloeibaar lood? Scan de QR-code en bekijk het filmpje. Dit filmpje illustreert het leidenfrost-effect.

Condenseren
De overgang van gasvormige fase naar vloeibare fase noemen we condenseren. Tijdens het condenseren gebeurt het omgekeerde proces als tijdens het verdampen. Als er thermische energie onttrokken wordt, neemt de bewegingsenergie af en komen de deeltjes dichter bij elkaar te zitten. Zowel de inwendige kinetische energie als de inwendige potentiële energie nemen dus af.
Op een bepaald moment bewegen de deeltjes zo traag en zijn ze zo dicht bij elkaar, dat ze terugkeren naar een vloeistof. De stof heeft haar kookpunt bereikt en condenseert. Tijdens het condenseren wordt alle onttrokken thermische energie gebruikt om de inwendige potentiële energie van de stof te verlagen. De inwendige kinetische energie van de deeltjes daalt niet meer en de temperatuur blijft constant. Alle warmte-energie die aan het systeem onttrokken wordt, zorgt voor een verandering van de aggregatietoestand.
De warmte die onttrokken wordt tijdens het condenseren is latente warmte.
Er moet evenveel warmte onttrokken worden om een stof te laten condenseren als dat er warmte nodig is om dezelfde stof te laten verdampen.
T Tkookpunt



vloeistof en gas komen samen voor gas

vloeistof

condenseren begintcondenseren is compleet t
Op de y-as van deze grafiek staat de temperatuur, op de x-as staat de tijd. Naarmate de tijd verstrijkt, wordt er meer warmte onttrokken. We zouden op de x-as dus ook de warmte Q kunnen noteren.
Condenseren gebeurt bij het kookpunt.
Bij die temperatuur gaat de stof over van gasvormige fase naar vloeibare fase.
Tijdens het condenseren blijft de temperatuurconstant en komt de stof tegelijkertijd in vloeibare en gasvormige fase voor.
Het kookpunt verschilt van stof tot stof en is afhankelijk van de druk. Bovenstaande grafiek toont wat er gebeurt bij atmosferische druk.
Een stof kan enkel op het kookpunt tegelijk in gasvormige en vloeibare toestand voorkomen.
De warmte die nodig is om een stof te laten verdampen is even groot als de warmte die onttrokken wordt tijdens het condenseren.
WIST-JE-DAT

Melk of chocolademelk wordt vaak opgewarmd door er stoom door te laten gaan. De latente warmte die de stoom laat condenseren zorgt dan voor de opwarming van de melk. Tijdens dit proces verandert ook de textuur van de melk. We spreken van het opschuimen van melk.
Een condensatieketel maakt gebruik van opgewekte warme rookgassen om water voor te verwarmen. Meer weten over de werking van een condensatieketel? Scan dan de QR-code en bekijk het filmpje.
Sublimeren en desublimeren
Sublimeren
De overgang van vaste fase naar gasvormige fase noemen we sublimeren. In de vaste fase zitten de deeltjes op een vaste plaats in het rooster en trillen daar ter plaatse. Als er thermische energie toegevoegd wordt, neemt de inwendige kinetische energie van de deeltjes toe en komen ze verder van elkaar te zitten. De temperatuur stijgt dus en de stof zet uit. Zowel de inwendige kinetische energie als de inwendige potentiële energie nemen dus toe.
Af en toe krijgt een deeltje genoeg inwendige energie om zich los te maken van het rooster en sublimeert. De stof heeft dan haar sublimatiepunt bereikt en sublimeert.

Sublimatie van droogijs (vaste vorm van CO2 )
Tijdens het sublimeren wordt alle toegevoegde thermische energie gebruikt om de inwendige potentiële energie van de stof te verhogen. De inwendige kinetische energie van de deeltjes neemt niet meer toe en de temperatuur blijft constant. Alle thermische energie die het systeem opneemt tijdens het sublimeren dient om de aggregatietoestand te veranderen, dus om de deeltjes uit de vaste stof los te maken.
De warmte die toegevoegd wordt tijdens het sublimeren is latente warmte.


Tsublimatiepunt

vaste stof en gas komen samen voor gas


vaste stof
sublimeren begintsublimeren is compleet t
Op de y-as van deze grafiek staat de temperatuur, op de x-as staat de tijd. Naarmate de tijd verstrijkt, wordt er meer warmte toegevoegd. We zouden op de x-as dus ook de warmte Q kunnen noteren.
Sublimeren gebeurt bij het sublimatiepunt.
Bij die temperatuur gaat de stof over van vaste fase naar gasvormige fase.
Tijdens het sublimeren blijft de temperatuurconstant en komt de stof tegelijkertijd in vaste en gasvormige fase voor.
Het sublimatiepunt verschilt van stof tot stof en is afhankelijk van de druk. Bovenstaande grafiek toont wat er gebeurt bij atmosferische druk.
Desublimeren
De overgang van gasvormige fase naar vaste fase noemen we desublimeren. Tijdens het desublimeren gebeurt het omgekeerde proces als tijdens het sublimeren. Als er thermische energie wordt onttrokken, neemt de bewegingsenergie af en komen de deeltjes dichter bij elkaar te zitten. Zowel de inwendige kinetische energie als de inwendige potentiële energie nemen dus af.
Op een bepaald moment bewegen de deeltjes zo traag en zijn ze zo dicht bij elkaar dat ze terugkeren naar een vaste stof. De stof heeft haar sublimatiepunt bereikt en desublimeert. Tijdens het desublimeren wordt alle onttrokken thermische energie gebruikt om de inwendige potentiële energie van de stof te verlagen. De inwendige kinetische energie van de deeltjes daalt niet meer en de temperatuur blijft constant. Alle thermische energie die aan het systeem onttrokken wordt tijdens het desublimeren, zorgt voor een verandering van de aggregatietoestand.
De warmte die onttrokken wordt tijdens het desublimeren is latente warmte.
Er moet evenveel warmte onttrokken worden om een stof te laten desublimeren als dat er warmte nodig is om dezelfde stof te laten sublimeren.
Tsublimatiepunt



gas
gas en vaste stof komen samen voor

vaste stof

desublimeren begintdesublimeren is compleet t
Op de y-as van deze grafiek staat de temperatuur, op de x-as staat de tijd. Naarmate de tijd verstrijkt, wordt er meer warmte onttrokken. We zouden op de x-as dus ook de warmte Q kunnen noteren.
Desublimeren gebeurt bij het sublimatiepunt
Bij die temperatuur gaat de stof over van gasvormige fase naar vaste fase.
Tijdens het desublimeren blijft de temperatuurconstant en komt de stof tegelijkertijd in vaste en gasvormige fase voor.
Het sublimatiepunt verschilt van stof tot stof en is afhankelijk van de druk.
Een stof kan enkel op het sublimatiepunt tegelijk in gasvormige en vaste toestand voorkomen.
De warmte die nodig is om een stof te laten sublimeren is even groot als de warmte die onttrokken wordt tijdens het desublimeren.
5.2.2 Verband tussen de latente warmte Q en de massa m
We onderzoeken de latente warmte nu even naderbij.
Het zeeijs smelt aan een ijl tempo. Dat leer je in het filmpje door de QR-code te scannen.

Wat denk je dat het verband is tussen de massa ijs die smelt en de toegevoegde warmte? Noteer.
We kunnen dat vermoeden controleren door een experiment uit te voeren. Scan de QR-code om het onderzoek naderbij te bekijken of zelf het experiment uit te voeren.
We zien dat de warmtehoeveelheid Q toeneemt als de massa m toeneemt.
De warmte Q is recht evenredig met de massa m.
We vinden dat Q m constant is.
Dus: Q is recht evenredig met m
Q = constante ⋅ m
Die constante is afhankelijk van de stof en van de faseovergang die gebeurt:
Q = l m
GROOTHEID
EENHEID
specifieke latente warmte l joule kilogram J kg
De specifieke latente warmte l is de warmte die nodig is om één kilogram van een stof een faseovergang te laten ondergaan.
In de index wordt de faseovergang bij de specifieke latente warmte genoteerd.
In onderstaande tabel vind je een aantal specifieke smeltingswarmtes en specifieke verdampingswarmtes.
Q = l · m
Met:
l = specifieke latente warmte in J kg
m = massa in kg
Q = warmte in J
Voorbeeld 1
Bij een hevige regenbui valt er 2,0 cm regen op een oppervlakte van 1,0 m2. Deze regen is ontstaan door condensatie van waterdamp in de atmosfeer. Hoeveel warmte is hierbij in de atmosfeer vrijgekomen? De specifieke verdampingswarmte van water is 2260 J g .
Gegeven: lv = 2260 J g
h = 2,0cm
A = 1,0m2
Gevraagd: Q
Oplossing: V = A ⋅ h = 1,0m2 0,020m = 0,020m3 = 20dm3 = 20l
⇒ m = 20kg
Q = lv ⋅ m = 2260 J g ⋅ 20 ⋅ 103 g = 4520 104 J = 452 105 J = 45MJ
Voorbeeld 2
Een loden beeld van 400 g heeft een temperatuur van 18 °C. Het beeld wordt gesmolten tot vloeibaar lood van 620 °C
cvastPb = 0,130 J g °C
cvlPb = 0,172 J g ⋅ °C
θs,Pb = 327°C
ls,Pb = 25 J g
Hoeveel warmte is hiervoor nodig?
Gegeven: cvastPb = 0,130 J g °C
cvlPb = 0,172 J g ⋅ °C
θs,Pb = 327°C
ls,Pb = 25 J g
θ1 = 18°C
θ2 = 620°C
m = 400g
Gevraagd: Q
Oplossing: Q = cvastPb m ⋅Δθ + ls,Pb m + cvlPb m ⋅Δθ
= 0,130 J g °C ⋅ 400g ⋅ (327°C 18°C)+ 25 J g ⋅ 400g + 0,172 J g ⋅ °C 400g (620°C 327°C)
= 16068J + 10000J + 20158,4J = 46kJ
Bij het proces om tot thermisch evenwicht te komen, moet de wet van energiebehoud steeds gerespecteerd worden.



In module 1 Energieomzettingen zagen we reeds de wet van energiebehoud.
Laten we deze wet van energiebehoud kort herhalen.
De totale energie in een geïsoleerd systeem blijft altijd constant.
In het geval van warmte-uitwisseling zal een warmtebalans dit energiebehoud garanderen.
Deze ziet er dan als volgt uit.
In een geïsoleerd systeem is de som van de uitgewisselde warmtehoeveelheden gelijk aan nul:
Q1 + Q2 + Q3 + ... = 0
Hierbij zijn de warmtehoeveelheden die het systeem opneemt positief en de warmtehoeveelheden die het systeem afgeeft negatief.
Bij de merkbare warmte worden de termen positief en negatief door het teken van de temperatuurverandering. Je moet hier dus geen minteken voorzien als de warmte afgestaan wordt, dat is automatisch in orde. Wel moet je voor Δθ steeds de eindtemperatuur min de begintemperatuur nemen: Δθ = θeind θbegin
Bij de latente warmte moet de specifieke latente warmte l negatief genomen worden als de warmte afgestaan wordt, zo wordt ook de latente warmte negatief.
Voorbeeld 1
Nemen we het voorbeeld van de ijsblokjes in het zomers drankje. Hierbij zullen de ijsblokjes warmte opnemen en zal het drankje warmte afgeven. De warmte die door het drankje afgegeven wordt, wordt door de ijsblokjes opgenomen.

We gaan dit in de oefeningen als volgt noteren.
Voorbeeld: ijsblokjes smelten in een zomers drankje
ijsblokjes zomers drankje


neemt warmte op geeft warmte af
• Is er sprake van merkbare warmte?
Ja, de temperatuur van de ijsblokjes verandert.
• Hoe kunnen we deze merkbare warmte voorstellen?
Qmerkbaarijsblokje
• Met welke formule kunnen we deze merkbare warmte uitrekenen?
Met de formule: Qmerkbaar = c ⋅ m ⋅Δθ. We moeten hierbij wel voorzichtig zijn.
IJs is immers ijs tot 0 °C, bij hogere temperaturen is het ijs gesmolten en dus water. We moeten deze berekening dus in twee delen opsplitsen.
Voor de temperatuurverandering onder 0°C:
Qmerkbaarijsblokje = cijs mijs ⋅Δθijs
Voor de temperatuurverandering boven 0°C:
Qmerkbaarijsblokje = cwater mijs ⋅Δθgesmoltenijs
Dit lijkt misschien raar, maar de specifieke warmtecapaciteit van water en ijs is niet dezelfde.
• Is deze warmtehoeveelheid positief of negatief?
Positief, want er wordt warmte opgenomen, bovendien is Δθ positief, want Δθ = θeind θbegin
• Is er sprake van latente warmte? Ja, de ijsblokjes smelten.
• Hoe kunnen we deze latente warmte voorstellen?
Qlatentijsblokje
• Met welke formule kunnen we deze latente warmte uitrekenen?
Qlatentijsblokje = lsmeltingswarmte,ijs mijs
• Is deze warmtehoeveelheid positief of negatief?
Positief, want er wordt warmte opgenomen.
• Is er sprake van merkbare warmte?
Ja, de temperatuur van het zomers drankje verandert.
• Hoe kunnen we deze merkbare warmte voorstellen?
Qmerkbaardrankje
• Met welke formule kunnen we deze merkbare warmte uitrekenen?
Qmerkbaardrankje = cdrankje mdrankje ⋅Δθdrankje
• Is deze warmtehoeveelheid positief of negatief?
Negatief, want er wordt warmte afgestaan, bovendien is Δθ negatief, want Δθ = θeind θbegin
• Is er sprake van latente warmte?
Nee, niet bij het zomers drankje, de fase van het drankje verandert niet.
Kwalitatief
De warmtebalans zegt nu dat:
Qmerkbaarijsblokje + Qlatentijsblokje + Qmerkbaardrankje = 0
cijs mijs ⋅Δθijs + lsmeltingswarmte,ijs mijs + cwater mijs ⋅Δθgesmoltenijs + cdrankje mdrankje ⋅Δθdrankje = 0
Als we dit schematisch voorstellen, wordt het allemaal wat duidelijker.
KOUD
ijsblokjes mijs
hier smelt ijs
eindtemperatuur 0 °C
θijs, begin
smeltpunt ijs
θeind
Qmerkbaar ijs Qmerkbaar gesmolten ijs
Qlatent ijs
opgenomen warmte
QO positief
warmtebalans:
QO + QA = 0
WARM drankje mdrankje
θdrankje, begin
Qmerkbaar drankje
afgestane warmte
QA negatief
Het is dus belangrijk om de smeltpunten en dergelijke te noteren op de temperatuur-as. Daar wordt immers latente warmte opgenomen.
Kwantitatief
We maken nu dezelfde oefening, maar met berekeningen.
60 g ijsblokjes met een temperatuur van –15 °C worden in een te warm drankje met een massa van 200 g en een temperatuur van 35 °C gedaan om het drankje te laten afkoelen. Bepaal de eindtemperatuur van het drankje met de ijsblokjes.
KOUD
ijsblokjes mijs = 60 g
WARM drankje mdrankje = 200 g
eindtemperatuur 0 °C
θijs, begin θsmelt, ijs = –15 °C = 35 °C θeind
θdrankje, begin
Qmerkbaarijs + Qlatentijs + Qmerkbaargesmoltenijs + Qmerkbaardrankje = 0
⟺ cijs ⋅ mijs ⋅Δθijs + ls ⋅ mijs + cwater ⋅ mijs ⋅Δθgesmoltenijs + cwater ⋅ mdrankje ⋅Δθdrankje = 0
Δθ = θeind θbegin
⟺ cijs mijs (0°C ( 15°C))+ ls mijs + cwater mijs (θeind 0°C)+ cwater mdrankje (θeind 35°C)= 0
⟺ cijs mijs 15°C + ls mijs + cwater mijs (θeind 0°C)+ cwater mdrankje (θeind 35°C)= 0
⟺ 2,200 J g °C 60g 15°C + 334 J g 60g + 4,186 J g °C 60g θeind + 4,186 J g °C ⋅ 200g ⋅ (θeind 35°C)= 0
⟺ 1980J + 20040J + 251,16 J °C ⋅ θeind + 837,2 J °C ⋅ (θeind 35°C)= 0
⟺ 1980J + 20040J + 251,16 J °C θeind + 837,2 J °C θeind 29302J = 0
⟺ 1088,36 J °C θeind 7282J = 0
⟺ θeind = 6,6908°C = 6,7°C
We zien dus dat het drankje toch flink afgekoeld is door de ijsblokjes, de eindtemperatuur bedraagt 6,7 °C
Bovendien zien we dat de ijsblokjes heel wat warmte nodig hebben om te smelten waardoor het drankje dus flink afkoelt.
Door de temperaturen correct in te vullen wordt de afgestane merkbare warmte negatief en is de opgenomen merkbare warmte positief.
Bij de latente warmte ligt dat anders. We moeten daar het teken bij de latente warmte veranderen als er warmte afgestaan wordt. Dat is dus bij stollen, condenseren en desublimeren. In dit voorbeeld smelten de ijsblokjes, dus was dit niet van toepassing. Bij de oefeningen in ‘Verder oefenen?’ zal je daar wel rekening mee moeten houden.
Voorbeeld 2
Een mama heeft in de tuin een zwembad geïnstalleerd voor haar twee dochters. De temperatuur van het water bedraagt 16 °C, wat de meisjes veel te koud vinden. Daarom beslist de mama om een paar emmers heet water van 60 °C bij het zwembadwater te gieten, in de hoop om zo de temperatuur van het water aangenaam te maken voor haar dochters.
Voorbeeld: zwembad bijvullen met warm water
KOUD
WARM
koud water in zwembad warm water


neemt warmte op geeft warmte af
• Is er sprake van merkbare warmte?
Ja, de temperatuur van het koude water neemt toe.
• Hoe kunnen we deze merkbare warmte voorstellen?
Qmerkbaarkoudwater
• Met welke formule kunnen we deze merkbare warmte voorstellen?
Qmerkbaarkoudwater = cwater ⋅ m ⋅Δθkoudwater
• Is deze warmtehoeveelheid positief of negatief?
Positief, want er wordt warmte opgenomen, bovendien is Δθ positief, want Δθ = θeind θbegin
• Is er sprake van latente warmte? Nee, de fase van het water blijft dezelfde.
• Is er sprake van merkbare warmte?
Ja, de temperatuur van het warm water daalt.
• Hoe kunnen we deze merkbare warmte voorstellen?
Qmerkbaarwarmwater
• Met welke formule kunnen we deze merkbare warmte voorstellen?
Qmerkbaarwarmwater = cwater ⋅ m ⋅Δθwarmwater
• Is deze warmtehoeveelheid positief of negatief?
Negatief, want er wordt warmte afgestaan, bovendien is Δθ negatief, want Δθ = θeind θbegin
• Is er sprake van latente warmte? Nee, de fase van het water blijft dezelfde.
Kwalitatief
We noteren deze oefening ook in een schema.
KOUD
zwembadwater mw1
WARM water mw2
eindtemperatuur
θzwembadwater, begin θwater, begin
Qmerkbaar zwembad positief
warmtebalans:
Qmerkbaar zwembad + Qmerkbaar water = 0 θeind
Kwantitatief
We maken nu dezelfde oefening, maar met berekeningen.
Qmerkbaar water negatief
In het zwembad bevindt zich 400 kg water met een temperatuur van 16 °C. Om het water op te warmen voegt de mama 40 kg warm water met een temperatuur van 60 °C toe. Bereken de eindtemperatuur van het zwembadwater.
KOUD
zwembadwater mw1 = 400 kg
WARM water mw2 = 40 kg
θzwembadwater, begin θwater, begin θeind eindtemperatuur = 16 °C = 60 °C
Qmerkbaarzwembad + Qmerkbaarwarmwater = 0
⟺ cwater mzwembad ⋅Δθkoudwater + cwater mwater ⋅Δθwarmwater = 0
met Δθ = θeind θbegin
⟺ cwater mzwembad (θeind 16°C)+ cwater mwater (θeind 60°C)= 0
⟺ 4186 J kg ⋅ °C ⋅ 400kg ⋅ (θeind 16°C)+ 4186 J kg ⋅ °C ⋅ 40kg ⋅ (θeind 60°C)= 0
⟺ 1674,4 kJ °C ⋅ θeind 26790,4kJ + 167,44 kJ °C ⋅ θeind 10046kJ = 0
⟺ 1841,84 kJ °C θeind 36836,4kJ = 0
⟺ θeind = 20°C
Door toevoeging van het warme water is de temperatuur van het zwembadwater gestegen tot 20 °C.
Thermische energie en temperatuur
Zet onderstaande temperaturen om.
Leg het verschil uit tussen de begrippen temperatuur, warmte en thermische energie.
Het deeltjesmodel
Beschrijf de aggregatietoestand ‘vaste stof’ aan de hand van het deeltjesmodel. Maak ook een tekening.
Beschrijf de aggregatietoestand ‘vloeistof’ aan de hand van het deeltjesmodel. Maak ook een tekening.
Beschrijf de aggregatietoestand ‘gas’ aan de hand van het deeltjesmodel. Maak ook een tekening.
De inwendige energie
Beschrijf wat de inwendige kinetische energie van een stof inhoudt.
Beschrijf wat de inwendige potentiële energie van een stof inhoudt.
Beschrijf wat de inwendige energie van een stof inhoudt.
Waarvoor is de absolute temperatuur een maat? Noteer. 1 2 3 4 5 6 7 8 9
Warmteoverdracht
10 11
Op welke drie manieren kan de uitwisseling van warmte gebeuren? Noteer.
Merkbare en latente warmte
Vul telkens het juiste begrip in. Kies uit: thermische energie, vloeistof, vaste stof, gas, plasma, fasetoestanden, stroming, geleiding, straling, inwendige energie, inwendige potentiële energie, inwendige kinetische energie, kelvin, absoluut nulpunt, thermisch evenwicht, temperatuur, absolute temperatuur, latente warmte, smelten, stollen, merkbare warmte, verdampen, sublimeren, desublimeren, condenseren, cohesiekrachten, warmte, warmteoverdracht
Deze aggregatietoestand wordt in een model als volgt voorgesteld:
Deze aggregatietoestand wordt in een model als volgt voorgesteld:
In deze aggregatietoestand zitten de deeltjes nog dicht bij elkaar, maar ze hebben geen vaste plaats meer. Ze kunnen vrij langs elkaar heen bewegen.
Zo wordt de temperatuur –273,15 °C ook genoemd.
Dit is de totale bewegingsenergie van de structurele elementen (atomen, moleculen …) van een systeem.
Dit is een andere benaming voor aggregatietoestanden.
Deze vorm van energie wordt ook wel warmteenergie genoemd.
Als twee systemen dezelfde temperatuur hebben, dan zijn deze in …
Deze grootheid is een maat voor het trillen van de atomen of moleculen.
Deze aggregatietoestand wordt in een model als volgt voorgesteld:
In deze fase is de krachtwerking tussen de verschillende deeltjes klein. De atomen (of moleculen) zijn heel beweeglijk en bewegen los van elkaar met verschillende snelheden kriskras door elkaar.
Deze energie bepaalt de fase waarin de stof zich bevindt.
Dit wordt uitgewisseld tussen systemen die niet in thermisch evenwicht zijn.
In deze vierde fasetoestand zijn sommige atomen (of moleculen) één of meerdere elektronen kwijtgeraakt. Deze toestand van het atoom (of molecule) noemen we geïoniseerd. De vrije elektronen bewegen zich hierbij vrij door de ruimte.
Dit is de som van alle vormen van energie die inwendig in het systeem aanwezig zijn, dus de som van de bewegingsenergie van de deeltjes (atomen of moleculen) en van de bindingsenergie.
Hierbij gebeurt de warmteoverdracht tussen twee systemen, die niet in aanraking zijn, zonder gebruik te maken van een middenstof.
Het warme systeem geeft elektromagnetische straling af en verliest zo dus warmte, het andere systeem absorbeert de elektromagnetische straling deels of volledig.
Deze energie wordt bepaald door de snelheid waarmee de deeltjes (atomen of moleculen) in een stof bewegen.
Dit gebeurt tussen systemen die niet in thermisch evenwicht zijn.
In deze aggregatietoestand zijn de aantrekkingskrachten tussen de verschillende deeltjes van de stof groot. De atomen zitten op een vaste plaats en kunnen amper bewegen. Als de temperatuur toeneemt, gaan ze wel heftiger trillen en gaan ze wat verder uit elkaar zitten.
Deze warmteoverdracht gebeurt binnen de stof, waarbij warmte stroomt van deeltjes met een hoge temperatuur naar deeltjes met een lage temperatuur. Noteer hier een ander woord voor conductie.
Dit is de eenheid van absolute temperatuur.
Hierbij gebeurt de warmteoverdracht door verplaatsing van een warm gas of warme vloeistof, of van een koud gas of koude vloeistof. Noteer hier een ander woord voor radiatie.
Noteer hier een ander woord voor convectie.
Zo noemen we de overgang van vaste fase naar gasvormige fase.
Zo noemen we de overgang van vaste fase naar vloeibare fase.
Deze warmte heeft een temperatuurverandering tot gevolg.
Deze grootheid voor temperatuur heeft als nulpunt 0K = 273,15°C .
Deze warmte heeft een verandering van aggregatietoestand tot gevolg, zonder dat daarbij een temperatuurverandering plaatsvindt.
Zo noemen we de overgang van vloeibare fase naar gasvormige fase.
Zo noemen we de overgang van vloeibare fase naar vaste fase.
Zo noemen we de overgang van gasvormige fase naar vaste fase.
Zo noemen we de overgang van gasvormige fase naar vloeibare fase.
Dit is de hoeveelheid energie die uitgewisseld wordt tussen twee voorwerpen ten gevolge van een temperatuurverschil.
Dit zijn de aantrekkingskrachten tussen deeltjes van dezelfde stof in het deeltjesmodel.
Noteer de faseovergangen op onderstaande figuur. Kies uit: smelten, stollen, sublimeren, desublimeren, verdampen, condenseren
vloeibaar vast gas

13 14 15 a b c d
Leg het verschil uit tussen latente en merkbare warmte.
Verbind.
verandering van inwendige kinetische energie temperatuurverandering verandering van inwendige potentiële energie faseovergang




Duid op de figuur het smeltpunt aan met Tsmelt
Kleur de t-as geel waar het smelten gebeurt.
Kleur de lijn in de grafiek groen waar de stof in vaste toestand voorkomt.
Kleur de lijn in de grafiek rood waar de stof in vloeibare toestand voorkomt.




Duid op de figuur het kookpunt aan met Tkook.
Kleur de t-as geel waar het koken gebeurt.
Kleur de lijn in de grafiek groen waar de stof in gasvormige toestand voorkomt.
Kleur de lijn in de grafiek rood waar de stof in vloeibare toestand voorkomt.




Duid op de figuur het stolpunt aan met Tstol.
Kleur de t-as geel waar het stollen gebeurt.
Kleur de lijn in de grafiek groen waar de stof in vaste toestand voorkomt.
Kleur de lijn in de grafiek rood waar de stof in vloeibare toestand voorkomt.






Duid op de figuur het kookpunt aan met Tkook. Kleur de t-as geel waar het condenseren gebeurt.
Kleur de lijn in de grafiek groen waar de stof in gasvormige toestand voorkomt.
Kleur de lijn in de grafiek rood waar de stof in vloeibare toestand voorkomt.
Waarom worden bij vriesweer de pas gevormde, fragiele bloesems besproeid met water? Leg uit.
Waarom zweten we? Leg uit.
Waarom zien we honden vaak met hun tong uit hun muil? Leg uit.
Als we de specifieke warmtecapaciteit van zand en water vergelijken, dan zien we een groot verschil. Wat betekent dat verschil juist? Zien we dat ook in de praktijk? Verklaar.
czand = 1600 J kg °C
cwater = 4186 J kg ⋅ °C
Door onze radiatoren stroomt water. Waarom eigenlijk? Olie zou namelijk beter zijn als het op roesten aankomt. Waarom wordt er dan toch voor water gekozen? Verklaar.
colie = 2000 J kg °C
cwater = 4186 J kg °C
Kruis aan of bij onderstaande voorbeelden sprake is van merkbare warmte, latente warmte of beide.
IJsblokjes smelten in een warme cola.
Water van 20 °C wordt in een kookpot op een elektrisch vuur gezet en aan de kook gebracht om er daarna spaghetti in te koken.
Een fruitsapje wordt al snel warm in de stralende zon.
Sien doet heel warm water bij haar badwater omdat ze het te koud vindt.
Een kaars wordt aangestoken en geeft na een tijdje een heel mooie vlam.
Bij het opwarmen van chocomelk laat men stoom door de chocomelk gaan.
Een ijsje smelt.
Water kookt.
Vul onderstaand schema aan met de juiste fases en faseovergangen.



Vul onderstaande grafiek aan met volgende begrippen: koken, smelten, smeltpunt, kookpunt, gas, vloeibaar, vast, vast en vloeibaar, vloeibaar en gas.
θ (°C)

Bij oefening 26 wordt warmte toegevoegd aan het systeem. Teken de θ (t)-grafiek voor het omgekeerde proces waarbij warmte onttrokken wordt aan het systeem.
Koper heeft een specifieke warmtecapaciteit van 386 J kg K . Welke van onderstaande beweringen is dan correct? Duid het juiste antwoord aan.
Als je 386 J aan warmte toevoegt aan 0,5 kg koper, dan stijgt de temperatuur van het koper 0,5 K.
Als 2,0 kg koper 386 J aan warmte opneemt, dan stijgt de temperatuur met 2,0 K
Als je 772 J aan warmte toevoegt aan 1,0 kg koper, dan stijgt de temperatuur met 2,0 K
Als 100 g koper 386 J aan warmte afgeeft, dan stijgt de temperatuur met 1,0 K
Warmtebalans
Omschrijf wat warmtebalans inhoudt. Welke belangrijke wet gebruiken we hierbij? Noteer.
Een waterijsje van 50 g wordt door een jongetje uit de diepvries (–18 °C) gehaald. Hij legt het op tafel en laat het daar liggen om het later op te eten. De temperatuur bedraagt op dat moment 18 °C. Het ijsje smelt natuurlijk voor het jongetje terug is. In dit proces onderscheiden we drie stappen: de temperatuur van het ijsje stijgt van –18 °C tot 0 °C het ijsje smelt bij 0 °C de temperatuur van het gesmolten ijsje stijgt van 0 °C tot 18 °C
Welke stap in dit proces heeft de meeste warmte nodig? Duid het juiste antwoord aan.
stap 1 stap 2 stap 3 ze hebben alle drie evenveel warmte nodig
De leiding van een jeugdbeweging heeft spaghettisaus gemaakt. De saus is echter veel te warm (90 °C) om op te dienen. Daarom beslist de leiding om een handvol ijsblokjes in de saus te doen. Duid de grafiek aan die het best de temperatuur van de saus en het ijs in functie van de tijd weergeeft.
Merkbare en latente warmte
De specifieke warmtecapaciteit van brons is 380 J kg °C .
Hoeveel warmte moet aan een bronzen standbeeld van 1,0 ton toegevoegd worden om zijn temperatuur met 5,0 °C te laten toenemen? Bereken.
We voegen 1,9 106 J warmte toe aan een zwembad gevuld met 100000 liter water. Hoeveel stijgt de temperatuur van het water? Bereken.
Als we met een hoeveelheid warmte gelijk aan 1,9 106 J een hoeveelheid water een temperatuurtoename van 5,0 °C willen geven. Hoeveel water moeten we dan opwarmen? Bereken.
Bereken hoeveel thermische energie nodig is om de temperatuur van 10 liter water 30 °C te laten toenemen.
Een ei heeft een warmtecapaciteit van 80 J °C . Hoeveel warmte is er nodig om de temperatuur van het ei met 15 °C te laten toenemen? Bereken.
Aan een heel groot blok ijs van 0 °C wordt 4000 kJ aan warmte toegevoegd. Hoeveel ijs smelt er? Bereken.
Je kan brandwonden oplopen als heet water in contact komt met je huid, maar ook als waterdamp op je huid terechtkomt.
In welk van de twee gevallen heb je echter de felste brandwonden? Vergelijk hierbij eenzelfde massa water en waterdamp van 100 °C die in contact komt met een even grote oppervlakte van je huid. Duid het juiste antwoord aan.
Het effect is afhankelijk van de temperatuur van jouw huid. De brandwonden zijn in beide gevallen even erg.
De brandwonden zijn het ergst bij waterdamp.
De brandwonden zijn het ergst bij water.
De specifieke smeltingswarmte van een metalen muntstuk is 206 kJ kg
De munt bevindt zich op de smelttemperatuur. Om de munt te laten smelten moet je 3000J aan warmte toevoegen.
Bepaal de massa van de munt.
Uit welk metaal is de munt vervaardigd? Zoek op.
Wat is het smeltpunt van het metaal? Zoek op.
Bereken hoeveel warmte nodig is om een zwembad van 8,0 m op 12,5 m en dat 2,0 m diep is, op te warmen van 10 °C tot 30 °C
Er wordt aan 5,0 kg nikkel cnikkel = 440 J kg °C evenveel warmte toegevoegd als aan
2,5 kg marmer cmarmer = 880 J kg °C
De temperatuur van het marmer stijgt met 10 °C. Hoeveel stijgt de temperatuur van het nikkel? Bereken en duid het juiste antwoord aan.
5,0 °C
10 °C
20 °C
Het water van de Niagara watervallen (hoogte 50 m) ondergaat een gemiddelde temperatuurstijging gedurende haar val omdat de zwaarte-energie voor de helft wordt omgezet in merkbare warmte, die aan de omgeving wordt afgestaan. Hoe groot is die temperatuurtoename? Bereken.
Een formule-1-auto van 605 kg rijdt aan 200 km h . Als de auto plots remt, komt hij tot stilstand. Hoeveel warmte komt daarbij vrij? Bereken. Als we deze warmtehoeveelheid zouden gebruiken om een emmer water (10 l) op te warmen, wat zou dan de temperatuurstijging van het water zijn? Bereken.
Warmtebalans
Bereken hoeveel warmte nodig is om 0,500 kg ijs bij 0 °C te laten smelten. Wordt deze warmte opgenomen of afgestaan door het ijs? Noteer. Geven we deze warmtehoeveelheid een positief of negatief teken in een berekening? Noteer.
Hoeveel warmte is er nodig om een ijsblokje van 16 g, dat uit de diepvries komt (–18 °C), te laten smelten? Bereken.
Een ijzeren radiator heeft een massa van 20 kg en is gevuld met 18 liter water. De temperatuur van de met water gevulde radiator daalt van 60 °C tot 20 °C in 4 uur.
Hoeveel warmte heeft de radiator dan afgestaan? Bereken. Wat geeft de meeste warmte af? De radiator of het water? Verklaar.
16
Een stukje koper met een massa van 84 g wordt lange tijd in een vlam gehouden tot de temperatuur ervan 450 °C bedraagt. Nadien wordt het ondergedompeld in water waardoor het afkoelt tot 54 °C. Hoeveel warmte wordt hierbij afgestaan aan het water? Bereken.
De warmtecapaciteit van een wasmachine bedraagt 2,40 kJ K ; de warmtecapaciteit van de was bedraagt 12,0 kJ K . De begintemperatuur van de wasmachine en de inhoud bedraagt
20°C. Hoeveel warmte is nodig om de wasmachine en de inhoud op te warmen tot 90 °C, als de wasmachine naast 4,5 kg was ook 20,0 kg water bevat? Bereken.
Een waterijsje van 50 g wordt door een jongetje uit de diepvries (–18 °C) gehaald. Hij legt het op tafel en laat het daar liggen om het later op te eten. De temperatuur bedraagt op dat moment 18 °C. Het ijsje smelt natuurlijk voor het jongetje terug is.
Hoeveel warmte heeft het waterijsje opgenomen in dit proces? Bereken.
Bepaal de eindtemperatuur nadat 10,0 kg warm water van 65 °C en 2,0 kg koud water van 5,0 °C bij elkaar gegoten worden. De invloed van de emmer is te verwaarlozen en er is geen warmteverlies aan de omgeving. Duid het juiste antwoord aan.
80 °C
35 °C
15 °C
55 °C
Een thermosfles met warmtecapaciteit van 60 J °C bevat 200 g water bij 15 °C. Er wordt
100g siroop van 30 °C bijgegoten csiroop = 4,0 J g °C .
Bepaal de eindtemperatuur van het water met de siroop in de thermosfles.
Hoeveel water van 5 °C moet je bij 70 kg water van 90 °C voegen om een eindtemperatuur van 40 °C te bekomen? Bereken.
Hoe groot is de eindtemperatuur van een kogel die met een snelheid van 105 m s tegen een koperen plaat vliegt? Je mag ervan uitgaan dat de begintemperatuur van de kogel 20 °C bedraagt en dat alle ontwikkelde warmte op de kogel is overgegaan. De specifieke warmtecapaciteit van het materiaal waaruit de kogel vervaardigd is, bedraagt
150 J kg °C
Een koperen pot van 150 g bevat 250 g olie van 18 °C. Er wordt 100 g loodkorrels van 100 °C in de olie gegoten. Bepaal de eindtemperatuur van het geheel.
Merkbare en latente warmte
1 2
In dit experiment zoek je het verband tussen de toegevoegde merkbare warmte en de temperatuurverandering.
BENODIGDHEDEN


isolerend vat gevuld met vloeistof (bijvoorbeeld water)
thermometerverwarmingselement of temperatuursensor




Meet een bepaalde hoeveelheid vloeistof af (bijvoorbeeld 400 g water).
Verwarm de vloeistof en meet voor verschillende hoeveelheden toegevoegde warmte telkens de temperatuurstijging.
In dit experiment zoek je het verband tussen de massa vloeistof en de temperatuurverandering.
BENODIGDHEDEN


isolerend vat gevuld met vloeistof (bijvoorbeeld water)
thermometerverwarmingselement of temperatuursensor





Meet achtereenvolgens verschillende massa's van een vloeistof af (bijvoorbeeld water).
Verwarm deze massa's vloeistof door telkens dezelfde hoeveelheid warmte toe te voegen.
Meet voor de verschillende massa's vloeistof telkens de temperatuurstijging.

Stikstof is een geur- en kleurloos gas dat 78 % van onze aardatmosfeer uitmaakt. Stikstof is bij kamertemperatuur in een gasvormige toestand. Als stikstof afgekoeld wordt tot aan zijn condensatiepunt, –196 °C, dan wordt stikstof vloeibaar. Met deze vloeibare stikstof kunnen er een aantal toffe experimenten rond faseovergangen gedaan worden.
Bekijk via de QR-code het filmpje dat verschillende faseovergangen demonstreert met behulp van vloeibaar stikstof.
ik ken het! paginanummer
Ik kan het verschil in betekenis tussen de begrippen temperatuur, warmte en thermische energie beschrijven. p. 4-6
Ik zie in dat het deeltjesmodel een geïdealiseerde voorstelling (model) van de werkelijkheid is die ons in staat stelt om thermodynamische systemen te beschrijven. Ik begrijp dat het gebruik van zo'n model zijn reikwijdten en beperkingen heeft. p. 7
Ik kan de aggregatietoestanden (vast, vloeibaar en gas) definiëren aan de hand van het deeltjesmodel, inclusief bijhorende schets. p. 7-11
Ik kan de cohesiekrachten beschrijven als aantrekkingskrachten tussen deeltjes van dezelfde stof in het deeltjesmodel. p. 7
Ik kan herkennen dat in het deeltjesmodel de snelheid van de deeltjes onderling verschillend is en voortdurend verandert. p. 12
Ik kan de inwendige energie van een voorwerp definiëren als de som van de inwendige kinetische energie en de inwendige potentiële energie. p. 12
Ik kan de inwendige kinetische energie van een voorwerp definiëren als de energie van de deeltjes van het voorwerp ten gevolge van hun snelheid. p. 12
Ik kan het begrip (absolute) temperatuur definiëren als een maat voor de gemiddelde kinetische energie van een deeltje van het voorwerp. p. 4, p. 12
Ik kan het verband tussen de temperatuurverandering en de verandering in inwendige kinetische energie toelichten. p. 12
Ik kan beschrijven dat de inwendige potentiële energie van de deeltjes stijgt als de afstand tussen de deeltjes stijgt. p. 12
Ik kan het principe van thermisch evenwicht omschrijven. p. 13-15
Ik kan warmte omschrijven als de hoeveelheid energie die uitgewisseld wordt tussen twee voorwerpen ten gevolge van een temperatuurverschil, inclusief grafische voorstelling. p. 13-16
Ik kan het begrip merkbare warmte omschrijven als warmte die zorgt voor een verandering van de temperatuur van een stof. p. 17
Ik kan het begrip latente warmte omschrijven als de warmte die zorgt voor een faseovergang van een stof, zonder dat er een temperatuurverandering optreedt.
Ik kan voor de grootheden (absolute) temperatuur, warmte en specifieke warmtecapaciteit de naam van de grootheid, het symbool van de grootheid, de naam van de (SI-) eenheid en het symbool van de (SI-) eenheid benoemen.
p. 17-18
p. 5, p. 22
Ik kan de formule Q = c m ⋅ΔT interpreteren. p. 18-24
Ik kan de merkbare warmte, specifieke warmtecapaciteit, de temperatuurverandering, begintemperatuur, eindtemperatuur of de massa berekenen als de andere gegevens gekend zijn aan de hand van een formularium met onder andere de formule Q = c ⋅ m ⋅ΔT . Ik kan deze formule omvormen om de gewenste grootheid te berekenen.
Ik kan de betekenis van de waarde van de specifieke warmtecapaciteit van een stof interpreteren aan de hand van voorbeelden uit het dagelijks leven.
Ik kan de juiste benamingen van de faseovergangen (smelten, stollen, verdampen, condenseren, sublimeren en desublimeren) herkennen.
p. 18-24, p. 55-57
p. 18-24, p. 47-54
p. 25-36
Ik kan verklaren dat door toevoegen of afstaan van thermische (inwendige) energie er een verandering in aggregatietoestand (een faseovergang) kan ontstaan. p. 25-36
Ik kan het verband tussen de faseovergang en de verandering in inwendige potentiële energie toelichten.
Ik herken het smeltpunt van een stof.
Ik kan aan de hand van voorbeelden verklaren dat de warmte nodig om te smelten, verdampen of sublimeren even groot is als de warmte die respectievelijk vrijkomt bij stollen, condenseren of desublimeren.
Ik kan het energietransport bij faseovergangen en bij temperatuurveranderingen van stoffen kwalitatief verklaren aan de hand van het deeltjesmodel.
Ik kan de formule Q = l m interpreteren.
p. 12, p. 25-36
p. 29-31
p. 25-36
p. 18-45, p. 47-55
p. 37-39
ik ken het!
Ik kan de latente warmte, specifieke latente warmte of de massa berekenen als de andere gegevens gekend zijn aan de hand van een formularium met onder andere de formule Q = l ⋅ m . Ik kan deze formule omvormen om de gewenste grootheid te berekenen.
Ik kan het verband tussen grootheden zoals de merkbare warmte en de temperatuurverandering, de temperatuurverandering en de massa en de latente warmte en de massa op kwantitatieve wijze onderzoeken. Ik kan hierbij de wetenschappelijke methode toepassen.
paginanummer
p. 37-39, p. 55-57
p. 18-24, p. 37-39, p. 58
Ik kan een warmtebalans opstellen waarbij temperatuurveranderingen en/of faseovergangen optreden. p. 40-45, p. 54-55, p. 56-57
Ik kan een onbekende grootheid berekenen door gebruik te maken van een warmtebalans en met behulp van een formularium. Ik kan uit het formularium de correcte formules selecteren, nodig bij het maken van een oefening.
p. 40-45, p. 56-57
Colofon
Auteur Freya Vermeiren
Met medewerking van Anke Van Roy
Eerste druk 2024
SO 0187/2024
Bestelnummer 90 808 0457
Module 2 van ISBN 978 90 4865 009 5
KB D/2024/0147/251
NUR 126
Thema YPMP5
Verantwoordelijke uitgever die Keure, Kleine Pathoekeweg 3, 8000 Brugge
RPR 0405 108 325 - © die Keure, Brugge
Niets uit deze uitgave mag verveelvoudigd en/of openbaar gemaakt worden door middel van druk, fotokopie, microfilm of op welke wijze ook zonder voorafgaande schriftelijke toestemming van de uitgever. No parts of this book may be reproduced in any form by print, photoprint, microfilm or any other means without written permission from the publisher. De uitgever heeft naar best vermogen getracht de publicatierechten volgens de wettelijke bepalingen te regelen. Zij die niettemin menen nog aanspraken te kunnen doen gelden, kunnen dat aan de uitgever kenbaar maken.
Die Keure wil het milieu beschermen. Daarom kiezen wij bewust voor papier dat het keurmerk van de Forest Stewardship Council® (FSC®) draagt.
Dit product is gemaakt van materiaal afkomstig uit goed beheerde, FSC®-gecertificeerde bossen en andere gecontroleerde bronnen.