8 minute read
Dermatofitosis en las especies de abasto. Tiñas, un riesgo sanitario con defecto estético (y II
from Albéitar 240
by Grupo Asís
En la segunda parte de este artículo se describe el abordaje diagnóstico y terapéutico de las dermatofitosis en el ganado.
García A1, Benítez JM2, Martínez R1 , Vizcaíno M1 y Alonso JM2
1Producción Animal. Cicytex. Badajoz 2Departamento de Sanidad Animal. Facultad de Veterinaria. Universidad de Extremadura. Cáceres Imágenes cedidas por los autores
DIAGNÓSTICO
La taxonomía de los dermatofitos y su identificación rutinaria en el laboratorio de micología clínica se basa fundamentalmente en criterios morfológicos, macro y microscópicos relacionados con la fase de reproducción asexual de estos hongos.
La lámpara de Wood emite luz ultravioleta y se utiliza en un cuarto oscuro para examinar el pelo, ya que ciertos dermatofitos muestras fluorescencia con esta luz. M. canis y M. equinum muestran una fluores-
cencia verde amarillenta debido a la pteridina que secretan cuando están creciendo. El uso de la lámpara de Wood es una herramienta útil en la clínica de pequeñas especies; aunque tiene ciertas limitaciones como que solo la mitad de las infecciones por M. canis emiten fluorescencia bajo la luz, o que otras especies de dermatofitos felinos y caninos no la emiten. Además, algunas pomadas y lociones pueden enmascararla, y si la piel de la lesión se desinfecta con alcohol, la fluorescencia puede ser mucho menos intensa o muy difusa. Cuando se utiliza la lámpara de Wood y se observa una fluorescencia verde amarillenta en el lugar de la lesión puede indicar una dermatofitosis, pero la no presencia de fluorescencia no descarta la existencia de infección.
La recolección del material debe ser abundante, se debe desinfectar con alcohol de 70° para eliminar la grasa, sustancias extrañas como cremas, suciedad, polvos, etc., y el paciente no debe estar en tratamiento antifúngico. En caso contrario, es conveniente suspenderlo al menos 15 días. Las muestras se recogen en recipientes o placas de Petri estériles y se envían lo más rápido posible al laboratorio.
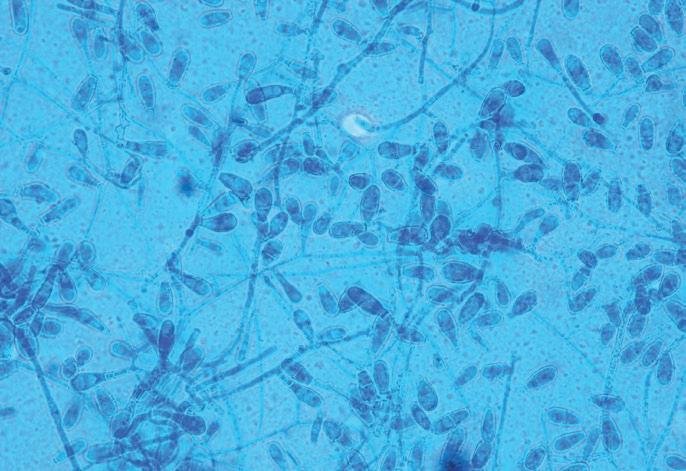
La identificación se efectúa, en primer lugar, por examen microscópico directo; un procedimiento muy simple, útil y de bajo coste. Para realizarlo colocaremos una gota de una solución clarificadora como KOH (al 10-40 %), aunque también se puede emplear dimetilsulfóxido (DMSO) al 40 %, glicerina al 10 % o azul de lactofenol. También se puede añadir un colorante como tinta Quink Parker negra (en proporción de 3:1 de KOH y tinta) y dejar reposar a temperatura ambiente durante unos minutos, dependiendo de la cantidad de queratina de la muestra, antes de proceder a su observación. Cuando la lesión se debe a un dermatofito se observan hifas septadas y artrosporas. Si el parasitismo es piloso, se observan tres tipos de parasitismo: • Ectotrix: artroconidios que se disponen como un mosaico alrededor del pelo o en cadenas en la superficie de la vaina del pelo. • Endotrix: cadenas de artroconidios en el interior del pelo.
Fávico: hifas y artroconidios en el interior del pelo y burbujas de aire.
Las distintas especies de dermatofitos invaden el pelo de una forma característica: habitualmente Microsporum presenta una invasión del pelo tipo ectotrix y Trichophytonde tipo endotrix, a excepción de T. verrucosum (ectotrix) y T. schoenleinii (fávica) (Murray et al., 2009).
El cultivo tiene valor epidemiológico y confirma con certeza el diagnóstico de dermatofitosis, pero tiene el inconveniente de ser un procedimiento diagnóstico lento (requiere un mínimo de 10-15 días para casi todas las demás especies). El medio que se utiliza universalmente para el aislamiento de los dermatofitos es el agar glucosado de Sabouraud con pH 5,6, al que se le pueden añadir antibióticos (cloranfenicol, gentamicina o tobramicina) o antifúngicos (cicloheximida) para inhibir el crecimiento de bacterias y hongos contaminantes, por lo general presentes en este tipo de muestras clínicas. Otros medios que se usan con mucha frecuencia son Lactritmel, Agar Miel y DTM (Dermatophyte Test Medium), que vira a color rojo como consecuencia de la alcalinización producida en el medio por el crecimiento del hongo. La incubación se puede realizar a 25 °C y 37 °C, realizando una observación semanal hasta los 1520 días.
Si bien la coloración de las colonias y su textura pueden ayudar a identificar estas especies, las características microscópicas son las que determinan su identificación en la mayoría de los casos.
IDENTIFICACIÓN DE LOS DERMATOFITOS La identificación de los dermatofitos se puede realizar a partir de las características macro y micromorfológicas del hongo. • Morfología macroscópica: las colonias alcanzan su madurez y estabilidad entre las dos y tres semanas. Se debe considerar el color de la superficie y reverso de la colonia, la textura de la superficie (pulverulenta, lanosa, algodonosa, granular o plegada), el diámetro alcanzado por la colonia y la presencia de pigmentos.
FIGURA 2. Imagen microscópica (20X) de macroconidias de Microsporum nanum.
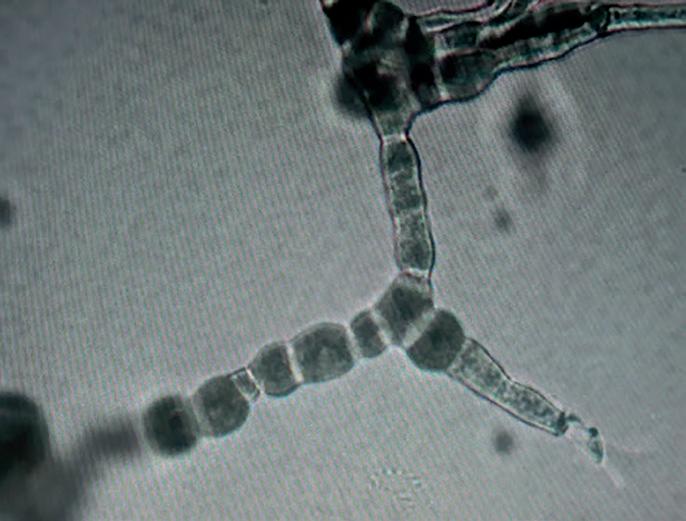
Morfología microscópica: todas las especies de dermatofitos presentan hifas hialinas, septadas y ramificadas. En algunas especies pueden observarse otras estructuras como hifas en raquetas (hifas que se dilatan en la extremidad), hifas pectinadas (hifas que simulan la forma de una peineta), hifas en espiral (hifas que simulan un resorte) o candelabros fávicos (ramificaciones dicotómicas con extremos dilatados).
La diferenciación entre los géneros se basa principalmente en las características de los macroconidios y microconidios.
CORTES HISTOLÓGICOS Las estructuras fúngicas pueden ser visibles en secciones teñidas de lesiones en piel o pseudomicetomas. Las tinciones disponibles incluyen la tinción de PAS (Periodic Acid-Schiff) y la plata metanamina.
TÉCNICAS MOLECULARES Se ha desarrollado un número creciente de técnicas basadas en ADN para la detección de ADN fúngico en muestras dermatológicas (Nardoni et al., 2007) y para su uso en la identificación de aislamientos fúngicos (Kamiya et. al., 2004).
TRATAMIENTO
Las principales medidas de control son el aislamiento de los animales enfermos y la desinfección de materiales e instalaciones (formol, yodo, etc.) para evitar la transmisión de la enfermedad a los animales sanos. Se pueden realizar tratamientos locales con povidona yodada cuando se trata de lesiones meno-

FIGURA 3. Observación microscópica de un pelo con una infección de tipo ectótrix. Se observan artrosporas compatibles con dermatofito.
res, aunque cuando la infección es generalizada se debe administrar un tratamiento con medicamentos antifúngicos.
El tratamiento puede incluir cremas antimicóticas de uso tópico o champús y/o antimicóticos sistémicos. En la mayoría de los antimicóticos tópicos y sistémicos el principal mecanismo de acción es el bloqueo de la síntesis de la membrana de la célula fúngica, a excepción de la griseofulvina, que actúa impidiendo la división celular .La dosis de griseofulvina en las especies de animales de abasto es muy variable. En las últimas décadas la terapia antifúngica de las micosis superficiales ha tenido un importante avance con el desarrollo de moléculas más seguras y efectivas, como el fluconazol, itraconazol y la terbinafina. Se han empleado diferentes dosis, duraciones y pautas de administración en los tratamientos con itraconazol y terbinafina y se ha demostrado su eficacia en algunas especies con pautas de administración deuna semana seguida de una semana de descanso, o de dos días por semana.
Como en los animales de abasto existe un alto porcentaje de resolución espontánea, a menudo no se administra ningún tratamiento.
En Europa se dispone de una vacuna con cepas vivas atenuadas de T. verruosum que producen abundantes microconidias que han sido empleadas con extraordinario éxito en campañas de vacunación masivas de ganado vacuno en los antiguos países del Este y Noruega.
BIBLIOGRAFÍA
Ajello L (1962) Present day concepts of the dermatophytes. MycopatholMycolAppl 17: 315-324. Bofill P.; W. Ramírez; J. Montañez; L. R. García; M. Pérez; María I. Percedo y María A. Abeledo. 2010. Dermatomicosis. En: Manual de Enfermedades Infecciosas. (T - III). Editorial Félix Varela, La Habana, Cuba, ISBN 978-959-07-0299–0, 86–103. Cabañes FJ. Dermatofitosis animales. Recientes avances. Rev. Iberoam. Micol. 2000; 17: S8- S12. Cafarchia, C., Romito, D., Sasanelli, M., Lia, R., Capelli, G.andOtranto,D.2004.The epidemiology of canine andfeline dermatophytoses in southern Italy. Mycoses Journal 47 (11-12):508-13. Cameron RDA. Diseases of the skin. In: Straw BE, D’Allaire S, Mengeling WL, Taylor DJ, eds. Diseases of Swine. 8th ed. Ames, Iowa: Iowa State University Press; 1999:941-958. Del Palacio A, Garau M, González- Escalada A, Calvo MT. Trends in the treatment of dermatophytosis. En: Kushwaha RKS, Guarro J (Eds.) Biology of dermatophytes and other keratinophilic fungi. Bilbao, Rev. Iberoam. Micol.2000; 148-158. Fonesca, E. and L. Mendoza, 1984. Favus in a fighting cock caused by Microsporumgallinae.AvianDis., 28: 737-741. García L.; López, R.; Ramírez, R.; L. Rodríguez, Nevárez, M. 2012. Descripción de unbrote de dermatofitosis en bovinos en el trópico mexicano. Revista RedVet Vol. 13 No7 Disponible: http://www.veterinaria.org/revistas/redvet/n070712. html. Grunder, S., P. Mayser, T. Redmann and E.F. Kaeita, 2005. Mycological examinations on the fungal flora of the chicken comb. Mycoses, 48:114-119. Hubalek, Z., 2000. Keratinophilic fungi associated with free-living mammals and birds. Rev. Ibeoam. Micol., 17: 93-103. Kamiya A, Kikuchi A, Tomita Y, Kanbe T. PCR and PCR-RFLP techniques targeting the DNA topoisomerase II gene for rapid clinical diagnosis of the etiologic agent of dermatophytosis, J DermatolSci, 2004, vol. 34 (pg. 35-48). Martín, A. 1999. Histopatología de los dermatophytes. Rev. Ibeoam. Micol., S15: VO-26. Murray PR, Rosenthal KS, Pfaller MA. Mic.méd. Barcelona: 6.ª ed.Elsevier; 2009. p. 715-2. Nardoni, S., Franceschi, A., Mancianti, F., 2007. Identification of Microsporum canis from dermatophytic pseudomycetoma in paraffin-embedded veterinary specimens using a common PCR protocol. Mycoses 50, 215–217. Nassif, M. Osman,S. 2003. An outbreak of dermatophytosis in goat kids. AssiutVet. Med. J. 49 (99): 142-1550. Pontón, J. 2002.Diagnóstico microbiológico de las micosis. Rev. Iberoam. Micol.,19:25-29. Radostits O. M., Gay, C. C., Blood, D. C. and Hinchcliff, K. W. 2007.Dermatomycoses.In:Veterinary Medicine. A Textbook of the diseases of cattle, sheep, pigs, goats and horses.10th Ed. W. B. Saunders.Pp 1476-1478. Swai E; y Sanka, P. 2012. Bovine Dermatophytosis Caused by Trychophyton Verrucosum: A Case Report. Revista Vet. World. Vol. 5(5):297-300. Wagner DK, Sohnle PG. Cutaneous defenses against dermatophytes and yeasts. ClinMicrobiolRev 1995; 8(3):317-35.












